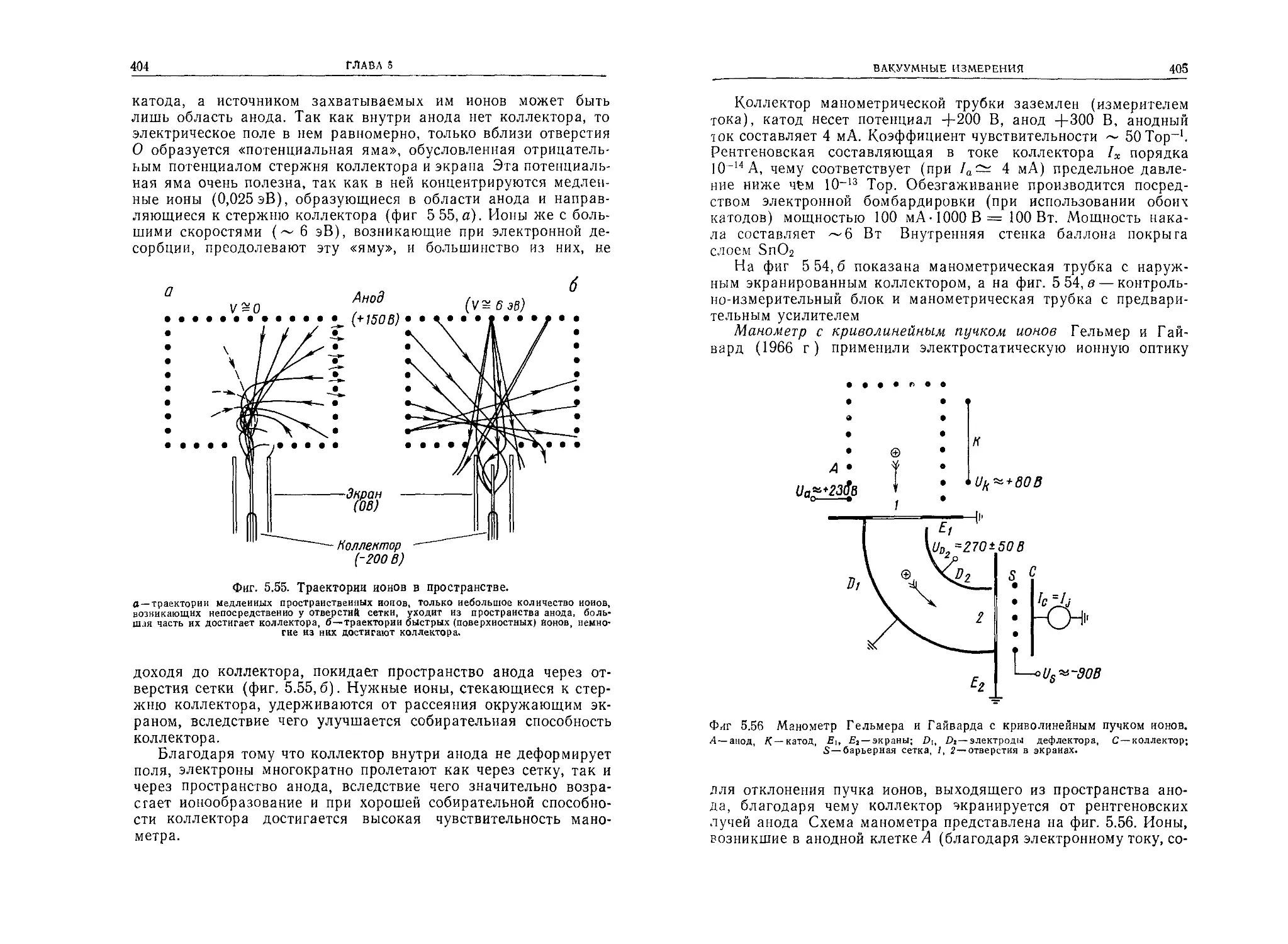
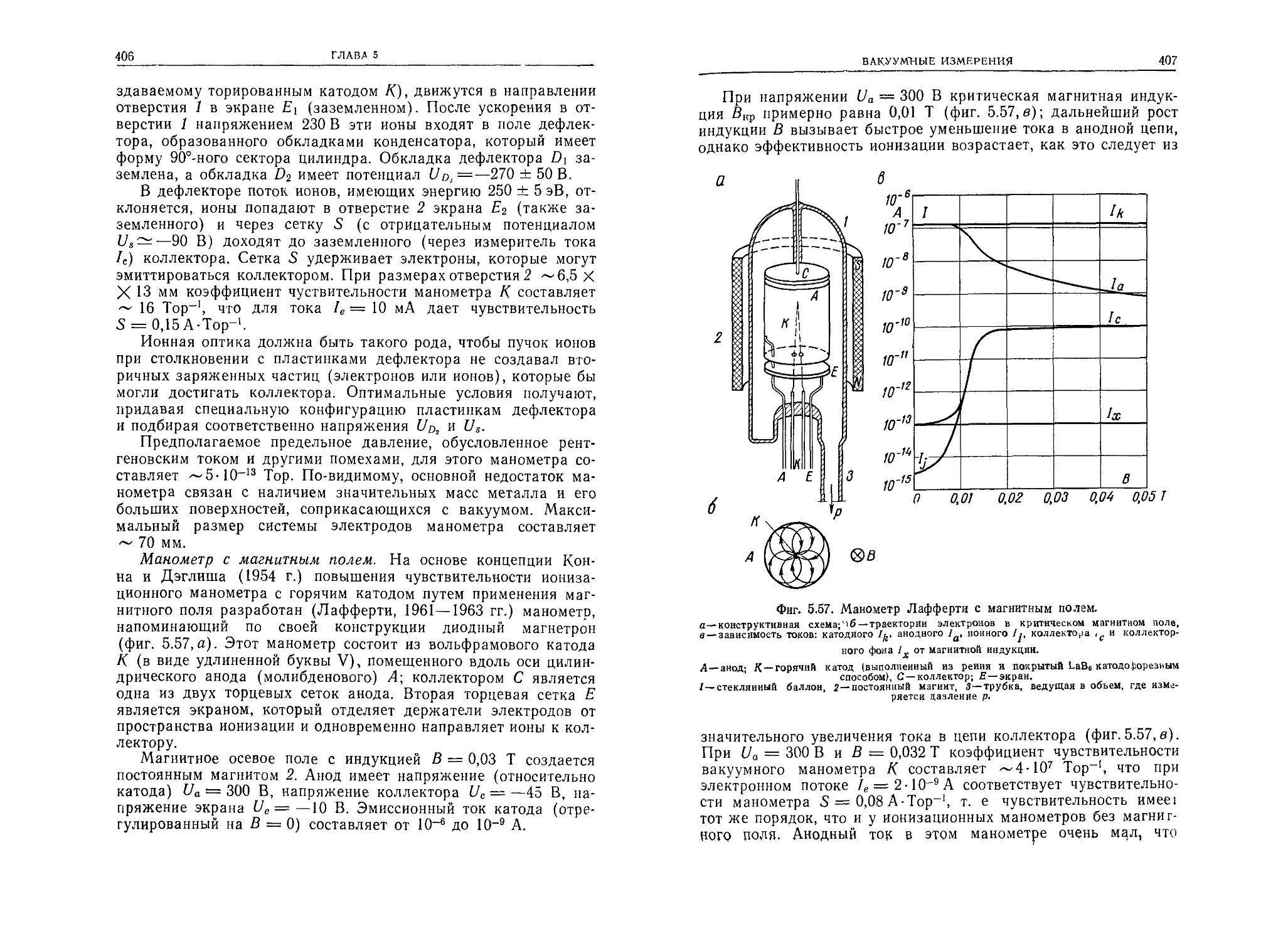
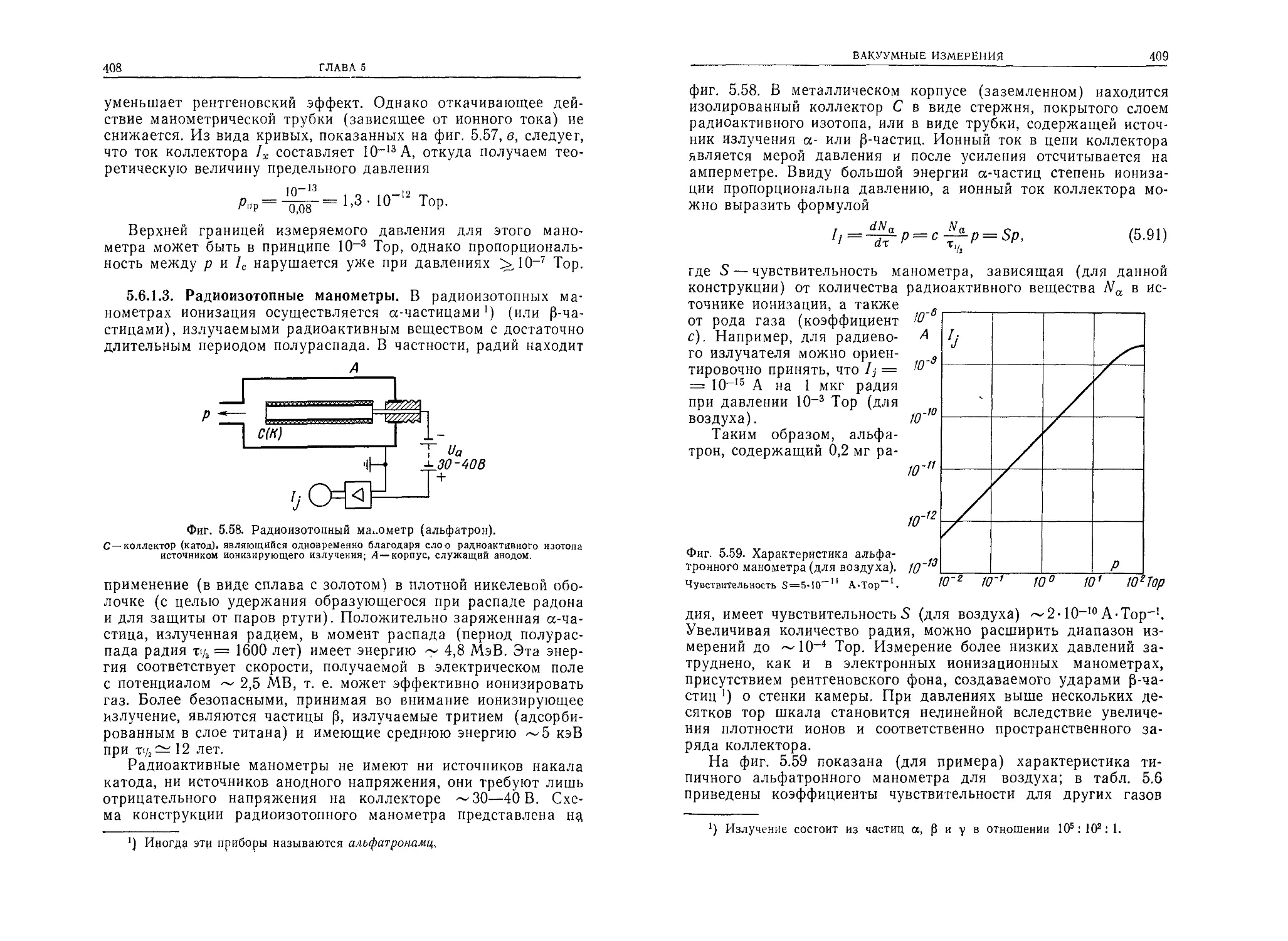
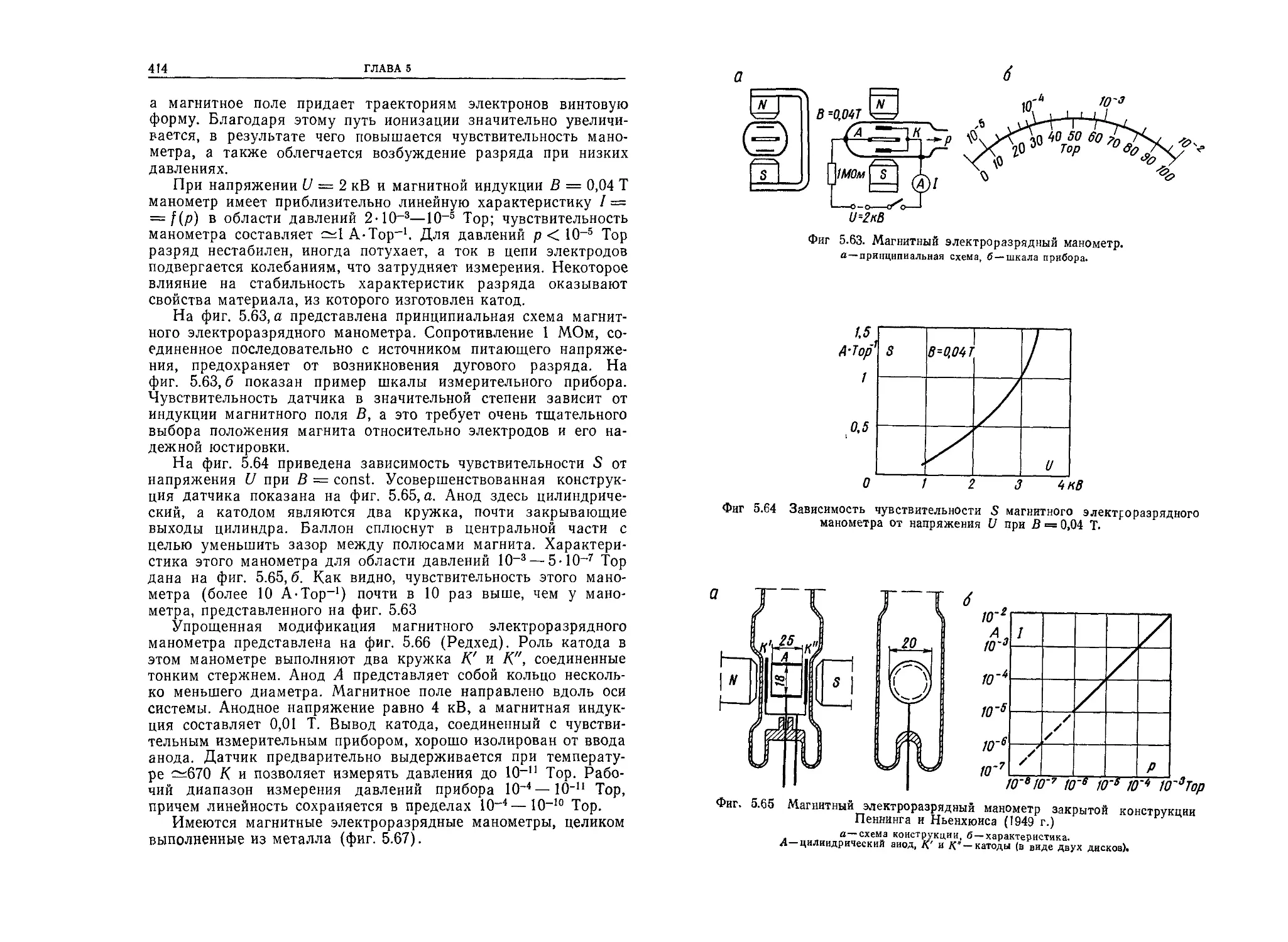
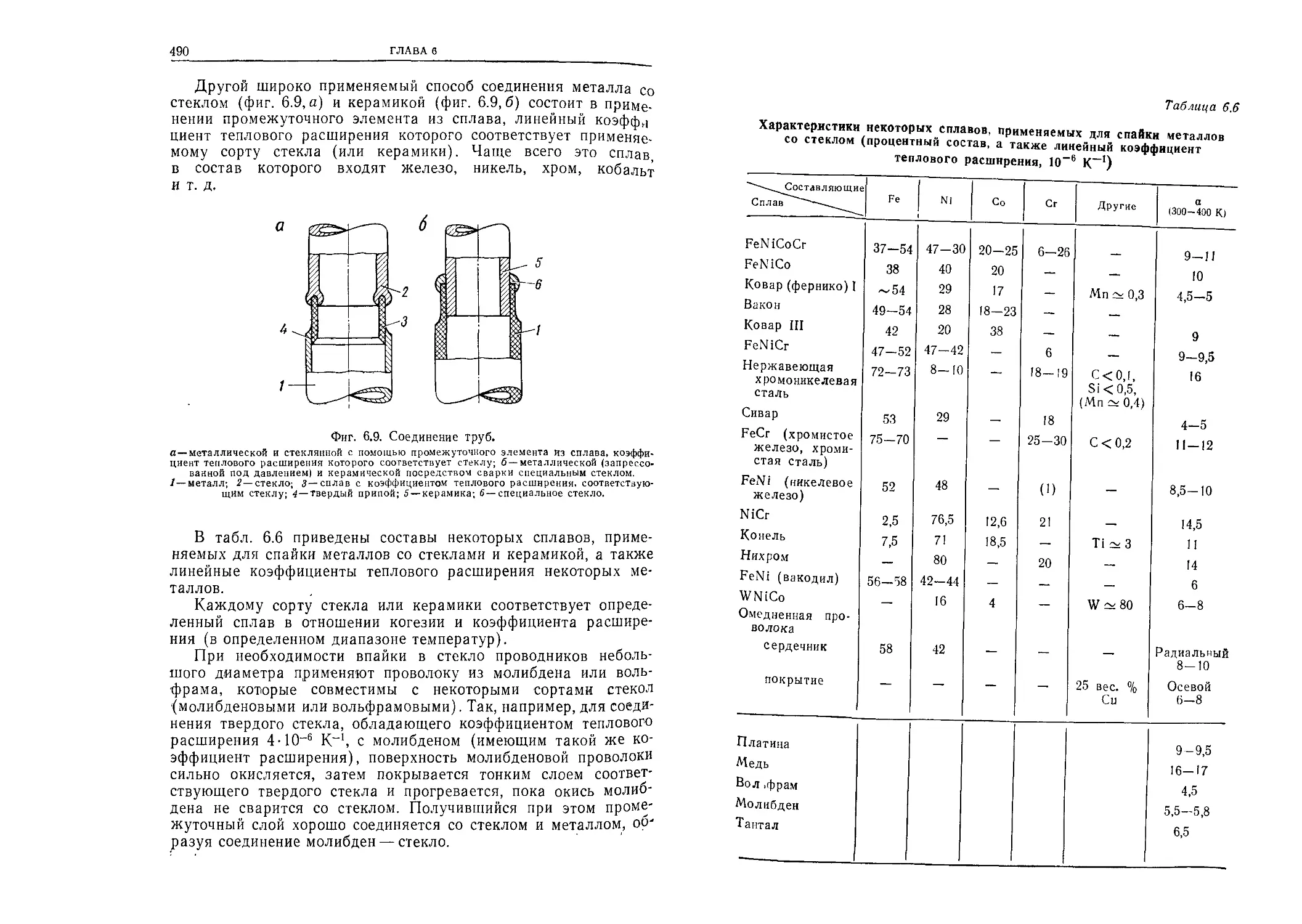
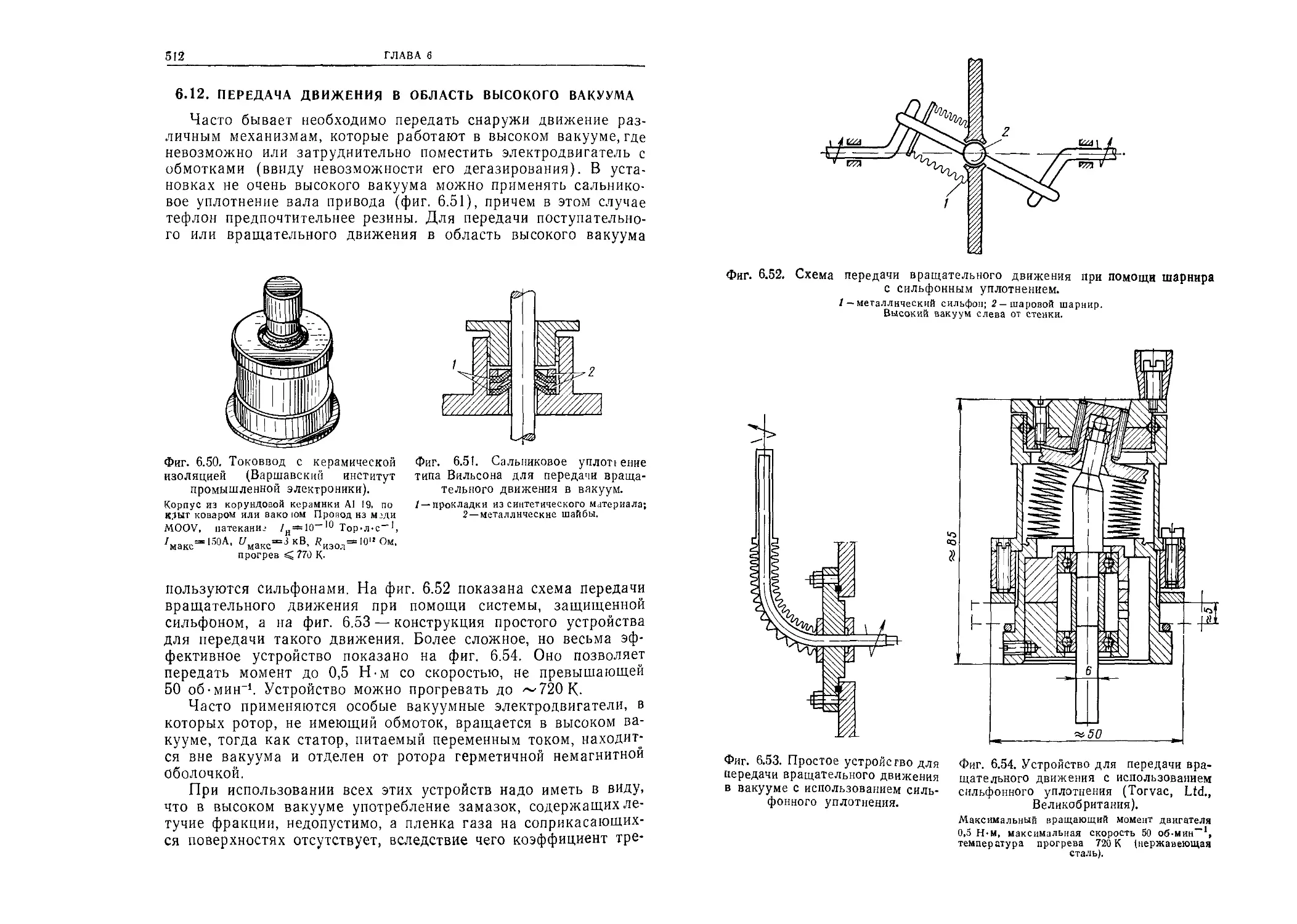
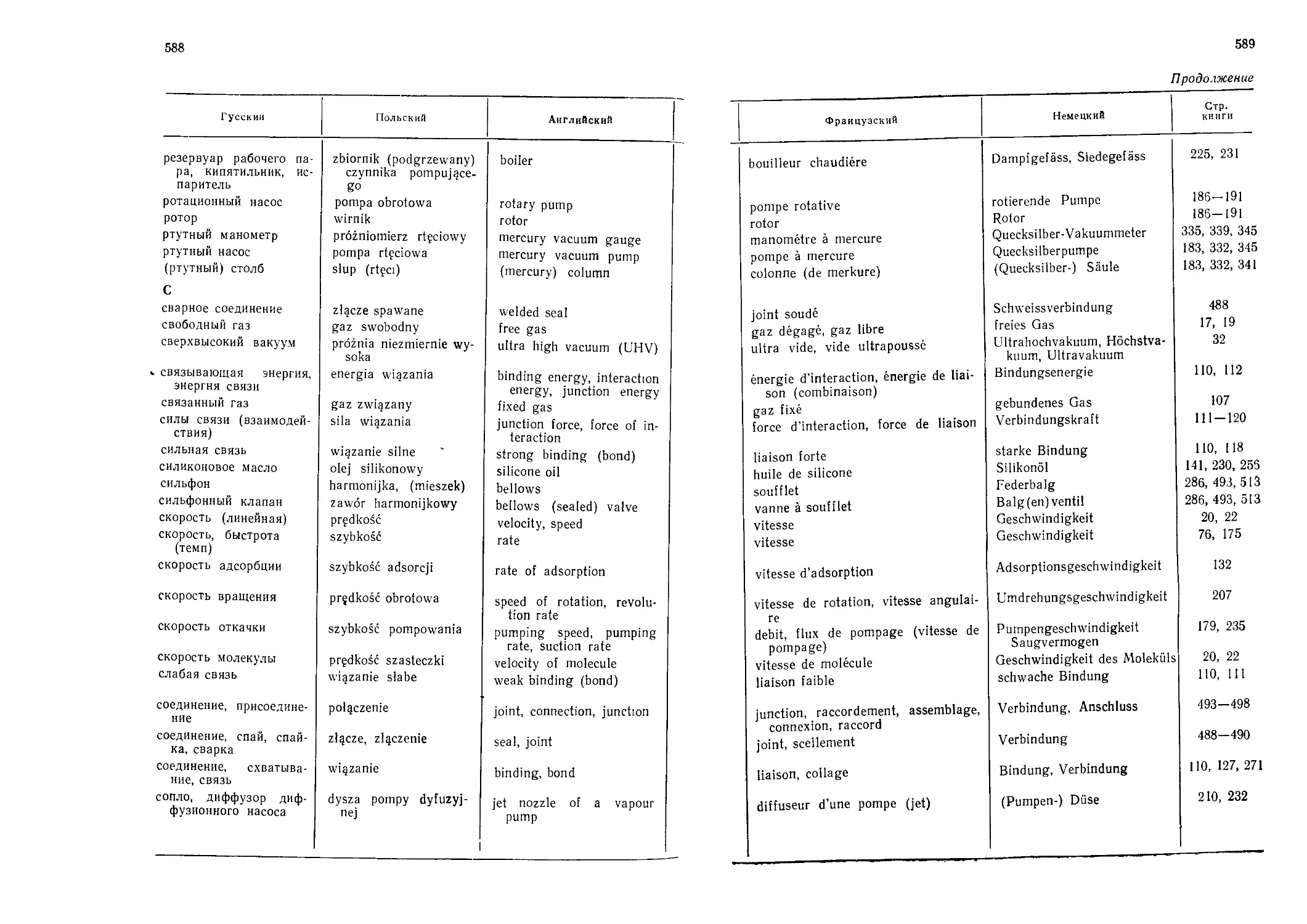
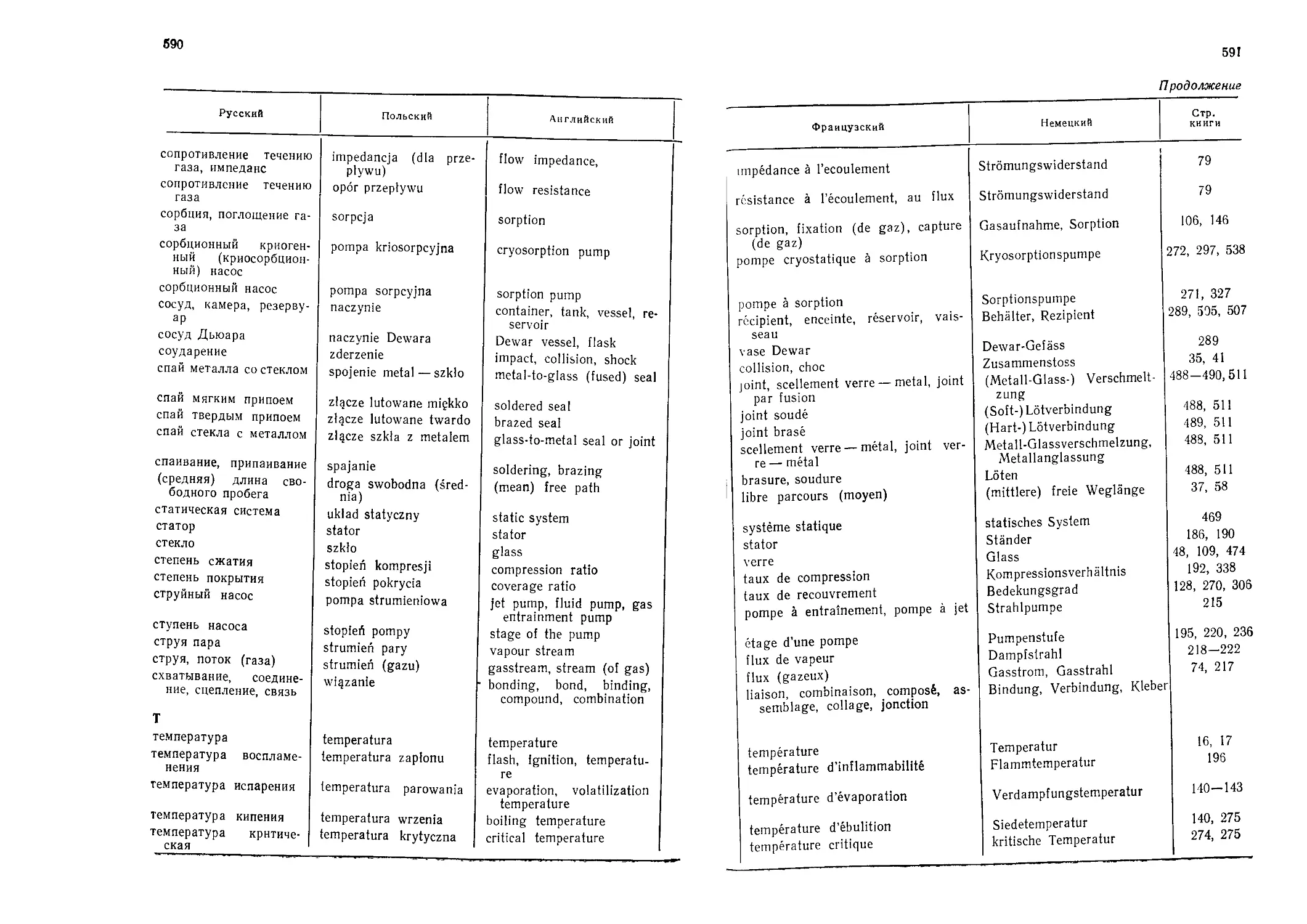
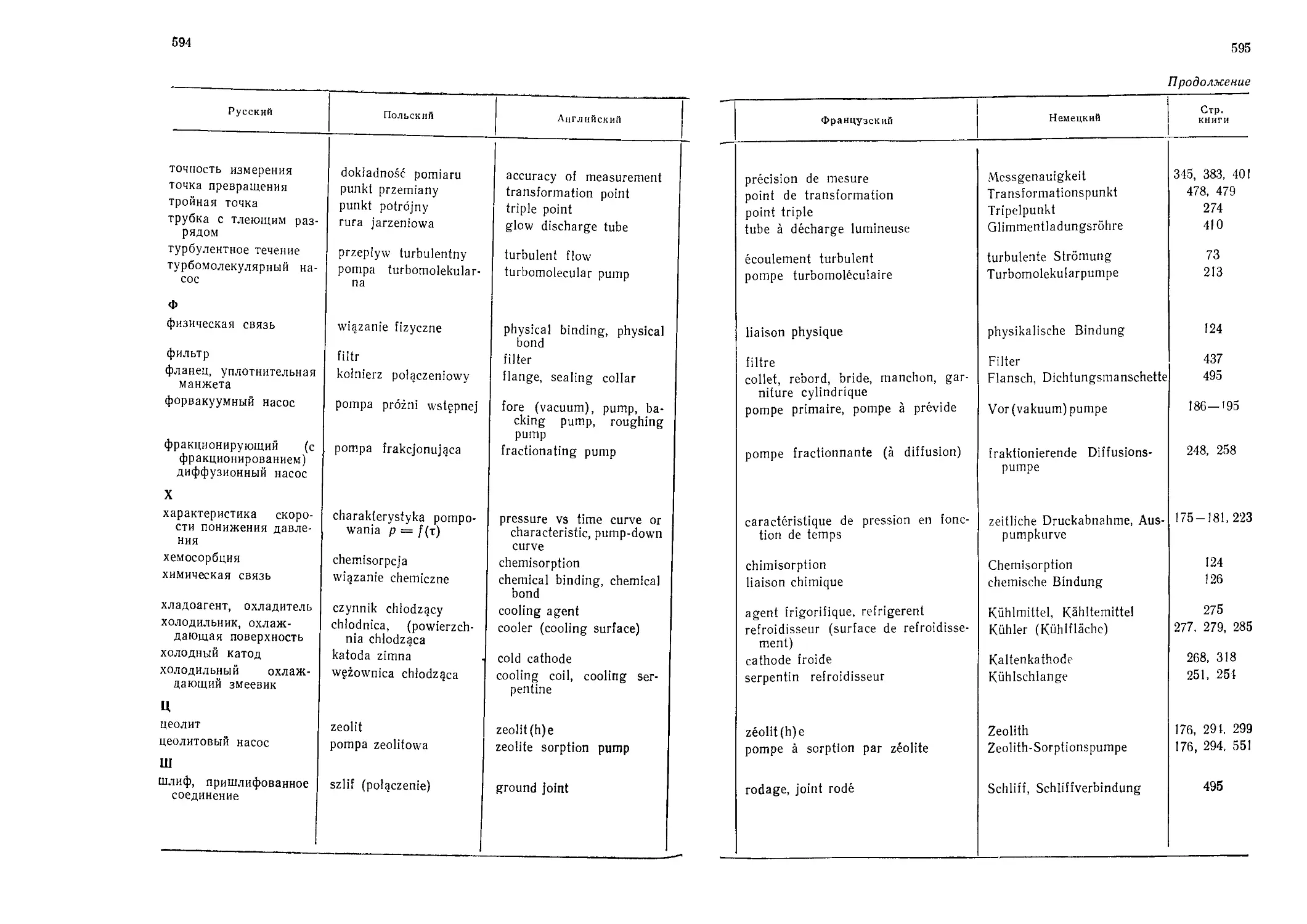
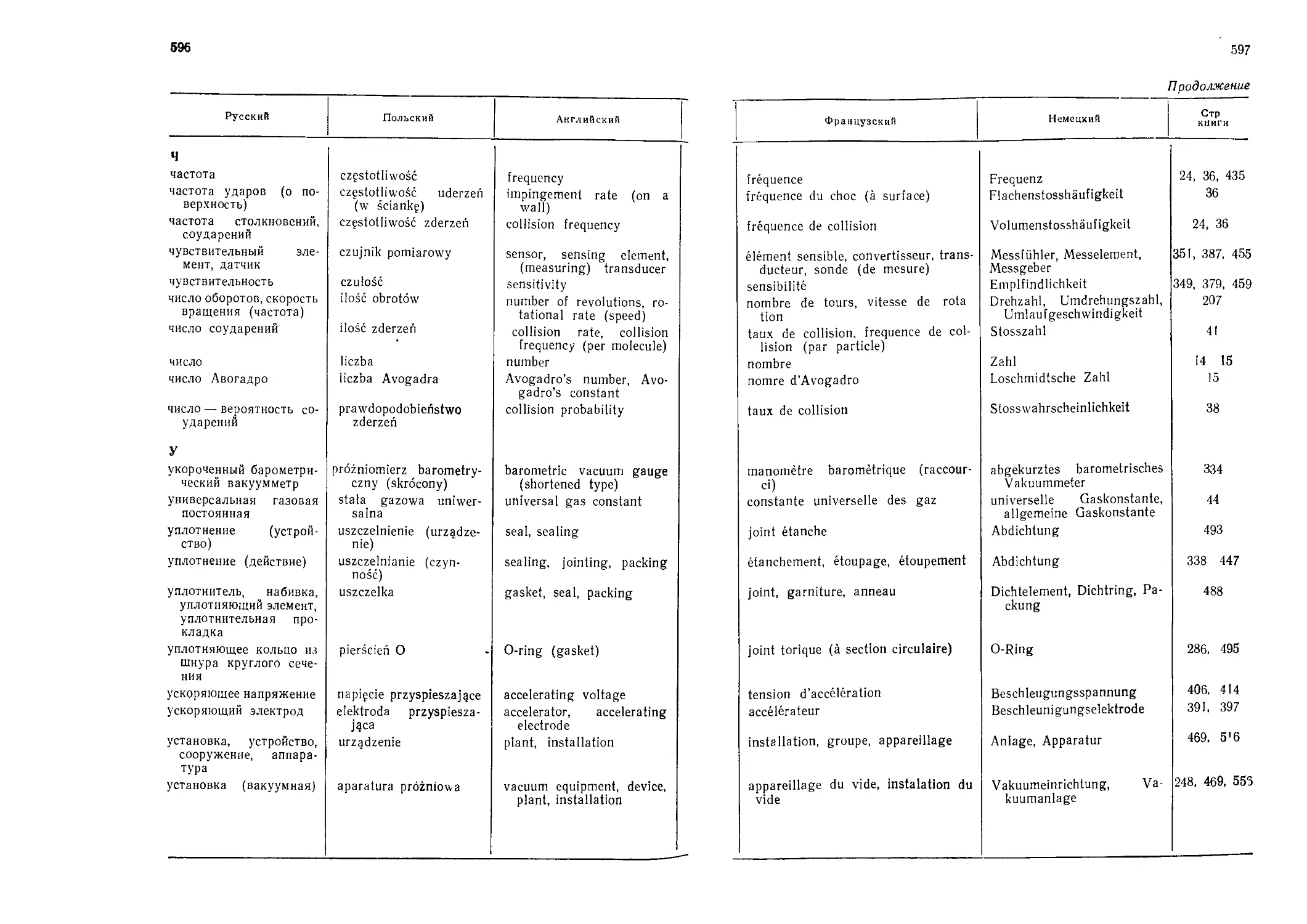
Автор: Грошковский Я.
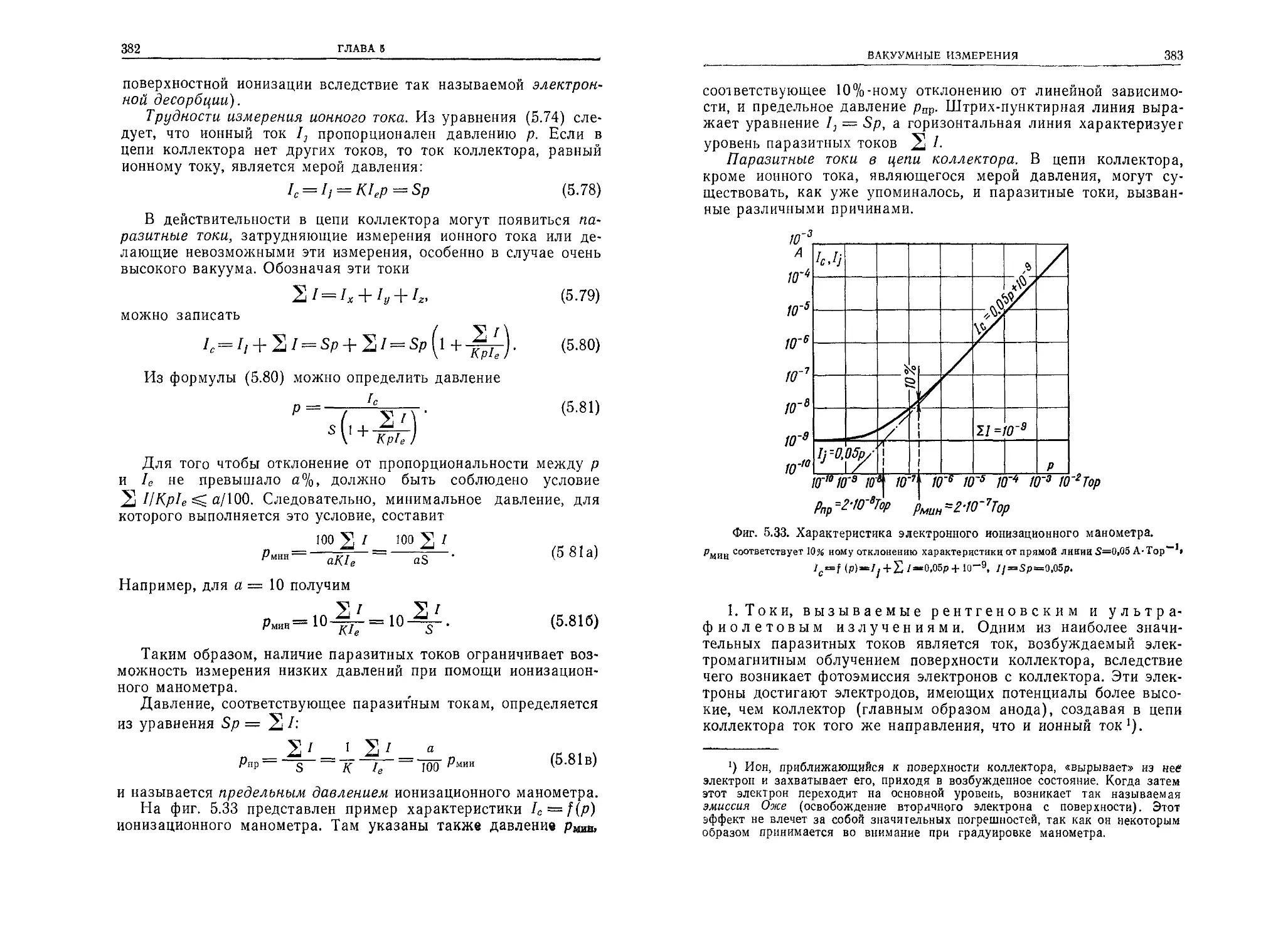
Теги: разреженные газы физика вакуума химия металлургия монография учебное пособие издательство мир вакуумные системы
Год: 1975
Текст
JANUSZ GROSZKOWSKI
Technika
wysokiej
prozni
WYDAWNICTWA
NAUKOWO-TECHNICZNE
WARSZAWA 1972
Я. ГРОШКОВСКИЙ
Техника
высокого
вакуума
ПЕРЕВОД С ПОЛЬСКОГО
В. Л. БУЛАТА И Э. Л. БУЛАТА
с приложением
проф., д-ра физ.-мат. наук РЕЙХРУДЕЛЯ Э. М.
и д-ра техн, наук СМИРНИЦКОЙ Г. В.
ИЗДАТЕЛЬСТВО «МИР»
МОСКВА 1975
УДК 533.6
Книга крупного специалиста в области вакуумной техники, академика
Польской Академии наук и почетного члена ряда зарубежных академий
Я. Грошковского представляет собой монографию, в которой на современном
уровне рассматриваются физика и техника высокого вакуума, методы его по-
лучения и измерения
Это — существенно переработанное и дополненное издание книги «Техно-
логия высокого вакуума» того же автора, которая вышла в русском переводе
в 1957 г. и приобрела широкую известность среди специалистов.
Книга отличается четкостью структуры и ясностью изложения. Поэтому
она окажется полезной широкому кругу научных работников, преподавателей
высших учебных заведений, инженеров заводских лабораторий, химиков, ме-
таллургов и других специалистов, а для студентов вузов соответствующих
специальностей она будет хорошим учебным пособием.
Редакция литературы по новой технике
30407 - 155
Г 041 (01) — 75
155 - 75
© Перевод на русский язык, «Мир», 1975
ПРЕДИСЛОВИЕ АВТОРА К РУССКОМУ ИЗДАНИЮ
Высокий вакуум, который до недавнего времени в научных
исследованиях находил лишь ограниченное применение, а в
промышленности — исключительно при производстве электрон-
ных ламп, начал широко использоваться в других областях
науки и техники, особенно в связи с появлением твердотельных
электронных приборов. Это стало возможным благодаря интен-
сивным теоретическим и экспериментальным исследованиям в
области вакуума физиков и инженеров всего мира, среди кото-
рых много советских ученых.
Разнообразные экспериментальные исследования в науке и
технологические процессы в современной промышленности, а
также многие технические устройства невозможны без высокого
вакуума, т. е. таких условий, при которых из определенного объ-
ема и с ограничивающих его стенок по возможности устранены
газы.
Свободные газы в таких устройствах, как, например, неопти-
ческие микроскопы, ускорители, напылители и др., нарушают
направленное движение частиц (электронов, нейтронов, прото-
нов, атомов, молекул), а в таких устройствах, как, например,
гироскопы, создают помехи вращательному движению роторов и
других подвижных элементов.
Газы, связанные на поверхностях и внутри материала, за-
трудняют получение чистых поверхностей, которые необходимы
при исследовании свойств материалов или при выполнении не-
которых технологических процессов (формирование тонких
слоев, введение присадок и т. п.).
Испытания космических кораблей перед их полетом должны
проводиться в условиях, наиболее близких к тем, которые суще-
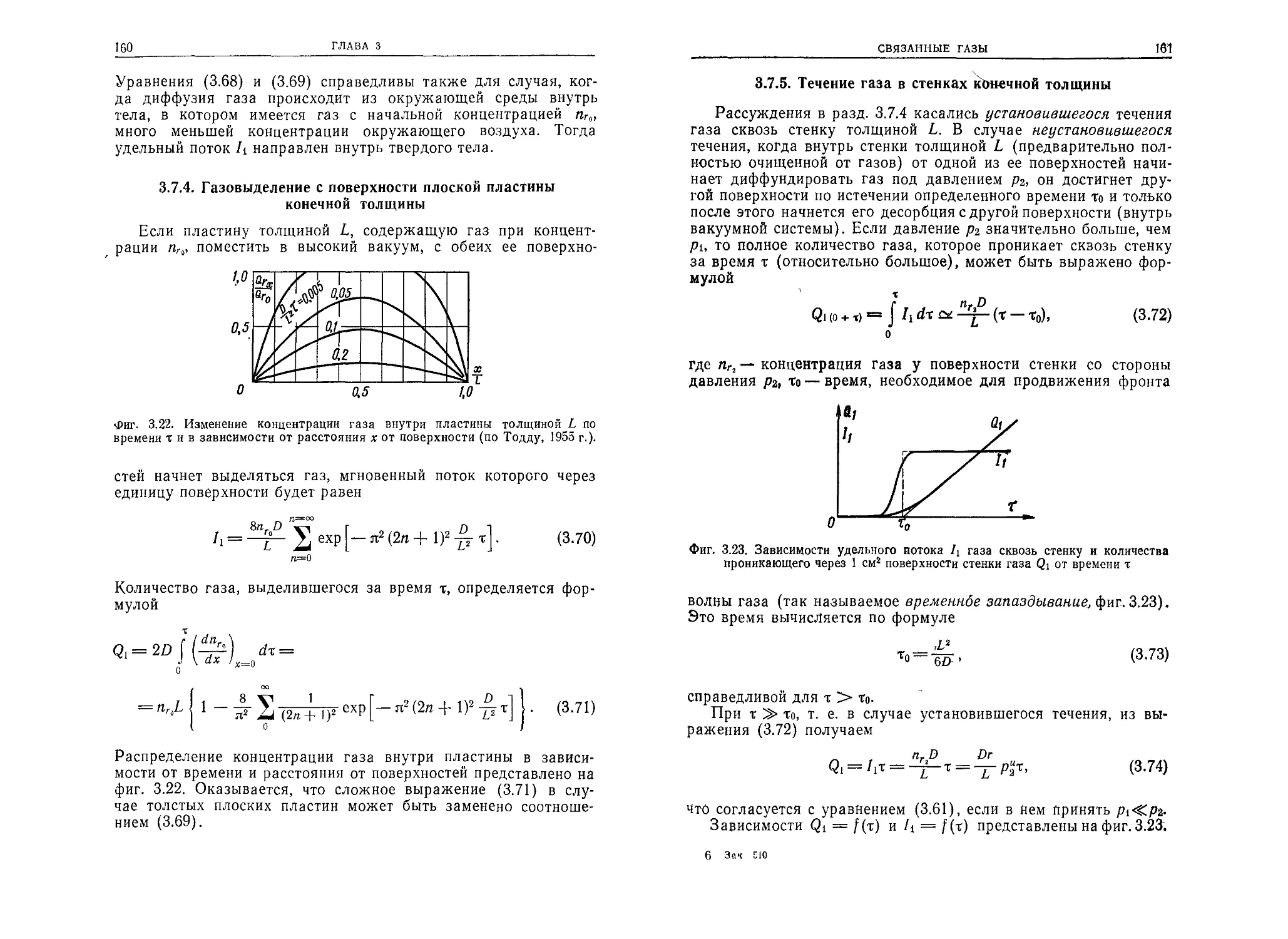
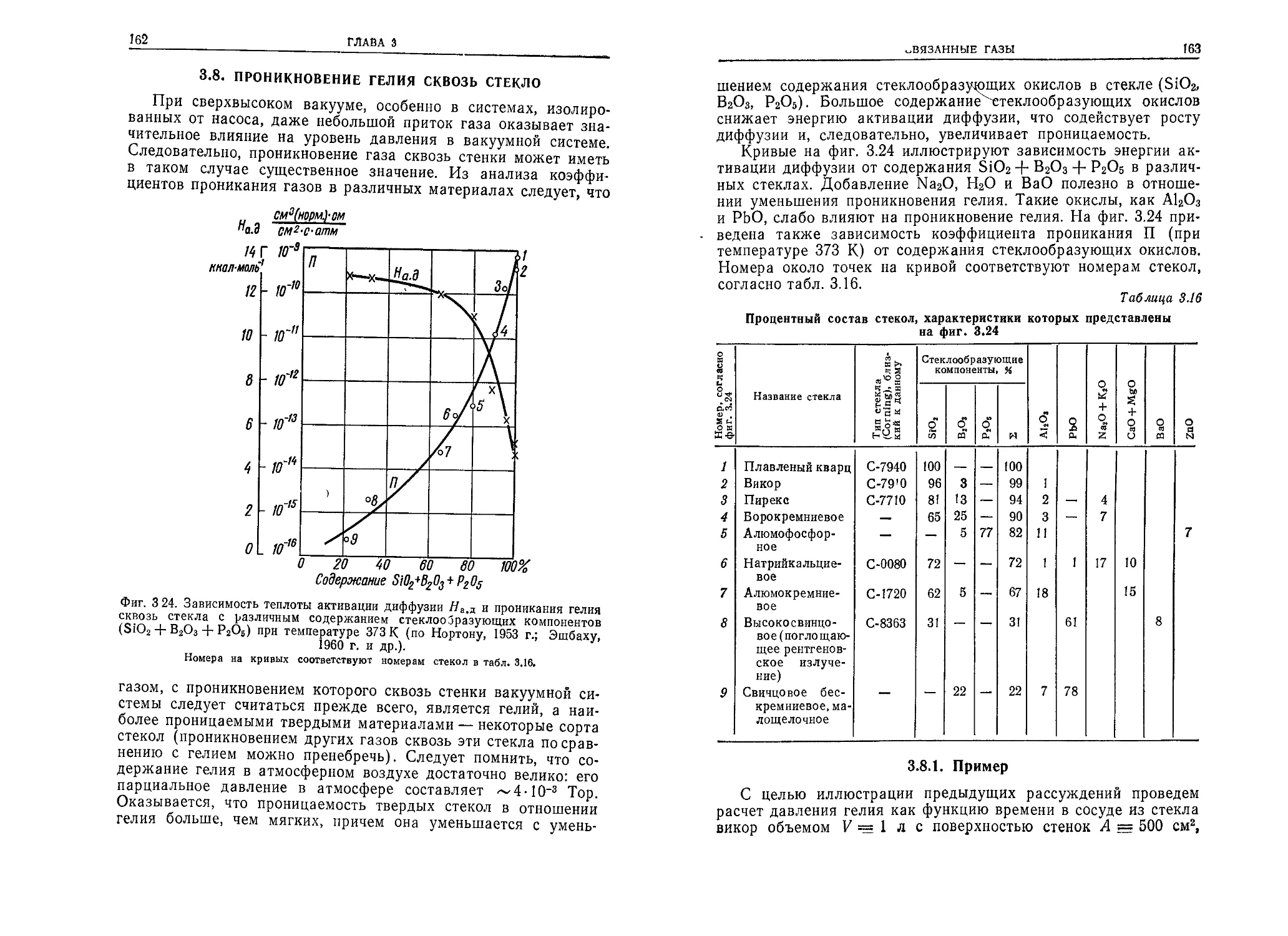
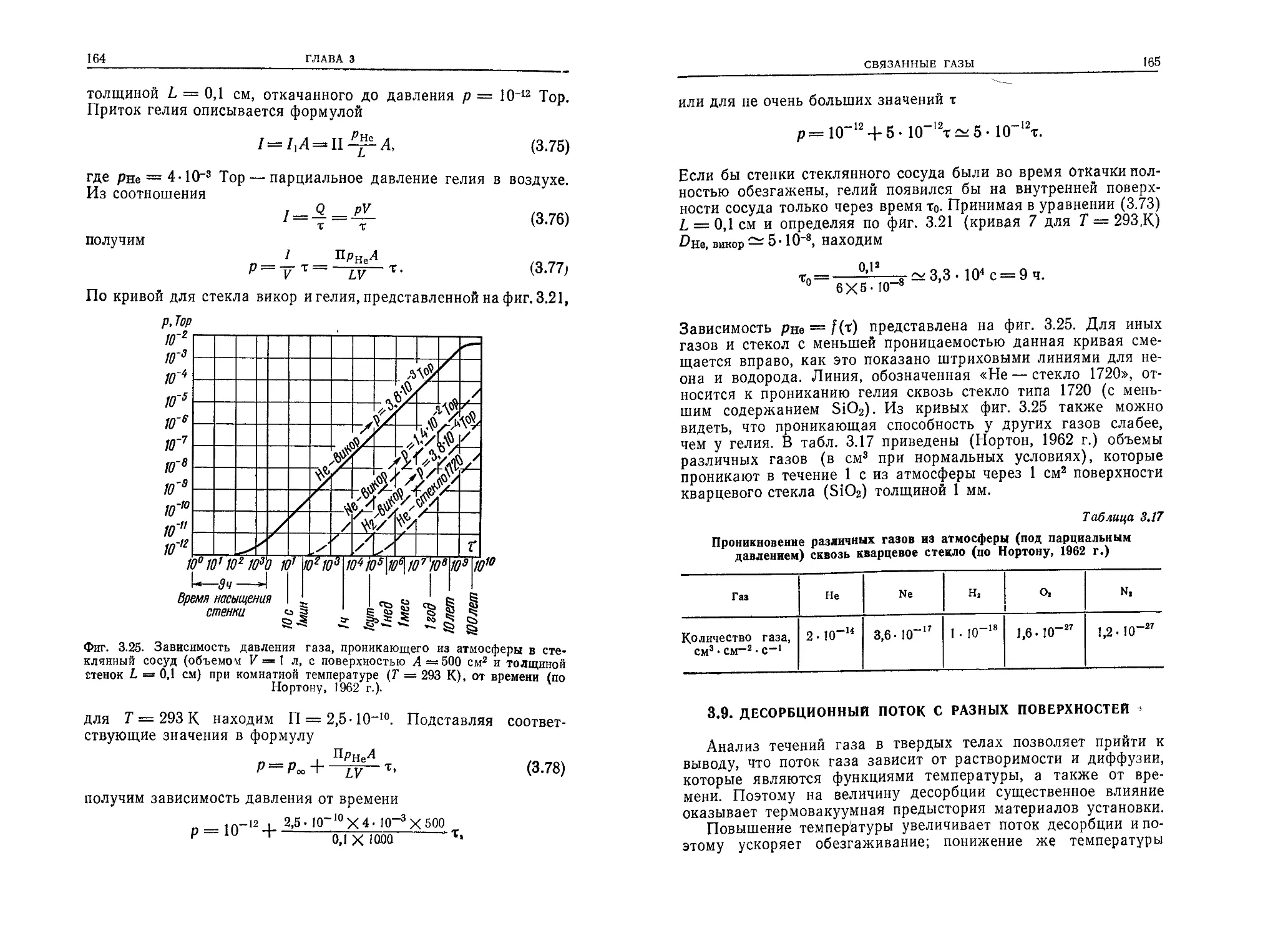
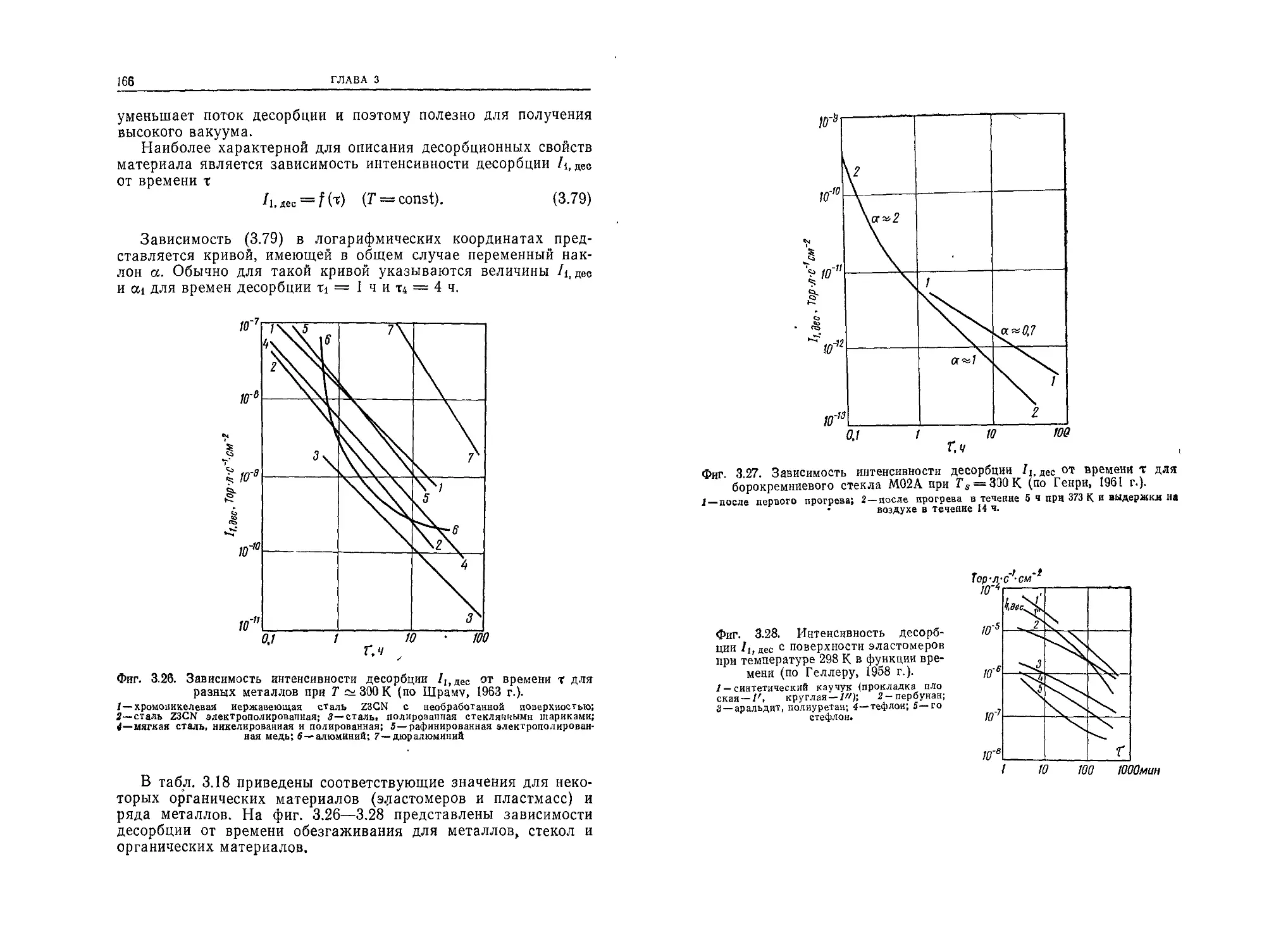
ствуют в космосе. Для этого используются имитаторы условий
космического пространства, в которых создается высокий ва-
куум.
Высоковакуумное оборудование является неотъемлемой ча-
стью различных установок для исследования фундаменталь-
ных физических явлений (ускорителей заряженных частиц,
6
ПРЕДИСЛОВИЕ АВТОРА К РУССКОМУ ИЗДАНИЮ
установок для получения высокотемпературной плазмы и др.)
и выполнения разнообразных технологических процессов (на-
пример, в вакуумной металлургии, при электронно-лучевой
сварке, при диффузионном прогреве и т. п.). Для создания ва-
куума используются вакуумные насосы, а для его контроля —
различные измерительные и управляющие устройства.
Что касается самой высоковакуумной техники, то в настоя-
щее время она, подобно другим техническим наукам, выдели-
лась из физики и стала самостоятельной технической дисципли-
ной.
В настоящей книге автор стремился изложить важнейшие
сведения о физике и технике высокого вакуума в виде, доступ-
ном как для инженеров и студентов, так и для специалистов в
других областях, которые хотели бы ознакомиться с определен-
ными разделами этой дисциплины.
Книга в значительной степени основана на предыдущих ра-
ботах автора (в частности, книге «Технология высокого ваку-
ума», известной советскому читателю), которые подготавлива-
лись и совершенствовались по мере развития вакуумной тех-
ники. В ней использованы достижения исследователей всего
мира, учтены собственные достижения автора, а также его со-
трудников и учеников.
Связь книги с предыдущими изданиями вызывает необходимость обра-
тить внимание читателей на одно обстоятельство. В последние годы в миро-
вой литературе появилось несколько книг по тематике высокого вакуума,
которые в некоторых отношениях схожи с предыдущими работами автора (на-
пример, в отношении охвата материала, его располржения, способа изложения),
а часто содержат заимствованные из них рисунки, схемы и диаграммы без
соответствующих ссылок. Вотизбежаниенедоразумений я вынужден предупре-
дить об этом читателя, не знакомого с предыдущими работами автора.
Расположение материала в книге соответствует принятому
мною порядку в предыдущих изданиях. Первые три главы яв-
ляются основой для гл. 4 и 5, которые освещают важнейшие во-
просы вакуумной техники: создание и измерение вакуума. Гла-
ва 6 содержит краткую характеристику основных материалов,
применяемых в технике высокого вакуума, а также элементов
вакуумной аппаратуры. В гл. 7 приведены примеры некоторых
вакуумных установок в соответствии с различными примене-
ниями высокого вакуума.
Перечень книг и журналов, посвященных проблемам техники
высокого вакуума, а также пятиязычный словарь наиболее важ-
ных терминов, связанных с физикой и техникой вакуума, состав-
ляют приложение, которое, как можно надеяться, окажется по-
лезным для читателя.
Русский перевод основывается на польском издании книги
«Техника высокого вакуума», вышедшей в 1972 г. Однако спе-
циально для русского издания автором в значительной мере пе-
ПРЕДИСЛОВИЕ АВТОРА к РУССКОМУ ИЗДАНИЮ
7
реработаны гл. 1—3, а также введен ряд существенных измене-
ний и поправок в остальные главы. Эти доработки книги свя-
заны с тем чувством ответственности, которое я испытываю
перед читателями Советского Союза — страны, где наука и тех-
ника достигли столь высокого уровня развития.
В заключение приношу сердечную благодарность профессору
Э. М. Рейхруделю, д-ру техн, наук Смирницкой Г. В., редактору
Ю. Б. Воронову, переводчикам В. Л. Булату и Э. Л. Булату за
труд по переводу, редактированию и дополнению советского из-
дания моей книги.
Януш Грошковский
Варшава, октябрь 1974 г.
1. Введение
1.1. ВАКУУМ
Вакуумом называется состояние газа в ограниченном стенка-
ми объеме при давлении (концентрации) ниже атмосферного.
Высокий или очень высокий вакуум имеет место тогда, когда
соответствующее ему давление газа значительно или весьма
значительно ниже атмосферного давления.
По мере увеличения высоты над уровнем земли воздух ста-
новится все более и более разреженным, его давление умень-
шается и на большой высоте уже соответствует высокому, а в
космосе — сверхвысокому вакууму.
1.1.1. Проблематика высокого вакуума
Проблематика высокого вакуума распространяется на его
научные основы, технику и технологию. Научные основы высо-
кого вакуума базируются на соответствующих разделах физики
и химии, описывающих газы и происходящие в них явления, а
также взаимодействия между газообразной фазой и другими фа-
зами вещества.
К технике высокого вакуума относятся устройства для полу-
чения, поддержания и использования вакуума, а также для из-
мерения соответствующих физических величин.
На научные основы и технику высокого вакуума опирается
технология высокого вакуума, которая изучает способы наибо-
лее рационального ведения процессов, связанных с получением,
поддержанием и использованием высокого вакуума. Технология
высокого вакуума включает также вакуумное материаловеде-
ние. Наконец к области техники и технологии высокого вакуума
обычно относят и установки, служащие для исследовательских
и промышленных целей.
1.1.2. Роль высокого вакуума в науке и технике
Высокий вакуум приобретает все большее значение в науке
и новой технике, а в последнее время и в промышленности. Для
примера можно назвать такие области науки, как физика
твердого тела, физика плазмы, ядерная физика, исследование
10
ГЛАВА I
космического пространства, электроника, в которых продвиже-
ние вперед без использования вакуумной техники вообще не
было бы возможным.
Для электронной промышленности высокий вакуум является
одним из основных «конструкционных материалов», используе-
мых в различных электронных элементах. Высокий вакуум яв-
ляется также основой многих технологических процессов, с ко-
торыми приходится иметь дело, например, при получении очень
чистых материалов, напылении тонких пленок и т. п. Без иссле-
дований адсорбции газов и паров на поверхности катализаторов
в условиях высокого вакуума не было бы возможным рацио-
нальное использование катализаторов во многих химико-техно-
логических процессах.
Одним из необходимых условий исследования термомолеку-
лярных процессов является получение и сохранение высокого
вакуума в больших объемах, в которых всегда имеются источ-
ники газов.
Разработка ракет и космических летательных аппаратов
была бы очень затруднена без исследования их в вакуумных ка-
мерах, в которых создаются условия, соответствующие космиче-
скому пространству. Основным из таких условий является высо-
кий вакуум.
Здесь не будем перечислять другие многочисленные области
применения вакуумной техники для промышленных целей (хи-
мия, фармакология, электротехника и т. п.). Упомянем лишь об
удалении водяных паров из различных материалов при низкой
температуре в вакууме, о насыщении материалов различными
веществами после предварительного удаления воздуха и т. п.
Для этих целей достаточен низкий или средний вакуум1), по-
скольку снижение давления (по сравнению с атмосферным) и
уменьшение количества активного кислорода здесь более важ-
но, чем удаление нежелательных примесных газов.
В вакуумной металлургии требования к качеству вакуума
более высокие, и они тем выше, чем более чистым должен быть
получаемый металлический материал. В этом случае, создавая
вакуум, задаются целью уменьшить над поверхностью металла
концентрацию активных атмосферных газов (в первую очередь
кислорода).
1.1.3. Применение высокого и очень высокого вакуума
Опуская рассмотрение вопроса о применении низкого и сред-
него вакуума для различных технических целей, например суш-
') В отечественной литературе категорию вакуума обычно определяют
соотношением между длиной свободною пробега молекул А и характерным
размером сосуда I. Для низкого вакуума А для среднего А — /, а для вы-
сокого А I. — Прим ред.
ВВЕДЕНИЕ
11
ни, обезвоживания, насыщения, использования в пневматических
устройствах и т. п., ограничимся краткой характеристикой при-
менения только высокого и очень высокого вакуума.
Существуют две основные области использования такого ва-
куума.
Для первой области применений характерно требование кон-
центрации газа в объеме ниже определенного уровня, поскольку
здесь преследуется цель обеспечить движение частиц и молекул,
свободное от соударений с молекулами или атомами газов либо
другими частицами. В этом случае вакуум должен быть таким,
чтобы длина свободного пробега молекул была больше харак-
терного размера сосуда. Типичными примерами такого приме-
нения являются приборы с электронным потоком (электронные
лампы, электронные микроскопы, кинескопы, рентгеновские лам-
пы и т. п.) или с потоками других частиц (ускорители, плазмен-
ные и термоядерные установки), а также устройства с роторами,
имеющими большую скорость вращения (гироскопы), и т. п.
Особенностью второй области применений является получе-
ние очень чистых поверхностей, свободных от адсорбированных
газов. Обезгаженная поверхность остается чистой тем дольше,
чем выше вакуум в системе.
Многие физико-химические исследования поверхностей, тех-
нология тонких пленок, различные процессы при производстве
электронных приборов, особенно полупроводниковых, могут быть
выполнены только в условиях высокого вакуума.
1.2. ГАЗ И НЕКОТОРЫЕ СВОЙСТВА ЕГО МОЛЕКУЛ (АТОМОВ)
Будем рассматривать газ как совокупность частиц (молекул
или атомов), имеющих форму твердых упругих шариков диамет-
ром d0 и массой Шо1), движущихся в свободном пространстве по
прямым траекториям, почти не взаимодействующих между со-
бой (статически) и способных упруго соударяться между собой
и со стенками (газ идеальный2)). Пар в состоянии, далеком от
насыщения, можно рассматривать как газ. Газ в состоянии,
близком к критическому, подобен пару (пар в присутствии жид-
кой фазы является насыщенным и перестает подчиняться зако-
нам идеального газа). Инертные газы, например аргон Аг, неон
Ne, гелий Не и т. д., являются одноатомными газами. Дру-
гие газы и пары обычно являются молекулярными газами.
') Масса атома (молекулы) газа имеет порядок 10*24— 10-23 г.
2) Объем частицы идеального газа равен нулю, масса сосредоточена
в точке, частицы химически нейтральны, абсолютно упруги, и силы взаимодей-
ствия между ними отсутствуют. При давлениях выше атмосферного и темпе-
ратурах выше критической реальные газы можно рассматривать как идеаль-
ный газ.
12
ГЛАВА 1
Например, азот N2, водород Н2, окись углерода СО — двухатом-
ные газы, двуокись углерода СО2, озон О3 — трехатомные,
а аммиак NH3 — четырехатомный газ.
1.2.1. Форма и размер атомов
Считается, что атомы имеют форму шариков. Форма молекул
в зависимости от их сложности более или менее отлична от ша-
рообразной. Например, молекула водорода Н2 является вытяну-
тым эллипсоидом, малая ось которого равна 0,215 нм, а большая
0,314 нм. Молекула кислорода О2 имеет соответственно размеры
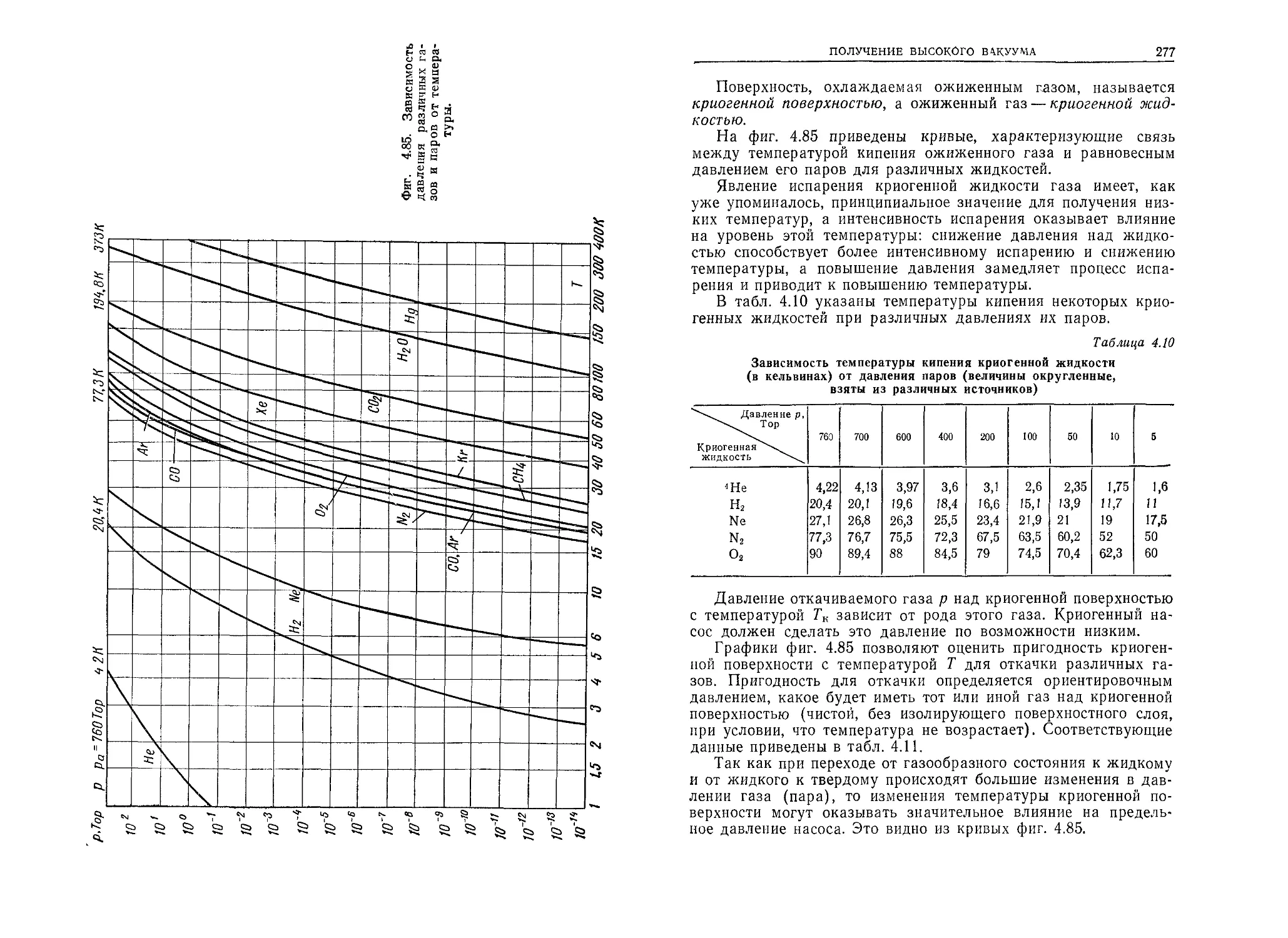
0,29 и 0,39 нм. Молекулы сложных веществ, например углеводо-
родов, могут иметь значительно большие размеры. Численные
данные различных исследователей о величине диаметров атомов
и молекул довольно различны. Это является следствием разных
методов их определения (например, на основе измерения вязко-
сти газа, постоянных в уравнении Ван-дер-Ваальса и т. п.) и
различных условий, при которых они получены.
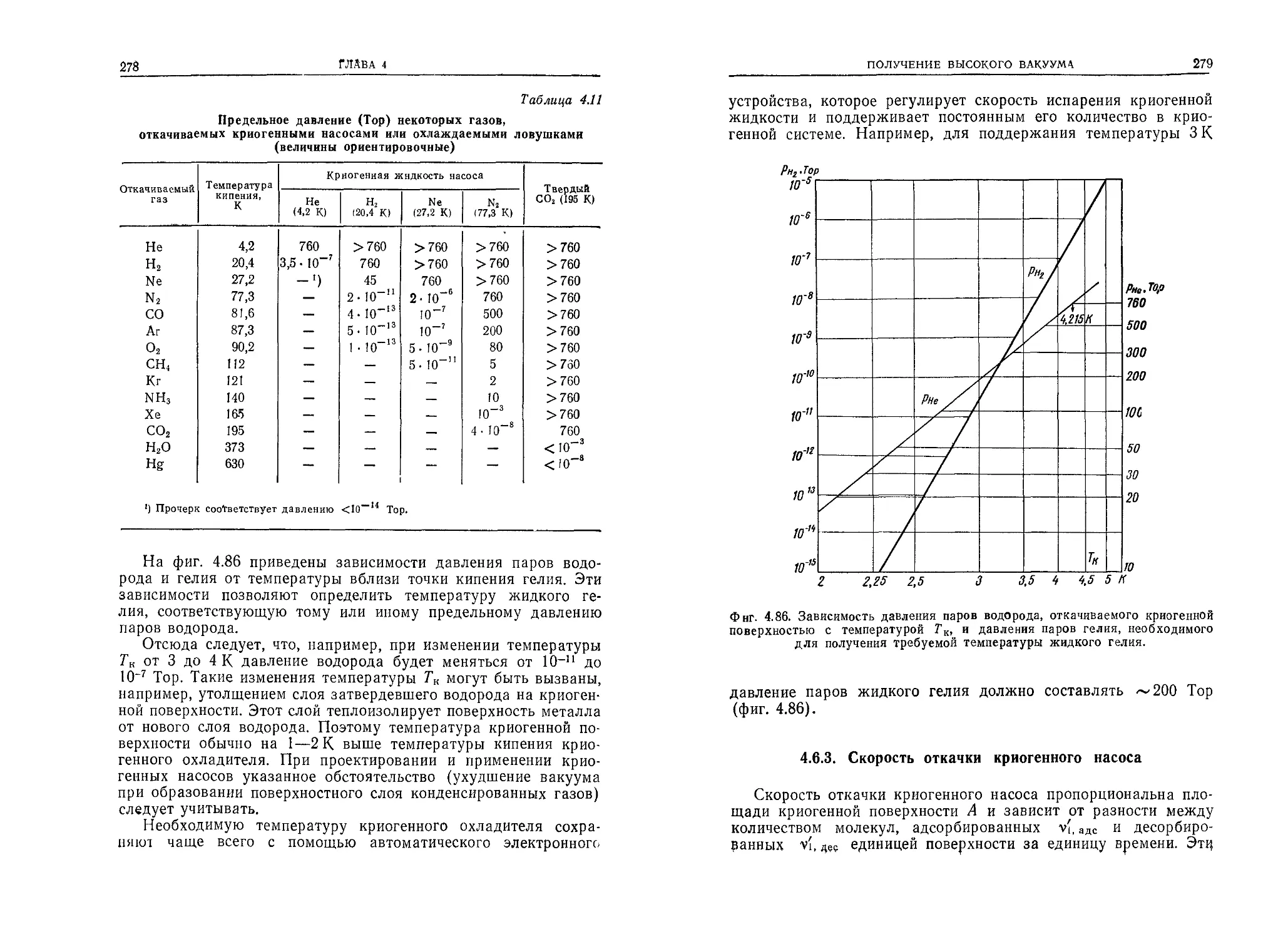
Таблица 1.1
Массы, молекулярные массы и диаметры молекул (атомов)
наиболее важных газов (паров)
Газ (пар) Обозна чение Масса молекулы тй, 10-24 г Мочекулярная масса Мо Диаметр da, нм
точное значение округ- ленное значение
Водород Н2 3,35 2,016 2 0,275
Гелий Не 6,65 4,003 4 0,218
Водяной пар Н2О 29,9 18,02 18 0,468')
Неон Ne 33,5 20,18 20 0,26
Окись углерода СО 46,5 28,01 28 0,38
Азот n2 46,5 28,02 28 0,38
Воздух 2) — 48,1 28,98 29 0,374
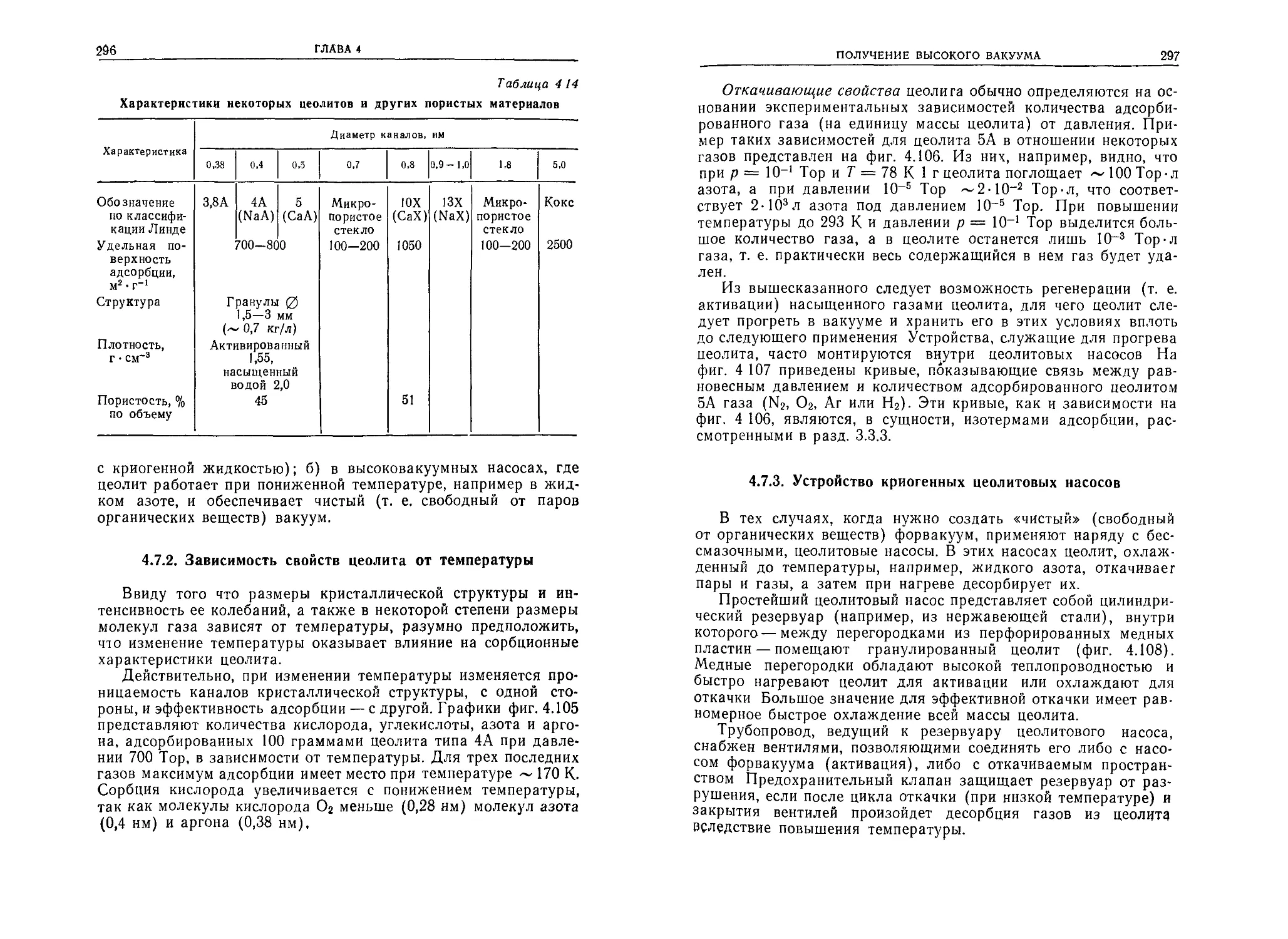
Кислород О2 53,1 32,00 32 0,364
Аргон Аг 66,3 39,94 40 0,367
Двуокись углерода со2 73,1 44,01 44 0,465
Криптон Кг 139 83,7 84 0,415
Ксенон Хе 218 131,3 131 0,491
Ртуть Hg 333 200,6 201 0,626')
|) При 273 К.
2) du, т^, подсчитаны для эквивалентной «молекулы» воздуха с учетом массового
содержания азота н кислорода, например
78 22
^’“"100 '28 + Тоб '32 “29,
ВВЕДЕНИЕ
13
В табл. 1.1 даны ориентировочные, наиболее часто приводи-
мые диаметры d0 молекул газов, представляющих наибольший
интерес для вакуумной техники; табл. 1.2 содержит величины
диаметров нескольких атомов, определенных различными мето-
дами, а табл. 1.3 в качестве примера — зависимость диаметра
молекулы ртути от температуры.
Таблица 1.2
Средние значения rfo (нм), определенные различными методами
(согласно Дэшману)
Моле- кула Метод определения
по вязкости из постоянных уравнеиня Ван-дер- Ваальса ПО плотности в жидком СОСТОЯНИИ по числу соударений молекул газа с электро- нами по числу соударений с поверх- ностью
при 273 К с учетом темпера- туры 7\
Н2 0,275 0,210 0,276 0,4'9 0,22 0,658
Н2О 0,468 0,245 0,289 0,348 0,38 0,953
Hg 0,626 0,250 0,293 . 0,373 — 1,026
Таблица 1.3
Зависимость диаметров (нм) атома ртути и молекулы водяного пара
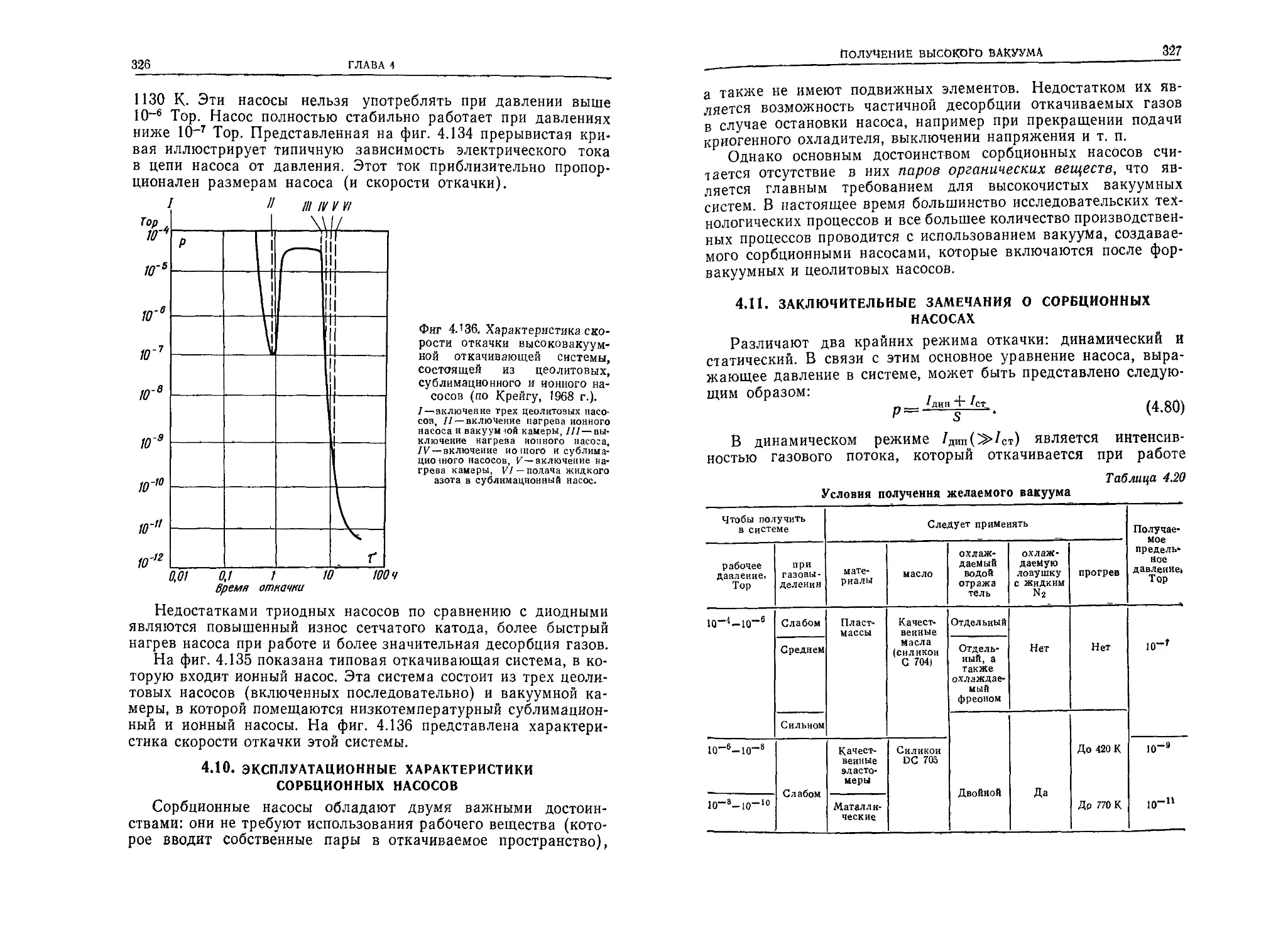
от температуры
Т, К 273 298 373 423 493
Hg 0,626 0,511 0,470 0,450 0,427
Н2О 0,368 0,385 — —
1.2.2. Молекулярная (атомная) масса
За основу для определения молекулярной (атомной) массы
любого вещества принимается в настоящее время ’) масса атома
углерода С.
Молекулярная масса Мо есть безразмерная величина,
представляющая собой отношение массы молекулы т0 данного
*) До недавнего времени за основу для определения молекулярной (атом-
ной) массы принимали кислород О2, для которого молекулярная масса ^о(о2>
составляет 32, а атомная масса Л4|)(О^ равна 16. После того как был принят
за основу изотоп углерода 6С12, имеем Af0lO1 == 15,9994, Мо (о > = 31,998, а
Мо (С) == 12,01115.
14
ГЛАВА I
вещества к V12 массы изотопа углерода 6С12, которая составляет
тад — 19,63 • Ю-24 г.
Массовым молекулярным (атомным) числом называется це-
лое число, наиболее близкое к молекулярной (атомной) массе
данного вещества.
1.2.3. Моль, грамм-моль, грамм-атом
Количество граммов (килограммов) данного однородного ве-
щества, численно равное молекулярной массе Мо, называется
молем (грамм-молем,грамм-молекулой). Один моль может быть
также определен как количество вещества, содержащее столько
молекул (атомов), сколько содержит масса 12 г чистого изотопа
углерода 6С12. Величина Л40 имеет размерность г-моль. Приме-
няется также в качестве единицы измерения киломоль (кг-моль),
равный 1000 молям.
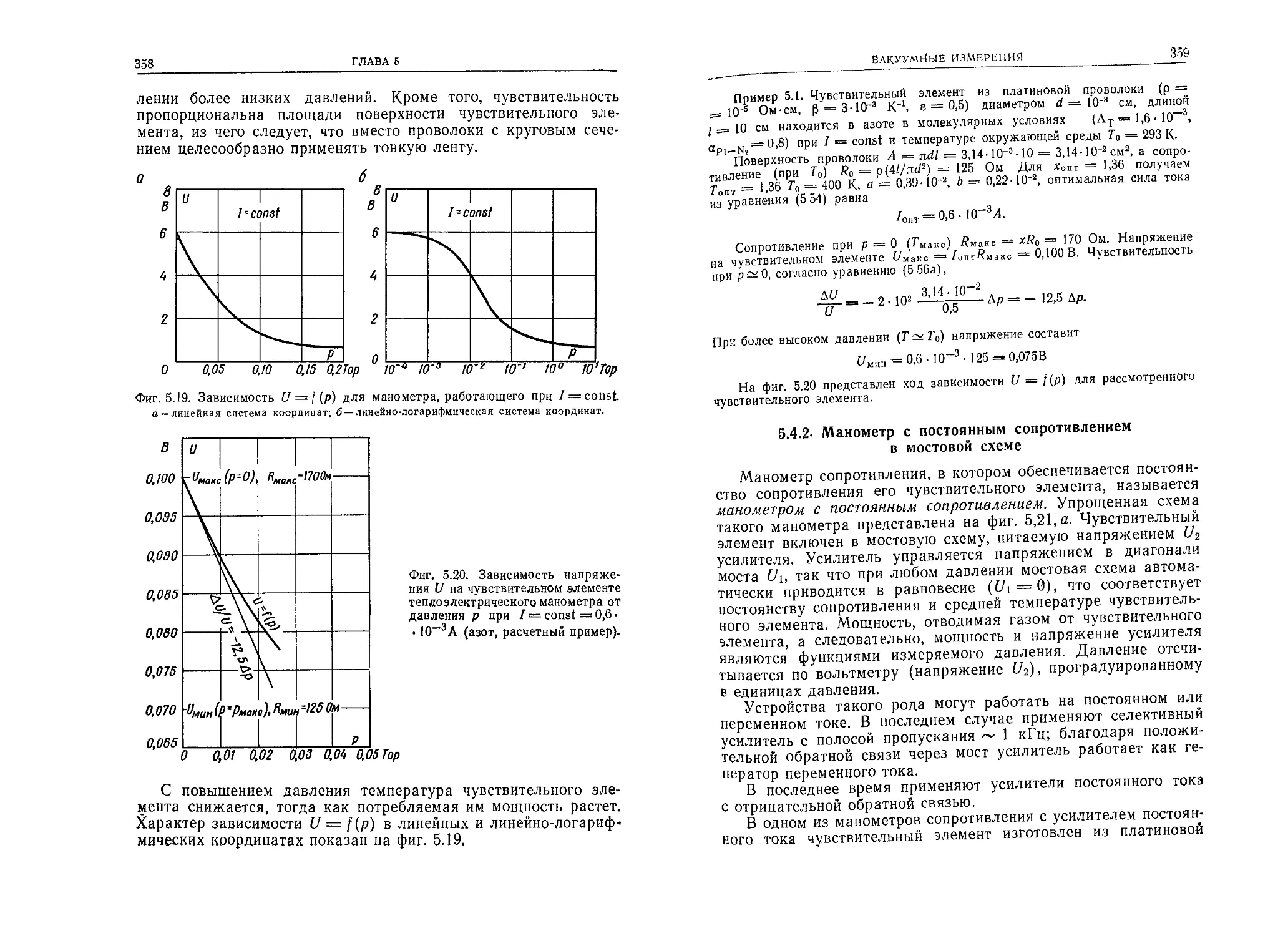
1.2.4. Закон Авогадро
В одинаковых объемах при одинаковых давлениях и темпе-
ратурах количество молекул различных газов одинаково.
1.2.5. Молекулярный объем
Один моль различных газов при одинаковых давлениях и
температурах имеет один и тот же объем.
При давлении 1 атм (760 Тор) и при температуре 0°С
(~273К), т. е. в так называемых нормальных условиях, этот
молярный объем составляет Vm = 22 415 см3-моль-1 —
— 22,4л -моль-1 —22,4 м3-кг-моль-1.
1.2.6. Число Авогадро
Число Авогадро определяет количество молекул в грамм-мо-
лекуле (или атомов в грамм-атоме); оно одинаково для всех
веществ.
Число Авогадро Na равно 6,0228-1023 моль-1
— 6,023-1023 моль-1 ~ 6,023-1026 кг-моль-1. Отсюда следует, что
между массой молекулы (атома) т0 и молекулярной (атомной)
массой Л40 существует зависимость
Mo —NAm0=- 6,023 • 1О23що г-моль-1; (1.1)
таким образом,
т0=1>66- 1О-24Мог. (1.2)
ВВЕДЕНИЕ
15
В табл. 1.1 для некоторых газов (паров) указаны диаметры
и массы молекул (атомов), а также молекулярные (атомные)
массы.
1.2.7. Число Лошмидта
Число Лошмидта получается делением числа Авогадро на
молекулярный объем Vm; следовательно, это число молекул в
единице объема (1 см3) при нормальных условиях равно
Nl = -гД ~ 2,69 1019 см"3. (1.3)
v т
1.3. ВАКУУМ И ДАВЛЕНИЕ
1.3.1. Высокий вакуум — низкое давление
Понятие высокого вакуума тесно связано с понятием низкого
давления. Чем ниже давление газа (паров), тем выше вакуум.
По мере перехода к более высокому вакууму термин «давле-
ние», связанный с механической силой, становится все менее
употребительным. Тем не менее, для того чтобы количественно
определить состояние вакуума, пользуются единицами давления,
т. е. величиной силы, с какой частицы, находящиеся в вакууме,
действуют на единицу поверхности.
1.3.2. Идеальный вакуум — давление, равное нулю
Можно себе представить, что в замкнутом сосуде, абсолютно
герметичном, например в полости внутри металлического блока,
имеющей форму куба с ребром 1 см, удалось создать абсолют-
ный вакуум.
Это означает, что указанный объем совершенно свободен от
всяких газов и паров, т. е. в его объеме и на поверхности стенок
нет молекул (атомов) какого-либо газа или пара, а также сво-
бодных частиц металла (паров металла). В этих условиях вну-
три кубической полости отсутствуют какие-либо частицы веще-
ства, которые, ударяясь о стенки, могли бы оказывать на них
механическое воздействие. Поэтому давление в рассматривае-
мом кубе равно нулю. Достижение такого состояния является
конечной (хотя, вообще говоря, недостижимой) целью вакуумной
техники. В объеме с идеальным вакуумом можно создать газо-
вую среду любого состава и давления, вводя туда определен-
ными дозами различные газы.
Таким образом, идеальный вакуум в работе с газами играет
такую же роль, как идеально чистые стенки сосуда в работе С
чистыми жидкостями.
16
ГЛАВА 1
1.4. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ХАРАКТЕРИСТИКИ ВАКУУМА
1.4.1. Газ при температуре, равной абсолютному нулю
Установим, что температура сосуда равна абсолютному ну-
лю, если по шкале Кельвина она составляет ОК, а по шкале
Цельсия —273,16° С. Внутри этого сосуда имеется п атомов ка-
кого-либо инертного газа, например аргона. Возникает вопрос:
как ведут себя в сосуде атомы аргона, когда стенки сосуда
имеют температуру О К? При соприкосновении со стенками со-
суда эти атомы осаждаются на их поверхности. Если количество
атомов аргона в сосуде не очень велико, то они не смогут по-
крыть всю поверхность стенок даже одноатомным слоем. Атомы
аргона будут удерживаться на стенках сосуда благодаря меж-
молекулярным (вандерваальсовым) силам. Силы такого рода ’)
начинают действовать на атомы (молекулы) при их приближе-
нии к стенке на расстояние того же порядка, что и размеры ато-
мов.
Поскольку принято, что температура стенок сосуда равна аб-
солютному нулю, структура материала (металла), из которого
сделаны стенки, не совершает тепловых колебаний. Атомы ар-
гона, покрывающие стенку, расположены в поле притяжения
ионов кристаллической решетки металла и так же, как и ионы
решетки, находятся в состоянии покоя. В этих условиях объем
сосуда свободен от атомов аргона, хотя внутрь сосуда введено п
его атомов. Это означает, что давление газа в сосуде равно
нулю, но вакуум не является идеальным, так как в сосуде
имеется газ, атомы которого покрывают стенки. Это один из
примеров несоответствия между понятиями давления и вакуума
в сосуде. Такое несоответствие особенно наглядно проявляется
В области очень высокого вакуума.
1.4.2. Газ при температуре выше абсолютного нуля
С повышением температуры колебания кристаллической ре-
шетки металлических стенок сосуда усиливаются. При таких ко-
лебаниях атомы аргона, находящиеся на стенках сосуда и свя-
занные силами притяжения с атомами металла, подвергаются
’) Если расстояние между частицами значительно больше их размеров
(r5>do)> то притяжения между ними практически нет. При r~d0 силы
притяжения играют важную роль, а при г < d0 возникают силы отталкива-
ния, которые существенны при г С do. Гравитационные силы притяжения об-
ратно пропорциональны г2; в отличие от них силы взаимодействия между
частицами, имеющие электрическую природу, обратно пропорциональны г“,
при этом для сил притяжения 5 и 6, а для сил отталкивания 9 и < 15
(см. гл. 3).
введение
17
сотрясениям, так что связи, удерживающие их на поверхности
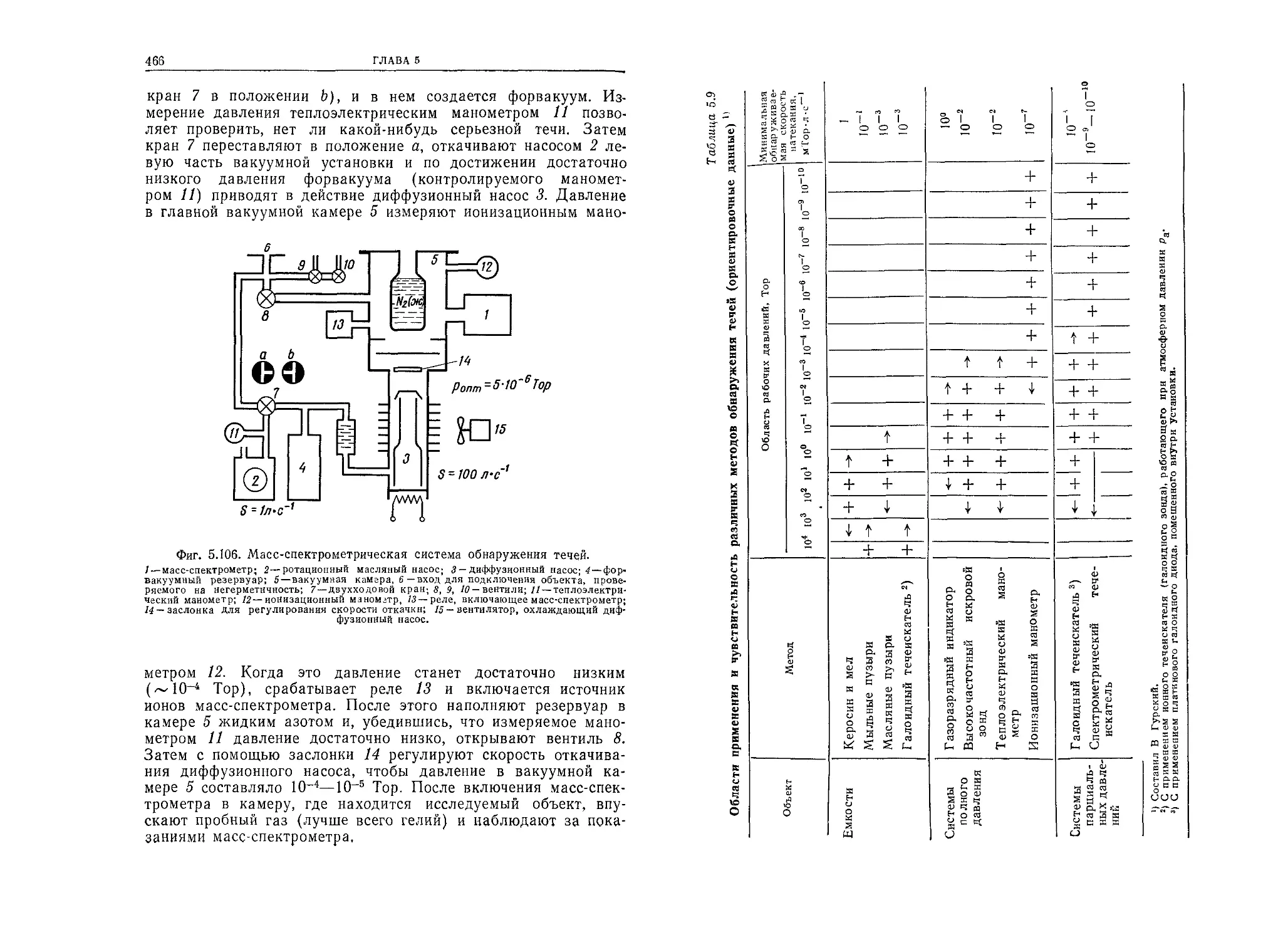
металла, могут быть разорваны. При этом некоторые атомы ар-
гона окажутся выброшенными с поверхности и будут переме-
щаться внутри сосуда. Попутно они могут соударяться с дру-
гими атомами аргона или со стенками сосуда. При соударении
со стенкой они могут быть опять захвачены, т. е. задержаны си-
лами межмолекулярного притяжения, а затем вновь выброшены
в объем сосуда.
1.5. ГАЗЫ В ОБЪЕМЕ, НА ПОВЕРХНОСТИ
И ВНУТРИ ТВЕРДЫХ ТЕЛ
Таким образом, в вакуумной системе газы могут находиться
в объеме и на поверхностях. Адсорбированные на поверхности
газы могут проникать внутрь тел, там пребывать и перемещать-
ся, вновь выходить через поверхность в объем и, таким образом,
проникать сквозь твердые тела. Газы, находящиеся на поверх-
ности и внутри тел, называются связанными газами. Газы в объ-
еме будем называть свободными.
Молекулы (атомы) газа, находящиеся в объеме, при прибли-
жении друг к другу начинают отталкиваться, но в случае вза-
имодействия с поверхностью силы притяжения между атомами
поверхности и частицами газа значительно превышают силы от-
талкивания, вследствие чего связь между поверхностью и нахо-
дящимся в контакте с ней слоем газа (моноатомным или моно-
молекулярным) сильнее, чем между этим и последующими слоя-
ми газа.
1.5.1. Свободный газ, его концентрация и плотность
Находящийся в объеме сосуда свободный газ определяет
давление в сосуде, которое является одним из важнейших пара-
метров газового состояния.
Количество молекул (атомов) в единице объема, например в
1 см3, называется концентрацией свободного газа и обозначает-
ся и. В случае N молекул в объеме V имеем
n = NjV (1.4)
(единицы измерения: см~3, м~3). Плотность свободного газа рг
определяется его массой в единице объема
Рг у (Гб)
(единицы: г-см-3, кг-м-3). В объеме V =1 см3 при концентра-
ции п находится п молекул газа. Масса пц этих частиц равна
18
ГЛАВА 1
плотности газа рг
/7?! = пт0= рг.
(1.6)
1.5.2. Адсорбированный газ и его концентрация
Для адсорбированного газа по аналогии с подходом, исполь-
зованным при рассмотрении свободного газа; можно ввести по-
нятие поверхностной концентрации:
= (1.7)
(единицы; см-2, м-2). Здесь N— количество частиц газа, А—
поверхность.
1.5.3. Абсорбированный газ, его концентрация и плотность
Концентрацию и плотность газа, находящегося в твердых те-
лах или жидкости, можно рассматривать по аналогии с концен-
трацией и плотностью свободного газа.
Эти величины можно определить подобно тому, как это сде-
лано в разд. 1.5.1.
2. Свободные
газы
При изучении газов обычно сначала рассматриваются сво-
бодные газы, так как в первую очередь к ним имеют отношение
процессы, типичные для техники высокого вакуума: откачива-
ние, течение в каналах, измерение давления. Физика газов и ва-
куумная техника до недавнего времени учитывали только эти
газы.
Свободные газы можно рассматривать при постоянных тем-
пературе и давлении (т. е. в статическом состоянии) или при
различных температурах и давлениях (т. е. в динамическом со-
стоянии) .
А. СВОБОДНЫЕ ГАЗЫ В СТАТИЧЕСКОМ СОСТОЯНИИ
Фундаментальные газовые законы относятся к статическому
состоянию, т. е. к таким случаям, когда во всем рассматривае-
мом объеме давление и температура газа постоянны. Главной
и по существу единственной характеристикой молекул газа) ко-
торая может подвергаться изменению, является их скорость; с
ней и связаны происходящие в газах физические явления.
Таким образом, всякие энергетические воздействия на газы
можно осуществлять, изменяя энергию движения их молекул й
главным образом их скорость1).
2.1. ЭНЕРГИЯ ГАЗА И ЕГО ТЕМПЕРАТУРА
Энергия газа, определяемая скоростью его частиц2), описы-
вается одним из основных законов кинетической теории газов.
*) В общем случае, кроме энергии поступательного движения, молекула
может иметь энергию вращательного движения и энергию колебаний (вну-
треннюю и внешнюю). Кроме того, может проявляться энергия электронных
Уровней.
2) В дальнейшем определение «частица» будет применяться как для
молекул, так и для атомов (одноатомных молекул), когда различия между
ними с точки зрения физики газов несущественны.
20
ГЛАВА 2
Этот закон выражает связь между кинетической энергией мо-
лекул в их хаотическом (тепловом) движении и средней темпе-
ратурой газа
JF = y/n0v2 = c7’, (2.1)
где W — кинетическая энергия молекулы газа, v — скорость мо-
лекулы, с — коэффициент пропорциональности, зависящий от
способа определения скорости частиц газа и выбора единиц из-
мерения.
Если частица газа имеет шарообразную форму, то ее кинети-
ческая энергия может быть исключительно энергией движения.
Эта энергия не зависит от рода газа, а только от его темпера-
туры. Из уравнения (2.1) находим скорость частицы
(2-2)
Отсюда следует, что чем легче газ, тем больше скорость части-
цы. Например, частицы водорода Н2 при одинаковой темпера-
туре имеют в 4 раза большую скорость, чем частицы кислоро-
да О2; скорость атомов ртути Hg при той же температуре при-
близительно в 10 раз меньше скорости частиц водорода.
Заменяя, согласно уравнению (1.1), массу молекулы молеку-
лярной массой Л10, можно записать формулу (2.2) в виде
(?.з)
2.1.1. Скорость частиц газа
Скорости отдельных частиц газа в закрытом сосуде зависят
от условий, в которых происходит обмен энергией между газом
и стенками сосуда или другими поверхностями, с которыми
сталкиваются частицы газа. Если при этом частицы получают
энергию, то их скорость возрастает, если отдают — уменьшается.
Если стенки сосуда подвергаются тепловому воздействию, то
структура материала стенок приходит в колебательное движе-
ние. В этом случае обмен энергией между стенками и частицами
газа подчиняется законам статистики, в связи с чем скорости
частиц становятся очень различными как по величине, так и по
направлению. Величины скоростей частиц при этом находятся
в очень широких пределах: от очень малых до очень больших,
теоретически от 0 до оо, а распределение направлений скоростей
(в отсутствие каких-либо внешних причин) имеет случайный ха-
рактер.
1 аким образом, в массе газа существуют частицы, движу-
щиеся очень медленно, среди которых чрезвычайно мало частиц
СВОБОДНЫЕ ГАЗЫ
21
со скоростями, близкими к нулю; есть частицы с очень боль-
шими скоростями, среди которых очень мало частиц, обладаю-
щих исключительно большими скоростями. Подавляющее боль-
шинство частиц имеет скорости, близкие к некоторой скорости,
называемой наиболее вероятной (иВер).
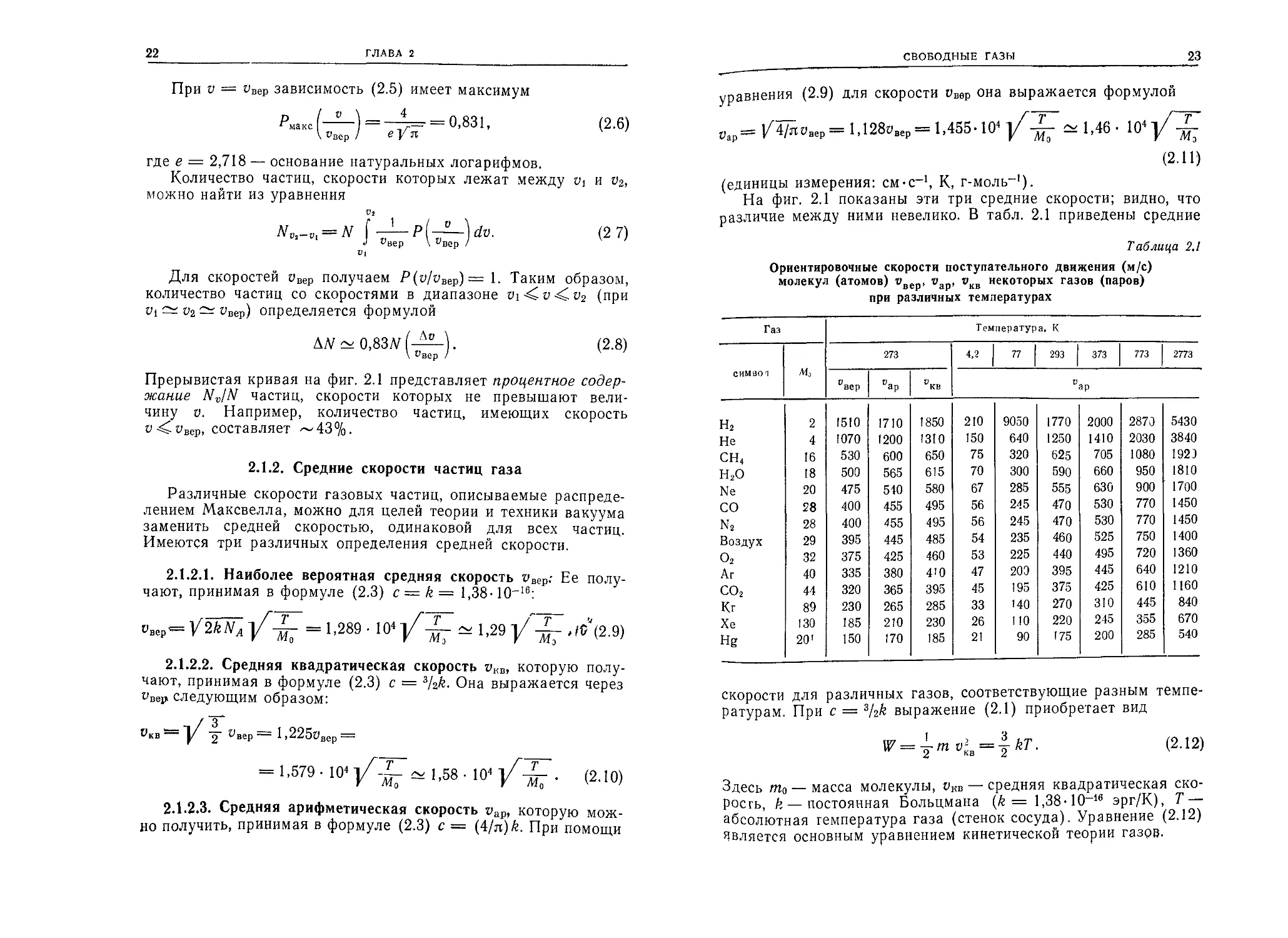
Фиг. 2.1. Плотность распределения вероятности скорости Р (о/овер) = f (ч/явер)
и
и нормированная функция распределения Nv/N= J Р (о/овер) (dv/vBep), харак-
о
теризующая процентное распределение частиц со скоростями, не превы-
шающими V.
Скорости отдельных групп частиц определяются законом
распределения Максвелла — Больцмана. Этот закон выражается
формулой
4/о \2 /о\21,/о\ /п
dN = N~(------- exp — ----- dl------ , (2.4)
У Л \ Овер / \ Овер / \ °вер /
в которой dN — количество частиц (из общего числа N), скоро-
сти которых находятся в диапазоне между v и v -}- du. Деля обе
части уравнения (2.4) на A/(dv/vBep), получим функцию
_ / v \ dN/N 4 / о \2 Г / о \21 /о к\
р —— ] = —= —^=-( exp — . (2.5)
\ Овер / do/oBep У Л \ Овер / L \ °вер / J
График этой функции представляет собой кривую распреде-
ления скоростей (сплошная кривая на фиг. 2.1).
22
ГЛАВА 2
При v = Ивер зависимость (2.5) имеет максимум
Рнакс(—) = -4= = °>831. (2-6)
\ ^вер /
где е = 2,718 — основание натуральных логарифмов.
Количество частиц, скорости которых лежат между щ и vz,
можно найти из уравнения
V1
NV1-vt = N [ (2 7)
J <^вер \ увер /
Для скоростей у вер получаем Р(и/ивер) = 1. Таким образом,
количество частиц со скоростями в диапазоне Vi v v2 (при
гц~ц2—^вер) определяется формулой
ДАТ ~ О,83И-^-). (2.8)
\ ^вер /
Прерывистая кривая на фиг. 2.1 представляет процентное содер-
жание NJN частиц, скорости которых не превышают вели-
чину V. Например, количество частиц, имеющих скорость
а-^^вер, составляет ~43%.
2.1.2. Средние скорости частиц газа
Различные скорости газовых частиц, описываемые распреде-
лением Максвелла, можно для целей теории и техники вакуума
заменить средней скоростью, одинаковой для всех частиц.
Имеются три различных определения средней скорости.
2.1.2.1. Наиболее вероятная средняя скорость vBep.- Ее полу-
чают, принимая в формуле (2.3) с = k = 1,38-10-16:
Таи;/4; = 1.289
2.1.2.2. Средняя квадратическая скорость vKB, которую полу-
чают, принимая в формуле (2.3) с = 3/г^- Она выражается через
«вер следующим образом:
Окв :=== ~2 ^вер == 1,225цвер =
= 1.579. 10-/Л- 1,58. (2.10)
2.1.2.3. Средняя арифметическая скорость иар, которую мож-
но получить, принимая в формуле (2.3) с = (4/л)й. При помощи
СВОБОДНЫЕ ГАЗЫ
23
уравнения (2.9) для скорости цВер она выражается формулой
Уар=/4Мавер= 1,128г»вер= 1,455-Ю4 ~ 1,46 • 104]/
(2.Н)
(единицы измерения: см-с-1, К, г-моль-1).
На фиг. 2.1 показаны эти три средние скорости; видно, что
различие между ними невелико. В табл. 2.1 приведены средние
Таблица 2.1
Ориентировочные скорости поступательного движения (м/с)
молекул (атомов) »вер, ®ар, щкв некоторых газов (паров)
при различных температурах
Газ Температур а, к
273 4,2 77 293 373 773 2773
симво т °вер вар °кв V ар
Н2 2 1510 1710 1850 210 9050 1770 2000 2870 5430
Не 4 1070 1200 1310 150 640 1250 1410 2030 3840
СН4 16 530 600 650 75 320 625 705 1080 1920
Н2О 18 500 565 615 70 300 590 660 950 1810
Ne 20 475 540 580 67 285 555 630 900 1700
СО 28 400 455 495 56 245 470 530 770 1450
n2 28 400 455 495 56 245 470 530 770 1450
Воздух 29 395 445 485 54 235 460 525 750 1400
о2 32 375 425 460 53 225 440 495 720 1360
Аг 40 335 380 4Ю 47 200 395 445 640 1210
СО2 44 320 365 395 45 195 375 425 610 1160
Кг 89 230 265 285 33 140 270 310 445 840
Хе 130 185 210 230 26 110 220 245 355 670
Hg 20' 150 170 185 21 90 175 200 285 540
скорости для различных газов, соответствующие разным темпе-
ратурам. При с = 3/2k выражение (2.1) приобретает вид
W = ±mv^ = lkT. (2.12)
Здесь то — масса молекулы, скв — средняя квадратическая ско-
рость, k—постоянная Больцмана (k = 1,38-10~16 эрг/К), Т—
абсолютная температура газа (стенок сосуда). Уравнение (2.12)
является основным уравнением кинетической теории газов.
24
ГЛАВА 2
2.2. ДАВЛЕНИЕ ГАЗА
Частицы газа с массой то и скоростью v, ударяясь о поверх-
ность твердого тела, создают давление на эту поверхность. Для
определения давления следует рассмотреть изменения, происхо-
дящие в движении частиц при ударе о поверхность, а также
найти количество таких ударов.
2.2.1. Количество ударов частиц газа о поверхность
Движение частиц происходит хаотически; это значит, что нет
преимущественных направлений движения. Поэтому все одина-
ковые по площади участки стенок сосуда, в котором находится
газ, испытывают статистически одинаковое число ударов за оп-
ределенный промежуток времени.
Фиг. 2.2. Единичный кубический объем с газом.
/, 2—две противоположные плоскости куба.
, Зная скорость частиц и их концентрацию п. можно вычислить
количество частиц, соударяющихся в течение единицы времени
с единицей поверхности, или так называемую частоту столкно-
вений Vp она тем больше, чем больше концентрация п и ско-
рость и, т. е.
v'i = cnv. (2.13)
I
Если п выражено в см-3, v = уар в см-с-1, a v[ в с-1-см-2, то для
случая молекулярного движения коэффициент пропорциональ-
ности с равен т. е.
vf = Y«4ap. (2.14)
Действительно (фиг. 2.2), среди п частиц газа, содержащихся
в объеме 1 см3, ‘/гп частиц имеет составляющую скорости в по-
ложительном направлении х (к стенке 2).
При средней арифметической скорости уар время, необходи-
мое молекуле на пробег пути / = 2 см между стенками 1 и 2
СВОБОДНЫЕ ГАЗЫ
25
туда и обратно, составляет
t = = —(с). (2.15)
flap fap ' v
Каждая частица ударяется о поверхность 1 (или 2) с частотой
|=(2-16)
поэтому количество ударов 1/2п частиц за единицу времени в со-
ответствии с формулой (2.14) составит
V1 = (у « 4 г“р) = Т пИаР (см~2 ' с~‘)-
2.2.2. Силы и давления, действующие со стороны газа
на поверхность
При ударе частицы о стенку величина нормальной состав-
ляющей скорости частицы, определяемая температурой стенки Т,
не меняется, так как соударение происходит упруго. Изменяется
только направление скорости (на обратное).
Силу воздействия частиц на стенку определим как разность
нормальных (к поверхности) составляющих импульсов частиц
после и до удара, помноженную на количество ударов в секунду
и отнесенную к единице поверхности. Очевидно, это и есть иско-
мое давление
Р = - (— "V'J] (2.17)
Подставляя сюда значение v[ из уравнения (2.14), получим
р = (2mdux) ппар) = у nmov ±иар. (2.18)
Так как нормальная составляющая скорости должна быть
пропорциональной средней скорости, можно записать
р со nmQv2. (2.19)
Коэффициент пропорциональности в этом случае зависит от вы-
бора единиц и от связи между &ар и v±. Если в качестве v при-
нять среднюю квадратическую скорость, то коэффициент пропор-
циональности будет равен ’/3. Тогда формула для давления при-
мет следующий вид:
р у = 4 rnfiL = у РЛкв- (2-20)
Формулу (2.20) можно вывести строго на основе следующего
Рассмотрения1).
*) См., например, К. А. Путилов, Курс физики, т. I, стр, 480.
26
ГЛАВА 2
Положим, что в сферическом сосуде радиусом г (фиг. 2.3),
т. е. в замкнутом объеме V = 4/3лг3, имеется М частиц. Тогда
концентрация газа составит
= (2.21)
Между двумя последовательными соударениями со стенкой
Фиг. 2.3. Давление, создаваемое молекулами газа на внутренние поверхности
стенок сферы
частица проходит путь I = 2r cos 0; на это (при скорости и) по-
требуется время
/ 2r cos О
т — — =--------.
v v
Количество соударений в секунду определяется выражением
/ 1 v
Л) SSS — ————
т 2r cos О'
При ударе частицы о стенку происходит изменение нормальной
составляющей импульса
mov cos О — (— mQv cos О) = 2/n0w cos О.
Так как количество ударов в секунду составляет v', то сила воз-
действия одной частицы на стенку равна
ft = 2mov (cos О) v' = .
Так как частицы имеют различные скорости vit ц2, Оз ... и т. д.,
общую силу воздействия частиц на стенки можно выразить сле-
дующим образом:
t=N N
где
N
= (2.22)
j
СВОБОДНЫЕ ГАЗЫ
27
Деля полную силу F на площадь поверхности сферического со-
суда А = 4лг* 1 2, находим давление
_ F _
Р==~А = 4лг2 ‘
Отсюда с учетом выражения (2.21) получим формулу (2.20).
2.2.3. Закон Дальтона
Смесь газов, состоящая из компонент с массами молекул moj
и концентрациями tij при парциальных давлениях pj, создает
полное давление, равное сумме парциальных давлений
k
Р=^Р/. (2.23)
/=i
2.2.4. Единицы давления
В международной системе мер (СИ) единицей давления яв-
ляется ньютон на квадратный метр: 1 Н/м21). Допускаются к
употреблению внесистемные единицы, кратные 1 Н/м2:
1 бар=105 Н/м2 = 1000 мбар, 1 мбар=102 Н/м2= 1000 мкбар.
Единица давления 1 дин/см2, применявшаяся в системе СГС,
равна 1 мкбар:
1 мкбар =10-1 Н/м2 = 1 дин/см2.
Давление газа иногда выражается в атмосферах, причем разли-
чают атмосферу физическую (нормальную) и техническую. По
новым нормативам атмосфера физическая (атм)2)
1 атм= 101 325 Н/м2,
а техническая атмосфера (ат)
1 ат =98066,5 Н/м2.
В вакуумной технике применяется единица давления
1 Тор3 *)=-^ атм= 133,322 Н/м2= 1333 дин/см2 =
= 0,99999986 мм рт. ст. ~ 1 мм рт. ст.
’) Эту единицу принято называть сейчас паскаль и обозначать Па;
1 Па = 1 Н/м2.
2) По старому определению (1927 г.) это давление столба ртути плот-
ностью 13,59 г/см3 и высотой 760 мм при ускорении силы тяжести
«Г = 980,67 см/с2. 1 атм (1927 г.) = 76-13,59-980,67 = 1 013250,14 дин/см2;
1 Тор = 1 мм рт. ст. = 1/760 атм — 1333,22 дин/см2 = 133,32 Н/м2.
’) Единица Тор названа в честь Торричелли. В иностранной литературе
применяются обозначения 1 Tr, 1 Torr, 1 torr, иногда IT.
%
ГЛАВА 2
Кратными величине 1 Тор являются
1 мТор=10-’3 Тор1), 1 мкТор = 10-6 Тор,
1 нТор=1(Г9 Тор, 1 пТор=10-12 Тор
Единицы давления и соотношения между ними приведены в
табл. 2.2 и 2.3 соответственно.
Таблица 2,2
Единицы давления
Единицы международной системы (СИ) Допускаемые к употреблению единицы других систем
название обозначение название обозначение
Паскаль (ньютон на квад- ратный метр) Па (Н-м-2) Бар Атмосфера техническая Атмосфера физическая Тор (миллиметр ртутного столба) Миллиметр водяного столба Дина на квадратный сантиметр Килограмм-сила на квадратный мил- лиметр Килограмм-сила на квадратный сан- тиметр Килограмм-сила на квадратный метр бар ат атм Тор (мм Hg) мм Н2О дин • см-2 кГ•мм-2 кГ•см-2 кГ•м-2
Таблица 2,3
Соотношения между единицами давления
Единица давления Па мкбар атм ат Тор Вт-ссм-* кал см—3
1 Па(1 Н-м-2) 1 10 0,987-10-5 1,02-I0~s 7,5-10“3 1-Ю-6 0,238 Ю-6
1 мкбар 0,1 1 0,987-Ю-6 1,02 10-6 0,75-10-3 1-Ю-7 0,238 10-7
(1 дир см-2) 1 ant 1.0133-105 1,0133-Ю6 1 1,033 760 0,1014 0,0241
I ат 0,9-ЗЫО5 0,981-Ю6 0,968 1 735,6 0,0981 0,234
1 Т°Р 133,322 1333,2 1,316-Ю-3 1,36-Ю-3 1 1,33-10-4 3 19-Ю-5
1 Вт’С’СМ-3 1-10® 1 107 9,86 10,2 74 900 1 0,238
1 кал-см-3 0.419-107 4,19 107 41,3 42,7 31.4-103 4,19 1
) В США 1 мТор называют микроном (1ц).
СВОБОДНЫЕ ГАЗЫ
29
2.3. АТМОСФЕРНЫЙ ВОЗДУХ
2.3.1. Давление атмосферного воздуха
Давление воздуха на уровне моря, определяемое высотой
столба ртути в барометре, составляет в среднем 760 мм рт. ст.,
или 760 Тор Это так называемое атмосферное давление.
2.3.2. Эквивалентность гравитационных
и термомолекулярных сил
Атмосферное давление также можно рассматривать как гид-
ростатическое давление, создаваемое массой воздуха, окружаю-
щего Землю и притягиваемого к ней гравитационными силами,
или как давление, вызванное ударами хаотически движущихся
частиц (термомолекулярные силы).
Фиг. 2.4. Устройство, демонстрирующее
эквивалентность гравитационных и термо-
молекулярных сил, создающих давление
газа
Высота столба ртути а1 br не зависит от того,
закрыт край 3 или открыт.
I — барометрическая трубка; 2—резервуар, 3—кран.
Устройство, подобное ртутному барометру (фиг. 2.4), состоя-
щее из запаянной сверху барометрической трубки 1, резервуа-
ра 2 и крана 3, позволяет установить эквивалентность этих сил.
При открытом кране 3 ртуть занимает в обоих коленах U-образ-
ной трубки такое положение, при котором столб ртути а'Ь'
Уравновешивает столб воздуха высотой от уровня а'а" до преде-
лов атмосферы.
Здесь следует отметить, что над ртутью, в запаянном колене
трубки, давление воздуха равно нулю, так как там образуется
так называемая торричеллева пустота, т. е. пространство, где
имеются только насыщенные пары ртути, давление которых за-
висит исключительно от температуры окружающей среды. Такое
Же давление паров ртути, уравновешивающее давление в правом
колене, существует над ртутью в левом колене После закрытия
30
ГЛАВА 2
крана 3 (т. е. когда давление столба воздуха начинает воздей-
ствовать на кран, а не на ртуть) равновесие ртути не нару-
шится, так как частицы газа, оставшиеся в левом колене, бла-
годаря тепловому движению ударяются о поверхность ртути и
создают давление, которое уравновешивается столбом ртути
а'Ь' в сосуде 1 (т. е силой тяжести).
Таким образом, и гидростатический, и термомолекулярный
подходы к определению давления приводят к одинаковым ре-
зультатам.
h. км
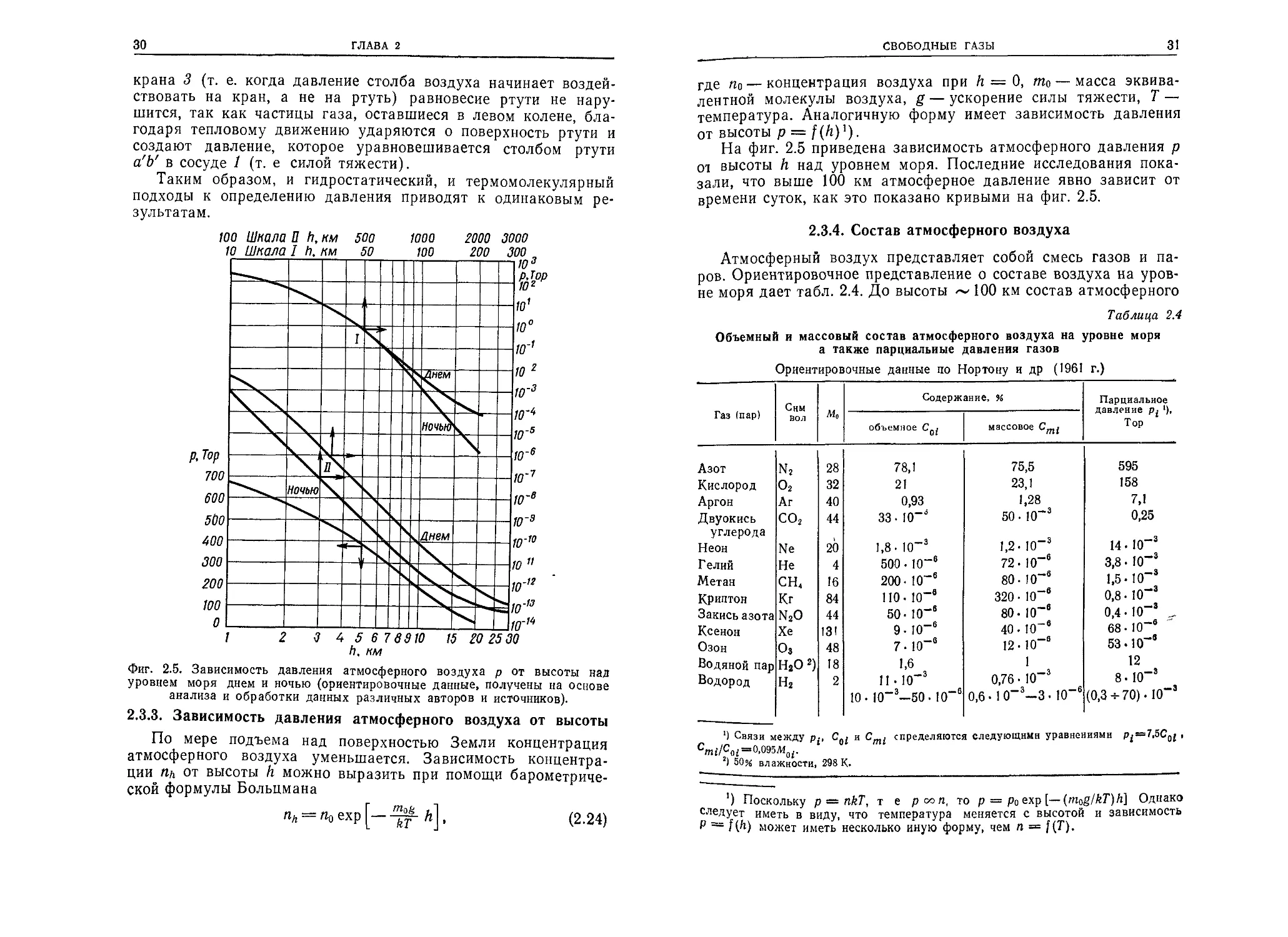
Фиг. 2.5. Зависимость давления атмосферного воздуха р от высоты над
уровнем моря днем и ночью (ориентировочные данные, получены на основе
анализа и обработки данных различных авторов и источников).
2.3.3. Зависимость давления атмосферного воздуха от высоты
По мере подъема над поверхностью Земли концентрация
атмосферного воздуха уменьшается. Зависимость концентра-
ции Пд от высоты h можно выразить при помощи барометриче-
ской формулы Больцмана
nh = По ехр [— /г], (2.24)
СВОБОДНЫЕ ГАЗЫ
31
где по — концентрация воздуха при h — 0, то — масса эквива-
лентной молекулы воздуха, g — ускорение силы тяжести, Т —
температура. Аналогичную форму имеет зависимость давления
от высоты р = f(hy).
На фиг. 2.5 приведена зависимость атмосферного давления р
от высоты h над уровнем моря. Последние исследования пока-
зали, что выше 100 км атмосферное давление явно зависит от
времени суток, как это показано кривыми на фиг. 2.5.
2.3.4. Состав атмосферного воздуха
Атмосферный воздух представляет собой смесь газов и па-
ров. Ориентировочное представление о составе воздуха на уров-
не моря дает табл. 2.4. До высоты ~ 100 км состав атмосферного
Таблица 2.4
Объемный и массовый состав атмосферного воздуха на уровне моря
а также парциальные давления газов
Ориентировочные данные по Нортону и др (1961 г.)
Газ (пар) Сим вол М„ Содержание, % Парциальное давление *)» Тор
объемное массовое Ст^
Азот N, 28 78,1 75,5 595
Кислород о2 32 21 23,1 158
Аргон Аг 40 0,93 1,28 7,1
Двуокись углерода СО2 44 33- 10““ 50 • 10“3 0,25
Неон Ne 20 1,8- 10“3 1,2- 10“3 14- 10“3
Гелий Не 4 500 • 10-8 72- 10“8 3,8 • 10“3
Метан СН4 16 200- 10“8 80- 10“8 1,5-10-3
Криптон Кг 84 НО. 10“8 320 • 10“’ 0,8 -10“3
Закись азота N2O 44 50- 10“’ 80- 10“’ 0,4-10“3 .
Ксенон Ixe 131 9 - 10—6 40 - 10“8 68-10“’
Озон Оз 48 7 • 10“8 12 - 10“8 53-10“’
Водяной пар Н2О 2) 18 1.6 1 12
Водород н2 2 п-ю-3 10- 10“3—50. 10“8 со 1 о 1 со 2 1 СО g о о ~ CD О 8 • 10“3 (0,3 + 70). 10“3
’) Связи между рр С„1 и Cmi определяются следующими уравнениями р^—Т.ЪС^ ,
Cmi/coi=OM5Moi.
2) 50% влажности, 298 К.
') Поскольку р — nkT, т е peon, то р = ро exp [— (mog/kT)h\ Однако
следует иметь в виду, что температура меняется с высотой и зависимость
Р -= f(h) может иметь несколько иную форму, чем п = }(Т).
Таблица 2.5
Области вакуума (давления)
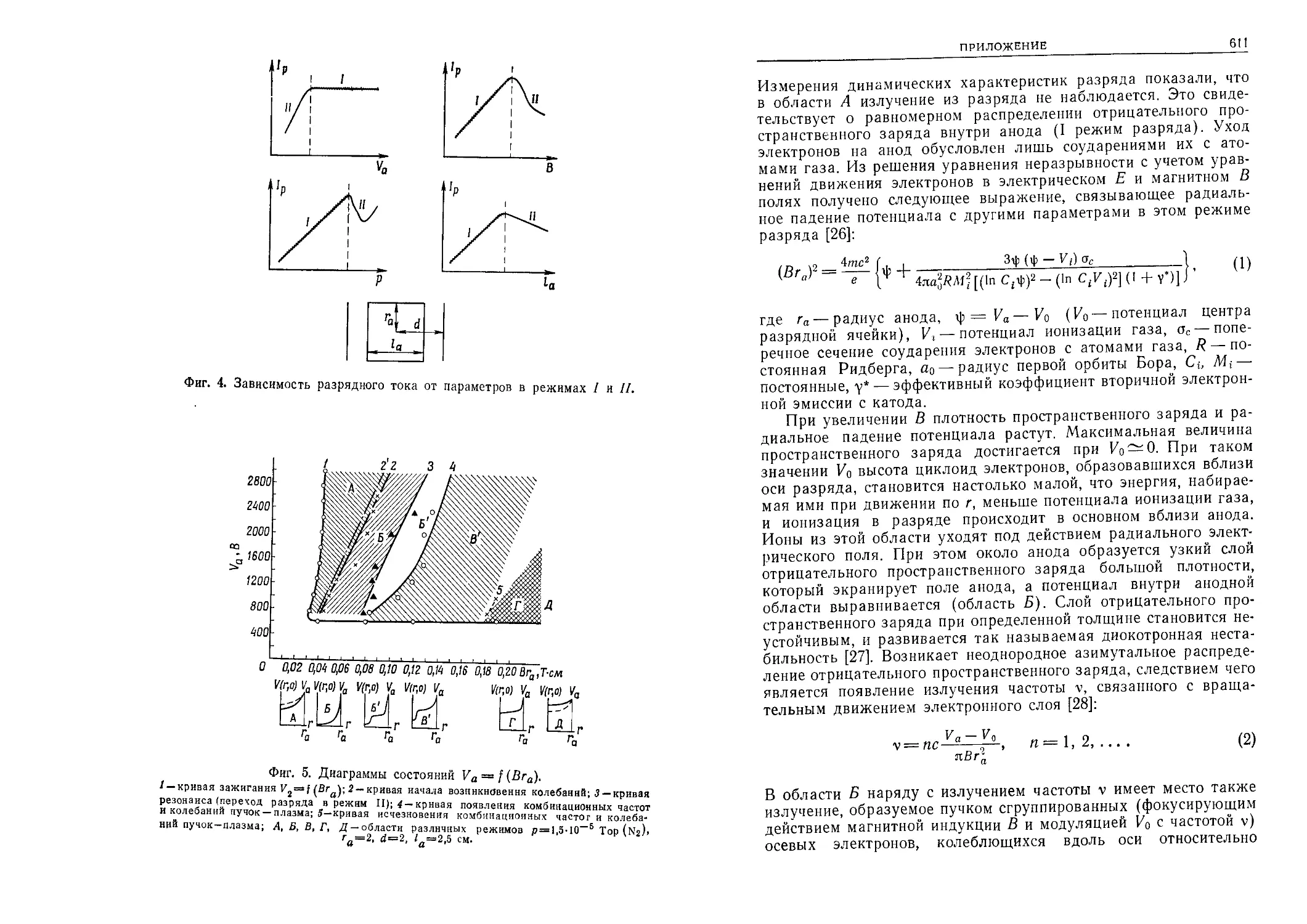
Вакуум Характеристика давления Величина, Тор Порядок вакуума ') Типичная область существо- вания или применения
— Атмосферное 760 На поверхности Земли
Технический (низкий) Пониженное 100 10 В газонаполненных лам- пах На входе водяного струй- ного насоса
Форвакуум (средний) Форвакуумное 1 ю-1 10“2 1 2 В различных газоразряд- ных лампах, заполнен- ных газами или парами
10-3 3 В металлургических пе- чах
Высокий Низкое ю-4 ю_3 10~в 10-7 4 5 6 7 В сосудах Дьюара (тер- мосах) При вакуумном осажде- нии паров В приемно-усилительных Лампах В генераторных лампах
Очень высокий Очень низкое 10-8 ю-9 8 9 В ускорителях частиц В рентгеновских трубках
ю-10 ю-11 10 11 В установках для иссле- дования поверхностей
Сверх- высокий Чрезвычайно низ- кое 10-12 10-13 12 13 В специальных экспери- ментальных установ- ках для исследования сверхвысокого ваку- ума
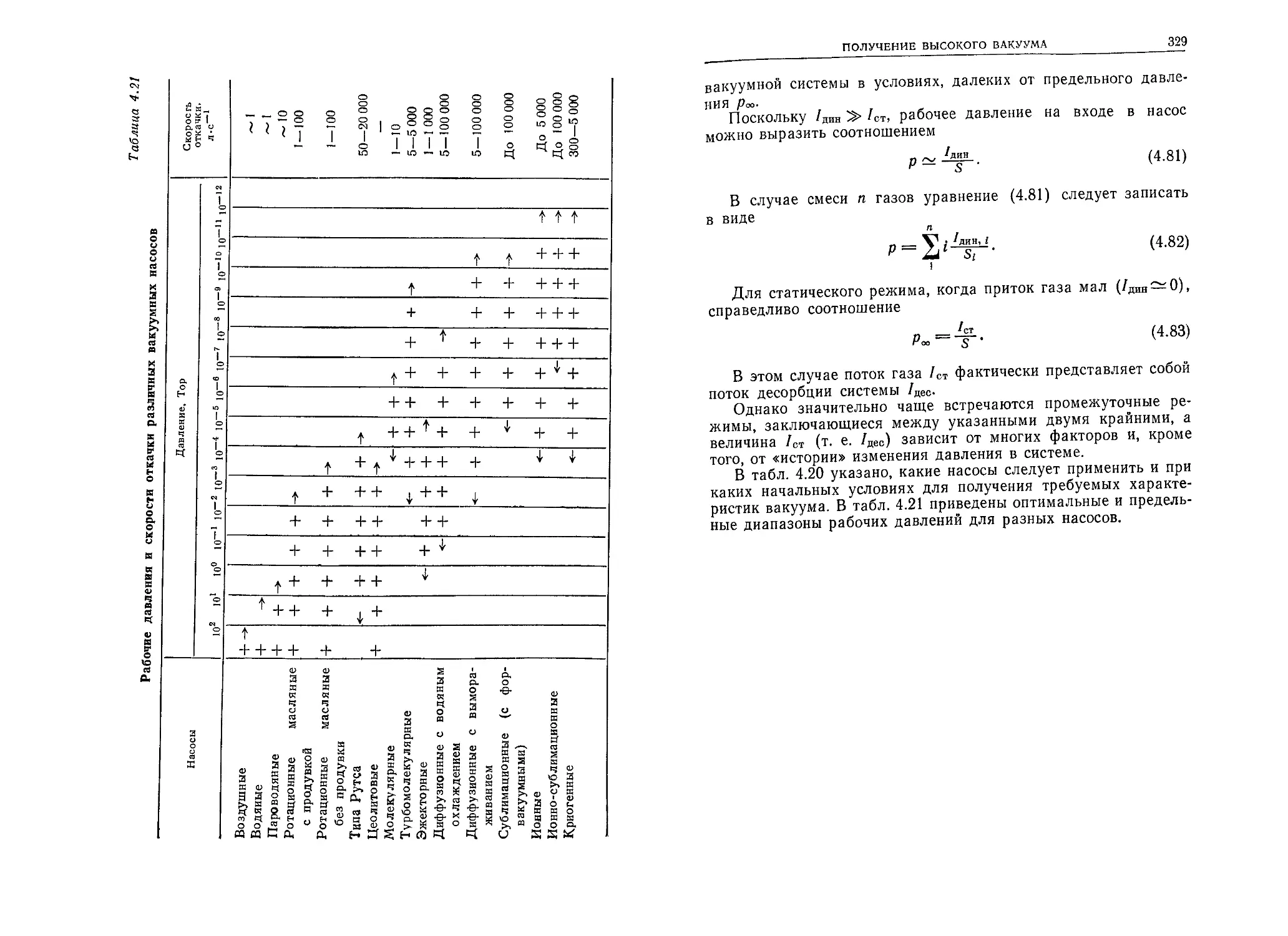
') Можно а в космнческо считать, что d рентг И пространстве-от 14 I0-14 ю-15 еновской т ГО до 15-го 14 15 рубке сущ< порядка. В космическом простран- стве ствует вакуум 9-го порядка,
СВОБОДНЫЕ ГАЗЫ
33
воздуха изменяется незначительно. На высоте 1000 км молеку-
лярные азот и кислород переходят в атомарные азот и кисло-
род. На высоте свыше 10 000 км имеются главным образом мо-
лекулярный водород и гелий.
Содержание водяных паров переменно и зависит от места и
времени. Также подвержено изменениям содержание молекуляр-
ного водорода и озона.
2.3.5. Области давления и вакуума
Как следует из графика, представленного на фиг. 2.5, давле-
ние атмосферного воздуха уменьшается по мере удаления от
поверхности Земли. На высоте 200 км оно имеет порядок 10-6Тор,
на высоте 600 км — 10~9Тор, а в космическом пространстве, вда-
ли от Земли и других небесных тел, давление газов, паров и раз-
личных космических частиц оценивается в 10~14—10~15 Тор.
Вакуум, которому соответствуют давления 10-4—10-8 Тор, бу-
дем называть высоким, 10 8—1012 Тор — очень высоким, а ва-
куум при давлении ниже 10'12 Тор — сверхвысоким.
Давление в космическом пространстве (10-15 Тор) приблизи-
тельно на восемнадцать порядков, т. е. в миллиард миллиардов
раз меньше атмосферного давления у поверхности Земли.
В табл. 2.5 представлены области вакуума и давления, а так-
же примеры применения вакуума в различных диапазонах дав-
ления.
2.3.6. Концентрация и размещение частиц
2.3.6.1. Связь между давлением, концентрацией и температу-
рой. Из уравнения (2.12) следует
moWKB = 3fer- (2.25)
Решая совместно (2.25) и (2.20), получим выражение
Р = nkT, (2.26)
связывающее давление с концентрацией и температурой. В зави-
симости от принятой системы единиц для давления и концентра-
ции (температура Т всегда в К) получим различные численные
значения постоянной Больцмана k. Если р измеряется в дин/см2
и п в СМ'3, то
k= 1,38- 10~16 эрг- К-1. (2.27)
Если р выражено в Тор, а п в см-3, то
kt = 1,0352 - 10“19 ~ 1,04 • 10~19 Тор • см3 • К-1, (2.28)
Если р представлено в Тор, а п в л-1, то
k2 = 1,04 • IO"22 Тор • л • К-'. (2.29а)
2 Зак. 510
34
ГЛАВА 2
Если р дано в Па, а п в м~3, то
k3 = 1,38 • 10-23 Дж • К"1. (2.296)
Соответственно получим
п[см-3] = 0,725 • 10,б Р . (2.30а)
п [см-3] = 0,966 • 1019(2.306)
п [л-1] = 0,966 • 1022 (2.30в)
п [м-3] = 0,725 • 1023 . (2.30г)
Формула (2.26) показывает, что для замкнутого сосуда при
п = const отношение давления к температуре есть величина по-
стоянная, т. е. изменениям температуры соответствуют пропор-
циональные изменения давления.
В табл. 2.6 приведены величины концентраций п (при Т =
= 273 К), соответствующие различным значениям давления.
Таблица 2.6
Зависимость концентрации п от давления р при Т = 273 К
Р. Тор 760 1 10-3 ю-8 10“’ 10“12 io-15
п, см~3 27- Ю18 37- IO'8 37- 10'2 37. 10’ 37 • (О8 37.10’ 37
2.3.6.2. Количество частиц газа в объеме 1 см3 при нормаль-
ных условиях (NTP). При нормальных условиях (р = 1 атм,
Т = 273 К) в сосуде объемом 1 см3 находится, независимо от
рода газа,
^ = 0,966- 1019-g§- = 2,69- 1019 ~ 2,7 • 1019 см"3 (2.31)
частиц газа соответственно с числом Лошмидта (1.3). Чтобы по-
лучить наглядное представление об этой величине, рассмотрим
сосуд объемом в 1 см3, помещенный в космическом пространстве.
В нем проделано отверстие, через которое в 1 с вылетает 10е мо-
лекул газа. На утечку всех молекул нужно было бы 800 000 лет.
2.3.6.3. Размещение молекул газа. Чтобы понять, как распо-
лагаются молекулы газа при различных концентрациях, рассмот-
рим сосуд объемом 1 см3, заполненный газом при атмосферном
давлении (760 Тор). Предположим, что молекулы каким-то об-
разом остановились. Поскольку в объеме 1 см3 находится при-
СВОБОДНЫЕ ГАЗЫ
мерно 27-1018 молекул, то при их равномерном распределе-
нии в объеме сосуда вдоль каждого ребра куба разместится
1X27"- 1018 =3-106 молекул на расстояниях 1/(3-106)^0,3-10~6см
одна от другой. Диаметр молекулы имеет порядок 10~8 см, по-
этому расстояние между ними примерно в 10 раз больше диа-
метра.
Для давления 10-12 Тор (которому соответствует концентра-
ция 37-Ю3 молекул на 1 см3) получим, что вдоль ребра разме-
3 -------------
щается у 37 000 ~ 33 молекулы, расположенные на расстоянии
1/33д^ 0,031 см ~ 0,3 мм одна от другой. В условиях космоса
(10'15 Тор) в объеме 1 см3 находятся 33 частицы, расположен-
ные на расстоянии нескольких миллиметров одна от другой.
Что касается длины свободного пробега при различных дав-
лениях, то в космическом вакууме средняя длина свободного
пробега составляет ~50-106 км, а это означает, что частицы ве-
щества, находящегося в космосе, так разрежены, что могут про-
летать расстояния, равные межпланетным. В то же время при
атмосферном давлении их свободный путь составляет 10~5 см, и
частицы хаотически движутся при очень частых соударениях.
2.4. СОУДАРЕНИЯ ЧАСТИЦ ГАЗА
Частицы газа обладают различными скоростями и, переме-
щаясь в объеме сосуда, соударяются как с его стенками, так и
Фиг. 2.6. Хаотическое движение молекул газа в сосуде.
я—преобладают соударения со стенками; б — преобладают соударения между молекулами.
ДРУГ с другом (фиг. 2.6). Как часто происходят эти соударения?
Для данного газа это зависит от концентрации частиц в сосуде.
При снижении концентрации относительное количество взаим-
ных соударений уменьшается, но возрастает количество соуда-
рений со стенками; при больших концентрациях со стенками со-
ударяются частицы, находящиеся вблизи них (фиг. 2.6,6).
2*
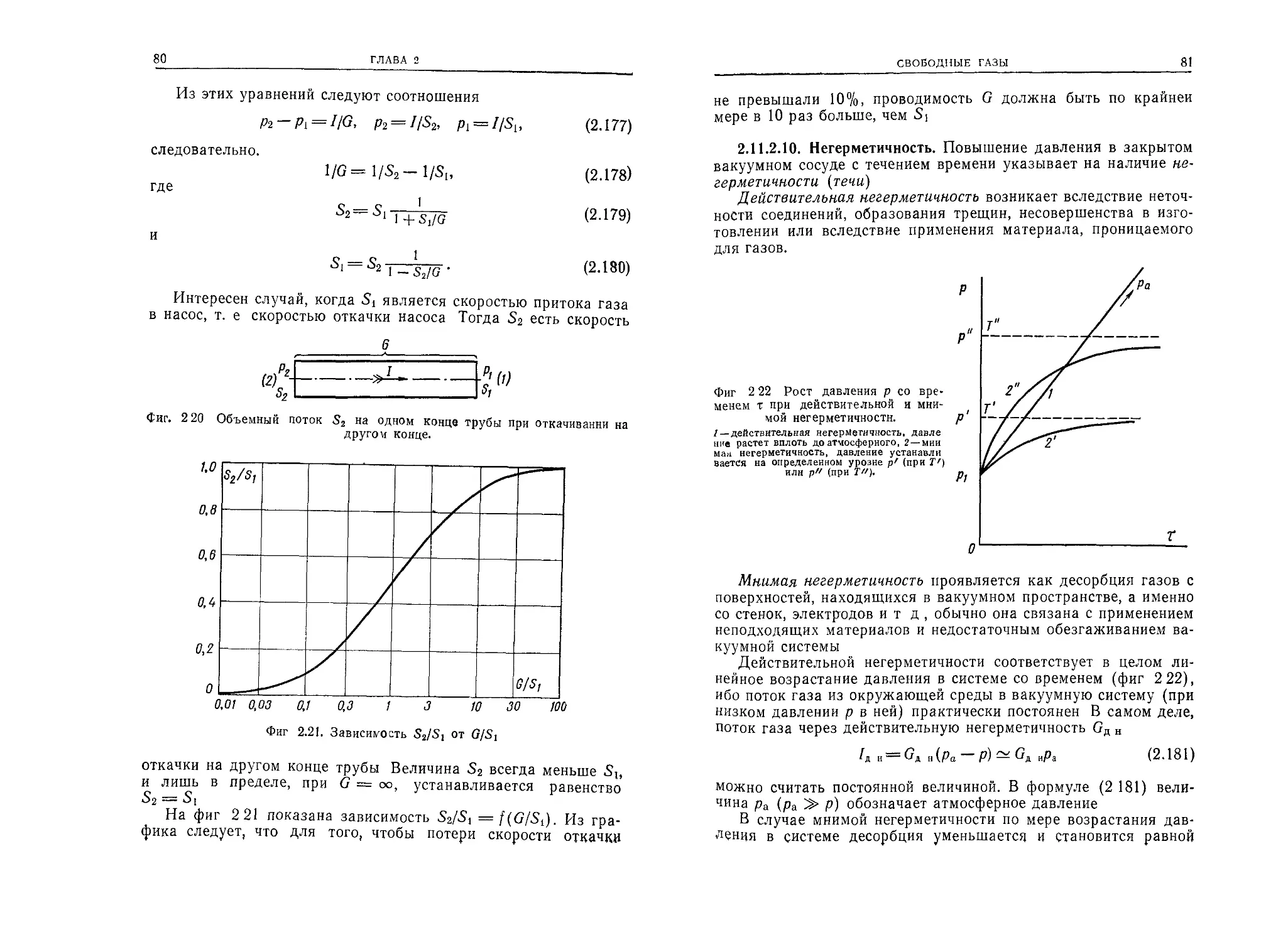
80
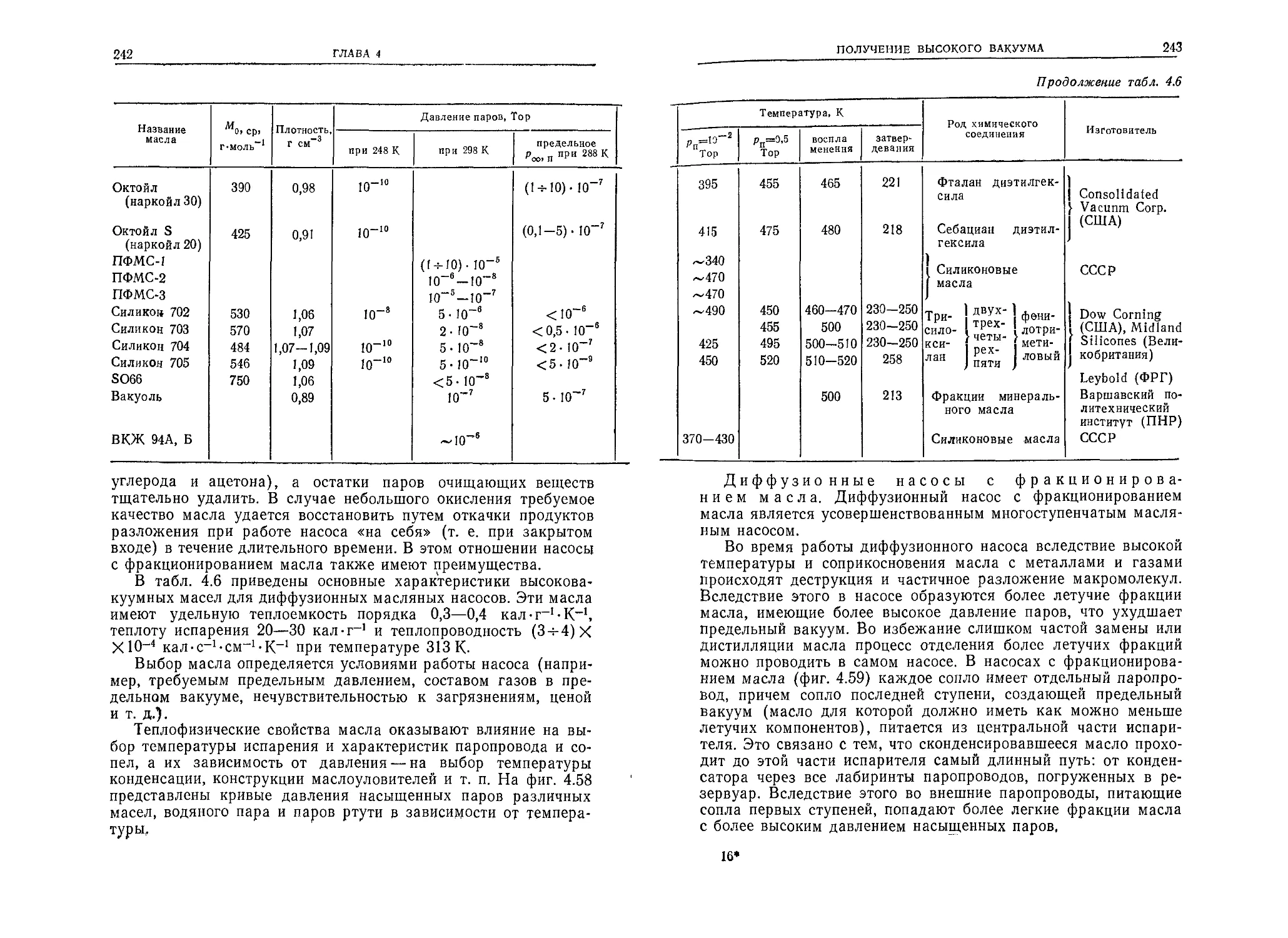
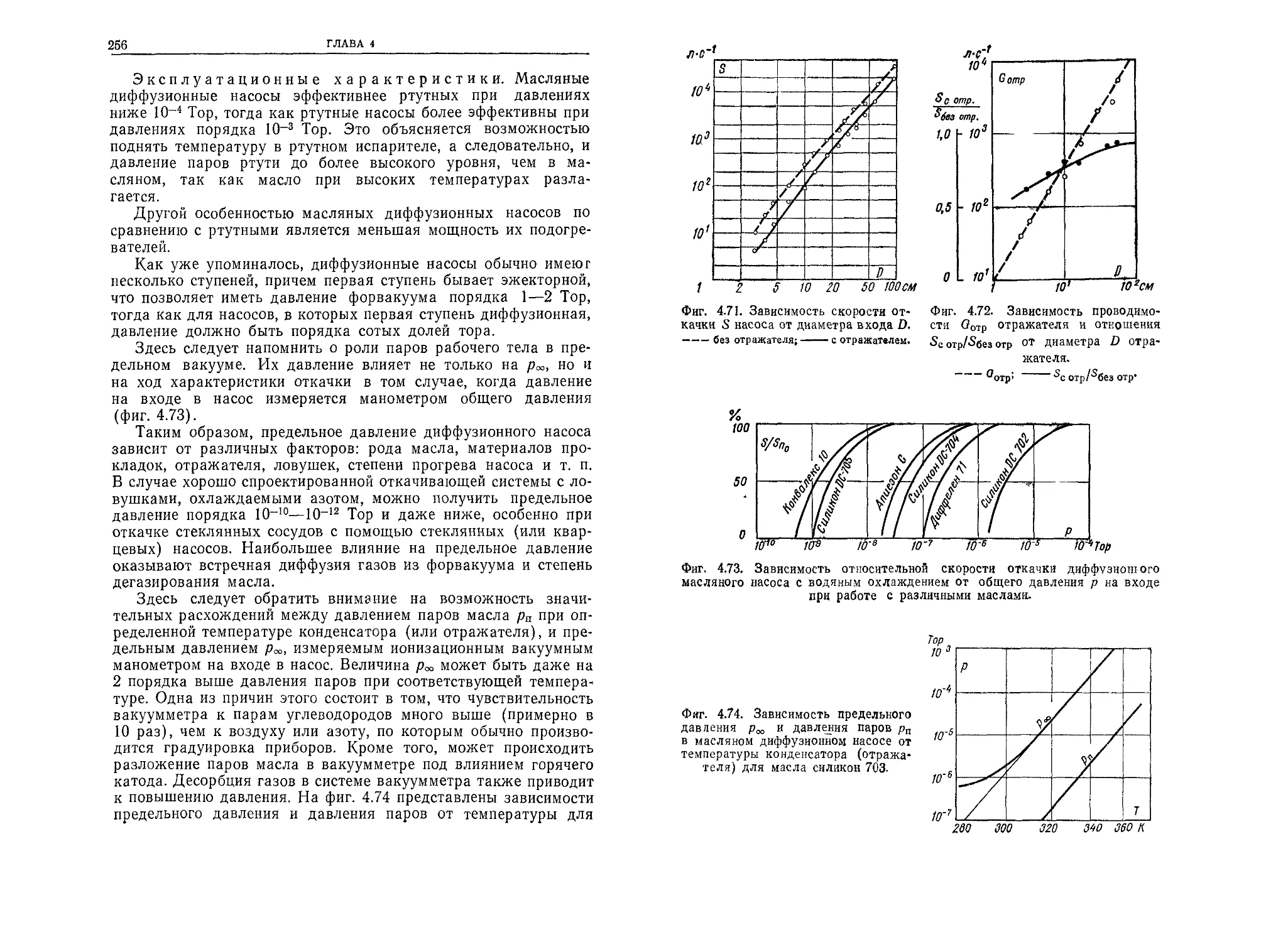
ГЛАВА 2
2.4.1. Количество и масса частиц, соударяющихся
с поверхностью
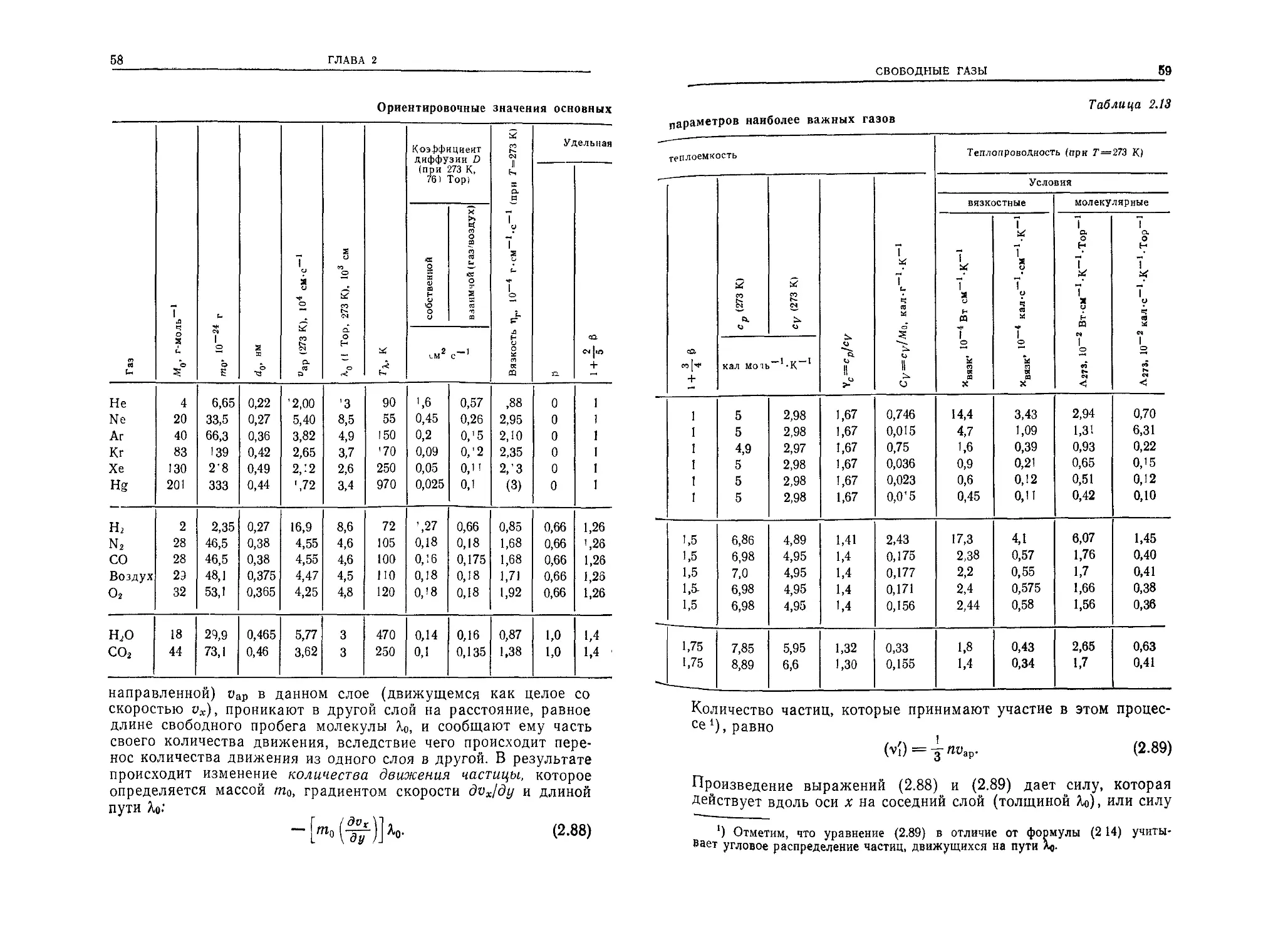
Подставляя вместо п и цар соответствующие величины из
(2.30) и (2.11) в формулу (2.14), получим выражение для коли-
чества частиц, ударяющихся о поверхность 1 см2 в течение 1 с:
v{= 3,5- 1022----(2.32)
Мо /Г '
(единицы: см-2-с-1, Тор, К). Масса этих частиц составляет
m'i = v'itnj = vi = 5,8 • 10~2 Мо (2.33)
(единицы: г-с-1-см-2, Тор, К).
2.4.2. Взаимные соударения частиц
Как соударения между частицами, так и соударения частиц
со стенками являются упругими, т. е. при соударении не проис-
ходит превращения энергии. Не изменяется также и потенциаль-
ная энергия частиц. Частицы могут изменять только свои скоро-
сти и направления движения, а суммы их энергий и импульсов
остаются постоянными.
Одной из характеристик соударения является направление
удара. Предельными случаями здесь являются центральный удар,
когда скорости совпадают с линией центров, и касательный удар,
когда частицы при встрече только касаются друг друга. В упро-
щенных расчетах вместо общего числа различных соударений
принимается, что все соударения являются центральными, а их
число в 2 раза меньше действительного числа соударений (ко-
зффициент осреднения равен 0,5).
Вероятность взаимного соударения частиц тем больше, чем
выше концентрация и больше их размеры, т. е. чем больше ча-
стиц в данном объеме и чем больше площадь поперечного сече-
ния частицы.
С ростом вероятности соударений длина свободного пробега
уменьшается. Этот пробег вычисляется как средняя величина по
совокупности участков между очередными соударениями
(фиг. 2.7) и называется средней длиной свободного пробега ча-
стицы. Она обратно пропорциональна концентрации газа и эф-
фективной площади поперечного сечения частицы.
2.4.3. Эффективное сечение частицы
Действие сил притяжения между частицами распространяет-
ся за пределы размеров частиц (если их рассматривать в виде
сферы, определяемой орбитами валентных электронов). В пер-
СВОБОДНЫЕ ГАЗЫ
37
вом приближении можно считать, что соударение двух частиц
произойдет, когда их центры находятся на расстоянии do. По-
этому эффективный диаметр частицы составляет 2с/0, а ее эффек-
тивное сечение
Лфф = 4л(2(/о)2=л4 (2.34)
2.4.4. Средняя длина свободного пробега частицы
Принимая, что средняя длина свободного пробега частицы
обратно пропорциональна концентрации газа и площади эффек-
тивного сечения частицы, получим
___________________________
° ЛЭфф« лф '
(2.35)
Вводя коэффициент пропорциональности Максвелла, учитываю-
щий распределение частиц по скоростям, получим для средней
длины свободного пробега выражение
1 = I
° У2 nd^n
(2.36)
(единицы: см, см2, см-3).
На фиг. 2.7 схематически представлен путь частицы, соуда-
ряющейся в процессе движения с другими частицами и со стен-
Фиг. 2.7. Средняя длина свободного пробега молекулы газа. [Например, она
равна сумме длин отрезков от 5 до 18, деленной на 13 (количество отрезков).]
ками. В этом примере количество соударений с частицами боль-
ше, чем со стенками. Средняя длина свободного пробега подсчи-
тывается как частное от деления сумм длин отрезков, обозна-
ченных от 5 до 19, на их количество (в данном случае 14).
38
ГЛАВА 2
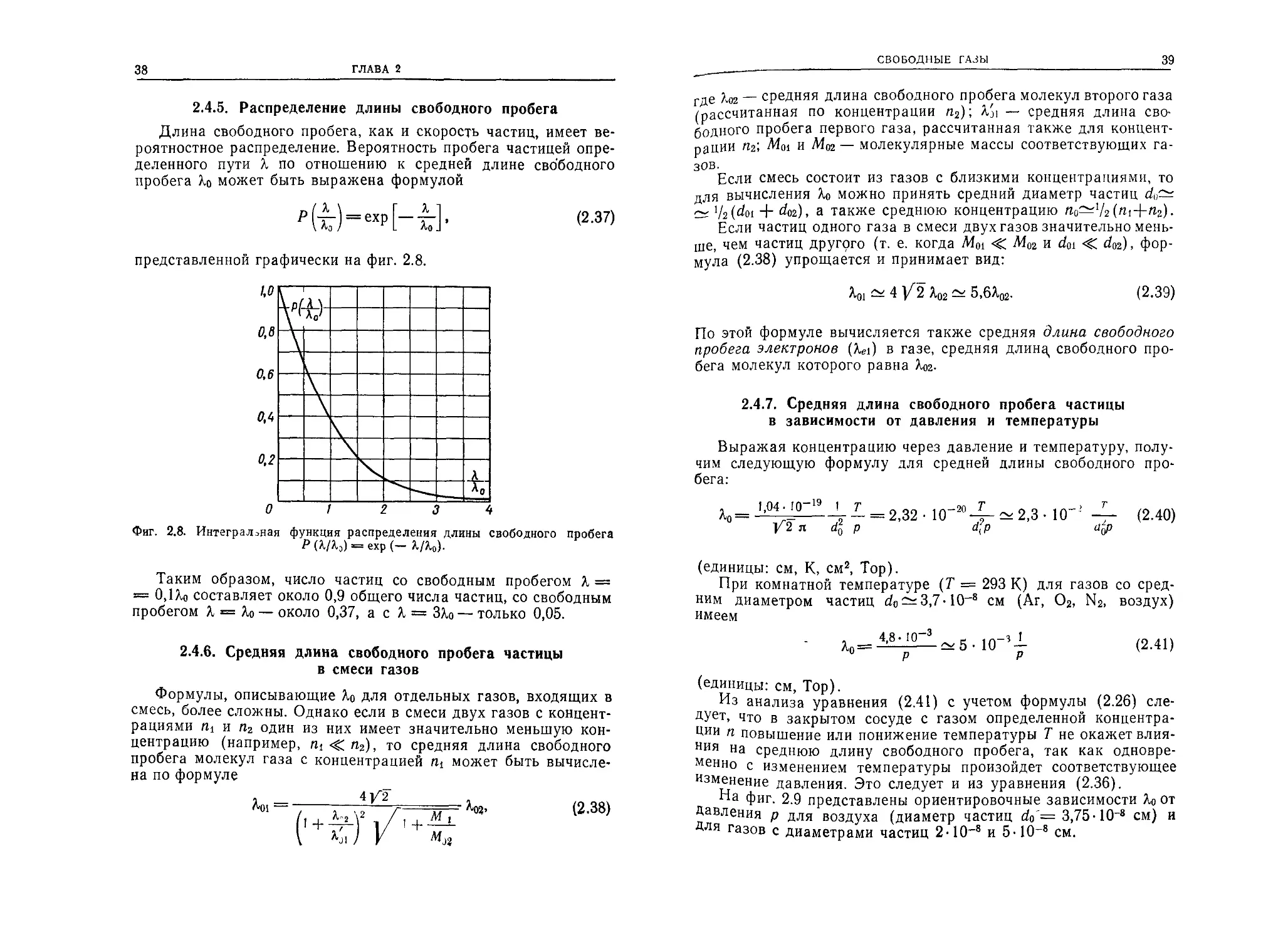
2.4.5. Распределение длины свободного пробега
Длина свободного пробега, как и скорость частиц, имеет ве-
роятностное распределение. Вероятность пробега частицей опре-
деленного пути i по отношению к средней длине свободного
пробега может быть выражена формулой
(2.37)
представленной графически на фиг. 2.8.
Фиг. 2.8. Интегральная функция распределения длины свободного пробега
Р (Шэ) = ехр (— Д-/М-
Таким образом, число частиц со свободным пробегом Л =
= 0,1Хо составляет около 0,9 общего числа частиц, со свободным
пробегом Л = Ло — около 0,37, а с Л, = ЗХо — только 0,05.
2.4.6. Средняя длина свободного пробега частицы
в смеси газов
Формулы, описывающие %о для отдельных газов, входящих в
смесь, более сложны. Однако если в смеси двух газов с концент-
рациями П1 и п2 один из них имеет значительно меньшую кон-
центрацию (например, ni<Cn2), то средняя длина свободного
пробега молекул газа с концентрацией rii может быть вычисле-
на по формуле
(2.38)
СВОБОДНЫЕ ГАЗЫ
39
где Хог — средняя длина свободного пробега молекул второго газа
(рассчитанная по концентрации п2); — средняя длина сво-
бодного пробега первого газа, рассчитанная также для концент-
рации П2, Л4о1 и Л4п2 — молекулярные массы соответствующих га-
зов.
Если смесь состоит из газов с близкими концентрациями, то
для вычисления Хо можно принять средний диаметр частиц d0—
~ ’/2 (doi + с/02), а также среднюю концентрацию «о—V2 («1+«2).
Если частиц одного газа в смеси двух газов значительно мень-
ше, чем частиц другого (т. е. когда MOi < и doi <С d02), фор-
мула (2.38) упрощается и принимает вид:
4 /2 Х02 — 5,6Х02. (2.39)
По этой формуле вычисляется также средняя длина свободного
пробега электронов (Хы) в газе, средняя длина, свободного про-
бега молекул которого равна Хог-
2.4.7. Средняя длина свободного пробега частицы
в зависимости от давления и температуры
Выражая концентрацию через давление и температуру, полу-
чим следующую формулу для средней длины свободного про-
бега:
^q=x .L04-2° Л — 2,32 1О-2О-^~2,3- 10-’ ~ (2.40)
/2 л d2 Р d2p
(единицы: см, К, см2, Тор).
При комнатной температуре (Т = 293 К) для газов со сред-
ним диаметром частиц с!о~3,7-10"8 см (Ar, О2, N2, воздух)
имеем
4’8^0—~5- (2.41)
(единицы: см, Тор).
Из анализа уравнения (2.41) с учетом формулы (2.26) сле-
дует, что в закрытом сосуде с газом определенной концентра-
ции п повышение или понижение температуры Т не окажет влия-
ния на среднюю длину свободного пробега, так как одновре-
менно с изменением температуры произойдет соответствующее
изменение давления. Это следует и из уравнения (2.36).
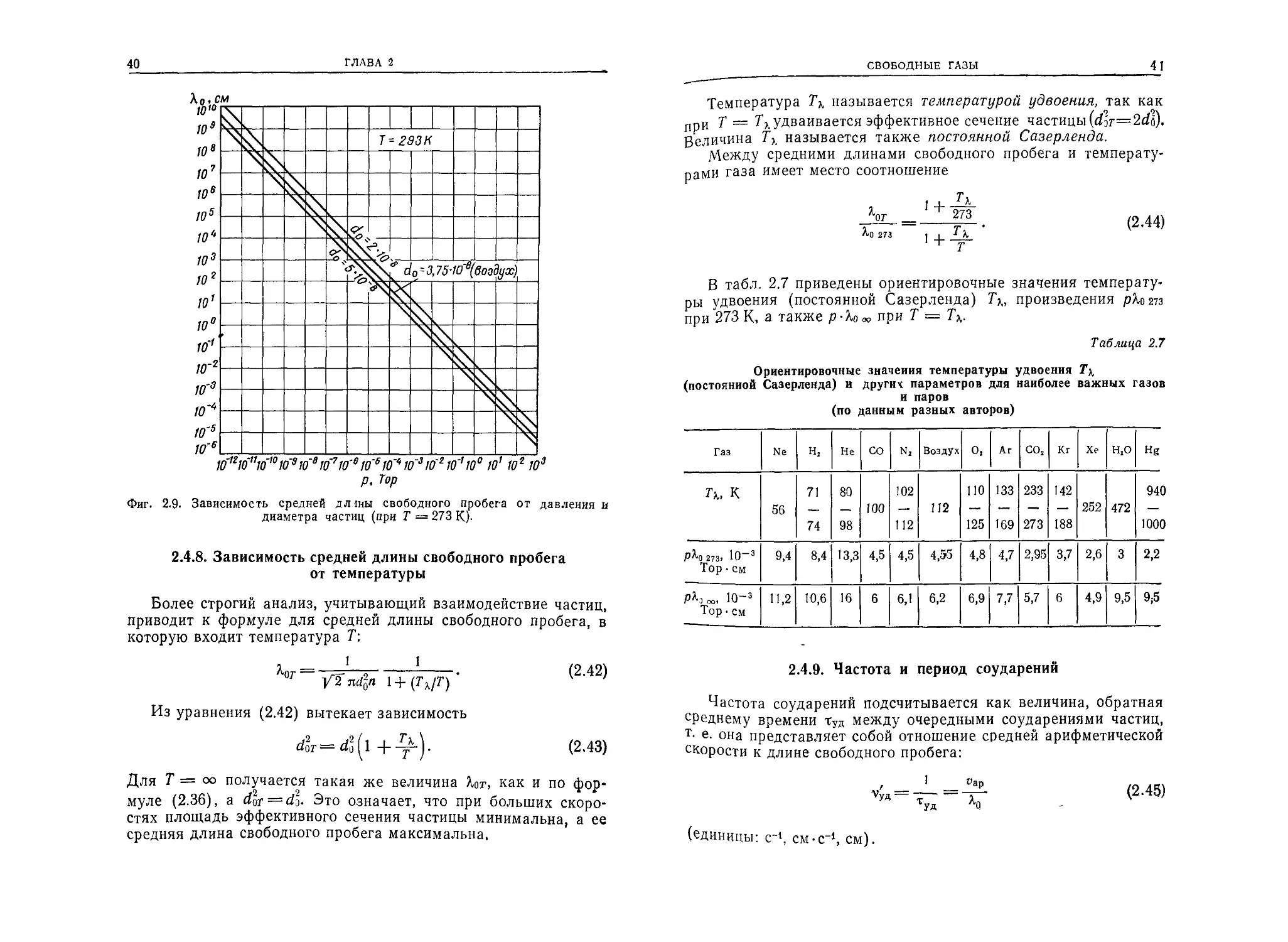
На фиг. 2.9 представлены ориентировочные зависимости Ао от
Давления р для воздуха (диаметр частиц do'= 3,75-10~8 см) и
Для газов с диаметрами частиц 2-Ю-8 и 5-10—8 см.
40
ГЛАВА 2
Фиг. 2.9. Зависимость средней дЛ1ны свободного пробега от давления и
диаметра частиц (при Т = 273 К).
2.4.8. Зависимость средней длины свободного пробега
от температуры
Более строгий анализ, учитывающий взаимодействие частиц,
приводит к формуле для средней длины свободного пробега, в
которую входит температура Т:
10т = '.,-----!----. (2.42)
/2 лф 1+(Тх/Г)
Из уравнения (2.42) вытекает зависимость
dor — do(l + (2.43)
Для Т = оо получается такая же величина Хог, как и по фор-
муле (2.36), a dor — da- Это означает, что при больших скоро-
стях площадь эффективного сечения частицы минимальна, а ее
средняя длина свободного пробега максимальна.
СВОБОДНЫЕ ГАЗЫ
41
Температура 7\ называется температурой удвоения, так как
прИ т = 7\ удваивается эффективное сечение частицы (<йт==2йб).
Величина 7\ называется также постоянной Сазерленда.
Между средними длинами свободного пробега и температу-
рами газа имеет место соотношение
1 л- Т }-
V + 273
Д-0 273 1 । 7X
-г т
(2.44)
В табл. 2.7 приведены ориентировочные значения температу-
ры удвоения (постоянной Сазерленда) 7\,
при 273 К, а также при Т = 1\.
произведения рАю 273
Ориентировочные значения температуры
(постоянной Сазерленда) и других параметров для
и паров
(по данным разных авторов)
Таблица 2.7
удвоения
наиболее важных газов
Газ Ne н2 Не со N, Воздух О, Аг С02 Кг Хе н2о Hg
Тк, К 56 71 74 80 98 100 102 112 112 ПО 125 133 169 233 273 142 188 252 472 940 1000
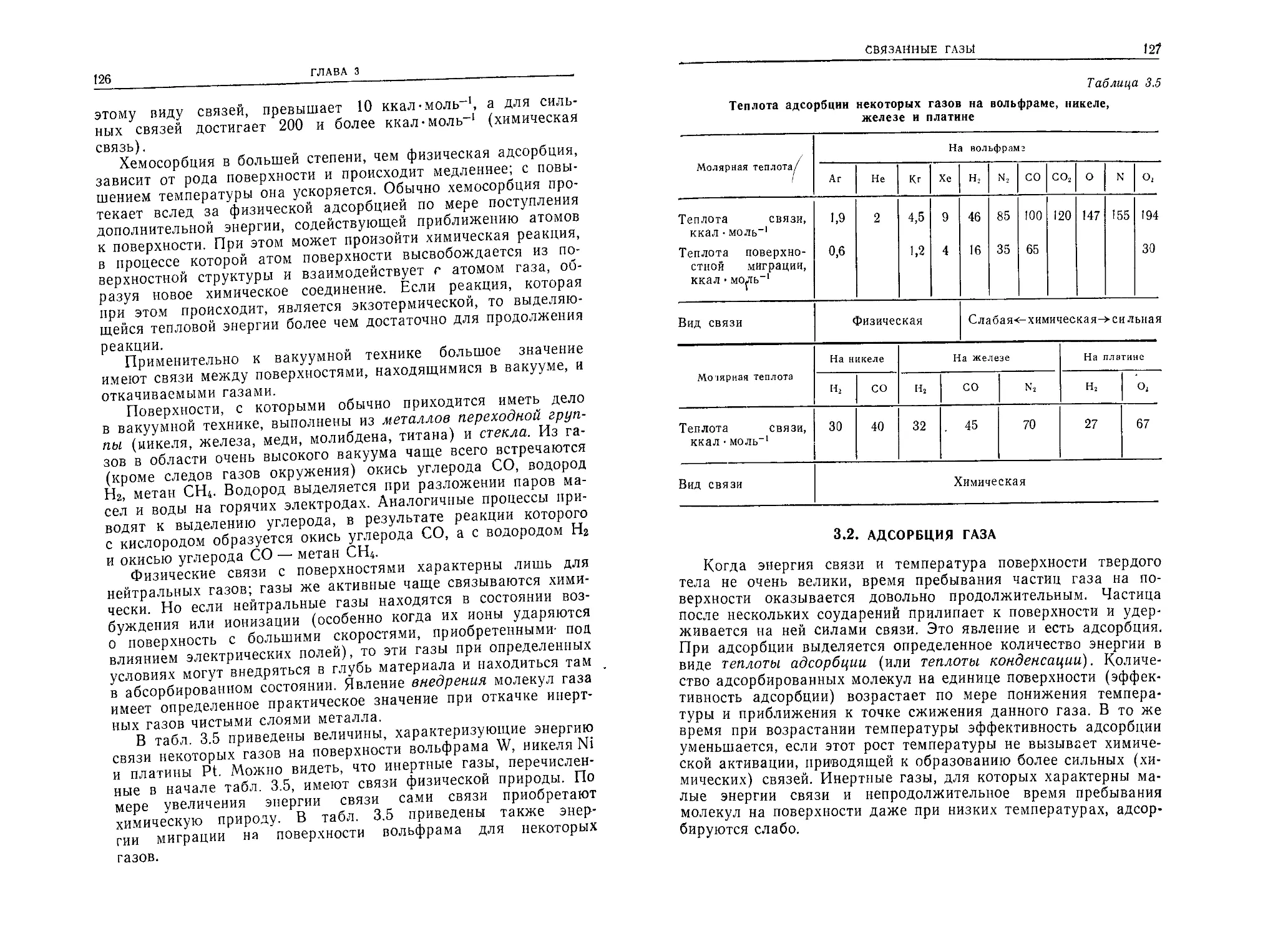
Л 273» Ю“3 Тор•см 9,4 8,4 13,3 4,5 4,5 4,55 4,8 4,7 2,95 3,7 2,6 3 2,2
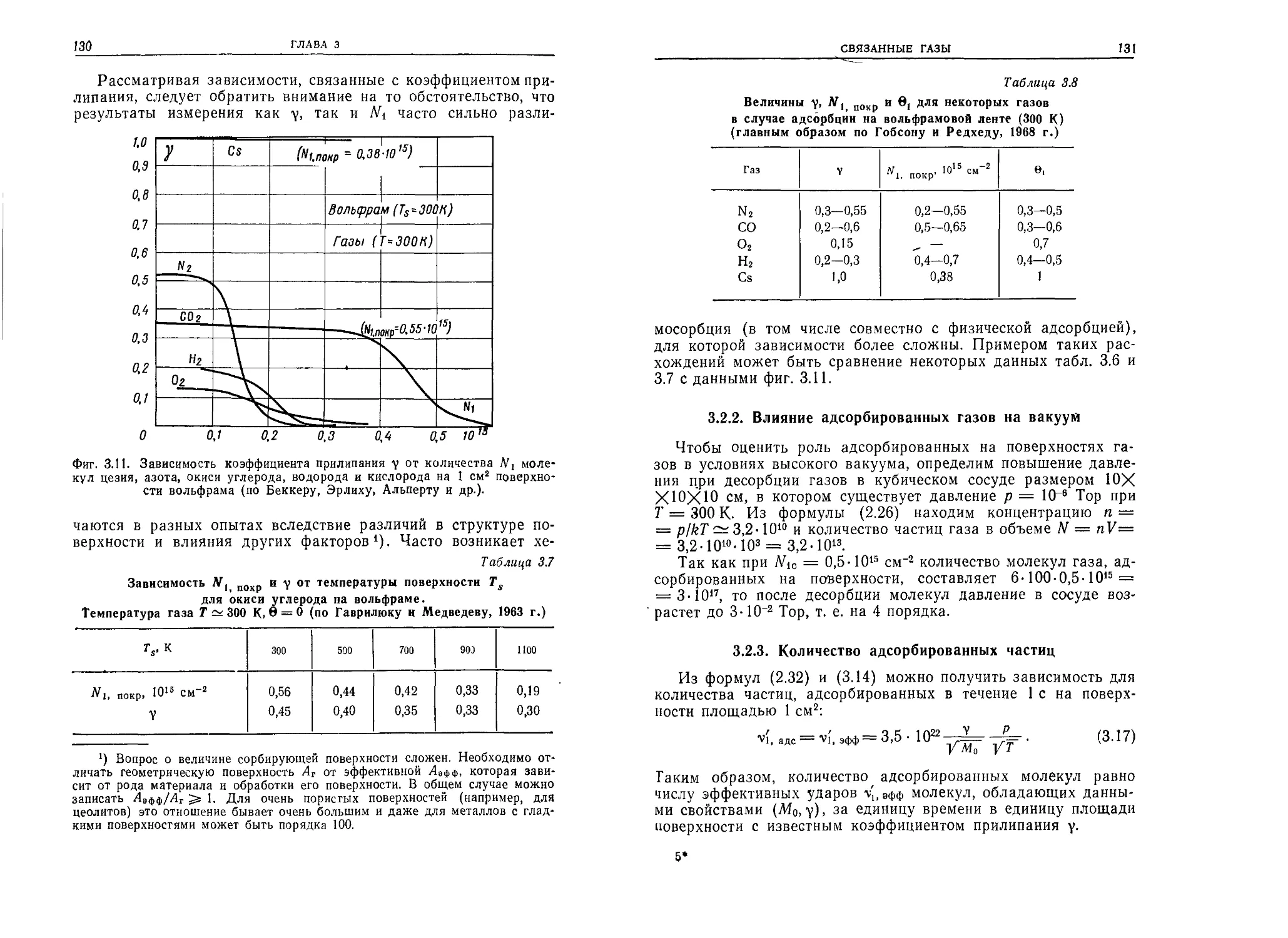
РД-ЭОО. Ю-3 Тор-см П,2 10,6 16 6 6,1 6,2 6,9 7,7 5,7 6 4,9 9,5 9,5
2.4.9. Частота и период соударений
Частота соударений подсчитывается как величина, обратная
среднему времени туд между очередными соударениями частиц,
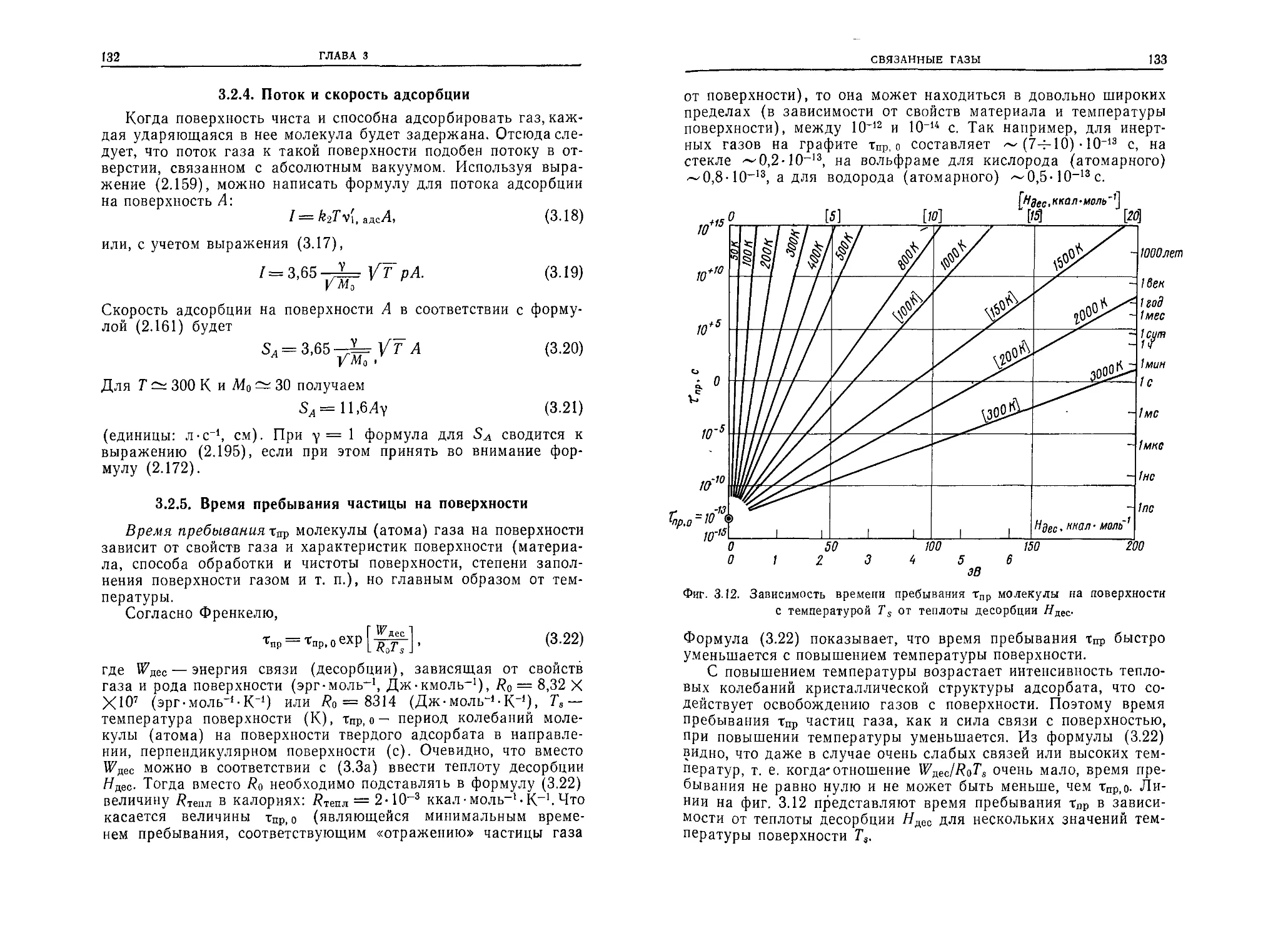
т- е. она представляет собой отношение средней арифметической
скорости к длине свободного пробега:
, 1 уар
VyA = "т
туд Л0
(единицы: с-1, см-с-1, см).
(2.45)
42
ГЛАВА 2
2.5. ОСНОВНЫЕ ЗАКОНЫ СВОБОДНЫХ ГАЗОВ
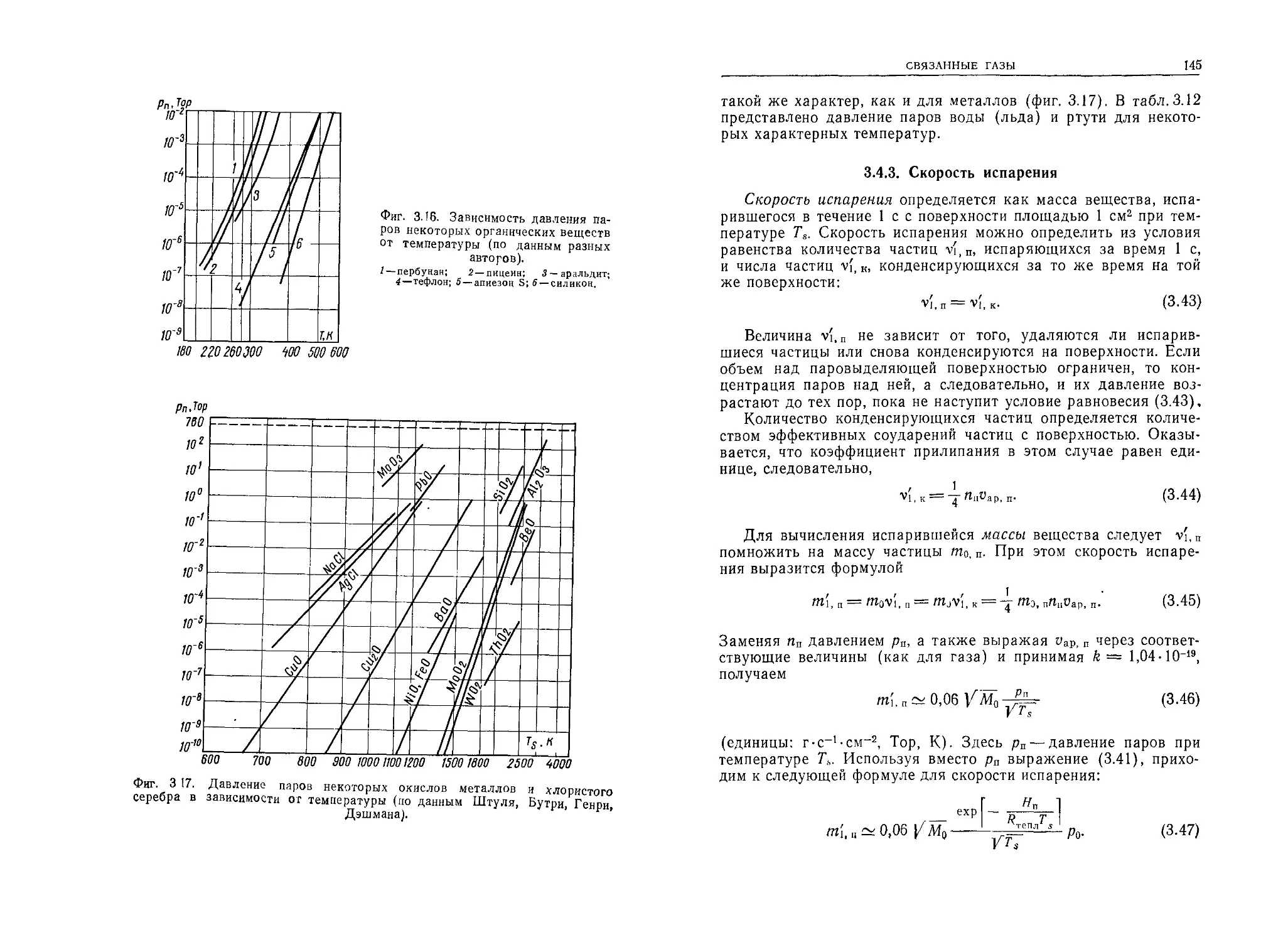
2.5.1. Законы кинетической теории газов
На основе изложенных простых зависимостей можно устано-
вить важнейшие законы, описывающие основные свойства газов.
Из формул (1.5) и (1.6) получаем
= (2.46)
откуда следует выражение для концентрации
Формула (2.47) позволяет найти концентрацию п газа мас-
сой т, содержащегося в объеме V, когда известен род газа, т. е.
масса частицы т0.
Давление этого газа вычисляется на основании формулы
(2.26) после введения вместо п выражения (2.47):
p = knT = k^-±T. (2.48)
Из формулы (2.48) следуют законы Бойля — Мариотта, Г ей-
Люссака и Шарля.
Умножая обе части уравнения (2.48) на V, получаем урав-
нение
pV=k-^T, (2.49)
представляющее собой закон Бойля — Мариотта, который уста-
навливает, что для данной массы данного газа при постоянной
температуре произведение давления на объем есть величина по-
стоянная.
Закон Гей-Люссака гласит, что для данной массы данного
газа при постоянном давлении объем пропорционален абсолют-
ной температуре
V — Т при р = const.
Выражая с помощью (1.1) т0 через Мо, получим
= (2.50)
Деля обе части уравнения на т и принимая во внимание (1.5),
преобразуем выражение (2 50) следующим образом:
(2.51)
СВОБОДНЫЕ ГАЗЫ
43
Это выражение представляет собой закон Шарля, согласно ко-
торому отношение давления к плотности для данного газа при
Т = const является постоянной величиной. Следовательно,
р — Т при V = const.
Это соотношение можно преобразовать в другую форму с по-
мощью определения
а' = 273,’5 ~ 273 ' ф (2.52)
Тогда связь между температурами по шкалам Кельвина и Цель-
сия можно выразить уравнением
Т = 273 + / = 273 [1 + 2^3 /) = Т0(1+а,/) = ^(1+аг/), (2.53)
где /— температура в градусах Цельсия, а То —273 К.
Вводя выражение (2.50) вместо Т в уравнение (2.53), можно
записать
рУ = ^л^-7’о(1 + аг/). (2.54)
Если при температуре / = 0° С давление и объем газа обозна-
чить соответственно через ра и IZ0, то получим
pQV0=kNA-^T0, (2.55)
а уравнение (2.54) примет вид
pV = pQV0 (1 + arf) = pQVoarT, (2.56)
так как
1 + аг/= arT. (2 57)
2.5.2. Количество газа
Произведение pV условно называется количеством газа в
единицах pV и обозначается Q,
Q = pV. (2.58)
Размерность количества газа Q определяется размерностями р
н К например Тор-см3, Па-м3, (Н/м2) -м3 = Н-м и т. д.
Таким образом, количество газа в единицах pV характери-
зует энергию (или работу), как это следует из размерности про-
изведения Н (силы) на м (путь). Следовательно, количество
аза pV можно понимать как энергию, содержащуюся в газе,
оторый при расширении может совершить работу. Чем больше
собЛеНИе И °®ъем газа> тем больше его энергия и больше спо-
ность к совершению работы. Таким же образом увеличение
44
ГЛАВА 2
давления газа при постоянном объеме (т. е. введение добавоч-
ного количества газа в данный объем) Увеличивает его количе-
ство в единицах pV. Сжатие же определенной массы газа (при
постоянной температуре) не изменяет количества газа.
Количество газа можно также выразить в единицах энергии
(например, в кал, эВ или Вт-с).
2.5.3. Уравнение состояния
Вводя в уравнение (2.55) новую постоянную
RQ=kNA (2.59)
(N А— число Авогадро, k — постоянная Больцмана), можно пред-
ставить уравнение (2.58) в виде
Q^pV = R0-~-T. (2.60)
Это выражение называется уравнением состояния идеального
Таблица 2.8
Универсальная газовая постоянная
Котичество газа pV Универсальная газовая постоянная Ro
Р V числен юг значение размерность
Тор Л 62,36 Тор • л • моль-1 • К-1
динсм~2 см3 8,315 • 107 эрг • моль-1 • К-1
ДИН • см — эрг
Дж = Вт • с 8,315 Дж • моль-1 К-1 Вт • с • моль-1 • К-1
Вт•с•см3 см3 8,315 8,315 • 103 Вт • с • моль-1 • К-1 Вт с • кмоль-1 • К-1
Вт • с
Па м3 8,315 Па • м8 • моль-1 • К-1 Н м моль-1 • К-1
Н • м
атм см3 82,06 атм • см3 • моль-1 • К-1
атм м3 0,0821 атм • м3 • кмоль-1 • К-1
кал•см-3 см3 1,987 кал • моль-1 • К-1
кал
СВОБОДНЫЕ ГАЗЫ
45
газа. Постоянная Ro называется универсальной газовой постоян-
ной. Она приобретает то или иное численное выражение в зави-
симости от выбора единиц. В табл. 2.8 приведены значения уни-
версальной газовой постоянной.
Для реальных газов уравнение состояния имеет более слож-
ную форму
[p+~)(V-b) = R0-^T. (2.61)
Это уравнение Ван-дер-Ваальса, в котором учтены так называе-
мое внутреннее давление a/V2 и собственный объем молекул (ато-
мов). Величины а и b для некоторых газов приведены в табл. 2.9.
Таблица 2.9
Округленные значения постоянных а и & в уравнении Ван-дер-Ваальса
(из различных источников)
Газ Не н, Аг О; N, СО Ne со. Хе Н,0 Hg
а, 106 атм-см0-моль-2 Ъ, см3 • моль-1 0,033 23,2 0,25 26,6 1,35 32,3 1,36 32 1,39 39 1,49 40 2,16 17,6 3,6 43 4,2 51 5,5 31 8,1 17
Уравнение (2.60) позволяет производить расчеты состояния
свободных газов при различных условиях (р, V, Т, m и т. д.). Это
уравнение, записанное в виде
pV/Т = const,
(2.62)
носит название уравнения Клапейрона.
Б. СВОБОДНЫЕ ГАЗЫ В ДИНАМИЧЕСКОМ СОСТОЯНИИ
2.6. ДИНАМИЧЕСКОЕ СОСТОЯНИЕ ГАЗА
В газе, имеющем неравномерное поле концентраций и темпе-
РатУР, происходит перенос массы и энергии. Такое состояние
аза можно назвать динамическим. Перенос массы газа, вызван-
ыи градиентом концентрации (давления), называют диффу-
°Нным потоком, а перенос массы под действием градиента
мператур — эффузионным потоком.
46
ГЛАВА 2
2.6.1. Средняя длина свободного пробега и характер процессов
в газах
Характер различных процессов, а следовательно, и свойств
газов в динамическом состоянии зависит от отношения длины
свободного пробега частицы Ао к характерному размеру сосуда X,
в котором протекает рассматриваемый процесс.
При Ao <С X молекулы участвуют в процессах посредством
взаимных столкновений, а обмен энергиями в этом случае про-
исходит почти исключительно между ближайшими молекулами.
Такие условия проявляются в виде вязкости газа, а соответ-
ствующие процессы называются вязкостными.
При Ао X молекулы взаимодействуют главным образом со
стенками сосуда или с другими поверхностями, находящимися в
объеме, и каждая частица выступает индивидуально. Процессы
в газах при таких условиях называют молекулярными.
При Ао~Х обычно существуют промежуточные условия, по-
скольку важную роль играют соударения частиц как между со-
бой, так и со стенками.
2.6.2. Число Кнудсена
Условия, в которых находится газ, определяют при помощи
числа Кнудсена Кп. Оно представляет собой отношение харак-
терного размера X вакуумного объема (например, длины трубы,
диаметра резервуара и т. д.) к средней длине свободного про-
бега Ао:
Кп = Х/А0. (2.63)
При Кп >> 1 имеют место вязкостные условия, при Кп <С 1 —
молекулярные, а при Кп 1 — промежуточные.
2.6.3. Выравнивание концентрации и энергообмен в газе
В замкнутом объеме при постоянной температуре газ (или
смесь газов) благодаря тепловому движению частиц очень бы-
стро приобретает статистически равновесную концентрацию, т. е.
его частицы полностью перемешиваются.
Такое состояние означает, что градиенты концентраций каж-
дой'компоненты смеси в любом направлении I равны нулю,
а соответствующие данной температуре скорости vapj молекул
разных компонент являются постоянными,
uap< = const.
СВОБОДНЫЕ ГАЗЫ
47
В этих условиях движение газа и перенос энергии не проис-
ходят.
Возникновение градиентов концентрации и изменение скоро-
стей молекул приводят к перемещению частиц, которые стре-
мятся выровнять градиенты и скорости путем перенос^ массы
газа (диффузия), изменения импульса (динамическая вязкость)
или переноса внутренней энергии (теплопроводность).
Явления переноса энергии в основном зависят от условий, в
которых находится газ (вязкостных, молекулярных и т. д.).
Кроме того, на обмен энергии между поверхностью и газом ока-
зывают влияние условия этого обмена, определяемые коэффици-
ентом аккомодации, характерным для данного газа, а также
рода и состояния поверхности. Наконец, имеет значение форма
молекул газа. Если молекула нешарообразна, то, кроме энергии
поступательного движения, она обладает энергиями вращатель-
ного и колебательного движений, которые следует учитывать
при рассмотрении энергообмена.
Упомянутые условия приводят к тому, что формулы, описы-
вающие обмен энергией, включают эмпирические поправочные
множители. В связи с этим получаемые по таким формулам ре-
зультаты не всегда оказываются точными. В значительной сте-
пени это вызвано тем, что часто существует неопределенность
эффективных диаметров молекул газа, в особенности их зави-
симости от температуры.
2.6.4. Коэффициент аккомодации
Обмен энергией при соударении частиц газа с поверхностью
зависит от условий, которые определяются упомянутым выше
коэффициентом аккомодации. Этот коэффициент определяется
выражением
т'2- Т,
а = —^—’ . (2,64)
1 2 1 I
где Т\— температура частиц, соударяющихся с поверхностью,
— температура поверхности, Т2 — температура, соответствую-
щая энергии частиц, отраженных от поверхности. Если а < 1,
то частица, отраженная от поверхности с температурой Т2, вме-
сто скорости v2, соответствующей этой температуре, приобретает
скорость v'2 < v2. Наоборот, если молекула приобретает скорость,
соответствующую температуре Т2 — Т2, то а=1.
Величина коэффициента аккомодации зависит от рода и со-
стояния поверхности, а также от рода газа.
Согласно Джинсу,
___ 4Л4ОПЛ4ОГ__
'(Мои + ад'’
(2.65)
48
ГЛАВА 2
где Мог и Моп — молекулярные массы соответственно газа и ве-
щества поверхности.
Опыты с различными поверхностями в целом подтверждают
правильность формулы (2 65) В соответствии с этой формулой
коэффициент аккомодации для газов с большой молекулярной
массой ближе к 1, чем для газов с малой молекулярной массой.
Кроме того, с уменьшением атомной массы вещества поверхно-
сти этот коэффициент возрастает. Он также больше для шеро-
ховатых и матовых поверхностей, чем для гладких и блестящих.
Таблица 2.10
Ориентировочные значения коэффициента аккомодации а некоторых газов
для температур поверхности и газа~ 300 К (по данным Дэшмана, Убища,
Лекка, Бремнера, Партингтона, Шефера, Герштеккера)
Материал Газ
Не н2 Аг Ne N, 02 Воздух со2 Hg
W Обыкновенный Чистый 0,3— 0,5 0,06 0,3- 0,4 ОД- ОД 0,75- ОД 0,85— 0,9 ОД- 0,9 0,85— 09 0,85
Pt Обыкновенная Полированная Очень чистая *) Черненая 0,5 0,44 0,03 0,9 0,25 0,3 0,71 0,55 0,7 ОД ОД 0,9 0,42 0,83 0,86 0,95 — ОД 0,85 0,95 1,0
Ni Покрытый га- зами Обыкновенный Обезгаженный 0,36 0,4 0,Об- ОД? о,з 0,95 од ОД 0,85 — ОД —
Fe ГГ Н2 Покрытое „ и? газами хт n2 0,1 0,27 0,45 —
Стекло (обыкновен- ное) 0,38 0,37 0,9 0,7 од ОД од
') По Томасу и Голику аНе~0,175, aNe=iO,4, aCOz с* 0,78
СВОБОДНЫЕ ГАЗЫ
49
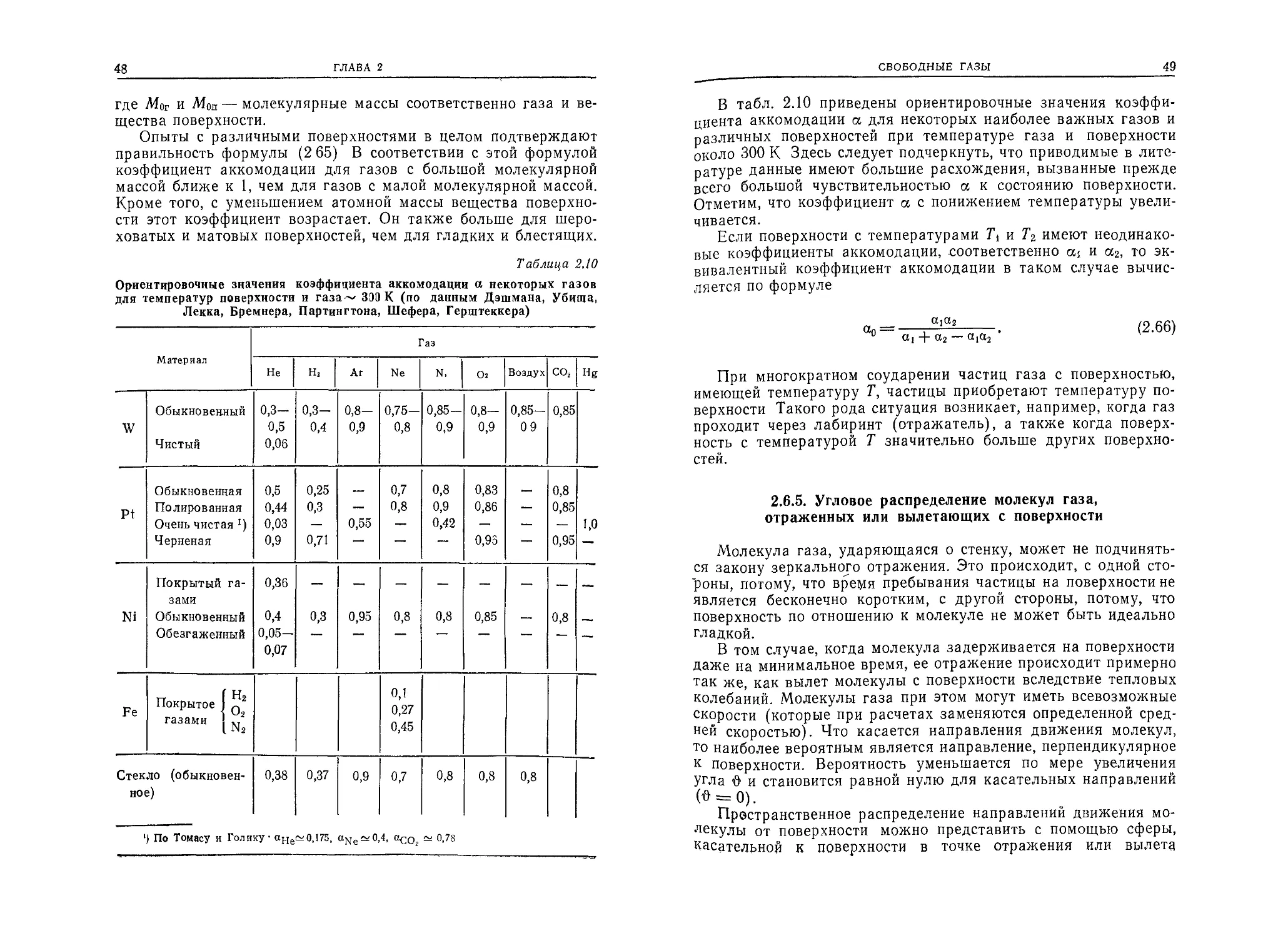
В табл. 2.10 приведены ориентировочные значения коэффи-
циента аккомодации а для некоторых наиболее важных газов и
различных поверхностей при температуре газа и поверхности
около 300 К Здесь следует подчеркнуть, что приводимые в лите-
ратуре данные имеют большие расхождения, вызванные прежде
всего большой чувствительностью а к состоянию поверхности.
Отметим, что коэффициент а с понижением температуры увели-
чивается.
Если поверхности с температурами Л и Т% имеют неодинако-
вые коэффициенты аккомодации, соответственно ai и а2, то эк-
вивалентный коэффициент аккомодации в таком случае вычис-
ляется по формуле
_______ «1«2
Ил---- .---------
и а2 + а2 — cti<x2
(2.66)
При многократном соударении частиц газа с поверхностью,
имеющей температуру Т, частицы приобретают температуру по-
верхности Такого рода ситуация возникает, например, когда газ
проходит через лабиринт (отражатель), а также когда поверх-
ность с температурой Т значительно больше других поверхно-
стей.
2.6.5. Угловое распределение молекул газа,
отраженных или вылетающих с поверхности
Молекула газа, ударяющаяся о стенку, может не подчинять-
ся закону зеркального отражения. Это происходит, с одной сто-
роны, потому, что время пребывания частицы на поверхности не
является бесконечно коротким, с другой стороны, потому, что
поверхность по отношению к молекуле не может быть идеально
гладкой.
В том случае, когда молекула задерживается на поверхности
Даже на минимальное время, ее отражение происходит примерно
так же, как вылет молекулы с поверхности вследствие тепловых
колебаний. Молекулы газа при этом могут иметь всевозможные
скорости (которые при расчетах заменяются определенной сред-
ней скоростью). Что касается направления движения молекул,
то наиболее вероятным является направление, перпендикулярное
к поверхности. Вероятность уменьшается по мере увеличения
угла О и становится равной нулю для касательных направлений
(0 = 0).
Пространственное распределение направлений движения мо-
лекулы от поверхности можно представить с помощью сферы,
Касательной к поверхности в точке отражения или вылета
50
ГЛАВА 2
молекулы (фиг. 2.10). Соответствующее плоское распределение
выражается косинусоидальной зависимостью (закон Кнудсена):
P('0’) = P0cosO'. (2.67)
Фиг. 2.10. Распределение вероятности угла отражения или вылета молекул
с твердой поверхности (максимум для 0 = 0°, нуль для 0 = 90°).
Таким образом, наиболее вероятными направлениями старта
частиц с поверхности (независимо от угла падения молекул) яв-
ляются направления, приближающиеся к нормали (Ф = 0°).
2.7. ДИФФУЗИЯ ГАЗА
Газ, находящийся в замкнутом объеме, благодаря хаотиче-
скому движению его молекул проявляет тенденцию к быстрому
выравниванию концентрации и по возможности равномерному
распределению частиц во всем объеме.
Явление переноса частиц одного газа по отношению к части-
цам другого (или того же самого) газа называется газовой диф-
фузией. Механизм диффузии зависит от условий, в которых на-
ходится газ.
В молекулярном режиме скорость переноса частиц зависит
от их скорости, а в вязкостном режиме, кроме того,— от их сред-
ней длины свободного пробега.
Для анализа явления диффузии рассмотрим замкнутый со-
суд (фиг. 2.11), в объемах которого а и b при температуре Т на-
ходятся два разных газа, разделенные перегородкой z— z. Их
давления ра и рь одинаковы (ра = рь). Таким образом, в объе-
ме а концентрация газа (а) равна па, а концентрация газа (Ь)
равна нулю; в объеме же b концентрация газа (&) равна пь,
а газа (а) равна нулю. В момент устранения перегородки прои-
зойдет перемещение частиц газа (а) из объема а в направлении
объема Ь, и наоборот.
2.7.1. Молекулярные условия
В молекулярных условиях молекулы обоих газов движутся
(>ез взаимных столкновений, а поэтому выравнивание коццент-
СВОБОДНЫЕ ГАЗЫ
51
радий происходит почти мгновенно. При данных размерах со-
суда это произойдет тем быстрее, чем больше скорость частицv
(чем выше температура и меньше масса частиц).
Ра‘-Уг________р^Уг
pS'-Уг р^'-Уг
О ----------------------------------
Фиг. 2.11. Диффузия газа. Области а и Ь сосуда разделены перегородкой,
которая убирается.
2.7.2. Вязкостные условия
В вязкостных условиях в момент устранения перегородки в
плоскости г — г возникают градиенты концентраций dnaldx и
dnbfdx, вызывающие движение частиц газа (а) в направлении b
и газа (&) в направлении а.
Количество частиц vf «ч и vf ц» соответствующих газов, про-
текающих за 1 с через 1 смг сечения сосуда, может быть
52
ГЛАВА 2
выражено на основании первого закона Фика: /
dtTi dtTin\
—^- = vna) = — Dat)—~-, (2.68а)
dnw __ п dnm
"ТТ” Vi (6| = — Doa-^, (2.686)
в которых Dab и Dba — коэффициенты пропорциональности, на-
зываемые коэффициентами диффузии (Отрицательные знаки в
правой части формул объясняются тем, что молекулы газа дви-
жутся в направлениях, противоположных градиентам ) В каж-
дый момент времени должно выполняться условие постоянства
полного давления в сечении z — z:
Ра + Pb = const, (2.69)
или па + пь = const, откуда dna dx dnb dx ’ (2.70)
а также dna _ dx dnb dx (2.71)
Поэтому Vl (a) = — Vl (6) (2.72)
и Dab — ®ba = Z). (2.73)
Это означает, что потоки частиц в обоих направлениях оди-
наковы (перемешивание газов происходит одновременно), а так-
же что коэффициент диффузии газа (а) в газе (&) равен коэф-
фициенту диффузии газа (й) в газе (а).
Коэффициент диффузии частиц газа (а), диффундирующих
в такой же газ (а), можно назвать коэффициентом собственной
диффузии (самодиффузии) Da. В случае же диффузии газа (а)
в газ (Ь) (или наоборот) это будет коэффициент взаимной диф-
фузии (Dab = Dba).
2.7.3. Коэффициент диффузии
Частица газа, движущаяся со скоростью vap, пробегает сво-
бодно путь Хо до удара с другой частицей. Величина, пропорцио-
нальная произведению пути на скорость vap, определяется как
коэффициент диффузии.
Рассмотрение механизма движения частиц газа от одного
слоя к другому приводит к формуле коэффициента собственной
СВОБОДНЫЕ ГАЗЫ
53
диффузии в виде
П = |уа[Ло (2-74)
(единицы: см2-с-1, см-с-1, см).
В случае различных газов, имеющих соответственно концент-
рации па и пь, коэффициенты собственной диффузии записы-
ваются в виде
Da = -g- Vapa^0a>
A,= yVap^o&. (2.75)
Коэффициент взаимной диффузии обоих газов, т. е. газа (а) в
газ (&) и газа (&) в (а), выражается формулой
Dab = Dba = Da ~~------h Db —5— • (2-76)
a0 Da a n + n. 1 ° Г1 + n. ' '
a 1 о a b
При na = пь уравнение принимает вид
Dab— Dba — бЧ^аОаРд + AobVapJ, (2.77)
а при пь па сводится к уравнению (2.74).
Более строгий анализ показывает, что формула (2.74) тре-
бует введения поправочного множителя который учитывает
максвелловское распределение скоростей молекул газа
= (2-78)
где до = 1,54-2,2. Подставляя в уравнение (2.78) вместо и
«ар соответствующие величины, выражая концентрацию п через
давление р и принимая значение коэффициента до = 2,1, полу-
чим
~ 2,2 • 10-16 —j—7=^-— (2.79)
(единицы: см2-с-1, см, г-моль-1, К, Тор).
Из уравнения (2.79) следует, что коэффициент диффузии воз-
растает с повышением температуры, а также с уменьшением дав-
ления, молекулярной массы и размеров частиц.
В табл. 2.11 приведены значения коэффициентов самодиффу-
зии некоторых газов. Видно, что для легких газов (Не, Н2) ко-
эффициент D больше, а для тяжелых газов и паров (например,
СО2, Hg) — значительно меньше.
54
ГЛАВА 2
Таблица 2.11
Ориентировочные значения коэффициентов самодиффузии
(при 273 К и 760 Тор) для наиболее важных газов
Газ Ж О) X о ж" О) 2 1 Воздух 1 О О о о о ьо X 1) X
D, см2 с-1 1,27 1,25 0,14 0,43 0,18 0,18 0,185 0,15 0,16 0,1 0,025 0,08 0,05
Для случая взаимной диффузии двух газов довольно
шее приближение к экспериментальным данным можно
чить при помощи формулы
Dab — Dba ~ 6,2
1 о-16
(doa+ dJb)2yМоаМ ь р
хоро-
полу-
(2.80)
При dOa = dQb и МОа = Моь формула (2 80) сводится к выраже-
нию (2 79). В табл. 2.12 приведены значения коэффициента Dab
для некоторых газов. Наибольшее значение коэффициента диф-
фузии в воздухе имеют водород и гелий. Эти газы (особенно ге-
лий) находят применение для обнаружения негерметичностей.
Габлица 2.12
Ориентировочные значения коэффициентов
взаимной диффузии для некоторых газов
при 273 К и 760 Тор
Диффундирующий газ Даг>, см’ с 1
в воздухе, О2 или N2 в Н2
н2 0,66 1,27
Не 0,57 1,25
Воздух, О2, Na 0,18 0,66
СО 0,175 0,64
СО2 0,135 0,54
2.8. ЭФФУЗИЯ ГАЗА
При неравномерном поле температур в вакуумном объеме
возникают течения газа из областей с более высокой темпера-
турой в области с более низкой температурой. Это явление но-
сит название тепловой эффузии (тепловой транспирации) или
термомолекулярного течения.
СВОБОДНЫЕ ГАЗЫ
55
Рассмотрим закрытый сосуд (фиг. 2.12), разделенный стен-
кой с очень малым отверстием площадью <40 (либо пористой пе-
регородкой или трубопроводом с малой проводимостью), в ко-
тором находятся газы с молекулярными массами, температура-
ми и давлениями (концентрациями) соответственно Л4оь ^02,
Ti, Т2, plt р2 (tii, п2).
Фиг 2.12. Эффузия гача Области 1 и 2 сосуда разделены диафрагмой
с малым отверстием Ло.
Если Ti == Т2 и Moi = Мог, то давления (и концентрации) бу-
дут в обеих частях сосуда одинаковы (pi = р2, tii = п2).
2.8.1. Молекулярные условия
В молекулярных условиях (Ло <С Хо) небольшая часть моле-
кул из обоих объемов попадает в отверстие, а поэтому концент-
рация в каждом из объемов определяется его температурой.
При Т2 > Ti преобладает движение газа из объема 2 в
объем 1, как это следует из уравнений, определяющих количе-
ство частиц, попадающих в единицу времени на единицу поверх-
ности:
vLi) = -^rtinap(i), (2 81а)
(2) = -у n2Vap (2). (2.816)
Количество молекул, переходящих за единицу времени че-
рез единицу площади граничной поверхности из объема 2 в
объем 1, составляет
v'i (2)-(1, = V1 12, — V|( I = 7 (2| “ «1 ^ар (1))- (2.82)
Перенос газа прекращается при условии
«2Оар (2) = «ifap (1)- (2.83)
Используя выражение (2.11) для vap, получим
(2.84)
56
ГЛАВА 2
Вводя вместо концентраций п давления р согласно уравнению
(2.26), соотношение (2 84) представим в виде
77 -/£-• <284а)
Это означает, что в объемах системы установятся давления, про-
порциональные корням квадратным из температур газов. С уче-
том конфигурации рассматриваемой системы уравнение (2 84а)
запишется в виде
а I.
(2.846)
В сосуде более сложной формы, когда перегородка между га-
зами удалена и частицы движутся от стенки к стенке, переходя
из одной области в другую с различными скоростями, в молеку-
лярных условиях трудно говорить о давлениях или концентра-
циях в отдельных объемах.
Распределение давлений (и концентраций) в этом случае за-
висит от конфигурации сосуда и температуры его стенок. Типич-
ными примерами таких систем являются нагреваемый сосуд и
установка с криогенным насосом.
2.8.2. Вязкостные условия
В вязкостных условиях при Ti =/= Т2 давления в обоих объе-
мах оказываются одинаковыми, а концентрации — различными
в соответствии с зависимостью
pl = knlTl = kn2T2 = p2. (2.85)
Отсюда определяется отношение концентраций в обеих частях
сосуда:
Таким образом, концентрации газа в обеих частях сосуда об-
ратно пропорциональны температурам.
2.9. ВЯЗКОСТЬ ГАЗА
Движению газа (как целого) по отношению к неподвижной
поверхности или движению поверхности относительно непод-
вижного (как целое) газа сопутствует внутреннее трение, илц
свойство рязкрстц.
СВОБОДНЫЕ ГАЗЫ
57
2.9.1. Вязкостные условия
При наличии вязкости в массе газа, движущейся параллель-
но неподвижной поверхности, например плоскости xz (фиг. 2.13),
скорость v движения слоев тем меньше, чем меньше расстояние
от этого слоя до плоскости xz, и непосредственно на этой по-
верхности (у = 0) ее можно считать равной нулю.
Уменьшение vx по мере уменьшения у характеризуется гра-
диентом скорости (dvx/dy). В реальных газах этот градиент
больше нуля, причиной чего является свойство вязкости (внут-
реннего трения).
Фиг 2.13 Течение газа в вязкостных условиях. Скорость слоев газа, близ-
ких к плоскости xz, в направлении х меньше скорости более удаленны
слоев.
Сила трения пропорциональна поверхности и градиенту ско-
рости. Для единицы поверхности эта сила может быть представ-
лена уравнением
<2-87>
где т]г — динамический коэффициент вязкости газа ').
Коэффициент вязкости т]г определяется касательной силой,
которая должна быть приложена к единице площади сдвигае-
мого слоя, чтобы поддержать в этом слое установившееся ла-
минарное течение с постоянной скоростью относительного сдви-
га, равной единице.
Сущность вязкостного трения в условиях течения газа со-
стоит в том, что частицы газа, обладающие скоростью (случайно
’) Единицей динамической вязкости является 1 пуаз (1 Пз) = 1 г-см-1-с-1.
Существует также понятие кинематического коэффициента вязкости, опреде-
ляемого как отношение динамической вязкости к плотности, цКин = Цг/рг;
размерность Цкин см2 с-1. Единицей кинематической вязкости является
1 Стокс (1 Ст) = 1 см2-с"* 1.
58
ГЛАВА 2
Ориентировочные значения основных
т св 7 х Ч О 3 и © 2= 1 о о g 3 X о тз иар (273 К), 104 см-с-1 (1 Тор, 273 К), 103 см И Коэффициент диффузии D (при 273 К, 76) Тор) Вязкость Г|г, Ю 4 г-см !-с 1 (при Г=273 К) Удельная
<зз. СМ |ю +
собственной взаимной (газ'воздух)
см2 с-1
Не 4 6,65 0,22 ’2,00 '3 90 ’,6 0,57 ,88 0 1
Ne 20 33,5 0,27 5,40 8,5 55 0,45 0,26 2,95 0 1
Аг 40 66,3 0,36 3,82 4,9 150 0,2 0,' 5 2,10 0 1
Кг 83 139 0,42 2,65 3,7 '70 0,09 0,'2 2,35 0 1
Хе 130 2’8 0,49 2,12 2,6 250 0,05 0,” 2,’3 0 1
Hg 201 333 0,44 ',72 3,4 970 0,025 0,1 (3) 0 1
н2 2 2,35 0,27 16,9 8,6 72 ',27 0,66 0,85 0,66 1,26
n2 28 46,5 0,38 4,55 4,6 105 0,18 0,18 1,68 0,66 1,26
СО 28 46,5 0,38 4,55 4,6 100 0,16 0,175 1,68 0,66 1,26
Воздух 29 48,1 0,375 4,47 4,5 НО 0,18 0,18 1,71 0,66 1,25
о2 32 53,1 0,365 4,25 4,8 120 0,’8 0,18 1,92 0,66 1,26
Н20 18 29,9 0,465 5,77 3 470 0,14 0,16 0,87 1,0 1,4
С02 44 73,1 0,46 3,62 3 250 0,1 0,135 1,38 1,0 1,4
направленной) уар в данном слое (движущемся как целое со
скоростью vx), проникают в другой слой на расстояние, равное
длине свободного пробега молекулы Хо, и сообщают ему часть
своего количества движения, вследствие чего происходит пере-
нос количества движения из одного слоя в другой. В результате
происходит изменение количества движения частицы, которое
определяется массой пг0, градиентом скорости dvx)dy и длиной
пути Хо.’
'О-
(2.88)
СВОБОДНЫЕ ГАЗЫ
59
Таблица 2.13
параметров наиболее важных газов
теплоемкость Теплопроводност ь (при 7 = 273 К)
Условия
вязкостные молекулярные
7 * 7 а о 7 О
7 7 X 7 7
S
1 7 7о
СО сч а. и Ио, кал* са т ч а 7 2 Вт см* 2 кал*с“
।
ей со [* + кал Moit -’•к-1 И (J bi « к со X со X Л273, IO’ Л273, 10'
1 5 2,98 1,67 0,746 14,4 3,43 2,94 0,70
1 5 2,98 1,67 0,015 4,7 1,09 1,31 6,31
1 4,9 2,97 1,67 0,75 1,6 0,39 0,93 0,22
1 5 2,98 1,67 0,036 0,9 0,21 0,65 0,15
1 5 2,98 1,67 0,023 0,6 0,12 0,51 0,12
1 5 2,98 1,67 0,0’5 0,45 0,11 0,42 0,10
’,5 6,86 4,89 1,41 2,43 17,3 4,1 6,07 1,45
1,5 6,98 4,95 1,4 0,175 2,38 0,57 1,76 0,40
1,5 7,0 4,95 1,4 0,177 2,2 0,55 1,7 0,41
1,5- 6,98 4,95 1,4 0,171 2,4 0,575 1,66 0,38
1,5 6,98 4,95 1,4 0,156 2,44 0,58 1,56 0,36
1,75 7,85 5,95 1,32 0,33 1,8 0,43 2,65 0,63
1,75 8,89 6,6 1,30 0,155 1,4 0,34 1,7 0,41
Количество частиц, которые принимают участие в этом процес-
се *), равно
(V1) = у «Дар- (2.89)
Произведение выражений (2.88) и (2.89) дает силу, которая
Действует вдоль оси х на соседний слой (толщиной Ло), или силу
') Отметим, что уравнение (2.89) в отличие от формулы (2 14) учиты-
вает угловое распределение частиц, движущихся на пути Л«.
60
ГЛАВА 2
трения
/=_ = -К)/пл (2.90)
Из условия равновесия сил F+ = F- находим
Т]г "дГ A.Q (291)
(единицы: г-см_1-с_!, г, см-3, см-с~’, см).
Более строгий вывод, в котором принимается во внимание
максвелловское распределение скоростей и средних длин сво-
бодного пробега молекул, требует введения в эту формулу по-
правочного коэффициента.
Согласно Чэпмену и Коулингу (1951 г.), в выражении (2.91)
следует заменить коэффициент 7з на 0,499 —'к, т. е.
Иг = у Отолуар^о- (2 92)
Подставляя в выражение (2.92) значения соответствующих ве-
личин, получим формулу
т)г = 0,27- 10~20Д^-/Т (2.93)
(единицы: г-см-1-с-1, К, см, г-моль-1)-
Формула (2.93) показывает, что в вязкостном режиме тече-
ния коэффициент вязкости (трения) не зависит от давления. Он
возрастает с уменьшением размеров и увеличением массы мо-
лекулы пропорционально корню квадратному из температуры1).
В табл. 2.13 приведены значения коэффициентов вязкости
при температуре 273 К наряду с другими параметрами для важ-
нейших газов, а в табл. 2.14 указаны значения коэффициента
вязкости воздуха для нескольких температур.
Таблица 2.14
Зависимость коэффициента вязкости от температуры
т. к too 150 200 250 273 300 350 400
т)г, 10-4 г-см-1 - с-1 0,68 1,0 1,3 1,56 1,71 1,82 2,08 2,32
*) При учете влияния температуры на размеры молекул (поправка Сазер-
ленда) зависимость т)г от температуры становится более сложной.
Вг = 4273
( Т V/. 273 + 7\
\ 273 ) Т + Тк '
(2.94)
СВОБОДНЫЕ ГАЗЫ
61
2.9.2. Молекулярные условия
При Хо L сила трения ’) в принципе не зависит от расстоя-
ния между поверхностями, перемещающимися одна относитель-
но другой, но зависит от массы и количества молекул, соударя-
ющихся в единицу времени с этими поверхностями, а также, в
определенной мере, от формы поверхностей и их свойств (ко-
эффициента аккомодации). Таким образом, сила трения зависит
от давления газа. При р — 0 она равна нулю, а при малых дав-
лениях она пропорциональна величине р
Сила трения пропорциональна массе т\ молекул газа, со-
ударяющихся в течение 1 с с площадью 1 см2 поверхности, а
также относительной скорости газа vs-.
Fi = rn'iv (s). (2.95)
Так как
= (т и°ар) то = 4 prVa? ’ (2.96)
то
Л = 4 РЛрЩ’ (2-97)
а после подстановки соответствующих величин
Л~(о,О6)/^- vs)p (2.98)
(единицы: дин-см-2, моль-1, К, см/с, Тор).
В заданных условиях (Г, р) для определенного газа (Л40) эта
сила пропорциональна V». При vs = const и Т = const сила F
может служить мерой давления р, что позволяет использовать
силу трения для измерения давления в молекулярных и проме-
жуточных условиях, когда вязкость зависит от давления (вяз-
костные манометры, манометры трения и т. п ).
2.9.3. Промежуточные условия
В промежуточных условиях (Хо ~ L) коэффициент вязкости
тем больше зависит от давления, чем ближе условия, в которых
находится газ, к молекулярным (фиг. 2.14).
') Не следует смешивать ее с внутренним трением (вязкости), про-
являющимся в вязкостном режиме течения. В молекулярных условиях
р чь может идти лишь о трении между твердым телом и газом.
62
ГЛАВА 2
1 Вязкостные
Промежуточные условия
условия ---л“«£
Фиг. 2.14. Зависимость коэффициента вязкости газа t)r от давления р.
В МОЛЭКулярНЫХ УСЛОВИЯХ Г]г ¥= f (р)-
2.9.4. Роль вязкости в вакуумной технике
Свойство вязкости (трения)
течении газа по трубам и через
новано действие молекулярных
ров.
газов играет важную роль при
отверстия. На трении также ос-
насосов и некоторых маномет-
2.10. ПЕРЕНОС ГАЗОМ ТЕПЛОВОЙ ЭНЕРГИИ
В вакуумной установке, различные поверхности которой
имеют разные температуры, частицы газа, соприкасающиеся с
этими поверхностями, приобретают различные скорости, а сле-
довательно, различные энергии, благодаря чему осуществляется
перенос энергии между поверхностями. Так как энергетически^
характеристики частицы определяются ее скоростью, то пере-
нос тепла может происходить единственно путем переноса энер-
гии движения. Таким образом, явления и зависимости, связан-
ные с переносом тепла в молекулярных условиях, подобны тем
которые имеют место при переносе количества движения (им-
пульса) в вязкостных условиях.
В молекулярных условиях перенос тепла осуществляется от-
дельными частицами; в вязкостных условиях движение отдель-
ных частиц ограничено. Поэтому в слоях газа, непосредственна
прилегающих к поверхности, явления в основном соответствукЯ
молекулярным условиям, а в удаленной от стенки массе гай
энергия переносится от частицы к частице.
В промежуточных условиях движение частиц усложняется
Перенос тепловой энергии в таком случае можно подсчитать
помощью уравнения, описывающего как вязкостные, так и npoj
межуточные и молекулярные условия. Для простого плоскопа
СВОБОДНЫЕ ГАЗЫ
63
раллельного случая (фиг. 2.15) это уравнение записывается в
виде
<2")
(единицы: Вт-см~2, Вт-см-'-К-1, К, см). Здесь Pi — — удель-
ная мощность, передаваемая через 1 см2 поверхности при раз-
ности температур Т2 — Т1 (она может быть выражена в механи-
ческих или тепловых единицах); х — коэффициент теплопровод-
ности газа; L — расстояние между поверхностями; А, — величи-
Фиг. 2.15. Перенос тепловой энергии в газе между параллельными плоско-
стями с температурами и Т2.
на, связанная с длиной свободного пробега молекул газа. Для
вязкостных условий К С L, молекулярных X L, промежуточ-
ных А ~ L.
С целью отыскания общей формулы для всех условий дви-
жения газа уравнение (2.99) представим в виде
• где
1
2 ~ 1 + А/L '
(2.100)
(2.101)
(2.102)
Положим, что X пропорциональна средней длине свободного
пробега %о, которая определяется выражением (2.40):
Л __ ^1^'1
° ]/~2
Здесь T0o^(l/2) (Ti + Т2)—средняя температура газа между
плоскостями с температурами Т2 и Л. Поэтому можно написать
Л или
_____________________________________s=s
L я d^L р р
(2.103)
Фиг. 2.16. Зависимости <г = /-(р) при п=10 2102 в качестве параметра.
СВОБОДНЫЕ ГАЗЫ
65
Поскольку
г т о
а = а —7-—..-,
л р2 dgL
(2 104)
то выражение (2.101) можно представить в виде
= <2-105)
где а является величиной, постоянной для данного газа (do) и
данной системы (L) при данной температуре (То)-
При р а получаем zc^\, и газ находится в вязкостных
условиях, при р «С a z — p/а, и имеют место молекулярные усло-
вия, при р^а z — 1/[+ (а/p)], т. е. существуют промежуточные
условия.
На фиг. 2.16 приведены графики зависимости z = f(p) при
а= 10-2-Н02 в качестве параметра.
При z 0,05 имеют место молекулярные условия, при z
>2 — вязкостные, а при 0,05^2 — промежуточные.
2.10.1. Вязкостные условия
В вязкостных условиях (ко С Ь) перенос теплоты происхо-
дит путем передачи энергии движения молекул на расстояние
средней длины свободного пробега ко'). При ко < L имеем z = 1
и формула (2.100) может быть записана в виде
Р1=Г1 = х^~^ = -хвязк(~), (2.106)
где дТ/дх— градиент температуры в направлении оси х
(фиг. 2 15).
Левую часть уравнения (2 106) можно выразить через изме-
нение количества движения частиц при их перемещении на рас-
стояние ко с соответствующим изменением скорости и темпера-
туры частиц. Энергия частицы может быть представлена сле-
дующим образом:
= = (2.107)
Изменение количества движения частицы равно
-(4 гаЛ)] ” - (4 Ч] • (2.108)
') Здесь не рассматривается перенос тепла с помощью конвекции, кото-
рая проявляется при более высоких давлениях и при больших размерах ва-
куумной системы, когда перемещаются большие массы газа под влиянием
темЫ Тяжести в результате изменения плотности газа, вызванного градиентом
меСтаРатУРЬ1 При низких давлениях явление конвекции, очевидно, не имеет
3 Зак 510
68
ГЛАВА 2
С учетом числа частиц
v'i=-^nvap (2.109)
энергия, переносимая частицами в течение 1 с через 1 см* 2 (т. е.
удельная мощность), составит
(2.110)
(единицы: эрг-с-1-см-2, эрг-Кг1, см-3, см, см-с-1, К-см-1). Из
сравнения выражений (2.110) и (2 106) можно вывести коэф-
фициент теплопроводности для вязкостных условий:
%вязк === "2~ (2.111)
(единицы- эрг-с-1-cm-1-К-1, эрг-Кг1, см-3, см, см-с-1). Подстав-
ляя в соотношение (2.111) выражения для Хо и иар, получим1)
Хвязк--^-. (2.112)
В эту формулу, как и в выражение для коэффициента вязкости,
не входит давление (концентрация). Таким образом, коэффи-
циент теплопроводности газа в вязкостных условиях не зависит
от давления и возрастает с ростом температуры2); он больше
для газов с частицами малой массы и малого диаметра.
Явления переноса механической и тепловой энергии подоб-
ны, поэтому между формулами (2.91) и (2.111) должна суще-
ствовать определенная зависимость.
Разделив (2 111) на (2.91), получим
„ 3 k 3 kN. 3 J
ВЯЗК _ ____ ______А __ __ Г) _ /Q 1 1 Q\
Т)Г 2 та ~ 2 Мо 2 Мо ’ 12.116)
Правую часть уравнения (2.113) можно выразить через удель-
ную теплоемкость — количество тепла, необходимое для нагре-
ва 1 г газа на 1 К (при V = const):
(2.114)
Энергия одной молекулы одноатомного газа определяется урав-
нением (2.107). Так как в одном грамме газа содержится 1//По
молекул, то
>) Точная формула будет дана позже
2) Имеется в виду поправка Сазерленда, как и для вязкостных условий. ;
СВОБОДНЫЕ ГАЗЫ
67
Поэтому
Cv = ~^Г “ "2 = Cv Л47 ’ (2.116)
где
cv=jR0 (2.117)
представляет собой молярную теплоемкость при V = const. Вы-
ражая постоянную Ro в тепловых единицах ')
п Ro 8,315 q —1 v_'i
*\тепл '— j —' “ КаЛ • МОЛЬ • 1\ >
получи^
cv ~ 3 кал • моль~' • К-1.
Молярная теплоемкость может быть выражена при помощи бо-
лее общей формулы
cv =4(1 + р)/?тепл, (2.118)
где р = О для одноатомных газов, р = 2/з для двухатомных га-
зов, р — 3/з = 1 для трехатомных газов и р + 5/з для много-
атомных газов. Между ср и Cv имеется связь, которая может
быть представлена в следующем общем виде:
cP = cv + £тепл(1 +₽) = Ц^-/?тепл. (2.119)
Из формул (2.118) и (2.119) получается характерная для газов
величина:
с„ 5 + зр
= (2J20)
При р = О получаем ус == 1,67, при р = 2/3 имеем =1,4, а при
Р = 1 у. — 1,33. Вводя (2.116) и (2.117) в выражение (2.113),
получим
2^ = 6?^, (2.121)
"Иг
откуда
хВязК = 'Пг^ (2.122)
(единицы: эрг-см-1-с-1-К"1, г-см“,-с-1, кал-г~’-К-1).
Таким образом, коэффициент теплопроводности газа в вяз-
костных условиях должен быть равен произведению коэффи-
циента вязкости на удельную теплоемкость (при V = const).
Опыт в основном подтверждает справедливость уравнения
(2.122), однако для учета изложенных выше соображений
’) Ro = 8,315 107 эрг моль-1-К-1, Z = 4,187-107 эрг-кал-1.
3*
68
ГЛАВА 2
должен быть введен поправочный коэффициент g. Поэтому ко-
эффициент теплопроводности газа в вязкостных условиях
можно выразить формулой
ХВЯЗК= (2.123)
где т]г — коэффициент вязкости с поправкой Чэпмена — Коулин-
га [см. формулу (2 92)], а поправочный коэффициент g опреде-
ляется выражением
t__ 9Vg ~~ 5 — 5 + 2Р (о 124)
4 2(1+Р)'
Этот коэффициент учитывает (по Ойкену) энергию вращатель-
ного и колебательного движения молекул. Подставляя в (2.123)
Фиг 2 17. Зависимость коэффициента теплопроводности от температуры
в вязкостных условиях с учетом поправки Сазерленда.
соответствующие выражения, получим формулу для теплопро-
водности газа в вязкостных условиях
Хвязк=2. Ю-20(1 -^= (2.125)’
\ 5 / tZoVмо
(единицы: кал-си-см-1-К"1, К, см, г-моль-1) или, переходя от
кал-с-1 к Вт,
хвЯзк = 0,84- 10-19(1 (2.126)
\ 3 / doy
СВОБОДНЫЕ ГАЗЫ
69
(единицы: Вт-см4-К”1, К, см, г-моль4)- Отсюда получаем ин-
тенсивность переноса энергии путем теплопроводности
Р1,вязк = 0,84 10-,9/1 (2.127)
\ 5 / dg у Мо L
(единицы: Вт-см-2, К, см, г-моль-1)- А.вязк не зависит от дав-
ления.
Значения коэффициента теплопроводности хВЯзк некоторых
газов для вязких условий при 273 К приведены в табл. 2.13, а на
фиг 2 17 показана зависимость коэффициента теплопроводности
от температуры, с учетом поправки Сазерленда, для некоторых
газов (О2, N2, Аг и воздуха).
2.10.2. Молекулярные условия
В молекулярных условиях почти все молекулы газа прини-
мают непосредственное участие в переносе тепла и теплопровод-
ность газа пропорциональна его концентрации п, т. е. давлению
р При этом коэффициент пропорциональности зависит от тем-
пературы поверхностей и рода газа, а также от размеров, фор-
мы и состояния поверхностей.
Для плоской системы (фиг. 2.15), состоящей из двух парал-
лельных, не очень далеко отстоящих друг от друга поверхностей,
при температурах Л и Т2 (Т2> Л) с единицей площади по-
верхности 2 в течение 1 с соударяется
vj = -|-nvap,o (2.128)
молекул, где vap> о — средняя арифметическая скорость, соответ-
ствующая средней температуре То.
Так как частица вылетает с поверхности 1 с энергией, соот-
ветствующей скорости Дкв, 1, а после отражения от поверхности 2
имеет скорость иКв, 2, то поверхность 2 сообщает ей энергию
|то(икв,2-’укв.1) (2.129)
(предполагается, что коэффициент аккомодации а равен 1).
Если в течение 1 с с этой поверхностью соударяется vf частиц,
то перенос энергии за это время составляет
Р1 = (т о) [т ,П<> (Икв, 2 - °кв, 1)] • (2-13°)
Используя выражение (2.107), уравнение (2.13б) можно запи-
сать в виде
Л = (4 ^ар.о) [4 k (Т2 - Г,)] =4 knvap, 0(72 - Л). (2.131)
Заменяя, подобно тому как это сделано для вязкостных условий,
ы на '/з, получим
Р1 = 4^ар.о(7’2-Л). (2.132)
70
ГЛАВА 2
Заменяя в уравнении (2.132) п и иар, о соответствующими выра-
жениями и вводя коэффициент аккомодации ао (средний для
обеих поверхностей), получим
Р, =-^-^(7’2-Л) (2-133)
1 ум0 /г0 7
(единицы: Вт-см2, г-моль-1, Тор, К).
Формула (2.133) верна для одноатомных газов. Молекулы
многоатомных газов не шарообразны, и при их соударении с по-
верхностью, кроме изменения энергии поступательного движе-
ния, происходит также изменение энергии вращательного и коле-
бательного движений молекулы. Это учитывается путем введе-
ния поправочного коэффициента, который с учетом формулы
(2.120) может быть представлен в виде
т^т=(1+44 <2134)
Для одноатомных газов (р = 0) он равен единице, для двух-
атомных (р = 0,66) составляет около 1,5, а для многоатомных
(Р = 1) — около 2.
После введения поправочного коэффициента в формулу
(2.133) получим
Л,мол = 0,97(1 +Ар)-^-^(Г2-7’1) (2.135)
\ 4 / уМа уГ0
(единицы: Вт-см-2, г-моль-1, Тор, К).
Таким образом, интенсивность передачи энергии путем теп-
лопроводности в молекулярных условиях возрастает пропорцио-
нально давлению.
Если ввести понятие коэффициента теплопроводности газа в
молекулярных условиях
Г” = (1+7^^- <2136>
то уравнение (2.135) можно представить в виде
Л, мол = ГМОЛ(7’2 -7Д (2.137)
(единицы: Вт-см-2, К-1, г-моль-1, Тор, К).
Коэффициент Гмол пропорционален давлению, он уменьшает-
ся с ростом температуры и с увеличением молекулярной массы.
Отметим, что размерность коэффициента Гмол иная, чем ко-
эффициента Хвязк для вязкостных условий, так как в формулы
(2.135) и (2.136) не входит расстояние между поверхностями.
Величина Гмол может быть записана в виде
Гмол ЛХаР
(2.138)
СВОБОДНЫЕ Г\ЗЫ
71
(единицы: Вт-см-2-К-1, Вт • см-2 • К-1-Тор-1, Тор), где величина
Лп-6. 10-2(1 + (2.139)
называется молекулярной теплопроводностью газа (при темпе-
ратуре То К).
Из формулы (2.139) следует, что определяющей эту характе-
ристику величиной является молекулярная масса газа. Чем
меньше масса молекул, тем больше теплопроводность газа в мо-
лекулярных условиях.
Величины Л27з (при Т — 273 К и ао = 1) некоторых газов,
выраженные в Вт и кал-с-1, приведены в табл. 2.13.
2.10.3. Промежуточные условия
Формула для интенсивности передачи тепла в плоской си-
стеме может быть представлена в следующем общем виде:
р ____ х Т2 — ТI
1 1+^ L
р
Для вязкостных условий (а <£ р)
р, =к ь-7-
г 1, ВЯЗК - Лвязк £
(2.140)
(2.141)
Для молекулярных условий (а р)
р, р.Ъ-т
* 1»мол ЛВЯЗК а
(2.142)
L
Таким образом, между Pi, ВЯзк и Pit мол существует связь
Р ьвязк ______________________
Р 1« мол Р
Подставляя выражения (2.127) и (2.135) в (2.143), получим
— = 0,87- 10~19— —|------£>_-
Р ао 1 + 3 р dnL р
т
Это соотношение с учетом формул (2.103) и (2.104) можно
Записать в виде
(2.143)
(2.144)
а _ Л
у ~ т
aj 1 + L ’
(2.145)
72
ГЛАВА 2
Отсюда следует выражение для коэффициента пропорцио-
нальности между К и Ко
9
а' = 3,7 —----, (2.146)
1-ф
позволяющее подсчитать а для данного газа (с?о, «о, Р) и данной
системы (А).
В формуле (2.140) коэффициент х, определяемый формулой
(2.126), фактически является коэффициентом теплопроводности
для вязкостных условий, поэтому для промежуточных условий
имеем
Р, пр = 0,84 • КГ'ф +{-ф- (2.147)
\ о / % “о^о 1 Я------
Р
(единицы: Вт-см-2, К, г-молы-1, см, Тор).
Смолуховский (1898 г.) с целью учета явлений, происходя-
щих в промежуточных условиях вблизи плоских поверхностей,
ввел концепцию так называемого скачка температуры, опреде-
ляемого величинами Ki и К2, на которые увеличивается расстоя-
ние L, входящее в формулу градиента температуры
т __т
Pl = Явязк £ _|_2 Л1 +\2 • (2< 1 48)
Для одноатомных газов он принял
. ________________________ 15 . 2 — а1
Ai —V
<2Л49>
где at и аг — коэффициенты аккомодации поверхностей при тем-
пературах Л и Т2, а Ко — средняя длина свободного пробега мо-.
лекул газа при То = 'А (Л + Т2). Например, при ai = a2 = 1
формула (2.142) приобретает вид
р — х . ^2 — Ti __Т2 — Tj-- 1
i'l — Хвязк £ + з)75£0 хвязк (I3,75Л0/Г) L’
что соответствует ранее полученным результатам.
Для системы, состоящей из внутреннего цилиндра с диамет-
ром б и температурой Т2 и внешнего — с диаметром D и темпера-
турой Т\ (длина цилиндров Г), интенсивность отвода энергии от
поверхности п81 с температурой Т2 выражается формулой
? = р g; 2t; IT,-Т,). (2.151)
1п Т + ДГ + ДГ
СВОБОДНЫЕ ГАЗЫ
73
причем Xi и Хг определяются из уравнения (2 149) (единицы: Вт,
Вт-см-К-1, см, К).
Для более высоких давлений, когда Ло < 6, а также при
б <С D уравнение (2 151) можно записать в виде
in 4-
0
(2.152)
2.11. ТЕЧЕНИЕ ГАЗА
Если в соединенных между собой объемах газ имеет различ-
ные концентрации (давления), происходит его течение из объема
с большей концентрацией (более высоким давлением) в объем
с меньшей концентрацией (меньшим давлением).
При данной разности давлений между двумя объемами по-
ток газа зависит от размеров и формы той части системы, кото-
рая соединяет эти объемы, и от числа Кнудсена Кп, соответ-
ствующего давлению данного газа и характеристическому раз-
меру системы X.
В качестве характеристического размера X принимается или
самый большой, или самый малый размер соединительной части
системы. Например, в случае длинной трубы диаметром/) X—D.
В зависимости от числа Кнудсена различают течения в вяз-
костном, молекулярном и промежуточном режимах.
2.11.1. Вид течения и давление
В вязкостных условиях (при Кп = X/Ко 100) различают
турбулентное течение, когда частицы наряду с поступательным
движением всей массы газа движутся хаотически со скоростями,
подвергающимися случайным изменениям, и слоистое (ламинар-
ное) течение, при котором частицы движутся по параллельным
траекториям со скоростями, мало отличающимися друг от дру-
га1). Очевидно, что как при турбулентном, так и при ламинар-
ном течении, кроме направленного движения, вызванного гра-
диентом давления, существует хаотическое тепловое движение
частиц, соударяющихся друг с другом и со стенками.
В молекулярных условиях (при Кп = Х/Ло 1) течение газа
сводится к независимому движению отдельных молекул по пря-
мым линиям в периоды между соударениями, которые имеют
место главным образом на стенках системы.
') Режим течения определяется так называемым числом Рейнольдса Re,
второе характеризует отношение энергии текущего газа к работе трения,
Ри больших Re течение турбулентное, при малых — ламинарное
74
ГЛАВА 2
В промежуточных условиях (при 1 Кп 100) в системе
могут существовать все описанные выше виды движения частиц.
2.11.1.1. Определение вида течения. В табл. 2.15 представ-
лены формулы, позволяющие определить режим течения. Эти
формулы приведены как в общем виде, так и в виде, соответ-
ствующем газам с диаметром частицы do — 0,37 нм, т. е. таким
газам, как, например N2, О2, воздух, СО, Аг (при температуре
293 К).
Таблица 2.15
Формулы для определения режима течения1)
Вязкостный
Кп = Х/Ъ>
Л0==(1/Кп)Л
1,04 -Ю~19 7
У 2л dg X
Кп > 100
Промежуточный
Молекулярный
Для воздуха
(d0 = 0,37 нм)
при Г = 293К
/.э < (1/ЮО) X
Ро>2-10 18-^2
1
Ро 200/
Кп< 1
') X — характеристический размер вакуум-юй системы; р0—приведенное среднее дав
ление (Тор, см, К); Кп —число Кнудсеза.
2.11.2. Величины, связанные с течением газа
При течении газа приходится иметь дело с величинами, отно-
сящимися либо к самому газу, либо к параметрам вакуумной
системы, через которую газ протекает.
2.11.2.1. Поток газа. Количество газа (в единицах pV), про-
текающего в течение секунды через данное сечение, называется
потоком газа-.
г dQ / dV \ .
1==ЧУ=Р\~^)у <2-153>
Поток газа выражается в Тор-см3-с-1, Тор-л-с-1 и т. п. Его
можно определить и в других единицах, в том числе в ваттах:
1 Тор-л • с-1 = 0,133 Вт.
СВОБОДНЫЕ ГАЗЫ
75
Поток газа может быть выражен с помощью количества v'
молекул, проходящих через сечение в единицу времени. Так как
масса этих молекул составляет
tn'—mov', (2.154)
из уравнения (2.49) с учетом (2.29) получаем
Г = (2.155)
(единицы: л, г, К, Тор), откуда
I dV \ , Т 1 dm , Т , ,о .
так как
dm , ,
— = m =mQV.
Отсюда следует связь между / и v'
'=',(47)„“‘*7v- <2-i57>
Удельным потоком газа называется величина
Л = 4 (2.158)
(единицы: Тор-л-с”1 -см-2), где А — площадь поперечного се-
чения.
Очевидно, что
h = k?Tv'i, (2 159)
где vi — количество молекул, проходящих в единицу времени че-
рез единичное поперечное сечение.
2.11.2.2. Объемная скорость течения. В выражении (2.153)
величина
=S (2.160)
\ dx /р—const
есть скорость изменения объема при постоянном давлении (объ-
емная скорость течения, объемный поток). Единицами объемной
спорости течения являются, например, см3-с-1, л-с-1, м3-ч-1.
В табл. 2.16 указаны соотношения между различными едини-
цами объемной скорости течения газа.
Объемная скорость течения характеризует изменение (поло-
жительное или отрицательное) объема газа в единицу времени
при постоянном давлении.
78
ГЛАВА 2
Т аблица 2.16
Соотношения между единицами объемной скорости течения
Единица см3-с 1 л-с 1 м’.с'1 3 —1 М МИН М3’Ч 1
1 см3-с-1 1 10~3 10“6 0,6- >0~4 3,6- ю_3
1 л • с-1 103 1 10~3 о,осо 3,6
1 м3 • С-1 10s 1000 1 ео 3603
1 м3 • мин-1 16 667 16,67 0,0’67 1 60
1 М3 • Ч -1 278 0,278 0,278- 10“3 0,0167 1
Если S имеет отрицательный знак, то имеет место отвод (рас-
ход) газа (применительно к вакуумной технике — сорбция, отка-
чивание и т. п.), если же S имеет положительный знак, то про-
исходит увеличение общего количества газа (например, десорб-
ция, натекание и т. п.).
Объемную скорость течения газа можно представить также
как скорость перемещения данного объема газа ДЕ в единицу
времени Дт.
2.11.2.3. Связь между /, S и р. Подставляя в формулу (2.153)
S вместо dV/dr, получим уравнение
I = Sp. (2.161)
2.11.2.4. Скорость изменения давления (при постоянном объ-
еме). Для того чтобы в сосуде объемом V, газ в котором нахо-
дится под давлением р, изменить давление на dp, следует отве-
сти из сосуда или ввести в сосуд некоторое количество газа dQ
так, чтобы выполнялось уравнение
Q + dQ = pV + V dp. (2.162)
Отсюда
dQ—V dp. (2.163)
Если это изменение должно произойти за время dr, то
1 = 4^-= 7 (-^-1 (2.164)
dr \ dr /v=const v '
является потоком газа, необходимым для изменения давления в
сосуде.
Выражение
/ dp \
\ dr /V=aconst
представляет собой скорость изменения давления при постоян-
ном объеме.
СВОБОДНЫЕ ГАЗЫ
77
Из соотношений (2.153) и (2.164) следует
(2.165)
откуда
и
(2 166)
Полагая S = const, после интегрирования уравнения (2.166)
получаем выражение
In р = -у- т + const, (2.167)
откуда находим уравнение изменения давления в замкнутом со-
суде
р = роехр[у-т]. (2.168)
Здесь ро — начальное давление при т — 0. Уравнение (2.168)
описывает изменение давления со временем при постоянных объ-
еме V и объемной скорости течения S.
Фиг. 2.18. Зависимость давлгния газа от времени в вакуумной системе:
S < 0 — сорбция; S > 0 — десорбция.
При S > 0 происходит повышение давления (вследствие, на-
пример, десорбции или натекания в вакуумную систему), а при
S < 0 — снижение давления (при сорбции или откачивании).
При этом давление по времени меняется экспоненциально.
Обычно такое изменение давления во времени представляется в
системе логарифмически линейных координат (фиг. 2.18). Тогда
78
ГЛАВА 2
оно представляется прямой линией, берущей начало (в момент
времени т — 0) при начальном давлении р = р0.
В случае S < 0 (откачивание) ее наклон отрицательный и
тем больше, чем больше отношение S/V.
Скорость (быстроту) откачки, необходимую для того, чтобы
откачать объем V в течение времени п до давления pi (начиная
Фиг 2.19 Зависимость коэффи-
циента sT от давления
от начального давления р0 — ра — 760 Тор), можно вычислить
из формулы
<2Л69)
Зависимость коэффициента sx от давления рх приведена на
фиг. 2 19.
2.11.2.5. Проводимость вакуумной системы. Если течение газа
возникает вследствие разности давлений р2 и pi в двух разных
точках вакуумной системы, то отношение потока газа I к разно-
сти давлений р2 — pi определяет проводимость (пропускную спо-
собность) вакуумной системы между указанными точками-
о = (2-170)
Единицами проводимости являются см3-с-1, л-с-1, м3-ч-1, т. е.
те же единицы, которыми измеряется объемная скорость течения.
2.11,2.6. Проводимость вакуумной системы и объемная ско-
рость течения. Если в формуле (2 170) принять pi = 0, а р2 обо-
значить как р, то эта формула примет вид
G=y. (2.171)
СВОБОДНЫЕ ГАЗЫ
79
Сравнивая выражения (2 171) и (2.161), можно записать
G — S. (2.172)
Это означает, что скорость откачки вакуумной системы рав-
на ее проводимости, если на одном конце системы давление рав-
но нулю, а на другом — величине р.
2.11.2.7. Сопротивление вакуумной системы. Обратная вели-
чина проводимости вакуумной системы называется сопротивле-
нием (импедансом) этой системы:
w=4 <2-173)
(единицами сопротивления являются с-см-3, с-л-1, ч-м~3 и т. п.).
2.11.2.8. Аналогии между течением газа и течением электри-
ческого заряда. Из предыдущих формул следует, что между ко-
личеством газа Q, потоком /, разностью давлений р2 — Pi, про-
водимостью G и сопротивлением W имеют место связи, анало-
гичные связям между электрическим зарядом Q, электрическим
током 7, разностью потенциалов U2—U1, проводимостью G и
сопротивлением R.
Формула (2.171) является, таким образом, эквивалентом за-
кона Ома Подобные аналогии существуют также в отношении
сопротивления и проводимости.
При параллельном соединении складываются проводимости:
п п
(2-174)
1 1
При последовательном соединении складываются сопротив-
ления-
п п
г = 2 г. = 2^7- (2.175)
1 1
2.11.2.9. Объемная скорость течения газа на выходе из трубы.
Когда в трубе с проводимостью G течет поток газа, то на кон-
цах трубы имеют место разные давления pi и р2, а также разные
объемные расходы Si и S2 (фиг. 2 20). Это позволяет написать
Уравнения
/ = С(р2 —Pi)> / = PiSi, l = p2S2, (2.176)
так как поток газа на участке между входом в трубу и выходом
из нее сохраняется неизменным.
80
ГЛАВА 2
Из этих уравнений следуют соотношения
P2-Pi = IIG, p2 = IIS2, Pl = I/Slt (2.177)
следовательно.
1/0=1/52-1/5!, (2.178)
где
s*=s'T+h<i <2Л79>
И
<2.180)
Интересен случай, когда 5j является скоростью притока газа
в насос, т. е скоростью откачки насоса Тогда S2 есть скорость
_____________6______________
(2)Р'\------------------" Я-? W
S2 __________________________ 5’
Фиг. 2 20 Объемный поток S2 на одном конце трубы при откачивании на
другом конце.
откачки на другом конце трубы Величина 5г всегда меньше 5Ь
и лишь в пределе, при G ~ оо, устанавливается равенство
S2 = 5i
На фиг 2 21 показана зависимость 5г/5! = f(G/St). Из гра-
фика следует, что для того, чтобы потери скорости откачки
СВОБОДНЫЕ ГАЗЫ
81
не превышали 10%, проводимость G должна быть по крайней
мере в 10 раз больше, чем Si
2.11.2.10. Негерметичность. Повышение давления в закрытом
вакуумном сосуде с течением времени указывает на наличие не-
герметичности (течи)
Действительная негерметичность возникает вследствие неточ-
ности соединений, образования трещин, несовершенства в изго-
товлении или вследствие применения материала, проницаемого
для газов.
Фиг 2 22 Рост давления р со вре-
менем т при действительной и мни-
мой негерметичности.
1—действительная негерметичность, давле
нив растет вплоть до атмосферного, 2—мни
мая негерметичность, давление устанавли
вается на определенном урозне р' (при Т'}
или р" (прн Т").
Мнимая негерметичность проявляется как десорбция газов с
поверхностей, находящихся в вакуумном пространстве, а именно
со стенок, электродов и т д , обычно она связана с применением
неподходящих материалов и недостаточным обезгаживанием ва-
куумной системы
Действительной негерметичности соответствует в целом ли-
нейное возрастание давления в системе со временем (фиг 2 22),
ибо поток газа из окружающей среды в вакуумную систему (при
низком давлении р в ней) практически постоянен В самом деле,
поток газа через действительную негерметичность GR н
/д н==<?д н(ра — р) ~ GA нра (2.181)
можно считать постоянной величиной. В формуле (2 181) вели-
чина ра (ра р) обозначает атмосферное давление
В случае мнимой негерметичности по мере возрастания дав-
ления в системе десорбция уменьшается и становится равной
82
ГЛАВА 2
нулю в момент установления состояния равновесия при опреде-
ленных давлении р( и температуре 7\. При более высокой тем-
пературе Т2 равновесное давление pz будет также выше.
Если в системе объемом V в течение времени т произошло
повышение давления на Др, то поток через негерметичность со-
ставит
= (2.182)
(единицы: Тор-л-с-1, л, Тор, с).
Если давление в вакуумной системе поддерживают (благо-
даря непрерывному откачиванию) на постоянном уровне, то
dpldx = const, и поток десорбции /део в этих условиях можно
считать постоянным.
Для многих материалов экспериментально определен удель-
ный поток (интенсивность) десорбции h,Rec, т. е. десорбции с
1 см2 поверхности при данной температуре. Такие данные позво-
ляют вычислить поток десорбции с поверхности А:
Дес“Л,дес-А. (2.183)
Величина десорбции разных материалов (см. табл. 3.18) за-
висит от степени обезгаживания. Например, листовая нержавею-
щая сталь толщиной 2 мм после выдерживания в течение 75 ч
при температуре ~573 К имеет удельный поток десорбции
/1,дес — 10-12Top л с-1 см-2.
После обезгаживания при еще более высоких температурах
(например, 1173 К) удельный поток десорбции понижается до
~ 10“15 Тор-л-с-1-см-2. Такую низкую десорбцию можно полу-
чить у хороших сортов стекла после предварительного обезга-
живания в течение длительного времени при высокой темпера-
туре.
2.11.2.11. Остаточное давление. Когда объемная скорость от-
рицательна (S <0), т. е. при откачивании (или сорбции), давле-
ние, согласно уравнению (2.168), должно стать равным нулю
через бесконечно долгий промежуток времени. Следовательно,
на практике такое состояние недостижимо. Так как в вакуумной
системе всегда имеются какие-либо источники газов (например,
течи), то обычно после периода откачки разумной продолжи-
тельности достигается предельное (остаточное) давление > 0.
Связь между р^, /п и S следует из уравнения (2.161), а
именно
Роо = -^- (2.184)
СВОБОДНЫЕ ГАЗЫ
83
Таким образом, в этом случае уравнение изменения давления
в замкнутом сосуде по времени (уравнение откачки) принимает
вид
Р = Poo + (Ро - Р J ехр [ - у- т]. (2.185)
При роо ро уравнение (2.185) сводится к более простому виду
Р^ А» + Aiexp [ — у т] (2.186)
или, учитывая уравнение (2 184),
р~+роехр[ —у т|. (2.187)
Существование остаточного давления можно также интерпре-
тировать как зависимость скорости откачки 5 от давления р:
Sp = s(l--^). (2.188)
При давлении р р,х можно считать Sp ~ S = const; с тече-
нием времени откачивания р уменьшается, р^р увеличивается,
Sp уменьшается и при р = р^ получаем Sp — 0.
Фиг. 2.23 Понижение давления в за-
висимости от времени откачивания
при различных значениях отноше-
ния S/V Штриховые кривые соот-
ветствуют остаточному давлению
р = 10~4 Тор
На фиг. 2 23 представлены в логарифмически линейных коор-
динатах характеристики откачивания (р0 = 760 Тор, роо =
= 10~4 Тор) для двух значений отношения S/V', чем больше это
отношение, тем быстрее снижается давление.
В. ПРОВОДИМОСТЬ ВАКУУМНЫХ СИСТЕМ
Для вакуумной техники важным вопросом является количе-
ственное определение течения газов, вызванного существующей
в системе известной разностью давлений.
Так как элементы вакуумных систем (соединительные трубо-
проводы, отверстия и др.) имеют разные конфигурации, условия
84
ГЛАВА 2
течения газа в них также бывают различными (по температуре,
числу Кнудсена и т. п.).
В некоторых системах течение может быть настолько слож-
ным, что такие системы приходится анализировать индивидуаль-
но. Однако некоторые результаты обобщенного рассмотрения
позволяют выявить методы, при помощи которых с достаточной
степенью точности можно рассчитать различные элементы си-
стем, а также составленные из них более сложные системы.
При определении проводимости элементов учитывается фор-
ма проточных каналов и отверстий и режим течения (вязкий,
молекулярный, промежуточный).
Для техники высокого вакуума типичным является течение
в молекулярных условиях.
2.12. ПРОВОДИМОСТЬ ОТВЕРСТИЙ
Самым простым элементом вакуумной системы, на котором
может возникнуть перепад давлений (рг — Pi), является отвер-
стие (фиг. 2.24).
2 /
Фиг. 2.24. Проводимость отверстия
площадью А (диаметром D) в пло-
ской стенке неограниченных разме-
ров (1,2 —области вакуумной си-
стемы).
Предполагается, что отверстие, имеющее площадь До, сдела-
но в плоскости бесконечно тонкой и неограниченной по величине
пластины, т. е. молекулы попадают в отверстие из объема 2 под
пространственным углом 180° и под таким же углом выходят
в объем 1, причем во всех точках объемов 1 и 2 господствуют
давления соответственно р< и рг- Если рг > pi, то газ течет из
объема 2 в объем 1.
2.12.1. Молекулярные условия
В случае молекулярных условий (Ao > L) вывод выражения
для проводимости отверстия довольно прост.
Количества молекул газа, проходящих за 1 с через 1 см2 пло-
щади отверстия со стороны а и со стороны Ь, соответственно
СВОБОДНЫЕ ГАЗЫ
85
равны V1 (6)— 4 «2Уар 4 far ^ар, (2.189) Vl (а) = ^ар, (2.190)
а количество молекул, прошедших за 1 с в направлении от а к Ь,
описывается формулой
а) — VI (6) — VHO) = (?2 — Р1)- (2 191)
Поток газа через отверстие площадью До, согласно форму-
ле (2.191), составит
I =|Мо(р2-Р1)> (2.192)
проводимость же отверстия в соответствии с формулой (2.170)
будет
(2-193)
Если скорость vap выражена в см-с-1, До — в см2, то G будет
иметь размерность см3-с-1.
Выражая vap с помощью формулы (2.11) и заменяя см3 на л,
получаем
Go =3,65)/-^ До (2.194)
(единицы: л-с-1, К, г-моль-1, см2).
Следовательно, проводимость отверстия пропорциональна его
площади1). Из формулы (2.193) видно, что коэффициентом про-
порциональности является средняя арифметическая скорость мо-
лекул, которая возрастает вместе с температурой и уменьшается
с увеличением массы молекул, как это вытекает из формулы
(2.194). Таким образом, например, для водорода проводимость
примерно в 4 раза больше, чем для воздуха. При температуре
жидкого гелия (~4 К) проводимость в ~9 раз меньше, чем при
комнатной температуре (~300К). Для воздуха при комнатной
температуре (Л40 = 29, Т = 293 К) проводимость
О0^11,6Д0 (2.195)
(единицы: л-с-1, см2), а удельная проводимость (До = 1) для
воздуха
G0i = ll,6 (2.195а)
(единицы: л • с-1 • см-2).
') Форма отверстия не оказывает существенного влияния на его прово-
димость, за исключением случая щели, длина которой соизмерима с Хо.
86
ГЛАВА 2
В случае круглого отверстия диаметром Do имеем Ао =
что после подстановки в формулу (2 194) дает
Go = 2,85]/ -^Dl (2.196)
(единицы: л-с-1, К, г-моль-1, см2).
Для воздуха при Т = 293 К
Gj = 9,1Dj
(2.197)
(единицы: л-с-1, см).
Фиг 2 25 Проводимость отверстия
площадью Ло (диаметром Do) в стенке
конечных размеров (площадью А и
диаметром D).
Проводимость для газа X с молекулярной массой Мо,х при
температуре Т находят по известным данным для воздуха из
формулы
6т. «о., = 6т. 0,315Ог„ „„ /(2.198)
В табл 217 приведены значения удельной проводимости
круглого отверстия GOi для водорода, воздуха и углекислого газа
при некоторых характерных температурах.
Таблица 2.17
Удельная проводимость отверстия в молекулярных условиях
для Н2, воздуха и СО2 при разных температурах
Газ м0 Проводимость Goi л с" м2
4,2 К (ЖИДКИЙ Не) 77 К (жидкий N2) 193 К (твердый С02) 273 К 293 К 373 К 773 К
н2 2 5,3 22 36 43 44 50 72
Воздух 29 ’,4 5,9 9,4 11,2 11,6 13 18,8
со2 44 1,1 4,8 7,8 9,1 9,4 10,6 15,3
2.12.1.1. Отверстие в стенке конечных размеров. Если поверх-
ность, в которой имеется отверстие, не бесконечна, а имеет огра-
ниченную площадь А (фиг 2 25), то проводимость отверстия Ао
СВОБОДНЫЕ ГАЗЫ
87
увеличивается по мере уменьшения отношения А/Ао. В случае
цилиндрического резервуара с отверстием в основании цилиндра
увеличение проводимости отверстия вызывается в некоторой сте-
пени фокусирующим действием, которое оказывает цилиндр диа-
метром D на молекулы газа, движущиеся в резервуаре в направ-
лении отверстия До.
Это влияние можно учесть, заменяя площадь Ао отверстия
эффективной площадью
(2.199)
При А — До резервуар превращается в трубопровод с попе-
речным сечением, равным площади отверстия.
Вводя в формулу (2.195) А' вместо До, получим следующее
выражение1) для проводимости отверстия (в случае воздуха):
G'= 11,6 До—Ц-т-. (2.200)
1 -
Полное сопротивление отверстия в стенке конечных размеров
определяется формулой
ir0 = -V = ------- = —- (J-------Ц, (2.201)
Go GQ G 11,6 \Л0 А)
где Go и G — проводимости отверстий диаметром Da и D соот-
ветственно.
2.12.2. Вязкостные условия
Формулы, описывающие течение газа в вязких условиях че-
рез отверстия, значительно сложнее, а проводимость зависит от
отношения давлений p2/Pi перед отверстием и после него.
Например, удельная проводимость отверстия для воздуха при
7300 К и £2 — 760 Тор вычисляется по формуле Прандтля:
G0I = 76,6 /Г- (/Ш)0’288 (при р,/р2>0,53). 12.202а)
1 ~ Р1/Р2
При pjp2 С 0,53 эта формула приобретает вид
г ~ 20
°01- 1-щ/Р?’
(2.2026)
’) Следует учесть, однако, что цилиндр диаметром D с отверстием Ао
на выходе имеет ограниченную проводимость на входе, тогда как неограни-
ченной поверхности с отверстием соответствует бесконечно большая прово-
димость
При А — Ав проводимость отверстия становится бесконечно большой,
так как оно составляет бесконечно малую часть трубопровода, имеющего ко-
нечную проводимость
88
ГЛАВА 2
а при ptlpz <С 0,53
G01 20
(2.202в)
(единицы: л • с-1 • см-2).
Как следует из формулы (2 202в), при малых давлениях pi
в вязкостных условиях проводимость не зависит от pi.
2.12.3. Промежуточные условия
Еще более сложными становятся рассмотренные выше зави-
симости для промежуточных условий.
Фиг. 2.26. Зависимость удельной проводимости отверстия <?о( (диаметром
0 = 5 см) от числа Кнудсена О/Лэ для воздуха при температуре 293 К-
На фиг. 2.26 показана в качестве примера зависимость удель-
ной (на 1 см2) проводимости отверстия G0l для воздуха при тем-
пературе 293 К от числа Кнудсена D/Ko, с помощью которого
давление ро выражается как ро = (£>Мо) • 10-3 (для отверстия ‘)
D = 5 см). Как видно из кривой, при р < 10-4 Тор имеет место
явно выраженный молекулярный режим течения (Goi —
~ 12 л-с-'-см-2), при р>1 Тор — вязкостный (Gqi~
~20 л-с-1-см~2), а при 10~3 р 10~* Тор — промежуточный^
) Следует обратить внимание на то, что Goi относится к площади 1 см2
отверстия диаметром D = 5 см.
СВОБОДНЫЕ ГАЗЫ
89
2.13. ПРОВОДИМОСТЬ КАНАЛОВ
Отверстие в бесконечно тонкой пластине можно рассматри-
вать как своего рода канал, соединяющий два пространства, раз-
деленные этой плоскостью. Такое отверстие можно считать объ-
емом бесконечно малой длины с поперечным сечением Ло.
Проводимость Go отверстия определяется формулой (2.194),
из которой следует, что проводимость эквивалентна объемной
скорости течения So газа, втекающего под давлением р в отвер-
стие, когда давление с другой стороны отверстия равно нулю.
Если за отверстием начинается трубопровод (длиной L и се-
чением Ло), в который поступает газ (фиг. 2.27), то поток газа
L
6L
Фиг. 2.27. Проводимость канала с поперечным сечением Аэ и длиной L.
в плоскости отверстия при давлении р4 окажется меньшим по
сравнению со случаем, когда трубопровод за отверстием отсут-
ствует (т. е. его длина равна нулю). Это связано с трением газа
о стенки трубы.
Влияние трения в вязкостных условиях понятно; в молеку-
лярных же условиях, когда определяющими становятся столкно-
вения молекул со стенками, явление трения можно истолковать
следующим образом.
Небольшая часть молекул газа, попадающих на вход кана-
ла L, поступает непосредственно в отверстие Ло, остальные же
ударяются о стенки трубопровода. Эти молекулы не сразу отра-
жаются от стенок, а некоторое время удерживаются на поверх-
ности (межмолекулярными силами). Направления их последую-
щего вылета с поверхности стенок описываются рассмотренным
выше вероятностным распределением (закон Кнудсена). В связи
с этим часть составляющей скорости молекул в направлении
движения теряется. Чем длиннее трубопровод и чем меньше его
диаметр, тем больше таких отражений и, следовательно, больше
сопротивление течению газа.
Таким образом, импеданс отверстия = 1/GO возрастает на
величину W = 1/Gl, и импеданс канала вакуумной системы
90
ГЛАВА 2
выражается формулой
Г = Г£ + ^о = т^ + -^. (2.203)
Д 0
Когда длина трубопровода L уменьшается до нуля, импеданс
WL становится равным нулю, а импеданс отверстия 1К0 остается
неизменным. Импеданс отверстия можно не учитывать лишь в
тех случаях, когда длина трубопровода намного больше его диа-
метра.
Теория позволяет вычислить проводимость трубопровода для
молекулярных и вязкостных условий; для промежуточных усло-
вий проводимость определяется путем интерполяции.
2.13.1. Молекулярные условия
2.13.1.1. Длинный канал с круговым сечением. Обычно кана-
лы (трубопроводы) имеют конечную длину, а их сечение может
иметь различные формы. Наиболее простым каналом является
цилиндрическая труба кругового сечения диаметром D и дли-
ной L, на одном конце которой давление равно pt, на другом р2
(pz> Pi). Предполагается, что L » D (фиг. 2 28). В случае
Фиг. 2 28. Цилиндрический трубопровод длиной L и диаметром D.
%о L молекулы газа движутся индивидуально; часть их дви-
жется непосредственно по трубе, не касаясь стенок, другие же
соударяются со стенками и перемещаются зигзагообразно. Вви-
ду того что период пребывания на стенке имеет конечную вели-
чину, молекула теряет часть скорости в направлении оси кана-
ла х, что равнозначно трению газа о стенки.
Так как сила трения преодолевается перепадом давлений
р2— pi, то должно выполняться условие равновесия двух сил:
1) силы F+, соответствующей перепаду давлений р2 — pt и
действующей на «столб» газа с основанием 'Дл/)2,
/7+ = 4я£)2(Р2 —Pi); (2.204)
2) силы трения F_, определяемой частотой соударений vnoz.
молекул газа со стенками трубы (площадью nDL) и составляю-
щей vx скорости массы газа.
СВОБОДНЫЕ ГАЗЫ
91
Частота соударений в 1 с определяется формулой
v'nDL = -^navapnDL, (2.205)
где по — средняя концентрация, вычисляемая по среднему дав-
лению
A) = y(Pi + Р2) (2.206)
как
nQ=-.pC3]kT. (2.207)
Что касается составляющей скорости vx, то ее находят, при-
нимая во внимание то, что изменение количества движения моле-
кулы при соударении со стенкой равно movx.
Произведение частоты соударений v'nDL на изменение коли-
чества движения tnovx дает полное изменение количества движе-
ния в секунду, или силу трения:
F- = v'nDLinovx = -J noV^nDLmoVx. (2.208)
Из равенства F+ = F_ следует
4 nD2 (р2 — pj = 1 nDLnotnovapvx. (2.209)
Отсюда после подстановки р0 вместо па находим
°-77 <2-210)
Движение столба газа с основанием со скоростью vx
эквивалентно объемной скорости течения 'ДлД2^, т. е.
^L = ±nD2vx. (2.211)
Учитывая давление ро, получаем общий поток газа
1=^-=р^=1’>1ур^- <2-212)
Из более строгого рассмотрения *) следует, что выражение
(2 212) должно содержать множитель 8/Зл (~0,85); таким об-
разом,
7 = А ' nD2p0vx = 4 D2p0vx. (2.213)
01 Ч О
') С учетом отношения скоростей Vx/oap и удаления различных точек те-
чения от стенок трубы.
92
ГЛАВА 2
Подставляя в формулу (2.212) вместо vx выражение (2.210),
вместо г?ар — выражение (2.11) и заменяя т0 на Мо, получим
/=3,81-^^(р2-Р1)
у Мо L
(2.214)
и проводимость длинного трубопровода
= —-— = 3,81^Х — (2.215)
-Р1 ’ А
(единицы: л-с-1, К, г-моль-1, см3, см).
Проводимость трубопровода прямо пропорциональна его диа-
метру в третьей степени и обратно пропорциональна длине; она
возрастает с повышением температуры и с уменьшением молеку-
лярной массы газа.
При Т — 293 К и Мо — 29 (например, для воздуха) прово-
димость длинного канала
GL~12,1-^ (2.216)
(единицы: л-с-1, см3, см).
Другой вид формулы для проводимости канала (в отношении
воздуха). Заменяя в формуле (2.216) диаметр D радиусом
г — *J2D и выражая его в мм, длину L — длиной I (также в мм),
получаем формулу (для воздухафв более легком для запомина-
ния виде
(2.217)
(единицы: л-с-1, мм3, мм).
2.13.1.2. Каналы с некруговым сечением. Во многих случаях
проводимость каналов с некруговыми сечениями можно вычис-
лить, заменяя некруговое сечение круговым с такой же пло-
щадью. В особых случаях применяют специальные формулы.
Длинный канал с прямоугольным сечением. Проводимость
канала длиной L с прямоугольным сечением шириной а и высо-
той b (L а ~ Ь) для воздуха при комнатной температуре
описывается формулой
°=‘3|тгтж’|'(т)-
График зависимости Чг(а/6) представлен на фиг. 2.29 (Клау-
зинг).
При аД ~ 1 прямоугольное сечение можно заменить круго-
вым той же площади, а при аД > 1 необходимо вводить по-
правку, определяемую функцией Т.
Длинный щелевой канал с прямоугольным сечением. Прово-
димость щелевого канала с размерами, указанными на фиг. 2.30
СВОБОДНЫЕ ГАЗЫ
93
(L > h, b h и h < Хо), для воздуха при комнатной темпера-
туре вычисляют по формуле
(2.219)
а/в
Фиг. 2.29. Зависимость Y от а/Ь.
Фиг. 2.30. Щелевой канал прямоугольного сечения
Зависимость T(L/b) приведена на фиг. 2.31, причем, если
L/b 10, то 4(L/b) ~lg(L/6).
Длинный канал с кольцевым сечением. Проводимость длин-
ного канала с кольцевым сечением (фиг. 2.32) для воздуха при
94
ГЛАВА 2
Фиг. 2 32. Канал кольцевого сечения.
Зависимость W (£>2/^1) для такого канала представлена на
фиг. 2.33.
Искривленный канал. Изгиб или излом канала на угол <р
(фиг. 2.34) приводит к некоторому изменению проводимости, ко-
торое можно учесть поправкой на длину канала L (согласно
Клозе):
AZ, = 2,60-^-. (2.221)
СВОБОДНЫЕ ГАЗЫ
95
Короткие каналы Из формулы (2.216) следует, что по мере
уменьшения длины канала его проводимость возрастает и при
L = 0 должна стать бесконечно большой; разумеется, это невоз-
можно, так как остается отверстие, проводимость которого ко-
нечна.
Фиг. 2.34. Канал с искривлением или изломом на угол <р.
Таким образом, формула (2.216) справедлива только для
длинных каналов, для коротких же каналов следует учитывать
проводимость отверстия.
Для определения полной проводимости системы, состоящей
из расположенных последовательно отверстия и канала, рассмо-
трим формулу (2.203). Подставляя в нее вместо Gl и Go
96 ГЛАВА 2
соответствующие выражения, приведенные в формулах (2.196)
и (2.215), получим ___
= (-J- (2.222а)
+ 3 L
и ___
Gdl = 2,85 У D2---------. (2.2226)
1 + ~4~D
Первой из этих формул удобно пользоваться при D < L, а
второй — при D > L.
Канал переменного сечения. Если площадь поперечного се-
чения канала изменяется скачкообразно (фиг. 2.35), то такой ка-
нал можно рассматривать как несколько каналов с различными
сечениями, соединенных последовательно, а его сопротивление
вычислять по формуле, в которой Wi, W2 ... являются импедан-
сами отдельных участков:
Г = и^ + ^ + ^зЧ- ... (2.223)
При Ln Dn импедансы отверстий можно не учитывать, а
при Ln <С Dn необходимо их точно оценивать и учитывать.
Рассмотрим для примера систему последовательно соединен-
ных участков канала, заключенную между двумя бесконечными
поверхностями Р1 и Рп- Сначала определим импедансы самого
канала в виде
2 WL = WLy + WL, + + ..., (2.224)
а затем по формуле (2.201) учтем импедансы отверстий.
Анализ формулы (2.224) приводит к следующим выводам:
1. Если диаметры участков канала между поверхностями Pi
и Рп последовательно возрастают или уменьшаются или же до
определенного места уменьшаются, а затем возрастают
(фиг. 2.35), то импеданс отверстия для системы в целом равен
импедансу наименьшего отверстия 1Ео,миН, который следует при-
бавить к импедансу WL, а поэтому
^х=2Г1 + ^о,МиН. (2.226)
2. Если диаметры последовательных участков канала возра-
стают и уменьшаются (фиг. 2.36), то к импедансу WL следует
прибавить сопротивления участков канала с минимальными диа-
метрами, т. е. полный импеданс определяется следующим обра-
зом:
2 WL+ 2 1Е0,ми„. (2.226)
Это уравнение справедливо при условии, что объем участков
канала между минимальными диаметрами достаточно велик.
Фиг. 2.35. Каналы переменного сечения с одним минимальным диаметром
Фиг. 2 36. Каналы переменного сечения с
метрами
несколькими минимальными диа-
Фиг 2 37. Канал с диафрагмами. Фиг. 2.38. Конусообразный канал.
Фиг. 2 39 Вакуумная система с охлаждаемым участком.
4 Зак 510
98
ГЛАВА 2
Вышеприведенные соображения относятся также к каналам
с диафрагмами £),л и Д2/ (фиг. 2 37) Импеданс вакуумной си-
стемы, представленной на фиг. 2 37, описывается приближенной
формулой
Fs = + Wl3 + n?D1/2 + (2.227)
где U7O1/, W — импедансы отверстий с диафрагмами.
Конический канал. Для канала в виде усеченного конуса
(фиг 2.38) эквивалентный диаметр вычисляется по формуле
3 D\D2
Дэкв = 2 п ‘ (2.228)
“Г и2
Эта формула получается из уравнения
L
1/G2 = IT2= (1/12,1) [-g-t
о D*
в котором Dx — Di -ф (Z)2 — Z)i) (x/L).
2.13.1.3 . Зависимость проводимости канала в молекулярных
условиях от рода газа. Если известно значение проводимости
Для воздуха бвозд, то проводимость в молекулярных условиях
для газа X находят из соотношения
]/^TGb- (2-229)
Пример Вычислить импеданс вакуумной системы (фиг. 2.39)
с размерами D, = D3 = 2 см, £>2 =1 см, Ц = L2 = £3 = 5 см
для гелия при температурах (1) Л = Тг = Т-, = 293 К и
(2) = Тз = 293 К, Л = 77 К. Импеданс вакуумной системы
Случай 1.
= H'L. = тД у /4 = 0,02 с л-1,
^.=-пЬ4/5=°’15 с'л''-
^.= 9Тт/5=-°’04С'Л’‘’
17s = 0,23 с • л"1.
СВОБОДНЫЕ ГАЗЫ
99
Случай 2.
FL,= l7Ls = 0,02 с-л-1,
WLt = 0,15 =0,3 с-л-1,
I7d, = 0,64 |/-^- = 0,08 с л-1,
17s = 0,42 с л-'.
Как видим, в случае 2 импеданс вакуумной системы почти в
2 раза больше.
2.13.1.4 . Проводимость ловушки. При определении импеданса
охлаждающей ловушки следует учитывать неодинаковые темпе-
ратуры разных ее участков. Например, ловушка, представленная
Фиг 2 40. Криогенная ловушка с раз-
личными температурами стенок
{РА<Рв>
на фиг. 2.40, может быть разделена на несколько участков
(табл. 2.18), для которых проводится подсчет сопротивления те-
чению с учетом температур.
2.13.1.5 . Другие методы вычисления проводимости. В случае
систем или трубопроводов более сложной конфигурации течение
газа в молекулярных условиях можно анализировать с помощью
других методов. Одним из таких методов является статистиче-
ский метод Монте-Карло, заключающийся в определении воз-
можных траекторий движения молекул, поступающих в трубо-
провод, и молекул, возвращающихся ко входному отверстию по-
сле отражения от стенок. При этом предполагается, что для
отражения молекул от стенок справедлив закон косинуса.
4*
100
ГЛАВА 2
Таблица 2.18
Элементы ловушки (фиг. 2.40)
Параметр Участок
1 2 3 4 5 6 7
Темпера- тура Диаметр Длина Примечание То Di Ц Трубо- провод To~Tt Di 1-2 Трубо- провод Ti DdD2 0 Отвер- стие Г, Dt/D2 l2 Кольце- вой трубо- провод 1 0 D2/Dt Тз Трубо- провод То D< 0 Отвер- стие То Ц Трубо- провод
При большом количестве молекул вероятности прохода моле-
кул через трубопровод; вычисляются на ЭВМ, а проводимость
входного отверстия умножают на этот показатель. Можно при
этом дополнительно учитывать характеристики поверхностей
(стенок), с которыми сталкиваются молекулы, и потерю скоро-
сти молекул (коэффициент прилипания и время пребывания; см.
гл. 3).
Метод Монте-Карло трудоемок, особенно в применении к ва-
куумным системам сложной конфигурации. Упрощенным вари-
антом его является метод графоаналитического моделирования
на плоскости.
2.13.2. Вязкостные условия
В вязкостных условиях сопротивление течению газа опреде-
ляется его вязкостью. Молекулы газа, находящиеся вблизи сте-
нок трубопровода, имеют меньшую скорость, чем молекулы, на-
ходящиеся вблизи оси (фиг. 2.41). Составляющая vx скорости
молекул газа, прилегающих к стенке, в первом приближении
равна нулю.
2.13.2.1. Длинный канал с круговым сечением. В канале с
круговым сечением распределение скоростей имеет, очевидно,
осевую симметрию. Столб газа, содержащийся в цилиндре ра-
диусом г, перемещается под действием силы, равной произведе-
нию разности давлений р2 — pi на поверхность яг2:
F+ = яг2 (р2 — Pi)- (2.230)
Эта сила уравновешивается силой трения Д_, приложенной
к цилиндрической поверхности 2яг£ столба газа.
Учитывая коэффициент вязкости цг и обозначая через dvxfdr
градиент составляющей скорости щ по радиусу г, можно опреде-
СВОБОДНЫЕ ГАЗЫ
101
лить силу трения следующим образом:
f_ = -nr2nrL^. (2.231)
Приравнивая силы F+ и У7-, получим уравнение
лг2(р2 — Pi) = 2лгАтЦ—(2.232)
откуда находим
= (2.233)
После интегрирования этого уравнения получаем
vx = P24^l' г2 + const (2.234)
При г = D/2, т. е. на стенке, имеем vx = 0, и, следовательно,
Таким образом, распределение скоростей vx вдоль радиуса
описывается уравнением
= (2.235)
которое графически выражается параболой (фиг. 2.41).
Фиг. 2.41. Вязкое течение в цилиндрической трубе.
Элементарный объемный поток газа, проходящий со скоро-
стью vx через кольцевую площадку радиусом г и шириной dr за
период времени 1 с, выражается следующим образом:
d (тг-) — vx dAr = 2nvxr dr, (2.236)
\ «т /р0
где
ро = ^(р1^р2) (2.237)
есть среднее давление в потоке газа.
102
ГЛАВА 2
Вводя вместо vx выражение (2.235), получаем
d Ш = 2^Г “ r2)r dr (2-238)
Объемный поток газа, проходящий в течение секунды через
все сечение А канала (объемная скорость течения), будет равен
V2d
dl7 л , . f I D2 z\ j я D* . .
\ \-T-r)rdr = -^-L^-P^
(2.239)
Таким образом, общий поток газа при давлении ро опреде-
ляется уравнением
<2-240>
Отсюда можно определить проводимость канала для вязкост-
ных условий:
G = -W/’°4- (2.241)
(единицы: см3-с-], г-см_1-с-1, дин-см-2, см4, см). Переходя от
см3-с-1 к л-с-1 (делением на 1000) и от дин-см-2 к Тор (умно-
жением на 1333), получим формулу Пуазейля
Для воздуха при температуре окружающей среды (Т ~ 293 К)
коэффициент вязкости т]возд равен 1,8-10~4. Подставляя эту вели-
чину в формулу (2.242), получим
П4
Свозд= 181р0-^- (2.243)
(единицы: л-с-!, Тор, см4, см).
Из формулы (2.242) следует, что в вязкостных условиях про-
водимость цилиндрического канала прямо пропорциональна дав-
лению и четвертой степени диаметра, а также обратно пропор-
циональна длине канала; кроме того, она зависит от рода газа
и больше для газов с малой вязкостью, т. е. с малой молекуляр-
ной массой и большим размером молекул.
2.13.2.2. Короткие каналы с некруговыми сечениями. Формулы
для таких каналов более сложны, и их часто получают эмпири-
ческим путем. Различные формы сечения можно учесть, вводя
коэффициент формы в формулы для трубопроводов кругового
сечения.
СВОБОДНЫЕ ГАЗЫ
ЮЗ
2.13.2.3. Зависимость проводимости канала в вязкостных ус-
ловиях от рода газа. Проводимость каналов в вязкостных усло-
виях для различных газов (по отношению к воздуху при Т =
= 293 К) можно представить зависимостью
Ивозд dp, X /~ Мд, в03д
^еозд Лх *0, возд ' **0, X
(2.244)
где do — диаметр молекул, а Ж — молекулярная масса газа.
2.13.3. Промежуточные условия
Для промежуточных условий применяют эмпирические фор-
мулы, основанные на комбинации формул, полученных для моле-
кулярных и вязкостных условий. Такой является формула Кнуд-
сена:
Опр == Связк + aGMn, (2.245)
где ОВяак — проводимость для вязкостных условий (2.242),
Смол — проводимость для молекулярных условий (2.215),
Фиг. 2.42. Зависимость проводимости G капала от давления р0 (воздух, тем-
пература 293 К, L — 10 см, D = 1 см).
а — коэффициент, который для воздуха (и подобных ему газов)
при -~300 К описывается эмпирическим выражением
__ 1 + 250рэД
1+310р3П’
(2.246)
где ро измеряется в Top, a D — в см. Коэффициент а в широком
диапазоне давлений изменяется от 1,0 до 0,8. Принимая среднее
значение а — 0,9, можно записать формулу (2.245) в простом
виде
Опр ~ бвязк + 0,9бмол. (2.247)
Подставляя вместо Связи и Смол соответствующие выраже-
ния, получим (для воздуха) формулу проводимости канала
104
ГЛАВА 2
длиной L и диаметром D (при L D) в широком диапазоне
давлений
Gnp ~ 180р0 + 12 4" = 12 Т-(1 + 15РоО- (2.248а)
График, показанный на фиг 2.42, представляет собой зави-
симость проводимости Gnp для воздухопровода (длиной L —
= 10 см и диаметром D = 1 см) от давления ро.
2.14. ТЕЧЕНИЕ ГАЗА В КАНАЛАХ МАЛОГО
ПОПЕРЕЧНОГО СЕЧЕНИЯ
2.14.1. Течение газа через капилляр
Применительно к негерметичностям важно знать законы те-
чения газа через длинный и узкий канал (капилляр), на одном
конце которого господствует низкое давление (р~ 0), а на дру-
гом конце — атмосферное (р = 760 Тор). Течение через такой
капилляр может иметь вязкостный, промежуточный или моле-
кулярный характер.
Для определения потока газа через капилляр можно исполь-
зовать формулу (2 248а). Для элемента dL капилляра (фиг. 2 43),
которому соответствует перепад давлений dp, можно записать
' = >• (2.248)
где dW — импеданс элемента длиной dL.
Из формулы (2.248а) находим
W 1 + 15£)р (2.249)
И
<2-250>
Следовательно,
/= 12Д3(1 + 15Др)-^-, (2.251)
откуда
/ [ dL — IL — 12D3 j (1 + 15Z)p)dp. (2.252)
о* о
После интегрирования получаем
/ = 9,1 • 103-^(1 +5700D) (2.253)
(единицы: Тор-л-с-1, см3, см).
w
Фиг 2 44 Изменение давления по длине капилляра (L = I см, D= 10 см).
На одном конце (х = 0) давление р ~ 0, на другом (х= 1 см) р=рс —
-760 Тор
106
ГЛАВА 2
Из уравнения (2.251) находим
= + l5Dp)dp. (2.254)
После интегрирования, обозначая расстояние, отсчитываемое
от конца капилляра (где pi = 0), через х, получим выражение
для распределения давления вдоль капилляра
х=^-р(1 +7,5Dp). (2.255)
На фиг. 2 44 представлена кривая изменения давления в ка-
пилляре длиной L = 1 см, диаметром D = 10~3 см, в котором
под влиянием разности давлений ра = 760 Тор и р = 0 уста-
навливается поток газа / = 6,1-10~8 Тор-л-с-1. Почти все па-
дение давления происходит на коротком участке капилляра
вблизи его конца, где рс^О.
2.14.2. Течение газа сквозь пористую стенку
Течение газа сквозь пористую стенку можно рассматривать
как течение через капилляры под влиянием разности давлений,
имеющих место по обе стороны стенки.
При этом важно знать параметры пористости, которые для
разных материалов определяются опытным путем. Такими пара-
метрами являются концентрация пор в объеме 1 см3, а также их
средний диаметр. Например, для фаянса (неглазурованного)
средний диаметр пор имеет порядок 1СМ см, а их концентрация
10е см-3.
3. Связанные
газы
3.0 . ОБЩАЯ ХАРАКТЕРИСТИКА
Газы, находящиеся на поверхности, поглощенные материа-
лом или содержащиеся в нем в виде объемных включений (на-
пример, в порах или трещинах), называются связанными. Свя-
занные газы могут переходить в свободное состояние и повы-
шать давление в замкнутом объеме, возможен и обратный
процесс — переход газов из свободного состояния в связанное.
В вакуумированном объеме, кроме газов, имеются пары раз-
личных веществ (металлов, синтетических материалов, смазок,
масел и т. д.).
Вследствие растворения и диффузии газов в твердых телах
возможно проникновение газов из окружающей среды внутрь
сосудов через их стенки *).
Твердые тела всегда содержат некоторое количество газов,
которые выделяются при определенных условиях. Количество и
род выделенного (или поглощенного) газа зависит от свойств
материала и его термовакуумной «истории». Процессы сорбции
и десорбции определяются свойствами материала и параметра-
ми окружающей среды (температурой, давлением и др.).
3.0 .1. Сорбция и десорбция газов
В понятие сорбции входят адсорбция, т. е. явление прилипа-
ния частиц газа к поверхности твердого тела под действием мо-
лекулярных сил притяжения, и абсорбция — явление проникно-
вения частиц газа внутрь твердого или жидкого тела. Если
концентрация газа внутри тела меньше равновесной, то газ, ад-
сорбированный на поверхности, может переходить внутрь тела
(под его поверхность), превращаясь в абсорбированный газ.
В металлах, например, с повышением температуры абсорб-
ция растет, тогда как адсорбция уменьшается. Адсорбция газов
‘) Явление проникновения газа не следует путать с обычным протека-
нием газа через неплотности (негерметичности) в стенках, возникающие
вследствие недоброкачественности соединений, образования щелей и т. п.
108
ГЛАВА. 3
проявляется отчетливо уже при комнатной температуре и ин-
тенсифицируется с понижением температуры по мере приближе-
ния к точке конденсации. Различные металлы по-разному ведут
себя в отношении адсорбции и абсорбции тех или иных газов.
Десорбция — это явление, обратное сорбции; оно состоит в
освобождении сорбированных газов. Основной причиной десорб-
ции является повышение температуры, вызывающее усиленные
тепловые колебания молекул материала. Десорбция может так-
же происходить под влиянием других факторов, например в ре-
зультате бомбардировки поверхности электронами или ионами,
вследствие механического трения, под действием электромагнит-
ного излучения соответствующей длины волны и т. п.
3.0.2. Материалы, применяемые в вакуумной технике
С учетом важной роли, которую играют сорбция и десорбция
газов, материалы, применяемые в вакуумной технике, особенно
в технике высокого и сверхвысокого вакуума, а также способы
их обработки должны отвечать определенным требованиям.
Наиболее важными из них являются: по возможности малое вы-
деление такими материалами газов и паров, малая способность
к поглощению и малая проницаемость для газов. Это значит,
что материалы, применяемые в вакуумной технике, должны об-
ладать высокими чистотой и сплошностью, а также иметь низ-
кое давление паров при рабочих температурах. Кроме того, та-
кие материалы должны выдерживать высокие и низкие темпе-
ратуры и механические напряжения. Иногда приходится счи-
таться с электрическими характеристиками материалов, такими,
как диэлектрическая постоянная, прочность на пробой, изоли-
рующие свойства.
В вакуумной технике применяются главным образом метал-
лы, стекла и керамика. В области более низкого вакуума, а
также в динамических системах с большой скоростью откачки
применяются также некоторые органические природные или син-
тетические материалы, как, например, резина, пластики, смазки,
замазки и т. п.
Из металлов в вакуумной технике применяются такие, кото-
рые обладают высокой температурой плавления, низким давле-
нием паров и устойчивы по отношению к коррозии. Основные
конструкционные материалы для крупных вакуумных систем не
должны быть слишком дорогими. Поэтому часто применяются
сплавы металлов (таких, как железо, никель, хром), нержавею-
щие и кислотоупорные стали (например, хромоникелевая сталь
с 18% Сг и 8% Ni), а также алюминий, медь и некоторые ее
сплавы (без олова и цинка), например томпак. Для изготовле-
ния небольших вакуумных устройств, а также некоторых спе-
СВЯЗАННЫЕ ГАЗЫ
109
циальных элементов (например, электродов) применяют воль-
фрам, тантал, молибден, никель, платину и некоторые ее сплавы
(в частности, платиноиридиевый сплав).
Из стекол наибольшее применение находят тугоплавкие (так
называемые твердые), в частности борокремниевые (содержа-
щие 11 — 14% В2О3) и очень твердые алюмоборокремниевые (со-
держащие 3—8% В2О3 и ~20% А12О3). Вакуумные устройства,
изготовленные из твердых стекол, в зависимости от их состава
выдерживают температуру до 720—820 К.
В последнее время разработаны методы пайки стекла с раз-
личными металлами и их сплавами, причем спаи получаются
прочными и газонепроницаемыми; такие соединения могут быть
использованы при температурах от 0 до 720 К.
Керамики (сплавы некоторых окислов алюминия, магния
и т. п.) более устойчивы к механическим и термическим воздей-
ствиям, чем стекла. Многие керамические материалы газонепро-
ницаемы, обладают хорошими электрическими свойствами и об-
разуют плотные соединения с металлами и стеклами при усло-
вии использования промежутрчных веществ и соответствующей
технологии обработки.
В качестве уплотнителей разъемных соединений в приборах
не очень высокого вакуума применяются различные сорта ре-
зины и пластмасс. Силиконовые резины выдерживают темпера-
туры до 570 К. Часто для уплотнения небольших щелей при-
меняются аральдит и глипталь — материалы, изготавливаемые
из живицы (сырой древесной смолы) и полимеризующиеся на
воздухе.
Для уплотнения течей в невысоком вакууме применяются
специальные замазки, мастики и прокладки из материалов с
низким давлением паров.
Вакуумные смазки (с низким давлением паров) служат для
смазывания кранов, а также ниппельных и фланцевых соедине-
ний.
Особую группу материалов составляют вакуумные масла и
ртуть, применяемые в качестве рабочих веществ в некоторых
насосах, а также в измерительных приборах.
А. ГАЗЫ, АДСОРБИРОВАННЫЕ НА ПОВЕРХНОСТИ
Газы концентрируются на поверхности твердых тел благо-
даря явлению сорбции. Рассмотрение сорбции и десорбции, а
также равновесия между ними составляет предмет данного раз-
дела.
Основой явлений сорбции и десорбции являются силы и энер-
гия взаимного притяжения между атомами и молекулами, зави-
сящие от расстояний между ними.
fio
Глава з
3.1. ВЗАИМОДЕЙСТВИЯ В ГАЗАХ
3.1.1. Виды взаимодействий
Различают два основных вида взаимодействий между части-
цами:
1) слабые взаимодействия, существующие на больших рас-
стояниях между частицами и вызываемые слабыми силами с
большим радиусом действия (дисперсионные силы Ван-дер-Ва-
альса) ;
2) сильные взаимодействия, которым соответствуют меньшие
радиусы действия, а притяжение осуществляется при помощи
больших сил с малым радиусом действия (валентные силы).
3.1.2. Силы и энергия взаимодействия между частицами
Сила F и энергия W взаимодействия могут быть как элек-
тростатического, так и квантового происхождения. Они изме-
няются в зависимости от расстояния между центрами частиц и
превращаются — по мере уменьшения расстояния между части-
цами — из сил притяжения в силы отталкивания. Энергия W си-
стемы частиц в зависимости от расстояния г определяется фор-
мулой
F(r)= j F(f)dr. (3.1)
В случае равенства сил притяжения F_ и отталкивания F+ воз-
никает состояние равновесия
F- + F+ = 0. (3.2)
Частицы при этом располагаются на таком расстоянии друг от
друга, при котором потенциальная энергия W системы оказы-'
вается минимальной.
3.1.3. Энергия связей
Разрыв связей и удаление частиц друг от друга сопровож-
даются затратой работы, которая равна энергии, выделившейся
при соединении частиц. Эта работа совершается силами взаимо-
действия и выражается формулой
W = ( F (г) dr. (3.3)
г,
Это так называемая энергия связи. Она может быть выра-
жена в различных единицах — механических, тепловых или элек-
трических. Наиболее часто она выражается в тепловых едини-
СВЯЗАННЫЕ ГАЗЫ
111
цах, относится к одному молю вещества и обозначается Нсв
[ккал-моль-1]. Энергию в электронвольтах относят к атому (или
молекуле). Ниже приводятся некоторые пересчеты из одних еди-
ниц в другие:
Н [кал] = Г [Jpr] , (3.3а)
где / = 4,187-107 эрг-кал-1. 1 ккал = 0,26-1023 эВ; так как
1 моль содержит 6,023-1023 частиц, то
1 ккал • моль-1 = 2J =0,043 эВ • частица
Соединение атомов в молекулы всегда сопровождается вы-
делением избытка энергии (в виде тепла), тогда как для раз-
рушения связей между частицами нужно подвести соответствую-
щую энергию. При замене сильных связей более слабыми также
происходит выделение тепла (экзотермические реакции).
3.1.4. Силы и связи Ван-дер-Ваальса
Силы Ван-дер-Ваальса проявляются при взаимодействиях
между частицами, которые (каждая в отдельности), вообще го-
воря, электрически нейтральны; по мере сближения частиц про-
исходит их поляризация и возникают силы взаимного притяже-
ния между диполями.
Составляющими силы притяжения являются:
— дипольное притяжение (если обе частицы имеют стабиль-
ный электрический момент), которое зависит от взаимной угло-
вой ориентации диполей;
— • индуктивная сила (если одна из частиц имеет устойчивый
электрический момент);
— дисперсионная сила (существенная для неполярных ча-
стиц), которая возбуждается в одной частице вследствие коле-
баний другой частицы.
Силы притяжения обратно пропорциональны расстоянию
между частицами в седьмой степени
F_ = -a±. (3.4)
Энергии, соответствующие этим силам, не превышают
10 ккал-моль-1 (0,43 эВ-частица-1). Когда расстояние стано-
вится соизмеримым с диаметром частицы, явление усложняется,
так как возникают квантовые обменные взаимодействия, для ко-
торых характерны значительные силы притяжения или отталки-
вания Взаимное сближение двух частиц под влиянием сил при-
1яжения продолжается до тех пор, пока эти силы не уравнове-
сятся возрастающими по мере сближения силами отталкивания.
112
ГЛАВА 3
Силы отталкивания проявляются при взаимодействии как '
положительных зарядов ядер, так и электронных оболочек их
атомов (молекул). Они обратно пропорциональны расстоянию г
в степени и, где и > 9:
F+ = + b±-. (3.5)
Анализ функций, описывающих зависимость сил притяжения и
отталкивания от расстояния между частицами, показывает, что
эти силы становятся заметными на расстояниях, соизмеримых
с диаметрами атомов и молекул, т. е. на расстояниях 0,1—
0,2 нм.
Равновесие сил притяжения и отталкивания, устанавливаю-
щееся при расстоянии г0 между центрами частиц, соответствует
минимуму потенциальной энергии системы 4).
На фиг. 3.1 показаны кривые зависимости энергии W от рас-
стояния г0 между частицами для силы притяжения F_, силы от-
талкивания F+ и их равнодействующей в зависимости от рас-
стояния между центрами молекул (атомов). Нулевое значение
энергии соответствует бесконечно большому расстоянию между
частицами.
Описанное вандерваальсово взаимодействие относится к раз-
ряду слабых (физических). Такое взаимодействие характерно
для атомов инертных газов (в частности, Не, Аг, Ne), а также
для молекул двухатомных газов (Н2, О2, N2, С12) и некоторых
других химических элементов в жидком и твердом состояниях.
Вандерваальсовы силы возрастают с увеличением атомного но-
мера элемента, так как при этом увеличиваются размеры элек-
тронной оболочки атома и при поляризации возникает большая
деформация атома. Эти силы уменьшаются с повышением тем-
пературы.
Вандерваальсовы силы могут возникать между частицами
газов и паров, с одной стороны, и атомами или молекулами по-
верхностей макроструктур (например, поверхности кристалла,
кристаллической решетки, металла и т. п.) — с другой. Актив-
ные центры поверхностной структуры материалов способны свя-
зывать с помощью вандерваальсовых сил частицы газов. Ча-
стица газа, перемещающаяся вблизи поверхности, притягивается
расположенными вблизи узлами этой поверхности (фиг. 3.2) и
окажется связанной с одним из них, если под влиянием резуль-
*) Расстояние между центрами частиц зависит от температуры, для
Т = 0 К оно равно г0 С повышением температуры (Г>0К) частицы при-
обретают колебательное движение,' причем вследствие асимметрии кривой
энергии среднее расстояние между частицами возрастает, например, до зна-
чения г , соответствующего наиболее вероятному положению d центра ча-
стицы.
СВЯЗАННЫЕ ГАЗЫ
113
тирующего притяжения приблизится к нему. После того как по-
верхность покроется мономолекулярным слоем газа, силы вза-
имодействия становятся намного слабее.
Таким образом, вандерваальсовы связи имеют большое зна-
чение для вакуумной техники, поскольку они определяют пове-
дение газов и паров на стенках вакуумной системы.
Наличие активных центров на поверхности твердого тела мо-
жет вызвать миграцию частиц адсорбированного на поверхности
Фиг. 3.1. Зависимость энергии
связи W от расстояния г между
двумя обособленными частицами
— минимум энерги! системы, соот
ветствующий расстоянию г0 При темпе
ратуре Т мотекулы колеблются в пре
Делах а—с, точка d соответствует паи
более вероятному расстоянию между
центрами молекуп При Г«Э расстоя
ние между молекулами равно г0
газа от одного центра к другому. На этот процесс оказывает
влияние тепловое состояние поверхности и другие факторы
энергообмена.
Энергия, необходимая для миграции, меньше энергии физи-
ческих связей Силы же физических (вандерваальсовых) связей
зависят от места кристаллической решетки, на котором происхо-
дит связь, т. е. от расстояния между адсорбированной частицей
и активным центром поверхности, вследствие чего энергия связи
может меняться в определенных пределах. Когда полярная ча-
стица (например, молекула водяных паров, окиси углерода, ам-
миака и т п ) приближается к поверхности вещества, не про-
являющего полярности (например, металла), в этом веществе
114
ГЛАВА 3
возбуждается диполь «зеркального отражения» с противополож-
ным знаком (фиг. 3.3), вследствие чего возникает дополнитель-
ная (к дисперсионным силам) сила притяжения, которая тем
больше, чем больше полярность диполя. Кроме того, эта сила
зависит от взаимной ориентации диполя и его отражения.
Молекула
газа
I
I
I Поверхность металла
777777777777777777777777777777777777777
I
I
I
I -
I
1-^
/Х| Х)
/ I / Зеркальное
отображение
Фиг 3.2. Силы Ван-дер-Ваальса,
действующие на молекулу газа, на-
ходящуюся над поверхностью твер-
дого тела.
Фиг. 3.3 Зеркальное отражение по-
лярной молекулы (диполя) в непо-
лярном твердом теле.
В табл. 3.1 для примера приведены значения Го, а также
№мин для одноатомных и многоатомных газов в случае конден-
сации и испарения (слабые взаимодействия). Взаимное сбли-
жение частиц под действием сил Ван-дер-Ваальса и возникаю-
щая при этом связь между частицами могут оказаться переход-
ным этапом последующего проявления более сильных связей,
Таблица 3.1
Расстояния между центрами частиц г0 и энергии связи
(конденсации) IFMHH для некоторых газов
Частица ф Я к" Z О <! 1 О О £ О О 1
1 Z 1 О о
Параметр связи Я £ о <! О
г0, 10_ь см 2,56 2,93 3,68 3,43 3,42 3,59 3,61 3,97
F J'0“3 эВ 0,88 3,’8 7,89 9,76 Ю,7 9,50 16,3 16,3
| ккал • моль-1 0,0203 0,0735 0,182 0,225 0,246 0,2'9 0,377 0,377
СВЯЗАННЫЕ ГАЗЫ
115
если для этого возникнут благоприятные обстоятельства. На-
пример, из атомов однородных активных газов (Н, О, N) может
возникнуть частица с атомными (физическими) связями, а из
разнородных атомов (если будет подведена добавочная энер-
гия) может возникнуть частица с химическими связями (напри-
мер, С + О — СО).
В табл. 3.2 приведен ряд значений г0 и Жтш для сильных
(химических) связей, существующих в двухатомных молекулах.
Как видно из этих данных, расстояния между атомами здесь
меньше, а энергии связи значительно больше, чем в случае кон-
денсации (табл. 3.1). Например, для молекул водорода Н2— Н2
г0 = 2,93-IO-8 см, а Ц7МИН = 0,0735 ккал-моль-1, тогда как для
атомов водорода в молекуле Н + Н = Н2 г0 = 0,74-10~8 см, а
Ц7МИН = 103 ккал-моль-1.
Т аблица 3.2
Расстояния г0 между центрами молекул и энергии
связи (диссоциации) 1РМИН Для некоторых двухатомных газов
Мо лекул а Параметр связи С12 н2 о2 n2 со
г0, 10~8 см 2,0 0,75 1,2 1,1 1,13
W J эВ 2,48 4,5 5,1 7,4 П,1
мин ( ккал моль-1 57,1 103 117 170 256
3.1.5. Атомы и молекулы
Атомы редко (только разве у нейтральных газов и-паров ме-
таллов) встречаются в естественных условиях как самостоятель-
ные частицы, так как под действием сил взаимного притяжения
они обычно объединяются в молекулы или более крупные ком-
плексы. Минимальным комплексом атомов является молекула,
максимальным — кристаллическая решетка (например, у метал-
лов). Наибольшей стабильностью отличаются атомы инертных
газов, у которых внешняя электронная оболочка заполнена це-
ликом. Поэтому они не образуют более устойчивых соединений
с другими атомами.
Атомы с незаполненной внешней оболочкой стремятся объ-
единиться с другими атомами так, чтобы возникли системы с
заполненными оболочками. Это происходит путем вытеснения
избыточных электронов или заполнения оболочки недостающими
электронами, причем внешняя оболочка по своей структуре при-
ближается к ближайшему инертному газу в периодической си-
стеме. На этой основе происходит соединение атомов (или мо-
лекул).
116
ГЛАВА 3
Молекула — это минимальная частица вещества, обладаю-
щая теми же химическими свойствами, что и все вещество. Мо-
лекулы могут состоять из атомов одинаковых (например, Ог, Н2,
О3) или неодинаковых (например, СН4, НО). Атомы, состав-
ляющие молекулы, связаны между собой благодаря взаимодей-
ствию валентных электронов.
В зависимости от числа атомов в молекуле различают моле-
кулы одноатомные, двухатомные и т. д.
Форма молекулы тем сложнее, чем большее число атомов
входит в ее состав. Двухатомная молекула имеет несколько сте-
пеней свободы, благодаря чему она может проявлять (в зависи-
мости от рода тепловых колебаний) различные физические свой-
ства.
/
Фиг 3 4. Расположение атомов в молекуле озона О3, двуокиси углерода СО2
и воды Н2О.
Молекулы, состоящие из однородных атомов, относятся к не-
полярным. Молекулы, состоящие из разнородных атомов, яв-
ляются полярными, причем такие молекулы, как, например, СО,
НС1, СН4, называются гомеополярными (однополярными), а та-
кие, как соли NaCl, K2SO4, — гетерополярными (разнополяр-
ными).
Если атому приписать форму сферы, то форма молекулы
оказывается более сложной. Молекулы двухатомных газов обыч-
но представляются в виде эллипсоидов. Для молекул, состоящих
из одинаковых атомов, характерно симметричное расположение
электронов относительно обоих ядер, вследствие чего полярные
свойства у таких молекул отсутствуют. В случае же разнород-
ных атомов может происходить смещение валентных электронов
в сторону одного из ядер, и молекула становится полярной (ди-
польной).
На фиг. 3.4 схематически показано расположение атомов в
молекулах озона Оз, двуокиси углерода СО2 и воды Н2О. Раз-
меры даны в нанометрах (10~9м).
3.1.6. Атомные связи
Атомные связи (ковалентные) возникают между однородны-
ми атомами, не обладающими полярностью. Когда два таких
атома сближаются (под влиянием сил Ван-дер-Ваальса) на-
СВЯЗАННЫЕ ГАЗЫ
117
столько, что оболочки их валентных электронов начинают
влиять друг на друга, могут возникнуть связи, создаваемые па-
рами валентных электронов, меняющихся местами (ковалентные
связи обменных сил). Для таких связей характерны определен-
ная энергия и определенное расстояние между центрами атомов.
Количество общих электронных пар зависит от рода атомов, как
это для примера показано на фиг. 3.5 для однородных однова-
лентных (Н2, С1), двухвалентных (О2) трехвалентных (N2) га-
зов. В результате этих связей возникает неполярная частица,
Н2 С12
(н‘)+(.н)—(нфн) (:сг) +(:сг)—(:ci-rci:)
о2 ’ n2
(:6:)+(:6 :)* (:о но:) (:n: •)+(. :ы:) -* ( :nHtn: )
Фиг 3 5. Связи между однородными атомами: одирдрная (Н2, С12), двой-
ная (О2), тройная (N2).
т. е. такая, которая нормально благодаря сферической симмет-
рии находится в электрически нейтральном состоянии. В инерт-
ных газах (одноатомных) атомные связи не проявляются.
Для разделения молекулы на атомы следует сообщить ей
энергию (так называемую энергию диссоциации), которая не-
обходима для преодоления в первую очередь сил ковалентной
связи, а затем — сил Ван-дер-Ваальса.
Ковалентные связи относятся к сильным связям (с теплотой
связи порядка 100—150 ккал-моль-1).
3.1.7. Металлические связи
Валентные электроны атомов некоторых элементов дви-
жутся по большим орбитам, они слабо связаны с ядром и легко
отделяются от него. В результате образуются частицы с поло-
жительным электрическим зарядом (ионы), которые соединяют-
ся, образуя пространственную кристаллическую решетку. Узла-
ми такой решетки, расположенными на определенных расстоя-
ниях друг от друга, являются ионы, тогда как свободные элек-
троны движутся в этой решетке свободно, в виде так называе-
мого электронного газа. Поскольку решетка состоит из отталки-
вающихся узлов, свободные электроны придают ей прочность.
Силы, действующие на электроны внутри кристаллической
решетки, взаимно уравновешиваются, тогда как снаружи решет-
ки, на ее поверхности, положительные заряды узлов нарушают
равновесие. Поле этих зарядов в какой-то степени удерживает
электронный газ внутри кристаллической решетки.
118
ГлАва 3
Такие связи, свойственные металлам, относительно сильны,
благодаря чему металлы обладают большой прочностью и высо-
кими температурами плавления и испарения.
3.1.8. Энергия активации
Вандерваальсовы связи часто являются переходными по от-
ношению к более сильным связям сил квантового взаимодей-
ствия. Чтобы такие связи могли возникнуть, необходимо подве-
сти дополнительную энергию — энергию активации IT'am-
Фиг. 3.6. Энергия системы атомов (молекул) при физических и химических
связях.
Переход от физической связи к химической требует подведения добавочной энергии
(активации) UZaec=uZaKT хим +^Хим' Химической связи соответствует меньшее расстоя-
’ ние между частицами (гхим<гфнз).
Квантовое взаимодействие обычно инициируется повышением
температуры. Благодаря тепловым колебаниям атомы прибли-
жаются друг к другу, а затем внутриатомные силы приводят
систему атомов в равновесие, определяемое расстоянием Го
между атомами и минимальной энергией системы 1^мин. На
фиг. 3.6 схематичнр показано изменение энергии системы при
переходе от физических к более сильным связям после сообще-
ния системе энергии активации. Когда система переходит к но-
вому состоянию равновесия с более слабыми связями, избыток
энергии выделяется обычно в виде теплоты (экзотермическая
реакция).
СВЯЗАННЫЕ ГАЗЫ
119
3.1.9. Связи между атомами с одинаковой полярностью
Для возникновения связей между разнородными атомами с
одинаковой полярностью (примером таких связей являются мо-
лекулы СО, СН4, НС1 и др.) сил Ван-дер-Ваальса недостаточно
и необходимо подведение энергии активации.
В результате таких взаимодействий может образоваться не-
полярная молекула (например, СН4, фиг. 3.7, а) или молекула,
Н
н:с:н hi а:
н
а 6
Фиг. 3.7. Схема связей между атомами с одинаковой полярностью,
а —молекула СН4; б —молекула HCI.
в которой полярность проявляется вследствие определенной
асимметрии в положении общей пары электронов (например,
НС1, фиг. 3.7, б).
Следом за связями между атомами с одинаковой полярно-
стью (в порядке повышения энергетического уровня) идут ион-
ные связи.
3.1.10. Ионные (гетерополярные) связи
Ионные связи проявляются между атомами разнородных
элементов — электроположительным, имеющим незаполненную
оболочку валентных электронов, и электроотрицательным, имею-
щим избыток валентных электронов
a Na’+.ci: -* (Na)+_(:ci:)
6 Ф • +2 :о:-*(:о:)'+(и)+_(’о’)
Фиг. 3.8. Ионные связи между разнородными элементами,
а—молекула NaCl; б —молекула ТЮ2-
При сближении двух таких атомов часть избыточных элек-
тронов с валентной оболочки электроотрицательного атома
переходит на оболочку электроположительного атома. Образую-
щаяся при этом молекула является устойчивой системой с силь-
ными (химическими) связями и заполненной электронами внеш-
ней оболочкой. Другими словами, возникают как бы два поляр-
ных элемента, между которыми существуют большие силы
притяжения. Молекула в целом является диполем, способным со-
единяться с такими же диполями и образовывать однородный
120
ГЛАВА 3
кристалл. Энергия ионных связей несколько меньше энергии ко-
валентных связей.
Способность к созданию биполярных молекул проявляют хи-
мические соединения типа солей и окислов (а также металлов,
щелочных и щелочноземельных элементов с неметаллическими
элементами). Пример ионных связей показан на фиг. 3.8.
3.1.11. Разрыв связей (диссоциация, разложение, замещение)
Энергия, необходимая для разрыва связей, примерно равна
энергии связи (с учетом энергии активации). Она^называется
энергией диссоциации (разложения). Эта энергия может быть
подведена различными способами — повышением температуры,
электронной бомбардировкой и т. п.
В табл. 3.2 приведены значения энергии диссоциации про-
стейших двухатомных молекул. В случае термической диссоциа-
ции, например, двуокиси углерода СО2 на СО и О при давлении
1 атм, и температуре ~3000 К диссоциирует ~50% молекул,
а при 2500 К только 15%. В молекулярных условиях, когда мо-
лекулы СО2 ударяются о горячий катод, процент диссоциирую-
щих молекул значительно выше.
При электронной бомбардировке свободного газа возникают
более сложные явления: происходит как ионизация молекул,
так и их диссоциация, а также ионизация диссоциировавших мо-
лекул. Аналогичные явления происходят при бомбардировке
электронами адсорбированных газов. Кроме того, происходит
освобождение нейтральных молекул газа с бомбардируемых по-
верхностей.
В отношении химических соединений (например, окислов ме-
таллов) диссоциация по существу является химическим разло-
жением. Она просходит главным образом при высоких темпера-
турах, но также и при электронной бомбардировке. В присут-
ствии газов (например, водорода), а также других металлов или
их слабых соединений может происходить восстановление. В за-
висимости от уровня температуры и давления диссоциация за-
хватывает большую или меньшую часть молекул. При этом
выделяется определенное количество газа, создающее «давление
паров» над поверхностью данного соединения.
3.1.12. Активация и ионизация газа
Способность частиц газов к взаимодействиям зависит от
электрического состояния его молекул (атомов), т. е. от их ак-
тивации.
Активированным газом называется газ, молекулы которого
разделены на отдельные атомы или группы атомов с незапол-
СВЯЗАННЫЕ ГАЗЫ
121
ненными валентными оболочками (диссоциированные молеку-
лы) , либо газ, молекулы которого имеют электрон, поднятый на
более высокий по отношению к нормальному энергетический
уровень (возбужденная, метастабильная молекула).
3.1.13. Ионизация газа
Ионизация газа состоит в отрыве электронов от атома или
молекулы. При этом основная часть атома (молекулы) стано-
вится положительным ионом, заряд которого по абсолютной
величине равен заряду электрона е (или кратен ему). Если
электрон присоединяется к нейтральной молекуле, то возникает
отрицательный ион.
Газ может быть ионизирован различными способами; наибо-
лее эффективным является -ударная ионизация в результате
бомбардировки газа электронами, энергия которых больше
энергии ионизации (выше нескольких десятков электронвольт).
Среди других способов ионизации следует отметить бомбарди-
ровку а- и р-частицами, облучение короткими электромагнитны-
ми волнами (рентгеновские и ультрафиолетовые лучи) и термо-
ионизацию.
Потенциал ионизации данного элемента характеризует энер-
гию, необходимую для срыва электрона с валентной оболочки
(где на него действуют силы связи с ядром) и удаления его от
ядра на расстояние, где силы связи с ядром ничтожно малы1).
Энергия ионизации зависит от заряда ядра и от порядкового
номера электронной оболочки атома; она пропорциональна
квадрату атомного номера и обратно пропорциональна порядко-
вому номеру оболочки.
В табл. 3.3 приведены потенциалы ионизации UH и возбужде-
ния UB некоторых газов. Наиболее высоким потенциалом иони-
зации обладает гелий, наиболее низким — цезий. Напряжение
более 25 В позволяет ионизировать любые газы.
Таблица 3.3
Потенциалы ионизации Uu и возбуждения UB некоторых газов (паров)
Hg
10,4
5
COg HgO
14,4 12,6
10,0 7,6
') Для ударной ионизации необходимо выполнение условия ае,
где ma, е, va — масса, заряд и скорость электрона, a Ua — потенциал иони-
зации
ti2
ГЛАВА 3
Если энергия, подведенная к атому, оказывается меньше той,
которая необходима для ионизации, атом может возбудиться-,
это означает переход одного из электронов на более высокий
энергетический уровень, где он пребывает в течение очень ко-
Фиг 3 9 Кривые относительной ионизации (количество ии пар ион — элек-
трон, созданных одним электроном на пути I см при давлении 1 Тор и
температуре 273 К)
роткого времени (порядка 10~7 с). При некоторых условиях ато-
мы ряда элементов (например, Hg, Аг) приобретают метаста-
бильное состояние (длящееся в течение времени порядка 10~2 с).
Дальнейший подвод энергии может вызвать ионизацию.
Процесс ионизации молекулярных газов состоит в диссоциа-
ции молекул (диссоциационная ионизация) и ионизации атомов.
СВЯЗАННЫЕ ГАЗЫ
123
При этом могут возникнуть комбинации молекул с ионизирован-
ными атомами и т. п.
Склонность газов к ионизации определяется коэффициентом
относительной ионизации хи, т. е. количеством пар ион — элек-
трон, созданных одним электроном на пути 1 см в данном газе
при давлении 1 Тор и температуре То К. Коэффициент ионизации
хи зависит от скорости движения электрона, а следовательно, ог
ускоряющего напряжения
xa = f(U). (3.6)
Ход этой зависимости для некоторых газов при температуре
То — 273 К представлен на фиг. 3.9. Максимальные значения
Хи, макс соответствуют оптимальным потенциалам ионизации
t/опт, заключающимся между 70 и 170 В. При дальнейшем росте
напряжения заметно снижение коэффициента ионизации. Кри-
вые фиг. 3 9 в области напряжений, не превышающих 200 В, мо-
гут быть аппроксимированы эмпирической формулой
хи = а£ (£/— + t/B)2 • (3.7)
где 1 зависит от температуры газа Т:
„ Т20 (е + Т)
^ — Т2{с + т0) •
(3.8)
Здесь а, с, L/H, UB — величины, постоянные для данного газа
(табл. 3 4). Из уравнения (3.7) можно найти оптимальное зна-
чение U (значение, для которого хи — хи,макс).
Таблица 3.4
Характеристические параметры ионизации
Газ (пар) Параметр Не Ne н2 n2 СО о2 Аг Hg
С 79 56 76 112 100 132 169 942
а 430 1780 750 3320 3850 4450 3850 5800
ив, в 24,5 21,5 ’5,6 15,8 14,1 12,6 15,7 10,4
С7В, В 85,5 148,5 50,7 81 88,4 167,5 74,3 74,6
Uопт НО 170 65 95 100 120 99 85
Ии, макс 1,2 3 3,7 10 11 12 ’3 19
С целью повышения коэффициента ионизации часто исполь-
зуется магнитное поле (напряженностью порядка долей теслы),
перпендикулярное полю электрическому. При этом электроны
124
ГЛАВА 3
движутся по винтовым линиям, вследствие чего длина их пути
в газе возрастает и увеличивается число соударений с частица-
ми газа.
3.1.14. Связь между скоростью иона, температурой
и потенциалом
Связь между энергией электрона и соответствующим ей по-
тенциалом вытекает из формулы
у = (3.9)
Записанное уравнение определяет кинетическую энергию
электрона с массой тэ и зарядом е, движущегося со скоростью
уэ в электрическом поле напряжением U. Между кинетической
энергией частицы газа, обладающей массой то и скоростью V,
и ее температурой Т существует следующая зависимость:
|m0«2 = W; (3.10)
здесь k — постоянная Больцмана. Для иона с зарядом е спра-
ведливо уравнение
^motf = eU, (3.11)
поэтому можно написать
^mQ& = kT= eU. (3.12)
Таким образом, энергию частиц, движущихся в электрическом
поле, можно определять температурой. Поэтому частицы иони-
зованного газа, ускоренные электрическим полем с напряже-
нием U, обладают такими скоростями, какие имели бы частицы
этого газа при температуре
T = f L/~ 1,16 • 104[/ (3.13)
(единицы: К, Кл, В). Из формулы (3.13) видно, какое большое
влияние оказывает ионизация на подвижность молекулы газов
в электрическом поле.
3.1.15. Физическая и химическая адсорбция на поверхностях
С точки зрения поведения газов и паров на поверхностях,
находящихся в условиях высокого вакуума, рассмотренные ра-
нее связи молекул и атомов с поверхностями можно разделить
СВЯЗАННЫЕ ГАЗЫ
125
на физические и химические (фиг. 3.10). Однако установление
четкой границы между этими видами связей часто бывает за-
труднительным.
Под физической адсорбцией газов на поверхности понимают
связь при помощи сил Ван-дер-Ваальса. Эта связь, возникаю-
щая быстро, является сравнительно слабой. Энергия таких свя-
зей имёет порядок нескольких ккал-моль-1 при расстоянии ме-
жду взаимодействующими частицами порядка 0,4 нм.
Фиг. 3.10. Зависимость энергии физической и химической (сильной и слабой)
связей от расстояния между частицами.
Частица, связанная физической адсорбцией, не изменяет
своих индивидуальных свойств, а процесс такой адсорбции бли-
зок к процессу конденсации. В этом случае, чтобы вызвать
десорбцию, следует подвести теплоту десорбции (равную теп-
лоте адсорбции). Физическая адсорбция характерна для частиц
ожиженных газов.
В отличие от физической химическая адсорбция (хемосорб-
ция) осуществляется с помощью обменных сил электронов (ва-
лентных энергий). Эти связи иногда сопровождаются диссоциа-
цией молекул газа на атомы, а равновесие системы атомы
газа — атомы поверхности существует для расстояний между
атомами порядка нескольких десятых долей нанометра (мень-
ших, чем при физической адсорбции). Энергия, соответствующая
126
ГЛАВА 3
этому виду связей, превышает 10 ккал-моль-1, а для силь-
ных связей достигает 200 и более ккал-моль-1 (химическая
связь).
Хемосорбция в большей степени, чем физическая адсорбция,
зависит от рода поверхности и происходит медленнее; с повы-
шением температуры она ускоряется. Обычно хемосорбция про-
текает вслед за физической адсорбцией по мере поступления
дополнительной энергии, содействующей приближению атомов
к поверхности. При этом может произойти химическая реакция,
в процессе которой атом поверхности высвобождается из по-
верхностной структуры и взаимодействует г атомом газа, об-
разуя новое химическое соединение. Если реакция, которая
при этом происходит, является экзотермической, то выделяю-
щейся тепловой энергии более чем достаточно для продолжения
реакции.
Применительно к вакуумной технике большое значение
имеют связи между поверхностями, находящимися в вакууме, и
откачиваемыми газами.
Поверхности, с которыми обычно приходится иметь дело
в вакуумной технике, выполнены из металлов переходной груп-
пы (никеля, железа, меди, молибдена, титана) и стекла. Из га-
зов в области очень высокого вакуума чаще всего встречаются
(кроме следов газов окружения) окись углерода СО, водород
Нг, метан СН4. Водород выделяется при разложении паров ма-
сел и воды на горячих электродах. Аналогичные процессы при-
водят к выделению углерода, в результате реакции которого
с кислородом образуется окись углерода СО, а с водородом Нг
и окисью углерода СО — метан СН4.
Физические связи с поверхностями характерны лишь для
нейтральных газов; газы же активные чаще связываются хими-
чески. Но если нейтральные газы находятся в состоянии воз-
буждения или ионизации (особенно когда их ионы ударяются
о поверхность с большими скоростями, приобретенными- под
влиянием электрических полей), то эти газы при определенных
условиях могут внедряться в глубь материала и находиться там
в абсорбированном состоянии. Явление внедрения молекул газа
имеет определенное практическое значение при откачке инерт-
ных газов чистыми слоями металла.
В табл. 3.5 приведены величины, характеризующие энергию
связи некоторых газов на поверхности вольфрама W, никеля Ni
и платины Pt. Можно видеть, что инертные газы, перечислен-
ные в начале табл. 3.5, имеют связи физической природы. По
мере увеличения энергии связи сами связи приобретают
химическую природу. В табл. 3.5 приведены также энер-
гии миграции на поверхности вольфрама для некоторых
газов.
СВЯЗАННЫЕ ГАЗЫ
12?
Таблица 3.5
Теплота адсорбции некоторых газов на вольфраме, никеле,
железе и платине
3.2. АДСОРБЦИЯ ГАЗА
Когда энергия связи и температура поверхности твердого
тела не очень велики, время пребывания частиц газа на по-
верхности оказывается довольно продолжительным. Частица
после нескольких соударений прилипает к поверхности и удер-
живается на ней силами связи. Это явление и есть адсорбция.
При адсорбции выделяется определенное количество энергии в
виде теплоты адсорбции (или теплоты конденсации). Количе-
ство адсорбированных молекул на единице поверхности (эффек-
тивность адсорбции) возрастает по мере понижения темпера-
туры и приближения к точке сжижения данного газа. В то же
время при возрастании температуры эффективность адсорбции
уменьшается, если этот рост температуры не вызывает химиче-
ской активации, приводящей к образованию более сильных (хи-
мических) связей. Инертные газы, для которых характерны ма-
лые энергии связи и непродолжительное время пребывания
молекул на поверхности даже при низких температурах, адсор-
бируются слабо.
128
Глава з
3.2.1. Коэффициент прилипания, степень заполнения
и число частиц мономолекулярного слоя
Количество частиц газа v', ударяющихся о единицу поверх-
ности за единицу времени, описывается уравнением (2.32).
Однако не каждая из ударяющихся о поверхность частиц сразу
задерживается силами связей и прилипает к поверхности. В свя-
зи с этим эффективным ударом назовем удар, в результате ко-
торого происходит прилипание частицы. Можно считать, что
количество эффективных ударов в единицу времени
пропорционально общему числу ударов vf за тот же период вре-
мени:
У1,эфф=У*ь (3.14)
где у — коэффициент прилипания (или коэффициент адсорб-
ции). Этот коэффициент меньше единицы (у < 1), а обратная
ему величина 1/у показывает, сколько (в среднем) раз частица
должна удариться о поверхность до тех пор, пока не прилипнет
к ней.
Если у — 1, то это значит, что каждая ударяющаяся о по-
верхность частица задерживается ею. При у = О каждая уда-
ряющаяся частица отражается от поверхности. На практике для
поверхностей, свободных от газа, максимальные значения у на-
ходятся в диапазоне между 0,1 и 1. По мере того как поверх-
ность покрывается молекулами газа, свободная от адсорбиро-
ванного газа часть поверхности сокращается и коэффициент при-
липания уменьшается.
Степенью заполнения поверхности газом называется отно-
шение количества A/’i частиц, осевших уже на единице поверх-
ности, к общему числу мест АД покр, на которых может произой-
ти адсорбция:
6> = W^i.noKp. (3.15а)
Таким образом, число осевших частиц можно определить через
степень заполнения
АГ1 = бМь покр. (3-156)
Для чистой поверхности 0 = 0; для поверхности, полностью по-
крытой газом, 0=1. По мере увеличения степени заполнения
поверхности коэффициент прилипания у уменьшается и при
0= 1 становится равным нулю1).
Общее число частиц АД покр, которое может поместиться на
площади I см2 в мономолекулярном слое, можно вычислить, ос-
!) Все это относится к мономолекулярному слою на поверхности, чаще
всего встречающемуся при адсорбции в высоком вакууме. Следующие слои
молекул газа связаны не с поверхностью, а между собой, и эта связь значи-
тельно слабее.
СВЯЗАННЫЕ ГАЗЫ
129
новываясь на известных размерах молекул газа или на разме-
рах атомной решетки адсорбирующего вещества.
Диаметры молекул для различных газов составляют 2-10-8—
5-Ю 8 см. Примерно такие же размеры имеет шаг кристалличе-
ской решетки металлов. Поэтому можно считать, что на площа-
ди поверхности 1 см2 может поместиться от [1/(5-10~8)]2 до
[1/(2-10~8)]2, т. е. от 0,4-1015 до 2,5-1015 молекул газа.
Таблица 3.6
Теоретическое число Ni, покр молекул (атомов) газа
на 1 см2 поверхности при полном покрытии
Газ Не Ne "н, 0, Аг N, со со2 н2о
N1, покр> Ю15СМ~2 2,42 1,72 1,52 0,87 0,85 0,81 0,81 0,53 0,53
В табл. 3.6 приведены расчетные значения количества моле-
кул (атомов) некоторых газов, умещающихся на 1 см2 поверх-
ности при полном ее покрытии. Часто ориентировочно прини-
мают
ЛГь покр = 0,5- 10'5 см-2. (3.16)
Кривые на фиг. 3.11 иллюстрируют зависимость коэффициента
прилипания у от количества Л/) молекул азота N2, окиси угле-
рода СО, водорода Н2, кислорода О2 и паров цезия Cs, осевших
на 1 см2 поверхности вольфрама W при Т — 300 К. Очевидно,
что вдоль оси абсцисс вместо количества частиц можно от-
кладывать соответствующую каждому из этих газов (паров)
степень заполнения поверхности О по формуле (3.15а).
Из фиг. 3.11 видно, что коэффициент прилипания у до опре-
деленного 0 является постоянной величиной; когда 0 прибли-
жается к единице, у падает до нуля. Только для цезия, ввиду
легкости его конденсации при комнатной температуре, коэффи-
циент у остается постоянным и равным единице вплоть до мо-
мента полного покрытия поверхности молекулами. При повы-
шении температуры поверхности кривые смещаются вниз, а при
понижении — вверх, сохраняя свою форму.
В табл. 3.7 представлены величины Nlt ПОКр и у для адсорб-
ции окиси углерода СО на вольфрамовой ленте при темпера-
туре Т = 300 К и 0 = 0 в зависимости от температуры поверх-
ности Ts.
Наконец, в табл. 3.8 приведены величины у и Nlt ПОкр для не-
которых газов (при Т = 300 К), а также соответствующие ука-
занным величинам Л/цпокр значения 0 = 0Ь при которых у начи-
нает уменьшаться.
5 Зак 510
(30
ГЛАВА 3
Рассматривая зависимости, связанные с коэффициентом при-
липания, следует обратить внимание на то обстоятельство, что
результаты измерения как у, так и Ni часто сильно разли-
Фиг. 3.11. Зависимость коэффициента прилипания у от количества моле-
кул цезия, азота, окиси углерода, водорода и кислорода на 1 см2 поверхно-
сти вольфрама (по Беккеру, Эрлиху, Альперту и др.).
чаются в разных опытах вследствие различий в структуре по-
верхности и влияния других факторов1). Часто возникает хе-
Таблица 3.7
Зависимость покр и у от температуры поверхности Ts
для окиси углерода на вольфраме.
Температура газа Т ~ 300 К,6 = 0 (по Гаврилюку и Медведеву, 1963 г.)
7\, К 300 500 700 903 1100
покр, Ю15 см"2 0,56 0,44 0,42 0,33 0,19
Y 0,45 0,40 0,35 0,33 0,30
') Вопрос о величине сорбирующей поверхности сложен. Необходимо от-
личать геометрическую поверхность Аг от эффективной Аэфф, которая зави-
сит от рода материала и обработки его поверхности. В общем случае можно
записать Аэфф/Аг 1. Для очень пористых поверхностей (например, для
цеолитов) это отношение бывает очень большим и даже для металлов с глад-
кими поверхностями может быть порядка 100.
СВЯЗАННЫЕ ГАЗЫ
T3t
Таблица 3.8
Величины у, ЛГ,, покр и для некоторых газов
в случае адсорбции на вольфрамовой ленте (300 К)
(главным образом по Гобсону и Редхеду, 1968 г.)
Газ V "1. покр- 1015 0.
n2 0,3—0,55 0,2—0,55 0,3—0,5
со 0,2—0,6 0,5—0,65 0,3—0,6
о2 0,15 — 0,7
Н2 0,2-0,3 0,4—0,7 0,4—0,5
Cs 1,0 0,38 1
мосорбция (в том числе совместно с физической адсорбцией),
для которой зависимости более сложны. Примером таких рас-
хождений может быть сравнение некоторых данных табл. 3.6 и
3.7 с данными фиг. 3.11.
3.2.2. Влияние адсорбированных газов на вакуум
Чтобы оценить роль адсорбированных на поверхностях га-
зов в условиях высокого вакуума, определим повышение давле-
ния при десорбции газов в кубическом сосуде размером 10Х
ХЮХЮ см, в котором существует давление р = 1045 Тор при
Т == 300 К. Из формулы (2.26) находим концентрацию п =
— p/kT 3,2-1010 и количество частиц газа в объеме N = nV=
= 3,2-1010-103 = 3,2-1013.
Так как при Nlc = 0,5-1015 см-2 количество молекул газа, ад-
сорбированных на поверхности, составляет 6-100-0,5-1015 =
= 3-1017, то после десорбции молекул давление в сосуде воз-
растет до 3-10-2 Тор, т. е. на 4 порядка.
3.2.3. Количество адсорбированных частиц
Из формул (2.32) и (3.14) можно получить зависимость для
количества частиц, адсорбированных в течение 1 с на поверх-
ности площадью 1 см2:
< адс= < эфф= 3,5 • 1022—== . (3.17)
У Мо ут
Таким образом, количество адсорбированных молекул равно
числу эффективных ударов \,0фф молекул, обладающих данны-
ми свойствами (Af0,у), за единицу времени в единицу площади
поверхности с известным коэффициентом прилипания у.
5*
132
ГЛАВА 3
3.2.4. Поток и скорость адсорбции
Когда поверхность чиста и способна адсорбировать газ, каж-
дая ударяющаяся в нее молекула будет задержана. Отсюда сле-
дует, что поток газа к такой поверхности подобен потоку в от-
верстии, связанном с абсолютным вакуумом. Используя выра-
жение (2.159), можно написать формулу для потока адсорбции
на поверхность А:
I = kiTv'\, адсЛ, (3.18)
или, с учетом выражения (3.17),
7=3,65—=== VT рА. (3.19)
V М3
Скорость адсорбции на поверхности А в соответствии с форму-
лой (2.161) будет
$л = 3,65у|=/Г Л (3.20)
Для Т 300 К и Мо — 30 получаем
5л=11,6Ду (3.21)
(единицы: л-с-1, см). При у = 1 формула для сводится к
выражению (2.195), если при этом принять во внимание фор-
мулу (2.172).
3.2.5. Время пребывания частицы на поверхности
Время пребывания тПр молекулы (атома) газа на поверхности
зависит от свойств газа и характеристик поверхности (материа-
ла, способа обработки и чистоты поверхности, степени запол-
нения поверхности газом и т. п.), но главным образом от тем-
пературы.
Согласно Френкелю,
Тпр = тпр>оехр[^-], (3.22)
где И7дес — энергия связи (десорбции), зависящая от свойств
газа и рода поверхности (эрг-моль-1, Дж-кмоль-1), Ro = 8,32 X
ХЮ7 (эрг-моль-1-К-1) или Ro = 8314 (Дж-мольи-К_)), Ts —
температура поверхности (К), тПр, о — период колебаний моле-
кулы (атома) на поверхности твердого адсорбата в направле-
нии, перпендикулярном поверхности (с). Очевидно, что вместо
Ц7дес можно в соответствии с (3.3а) ввести теплоту десорбции
Ддес- Тогда вместо Ro необходимо подставлять в формулу (3.22)
величину /?Тепл в калориях: /?тепл = 2• 10-3 ккал-моль-1-К-1.Что
касается величины тпр, о (являющейся минимальным време-
нем пребывания, соответствующим «отражению» частицы газа
СВЯЗАННЫЕ ГАЗЫ
133
от поверхности), то она может находиться в довольно широких
пределах (в зависимости от свойств материала и температуры
поверхности), между 10~12 и 10-14 с. Так например, для инерт-
ных газов на графите тПр, о составляет ~ (74-10) • 10из с, на
стекле ~0,2-10~13, на вольфраме для кислорода (атомарного)
~0,8-10-13, а для водорода (атомарного) ~0,5-10-13с.
Фиг. 3.12. Зависимость времени пребывания тпр молекулы на поверхности
с температурой Ts от теплоты десорбции Ядес.
Формула (3.22) показывает, что время пребывания Тпр быстро
уменьшается с повышением температуры поверхности.
С повышением температуры возрастает интенсивность тепло-
вых колебаний кристаллической структуры адсорбата, что со-
действует освобождению газов с поверхности. Поэтому время
пребывания тпр частиц газа, как и сила связи с поверхностью,
при повышении температуры уменьшается. Из формулы (3.22)
видно, что даже в случае очень слабых связей или высоких тем-
ператур, т. е. когда-отношение WRec/R0Ts очень мало, время пре-
бывания не равно нулю и не может быть меньше, чем тПр,о- Ли-
нии на фиг. 3.12 представляют время пребывания тпр в зависи-
мости от теплоты десорбции Няес для нескольких значений тем-
пературы поверхности 7\.
134
ГЛАВА 3
3.2.6. Взаимосвязь между временем пребывания и давлением
Анализ формулы (3.22) приводит к важным выводам для
техники высокого вакуума в отношении как адсорбции газов, так
и процессов обезгаживания поверхностей. Чтобы наглядно пред-
ставить, какая связь имеется между временем пребывания час-
тиц тПр на стенках сосуда и давлением газа в сосуде, рассмот-
рим два крайних тепловых состояния стенок сосуда (идеально
чистого), в который введено п частиц какого-либо газа1) (на-
пример, аргона).
Для температуры сосуда 2) Ts = 0 время пребывания частиц
аргона на стенках бесконечно велико. При этом в объеме со-
суда свободные частицы газа должны отсутствовать, а значит,
давление в сосуде равно нулю.
При нагревании сосуда до достаточно высокой температуры
время пребывания приближается к нулю, а следовательно, почти
все частицы десорбируют со стенок, и в объеме сосуда устанав-
ливается давление
р = knTs.
Для промежуточных температур давление находится в пре-
делах между 0 и р. Таким образом, если в данном замкнутом
сосуде имеется некоторое количество газа, то каждой темпера-
туре соответствует определенное давление, при котором уста-
навливается равновесие между газом, адсорбированным на по-
верхности (связанным), и газом, заполняющим объем (сво-
бодным).
3.2.7. Время полного покрытия поверхности
Когда вакуумно-чистая поверхность оказывается открытой
для ударов частиц газа, а время пребывания частиц достаточно
велико (т. е. температура невысока), поверхность начинает по-
степенно покрываться газом. Время, необходимое для полного
покрытия поверхности мономолекулярным слоем газа, можно
вычислить, «£ли известно количество свободных мест на поверх-
ности Nic, а также количество прилипаний, т. е. количество эф-
фективных соударений с поверхностью в секунду v', Эфф. Это
время определяется формулой
Т-покр == N1, покр/^1, эфф- (3.23)
’) Количество частиц газа не должно быть слишком большим: их должно
быть меньше, чем это необходимо для полного покрытия поверхности стенок
мономолекулярным слоем.
2) Температура газа в этом случае Т = Ts.
СВЯЗАННЫЕ ГАЗЫ
135
Подставляя в формулу (3.23) вместо vf, Эф$ выражение (3.17),
приходим к формуле
— ___ Nj, покр V~Mq Л ла — 22.. V Мд 7 /О
тпокр 3,5. iq22 y р —o,zo • 1U Д/1,покр у р • (3.24)
Время полного покрытия поверхности газом при данной темпе-
ратуре Т обратно пропорционально давлению р.
Если для газов с молекулярной массой Л40 — 30 (т. е. газов,
близких к воздуху) при температуре Т ~ 300 К принять у = 0,5
(среднее значение для кислорода между 0 и 1) и Л\покр—Ю15,
то формула (3.24) примет вид
Тпокр^б-10'6у (3.25)
(единицы: с, Тор). При атмосферном давлении (р — 760 Тор)
время полного покрытия поверхности газом оказывается чрезвы-
чайно малым, а при давлении р = 10“12 Тор составляет несколь-
ко месяцев.
3.2.8. Вакуумно-чистая поверхность
Время покрытия поверхности газом является важным пара-
метром в технике высокого вакуума. Если предстоит провести
какие-либо исследования (или технологические процессы) с чи-
стыми поверхностями, то необходимо не только уметь получать
такие поверхности, но и сохранять их чистоту в течение вре-
мени, необходимого для проведения исследований.
Чистую поверхность можно получить разными способами:
нагревая, например, поверхность до достаточно высокой темпе-
ратуры, разламывая монокристалл, напыляя свежий слой и т. п.
Очевидно, что все эти операции следует производить в доста-
точно высоком вакууме, в котором адсорбция газов на поверх-
ность происходит медленно. Так, например, при давлении р =
~ 10-10 Тор пройдет несколько часов, прежде чем поверхность
покроется мономолекулярным слоем газа. Надо помнить, что
заполнение поверхности газом происходит постепенно, сначала
пропорционально времени, а затем все медленнее и медленнее
(так как с увеличением степени заполнения поверхности умень-
шается у), вплоть до полного покрытия по истечении времени
Тпокр. Обычно считается, что для чистой поверхности 0 не дол-
жно превышать 0,1.
3.3. ДЕСОРБЦИЯ ГАЗА
Интенсивность тепловых колебаний частиц твердого тела
с повышением температуры возрастает, вследствие чего осевшие
на поверхности тела молекулы (атомы) газа, удерживаемые
136
ГЛАВА 3
силами связей, могут освободиться. Это явление носит назва-
ние термической десорбции адсорбированного газа1). Чем сла-
бее связь адсорбента с поверхностью, тем ниже температура,
при которой начинается десорбция. Так, например, десорбция
инертных газов может происходить даже при низких темпера-
турах, тогда как активные газы, энергия связи которых с по-
верхностью велика, с трудом десорбируют даже при высоких
температурах (этим объясняется сложность очистки, например,
окисленных поверхностей). Явление десорбции могут вызывать
и другие факторы, например бомбардировка поверхности раз-
личными частицами (электронами, ионами), механическое тре-
ние и даже световое облучение определенной длины волны.
Десорбция газов представляет интерес для техники высокого
вакуума в двух аспектах: во-первых, в отношении удаления га-
зов с поверхности для получения высокого вакуума, т. е. при
обезгаживании масс и поверхностей вакуумных систем, и, во-
вторых, с точки зрения сохранения высокого вакуума, т. е. пре-
дотвращения выделения газов с поверхности в объем.
Из предыдущего следует, что обезгаживание во время от-
качки должно проводиться при возможно более высокой темпе-
ратуре, чтобы полнее удалить газы, даже очень сильно связан-
ные с поверхностями, тогда как для предотвращения десорбции
с поверхности (после прекращения откачки) следует поддер-
живать поверхности при возможно более низкой температуре,
чтобы уменьшить десорбцию путем увеличения времени пребы-
вания частиц газа на поверхности.
3.3.1. Количество десорбированных молекул газа
Мерой десорбции является количество частиц газа, освобо-
дившихся с поверхности площадью 1 см2 за время 1 с:
vUec---^-. (3.26)
Количество десорбированных частиц пропорционально общему
количеству частиц газа на поверхности и обратно пропорцио-
нально времени пребывания:
v' = _~ exD Г ^дсс 1 /о о?)
"дес— _ _ о т )
пр пр, О L ^тепл4 s J
*) Освобождающиеся вследствие десорбции участки поверхности твердого
тела могут быть заняты газом, диффундирующим изнутри тела на его по-
верхность.
СВЯЗАННЫЕ ГАЗЫ
137
3.3.2. Равновесие между адсорбцией и десорбцией
Между протекающими непрерывно процессами адсорбции и
десорбции молекул газа устанавливается равновесие, когда ско-
рость адсорбции оказывается равной скорости десорбции, т. е.
когда vb аде = vi, дес-Приравнивая выражения (3.17) и (3.27),
можно найти число частиц Nlt находящихся в данный момент
на 1 см2 поверхности:
^ = 3,5-1022тпр о-^-^ехр
Р’°/'И0 ут р[/?теплг
(3.28)
Количество частиц Nt газа с известными характеристиками
(Мо, у, тПр), имеющего температуру Т и покрывающего 1 см2
данной (у, //дес) поверхности при температуре Ts, пропорцио-
нально давлению /?; кроме того, оно уменьшается экспоненци-
ально с ростом температуры поверхности Ts. Зная М, можно
определить степень заполнения поверхности из уравне-
ния (3.15а).
3.3.3. Уравнение адсорбции
Если количество частиц N выразить через объем газа, при-
веденного к нормальным условиям (NTP), то уравнение (3.28)
примет вид так называемого основного уравнения адсорбции
V = f(p,T). (3.29)
Из этого уравнения следуют дальнейшие зависимости, а именно:
изотерма адсорбции V = f (р) при Т = const,
изобара адсорбции V — f(T) при р = const, (3.30)
изохора адсорбции р = f (Т) при V — const.
Изотерма адсорбции обычно аппроксимируется эмпирически-
ми уравнениями, особенно в области высоких давлений, при ко-
торых в процессе адсорбции образуется более чем один молеку-
лярный слой.
Фрейндлих представляет изотерму адсорбции параболиче-
ским уравнением
И = ар'/6, (3.31)
где а и b — постоянные, зависящие от свойств газа и характе-
ристик поверхности, а также от температуры. По Ленгмюру же
изотерма адсорбции описывается гиперболическим уравнением
Ср
V = Vпокр 1 Qp • (3.32)
133
ГЛАВА 3
где Упокр — объем газа, соответствующий полному покрытию
поверхности мономолекулярным слоем, а С — постоянная. Это
уравнение можно записать и в другом виде:
= т <3-33)
Оно представляется прямой (фиг. 3.13) с наклоном 1/КПокр,
сдвинутой на 1/СУпокр в системе координат p/V — f(p). При
Фиг. 3.13. Диаграмма уравнения десорбции (по Ленгмюру).
р <С 1/С получаем V — CVnoEpp, т. е. адсорбция прямо пропор-
циональна давлению. Если же р 1/С, то V = Епокр и адсорб-
ция приходит в состояние насыщения и не зависит от давления.
3.4. ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
Подобно тому как частицы газа, адсорбированного на по-
верхности твердого тела, десорбируют с нее под влиянием теп-
ловых колебаний молекул, так же и частицы твердого тела
могут отрываться от этой поверхности п создавать пар. Этот про-
цесс называется испарением (или возгонкой — когда пар полу-
чается непосредственно из твердого тела, минуя жидкую фазу).
Как и процесс десорбции, испарение требует некоторой энер-
гии, необходимой для преодоления сил, связывающих частицы
с поверхностью твердого тела.
Пар при определенной концентрации, подобно газу, создает
давление. Чтобы частица могла отделиться от поверхности, она
должна иметь энергию, достаточную для разрыва связей с ча-
стицами, остающимися на поверхности. Чаще всего эта энергия
подводится в виде теплоты.
Обратный процесс, когда частица при встрече с поверхностью
оседает на ней, называется конденсацией', этот процесс про-
исходит с выделением теплоты.
СВЯЗАННЫЕ ГАЗЫ
139
В технике высокого вакуума конденсация происходит в крио-
генных ловушках, криогенных насосах, а также при осаждении
и напылении металлов.
3.4.1. Теплота испарения и конденсации
Энергия, необходимая для превращения единицы массы ве-
щества при температуре Т в насыщенный пар при той же тем-
пературе, называется удельной теплотой испарения (возгонки)
при данной температуре.
Если в сосуде объемом V (свободном от газов) находится
1 г вещества при температуре Т, то с увеличением температуры
на dT давление паров возрастает на dp, т. е.
— при Е = const, (3.34)
откуда получаем
Р = Т^г. (3.35)
Поскольку объем пара равен V, то его количество в единицах
pV, характеризующее энергию испарения, составит
pV = VT^r=Wnzn. (3.36)
В тепловых единицах эта энергия выражается следующим об-
разом:
Нисп = у1ГИСп = уУГ^-. (3.37)
Такое же количество теплоты выделяется при конденсации.
Уравнение (3.37) называется уравнением Клапейрона — Клау-
зиуса.
3.4.2. Давление насыщенных паров
Из уравнения состояния газа (2.60) находим
V = Roj- (3.38)
и, подставив в (3.37), получаем
^- = J-^dT. (3.39)
После интегрирования имеем
In р = const — J -р"2.п-, (3.40)
140
ГЛАВА 3
откуда (с учетом Ro/J — /?теПл) приходим к уравнению
рп = роехр[ — = /?оехР /ис-у]' (3-41)
L л0 J L лтепл J
Уравнение (3.41) можно также записать в логарифмической
форме:
lgpn = An--fi. (3.42)
•* S
Это основное уравнение, выражающее зависимость давления на-
Таблица 3.9
Значения постоянных 4П, Вп> константы скорости испарения Сисп
температур плавления Тпл и кипения Ткип и давления паров рп
(при температуре плавления) некоторых элементов.
Значения ориентировочные,
особенно Ткип, заимствованы из разных источников
Элемент Лп Bn СИСП, г-см'2-с-1 T * ПЛ» К P„ (при Гп> T°P ГКИП (при 760 Top), К
Ag 8,85 14 270 8,63 1 230 25-10-3 2 450
Al 8,79 15 940 8,27 933 — 2 620
Au 8,89 17 580 8,80 1 338 5-10~5 2 930
В 10,07 29620 9,36 2 570 2-IO-3 2 820
С 12,73 40 300 12,04 4 620 — 4 620
Со 9,70 21 110 9,35 1 760 6,7 • IO-2 3 270
Cs 6,91 3 800 6,74 302 2,6- IO-6 960
Си 8,96 16 980 8,63 1 378 2,6- IO-4 2 850
Fe 9,44 19 970 8,08 1 810 3-10-2 ЗОЮ
Ga 8,41 13 840 8,09 303 Очень 2 370
низкое
Ge 8,71 18 030 8,40 1 220 7-IO-7 2 970
In 8,23 12 480 8,03 428 — 2 370
Ir 10,07 31 230 9,98 2 730 5- IO-2 5 070
La 8,60 20 850 8,44 1 193 2 070
Mg 8,64 7 650 8,10 923 2,5-10“® 1 38Э
Mo 8,64 30 850 8,40 2 900 8-IO-3 5 090
Ni 9,75 20 960 9,40 1 725 5-IO-3 3 070
Pd 8,78 19710 8,56 1 830 1,1-IO"2 3 830
Pt 9,53 27 280 9,44 2 040 1,7- Ю-4 4 400
Re 10,10 40 000 10,05 3 450 2,5. IO-2 5 900
Si 9,7 21 300 9,21 1 710 1 • IO-3 3 070
Ta 7,04 40 210 9,33 3 270 6- 10“3 4 400
Th 9,52 28 440 9,47 2 100 9.3-10-5 3 770
Ti 9,50 23 230 9,11 2 000 5-10*7 3 570
W 9,40 40 680 9,30 3 640 2- IO-2 6 200
СВЯЗАННЫЕ ГАЗЫ
Hl
Таблица 3.10
Постоянные Ап и Вп давления паров некоторых
высоковакуумных масел (по различным источникам)
Масло ^п
Клофен А40 10,15 4130
Амой л 10,6 4600
Амойл S 11,4 5200
Апиезон С 11,7 5900
Окто й л 10,0 4870
12,2 5590
Октойл S 11,26 5510
13,5 6430
b-S 12,78 6320
Силикон1) х=12 11,6 5350
х= 15 12,9 6430
х= 18 14,3 7510
Силикон DC-703 11,3 6160
') [ (CHJSiO./J (СН3)Ж.
Таблица 3.11
Постоянные Ап и Вп, а также давление паров
некоторых органических веществ (по Енсену, 1956 г.)
Вещество Лп X Рп (при 298 К). Тор
Тефлон 4,3 3400 <10"* 7
Бутиловый каучук 11,4 4900 <10-5
Полиэтилен 7,4 4500 < 10'7
Виниловый эластомер 11,5 5900 <10~8
сыщенного пара от температуры1) рабочей поверхности Ts; здесь
Лп, Вц, Яисп = Wacn/J и ро постоянные величины, значения кото-
рых для разных веществ известны. В табл. 3.9 приведены зна-
чения постоянных Ап, Вп и константы скорости испарения СИСП
для некоторых химических элементов. В табл. 3.10 приведены
значения Ап и Вп для нескольких сортов высоковакуумных ма-
сел, а в табл. 3.11 —для ряда органических веществ.
’) Следует иметь в виду, что температура газа Т не обязательно должна
быть равна температуре поверхности Ts, с которой происходит испарение.
В данном случае рассматривается замкнутый металлический сосуд и равен-
ство Т = Т„ соблюдается.
(а также для сравнения и воды) от температуры Ts (по Хонигу).
Фиг. 3.15. Зависимость давления газов (паров) от температуры (по Хонигу
и Гуку, 1960 г.).
СВЯЗАННЫЕ ГАЗЫ
143
На основе формулы (3.42) можно построить кривые, выра-
жающие давление пара над поверхностью тел в зависимости от
температуры испаряющей поверхности Ts. Такие кривые для не-
которых веществ, применяемых в технике и технологии высо-
кого вакуума, представлены на фиг. 3.14—3.18. В табл. 3.9 при-
ведены температуры плавления и кипения для различных ме-
таллов (и углерода), а также давления паров при температуре
плавления.
На основании данных фиг. 3.14 можно заключить, что из ме-
таллов, важных для техники и технологии высокого вакуума,
наиболее низкое давление паров имеет вольфрам, наиболее вы-
сокое— ртуть; из газов (фиг. 3.15) наиболее низкое давление
паров у гелия. Для того чтобы давление водяных паров над во-
дой было ниже 10й2 Тор, следует охладить воду (т. е. лед) до
120 К. Над вольфрамовой проволокой при температуре 2600 К
(примерно такую температуру имеет раскаленная нить лампы
накаливания) давление паров вольфрама составляет ~10-8Тор.
Давление паров ртути (табл. 3.12) при комнатной температуре
имеет порядок нескольких тысячных тора, а при температуре
жидкого азота (~78К) неизмеримо мало.
Таблица 3J2
Давление водяных паров и паров ртути для некоторых температур
(величины округленные, из разных источников)
т, к РН2О» Тор PHg Т, К РН2О Тор PHg
90 ~ 10-22 ~ 10-27 243 0,3 6-10-6
123 7,5- 10“ls 3- 10“18 253 0,8 2- 10-5
143 7- 10-9 8- 10~IS 263 2 7-10-5
173 1 • 10-5 2,4- 10-11 273 4,6 2- 10“4
195 0,5- 10-3 3 • 10-9 283 9,2 4- Ю-4
223 3-10-2 5-10-7 293 17,5 1,3 • 10-3
233 10-1 2- Ю-8 303 32 3- 10-3
313 55 6- ю-3
На фиг. 3.16 представлена для примера зависимость давле-
ния паров некоторых органических веществ от температуры. На
характер изменения давления паров синтетических материалов,
замазок, смазок и масел значительно влияет состав этих мате-
риалов, который в свою очередь меняется в зависимости от спо-
соба приготовления данного материала, времени, температуры,
степени окисления, степени прогрева в вакууме и т. д.
Зависимость давления паров металлических соединений (на-
пример, окислов и хлоридов металлов) от температуры имеет
Фиг. 3.16. Зависимость давления па-
ров некоторых органических веществ
от температуры (по данным разных
авторов).
1—пербунан; 2—пицеин; 3 — аральдит;
4—тефлон; 5—апиезон S; 6 — силикон.
Фиг. 3 17. Давление паров некоторых окислов металлов и хлористого
серебра в зависимости от температуры (по данным Штуля, Бутри, Генри,
Дэшмана).
СВЯЗАННЫЕ ГАЗЫ
145
такой же характер, как и для металлов (фиг. 3.17). В табл.3.12
представлено давление паров воды (льда) и ртути для некото-
рых характерных температур.
3.4.3. Скорость испарения
Скорость испарения определяется как масса вещества, испа-
рившегося в течение 1 с с поверхности площадью 1 см2 при тем-
пературе Ts. Скорость испарения можно определить из условия
равенства количества частиц vf,n, испаряющихся за время 1 с,
и числа частиц vf, к, конденсирующихся за то же время на той
же поверхности:
v't,n = vi, к- (3.43)
Величина vi,n не зависит от того, удаляются ли испарив-
шиеся частицы или снова конденсируются на поверхности. Если
объем над паровыделяющей поверхностью ограничен, то кон-
центрация паров над ней, а следовательно, и их давление воз-
растают до тех пор, пока не наступит условие равновесия (3.43),
Количество конденсирующихся частиц определяется количе-
ством эффективных соударений частиц с поверхностью. Оказы-
вается, что коэффициент прилипания в этом случае равен еди-
нице, следовательно,
V1, к == ИцЦар, п- (3-44)
Для вычисления испарившейся массы вещества следует v',n
помножить на массу частицы то, п. При этом скорость испаре-
ния выразится формулой
п — Cn^V\, п — OTjVl, к — пИпОар, п. (3.45)
Заменяя пП давлением рп, а также выражая vap, п через соответ-
ствующие величины (как для газа) и принимая k— 1,04-Ю-19,
получаем
п ~ 0,06 /ЛГО (3.46)
г * S
(единицы: г-с-1-см~2, Тор, К). Здесь рп — давление паров при
температуре Ть. Используя вместо рп выражение (3.41), прихо-
дим к следующей формуле для скорости испарения:
___________________-----п Г
mi „ ~ 0,06 |/Л40-------.............Л- (3-47)
V * S
146
ГЛАВА 3
Если пар не полностью удаляется из объема и давление его
возрастает, например, до величины рк, то часть его конденси-
руется, а масса отведенного пара описывается уравнением
mi, п = 0,06 /Мэ,п —L=-(pn —рк). (3.48)
Ум
При рк = 0 (полное удаление пара) используется уравне-
ние (3.46), а при рк = рп (пар не удаляется) имеем
ш',п = 0. (3.49)
Зависимость скорости испарения т'\, п от температуры можно
представить, аналогично зависимости для давления паров, с по-
мощью логарифмической функции, получаемой из форму-
лы (3.46):
lg<n = C„cn- 0,5 IgT-Bn/r, (3.50)
в которой Сисп зависит от молекулярной массы Мо-.
С„сп = А, + 0,51g Мо- 1,234 (3.51)
(единицы: г-см~2, с-1). Значения Дп, Вп, Сисп для некоторых твер-
дых веществ указаны в табл. 3.9.
3.4.4. Значение сорбции, десорбции и давления паров
для вакуумной техники
Выводы, которые можно сделать из формулы (3.28) для тех-
ники и технологии высокого вакуума, имеют фундаментальное
значение. Если задача заключается в том, чтобы количество
частиц на поверхностях, находящихся в вакууме, оставалось
как можно более малым, следует — при достаточно низком дав-
лении р — обеспечить как можно более высокую температуру
десорбирующей поверхности Ts, тем более высокую, чем выше
энергии связи 1Гдас адсорбированных газов. Такая ситуация воз-
никает при обезгаживании вакуумной системы во время откач-
ки. Процесс обезгаживания должен продолжаться тем дольше и
происходить при тем более высокой температуре, чем более за-
грязнены поверхности.
На фиг. 3.18 представлены кривые изменения давления (в
торах) кислорода над окислами (и азота над нитридами) неко-
торых металлов в зависимости от температуры. Величина дав-
ления паров является мерой скорости разложения этих соеди-
нений и поэтому указывает на степень трудности удаления с
поверхностей металлов химически связанных газов.
Для сохранения высокого вакуума в уже обезгаженной ва-
куумной установке (путем адсорбционного захвата газов и по-
следующего их удержания) необходимо температуру поверх-
СВЯЗАННЫЕ ГАЗЫ
147
ности Ts сохранять по возможности низкой, тем ниже, чем сла-
бее вещество поверхности удерживает находящиеся в установке
газы (чем меньше энергия связи). Такая ситуация возникает,
когда после обезгаживания вакуумной установки хотят улуч-
шить вакуум с помощью охлаждаемых адсорбирующих поверх-
ностей (криогенных панелей). В целом поддержание высоко-
вакуумной установки при низкой температуре всегда полезно,
так как это способствует уменьшению десорбции газов со
стенок, а также снижению давления паров. Однако необходимо
Фиг. 3.18. Зависимости давления кислорода над окислами и азота над нит-
ридами некоторых металлов от температуры поверхности (по Дэшману).
предварительно (при откачке) основательно прогреть все эле-
менты вакуумной системы, чтобы в ней не осталось веществ
(например, паров воды, двуокиси углерода), имеющих темпе-
ратуру вымораживания более высокую, чем та, которая ожи-
дается в установке.
Вопрос о давлении паров различных веществ в технике вы-
сокого вакуума имеет два аспекта.
Первый касается паров так называемых высоковакуумных
металлов, т. е. металлов, применяемых для изготовления элект-
родов и других устройств, работающих при высоких или повы-
шенных температурах. Для такого применения пригодны метал-
лы, обладающие низким давлением паров при высоких темпера-
турах (фиг. 3.14).
Второй аспект касается паров воды, ртути, масел, смазок и
герметиков. Понижение температуры влечет за собой конденса-
цию, а затем затвердевание этих материалов. Естественно, что при
этом давление паров понижается, что приводит к улучшению
148
ГЛАВА 3
вакуума. На этом принципе основаны вымораживающие
устройства (различные ловушки) и криогенные насосы. Напри-
мер, если в объеме, где имеется невысокий вакуум, охладить
какую-либо поверхность до температуры жидкого гелия (~4 К),
то на этой поверхности сконденсируются многие газы (исклю-
чая гелий), а давление большинства газов (собственно, давле-
ние их насыщенных паров) окажется ниже 10-12 Тор. При этой
температуре остаются в газообразном состоянии только гелий
под его парциальным давлением и водород, давление паров ко-
торого, в соответствии с данными фиг. 3.15, составит -~10’7Тор.
Дальнейшее понижение температуры (например, путем по-
нижения давления гелия в вымораживающем устройстве при
его быстром испарении) ниже 4 К приводит к дополнительному
уменьшению давления водорода, так что практически в вакуум-
ной системе остается один гелий.
А. ГАЗЫ В ТВЕРДЫХ ТЕЛАХ
Взаимодействие между газами и твердыми телами не огра-
ничивается только их поверхностью. Поведение газов, находя-
щихся внутри твердого тела, определяется физическими свой-
ствами этого тела. В зависимости от свойств твердого материа-
ла газы, находящиеся в нем, могут быть в молекулярном или
атомарном виде. Например, в металлах и полупроводниках та-
кие газы, как водород, азот, кислород и т. п., содержатся в ато-
марном виде, тогда как в стеклах и полимерах они обычно вы-
ступают в молекулярном виде (как Нг, N2, О2). Одноатомные
(инертные) газы, очевидно, всегда содержатся в твердом теле
как атомарные. Состояния газов в твердом теле могут быть
различными: от физически свободного со сравнительно большой
подвижностью вплоть до химически связанного состояния с
большой энергией связи (например, в виде окислов).
По существу ни одно из этих состояний газа в твердых телах
не является желательным для техники и технологии высокого
вакуума, так как материалы, содержащие в своем объеме газы,
являются или могут явиться источниками газов. Для создания
и поддержания высокого вакуума необходимо тщательно уда-
лять газы из конструкционных материалов, соприкасающихся с
вакуумом (стенок вакуумной установки, электродов и т. п.), так
как будут происходить диффузия этих газов к поверхности и
последующая десорбция.
Подготовка деталей и устройств, которые затем предпола-
гается поместить в высоком вакууме, должна включать их пред-
варительное обезгаживание. Правильное проведение процесса
обезгаживания во время откачки оказывает значительное влия-
ние на качество получаемого в итоге вакуума.
СВЯЗАННЫЕ ГАЗЫ
149
Процесс обезгаживания нагреванием основан на использо-
вании явления диффузии газов в материале. С одной стороны,
нагревание создает возможность удаления газов, однако, с дру-
гой стороны, оно может привести к проникновению газов из
окружающей среды сквозь стенки вакуумной установки внутрь.
Даже если стенки вакуумного сосуда не имеют щелей или пор,
всегда следует считаться с возможностью проникновения сквозь
них определенных газов. Обычно этот процесс медленный, ска-
зывается через длительное время и касается лишь некоторых
газов с высокой проникающей способностью, среди которых на
первом месте находится гелий. Очевидно, что различные мате-
риалы, из которых выполняются вакуумные приборы, обладают
разной проницаемостью. Так, например, в электронных вакуум-
ных приборах, откачанных во время изготовления до очень низ-
кого давления (например, в больших генераторных лампах),
а затем хранящихся в течение долгого времени, может поя-
виться гелий, проникший из окружающей атмосферы, где его
содержание относительно велико1).
3.5. РАСТВОРЕНИЕ ГАЗА В ТВЕРДЫХ ТЕЛАХ
Газы способны растворяться в металлах, стеклах и других
конструкционных материалах. Когда концентрация газа внутри
материала меньше, чем снаружи, частицы газа, адсорбирован-
ные на поверхности, могут проникать вглубь материала. Это
явление, представляющее собой первый этап растворения газа
в твердом теле, носит название абсорбции. Количество газа, рас-
творяющегося в твердом материале, зависит от свойств газа и
характеристик материала; растворимость возрастает с повыше-
нием давления над поверхностью и температуры. Влияние
свойств газа и характеристик поглощающего материала учиты-
вается коэффициентом растворимости.
В металлах газы растворяются только в атомарном состоя-
нии, поэтому молекулярные газы в металле должны предвари-
тельно диссоциировать. В стеклах же и керамиках газы могут
растворяться как в атомарном, так и в молекулярном состоянии.
Растворимость газов в твердых телах описывается законами
Рауля, Генри и Сивертса, которые определяют связь между дав-
лением и количеством растворенных в твердом теле молекул
газа (пара).
') Поэтому при использовании такого прибора необходимо учитывать
возможность наличия в нем газов под давлением, достаточным для возникно-
вения газовою разряда, «то может испортить прибор Поэтому после вклю-
чения нового прибора напряжения и токи в нем повышают постепенно, пока
не произойдет самопроизвольная откачка ионов газа Нужно иметь в виду,
что поглотители, имеющиеся в электронных приборах (геттеры), не адсорби-
руют инертные газы (следовательно, и гелий) в неионизированном состоянии.
150
ГЛАВА 3
Для одноатомных (т. е. инертных) газов, растворенных в ме-
таллах или стеклах, а также молекулярных газов, растворен-
ных в стеклах, резинах, пластиках и т. п., т. е. в случаях, когда
при растворении не происходит диссоциации молекул на атомы,
применяется закон Генри. Этот закон может быть представлен
в виде уравнения
пг = Гр, (3.52)
где пг — количество газа (в единицах pV при нормальных усло-
виях), растворенного в 1 см3 объема твердого тела, т. е. объ-
емная концентрация газа; г' — коэффициент растворимости;
р — давление газа над поверхностью.
Для двухатомных молекулярных газов, растворяющихся в
металлах, когда предварительно должна произойти диссоциация
молекул на атомы, применяется закон Сивертса, который опи-
сывается уравнением
пг = г" Ур\ (3.53)
В общем случае можно записать
пг = гра,
(3.54)
где и — 1, >/2, >/3, ... в зависимости от количества атомов в
молекуле. Коэффициент растворимости г в формуле (3.54) имеет
размерность, зависящую от показателя степени и. Например,
при и = 1 коэффициент растворимости является безразмерной
величиной1), тогда как при и — ^ъ этот коэффициент имеет
размерность Тор 1/2.
Для растворения газа в твердом теле необходима энергия
активации. Она является экспоненциальной функцией темпера-
туры и входит в формулу коэффициента растворимости;
г = гй ехр
Н&. р
"п
Атеш1 $ .
(3.55)
Здесь гр — постоянная растворимости, а На.р— теплота актива-
ции растворения.
В связи с тем что растворению молекулярных газов в метал-
лах предшествует их диссоциация, энергия активации этих га-
зов, а также рост их растворимости с температурой больше, чем
для атомарных газов. Так, например, для растворения одина-
ковых количеств водорода и гелия в кварцевом стекле в первом
случае необходима температура 1000 К, а во втором — лишь
*) Количество газа пг обычно выражается в атм-см3(норм.)-см-3, или ат-
мосферах, а давление р — в единицах давления, например в торах. В формуле
Генри г' является безразмерной величиной, а в формуле Сивертса г" имеет
размерность единицы давления в степени V2.
Фиг. 3.19. Зависимость коэффициента растворимости г от температуры Т
(по Вальдшмидту, 1954 г.; Дэшману и Лафферти, 1962 г.; Муру и Унтер-
вальду, 1964 г.; Роджерсу, 1954 г.; Лейби и Чену, I960 г.; Эшбаху, 1960 г.;
Барреру, 1961 г-).
Газы в металлах (и=у2, \ : 2-На->Мо; 3-H3->Pd;
\ L см3-Тор7* J /
5-H2->Cu; 6—Н2->нержавеюш,ая сталь; 7 —N2-»Fe; 8—N2->W; 9—N3->Mo;
10 ~ O2 Си.
Газы в стеклах ^м=1. : ^--H2->SiO2; 12 — Н2->стекло 12; 13—Н2->сте
кло 13; 14 — Н2->стекло 14; 15 — Н2->стекло 15; 16 — Не->стекло 16 (викор); 17—Н2->сте
кло 16 (викор); 18—Не->стекло 17 (пирекс 7740).
Состав стекол, %
____________________*----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Номер 31Ог В2О3 А12О, n2o КгО РЬО
12 76 16 0»4 5 0,8
13 65 23 4 4 4
14 56 1 7,5 4,5 30
15 69 — 3 13 1,7
16 96 4 — —— — —.
17 80 12 2 9 3 —
152
ГЛАВА 3
400 К. Подобно этому азот в вольфраме при температуре
~2300 К растворяется в таком же количестве, как водород в
никеле при температуре 500 К. Зависимости коэффициента рас-
творимости г от температуры для некоторых газов в стеклах и
металлах приведены на фиг. 3.19. Из этих данных видно, что
для металлов коэффициенты растворимости имеют большие зна-
чения и существенно зависят от температуры. Для большинства
металлов и молекулярных газов при температурах 500—1300 К
величины коэффициента растворимости находятся в пределах
102—ю-1.
Растворимость газов в стеклах меньше; она также меньше
зависит от температуры. Температурная зависимость ослаб-
ляется с увеличением содержания стеклообразующих компонен-
тов. Например, стекла 13 и 17 (фиг. 3.19), содержащие более
80% стеклообразующих компонентов, имеют коэффициент рас-
творимости для гелия г'и эта величина почти по-
стоянна в диапазоне 350—700 К, тогда как стекло 14 (с меньшим
содержанием кремния) имеет меньшую растворимость.
3.6. ДИФФУЗИЯ ГАЗА В ТВЕРДЫХ ТЕЛАХ
Газ, растворенный в твердом теле, может перемещаться, т. е.
диффундировать из области, где его концентрация больше, в
область, где она меньше. Таким образом, внутри твердого тела
возникает поток газа, пропорциональный разности концентра-
ций (точнее, градиенту концентрации) в данном направлении.
Диффузионный поток через единицу поверхности в направлении
максимального градиента концентрации определяется законом
Фика, который использовался для описания газофазной диф-
фузии:
I^-Dgradn^-D^-. (3.56)
Здесь D — коэффициент диффузии газа в данном материале,
пг — концентрация газа внутри материала, х — расстояние от
поверхности.
Коэффициент диффузии газа экспоненциально зависит от
температуры материала:
D = До exp
Яа.д 1
р т
тепл 5.
(3.57)
(единицы: см2-с-1, см2-с-1, ккал-моль-1-К-1, К). В формуле(3.57)
/7а. д — теплота активации диффузии, Do — коэффициент про-
порциональности (равный коэффициенту диффузии при Ts—>оо),
Ts — температура твердого тела, Дтепл — 2-10”3 ккал-моль”1-К”1.
/7а. д и Dq — вообще постоянные величины и зависят от свойств
СВЯЗАННЫЕ ГАЗЫ
153
газа и характеристик поглощающего материала. Величина /7а. д
характеризует энергию, необходимую для того, чтобы частицы
газа могли преодолеть сопротивление перемещению в материа-
ле твердого тела. Чем меньше эта энергия, тем интенсивнее диф-
фузия газа при данной температуре. Например, в твердых стек-
Ts. к
Фиг. 3.20. Зависимость коэффициента диффузии D от температуры (по дан-
ным авторов, указанных в подписи к фиг. 3.19, и Дейтона, 1960 г.).
Газы в металлах’. /—H2->W; 2 — Н2->Мо; 3 — H2->Pd, 4 — H2->Ni; 5—H2-»Cu, 6—02->Ni:
7—N2->Fe; 8—02->Ti; 9—H2->Fe; 10—02->Cu.
Газы в стеклах: 11 — H2->SIO2; 12 — Н2->стекло 12; 13 — Н2->стекло 13; 14— Н2->стекло 14;
15—Н2->стекло 15; 16—Н2->стекло 16 (викор); 17 — Не->стекло 17 (пирекс 7740).
Номера стекол и их состав соответствуют таблице фиг. 3.19.
лах /7а. д Для водорода в 2 раза больше, чем для гелия, а для
азота и кислорода даже в 6 раз больше, чем для гелия. Отсюда
следует, что гелий должен лучше диффундировать, чем водо-
род, а водород — лучше, чем кислород и азот. Что касается ме-
таллов, то водород, например, лучше диффундирует в железе и
никеле, чем в нержавеющей стали; кислород в железе диффун-
дирует хуже, чем водород.
На фиг. 3.20 представлена зависимость коэффициента диф-
фузии D от температуры для некоторых газов в различных
154
ГЛАВА 3
металлах и стеклах. В металлах водород диффундирует легче,
чем другие двухатомные газы. Представляет интерес диффузия
водорода в палладии, происходящая довольно интенсивно при
умеренных температурах. Следует также отметить, что диффу-
зия таких газов, как кислород и азот, начинается лишь при от-
носительно высоких температурах.
В стеклах диффузия газов происходит вообще хуже, чем в
металлах.
В табл. 3 13 для примера приведены ориентировочные зна-
чения Яа д и £>о Для гелия в плавленом кварце (100% SiO2), а в
табл. 3 14 — величины Яад для некоторых газов и стекол. Вид-
но, что величины На д и Da зависят от температуры.
Таблица 3.13
Теплота активации Яа и коэффициент диффузии
Do для гелия в плавленом кварце
(по разным источникам, величины ориентировочные)
Гелий в плавленом кварце К
300 - 500 600 - 1300
На. д, ккал • моль-1 5,6 6,6
Do, см2 • с-1 3- 10~4 7-10-4
Таблица 3.14
Теплота активации диффузии Яа для некоторых газов
в различных стеклах с разным содержанием
стеклообразующих компонентов при Ts = 300 К
(по разным источникам, величины ориентировочные)
Газ Стекло Содержание стеклообра зующих компо тентов, % Ня ккал моль 1 d. д
Кварц 100 5,4—5,7
Не Викор 99 5—6
Пирекс 94 6,2—7
Дюран 92 6,4
н2 Кварц 100 9—12
Дюран 92 ~ 13,5
n2 Кварц 100 22-30
о2 » 100 30
СВЯЗАННЫЕ
!Ы
155
3.7. ПРОНИКНОВЕНИЕ ГАЗА СКВОЗЬ СТЕНКИ
Проникновение газа сквозь стенки сосуда является след-
ствием растворения и диффузии газа, описываемых уравнения-
ми (3.54) и (3.57) Количество газа, протекающего через 1 см2
поверхности стенки единичной толщины в течение 1 с, т. е.
удельный поток It, зависит от коэффициента диффузии D, коэф-
фициента растворимости г и от давлений по обе стороны стенки
Зависимость потока от давления более сложна, чем в случае
течения свободного газа.
При растворении происходит диссоциация газа, зависящая
от количества атомов в молекуле. В связи с этим поток газа
сквозь стенку пропорционален разности давлений в степени и,
т. е. р* — p’f, причем здесь верны те же критерии, что и при
растворении.
Если внутри вакуумной системы давление низкое, а снаружи
атмосферное, то диффузия со стороны атмосферы растворяю-
щегося в стенках газа может привести к проникновению некото-
рых атмосферных газов внутрь вакуумной системы. Это натека-
ние газа может быть количественно определено некоторым пото-
ком натекания.
В том случае, когда растворимость и диффузия невелики,
время, необходимое для проникновения газа через стенку и
установления стационарного потока, может быть относительно
большим.
3.7.1. Течение газа в твердых телах
Как установившееся, так и неустановившееся течение газа
сквозь твердое тело, вызванное растворением и диффузией, мож-
но рассматривать на основе уравнения (3 56).
Установившееся течение. Предположим, что по одну сторону
стенки площадью 1 см2 и толщиной L имеется давление pit а по
другую — давление /?2- Согласно уравнению (3.54), объемные
концентрации газа на обеих поверхностях будут соответственно
пГ[ = гр“, \ = гр“. (3.58)
Показатель степени и может иметь значение 1, */2 и т. д. в за-
висимости от свойств газа и характеристик материала стенки.
При рг > pt диффузия происходит от поверхности 2 к поверх-
ности 1. Поток, соответствующий этой диффузии, находится из
закона Фика:
I[dx = — Ddnr. (3.59)
Уравнение (3 59) можно проинтегрировать в соответствую-
щих пределах, принимая D = const, а также Л = const в
156
ГЛАВА 3
установившемся потоке:
L пг,
I, dx = I{L =— D J dnr = D (tir2 — nr). (3.60)
° «г2
Подставляя выражения (3.58) для пг, и пг,, получим
и__ а
I\ = Dr . (3.61)
Таким образом, удельный поток 1{ возрастает вместе с уве-
личением перепада давлений по обе стороны стенки и умень-
шается при увеличении ее толщины; он пропорционален произ-
ведению коэффициентов диффузии и растворимости газа в ма-
териале стенки.
3.7.2. Коэффициент и постоянная проникания газа
Произведение коэффициентов растворимости г и диффузии D
называется коэффициентом проникания:
U = rD. (3.62)
Так как г и D зависят от температуры (входящей в числитель
экспоненциальной функции), то можно записать
П = По ехр
На. пр
"о Т~
Атепл 5.
(3.63)
где
По — г 0Da
(3.64)
есть постоянная проникания газа, а На Пр — теплота активации
проникания газа.
Величина Нй. цр включает теплоту диффузии, теплоту рас-
творения и, в частных случаях, энергию диссоциации молекул
на атомы. Коэффициент проникания П увеличивается с ростом
температуры и с уменьшением теплоты активации проника-
ния На. пр-
Принимая в выражении (3.61) р2 = ра, Pi С Р2 и L = 1, эту
формулу можно записать в виде
Ц = Пр“. (3.65)
В формуле (3.65) коэффициент проникания П равен потоку газа
в единицах pV, проникающему через 1 см2 стенки толщиной
1 см в течение 1 с под действием атмосферного давления.
Кривые, представленные на фиг. 3.21, показывают зависи-
мость коэффициента проникания от температуры для некоторых
двухатомных газов в металлах (и = '/2), а также для некото-
рых одно- и двухатомных газов в стеклах и керамиках (и = 1).
Фиг. 3.21. Зависимость коэффициента проникания П от температуры (по
Вальдшмидту, 1954 г.; Нортону, 1957 г.; Мюллеру и Шепарду, 1961 г.;
Роджерсу, Дэшману и Лафферти, 1962 г.; Гормену и Норделлу, 1962 г. и др.),
г, I ч тт 1 см3(норм.)-ем 1 \ , „ ,,
Газы в металлах а=1/2, П= --------------— 1 — H2-»Pd; 2—H2-»Ni; з—Н2-»Ре;
\ L см!-с-атм '2 1 )
4—Н2-» ковар, нержавеющая сталь; 5—Н2-»Си; 6—N2-»N1.
Газы в стеклах и керамике ^«=1, П=: 7—Не-»викор; 8— Не-»пи
реке 7740; 9— H2-»S1O2; 10— M2-»SiO2; 11 — Не-»керамика; 12 — Н,-»стекло 1720; 13— Не-»
> стекло G; 14— воздух-»пирокерамика, /5 —воздух-»пирекс; Iff —воздух-»керамика,
17— воздух-»стекло 1720; 18—О2, N2-»пирекс.
158
ГЛАВА 3
Как видно из кривых, в целом проникновение газов через
металлы больше, чем через стекло. Гелий обладает наибольшей
способностью к прониканию сквозь стекла, особенно твердые.
Вопрос о проникании гелия сквозь стекла будет рассмотрен от-
дельно.
Проницаемость органических веществ (пластмасс, эласто-
меров и т. п.) относительно велика. Для большинства этих ма-
териалов коэффициенты проникания различных газов (особен-
Таблица 3.15
,, тт Г,л Я см3 (норм) СМ 1
Коэффициент проникания П I 10-8—см2 с атм— различных газов
в некоторых органических веществах (по различным источникам,
главным образом по Ван-Амеронгену, Мейерсу и др.,
Барреру, Бартону, Нортону)
Материал (rs~300 Газ
n2 О, Н2 со2 Не Аг
Каучук натуральный Каучук метиловый (на ос- нове диметилбутадиена) Каучук бутиловый (на ос- нове изобутилена) 6 0,4 0,25 18 2 1 38 13 6 100 6 4 20 11 5
S Изопрен акрилонитриловый Изопрен метакрилонитрило- вый 0,15 0,5 0,7 1,8 6 10 3 И 6
Пербунан 18 (бутадиенакри- лонитриловый) Пербунан (хлоропреновый) 2 0,4 6 3 15 10 50 25 10 5
Неопрен G (хлоропреновый) Буна-S (полибутадиен сти- роловый) 25 5 3 13 10 30 20 95 4 18 6
Эластомеры, смолы 1 Тефлон (PTFE — политетра- фторэтилен) ) Полихлорвинил Полистирол Плексиглас (полиметилмета- крилат) Вулкапрен (полиэфирная смола) 0,002 0,1 0,2 2 0,3 0,007 0,5 0,5 1 4 6 18 5 0,05 6 14 10 5 7
’) Некоторые исследователи приводят значительно ботьшие значения коэффициента
проникания.
СВЯЗАННЫЕ ГАЗЫ
159
но легко ожижаемых газов типа СО2, NH3) имеют большие зна-
чения.
В табл. 3.15 приведены значения коэффициента проникания
некоторых газов в различных металлах при комнатной темпе-
ратуре.
3.7.8. Газовыделение с поверхности и приток газа
к поверхности в случае очень толстой стенки
Положим, что масса материала стенки равномерно насыще-
на газом при давлении ра, а начальная объемная концентрация
этого газа равна пГа. Когда давление над поверхностью стенки
снизится до уровня р (р<СРо), начнется десорбция с поверх-
ности и переход газа в объем сосуда; его место будет занимать
газ, диффундирующий из глубины материала к поверхности.
Очевидно, что тут же у поверхности (при х = 0) возникнет гра-
диент концентрации. При этом интенсивность газовыделения с
поверхности можно описать формулой
Л,о = -/)(^=о- (3.66)
По мере газовыделения с поверхности стенки изменяется
пространственное и временное распределения его концентрации
в глубине материала. Такое состояние описывается вторым за-
коном Фика:
(3>67а)
дт дх \ дх } а/
При условии D — const это уравнение может быть записано
в виде
= (3.676)
Решение уравнения (3.676) дает поток газовыделения с единицы
поверхности очень толстой стенки в момент т (отсчитываемый
с момента начала понижения давления):
£ • (3.68)
Таким образом, Ц,х имеет максимальное значение в момент
г = 0 и уменьшается со временем. Теоретически при т = 0
Л, т = оо, что означает мгновенную десорбцию поверхностного
слоя газа. Общее количество газа, истекающего с единицы по-
верхности за время т, определяется интегралом
Qi = J Л, .dx = 2щ0 |/ (3.69)
160
ГЛАВА 3
Уравнения (3.68) и (3.69) справедливы также для случая, ког-
да диффузия газа происходит из окружающей среды внутрь
тела, в котором имеется газ с начальной концентрацией пГо,
много меньшей концентрации окружающего воздуха. Тогда
удельный поток It направлен внутрь твердого тела.
3.7.4. Газовыделение с поверхности плоской пластины
конечной толщины
Если пластину толщиной L, содержащую газ при концент-
рации пГа, поместить в высокий вакуум, с обеих ее поверхно-
Фиг. 3.22. Изменение концентрации газа внутри пластины толщиной L по
времени т и в зависимости от расстояния х от поверхности (по Тодду, 1955 г.).
стей начнет выделяться газ, мгновенный поток которого через
единицу поверхности будет равен
8иг D w-ч 1
It = J} exp [— л2 (2л + I)2 -р- т].
п=0
(3.70)
Количество газа, выделившегося за время т, определяется фор-
мулой
т
г / dn„ \
«‘=2О/ЫЧ=Л=
= nf0L
оо
1 — л2" S (2«+ I)2 еХР [~ л2 + I)2 Z2 Т]
О
(3.71)
Распределение концентрации газа внутри пластины в зависи-
мости от времени и расстояния от поверхностей представлено на
фиг. 3.22. Оказывается, что сложное выражение (3.71) в слу-
чае толстых плоских пластин может быть заменено соотноше-
нием (3.69).
СВЯЗАННЫЕ ГАЗЫ
161
3.7.5. Течение газа в стенках конечной толщины
Рассуждения в разд. 3.7.4 касались установившегося течения
газа сквозь стенку толщиной L. В случае неустановившегося
течения, когда внутрь стенки толщиной L (предварительно пол-
ностью очищенной от газов) от одной из ее поверхностей начи-
нает диффундировать газ под давлением рг, он достигнет дру-
гой поверхности по истечении определенного времени го и только
после этого начнется его десорбция с другой поверхности (внутрь
вакуумной системы). Если давление р2 значительно больше, чем
Pi, то полное количество газа, которое проникает сквозь стенку
за время т (относительно большое), может быть выражено фор-
мулой
’ т
Г Пг D
Q1 (0 + т) = J II dr с*(т — т0), (3.72)
о
где Пг2 — концентрация газа у поверхности стенки со стороны
давления р2| То — время, необходимое для продвижения фронта
Фиг. 3.23. Зависимости удельного потока Л газа сквозь стенку и количества
проникающего через 1 см2 поверхности стенки газа Qi от времени т
волны газа (так называемое временное запаздывание, $№.3.23).
Это время вычисляется по формуле
,72
То = -^. (3.73)
справедливой для т > то.
При т То, т. е. в случае установившегося течения, из вы-
ражения (3.72) получаем
п. D Dr
Q\ = I\.r — -~-x — — p^r, (ЗЛА)
Что согласуется с уравнением (3.61), если в Нем принять pi<CP2-
Зависимости Q! = f(x) и А = f(x) представлены на фиг. 3.23.
6 Зак 510
162
ГЛАВА 3
3.8. ПРОНИКНОВЕНИЕ ГЕЛИЯ СКВОЗЬ СТЕКЛО
При сверхвысоком вакууме, особенно в системах, изолиро-
ванных от насоса, даже небольшой приток газа оказывает зна-
чительное влияние на уровень давления в вакуумной системе.
Следовательно, проникновение газа сквозь стенки может иметь
в таком случае существенное значение. Из анализа коэффи-
циентов проникания газов в различных материалах следует, что
сма(норм)-ом
^о.Э смг-с-атм
Фиг. 3 24. Зависимость теплоты активации диффузии Нв,л и проникания гелия
сквозь стекла с различным содержанием стеклооЗразующих компонентов
(SiO2 + В2О3 + Р2О5) ПРН температуре 373 К (по Нортону, 1953 г.; Эшбаху,
1960 г. и др.).
Номера на кривых соответствуют номерам стекол в табл. 3.16.
газом, с проникновением которого сквозь стенки вакуумной си-
стемы следует считаться прежде всего, является гелий, а наи-
более проницаемыми твердыми материалами — некоторые сорта
стекол (проникновением других газов сквозь эти стекла по срав-
нению с гелием можно пренебречь). Следует помнить, что со-
держание гелия в атмосферном воздухе достаточно велико: его
парциальное давление в атмосфере составляет ~4-10-3 Тор.
Оказывается, что проницаемость твердых стекол в отношении
гелия больше, чем мягких, причем она уменьшается с умень-
•ВЯЗАННЫЕ ГАЗЫ
Т63
шением содержания стеклообразующих окислов в стекле (SiOa,
В2О3, Р2О5). Большое содержание стеклообразующих окислов
снижает энергию активации диффузии, что содействует росту
диффузии и, следовательно, увеличивает проницаемость.
Кривые на фиг. 3.24 иллюстрируют зависимость энергии ак-
тивации диффузии от содержания SiO2 + В2О3 + Р2О5 в различ-
ных стеклах. Добавление Na2O, Н2О и ВаО полезно в отноше-
нии уменьшения проникновения гелия. Такие окислы, как А12О3
и РЬО, слабо влияют на проникновение гелия. На фиг. 3.24 при-
ведена также зависимость коэффициента проникания П (при
температуре 373 К) от содержания стеклообразующих окислов.
Номера около точек на кривой соответствуют номерам стекол,
согласно табл. 3.16.
Таблица 3.16
Процентный состав стекол, характеристики которых представлены
на фиг. 3.24
S а ч а блнз- 4ОМУ Стеклообр азу ющие компоненты, %
1 Номер, col фнг. 3.24 Название стекла Тип стекл. (Corning), кий к даш 2 W о са О CU м О РЬО УХ + О!ВМ Ъй + о Л и 2 CQ N
1 2 3 4 5 6 7 8 9 Плавленый кварц Викор Пирекс Борокремниевое Алюмофосфор- ное Натрийкальцие- вое Алюмокремние- вое Высокосвинцо- вое (поглощаю- щее рентгенов- ское излуче- ние) Свинцовое бес- кремниевое, ма- лощелочное С-7940 С-79'0 С-7710 С-0080 С-1720 С-8363 100 96 81 65 72 62 31 3 13 25 5 5 22 1 II 1 3 1 1 1 1 100 99 94 90 82 72 67 31 22 1 2 3 11 1 18 7 1 61 78 4 7 17 10 15 8 7
3.8.1. Пример
С целью иллюстрации предыдущих рассуждений проведем
расчет давления гелия как функцию времени в сосуде из стекла
викор объемом V == 1 л с поверхностью стенок А = 500 см2,
164
ГЛАВА 3
толщиной L — 0,1 см, откачанного до давления р = 10~12 Тор.
Приток гелия описывается формулой
/=М=-П-т£'Л (3.75)
где рне = 4-10"3 Тор — парциальное давление гелия в воздухе.
Из соотношения
/=4=4- <3-7б>
получим
По кривой для стекла викор и гелия, представленной на фиг. 3.21,
Фиг. 3.25. Зависимость давления газа, проникающего из атмосферы в сте-
клянный сосуд (объемом К = 1 л, с поверхностью 4=500 см2 и толщиной
стенок L = 0,1 см) при комнатной температуре (Т = 293 К), от времени (по
Нортону, 1962 г.).
для Т = 293 К находим П = 2,5-10~10. Подставляя соответ-
ствующие значения в формулу
Пр.» А
Р==Роо + —ЦГ-^> (3.78)
получим зависимость давления от времени
Р - Ю"12 +
2,5- 1О~1оХ4 - Ю-’ХбОО
0,1 X 1000 Т1
СВЯЗАННЫЕ ГАЗЫ
165
или для не очень больших значений т
р=Ю"12 + 5- 10“12т~5- 10“12т.
Если бы стенки стеклянного сосуда были во время откачки пол-
ностью обезгажены, гелий появился бы на внутренней поверх-
ности сосуда только через время т0. Принимая в уравнении (3.73)
L = 0,1 см и определяя по фиг. 3.21 (кривая 7 для Т = 293,К)
£>Не, викор — 5-108, находим
О I2
т0=---------В- ~ 3,3 • 104 с = 9 ч.
0 6X5-10-8
Зависимость рне = f(t) представлена на фиг. 3.25. Для иных
газов и стекол с меньшей проницаемостью данная кривая сме-
щается вправо, как это показано штриховыми линиями для не-
она и водорода. Линия, обозначенная «Не — стекло 1720», от-
носится к прониканию гелия сквозь стекло типа 1720 (с мень-
шим содержанием SiO2). Из кривых фиг. 3.25 также можно
видеть, что проникающая способность у других газов слабее,
чем у гелия. В табл. 3.17 приведены (Нортон, 1962 г.) объемы
различных газов (в см3 при нормальных условиях), которые
проникают в течение 1 с из атмосферы через 1 см2 поверхности
кварцевого стекла (SiOg) толщиной 1 мм.
Таблица 3.17
Проникновение различных газов из атмосферы (под парциальным
давлением) сквозь кварцевое стекло (по Нортону, 1962 г.)
Газ Не Ne н, О, N,
Количество газа, см3 •см-2•с-1 2-10“14 3,6- 10-17 1 • 10“18 1,6 -10-27 1,2 • Ю“27
3.9. ДЕСОРБЦИОННЫЙ ПОТОК С РАЗНЫХ ПОВЕРХНОСТЕЙ
Анализ течений газа в твердых телах позволяет прийти к
выводу, что поток газа зависит от растворимости и диффузии,
которые являются функциями температуры, а также от вре-
мени. Поэтому на величину десорбции существенное влияние
оказывает термовакуумная предыстория материалов установки.
Повышение температуры увеличивает поток десорбции и по-
этому ускоряет обезгаживание; понижение же температуры
166
ГЛАВА 3
уменьшает поток десорбции и поэтому полезно для получения
высокого вакуума.
Наиболее характерной для описания десорбционных свойств
материала является зависимость интенсивности десорбции Л, де0
от времени т
11, дес = Мт) (Г = const). (3.79)
Зависимость (3.79) в логарифмических координатах пред-
ставляется кривой, имеющей в общем случае переменный нак-
лон а. Обычно для такой кривой указываются величины Л, део
и cci для времен десорбции щ = 1 ч и Т4 = 4 ч.
Фиг. 3.26. Зависимость интенсивности десорбции /1>дес от времени т для
разных металлов при Т ~ 300 К (по Шраму, 1963 г.).
1—хромоникелевая нержавеющая сталь Z3CN с необработанной поверхностью;
2— сталь Z3CN электрополированная; 3—сталь, полированная стеклянными шариками;
4—мягкая сталь, никелированная и полированная; 5—рафинированная электрополирован-
ная медь; 6—алюминий; 7—дюралюминий
В табл. 3.18 приведены соответствующие значения для неко-
торых органических материалов (эдастомеров и пластмасс) и
ряда металлов. На фиг. 3.26—3.28 представлены зависимости
десорбции от времени обезгаживания для металлов, стекол и
органических материалов.
Фиг. 3.27. Зависимость интенсивности десорбции Л.десОТ временит для
борокремниевого стекла М02А при 7S = 300K (по Генри, 1961 г.).
1—после первого прогрева; 2—после прогрева в течение 5 ч при 373 К и выдержки на
• воздухе в течение 14 ч.
Фиг. 3.28. Интенсивность десорб-
ции lt, дес с поверхности эластомеров
при температуре 298 К в функции вре-
мени (по Геллеру, 1958 г.).
1 — синтетический каучук (прокладка пло
ская —круглая — ///); 2 —пербунан;
3—аральдит, полиуретан; 4—тефлон; 5—го
стефлон.
Таблица 3.18
Интенсивность десорбционного потока If atc [ 10~т Top • л • с~* • см-2]
через 1 ч и через 4 ч после начала откачки, а также
коэффициенты а(1) и а(4) для некоторых материалов при Т ^300 К.
Величины ориентировочные (по Дейтону, 1959 г., и др.)
Материал Время с начала откачки
1 ч 4 Ч
!1, дес (1) “(1) Л, дес (4) °(4)
Эластомеры
Каучук натуральный, резина белая 12 0,5 6 0,5
и красная
Каучук бутиловый 20 0,7 6 0,6
Неопреи 30-300 0,4—0,5 15-180 0,4-0,5
Неопрен обезгаженный 120 0,5 — —
Пербунан 5-90 0,65 2-40 0,6-1,1
Пластмассы
Тефлон 5 0,7 1,5 1
Тефлон, дегазированный - 0,1 2 — - -
Аральдит 5-80 0,3-1,3 1-20 0,5-1,3
Эпоксидная смола дегазированная 0,2 1,5 ___
влажная 100 0,6 — —
Полиэтилен 2,5 0,5 1,2 0,5
Полиуретан 5 0,5 2,5 0,5
Полихлорвинил дегазированный - 0,1 3 — —
4. Получение
высокого
вакуума
4.0. ВВЕДЕНИЕ
Для выяснения сущности задачи получения и сохранения
возможно низкого давления в каком-либо закрытом сосуде вновь
рассмотрим сосуд, в котором нет молекул газа, т. е. существует
абсолютный вакуум (давление равно нулю).
Из того, как ведут себя связанные газы, можно сделать вы-
вод, что для создания абсолютного вакуума недостаточно уда-
лить газы и пары из объема сосуда, поскольку по мере пониже-
ния давления будет происходить десорбция газов (находящих-
ся при данном давлении в равновесии со свободными газами в
сосуде), в связи с чем концентрация газа в сосуде будет выше
нуля.
Предварительное удаление газов с поверхности стенок (на-
пример, путем нагрева поверхности или бомбардировки ее элек-
тронами и т. п.) оказывается малоэффективным, так как при
откачке сосуда из толщи материалов, находящихся в условиях
пониженного давления, сразу же начинают выходить на поверх-
ность новые атомы или молекулы газов.
Вышедший на поверхность газ вследствие тепловых колеба-
ний структуры конструкционных материалов, соприкасающихся
с вакуумом, подвергается десорбции и переходит в объем сосу-
да как свободный газ. Вследствие этого давление в сосуде по-
вышается, а вакуум ухудшается. Удаление адсорбированных
газов и повторная очистка стенок также не дают длительного
эффекта, так как снова начинается описанный процесс выделе-
ния газа изнутри материалов. Таким образом, в условиях абсо-
лютного вакуума имеет место непрерывный процесс диффузии
газа из глубины элементов конструкции на поверхность и де-
сорбции газов с поверхности.
Таким образом, необходимым условием получения и сохране-
ния высокого вакуума в сосуде является удаление не только
свободных газов из объема сосуда, но и газов, связанных с по-
верхностью (адсорбированных) и толщей материала (абсорби-
рованных и растворенных). Следует, однако, иметь в виду, что
на место газов, перешедших из объема стенок на внутренние
170
ГЛАВА 4
поверхности и оттуда в объем сосуда, поступают новые порции
газа из внутренних слоев материала, которые также постепенно
переходят в объем сосуда.
Отсюда следует, что вакуумная система для сохранения в ней
требуемого низкого давления должна периодически или непре-
рывно подвергаться откачке.
Таким образом, целью откачки является создание в объеме
требуемого низкого давления в как можно более короткое вре-
мя и сохранение вакуума в течение как можно более длитель-
ного периода времени.
4.0.1. Давление в вакуумной системе
Любая вакуумная система может быть представлена как
некоторое пространство, ограниченное замкнутой поверхностью,
элементы которой либо десорбируют1), либо сорбируют газы.
.Если преобладает десорбция, то давление в системе возрастает,
если же преобладает сорбция — давление уменьшается.
Величина давления, которое установится в системе, следует
из формулы
(4Л)
где 5 обозначает сумму потоков натекающего газа, S S —
сумму скоростей откачки (вместе с сорбцией).
Зависимость (4.1) выражает важную закономерность: для
получения возможно низкого давления р следует применять
устройства с возможно большей скоростью откачки S, а также
всемерно стремиться к уменьшению притока I газов в вакуум-
ную систему.
Выводы, следующие из этого положения, являются основой
рационального проектирования и изготовления устройств высо-
кого вакуума.
Следует отметить, что даже при самом тщательном обезга-
живании стенок сосуда и ограничении проникания газов извне
всегда существует некоторый приток газа в объем сосуда. Это
можно представить так: каждая единица элемента поверхности
стенки сосуда является источником газа с интенсивностью га-
зовыделения Ц.
Обе эти задачи — удаление газов и уменьшение интенсивно-
сти их выделения с поверхности стенок — являются основными
задачами' первая — техники, а вторая — технологии высокого
вакуума.
') Впуск газа через отверстие в подвергаемый откачиванию объем можно
считать эквивалентным десорбции с пдощади впускного отверстия
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
171
Первая задача решается путем откачки сосудов с помощью
вакуумных насосов разнообразных конструкций, действие кото-
рых основано на различных принципах.
Вторая задача касается газов, связанных с поверхностью и
объемом материалов, из которых изготавливаются стенки со-
суда, вакуумные трубопроводы и другие элементы вакуумных
устройств. Эти вопросы являются предметом изучения техноло-
гии материалов высокого вакуума, в основе которой лежат фи-
зика и химия явлений в толще и на поверхности материалов.
Сюда входят процессы выделения (десорбции) газов твердыми
телами, поглощения (сорбции), связывания газов на поверх-
ности (адсорбции) и внутри стенок сосуда (абсорбции), рас-
творения газов в материале стенок, переноса массы газов вну-
три материала (диффузии) и, наконец, проникновения сквозь
стенки.
Явления, происходящие при создании и поддержании ваку-
ума, — процессы откачки, сорбции, десорбции и т. д. — характе-
ризуются определенными параметрами, которые требуют количе-
ственных измерений, составляющих предмет вакуумной метро-
логии.
4.0.2. Понижение давления при утечке частиц газа
Основным явлением, которое используется в вакуумной тех-
нике, является движение частиц газа. Именно благодаря сво-
ему движению частицы оставляют откачиваемое пространство.
Если частицы газа, оставив откачиваемый объем, уже не могут
возвратиться в него, то выполняется главное условие получения
вакуума.
Быстрота, с которой при этом происходит понижение давле-
ния (определяемое количеством частиц газа, оставляющих в
единицу времени откачиваемое пространство), зависит от кон-
центрации газа в пространстве, скорости движения частиц и
площади отверстия, через которое частицы удаляются из про-
странства, или от размеров поверхности, на которой они адсор-
бируются.
Таким образом, сам газ, благодаря движению своих частиц,
скорость и кинетическая энергия которых зависят от темпера-
туры, имеет естественную склонность к утечке из данного объ-
ема.
Если бы, например, кубический сосуд объемом V, содержа-
щий У молекул газа [что соответствует давлению р = k(N/V)T],
поместить в космическом пространстве, где давление практи-
чески равно нулю, а затем все стенки этого сосуда внезапно
удалить, то в том месте, где был газ, очень быстро создался бы
космический вакуум. Для того чтобы молекулы прошли путь
172
ГЛАВА 4
от точек, в которых они находились в момент удаления стенок,
до точек, расположенных вне поверхностей, ограничивающих
куб, достаточен относительно малый промежуток времени.
Если вместо удаления стенок сосуда в одной из них сделать
небольшое отверстие, то время, необходимое для опорожнения
сосуда, значительно возрастет, так как в каждое мгновение со-
суд оставляют лишь те молекулы, которые в своем беспорядоч-
ном движении попадают непосредственно в отверстие. По мере
уменьшения концентрации газа в сосуде количество молекул,
оставляющих сосуд через отверстие, становится все меньше, так
как в каждый момент оно пропорционально количеству моле-
кул, находящихся в сосуде.
Этот процесс можно описать уравнением
_^ = aN, (4.2)
в котором левая часть выражает скорость убывания количе-
ства молекул —dN по времени di, правая же — пропорциональ-
ность (с коэффициентом а) этого процесса количеству моле-
кул N в объеме.
Уравнение (4.2) можно переписать в виде
т. е. привести к виду (2.166); решение уравнения (4.3) анало-
гично уравнению (2.167):
N = No exp (— ат), (4.4)
где No— начальное количество молекул, а — коэффициент, про-
порциональный скорости откачки S.
Из формулы (4.4) легко сделать вывод, что последняя мо-
лекула оставит сосуд через бесконечно длинный промежуток
времени.
Вышеприведенные рассуждения показывают, что главная
трудность при создании вакуума состоит в том, чтобы не допу-
стить попадания в сосуд частиц, находящихся в окружающей
среде. Понятно, что лучшим условием получения вакуума в
сосуде было бы наличие идеального вакуума вокруг сосуда. Так,
можно себе представить, что сосуд с отверстием помещен на не-
которое время снаружи космического корабля, а затем его от-
верстие плотно закрыли; при этом внутри сосуда будет иметь
место вакуум, соответствующий вакууму космического про-
странства.
В земных условиях вакуум создается с помощью вакуумных
насосов.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
173
4.0.3. Отверстие в область высокого вакуума
как идеальный вакуумный насос
Идеальным вакуумным насосом является отверстие в про-
странство с идеальным вакуумом, где концентрация газа посто-
янно равна нулю (и = 0). Это значит, что в указанном про-
странстве давление постоянно равно нулю. В этих условиях мо-
лекула газа, покидающая сосуд через отверстие, уже не возвра-
щается; нет также молекул, которые бы через это отверстие
проникали из окружающего пространства в откачиваемый
объем. Если сосуд, давление в котором составляет р = knT,
связан с вакуумом отверстием, имеющим площадь А, то из этого
сосуда каждую секунду будет улетучиваться в соответствии с
формулами (2.14) и (2.32)
v'a = j nvapA (4.5)
молекул газа.
Выражая п через р и Т, а иар через Mq и Т, получим
]/ L Л^3,5-Ю22—(4.6)
V 2nk / Мо УТ ума Ут к
Таким образом, для данного газа (Мо) при известных тем-
пературе Т и давлении р количество откачиваемых в течение
1 с молекул v'a пропорционально поверхности отверстия А.
Используя формулу (2.159), интенсивность утечки газа через
отверстие площадью А можно выразить как
7 = М = 3,64|/-^рА, (4.7)
а скорость (быстрота) откачки, согласно формуле (2.161), как
3=^_3,64/£л (4.8)
(единицы: л-с-1, К, г-моль-1, см2).
4.0.4. Отверстие в пространство с давлением,
не равным нулю
Если откачка из сосуда производится через отверстие, с дру-
гой стороны которого давление р' > 0, то через отверстие, кро-
ме движения молекул, направленного наружу, происходит так-
же движение и в противоположном направлении. Количество
молекул, возвращающихся в объем (обратный поток газа), мо-
жно выразить формулой, подобной формуле (4 7), заменив в ней
р на р'. Таким образом, количество молекул, в действительности
174
ГЛАВА 4
удаляемых из объема в единицу времени, оказывается равным
разности количеств молекул, движущихся через отверстие на-
ружу и внутрь сосуда:
v^== 3,64-4- (р-р') А, (4.9)
у мот
которую можно записать как
v^ = 3,644(1 (4.10)
\ р / у мот
Очевидно, формула для скорости откачки соответствующим
образом изменится: ___
5„ = 3,64/Д-д(1-<) (4.11)
(единицы: л-с-1, К, моль-1, см2).
Выражение 4(1—р'/р) является основной характеристикой
насоса. При р р' газооткачивающая способность насоса оп-
ределяется только площадью впускного отверстия 4. В про-
цессе откачки давление р уменьшается и приближается к вели-
чине р', а эффективность откачки уменьшается; при р = р' про-
цесс откачки полностью прекращается.
Таким образом, насос не может создать давление ниже р'.
Это давление называется предельным (остаточным) давлением
(р' = роо). Его можно рассматривать как причину существова-
ния обратного потока газа в насосе.
Итак, хороший вакуумный насос должен иметь выходное от-
верстие с большой площадью 4 и как можно более низкое пре-
дельное давление щ»; такой насос в состоянии создать хороший
вакуум за короткий промежуток времени.
4.0.5. Классификация вакуумных насосов
Действие вакуумных насосов основывается на различных
процессах, являющихся объектом изучения физики, химии и элек-
троники. Насосы можно разделить на две основные группы:
А Проточные насосы, которые удаляют газ из откачивае-
мого пространства наружу.
Б. Сорбционные насосы, не удаляющие газа из освобождае-
мого пространства, но связывающие его каким-либо образом
внутри сосуда.
Проточные насосы, как правило, являются насосами механи-
ческого действия и нуждаются в том, чтобы некоторые их де-
тали приводились в механическое движение; сорбционные насо-
сы являются статическими. Проточные насосы имеют вход и
выход, а сорбционные — по существу только вход, так как газ
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
175
в принципе не удаляется из них наружу (поэтому при опреде-
ленных условиях сорбированный газ может частично подвер-
гаться десорбции и возвращаться в откачиваемое пространство).
В связи с различием принципов, на которых\Основана рабо-
та этих насосов, для их характеристики используются различ-
ные параметры.
цнонного насоса Sp от давления р; зависимость производительности диффузион-
ного насоса ^ДИфф и ротационного насоса от давления р
Вообще говоря, независимо от рода насоса скорость откачки
S определяется в соответствии с формулой (4.8) величиной по-
верхности А (площади входного отверстия, сорбирующей по-
верхности и т. д.).
Предельное давление р<х, зависит прежде всего от обратного
потока газа в насосе, т. е. от того, в какой степени откачивае-
мый газ возвращается на вход в насос (или десорбируется с
поверхности сорбционного насоса). На предельное давление на-
соса оказывает также влияние давление паров веществ, нахо-
дящихся в откачиваемом сосуде (например, в ротационных и
диффузионных насосах — паров масла или ртути).
Так как скорость откачки не является величиной постоян-
ной, то часто ее зависимость от давления представляется в
виде функции S = f(p), как это для примера показано на
рис. 4.1 сплошными линиями для проточных насосов: масляного
176
ГЛАВА 4
ротационного и диффузионного. Штриховыми линиями на фиг. 4.1
представлена зависимость производительности насоса I = Sp от
давления. Эти кривые могут использоваться и при расчете сов-
местной работы насосов.
- Для сорбционных насосов, где газ не удаляется из откачи-
ваемого сосуда, более показательной характеристикой является
зависимость количества Q связанного газа от давления р. Это
Фиг. 4.2. Количество Q/m азота N2> связываемого одним граммом цеолита 5А,
в зависимости от давления р при температуре жидкого азота (Г =78 К) и
при комнатной температуре (7 =293 К) (по Тарнеру и Файнлебу).
количество может быть выражено либо в единицах pV, либо в
граммах на единицу массы или единицу поверхности связываю-
щего материала.
На фиг. 4.2 представлена зависимость количества азота, свя-
зываемого одним граммом цеолита типа 5А в цеолитовом на-
сосе (Q/m), от давления р.
А. ПРОТОЧНЫЕ НАСОСЫ
По принципу действия проточные насосы можно подразде-
лить на: 1) объемные насосы (вытеснения), в которых пониже-
ние давления происходит благодаря увеличению объема газа,
2) скоростные насосы, в которых молекулам газа сообщается
скорость в направлении откачивания (т. е. от входа к выходу
насоса), вследствие чего они уходят из откачиваемого про-
странства, 3) молекулярные насосы, в которых молекулы газа,
временно адсорбированные на поверхности, переносятся путем
перемещения адсорбционной поверхности из одного места про-
странства в другое, 4) аккомодационно-эффузионные насосы, в
которых молекулы газа переходят из одной области замкнутого
пространства в другую благодаря различным коэффициентам
аккомодации сорбирующих поверхностей и разным их темп§-
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
177
ратурам (эффузия). Насосы двух последних типов более инте-
ресны с точки зрения их принципа действия, чем практического
использования.
В проточном насосе скорость откачки ограничивается ми-
нимальной площадью проходного сечения канала между отка-
чиваемым сосудом и аходом в насос. Входное отверстие насоса
можно рассматривать как сорбирующую поверхность, имеющую
коэффициент прилипания менее единицы; от минимального дав-
ления, создаваемого в этом отверстии, зависит остаточное дав-
ление' в сосуде.
Поток газа / протекает от входа к выходу проточного насо-
са, сохраняя постоянную величину:
1=4- у • <4Л2>
и • \ И / у \ I* I/ / п
На пути откачивания подвергаются изменению как давле-
ние, так и объем откачиваемого газа.
4.1. ОБЪЕМНЫЕ НАСОСЫ
Объемные насосы действуют, как указывалось выше, по
принципу увеличения объема данного количества газа, вслед-
ствие чего, согласно закону Бойля — Мариотта, давление этого
газа понижается:
Увеличение объема, содержащего данное количество газа,
может быть осуществлено разными способами. В самом про-
стом случае насос представляет собой камеру (обычно непо-
движную) с установленным в ней поршнем, движущимся таким
образом, что замыкаемый поршнем объем камеры сначала уве-
личивается и заполняется газом, поступающим из откачивае-
мого пространства через входное отверстие (вход) насоса, —
это процесс наполнения. Затем объем камеры уменьшается (пу-
тем возвратного движения поршня), а сжимаемый в ней газ
удаляется через выходное отверстие (выход) насоса — это про-
цесс удаления ’).
Принцип действия объемных насосов. Если откачиваемый
объем Vo (фиг. 4.3) соединить с входом насоса, у которого объем
камеры (цилиндра) увеличивается от величины Умин~0 до
*) В ротационных объемных насосах роль возвратно-поступательного
движения поршня выполняет вращение ротора. Полный цикл (наполнение и
удаление) соответствует одному полному обороту ротора,
178
ГЛАВА 4
величины Умакс, то давление р0, существующее в пространстве
Vo, уменьшается до величины pi, соответствующей уравнению
PoV0 — Pl (Vo + Vмакс)-
(4.13)
После этого с помощью крана или клапана объем Vo отде-
ляется от насоса, а газ из цилиндра посредством передвижения
поршня выбрасывается под давлением pi через выход насоса'
в окружающее пространство с давлением ра (например, атмо-
сферным). Для следующих циклов откачки можно написать
уравнения
Pl Vfl = Р2 (Vо Vмакс),
P2V0 = Рз (Vo + Умакс), (4-14)
PjV—l Vо PN(Vо + Vмакс).
Таким образом, объемный насос при каждом цикле откачки
удаляет один и тот же объем газа при том давлении, которое
Фиг. 4.3 Принцип действия объем-
ного (поршневог'о) насоса.
/, 2—автоматические клапаны.
Умакс —максимальный объем цилиндра;
Умин —вредный объем; Уо —откачивае-
мый объем, р0—начальное давление;
рд—давление на выходе (например, ат-
мосферное).
в данный момент существует в откачиваемом пространстве, мас-
са же удаляемого газа по мере понижения давления умень-
шается.
После W циклов откачки давление в откачиваемом простран-
стве определяется выражением
Р№Ро(-Го+ Кмакс) =Р° f, , Гамаке И ' (4Л5)
Чем больше отношение VMaKc/Vo, тем меньшее количество
циклов N необходимо для того, чтобы получить требуемое низ-
кое давление pNc^(). Теоретически после Af—> оо циклов от-
качки достигается ря = 0. В действительности же вследствие
негерметичностей, наличия вредных объемов (например, объ-
ема Умин), паров смазок и т. п. после достаточно большого чис-
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
179
ла циклов достигается некоторое предельное давление рх, не-
равное нулю.
Конструктивная скорость откачки объемного насоса. Если
объем камеры во время движения поршня (или ротора) изме-
няется от Емакс до Умин с частотой N', то объем отводимого в
единицу времени газа, т. е. скорость откачки, выразится фор-
мулой
5к = -4^==ЛУ(7макс-Умин)==Г7Макс(1 -Ф^). (4.16)
Это так называемая конструктивная скорость откачни, опре-
деляемая частотой движения поршня и размерами (Объемом)
камеры.
Увеличение SK путем увеличения Умакс приводит к возраста-
нию размеров и стоимости конструкции, увеличение частоты N'
имеет свои пределы, так как она связана с временем протекания
газа через входной трубопровод насоса (временем наполнения
камеры) и выбирается с учетом механико-конструктивных сооб-
ражений (силы, ускорения подвижных частей, износ поверхно-
стей) .
Теоретическая скорость откачки объемного насоса. При дав-
лении р на входе в насос поток газа, согласно формуле (4.16),
составит
/+ = pSK = WMaKC(l (4.17)
Если на выходе из насоса существует давление рВых, то во
время удаления газа объем Умин содержит газ при давлении
рвых в количестве рвых Умин. Некоторая часть ц этого количества
газа проникает в откачиваемое пространство как возвратный
поток, который можно выразить формулой
1_ = ^иИминрвых. (4.18)
Следовательно, производительность насоса определяется вы-
ражением
4 = Z+-/- = WMaKC(l1
\ У макс /
Умии
г* т/ Рвых
У макс_____
1 ^мин \
17 /Р
. у макс /
(4-19)
Полагая 1 (Умин/Умакс) — 1, тик как Умин/Умакс 1, и учи-
тывая зависимость (4.16), можно написать выражение для так
называемой теоретической скорости откачки
STeop = (1 - И (4.20)
Р \ У макс Р /
180
ГЛАВА 4
и, обозначая
Роо^К^-Рвых, (4.21)
* макс
переписать (4.20) в следующем виде:
5теОр = 5к(1 (4.22)
Для р р<х, получим STeop — 5К. Когда р уменьшается и при-
ближается к роо, скорость откачки 5теор уменьшается и при
р = рх становится равной нулю.
Предельное давление объемного насоса. Давление роо, опи-
сываемое формулой (4.21), является предельным давлением
объемного насоса, так как при р = теоретическая скорость
откачки становится равной нулю.
Объем Кмин является вредным объемом, так как с увеличе-
нием его возрастает величина предельного давления роо- Для
уменьшения роо уменьшают Кмин (путем усовершенствования
конструкции насоса), коэффициент ц (например, путем запол-
нения объема Кмин маслом), а также давление рВых (например,
понижением давления на выходе путем последовательного со-
единения нескольких насосов).
В ртутных или масляных объемных насосах', в которых суще-
ствуют пары уплотняющих веществ (ртути, масла), предельное
давление может быть выражено формулой
Роо = Ро0,г + Рп> (4.23)
где роо, г — давление газа, а рП— давление насыщенного пара
уплотняющих веществ или смазок при температуре камеры на-
соса. Следует, конечно, стремиться, чтобы рП было много ниже
(например, на порядок), чем Роо, г-
Следует обратить особое внимание на роль в предельном дав-
лении величины рп, которая также может влиять на характе-
ристику скорости откачки S = f(p). Если вакуумметр измеряет
полное давление Роо, то в случае даже идеальной откачки газов
насосом скорость откачки, согласно формуле (4.22), становится
равной нулю при р = ри (фиг. 4.4, кривая 2'), если же вакуум-
метр не измеряет давления паров (или они удалены, например,
путем вымораживания), то характеристика скорости откачки
может иметь вид кривой 2.
Подобные зависимости остаются справедливыми и для дру-
гих насосов, если в создаваемом ими вакууме имеются пары
каких-либо веществ.
Действительная скорость откачки объемных насосов. Как
указывалось выше, N' нельзя увеличивать выше определенного
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
181
значения. Эта величина должна соответствовать времени напол-
нения насосной камеры. Отсюда следует, что действительная
скорость откачки Здейств меньше теоретической ЗтеОр. Дело в
том, что насосная камера не наполняется газом до того же дав-
ления, какое имеет место в откачиваемом пространстве, из-за
сопротивления протеканию газа во входном канале насоса. По
мере понижения давления р, а также с увеличением рабочей ча-
стоты насоса N' действительная скорость откачки снижается,
Фиг. 4.4. Характеристики откачки ротационных насосов.
Z—линия, соответствующая скорости откачки Зк; 2—характеристика STeOp, снятая при
измерении давления р без составляющей рп; 2'—с составляющей рп; 3—характеристика
$действ= f
так как поток газа уменьшается, а промежуток времени, в тече-
ние которого может наполняться насосная камера, становится
все короче. ,
В связи с этим можно написать следующее соотношение:
"^действ =:'П'5Теор» (4.24)
где параметр т] — f(p,N')^. 1 является так называемым коэф-
фициентом наполнения.
Пример зависимости it)=zf(p, N') для масляного ротацион-
ного насоса представлен на фиг. 4.5, а.
Уменьшение Здейств с увеличением N' (при низких давле-
ниях) объясняется тем, что /_ при этом растет, тогда как 1+ до-
стигает постоянного уровня, не зависящего от N'. Кривая 3 на
фиг. 4.4 представляет зависимость Здейств = f(p) для случая,
когда г) < 1.
На фиг. 4.5, б показана для того же масляного ротационного
насоса зависимость действительной скорости откачки Здейств от
частоты вращения N' для разных давлений р. Видно, что для
низких давлений действительная скорость откачки может быть
больше при меньшей частоте вращения ротора. Так, например,
182
ГЛАВА 4
для р = 0,02 Тор (2,70 Па) максимум 5действ дос^гается при
/V'=310 об/мин, а не при номинальной частоте N'=375 об/мин.
Классификация объемных насосов. В зависимости от вы-
бранного принципа работы системы камера — поршень можно
выделить две главные группы объемных насосов: 1) насосы с
поступательным движением поршня, 2) насосы с вращательным
движением поршня (ротационные).
В зависимости от материала поршня различают насосы ме-
ханические и ртутные.
В зависимости от того, какое вещество служит для уплотне-
ния (смазки) системы камера — поршень, насосы можно делить
на ртутные, масляные и несмазываемые (бессмазочные).
4.1.1. Поршневые насосы
4.1.1.1. Ртутные поршневые насосы. Ртутные насосы, в кото-
рых роль поршня (и уплотнения) исполняет ртуть, на практике
в настоящее время не применяются. В этих насосах столб или
капли ртути, падающие в вертикальной трубе (с высоты, пре-
вышающей барометрическую 760 мм), закрывают камеру, объем
которой подвергается изменению. Действие насосов этого типа
основано на использовании так называемой торричеллиевой пу-
стоты, которая образуется в барометрической трубке высотой
больше 760 мм.
На фиг. 4.6, а представлен бескрановый ртутный насос. Газ
через вход заполняет камеру 1, объем которой затем уменьшают
путем введения в нее ртути из резервуара 2 (который для этого
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
183
поднимается). Ввиду того что ртуть закрывает обратный кла-
пан 3, газ из камеры 1 выталкивается через трубку 4 (являю-
щуюся сифонным затвором) в резервуар 5, а оттуда через труб-
ку 6 и сквозь ртуть в резервуаре 7 в атмосферу. При опускании
баллона 2 клапан 3 открывается и резервуар 1 заполняется га-
зом из баллона 8. Резервуар 2 непрерывно пополняется ртутью
из резервуара 7, в который она сливается в процессе откачки.
На фиг. 4.6, б показан капельный ртутный насос. Из резервуа-
ра 9 со ртутью через капельный кран 10 в трубку 11 вводятся
капли ртути, которые стекают в сосуд 12. В образующиеся между
очередными каплями ртути разрывы через трубку и газовый
кран 10 входит газ; этот газ затем удаляется из сосуда 12 через
ртуть в атмосферу.
Скорость откачки ртутных насосов, естественно, невелика
ввиду малой частоты изменений объема. Другим их недостатком
Т84
ГЛАВА 4
является присутствие паров ртути в откачиваемом простран-
стве.
4.1.1.2. Механические поршневые насосы. Первыми применяв-
шимися вакуумными насосами были поршневые насосы (насос
Герике); их действие в свете рассмотренного выше принципа
откачки путем изменения объема (фиг. 4.3) не требует особых
пояснений. При движении поршня вверх клапан 2 закрывается,
а клапан 1 открывается и происходит наполнение камеры; при
движении поршня вниз клапан 1 закрывается, а клапан 2 откры-
вается и осуществляется удаление газа. Скорость откачки
определяется размерами цилиндра (Гмакс) и пропорциональна
частоте Af' движения поршня, которая не может превышать опре-
деленной величины. Зазор между поршнем и цилиндром уплот-
няется с помощью смазки, которая одновременно предназнача-
ется для уменьшения трения. Она также заполняет вредные объ-
емы, уплотняет клапаны и, кроме того, облегчает охлаждение
насоса.
Предельное давление зависит от конструкции и характеристик
насоса (вредные емкости, уплотнения, род смазки), а также от
температуры, определяющей давление паров масла и изменение
степени герметичности. Последовательное (каскадное) соедине-
ние нескольких насосов позволяет получить более низкое пре-
дельное давление.
Поршневые насосы, даже после введения многих улучшений
(фиг. 4.7), уступают по эффективности ротационным насосам.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
Т85
4.1.2. Ротационные насосы
В ротационных насосах возвратно-поступательное движение
поршня заменено вращательным движением элемента или эле-
ментов, выполняющих роль поршня.
В зависимости от рода уплотняющего вещества различаются,
как указывалось выше, ртутные, масляные и бессмазочные рота-
ционные насосы.
4.1.2.1. Ротационные ртутные насосы. Принцип работы рота-
ционного ртутного насоса Геде (который по существу является
. Выход в форвакуум
Из откачива-
। емозо объема
Ротационный ртутный насос Геде.
-полости камеры;
газомером, вращающимся в обратном направлении/ иллюстри-
рует фиг. 4.8. Фарфоровый или стальной ротор в виде спираль-
ного лабиринта с двумя (или тремя) камерами вращается в ци-
линдрическом сосуде — статоре, наполненном до определенного
уровня ртутью.
При вращении ротора против часовой стрелки объем про-
странства 3 увеличивается, и в него засасывается газ из отвер-
стия 4, соединенного с вспомогательной камерой 5 и через труб-
ку— с откачиваемым объемом. Одновременно объем простран-
ства 6 уменьшается, вследствие чего газ вытесняется через
отверстие 7 и сквозь ртуть выходит в пространство 8, соединенное
с выходом (с форвакуумом, в котором создается соответствую-
щее разрежение). Этот насос требует создания предваритель-
ного вакуума порядка 10—20 Тор для того, чтобы не нарушился
уровень ртути в лабиринтах ротора и она не попала в откачи-
ваемое пространство.
186
ГЛАВА 4
Начальная скорость откачки в этом насосе имеет порядок не-
скольких децилитров в секунду, но она быстро уменьшается,
когда давление приближ-ается к 10~3 Тор, и составляет лишь
~25 см3-с-1 при давлении 10~4 Тор. Предельное давление ртут-
ного ротационного насоса может достигать 10~4—10~5 Тор. Та-
ким насосом следует пользоваться осторожно, так как в случае
внезапной разгерметизации может произойти повреждение на-
соса (фарфоровый цилиндр может треснуть) вследствие силь-
ного удара ртути.
Ртутные ротационные насосы на практике в настоящее время
не применяются.
4.1.3. Ротационные масляные насосы
Ротационные масляные насосы обычно имеют эксцентриково-
золотниковую конструкцию. Чаще других применяются насосы
Выход Вход
Фиг. 4.9. Масляный ротационный насос с золотниками в роторе.
/—статор; 2— ротор- 3, 4, 5 —части камеры; б, 7—золотники; 8—пружина; 9—обратный
клапан; 10—маслоуловитель; 11—фильтр; 12, 13—боковые крышки; 14—ось; 15—уровень
1) с золотниками в роторе, 2) с золотником в статоре и 3) с шар-
нирным золотником.
4.1.3.1. Ротационный масляный насос с золотниками в роторе.
Схема конструкции наиболее простого ротационного масляного
насоса с золотниками в роторе (называемого также лопастным)
представлена на фиг. 4.9. В цилиндрической полости статора 1
вращается на оси 14 помещенный эксцентрически ротор 2, также
цилиндрический.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
187
Цилиндр ротора имеет вырез, в котором находятся золотни-
ки 6 и 7. Пружина 8 прижимает эти золотники к поверхности
цилиндрической полости статора. Боковые крышки 12 и 13 за-
крывают полость.
Золотники делят полость статора на области 3, 4 и 5. Об-
ласть 3 соединяется с входом в насос, область 5 — с выходом,
область 4 ограничена двумя золотниками. При вращении ротора
(по часовой стрелке) область 3 увеличивается, область 5 умень-
шается, а область 4 перемещается от входа к выходу, превра-
щаясь в некоторый момент в область 5; таким образом газ пе-
ремещается от входа в насос к выходу.
Вход в насос снабжен фильтром 11 (сетка), предохраняю-
щим от проникновения внутрь насоса нежелательных твердых
частиц; на выходе имеется так называемый маслоуловитель
(лабиринт) 10, уменьшающий унос распыленного масла1).
Кроме того, на выходе из насоса находится обратный клапан 9,
благодаря которому в выходной камере насоса поддерживается
давление намного ниже атмосферного. Это способствует умень-
шению ц и, следовательно, рсо. Обратный клапан также предо-
храняет насос (в случае остановки) от попадания масла через
вход в откачиваемое пространство2).
Корпус насоса частично заполнен маслом, которое уплотняет
и смазывает камеру, а также отводит тепло. Смазка подвижных
частей производится маслом, подаваемым вдоль оси ротора на
золотники, где оно распыляется благодаря низкому давлению
в камере.
Основные недостатки конструкции ротационных масляных
насосов связаны с наличием вредных объемов и трудностью
уплотнения зазора между ротором и статором. На фиг. 4.10 по-
казан пример вредного объема 1 в золотниковом насосе. Это
объем внутри «клина», который возникает между поверхностями
ротора 4 и статора 6 в зоне между их линией касания 3 и краем
выходного отверстия 2. При вращении ротора золотних захва-
тывает газ в объеме клина при давлении, равном давлению на
выходе, проталкивает этот газ к линии касания, а затем вместе
с маслом, насыщенным этим газом, — ко входу в насос, вслед-
ствие чего вакуум в откачиваемом пространстве ухудшается.
Неблагоприятное влияние этого вредного объемаложет быть
уменьшено различными конструктивными путями. Одним из при-
меров является конструкция насоса, представленная на фиг. 4.11,
*) Маслоуловитель, спроектированный должным образом, уменьшает
также шум, возникающий при выхлопе газа.
2) Другой способ предотвращения попадания масла в откачиваемый
объем состоит в установке небольшого резервуара у входа в насос. В этом
резервуаре скапливается масло, которое после выравнивания давлений сте-
кает обратно в насос.
188
ГЛАВА 4
где ось ротора 3 несколько смещена в сторону выхода, а статор
на участке возможного образования клина имеет углубление, со-
ответствующее по кривизне ротору, благодаря чему контакт
между ротором и статором происходит на более длинной дуге
окружности.
Фиг. 4.11. Пример конструк-
тивного уменьшения вред-
ного объема между точками
2 и 3 (фиг. 4.10) благодаря
цилиндрическому углубле-
нию в статоре (уплотнение
„дуосил" Уэлча).
Фиг. 4.10. Вредный объем в золотни-
ковом насосе.
/— вредный объем; 2, 3—характерные точки;
4—ротор; 5—золотник; 6—статор.
/—ось вращения ротора; Я—ось
цилиндрической полости статора.
4.1.3.2. Ротационный масляный насос с золотником в статоре.
В насосах этого типа цилиндрический ротор 1 (фиг. 4.12) вра-
щается на эксцентрическом валу 2, этот вал расположен на оси
внутренней цилиндрической полости статора 3, так что ротор
постоянно соприкасается с поверхностью статора. Золотник, по-
мещенный в щели статора, прижимается пружиной к поверхно-
сти ротора. Торцы ротора и золотника плотно прилегают к
внутренним поверхностям торцевых стенок статора. Таким обра-
зом насосная камера, образующаяся между статором и ротором,
делится золотником на две области: 4 и 5. Действие насоса не
требует специальных пояснений.
На фиг. 4.12,6 представлено другое конструктивное решение
насоса с золотником в статоре. Для уменьшения износа тру-
щихся поверхностей ротора и статора трение скольжения заме-
нено трением качения. Для этого в качестве ротора используется
полый цилиндр 9, в котором установлен эксцентрик 8. В проме-
жутке между этими цилиндрами имеются роликовые подшип-
ники. Золотник 7 прижимается к ротору при помощи рычага
с пружиной. Износ поверхностей в таком насосе более равно-
мерный, чем в обычных насосах с золотниками в роторе. Вред-
ные объемы в этой конструкции также значительно меньше.
Фиг. 4.12. Ротационный масляный насос с золотником в статоре.
а—золотник скользит по эксцентрической поверхности ротора; б—золотник упивается
в Цилиндрическое кольцо, катящееся по эксцентрику ротора. упиРается
/-эксцентрический ротор; 2-ось; 3~статор; 4, 5-области насосной камеры; 6-шари-
ковый обратный клапан; 7-золотиик; S-обойма; 9— цилиндр эксцентрика.
Фиг. 4 13. Ротационный масляный эксцентриковый насос с шарнирным золот-
ником (Стокса).
/“30-’°™ик; 2—цилиндр ротора; 3— шарнирное устройство; 4—эксцентрик; 5-вал-
в, 7 области насосной камеры; 8—обратный клапан; 9— отвод охлаждающих воды-
10—масло; // — отверстие для слива масла. '
190
ГЛАВА 4
4.1.3.3. Ротационный масляный насос с шарнирным золотни-
ком. В насосе этого типа шарнирный золотник 1 жестко соеди-
нен с полым цилиндром ротора 2 (фиг. 4.13) и скользит в шар-
нирном устройстве 3, шарнир может поворачиваться в пределах
небольшого угла относительно корпуса статора Цилиндр рото-
ра 2 приводится в движение эксцентриком 4, закрепленным на
валу 5
Фиг. 4.14. Эксцентриковый ротационный насос с шарнирным золотником
Кинни.
а—завершение периода удаления и начало периода наполнения; б —промежуточное по-
ложение.
/—золотник; 2—ротор, 3—канал в золотинке; 4— выходной обратный клапан открыт;
5—выходной обратный клапан закрыт; 6— вода, охлаждающая статор насоса.
При вращении эксцентрика 4 цилиндр ротора 2 вытесняет
газ из объема 6 через клапан 8 в картер насоса, а оттуда через
масло к выходу. Одновременно увеличивающийся объем 7 на-
сосной камеры наполняется газом со стороны входа. Корпус
насоса охлаждается водой.
Другая, улучшенная, но более сложная конструкция насоса
с шарнирным золотником показана на фиг. 4.14. В этом насосе
золотник 1 имеет канал 3, через который газ из откачиваемой
полости поступает в насосную камеру. Возможность попадания
встречного потока газа на вход в насос здесь в значительной
степени ограничена благодаря более раннему закрытию входа
при движении золотника, вредное пространство может быть
также уменьшено, Герметичность контакта ротора (золотником)
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
191
с цилиндром в насосах рассматриваемого типа лучше потому,
что в клине между ротором и цилиндром образуется более тол-
стый слой масла; кроме того, эти насосы создают меньше шума.
4.1.4. Ротационные масляные насосы
с балластировочным воздухом ')
В масляных ротационных насосах удаляемый газ сжимается
до сравнительно высокого давления. Если в газе находятся пары
каких-нибудь веществ (например, водяной пар), то при сжатии
до давления выше критического происходит конденсация паров,
и они растворяются в масле. Чтобы избежать этого, в область
насосной камеры, где происходит сжатие, вводится через допол-
нительное входное отверстие воздух в таком количестве, чтобы
давление смеси воздух — водяной пар оказалось достаточным
для открытия выходного клапана, прежде чем водяной пар
достигнет точки насыщения, соответствующей температуре на-
соса. Таким образом, водяной пар удаляется раньше, чем он
успевает сконденсироваться на стенках камеры.
На фиг. 4 15 схематически представлены последовательные
фазы процесса откачки с использованием балластировочного
воздуха. Когда золотник отделяет камеру от вакуумной уста-
новки (точка А), на входе в насос и в камере существует дав-
ление рвх- При движении ротора и золотника вплоть до поло-
жения С объем насосной камеры увеличивается, а давление в
ней снижается до величины рмт- Если насос откачивает газ, не
подвергающийся конденсации, то давление в насосной камере
постепенно повышается до уровня /?Вых, необходимого для пре-
одоления сопротивления пружины выходного клапана (точка G).
Начавшийся в точке G процесс удаления газа через выходной
клапан продолжается вплоть до точки Н, когда золотник ми-
нует нижний край выходного отверстия.
В случае откачки пара, давление насыщения которого при
температуре насоса равно рНас, давление в насосной камере воз-
растает только до этого уровня, т. е. до точки F. С этого момен-
та начинается процесс конденсации пара, а так как его давление
недостаточно для открытия выходного клапана, то пар не уда-
ляется из насоса наружу. Конденсат смешивается с маслом, об-
разуя эмульсию, а затем, после проникновения во входную ка-
теру, снова испаряется и заполняет входную камеру, уменьшая
эффективную скорость откачки.
Когда золотник насоса открывает входное отверстие (точ-
ка В), в насос начинает засасываться воздух Этот процесс про-
должается до тех пор, пока давление в камере не сравняется
’) Нем Gasballastpumpen.
192
ГЛАВА 4
с атмосферным (точка D). В этот момент дренажное отверстие
закрывается, а давление в камере возрастает до уровня рВых,
при котором открывается выходной клапан (точка Н).
Для правильного функционирования такого насоса необхо-
димо, чтобы полное давление в насосной камере достигало
Фиг. 4.15. Круговая диаграмма давлений при работе ротационного насоса
с балластировочным воздухом (с воздушной продувкой)
уровня /?вых, когда парциальное давление пара еще не достигло
критической величины, равной рнас- Это означает, что точка Е
на графике должна предшествовать точке F. Это условие позво-
ляет определить допустимое давление водяного пара pHjOj макс
на входе в насос (табл. 4.1).
Другим важным параметром насоса с балластировочным га-
зом является максимальное количество пара, которое может
Таблица 4.1 Характеристика ротационных масляных насосов (данные ориентировочные, по различным источникам) » О Ю 00 CM CO О <Z) Q 00 Д § s s § сч <Х <Л сл Q ГЛ Щ Щ Щ - - & в ООО ООО QQ Q со СО — < < CQ СО CQ
5 1 S Leybold-He- raeus (ФРГ) Edwards (Ве- ликобритания) Balzers (Лихтенштейн) S0GEV (Франция)
JM ‘оод О О О О S ~ о ю ю ю Ю S ю S ? § О ю о !Л см Тр ю LQ LQ СО
вииэТпвая BioiiBh о о о о LQ СО СО Ю § § § О О О О О О О О О О ю ю ю ю ю
ign ‘Hirsi -влияй qiooHtnow сч S S- LO о" о - 2- ” 5 СО S ’Ф со o' о o' о” О*4
W ‘BIfOBW W949Q ogo; - £ О СМ СМ О' О 00- 1,1 —1,4 1,3—1,7 1 — 1,6 1,1—1,9 1,1-1,9 ия паров).
gl 11 .ояви ‘'о'нш й = 8 о О О О О £ 00 о ю Ю о И §
dox ‘эяви ‘xa ‘o!Hd § м § м СО СО СО СМ ю со см со S о о о о о g тр тр g
£ a8 | I -Hittodu о Д-Л 2 S 2 2 00 СО СО 5/25 4/10 0,5 0,5 0,5 да (не изме
hxsXV -odu вэд I ,-01-г I г-0!-5 ,-01-г 1 г-01 ю ю ю L L L ю см см 1 1 1 1 1 5 22222 g Ю Ю О) О) сч §
J -l« II Bos -sXttodn a 'о <N 2 "о L О 00 7 7 7 1 о о о о о К ~ ~ S СО s 2
и»еХй •odn сэр L ”о "о о L "о "о СМ СО см 7 7 7 7 7 § о о о о о о
УЭНЭПХЮ OlTDHh — см - см - - О) — см см см — — oq еч oq “
Й'о * s4 о г о 5- 00 ° 2 2,2 8,4 2,2 4,2 8,4 ') Измерен
194
ГЛАВА 4
быть удалено насосом в единицу времени, т е так называемая
пароводяная производительность. Эта величина выражается
обычно в граммах за 1 ч и рассчитывается по формуле
макс = 3600$~ 6О5Мо п£м- (4.25)
(единицы г-ч-1, л-с^1, К, Тор). Здесь Твх обозначает темпера-
туру пара на входе в насос, рВх, макс — давление, а Мо, п — моле-
кулярную массу пара.
Почти все ротационные насосы в настоящее время имеют
устройство для продувки балластировочным воздухом. Посколь-
ку, однако, впуск воздуха вызывает увеличение остаточного дав-
ления на один-два порядка, насосы эти, как правило, снабжены
дополнительным клапаном, который на заключительном этапе
откачки полностью отключает приток воздуха.
Максимальное давление любого пара, который можно отка-
чивать, не опасаясь его конденсации, т. е. так называемое наи-
большее допустимое давление паров, вычисляют по формуле
•^возд РнасРа “ РвыхРп, возд Рвх, воздрнас , .
Рвх, п, макс= q „_________п • ___„» (4.20)
Рвых Рнас Рвых Рнас *
где $возд — скорость засасывания насосом балластировочного
воздуха при атмосферном давлении; рНас — давление насыще-
ния; ря — атмосферное давление; рП, возд — парциальное давле-
ние пара в балластировочном воздухе; рВх,возд— парциальное
давление неконденсирующихся газов на входе в насос.
При приблизительных подсчетах (когда малыми величинами
Рп, возд и рвх, возд можно пренебречь) формула (4.26) приобре-
тает вид
_ ЗвоздРнасРа _
Рвх, п. макс - s (рвых _ рнас) • <.4.zoa;
Из формул (4 26) и (4.26а) следует, что основное влияние
на способность насоса откачивать пар оказывают следующие
факторы: $в03д/$ (для большинства применяемых насосов отно-
шение $возд/$ находится в пределах 0,05—0,1); рнас— давление
насыщения паров при рабочей температуре насоса (эта темпе-
ратура в значительной степени зависит от условий функциони-
рования насоса) ; рвых предельное давление (до момента от-
крытия выходного клапана), которое должно быть по возмож-
ности минимальным.
В табл. 4 1 для некоторых типов ротационных масляных на-
сосов с воздушной продувкой приведены значения рН20, вх, макс
и тн2о, вх, макс [формула (4 25)] для случая, когда насос отка-
чивает водяной пар.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
195
4,1.5. Подключение нескольких ротационных
масляных насосов
Насосы могут подключаться параллельно или последователь-
но. Параллельное подключение имеет целью увеличить скорость
2
Фиг 4 16. Двухступенчатая откачивающая система, состоящая из двух рота-
ционных масляных насосов, включенных последовательно (фирма Сепсо
Hypervac).
/, 2— насосы, 3—пружина, прижимающая золотник; 4—обратный клапан; 5—дополнитель-
ный обратный клапан.
Фиг 4 17 Двухступенчатый ротационный масляный насос с роторами на
общем валу (VEB Geraer Kompressorenwerk, ГДР)
/ — первая ступень, 2—вторая ступень, 3—обратные клапаны, 4 — лабиринтный набор
маслоуловителя на выходе из насоса
откачки, последовательное (обычно не более двух насосов) по-
зволяет получить лучший вакуум.
7
198
ГЛАВА 4
На фиг 4 16 представлена для примера двухступенчатая си-
стема откачки, состоящая из основного насоса 2 и вспомогатель-
ного насоса 1 Назначение вспомогательного насоса состоит в
том, чтобы снизить давление на выходе основного насоса, бла-
годаря чему количество газа, возвращающегося из вредного объ-
ема основного насоса, значительно уменьшается и предельное
давление существенно снижается
Вспомогательный насос может быть меньше основного, так
как он перекачивает то же количество газа, что и основной,
однако под значительно более высоким давлением.
На фиг. 4 17 показана конструкция двухступенчатого рота-
ционного насоса с роторами на общем валу.
4.1.6. Масла для ротационных насосов
В качестве масел для ротационных насосов пригодно боль-
шинство хороших минеральных машинных масел (предельные
углеводороды) с плотностью ~0,9 г/см* 2 3 и вязкостью 30—65 сПз
при температуре 323 К.
Давление паров масла в предельном вакууме 4 s) может быть
понижено путем предварительной дистилляции масла в вакууме
при температуре 350—370 К, особенно если во время дистилля-
ции отгоняется 5—20% общего количества масла.
Мерой качества масла является температура воспламене-
ния2), возрастающая после дистилляции до 480—490 К и выше.
Температура воспламенения для насосных масел должна быть
не ниже 470 К.
Давление паров хороших масел, измеряемое на входе в ро-
тационный насос (работающий «на себя»), не должно превы-
шать для одноступенчатого насоса 5-Ю-4 Тор, а для двухсту-
пенчатого — 5-10-5 Тор.
Кислотное число 3) масла должно быть не больше 0,05.
Качество чистых минеральных масел, применяемых в ваку-
умных насосах, может быть улучшено добавлением небольшого
количества жирных кислот, триглицеридов и других органиче-
ских веществ, имеющих длинноцепочечную структуру.
’) Более летучие компоненты масла проникают в виде обратного потока
в откачиваемый объем, этот поток определяется массой (в граммах) масла,
проходящего в течение 1 мин через 1 см2 сечения входа в насос
2) Температурой воспламенения масла называется самая низкая тeмпe^
ратура, при которой масло (нагреваемое определенным образом) выделяет
количество паров, достаточное для образования в воздухе смеси, воспламе-
няющейся при приближении к ней пламени
s) Кислотное число масла определяется количеством миллиграммов ще-
лочи КОН, необходимым для нейтрализации нерастворимых в воде органиче-
ских кислот, содержащихся в 1 г данного масла
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
197
Температура масла в насосе не должна быть значительно
выше 320 К; для этого иногда используется водяное охлаждение
насоса.
При температуре выше 320 К давление паров масла быстро
возрастает, а вязкость уменьшается (хуже становится смазка и
уплотнение), что влечет за собой ухудшение конечного получае-
мого вакуума. Слишком низкая температура также нежелатель-
на из-за конденсации паров. Кроме того, слишком густое масло
плохо проникает в щели и капилляры, особенно при низкой тем-
пературе конструкции насоса
0
. без ионного отражателя
~‘м
"In С ионным отражателем
_1—1____ 1 I __________
О 1214 16171828 36 43 57 85 108
Фиг 4.18 Ионный отражатель масляных паров,
применяемый на входе масляного ротацион-
ного насоса (по Хеферу, 1961 г), и масс-спек-
трограммы газов и паров в обратном потоке
насоса с ионным отражателем и без него
(фирма Balzers)
А - анод, К— катод
1—постоянный магнит, 2—изолятор; 3—траектория
электрона, /м—ток, пропорциональный давлению газа
(пара) с молекулярной массой
Исследование процессов смазки и уплотнения показывает,
что для получения хорошей герметичности зазоры между вза-
имодействующими деталями насоса (например, между ротором
и статором) не должны превышать 0,01 мм. При больших зазо-
рах вязкое масло не в состоянии обеспечить достаточной герме-
тизации, особенно при больших скоростях движения контакти-
рующих поверхностей.
Как уже упоминалось, пары масла оказывают значительное
влияние на качество вакуума, создаваемого ротационным мас-
ляным насосом. Имеющиеся в масле летучие компоненты (на-
пример, летучие углеводороды) могут проникать (даже через
диффузионный насос) в откачиваемое пространство и ухуд-
шать характеристики вакуума Для удаления этих паров приме-
няются лабиринтные сепараторы, однако более эффективно они
19?
ГЛАВА 4
удаляются с помощью поглотителей (например, цеолитовых),
фильтров и т. п., а еще лучше — путем вымораживания.
Одним из эффективных устройств для удаления паров масла
является ионный отражатель, представленный в левой части
фиг. 4.18. Он состоит из трубы К (заземленной), являющейся
катодом, и коаксиального стержня А — анода с постоянным по-
тенциалом ~3 кВ. Магнитное поле, создаваемое постоянным
магнитом, направлено вдоль оси трубы. Между электродами
возникает тлеющий разряд; образующиеся в нем электроны
бомбардируют молекулы паров масла, ионизируют их и пре-
вращают в полимеры типа СтНп, которые осаждаются в твер-
дом виде на стенках цилиндра.
В правой части фиг. 4.18 показаны спектры молекулярных
масс газов, присутствующих в обратном потоке насоса с ион-
ным отражателем и без него. Видно, что при использовании
ионного отражателя концентрация легких газов заметно умень-
шается (вакуум улучшается на порядок), а тяжелые компонен-
ты исчезают полностью. Изменение давления над отражателем
после выключения напряжения показано на фиг. 4.19.
Фиг. 4.19. Изменение давления над ионным отражателем со временем после
выключения напряжения (по Хеферу, 193! г.).
4.1.7. Мощность, потребляемая масляным
ротационным насосом
Мощность, потребляемая масляным ротационным насосом,
не является постоянной величиной: она зависит от давлений на
входе и выходе. Прщ давлении на выходе, близком к атмосфер-
ному, потребляемая насосом мощность невелика вследствие не-
большой степени сжатия газа в насосе; при низком давлении
она также мала, так как невелико количество сжимаемого газа.
Более строгий анализ показывает, что мощность, потребляе-
мая насосом (при откачивании воздуха), имеет максимум при
Получение Высокого вакуума
1§9
давлении ~250 Тор. Ориентировочно можно принять (для не
очень малых насосов), что для скорости откачки ~10 л-с-1 тре-
буется мощность ~ 1 кВт.
На фиг. 4.20 представлена зависимость потребляемой мощно-
сти от рабочего давления для масляного ротационного насоса
Фиг. 4.20. Зависимость мощности Р, потребляемой масляным ротационным
насосом, от давления на входе р (фирма Leybold).
------без продувки;--------с процувкой.
со скоростью откачки S = 30 л-с-1, работающего с балластиро-
вочным воздухом и без него (т. е. -с продувкой -и без продувки).
Как видно из фигуры, в области низких давлений при работе
с продувкой потребляется почти в 2 раза большая мощность.
4.1.8. Эксплуатационные характеристики масляных
ротационных насосов
Достоинствами масляных ротационных насосов являются
легкость их обслуживания, быстрое включение в работу и срав-
нительно большие скорости откачки при не особенно низких
(>10-2 Тор) давлениях, а недостатками — попадание паров
масла в вакуумируемое пространство, снижение скорости от-
качки при понижении давления и чувствительность к загрязне-
нию масла легко конденсирующимися парами. Последний недо-
статок частично устраняется в насосах с продувкой, которые
находят все более широкое применение (несмотря на то, что
при работе с продувкой конечное давлениё повышается).
Масляные ротационные насосы Требуют тщательного ухода,
аккуратной переборки при.ремонте И всегда Чистого масла. Для
изготовления высокоэффективных насосов необходимы соответ-
ствующие матёриалЫ и прецизионная обработка де'талей. Для
уменьшения шума насосы устанавливают на амортизаторах, а
200
ГЛАВА 4
также применяют специальные маслоуловители и т. п. Однако
главной задачей маслоуловителей является задержание распы-
ленного масла на выходе из насоса. Пример конструкции такого
рода маслоуловителя представлен на фиг. 4.21. Поток воздуха
с распыленным маслом тормозится о коническую поверхность
маслоуловителя и на конусе оседает значительная часть масла,
стекающего затем в насос.
При остановке насоса, работающего на вакуумную систему,
между выходом и входом насоса возникает перепад давлений,
Фиг. 4.21. Лабиринтный маслоуловитель.
Фиг. 4.22. Характеристики откачки одноступенчатых (S6) и двухступенча-
тых (D6) ротационных насосов (фирма Leybold).
------без продувки;-----—с продувкой.
который может вызвать вытеснение масла в вакуумируемое,
пространство. От этого в некоторой степени предохраняет вы-
пускной клапан насоса. Однако применяются и специальные уст-
ройства. Особенно часто используется впуск, атмосферного воз-
духа во входную область форвакуумного насоса, благодаря чему
выравнивается давление на его входе и выходе. Для впуска
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
201
воздуха применяется трехходовой кран, который одновременно
отключает установку от форвакуума.
В табл. 4.1 приведены характеристики нескольких современ-
ных масляных ротационных насосов разной производительности.
Данные фиг. 4.22, а демонстрируют эффективность последова-
тельного подключения двух насосов, а также влияние продувки
воздухом на предельное давление; на фиг. 4.22, б представлены
кривые откачки резервуара объемом 50 л с помощью этих на-
сосов.
Фиг. 4.23. Ротационный масляный насос типа AL8.
Внутри статора виден рогор с двумя золотниками (золотники и крышка камеры показаны
справа от насоса). С левой стороны иа корпусе насоса имеется ручка для включения и
выключения продувки.
На фиг. 4.23 представлен фотоснимок масляного ротацион-
ного насоса типа AL8 производства Кошалинского завода ваку-
умных насосов «Унимаш» (по лицензии SOGEV, Франция).
4.1.9. Бессмазочные ротационные насосы
Недостатками рассмотренных выше насосов является умень-
шение их скорости откачки при низких давлениях, а также воз-
можность попадания паров масла (или ртути) в откачиваемый
объем. Эти недостатки отчасти устранены в бессмазочных рота-
ционных насосах.
4.1.9.1. Бессмазочные насосы типа Рутса. В области давлений
0,01—10 Тор, особенно важной для обеспечения надежной ра-
боты диффузионных насосов, применяются насосы, действующие
по принципу, примененному в 1867 г, Рутсом для построения
воздуходувок,
202
ГЛАЗА 4
Ротационные многороторные (многоступенчатые) насосы
типа Рутса не требуют смазки, так как их роторы и статоры не
соприкасаются ввиду наличия между ними небольших зазо-
ров *)•
Связанная с этими зазорами негерметичность несколько
уменьшает скорость откачки и повышает предельное давление.,
однако «чистота» получаемого вакуума и высокая скорость от-
качки, обусловленная большой скоростью вращения, являются
важными достоинствами насосов типа Рутса.
а 6
Фиг. 4.24. Ротационный бессмазочный насос типа Рутса (два различных по-
ложения роторов).
/, 2—.роторы; статор; 4 — щели. Ун —объем полости.
Положение роторов на фиг. б соответствует Vs оборота по отношению к фиг. а.
Фиг. 4.24 йллюстрируёт принцип работы насоса типа Рутса.
Насос имеет два ротора 1 и 2 такого вида, что при синхронном
их вращении (в направлении стрелок) зазор между ними всегда
достаточно мал (порядка долей миллиметра); мал также и за-
зор между роторами и статором 3. Роторы должны быть хорошо
центрированы; они вращаются с частотой несколько тысяч обо-
ротов в минуту2) при помощи шестеренчатого редуктора, поме-
щенного снаружи насоса или в форвакууме (фиг. 4.25).
Производительность насоса, типа Рутса определяется как
разность основного потока газа /+, следующего от входа к вы-
ходу насоса, и обратного потока 1_, создаваемого зазорами
между роторами, а также между роторами и статором.
Спорость откачки ц предельное давление ротационных насо-
сов типа Рутса. Поток в направлении Откачивания, создаваемый
вращением роторов, может £ыть представлен формулой
I+ = Srp, (4.27)
’) Однако для работы насосов этого типа нужен форвакуум порядка не-
скольких тор (создаваемый, например, масляным ротационным насосом).
2) Большие насосы имеют частоту вращения порядка 2000 об/мир, ма-
лые — 4000 об/мин.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
203
где Sr — скорость откачки, зависящая от рабочего объема Vp
между роторами и статором (фиг. 4.24) и частоты вращения
N'p роторов:
Sr = VpV'p, (4.27а)
Поток в обратном направлении, вызванный негерметичностя-
ми, выражается формулой
I- = GH (ро — Р), (4.28)
где GH— средняя проводимость негерметичностей (зазоров)1),
р — давление на входе, а ро — давление на выходе из насоса,
равное давлению форвакуума (фиг. 4.25).
Фиг. 4.25. Двухроторный ротационный бессмазочный насос с приводным дви-
гателем, помещенным в форвакууме (фирма Heraeus).
/ — внешний корпус; 2—внутренний корпус; 3, 4— роторы; 5—шестерни; d—рртор двига-
теля; 7 —статор двигателя; 8— герметизированные токозыводы; 9—водяное охлаждение
двигателя; 10 — смазочный насос; // — резервуар масла; 12—соединение вакуумируемого
объема с форвакуумом; 13 — зазоры.
Эффективная скорость откачки определяется разностью вы-
ражений двух потоков:
/эфф = /+-/- = 5гр-Он(р0-р). (4.29)
Скорость откачки на входе в насос описывается выражением
S=^ = Sr-GH(|-l)=Sr[l ОL (4-30)
Для увеличения скорости откачки следует стремиться, чтобы
отношение GH/Sr было по возможности малым. Этого можно до-
стигнуть, уменьшая по возможности зазоры, увеличивая объем
насосной камеры и увеличивая скорость вращения роторов.
') Проводимость зазоров («мгновенная») зависит от положения роторов.
Для насоса со скоростью откачки Sr^ 60 Л’С-1 проводимость зазоров Оа со-
ставляет 1,5—2 л-с-1.
204
ГЛАВА 4
Предельное давление находится из условия S = 0 по урав-
нению
/>„=—V-tfa- <43’)
1+-^ г
иа
Поскольку обычно Sr GH, то отношение polpoo — SrIGn в обла-
сти низких давлений достигает нескольких десятков и ограничи-
вается негерметичностями, а также прилипанием частиц газа
к поверхностям роторов, которые переносят их обратно в область
высокого вакуума.
При определенных GH и Sr предельное давление р™ будет
тем ниже, чем ниже давление на выходе из насоса. С учетом
этих соображений, а прежде всего для разгрузки роторов на-
соса от действия больших сил, уменьшения потребляемой мощ-
ности 1) и во избежание перегрева конструкции (вследствие вы-
деляющегося при сжатии газа тепла) на выходе насоса Рутса,
как уже упоминалось, создается форвакуум с давлением поряд-
ка нескольких тор. Форвакуум полезен также потому, что про-
водимость GH с понижением давления уменьшается. Однако сле-
дует иметь в виду, что из-за наличия зазоров отвод тепла от
роторов в вакууме затруднен.
Привод роторов может быть осуществлен различными спосо-
бами: непосредственно (например, с помощью двигателя, поме-
щенного в форвакууме) или через передачу (ременную, цепную,
гидравлическую и т. п.).
Одноступенчатые насосы обеспечивают максимальную ско-
рость откачки при давлении порядка 10-1 Тор, двухступенча-
тые— при 10~2—10-3 Тор. Предельное давление насосов Рутса
составляет 10~3—10~4 Тор, а для их работы требуется форва-
куум порядка нескольких тор.
На фиг. 4.26, а представлены характеристики скорости от-
качки двухступенчатых насосов Рутса нескольких типов. Там
же указаны значения частоты вращения N', скорости откачки S,
диаметра входа D и мощности двигателя Р для этих насосов.
На фиг. 4.26, б представлены характеристики бессмазочного
насоса, работающего совместно с различными форвакуумными
насосами: одноступенчатым S6 и двухступенчатым D6 без про-
дувки (сплошные кривые) и с продувкой (штриховые кривые).
Как следует из кривых, улучшение форвакуума отражается по-
ложительно на предельном вакууме.
*) Мощность, необходимая для работы насоса, пропорциональна скорости
откачки и разности давлений, она может быть выражена соотношением
P^S(po-p). Так как Sp — SQp0, то Р^ Sp[(S/S0) — 1], где So — скорость
откачки форвакуумного насоса.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
205
Форвакуумный насое должен иметь скорость откачки 5фвак не
менее Vis скорости откачки S насоса Рутса при давлении 10-1—
IO-2 Тор.
Фиг. 4.26. Характеристики откачки ротационных бессмазочных насосов Рутса
(фирма Leybold).
а—двухступенчатые насосы; б—двухроторный насос Рутса с одноступенчатым S6 илн
двухступенчатым D6 форвакуум 1ым насосом.
АГ' —частота вращения; S—номинальная скорость откачки. D—диаметр входа; Р —мощность
двигателя.
Для предупреждения перегрузки в больших бессмазочных
насосах часто предусматривается обводная магистраль, снаб-
женная предохранительным клапаном, который открывается или
20$ ГЛАВА 4
же автоматически выключает приводной двигатель (фиг. 4.27),
если разность давлений между входом и выходом превысит до-
пустимую величину.
Когда на выходе насоса Рутса давление выше, чем на входе
(а двигатель не работает), насос может начать вращаться в об-
ратную сторону.
В табл. 4.2 приведены характеристики нескольких ротацион-
ных бессмазочных насосов типа Рутса, выпускаемых различны-
ми предприятиями.
Фиг. 4.27 Обводная магистраль с предохранительным клапаном в насосе
Рутса, предохраняющая от перегрева и перегрузки насоса.
/ — насос Рутса, 2 — предохранительный клапан; 3— обводная магистраль.
В некоторых конструкциях (например, VEB Geraer Kom-
pressorenwerk, ГДР) приводной двигатель помещен в форваку-
умной камере. Во избежание возникновения газового разряда
напряжение питания двигателя составляет лишь ~40 В.
Следует также отметить, что разработан насос со скоростью
откачки 36 000 л/с (фирма Alcatel, Франция). Насос весит
17 000 кг, а каждый из его роторов диаметром почти 1 м — свы-
ше 3000 кг; при скорости вращения 1500 об/мин серьезную про-
блему в таком насосе представляют центробежные силы, особен-
но с учетом того, что зазоры в насосе имеют порядок 0,5—1 мм.
4.1.9.2. Бессмазочные эксцентриковые ротационные насосы.
Принцип построения и действия эксцентриковых бессмазочных
ротационных насосов поясняется на фиг. 4.28. Два валика, ве-
домые эксцентриками, вращаясь в соответствующих полостях,
Тип © о о | ” 2 О. о. о. 04 04 04 Щ ОО 22 AR 350 AR 2 000 RUO 500 RUO 8 000 b- tn ¥2 8 о uu о > 8> > > □ -Э Э □ 04 Ы04 04 04 X* о © о — © © © О) со со m g S % О, О, Ом
Изготовитель Geraer Kom- pressoren- werk (ГДР) Edwards (Великобри- тания) SOGEV (Франция) Balzers (Лихтенштейн) Leybold, в настоящее время Leybold- Heraeus( ФРГ) ULVAC (Япония)
Примечания Диапазон рабочих да- влений 10—10“3 Тор Рабочая температура 300-360 к С гидравлическим при- водом работает при ат- мосферном давлении Предварительный ва- куум 4—12 Тор © © а а м я И Ч CD CD Cl Cl ЕЗ ЕЗ co co Работает при атмосфер- ном давлении Двухступенчатый
Вес, кг 122 220 1 950 1 56 170 260 1 830 ь~ ©о ” 8 S
w £ -7 W £ 3 № 1 »Т< О <я S х *-* f- CL X X ° м s 1 410 2 890 2 910 2 000 1 410 3 000 3 000 2 880 1 450 1 400 1 200 1 450 2100 3 000 2 100 790
Предель- ное давление, Тор 7 1 1 © © Ю Ш ©’ © CO 1 о 9-0’ ,_01*г тр 1 1 1 © © © — —
Охл ажде- ние Воздушное Водяное Водяное » Водяное » Водяное x> Водяное » Воздушное Водяное
Мощность двига- теля, кВт 1,1 3 13 (напря- жение 42 В) сч со 1П © СО 2,2 22 0,6 22 В зависи- мости от режима работы 1,1 0,5 5 40
Дна- метр входа, мм cos 0SI 001 75 280 150 250 95 330 65 250 800 65
Допусти- мый перепад давлений в насосе, Тор О © 1П Ч* сч © ю О о О) сч © Ш СЧ — Нет огра- ничения сч
S при 10 1 Тор, м3-ч~1 300 1 80Э 15 000 © in СОЮ 280 1 800 000 Z ose 30-40 2 500—3 00Э 120 000 ‘(при 5-Ю-7 Тор) 90 (при 10—2 Тор) юо 1 0JP 20 000
208
ГЛАВА 4
перекачивают газ от входа к выходу насоса. Валики снабжены
двумя выступами, скользящими один по другому и постоянно
отделяющими вход в насос от выхода. Привод роторов уплотнен
Фиг. 4 28 Бессмазо шый эксцентриковый ротационный насос.
а, б, в, г —различные положения эксцентрика (по Лемуану, 1967 г.)
(по отношению к атмосфере) с помощью мехов. Конструкция
насоса является довольно сложной.
4.2. СКОРОСТНЫЕ НАСОСЫ
В скоростных насосах молекулы газа получают от быстро
движущихся элементов насоса дополнительную составляющую
скорости к своим хаотическим скоростям теплового движения,
вследствие чего возникает поток газа от входа к выходу на-
соса.
Среди скоростных насосов различают:
1) молекулярные насосы, в которых частицам газа сооб-
щается скорость от поверхности движущегося конструктивного
элемента;
2) струйные насосы, в которых частицы газа приобретают
скорость от струи жидкого или газообразного рабочего тела;
3) насосы с электростатическим полем, в которых предвари-
тельно ионизованные частицы газа под действием сил электри
ческого поля перемещаются от входа к выходу насоса.
4.2.1. Молекулярные насосы
В молекулярных нагосах частицы газа, ударяясь о быстро
перемещающуюся поверхность, отражаются от нее с дополни-
тельной составляющей скорости в направлении движения по-
верхности
Различают насосы собственно молекулярные и турбомолеку-
лярные.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
209
Собственно молекулярные насосы Устройство и принцип дей-
ствия молекулярного насоса иллюстрирует фиг. 4 29 Внутри ци-
линдрической полости статора 1 находится ротор 2. Статор
имеет такую конфигурацию, что на участке поверхности 3—4 за-
зор между ним и ротором очень мал и создает сравнительно
большое сопротивление потоку; на остальном же участке 3—5—4
длиной L между ротором и статором образуется камера шири-
ной h, где и происходит процесс откачки. Молекулы газа, попа-
дающие во входное отверстие насоса и ударяющиеся о поверх-
ность ротора, остаются на ней некоторое время (равное времени
пребывания), а затем отрываются со скоростью, зависящей от
температуры ротора. Однако, ввиду того что ротор обладает
Фиг 4.29 Молекулярный насос Геде
1—статор, 2—ротор, 3, 4, 5—участки коль
цевого канала.
Вход Выход
окружной скоростью Vw, молекулы газа приобретают тангенци-
альную составляющую скорости в направлении движения ро-
тора и движутся вслед за ним от входа к выходу насоса.
Механизм приобретения молекулами составляющей скорости
в направлении откачки связан с тем, что круговая диаграмма
вероятности распределения направлений вылета частиц с по-
верхности (фиг. 2.10) при движении ротора со скоростью Vw
смещается в направлении его движения. Молекулы, обладаю-
щие скоростями, касательными к поверхности, после многих от-
ражений от стенок камеры приближаются к выходу из насоса,
где газ накапливается и его концентрация возрастает, вслед-
ствие чего газ вытекает в форвакуум, созданный у выхода из на-
соса. Зазор 3—4, имеющий большое сопротивление, затрудняет
перетекание газа со стороны выхода ко входу (т е. ограничи
вает обратный поток). Тем не менее такой поток существует и
в насосной камере в направлении 4—5—3, так что эффектив-
ный откачиваемый поток представляет собой основной поток
за вычетом двух обратных потоков (в направлениях 4—5- 3
и 4—3).
210
ГЛАВА 4
Теоретическая (максимальная) скорость откачки молекуляр-
ного насоса определяется приближенно по формуле *)
«ЗтеОр — у vwbh, (4.32)
где Ь — длина камеры откачивания (например, длина цилиндра
ротора), a h — ширина камеры (фиг. 4.29).
Эффективная скорость откачки 3Эфф меньше определяемой
из формулы (4.32) вследствие разных неучтенных факторов.
Так, обратный поток газа равен
Z_ = GH(p-p0). (4.33)
где GH — проводимость негерметичностей 4—5—3 и 4—3
(фиг. 4.29), р — давление на входе, р0 — давление на выходе из
насоса (давление форвакуума). Отсюда
S_ = ^ = G„(^-1). (4.34)
Таким образом, скорость откачки насоса
5эфф = 5+ + 5_, (4.35)
причем
<§+ STeOp.
Теоретический анализ показывает, что в молекулярных усло-
виях отношение давлений на выходе и входе (степень сжатия)
для предельного вакуума, когда поток равен нулю, может быть
выражено формулой
_*=еХр(-^), (4.36)
Роо ah /’ ' '
в которую, кроме известных величин, входит коэффициент а, за-
висящий от температуры и рода откачиваемого газа:
— 3 V лМ0
На фиг. 4.30 показана принципиальная конструктивная схема
одного из первых молекулярных насосов (насоса Геде). Для
увеличения длины пути £3-5-4 (фиг. 4.29) делают статоры с же-
лобками в виде винтовой линии (цилиндрический насос Голвека,
конический насос Голланда — Мертена) или спиральной линии
(дисковый насос Зигбана).
’) Это объем газа bhdx, проходящего через сечение bh за время dx
(так как Vw = dx/dx); коэффициент учитывает среднюю скорость газа:
Т °№' = Т (°+ vw)'
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
211
На фиг. 4.31 представлен цилиндрический молекулярный на-
сос в разрезе.
Фиг. 4.3Э. Молекулярный насос Геде.
Г —статор; 2 —ротор; 3 — перегородка; 4—каналы в роторе.
Фиг. 4.31. Молекулярный цилиндрический насос Голвека (по Трюбу и
Тойберу).
Внутренняя поверхность цилиндра статора имеет винтовые
желобки правой и левой нарезки. Ширина желобков является
постоянной, высота "же их уменьшается от средней части ци-
линдра (вход) к его торцам (выход). Ротор выполнен в виде
гладкого цилиндра радиусом 15 см (на 0,06 мм меньше внутрен-
него диаметра полости статора). Ротор приводится в движение
212
ГЛАВА 4
двухфазным двигателем с вращающимся магнитным полем (по-
вышенной частоты); при частоте вращения 4500 об/мин насос
потребляет мощность ~10 Вт. При форвакууме ~10~3 Тор по-
лучается предельный вакуум порядка 10-6 Тор. Скорость от-
качки составляет несколько литров в секунду.
Подшипники насоса и двигатель находятся в пространстве
форвакуума. Имеются также конструктивные решения, по кото-
рым ротор (короткозамкнутый) двигателя находится в вакууме,
а статор — снаружи насоса; при этом ротор двигателя отделен
от статора цилиндрической стенкой из немагнитного материала.
Фиг. 4.32 Молекулярный дис-
ковый насос Зигбана
/ — сцепление, 2—спиральные кана-
лы, 5—вращающийся диск.
На фиг. 4.32 показан дисковый молекулярный насос в раз-
резе; его конструктивная схема и принцип действия не требуют
дополнительных пояснений.
Молекулярные насосы работают при форвакууме порядка со-
тых долей тора; такой форвакуум необходим для обеспечения
достаточно большой (по отношению к характерному размеру
насоса) длины свободного пробега молекул откачиваемого газа,
с тем чтобы откачиваемый газ находился в молекулярных усло-
виях.
Молекулярные насосы имеют большие частоты вращения.
Для малых насосов они достигают 10—20 тыс. об/мин; для боль-
ших насосов они меньше. Диаметры роторов имеют порядок
нескольцих десятков сантиметров, а зазоры должны составлять
несколько сотых миллиметра, что создает серьезные конструк-
тивные трудности.
Скорость откачки современных молекулярных насосов дости-
гает нескольких десятков литров в секунду. Они обеспечивают
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
213
предельный вакуум ~10~6 Тор при предварительном вакууме
порядка долей тора.
В некоторых молекулярных насосах (например, Бимса,
1959 г.) роторы диаметром до ~20 см устанавливаются в маг-
нитном подвесе, создаваемом системой электромагнитов, ток ко-
торых контролируется электронной системой. Для привода ис-
пользуется магнитное поле, вращающееся со скоростью до
20 000 об/мин. Насос при работе может нагреваться до 670 К.
При ро = 10-7 Тор насос обеспечивает S — 6 л/с и предельное
давление рх — 10-9 Тор.
Смазываемые узлы молекулярного насоса целесообразно рас-
полагать в форвакууме, благодаря чему в предельном вакууме
пары смазок почти не заметны.
Турбомолекулярные насосы. Существенным недостатком мо-
лекулярных насосов, создающим конструктивные и эксплуата-
ционные трудности, является малый зазор между ротором и ста-
тором; этот недостаток в значительной степени устранен в тур-
бомолекулярных насосах.
Турбомолекулярный насос своей конструкцией напоминает
многоступенчатый турбокомпрессор или паровую турбину
(фиг. 4.33, а). Как его статор, так и ротор снабжены лопатками,
установленными под соответствующим углом (фиг. 4.33, б).
Молекулы газа через входное отверстие насоса попадают на
быстро вращающиеся лопатки ротора и, как в молекулярном
насосе, получают при соприкосновении с лопатками ротора тан-
генциальные составляющие скоростей в направлении выхода из
насоса. После многократных отражений от лопаток ротора на-
правляемые лопатками статора молекулы доходят двумя
потоками (налево и направо) до торцов насоса, а отту-
да — к его выходу, у которого существует форвакуум (порядка
10~2 Тор).
Ниже приведены данные турбомолекулярного насоса (по
Беккеру, 1958 г.), конструкция которого в принципе близка кон-
струкции, представленной на фиг. 4.33. Насос имеет 19 дисков
с лопатками, из которых 13 предназначены для откачки, а 6 —
для сжатия газа; каждый диск имеет 40 лопаток; диаметр ро-
тора равен 170 мм; зазор между ротором и статором составляет
~1 мм; скорость вращения ротора равна 16 000 об/мин; мощ-
ность приводного двигателя составляет ~0,3 кВт; время запу-
ска не превышает нескольких минут; скорость откачки достигает
150 л/с. При скорости откачки 5 л/с и давлении форвакуума
~ 10~3 Тор с помощью этого насоса можно получить предельный
вакуум порядка 10-10 Тор На фиг. 4.33, в представлена зависи-
мость предельного вакуума от давления форвакуума для воз-
духа и водорода. Высоковакуумная часть насоса с целью обез-
гаживания нагревается до ~420 К
Top
Фиг. 4 33 Турбомолекулярный насос
W' си 16 000 об мин-1, ширина зазоров ~1 мм 8 150 л с-1, р^ < 10~9 Тор, Рфвак—
~ 10—3 Тор, обезгаживаиие при температуре 720 К (по Беккеру, 1958 г)
а—схематический разрез, б—расположение лопаток, в — зависимость предельного давле-
ния от давления форвакуума Рфвак для водорода и воздуха
1 2 — лопатки; 8 —двигатель, 4—подшипники, 5 —масляный насос для смазки подшйп-
* инков
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
215
В последнее время созданы насосы со скоростями откачки
до 10 000 л/с при частоте вращения ~ 10 000 об/мин, обеспечи-
вающие предельный вакуум < 5-10~10 Тор.
На фиг 4 34 схематически показан турбомолекулярный насос
типа ТМ-400 (фирма Leybold-Heraeus) с вертикальным распо-
ложением ротора (1971 г.).
4.2.2. Струйные насосы
В струйных насосах частицам газа сообщается дополнитель-
ная скорость (в направлении откачки) от струи рабочего тела.
В зависимости от фазового состояния рабочего тела разли-
чают.
1) жидкостные насосы, в которых рабочим телом является
струя жидкости (обычно воды);
2) газовые насосы, в которых рабочим телом является струя
газа (обычно воздуха),
3) пароструйные насосы, в которых рабочим телом является
струя водяных, ртутных или масляных паров
4.2.2.1. Водоструйные насосы. Водоструйные насосы назы-
вают также водяными аспираторами В этих насосах высоко-
Вход
Фиг 4 34 Турбомолекулярный
вертикальный насос (фирма Ley-
bold-Heraeus, 1971 г).
Диаметр входа ~15 см А ~-100 л с-1
(в диапазоне 10~3—10~8 Тор), Рфвак =
= 10~3 Тор, Роо< 5 1Э—8 Тор, двигатель
питается переменным током 400 Гц под
шипники находятся в форвакууме
1—статор 2 —лопатки статора, 3— ротор,
4—лопатки ротора 5—вал ротора с ко-
роткозамкнутой обмоткой 6—двигатель,
7—обмотка статора, 8 — провода питания
статора 9—подшипники вала ротора,
10—часть статора на которой смонтиро-
вав двигатель, работающий в форваку-
уме, П — охлаждающий змеевик, 12 — по-
дача охладителя (воды)
скоростная коническая струя воды (фиг 4 35,а), истекающая
из сопла, попадает в конический канал с углом сходимости,
несколько меньшим угла раствора водяного конуса. Вблизи по-
верхности водяной струи создается спутный поток газа, который
218
ГЛАВА 4
вместе с водой поступает в конический канал, а затем удаляется
из насоса.
В другой конструкции водяного насоса струя воды обтекает
газовое сопло снаружи (фиг. 4.35, б) и газ засасывается из от-
верстия сопла в середину водяной струи. На фиг. 4.36 представ-
лен металлический струйный насос в разрезе.
В хорошо спроектированном насосе при достаточной скоро-
сти струи воды (следовательно, при довольно высоком давлении
Фиг. 4 36 Водоструйный ме-
таллический насос (фирма
Leybold).
а
Фиг 4.35. Водоструйный насос,
а —с внутренней струей, б—с внешней струей.
подачи воды) можно получить низкое предельное давление
(фиг. 4.37), равное давлению насыщенных водяных паров, соот-
ветствующему температуре воды (фиг. 4.38), т. е. порядка де-
сятков тор. Небольшой насос лабораторного типа обеспечивает
скорость откачки порядка десятых долей литра в секунду. Есте-
ственно, что получаемый вакуум содержит водяной пар.
Потребление воды насосом зависит от его производительно-
сти и давления подачи воды, а также от давления в откачивае-
мом пространстве,
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
217
Насос, представленный на фиг. 4.36, создает предельный ва-
куум ~ 10——20 Тор, скорость откачки составляет ~0,1 л-с-1 при
давлении подачи воды 2,8 бар (потребление воды ~400л-ч~!).
Фиг. 4 37. Зависимость пределы ого
давления р водяного струйного
насоса от давления подачи воды рв.
— совершенный насос,-----— несовершен-
ный насос.
Фиг. 4 38. Зависимость давления па-
ров рп в предельном вакууме водо-
струйного насоса от температуры
воды.
Тор
Фиг. 4.39. Характеристика откачки
воздушного струйного насоса.
Объем откачиваем >го сосуда 100л, давле
нне воздуха в сосуде 6 бар, расход воз
духа 5—8 кг-4-\ скорость откачки
0,6 л-с~*.
Водоструйные насосы обычно изготавливаются из нержавею-
щей стали или из пластмасс (в последнем случае применяются
сопла из стали).
4.2.2.2. Воздушные струйные насосы. В воздушном струйном
насосе, называемом также воздушным эжектором, для создания
струи используется сухой очищенный воздух при давлении
218
ГЛАВА 4
5—10 бар. Сверхзвуковая струя воздуха создается в сопле типа
Вентури и, передавая свой импульс окружающим частицам газа-,
уносит их к выходу из насоса. Предельное давление откачки со-
ставляет ~ 100 Тор (фиг. 4.39). Потребление откачивающего
воздуха ~5—8 кг-ч-1, Насос обычно изготовляется из алюми-
ния, а сопла — из бронзы или нержавеющей стали.
На фиг. 4.40 схематично представлен общий вид воздушного
струйного насоса.
Фиг. 4.40. Воздушный струйный насос (фирма Varian).
1, 2—клапаны, 3—манометр
4.2.2.3. Пароструйные насосы. Насосы, в которых откачиваю-
щим рабочим телом является струя пара, можно разделить на
эжекторные и диффузионные насосы.
Эжекторные пароструйные насосы В эжекторных насосах
откачиваемый газ захватывается сверхзвуковой струей пара,
причем часть молекул откачиваемого газа получает импульс
скорости в направлении откачивания в результате столкновения
с паровой струей, а часть поглощается этой струей, так как
внутри нее парциальное давление газа ниже, чем в окружаю-
щем струю откачиваемом пространстве.
Различают эжекторные насосы, работающие на водяном паре
(паровые), на парах ртути (ртутные), а также на парах масла
(масляные). Для создания высокого вакуума из эжекторных на-
сосов используются лишь ртутные и масляные.
Паровые эжекторные насосы. В эжекторном на-
сосе, работающем на водяном паре, откачивающим рабочим телом
является струя водяного пара. Водяной пар при определен-
ном давлении генерируется в паровом котле и подается в эжек-
тор насоса (фиг. 4.41, а), где энергия давления пара преобра-
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
219
зуется в энергию движения струи. Паровая струя захватывает
откачиваемый газ и направляется в сопло Лаваля, где она тор-
мозится с частичным преобразованием кинетической энергии в
потенциальную.
Распределение давлений водяного пара и откачиваемых га-
зов в эжекторном насосе показано на фиг. 4.41,6. В зазоре ме-
жду выходом эжектора и конфузором Создается разрежение р™,
после чего в конфузоре давление пара возрастает до величи-
ны рп.
' Фиг. 4.41. Эжекторный паровой насос.
а— схема конструкции, б — распределение давлений пара н газа вдоль оси насоса (по Морзе»
1940, 1947 гг.).
1—подача откачиваемого газа; 2— подача откачивающего пара, 3—выход парогазовой смеси;
4 —сопло, 5 — межсопловой зазор.
Газ (после сжатия до давления рг) струей пара через трубу
удаляется вместе с паром в камеру атмосферного давления, где
пар рабочего тела конденсируется, жидкость стекает в резер-
вуар, откуда снова поступает в паровой котел.
Скорость истечения водяного пара из сопла очень велика,
зачастую больше скорости звука; вследствие этого диффузия
пара из межсоплового зазора х (фиг. 4.41) в направлении, пер-
пендикулярном потоку, незначительна.
Паровые эжекторные насосы (обычно двухступенчатые) мо-
гут обеспечивать очень большие скорости откачки и предельное
давление ~0,5 Тор (фиг. 4.42); они широко применяются в хи-
мической и металлургической промышленности.
Пароводяные эжекторные насосы. Пароводяные
насосы обычно конструируются также по двухступенчатой схе-
ме. Первая ступень является водяным эжектором, а во второй
откачивающим рабочим телом служит водяной пар. Напримео.
220
ГЛАВА 4
стеклянный насос со скоростью откачки ~0,5 л/с (при рабочем
давлении 4 Тор) создает предельное давление р^ = 2 Тор при
расходе воды 3 м3/ч под давлением 2,5 бар и потреблении пара
~1 кг/ч (при 0,2 бар). Диапазон рабочих давлений такого на-
соса 70—2 Тор.
Масляные и ртутные эжекторные насосы. Из
эжекторных насосов в текнике высокого вакуума находят при-
менение лишь ртутные и масляные насосы
п . I ступень ; I
Откачиваемый газ и 5
Выход
парогазовой смеси
Фиг 4.42. Двухступенчатый эжекторный паровой насос Морзе.
/» 2— сопла.
Эжекторный насос часто используется не самостоятельно, а
в качестве ступени диффузионного насоса. Насосы с эжекторной
ступенью иногда называются бустерами. Как эжекторные на-
сосы, так и бустеры являются промежуточными между диффу-
зионными и форвакуумными насосами. Как будет показано
ниже, на выходе диффузионных насосов (особенно одноступен-
чатых) давление должно иметь порядок десятых и даже сотых
долей тора. Создание такого форвакуума масляными ротационг
ными насосами затруднительно, так как в этой области давле-
ний они имеют ниспадающую характеристику S = f(p), что
требует применения ротационных насосов с большей номиналь-
ной скоростью откачки (т. е. больших размеров). Этот пробел
как раз и заполняют промежуточные насосы, а в последнее
время также бессмазочные насосы типа Рутса, которые не
имеют паров рабочего тела и характеристики скорости откачки
которых в этой области давлений особенно благоприятны.
В масляных и ртутных эжекторных насосах струя паров ра-
бочего тела, генерируемых в испарителе, обладает большой
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
221
плотностью и высокой скоростью, а это позволяет производить
откачку при сравнительно высоком давлении форвакуума. На-
сосы промежуточного диапазона особенно удобно применять в
области вакуума порядка 10~3 Тор и выше, где скорость откачки
ротационных масляных насосов уже довольно низка, а диффу-
зионных насосов еще невелика.
В промежуточных насосах двухступенчатой конструкции пер-
вая ступень насоса со стороны форвакуума является, как пра-
вило, эжекторной, вторая же ступень работает как диффузион-
ный насос.
Промежуточные масляные насосы требуют предварительного
вакуума порядка 2—5 Тор, ртутные — порядка 20—30 Тор.
В эжекторных насосах струя паров откачивающего рабочего
тела должна иметь большую плотность и высокую скорость
ввиду высокого предварительного вакуума. В связи с этим по-
верхность испарения рабочего тела, а следовательно, и мощ-
ность нагревателя в эжекторных насосах должны быть значи-
тельно больше, чем в диффузионных.
Для работы масляных эжекторных насосов необходимы спе-
циальные масла, устойчивые по отношению к окислению. По-
этому в таких насосах применяют некоторые сорта силиконовых
масел, невзирая на их высокую цену.
Для примера рассмотрим несколько конструкций промежу-
точных насосов (эжекторных, а также эжекторных с одной или
несколькими диффузионными ступенями).
На фиг. 4.43 представлен эжекторный масляный насос со
скоростью откачки 350 л-с-1 при давлении 10-1—10-2 Тор. Пре-
дельное давление, создаваемое этим насосом, имеет порядок
10~2 Тор, предварительный вакуум 1—3,5 Тор, мощность нагре-
вателя 5—10 кВт (в зависимости от давления форвакуума).
Струя паров масла после выхода из сопла 3 уносит откачи-
ваемый газ и конденсируется на стенках конфузора 4; масло
стекает через трубку 7 в резервуар 1 Разность уровней масла
в резервуаре и трубке Н= 150 4- 300 мм соответствует давле-
нию пара 10—20 Тор. На выходе из насоса имеется лабиринт 5,
предотвращающий утечку масла в форвакуум.
На фиг. 4.44 представлена схема бустера, состоящего из од-
ноступенчатого эжекторного насоса (сопло /) и двухступенча-
того диффузионного насоса (сопла 2 и 3).
Скорости откачки больших насосов промежуточного диапа
зона достигают десятков тысяч литров в секунду при давле-
нии 10~4 Тор, мощность подогревателя составляет до 100 кВт,
количество масла — несколько сот литров, вес насоса — не-
сколько тонн, расход охлаждающей воды — от сотен до не-
скольких тысяч литров в час, время нагревания — от 10 мин до
1 ч.
222
ГЛАВА 4
На фиг. 4.45 представлены характеристики ртутных и масля-
ных насосов, а на фиг. 4.46 — ртутных и масляных эжекторных
Вход
Фиг. 4.43. Одноступенчатый эжекторный масляный насос.
Давление масляных паров на выходе 10—20 Тор определяется высотой столба масла Н
(фирма Distillation Products Inc., США).
1 —резервуар масла; 2 - подогреватель; 3—сопло; 4 — конденсатор; 5—лабиринт, 6—тепло-
изоляция, 7 —трубка для стока масла; 8—водяная рубашка.
Вход
Фиг. 4.44. Промежуточный масляный
насос (бустер).
3=850 л-с-1; Рнач св 2-5 Тор, 10-3 Тор
(фирма Edwards, Великобритания).
1 — эжекторное сопло; 2, 3—диффузионные
сопла; 4— охлаждаемый колпак над верхним
соплом, 5—маслоуловитель; 6—измеритель
уровня масла.
(сплошные линии) и диффузионных (штриховые линии) насо-
сов.
Диффузионные пароструйные насосы В противоположность
эжекторным насосам, работающим при сравнительно высоких
Фиг. 4.45. Характеристики промежуточных насосов (фирма Leybold).
а— ртутные насосы- --одна эжекторная и одна диффузионная ступени, р> = 12 Тор,
объем ртути VpT=9'J см3, мощность подогревателя Ргр=450 Вт, расход охлаждающей
воды Q=50 л-ч-1, р = 10-6 Тор, время нагрева Т=25 мин, вес насоса кг, Т>вх =
= 20 мм,----одна эжекторная н две диффузионные ступени, pj=10 Тор, Урт=250 см3,
/>гр=1 кВт, Q = 103 л-ч-1, роо = 10—s Тор, Т=45 мин, 17=20 кг, £>вх=50 мм.
б—масляные насосы: -Pj=3 Тор, 30=9л-с—объем масла 7М= 1,5 л, Ргр = 1,8кВт,
<2 = 150 л-ч-1, т=25 мин,--р^=4Тор, 5о=100л-с— ’, VM=320 л, Ргр=100 кВт,
Q=60j0 л-ч-Т=60 мин,--------Pj=4 Top, SQ=100 л-с-1, 7м=320 л, Ргр=50 кВт,
<2=6000 л-ч-1, 11=60 мин.
224
ГЛАВА 4
выходных давлениях, диффузионные насосы требуют предвари-
тельного вакуума на выходе порядка тора или долей тора.
Откачиваемый газ диффундирует в струю паров ртути или
масла, которая переносит его в направлении выхода из насоса.
Чтобы этот процесс протекал достаточно интенсивно, скорость и
плотность пара в струе должны быть достаточно большими в
сравнении со скоростью и плотностью откачиваемого газа.
В одной из первых конструкций (Геде, 1915 г.) диффузион-
ного насоса (фиг. 4.47, а) молекулы газа, движущегося во вход-
ном канале насоса 2, диффундируют через отверстие 3 в поток
ртутных паров. Однако часть потока ртутных паров турбули-
зуется в отверстии 3 и, двигаясь навстречу молекулам газа,
Фиг. 4.46. Характеристики откачки насосов (фирма Leybold).
1—эжекторный ртутный насос; 2—эжекторный масляный насос; 3— диффузионный ртут-
ный насос; 4— диффузионный масляный насос
откачки. Этот эффект можно уменьшить с помощью холодиль-
ника 4. Указанный эффект устраняется полностью, если откачи-
вающий и откачиваемый потоки имеют одинаковое направление
(фиг. 4.47,6). При этом холодильник (конденсатор) 4 поме-
щается на выходе из сопла 3. Такой насос сначала был назван
диффузионно-конденсационным (Ленгмюр, 1916 г.), а в настоя-
щее время называется просто диффузионным.
На фиг. 4.48 представлена схема диффузионного насоса.
В резервуаре 1 с рабочим телом (маслом, ртутью), подогревае-
мом электрическим подогревателем или газовой горелкой 4, гене-
рируется пар1), который по трубе 2 попадает в тарельчатое
сопло 3.
В сопле происходит преобразование энергии давления пара
в кинетическую энергию; одновременно струя пара приобретает
форму кольцевого усеченного конуса аа' — bb'. Корпус насоса
на участке bb' (конденсатор) охлаждается водой или воздухом.
Пар на этой поверхности конденсируется, а жидкость стекает
по стенке в резервуар, где снова испаряется. Таким образом,
') Ввиду пониженного давления в насосе, температура испарения рабо-
чей жидкости невысока и составляет 370—420 К в зависимости от рода
жидкости.
a
Ртуть
Фиг. 4.47. Диффузионные насосы Геде (а) и Ленгмюра (б).
1 — трубопровод ртутных паров; 2— вход в насос; з — откачивающее отверстие (круглое
или кольцевое); 4—конденсатор.
Фиг. 4.48. Диффузионный насос (масляный или ртутный).
I—резервуар рабочего тела (испаритель); 2—паропровод; 3 — сопло, 4— .одогреватель;
5—конденсатор; б~масло (ртуть); ab —откачивающая поверхность паровой струи («диа-
фр агма»).
226
ГЛАВА 4
между соплом и конденсатором насоса постоянно существует
поток паров рабочего тела.
Молекулы откачиваемого газа со стороны входа в насос по-
падают на коническую поверхность ab струи, называемую диа-
фрагмой, и диффундируют внутрь струи. При этом они сталки-
ваются с молекулами пара и получают импульс скорости в на-
правлении движения струи рабочего тела. Концентрация газа в
расширившейся после выхода из сопла струе пара очень мала,
благодаря чему молекулы газа легко диффундируют внутрь
Фиг. 4.49. Принцип работы диффузионного насоса.
а—идеализированная цилиндрическая струя пара; б—изменение давления откачиваемого
газа вдоль паровой струи.
/—откачивающая поверхность (диафрагма) площадью Лв; 2—поверхность конденсатора;
3 — поток пара.
струи. Однако часть молекул откачиваемого газа не захваты-
вается струей или просто отражается от молекул пара при
столкновении. Этот эффект можно учесть коэффициентом при-
липания у, меньшим единицы.
После конденсации паров на стенках захваченный паром газ
оказывается в выходном пространстве насоса, где давление рав-
но давлению предварительного вакуума (порядка 1—10-2 Тор),
Отсюда газ удаляется в атмосферу форвакуумным насосом.
Принцип работы диффузионного насоса (по
Жеккелю). Для анализа явлений, происходящих в диффузи-
онном Насосе, коническую поверхность струи пара заменим ци-
линдрической (фиг. 4.49, а). Пусть струя эта движется со ско-
ростью цп от верхнего основания 1 цилиндра, который можно
принять за диафрагму насоса, к нижнему основанию 2, которое
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
227
в данной схеме выполняет роль конденсатора. Таким образом,
откачиваемые газы после входа в насос попадают на диафрагму,
диффундируют внутрь цилиндрической струи и переносятся ею
в направлении откачивания, а затем освобождаются в конден-
саторе 2, откуда следуют к выходу из насоса. Давление на входе
в насос равно р, а на выходе составляет pt (pi р); этим дав-
лениям соответствуют концентрации п и tii. Концентрация газа
в струе пара возрастает по мере переноса газа струей от вели-
чины п (при х = 0) до П\ (при х = L).
Концентрация пара в струе пп обычно значительно больше
концентрации газа пг, несмотря на это, часть газа под воздей-
ствием перепада давлений между входом и выходом насоса воз-
вращается по струе пара обратно, образуя обратный поток газа.
Теперь можно установить основные уравнения, описывающие
течение газа в диффузионном насосе.
Движение газа в направлении откачки может быть выра-
жено уравнением
vi+ = vnrt, (4.37)
а в обратном направлении — уравнением
vU = (4.38)
В этих уравнениях и являются количествами моле-
кул газа, проходящих через 1 см2 сечения струи в течение 1 с,
Dr. п — коэффициент диффузии газа в пар.
Предельное давление диффузионного н а со-
с а. Из уравнений (4.37) и (4.38) можно найти предельное дав-
ление, создаваемое насосом.
Состояние равновесия, при котором течение газа прекра-
щается, можно охарактеризовать равенством
vi+ + vi- = 0,
т. е.
vnrt = Dr.n-g-. (4.39)
Так как концентрация п пропорциональна давлению, можно
написать уравнение
которое после интегрирования (при D = const) принимает вид
1пр = -^2-х + С, (4.41)
п
228
ГЛАВА 4
где С — постоянная интегрирования, которая для состояния рав-
новесия определяется из условия р = рх при х = 0; следова-
тельно, С — In Роо,
In
р
Роо
(4.42)
и
Р = Роо ехр(^- *)•
X иг. п /
(4.43)
Уравнение (4 43) представляет собой уравнение распределе-
ния давления в струе рабочего тела (фиг. 4 49, б).
На фиг. 4.50 представлены полученные экспериментально
изобары распределения давления аргона в струе паров масла
Вход
р^Ю'5Тор
при давлении на входе в насос
р = 10~5 Тор для случая, ког-
да струя пара из сопла 1 до-
стигает сопла II. Видно, что
давление газа в струе сущест-
венно меньше давления в окру-
жающей среде и уменьшается
до 0,1 р на внутренней стороне
паровой диаграммы, зато по
мере приближения к конденса-
тору оно быстро возрастает до
давления, почти на порядок
превышающего величину р
(например, изобара 8р).
Фиг. 4 50. Распределение давления
газа в диффузионном насосе, выра-
женного через давление на входе р
(по Савинскому, 1955 г.)
При х = L имеет место равенство р = pi, т. е. давление на
выходе из насоса может быть записано следующим образом:
Р1 = РооПЧ>(-тг~Ь}’
\ ^г. п /
(4.44а)
откуда определяется предельное давление
P«, = Piexp^^-L].
(4.446)
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
229
Таким образом, предельное давление диффузионного насоса
во много раз ниже давления форвакуума pi. Отношение давле-
ний
^i- = exp(-^-L) (4.45)
называется степенью сжатия газа струей пара и характеризует
связь между предельным давлением насоса р^ и давлением на
выходе р\. При данном р\ величина рх тем меньше, чем больше
скорость паров рабочего тела vB, длиннее путь откачивания L
и меньше коэффициент диффузии газа в паре Dr п.
Что касается коэффициента диффузии Dr п, то для случая,
когда давление пара ра значительно больше давления газа
р(Рп^> р), он может быть выражен с помощью формулы (2 80):
Рг п= 6,2 • 10-161/ Д-.v-—• (4.46)
I MqMq, п (do-Т rfo, п)2 Ра
Коэффициент диффузии Dr п тем меньше, чем больше дав-
ление пара рП на диафрагме, а также чем больше молекулярные
массы пара Мо, п и газа Л1о.
С учетом формулы (4.'46) выражение (4.45) для данной тем-
пературы Т можно записать в виде
Pi
Роо
= ехр с (Lvnpn)
MqMq, п (dj 4- dp, п)2
Ума + Мв>п
= ехр {С].
(4-47)
В формуле (4 47) величина с является для данной темпера-
туры постоянным коэффициентом, выражение в круглых скоб-
ках определяется конструкцией (L) и условиями работы насоса
(уп, Рп), а выражение в квадратных скобках зависит от рода ра-
бочего тела (d0,а, М0,а) и откачиваемого газа (d0, Мо).
В табл. 4 3 приведены величины, пропорциональные выраже-
нию в квадратных скобках формулы (4.47), для трех газов раз-
личной плотности: водорода Иг, воздуха (О2, N2) и двуокиси
углерода СО2, а также для паров трех рабочих веществ- ртути,
масла с молекулой средней величины и масла с большой моле-
кулой.
Из табл. 4.3 следует, что труднее получить низкое предель-
ное давление для водорода с помощью ртутного насоса, чем для
углекислоты с помощью насоса на силиконовом масле.
В совершенных насосах отношение pi/p<x может достигать ве-
личины порядка 103 и больше.
Полное предельное давление должно включать давление па-
ров откачивающего рабочего тела:
P^Poo.r + fe (4-48)
230
ГЛАВА 4
Таблица 4.3
Ориентировочные значения величины, пропорциональной выражению
[/МОМО>П (d0 + d0 п)2]/ /Мй + Мо, п в формуле (4.47)
(по Зобачу, 1954 г.)
Газ Я 2 30 44
d0, 10“8 см 2,8 3 7 4,7
Пар Ч,п d0, п Н, О2, N2, воздух СО2
Ртуть 201 5,1 1 4,5 6,5
Апиезон 340 9,5 2,5 10 15
Силиконовое масло 550 11 3 13 18
где ра — давление паров, являющееся функцией температуры
Pn = f(W (4.49)
За Тхол следует принимать самую низкую температуру в про-
странстве высокого вакуума (например, температуру конденса-
тора или других охлаждаемых поверхностей).
Обычно рабочее тело и температуру Тхол подбирают из усло-
вия рп <С рсо.г. Отметим, что на предельное давление оказывают
влияние газы, растворенные в масле; эти газы вместе с парами
попадают в сопло и тем самым снижают эффективность работы
насоса.
Рассмотрим далее величину в круглых скобках формулы
(4.47), характеризующую конструкцию и условия работы на-
соса.
Длина L зависит от конструкции насоса (точнее, от длины
свободного пробега молекул газа в струе пара). Если концен-
трацию пара пп не требуется существенно снижать вблизи кон-
денсатора (точка b на фиг. 4.48), то длину L не увеличивают,
за исключением случаев, когда количество вводимого в струю
пара велико (следовательно, испаритель и подводящие трубы
имеют большие размеры).
Скорость струи пара оп зависит от конструкции сопла и ско-
рости испарения рабочей жидкости. Большое влияние на ско-
рость истечения пара оказывает температура испарения рабочей
жидкости в резервуаре, а также распределение температур по
длине подводящего трубопровода и сопла. Пример такого рас-
пределения показан на фиг. 4.51.
Увеличение скорости истечения пара за счет повышения тем-
пературы испарения может привести к излишнему увеличению
тепловых скоростей частиц газа, В результате этого происходит*
Фиг. 4.51. Распределение температур в диффузионном насосе.
Фиг. 4.52. Влияние мощности подогревателя на работу диффузионного
насоса.
а—зависимость давления на входе от мощности подогревателя и давтення форвакуума;
б—зависимость предельного давления от давления форвакуума и мощности подогре"
вателя.
232
ГЛАВА 4
рассеивание струи на диафрагме, обратный поток пара возра-
стает и пары масла проникают в область высокого вакуума.
Если же при этом интенсивность струи мала (например, при не-
достаточной мощности подогревателя Ргр), то диафрагма оказы-
вается слишком «слабой», что требует более низкого давления
в форвакууме и приводит к уменьшению скорости откачки. Эти
положения иллюстрируются графиками фиг. 4 52.
Конфигурация сопла в насосе имеет принципиальное значе-
ние, так как в нем происходит преобразование энергии давления
пара в кинетическую энергию струи. От формы сопла зависят
скорость, плотность и степень рассеивания струи.
Фиг. 4.53 Сопла диффузионных насосов,
а—прямые, б—тарельчатые (с поворотом струи на 180°).
На фиг. 4.53 показано несколько конфигураций сопел. Соп-
ла а обычно делают из стекла, а сопла б — из металла. Опе-
ренные стрелки обозначают поток рабочего тела, обыкновен-
ные — поток откачиваемого газа.
На фиг. 4.54 представлена зависимость скорости откачки S
от угла наклона 4 направляющей тарели кольцевого сопла, а
также от расстояния b между тарелью и стенкой насоса. Увели-
чение b (т. е. минимального сечения, которое отделяет простран-
ство высокого вакуума от диафрагмы) способствует увеличению
скорости откачки, однако только до определенного уровня, по-
сле чего скорость откачки резко уменьшается. Поэтому вместо
одной диафрагмы с большой поверхностью часто создают не-
сколько диафрагм при помощи сопловой решетки.
Наиболее благоприятный угол наклона направляющей таре-
ли "О' находится в диапазоне 60—90°.
Размеры сопла зависят от количества и давления паров ра-
бочего тела, которые в свою очередь определяются производи-
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
233
тельностью насоса, теплотой испарения и температурой кипения
рабочей жидкости.
Скорость откачки диффузионного насоса.
Если бы струя пара в области диафрагмы была идеально лами-
нарной и обладала бесконечно большой скоростью, то поверх-
ность диафрагмы выполняла бы примерно ту же роль, что и от-
верстие, ведущее в идеальный вакуум. Попадающие в струю
молекулы газа немедленно бы удалялись, и поэтому давление
газа в струе было бы равно нулю. Скорость откачки, обеспечи-
Фиг. 4 54. Зависимость скорости от-
качки S от ширины кольцевого канала b
и угла тарели 4 (по Гольстмарку, Рамму,
Вестину).
ваемая струей, имела бы максимально возможное значение, рав-
ное скорости откачки отверстия, ведущего в идеальный вакуум
(т. е проводимости этого отверстия Go). При скорости струи
пара уп проникающий в нее под давлением р газ перемещается
с той же скоростью уп (фиг. 4.49). Таким образом, струя пара,
подобно поршню, перемещает газ; поток газа можно выразить
формулой
т dQ dV An dx t it H/y.
1 = W = P ~dT = p = PA°V™ (4-5°)
где Ao — площадь кольцевой диафрагмы. Скорость откачки, со-
ответствующая потоку /, выражается формулой
So = 7 = Mo. (4.51)
Проводимость кольцевого отверстия, в котором образуется
диафрагма, можно записать как
G0 = jVaPA>, (4.52)
234
ГЛАВА 4
где vap — средняя арифметическая скорость течения откачивае-
мого газа (при температуре Т на входе в насос).
Из уравнения
получаем скорость откачки в диафрагме
S° = 1 + Go/So G°' (4‘54)
Для идеальной диафрагмы (уп = оо) имеем So = So и скорость
откачки насоса достигает своей максимальной величины So —
So = Go, равной скорости в отверстии, ведущем в идеальный
вакуум. Для запирающей диафрагмы (уп = 0) получаем So = 0
и So — 0.
Выражение
=Л. = 1 _ 1
Х Go 1 + Go/So 1+^.(аар/ап)
(4.55)'
называется коэффициентом эффективности диафрагмы.
Коэффициент эффективности диафрагмы учитывает способ-
ность струи пара захватывать молекулы газа.
Для данного газа при определенной температуре коэффи-
циент % возрастает с увеличением средней скорости молекул
пара vn и с уменьшением тепловой скорости частиц откачивае-
мого газа vap; таким образом, % зависит от формы сопла, а
также от скорости и распределения частиц пара. Из сказанного
следует, что размеры испарителя, род и количество рабочей
жидкости в нем, характеристики паропровода от испарителя до
соплового насадка (длина и толщина стенок, род материала),
а также распределение температур вдоль этого паропровода
должны быть соответствующим образом подобраны.
В табл. 4.4. приведены вычисленные по формуле (4.55) зна-
чения коэффициента % для некоторых откачиваемых газов при
Таблица 4,4
Коэффициент эффективности диафрагмы (по Зобачу, 1954 г,)
Откачиваемый газ °ар при 300 К, м с-1 Оо/Ло- — I —2 Л«С ’СМ Скорость пара »п. м •С"1
200 150 100 50
н2 1710 44 0,3’ 0,26 0,19 0,1
Воздух 450 11,6 0,63 0,56 0,46 0,3
СО2 370 9,4 0,68 0,62 0,52 ,0,35
Получение высокого вакуума
235
нескольких значениях скорости пара. Из таблицы видно, что бо-
лее тяжелые газы (с более медленным движением молекул) от-
качиваются струей пара лучше, чем более легкие газы (с «бы-
стрыми» молекулами), а значения % находятся в довольно ши-
роком диапазоне.
Интенсивность откачки в диафрагме можно определить через
скорость движения молекул и коэффициент эффективности ди-
афрагмы следующим образом:
So Go Sq 1 -л,
47= <4-5б>
Ориентировочные значения 50/Ло при пп = 150 м-с"1 равны
11,2 для Нг, 6,55 для воздуха и 5,78 для СО2.
Таким образом, несмотря на то что для водорода величина %
почти в 2 раза меньше, чем для воздуха, проводимость отвер-
стия для водорода почти в 4 раза больше, вследствие чего ско-
рость откачки водорода примерно вдвое превышает скорость от-
качки воздуха.
Скорость откачки So относится к проходному сечению насоса
в области диафрагмы. Так как часть пространства на входе
в насос занята паропроводом, имеющим диаметр £>тр и длину
£Тр, следует учесть и его проводимость GTp при расчете скорости
откачки для входа насоса:
5Эфф = So ! + So/0tp • (4.57)
Зависимость скорости откачки диффузион-
ных насосов от рода газа. Зная скорость откачки диффу-
зионного насоса для воздуха 5ВОЗд, можно ориентировочно опре-
делить скорость откачки для газа X по формуле
Sx ~ ^х^возл> (4.58)
где Sx — коэффициент, значения которого для некоторых газов
приведены в табл. 4 5.
Таблица 4.5
Коэффициенты скорости откачки диффузионного насоса
для различных газов
Газ X н2 Не Аг, Н2О Ne Воздух, n2, СО О2 СО2 Кг
sx ~ $х/^ВОЗД ’,8 ’,6 1,2 1,1 1 0,95 0,85 0,7
Зависимость скорости откачки диффузион-
ных насосов от д а в л е н и я. Более строгий анализ приво-
236
ГЛАВА 4
дит к следующей зависимости скорости откачки в диафрагме от
давления:
1 — — ехр {— С}
So, п = Go-------------------- f (р). (4.59)
1 + -^-[1-ехр {—С}]
В выражении (4.59) параметр С, как и в формуле (4.47), за-
висит от конструкции насоса, а также от свойств рабочего тела
и откачиваемого газа.
Фиг. 4.55. Распределение давле-
ния в диффузионном насосе при
различных давлениях р на входе.
Pt — давление на выходе; Рфвак—давле-
ние на входе форвакуумного насоса
(Рфвак=с°П8‘)-
При р роо, т. е. когда скорость откачки существенна, полу-
чаем (pi/p)exp{—С} 1, и выражение (4.59) принимает вид
формулы (4.54). По мере того как давление р уменьшается и
приближается к рто, числитель выражения (4.59) также умень-
шается, и при р = рк, получаем
PilPoo = exp {С} и So, п = 0.
С другой стороны, когда р возрастает и приближается к рь
скорость откачки So, п может снова начать уменьшаться и стать
малой величиной, вследствие невыполнения условия р С рп.
Распределение давления газа в струе паров также изменяется
с изменением р, как это показывают кривые на фиг. 4.55. Кри-
вая 0 соответствует условию р = р<», а кривые 1 и 2 — большим
значениям давления на входе в насос (p2>pi). При этом не-
сколько изменяется также давление на выходе из насоса Р\ (при
постоянном давлении форвакуума Рфвак — const, фиг. 4.55).
Подключение нескольких диффузионных на-
сосов и многоступенчатые диффузионные на-
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
237
с о с ы. Диффузионные насосы, подобно ротационным, могут
включаться последовательно, т. е. выход одного насоса соеди-
няется с входом другого и т. д. Это позволяет повысить предель-
ный вакуум или использовать насосы с менее жесткими требо-
ваниями в отношении форвакуума.
Многоступенчатый диффузионный насос является своего рода
реализацией последовательного соединения нескольких диффу-
зионных насосов в общем корпусе. В таком насосе обычно при-
меняются общий испаритель и общий паропровод для питания
Фиг. 4.56. Схема трехступенчатого
диффузионного насоса.
Размеры поверхности паровой диафраг-
мы сопла Ш ступени определяют ско-
рость откачки насоса; характеристики
сопла I ступени определяют давление
форвакуума. Указаны также примерные
величины скорости откачки S н давле-
ния р в различных ступенях.
сопел отдельных ступеней (фиг. 4.56). Скорость откачки насо-
сов определяется скоростью откачки первой ступени со стороны
входа в насос.
Из условия неразрывности откачиваемого потока газа / для
всех откачивающих паровых струй должно выполняться соотно-
шение
I=Sp (вход) = S3p3 = S2p2 = SiPi (выход), (4.60а)
где Si и рг — соответственно скорость откачки и давление для
i-й ступени насоса. Однако для работы каждой ступени с неко-
торым запасом желательно, чтобы имело место неравенство
/ — Sp (вход) < S3p3 < S2p2 < Slp1 (выход). (4.606)
Соотношение р < Рз < Рг < Pi показывает, что для каждой
последующей ступени площадь диафрагмы может быть меньше.
Эффективная работа ступеней насоса зависит от правиль-
ного распределения пара между соплами. Это достигается путем
238
ГЛАВА 4
подбора размеров расходных отверстий и обеспечения соответ-
ствующего распределения температуры.
Часто первая ступень насоса является эжекторной ступенью;
это значит, что вместо сопла (например, тарельчатого), обра-
зующего коническую поглощающую диафрагму с большой по-
верхностью, применяется сопло (или несколько сопел) малого
диаметра, дающих короткую, но плотную струю пара. Эжектор-
ная ступень позволяет ограничиться более высоким давлением
форвакуума.
Масла для диффузионных насосов. Главным пре-
имуществом масляных диффузионных насосов по сравнению со
ртутными является возможность работы без криогенных лову-
шек, которые создают много затруднений из-за необходимости
применения охлаждающих веществ (твердого СО2 или жидкого
N2). В масляных диффузионных насосах в принципе достаточно
маслоуловителей с температурой, близкой к температуре кар-
тера насоса или конденсатора, охлаждаемого водой из водопро-
вода или атмосферным воздухом. Давление паров масла /?«>, и
в предельном вакууме при такой температуре должно быть зна-
чительно ниже предельного давления откачиваемого газа /?оо,г-
Это — важнейшее требование к вакуумному маслу. Кроме того,
масло должно иметь большую молекулярную массу (и большие
размеры молекул). Для эффективной откачки газов масло долж-
но быть устойчивым против окисления и разложения при рабо-
чих температурах насоса.
Этим требованиям удовлетворяют некоторые сорта углево-
дородных натуральных (минеральных) масел и синтетических
(так называемых высоковакуумных) масел. К ним относятся
рафинированные продукты (нафтены, нафталины, парафины),
получаемые путем дистилляции тяжелых фракций нефти, и
сложные эфиры некоторых органических кислот (фталаны,
эфиры себациновой кислоты), а также хлорзамещенные угле-
водороды и кремнийорганические соединения (силиконы). Ха-
рактерной особенностью этих масел являются большие размеры
и масса их молекул. Некоторые из них (например, силиконовые
масла) отличаются высокой стабильностью молекулярной цепи
и термической стойкостью (они не окисляются и не разлагаются
при высоких температурах, особенно в присутствии металличе-
ских катализаторов).
Вообще масла не являются однородными веществами и пред-
ставляют собой смесь многих компонентов с разными мас-
сами и диаметрами молекул. На фиг. 4.57 показана для
примера спектрограмма молекулярных давлений составляю-
щих масла апиезон В в зависимости от их молекулярных
масс Af0.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
239
Масла с узким спектром молекулярных масс получаются пу-
тем молекулярной перегонки1).
Однако с течением времени используемое в насосе масло раз-
лагается (появляются более летучие компоненты с меньшими
массами и диаметрами молекул), в результате чего возрастает
рх< п. Эти трудности в значительной степени разрешены в диф-
фузионных насосах с фракционированием масла (см. ниже).
Фиг. 4.57. Спектрограмма молекулярных давлений масла апиезон В на фоне
молекулярных давлений других газов с массами 12<Л40<40 (по GEC—AEI).
В случае повреждения вакуумной системы и попадания воз-
духа в горячий насос масло может подвергнуться окислению,
что сопровожается появлением белого дыма на выходе из форва-
куумного насоса. Степень окисления масла зависит от давления
воздуха и времени его воздействия. В случае сильного окис-
ления масло следует заменить, а насос и другое вакуумное обо-
рудование очистить (например, при помощи четыреххлористого
’) Для молекулярной перегонки требуется такой вакуум, в котором моле-
кулы масла при своем движении из испарителя в конденсатор не сталки-
ваются с молекулами газов.
Характеристики масел для диффузионных
Название масла мо, ср, —1 г моль Плотность, г-см“3 Давление паров, Тор
при 248 К при 298 К предельное Роо, П при 288 К
Амойл 306 1,02 10-8 10-5 (54-50) • 10-8
Амойл S 343 0,93 <10“9 (14-2). 10~8 (14-10). 10-8
Апиезон А 350-400 0,87 <10-9 (14-10)- 10-6 (104-49). 10-8
Апиезон В 409-450 0,88 <5 • 10~10 (0,14-0,5). 10-8 (14-10). 10-8
Апиезон С 500-550 0,8—0,9 <10-'° (0,14-0,5). 10-8 10-7
Арохлор 1254 326 1,55 ю-8 10-8 (2-5)-10-5
Атенсоль А 356 0,89 (24-5) • 10_6
Атенсоль В, 390-530 0,9 (24-5) • 10~6
С, D Конвахлор 8 290 1,45 7 • 10-4
Конвахлор 12 325 1,54 0,5- 10 6 2- Ю-4
Конвалекс 10 454 1,2 2- 10—9
Конвойл 10 Конвойл 20 250 400 0,9 0,86 10-7 Ю-10 2- 10~3 8 ТО-6
D-1A ~500 0,89 10-7 2-10
Диффелен 335 0,884 2 • 10-8 <10
(легкий)
Диффелен 435 0,880 10~8 <10
(нормаль- ный)
Диффелен 450 0,878 5 • 10—9 10~8-10-9
ультра
Диффойл 61 <3-10 8
Диффойл 71 432 0,88 <5 • 10~7
Лейбольд Н 10~8 5-10 8
Лейбольд L50 300 1,55 <10 4
Люваколь-6 470 0,87 IO"’0 10-7
.Люваколь-8 525 0,86 <10-9
/Миван 20 326 0,87 (14-10). 10-8
Наркойл 10 326 1,54 10“8 IO"5 (24-5)- 10-5
Наркойл 40 418 0,97 5 • 10—8
Таблица 46
насосов (данные ориентировочные)
Температура, К Род химического соединения Изготовитель
Рп=10~2 Тор Рп=0,5 Тор воспламе нения затвер деваиия
370 390 385 410 435 370 330 345 475 345 395 415 420 430 475 425 475 485 370 400 425 475 495 395 405 550 410 465 465 480-490 490-495 510-520 470 560 450 500 505 510 525 525 480 517 550 263-269 263-269 261-263 283 266 283 278 249 263 246 246 244 283 241 Фталан i-диамила Себациан ьдиамила Смеси насыщенных углеводородов (из минерального масла) Пятихлористый дифенил 1 Углеводороды из 1 минерального масла 1 Хлорзамещенные 1 углеводороды Полифениловый эфир Смеси углеводо- родов, получае- мых из минераль- ного масла Четыреххлористый дифенил 1 Смеси углеводоро- 1 дов Дифенил хлорза- мещенный Эфир фталевой кислоты ] Consolidated > Vacuum Corp. J (США) J. G. Biddle (США), Metropo- htan Vickers (Великобрита- ния) Monsanto Che- mical Corp. (США) | Чехословакия Consolidated Vacuum Corp. (США) ’ СССР Balzers ’ (Лихтейнштейн) Leybold — He- raeus (ФРГ) I VEB Mineralo- } Iwerk Lutzken- J dorf (ГДР) Consolidated Vacuum Corp. (США)
242
ГЛАВА 4
Название масла М0,ср, г-моль-1 Плотность, г см-3 Давление паров, Тор
при 248 К при 298 К предельное Роо> П ПРИ 288 К
Октойл (наркойл 30) Октойл S (наркойл 20) ПФМС-1 ПФМС-2 ПФМС-3 390 425 0,98 0,91 IQ-Ю Ю-ю > во t- 2 о О А 7 7 О <о ю 7 1 1 т ° 2 (14-10)- 10-7 (0,1-5)- I О-7
Силикон 702 Силикон 703 530 570 1,06 1,07 10-8 ND СП О О L L <10~6 <0,5- 10-8
Силикон 704 484 1,07-1,09 10~10 5-10~8 <2- 10—7
Силикон 705 SO66 Вакуоль ВКЖ 94А, Б 546 750 1,09 1,06 0,89 1О~10 5 - 1О~10 <5- 10-8 10~7 ~10"6 <5-10-9 5-10~7
углерода и ацетона), а остатки паров очищающих веществ
тщательно удалить. В случае небольшого окисления требуемое
качество масла удается восстановить путем откачки продуктов
разложения при работе насоса «на себя» (т. е. при закрытом
входе) в течение длительного времени. В этом отношении насосы
с фракционированием масла также имеют преимущества.
В табл. 4.6 приведены основные характеристики высокова-
куумных масел для диффузионных масляных насосов. Эти масла
имеют удельную теплоемкость порядка 0,3—0,4 кал • г-1 • К-1,
теплоту испарения 20—30 кал-г-1 и теплопроводность (Зч-4)Х
Х10-4 кал-с-1-см-1-К-1 при температуре 313 К.
Выбор масла определяется условиями работы насоса (напри-
мер, требуемым предельным давлением, составом газов в пре-
дельном вакууме, нечувствительностью к загрязнениям, ценой
и т. д.).
Теплофизические свойства масла оказывают влияние на вы-
бор температуры испарения и характеристик паропровода и со-
пел, а их зависимость от давления — на выбор температуры
конденсации, конструкции маслоуловителей и т. п. На фиг. 4.58
представлены кривые давления насыщенных паров различных
масел, водяного пара и паров ртути в зависимости от темпера-
туры,
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
243
Продолжение табл. 4.6
Температура, К Род химического соединения Изготовитель
РП=10"2 Тор Рп=0.5 Тор воспла менення затвер- девания
395 455 465 221 Фталан диэтилгек- сила Consolidated Vacunm Corp.
* ? i 4b. 4ь СО — N Ч СЛ ООО 475 480 218 Себациан диэтил- гексила Силиконовые масла (США) СССР
~490 450 455 460-470 500 230-250 230-250 Три' | трех- ] фвНИ” сил0’ Учеты- лотри' кси- | nД. | мети- Dow Corning (США), Midland
425 495 500-510 230-250 Silicones (Вели-
450 370-430 520 510-520 500 258 213 лан (пяти ]ловый Фракции минераль- ного масла Силиконовые масла кобритания) Leybold (ФРГ) Варшавский по- литехнический институт (ПНР) СССР
Диффузионные насосы с фракционирова-
нием масла. Диффузионный насос с фракционированием
масла является усовершенствованным многоступенчатым масля-
ным насосом.
Во время работы диффузионного насоса вследствие высокой
температуры и соприкосновения масла с металлами и газами
происходят деструкция и частичное разложение макромолекул.
Вследствие этого в насосе образуются более летучие фракции
масла, имеющие более высокое давление паров, что ухудшает
предельный вакуум. Во избежание слишком частой замены или
дистилляции масла процесс отделения более летучих фракций
можно проводить в самом насосе. В насосах с фракционирова-
нием масла (фиг. 4.59) каждое сопло имеет отдельный паропро-
вод, причем сопло последней ступени, создающей предельный
вакуум (масло для которой должно иметь как можно меньше
летучих компонентов), питается из центральной части испари-
теля. Это связано с тем, что сконденсировавшееся масло прохо-
дит до этой части испарителя самый длинный путь: от конден-
сатора через все лабиринты паропроводов, погруженных в ре-
зервуар. Вследствие этого во внешние паропроводы, питающие
сопла первых ступеней, попадают более легкие фракции масла
с более высоким давлением насыщенных паров,
16*
244
Глава 4
Предельное давление в насосе с фракционированием масла
на I—2 порядка ниже, чем в обычном диффузионном насосе.
Другим преимуществом насоса с фракционированием масла яв-
ляется то, что в случае окисления масла при помощи этого на-
соса можно в более короткое время восстановить низкое давле-
ние (в нем быстрее происходят регенерация и дегазирование
масла). И действительно, в случае применения не поддающихся
Фиг. 4.58. Зависимость давления паров некоторых масел (в сравнении с кри-
выми для ртути и воды) от температуры (по различным источникам).
Желательное давление паров в резервуаре насоса ~0,5 Тор; температура маслоуловителей
(прн водяном охлаждении) ~298 К.
легкому разложению масел (например, силиконового) насосы
с фракционированием не дают почти никаких преимуществ
(кроме дегазирования масла).
На фиг. 4.60 показан для примера небольшой стеклянный
насос с фракционированием масла, в котором более летучие
фракции масла оседают в отстойниках 4 перед первой ступенью
насоса, а в резервуаре 3 собираются самые тяжелые фракции.
Паропровод из резервуара снабжает паром сопло 6.
На фиг. 4.61 представлена конструкция металлического на-
соса с фракционированием масла. Резервуар с маслом разделен
перегородкой 3 на секции 1 и 2. из которых секция 1 питает вы-
Получение высокого вакуума
245
соковакуумные сопла, а секция 2 — форвакуумные сопла. Резер-
вуар имеет ряд лабиринтных перегородок, благодаря которым
масло совершает при переходе из секции 2 в 1 более длинный
путь, что создает возможность отделения более летучих компо-
нентов, а также удаления растворенных газов. Стекающее после
Вход
Фиг. 4.59. Диффузионный насос с фракционированием масла.
Г. II, III —сопла, 1, 2, а—паропроводы; О, Г, 2', 3' —кольцевые области пара в резерву-
аре (испарителе); а, Ь, с —каналы лабиринта, по которым масло попадает в центральную
часть резервуара.
конденсации масло поступает сначала в секцию 2, питающую
форвакуумные сопла, и только после этого попадает в секцию 1
(здесь следует обратить внимание на конфигурацию сопла II).
В настоящее время большинство масляных насосов основано
на принципе фракционирования масла.
Насосы с частичным фракционированием
масла. В насосах с частичным фракционированием очистка
масла от более летучих фракций, а также от растворенных
в масле газов происходит в процессе его стекания вдоль горячих
Фиг. 4.60. Двухступенчатый стеклянный насос на S ~ 5 л с-1 с фракцио-
нированием масла, отстойниками более легких фракций и воздушным охла-
ждением.
Спирали подогревателя погружены непосредственно в масло (фирма Distillation Products
Inc., США).
1, 2, 3 —резервуары; 4 — отстойники более легких фракций масла; 5, 6 — сопла; 7—отстой-
ник более тяжелых фракций масла.
Фиг. 4 61. Схема четырехступенча-
того металлического насоса с фрак-
ционированием масла (фирма Distil-
lation Products Inc., США).
I, II, III, IV—сопла, 1, 2—секции резер-
вуара, 3 — перегородка, 4—змеевик водя-
ного охлаждения, 5 —отражатель паров,
6— лабиринтные перегородки.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
247
стенок картера в резервуар с маслом. Форвакуумный насос от-
качивает эти газообразные фракции.
Ртутные и масляные диффузионные насосы. Между этими
двумя типами насосов нет особого различия как в отношении
принципа действия, так и конструкции, за исключением не-
сколько увеличенных размеров питающих отверстий в случае
более вязких масел, а также разных температур пара, опреде-
ляемых температурой испарения и теплоемкостью рабочего тела.
Однако эти насосы существенно различаются по уровню со-
здаваемого ими предельного вакуума, который зависит от дав-
ления паров соответствующего рабочего тела.
В ртутных насосах, как правило, необходимо вымораживание
паров ртути, давление которых при температуре окружающей
среды (293 К) составляет 1,3-10~3 Тор, т. е. на три порядка
больше предельного давления газов, создаваемого диффузион-
ным насосом (/?oo,r< 10-6Тор); лишь при температуре твердого
СО2 (~199 К) давление паров ртути уменьшается до 10~9 Тор,
а при температуре жидкого азота (77 К) практически равно
нулю.
Масляные насосы в принципе могут работать без вымора-
живания, так как давление паров масла при комнатной темпе-
ратуре обычно ниже 10~6 Тор. В масляном насосе, как правило,
достаточно охлаждать маслоуловители воздухом или водой из
водопровода (в некоторых случаях — специальным охладите-
лем). Однако для надежного удаления водяного пара и паров
масел часто используется вымораживание с помощью жидкого
азота.
Ртутные насосы работают при более высоком давлении паров
(10—15 Тор), чем масляные насосы (1—5 Тор). Однако расход
паров рабочего тела в ртутном насосе значительно больше, чем
в масляном. Поэтому мощность подогревателей у ртутных насо-
сов раз в 5 больше мощности подогревателей таких же по про-
изводительности масляных насосов. С другой стороны, давление
форвакуума для ртутных насосов (10—20 Тор) может быть зна-
чительно выше, чем для масляных (порядка 0,05—0,5 Тор).
Крупные диффузионные насосы изготовляются главным об-
разом из металла и имеют водяное охлаждение. Малые насосы
обычно делают из стекла и с воздушным охлаждением; чаще
всего они являются многоступенчатыми.
Диаметр корпуса диффузионного насоса, определяемый
внешним диаметром поглощающей поверхности, составляет от
нескольких сантиметров до двух метров, скорость откачки — от
доли литра до нескольких сот тысяч литров в секунду.
Для изготовления ртутных насосов применяется, как пра-
вило, нержавеющая сталь; в масляных же на изготовление кор-
пусов идет нержавеющая сталь, а сопел — никелированная медь
248
ГЛАВА 4
или алюминий, обладающие повышенной теплопроводно-
стью.
Ртутные диффузионные насосы. Ртутные диффу-
зионные насосы в настоящее время применяются реже, чем мас-
ляные. Они находят применение в особых случаях, например
8ъЗл-с-'р*210-,3Тор
150 Вт
для создания особо высокого
вакуума или вакуума, свобод-
ного от органических ве-
ществ.
Схема небольшого стеклян-
ного двухступенчатого насоса
для создания очень высокого
вакуума представлена на фиг.
4.62.
Откачивающая система со-
стоит из собственно насоса и
двух последовательно соеди-
ненных криоловушек 1 и 2 с
Фиг. 4.62. Стеклянная откачивающая
система для создания вакуума до
jq—13 Тор, состоящая из ртутного
диффузионного насоса и двух после-
довательно соединенных ловушек,
заполняемых жидким азотом (фирма
Edwards).
Потребление жидкого азота 2X0,3 Л'Ч~*.
В различных точках системы указаны1 ско-
рость откачки S, давление газа р, проводи-
мость ловушек G, количество жидкого азо-
та, количество и температура охлаждающей
воды (размеры в мм).
1, 2 —ловушки; 3, 5 —сопла; 4, 6— конден-
саторы; 7 — резервуар; 8 — сифонный затвор.
жидким азотом. Первая ступень насоса имеет простое сопло 3
и конденсатор 4 в трубе, ведущей к выходу из насоса. Вторая
ступень имеет тарельчатое сопло 5. Охлаждающая вода из кон-
денсатора 6 протекает в конденсатор 4, находящийся на выходе
из насоса. Ртуть1) после осаждения на стенках конденсатора
стекает в резервуар 7 через сифон 8.
*) Ртуть для диффузионных насосов должна быть очень чистой, а для
высоковакуумных диффузионных насосов — несколько раз дистиллированной.
В случае значительного окисления ртути требуется ее предварительная филь-
трация.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
249
Для получения наиболее высокого вакуума откачиваемый
сосуд, обе ловушки (освобожденные от азота), а также верхнюю
часть насоса (с освобожденным от воды конденсатором) нагре-
вают до 670—820 К1) и выдерживают в течение довольно про-
должительного времени при этой температуре, а затем вклю-
чают насос, наполняют нижнюю ловушку жидким азотом и про-
должают прогревание откачиваемого сосуда и верхней ловушки.
Фиг. 4.63. Ртутный диффузионный на*
сос с эжекторной первой ступенью (а)
и его характеристика откачки (б)
(SGR, Франция).
= Top, V]_jg = 65 см3, рГр=550 Вт,
<2в=60 л-ч-1, W'H=15 кг.
1—диффузионные сопла II и Ш ступени;
2—-эжекторное сопло I ступени; 3 — подо-
греватель (внутри ртутного испарителя).
Наконец, наполняют жидким азотом верхнюю ловушку (после
того, как она остыла). Предельное давление в этом случае мо-
жет быть доведено при благоприятных условиях до величины
порядка 10~13 Тор.
Пример ртутного металлического насоса средних размеров
представлен на фиг. 4.63, а. Это трехступенчатый насос с эжек-
торной первой ступенью. Использованная в нем конструкция по-
догревателя обеспечивает очень быстрый запуск насоса.
Характеристика скорости откачки этого насоса приведена на
фиг. 4.63,6.
]) В это время на выходе прогреваемого насоса действует другой диффу-
зионный насос.
250
ГЛАВА 4
Масляные диффузионные насосы. Масляные диф-
фузионные насосы проектируются на скорости откачки от не-
скольких до сотен тысяч литров в секунду. Это преимущественно
металлические двух-, трехступенчатые насосы, чаще всего
с фракционированием масла; обычно они охлаждаются водой и
оснащены маслоуловителями и криоловушками.
Среди масляных диффузионных насосов различают насосы
собственно диффузионные, насосы с фракционированием масла
и промежуточные насосы.
Масляные диффузионные насосы по конструкции в принципе
не отличаются от ртутных диффузионных насосов, и часто, осо-
бенно в случае малых стеклянных насосов, возможно даже при-
менение масла вместо ртути.
Однако следует иметь в виду, что теплопроводность масла
меньше и его температура конденсации выше, чем у ртути; по-
этому для обеспечения эффективной работы насоса при такой
замене рабочего тела необходимы некоторые изменения кон-
струкции и применяемых материалов. При выборе материала
следует учитывать его химическую активность по отношению к
маслу (что может содействовать его окислению или разложе-
нию), а также коэффициент теплопроводности материала, ока-
зывающий влияние на распределение температур паропровода.
Подбор мощности подогревателя для масляных насосов имеет
большее значение, чем для ртутных. Слишком низкая темпера-
тура паров является причиной пониженной эффективности дей-
ствия струи, а чрезмерно высокая может вызвать быстрое раз-
ложение масла и усиление встречного потока его паров.
На фиг. 4.64 представлена зависимость предельного давле-
ния роо от мощности подогревателя масляного диффузионного
насоса. Оптимум Ргр здесь довольно явный и составляет
~250 Вт. При этой мощности получается предельное давление
Роо~6 -10-6 Тор.
При конструировании резервуара для масла и подогревателя
следует принимать во внимание возможность химического раз-
ложения масла в насосе. Считается, что количество разложив-
шегося масла находится в прямой зависимости от его темпера-
туры и от общего количества масла в резервуаре. Поэтому
следует точно выполнять указания предприятия-изготовителя
насоса в отношении температуры масла, а также заливать в на-
сос столько масла, сколько необходимо для работы. С учетом
этого последнего обстоятельства резервуару придают такую
форму, которая обеспечивает как можно большую поверхность
испарения масла. Количество масла должно быть таким, чтобы
его слой в резервуаре с плоским дном в небольших насосах со-
ставлял ~3—5 мм. Поскольку скрытая теплота испарения мас-
ла относительно невелика, паропровод должен иметь достаточно
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
251
высокую температуру; для этого паропровод обычно изготов-
ляют из материала с высокой теплопроводностью, чтобы он на-
гревался, проводя тепло из резервуара, но не от конденсирую-
щихся на его стенках паров масла.
Ширина щелей (между соплом и стенкой насоса) ввиду воз-
можности загустевания масла и скопления его на краях сопла
не должна быть меньше чем 3 мм; это имеет значение главным
образом в соплах форвакуумных ступеней.
Фиг. 4.64. Зависимость предельного
давления рю от мощности подогре-
вателя Ргр.
Фиг. 4.65. Масляный диффузионный
насос со змеевиком для быстрого ох-
лаждения резервуара масла (снизу).
Масло может поглощать газы и пары, и поглощение это тем
значительнее, чем ниже температура масла. Поэтому возвра-
щаемое в резервуар масло должно иметь достаточно высокую
температуру1). С другой стороны, следует иметь в виду, что
масло сильно окисляется при повышенных температурах в при-
сутствии кислорода воздуха. Поэтому рекомендуется поддержи-
вать такую температуру, чтобы при горячем масле давление
в насосе не поднималось выше 0,1 Тор.
Кроме того, обычно принимают предохранительные меры на
случай внезапного попадания воздуха в насос во время его ра-
боты. Эффективным способом сохранения масла в этом случае
является охлаждение резервуара с маслом, что выполнить тем
легче, чем меньше тепловая емкость резервуара.
В некоторых конструкциях насосов предусмотрена специаль-
ная система охлаждения резервуара, в которую быстро вво-
дится холодная вода или воздух в том случае, когда возникает
’) Так делают обычно в рассмотренных выше диффузионных насосах
с частичным фракционированием масла.
252
ГЛАВА 4
необходимость охлаждения масла. Такое решение применено, на-
пример, в насосе, показанном на фиг. 4.65 (нижний змеевик).
Другое решение состоит в использовании съемного подогрева-
теля, который охлаждается отдельно водой или струей воздуха.
. Ввиду малой тепловой инерции резервуара и подогревателя
некоторую пользу приносит (в случае небольших стеклянных на-
сосов) размещение спирали подогревателя непосредственно в
масле (см. фиг. 4.60).
Охлаждение насосов бывает чаще всего водяное, однако
в небольших насосах иногда применяется воздушное охлаж-
дение.
При проектировании металлических насосов следует обра-
щать внимание на то, чтобы тепловое сопротивление части кор-
пуса насоса между резервуаром и конденсатором было по воз-
можности большим; для этого стенку корпуса обычно делают
тонкой и длинной из сплавов с малой теплопроводностью.
Вода, поступающая в охлаждающую рубашку конденсатора,
должна иметь по возможности низкую температуру (например,
288—293 К), а нагрев ее в рубашке не должен превышать не-
скольких градусов.
На фиг. 4.66 схематично представлена конструкция металли-
ческого масляного диффузионного одноступенчатого насоса;
видно, что она аналогична конструкции ртутного насоса. Ко-
зырьки 3, размещенные на паропроводе, позволяют удалить сте-
кающее масло с поверхности паропровода, а также затрудняют
возникновение потока пара, обтекающего паропровод. Охлаж-
даемое кольцо 4 над соплом действует как отражатель, который
предотвращает непосредственный проход рассеянных молекул
масла в направлении высокого вакуума. Для удержания движу-
щихся прямолинейно молекул масла выходная труба насоса, ве-
дущая в форвакуум, загнута кверху, вследствие чего пары масла
более эффективно конденсируются на стенках трубы и в мень-
шей степени проникают в форвакуум. Часто на входе в насос
устанавливают лабиринты и применяют водяное охлаждение.
На фиг. 4.67 представлен общий вид современного масляного
диффузионного пятиступенчатого (четыре диффузионные сту-
пени и одна эжекторная) насоса с фракционированием масла.
Колпак над последним соплом охлаждается. Характеристики
этого насоса указаны в последней строке табл. 4.8.
Отражатель паров. В масляном диффузионном насосе
(даже при наилучшей конструкции последней ступени) суще-
ствует поток паров рабочего вещества от поглощающей поверх-
ности в направлении входа в насос. Это так называемый обрат-
ный поток паров масла. Вызван он рассеиванием потока паров
в диафрагме (особенно у краев тарели сопла), а также движе-
нием молекул рабочей жидкости, оторвавшихся от разных по-
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА.
253
верхностей (паропровода, конденсатора и т. д.). Этот поток осо-
бенно нежелателен в масляных насосах, так как пары масла
покрывают поверхности входного патрубка насоса и мигрируют
в направлении откачиваемого объема.
Количественно обратный поток паров определяется массой
паров, выделяющихся с единицы площади входа в насос за
Вход
Фиг. 4.66. Масляный диффузионный
насос с тарельчатым соплом и отра-
жателем. (Лаборатория радиотехни-
ки Варшавского политехнического ин-
ститута, 1955 г.)
/—подогреватель; 2 — масло; <9 —козырьки;
4—кольцо отражателя.
Фиг. 4.67. Масляный пятиступенча-
тый диффузионный насос с фракцио-
нированием масла (фирма Edwards).
Четыре диффузионные ступени и одна эжек-
торная ступень с охлаждаемым колпаком
над соплом.
1 мин в направлении высокого вакуума. Для хорошего насоса
этот поток не превышает (1 4- 10) -10~6 г • см~2 • мин-1 (в зависи-
мости от рода масла).
Для уменьшения обратного потока применяют так назы-
ваемые отражатели паров. В принципе это лабиринтные уплот-
нения такой конструкции, которая, с одной стороны, является
препятствием для паров перед диафрагмой, но, с другой стороны,
не должна представлять чрезмерного сопротивления для потока
откачиваемых газов.
Температура отражателя должна быть близкой к тем-
пературе конденсатора, что можно обеспечить при хорошей
254
ГЛАВА 4
теплопроводности между лабиринтом и корпусом насоса. Одна-
ко часто для дополнительного охлаждения отражателя исполь-
зуется вода или фреон из специального охлаждающего устрой-
ства. Температура отражателя определяет давление роо.п на
входе в насос.
Фиг 4.68. Отражатели масляных паров, охлаждаемые путем отвода тепла
к кожуху насоса.
На фиг. 4.68 и 4.69 показано несколько конструкций отра-
жателей; они хорошо охлаждаются благодаря высокой тепло-
проводности их соединения с конденсатором насоса (фиг. 4.68)
или при помощи специальных змеевиков, через которые проте-
кает охладитель (фиг. 4.69).
Змеевик'
Охлаждающее
вещество
Фиг. 4.69. Отражатели масляных паров, охлаждаемые с помощью змеевика.
Находят применение также термоэлектрические отражатели,
которые охлаждаются посредством устройств, основанных на
явлении Пельтье. Для этой цели особенно эффективны полупро-
водники, например теллуриды или селениды висмута1). При
охлаждении корпуса полупроводникового отражателя водой из
водопровода (288 К) температура отражателя может пони-
зиться до 248—250 К. Охлаждающий элемент питается постоян-
ным током порядка нескольких десятков ампер от выпрямителя,
*) Теллурид висмута, теллуровисмут, селенид висмута, селеновисмут-гу-
анахуатит. — Прим, перев.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
255
потребляющего из сети мощность от десяти до нескольких де-
сятков ватт. При охлаждении корпуса отражателя воздухом
температура лабиринта понижается до 255—260 К.
Уменьшение обратного потока паров масла достигается
иногда путем применения охлаждаемого колпака над диафраг-
мой последней ступени (фиг. 4.70). Снижение температуры кол-
пака обеспечивается обычно при помощи хорошо проводящего
соединения с отражателем или конденсатором (см. также
фиг. 4.67).
Фиг. 4.70. Насос с охлаждаемым колпа-
ком, помещенным над диафрагмой сопла
и служащим для уменьшения обратного
потока паров масла (фирма Edwards),
/—колпак, 2—охлаждающие ребра, 3—кольцо,
прилегающее к охлаждаемому корпусу насоса,
4—водяная рубашка насоса.
В последнее время для удаления паров масла все чаще нахо-
дят применение цеолитовые поглотители, помещаемые на по-
верхностях лабиринта во входном патрубке насоса. Об устрой-
ствах этого рода будет сказано при рассмотрении цеолитовых
насосов.
Для удаления рассеянных паров масла применяются также
устройства, работающие по принципу разложения паров на не-
конденсирующиеся газы (которые откачиваются насосом) или на
твердые вещества (уголь, полимеры и т. д.). Разложение дости-
гается путем сжигания паров или с помощью электрического
разряда. Принцип удаления паров электрическим разрядом рас-
смотрен при описании масляных ротационных насосов.
Наличие отражателя на входе в насос увеличивает сопро-
тивление потоку откачиваемого газа и, таким образом, умень-
шает скорость откачки. Это видно из хода характеристик насо-
сов, работающих с отражателем и без него. Подтверждают это
также графики фиг. 4.71, показывающие зависимость скорости
откачки S от диаметра D входа при наличии отражателя и без
него.
На фиг. 4.72 представлены зависимости проводимости отра-
жателей Gotp и отношения скоростей откачки Sc отр/Збез отр от
диаметра D отражателя.
256
ГЛАВА 4
Эксплуатационные характеристики. Масляные
диффузионные насосы эффективнее ртутных при давлениях
ниже 10-4 Тор, тогда как ртутные насосы более эффективны при
давлениях порядка 10~3 Тор. Это объясняется возможностью
поднять температуру в ртутном испарителе, а следовательно, и
давление паров ртути до более высокого уровня, чем в ма-
сляном, так как масло при высоких температурах разла-
гается.
Другой особенностью масляных диффузионных насосов по
сравнению с ртутными является меньшая мощность их подогре-
вателей.
Как уже упоминалось, диффузионные насосы обычно имеют
несколько ступеней, причем первая ступень бывает эжекторной,
что позволяет иметь давление форвакуума порядка 1—2 Тор,
тогда как для насосов, в которых первая ступень диффузионная,
давление должно быть порядка сотых долей тора.
Здесь следует напомнить о роли паров рабочего тела в пре-
дельном вакууме. Их давление влияет не только на рх, но и
на ход характеристики откачки в том случае, когда давление
на входе в насос измеряется манометром общего давления
(фиг. 4.73).
Таким образом, предельное давление диффузионного насоса
зависит от различных факторов: рода масла, материалов про-
кладок, отражателя, ловушек, степени прогрева насоса и т. п.
В случае хорошо спроектированной откачивающей системы с ло-
вушками, охлаждаемыми азотом, можно получить предельное
давление порядка 10~10—10-12 Тор и даже ниже, особенно при
откачке стеклянных сосудов с помощью стеклянных (или квар-
цевых) насосов. Наибольшее влияние на предельное давление
оказывают встречная диффузия газов из форвакуума и степень
дегазирования масла.
Здесь следует обратить внимание на возможность значи-
тельных расхождений между давлением паров масла ра при оп-
ределенной температуре конденсатора (или отражателя), и пре-
дельным давлением /?оо, измеряемым ионизационным вакуумным
манометром на входе в насос. Величина р^ может быть даже на
2 порядка выше давления паров при соответствующей темпера-
туре. Одна из причин этого состоит в том, что чувствительность
вакуумметра к парам углеводородов много выше (примерно в
10 раз), чем к воздуху или азоту, по которым обычно произво-
дится градуировка приборов. Кроме того, может происходить
разложение паров масла в вакуумметре под влиянием горячего
катода. Десорбция газов в системе вакуумметра также приводит
к повышению давления. На фиг. 4.74 представлены зависимости
предельного давления и давления паров от температуры для
Фиг. 4.72. Зависимость проводимо-
сти Сотр отражателя и отношения
Sc отр/^'без отр от диаметра D отра-
жателя.
®отр: sc отр/^без отр"
Фиг, 4.71. Зависимость скорости от-
качки S насоса от диаметра входа D.
-----без отражателя;-----с отражателем.
Фиг. 4.73. Зависимость относительной скорости откачки диффузионюго
масляного насоса с водяным охлаждением от общего давления р на входе
при работе с различными маслами.
Фиг. 4.74. Зависимость предельного
давления рх и давления паров рп
в масляном диффузионном насосе от
температуры конденсатора (отража-
теля) для масла силикон 703.
260 300 320 360 360 К
258
ГЛАВА 4
Характеристики ртутных
Номер насоса Скорость откачки 0 воздуха без охлаждаемой ловушки (при 10~3 Тор), л-с-1 Число ступеней Материал Макси- мальное давление на входе, Тор Предель- ное дав ление с выморажи- ванием, Тор Характе рисгики
Pi. Тор л-с"1
1 5 33) Кварц 10~3 10~7 15 0,2
2 8 33) Стекло ю-2 10-7 20 0,2
3 20 3 Металл 10-2 10~6 15 0,2
4 8 2 » 5- 10-2 10-в 2 0,2
5 70 3 » 10-2 10-в 1,4 0,7
6 650 3 » 10~3 ю-7 0,7 3,5
7 2 7С0 3 » 5. 10-3 10~7 0,5 8,5
8 10 000-12 000 4 » 5 • Ю-3 ю-7 0,35 25
') Охлаждаемая ловушка уменьшает скорость откачки в 2 раза или более.
2) Время нагревания.
з) С эжекторной ступенью.
температуры для масла силикон 703, которые иллюстрируют
указанное расхождение.
Фиг, 4 75 Характеристики скорости откачки воздуха диффузионными иа-
сосами.
а—ртутные насосы с вымораживанием паров ртути только на входе в вакуумный мано-
метр (нумерация насосов соответствует табл 4.7), б—масляные насосы без отражателя
(нумерация иасосов соответствует табл 4.8).
В табл. 4.7 сопоставлены для примера наиболее важные па-
раметры некоторых различных по конструкции ртутных диффу-
зионных насосов, от самых малых до самых больших, а на
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
259
диффузионных насосов
Таблица 47
Подогреватель Количество рабочего тела (ртути), см4 Расход охладителя (воды), л-ч-1 Диаметр входа в иасос, мм Высота насоса, мм Вес насоса» кг
? гр. кВт Т 2), мин
0,4 10 60 50 30 450 0,8
0,4 10 60 50 30 570 0,8
0,55 10 65 60 25 510 1,5
0,25 10 15 60 20 280 1,5
0,4 15 50 60 60 320
0,85 20 200 75 135 360
1,5 40 500 130 250 700
4,5 60 2000 400 570 1400 150
фиг. 4.75, а приведены их характеристики скорости откачки (дав-
ление на входе измеряется иони-
зационным вакуумметром, отде-
ленным от входа в насос ло-
вушкой) .
В табл. 4.8 указаны парамет-
ры ряда масляных диффузион-
ных насосов; характеристики ско-
рости откачки для некоторых из
них представлены на фиг. 4.75, б.
И здесь в вакуумметр не до-
Фиг. 4.76. Зависимость мощности подо-
гревателя Ргр> количества масла 7М,
расхода охлаждающей воды QB, веса
насоса 1ГН и времени нагрева т от диа-
метра D масляного насоса (данные
ориентировочные).
пускались пары масла. Скорости откачки относятся к насо-
сам без отражателей (или же без криоловушек). Как уже
9*
260
ГЛАВА 4
Характеристики масляных
Номер насоса Скорость откач- ки воздуха (при 10~3 Тор) без отражателей па- ров масла, л-с"1 Число ступеней (э — эжекторная, ф — с фракцио- нированием) Материал Максимальное давление на входе, Тор Предельное давление, Тор Форвакуумный насос Подогрева- тель
Pi, Тор Si. л-с 1 £ о. См Оч И S S
1 10 2ф Mei алл ю-2 5 • 10~6 0,5 0,5 0,18
2 20 2ф Стекло 10_3 5 10-8 0,25 0,5 0,25 10
3 40 2+1э Металл 1 <10“4 2-5 7,5 1,9 25
4 100 » 5 • 10—10 0,6 0,35
5 700 34-1э » 10~6 2-10“8 0,4 7 1,1
6 1 400 Зф » ю_3 5 - Ю“7 0,12 — 2,4 30
7 11 000 4+1ф 10~4 10-° 0,4 60 8,4
8 22 000 2-Нэ » 1 <10~4 1-2 100 90 60
9 40 000 4+1ф » 10“4 ю-7 0,35 55 15
Ч Время нагревания.
Ч Вода при температуре < 288 К.
3) С дополнительным подогревателем для ускорения запуска н устройством для охлаж
упоминалось, ловушки и отражатели уменьшают скорость от-
качки в 2 раза и более.
На фиг. 4.76 приведены осредненные зависимости для основ-
ных параметров масляных диффузионных насосов, полученные
в результате изучения многочисленных фактических данных.
Диаметр D, согласно графикам фиг. 4 71, является одним из
важнейших параметров, определяющих скорость откачки
насоса.
Из насосов с очень большой скоростью откачки можно на-
звать четырехступенчатый насос типа DPL 1250 (фирма Leybold),
имеющий следующие значения параметров- скорость откачки
(при давлении р = 10-4 Тор) 5ВОзд = 70 000 л-с-1, —
ви 140 000 л-с-1, диаметр входа D = 1250 мм, высота насоса
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
261
Таблица 48
диффУЗИ0ННЫХ насосов
Масло (количество, л) Охладитель (расход, Л’ч”1) Диаметр входа в насос, мм Высота насоса, мм Вес насоса, кг Примечание Изготовитель И s
Силикон 704 (0,01) Октойл S Воздух Воздух или вода 2) 20 20 250 300 1 Edwards E01 EF5A
Октойл S (1,5) Октойл S (0,3) Вода 2) (150) Вода2) (30) 60 50 820 Бустер Edwards 9B1 PULO2
Силикон 704 (0,18) Вода2) (60) 150 435 14 SOGEV DMC15
Минераль- ное масло (0,5) Вода2) (50) 205 455 243) Leybold DIFF 1500
Силикон или апие- зон С (3) Силикон или апие- зон С (320) Вода 2) (360) Вода 2) (550) 600 1350 4200 150 Бустер Alcatel Edwards 6600 100B4
Апиезон С (5) Вода2) (1200) 800 1850 » F3605
дения.
~4м, встречный диффузионный поток масла ~0,6• 10~6г-см~2Х
X мин-1, диапазон рабочих давлений 10“4—5-Ю*9 Тор, масло —
силикон 704, давление форвакуума pi = 0,2 4- 0,3 Тор.
4.3. СОВМЕСТНАЯ РАБОТА ДИФФУЗИОННЫХ
И РОТАЦИОННЫХ НАСОСОВ
Возможность совместной работы, а также диапазон соответ-
ствия диффузионных и ротационных насосов определяются их
скоростью откачки и производительностью в зависимости от дав-
ления. Из кривых на фиг. 4 77 видно, какую роль играют про-
межуточные насосы: они заполняют разрыв между диффузион-
ными и ротационными насосами.
262
ГЛАВА 4
Диапазон производительности масляных ротационных насо-
сов, как это следует из данных табл. 4.1, вообще значителен.
Он зависит в основном от типа и конструкции насоса. В насо-
сах старых типов при давлениях порядка 0,1 Тор производи-
тельность очень мала. В хороших современных насосах бла-
годаря использованию больших проходных сечений, а также
Фиг. 4.77. Зависимость производительности I от давления р для различных
насосов.
2 —диффузионный насос; 2— промежуточный насос; 3—насос Рутса; 4—ротационный
масляный насос.
уменьшению вредных пространств производительность насосов
при давлении 10~3 Тор еще удерживается на уровне ~25°/о
производительности при 760 Тор.
4.3.1. Выбор форвакуумного насоса
для диффузионного насоса
Параметры форвакуумного насоса, соответствующего дан-
ному диффузионному насосу, определяются исходя из уравнения
неразрывности течения газа
= Рр5р = Рдифф^ДИфф, (4.61)
где рр— давление на входе ротационного насоса (т. е. на вы-
ходе диффузионного насоса, или же давление форвакуума р0);
Рдифф — давление на входе в диффузионный насос (или же ра-
бочее давление р). Для надежности в работе должно иметь ме-
сто неравенство
Ро^р sJs рЗдифф- (4.62)
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
263
Так как и Sp, и £ДИфф являются функциями давления, то усло-
вие (4.62) должно выполняться даже в наиболее неблагоприят-
ном случае, а именно:
Ро,
мии^р, мии Рмакс^дифф, макс»
(4.63)
где Рмакс — максимальное рабочее давление диффузионного на-
соса, ро, мин —минимальное давление форвакуума, $ДИфф, макс —
максимальная скорость откачки диффузионного насоса,
Sp, мин—скорость откачки ротационного насоса при р0, мин-
В условии (4.63) учтен некоторый запас, связанный с тем,
что Рмакс и 5ДИфф, макс не имеют места одновременно.
Таким образом, скорость откачки форвакуумного насоса
должна определяться из условия
' Рмакс q
Р. мип^ °дифф. макс*
(4.64)
4.3.2. Совместная работа насосов
Для примера рассмотрим работу откачивающей системы, со-
стоящей из диффузионного и ротационного насосов. Характери-
Фиг. 4.78. Скорость откачки S и производительность системы диффузион-
ного и ротационного насосов.
характеристикам кривые производительности I = Sp = f{p)
для обоих насосов представлены на фиг. 4.78.
Эти данные относятся к известным мощности подогревателя
Ргр и давлению форвакуума р0<С Ро, макс диффузионного насоса.
264
ГЛАВА 4
а также скорости вращения N' и давлению на выходе ра —
—760 Тор для ротационного насоса.
На основании графиков S = f(p) можно проанализировать
какое-либо определенное состояние откачивающей системы, ра-
ботающей на вакуумную систему с определенным притоком
газа.
Предполагается, что давление на входе в диффузионный на-
сос имеет постоянное значение р' = 10-4 Тор. Этому давлению
соответствует скорость откачки диффузионного насоса 5ДИфф =
= 200 л-с-1 и производительность/ДИфф=200-10'4=2-10-2 ТорХ
X л-с-1 (точка А на фиг. 4.78).
Не меньшую производительность должен развивать рота-
ционный насос. Из кривой Ip = f(p) для /р = 2-10-2 Тор-л-с-1
находим давление ро = 7-1О'2 Тор (точка В"). Оно меньше,
чем ро, макс = Ю-1 Тор, которого требует диффузионный насос1).
Можно также оценить, что произойдет, если вследствие уве-
личения притока газа давление на входе в диффузионный насос
возрастет до р" = 10-3 Тор. Скорость откачки ротационного
насоса при этом уменьшится до Sp = 40 л • с-1, а производитель-
ность диффузионного насоса увеличится до /ДИфф = 4-10~2 ТорХ
Хл-с-1 (точкаЛ7). Этой производительности соответствует дав-
ление форвакуума ро = 10-1 Тор (точка В'), т. е. уровень дав-
ления ро, макс окажется предельным, и в случае небольшого
уменьшения скорости откачки ротационного насоса может про-
изойти запирание диффузионного насоса.
В качестве примера неправильно подобранного форвакуум-
ного насоса может служить ротационный насос, характеристики
которого представлены на фиг. 4.78 штриховыми линиями. При
давлении р = 10~4 Тор этот насос не подходит для диффузион-
ного насоса (точка С") и тем более не обеспечит его работу
при давлении р= 10-3 Тор (точка С7). Возможно, удастся не-
сколько повысить эффективность откачивающей системы путем
увеличения мощности испарителя диффузионного насоса, что
позволит работать при несколько повышенном давлении форва-
куума ро, макс-
4.3.3. Продолжительность откачки
В формуле (4.64) не принято во внимание время откачки
данного объема от атмосферного давления р& до давления р0,
т. е. до момента включения диффузионного насоса. На этом
') Вследствие того что давление на выходе из диффузионного насоса
окажется ниже, чем р0, макс, произойдет некоторое увеличение скорости от-
качки диффузионного насоса; это повлечет за собой увеличение его произво-
дительности (смещение точки А вверх) до уровня, соответствующего снизив-
шемуся давлению р0 и новой производительности ротационного насоса.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
235
этапе откачка происходит согласно уравнению
п Г Sp 1
р|^ = РоехР[--1Г'Г]. (4.65)
где Sp = f(p), а V — объем всей вакуумируемой системы. Для
того чтобы сократить время откачки от ра до р0, скорость Sp
целесообразно выбрать несколько большей, чем это следует
из формулы (4.64).
Когда давление понизится до уровня р0, дальнейшая откачка
будет происходить в соответствии с уравнением
Plp0 = Poo + Poexp[—(4.66)
причем Здифф также является функцией давления.
Обозначая интервал времени, соответствующий работе в пре-
делах давлений ра 4- ро, через т', а интервал времени, соответ-
ствующий работе в пределах давлений ро 4- р<х>, через т", по-
лучим полное время откачки от давления рй до р»:
т = х' + х". (4.67)
Для того чтобы это время было по возможности коротким, под-
бирают соответствующие участки характеристик откачки.
На фиг. 4.79,6 представлены кривые откачки резервуара ем-
костью V = 50 л с помощью откачивающих систем, показанных
схематически на фиг. 4.79, а.
В указанных откачивающих системах ртутный диффузионный
насос 1 обеспечивает скорость откачки 5^20 л-с-1 при мак-
симальном давлении форвакуума Ро~ 15 4-20 Тор; ротацион-
ные насосы 2 и 3 обеспечивают скорость откачки 1,3 и 7,5 л-с"1
соответственно.
При использовании одного ротационного насоса 2 для сни-
жения давления в резервуаре от 760 до 10~2 Тор требуется
время откачки ti = 40 мин (кривая /); в случае совместной ра-
боты диффузионного насоса 1 с ротационным насосом 2 это
время уменьшается до т2 = 19 мин (кривая II). Если откачка
до давления р0 осуществляется с помощью насоса 2, а затем
с помощью насоса I, то время откачки сокращается до
Тз16 мин (кривая III). Наконец, применение большого рота-
ционного насоса 3, который откачивает резервуар до давле-
ния ро, а затем системы насосов 1 и 2 (кривая IV) сокращает
время откачки до Т4 = 10 мин.
Другой пример сравнения времен откачки для систем рота-
ционного и диффузионных насосов представлен на фиг. 4.80.
В случае применения (совместно с ротационным) ртутного
266
ГЛАВА 4
диффузионного насоса момент его включения в работу наступает
раньше, так как он может работать при довольно высоком дав-
лении форвакуума (ро — 10 Тор); однако скорость откачки ртут-
ного насоса при давлениях ниже 10-3 Тор сильно уменьшается,
а
Фиг. 4.79. Откачивающие си-
стемы (а) и характеристики их
скорости откачки (б) (данные
CGR, Франция).
1— ртутные диффузионные насосы;
2—ротационные насосы.
что приводит к увеличению времени откачки (например, для
получения давления 10~6 Тор —до 10 мин).
При использовании системы, состоящей из ротационного и
масляного диффузионного насосов, время откачки до давления
р=10-2 Тор, необходимого для включения масляного насоса,
составляет -~-5,4 мин, но после включения в работу этого на-
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
267
coca давление быстро снижается, так что требуемый вакуум
получается за ~7,3 мин.
Таким образом, для откачки до давлений 10“2—10~4 Тор
целесообразно использовать (совместно с ротационным) ртут-
Фиг. 4.80. Характеристики откачки систем, состоящих из ротационного и
диффузионного (ртутного или масляного) насосов.
1— ротационный насос, 2 — масляный диффузионный насос; 3—ртутный диффузионный насос.
ный диффузионный насос, а в случае более низких давлений
(<10'5 Тор) больше подойдет масляный диффузионный насос.
4.4. НАСОСЫ С ЭЛЕКТРОСТАТИЧЕСКИМ ПОЛЕМ
В насосе с электростатическим полем для сообщения моле-
кулам газа импульса скорости в направлении откачки исполь-
зуются силы воздействия постоянного электрического поля на
заряженные частицы газа (ионы).
Для этого газ подвергается ионизации; ионы под воздейст-
вием электрического поля, образованного электродами Е\ и Е2
(фиг. 4.81), движутся от входа к выходу из насоса.
Для эффективной откачки поток ионов в направлении от-
качки 1+ должен быть достаточно большим по сравнению с по-
током газа вызванным встречной диффузией, возникающей
под влиянием разности давлений pi — р:
I~=G(pi-p), (4.68а)
где G — проводимость насоса, pi — давление на выходе из на-
соса, р — давление на входе в насос.
268
ГЛАВА 4
Если принять I- Ч1о1+, то получим условие
/+>10G(a -р). (4.686)
Выполнение такого условия требует очень эффективной иони-
зации и малой проводимости G, т. е. насос должен иметь боль-
шую длину и малое проходное сечение. Такие характеристики
трудно обеспечить, так как для этого необходимы мощный иони-
затор и предотвращение рекомбинации ионов на стенках на-
соса между электродами Е] и Е2.
Один из способов повышения ионизации в объеме и уменьше-
ния рекомбинации на стенках состоит в создании магнитного
поля, направленного вдоль оси насоса. Такое магнитное поле
управляет движением электронов и не допускает их к стенке. Но
Зона
ионизации в
Фиг. 4.81. Схема насоса с электростатическим полем.
для этого необходима сложная система магнитных линз, созда-
ваемая мощными электромагнитами. Результаты исследовате-
лей, использовавших насосы такого типа !) (Шампе, Шварц), не
являются обнадеживающими, поскольку трудно отделить эффек-
ты сорбционной откачки (возникающей в присутствии горячего
катода, распыленного металла, а также электрического и маг-
нитного полей) от чисто электростатической откачки ионов газа.
Для примера рассмотрим магнитный электроразрядный на-
сос, показанный на фиг. 4.82 (Фостер, Лоуренс, Лофгрен), хотя
этот насос не нашел почти никакого применения на практике.
В средней части насоса в пространстве около входа имеет ме-
сто давление порядка 10~6 Тор, а на концах, со стороны форва-
куума,— порядка 10-3 Тор. Основной механизм откачки здесь
создается сильным тлеющим разрядом, сосредоточенным с по-
мощью магнитного поля вдоль оси насоса. Разряд растягивается
между горячим катодом К.' и холодным катодом К"’, на этом
участке электроны движутся по спиралям, расходуя свою энер-
гию на ионизацию и возбуждение молекул, после чего они по-
’) При пониженных давлениях поток, откачиваемый полем ионов такого
насоса, становится сравнимым с потоком обратной диффузии нейтралов.—
Прим ред.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
269
глощаются стенками насоса, имеющими положительный потен-
циал в несколько сот вольт по отношению к катодам. Образо-
вавшиеся ионы движутся к катодам, а после нейтрализации
в большинстве своем отводятся насосом форвакуума. Нейтраль-
ные частицы, которые могли бы двигаться в обратном направ-
лении (к высокому вакууму), снова подвергаются ионизации и
возвращаются к катоду. Часть нейтрализованных вблизи като-
дов молекул адсорбируется окружающими стенками, а другая
часть вступает в химическую реакцию с материалом катода.
Описанный насос позволяет получить скорость откачки
3000—7000 л-с-1 при давлении форвакуума ~ 10~3 Тор; пре-
дельное давление этого насоса составляет ~10~6 Тор.
Фиг. 4.82. Магнитный электроразрядный насос (по Фостеру, Лоуренсу, Лоф-
грену).
Д'—горячий катод; К"—холодный катод,
/—периферийный электромагнит; 2— центральный соленоид; 3—центрирующая горловина
анода; 4—газовый разряд цилиндрической формы.
Рабочее напряжение равно 300—400 В при токе 20—10 А.
Мощность накала составляет ~4,5 кВт, периферийные электро-
магниты потребляют ~20 кВт, а центральный соленоид —
~ 12 кВт. Срок службы вольфрамового катода составляет
— 1000 ч.
Таким образом, полная мощность, потребляемая насосом при
— 7000 л-с-1, довольно велика.
4.5. АДСОРБЦИОННО-ПРОТОЧНЫЕ
И АККОМОДАЦИОННО-ЭФФУЗИОННЫЕ НАСОСЫ
4.5.1. Адсорбционно-проточные насосы
Откачка может осуществляться путем адсорбции газа и пе-
реноса его движущимися поверхностями (фиг. 4.83). Газ, по-
ступающий в насос под давлением pi, попадает в камеру 1 и
адсорбируется на поверхностях 4, 5 и 6 цилиндра 3. При вра-
щении цилиндра газ переносится в камеру 2, где он десорби-
270
ГЛАВА 4
руется (например, путем бомбардировки потоком электронов),
а затем отводится в форвакуум (с давлением рг), который су-
ществует на выходе из насоса. Камеры 1 и 2 разделены герме-
тизирующими перегородками 7 и 8.
Работа адсорбционно-проточного насоса может быть опи-
сана следующими уравнениями.
Количество молекул, адсорбированных на 1 см2 поверхности
в течение 1 с, выражается формулой
. П R . 1№2
Vi. адс = ~4=-у(! ~ ®)Р = ар, (4.69а)
у 1 /Ио
где у—коэффициент прилипания, 0 — степень покрытия, р—
давление над поверхностью, Мо — молярная масса, Т — темпе-
Вхоо
(в форвакуум)
Фиг. 4.83 Адсорбционно-проточный
насос.
1, 2 —камеры, 3—цилиндр, 4, 5, точки
поверхности цилиндра, 7—зазоры, S—пере-
городки.
ратура газа. Если адсорбирующая поверхность одновременно
бомбардируется электронным потоком с плотностью г, то коли*
чество десорбированных вследствие этого молекул равно
V1, дес — 08 е >
(4.696)
где е — эффективность электронной десорбции (количество мо-
лекул, освобожденных одним электроном с зарядом е=1,6Х
X Ю-19 Кл). Сравнивая формулы (4.69а) и (4.696), можно найти
степень заполнения поверхности в состоянии равновесия (для
данного тока i), а именно:
—т-г- (4-7°)
1-4- — —
• ае р
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
271
Эта поверхность при перемещении в камеру 1 откачивает
газ с начальной скоростью
So = 3,65 Y (1 - 0о) = 3,651/4--------------• (4-71)
u V Мо ' х Г Мо д । ае р 4 '
8 i
С течением времени по мере возрастания 0 (от значения 0 = 0о
до 0= 1) скорость откачки S уменьшается. Затем поверхность,
покрытая газом, перемещается из камеры 1 в камеру 2, где
происходит десорбция газа. Для стабильной работы насоса не-
обходимо соответствующим образом подобрать скорость вра-
щения цилиндра и плотность тока i так, чтобы при данном
давлении (р = р2) выполнялось условие [(ае/е) (p/i)]^ С, где
С — заданная постоянная величина, например 0,1.
Ориентировочно можно принять £~10"3 мол-А-1 при энер-
гии электронов в пределах между несколькими десятками и
несколькими сотнями вольт.
4.5.2. Аккомодационно-эффузионные насосы
Аккомодационно-эффузионный насос (Гобсон, 1970 г.) в об-
щем случае представляет собой трубу с перемежающимися
молекулярно-гладкими и молекулярно-шероховатыми участками
(например, пирекс гладкий и травленный для получения мато-
вой поверхности), причем температуры переходов между участ-
ками также попеременно разные (например, комнатная и жид-
кого азота). В этих условиях между концами трубы (в условиях
в общем высокого вакуума) создается перепад давлений.
Действие насоса основано на том, что молекулы, движу-
щиеся в направлении от холодных переходов к горячим и от
горячих к холодным, испытывают различные отражения на глад-
ких и шероховатых поверхностях.
Например, в насосе с 28 ступенями, последовательные уча-
стки которого работают при температурах комнатной и жид-
кого азота, для гелия получено более чем 20-кратное снижение
давления pjр2.
Адсорбционно-проточные и аккомодационно-эффузионные
насосы не имеют большого практического значения.
Б. СОРБЦИОННЫЕ НАСОСЫ
Действие сорбционных насосов основано на связывании га-
зов и паров на поверхностях и в материалах, специально под-
готовленных для этого. Для того чтобы откачивание было эф-
фективным, коэффициент прилипания газа у на сорбирующих
поверхностях должен быть по возможности близким к единице,
272
ГЛАВА 4
а время пребывания частиц газа тПр — по возможности продол-
жительным. Для этого используются материалы с большой
энергией физической или химической связи (к которым отно-
сятся некоторые металлы, например титан, и пористые мате-
риалы, например цеолиты), снижение температуры сорбирую-
щей поверхности (в результате чего увеличивается WaadTs),
физическое и химическое активирование газа, сообщение
молекулам газа больших скоростей (ионизация и сильные
электрические поля), покрывание адсорбированного газа слоем
металлических паров или напыление металла и т. д.
Откачиваемый сорбционным методом газ в принципе оста-
ется внутри насоса1) в связанном виде на сорбирующих поверх-
ностях или в подповерхностных слоях.
Скорость откачки сорбционных насосов вообще пропорцио-
нальна площади сорбирующей поверхности. Величина получае-
мого при сорбционной откачке предельного давления зависит
от степени десорбции с откачивающей поверхности.
Среди сорбционных насосов различаются:
1) криогенные насосы, в которых время пребывания молекул
адсорбированного газа очень велико благодаря низкой темпе-
ратуре поверхности;
2) цеолитовые насосы, в которых связывание газов происхо-
дит на сильно развитых поверхностях пористых материалов при
температуре окружающей среды или при пониженной темпера-
туре (низкотемпературные цеолитовые насосы);
3) сублимационные насосы, состоящие из чистых, сильно
сорбирующих поверхностей, которые получают путем конден-
сации паров или напыления специальных металлов, сорбирую-
щих или покрывающих адсорбированные газы. Эти поверхности,
кроме того, могут быть предварительно охлаждены (низкотем-
пературные сублимационные насосы), а газы — ионизированы
(ионно-сублимационные насосы);
4) ионные насосы, в которых откачиваемые газы подвер-
гаются предварительной ионизации и ускорению с целью их ак-
тивации для лучшего поглощения сорбирующими поверхно-
стями.
4.6. КРИОГЕННЫЕ НАСОСЫ
4.6.1. Принцип действия
Действие криогенных насосов заключается в адсорбирова-
нии и конденсации газов и паров на поверхности, температура
которой значительно ниже температуры окружающей среды.
*) Исключением является адсорбционно-проточный насос, в котором
адсорбированный на поверхности газ вместе с поверхностью перемещается
за пределы откачиваемого объема.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
273
Молекулы, ударяющиеся о такую поверхность, связываются ею,
причем количество связанных молекул, согласно формуле
(3.28), тем больше для данного газа и определенного сорби-
рующего материала, чем ниже температура поверхности, по-
скольку время пребывания молекулы на поверхности с пони-
жением температуры экспоненциально возрастает.
Криогенные насосы являются своего рода усовершенство-
ванным вариантом так называемых охлаждаемых ловушек
(криоловушек), издавна применяемых для улучшения вакуума
путем вымораживания паров, а также некоторых (легко конден-
сирующихся) газов.
В принципе к криогенным насосам относятся насосы, кото-
рые эффективно откачивают как пары (например, водяные или
ртутные), так и большинство газов, находящихся в вакууми-
руемой системе. Таким образом, криогенными являются насосы,
сорбционные поверхности которых имеют температуру ниже
30 К, т. е. температуру, соответствующую жидким гелию и во-
дороду.
Насосы с жидким азотом в качестве охладителя следует
рассматривать скорее как охлаждаемые ловушки, так как они
эффективно откачивают, кроме паров, лишь некоторые газы.
Сорбционные насосы с жидким азотом весьма эффективны
в тех случаях, когда вакуумная система содержит источники
паров (например, пластические, пористые и гигроскопичные
материалы). Например, давление водяного пара, откачка кото-
рого другими насосами очень затруднительна, снижается при
температуре жидкого азота (77 К) до величины, уже не изме-
ряемой.
Криогенные насосы используются прежде всего для создания
очень высокого вакуума. Их включают в работу обычно только
после того, как с помощью других насосов (диффузионных,
ионных) получено достаточно низкое давление '). Использование
криогенных насосов при невысоком вакууме приводит к быст-
рому образованию мономолекулярного слоя адсорбата на хо-
лодной поверхности, а поверхностный слой сжиженных или от-
вердевших паров и газов действует как тепловой изолятор,
вследствие чего эффективность действия насоса снижается.
Скорости откачки криогенных насосов, обычно имеющих
большие поглощающие поверхности, вообще бывают довольно
большими. Поэтому конфигурация этих поверхностей, как и
всей вакуумной системы, должна быть приспособлена к значи-
тельным скоростям откачки (в частности, должны быть обеспе-
чены малые расстояния от источника газов и большие проход-
ные сечения каналов).
') Возможность откачки криогенными насосами от атмосферного давле-
ния рассмотрена в приложении. — Прим, ред.
274
ГЛАВА 4
Криогенные насосы не являются изотермическими систе-
мами; в них существуют очень различающиеся температуры
и градиенты этих температур, что следует принимать во внима-
ние при рассмотрении течений и при измерениях давления.
4.6.2. Жидкая фаза газов
Характеристики ожиженных газов. Вещество может нахо-
диться в твердой, жидкой или газообразной фазе в зависимости
от температуры и давления, как это представлено на фазовой
диаграмме (фиг. 4.84).
Тройная точка рш соответствует состоянию равновесия трех
фаз вещества. Другой характерной точкой является критическая
точка рКр- В табл. 4.9 указаны значения давлений рпь Ркр и
О
Фиг. 4.84. Фазовая диаграмма вещества.
температур Гщ, Др, соответствующих тройной и критической
точкам, а также температурам кипения и плавления и молярной
скрытой теплоте испарения (при температуре кипения).
При невысоком давлении на криогенной поверхности с тем-
пературой Т, если эта температура ниже температуры тройной
точки Tin, газ может затвердевать; если же температура выше
Tni, то может произойти ожижение газа. Любой температуре
или давлению соответствует состояние равновесия на кривой
конденсация — сублимация или на кривой ожижение — испаре-
ние. Это означает, что при данной температуре невозможно по-
лучить давление ниже того, которое следует из кривых Opni
или ршрьр и которое, таким образом, представляет собой дав-
ление равновесия пар —твердое тело (рп-тв) или пар — жид-
кость (рп.-ф)-
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
275
Таблица 4.9
Теплофизические характеристики некоторых газов
(величины округленные, взяты из различных источников)
Л (О Тройная точка Критическая точка Точка кипения Температура плавления Тпл К Плотность ожиженного —3 газа, г-см
о. о Н Q. RIB S S X Сисп 2)’ ккал’Моль"”
4 Не —- 5,25 2,26 4,215 0,02 0,125
н2 14 54 33,3 128 20,4 0,215 14,2 0,07
Ne 24,6 324 44,5 26 27,1 0,42 24,2 1,21
n2 63,2 94 126,2 33,5 77,3 1,33 63,2 0,81
Ar 83,8 516 151,1 48,2 87,3 1,56 83,9 1,4
О2 54,4 1,1 154,8 50,1 90,2 1,63 54,2 1,15
Кг 116 548 209,3 54,2 120 2,26 116,2 2,41
Хе 16',3 612 289,8 58,5 165 3,02 161,2 3,06
со2 216,6 3885 304,2 72,9 194,8 3) 4 — 1,57 (тв.)
СО — — 32,9 36,4 81,8 1,44 66,2 —
СН4 — — 190,6 45,8 111,5 1,96 89,1 —
Воздух1) — — — — ~ 80 — — 60 0,92
) При р=1 атм.
!> ПРИ Гкип
3) Сублимация.
4) Температура жидкого воздуха зависит от его состава, который не соответствует
составу атмосферного воздуха вследствие различия температур кипения его составных
частей. В конденсированной фазе после испарения азота остается жидкий кислород и
температура кипения жидкости повышается с 80 до 93 К. Некоторым показателем состава
ожиженного воздуха может служить цвет жидкости. В свежем состоянии жидкий воздух
представляет собой светло-голубую прозрачную жидкость, которая по мере испарения
азота становится голубой. Ввиду возможности взрыва чистого кислорода, например при
попадании в него масла, вообще избегают применять жидкий воздух для целей криоот-
качки. Более удобен в этом отношении химически инертный жидкий азот.
Итак, при данной температуре газ не будет отвердевать
(или ожижаться), если его давление ниже давления рп.-тв (или
Рп.-ж), соответствующего этой температуре. Например, при тем-
пературе 4,2 К водород нельзя превратить в твердое тело, так
как для водорода рп.-тв=Ю'7 Тор; давление же, например,
пеона при такой температуре еще ниже (<10-12 Тор, фиг. 4.85).
Ожиженный газ как охладитель. Ожиженные газы, находя-
щиеся при атмосферном давлении, прогреваются до темпера-
туры кипения и интенсивно испаряются; такую же (или не-
сколько более высокую) температуру приобретает поверхность,
охлаждаемая ожиженным газом.
И
S
Е
Е
S
Ч
W
св
й
к
м
о
р.Тор р ра=760Тор 4 2 К_______20,W_________77,ЗК____1Э0,вК 373К
ь-
4
£
cS Со
з:
&
15 20 30 00 50 60 80100 150 200 300 000 К
(Q
ь
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
277
Поверхность, охлаждаемая ожиженным газом, называется
криогенной поверхностью, а ожиженный газ — криогенной жид-
костью.
На фиг. 4.85 приведены кривые, характеризующие связь
между температурой кипения ожиженного газа и равновесным
давлением его паров для различных жидкостей.
Явление испарения криогенной жидкости газа имеет, как
уже упоминалось, принципиальное значение для получения низ-
ких температур, а интенсивность испарения оказывает влияние
на уровень этой температуры: снижение давления над жидко-
стью способствует более интенсивному испарению и снижению
температуры, а повышение давления замедляет процесс испа-
рения и приводит к повышению температуры.
В табл. 4.10 указаны температуры кипения некоторых крио-
генных жидкостей при различных давлениях их паров.
Таблица 4.10
Зависимость температуры кипения криогенной жидкости
(в кельвинах) от давления паров (величины округленные,
взяты из различных источников)
Давление р, Тор Криогенная''^. ЖИДКОСТЬ 760 ТОО 600 400 200 100 50 10 5
< Не 4,22 4,13 3,97 3,6 3,1 2,6 2,35 1,75 1,6
н2 20,4 20,1 19,6 18,4 16,6 15,1 13,9 11,7 11
Ne 27,1 26,8 26,3 25,5 23,4 21,9 21 19 17,5
n2 77,3 76,7 75,5 72,3 67,5 63,5 60,2 52 50
о2 90 89,4 88 84,5 79 74,5 70,4 62,3 60
Давление откачиваемого газа р над криогенной поверхностью
с температурой Тк зависит от рода этого газа. Криогенный на-
сос должен сделать это давление по возможности низким.
Графики фиг. 4.85 позволяют оценить пригодность криоген-
ной поверхности с температурой Т для откачки различных га-
зов. Пригодность для откачки определяется ориентировочным
давлением, какое будет иметь тот или иной газ над криогенной
поверхностью (чистой, без изолирующего поверхностного слоя,
при условии, что температура не возрастает). Соответствующие
данные приведены в табл. 4.11.
Так как при переходе от газообразного состояния к жидкому
и от жидкого к твердому происходят большие изменения в дав-
лении газа (пара), то изменения температуры криогенной по-
верхности могут оказывать значительное влияние на предель-
ное давление насоса. Это видно из кривых фиг. 4.85.
278
ГЛАВА 4
Таблица 4.11
Предельное давление (Тор) некоторых газов,
откачиваемых криогенными насосами или охлаждаемыми ловушками
(величины ориентировочные)
Откачиваемый газ Температура кипения, К Криогенная жидкость насоса Т вер дый СО2 (195 К)
Не (4,2 К) н2 (20,4 К) Ne (27,2 К) n2 (77,3 К)
Не 4,2 760 >760 >760 >760 >760
н2 20,4 3,5 • 10-7 760 >760 >760 >760
Ne 27,2 -1) 45 760 >760 >760
n2 77,3 — 2 • 10—11 2- 10~6 760 >760
СО 81,6 — 4- 10~13 ю-7 500 >760
Аг 87,3 — 5- 10~13 10-7 200 >760
о2 90,2 — 1 • 10~13 5 • 10-9 80 >760
сн4 112 — — 5- 10~" 5 >760
Кг 121 — — — 2 >760
NH3 140 — — — 10 >760
Хе 165 — — — !0~3 >760
со2 195 — — —. 4- 10-8 760
Н2О 373 — — — — <ю_3
Hg 630 — — — — <10-8
') Прочерк соответствует давлению <10 14 Тор.
На фиг. 4.86 приведены зависимости давления паров водо-
рода и гелия от температуры вблизи точки кипения гелия. Эти
зависимости позволяют определить температуру жидкого ге-
лия, соответствующую тому или иному предельному давлению
паров водорода.
Отсюда следует, что, например, при изменении температуры
Тк от 3 до 4 К давление водорода будет меняться от 10-11 до
10~7 Тор. Такие изменения температуры Тк могут быть вызваны,
например, утолщением слоя затвердевшего водорода на криоген-
ной поверхности. Этот слой теплоизолирует поверхность металла
от нового слоя водорода. Поэтому температура криогенной по-
верхности обычно на 1—2 К выше температуры кипения крио-
генного охладителя. При проектировании и применении крио-
генных насосов указанное обстоятельство (ухудшение вакуума
при образовании поверхностного слоя конденсированных газов)
следует учитывать.
Необходимую температуру криогенного охладителя сохра-
няю: чаще всего с помощью автоматического электронного
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
279
устройства, которое регулирует скорость испарения криогенной
жидкости и поддерживает постоянным его количество в крио-
генной системе. Например, для поддержания температуры ЗК
Фнг. 4.86. Зависимость давления паров водорода, откачиваемого криогенной
поверхностью с температурой Тк, и давления паров гелия, необходимого
для получения требуемой температуры жидкого гелия.
давление паров жидкого гелия должно составлять ~200 Тор
(фиг. 4.86).
4.6.3. Скорость откачки криогенного насоса
Скорость откачки криогенного насоса пропорциональна пло-
щади криогенной поверхности А и зависит от разности между
количеством молекул, адсорбированных v', адс и десорбиро-
ванных Vi, единицей поверхности за единицу времени. Этц
280
ГЛАВА 4
количества определяются выражениями, аналогичными формуле
(3.17);
< адс = 3,5 1022 ' (4.72а)
у Mt) у 1
дес = 3,5 ДО22—J=-^==-, (4.726)
V V
где А! о — молекулярная масса; р — давление откачиваемого
газа; Т — температура газа; 7К — температура криогенной по-
верхности; рк — равновесное давление пара (газа), соответ-
ствующее температуре Гк; у — коэффициент прилипания (кон-
денсации) откачиваемого газа на криогенной поверхности.
Таким образом, скорость откачки насоса с криогенной по-
верхностью Лк выражается следующим образом:
Ял = (vl. „ - VI. д„) л = 3.64 Ут (1 - Ь А /£) Л.
(4.73)
Представляя предельное давление в виде
Роо = 7Рк1/ (4.74)
Y F К
можно написать
= 3,64 у|=- УЦ1 -^)ак. (4.75а)
Для Р > Роо получим
Sx = 3,64^]/f Ак. (4.756)
Коэффициент у всегда меньше единицы, однако его вели-
чина приближается к единице тем больше, чем ниже темпера-
туры Т и Т[( и чем ближе они к температуре конденсации от-
качиваемого газа.
Например, при Т = 77К и Тк=10К для газов N2, СО2, Аг
и О2 у = 1; при Тк = 20 К для газов N2, СО и Аг 0,8 у 0,9,
а для О2 у ~ 1. Для Н2 при 2,6 С Тк 3,8 К у находится в ин-
тервале 0,3—0,5, а при Т ->300 К у увеличивается до ~ 0,6—0,8.
Кривые фиг. 4.87 показывают примерную зависимость у от Тк
для N2 при нескольких температурах.
В табл. 4.12 приведены данные по коэффициенту у для раз-
личных газов и температур. Обычно считается, что температура
откачиваемого газа Т находится в диапазоне между Тк и 300 К
или между Тк и 77 К в зависимости от характеристик откачи-
вающей системы (криогенной поверхности и рода охладителя)
Фиг. 4.87. Зависимость коэффи-
циента прилипания азота при раз-
личных температурах от темпера-
туры криогенной поверхности Тк.
Фиг. 4.88. Зависимость удельной скорости откачки 8] от температуры крио-
генной поверхности Тк при у= 1.
а —откачка азота при температурах жидкого водорода; б—откачка водорода при темпе-
ратурах жидкого гелия.
Фиг. 4.89. Характеристики откачки
азота и аргона криогенным насо-
сом с поверхностью 2000 см2 при
температуре 15 К-
282
ГЛАВА 4
Таблица 4.12
Коэффициент прилипания у газов с температурой Т
к поверхности с температурой Гк (ориентировочные
значения, взятые из различных источников)
Газ Температура поверхности тк. к Температура газа Т, К
77 195 300 400
со2 10 1 0,75 0,52
77 0,8 0,62 0,5
n2 10 1 0,65 0,5
20 0,75 0,6 0,45
со 10 1 0,9 0,8
20 1 0,85 0,8
Аг 3,8 0,998 — 0,996
10 1 1 0,7 0,5
20 0,9 1 0,65 0,5
02 20 1 0,8 0,85
н2 3-4 0,98 0,96 0,92 0,85
На фиг. 4.88 представлена удельная скорость откачки (в
расчете на 1 см2 криогенной поверхности) азота при температу-
рах жидкого водорода (фиг. 4.88, а) и водорода при темпера-
турах жидкого гелия (фиг. 4.88,6) в зависимости от темпера-
туры Т’к для разных давлений р. Таким образом, эти кривые
графически выражают уравнение (4.75а), в котором принято
Т = 293 К, у = 1 и Дк — 1 см2, а рк соответствует заданной ве-
личине 7К.
На фиг. 4.89 приведены характеристики откачки азота и ар-
гона криогенным насосом с поверхностью 2000 см2, охлаждае-
мой до температуры 15 К жидким водородом. Скорость откачки
для азота больше, чем для аргона; эти скорости возрастают
с повышением давления. Скорость откачки водяного пара в та-
ких условиях достигает величины 105л-с-1.
4.6.4. Предельное давление криогенных насосов
Предельное давление рх, создаваемое криогенным насосом,
определяется по формуле (4.74), из которой следует, что это
давление зависит главным образом от давления паров рк при
температуре криогенной поверхности Тк.
Как указывалось выше, криогенные системы вообще не яв-
ляются изотермическими; поэтому распределение давлений в
таких системах является неравномерным и не всегда поддается
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
283
расчету. Результаты измерений приходится тщательно анали-
зировать.
Перепады температур вызывают термомолекулярные (эф-
фузионные) потоки, которые в свою очередь создают градиенты
давлений (концентраций). Различие температур влечет за со-
бой необходимость учета их при градуировке вакуумметров.
Фиг. 4.90. Вакуумметры в корпусе (/) и без корпуса (2), установленные в криО'
генной системе при температуре Тк в камере 3.
Например, ионизационные манометры, измеряющие концентра-
цию газа, обычно градуируют при комнатной температуре, по-
этому их показания (если они выражены в единицах давления)
следует корректировать по этой температуре.
Температура газа Т, необходимая для нахождения предель-
ного давления по формуле (4.74), зависит от характеристик от-
качивающей системы и в первую очередь от площади криоген-
ной поверхности Ак, ее температуры Тк, площади поверхности
системы Ас и ее температуры Тс. Поэтому измеренная темпера-
тура газа может находиться в пределах между Тк и Тс.
Например, в криогенной системе (фиг. 4.90), состоящей из
камеры 3 с температурой стенок Тк < То (То —300К.) и насоса,
показания имеющего корпус вакуумметра 1, помещенного сна-
ружи системы при температуре То и связанного вакуумным
патрубком с камерой, и обнаженного вакуумметра 2, помещен-
ного в камере, не будут одинаковыми ввиду различия их
температур и конечной проводимости патрубка G, а также
вследствие дополнительной десорбции газов со стенок изолирую-
284
ГЛАВА 4
щего кожуха, в котором находится вакуумметр 1. Поэтому воз-
никает необходимость пересчета показаний вакуумметров. Если
бы не было десорбции и сопротивления течению через патрубок,
соединяющий вакуумметр 1 с камерой, то благодаря эффузион-
ному потоку отношение давления р\ в головке вакуумметра 1 к
давлению рз в камере можно было бы выразить формулой
(2.846):
Pi / То V/г / То \'/з
Рз \ т / \ тк)
где параметр а 1 определяется конфигурацией системы. По-
этому давление в камере (при а — 1) можно представить в виде
(4.76а)
Например, если То — 300К и Т'к~77К, то истинное давление
примерно в 2 раза меньше, чем то, которое показывает вакуум-
метр в корпусе. Показания находящегося в камере вакууммет-
ра 2, который проградуирован при Го—300 К, должны быть
пересчитаны на температуру Тк по следующей формуле (для
ионизационного вакуумметра)1):
р3~р2(Гк/7’0). (4.766)
Для указанных выше значений температур давление р3 ока-
жется примерно в 4 раза меньше, чем то, которое показывает
вакуумметр 2.
Таким образом, между показаниями обоих манометров и
измеряемыми давлениями появятся значительные расхождения.
Они будут еще больше для гелиевых температур (4,2 К).
4.6.5. Конструкция криогенных насосов
Конструкция криогенного насоса довольно проста. Это со-
суд с большим отношением поверхности к объему и двойными
стенками, между которыми находится криогенная жидкость, или
простым жестяным кожухом с напаянным змеевиком, через ко-
торый протекает криогенная жидкость. Эта жидкость по мере
испарения непрерывно пополняется.
С целью уменьшения скорости испарения криоагента (вслед-
ствие нагревания поверхности сосуда, в котором он заключен,
от излучения окружающей среды) применяются охлаждающие
экраны, обладающие промежуточной температурой между крио-
генным сосудом и окружающей средой.
*) Ионизационный вакуумметр измеряет концентрации и при понижении
температуры показывает меньшее давление в соответствии с соотношением
Рз/рг — Тк/То-
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
285
Так, например, сосуд с жидким гелием') (при темпера-
туре 4 К) помещается в азот (при температуре ~77К), см.
фиг. 4.91. В этих условиях расход гелия значительно умень-
шается по сравнению со случаем, когда сосуд, в котором содер-
жится гелий, находится непосредственно под воздействием
окружающей среды (с температурой ~300 К). Очевидно, что обе
поверхности двухоболочечного сосуда действуют как насосы:
газы, легко конденсирующиеся,
оседают на обеих поверхно-
стях, а газы, трудно конден-
сирующиеся, — на поверхности
сосуда с гелием. Отсюда следует,
что сначала нужно включать
азотный насос, а затем гелие-
вый.
На фиг. 4.92 представлено не-
сколько типовых схем экраниро-
вания криогенных гелиевых по-
верхностей.
На фиг. 4.93 показан азотный
криогенный насос. Этот насос
состоит из тороидального резер-
вуара жидкого азота N2 (ж.)
Фиг. 4.91. Схема криогенного гелие-
вого насоса с экраном на жидком
азоте.
Nz (ок.)
Вход
и крышки 2, передвигаемой с помощью винтовой передачи S,
теплоизолированной сильфоном 4.
Соединение между крышкой 2 и платформой 6 герметизи-
руют с помощью кольцевого уплотнения 5. Насос соединяют
с вакуумируемой системой болтами за фланец платформы 6.
Крышку 2 прижимают к платформе 6, откачивают через пат-
рубок 7 газы из объема под крышкой и наполняют азотом ре-
зервуар 1. После того как газы из вакуумируемой системы уда-
лены каким-либо насосом (например, диффузионным), отводят
крышку 2 вниз для того, чтобы поверхность тороидального
’) Обычно пары гелия (ввиду его высокой цены) собирают в резервуары,
а затем сжимают и конденсируют. Таким образом жидкий гелий почти це-
ликом восстанавливается (небольшие его потери имеют место лишь вслед-
ствие утечек).
286
ГЛАВА 4
резервуара 1 могла сорбировать оставшиеся в откачиваемом
объеме газы. На фиг. 4.94 показано, как снижается давление
в вакуумируемой системе при работе одного только диффузион-
Охладитель
'NzM f
, nDo, 2
4
Nzbte)/
Фиг. 4.92. Схемы экранирования криогенных гелиевых поверхностей с по-
мощью криогенных азотных поверхностей.
/ — поверхность, охлаждаемая жидким азотом; 2 —криогенный элемент, охлаждаемый
жидким гелием; 3—экран, охлаждаемый жидким азотом; 4—пространство криогенной
камеры.
Фиг. 4.94. Изменение давления в ва-
куумируемой системе при откачке
диффузионным насосом (/) и систе-
мой диффузионного и криогенного
насосов (II).
Фиг. 4.93. Азотный криогенный насос
(фирма Varian).
1 — тороидальный резервуар жидкого азота,
2— крышка в отведенном положении, 3—вин-
товая передача дтя перемещения крышки;
4 — изолирующий енльфои винтовой пере-
дачи, 5—кольцеобразная уплотняющая про-
кладка, основание насоса;7—фланец для
соединения с диффузионным насосом.
ного насоса, а также при его совместной работе с криогенным
насосом.
На фиг. 4.95 представлена схема криогенного гелиевого на-
соса, у которого резервуар жидкого гелия снабжен внешней
оболочкой 2 из гофрированной жести. Эта оболочка посредством
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
287
цилиндра 3 соединена с резервуаром жидкого азота 4. Как
оболочка гелиевого резервуара, так и цилиндр изготовлены из
металла, обладающего высокой теплопроводностью.
Резервуар с азотом также имеет рубашку, переходящую во
фланец 5, который служит для фиксации криогенного насоса
в отверстии вакуумируемой системы.
Фиг. 4.95. Криогенный гелиевый на-
сос с азотным экраном.
1 — резервуар жидкого гелия; 2—оболочка;
3—цилиндрический переходник с высокой
теплопроводностью; 4—резервуар жидкого
азота; 5—фланцы; 6— датчик уровня гелия;
7—выход датчика.
Фиг. 4.96. Криогенный гелиевый на-
сос (фирма Leybold).
/ — резервуар жидкого гелия; 2—змеевик с
жидким гелием, 3 — внутренний контур; 4—
внешний контур; 5, 8—клапаны; 6—масля-
ный ротационный иасос; 7—термопара;
р—ионизационный манометр. Насос 6 слу-
жит для откачки паров жидкого гелия и
соответствующего понижения его темпера-
туры.
Оболочка 2 имеет температуру, близкую к температуре жид-
кого азота, и защищает резервуар с гелием от теплового излу-
чения окружающей среды (стенок вакуумируемой системы).
Температура поверхности резервуара жидкого гелия, равная
теоретически (при р = 760 Тор) 4,2 К, может быть дополни-
тельно снижена путем уменьшения давления над гелием (путем
откачки); например, при давлении 50 Тор температура жидкого
гелия снижается до 2,3 К.
288
ГЛАВА 4
Уровень гелия в резервуаре регулируется с помощью дат-
чика уровня 6 и управляющего электронного устройства, соеди-
ненного с выходом 7 датчика. Гелиевый криогенный насос
(с диаметром входа ~10 см) обеспечивает скорость откачки
~ 1000 л-с-1 для воздуха и ~3000 л-с-1 для водорода (при
2,3 К). Расход жидкого гелия (при р < 10-s Тор) составляет
~30 см3-ч-1, расход жидкого азота — около 0,5 л-ч-1. Время
запуска насоса составляет ~8 ч (после предварительного про-
грева до 670—680К). Скорости откачки воздуха и водорода
для более мощного насоса достигают соответственно 5000 и
10000 л-с"1 при расходе гелия 60 см3-ч-1.
Например, гелиевый криогенный насос Veeco CMS 100 имеет
следующие параметры: предельное давление ~10“п Тор (на-
чальное давление ~10^2 Тор); скорость откачки 5(л-с-1) для
Н2О—1100, N2 — 200, Н2 —750, О2—190, Аг —170, Не —0,
Не в присутствии аргона — 500. Перед запуском насос про-
гревается до 470—475 К-
Основные детали насоса изготовляются из нержавеющей
стали, тепловые экраны — из никелированной меди, отража-
тели — из черненой меди. Расход криогенных жидкостей на уста-
новившемся режиме составляет: Не — 0,5 л-сут-1, N2 —
2 л-сут-1.
Другое конструктивное решение гелиевого криогенного на-
соса представлено на фиг. 4.96. Основным его рабочим эле-
ментом является двухконтурный цилиндрический змеевик 2 из
медной трубки. Внешний контур 4 является своего рода тепло-
вым экраном для внутреннего контура 3. Жидкий гелий (под
давлением ~1 атм) из сосуда Дьюара поступает в змеевик,
затем через регулятор 5 в масляный ротационный насос 6, а от-
туда — в конденсатор. Этот насос позволяет снизить давление
паров над жидким гелием, а тем самым и температуру жидкого
гелия. Температура змеевика измеряется термопарой 7, по сиг-
налу которой регулятор 5 поддерживает требуемую темпера-
туру путем увеличения или уменьшения скорости откачки паров
гелия из пространства над жидкостью.
Систему предварительно откачивают форвакуумным насосом
(например, цеолитовым) через вентиль 8, который затем за-
крывают.
Такой криогенный насос со скоростью откачки азота и водо-
рода соответственно 5000 и 2500 л-с-1 расходует гелия 0,5 л-ч-1;
при этом температура внутреннего контура змеевика состав-
ляет 2,5 К, а внешнего 14 К. Ожижение паров гелия произво-
дится путем сжатия газа, отведенного насосом 6, до 150 атм в
стальных баллонах объемом ~40 л.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
289
4.6.6. Вспомогательные устройства криогенных насосов
Криогенные насосы требуют ряда вспомогательных уст-
ройств, таких, как резервуары для криогенных жидкостей,
устройства для их переливания, регуляторы уровня, конденса-
торы для ожижения гелия и т. п.
Кроме того, для уловителей и охлаждаемых ловушек паров
масла и ртути необходимы холодильные агрегаты, поддержи-
вающие пониженные температуры (~230—240К).
Фиг. 4.97. Сосуды Дьюара.
а—металлический (одинарный) сосуд для хранения жидкого азота: 1—внутренняя стен-
ка; 2—внешняя оболочка; 3—вакуумная полость; 4—активированный уголь (под сеткой);
5—герметичная пробка; 6— упругая подвеска; 7—кожух; 8—ручка.
б—двойной сосуд для хранения жидкого гелия: / — внутренний сосуд (жидкий гелий);
2— наружный сосуд (жидкий азот), 3— кожух; 4— гелиевый манометр; 5 —предохранитель-
ный клапан гелия.
Сосуд Дьюара для жидкого азота схематично представлен
на фиг. 4.97, а. В пространство между двойными стенками со-
суда помещается активированный уголь; с момента начала за-
ливки жидкого Na он абсорбирует остатки газов, улучшая ва-
куум между стенками сосуда.
Двойной сосуд Дьюара для хранения жидкого гелия пока-
зан на фиг. 4.97,6. Собственно резервуар с жидким гелием
(30 л) помещен в другой сосуд, содержащий жидкий азот.
Ванна из жидкого азота служит для уменьшения потерь гелия.
290
ГЛАВА 4
В хорошо спроектированных и изготовленных сосудах Дьюара
объемом в несколько десятков литров суточная потеря гелия
не превышает 0,25 л.
Рабочий резервуар для аккумулирования, хранения и ис-
пользования жидкого азота представлен схематично на
фиг. 4.98.
4.6.7. Низкотемпературные отражатели паров
Низкотемпературные отражатели можно в определенном
смысле считать криогенными насосами. На входе в насос перед
низкотемпературным отражателем устанавливается отражатель
с водяным охлаждением, предназначенный для защиты первого
от быстрого насыщения легко конденсирующимися парами.
На фиг. 4.99 представлены две конструкции часто применяе-
мых уголковых (шевронных) отражателей. Уголки (из металла
с хорошей теплопроводностью) крепятся изнутри к кольцеоб-
разному кожуху, через который протекает охлаждающая жид-
кость (вода, фреон, жидкий азот). Кожух отражателя обычно
выполняется из нержавеющей стали, а уголки — из никелиро-
ванной меди.
4.6.7.1. Регулирование уровня криогенной жидкости. На
фиг. 4.100 представлено простое устройство для поддержания
постоянного уровня жидкого азота в вакуумной системе. Когда
уровень жидкого азота в сосуде 6 снижается, датчик уровня 5
посылает в регулятор 4 и на подогреватель 2 электрический сиг-
нал. Давление паров азота в подогреваемом резервуаре 1 по-
вышается, и расход жидкого азота через регулятор увеличи-
вается. Таким образом, в сосуд Дьюара подается определенное
количество жидкого азота, и его уровень восстанавливается.
Схемы подобных систем для питания отражателя жидким азо-
том показаны на фиг. 4.101 и 4.102.
4.6.7.2. Холодильные агрегаты. Для питания отражателей
криогенной жидкостью часто используются небольшие фреоно-
вые холодильные агрегаты, обеспечивающие поддержание тем-
пературы на уровне ~235 К. Агрегат размерами 50 X 30 X 50 см
состоит из компрессора, конденсатора, резервуара с фреоном и
клапанов, а также датчиков давления и температуры.
4.6.8. Охлаждаемые ловушки
К криогенным насосам можно отнести и охлаждаемые ло-
вушки, главной задачей которых является удаление паров воды,
масла, ртути и других легко конденсирующихся веществ. Обыч-
Фиг. 4.98. Сосуд жидкого азота.
1—кожух; 2 — внутренний сосуд; 3 — гор-
ловина; 4— трубка для выведения
жидкого азота; 5—клапан; 6—упругая
подвеска внутреннего сосуда; 7—тепло-
изоляция; 8 —ручкн.
300 < D < 500 ММ. 500 < Н < 900 мм,
объем внутреннего сосуда 20—70 л, вес
15 — 40 кг (фирма Cryodiffusion, Фран-
ция).
D
Фиг. 4.99. Уголковый (шевронный) отражатель паров.
Л—с охлаждением за счет отвода тепла к корпусу, б —с охлаждением за счет отвода
тепла к фланцу насоса,
/—корпус; 2—уголки; 3 —прокладки.
292
ГЛАВА 4
но охлаждаемые ловушки устанавливаются между источником
паров и системой, которая должна быть свободной от этих па-
ров, например, на выходе масляного или ртутного насоса, на
Фиг. 4.100. Устройство для поддер-
жания постоянного уровня охлади-
теля в сосуде Дьюара.
/—резервуар для хранения жидкого азота;
2—подогреватель; 3— электромагнитный
клапан; 4—регулятор уровня (управляю»
щий током подогревателя); 5—датчик уров-
ня; 6 — резервуар, в котором поддержи-
вается постоянный уровень жидкого азота.
Фиг. 4.101. Система питания отра-
жателя паров (устанавливаемого над
отражателем, охлаждаемым водой)
жидким азотом.
/—резервуар жидкого азота; 2—регулятор;
3—электромагнитный клапан; 4—отража-
тель, охлаждаемый жидким азотом; 5—от-
ражатель, охлаждаемый водой; 6 —диффу.
знойный насос; 7—откачиваемый объем;
8—датчик уровня жидкого азота в отра-
жателе.
Фиг. 4.102. Система питания отра-
жателя паров жидким азотом.
/ — резервуар жидкого азота; 2— клапаи;
3—управляющий электромагнит клапана;
4 —теплоизолированная трубка для подвода
жидкого азота; 5—отражатель паров;
датчик уровня жидкого азота; 7— регу-
лятор уровня (управляющий клапаном 2).
входе ртутного манометра и т. д. В качестве криогенного ра-
бочего тела в них применяется жидкий азот, твердая двуокись
углерода (смешанная с какой-либо незамерзающей жидкостью,
например с ацетоном) или охладители, применяемые в техни-
ческих рефрижераторах (например, аммиак, фреон).
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
293
Давления наиболее часто подвергаемых вымораживанию
водяного пара и паров ртути для некоторых характерных тем-
ператур приведены в табл. 4.13.
Таблица 4.13
Давления (Тор) водяного пара и паров ртути
при некоторых температурах
Темпер а- тура, К Пар 373 293 273 195 77
Н2О Hg 760 0,27 18 1,3 10~3 4,6 2-10-4 сл со "ел о о L L еч ея сч СО 1 о vn
Скорость откачки и предельное давление охлаждаемых ло-
вушек определяются в принципе так же, как и в криогенных
насосах.
Фиг. 4.103. Охлаждаемые ловушки.
а — в - стеклянные; г —металлическая.
/—сосуд Дьюара; 2—охладитель; 3—направление к насосу.
В основе конструирования охлаждаемых ловушек лежит
«оптическое» экранирование источника паров от пространства,
которое должно быть свободным от паров, при одновременном
сохранении большой проводимости охлаждаемой ловушки для
потока газов, а также возможно большей поверхности, на ко-
торой должны конденсироваться пары.
Конструкции нескольких наиболее простых охлаждаемых ло-
вушек (трех стеклянных и одной металлической) показаны
на фиг. 4.103. Две последние не требуют отдельных сосудов
294
ГЛАВА 4
Дьюара, так как они сами являются такими сосудами. Вакуум
в их рубашке создается одновременно с вакуумом в откачивае-
мой системе.
Эффективность действия охлаждаемой ловушки, представ-
ленной на фиг. 4.103,6, по отношению к парам ртути может быть
значительно повышена, если ее центральную трубу обмотать
тонкой гофрированной фольгой из чистой меди.
4.7. ЦЕОЛИТОВЫЕ НАСОСЫ
4.7.1. Принцип действия
В цеолитовых насосах для адсорбции газов и паров исполь-
зуются вещества, называемые цеолитами1).
Цеолиты — это природные минералы, главным образом гид-
рированные алюмосиликаты щелочных или щелочноземельных
металлов2), с трехмерной кристаллической решеткой, образо-
ванной тетраэдрами АЮГ и SiO?. В настоящее время нала-
жено производство искусственных цеолитов.
Атомы кислорода соединяются с атомами алюминия и крем-
ния определенным образом, следствием чего является особая
структура цеолита, в которой имеются полости объемом менее
кубического нанометра, соединенные каналами диаметром
~1 нм (фиг. 4.104) и заполненные молекулами воды. После ее
удаления получается пористое вещество с очень развитой внут-
ренней поверхностью (доходящей до 1000 м2 на 1 г цеолита),
способной сорбировать воду или газы.
Так как размеры пор в цеолитах зависят от размеров ато-
мов и их связей в кристаллической структуре, можно путем под-
бора компонентов влиять на эти размеры, а тем самым на
проницаемость каналов для газов с разными размерами моле-
кул. Поэтому цеолиты носят также название молекулярных сит.
Синтетические цеолиты обычно обозначаются числом, опре-
деляющим максимальный диаметр молекул газа, которые еще
’) От греческого дзео — кипеть, литое — камень.
2) Общая формула алюмосиликатного цеолита имеет вид рМе VsO-
ч/АЬОз-гЗЮг-пНаО. Например, составными частями натриевого цеолита яв-
ляются: натриевая щелочь, гидрат окиси алюминия и жидкое стекло; сме-
шанные в соответствующих пропорциях, они дают гель, который при темпе-
ратуре 373 К кристаллизуется, образуя кристаллы размером 0,1—1 мкм. Из
них после промывания и добавления вяжущего вещества (например, глины)
изготовляют гранулы размером в несколько миллиметров (шарообразные или
цилиндрические), пригодные для активации Природный цеолит, например
шабазит, имеет химическую формулу СаИазАЬЗцОи-бНзО. Размер полостей
В его гексагональной кристаллической структуре составляет 1,14 нм, объем
полостей 0,925 нм3 * * * *, а диаметр соединяющих их каналов 0,49 нм. Внутренняя
поверхность всех каналов и полостей, имеющихся в одном грамме цеолита;
составляет ~750 м8.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
295
могут проникнуть через каналы, а также буквой А или X в за-
висимости от структуры цеолита.
В табл. 4.14 приведены характеристики некоторых цеолитов.
В обычном состоянии (насыщения водой) полости и каналы
цеолита наполнены молекулами воды, которая может быть уда-
лена путем отжига при температуре 920—930 К. (После обез-
воживания масса 1 см3 цеолита уменьшается с ~21 до 1,5 г.)
0,447дм
Q.A11 нм
Фиг. 4.104. Разрез цеолита типа NaA
(по Соколову и др., 1964 г.).
Фиг. 4.105. Количество газа (СО, О2,
N2 или Аг), адсорбируемого цеоли-
том типа 4А при давлении 700 Тор,
в зависимости от температуры (по
Эспе, 1965 г., Томасу и Мэйсу, 1961 г.).
Адсорбированные на внешней поверхности цеолита молекулы
газов и паров могут мигрировать по внутренним поверхностям
и проникать через каналы в полости, где они оседают на стен-
ках. Таким образом, цеолиты обладают большой сорбционной
способностью, которая более или менее различается для разных
газов. Сорбционная способность цеолитов в отношении инерт-
ных газов, например гелия и неона, практически равна нулю,
а для водорода очень мала.
В технике высокого вакуума цеолиты находят применение
главным образом а) как поглотители, используемые при тем-
пературе окружающей среды, которые помещают между источ-
ником распыленного масла, его паров или паров ртути и про-
странством высокого вакуума, например между диффузионным
насосом и откачиваемым объемом или же между ртутным и
ионизационным манометрами и т. д. (т. е. вместо отражателей
296
ГЛАВА 4
Таблица 414
Характеристики некоторых цеолитов и других пористых материалов
Характеристика Диаметр каналов, нм
0,38 0,4 0,5 0,7 0,8 0,9 - 1,0 1.8 5,0
Обозначение по классифи- кации Линде 3,8А 4А (NaA) 5 (СаА) Микро- пористое стекло 10Х (СаХ) 13Х (NaX) Микро- пористое стекло Кокс
Удельная по- верхность адсорбции, м2•г-1 Структура Плотность, г • см'3 Пористость, % по объему 700-800 Гранулы 0 1,5—3 мм (—0,7 кг/л) Активированный 1,55, насыщенный водой 2,0 45 100—200 1050 51 100-200 2500
с криогенной жидкостью); б) в высоковакуумных насосах, где
цеолит работает при пониженной температуре, например в жид-
ком азоте, и обеспечивает чистый (т. е. свободный от паров
органических веществ) вакуум.
4.7.2. Зависимость свойств цеолита от температуры
Ввиду того что размеры кристаллической структуры и ин-
тенсивность ее колебаний, а также в некоторой степени размеры
молекул газа зависят от температуры, разумно предположить,
чю изменение температуры оказывает влияние на сорбционные
характеристики цеолита.
Действительно, при изменении температуры изменяется про-
ницаемость каналов кристаллической структуры, с одной сто-
роны, и эффективность адсорбции — с другой. Графики фиг. 4.105
представляют количества кислорода, углекислоты, азота и арго-
на, адсорбированных 100 граммами цеолита типа 4А при давле-
нии 700 Тор, в зависимости от температуры. Для трех последних
газов максимум адсорбции имеет место при температуре — 170 К.
Сорбция кислорода увеличивается с понижением температуры,
так как молекулы кислорода О2 меньше (0,28 нм) молекул азота
(0,4 нм) и аргона (0,38 нм).
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
297
Откачивающие свойства цеолита обычно определяются на ос-
новании экспериментальных зависимостей количества адсорби-
рованного газа (на единицу массы цеолита) от давления. При-
мер таких зависимостей для цеолита 5А в отношении некоторых
газов представлен на фиг. 4.106. Из них, например, видно, что
при р = 10_| Тор и Т = 78 К 1 г цеолита поглощает ~ 100 Тор-л
азота, а при давлении 10-5 Тор ~2-10~2 Тор-л, что соответ-
ствует 2-103л азота под давлением 10~5 Тор. При повышении
температуры до 293 К и давлении р — 10-1 Тор выделится боль-
шое количество газа, а в цеолите останется лишь 10~3 Тор-л
газа, т. е. практически весь содержащийся в нем газ будет уда-
лен.
Из вышесказанного следует возможность регенерации (т. е.
активации) насыщенного газами цеолита, для чего цеолит сле-
дует прогреть в вакууме и хранить его в этих условиях вплоть
до следующего применения Устройства, служащие для прогрева
цеолита, часто монтируются внутри цеолитовых насосов На
фиг. 4 107 приведены кривые, показывающие связь между рав-
новесным давлением и количеством адсорбированного цеолитом
5А газа (N2, О2, Аг или Н2). Эти кривые, как и зависимости на
фиг. 4 106, являются, в сущности, изотермами адсорбции, рас-
смотренными в разд. 3.3.3.
4.7.3. Устройство криогенных цеолитовых насосов
В тех случаях, когда нужно создать «чистый» (свободный
от органических веществ) форвакуум, применяют наряду с бес-
смазочными, цеолитовые насосы. В этих насосах цеолит, охлаж-
денный до температуры, например, жидкого азота, откачивает
пары и газы, а затем при нагреве десорбирует их.
Простейший цеолитовый насос представляет собой цилиндри-
ческий резервуар (например, из нержавеющей стали), внутри
которого — между перегородками из перфорированных медных
пластин — помещают гранулированный цеолит (фиг. 4.108).
Медные перегородки обладают высокой теплопроводностью и
быстро нагревают цеолит для активации или охлаждают для
откачки Большое значение для эффективной откачки имеет рав-
номерное быстрое охлаждение всей массы цеолита.
Трубопровод, ведущий к резервуару цеолитового насоса,
снабжен вентилями, позволяющими соединять его либо с насо-
сом форвакуума (активация), либо с откачиваемым простран-
ством Предохранительный клапан защищает резервуар от раз-
рушения, если после цикла откачки (при низкой температуре) и
закрытия вентилей произойдет десорбция газов из цеолита
вследствие повышения температуры.
Фиг. 4.106. Зависимость количества
газа, адсорбируемого цеолитом типа
5А, от рабочего давления р (по Тер-
неру и Файнлебу, 1961 г.).
----- 293 К. -- 78 К.
HOf 0,1 1 10 ем3-г~*
Количество адсорбированного saaa
Фиг. 4.107. Зависимость равновесного
давления от количества газа (N2, О2>
Аг или Н2), адсорбируемого цеоли-
том типа 5А, при 77 К.
Фиг. 4.108. Цеолитовый насос.
1—цеолит; 2—перегородки, 3— предохрани
тельный клапан*, 4—сосуд Дьюара; 5—сет-
ка; 6—магистраль к ротационному насосу;
7—магистраль к вакуумной системе;
5—клапаны; Р—подсоедииительиый патру-
бок насоса из материала с малой теплопро-
водностью (например, из нержавеющей
стали)..
Фиг. 4.109. Цеолитовый насос.
а—разрез иасоса с большой сорбирующей
поверхностью, охлаждаемой в сосуде Дью-
ара; б —асбестовый подогреватель насоса.
1 — резерву а р жидкого азота; 2—цеолит;
3—сосуд Дьюара; 4—предохранительный
клапан; фланец; 6—трубка для отводу
паров азота^
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
299
Патрубок цеолитового насоса, соединяющий резервуар цео-
лита с откачиваемой системой, для уменьшения расхода крио-
генного охладителя должен быть изготовлен из материала, имею-
щего малую теплопроводность.
На фиг. 4.109,а представлена схема цеолитового насоса со
специальной трубкой, служащей для отвода испаряющегося
Вход
Фиг. 4.110. Цеолитовый криогенный насос.
а—продольный разрез (насос, снабженный подогревателем для регенерации, помещен
в сосуд Дьюара); б—характеристики откачки резервуара объемом 20 л одним насосом
(прерывистая кривая) и резервуара объемом 200 л с помощью двух насосов, включаемых
последовательно (сплошная линия).
/-цаолит; 2—подогреватель; 3 —сосуд для жидкого азота; 4—заправочная горловина;
5—металлическая сетка; 3—предохранительный клапан.
азота из резервуара насоса. В полость резервуара можно также
вводить подогреватель для регенерации цеолита.
С целью регенерации цеолита в насосах применяют также
специальные подогреватели в виде асбестовых цилиндров с на-
гревающей проволокой, которые надеваются на корпус насоса
(фиг. 4.109,6).
Другая конструкция цеолитового насоса представлена на
фиг. 4.110, а. В кожухе насоса размещаются как сосуд Дьюара
для жидкого азота, так и нагреватель для регенерации цеолита.
300
ГЛАВА 4
Хороший теплообмен между резервуаром и цеолитом обеспечи-
вается соответствующим выбором формы резервуара. Насос
Фиг. 4.111. Характеристики откачки
цеолитовым криогенным насосом ат-
мосферного воздуха, аргона и азота
(по Стерну и Ди Паоло, 1969 г.).
диаметром 20 см и высотой 40 см весит ~12 кг. Он содержит
1 кг цеолита 5А1). Входной патрубок насоса имеет диаметр
Таблица 4.15
Парциальное молекулярное давление газов и пасов (%)
при откачивании одним, двумя и тремя цеолитовыми')
насосами, а также системой двух цеолитовых и
одного масляного ротационного насосов (Магелко, 1970 г.)
Газ (пар) Цеолитовые насосы, шт. Цеолитовые и масляный иасосы
1 2 3
со2 0,5 0,1 0,1 0,2
Аг 0,5 0,1 0,2 0,1
о2 1 1 4 0,6
N2+co 0,5 1 2 1
Ne 58 64 53 57
н20 6 4 7 28
Не 28 22 26 0,1
н2 5,5 8 8 13
Рполн, Тор 1,1 • 10-2 2,8 - 10-3 7- 10“* 4- Ю-4
9 450 г цеолита 5А в каждом цеолитовом насосе.
Цеолит 5А хорошо откачивает различные газы, в особенности водяной
пар, азот, кислород и двуокись углерода, хуже — аргон, а такие газы, как
неон, гелий, водород, не откачиваются вовсе, т. е. их давление в системе
остается таким же, каким было в атмосфере.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
301
22 мм. Регенерация цеолита проводится при температуре
~620 К в течение нескольких часов. Для этого необходима
мощность 0,5 кВт.
На фиг. 4.110,6 показаны характеристики откачки цеолито-
выми насосами резервуаров объемом 20 л (прерывистая линия)
и 200 л (сплошная линия). После откачки резервуара объемом
Фиг. 4.112. Система двух цеолитовых насосов.
в—схема; б—общий вид иасосов с клапанами, изготовленных Варшавским институтом
промышленной электроники.
/» 2— резервуары с цеолитом; 3—-теплоизолированные емкости с жидким азотом;
4, 5, 6, 7—клапаны, 5—вакуумметр.
V = 200 л одним насосом от атмосферного давления до давле-
ния ~ 100 Тор включается второй насос; по истечении ~15 мин
получается давление порядка 10-2—10-3 Тор. Резервуар объе-
мом 20 л откачивался одним насосом.
Следует обратить внимание на то, что предельное давление
при откачке цеолитовым насосом атмосферного воздуха значи-
тельно выше, чем при откачке чистого азота или кислорода. Это
связано с тем, что цеолит почти не откачивает неон, гелий и во-
дород, которые следует удалять другим насосом. Эту особен-
ность цеолитового насоса отражают кривые фиг. 4.111, а также
данные табл. 4.15. Из таблицы видно, что при использовании
302
ГЛАВА 4
ротационного насоса снижается содержание инертных газов, но
зато появляются водяные пары, а также некоторое количество
водорода.
На фиг. 4.112 представлена схема системы цеолитовых насо-
сов, а также показан внешний вид этих насосов, изготовленных
в Варшавском институте промышленной электроники.
4.7.4. Цеолитовые поглотители паров масла
Цеолиты находят также применение в качестве поглотителей
паров масел и воды. В этом случае поглощение происходит при
комнатной температуре, а регенерация — при прогреве. На
фиг. 4.113 представлено одно из самых простых абсорбирующих
устройств этого рода, устанавливаемых на входе масляного диф-
фузионного насоса.
Поглощающее устройство для масляного ротационного на-
соса показано на фиг. 4.114. В него вмонтирован подогреватель,
позволяющий прогревать цеолитовую массу (в течение ~2 ч
в месяц). Для этого подходит цеолит типа 13Х (или активиро-
ванные алюминаты), поглощающий как водяной пар, так и уг-
леводороды с большими молекулярными массами (Af0>50).
Через такой поглотитель можно пропускать поток газа (воз-
духа) порядка нескольких литров в секунду.
На фиг. 4.115 представлена схема небольшого стеклянного
поглотителя. Гранулированный цеолит вводится через проточные
трубки при сборке системы. Прогрев до температуры 525—625 К
длится ~ 1 ч, охлаждение — около 2 ч.
Еще одна конструкция цеолитового поглотителя показана
на фиг. 4.116. Цеолит типа 13Х (0,5 кг), помещенный между ко-
жухом поглотителя и внутренней трубой, сделанной из метал-
лической сетки, способен поглотить 2000 л атмосферного воздуха
при влажности 50% и давлении ~10-3 Тор (это соответствует
2 Тор-л поглощенного газа). Подогреватель-змеевик мощностью
300 Вт обеспечивает регенерацию цеолитовой массы после вы-
держки поглотителя в течение 40 мин при температуре ~625 К.
В другой конструкции поглотителя предусматривается съем-
ный подогреватель, с тем чтобы цеолитовую камеру можно было
помещать в сосуде с жидким азотом.
Когда цеолитовый насос работает вместе с масляным рота-
ционным насосом, можно (благодаря удалению паров масла)
получить давление ~10-5 Тор, особенно если цеолит охлаждает-
ся до 77К (фиг. 4.117). Если же применить цеолитовый поглоти-
тель на входе в диффузионный масляный насос, то можно зна-
чительно улучшить предельный вакуум, даже не прибегая к
вымораживанию жидким азотом, как это видно из данных
табл. 4.16. Цеолитовый поглотитель полностью удаляет пары
газы
Фиг. 4.113. Поглотитель паров с гра-
нулированным цеолитом.
Фиг. 4.115. Небольшой стеклянный
поглотитель паров масла с гранули-
рованным цеолитом.
Фиг. 4-114. Устройство для поглоще-
ния паров масла ротационного масля-
ного насоса.
У —патрубок для наполнения цеолитом;
2 —подогреватель; 3—патрубок для соеди-
нения с масляным ротационным насосом;
4 — патрубок для соединения с откачивае-
мым объемом.
Фиг. 4.116. Цеолитовый поглотитель
(с регенерационным подогревателем),
устанавливаемый на входе в фор-
вакуумный масляный ротационный
насос с целью поглощения углеводо-
родных продуктов разложения масла
(фирма Varian).
1—цеолит; 2— патрубок для наполнения цео-
литом, 5 —кран; 4 — подогреватель; 5 —пат-
рубок для соединения с откачиваемым
Объемом, 6 —корпус поглотителя, 7—за-
жимы питания подогревателя*
Фиг. 4.117. Характеристики откачки масляным ротационным насосом атмо-
сферного воздуха без поглотителя (прерывистая линия) и с цеолитовым
поглотителем (сплошные линии) при 300 и 77 К.
Измеряется общее давление, V = 100 л, 3=7 л.с-1.
Фиг. 4.118. Цеолитовый насос-погло-
титель конструкции Варшавского
института промышленной электро-
ники.
Цеолит типа 13Х (150 г).
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
305
углеводородов и понижает давление многих газов и паров,
но может ввести в вакуум некоторое количество водяных паров.
Таблица 4.16
Величины тока (10—14А) масс-спектрометра, соответствующие
парциальным давлениям газов и паров в предельном вакууме
диффузионного масляного насоса с поглотителями при различ-
ных температурах (Магелко, 1970 г.)
Газ(пар) Поглотитель, охлаждаемый водой Поглотитель, охлаждаемый Жидким азотом Поглотитель с цеолитом 13Х
после 150 ч при Т~300 К после 10 ч при 300 К после 7 сут при 300 К
н2 100 22 4 1 6
СНз 80 1 — — —-
ОН 18 1 4 8 30
Н2О 55 7 15 37 105
co+n2 300 75 3 4 5
О2 — — — 7 10
СНзН 850 190 — —
СО2 — — 1 2 2
С4Н 830 по —, 1 2
С5Н 680 90 — — —
с6н 700 80 — — —1—
С7Н 630 70 — — —1—
с8н 400 55 — — —
Рполи > 10~7 Тор 7 1 0,2 0,5 2
На фиг. 4.118 представлен внешний вид цеолитового поглоти-
теля Варшавского института промышленной электроники.
4.8. СУБЛИМАЦИОННЫЕ НАСОСЫ
4.8.1. Принцип действия и устройство
В сублимационных насосах газы связываются поверхностями,
на которые путем осаждения или напыления нанесено опреде-
ленное количество чистого металла. Такими поверхностями чаще
всего являются стенки кожуха насоса или специальные металли-
ческие листы, помещенные в вакуумной камере.
Свежие, постепенно осаждаемые на поверхность слои чистого
металла связывают (главным образом химически) газы, находя-
щиеся в откачиваемом объеме, а также поглощают адсорбиро-
ванные газы,
306
ГЛАВА 4
Сублимационные насосы особенно эффективны в тех случаях
когда нужно откачивать выделяющиеся импульсивно большие
количества активных газов. Эффективность откачки химически
неактивных газов, а также паров предельных углеводородов
при температуре окружающей среды практически равна нулю
Поэтому такие газы и пары необходимо удалять другими насо-
сами (диффузионными или, еще лучше, ионными). Скорость
откачки этих насосов может быть значительно меньшей (напри-
мер, в 10 раз).
Эффективность сублимационной откачки может быть значи-
тельно увеличена путем снижения температуры поглощающей
поверхности (низкотемпературные сублимационные насосы) или
путем ионизации откачиваемого газа (ионно-сублимационные
насосы). Чаще всего сублимационные насосы работают вместе
с электроразрядными (тлеющего разряда) насосами.
Для напыления в последнее время употребляют исключи-
тельно титан, который химически связывает активные газы (О?,
N2, Н2О), создавая окислы, нитраты и т. п., обладающие нич-
тожно малым давлением паров (при температурах <1800 К).
Удельная скорость откачки сублимационного насоса зависит
от давления газа, а также от скорости осаждения металла, по-
скольку коэффициент прилипания у, влияющий на скорость от-
качки, уменьшается с увеличением степени покрытия 0, которая
в свою очередь увеличивается по мере уменьшения времени по-
крытия Тпокр, т. е. с повышением давления.
Удельные скорости откачки некоторых газов (находящихся
при комнатной температуре) чистой поверхностью титана (0=0)
с температурой 293 и 77 К приведены в табл. 4.17. При наличии
сопротивления течению газов в направлении сорбирующей по-
верхности скорости откачки уменьшаются.
Таблица 4.17
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
307
пования титана целесообразно включать сублимационный насос
при давлении ниже ICk5 Тор. Это давление получают с помощью
какого-либо другого насоса. При понижении начального рабо-
чего давления количество напыляемого титана может быть
уменьшено.
фиг. 4.119. Характеристики откачки азота сублимационными насосами при
293 К и различных величинах тока сублиматора титана.
______насос со скоростью откачки 700 л-с'1; ---- насос со скоростью откачки
50 л-с-1.
На фиг. 4.119 представлены характеристики откачки субли-
мационных насосов со скоростями откачки 700 и 50 л-с-1. Об-
ласть эффективной работы насоса зависит от скорости сублима-
ции титана, как это следует из хода характеристик для двух
значений тока в сублиматоре титана.
4.8.2. Сублиматор
Для получения паров титана используется сублиматор. Суб-
лиматор представляет собой устройство, состоящее из вольфра-
мового стержня, на который намотана титановая проволока
(или лента). Чтобы избежать стекания жидкого титана, парал-
лельно с титановой проволокой на стержень наматывается не-
сколько более тонкая молибденовая проволока, создающая по-
добие винтовой канавки, в которой удерживается расплавлен-
ный (или близкий к расплавлению) титан.
На фиг. 4.120, а представлен участок вольфрамового стержня
(предназначенного для большого сублимационного насоса) с на-
мотанными титановой и молибденовой проволоками, а на
Фиг. 4.120, б показан сублиматор в сборе.
В некоторых сублимационных насосах титан наносится не
пУтем осаждения паров, а анодным напылением; в этом случае
°н Распыляется из титанового анода при бомбардировке его пуч-
ком электронов (с током /~200 мА) при напряжении ~ 7 кВ.
и катод, и анод в таких сублиматорах могут заменяться.
308
ГЛАВА 4
Ресурс такого сублиматора, работающего при давлениях
<10-7 Тор, достигает 10 000 ч.
Испарение титана на вольфрамовом стержне обычно произ-
водится импульсами (продолжительностью, например, 2 мин);
продолжительность перерывов между импульсами зависит от
давления в откачиваемой системе; время покрытия поверхности
мономолекулярным слоем газов обратно пропорционально этому
давлению.
Ф0,8мм П Ф0,6мм Мо
тряпок "*)
Фиг. 4.120. Сублиматор.
а — участок вольфрамового стержня с молибденовой проволокой, создающей углубление
для намотки титановой проволоки, б — собранный сублиматор большого насоса (на опоре 1
установлены три титановых стержня 2, соединенные „звездой"; ток в стержне ^40 А),
В табл. 4.18 приведены данные по продолжительности пере-
рывов между 90-секундными импульсами в зависимости от дав-
ления р.
Таблица 4.18
Продолжительность перерывов между 90-секундными
импульсами распыления титана в сублимационном насосе
в зависимости от давления (примерные данные)
р. Тор <10-s io-6 10-7 10~8 10-9 ,0-10
Продолжительность пе- рерыва между импуль- сами Непре- рывная работа 5 мин 15 мин 30 мин 1 ч 8 ч 24 ч
Наиболее эффективно титановые насосы работают в области
давлений 10~6—10-9 Тор. При давлении выше 10~5 Тор титан
быстро расходуется вследствие очень быстрого насыщения по-
верхности газом.
ПОЛУЧЕНИЕ высокого ВАКУУМА
309
4.8.3. Характеристики сублимационного насоса
Расход титана в сублимационном насосе можно легко рас-
считать, имея в виду, что 1 г титана соответствует l/i& г-моля.
Так как одна молекула N2, О2, Н2 или СО2 связывается с двумя
атомами Ti, то теоретически 1 г титана поглощает '/эв г-моля,
т. е. 180 Тор-л этих газов. На практике эффективность исполь-
зования титана составляет ~2О°/о, а поэтому можно считать, что
1 г титана связывает ~40 Тор-л газов (при 300 К).
Фиг. 4.121. Сублимационный насос.
1—источник титановых паров (сублиматор);
2—кожух насоса, охлаждаемый водой;
3—источник газов; 4—экран; 5— магистраль
к диффузионному насосу, откачивающему
неактивные газы; б—ионизационный маио*
метр (частично экранированный).
Вода
Вода
7
На фиг. 4.121 представлена схема типичного сублимацион-
ного насоса, в котором основным элементом является источник
паров титана 1. Входной патрубок насоса соединяется с откачи-
ваемой емкостью, в которой находится источник газа 3 и мано-
метр 6\ к этой емкости параллельно подключен диффузионный
(или ионный) насос 5, который откачивает неактивные газы.
На фиг. 4.122 показан общий вид и представлены характери-
стики откачки сублимационного (верхняя кривая) и электрораз-
рядного (нижняя кривая) насосов Варшавского института про-
мышленной электроники.
Рабочее давление сублимационного насоса. Если в сублима-
ционном насосе поток газа из источника 3 (фиг. 4.121) равен
7г, то давление, измеряемое манометром 6, равно
___________________________7г 7ст
5днфф + ^субл '
(4.77)
310
ГЛАВА 4
где 5ДИфф и 3Субл обозначают скорости откачки диффузионного
и сублимационного насосов соответственно, а /ст— газовыделе-
ние из стенок системы.
10 s иг7
Фиг. 4.122. Блок сублимационного и электроразрядного насосов типа PST-1000
Варшавского института промышленной электроники.
Звозд=2800 л'с~5ц2=400Э л-с-1, Роо=Ю-10 Тор, Рмакс=,°_2 ТоР- температура про-
грева < 720 К, титановый сублиматор с четырьмя стержнями, ток ~40 А.
а—общий вид’(нижняя часть — электроразрядный насос, верхняя часть — сублимационный
насос); б—характеристики откачки сублимационного (прерывистая линия) и электрораз-
рядного (сплошная линия) насосов.
Перед появлением импульса газа из источника 3 и введе-
нием в действие сублимационного насоса давление в системе со-
ставляет
° дифф
(4.78)
С момента появления импульса газа и включения сублима-
ционного насоса давление описывается формулой
р" —_____,/ст______~________—_______ (4.79)
-’дифф + -’субл -’дифф + ^Субл
(так как/ст <С 7г) •
При большой величине 5Субл давление р" может стать малой
величиной нужного порядка. Однако с течением времени, по мере
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
311
увеличения степени заполнения поверхности титана газом, про-
исходит уменьшение 5субл, в связи с чем давление р" возрастает.
В работе сублимационных насосов различают два периода:
период низких давлений (р < 10-5 Тор), когда скорость откачки
ограничена проводимостью входа в насос, и период относительно
высоких давлений (р > 10-5 Тор), когда скорость откачки зави-
сит от скорости осаждения титана. При высоком давлении титан
испаряется быстрее, чем происходит его осаждение. Эти периоды
на фиг. 4.122,6 разделены прерывистой вертикальной линией.
Нижняя кривая представляет характеристику форвакуумного
электроразрядного насоса (со скоростью откачки в 10 раз мень-
шей), работающего вместе с сублимационным.
4.8.4. Низкотемпературные сублимационные насосы
На фиг. 4.123 представлен низкотемпературный сублима-
ционный насос (СЕА, Фонтэнэ-о-Роз, Франция) с сорбционной
поверхностью 12 000 см2, охлаждаемый жидким азотом; он ис-
пользуется вместе с 4-ступенчатым диффузионным насосом, ра-
Фиг. 4.123. Большой низкотемпера-
турный сублимационный насос
со скоростью откачки SH2 =
= 150 000 л-с-1 (по Прево и
СлеДзевскому, 1954 г.).
/ — кожух; 2 — азотная рубашка; 3—те-
плоизоляционный экран; 4—источник па-
ров титана; 5—токовывод; б —заливка
азота.
ботающим на силиконовом масле, с диаметром входа 60 см, ско-
ростью откачки воздуха (при р= 10-5 Тор) 10000 л-с-1 и во-'
Дорода 30 000 л-с-1. В этих условиях сублимационный насос
обеспечивает скорость откачки воздуха и водорода соответ-
ственно 127 000 и 150 000 л-с-1. Однако с учетом сопротивления
течению в трубах эти величины на входе в насос уменьшаются
роотцетствейно до 30 000 и 75000 л-с-1.
312
ГЛАВА 4
Емкость свеженапыленного слоя титана составляет ~1015
молекул на 1 см2. Мощность, потребляемая источником паров
титана, составляет 150 А-20 В = 3 кВт. После получения с по-
мощью диффузионного насоса давления 10-5—10~6 Тор и после
обезгаживания источника титана охладительная рубашка за-
полняется жидким азотом и приводится в действие сублима-
ционный насос. Через несколько минут давление снижается до
уровня 10-8—10-10 Тор.
Теоретическая скорость откачки низкотемпературного субли-
мационного насоса диаметром 3 м и высотой 4 м с сорбционной
поверхностью 18 м2 составляет ~2-106 л-с-1. На входе в насос
эта скорость уменьшается до 105 л-с-1. Насос в системе объе-
мом 600 м3 при потоке десорбции 0,4 Тор-л-с-1 создает разре-
жение ~ 10-5 Тор, потребляя 2 кг титана за 2000 ч работы. Пре-
дельное давление в системе составляет ~10-9 Тор.
Низкотемпературные сублимационные насосы наиболее
целесообразно использовать для откачки часто открываемых
вакуумных систем, в которых затем должен быть быстро создан
высокий вакуум.
В насосах этого типа некоторые затруднения создает титан,
осажденный на стенках. Из него образуются пласты, которые
отслаиваются и отпадают; их приходится время от времени уда-
лять химическим или механическим способом (например, прово-
лочной щеткой).
4.9. ИОННЫЕ НАСОСЫ
4.9.0. Принцип действия и классификация ионных насосов -
Прототипом ионных насосов является вакуумный манометр
Пеннинга (фиг. 5.62), в котором при измерениях давления про-
исходит заметное откачивание газов.
Это явление вызвано, с одной стороны, эффективной иониза-
цией газа благодаря присутствию магнитного поля (увеличи-
вающего путь ионизации электронов), а с другой, распылением
металла катода под влиянием бомбардировки его ионами.
Для откачки химически неактивных газов, особенно инерт-
ных, их частицам сообщают большие скорости; такие частицы
при столкновении с поверхностью металла внедряются в него, а
затем «замуровываются» слоями напыленного или осажденного
из паров металла. Ускорение частиц газа осуществляется с по-
мощью электрического поля после предварительной их иониза-
ции. Ионы же химически активных газов вступают в реакцию
с металлом катода.
ИонНые насосы подразделяют на насосы с горячим катодом
(термокатодные) и насосы с холодным катодом (электроразряд-
ные),
Получение высокого вакуума
313
4.9.1. Ионные насосы с горячим катодом
Простейшим ионным насосом с горячим катодом является
триодный вакуумный манометр (фиг. 5.36), в котором ионизация
происходит под влиянием бомбардировки молекул газа электро-
нами, движущимися между катодом и анодом. Образовавшиеся
ионы сорбируются на коллекторе и стенках баллона, чему бла-
гоприятствует слой напыленного на стенки катодного или анод-
ного металла.
Фиг. 4.124. Ионно-сублимационный
насос.
1—катушка с титановой проволокой, 2—на-
правляющая трубка; 3—тигель, являю-
щийся аиодом; К —катод, S—сетка;
А— анод.
Триодный вакуумный манометр применялся в прошлом (а
иногда применяется и в настоящее время) для получения очень
высокого вакуума в небольших объемах (Альперт). Оказы-
вается, однако, что эффективность действия насоса по отноше-
нию к активным газам определяется испарением металла. По-
этому ионный насос с горячим катодом не имеет самостоятель-
ного практического значения; его следует рассматривать скорее
как ионно-сублимационный насос, в котором обеспечивается
ионизация, необходимая для откачки химически неактивных
газов ').
4.9.1.1. Ионно-сублимационный насос с подачей титана.
Принципиальная схема ионно-сублимационного насоса с подачей
титана приведена на фиг. 4.124. Такой насос представляет собой
своего рода цилиндрический триод, в котором анод А имеет по-
тенциал около +1000 В, катод К в форме кольца — потенциал
около +100 В, а заземленный наружный цилиндр (корпус) иг-
рает роль приемного электрода для ионов, т. е. является элект-
родом, который откачивает газы. Вдоль оси системы электродов
установлена направляющая 2 для подачи титановой проволоки,
*) Насос этого типа при рабочем давлении порядка Ю-4 Тор быстро насы-
щается вследствие изменения знака заряда стенки по мере поглощения ею
газа Поэтому такой насос целесообразно использовать при давлении
~ 10~7 Тор и ниже. —- Прим ред.
314
ГЛАВА 4
которая, разматываясь с ролика, поступает в тигель 3. Тигель
(имеющий потенциал сетки) подогревается бомбардирующими
его электронами до температуры, необходимой для испарения
титана (см. табл. 3.9). Титан оседает на стенках корпуса насоса,
имеющего водяную рубашку или охлаждаемого змеевиком. Ско-
рость вращения ролика с проволокой регулируется снаружи.
Ионизация газа в насосе происходит под действием электронов,
эмиттируемых катодом. Ионизированные, возбужденные и дис-
6
Фиг. 4.125. Ионно-сублимационный насос (стеклянный).
а— схема; б—зависимость скорости откачки от давления для некоторых газов. С—кол-
лектор (прерывистой линией показан слой напыленного титана); А — анод, покрытый тита-
ном; К—катод.
социированные при этом газы связываются химически и физи-
чески на поверхности и в глубине материала, а также «замуро-
вываются» непрерывно оседающими парами титана.
Например, при испарении титана со скоростью 5 мг-с-1
скорости откачки различных газов будут следующими:
SH2 = 3000 л • с"1, Sn2 = 2000 л • с-1, So2= 1000 л • с"1, 5возд =
= 600 л-с-1, SAr = 5 л • с-1. Диаметр корпуса такого насоса
составляет ~40 см.
4.9.1.2. Ионно-сублимационные триодные насосы. На
фиг. 4.125, а представлен небольшой стеклянный насос, состоя-
щий из горячего катода, сетчатого анода и коллектора, образо-
ванного слоем титана на стенках баллона. Электроны из катода,
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
315
проскакивая через отверстия сетчатого анода, ионизируют газ.
Образовавшиеся положительные ионы под действием электри-
ческого поля движутся к коллектору, имеющему отрицательный
потенциал, и внедряются в его поверхность. При достаточно ин-
тенсивной бомбардировке анода электронами, эмиттируемыми
из катода, температура анода повышается, титан с его поверх-
ности сублимируется и, оседая на стенках (на коллекторе), «за-
муровывает» внедряющиеся в нее газы. Стенки баллона охлаж-
даются водой.
На фиг. 4.125,6 приведены кривые зависимости скорости
откачки от давления для некоторых газов.
4.9.1.З. Ионно-сублимационный насос с испарителем титана.
На фиг. 4.126 представлена схема небольшого стеклянного
ионно-сублимационного насоса, состоящего из испарителя ти-
тана (титановая проволока, намотанная на вольфрамовый стер-
жень), рабочего (Л') и запасного (К") катодов и коллектора С.
Титан, испаренный (сублимированный) путем нагревания вольф-
рамового стержня, оседает на стенках баллона и откачивает
активные газы. Электронный ток (~1 мА), текущий от катода
К' к испарителю Ti (имеющему потенциал +170 В относительно
катода), ионизирует газы, а образовавшиеся ионы, ускоряемые
электрическим полем, внедряются в слой титана на стенках, где
они, кроме того, могут быть замурованы непрерывно оседаю-
щим титаном. Коллектор (с потенциалом —30 В относительно
катода) можно использовать для измерения ионного тока (чув-
ствительность его ~10~3 А-Top-1). Напряжение на выходах
вольфрамового стержня испарителя составляет несколько вольт.
Скорость откачки (при одновременной ионизации) различных
газов этим насосом следующая: для азота 8 л-с-1, гелия
1,2 л-с-1, аргона 0,5 л-с-1; без ионизации скорость откачки для
азота составляет 4 л-с-1.
4.9.1.4. Электростатический ионно-сублимационный насос.
Принцип действия и конструкция электростатического (с ра-
диальным электростатическим полем) ионно-сублимационного
насоса ясны из фиг. 4.127.
Насос состоит из коллектора в виде трубы С, стержневого
титанового анода с положительным потенциалом порядка не-
скольких тысяч вольт и вольфрамового катода К с потенциалом,
близким к потенциалу цилиндрического коллектора. Вольфра-
мовый катод установлен и заэкранирован таким образом и имеет
такой потенциал, что испускаемые им электроны попадают на
титановый анод не кратчайшим путем, а по спиральным траек-
ториям между стержнем анода и цилиндром, вследствие чего
путь ионизации значительно удлиняется. Ионизированные ча-
316
ГЛАВА 4
стицы с большими скоростями ударяют в слой напыленного ти-
тана на цилиндре С, где они химически связываются, или же
внедряются в глубь материала и покрываются вновь напыляе-
мыми слоями титана.
Электроны же после прохождения длинного пути, увеличи-
вающего вероятность столкновений с молекулами, бомбарди-
руют титановый анод и нагревают и распыляют титан. Скорость
откачки азота насосом с диаметром входа ~ 100 мм и высотой
Фиг. 4.126. Небольшой ионно-субли-
мационный насос (стеклянный).
К', К"—катоды; С—коллектор; A(Ti)—по
крытый титаном анод.
Фиг. 4.127. Электростатический
ионно-сублимационный насос (Вар-
шавский институт промышленной
электроники).
К—катод; A (Ti)—титановая проволока
(анод); С —коллектор с напыленным слоем
титана; Е', Е"—экраны.
~500 мм при давлении 10-7 Тор составляет ~400 л-с-1. Насос
работает начиная от давления ~ 10-3 Тор. Анодный ток насоса
не превышает 40 мА (при напряжении 5 кВ), расход охлаждаю-
щей воды составляет ~0,5 л-мин-1.
Схема и конструкция современного электростатического
ионно-сублимационного насоса представлена на фиг. 4.128. Этот
насос состоит из четырех элементов, между которыми находится
подогреваемый титановый сублиматор. Весь этот комплект по-
мещен в охлаждаемом водой корпусе, стенки которого покрыты
изнутри осажденным из пара титаном и представляют собой
сорбирующую поверхность.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
317
Комплект четырех сублимационных элементов со стороны
входа насоса защищен отражателем с тремя поверхностями, эк-
ранирующим пространство высокого вакуума от теплового из-
Фиг. 4.128. Четырехсекцианный
электростатический ионно-сублимационный
насос.
а—схема; б—конструкция насоса типа РО-2000 в исполнении Варшавского института про-
мышленной электроники.
TI—титановый сублиматор (с подогревателями внутри), Л —анодные стержни; К—катоды
(рабочие и запасные), S—сетки (соединенные с катодами); С—корпус (являющийся кол-
лектором).
Характеристики: 3^=3^ са 3000 л-с-1, 5вОЗд=120Э л-с-1, Здг=25 л.с-1 (при
р=10-6 Тор), роо=5-10-10 Тор, Рмакс — Ю—3 Тор, анодное напряжение 7 кВ, ресурс
работы анодов —около 1003 ч; диаметр входа 270 мм, максимальная температура про-
грева 720 К; потребляемая мощность 1 кВт, вес 25 кг.
1—корпус; 2—фланец; 3— прокладка; 4 — водяная рубашка, 5—стенки камер, 6—стержень
анода; 7—вывод анода; 8 — верхний захват стержня; 9—титан; 10—эмиттер электронов,
11—экран.
лучения (~1 кВт), а также предохраняющим от напыления ти-
тана.
Сублимационные элементы состоят из цилиндрических сеток
S, стержневых анодов А и катодов К (один резервный). Корпус
насоса, являющийся коллектором С, заземлен и имеет отрица-
318
ГЛАВА 4
тельный потенциал —370 В относительно сеток; аноды имеют
положительный потенциал +4000 В относительно сеток (т. е.
+4370 В относительно земли); катоды соединены с сетками.
Электроны выходят с катода к аноду со скоростями, близкими
к нулю. Катоды (небольшой длины) помещены на точно рассчи-
танном расстоянии от анодов. Сублиматор из бериллиевой кера-
мики ВеО имеет форму цилиндрического стержня, содержащего
6 подогревателей, помещенных в соответствующих полостях. Ке-
рамический стержень покрыт молибденовой фольгой, на кото-
рую нанесен слой титана. Мощность подогревателя составляет
750 Вт (15 А, 50 В). Испарение титана происходит непрерывно
независимо от ионизационного разряда, поэтому в приборе не
наблюдается явления так называемой аргонной нестабильности
(см. разд. 4.9.2.1). При диаметре входа в насос 150 мм скорость
откачки N2 составляет ~ 1700 л-с-1, Аг — около 25 л-с-1.
Одним из достоинств электростатических ионно-сублимацион-
ных насосов является малое сопротивление потоку газа от входа
к сорбирующим поверхностям в противоположность магнитным
электроразрядным насосам, где — ввиду необходимости созда-
ния узких щелей в магнитном поле — поток газа, проходящего
через эти щели, испытывает большое сопротивление течению.
На фиг. 4.128,6 представлен такой насос Варшавского инсти-
тута промышленной электроники.
4.9.2. Ионные насосы с холодным катодом
В ионных насосах с холодным катодом под действием высо-
кого напряжения в разреженном газе между двумя электродами
появляется электрический тлеющий разряд. При этом происхо-
дит ионизация газа, в результате чего образуются ионы и элек-
троны. Разряд в газе поддерживается благодаря тому, что ионы,
ударяясь о поверхность катода, вызывают эмиссию из него элек-
тронов. Эмиссия электронов приводит к дальнейшей ионизации-,
газа, которая в свою очередь способствует эмиссии электронов.
Такой процесс называется тлеющим разрядом. Тлеющий разряд
легче возникает в присутствии магнитного поля.
Проходящий через насос электрический ток образован глав-
ным образом электронами (которые обладают значительно боль-
шей подвижностью, чем ионы) и приблизительно пропорциона-,
лен давлению газа !).
При возникновении тлеющего разряда катод подвергается
распылению, а распыленный металл, оседая на стенках насоса,,
электродах и т. п., действует как чистая сорбирующая поверх-
’) Более подробный анализ подвижности электронов и ионов, а также опи-
саиие механизмов разряда и откачного действия ионных насосов- приведены-
В приложении, — Прим, рвд, +
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
319
ность (фиг. 4.129). Распыление металла в присутствии электри-
ческого поля (т. е. в условиях ионизации) обеспечивает хорошее
откачивание газов, главным образом активных и в определенной
степени неактивных, причем неактивные газы удаляются в ре-
зультате их внедрения в поверхность и замуровывания напыляе-
мым металлом.
Количество распыляемого металла приблизительно пропор-
ционально току (и, следовательно, давлению газа); это озна-
чает, что распыление металла саморегулируется в зависимости
от состояния вакуума. Величина разрядного тока является в не-
которой степени мерой давления в откачиваемой системе.
Эффект откачивания значительно улучшается, если разряд
происходит в магнитном поле (магнитные электроразрядные на-
сосы). Это происходит потому, что значительно удлиняется путь
электронов от катода к аноду и увеличивается вследствие этого
количество столкновений электронов с молекулами, а следова-
тельно, и число ионов, образованных одним электроном. Ввиду
этого в насосах с тлеющим разрядом применяется магнитное
поле соответствующей величины (несколько сотых теслы) и на-
правления (перпендикулярно плоскости электродов).
Различают два вида тлеющего разряда. При низком давле-
нии (р < 10~4 Тор) разряд является типично тлеющим в виде
столба, а распыление катода при таком разряде происходит
в небольшой области типа кратера. В области более высоких
давлений (р > 10~3 Тор) разряд переходит в дуговой и запол-
няет всю вакуумную систему, причем металл распыляется с боль-
шой поверхности катода.
Для давлений в области 10-4 < р < 10-3 Тор мощность, вы-
деляемая в насосе, возрастает и электроды сильно нагреваются,
в результате чего интенсивно выделяются газы, адсорбирован-
ные на электродах. Зависимости тока I, напряжения U и мощ-
ности тока Р от давления р представлены на фиг. 4.130.
Обычно магнитные электроразрядные насосы работают в об-
ласти давлений ниже 10~4 Тор.
4.9.2.1. Электроразрядные двухэлектродные насосы. Глав-
ным элементом двухэлектродного электроразрядного насоса яв-
ляется устройство типа показанного на фиг. 4.129. На фиг. 4.131
представлено другое конструктивное решение такого устройства.
Разряд происходит между двумя электродами (холодными): ци-
линдрическим анодом А и катодом К в виде двух пластинок.
Электроды помещены в магнитном поле с индукцией В, на-
правленном вдоль оси системы электродов. В результате бом-
бардировки катодов ионами металл распыляется и покрывает
тонким слоем анод и стенки баллона. В качестве материала для
электродов, в первую очередь катодов, обычно применяется титан.
© Ион
Атом
О (молепула) газа
о Электрон
ф Атом титана
Фиг. 4.129 Электроразрядный диодный насос (с холодными электродами).
А-цилиндрический анод Ki, Кз—два элемента титанового катода, В —индукция магнит
Фиг.
4.130. Зависимость параметров электроразрядного насоса от давления.
Фиг. 4.131. Магнитный электроразрядный насос.
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
321
Напряжение между анодом и катодом находится в преде-
лах 2—10 кВ, а магнитная индукция — в пределах 0,01—0,2 Т.
Для получения большой скорости откачки соединяют парал-
лельно большое число откачивающих элементов. Обычно анод
имеет ячеистую конструкцию (наподобие восковых сот —
фиг. 4.131, 4.132), а катод состоит из двух титановых пластинок,
расположенных по обе стороны анода. Вся анодно-катодная
система помещена в пространство между полюсами сильного
постоянного магнита. Перед прогревом насоса эти магниты
обычно снимаются.
В процессе разряда распыляемый из катода титан оседает
на аноде, на противоположном катоде, а также на поверхностях
корпуса насоса, связывая химически активные газы. Неактивные
газы также частично адсорбируются, благодаря тому что их
ионы после ускорения в магнитном поле внедряются в поверх-
ность катодов.
Титановый катод в местах, расположенных напротив отвер-
стий в анодах, подвергается постепенной эрозии (ресурс работы
катода составляет ~ 50 000 ч). В местах, соответствующих пе-
регородкам, происходит утолщение катода в результате осажде-
ния титана (который замуровывает там неактивные газы). Этот
эффект показан на фиг. 4.132, а.
Механизм откачивания электроразрядного двухэлектродного
насоса довольно сложен и часто различается для разных газов.
Активные газы (N2, О2) химически связываются с титаном, об-
разуя окислы или нитриды, устойчивые при температурах до
1800 К. Энергия ионов легких газов (Н2, Не, дейтерий, тритий)
недостаточна для того, чтобы распылять титан; эти ионы после
соударения с поверхностью титана диффундируют в глубь него.
Более тяжелые инертные газы (например, Аг, Хе) замуровы-
ваются металлом, распыляемым с противоположной пластинки
катода. Неактивные сложные газы подвергаются разложению
в электрическом разряде (например, СН4 разлагается на С и
Н2) и откачиваются, как простые газы; при этом углерод осаж-
дается в виде твердого вещества/ Вследствие диффузии легких
газов в глубь катода происходит постепенное насыщение катода
и эффективность откачки этих газов со временем уменьшается;
поэтому для регенерации насоса требуется его длительный про-
грев в вакууме Из вышесказанного следует, что скорости от-
качки насосом разных газов могут значительно различаться ме-
жду собой. В табл. 4.19 приведены значения скоростей откачки
различных газов, отнесенные к скорости откачки воздуха.
Для давлений выше 5-10~5 Тор скорости откачки невелики;
они возрастают по мере снижения давления и при р —5- 10-6Тор
достигают максимума, а зачем снова уменьшаются (вдвое при
давлении ~5-10~10 Тор).
Фиг. 4.132. Различные конструктивные схемы магнитного электроразрядно/
насоса.
А—анод, К —титановый катод; О—корпус, / — изолятор; В—индукция магнитного по.
(несколько сотых долей теслы), напряжение разряда—несколько киловольт.
а —диодный насос с плоским катодом / — кратер, 2—утолщение катода в результг
осаждения титана, б —диодный насос с ребристым катодом, в—триодный насос с ренн
чатым или сетчатым катодом (прерывистыми линиями показан напыленный титан като,
замуровывающий газы на стенке корпуса).
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
323
Таблица 4.19
Эффективность откачки различных газов диодными и триодными
электроразрядными насосами
\ Газ X. (пар) Насос X. Jh2 Дей- рий сн4 Пары масел н2о со2 Воз дух n2 о2 Ne Не Аг
Диодный насос 2,7 1,9 1,5 1-1,6 1 1 1 0,9 0,6 0,12 0,1 0,01
Триодный насос 2,0 0,15 0,1-0,3 0,1-0,3
Особенно много забот при откачке доставляет аргон, содер-
жание которого в воздухе составляет ~1%. Так как скорость
откачки аргона примерно в 100 раз меньше скорости откачки
воздуха, в насосе постоянно имеется избыток аргона. Аргон
откачивается путем замуровывания его ионов в поверхность ка-
тода (вне кратеров) вплоть до момента насыщения. После этого
ионы аргона, ударяющиеся о поверхность титана, начинают ос-
вобождать замурованные ранее ионы; в результате происходит
повышение давления, затем интенсивное распыление титана и
снова быстрое откачивание аргона, вплоть до следующего мо-
мента насыщения. Это явление свойственно диодным насосам
и называется аргонной нестабильностью.
4.9.2.2. Электроразрядный насос с ребристым катодом').
В определенной степени лишен недостатка аргонной нестабиль-
ности электроразрядный насос сребристым катодом (фиг. 4.132, б).
Часть ионов аргона, бомбардирующих катод, попадает на по-
верхности катодных ребер, а часть на дно ячеек. Поскольку
распыление с боковых поверхностей ребер происходит более ин-
тенсивно (благодаря более благоприятным углам распыления),
аргон эффективнее замуровывается на дне ячеек между
ребрами, вследствие чего откачка аргона и других, более тяже-
лых инертных газов происходит быстрее, чем в насосе с плоским
катодом.
4.9.2.3, Триодные электроразрядные насосы. Усовершенство-
ванным электроразрядный насосом, эффективно откачивающим
инертные газы, является триодный насос, в котором катод играет
роль только источника титана, а сорбирующей поверхностью
является стенка насоса (фиг. 4.132, в).
') Другие типы электроразрядных насосов, в которых устранена аргонная
нестабильность, описаны в приложении. — Прим. ред.
11*
324
ГЛАВА 4
Триодный насос действует следующим образом Положи-
тельные ионы, возникающие в межэлектродном пространстве,
двигаясь к катоду по винтовым траекториям, проходят через
отверстия решетчатого (или сетчатого) катода, входят в тормо-
зящее электрическое поле и с небольшими скоростями достигают
стенок корпуса, где они нейтрализуются и адсорбируются Часть
ионов, имеющих повышенные скорости, попадает на катод и рас-
пыляет с него титан, который осаждается на стенке корпуса,
фиг 4 133 Триодный элекзрораз-
рядный цилиндрический насос
с постоянными магнитами в герме-
тическом кожухе
М—постоянный магнит А —анод, К—ка-
тод, С — коллектор (кожух магнита).
замуровывает находящиеся на ней газы и одновременно обра-
зует чистую поверхность титана, связывающую активные газы.
В таких условиях замурованные газы не будут высвобождаться, а
это значит, что триодный насос откачивает неактивные газы во
много раз более эффективно, чем диодный (примерно в 20 раз).
Пример конструкции триодного электроразрядного насоса
с тлеющим разрядом представлен на фиг 4 133 Четыре постоян-
ных магнита, закрытых герметически немагнитным кожухом (из
нержавеющей стали), создают в четырех щелях магнитное поле
с индукцией ~0,02Т. В этих щелях помещены секции триодных
насосов, каждая из которых состоит из одного крупноячеечного
анода и двух мелкоячеечных катодов. Роль сорбирующих стенок
исполняют кожухи магнитов. Потенциал катода (отрицательный)
составляет ~ 5000 В, остальные электроды заземлены
На фиг. 4 134 представлена типовая характеристика насоса
с номинальной скоростью откачки ~ 120 л-с”1, вес этого на-
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
325
coca составляет —60 кг, диаметр 300 мм, высота 300 мм Насос
снабжен блоком кондиционирования энергии, вырабатывающим
высокое напряжение питания и обеспечивающим автоматическое
регулирование мощности
Фиг. 4 134 Характеристики откачки воздуха и аргона магнитным электро-
разрядным насосом,
$возд, •S'ArСКОР°СТИ откачки воздуха и аргона, /р —разрядный ток.
Фиг 4 135 Откачивающая система с ионным насосом (GEC — AEI, Велико
британия).
/ — насосная камера, содержащая низкотемпературный сублимационный и ионный насосы
2—рабочая вакуумная камера (вакуумный колокол), 3— агрегат из трех цеолитовых насо
сов, 4—теплоизоляционные экраны, 5 —подъемник для снятия колокола 6 — наблюдатель-
ное окно, 7—клапан прогрева, 8—отверстия для подключения вакуумметров, сублиматоров
ит.д, 9—термоэлектрический вакуумметр, 10— клапан, 11 — вентиль впуска воздуха,
12—коллекторная магистраль, /<?—контрольно-измерительный шкаф.
Максимальные скорости откачки триодных электроразряд-
ных насосов составляют 10—500 л-с"1. Насосы без кожуха
имеют на 10—20% большую скорость откачки Насос (после
снятия постоянных магнитов) можно прогревать до 1120—
326
ГЛАВА 4
ИЗО к. Эти насосы нельзя употреблять при давлении выше
10~6 Тор. Насос полностью стабильно работает при давлениях
ниже 10-7 Тор. Представленная на фиг. 4.134 прерывистая кри-
вая иллюстрирует типичную зависимость электрического тока
в цепи насоса от давления. Этот ток приблизительно пропор-
ционален размерам насоса (и скорости откачки).
Фиг 4.'36. Характеристика ско-
рости откачки высоковакуум-
ной откачивающей системы,
состоящей из цеолитовых,
сублимационного и ионного на-
сосов (по Крейгу, 1968 г.).
I—включение трех цеолитовых насо-
сов, II— включение нагрева ионного
насоса и вакуумюй камеры, III—вы-
ключение нагрева ионного насоса,
/V —включение иошого и сублима-
ционного иасосов, /—включение на-
грева камеры, // — подача жидкого
азота в сублимационный насос.
Недостатками триодных насосов по сравнению с диодными
являются повышенный износ сетчатого катода, более быстрый
нагрев насоса при работе и более значительная десорбция газов.
На фиг. 4.135 показана типовая откачивающая система, в ко-
торую входит ионный насос. Эта система состоит из трех цеоли-
товых насосов (включенных последовательно) и вакуумной ка-
меры, в которой помещаются низкотемпературный сублимацион-
ный и ионный насосы. На фиг. 4.136 представлена характери-
стика скорости откачки этой системы.
4.10. ЭКСПЛУАТАЦИОННЫЕ ХАРАКТЕРИСТИКИ
СОРБЦИОННЫХ НАСОСОВ
Сорбционные насосы обладают двумя важными достоин-
ствами: они не требуют использования рабочего вещества (кото-
рое вводит собственные пары в откачиваемое пространство),
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
327
а также не имеют подвижных элементов. Недостатком их яв-
ляется возможность частичной десорбции откачиваемых газов
в случае остановки насоса, например при прекращении подачи
криогенного охладителя, выключении напряжения и т. п.
Однако основным достоинством сорбционных насосов счи-
тается отсутствие в них паров органических веществ, что яв-
ляется главным требованием для высокочистых вакуумных
систем. В настоящее время большинство исследовательских тех-
нологических процессов и все большее количество производствен-
ных процессов проводится с использованием вакуума, создавае-
мого сорбционными насосами, которые включаются после фор-
вакуумных и цеолитовых насосов.
4.11. ЗАКЛЮЧИТЕЛЬНЫЕ ЗАМЕЧАНИЯ О СОРБЦИОННЫХ
НАСОСАХ
Различают два крайних режима откачки: динамический и
статический. В связи с этим основное уравнение насоса, выра-
жающее давление в системе, может быть представлено следую-
щим образом:
р = (4.80)
В динамическом режиме /ДИн(>/ст) является интенсив-
ностью газового потока, который откачивается при работе
Таблица 4.20
Условия получения желаемого вакуума
Чтобы получить в системе Следует применять Получае- мое предель* ное давление* Тор
рабочее давление, Тор при г азовы- делении мате- риалы масло охлаж- даемый водой отража тель охлаж- даемую ловушку с жидким n2 прогрев
10-4-10-6 Слабом Пласт- массы Качест- венные Масла (силикон С 704) Отдельный Нет Het 10-г
Среднем Отдель- ный, а также охлаждае- мый фреоном
Сильном Двойной Да До 420 К Др 770 К
10—б—10~8 Слабом Качест- венные эласто- меры Силикон DC 705 10~9 10-П
10“8— К)-10 Металли- ческие
ПОЛУЧЕНИЕ ВЫСОКОГО ВАКУУМА
329
_ Таблица 4.2! - Рабочие давления и скорости откачки различных вакуумных насосов Скорое гь откачки, л-с-1 О О © О _ О о _ с о о 8 g g 8 8 8 g § § О 7 2 ° 8 । о ° 8 g g g юg ю J. ± i 1111 1 о 3 о g 1Л — Ю—Н5 Ю 1=3 ОЭ
Давление, Тор 7 7 о 7. сь 1 о «0 1^ 7^ <о 1 о СО k сч 1 о 7 о сч о f t t
| | + + +
f + + + + +
+ + + + + +
+ 1 + + + + +
+ + + + + +
+ + + + + + +
ф ++^+ + + +
| + ф ^ + + + +
f + ++ 4 + + 4
+ + ++ ++
+ + ++ +
। + + + + 1
+ + + 1 + V
t + + + + 4- +
Насосы 0> 0> S ' • 3 3 и " §• ® « я О Я R Я й S а> Ч Ч Ч 5 3 О О <и о а о и 3 S g И § •S S ® я o>So> з . га ® о О a, S 3 3 £ 3 g « g ® B3g3^w®g.M®gg»soS §а> 3 KSMogS&SaOgogSs «о 3 S2§o3§o.£.§43g.S5ssgs ►> я М Ч н f * в о Ч схФ 2 \о ЭД ® S оой2о^о'®аз<1,0>^^®0к*>»ааооэд« и и К а. а. Ч и S52
вакуумной системы в условиях, далеких от предельного давле-
ния Р<х>
Поскольку /дия /Ст, рабочее давление на входе в насос
можно выразить соотношением
(4.81)
О
В случае смеси п газов уравнение (4.81) следует записать
в виде
p = (4.82)
1
Для статического режима, когда приток газа мал (/ДИн —0),
справедливо соотношение
роо=^. (4.83)
В этом случае поток газа /ст фактически представляет собой
поток десорбции системы /дес.
Однако значительно чаще встречаются промежуточные ре-
жимы, заключающиеся между указанными двумя крайними, а
величина /ст (т. е. /дес) зависит от многих факторов и, кроме
того, от «истории» изменения давления в системе.
В табл. 4.20 указано, какие насосы следует применить и при
каких начальных условиях для получения требуемых характе-
ристик вакуума. В табл. 4.21 приведены оптимальные и предель-
ные диапазоны рабочих давлений для разных насосов.
5. Вакуумные
измерения
Виды измерений. Наиболее важной из величин, измеряемых
в технике вакуума, является давление. Измерения других вели*
чин, встречающихся в технике вакуума, также обычно сводятся
к измерению давления. Например, расход часто вычисляют по
перепаду давлений р2— pi в трубопроводе, проводимость кото-
рого G определяют на основании его геометрических размеров.
Для определения других величин пользуются основными урав-
нениями, которые связывают проводимость трубопровода G с по-
током I и объемную скорость течения 5 с давлениями р\ и р2:
I~G(P2 — P^ — Sipi —§2р2- (5.1)
Поток
<5-2’
ZAT \ ZAT /р \ UT /у
может быть определен при постоянном давлении через дополни-
тельный объем газа AV, введенного в сосуд за время Дт, или же
при постоянном объеме — через изменение давления Др за время
Дт. Для определения потока этим методом необходимо измерять
давление и время течения, а также знать объем.
Таким образом, параметры вакуума либо измеряют непос-
редственно специально предназначенными для этого приборами,
либо определяют косвенно по результатам измерения соответ-
ствующих величин. Для этого исследуемые системы и агрегаты
оборудуются измерительной аппаратурой.
В случае атмосферы, состоящей только из одного газа, изме-
ряемое общее (полное) давление эквивалентно парциальному.
В смеси газов часто приходится измерять парциальные давления
ее составляющих, что требует применения специальных более
сложных приборов.
Аналогичные несколько упрощенные приборы применяют для
обнаружения негерметичностей в вакуумной аппаратуре. Эта
процедура имеет большое практическое значение при эксплуа-
тации вакуумных устройств.
Вакуумные Измерения
331
А. ИЗМЕРЕНИЕ ПОЛНЫХ ДАВЛЕНИИ
Приборы, служащие для измерения полного давления в ва-
куумных системах, называются вакуумметрами (вакуумными
манометрами).
Манометры и их классификация. Ввиду большого диапазона
измеряемых давлений газов (10~3—10-14 Тор) как измеритель-
ные приборы, так и методы измерения очень разнообразны и за-
висят от величины измеряемого давления и условий применения
прибора. Для измерения давления используются различные яв-
ления, в которых проявляется зависимость какой-либо физиче-
ской величины, поддающейся измерению, от давления газа. Так, в
барометрических и компрессионных манометрах непосредственно
измеряются механические силы, действующие на чувстви-
тельный элемент со стороны молекул газа; в термомолекуляр-
ных— также механические силы, соответствующие повышен-
ной энергии нагретого газа; в теплоэлектрических манометрах
используется зависимость теплопроводности газов от давления;
в вязкостных манометрах — зависимость внутреннего трения
разреженных газов от давления; в ионизационних манометрах—
ток ионов, возникающий при ионизации газа и являющийся ме-
рой концентрации газа, и т. п.
5.1. БАРОМЕТРИЧЕСКИЕ МАНОМЕТРЫ
Самым простым и давно применяющимся прибором, служа-
щим для измерения давления, является барометрический мано-
метр (фиг. 5.1). Он состоит из двух сообщающихся сосудов, об-
разованных 17-образной стеклянной трубкой (установленной
вертикально); конец более короткого колена трубки сообщается
с резервуаром 2, наполненным ртутью, второй же конец соеди-
няется с пространством, где измеряется давление.
Разность высот столбов ртути определяет, собственно, раз-
ницу давлений: атмосферного ра, действующего на ртуть в ре-
зервуаре 2, и измеряемого давления р, действующего на ртуть
в трубке 1.
Когда давление р равно атмосферному давлению ра, в обоих
коленах трубки давления одинаковы и разность высот столбов
ртути h равна нулю. Когда давление р уменьшается, разность
высот h увеличивается и при р — 0 становится равной высоте
барометрического столба ртути, соответствующей существую-
щему в данный момент давлению атмосферы (~760 мм). Так
как атмосферное давление подвергается колебаниям, измерение
таким способом давлений, близких к нулю, связано с большими
погрешностями, и поэтому вакуумметр описанного типа не при-
меняется для измерения низких давлений.
332
ГЛАВА 5
Другие измерительные ошибки в барометрических маномет-
рах возникают при отсчете уровней ртути благодаря наличию
менисков ртути и оптическому преломлению в стекле. Форма
мениска зависит от диаметра трубки, а также от состояния ее
поверхности. При одинаковых менисках в двух коленах трубки
погрешность измерений меньше.
5.1.1. Барометрический манометр с запаянным коленом
Более удобным для измерения низких давлений является ба-
рометрический манометр с запаянным коленом, представленный
на фиг. 5.2. Одно колено манометра образует запаянная трубка,
Фиг. 5.1. Барометрический манометр
(Л = ра при р = 0).
1 —измерительная трубка; 2—резервуар
ртути; р —измеряемое давление.
Фиг. 5.2. Барометрический манометр
с закрытым коленом (h = 0 при
р = 0).
р— измеряемое давление.
а другое — трубка, соединяющаяся с пространством измеряе-
мого давления. В запаянном колене давление газов равно нулю,
так как сначала трубка целиком заполняется ртутью, а при
понижении уровня ртути в запаянном колене создается торри-
челлева пустота.
Так как на столб ртути в левом колене манометра фиг. 5.2,
кроме силы тяжести, никакие силы не действуют, а давление
паров ртути в обоих коленах одинаково, то разность высот стол-
бов ртути, т. е. высота h, является мерой давления газа р, кото-
рое действует на правый столб. Это давление выражается в мил-
лиметрах ртутного столба. Когда давление уменьшается до
нуля, правый столб поднимается, а левый опускается так, что
h становится равной нулю1).
') Если при р = 0 получается величина h < 0, то это значит, что вслед-
ствие плохого обезгаживания ртути (а также стекла, из которого сделана
трубка манометра) давление газа в левом колене не равно нулю.
вакуумные Измерения
333
Теоретически наиболее низкое давление, которое можно
измерять этим манометром, зависит от минимальной разности
высот h, которую можно определить. На практике ввиду появле-
ния дополнительных погрешностей (например, разное поверх-
ностное натяжение ртути в коленах манометра) измерения дав-
ления ниже нескольких тор становятся ненадежными.
5.1.2. Укороченный барометрический манометр
При измерениях форвакуумных давлений нет необходимости
пользоваться барометрическим манометром с полной высотой
колена (760 мм). В этих случаях применяется укороченный ва-
куумный манометр с U-образной трубкой (фиг. 5.3, а) или с ко-
аксиальными трубками (фиг. 5.3,6).
При уменьшении измеряемого давления в определенном диа-
пазоне, начиная от атмосферного, уровень ртути в барометре не
изменяется; при дальнейшем уменьшении давления столб ртути
в левом колене понижается (фиг. 5.3, а) и при р = 0 уровни
ртути в обоих коленах выравниваются.
Для более точного отсчета разности уровней ртути часто
применяют передвижную зеркальную шкалу.
5.1.3. Масляный барометрический манометр
В некоторых случаях ртуть заменяют специальным маслом
(с низким давлением паров). Это позволяет избавиться от паров
ртути и получить в 10—20 раз большую чувствительность ва-
куумного манометра (вследствие меньшей плотности масла;
плотность масла составляет ~ 1 г-см-3, тогда как ртути
13,6 г-см-3). Однако существенным недостатком масла по срав-
нению со ртутью является смачивание им стекла, а возникаю-
щий при этом вогнутый мениск, а также медленное стекание
масла по стенкам создают определенные трудности при отсчете
уровня. Другим недостатком является значительное растворение
газов и паров в масле; это влечет за собой необходимость регу-
лярного откачивания газов из пространства в закрытом колене
манометра (что связано с прогревом манометра под вакуумом)
и требует применения дополнительных кранов и частых манипу-
ляций с ними (фиг. 5.4).
5.1.4. Оптико-интерференционные методы измерения
разности уровней жидкости
В некоторых случаях находят применение оптико-интерфе-
ренционные методы измерения разности уровней жидкости
(ртути или масла с низким давлением паров) в сообщающихся
сосудах манометра. Над жидкостью, в одном из колен, создают
Фиг. 5.3. Укороченный ртутный барометрический манометр.
а — U-образный; б—с коаксиальными трубками.
Фиг. 5.4. Укороченный масляный барометрический манометр.
а—с двумя кранами (краны показаны в положении, соответствующем откачке газа из ма-
нометра, для проведения измерений правый кран следует повернуть на 90°, а левый —
на 180°), б — с одним двухходовым краном (кран показан в положении откачки, для изме<
рений кран повернуть на 180°).
р—измеряемое давление. Измерения производятся после предварительного прогрева тру-
бок вместе с маслом и создания вакуума с давлением Рвак^Р над маслом в закрытом
колене»
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
335
как можно более низкое давление, а в другое колено вводят
газ с измеряемым давлением.
Если на поверхностях жидкости в обоих коленах поместить
зеркала, на которые направить два когерентных луча света (из
одного источника), то интерференция после их отражения позво-
ляет очень точно определить разность уровней жидкости, возник-
шую под действием измеряемого давления.
Манометры такого типа дают возможность измерять абсо-
лютные давления ~ 10-6 Тор. Однако они чувствительны к со-
трясениям и колебаниям температуры; поэтому обычно их при-
меняют в лабораторных условиях.
5.1.5- Ртутный поплавковый манометр
Ртутный поплавковый манометр (фиг. 5.5) позволяет непо-
средственно и непрерывно измерять давления газов и паров до
10~!0 Тор. Важным элементом такого манометра является по-
плавок 1, находящийся на по-
верхности ртути, которая запол-
няет частично сосуд 3 (стеклян-
ный или металлический) мано-
метра. Поплавок снабжен несу-
щим кольцом 2 и балластом 4,
подобранным таким образом, что-
бы центр тяжести поплавка на-
ходился значительно ниже его
Фиг. 5.5. Ртутный поплавковый мано-
метр типа FG В. Рурского (Лаборато-
рия электронной технологии Варшав-
ского политехнического института).
Поплавок с несущим кольцом (нагруженный
балластом) плавает в ртути, которая отделяет
область измеряемого давления от области
вспомогательного вакуума (с давлением значи-
тельно ниже измеряемого), глубина погруже-
ния поплавка является мерой давления
1— поплавок, 2 — несущее кольцо поплавка,
3— корпус манометра, 4—балласт поплавка
центра давления; это обеспечивает стабильность вертикального
положения поплавка и сводит к минимуму его трение об обо-
лочку.
Когда внутри и снаружи поплавка давление одинаково,
он находится р самом верхнем положении. При повышении
33f>
ГЛАВА 5
измеряемого давления поплавок погружается в ртуть на допол-
нительную глубину Н, на которой устанавливается равновесие
силы давления газа на поверхность поплавка и выталкивающей
силы, действующей на поплавок Трубка, введенная внутрь по-
плавка, поддерживает в нем давление, намного более низкое,
чем измеряемое.
Коэффициент с, представляющий отношение глубины Н до-
полнительного погружения к величине измеряемого давления р,
может быть рассчитан по формуле
с ~ V = D2 - d2 ’ (5’3)
где d — внутренний диаметр поплавка (d = 2r), a D — внешний
диаметр поплавка [D = 2(г 4-б)],
7-/4 +1-1; (5.4)
здесь 5 — толщина стенки поплавка, г — его внутренний радиус.
Из формулы 5.4 можно рассчитать для разных значений
коэффициента с соответствующие значения отношения б/г
(табл 5 1).
Таблица 5.1
Зависимость коэффициента с от отношения б/г в поплавковом
ртутном манометре
С 1 2 5 10 20 50 100 1000
б/г 0,4142 0,2247 0,0954 0,0488 0,0247 0,00995 0,00499 0,0005
Поплавковый ртутный манометр в зависимости от его типа
позволяет производить измерения в пределах любых трех сосед-
них декад в диапазоне 10—10~4 Тор. Важнейшим достоинством
такого манометра является возможность непосредственного из-
мерения давления независимо от рода газа и без искажения
измеряемой величины. Манометр этого рода не требует градуи-
ровки, так как коэффициент с можно определить непосред-
ственно по размерам поплавка (или путем измерения силы, не-
обходимой для определенного его погружения).
5.2. МЕХАНИЧЕСКИЕ МАНОМЕТРЫ
В механических (деформационных) манометрах давление
газа определяется по вызванной им деформации какой-либо уп-
ругой детали, Различают манометры мембранные и трубчатые.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
337
В мембранных манометрах (фиг. 5.6, а) под действием дав-
ления газа прогибается тонкая упругая мембрана 1 (например,
круговая, часто концентрически гофрированная). Мембрана по-
средством рычага 4 и передачи 2 воздействует на стрелку 3 ма-
нометра. С одной стороны мембраны имеет место известное эта-
лонное давление, а с другой — измеряемое. Эталонное давление
обычно значительно ниже измеряемого.
Фиг. 5.6. Механические манометры.
а—мембранный, б —со сплющенной трубкой, в, г —шкалы механических манометров.
/ — мембрана, 2-зубчатая передача; 3-~стрелочный индикатор, 4— рычаг, р—измеряе-
мое давление.
Вместо мембраны можно использовать тонкостенную, изог-
нутую по дуге окружности, сплющенную и запаянную с одного
конца трубку (фиг. 5.6,6), соединенную другим концом с про-
странством измеряемого давления (трубка Бурдона). При из-
мерении давления изменяется и кривизна трубки, что вызывает
338
ГЛАВА 5
передвижение индикаторной стрелки (приводимой в движение
посредством передачи, например зубчатой). Показания мано-
метра в этом случае относятся к давлению среды, в которой
находится трубка Бурдона (обычно это — атмосферное дав-
ление) .
На фиг. 5 6, в, г показаны шкалы механических манометров.
Механические манометры измеряют давление в пределах
1—760 Тор с точностью ~2°/0.
Для специальных целей изготовляются дифференциальные
механические манометры, в которых по обе стороны мембраны
Фиг. 4.7. Схема сильфонного манометра
для измерения давлений в диапазоне
10 — 760 Тор.
/ — сильфон» соединенный с пространством на-
меряемого давления; 2 —сильфон с высоким
вакуумом (р2 < Pi), 3 — ось поворота рычага;
4—пружина, 5—рычаг, 6—толкатель, приводя-
щий в действие электромагнитную систему,
которая компенсирует силу, действующую на
рычаг» и одновременно ее нзм >ряет; р—-изме-
ряемое давление.
(внутри и снаружи трубки Бурдона) находятся среды с разными
и часто непостоянными давлениями; возникающие при этом про-
гибы мембраны, определяемые, например, электрическим мето-
дом (изменение емкости, индуктивности и т. п.), пропорцио-
нальны разности давлений.
На фиг. 5.7 показана схема устройства вакуумного мано-
метра фирмы Askania.
5.3. КОМПРЕССИОННЫЕ МАНОМЕТРЫ
Для того чтобы с помощью столба ртути измерить давление
значительно ниже величины 1 Тор, применяют метод сжатия
(компрессии) газа. Он состоит в том, что газ с измеряемым дав-
лением pi, заключенный в объеме Vi, сжимается до меньшего
объема V2; давление газа при этом возрастает до величины рг,
согласно формуле
PiVi = p2V2- (5.5)
Если давление Р2 настолько велико, что его можно опреде-
лить непосредственным измерением высоты столба ртути, то
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
339
измеряемое давление вычисляют по формуле
= (5.6)
Отношение
* = (5.7)
т. е. степень компрессии, можно подсчитать на основании обоих
известных объемов, определяемых по их размерам.
5.3.1. Манометр Маклеода
5.3.1.1. Принцип действия и характеристики. Прототипом
компрессионного манометра является манометр Маклеода
(1890 г.), представленный на фиг. 5.8, а. Сжатие газа в нем про-
исходит с помощью ртути, которая вводится из резервуара 5
в резервуар 3 объемом Уг, когда ртуть достигает уровня хх, она
перекрывает соединение ресивера 3 с пространством измеряе-
мого давления pi, а поднимаясь выше, действует как поршень,
который сжимает газ в ресивере 3, а затем в компрессионном
капилляре 1, вследствие чего ртуть поднимается до уровня уу
(находящегося ниже уровня ии вершины капилляра /). В от-
крытом капилляре 2 уровень ртути zz, разумеется, выше, чем
в закрытом капилляре1).
Рассматривая (после сжатия газа) состояние равновесия
ртути в сообщающихся сосудах, которыми являются капилляры
1 н 2, давление газа в объеме У2 капилляра 1 можно определить
как
p2=H + Pl, (5.8)
где Н обозначает разность высот столбов ртути между уров-
нями ZZ и уу.
Степень сжатия k определяется из формулы (5.7), в которой
Pi — объем ресивера 3, объем же газа после сжатия равен
V2 = ^nd2h, (5.9)
Где d — диаметр капилляра, h — разность между уровнями
«« и уу.
’) Диаметр трубки 4 значительно больше диаметра капилляров 1 и 2;
это необходимо для обеспечения малого сопротивления течению газа между
пространством измеряемого давления и резервуаром 5 (в начальный момент
измерения) При этом уровни ртути в трубке 4 и капилляре 2 оказываются
различными ввиду существенного различия их диаметров.
340
ГЛАВА 5
Таким образом, формулу (5.6) можно переписать в виде
Pi^!^h[H + pi} = ^_h(H + pt)' (5.10)
Величина
называется постоянной манометра. Из формулы (5.10)
преобразования получаем
nd2 .
47, hH = chH
nd2 , 1 — ch
1 “ ~Tu~ h
При ch <C 1 можно принять
Pi ~ ch H.
При измерении так называемым линейным методом
уровней h поддерживается постоянной, например
(фиг. 5.8,а). Тогда давление, выражающееся формулой
Р^^Н = С1Н,
после ее
(5.12)
(5.12а)
разность
h — h0
(5.13)
пропорционально Н.
При измерении так называемым квадратическим методом
столб ртути в открытом капилляре доводят обычно до уровня
вершины ии компрессионного капилляра 2 (фиг. 5.8,6); при
этом выполняется условие Н = h, а уравнение (5.12) принимает
вид
(S-I4)
В формуле (5.14) величину с2 можно считать постоянной
лишь для n,cPHl$V\ <С 1, так как степень сжатия зависит от ве-
личины измеряемого давления. Очевидно, что это не мешает
создать шкалу, учитывающую непостоянство с2 (квадратиче-
скую) .
На фиг. 5.9 представлен пример шкалы компрессионного
манометра, приспособленного к измерению квадратическим ме-
тодом.
Компрессионный манометр позволяет измерять тем более
низкие давления, чем меньше его постоянная с, т. е. чем больше
степень сжатия газа и, следовательно, чем больше объем Vi ре-
сивера 3, меньше диаметр капилляра d и меньше высота h0.
Уменьшению с мешают разные обстоятельства, например: при
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
341
увеличении возрастают масса и объем ртути, что затрудняет
обезгаживание сосуда; при уменьшении d ртуть прилипает к вер-
шине и стенкам чрезмерно тонкого капилляра; при малом ha
трудно определить истинную разность уровней и т. д. Из-за этих
Фиг. 5.9. Пример квадратической
шкалы компрессионного мано-
метра.
Фиг. 5.8. Компрессионный манометр
Маклеода.
а—измерение линейным методом; ртуть в ка-
пилляре 1 доводится до уровня уу которому
соответствует высота запертого отрезка капил-
ляра а в капилляре 2 отсчитывается высота
ртути Я, которая и является мерой давления;
б—измерение квадратическим методом: ртуть
в капилляре 2 доводится до уровня им, а в ка-
пилляре 1 отсчитывается высота ртути h=H,
являющаяся мерой давления.
J —компрессионный капилляр; 2 —капилляр
сравнения (отнесения); 3—компрессионный ре-
зервуар (ресивер), 4—трубка, 5—сильфонный
резервуар ртути; хх - уровень перекрытия
ртутью ресивера 3, р —измеряемое давление.
ограничений обычно степень компрессии не превышает 105, что
вообще не дает возможности измерять давления ниже, чем
Ю-5 Тор.
5.З.1.2. Определение положения вершины компрессионного
капилляра путем экстраполяции. Когда точное положение вер-
шины компрессионного капилляра 1 (уровня ии) неизвестно,
342
ГЛАВА 5
его можно определить методом экстраполяции. Для этого по
нескольким измерениям определяется (фиг. 5.10) зависимость
положения уровня уу (отсчитанного от произвольного уровня
Фиг. 5.10. Определэние путем экстраполяции положения запирания компрес-
сионного капилляра.
а —капилляры с ртутью, б —пример экстраполяционного графика
/ — компрессионный капилляр, 2 — капилляр отнесения (по Энгелю, 1951 г.).
и'и', например неточно определенного уровня вершины компрео
сионного капилляра), т. е. величины Н от величины Д/7, пред-
ставляющей разность уровня zz ртути в открытом капил-
ляре 2 и уровня уу в компрессионном капилляре. Затем строится
график
" = 1Ш <5-15)
и путем экстраполяции для МкН = 0 находят точную величину
До, соответствующую действительному уровню ии. Действи-
тельно, из формулы
определяем
Р = ^(Н-Н0) ДЯ
Н-Н* + ^Р}-Кн-
(5.16)
(5.17)
Так как р — const, то, обозначая выражение в скобках че-
рез а. можно записать
Я = Я0
а
(5.18)
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
343
Таким образом при а/Д/7->0 находят искомую величину Но,
а отсюда и действительный уровень ии
5.3.1.3. Модификации компрессионных манометров. Ком-
прессионные манометры изготовляются в разных конструктив-
ных вариантах. Например, для расширения пределов измерения
применяют несколько компрессионных капилляров (/, 2, 3, 4) и
несколько открытых капилляров (1', 2', 3', 4') разного диаметра
(фиг. 5.11).
Чувствительность манометра можно повысить путем так на-
зываемой многократной компрессии, которая состоит в том, что
перед окончательным измерением в компрессионный капилляр
вводят по очереди несколько одинаковых порций сжатого газа.
Это осуществляется с помощью миниатюрного клапана, поме-
щенного в компрессионном капилляре (фиг. 5.12).
Для измерения не очень низких давлений изготовляются
упрощенные компрессионные манометры (фиг. 5.13).
5.3.1.4. Введение ртути в компрессионный резервуар. Изме-
рения компрессионным ртутным манометром могут проводиться
только после введения ртути в ресивер 3 (фиг. 5.8). Это может
быть сделано различными способами, например так, как на
фиг. 5 8, путем сжатия сильфонного сосуда 5, путем поднятия
сосуда со ртутью, соединенного с компрессионным резервуаром
гибким шлангом соответствующей длины (фиг. 5.13), путем вы-
теснения ртути из сосуда 11 атмосферным давлением (фиг. 5.14)
и т. д. Ртуть следует вводить медленно во избежание возникно-
вения переходных состояний в вакуумной системе, а также ди-
намических нагрузок от ртути.
Ртуть в вакуумном манометре должна быть совершенно чи-
стой (дистиллированной в вакууме, свободной от влаги и т. п.);
поэтому важная задача при изготовлении ртутного компрессион-
ного манометра состоит в том, чтобы предотвратить контакт
ртути с атмосферным воздухом во избежание окисления и ув-
лажнения ртути. Пленки окислов, образующиеся на поверхности
ртути, могут закупорить капилляры.
5.3.1.5. Пределы измерения и чувствительность компрессион-
ных манометров. Нижний предел измерения для описанных
компрессионных вакуумных манометров на практике составляет
Ю~5—10~6 Тор, а верхний предел примерно равен 10_| Тор.
Считается, что при диаметре капилляра d = 1 мм и объеме
компрессионного резервуара Vi = 200 см3 достаточно точные из-
мерения можно производить до давления 10~4 Тор, причем ввиду
неопределенности формы компрессионного капилляра у вер-
шину высоту Н (либо ho) принимают равной не менее 1 мм.
Фиг. 5.11. Компрессионный манометр
с капиллярами разных диаметров.
Компрессионные капилляры 1, 2, 3, 4, капил-
ляры отнесения Г, 2', 3’, 4' (по Дюнуайе,
1923 г.),
Фиг. 5.12. Автоматический миниатюр-
ный клапан у основания компрессион-
ного капилляра, применяемый для
многократной компрессии (по Грош-
ковскому, 1949 г.).
/ — компрессионный капилляр, 2—предка-
мера, 3 — клапан (нержавеющая сталь);
4— пришлифованные поверхности запорного
и посадочного конусов- 5—компрессионный
резервуар-,6—камера клапана.
Фиг. 5.13. Поворотный манометр Брюнера (1930 г.).
Измерение начинается от положения манометра, изображенного штриховыми линиями,
когда вся ртуть находится в баллоне / в нижней части рисунка. При повороте манометра
в направлении, указанном стрелкой, происходит сжатие газа в трубке 2 снабжений
шкалой. /—баллон; 2—трубка; 5—ось поворота»
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
345
Уменьшение d и увеличение 1А по сравнению с указанными
выше значениями позволяют передвинуть диапазон измерений
в область более низких давлений.
Чувствительность манометра ограничивается, как уже упоми-
налось, размерами капилляров и компрессионного резервуара;
капилляры диаметром менее 0,7 мм и резервуары объемом более
500 см3 вообще не применяются ввиду возникновения различных
помех (электризации, прилипания
ртути к стенкам и т. д.).
В качестве исключения можно
назвать компрессионный мано-
метр, который имеет резервуар
объемом 1300 см3 (масса рту-
ти ~32 кг) и капилляры диа-
метром ~0,6 мм. Постоянная
этого манометра с2 = 2,4-10—7
Тор-мм-2. Такой манометр, на-
пример, при Н =2 мм измеряет
давление 10~6 Тор.
Фиг. 5.14. Компрессионный манометр
с автоматической регулировкой уровня
ртути (по Уорку и Хоук-Гастингсу).
/» 2—компрессионные капилляры; 3—квадра-
тическая шкала; 4 — капилляр отнесения;
5—линейная шкала; 6—двухходовой кран;
7—ртутный край; 8— шариковый клапан;
трубка для переливания ртути; 10 — клапан
подачи ртути (открыт), // — резервуар ртути.
5.3.1.6. Пример конструктивного решения компрессионного
манометра. Современный компрессионный вакуумный манометр
с автоматическим поддержанием уровня ртути при измерении
квадратическим методом представлен на фиг. 5.14. Манометр
имеет два компрессионных капилляра: высокочувствительный
капилляр 1 (10 мм столба ртути соответствуют 5-10~4 Тор) и
менее чувствительный капилляр 2 (10 мм столба ртути соответ-
ствуют 5-Ю-2 Тор). Совместно с квадратической шкалой 3 они
дают возможность проводить измерения в пределах от 2-10~5 до
20 Тор. Капилляр 1 предназначен также для измерения линей-
ным методом в пределах 20—50 Тор. Высота открытого капил-
ляра 4, помещенного в более широкой трубке, равна высоте за-
пирания компрессионных капилляров. Таким образом, уровень
ртути в открытом капилляре устанавливается автоматически —
При измерении линейным методом уровень ртути в капил-
ляре 1 поддерживается на нулевой линии шкалы <3. а отсчет
кран 6 в резервуар 11 впускают воздухУ(лучше азот) под атмос-
служит кран 7. Шариковый клапан 8 при введении ртути в
манометров. Компрессионные манометры непригодны для изме-
сюянии насыщения,Уа давление их в этом случае является функ-
цией температуры, а не объема. Это касается, например, ам-
миака, водяного пара, а также паров масел.
компрессионного манометра, если не применяются предохрани-
вушку, охлаждаемую твердой двуокисью углерода или, лучше,
пара в диффузионном Засосе (см. гл.У4), увлекая^ собой газы,
давление которых измеряется. Это может быть причиной значи-
связан с тем, что ртуть можеУ поглощать газы из вакуумной си-
стемы или вводить в нее другие газы, или пары (т. е. ухудшать
вуары, трубки и капилляры вакуумного манометра,Р/тем чтобы
удалить^сорбированные влагу и газы из ртути и с поверхности
трических зарядов с внешней поверхности капилляров. Приме-
няемая ртуть должна быть очень чистой, т. е. свежедистилли-
Постоянные компрессионного манометра можно определить
ровке, например, тепловых и ионизационных манометров. Р ДУ
5.4. ТЕПЛОЭЛЕКТРИЧЕСКИЕ МАНОМЕТРЫ
5.4.0. Принцип действия и классификация
его давления. Нижний предел измерений этих манометров огра-
ветствующими молекулярным и промежуточным условиям.
Давление в теплоэлектрических манометрах определяется пу-
тем измерения какой-либо физической величины, которая изме-
нение давления газа вызывает изменение отводимой благодаря
мента при изменении теплопроводности"среды необходимо изме-
в пространстве, где находится чувствительный элементД Обычно
легко измерять как мощность,„так и температуру.
температуры Т (более высокой, чем температура окружающей
кого на воздух манометра следует умножить на 0,65, дУдля бо-
iee тяжелого аргона — на 1,6.
Таблица 5.3
коэффициент Р (о
Металл Ом3еКм Р(273 ^373К).
KO40%aNa)H (60°/0 CU’ 50-Ю*6 ~о
М^кженнаТ'™0126™351’ 1,6-10-° 4,5-10“
Молибден (отпущенный) 4 5 • 10—8 3,3 • 10
Никель (обыкновенный) 6,5 • 10~б 6.10
П патина 10 • 10 3 * 10
Платииородий (90% Pt) 21 • 10“6 04 • 10~3
Серебро электро литиче- 1,5-10- 4-10“
Тантал 15 • 10“6 3,3 • 10-а
Вольфрам (отпущенный) (4,54-5,5) - 10~6 4,5 • 10“
Железо (чистое) 9-10-° 5-10"
Сопротивление /? является линейной функцией температуры:
/? = 7?0[1 +р(Т-7’о)]> (5-2Р
где Ro — сопротивление чувствительного элемента при темпера-
туре То, а £ —температурный коэффициент сопротивления.
Значения коэффициента р и удельного сопротивления р неко-
аЛтЛ (Г — Т0)Ф (р) ~ ц _|_р(7’ _ . (5.28)
откуда иг
Ф^- ^аХтА(Т-Т0)[1+ЦТ-Т0)]’
лг,=^/^=.1,5.10-4^--^/^. (5.25)
= Л + (^зл + ^репл).
Из (5.31) и (5.32) находим
(5-33>
Приравнивая выражения (5.23) и (5.33), получим уравнение
(5.34)
(5.35)
Фиг. 5.18. Зависимость (£/2/{7^ин—1) ==
уравнение (5.38) можно переписать в виде
(5.41)
(5.42)
Для определения наиболее благоприятной величины тока на-
9х4 — 12Х3 — 1 = 0.
(5.50)
(5.51)
Для низких давлений ф(р)~р, следовательно,
Топт= 1,36Т0.
(5.53)
На основании соотношений (5.42) для а и b можно записать
Дифференцируя уравнение (5.44), находим
а затем, подставляя в (5.45) выражение для dp/dx, получаем
У = = (3^“4^ + « + 6)- (5-47)
ах — bx4 + b = О,
(5.48)
(5.49)
<5.49а)
подставляя х = 1,36 и выражение (5.42) для Ь:
ными изменениями давления, будет иметь вид
(5.55)
(5.56)
(5.56а)
Ппимер 5.1. Чувствительный элемент из платиновой проволоки (р-
10*5 Ом-см, р = 3-Ю-3 К’1, 8 = 0,5) диаметром d = 10 см, длиной
10 см находится в азоте в молекулярных условиях (Лу- 1,6-10 ,
= 0 8) при / = const и температуре окружающей среды То = 293 К.
raceme ^при J°)oo^ 6 = о,22-10 2, оптимальная сила тока
^уравнения (5 54) равна _з
= xR0 = 170 Ом. Напряжение
При более высоком давлении (Т^Т0) напряжение составит
[7МИН = 0,6 • 10~3- 125 = 0,075В
На фиг. 5.20 представлен ход зависимости U = f(p) для рассмотренного
5.4.2- Манометр с постоянным сопротивлением
уравновешивается при U2 = 5 В, а при р < 10~3 Тор балансиро-
вочное напряжение U,. равно 0.85 В. Большой наклон кривых
но, высокую точность измерений. Кривая зависимости U2 = f(p)
представлена на фиг. 5.21, в, а на фиг. 5.21, г показан внешний
Фиг. 5.22. Вольт-амперная характеристика термисторного датчика.
Фиг. 5.23. Термисторный манометр Пытковского (1955).
а—электрическая схема: 1 — элекгроразрядный стабилизатор напряжения; 2—выпрями-
тель тока; 3—электрический фильтр; б—градуировочные кривые для воздуха при равно-
весии моста:--мост сбалансирован при 10“3 Тор;--------мост сбалансирован при
Тор.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
363
Проволочное сопротивление обычно питается постоянным
или переменным током при I = const. Кривые, изображенные на
фиг. 5.24,6, иллюстрируют зависимость UT = f(p) для трех ра?
ных газов.
Фиг. 5.24. Термопарный манометр.
а —электрическая схема: 1 — проволочное сопротивление, 2 — термопара; 3 — балло
б—градуировочные кривые Uf = f (р) (при 7=0,1 А) для аргона, воздуха и водород
Кривая для водорода проходит ниже остальных ввиду ег
более высокой теплопроводности (более сильное охлаждени
сопротивления). Охлаждение корпуса чувствительного элемент
Фиг. 5.25. Термопарный манометр с трансформаторным мостом (фирма Has
tings-Raydist).
а—схема соединений; б—шкалы.
1» 2, 3—термопары; 4, 5—элементы дифференциального трансформатора; А—измерител
давления.
смещает характеристики, как и в манометре сопротивления, вле
во, в направлении более низких давлений; увеличение же нагре
вающего тока смещает их вправо, к более высоким давлениям
На фиг. 5.25, а представлена схема термокомпенсированноп
гермопарного манометра с трансформаторным мостом. Измери
гельный датчик содержит три одинаковые термопары, две и;
364
ГЛАВА 5
которых (1 и 2) образуют чувствительный элемент, питаемый
переменным током, а третья термопара включена в диагональ
моста 1 — 2 — 4 — 5 (через которую проходит очень малый ток)
и предназначена для термокомпенсации. Двойные стрелки обоз-
начают переменный нагревающий ток, одинарные стрелки —
постоянный измерительный ток /м, который является мерой дав-
ления.
На фиг. 5.25,6 в качестве примера показаны шкалы этого
прибора для двух диапазонов измеряемых давлений.
5.4.5. Дилатационный манометр
В манометрах с дилатационным чувствительным элементом
температура (а следовательно, и давление) определяется по де-
формации элемента, геометрические параметры которого (объ-
ем, длина или угол закручивания) зависят от температуры.
Фиг. 5.26. Биметаллический дилата-
ционный манометр Клумба и Хазе
(1936 г).
Две биметаллические спирали нагреваемые
током, закреплены концами в точках хх\
другие их концы, соединенные вместе, по-
ворачивают ось индикаторной стрелки.
На фиг. 5.26 показан биметаллический дилатационный ва-
куумный манометр. Чувствительным элементом в нем является
тонкая биметаллическая лента из двух плотно спаянных между
собой слоев металла с разными коэффициентами теплового
расширения. Биметаллическая лента скручена спирально или
винтообразно; внешний ее конец закреплен, внутренний соеди-
нен с индикаторной стрелкой (непосредственно или через пере-
дачу). Через биметаллическую ленту пропускают электрический
ток (/ = const), который нагревает ее до определенной темпе-
ратуры (выше температуры окружающей среды). Угол закру-
чивания <р биметаллической ленты зависит от ее температуры,
а та в свою очередь — от давления газа; таким образом, суще-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
365
ствует зависимость ср — f(p), которая позволяет определять дав-
ление газа.
Во избежание утечки электрического тока на ось индикатор-
ной стрелки часто применяют две биметаллические ленты, со-
единенные между собой около оси (фиг. 5.26); тогда постоянный
ток подводится к неподвижным концам биметаллических лент
в точках хх. Использование двух биметаллических лент позво-
ляет, кроме того, компенсировать колебания температуры окру-
жающей среды.
Мощность, потребляемая дилатационным манометром, со-
ставляет ~ 5 Вт. Манометр измеряет давления в диапазоне
1 —10~3 Тор с относительно невысокой точностью, а чувстви-
тельность его зависит от рода газа.
5.4.6- Эксплуатационные характеристики
теплоэлектрических манометров
Теплоэлектрические манометры не относятся к прецизион-
ным приборам. Причиной этого, среди прочих, является неопре-
деленность коэффициента аккомодации а и излучательной спо-
собности е, которые зависят от состояния поверхности чувстви-
тельного элемента; это состояние может быть связано с «ваку-
умной историей» элемента (измерявшимся ранее давлением,
родом газа, продолжительностью использования прибора и т. д.).
В связи с этим рекомендуется, особенно при измерении низких
давлений, очищать перед измерениями поверхность чувстви-
тельного элемента путем выдержки его в течение непродолжи-
тельного времени при довольно высокой температуре (в доста-
точно хорошем вакууме). В области более высоких измеряемых
давлений благодаря явлению конвекции некоторое влияние на
показания манометра может оказать пространственное положе-
ние чувствительного элемента.
Некоторые осложнения создают колебания температуры
окружающей среды и питающего напряжения, что влияет на
нулевое положение индикаторной стрелки и на градуировку
шкалы.
При давлениях, близких к атмосферному, на показаниях
сильнее сказываются колебания температуры, а при низких дав-
лениях— колебания питающего напряжения. Для уменьшения
этих влияний применяются разные способы, например термо-
статирование корпуса чувствительного элемента, специальные
мостовые схемы с компенсирующим элементом (идентичным
чувствительному элементу, но работающим в стабильных усло-
виях, например в высоком вакууме) и т. п.
Компенсацию можно также осуществить путем использова-
ния вспомогательной термопары, установленной на стенке
356 ГЛАВА 5
корпуса чувствительного элемента. Эта термопара воздействует
через транзисторный усилитель на всю систему таким образом,
чтобы разность температур между корпусом и чувствительным
элементом была постоянной и определенной (например, 80 К);
при этом электрическое напряжение в чувствительном элемен-
те может служить мерой давления.
5.5. ТЕРМОМОЛЕКУЛЯРНЫЕ, КИНЕТОМОЛЕКУЛЯРНЫЕ
И ВЯЗКОСТНЫЕ МАНОМЕТРЫ
В манометрах рассматриваемой ниже группы используется
явление переноса механической энергии молекулами газа, в ре-
зультате чего происходит отклонение специального подвижного
элемента, пропорциональное давлению газа.
5.5.1. Термомолекулярные манометры
5.5.1.1. Принцип действия и характеристики. Принцип дей-
ствия и характеристики термомолекулярного манометра (Кнуд-
сен, 1910 г.) видны из конструктивной схемы фиг. 5.27. Мано-
метр состоит из системы неподвижных (S) и подвижных (JR)
пластинок, подвешенных на тонкой упругой нити 1. Зеркальце
2 служит для измерения (при помощи светового луча) угла
закручивания системы подвижных пластинок. В идеальном
вакууме подвижные пластинки R в состоянии равновесия зани-
мают положение, показанное на фиг. 5.27. Температура под-
вижных пластинок и баллона <3 приблизительно равна темпера-
туре окружающей среды Т, неподвижные же пластинки имеют
более высокую температуру Т'. Свободные молекулы газа при
давлении р движутся, согласно формуле (2.3), со средними ско-
ростями v (соответствующими температуре окружающей среды
Т) и ударяются о поверхность г пластинок R. Поверхности г'
этих пластинок бомбардируются молекулами, отраженными от
поверхности пластинок S, имеющих температуру Т' и, следова-
тельно, скорости о'. Таким образом, пластинки R отталкиваются
от пластинок S силой, равной разности сил, действующих с
обеих сторон пластинок. Эту разность можно вычислить на
основании формул, приведенных в разд. 2.2.2.
Со стороны пластинок S на единицу поверхности г' пласти-
нок R действует сила
Fi, s = 2/n0Vj.Vb (5.57 а)
а со стороны стенок баллона 3 (имеющего такую же темпера-
туру, как и пластинки R) на единицу поверхности г пластинок R
действует сила
(5.576)
FltR = 2m0vj_vl.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
367
Разность обеих сил составляет
^мол = Fl, S — Fl, R = Ъпо Vi (v'j. — V±).
Подставляя Vl = '/4>Wap> получим
Г 1 ] / v'j_ \
'мол l"2~ I 1 I •
(5.58a)
(5.586)
Выражение в квадратных скобках уравнения (5.586), согласно
уравнению (2.18), является давлением газа р; отношение же
Фиг. 5.27. Термомолекулярный манометр (Геде, 1934 г.).
а —схема конструкции' б—манометр с электрической схемой измерений отклонения пла-
стинок; в — кривая градуировки манометра.
S —неподвижные пластинки (с повышенной температурой); Я—^подвижные пластинки
(с температурой осружения).
I —нить подвеса; 2 — зеркальце; 3—баллон,- 4—обмотка, создающая магнитное поле; 5—по-
стоянный магнит; 6— алюминиевая рамка; 7—обкладки с повышенной температурой.
скоростей молекул может быть заменено на основании фор-
мулы (2.2) корнем из отношения температур. Таким образом,
сила, действующая на подвижные пластинки, пропорциональна
Давлению газа р и выражению, которое определяется темпера-
368
ГЛАВА 5
турами V и Т, т. е
(5 59)
Отсюда следует, что давление пропорционально (при постоян-
ных Т' и Т) силе Fмол*
Р~ vff-' =cF„„ (5.60)
Ут-1
где с — константа манометра.
При известных и постоянных температурах V и Т давление
газа определяется величиной силы Гмол, которая действует на
поверхность пластинок R, эту силу можно измерить углом за-
кручивания нити, на которой подвешены пластинки
Теоретически давление не должно зависеть от рода газа;
в действительности же эффективность обмена энергией (тепло-
вой или механической) между молекулой и поверхностью зави-
сит от рода газа и характера поверхности. Это свойство, как из-
вестно, выражается коэффициентом аккомодации а.
Таким образом, тот факт, что показания термомолекулярного
манометра зависят от рода газа, не позволяет считать его абсо-
лютным вакуумным манометром, тем более что некоторое влия-
ние на постоянную этого прибора оказывает форма пластинок,
а также их размеры.
Неподвижные пластинки обычно нагревают при помощи
электрического тока. Угол закручивания нити часто измеряют
также электрическими способами, например путем приведения
этого угла к нулю посредством тока, величина которого служит
мерой давления.
Существуют различные конструктивные решения термомоле-
кулярных манометров, однако ввиду сравнительно редкого их
применения они тут рассматриваться не будут.
Измерение низких давлений термомолекулярным методом за-
труднено в связи с тем, что на пластинки действуют также силы
давления теплового излучения.
Давление (в дин-см-2) теплового излучения пластинок с тем-
пературой Т' на пластинки с температурой Т может быть выра-
жено формулой
^изл=|^(Г4-Г), (5.61)
где е — коэффициент излучения поверхности, сг — постоянная
Стефана — Больцмана, — скорость света (3-1Q10 см-с-1),
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
369
В табл. 5.4 приведены величины давления теплового излуче-
ния Гизл, подсчитанные по формуле (5.61) для е — 1, и вели-
чины молекулярного давления РМол, подсчитанные по формуле
(5.59) для нескольких значений разности температур (Г~ 300 К)
и давлений IO*6, 10-7 и 10~8 Тор. Для давлений порядка
10~7 Тор эффект теплового излучения не превышает 10%, при
давлениях ~10~7 Тор величины ТИзл и Рмол почти одинаковы;
для давлений порядка 10~8 Top FK31i во много раз превышает
величину Лмол
Таблица 5.4
Соотношение сил излучения и молекулярных
в термомолекулярном манометре (при Т ~ 300 К)
г - г, к Р, Тор ^изп’ ^МОЛ* °0
10~8 6 94
10 ю-7 37 63
ю-8 86 14
10-s 7 93
60 10-7 44 56
ю-8 89 II
IO-6 9 91
100 10-7 50 50
IO-8 91 9
Таким образом, при относительно высоких давлениях силы,
вызванные излучением, можно не принимать в расчет; по мере
же снижения давления их «фон» все более затрудняет измере-
ние убывающих термомолекулярных сил. Поэтому область из-
мерений термомолекулярного манометра ограничена, с одной сто-
роны, вязкостным режимом течения газа (давление ~ 10-1 Тор),
а с другой — эффектом излучения (давление ~ 10~7 Тор). На
фиг. 5 27, в приведен пример градуировочной кривой термомоле-
кулярного манометра.
Термомолекулярный манометр можно также применять для
измерения давления косвенными методами.
5.5.1.2. Измерение давлений методом измерения периода ко-
лебаний. Более низкие давления можно измерять с помощью
термомолекулярного манометра, применяя метод определения
Периода колебаний подвижной системы. Для этого подвижную
370
ГЛАВА 5
систему возбуждают каким-либо импульсом (например, импуль-
сом тока в катушке, действующим на железный сердечник),
после чего наблюдается затухание амплитуды колебаний. Из
теоретических расчетов следует, что между периодом колеба-
ний т подвижной системы и вращающим моментом р,, вызван-
ным давлением молекул газа и упругостью нити, на которой
подвешена система, существует связь
(5-62а)
где с' — коэффициент пропорциональности.
Когда пластинки подвижной системы имеют одинаковую тем-
пературу, силы, создаваемые молекулами газа, равны нулю, а
период колебаний обусловлен лишь моментом упругости нити:
Ро = ^2'- (5.626)
К
Вращающий момент молекулярных сил, таким образом, вы-
ражается уравнением
ц —u.o^cV-'j-----yV (5.63)
\ т то /
Сила, вызванная молекулами, ударяющимися о пластинки
подвижной системы, пропорциональна этому моменту
/7мол=с"(р — Ро) = С (Ц-~~ AV (5.64)
\ Т т0 J
а измеряемое давление, которое пропорционально этим силам,
выражается формулой
где с — постоянная манометра, зависящая от его конструкции
и температуры пластинок.
Таким образом, измерение давления сводится к измерению
периода колебаний подвижной системы (при определенном на-
гревающем токе и известной постоянной с). Период то при тем-
пературе неподвижной системы, равной температуре окружаю-
щей среды, является также величиной постоянной.
Эти постоянные для типичного манометра составляют
с~10~2, то —30 с, что дает, например, при р = 10~5 Тор период
колебаний т —22 с. Описанный метод позволяет измерять дав-
ление в пределах 10~3— 10~7 Тор.
5.5.1.3. Измерение давлений методом измерения амплитуд.
Тот же вакуумный манометр дает возможность определять дцв’
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
371
ление путем изменения затухания колебаний подвижной систе-
мы в разреженном газе.
Если угловая амплитуда колебаний (при холодных пластин-
ках) в течение времени Тг—Ti уменьшается от величины cpi до
величины <р2, то
1g М
п-а—L-—W (5.66)
У Ма т2 — Tj
где Af0—молекулярная масса газа, а а — коэффициент, завися-
щий от конструкции манометра.
В случае смеси газов Мо представляет собой эффективную
молекулярную массу газовой смеси.
Этот же метод может быть использован для определения
молекулярной массы газа, если его давление в вакуумной си-
стеме известно (например, измерено каким-либо другим мано-
метром).
5.5.2. Кинетомолекулярные и вязкостные манометры
Кинетомолекулярные и вязкостные манометры основаны на
принципе переноса количества движения либо непосредственно
молекулами газа (кинетомолекулярные), либо косвенно — от мо-
лекулы к молекуле (вязкостные). В первом случае молекулы
приводят в движение измерительный элемент, а во втором —
тормозят его. Несмотря на то что такие манометры имеют очень
ограниченное применение, целесообразно рассмотреть для при-
мера устройства, показанные на фиг. 5.28 и 5.29.
Над вращающимся с определенной скоростью диском /
(фиг. 5.28) подвешен на нити 2 другой диск <3. В идеальном ва-
кууме приведение в движение или остановка диска 1 не влияет
на положение диска 3. Однако, когда в пространстве между ди-
сками появляются молекулы газа, они ударяются о поверхность
вращающегося диска 1 и, отражаясь от нее с некоторой состав-
ляющей скорости в направлении вращения, ударяются о диск 3.
Молекулы газа, сталкивающиеся с диском 3, передают ему ко-
личество движения в направлении вращения диска 1 и повора-
чивают его, в результате чего происходит закручивание нити.
Ввиду того что количество молекул, принимающих участие в
передаче импульса от диска 1 к диску 3, пропорционально кон-
центрации газа, а концентрация — давлению, угол поворота
диска 3 (отсчитываемый при помощи зеркальца 4) пропорцио-
нален давлению.
Имеются также вязкостные вакуумные манометры, в которых
ротор, подвешенный в высокочастотном вращающемся магнит-
ном поле, вращается с большой угловой скоростью (~ 100 000
372
ГЛАВА 5
об-мин-1). При постоянной частоте поля скорость вращения ро-
тора является функцией трения и в том числе составляющей
трения, обусловленной вязкостью газа, эта составляющая зави-
сит от давления газа и может служить мерой давления.
Действие других вязкостных манометров основано на прин-
ципе затухания колебаний стержня (кварцевого) или диска,
подвешенного на упругой (кварцевой) нити (фиг. 5 29) Время
Фиг. 5.29. Вязкостные манометры
(принцип Сазерленда, 1897 г.)
а —с качающимся стержнем, б—с диском,
совершающим крутильные колебания, в—со
стержнем, совершающим крутильные коле-
бания
/—стальной шарик, служащий для приве-
дения в колебательное движение подвижного
элемента при помощи постоянного магнита;
2—диск, тормозящийся под действием вяз-
кости газа
Фиг. 5.28. Кинетомолекулярный мано-
метр Ленгмюра — Дэшмана.
/ — вращающийся диск, 2 -нить 3 —диск,
подвешенный на нити, 4—зеркальце, 5—диск
магнитного привода.
т затухания амплитуды колебаний (например, до половины пер-
воначальной величины амплитуды) может служить мерой дав-
ления. Например, для стержня, подвешенного на кварцевой
нити, связь между давлением газа р и временем т выражается
формулой
_________________________ а
х~ рУ"м} + ь '
где а и b — постоянные величины, определяемые характеристи-
ками стержня и свойствами газа, а Мо — молекулярная масса
газа.
Возбуждение колебаний подвижной системы производится
импульсом, вызванным перемещением магнита; амплитуду ко-
лебаний определяют, например, по ширине пятнышка, образо-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
373
ванного световым лучом, который отражается от зеркальца, при-
крепленного к колебательной системе
Диапазон измерения давлений вязкостными вакуумметрами
заключается между 10-2—10~6 Тор.
5.6. ИОНИЗАЦИОННЫЕ МАНОМЕТРЫ
5.6.0. Принцип действия и классификация
ионизационных манометров
В случае высокого вакуума методы измерения давления, ос-
нованные на измерении механических сил, теплопроводности,
термомолекулярных эффектов и т. п., не являются достаточно
чувствительными Остаются единственно электрические методы,
в соответствии с которыми молекулам газа сообщаются элек-
трические заряды и измеряется возникающий при этом ионный
ток На указанном принципе основывается действие ионизацион-
ных (ионных) манометров
Сообщение электрических зарядов молекулам газа происхо-
дит путем ионизации свободного газа. Так как ионизации под-
вергаются не все молекулы, а только часть их, то при данной
концентрации газа п концентрация образовавшихся ионов со-
ставляет п} — &г, где £ < 1
Концентрация газа п и давление р связаны зависимостью
р = knT Таким образом, при Т — const концентрация газа яв-
ляется мерой давления Однако при измерениях давления газа,
имеющего температуру, отличающуюся от температуры градуи-
рования, приходится пересчитывать показания манометра.
Для того чтобы ионный ток мог служить мерой давления,
должно выполняться условие пропорциональности между коли-
чеством возникающих в единицу времени ионов и концентра-
цией газа. Если коэффициент пропорциональности не известен,
то, во всяком случае, он должен быть постоянным в пределах
давлений, для которых предназначен вакуумный манометр.
Другое важное условие состоит в том, что ионный ток дол-
жен быть образован исключительно ионами, возникающими в
процессе ионизации газа, и не должен содержать каких-либо
посторонних токов. Это условие приобретает особое значение
по мере перехода к более низким давлениям
Проблема ионизационных манометров сводится, таким обра-
зом, к возможно более интенсивному образованию ионов в ко-
личестве, пропорциональном концентрации газа, их эффектив-
ному собиранию и измерению «чистого» ионного тока.
Существенными недостатками большинства ионизационных
манометров являются, с одной стороны, их откачивающее дей-
ствие, обусловленное сильной сорбцией газов под действием
374
ГЛАВА 5
электрического разряда, особенно при распылении металла, а с
другой стороны, десорбция газов вследствие высокой темпера-
туры электродов, электронной бомбардировки и т. п. Указанные
эффекты могут оказаться причиной значительных ошибок из-
мерения.
С учетом этого ионизационные манометры (в особенности
предназначенные для очень высокого вакуума) должны быть
тщательно обезгажены путем прогрева корпуса и электродов
(например, электронной бомбардировкой), а трубки, соединяю-
щие их с вакуумной системой, должны иметь как можно более
высокую проводимость для того, чтобы было возможно свобод-
ное движение газа между манометром и контролируемым объе-
мом. Лучше всего этим требованиям удовлетворяют манометри-
ческие датчики без корпуса, введенные внутрь контролируемого
объема. За пятьдесят лет, прошедших со времени изобретения
ионизационного манометра, было разработано много различных
схем и конструкций вакуумных манометров такого рода.
Важную роль в ионизационных манометрах играет электри-
ческое поле; иногда в дополнение к нему используется магнит-
ное поле.
Ионизационные манометры можно разделить на две основ-
ные группы:
1. Манометры с контролируемой ионизацией (электронные
и радиоизотопные);
2. Манометры с неконтролируемой ионизацией (электрораз-
рядные).
Ионизационный вакуумный манометр состоит из манометри-
ческой трубки (датчика) и соединенного с ней проводами кон-
трольно-измерительного блока. Этот блок служит для питания
датчика и для измерения ионного тока (в частности, усилен-
ного); одновременно он питает манометр электрическим током,
необходимым для обезгаживания датчика.
5.6.1. Вакуумные манометры с контролируемой ионизацией
Различают вакуумные манометры, в которых для ионизации
используется электронный поток (электронные ионизационные
манометры) или поток а- и 0-частиц (радиоизотопные иониза-
ционные манометры).
Из группы электронных ионизационных манометров можно
выделить специальную подгруппу приборов, которые приме-
няются для измерений очень низких давлений.
5.6.1.1. Электронные ионизационные манометры. Электрон-
ный ионизационный манометр можно считать исторически пер-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
375
вым ионизационным манометром1). Он состоит по крайней мере
из трех электродов: горячего катода К., эмиттирующего элек-
троны, анода А, ускоряющего и отводящего электроны, и кол-
лектора ионов С, который собирает образующиеся ионы
(фиг. 5.30).
Анод имеет положительный относительно катода потенциал
( + (7О), коллектор — отрицательный потенциал (—Uc). Катод
создает электронный ток 1е, ионизирующий газ. Величина этого
тока обычно поддерживается постоянной путем регулирования
температуры катода (например, регулированием мощности
накала).
Фиг. 5.30. Принцип действия ионизацион-
ного манометра.
А — анод, К—катод (источник электронного
тока к аноду); С — коллектор образовавшихся
ионов (имеет отрицательный потенциал)
Система анод — катод предназначена для ионизации газа в
пространстве между электродами, а коллектор собирает обра-
зующиеся ионы (при устранении других, нежелательных то-
ков). Форма электродов и межэлектродные напряжения выби-
раются прежде всего из условий выполнения этих задач.
Образование ионов. Как указывалось выше, важнейшим па-
раметром процесса ионизации является коэффициент относитель-
ной ионизации хи, характеризующий количество пар ион — элек-
трон, образованных одним электроном с энергией eU электрон-
вольт на пути 1 см в данном газе с давлением 1 Тор при темпе-
ратуре 273 К- Коэффициент относительной ионизации зависит,
таким образом, от потенциала в данной точке пространства Ux.
Графики зависимости
xH = f(C/x) (5.68)
>) Газоразрядная трубка Гейслера, применявшаяся раньше для ориенти-
ровочной оценки вакуума, не может считаться вакуумным манометром.
376
ГЛАВА 5
для некоторых газов при температуре 273 К представлены на
фиг. 3.9. Максимальные значения коэффициента относительной
ионизации хи,макс соответствуют оптимальным значениям потен-
циалов /7опт, находящимся между 70 и 170 В. Зависимость (5.68)
аппроксимируется эмпирической формулой (3.7).
В пространстве ионизации распределение потенциалов между
анодом и катодом может быть выражено в функции расстояния
Ux — F(x), (5.68а)
причем для анода Ux — Ua-
С учетом зависимости (5.68а) коэффициент относительной
ионизации можно представить в виде
хи = W1 = «и (*)• (5-69)
Из определения хи следует, что количество ионов, созданных
за 1 с Ne электронами, двигающимися в газе при давлении р и
температуре 273 К на пути L, описывается формулой
L L
N'j— | N'ep%a (х) dx = N'ep | хи(х) dx. (5.70)
О 0
Интегральное выражение этой формулы можно представить
в виде
ь
J хи (х) dx = макс- (5.70а)
о
При данном анодном потенциале Ua путь ионизации опреде-
ляется прежде всего размерами системы электродов датчика,
а также условиями, в которых происходит движение электронов.
Многократность прохождения электронов через данную область
пространства, движение по винтовым или спиральным линиям
в присутствии магнитного поля и т. п. могут значительно увели-
чивать длину пути L.
Из количества N] возникших ионов достигает коллектора
только определенная часть j, 1. Таким образом, ионный ток
коллектора
Цс = I ~ макс- (5.71)
Произведение /;£3хи,макс называется коэффициентом чувстви-
тельности ионизационного манометра
К === макс- (5.72)
Эта величина для данного газа зависит от формы электродов
датчика, питающих напряжений, а также от эффективности со-
бирания ионов коллектором,
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
377
Из формул (5.71) и (5.72) следует
/< = -тЦ (5.73)
le Р
(единицы: Тор-1, А, Тор). Отсюда
//f = K/ep = Sp, (5.74)
где S — чувствительность датчика (для тока /е)
S = KIe (5.75)
(единицы: А-Top-1, Тор-1, А).
Чувствительность датчика возрастает с усилением электрон-
ного тока. Обычно ток 1е имеет величину между 10-5 и 10-2 А
(чаще всего несколько миллиампер).
Вышеприведенное рассмотрение относится к однородному
газу. В случае смеси газов следует определить чувствительность
и электронный ток для отдельных газов, а суммарный ионный
ток определяется по формуле
7/с == S Sipi,
где S, — чувствительность манометра по отношению к данному
газу, a Pi — парциальное давление газа.
Многократное прохождение электронов через пространство
ионизации. Если по обе стороны сетчатого анода электроны под-
вергаются торможению, то электрон, обладающий скоростью,
соответствующей потенциалу анода, после прохождения через
отверстие сетки будет колебаться около анода между этими
пространствами до тех пор, пока не ударится о проволоку
сетки.
Вероятность такого удара тем меньше, чем меньше отноше-
ние da!da (где 6а — диаметр проволоки сетки, a da — расстояние
между проволоками, т. е. шаг сетки), другими словами, чем
тоньше проволока, из которой изготовлена сетка (фиг. 5.31).
Можно показать, что степень увеличения пути ионизации при
многократных пролетах по отношению к однократному состав-
ляет
* = Т^г, где (5.76)
Величина z при благоприятных условиях может достигать 10.
Таким образом, ионизационный путь электрона, являющийся
частью расстояния анод — коллектор, увеличивается в z раз,
что, естественно, в такой же степени повышает чувствительность
датчика.
378
ГЛАВА 5
В этих условиях могут возникнуть так называемые колеба-
ния Баркгаузена—Курца, т. е. электрические колебания в си-
стеме электродов манометра, способствующие дальнейшему уве-
личению z. Обычно эти колебания являются стабильными и не
оказывают значительного влияния на воспроизводимость резуль-
татов измерений; их частота составляет 90—130 МГц.
Чувствительность манометра к различным газам. Чувстви-
тельность ионизационных манометров к разным газам неоди-
накова, как это следует из величины хи,макс (табл. 3.4). На осно-
Фиг. 5 31. Многократные пролеты элек-
тронов через отверстия сеточного анода,
находящегося между тормозящими по-
лями.
1, 2—областитормозящего электрического поля;
Л—сеточный аиод.
вании исследований различных ионизационных манометров мож-
но оценить их чувствительность, а также множитель показаний
для различных газов (табл. 5.5).
Собирание ионов коллектором. Эффективность собирания
ионов коллектором зависит от его потенциала, формы и поло-
жения относительно пространства ионизации. При анализе эф-
фективности коллектора следует учитывать тот факт, что ионы,
образующиеся в области анода, имеют очень малые начальные
скорости; они соответствуют тепловым скоростям газа, имею-
щего температуру чувствительного элемента манометра. Тем-
пература газа в манометре на несколько десятков градусов
выше температуры окружающей среды вследствие выделения
энергии на катоде и аноде. Горячий катод, хотя он и имеет
температуру порядка 2000 К, лишь в незначительной степени на-
гревает газ, так как поверхность раскаленной проволоки ка-
тода составляет лишь незначительную часть полной поверхно-
сти, с которой соприкасается газ в манометре. Принимая, таким
образом, температуру газа в манометре равной, например,
400 К, получим, что ей соответствует энергия молекул газа по-
рядка нескольких сотых электроновольта. Так как эта величина
пренебрежимо мала по сравнению с энергией, получаемой ио-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
379
Таблица 5.5
Чувствительность и множитель (по отношению к азоту)
показаний ионизационного манометра для различных газов
нами в ускоряющем поле коллектора, потенциал которого (от-
рицательный) имеет порядок сотен вольт, можно считать, что
образовавшиеся ионы начинают движение с начальными ско-
ростями, практически равными нулю. Таким образом, они дви-
жутся почти точно вдоль силовых линий электрического поля,
ведущих к коллектору. Следует иметь в виду, что ионы, обра-
зующиеся в пространстве ионизации, имеют такой потенциал,
какой существует в этом пространстве, т. е. равный потенциалу
анода Uа или несколько ниже его.
Если коллектор является пластинкой со сравнительно боль-
шой поверхностью, то отклонение траекторий движения ионов
от силовых линий электрического поля не имеет существенного
значения, и все ионы достигают коллектора. Однако в случае,
когда коллектор представляет собой стержень малого диаметра,
эффективность захвата ионов коллектором может понизиться
вследствие отклонения траекторий ионов от силовых линий поля
вблизи коллектора, вызванного начальными скоростями элек-
тронов. При этом возникает вращение ионов вокруг коллек-
тора, которое может закончиться их утечкой или захва-
том в зависимости от диаметра проволоки коллектора, места
380
ГЛАВА 5
образования ионов в пространстве коллектора и их начальной
скорости (ее направления и величины).
Если бы пространство ионизации было свободным от элек-
тронов, потенциал коллектора мог бы быть только немного
ниже потенциала, существующего в пространстве ионизации (и
равного потенциалу анода С7а). Однако вследствие присутствия
электронов, выходящих из катода (который имеет потенциал
—Uа по отношению к пространству ионизации), потенциал кол-
лектора во избежание захвата им электронов должен быть ниже
Фиг. 5.32. Зависимость начального элек-
тронного тока от потенциала коллек-
тора Uc при различных температурах
катода Ть.
/ —ток при данном Uc\ /,0 —ток при Пс=0.
чем —Ua. Следует, кроме того, принять во внимание наличие
начальной скорости электронов, вызванной высокой температу-
рой катода.
Соответствующий этой начальной скорости электронный ток
к электроду с потенциалом UCk (отрицательным по отношению
к катоду) может быть выражен формулой
г г Г а | Uck i 1__________
Л(—) — h(о) exp J
= /с(0)ехрГ-1,16- 10^1, (5.77a)
L * k J
где /с(0) — ток при UCk = 0, elk — 1,16-104 в соответствии с фор-
мулой (3.13), a Tk — температура катода.
Например, для вольфрамового катода (7\с^ 2300 К) имеем
/с (_) =/сю) exp (—5Ucb). (5.776)
На фиг. 5.32 показаны графики этой зависимости для двух
температур. Чтобы не возникало помех в измерении ионного
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
381
тока 1С], электронный ток /С(-> должен быть существенно мень-
ше, например
(5.77в)
Ввиду того, что со снижением измеряемого давления/с;- умень-
шается, ток /с(_) должен быть тем меньше (т. е. отрицательная
величина UCk должна быть тем больше), чем выше измеряемый
вакуум. Условие (5.77в) выполняется достаточно хорошо, если
| Uck | 5* 25 В.
Таким образом, между пространством образования ионов,
где имеет место потенциал порядка 100—150 В, и коллектором
с отрицательным потенциалом порядка —50 В возникает раз-
ность потенциалов 150—200 В. Под действием этой разности
потенциалов ионы из пространства ионизации движутся к кол-
лектору и создают в его цепи ионный ток.
Положение коллектора относительно пространства иониза-
ции, влияющее на эффективность собирания ионов, должно быть
таким, чтобы путь ионов к коллектору из каждой точки этого
пространства был по возможности кратчайшим. С другой сто-
роны, отрицательный потенциал коллектора должен ухудшать
эффективность образования ионов. Еще одной важной пробле-
мой является защита коллектора от действия помех, которые
в общем возрастают с увеличением поверхности коллектора и
уменьшением расстояния до анода.
Характеристики тонкого коллектора. Форма коллектора мо-
жет оказывать большое влияние на его эффективность. Если
коллектор представляет собой тонкий стержень, то его способ-
ность улавливать ионы зависит от диаметра стержня и от на-
чальной скорости ионов. Если бы начальная скорость ионов
была равна нулю, то их траектории совпадали бы с силовыми
линиями электрического поля, выходящими из пространства
анода и оканчивающимися на коллекторе; при этом все ионы
из пространства анода должны были бы достичь коллектора. Од-
нако начальные скорости ионов не равны нулю (например, при
Т = 300К они соответствуют энергии ~ 0,025 эВ); таким обра-
зом, в случае стержневого коллектора с малым диаметром
часть ионов, начальные скорости которых составляют значи-
тельный угол с направлением силовых линий электрического
поля, не попадает в коллектор, но траектория их искривляется.
Вероятность огибания ионами коллектора возрастает с увели-
чением начальной скорости ионов и с уменьшением диаметра
коллектора. Если коллектор имеет большие размеры (например,
коллектор в форме пластинки), то эффект практически отсут-
ствует. Отклонение быстрых ионов у тонкого коллектора в опре-
деленных случаях может быть полезным, так как помогает от-
делять быстрые ионы (которые образуются, например, при
382
ГЛАВА 6
поверхностной ионизации вследствие так называемой электрон-
ной десорбции).
Трудности измерения ионного тока. Из уравнения (5.74) сле-
дует, что ионный ток пропорционален давлению р. Если в
цепи коллектора нет других токов, то ток коллектора, равный
ионному току, является мерой давления:
Ic = h = KIeP = Sp
(5.78)
В действительности в цепи коллектора могут появиться па-
разитные токи, затрудняющие измерения ионного тока или де-
лающие невозможными эти измерения, особенно в случае очень
высокого вакуума. Обозначая эти токи
можно записать
2z=/% + /y + /2,
(5.79)
Л=Л + 2/=$р + 2/=5р(и-^-).
(5.80)
Из формулы (5.80) можно определить давление
(5.81)
Для того чтобы отклонение от пропорциональности между р
и /е не превышало а%, должно быть соблюдено условие
2 IlKpIe а/100. Следовательно, минимальное давление, для
которого выполняется это условие, составит
100 2 I 100 2 7
мм«н— aKIe aS
Например, для а = 10 получим
(5 81а)
рмин—10 к1е —10 s •
(5.816)
Таким образом, наличие паразитных токов ограничивает воз-
можность измерения низких давлений при помощи ионизацион-
ного манометра.
Давление, соответствующее паразитным токам, определяется
из уравнения Sp = 2 Д
27 J sz = а
(5.81в)
и называется предельным давлением ионизационного манометра.
На фиг. 5.33 представлен пример характеристики Ic = f(p)
ионизационного манометра. Там указаны также давление рми».
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
383
соответствующее 10%-ному отклонению от линейной зависимо-
сти, и предельное давление рпр. Штрих-пунктирная линия выра-
жает уравнение = Sp, а горизонтальная линия характеризует
уровень паразитных токов У 1.
Паразитные токи в цепи коллектора. В цепи коллектора,
кроме ионного тока, являющегося мерой давления, могут су-
ществовать, как уже упоминалось, и паразитные токи, вызван-
ные различными причинами.
Фиг. 5.33. Характеристика электронного ионизационного манометра.
Рмнн соответствует 10% ному отклонению характеристики от прямой линии 5=0,05 А-Тор—1»
Zc=f (p)=Zy + Е /=0,05р + 10“9, Т/=5р=0,05р.
1.Токи, вызываемые рентгеновским и ультра-
фиолетовым излучениями. Одним из наиболее значи-
тельных паразитных токов является ток, возбуждаемый элек-
тромагнитным облучением поверхности коллектора, вследствие
чего возникает фотоэмиссия электронов с коллектора. Эти элек-
троны достигают электродов, имеющих потенциалы более высо-
кие, чем коллектор (главным образом анода), создавая в цепи
коллектора ток того же направления, что и ионный ток1).
’) Ион, приближающийся к поверхности коллектора, «вырывает» из нее
электрон и захватывает его, приходя в возбужденное состояние. Когда затем
этот электрон переходит на основной уровень, возникает так называемая
эмиссия Оже (освобождение вторичного электрона с поверхности). Этот
эффект не влечет за собой значительных погрешностей, так как он некоторым
образом принимается во внимание при градуировке манометра.
384
ГЛАВА 5
Поверхность анода, бомбардируемая электронами анодного
тока /а с энергией eUa, становится источником сильных рентге-
новских лучей. Эффект рентгеновского излучения катода отно-
сительно невелик, так как фотоэмиссия связана только с ультра-
фиолетовой частью спектра накаленного катода. Поэтому целе-
сообразно использовать катоды с низкой рабочей температурой.
Электронный ток коллектора, вызванный рентгеновским из-
лучением, описывается уравнением
Ix = oAc[Zaf(Ua)]<I>caIa, (5.82)
где с — коэффициент, зависящий от материала и состояния по-
верхности коллектора; Ас — поверхность коллектора; 1а — анод-
ный ток; f(Ua) — величина, зависящая от анодного напряжения
[f(Ua)—Ua tn ~ 1,1 4- 1,6]; Фса — величина, зависящая от кон-
фигурации системы анод — коллектор (уменьшается с увели-
чением расстояния от анода до коллектора).
Коэффициент Za зависит от свойств материала, из которого
изготовлен анод, но в общем различия между значениями Za
для разных материалов невелики; например, для А1, Мо, Та,
W можно принять Za — 1, а для Ag и Au Za составляет ~0,8.
Следует отметить, что ток зависит от состояния поверхности
электродов, прежде всего коллектора; он может измениться
при осаждении на коллектор вещества катода или же в ре-
зультате очистки поверхности при прогреве катодов.
Электромагнитное излучение может достигать коллектора
также косвенно (посредством переизлучения от различных по-
верхностей).
Уменьшение тока /С(Х) возможно прежде всего путем умень-
шения поверхности коллектора Ас и величины Фса. Уменьшение
Фса обеспечивается применением электродов такой конфигура-
ции, при которой поверхность анода наблюдается со стороны
коллектора под наименьшим углом зрения. Это самый эффек-
тивный путь уменьшения тока /С(х), так как уменьшение вели-
чины f(Ua) сопровождается снижением эффективности иониза-
ции, а следовательно, и чувствительности манометра.
2. Ток, вызываемый электронной десорбцией.
Если покрытая газом поверхность бомбардируется электронами
с энергией, превышающей ~20 эВ, то с нее могут освобождать-
ся газы в виде нейтральных молекул и атомов, ионизированных
молекул и атомов или диссоциированных молекул. Нейтраль-
ные молекулы и атомы рассеиваются по всей вакуумной си-
стеме, увеличивая в некоторой степени давление, а ионизирован-
ные частицы могут достигать коллектора, создавая паразитный
ионный ток электронной десорбции.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
385
Количество десорбированных молекул зависит от рода газа
и поверхности, а также от характера и энергии связи. Обычно
количество ионов на 2 порядка меньше, чем нейтральных моле-
кул Оптимальная энергия бомбардирующих электронов состав-
ляет 60—150 эВ Максимальная энергия ионизированных частиц
может достигать 6—8 эВ Эффект электронной десорбции осо-
бенно существен в случае СО и О2, адсорбированных на вольф-
раме и молибдене, причем образуются ионы СО+ и О+ с энергией
до 7,5 эВ, а коэффициент поверхностной ионизации составляет
~10-5 ион/электрон.
Коллекторы, имеющие форму тонкого стержня, менее эффек-
тивно захватывают поверхностные ионы, начальная энергия ко-
торых (~7 эВ) значительно выше, чем у объемных (~ 0,025 эВ)
Ионы с малой начальной скоростью, движущиеся почти вдоль
силовых линий электрического поля, легче достигают тонкого
коллектора, чем ионы с большой начальной скоростью, подвер-
гающиеся сильному отклонению
Другим способом уменьшения эффекта тока /дес является
непрерывная очистка поверхности от адсорбированных газов пу-
тем подачи анодного тока большой плотности или соответствую-
щая обработка поверхности (например, платинирование), благо-
даря чему степень покрытия газами значительно уменьшается.
3. Ток фотоэлектронов со стенок баллона.
Если потенциал баллона ионизационного манометра равен по-
тенциалу коллектора или ниже его (что может иметь место, на-
пример, в случае вторичной эмиссии или колебаний тока), то
электроны, вылетающие из стенок баллона в результате электро-
магнитного облучения, будут достигать коллектора. Чтобы пред-
отвратить это, внутренние поверхности баллона покрывают про-
водящим слоем (чаще всего прозрачной двуокисью олова SnO2,
вплавленной в стекло), которому сообщается соответствующий
потенциал, например, путем соединения с катодом Более низкий
потенциал (например, при заземлении) чрезмерно снижает чув-
ствительность ионизационного манометра.
4. Ионный ток из накаленного катода. Высоко-
температурный катод является источником ионов (и паров ме-
талла, которые могут быть ионизированы). Чтобы предотвра-
тить возникновение такого паразитного тока, иногда применяют
катоды с низкой рабочей температурой или же между катодом
и коллектором помещают сетку с положительным потенциалом,
предотвращающую попадание ионов на коллектор. Однако ион-
ный ток из накаленного катода становится существенным лишь
при очень больших разрежениях и высоких температурах катода.
5. Токи утечки. Токи утечки вызываются несовершенной
изоляцией коллектора от остальных электродов. Эти токи
13 Зак 510
386
ГЛАВА 5
уменьшают путем соответствующего выбора изоляционного ма-
териала (стекло, керамика), поддержания поверхности в чи-
стоте (защита от напыления на внутренние поверхности бал-
лона), выбора конфигурации баллона и, в частности, примене-
ния заземленного металлического кольца, которое отделяет узел
коллектора как от остальной части баллона (фиг. 5.34), так
и от экрана.
Фиг. 5.34. Изоляция коллектора С от
токов катода и анода при помощи зазе-
мленного кольца.
Z —стеклянный баллон, 2—заземленное кольцо,
5—экран.
Ионная и химическая откачка манометра. Предполагая, что
собираемые коллектором ионы остаются прочно с ним связан-
ными, можно определить скорость ионной откачки из зависи-
мости уменьшения количества молекул газа со временем
dN _
dx е е
(5.83)
Здесь IJe— количество ионов, захватываемых в течение I с кол-
лектором. С учетом формул (1 4) и (2.26) выражение (5.83) пре-
образуется к виду
dp kT dN kT у.
~dx~~ dx Ve
(5.84)
где V — откачиваемый объем.
Скорость откачки манометра
(ЭД
пропорциональна коэффициенту чувствительности К и анодному
току 1е. Скорость откачки SPJ дополнительно возрастает за счет
связывания части ионов на стенках баллона.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
387
Например, при Т — 293 К, # = 1,04-10-19, е~ 1,6-10-19 Кл,
К = 20 Тор-1 и /е = 5-10-3 А получаем SP] = 0,02 л • с-1.
Разумеется, SP3 зависит от свойств газа, в частности от его спо-
собности к связыванию на коллекторе и стенках.
Кроме ионной откачки, может иметь место химическая от-
качка активных газов в результате их реакции с горячим ка-
тодом.
Триодный манометр. Принцип действия и характеристика.
В 1916 г. Бакли применил в качестве чувствительного элемента
вакуумного манометра небольшой триод с вольфрамовым като-
дом и двумя другими электродами, выполняющими роль анода
Фиг. 5.35. Схема триодных манометрических трубок ионизационных мано
метров.
А—анод; К—катод, С —коллектор.
и коллектора. Из двух возможных схем (фиг. 5.35) более широ-
кое применение ввиду ее лучшей чувствительности нашла схема,
в которой на месте коллектора установлен анод, а на месте
анода — коллектор (фиг. 5.35,6). При такой схеме путь, который
проходят электроны в пространстве ионизации между катодом
и анодом, в 2 раза больше (благодаря многократным пролетам),
чем в схеме, показанной на фиг. 5 35, а.
Электроды в триодах, применяемых для измерения давле-
ния, чаще всего имеют цилиндрическую форму (фиг. 5.36). На
аноде имеется положительное напряжение Ua — Ю0—200 В, на
коллекторе — отрицательное Uc — 20 — 75 В; электронный
(анодный) ток составляет от нескольких микроампер до десяти
миллиампер.
На фиг. 5.37 представлены схема электродов и распределе-
ние электрического поля в цилиндрическом триодном манометре.
Коллектор собирает ионы из пространства С перекрестной
13*
388
ГЛАВА 5
штриховкой; ионы из пространства с одинарной штриховкой за-
хватываются катодом или оседают на стенках баллона.
Коэффициент чувствительности К цилиндрического триод-
ного манометра в зависимости от размеров, конструкции, гу-
Фиг. 5.37. Расположение электродов
и распределение электрического поля
между электродами цилиндрического
триодного манометра с цилиндриче-
ским коллектором, окружающим се-
точный анод.
Фиг. 5.35. Триодный ионизационный
манометр с цилиндрической системой
электродов (с коллекторным анодом).
стоты сетки и других параметров составляет 10—30 Тор-1, что
при /е —5-10~3 А соответствует величинам S в диапазоне
0,05—0,15 А-Top-1. Таким образом, ионный ток (в амперах) на
1—2 порядка величины меньше соответствующего давления
(в торах).
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
38!
На фиг. 5.38 показана зависимость коэффициента чувстви
тельности К от анодного напряжения для триодной головки
Увеличение К при опт объясняется увеличением про
странства, в котором ху достигает максимальной величины.
В качестве материала для изготовления катодов обычно при
меняется чистый или торированный вольфрам; оксидные катодь
не находят применения ввиду того, что такие катоды не могу'1
работать в режиме насыщения, а также ввиду чувствительность
окислов к дезактивации. Обычно стремятся применять катодь
с пониженной рабочей температурой. Часто в манометрах пре-
дусматривают два катода (один из них, запасной, используется
также во время обезгаживания манометра).
Фиг. 5.38. Типовая зависимость коэффициента чувствительности У от анод-
ного напряжения Uа для триодного манометра.
Диапазон измерений триодного манометра. В триодном ма-
нометре цилиндр с большой поверхностью (окружающий анод
и катод) является коллектором. Он перехватывает почти полно-
стью рентгеновское излучение анода и ультрафиолетовое излу-
чение катода, в результате чего возникает большой ток 1Х, ко-
торому соответствует высокое предельное давление.
Действительно, зависимость le = f(p') для триодных мано-
метров явно отходит от прямой линии уже при давлениях ниже
10~7 Тор. Например, для триодного манометра с чувствитель-
ностью S = 0,05 А-Тор-1 ток 1Х равен 10'9 А, откуда можно
получить следующее уравнение тока коллектора:
Д = 0,05р+ 10-9
(единицы: А, Тор).
Минимальное .измеряемое давление, соответствующее 10%-
ному отклонению от прямой линии, согласно формуле (5.816)
составляет
10Zx Ю-Ю~э „ 1П-т т
Рмин— 5 0,05 —2-10 Тор,
390
ГЛАВА 5
а предельное давление
in-9 _
Рпр = -ОД5~=2- 10 Т°Р-
Типичная характеристика триодного манометра и значения со-
ответствующих давлений представлены на фиг. 5.33.
Верхний предел измеряемого давления находится между
Ю-4—10~3 Тор. Работа триодного манометра в пределах давле-
ний выше 10-3 Тор грозит повреждением катода (окисление, воз-
можная бомбардировка ионами). Ход характеристики при
Фиг. 5.39. Манометр Баярда — Аль-
перта с внутренним коллектором.
В—стеклянный баллон, К —катод, А — анод;
С —коллектор, Я —рукав, £—проводящий
слой.
р > 10-4 Тор также отклоняется от линейного вследствие воз-
растания ионного тока, который становится заметным по
сравнению с электронным током, а также в результате воздей-
ствия пространственного заряда положительных ионов. Для
расширения пределов измерений в сторону более высоких дав-
лений, например до 10~2 Тор и выше, применяют катоды, устой-
чивые к воздействию газов (из платины и иридия, иногда покры-
ваемые окислами') тория или иттрия), а также уменьшают по
мере возможности межэлектродные расстояния и применяют
более низкие анодные напряжения.
Манометр Баярда — Альперта. Главный недостаток триод-
ного манометра — высокое предельное давление, обусловленное
большим током 1Х вследствие большой поверхности коллекто-
ра— в значительной степени устранен в манометре Баярда—-
*) Ресурс катода, покрытого оксидом тория, при давлении 1 Тор состав-
ляет всего лишь несколько сот часов.
Вакуумные ИЗМЕРЕНИЯ
Альперта (1951 г.), коллектор которого имеет очень малую п
верхность Коллектор представляет собой стержень небольшо
диаметра (фиг 5 39), расположенный вдоль оси цилиндрич
ского сеточного анода, сна-
ружи которого находится
катод.
Рентгеновский ток /ж в
таком манометре уменьшает-
ся в отношении что
значительно снижает р1[р.
Часть коллектора, которая
не собирает ионов, специаль-
но защищается от рентгенов-
ских лучей (например, с по-
мощью стеклянного чехла).
Внутренние стенки баллона
часто покрываются токопро-
водящим слоем.
На фиг. 5.40, а показана
система электродов и стенка
баллона в разрезе, а на
фиг. 5.40, б — распределение
потенциалов вдоль радиуса
в предположении, что сетка
является идеально тонкой,
а катод не вносит помех.
Пространство ионизации,
из которого коллектор со-
бирает ионы, образовано
Фиг. 5.40. Система электродов и
распределение электрического по-
ля между электродами цилиндри-
ческого манометра Баярда — Аль-
перта с внутренним коллектором.
Заштрихована область ионизации
А—анод; В—баллон, К — катод; С — кол-
лектор.
полым цилиндром с внешним диаметром Оа и внутренним б
это пространство при тонком коллекторе сравнительно велик
ввиду логарифмического распределения потенциала вблизи кол
лектора. (В усовершенствованных манометрах Баярда — Аль
392
ГЛАВА 5
перта выходы анодного цилиндра закрыты сетками, которые
препятствуют утечке ионов.)
Потенциал на расстоянии г от оси системы электродов мо-
жет быть выражен формулой
^ = ^ + -й^1п —.
|„ АА °C
(5.86)
Зная распределение потенциалов, можно вычислить чувстви-
тельность манометра на основании проведенного анализа. Ко-
эффициент чувствительности манометра описывается выраже-
нием, вытекающим из формул (3.7), (3.8) и (5.72):
_ 7^ С + Т 2,3 1g (Да/6с)
т2 с + т3 а иа-ис А
Ua + Ub-Uj Ua-Ut 1
g~ Ub Ua + Ub-UjY
(5.87)
Формула (5.87) не учитывает выигрыша, связанного с многократ-
ными пролетами электронов, для которых условия в манометри-
ческой трубке Баярда—Альперта довольно благоприятны1).
В то же время здесь не учтена частичная потеря ионов вслед-
ствие их утечки из пространства ионизации (особенно в случае
отсутствия сеток на торцах анодного цилиндра).
Из расчета по формуле (5.87) получаются значения коэффи-
циента чувствительности К в пределах 10—20 Тор-1, а при 1е
порядка нескольких миллиампер получаются примерно такие
же значения К, как для триодной манометрической трубки.
Для улучшения стабильности и повышения чувствительности
манометра устанавливают экран между катодом и баллоном
(фиг. 5.41) или используют датчик осесимметричной конструк-
ции (например, с кольцевым катодом, окружающим анод).
Характеристики манометров типа Баярда — Альперта мно-
гократно исследовались и вообще довольно хорошо известны.
Например, отмечено, что если у анода отсутствуют концевые
сетки, то чувствительность манометра почти не зависит от по-
ложения коллектора в цилиндре анода (фиг. 5.42); установлено
также, что длина катода и его положение относительно анода
(фиг. 5.43) оказывают слабое влияние на чувствительность ма-
нометра.
’) Из формулы (5 76), например, для da — 2 мм и да — 0,2 мм получаем
b = 0,9, Ь2 = 0,81 и z = 4,5 В действительности вследствие «выталкиваю-
щего» действия коллектора г будет меньше, порядка 2,5—3.
Фиг. 5.41. Сеточный экран, защи-
щающий катод со стороны бал-
лона и концентрирующий электро-
ны в области ионизации манометра
типа Баярда — Альперта (по Ргд-
хеду).
Л —анод, В —баллон, К —катод, В—эк-
ран, С —коллектор.
Фиг. 5.42. Линии постоянной относитель-
ной чувствительности k манометра Баяр-
да — Альперта в зависимости от поло-
жения коллектора в цилиндре анода.
— расстояние между анодом и катодом;
В —стержень, поддерживающий спираль анода;
К —катод.
а d
Фиг. 5.43 Зависимость относительной чувствительности манометра Баярда —
Альперта от длины катода Lk (а) и расстояния между катодом и анодо^
dak (б).
• U образный кагод,
Фиг. 5.44. Зависимость относительной чувствительности k манометра Ба-
ярда — Альперта от диаметра проволоки из которой сделан коллектор
(k = 1 для Ъс = 1 мм).
Фиг. 5.45. Зависимость относительной чув-
ствительности k манометра Баярда - Аль-
дерта от длины коллектора L для рад,ы\
ролщин проволоки дс.
Фиг. 5.46. Зависимость чувстви-
тельности S манометра от диа-
метра анода Da и длины кол-
лектора Lc. В верхней части
рисунка показано расположение
9дек 1 родов и их размеры.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
395
Зависимость чувствительности манометра Баярда — Альпер-
та от диаметра проволоки коллектора дс представлена на
фиг. 5.44, а от его длины Lc в манометре без концевых сеток —
на фиг. 5.45; влияние диаметра цилиндра анода на чувствитель-
ность показано на фиг. 5.46.
5.6.1.2. Электронные ионизационные манометры с низким
предельным давлением. Манометр Баярда — Альперта представ-
ляет собой значительный шаг вперед по сравнению с триодным
манометром, тем не менее он не удовлетворяет требованиям
измерения очень низких давлений.
Как следует из формулы (5.81в), для снижения порогового
давления манометра необходимо уменьшить паразитные токи
или увеличить коэффициент чувствительности1). Оба эти прин-
ципа находят применение в разных конструкциях манометров
с низким предельным давлением.
Паразитные токи, главным образом ток 1Х, можно умень-
шить путем выбора оптимальной конфигурации системы анод —
коллектор (удаление коллектора от источника рентгеновских
лучей, экранирование, искривление траекторий ионов и т. п.)
или путем предотвращения утечки электронов с коллектора (на-
пример, применение потенциального барьера).
Повышение чувствительности манометра достигается увели-
чением пути ионизации электронов. Для этого используют маг-
нитные или радиальные электрические поля, принуждающие
электроны двигаться по винтообразным или спиральным траек-
ториям, или же тормозящие электрические поля, в которых
электроны колеблются.
Эти методы находят применение в различных высоковакуум-
ных ионизационных манометрах; наиболее перспективные из
них рассматриваются ниже.
Одним из таких приборов является манометр с внешним
коллектором, т. е. коллектором, помещенным за пределами се-
точной ионизационной камеры. Достоинство таких манометров
заключается в том, что движущиеся в пространстве анода элек-
троны не «выталкиваются» оттуда отрицательным полем кол-
лектора, вследствие чего количество пролетов каждого элек-
трона сравнительно велико2).
К манометрам очень высокого вакуума, кроме достаточно
низкого предельного давления, предъявляется ряд дополнитель-
’) Увеличение тока 1е не дает снижения Дпр, так как самый существенный
из паразитных токов — ток I*— пропорционален 1е.
2) В этих условиях может произойти возбуждение колебаний Баркгаузе-
на — Курца в цепи, образованной емкостями и индуктивностями системы
электродов, это явление можно использовать для значительного увеличения
чувствительности манометра (за счет стабильности).
396
ГЛАВА 5
ных требований. Следует помнить прежде всего, что манометр
не должен вести себя как насос или же как источник газов.
Связанные с этим погрешности измерений тем больше, чем
меньше проводимость каналов между манометром и простран-
ством измеряемого давления, а также чем больше сорбционная
или десорбционная способность баллона и электродов.
Вакуумпровод между манометром и пространством изме-
ряемого давления должен быть коротким и иметь большой диа-
метр. Лучше всего применять открытые манометры (без изо-
лирующего корпуса), помещенные непосредственно в простран-
стве измеряемого давления ').
Принимая во внимание сорб-
ционные и десорбционные свой-
ства электродов и баллона мано-
метрической трубки, лучше при-
менять манометры с малым коли-
чеством металла и с небольши-
ми поверхностями электродов.
Часто эти характеристики более
важны, чем высокая теорети-
ческая точность манометра, так
Фиг. 5.47. Манометр Баярда — Алыгерта
с модулятором Редхеда.
4—анод, К—катод; С — коллектор; М~ моду-
лятор, Z—земля.
как погрешности, вызываемые сорбцией и десорбцией, приво-
дят к местным изменениям давления, превышающим порой на
порядок среднее значение давления.
Модуляционный манометр Редхеда. Многим требованиям,
предъявляемым к манометрам для очень высокого вакуума,
удовлетворяет модуляционный манометр Редхеда (1962 г.), мо-
дифицировавшего манометрическую трубку Баярда — Альперта
с тонким коллектором, в результате чего ее диапазон измере-
ний сместился в область более высокого вакуума. Модификация
состояла во введении в цилиндр анода дополнительного стерж-
ня М, аналогичного коллектору (фиг. 5.47). Этот стержень на-
зывается модулятором.
*) Различие показаний открытого и снабженного корпусом манометров
называется эффектом Блирса.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
397
При измерениях потенциал модулятора изменяется от ве-
личины, равной потенциалу анода (Л4->Д), до величины, рав-
ной потенциалу коллектора (M-^Z)1). Для этих двух по-
тенциалов модулятора можно написать следующие уравнения
тока коллектора:
Л4->Л I'c = S'p + I'x, (5.88а)
M->Z a = S"p + n. (5.886)
Здесь S' и S"— чувствительности манометра для соответ-
ствующих соединений модулятора. Разумеется, S" < S', так как
при переключении М -> Z часть ионов, уходя на стержень моду-
лятора, уменьшает ток коллектора.
Вычитая уравнение (5.886) из (5.88а), получаем
Гс- Д' = (У-3")р + (Д-/Д. (5.89)
Если предположить, что переключение модулятора не влияет
на эффект рентгеновского излучения в манометрической трубке,
то 1х = 1'х, и из уравнения (5.89) получим
Д/с
= (5‘90)
где Мс = ['с — Гс — дифференциальный (разностный) ток моду-
ляции, a S = S'— S"— чувствительность модуляционного ма-
нометра. Таким образом, измеряемое давление пропорциональ-
но разности двух отсчетов тока коллектора, соответствующих
положениям переключателя модулятора.
На фиг. 5.48 показаны характеристики для этих двух поло-
жений переключателя: М->А и 44->Z. Токи коллектора пред-
ставлены в зависимости от разности Д/с, которую (поскольку
она не содержит ошибки в измерении тока 1Х) можно считать
пропорциональной действительному давлению р; характеристи-
ка этого разностного тока Д/с представлена штриховой линией.
Хотя модуляционный манометр Редхеда в значительной сте-
пени уменьшает влияние рентгеновского излучения и смещает
предельное давление на 1—2 порядка величины в сторону ма-
лых давлений, он, однако, не решает проблему измерения очень
низких давлений. Сверх того, измерение усложняется необходи-
мостью выполнения двух отсчетов.
Серьезным недостатком метода является также и то, что
условие I'x — Гх. часто выполняется только приблизительно2).
Кроме того, при модуляции происходят десорбция и сорбция
газов, что затрудняет отсчет истинных значений токов Гс и Гс
*) Коллектор имеет в принципе потенциал земли.
2) Введение поправки Аппельта уменьшает ошибку, связанную с предпо-
ложением
398
ГЛАВА 5
(фиг. 5.49). Наконец, глубина модуляции в некоторой степени
зависит от рода газа. Несмотря на это, манометр Баярда —
Фиг. 5.48. Характеристики модуляционного манометра.
/ н
Токи коллектора: /с—для модулятора М, соединенного с анодом /с—для мо-
дулятора, соедниеиного с земзей
—-----зависимость давления от разностного тока модуляции
Замедленная /стабилизация тока I вызвана отчасти явлениями сорбции и десорбции газа
модулятором.
Альперта — Редхеда является большим шагом вперед в изме-
рении очень низких давлений, а два отсчета составляют своего
рода взаимный контроль обоих измерений.
Манометр с модулятором, работающим без электронного
тока. Эффекты сорбции и десорбции газов, вызванные модуля-
цией, устраняются, если модулятор работает без электронного
тока, т. е. его потенциал никогда не бывает выше потенциала
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
399
катода. Это имеет место при переключениях М -> К и М -> Z.
Однако манометр Баярда — Альперта — Редхеда имеет при этом
малую величину постоянной модуляции.
В манометре, представленном на фиг. 5.50 (Грошковский,
1970 г.), посредством модулятора в форме клетки, опоясываю-
щей коллектор, обеспечивается сравнительно высокая модуля-
ционная чувствительность S, а также достаточная глубина мо-
дуляции при переключении модулятора между катодом и
землей.
Фиг. 5.50. Манометр с модулятором в виде клетки, работающим без элек-
тронного тока.
Д'. К"—катоды (одни запасной), А— анод, С—коллектор; М— модулятор в виде клетки,
Специальная электронная система с переключателем и па-
мятью позволяет в любой момент получить на измерительном
приборе разностный ток модуляции (Грошковский, Пытковский,
Тшох, 1973 г.).
Манометр с потенциальным барьером. Для уменьшения
утечки электронов из коллектора, образующих ток 1Х, Шуман
(1964 г.) поместил между анодом А и коллектором С
(фиг. 5.51) кольцевой электрод S (так называемый подавитель)
с довольно высоким отрицательным потенциалом. Подавитель
создает в плоскости кольца потенциальный барьер, через kq-
400
ГЛАВА 5
торый не могут пройти электроны, эмиттированные из коллек-
тора Для того чтобы барьерное кольцо само не было источни-
ком электронов (которые могли бы достичь коллектора), его за-
слоняют от анода цилиндрическим экраном Е
Подавитель S и коллектор С с отрицательными потенциа-
лами совместно с экраном Е, имеющим нулевой потенциал, об-
разуют электронно-оптическую систему для ионов, возникших
в пространстве анода, вследствие чего большинство их сво-
бодно поглощается коллектором и только незначительная часть
Фиг. 5.51. Манометр с потенциальным барьером Шумана.
Я—сеточный анод. К — катод, С—коллектор, Е — экран, S — кольцевой барьерный электрод
В — баллон.
захватывается подавителем. Потенциалы электродов (относи-
тельно земли) типичного манометра с потенциальным барьером
следующие: Ua = +200 В, Uh— +50 В, Uc = 0, Us = —300 В
Чувствительность манометра при 1е = 10 мА составляет
~20 А-Тор-1.
Роль, выполняемую барьерным кольцом, можно пояснить при
помощи графиков фиг 5 52, которые иллюстрируют зависимость
тока коллектора от потенциала подавителя и давления р При
измерении давлений выше 10-8 Тор, где влияние тока 1Х не имеет
уже значения, ток /с не зависит от Us Польза от применения
подавителя существенна лишь при очень низких давлениях, где
очень важно, чтобы ток коллектора не содержал составляющей
!х (при | Us\> 300 В) Например, при Us — 0 ток коллектора 1С
не может быть ниже примерно 5-10~9А (что соответствует пре-
дельному давлению рпр = 2,5-10-10 Тор), а при Us = —300 В
Возможно измерение давлений порядка 10-12 Тор.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
401
Экстракторный манометр. Еще один усовершенствованный
манометр (Редхед, 1966 г.) представлен на фиг. 5 53 Катод К
(торированный) имеет форму кольца (применяются также ка-
тоды в виде буквы V) Коллектор С (в виде тонкого стержня)
помещен вне пределов анода, в центре полусферического отра-
жателя ионов 2, отражатель имеет потенциал анода, но отделен
от него экраном Е (с отверстием), имеющим потенциал катода.
Внутренняя стенка стеклянного баллона покрыта наплавлен-
ным на стекло прозрачном слоем проводящей двуокиси олова
SnOg; этот слой также имеет потенциал катода
Фиг. 5.52 Зависимость тока коллектора 1С от потенциала (отрицательного)
кольцевого барьерного электрода Us и давления р.
г
Электроды манометра обезгаживаются электронной бомбар-
дировкой (250 мА, 1 кВ). Манометр может быть снабжен моду-
лятором М (в виде тонкой короткой проволоки, помещенной
вдоль оси анода), обеспечивающим модуляцию ~ 50%. Кол-
лектор в этом манометре заземлен (через измеритель ионного
тока), катод, баллон и экран имеют потенциал +200 В, а анод
и отражатель +305 В Электронный ток (к аноду) не превы-
шает 2 мА. Коэффициент чувствительности манометра К состав-
ляет ~13 Тор-1, а предельное давление, определяемое рентге-
новским излучением, несколько выше 10~13 Тор.
Ионы, созданные в области анода электронным током от ка-
тода, притягиваются в направлении экрана; большинство из
них проходит через отверстие в экране и вследствие положи-
тельного потенциала полусферического отражателя направ-
ляется к коллектору.
Поток рентгеновских лучей, падающих на коллектор, неве-
дцк; в значительной степени снижено и влияние электронной
402
ГЛАВА 5
десорбции из анода. Однако при больших электронных токах
чувствительность этого манометра снижается.
Фиг. 5.53. Экстракторный манометр Редхеда.
д —принципиальная схема; б—конструктивная схема.
Экран и баллон имеют потенциал катода (200 В), отражатель ионов соединен с анодом (305 В);
Л—сеточный анод, открытый с одной стороны; В-экран; К —кольцевой катод (ториро-
ванный вольфр'йм'; С—коллектор; М — модулятор.
/-—баллон с металлизированной внутренней поверхностью; 2—отражатель ионов.
Манометр с экранированным внешним коллектором. На
фиг. 5.54, а представлена схема манометра с экранированным
внешним коллектором (Грошковский, 1966 г.), который состоит
из анода А, катодов (рабочего К' и не показанного запасного
/С"), коллектора С и экрана Е. Анод представляет собой замк-
нутую цилиндрическую сетку; напротив отверстия О, имеюще-
гося в одном из ее торцов, помещен коллектор С в виде
тонкого короткого стержня. Коллектор окружен экраном Е (стек-
лянным или металлическим), который доходит почти до торце-
вой поверхности сетки. Коллектор и экран так расположены
относительно анода, что стержень коллектора открыт лишь в
направлении центральной части удаленного торца сетки. Таким
образом, коллектор защищен от значительной части рентгенов-
ского излучения анода, а также ультрафиолетового излучения
д
Ф 65
Фиг. 5.54. Манометр J. G. с экранированным внешним коллектором.
о—разрез; б—внешний вид; в—контрольно-измерительный блок Лаборатории электронной
технологии Варшавского политехнического института.
Иереях контрольно-измерительным блоком — МанОМеТПииргк’яя Tnvrti^a г> ппРПУГипитрляМ
404
ГЛАВА 5
катода, а источником захватываемых им ионов может быть
лишь область анода. Так как внутри анода нет коллектора, то
электрическое поле в нем равномерно, только вблизи отверстия
О образуется «потенциальная яма», обусловленная отрицатель-
ным потенциалом стержня коллектора и экрана Эта потенциаль-
ная яма очень полезна, так как в ней концентрируются медлен-
ные ионы (0,025эВ), образующиеся в области анода и направ-
ляющиеся к стержню коллектора (фиг 5 55, а). Ионы же с боль-
шими скоростями (~ 6 эВ), возникающие при электронной де-
сорбции, преодолевают эту «яму», и большинство из них, не
Фиг. 5.55. Траектории ионов в пространстве.
д —траектории медленных пространственных ионов, только небольшое количество ионов,
возникающих непосредственно у отверстий сетки, уходит из пространства анода, боль-
шая часть их достигает коллектора, б—траектории быстрых (поверхностных) Ионов, немно-
гие из них достигают коллектора»
доходя до коллектора, покидает пространство анода через от-
верстия сетки (фиг. 5.55,6). Нужные ионы, стекающиеся к стер-
жню коллектора, удерживаются от рассеяния окружающим эк-
раном, вследствие чего улучшается собирательная способность
коллектора.
Благодаря тому что коллектор внутри анода не деформирует
поля, электроны многократно пролетают как через сетку, так и
через пространство анода, вследствие чего значительно возра-
стает новообразование и при хорошей собирательной способно-
сти коллектора достигается высокая чувствительность мано-
метра.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
405
Коллектор манометрической трубки заземлен (измерителем
тока), катод несет потенциал +200 В, анод +300 В, анодный
юк составляет 4 мА. Коэффициент чувствительности ~ 50 Тор-1.
Рентгеновская составляющая в токе коллектора 1Х порядка
10-14А, чему соответствует (при /а— 4 мА) предельное давле-
ние ниже чем 10-13 Тор. Обезгаживание производится посред-
ством электронной бомбардировки (при использовании обоих
катодов) мощностью 100 мА-1000 В = 100 Вт. Мощность нака-
ла составляет ~6 Вт Внутренняя стенка баллона покрыта
слоем SnO2
На фиг 5 54,6 показана манометрическая трубка с наруж-
ным экранированным коллектором, а на фиг. 5 54, в — контроль-
но-измерительный блок и манометрическая трубка с предвари-
тельным усилителем
Манометр с криволинейным пучком ионов Гельмер и Гай-
вард (1966 г) применили электростатическую ионную оптику
Фиг 5.56 Манометр Гельмера и Гайварда с криволинейным пучком ионов.
А— анод, /(—катод, £i, £2 — экраны; D\, Р2—электроды дефлектора, С—коллектор;
S—барьерная сетка, 1, 2—отверстия в экранах.
для отклонения пучка ионов, выходящего из пространства ано-
да, благодаря чему коллектор экранируется от рентгеновских
лучей анода Схема манометра представлена на фиг. 5.56. Ионы,
возникшие в анодной клетке А (благодаря электронному току, со-
406
ГЛАВА 5
здаваемому тарированным катодом К), движутся в направлении
отверстия 1 в экране Е] (заземленном). После ускорения в от-
верстии 1 напряжением 230 В эти ионы входят в поле дефлек-
тора, образованного обкладками конденсатора, который имеет
форму 90°-ного сектора цилиндра. Обкладка дефлектора Di за-
землена, а обкладка D% имеет потенциал Ud, =—270 ± 50 В.
В дефлекторе поток ионов, имеющих энергию 250 ± 5 эВ, от-
клоняется, ионы попадают в отверстие 2 экрана Е% (также за-
земленного) и через сетку 5 (с отрицательным потенциалом
Us~-—90 В) доходят до заземленного (через измеритель тока
/с) коллектора. Сетка 5 удерживает электроны, которые могут
эмиттироваться коллектором. При размерах отверстия 2 ~6,5Х
X 13 мм коэффициент чуствительности манометра К составляет
~ 16 Тор-1, что для тока 1е = 10 мА дает чувствительность
5 = 0,15 А-Тор-1.
Ионная оптика должна быть такого рода, чтобы пучок ионов
при столкновении с пластинками дефлектора не создавал вто-
ричных заряженных частиц (электронов или ионов), которые бы
могли достигать коллектора. Оптимальные условия получают,
придавая специальную конфигурацию пластинкам дефлектора
и подбирая соответственно напряжения UD2 и Us-
Предполагаемое предельное давление, обусловленное рент-
геновским током и другими помехами, для этого манометра со-
ставляет ~5-10-13 Тор. По-видимому, основной недостаток ма-
нометра связан с наличием значительных масс металла и его
больших поверхностей, соприкасающихся с вакуумом. Макси-
мальный размер системы электродов манометра составляет
~ 70 мм.
Манометр с магнитным полем. На основе концепции Кон-
на и Дэглиша (1954 г.) повышения чувствительности иониза-
ционного манометра с горячим катодом путем применения маг-
нитного поля разработан (Лафферти, 1961 —1963 гг.) манометр,
напоминающий по своей конструкции диодный магнетрон
(фиг. 5.57,я). Этот манометр состоит из вольфрамового катода
К (в виде удлиненной буквы V), помещенного вдоль оси цилин-
дрического анода (молибденового) А; коллектором С является
одна из двух торцевых сеток анода. Вторая торцевая сетка Е
является экраном, который отделяет держатели электродов от
пространства ионизации и одновременно направляет ионы к кол-
лектору.
Магнитное осевое поле с индукцией В — 0,03 Т создается
постоянным магнитом 2. Анод имеет напряжение (относительно
катода) Ua = 300 В, напряжение коллектора Uc = —45 В, на-
пряжение экрана Ue =—10 В. Эмиссионный ток катода (отре-
гулированный на В = 0) составляет от 10-6 до 10-9 А.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
407
При напряжении Ua — 300 В критическая магнитная индук-
ция Вкр примерно равна 0,01 Т (фиг. 5.57, в); дальнейший рост
индукции В вызывает быстрое уменьшение тока в анодной цепи,
однако эффективность ионизации возрастает, как это следует из
Фиг. 5.57. Манометр Лафферти с магнитным полем.
а—конструктивная схема;'^б—траектории электронов в критическом магнитном поле,
в — зависимость токов: катодного 1^, анодного J&, ионного /у, коллектора <с и коллектор-
ного фона Iх от магнитной индукции.
Л—анод; К —горячий катод (выполненный из реиия и покрытый LaBe катодофорезиым
способом), С—коллектор; Е—экран.
/ — стеклянный баллон, 2—постоянный магнит, 3—трубка, ведущая в объем, где изме-
ряется дазлеиие р.
значительного увеличения тока в цепи коллектора (фиг.5.57,в).
При Uа — 300 В и В — 0,032 Т коэффициент чувствительности
вакуумного манометра К составляет ~4-107 Тор-1, что при
электронном потоке 1е = 2•10-9А соответствует чувствительно-
сти манометра 3 — 0,08 А-Тор-1, т. е чувствительность имее1
тот же порядок, что и у ионизационных манометров без магнит-
ного поля. Анодный ток в этом манометре очень мал, что
408
ГЛАВА 5
уменьшает рентгеновский эффект. Однако откачивающее дей-
ствие манометрической трубки (зависящее от ионного тока) не
снижается. Из вида кривых, показанных на фиг. 5.57, в, следует,
что ток коллектора 1Х составляет 10~13 А, откуда получаем тео-
ретическую величину предельного давления
1Q~13 19
Р”р=4ж“=1’3'10 Тор-
Верхней границей измеряемого давления для этого мано-
метра может быть в принципе 10-3 Тор, однако пропорциональ-
ность между р и 1С нарушается уже при давлениях ^.Ю-7 Тор.
5.6.1.З. Радиоизотопные манометры. В радиоизотопных ма-
нометрах ионизация осуществляется «-частицами1) (или р-ча-
стицами), излучаемыми радиоактивным веществом с достаточно
длительным периодом полураспада. В частности, радий находит
А
Фиг. 5.58. Радиоизотопный манометр (альфатрон).
С —коллектор (катод), являющийся одновременно благодаря ело о радиоактивного изотопа
источником ионизирующего излучения; А—корпус, служащий анодом.
применение (в виде сплава с золотом) в плотной никелевой обо-
лочке (с целью удержания образующегося при распаде радона
и для защиты от паров ртути). Положительно заряженная «-ча-
стица, излученная радием, в момент распада (период полурас-
пада радия ti/2 = 1600 лет) имеет энергию ~ 4,8 МэВ. Эта энер-
гия соответствует скорости, получаемой в электрическом поле
с потенциалом ~ 2,5 МВ, т. е. может эффективно ионизировать
газ. Более безопасными, принимая во внимание ионизирующее
излучение, являются частицы р, излучаемые тритием (адсорби-
рованным в слое титана) и имеющие среднюю энергию ~5 кэВ
при Ti/2— 12 лет.
Радиоактивные манометры не имеют ни источников накала
катода, ни источников анодного напряжения, они требуют лишь
отрицательного напряжения на коллекторе ~30—40 В. Схе-
ма конструкции радиоизотопного манометра представлена на
') Иногда эти приборы называются альфатронами^
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
409
фиг. 5.58. В металлическом корпусе (заземленном) находится
изолированный коллектор С в виде стержня, покрытого слоем
радиоактивного изотопа, или в виде трубки, содержащей источ-
ник излучения а- или р-частиц. Ионный ток в цепи коллектора
является мерой давления и после усиления отсчитывается на
амперметре. Ввиду большой энергии а-частиц степень иониза-
ции пропорциональна давлению, а ионный ток коллектора мо-
жно выразить формулой
= = (5.91)
где 3 — чувствительность манометра, зависящая (для данной
конструкции) от количества радиоактивного вещества Na в ис-
точнике ионизации, а также
от рода газа (коэффициент
с). Например, для радиево-
го излучателя можно ориен-
тировочно принять, ЧТО Ij =
= 10-15 А на 1 мкг радия
при давлении 10~3 Тор (для
воздуха).
Таким образом, альфа-
трон, содержащий 0,2 мг ра-
Фиг. 5.59. Характеристика альфа-
тронного манометра (для воздуха).
Чувствительность S = 5-10~" А-Тор~*.
дия, имеет чувствительностьS (для воздуха) ~2-10-10 А-Тор-!.
Увеличивая количество радия, можно расширить диапазон из-
мерений до ~10~4 Тор. Измерение более низких давлений за-
труднено, как и в электронных ионизационных манометрах,
присутствием рентгеновского фона, создаваемого ударами р-ча-
стиц ’) о стенки камеры. При давлениях выше нескольких де-
сятков тор шкала становится нелинейной вследствие увеличе-
ния плотности ионов и соответственно пространственного за-
ряда коллектора.
На фиг. 5.59 показана (для примера) характеристика ти-
пичного альфатронного манометра для воздуха; в табл. 5.6
приведены коэффициенты чувствительности для других газов
') Излучение состоит из частиц а, 0 и у в отношении 105: 102: 1.
4 Ю
ГЛАВА 5
(показания манометра следует делить на эти величины). Этот
вакуумный манометр содержит в качестве источника a-излуче-
ния радий с радиоактивностью 100 мкКи.
Таблица 5.6
Относительная чувствительность (по сравнению с воздухом)
альфатрона для некоторых газов
Газ (пар) с3нб0 (ацетон) со2 Аг Воз- дух Н20 Ne Н2 Не
Относительная чув- ствительность (•^возд = t) 2,5 1,5 IJ 1 0,85 0,5 0,25 0,3
Диапазон измерения давлений для этого манометра состав-
ляет 10—10~4Тор, масштаб линейный, точность ±2%.
5.6.2. Манометры с неконтролируемым источником ионизации
В манометрах с неконтролируемым источником ионизации
ток, характеризующий величину давления, одновременно вызы-
вает ионизацию и поддерживает разряд в газе. Следовательно,
действие этих манометров основано на самоподдерживающемся
(самостоятельном) разряде, возникающем в результате доволь-
но высокого напряжения, приложенного через большое сопро-
тивление между двумя электродами: холодным катодом и ано-
дом. Ток I, проходящий в цепи этих электродов, является функ-
цией давления I = f(p).
Обязательное условие правильного функционирования мано-
метра состоит в том, что в пределах измерений эта функция
должна быть непрерывной и однозначной (т. е. не иметь ни раз-
рывов, ни петель).
Механизм такого самоподдерживающегося разряда, назы-
ваемого тлеющим разрядом, заключается в том, что электроны,
движущиеся под действием приложенного напряжения от ка-
тода к аноду, при столкновении с молекулами газа выбивают
из них электроны; возникающие в результате этого ионы дви-
жутся к катоду. Катод под влиянием этих ударов, большого
напряжения электрического поля вблизи поверхности катода и
катодного облучения становится источником электронов (вто-
ричных, холодной эмиссии, фотоэмиссии), которые, двигаясь к
аноду, вызывают образование ионов. Таким образом, при дан-
ном давлении устанавливается определенный ток, приводящий
к образованию такого количества ионов, которое необходимо
для того, чтобы вызвать эмиссию электронов, достаточную для
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
411
поддержания разряда. При изменении давления устанавливается
новое состояние, которому соответствует новая величина тока.
Связь между током I и давлением р можно выразить при-
близительной формулой
/ NeLjdoi ЭфФ Р ехр ], (5.92)
где е — заряд электрона, k — постояннная Больцмана, Т — тем-
пература газа, Ne — количество электронов, выходящих из ка-
тода в единицу времени, й?0,эфф— эффективный диаметр моле-
кулы, р— давление, U:— потенциал ионизации газа, Е — напря-
женность электрического поля, L3 — путь ионизации.
Р
-II +
Фиг. 5.60. Схема простейшего электроразрядного манометра (с тлеющим
разрядом).
Размещение трубки в магнитном поле индукции В повышает степень ионизации.
А—анод; К—холодный катод; Я—сопротивление, предохраняющее от дугового разряда.
Для малых давлений (например, р < 10-3 Тор) и больших
напряженностей электрического поля уравнение (5.92) сводится
к виду
1 = [ W N^d], эфф] р = Sp. (5.93)
Выражение в квадратных скобках характеризует чувствитель-
ность манометра
3=4^^М,Эфф. (5.94)
Чувствительность 3 можно увеличить разными способами,
в основном посредством удлинения пути ионизации L3, придавая
траекториям электронов винтовую или спиральную форму (при
помощи магнитного поля) или увеличивая кратность пролета
электронов через пространство ионизации (при помощи тормо-
зящих электрических полей). Эти способы находят применение
во многих манометрах рассматриваемой группы. 1
На фиг. 5.60 представлена схема электроразрядного (с тлею-
щим разрядом) манометра. Последовательно с источником
высокого напряжения (2—10 кВ), как правило, включается
412
ГЛАВА 5
сопротивление R, предохраняющее от перехода тлеющего раз.
ряда в дуговой.
Одним из неудобств электроразрядного манометра является
трудность возбуждения разряда в очень высоком вакууме, когда
после перехода к очень низкому давлению электрическая цепь
манометра размыкается, а затем снова замыкается. Для сра.
батывания манометра (появления тока) в этом случае нужен
какой-то внешний электрический импульс (например, разряд
Фиг. 5.61. Характеристики различ-
ных электроразрядных манометров.
« — показатель степени в уравнении
I~PU.
1, 2—старая конструкция (нелинейные
характеристики с разрывами), 3 -усо-
вершенствованная конструкция (лога-
рифмически линейная непрерывная ха-
рактеристика).
трансформатора Тесла) или импульс газа (например, накали-
вание вспомогательного малого катода, который выбрасывает
некоторое количество газа или создает небольшую эмиссию
электронов).
Разные конструктивные решения манометров с тлеющим
разрядом имеют целью расширение их пределов измерений в
направлении высокого вакуума, повышение чувствительности,
обеспечение линейности, облегчение возбуждения, исключение
разрывов характеристики и т. д.
Серьезным недостатком манометров с магнитными и элек-
трическими полями являются возникающие в них разного р°Да
колебания электрических зарядов (малой и большой частоты^
влекущие за собой «скачки» измерительного тока, которые
свою очередь воздействуют на усилитель ионного тока и могу
нарушить нормальную его работу. и
На фиг. 5.61 показаны в качестве примера характерист^
I — Для трех манометрических трубок: старого типа I
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
413
и современной 3 (инверсно-магнетронной). Как видно, связь
между током и давлением у этих приборов не является линей-
ной; кроме того, у приборов старого типа показатель степени и
меняется вместе с давлением.
Другим неудобством электроразрядных манометров с маг-
нитным полем является их сильное откачивающее действие (уси-
ленное высоким напряжением и катодным напылением), а так-
же связанная с ним сильная десорбция, которая может проявить
себя при переходе от высоких давлений к низким.
а
Фиг. 5.62. Магнитный электроразрядный манометр Пеннинга (1937 г.),
а —схема расположения электродов; б—внешней вид.
4 —анод; К', К" —катоды; В —магнитная индукция.
Магнитный электроразрядный манометр. Пеннинг (1937 г.)
на основе концепции Филипса разработал первый магнитный
электроразрядный манометр (с тлеющим разрядом, фиг. 5.62).
Система электродов такого манометра состоит из прямоуголь-
ной проволочной рамки А, выполняющей роль анода, и като-
дов К7 и К" в виде пластинок (размером меньше рамки), поме-
щенных симметрично по обеим сторонам. Магнитное поле с ин-
дукцией В, равной нескольким сотым теслы, создаваемое элек-
тромагнитом или постоянным магнитом (размещаемым снаружи
баллона), действует в направлении оси системы электродов.
Пластинки катода сделаны из тантала или алюминия (иногда
Они покрываются слегка окисленным цирконием или торием),
а анода — из молибдена или никеля.
Система электродов способствует возникновению колебатель-
ного движения электронов между обеими пластинками катода,
414
ГЛАВА 5
а магнитное поле придает траекториям электронов винтовую
форму. Благодаря этому путь ионизации значительно увеличи-
вается, в результате чего повышается чувствительность мано-
метра, а также облегчается возбуждение разряда при низких
давлениях.
При напряжении U = 2 кВ и магнитной индукции В = 0,04 Т
манометр имеет приблизительно линейную характеристику I=
= f(p) в области давлений 2-10~~3—10~5 Тор; чувствительность
манометра составляет ^1 А-Top-1. Для давлений р < 10~5 Тор
разряд нестабилен, иногда потухает, а ток в цепи электродов
подвергается колебаниям, что затрудняет измерения. Некоторое
влияние на стабильность характеристик разряда оказывают
свойства материала, из которого изготовлен катод.
На фиг. 5.63, а представлена принципиальная схема магнит-
ного электроразрядного манометра. Сопротивление 1 МОм, со-
единенное последовательно с источником питающего напряже-
ния, предохраняет от возникновения дугового разряда. На
фиг. 5.63,6 показан пример шкалы измерительного прибора.
Чувствительность датчика в значительной степени зависит от
индукции магнитного поля В, а это требует очень тщательного
выбора положения магнита относительно электродов и его на-
дежной юстировки.
На фиг. 5.64 приведена зависимость чувствительности S от
напряжения U при В = const. Усовершенствованная конструк-
ция датчика показана на фиг. 5.65, а. Анод здесь цилиндриче-
ский, а катодом являются два кружка, почти закрывающие
выходы цилиндра. Баллон сплюснут в центральной части с
целью уменьшить зазор между полюсами магнита. Характери-
стика этого манометра для области давлений 10-3 — 5-10~7 Тор
дана на фиг. 5.65,6. Как видно, чувствительность этого мано-
метра (более 10 А-Top-1) почти в 10 раз выше, чем у мано-
метра, представленного на фиг. 5.63
Упрощенная модификация магнитного электроразрядного
манометра представлена на фиг. 5.66 (Редхед). Роль катода в
этом манометре выполняют два кружка К' и К", соединенные
тонким стержнем. Анод А представляет собой кольцо несколь-
ко меньшего диаметра. Магнитное поле направлено вдоль оси
системы. Анодное напряжение равно 4 кВ, а магнитная индук-
ция составляет 0,01 Т. Вывод катода, соединенный с чувстви-
тельным измерительным прибором, хорошо изолирован от ввода
анода. Датчик предварительно выдерживается при температу-
ре ~670 К и позволяет измерять давления до 10-11 Тор. Рабо-
чий диапазон измерения давлений прибора 10-4— 10-11 Тор,
причем линейность сохраняется в пределах 10"4—10-10 Тор.
Имеются магнитные электроразрядные манометры, целиком
выполненные из металла (фиг. 5.67).
Фиг 5.63. Магнитный электроразрядный манометр,
а—принципиальная схема, б—шкала прибора.
Фиг 5.64 Зависимость чувствительности S магнитного электроразрядного
манометра от напряжения U при В = 0,04 Т.
Фиг. 5.65 Магнитный электроразрядный манометр закрытой конструкции
Пеннинга и Ньенхюиса (1949 г.)
а—схема конструкции, б—характеристика.
А—цилиндрический аиод, К' и К"—катоды (в виде двух дисков).
Фиг. 5.66. Упрощенный магнитный электроразрядный манометр Редхеда.
А— анод; К' и К" —катоды.
Фиг. 5.67. Металлический электроразрядный манометр (Варшавский поли-
технический институт).
а —внешний вид; б —схема конструкции, / — железо; 2—медь; <3— стекло, 4—спай.
Фиг. 5.68. Электроразрядный манометр фирмы Alcatel.
А—анод (пластинка с двумя отверстиями); К—катод (эллиптический цилиндр, соединен-
ный с корпусом); В— изолятор ввода.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
417
На фиг. 5.68 представлена схема конструкции манометра с
тлеющим разрядом фирмы Alcatel (Франция). Катод здесь имеет
вид эллиптического цилиндра, а анод представляет собой плос-
кую пластинку с двумя отверстиями. Область измерения давле-
ний этого вакуумного манометра составляет 5-10~7—I0-2 Тор.
Инверсно-магнетронный манометр. Гобсон и Редхед (1958 г )
разработали манометрическую трубку, система электродов ко-
торой напоминает инверсный магнетрон (фиг. 5.69). Катод К
выполнен в форме почти полностью закрытого цилиндрического
Фиг. 5.69. Инверсно-магнетронный
манометр Редхеда и Гобсона.
А — стержневой анод; К—катод в виде
почти закрытой цилиндрической ко
робки, Е' и Я" —экраны, отделяющие
края катода от анода.
баллона, вдоль оси которого установлен металлический стер-
жень А, являющийся анодом. Для того чтобы не допустить воз-
никновения холодной эмиссии с острых краев катода в местах,
где через торцевые поверхности катода проходит анодный стер-
жень, применены короткие цилиндрические экраны, переходя-
щие далее в дисковые экраны Е' и Е" (вспомогательные като-
ды), которые частично экранируют цилиндр катода. Анодное
напряжение Ua составляет 5—6 кВ, а магнитная индукция (на-
правленная вдоль оси системы) В — 0,02 Т. Анодное напряже-
жение приложено между анодом и остальными электродами,
выполняющими роль катода, однако коллектором является по
существу баллон К, в цепь которого включен измеритель тока
(градуированный в единицах давления).
Характеристика тока /с в функции давления р имеет вид
[С = сра, (5.95)
причем для большинства газов 1,10 -^«^1,15 в пределах дав-
лений 10-4— 10-9Тор и« = 1,26 для давлений 10'8 — 3 • 10'13Тор.
[4 Зак 510
418
ГЛАВА 5
Неопределенность измерений манометра этого типа состав-
ляет 50—200% в зависимости от диапазона давлений, в котором
работает датчик, а также от других условий (например, «исто-
рии» изменения давления в системе). Однако чувствительность
этого манометра во много раз выше, чем, например, манометра
Баярда — Альперта.
ЗАКЛЮЧИТЕЛЬНЫЕ ЗАМЕЧАНИЯ О МАНОМЕТРАХ
Рассмотренные выше манометры принадлежат к наиболее
типичным; кроме того, существуют и другие, однако они не
имеют большого практического значения.
Для повышения чувствительности и для расширения пре-
делов измерения часто одновременно применяется несколько
измерительных приборов, построенных на различных принци-
пах. Например, совместное использование теплоэлектрического,
ионизационного и магнитного электроразрядного манометров
с общим блоком питания и измерений дает измерительную си-
стему, работающую в широком диапазоне давлений. Принцип
компрессии в теплоэлектрическом манометре позволяет сдвинуть
его диапазон измерений на несколько порядков в направлении
более низких давлений
Очень удобными являются измерительные устройства с де-
кадной шкалой и автоматическим переключением диапазонов
измерений в зависимости от давления в вакуумной системе.
Выходное напряжение манометра часто используется для авто-
матического управления клапанами, вентилями и регуляторами
системы, а также выключателями двигателей и насосов и дру-
гими устройствами. Что касается ионизационных манометров,
то следует помнить, что ионный ток коллектора пропорциона-
лен не давлению р, а концентрации п, т. е. в соответствии с фор-
мулой (2.29)
// ~ п = ,
откуда р ~ I].
Если вакуумный манометр был проградуирован при темпе-
ратуре То, то при температуре Т показанию ро будет соответ-
ствовать давление
т
Рт = Ро-т-‘> (5.96а)
< о
следовательно, отсчет давления ра необходимо корректировать.
Если заключенная в корпус манометрическая трубка градуи-
рована и находится при одной и той же температуре Тй, но из-
меряет давление в пространстве с температурой Т, то давле-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
419
ние, скорректированное с учетом эффузии, определяется по фор-
муле ___
Рт = Ро]/ уу (5.966)
Из многих эффектов, которые могут быть причиной ошибок
при измерении очень низких давлений, в первую очередь следует
упомянуть десорбцию газов из элементов манометрической
трубки (ее электродов и стенок баллона) под влиянием повы-
шенной температуры и сорбцию газов некоторыми из этих эле-
ментов, в особенности сорбцию ионизированных газов в присут-
ствии магнитного поля Преобладание одного из этих эффек-
тов— десорбции или сорбции — зависит от термовакуумной
Фиг 5.70. Соединение манометра и объема измеряемого давления при по-
мощи трубки.
«истории» манометра, т. е. от процессов, предшествовавших из-
мерению, от электрических параметров (например, анодного на-
пряжения) рода газа, очередности включения питающих напря-
жений и т. п Эти эффекты тем сильнее влияют на точность из-
мерений, чем меньше проводимость канала между датчиком
(заключенным в корпус) и пространством, в котором изме-
ряется давление
Рассмотрим связь между давлениями, имеющими место в
канале, соединяющем манометр с пространством измеряемого
давления (фиг. 5.70).
Если в манометре происходит выделение газов со скоростью
+ S (л-с-1) или поглощение газов со скоростью — 5 (л-с-1),
то давление в манометре р' будет соответственно выше или ни-
же давления р, которое существует в исследуемом пространстве.
Из уравнения потока газа / через канал
I = Sp' = G(p'-p) (5.97а)
находим давление в манометре
р' = —Ц-р- (5.976)
Области измерения давлений различными манометрами
Давление, Тор 104 103 102 10 1 10-' 10-2 10~3 IQ-1 Ю~5 10~6 Ю~7 ю~8 10~9 1О~10 Ю~" Ю~~12 н|~'3
4
+ +
+ +
f + +
+ + +
t + + +
f + + + +
t + t + + + +
+++++ i + в та
+ + + + + 4 1 4>
w + + + + + ? X
t + + + + M + § о
t + + + +; i LI ив и
t + + + + + p я- °
i " - - и 5 •« в 4- + + -f- 4. 1 1“*
1 S CQ й • *" + + Н 1 §IfBs?
1 ( »s хрии Т 4 S s 3 к S 2
+ lissgs «X (R g г—». _ J- О « О P c t О В RIO h ф Щ . u Я о я О я к ,. я А о25°°и & о з 2 8 gg-5°«&£ § S 3 8 sceg.®Ss О -1 S 5(Г “ и SSsffcSg Л ю я • Ч Ле Л й “£о§«~3 s я £ 5 ча>к5у2и 'О Й о са Я”1 ® л ^2 <р L” ”. cj <г^ а> <у w« о? ® sl о ® я S' ГГ w tr я О « °н 5 s о Я Я 3 о о я та т в> s я у со г; л я w «о ч ь н Л, и s Ф Я Ф н CL,— _ * о £ e> S £ р S a S S а К к Щ <u^- (РС*^ О ч « S s s 2 ч а з« S- Щ SS.^grS « 5 ® £-5 Л &« « § И gIgзg u ~ ^2 OO^cao >> я **4 о . ^Л1й5озчяя22>>о «®'£'£S2‘S E £“s та изо. 0.0 та0 5^1®Ss<ha.t:s®rofc«5S^ ххььб^л s£0^0©S’SOcoro6?co®<l> C3S®^s^S?:Ss®Sa^® XMoOt^i-SuS^EX^KOU ФОфО-сдфО^/пОО®©^^ £ дСль^Йн 85 к S
Манометры
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
421
Давление р' тем меньше будет отличаться от р, чем меньше
величина S/G, т. е. чем больше проводимость канала G по
сравнению со скоростью десорбции или сорбции (S). Если при-
нять в качестве допустимой погрешности 10%, то должно вы-
полняться условие G > 10|S|.
Например, для D = 3 см и L = 10 см имеем Gc^2,7 л-с-1
и скорость десорбции или сорбции в манометре не должна, та-
ким образом, превышать ±0,3 л-с-1.
Из приведенных выше рассуждений можно сделать и другой
вывод: для получения высокоэффективного манометра жела-
тельно, чтобы количество металла, употребленного на изготов-
ление системы электродов, было минимальным, а электроды
можно было легко обезгаживать. Время прогрева элементов
датчика должно быть минимальным, что сводит к минимуму
периоды десорбции и сорбции газов.
В табл. 5.7 дана характеристика различных манометров в
отношении их областей измерения.
Б. ИЗМЕРЕНИЕ ПАРЦИАЛЬНЫХ ДАВЛЕНИЙ
Рассмотренные ранее манометры измеряют полное (общее)
давление, т. е. сумму давлений всех газов в вакуумной системе.
Предельный вакуум обычно содержит остатки газов из окру-
жающей среды (вместе с водяным паром), пары органических
веществ, находящихся в вакуумной системе, а также газы,
образовавшиеся из разложения этих веществ и из синтеза на
чистых поверхностях, действующих как катализаторы.
В очень высоком вакууме остаточными газами являются Нг,
СО, Ar, N2, Ог, СОг, углеводороды, образовавшиеся от разло-
жения или катализа.
В сверхвысоком вакууме, кроме того, обычно имеется гелий,
который диффундирует из атмосферы через стенки. Водяного
пара в стеклянных системах больше, чем в металлических.
Таким образом, состав газов в вакуумной системе может
быть очень разнородным. Если к тому же принять во внимание,
что различные газы могут по-разному влиять на исследуемые
процессы, то вполне понятно, что по мере развития техники
высокого вакуума знание одного только полного давления ста-
новится недостаточным и появляется необходимость знать со-
став газа и давления его составляющих (так называемые пар-
циальные давления).
Наиболее адекватную картину состава газов в вакууме дает
линейчатый спектр давлений1), представленный, например, на
*) Он в некоторой степени искажается газами, которые вводит в вакуум-
ную систему измерительное устройство
422
ГЛАВА 5
фиг. 5.71, где положение полоски на оси молекулярных (атом-
ных) масс определяет род газа, высота же — его парциальное
давление.
Фиг 5.71. Массовый спектр паров силиконового масла типа DC 704 при тем-
пературе 303 К в случае вольфрамового (высокотемпературного) и LaB6 (низ-
котемпературного) катодов (по Губеру).
Приборы, служащие для получения спектров отдельных масс,
называются газоанализаторами или масс-спектрометрами (масс-
спектрографами).
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
423
За последние годы масс-спектрометрия быстро развивалась
и составляет в настоящее время обширный раздел вакуумной
метрологии.
5.7. МАСС-СПЕКТРОМЕТРЫ
Устройство. Основными элементами масс-спектрометра
(фиг. 5.72) являются источник ионов, устройство, разделяющее
ионы (сепаратор), коллектор ионов (с усилителем ионного
гока), регистратор ионного тока и контрольно-измерительный
блок.
Масс-спектрометр, подобно вакуумному манометру, должен
удовлетворять ряду условий. Он должен обладать хорошей раз-
решающей способностью и высокой чувствительностью, а пока-
зания его должны быть пропорциональны полному давлению и
парциальным давлениям. Определение массового спектра
должно производиться достаточно быстро (постоянные времени
измерительных систем должны быть по возможности малыми).
На фиг. 5.73 представлена схема масс-спектрометра: вверху
вакуумная часть, внизу — электронная.
Источники ионов. В масс-спектрометрах ионы создаются —
как и в электронных ионизационных вакуумных манометрах —
обычно путем ионизации газа бомбардирующими электронами.
Пример такого источника ионов представлен на фиг. 5.74. Поток
электронов из катода К, образованный при помощи электриче-
ских линз 1 и 2, входит в пространство ионизационной камеры,
где вызывает ионизацию газа, а затем достигает анода А. Ионы,
ускоряемые и сформированные в пучок при помощи диафраг-
мы 3, попадают в выходное отверстие ионной пушки, откуда с
разными скоростями, зависящими от их масс, входят в сепа-
ратор.
Другим простым источником ионов может быть цилиндриче-
ский сеточный анод с отверстием в концевой сетке, как в иони-
зационных манометрах с внешним коллектором.
Электронные токи в источниках ионов невелики (от несколь-
ких до нескольких десятков микроампер).
Сепараторы. В зависимости от того, какой принцип приме-
нен для разделения ионов, различают несколько типов масс-
спектрометров.
Классификация спектрометров может быть произведена по-
разному; например, можно их разделить на
статические, в которых время не оказывает влияния на эф-
фект разделения ионов, и
динамические, в которых фактор времени имеет принципи-
альное значение.
Источник ионоб
Фиг. 5.72. Принципиальная схема масс-спектрометра.
Ионы, образовавшиеся в источнике ионов в результате бомбардировки электронами, вхо-
дят в сепаратор, откуда после разделения по молекулярным массам поступают в коллек-
тор; после усиления ионный ток регистрируется.
Фиг. 5.73. Блок-схема масс-спектрометра: вакуумная часть (вверху) и элек-
тронная часть (внизу).
Фиг. 5.74. Источник ионов масс-спектрометра.
Я —анод; К,— катод.
J, 2— электроды, формирующие электронный пучок, з, 4—диафрагмы ионно оптической
системы для формирования пучка ионов; 5—ионизационная камера.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
425
Можно различать масс-спектрометры по траектории заря-
женных частиц (круговая, циклоидальная, спиральная, прямо-
линейная). Наконец, классификация возможна на основании тех
величин, которые используются для измерительных целей. При
разделении по этому принципу различают:
магнитные масс-спектрометры, в которых кривизна траекто-
рии зависит от массы частицы;
резонансные масс-спектрометры, в которых используется раз-
личие резонансных частот частиц, обладающих разными мас-
сами;
времяпролетные масс-спектрометры, основанные на разли-
чии времен, необходимых для пролета частицами с разными
массами одного и того же определенного пути.
Фиг. 5.75. Кривая интенсивности то :а l/=f(Ma) в масс-спектрометре.
Ширина определяется на разных высотах (для нескольких величин
Одной из важных характеристик сепаратора является так
называемая разрешающая способность, т. е. способность раз-
делять газы с молекулярными массами, мало разнящимися
между собой. Она определяется как отношение молекулярной
массы Af0 к ширине полосы ДЛ/0 на определенной ее высоте, на-
пример у основания (при /, = 0,1 /Макс), на половине высоты
полосы (при 0,5 /Макс) и в верхней части (при 0,9/макс) (фиг. 5.75).
Разрешающая способность хороших масс-спектрометров состав-
ляет от нескольких десятков единиц массы до нескольких сотен
(при 0,5 /макс) •
Коллектор ионов. Поток ионов, выделенных в сепараторе,
доходит через узкую щель до пластинчатого коллектора, кото-
рый обычно помещается в кожухе, также имеющем у входа
узкую щель. Ввиду очень малой величины ионных токов необ-
ходимо тщательно экранировать коллектор, а также использо-
вать усилитель тока (действие которого обычно основано на вто-
ричной эмиссии).
426
ГЛАВА 5
5.7.1. Статические масс-спектрометры
В статических масс-спектрометрах, основанных на использо-
вании магнитного поля, процесс разделения ионов, как уже упо-
миналось, не зависит от фактора времени. Траектории ионов
в них имеют круговую или циклоидальную форму.
Статические спектрометры позволяют выделять сравнительно
небольшие парциальные давления на фоне полного давления
(возможно, например, измерение парциального давления, отно-
шение которого к полному давлению составляет примерно 10~6).
5.7.1.1. Статические масс-спектрометры с круговыми траек-
ториями. Сущность действия статических магнитных масс-
спектрометров состоит в отклонении потока ионов с разными
Фиг. 5.76. Принцип действия магнитного масс-спектрометра.
Ионы со скоростями Vj попадают в область магнитного поля с индукцией В, где дви-
жутся по круговым траекториям радиусов гу г%. ... пропорциональным массам
Al", Af''. ... (принцип Демстера, 1918 г.).
1— источник ионов; 2 —коллектор ионов.
массами в магнитном поле (перпендикулярном направлению
движения ионов). Поскольку ионы, входящие в сепаратор, обла-
дают разными скоростями, зависящими от их масс, то откло-
няющая сила магнитного поля (скрещенного с электрическим
полем), действующая на перпендикулярно движущиеся заря-
женные частицы, пропорциональна их скоростям. В результате
этого поток расщепляется на пучки, соответствующие разным
молекулярным массам (фиг. 5.76).
Скорость Vj иона с массой т0 и зарядом eJ = |e|, прошед-
шего в электрическом поле разность потенциалов U, опреде-
ляется из уравнения
~ 171^ = eU. (5.98а)
В магнитном поле, обладающем индукцией В, на частицу
с массой /щ и зарядом е, движущуюся со скоростью Vj перпен-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
427
дикулярно направлению поля, действует центростремительная
сила, которая описывается уравнением
2
^- = eVjB, (5.986)
где г — радиус траектории иона.
Из уравнений (5.98а) и (5.986), заменяя т0 величиной Мо,
получаем
г = а^\П\Ц}. (5.99)
В формуле (5.99) а — коэффициент пропорциональности, за-
висящий от выбора единиц. Если U выразить в вольтах, г — в
сантиметрах, а В — теслах, то а — 0,0144.
Фиг. 5.77. 180°-ный магнитный масс-спектрометр (фирма AEI, Великобри-
тания).
Пучок ионов имеет прямоугольное сечение, В~0,4Т, г^Юмм.
/—источник ионов (К—катод, Л —анод); 2, 3, 4, 5 — щелевые диафрагмы; 6—коллектор
ионов.
Формула (5.99) показывает, что при В = const и U = const
ионы с разными молекулярными массами Л1о будут двигаться
по разным траекториям; следовательно, произойдет их разде-
ление. В то же время при В = const и г = const получаем
M0U = const; это значит, что каждой молекулярной массе соот-
ветствует определенная величина U. Непрерывно изменяя U,
можно обеспечивать выполнение условия M0U = const для мо-
лекул определенной массы, траектории которых должны иметь
радиус г. Этот принцип находит применение в различных кон-
структивных решениях масс-спектрометров. В зависимости от
величины угла, который описывают ионы, отклоняемые магнит-
ным полем, различают 180, 90 и 60°-ные спектрометры.
Схема 180°-ного спектрометра представлена на фиг. 5.77.
Через щелевую диафрагму источника 1 выбрасывается пучок
428
ГЛАВА 5
ионов. Этот пучок ускоряется электрическим полем с разностью
потенциалов U, затем, искривленный магнитным полем с индук-
цией В, он попадает в щель 2, а потом в щельЗ и достигает кол-
лектора ионов 6, помещенного внутри резервуара со щелью 5.
Разумеется, магнитное поле, отклоняющее пучок ионов, одно-
временно расщепляет его соответственно молекулярным массам,
так что в щели 4 и 5 попадают лишь ионы с определенной мас-
сой; другие же ионы попадают на диафрагму перед щелью (или
за ней) и, следовательно, до коллектора не доходят.
При анализе состава газа напряжение изменяют непрерывно,
от самой малой величины (7МИН (которая соответствует наиболь-
шей величине молекулярной массы, Мо.маьс) До самой большой
t/макс (которая соответствует массе М0,мин)- Величины, пропор-
циональные напряжению ионного тока в цепи коллектора, реги-
стрируются на бумажной ленте, движущейся с постоянной ско-
ростью. Таким образом, по оси времени ленты можно опреде-
лить величины масс Мо, соответствующие данным величинам U,
и произвести отсчет соответствующих им ионных токов, которые
являются мерой парциальных давлений газа. Вместо ленты мож-
но применить катодный осциллоскоп с послесвечением (т. е. за-
держивающий на экране в течение некоторого времени световые
изображения, вычерченные электронным лучом).
Пример массовой спектрограммы представлен на фиг. 5.78.
Можно различить сильную линию водорода (М0 = 2), некото-
рое количество метана (Мо=16), большое содержание водя-
ного пара (Мо — 18), некоторое количество азота с окисью угле-
рода (Мо = 28), немного кислорода (М0 = 32), а также следы
двуокиси углерода (Мо = 44). Парциальное давление азота и
окиси углерода (Мо —28) равно ~ 1,3-10“'° Тор, полное давле-
ние (определяемое суммой всех токов) составляет ~10-9 Тор.
Разрешающая способность масс-спектрометра с магнитным
полем зависит от ширины щелей источника ионов и коллек-
тора 62; она может быть выражена формулой
Мо г
Ь\ “р &2
(5.100)
Уменьшение ширины щелей 6| и &2 с целью увеличения раз-
решающей способности имеет свои пределы, так как при этом
уменьшается ионный ток и, следовательно, снижается чувстви-
тельность спектрометра. Оказывают влияние и другие факторы
(например, неравномерность и неоднородность магнитного поля,
разброс скоростей ионов данного газа и т. д.), которые приво-
дят к уменьшению разрешающей способности. Ориентировочно
можно принять, что чувствительность Мо/АМо находится в диа-
пазоне от нескольких десятков до нескольких сотен в зависи-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
429
мосги от качества спектрометра Минимальное измеряемое дав-
ление составляет ~ 10~10 Тор при точности измерений ~ 2%.
5.7.1.2. Статический масс-спектрометр с циклоидной траек-
торией (трохотрон). Принцип действия циклоидного спектро-
метра (Хиппл, Блэкни, 1938 г.) можно уяснить из фиг. 5.79.
Ионы движутся в скрещенных под прямым углом однородных
полях: электрическом1) с напряженностью Е и магнитном с
индукцией В. Расстояние между фокусами ионного пучка (т. е.
между источником ионов и коллектором) для такой системы
определяется уравнением
В3
(5 101)
где с — коэффициент пропорциональности.
Конструктивное решение циклоидного спектрометра пред-
ставлено схематически на фиг. 5.80. Источником ионов является
миниатюрное устройство, вольфрамовый катод которого создает
стабилизированный электронный ток с энергией 100 эВ, иони-
зирующий анализируемый газ. Образовавшиеся ионы извле-
каются системой диафрагм (размер щели в последней диафраг-
ме 0,3 X 8 мм) и входят в скрещенные поля — электрическое и
магнитное. Коллектор ионов помещен в экранирующем баллоне
со щелью 0,2 X 4 мм Использование усилителя тока дает воз-
можность измерять очень слабые токи (уровень шумов состав-
’) Электрическое поле образуется 13 параллельными пластинками с по-
тенциалами, задаваемыми потенциометром.
Фиг. 5.79. Схема циклоидного масс-спектрометра Хиппла и Блэкии (1938 г.)
/ — источник ионов, 2—коллектор ионов.
Фиг. 5.80. Циклоидный масс-спектрометр Губера и Транделенбурга (1961 г.).
/ —токовводы; 2—магнитное поле, 3 —источник ионов; 4—коллектор ионов; 5—система
пластинок, от которых зависит распределение электрического поля.
Фиг. 5.81. Масс-спектрометрические датчики,
а —металлический; б— стеклянный (фирма AEI, Великобритания).
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
431
ляет — 5 • 10”16А). Например, парциальное давление аргона по-
рядка 10—12 Тор можно без труда измерять при электронном токе
в источнике порядка 0,2 • 10"3А. При магнитном поле 0,05 Т
область измерений спектрометра охватывает молекулярные мас-
сы от 1 до 500. Разрешающая способность (для Мо~ 100) по-
рядка единицы массы.
Металлические масс-спектрометрические датчики (нержавею-
щая сталь) показаны на фиг. 5.81, а, стеклянные (твердое стек-
ло)— на фиг. 5.81,6. Катод (из рения) — сменный, потребляет
мощность ~ 2 Вт; анодный ток составляет 6—60 мкА. Поверх-
ность электродов ~ 50 см2, масса электродов ~ 5 г. Масс-спек-
трометры, представленные на фиг. 5.81, имеют два диапазона
измерений молекулярных масс (12—60 и 48—240); кроме того,
предусмотрена отдельная область измерений для 2АЛ40А4.
5.7.2. Динамические масс-спектрометры
В динамических масс-спектрометрах для разделения масс
используется время (или частота). Эти спектрометры имеют
меньшую, чем статические, способность выявления слабых пар-
циальных давлений на фоне полного давления.
5.7.2.1. Динамический масс-спектрометр со спиральной тра-
екторией (омегатрон). В омегатроне (Хиппл, Зоммер, Томас,
1951 г.) используются магнитное поле и перпендикулярное к
нему переменное электрическое поле большой частоты. В этого
рода полях ионы определенной массы, черпая энергию из поля
большой частоты, движутся по раскручивающейся спиральной
линии с определенным шагом и попадают на коллектор; ионам
же с иными массами энергия от электрического поля не пере-
дается, а их траектории замыкаются вблизи оси, около которой
они образовались (на удалении от коллектора).
На фиг. 5.82 представлены схема и конструкция омегатрона.
Через отверстия 4 и 5 и кубическую камеру 1, нижняя и верхняя
стенки которой изолированы и образуют конденсаторные пла-
стины 2 и 3, проходит поток электронов, возникающий на ка-
тоде К и принимаемый анодом А. Этот поток ионизирует газы
вдоль оси хх. Между пластинами 2 и <3 создается переменное
электрическое поле с амплитудой напряжения Ео и с часто-
той со, которое действует на ионы, образующиеся вдоль оси хх.
Вдоль этой оси создается магнитное поле с индукцией В. Под
влиянием обоих полей ионы движутся в плоскостях, перпенди-
кулярных оси хх.
Решение уравнений движения ионов, вылетающих из различ-
ных точек оси со скоростями, близкими к нулю (т — 0, ц = 0),
*20
Фиг. 5.82. Омегатрон Альперта и Бу-
ритца (1954 г.).
а—конструктивная схема, б — схематичный раз
рез в плоскости магнита, в —электрическая
схема, г — внешний вид манометра Варшав-
ского института промышленной электроники.
Характеристики манометра объем <^80см\
вес '-''70 г, коэффициент чувствительности (для
аргона) ~ 10 Тор"*1, рабочий диапазон моле-
кулярных масс 10—50—(200), рабочий диапазон
давлений ~ 10~10-10~s Тор, 20 кГц<7<8МГц,
0,5<C7sj<5 В. температура вольфрамового ка-
тода 2300К, температура катода покрытого LaBa,
1300 К.
1 — камера, 2, 3—торцевые электроды перемен-
ного поля частотой со, 4, 5 — отверстия для
электронного пучка, 6 —пластинка коллектора
ионов, 7 — потенциометр, питающий промежу-
точные пластинки конденсатора 2—3.
К —катод, Л —анод, С—коллектор.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
433
дает уравнение траектории ионов
Ео 1 , ,
Г = S-.-------г Sin тг т,
В (ш — <ВС) 2 ' с'
(5.102)
где сос — так называемая циклотронная частота, определяемая
уравнением
<Ос = ^, (5.103)
где
тс=^- (5.104)
является временем пробега иона, обладающего массой то и
скоростью v, по окружности длиной 2лг с радиусом
Подстановка выражений (5.104) и (5.105) в формулу (5.103)
дает
®с = —. (5.106)
При со = Юс уравнение (5.102) в пределе примет вид
г = >т. (5.107)
В этом случае траектории ионов имеют форму раскручиваю-
щейся спирали; это означает, что радиус траектории возрастает
с течением времени т, а ион потребляет энергию от поля высо-
кой частоты.
Если на нижней пластине конденсатора установлен коллек-
тор С (имеющий вид металлической полоски, перпендикулярной
плоскости спирали), то ионы, движущиеся с циклотронной ча-
стотой, будут им собираться. Траектории нерезонансных ионов
изменяются по времени, а их максимальный радиус описывается
выражением
г =_____________
Г макс В(а-ае)
Если коллектор помещен на расстоянии г > гМакс> то
не достигают его.
Изменяя частоту электрического поля (о, можно
условие резонанса для отдельных газов с массами Мо
Из предыдущих уравнений следует, что разрешающая спо-
собность омегатрона определяется формулой
= = (5.109)
A/Wj АМо 2Е0т0 '
(5.108)
эти ионы
получить
где г0 — радиус витка спирали, достигающего коллектора.
434
ГЛАВА 5
Из графиков, представленных на фиг. 5.83, следует, что на-
пряженность высокочастотного электрического поля между
верхней и нижней пластинами камеры оказывает большое влия-
ние как на разрешающую способность, так и на чувствитель-
ность прибора (ток коллектора) С ростом напряженности этого
поля увеличивается и ток коллектора, но ухудшается разре-
шающая способность. Таким образом, приходится выбирать не-
которую компромиссную величину напряженности поля (на-
пример, 0,3 В - см-1).
Фиг. 5.83. Зависимость разрешающей способности и относительной чув-
ствительности от напряженности высокочастотного электрического поля
в омегатроне.
Преимуществом омегатрона является его простота по сравне-
нию с другими масс-спектрометрами, в которых используется
большое количество металла, что создает значительные труд-
ности, особенно в области очень высокого вакуума.
Камера омегатрона изготовлена из тонкой немагнитной
жести (например, константановой с присадкой родия или плати-
ноиридиевой) и имеет размеры ~ 30 X 20 X 20 мм. Электронный
ток составляет от нескольких до двадцати микроампер, магнит-
ная индукция порядка доли теслы, напряженность переменного
электрического поля порядка 1 В • см~’. Разрешающая способ-
ность спектрометра достигает нескольких десятков единиц мас-
сы. Например, в спектрометре усовершенствованной конструк-
ции диапазону молекулярных масс от 1 до 200 соответствует
частота электрического поля от 8 МГц до 20 кГц при магнитной
индукции порядка 0,035 Т. Иногда для создания более равномер-
ного поля большой частоты между плоскостями 2 и 3 устанав-
ивают дополнительные пластины, получающие от потенцио-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
435
метра промежуточные потенциалы, как это показано на
фиг. 5 82, б и в.
5.7.2.2. Динамические времяпролетные масс-спектрометры.
Во времяпролетных масс-спектрометрах (называемых также
хронотронами) ионы, извлекаемые из ионизационной камеры
(источника ионов) кратковременными импульсами напряжения,
входят в ускоряющее электрическое поле с разностью потенциа-
лов U, где приобретают скорости
зависящие от масс их молекул. С этими скоростями они попа-
дают в пространство дрейфа, в котором напряжение поля равно
нулю, и движутся к коллектору, расположенному на расстоя-
нии L В пространстве дрейфа происходит разделение ионов по
массам, ввиду различия их скоростей, так как время пролета
ионов до коллектора зависит от их массы т0:
’=-Г=Л/^- (5Л11>
На фиг. 5.84 представлена схема импульсного масс-спектро-
метра, действующего по принципу времени пролета, а на
фиг. 5.85 показана зависимость пути ионов с разными массами
от времени в пространстве дрейфа. Видно, что ионы с самой ма-
лой массой т'о достигают коллектора раньше всего (по
истечении времени т')> тогда как ионы с большой массой т'"
затрачивают на это самое большое время т"'.
Таким образом, ионный ток в цепи коллектора имеет, как и
напряжение, импульсный характер. После усиления с помощью
широкополосного усилителя можно, управляя импульсами иони-
зационного потенциала в источнике ионов, выделять компо-
ненты, соответствующие желаемой молекулярной массе, а затем
регистрировать их на осциллографе или ленточном самописце.
Типичный времяпролетный масс-спектрометр имеет диапазон
измерений молекулярных масс Мо = 0-4-5000, разрешающую
способность (при фоновых помехах 10%) ~400 и длину про-
лета ионов ~ 100 см.
5.7.2.3. Резонансный высокочастотный динамический масс-
спектрометр. На фиг. 5.86 показана схема резонансного масс-
спектрометра. Это своего рода линейный ионный ускоритель,
действующий по принципу, разработанному Беннетом и Варади
(1950, 1955 ); он носит также название топатрона В таком
масс-спектрометре электроны из вольфрамового катода К,
Ускоряемые положительным напряжением (~ 100 В) сеточного
анода 1, ионизируют газ, а образованные ионы, извлекаемые че-
Фиг. 5.84. Схема времяпролетного масс-спектрометра Камерона и Эггерса
(1948 г.).
/ — источник ионов, 2 — сепаратор.
Фиг. 5.85. Движение ионов с разными массами в области дрейфа.
Фиг. 5.86. Схема резонансного высокочастотного масс-спектрометра.
Электроны, идущие из катода К к сетке 1 (являющейся анодом', ионизуют газ, а обра-
зовавшиеся ионы выходят из пространства сетки 2 Через отрицательную сетку 3; не-
сколько следующих сеток (с пульсирующим напряжением) доводят до коллектора С ионы
определенной молекулярной массы.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
437
рез сетки 2 и 3, входят в сепаратор. Сепаратор состоит из пяти
пар сеток (от 4 до 14), размещенных на точно определенном рас-
стоянии друг от друга (/ = 2,5 мм). Сетка 3, ускоряющая ионы,
имеет отрицательный потенциал UP] = —150 В, весь же сепара-
тор находится под напряжением, регулируемым в диапазоне
20—100 В.
На каждой паре соседних сеток сепаратора создается пере-
менное напряжение большой частоты к> и соответствующей
амплитуды (порядка нескольких десятков вольт). Из числа ио-
нов с разными массами при данной частоте ш лишь ионы с опре-
деленным значением е!т0 могут получать энергию от высоко-
частотного электрического поля большой частоты и благодаря
этому проходить от сетки к сетке и попадать в коллектор, тогда
как ионы другой массы не получают дополнительной энергии и
рассеиваются. Для определенных напряжений связь между
m0, L и и может быть выражена формулой
(5.112)
Резонансные масс-спектрометры не отличаются особенно вы-
сокими параметрами; их разрешающая способность невелика
(порядка 10—20 единиц массы).
5.7.2.4. Четырехполюсный (квадрупольный) масс-спектро-
метр. Четырехполюсный масс-спектрометр, называемый также
массовым фильтром (Пауль, Редер, 1955 г.), представленный на
фиг. 5.87, состоит из источника ионов 1, сепаратора 2 и коллек-
тора ионов 3 (часто с усилителем тока). У входа и выхода сепа-
ратора находятся диафрагмы 4, 5 и 6, выполняйте роль ионных
линз.
Сепаратор образован четырьмя параллельными металличе-
скими цилиндрами (соединенными через один парами), которые
питаются пульсирующим напряжением большой частоты
и = UQ + cos at (5.113)
от источников постоянного напряжения Uo и переменного с ам-
плитудой U\ и частотой со. Под действием этого напряжения в
пространстве между цилиндрами возникает электрическое поле,
распределение потенциала которого описывается уравнением
и (х, у, т) — Uo(1 + — cos (5.114)
\ с0 / rj
Здесь г0 — половина расстояния между осями противолежащих
цилиндров.
438
ГЛАВА 5
Силы этого поля действуют на ионы из источника 1, движу-
щиеся вдоль оси в направлении коллектора. Движение частицы
Фиг. 5.87. Квадрупольный масс-спектро-
метр.
а —схема; б —внешний вид спектрометра Вар-
шавского института промышленной электро-
ники.
Рабочий диапазон масс 2—120, рабочий диапа-
зон давлений IO-*11 —10~4 Тор, разрешающая
способность (Л/о/Д7И0)д|<;6д=60, длина 330 мм,
прогрев до 670 К*
/—источник ионов, которые входят через отвер-
стия в диафрагмах 4 и 5 в область 7 между
четырьмя стержнями; ионы соответствующей
массы проходят через отверстие диафрагмы 6
и достигают коллектора 3; 2—сепаратор ионов;
3— коллектор ионов; 8, 9, 10, //—цилиндриче-
ские стержни, соединенные попарно через один
(получают пульсирующее напряжение: постоян-
ное и переменное Gjcoson).
массы то с зарядом е описывается следующими уравнениями:
тй ~ ~ (UQ + С/, cos от) х = 0, (1 Т Гф di г, (U° + cos сот) г/ — 0, (5.115) (5.116) (5.117)
которые сводятся к уравнениям Матье типа
где х + (а + 2b cos 2$) х — 0, (5.118)
л 8eUa , AeUi 2'0'= от, а — j-y, Ь — -—5—7. /ПцГуО т0Гц(й (5.119)
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
439
Решение этих уравнений дает выражение для траектории
ионов. Вообще говоря, траектория имеет колебательный харак-
тер с быстро возрастающей амплитудой. Так как амплитуда
ограничена радиусом г0, то коллектора достигнут лишь ионы
с массами в диапазоне между тп и иг'о, для которых амплитуда
не превышает го. Именно им соответствуют устойчивые решения
уравнения. Ионы с другими массами, стремящиеся приобрести
амплитуды большие, чем г0, перехватываются цилиндрами сепа-
ратора; этим ионам соответствуют неустойчивые решения.
Фиг. 5.88. Зависимость a — f (b).
Область стабильности (устойчивого решения) заштрихована (по Блауту, 1965 г.).
Из приведенного выше обсуждения следует, что решения
устойчивы, когда параметры а и b лежат в заштрихованном
пространстве графика а = f(b), представленного на фиг. 5.88.
Чтобы получить большую разрешающую способность спек-
трометра, следует выбрать такой режим работы (в пространстве,
соответствующем устойчивым решениям), чтобы диапазон т'з—tn’s
был по возможности мал. Таким образом, рабочая точка должна
быть как можно ближе к точке Ро (которой, как это следует из
рассмотрения, соответствуют Ьо = 0,71 и а0 = 0,237), поскольку
в этом случае минимальное изменение т0 смещает рабочий ре-
жим в пространство неустойчивости.
Прямые линии, проходящие через точку 0 системы коорди-
нат, описываются уравнением
4 = 2-^ = const. (5.120)
О U J
Для точки Ро имеем
«1 = ^237 = озз5 ^0. = 0,168, (5.121)
0,71
440
ГЛАВА 5
тогда как для точки Р следует принять а <10,237 и b 0,71. Со-
ответствующие величины Ь' и Ь" (фиг. 5.88) определяют диапа-
зон m'j — т” — Дгио, т. е. разрешающую способность
__ t) 6" __ 0.71 гр. < „ОХ
Ь" -Ь' ~ Ь" - Ь' ’
Приближение точки Р к Ро влечет за собой сближение вели-
чин Ь" и Ь', т. е. повышение разрешающей способности. Однако
повышение разрешающей способности ограничивается другими
условиями (например, необходимостью увеличения длины сепа-
ратора или же снижения ускоряющего напряжения, которое все
же нельзя уменьшить ниже определенной величины).
Снятие массового спектра производится обычно при Uo =
= const и Ui ~ const путем изменения ш или (при а — const)
путем одновременного изменения Uo и Uj (при постоянном,
однако, отношении U0/Ui).
Длина четырехполюсного масс-спектрометра 150—350 мм,
разрешающая способность 5—100, примерные диапазоны изме-
рения масс 1—50 и 10—250, диапазон рабочих давлений 10 4—
10-12 Тор (причем в пределах 10~8—10~12 Тор применяется умно-
житель тока), чувствительность порядка (1 ч-4) • 10~4 А-Тор-1,
время снятия спектра (при р = 10~6 Тор) ~ 0,2 с. Металличе-
ские детали прибора можно прогревать до 720 К.
Одно из преимуществ спектрометров рассматриваемого типа
заключается в том, что вводимые в спектрометр ионы могут
иметь неодинаковые энергии.
5.7.2.5. Однополюсный масс-спектрометр. Однополюсный
масс-спектрометр (Цан, 1963 г.) отличается от четырехполюс-
ного тем, что в нем вместо электрической схемы с четырьмя
Фиг. 5.89. Схема однополюсного магс-спектрометра.
Г—цилиндрический электрод; 2— уголковый электрод; 3—отверстие в диафрагме, через
которое выводятся ионы.
цилиндрами применена схема, содержащая систему двух элек-
тродов (фиг. 5.89). Эта система состоит из сектора цилиндра 1
и заземленного угольника 2; секторный электрод питается пуль-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
441
сирующим напряжением, а ионы вводятся в сепаратор через от-
верстие 3 в вершине угольника параллельно оси прибора. Этот
спектрометр имеет сходные с предыдущим параметры, но более
простую конструкцию (меньше металла).
5.7.3. Замечания, касающиеся масс-спектрометров
Разделение компонент смеси в масс-спектрометрах произво-
дится по величине отношения т0/е-, таким образом, в случае
н-кратной ионизации это отношение становится равным molqe,
что соответствует массам в q раз меньшим. Это обстоятельство
может быть причиной появления помех — субгармонических по-
лосок, отражающих мнимое появление частиц с массами в 2—
3 раза меньшими.
Уменьшение возможности многократной ионизации дости-
гается путем соответствующего конструирования источника
ионов.
Как и в вакуумных манометрах с горячим катодом, в спек-
трометрах содержание некоторых газов, особенно кислорода,
обычно занижается вследствие химических реакций газов с го-
рячим катодом. С другой стороны, горячий катод, а также
электронная десорбция с поверхности могут приводить к разложе-
нию (крекингу) некоторых сложных газов, а чистые поверх-
ности могут стать катализатором синтеза простых газов. Вслед-
ствие этих эффектов спектрограмма может иметь ряд полос, ко-
торые искажают истинную картину вакуума.
В табл. 5.8 даны для примера величины (в °/о) полос помех,
которые могут появиться в масс-спектрометре при анализе оста-
точных газов. Масс-спектрограмма, представленная на фиг. 5.71,
является свидетельством интенсивного крекинга на вольфра-
мовом катоде, имеющем температуру более высокую, чем катод
из борида лантана.
Так, например, аргон с массой Л40(аг) = 40, которой соответ-
ствует собственная полоса 100, имеет полосу помех при Мо =
= 20, а гелий с массой Л4о(Не> = 4 — полосу помех при Л40 = 2.
Очевидно, молекулярный кислород с массой Мо юя — 32 может
иметь полосу атомарного кислорода при М0(о> = 16. Эта полоса
может и не быть полосой помех. Упрощенные масс-спектро-
метры (настроенные на определенную молекулярную массу) на-
ходят широкое применение в качестве так называемых тече-
искателей.
В. ГРАДУИРОВКА МАНОМЕТРОВ
Градуировка манометра может проводиться непосредственно
пли путем сравнения его показаний с показаниями другого ма-
нометра, который считается образцовым (эталонным). Непо-
средственная градуировка производится путем выполнения
442
ГЛАВА 5
Таблица 5.8
Полосы помех (%) в масс-спектрограмме
Примечания: I. {100]— главная линия, (0, (2) —линии, не всегда появляющиеся-
2. Таблица составлена по данным Баррингтона (1963 г.), Клопфера и Шмидта (1960 г.),
Крейга и ХардЛена (1965 г.)
измерений в основных единицах (длины, массы, времени). К ва-
куумным манометрам, которые градуируются непосредственным
методом, относятся гидростатические манометры, в которых дав-
ление определяется с помощью известных значений плотности
рабочего вещества (например, ртути), земного ускорения и вы-
соты ртутного столба. При градуировке компрессионного ма-
нометра непосредственным методом дополнительно выполняются
еще измерения объема, определяющие степень компрессии.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
443
При градуировке манометров сравнительным методом в ка-
честве образцовых используют гидростатические, поплавковые и
компрессионные манометры1). Широко используются в послед-
нее время также гидравлические интерференционные мано-
метры.
Строго говоря, любая градуировка манометра правильна
лишь для определенной температуры и только для данного
газа. При градуировке должен быть выполнен ряд условий и
требований, которые тем многочисленнее и труднее для выпол-
нения, чем выше вакуум. Прежде всего измерительная система
(вместе с манометрами) должна быть идеально обезгажена,
давление во всей системе выровнено, а предельное давление
вакуумной системы должно быть намного ниже давления, при
котором проводится градуировка.
По мере понижения давления возрастают трудности градуи-
ровки, подобно тому как усложняются измерения этих давле-
ний и снижается точность манометров.
5.8. МЕТОДЫ ГРАДУИРОВКИ
Чаще всего в качестве образцового манометра применяют,
как уже упоминалось, гидростатический (или компрессионный)
ртутный манометр, в котором давление определяется высотой
ртутного столба (а степень компрессии вычислена по геометри-
ческим характеристикам или другим соответствующим мето-
дом). Для целей градуировки могут быть также применены ма-
нометры поплавкового и мембранного типов, в которых давле-
ние определяется взвешиванием (разд. 5.1.5).
Так как нижний предел работы гидростатических манометров
ограничивается точностью измерений, возникает необходимость
редуцирования (в известном отношении) давления, измеряемого
образцовым гидростатическим манометром, до более низкого
давления.
Методы редуцирования давления можно разделить на стати-
ческие и динамические.
5.8.1. Статические методы
Из статических методов рассмотрим метод расширения и ме-
тод медленного возрастания давления.
5.8.1.1. Метод объемного расширения. Этот метод сводится
к снижению давления с использованием закона Бойля —
’) Радиометрические манометры, которые раньше использовались в ка-
честве образцовых, дают показания, зависящие от неизвестного и непостоян-
ного коэффициента аккомодации.
444
ГЛАВА 5
Мариотта. При помощи эталонного манометра измеряется срав-
нительно высокое давление существующее в объеме V\, кото-
рый затем путем присоединения большого объема V2 увеличи-
вается до объема + V2. Сниженное таким образом давление
составляет
V,
К, + и2 (5.123)
Если Vi <С Е2, то можно принять
(5.123а)
Очевидно, что
Расширяя газ таким способом несколько раз или применяя
разные вспомогательные объемы, можно понизить давление во
много раз.
5.8.1.2. Метод медленного возрастания давления. В измери-
тельной системе, состоящей из двух резервуаров с объемами
Vi и V2 (фиг. 5.90), соединенных трубопроводом I малой прово-
димости G, градуируемый манометр 2 присоединяют к резер-
вуару V2- В резервуаре У) создается вакуум порядка 10~3 Тор.
Давление в этом резервуаре р\ определяется при помощи гра-
дуируемого манометра (для которого имеется градуировка в
области таких давлений) или же при помощи другого мано-
метра. После этого, закрыв кран 3, откачивают резервуар V2
до минимального давления, с которого начинается градуи-
ровка манометра. Затем закрывают кран 4, открывают кран 3
и отсчитывают показания манометра 2 в функиии времени.
Для трубопровода 1 с проводимостью G можно написать, со-
гласно формуле (2.176), уравнение расхода
7 = G(a-M (5.124)
которое При Р2<^.р1 сводится к виду
Ic^Gpy. (5.124а)
С другой стороны, для притока газа в резервуар У2
(фиг. 5.90) является правильной соответствующая формуле
(2.164) зависимость
/ = (5 125)
Из уравнений (5.124) и (5.125) получаем
(5.126)
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
445
Если величина а постоянна и известна, то, интегрируя урав-
нение (5.126), для начального участка кривой р2 = f(x) можно
написать
р2 = р0 + ат. (5 126а)
Если благодаря хорошей откачке вакуумной системы удается
получить ро~Ь, то уравнение (5.126а) можно переписать как
р2—ах (5.1266)
Таким образом, необходимые для градуировки манометра
значения р2 получают путем отсчета времени т (фиг. 5.91).
Фиг. 5.90. Установка для градуировки ма-
нометров в области очень высокого вакуума
методом медленного возрастания давления.
1—трубка с известной проводимостью G; 2—гра
дуируемый манометр; S, 4—краны.
Фиг. 5.91. Изменение давления
в баллоне (объемом И2) по
времени х.
Недостатком статических методов является сорбция и десорб-
ция газов с поверхности вакуумной системы при изменении дав-
ления, вследствие чего формулы (5.123) и (5.123а) дают неточ-
ные результаты, особенно в области высокого вакуума, когда
возрастает отношение количества связанных газов к свободным.
5.8.2. Динамические методы
Динамические методы свободны от указанного выше недо-
статка, так как вследствие стационарного течения газа поверх-
ности вакуумной системы насыщены им в достаточной степени
446
ГЛАВА 5
н при данном установившемся давлении процессы сорбции и де-
сорбции находятся в равновесии.
5.8.2.1. Метод постоянной интенсивности течения. Метод по-
стоянной интенсивности течения (постоянного расхода) стано-
вится ясным из рассмотрения вакуумной системы, представлен-
ной на фиг. 5.92. В измерительный резервуар, состоящий из трех
секций, соединенных двумя отверстиями с проводимостями Gi
Фиг. 5.92. Установка для градуировки манометров методом постоянного
расхода.
Вместо двух манометров (7, 8) может быть использован один (9) с двухходовым краном (10),
1, 10—краны; 2, 4, 6—камеры; 3, 5, 7, 8, 9—манометры.
Gi, вг— проводимости отверстий между соответствующими камерами.
и G2, входит через регулирующий клапан 1 газ с секундным
расходом I (измеряемым в единицах pV); этот газ непрерывно
откачивается насосом со сравнительно большой скоростью от-
качки S. Давление pt в камере 2 измеряется градуируемым ма-
нометром 3, давление же рг в камере 4 измеряется с помощью
эталонного манометра 5.
Для условий стационарного течения газа при установившихся
температурах и давлениях можно записать
/ = G2 (р2 — Pl) = Qi (pt — р').
Отсюда степень редуцирования давления
— 1 _l_2j__— 1 f 1 _i_
Pl ~1 + G2 g2 Pl + g2 11 + P J •
(5.127)
(5.128)
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
447
Если скорость откачки S на выходе из камеры 6 достаточно
велика, то Тогда
(5.129)
и, следовательно,
1
Pl “’ Т+ Gi/G2 р2'
Полагая G2 <С Gi, получим
Рг^р2, (5.130)
т. е. pi < р2.
Таким образом, зная проводимости Gi и G2, а также давле-
ние р2, измеряемое эталонным манометром, можно проградуи-
ровать манометр в области более высокого вакуума.
Для получения эталонных проводимостей б) и G2 исполь-
зуются калиброванные шайбы или трубки с проводимостями,
рассчитанными теоретически на основании их геометрических
размеров либо измеренными в пределах давлений, для которых
имеются в распоряжении эталонные манометры. Часто в каче-
стве эталонов малой проводимости применяются пористые
пробки, изготовленные из специальных керамических или стек-
лообразных материалов.
Чтобы измерения были правильными, в камерах не должны
образовываться направленные потоки молекул газа, ибо они
создают неравномерную плотность газа у отверстий и в мано-
метрах. Для этого входные и выходные отверстия размещаются
соответствующим образом или же применяются экраны, предо-
храняющие от прямого попадания молекул из входа на выход
камер либо непосредственно на манометры.
5.8.2.2. Стандартный метод градуировки манометров в диа-
пазоне давлений Ю-3—10~7 Тор. Для области давлений 10~3—
— 10-7 Тор в настоящее время принят динамический метод гра-
дуировки, опирающийся на абсолютные измерения.
Исходным уравнением является
Р = ~, (5.131)
О
где р — давление, возникающее в пространстве, в которое вте-
кает газ с расходом I, откачиваемый со скоростью S. Расход
газа I определяется при давлении ро, постоянном и известном
из абсолютных измерений, с помощью формулы
/ = Ро4г- (5.132)
Где ДУ — объем газа, отводимый за время Дт.
448
ГЛАВА 5
Скорость откачки S можно рассматривать как скорость от-
качки отверстия, за которым расположен насос со скоростью
откачки S' S; при этом скорость откачки S может быть вы-
числена на основании размеров отверстия как скорость откачки
отверстия, ведущего в идеальный вакуум.
Таким образом, и / и S можно определить с помощью из-
вестных основных величин.
Фиг. 5.93. Стандартный метод градуировки манометров в области давлений
Ю-3-1 (Г7 Тор.
/, 3—камеры; 2—калиброванное отверстие; 4—градуировочный (прецизионный) манометр;
5, 6, 7—манометры; «—регулирующий клапан (задвижка); 9— дозирующий клапан; 10—диф-
фузионный иасос; 11—волюмометрнческое устройство.
Чтобы получить точные результаты измерений, необходимо
выполнить ряд условий, из которых самыми важными являются:
обеспечение стабильных значений I, р и Т, равномерное распре-
деление плотности газа в камерах, S'^-50 3, скорость откач-
ки S много больше (по крайней мере в 100 раз), чем скорость
откачки градуируемых и измерительных манометров, а диа-
метр Do 4С 1 см. Если температуры манометров и камер не оди-
наковы, следует ввести соответствующие поправки.
На фиг. 5.93 схематически изображена вакуумная система
для градуировки манометров. Она состоит из камер для реду-
цирования давления и из волюмометрического устройства для
дозирования притока газа. Волюмометрнческое устройство поз-
воляет регулировать и поддерживать постоянным мгновенный
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
449
расход /, а также регистрирует суммарный расход газа V с из-
вестным давлением р0 за определенное время т.
Скорость откачки диффузионного насоса регулируется с по-
мощью задвижки 8. Манометры, подлежащие градуировке, при-
соединяются к верхней камере. Проводимость калиброванного
отверстия 2 вычисляется на основании его размеров.
Г. ИЗМЕРЕНИЯ ДРУГИХ ВЕЛИЧИН
5.9. ИНТЕНСИВНОСТЬ ТЕЧЕНИЯ И СКОРОСТЬ ОТКАЧКИ
В технике высокого вакуума большое значение имеют изме-
рения интенсивности течения (расхода) и скорости откачки.
5.9.1. Измерение интенсивности течения
Для измерения некоторых величин бывает необходимо соз-
дать течение газа определенной интенсивности. Основной способ
создания и измерения такого течения следует из определения
~ dQ d(pV) / dV \
dx dx P\dx>p=cOnst'
(5.133a)
При p = po — const для отыскания I следует определить при-
ток (или убыль) газа (в единицах объема при давлении ро), а
Фиг. 5.94. Простое устройство для
создания и измерения определенного
газового потока.
Г— резервуар; /"—трубка; 2—к сосуду
с жидкостью; 3—краны; 4—дозирующие
клапаны; 5—к вакуумной установке.
также время, в течение которого происходит это изменение ко-
личества газа.
Для конечных отрезков времени будем иметь
(5.1336)
Т2 — Т]
Пример простого устройства для создания и измерения опре-
деленного потока газа представлен на фиг. 5.94. Измерение
15 Зак. 510
450
ГЛАВА 5
проводится путем определения времени, необходимого для на-
полнения жидкостью (водой, маслом) известного объема, напри-
мер резервуара Г или трубки 1", погруженных в сосуд с жид-
костью 2. Чтобы давление газа в резервуаре (или трубке) при
его наполнении было всегда постоянным (например, атмосфер-
ным), уровни жидкости внутри и вне сосуда должны быть по
возможности одинаковыми. Кран 3 (во время измерения за-
крыт) служит для удаления жидкости из резервуара после того,
как измерения закончены. Интенсивность течения (расход) ре-
гулируется дозирующим клапаном 4 (например, игольчатым; см.
Фиг. 5.95. Вакуумное устройство для измерения расхода газа.
/, 2— манометры; G— трубка с известной проводимостью.
разд. 6.6.3), включенным между наполняемым объемом и ва-
куумной системой 5, в которую вводится газ с данным расходом.
Измерение интенсивности течения 1 основано на зависимости
(5.124). Зная проводимость G, вычисленную на основании раз-
меров трубопровода или отверстия, а также измеряя давления
р2 и pi на его концах (фиг. 5.95), подсчитывают I.
5.9.2. Измерение скорости откачки
Различают методы: 1) постоянного объема; 2) постоянного
давления и 3) постоянного количества газа.
5.9.2.1. Метод постоянного объема. Этот метод заключается
в определении скорости откачки на основании зависимости дав-
ления р от времени откачки т для резервуара известного объ-
ема V.
Скорость откачки вычисляется по формуле (2.169), которая
для давлений р' и р", существующих соответственно в моменты
времени г' и т", принимает вид
St»_r = 2,3v^lg^. (5134)
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
451
Объем резервуара должен быть достаточно большим, и тем
больше, чем выше измеряемая скорость откачки. Это необхо-
мо для того, чтобы можно было успевать отсчитывать пока-
зания манометра во время проведения измерений давления в
соответствующие моменты времени.
Соединение резервуара с исследуемым насосом, например ро-
тационным, должно иметь по возможности большую проводи-
мость, измерения же давления выполняться быстро, т. е. при по-
мощи манометров, непосредственно показывающих давление
(компрессионные манометры для этой цели не подходят). Так
как введение клапана между насосом и резервуаром нежела-
тельно (ввиду его сопротивления и возмущений потока при его
срабатывании), за начальный момент измерения т' можно при-
нять момент опускания крышки D на фланец отверстия О боль-
шого диаметра.
Используя три манометра, например механический (760—
50 Тор), укороченный барометр (50—5 Тор) и теплоэлектри-
ческий (10—10'3 Тор), можно производить измерения во всем
охватываемом ротационными насосами диапазоне давлений.
5.Э.2.2. Метод постоянного давления. Повсеместно принятым
в последнее время стандартным методом измерения скорости
откачки насосов является метод постоянного давления. Он за-
ключается в определении расхода I на входе насоса при дан-
ном давлении р, согласно формуле (5.131), и построении зави-
симости
$ = /(/>)• (5.135)
С этой целью для измеряемых (через определенный интер-
вал величин) давлений р определяется соответствующий им рас-
ход I и находится S = I/р, а затем строится кривая зависи-
мости S от р.
Регулирование и измерение расхода I осуществляется при
помощи описанной в разд. 5.9.1 системы для создания устано-
вившегося течения.
Подвод газа к насосу, а также измерение давления выпол-
няют с помощью резервуара, представленного на фиг. 5.96. Сни-
зу к резервуару непосредственно или через переходник присое-
диняют исследуемый насос (диффузионный или ротационный)
и устанавливают манометр, а газ, вводится через специальный
трубопровод с угловым патрубком.
Объем резервуара должен быть по крайней мере в 5 раз
больше объема насосной камеры ротационного насоса.
5.9.2.3. Метод постоянного количества газа. Этот метод при-
годен для непосредственного определения скорости откачки
It*
452
ГЛАВА 5
диффузионного насоса, функционирующего в составе установки,
т. е. в принципе при использовании существующей вакуумной си-
стемы (вакуумных манометров, трубопроводов, вентилей и т. п.).
Установка для измерений по этому методу представлена на
Фиг 5 96. Камера для определения
скорости откачки диффузионного
насоса методом постоят ого
объема.
Внизу — переходник к ротационному
насосу.
фиг. 5.97. Диффузионный насос /, скорость откачки которого
измеряется, работает в замкнутом контуре (вход насоса соеди-
нен трубкой 2 с форвакуумным резервуаром 5).
Фиг. 5.97. Установка для измерения
скорости откачки диффузионного на-
соса методом постоянного количе-
ства газа.
1—диффузионный насос; 2—Труба дли-
ной L и диаметром D (т. е. с известной
проводимостью G); 3 — форвакуумный ре-
зервуар; 4, 5—ионизационные манометры
высокого вакуума; ff—кран; р„—форва-
куумный манометр.
Манометр 4 измеряет давление pi на одном конце трубы 2,
а манометр 5 — давление рг на другом конце этой трубы. При
частично закрытом кране 6 в резервуаре 3 будет иметь место
давление форвакуума рд.
Так как при установившемся течении расход газа на обоих
концах трубы 2 одинаков, то, согласно формуле (5.124), полу-
чаем
I = G (р2 — Pi) — P1S,
(5.136)
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
453
откуда
S = G(21_ iV
\ Pi )
(5 137)
Здесь G — проводимость трубы, определяемая ее длиной L
и диаметром D.
Таким образом, зная G и измеряя р\ и р%, можно вычислить
скорость откачки S насоса для данного давления форвакуума
р0 Изменяя значение ро, например до р' (путем включения
форвакуумного насоса или напуска некоторого количества газа
в резервуар 5), определяют подобным же способом соответ-
ствующую этому состоянию скорость откачки S' и т. д.
Фиг. 5.98. Устройство для переключения манометра при использовании ме-
тода постоянного количества газа.
Труба длиной L и диаметром D имеет известную проводимость G.
Применяя соответствующую систему трубопроводов и двух-
ходовой кран (фиг. 5.98), можно проводить такие измерения
при помощи только одного высоковакуумного манометра. В этом
случае не обязательно знать абсолютные величины давлений
pi и р2. Ввиду того что в формулу (5.137) входит их отношение,
достаточно, чтобы показания манометра были лишь пропорцио-
нальны давлению.
Д. ОБНАРУЖЕНИЕ ТЕЧЕЙ
5.10. ТЕЧИ В ВАКУУМНОЙ СИСТЕМЕ
Если после отсоединения от насоса откачанной емкости ва-
куум в ней ухудшается или если при откачке через положен-
ный промежуток времени не получается ожидаемое низкое дав-
ление, то следует предположить, что в системе есть неплотность
(течь)1).
В стеклянной аппаратуре течи появляются чаще всего в ме-
стах соединений, спаев, металлических выводов через стекло, а
') Иногда имеет место мнимая течь, т. е. интенсивное выделение газов
и паров из масс и поверхностей откачиваемого пространства и аппаратуры
454
ГЛАВА 5
также в клапанах, шлифах и кранах. В металлической аппара-
туре они, кроме того, могут появляться в различных местах ва-
куумной системы вследствие пористости самого металла.
Поиск места течи вообще, особенно в металлической аппара-
туре, представляет собой очень кропотливую и трудную работу.
В стеклянной же аппаратуре эта задача значительно облег-
чается благодаря возможности наблюдения электрического раз-
ряда в щели, являющейся причиной течи.
Предварительная проверка на герметичность отдельных эле-
ментов системы (перед их монтажом) в значительной степени
уменьшает вероятность проявления течей в собранной уста-
новке.
Современные способы выявления, изоляции и количествен-
ного определения течей основаны на применении специальных
течеискателей, действующих по принципу массовой спектро-
метрии. Целесообразно рассмотреть также некоторые способы
обнаружения течей, основанные на использовании простого
оборудования, в частности манометров, которые обычно имеют-
ся в вакуумной системе.
5.10.1. Основы обнаружения течей
Наиболее рациональный метод Обнаружения течи состоит
в применении индикатора парциальных давлений, реагирую-
щего на определенный газ (так называемый пробный газ), вво-
димый специально в течь. Таким индикатором обычно является
упрощенный масс-спектрометр (с узким рабочим диапазоном).
В качестве пробного газа применяют газ, который а) обычно
содержится в атмосферном воздухе в небольшом количестве,
б) имеет по возможности малую молекулярную массу (т. е.
легко проникает через течи), в) хуже других газов откачи-
вается насосом вакуумной системы. Ввиду того что водород не-
желательно применять по соображениям безопасности, чаще
всего для обнаружения течей применяют гелий, иногда аргон.
Для подвода пробного газа к месту предполагаемой течи
вакуумный зонд окружают своего рода оболочкой (например,
пластмассовой), в которую вводится пробный газ в количестве,
обеспечивающем высокую концентрацию его в содержащемся
там воздухе. После обнаружения негерметичности снимают
пластмассовую оболочку и тонкой струей пробного газа обду-
вают поверхность, где предполагается течь, с целью более точ-
ного определения ее местоположения.
Количественно оценить течь можно путем ее сравнения с ка-
либрованной течью, через которую в установку вводится проб-
ный газ с таким расходом, которому соответствует сигнал тече-
искателя, идентичный сигналу для обнаруженной течи.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
455
На точность оценки течи влияют различные факторы: а) ка-
чество пробного газа, вводимого в систему (т. е. проводи-
Лость течи Он и вязкость газа t]r); б) отношение скорости от-
м„чКИ S вакуумной системы к объему этой системы V; в) чув-
ствительность течеискателя; г) взаимное расположение течи и
течеискателя и т. п.
5.10.2. Методы обнаружения течей
Методы обнаружения течей можно классифицировать, на-
пример, следующим образом:
I. Методы обнаружения течей элементов систем.
а) Обычные методы, издавна применяемые для обнаруже-
ния негерметичностей, например резервуаров, трубопроводов,
баллонов, камер шин и т. п., и основанные на создании избы-
точного давления и обнаружении места выхода газа; одним из
таких методов является метод пузырьков (мыльных, масляных
и т. д.).
б) Разновидность метода «а», заключающаяся в примене-
нии специальных детекторов для обнаружения выходящего из
объема определенного газа. Примерами методов этой группы
являются галоидный и водородный методы.
II. Методы обнаружения течей в вакуумных системах. Сре-
ди них различают методы статические и динамические.
При использовании статического метода в исследуемой си-
стеме (предварительно откачанной) давление, измеряемое ка-
ким-либо датчиком, постепенно возрастает вследствие притока
воздуха через течь. Когда в течь вводится легкопроникающий
пробный газ (например, гелий), его парциальное давление
быстро растет, что можно заметить по показаниям датчика дав-
ления, особенно если датчик более чувствителен к используе-
мому газу1); это явление используется в масс-спектрометре,
настроенном на определенный пробный газ.
При использовании динамических методов (которые в на-
стоящее время нашли широкое применение) исследуемая систе-
ма непрерывно откачивается таким образом, чтобы давление в
ней поддерживалось постоянным. В остальном поиск и оценка
течи не отличаются от соответствующих операций статических
методов.
5.10.2.1. Методы обнаружения течей в сосудах. Метод мыль-
ных пузырей. Для поиска течей в исследуемом на герметич-
’) Аналогичный эффект дают пары некоторых органических веществ (на-
пример, спиртов), по отношению к которым манометры обычно имеют высо-
кую чувствительность.
45S
ГЛАВА 5
ность сосуде или вакуумной установке создают определенное
избыточное давление (до нескольких атмосфер, если это допу-
скает механическая прочность сосуда). Затем покрывают (на-
пример, с помощью кисти) место предполагаемой течи водным
раствором мыла; при этом в местах течей образуются наблю-
даемые визуально пузырьки. (При использовании этого метода
следует иметь в виду, что под влиянием избыточного давления
могут быть вырваны из гнезд шлифы и трубки, а поэтому их
следует перед испытанием соответствующим образом укре-
пить).
Метод мыльных пузырей позволяет получить и определенное
количественное представление о течи. Например, если пузырь
газа диаметром 2 мм, т. е. объемом V — 4-10~в л, при давлении
760 Тор образуется за 4 с, то скорость натекания (в Тор-л-с-1)
составляет
. _ 760 X 4 - КГ6
/н— 4
0,76 • 10 3 Тор -л-с 1,
а проводимость негерметичности (для воздуха)
/п 0,76-’0-3 ,л-б _
——------аа----“““ 10 Л * С
р2 — pt /60
G
н
Когда исследуется сосуд небольших размеров, то его про-
верку на герметичность методом избыточного давления можно
провести в стеклянной ванне с водой. Проверка на герметич-
ность отдельных узлов установки перед их монтажом всегда
очень желательна, так как впоследствии это экономит много
времени и труда при отыскании течей в собранной системе.
Метод мыльных пузырей непригоден в случае очень малень-
ких течей. Если для обнаружения течей применять водород вме-
сто воздуха, то благодаря его в 4 с лишним раза большей про-
никающей способности можно значительно повысить эффектив-
ность метода. Гелий дает в 2 раза меньшую чувствительность,
чем водород, но зато он безопасен.
Метод пузырей можно сделать значительно более чувстви-
тельным, если внутреннюю сторону исследуемого резервуара
покрыть тонким слоем пробной жидкости (например, смазоч-
ного масла). После откачки в' местах негерметичностей обра-
зуются и быстро растут пузыри, которые можно наблюдать че-
рез смотровое стекло.
Обнаружение негерметичностей водородным течеискателем.
Этот метод заключается в обнаружении следов водорода, ис-
пользуемого в качестве пробного газа, с помощью палладиевого
электронного ионизационного манометра, в который проникает
только водород, вводимый в чистом виде или же содержащийся
в так называемом формовочном газе (20% Н2 + 80% Nj), све-
тильном газе и т. п.
ВАКУУМНЫЕ ИЗМЕРЕНИЯ 457
Палладиевая трубка отличается от обыкновенной триодной
пубки ионизационного манометра тем, что ее ускоряющий
электрод (анод) изготовлен из палладия; этот анод является
одновременно перегородкой, которая отделяет полость трубки
от исследуемого объема (фиг. 5.99). Нагретый до температуры
~1100 К, палладий пропускает водород, но других газов или
паров не пропускает. Таким образом, находящийся в установке
Фиг. 5.99. Водородный течеискатель (палладиевый
ионизационный манометр).
а—течеискатель в вакуумной системе; б—общий вид Датчика.
1, 2—вентили; 3— исследуемый объект; 4—палладиевая пла-
стинка, закрывающая коваровую трубку; 5—колокол; 6— ре-
зиновый переходник.
К—катод, нагреваемый излучением, G —катодный нагрева-
тель; S—цилиндрическая сетка; А—анод.
водород пройдет через горячую палладиевую перегородку в
трубку манометра, тогда как другие газы не проникнут в нее.
Появление водорода в трубке приводит к увеличению ионного
тока в цепи приемного электрода — сетки S, которая обычно
имеет цилиндрическую форму. По окончании работы водород
можно удалить из манометрической трубки диффузионным на-
сосом при нагретой до ~1100 К палладиевой пластинке. На-
гревание палладиевой пластинки в описываемой трубке осу-
ществляется путем бомбардировки ее электронами (ток
~ 30 мА при напряжении ~200 В).
Схема исследования на герметичность различных вакуум-
ных объектов (например, смонтированных электронных ламп
458
ГЛАВА 5
перед их установкой в насосный автомат) показана на
фиг. 5.99, а. Откачав насосом при открытых вентилях 1 и 2 ис-
следуемый объект 3 (присоединенный обычно с помощью рези-
нового насосного гнезда), а также трубку вакуумного мано-
метра (до палладиевой перегородки), закрывают вентиль 2,
раскаляют палладиевую пластинку 4 и на исследуемый объект
надвигают колпак 5, наполняемый водородом. В случае негер-
метичности объекта 3 водород проникает через горячий палла-
дий и вызывает рост ионного тока в цепи сетки манометра с
отрицательным потенциалом.
Этот метод позволяет определять негерметичности со ско-
ростью натекания 10-8 Тор-л-с-1 (для водорода).
Между водородным течеискателем и вентилем 1 желательно
установить охлаждаемую ловушку, защищающую датчик о г
углеводородов, которые могут загрязнить палладиевую перего-
родку и вызвать ложные сигналы.
Обнаружение негерметичностей галоидным течеискателем.
Более чувствительным, чем описанные выше методы, является
галоидный метод, заключающийся в том, что внутри вакуумной
системы после предварительной откачки ее от воздуха соз-
дается избыточное давление путем введения какого-либо хлор-
содержащего газа, например арктона или фреона (СжС1уРг),
хлора, хлористого метилена, хлороформа, четыреххлористого
углерода или, в крайнем случае1), хлористого метила. Натека-
ние через щель газа, содержащего хлор, можно довольно легко
установить при помощи специальных детекторов.
Одним из простых устройств такого рода является лампа
бесхлорного газа, например ацетиленовая горелка. Струя аце-
тилена перед входом в горелку засасывает воздух через так на-
зываемую пробную трубку. Этой трубкой водят по поверхности
вакуумной системы, проверяемой на герметичность. Пламя аце-
тиленовой лампы нормально нагревает медную пластинку до
красного свечения; при попадании в пробную трубку газа, со-
держащего хлор, пламя окрашивается в зеленый цвет вслед-
ствие образующейся хлористой меди.
Вместо ацетиленовой горелки можно использовать другой
индикатор, реагирующий на данный газ, например галоидный
детектор. Принцип его действия состоит в значительном увели-
чении эмиссии положительных ионов (в воздушной среде) из
горячей поверхности платины, когда в окружающей среде нахо-
') Железо под действием хлористого метила СН3С1 в присутствии воды
корродирует, смешанный с воздухом хлористый метил является взрывчатым
веществом, кроме того, он вреден для здоровья Самым безопасным из галоид-
ных соединений во всех отношениях является фреон CCI2F2, применяемый в
рефрижераторных системах (фреон 12 с температурой кипения 245 К).
вакуумные измерения
459
ятся пары хлористых соединений. Схема этого детектора пред-
ставлена на фиг. 5.100.
Платиновый цилиндр А, нагреваемый до температуры
Л20__1220 К, является источником положительных ионов, кото-
рые оказываются в пространстве концентрического ему цилин-
дра, который является катодом К. Электродная цепь питается
постоянным напряжением, а текущий по ней ток положи-
тельных ионов измеряется при помощи микроамперметра. Си-
стема электродов находится в баллоне 1, переходящем в проб-
ную трубку 2, которая служит для отыскания течей. В другом
конце баллона 1 находится вращающийся вентилятор 3 для за-
сасывания воздуха через пробную трубку 2 в пространство
Фиг. 5.100. Галоидный детектор течей.
/ — баллон; 2—пробная трубка, засасывающая газ из течи, 3—вентилятор.
Л —платиновый анод, являющийся источником ионов; К—-цилиндрический катод.
между электродами. Применение усилителя перед микроампер-
метром делает устройство более чувствительным.
5.10.2.2. Обнаружение течей в системах. Условия чувстви-
тельности системы к импульсу пробного газа. Чтобы вакуумная
система была по возможности чувствительной к импульсу проб-
ного газа (который попадает в течеискатель при перемещении
зондирующей трубки вблизи течи), должны выполняться неко-
торые условия.
До момента введения гелия в вакуумную систему ток кол-
лектора масс-спектрометра очень мал. В процессе перемещения
трубки гелиевого течеискателя вблизи негерметичности в дат-
чике происходит повышение давления вследствие проникнове-
ния гелия, а затем быстрое его снижение (вследствие процесса
откачки). Характер роста и снижения давления зависит от от-
ношения скорости откачки S к откачиваемому объему V.
Если поток газа, проходящего через течь в аппаратуру за
время dr, составляет Iadr, а количество откачанного газа равно
460
ГЛАВА 5
pSdx, то изменение давления описывается уравнением
V dp = (Ia-Sp)dx. (5.138
В этих условиях рост давления происходит согласно формуле
(5.139;
Так как в определенный момент т = п, приток гелия прекра-
щается, давление начинает падать в соответствии с уравнением
р =-у[1 — ехр(—-р-ехр [—у (т — (5.140)
Чтобы спектрометр реагировал на изменение давления, от-
ношение S/V должно быть не меньше некоторой величины (на-
пример, 100 с-1).
О 0 1с
Фиг. 5.101. Влияние отношения S/V
на форму импульса давления р,
вызванного прямоугольным им-
пульсом течи 1„ в откачиваемой
вакуумной системе.
а—вакуумная система объемом V
с течью /н, откачиваемая насосом со
скоростью откачки S; б—импульс газа
через щель; в — изменение давления во
времени для различных значений S(V*
/ — манометр; 2 —место течи (щель).
Влияние отношения S/V на форму импульса давления для
резервуара объемом V, соединенного с насосом, имеющим ско-
рость откачки S, показано на фиг. 5.101. В резервуар через
щель 2 вводится прямоугольный импульс расхода газа с уров-
нем /н в течение 1 с. В нижней части фигуры показаны харак-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ 461
ерисгики импульса давления р, регистрируемого манометром 1
в случае разных значений отношений S/V (т. е. для разных по-
стоянных времени вакуумной системы то — V/S). Как видно из
графиков, для чрезмерно малых значений S/V импульс стано-
вится размазанным и его трудно обнаружить.
Вышеприведенное рассмотрение дает лишь очень прибли-
женную картину явлений, имеющих место при обнаружении те-
чей.
Зависимость реакции течеискателя от его местоположения в
вакуумной системе. Реакция течеискателя на импульс пробного
газа зависит от взаимного расположения течеискателя, насоса
Фиг. 5.102. Обнаружение течей с помощью манометров в откачиваемой
системе.
д—место течи расположено вблизи насоса и удалено от манометра р\\ б—место течи
удалено от иасоса и расположено вблизи манометра pi.
1, 2— манометры, 5—место течи.
и течи. Так, например, взаимное расположение вакуумного ма-
нометра 1, течи 3 и насоса в системе фиг. 5.102, а менее благо-
приятно, чем в системе фиг. 5.102,6; по отношению же к мано-
метру 2 разница между обеими системами несущественна.
Кроме того, реакция манометра зависит от скорости откачки
насоса.
Обнаружение течей с помощью манометров вакуумной си-
стемы. В установившемся режиме работы откачиваемой ваку-
умной системы, имеющей течь, манометры показывают некото-
рые постоянные давления, более высокие, чем ожидаемые, при-
чем эти давления могут быть разными в разных точках си-
стемы. Если место течи окружить пробным газом, то он начнет
всасываться в систему. Если при этом чувствительность вакуум-
ного манометра больше для пробного газа, чем для воздуха,
или если проводимость течи для пробного газа больше, чем для
воздуха, то происходит рост показаний манометра.
Пусть в вакуумной системе объемом V, отделенной от на-
соса (фиг. 5.103, а), существует течь, проводимость которой для
атмосферного воздуха и пробного газа равна соответственно
Свозд и Gr. Пусть в момент т = 0 (отсечка насоса) в вакуумной
системе существовало давление р0 ра. Под действием
462
ГЛАВА 5
перепада давлений ра—ро~рА в систему поступает поток воздуха
/ — — Q п
'возд — dx dx С'возд/'а,
(5.141)
вследствие чего давление в системе возрастает согласно зави-
симости
+ (5.142)
это иллюстрирует линия АВ на фиг. 5.103, б.
Фиг. 5.! 03. Обнаружение течей в вакуумной системе, отключенной от насоса.
а — система, (> —зависимость
7—манометр; 2— место течи-
В момент введения пробного газа наклон линии роста давле-
ния увеличивается (так как Gr > GB03n):
(5143)
как это показывает участок ВС (фиг. 5.103,6). Изменения ха-
рактера нарастания давления можно наблюдать по манометру.
Обнаружение течей при помощи дифференциальной системы
манометров. Такая система состоит из двух теплоэлектрических
манометров, например манометров сопротивления, включенных
в противолежащие плечи моста Уитстона. Оба вакуумных ма-
нометра 3 и 4 подсоединяют к проверяемому на герметичность
вакуумному резервуару 1: манометр 3 — непосредственно, а ма-
нометр 4 — через охлаждаемую ловушку 5 (фиг. 5.104).
После получения равновесия на гальванометре G (с нулем
посередине шкалы) место предполагаемой негерметичности 2
резервуара 1 покрывают какой-нибудь жидкостью, дающей
пары, которые конденсируются при температуре ловушки. Про-
никающие вместе с воздухом через щель пары, проходя через
охлаждаемую ловушку, конденсируются в ней, вследствие чего
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
463
анометр 4 показывает давление только одного воздуха, тогда
как манометр 3 измеряет полное давление (паров и воздуха);
оавновесие моста, таким образом, нарушается. Дифференциаль-
ная система используется в диапазоне хорошей чувствительно-
сти манометров (1 — 10~3Тор) и позволяет обнаружить наличие
конденсирующихся паров в
0,001.
Обнаружение течей при
лянной вакуумной системе
вода, вентиле, кране и т. п.
воздухе при концентрации порядка
помощи искрового разряда. В стек-
негерметичность в стенке трубопро-
может быть обнаружена с помощью
Фиг. 5.104. Обнаружение течей при помощи дифференциальной системы
манометров (с вымораживанием паров в одном из манометров).
1 — резервуар; 2—течь; 3, 4—теплоэлектрические манометры; 5—охлаждаемая ловушка;
Ri, Rz—сопротивления мостовой схемы.
специального высокочастотного электрического зонда путем пе-
ремещения его электрода с высоким напряжением вдоль стенок
проверяемой системы1). Когда электрод находится довольно
близко от места течи (на расстоянии порядка 1 см), происходит
поверхностный разряд по стеклу от электрода к щели, а через
нее внутрь системы, что проявляется в виде сильного пурпурно-
белого свечения в щели, через которую просачивается воздух.
Этот метод применяется при давлениях 10—5-10~2 Тор.
В качестве зонда для отыскания течей и исследования со-
стояния вакуума в вакуумных установках используется неболь-
шой индуктор Румкорфа или трансформатор Тесла. Можно для
этой цели применять также высокочастотный аппарат для элек-
трического «массажа».
В состав этого прибора входит коробка, содержащая
электромагнитный прерыватель (действующий как искровой
’) При этом надо следить, чтобы слишком сильный искровой разряд не
пробил стекло и не вызвал новой течи; поэтому длина искрового разряда не
должна быть больше 10—20 мм, а электрод должен быть не заостренным, з
Иметь вид металлической кисточки,
464
ГЛАВА 5
разрядник) с регулятором тока и переключателем, и рукоятка
(оканчивающаяся зажимом для сменного электрода), в которой
помещается высокочастотный трансформатор.
Такие приборы, предназначенные для проверки состояния
вакуума (фиг. 5.105), имеют частоту порядка нескольких мега-
герц при напряжении порядка нескольких десятков киловольт.
Зонд питается от сети переменного тока. Применение описан-
ного прибора позволяет оценить состояние вакуума стеклянной
Фиг. 5.105. Искроразрядный течеискатель.
вакуумной аппаратуры даже в случае, когда в ней нет индика-
тора с впаянным электродом. В таких случаях достаточно при-
близить электрод зонда к стенке вакуумного прибора, чтобы
возбудить внутри нее свечение.
Если для питания зонда применяется индуктор Румкорфа,
то параллельно следует включить искровой разрядник с меж-
электродным зазором до 10—15 мм для ограничения напря-
жения.
Высокочастотный разрядный зонд облегчает также отыска-
ние течей в стеклянной вакуумной аппаратуре, так как в местах
трещин или щелей разряд, как упоминалось, проявляется в
виде довольно яркого свечения.
Величина давления в вакуумной аппаратуре, если только
она меньше 10-3 Тор, не ограничивает возможности применения
разрядных высокочастотных зондов, так как в течи всегда бу-
дут иметь место давления, при которых возможно сильное све-
чение газа.
Обнаружение течей при помощи тлеющих разрядов. Метод
обнаружения течей, основанный на наблюдении тлеющего раз-
ВАКУУМНЫЕ ИЗМЕРЕНИЯ
465
ряда в вакуумной индикаторной трубке, состоит в следую-
щем.
В разрядной трубке, присоединенной к исследуемой на течь
вакуумной установке, вызывают тлеющий разряд газа. Если
в установке имеются следы воздуха, то свечение обычно имеет
пурпурно-белый цвет. Если к месту предполагаемой течи при-
коснуться ватой, увлажненной, например, спиртом, или распы-
лить спирт (с помощью пульверизатора) вблизи этого места, то
можно заметить изменение цвета свечения внутри установки
вследствие проникновения паров спирта через щель.
Недостаток этого метода состоит в том, что проникновение
жидкости через незначительные течи происходит очень медлен-
но и изменение цвета свечения может произойти с запозданием,
когда проверяется на герметичность уже другое место установ-
ки, что может ввести в заблуждение наблюдателя. Поэтому
лучше использовать вместо жидкости какой-либо газ — водо-
род, пары эфира или более безопасного четыреххлористого угле-
рода либо, в крайнем случае, углекислый газ, который дает бе-
ловато-зеленое свечение. Пробный газ лучше всего подвести к
предполагаемому месту течи с помощью плотно прижатой
к нему резиновой трубки, соединенной с резервуаром газа (на-
пример, с баллоном СОг). В момент попадания газа на место
течи пурпурно-белое свечение внутри разрядной трубки, харак-
терное для воздуха, немедленно изменяется на беловато-зеле-
ное. Наблюдение изменения цвета свечения лучше всего прово-
дить в пространстве так называемого положительного свече-
ния тлеюще.го разряда.
5.10.3. Обнаружение течей при помощи
спектрометрической системы
Спектрометрическая система для обнаружения течей в
вакуумных установках или их элементах представлена на
фиг. 5.106.
Основными элементами системы являются масс-спектро-
метр 1 (обычный или упрощенный, с узкой полосой спектра
молекулярных масс, охватывающей, например, только гелий),
блок насосов (масляный ротационный насос 2 и паромасля-
ный диффузионный насос 3 с воздушным охлаждением), ва-
куумная камера 5 с помещенной внутри нее криопанелью, ох-
лаждаемой жидким азотом, и вспомогательные устройства (ва-
куумный резервуар 4, вентили, вакуумные манометры, реле
и т. п.).
Исследуемый на герметичность объект присоединяется к вхо-
ду 6 спектрометрической системы (вентили 8} 9 и 10 закрыты,
463
ГЛАВА 5
кран 7 в положении Ь), и в нем создается форвакуум. Из-
мерение давления теплоэлектрическим манометром 11 позво-
ляет проверить, нет ли какой-нибудь серьезной течи. Затем
кран 7 переставляют в положение а, откачивают насосом 2 ле-
вую часть вакуумной установки и по достижении достаточно
низкого давления форвакуума (контролируемого маномет-
ром И) приводят в действие диффузионный насос 3. Давление
в главной вакуумной камере 5 измеряют ионизационным мано-
Фиг. 5.106. Масс-спектрометрическая система обнаружения течей.
/ — масс-спектрометр; 2— ротационный масляный насос; 5 —диффузионный насос; 4—фор-
вакуумный резервуар; 5—вакуумная камера, 6—вход для подключения объекта, прове-
ряемого на негерметичность; 7—двухходовой кран-, 8, 9, /0 — вентили;// — теплоэлектри-
ческий манометр; 12—ионизационный манометр, 13— реле, включающее масс-спектрометр;
14 — заслонка Для регулирования скорости откачкн; 15 - вентилятор, охлаждающий диф-
фузионный насос.
метром 12. Когда это давление станет достаточно низким
(~10~4 Тор), срабатывает реле 13 и включается источник
ионов масс-спектрометра. После этого наполняют резервуар в
камере 5 жидким азотом и, убедившись, что измеряемое мано-
метром 11 давление достаточно низко, открывают вентиль 8.
Затем с помощью заслонки 14 регулируют скорость откачива-
ния диффузионного насоса, чтобы давление в вакуумной ка-
мере 5 составляло 10~4—10~5 Тор. После включения масс-спек-
трометра в камеру, где находится исследуемый объект, впу-
скают пробный газ (лучше всего гелий) и наблюдают за пока-
заниями масс-спектрометра,
Таблица 5.9 Области применения и чувствительность различных методов обнаружения течей (ориентировочные данные) " Минимальная обнаруживае- мая скорость натекания, мТор-л-с"”1 — « tO -III о о о _ еч еч ь- Ь 1 1 । о о о Of—6—0’
Область рабочих давлений, Тор о т О <75 lo 00 1 О 7 о <о 1 О ю 1 о т о п 1 О я 1 о Хз о о *о сч о со о "с + +
+ +
+ +
+ +
+ +
+ +
+ t +
t f + + +
f + + 4 + +
+ + + + +
+ + + + +
t + + 4- + + —
+ + 4 + + +
+ 4 4 4 4
4 14 f
+ +
Метод Керосин и мел Мыльные пузыри Масляные пузыри Галоидный течеискатель2) Газоразрядный индикатор Высокочастотный искровой зонд Тепло электрический мано- метр Ионизационный манометр Галоидный течеискатель3) Спектрометрический тече- искатель
Объект Емкости Системы полного давления Системы парциаль- ных давле- ний
Ч Составил В Гурский.
2) С применением ионного течеискателя (галоидного зонда), работающего при атмосферном давлении
3) С применением платинового галоидного диода, помешенного внутри установки.
4G8 ГЛАВА 5
Описанная система позволяет обнаружить негерметичность
со скоростью натекания от 10~12 до 10-1 Тор-л-с-1.
При проверке на герметичность вакуумной установки в сбо-
ре отверстие 6 закрывают, а установку присоединяют к вентилю
S Кран 10 служит для заполнения установки воздухом. Обычно
испытательная система в значительной степени автоматизи-
рована (например, клапаны управляются электромагнитами
и т. п.).
В табл. 5.9 сведены данные, касающиеся областей примене-
ния и чувствительности различных методов обнаружения течей.
6. Вакуумная
аппаратура
6.1. ВАКУУМНЫЕ УСТРОЙСТВА
Основными вакуумными устройствами являются насосы и
вакуумметры. Кроме того, к вакуумной аппаратуре относятся
устройства, предназначенные для соединения и разделения объ-
емов, регулирования параметров вакуума, введения тех или
иных газов и выполнения различных операций, связанных с по-
лучением, сохранением и использованием вакуума, т. е. вакуум-
ные емкости (сосуды), трубопроводы, регуляторы, клапаны, кра-
ны и т. п. Вакуумное устройство должно быть разборным, если
оно имеет значительные размеры или возникает необходи-
мость доступа внутрь его. Такие вакуумные устройства должны
иметь соединительные элементы (разъемные соединения, муф-
ты). Кроме того, в состав устройства могут входить приспособ-
ления, необходимые для выполнения различных функций (на-
пример, приспособления для передачи внутрь вакуумной систе-
мы механического движения, электрического тока, введения
специальных газов и т. п.).
Очевидно, что вакуумная система должна быть герметич-
ной, а поэтому она должна быть изготовлена из вакуумных
материалов, т. е. из таких материалов, которые в вакууме вы-
деляют минимальное количество газов или паров и легко под-
даются обезгаживанию.
Кроме того, при больших размерах вакуумных сосудов воз-
никает проблема их прочности под действием сил атмосферного
давления, которые могут вызвать потерю устойчивости (вдавли-
вание) стенок.
С точки зрения распределения давлений, возникающих во
время работы, вакуумные системы можно разделить на статиче-
ские и динамические.
Основным признаком статической системы является равно-
мерное распределение давления в откачиваемом объеме и всей
системе. Такое распределение давления имеет место, когда
установка хорошо откачана и обезгажена, а откачиваемый
объем герметично закрыт.
470
ГЛАВА 6
В динамической системе одновременно происходят откачка ц
выделение газов внутри системы, а также проникновение их в
систему через течи. В этом случае давление не является одина-
ковым во всех частях системы: оно тем больше, чем дальше от
насоса находится соответствующая точка системы.
От выбора насосов и поперечных сечений трубопроводов при
проектировании вакуумной системы в значительной степени за-
висит, будет она статической или динамической.
Вакуумные установки обычно выполняются из стекла или
металла. Металлические установки часто имеют пластмассовые,
стеклянные или керамические элементы. Вакуумная установка
может быть предназначена для лабораторных или производ-
ственных целей. Производственная вакуумная установка ис-
пользуется для индивидуальной или массовой откачки вакуум-
ных приборов (в последнем случае она обычно автоматизи-
руется) или для ведения вакуумных технологических процессов.
Часто вакуумные установки оборудуют вспомогательными
устройствами, такими, например, как печи для нагревания де-
талей (газовые, электрические), источники напряжения, газо-
вые резервуары, течеискатели, холодильные агрегаты и т. п.
Здесь не рассматриваются отражатели паров, охлаждаемые ло-
вушки и другие элементы насосов, которые описаны вместе с
насосами в гл. 4.
6.2. МАТЕРИАЛЫ ДЛЯ ВАКУУМНЫХ УСТРОЙСТВ
Материалы для вакуумных устройств должны обладать пре-
жде всего непроницаемостью (даже в тонких слоях) и малой
десорбцией газов (и паров) при достаточной теплостойкости1).
Поэтому для изготовления вакуумных устройств обычно
используются соответствующим образом подобранные металлы,
стекла и керамические материалы. Органические вещества, та-
кие, как пластмассы, резины, цементы, герметики и т. п., при-
меняются только в исключительных случаях, а именно в си-
стемах с большой скоростью откачки, не прогреваемых и не
предназначенных для работы в статическом режиме или для
создания очень высокого вакуума.
Очевидно, что выбор материала в каждом конкретном слу-
чае зависит еще от многих дополнительных условий: магнитных
и электрических свойств материалов, возможности герметично-
го соединения различных материалов и т. д. Большое значение,
особенно в случае крупногабаритных установок, имеет стои-
мость материалов.
') Требование теплостойкости в первую очередь касается материалов для
установок очень высокого вакуума, которые прогреваются до температуры
~ 750 К.
ВАКУУМНАЯ АППАРАТУРА
471
Наиболее важными металлическими материалами для круп-
ногабаритных вакуумных установок являются нержавеющие
стали (сплавы железа с никелем, хромом, титаном и другими
легирующими элементами). Молибденовые присадки вообще
полезны, но полировка поверхности молибденовых сталей за-
труднена.
Из неметаллов широко применяются в вакуумных системах
твердые стекла (пирекс, дюран и др.) и высококорундовые ке-
рамики (например, А1 19).
Золото и медь иногда употребляются как уплотнительные
материалы; в качестве припоев обычно используются твердые
припои (серебро, золото, иногда сплавы меди).
Плотные соединения со стеклами и керамикой образуют раз-
личные сплавы железа, никеля, кобальта (и хрома) в соотно-
шениях, подобранных так, чтобы коэффиценты температурного
расширения сплава и стекла (или керамики) были одинако-
выми. К таким сплавам относятся ковар, конель, сивар и др.
(см. также табл 6 1).
6.2.1. Металлы
Из металлических материалов в вакуумных системах при-
меняются нержавеющие и кислотостойкие стали (в частности,
никелевые), а также медь (вакуумная MOOV) и алюминий.
Нежелательны латунь и некоторые сорта бронзы (особенно при
температурах выше 420 К), так как в них.содержатся испаряю-
щиеся металлы (цинк и др.). В некоторых элементах вакуум-
ных установок допускается применение бесцинковых бронз
(например, бериллиевых, алчоминиевых).
Применение меди и алюминия часто ограничивается их тер-
мической прочностью, а в установках, содержащих ртуть или ее
пары, возможностью образования амальгам. Применение дюр-
алюминия встречает трудности из-за его неудовлетворительных
характеристик пайки и сварки.
В небольших вакуумных устройствах для изготовления спе-
циальных деталей применяют тугоплавкие металлы: молибден,
тантал, вольфрам, а также никель и его сплавы, не содержащие
меди, и даже платину. Металлические материалы для примене-
ния в вакуумной технике должны быть исключительно чистыми
и не содержащими пустот; для этого их выплавляют и обраба-
тывают в тщательно контролируемых условиях (по возможно-
сти в вакууме) и хранят при пониженном давлении в инертной
среде.
Металлические отливки, если они выполнены не под давле-
нием, отличаются невысокой вакуумной плотностью; поэтому
такие металлические материалы стараются не применять, осо-
бенно в очень высоком вакууме.
472
ГЛАВА 6
Чаще применяются изделия из прокатанного или тянутого
металла. Однако и в этом случае следует учитывать возмож-
ность образования пор и трещин. Их обнаружение оказывается
очень затруднительным, а при дальнейшей обработке деталей,
особенно при сварке, такие несплошности материала часто при-
водят к возникновению течей.
Металлы вообще содержат довольно много газов, главным
образом кислорода, азота, моно- и двуокиси углерода. Газы по-
падают в металл во время металлургических процессов, а так-
Фиг. 6.1. Зависимость количества
водорода, см3 (норм.), растворенного
в 100 г металла, от температуры
(по Вальдшмидту и др., 1954 г.).
же поглощаются из окружения при обработке и хранении ма-
териала. Количество таких абсорбированных и растворенных
газов зависит от рода металла, а также от условий, в которых
происходило поглощение. Количество растворенного газа при-
близительно пропорционально корню квадратному из давления,
которое имел газ над расплавленным металлом, причем раство-
римость газа растет экспоненциально с температурой металла.
Например, 1 кг обычного алюминия содержит 10—20 см3 га-
зов (в пересчете на нормальные условия). Кривые на фиг. 6.1
показывают содержание растворенного водорода в некоторых
металлах в зависимости от температуры.
Водород растворяется во многих металлах; в Ni, Fe, Со, Си,
Ag, Мо, W и Pt растворимость водорода с повышением темпе-
ратуры возрастает, а в Ti, Zr, Та, Pd — уменьшается. В Au, Zn,
Cd и In растворимость водорода вообще невелика.
Азот поглощают металлы, образующие нитраты, т. е. Сг, Мо,
W, Fe, Мп и Та.
Кислород поглощают все металлы (за исключением благо-
родных).
ВАКУУМНАЯ АППАРАТУРА
473
Такие газы, как СО, СО2, SO2, СН4 (и Н2О), обычно обра-
тен на поверхности металла из составляющих их элементов,
3?лЮи последние содержатся в металле.
еС обезвоживание металлов производят в вакууме или в газах
/иНертных либо восстановительных). Обезгаживанию путем на-
пева в воздушной среде поддаются только благородные ме-
аллы, что делается с целью устранения с их поверхности за-
грязнений. Таким же образом можно очищать поверхность ни-
келя, молибдена и вольфрама, однако нагрев этих металлов в
Фиг. 6-2. Удельный поток десорбции
/ дес с поверхности металлов и сте-
кла в зависимости от времени пребы-
вания материала в вакууме (по Генри,
1969 г.).
Нержавеющая сталь Х18Н10 при 670 К
(сплошные линии): /— необработанная, тра-
вленая; 2— механически полированная,
травленая, 3—электрополированиая в тече-
ние 15 мин.
Сплав алюминиевый, легкий (с добавкой
Mg, Мо и Сг) при 300 К (штриховые линии):
4— необработанный; 5—необработанный,
травленый.
Стекло борокремнневое при 300 К (штрих-
пунктирные линии): 6—предварительно не
обезгаженное; 7—после предварительного
обезгаживания при температуре 370 К в тече-
ние 5 ч, а затем при выдержке на воздухе
в течение 14 ч.
воздушной среде должен выполняться так, чтобы не превысить
температуру окисления.
Процесс откачки вакуумного прибора облегчается и упро-
щается, если для изготовления прибора использованы металлы
(в виде листов, проволоки и др.), по возможности свободные
от абсорбированных газов, т. е. металлы, получаемые (выплав-
ленные, отлитые, термообработанные) в вакууме.
Все металлические детали перед монтажом или введением
их в вакуумную установку должны быть обезгажены посред-
ством нагревания. Таким путем устраняются не только значи-
тельное количество абсорбированных и окклюдированных га-
зов, которые остались в металле при его изготовлении или были
поглощены им при соприкосновении с воздухом во время хра-
нения и транспортировки, но и загрязнения органического
происхождения (как, например, смазка, жиры, пот от рук и
1 п), а также восстанавливаются окислы, образовавшиеся на
474 глава 6
поверхности в процессе обработки (например, во время
сварки) ')•
Обезгаживание металлических деталей производится в спе-
циальных вакуумных или водородных печах* 2). Продолжитель-
ность обезгаживания зависит от рода металла. Давление в ва-
куумной печи при этом не должно превышать 10-3 Тор
(~0,13Па).
Температура обезгаживания должна быть по возможности
высокой (какую допускают физико-механические и химические
свойства данного металла), так как скорость удаления газа
растет с температурой. Для большинства металлов температура
обезгаживания в вакууме составляет 1100—1800 К, в водороде
900—1400 К.
В табл. 6.1 представлены данные по времени и температуре
обезгаживания металлов в различных условиях. На фиг. 6.2 по-
казано, как уменьшается удельная десорбция нержавеющей
стали (при 670 К), алюминиевого легкого сплава и борокрем-
ниевого стекла (при 300 К) со временем при различных состоя-
ниях их поверхностей.
6.2.2. Стекла
Стекло широко применяется в вакуумной технике благодаря
его хорошим вакуумным (низкое давление паров, малая десорб-
ция) и электрическим (хороший изолятор) свойствам. Однако
хрупкость стекла ограничивает возможности изготовления из
него больших элементов вакуумных установок.
Стекло представляет собой сплав (частично химическое со-
единение) нескольких соответствующим образом подобранных
неорганических компонентов, главным образом окислов. После
охлаждения из расплава оно становится аморфным твердым
веществом (вид переохлажденной жидкости), обладающим ме-
ханическими свойствами твердого тела.
Основными компонентами стекла являются окислы кремния
SiO2, бора В2О3, а иногда фосфора Р2О5; затем идут окислы
натрия Na2O, калия К2О, алюминия А120з, свинца РЬО, а также
кальция СаО, марганца MgO, бария ВаО, цинка ZnO и в спе-
циальных случаях некоторые другие. Чистый природный или
плавленый кварц можно рассматривать как стекло, состоящее
только из SiO2.
') Металлические детали перед обезгаживанием должны быть хорошо
обезжирены (например, промыванием в чистом треххлористом этилене) во
избежание взаимодействия углеводородов жира с металлом.
2) В водородной печи нагретые металлические детали находятся в атмо-
сфере чистого водорода (под давлением, несколько превышающим атмосфер-
ное) или смеси, содержащей 20% Н2 и 80% N2 (так как не все металлы мо-
гут быть обезгажены в водороде; см. табл. 6.1).
ВАКУУМНАЯ АППАРАТУРА
475
Таблица 6.1
Хаоактеристики обезгаживания некоторых материалов
Материал Обезгаживанне Примечание
в вакууме в атмосфере водорода
температура, К время, ч температура, К время, мин
Вольфрам (в виде проволоки или стержней) Молибден Тантал 2100 1200 1300-1800 8-10 1400-1700 1300-1500 Недопу- стимо 2-5 30 Вольфрамовые ка- тоды не обезга- живаются в печи В атмосфере водо- рода охрупчи- вается
Платина Никель и его сплавы, не со- держащие меди 1200-1300 (на воздухе 900—1100) 1000-1250 >0,5 1200 1200-1300 5-10 5-15 Температура вы- держки зависит от формы пред- мета
Железо и его спла- вы, не содержа- щие меди высо- кохромовая, нержавеющая и кислотостойкая стали 1200-1300 1100—1300 WW ю —» Водородная атмо- сфера должна быть очень чи- стой
Медь и ее спла- вы, не содер- жащие цинка и олова 800 Не рекомен- дуется Цинковые и оло- вянные сплавы не обезгажи- ваются в печи
Графит и графи- тизированные металлы Вольфрам и ни- кель, покрытые окисью хрома В зависи- мости от рода метал- ла, чистый графит при 1200-1800 Недопу- стимо 1200 15 В водородной ат- мосфере обра- зуются углево- дороды
476
ГЛАВА 6
Различные упомянутые выше добавки придают стеклу опре«
деленные физические и химические свойства, как, например^
определенный коэффициент теплового расширения, требуемы^
термомеханические характеристики, электрическое сопротивле.
ние, диэлектрическую проницаемость, химическую инертности
(например, по отношению к влаге), тепловую стабильность,
прозрачность в определенном диапазоне спектра излучения,
коэффициент преломления света, а также стабильность аморф-
ной структуры. Например, добавка Na2O и СаО снижает тем-
пературу плавления стекла, добавка же Na2O противодействует
нежелательной кристаллизации (так называемому расстекло-
выванию) !), СаО уменьшает растворимость стекла в воде,
А120з и ZnO увеличивают химическую инертность и облегчают
механическую обработку стекла, а коэффициент линейного рас-;,
ширения стекла уменьшается при добавлении SiO2 и особенно
В20з, который стабилизирует стеклообразное состояние.
Классификация стекол часто проводится в соответствии с их
химическим составом в зависимости от входящих в них компо-
нентов. Стекла на основе двуокиси кремния называются крем-
ниевыми, а на основе окислов бора — боровыми. Если, кроме
основного окисла, стекло содержит дополнительный окисел, то
в название стекла добавляется соответствующее определение,
например алюмокремниевое, свинцовокремниевое и т. д. В слу-
чае большого количества компонентов они перечисляются в на->
звании в следующем порядке: сначала окислы щелочноземель-
ных металлов (Ва, Са), затем щелочных (Na, К), а дальше —
в порядке возрастания процентного содержания. Например,
стекло, состоящее из 73% SiO2, 16,1% В20з, 6,4% РЬО и 4,3%
Na2O, называется стеклом натрийсвинцовоборокремниевым.
Стекло же, состоящее из 23% SiO2, 37% В2О3, 24% А12О3 и 10%
СаО, называется стеклом кальцийалюмоборокремниевым. Со-
ставные части, содержащиеся в меньшем количестве, могут
быть в названии стекла пропущены.
В табл. 6.2 представлена классификация стекол и указаны
их основные характеристики. Стекла подбираются в соответ-
ствии с условиями их работы в вакуумной аппаратуре. Кроме
коэффициента теплового расширения, от которого зависит спо-
') Расстекловывание (девитрификация) — это переход стекла из аморф-
ного состояния в кристаллическое вследствие кристаллизации одного или не-
скольких его составных частей (прежде всего SiO2 или CaSiO3). Расстекло-
вывание может происходить как при изготовлении стекла, так и во время
его обработки, если тепловые процессы ведутся неправильно. Особенно
содействует расстекловыванию долгая выдержка стекла при высокой темпера-
туре. Часто во время обработки стекла происходит поверхностное расстекло-
вывание, которое устраняется путем так называемого соления стекла, т. е.
введения в пламя, в котором обрабатывается стекло, паров натрия (из пова-
ренной соли или соды).
Общая классификация стекол и некоторые их свойства (данные Эспе
Ч См. фиг. 6.3.
478
ГЛАВА S
соб соединения стекол между собой и с другими конструктив-
ными элементами, большое значение имеют и другие теплол
физические свойства, от которых зависят возможность обезга?
Фиг. 6.3. Зависимость коэффициента вязкости стекла от температуры.
Т „ — минимальная температура отжига (при которой напряжения исчезают в течение 4 ч);
хр
ГОтж —температура отжига (при которой напряжения исчезают в течение 15 мин);
Тдревр-температура превращения (начало возрастания коэффициента теплового расши-
рения и изменения других свойств); ?м—температура размягчения (определяется дилато-
метрически); Тм—температура размягчения (по Литтлтону); Гра^—средняя температура
области механической обработки (по Шервуду, 1918 г.).
живания стекла, десорбция газов, их проникновение сквозь
стенки, а также условия тепловой и механической обработки
стекла.
Важной характеристикой стекла является зависимость его
вязкости от температуры. На фиг. 6.3 представлена зависимость
коэффициента вязкости стекла от температуры и указаны ха-
рактерные точки, а также области, соответствующие различным
видам обработки стекла. Вязкость стекла приведена в пуазах
ВАКУУМНАЯ АППАРАТУРА
479
Пз) *)• При охлаждении расплавленное стекло из жид-
1 го состояния переходит в эластическое, а затем при снижении
К°мпературы ниже точки превращения2) — в хрупкое состояние.
Т Границей между эластическим и жидким состояниями яв-
ляется точка плавления (у стекол она не является столь отчет-
ливой, как у металлов).
Точкой размягчения (отвердевания) называется температу-
ра при которой даже небольшая стеклянная деталь заметно
деформируется под действием силы тяжести.
Для механической обработки стекло нагревается до тем-
пературы размягчения (820—1070 К, кварцевое стекло — до
1770 К), при этом вязкость должна находиться в пределах ме-
жду 108 Пз (при ручной обработке) и 102 Пз (при обработке
в формах). Слишком длительное пребывание стекла при высо-
кой температуре приводит к расстекловыванию.
При механической обработке стекла возникают внутренние
напряжения. Процесс их снятия или уменьшения путем нагрева
(без деформации) называется отжигом стекла.
Стекло при температурах отжига имеет такую вязкость, при
которой существовавшие механические напряжения исчезают, а
новые не возникают. Релаксация напряжений происходит тем
быстрее, чем выше температура стекла. При температурах ниже
температуры превращения напряжения возникать не могут, а
существующие почти не снимаются.
Для вакуумной техники важными являются проницаемость
стекол в отношении газов и способность их растворять, а также
зависимость этих свойств от температуры. Как уже упомина-
лось, важным параметром стекла является коэффициент линей-
ного расширения, имеющий большое значение для создания
прочных и герметичных соединений стекол между собой, а так-
же с другими материалами (металлами, керамикой).
Механическая прочность стекол на разрыв составляет
3—9 кГ-мм~2 (1 кГ-мм-2= 107 Н-м~2), а на сжатие 80—
НО кГ-мм~2. Для кварца эти характеристики соответственно
равны 12 кГ-мм-2 и 150—200 кГ-мм-2.
Теплопроводность стекол вообще мала и составляет 0,002—
0,003 кал • см~1 • с*1 • К-1 (1 кал • см-1 • с-1 • К-1 = 420 Вт-м-'-К-1).
’) Среда имеет вязкость, равную 1 Пз, если для перемещения 1 см2 по-
верхности в этой среде со скоростью 1 см-с*1 параллельно неподвижной по-
верхности, находящейся на расстоянии 1 см, нужна сила в 1 дин (10~s Н).
Размерность пуаза (в системе СГС) дин-с-см~2. В Международной системе
единиц СИ за единицу вязкости принимается вязкость среды, в которой для
перемещения 1 м2 поверхности параллельно неподвижной поверхности, находя-
щейся на расстоянии 1 м, нужна сила в 1 Н. Эта единица равна Н-с-м"2 =
== 10 Пз. — Прим, перев.
2) В окрестности температуры превращения Гпревр происходит быстрое
изменение коэффициента линейного расширения стекла и других его харак-
теристик.
480
ГЛАВА 6
Теплоемкость стекол находится в диапазоне 0,1—0,4 кал
• г-’-К-1, (1 кал-г-’-К-1 = 4,2 Дж-г-’-К-1)- '
Стекла (особенно содержащие окислы щелочных металлов
являются химически активными материалами, и, хотя давлена
их собственных паров очень мало, они могут связывать на пс
верхности и в поверхностном слое большое количество водяны
паров и других газов (СО2, N2). Толщина этого слоя зависит о
химического состава стекла, времени его хранения, а также б
способа обработки. Стекла, содержащие окислы щелочных ме
таллов, сильно поглощают влагу. Газы, сорбированные в по
Фиг. 6.4. Зависимость количества газов (в см3 при нормальных условиях)
выделяющихся из борокремниевого стекла G702P (корнинг), от температурь
прогрева (Т' ~ 580 К, Т" = 740 К) (по Шервуду).
слой стекла, например во фтористоводородной кислоте. Щелочи
ные стекла при нагреве до ~420К выделяют большое коли-
чество водяных паров (70—90% всех выделенных газов),
5—25% СО2 и до 4% СО. Газовыделение с 1 см2 поверхности
стекла достигает нескольких десятков миллитор-литров !).
Другой способ удаления газов из поверхностного слоя со-
стоит в выдержке стекла на воздухе при ~470 К.
Удельное газовыделение алюмокремниевых стекол сравниН
тельно невелико, причем наиболее интенсивное выделение газов
из этих стекол происходит при температуре ~570—580 К. При
дальнейшем повышении температуры интенсивность выделений
водяных паров уменьшается, достигает минимума при некото-'
рой температуре, а затем опять сильно увеличивается при тем-
пературе выше 770 К, когда уже происходят физико-химиче*
ские превращения самого стекла (его частичное разложение С
выделением воды). Из других газов выделяется сравнительно
много СО2 (5—25%), а также СО (до 4%).
!) 1 миллитор-литр — количество газа, который при давлении 1 мТор
(0,133 Н/м2) занимает объем 1 л, а при нормальном давлении 1,316 см3.—
Прим, перев.
ВАКУУМНАЯ АППАРАТУРА
481
Газовыделение из поверхностного слоя стекла возрастает с
повышением температуры и оно пропорционально корню квад-
ратному из времени выдержки при этой температуре.
Кроме сорбированных газов, стекло может содержать опре-
деленное количество растворенных газов, таких, как СО2, О2, N2
и Нг- Окончательное обезгаживание стекла обычно производит-
ся при откачке уже готового стеклянного прибора.
На фиг. 6.4 приведен пример зависимости газовыделения из
борокремниевого стекла корнинг (G702P) от температуры. Ха-
рактеристические температуры максимального и минимального
газовыделения равны 580 и 740 К соответственно.
Характеристики удельной десорбции такого стекла при тем-
пературе 300 К в процессе откачки (без предварительного обез-
гаживания и с обезгаживанием) представлены на фиг. 6.2.
6.2.3. Керамические материалы
Керамические материалы в вакуумной технике часто заме-
няют стекло, так как они обладают большей механической проч-
ностью, выносят быстрые изменения температуры и не требуют
отжига после обработки. Кроме того, они обладают лучшими
электрическими свойствами, особенно в области высоких частот.
Фиг. 6.5. Кривые зависимости коэф-
фициента диэлектрических потерь
стекла корнинг 704 (прерывистая
линия) и керамики альсимаг 243
(сплошная линия) от частоты f.
Для примера на фиг. 6.5 показана зависимость коэффици-
ента диэлектрических потерь tg 6 от частоты f для стекла (кор-
нинг 704) и для керамики (альсимаг 243). Очевидно, что при
высоких частотах целесообразно применять керамику, особенно
Для изготовления изоляторов и токовыходов.
Керамические изделия изготовляются из окислов металлов
и их смесей: силикатов, алюминатов, титанатов, боридов, карбо-
натов, нитратов, силицидов и т. п. Применяются также ока-
тыши чистых окислов металлов, например алюминия, магния,
Циркония и т. п. Из этих веществ изготавливают гранулы, их
16 Зак. 510
482
ГЛАВА 6
сушат, обжигают, затем размельчают, добавляют вяжущие в®
щества (тальк или силикат алюминия, а иногда органически^
вещества), формуют во влажном состоянии, сушат и обжигают
Полученные таким образом керамические изделия можно шли-
фовать. На различных этапах процессов сушки и отжига про.
исходит деформация изделия, что должно быть учтено при ме-
ханической обработке. Детали, изготовленные из керамики!
можно подвергать глазуровке.
Существует много видов керамики с различными свойствами
(фарфоры, силикаты магния, чистые окислы металлов). По от?
ношению к вакууму различают плотные и пористые керамиче*
ские материалы. Как те, так и другие должны обладать малой
десорбцией, а первые, кроме того, малой газопроницаемостью^
Газопроницаемость керамических материалов во многих слу-*
чаях может быть уменьшена путем глазуровки или покрытия
поверхности стеклом. Однако покрытие стеклом и глазуровка
ухудшают термические и электрические свойства керамики.
Что касается свойств материалов, помещаемых внутрь ва-
куумных приборов, то предпочтение следует отдавать пористым
материалам, так как их легче обезгазить, не опасаясь, что вну-
три их или под глазурью остается газ.
Значения коэффициента линейного расширения керамиче-
ских материалов находятся в диапазоне 4• 10~6—12-I0-6 К-1,
теплопроводность составляет 2—9 кал-см-1-с-1-К-1, темпера-
тура плавления имеет порядок 1800—3100 К, т. е. значительно
выше, чем у стекол. Рабочая температура обычных керамиче-
ских материалов составляет 1250—1300 К. Специальные жаро-
стойкие керамики имеют еще более высокую рабочую темпе-
ратуру.
К пористым керамикам в первую очередь относятся чистые
окислы металлов (главным образом алюминия и магния). Та-
кие окислы предварительно обжигаются в воздушной атмосфе-
ре при температуре -—1300 К, а затем в водородной печи при
температуре ~ 1900 К. Полученный агломерат дробят до порош-
кообразного состояния с помощью гидравлических прессов или
мельниц, смешивают с небольшим количеством талька или си-
ликата алюминия, формуют во влажном состоянии, сушат и об-
жигают при температуре 1850—1900 К.
Алундовая (корундовая) керамика содержит 75—99,9%
AI2O3. Она часто применяется для изготовления различных вы-
сокотемпературных изоляторов, устанавливаемых внутри ваку-
умных ламп (например, изоляторов нагревателей, катодов и
держателей раскаленной проволоки).
Чистая окись алюминия AI2O3 часто используется в виде
эмульсии с какой-либо органической жидкостью для изготовле-
ния изоляции путем напыления,
ВАКУУМНАЯ АППАРАТУРА
483
14з более новых вакуумных керамических материалов сле-
т назвать лавы, в том числе плавленый природный тальк
^лава А) и КОРУНД алюминия (лава В), а также «белый гра-
фит» (азит бора).
Кроме того, можно упомянуть стеатитовые керамики, полу-
чаемые из силикатов магния, причем в состав керамики обычно
входят тальк 3MgO-4SiO2-H2O и магнезит MgO-CO3. К этой
группе керамик относятся улучшенные стеатиты, такие, как ка-
лит, калан, фреквента, альсимаг и т. д., содержащие различные
добавки (барий, стронций). Добавление циркона (ZrO2-SiO2)
с некоторыми флюсами дает цирконовый фарфор, обладающий
повышенной жаростойкостью. Стеатитовая керамика, обожжен-
ная при высокой температуре, обладает стеклообразной, очень
однородной структурой.
К группе вакуумно-плотных керамик следует отнести неко-
торые сорта фарфора, главным образом электротехнического,
содержащего 40—60% каолина (Al2O3-2SiO2-2H2O), 20—30%
полевого шпата (алюмосиликатов Na, К, Са) и 25—45% квар-
цевого песка, спеченных при температуре 1550—1750 К.
Находит также применение форстеритовая керамика (напри-
мер, альсимаг 243), изготовляемая из форстерита 2MgO-SiO2
(содержащего 35—55% MgO) с температурой спекания
~ 1620 К- Она идет на изготовление корпусов вакуумных ламп.
Многие керамические материалы образуют прочные и гер-
метичные соединения с металлами и стеклами (например, мул-
лит 3Al2-2SiO2) при соответствующем подборе коэффициентов
теплового расширения и в некоторых случаях металлизации по-
верхностей.
Керамические материалы вследствие высокотемпературных
процессов их изготовления содержат ничтожные количества га-
зов (главным образом Н2О, СО, СО2, Н2). Однако при бомбар-
дировке их поверхности электронами высоких энергий происхо-
дит разложение компонентов керамики с выделением значи-
тельного количества кислорода.
6.2.4. Органические материалы
Органические материалы ввиду значительного выделения
ими газов, большой пористости, малой тепловой и механиче-
ской стабильности находят ограниченное применение в изго-
товлении вакуумной аппаратуры, особенно для высокого ваку-
ума.
В устройствах низкого вакуума иногда применяются
толстостенные трубки из синтетической резины специальных
сортов, а также замазки для уплотнения клапанов и кранов.
Некоторые соединения уплотняются и армируются с помощью
16*
484
ГЛАВА 6
затвердевающих материалов (восков, цементов, лаков). Маст
ки, цементы и лаки могут служить для быстрой ликвидащ
возникшей течи даже в высоковакуумных системах.
В устройствах высокого вакуума применяются синтетичесщ
материалы для уплотнения разъемных соединений и для инь
целей (иногда даже для изготовления элементов конструкции
Основными требованиями, предъявляемыми ко всем эти
материалам, являются возможно низкое давление паров и ли
лое газовыделение при рабочей температуре. УплотнительнН
материалы, кроме того, должны обладать достаточной мехащ
ческой прочностью и малой пористостью.
Давление паров органических материалов (особенно замазо!
восков, цементов) прежде всего зависит от их состава, однай
важную роль играют также параметры процесса предварител!
ного обезгаживания эЗрих материалов (время, температура).
Для изготовления замазок, восков и цементов используют©
так называемые апиезоновые4) материалы, которые получаю
посредством молекулярной дистилляции производных от тяже
лых углеводородов (с добавкой натурального каучука, пчелй
ного воска, очищенного вазелина, пека и т. п.).
Вязкость и температура плавления апиезоновых материал©!
зависят от их состава. Температура плавления большинства за
мазок составляет ~320К, а восков — до 370 К; максимальна^
рабочая температура не превышает 310—320 К.
Силиконовые замазки (на основе кремнийорганических со
единений) выдерживают температуры от 230 до 470 К.
Пицеиновые воски используются для заливки неплотносте!
в неразъемных соединениях. Обычно это битуминозные мате
риалы (с добавлением каучука, шеллака, пчелиного воска, пе-
ка). Они хорошо смачивают стекло и металлы. Если они на-
кладываются при температуре 350—370 К, то их максималь-
ная рабочая температура составляет 310—330 К.
Цементы имеют более высокую температуру плавления и
эксплуатации; например, хлористое серебро плавится при тем-
пературе 730 К, а его максимальная рабочая температура со-
ставляет ~570К.
Аральдит (синтетическая эпоксидная смола) употребляется
в виде порошка, палочек или лака. Аральдит хорошо прили-
пает к стеклу и металлу. Для получения требуемых свойств он
подвергается полимеризации при температуре 450 К (2 ч) и
510 К (Ю мин). Температура плавления аральдита составляет
390 К.
Глипталь представляет собой вязкую алкидную смолу (гли-
церин, обработанный фталевой кислотой), которая по истече-
*) От греческого «пиезо» — давлю, апиезоновый — без давления.
ВАКУУМНАЯ АППАРАТУРА
485
8 ч при нормальной температуре затвердевает. Глипталь
нИИтВОряется в ацетоне и разбавляется ксилолом.
РаСдля покрытия поверхности стенок, газонепроницаемостько-
ух вызывает сомнение, применяются специальные лаки, на-
поимер глипталевый.
F В табл. 6 3 сопоставлены некоторые данные (ориентировочные)
ряда замазок, восков, цементов и лаков, применяемых в области
Фиг. 6.6. Зависимость давления паров
некоторых замазок и восков от тем-
пературы.
В зависимости от степени обезгаживания
материала давление паров может измениться
на два порядка, как это показано при по
мощи заштрихованных областей
Фиг. 6.7. Зависимость удельного по-
тока десорбции /Ьдес с поверхности
некоторых эластомерных материалов
при 298 К от времени (по Геллеру,
1958 г.).
/ — синтетический каучук (---— плоская
прокладка,---круглая прокладка), 2—пер-
бунан, 3—аральдит, полиуретан, 4—тефлон;
5—гостефлон-
умеренно высокого вакуума, а на фиг. 6.6 приведена зависимость
Давления паров замазок и восков (мастик) от температуры.
Синтетические материалы (пластики, эластомеры) также
применяются в установках умеренно высокого вакуума. Они не-
чувствительны к воде, кислотам, основаниям, но растворяются
в некоторых органических жидкостях.
Для уплотнения разъемных соединений часто применяются
синтетические каучуки (эластомеры). Эти высокомолекулярные
полимеры обладают способностью сильно деформироваться и
быстро принимать первоначальную форму после снятия нагруз-
ки Содержание пластификатора (смягчителя) не должно быть
Таблица 6.3
Некоторые данные (ориентировочные) замазок, восков, цементов и лаков
Температура, К Давление
Вид материала Применение плавления (размяг. чения) макси- мальная рабочая паров ') (при 298 К), Тор
Замазки Апиезоновые L 1 м 1 N } Leybold Т | Сельвацен (DisMUa- tion Products) Замазка Рамзая Силиконовые Воски Апиезоновые Мягкие (Q) Средние WIOO) Jbeybold Твердые w| Пииеиновые Цементы и лаки Аральдит Глипталь Хлористое серебро Хлористое серебро с хлористым таллием Цемент Хотинского Лак глипталевый Шлифы Краны Шлифы при высо- кой температуре Шлифы и краны при высокой темпера- туре Шлифы и краны Шлифы и краны, ред- ко- используемые Недостаточно при- шлифованные сое- динения Разные соединения Соединения, подвер- женные сотря- сениям Соединения жест- кие Недостаточю при- шлифованные сое- динения Соединения и уплот- нения Уплотнения Соединения и уплот- нения для высоких температур Соединения и уплот- нения Соединения Уплотнения неглад- ких поверхностей 310-320 400 310-320 315-325 330 310-350 370 (350) (390) 730 470-570 320-340 300 300 300 380 300 230-470 300 300-310 350 310-330 570 420 320 370 °1 А А ° °1 _ ° ° ° ° Г°1 °( °|°| L 1 ° SI°! L° °I ° ILL X -м со СП о о 00 *• О ** 05 О О О 1 11 1 III I L о. « ® ®
') Зависит в значительной мере от рода материала, процесса обезгаживания, вре
работы в вакууме и т. п. Указанные величины следует считать слишком оптимистическ
(взяты из каталогов).
ВАКУУМНАЯ АППАРАТУРА
48?
в них слишком большим. Некоторое применение находят и пла-
стики.
В табл. 6.4 перечислены наиболее важные эластомерные ма-
териалы и указаны их ориентировочные рабочие температуры,
а в табл. 6.5 приведены некоторые данные, характеризующие
вакуумные свойства уплотнений, изготовленных из этих мате-
риалов. Особого внимания благодаря своим хорошим вакуум-
ным свойствам заслуживает тефлон.
Таблица 6.4
Эластомерные каучуки
Род синтетического каучука Состав Название Рабочая темпе- ратура, К
Изобутиловый Сополимер изобути- лена с добавкой изо- прена Бутил, изопрен (бутадиен) 290-400
Бутадиен акрилонитри- ловый Бутадиеностироловый Фторполимерный Уретановый Сополимер бутадиена и акрилонитрила Сополимер стирола с разными мономе- рами Сополимер фторвини- лидена и гексахлор- пропилена Сополимер трифтор- хлорэтилена с фтор- винилиденом Политетрафторэтилен Сополимер цианидов со спиртами и Дру- гими добавками Пербунан’), бу- тапрен N Буна-S, Kep-S Кель-F, витон А и В, ВИТОЛ Флуоротен, фто- ропласт, госте- флон Тефлон 2) Десмодур, десмо- фен, адепрен 290-370 300—520
Хлоропреновый Полихлоропрен Хлоропрен, нео- прен 290-350
Силиконовый Сополимер диметил- дихлорсилана с триметилхлорсила- ном Силастик 3), сило- прен 320-520
Нечувствителен к бензину.
2) Обладает очень хорошими вакуумными свойствами. Нечувствителен к большинству
органических соединений и кислот. Выдерживает температуру до 520 К.
3) Чувствителен к углеводородам.
На фиг. 6.7 представлены характеристики удельной десорб-
ции некоторых эластомеров.
488
Глава 6
Таблица 6.5
Характеристики (ориентировочные) эластомерных уплотнений
Материал Натекание через 1 см длины уплот- нения при 298 К и 760 Тор посте 1 ч работы, Тор л-с”1 см”1 Газовыде тение после пребывания уплотняющей замазки в ваку^мз в течение 24 ч при 298 К, Тор-л-с”1 -см”2 Предельное давле- ние, потучаемае при данном уплот- нении в динами- ческой системе, Тор
Силиконовый кау- 40- 10-8 0,5- 10-8 2- 10“7
чук
Полиуретан 1 • 10-8 — •—
Витон А (14-2)- 10~8 2- 10"8 1 • ю*9
Бутиловый каучук (0,1 н-0,2) • 10-8 1 • 10-8 1 • 10~9
Неопрен — 5- I0"8 2- ИГ9
Тефлон — 3- ю-8 4- 10“э
Нитриловый кау- (0,1 4-2). (О-8
чук
Кель-F 1 • 10~8
Хлоропрен 0,1 • 10~8
Буна-N — — 4 • 10-9
Резина 4- 10~8 2 • 10—8 5- 10“9
Примечание. Покрытие уплотнений (прокладок) замазкой уменьшает натекание
газа; повышение температуры с 300 до 425 К увеличивает натекание на два порядка ве-
личины.
6.3. ПРОЧНЫЕ И ГЕРМЕТИЧНЫЕ НЕРАЗЪЕМНЫЕ
СОЕДИНЕНИЯ РАЗЛИЧНЫХ МАТЕРИАЛОВ
Когда применяются материалы с разными коэффициентами
теплового расширения, возникает проблема такого соединения
деталей из этих материалов, которое обеспечивало бы одно-
временно вакуумную плотность (герметичность) и механиче-
скую прочность. Прочность соединений должна приниматься во
внимание прежде всего в крупногабаритных вакуумных систе-
мах, где внешнее атмосферное давление создает большие на-
грузки. С учетом этого фактора часто выбирают определенную
форму деталей и толщину их стенок. С другой стороны, раз-
личие коэффициентов теплового расширения элементов уста-
новки требует специальных технологических и конструктивных
решений во избежание возникновения трещин в местах соеди-
нения под влиянием неизбежных значительных изменений тем-
ВАКУУМНАЯ АППАРАТУРА
489
пературы. Так, при обезгаживании вакуумной установки эле
менты ее нагреваются до высокой температуры, а при охлаж-
дении (например, в криогенных насосах) температура этих эле-
ментов становится близкой к абсолютному нулю.
Особую трудность представляет соединение стекла с метал-
лом ввиду большого различия в их коэффициентах теплового
расширения, а также ввиду плохой когезии стекла и металла,
что существенно влияет на герметичность и прочность соеди-
нения.
Фиг. 6.8. Типовые способы гибкого сварного соединения меди со стеклом.
Утонение стенок медной трубы обеспечивает гибкость соединения при сильно различаю-
щихся коэффициентах теплового расширения стекла и меди.
1 — стекло; 2—медь; 3 — твердое стекло (нонекс).
Например, для меди линейный коэффициент теплового рас-
ширения равен 17-10~6К-1, тогда как для стекол этот коэф-
фициент составляет (Зн-10) • 10~6 К-1. Вследствие такого боль-
шого различия коэффициентов при нагреве или охлаждении же-
сткого соединения, например толстостенной медной трубы с тон-
костенной стеклянной трубой, стекло бы лопнуло. Один из спо-
собов избежать этого состоит в значительном утонении стенок
медной трубы и соединении ее с толстостенной стеклянной тру-
бой (фиг. 6.8).
Напряжения, возникшие в зоне соединения при изменении
температуры, воспринимаются медной трубой, которая упруго
деформируется, не разрушая стеклянной трубы. Другая важ-
ная проблема состоит в том, как улучшить когезию металла со
стеклом, так как от этого зависит герметичность соединения.
Для этого конец медной трубы подвергают окислению, чтобы
стекло сплавилось с окисью меди, и, таким образом, возник пе-
реходный слой. Такой переходный слой, состоящий из стекла и
окиси меди, хорошо сваривается со стеклянной трубой и окис-
ленным концом медной трубьр
490
ГЛАВА 6
Другой широко применяемый способ соединения металла со
стеклом (фиг. 6.9, а) и керамикой (фиг. 6.9,6) состоит в приме-
нении промежуточного элемента из сплава, линейный коэфф,]
циент теплового расширения которого соответствует применяе-
мому сорту стекла (или керамики). Чаще всего это сплав
в состав которого входят железо, никель, хром, кобальт
и т. д.
Фиг. 6.9. Соединение труб.
а—металлической и стеклянной с помощью промежуточного элемента из сплава, коэффи-
циент теплового расширения которого соответствует стеклу; б—металлической (запрессо-
ванной под давлением) и керамической посредством сварки специальным стеклом.
/—металл; 2— стекло; 3— сплав с коэффициентом теплового расширения, соответствую-
щим стеклу; 4—твердый припой; 5 — керамика; 6— специальное стекло.
В табл. 6.6 приведены составы некоторых сплавов, приме-
няемых для спайки металлов со стеклами и керамикой, а также
линейные коэффициенты теплового расширения некоторых ме-
таллов.
Каждому сорту стекла или керамики соответствует опреде-
ленный сплав в отношении когезии и коэффициента расшире-
ния (в определенном диапазоне температур).
При необходимости впайки в стекло проводников неболь-
шого диаметра применяют проволоку из молибдена или воль-
фрама, которые совместимы с некоторыми сортами стекол
(молибденовыми или вольфрамовыми). Так, например, для соеди-
нения твердого стекла, обладающего коэффициентом теплового
расширения 4-10“6 К*"1, с молибденом (имеющим такой же ко-
эффициент расширения), поверхность молибденовой проволоки
сильно окисляется, затем покрывается тонким слоем соответ-
ствующего твердого стекла и прогревается, пока окись молиб-
дена не сварится со стеклом. Получившийся при этом проме-
жуточный слой хорошо соединяется со стеклом и металлом, оо-
разуя соединение молибден — стекло.
Таблица 6.6
Характеристики некоторых сплавов, применяемых для спайки металлов
со стеклом (процентный состав, а также линейный коэффициент
теплового расширения, 10-6 К-1)
^---^Составляющие Сплав Fe Ni Со Сг Другие а (300-400 К)
FeNiCoCr 37-54 47-30 20-25 6-26 9-11
FeNiCo 38 40 20 — — 10
Ковар(фернико)I ~54 29 17 — Мп ~ 0,3 4,5-5
Вакон 49—54 28 18-23 — —
Ковар III 42 20 38 — — 9
FeNiCr 47-52 47-42 — 6 9-9,5
Нержавеющая 72—73 8—10 18—19 С < 0,1, 16
хромоникелевая Si <0,5,
сталь (Мп ~ 0,4)
Сивар 53 29 — 18 4-5
FeCr (хромистое железо, хроми- стая сталь) 75—70 — — 25-30 С <0,2 11-12
FeNi (никелевое 52 48 (1) 8,5-10
железо)
NiCr 2,5 76,5 12,6 21 — 14,5
Конель 7,5 71 18,5 — Ti ~ 3 11
Нихром — 80 — 20 — 14
FeNi (вакодил) 56-58 42—44 — — — 6
WNiCo Омедненная про- — 16 4 — W ~ 80 6-8
волока
сердечник 58 42 .— Радиальный
8-10
покрытие — — 25 вес. % Осевой
Си 6-8
Платина 9-9,5
Медь 16-17
Вол ,фрам 4,5
Молибден 5,5-5,8
Тантал 6,5
492
ГЛАВЛ в
6.4. вакуумпроводы
Трубопроводы. Вакуумпроводы должны быть по возможно-
сти короткими, прямыми и большого сечения. В качестве ва-
куумпроводов применяются не очень длинные стеклянные труб-
ки небольшого диаметра (до нескольких десятков миллимет-
ров). Если вакуумная система подвержена перемещениям или
сотрясениям, то трубопроводы должны быть гибкими или иметь
гибкие элементы (например, сильфоны).
Металлические вакуумные трубопроводы чаще всего бывают
цилиндрическими. Если обычные неразъемные (сварные) со-
единения неприемлемы, то применяются фланцевые соединения
Фиг. 6.10. Арматура вакуумных трубопроводов,
а—уголок (колено); б —тройник.
с различными уплотнениями. Вид соединений и уплотнений
выбирается в зависимости от назначения трубопровода и харак-
тера возможных неисправностей. Особыми элементами трубо-
проводов являются колена, разветвления (фиг. 6.10) и пере-
ходники, служащие для соединения трубопроводов различных
диаметров (фиг. 6.11) или трубопроводов из различных мате-
риалов (фиг. 6.12).
Гибкие соединения. В тех случаях, когда соединения раз-
личных элементов вакуумной установки должны быть гибкими,
а условия вакуума не позволяют применять резину, исполь-
зуются сильфоны, выполненные из латуни или, еще лучше, из
нержавеющей стали толщиной ~0,15 мм (фиг. 6.13). Соедине-
ния сильфонного типа применяются также для передачи вра-
щательного движения извне внутрь вакуумной системы, в кла-
панах и т. п. В вакуумной технике применяются сильфоны диа-
метром от 10 до 200 мм. Они допускают большие линейные
перемещения, а максимальный угол изгиба зависит от диаметра
сильфона. Например, при диаметре сильфона D 30 мм угловое
отклонение может достигать 120° при радиусе изгиба 50 мм. .
ВАКУУМНАЯ АППАРАТУРА
493
Латунные сильфоны припаиваются к трубопроводам твер-
дыми припоями, а остальные — посредством электронно-луче-
вой или дуговой сварки в атмосфере аргона или гелия.
Фнг. 6.11. Переходник для соедине-
ния труб с различными диаметрами.
Фнг. 6.12. Переходный патрубок
стекло—металл.
1 — стекло; 2—металл.
Наконец, находят применение сильфоны из твердого стекла
(например, пирексового) диаметром ~15 мм, длиной ~ 150 мм
Фиг. 6.13. Сильфоны.
а—катаный, б— сварной; в — изготовленный из твердого стекла (для небольших дефор-
маций}.
(фиг. 6.13,в). Они используются в качестве компенсационных
элементов в стеклянных или стеклометаллических высоковаку-
умных установках небольшого объема.
6.5. РАЗЪЕМНЫЕ СОЕДИНЕНИЯ
Разъемные соединения служат для доступа внутрь установ-
ки, а также быстрого и легкого соединения отдельных элемен-
тов и узлов установок. Основным требованием к ним является
герметичность соединения. В зависимости от условий примене-
ния существуют различные конструкции разъемных соединений.
По типу уплотнения разъемные соединения разделяются на
уплотняемые смазкой и эластичными прокладками. Уплотнение
при помощи смазки (вакуумной, с низким давлением паров)
494
ГЛАВА 6
применяется в шлифах. Оно пригодно для температур, мало
превышающих комнатную, и в области не очень высокого ва*
куума. Такие соединения, выполняемые из стекла или металла/
могут иметь плоскую, сферическую или коническую форму
(фиг. 6.14).
Соединение с эластичной прокладкой представлено на
фиг. 6.15. Его основными элементами являются фланцы с ка-
навкой, в которую закладывается эластичная прокладка. Флан-
цы стягиваются болтами. Прокладки могут употребляться мно-
гократно.
В соединениях, работающих при умеренно высоких темпе-
ратурах (400—500 К) и не очень высоком вакууме, применяются
прокладки из органических материалов. Чаще всего это пласт-
массы, легко деформируемые и восстанавливающие свою фор-
му после снятия нагрузки, а также выделяющие мало газов и
паров (табл. 6 4 и 6.5). Чаще всего используются уплотни-»
тельные прокладки кольцеобразной формы диаметром от 10 до
1000—2000 мм. Они имеют обычно круговое (диаметром 2—
20 мм), иногда прямоугольное или трапециевидное поперечное
сечение (фиг. 6.16).
Максимальная рабочая температура эластомерных прокла-
док не превышает 370 К (пербунан). Для некоторых специаль-
ных материалов (например, для витилана) допускается тем-
пература 470 К.
Для быстрого соединения фланцев вместо обычных болтов
иногда применяется съемное ярмо клинообразного профиля,
стягивающее оба фланца (фиг. 6.17), а также поворотные вин-
ты с захватами (фиг. 6.18) и прижимы фланцев (фиг. 6.19).
В условиях высокого вакуума, где нельзя применять орга-
нические вещества, так как аппаратуру необходимо прогревать
до высокой температуры (например, до 700 К и выше) приме-
няются металлические уплотнительные прокладки (медные,
алюминиевые, золотые). В таких случаях используются спе-
циальные фланцы (фиг. 6.20). На фиг. 6.21 показаны пример-
ные размеры медной прокладки, помещаемой между двумя
кольцевыми остриями фланцев вакуумно-плотного соединения.
В связи с тем что для деформации пластмассовых прокла-
док достаточна относительно небольшая нагрузка, а соприкбс-
новение их с фланцами происходит на довольно большой по-
верхности, число зажимных болтов по окружности фланца
обычно невелико. Металлические уплотнения требуют гораздо
более сильного стягивания фланцев, в связи с чем число болтов
в них значительно больше.
На фиг 6.22 представлено соединение с уплотнением из алю-
миниевой фольги толщиной 20 мкм. Фольга 1 сжимается с одног
стороны плоской поверхностью фланца, а с другой — острием
фиг. 6.14. Шлифовые соединения (стеклянные или металлические).
я—плоское б—сферическое, в —коническое. Между пришлифованными поверхностями
° ’ имеется слой смазки.
Фиг. 6.16. Эластическая кольцевая
прокладка с круглым (прямоугольным
или трапециевидным) поперечным
сечением.
Фиг. 6.15. Фланцевое соединение,
/—прокладка, 2—центрирующее кольцо
Фиг. 6.17. Ярмо с клиновидным быстроразъемным зажимом (фирма Leybold).
Фиг. 6.18. Соединение фланцев при помощи
винтов с захватами.
а —соединение в сборе, б —винт.
Фиг. 6.19. Соединение фланце
при помощи прижимных нгкл;
док.
Фиг. 6.20. Специальные фланцевые соединения с медными прокладками,
а—прокладка, работающая на срез, б—прокладка, сжимаемая остриями с двух сторон;
е —прокладка с выступами, сжимаемая плоскими поверхностями; е—соединение типа
conflat
Фиг. 6.22. Соединение с уплотнением
из тонкой алюминиевой фольги.
1 — алюминиевая прокладка, 2— центрирую-
щие пружины, з — кольцо с заостренными
выступами.
Фиг. 6.21. Медная прокладка между
двумя кольцевыми Остриями фланцев,
/—сталь, 2—медь.
ВАКУУМНАЯ АППАРАТУРА
497
ольцевого вкладыша 3, причем пружины 2 центрируют вкла-
яЫШ, фольгу и фланцы. Стягивание фланцев осуществляется с
помощью зажимных винтов специальной формы, устанавливае-
мых на краях фланцев. Такие соединения могут иметь диаметр
несколько десятков сантиметров.
Металлические уплотнения в принципе заменяются после
однократного применения; однако иногда, если соединение не
прогревалось, их можно употреблять и два раза.
н На фиг. 6.23 показано соединение с прокладкой из золотой
проволоки, центрированной с помощью втулки, вставленной
Фиг. 6.23. Соединение с прокладкой
из золотой проволоки, центрирован-
ной при помощи втулки.
/ — центрирующая втулка, 2 — золотая про-
кладка, 3, 4— фланцы.
Фиг. 6.24. Уплотнение торца трубы
при помощи заглушки и золотой про-
кладки.
1 — золотая прокладка, 2—стальная за-
глушка; 3—труба из хромоникелевой стали
внутрь соединяемых труб в том месте, где сходятся фланцы.
Диаметр золотой проволоки составляет ~ 0,5 мм. Для соедине-
ния труб диаметром 150 мм нужны фланцы диаметром ~ 190 мм
с 20 зажимными винтами, равномерно расположенными по ок-
ружности. Способ уплотнения торца трубы при помощи за-
глушки и золотой прокладки (или прокладки из сплава золота
с серебром) иллюстрирует фиг. 6 24.
Применяя соединения с острием, необходимо учитывать, что
при тепловых деформациях фланцев (например, вследствие на-
грева или сильного охлаждения) может произойти срезывание
уплотнительной прокладки. Прокладка должна по возможности
находиться в канавке (так, чтобы металл не мог течь), как это
сделано в соединении типа conflat (фиг. 6.25).
В термогерметичных соединениях уплотнительная прокладка
помещается между поверхностями, которые прижимаются по
окружности с помощью радиальных сил, возникающих при
498
ГЛАВА 6
охлаждении предварительно нагретой трубы. Одна из соединяй
мых труб — гладкая или снабжена кольцевым острием, дру3
гая — гладкая и выполнена из металла более мягкого, чем пер,
вая. Примеры такого соединения двух труб и герметизации тора
ца трубы показаны на фиг. 6.26. Для соединения двух Tpyj|
(например, из нержавеющей стали с коэффициентом линейногс
расширения а = 16-10-8 К-1) на их установленные встык кощ
цы, снабженные острыми закраинами, надевается нагретая до
470—500 К муфта из мягкого металла (например, из меди с
Фиг. 6.25. Разъемное соединение типа
conflat.
Медная прокладка, зажатая несимметрично
заостренными кольцевыми выступами, за-
полняет ограниченное пространство, что
предотвращает течение медн.
Фиг. 6.26. Термогерметичные соеди-
нения двух труб (а) и трубы с за-
глушкой (б) (по Грошковскому и
Пытковскому, 1969 г.).
/—нержавеющая сталь; 2—медь.
а = 16-10~6 К-1). Внутренний диаметр муфты в нагретом со-
стоянии на несколько десятых долей миллиметра меньше внеш-
него диаметра закраин. После охлаждения острия врезаются в
медь и создают герметичное соединение. Для разъединения труб
узел соединения нагревают и трубы извлекают из муфты. При
одновременном изменении температуры всего соединения даже
в широком диапазоне герметичность соединения не нарушается,
так как коэффициенты теплового расширения стали и меди при-
мерно одинаковы.
Достоинством термогерметичного соединения в сравнении с
обычным фланцевым является отсутствие в нем больших мо-
ментов внешних сил, которые появляются во фланцевых соеди-
нениях при затягивании винтов на фланцах, тогда как силы в
термогерметичном соединении действуют в радиальном направ-
лении и тем самым взаимно компенсируются.
6.6. КЛАПАНЫ И КРАНЫ
6.6.1. Клапаны
Клапаны служат для управления потоком газа между раз-
личными участками вакуумной системы. Клапан в закрытом со-
стоянии должен быть герметичным, а в открытом состоянии об-
ладать возможно большей проводимостью.
ВАКУУМНАЯ АППАРАТУРА
49g
Клапан в принципе состоит из двух элементов: неподвиж-
ного (корпуса) и подвижного (заслонки), который закрывает и
открывает проходное сечение. Если подвижный элемент управ-
ляется извне, где существует атмосферное давление, то он
должен быть снабжен устройством для передачи движения в ва-
куумную полость и соответствующим образом уплотнен. Обыч-
но применяется уплотнение прижимное (фиг. 6.27) или силь-
фонное (фиг. 6.28). Последнее обеспечивает полную герметич-
ность.
Фиг. 6.27. Клапан с тарелью, прижи-
маемой при помощи винта.
/ — маховичок; 2— уплотнение; 3—про-
кладка; 4—верхний фланец; 5— тарель;
нижний фланец; 7—уплотнительная про-
кладка тарели.
Фиг. 6.28. Клапан с сильфонным уплот-
нением.
Для изоляции друг от друга отдельных объемов вакуумной
системы используются приспособления, подобные тем, которые
применяются при соединении труб, т. е. эластичные (в вакууме
выше IO’8 Тор) и (реже) металлические уплотнения (при дав-
лениях ниже Ю'8 Тор). Последние требуют сильного прижима,
а поэтому непригодны для отверстий большого диаметра.
В случае трубопроводов большого сечения находят приме-
нение заслоночные клапаны (фиг. 6.29), в которых заслонка
перемещается перпендикулярно оси трубопровода; когда кла-
пан открывается, заслонка убирается в плоскую камеру. При
закрытии клапана заслонка, снабженная кольцевой эластич-
ной прокладкой, прижимается к кольцевому уплотнительному
выступу (седлу) корпуса клапана.
500
ГЛАВА 6
Перемещение подвижного элемента клапана может произвс
диться от руки (маховиком или рычагом — такой клапан час'!
называют вентилем), с помощью электромагнита, пневмопра
вода, гидропривода и т. п.
Заслонка клапана, установленного в диффузионном насосу
одновременно может служить и отражателем пара (фиг. 6.30)
В таких насосах диаметр проходного сечения клапана можв!
составлять 10—200 мм, что соответствует расходам от нескол^
ких литров в секунду до 20 000 л-с-1. Для закрытого клапащ
Фиг. 6.29. Заслоночный клапан.
После закрытия отверстия заслонка прижимается с помощью рычагов.
I, 2—рычаги, 3 —заслонка.
диаметром, например, 15 см с эластомерным кольцевым уплот-
нением натекание составляет ~5- 10"7л-с-1. Для клапана с ме-
таллическим уплотнением и острой посадочной кромкой натека-
ние может быть очень малым (~10~14 л-с-1).
Радиальные термоупругие еилы можно использовать для
уплотнения диска, закрывающего большое проходное сечение
трубопровода. Принцип устройства и действия такого клапана
(затвора) ясны из фиг. 6.31. В цилиндрическом трубопроводе,
снабженном внутренним заостренным кольцевым выступом из
твердого металла, находится диск из более мягкого металла,
который перемещается с помощью рычага (оба металла имеют
примерно одинаковые коэффициенты теплового расширения).
Для открытия затвора нагревается часть трубопровода с уплот-
нительным кольцевым выступом, диаметр его увеличивается;
после этого заслонка свободно поднимается (и устанавливает-
ВАКУУМНАЯ АППАРАТУРА
501
сЯ в положение, параллельное оси трубы). Рычаг уплотнен
сильфонным устройством. При равномерном нагреве всего агре-
гата герметичность закрытого клапана сохраняется.
Фиг. 6.30. Клапан с заслонкой, кото-
рая одновременно служит отража-
телем в насосе.
Фиг. 6.31. Затвор с термогерметич-
ным уплотнением крышки (по Грош-
ковскому и Пытковскому, 1969 г.).
1 — рычаг, уплотненный сильфоном, 2—за*
слойка, -медное покрытие, 4—подогрева»
тель; 5—стержеиь, поворачивающий за*
слойку при ее подъеме, 6—-ось поворота
рычага.
Если клапаны снабжены металлическими уплотнительными
прокладками, то их можно нагревать до 720 К в открытом по-
ложении и до 570 К — в закрытом. Более низкая допустимая
Фиг. 6.32. Клапан для умеренно высо-
кого вакуума с мембранным уплотне-
нием (фирма Leybold).
температура закрытого клапана связана с возможностью де-
формации уплотнительной прокладки или ее спекания. Допу-
стимая температура прогрева пластмассовых прокладок ниже
указанных температур для металлических прокладок.
На фиг. 6.32 показан клапан простой конструкции с мемб-
раной из эластомера (силикона, витона или другого подобного
502
ГЛАВА 6
материала), которая работает аналогично заслонке; она зажа-
та по окружности, а в средней части перемещается вверх или
вниз при помощи винта. Клапан пригоден для умеренно высо-
кого вакуума. Очевидно, что максимальная температура нагре-
ва такого клапана зависит от рода материала, из которого из-
готовлена мембрана.
В области очень высокого вакуума применяются цельноме-
таллические клапаны, обычно с уплотнением по заостренному
Фиг. 6.33. Конусный клапан с мембранным уплотнением для очень высокого
вакуума.
а—разрез; б—внешний вид клапана конструкции Варшавского института промышленной
электроники.
кольцевому выступу. Конструктивные трудности возрастают по
мере увеличения диаметра трубопровода, так как при этом воз-
растают силы, необходимые для обеспечения герметичного
контакта рабочих поверхностей. При сверхвысоком вакууме в
небольших приборах применяют металлические клапаны
(фиг. 6.33), в которых уплотнение осуществляется с помощью
90°-ного конуса из ковара, который вдавливается в отверстие
медной шайбы. Конус соединен с упругой мембраной из ковара
и вместе с ней отводится от медной шайбы посредством про-
стого винтового механизма (ход винта ~2,5 мм). Все паяные
соединения выполняются при помощи серебряно-медного при-
поя в водородной печи без применения каких-либо паяльных
паст, благодаря чему клапан после пайки не нуждается в очи-
стке.
На фиг. 6.34,а показан простой стеклянный бессмазочный
клапан для высокого вакуума, применяемый в тех случаях, ко-
ВАКУУМНАЯ АППАРАТУРА
503
гда к герметичности разделения объемов предъявляются не
очень жесткие требования. Стальной шарик (или стеклянный с
заплавленным внутри порошком железа) при помощи магнита
помещается в горловине трубки 1 с притертыми стенками или
в полости 2. На фиг. 6.34,6 представлен другой клапан (коло-
колообразного типа), приводимый в действие электромагнитом
Фиг. 6.34. Бессмазочные стеклянные кла-
паны.
а—шариковый, приводимый в действие магничэм
(вручную); б — колоколообразного типа, приводимый
в действие электромагнитом (автоматически) или
обычным магнитом (вручную).
1—горловина; 2—полость для шарика; 3—стер-
жень; 4—железный сердечник; 5—петля для опоры
стержня после открытия клапана.
Фиг. 6.35. Стеклянный кла-
пан с индиевым уплотне-
нием.
/ — колокол; 2, 4 —обмотки элек-
тромагнитов; 3—ванночка с ин-
дием; 5—железный сердечник,
или (от руки) постоянным магнитом. После подъема колокола
стержень 3 с сердечником 4 опирается на петлю 5.
На фиг. 6.35 показан стеклянный клапан с индиевым уплот-
нением. Индий в полости 3 нагревается до 300—320 К, после
чего стопорный стержень с сердечником 5 отводится в сторону
электромагнитом 4; колокол 1 освобождается, и электромаг-
нит 2 отпускает его. Колокол своим торцом попадает в расплав
индия, и после его затвердевания надежно закрывает отверстие,
6.6.2. Краны
Краны применяются только в небольших (главным образом
стеклянных) установках в области умеренно высокого вакуума.
Причиной тому их относительно малая проводимость, а также
Фиг. 6.36. Стеклянные краны для соединения объема 1 с объемом 2 или 3.
Фиг. 6.37. Металлический запорный
кран.
Фиг. 6.33. Принцип устройства иголь-
чатого регулятора.
Фиг. 6.39. Зависимость расхода газа
через регулятор от положения иглы
(количества поворотов маховичка).
Фиг. 6.40. Регулятор с тефлоновым
сильфоном (фирма Leybold).
/— чгла. 2—сильфов,
ВАКУУМНАЯ АППАРАТУРА
505
необходимость применения смазки для уменьшения трения ме-
жду затвором крана и его корпусом и уплотнения зазора между
ними. Диаметр больших стеклянных кранов не превышает 20 мм.
Необходимым условием хорошей герметичности и надеж-
ной работы кранов является аккуратность их изготовления и
эксплуатации. Ввиду применения в кранах смазки их нельзя
прогревать, поэтому они непригодны для высокого вакуума.
На фиг. 6.36 для примера представлены краны двух различ-
ных конструкций, выполняющие одинаковые функции. На
фиг. 6.37 показан простой металлический кран.
6.6.3. Регуляторы
Клапаны с регулируемой проводимостью служат для управ-
ления газовым потоком и контроля за расходом газа, например,
при измерении скорости откачки. В вакуумной технике обычно
используются регуляторы с регулирующим органом в виде тон-
кой конической иглы, вводимой в канал соответствующей фор-
мы вплоть до полного его перекрытия (фиг. 6.38). Ход иглы
может изменяться непрерывно с помощью микрометрического
винта. В узле управления перемещением иглы применяются соот-
ветствующие уплотнения, а пространство высокого вакуума гер-
метизируется сильфоном (из металла или тефлона). Опреде-
ленную трудность представляет регулирование проводимости в
области минимальных расходов через регулятор. На фиг. 6.39
показан график зависимости расхода газа от положения махо-
вичка (количество поворотов п) для игольчатого регулятора,
применяемого в области очень высокого вакуума; на фиг. 6.40
представлен регулятор (с тефлоновым сильфоном) расхода газа
в пределах 10-4—100 Тор-л-сЛ Он допускает нагрев до 420 К.
В закрытом положении регулятор пропускает ~ 10~5 Тор-л-с-1.
6.7. ВСПОМОГАТЕЛЬНЫЕ ВАКУУМНЫЕ РЕЗЕРВУАРЫ
Кроме сосудов, в которых создается желаемое низкое дав-
ление, в вакуумных установках обычно имеются различные
вспомогательные емкости. К ним прежде всего относятся так
называемые форвакуумные резервуары, включаемые часто ме-
жду диффузионным насосом и ротационным масляным форва-
куумным насосом для того, чтобы иметь возможность, когда это
целесообразно, работать без форвакуумного^насоса (на резер-
вуар).
Такой вспомогательный вакуумный резервуар обычно пред-
ставляет собой герметичный металлический цилиндрический со-
суд, часто разборный (для чистки), объемом от десяти до не-
скольких десятков литров, снабженный патрубками с фланцами
508
ГЛАВА й
(фиг. 6.41). Резервуары небольшого объема выполняются
стекла, и на них надевается чехол из сетки для предохранений
от осколков в случае разрушения.
Фиг. 6.41. Вспомогательный вакуум-
ный резервуар.
Резервуар часто снабжается манометром для измерения фор-
вакуума, а иногда предохранительным устройством, включаю-
Ф ir. 6.42. Вакуумная камера с отвер-
стиями для установки различных
элементов.
Нижняя часть, охлаждаемая водой, позво
ляет применять пластмассовые прокладки.
Остальные прокладки металлические.
Фиг 6.43. Баллоны для чистых газов.
1, 2—трубки, .3—груз, 4-—коллектор;
5, в—краны, 7—изолируемый объем, 8— ре-
зервуар, содержащий 1—2 л инертного газа
при начальном давлении ~650 Тор.
щим форвакуумный насос, когда давление в резервуаре под-
нимается выше допустимого.
На фиг. 6.42 показана вакуумная камера для проведения ис-
следований или технологических процессов в высоком и очень
ВАКУУМНАЯ АППАРАТУРА
507
iCOj<om вакуумах. Она имеет ряд отверстий различного диа-
веГра с патрубками, позволяющими присоединять различные
Мгрегагы и приборы (например, насосы, вакуумметры, токовво-
j и т. д.). Натекание в такой камере может составлять не бо-
лее 10-9 Тор-л-с-1. Камера допускает прогрев до ~620 К.
В нижнем фланце, охлаждаемом водой, можно применить пласт-
массовое уплотнение. Другие уплотнения камеры металличе-
ские. Примерные размеры камеры: диаметр D 350 см, высота
/7 450 см.
6.8. РЕЗЕРВУАРЫ ДЛЯ ЧИСТЫХ ГАЗОВ
В вакуумной технике для различных целей (градуировки ва-
куумметров, отыскания течей, наполнения специальных прибо-
ров и т. п.) применяются чистые газы. Инертные, а также дру-
гие спектрально чистые газы 4) обычно поставляются в стеклян-
ных запаянных баллонах объемом 1—2 л под давлением 650 Тор.
Эти баллоны имеют специальную конструкцию, которая позво-
ляет использовать газ, не опасаясь загрязнения его воздухом.
Одно из конструктивных решений показано на фиг. 6.43. Бал-
лон с газом оканчивается тонкой запаянной трубкой /, которая
находится внутри более широкой трубки 2 (фиг. 6.43,а). В труб-
ку 2 вкладывается цилиндрический железный груз <3, и труб-
ка припаивается к коллектору 4, снабженному двумя крана-
ми 5 и 6 (фиг. 6.43,6). Другой конец коллектора 4 припаивает-
ся к вакуумной установке. Краны 5 и 6 открываются, и про-
странство между запаянным баллоном и краном 6 откачивается
и обезгаживается, после чего краны закрываются. Затем с по-
мощью магнита груз 3 поднимается на высоту 2—3 см над труб-
кой 1, после чего магнит удаляется (или выключается ток, пи-
тающий электромагнит). Груз падает и разбивает запаянный
конец трубки 1, в результате чего резервуар соединяется с объ-
емом 7, отделенным краном 5 от объема коллектора 4. Откры-
вая кран 5, впускают в коллектор определенную порцию газа.
Затем кран 5 закрывают и открывают кран 6, и порция газа
впускается в установку. Повторяя описанную операцию, можно
получить в установке желаемое давление газа определенного
состава. Поскольку газ впускается порциями, его избыток (если
он возникает) откачивается. Очевидно, что краны 5 и 6 никогда
не должны быть открыты одновременно.
Газы технической чистоты поставляются в стальных балло-
нах при высоком Давлении. Поэтому их отбор из баллона
не составляет трудностей. Технические газы можно очистить
') Газы так называемой технической чистоты содержат примеси других
газов в пределах 0,5—1% Спектрально чистые газы имеют значительно мень-
ше загрязнений Обычно каждый газ содержит свойственные ему примеси.
508
ГЛАВА 6
в значительной степени химическим путем или пропусканий!
через фильтры или поглотители.
Для градуировки вакуумметров, масс-спектрометров и т. п.
а также для измерения натекания газа или для других целей
применяются калиброванные источники чистых газов. Такие со-
суды (металлические или стеклянные) имеют объем ~0,5 л tl
наполняются газом под давлением 1—2 атм. Они снабжаются
капиллярным каналом или пористой перегородкой. Проводи-
мость канала или перегородки подбирается таким образом, что-’
бы при данном давлении газа в резервуаре получить опреде-
ленный (с точностью ±10%) поток газа в пределах 10~4-—
10~9 Тор-л-с-1. Из таких резервуаров можно черпать газ в те-
чение нескольких лет.
6.9. СУШИЛКИ
Присутствие водяных паров в вакуумных приборах крайне
нежелательно, а их удаление является трудоемким процессом,
так как требует прогревания установки и длительной откачки^
В случае когда затруднительно или вообще невозможно про-
греть установку до или во время откачки (а вымораживание
жидким азотом не применяется), водяной пар может быть уда- ,
лен с помощью осушающих веществ. Эти вещества обычно по-
мещают в так называемые сушилки, т. е. небольшие сосуды,
легко отделяемые от установки с целью замены осушающих ве-
ществ свежими. Обычно в сушилках используется пятиокись
фосфора Р2О5 (ангидрид фосфорной кислоты), которая связы-
вает водяные пары, образуя (в результате реакции с ними) фос-
форную кислоту:
Р2О5 + ЗН2О == 2Н3РО3.
В присутствии чистой пятиокиси фосфора упругость водяных
паров при комнатной температуре составляет ~10~s Тор. Для
более сильного понижения упругости водяных паров в системе
приходится применять ловушку, охлаждаемую жидким азотом.
На фиг. 6 44 представлены схемы металлической и стеклян-
ной сушилок1). Поскольку сушилки обычно помещаются в об-
ласти форвакуума, они могут уплотняться замазками или эла-
стомерными прокладками.
Для осушения вакуума применяется также кремниевый гель
с добавкой красящих солей кобальта. Такой гель изменяет свой
’) При очистке сушилки от остатков осушающих веществ надо иметь в
виду, что фосфорный ангидрид Р2О5 интенсивно реагирует с водой, при этом
температура его сильно возрастает Поэтому Р2О5 следует хранить в гермети-
ческих сосудах с притертыми пробками, залитыми парафином Свежий фос-
форный ангидрид Р2О5 имеет белый цвет, использованный — бронзово жел-
тый
Фиг. 6.44. Сушилки с Р2О5.
а—металлическая; 6—стеклянная,
/—труба, 2—свинцовая ванночка с PSO₽, 3—’Стеклянная колба с Р>05, 4—крышка, 5— уп-
лотняющая замазка.
Фиг. 6.45 Сушилка со смотровым окном для наблюдения за состоянием
осушающего вещества.
I— уплотнительная прокладка, 2—ванночка с P2OS, з— смотровое окно.
Фиг. 6.46. Смотровые окна в металлическом корпусе.
a — стеклянное, б—сапфировое
/ — стекло, 2 —металл (сплар), 3—’специальное стекло, 4— сапфир^
510
ГЛАВА 6
цвет (от голубого до красного) по мере поглощения воды. Г]
еле нагревания до 490 К вода выделяется и масса опять пригс
на к употреблению Кремниевый гель менее эффективен, ч<
РгО5, так как давление водяных паров над ним составляет
меньше 10~2 Тор.
На фиг. 6.45 представлена сушилка, снабженная смотровь
окном для наблюдения за состоянием поглотителя влаги.
6.10. СМОТРОВЫЕ ОКНА
Смотровые окна служат для наблюдения за устройствам
установленными внутри вакуумной установки, а также для а
вещения или облучения устройств установки. Смотровые окн
изготовляются из материалов, оптически прозрачных в соотве'
ствующих участках спектра. На фиг. 6.46 показаны смотровь
окна двух типов — стеклянное и сапфировое (диаметром 25-
150 мм). Их можно применять в широком диапазоне темперг
тур (от абсолютного нуля до <~720 К). Для сохранения проз
рачности смотровых стекол предусматриваются экраны, при
крывающие их изнутри при некоторых операциях (например
во время напыления), или устройства для их механической очи
стки. Характеристики некоторых материалов, используемыхдл|
изготовления смотровых окон, приведены в табл. 6.7.
Таблица 6.,
Характеристики материалов для смотровых стекол
Металл корпуса окна Стекло Длина волны пропускаемого излучения, нм Рабочая температура. К
Ковар Сгекло 7056 — —
Нержавеющая
сталь | Пирекс 7740 300-3000 220-700
Медь
Ковар Сапфир 2000-5000 0-720
6.11. ВВОД ПРОВОДОВ
Ввод проводов для слабых токов (фиг. 6.47) осуществляется
путем вплавления проволок небольшого диаметра непосред-
ственно в стеклянную стенку вакуумного прибора (которой В
этом месте придается соответствующая форма) или в стеклян-
ную бусинку, вплавленную в отверстие металлической стенки
прибора (фиг. 6.47, а и б соответственно). Металлы и стекло
ВАКУУМНАЯ АППАРАТУРА
5Н
лжны обладать хорошей когезией и примерно одинаковыми
коэффициентами теплового расширения.
к Вводы в случае сильных токов осуществляются с помощью
паев металл — стекло (фиг. 6.48) или металл — керамика
Фиг. 6.47. Вводы проводов для слабых токов.
а—медная луженая или платинитовая проволока в стеклянной стенке; б—провод со
стеклянной бусинкой в металлической стенке.
/-стекло, 2—медь; 3— никель; 4— медная луженая (или платинитовая) проволока; 5—хро-
мистое железо или иной сплав; 6— сталь, 7 —молибден; S—таердое стекло (молибденовое);
9—ковар.
(фиг. 6.49), подобных тем, котррые применяются для соедине-
ния трубопроводов.
Фиг. 6.48. Ввод провода для сильных
токов через стеклянную трубу,
провод, 2—стекло; 3— чашка из ковара;
4— припой.
Фиг. 6.49. Керамический ввод в метал-
лической стенке для сильных токов,
/—провод; 2—*спай металл —керамика»
5—керамическая втулка, 4— стенка ваку-
умюго прибора; 5 - электрод.
На фиг. 6.50 показан ввод проводника с керамической изо-
ляцией на ток до 150 А и напряжение до 3 кВ (допускающий
нагрев 700 К) в исполнении Варшавского института промыш*
электроники. Течь в таком соединении не превышает
1и° Тор-л-с'1.
512
ГЛАВА 6
6.12. ПЕРЕДАЧА ДВИЖЕНИЯ В ОБЛАСТЬ ВЫСОКОГО ВАКУУМА
Часто бывает необходимо передать снаружи движение раз-
личным механизмам, которые работают в высоком вакууме, где
невозможно или затруднительно поместить электродвигатель с
обмотками (ввиду невозможности его дегазирования). В уста-
новках не очень высокого вакуума можно применять сальнико-
вое уплотнение вала привода (фиг. 6.51), причем в этом случае
тефлон предпочтительнее резины. Для передачи поступательно-
го или вращательного движения в область высокого вакуума
Фиг. 6.50. Токоввод с керамической
изоляцией (Варшавский институт
промышленной электроники).
Корпус из корундовой керамики AI 19. по
К;1ыт коваром или вакоюм Провод из мзди
MOOV, натекание Тор’Л’С--’,
'макс”150*- иМакс=5кВ. «иэол=10,г Ом-
прогрев С 770 К.
Фиг. 6.51. Сальниковое уклонение
типа Вильсона для передачи враща-
тельного движения в вакуум.
/ — прокладки из синтетического материала;
2 —металлические шайбы.
пользуются сильфонами. На фиг. 6.52 показана схема передачи
вращательного движения при помощи системы, защищенной
сильфоном, а на фиг. 6.53 — конструкция простого устройства
для передачи такого движения. Более сложное, но весьма эф-
фективное устройство показано на фиг. 6.54. Оно позволяет
передать момент до 0,5 Н-м со скоростью, не превышающей
50 об-мин-1. Устройство можно прогревать до -~720 К.
Часто применяются особые вакуумные электродвигатели, в
которых ротор, не имеющий обмоток, вращается в высоком ва-
кууме, тогда как статор, питаемый переменным током, находит-
ся вне вакуума и отделен от ротора герметичной немагнитной
оболочкой.
При использовании всех этих устройств надо иметь в виду,
что в высоком вакууме употребление замазок, содержащих ле-
тучие фракции, недопустимо, а пленка газа на соприкасающих-
ся поверхностях отсутствует, вследствие чего коэффициент тре-
Фиг. 6.52. Схема передачи вращательного движения при помощи шарнира
с сильфонным уплотнением.
/ — металлический сильфон; 2 —шаровой шарнир.
Высокий вакуум слева от стенки.
Фиг. 6.53. Простое устройство для
передачи вращательного движения
в вакууме с использованием силь-
фонного уплотнения.
Фиг. 6.54. Устройство для передачи вра-
щательного движения с использованием
сильфонного уплотнения (Torvac, Ltd.,
Великобритания).
Максимальный вращающий момент двигателя
0,5 Н-м, максимальная скорость 50 об-мин~*,
температура прогрева 720 К (нержавеющая
сталь).
514
ГЛАВА 6
ния значительно возрастает (сухое трение). Например, коэффи-
циент трения меди о медь, латуни о латунь в вакууме возра-
стает в 2 раза; в случае трения нержавеющей стали о нержа-
веющую сталь, нержавеющей стали о бронзу, серебра о сереб-
ро—почти в 3 раза (однако коэффициент трения для системы
алюминий—-алюминий даже при большом прижатии не изме-
няется) .
Для уменьшения трения применяются порошковые смазки:
сульфиды и селениды молибдена или вольфрама, иодиды кад-
мия, висмута, порошковый графит. Коэффициенты трения пере-
численных выше металлических пар, составляющие 0,2—0,5, по-
сле применения порошковых смазок уменьшаются до 0,1 и даже
до 0,02 для сульфатов и селенатов.
6.13. ОБСЛУЖИВАНИЕ ВАКУУМНЫХ СИСТЕМ
Одним из важных условий получения и сохранения высокого
вакуума в вакуумных приборах является чистота соответствую-
щих поверхностей. Здесь действует принцип: чем чище все эле-
менты откачивающей системы (и вакуумного прибора) перед
монтажом, тем короче процесс откачки и тем более низкое дав-
ление в конечном счете будет получено.
В связи с этим материалы, предназначенные для примене-
ния в условиях вакуума, должны быть не только обезгажены,
но их поверхности перед помещением в вакуум должны быть
очищены и обезжирены путем травления, механической и элек-
тролитической полировки и т. п. Поверхности должны быть
гладкими и не должны иметь пор и трещин.
Обезжиривание осуществляется в соответствующих ваннах
химическими и физическими методами (в органических раствори-
телях: бензине, бензоле, эфире, четыреххлористом углероде ит. д.)
или электролитическими методами (в щелочных растворах).
Травление (заключающееся в удалении окислов и т. п.) про-
водится в химических ваннах при комнатной или повышенной
температуре или осуществляется электрохимическим путем.
Травление не должно быть слишком кратковременным.
Очистка осуществляется главным образом перед монтажом
вакуумных приборов, так как после монтажа она затруднитель-
на или просто невозможна, тем более что при очистке химиче-
скими методами следует иметь в виду, что различные загряз-
няющие вещества требуют различных очищающих средств. Так,
например, стекло сначала очищают щелочами, которые его
обезжиривают, затем хромовой кислотой (желательно горячей),
азотной кислотой или неконцентрированным раствором фтори-
стоводородной кислоты. Затем стекло следует очень тщатель-
но промыть обычной кипяченой водой и ополоснуть сначала ди-
ВАКУУМНАЯ АППАРАТУРА
515
стиллированной водой, а затем для ускорения сушки — спиртом
или эфиром.
Металлы очищаются различными реактивами, главным об-
разом кислотами. Лучшим способом их очистки является про-
калка в атмосфере водорода или в вакууме. Важность предва-
рительной очистки внутренних поверхностей вакуумного прибо-
ра снижается, если этот прибор можно во время откачки
нагреть до высокой температуры, при которой органические ве-
щества разлагаются или испаряются.
Хороший результат получается, если одновременно с обез-
жиривающими ваннами облучать поверхность звуковыми или
ультразвуковыми колебаниями. Это сокращает время и улуч-
шает очистку, особенно в случае поверхностей сложной формы.
В некоторых случаях вакуумные поверхности покрывают
(электролитическим путем) веществами, лучше сохраняющими
высокий вакуум. К очищенным поверхностям следует прика-
саться лишь руками в перчатках во избежание загрязнения жи-
ром и потом. Такие поверхности должны как можно меньше
времени находиться на воздухе. Небольшие вакуумные устрой-
ства должны храниться в специальных шкафах под понижен-
ным давлением в атмосфере, свободной от водяных паров.
7. Вакуумные
установки
7.0. ПРИМЕНЕНИЕ ВЫСОКОГО ВАКУУМА
В различных областях науки и техники в последнее врем!
все чаще используется высокий и сверхвысокий вакуум.
Вне области производства электронных вакуумных прибо
ров, где высокий вакуум является в некоторой степени основ'
ным «конструктивным» материалом (без которого вообще невоз1
можно производство этих приборов) и применяется уже боле<
полувека, новые направления развития науки и техники открылв
более широкое поле применения вакуума, особенно сверх*
высокого вакуума. Главным образом это связано с интенсивны-
ми исследованиями микромира — строения вещества — и макро-
мира— космоса. Для проведения исследований в первом
случае необходимо получить чрезвычайно чистую среду и мате-
риалы, свободные от следов загрязнений, в том числе газами,
а во втором — создать в лабораториях на Земле условия, по-
добные тем, какие существуют в космосе.
Для этих целей строятся разнообразные вакуумные установ-
ки, обеспечивающие возможность создания и сохранения в от-
качиваемых объемах необходимого низкого давления в течение
определенного времени. В вакуумных камерах (часто больших
размеров) проводят научные исследования и технические ис-
пытания. Из числа многих применений высокого вакуума ниже
рассматриваются лишь некоторые, наиболее интересные с точки
зрения вакуумной техники и технологии.
Следует отметить, что современные вакуумные установки
все в большей степени автоматизируются, причем это относится
как к их запуску, так и к проведению процессов, для которых ’
они предназначены. Разумеется, важнейшее значение имеет при
этом информация, получаемая от манометров, подсоединенных
к различным точкам вакуумной установки. На основании пока-
заний манометров управляют клапанами, выключателями элек-
трических двигателей, нагревателей и другими элементами ва-
куумной аппаратуры.
ВАКУУМНЫЕ УСТАНОВКИ
517
7.1. УСТАНОВКИ ВЫСОКОГО ВАКУУМА В МЕТАЛЛУРГИИ
различные металлургические процессы, как, например, плав-
спекание, агломерирование и литье металлов или сплавов,
Кvbствительных к окислению (особенно тех, которые образуют
стойчивые соединения с газами), должны проводиться в ва-
куум'ё Вакуум обеспечивает возможность получения металли-
ческих материалов значительно лучшего качества главным об-
разом благодаря уменьшению содержания в них растворенных
газов Для этих целей служат специальные лабораторные и
промышленные вакуумные установки.
В качестве примера такой установки рассмотрим в общих
чертах вакуумную высокочастотную электропечь, предназначен-
ию для переплавки металлических материалов, с загрузкой
шихты 25—50 кг при температуре ~1400 К. Печь представляет
собой цилиндрическую камеру (фиг. 7.1) объемом ~ 1,5 м3 с
герметичной крышкой. Внутри камеры помещен тигель с
индуктивным подогревом токами высокой частоты от 1000 до
20 000 Гц и удельным энергопотреблением ~2,5 кВт на 1 кг
шихты.
Для опрокидывания тигля в камере с целью переливания
расплавленного металла в установленную под тиглем форму
служит специальное устройство, приводимое в действие извне
и позволяющее точно управлять наклоном тигля, благодаря
чему можно эффективно регулировать разливку металла.
Поворотная станина позволяет подставлять под лоток раз-
ные литейные формы. Имеется также возможность добавлять
различные специальные присадки для получения нужного со-
става сплава. Камера охлаждается водой. Скорость натекания
газов из окружающей среды для самой камеры составляет
~50 мТор-л-ч-1.
Откачивающая система состоит из двух бустерных диффу-
зионных насосных агрегатов (с диаметром входа ~15 см) про-
изводительностью ~25 Тор-л-с-1 в пределах давлений на входе
Ю—750 мТор. Форвакуум в системе обеспечивает масляный ро-
тационный насос со скоростью откачки ~ 100 л-с-1. Еще один
насосный агрегат является резервным. Управление насосами и
клапанами автоматизировано.
Применение вентилей в магистралях высокого вакуума и
форвакуума позволяет предварительно откачать камеру, не
включая диффузионный насос.
В одной из конструктивных схем вакуумной электропечи ин-
дукционная нагревательная катушка тигля имеет 12 витков при
параллельной емкости 500 мкФ. Она питается током частотой
2000 Гц под напряжением 400 В. Подводимая мощность со-
ставляет свыше 50 кВ г. Печь изготовлена из нержавеющей
Фиг. 7.1. Высоковакуумная электропечь для металлургических целей.
/ — рабочая камера; 2 — тигель; <3 — смотровое окно; 4, 7, 8 — вентили; 5 — днффузи'
ный насос; 6 — ротационный вакуумный иасос.
Фиг. 7.2. Индукционная вакуумная печь для плавки и литья металлов (за-
грузка — несколько десятков килограммов, мощность ~ 50 кВт, температура
~ 2000 К) (фирма Balzers).
ВАКУУМНЫЕ УСТАНОВКИ
519
дни; система форвакуумных и диффузионных насосов управ-
с^ется автоматически.
л На фиг. 7.2 показана большая вакуумная установка для
лавки и литья металлов (индукционная вакуумная печь). На-
певание тигля осуществляется переменным током высокой ча-
стоты.' Установка автоматизирована и позволяет производить
в тигельной камере различные операции. Печи такого типа
строят на загрузку шихты до Ют.
7.2. УСТАНОВКИ ДЛЯ ЭЛЕКТРОННО-ЛУЧЕВОЙ СВАРКИ
Для местного расплавления металла, а особенно для преци-
зионной сварки мелких деталей используют тепловую энергию,
выделяемую концентрированным пучком электронов высокого
напряжения, направленным на точно определенное место. Ток
Фиг. 7.3. Электронно-лучевой вакуумный сварочный аппарат типа SE 6/25
(Варшавский институт промышленной электроники).
I — люк в рабочую камеру; 2 — электронная пушка; 3 - шкаф с насосами; 4 — источник
высокого напряжения; 5 — пульт управления.
и напряжение электронного пучка, а также его фокусировка
(обычно магнитная) могут регулироваться непрерывно.
Бомбардируемые электронным пучком предметы устанавли-
вают на манипуляционном столике, который можно точно пе-
ремещать вдоль осей х и у и вращать вокруг оси z.
Разрежение в камере (~10-5 Тор) достигается за несколь-
ко десятков минут при помощи ротационного и диффузионного
насосов.
Камера снабжена смотровым окном, а вакуумная установ-
необходимыми клапанами, кранами и измерительными при-
ми.
520
ГЛАВА 7
Установки этого рода называют также электронно-лучевыми
вакуумными сварочными аппаратами
На фиг. 7.3 представлена схема электронно-лучевого сва-
рочного аппарата средних размеров (тип SE 6/25) конструк-
ции Варшавского института промышленной электроники. На-
Фиг. 7.4 Электронно-лучевая сварочная установка (Варшавский институт
промышленной электроники).
пряжение электронного пучка составляет 0—25 кВ, ток 0—
240 мА, максимальная мощность 6 кВт, фокусировка пучка маг-
нитная. После установки свариваемых деталей напряжение и
ток пучка, а также магнитное поле стабилизируются.
Рабочая камера (размером ~ 0,5X0,5X1 м) снабжена тре-
мя смотровыми окнами. Управление положением манипуляци-
онного столика осуществляется непрерывно. Предельное давле-
ние в камере (5-Ю-5 Тор) достигается по истечении ~25 мин
ВАКУУМНЫЕ ОСТАНОВКИ
521
при помощи форвакуумного (~15 л-с-1), а также диффузион-
ных (2000 л-с-1, 250 л-с-1) насосов. Расход охлаждающей воды
составляет 10 л-мин-1 (под давлением 4 бар). Клапаны управ-
ляются автоматически Сварочный аппарат весит ~200 кг, блок
питания ''-'800 кг, потребляемая из сети мощность составляет
~ 5 кВт.
На фиг. 7.4 показан большой сварочный аппарат конструк-
ции Варшавского института промышленной электроники.
7.3. УСТАНОВКИ ДЛЯ ОПРЕДЕЛЕНИЯ КОЛИЧЕСТВА И СОСТАВА
ГАЗОВ, ВЫДЕЛЯЕМЫХ ПРИ НАГРЕВЕ
Действие установок, служащих для определения количества
и состава газов, выделяемых при нагреве, основано на принци-
пе, который иллюстрирует схема вакуумной установки, пред-
ставленная на фиг. 7 5.
Фиг 7 5 Установка для определения содержания газов в металлах
/ — рабочая камера с поворотным тиглем, 2— кассета со шлюзом для введения проб;
3 _ масляный диффузионный насос, 4 — ротационный насос, 5- газовый баллон, 6 — ре-
зервуар ртути для сжатия газа в баллоне 5, 1 — анализатор газа, 5 — регистратор, 9 —
кран, 10— привод поворота тигля, 11— контакты подвода тока нагревателя (см фиг. 7 6).
Пробу металла определенных массы и размеров вводят че-
рез шлюзовую камеру в графитовый тигель, подогреваемый тем
или иным способом (джоулевой теплотой — как на рисунке,
токами высокой частоты, при помощи электронной бомбар-
дировки и т. п ) до температуры плавления пробы. Выделяю-
щиеся во время плавления газы откачиваются диффузионным
522
ГЛАВА 7
насосом 3 в баллон 5, а затем каким-либо способом (например,
компрессионным при помощи ртути) вводятся в анализатор 7,
который быстро определяет рс
газов (например, СО — путем
I и количественное содержание
измерения поглощения инфра-
красного излучения, N2 + СО—
путем измерения теплопровод-
ности и т. п.).
Графитовый тигель (фиг.
7.6) с конусообразным дном 2
защищен системой металличе-
ских экранов 3' и 3", а также
огнеупорным экраном 4 двух-
затворного шлюза тигельной
камеры. Нагреватель 5 тигля
получает питание через токо-
вводы 6. Вал 7, соединенный с
двигателем 8, служит для со-
общения тиглю вращательного
Фиг. 7 6 Тигельная камера установ-
ки фиг. 7.5 (фирма Balzers).
/ — шлюз, 2 —тигель, 3', 3" — металличе
скне экраны, 4 — огнеупорный экран, 5 —
нагреватель, 6 — токовводы, 7 — вал тигля,
8 — двигатель.
движения и удаления центробежными силами расплавленного
металла после исследования пробы.
7.4. УСТАНОВКИ ДЛЯ ПОКРЫТИЯ МЕТАЛЛАМИ
ПОВЕРХНОСТЕЙ В ВАКУУМЕ
Различные вещества, в особенности металлы, можно в очень
чистом виде осаждать на поверхностях слоями желаемой тол-
щины Покрытия поверхности металлом (металлизация) произ-
водится путем напыления или осаждения паров в вакууме. В
процессе металлизации давление газов в окружающем про-
странстве должно быть достаточно низким, чтобы покрываемая
поверхность была свободна от адсорбированных газов и чтобы
молекулы осаждаемого вещества, движущиеся от его источника
к покрываемой поверхности, не сталкивались с молекулами хи-
мически активных газов. Следует иметь в виду, что распыляе-
мое или испаряемое вещество может само десорбировать зна-
ВАКУУМНЫЕ УСТАНОВКИ
523
чительное количество газов независимо от десорбции самой ва-
куумной установки. Ввиду этого откачивающая система должна
достаточно быстро откачивать выделяемые газы.
Металлизация находит очень широкое применение для са-
мых разнообразных научных и технических целей.
Одной из важнейших проблем при вакуумной металлизации
является получение слоя соответствующей толщины. Суще-
ствуют разные способы контроля толщины осаждаемого слоя.
Один из них заключается в равномерном осаждении металла на
кварцевой пластинке, которая электрическим способом приво-
дится в колебательное движение. Частота колебаний изменяет-
ся вместе с изменением толщины осаждаемого слоя металла и
служит для контроля толщины слоя по мере ее увеличения.
Давление газа во время металлизации должно непрерывно
контролироваться. В случае когда требования к чистоте вакуу-
ма очень высокие, одновременно с напылением проверяется со-
став газов при помощи масс-спектрометра. Предметы, подлежа-
щие металлизации, часто помещают в карусельное устройство,
позволяющее по очереди подставлять их под струю осаждаемого
из пара или напыляемого металла.
Вакуумная камера (колпак, колокол) обычно может исполь-
зоваться как для осаждения из пара, так и для катодного на-
пыления. С целью обезгаживания ее нагревают до ~650—700 К.
Основание камеры должно иметь устройства, позволяющие
подводить необходимое электропитание. Конструкция и харак-
теристики применяемых уплотнений зависят от качества требуе-
мого вакуума.
Для быстрого введения и удаления металлизируемых пред-
метов должна быть предусмотрена возможность отключать диф-
фузионный насос (работающий непрерывно) от колпака, запол-
нять колпак воздухом, а затем откачивать его форвакуумным
насосом (без подсоединения диффузионного).
7.4.1. Осаждение из пара
При осаждении из паровой фазы используемый для получе-
ния паров материал должен быть нагрет до такой температуры,
при которой давление его паров окажется выше давления, гос-
подствующего в системе. Скорость испарения, определяемая как
масса вещества (в граммах), испаренного с 1 см2 поверхности
в течение 1 с, пропорциональна давлению пара, поэтому она
возрастает экспоненциально с температурой; количество осаж-
денного вещества зависит, кроме того, от расстояния между ис-
точником пара и покрываемой поверхностью.
Установка для осаждения из паровой фазы (фиг. 7.7)
состоит в принципе из съемного колпака (стеклянного или
524
ГЛАВА 7
металлического, со смотровым окном), платформы и откачиваю-
щей системы.
Колпак герметизируется с помощью уплотняющего кольца
или пришлифованных поверхностей (в последнем случае по-
верхности смазываются). Под колпаком помещают источник
Фиг. 7.7. Устройство для осаждения из па-
ровой фазы.
/ — колокол, 2 — смотровое стекло; 3 — измери-
тельный датчик; 4—токоввод для питания тнгля;
5 — уплотняющее кольцо; 6 — клапан; 7 — источ-
ник пара, 8 — передвижной экран, 9 — покрывае-
мый объект.
пара (испаряемое вещество) и покрываемый объект. Передвиж-
ной экран служит для задержки первой (обычно загрязненной)
порции паров. Испаряемое вещество помещается в металличе-
ский или керамический тигель, нагреваемый электрическим на-
IV / (капля)
Фиг. 7.8. Источники паров.
С —тигель; б — тугоплавкая проволока (с каплей расплавленного металла, например
серебра); в — тугоплавкий стержень, вокруг которого навита проволока из испаряемого
металла.
/ — тигель; 2 — испаряемый металл; 3 — нагреватель.
гревателем (фиг. 7.8,а), или непосредственно на проволоку из
тугоплавкого материала (фиг. 7.8,6). Часто на вольфрамовый
стержень навиваются параллельно тонкая вольфрамовая про-
волока и проволока испаряемого металла, благодаря чему жид-
кий металл удерживается между витками (как в сублимацион-
ных насосах) и не стекает (фиг. 7,8,в). Нагревание можно
также осуществить с помощью бомбардировки потоком элек-
тронов.
ВАКУУМНЫЕ УСТАНОВКИ
525
Откачивающая установка состоит из насоса, клапана и из-
мерительного датчика.
Чем выше требования к чистоте проводимого процесса, тем
ниже должно быть давление газов в пространстве осаждения
паров и тем более старательно должны быть очищены внутрен-
ние поверхности колпака перед началом процесса.
Давление под колпаком во время испарения вещества не
должно быть выше 10-4 Тор. Во многих случаях требуется еще
более высокий вакуум, свободный от паров органических ве-
ществ. В таких случаях рекомендуется применять цеолитовые
насосы или насосы Рутса, а затем ионные или вымораживание
паров жидким азотом. Часто ставятся требования об отсутст-
вии определенных газов, особенно нежелательных в процессе
осаждения паров. В этом случае уплотнения колпака не долж-
ны содержать органических материалов. Эти условия требуют
применения насосов с большими скоростями откачки (порядка
нескольких тысяч литров в секунду), чтобы при наличии интен-
сивной десорбции газов (со стенок, из материалов уплотнения
и подогреваемого вещества) можно было получать низкое дав-
ление, которое обеспечивает требуемую чистоту процесса.
Следует также принять во внимание, что первые порции ис-
паряемого вещества обычно недостаточно чисты и поэтому не
должны попадать на металлизируемую поверхность; для этого,
как уже упоминалось, поверхность первоначально прикрывает-
ся экраном, который в соответствующий момент отодвигается.
Металлизируемый предмет необходимо сначала тщательно
очистить от масла, а затем подвергнуть вакуумной очистке1).
Он должен быть соответствующим образом расположен относи-
тельно источника пара (достаточно далеко от источника пара,
чтобы пути молекул пара не слишком сильно отличались от
параллельных линий и были по возможности перпендикулярны
поверхностям, на которых молекулы должны осаждаться).
Установка для вакуумного осаждения паров представлена
на фиг. 7.9. Откачивающая система состоит из рабочих насо-
сов: ротационного форвакуумного 1 и диффузионных (ртутно-
го 2 и масляного 3), а также из вспомогательного ротационного
насоса 4. Рабочие насосы функционируют во время осаждения
) Очень хорошие результаты дает очистка металлизируемых предметов
ионной (или же электронной) бомбардировкой. Для этого вводится высокое
напряжение между очищаемой поверхностью и вспомогательным электродом.
Источником этого напряжения является специальный трансформатор. Такая
процедура не только очищает поверхность, на которую предполагается оса-
ждать пары, но и ускоряет процесс обезгаживания полости колпака и метал-
лических деталей. При зажшании электрических разрядов необходимо сле-
дить, чтобы они не достигали масляного диффузионного насоса, где они мо-
гут вызвать нежелательное разложене масла. Электрические разряды могут
также влиять на показания ионных манометров.
526
ГЛАВА 7
пара. Вспомогательный насос осуществляет предварительное
откачивание установки (после впуска воздуха) вплоть до того
момента, когда могут быть включены рабочие диффузионные
насосы.
Переключение с диффузионных на вспомогательный насос и
наоборот производится при помощи сильфонного клапана 5.
Фиг, 7.9. Установка для вакуумного осаждения паров.
/ — форвакуумный насос; 2—ртутный диффузионный насос; 3 — масляный диффузион-
ный насос; 4 — вспомогательный ротационный насос; 5 — переключающий клапан; 6 —
рычаг переключающего клапана, 6а — положение рычага, когда тарель 18 прижата
к седлу плиты /2; 6b — положение рычага, когда отверстие 14 закрыто плитой 13;
Т, 7", 8', 8" — краны; 9 — датчик форвакуума; 10 — форвакуумный баллон; // — иониза-
ционный манометр; 12, 13 — плиты; 14 — отверстие; /5 —колокол; 16 — эластомерное
уплотнение колокола; /7 — эластомерное уплотнение седла тарели 18; 19 — сильфон; 20 —
опоры плиты 13
Этот клапан в положении а рычага 6 перекрывает вакуумпро-
вод между колпаком и насосом 3 и соединяет колпак с насо-
сом 4; в положении же b рычага происходит обратное переклю-
чение. Таким образом, перед поднятием колпака отключают насос
4, открывают краны 7' и 7" и в установку впускают воздух.
После установки колпака в уплотнения 16 эти краны закры-
вают, включают насос 4 и после снижения давления до ~10~3Тор
переключают клапан на диффузионные насосы (работающие
непрерывно).
Насосы описанной вакуумной системы имеют следующие ха-
рактеристики: ротационный насос 1 — скорость откачки 0,6 л -с-1,
объем вакуумного резервуара 10 л; масляный диффузионный
ВАКУУМНЫЕ УСТАНОВКИ
527
насос 3 с ртутным диффузионным насосом 2 — скорость откач-
ки 35 л-с-1 (диаметр вакуумного тракта насоса <3 ~70 мм);
вспомогательный ротационный насос 4— скорость откачки
8 л • с"1.
Откачивание колпака до порогового рабочего давления диф-
фузионных насосов занимает ~ 5 мин. Диффузионные насосы
доводят давление до 10"4 Тор за ~10 мин, а до 10“5 Тор — за
~ 30 мин.
Колпак имеет диаметр ~500 мм и высоту ~600 мм, изго-
товлен из нержавеющей стали и снабжен тремя смотровыми
окнами. Уплотнение между краями колпака и платформой уста-
новки представляет собой резиновое кольцо, уложенное в коль-
цевую канавку. Для измерения давления в вакуумной системе
используются электронный ионизационный и термопарный ва-
куумные манометры; неоновые индикаторы позволяют контро-
лировать характеристики низкого вакуума.
На фиг. 7.9 не показано устройство для получения паров.
В качестве источника энергии для испарения служит транс-
форматор низкого напряжения (20 В) на ток 200 А. Для
возможного катодного напыления, а также обезгаживания и очи-
стки внутренних поверхностей колпака тлеющим разрядом пре-
дусмотрен трансформатор высокого напряжения (10 кВ, 100 мА).
Установка потребляет электрическую мощность ~4 кВт, расход
охладителя составляет ~3л-мин"‘.
На фиг. 7.10 показана установка для покрытия автомобиль-
ных рефлекторов методом вакуумного осаждения паров, разра-
ботанная Радиотехнической лабораторией Варшавского поли-
технического института (1951 г.). Она состоит из ротационного
насоса, масляного диффузионного насоса (Sc^lOOO л-с-1), съем-
ного вакуумного колокола (диаметром ~40 см) со смотровым
окном, манометра сопротивления (диапазон измерений 10~3—
1 Тор), электроразрядного манометра (7-10-6—5-Ю"3 Тор),
трансформатора накала (мощностью ~2 кВА) и необходимых
клапанов и кранов.
На фиг. 7.11,а показана современная установка для метал-
лизации поверхностей в вакууме, разработанная Варшавским
институтом промышленной электроники. В ее состав входят:
система из трех цеолитовых сорбционных форвакуумных насо-
сов и ротационного насоса с цеолитовым поглотителем, высо-
ковакуумная насосная система с ионно-сублимационным насо-
сом, несколько переходников (между ионным насосом и колпа-
ком), а также колпак (со смотровыми окнами) диаметром 350
и высотой 450 мм и его гидравлический подъемник.
Переходные фланцы по окружности установки (фиг. 7.11,6)
предназначены для введения под колпак разных вспомогатель-
ных устройств и их питания.
528
ГЛАВА 7
Скорость откачки воздуха ионно-сорбционным насосом со-
ставляет ~ 1000 л-с1, предельное давление под колпаком без
прогрева после 5 ч откачивания составляет 5-Ю-9 Тор, с про-
ишммишв
Фиг 710 Установка для вакуумного осаждения паров (Радиотехническая
лаборатория Варшавского политехнического института, 1951 г)
гревом колпака (в течение 2 ч при температуре 520 К) после
10 ч откачивания <^5-10~10 Тор, вес установки 200 кг
7.4.2. Катодное напыление
Катодное напыление основано на принципе перенесения ато-
мов металла под действием тлеющего электрического разряда
с отрицательного электрода на какую нибудь поверхность, по-
Фиг 711 Устройство для вакуумного осаждения паров металлов (Варшав-
ский институт промышленной электроники)
а — общий вид устройства (колокол с гидравлическим подъемником ионно сублимацион
ные цеолитовые насосы ротационный насос с цеолитовым поглотителем клапаны с ав
тематическим управлением и манометры) б — переходник с соединительными флан
цами и измерительными приборами.
530
ГЛАВА 7
мещенную в пространстве разряда и выполняющую роль ано-
да. При соответственно подобранных условиях (напряжение,
давление газа, время) можно получить быстрое, равномерное и
довольно прочное покрытие металлом различных поверхностей
(металлических, стеклянных, керамических, натуральных и ис-
кусственных тканей и т. п.).
Механизм этого явления недостаточно изучен; его объясняют
либо обыкновенным испарением металла катода при высокой
температуре, возникающей в
межатомных пространствах
под действием бомбардировки
катода ионами, либо отделе-
нием атомов металла катода
под влиянием энергии, которую
сообщают им ионы, бомбарди-
рующие катод.
Простая установка для ка-
тодного напыления представле-
на на фиг. 7.12. После тщатель-
ного удаления воздуха из по-
лости стеклянного колпака в не-
го вводят (при помощи иголь-
RH
К диатцзионноми
насосу
Фиг. 712. Установка для катодного
напыления.
1 — колокол, 2 — уплотняющая прокладка,
3 — столик, 4 —напыляемый предмет, 5 —
экран катода, 6 — элек1ромагни1, 7 — за-
слонка, 8 — экран колпака, 9 — пьезоквар-
цевый датчик; /0 —клапан, 11, /2—краны,
1S — зажимы теплоэлектрического мано-
метра, К — катод (распыляемый).
чатого дозирующего клапана) соответствующий газ, а затем —
при включенном насосе и отрегулированном клапане — поддер-
живают под колпаком определенное постоянное пониженное дав-
ление. Величина давления газа при этом не играет особой ро-
ли— оно может составлять от нескольких тор до нескольких
миллитор. Напряжения, используемые для распыления, тоже
могут находиться в широких пределах — от одного до несколь-
ких киловольт. Кроме того, напряжение может быть перемен-
ным, хотя постоянное напряжение позволяет создать оптималь-
ные условия напыления.
Катод К выполняется из металла, который предназначен для
распыления, анод А — из железа или (лучше) из алюминия
ВАКУУМНЫЕ УСТАНОВКИ
531
(анодом может служить, например, металлическое основание
колпака).
Под колпаком 1, уплотненным при помощи кольца 2, поме-
щен столик 3, на котором располагают предметы 4, подвергае-
мые напылению. Катод К изолирован экраном 5 и заслонкой 7.
Заслонка может открываться при помощи электромагнита 6.
Стеклянный цилиндрический экран 8 предохраняет колпак от
напыления. Пьезокварцевый датчик 9 служит для контроля тол-
щины напыляемого слоя. Главный клапан 10 диффузионного
Фиг. 7.13. Ионизационная камера
(фирма Balzers).
насоса, вспомогательные краны, соединяющие установку с га-
зовым резервуаром 11 и атмосферой 12, а также теплоэлектри-
ческий манометр 13 используются для управления работой уста-
новки. Минус высокого напряжения присоединяется к ВН,
плюс — к земле.
В установки напускается газ, неактивный по отношению к
напыляемому металлу. Лучше всего для этого подходит водо-
род, а из инертных газов — аргон (относительно дешевый).
Прибавляя к неактивному газу некоторое количество кислоро-
да, можно получить напыление окислами данного металла. Мо-
жно также получить сложный слой путем одновременного
распыления двух разных металлов. Толщина слоя зависит от
Интенсивности напыления (т. е. от напряжения и силы тока) и
времени напыления.
Давление газа подбирается таким образом, чтобы при на-
пряжении 1000 В катодное темное пространство находилось на
расстоянии ~ 1 см от напыляемой поверхности. Обычно напы-
ляемая поверхность располагается на расстоянии в несколько
сантиметров от катода.
Время напыления составляет от 10 мин до нескольких ча-
сов. Средняя плотность разрядного тока равна ~10 мА-см-2.
532
ГЛАВА 7
Скорость напыления возрастает с увеличением напряжения и
силы тока.
На фиг. 7.13 показана ионизационная камера (вакуумный
колпак снят и находится на заднем плане). Стержневой катод
установлен вдоль оси камеры, а анодный диск помещен на та-
релке колпака. При давлении ~10~4 Тор получаемая плотность
ионного тока достаточна для эффективной металлизации пред-
метов под колпаком.
Катодному напылению лучше подвергать поверхности про-
стой формы, не имеющие углублений, лабиринтов и т. п., так
как к таким местам не проникают атомы распыляемого метал-
ла. Однако поверхность не должна быть слишком гладкой, на-
пример полированной, поскольку напыленный слой на ней пло-
хо держится. Поверхность для катодного напыления, как и при
осаждении из паровой фазы, должна быть очень чистой.
В табл. 7.1 приведены различные металлы в порядке эффек-
тивности их использования для напыления в атмосфере газов,
обычно применяемых при катодном напылении.
> Таблица 7.1
Катодное напыление металлов в различных газах
Газ Металлы (в порядке уменьшения их склонности к напылению)
Воздух (су- хой) Азот Аргон Водород Pd, Au, Ag, Pt, Cu, Cd, Ni, Fe, Al, Mg Ag, Au, Pt, Pd, Cu, Ni, Fe Cd, Ag, Pb, Au, Cu, Pt, Ni, Fe, W, Zn, Si, Al, Mg Ag, Au, Pb, Zn, Cu, Fe, Ni, W, Co, Mo, Mn, Cd, Al, Cr, Ta, Mg
Кислород Zn, Ag, Au, Pb, Cu, Fe, Mo, W, Ni, Cd
7.5. ИСПОЛЬЗОВАНИЕ ВЫСОКОГО ВАКУУМА
в ускорителях частиц
7.5.1. Протонный синхротрон «Нимрод»
Одной из наиболее крупных установок для получения ча-
стиц больших энергий, уже несколько лет находящейся в экс-
плуатации в Лаборатории им. Резерфорда (Великобритания),
является протонный синхротрон «Нимрод». Его кольцеобразная
вакуумная камера, в которой создаются протоны с энергией
7 ГэВ, изготовлена из эпоксидной смолы, армированной стекло-
волокном. Выбор такого композиционного материала обусловлен
присутствием сильных переменных магнитных полей и интенсив-
ВАКУУМНЫЕ УСТАНОВКИ
533
ной радиации (порядка 107 Дж-кг-1). Чтобы пучок протонов не
рассеивался во время очень длинного пути в ускорителе, допу-
стимое давление газов и паров не должно превышать Ю~6 Тор.
Для создания и поддержания такого вакуума требуется слож-
ная система откачивания, а также специальный подбор и обра-
ботка материалов, особенно если принять во внимание большой
объем камеры.
Протоны (получаемые путем ионизации водорода) перед вве-
дением в кольцевой ускоритель сначала ускоряются постоянным
напряжением 0,6 МВ, а затем, после фокусировки и упорядоче-
ния, вводятся в линейный ускоритель, имеющий форму длинного
цилиндра, в котором под действием переменного электрического
поля частотой 115 МГц ускоряются до энергии 15 МэВ. Затем
из линейного ускорителя протонный пучок попадает в кольцевую
камеру, помещенную также в кольцевом электромагните диамет-
ром 48 м. Поперечное сечение электромагнита, питаемого током
большой частоты (в пределах между 1,4 и 8 МГц), имеет форму
буквы С; внутри нее и размещена кольцевая вакуумная камера,
в которой происходит дальнейшее ускорение протонов,- состав-
ляющее 7 кэВ на один кольцевой пробег. Цикл ускорения пакета
1015 протонов длится 0,7 мкс; в течение этого времени пакет про-
тонов обегает кольцевую камеру 106 раз, преодолевая путь
л-48-106 = 150 000 км, и приобретает энергию 7 ГэВ. Частота
введения протонных пакетов составляет 28 с-1. Протоны с этой
энергией или выводятся из камеры, или же направляются на оп-
ределенную цель, помещенную внутри камеры. Магнитная индук-
ция в камере составляет 0,03—0,14 Т.
Вакуумная установка ускорителя состоит из двух систем: ка-
меры линейного ускорителя и кольцевой камеры главного уско-
рителя (фиг. 7.14).
Вакуумная камера линейного ускорителя имеет форму полу-
цилиндра длиной 14 м и диаметром ~2,5 м. Она представляет
собой собственно камеру в виде полуцилиндра, установленную
на основании и уплотненную по краям при помощи резинового
валика. Объем камеры составляет свыше 70 м3, площадь поверх-
ности стенок — 400 м2.
Скорость натекания в камеру (десорбция и истинная негерме-
тичность) составляет ~2,5-10-4 Тор-л-с-1; при таком натекании
вакуум —2-10-6 Тор получается после 12 ч работы насосов. Ка-
мера линейного ускорителя откачивается четырьмя системами
ртутных диффузионных насосов с отражателями, охлаждаемых
водой при температуре — 283 К, со скоростью откачки
— 2000 л-с-1. Форвакуум создают масляные ротационные насосы
со скоростью откачки НО л-с-1, отделенные от диффузионных
насосов ловушками, охлаждаемыми до 220 К с целью предотвра-
тить попадание паров масла в ртутные диффузионные насосы.
534
ГЛАВА 7
Применение ртутных (а не масляных) насосов диктуется опасе-
нием загрязнить поверхность камеры парами масла.
Вакуумная камера кольцевого ускорителя является торои-
дом диаметром 48 м с прямоугольным поперечным сечением
Фиг. 7.14. Протонный синхротрон «Нимрод» (Великобритания).
о —системы инжектора и ускорителей; б — схема откачивающей системы одного из
восьми сегментов кольцевой камеры (разрез по У—У).
/ — вакуумная камера; 2—масляные ротационные насосы; 3 — предохранительная мем-
брана (прорывающаяся при слишком большом перепаде температур); 4 — ртутный диф-
фузионный насос; 5 — отражатель ртутных паров; 6 — промежуточный насос; 7 — катушка
электромагнита; 8 — полюсный наконечник; 9 — высокочастотная катушка; 10 — внешняя
камера (металлическая); // — внутренняя камера (композиция из эпоксидной смолы и
сте.к .оволокна); 12 — затвор; 13 — сегмент кольцевой камеры; 14 — вакуумная камера.
1X0,25 м. Она имеет 8 сегментов длиной ~ 15 м каждый
(фиг. 7.14,а).
Ввиду невысокой механической прочности на сжатие камеры
из эпоксидной смолы и стекловолокна атмосферным давлением
ВАКУУМНЫЕ УСТАНОВКИ
535
она вместе с полюсами электромагнитов находится во внешней
камере, где давление составляет менее 1 Тор. Внутреннюю ка-
меру (фиг. 7.14,6) обслуживает 40 ртутных диффузионных насо-
сов с диаметром входа 60 см и скоростью откачки у каждого
5000 л-с-1, что составляет в сумме 200 000 л-с-1. При давлении
10-6 Тор скорость откачки уменьшается до 100 000 л-с-1. Так как
кольцевая камера имеет объем ~ 100 000 л, это дает скорость
откачки ~ 1 л-с-1 на 1 л объема (или ~300 л-с-1 на 1 м2 по-
верхности).
Форвакуум для ртутных диффузионных насосов (10-4 Тор)
создается системой бустерных масляных насосов. Для того чтобы
предотвратить попадание паров масла в ртутные насосы, приме-
няют отражатели, охлаждаемые до ~250 К (фиг. 7.14,5).
7.5.2. Линейный ускоритель «Орсэ»
На фиг. 7.15 представлена вакуумная система одной из 38
секций линейного ускорителя «Орсэ» (Франция), создающего
электронный пучок с максимальным током 100 мА при энергии
электронов 2 ГэВ. Эти электроны, проходя через вещество,
образуют фотоны, которые в свою очередь создают пары пози-
трон (е+)—электрон (е-). Таким образом создается пучок по-
зитронов большой энергии.
Каждая секция состоит из цилиндрической камеры 1 (длиной
~6 м), внутри которой находится ~240 эндовибраторов боль-
шой частоты (фиг. 7.16); через отверстия в них проходит уско-
ряемый пучок. Эндовибраторы каждой секции получают питание
через волновод от клистрона, работающего на частоте
3000 МГц с мощностью порядка 20 МВт в импульсе, для-
щемся ~2 мкс.
Вакуум в клистроне создается в основном титановым субли-
мационным насосом 13 (S = 140 л-с-1). Масляный диффузион-
ный насос 5 (с отражателем 6, для охлаждения которого исполь-
зуется эффект Пельтье) создает форвакуум, после чего этот на-
сос отключается клапаном 7.
Вакуум в волноводе сохраняется при помощи небольшого ти-
танового сублимационного насоса 13. Волновод от клистрона и
камеры отделен окнами, пропускающими электромагнитные
волны.
Удельный поток десорбции с находящихся в вакууме поверх-
ностей камеры (~20 м2) составляет ~2-10-8 Тор-л-с-1-см-2,
вследствие чего скорость натекания равна 20-104-2-10-8=
= 4-10-3 Тор-л-с-1. При скорости откачки 140 л-с-1 получается
давление р (4-10-3)/140с^З-10-5 Тор. После 100 ч откачивания
давление в вакуумной камере снижается до 3-10—8 Тор.
f = 3000 МГц
13
___К следующей
— секции
Фиг, 7.15. Вакуумная система одной из 38 секций линейного ускорителя
«Орсэ» (Франция).
1 — цилиндрическая камера с эндовибраторами; 2— клистрон, питающий эндовибраторы
через волновод; 3 — волновод; 4 — титановый насос; 5 — диффузионный насос; 6 — охлаж-
даемый отражатель Пельтье, 7 — отсечной клапан диффузионного насоса; 8 — масляный
ротационный насос; 9 — ионизационный манометр; 10 — теплоэлектрический мано-
метр, 11 — окно в клистроне, разделяющее вакуумные области, но пропускающее электро-
магнитное излучение; 12 - сильфоны; 13 — титановый сублимационный насос; 14 — пучок
ускоряемых частиц.
Фиг. 7.16. Эндовибраторы (объемные колебательные контуры), питаемые
клистроном с частотой 3000 МГц с мощностью 20 МВт в импульсе, длящемся
~2 мкс.
ВАКУУМНЫЕ УСТАНОВКИ
537
7.6. УСТАНОВКИ ДЛЯ ПОЛУЧЕНИЯ И ИССЛЕДОВАНИЯ
ПЛАЗМЫ
В качестве примера одного из современных применений тех-
ники высокого вакуума рассмотрим ваккумную часть установки
для получения и исследования плазмы методом так называемой
инжекции и аккумуляции ионов с магнитным зеркалом (лабора-
тория Евратома в Фонтэнэ-о-Роз, Франция).
В этой установке для уменьшения потери ионов на краях про-
странства, занятого плазмой, давление инертных газов должно
быть по возможности низким, порядка 10-6 Тор, по крайней мере
в течение времени не менее 1 с в присутствии источников газа,
которыми являются источник и пучок ионов. Например, пучок
ионов Н2+, несущих ток 0,2 А (при к. п.д. ~5%), эквивалентен
скорости натекания газа 1 Тор-л-с-1. Следовательно, для по-
лучения требуемого вакуума необходимы насосы со скоростью
откачки, достигающей 106 л-с-1.
Ввиду больших размеров камеры ее прогрев невозможен и,
следовательно, десорбция со стенок может быть уменьшена лишь
путем надлежащего подбора материала стенок и хорошей очи-
стки поверхностей.
Плазменная камера(в которой находятся источник ионов и
магнитная система) имеет форму прямоугольного параллелепи-
педа (фиг. 7.17) размером ~ЗХЗХ 1,5 м. Она изготовлена из
нержавеющей стали и имеет толщину стенок ~15 мм. Несмотря
на то что стенки усилены ребрами, прогиб стенок под действием
сил атмосферного давления достигает 4 мм.
Водородные ионы Н2+, выходящие из кольцевого источника и
ускоряемые щелевым кольцевым электродом, попадают в цент-
ральную камеру, где происходит разряд между электродами Е\
и Е2- В пространстве источника ионов и ускоряющих электродов
действуют кольцеобразные титановые насосы, которые напы-
ляют титан на криопанели. Пространство центральной камеры
откачивают также титановые насосы и криопанели. К установке
подключены также два больших диффузионных насоса, по-
мещенные ниже криопанелей. Электромагнитные катушки, уста-
новленные в разных местах системы, служат для концентрации
плазмы.
Таким образом, вакуум в камере создается при помощи двух
масляных диффузионных насосов (каждый диаметром 130 см со
скоростью откачки водорода 77 000 л-с-1, создающих предельный
вакуум без жидкого азота ~2-10-9 Тор и с жидким азотом
~3-10-10 Тор), двух охлаждаемых жидким азотом титановых
сублимационных насосов (каждый с сорбционной поверхностью
12,5 м2 и скоростью откачки 1,25-106 л-с-1), а также двух титано-
вых кольцеобразных сублимационных насосов (один с сорбцион-
538
ГЛАВА 7
ной поверхностью 8 м2 и скоростью откачки ~8- 10ё л-с-1, вто-
рой с поверхностью 6 м2 и скоростью откачки ~6-105 л-с-1.
Отражатели масляных диффузионных насосов (масло сили-
кон DC705) охлаждаются фреоном до температуры 220 К; стенки
Фиг. 7.17. Установка для получения и исследования плазмы (Евратом, Фон-
тэнэ-о-Роз, Франция).
1 — кольцевой источник ионов, 2 — щелевой кольцевой электрод; 3 — центральная камера;
4 — электромагнитные катушки; 5 —система титановых насосов, 6’ —система титановых
и диффузионных насосов; 7 — титановые сублимационные насосы; 8 — криопанелн;
Ei, Е2 — электроды.
камеры имеют ряд экранов (из теплопроводного металла), со-
единенных с резервуарами ^жидкого азота, имеющего темпера-
туру -77 К- Центральная камера, в которой происходит плаз,-
менный дуговой разряд (между электродами Е\ и кроме
того, откачивается с каждой стороны титановым сублимацион*
ным насосом в криогенном (азотном) цилиндре (скорость от-
качки 3000 л-с-1); эти насосы работают вместе с диффузионным
ВАКУУМНЫЕ УСТАНОВКИ
539
насосом (отражатель которого охлаждается азотом), имеющим
скорость откачки 2000 л-с-1.
Форвакуум обеспечивают два последовательно соединенных
насоса типа Рутса со скоростью откачки 2000 м3-ч-1 и 350 м3-ч-1
и масляный ротационный насос со скоростью откачки 80 м3-ч-1.
Объем всей вакуумной системы составляет ~40 м3, ее поверх-
ность 300 м2. Представляет интерес в этой установке работа суб-
лимационных насосов. Титан осаждается из пара на криопанели,
охлаждаемые жидким азотом, что обеспечивает коэффициент
прилипания для азота и кислорода ~0,9, для водорода ~3,3;
Фиг. 7.18. Зависимость давления водорода Рн2 в процессе осаждения паров
титана на поверхность площадью 1 м2 при температурах 77 и 293 К.
Скорость натекания водорода 3 • 10~2 Тор • л•с“!, скорость откачки одновременно дей-
ствующего диффузионного насоса 10 000 л с“*. Мощность нагревателя 3 кВт (Прево, След-
зевский, 1964, 1968 гг.).
этому соответствует скорость сорбционной откачки 11 и 17 л-с-!-
•см-2. Следовательно, можно считать, что скорость откачки со-
ставляет по меньшей мере 10 л-с-1 на 1 см2 сорбирующей по-
верхности. Сорбционная емкость поверхности криопанелей (при
наиболее благоприятных условиях, считая, что образуется не-
сколько мономолекулярных слоев газа) составляет ~(1—5)• 1015
молекул на 1 см-2, чему соответствует количество газа (0,34-1,5)-
• 10-4 Тор-л-см-2. Однако на практике наблюдается уменьшение
скорости откачки по мере увеличения количества адсорбирован-
ного газа. С учетом этого на криоианели периодически оса-
ждаются все новые слои титана; частота осаждения зависит от
количества натекающего или же вводимого в систему газа.
На фиг. 7.18 показано изменение давления водорода по вре-
мени при осаждении титана из паровой фазы на поверхность
540
ГЛАВА 7
1 м2 при температурах 77 и 293 К. В камеру непрерывно
вводится водород в количестве 3•1О-2 Тор-л-с-1 при одновре-
менно действующем диффузионном насосе со скоростью откачки
10 000 л-с-1. Мощность naiревателей, испаряющих титан, состав-
ляет 3 кВт. Криогенные поверхности, на которые осаждается
титан, имеют вид цилиндров с двойными стенками (между кото-
рыми течет жидкий азот) из алюминиевой бронзы (89% Си, 10%
А1, 1% Мп); этот сплав имеет довольно хорошую теплопровод-
ность и достаточную механическую прочность. Испаритель ти-
тана состоит из вольфрамового стержня диаметром 2 мм, на ко-
торый навиты титановая проволока диаметром 0,8 мм и молиб-
деновая проволока диаметром 0,6 мм. Температура проволок
несколько ниже температуры плавленгя титана и составляет
1800—1900 К; в случае ее повышения титан не стекает, а удер-
живается силами вязкости между витками молибденовой прово-
локи.
Скорость испарения титана составляет 4 г-ч-1 (1,5-1019 ато-
мов титана в 1 с). Количество титана, осаждаемого в течение
1 мин на 1 м2 поверхности, обеспечивает адсорбирование 1 Тор-л
газа (воздуха или водорода). В описанной вакуумной системе
работает много таких титановых сублиматоров; каждый из них
потребляет мощность ~3 кВт.
Как уже упоминалось, вместе с титановыми насосами непре-
рывно работают масляные диффузионные насосы, поддерживаю-
щие в системе достаточно низкое давление. Применение охлаж-
даемых отражателей паров масла в данной системе затрудни-
тельно и, кроме того, снижает скорость откачки. С другой сто-
роны, адсорбция паров масла на криогенных поверхностях
с осаждающимся титаном невыгодна, так как тоже значительно
уменьшает эффективность откачки даже в случае применения
наилучших масел (например, силикона DC705). Поэтому, невзи-
рая на неудобства охлаждаемых отражателей, на входе в диф-
фузионные насосы установлены лабиринтные отражатели, охла-
ждаемые до температуры 220 К при помощи фреоновой холо-
дильной машины. Кроме того, введен экран, охлаждаемый
жидким азотом, который заслоняет титановые поверхности от
молекул масла, распространяющихся со стороны диффузион-
ного насоса. В результате на титановых поверхностях не отме-
чалось следов масла даже по истечении многих недель работы
диффузионных насосов.
Давление в системе снижается очень быстро даже без нагре-
ва стенок. Через несколько часов откачки получается давление
порядка 10-6—10-7 Тор, еще через 24 ч— 10-8 Тор, а еще через
24 ч — 10-9 Тор (без титановых насосов и вымораживания). При
использовании титановых насосов и охлаждении жидким азо-
том давление 10-9 Тор получается после 24 ч откачки.
ВАКУУМНЫЕ УСТАНОВКИ
541
7.7. ИМИТАТОРЫ УСЛОВИЙ КОСМИЧЕСКОГО ПРОСТРАНСТВА
В термобарокамере имитатора космического пространства
создаются условия, по возможности приближающиеся к тем, ко-
торые существуют в космосе. В таких камерах проводятся раз-
личные испытания (тепловые, вакуумные, механические и т. п.)
деталей, узлов и целых космических летательных аппаратов пе-
ред отправкой их в космос.
Фиг. 7.19. Космический имитатор (Центр им. Годдарда, NASA, США).
Предельный вакуум ~Ю 9 Тор.
/ — механические форвакуумные насосы; 2— масляные диффузионные насосы, 3— вну-
тренняя камера, охлаждаемая жидким азотом (80 К); 4 — криопанели, охлаждаемые газо-
образным гелием (20 К); 5 —лампы, имитирующие солнечное излучение; 6 — охлажде-
ние имитатора солнечного излучения, 7 — платформа для установки космического ко-
рабля; 8 — воздушный шлюз с двумя люками, 9 — исследуемый космический корабль.
Одну из сложных проблем создает наличие у камеры стенок,
отсутствующих в космосе. Они выделяют молекулы, которые дви-
жутся от стен к центру камеры и затрудняют сохранение надле-
жащего вакуума.
Влияние высокого вакуума на космический аппарат и его обо-
рудование разнообразно. Так, например, десорбция газов из
металлических конструкций, соприкасающихся с вакуумом, вы-
зывает определенные изменения структуры металлов. В то же
время испарение различных смазок и улетучивание газов с тру-
щихся поверхностей (например, в подшипниках) приводит к зна-
чительному увеличению коэффициента трения, что вызывает
трудности обеспечения надежной работы подвижных механизмов
и узлов трения, работающих в условиях вакуума.
542
ГЛАВА 7
В космическом пространстве имеет место вакуум порядка
10-15 Тор при температуре, близкой к О К; в нем распростра-
няется солнечное излучение мощностью ~0,15 Вт-см-2 и суще-
ствуют потоки метеорных и заряженных частиц. Космические ап-
параты при свободном полете в космосе находятся в невесомо-
н--------------------------- ~ 13 м ----ч
Фиг. 7.20. Имитатор космического пространства больших размеров (Центр
им. Арнольда, ВВС США).
сти. Таким образом, условия в космосе весьма многообразны и
сильно отличаются от земных; поэтому в имитаторах космиче-
ского пространства обычно воспроизводятся лишь те условия
космоса, которые являются определяющими для данного иссле-
дования. В исключительных случаях можно получить давление
в космической камере порядка 10-10 Тор. Для многих исследова-
ний обычно достаточно давления порядка 10-5—10-7 Тор.
Камеры имитаторов строятся разных размеров: от малых
(с диаметром порядка нескольких десятков сантиметров) для
ВАКУУМНЫЕ УСТАНОВКИ
543
испытания мелких деталей до очень больших (диаметром по-
рядка десятков метров), позволяющих поместить целый косми-
ческий корабль. Чаще всего используются цилиндрические ка-
меры диаметром 7—8 м и длиной 9—10 м для испытаний отдель-
ных узлов и систем корабля. Имитаторы изготавливаются из
нержавеющей стали с частичным применением меди и алюми-
ния.
Фиг. 7.21. Имитатор космического пространства (J. Stokes Со., США).
Для откачки камер чаще всего применяются эжекторные или
бессмазочные насосы Рутса, а вслед за ними — масляные диффу-
зионные насосы. Криосорбционные поверхности обычно охлаж-
дают азотом, газообразным или жидким гелием.
В случаях, когда необходимо создать предельный вакуум
~1СН° Тор, атмосферный гелий, не поддающийся криогенной
откачке, удаляется сублимационно-ионными насосами. Для
термовакуумных испытаний, как правило, достаточно рабочее
544
ГЛАВА ?
давление порядка 10~4—10-7 Тор. Если в камере выделяется
большое количество водяного пара, то его откачивают при по-
мощи криопанелей, охлаждаемых жидким азотом. Для получе-
ния низкого давления большой имитатор условий космического
пространства откачивают от 2—3 ч до двух недель.
На фиг. 7.19 представлен большой космический имитатор
с полезными размерами ~8,5Х 12 м для комплексных испыта-
ний космических кораблей. Температура в камере составляет
80 К, а имитированная мощность солнечной радиации ~2,5 кВт.
Откачка производится системой масляных диффузионных насо-
сов (с ротационными форвакуумными насосами) и азотными
криопанелями (80 К); предельный вакуум 10-9 Тор получают
при помощи охлаждаемых газообразным гелием (20 К) криопа-
нелей, которые установлены за азотными панелями.
Один из самых больших имитаторов (Mark 1, Научно-иссле-
довательский центр им. Арнольда, США) показан на фиг. 7.20.
Его высота ~26 м, диаметр ~ 13 м.
На фиг. 7.21 представлена термобарокамера, позволяющая
имитировать вакуумные и тепловые условия Луны с целью тре-
нировок космонавтов.
7.8. ОТКАЧКА ЭЛЕКТРОННЫХ ВАКУУМНЫХ ПРИБОРОВ
Откачка электронных вакуумных приборов (электронных
ламп) производится индивидуально или на автоматических уста-
новках (насосных автоматах), предназначенных для массового
производства. Характеристики и конструкция откачивающих
устройств зависят от размеров, стоимости, масштаба производ-
ства ламп, а также от технологических, вакуумных и электриче-
ских параметров.
Общий вид установки для индивидуальной откачки больших
кинескопов цветных телевизоров представлен на фиг. 7.22.
Откачка таких сравнительно дорогих приборов, связанная
с довольно сложными технологическими процессами, требует
очень чистого вакуума, свободного, в частности, от органических
загрязнений. Поэтому в таких откачивающих системах стараются
не применять масляных насосов, заменяя их цеолитовыми, суб-
лимационно-ионными криогенными насосами.
На фиг. 7.23 представлен высокоавтоматизированный насос-
ный шкаф для откачки специальных электронных ламп сериями
по нескольку десятков штук сразу. Кроме системы насосов,
в нем имеются печи для нагревания ламп при откачке и источ-
ники электропитания.
Установки для откачивания небольших вакуумных приборов
массового производства (например, малых приемно-усилитель-
ных радиоламп, ламп накаливания, газосветных ламп и т. д.)
Фиг. 7.22. Установка для индивидуальной откачки больших цветных кине-
скопов при помощи системы безмасляных насосов (цеолитовых, ионных, суб-
лимационных и криосорбционных) (фирма Ultek, США),
Фиг. 7 23 Автоматизированный насосный шкаф для откачки специальных
электронных ламп (Edwards Hochvakuum GmbH, ФРГ),
546
ГЛАВА 7
должны обеспечивать возможно быструю автоматическую от-
качку совместно с рядом попутных операций (таких, как нагре-
вание, обезгаживание, формирование катодов, наполнение га-
зами и г. п.). Такое откачивание производится на так называе-
мых карусельных автоматах.
Насосные автоматы, на которых некоторые операции (как,
например, установка ламп для откач,<и и т. п.) выполняются
вручную, называют полуавтоматами.
Карусельный автомат имеет две основные части: неподвиж-
ное основание и карусель, на которую устанавливаются объекты,
подвергаемые откачке.
На неподвижном основании обычно размещаются нагрева-
тельные печи (газовые или электрические высокой частоты), го-
релки для отпаивания, измерительные приборы и т. п., а также
насосы; на карусели размещаются откачиваемые объекты, а
иногда также и диффузионные насосы.
Различают два типа карусельных автоматов, с неподвижными
и подвижными насосами.
Между каруселью и неподвижным основанием автомата
имеется шлифовый венец, предназначенный для герметичного со-
единения обеих частей автомата. Он состоит из двух колец или
пришлифованных дисков (фиг. 7.24), через которые проходят
вакуумные каналы. Два кольцевых паза с обеих сторон выходов
каналов наполняются смазкой и служат для уплотнения колец.
В автоматах с неподвижными насосами каналы карусели ве-
дут к резиновым насосным гнездам с отверстиями (фиг. 7.25),
в которые вставляются ниппельные трубки откачиваемых объек-
тов, так как ввиду большой скорости работы автомата припаи-
вание объектов неприемлемо. В автоматах с движущимися насо-
сами вакуумные каналы доводятся до выходов диффузионных
насосов, входы которых соединены с насосными гнездами. Ка-
налы неподвижного кольца ведут к насосам.
Карусель автомата поворачивается на угол, соответствующий
угловому шагу между соседними позициями. В каждом положе-
нии она задерживается на некоторое время, в течение которого
происходит соответствующая операция процесса откачки. Про-
должительность операций в каждой позиции составляет не-
сколько секунд.
На фиг. 7.26 представлена для примера схема неподвижного
кольца (статора) и системы форвакуумных и диффузионных на-
сосов в 24-позиционном карусельном автомате с неподвижными
насосами. Этот автомат применяется для откачки приемно-уси-
лительных радиоламп.
В позиции 1 производится выемка из гнезда ниппеля, остав-
шегося после снятия готовой лампы. В позициях 2 и 3 встав-
ляются лампы для откачки; в позиции 4 происходит первая one-
Фиг. 7.24. Венец карусельного автомата.
/ — патрубок к лампе на карусели (форвакуум); 2 — патрубок к лампе на карусели (вы-
сокий вакуум); 3 —к ротационному йасосу; 4 —- к диффузионному насосу; 5 — подвижное
кольцо (карусели); 6 — неподвижное кольцо (основания); 7 — кольцевые канавки с уплот-
нительной смазкой; 8 — пришлифованные поверхности колец.
Фиг. 7.25 Гнездо насосного автомата.
/ — откачиваемая лампа; 2 — ниппель; -3—переход*
ник (на карусели); 4 — резиновая трубка; 5 — нако-
питель стеклянного лома; 6 — выход в вакуумпровод
подвижного кольца.
Статорное кольцо
Ротационные насосы
Фиг. 7.26. Схема статора в 24-позиционном карусельном автомате.
1—24 — рабочие позиции автомата.
548
ГЛАВА 7
рация откачки, в позиции 5 — контроль герметичности (напри-
мер, при помощи укороченного барометра, соединенного регули-
руемым каналом малого сечения с форвакуумом). В позициях
от 6 до 14, а затем от 15 до 18 лампы проходят через печь, где
подвергаются прогреву. В позициях 19—21 производится про-
калка электродов в индукционной печи высокой частоты; в по-
зициях 22, 23 осуществляется прогрев поглотителя (геттера) и
его распыление. В позиции 24
снимается готовая лампа. Как
видно из фигуры, только по-
следние четыре позиции обслу-
живаются диффузионными на-
сосами, а все остальные — ма-
сляными ротационными.
В насосных автоматах с
подвижными насосами каждо-
му гнезду соответствует собст-
венный диффузионный насос,
соединенный своим входом не-
Фиг. 7.27. Карусельный автомат на
36 рабочих позиций для откачки
приемных радиоламп.
посредственно с отверстием этого гнезда, выходы насосов связа-
ны отдельными каналами с венцом, к которому подведен общий
форвакуум. Часто между венцом и диффузионными насосами
устанавливают индивидуальные резервуары форвакуума; это в
значительной степени демпфирует колебания давления на входе
в диффузионный насос в случае внезапного увеличения давления
(например, вследствие разрушения баллона одной из ламп).
На фиг. 7.27 представлен 36-позиционный автомат с подвиж-
ными диффузионными насосами. Вакуум подводится к венцу
в четырех секциях; эти секции обслуживает один большой мас-
ляный ротационный насос.
7.9. УСТАНОВКИ ВЫСОКОГО ВАКУУМА ДЛЯ НАПОЛНЕНИЯ
ПРИБОРОВ ОПРЕДЕЛЕННЫМИ ГАЗАМИ
На фиг. 7.28 представлена схема простой установки для на-
полнения вакуумных приборов определенными газами, преиму-
щественно инертными1).
') Резервуары для инертных газов и способы их присоединения к насо-
сам описаны в разд. 6.8.
ВАКУУМНЫЕ УСТАНОВКИ
549
Последовательность работы установки следующая. После от-
пайки от насоса последнего вакуумного прибора, наполненного
инертным газом, из-под охлаждаемой ловушки удаляется сосуд
с жидким азотом, закрывается кран 3 и открывается носок вспо-
могательной трубки 5, через которую воздух входит в гребенку
И (отсоединенную часть вакуумного тракта). Затем открывают
Фиг. 7.28. Схема установки для наполнения вакуумных приборов инертными
газами.
1 — 4 — краны, 5 — ниппель гребенки; 6 — укороченный барометрический манометр; 7 —
манометр Маклеода; 8—ротационный насос; 9 — диффузионный иасос; 10 — сушилка;
// — гребенка для напайки вакуумных приборов; /2 — форвакуумный баллон; Ne — резер-
вуары чистого инертного газа (неона).
трубки откачки и напаивают поочередно новые вакуумные при-
боры, которые должны быть наполнены газом (во время напаи-
вания для обдува пользуются вспомогательной трубкой 5).
После этого отверстие 5 запаивают. Затем устанавливают кран 1
в положение //, а кран 2— из положения // в положение / и по-
степенно открывают кран 3, благодаря чему в напаянных на на-
сос приборах устанавливается давление форвакуума. После про-
верки герметичности (с помощью манометров, при установке на
определенное время крана 2 в положение ///) надвигают на от-
качанные приборы электрическую печь и нагревают их. По исте-
чении 10—20 мин, когда приборы нагреются до 500—550 К, по-
степенно надвигают (снизу) сосуд с жидким азотом на охлаж-
даемую ловушку и устанавливают кран 2 в положение II, а кран
550
ГЛАВА 7
1— в положение /. При этом вводится в действие диффузион-
ный насос.
Когда после дальнейшего прогрева и обезгаживания в высо-
кочастотной индукционной печи вакуум достигнет уровня 10-6 Тор
(нижний предел диапазона измерений манометрами Маклеода),
устанавливают краны 1 и 2 в положение III и наполняют си-
стему инертным газом. Давление этого газа контролируется уко-
роченным барометром 6 или вакуумным манометром Маклеода
7. Отпайка приборов от насоса может проводиться при открытом:
или закрытом кране 3. Второй вариант имеет то преимущество,
что в случае внезапного нарушения герметичности манометры
не повреждаются (вследствие резкого удара ртути); недостат-
ком же его является то, что из-за малого объема вакуумного
тракта выделяемые из стекла газы могут при отпайке несколько
ухудшить вакуум.
7.10. УСТАНОВКИ ДЛЯ ПОЛУЧЕНИЯ ОЧЕНЬ ВЫСОКОГО ВАКУУМА
На фиг. 7.29 представлена схема одной из наиболее современ-
ных установок для создания очень высокого вакуума (порядка
Фиг. 7 29 Установка для получения очень высокого вакуума (фирма
Varian, США).
/—колпак из пирекса, 2 —защитная сетка, 3 — сублимационный насос; 4~ экран, 5 —
? —краны, /0 — контрольно-измерительная стойка; //— цеолитовые насосы; 12— магнит-
ный электроразрядный насос.
10-10 Тор); в ней применяются только сорбционные насосы, и,
таким образом, загрязнение парами органических веществ ис-
ключено.
Основными элементами установки являются колпак объемом
120 л (диаметр 45 см, высота 75 см), установленный на ка-
ВАКУУМНЫЕ УСТАНОВКИ
551
мере сублимационного насоса, магнитный электроразрядный на-
сос, три цеолитовых насоса, краны, контрольно-измерительная
стойка и блок питания. Колпак защищен предохранительной сет-
кой и снимается при помощи небольшого электрического подъем-
ника (на рисунке не показано).
Цеолитовые насосы, включаемые последовательно, снижают
давление от атмосферного вплоть до давления порядка 10~3 Тор;
после этого включается электроразрядный и, если надо, субли-
мационный насос Изменение давления по времени при работе
насосов показано на фиг. 7.30.
Фиг. 7.30. Характеристика откачки
установки очень высокого вакуума
(представленной на фиг. 7 29).
/ — цеолитовые насосы (I, II, III); 2 —
магнитный электроразрядный иасос, <? —
магнитный электроразрядный и сублима-
цнонный насосы.
Сублимационный насос обеспечивает скорость откачки (азо-
та) ~8000 л-с-1. Откачка производится с помощью четырех
вольфрамовых стержней (нагреваемых электрическим током до
высокой температуры), на которые навита титановая проволока.
Титан осаждается из паров на стенки резервуара насоса.
Магнитный электроразрядный насос с холодным катодом
обеспечивает скорость откачки 400 л-с-1. Цеолитовые насосы для
повышения эффективности откачки можно погружать в сосуды
Дьюара с жидким азотом; регенерация цеолита проводится пу-
тем нагревания.
В принципе установка может работать без охлаждения жид-
ким азотом. Рекомендуется прогревать колпак и резервуар суб-
лимационного насоса (до умеренно высокой температуры) при
помощи асбестовых тканей, прошитых нагревательной прово-
локой.
552
ГЛАВА 7
Активные газы откачиваются цеолитовыми и сублимационным
насосами, неактивные газы — магнитным электроразрядным на-
сосом.
Стеклянная насосная установка для создания сверхвысокого
вакуума в небольших объемах была описана в разд. 4.2.2.6. Дав-
ление порядка 10-13 Тор можно также получить с помощью од-
ного лишь диффузионного насоса при условии идеального обез-
гаживания системы и вымораживания паров ртути жидким азо-
том.
7.11. ОБОРУДОВАНИЕ ДЛЯ ГРАДУИРОВКИ МАНОМЕТРОВ
И ИССЛЕДОВАНИЯ НАСОСОВ
Методы градуировки манометров, а также измерения ско-
рости откачки и других параметров вакуумных систем рассмат-
ривались в разд. 5.8.
Для проведения таких измерений и исследований исполь-
зуются специальные установки.
Градуируемые и эталонные манометры или же исследуемые
насосы присоединяют к системе, в которой создается требуемое
давление определенного газа, чаще всего динамическим (проточ-
ным) методом.
Оборудование должно отвечать требованиям, вытекающим из
применяемого измерительного метода, как, например, обеспече-
ние достаточно низкого предельного давления (герметичность,
хорошие насосы), соответствующего распределения давлений и
температур, дозировки притока (калиброванные отверстия, регу-
ляторы) и оттока газа (регулирование скорости откачки при по-
мощи диафрагмы) и т. п.
На фиг. 7.31 схематически представлена система для абсо-
лютной градуировки манометров в пределах 10~2—10~8 Тор. Пре-
дельное давление в системе составляет 10-10 Тор. Погрешность
градуировки при давлении 10-8 Тор не превышает 5%, а при
давлении 10-4 Тор — 3%. В диапазоне давлений 10-2—10-4 Тор
градуировка производится путем непосредственного сравнения
результатов измерений с показаниями вакуумного манометра
Маклеода; при этом погрешность градуировки не превышает 3%.
7.12. ОТДЕЛЕНИЕ ВАКУУМНОГО УСТРОЙСТВА ОТ НАСОСА
После откачки вакуумного устройства его следует отделитв
от насоса. Различают отпайку, когда вакуумпровод стеклянный,
зажим (часто со сваркой) и отсечку, когда вакуумпровод метал-
лический.
ВАКУУМНЫЕ УСТАНОВКИ
553
7.12.1. Отпайка
Трубка, через которую производится откачка, имеет суженный
участок (ниппель) (фиг. 7.32). При отпайке ее нагревают в месте
сужения с помощью ручной газовой горелки до размягчения
Фиг. 7.31. Схема установки для абсолютной градуировки манометров (фирма
Edwards, Великобритания).
/—рабочая камера (к верхней ее части присоединяются манометрические датчики), 2 —
система уголковых отражателей (два верхних охлаждаются жидким азотом, температура
инжнего 243 К), 3 — масляный диффузионный насос (2700 л-с’1); 4 —масляный диффу-
зионный насос (50 л с’1), 5 — масляный диффузионный насос (8 л с'1); 6 — масляный
ротационный насос (4 л • с’1). 7 — масляный ротационный насос (1,5 л с'1), 8 — ловушки
с централизованным питанием жидким азотом (расход N2 ~ 100 л в сутки); S — клапаны
и краны; 10, 11— вакуумные резервуары, 12— калиброванные жиклеры, 13— печка
(12 кВт, 720 К).
стекла и одновременно растягивают, пока стенки ниппеля не
смыкаются и не возникает герметичная перемычка из стекла ме-
жду отпаиваемым прибором и вакуумным каналом. Отпайку хо-
рошо производить специальной горелкой с двумя факелами, на-
правленными навстречу друг другу и нагревающими трубку в
месте отпайкр с обеих сторон одновременно.
554
ГЛАВА 7
При отпайке следует обращать внимание на выделение неко-
торого количества газов с размягчаемого участка отпаиваемой
трубки. Поэтому рекомендуется после предварительного сильного
прогрева места отпайки дать насосу некоторое время для от-
качки выделившихся газов и только после этого окончательно
отпаять вакуумный прибор, причем суженная трубка должна за-
крыться сначала со стороны вакуумного прибора, а затем за-
крытый участок следует удлинять в направлении насоса. На
Фиг. 7.33 Зажим (с последующей
сваркой) вакуумной металлической
трубки.
1 — место отделения от вакуумной установ-
ки; £', Е" — электроды сварочного аппа-
рата.
Фиг. 7.32 Отпайка от вакуумной
установки
а — неправильное сужение; б — правильное
сужение; в — оплавленный конец трубки.
фиг. 7.32, а представлено неправильное сужение, на фиг. 7.32, б —
правильное, а на фиг. 7.32, в показан оплавленный конец
трубки.
Отпайку можно производить как при отключенном, так и при
подключенном насосе. Каждый из этих способов имеет свои пре-
имущества и недостатки. Первый способ позволяет предохра-
нить насос от вторжения воздуха в случае образования трещин
во время отделения откачанного вакуумного прибора. Однако
при этом способе отпайки вакуум в приборе хуже вследствие
бездействия насоса во время отпайки.
Приступая к откачиванию следующей серии приборов, после-
довательно отсекают от канала остатки ниппелей и напаивают
новые приборы, предназначенные для откачки.
ВАКУУМНЫЕ УСТАНОВКИ
555
7.12.2. Зажим (и сварка)
В случае металлических трубок (диаметром до 20 мм) ваку-
умные приборы отделяют от насосной «гребенки» после предва-
рительного зажима (и возможной сварки) трубки между насо-
сом и прибором. Для этого трубку сплющивают специальными
клещами, а затем острыми накладками с большим удельным на-
гружением обжимают металл до получения требуемой степени
герметичности. Место зажима можно дополнительно заварить
электрическим сварочным аппаратом с острыми электродами
(фиг. 7.33) или запаять после отделения с помощью припоя, вве-
денного в щель трубки.
7.13. АВТОМАТИЗАЦИЯ ВАКУУМНЫХ УСТАНОВОК
В вакуумных установках, предназначенных преимущественно
для непрерывной эксплуатации, с целью повышения производи-
тельности, а также для улучшения качества технологических
процессов (например, когда требуется точно выдерживать опре-
деленное давление при проведении процесса) все шире приме-
няется автоматизация оборудования, а также программирование
процессов. Степень автоматизации зависит от назначения уста-
новки и ограничена главным образом экономическими сообра-
жениями.
В вакуумной системе прежде всего автоматизируют такие
элементы, как вакуумные клапаны и электрические выключатели
двигателей, нагревателей, электрических печей и механизмов,
служащих для передачи движения в вакуум, регуляторы расхода
и стабилизаторы уровня охладителя в отражателях, охлаждае-
мых ловушках и криогенных насосах и т. п.
Источниками управляющих сигналов обычно являются мано-
метры, масс-спектрометры, термометры, измерители расхода и
другие устройства. Эти сигналы через посредство электронных
усилителей, преобразователей и реле воздействуют на исполни-
тельные элементы (электромагнитные, пневматические, гидрав-
лические, механические и т. п.) соответствующих устройств (от-
крывание и закрывание клапанов, выключение и включение на-
сосов и т. д.).
В таких случаях манометры снабжаются приспособлениями,
которые автоматически переключают измерительные пределы
в зависимости от величины измеряемого давления.
Автоматизация вакуумного стенда касается прежде всего его
пуска и подготовки к нормальной работе (последовательность
включения отдельных насосов по мере получения требуемых дав-
лений, блокировка нежелательных действий ввиду возможности
повреждения установки и т. п.).
556
ГЛАВА 7
Выключение вакуумного стенда после нормальной работы
также требует соответствующей последовательности действий,
Г
Фиг. 7.34. Схема автоматизированного вакуумного стенда.
Толстые линии — вакуумная система; штриховые линии - электронные и электрические
системы; тонкие линии — функциональные связи.
/ — масляный ротационный насос; 2—масляный диффузионный насос, 3 — вакуумный
баллон, 4 — охлаждаемая ловушка; 5 — вакуумная технологическая камера, 6—/^ — кла-
паны; 11 — регулятор расхода и температуры охлаждающей воды; 12, 13 — теплоэлектри-
ческие манометры; 14 — ионизационный манометр.
определяемой, в частности, медленным остыванием нагретых или
нагреванием охлажденных элементов. Подача охладителя, на-
пример, не прекращается, пока не остынет масло в насосе. Крио-
ВАКУУМНЫЕ УСТАНОВКИ
557
агент нельзя удалять из охлаждаемой ловушки до закрытия
крана, соединяющего ее с пространством высокого вакуума.
Вакуумная система запускается и останавливается особенно
часто, если технология производства требует частой смены газо-
вой среды (например, для помещения в нее новых объектов).
В ходе проведения технологического процесса часто бывает
необходимо поставить скорость выделения газов в зависимость
от возможности поддержания определенного давления; для этого
ускоряют или замедляют процесс обезгаживания, регулируют ко-
личество вводимого газа и т. п.
Автоматика должна предусматривать блокировку с целью
предотвращения повреждения важных элементов в случае ава-
рии или неправильного обращения.
На фиг. 7.34 представлена схема сравнительно простого авто-
матизированного вакуумного стенда для откачки вакуумной ка-
меры, предназначенной для проведения технологических процес-
сов.
Оборудование стенда состоит из масляного ротационного на-
соса 1, масляного диффузионного насоса 2 (с водяным охлажде-
нием), вакуумного баллона 3, охлаждаемой ловушки 4, тепло-
электрических манометров 12 и 13, ионизационного манометра
14, вакуумных клапанов с электроприводом 6, 7 и 8, высокова-
куумного клапана 9 и напускного клапана 10, а также регуля-
тора расхода и температуры охладителя диффузионного насоса
7.14. ТЕХНИКА БЕЗОПАСНОСТИ
Обслуживание вакуумных установок и проведение технологи
ческих процессов в вакууме требуют соблюдения определенных
правил техники безопасности.
Специфическая опасность работы с вакуумом сопряжена
с возможностью разрушения вакуумных резервуаров под дей-
ствием атмосферного давления. При этом, особенно в случае
стеклянных резервуаров, может произойти травмирование оскол-
ками стекла. Предохранительной мерой является размещение
резервуаров за металлической сеткой или пластинчатым экра-
ном.
Причиной взрыва могут быть также взрывчатые смеси, обра-
зующиеся из остатков газов и паров, содержащих углеводороды
или водород, например, при сварке промытых, но не проветрен-
ных резервуаров или при использовании жидкого воздуха в ох-
лаждаемых ловушках, установленных вблизи входа в масляный
насос.
Применяя ртуть (в диффузионных насосах, манометрах, за-
творах и т. п.), всегда следует считаться с присутствием ее паров
вблизи установки, а также возможностью их распространения
558
ГЛАВА 7
в помещении, особенно если ртуть была пролита. В случае пре-
вышения допустимого для здоровья уровня концентрации паров
ртути следует провести обработку помещений с целью нейтрали-
зации паров ртути и применить усиленную вентиляцию.
При работе с криогенными жидкостями существует опасность
обморожения, а со сжатыми газами — взрыва; поэтому баллоны
с такими веществами должны находиться в бетонных оболоч-
ках вне помещения.
Кроме этих специфических опасностей вакуума, существуют
опасности, связанные с применением высоких напряжений, а
также взрывчатых и отравляющих веществ, что требует соответ-
ствующей техники безопасности.
БИБЛИОГРАФИЯ
Adam Н., Diels К., Industrielle Anwendungen der Vakuumtechnik in der
Metaliurgie, Essen, 1964.
Акишин А И., Ионная бомбардировка в вакууме, Госэнергоиздат, М.,
1963.
Александрова А. Т., Бродский С. И , Ширенко Г. Н , Технологическое обо-
рудование электровакуумного производства, Госэнергоиздат, М., 1962.
Alpert D„ Production and Measurement of Ultrahigh Vacuum (Handbuch
der Physik, Bd. 12), Springer, Berlin, 1958.
Ardenne M. von, Tabelleen der Elektronenphysik, lonenphysik und Ubermik-
roskopie, Bd II, VEB Deutscher Verlag der Wissenschaften, Berlin, 1956.
Ardenne M. von; Tabellen zur angewandten Physik, Bd II, Physik und
Technik des Vakuums, Plasma Physik, VEB Deutscher Verlag der Wissenschaf-
ten, Berlin, 1964.
Atta С. M. van, Vacuum Science and Engineering, McGraw-Hill, New
York, 1965.
Bachman W., Manometrie, Leipzig, 1966.
Bachner D„ Koelzer W., Muller D., Untersuchungen tiber die Kondensation
verschiedener Gase, Berlin, 1966.
Балицкий А В., Технология изготовления вакуумной аппаратуры, изд-во
«Энергия», М., 1966.
Barrington А. Е„ High Vacuum Engineering, Prentice-Hall, Englewood
Cliffs, New York, 1963.
Bachler W„ Sputter-ion-pumps, Working Principle and Applications, Ley-
bold’s Nachf., Cologne.
Beck A. H. (ed.), Handbook of Vacuum Physics, Vol. I, Gases and Vacua,
vol. II, Electrinics, vol. Ill, Technology, Pergamon Press, Oxford, 1964.
Behrndt К. H. (ed.), Vacuum Microbalance Techniques, Plenum Press, New
York, 1966.
Belk J. A., Vacuum Techniques in Metallurgy, Pergamon Press, Oxford,
1963
Bentley G. P., Leece J., The Omegatron, DEG Report 327, Risley, 1961.
Berenson H., Materialoznawstwo techniki prozniowej, PWT, Warszawa,
1955.
Blaha A, Teoria vakuovej techniky, SNTL, Bratislava, 1953.
Blaha A., Vyroba a kontrola vakua, SNTL, Bratislava, 1954.
Blaha A„ Vakuove merania, SVTL/SNTL, Bratislava. 1960.
Blauth E. W., Dynamische Massenspektrometer, F. Vieweg u. S., Braunsch-
weig, 1965.
Блискунов H. А., Каменецкий И Я., Технология производства электро-
вакуумных приборов, Госэнергоиздат, Л. — М., 1959,
560
БИБЛИОГРАФИЯ
Борозденков В. И., Вакуумные насосы в химической промышленности, Маши-
ностроение, М., 1964.
Брейдо И. Я-, Ламповые усилители сигналов постоянного тока, Госэнер-
гоиздат, М., 1960.
Brombacher W. G„ Bibliography and Index on Vacuum and Low Pressure
Measurement, National Bureau of Standards Monograph 35, Supplement 1960—
1965, Washington, 1961, 1967.
Brunee C., Voshage H., Massenspektroskopie, K- Thiemig, Mfinchen, 1964.
Brunner W. F., Batzer T. H., Practical Vacuum Techniques, Reinhold Pub-
lishing Corp., New York, 1965.
Buch S., Einfiihrung in die allgemeine Vakuumtechnik, Wissenschaftliche
Verlagsgesellschaft, Stuttgart, 1962.
Булыга А. В., Полупроводниковые теплоэлектрические вакуумметры, изд-
во «Энергия», М., 1966.
Wagner G., Erzeugung und Messung von Hochvakuum, F. Deuticke, Wien,
1950.
Vance E. D., Cryogenic Technology, New York, 1963.
Vance R. W., Duke W. M., Applied Cryogenic Engineering, New York, 1962.
Ward L., Bunn J. P., Introduction to the Theory and Practice of High Va-
cuum Technology, Butterworth, London, 1967.
Weber F., Elsevier’s Dictionary of High Vacuum Science and Technology
(in 6 languages), Elsevier Publishing Company, Amsterdam/London/New
York, 1968.
Веклич П. M., Ощипков Ф. П., Фролов В. К., Технология электровакуум-
ного стекла, Госэнергоиздат, М., 1961.
Wesolowski К-, Metaloznawstwo, t. II, WNT, Warszawa, 1969.
Windsor E. E., Physik und Technik von Sorptions- und Desorptions Vor-
gangen bei niederen Driicken. R. A. Lang Verlag, Esch, 1963.
Winkler 0., Bakish R., Vacuum Metallurgy, Elsevier, Amsterdam, 1971.
Воронов T. А., Соболев В. Д., Физические основы электровакуумной тех-
ники, изд-во «Высшая школа», М., 1968.
Востров Г. А., Розонов А. Н., Вакуумметры, Машиностроение, М., 1967.
Wutz М., Theorie und Praxis der Vakuumtechnik, F. Vieweg, Braunschweig,
1965.
Wutz M., Molekularkinetische Deutung der Wirkungsweise von Diffusion-
spumpen, F. Vieweg, Braunschweig, 1970.
Goetz A., Physik und Technik des Hochvakuums, F. Vieweg, Braunschweig,
1926.
Gorski W., Pytkowski S-, Wykrywanie nieszczelnosci w aparaturze proznio-
wej, PWN, Warszawa, 1961.
Gray H. B., Elektrony i wiqzania chemiczne, PWN, Warszawa, 1968.
Green G. W., Design and Construction of Small Vacuum Systems, Chap-
man and Hall, London, 1968.
Gregg S. J., Sing K. S., Adsorption. Surface Area and Porosity, Acade-
mic Press, London, 1967.
Groszkowski J., Technika wysokiej prozni, Panstwowy Instytut Telekomu-
nikacyjny, Warszawa, 1948.
Groszkowski J., Technologia wysokiej prozni. PWT Warszawa Wvd I —
1953, Wyd. II — 1955.
Groszkowski J., Technika wysokej prozni, WNT, Warszawa, 1972.
Грошковский Я., Технология высокого вакуума. ИЛ, М., 1957.
Groszkowski J., Zagadnienia wysokiej prozni, WKiL, Warszawa, 1968.
Гуляев. M. А., Ерюхин A В., Измерение вакуума, изд-во «Стандарты»,
М., 1967.
Guericke, Otto von, Neue (sogenannte) Magdeburger Versuche fiber den
leeren Raum, VDI-Verlag, Dusseldorf, 1968.
БИБЛИОГРАФИЯ
561
Guthrie A., Vacuum Technology, John Wiley, New York, 1963.
Guthrie A.. Wakerling R., Vacuum Equipment and Techniques, McGraw-
Hill, New York, 1949.
Giintherschulze G., Vacuum Technique, Pergamon Press, Oxford, 1965.
Данилин Б. С., Металлические вакуумные установки, ВЗЭИ, М., 1958.
Данилин Б. С., Конструирование вакуумных систем, Госэнергоиздат, М.,
1959.
Данилин Б. С., Вакуумные насосы и агрегаты, Госэнергоиздат, М,, 1957.
Данилин Б. С., Вакуумное нанесение тонких пленок, изд-во «Энергия»,
М„ 1967.
Данилин Б. С., Минайчев В. Е., Основы конструирования вакуумных си-
стем, изд-во «Энергия», М., 1971.
David R., Richard A., Le vide — Formation et controle des couches minces,
Dunod, Paris, 1970.
Davy J. K-, Industrial High Vacuum, Pitman and Sons, London, 1951.
Delafosse J., Mongodin G., Les calculs de la technique du vide, SFITV,
Paris, 1970.
Dennis N. T. M., Heppell T. A„ Vacuum System Design, Chapman and
Hall, London 1968.
Diels K., Jaeckel R., Leybold Vakuum Taschenbuch, Springer, Berlin, 1958.
Dunoyer L., La technique du vide, Presses Universitaires, Paris, 1924.
Dunoyer L., Le vide et ses applications, Paris, 1951.
Dushman S., High Vacua, GEC—Schenectedy, New York, 1922.
Dushman S., Production and Measurement of High Vacua, New York, 1923.
Дэшман С., Научные основы вакуумной техники, изд-во «Мир», М., 1964.
Зандберг Э. Я., Ионов Н. И., Поверхностная ионизация, изд-во «Наука»,
М., 1969.
Zatuka Н., Spawanie wiqzkg elektronowg, WNT, Warszawa, 1968.
Zobac L., Zaklady vakuove techniky, SNTL, Praha, 1957.
Иориш A. E., Кацман Я. А., Птицын С. В., Шейнгауз А. А.. Основы тех-
нологии производства электровакуумных приборов, изд-во «Энергия», М.,
1971.
Иванов А. А., Электровауумная технология, Госэнергоиздат, М., 1944.
Иванов Ф. М., Вакуум, Гостехиздат, М., 1958.
Jaeckel R., Allgemeine Vakuumphysik (Handbuch der Physik, Bd. 12.),
Springer, Berlin, 1958.
Jnanananda S., High Vacua, Van Nostrand, New York, 1947.
Juillet F., Nieuwenhuyze F. van, Techniques et applications de 1’ultravide,
Masson, Paris, 1969.
Капцов H. А., Электрические явления в газах и вакууме, Гос. изд. техн,-
теор. лит., М., 1950.
Kaye G. W. С., High Vacua, Langmans, Green Co., London, 1927.
Кешишян T. H., Бутт Л. M., Технология стекла, Промстройиздат, M.,
1949.
Kohl W. H., Materials Technology for Electron Tubes, Chapman and Hall,
New York, 1951.
Королев Б И., Основы вакуумной техники, изд-во «Энергия», М., 1964.
Ковалевский Р. Е., Чекмарев А. А., Конструирование и технология ва-
куумноплотных паяных соединений, изд-во «Энергия», М., 1968.
Казаков Н. Ф. (ред.), Диффузионное соединение в вакууме металлов,
сплавов и неметаллических материалов, Министерство высш, и сред, образо-
вания РСФСР, М., 1971,
562
БИБЛИОГРАФИЯ
Крылов К. И., Физические основы электровакуумной техники, Госэнерго-
издат, М., 1953.
Kuczynski W., Adsorpcja gazow, Cz. I. Poznanskie Tow. Przyjaciol Nauk,
Poznan, 1963.
Кузнецов В. И., Механические вакуумные насосы, Госэнергоиздат, М.,
1959.
Кльнев В., Григоров Г., Висок вакуум, Техника, София, 1965.
Ланис В. А., Левина Л. Е., Техника вакуумных испытаний, Госэнергоиз-
дат, М., 1963.
Laporte Н., Hochvaktium, seine Erzeugung, Messung und Anwendting, W.
Knap, Halle, 1951.
Laporte H. G., Vakuummessungen, VEB Verlag Technik, Berlin, 1955.
Лебединский M. А., Электровакуумные материалы, изд-во «Энергия», М.,
1966.
Лебединский М. А., Технология электровакуумного производства, Гос-
энергоиздат, М., 1961.
Leblanc М., La technique du vide, A. Colin, Paris, 1951.
Лекк Дж., Измерения давления в вакуумных системах, изд-во «Мир»,
М., 1966.
Лейканд М. С., Вакуумные электрические печи, изд-во «Энергия», М.,
1968.
Lewin G., Fundamentals of Vacuum Science and Technology, McGraw-Hill,
New York, 1965.
Loeb L. B., Basic Processes of Gaseous Electronics, Berkely, 1960.
Loeb L. B., The Kinetic Theory of Gases, New York, 1961.
Любимов M. Л., Спаи металла co стеклом, Госэнергоиздат, M., 1957.
McDaniel Е. Collision Phenomena in Ionized Gases, John Wiley, New
York, 1964.
McDowell C. A. (ed.), Mass Spectrometry, McGraw-Hill, New York, 1963.
Malkiewicz T., Radzwicki K., Zakowa H., Metalurgia prozniowa, Kato-
wice, 1961.
Martin L. H., A Manual of Vacuum Practice, University Press, Melbourne,
1949.
Martin L. H., Hill R. D., A Manual of Vacuum Practice, University Press,
Melbourne, 1946.
Мармер E. H., Ферштер Л. M., Расчет и проектирование вакуумных си-
стем электропечей, Госэнергоиздат, М., 1960.
Maurand М„ Traite pratique de technique du vide, Ass. Nation, des Inge-
nieurs, Paris, 1958.
Miller A. R., Adsorption of Gases in Solids, London, 1949.
Millner, Szalkay, Porubsky, Vamberi, Deri, Vakuumtechnika, Neheazipari
Konyvkiado, Budapest, 1953.
Morice L., Pratique du controle de I’etancheite a 1’helium. SFITV, Paris,
1967
M6nch G. Ch., Hochvakuumtechnik, R. A. Lang, Posneck, 1950.
Monch G. Gh„ Neues und Bewahrtes aus der Hochvakuumtechnik, W. Knap,
Berlin, 1961,
Muller K. G., Vakuumtechnische Berechnungsgrundlagen, Verlag Chemie,
Weinheim, 1961.
Мейснер С. P. (ред.). Современная вакуумная техника, ИЛ, М., 1963.
Newman F. Н., Production and Measurement of Low Pressures, E. Benn,
London, 1925,
БИБЛИОГРАФИЯ
563
Неуструев А. А., Ходоровский Г. Л., Вакуумные гарниссажные печи, изд-
во «Металлургия», М., 1967.
Овсянников К. М., Основы расчета вакуумных систем, применяемых в
литейном производстве, изд-во «Машиностроение», Л., 1971.
Paty L., Fizika nizkych tlaku, Akademia, Praha, 1968.
Пазухин В. А., Фишер А Я., Вакуум в металлургии, Металлургиздат,
М., 1956.
Pietraszewicz W., Styrczula A., Glogowski J., Szulc E., Manometry, PWT,
Warszawa, 1957.
Пипко А. И., Плисковский В. Я., Пенчко Е. А., Оборудование для от-
качки вакуумных приборов, изд-во «Энергия», М., 1965.
Пипко А. И., Плисовский В. И., Пенчко Е. А., Конструирование и расчет
вакуумных систем, изд-во «Энергия», М., 1970.
Pirani М., Yarwood J., Principles of Vacuum Engineering, Chapman-Hill,
London, 1961.
Пивоваров Г. Я., Технологические процессы электровакуумного производ-
ства, изд-во «Энергия», М., 1964.
Плешивцев Н В., Катодное распыление, Атомиздат, М., 1968.
Papoular R., Electrical Phenomena in Gases, London, 1965.
Power B. D., High Vacuum Pumping Equipment, Chapman and Hall Ltd.,
London, 1966.
Powell C. F., Oxley J. H., Blocher M., Vapor Deposition, John Wiley, New
York, 1966.
Pupp W., Vakuumtechnik, Bd. I. Grundlagen, 1962; Bd II. Anwendungen,
1964, K. Thiemig, Munchen.
Redhead P. A., Hobson I. P., Kornelsen E. V., Ultrahigh Vacuum (Advan-
ces in Electronic and Electron Phvsic, vol. 17), Academic Press, London,
1962.
Redhead P. A., Hobson J. P., Kornelsen E. V., The Physical Basis of Ul-
trahigh Vacuum. Chapman and Hall, London, 1968.
Reiman A. L., Vacuum Technique, Chapman and Hall, London, 1952.
Riviere J. C., An Introduction to Vacuum Technique, London, 1962.
Roberts E. W., Vanderslice T. A., Ultrahigh Vacuum and its Applications,
Prentice Hall Inc., New York, 1964.
Robinson N. W., The Physical Principles of Ultrahigh Vacuum Systems
and Equipment, Chapman and Hall, London, 1968.
Roseburg F., Handbook of Electron Tubes and Vacuum Techniques, Ad-
dison Wesley Publ. Co., Reading (USA) 1965.
Роуз-Инс А., Техника низкотемпературного эксперимента, изд-во «Мир»,
М., 1966.
Roth A., Vacuum Sealing Techniques, Pergamon Press, Oxford, 1966.
Rous B., Sklo v elektronice, SNTL, Praha, 1966.
Савинский К- А., Высоковакуумные насосы и агрегаты, Изд-во АН СССР,
М., 1954.
Scott R. В., Technika niskich temperatur, WNT, Warszawa, 1963.
Sitko V., Vakuova technika, SNTL, Praha, 1966.
Славянский В. T., Газы в стекле, Оборонгиз, М., 1957.
Сливаков И. Н., Михайлов В. И., Сидоров И. И„ Настюка А. И., Элек-
трические приборы и разряды в вакууме, Атомиздат, М.. 1968.
Spinks W. S., Vacuum Technology, Chapman and Hall Ltd., London, 1963.
564
БИБЛИОГРАФИЯ
Steinherz Н. A., Handbook of High Vacuum Engineering, Reinhold Publ.
Co., N. Y.
Steyskal H., Arbeitsverfahren und Stoffkunde der Hochvakuums-technik,
Physik-Verlag, Mosbach/B, 1955.
Тетерюков В. И., Ротационные вакуум-насосы и компрессоры с жидкост-
ным поршнем, Госэнергоиздат, М, 1966.
Timmerhaus К. D., (ed.), Advances in Cryogenic Engineering, Plenum
Press Inc., New York, 1970.
Trendelenburg E. A., Ultrahochvakuum, G. Braun, Karlsruhe, 1963.
Turnbull A. H., Barton R. S., Riviere J. C., Vacuum Technique, New York,
1962.
Тягунов Г. А., Основы расчета вакуумных систем, Госэнергоиздат, М.,
1948.
Urbanski W. S., Zarys kinetycznej teorii gazow, PWN, Warszawa — Lublin,
1955.
Фастовский В. Г., Петровский Ю. В., Ровинский А. Е., Криогенная тех-
ника, изд-во «Энергия», М., 1967.
Flood Е. A., The Solid-Gas Interface, Arnold-Dekker, London, 1967.
Heinze W., Einfiihrung in der Vakuumtechnik, VEB Verlag, Berlin, 1955.
Helgesson I. C., Ceramic to Metal Bonding, Sateborg, 1968.
Henry R. P., Cours de science et technique du vide, Societe Fran^aise des
Ingenieurs et Techniciens du Vide, Paris, 1969—1970.
Hildebrand J. H„ An Introduction to the Molecular Kinetic Theory, New
York, 1963.
Holland L., The Properties of Glass Surfaces, Chapman and Hall, London,
1964.
Holland J., Vacuum Deposition of Thin Films, Chapman and Hall, London,
1956.
Holland-Merten E. L„ Die Vakuumtechnik, Erfurt, 1930.
Holland-Merten E. L., Handbuch der Vakuumtechnik, W. Knap, Halle/S,
1936.
Holland-Merten E. L., Tabellenbuch der Vakuumverfahrenstechnik in der
Grundesstoffindustrie, VEB Deutscher Verlag, Leipzig, 1964.
Carpenter L. G„ Vacuum Technology, Elsevier’s Publishing Co., New York,
1970.
Цейтлин А. Б., Пароструйные вакуумные насосы, изд-во «Энергия», М.,
Champeix R., Physique et technique des tubes electroniques, vol. I, Elements
de techniques du vide, Dunod, Paris, 1968. •
Colnot P., Gallet G., La verre et la ceramique dans la technique du vide.
Paris, 1962.
Черепнин H. В., Вакуумные свойства материалов для электронных при-
боров, изд-во «Советское радио», М., 1966.
Черепнин Н. В., Основы очистки, обезгаживания и откачки в вакуумной
технике, изд-во «Советское радио», М., 1967.
Yarwood J., High Vacuum Technique, Chapman and Hall, London, 1967.
Young D. M., Growell A. D„ Physical Adsorption of Gases, Butterworths,
London, 1962.
БИБЛИОГРАФИЯ
565
Энгель А., Ионизованные газы, Физматгиз, М., 1959.
Eschbach Н. L„ Praktikum der Hochvakuumtechnik, Akademische Verlags-
gesellschaft, 1964.
Espe W., Werkstoff der Hochwakuumtechnik; Bd I., Metalle und metallisch-
leitende Werkstoffe, 1959; Bd II., Silikat Werkstoffe, 1960; Bd III., Hilfwerk-
stoffe, 1961; VEB Deutscher Verlag der Wissenschaften, Berlin.
Espe W , Werkstoffkunde der Hochvakuumtechnik, VEB Deutscher Verlag
der Wissenschaften, Berlin, 1961.
Юдин E. И., Насосы, основные параметры и расчет, Москва, 1965.
Яккель Р., Получение и измерение вакуума, ИЛ, М., 1952.
ПЯТИЯЗЫЧНЫЙ СЛОВАРЬ ВАЖНЕЙ
С ПРЕДМЕТНЫМ
Русский Польский Английский
А абсорбция адсорбция аккомодация активированный газ альфатрон анализатор (газа) анод атмосферное давление Б бессмазочный вентиль бустер, бустерный насос быстродействующее со- единение бустерный насос, вспо- могательный насос биметалл барометр В вакуум вакуум абсолютный вакуумная камера вакуумный колокол вакуумная печь вакуумный трубопровод вакуумное простран- ство, откачанный объ- ем вакуумный сосуд absorpcja adsorpcja akomodacja gaz zaktywowany alfatron analizator anoda cisnienie atmosferyczne zawor bezsmarowy pompa posrednia (bo- oster) pol^czenie «szybkie» booster bimetal barometr proznia proznia absolutna komora prozniowa klosz prozniowy piec prozniowy kanal prozniowy obszar prozniowy naczynie prozniowe absorption adsorption accomodation activated gas alphatron analyzer anode atmospheric pressure grease free valve booster, intermediate pump quick connections, quick joints booster pump bimetal barometer vacuum absolute vacuum vacuum chamber vacuum bell jar vacuum oven vacuum line, pipe vacuum space, evacuated volume vacuum container, tank, vessel 1
ШИХ ТЕРМИНОВ вакуумной ТЕХНИКИ
УКАЗАТЕЛЕМ
Французский Немецкий Стр. книги
absorption Absorption 107
adsorption Adsorption 107, 124, 269
accomodation Akkomodation 47,269,271
gaz active aktiviertes Gas 120
alphatron Alphatron 408
analyseur Analysator 422
anode Anode 269, 375
pression atmospherique atmospharischer Druck 29
vanne exempte de lubrification Fettlosventil 503
ponipe intermediate Zwischenpumpe 220
raccord rapide Schnellverbindung 495
pompe intermediate, pompe de boos- ter Boosterpumpe 220, 258
bimetal Bimeta 11 364
barometre Barometer 332 - 337
vide Vakuum 9
vide absolu ideales Vakuum 15
chambre a vide Vakuumkammer 516
cloche a vide Vakuumbehalte, Vakuumglocke 531
four a vide Vakuum-Ofen 519
conduite, canalisation, a vide Vakuumleitung 492
espace sous vide, volume evacue Vakuumraum 453, 505
vase a vide Vakuum-Gefass 455
568
Русский Польский Английский
вакуумная система uklad prozniowy vacuum system
вакуумная смазка, за- мазка smar prozniowy (vacuum) grease
вакуумный цемент kit prozniowy vacuum cement
вакуумпровод, ваку- умный трубопровод przewod (prozniowy) (vacuum) line, pipe
ввод тока dopromadzenie pr^dowe current lead-in, current lead-through
вентиль, клапан zawor valve
вентиль, клапан пере пускной zawdr bocznikujgcy by-pass valve
вероятность прилила- prawdopodobienstwo sticking probability, cap-
ния, сцепления przylgnie?ia ture probability, trapping efficiency
взаимодействие oddzialywanie (np ato- mow) interaction
влага wilgo6 humidity, moisture
внутреннее трение tarcie (wewngtrzne) (inner) friction
водоструйный насос pompa wodna water jet pump
водяной эжекторный на aspirator wodny water jet pump, aspirator
сос (аспиратор) pump
водяная рубашка plaszcz wodny water jacket
воск wosk wax
впайка, впаивание wtopienie seal-in, melt-in
впуск, вход (насоса) wlot (pompy) (pump) inlet, intake, mouth
вращающийся поршень tlok obrotowy rotary piston
время czas time
время образования мо- czas calkowitego pokry- monolayer time
номолекулярного слоя cia
время откачки czas pompowania pumping time, pump-down time
время пребывания czas przebywania time of sojourn, sojourn time, sticking time
всасывание, откачка, от- ssanie suction, sucking, inspira-
качивание tion
входное отверстие, otwor wlotowy (pompy) pump inlet, mouth, intake
впускное отверстие port
высокий вакуум prdznia wysoka high vacuum (HV)
высоковакуумное (на- сосное) масло olej (wysokoprozniowy) (high vacuum) oil
выпускное (выходное) отверстие otwor wylotowy outlet, exhaust port
выход, выходное отвер- wylot (pompy) (pump) outlet, exhaust
стне (насоса) (pump), exhaust port
569
Продолжение
1 1 Французский | Немецкий Стр. книги
systeme a vide Vakuum-System 469
graisse (a vide), (pour le vide) (Vakuum-) Fett 108, 484
ciment a vide, mastic pour le vide Vakuumkitt 108, 485
conduite, canalisation, tuyau (a vi- (Vacuum-) Leitung 492
de)
passage, traversee, amenee de cou- (Strom-) Zufiihrung, Strom- 510
rant durchfuhrung
vanne, soupape Ventil 498
vanne de derivation Beipassventil 205
probability de collage, de fixation, Haftwahrscheinlichkeit 128
d’adhesion Einfangkoeffizient
interaction, reaction reciproque Wechselwirkung 24, 35
humidite Feuchtigkeit 31, 33
friction (interne), frottement (innere) Reibung 51, 56
pompe a jet d’eau Wasserstrahlpumpe 215
pompe a jet d’eau Wasserstrahlpumpe 215
chemise d’eau Wassermantel 251, 259
cire Wachs 484
joint seelie Einschmelzung 511
admission, entree, (d’une pompe) Emlass einer Pumpe 174, 192,225
piston rotatif, piston tournant rotierender Kolben 177, 185
temps Zeit
temps de recouvrement (readsorp- Wiederbedeckungszeit 134, 307
tion)
temps de pompage Pumpzeit, Auspumpzeit 265
temps de collage, temps de retention Verweilzeit 49,132,280
aspiration, succion, pompage Saugen, Ausaugen, Einsaugen 171, 179,202
orifice d’entree d’aspiration Einlass, Ansaugoffnunung 173, 192,224
vide pousse, vide eleve Hochvakuum 15, 516
huile (a basse pression, pour pompes (Hochvakuum-) 61 141,230,238
a vide)
orifice d’echappement, d’expulsion Auspuff, Auspuffoffnung 173, 187,224
sortie, orifice d’echappemetit (d’une Auspuffoffnung 187, 224
pompe) (der Pumpen)
570
Русский Польский Английский
вязкий ВЯЗКОСТЬ вязкое течение Г lepki lepkosc ruch lepki, przeplyw lepki viscous viscosity viscous flow
газ газ благородный, инерт- ный газ газоразрядный (элек- троразрядный, с тлею- щим разрядом) насос геттер, поглотитель геттерный насос, суб- лимационный насос глазок для наблюдения, контрольное стекло (смотровое окно) gaz gaz rzadki, gaz szla- chetny pompa jarzeniowa pochlaniacz pompa sublimacyjna wziernik gas rare gas, noble gas sputtering ion pump getter sublimation pump viewing port, sight glass
д давление деионизация десорбция дегазирование, обезга- живание диаграмма откачки диапазон (измерения) динамическая система дистилляция диффузия диффузионный насос диффузионно-эжектор- ный насос дифференциальный ма- нометр дозирующий клапан (регулятор) cisnienie dejonizacja desorpcja odgazowanie krzywa pompowania zakres pomiarowy uklad dynamiczny destylacja dyfuzja pompa dyfuzyjna pompa ejektorowa prozniomierz roznico- wy zawor dozujqcy pressure deionization desorption degasification, degassing, outgassing pump-down curve measuring range dynamic system distillation diffusion diffusion pump ejector, booster pump differential vacuum gauge variable leak, dosage val- ve
Е единица jednostka unit
Ж жидкий газ, ожиженный газ, криогенная жид- кость ciekly gaz, skroplony gaz liquid gas
571
Продолжение
Французский Немецкий Стр. книги
visqueux viskos 51, 196, 478
viscosite Viskositat (Zehigkeit) 478
ecoulement visqueux viskose Stromung 65, 87, 100
gaz Gas II
gaz rare, gaz noble Edelgas 11, 31, 123
pompe du type Penning, a catode froide lonenzerstauberpumpe 318
getter absorbant, getter Getter 197,254,302
pompe a sublimation, pompe de sub- Sublimationspumpe 273, 307, 539
limation
hublot, fenetre d’observations Beobachtungsfenster 510
pression Druck 15, 24, 139
deionisation Deionisation 376, 384
desorption Desorption 324, 380, 405
degazage Entgazung, Entgazen 135, 469, 473
courbe de pompage Auspumpkurve 264, 307, 551
gamme, zone, plage de mesures (Mess-) Bereich 331, 441
systeme dynamique dynamisches System 470
distillation Distillation 196, 238
diffusion Diffusionspumpe 152, 224
pompe a diffusion, a condensation Diffusion 222-260
ejecteur, pompe a ejecteur Ejektorpumpe, Dampfstrahl- 218
manometre differentiel Differenz-Vakuummeter 397, 463
vanne de dosage, vanne de reglage" Dosierventil 505
unite Einheit 27, 74
gaz liquide fliissiges Gas 249, 273, 285
572
Русский Польский Английский
3
зависимость скорости charakterystyka szyb- pumping speed vs pressure
откачки от давления kosci pompowania $ = f(p) curve (or characteristic)
закон (Кнудсена) prawo (Knudsena) (Knudsen) law
зазор, щель, промежу- ток szczelina gap, clearence, interspace
загрязнение масла zatrucie oleju oil contamination, fouling
затвор, клапан zawdr (prozniowy) (vacuum) valve
зонтичное (тарельчатое) сопло dysza parasolowa umbrella jet nozzle
биметаллический ваку- prozniomierz bimeta- bimetallic strip vacuum
умметр) И liczny gauge
идеальный вакуум proznia doskonala ideal vacuum, perfect va- cuum
избыточное давление nadcisnienie overpressure, excess pres- sure
измерительный зонд, glowica proznomierza vacuum gauge, sensing
датчик (вакууммет- head, measuring tube
Ра)
измерение pomiar measurement, measuring, gauging
изобара izobara isobar
изотерма izoterma isotherm
имитационная камера symulator przestrzeni (space) simulator, (space)
(космических усло- вий), имитатор kosmicznej chamber
имплозионный взрыв implozia implosion
импульс газа impuls gazu gas impulse
инертный газ gaz nieczynny inert gas
ионизация jonizacja ionization (ionisation)
ионизационная камера komora jonizacyjna ionization chamber
ионизационный насос pompa jonizacyjna ionization pump
ион jon ion
ионный вакуумметр prozniomierz jonowy ion vacuum' gauge
ионный насос pompa jonowa ion pump
ионизационный вакуум- prozniomierz jonizacyj- ionization vacuum gauge
метр ny
ионно-сорбционный на- pompa jonowosorpcyj- ion sorption pump
сос na
испарение wyparowywanie, odpa- rowanie evaporation, vaporization
испарительный (субли- pompa naparowujgca evaporation-ion pump
мационный) ионный насос jonowa
573
Продолжение
Французский Немецкий Стр. книги
characteristique, courbe, de debit en fonction de la pression Saugenvermogenskurve 175, 181, 200
loi (de Knudsen) (Knudsensches) Gesetz 50
interstice, espace, intermediate Zwischenraum 197, 201, 209
encrassement, pollution d’huile Olveschmutzung 199, 221
vanne (a vide) (Vakuum-) Ventil 498, 501
deflecteur Umlenkduse 219, 232, 251
manometre bimetallique Bimetall-Vakuummeter 364
vide ideal, vide parfait ideales Vakuum 8, 516
surpression excess de pression Uberdruck 29, 191
tete de jauge a vide, tete manometri- que, tube de mesure, burette a vide Vakuum-Messkopf Messrohre Mess-sonde 360, 387, 416
mesure, mesurage. Messung 331, 382, 421
isobare Isobare 137, 228
izotherme Izotherme 137
simulateur (de 1’espace cosmique), chambre (spatiale) (Raum-) Simulator, (Raum-) Kammer 540, 543
implosion Implosion 469, 554
coup de gaz Gasstoss 460
gaz inerte Inertgas 31, 127, 410
ionisation Ionisation, lonisierung 121, 267, 312
chambre d’ionisation lonisationskammer 531
pompe a ionisation lonisationspumpe, lonenpumpe 312, 315, 384
ion Ion 121
manometre ionique lonen-Vakuummeter 373, 387
pompe ionique, a ionisation lonenpumpe 312, 373
manometre a ionisation lonisationsvakuummeter 375
pompe ionique a sorption lonen-Sorptionpumpe 312
evaporation, vaporisation Verdampfung 138
pompe ionique par evaporation (par vaporisation) lonen Verdarnpferpumpe 224, 312, 321
574
Русский Польский Английский
к
кажущаяся (мнимая) nieszczelnosc pozorna virtual leak
течь
камера сжатия komora kompresyjna compression chamber
калибровка, градуиро- skalowanie calibration
вание
калиброванная течь nieszczelnosc kalibro- wana calibrated leak
капиллярная трубка kapilara capillary, capillary pipe, tube
капилляр отнесения kapilara, porownawcza reference capillary
(сравнения)
каскадное расположе- kaskadowy (uklad) cascade (system)
ние
катод katoda cathode
катодное распыление rozpylanie katodowe cathode sputtering
катодное напыление napylanie katodowe coating by cathodic sputte- ring
катодное свечение poswiata katodowa cathode glow light
керамика ceramika ceramics
комбинация, группа на- zespol (pompowy) group, system (of pumps)
сосов
компрессионный мано- метр prozniomierz kompre- syjny compression vacuum gauge
конечный (предельный) вакуум proznia koncowa ultimate vacuum, limiting vacuum
корпус насоса obudowa pompy pump body, casing
кинетическая энергия energia kinetyczna kinetic energy
кипение wrzenie boiling
колба, балон, лампа banka (glowicy) bulb
кольцевое сопло dysza pierscieniowa annular jet nozzle
коллектор kolektor collector
коллекторный электрод elektroda zbiorcza collector, collecting ele- ctrode '
количество газа ilosc gazu (Q = pV) quantity of gas
компрессия, сжатие kompresja compression
компрессионный капил- kapilara kompresyjna compression capilary
ляр
конденсация kondensacja condensation
конденсатор пара kondensator (рагу) (vapour) condenser
конденсирующийся газ gaz kondensujqcy si? condensable gas
концентрация koncentracja concentration
коэффициент wspolczynnik coefficient
575
Продолжение
Французский Немецкий Стр. книги
fuite virtuelie, fuite semblante, fuite scheinbares Leek 81, 453
apparente
chambre de compression Kompressionsraum 178, 343
etalonngge, calibrage Eichung 445
. fuite calibree, fuite etalon Eichleck 455
tube capillaire, capillaire Kapillarrohre, Kapillare 104
capillaire de reference Vergleichskapillare 339
(systeme) en cascade Kaskaden- (Anordnung) 237, 339
cathode Kathode 269, 375
pulverisation, cathodique Kathodenzerstaubung 312, 318, 413
metallisation (par pulverisation cat- Katodenzerstaubungs 528, 531
hodique) 318, 410, 465
lumiere (cathodique) (Kathoden-) Glimmlicht
ceramique Keramik 481
combinaison, groupage, systeme (de Pumpstand (von Vakuum- 261, Ь16
pompes) pumpen) 338, 343, 343
manometre a compression Kompressions-Vakuummeter
vide final, vide limite Endvakuum 82, 175, 217
corps de pompe Pumpenkorper 201, 209
energie cinetique kinetische Energie 20
ebullition Sieden 140, 278
ampoule, tube Kolben, Rohre 315, 350, 387
deflecteur annulaire ringformige Diise 218, 230, 247
collecteur Kollektor, Auffanger 375, 381
Sammlungselektrode, Kol- lektor 383, 390, 402
quantite de gaz Gasmenge 43
compression, condensation Kompression, Verdichtung 338
capillaire de compression Kompressionkapillare 339, 341, 345
condensation Kondensation, Verdichtung 138, 274
condensateur (de vapeur) (Dampf-) Kondensator 224
gaz condensable kondensierbares Gas 192, 198
concentration Dichte 9, 17, 57
coefficient Koeffizient 27, 47, 376
57ff
Русский Полы кий Английский
коэффициент расшире- ния коэффициент прилипа- ния коэффициент аккомода- ции кран криогенная поверхность, криопанель криогенная техника wspolczynnik rozsze- rzalnosci wspolczynnik przylg- nigcia wspolczynnik akomo- dacji kran powierzchnia krioge- niczna kriotechnika expansion coefficient sticking coefficient accomodation coefficient cock, stopcock, tap, plug valve cryosurface cryogenics, cryotechnique, cryonetics cryogenic (fluid) pump laminary flow trap (for vapours), (va- pour) trap sliding blade, vane manometer, pressure gauge vacuum gauge
криогенный насос Л ламинарное течение ловушка (для паров) pompa kriogeniczna przeplyw laminarny (ruch laminarny) pulapka (par)
лопатка, вращающая пластинка М манометр манометр, вакуумметр lopatka manometr prozniomierz
магнетронный манометр магнитно-электрораз- рядный напыляющий насос магнитно-электрораз- рядный насос, геттер- но-ионный насос манометр абсолютный манометр вязкостный манометр электрораз- рядный (газоразряд- ный) манометр с горячим ка- тодом манометр расширения prozniomierz magnetyc- zny pompa napylajgca jo- nowa pompa z zimn§ katodg prozniomierz absolutny prozniomierz lepkos- ciowy prozniomierz jarzenio- wy prozniomierz z gorges katodg prozniomierz dylatacyj- "У magnetic vacuum gauge sputtering-ion pump cold cathode type, getter- ion pump, sputtering ion pump, Penning type pump sbsolute vacuum gauge viscosity vacuum gauge glow discharge vacuum gauge hot catode vacuum gauge thermal expansion vacuum gauge
577
- Продолжение
Французский Немецкий Стр. книги
coefficient de dilatation Ausdehnungskoefficient 42, 476, 498
coefficient de capture, coefficient de collage, coefficient de fixation Haftkoefficient 128, 226, 270
coefficient d’accomodation Akkomodationskoeffizient 47, 352
robinet a boisseau Absperrhahn 503
surface crygenique, cryosurface Kryooberflache 277, 285
cryo-technique, cryogenie Kryotechnik 147
pompe cryogenique Kryopumpe 273, 285
ecoulement laminaire laminare Stromung 73
piege (a vapeur) Faile (fur Dampfe, Dampf- falle) 99, 248, 273
palette, vanne, coulisse Drehschieber 186, 189
manometre manometre, jauge, vacuometre, vacu- Manometer Vakuummeter, Manometer 331
metre Vakuum Messgerat 333, 347, 373
manometre a magnetron Magnetron-Vakuummeter 378, 417
pompe ionique a getter par pulveri- sation, pompe type Penning lonenzerstauberpumpe 319, 322
pompe (ionique) a cathode froide, pompe du type Penning a pulveri- sation cathodique lonenzerstauberpumpe, Penning Pumpe 318, 322
manometre absolu absolutes Vakuummeter 443
manometre a viscosite Viscositats-Vakuummeter 371
manometre a ionisation, manometre a cathode froide, jauge de Pen- ning Glimmentladungsvakuum- meter 410
manometre a cathode chaude Gliihkathoden-Vakuummeter 387
manometre a dilatation thermique Warmeausdehnungsvakuum- meter 364
678
Русский ПОЛЬСКИЙ Английский
манометр образцовый (эталонный) prozniomierz odniesie- nia reference vacuum gauge
манометр, основанный на трении prozniomierz tarciowy decrement vacuum gauge, viscosity vacuum gauge
манометр с холодным prozniomierz z zimn^ cold cathode vacuum gau-
катодом katodg ge
масляная ловушка, ма- слосборник odoliwiacz oil trap, oil separator, oil splash baffle
масса masa mass
масса молекулы masa cz^steczki mass of a molecule
масс-спектрометр spektrometr masowy mass spectrometer, spe- ctrograph
масляный манометр prozniomierz olejowy oil vacuum gauge
материал, вещество material material
мембранный манометр prozniomierz membra- nowy diafragm vacuum gauge
мембранный клапан zawor membranowy (przeponowy) diaphragm valve
металлизация metalizacja metallizing, metal coa- ting
метод измерения metoda pomiarowa measuring method
механический насос pompa mechaniczna mechanical pump
миграция migracja migration
модуляция modulacja modulation
модулятор modulator modulator
молекула czgsteczka molecule
молекулярная (моляр- masa czqsteczkowa molecular mass
ная) масса
молекулярный насос pompa molekularna molecular pump
молекулярное течение ruch (przeplyw) mole- kularny molecular flow
молекулярный манометр prozniomierz moleku- larny molecular vacuum gauge
молекулярное сито sito molekularne molecular sieve
молекулярный объем objgtosc molowa molar volume
мощность нагревателя moc grzejnika heater power
н
нагревательный элемент grzejnik heater, heater element
нагрев, прогрев (элек- тродов) wygrzewanie (elektrod) bakeout (of electrodes)
наибольшая производи- тельность по воде wydajnosc parowodna water vapour handling capacity
наибольшее допустимое давление паров воды wydolnosc parowodna water vapour tolerance pressure
579
Продолжение
Французский Немецкий Стр. книги
manometre de reference Vergleichs-Vakuummeter 441
manometre a amoitissement, a viscosite Reibung-Vakuummeter 371
manometre a cathode froide Kaltkathoden-Vakuummeter 410
collecteur d'huile, piege a huile, sc- Olfanger, auspuffseitiger 201
parateur d’huile d’echappement Olfanger
masse Masse 11
masse d’une molecule Masse eines Molekiils 12, 13
spectrometre, spectrographe de masse Massenspektrometer 423, 441
manometre a huile Ol-Vakuummeter 333
materiel Material 108, 470
manometre a membrane Membran-Vakuummeter 327
\anne a membrane Membra nventil 501
metallisation Metallisierung 532
methode de mesure Messmetode 332
pompe mecanique mechanische Pumpe 177
migration Kriechen, Wandern 113, 295
modulation Modulierung 396, 401
modulateur Modulator 396, 401
molecule Molekiil 12, 115
masse moleculaire Molekularmasse 11-13
Molekulargewicht 11-13
pompe moleculaire Molekularpumpe 209
ecoulement moleculaire molekulare Stromung 90
manometre moleculaire Molekular-Vacuummeter 366
tamis moleculaire Molekularsieb 294
volume molaire Molvolumen 14, 15
puissance de chauffage Heizleistung 231, 251, 259
element de chauffage Heizkorper, Heizelement 249, 259
etuvage, chauffage (d’electrodes) Ausheizen (der Elektroden) 313
taux de vapeur, d’eau admissible Wasserdampfkapazitat 194
compatibilite a vapeur d’eau, pres- sion de vapeur d’eau maxima ad- Vasserdampfvertaglichkeit 194
missible —
S80
Русский Польский Английский
накаленный катод katoda gorgca hot cathode
напряжение, потенциал napigcie, potencjal voltage, potential
напряжение (механиче- ское), натяжение naprgzenie strain, tension
напряжение возбужде- ния napigcie pobudzenia excitation voltage
напряжение ионизации napi$cie jonizacji ionization voltage
напыление, металлиза- naparowywanie proz- vacuum coating, evapora-
ция niowe lion coating
насос pompa pump
насос, свободный от па- ров, не содержащий паров pompa bezparowa vapour free pump
насос масляный pompa olejowa oil-sealed pump
насос бессмазочный pompa bezsmarowa (bezolejowa) oil free pump
насос с продувкой pompa z przedmuchem gas ballast pump
насос типа Рутса pompa Rootsa Roots pump
насос с фракционирова- нием в паровой фазе pompa polfrakcjonuj^ca semi-fractionating pump
насос с эксцентрическим pompa mimosrodkowa rotary pump with excentric
ротором rotor
насос с электрическим полем pompa polowa electric field pump
насыщение nasycenie saturation
насыщенный пар para nasycona saturated vapour
накидной фланец wieniec kolnierzowy collar flange
натекательный вентиль, игольчатый вентиль zawor iglicowy needle valve
неконденсируемый газ gaz niekondensuj^cy sip non condensable gas
нестабильность по арго- ну niestabilnosc argonowa argon instability
нержавеющая сталь stal nierdzewna stainless steel
низкий вакуум proznia niska low vacuum
нормальные температу- NTP — normalna tem- NTP, STP — normal (stan-
ра и давление peratura i cisnienie dard) temperature and
О (760Tr, 0°C) pressure
объем objptosc volume
объемный (свободный) газ gaz objptosciowy volumetric gas
объемный насос pompa objgtosciowa positive displacement pump
581
И родолжение
Французский Немецкий Стр. книги
cathode chaude Heizkathode 313, 385
tension, potentiel Spannung, Potenzial 124, 376
tension Spannung 469
tension d’excitation Erregungsspannung 124
tension d’ionisation lonisationsspannung 124
metallisation sous vide, par evapo- ration Vakuumbedampfung 523
pompe Pumpe Г4
pompe exempte de vapeurs dampffreie Pumpe 173, 201
pompe a joint d’huile olgedichtete Pumpe 188, 191, 243
pompe exempte d’huile ollose Pumpe 201, 205, ‘.03
pompe a lest d’air, pompe a injec- tion d’air Gasballastpumpe 191, 193
pompe Roots, depresseur Roots, bo- oster mecanique Rootspumpe 201, 206
pompe semi-fractionnante halbfraktionierende Pumpe 245
pompe a piston excentrique Drehkolbenpumpe 188, 195, 206
pompe a champ electrique Feld-ionenpumpe 267
saturation Sattigung 11
vapeur saturee gesattigter Dampf 11, 343
bride a chapeau Uberwurfflansch 496
vanne a aiguille Nadelventil 505
gaz noncondensable nicht kondensierbares Gas 11
instabilite a 1’argon Argoninstabilitat 318, 323
acier inoxydable nichtrostender Stahl 471
vide grossier niedriges Vakuum, Grobva- kuum 181, 204 256
TPN — temperature et pression nor- males Normdruck 15 38, 150
volume Volumen 14, 15
gaz volumetrique Volumengas 17
pompe volumetrique Verdrangerpumpe 177, 182
582
Русский Польский Английский
объемный расход, объ- емная скорость тече- ния обратная диффузия обратная струя, обрат- ный поток, обратная миграция обратное течение ожижение окклюдированный газ омегатрон орбитронный (ионно-суб- лимационный) насос остаточный газ остаточное (предельное) давление остаточный ( ое) ток, да- вление остаточное давление га- зов отверстие отжиг (стекла) откачка, откачивание откачной карусельный автомат открытый манометр, зонд (без оболочки) отражение (молекулы) отражатель масляных паров, отражатель ма- сла, маслоуловитель отсоединение (отпайка) отсчет осцилляции, колебания, пульсации охлаждающая смесь охлаждаемая ловушка (криоловушка) очень высокий вакуум szybkosc przeplywu dyfuzja wsteczna strumien wsteczny strumien wsteczny skraplanie gaz okludowany omegatron pompa orbitronowa gaz resztkowy cisnienie koiicoxxe resztkowy (prqd, cis- nienie) cisnienie gazow reszt- kowych otwor odprpzanie (szkla) pompowanie (wypom- powywanie, odpom- powywanie) automat pompowy ka- ruselowy glowica obnazona, za- nurzona odbicie (czqsteczki) odrzutnik (par oleju) odcinanie (od pompy) odczytanie (wskazan) oscylacje, drgania mieszanina chlodzqca wymrazarka proznia bardzo wysoka volume flowrate, volumet- ric throughput back diffusion back stream, back strea- ming, back migration back flow, reflux liquefaction, liquefying occluded gas omegatron orbitron pump residual gas ultimate pressure residual (current, pressure) residual gas presure aperture, orifice, mouth annealing (of glass) pumping (action) rotary exhaust machine nude, bare, open type, built- in, immersed vacuum gauge reflection, rebound (of a molecule) baffle, oil baffle, oil va- pour, baffle oil separa- tor cut-off, cutting-off, seal- ing-off reading (of measurement) oscillations freezing mixture, fluid cold trap, cooling trap, condensation trap very high vacuum (VHVj
583
Продолжение
Французский Немецкий Стр. КНИГИ
debit volumetrique, debit-volume Volumendurchsatz, Volumen- strom, Durchflussgeschwin- digkeit 74
retrodiffusion Riickdiffusion 252
flux inverse, reflux, migration en re- tour Riickstrahl, Riickstrom 175, 252, 313
reflux Riickfluss 175, 252
liquefaction, liquidification Verfliissigung 138, 191, 226
gaz occlus Gaseinschluss 148
omegatron Omegatron 431
pompe a orbitron Orbitronpumpe 316
gaz residuel Restgas 82, 175, 202
pression finale Enddruck 82, 175, 202
(courant, pression) residuel(le) Rest-(Druck, Strom) 82, 175, 202
pression de gaz residuel Restgasdruck 82, 175, 202
orifice, ouverture Offnung (Blende) 84
recuit (de verre) Gliihen (des Glasses) 477
effet de pompage Pumpen, Pumpwirkung 174
banc de pompage rotatif Pumpkarussell, Pumpautomat 545-548
jauge nue, noyee, inseree, immerge, incorporee Einbaumessonde, Einbau- messrohre 283, 396
reflexion, rebond (de molecule) Reflexion, Abprall (des Molekiils) 49, 132
baffle, ecran, piege (a vapeur d’hui- le) Baffle, Dampfsperre, Olfang- blech 252
separation (d’une pompe), scelle- ment Abklemmen, Abschmelzen 552
indication (de mesure) Messergebnisse 332, 341, 443
oscillations Oszillation 16, 318
melange refrigerant (ou frigorifi- que) Kaltemischung 248
piege, piege refroidi Kflhlfalle 99, 248, 273
vide tres pousse sehr hohes Vakuum 15, 516, 560
584
Русский Польский Английский
п
пайка lutowanie soldering, brazing
пайка твердым припоем lutowanie twarde brazing (hard soldering)
пайка мягким припоем lutowanie migkkie soldering
пар para vapour
паропровод prowadnica рагу vapour chimney, vapour conduit, nozzle assemb- ly
парциальное давление cisnienie cz^stkowe partial pressure
патрубок (соединитель- ный) dol^czenie connector
передача энергии przekazywanie energii energy transfer
переходник adapter (krociec) reducer, reducing piece
печь piec furnace, oven
плавление topnienie melting, fusion
пластмасса tworzywo sztuczne artificial material, plastic
пластина, лопатка насо- са suwak (pompy) sliding vane, blade
пластинчато-роторный насос pompa suwakowa sliding vane (rotary) pump
плотность (удельная масса) ggstosc density
плотность, герметич- ность szczelnosc tighthness, leakproofness
поверхностное напряже- napigcie powierzchnio- surface tension
ние we
поверхностный газ gaz powierzchniowy surface gas
поверхностная иониза- jonizacja powierzch- surface ionization
ция niowa
поглощение, геттериро- pochlanianie absorption, gettering, cle-
вание an-up
поиск течей wykrywanie nieszczel- nosci leak detection
полное (общее) давле- ние cisnienie calkowite total pressure
пора рог pore
пористый porowaty porous
поршень (плунжер) tlok piston
предварительный ваку- proznia wstgpna backing vacuum, fore va-
ум cuum
предельный вакуум prdznia graniczna limit vacuum
585
П родолжение
Французский Немецкий Стр. книги
soudure, brassage Loten 471, 502
brassage Hartloten 471, 502
soudure tendre (a I'etain) Weichloten 471, 502
vapeur Dampf 11, 345
cheminee, conduite de vapeur Dampfsteigrohr 218, 228, 245
pression partielle Teildruck 27, 239, 421
raccord Anschluss 419, 492
transfert, transmission d’energie Energieiibertragung 47
reducteur, piece d’adaption Reduzierstiick 507
fourneaon, four, etuve Ofen 518
fusion Schmelzen 518, 520
matiere artificielle, plastique Plastik 487
palette, coulisse Schieber 160, 183, 214
pompe rotative a palettes Drehschieberpumpe 186-192
densite Dichte 17, 224 240
etancheite Dichtigkeit 81, 488
tension superficielle Oberflaschenspannung 333
gaz superficiel Oberflaschengas 18, 109, 127
ionisation superficielle Oberflachenionisation 385
absorption, sorption, fixation (de Absorption, Gettern, Gette- 198, 255, 302
gaz) rung
detection de fuites Lecksuche 453
pression totale Totaldruck 27, 330, 421
pore Pore 447
poreux pords 105, 295, 482
piston Kolben 178, 184
vide primaire, vide prelimina're pre- Vorvakuum 185, 205, 220
vide
vide limite Grenzvakuum 15, 278, 516
586
Русский Польский Английский
производительность, эф- фективность wydajnosc performance, efficiency, ca- pacity
поршневой насос pompa tlokowa piston pump
предварительное давле- cisnienie prozni wstgp- fore-pressure, backing pres-
ние форвакуума nej sure, prelimminary va- cuum pressure
предельное давление cisnienie graniczne limiting pressure
пробный газ gaz prdbny probe gas, test gas, tracer gas
проводимость, пропуск- przewodnosc conductance
пая способность
проводимость трубопро- przewodnosc conductance of the pipe, li-
вода przewodu ne conductance
проводимость отверстия przewodnosc otworu conductance of the orifice, aperture conductance
продувка przedmuch gas ballast
проникновение przenikanie permeation
проницаемость (для га- за) przenikalnosc (dla ga- zu) permeability (for gas)
поток, расход natgzenie przeplywu gas throughput, rate of gas flow
поток течи, скорость па- natgzenie nieszczelnosci leak gas throughput
текания Р
рабочий вакуум proznia robocza working vacuum, operating vacuum
рабочее давление cisnienie robocze working pressure
рабочее вещество czynnik pompuj^cy pump fluid
радиоактивный мано- prozniomierz radio- radioactive ionization va-
метр aktywny cuum gauge
растворенный газ gaz rozpuszczony dissolved gas
расстекловывание odszklanie devitrification
регенерация (масла) rozklad (oleju) (oil) regeneration, recovery
рентгеновские лучи promienie Roentgena (promienie X) X-rays, Roentgen rays
разложение (масла) rozklad (oleju) (oil) decomposition
равновесное состояние rownowaga (stan) (state of) balance, equili- brium
растворимость rozpuszczalnosc solubility
распределение скорости rozklad prpdkosci velocity distribution
распределительный щит zasilacz, zasilajgce urz^dzenie power supply box, cabinet box, power unit
резервуар, сосуд zbiornik reservoir, container, vessel
587
Продолжение
Французский Немецкий Стр. книги
performance, efficacite, capacite Leistung, Leistungsvermo- gen, Leistungsfahigkeit 175, 194, 516
pompe a piston Kolbenpumpe 182-184
pression de vide primaire Vorvakuumdruck 229, 258, 260
pression limite Grenzdruck 15, 193, 382
gaz d’epreuve, gaz temoin Prtifgas, Testgas 454—459
conductance Leitwert 84, 90
conductance de conduite, conductan- ce de canalisation Leitwert der Leitung 89, 90
conductance d’orifice, conductance d’ouverture Leitwert der Offnung 84, 90
lest d’air, injection d’air Gasballast 191
penetration Permeation 155
permeabilite (au passage de gaz) Durchlassigkeit (fur Gas) 105, 149, 155
flux gazeux Durchsatzmenge 74, 75, 161
flux de fuite Mengenstrom, Mengedurch- satz, Leck-Durchsatzmenge 81, 507, 517
vide de travail Arbeitsvakuum 516, 526
pression de travail Arbeitsdruck 516, 546
fluide moteur Pumpen-Treibmittel 224
manometre a source radioactive radioaktives Vakuummeter 408
gaz dissous geldstes Gas 481
devitrification Entglassung 476
regeneration, recuperation (d’huile) (O1-) Regenierung 242
rayons X, rayons de Roentgen Rontgenstrahlen 383, 391, 395
decomposition (d’huile) (01) zerfall 196, 476
regime (condition, etat) d’equilibre Gleichgewicht (Zustand) 29
solubilite Loslichkeit 149, 333, 479
repatrition, dispersion des vitesses Geschwindigkeitsverteilung 21
boite d’alimentation, coffret d’ali- mentation Netzanschlusskasten 519, 556
recipient, enceinte, reservoir Behalter 224, 246, 506
588
Гусскии Польский Английский
резервуар рабочего па- zbiornik (podgrzewany) boiler
ра, кипятильник, ис- czynnika pompuj^ce-
паритель go
ротационный насос pompa obrotowa rotary pump
ротор wirnik rotor
ртутный манометр pr6zniomierz rtgciowy mercury vacuum gauge
ртутный насос pompa rtpciowa mercury vacuum pump
(ртутный) столб slup (rtgci) (mercury) column
с сварное соединение zlgcze spawane welded seal
свободный газ gaz swobodny free gas
сверхвысокий вакуум proznia niezmiernie wy- ultra high vacuum (UHV)
связывающая энергия, soka energia wi^zania binding energy, interaction
энергия связи energy, junction energy
связанный газ gaz zwigzany fixed gas
силы связи (взаимодей- sila wi^zania junction force, force of in-
ствия) teraction
сильная связь wi^zanie silne strong binding (bond)
силиконовое масло olej silikonowy silicone oil
сильфон harmonijka, (mieszek) bellows
сильфонный клапан zawdr harmonijkowy bellows (sealed) valve
скорость (линейная) prgdkosc velocity, speed
скорость, быстрота szybkosi rate
(темп) скорость адсорбции szybkosc adsorcji rate of adsorption
скорость вращения prgdkosc obrotowa speed of rotation, revolu-
скорость откачки szybkosc pompowania tion rate pumping speed, pumping
скорость молекулы prgdkosc szasteczki rate, suction rate velocity of molecule
слабая связь wi^zanie slabe weak binding (bond)
соединение, присоедине- polgczenie joint, connection, junction
ние соединение, спай, спай- zlgcze, zlgczenie seal, joint
ка, сварка соединение, схватыва- wigzanie binding, bond
ние, связь сопло, диффузор диф- dysza pompy dyfuzyj- jet nozzle of a vapour
фузионного насоса nej pump
589
П родолжение
Французский Немецкий Стр. книги
bouilleur chaudiere Dampfgefass, Siedegefass 225, 231
pompe rotative rotierende Pumpe 186-191
rotor Rotor 186-191
manometre a mercure Quecksilber-Vakuummeter 335, 339, 345
pompe a mercure Quecksilberpumpe 183, 332, 345
colonne (de merkure) (Quecksilber-) Saule 183, 332, 341
joint sonde Schweissverbindung 488
gaz degage, gaz libre freies Gas 17, 19
ultra vide, vide ultrapousse Ultrahochvakuum, Hochstva- kuum, Ultravakuum 32
energie d’interaction, energie de liai- Bindungsenergie ПО, 112
son (combinaison)
gaz fixe gebundenes Gas 107
force d’interaction, force de liaison Verbindungskraft 111-120
liaison forte starke Bindung НО, 118
huile de silicone Silikonol 141, 230, 255
soufflet Federbalg 286, 493, 513
vanne a soufflet Balg(en)ventil 286, 493, 513
Vitesse Geschwindigkeit 20, 22
vitesse Geschwindigkeit 76, 175
vitesse d’adsorption Adsorptionsgeschwindigkeit 132
vitesse de rotation, vitesse angulai- Umdrehungsgeschwindigkeit 207
re
debit, flux de pompage (vitesse de pompage) Pumpengeschwindigkeit Saugvermogen 179, 235
vitesse de molecule Geschwindigkeit des Molekiils 20, 22
liaison faible schwache Bindung ПО, 111
junction, raccordement, assemblage, Verbindung, Anschluss 493-498
connexion, raccord
joint, sceilement Verbindung 488—490
liaison, collage Bindung, Verbindung ПО, 127, 271
diffuseur d’une pompe (jet) (Pumpen-) Diise 210, 232
690
Русский Польский Английский
сопротивление течению газа, импеданс сопротивление течению газа сорбция, поглощение га- за сорбционный криоген- ный (криосорбнион- ный) насос сорбционный насос сосуд, камера, резерву- ар сосуд Дьюара соударение спай металла со стеклом impedancja (dla prze- plywu) opor przeplywu sorpcja pompa kriosorpcyjna pompa sorpcyjna naczynie naczynie Dewara zderzenie spojenie metal — szklo flow impedance, flow resistance sorption cryosorption pump sorption pump container, tank, vessel, re- servoir Dewar vessel, flask impact, collision, shock metal-to-glass (fused) seal
спай мягким припоем спай твердым припоем спай стекла с металлом гЦсге lutowane mipkko zlgcze lutowane twardo zlgcze szkla z metalem soldered seal brazed seal glass-to-metal seal or joint
спаивание, припаивание (средняя) длина сво- бодного пробега статическая система статор стекло степень сжатия степень покрытия струйный насос ступень насоса струя пара струя, поток (газа) схватывание, соедине- ние, сцепление, связь spajanie droga swobodna (sred- nia) uklad statyczny stator szklo stopien kompresji stopien pokrycia pompa strumieniowa stopiert pompy strumien рагу strumien (gazu) wi^zanie soldering, brazing (mean) free path static system stator glass compression ratio coverage ratio jet pump, fluid pump, gas entrainment pump stage of the pump vapour stream gasstream, stream (of gas) • bonding, bond, binding, compound, combination
Т температура температура воспламе- нения температура испарения temperature temperature zaplonu temperatura parowania temperature flash, ignition, temperatu- re evaporation, volatilization temperature boiling temperature critical temperature
температура кипения температура крнтиче- temperature wrzenia temperatura krytyczna
ская
59!
П родолжение
Французский Немецкий Стр. книги
impedance a 1’ecoulement Stromungswiderstand 79
resistance a 1’ecoulement, an flux Stromungswiderstand 79
sorption, fixation (de gaz), capture (de gaz) Gasaufnahme, Sorption 106, 146
pompe cryostatique a sorption Kryosorptionspumpe 272, 297, 538
pompe a sorption Sorptionspumpe 271, 327
recipient, enceinte, reservoir, vais- Behalter, Rezipient 289, 595, 507
seat:
vase Dewar Dewar-Gefass 289
collision, choc Zusammenstoss 35, 41
joint, scellement verre — metal, joint par fusion (Metall-Glass-) Verschmelt- zung 488-490,511
joint soude (Soft-) Lotverbindung 488, 511
joint brase (Hart-) Lotverbindung 489, 511
scellement verre — metal, joint ver- re — metal Metall-Glassverschmelzung, Metallanglassung 488, 511
brasure, soudure Loten 488, 511
libre parcours (moyen) (mittlere) freie Weglange 37, 58
systeme statique statisches System 469
stator Stander 186, 190
verre Glass 48, 109, 474
taux de compression Kompressionsverhaltnis 192, 338
taux de recouvrement Bedekungsgrad 128, 270, 306
pompe a entrainement, pompe a jet Strahlpumpe 215
etage d’une pompe Pumpenstufe 195, 220, 236
flux de vapeur Dampfstrahl 218-222
flux (gazeux) Gasstrom, Gasstrahl 74, 217
liaison, combinaison, compost, as- Bindung, Verbindung, Kleber
semblage, collage, jonction
temperature Temperatur 16, 17
temperature d’inflammabilite Flammtemperatur 196
temperature d’evaporation Verdampfungstemperatur 140-143
temperature d’ebulition Siedetemperatur 140, 275
temperature critique kritische Temperatur 274, 275
592
Русский Польский Английский
температура окружаю- temperatura otoczenia ambient temperature
щая
температура отвердева- temperature krzepnigcia solidication temperature
НИЯ
температура нагрева temperatura wygrzewa- nia bake-out temperature
температура плавления temperatura topnienia melting temperature
температура рабочая temperatura robocza working temperature
температура размягче- temperatura migknienia softening temperature
ния
теплота адсорбции cieplo adsorpcji heat of adsorption, adsorp- tion heat
теплота десорбции cieplo desorpcji heat of desorption, desorp- tion heat
теплота конденсации cieplo kondensacji heat of condensation, con- densation heat
теплопроводность przewodnictwo cieplne heat (thermal) conduction
теплопроводностный (теплоэлектрический) prozniomierz cieplno- przewodnosciowy thermal vacuum gauge
манометр
термодиффузия termodyfuzja thermal diffusion, thermal transpiration
термистор termistor thermistor
термический коэффици- cieplny wspolczynnik thermal coefficient
ент
термисторный манометр prozniomierz termisto- rowy thermistor vacuum gauge
термоэлектрический ма- prozniomierz termo- thermocouple vacuum gau-
нометр, термопарный elektryczny ge
манометр
термомолекулярный ма- prozniomierz termomo- thermomolecular vacuum
нометр lekularny gauge
течь nieszczelnosc, przeciek leak, leakage
течеискатель wykrywacz nieszcze- nosci leak detector
течение газа, газовый поток przeplyw gazu gaz flow, current, stream, flow of gas
течение газа ruch gazu gas (gazeous) flow
течение Кнудсена ruch, przeplyw po§redni transition flow
титановый геттерно-ион- pompa tytanowa jono- titanium ion (ionization)
ный насос wa pump
тлеющий разряд jarzenie glow discharge
токовод przepust prgdowy (current) lead-in
593
Продолжение
Французский Немецкий Стр. книги
temperature ambiante Raumtemperatur, Umge- 19, 150
bungstemperatur
temperature de solidification Stocktemperatur 240
temperature d’etuvage Ausheiztemperatur 486, 501
| temperature de fussion Schmelztemperatur 140, 275, 486
temperature de travail Betriebstemperatur 256, 273, 296
temperature d’amolissement Erweichungstemperatur 478, 486
chaleur d’adsorption Adsorptionswarme 127
chaleur de desorption Desorptionswarme 135
chaleur de condensation Kondensationswarme 139
conduction thermique, conduction de Warmeleitung, Warmeleit- 63, 352
chaleur vermogen, Warmeleitfa-
higkeit
jauge thermique, manometre, a ther- Varmeleitungsvakuummeter 347, 365
mistance (a thermocouple)
diffusion thermique, effusion, ther- thermische Diffusion 54
modiffusion
thermistor Thermistor 361
coefficient thermique thermischei Koeffizient 351
manometre a thermistance Thermistor-Vakummeter 361
manometre thermoelectrique, mano- thermoelektrisches Vakuum- 361
metre a thermocouple meter
manometre thermomoleculaire thermomolecular Vakuum- 367
meter
fuite Leek, Undichtigkeit 81, 453
detecteur de fuites Lecksucher
ecoulement, flux, courant (gazeux) Gasstromung, Gasstrom 453
(de gaz) 73
ecoulement (du gaz) (Gas) Stromung RS
ecoulement en regime intermediate Knudsen — Stromung 409 549
pompe ionique a titane Titanionpumpe
decharge luminescente Glimmentladung 320, 410
traversee, passage (de courant) (Strom-) Durchfuhrung 510
594
595
Продолжение
Русский Польский Английский Французский Немецкий Стр. книги
точность измерения точка превращения тройная точка трубка с тлеющим раз- рядом dokladnosc pomiaru punkt przemiany punkt potrojny rura jarzeniowa accuracy of measurement transformation point triple point glow discharge tube precision de mesure point de transformation point triple tube a decharge lumineuse Mcssgenauigkeit Transformationspunkt Tripelpunkt Glimmentladungsrohre 345, 383, 401 478, 479 274 410
турбулентное течение турбомолекулярный на- сос przeplyw turbulentny pompa turbomolekular- na turbulent flow turbomolecular pump ecoulement turbulent pompe turbomoleculaire turbulente Stromung Turbomolekularpumpe 73 213
Ф физическая связь wi^zanie fizyczne physical binding, physical bond filter flange, sealing collar fore (vacuum), pump, ba- cking pump, roughing pump fractionating pump liaison physique physikalische Bindung 124
фильтр фланец, уплотнительная манжета форвакуумный насос filtr kolnierz pol^czeniowy pompa prdzni wstgpnej filtre collet, rebord, bride, manchon, gar- niture cylindrique pompe primaire, pompe a previde Filter Flansch, Dichtungsmanschette Vor(vakuum) pumpe 437 495 186—195
фракционирующий (с фракционированием) диффузионный насос pompa frakcjonujqca pompe fractionnante (a diffusion) fraktionierende Diffusions- pumpe 248, 258
X характеристика скоро- сти понижения давле- ния хемосорбция химическая связь хладоагент, охладитель холодильник, охлаж- дающая поверхность холодный катод холодильный охлаж- дающий змеевик ц цеолит цеолитовый насос Ш шлиф, пришлифованное соединение charakterystyka pompo- wania p = f(r) chemisorpcja wiqzanie chemiczne czynnik chlodzqcy chlodnica, (powierzch- nia chlodzqca katoda zimna wgzownica chlodzqca zeolit pompa zeolitowa szlif (polqczenie) pressure vs time curve or characteristic, pump-down curve chemisorption chemical binding, chemical bond cooling agent cooler (cooling surface) cold cathode cooling coil, cooling ser- pentine zeolit(h)e zeolite sorption pump ground joint caracteristique de pression en fonc- tion de temps chimisorption liaison chimique agent frigorifique, refrigerent refroidisseur (surface de refroidisse- ment) cathode froide serpentin refroidisseur zeolit (h) e pompe a sorption par zeolite rodage, joint rode zeitliche Druckabnahme, Aus- pumpkurve Chemisorption chemische Bindung Kiihlmittel, Kahltemittel Kiihler (KuhIflachc) Kaltenkathode Kiihlschlange Zeolith Zeolith-Sorptionspumpe Schliff, Schliffverbindung 175-181, 223 124 126 275 277. 279, 285 268, 318 251, 254 176, 291, 299 176, 294, 551 495
696
Русский Польский Английский
ч
частота czgstotliwosc frequency
частота ударов (о по- czgstotliwosc uderzen impingement rate (on a
верхность) (w sciankg) wall)
частота столкновений, czgstotliwosc zderzen collision frequency
соударений
чувствительный эле- мент, датчик czujnik pomiarowy sensor, sensing element, (measuring) transducer
чувствительность czulosc sensitivity
число оборотов, скорость вращения (частота) ilosc obrotow number of revolutions, ro- tational rate (speed)
число соударений ilosc zderzen collision rate, collision frequency (per molecule)
число liczba number
число Авогадро liczba Avogadra Avogadro’s number, Avo- gadro’s constant
число — вероятность со- ударений prawdopodobienstwo zderzen collision probability
У
укороченный барометри- prozniomierz barometry- barometric vacuum gauge
ческий вакуумметр czny (skrdcony) (shortened type)
универсальная газовая постоянная stala gazowa uniwer- salna universal gas constant
уплотнение (устрой- ство) uszczelnienie (urzqdze- nie) seal, sealing
уплотнение (действие) uszczelnianie (czyn- nosc) sealing, jointing, packing
уплотнитель, набивка, uszczelka gasket, seal, packing
уплотняющий элемент, уплотнительная про- кладка
уплотняющее кольцо из pierscien 0 О-ring (gasket)
шнура круглого сече- ния
ускоряющее напряжение napigcie przyspieszajqce accelerating voltage
ускоряющий электрод elektroda przyspiesza- jgca accelerator, accelerating electrode
установка, устройство, urzqdzenie plant, installation
сооружение, аппара- тура
установка (вакуумная) aparatura prozniowa vacuum equipment, device, plant, installation
597
П родолжение
Французский Немецкий Стр КНИГИ
frequence Frequenz 24, 36, 435
frequence du choc (a surface) Flachenstosshaufigkeit 36
frequence de collision Volumenstosshaufigkeit 24, 36
element sensible, convertisseur, trans- ducteur, sonde (de mesure) Messfiihler, Messelement, Messgeber 351, 387, 455
sensibilite Emplf indlichkeit 349, 379, 459
nombre de tours, vitesse de rota tion Drehzahl, Umdrehungszahl, Umlaufgeschwindigkeit 207
taux de collision, frequence de col- lision (par particle) Stosszahl 41
nombre Zahl 14 15
nomre d’Avogadro Loschmidtsche Zahl 15
taux de collision Stosswahrscheinlichkeit 38
manometre barometrique (raccour- ci) abgekurztes barometrisches Vakuummeter 334
constante universelie des gaz universelle Gaskonstante, allgemeine Gaskonstante 44
joint etanche Abdichtung 493
etanchement, etoupage, etoupement Abdichtung 338 447
joint, garniture, anneau Dichtelement, Dichtring, Pa- ckung 488
joint torique (a section circulate) O-Ring 286, 495
tension d’acceleration Beschleugungsspannung 406, 414
accelerateur Beschleunigungselektrode 391, 397
installation, groupe, appareillage Anlage, Apparatur 469, 5’6
appareillage du vide, instalation du vide Vakuumeinrichtung, Va- kuumanlage 248, 469, 556
598
Русский Польский Английский
э экран, заслонка, дефлек- тор эксикатор, сушилка эластическое соединение электрод электрический разряд ekran suszka zfgcze elastyczne elektroda wyladowanie (elektry- screen dryer, drying vessel, dry- ing jar elastic seal electrode (electric) discharge
электронная бомбарди- ровка энергия энергия активации эталонный манометр bombardowanie elektro- nowe cnergia energia aktywacji prozniomierz wzorcowy electron bombardment energy activation energy standard vacuum gauge
эффективность откачки эффективность иониза- ции, удельная иониза- ция эффективный радиус эффект Блирса эффузия wydajnosc pompowania wydajnosc jonizacji promien skuteczny efekt Blearsa efuzja pump(ing) efficiency ionization efficiency collision radius Blears effect effusion
Продолжение
59Э
Французский Немецкий Стр. книги
ёсгап Schirm 285 316, 400
secheur, vase de sechage, vase de dessication Trockengefass. Trockner 508
joint elastique elastische Verbindung 489, 492
electrode Elektrode 313, 375 405
decharge (electrique) (elektrische) Entladung 267. 319, 464
bombardement electronique Elektronenbombardement 120, 320
energie Energie, Leistung 19. ПО, 118
energie d’activation Aktivationsleistung 118
manometre de calibrage, manometre standard Standard-Vakuummeter 441, 448
efficacite d’une pompe Pumpleistung 194
efficacite d’ionisation lonisationsfahigkeit 121, 322
rayon de collision Stossradius 36, 37
effect de Blears Blears-Effekt 396
effusion Effusion 54
ПРИЛОЖЕНИЕ
Последние достижения
в области получения
сверхвысокого вакуума
Э. М. Рейхрудель, Г. В. Смирницкая
В последние годы для по пучения высокого и сверхвысокого
вакуума все шире используются методы и насосы безмасляной
откачки, из которых наиболее прогрессивными являются криоген-
ные, турбомолекулярные и магнитные электроразрядные насосы
[1, 2]. Ниже приведены относящиеся к насосам этих типов ре-
зультаты работ последних лет, которые не вошли в книгу
Я. Грошковского.
Турбомолекулярные насосы
Основными параметрами, характеризующими турбомолеку-
лярные насосы, являются вакуум-фактор W (отношение числа
откачиваемых молекул к числу молекул, поступающих на от-
качку), коэффициент сжатия К (равный отношению давления на
выходе р2 к давлению на входе щ) и скорость (быстрота)
откачки S. Величины К и W сильно зависят от рода газа. Так, на-
пример, при частоте вращения 24 000 об-мин-1 А(Н2) = 630,
K(N2) = 4-108, А(Аг) = 6• 109, а для углеводородных соедине-
ний А еще больше. Вакуум-фактор также возрастает с увеличе-
нием массы газа. К и W экспоненциально увеличиваются с
частотой вращения ротора насоса. Остаточное давление в турбо-
молекулярных насосах определяется давлением легких газов (в
первую очередь водорода). Для увеличения быстроты откачки тур-
бомолекулярных насосов и получения более низкого предельного
давления необходимо увеличивать скорость вращения. Предель-
ное значение окружной скорости определяется прочностью мате-
риала ротора и в настоящее время достигает 380 м-с-1.
Развитие турбомолекулярных насосов в последние годы шло
по пути оптимизации параметров насоса, позволяющих увеличить
скорость вращения ротора. В работе [3] приводятся характери-
стики конструкции высокопроизводительного турбомолекуляр-
ного насоса. Анализ различных конструкций дисков и лопаток
позволил выбрать оптимальные параметры, обеспечивающие
большую скорость вращения ротора. Опыты показали, что рас-
ПРИЛОЖЕНИЕ
601
стояние между дисками не должно превышать минимальной ве-
личины, выбранной по соображениям безопасности работы; по
всей длине лопаток диски должны быть оптически плотными. Ло-
патки имеют форму, обеспечивающую минимальное нарастание
массы по радиусу, и выполнены таким образом, что угол, обра-
зуемый лопатками с плоскостью диска, убывает в радиальном
направлении от центра диска (фиг 1). Такая конфигурация ло-
паток позволяет существенно уменьшить давление с их стороны
на вал и тем самым увеличить частоту вращения, благодаря
чему возрастают К и W Так, если в прежних
конструкциях коэффициент сжатия составлял
2,5—3, то в новых насосах К находится в диа-
пазоне 10—30. Вакуум-фактор при этом уве-
личился от 0,05 до 0,5. В результате оптими-
зации параметров дисков и лопаток разрабо-
таны насосы, которые по сравнению с преж-
ними при одинаковых диаметрах дисков имеют
значительно большую быстроту откачки и тре-
буют меньшее число пар дисков для получения
заданной величины К.
В работе [4] даны основы расчета и опи-
саны конструкции серии турбомолекулярных
насосов вертикальной компоновки, выпу-
Фиг. 1. Часть высокопроизводительного диска.
скаемых фирмой Leybold Heraeus производительностью 200,
450 и 1500 л-с-1. Турбина насоса состоит из двух частей: высо-
ковакуумной и форвакуумной, соединенных фланцем. Обе части
ротора вытачиваются из цельных заготовок (алюминиевыи
сплав), затем нарезаются лопатки, которые разводятся на опре-
деленный угол установки а. Толщина лопаток у основания вдвое
больше, чем на конце. Пакеты статора набираются из алюминие-
вых пластин, имеющих форму полукруга; они располагаются ме-
жду каждыми двумя соседними ступенями ротора. Расстояние
между статорными пластинами выдерживается с помощью ди-
станционных колец. Корпус насоса, имеющий входной фланец
в верхней части, одевается на самоцентрирующиеся пакеты ста-
тора. Такая конструкция насоса позволяет легко производить де-
монтаж статора без необходимости разбирать ротор. У насосов
этой конструкции вакуум-фактор имеет максимальное значение
при а = 35°. Для оптимальной работы турбина должна иметь
диски различной конфигурации; при этом на входе в насос
602
ПРИЛОЖЕНИЕ
обеспечивается максимум W, а в форвакуумной ступени на вы-
ходе из насоса необходимо получить максимум К- При выбран-
ных параметрах дисков и лопаток частота вращения ротора
составляет 21000—36 000 об-мин-1.
Параметры современных турбомолекулярных насосов анали-
зируются в работе [5]. Показано, что при замене одного пакета
лопаток с полным перекрытием сечения насоса (68 лопаток) на
пакет с неполным перекрытием (56 лопаток) быстрота откачки
увеличивается на 4%. При этом коэффициент сжатия умень-
шается в 2 раза. Указанная замена большого числа пакетов ве-
дет к значительному уменьшению величины К. При К меньше
100 быстрота откачки сильно уменьшается. На основании анали-
за сделан вывод, что оптимальный турбомолекулярный насос
должен иметь двойной симметричный горизонтальный ротор
с пакетами лопаток переменной геометрии и полным перекры-
тием сечения. Комбинируя диски с лопатками различной формы,
можно добиться максимальной быстроты откачки того или
другого газа. Так, при окружной скорости вращения лопа-
ток 370 м-с-1 К(Н2)= 1500 и S(H2)= 500 л-с-1, a S(N2) =
= 400 л-с-1. Одним из преимуществ турбомолекулярных насосов
с горизонтальным ротором перед насосами с вертикальным ро-
тором является простота смены подшипников без разбаланси-
ровки ротора.
Другая проблема разработки турбомолекулярных насосов
связана с удалением масла, которое используется для смазки
подшипников и загрязняет откачиваемый объем. Наряду с элек-
тромагнитным подвесом подшипников в последнее время также
используются газовые подшипники [6]. Вал с установленным кон-
сольно ротором насоса размещается в.статорном элементе; он
центрируется и фиксируется в осевом направлении с помощью
газовых подшипников. В зазор между статорным элементом и
валом через жиклеры подается сжатый воздух. Дискообразный
выступ вала фиксирует вал в осевом направлении, а сжатый воз-
дух, обтекающий диск с обеих сторон, создает упорный и контр-
упорный подшипники. Усовершенствование турбомолекулярных
насосов продолжается.
Криогенные насосы
В последнее время все шире применяется конденсационно-
адсорбционная откачка водорода, неона и гелия на слоях лег-
коконденсируемых газов. Интерес к новому классу сорбентов —
криогенным молекулярным кристаллам — не случаен. Слои от-
вердевших газов обладают высокой сорбционной способностью
и имеют малый коэффициент поглощения излучения, что позво-
ляет снизить мощность холодильных машин, обслуживающих
криогенные насосы большой производительности. Коэффициент
ПРИЛОЖЕНИЕ
603
поглощения теплового излучения сконденсированных слоев воз-
растает по мере увеличения их толщины, что дает энергетический
выигрыш. Запуск системы и ее выведение на рабочий режим уп-
рощаются, поскольку не требуются обезгаживание и тренировка
прогревом, а отработавший сорбент может быть легко удален из
системы. При этом сорбенты (газообразные в нормальных усло-
виях) не оставляют пыли и загрязнений в системе.
Структура слоев газов, сконденсированных в вакууме, зави-
сит от природы вещества, энергетического и углового распреде-
ления частиц, падающих на поверхность, природы и структуры
вещества подложки, наличия примесей и их свойств, от темпера-
туры поверхности, условий теплопередачи, скорости осаждения и
т. Д. [7].
В настоящее время исследованы адсорбционные свойства пле-
нок разнообразных газов и паров; все они в той или иной мере
являются сорбентами для водорода, неона и гелия.
В области температур жидкого водорода хорошими сорбен-
тами для Н2 и Ne являются СО2, SO2, N2O, Н2О, Хе, спирт, бен-
зин и ацетон — вещества, конденсирующиеся при Тос /з^субл,
где Гос — температура осаждения, а ГСубЛ — температура субли-
мации слоя. Измерения показали, что при таких переохлажде-
ниях все указанные выше вещества конденсируются в поликри-
сталлические слои с размерами кристаллических зерен ~10~6см.
Повышение температуры осаждения до Тос (напри-
мер, СО2 при 78 К) приводит к образованию слоя с размером
зерна ~10~4 см, обладающего при 20 К незначительной сорб-
ционной емкостью. Слои N2, Аг, О2, СН4, осажденные при темпе-
ратуре 20 К, имеют размер зерен ~5• 10-5 см и являются сла-
быми сорбентами. Снижение же температуры осаждения для N2
и Аг до 14 К приводит к увеличению сорбционной емкости на
2—3 порядка величины. При температуре осаждения 4—8 К сорб-
ционные емкости Аг и N2 по отношению к Н2 и Не достигают
значения сорбционных емкостей слоев СО2 (размер кристалли-
ческих зерен Аг в этих условиях составляет ~ 10~6 см). В ге-
лиевой области температур все вещества являются сорбентами
для Не. Даже Н2, осажденный при 2К (размер зерна ~10-6см),
сорбирует Не в заметных количествах.
Структура слоев и их адсорбционные свойства зависят также
от наличия примесей. Различают четыре условные группы при-
месей: 1) примеси, у которых теплота конденсации больше, чем
у основных молекул слоя (например, Н2О, SO2 в СО2); 2) при-
меси с меньшими теплотами (Ar, N2 в СОД; 3) примеси, не кон-
денсируемые, а лишь сорбируемые при данных температурах в
малых концентрациях (Н2 и Не в СО при 20 К); 4) примеси,
сорбируемые в больших концентрациях (Н2 в СО2, Аг при
4,2 К). Примеси в зависимости от их концентрации и природы
604
ПРИЛОЖЕНИЕ
(размера, формы молекул, типа связи) располагаются либо
изотропно внутри и на поверхности зерна, образуя твердые рас-
творы, либо выступают в виде зерен второй фазы при ограничен-
ной растворимости [7].
Формирование слоев отвердевших газов можно представить
следующим образом: в начальный момент на поверхности обра-
зуется большое число различно ориентированных зародышей
слоя; затем, в процессе конденсации, они срастаются в компакт-
ный слой с текстурированными столбчатыми зернами. Для боль-
шинства веществ, конденсирующихся в ГЦК-модификацию, при
большом переохлаждении рост зерен происходит в направлении
плоскости (111), параллельной подложке. По мере роста тол-
щины слоя крупные зерна поглощают мелкие, и средний размер
зерен растет. Сложная межзеренная граница столбчатых кри-
сталлов характеризуется развитой поверхностью и большим чис-
лом пор с размером в несколько диаметров молекул вещества
слоя.
Использование для конденсации слоев отвердевших газов
позволило создать криогенные насосы, работающие в диапазоне
давлений от атмосферного до 10~13 Тор и обеспечивающие пол-
ностью безмасляную откачку камер большого объема. Приме-
ром может служить насосная система, описанная в работе [8].
Основным элементом ее является цилиндрическая криопанель из
листовой меди толщиной 1,5 мм, которая располагается в ваку-
умной камере объемом 800 л и охлаждается жидкими N2> Н2 и
Не. Криопанель с торцов защищается от излучения стенок камеры
медными экранами, охлаждаемыми жидким N2. В пространстве
между экраном и криопанелями размещается трубка для на-
пуска газов-сорбентов. Вакуумная камера через один клапан со-
единяется с водородным конденсационно-сублимационным насо-
сом, а через другой — с гелиевым криосорбционным насосом.
В интервале давлений 760—45 Тор газ из камеры удаляется
е помощью конденсационного насоса, работающего на жидком
водороде. При р = 45 Тор сборник вместе с конденсированным
в нем жидким воздухом отъединяется от камеры. В интервале
давлений 45 — 2-10—2 Тор откачка происходит за счет конденса-
ции газов в твердую фазу на поверхности спирали водородного
конденсационного насоса. Предельное давление 2-10-2 Тор оп-
ределяется суммой парциальных давлений N2, Н2 и Не в воз-
духе, которые не откачиваются водородным конденсационным
насосом. При р = 2-10-2 Тор водородный конденсационный на-
сос отключается и включается гелиевый криосорбционный насос.
Перед его включением на поверхности шара, охлаждаемого
жидким Не, конденсируются слои Аг при 4,2 К, которые затем
поглощают Ne. Охлаждение криопанели до 20 К обеспечивает
откачку Н2 и понижение давления до 6-Ю-11 Тор. При темпера-
ПРИЛОЖЕНИЕ
605
туре криопанели 5 К происходит откачка Не, и давление в ка-
мере снижается до 10~13 Тор. Такая насосная система откачивает
камеру объемом 800 л от атмосферного давления до 10~13 Тор за
2 ч, при этом расходуется 40 л жидкого N2, 20 л жидкого Н2 и
20 л жидкого Не.
Поскольку в настоящее время откачка криогенными насосами
производится в широком диапазоне давлений, при теоретическом
рассмотрении быстроты откачки необходимо различать режимы
работы насоса в области больших давлений (вязкостные усло-
вия течения газа) и в области низких давлений (молекулярные
условия течения газа). Метод расчета быстроты откачки крио-
генных насосов (встроенных и выносных) в вязкостном режиме
течения изложен в работе [9]. Расчет эффективной быстроты от-
качки при молекулярном течении газа методом статистического
моделирования для систем с бесконечными параллельными пло-
скостями, концентрическими сферами и цилиндрами приведен
в работе [10].
Быстрота откачки криогенных насосов и их экономичность
зависят также от конструкции криопанелей и экранов. Обычно
охлаждаемые жидким Не рабочие элементы насосов (криопа-
нели) защищены от источников теплового излучения экранами,
охлаждаемыми жидким N2 и имеющими оптически непрозрач-
ную конструкцию. Чаще всего криогенные насосы используются
в вакуумных камерах цилиндрической или сферической формы.
При этом, как правило, главный источник выделения газа и
тепла находится в центральной части камеры. Газовые и теп-
ловые потоки имеют радиальное направление в сторону стенок.
Существуют различные конфигурации экранов, охлаждаемых
жидкими N2 и Не. Однако в системе со сферической или цилинд-
рической симметрией для получения высокого коэффициента
захвата молекул газа криопанели, охлаждаемые жидким Не, не
должны быть закрыты оптически непрозрачными экранами [11].
Например, в вакуумной цилиндрической камере радиусом
600 мм, имеющей коаксиально расположенный с нею цилиндри-
ческий источник газа и тепла радиусом 35 мм, в случае W-об-
разной конфигурации экранов может быть получен коэффициент
захвата ~0,6 (при отражении молекул от экранов по закону
косинуса) или ~1 (при зеркальном отражении). Панели охлаж-
даются жидким Не и устанавливаются параллельно потокам
(фиг. 2). Для уменьшения попадания лучистой энергии на гелие-
вые панели над каждой панелью имеется небольшой треугольный
экран, ширина которого в 3,5 раза меньше расстояния между
соседними панелями. Эти экраны охлаждаются жидким азо-
том. Такая конфигурация экранов и панелей позволяет
увеличить коэффициент захвата в 2 раза по сравнению с ранее
606
ПРИЛОЖЕНИЕ
использовавшимися криопанелями с непрозрачными азотными
экранами.
Предельное давление, получаемое с помощью криогенных на-
сосов, зависит также от материала поверхности конденсации.
Фиг. 2. Расположение экранов и криопанелей.
Так, при 3 К наименьшее рабочее давление обеспечивает поверх-
ность, покрытая пленкой Ag [12]. При температуре защитной шев-
ронной ловушки 78 К это давление составляет 1СН4 Тор.
Цеолитовые насосы
В последнее время наряду с широко применяемыми цеоли-
тами типов А и X разработаны и используются цеолиты других
типов. В работе [13] исследовалась адсорбция воздуха в области
низких давлений на цеолите типа Е. Оказалось, что цеолит
СаЕ-Т обладает очень высокой сорбционной способностью в от-
ношении воздуха при низких давлениях и более чем в 3 раза
превосходит в этом отношении промышленные цеолиты, приме-
няемые в настоящее время в вакуумной технике. Масс-спектро-
графическое исследование газовой фазы над цеолитами типа Е
и А после адсорбции воздуха при давлениях 10-8—10-5 Тор и
температуре жидкого азота в условиях, близких к равновесным,
показало, что цеолит СаЕ-Т обладает повышенной адсорбцион-
ной способностью в отношении Аг, О2 и Н2. Новый цеолит по
адсорбционной способности в отношении водорода значительно
превосходит все промышленные цеолиты и не уступает приме-
няемым в настоящее время специальным поглотителям водо-
рода— палладированному силикагелю и AgO.
Магнитные электроразрядные насосы
Разрядная ячейка магнитного электроразрядного (магнито-
разрядного) насоса аналогична ячейке, примененной Пеннингом
в магнитном ионизационном манометре [14]. В магниторазряд-
ПРИЛОЖЕНИЕ
607
ном насосе использовались угольные электроды. Однако через
некоторое время наступало насыщение насоса, поскольку в
электродах происходило поглощение ионов. Насос непрерывного
действия, использующий электрический разряд с холодными ме-
таллическими электродами во внешнем магнитном поле, впервые
описан в работе [16]. Этот насос имеет следующие преимущества:
1) отсутствие жидких рабочих веществ и паров; 2) не нужна не-
прерывная откачка насосами предварительного разрежения и
охлаждение жидким азотом; 3) отсутствие накаленных элементов
и возможность работы с агрессивными газами; 4) сохранение ра-
ботоспособности при внезапном повышении давления; 5) широ-
кий рабочий диапазон (10-2—1СН2 Тор); 6) ток является мерой
давления; 7) большой срок службы, определяемый временем рас-
пыления материала катода (при р ~ 10-6 Тор он составляет де-
сятки тысяч часов); 8) высокая экономичность (мощность, пот-
ребляемая насосом с быстротой откачки 100 л-с-1 при
р ~ 10-5Тор, составляет несколько ватт и уменьшается по мере
снижения давления (диффузионный насос той же производитель-
ности потребляет мощность ~500 Вт); 9) возможность увеличе-
ния быстроты откачки путем оптимизации геометрических и фи-
зических параметров и увеличения числа разрядных ячеек;
10) удобство использования насоса для автоматизации процесса
производства.
В 1958 г. Холл [17] создал удачную металлическую конструк-
цию насоса повышенной производительности, в которой исполь-
зуется многоячеистый анод. Такая конструкция лежит в основе
ионных насосов типа «Вакион», имеющих ячейки размером
8 X 8 X 15 мм3, Va — 3 — 3,5 кВ или 6 кВ и В — 0,12 — 0,15 Т.
В магниторазрядных насосах типа НЭМ, выпускаемых в Со-
ветском Союзе, до последнего времени использовалась двухсек-
ционная система, два анода и три катода которой расположены
в одном магнитном зазоре [18]. Характеристики ионных насосов
НЭМ: размеры ячеек 20X 20X15 мм3, Va — 7 кВ, В = 0,07 I
(фиг. 3).
Многочисленные исследования, проводившиеся в последние
10 лет, привели к выяснению механизма действия ионных на-
сосов и позволили обоснованно производить выбор опти-
мальных значений геометрических и физических параметров
насоса.
В основе механизма действия ионных насосов лежат следую-
щие явления: 1) ионизация атомов и молекул колеблющимися
электронами и возникновение электрического разряда в высоком
вакууме; 2) распыление катода ударами положительных ионов;
3) химическая и физическая сорбция атомов газа на электродах
и пленках металла, непрерывно напыляющихся на стенках раз-
рядной камеры.
cos
ПРИЛОЖЕНИЕ
Рассмотрим основные процессы, происходящие в объеме раз-
реженного газа и на граничных поверхностях. Процессы, разви-
вающиеся в разряде, зависят от анодного напряжения, индукции
магнитного поля В, давления р и рода газа, а также от геомет-
рических размеров ячейки. При низких давлениях длина свобод-
ного пробега частиц значительно больше размеров разрядного
пространства. Специальная конфигурация электрического и на-
личие магнитного поля создают ловушку для электронов, увели-
чивают время пребывания их в разрядном пространстве и делают
+ 7x8
возможным зажигание разряда при
сверхвысоком вакууме. Неоднородное
электрическое поле разрядного простран-
ства искажается в горящем разряде про-
странственными зарядами. Опыты по-
казали, что при низких давлениях раз-
ряд развивается в основном вблизи про-
дольной оси z ячейки и внутри полости
анода (вблизи плоскости симметрии,
перпендикулярной оси). Для этих обла-
стей распределение потенциала с доста-
точной точностью описывается квадра-
Фиг. 3. Двухсекционная электродная
система магниторазрядного насоса типа
НЭМ.
тичной функцией от г и г. При индукции магнитного поля
больше критической Вкр для всех электронов, участвующих в
ионизации (Вкр — значение В, при котором траектория элек-
трона, образовавшегося в данном месте, касается анода),
проекции траекторий электронов на плоскость симметрии пред-
ставляют собой циклоиды; одновременно электроны совер-
шают колебательное движение между плоскостями катодов.
В стационарных условиях электроны перемещаются к аноду, ис-
пытывая упругие и неупругие соударения с атомами газа. В ра-
боте [19] определены значения коэффициента подвижности и
таунсендовского коэффициента ионизации газа по г с учетом не-
однородности электрического поля в пределах витка циклоиды.
При больших значениях В, когда поле в пределах витка цик-
лоиды можно считать однородным, уход электронов на анод про-
исходит по закону классической подвижности,
ПРИЛОЖЕНИЕ
609
Положительные ионы, образовавшиеся в результате иониза-
ции, свободно уходят на катоды. Ионы, образовавшиеся на оси
разряда, движутся прямолинейно к катодам; ионы, образовав-
шиеся на некотором расстоянии от оси, уходят на катод, совер-
шая одновременно колебательное движение относительно оси.
Угол падения ионов в центральную область катода (г —3 мм)
тем больше, чем дальше от оси образовался ион. Фокусирующее
действие радиального электрического поля на ионы приводит к
неравномерному распределению плотности ионного тока по ра-
диусу катода: она максимальна в центральной части катода и
спадает к краям [20].
Ионы, ударяясь о катод, вызывают ряд эффектов. Возникает
вторичная электронная эмиссия; часть ионов захватывается кри-
сталлической решеткой металла; часть может испытать переза-
рядку и отразиться в виде энергичных нейтралов. Передавая
импульс атомам металла, ионы производят также распыление ма-
териала катода. Распыленный металл осаждается на противопо-
ложном катоде, аноде и стенках разрядной трубки, поглощая
при этом газ.
Механизм зажигания разряда данного типа рассмотрен
в ряде работ [19, 21]. В работе [19] получено уравнение, связы-
вающее потенциал при зажигании разряда с другими парамет-
рами, и показано, что при больших В необходимо учитывать
влияние на распределение потенциала отрицательного объемного
заряда, накапливающегося в процессе формирования разряда
При зажигании разряда в сверхвысоком вакууме наблюдается
затягивание зажигания, достигающее в условиях разрежения
10-9—10-11 Тор десятков минут и затрудняющее запуск насоса.
Затягивание зажигания определяется временем, необходимым
для накопления отрицательного пространственного заряда, со-
здаваемого в процессе формирования разряда. Зависимость тока
в разряде с осциллирующими электронами от различных пара-
метров является сложной (фиг. 4). Такая зависимость тока свя-
зана с различными распределениями потенциала, с условиями
ионизации и механизмом ухода электронов на анод. Измерения
радиального падения потенциала, выполненные различными ме-
тодами [22—24], показали, что V(r, 0) при определенных значе-
ниях параметров является квадратичной функцией г и зависит
от Va, В, р, рода газа и размеров ячейки. Совместные измерения
радиального падения потенциала и спектра электромагнитных
излучений из разряда, проведенные в работе [25], позволили по-
строить диаграммы состояний и детально проследить переход
разряда от одного режима в другой при изменении параметров.
На фиг. 5 показаны кривая зажигания разряда как функция В
и ряд областей, соответствующих различным режимам. Внизу
показано распределение У (г, 0) для соответствующих областей,
Фиг. 4. Зависимость разрядного тока от параметров в режимах / и II.
2800
2400
2000
со
1600
1200
800
400
0 0,02 0,04 0,06 0,08 0,10 0,12 0,й 0,!6 0,18 0,20 вга,Т-см
V(r,o) V„ V(r,o) V„ Vlr,o) V„ Vfr,o) 14, Vir.o) V„ Wro) И,
Фиг. 5. Диаграммы состояний Va = f (Bra).
/ — кривая зажигания V2=f [Bray 2 — кривая начала возникновения колебаний; 3 —кривая
резонанса (переход разряда в режим И); 4 — кривая появления комбинационных частот
и колебаний пучок —плазма; 5—кривая исчезновения комбинационных частот и колеба-
ний пучок—плазма; А, Б, В, Г, Д — области различных режимов р=1,5-10—6 Тор (Ыг)>
re=2, d=2, /а=2,5 см.
ПРИЛОЖЕНИЕ
611
Измерения динамических характеристик разряда показали, что
в области А излучение из разряда не наблюдается. Это свиде-
тельствует о равномерном распределении отрицательного про-
странственного заряда внутри анода (I режим разряда). Уход
электронов на анод обусловлен лишь соударениями их с ато-
мами газа. Из решения уравнения неразрывности с учетом урав-
нений движения электронов в электрическом Е и магнитном В
полях получено следующее выражение, связывающее радиаль-
ное падение потенциала с другими параметрами в этом режиме
разряда [26]:
(Вг)2 = ^Ггк +____________________________________1 (И
е Г r4na02/?Af2[(ln C^)2-(ln Czr.)2j(l + Y*)]/
где /-а —радиус анода, ф=Иа—J70 (J/o — потенциал центра
разрядной ячейки), Уг — потенциал ионизации газа, ос — попе-
речное сечение соударения электронов с атомами газа, R — по-
стоянная Ридберга, а0 — радиус первой орбиты Бора, Ci, —
постоянные, у* — эффективный коэффициент вторичной электрон-
ной эмиссии с катода.
При увеличении В плотность пространственного заряда и ра-
диальное падение потенциала растут. Максимальная величина
пространственного заряда достигается при |/0 —0. При таком
значении Vq высота циклоид электронов, образовавшихся вблизи
оси разряда, становится настолько малой, что энергия, набирае-
мая ими при движении по г, меньше потенциала ионизации газа,
и ионизация в разряде происходит в основном вблизи анода.
Ионы из этой области уходят под действием радиального элект-
рического поля. При этом около анода образуется узкий слой
отрицательного пространственного заряда большой плотности,
который экранирует поле анода, а потенциал внутри анодной
области выравнивается (область Б). Слой отрицательного про-
странственного заряда при определенной толщине становится не-
устойчивым, и развивается так называемая диокотронная неста-
бильность [27]. Возникает неоднородное азимутальное распреде-
ление отрицательного пространственного заряда, следствием чего
является появление излучения частоты v, связанного с враща-
тельным движением электронного слоя [28]:
•v=nc—~9--, п=1,2, .... (2)
В области Б наряду с излучением частоты v имеет место также
излучение, образуемое пучком сгруппированных (фокусирующим
действием магнитной индукции В и модуляцией Йо с частотой v)
осевых электронов, колеблющихся вдоль оси относительно
6’2
ПРИЛОЖЕНИЕ
плоскости симметрии с частотой
_ 1 -,/ЖГ №
Vz 2л V md* ’
где 2d — расстояние между катодами. Область Б, для которой
характерны неоднородное распределение отрицательного про-
странственного заряда и наличие излучений частот v и vz, яв-
ляется переходным режимом разряда. Условие стационарности,
имеющее место в режиме I, здесь нарушается, и разряд перехо-
дит в динамический режим. В первом и переходном режимах
разряда можно пренебречь влиянием положительного простран-
ственного заряда на распределение потенциала.
С увеличением В частоты v и v2 сближаются и при некотором
значении В наступает резонанс (кривая 3 на фиг. 5). При этом
электроны, образовавшиеся вблизи оси разряда, получают до-
полнительную энергию и начинают ионизировать-газ, находя-
щийся в этой области. Образующиеся в результате ионизации
положительные ионы создают положительный пространственный
заряд в той области, где поле было ранее экранировано, и ча-
стично компенсируют отрицательный пространственный заряд
вблизи анода. При этом радиальное падение потенциала умень-
шается (скачком), и разряд переходит в режим II, в котором на
распределение потенциала влияет заряд положительных ионов
(область Б'). Амплитуда излучения частоты при резонансе резко
возрастает от милливольт до нескольких вольт, а с дальнейшим
увеличением В амплитуда излучений частоты v уменьшается.
С переходом разряда в режим II характер кривых У (г, 0) и
спектр излучений из разряда меняются. На кривой У (г, 0) воз-
никает излом, появляются излучение типа пучок — плазма ча-
стоты Vz и комбинационные частоты v' = v ± v2. Вблизи оси об-
разуется «виртуальный катод»; основная лавина развивается
при движении электронов по г. На некотором расстоянии г01 от
оси возможно образование плазменного слоя, простреливаемого
быстрыми электронами и ионами. Большое положительное анод-
ное падение потенциала и перпендикулярное ему магнитное
поле приводят к образованию на внешней границе плазмы тон-
кого слоя отрицательного пространственного заряда, частота
вращения которого определяется формулой
При еще больших В плазменная область расширяется, виртуаль-
ный катод вблизи оси разряда и колебания у'г и у' пропадают
(область Г). При дальнейшем увеличении В анодное падение
потенциала уменьшается, слой отрицательного пространшвен-
ного заряда и излучение частоты у пропадают, а всю область
ПРИЛОЖЕНИЕ
613
внутри анода заполняет квазинейтральная плазма. В динамиче-
ских режимах (при наличии излучений) уход электронов на анод
вызывается не только соударениями с атомами газа, но и ано-
мальной диффузией вследствие развивающейся в разряде неста-
бильности. Положение границ рассмотренных областей зависит
от конфигурации и размеров системы, а также от давления и
рода газа. Аналогичные области наблюдаются на диаграмме
Фиг. 6. Диаграммы состояний Vu = f (р).
a-B=3,3-I0-2 Т; б —В—6, 6 10~2 Т. Обозначения см. фиг. 5.
Va = t(p) (фиг. 6), характеризующей различные режимы раз-
ряда при изменении давления газа Размеры различных областей
зависят от величины В и геометрических размеров ячейки.
Переход разряда при изменении его параметров через раз-
личные режимы говорит о том, что разрядный ток не может быть
выражен одной формулой для всех состояний разряда.
В работе |2о| проведен расчет тока в предположении одно-
родного электрического поля по г и получено выражение, связы-
вающее разрядный ток с пространственным зарядом. Однако,
поскольку величина пространственного заряда не была известна,
сравнение теории с экспериментом не проводилось. В работе [21]
получена зависимость тока от параметров в предположении
ухода электронов на анод по закону классической подвижности;
при этом вероятность ионизации считалась постоянной. Однако
614
ПРИЛОЖЕНИЕ
указанная зависимость не учитывает изменение распределения
потенциала с изменением магнитного поля и не объясняет умень-
шение тока в режиме // разряда. Расчет стационарной компо-
ненты разрядного тока с учетом реального изменения V(г, 0) и
вероятности ионизации в горящем разряде проведен в работе
[29]. Для первого и переходного режимов разряда получена сле-
дующая зависимость для тока:
/ = | /2й)2 + /2ю2 - р2
Р ~ [ 2 /2 (О)2 + ₽2)
I !( — |Р- —- )v pl г* (5)
Це d2 J ° ° v ’
где о = еВ!2тс, р2 = 2е(Иа—Vo)/mra2, vci— частота соударе-
ний электронов с атомами газа при р = 1 Top, vci = 2<yci c(Va —
— V^/Bra, la— длина анода. Потенциал Vo может быть вычис-
лен по выражению (1), а также определен экспериментально
[24]. В режиме Я разряда, когда вблизи оси образуется вир-
туальный катод, а ионизация электронами, движущимися по г,
начинается с некоторого расстояния гОь стационарная компо-
нента разрядного тока определяется формулой
, _ 3 v „ т ₽1 (Г а - Г01
/п = — V/-1P------------Т
Р 4 е 2со2-₽|2
2 _ 2е(Уд — 70|)
1 т(га-глу
а»
(6)
Положение внешней границы виртуального катода rOi и ее потен-
циал Vol определяются экспериментально.
В динамических режимах разряда ток на анод образуется
двумя составляющими: одна из них обусловлена постоянными
полями и соударениями в разряде, а другая представляет собой
среднее значение тока, создаваемого уходом электронов из вра-
щающегося электронного слоя под действием переменного элект-
рического поля развивающейся нестабильности. Последняя со-
ставляющая тем больше, чем больше амплитуда колебаний, и
особенно существенна при резонансе колебаний v и vz и переходе
разряда в плазменный режим. Вклад аномальной диффузии
также увеличивается с уменьшением давления газа, и при
р ~ 10~8 Тор переменная составляющая разрядного тока стано-
вится сравнимой с постоянной. Уход части электронов из элект-
ронного облака без соударений приводит к уменьшению плот-
ности пространственного заряда и к нарушению постоянства
интенсивности (1р/р) разряда в области сверхвысокого вакуума.
Указанные особенности разряда следует учитывать при исполь-
зовании этого механизма в ионном насосе.
Исследованные зависимости распределения потенциала и
разрядного тока позволяют обоснованно выбрать оптимальные
ПРИЛОЖЕНИЕ
615
значения параметров для ячеек ионного насоса. Из выражений
(1) и (5) следует, что радиальное падение потенциала и ток на
единицу длины анода остаются постоянными при В • ra = const,
если можно пренебречь осевым падением потенциала по сравне-
нию с радиальным. В работе [30] показано, что произведение
В-га является параметром подобия в первом и переходном режи-
мах разряда для определенного интервала значений геометри-
ческих параметров (0,57 < 1а/га < 3, 0,4 < (d~/a/2)/d < 0,8).
Для коротких анодов подобие нарушается вследствие влияния
компоненты z скорости, для длинных анодов — из-за увеличе-
ния величины осевого падения потенциала и влияния положи-
тельного пространственного заряда. В режиме II разряда
подобие нарушается вследствие влияния положительного про-
странственного заряда и аномальной диффузии электронов к ано-
ду. На основании параметров подобия можно определить опти-
мальные соотношения физических и геометрических величин. Опы-
ты показали, что для подобных промежутков в первом и пере-
ходном режимах разряда величины /р//а всегда больше, чем для
неподобных. Чтобы получить максимальное значение /р в широ-
ком диапазоне давлений, следует выбирать конфигурацию систе-
мы, отвечающую условиям подобия, и работать вблизи максиму-
ма кривой /р = f (Bra). Значение Вга, соответствующее /р>макс,
для любого Va определяется из выражения (1) при условии
4 = 0 (например, при 14 = 3 кВ получаем Вга ~ 0,09 Т- см).
Выбор радиуса ячейки зависит от напряженности имеющегося
магнитного поля. При выборе параметров разряда в ионных на-
сосах при низких давлениях следует не только добиваться ма-
ксимальной интенсивности разряда в каждой ячейке и ее по-
стоянства, но также обеспечивать получение максимального зна-
чения суммарного разрядного тока в выбранных габаритах и
учитывать многоячеистость конструкции.
Быстрота откачки ионных насосов S в первом приближении
пропорциональна интенсивности разряда, однако при определе-
нии S следует учитывать не только процессы в объеме, но и на
поверхностях. Область максимума S может быть смещена в сто-
рону низких р соответствующим подбором значений Va, В и раз-
меров ячейки.
Быстрота откачки ионных насосов зависит также от рода
газа. Механизм поглощения газа в магниторазрядных насосах
рассмотрен в ряде работ [31—39]. Химически активные газы в
основном откачиваются за счет хемосорбции на электродах и
стенках насоса. Быстрота откачки Н2 примерно в 2 раза больше,
чем воздуха. Вследствие малой массы Н2 распыление катодов
при работе в атмосфере водорода незначительно. Для катодов из
Ti на каждый электрон, протекающий во внешней цепи, откачи-
вается несколько атомов водорода. Это говорит о том, что
616
ПРИЛОЖЕНИЕ
ионизация каждого откачиваемого атома Н2 не является необхо-
димой. Атомы и ионы Н2, попадая на очищенную под действием
ионной бомбардировки поверхность Ti, диффундируют в глубь
металла, образуя соединение TiH. Так как TiH имеет больший
объем, чем сам Ti, то образование гидрида по всей толще мате-
риала при длительной работе насоса вызывает растрескивание
и деформацию катодов.
Механизм откачки Ns отличается от механизма откачки Н2.
Так как масса N2 больше, чем Н2, то при разряде в азоте про-
исходит сильное катодное распыление, поэтому в откачке газа
принимают участие не только катоды, но также анод и стенки
трубки. Поглощение газа катодами происходит в областях, где
осаждение металла с противоположного катода преобладает над
распылением (периферийные части катода). Для откачки одной
молекулы N2 необходим один электрон во внешней цепи, так что
эффективность использования ионизации при откачке N2 до-
вольно высокая.
Механизм откачки О2 сходен с механизмом откачки N2.
Окислы Ti являются устойчивыми, и ионы кислорода исполь-
зуются с меньшей эффективностью, чем ионы азота: на каждый
откачиваемый ион кислорода тратится в среднем около двух
электронов, протекающих во внешней цепи, вследствие чего
быстрота откачки кислорода меньше, чем воздуха.
Механизм откачки сложных молекул (Н2О, СО2, СН4 и др.)
не вполне ясен. Предполагается, что при откачке сложных мо-
лекул имеют место ионизация, диссоциация и откачка отдельных
компонент. Для увеличения быстроты откачки химически актив-
ных газов следует выбирать материалы с большим коэффициен-
том катодного распыления; при этом необходимо также учиты-
вать химическое взаимодействие газа с материалом катода. Бы-
строта откачки инертных газов магниторазрядными насосами
значительно меньше, чем химически активных газов. Характер-
ным для откачки инертных газов (особенно Аг) являются перио-
дические колебания давления в области 10-5—10-4 Тор (аргон-
иая нестабильность). Низкие скорости и нестабильность откачки
инертных газов связаны с особенностями механизма их откачки.
Ионы инертного газа откачиваются в основном, внедряясь в ка-
тод и удерживаясь в нем силами физической сорбции. При рас-
пылении катода значительная часть атомов газа может вновь
выделиться; этим определяется малая быстрота откачки инерт-
ных газов. Изменение распределения плотности ионного тока по
поверхности катода при изменении давления газа приводит к пе-
рераспределению областей распыления и поглощения на катоде
и к выделению ранее поглощенного на катоде газа, вследствие
чего наступает аргонная нестабильность. Для объяснения от-
качки инертного газа анодом Джепсен выдвинул гипотезу об от-
ПРИЛОЖЕНИЕ
617
качке на аноде энергичных нейтралов. Нейтралы высокой энер-
гии образуются при перезарядке и при отражении падающего
иона от катода. Чем больше m2/mi (где т\— масса иона, т2 —
масса атома металла), или чем больше угол падения ионов на
катод, тем большая доля ионов отражается от катода в виде
энергичных нейтралов и тем больше их энергия. Известно не-
сколько конструкций магниторазрядных насосов, которые приво-
дят к устранению аргонной нестабильности. На фиг. 7 показаны
Фиг. 7. Схемы различных ячеек ионно-сорбционных насосов.
а —триод Брубейкера; б —диод с ребристым катодом Дженсена в —трнод Гамильтона;
а —триод фирмы Varian; д — дифференциальный ионный насос Тома и Джеймса, в —маг-
нетронный насос Эндрью.
схемы таких насосов. Наряду с триодными насосами, описан-
ными в гл. 4 книги, применяются и другие насосы такого типа.
Во всех триодных насосах распыленный металл в основном на-
правляется на третий электрод—коллектор (стенку) и погло-
щает там газ. Поскольку ионы непосредственно не бомбарди-
руют коллектор, изменение распределения тока по поверхности
катода не сопровождается выделением поглощенного газа.
Быстрота откачки инертных газов триодным насосом выше, чем
диодным, а для активных газов одинакова.
В насосе с ребристыми катодами (фиг. 7,6) увеличение рабо-
чей поверхности катода, разделение областей распыления и
осаждения позволяет повысить быстроту откачки Аг до 10%
быстроты откачки воздуха. Магнетронный ионный насос
(фиг. 7, е) позволяет увеличить быстроту откачки Аг до 12—20%
относительно воздуха и не обнаруживает аргонной нестабиль-
ности. Если на оси насоса поместить металлический стержень,
потенциал которого равен потенциалу катода, то при изменении
давления не происходит изменение потенциала центра и моды
разряда. Устранение аргонной нестабильности в дифференциаль-
ном ионном насосе (фиг. 7,д) объясняется увеличением числа
618
ПРИЛОЖЕНИЕ
энергичных нейтралов вследствие увеличения отношения R =
= m2/W Установлено, что насосы с R > 2,5 стабильно откачи-
вают инертные газы [35]. Для устранения аргонной нестабиль-
ности можно в центральной части катода поместить металл
с большим коэффициентом распыления (Си, Ag) [38, 39].
При эксплуатации магниторазрядных насосов необходимо
учитывать некоторые их особенности. В частности, источник
питания должен соответствовать условиям работы насоса в широ-
ком диапазоне давлений. При тренировке и запуске магнитораз-
рядных насосов происходит резкое увеличение давления и тока,
поэтому схема должна содержать сопротивление, предохраняю-
щее разряд от больших токов. Целесообразно предусмотреть
в схеме автоматическое устройство, которое отключало бы насос
от источника питания при возникновении больших tokqb, Трени-
ровку насосов можно производить кратковременным включением
источника питания. Длительность промежутков между импуль-
сами зависит от соотношения между быстротой откачки и ско-
ростью выделения газа и имеет порядок нескольких десятков
секунд.
Для получения сверхвысокого вакуума при безмасляной от-
качке предварительное разрежение создается цеолитовыми на-
сосами. Предельное давление насоса зависит от соотношения
между быстротой откачки и натеканием в систему. Для получе-
ния предельного давления ~10-12 Тор насосом с производитель-
ностью 100 л-с-1 необходимо, чтобы натекание было меньше
10~10 Тор-л-1-с-1, а десорбция с единицы поверхности стекла на-
соса не превышала 10~16 Тор-л-1 -с-1 -см~2. Для обеспечения та-
кой малой десорбции требуется тщательное обезгаживание как
вакуумной системы, так и самого насоса.
В последние годы магниторазрядные насосы получили широ-
кое применение. Небольшие насосы и отдельные ячейки поме-
щаются непосредственно в электровакуумные приборы, благо-
даря чему срок службы и надежность приборов повышаются.
Созданы насосы различной производительности — от нескольких
литров в секунду до десятков тысяч литров в секунду. Для лабо-
раторных целей наряду с насосами в металлических корпусах
используются насосы в стеклянных корпусах с быстротой откачки
5—10 л-с-1 [1]. Такие насосы просты в изготовлении и весьма
экономичны. Большую скорость откачки при высоких давлениях
обеспечивают откачные системы, в которых магниторазрядные
насосы комбинируются с криогенными и сублимационными насо-
сами.
ЛИТЕРАТУРА
1. Рейхрудель Э. М., Смирницкая Г. В., ЖТФ, 33, № 12, 1405 (1963).
2 Глазков А. А., Милованова Р. А., Учебная лаборатория вакуумной тех-
ники, Атомиздат, М., 1971.
ПРИЛОЖЕНИЕ
619
3. Becker W., Nesseldreher W., Vak. Techn., 23, № 1, 12 (1974).
4. Frank R., Vak. Techn., 23, № 4, 109 (1974).
5. Henning J., Vak. Techn., 23, № 3, 65 (1974).
6. Louis M., франц, пат., кл. 04. в. 37/00, № 2161180, 6.07.73.
7. Юферов В. Б., Вопросы атомной науки и техники, № 3, 11 (1973).
8. Юферов В. Б., Кобзев П. М., Гласов Б. В., ЖТФ, XL, № 3, 592 (1970).
9. Житомирский И. С„ Лурье М. А., Криогенная и вакуумная техника, № 3,
3 (1973).
10. Кислов А. М., Криогенная и вакуумная техника, № 1(4), 3, 16 (1973).
11. Hands В. A., Cryogenics, 13, № 12, 699 (1974).
12. Benvenuti С., J. Vac. Sci. and Techn., 11, № 3, 591 (1974).
13. Сказываев В. E., Хвощев С. С., Жданов С. П., IV Всесоюзная научно-тех-
ническая конференция по физике и технике высокого вакуума, Ленин-
град, 1974.
14. Penning F. М., Physica, 4, 71 (1937)
15. Gurewitsch A., Westendorp W., Rev. Sci. Inst., 25, 389 (1954); пат. США,
Ns 2755014, 17/VH 1956.
16. Рейхрудель Э. M., Смирницкая Г. В., Борисенко А. И., Радиотехника и
электроника, 1, № 2, 253 (1956).
17. Hall L. D„ Science, 128, 279 (1958).
18. Рейхрудель Э. М., Смирницкая Г. В., АС. № 139375, Бюл. из. 13, 1961.
19. Смирницкая Г. В., Нгуен Хыу Ти, ЖТФ, 39, № 4, 694 (1969).
20. Smirnitskaya G. V., Nguyen Khiu Tee, Proc, of the 4th Int. Conrg., Man-
chester, 1968.
21. Schuurman W., Diss., Utrecht (1966).
22. Knauer W., Lutz M., Appl. Phys. Let., 2, 109 (1963).
23. Dow D„ J. Appl. Phys., 2, 109 (1963).
24. Reikhrudel E. M., Smirnitskaya G. V., Babertzjan R. P., Proc. 7th Int. Conf,
on Phen, in foniz. Gases, Beograd, 1965.
25. Smirnitskaya G. V., Reikhrudel E. M., Yageasaryan G. A., Proc. 11th Int.
Conf, on Phen, in loniz. Gases, Prague, 1973.
26. Смирницкая Г. В., Нгуен Хыу Ти, ЖТФ, 39, № 6, 1044 (1966),
27. Knauer W., /. Appl. Phys., 37, № 2, 602 (1966).
28. Jepson R. L„ J. Appl. Phys., 32, 2619 (1961).
29. Reikhrudel E. M., Smirnitskaja G. V., Nguyen Khiu Tee, Proc. 8th Int. Conf
of Phen, in loniz. Gases, Vien, 1967.
30. Смирницкая Г. В., Нгуен Хыу Ти, ЖТФ, 40, № 5, 1005 (1970).
31. Andrew D. et al., Proc. 4th Int. Vac. Congr., Manchester, 1968.
32. Bachler W., Henning H., Proc. 4th Int. Vac. Congr., Manchester, 1968.
33. Jepsen R., Proc. 4th Int. Vac. Congr., Manchester, 1968.
34. Baker P. N., Laurenson L., Z. Vac. Sci. and Techn., 9, № 1, 375 (1972).
35. Vaumoron J., Biasio M., Vacuum, 20, № 3, 103 (1970).
36. Singleton J. H., J. Vac. Sci and Techn., 8, № 1, 275 (1971).
37. Harra D. J., Z. Vac. Sci. and Techn., 11, № 1, 331 (1974).
38. Czarycki W., Nowicka C., Pr. Przetn inst. electr., 12, № 1—2, 13 (1971).
39. Рейхрудель Э. M., Смирницкая Г. В., Курбанова Л. Р., ЖТФ, 43, Ns 2,
341 (1973).
ОГЛАВЛЕНИЕ
Предисловие автора к русскому изданию...............................5
Глава 1. Введение ................................................. 9
1 1. Вакуум.....................................................9
1.2 Газ и некоторые свойства его молекул (атомов)..............11
1.3. Вакуум и давление..........................................15
1.4. Влияние температуры на характеристики вакуума..........16
1.5. Газы в объеме, на поверхности и внутри твердых тел .... 17
Глава 2. Свободные газы.............................................19
А. Свободные газы в статическом состоянии..................19
2.1. Энергия газа и его температура............................19
2.2. Давление газа.............................................24
2.3. Атмосферный воздух........................................29
2.4. Соударения частиц газа....................................35
2.5 Основные законы свободных газов...........................42
Б. Свободные газы в динамическом состоянии.................45
2.6. Динамическое состояние газа . . . ........................45
2 7. Диффузия газа...........................................59
2.8. Эффузия газа..............................................54
2.9. Вязкость газа..............................................56 '
2.10. Перенос газом тепловой энергии............................62
2.11. Течение газа..............................................73
В. Проводимость вакуумных систем..........................83
2.12 Проводимость отверстий.....................................84
2.13. Проводимость каналов......................................89
2 14. Течение газа в каналах малого поперечного сечения ...... 104
Глава 3. Связанные газы...........................................107
3.0. Общая характеристика.....................................107
А. Г азы, адсорбированные на поверхности..................109
3.1 . Взаимодействия в газах...................................ПО
3.2 Адсорбция газа...........................................127
ОГЛАВЛЕНИЕ
621
3.3 . Десорбция газа............................................
3 4. Испарение и конденсация...............................138
Б. Газы в твердых телах..................................I48
3 5 Растворение газа в твердых телах.................. .... 149
3.6 Диффузия газа в твердых телах............................152
3 7 Проникновение газа сквозь стенки........................15t>
3 8. Проникновение гелия сквозь стекло.......................162
3.9. Десорбционный поток с разных поверхностей...............165
Глава 4. Получение высокого вакуума..............................169
4.0. Введение ...............................................169
- А. Проточные насосы.....................................176
4.1. Объемные насосы........................................177
4.2. Скоростные насосы.......................................208
4.3. Совместная работа диффузионных и ротационных насосов . . 261
4.4. Насосы с электростатическим полем.......................267
4.5. Адсорбционно-проточные и аккомодационно-эффузионные насосы 269
Б. Сорбционные насосы....................................271
4 6. Криогенные насосы.....................................272
4.7. Цеолитовые насосы ......................................294
4 8. Сублимационные насосы.................................305
4.9 Ионные насосы...........................................312
4.10. Эксплуатационные характеристики сорбционных насосов . . . 326
4.11. Заключительные замечания о сорбционных насосах.........327
Глава 5. Вакуумные измерения.....................................330
А. Измерение полных давлений.............................331
5.1. Барометрические манометры...............................331
5.2. Механические манометры..................................336
5.3 Компрессионные манометры...............................338
5.4 Теплоэлектрические манометры............................347
5.5. Термомолекулярные, кинетомолекулярные и вязкостные мано-
метры ......................................................366
5.6. Ионизационные манометры................................373
Б. Измерение парциальных давлений ...................... 421
5.7. Масс-спектрометры .....................................423
В^.Градуировка манометров................................441
5.8. Методы градуировки.....................................443
Г. Измерения других величин..............................449
5.9. Интенсивность течения и скорость откачки...............449
Д. Обнаружение течей.....................................453
5.10. Течи в вакуумной системе...............................453
Глава 6. Вакуумная аппаратура....................................469
6.1. Вакуумные устройства...................................469
6.2. Материалы для вакуумных устройств......................470
622
ОГЛАВЛЕНИЕ
6.3. Прочные и герметичные неразъемные соединения различных ма-
териалов .................................................488
6.4. Вакуумпроводы ...........................................492
6.5. Разъемные соединения.....................................493
6.6. Клапаны и краны..........................................498
6.7. Вспомогательные вакуумные резервуары.....................505
6.8. Резервуары для чистых газов..............................507
6.9. Сушилки .................................................508
6.10. Смотровые окна..........................................510
6.11. Ввод проводов...........................................510
6.12. Передача движения в область высокого вакуума............512
6.13. Обслуживание вакуумных систем...........................514
Глава 7. Вакуумные установки......................................515
7.0. Применение высокого вакуума..............................515
7.1. Установки высокого вакуума в металлургии.................517
7 2. Установка для электронно-лучевой сварки................519
7.3 Установки для определения количества и состава газов, выде-
ляемых при нагреве............................................521
7.4. Установки для покрытия металлами поверхностей в вакууме . 522
7 5 Использование высокого вакуума в ускорителях частиц .... 532
7.6. Установки для получения и исследования плазмы............537
7.7. Имитаторы условий космического пространства..............511
7.8. Откачка электронных вакуумных приборов...................544
7.9. Установки высокого вакуума для наполнения приборов опреде-
ленными газами................................................548
7.10. Установки для получения сверхвысокого вакуума...........550
7.11. Оборудование для градуировки манометров и исследования на-
сосов ........................................................ 552
7.12. Отделение вакуумного устройства от насоса...............552
7.13. Автоматизация вакуумных установок.......................555
7.14. Техника безопасности ..............................557
Библиография .....................................................559
Пятиязычный словарь важнейших терминов вакуумной техники с пред-
метным указателем.................................................566
Приложение .......................................................600
УВАЖАЕМЫЙ ЧИТАТЕЛЬ!
Ваши замечания о содержании книги, ее оформ-
лении, качестве перевода и другие просим присылать
по адресу: 129820, Москва, И-110, ГСП, 1-н Рижский
пер., д. 2, издательство «Мир».
Я. Грошковский
ТЕХНИКА
ВЫСОКОГО ВАКУУМА
Редактор Ю. Воронов
Художник В Шульженко
Художественный редактор В. Бисенгалиев
Технический редактор Е. Потапенкова
Сдано в набор 8/1 1975 г. Подписано к печати
3/VI 1975 г. Бумага тип. № 1 бОХЭЭ’Дв. 19.50 бум л.
39,00 печ, л. Уч.-нзд. л. 36,94 Изд. № 20/7607
Цена 2 р. 87 к. Зак. 510
Ордена Трудовою Красного Знамени
Ленинградская типография № 2
имени Евгении Соколовой Союзполиграфпрома
прн Государствечном комитете Совета Министров СССР
по делам издательств, полиграфии
и книжной торговли.
198052, Ленинград, Л-52, Измайловский проспект, 29