Автор: Бесков В. С. Сафронов В.С.
Теги: химическая технология химическая промышленность основные процессы и аппараты химической технологии химия экология нефтехимия издательство химия пособие для высшей школы
ISBN: 5-7245-1133-9
Год: 1999
В. С. Бесков
В. С. Сафронов
Общая
химическая
технология
и основы
промышленной
экологии
Рекомендовано Министерством общего
и профессионального образования
Российской Федерации
в качестве учебника для студентов
химико-технологических специальностей
высших учебных заведений
МОСКВА
“ХИМИЯ”
I 1999
ЗКЬбЬЬ
ББК 35.11
Б 532
УДК 66.0
“Федеральная программа книгоиздания России”
Издание осуществлено при поддержке
ОАО “Химический завод им. П.Л. Войкова
(ОАО“Аурат”) и Государственного комитета
по экологии и природным ресурсам
Самарской области
Рецензенты: кафедра ОХТ Ивановского государственного хи.мико-
технологического университета - зав. кафедрой докт. хи.м. наук, проф.
В.А. ШОРМАНОВ; зав. кафедрой химической технологии Московского
государственного университета инженерной экологии докт. хи.м наук
проф. Т.Н БОНДАРЕВА
Бесков В.С., | Сафронов В.С. |
Б 532 Общая химическая технология и основы промышлен-
ной экологии: Учебник для вузов. - М.: Химия, 1999.
472 с.: ил.
ISBN 5-7245-1133-9
В учебнике изложены общие закономерности реакционных процессов
химической технологии, основы теории, расчета и выбора химического ре-
актора. Рассмотрено химическое производство как хи.мико-технологическая
система, даны подходы к ее синтезу и анализу. Обсуждены общие вопросы
промышленной экологии, способы достижения экологической безопасности
химического производства Описаны производства некоторых важнейших
промышленных продуктов химических производств.
Для студентов химических и химико-технологических факультетов
вузов, также может быть полезен аспирантам, инженерно-техническим ра-
ботникам химической и смежных отраслей промышленности.
2802000000 006
Б --------------- Без объявл. ББК 35.11
050(01) 99
ISBN 5-7245-1133-9 © В.С. Бесков, В.С." Сафронов, 1999
J. д’ли-'
ОГЛАВЛЕНИЕ
Предисловие .................................................... 6
Условные обозначения.............................................. 8
Глава 1
ОБЩИЕ ПОЛОЖЕНИЯ .................................................. 9
1.1 Химическая технология......................................... 9
1.2 . Краткий очерк развития химической технологии............... 12
1.3 . Химическое производство.................................... 16
1 4. Химико-технологический процесс ............................ 19
1.5. Показатели химического производства и химико-технологического
процесса..................................................... 21
1.6. Предмет “Общая химическая технология”....................... 24
Глава 2
ХИМИЧЕСКИЕ ПРОЦЕССЫ И РЕАКТОРЫ................................... 25
2.1. Введение.................................................... 25
2.1.1. Химический реактор (общее представление)............. 25
2.1.2. Математическое моделирование как метод исследования
химических процессов и реакторов............................. 29
2.2. Физико-химические основы химических процессов............... 34
2.2.1. Стехиометрия химических превращений.................. 34
2.2.2. Термодинамика химических превращений................. 41
2.2.3. Кинетика химических реакций........................ 51
2.2.4. Классификация химических процессов................... 55
2.3. Гомогенные химические процессы.............................. 57
2.3.1. Простая реакция...................................... 57
2.3.2. Сложная реакция...................................... 61
2.4 Гетерогенные химические процессы............................ 64
2.4.1 Основные определения ................... . . .. 64
2.4.2. Система “газ(жидкость)-твердое”...................... 65
2.4.3. Система “газ(жидкость)-жидкость”..................... 79
2.5. Каталитический химический процесс........................... 83
2.5.1. Катализ и катализаторы............................. 83
2.5.2 Пористое зерно катализатора........................... 86
2.5.3. Непористое зерно катализатора........................ 96
2.5.4. Тепловые явления. Число стационарных режимов и их
устойчивость................................................. 97
2.6 Процессы в химическом реакторе............................. 103
2.6.1 Математические модели процесса в химическом реакторе. 103
2.6.2. Классификация химических реакторов и их математических
моделей..................................................... 109
2.6.3. Анализ процессов в химических реакторах............. 111
2.7. Изотермический процесс в химическом реакторе............... 112
2.7.1. Режимы идеального смещения периодический и идеального
вытеснения.................................................. 112
2.7.2. Режим идеального смещения в проточном реакторе...... 123
2.7.3. Сопоставление непрерывных процессов в режимах идеального
смешения и вытеснения....................................... 125
2.7.4 Неидеальные режимы в реакторах....................... 128
2.8. Нсизотермический процесс в химическом реакторе............. 132
3
2.8.1. Организация теплообмена в реакторе и температурные режимы 132
2.8.2. Режимы идеального смешения периодический и идеального
вытеснения проточный с теплообменом......................... 134
2.8.3. Температурные режимы в проточном реакторе идеального
смешения.................................................... 139
2.8.4. Автотермический реактор................................ 142
2.9. Промышленные химические реакторы.............................. 145
2.9.1. Общие замечания о расчете химических реакторов......... 145
2.9.2. Оптимизация химических процессов и реакторов........... 148
2.9.3. Конструктивные элементы химических реакторов........... 158
2.9.4. Схемы и конструкции промышленных химических реакторов 161
Глава 3
ХИМИКО-ТЕХНОЛОГИЧЕСКАЯ СИСТЕМА..................................... 175
3.1. Введение...................................................... 175
3.1.1. Химико-технологический процесс как химико-технологичес-
кая система................................................. 175
3.1.2. Системный анализ - метод исследования химико-технологи-
ческой системы.............................................. 177
3.2. Химико-технологическая система................................ 178
3.2.1. Состав и структура химико-технологической системы.... 178
3.2.2. Элементы и связи химико-технологической системы...... 179
3.2.3. Модели химико-технологической системы.................. 184
3.3. Состояние химико-технологической системы...................... 192
3.3.1. Основные понятия и определения......................... 192
3.3.2. Материальный баланс.................................... 194
3.3.3. Тепловой баланс........................................ 203
3.3.4. Расчет состояния химико-технологической системы........ 207
3.4. Анализ химико-технологической системы......................... 212
3.4.1. Задачи анализа химико-технологической системы.......... 212
3.4.2. Свойства ХТС как системы............................... 212
3.4.3. Эффективность использования материальных ресурсов.... 221
3.4.4. Энергетическая и эксергетическая эффективность химико-тех-
нологической системы........................................ 222
3.4.5. Эффективность организации процесса в химико-технологичес-
кой системе................................................. 230
3.5. Синтез химико-технологической системы......................... 235
3.5.1. Задачи синтеза химико-технологической системы.......... 235
3.5.2. Подход к синтезу химико-технологической системы........ 236
3.6. Синтез химико-технологической системы и сырьевые ресурсы.... 241
3.6.1. Сырье в химическом производстве........................ 241
3.6.2. Концепция полного использования сырьевых ресурсов.... 248
3.6.3. Комбинированные химико-технологические процессы и ком-
плексное использование сырья................................ 255
3.7. Синтез химико-технологической системы и энергетические ресурсы 259
3.7.1. Энергия в химическом производстве...................... 259
3.7.2. Концепция полного использования энергетических ресурсов 261
3.7.3. Вторичные энергетические ресурсы....................... 265
3.7.4. Энерготехнологическая система.......................... 268
3.8. Синтез химико-технологической системы и отходы производства. 270
3.8.1. Отходы химического производства........................ 270
3.8.2. Концепция минимизации отходов.......................... 271
3.9. Синтез химико-технологической системы и оборудование.......... 273
3.9.1. Оборудование химического производства.................. 273
3.9.2. Концепция эффективного использования оборудования.... 274
4
3.9.3. Совмещение процессов.......................................... 278
3.9.4. Перестраиваемые химико-технологические системы................ 282
3.10. Однородные химико-технологические системы........................... 284
310.1. Система химических реакторов................................. 284
3.10.2. Система разделения........................................... 288
3.10.3. Система теплообменников...................................... 289
3.11. Эксплуатация химико-технологической системы......................... 292
3.11.1. Эксплуатационные свойства химико-технологической систе-
мы......................................................... 292
3.11.2. Управление химическим производством.......................... 296
3.11.3. Пуск и остановка химического производства.................... 302
3.11.4. Безопасность и диагностика химико-технологической системы ... 304
Глава 4
ОСНОВЫ ПРОМЫШЛЕННОЙ ЭКОЛОГИИ.............................................. 309
4.1. Окружающая среда как система......................................... 309
4.1.1. Общие понятия об экологии и промышленной экологии... 309
4.1.2. Масштабы потребления природных ресурсов....................... 314
4.1.3. Взаимодействие производства и окружающей среды................ 317
4.1.4. Контроль состояния окружающей среды .......................... 321
4.1.5. Экономические последствия загрязнения окружающей среды 324
4.1.6. Основные принципы создания безотходных производств.. 325
4.1.7. Экономическая эффективность безотходных производств. 330
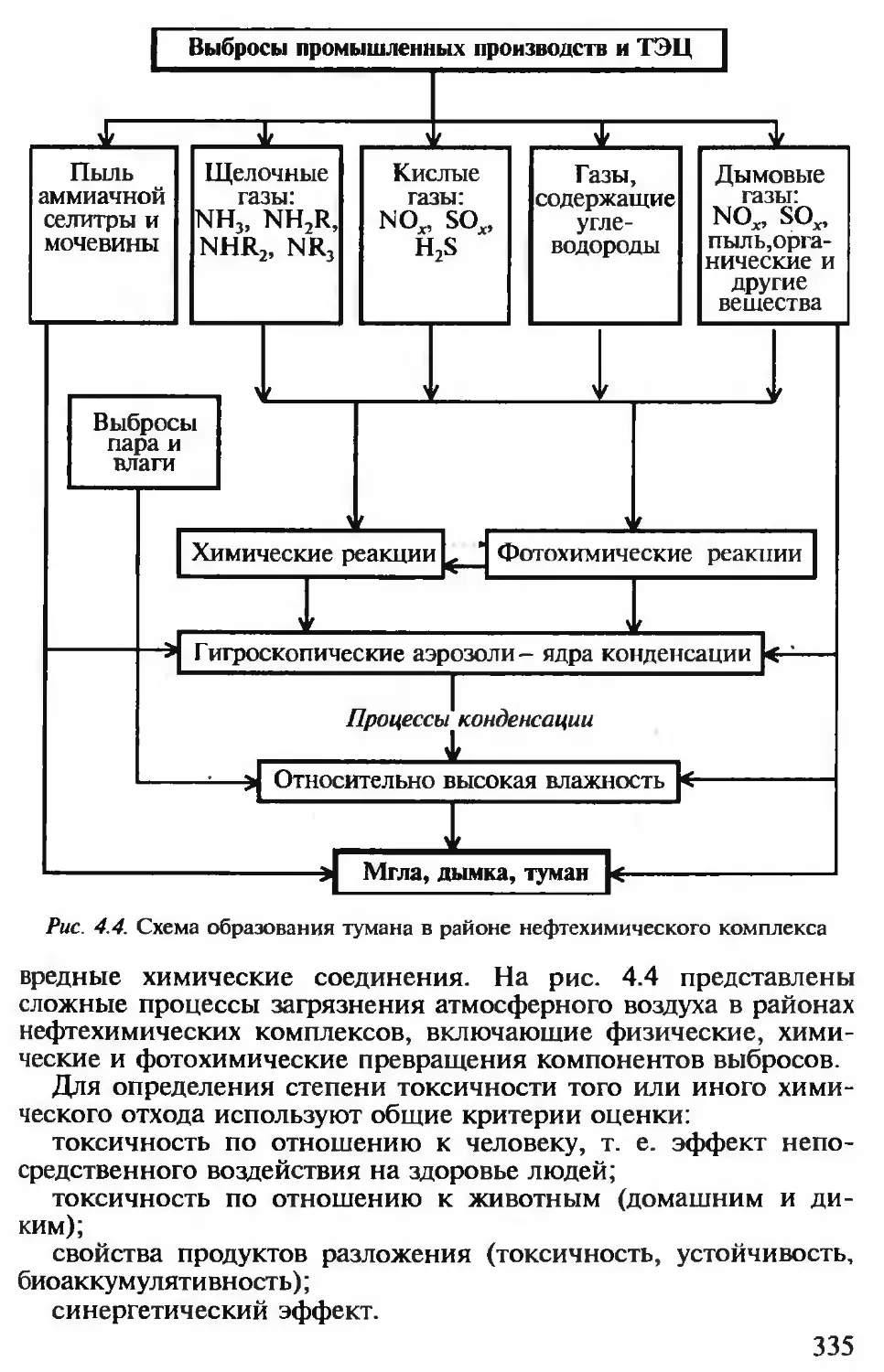
4.2. Экологические проблемы химических производств........................ 332
4.2.1. Виды вредных воздействий химических производств на биосферу 332
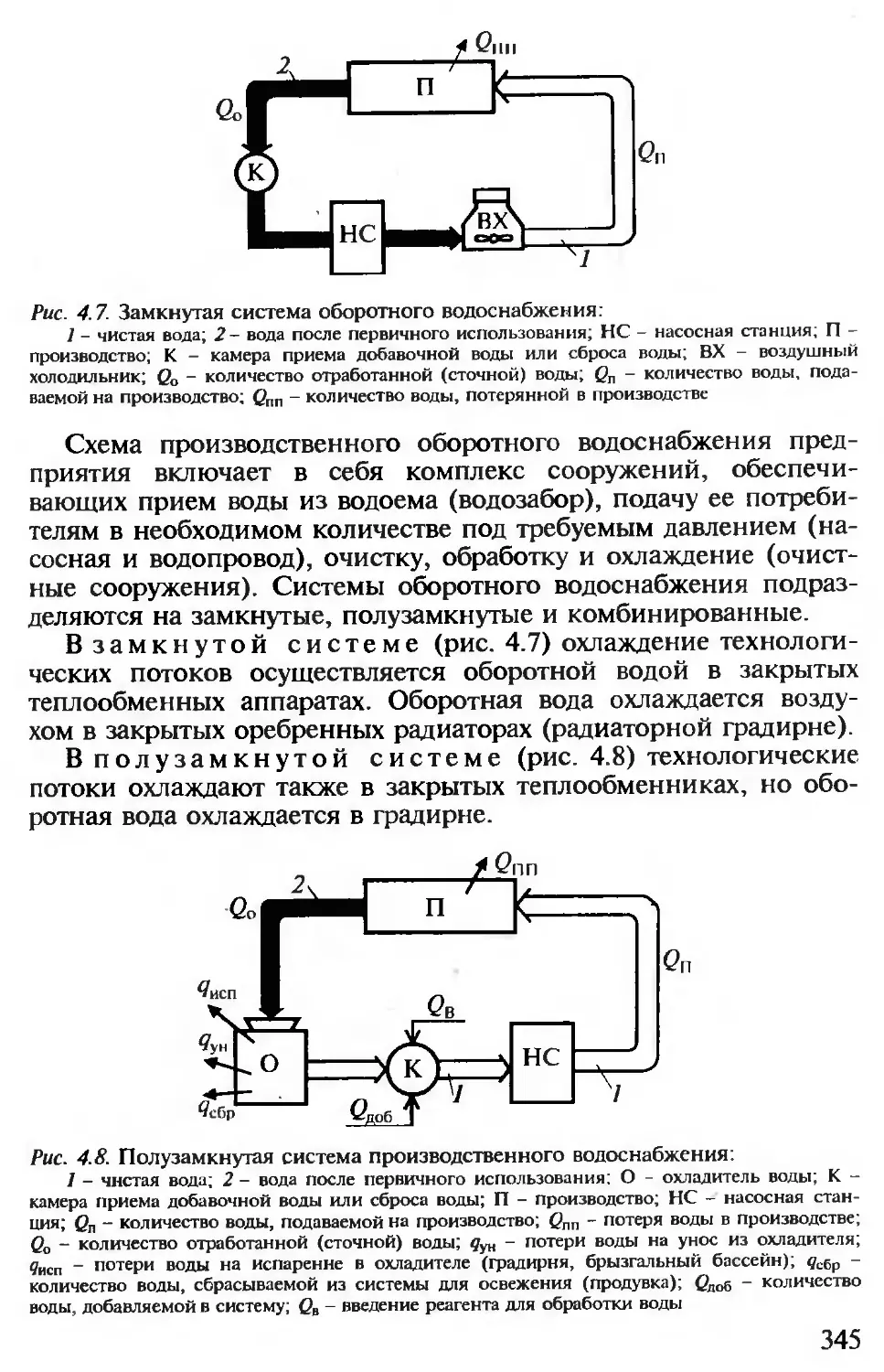
4.2.2. Водные ресурсы и химическая технология........................ 338
4.2.3. Классификация отходов химической промышленности и мето-
дов их обезвреживания...................................... 352
4.2.4. Утилизация и обезвреживание твердых отходов................... 355
4.2.5. Утилизация и обезвреживание жидких отходов.................... 360
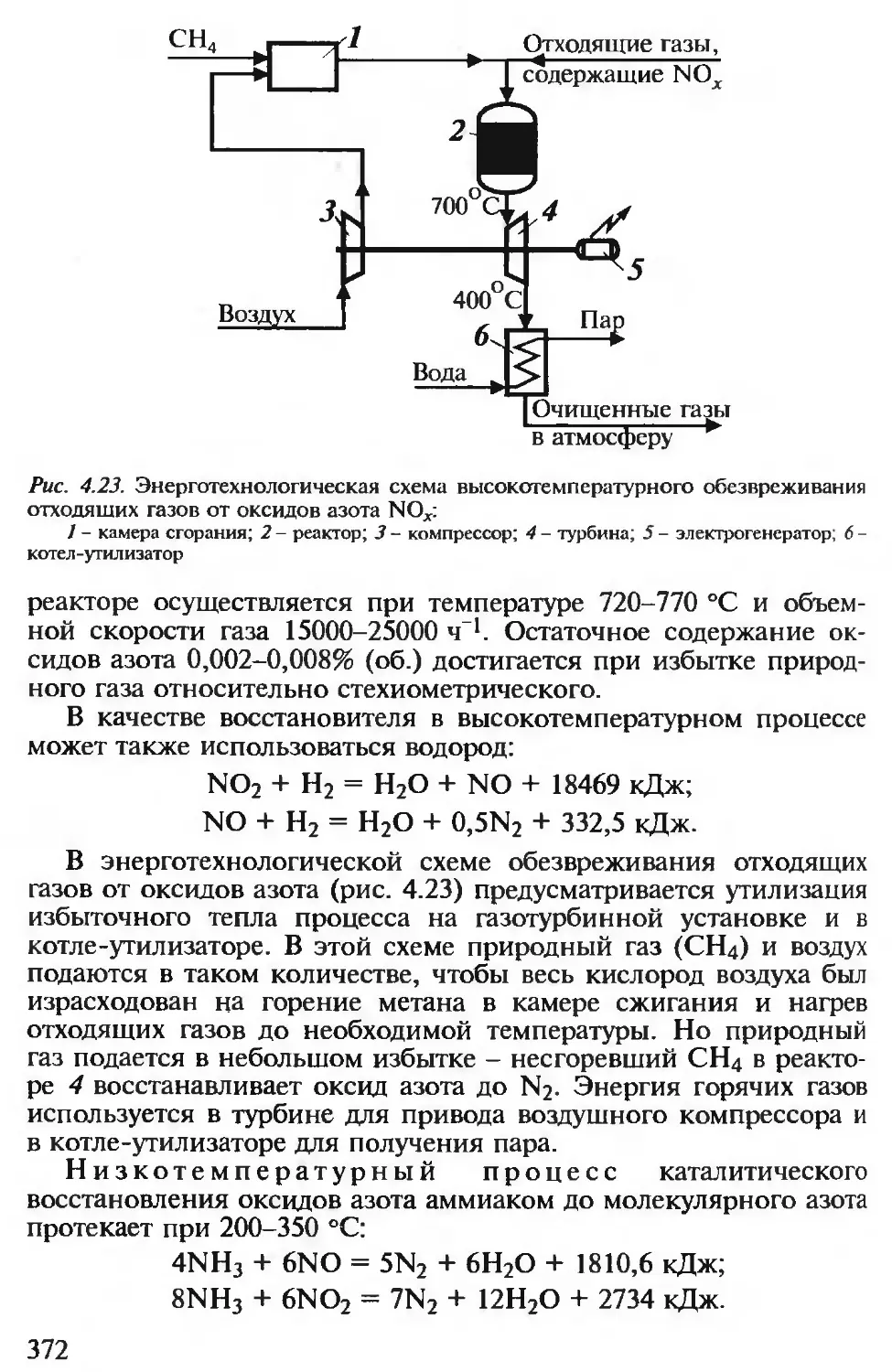
4.2.6. Утилизация и обезвреживание газообразных отходов.... 367
4.2.7. Утилизация и обезвреживание шламов химических производств 373
4.2.8. Обезвреживание особо токсичных и радиоактивных отходов.. 375
Глава 5
ХИМИЧЕСКИЕ ПРОИЗВОДСТВА................................................... 379
5.1. Введение............................................................. 379
5.2. Химическая переработка нефти......................................... 380
5.2.1. Общая характеристика нефтехимического комплекса..... 380
5.2.2. Первичная перегонка нефти..................................... 381
5.2.3. Каталитический риформинг углеводородов........................ 383
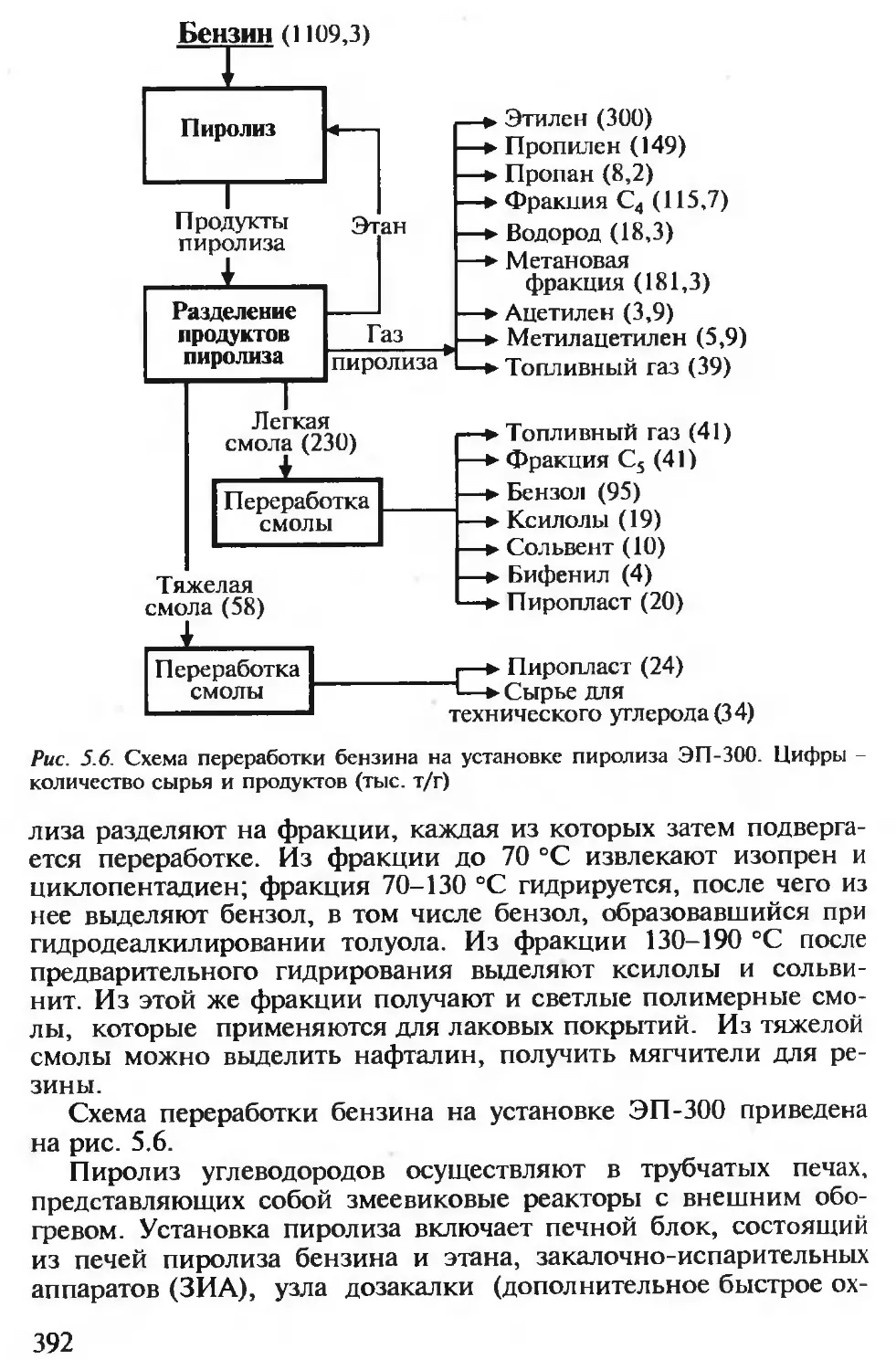
5.2.4. Производство низших олефинов пиролизом углеводородов .. 388
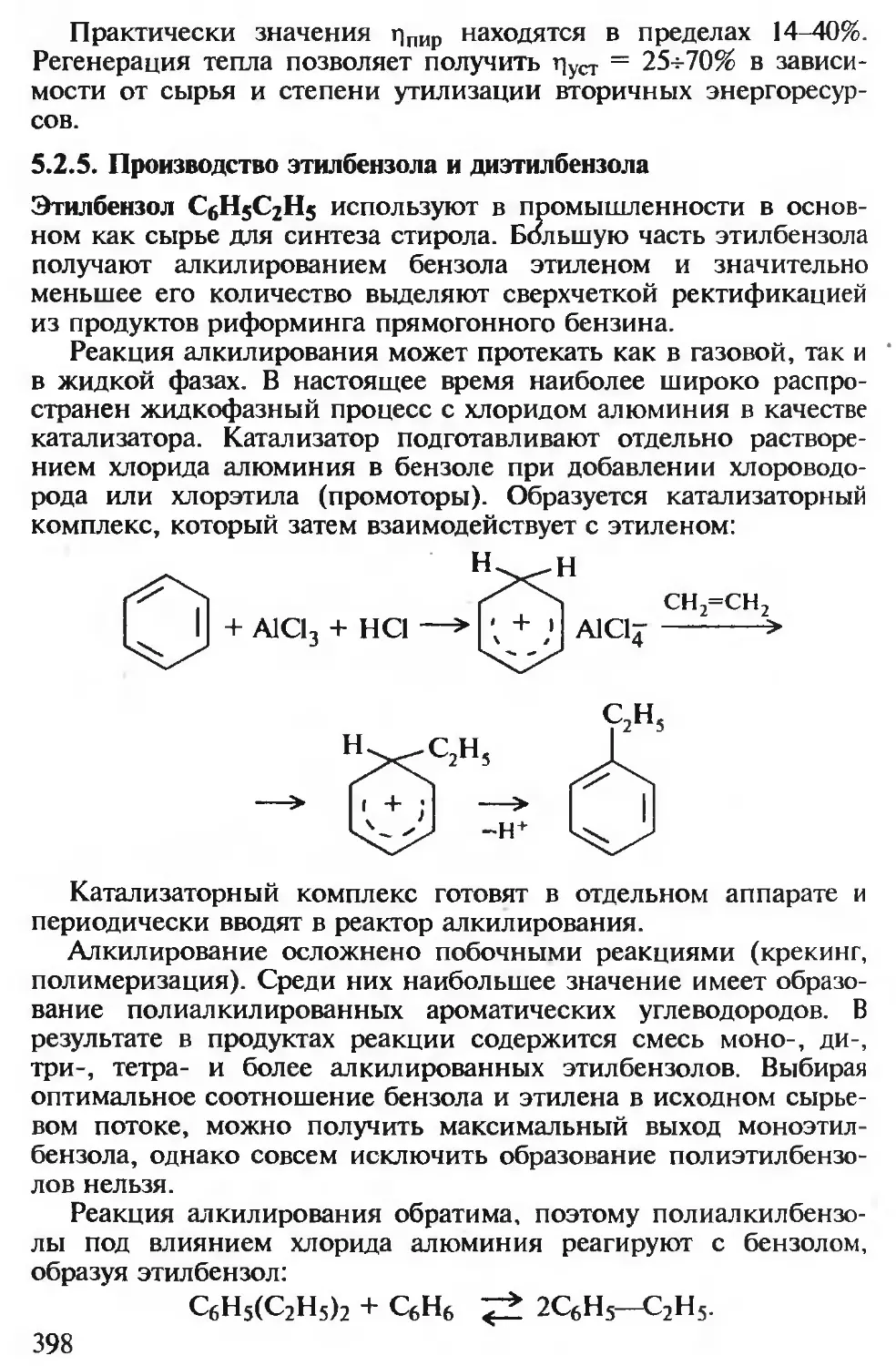
5.2.5. Производство этилбензола и диэтилбензола...................... 398
5.2.6. Производство стирола.......................................... 404
5.2.7. Производство полиолефинов и полистирола....................... 410
5.3. Производство удобрений............................................... 420
5.3.1. Общая структура производства удобрений........................ 420
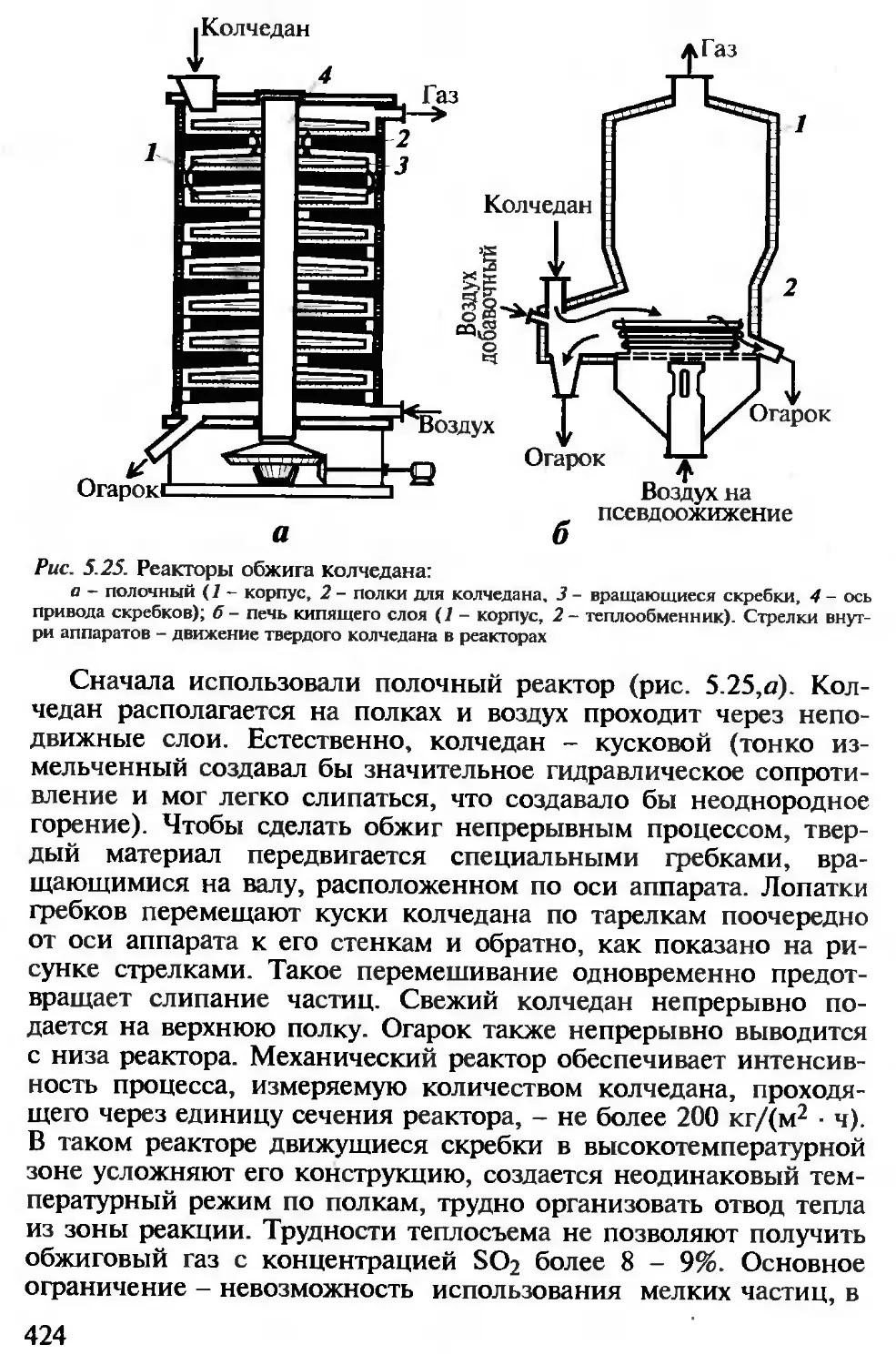
5.3.2. Производство серной кислоты................................... 421
5.3.3. Производство аммиака.......................................... 435
5.3.4. Производство азотной кислоты.................................. 452
5.3.5. Производство фосфорной кислоты................................ 459
Заключение................................................................ 464
Библиографический список.................................................. 467
ПРЕДИСЛОВИЕ
В течение многих лет заведующие кафедрами и ведущие препо-
даватели общей химической технологии (ОХТ) ежегодно соби-
рались для обсуждения программы и содержания одноименной
учебной дисциплины. Курс ОХТ преподавали как химикам-
технологам, так и в тех вузах, где студентов надлежало лишь
ознакомить с химической промышленностью, химической тех-
нологией. Естественно, поэтому структура, содержание, методи-
ка преподавания и название курса в разных вузах различались.
На совещаниях было выработано общее содержание курса, про-
читаны лекции по отдельным разделам, особенно новым. Мно-
гие вопросы были обсуждены на международных совещаниях
специалистов стран Восточной Европы. Так сформировался
курс “Общая химическая технология”, который составляет со-
держание настоящего учебника.
В него по возможности включены все разделы, находившие
отражение в тех или иных вариантах учебной дисциплины ОХТ.
Поэтому, вероятно, большинство преподавателей и студентов
найдут в нем необходимый материал. Вместе с тем все замеча-
ния и предложения по учебнику будут с благодарностью приня-
ты в целях его дальнейшего совершенствования.
За время сбора и подготовки материала, его обобщения и
“обкатки” в практической работе преподавателей многое изме-
нилось. Вместо единой системы обучения в единой стране обра-
зовались самостоятельные структуры в странах Содружества
Независимых Государств. Однако общность учебной дисципли-
ны ОХТ сохранилась, так как в становлении курса принимали
участие специалисты из Украины, Белоруссии, Казахстана, Ар-
мении, Азербайджана, Узбекистана, Эстонии и всех других те-
перь независимых государств. Это позволяет обеспечить подго-
товку инженеров-технологов в соответствии с общим уровнем
качества, принятым в мировом сообществе.
К сожалению, за время подготовки рукописи ушел из жизни
один из авторов учебника - профессор, доктор технических
наук, зав. кафедрой ОХТ Самарского технического университета
(бывший Куйбышевский политехнический институт) Валентин
Семенович Сафронов, инженер-технолог высокой квалифика-
ции, новатор в преподавании ОХТ. Он успел подготовить свою
часть рукописи. Им написаны глава по основам экологии (гл. 4)
и раздел по нефтехимическим производствам (разд. 5.2), а также
разделы 3.6.1, 3.7.1 и 3.11. Я как соавтор только расположил
этот материал в соответствии с планом книги.
6
В формировании содержания учебника большую помощь
оказали академики Н.М.Жаворонков, В.В.Кафаров, Н.М.Куте-
пов, чл.-корр. РАН М.Г.Слинько, профессора И.П.Мухленов,
В.И.Ксензенко, Т.Н.Бондарева, ЛЛ.Таважнянский, З.М.Царева,
В.А.Шорманов и многие другие, с кем мы работали на совеща-
ниях и имели личные встречи. В апробацию нового материала
внесли свой вклад сотрудники кафедры ОХТ РХТУ им.
Д.И.Менделеева доценты И.Э.Фурмер, В.Н.Зайцев, Г.М.Семе-
нов, Л.В.Гришин, В.И.Игнатенков, А.П.Жуков (последним на-
писан разд. 1.2 - “Краткий очерк развития химической техноло-
гии”) и другие. В подготовке материалов и рукописи активно
участвовали сотрудники кафедры ОХТ СТУ доценты Ю. И Бого-
молов, Н.Г.Гладышев, Г.Я.Богомолова, В.Д.Измайлов и другие.
Большая часть рукописи была напечатана моей дочерью
Е. В. Бесковой.
Я благодарен всем им за помощь в подготовке материала
учебника и активную поддержку.
В. С. ВЕСКО В
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
Ниже приведены обозначения только основных параметров и
переменных, которые используются в научной и технической
литературе и которые целесообразно использовать в настоящем
курсе. Другие обозначения расшифровываются по мере их появ-
ления в тексте. Там же даются пояснения индексов.
А, В,...,- обозначения исходных ве-
R, S ществ и продуктов реакции
в стехиометрических урав-
нениях;
С - концентрация;
с£ - теплоемкость (изобарная);
D, D& - коэффициент диффузии мо-
лекулярный и кнудсенов-
ский;
7>эф - эффективный коэффициент
диффузии в пористом теле;
Е - энергия активации; выход
продукта;
Е, - поверхность теплообмена;
G - весовое количество вещест-
ва; энергия Гиббса;
g - массовый поток; массовая
концентрация;
Н - энтальпия;
Кр - константа равновесия;
X- - коэффициент теплопередачи;
Кн - наблюдаемая константа ско-
рости;
к - константа скорости реакции;
L, I - длина реакционной зоны
полная и текущая соответ-
ственно;
N - мольный поток;
Ср - тепловой эффект реакции;
количество тепла;
Р - давление;
Pi - парциальное давление;
q - тепловой поток;
г - скорость реакции;
R, г - радиус полный и текущий
соответственно;
S', S - селективность дифференци-
альная и интегральная;
S - энтропия; площадь сечения;
Т - температура;
ДГад - величина адиабатического
разогрева;
t - время;
и - скорость потока;
V - объемный поток;
vp, vk> _ объем реактора, слоя и
v3 зерна катализатора;
W - объемная нагрузка в реакто-
ре;
w - скорость превращения;
WH - наблюдаемая скорость пре-
вращения;
х - степень превращения;
у - безразмерная концентрация;
а - коэффициент теплообмена;
Р - коэффициент массообмена;
т] - коэффициент полезного
действия;
X - коэффициент теплопровод-
ности;
v - стехиометрический коэф-
фициент; кинематическая
вязкость;
р - безразмерный радиус; плот-
ность вещества;
т - условное время реакции.
Глава 1
ОБЩИЕ ПОЛОЖЕНИЯ
1.1. ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
“Технология - учение о выгодных (т. е. поглощающих наименее
труда людского и энергии природы) приемах переработки природ-
ных ресурсов в продукты, потребные (необходимые, или полезные,
или удобные) для применения в жизни людей” - так начинается
статья “Технология”, написанная Д.И.Менделеевым в Энциклопе-
дическом словаре под редакцией Ф.А.Брокгауза и И.Л. Ефрона.
Происхождение слова “технология” (от греческих “technos” -
искусство, ремесло и “logos” - учение, наука) вполне отвечает
его содержанию: учение об умении, искусстве перерабатывать
исходные вещества в полезные продукты.
В зависимости от основных приемов переработки исходных
веществ и назначения продуктов различают: технологию метал-
лов (их получение и обработка), технологию машиностроения
(изготовление машин и аппаратов), пищевую технологию
(получение продуктов питания) и т. д. Классификация, как вид-
но, в основном связана с отраслями промышленности. Очевид-
но, что провести четкую границу в признаках классификации
технологии получения различных продуктов нельзя, ибо одина-
ковые приемы обработки исходных материалов могут быть ис-
пользованы при получении различных продуктов (например,
приемы штамповки металлов используются как в технологии
металлов, так и в машиностроении).
Химическая технология представляет собой переработку, в
процессе которой превалируют химические и физико-хими-
ческие явления, что приводит к коренному изменению состава,
свойств и строения веществ.
Химическая технология - естественная, прикладная наука о
способах и процессах производства продуктов (предметов по-
требления и средств производства), осуществляемых с участием
химических превращений технически, экономически и соци-
ально целесообразным путем.
Как наука химическая технология имеет: предмет изучения -
химическое производство; цель изучения - создание целесооб-
разного способа производства необходимых человеку продуктов;
методы исследования - экспериментальный, моделирование и
системный анализ.
9
Как естественная наука химическая технология изучает мате-
риальные явления и объекты (в отличие от естественных обще-
ственные науки - такие, как философия, логика, история - изу-
чают идеальные явления).
Как прикладная наука технология изучает производство. Ко-
нечной целью изучения является создание способа производства
(в отличие от “чистой” науки, изучающей явления природы с
целью получения более отвлеченных знаний о них). Этот при-
знак классификации условен, ибо прикладная наука также соз-
дает знания о явлениях, наблюдаемых в производстве, но тем не
менее такая классификация наук существует. Отметим, что по-
нятие “прикладная наука” ни в коей мере не означает ее
“второсортности”. Как “чистая”, так и “прикладная” науки да-
ют фундаментальные знания о явлениях, характерных для изу-
чаемого объекта. Это замечание относится и к химической тех-
нологии как к прикладной науке.
Химическая технология интегрирует в себе знания о химиче-
ских превращениях, физико-химических свойствах и явлениях,
физических явлениях переноса, сведения из математики, меха-
ники, экономики и других наук и вырабатывает знания о вза-
имодействии отдельных явлений. Как видно, химик-технолог
должен быть эрудирован во многих научных областях. “Учение
о способах ... освещает научным началом то, что вырабатывается
практикой, и через это не только усовершенствуется производ-
ство, но и расширяется область научного понимания вещей и
явлений” (Д.И.Менделеев, там же).
Методы химической технологии весьма распространены в
нехимических отраслях промышленности - металлургии, тран-
спорте, электронике, энергетике, строительстве и др. Процессы
получения металлов (в доменных, мартеновских и других пла-
вильных печах) - типичные химические процессы. Горение топ-
лива в топках паровых котлов, в двигателях внутреннего сгора-
ния или ракетных - типичный химический процесс. Получение
материалов электроники и строительных материалов тоже во
многом связано с химическими процессами. Защита окружаю-
щей среды также использует химические методы.
Большое значение приобретают материалы, которых нет или
недостаточно в природе, но которые необходимы для всех про-
изводств (полимерные и другие композиционные материалы,
обладающие специальными свойствами, материалы защитные и
красящие, скрепляющие и разрушающие и т. д.). Соответствен-
но роль химика-технолога возрастает и в нехимических отраслях
промышленности.
Отметим, что химическая технология нередко не только
означает область науки, но и используется в других значениях -
как способ получения или производства определенного продук-
10
та (технология серной кислоты, технология аммиака, технология
газов и т. д.) или отражает основной способ или метод перера-
ботки сырья (мембранная технология - разделение смесей с
помощью мембран, плазменная технология - использование
плазмы при переработке веществ или обработке изделий и др.).
Химическую технологию классифицируют на основе различ-
ных признаков - характер используемых технологических про-
цессов, происхождение и характер сырья, характер и потреби-
тельские свойства продуктов.
По отраслям, как они исторически сформировались в хозяй-
ственной жизни, химическую технологию классифицируют так:
А. Неорганическая химическая технология
1) основной неорганический синтез - производство кислот,
щелочей, солей и минеральных продуктов;
2) тонкий неорганический синтез - производство неоргани-
ческих препаратов, реактивов, редких элементов, материалов
электроники, лекарственных веществ и др.;
3) ядерно-химическая технология;
4) металлургия - производство черных и цветных металлов;
5) силикатные производства - производства вяжущих мате-
риалов, керамических изделий, стекла.
Б. Органическая химическая технология
1) переработка нефти и газа - первичная переработка
(первичное разделение, очистка, облагораживание) газообраз-
ных, жидких и твердых природных углеводородов (ископаемого
топливного сырья);
2) нефтехимический синтез - производство органических
продуктов и полупродуктов на основе переработки газообраз-
ных, жидких и твердых углеводородов, а также на основе окси-
дов углерода и водорода;
3) основной органический синтез - производство органических
продуктов на основе главным образом углеводородного сырья;
4) биотехнология - производство кормовых дрожжей, амино-
кислот, ферментов, антибиотиков и др. на основе биологиче-
ских процессов;
5) тонкий органический синтез - производство органических
препаратов, реактивов, лекарственных веществ, средств защиты
растений и др.;
6) высокомолекулярная технология - получение высокомоле-
кулярных соединений (синтетический каучук, пластмассы, хи-
мические волокна, пленкообразующие вещества);
7) технологии переработки растительного и животного сырья.
Очевидно, что приведенная классификация химической тех-
нологии так же условна, как и классификация технологии во-
обще. Приведенная классификация основана на том, что в ука-
занных процессах переработки сырья в продукты происходит
11
коренное изменение состава, свойств и строения участвующих
веществ, т. е. химическое превращение или физико-химический
процесс, хотя металлургия, силикатные производства, биотехно-
логия, переработка растительного и животного сырья относятся
к “нехимическим” отраслям промышленности.
1.2. КРАТКИЙ ОЧЕРК РАЗВИТИЯ
ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
Укрощение огня человеком стало отправной точкой в развитии
прахимии и первичных ремесел. Вода, огонь и природные мате-
риалы (минеральное, растительное и животное сырье) - эти
доступные древнему человеку элементы природы стали основой
в освоении простейших производств, давших затем толчок к
созданию первичной базы той науки, которую мы называем
химией. Появились секреты искусства ремесла, передававшиеся
по наследству, т. е. то, что сегодня именуется технологией. Ор-
ганизационные формы первичных технологий совершенствова-
лись по цепочке: ремесло - промысел - промышленность, но
основные компоненты оставались по сути теми же: сырье -
энергия (тепловая) - взаимодействие - разделение (очистка).
Самым неизведанным, магическим звеном в этой цепочке были
правила проведения процесса и механизм взаимодействия (т. е.
химическая реакция).
Люди античности знали и использовали многие продукты:
серу, соду (природную), уксус, зажигательные смеси, минераль-
ные и растительные краски, растительные масла. В Древнем
Китае было известно получение бумаги, красителей, сахара;
финикийцы производили пурпур. Индейцы доколумбовых вре-
мен упаривали природные соки. Древние ремесла включали все
известные сегодня единичные процессы технологии - гидравли-
ческие, механические, тепловые, диффузионные, химические и
биохимические. В XIV в. Европа узнала черный порох, изобре-
тение которого связывают с именем монаха Бертольда Шварца.
Алхимики - египетские, китайские, арабские, европейские -
не только закрепили в сознании человечества термин “химия”,
известный по греческим письменным источникам с середины
V в., не только произвели новые продукты - серную, азотную,
мышьяковистую кислоты, сулему, нашатырь и др.; они дали
толчок развитию новых ветвей науки - химии благородных ме-
таллов и фармацевтической химии. Началась эпоха химии как
науки, пришло время собирать, описывать, систематизировать,
время анализа и синтеза на основе опыта древних ремесел.
Арабский алхимик Абу-ар-Рази в “Книге тайн” (X в.) описал
различные химические аппараты и процессы, ввел классифика-
цию веществ на землистые (минеральные), растительные и жи-
12
вотные; описал кальцинацию (обжиг), растворение, сгущение,
фильтрование, дистилляцию, амальгамирование. Пришло время
технологии на уровне промыслов или мануфактур.
В России уже известны к середине XVI в. промыслы по изго-
товлению пороха, красок, селитры, соды, серной кислоты,
“серы горючей”, канифоли, воска и др. К старинным россий-
ским промыслам, так или иначе причастным к химической тех-
нологии, следует отнести варку поваренной соли, обжиг древес-
ного угля, смолокурение. Все это подробно описано в шести
томах “Истории химических промыслов и химической промыш-
ленности России”, подготовленных профессором П.М.Лукья-
новым (М.: Изд. АН СССР, 1948 - 1965 гг ).
Во второй половине XVIII в. устанавливаются качественно но-
вые связи между химией и химическим производством: на базе
фундаментальных наук рождается наука о химической технологии.
Химическая промышленность в современном ее понимании ведет
отсчет от разработки в 1789 г. французским химиком Н.Лебланом
метода получения синтетической воды по реакции
Na2SO4 + 2С + СаСО3 = Na2CO3 + 2СО2 + CaS,
что потребовало интенсивного развития производства серной
кислоты для получения сульфата натрия:
2NaCl + H2SO4 = Na2SO4 + 2НС1.
Возникла проблема утилизации хлороводорода - появилось
производство соляной кислоты. Затем на промышленном уровне
была решена проблема утилизации твердых и газовых отходов в
производстве соды
CaS + СО2 + Н2О = СаСО3 + H2S;
2H2S + ЗО2 = 2Н2О + 2SO2
и далее до получения серной кислоты. Процесс вышел замкну-
тым по сере (Na2SO4-CaS-H2S-SO2-H2SO4-Na2SO4) и с утили-
зацией выброса СО2.
Расширение гаммы продуктов потребления, получаемых хи-
мическими способами, стремление получать более дешевые
продукты привело к созданию качественно новых, непрерыв-
ных, экономичных технологий. Проблемы, связанные с интен-
сификацией земледелия, вызвали к жизни создание технологий
по производству минеральных удобрений сначала фосфатных,
затем калийных и, наконец, азотных. Последнее требовало про-
стейшей переработки неограниченного по запасам сырья - азота
воздуха. Синтез NH3 по методу Габера - Боша открыл новый
этап развития химической технологии, когда от стехиометриче-
ских уравнений как базы создания процесса исследователи пе-
решли к термодинамическим и кинетическим расчетам вероят-
ности и скорости реализации технологических процессов.
13
В начале XIX в. в России формируется система технологиче-
ского образования. С 1804 г. в университетах Москвы, Казани,
Харькова создаются кафедры технологии, а с 1803 г. в рабочем
плане Петербургского педагогического института появился курс
“химической технологии”, образован технологический кабинет.
Фактически впервые курс “Химическая технология” начал чи-
тать проф. И.А.Двигубский в Московском университете в 1806 г.
В 1837 г. Петербургский технологический институт выпустил
первую группу инженеров-химиков. В эти годы выходят первые
русские учебники по химической технологии: И.А.Двигубский.
Начальные основания технологии, или краткое показание работ,
на заводах и фабриках производимых. В 2 частях. М. 1807 -
1808 гг.; Ф.Денисов. Пространное руководство общей техноло-
гии, или к познанию всех работ, средств, орудий и машин,
употребляемых в разных технических искусствах. М., 1828 г.
Можно считать, что эти первые отечественные издания - про-
образы будущего курса “Общая химическая технология”. Расту-
щий общественный интерес к развитию производства отражают
такие специальные периодические издания, как “Техноло-
гический журнал, или собрание сочинений, относящихся до
технологии” (1804 - 1826 гг.); “Новый магазин естественной
истории, физики, химии и сведений экономических” (1826 -
1829 гг.); “Указатель открытий по физике, химии, естественной
истории и технологии” (1824 - 1832 гг.).
Первая специализированная химико-технологическая лабора-
тория была организована по проекту Р.Х.Геймана в Московском
университете в 1834 г. В разные годы ее возглавляли такие хи-
мики, как М.Я.Киттары, И.П.Архипов, В.В.Марковников,
Н.Н. Любавин.
В конце XIX в. в России шел процесс концентрации хими-
ческой промышленности, работали не только мелкие, неболь-
шие заводики, но и такие хорошо организованные производства
основной химии, как Тентелевский, Бондюжский, но в целом
химическая промышленность все-таки еще не играла заметной
роли в экономике страны.
Мощный импульс развитию химической промышленности
был дан в 1920 - 1932 гг. Создана отрасль минеральных удобре-
ний (включая производство серной, азотной кислот и аммиака),
построены крупные заводы по выпуску химических волокон,
синтетического каучука, строительных и оборонных материалов,
пластмасс и синтетических смол. Следующий период интенсив-
ной химизации народного хозяйства нашей страны был пред-
принят в 1959 - 1970 гг. - огромные мощности были задейство-
ваны в производстве сложных и комплексных удобрений, неф-
техимии, в производствах целлюлозы, цемента и др. Значитель-
ный вклад в развитие химической технологии и создание хими-
14
ческой промышленности внесли видные ученые нашей страны
Г.С.Петров, Н.Д.Зелинский, П.А.Каблуков, Н.Ф.Юшкевич,
П.А.Тищенко, В.Н.Шульц, Н.Н.Ворожцов, А.Г.Касаткин,
П.М.Лукьянов, Н.М.Жаворонков, Г.К.Боресков, М.М.Дубинин,
И.И.Китайгородский, В.В.Кафаров и многие другие.
В 1920 г. на базе Московского промышленного училища был
организован Московский технологический институт им.
Д.И.Менделеева (в дальнейшем - МХТИ им. Д.И.Менделеева, а
с 1992 г. - Российский химико-технологический университет
им. Д.И.Менделеева). От него отпочковались несколько инсти-
тутов химического профиля. Основатель института ИА-Тищен-
ко полагал, что главное отличие высшего химико-техно-
логического образования от университетского и политехниче-
ского должно заключаться в том, что сердцевиной его, основной
спецификой должны быть инженерно-технологические дисци-
плины, и в первую очередь - курс процессов и аппаратов хими-
ческой технологии и курс общей химической технологии.
Это, как выяснилось позже, было тем недостающим звеном,
которое завершило систему подготовки инженеров-технологов,
связав в единое целое общенаучную и общеинженерную подго-
товку со специально-технологической. Кафедрой курса общей
химической технологии МХТИ им. Д.И.Менделеева в разное
время руководили профессора: М.П.Дукельский, Н.М.Жаворонков,
А.Е.Маковецкий, П.М.Лукьянов, Д.А.Кузнецов, А.Г.Амелин.
В 1940 г. кафедрой ОХТ Военной академии химической за-
щиты РККА им. К.Е.Ворошилова был издан фундаментальный
учебник: Общая химическая технология/Под редакцией проф.
С.И.Вольфковича. I том. М.: Госхимиздат, 1946 г. Редактор от-
мечал, что “химическая технология как наука до сих пор еще не
перешла из стадии описательной, содержащей весьма обшир-
ные, но недостаточно систематизированные материалы, в ста-
дию глубокого физико-химического и инженерного ее изуче-
ния”. Переход от описательного характера химико-технологи-
ческих процессов к физико-химическому и инженерному анали-
зу осуществлен в учебнике: Общая химическая технология/Под
редакцией И.П.Мухленова и Д.А.Кузнецова. Изд. 2-е. М.: Выс-
шая школа, 1970 г.; этот учебник выдержал несколько изданий.
В дальнейшем кафедра ОХТ РХТУ им. Д.И.Менделеева стала
инициатором формирования и развития принципиально нового
курса общей химической технологии с использованием методов
математического моделирования, глубокого физико-хими-
ческого и инженерного ее изучения. В становление нового курса
решающий вклад внесли профессора И.П.Мухленов, А.Г.Аме-
лин, В.И.Ксензенко. Его формирование и развитие происходили
при активном участии ведущих преподавателей этой дисципли-
ны почти всех вузов бывшего СССР. По мере совершенствова-
15
ния курса издавались новые учебники: И.П.Мухленовым и
А.Г.Амелиным, коллективами авторов - А.М.Кутепов, Т.И.Бон-
дарева, М.Г.Беренгартен и Л.Л.Таважнянский, З.М.Царева,
В.И.Орлова (Харьков) - см. Библиографический список в конце
книги. Развитие науки, промышленности и образования в об-
ласти химической технологии продолжается.
1.3. ХИМИЧЕСКОЕ ПРОИЗВОДСТВО
Объектом исследования химической технологии является хими-
ческое производство.
Химическое производство - совокупность процессов и опера-
ций, осуществляемых в машинах и аппаратах и предназначен-
ных для переработки сырья путем химических превращений в
необходимые продукты.
Сформулируем общие требования к химическому
производству:
получение в производстве необходимого продукта;
экологическая безопасность;
безопасность и надежность эксплуатации;
максимальное использование сырья и энергии;
максимальная производительность труда.
Основное назначение химического производства - получение
продукта, при этом химическое производство является многофунк-
циональным. Общая структура химического производства включает
в себя функциональные части, представленные на рис. 1.1.
Поз. 1-3 на рис. 1.1- собственно химическое производство, в
котором сырье перерабатывается в продукт.
Подготовка сырья (поз. 1 на рис. 1.1) включает в себя его
предварительную обработку - измельчение, очистку от приме-
сей, смешивание компонентов и т. д. Процессы подготовки
сырья зависят от вида сырья и условий превращения.
Подготовленное сырье проходит ряд превращений (поз.2 на
рис. 1.1), в результате чего образуется необходимый продукт
производства. Поскольку исходное природное сырье, как прави-
ло, содержит примеси, превращение может быть неполным и
могут образовываться другие вещества, поэтому приходится вы-
делять основной продукт из образовавшейся смеси, очищать его
от примесей (поз. 3 на рис. 1.1).
Отходы производства или невостребованные продукты пере-
работки сырья могут содержать как вредные компоненты, кото-
рые опасно выбрасывать в окружающую среду, так и полезные,
которые нецелесообразно выбрасывать. Поэтому существенным
элементом химического производства является санитарная
очистка и утилизация отходов производства (поз. 4 на рис. 1.1).
Санитарная очистка, или обезвреживание отходов, - перевод
токсичных составляющих в безвредные, с тем чтобы их можно
16
Сырье
1
Энергия
Продукт,
основной
3
Продукт
дополнит.
Отходы
Отходы
основного
производства
Рис. 1.1. Структура и функциональные элементы химического производства:
/ - подготовка сырья; 2 - переработка сырья; 3 - выделение основного продукта; 4 - са-
нитарная очистка и утилизация отходов; 5 - энергетическая система; 6 - подготовка вспомо-
гательных материалов и водоподготовка; 7 - система управления
было удалить из производства, не опасаясь заражения окру-
жающей среды. Хотя, конечно, даже обезвреженные отходы
производства не являются полностью безопасными для окру-
жающей среды, ибо загрязняют ее в любом случае. Выбрасывая
отходы в окружающую среду, необходимо позаботиться об обес-
печении безвредности существования в той экосистеме, в кото-
рой расположено производство. В гл. 4 специально обсуждаются
вопросы экологической безопасности производства. Безусловно,
наиболее рациональным является превращение отходов основ-
ного производства в дополнительный полезный продукт, с тем
чтобы если и не исключить, то существенно уменьшить количе-
ство выбрасываемых отходов.
Химическая промышленность потребляет довольно много
энергии, чтобы обеспечить переработку сырья в продукты, -
около 15% всех энергоресурсов расходуется в этой области тех-
ники. Поэтому энергетическая система - важный и сложный
элемент химического производства (поз. 5 на рис. 1.1). Энергия
не столько потребляется непосредственно для получения про-
дукта, сколько обеспечивает условия его производства. Кроме
того, нередко химические превращения сопровождаются выде-
лением энергии (экзотермические реакции). Поэтому энергети-
ческая система должна обеспечивать не только распределение
энергии по стадиям производства, но и по возможности воз-
вращение ее после использования в переработке сырья.
Кроме энергии в химическом производстве используются
вспомогательные материалы. К ним относятся, например, сор-
бенты для очистки и выделения продуктов; вещества, с по-
мощью которых создается среда, необходимая для протекания
процессов, и др. Особое место занимает вода - она используется
для охлаждения технологических потоков, выработки пара, рас-
творения и разбавления технологических потоков. Потребление
ее может быть значительным. Подготовка вспомогательных ма-
17
териалов и особенно водоподготовка (поз. 6 на рис. 1.1) - также
очень важная и сложная часть химического производства. По-
скольку вспомогательные материалы и вода обеспечивают тех-
нологический процесс, но, как правило, не входят в конечные
продукты производства, то система подготовки должна обеспе-
чивать восстановление их свойств после проведения цикла опе-
раций с их участием и возврат их в производство.
Сложное химическое производство невозможно эксплуатиро-
вать без системы управления (поз. 7 на рис. 1.1). Она обеспечи-
вает контроль за состоянием производства, проведение процес-
сов при наилучших условиях, защиту от нежелательных (ава-
рийных) ситуаций, пуск и остановку сложной системы. Этот
элемент представляет собой автоматизированную систему
управления технологическим процессом (АСУТП).
Теперь можно определить компоненты химического произ-
водства.
Переменные компоненты постоянно потребляются
или образуются в производстве:
сырье, поступающее на переработку;
вспомогательные материалы;
продукты - основной и дополнительный - как результат пе-
реработки сырья;
отходы производства;
энергия, обеспечивающая функционирование производства.
Постоянные компоненты закладываются в произ-
водство (оборудование, конструкции) или участвуют в нем
(персонал) на весь или почти весь срок его существования:
аппаратура (машины, аппараты, емкости, трубопроводы, ар-
матура);
устройства контроля и управления;
строительные конструкции (здания, сооружения);
обслуживающий персонал (рабочие, аппаратчики, инженеры
и другие работники производства).
Последний из упомянутых компонентов надо бы отнести в
соответствии с классификацией общественных наук к “про-
изводительным силам”. В технической науке этот компонент
производства следует отнести в раздел “постоянные компоненты
производства”, хотя и обладающие особыми свойствами и тре-
бующие особого внимания как социальная, а не только техниче-
ская составляющая производства.
Рассмотрим состав химического производства,
обеспечивающий его функционирование как производственной
единицы:
собственно химическое производство;
хранилища сырья, продуктов и других материалов;
транспортировка сырья, продуктов, промежуточных веществ,
отходов;
18
обслуживающий персонал производственного подразделения;
система управления, обеспечения и безопасности.
Собственно химическое производство было представлено выше.
Назначение хранилищ сырья, продуктов и других материалов
понятно: при непрерывном производстве доставка сырья и от-
грузка продуктов происходят нередко периодически, да и обес-
печить стабильность производства возможно при наличии опре-
деленного запаса. Нередко они представляют собой технически
сложные сооружения. Аммиак - один из продуктов азотной
промышленности - хранится в жидком виде (в газообразном
состоянии его объем в 7 - 8 тысяч раз больше) под давлением
1 - 2 МПа. Жидкий аммиак испаряется, что может привести к
разрыву емкости. Необходимо поэтому поддерживать в ней
определенную температуру и отвод испаряющегося аммиака с
его возвратом в хранилище. Даже хранение казалось бы без-
опасных веществ - удобрений - требует обеспечения особых
условий. В непрерывных крупнотоннажных производствах про-
дукт на складе хранится “внавал”. Несоблюдение режима
влажности может привести к слипанию, а неизбежные процессы
разложения, в том числе и примесей, как бы их мало ни было,
могут привести к саморазогреву большой засыпанной массы и
далее - к самовозгоранию. Хранение горючих и токсичных ве-
ществ недопустимо без соблюдения специальных охранных ме-
роприятий, которые могут быть обеспечены лишь в сложных
инженерных сооружениях.
Отдельными сооружениями на производстве являются уст-
ройства для транспортировки веществ и материалов - доставки
сырья из хранилищ к собственно производству и продуктов в
соответствующие хранилища, разгрузки поступающего сырья и
отгрузки продукта. Здесь также высоки требования к технике
безопасности, механизации и автоматизации процессов.
Обслуживающий персонал включает кроме тех, кто занят непо-
средственно в производстве продукта, работников других подразде-
лений и служб: хозяйственных и финансовых, ремонтных и убо-
рочных, лаборатории контроля производства и продуктовой др.
Система управления и безопасности персонала обычно обес-
печивается администрацией на основе соответствующей норма-
тивной технической и управленческой документации.
1.4. ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС
Собственно совокупность операций и процессов переработки сырья
и материалов в продукты называют технологическим процессом.
Химико-технологический процесс - последовательность процес-
сов целенаправленной переработки исходных веществ в продукт
- химических и физико-химических процессов и их сочетаний.
Поясним на примере синтеза аммиака из азота и водорода.
Аммиак образуется в результате протекания химической реак-
19
ции N2 + ЗН2 — 2NH3. Превращение осуществляют при темпе-
ратуре 700 - 850 К и давлении 30 МПа. Из-за обратимости
реакции исходная азотоводородная смесь превращается не
полностью. Необходима физико-химическая стадия - конденса-
ция - для выделения образовавшегося аммиака. Непрореагиро-
вавшие N2 и Н2 возвращают в реактор. Для повышения давле-
ния. а также для циркуляции газов необходимо их сжатие, яв-
ляющееся механическим процессом. Нагрев и охлаждение пото-
ков, осуществляемые при этом, - теплообменные процессы.
Совокупность указанных операций в их последовательности,
реализующих получение аммиака из водорода и азота, есть хи-
мико-технологический процесс синтеза аммиака.
Чтобы получить азот и водород, надо сначала получить водо-
род из природного газа и воды, а азот выделить из воздуха. Со-
вокупность процессов и операций, осуществляемых для превра-
щения природного газа, воды и воздуха в аммиак, - химико-
технологический процесс производства аммиака из природных
материалов. Как часть он включает в себя и химико-
технологический процесс синтеза аммиака. Из функциональных
элементов химического производства, показанных на рис. 1.1, к
химико-технологическому процессу можно отнести стадии 1 - 4,
на которых происходит собственно переработка сырья в продукты.
В совокупном химико-технологическом процессе выделяются
следующие виды отдельных процессов и операций, классифи-
цированных по их основному назначению, и соответствующие
аппараты или машины, в которых они осуществляются.
Механические и гидромеханические процес-
сы - перемещение материалов, изменение их формы и разме-
ров, сжатие и расширение, смешение и разделение потоков. Все
они протекают без изменения химического и фазового состава
обрабатываемого материала. Для проведения этих процессов
предназначены транспортеры, питатели, дробилки, диспергато-
ры, формователи, компрессоры, насосы, смесители, фильтры.
Теплообменные процессы - нагрев, охлаждение, из-
менение фазового состояния. Химический и фазовый состав в
них не меняется. Они протекают в теплообменниках, кипятиль-
никах, конденсаторах, плавилках, сублиматорах.
Массообменные процессы - межфазный обмен, в
результате которого меняется компонентный состав контакти-
рующих фаз без коренного изменения химического состава, т. е.
химических превращений. К ним относятся растворение, кри-
сталлизация, сушка, дистилляция, ректификация, абсорбция,
экстракция, десорбция, осуществляемые в соответствующих
аппаратах - сушилках, дистилляторах, ректификаторах, абсорбе-
рах, экстракторах, десорберах.
Химические процессы - коренное изменение хими-
ческого состава в химических реакторах.
20
Кроме указанных основных процессов совокупного химико-
технологического процесса в химическом производстве осу-
ществляются также:
энергетические процессы - взаимное преобразова-
ние различных видов энергии (тепловой, механической, элек-
трической) в турбинах, генераторах, моторах;
процессы управления - получение и передача ин-
формации о состоянии потоков и веществ, изменение их со-
стояния. К устройствам управления относятся датчики, сиг-
нальные и информационные системы, клапаны, задвижки, вен-
тили, системы автоматического регулирования и т. д.
Часто в каком-либо процессе имеют место одновременно два
явления и более. В таких случаях процесс следует классифици-
ровать по его основному назначению в общем технологическом
процессе. Например, сжатие газа в компрессоре сопровождается
его нагревом, но по основному назначению это процесс меха-
нический. В детандере сжатый газ совершает механическую ра-
боту, сильно при этом охлаждаясь. По назначению это процесс
теплообменный, предназначенный для выработки холода.
Исследование и разработка отдельных процессов и их сово-
купности - химико-технологического процесса - основная про-
фессиональная область деятельности химика-технолога.
1.5. ПОКАЗАТЕЛИ ХИМИЧЕСКОГО ПРОИЗВОДСТВА
И ХИМИКО-ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
Определение полезности и эффективности химического произ-
водства и технологического процесса в нем производится по раз-
ным показателям, которые сгруппированы следующим образом.
Технические показатели определяют качество химико-
технологического процесса.
Производительность (мощность) производ-
ства - количество получаемого продукта или количество пере-
рабатываемого сырья в единицу времени:
П = G/t,
где П - производительность; G - количество получаемого продукта или перера-
батываемого сырья за время t.
Обычно производительность выражают в количестве продук-
та за 1 ч или 1 сут, показывая максимальную возможность про-
изводства в непрерывном режиме. Производительность за дли-
тельный срок работы - один год - учитывает плановые останов-
ки производства. Поэтому для химических производств для свя-
зи часовой или суточной производительности с годовой прини-
мают, что производство работает 8000 ч, или 330 сут, в году.
Значение П зависит, конечно, от конкретного производства.
Крупнотоннажные производства выпускают десятки и сотни
тысяч тонн продукта в год: серной кислоты - 360-500 тыс. т
21
в год (1080 - 1500 т/сут), аммиака - до 450 тыс. т в год
(1360 т/сут). Установки первичной переработки нефти потребляют
до 2 млн. т сырья в год. В малотоннажных производствах (реактивы,
редкие металлы, продукты тонкого органического синтеза) произво-
дительность составляет килограммы и даже граммы продукта в час.
Расходный коэффициент показывает количество за-
траченного сырья, материалов или энергии на производство
единицы продукта. Его размерность очевидна: |кг сырья/т про-
дукта], [м3 сырья/ кг продукта], [кВт-ч/кг продукта], (Гкал/т
продукта] и т. д. Расходный коэффициент показывает количе-
ственно затраты на производство продукта, но не отражает эф-
фективности использования расходуемых компонентов. Послед-
няя определяется следующим показателем.
Выход продукта - отношение реально получаемого ко-
личества продукта из использованного сырья к максимальному ко-
личеству, которое теоретически можно получить из того же сырья.
Например, на получение 1 т HNO3 реально расходуется 290 -
296 кг NH3. Если аммиак полностью превратить в азотную кис-
лоту, его потребуется 270 кг. Выход продукта - 91—93%. Непол-
нота выхода продукта зависит от неполноты превращения, по-
терь, наличия примесей.
Интенсивность процесса - количество перерабаты-
ваемого сырья или образующегося продукта в единице объема
аппарата. Этот показатель характеризует интенсивность проте-
кания процесса в технологическом аппарате и совершенство
организации процесса.
Удельные капитальные затраты - затраты на обо-
рудование, отнесенные к единице его производительности. Для
начала производства необходимы единовременные затраты на
аппараты, машины, трубопроводы, сооружения и прочее, т. е.
капитальные затраты. Отнесенные к единице производитель-
ности, удельные капитальные затраты характеризуют эффектив-
ность организации процесса в отдельных аппаратах и в произ-
водстве в целом, совершенство используемых конструкций. Этот
показатель выражается в натуральных величинах, например |т
металла/1000 т продукта в сутки], или в денежном выражении.
Качество продукта определяет его потребительские
свойства и товарную ценность. Показатель индивидуален для
каждого продукта. Он может включать содержание (состав и
количество) примесей, физические и химические показатели,
внешний вид и размеры, цвет, запах и прочее. Определяется
нормативными документами (ГОСТ - государственный отрасле-
вой стандарт, технические условия, сертификат качества).
Экономические показатели определяют экономическую эф-
фективность производства.
Себестоимость продукции - суммарные затраты на
получение единицы продукта. Себестоимость складывается из сле-
22
дующих расходов: затрат на сырье, энергию, вспомогательные ма-
териалы; единовременные, капитальные затраты, распределяемые
равномерно на срок эксплуатации оборудования; затраты на оплату
труда работников. Общая структура себестоимости С:
С = (ЕЦ,(7Н/ + ЛЗК + 3Т)/(7П,
где Ц и GHj - иена и количество израсходованных сырья, энергии, материалов
на производство продукта в количестве G,,; Зк - капитальные затраты; к - ко-
эффициент окупаемости капитальных затрат (их доля, отнесенная на
время производства количества продукта Gn; в среднем для химических произ-
водств к = 0,15 в расчете на годовую производительность С„); Зт - оплата труда.
Себестоимость имеет денежное выражение.
Производительность труда - количество продук-
ции, произведенной в единицу времени (обычно за год) в пе-
ресчете на одного работающего; характеризует эффективность
производства относительно затрат труда.
Экономические показатели рассчитываются на основе техни-
ческих показателей. Некоторые из них (производительность,
расходные коэффициенты, удельные капитальные затраты)
можно представить в денежном выражении. Эти и экономиче-
ские показатели также называют техноэкономическими.
Эксплуатационные показатели характеризуют изменения, воз-
никающие в химико-технологическом процессе и производстве
во время их эксплуатации при появлении отклонений от регла-
ментированных условий и состояний. Влияние отклонений на
показатели процесса, возможность управления процессом опре-
деляются эксплуатационными показателями.
Надежность характеризуют средним временем безава-
рийной работы либо числом аварийных остановов оборудования
или производства в целом за определенный отрезок времени.
Этот показатель зависит от качества используемого оборудова-
ния и правильности его эксплуатации.
Безопасность функционирования - вероятность
нарушений, приводящих к нанесению вреда или ущерба обслу-
живающему персоналу, оборудованию, а также окружающей
среде, населению.
Чувствительность к нарушениям режима и изменению
условий эксплуатации; определяется отношением изменения
показателей процесса к этим отклонениям.
Управляемость и регулируемость характеризуют
возможность поддерживать показатели процесса в допустимых
пределах, определяют величину допустимых изменений условий
процесса, управляющие параметры и их взаимовлияние
(сложность управления).
Социальные показатели определяют комфортность работы на
данном производстве и его влияние на окружающую среду.
Безвредность обслуживания следует из сопоставле-
ния санитарно-гигиенических условий для обслуживающего
23
персонала с соответствующими нормами по загазованности,
запыленности, уровню шума и др.
Степень автоматизации и механизации опреде-
ляет долю ручного и тяжелого труда в эксплуатации производства.
Экологическая безопасность - степень воздействия
производства на окружающую среду и экологическую обстанов-
ку в регионе.
Перечень основных показателей химического производства
свидетельствует о том, насколько высоки требования к качеству
его разработки, проектирования, создания и эксплуатации. Не-
редко одновременное достижение наилучших результатов по
каждому из этих требований вступает в противоречие друг с
другом. Необходимы компромиссные решения. Поэтому инже-
нер-технолог должен обладать не только обширными, разносто-
ронними знаниями, но и высокой культурой.
1.6. ПРЕДМЕТ “ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ”
Д.И.Менделеев говорил, что технология как наука “содержит в
себе приложения к жизни других более отвлеченных знаний”,
т. е. технология опирается на фундамент “чистых” наук.
Научным фундаментом для исследования и изучения меха-
нических, тепло- и массообменных процессов служат в основ-
ном знания о явлениях, не связанных с коренным изменением
состава участвующих в них веществ. Эти знания представляют
собой физический цикл естественно-научных учебных дисци-
плин. Исследование и изучение химических процессов основано
в первую очередь на химических науках, или химическом цикле
естественно-научных учебных дисциплин. Изучение химико-
технологического процесса, как он определен ранее, во многом
опирается также на химические и физико-химические знания.
Исходя из этого “Общая химическая технология” как учеб-
ный предмет, предназначенный для изучения основ тех областей
науки “химическая технология”, которые опираются в основном на
химический цикл дисциплин, включает в себя разделы: реакцион-
ные процессы (глава 2 - “Химические процессы и реакторы”);
химико-технологические процессы (глава 3 - “Химико-тех-
нологическая система”); экологические проблемы в химической
технологии (глава 4 - “Основы промышленной экологии”).
Реализация основных положений этих разделов рассматри-
вается на некоторых конкретных примерах в главе 5 -
“Промышленные процессы”.
В зависимости от цели изучения “Общей химической техно-
логии” (специализации обучающегося, объема подготовки, об-
щего учебного плана) этот учебный предмет может быть пред-
ставлен несколькими учебными курсами или иметь другое на-
звание. Поэтому изложение материала курса рассчитано на воз-
можные варианты предмета “Общая химическая технология”.
Глава 2
ХИМИЧЕСКИЕ ПРОЦЕССЫ И РЕАКТОРЫ
2.1. ВВЕДЕНИЕ
2.1.1. Химический реактор (общее представление)
Химический реактор - устройство, аппарат для проведения хи-
мических превращений (химических реакций).
На практике, исходя из назначения или даже внешнего вида,
используют много различных названий химических реакторов -
реактор, колонна, башня, автоклав, камера, печь, контактный
аппарат, полимеризатор, дожигатель, гидрогенизатор, окисли-
тель и другие. Общие схемы некоторых из них приведены на
рис. 2.1.
Реактор 1 - емкостной. Реагенты (чаще жидкость, суспензия)
загружают в начале рабочего цикла. Мешалка обеспечивает пе-
ремешивание реагентов. Температурный режим поддерживается
с помощью теплоносителя, циркулирующего в рубашке или во
встроенном теплообменнике. После проведения реакции про-
дукты выгружают, и после очистки реактора цикл повторяется.
Процесс периодический.
Реактор 2 - емкостной, проточный. Реагенты (чаще газ, жид-
кость, суспензия) непрерывно проходят через реактор. Газ бар-
ботирует через жидкость.
Реактор 3 - колонный. Характерное для промышленных ко-
лонных реакторов отношение высоты к диаметру составляет 4-6
(в емкостных реакторах это отношение около 1). Взаимодей-
ствие газа и жидкости подобно таковому в реакторе 2.
Реактор 4 - насадочный. Взаимодействуют газ и жидкость.
Объем реактора заполнен кольцами Рашига или другими не-
большими элементами - насадкой. Жидкость стекает по насад-
ке. Газ движется между элементами насадки.
Реакторы 5-8 используют в основном для взаимодействия
газа с твердым реагентом.
В реакторе 5 твердый реагент неподвижен, газообразный
(или жидкий) реагент непрерывно проходит через реактор.
Процесс периодический по твердому веществу.
В реакторах 6-8 процесс по твердому реагенту непрерыв-
ный. Твердый реагент продвигается вдоль вращающегося на-
25
Рис. 2.1. Схемы химических реакторов:
Г - газ; Ж - жидкость; Т - теплоноситель; Н - насадка; Тв - твердый реагент; К - ката-
лизатор; Хг - холодный газ
клонно установленного круглого реактора 6 или просыпается
через реактор 7 (подобно песочным часам). В реакторе 8 газ
подается снизу, и при достаточно большой скорости подачи газа
твердые частицы оказываются во взвешенном состоянии. Это -
псевдоожиженный, или кипящий, слой, который обладает неко-
торыми свойствами жидкости. Можно организовать непрерыв-
ный поток твердого материала через аппарат.
Реакторы 5, 9 используют также для проведения процессов
на твердом катализаторе.
Реактор 9 - трубчатый. По виду он подобен кожухотрубному
теплообменнику. Через трубки, в которых протекает реакция,
проходят газообразные или жидкие реагенты. Обычно в трубки
загружен катализатор. Температурный режим обеспечивается
циркуляцией в межтрубном пространстве теплоносителя.
26
Рис. 2.2. Структурные элементы реактора: pjt
/ - реакционная зона; 2 - устройство ввода реакционной * 2
смеси; 3 - смеситель: 4 - теплообменник; 5 - выходное
устройство; Хг - холодный газ; Т - теплоноситель, И и П - г
исходный и конечный продукты соответственно
1—ГГ 4 J
Трубчатый реактор 10 используют часто - /
для проведения высокотемпературных j — 5
гомогенных реакций, в том числе в вязкой 4
жидкости (например, пиролиз тяжелых НН^В- ~ 1
углеводородов). Нередко такие реакторы ~ $
называют печами. |
Реактор 11 - многослойный реактор
(несколько слоев, например, катализатора)
с промежуточным охлаждением (или нагревом) реагирующей
смеси. На рисунке показано охлаждение путем ввода холодного
газа после первого слоя и нагрев при помощи теплообменников
после второго и третьего слоев.
Реактор 12 - многослойный для газожидкостных процессов.
В промышленности типов реакторов (даже по общему виду)
еще больше. Чтобы иметь возможность исследовать все разно-
образие реакторов, проведем систематизацию конструкций ре-
акторов и процессов, протекающих в них. На рис. 2.2 представ-
лен реактор, аналогичный 11-му на рис. 2.1. Выделим структур-
ные элементы, характерные для всех реакторов. В реактор засы-
пано несколько слоев катализатора, где протекает химическая
реакция. Это - реакционная зона 1, имеющаяся во всех
реакторах. Исходная реакционная смесь подается через верхний
штуцер. Чтобы обеспечить однородное прохождение газа через
реакционную зону, установлен распределитель потока. Это -
устройство ввода 2. В реакторе 2 на рис. 2.1 распредели-
телем газа является барботер. К смесителям предъявляются осо-
бые требования обеспечить однородный контакт реагентов.
Между первым (сверху) и вторым слоями на рис. 2.2 в смеси-
теле 3 смешиваются два потока - после первого слоя и добав-
ляемый холодный газ, а после второго слоя помещен тепло-
обменник 4. Продукты выводятся через выходное
устройство 5. Возможны устройства разделения потоков.
В устройствах ввода, вывода, смешения, разделения, распре-
деления потоков и в теплообменниках протекают физические
процессы. Поэтому дальнейшим объектом исследования будут в
основном реакционные зоны, где протекают химические про-
цессы. Процесс, происходящий в реакционной зоне, состоит из
многих частных процессов, которые схематически показаны на
рис. 2.3 для двух процессов - каталитического и газожидкост-
ного.
27
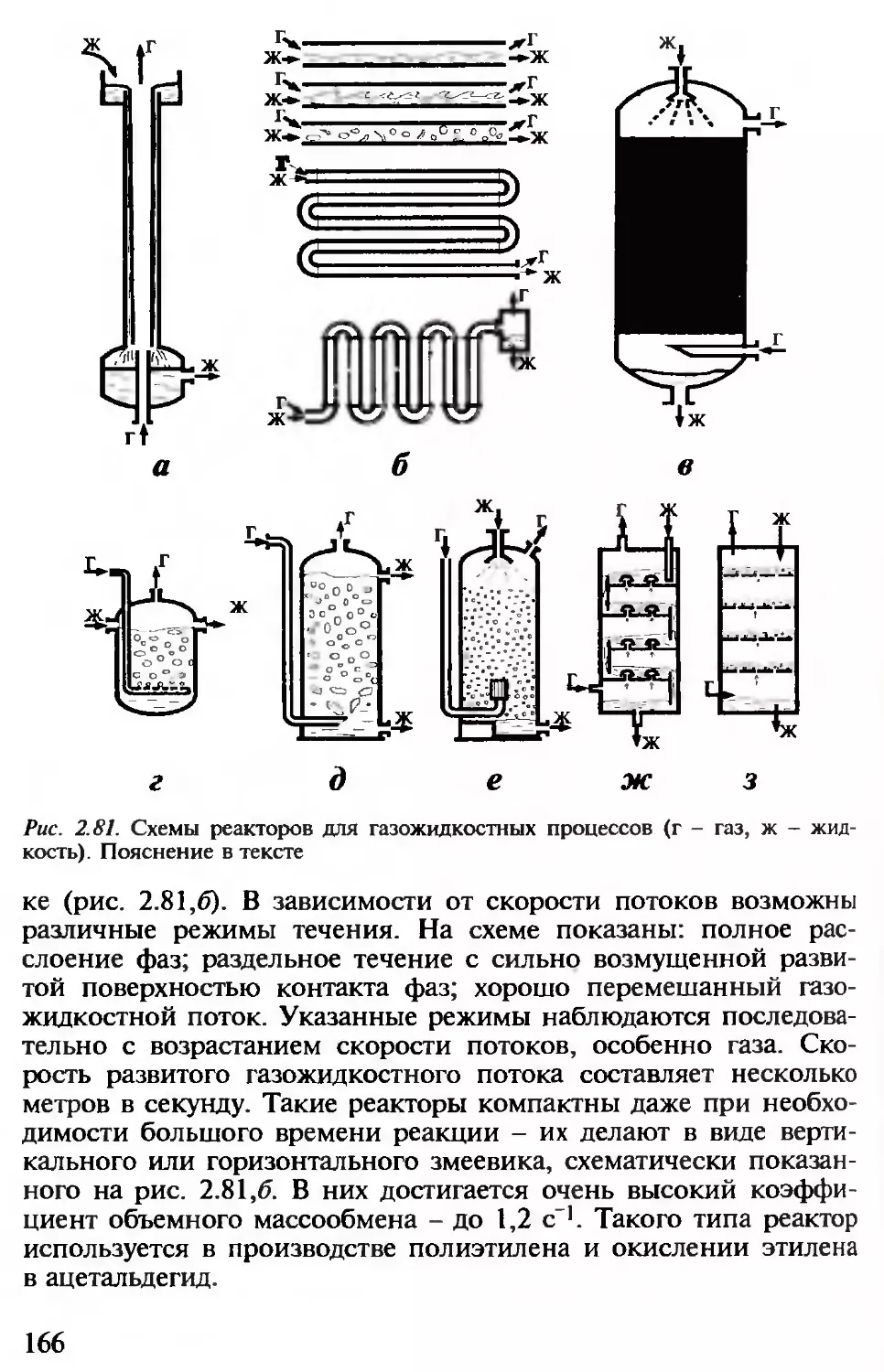
Рис. 2.3. Структура протекающих в химическом реакторе каталитического (о) и
газожидкостного (б) процессов. Пояснение в тексте
На рис. 2.3, а представлен неподвижный слой катализатора и
вьщелены протекающие в нем процессы - составляющие общего
процесса. Общий (конвективный) поток реагентов 7 проходит
между зернами катализатора. Из потока реагенты диффундиру-
ют к поверхности зерен (2) и в поры катализатора (5), на внут-
ренней поверхности которых протекает реакция (4). Продукты
обратным путем отводятся в поток. Выделяющееся тепло пере-
носится по слою (5) и затем от слоя через стенку - к хладагенту
(6). Возникающие вследствие протекания реакции градиенты
концентрации и температуры вызывают потоки вещества и
тепла (7), дополнительные к основному конвективному движе-
нию реагентов.
На рис. 2.3, б представлен процесс в слое жидкости, через
который барботирует газ. Последний проходит в виде пузырей
(7). Между газом и жидкостью имеет место массоперенос (2).
Жидкость не неподвижна - можно выделить ее движение около
пузыря (5) и циркуляцию в масштабе слоя (4). Первое подобно
турбулентной диффузии выравнивает градиенты концентраций,
вторая аналогична циркуляционному конвективному движению
жидкости через реакционную зону.
Только два примера показывают сложную структуру процес-
сов, протекающих в реакционной зоне. Если учесть множество
схем и конструкций реакторов, то многообразие процессов в
них многократно возрастает. Необходим научный метод, позво-
ляющий систематизировать это многообразие, найти общность в
нем, выработать систему представлений о закономерностях яв-
лений в этом многообразии и связей между ними, т. е. создать
теорию химических процессов и реакторов. Такой научный ме-
тод рассмотрен далее.
28
2.1.2. Математическое моделирование
как метод исследования химических процессов и реакторов
Моделирование - метод исследования объекта (явления, про-
цесса, устройства) на модели - давно используется в различных
областях науки и техники. Суть его состоит в том, что исследо-
вание самого объекта заменяют исследованием его модели. По-
лученные свойства модели переносят на свойства моделируе-
мого объекта.
Модель - специально созданный объект любой природы, бо-
лее простой по сравнению с исследуемым по всем свойствам,
кроме тех, которые надо изучить, и способный заменить иссле-
дуемый объект так, чтобы можно было получить новую инфор-
мацию о нем.
Известный пример моделирования: обтекание самолета, ле-
тящего в воздухе, исследуют обтеканием его модели в аэроди-
намической трубе. В данном случае модель самолета - его гео-
метрически подобная уменьшенная копия. Моделируется
(исследуется) только обтекание корпуса самолета потоком воз-
духа и не исследуются другие свойства самолета, например
удобство и безопасность пассажира в кресле. Для этого надо
построить другую модель - отдельное кресло с манекеном на
устройстве, воспроизводящем возможные его положения в поле-
те. Как видим, модель учитывает какие-то явления (обтекание
корпуса самолета потоком воздуха в одном случае или располо-
жение человека в кресле в другом случае при моделировании
разных процессов в самолете) и параметры процессов
(конфигурация крыльев и корпуса или конфигурация кресла).
Учитываемые в модели явления назовем составляющими мо-
дели.
Некоторые комментарии к определению модели. Ее специ-
ально создают, чтобы исследовать какие-либо конкретные
свойства. Для изучения разных свойств объекта может быть соз-
дано несколько его моделей, каждая из которых отвечает опре-
деленной цели исследования. Можно говорить о единстве “цель -
модель”. Если модель отражает большее (или меньшее) число
свойств, то она называется более широкой (или более узкой).
Используемое иногда понятие “общая модель” как модель, от-
ражающая все свойства объекта, - бессмысленно по сути.
Чтобы достигнуть поставленной цели, на изучаемые свойства
модели должны оказывать влияние те же факторы, что и на
свойства объекта. В этом и заключается творческий и научный
подход к построению модели: учесть именно те явления, кото-
рые существенны для изучаемых свойств. Не все составляющие
и параметры в одинаковой степени влияют на изучаемые
29
свойства. Изменение некоторых параметров и наличие тех или
иных составляющих может очень слабо влиять на эти свойства.
Такие составляющие и параметры называют несущественными,
и их можно не учитывать в модели. Соответственно, простая
модель содержит лишь существенные составляющие, иначе мо-
дель будет избыточной. Поэтому простая модель не есть простая
по внешнему виду (например, несложная по структуре, кон-
струкции). Но если в модель входят не все составляющие, суще-
ственно влияющие на изучаемые свойства, то она будет непол-
ной, и результаты ее исследования могут не отвечать свойствам
объекта.
Обратим внимание на следующий признак модели: она
должна предсказывать неизвестные свойства объекта, давать о
нем новую информацию. Это может быть достигнуто, во-
первых, если модель простая, и ее можно исследовать, работать
с ней, и, во-вторых, если она достаточно полная, чтобы могли
проявиться изучаемые свойства.
Впервые моделирование как метод научного познания был
использован в аэро- и гидродинамике. Была развита теория по-
добия, позволяющая переносить результаты экспериментов,
получаемых на установках небольшого масштаба (моделях), на
реальные объекты большого масштаба. Основой таких исследо-
ваний является физическое моделирование, при котором природа
модели и исследуемого объекта одна и та же. Физическое моде-
лирование и теория подобия нашли широкое применение в хи-
мической технологии при исследовании тепловых и диффузи-
онных процессов. Были сделаны попытки использовать теорию
подобия и для химических процессов и реакторов. Однако ее
применение здесь оказалось весьма ограниченным из-за не-
совместимости условий подобия для химических и физических
составляющих процесса в реакторах разного масштаба. Напри-
мер, степень превращения реагентов зависит от времени пребы-
вания их в реакторе, равного отношению размера к скорости
потока. Условия тепло- и массопереноса, как следует из теории
подобия, зависит от критерия Рейнольдса, пропорционального
произведению размера на скорость. Сделать одинаковыми в
аппаратах разного масштаба и отношение, и произведение двух
величин невозможно. Вклад химических и физических состав-
ляющих реакционного процесса и их взаимовлияние и, следова-
тельно, влияние их на результаты процесса в целом зависят от
масштаба. В аппарате небольшого размера выделяющаяся тепло-
та легко теряется и слабо влияет на скорость превращения. В
аппарате большого размера выделяющаяся теплота легче
“запирается” в реакторе, существенно влияет на поле темпера-
тур и, следовательно, на скорость и результаты протекания ре-
ЗО
Рис. 2.4. Классификация моделей
акции. Вклад физических составляющих в реакционный про-
цесс в аппарате большого масштаба становится существенным
Трудности масштабного перехода для реакционных процес-
сов удается преодолеть, используя математическое моделирова-
ние, в котором модель и объект имеют разную физическую при-
роду, но одинаковые свойства. Два устройства - механический
маятник и замкнутый электрический контур, состоящий из кон-
денсатора и катушки индуктивности, - имеют разную физи-
ческую природу, но одинаковое свойство: колебания механиче-
ские и электрические соответственно. Можно так подобрать
параметры этих устройств (длину маятника и отношение ем-
кости к индуктивности), что колебания по частоте будут одина-
ковыми. Тогда электрический колебательный контур будет мо-
делью маятника. Это возможно потому, что свойство обоих уст-
ройств - колебания - описывается одними и теми же уравне-
ниями. Отсюда и название вида моделирования - математиче-
ское. Уравнение колебания в данном случае также является ма-
тематической моделью и механического маятника, и электриче-
ского контура. Соответственно, математические модели подраз-
деляются на реальные, представленные неким физическим уст-
ройством, и знаковые, представленные математическими урав-
нениями. Классификация моделей приведена на рис. 2.4.
Естественно, для построения реальной математической моде-
ли надо сначала создать знаковую. Поэтому, как правило, мате-
матическую модель отождествляют только с уравнениями, опи-
сывающими объект, т. е. со знаковой математической моделью,
а исследование свойств этих уравнений называют математиче-
ским моделированием. Универсальной реальной математи-
ческой моделью является электронная вычислительная машина
(ЭВМ). По уравнениям, описывающим объект, ЭВМ “настраи-
вают” (программируют), и ее “поведение” будет описываться
этими уравнениями.
Поскольку влияние физических и химических составляющих
(явлений) на реакционный процесс зависит от масштаба, имен-
но их выделение - наиболее существенный момент в математи-
31
Рис. 2.5. Схема математического моделирования химических процессов и реак-
торов
ческом моделировании химических процессов и реакторов. В
общем виде математическое моделирование реакторов можно
представить схемой, показанной на рис. 2.5. Ответственным
этапом является анализ процесса, протекающего в химическом
реакторе; анализ выявляет составляющие процесса и их взаимо-
действие. Затем определяют их закономерности: термодинами-
ческие и кинетические для химических превращений, парамет-
ры явлений переноса и т. д. На этом этапе используют данные
экспериментальных исследований. Математическое моделиро-
вание не исключает эксперимент, а активно его использует, но
эксперимент прецизионный, более точный, чем может быть
эксперимент на реакторе. Результаты анализа процесса и иссле-
дования его составляющих позволяют построить математи-
ческую модель процесса - уравнения, описывающие его. Их
исследуют, используя математический аппарат качественного
анализа и вычислительные методы, или, как говорят, проводят
вычислительный эксперимент. Полученные свойства модели
надо интерпретировать как свойства изучаемого объекта, в дан-
ном случае химического реактора.
Выделение составляющих сложного процесса (его декомпо-
зиция) должно отвечать также условию инвариантности выде-
ленных составляющих к масштабу, влияние которого учитывают
в параметрах полученных уравнений математической модели и
граничных условиях. Требование инвариантности можно удо-
влетворить, если использовать иерархический подход к построе-
нию модели. Для этого декомпозицию процесса проводят не
только на составляющие, но и по их масштабу. Существенной
особенностью математических моделей процесса в реакторах
является их иерархическое строение (рис. 2.6).
В молекулярном масштабе протекает химическая реак-
ция, состоящая из элементарных стадий. Ее свойства
(например, скорость) не зависят от масштаба реактора, т. е. ско-
рость реакции зависит от условий ее протекания независимо от
того, как эти условия созданы. Результатом исследования на
этом уровне является кинетическая модель - зависимость ско-
32
Реактор
(реакционный
узел)
Реакционная
зона
Химическая
реакция
Элементарный
объем
(химический
процесс)
Рис. 2.6. Иерархическая структура математической модели процесса в хими-
ческом реакторе
рости реакции от условий. Следующий масштабный уровень,
назовем его химический процесс, есть совокупность ре-
акции и явлений переноса, таких, как диффузия, теплопровод-
ность. Кинетическая модель реакции входит как одна из состав-
ляющих. Объем, в котором рассматривается химический про-
цесс, выбирается так, чтобы закономерности процесса не зави-
сели от размера реактора. Например, это может быть зерно ка-
тализатора. Скорость превращения в нем зависит только от раз-
мера и характеристик зерна и от условий (концентрация и тем-
пература), в которых оно находится, независимо от того, как эти
условия созданы. Модель химического процесса входит как одна
из составляющих на следующем масштабном уровне - реак-
ционная зона. Другие составляющие - явления переноса -
такого же масштаба. В масштабе реактора входят как состав-
ляющие реакционная зона, узлы смешения, теплообмена и др.
Таким образом, математическая модель процесса в реакторе
представлена системой математических моделей разного мас-
штаба.
Иерархическая структура математической модели процесса в
реакторе позволяет:
полностью описать свойства процесса путем детального ис-
следования основных процессов разного масштаба;
33
проводить изучение сложного процесса по частям, применяя
к каждой из них специфические, прецизионные методы иссле-
дования, что повышает точность и надежность результатов;
установить связи между отдельными частями и выяснить их
роль в работе реактора в целом;
облегчить изучение процесса на более высоких уровнях, так
как исследованием процесса на низшем уровне укрупняется
информация при переходе на более высокий уровень;
решать задачи масштабного перехода.
Изучение процесса в химическом реакторе будем проводить
описанным выше научным методом - математическим модели-
рованием.
2.2. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ
ХИМИЧЕСКИХ ПРОЦЕССОВ
В этом разделе содержится краткий обзор тех разделов химии и
физической химии, которые необходимы для дальнейшего си-
стематического изложения материала.
2.2.1. Стехиометрия химических превращений
Стехиометрические уравнения. Вещества вступают во взаимодей-
ствие в определенных соотношениях, которые находят отраже-
ние в химических уравнениях. Из них определяют изменение
состава реагирующей смеси при протекании реакции, т. е. ре-
зультат химического превращения.
Стехиометрические уравнения показывают, в каких соотноше-
ниях вещества вступают в химическое взаимодействие.
Общий вид стехиометрического уравнения:
удА + vgB + ... =vrR + vgS + ... (2.1)
где А, В ... - исходные вещества; R, S ... - продукты; vA, vr, ..., vr, vs - стехио-
метрические коэффициенты.
В стехиометрическом уравнении соблюдается баланс по хи-
мическим элементам: количества каждого из них во всех исход-
ных веществах и во всех продуктах равны между собой. Поэтому
стехиометрические уравнения можно рассматривать как алгеб-
раические и представить в виде
L]V]Ai = 0, (2.2)
где А| - наименование веществ [А[ = А, В, R, S ... из уравнения (2.1); v| -
стехиометрический коэффициент 1-го вещества.
В формуле (2.2) принято: vj < 0 для исходных веществ, кото-
рые расходуются; vj > 0 для продуктов, которые образуются.
34
И можно ввести в уравнение (2.2) вещество-инерт (не уча-
ствующее в превращении), для которого V| = 0.
Из смыслового определения стехиометрического уравнения
следует
(М - No)M = (tf2 - Л%)Л2 = ... (М - Mo)/vi = const, (2.3)
где TVio, N20. Mo - начальные количества компонентов; М, TV2, -> М -
количества компонентов после превращения; vb v2, ...., vi - соответствующие
стехиометрические коэффициенты.
Подчеркнем, что стехиометрические уравнения показывают
только соотношение количеств реагирующих веществ, но не
отвечают действительно протекающим взаимодействиям (хотя и
могут совпадать).
Простые и сложные превращения. Если превращение протека-
ет по нескольким направлениям, то стехиометрических уравне-
ний вида (2.1) или (2.2) будет несколько. Простая реакция опи-
сывается одним стехиометрическим уравнением, сложная реак-
ция - несколькими.
Пример простой реакции - окисление диоксида серы:
SO2 + 0,5О2 = SO3,
сложной - окисление метанола в формальдегид:
2СН3ОН + О2 = 2СН2О + 2Н2О;
2СН3ОН + ЗО2 = 2СО2 + 4Н2О.
Подчеркнем: здесь простая или сложная реакция определяет-
ся по направлениям превращения (или, можно сказать, по схеме
превращения). Простыми или сложными реакции могут быть
также по механизму их протекания. С этой точки зрения окис-
ление SO2 - многостадийная реакция, сложная по механизму.
Число стехиометрических уравнений. Стехиометрические
уравнения могут быть записаны несколькими способами. Реак-
ция синтеза аммиака может быть представлена стехиометриче-
ским уравнением
N2 + ЗН2 = 2NH3 или 0,5N2 + 1,5Н2 = NH3.
Паровая конверсия метана протекает в два этапа:
СН4 + Н2О = СО + ЗН2;
СО + Н2О = СО2 + Н2.
Можно записать и такое стехиометрическое уравнение:
СН4 + 2Н2О = СО2 + 4Н2.
Все эти уравнения отвечают определению стехиометрических
и список их можно продолжить. Но поскольку стехиометриче-
ские уравнения - уравнения алгебраические, то многообразие
35
записей делает систему алгебраических уравнений переопреде-
ленной, т. е. число уравнений больше числа веществ. Чтобы
состав прореагировавшей смеси был определен, система уравне-
ний должна быть определенной.
Пусть в превращении участвует В веществ, количество кото-
рых после превращения надо определить. Для этого надо было
бы иметь В уравнений. Но вещества состоят из Э химических
элементов, и в каждом уравнении соблюдается поэлементный
баланс. Поскольку и общее число элементов определено, то
фактически имеется Э-1 независимых элементных балансов.
Поэтому для определения состава прореагировавших веществ
надо иметь следующее количество уравнений:
У = В - (Э - 1). (2.4)
В окислительно-восстановительных реакциях соблюдается не
только поэлементный баланс, но и баланс по электронам (как
изменение заряда участвующих в реакции веществ). В этом слу-
чае к поэлементному балансу надо добавить баланс зарядов, а
уравнений необходимо иметь
У = В - Э. (2.5)
Уравнение (2.4) для обменных реакций и уравнение (2.5) для
окислительно-восстановительных определяют число стехиомет-
рических уравнений, которые делают возможным расчет состава
прореагировавшей смеси.
Тем не менее этими уравнениями надо пользоваться с осто-
рожностью. Пример: реакция гидродеалкилирования С4Н8+Н2=
= С3Н6+СН4 представлена одним уравнением, а из формулы
(2.5) следует, что уравнений должно быть два (4 вещества и 2
элемента). Расхождение связано со следующим. Предста-
вим бутилен и пропилен структурными формулами Н2С=СН-
-СН2-СН и Н2С=СН-СНз соответственно. Группа Н2С=СН-
сохраняется в обоих веществах и играет роль третьего элемента
кроме С и Н (группы -СН2- и -СН3 в бутилене не сохраняются:
первая превращается в группу -СН2- пропилена, а вторая - в
СН4). Поэтому надо принимать Э = 3, и из формулы (2.5) получим
У = 1. Применяя формулы (2.4) и (2.5) для расчета числа стехио-
метрически независимых уравнений, следует в число Э включать
не только химические элементы, но и устойчивые группы.
Стехиометрически независимые уравнения. Система алгебраи-
ческих уравнений имеет решение, если уравнения, входящие в
нее, - линейно независимые, т. е. ни одно из них не может быть
получено линейной комбинацией других. Применяя это прави-
ло к системе химических уравнений, можно констатировать:
определить состав реагирующей смеси возможно, используя
36
стехиометрически независимые уравнения, т. е. уравнения, ни
одно из которых не может быть получено линейной комбинаци-
ей других.
Чтобы определить, есть ли в выбранной системе уравнений
стехиометрически зависимые, можно воспользоваться алгорит-
мом, суть которого сводится к следующему. Реагирует п веществ
А], А2, A3, ..., А„. Их взаимодействие описано т уравнениями
вида (2.2), которые представим в матричной форме:
V11 V21 v31- ....v„i A]
V12 v22 v32-- ...v„2 A2
v13 v23 v33--- ...v„3 X A3 = 0.
Vlw V3m — An
Здесь vy - стехиометрический коэффициент 1-го вещества в у-м
стехиометрическом уравнении. Если какое-то вещество не вхо-
дит в одно из уравнений, то соответствующее v,y = 0. Матрицу
коэффициентов надо привести к виду
1 «21 «31...«л1
О 1 «32...«л2
О 0 1....а„3
О 0 0...1.....
О 0 0......апт
(2-6)
с выделенным треугольником нулевых элементов матрицы и
единичными элементами по диагонали, как показано выше. Эту
процедуру, известную в алгебре, продемонстрируем на следую-
щем простейшем примере.
Окисление аммиака представлено уравнениями
4NH3+ 5О2 = 4NO + 6Н2О; (2.7)
4NH3 + ЗО2 = 2N2 + 6Н2О; 2NO = N2 + О2,
или в алгебраическом виде:
-4NH3 -5О2 +4NO +6Н2О = О
-4NH3 -ЗО2 +2N2 +6Н2О = О
-О2 +2NO -N2 =0
37
Уравнения написаны так, чтобы в столбцах оказались одни и
те же вещества. Стехиометрические коэффициенты представим
в виде матрицы (2.8 а):
-4 -5 4 0 6
-4 -3 0 2 6
0 1-210
1 1,25 -1 0 -1,5
1 0,75 0 -0,5 -1,5
0 1-21 0 б
б
а
1 .Ь.25..-1....0....-1’5
(Г-0,5 1 -0,5 0
01-21 0
в
(2.8)
Нулевые элементы матрицы относятся к веществам, не вхо-
дящим в данное уравнение.
Сделаем элементы первого столбца единичными, для чего
разделим все элементы каждой строчки на значение первого
элемента в ней. Получим матрицу (2.8 б). Эта процедура не от-
носится к третьей строке, в которой первый элемент нулевой.
Далее сделаем первые элементы всех строк, кроме первой, нуле-
выми. Для этого вычтем из каждой строки, начиная со второй,
первую (для третьей строки этого делать не имеет смысла).
Матрица примет вид (2.8 в).
Повторим эти две процедуры с частью матрицы (2.8 в), отде-
ленной пунктиром, - сделаем ее первые элементы единичными
(2.8' г), а затем второй элемент третьей строки - нулевым (2.8'д):
1 1,25 -1-1,5 0 1-20 0 1-20 —> 1 1,25 -1 0 -1,5 0 1 0,5 0,25 0 0 0 0 0 0 (2.8')
Г д
Третья строка стала нулевой. Это уравнение стехиометриче-
ски зависимо. Это было видно из исходной системы уравнений
(2.7): третье уравнение получается линейной комбинацией двух
первых. Умножаем первое на -0,5, второе - на +0,5 и склады-
ваем - получим третье.
Степень превращения. Соотношение (2.3) связывает между со-
бой количества N, всех реагентов. Конечно, удобнее ввести
один показатель, через который можно выразить количества и
концентрации всех реагентов. Таким показателем является сте-
пень превращения х какого-либо исходного вещества, показы-
вающая, какая доля вещества превратилась. Для вещества А
xa = (JVao-Wao. (2-9)
38
Используя (2.3) и (2.9), можно определить количество любого
вещества N, в реагирующей смеси:
М= tyo-(v,/vA)AWA- (2.Ю)
Степень превращения может быть определена для любого ис-
ходного реагента, например = (^в о - ^в)/^в о- Из уравнения
(2.3) и определений для хА и получим
Если исходная реакционная смесь имеет неэквимолярный
состав, то состав реакционной смеси удобней выражать через
степень превращения того вещества, которое в недостатке. Его
называют ключевым компонентом. Когда ключевой компонент
превратится полностью, другие исходные компоненты еще
остаются.
Если компонент А участвует в нескольких реакциях, опреде-
лим хАу - его степень превращения в j-й реакции; уравнение
(2.10) примет вид
^, = Мо-— WaoXa,. (2.12)
VA/
Концентрации компонентов в реакционной смеси. Концентра-
ция компонента в реакционной смеси С,-= . Общее
i
количество реакционной смеси ~£Ni найдем суммированием
I
выражений (2.10):
XNj =LA/0-*aL(v,/va). (2.13)
i i i
Величина £v,=Av- изменение числа молей в реакции.
i
Аналогично определению С, начальные концентрации
G 0 = 0/X i 0> и из (2.13) получим
i
с = С,о - (у/ЛаКаО^А (2 14)
1-(Av/va)Caoxa
Числитель в (2.14) отвечает за изменение концентрации
вследствие превращения веществ, а знаменатель - вследствие
39
изменения объема реакционной смеси. Для реакции синтеза
аммиака
С10(!-х) _С20-ЗС10х _С30 + 2С10х
1-1-2С10х’ 2~ 1-2С10х ’ 3~1-2СИ)х’
где С|, С2, Сз - концентрации N2, Н2, NH3; Сю, С2о, С3 0 - начальные кон-
центрации тех же компонентов; х- степень преврашения N2.
Знаменатель в (2.15) меньше единицы, и концентрация, на-
пример, аммиака как бы увеличивается из-за уменьшения объе-
ма реакционной смеси (Av = -2).
Сложная реакция описывается несколькими стехиометриче-
скими уравнениями, и для каждого из них можно ввести сте-
пень превращения какого-то исходного вещества. Удобно было
бы иметь такие уравнения, в которые входит одно и то же ис-
ходное вещество, причем ключевое. Тогда можно ввести степени
превращения xj этого компонента для каждого стехиометриче-
ского уравнения, что упрощает определение состава реакцион-
ной смеси с использованием уравнения (2.12).
Но не всегда исходная система стехиометрических уравнений
бывает такой. Линейные преобразования позволяют получить
желаемую систему уравнений.
Конверсия метана с водяным паром описывается уравне-
ниями:
СН4 + Н2О = СО + ЗН2; (2.16 а)
СО + Н2О = СО2 + Н2. (2.16 б)
Ключевой компонент, который в недостатке, - метан, и ис-
пользование его степени превращения в первом уравнении
оправданно. Во втором уравнении ключевой компонент - СО,
но использовать его степень превращения невозможно,так как
начальная концентрация СО равна нулю. Суммирование (2.16 а)
и (2.16 б)
СН4 + 2Н2О = СО2 + 4Н2 (2.16 в)
дает систему уравнений (2.16 а) и (2.16 в) превращения метана
по двум направлениям. Определим xj и х2 - степени превраще-
ния СН4 по этим уравнениям. Исходная смесь содержит Мои
М о молей СН4 и Н2О. Количество СН4, Н2О, Н2, СО, СО2 (М,
М, ..., М соответственно) в реагирующей смеси:
М = М 0 ~ М о(*1 + Х1У, М = М о
М = М о - М о *1 ~ 2М о х1, о Х2 .
N2= 3N! oxi + 4М о*2;
40
Далее, суммируя все Nt, определим общее число молей £ Nj ,
i
а отношение С, = А, /£ 7V) есть концентрация каждого компо-
j
нента.
Селективность процесса и выход продукта. Превращение ис-
ходного вещества в сложной реакции протекает по разным на-
правлениям. Не во всех реакциях образуется желаемый продукт,
и для сложной реакции вводят кроме степени превращения сле-
дующие характеристики процесса.
Селективность процесса показывает, какая доля превра-
тившегося исходного вещества пошла на образование заданного.
Пусть превращение исходного вещества А описано несколь-
кими уравнениями. Образование продукта R описано только
одним. Стехиометрические коэффициенты для А и R - уд и vr -
именно в этом уравнении. Селективность превращения А и R:
va(^r ~ Ar0)
Vr(^A “ Ao)
(2.17)
Выход продукта показывает, какая доля всего вещества пре-
вратилась в заданное. Используя приведенные выше обозначе-
ния, определим Er - выход продукта R :
£r=va(^r -^o)/(-vr7Vao). (2.18)
Из определения степени превращения (2.9) и выражений
(2.17) - (2.18) получим
Er = 5rxa. (2.19)
Для простой реакции 5r = 1, и Er = хА.
Селективность процесса и выход продукта характеризуют
эффективность химического процесса по использованию сырья
для получения нужного продукта.
2.2.2. Термодинамика химических превращений
Направленность реакции. Химический процесс принципиально
осуществим, если реакция протекает с уменьшением химическо-
го потенциала, который есть изобарный потенциал, или энергия
Гиббса, т. е. возможность протекания реакции определяется не-
равенством
Дбру-сО, (2.20)
где &Gp T - изменение энергии Гиббса при превращении исходных веществ в
продукты.
41
Для расчета &Gp T используют следующие данные и соотно-
шения. В справочной литературе по термодинамике приведены
значения стандартных энергий Гиббса (Дб29в)обр образования
веществ при температуре 298 К. Для реакции
Д^298 = vi^^'298^°6p,‘ (2-21)
i
Зависимость энергии Гиббса от температуры:
Д(7° = ДЯ° - T\S, (2.22)
где Д//0, Д5 - изменения энтальпии и энтропии, которые рассчитываются по
формулам, аналогичным (2.21).
Зависимость энергии Гиббса от состава реакционной смеси
(для газовых смесей):
\GP T = ДС£ + RT In Пp? , (2.23)
где П - знак произведения; р, - парциальные давления компонентов.
Неравенство (2.2(5) позволяет определить возможность ис-
пользования процесса для получения желаемого продукта - с
этого начинают разработку нового способа производства. Другое
использование неравенства (2.20) - нахождение условий, пред-
отвращающих протекание нежелательных реакций. Продемон-
стрируем это на следующем примере. При конверсии метана с
водяным паром возможно образование сажи. Одна из вероятных
реакций:
СО + Н2 = С + Н2О. (2.24)
Из справочных данных и формул (2.21) и (2.22) получено для
этой реакции: Д(?£ = -132 + ОДЗЗТ (кДж/моль). Конверсия мета-
на в промышленном реакторе протекает вблизи равновесия.
Соответствующее содержание компонентов, ответственных за
образование сажи (углерода) для исходной смеси с соотношени-
ем пар : метан = 2:1 при температуре 873 К и давлении 0,1
МПа следующее: Ссо = 0,071, Сц2 = 0,53, Сц2о = 0,24. Можно
получить такие данные для других температур и начального со-
става и рассчитать для них ^Gp? по формуле (2.23). Результаты
представлены на рис. 2.7. При начальном составе пар : газ =1:1
во всем температурном интервале \Gp p< 0, и потому возможно
выделение сажи. Для начальной смеси пар : газ = 2 : 1 в части
реактора (при температурах ниже 900 К) также возможно саже-
образование. И только при четырехкратном избытке водяного
пара выделение сажи становится невозможным (Дбг/>>у> 0).
42
Рис. 2.7. Зависимость от температуры Т
энергии Гиббса ДО реакции конверсии
метана (/) и реагирующей смеси в конвер-
торе метана с начальным соотношением
партаз =1:1 (2), 2:1 (5) и 4:1 (4)
г,к
Термодинамическая возможность
протекания реакции не означает,
что она обязательно должна проте-
кать. Это зависит от скорости реак-
ции. Но условия, определяющие
принципиальную невозможность ее
протекания, гарантируют, что реак-
ция протекать не будет.
Тепловой эффект реакции. Другой важной для технологиче-
ских исследований термодинамической величиной является
тепловой эффект Qp, или изменение энтальпии Д.Н реакции. Они
противоположны по знаку: Qp = f\H. Изменение энтальпии
рассчитывается через энтальпии образования веществ, уча-
ствующих в реакции. В зависимости от знака А// или Qp.
&Н < 0; Qp > 0 - реакция экзотермическая;
А//>0; Qp < 0 - реакция эндотермическая.
Далее будем использовать величину Qp как более соответ-
ствующую смысловому содержанию: если реакция экзотермиче-
ская, то тепло выделяется, и Qp > 0.
Тепловой эффект реакции входит в запись термохимического
уравнения:
vaA + vBB + ... = vrR + vsS + ... + Qp. (2.25)
Величина Qp в (2.25) зависит от записи химического уравне-
ния. Например, значения Qp в уравнениях N2 + ЗН2 = 2NHj и
0,5N2 + 1,5Н2 = NH3 различаются в два раза, как различаются
стехиометрические коэффициенты. В справочной литературе Qp
приводят прямо в уравнениях, как это сделано в (2.25), или ука-
зывают изменение энтальпии при превращении 1 моля ве-
щества.
Тепловой эффект реакции необходим для определения теп-
ловых явлений в технологических процессах. Количество выде-
лившейся (или поглощенной) теплоты q зависит от количества
превращенного вещества ДЛС Если Qp представлена в записи
(2.25), то q = СрАЛ\/va-
Равновесие. Одни из первых количественных расчетов в хи-
мической технологии были термодинамические. Они включали
определение равновесия химически реагирующих систем: это
остается актуальным и сегодня.
43
c*Rc^..?
К о___
C?CbB-J
Равновесный состав смеси, реагирующий в соот-
ветствии с уравнением (2.1), связан с константой равновесия Кр.
= П(С/')равн, (2.26)
/
равн
где V, - стехиометрические коэффициенты в уравнении (2.1).
Концентрации С, в (2.26) - равновесные. Если реагирующая
смесь описывается несколькими стехиометрическими уравнениями
(сложная реакция), то химическое равновесие в такой смеси будет
представлено таким же числом уравнений вида (2.26).
Константа равновесия Кр - термодинамическая функция:
А (7° = АЯ° - T\ST = -RT\nKp, (2.27)
она зависит только от температуры. Если реакционная смесь
идеальна (небольшие температуры и давления, разбавленные
растворы), то, используя справочные значения Абу, можно рас-
считать Лр из (2.27). Многие реальные смеси не являются иде-
альными, и для них используют формулы расчета Кр в виде
Кр = Kp^/RT = Kp^/RT (2.28)
или более сложные зависимости, в том числе от давления.
Из (2.27) и (2.28) видно, что Кр будет увеличиваться с темпе-
ратурой для эндотермических реакций (Qp < 0) и уменьшаться
для экзотермических (Qp > 0) (рис. 2.8).
Для газофазной реагирующей смеси в (2.26) используют рав-
новесные парциальные давления компонентов р, :
^Р=П(л')раВн- (2-29)
/
Для неидеальной смеси в (2.26) используют активности вмес-
то концентраций, а в (2.29) - летучести вместо парциальных
давлений.
Если какой-то компонент в реагирующей системе находится
в твердом состоянии, то его концентрация тем самым фиксиро-
вана. Эту постоянную величину обычно включают в константу
равновесия. В таком случае в выражение, например, (2.29) вой-
дут равновесные парциальные давления только газообразных
компонентов. Для упомянутой выше реакции сажеобразования
СО + Hj = С|В + Н2О углерод (сажа) СрВ образуется в твердом
состоянии, и
44
X
Рис. 2.8. Изменение константы равновесия Кр с температурой Т для экзотерми-
ческой (7) и эндотермической (2) реакций
Рис. 2.9. Изменение равновесной степени превращения с температурой Т для
обратимых экзотермической (7) и эндотермической (2) реакций
Аналогично, парциальные давления только газообразных ком-
понентов были использованы в уравнении (2.23) для расчета энер-
гии Гиббса при определении возможности протекания реакции.
Расчет равновесного состава. Концентрации всех
компонентов в реагирующей смеси связаны между собой сте-
хиометрическим уравнением, и их можно определить через на-
чальный состав и степень превращения ключевого компонента
х В равновесии достигается равновесная степень превращения хр,
так что выражение (2.26) или (2.29) примет вид
^Р=/(хр).
Определив х, далее находят равновесные концентрации всех
компонентов. Приведем примеры.
1. Простая обратимая реакция: А = R. Начальная концентра-
ция компонента А - Сд ц, компонент R отсутствует. В равновес-
ном СОСТОЯНИИ Сдравн Одц(1 — хр) и Cr равн Сд q хр. Из
(2.26) получим
Учитывая зависимость Кр(Т) для экзо- и эндотермических ре-
акций (см. рис. 2.8), можно построить зависимость хр(7) для
этих реакций (рис. 2.9). Характер изменения хр в зависимости от
температуры будет таким же для любых экзо- и эндотермиче-
ских реакций соответственно.
2. Конверсия СО с водяным паром: СО +Н2О = СО2 + Нг-
Для нее
к рсо2Рн2^
1 равн
где парциальные давления компонентов д = РСХ\ Р - общее давление.
45
Концентрации СО, Н2О, СО2, Н2 в начальной смеси равны
С| о> С? о, Q о, (-4 о» а в равновесии — С] р, С2 р, Сз р, С4 р соот-
ветственно. Выразим С| р через равновесную степень превраще-
ния хр:
Ci р — С\ о(1 - -Хр), Oz р С2 о _ Q о-Хр, С3 р - С3 0 + С, оХр,
С4 р~ С4 о-*" С\ (Р-р,
тогда из (2.29) подучим квадратное уравнение относительно хр:
_(Сзо + C’lo-^pXQo + Qoxp)
р QoO _ xp)(Qo _ QoxP)
Его решение:
Хр = а + >Ja2 - b2,
где а — КР/[2С1 0(Ар - 1)1: b = (С2 o/Ci о) [Ар - Сз oG о ЛС oQ о)1-
Знак “+” или выбирается так, чтобы значение хр имело
физический смысл (0 < хр< 1). В данном случае - знак “минус”.
3. Не всегда можно получить аналитическое выражение для
Хр. Реакция SO2 + 0,5Ог = SO3 протекает с изменением объема.
Начальные концентрации SO2 и О2 равны Q о и С2 о соответ-
ственно. Парциальные давления компонентов получим из опре-
деления р, = PCt (Р - общее давление). Концентрации компо-
нентов выразим через степень превращения SO2 - х, используя
уравнение (2.14):
с _ cioU~x) _ С10х
1 ~ 1 + 0,5С] ох ’ 2 " 1 + 0,5С10х ’ 3 “ 1 + 0,5С10х
(индекс “3” относится к SO3).
В равновесии уравнение (2.29) преобразуется к виду
Г I 1 ~ дХр
хп=лп лп+ ------------------- . (2.31)
Р Р Р ^(С2О-О,5С1Охр
Уравнение (2.31) решают методом подбора хр, после чего на-
ходят концентрации всех компонентов.
Для смеси, превращение в которой описывается несколькими
стехиометрическими уравнениями (обозначим число их N),
имеем столько же (Л) выражений вида (2.26) или (2.29). Кон-
центрации всех компонентов выражаем через W степеней пре-
вращения хру, где J = 1,2, ..., N (см. разд. 2.2.1 по стехиомет-
рии). Решением системы N уравнений вида (2.30) находим N
значений хру и далее все концентрации.
46
Изменение химического равновесия достигается
изменением внешних условий. Направленность влияния опре-
деляется правилом, называемым принципом Ле-Шателье, за-
ключающимся в следующем: если воздействовать на систему,
находящуюся в химическом равновесии, то состояние системы
изменяется таким образом, что это воздействие ослабляется.
Из этого правила и вытекают способы управления химиче-
ским процессом Рассмотрим возможности воздействия на рав-
новесие.
1. Температура. Повышение температуры связано с подводом
дополнительной теплоты. Уменьшить этот эффект (поглотить
эту теплоту) возможно, если эндотермическая реакция пройдет
в прямом направлении, а экзотермическая - в обратном. Соот-
ветственно, равновесная степень превращения для эндотерми-
ческой реакции увеличится, а' для экзотермической
уменьшится. Такое изменение хр(7) показано на рис. 2.9. Из
этого и следует способ увеличения хр: повышение температуры
для эндотермической реакции и понижение - для экзотерми-
ческой.
2. Давление. В соответствии с принципом Ле-Шателье увели-
чению давления Р должно противодействовать смещение равно-
весия, приводящее к уменьшению Р, т.е. уменьшению объема
реакционной смеси. Если реакция протекает с уменьшением
объема, то увеличение Р приведет к большему превращению
(увеличению хр). И наоборот - в системе, где реакция протекает
с увеличением объема, равновесие сдвинется в сторону умень-
шения хр.
Действительно, используя связь pj = PC, и уравнение (2.29)
для газофазных реакций, преобразуем последнее к виду
[rvRrvs
C?CRB->
AB' равн
(2.32)
где Av = (vR + vs +...) - (vA + vB +...) - изменение числа молей в реакции.
Если реакция протекает с увеличением объема (Av > 0), то
увеличение Р (и также PAv), как следует из равенства (2.32),
приведет к уменьшению концентраций продуктов R, S, ..., т. е.
к уменьшению степени превращения. Если Av < 0, то увеличе-
ние Р (уменьшение РAv) компенсируется ростом концентраций
продуктов и степени превращения.
Синтез аммиака (N2 + ЗН2 = 2NH3) протекает с уменьшени-
ем объема. При Р = 1 ат (» 0,1 МПа) образуется менее 1% ам-
миака. Реакция экзотермическая, но увеличение хр понижением
47
Рис. 2.10. Зависимости равновесной концент-
рации аммиака ip от температуры Т при дав-
лениях 10 МПа (7) и 30 МПа (2)
температуры потребует очень сильно-
го охлаждения, при котором скорость
превращения на практике нулевая.
Можно увеличить давление, что и
делают практически - реакцию про-
водят под давлением около 300 ат
(»30 МПа). Исходная смесь - стехиометрическая с отношением
Н2 : N2 = 3, которое сохраняется в течение реакции. Обозначим
Ср равновесную концентрацию NH3. Тогда 1-Ср - сумма равно-
весных концентраций N2 и Н2, равных Q р = 0,25(1 - Ср) и р =
= 0,75(1 - Ср) соответственно. Уравнение (2.32) примет вид
44 Ср
р 33Р2(1-Ср)4
При большом давлении реакционная смесь - не идеальный
газ, и эмпирическую зависимость Кр(Т, Р) представим прибли-
женной формулой:
Кр = 4,65 • 10"нРО’4ехр(12720/Т),
где размерность Р- [МПа1.
Рассчитанные значения Ср(Р, 7) приведены на рис. 2.10.
Аналогичные выводы делаются и для гетерогенных реакций -
влияние давления на смещение равновесия зависит от изменения
объема смеси в реакции. Увеличение давления приводит к больше-
му риску выделения углерода в реакции сажеобразования (2.24).
Для реакций в жидких и конденсированных средах (жидких и
твердых) давление практически не сказывается на равновесном
составе.
3. Разбавление реакционной смеси - добавление инертного
вещества - равнозначно уменьшению давления. Покажем это на
примере реакции дегидрирования бутана до бутилена С4Н10 =
=С4Н8 + Н2, протекающей с увеличением объема реакционной
смеси. Начальное содержание бутана С| о- Равновесная степень
превращения бутана Хр, и уравнение (2.29) примет вид
л- „2
К Р С1° р
Р 1 + С10*р 1 -*р
Из него следует, что разбавление, т. е. уменьшение Q о, бу-
дет компенсироваться увеличением хр - равновесной степени
48
превращения бутана. Поэтому в промышленности дегидрирова-
ние бутана (как и другие процессы дегидрирования) проводят
при разбавлении водяным паром.
4. Избыток и удаление реагентов. Равновесие в реагирующей
смеси представлено уравнением
*Р =
(2.33)
Пусть содержание одного из исходных реагентов, например
В, увеличено (взято в избытке). Чтобы при этом выполнялось
равенство (2.33), концентрации исходных компонентов (СА)
уменьшатся, а продуктов (Cr, Cs) увеличатся, т. е. возрастет
степень превращения компонента А. Это учитывают для дости-
жения более полного использования более ценных компонентов
сырья.
Равновесная степень превращения метана в его реакции с
водяным паром при начальном соотношении пар : метан = 2:1
равна 0,54 (Р = 4 МПа, Т= 1100 К). Избыток водяного пара до
соотношения пар : метан = 4:1, которое используется в про-
мышленности, позволяет увеличить максимальное (равновесное)
превращение метана до 0,74.
Вывод одного из продуктов из реакционной зоны позволяет
увеличить равновесный выход других продуктов. Это достигает-
ся отгонкой летучего продукта и является основой реакционно-
ректификационных процессов.
Термодинамический анализ реакционной
смеси устанавливает влияние условий (начальный состав,
температура, давление) на равновесное соотношение реагентов,
т. е. на состав смеси при полном завершении химического пре-
вращения. Из получаемых данных делают выводы о целесооб-
разности процесса, возможной полноте превращения, условиях
достижения желаемого выхода продуктов и т. д.
Один из примеров - анализ данных по равновесию аммиака
(см. рис. 2.10). Из него видно, что в области температур 450 -
550 °C, в которой работает катализатор, промышленный выход
аммиака (концентрация более 20%) достигается при давлении
более 20 МПа.
Еще один пример - анализ выхода продуктов при изомери-
зации диэтилбензола (ДЭБ) (изменении положения этильных
49
групп в ядре - структурной изомеризации):
В этой схеме два из трех изомерных превращений - стехио-
метрически независимые. Константы равновесия реакций (1) и
(2) равны:
Кр , = 1,74 ехр(-100/7); Кр 2 = 0,86 ехр( 860/7).
В равновесии Кр х = Рм /Ро и Кр2 = Р„ /Ро, где Ро, Рм, Рп -
равновесные парциальные давления соответствующих изомеров.
Исходная смесь содержит о-диэтилбензол. Его степени превра-
щения в мета- и параизомеры - хм и х„ соответственно. Они
совпадают с содержанием этих изомеров. Равновесные условия:
АГР1
откуда получим
1 + *Р1 +*р2’
*Р2
l + A'pj +Кр2
Содержание всех изомеров представлено на рис. 2.11. Наи-
больший интерес может представить л-диэтилбензол. Макси-
мальный его выход будет в области 600
К, но мало меняться с температурой.
Примесей довольно много - около
35%, причем с увеличением темпера-
туры возрастает содержание малопо-
Рис. 2.11. Зависимость равновесного содержания
изомеров диэтилбензола от температуры (7 - м-,
2- п-, 3 - о-диэтилбензол)
50
лезного ортоизомера. Далее можно делать и другие технологи-
ческие выводы.
Приведенные примеры - приближенные, в них представлены
логика и возможности термодинамического анализа.
2.2.3. Кинетика химических реакций
Схема превращения. Кинетика химических реакций описывает,
как и с какой скоростью превращаются вещества. Для предска-
зания количества оставшихся и образовавшихся компонентов
надо иметь стехиометрические уравнения, число которых опре-
делено из условия их независимости. Стехиометрия окисления
аммиака представлена двумя уравнениями:
4NH3+5O2=4NO+6H2O; 4NH3+3O2=2N2+6H2O. (2.34)
Если бы имело место только параллельное окисление NH3 до
NO и N2, то процесс описывался бы пунктирными линиями на
рис. 2.12: когда весь аммиак окислится, содержание NO и N2 не
будет меняться. Реальное изменение концентраций NO и N2
представлено сплошными линиями на рис. 2.12. Содержание
NO сначала растет, а затем уменьшается. Значит, наряду с обра-
зованием NO в соответствии с (2.34) происходит его дальнейшее
превращение. Установлено, что кроме реакций (2.34) имеют
место следующие превращения:
2NO = N2 + О2; 6NO + 4NH3 = 5N2 + 6Н2О. (2.35)
Схема превращения показывает реальные взаимодействия
(пути превращения) в реагирующей системе. Она может быть
представлена химическими (кинетическими) уравнениями по-
добно (2.34) - (2.35) или графически:
i^-NO
NH3 (2.36)
7"^ n2
Схема превращения состоит из частных реакций, или этапов.
В отличие от стехиометрических уравнений, кинетические не
могут быть записаны произвольно и их число должно соответ-
ствовать реальным путям превращения компонентов.
Скорость превращения и скорость реакции. Как быстро пре-
вращаются реагенты по этапам, определяется скоростью пре-
вращения вещества. Обозначим ее и»,-, где i - наименование ве-
щества, и примем естественное условие: и», < 0, если вещество
расходуется (исходное) и иу > 0, если вещество образуется (про-
дукт).
51
Рис. 2.12. Изменение со временем т концентраций
NHj (7), NO (2) и N2 (J) при окислении аммиака.
Пунктир - в соответствии с уравнениями (2.34),
сплошные линии - экспериментальные и в соот-
ветствии со схемой превращения (2.36)
Скорость превращения w, показывает
количество вещества, превращающегося в
единице реакционного пространства за
единицу времени.
Если реакция протекает в объеме, то единицей реакционного
пространства является единица объема, если на поверхности -
единица поверхности.
Из кинетического уравнения реакции
v дА + vbB + ....= vrR + vgS+.... или Zv/Az- = О
i
и соотношения между количествами АЛд,- превращенных ве-
ществ ЛЛд, /v, = const следует также w, /v, — const.
Это отношение назовем скоростью реакции г = w,/v,. Отме-
тим, что знак скорости превращения w, определяет, образуется
или расходуется вещество. Скорость реакции г всегда положи-
тельна. Через скорость реакции вычисляются скорости превра-
щения веществ
(2-37)
wi ~ vi г-
Если реакция сложная и вещество участвует в нескольких
частных реакциях, то
(2.38)
wi ='Lvijrj,
где п - скорость у-й реакции (этапа сложной реакции); vg - стехиометрический
коэффициент i-го вещества в у’-й реакции.
Скорость реакции также определяют как г = dC/dt - измене-
ние концентрации во времени, если реакцию проводить в за-
крытом сосуде. Если в реакционный сосуд непрерывно подавать
исходные вещества и непрерывно выводить из него соответ-
ствующее количество продуктов, то концентрация не будет ме-
няться во времени, т. е. dC/dt = 0. Но реакция протекает. Урав-
нение г = dC/dt только описывает, как измерить скорость реак-
ции в закрытом сосуде, но не является ее определением.
Кинетическая модель реакции. Скорость реакции зависит от
условий ее протекания, главным образом от температуры и кон-
центраций (парциальных давлений) компонентов. На скорость
реакций в каталитических процессах влияет также концентра-
ция катализатора, на скорость фотохимических реакций - ин-
тенсивность излучения и т. д.
52
Зависимость скорости превращения или скорости реакции от
условий ее протекания называют кинетическим уравнением или
кинетической моделью реакции.
Формы кинетических уравнений весьма разнообразны. Ме-
тоды построения кинетических моделей и способы определения
ее параметров являются предметом специального раздела физи-
ческой химии.
Для элементарной реакции А + vB = R + ... кинетическое
уравнение строится на основе действующих масс:
r = kCKC^,
здесь v показывает, сколько молекул В участвует в химическом акте.
Большинство реакций сложны по механизму и состоят из ря-
да последовательных взаимодействий (стадий). Кинетические
модели - сложные выражения, которые можно построить на осно-
ве механизма реакции. Характерный вид кинетической модели:
КС.пС”.
Г " (1 + YaiCi)p ’
где К, а», п, т, р - параметры модели, представляющие собой комбинации
констант скоростей и параметров элементарных стадий.
В кинетическое уравнение для гомогенной каталитической
реакции входит концентрация катализатора Ск.
Скорость реакции с физическим воздействием (электрохи-
мической, фотохимической и др.) зависит от интенсивности
этого воздействия. Скорость фотохимической реакции пропор-
циональна интенсивности излучения 1$. г = kl^C. Количество
вещества g, образовавшегося в электрохимической реакции, в
соответствии с законом Фарадея пропорционально количеству
электричества, прошедшего через электролит:
g = aQ = ait,
ще а - электрохимический эквивалент данного вещества, i - сила тока, t - время.
В каком-то интервале концентраций кинетическое уравнение
можно аппроксимировать более простой формулой, например
r= кСп.
Такой вид кинетического уравнения будем использовать да-
лее, чтобы проследить основные свойства химических процессов.
В кинетическом уравнении к - константа скорости, завися-
щая от температуры по уравнению Аррениуса:
к = кое ~E/RT, (2.39)
где Е - энергия активации. Чем больше Е, тем сильнее увеличивается к с тем-
пературой.
53
Показатель степени у концентрации п называют порядком ре-
акции.
Простая обратимая реакция А = R есть фактически сложная
реакция, в которой протекают две частные реакции: А превра-
щается в R (прямая реакция) и R превращается в А (обратная
реакция). Скорость превращения и, следовательно, скорость
реакции будет равна разности скоростей прямой Г] и обратной
Г2 реакций: г= гх- г2.
Пусть обе реакции - первого порядка: гх = kxC\, r2 = k2C^.
Тогда
г = kxCK-k2CK=kxcS\-'^.
Л1СА .
В равновесии г = 0, а СА и Cr - равновесные степени пре-
вращения Это возможно, если выражение в квадратных скобках
равно нулю. Но для данной обратимой реакции (Ск/Сд)раВН =
Ер» т. е.
kx/k2 = Кр. (2.40)
Зависимости кх, к2, Кр от температуры имеют вид
кх =kxoe^/RT; к2 = к20е~Е^RT; Kp^KpOeQ^RT.
Подставив их в (2.40), получим
Qp - Е?- Ех,
(241)
т. е. тепловой эффект обратимой реакции равен разности энер-
гий активации обратной и прямой реакций. Это фундаменталь-
ное соотношение следует из рассмотрения диаграммы “путь
реакции - потенциал реагирующей системы” (рис. 2.13). На
диаграмме ЕА и Er - потенциалы исходного вещества А и про-
дукта R соответственно. Разность их Qp - высвобожденная
энергия в результате превращения. Для превращения А в R не-
обходимо преодолеть энергетический барьер Ех (энергия ак-
тивации прямой реакции). В обратном направлении величина
потенциального барьера составляет Е2. Разность между ними
и дает величину теплового эффек-
та Qp.
Для экзотермической реакции Qp > 0
и Е2 > Ех. Для эндотермической (2Р < 0
и Е2 < Ех.
Реакционный путь
Рис. 2.13. Изменение энергии реагирующей сме-
си Е по мере протекания реакции (по реакци-
онному пути)
54
Скорость любой обратимой реакции всегда можно предста-
вить так:
Ар '
(2-42)
где и - скорость реакции в прямом направлении; уу сv< _ выражение закона
действующих масс как в уравнении (2.26), но концентрации текущие, а нс
равновесные.
2.2.4. Классификация химических процессов
Цель классификации - выделить такие характеристики состав-
ляющих процесса, комбинация которых определяет те или иные
свойства химического процесса в целом, его закономерности и
особенности. Поскольку химический процесс - система взаимо-
связанных явлений, то классификацию проводят по разным
признакам, и она имеет разветвленную структуру:
Классификация химических процессов
А. Физико-химические признаки
Тип химической реакции
Термодинамические показатели
Кинетические характеристики
Б. Физические признаки
Фазовый состав реагентов
прямое химическое взаимодей-
ствие с химическим воздействием
(каталитическая реакция)
с физическим воздействием
тепловой эффект
экзотермический процесс
эндотермический процесс
обратимость
необратимая реакция
обратимая реакция
схема превращения
простая реакция
сложная реакция
параллельная схема
последовательная схема
общий случай
кинетическая модель
число участвующих фаз с реаген-
тами
однофазный процесс
многофазный процесс
состояние фаз
газ
жидкость
твердое
55
В химическом процессе происходят химическая реакция и
явления переноса между фазами, обеспечивающие транспорт
реагентов к месту их взаимодействия. Поэтому выделяются две
группы признаков классификации - физико-химические, харак-
теризующие протекающую реакцию, и физические, характери-
зующие фазовый состав среды с реагентами.
Физико-химические признаки классифика-
ции. Какие воздействия необходимы, чтобы произошло хими-
ческое превращение, - признак классификации по типу хими-
ческой реакции. Если достаточен только контакт реагентов, т. е.
собственной энергии молекул достаточно для их превращения,
то это прямое химическое взаимодействие. Реакции типа “с
химическим воздействием” протекают с участием катализаторов.
Катализатор не только ускоряет реакцию, но и открывает новые
реакционные пути Реакции типа “с физическим воздействием”
протекают при инициировании электрическим током, излу-
чением разной природы, механическим воздействием (электро-,
фото-, радиационно-, механохимические реакции).
Термодинамические признаки включают энергетику процесса
(тепловой эффект) и обратимость реакции. Энергетика реакций
определяет характер не только тепловых явлений в процессе, но
и равновесных состояний. Обратимость реакции определяет
принципиально возможную глубину превращения реагентов.
Кинетические признаки характеризуют динамику развития
реакции и определяют направленность превращений и характер
влияния условий (концентрации, температуры) на протекание
(кинетику) реакции.
Физические признаки классификации включа-
ют фазовый состав химического процесса. По числу фаз разли-
чают гомогенные (однофазные) и гетерогенные (многофазные)
процессы. В гетерогенном процессе реагенты находятся в раз-
ных фазах, хотя реакция может протекать в одной из них, т. е.
сама химическая реакция может быть гомогенной. Необходи-
мость транспорта реагентов к месту реакции вносит особен-
ности в процесс в целом. Характер переноса веществ зависит,
конечно, от агрегатного состояния взаимодействующих фаз.
Сочетание разных признаков проявляется в особенностях,
свойствах химического процесса. Основной целью исследования
и изучения химического процесса является определение скорос-
ти превращения в нем и влияния на скорость превращения
условий протекания и типа процесса, определяемого комбина-
цией его характеристик из разных признаков классификации.
56
2.3. ГОМОГЕННЫЕ ХИМИЧЕСКИЕ ПРОЦЕССЫ
Гомогенные химические процессы протекают в одной фазе,
чаще газовой или жидкой, в которой выравниваются условия
протекания реакции во всем выбранном объеме. Поскольку яв-
ления переноса здесь не существенны, то закономерности гомо-
генного химического процесса совпадают с закономерностями
химической реакции.
2.3.1. Простая реакция
Необратимая реакция А= R представлена кинетическим уравне-
нием
г=кСп. (2.43)
Зависимость скорости реакции от концентрации показана на
рис. 2.14, а. Перейдя к степени превращения х = (Go - C)/Cq,
получим
r = kCfi(l-x)n. (2.44)
Зависимость г(х) изображена на рис. 2.14, б. Порядок реак-
ции п изменяет темп возрастания скорости с концентрацией -
он выше для реакции более высокого порядка.
Константа скорости к зависит от температуры по уравнению
Аррениуса (2.39). Характер изменения г (7) будет таким же, как
и к (7) (рис. 2.15, а). Для двух реакций с различными энергиями
активации Е\ и £2 скорость возрастает с температурой больше у
той реакции,у которой энергия активации больше (на рис. 2.15, а
Е] > Ез)- Увеличение температуры изменит зависимости г (С)
и г(х). Концентрационная (рис. 2.15, б) и конверсионная (рис.
2.15, в) кривые скорости реакции показаны при температурах Т\
и 7з, причем ?2 > Т\. При более высокой температуре Ti ско-
рость процесса больше: с увеличением Т возрастает константа
скорости реакции к, а из уравнений (2.43) и (2.44) видно, что
скорость реакции тоже возрастет.
Рис. 2.14. Зависимость скорости простой необратимой реакции г от концентра-
ции С (а) и степени превращения х (б) исходного реагента; п - порядок реак-
ции
57
Рис. 2.15. Влияние температуры Т на скорость простой необратимой реакции
г: г(Т)(а) для реакций с энергиями активации Ех и £2 (£| > ЕгУ, г (C)(6) и
г(х) (в) при температурах 7] и ?2 (7j > 7])
Из (2.44) также следует, что характер влияния начальной
концентрации Q на зависимость г (х) будет таким же, как влия-
ние температуры: увеличение Q приведет к возрастанию ско-
рости при той же степени превращения.
Рост температуры обусловливает интенсификацию процесса
(увеличение скорости) для необратимой реакции. Если необхо-
димо достичь максимальной интенсивности (будем называть эти
условия оптимальными), то температура должна быть макси-
мально возможной, допустимой для данной реакционной си-
стемы, при любых концентрациях (степени превращения).
Ограничение на температуру обусловлено появлением нежела-
тельных реакций, возможностью самовоспламенения, устойчи-
востью материала аппаратуры и т. д.
Обратимая реакция А = R представлена кинетическим урав-
нением первого порядка в обоих направлениях:
r= (tiCA-JtCR. (2.45)
Поскольку скорость реакции зависит от концентраций двух
компонентов, то зависимость г(СА) будет представлена серией
кривых, полученных при разных значениях Cr (рис. 2.16, а).
Рис. 2.16. Зависимость скорости обратимой реакции г от концентрации исход-
ного компонента СА при различных значениях концентрации продукта CR (о) и
от степени превращения хА (6)
58
Равновесие в обратимой реакции, когда г = 0, будет при опреде-
ленном соотношении Cr/ Са = Кр. Точка Сд пересечения кри-
вой г(СА) с осью абсцисс при каждом значении Cr на рис.
2.16, а отвечает равновесию при этих концентрациях - СА и
Cr. Если СА < СА, то скорость становится отрицательной
(пунктир на рис. 2.16, а) - реакция протекает в обратном на-
правлении.
Чтобы получить однофункциональную зависимость для ско-
рости реакции, перейдем к степени превращения х компонента А:
Са= Са о (1 - х) : CR = СА 0 х
и
г = £1Сдо(1 - х) - А^Сдо-х = ^Сдо - (ki + &2)С\о х- (246)
Зависимость г(х) - линейно убывающая (рис. 2.16, б). При
некотором значении х = k\/(k\ + kj) достигнем г = 0. Ранее бы-
ло получено: k\/ki = Кр - см. уравнение (2.40) и хр = Ар/(1 +
+Ар) - см. уравнение (2.30). Используя эти выражения в урав-
нении (2.46), получим, что г = 0 именно при равновесной сте-
пени превращения, что естественно.
От температуры Т зависят две константы в кинетическом
уравнении - к\ и kj. Обе константы увеличиваются с ростом
температуры, но их влияние на г противоположно: увеличение
к\ ускоряет реакцию, а /:2 - замедляет. Их совместное влияние
зависит от того, какая из констант быстрее увеличивается с тем-
пературой, от соотношения энергий активации прямой и обрат-
ной реакций. Последнее различно для экзо- и эндотермической
реакции.
Зависимость г (х) - убывающая линия между г = к[ Са о при
х = 0 и г = 0 при равновесной степени превращения хр. С уве-
личением температуры начальная (при х = 0) скорость увеличи-
вается. Равновесие изменится в зависимости от того, какая про-
текает реакция - экзо- или эндотермическая. В эндотерми-
ческой Хр возрастает, и скорость реакции возрастет во всем
интервале изменения х от х = 0 до х = хр (кривая 7 на рис. 2.17).
Равновесие в экзотермической реакции сдвигается влево. Уве-
личение температуры приведет к увеличению скорости реакции
при небольших значениях х. Начиная с некоторого значения х
скорость реакции станет меньше, несмотря на более высокую
температуру (кривая 2 на рис. 2.17).
Влияние температуры на скорость реакции при определен-
ном составе газа (степени превращения) проанализируем, сопо-
ставляя графики в координатах Т- г и Т- х. Сначала рассмот-
59
Рис. 2.17. Зависимость скорости обратимой
реакции г первого порядка от степени пре-
вращения хА при температурах 7\ (пунктир)
и > Т| (сплошные линии):
/ - эндотермическая реакция; 2 - экзотермиче-
ская реакция; штрих-пунктирная линия - при увели-
чении начальной концентрации и температуре 7|
Рис. 2.18. Зависимость скорости обратимой
экзотермической реакции г от температуры
Т (а) и график Т-х (б):
Хр - равновесная степень превращения; Гопт -
оптимальные температуры
рим обратимую экзотермическую реакцию (рис. 2.18, а). Изме-
нение скорости с температурой при заданном х проследим,
двигаясь по пунктирной линии, например jq, на диаграмме Т -
х (рис. 2.18, б). При низких температурах, далеко от равновесия,
влияние обратной реакции незначительно. Скорость обратной
реакции почти равна скорости прямой и также возрастает с
температурой - см. рис. 2.18, а. По мере увеличения Т скорость
обратной реакции возрастает быстрее, чем прямой: для экзотер-
мической реакции Е2 > Е\. Вклад обратной реакции в общую
скорость превращения становится все больше и больше. При
некоторой температуре она начинает превалировать, скорость
проходит через максимум и далее уменьшается с температурой.
По достижении температуры, при которой заданное значение Х|
становится равновесным (равновесной температуры), скорость
реакции будет равна нулю. Зависимость г(Т)~ колоколообраз-
ная кривая с максимальным значением при температуре, кото-
рую назовем оптимальной - 7ОГТГ. Аналогичной будет зависи-
мость г(Т)и при других степенях превращения. С увеличением
х скорость реакции будет меньше, при более низких температу-
рах будет достигаться максимальная скорость и устанавливаться
равновесие - см. зависимости г (Г) при *2 > -Ч, -*з > *2 и т- Д-
Если объединить все значения температур с максимальной ско-
ростью реакции, то на графике Т-х получим линию оптималь-
ных температур - Гопт на рис. 2.18, б. Она показывает для каж-
60
Рис. 2.19. Зависимость скорости обратимой
эндотермической реакции г от температуры
Т (о) и график Т-х (б). Обозначения - как
на рис. 2.18
дой степени превращения температу-
ру, при которой скорость реакции бу-
дет максимальна. Уменьшение темпе-
ратуры по мере протекания реакции
(увеличения х) будет отвечать макси-
мальной интенсивности процесса.
Графики Т - г и Т-х для эндо-
термической реакции показаны на
рис. 2.19. Реакция будет протекать в
прямом направлении, если х < хр,
что соответствует области х - Т ни-
же кривой хр(Т)на рис. 2.19, б. Для
каждого значения х есть температу-
ра, при которой реакционная смесь
равновесна и г = 0. Начиная от
этой равновесной температуры за-
висимость г(Т) - возрастающая
кривая. Оптимальная температура
обратимой эндотермической реакции
равна максимально допу-
стимой, как для необратимых реакций.
2.3.2. Сложная реакция
Сложная реакция состоит из этапов, или частных реакций. Ха-
рактер зависимости их скоростей от концентраций и температу-
ры такой же, как для простой реакции. В сложной реакции про-
дукты образуются в разных частных реакциях, и появляется ха-
рактеристика процесса, связанная с соотношением скоростей
образования таких продуктов.
Дифференциальная селективность - отношение скорости пре-
вращения исходного вещества в определенный продукт к общей
скорости его превращения.
Селективность, определенная ранее как доля исходного вещест-
ва, превратившегося в нужный продукт, характеризует конечный
результат процесса и называется интегральной селективностью.
Параллельная схема превращения:
*1» ^1’ ”1^R
а<СГ
^2> ^2’ ,г2
Здесь обозначены константы скоростей (k\, к-Д, энергии акти-
вации (Е\, £2) и порядки («1, п2) частных реакций. Дифферен-
61
циальная селективность по R:
wv к,Сп'
, (2.47)
H’R+H’S кхСп£+к2Сп*
где wr и M's - скорости образования продуктов R и S.
Если порядки частных реакций одинаковы («] = п2), то
Sr = Л] /(к] + к2) и не зависит от концентрации.
Если > п2, то Sr= ^Сд1'”2/(/qC”1-”2 +/с2) и возрастает с
увеличением СА, асимптотически приближаясь к Sr = 1. Дей-
ствительно, с увеличением СА скорость реакции А -> R больше,
чем А -> S, увеличивается доля первого этапа в общей скорости
превращения исходного вещества.
Если Л| < п2, то Sp_=kl/(kl +к2Сп^~щ) и уменьшается с
увеличением СА, поскольку сильнее возрастает скорость образо-
вания R. Вид зависимостей Sr (Са ) приведен на рис. 2.20.
Из полученных данных можно сделать следующие выводы о
целесообразном режиме проведения процесса с параллельной
схемой превращения.
Если порядок реакции образования целевого продукта боль-
ше, чем порядки реакций образования других продуктов, про-
цесс выгоднее проводить при высоких концентрациях исходных
веществ - и селективность, и интенсивность процесса будут
наибольшими.
При равных порядках частных реакций концентрация не
влияет на селективность, и повышение концентрации целесооб-
разно для увеличения скорости реакции.
Если порядок реакции образования побочного продукта
больше, то селективность будет увеличиваться при снижении
концентрации. Однако скорость превращения будет уменьшаться.
Повышение температуры приведет к увеличению дифферен-
циальной селективности, если при этом скорость образования R
возрастет больше, чем скорость образования S. Это возможно в
случае Е\ > Е2. При обратном соотношении энергий активации
{Е\ < Е2) увеличению селективности будет способствовать сни-
жение температуры в ущерб интенсивности.
Последовательная схема превращения:
д к\,Еъпх к2,Е2,п2 g
Скорости первой и второй стадий: Г\ = к\С^ и г2 = к2Сц.
Скорость образования целевого продукта R : wr = /qCA - к2Сц.
62
Рис. 2.20. Зависимость дифференциальной селективности S'R от концентрации
СА для параллельной схемы превращения (я - порядок реакции)
Рис. 2.21. Зависимость дифференциальной селективности So от концентраций
СА и CR для последовательной схемы превращения. Стрелкой показано увели-
чение CR - концентрации промежуточного продукта R
Скорость общего превращения исходного вещества wA = kjCA.
Дифференциальная селективность
К1СА К1СА
зависит от концентрации двух реагентов. Можно построить се-
мейство кривых *Sr(Ca) при разных Cr (рис. 2.21).
При некотором соотношении Cr и Са, а именно Cr/Ca =
-к\/к^, скорость образования R из А и дальнейшего превраще-
ния R в S будут равны, и Sr = 0. Если отношение CR /СА пре-
вышает это значение, дифференциальная селективность станет
отрицательной. Отметим, что интегральная селективность -
всегда положительная величина.
Влияние температуры проследим при заданных концентра-
циях СА и Cr. Если Е\ > Е^, то с повышением температуры к\
увеличивается сильнее, чем Л2, и, как следует из (2.48), диффе-
ренциальная селективность 5r будет возрастать. При обратном
соотношении энергий активации частных реакций (£] < £2)
температура будет отрицательно сказываться на селектив-
ности.
63
2.4. ГЕТЕРОГЕННЫЕ ХИМИЧЕСКИЕ ПРОЦЕССЫ
2.4.1. Основные определения
В гетерогенном химическом процессе исходные вещества и (в
общем случае) продукты находятся в разных фазах. По виду
участвующих в процессе фаз различают следующие гетероген-
ные процессы:
а) система “газ - твердое” (к этому типу процессов относятся
адсорбция и десорбция газов, возгонка, обжиг руд, окисление
металлов, восстановление твердых оксидов, горение твердых
топлив);
б) “жидкость - твердое” (адсорбция, десорбция из жидкости,
растворение, выщелачивание, кристаллизация);
в) “газ - жидкость” (абсорбция, десорбция из жидкости,
концентрирование растворов испарением растворителя, конден-
сация, перегонка жидких смесей - дистилляция, ректификация);
г) несмешивающаяся система “жидкость - жидкость”
(экстракция, эмульгирование);
д) “твердое - твердое” (спекание, процессы получения це-
мента и керамики, высокотемпературный синтез неорганиче-
ских материалов);
е) многофазные системы - “газ-жидкость-твердое”, “несме-
шивающиеся жидкости - газ или твердое”.
Предметом дальнейшего рассмотрения будут химические
превращения, происходящие в этих процессах. В них участники
реакции - реактанты - находятся в разных фазах, а реакция
протекает по крайней мере в одной из них или на границе раз-
дела фаз. Следовательно, для осуществления реакции необходим
перенос компонентов из объема фаз к месту их реагирования.
Условия процесса - состояние каждой из фаз и параметры их
взаимодействия. При контакте фаз реактанты переносятся к
месту протекания реакции, и их содержание в этом месте -
условия реакции - будет отличаться от созданного внешними
условиями; различаться может и температура.
Перенос вещества и тепла зависит от условий взаимодей-
ствия фаз (скоростей и направлений потоков, конфигурации
поверхностей) и их транспортных свойств (коэффициентов
диффузии, теплопроводности, вязкости). Условия реакции есть
результат перераспределения концентраций и температур
вследствие одновременного протекания химической реакции и
явлений переноса, т. е. гетерогенный процесс является много-
стадийным. Условия реакции можно выразить через условия
процесса, которые заданы или известны, которые можно изме-
рять или “наблюдать”.
64
Скорость превращения в гетерогенном химическом процессе,
выраженная через условия процесса, есть наблюдаемая скорость
превращения
Если скорость превращения зависит от концентрации С' и
температуры Т' в месте протекания реакции, т. е. w(C',T'), а
С' и Т' определяются условиями процесса, то от его пара-
метров (например, скорости потока и) будет зависеть наблюдае-
мая скорость превращения:
w(C, Т') = №Н(С, Т, и, ...).
Основной задачей исследования гетерогенного химического
процесса является установление зависимости И^С, Т, и, ...).
В многостадийном процессе интенсивность его составляю-
щих (этапов, стадий) может быть различна. Вводятся понятия:
лимитирующая стадия, ограничивающая скорость процесса, и
режим процесса, определяемый этой стадией. Эти понятия будут
определены и охарактеризованы далее при рассмотрении кон-
кретных систем.
Механизмы переноса в твердом теле существенно отличаются
от таковых в жидкости и газе. Газ и жидкость - фазы текучие, с
подвижной поверхностью. Вклад конвективной составляющей
переноса в них весьма велик, чего нет в твердом теле с жестки-
ми и неподвижными внутренней структурой и внешней конфи-
гурацией. Это позволяет для построения моделей химического
процесса указанное выше многообразие гетерогенных систем
свести к двум видам:
“газ(жидкость)-твердое” - взаимодействие текучей и жесткой
фаз;
“газ(жидкость)-жидкость” - взаимодействие текучих фаз.
2.4.2. Система “газ (жидкость) - твердое”
В рассматриваемой системе твердый реагент - кусковой или
зернистый материал, омываемый потоком газа или жидкости
(при построении модели процесса это различие не принципи-
ально). Для целей исследования основных свойств процесса
твердый реагент представим частицей шарообразной формы.
Поверхность частицы - равнодоступная, т. е. перенос компо-
нентов между потоком и частицей одинаков по всей поверх-
ности частицы. Размеры твердой частицы в процессе могут ме-
няться в результате горения, растворения и т. д.) или оставаться
почти неизменными, если образуется твердый продукт, который
“замещает” исходный твердый реагент. Полагаем, что темпера-
туры частицы и потока равны.
65
г
Рис. 2.22. Схема гетерогенного процесса с ре-
акцией Лг + В, = R, (“сжимающаяся сфера”).
Пояснение в тексте
Процесс с изменением размера твер-
дой частицы. В этом процессе продукт
взаимодействия газа с твердой части-
цей - газообразный:
Ar + Вт = Rr. (2.49)
Индексы “г” и “т” указывают, в какой
фазе находится компонент.
Примеры таких процессов - горе-
ние угля (С + 02 = СО2), газифика-
ция угля (С + Н2О = СО + Н2), рас-
творение. В них происходит уменьше-
ние размера твердого материала по
мере протекания процесса вплоть до его исчезновения.
Схема процесса представлена на рис. 2.22. Обтекающий
частицу поток хорошо перемешан в объеме, так что концентра-
ция компонента А в потоке (говорят: “в ядре потока”) постоян-
на и равна Со. У поверхности частицы образуется пограничный
слой (на рисунке ограничен пунктиром). Через него компонент
А проникает к поверхности частицы, где и происходит реакция.
Газообразные продукты удаляются в поток обратным путем.
Вещество переносится через пограничный слой толщиной 5
диффузией (коэффициент диффузии /)), и массообмен характе-
ризуют коэффициентом р = Л/5. Механизм переноса может
быть и более сложным, но в любом случае его характеризуют
коэффициентом массообмена р. Для расчета р используют кри-
териальные уравнения. Например, при обтекании одиночной
частицы диаметром d:
Nu = 2 + 0,93Re°-5 Sc’/3, (2.50 a)
где критерий Нуссельта Nu = p<7/Z>; критерий Рейнольдса Re = ud/v, критерий
Шмидта Sc = v/Z); и - скорость потока; v - вязкость газа.
При обтекании частицы в неподвижном зернистом слое:
Nug = 0,395Re°’64 Sc1 /3; Re3> 30, (2.50 6)
где Nu3 = prf3/Z>; Re3 = ud3/ev; d3 = tya - эквивалентный диаметр частиц; e -
породность слоя; а - удельная поверхность частиц.
Структура процесса представлена следующими ста-
диями (этапами). В газовой фазе:
1) перенос реагента А из потока к поверхности (этап I на
рис. 2.22); для этого концентрация А у поверхности Сп должна
быть меньше, чем в потоке; распределение концентраций пока-
зано в нижней части рисунка;
66
2) реакция А с твердым В (этап П) на наружной поверхности
частицы;
3) перенос продукта реакции R от поверхности в поток; по-
лагаем, что скорость реакции не зависит от концентрации R и
его отвод от поверхности не влияет на процесс.
В твердой фазе:
1) реакция В с газообразным компонентом А поверхности
(этап II);
2) изменение (уменьшение) размера частицы г (этап III);
первоначально частица имела радиус Rq.
Схему такого гетерогенного процесса, при котором твердый
реагент, частица, уменьшается в размере, называют “сжима-
ющаяся сфера ”.
Математическая модель включает описание поведе-
ния реагентов газообразного А и твердого В. Объемное содер-
жание вещества в конденсированной фазе - в твердой частице -
в сотни раз больше, чем в газе. Уменьшение размера частицы
происходит гораздо медленнее, чем устанавливается распределе-
ние концентраций в пограничном слое, так что в каждый мо-
мент времени процессы в газовой фазе можно считать стацио-
нарными. В стационарном режиме поток вещества А к поверх-
ности (И'] - этап I) и скорость реагирования А на ней (Ин -
этап II) равны:
= 1ГП. (2.51)
Поток компонента А пропорционален поверхности частицы
5Г радиуса г и разности концентраций А в потоке Со и у поверх-
ности Сп:
IT, = -р5г(С0-Сп). (2.52)
На поверхности протекает реакция первого порядка, и скорость
превращения А пропорциональна наружной поверхности частицы:
Wn = -kCnSr. (2.53)
Подставляя (2.52) и (2.53) в (2.50), получим
Р(Со — Сп) = кСп.
Далее определим концентрацию А у поверхности:
С
п 1 + Л/р
и наблюдаемую скорость превращения:
И/н = -кСп =---
н п 1 + Л/р
Комбинацию параметров Лир обозначим Кн - наблюдае-
мая константа скорости (по аналогии с наблюдаемой ско-
67
(2.54)
(2.55)
ростью реакции):
(2.56)
(2-57).
и далее
>гн = кнс0.
Видно, что 1УН представлена как реакция первого порядка, но
Кн не имеет физического смысла, а является параметром, зави-
сящим от условий процесса. Можно проследить: если реакция
будет не первого порядка, то выражение для будет отличать-
ся от вида кинетического уравнения. Например, если на по-
верхности протекает реакция второго порядка (wA = -kC2),
то 1VH = -р2/4/с[л/(1 + 4/сСо/р) - I]2 - форма выражения
для (Со) - сильно отличается от кинетического уравне-
ния.
Изменение количества твердого компонента N в единицу
времени равно скорости его превращения на наружной поверх-
ности частицы:
dN/dt = wbS, - (2.58)
Скорости превращения веществ связаны стехиометрическим
соотношением wg/vB = В рассматриваемой реакции (2.49)
vB = vA и wB = wA =-kCn =-KHC0.
Количество твердого компонента в единице объема обозна-
чим по (если частица - непористое вещество с молекулярной
массой М и плотностью р, то по = р/М). За время dt прореагирует
тонкий поверхностный слой толщиной dr, в котором содержится
dN = noSrdripesLKma В. Уравнение (2.58) преобразуем к виду
noS^dr/df) =-KHCQSr
и далее:
dr/dt=-KH(Co/no). (2.59)
Интегрируя (2.59) в пределах от начального момента t = О
(размер частицы - первоначальный, т. е. Rq) до момента t
(размер частицы уменьшился до г), получим
Ro-r= KH(Co/no)t. (2.60)
Через некоторое время tK твердая частица прореагирует пол-
ностью (индекс “к” означает конец реакции), т. е. в этот мо-
мент г = 0. Время полного превращения найдем из (2.60):
= ЛоЛо/(АнСо). (2.61)
Введя безразмерный радиус р = г/Ro и используя выражение
(2.61), приведем (2.60) к безразмерному виду:
P = 1 - t/tK. (2.62)
68
Рис. 2.23. Изменение во времени t безразмерного радиуса частицы р (о), степе-
ни превращения твердого реагента Xg (6) и скорости превращения частицы
Ичаст (в) для гетерогенного процесса “сжимающаяся сфера”. /к - время полного
превращения. Пунктир - изменение р при учете влияния меняющегося размера
частицы на коэффициент массообмена р
На практике превращение удобно выразить через степень
превращения твердого: хв ~ (No ~ М/^о- Количество твердого в
первоначальной частице составляет No = (4/3)л7?3но и в теку-
щий момент N =(4/3) пг^п0, откуда получим
хв = 1 - р3 и р = (1 - хв)’/3. (2.63)
Изменение степени превращения со временем:
хв = 1 - (1 - (2.64)
Можно найти, как будет меняться со временем наблюдаемая
скорость превращения, отнесенная к одной частице:
Нечаст) = >KA= =-ФлЯ2^нС0(1-///к)2. (2.65)
Анализ гетерогенного процесса “сжимаю-
щаяся сфера”. Зависимости p(t/tK), x#(t/tK), И<1аст(г/гк) пред-
ставлены на рис. 2.23 в предположении постоянства коэффици-
ента массообмена р в указанном процессе. В этом случае значе-
ние (на единицу поверхности) постоянно, и за каждый ин-
тервал времени “снимается” слой одной и той же толщины - р
линейно уменьшается со временем (рис. 2.23, а). Но количество
прореагировавшего твердого реагента пропорционально поверх-
ности частицы, которая пропорциональна р2 и уменьшается со
временем. Поэтому вначале хв будет увеличиваться быстро, а
затем - медленнее (рис. 2.23, б). Скорость реагирования части-
цы Нечаст) будет уменьшаться во времени вместе с уменьшени-
ем частицы, уменьшением поверхности реагирования.
Коэффициент массообмена р в общем случае зависит от раз-
мера омываемых частиц: возрастает с ее размером - см. форму-
69
лы (2.50). Учет этого эффекта несколько повлияет на рассмат-
риваемые зависимости. Максимальное влияние изменения р с
размером частицы показано на рис. 2.23, а пунктиром.
Лимитирующие стадии и режимы процесса.
Скорость отдельного процесса (реакции, массопереноса) опре-
деляется величиной его параметра (константы скорости, коэф-
фициента массообмена) и движущей силы (концентрации для
реакции, разности концентраций для массопереноса). Параметр
процесса - характеристика его интенсивности. В многостадий-
ном процессе возможны разные соотношения параметров его
стадий (этапов). В рассматриваемом процессе наблюдаемая ско-
рость реакции 1VH и соответственно Кн зависят от константы
скорости реакции к и коэффициента массообмена р.
Если к « р, т. е. реакция малоинтенсивна, то из (2.54) полу-
чим Сп « Q) - реакция протекает при максимально возможной в
этих условиях концентрации (у реакции максимальная движу-
щая сила). Наблюдаемая скорость превращения равна скорости
реакции (=-кС0) и не зависит от параметров переноса. Про-
цесс протекает в кинетическом режиме, а реакция является ли-
митирующей стадией.
В случае k » р интенсивность массообмена мала; из (2.54)
получим Сп « Со, а из (2.55) =~рСо - массоперенос осу-
ществляется при максимальной движущей силе Со - Сп « Со-
Скорость превращения не зависит от параметров реакции
(константы скорости). Это - диффузионный режим, а массопере-
нос - лимитирующая стадия.
Режим (или область протекания процесса) и лимитирующая
стадия - понятия и характеристики, присущие многостадийному
процессу.
Лимитирующая стадия - этап многостадийного процесса, ха-
рактеризующийся максимальной движущей силой или мини-
мальной интенсивностью. Лимитирующая стадия определяет
режим, или область протекания, процесса.
Второй признак лимитирующей стадии (минимальная интен-
сивность, характеризуемая величиной параметра) применять
можно только в том случае, если у всех стадий движущая сила -
одного порядка по концентрации. В рассматриваемом процессе
движущие силы реакции и массопереноса - первого порядка по
концентрации. Невозможно, например, сравнивать по величине
такие параметры, как коэффициент массопереноса р и констан-
ту скорости реакции второго порядка к, имеющие разные раз-
мерности: [м/с] для р и [м4/(моль с)] для к.
Можно встретить определение лимитирующей стадии как
самой медленной стадии. Это определение кажется естествен-
70
Рис. 2.24. Зависимость наблюдаемой константы Кк скорости преврашения в
гетерогенном процессе “сжимающаяся сфера” от температуры Т (а) и скорости
обтекания частицы и (б). Режимы процесса:
1 - кинетический; 2 - переходный; 3 - диффузионный
ным. Но в стационарном режиме скорости всех стадий равны:
их равенство (2.51) W\ = 1Гц соблюдается всегда!
Лимитирующую стадию называют также определяющей ста-
дией. Под этим понимают следующее. Если какая-то стадия
процесса - лимитирующая, то закономерности соответствую-
щего режима и этой стадии совпадают. Например, в кинети-
ческом режиме наблюдаемая скорость превращения зависит от
температуры так же, как и скорость реакции. В диффузионном
режиме совпадают WH и скорость массопереноса. В дальнейшем
увидим, что понятия “лимитирующая стадия” и “определяющая
стадия” не всегда совпадают.
Рассмотрим влияние условий процесса на ско-
рость превращения.
1. Влияние температуры. Оно сказывается на значении Кн
[уравнение (2.56)]. Представим эту зависимость в аррениусов-
ских координатах “ln/fH - \/Т” (рис. 2.24, а). На графике пунк-
тиром показана зависимость к(Т). При небольших температурах
(правая часть графика) константа скорости реакции мала (к «
« Р), режим кинетический. В этой области Кн совпадает с к.
При больших температурах (левая часть графика) к » р, режим
диффузионный; Кн = р и почти не зависит от температуры.
Действительно, коэффициент массообмена р пропорционален
коэффициенту диффузии. Нагрев на 10 °C увеличивает скорость
реакции примерно вдвое, а скорость диффузии - на несколько
процентов. Между этими областями температур лежит переход-
ная область.
2. Влияние скорости потока. От нее зависит р [см. уравнения
(2.50)]. При малой скорости потока и можно полагать р « к;
режим диффузионный; Кн = р и увеличивается со скоростью
потока. При больших скоростях потока с возрастанием р режим
процесса переходит в кинетический и перестает зависеть от и.
Характер изменения Кн (и) показан на рис. 2.24, б.
71
Интенсификация процесса. Ее будем определять по
уменьшению времени полного превращения /к. Из уравнений
(2.61) и (2.56) получим
t = (— + —1 к°п°
к U Со
Из структуры этого выражения видны пути уменьшения /к и,
следовательно, интенсификации процесса: увеличение концент-
рации компонента в газе Со; дробление частиц - уменьшение
7?о; увеличение константы скорости к подъемом температуры
(особенно в кинетической области); увеличение коэффициента
массообмена 0 турбулизацией потока, увеличением скорости
обтекания им частицы (особенно в диффузионной области).
Влияние Т и и на интенсификацию процесса ограничено.
Процесс без изменения размера твердой частицы. Один из про-
дуктов взаимодействия газа с твердой частицей - твердое веще-
ство:
Аг + Вт = Rr + ST. (2.66)
Реакция протекает на границе раздела твердых фаз исходного
реагента и продукта и называется топохимической реакцией.
Процесс распространен в промышленности: сероочистка при-
родного газа на оксидно-цинковом поглотителе (H2S + ZnO =
=Н2О + ZnS), обжиг серосодержащих руд (4FeS2 + 11О2 =
=8SO2 + 2Ее2Оз), восстановление оксидов металлов и окисле-
ние металлов и др. К этому же типу относятся процессы, в ко-
торых в многокомпонентном твердом реагирует часть его со-
ставляющих: горение зольных углей (не реагируют и остаются в
твердом виде минеральные составляющие); выщелачивание
(растворение части компонентов); некоторые процессы хемо-
сорбции, восстановления и отравления катализаторов (в них
процесс продвигается фронтально в глубь твердой частицы).
Схема процесса следующая (рис. 2.25). Частица радиу-
сом Rq обтекается потоком газа с концентрацией реагента в нем
Со. Частицу окружает пограничный слой, через который осу-
ществляется массообмен между поверхностью частицы и ядром
потока. Реакция начинается на поверхности и фронтально про-
двигается в глубь частицы. В какой-то момент времени частица
будет состоять из ядра радиусом гя, содержащего непрореагиро-
вавшее вещество В, и наружного слоя продукта или/и нереаги-
рующих компонентов, т. е. инертных по отношению к проте-
кающей реакции. Реакция протекает на границе раздела твердых
фаз - на поверхности ядра, в результате ядро уменьшается, но
размер частицы (7?Ь) сохраняется. Такую схему процесса назы-
вают “сжимающееся ядро”.
72
Рис. 2.25. Схема гетерогенного процесса с реак-
цией Ar + Вт = Rr + ST (“сжимающееся ядро”)
Структура процесса включает сле-
дующие стадии (этапы).
Для газообразных компонентов:
1) перенос компонента А из потока
к поверхности частицы (этап I на рис.
2-25);
2) перенос реагента через слой
инерта к поверхности ядра (этап 11);
как правило, инерт - пористый мате-
риал, и перенос компонента осу-
ществляется диффузией по порам;
3) реакция Аг с Вт на поверхности
ядра (этап 111).
Газообразные продукты отводятся в обратном порядке. Счи-
таем, что они не влияют на скорость превращения.
Для твердых компонентов:
1) реакция твердого В с Аг на поверхности ядра (этап III);
2) изменение размера ядра (этап IV).
Распределение концентраций А показано в нижней части
рис. 2.25.
Математическая модель этого процесса строится по
аналогии с вышерассмотренной. Обозначим Сп, Ся
концентрации А у наружной поверхности частицы и у ядра: D -
коэффициент диффузии А в слое инерта: W\, Hj, - потоки
компонента А или скорость превращения А на соответствующих
стадиях процесса. В стационарном режиме
~ Ян - 1FHI.
(2-67)
Поток компонента А к поверхности частицы радиусом Rq со-
ставляет
^=-4л/?2р(С0-Сп). (2.68)
Перенос компонента А через слой инерта - диффузионный
процесс, описываемый уравнением Фика. Поток А через сфери-
ческую поверхность радиусом г внутри слоя инерта (гя < r< Rq):
=-4nr2D(dC/dr). (2.68 а)
Поверхность переноса реагентов 4лг2 зависит от г, но вели-
чина потока РКц неизменна в стационарном состоянии, так что
dlPn/dr = 0 или
[-D 4лг2 —1
I dr)
d
dC
= 0.
73
Граничные условия:
при г = Rq С = Сп; при r= R„ С = Ся.
Введем безразмерный радиус р = г/Rq. Подставив г = р7?о в
последнее уравнение и сократив постоянные величины, преоб-
разуем его:
—(р2^1 = °- (2.69)
dp\ ar J
Граничные условия:
С(1) = Сп; С(Ря) = Ся> (2.69 а)
где ря = Гя/Ло-
Интегрируем (2.69 а) дважды:
первое интегрирование:
p^dC/dp = А, или dC/dp — А/р^\ (2.70)
второе интегрирование: С =-А/р + В.
Константы интегрирования А и В находим из граничных
условий (2.69а):
С(1) =-А + В = Сп; С(Ря) =-Л/ря + В = Ся.
Из двух последних уравнений получим
Я=-Р^(СП -Ся).
1~Ря
Теперь преобразуем выражение (2.68 а), для чего определим
поток Й'п при г = гя и перейдем к безразмерному радиусу ря; в
приведенное уравнение для Иц подставим dC/dp из (2.70) при
р = ря, используя выражение для А. Получим
Гц = -4nR0D-^-(Cn - Ся). (2.71)
1“Ря
Принимаем, что реакция А с В - первого порядка. Скорость
превращения Й'щ пропорциональна поверхности ядра:
= -4пг^Ся = -4п А 2 Лр2 Ся. (2.72)
Подставим (2.68), (2.71) и (2.72) в (2.67) и получим
47гЛ02₽(С0-Сп)= -4п/?0£)_Ра_(Сп- Ся)= -4лА2 /ср%Ся= JK,acT.
1 - Ря
(2.73)
Скорость превращения на ядре РКщ есть также скорость пре-
вращения А на частице №част. Каждое из выражений двойного
74
равенства (2.73) равно И<1аст. Наблюдаемую скорость превраще-
ния отнесем к единице объема твердой частицы, равной
(4/3)л^:
-3//?0Р(С0-СП) = -3//?02Дря/(1-ря)(Сп-Ся)= -3//?0А:р2Ся^н.
а b с
(2.74)
Это двойное равенство есть система двух уравнений (а = b и
b = с), из которого можно найти “не наблюдаемые” концентра-
ции Сп и Ся и затем WH:
_(3/7?о)£ряС() 75)
1 + (А:/£))/?оря(1 - ря) + (Л / Р)ря
Изменение размера ядра ря определяем из уравнения, анало-
гичного (2.58):
dN/dt — wg 4пгя. (2.76)
Количество твердого dN, превращаемого за время dt у по-
верхности ядра, равно: dN = 4лгя dr„no. Скорость превращения
компонента В твердого ядра в частице равна скорости превра-
щения А в частице: wg • 4лгя = (4/3)n/?Q. Используя эти
соотношения и безразмерный радиус ядра, преобразуем (2.74):
ФяМ = и'нДЗлор2 ). (2.77)
Подставляя (2.73) в (2.75), можно найти изменение радиуса
ядра во времени и другие показатели процесса.
Анализ процесса проведем для режимов процесса с
различными лимитирующими стадиями.
А. Внешнедиффузионный режим. Лимитирующая стадия -
перенос компонента через слой газа, окружающий частицу. По
определению лимитирующей стадии, максимальная движущая
сила в рассматриваемом режиме на этапе внешнего переноса
будет Сп << Со, или Q - Сп ~ Q. Распределение концентраций
показано на рис. 2.26 линией 1. Используя выражение а из
(2.74) для И^н, получим из (2.77)
-dpfjdt = рС0/(Яо«оРя )•
Интегрируем это уравнение:
-/ РяФя
О о
75
Рис. 2.26. Распределение концентрации С газообразного
компонента Аг в гетерогенном процессе “сжимающееся
ядро” в режимах:
1 - внешнедиффузионном: 2 - внутридиффузионном; 3 - ки-
нетическом; 4 - переходном
получим
Время полного превращения (когда ря = 0)
/к = 7?о«о/(3₽Со). (2.78)
Степень превращения твердого хв = 1 - ря. Теперь можно
получить окончательные выражения для ря, хв и из выраже-
ния а (2.74):
( Н1/3 t 3
Ря=1-у- ; *В=у-; fFH=--i-₽C0. (2.79)
к гк/ 'к л0
Соответствующие зависимости представлены линиями 1 на
рис. 2.27. Размер частицы и условия массообмена не меняются
во времени, и скорость процесса тоже постоянна. Поэтому
хв увеличивается линейно, а ря сначала меняется медленно, за-
тем, по мере уменьшения ядра, быстрее.
Б. Внутридиффузионный режим. Лимитирующая стадия -
диффузионный перенос внутри частицы, через слой инерта.
Максимальная движущая сила будет иметь место на этой ста-
дии: Q » Сп, Ся « Сп и можно принять Сп - Ся » Со. Соответ-
ствующее распределение концентрации показано на рис. 2.26
линией 2. Подставим выражение b из (2.74) в уравнение (2.77):
Фя
dt
DC
- ) Ря(1 Ря)-
*о«о
Интегрируем это уравнение:
/=A^L(l-3p2 +р3)
6£»СО
Время полного превращения
'к = ЯОЧ/(6ЯСО).
(2.80)
Получить зависимость ря(/) и хв(/) в явном виде не удается:
/Дк = 1 - 3Ря + Ря; t/t* =1-3(1 -хв)2/3 +2(1- хв). (2-81 а)
76
Рис. 2.27. Изменение во времени t размера ядра ря (о). степени превращения
твердого реагента (б), наблюдаемой скорости превращения 1¥н (в) и зависи-
мость (xg) (г) в гетерогенном процессе “сжимающееся ядро”. Режимы:
1 - внешнедиффузионный; 2- внутридиффузионный; 3 - кинетический
Наблюдаемая скорость превращения из выражения b в (2.74)‘
или ^н=-~ (-1-Хв)1/3 С0.(2.81б)
«о *о 1-(1-*в),/3
Соответствующие зависимости показаны линиями 2 на рис.
2.27. Со временем превращение сильно замедляется, поскольку
растет толщина слоя инерта, диффузия через который лимити-
рует процесс. Обратим внимание на стремление к бесконеч-
ности в самом начале процесса, когда ря -> 1 или хц -> 0. В са-
мом начале слой инерта настолько тонок, что предположение,
будто лимитирующая стадия процесса - массоперенос через
него, малообоснованно, и модель внутридиффузионного режима
[уравнения (2.81)] неприменима. Результат: -> <х> при хц ->
О - есть свойство модели, но не процесса.
В. Кинетический режим. Лимитирующая стадия - химическая
реакция, протекающая при максимально возможной концентра-
ции: CbwQ1fJ Ся. Распределение концентраций представлено лини-
ей 3 на рис. 2.26. Подставим выражение b из (2.74) в (2.77):
dpjdt =-3^Q)/(7?o«o)-
Интегрируем это уравнение:
Тс7* Ря)-
77
Время полного превращения (при ря = 0)
Ас = ^bQ/(^Q),
и окончательные выражения для ря, хв и [из выражения b в
(2.74)] будут
Ря = 1- ///к; хв = 1 - (1 - ///к)3; (2.83 а)
= (-ЗЛ//?Ь)(1 - г//к)3С0;
WH = (-3/c//fo)(l - хв)2/3С0. (2.83 б)
Соответствующие зависимости - линии 3 на рис. 2.26. Ско-
рость превращения в частице снижается со временем, поскольку
уменьшается место проведения реакции - поверхность ядра.
Скорость реакции, отнесенная к единице поверхности, не ме-
няется - реакция протекает при постоянной концентрации Со,
равномерно уменьшается размер ядра.
Влияние условий процесса на скорость пре-
вращения будет различно для описанных режимов. Просле-
дим за этим по времени полного превращения /к [уравнения
(2.78), (2.80), (2.82)] и наблюдаемой константе скорости Кн. Ее
получим из (2.75) как сомножитель перед Со и представим в
следующем виде:
= + —+ —"I . (2.84)
(Аря О Ря ₽ J
Каждое из слагаемых в скобках “отвечает” за соответствую-
щий этап процесса. Наблюдаемая константа скорости зависит от
параметров стадий процесса (k, D, р), размера частицы (/?о) и
размера ядра (ря), т. е. она меняется в процессе Последнее мо-
жет привести к тому, что по мере превращения твердой частицы
возможен переход из одного режима в другой. Например, на-
чавшись во внешнедиффузионном режиме (третье слагаемое в
скобках значительно больше остальных), процесс перейдет во
внутридиффузионный или кинетический, поскольку с уменьше-
нием ря возрастают первое и второе слагаемые, “ответственные”
за эти области протекания процесса.
Выделим режимы, в которых наиболее значительно влияние
тех или иных условий процесса.
Температура наиболее сильно влияет на величину константы
скорости к. Она входит в выражение для /к в кинетической об-
ласти (2.78), и именно в кинетическом режиме температура бу-
дет сильнее всего влиять на ицтенсивность процесса. Но влия-
ние ее ограничено: при значительном повышении температуры
первое слагаемое в (2.84) будет мало, наблюдаемая константа
78
скорости Кн не будет зависеть от Т, процесс перейдет в другой
режим.
Скорость обтекающего частицу потока влияет на коэффици-
ент массообмена р, т. е. на процесс во внешнедиффузионном
режиме [см. уравнение (2.80)]. И здесь влияние скорости потока
ограничено.
Дробление частиц (уменьшение Rq) всегда благоприятно
влияет на интенсивность процесса, но особенно сильно - во
внутридиффузионной области, в которой зависимость tK от Rq -
квадратная [уравнение (2.82)]. В этом режиме практически нет
других способов влиять на процесс, ибо D - индивидуальный
параметр образующегося инертного материала.
2.4.3. Система “газ(жидкость)-жидкость”
Взаимодействие “газ(жцдкость)-жидкость” представлено в про-
мышленности несколькими разновидностями по способу кон-
такта фаз:
барботаж (диспергированный газ в виде пузырей поднимает-
ся в слое жидкости);
орошение (диспергированная в виде капель жидкость проле-
тает через газ);
пленочное течение (жидкость пленкой стекает по поверх-
ности, поток газа проходит вдоль нее);
контакт в насадочной колонне (близок к пленочному тече-
нию: жидкость стекает по насадке в виде нерегулярной, возму-
щенной пленки, газ проходит в свободном пространстве);
газожидкостной поток (возмущенные потоки газа и жидкости
движутся в одном направлении).
Схема процесса взаимодействия газа с жидкостью при
всех способах их контакта может быть представлена следующим
образом (рис. 2.28): соприкасаются потоки газа и жидкости:
имеется граница раздела фаз; компоненты переносятся через
поверхность раздела фаз; реакция протекает в одной из фаз или
в обеих. В пределах выделенного элемента концентрации ком-
понентов в каждой из фаз одинаковы. В качестве такого эле-
мента можно выделить: газовый пузырь с некоторым объемом
жидкости вокруг него; каплю в газовом объеме или элементар-
ный участок пленочного газожидкостного потока.
Рассматриваем такой вариант процесса. Исходные компонен-
ты содержатся в газе - А и в жидкости - В. Их содержание
определено условиями процесса: парциальное давление А в
газе - /д и концентрация В в жидкости - Св- Реакция протекает
в жидкой фазе. Продукты реакции остаются в жидкости или
могут перейти в газ:
Ар + Вж *" (Sr)-
79
Газ Жидкость
Рис. 2.28. Схема гетерогенного процесса “газ -
жидкость”. Пояснение в тексте
Скорость реакции описывается кине-
тическим уравнением
г = ЛСАСВ, (2.85)
где СА - концентрация А в жидкой фазе.
Структура процесса. Обе фазы
текучие, поэтому у границы раздела фаз
можно выделить диффузионные погра-
ничные слои. Этапы (стадии) процесса
следующие:
1) перенос компонента А из объема га-
за через газовый пограничный слой к
поверхности раздела фаз (этап I);
2) перенос А через поверхность разде-
ла из газа в жидкость (этап II);
3) перенос А от поверхности раздела через жидкостной по-
граничный слой в объем жидкости (этап III);
4) реакция между А и В в жидкости (этап IV).
Конечно, реакция может протекать и в жидкостном погра-
ничном слое, но поскольку его объем и потому вклад в общее
превращение малы, реакция сосредоточена в объеме жидкости.
Продукты реакции не влияют на скорость процесса и параметры
массопереноса, и этапы их переноса можно не учитывать.
Возможное распределение концентраций А представлено на
рис. 2.28.
Математическая модель указанной последователь-
ности этапов основана на равенстве потоков Wzi, Иц и на
стадиях переноса и скорости превращения компонента А:
= JrIv. (2.86)
Перенос через газовый пограничный слой можно записать как
IFj = -₽г5(р; - РА), (2.87)
где рг - коэффициент массообмена между газом и поверхностью раздела фаз;
Рд - парциальное давление А у поверхности раздела фаз; 5 - величина по-
верхности раздела фаз.
Перенос через поверхность раздела фаз осуществляется на
расстоянии размера молекул, и можно утверждать, что припо-
верхностные парциальное давление в газе РА и концентрация в
жидкости СА (см. рис. 2.28) находятся в равновесии:
где Ка - константа абсорбции.
80
С А -^а^А >
(2.88)
Перенос А через жидкостной пограничный слой:
^п=-Рж^(СА-СХ), (2.89)
где рж - коэффициент массообмена между поверхностью раздела фаз и объемом
жидкости.
Реакция протекает в жидкости, и скорость превращения А в
ее объеме гж равна:
FPiv =-ЛСАСвгж. (2.90)
Подставляем (2.87), (2.89) и (2.90) в (2.86):
-М(П - Ра) = -Рж^(СА-а) =-ЛСдСвЬк. (2.91)
а b с
Поток через границу раздела фаз заменяется условием фазо-
вого равновесия (2.88). Три уравнения: одно - (2.88) и два - из
(2.91) (а = b и b = с) - позволяют определить три неизвестных -
установившиеся концентрации Pq , Сд и Сд. Из уравнения а =
= b в (2.91) с учетом соотношения (2.88) получим
С'а = (РжСд + ргРд)/(Рж + Рг/*а)- (2.92)
Подставив (2.92) в уравнение b = с из (2.91), получим
СА =-----------Кг.РА-----------. (2.93)
А 1 + (Л/5уд)На/рг + 1/рж)Св
Здесь использована удельная поверхность раздела фаз 5уд =
=5уд = 5/гж, обычно используемая для характеристики разви-
тости площади контакта жидкости и газа.
Если перенос из одной среды в другую проходит через
несколько последовательных этапов, то его интенсивность опре-
деляют общим коэффициентом массопереноса между газом и
жидкостью р:
1/Р = Ад/р,- + 1/рж. (2.94)
В подвижной системе, состоящей из текучих сред, граница
раздела фаз также подвижна. Условия массообмена между фаза-
ми, определяемые коэффициентом р и поверхностью контакта
5уд, усредняют по объему, например, жидкости, используя ко-
эффициент массопереноса ро, отнесенный к единице объема
жидкости:
Ро ~ Р^уд- (2-95)
Можно проверить, что размерность ро совпадает с отноше-
нием размерностей концентрации и времени, например
[моль/(м3 • с)].
81
Такой “объемный” коэффициент массопереноса удобен для
расчета процесса - его размерность совпадает с размерностью
константы скорости первого порядка. Кроме того, в экспери-
ментальных исследованиях измеряют поток вещества между
фазами задаваемого состава, откуда и получают именно объем-
ный коэффициент массопереноса ро. Используя (2.94) и (2.95),
представим концентрацию компонента А в жидкой фазе (2.93) в
виде
1 + (Л/₽о)Св’
(2.96)
Наблюдаемую скорость превращения получим, подставив
найденное выражение для Сд (2.96) в кинетическое уравнение
(2.85):
кКаРАСв
1+(к/$о)Съ
(2.97)
Анализ процесса “газ-жидкость”. Первое, что
бросается в глаза, - иной вид выражения для WH по сравнению
с кинетическим уравнением. Если скорость реакции - первого
порядка по компонентам А и В, то наблюдаемая скорость опи-
сывается уравнением, характерным для реакций с торможением
скорости одним из компонентов. В данном случае с увеличени-
ем концентрации В реакция переходит в область независимости
ее скорости от содержания В - нулевой порядок по этому ком-
поненту, как следует из уравнения (2.97) и показано на рис.
2.29. Причина “торможения” скорости реакции связана с не-
хваткой в жидкости компонента А. С увеличением концентра-
ции В поступающий в жидкость компонент А расходуется все
интенсивнее, и его концентрация уменьшается. Дальнейшее
увеличение Св приводит к тому, что все количество реагента А,
которое переносится в жидкость, тут же вступает в реакцию, его
не хватает, и скорость реакции перестает зависеть от Св-
Режимы процесса. В кинетическом режиме макси-
мальная движущая сила у реакции. В данном случае это воз-
можно, если жидкость будет насыщена компонентом А, т. е. при
условии Сд = КаРА. Это выполнимо при А/роСв « 1 [см. (2.96)[,
и тогда
WH =-кКаРАСъ, (2.98)
т. е. скорость превращения зависит от кинетической констан-
ты к.
В диффузионном режиме лимитирующий этап - перенос ве-
щества из газа в жидкость. В этом случае Сд близко нулю, что
82
Рис. 2.29. Зависимость наблюдаемой скорости
превращения от концентрации реагента В в
жидкости Св в гетерогенном процессе “газ -
жидкость”
ВОЗМОЖНО при ЛСв/Ро» 1 и /
= «Pa, (2.99) /
которая равна скорости переноса ком- V---------------►Q
понента А в чистую, не содержащую А
жидкость, и зависит от коэффициента массопереноса ро
Интенсификация процесса. В кинетической облас-
ти основное влияние оказывает температура - от нее зависит
константа скорости реакции к [см. (2.98)], в диффузионном ре-
жиме - скорости потоков и их турбулизация, от которых зависит
коэффициент массопередачи ро [см. (2.99)].
На ро влияет удельная поверхность контакта фаз. Поэтому
диспергирование потоков (уменьшение размера пузырей или
капель) всегда благоприятно. Но здесь есть ограничения. В бар-
ботаже движение пузырей, их всплытие в слое жидкости опре-
деляются гравитацией, явлением неуправляемым. При подъеме
мелкие пузыри сливаются, крупные - дробятся. Реально можно
достигнуть значения объемного коэффициента ро=0,24-0,3 с”1.
Увеличить поверхность контакта фаз возможно путем принуди-
тельного создания развитой поверхности с помощью насадки.
Но и этот прием также ограничен. В слое мелкой насадки с
развитой поверхностью пространство для потоков газа и жид-
кости ограничено. Можно достигнуть значения объемного ко-
эффициента массопередачи 0,5 - 0,6 с'1.
Есть еще способ управления интенсивностью газожид-
костного процесса в любом режиме - изменением растворимос-
ти газа в жидкости: с увеличением константы абсорбции Ка [см.
(2.88)] наблюдаемая скорость превращения будет возрастать [см.
(2.97)].
2.5. КАТАЛИТИЧЕСКИЙ ХИМИЧЕСКИЙ ПРОЦЕСС
2.5.1. Катализ и катализаторы
Ряд химических превращений требует инициирования, чтобы
превращения могли протекать с заметной скоростью. Таким
инициатором могут быть химические вещества - катализаторы.
Химические процессы с их участием называются каталитиче-
скими.
Катализ - явление возбуждения химических реакций специ-
альными веществами - катализаторами. Катализатор много-
83
Реакционный путь
Рис. 2.30. Изменение энергии системы Е по
мере протекания реакции (по реакционному
пути) при непосредственном химическом вза-
имодействии (Г) и с участием катализатора (2):
А - активный комплекс; К - промежуточное со
единение с катализатором; Eq, Ек - энергии исходных
веществ и продуктов; Е[, Ег - энергии активации
превращения в прямом и обратном направлениях; Д//
- изменение энергии в результате превращения
(тепловой эффект)
кратно вступает в промежуточное химическое взаимодействие с
веществами, участвующими в реакции, и восстанавливает свой
состав после каждого цикла промежуточных взаимодействий.
Суть каталитического действия заключается в следующем.
Химическое превращение протекает через образование активно-
го комплекса, обладающего избыточной энергией. Ее достаточ-
но для перестройки участвующих в превращении компонентов и
образования новых химических связей, т. е. новых веществ -
продуктов реакции. Изменение энергии системы при хими-
ческом взаимодействии (по реакционному пути) показано кри-
вой 1 на рис. 2.30.
Но не все молекулы обладают достаточной энергией для об-
разования активного комплекса - только те, энергия которых
превышает энергию активации Е\ (см. рис. 2.30). Если необхо-
димая энергия Е\ велика, то реакция практически не протекает.
Катализатор открывает новый реакционный путь благодаря
тому, что вступает в химическое взаимодействие с образованием
активного комплекса с меньшей энергией, чем требуется для
образования активного комплекса без катализатора. Промежу-
точное соединение, в которое входит катализатор, превращается
далее в продукты через другой активный комплекс, но тоже с
меньшей энергией. После второго этапа (стадии) реакции ката-
лизатор восстанавливает свой химический состав и его компо-
ненты не входят в состав продуктов. И хотя реакционный путь
удлиняется, становится стадийным, уменьшение энергии ак-
тивных комплексов приводит к увеличению скорости реакции.
Изменение энергии системы в каталитической реакции показа-
но кривой 2 на рис. 2.30.
Начальное и конечное состояния реагирующей системы, в
том числе и свободная энергия Гиббса, одинаковы в режимах
как с катализатором, так и без него - катализатор в результате
акта химического превращения восстанавливается, не изменяет-
ся. Поэтому катализатор не изменяет равновесие системы, хотя
и изменяет скорость превращения.
84
Промежуточное соединение реагентов с катализатором может
превращаться далее в различных термодинамически возможных
направлениях. Тем самым катализатор открывает новые пути
для превращений, т. е. проявляет селективное воздействие. Ка-
тализ является не только методом ускорения реакций, но и мето-
дом управления ими для направленного осуществления тех или
иных превращений, в том числе с получением веществ, которых
нет в природе. Пример тому - получение многих высокомолеку-
лярных соединений, полимерных материалов. Химическое
окисление, например, нафталина (горение) приводит к полной
деструкции молекулы с образованием СО2 и Н2О. В при-
сутствии катализатора происходит неполное (парциальное)
окисление нафталина с образованием фталевого ангидрида.
Катализаторами могут быть элементарные вещества (метал-
лы, активированный уголь), химические соединения (оксиды,
сульфиды, хлориды), сложные комплексы и многоатомные мо-
лекулы, их смеси. Специфичность катализатора зависит как от
его состава и строения, так и от вида химической реакции.
Катализ играет исключительную роль в осуществлении хими-
ческих превращений в природе и в промышленности. Сейчас в
производстве более 30% продукции всей промышленности при-
меняют катализаторы. Абсолютное большинство важнейших
химических продуктов (более 70%) получают с использованием
катализаторов на той или иной технологической стадии.
Каталитические реакции можно классифицировать по раз-
ным признакам. Наиболее простая классификация основана на
фазовых признаках и включает гомогенные, гетерогенные и
микрогетерогенные каталитические реакции.
В гомогенной каталитической реакции (или гомогенном ка-
тализе) реагирующие вещества и катализатор образуют одну
фазу (например, жидкую или газовую).
В гетерогенном катализе реагирующие вещества и катализа-
тор находятся в разных фазах (например, катализатор - твердый,
а реагирующие вещества - в газовой фазе).
Микрогетерогенный катализ занимает промежуточное место
между гомогенным и гетерогенным. В нем катализатор - боль-
шие полимерные молекулы. Для взаимодействующих на них
небольших молекул они подобны гетерогенным частицам, но
образуют с реагентами одну физическую фазу. В эту группу
входят ферментативные реакции, в которых катализатор
(фермент) - крупные белковые молекулы сложного состава и
строения. Потому микрогетерогенный катализ называют также
ферментативным.
Гомогенный и микрогетерогенный катализ - однофазные
процессы, и к ним применимы рассмотренные выше законо-
85
Рис. 2.31. Схема и структура гетерогенно-
каталитического химического процесса:
К - катализатор; П - поры катализатора; Пс - пограничный
слой: I, II, III - этапы процесса
мерности гомогенных и газожидкостных хи-
_________ мических процессов. Необходимо только
^Пс/ учитывать в кинетическом уравнении кон-
центрацию катализатора. В дальнейшем бу-
дем рассматривать гетерогенно-каталитический процесс.
Место протекания такой реакции - поверхность твердого ка-
тализатора. Чтобы увеличить ее, используют пористые катализа-
торы. Поверхность в них (внутренняя) - десятки и сотни квад-
ратных метров в одном кубическом сантиметре. Наружная по-
верхность тела такого объема менее 10 3 м2, т. е. внутренняя по-
верхность в 103 - 105 раз больше наружной, и вклад последней в
общую скорость превращения можно не учитывать.
Схема процесса представлена на рис. 2.31. Реагенты
диффундируют сначала из газового объема через пограничный
слой к наружной поверхности частицы-катализатора (этап I на
рис. 2.31), затем - по порам внутри нее (этап II). При движении
по порам одновременно протекает реакция на поверхности пор
(этап III). Продукты удаляются обратным путем.
2.5.2. Пористое зерно катализатора
Катализаторы готовят осаждением или соосаждением компонен-
тов из растворов, их смешиванием. Полученную массу сушат,
прокаливают. В результате образуется структура из слипшихся,
спекшихся мелких частиц. Пространство между ними - поры,
по которым диффундируют реагенты. Это - осажденные или
смесные катализаторы. Таким же образом готовят инертный
пористый материал - носитель. На него наносят активные ком-
поненты, например пропиткой из раствора, из которого на
внутреннюю поверхность носителя осаждаются каталитически
активные компоненты (нанесенные катализаторы). Другие ме-
тоды приготовления также приводят к образованию сети капил-
ляров сложной формы. Заметим, что такие же методы исполь-
зуют в приготовлении твердых сорбентов - адсорбентов. Полу-
ченный пористый материал формуют в виде элементов цилин-
дрической, кольцеобразной или иной формы, в том числе гео-
метрически неправильной. Размер элементов, или, как их назы-
вают, зерен промышленного катализатора, составляет несколько
миллиметров (3-6 мм - наиболее распространенный). Таким
образом, катализатор представляет собой пористые зерна с раз-
витой внутренней поверхностью.
86
Пористую структуру характеризуют следующими параметра-
ми, которые можно измерить известными методами:
5уд [м2/г] или [м2/см3] - удельная внутренняя поверхность;
величина 5уД - от единиц до сотен квадратных метров в одном
кубическом сантиметре частицы катализатора; на внутренней
поверхности протекает реакция;
е - порозность - свободный объем, поры (в долях от общего
объема зерна катализатора), в котором происходит транспорт
реагентов; обычно значение с составляет 0,1-0,5;
гп - средний радиус пор; его значения лежат в интервале
Ю-6-10-9 м.
Число частиц или отдельных образований в зерне катализа-
тора, которые образуют его пористую структуру, - 106-109, и
возможен статистический подход к построению модели процес-
са в нем. Пористое зерно катализатора рассматривают как одно-
родную сплошную среду. Перенос компонентов в нем представ-
лен как диффузия с эффективным коэффициентом ЛЭф. Реак-
ция протекает во всем объеме. Скорость превращения в такой
однородной среде w. Действительная скорость превращения на
поверхности пор иуд (отнесена к единице поверхности) связана
с w соотношением
w— мудЛ^д. (2.100)
Эффективный коэффициент диффузии £)Эф характеризует пе-
ренос через всю среду. В действительности диффузия протекает
только в свободном объеме зерна в порах среднего радиуса гп.
Коэффициент диффузии в порах такого размера как в капилля-
ре - £>г. Перенос в порах осложнен рядом факторов - извилис-
тостью пор, пересечением и разветвлением их, переменным их
сечением. Можно связать /)эф и Dr через эмпирический коэф-
фициент проницаемости П:
£>эф = ПД (2.101)
Обработка данных измерения Оэф сотни самых разных порис-
тых катализаторов, носителей для них и адсорбентов показала,
что в абсолютном большинстве случаев значения коэффициента
проницаемости лежат в сравнительно узком интервале: П =
= 0,U0,2.
В очень тонких капиллярах, размер которых меньше длины
свободного пробега молекул X (при атмосферном давлении -
меньше 10"8 м), молекулы сталкиваются в основном со стенка-
ми, а не друг с другом. Перенос вещества в них определяется
диффузией Кнудсена. Коэффициент кнудсеновской диффузии
87
DK вычисляется по формуле
DK = 9700гпJT/M , (2.102)
где М - молекулярная масса компонента; коэффициент 9700 получен из физи-
ческих констант, входящих в оригинальную формулу Кнудсена, при размерно-
стях £>к [см2/с], гп [м], Г [К].
В порах размера много больше X диффузия молекулярная
(коэффициент диффузии D). Если размер пор сопоставим с ве-
личиной Л, то диффузия - переходная между кнудсеновской и
молекулярной, и коэффициент диффузии в капилляре опреде-
ляется из формулы
1/Д. = I/Ас + 1/Z). (2.103)
Указанное выше значение П и формулы (2.102) и (2.103) по-
зволяют довольно точно оценить значение 7)эф, если нет прямых
измерений.
Математическая модель. Обоснование представления
сложной пористой структуры катализатора в виде сплошной
(квазигомогенной) среды позволяет перейти к построению ма-
тематической модели процесса в пористом зерне катализатора.
Рассматриваем процесс при интенсивном внешнем переносе,
когда последним можно пренебречь. Основные особенности
процесса проследим сначала на зерне катализатора простой
фюрмы - в виде пластинки толщиной 2/?о, омываемой с двух
противоположных сторон потоком с концентрацией реагента Q
(рис. 2.32). Торцевые стороны пластинки “запечатаны”, так что
реагент проникает внутрь катализатора только через боковые
грани площадью 61 каждая. Процесс протекает симметрично
относительно плоскости, проходящей в середине между омы-
ваемыми гранями (плоскость симметрии показана штрих-
пунктиром на рис. 2.32). Реагенты диффундируют внутрь по-
ристой пластинки и в ней реагируют. Концентрация их умень-
шается к центру, как показано в нижней части рис. 2.32. Учиты-
вая симметричность процесса, его математическую модель стро-
им только для одной половины плоского зерна.
На расстоянии г от плоскости симметрии выделим плоский
слой толщиной dr. Диффузионный поток вещества А, проходя-
щий сечение, параллельное плоскости симметрии, равен
-D^SdC/dr. Изменение этого потока, проходящего через выде-
ленный слой, обусловлено появлением (исчезновением) в этом
слое вещества А в результате протекания реакции. Скорость
образования А равна w(C)Sdr (здесь Sdr - объем катализатора в
выделенном плоском слое). В стационарном режиме
d[-Z)^5(JC/dr)] = w(C)Sdr.
88
Рис. 2.32. Плоское зерно катализатора Пояснение в
тексте
Преобразуем это уравнение:
+ =°>
dr \ dr 7
или
d2C
= 0. (2.104)
dr
Уравнение (2.104) - дифференциальное
второго порядка. При его интегрировании
появятся две неопределенные константы ин-
тегрирования. Чтобы решение было одно-
значным, необходимо иметь еще два уравне-
ния для определения констант интегрирования. Ими являются
дополнительные условия на границах рассматриваемой области
- половины пластинки (граничные условия). Дифференциаль-
ные уравнения с необходимым числом граничных условий на-
зывают замкнутой системой уравнений.
Одно условие очевидно: на наружной поверхности пластин-
ки-катализатора концентрация реагента равна Q:
приг=7?о С = Q. (2.104а)
Запишем другое условие в начале координат:
при г — 0 dC/dr =Q (2.1046)
и обсудим его. Поток через плоскость симметрии равен
-D3fyS(dC/dr)r = о- Положим, что градиент концентраций не ра-
вен нулю - например, dC/dr > 0, как показано на рис. 2.32
пунктиром. Это означает, что к плоскости симметрии справа
подходит некоторый поток. Из условия симметрии следует, что
и слева к плоскости симметрии подходит такой же поток
(показано на рисунке стрелками). И ни одного потока не выхо-
дит, что невозможно. Аналогично, при dC/dr < 0 получим, что
из плоскости симметрии будут выходить слева и справа два по-
тока и не будет входящих. Физически оправданным услови-
ем явится отсутствие потока через плоскость симметрии:
-D^SdC/dr = 0. Из этого и следует граничное условие (2.1046)
как условие симметрии.
Качественный анализ модели процесса в пористом
зерне катализатора проведем для реакции первого порядка:
м'(С) = -кС. Введем безразмерный радиус р = г/Rq (г = p/fo) и
относительную концентрацию у = C/Cq (С = уСо). Уравнение
89
(2.104) и условия (2.104а) и (2.1046) преобразуем к виду
d^y/dp1 = <р2у; (2.105)
Ф/Ф1о = У '(0) = 0; у (1) = 1. (2.105а)
В уравнении (2.105) условия процесса сгруппированы в без-
размерный параметр:
ф = ло7^ф- (2-106)
Решение такой задачи впервые было выполнено российским
ученым Я.Б.Зельдовичем и американским ученым Е.Тиле, и
потому параметр <р называют модулем Зельдовича-Тиле.
Уравнение (2.105) - линейное дифференциальное уравнение
с постоянными коэффициентами типа
ay" + by' + су = 0,
где у" и у’ - вторая и первая производные у по р.
Общее его решение
у = ЛеР1Р + ВеР2Р,
где А, В - константы интегрирования; щ, pj - корни характеристического урав-
нения
оц2 + + с = 0.
Для уравнения (2.105) щ, i = ±<р, и общее решение будет
иметь вид
у = Ле’”’ + Ве^.
Определим Л и Виз граничных условий (2.105а). Первое из
них
у '(0) = Л<рефр - /?фе-фр|р = о ~ Лф - Дф = 0,
откуда А = В. Второе условие из (2.105а) с учетом полученного
А = В
у (1) = Лефр - = 1 = Леф - Be* = 1,
откуда А = 1/(еф - е*). Решение всей задачи (2.105) - (2.105а) -
распределение концентрации по глубине зерна:
у = (ефр - е-ф₽)/(еф - e~v). (2.1 Оба)
Зависимость у (р) будет иметь вид, показанный в нижней
части рис. 2.32 сплошной линией в виде распределения кон-
центрации С(г). Наблюдаемая скорость превращения есть сред-
неинтегральная по пластинке:
R R
= тМ w|C(r)]5f/r = - J- f kC{r)dr.
^0*5 0 л0 0
90
Переходя к безразмерным переменным у и р и используя
(2.106а), получим
WH = -kC0]y(p)dp = --^-}(e^-e-^)dp =
0 ev + е 410
kCQ
<Р е<₽+е-‘₽
(2.107)
Используем далее гиперболические функции - синус, коси-
нус, тангенс гиперболические соответственно:
sh<p = (е9 - е’ф)/2; ch<p = (е<₽ + е'ф)/2;
th<p = sh<p/ch(p. (2.108)
Операции с ними (дифференцирование, интегрирование) по-
добны операциям с соответствующими тригонометрическими
функциями. Выражение (2 107) приводится к виду
И'н = --У—-
*0
lkD^
th<p • Со.
(2.109)
Наблюдаемая скорость превращения сохраняет первый поря-
док по концентрации, и часть выражения перед Q назовем на-
блюдаемой константой скорости:
(2.110)
Концентрация компонента уменьшается вглубь зерна катали-
затора, и потому меньше, чем скорость при “наблюдаемой”
концентрации Cq. Степень ее уменьшения также является ха-
рактеристикой процесса.
Отношение наблюдаемой скорости превращения WH в зерне
катализатора к скорости при условиях на поверхности w(Cq)
называется степенью использования внутренней поверхности ц:
w(C0)
jkD^ th<p Co _ th<p
/?о -kC0 <p
(2.111)
Эта величина показывает эффект влияния процессов перено-
са в пористом зерне на скорость превращения в нем и зависит
только от параметра ф. График т](ф) приведен на рис. 2.33.
Анализ процесса в пористом зерне катали-
затора. Режимы процесса. Из (2.110) с учетом выраже-
ний (2.108) можно получить при ф -> 0 т] -> 1 Действительно,
91
Рис. 2.33. Зависимость степени использования внутренней поверхности катали-
затора г] от параметра <р. Пунктиры - примерные границы режимов:
I - кинетического; II - переходного; III - внутридиффузионного
Рис. 2.34. Распределение относительной концентрации у по толщине зерна
катализатора р в кинетическом (I), переходном (II) и внутридиффузионном
(III) режимах
малое <р возможно, если пластинка очень тонкая (мало Rq).
Реагенты легко достигают ее середины, концентрация реагентов
мало меняется по глубине зерна, и реакция внутри него проте-
кает при концентрации, близкой к поверхностной. Это же сле-
дует из (2.106): для р = 0 и при ф -> 0 получим у(0) ~ 1, т. е.
концентрация в центре почти такая же, как на поверхности.
Линия I на рис. 2.34 показывает такое распределение концент-
раций. В таком случае близка к w(Cq) и ц ® 1. Кроме того,
условие у(0) = 1 указывает на максимальную движущую силу
реакции, и по определению: лимитирующая стадия - реакция,
режим - кинетический. Если считать, что ц отличается от еди-
ницы не более чем на 10% (обычная точность кинетических
измерений), то кинетический режим будет при ф < 0,5. Это есть
граница кинетического режима, она показана на рис. 2.33.
Если ф велико (толстая пластинка), то реагентам трудно до-
стигать середины пластинки. Из (2.106) получим, что при боль-
ших ф в центре зерна у(0) ® 0. Распределению концентраций
отвечает линия III на рис. 2.34. С увеличением ф ц -> 1 и
ц = 1/ф. (2.112)
У процесса переноса - максимальная движущая сила, и по
определению: лимитирующая стадия - диффузия, режим - внут-
ридиффузионный. С практически достаточной точностью мож-
но принять, что внутридиффузионный режим будет при ф > 3,
что отмечено на рис. 2.33.
Между кинетическим и внутридиффузионным располагается
область переходных режимов.
Форма зерна. Рассмотрим форму зерна катализатора, бо-
лее близкую к реальной, - шар. Эта форма имеет центральную
92
симметрию. Построение модели делаем как для плоского зерна.
Диффузионный поток через сферическую поверхность равен
-Дэ* • A-ni^dC/dr. Скорость превращения в сферическом слое
w(C) 4л/2dr. В стационарном режиме
Л(-Яэф • ^nfidC/dr) = w(C) -4nr2dr.
Приведем это уравнение к обычно используемым двум фор-
мам записи:
^эф d
r2 dr
,ldC
dr.
+ w(C) = О,
(2.113)
или
„ f d2C 2 dC}
4 dr2 r dr)
+ w(Q = 0.
(2.113a)
Граничные условия, подобные (2.104a) и (2.1046), заданы на
поверхности частицы-шара радиусом До и в центре его.
Решение получим для процесса с реакцией первого порядка.
Используем безразмерные р = г/Rq и у = C/Q. Из (2.113а) и
граничных условий (2.104а) и (2.1046) получим
d2y 2 dy 2
—т + л = ф у’
dp2 Р dp
(2-114)
У(0) = 0; у(1)= 1. (2.114а)
Как и в модели процесса на плоском зерне параметр ср =
— ^Од/^/^эф •
Введем переменную z = УР и подставим у = z/p в уравнение
(2.114):
d2z/dp2 = <p2z.
Решение такого уравнения было получено выше:
z = Ае^ + Ве'^, или у = (Лефр + Ве^/р2.
Используя граничные условия (2.114а), получим окончатель-
ное решение для изменения концентрации по глубине зерна:
1 _ е- w 1 sh соо
у=------------= 121<₽Р (2.Ц5)
Ре9- е-9 р sh ср
Наблюдаемую скорость превращения можно определить
иным способом. Компонент, проникающий внутрь зерна в ста-
ционарном режиме, полностью реагирует. Поэтому диффузион-
93
ный поток компонента от наружной поверхности J = -Дэф х
х 4n/^(JC/Jp)r=равен скорости превращения этого компо-
нента во всем зерне. Отнеся ее к единице объема зерна v3 =
= (4/3)tt/?q, получим наблюдаемую скорость превращения:
w j 4л/^Дэф Г JC3
Н v3 (4/3)л/^ VjrJr=Xo
3 Д.„>.Сл
=-----^-(dy/dp)p=x.
ко
Из (2.115) получим
dy _ 1 ch <рр 1 вЬфр
dp р shp р2 кЬф
и далее
(cth <р - 1/ф).
Ф
Степень использования внутренней поверхности
„ И/н
м^Со) -кС0
— сгЬф-----
ф V ф>
(2.116)
График этой зависимости приведен на рис. 2.35, и здесь же
для сравнения приведена зависимость ц(ф) для пластинки
(обозначено: для шара - г>ш, для пластинки - Г]ги). Их различие
показывает существенное влияние формы зерна ц. Попробуем
совместить обе зависимости. Введем приведенный размер зерна
ЛПр ~ Уз/*5з - отношение его объема v3 к наружной поверхности 53:
для пластинки Rnp = 2RqS/2S = Ro (5 - боковая поверхность);
4 JtR0 Rq
для шара Rnp = --
3 4тг/?£ 3
Введем модифицированный параметр:
ф"=Ж <2ш)
(для пластинки фт = ф, для шара <рт = ф/3) и преобразуем
(2.115):
Пш = — fcth39m - (2.118)
Фт < Зфт;
94
Рис. 2.35. Зависимость степени использо-
вания внутренней поверхности и катали-
затора в виде пластинки (ппл) и шара (пш)
от параметра ф и приведенного параметра
Фпр- ПуНКТИр — Т]ш(фпр)
АСИМПТОТЫ ДЛЯ Ппл(фт) и
Пш(фт) при ф„, -> 0 и фга -> оо сов-
падают и равны соответственно 1
и 1/фт. Для шара г)ш(фт) показано
на рис. 2.35 пунктиром. Максимальное различие между г)ш и Ппл
в переходной области немногим более 10%. Проведенные расче-
ты т](фт) для многих других форм зерен катализатора показали,
что параметр <рт в виде (2.117) универсален, и его можно ис-
пользовать для расчета г] по формуле (2.111) или (2.118) с доста-
точной для практических целей точностью для зерен катализа-
тора любой формы.
Влияние температуры на наблюдаемую ско-
рость превращения определим из (2.109). От температуры
зависит константа скорости реакции к = к^ехр(-Е/RT). По срав-
нению с ней можно принять, что 7),ф от температуры не зави-
сит. Во внутридиффузионной области (большое ф, 1йф ~ 1)
Часть выражения перед Q - наблюдаемая константа скорости
Кн. Она сохраняет экспоненциальную, аррениусовскую зависи-
мость Кн от температуры, но с энергией активации Е/2, вдвое
меньшей, чем у константы скорости реакции к. Общий вид за-
висимости Кц(Т)представлен на рис. 2.36, а. В области низких
температур к и, следовательно, ф малы, процесс протекает в
кинетической области и КИ совпадает с к (правая часть графи-
ка). При высоких температурах в диффузионном режиме темпе-
Рис. 2.36. Зависимость константы скорости реакции к (пунктир) и наблюдаемой
скорости превращения Кн в пористом зерне катализатора от температуры Т (а)
и размера зерна катализатора До (б). Пунктиры разделяют области режимов:
I - кинетический; II - переходный; III - внутридиффузионный
95
ратурная зависимость КН(Т) также экспоненциальная, но с вдвое
уменьшенной энергией активации и не совпадающая с темпера-
турной зависимостью коэффициента диффузии. Температурные
области режимов выделены на рисунке.
Как видим, режим диффузионный, но свойства процесса
(температурная зависимость) не отвечают свойству лимитирую-
щей стадии (ДЭф слабо зависит от температуры). Это подтверж-
дает ранее высказанное замечание о том, что понимание лими-
тирующей стадии как определяющей имеет ограниченный ха-
рактер.
Размер зерна. В кинетической области (малый размер
зерна Rq) JVh, естественно, не зависит от Rq. Во внутридиффузи-
онной области (большое Ro), как следует из (2.109),
= -^JkD^C0,
т. е. обратно пропорциональна Rq. Зависимость И^(1//?о)
представлена на рис. 2.36, б. Здесь также выделены режимы
процесса.
2.5.3. Непористое зерно катализатора
Не все катализаторы имеют пористую структуру. Если реакция
быстрая, то развивать внутреннюю поверхность не имеет смыс-
ла. Например, окисление аммиака протекает на платиновом
катализаторе в виде проволоки, сплетенной в сетку. Для полно-
го окисления достаточно нескольких слоев сетки. На непо-
ристом катализаторе реакция протекает на внешней поверх-
ности, где взаимодействуют компоненты из обтекающего его
газового потока. Реагенты должны проникнуть через погранич-
ный слой к поверхности твердого тела - катализатора. Схема
процесса такая же, как в системе “газ - твердое” (см. разд. 2.4.2,
модель “сжимающаяся сфера”), за одним исключением: твердое
тело не превращается в продукт реакции, не изменяется в про-
цессе, исключается этап III. Достаточно воспользоваться описа-
нием превращения компонента только газовой фазы в гетеро-
генном процессе “газ - твердое”.
Математическая модель процесса:
₽(СП - СЬ) = HQ). (2.119)
Концентрация у поверхности зерна для реакции первого по-
рядка:
Сп = с0/(1 + л/р).
Наблюдаемая скорость превращения:
1FH = кСо/{\ + Л/р).
96
Влияние условий процесса (концентрации, температуры,
скорости потока), режимы и лимитирующие стадии - такие же,
как для процесса “сжимающаяся сфера” (см. рис. 2.24).
Хотя был рассмотрен процесс на непористом зерне катализа-
тора, его описание можно применить и в случае пористого зер-
на, если в (2.119) использовать наблюдаемую скорость превра-
щения.
2.5.4. Тепловые явления
Число стационарных режимов и их устойчивость
Химические реакции сопровождаются выделением или погло-
щением теплоты, что может привести к возникновению темпе-
ратурных градиентов, влияющих в свою очередь на скорость
превращения.
Пористое зерно катализатора. Перенос и превращение ве-
щества описываются уравнением (2.104):
d2C
Т^ф^Ц- +w(C,T) = 0 (2.120)
dr*
(здесь учтена зависимость скорости реакции от концентрации С
и температуры 7).
Граничные условия:
приг=0 dC/dr = 0; при г = Rq С= Q. (2.120а)
Тепловыделение вызовет температурный градиент в зерне.
Перенос теплоты по зерну определяется его коэффициентом
теплопроводности Х3. Описание тепловых явлений в зерне ана-
логично (2.120): изменение теплового потока 'k3dT/dr связано с
тепловыделением реакции Qpr (С, Т):
d2T
>3^- + Орг(С, 7) = 0. (2.121)
dr
Граничные условия также аналогичны (2.120а):
приг=0 dT/dr=fy приг=7?о Т= То. (2.121а)
Для единственной реакции w(Q = -г(С, Т). Приведем
(2.120) и (2.121) к следующему виду:
Аф^|=г(С,Т); _Ь_^1 = Г(С,П.
dr Qp dr*
Правые части этих уравнений равны, поэтому
d2T брАф d2C
dr2 Х3 dr2
97
После первого интегрирования, используя граничные усло-
вия (2.120а) и (2.121а) при г = 0, получим
dT брДэф dC
dr Х3 dr
Второе интегрирование в пределах от условий при г = Ro до
текущих значений Си Тдает
Т — То — Ср7)Эф/х3(Со ~ О-
Перейдем к степени превращения х = (Со - С)/Со и введем
теплоемкость реагирующей смеси ср:
QnCo
Т- То = р р х. (2.122)
Ср Х3
Параметр QpCo/cp показывает следующее. Если Qp - количе-
ство теплоты, выделяющееся при превращении моля вещества,
то Ср Со - количество теплоты, выделившееся при полном пре-
вращении этого вещества, содержащегося в единице объема
реакционной смеси. Для нагрева на ЛТ единицы количества
вещества потребуется теплоты СркТ. Если на нагрев смеси пой-
дет вся теплота реакции (срд7’ = СрСо), то смесь разогреется на
&Т = СрСц/Ср.
Адиабатический разогрев ЬТ^ = QpCq/cp показывает, на
сколько градусов нагреется реакционная смесь, если реакция
пройдет до конца адиабатически.
Величина Л 7^ - важная характеристика химического процес-
са, она будет неоднократно встречаться при его анализе. Харак-
терная величина А 7^ для многих промышленных реакций -
несколько сот градусов.
Эффективный коэффициент диффузии 7)Эф = П7)г был опре-
делен выше [см. уравнение (2.101)]. Если учесть переходный вид
диффузии в порах, то Dr в порах меньше молекулярного коэф-
фициента диффузии D [уравнение (2.103)]. Примем 7)Эф = 0,17).
Теплопроводность пористого катализатора по данным много-
численных исследований Х3 » 10Х, где X - теплопроводность
заполняющего поры газа. Такой результат связан с тем, что
структура пористого катализатора образована спекшимися,
слипшимися микрочастицами. Точки контакта оказывают боль-
шое термическое сопротивление, и в переносе теплоты участву-
ет прослойка газа, примыкающая к точкам контакта микро-
частиц. Этим и объясняется тот факт, что теплопроводность
пористого тела зависит в основном от теплопроводности запол-
няющего его газа и в значительно меньшей степени зависит от
98
теплопроводности материала. Отношение к/ср = а - температу-
ропроводность; для газов а ~ D. Из приведенных данных полу-
чим оценку параметра в уравнении (2.122) D^Cr/K^ « 0,01 и зна-
чение перепада температур в зерне ДТ = 0,01Д/адх. Максималь-
ный разогрев будет иметь место в центре зерна в области внут-
ренней диффузии, где превращение полное (х - 1), и не превы-
сит нескольких градусов. Если реакция эндотермическая (£?р < 0
и, следовательно, ДТад < 0), то температура в центре зерна, есте-
ственно, будет меньше, чем на поверхности. В переходных ре-
жимах (в центре зерна х < 1) перепад температур по зерну еше
меньше.
Процесс в пористом зерне катализатора можно считать изо-
термическим. Малый разогрев внутри зерна связан с существен-
ным (на два порядка) различием в интенсивности переноса
тепла и вещества.
Непористое зерно катализатора. Через пограничный слой у
его поверхности происходит не только массоперенос, но и отвод
(подвод) теплоты. Коэффициент теплообмена между поверх-
ностью зерна и потоком - а3, скорость теплообмена - -
- То), где Тп, То - температуры на поверхности и в объеме пото-
ка соответственно. Скорость тепловыделения вследствие проте-
кания реакции на поверхности - Qpr(Cn, Тп). В стационарном
режиме уравнение (2.119) дополним уравнением для тепловых
явлений:
аз(^п-ТЬ)= Орг(Сп, ГД (2.123)
Механизмы массо- и теплообмена между поверхностью и по-
током одинаковы: молекулярный перенос через пограничный
слой диффузией и теплопроводностью соответственно. Потому
уравнения расчета 03 и а3 идентичны:
для массообмена [см. уравнение (2.506)]
NuD = JRe3Sc'";
для теплообмена
Nur= JRegPr'".
Коэффициенты A, n, ш одинаковы в обеих формулах. Nup =
= WdJD и Nu-/- = а3</зД - диффузионный и тепловой критерии
Нуссельта (d3 - размер зерна).
Sc = v/D и Pr = vCp/X - критерии Шмидта и Прандтля, при-
чем первый называют также диффузионным критерием
Прандтля. Для газов критерии Sc и Рг близки друг к другу, так
как близки значения температуропроводности а = Х/ср и коэф-
фициента диффузии D. И поскольку Рг = Sc, то р3 = О-з/Ср.
Для простой реакции w(Cn, Тп) = -г(Сп, Тп), и из отношения
(2.123) к (2.119) получим - То) = СР(СО - Сп). Введя сте-
99
Рис. 2.37. Зависимости qv(T^) и ?Т(ГП) для
процесса на внешней поверхности катализато-
ра. Точки пересечения 1, 2, 3 - стационарные
режимы. Прямые qY (Тп) - для разных То
пень превращения на поверхности хп =
= (Со - Сп)/Со и используя определение
А и соотношение между р3 и а3, полу-
чим разогрев поверхности катализатора:
Тп - 7Ь = ДТадХп, (2.124)
равный адиабатическому разогреву при
установившейся степени превращения хп.
Для реакции первого порядка r(C, Т) = к(Т)С; с учетом ряда
полученных выше соотношений преобразуем (2.119) и (2.123):
хп = А/р3( 1 - хп); Гп - Го = АШ( 1 - хп).
Из первого уравнения этой системы получим хп*= 1/(1 + Л/Р3)
и подставим во второе:
Тп - 7Ь А Тад
I.__________t !_________
£/Рз
1 + Л/Р3
(2.125)
<7т
J
Экспоненциальная зависимость Л(ГП) = Лоехр(-Г/ЛГп) не по-
зволяет из (2.125) получить в явном виде значение Тп. Исполь-
зуем графический метод решения.
Количество отводимой от поверхности теплоты равно а3(Тп -
- То), и левая часть (2.125) с точностью до коэффициента а3
представляет теплоотвод, который обозначим qT. Соответственно
правая часть этого равенства с точностью до того же коэффици-
ента а3 = рзСр - тепловыделение qp. Пересечение кривых графи-
ков 9т(Тп) и 9Р(ТП) - они показаны на рис. 2.37 - будет, решени-
ем уравнения (2.125).
Зависимость qp( Тп) - S-образная кривая. При малых темпера-
турах, когда А/Рз « 1, ?Р(ТП) - экспоненциальная функция, по-
добная Л(ТП). При больших температурах, когда А/р3 »1, qp =
= А Гад и не зависит от Гп. График <?Т(ГП) - прямая линия. Из
рис. 2.37 видно, что в зависимости от значения Го возможно
одно или три пересечения ?Т(ГП) и qp(Tn), одно или три реше-
ния уравнения (2.125). Наличие трех решений указывает на то,
что при одних условиях процесса (температура потока Го и кон-
центрация Со в нем, условия тепло- и массообмена) возможны
один или три стационарных режима, т. е. существует неодно-
значность стационарных режимов. Из рис. 2.37 вид-
но, что в случае трех стационарных режимов в одном из них
температура поверхности Гп близка к температуре газа Го. Это
100
Рис. 2.38. К определению устойчивости стационарных режимов. Пояснение в
тексте
низкотемпературный режим (7 на рис. 2.37). В режиме 3 разо-
грев поверхности близок к адиабатическому - высокотемпера-
турный режим. Состояние 2 - промежуточное. Какое из этих
стационарных состояний будет реализовано, зависит от
предыстории процесса. Можно полагать, что если вначале ката-
лизатор имел температуру, близкую к температуре газа То, то
будет реализован низкотемпературный режим 7 на рис. 2.37.
Если вначале катализатор был сильно разогрет, то установится
высокотемпературный режим 3.
Устойчивость стационарных режимов. Рассмотрим протекание
процесса при отклонении его от стационарного. Для этого на
рис. 2.38 отдельно показаны три стационарных состояния как
фрагменты рис. 2.37. Пусть процесс находится в стационарном
режиме 7 (см. рис. 2.38, а). Температура поверхности Т\. Если
по каким-либо причинам температура поверхности увеличилась
до Т[, то и тепловыделение др, и теплоотвод <?т также увеличи-
лись, но последний возрос больше, чем тепловыделение. Если
источник возмущения устранен, то превалирующий теплоотвод
приведет к снижению температуры поверхности, режим само-
произвольно вернется в первоначальное состояние с температу-
рой Т\. Если температура поверхности уменьшится до Т[', то др
станет больше дт, и температура поверхности возрастет - вос-
становится прежняя температура Т\. Аналогичная ситуация бу-
дет и в высокотемпературном стационарном состоянии 3 (см.
рис. 2.38, в). Такие стационарные состояния называются устой-
чивыми, и в них выполняется условие
dgp/dTn < dgJdTp. (2.126)
В среднетемпературном режиме 2 (см. рис. 2.38, б) повыше-
ние температуры катализатора от ?2 до приведет к более
сильному возрастанию тепловыделения др, нежели теплоотвода
101
Рис. 2.39. Стационарные режимы неизотермического процесса на непористом
зерне катализатора. Диаграмма q^, qx(Tn) (о) и изменение температуры поверх-
ности Тп с температурой потока /о (б)
qT. Температура катализатора будет продолжать увеличиваться,
пока не будет достигнуто высокотемпературное стационарное
состояние. Самопроизвольно прежний среднетемпературный
режим не восстановится. Понижение температуры до Гу при-
ведет к дальнейшему остыванию катализатора вплоть до дости-
жения низкотемпературного состояния. И это будет происхо-
дить при любых малых изменениях Тп - первоначальный ста-
ционарный режим не будет восстанавливаться самопроизвольно.
Такой режим называется неустойчивым. Для него dqp/dTn >
dqT/dTp.
Устойчивое стационарное состояние характериззуется следую-
щим:
если в стационарное состояние внесено возмущение и затем
источник возмущения убран (восстановлены условия процесса),
то первоначальное состояние самопроизвольно восстанавливает-
ся. Неустойчивое стационарное состояние самопроизвольно не
восстанавливается после внесения в него возмущений.
Проследим изменение состояния процесса на зерне - темпе-
ратуры поверхности Тп (или разогрев поверхности Тп - Tq) при
постепенном повышении температуры потока То. Ряд последо-
вательных стационарных режимов можно определить из пересе-
чений серии прямых qT для разных То с кривой тепловыделения
qp (рис. 2.39, а). Постепенное повышение То приводит к посте-
пенному увеличению Тп - режимы отмечены точками на рис.
2.39, о и им соответствует нижняя кривая на рис. 2.39, 6. По
достижении То в низкотемпературные режимы перестанут суще-
ствовать (последний режим обозначен Г) и произойдет скачок в
область высокотемпературных режимов, начиная с состояния 3'.
102
Температуру То в назовем “температурой зажигания”. На рис.
2.39, б направление изменения Тп с увеличением То показано
стрелками.
Обратное движение с постепенным уменьшением То также
показано стрелками, а стационарные режимы на рис. 2.39, а
отмечены кружочками. Высокотемпературные режимы до со-
стояния 3' повторятся. Но дальнейшее уменьшение То сохранит
высокотемпературные режимы вплоть до То н, после чего про-
изойдет скачкообразный переход от состояния 3" к состоянию
1". Температуру То, н назовем “температурой потухания”. Далее
будут повторяться режимы, полученные при подъеме То- Такой
гистерезис стационарных режимов был получен и эксперимен-
тально.
Условия “зажигания” процесса можно использовать. Высоко-
температурный, интенсивный режим проводится при неболь-
шой температуре потока. Чтобы выйти на такой режим, не разо-
гревая катализатор и поток реагентов, на короткое время повы-
шают концентрацию реагента и по выходе на необходимые тем-
пературы концентрацию возвращают к заданной.
Выйти на высокотемпературный режим, не разогревая пред-
варительно слой, можно с помощью небольшого количества
(даже одной таблетки) высокоактивного катализатора. При за-
данных условиях на таблетке реализуется только высокотемпе-
ратурный режим, и эта таблетка разогревает соседние. Процесс
на них, менее активных, также выходит на высокотемператур-
ный режим, и они в свою очередь “зажигают” последующие.
Распространяющаяся волна постепенно прогревает весь слой.
Поскольку процесс на наружной поверхности катализатора
подобен гетерогенному процессу “газ - твердое”, то в нем будут
наблюдаться такие же явления: “зажигание” и “потухание” про-
цесса, гистерезис режимов. Пример - самовозгорание твердых
горючих материалов.
2.6. ПРОЦЕССЫ В ХИМИЧЕСКОМ РЕАКТОРЕ
2.6.1. Математические модели процесса в химическом реакторе
Согласно общей схеме построения математической модели в
химическом реакторе (см. рис. 2.5) рассмотрим процесс в реак-
ционной зоне. Можно так представить последовательность по-
строения модели процесса.
1. Выяснить макроструктуру потока в реакционной зоне. Это
творческий этап, требующий прецизионных измерений и интел-
лектуального подхода. Здесь будем рассматривать простейшие
103
структуры потока, чтобы получить первоначальные представле-
ния о процессе в химическом реакторе.
2. Выделить элементарный объем, в котором протекает хими-
ческий процесс, как он был определен выше. Напомним, что
выделенный элементарный объем многократно повторяется в
реакционной зоне, закономерности протекания в нем химиче-
ского процесса не зависят от масштаба, а условия для протека-
ния процесса создаются потоками в масштабе реактора.
3. Для элементарного объема получить наблюдаемую ско-
рость превращения И^(С, Т), что было сделано в предыдущих
разделах. Для первоначальных представлений о процессе в реак-
торе принимаем, что И^(С, Г) имеет вид (структуру) кинети-
ческой модели.
4. Установить явления переноса между элементарными объе-
мами, создающие условия протекания процесса в них и опреде-
ляющие их взаимодействие. Совокупность этих явлений вместе
с химическими процессами позволяет представить схему про-
цесса в целом, включающую существенные для построения мо-
дели составляющие. Будем полагать, что модель должна пред-
сказать распределение температуры и концентраций и, следова-
тельно, позволит определить превращение исходных веществ в
продукты.
5. Исходя из представлений о структуре и схеме процесса,
построить математическую модель, которая в самом общем виде
выглядит следующим образом:
dN/dt = £NBX + L7V„CT; (2.127) dq/dt = L(?BX + ZG„CT. (2.128)
Здесь dN/dt и dq/dt - накопление вещества и теплоты в выде-
ленном элементарном объеме.
/VHX и £?вх - материальные и тепловые потоки, входящие в вы-
деленный объем (покидающие объем потоки имеют отрицательное
значение); входящие потоки могут быть как конвективными
(течение реагентов), так и диффузионного характера (вследствие
возникновения градиентов концентраций и температуры).
Л/ист и Смет _ источники вещества и тепла внутри выделенно-
го объема. Источником вещества является химическая реакция,
источником тепла - химическая реакция и фазовые переходы и
превращения.
Уравнения вида (2.127) составляются для всех участвующих в
процессе веществ. Практически можно использовать меньшее
их число, учитывая сохранение общей массы веществ и стехио-
метрические соотношения между реагирующими веществами.
Для многофазных процессов уравнения (2.127) и (2.128) со-
ставляют для каждой фазы и учитывают тепло- и массообмен
между ними.
104
а б в
Рис. 2.40. Схемы реакторов:
я - в режиме идеального смешения периодическом (ИС-п); б - идеального смешения
проточном (непрерывном) (ИС-н); в - идеального вытеснения (ИВ). Пояснение в тексте
6. Чтобы уравнения (2.127) и (2.128) имели определенное ре-
шение или, как говорят, были замкнуты, их надо дополнить
начальными и граничными условиями. Они строятся на основе
условий осуществления процесса в реакторе и поведения пото-
ков на границах изучаемой области - реакционной зоны.
Реализацию такой процедуры рассмотрим при построении
математических моделей процессов в реакторах, представленных
на рис. 2.1.
Периодические процессы в реакторе 1 на рис. 2.1. Все компо-
ненты одновременно загружают в него. Реакция протекает при
интенсивном перемешивании, так что можно считать концент-
рации и температуру в каждый момент времени одинаковыми
по всему объему. Поэтому элементарным будет весь объем гр
реакционной зоны (далее реактора). Возможен теплообмен с
теплоносителем, имеющим температуру Тк. Поверхность тепло-
обмена FT и коэффициент теплообмена Кт. Схема процесса в
таком реакторе представлена на рис. 2.40, а.
Процесс - нестационарный. В реакторе нет входящих и вы-
ходящих потоков, и E7VBX — 0. Источником /-го вещества являет-
ся химическое превращение: T,NMCJ = И^(С, T)vp. Уравнение
(2.127) будет выглядеть следующим образом (для i-ro вещества):
dNj/dt= Wj(C, T)vp.
Количество вещества в реакторе Nj = грС„ и предыдущее
уравнение примет вид (полагаем, объем реагирующей смеси,
равный гр, не меняется):
dCj/dt = Wj(C, Т). (2.129а)
Источник тепла - изменение энтальпии в химическом пре-
вращении [для единственной реакции ЕСист = Qpr(C, 7')гр] и
теплообмен с теплоносителем - Т). Уравнение (2.128)
примет вид
dq/dt= Qpr(C,T)vp + ад(7х - Т).
Изменение количества теплоты в реакторе dq связано с изме-
нением температуры в нем: dq = cpvpdT (принимаем теплоем-
105
кость ср неизменной). Определим удельную поверхность тепло-
обмена /уд = /т/Vp и получим
dT/dt = ерг( С, Т) - KTFya( Т - Тх). (2.1296)
Процесс начинается при концентрациях С, о и температуре
То. Начальные условия для (2.129а) и (2.1296) задаем для начала
процесса:
при/=0 С= С,о, Т=7о- (2.129в)
Такой процесс и описывающие его уравнения называ-
ют режимом (моделью) идеального смешения периодическим -
ИС-п.
Процессы в реакторах типа 2, 3, 8 и в реакционной зоне реак-
тора 12 на рис. 2.1. Схема процесса представлена на рис. 2.40, б.
Рассматриваем одну фазу, интенсивно перемешиваемую. Реак-
тор проточный, и процесс протекает непрерывно. В реактор в
единицу времени входит поток реагентов объема Pq и с ним
каждого компонента в количестве PoQo- Температура во вход-
ном потоке То. Принимаем, что объем реакционной смеси не
меняется, и из реактора выходит поток Pq с температурой Т и
каждого компонента - PqC,-. Здесь Q, Т - концентрации компо-
нентов и температура как в реакторе, так и в выходящем потоке.
Источник веществ - химическое превращение, т. е. ист =
= РР/(С, T)vp. Процесс протекает стационарно: dNj/dt = 0 и
dq/dt = 0. Уравнение (2.127) примет вид
0 = И0С,0 - r0Q + И<(С, T)vp. (2.130)
Определим отношение Vp/l'o = т - условное время реакции,
названное так из-за своей размерности (если Pq [м3/с] и vp [м3],
то т [с]). Отметим, что т - отношение двух величин и не имеет
физического смысла. По виду выражения т похоже на определе-
ние среднего времени пребывания потока в объеме, но обычно
Ро измеряют при нормальных условиях, а температура в реакто-
ре и объем реакционной смеси в нем отличаются от нормальных
условий. Уравнение (2.130) примет вид:
(Q- С/0)Л= ИЦС, Т). (2.131а)
Источник теплоты в реакторе - химическое превращение
Qpr(C, T)vp и теплообмен -Т) (обозначения параметров
теплообмена как в предыдущем процессе). Полагаем, что теп-
лоемкость Ср реакционной смеси не меняется в процессе. Урав-
нение (2.128) принимает вид
0 = VocpTn - VocpT+ Qpr(C, Dvp + ВД(Т; - T).
106
Используя определение условного времени реакции т и
удельной поверхности теплообмена Fyn = EJvp, получим
ср(Т- Т0)/т = Qpr(С,Т)~ КМТ-Тх). (2.131 б)
Начальные условия - концентрации С, о и температура Tq -
входят в уравнения (2.131а и б). Такой процесс и описывающие
его уравнения называют режимом (моделью) идеального смешения
непрерывным - ИС-н.
Процессы в реакторах 4-7 и 9-11 на рис. 2.1 - непрерывные.
Рассмотрим режим течения потока через реактор без перемеши-
вания. Профиль скорости по сечению - плоский. Это возможно
допустить, если масштаб отклонений много меньше масштаба
реакционной зоны, что во многих реакторах выполняется. Та-
кой режим потока называют поршневым, или идеального вытесне-
ния. Реактор представим в виде трубки сечением S, через кото-
рое проходит поток величиной Vo (см. рис. 2.40, в). Координата
по направлению потока - /. По мере прохождения потока реак-
ционной смеси вследствие химических превращений изменяют-
ся концентрации компонентов Q и в общем случае - температу-
ра потока Т. Одновременно может происходить теплообмен с
теплоносителем через стенку. Элементарный объем в этом слу-
чае - участок толщиной dl и объемом dvp — Sdl. В него входит с
потоком компонент i в количестве И0С, и выходит йо(С, + dC,).
Источник вещества в выделенном объеме - химическое превра-
щение Z7VHCTi i — И^(С, T)dvp. Процесс протекает стационарно
(dNj/dt = 0), объем реакционной смеси не меняется и уравнение
(2.127) принимает вид
0 = И0С( - И0(С,- + dCd + И<(С, T)dvp.
Использовав приведенное выше определение т и, соответ-
ственно, de = dvp/V$, получим уравнение:
dC./dx = Wj(C, Т). (2.132а)
Скорость во всем сечении реактора и = Vq/S\ до сечения /
объем реактора vp = IS и условное время реакции можно свя-
зать со скоростью потока: т = vp/ = l/u.
Для теплового уравнения (2.128): dq/dt — 0 - процесс стацио-
нарен; VqcpT - тепловой поток, входящий в элементарный объ-
ем, и Vqcp(T + dT) - выходящий из него; Qpr(C, T)dvp +
+ KTdFr(Tx- Т) - источники теплоты (реакция и теплообмен
через боковую поверхность dFT в выделенном объеме). Далее:
0 = VQcpT- Vocp(T + dT)+ Qpr(C, T)dvp + К^{ТХ - Г);
dFy/dvp = Fya - удельная поверхность теплообмена; для трубки
диаметром DTp: /уд = яЛтр/(0,25лD^l) = 4/£)тр. После преобра-
107
зований получим:
ср~ = 0рГ(С’ 7 )" KrFyn(Т~ Тх) (2 ’32б)
Для замыкания двух дифференциальных уравнений (2.132а) и
(2.1326) задаются начальные условия - концентрации С, о и тем-
пература То на входе в реактор:
при т = О С= С,о и Т= Tq. (2.132в)
Такой процесс и описывающие его уравнения называют ре-
жимом (моделью) идеального вытеснения - ИВ.
Процесс в реакторе с двухфазным потоком. Математическая
модель включает в себя описание процесса в каждой из фаз.
Построение модели проводится так же, как было описано выше,
но добавляются массо- и теплообмен между фазами. Они могут
быть представлены как источники вещества и теплоты в фазе,
например, выражениями
р5уд(С2 - Q); (2.133а) а5уд(Т2 - Л), (2.1336)
где р, а - коэффициенты межфазного обмена; 5уд - поверхность контакта фаз,
приходящаяся на единицу объема фазы; С\, - концентрации в контакти-
рующих фазах; 72, 7] - температуры тех же фаз.
Обратим внимание на использование первого из выражений
(2.133) для систем с фазами в различных агрегатных состояниях,
например “газ - жидкость”. Концентрации компонента в раз-
ных фазах вычитать некорректно - у них разная размерность:
(моль/м3 газа] и [моль/м3 жидкости]. Необходимо использовать
вместо концентрации в газовой фазе ее приведенное значение
С, = где КА - константа абсорбции, а Р/ - парциальное
давление компонента (см. разд. 2.4.3).
Для компонентов, которые поступают с одной фазой и реа-
гируют в другой, вместо (2.133а) используют выражение для
наблюдаемой скорости превращения.
Этим замечанием ограничим обсуждение вопроса построения
модели двухфазного процесса в реакторе, поскольку далее будем
рассматривать процессы в реакторе, описываемые уравнениями
(2.129а, б, в), (2.131а, б) и (2.132а, б, в). Они должны дать пред-
ставление об общих свойствах процесса в реакторе. Такие моде-
ли иногда называют “идеальным реактором”. Тем не менее
практика показывает, что эти модели позволяют предсказывать
показатели многих реальных промышленных реакторов.
108
2.6.2. Классификация химических реакторов
и их математических моделей
Как сложный по структуре и составу объект реакторы класси-
фицируют по нескольким признакам. Выберем только те, кото-
рые позволят систематизировать изучение процессов в химиче-
ских реакторах в рамках этого учебного курса.
Классификация химических реакторов
А. Организация материальных потоков
1. Количество фаз реагентов
2. Движение потоков через реактор
3. Режим движения потоков в реак-
ционной зоне
Б. Организация тепловых потоков
1. Тепловой режим в реакторе
2. Способ теплообмена
однофазный
многофазный
проточный
непроточный
полупроточн ый
идеальное вытеснение
идеальное смешение
неидеальный
изотермический
адиабатический
с теплообменом
автотермический
в реакционной зоне
вне реакционной зоны
Условия протекания химических процессов в реакторе в це-
лом зависят от организации движения реактантов (материаль-
ных потоков) и организации теплового режима (тепловых пото-
ков) в реакторе.
Тип химического процесса, необходимость контакта потоков
в разных фазовых состояниях подразделяют реакторы на одно- и
многофазные. По-разному будет сказываться на характере про-
цесса движение потоков через реактор и внутри реакционной
зоны - ведь даже полученные выше математические модели
процессов в проточных реакторах (движение через реактор) в
режимах идеального смешения и вытеснения (движение в реак-
ционной зоне) существенно различны. Выше были выделены
только два способа движения реактантов через реактор - про-
точная и непроточная схемы. Возможен и полупроточный ре-
жим: часть компонентов загружается в реактор в начале процес-
са, а часть подается в реактор во время ведения процесса. Также
два режима движения потока в реакционной зоне - смешения и
вытеснения - были рассмотрены выше. Они названы идеальны-
ми. В реальных условиях возможны отклонения от них - неиде-
альное движение потока.
109
В организации теплового режима выделим собственно тепло-
вой режим и способ теплообмена. В адиабатическом режиме вся
теплота реакции идет на нагрев (или охлаждение) реакционной
смеси. В режиме с теплообменом часть теплоты реакции пере-
дается постороннему теплоносителю. В изотермическом режиме
поддерживается одинаковая температура во всем реакторе. Хотя
этот режим и кажется искусственным, он весьма важен для
понимания многих свойств процесса в реакторе. Выделен реак-
тор с “внутренним теплообменом” - автотермический. В нем
процесс протекает без участия постороннего теплоносителя.
Движение потока в нем организовано так, что происходит теп-
лообмен между разными частями потока, например между вхо-
дящим в реактор и выходящим из него. Среди различных спо-
собов теплообмена выделяются два - теплообмен с реакционной
зоной через теплообменную поверхность (одновременно с про-
теканием реакции), как в реакторах 7, 9, Юна рис. 2.1, и способ
с промежуточным теплообменом в многослойном реакторе 11 на
рис. 2.1, в котором реакционная зона и зона теплообмена разде-
лены. Конечно, возможна и комбинация этих способов.
Более детальное изучение процесса в химическом реакторе
или иные цели (например, конструирование) может потребовать
выделить иные признаки классификации или ввести дополни-
тельные признаки либо иную детализацию каждого из них.
Классификация математических моделей проводится по типу
полученных уравнений. При построении математических моде-
лей процесса в химическом реакторе были рассмотрены две
структуры потока - идеального смешения и вытеснения. Учиты-
вая еще два рассмотренных способа организации движения ре-
актантов через реактор: проточная и непроточная схемы,- были
выведены три математические модели:
ИС-п ИС-н ИВ
dC/dt = И/(О (С - С())/т = 1E(Q dC/dt =№(С) (2.134)
(а) (Ь) (с)
(здесь записаны уравнения только для одного компонента).
Количество математических моделей, описывающих процес-
сы в реакторах, значительно меньше числа последних. Это по-
зволяет находить общие свойства в различных типах реакторов,
проводить обобщение. Свойства процессов в реакторах изучаем
по их математическим моделям, т. е. изучаем свойства уравне-
ний, перенося затем их на свойства реактора. Если внимательно
посмотреть на уравнения (2.134), то становится очевидно, что
уравнения в реакторах идеального смешения периодическом (д)
и идеального вытеснения (с) математически одинаковы. Есте-
ПО
ственно, что свойства этих моделей также одинаковы. Но опи-
сываемые ими процессы принципиально различны - периоди-
ческий нестационарный и непрерывный стационарный. Разли-
чие свойств процессов в реакторах при одинаковых свойствах их
моделей будет проявляться при интерпретации свойств модели
на свойства процесса.
Таким образом, многообразие рассматриваемых химических
реакторов сводится к изучению свойств весьма ограниченного
числа математических моделей [в данном случае только двух -
дифференциальные уравнения (2.134а) или (2.134с) и алгебраи-
ческие (2.134/>)].
2.6.3. Анализ процессов в химических реакторах
Анализ процесса в химическом реакторе - исследование влияния
условий процесса и характеристик (свойств) его составляющих
на показатели работы реактора, а также выявление особенно-
стей процесса и режима.
Условия процесса - состав исходной реакционной
смеси (начальные концентрации реагентов), величина посту-
пающего потока (нагрузка на реактор), температуры входного
потока, хладагента (для процессов с теплоотводом) или в реак-
торе (для изотермического процесса).
Свойства составляющих процесса - характери-
стики химического процесса: схема превращения и тип реакций
(вид кинетических уравнений), энергия активации, тепловой
эффект; для неизотермических процессов - параметры теплоот-
вода (коэффициенты теплопередачи, поверхность теплообмена,
теплофизические свойства реактантов).
Показатели процесса - степень превращения х, се-
лективность 5, выход продукта Е, а также профили концентра-
ций, степени превращения и температуры в реакторе, их изме-
нение во времени. Зная эти показатели, можно далее определять
и другие: конструктивные параметры реактора, энергетические
затраты, экономические характеристики и пр.
Особенности процесса и режима - влияние усло-
вий и свойств процесса на его показатели, управление процес-
сом (изменение условий и свойств для достижения желаемых
показателей), критические режимы (например, их существова-
ние, неустойчивость).
Анализ процесса проводим с использованием метода матема-
тического моделирования. Можно представить такую последова-
тельность анализа процесса в химическом реакторе.
1. Обоснование и построение математической модели про-
цесса. Как было показано выше, одна математическая модель
может описывать процесс в различных реакторах.
111
2. Преобразование уравнений математической модели к виду,
удобному для дальнейшего исследования.
3. Решение уравнений математической модели для получения
зависимостей, подлежащих анализу. Далее в основном будем
использовать модели, для которых возможно получить аналити-
ческое решение. Это позволяет провести их качественный ана-
лиз, выявить основные свойства уравнений. В ряде случаев та-
кой анализ удобнее провести, используя графические методы
решения уравнений. Численные методы решения уравнений
здесь практически не используются (это задача специального
курса вычислительной математики), хотя численный экспери-
мент широко используется в практике исследований.
4. Представление результатов решения уравнений в основном
в графическом виде как наиболее удобном для общего анализа.
5. Интерпретация результатов решения уравнений на процесс
в исследуемом реакторе, т. е. установление связей между пере-
менными и коэффициентами уравнений и физическими харак-
теристиками и параметрами процесса, необходимых для перено-
са свойств уравнений (модели) на свойства реактора.
6. Собственно анализ модели и процесса: выявление свойств
математической модели на основе поведения (изменения) ре-
шения при изменении параметров уравнений и перенос свойств
модели на процесс в реакторе.
7. Сопоставление процессов в реакторах различных типов.
8. Дальнейший анализ процесса - выявление особенностей
решения уравнений математической модели и, следовательно,
особенностей режима.
Анализ процессов в химическом реакторе будем проводить
по мере их усложнения, 'с учетом увеличивающегося числа яв-
лений, имеющих место в процессе. Сначала рассмотрим изотер-
мические процессы, а затем - процессы с явлениями теплопе-
реноса (неизотермические). Будем рассматривать процессы,
описываемые полученными выше математическими моделями
(или, как говорят, будем изучать процессы в рамках этих моде-
лей).
2.7. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
В ХИМИЧЕСКОМ РЕАКТОРЕ
2.7.1. Режимы идеального смешения периодический
и идеального вытеснения
Процессы в реакторах, работающих в режимах идеального сме-
шения периодическом (ИС-п) и идеального вытеснения (ИВ),
описываются уравнениями:
112
ИС-п ИВ
dC/dt = W(C) dC/dx = Ж(0
при t = О С = Со при т = О С = Со
Математически эти уравнения полностью идентичны. Разни-
ца в обозначении независимой переменной: t или т. Физически
эти переменные принципиально различны: t - астрономическое
время, т = 1/и - переменная, пропорциональная линейной вели-
чине - длине реактора. Поскольку проводим анализ модели, то
в дальнейшем будем использовать следующий вид уравнения:
dC/dx =W(C); при т = 0 С= Со, (2.135)
полагая т s x,t в зависимости от модели процесса. Анализ про-
цесса проводим для случаев протекания реакций разного типа.
Простая необратимая реакция А = R. Скорость превращения
Ж(С) для реакции первого порядка
РЦС)=-А:С, (2.136)
или, переходя к степени превращения,
1Г(С) = - ЛС0(1-х). (2.136а)
Подставим (2.126) в (2.135):
dC/dx = -кС; при т = 0 С= Со. (2.137)
В (2.137) переменные Сит разделяются. Интегрируем это урав-
нение:
С т
J dC/C = k\dx, или 1пС/Со = -кх.
Со о
Представим решение в виде двух зависимостей:
Т = 11П^; С = С^кХ- (2-138)
Если использовать степень превращения х, то (2.135) примет
вид
dx/dT = k(\ -х); при г = 0 х = 0 (2.139)
и его решение будет
т = -1п—— и х = \-е~к\ (2.140)
к 1-х
Графическое представление С(т) из (2.138) и х(т) из (2.140)
дано на рис. 2.41 (п = 1). Эти зависимости - экспоненциально
уменьшающаяся для С(т) и зеркальная ей для х(т) - асимптоти-
113
Рис. 2.41. Зависимость С(т) (о) и х (т) (б) для простых необратимых реакций
разного порядка п
чески приближаются при т -> а к С = 0 или х — 1 соответствен-
но. Для необратимой реакции исходное вещество постепенно
расходуется до его полного превращения.
Интерпретация решения (2.138) уравнений математи-
ческой модели (2.137) для процессов в режимах идеального
смешения и вытеснения такова. В режиме ИС-п процесс проте-
кает нестационарно, т = /, со временем t концентрация исходно-
го вещества С уменьшается в соответствии с зависимостью
(2.138) (рис. 2.42, а). Но в каждый момент времени концентра-
ция во всех точках реактора одинакова. Если взять любое ли-
нейное измерение I внутри объема реактора, то зависимости
С(7) в разные моменты времени будут иметь вид, представ-
ленный на рис. 2.42, б - каждая из них есть C(J) = const. В ре-
жиме ИВ процесс протекает стационарно. Концентрация С ме-
няется по длине реактора /, которая пропорциональна т(/ = ты),
как показано на рис. 2.42, г. Но в каждом сечении / реактора
C(t) = const (рис. 2.42, в). Таким образом, анализ зависимостей
С(т) или х(т) покажет влияние условий процесса на изменение
С и х во времени в режиме ИС-п и распределение С и х по
длине реактора в режиме ИВ.
Влияние порядка реакции. Для реакции л-го по-
рядка, скорость которой описывается выражением И4(С) = кС1,
уравнение (2.135) преобразуется к виду
dC/dx = -кСп или dx/dx =кС”~х(1 - х)". (2.141)
В (2.141) переменные Сит разделяются, и после интегрирова-
ния получим
—(С1-я-С’-") = -А;т; —[1 - (1 - х)1’"] = кС"~'х. (2.142)
п -1 и 1 - п и
Из (2.142) получим зависимость С(т):
С = [С*"" - (1 - л)Лт]1/(1"я>. (2.143)
114
Рис 2.42. Изменение концентрации С от времени t {а, в) и по длине реактора /
(б, г) в реакторе периодического идеального смешения (а, б) и проточном реак-
торе идеального вытеснения (в, г)
Из (2.143) видно, что с увеличением т концентрация С
уменьшается - исходное вещество, естественно, расходуется.
Соответственно, х = (Cq - C)/Cq будет возрастать. Изменение
С(т) будет различно для п < 1 и п > 1. Если п < 1, то из
(2.143) получается, что реакция пройдет до конца, т. е. бу-
дет достигнуто С — 0 (или х = 1) при конечном значении т =
=С^~п/к(\ - п). Для случая п > 1 приведем (2.143) к виду
С = 1/[С*-л + (п - BAx]1/*"-0,
из которого следует, что С -> 0 при т -> оо, т. е. с увеличением т
концентрация С асимптотически стремится к нулю как для ре-
акции первого порядка. Соответствующие зависимости С(т) и
х (т) для п < 1 и п > 1 показаны на рис. 2,41.
Влияние температуры. В модели (2.137) или (2.141)
только константа скорости к зависит от температуры Т: согласно
соотношению к = к$ exp(-E/RT) она увеличивается с температу-
рой. Естественно полагать, что при проведении процесса при
более высокой температуре скорость реакции будет больше и
концентрация С будет быстрее уменьшаться со временем т. Дей-
ствительно, в зависимостях С(т) (2.138) и (2.143) можно просле-
115
с
Рис. 2.43. Влияние температуры Т на зависи-
мость С (т) (Тг > Т\)
дить: при одном значении т и увели-
чении к, т. е. при более высокой
температуре, С станет меньше. Из-
менение зависимости С(т) при уве-
личении температуры процесса от Т\
до Tj показано на рис. 2.43. При
протекании простой необратимой реакции повышение темпера-
туры всегда благоприятно влияет на интенсивность процесса в
реакторе - уменьшается т (объем реактора в проточном режиме
или время процесса в периодическом реакторе) для достижения
заданной степени превращения. Процесс целесообразно прово-
дить при максимально допустимой температуре.
Влияние начальной концентрации СЬ на процесс
в реакторе оценим по двум показателям. Один из них - интен-
сивность процесса, т. е. количество вещества, претерпевающего
превращение в реакторе. Скорость реакции увеличивается с
концентрацией (для тех кинетических уравнений, которые здесь
рассматриваются, - вида г = кС"). С увеличением С (и Со) коли-
чество превращаемого вещества, интенсивность процесса будут
возрастать.
Другой показатель влияния Со - изменение степени превра-
щения при определенной нагрузке на реактор Vq. С увеличени-
ем концентрации возрастает скорость реакции, но также воз-
растает и количество вещества, которое должно превращаться.
Из зависимости (2.140) видно, что для процесса с реакцией пер-
вого порядка начальная концентрация не влияет на зависимость
х (т). Если реакция не первого порядка, начальная концентра-
ция влияет на степень превращения в реакторе, что показано на
рис. 2.44. В этом случае Со входит в модель процесса (2.141) как
ее коэффициент в виде кС^1. Если п > 1, то влияние Со на
х (т) будет таким же, как и влияние температуры Т: увеличение
и Со, и Г (т. е. к) приводит к уменьшению т (или увеличению
степени превращения в реакторе при фиксированном т). При п >
> 1 скорость реакции возрастает больше, чем количество пре-
вращаемого вещества. Если п < 1, то влияние Со противополож-
но влиянию температуры: превращение в реакторе будет подав-
ляться (скорость реакции с концентрацией возрастает меньше,
чем количество вещества в реакционной смеси).
116
Рис. 2.44. Влияние Q на зависимость х (т) для реакций порядка п. Сплошные
линии - при Qi, пунктир - при С(й > Он
Рис. 2.45. Зависимость степени превращения х от т для простой обратимой
реакции (пунктир - для необратимой реакции)
Простая обратимая реакция A R. Скорость реакции
г (Q = к\С^ - к^С^
зависит от концентрации двух реагентов, и в общем случае для
описания процесса надо использовать два уравнения вида
(2.135) - для обоих реагентов. Удобнее перейти к одной
переменной - степени превращения х реагента А: СА = Со(1-х);
CR = Cqx (Со - начальная концентрация А). Модель процесса
примет вид
dx/dx = к\(\ - х) - kzx; при т = 0 х = 0. (2.144)
Перейдя к виду dx/dx = - (Aj + kfi x, проинтегрируем это
уравнение:
ln[£i - {к\ + А2)х] - In _
+ к^
или
х = —[1-е(*1+*2)]. (2.145)
к\+ к2 L 1
С увеличением х степень превращения, естественно, увели-
чивается, и при х -> оо получим из (2.145): х -> к\/(к\ + Л2).
Вспомним из разделов 2.2.2 и 2.2.3: константа равновесия для
обратимой реакции Ар = к\/к^ и равновесная степень превраще-
ния хр = Ар/(1 + Ар). Отсюда предельное значение х, достигае-
мое в реакторе, есть хр. Это естественно - реакция протекает до
равновесия. Зависимость х (т) представлена на рис. 2.45. Для
сопоставления здесь же пунктиром показана зависимость х (т)
для необратимой реакции.
Рассматриваемая реакция в прямом и обратном направлениях
первого порядка, и начальная концентрация не влияет на сте-
пень превращения.
117
Рис. 2.46. Зависимость х (т) при температурах
Т\ (Г) и Т} > 7i (2, J). Реакции: эндотерми-
ческая (2) и экзотермическая (5). Пунктир -
равновесные степени превращения Хр для тех
же условий
Влияние температуры. От
нее зависят константы к\ и к^, каж-
дая из которых увеличивается с тем-
пературой. Изменение констант раз-
личным образом влияет на скорость реакции: к\ увеличивает, а
ki уменьшает скорость. Суммарный эффект зависит от интен-
сивности увеличения к\ и к^ с температурой. Оно различно для
экзо- и эндотермических реакций. В разд. 2.2.3 показано: Qp =
=£2 - Е\ [уравнение (2.40)]. Для экзотермической реакции Qp > 0,
£2 > Е\ и ^2 (и скорость обратной реакции) увеличивается с
температурой сильнее, чем к\ (и скорость прямой реакции). Для
эндотермической реакции это соотношение будет обратным.
Изменение зависимости х (т) для обратимой реакции с по-
вышением температуры Т качественно можно установить из
следующих рассуждений. Зависимость х (т) - монотонно воз-
растающая функция от х = 0 при т = 0 до хр при т -> оо. С уве-
личением Т вначале, при т, близком к 0, скорость реакции воз-
растает - вклад обратной реакции (здесь х » 0) незначителен.
Реакция протекает более интенсивно (левая часть графика на
рис. 2.46). С увеличением т степень превращения х асимптоти-
чески приближается к равновесной хр. По правилу Ле-Шателье
с ростом температуры равновесие в эндотермической реакции
сдвигается в сторону образования продукта, т. е. хр увеличивает-
ся. Эндотермическая реакция протекает интенсивнее - кривая 2
на рис. 2.46. В этом случае к} с температурой возросла больше,
чем к2, и вклад прямой реакции в общую скорость превращения
увеличился при всех х. Для экзотермической реакции влияние
температуры на равновесие обратное: хр уменьшается. В реакто-
ре процесс, протекающий более интенсивно с увеличением Т,
затем снижает свою интенсивность - кривая 3 на рис. 2.46. В
этом случае увеличилась с температурой больше, чем к\, и
вклад обратной реакции в общую скорость превращения при х,
близких к хр, увеличился.
Сложная реакция, параллельная схема превращения
Обе реакции первого порядка, так что скорости превращения
компонентов реакции A, R и S в соответствии с уравнением
118
(2.38) составляют:
И^д = -*jCa - = -(kt + Л2)СА; Wr = *iCA;
= Л2Са-
Математически процесс описывается уравнениями
dC\/dx = ~(к\ + /с2)СА;
dCR/A = A1CA;
dCs / dx = к2С^;
(2.146)
при т — 0 Сд — Сц, Cr — С§ — 0.
Решение первого уравнения системы (2.146) аналогично ре-
шению (2.135):
СА =С0е“(*1+*2)т. (2.147а)
Подставим (2.147а) во второе уравнение системы (2.146):
JCr/Jt = к\Со exp[-(&i + Л2)т]
и проинтегрируем его:
Cr = v-^— Со[1 - e"(*‘+*2)TL (2.1476)
«1 + К2
Аналогично получим для Cs:
Cs= -2, QI - е’<*1+*2)т]. (2.147в)
«1 + к2
Зависимости концентраций реагентов от т представлены на
рис. 2.47. Обе частные реакции первого порядка. Дифференци-
альная селективность 5^ по продукту R не зависит от концент-
рации СА и равна 5ft = к\/(к\ + к2) - см. уравнение (2.47) при
«1 = и2 = 1 и рис. 2.48, а, линия п\ = л2. Поэтому и интеграль-
ная избирательность
•Sr ~ Cr/(Cr + Cs) - к\/(к\ + Л2)
не зависит от Сд, не меняется по мере
протекания процесса (с увеличением т).
Это отражено линией п\ = п2 на рис.
2.48, б.
Рис. 2.47. Изменение концентрации реагентов в
реакторе ИВ (или ИС-п) при протекании сложной
параллельной реакции. Сплошные линии - при
температуре 7), пунктир - при Тг > Т\ и Е\ > Ег
119
Рис. 2.48. Зависимость дифференциальной селективности 5^для параллельной
реакции от концентрации СА (а) и интегральной селективности 5R от т (6) в
реакторе ИВ (или ИС-п) при различном соотношении порядков частных реак-
ций П\ И П2
На рис. 2.48, а представлены изменения Sfc от СА при раз-
ном соотношении порядков частных реакций И] и «2- В реакторе
концентрация СА исходного компонента А уменьшается от Q.
По мере протекания процесса в реакторе, с увеличением т и
уменьшением СА, интегральная селективность будет меняться
как среднеинтегральная величина 5ft в интервале между Со и
текущим значением СА, как показано на рис. 2.48, б.
С увеличением температуры процесс в реакторе будет проте-
кать, естественно, интенсивнее. Насколько интенсивнее будут
образовываться продукты R и S, зависит от соотношения энер-
гий активации Е\ и Еу частных реакций. На рис. 2.47 пунктиром
показано изменение профилей концентраций О(т) при увеличе-
нии температуры и условии Е\ > Ej. В этом случае соотношение
концентраций Cr и Cg будет в пользу R.
Из этих результатов следуют и практические выводы. При
равенстве порядков реакций в параллельной схеме превращения
(«I = Л2) достигаемая в реакторе степень превращения не будет
влиять на селективность процесса. Если п\ > п^, то достижение
высоких степеней превращения может быть нецелесообраз-
ным из-за уменьшения избирательности по продукту R. Если
щ < я2> то увеличение степени превращения благоприятно для
селективности по продукту R. Повышение температуры благо-
приятно и для интенсивности, и для селективности процесса,
если Е\ > Eq. В противоположном случае (Е\ < £2) снижение
температуры благоприятно для селективности процесса в ущерб
его интенсивности.
Сложная реакция, последовательная схема превращения
А -> R -> S.
120
Обе частные реакции первого порядка, и процесс математи-
чески описывается системой уравнений:
dCk/dT = -kxCK-
dCR/dz = кх(\ - k2CR, dCs/dt = k2CR; (2.148)
при т = О СА = Со, CR = Cs = 0.
Решение первого уравнения из системы (2.148) было получе-
но ранее:
СА=Се^т. (2.149а)
Подставим (2.149а) во второе уравнение:
JCR /А = кхСое~к'х - k2CR. (2.150)
Это - линейное дифференциальное уравнение с правой час-
тью вида
Ух +P(x)y = Q(x),
общее решение которого имеется в справочной литературе:
у = еЧ P(^[fQ(x)eJ P^dx + А],
где А - константа интегрирования.
Для уравнения (2.150)
Р(х)-*2; Q(x) = kxCQe-k^-
e-jP(x)dx ^e-[k2dt =e-k2t.^
lQ(x)eiP(x)dxdx = \ кхС^е~к}Х ek2X dx = *l Coe(k2~kl)x.
kx- k2
Подставляя эти выражения в общее решение и используя на-
чальное условие Cr(0) = 0 для определения константы интегри-
рования А, получим
Cr = -г^-Со1е-к}Х - е^х ]. (2.1496)
к\~ к2
Подставляем (2.1496) в третье уравнение системы (2.148) и
интегрируем:
Cs = с0 1 _ ехР(~А:1-т) - *i ехр(-А:2т)1 & ^2 ~
121
Рис 2.49 Изменение концентрации реагентов в реакторе ИВ (или ИС-п) при
протекании последовательной реакции. Сплошные линии - при температуре
Т\, пунктир - при Ti > 7; и Et > Е?
Рис. 2.50. Зависимость интегральной селективности Sr от т в реакторе ИВ (или
ИС-п) при протекании последовательной реакции. Сплошная линия - темпера-
тура 7\, пунктир - Т2 > 7\ и £| > Ej
Графически виды зависимостей (2.149а-в) представлены на
рис. 2.49. Компонент А в процессе расходуется, его концентра-
ция Сд уменьшается. Концентрация Cr сначала возрастает - R
образуется интенсивно из А. По мере протекания реакции
уменьшается Сд и скорость образования R. Одновременно на-
копление R усиливает его дальнейшее превращение. В какой-то
момент (ттах на рис. 2.49) скорости образования и расходования
R уравниваются и далее R в основном расходуется на образова-
ние S - концентрация Cr, пройдя через максимум, уменьшает-
ся. Скорость образования S вначале небольшая - мало компо-
нента R, из которого образуется S. Затем интенсивность образо-
вания S возрастает, и в конце останется один конечный продукт
S. Интегральная селективность по промежуточному продукту R
уменьшается с глубиной превращения (рис. 2.50).
С увеличением температуры все процессы протекают интен-
сивнее. Если при этом скорость первой частной реакции воз-
растает больше, чем второй > E-j), то максимум выхода R
(концентрации Cr) не только будет раньше достигаться, но и
окажется большим по величине. Селективность процесса также
будет больше. Это показано на рис. 2.49 и 2.50 пунктиром.
Практические выводы из сказаннного следующие. Чтобы по-
лучить максимальный выход промежуточного компонента, вре-
мя реакции должно быть определенным, равным ттах (опре-
деленные длина реактора в режиме идеального смешения или
время проведения периодического процесса). Уменьшение т
дает возможность увеличить селективность процесса, снижая
общее превращение. Увеличение т приведет к уменьшению и
селективности, и выхода промежуточного продукта. Увеличение
122
температуры целесообразно, если Е\ > Е^, - возрастут и интен-
сивность, и выход R, и селективность. Если же полезный про-
дукт - конечный (S), то следует добиваться как можно большего
общего превращения.
2.7.2. Режим идеального смешения в проточном реакторе
Изотермический процесс в проточном реакторе идеального
смешения описывается уравнением (2.131а):
(С-С0)/т= ЩС). (2.150)
Простая необратимая реакция А = R. При протекании реак-
ции первого порядка И^С) = -кС, и (2.150) примет вид
(С0-С)/т = кС (2.151а)
или, переходя к степени превращения х = (Со - С)/Со,
х/т = Л(1-х). (2.1516)
Решая уравнения (2.151а,б), найдем концентрацию и степень
превращения в реакторе:
С = Со/(1 + Лт); х = Ат/(1 - kt). (2.152)
Аналитическое решение (2.150) относительно С для реакций
не первого порядка ограничено (разве только для п = 0,5 или 2).
Удобнее определять т = W(C)/(C- Со).
Произведем интерпретацию полученного решения. В про-
точном реакторе идеального смешения т = vp/Pb - фиксирован-
ная величина для данного реактора. Концентрации реагентов
одинаковы во всех его точках и равны С, а на входе - Со- Это
означает, что на входе происходит скачок концентраций от Со
до С (реально область перехода от Со до С настолько мала, что
ею можно пренебречь). В таком представлении распределение
концентраций в координатах С - т является ступенчатой лини-
ей. На рис. 2.51 такие зависимости приведены при различных
значениях т, т. е. или в реакторах разного объема vp, или в од-
ном реакторе при разной нагрузке Vq- Соединив конечные" точ-
ки проведенных ломаных линий,
как показано на рис. 2.51, полу-
чим кривую С(т) как графическое
отображение формулы (2.152) [или
(2.150) в общем случае). Поэтому
Рис. 2.51. Распределение концентрации С
в проточном реакторе идеального смеше-
ния при различных т
123
с
а
б
Рис. 2.52. Зависимости С (т) при температурах Т\ и Tj > Г, (о) и х (т) (б) при
протекании реакций разного порядка п в реакторе идеального смешения
зависимость С(т) надо представлять как набор режимов различ-
ных реакторов, но не изменение концентрации в одном из них,
как это имеет место в реакторе идеального вытеснения или в
периодическом.
Характер влияния Т, Со, п на О(т) будет такой же, как и в
рассмотренном выше процессе в режиме идеального вытесне-
ния. Как пример на рис. 2.52,а показано влияние температуры,
а на рис. 2.52,6 - порядка реакции на зависимость С(т).
Простая обратимая реакция A <^R. Модель процесса (2.150)
с использованием степени превращения х имеет вид
или
х/т = Л|(1 - х) - к2х,
кхх
1 + (кх + к2У '
(2.153)
Предельное значение х при т -> <ю х = кх/(кх + к2). Как было
отмечено в разд. 2.7.1, оно отвечает равновесной степени пре-
вращения. Вид зависимости х (т) и влияние на нее температуры
будут такими же, как в режиме ИВ.
Сложные реакции. Приведем только описание процесса и ре-
шение уравнений модели (частные реакции первого порядка).
Параллельная схема превращения
(Со- СА)/т-----(кх + к2)С^
Cr/* =
Cs/T = Л2СЛ
СА = Со/[1 + (кх + Л2)т]
Cr = кххС0/[\ + (кх + Л2)т]
Cs = к2хС0/[1 + (кх + Л2)т]
124
Последовательная схема превращения А —► R —► S
(Со-
Cr/t = Л]Сд - k2CR
Q/T = ^2CR
СА = Со/(1 + ktx)
CR = ЛпСо/Kl +Л,т)(1 +Л2т)1
Cs = к\Л2т2Со/[( И-Л]Т)( I + Л2т)]
Качественный характер зависимости С(т), влияние на нее
температуры, а также изменение избирательности с изменением
т будут такими же, как и в режиме идеального вытеснения (см.
рис. 2.47-2.50). Читателю предлагается самому убедиться в этом.
2.7.3. Сопоставление непрерывных процессов
в режимах идеального смешения и вытеснения
Сопоставлять будем проточные реакторы в режимах идеального
вытеснения и идеального смешения. Качественный характер
зависимостей С(т) и х(т), а также влияние параметров процесса
на них совпадают. Проведем количественное сопоставление
указанных процессов. Сравним их по интенсивности: в каком
режиме объем реактора vp будет меньше для достижения одина-
ковой степени превращения при прочих равных условиях (Ио,
Со, Т). На рис. 2.53 в одинаковом масштабе показаны зависи-
мости С(т) для режимов ИС-н и ИВ при протекании реакции
первого порядка с константой скорости к = 1. Из графиков
видно, что для достижения одинаковой степени превращения
или одинаковой конечной концентрации Ск условное время в
режиме идеального вытеснения тив меньше той же величины в
режиме идеального смешения тис, т. е. тив < тис. Соответственно
так же будут соотноситься объемы реакторов: vp ив < v„ ис, т. е.
процесс в режиме ИВ интенсивнее процесса в режиме ИС.
Для подтверждения этого результата для других реакций вос-
пользуемся графическим методом решения уравнений матема-
тических моделей процессов (2.135) и (2.150). Представим их в
следующем виде соответственно:
Cq л/"* г г
(2.154а) и тис = -0 к . (2.1546)
СКГ(С) г(Ск)
Здесь использовано соотношение IkIC) = -г (С). Зависимость
обратной скорости реакции 1/г от концентрации С представлена
на рис. 2.54 вогнутой кривой. Поскольку г (С) в большинстве
случаев - монотонно растущая с концентрацией С функция (по
крайней мере, такие здесь рассматриваются), обратное ее значе-
ние - функция убывающая. При С -> 0 г ~*(С) -> оо [для обрати-
мой реакции г -|(С) -> оо при С -> Ср, как показано на рис. 2.54
125
Рис. 2.53. Зависимость С (т) в проточных реакторах идеального вытеснения
(ИВ) и идеального смешения (ИС)
Рис. 2.54. Зависимость обратной величины скорости реакции г от концентрации
С и определение условного времени в реакторах идеального смешения (тис) и
идеального вытеснения (тив). Пунктир - 1/г (С) для обратимой реакции
пунктиром]. Площадь под кривой подынтегральной функции
г-,(0 в интервале между Ск и Q равна интегралу от этой
функции в этом же интервале, т. е. равна тив - см уравнение
(2.154а) и соответствующий заштрихованный участок на рис.
2.54.
Условное время в режиме ИС тис есть произведение обрат-
ной величины скорости реакции при конечной концентрации
г-,(СК) и разности концентраций Q - Ск. В координатах С-
г -| это произведение есть площадь прямоугольника со сторона-
ми Со - Ск и г '(Ск), что показано также на рис. 2.54. Для всех
уменьшающихся зависимостей г-1(0 всегда тив < тис. Численное
сопоставление тив и тис при протекании реакции первого поряд-
ка можно провести по данным, приведенным ниже (приведены
значения кт, поскольку в модели процесса этот параметр всегда
можно выделить):
^ТИВ ........
^ТИС ........
0,05 0,1 0,2 0,5 0,8 0,9 0,95 0,99
0,051 0,105 0,22 0,69 1,61 2,3 3,0 4,6
0,053 0,111 0,25 1,00 4,00 9,0 19 99
Из приведенных данных видно, что при х < 0,1
интенсив-
ности процессов в режимах идеального смешения и вытеснения
одинаковы (разница менее 5%). С увеличением х различие резко
возрастает. Режим ИВ интенсивнее режима ИС почти в 4 раза
при х = 0,9 и более чем в 20 раз - при х = 0,99. Соответственно
будут различаться и объемы реакторов.
Это объясняется следующим. Реакция протекает при условии
(концентрации), которое создается в реакторе. В реакторе ИВ
концентрация уменьшается от Q до Ск. Скорость превращения
126
также будет уменьшаться от максимальной при Сд на входе до
минимальной при Ск на выходе. В режиме ИС все превращение
протекает при конечном значении концентрации Ск, т. е. с ми-
нимальной скоростью. Поэтому тив < тис, что и было получено
выше из анализа уравнений
Проточный реактор идеального смешения удобен для про-
цессов с медленной реакцией, когда необходимое время состав-
ляет минуты или десятки минут. В этом случае в емкости с пе-
ремешиванием можно обеспечить необходимое достаточно
большое т. Реактор ИВ будет представлять собой длинную уз-
кую трубу (чтобы реализовать поршневое течение) с большим
гидравлическим сопротивлением. Но процесс в режиме ИС ме-
нее интенсивен, чем при ИВ, и объем реактора ИС может ока-
заться очень большим. Компромиссом является последователь-
ность (каскад) реакторов в режиме идеального смешения, рас-
смотренная далее, в разд. 3.10.1.
Реакторы с различным режимом движения потока при про-
текании сложных реакций сравнивают не только по интенсив-
ности, но и по селективности процессов в них. Селективность
процесса S есть интегральная величина из значений дифферен-
циальной селективности S'. Последняя зависит от концентра-
ций реагентов. В режиме ИС весь процесс протекает при ко-
нечном значении концентрации исходного компонента Ск, а в
режиме ИВ концентрация меняется от начальной Сц до конеч-
ной. На рис. 2.48,а приведена зависимость 5' от концентрации
для параллельной схемы превращения. Поскольку процесс в
режиме ИС протекает при конечной концентрации Ск, то и
селективность процесса будет равна дифференциальной при
этой же концентрации - S'(CK). В режиме ИВ селективность
процесса будет равна среднеинтегральной величине между
S'(Cq ) и Из рис. 2.48,а можно получить
‘-'ив *^ис ДЛЯ П\ nj, *^ив ** *$ис ДЛЯ И| > Hj,
*^ив < ‘-'ис ДЛЯ П\ < П2-
При п\ > П2 процесс в реакторе ИВ и интенсивнее, и селек-
тивнее. При п\ < П2 увеличение селективности процесса в реак-
торе ИВ происходит в ущерб его интенсивности.
В случае последовательной схемы превращения селектив-
ность по промежуточному продукту всегда уменьшается с глу-
биной превращения, и потому 5ИС < 5ИВ. Режим идеального вы-
теснения и более интенсивен, и более селективен. В этом режи-
ме также больше максимальный выход промежуточного про-
дукта.
127
2.7.4. Неидеальные режимы в реакторах
Организовать идеальный режим - смешения или вытеснения -
практически затруднительно. Реально всегда имеют место от-
клонения от идеальных режимов, которые вызываются рядом
причин.
Причины отклонений от идеального режима, встречающиеся
наиболее часто, следующие.
Застойные зоны возникают, если конфигурация реак-
ционного пространства такова, что не обеспечивается одинако-
вая доступность всех его частей. На рис. 2.55 показаны застой-
ные зоны (они заштрихованы), обусловленные геометрией ап-
парата (а, б) и образующиеся в зернистом слое (в). В них реаги-
рующая смесь задерживается, обмен веществом (и теплом) с
основным объемом ограничен, превращение в этих зонах проте-
кает в иных условиях. Это может сказываться на общем пре-
вращении и даже создавать аварийные ситуации. Известны слу-
чаи, когда в процессе жидкофазного каталитического окисления
в застойной зоне, как на рис. 2.55,а, скапливался каталитиче-
ский комплекс. Создавалась кислая окислительная среда, проте-
кала химическая коррозия стенки реактора, происходил разрыв
стенки с серьезными аварийными последствиями.
Циркуляционные потоки возникают в реакторах с
перемешиванием из-за конечной интенсивности перемеши-
вания. Это заметно в колонных барботажных аппаратах при
отношении высоты Н к диаметру Dan более трех (H/Dan>3) (рис.
2.56,а). Поднимающиеся пузыри газа создают довольно интен-
сивную циркуляцию жидкости и ее перемешивание. Почти иде-
альное перемешивание создается в емкостных реакторах при
H/Dan »1, но в колонных аппаратах (у них обычно ///ДН1=5-6)
время циркуляции может быть сопоставимо со временем проте-
кания реакции, и использование модели идеального смешения
не обосновано для описания процесса. Возможно возникнове-
ние и нескольких циркуляционных зон, например в колонном
аппарате с многоступенчатой мешалкой (рис. 2.56,б).
Рис. 2.55. Варианты образования застойных зон (зачернены) в реакторах (а,
б) и в зернистом слое (в)
128
Рис. 2.56. Циркуляционные потоки в колонных реакторах
Неоднородность распределения потока обычно
связывают с неравномерными условиями для входа реакцион-
ной смеси в реактор. Пример - вход реакционной смеси в реак-
тор с зернистым слоем (катализатором) на рис. 2.57,а. Во вход-
ном патрубке,как в газоходе,скорость потока 10 - 20 м/с, а в
реакторе - нередко менее 1 м/с. Динамический напор входящей
струи “вгоняет” поток в зернистый слой. Скорость газа у пери-
ферии слоя мала. Только на некоторой глубине сопротивлением
зернистого слоя поток распределяется по всему сечению. Даже в
реакторе с интенсивным перемешиванием, как на рис. 2.57,6,
смешение вводимой реакционной смеси с ее массой в реакторе
происходит не мгновенно. И если реакция достаточно интен-
Рис. 2.57. Неоднородность распределения потока у места его ввода в реактор с
зернистым слоем (а) и в жидкофазном реакторе с перемешиванием (б)
129
Рис. 2.58. Возможные траектории движения вещества в реакторе с перемеши-
ванием (а) и распределения скорости потока по сечению полого трубчатого
реактора (б) и в зернистом слое (в)
сивна, то в зоне смешения она будет протекать иначе, чем в
объеме. Например, такое возможно в реакторах кислотного раз-
ложения апатита. В этом процессе требуется весьма строгое
поддержание концентрации кислоты - превышение ею опреде-
ленной нормы усиливает осаждение сульфата кальция. У вход-
ного участка, где подаются сырье и кислота, смешение не мгно-
венно. Могут возникнуть локальная повышенная концентрация
кислоты и усиленное осаждение сульфата кальция на поверх-
ности частиц апатита. Осадок блокирует поверхность и препят-
ствует дальнейшему растворению. В результате уменьшается
степень извлечения фосфора из сырья.
Распределение времени пребывания реакци-
онной смеси всегда имеет место в реакторах с перемешива-
нием (рис. 2.58,а). Какая-то часть входящего потока быстро
достигает выхода. Время для превращения веществ будет не-
большим. Другая часть потока долго находится в реакционной
зоне. На выходе все части потока перемешиваются. Если за
время пребывания каждой порции реакционной смеси акт хи-
мического превращения (т. е. превращения молекулы исходного
вещества в продукт) заканчивается, то распределение времени
пребывания не скажется на общем превращении. Но возможны
длительные, многоэтапные превращения. Полимеризация - по-
следовательное присоединение молекул мономера к растущей
цепочке образующегося продукта. Длина полимерной цепи за-
висит от времени проведения реакции. В проточном реакторе с
перемешиванием из-за различного времени пребывания отдель-
ных частей потока в нем на выходе будем иметь смесь полимер-
ных молекул с различной длиной цепи, или с различной моле-
кулярной массой. Неоднородность молекулярно-массового со-
става продукта сказывается на его качестве.
130
Неоднородность продукта будет иметь место и в случае про-
цесса типа “жидкость-твердое” в проточном реакторе с пере-
мешиванием. При малом времени пребывания смеси (суспен-
зии) превращение твердой частицы будет небольшим, а при
большом - превращение будет полным. На выходе при этом
получается неоднородная смесь, содержащая твердые частицы с
различной степенью превращения.
В трубчатом реакторе поток движется с различной скоростью
по оси трубки и у стенки (рис. 2.58,6). В реакторе с зернистой
насадкой (например, катализатором) последняя выравнивает
скорость по сечению. Тем не менее у стенки, где плотность упа-
ковки частиц меньше, газа будет проходить больше (рис. 2.58,в).
Различное время пребывания в центральной части слоя и на
периферии будет приводить к различному превращению в этих
частях слоя. Возникнет градиент концентраций в сечении слоя.
Он же вызовет поперечное диффузионное перемешивание. Если
оно интенсивно, то концентрация в сечении будет выравнивать-
ся, процесс можно описать моделью идеального вытеснения.
Диффузионный перенос в проточном реакторе почти
всегда имеет место вследствие возникновения градиента кон-
центраций по длине (см. рис. 2.41). Необходимо отметить, что
механизм такого переноса не только молекулярный - поток ве-
щества D3dC/dl определяется через некий эффективный коэф-
фициент диффузии D3 (например, турбулентная диффузия). И
если этот поток сопоставим с конвективным - Си (перенос ве-
щества с потоком, движущимся со скоростью и), то становится
очевидным, что его надо учитывать при построении модели.
Учет неидеальности потока в реакторе включает такие этапы
предварительных исследований. Первый этап - установление
поля скоростей потока в объеме реактора и других явлений пе-
реноса (например, диффузионного). Чаще это эксперименты с
прямым измерением векторов скоростей и другие методы аэро-
или гидродинамических испытаний. Второй этап - построение
модели, наиболее полно отражающей полученную структуру
потока и явлений переноса. Конечно, эти модели сложнее рас-
смотренных. Третий этап - анализ полученной модели с целью
выявить роль отклонений от идеальности потока в показателях
процесса. Например, такой анализ показал, что диффузионный
перенос вдоль основного потока можно не учитывать в практи-
ческих расчетах, если Lu/D3 > 50, где L - длина реактора. В спе-
циальной литературе по химическим реакторам такого рода
оценки сделаны. Можно ожидать, что в большинстве случаев
результаты расчета реактора с неидеальным потоком будут нахо-
диться в области между двумя крайними режимами - идеально-
го смешения и вытеснения.
131
Необходимо отметить, что хотя структура реального потока в
реакторе отличается от идеальной, представленные выше
“идеальные” модели практически применимы для расчета реак-
торов в очень многих случаях.
2.8. НЕИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
В ХИМИЧЕСКОМ РЕАКТОРЕ
2.8.1. Организация теплообмена в реакторе
и температурные режимы
Химическое превращение всегда связано с изменением энталь-
пии реагентов, выделением или поглощением тепла, что изме-
няет температуру реагирующей смеси. Возможен теплообмен с
окружающей средой. К ней относится и теплоноситель, с по-
мощью которого можно поддерживать желаемые температурные
условия в зоне протекания реакции.
В разд. 2.6.2 приведена классификация химических реакторов
по тепловым режимам. Общий вид технических решений по
теплообмену с реакционной зоной приведен на рис. 2.59. В схе-
мах о, б, е, ж отвод тепла осуществляется через теплообменную
поверхность непосредственно из реакционной зоны к теплоно-
сителю. В схемах в, г теплообменная поверхность вынесена из
реакционной зоны. В схеме в теплота отводится за счет испаре-
ния части реакционной смеси, которая конденсируется и воз-
вращается в реактор. В схеме г реакционная смесь циркулирует
между реакционной зоной и теплообменником, где и происхо-
дит теплообмен. В схеме д тепло отводится только за счет испа-
рения жидкости, обычно растворителя, который уносится с бар-
ботирующим компонентом. “Поджимая” вывод газового ком-
понента, т. е. изменяя давление в реакторе, можно изменить
содержание уносимых паров в газовом потоке и тем самым ко-
личество отводимого с паром тепла.
В многослойном реакторе или в последовательности реакто-
ров теплота отводитсй из межслойного пространства (или между
реакторами) при помощи поверхностных теплообменников, а
также вводом холодной (горячей) реакционной смеси или ее
компонентов. Схемы приведены на рис. 2.60. В реакторе окис-
ления SO2 (схема о) после второго слоя катализатора и после-
дующих тепло отводится через теплообменную поверхность, а
после первого слоя - вводом холодной реакционной смеси. Для
этого часть исходной смеси подогревается до необходимой тем-
пературы и направляется в первый слой, а оставшаяся часть, не
подогретая, подмешивается к горячему потоку после первого
132
Рис. 2.59. Организация теплообмена в реакционной зоне химических реакторов
И - исходные вещества, П - продукты, Т - теплоноситель. Пояснение в тексте
слоя, охлаждая его. В реакторе паровой конверсии СО в произ-
водстве аммиака (схема б) реакционная смесь после первого
слоя охлаждается путем впрыска одного из реагентов - жидкой
воды. Охлаждение происходит в основном за счет испарения
воды. В реакторах производств мономеров синтетического кау-
чука (схема в) протекают эндотермические реакции дегидриро-
вания (бутана, бутилена, этилбензола и др.). Как инертный раз-
бавитель используют водяной пар. После первого слоя темпера-
туру реакционной смеси повышают вводом высокотемператур-
ного острого пара.
Рис 2.60. Организация промежуточного теплообмена в многослойных реакторах
и в последовательности реакторов. И, П, Т - как на рис. 2.59, Хг - холодный
газ, Исп - испаритель. Пояснение в тексте
133
Многослойные реакторы и системы реакторов будут рассмот-
рены позже как часть химико-технологической системы Здесь
рассмотрим процессы в одной реакционной зоне. Как и для
изотермического процесса, анализ процесса в реакторе с тепло-
обменом будем проводить в рамках полученных моделей.
2.8.2. Режимы идеального смешения периодический
и идеального вытеснения проточный с теплообменом
Ранее была показана идентичность математических моделей
процессов в реакторах идеального смешения непроточном и
идеального вытеснения. Воспользуемся описанием процесса в
режиме ИВ (2.132а-в):
~ = IV (С,Ту
di
ср~ = Qpr(C,T) - KTFya(T - Тк\,
di
при т = 0 С = Сн, Т = ТН.
(2.155)
Для периодического процесса в реакторе идеального смеше-
ния условное время т есть время астрономическое t = т. А в слу-
чае протекания простой реакции И7 (С, Т) =-r (С, Т). Перейдя к
степени превращения х = (Со - С)/Со, приведем систему (2.155)
к виду
dx /-(С,П.
</т Со
JT = QpCo г(С,Т) ^т^уд . (2.156)
А ср Со ср
при т = 0 х = хн , Т = ТМ
Здесь использованы: Q - начальная концентрация исходного
компонента в непрореагировавшей смеси; Сн - концентрация
этого же компонента на входе в реактор, которая может отли-
чаться от Со, если в реактор подается частично прореагиро-
вавшая смесь (тогда хн * 0).
Выражение QpCq/cp = ЛТад - адиабатический разогрев - всзре-
чалось ранее (в разд. 2.5.4). Отношение скорости реакции г (С,
7) к исходной концентрации Со выразим через степень превра-
щения х и обозначим: г (С, 7)/С0 = г (X, Т). Соотношение
K-lFya/cp = B (2.157)
есть параметр теплоотвода.
134
С этими обозначениями система (2.156) приобретает более
стройный вид:
dx/ <7т = г(х,Т);
dT/dx = АТадг(х,Т) - В(Т - Тх);
(2.158)
при т = О
х = хн,
т = тн.
В этой системе только три параметра для характеристики
тепловых явлений в реакторе: А Тад, В и Тк. Если протекает
сложная по схеме превращения реакция, то первые слагаемые
правых частей дифференциальных уравнений системы (2.158)
примут вид: T.fj(x,T) и Е ^Т^г^х/Г), где индекс j относит-
j J
ся ку-й частной реакции.
Анализ процесса. Аналитическое решение в общем виде полу-
чить не удается, но тем не менее анализ процесса проведем.
В адиабатическом режиме нет теплообмена с окру-
жающей средой (теплоносителем), т. е. В = 0 и (2.158) примет
вид
dx/dx - г(х,Т);
dT /dx = &Тадг(х,Т);
(2.159)
при т = 0 х = хн, Т = ТН.
Разделим второе уравнение этой системы на первое, получим
dT/dx = А Тад. Проинтегрируем его в пределах от хн до х и от Т„
до Т. Получим разогрев реакционной смеси (Т - Тн) до дости-
жения степени превращения х:
Т- Тн = А7ад(х-х„). (2.160)
Если начальная реакционная смесь содержит только исход-
ные вещества (хн = 0) и реакция будет проведена до конца (до
х - 1), то реакционная смесь нагреется на Т - Тн = А Тад, на
величину адиабатического разогрева, что и отвечает определе-
нию А Тад.
В уравнении (2.160) очевидна линейная связь х и Т, причем
она не зависит от вида кинетической зависимости. Результат
процесса (конечная температура Т) зависит от изменения со-
стояния химически реагирующей системы (степени превраще-
ния х) и не зависит от пути превращения, от того, как оно про-
текает, от кинетики. На диаграмме “Т-х” (рис. 2.61), которой
будем пользоваться и далее при анализе процесса в реакторе,
зависимость х(Т) в адиабатическом процессе - прямая с накло-
135
Рис. 2.61. График “Т-х” для адиабатического про-
цесса:
1 - эндотермическая реакция; 2 - экзотермическая ре-
акция при ДТад; 3 — то же для А Тад >
ном (точнее, с тангенсом угла наклона
а), равным обратной величине адиабати-
ческого разогрева: tg а = 1/ЛТм. Для
экзотермической реакции наклон поло-
жительный (Ср > 0 и ДГад > 0), для эндотермической - отрица-
тельный (СР < 0 и ЛТщ > 0). Чем больше А 7^ (например, при
увеличении концентрации исходного реагента Q), тем наклон
прямой х(Т) более пологий - реакционная смесь будет сильнее
разогреваться или охлаждаться (пунктир на рис. 2.61 для экзо-
термической реакции).
Изменение Т и х с т показаны на рис. 2.62 и 2.63. По мере
протекания реакции (увеличения т) х, естественно, возрастает и
пропорционально повышается (или уменьшается для эндотер-
мической реакции) температура Т. Максимальный разогрев бу-
дет при х -> 1 и равен А 7"ад. Увеличение начальной концентра-
ции и, следовательно, Априведет к большему возрастанию
температуры и ускорению превращения (кривая 2 на рис. 2.62).
Сопоставление с изотермическим процессом. Ре-
зультат зависит от температуры последнего. Пусть изотермиче-
ский процесс осуществляется при температуре 7"0 = 7"н- Она
ниже меняющейся температуры адиабатического экзотермиче-
ского процесса и выше - в эндотермическом процессе. В первом
случае изотермический процесс будет менее интенсивным, а во
втором превращение будет протекать быстрее (пунктирные ли-
нии 1 на рис. 2.62 и 2.63). Если То > Гн, то в изотермическом
режиме вначале процесс будет интенсивнее адиабатического
экзотермического. Когда температура в адиабатическом процес-
се достигнет значения То, он станет более интенсивным (пун-
Рис. 2.62. Профили температуры Т(о) и степени превращения х(б) в режиме ИВ.
Сплошные линии - экзотермический адиабатический процесс при Л.Тт (1) и ДТ^ >
> ДГад (2); пунктирные линии - изотермический процесс при температурах Д и 7j
136
Рис. 263. Профили температуры Т (а) и степени превращения х (б) в режиме
ИВ. Сплошные линии - эндотермический адиабатический процесс; пунктир-
ные линии - изотермический процесс при температурах 7) и Г2
ктирная линия 2 на рис. 2.62). В эндотермическом процессе при
То < Тн картина будет обратной (пунктирная линия 2 на рис.
2.63).
Если реакция обратима, то общий характер зависимостей
“х - т” и “ Т - т” сохраняется, но процесс будет протекать толь-
ко до равновесия. Максимальный разогрев составит Т - Гн =
= АТад[л^(7’) - хн]. Определить его можно из графика “Т-х” (рис.
2.64), на котором построены зависимости xj,(T) и прямая х(Т)
адиабатического процесса, описываемая уравнением (2.160). Из
пересечения этих зависимостей определяется максимальный
разогрев в слое - А Тмакс, как показано на этом графике.
Рассмотрим процесс в реакторе с теплоотводом. Ре-
шение системы уравнений (2.158) возможно с помощью ЭВМ. За-
висимость “Т-т” для экзотермического процесса имеет вид, по-
казанный на рис. 2.65, а. Температура входящей реакционной сме-
си Тн обычно ниже температуры хладагента Тх. Сначала допус-
тим, что реакция не протекает, происходит только нагрев потока,
температура которого постепенно приближается к Тх (пунктир
на рис. 2.65,а). Если реакция протекает, то температура будет
возрастать сильнее за счет теплоты реакции. По достижении
Рис. 2.64. К определению максимального адиабатического разогрева дГтах при
протекании обратимых экзотермической (а) и эндотермической (б) реакций;
Хр - равновесные степени превращения; прямые - адиабаты в режиме ИВ
137
Рис. 2.65. Профили температуры Т (а, в) и степени превращения т (6) в реакто-
ре с теплообменом без реакции (пунктир) и при протекании реакций
(сплошные линии) - экзотермической (а) и эндотермической (в). Две зависи-
мости “Г-г” (7 и 2) - при разных температурах хладагента Гх
Тк температура возрастает далее. Но интенсивность про-
цесса будет уменьшаться из-за расходования исходных реаген-
тов, а теплоотвод - возрастать вследствие увеличения его дви-
жущей силы - разности температур Т - Тк. Температура до-
стигнет максимального значения, когда тепловыделение и теп-
лоотвод сравняются, и затем она уменьшится до 7Х при завер-
шении реакции. Реакционная смесь при протекании эндотер-
мической реакции будет прогреваться медленнее, чем в отсут-
ствие реакции (рис. 2.65,в).
Температура внутри реактора при протекании экзотерми-
ческой реакции имеет максимальное значение, и ее контроль
весьма важен для управления режимом реактора. Это сечение
наиболее опасное и его называют “горячей точкой”. Во-первых,
ее температура Тгтне должна превышать допустимую в данном
процессе, а ее уменьшение снижает общую температуру и ин-
тенсивность процесса в целом. Поэтому желательно Тт т поддер-
живать вблизи допустимой. Во-вторых, положение (расстояние
от входа потока в реактор) Тг т изменяется с изменением условий
эксплуатации реактора, что затрудняет ее измерение (контроль
процесса). В-третьих, изменение условий эксплуатации наибо-
лее сильно сказывается на значении Ггт, и даже небольшие из-
менения условий могут привести к значительному превышению
максимально допустимой температуры. Влияние изменения
на профиль температур показано на рис. 2.65,а.
138
Интерпретация результатов исследования модели для реального
объекта - реактора. Исследованная модель описывает процесс в
реакторах идеального вытеснения и периодическом идеального
смешения. Для первого режима зависимости х(т) и 7(т) показы-
вают изменение степени превращения и температуры по длине
реактора, но они постоянны во времени; для второго режима
х и Т изменяются во времени, но по объему реактора они одина-
ковы в каждый момент времени. Характер распределения кон-
центраций (степени превращения) и температуры по объему
этих реакторов и во времени такое же, как в случае изотермиче-
ского процесса.
2.8.3. Температурные режимы
в проточном реакторе идеального смешения
Анализ процесса. Математически процесс в проточном реакторе
идеального смешения описывается уравнениями (2.131*7,6). Ис-
пользуя введенные параметры Л 7^ и В, а также выражение г (х,
Г), опишем процесс системой
х/т = r(x,T)\ 1
) (2.161)
Т/т = ДТадг(х,П - В(Т - Тх).{
В адиабатическом режиме (параметр теплоотвода
В = 0):
(х - хн)/т = r(x,T); 1
I (2.162)
(Т-Тн)/т = ЛТадг(х,Т).]
Разделив второе уравнение на первое, получим линейную
связь между х и Т Т - Тн = ДТаа(х - хн), совпадающую с урав-
нением (2.160) для режима идеального вытеснения. В обоих
режимах величина разогрева совпадает при одинаковой степени
превращения, т. е. конечный результат не зависит от пути про-
цесса.
Профили температуры и степени превращения в реакторе бу-
дут иметь ступенчатое распределение подобно изотермическому
режиму (см. разд. 2.7.2) - рис. 2.66,а,б. На графике “Т- х” ре-
жим в реакторе будет представлен двумя точками - начальной
при хн, Тн и в реакторе с заданным т при получаемых в нем х и
Т (рис. 2.66,в). Семейство точек при разных т будет лежать на
кривых Т(т) и х (т), показанных на рис. 2.66,а,б и описываемых
системой (2.162), и в координатах “Г - х” на прямой Т= Тн +
+Д7'ад(х - хн), показанной на рис. 2.66,в пунктиром.
139
Рис. 2.66. Профили степени превращения х (т) (а) и температуры Дт) (б), гра-
фик “Г-х” (в) для проточных реакторов ИС с различными значениями услов-
ного времени т,- (реакция экзотермическая)
Рассмотрим решение системы (2.162) в случае протека-
ния реакции первого порядка и хн = 0:
х/т = к(Т)(\ - х); 1
) (2.163)
(Т -Тн)/т = ДТадЛ(Т)(1-х).]
В этой системе подчеркнуто, что от температуры Т зависит
константа скорости реакции к(Т). Перейдем от системы (2.163)
двух уравнений к одному, для чего из первого уравнения си-
стемы (2.163) выразим х как функцию Т.
v
1 + к(Т)т
и подставим во второе уравнение:
7’-7'» = 4Г-ТЖ- <21И)
Подобное уравнение (2.125) было проанализировано в разд.
2.5.4 (тепловые явления на непористом зерне катализатора).
Если переобозначить k(T\t как к/$3, то уравнения (2.164) и
(2.125) полностью совпадают. Из анализа уравнения (2.125) бы-
ло установлено: возможно одно или три решения уравнения.
Следовательно, возможно существование одного или трех ста-
ционарных режимов процесса в проточном реакторе идеального
смешения при одинаковых условиях (как одного или трех ста-
ционарных режимов на непористом зерне катализатора). Из
трех режимов два - устойчивые и один - неустойчивый. В разд.
2.5.4 было дано определение устойчивости стационарного ре-
жима, получено условие устойчивости в общем виде, показан
гистерезис стационарных режимов при изменении температуры
потока. Все эти выводы и их интерпретация для процесса при-
менимы здесь для адиабатического процесса в проточном реак-
торе идеального смешения.
140
Рис. 2.67. К определению числа стационарных
режимов в проточном реакторе ИС в адиабати-
ческом режиме (сплошные линии) и с теплоот-
водом (пунктир) при различных значениях
параметра теплоотвода В (стрелка указывает
направление увеличения значений В)
Процесс с теплоотводом.
Обсудим влияние теплоотвода на чис-
ло стационарных режимов. При про-
текании реакции первого порядка си-
стему (2.161) преобразуем, как это
было сделано при получении уравне-
ния (2.164):
т _ То + ВтТк = к(Т)х
1 + Bi ,1 + Вт 1 + А:(7>'
?т ?р
(2.165)
Как и в (2.125), левая часть уравнения обозначена как теп-
лоотвод, правая - др как тепловыделение. На рис. 2.67 сплош-
ными линиями показаны зависимости qp (Т) и </,( Т) в адиабати-
ческом режиме (В — 0), а пунктиром - в режиме с теплоотводом
(В * 0). В условиях теплоотвода постоянный коэффициент в qp -
выражение ДТ’ад/(1 + Вт) - меньше, чем в адиабатическом ре-
жиме, и S-образная кривая qp( Т) станет более пологой. Вследст-
вие теплоотвода максимальный разогрев в реакторе будет мень-
ше адиабатического и равен Д 7^/(1 + Вт). При некотором зна-
чении параметра В возможен только один стационарный режим.
Подбирая То и Тк [значение параметра (То + ВтТ^)/(1 + Вт), при
котором прямая q7(Т) пересекает ось абсцисс], можно будет по-
лучить любое заданное превращение в таком реакторе с устой-
чивым режимом в нем.
Неоднозначность и неустойчивость стационарных режимов
проявляются при масштабном переходе от лабораторных иссле-
дований к промышленному реактору. Температуру в лаборатор-
ном реакторе приходится поддерживать искусственно вследст-
вие больших тепловых потерь из-за малого масштаба, и практи-
чески любой режим устойчив. Пусть лабораторные условия по-
зволили определить из каких-то соображений наилучший режим
- температуру Т и степень превращения х. В промышленном
реакторе потери малы, процесс протекает адиабатически и мож-
но определить входные условия, например температуру входа
Т„ = Т - ДГадХ Но полученный режим может оказаться не-
устойчивым, и подобранная в лабораторном реакторе темпера-
тура может быть не реализуема в промышленном масштабе.
141
т
б
Рис. 2.68. Зависимость х (т) (а) и Т(г) (б) в проточных реакторах ИВ (сплош-
ные линии) и ИС (пунктир) в адиабатическом реакторе
Сопоставление адиабатического процесса в проточных режимах
идеального смешения и вытеснения. Полагаем, что в режиме ИС
реализуются все возможные степени превращения. Сравниваем
интенсивности процессов в этих режимах, т. е. зависимости “х-
т” при одинаковых параметрах и условиях процессов. Сначала
рассмотрим экзотермический процесс. Соответствующие зави-
симости приведены на рис. 2.68. В режиме идеального смеше-
ния процесс протекает при конечных (температура и концент-
рация) условиях, а в режиме идеального вытеснения условия
протекания процесса меняются от начальных до конечных. По-
этому в режиме ИВ средняя концентрация исходных веществ
больше, а средняя температура - меньше. Температурное влия-
ние на скорость превращения - положительное и более силь-
ное, чем отрицательное влияние концентрации. Сравните: пусть
Тн = 500 К; Л Тад = 200 град; х = 0,5. Средние условия протека-
ния процесса в режиме ИВ: х » 0,25; Т = Гн + Л 7^ х а 550 К. В
режиме ИС: х = 0,5; Т = 600 К. Скорость реакции, пропорцио-
нальная 1 - х; в режиме ИВ будет в 1,5 раза выше, чем в режиме
ИС. Но разница в температурах в 50 градусов дает выигрыш в
скорости реакции для режима ИС примерно в 4 раза, что пре-
вышает “концентрационные” потери. Режим идеального сме-
шения более интенсивен, чем режим идеального вытеснения -
для достижения одинаковой степени превращения условное
время процесса в реакторе ИС меньше. Только при достаточно
больших степенях превращения, когда влияние концентрацион-
ного фактора будет превалирующим, процесс в режиме ИС бу-
дет менее интенсивен. Это видно из рис. 2.68. В эндотерми-
ческом процессе режим ИВ всегда интенсивнее режима ИС.
2.8.4. Автотермический реактор
Вариант трубчатого реактора с отводом тепла из реакционной
зоны показан на рис. 2.69. Теплоносителем является исходная
реакционная смесь. Она подается в трубки реактора, в которых
142
Рис. 2.69. Схема автотермического
реактора и профиль температур в
нем
нагревается теплом экзотер-
мической реакции. Пройдя
трубки, поток направляется в
межтрубное пространство, где
и протекает реакция (на ката-
лизаторе). Выделяющееся
тепло отводится через стенку
к “холодильнику”, т. е. све-
жей реакционной смеси. Та-
кая схема реактора используется, например, в синтезе аммиака.
Размещение катализатора не в трубках, а в межтрубном про-
странстве - не принципиально для режима и определено из
конструктивных соображений.
Математически процесс описывается системой уравнений
(2.155), дополненной уравнением нагрева реакционной смеси:
cp{dTJdry) -КтРуа х( Ту -Т).
(2.166)
Это уравнение аналогично второму уравнению системы
(2.155). В нем отсутствует первое слагаемое в правой части -
реакция не протекает при нагреве свежей реакционной смеси. В
левой части стоит знак “минус” - направление нагреваемого
потока противоположно его движению в слое катализатора.
Нижние индексы “х” указывают на отношение данной величи-
ны к “холодильнику”. Условное время тх = Vx/f'Cb а удельная
поверхность теплообмена К,д х = FT/vx. Если использовать опре-
деление т = Vp/Eo и ЕуД = Х/гр для реакционного пространства,
то уравнение (2.166) примет вид
-cp(dTyJdr) =-KTFya (Ту -Т)
и вместе с (2.158) опишет процесс в таком реакторе:
dx/dx = r(x, Т);
dT / Л = ьТшг(х,Т) - В(Т - Ту);
dTy /dx = -В(Т - Ту);
при Т = О Т = Ту (х = хн);
при т = тк Гх=7’н (-^ = хн)-.
(2.167)
Первое граничное условие Т = Ту показывает, что поток,
вышедший из трубок с температурой Ту, тут же направляется в
слой катализатора, второе граничное условие - состояние пото-
143
ка на входе в реактор при т = 0. Поскольку в трубках не проис-
ходит превращения, то х = хн. Второе граничное условие опре-
деляет температуру Тн, с которой поток входит в трубки.
Граничные условия в системе (2.167) заданы на разных гра-
ницах слоя. Для численного интегрирования такой системы
используют метод “стрельбы”: подбирают значение температу-
ры То при т = 0, т. е. используют граничное условие: при т = О
Т = Тх = То; х = хн - так, чтобы в конце интегрирования, при
т = тк, выполнить условие Тх = Ты.
Профиль температур в реакционной зоне имеет типичный
для реакторов с теплоотводом вид экстремальной зависимости.
Температура хладагента - свежей реакционной смеси - будет
возрастать по мере продвижения вдоль трубок. Температурные
профили показаны справа на рис. 2.69. Процесс в реакционной
зоне протекает с теплоотводом, а в реакторе в целом - адиаба-
тически, поскольку посторонний теплоноситель отсутствует.
Поэтому разность температур между входным и выходным по-
токами равна адиабатическому разогреву ДГадх. Такой режим и
реактор называют автотермическими.
В этом реакторе можно проследить обратную связь по геплу
между выходящим и входящим потоками через стенки трубок.
Допустим, что по каким-либо причинам температура в слое
увеличится, например вследствие временного увеличения кон-
центрации, т. е. тепловыделения. Исходная реакционная смесь
будет подогреваться сильнее. Это в свою очередь приведет к
увеличению скорости реакции и дополнительному тепловыделе-
нию. Подогрев исходной смеси станет еще больше. Скорость
реакции опять возрастет, и так далее - возмущение будет нарас-
тать со временем. Прежний стационарный режим может не вос-
становиться, когда будет убран источник возмущения режима -
увеличенная концентрация. Такое поведение процесса при воз-
мущении режима встречалось дважды - в процессе на поверх-
ности катализатора и в проточном реакторе идеального смеше-
ния: неустойчивый стационарный режим. Это же указывает на
возможность существования множественности стационарных
режимов в рассматриваемом реакторе.
Решая систему (2.167) описанным выше методом, можно по-
лучить три решения с различными значениями Тх при одинако-
вых начальных условиях Тн. Это показано на рис. 2.70,а,б. Один
стационарный режим будет низкотемпературный, с небольшим
превращением; другой - с полным превращением и с очень
большим перегревом внутри реактора. Перегрев может быть в
несколько раз больше адиабатического разогрева. Третий режим
- средний между ними. Он неустойчив и потому практически не
реализуем. Варьируя Тн, получим S-образную зависимость Тн от
144
Рис. 2.70. Стационарные режимы в автотермическом реакторе. Пояснение в
тексте
?Ь (рис. 2.70,е). В некоторой области изменения Тн существуют
три режима. Если при этом процесс реализован в высокотемпе-
ратурном режиме (выделено жирной линией на рисунке) и на-
чальная температура снизилась до Т\, то процесс “затухнет” -
температура необратимо снизится в направлении стрелки. Для
вывода на прежний режим потребуется специально разогревать
реактор. Такие явления действительно имеют место в реакторе
синтеза аммиака.
2.9. ПРОМЫШЛЕННЫЕ ХИМИЧЕСКИЕ РЕАКТОРЫ
2.9.1. Общие замечания о расчете химических реакторов
Математические модели химических процессов и реакторов
включают приведенные переменные (степень превращения,
условное время, относительный размер) и коэффициенты в виде
комбинации констант, параметров и условий процесса. Показа-
тели и условия процесса, работы реактора определяются изме-
ряемыми величинами - производительностью, нагрузкой, кон-
центрацией, температурой, размерами и объемом реактора. При
расчетах процесса в реакторе постоянно приходится переходить
от показателей процесса к параметрам и переменным модели и
обратно. От аккуратности этих переходов зависит и достовер-
ность расчетов.
Параметры и переменные модели рассчитывают по форму-
лам, приведенным при их построении и преобразовании урав-
нений. Здесь надо обратить внимание на следующее.
Размерности величин, входящих в параметры. Их надо брать
такими, чтобы после подстановки физических величин в пара-
метры и переменные модели размерности всех членов уравне-
ния получались одинаковыми. Поясним на примере.
Проведены кинетические исследования реакции vaA + vbB =
=vrR и получено кинетическое уравнение г = кСд. Ско-
145
рость реакции измеряли по скорости образования продукта
[г R/(ji мин)]. Концентрация А - мольная, размерность [моль
А/моль смеси]. Исходные данные по реактору следующие: объ-
ем ур [м3]; в реактор подают реакционную смесь в количестве ЙЬ
[м3/ч] с начальной концентрацией реагентов Q [об. доля]. Про-
цесс в реакторе описывается моделью идеального смешения:
САт£о. = ИДСа), или Со - С А = А.Сд > (2]68)
или — = £(1 - х).
т
Эти три уравнения равноценны. Для расчетов, конечно,
удобнее использовать третье из них как более простое. Исход-
ные данные в тех размерностях, в каких они были получены
или заданы, дадут следующие размерности параметров модели:
к = г/СА [г R моль смесиДл • мин • моль А)]; т = гр/йЬ [ч|.
Очевидно, что размерности левой и правой частей последнего
уравнения в (2.168) не совпадают. Чтобы избежать ошибок,
можно рекомендовать такие приемы:
1. Вводить коэффициенты пересчета:
десятичных приставок (кило-, деци-, милли- и др.);
единиц измерения {джоуль - калория, тонна - килограмм,
час - секунда и др.);
в виде физических и физико-химических констант (плотность р
[г/л], молекулярная масса М [г/моль], молекулярный объем 22,4
[л/г-моль], стехиометрический коэффициент v [моль] и др.).
Все эти коэффициенты имеются в справочной литературе.
2. Безразмерные величины подставлять в их первоначальной
размерности: например, вместо [доля] - [л/л] или [кг/кг].
3. Указывать в размерности фазовое состояние: [Дж/лг град]
или [Дж/лж град] (индексы “г”, “ж” относятся к газовой и
жидкой фазам).
4. Обозначать в размерностях наименование компонента: v
[моль R], М [г/моль А] и так далее.
В результате вероятность ошибок из-за несоответствия раз-
мерностей (распространенной ошибки в вычислениях) значи-
тельно уменьшится.
В рассматриваемом случае измеренные величины скорости
реакции г надо выразить через скорость превращения компо-
нента Ид:
(/•/Mr) • (va/vr) = И/А.
(г 1 /Г мольВ 1 мольА1_ моль А1
|_л-мин]/|_ rR J мoльRJ л-mhhJ
146
Вводя пересчетные коэффициенты, их размерности удобно
записывать тут же, как показано, внизу под уравнением - при
этом легче избежать ошибок. Концентрацию Сд представим как
мольную:
Время, входящее в размерности г и Pq (и t), надо выразить в
одних единицах, например в [мин].
На соблюдение размерностей следует обращать внимание
при расчете параметров модели, являющихся комбинацией фи-
зических величин. Например, при расчете адиабатического
разогрева ДГад = QpC0/cp размерности используемых справоч-
ных значений Qp - |кДж/моль], Cq - [об. доля или л/л] и ср -
[Дж/(кг град)] не дадут необходимой размерности Д7ад [град|.
Справочные или расчетные значения коэффициента теплопере-
дачи имеют, как правило, размерность [кДж/(м2 ч град)], а
время, используемое в математических моделях химических
процессов и реакторов, чаще имеет размерность [с]. Необходимо
использовать также пересчетные коэффициенты.
Условия процесса и параметры модели нередко представлены в
различной форме. Среди данных для реактора чаще фигурируют
такие, как производительность, нагрузка, выход продукта, объ-
ем, геометрические размеры и др. В уравнениях математической
модели, по которой рассчитывают процесс в реакторе, обычно
используют степени превращения, условное время реакции и
параметры, являющиеся комбинациями физических величин -
адиабатический разогрев ДГад, параметр теплоотвода В, коэф-
фициент изменения объема смеси и др. Требуется переход меж-
ду ними. Например, заданы производительность реактора П и
состав сырья (содержание основного реагента Со). Необходимо
определить объем реактора vp при заданной степени превраще-
ния х (или выходе продукта Е). Расчет реактора производится
по его модели, в которую входят условное время реакции т, а
также Со и другие параметры в соответствующих размерностях.
Производительность П связана с нагрузкой на реактор Vq, на-
чальной концентрацией Со, степенью превращения х и стехио-
метрическими коэффициентами уд и vr соотношением
П= PqQ х уд/vr (если задана еще и селективность 5, то П =
= ^oCox5va/vr), откуда можно определить нагрузку на реактор
Ро=П/РоСоуд/ук. Конечно, при расчете Vq надо соблюдать раз-
мерности и вводить необходимые коэффициенты пересчета, как
было сказано выше. Зная Со и х, рассчитывают условное время
147
контакта. Нагрузка Го была определена ранее, и необходимый
объем реактора vp — Гот.
Сделанные замечания имеют целью еще раз обратить внима-
ние на аккуратность в подготовке данных к расчетам, ибо на
этом этапе ошибки возникают нередко, и результаты творческой
работы по научному обоснованию модели и ее тщательному
построению обесцениваются.
2.9.2. Оптимизация химических процессов и реакторов
Оптимальный означает “наилучший”. И когда говорят “опти-
мальный режим”, “оптимальный реактор”, следует выяснить: в
каком смысле наилучший? какой показатель имеет наилучшее
значение? Поскольку такими показателями могут быть: объем
реактора, степень превращения, выход продукта, селективность
процесса и т. д.; задач определения оптимального режима также
может быть несколько, в зависимости от того, какой показатель
оптимизируют. Задача оптимизации возникает почти на каждом
этапе разработки процесса и реактора. Например, при разработ-
ке или выборе катализатора определяют оптимальную пористую
структуру, обеспечивающую максимальную скорость превраще-
ния на зерне катализатора. Выбрав реактор, определяют опти-
мальные концентрации и температуру, обеспечивающие макси-
мальное превращение или выход продукта в нем. Определяют
оптимальные конструктивные размеры, обеспечивающие мини-
мальные общие затраты на реактор, и так далее. Оптимизация
химических процессов и реакторов - многовариантная задача.
Оптимизация - нахождение экстремального (минимального
или максимального) значения некой функции (критерия опти-
мизации) в допустимой области изменения переменных этой
функции, определяемой уравнениями и неравенствами.
Задача оптимизации - сугубо математическая процедура. И
когда, проведя эксперименты или расчеты процесса, указывают,
что такой-то вариант - оптимальный, это, строго говоря, не так.
Выбранный вариант лучше других удовлетворяет (нередко ин-
туитивно) каким-то требованиям или желаниям разработчика.
Но это еще не оптимизация.
Оптимизация как математическая процедура включает в себя
постановку (формулировку) задачи и ее решение.
Постановка задачи оптимизации предусматривает
следующее.
1. Установить критерий оптимизации F, экстремальное значе-
ние которого надо найти. Как отмечено выше, могут быть вы-
браны различные критерии, в зависимости от этапа исследования
или разработки. Это может быть какой-то показатель процесса,
148
максимальное или минимальное, т. е. наилучшее, значение ко-
торого желательно получить. Необходимо отметить, что в каж-
дом случае должен быть один критерий, ибо несколько крите-
риев обычно несовместимы. Одновременно обеспечить мак-
симальное превращение и минимальный объем реактора (два
критерия оптимизации) - невозможно. Для первого условия
надо иметь очень большой реактор, а для второго - небольшую
степень превращения.
2. Выбрать переменные, значения которых надо найти таки-
ми, чтобы критерий F принял экстремальное значение. Это мо-
гут быть условия процесса и/или его параметры, которые мож-
но менять. Их называют управляющими параметрами', обо-
значим их и.
3. Установить математическую связь критерия оптимизации F
с управляющими параметрами и, т. е. получить зависимость
F(u). Кроме управляющих переменных, функция F(u) может
зависеть и от других переменных х, так что критерий оп-
тимизации обычно представлен функциональной зависимостью
F(x, и). Например, необходимо получить максимум выхода про-
дукта Е (тогда Е = F), выбирая соответствующее (оптимальное)
значение т(т = и). Но т зависит от концентраций реагентов в
процессе (С & х), т. е. F(x, и) = Е(С, т). В таких случаях может
появиться необходимость в дополнительных уравнениях:
ими могут быть уравнения математической модели процес-
са. Обозначим эти уравнения Дх) = 0. В приведенном примере
fix) е Т(О.
Таким образом, задача оптимизации выглядит так:
F(x, и) = extr(w); (2.169)
Дх) = 0. (2.169а)
4. Определить ограничения, накладываемые на переменные.
Например: температура не может превышать допустимую по
условиям термостойкости материала; концентрация не должна
находиться в области его самовоспламенения; селективность не
может быть ниже заданной и т. д. Поэтому формулировка зада-
чи оптимизации дополняется неравенствами
Mmin $ м ытах, -^min х -*тах • (2-1696)
Например, Т Tms3c, Св н С Св в( Св н, Св в - нижняя и верх-
няя концентрационная границы воспламенения); S > 5mjn и т. д.
Уравнения (2.169) - (2.1696) есть общая постановка задачи
оптимизации.
Решение задачи оптимизации - определение зна-
чений и, при которых выполняется условие (2.169) при допол-
нительных связях (2.169а) и ограничениях (2.1696). В самом
149
общем случае решение ищут через определение экстремума
функции:
dF(x, и)/ди = 0.
Не всегда этим уравнением удается получить явное решение
и даже аналитическое решение для производной. Как правило,
прибегают к численным методам оптимизации, используя ЭВМ.
Суть их сводится к подбору по каким-то правилам (алгоритму)
таких значений н, при которых с некоторой точностью достига-
ется условие (2.169). Но это - предмет другой дисциплины.
Здесь рассмотрим несколько задач оптимизации с целью даль-
нейшего анализа процесса в химическом реакторе.
Теоретическая оптимизация. Получив описание химического
процесса (главным образом его кинетическую модель), проводят
теоретическую оптимизацию. Скорость превращения зависит от
концентраций реагентов и температуры. В ходе превращения
состав реакционной смеси меняется, и возникает вопрос: как
надо менять температуру по мере протекания реакции, чтобы
получить заданное превращение с максимальной интенсив-
ностью? Критерием оптимизации является т, управляющим па-
раметром - Т:
F(u) = т(Г) = f dx/r(x, Ту, Т < Гтах. (2.170)
о
Простые необратимая и обратимая реакции.
В процессе с простой реакцией концентрации всех компонентов
меняются в соответствии со стехиометрией реакции, и состав
реакционной смеси определяется единственной независимой
переменной - степенью превращения х ключевого компонента,
он не зависит от других переменных, не связан с ними. Такой
процесс называют несвязанным процессом. Максимальная интен-
сивность процесса (минимальное т) достигается, если скорость
превращения г будет максимальна при каждом значении х.
Скорость простых необратимой и обратимой эндотермиче-
ских реакций возрастает с температурой (см. рис. 2.15,а и
2.19,о). Максимально возможное ее значение будет при макси-
мально допустимой температуре Это и есть оптимальная
температура процесса: Гот = Лпах при любом значении х. Соот-
ветствующая зависимость Тош(х) для этих реакций показана
прямой 1 на рис. 2.71. Для обратимой эндотермической реакции
возникает ограничение по достижению некоторых степеней
превращения - х не может превышать равновесного значения
при максимальной температуре, определяемого пересечением
Tjnax с (см. Рис- 2.71). Для этих значений х решения не су-
ществует. Скорость обратимой экзотермической реакции имеет
150
Рис. 2.71. Оптимальные температуры Топт для
простых реакций:
1 - обратимая эндотермическая и необратимая; 2 -
обратимая экзотермическая; Хр - равновесные степени
превращения обратимых экзотермической (сплошная
линия) и эндотермической (пунктир) реакций
экстремальную зависимость от темпера-
туры (см. рис. 2.18,а). Значения Топт,
при которой скорость реакции макси-
мальна, уменьшаются с увеличением х,
как показано на рис. 2.18,6 и повторено
на рис. 2.71 (кривая 2).
При ограничении Т < Т'П1ах вначале 7ОПГ = 7тах и затем умень-
шается.
Для сложной схемы превращения при определении макси-
мальной интенсивности следует добавить ограничение на селек-
тивность процесса по компоненту, который далее обозначен R :
5 > £min- В рассматриваемых здесь последовательной и парал-
лельной схемах превращения частные реакции необратимые, и
максимальная интенсивность процесса будет при Ттах. Но огра-
ничение на селективность при этом может не выполниться.
Процесс связанный - два его показателя (х и S) взаимосвязаны в
течение процесса. Корректное решение этой задачи оптимиза-
ции возможно с применением специального математического
аппарата. Здесь приведем только конечный результат и объяс-
ним характер изменения оптимальной температуры с глубиной
превращения.
Параллельная схема превращения
Если энергии активации частных реакций £] и £2 связаны
соотношением £j > £2, то увеличение температуры будет благо-
приятно как для интенсивности, так и для селективности про-
цесса, т. е. 7ОПТ = Ттах (прямая 1 на рис. 2.72,а). Естественно,
решения не существует, если при Ттах не достигается граничное
значение селективности Если Е\ < Е2, то увеличение /’,
приводящее к интенсификации процесса, будет отрицательно
влиять на его избирательность. В этом случае вначале, когда
концентрация исходных веществ и потому скорость превраще-
ния большие, температуру можно снизить, проигрывая в интен-
сивности, но выигрывая в избирательности. По мере превраще-
ния (увеличения х) уменьшение из-за этого скорости превраще-
ния компенсируют увеличением температуры, проигрывая в
избирательности реакции. Интегральное значение S будет не
151
Рис. 2.72. Оптимальные температуры Тотл (а) для параллельной (1, 2) и после-
довательной (/, 3) схем превращения (/ - Е\ > Ец 2, 3 - Е\ < £г) и изменение
интегральной 5 и дифференциальной S' селективности процесса (6) в опти-
мальном режиме для параллельной схемы превращения
менее 5^in. Оптимальная температура Гопт - возрастающая
(кривая 2 на рис. 2.72,а). Изменение дифференциальной S' и
интегральной S избирательности в процессе показано на рис.
2.72,6.
Последовательная схема превращения
1 2
А-----> R-----> S. Если £i > £2, то оптимальная температура,
как и для параллельной схемы, равна максимальной: Гопт = ТП1ах
(прямая 1 на рис. 2.72). Поскольку в последовательной схеме
избирательность по промежуточному продукту R уменьшается
по мере протекания процесса (см. рис. 2.50), то степень пре-
вращения в нем ограничена для выполнения условия S > £min,
что отмечено на рис. 2.72,6. Если £( < £2, то процесс можно
начать при максимальной температуре. Скорость превращения
будет максимальной. Избирательность превращения близка к
единице, поскольку еще не накопился промежуточный компо-
нент R. По мере его накопления температуру уменьшают. Сни-
жение интенсивности процесса сопровождается подавлением
скорости превращения R в S (£2 > £р, т. е. в конечном счете
выигрышем в избирательности. Малая интенсивность процесса
в конце компенсирована максимальной в начале. Изменение
?опт5 $ и £ в процессе показано на рис. 2.72.
Зачем нужна теоретическая оптимизация? Здесь не опреде-
ляется, как технически реализовать оптимальный режим. Да это
и практически невозможно - надо сложным образом непрерыв-
но менять условия теплоотвода по мере протекания реакции,
чтобы следовать 7^пт.
Во-первых, теоретический режим - условие максимальной
интенсивности процесса, предельный показатель. По степени
приближения к нему можно судить о совершенстве организации
процесса в реакторе.
152
Рис. 2.73. К выбору реактора и оптимизации его режима: схема многослойного
реактора с промежуточными теплообменниками (с); графики “Т-х" при проте-
кании обратимой экзотермической (б) и эндотермической (в) реакций; хр -
равновесные степени превращения; 7^>пт - оптимальные температуры
Во-вторых, вид зависимости Гопт(х) позволяет сделать пред-
варительный выбор типа реактора среди множества возможных
и сделать принципиальный вывод о характере температурного
режима в нем. Окисление SO2 в SO3 - обратимая экзотермиче-
ская каталитическая реакция. Оптимальная температура умень-
шается с увеличением степени превращения (кривая 2 на рис.
2.71). Температура в реакторе тоже должна уменьшаться по мере
протекания процесса. Это возможно достичь в многослойном
реакторе с промежуточным охлаждением реакционной смеси.
Схема реактора показана на рис. 2.73,а. На графике “Г-х” ади-
абатический процесс в слое - прямая наклонная линия [см. рис.
2.61 и уравнение (2.160)]. Между слоями в теплообменнике тем-
пература снижается, но превращения не происходит - х не ме-
няется. В координатах “Т-х” процесс в теплообменнике будет
представлен горизонтальной линией. Режим процесса в много-
слойном реакторе - ломаная линия на этом графике (рис.
2.73,6). Она располагается вокруг кривой Топт, и температура от
слоя к слою уменьшается. Такой же тип аппарата применим и
для эндотермического процесса (дегидрирование углеводородов
в производстве мономеров для получения синтетического каучу-
ка), только между слоями поток нагревается и температура
должна быть максимальной (рис. 2.73,в).
Оптимизация реакторов. В реакторе условия теплообмена, по-
дача реагентов определены его конструкцией, и необходимо
выбрать такие режимы, которые обеспечили бы наилучшие по-
казатели процесса. Имея математическое описание процесса и
используя методы оптимизации с помощью ЭВМ, это можно
сделать. Здесь рассмотрим примеры, в которых можно произвес-
ти некоторый анализ оптимальных режимов.
153
1 2 ........... i ................... n
Рис. 2.74. Каскад реакторов идеального смешения
Каскад однотемпературных реакторов иде-
ального смешения. Схема и необходимые обозначения
показаны на рис. 2.74. Такая схема характерна для последова-
тельности жидкофазных реакторов или в многослойном реакто-
ре с псевдоожиженными слоями катализатора. Необходимо так
подобрать реакторы, чтобы их суммарный объем был мини-
мальным: X vp/ = min. Заданы нагрузка Ро, начальная Со и ко-
I
нечная Ск концентрации. Поскольку ур = Рот, критерий опти-
мизации £Vp, можно заменить на = min. В качестве управ-
i i
ляющих переменных выберем концентрации после каждого ре-
актора Cb С2, ..., С„ 1 (С„ = Ск - задано). Пусть протекает реак-
ция первого порядка. Температура во всех реакторах одинакова,
потому равны и константы скорости к в них, так что
(Q - СЬ)/т, = -fcQ;
(С2 - С,)/т2 = - кС2;
(Q- = - kQ,
Из системы получим кт:, = (С,| - С,)/С,. От критерия оптими-
зации £т/ перейдем к эквивалентному критерию:
i
С/- - l)=minC/ (/ = 1,2,...,л-1). (2.171)
Итак, для решения адачи надо найти п - 1 неизвестное. Экстре-
муму функции (2.171) отвечает такая система:
/ = 1,2,...,л-1. (2.172)
оС/ ос, к С/ )
От каждого С, зависят т в /-м и (/ + 1)-м реакторах, т. е. только
два слагаемых под знаком суммы. Это упрощает решение (2.172):
154
Из последнего выражения следует
С;_1 С, С: . С,
или -2_1-1 = —-----1, или кх; = кт1+ь (2.173)
{'14-1 '-'i '"'f + 1
а также соотношение
Cz+1 = С?/С/_1; i = 1.2,..., п - 1. (2.174)
Результат анализа следующий. Из (2.173) следует равенство
объемов всех реакторов: vp| = vp2 — ... — vpzi. Но это только для
реакции первого порядка. Если кинетика превращения иная, то
оптимальным будет различие объемов реакторов: увеличи-
вающиеся (vpi < vP2 < Грз ...), если порядок реакции больше пер-
вого, и уменьшающиеся (vP[ > vp2 > прз ...), если порядок реак-
ции меньше первого.
И хотя окончательное решение задачи оптимизации не полу-
чено, соотношение (2.174) сводит решение (п - 1)-мерной зада-
чи к одномерной: подбирают концентрацию только после пер-
вого реактора С\ так, чтобы из цепочки соотношений (2.174)
получить С„ = СК. Конечно, решение одномерной задачи опти-
мизации гораздо легче, чем многомерной.
Каскад адиабатических реакторов с проме-
жуточными теплообменниками. К этому типу отно-
сятся многослойные реакторы окисления диоксида серы, синте-
за аммиака, конверсии оксида углерода и другие, в которых
протекает обратимая экзотермическая реакция. Схема реактора
и график “Т- х” его режима показаны на рис. 2.73,о,б.
Реакционная смесь объемом Vq поступает на первый слой ка-
тализатора. Начальные значения температуры н и степени
превращения хц. На выходе из слоя их значения равны Т\ к и X].
После теплообменника температура снижается и перед вторым
слоем равна н, а степень превращения, естественно, не ме-
няется. Далее такая последовательность “реакция-теплообмен”
повторяется. Реактор состоит из п слоев. Условием максималь-
ной интенсивности процесса (критерием оптимальности F) яв-
ляется суммарный минимальный объем катализатора во всех
слоях:
F = = min (2.175)
i
для достижения заданного превращения в реакторе хк.
Управляющие параметры выбираем такие: х, (i =1, 2, ...,
л-1) - до какой степени превращения надо вести процесс в
каждом слое (на выходе из последнего слоя задано хик = хк) и
температуры перед каждым слоем 7}н(/ = 2, ... л; температура на
входе Т\ н обычно задана). Из описания адиабатического про-
155
цесса в слое [см. уравнения (2.159) и (2.160)] следует
7 -^-=Xif{x,T)dx-
Xi_}r{x,T) х._{
(2.176)
Т= TiH + ДГад(х-х1Н), (2.177)
где f (х, Т) = \/r (х, Т) - обратная величина скорости реакции.
Итак, задача свелась к определению 2(л - 1) переменных х,
(/ = 1, 2, ..., п -1) и 7}н (/ = 2, ..., п), чтобы получить минимум
значения критерия оптимизации (2.175). Задача довольно гро-
моздкая - много параметров управления, да и критерий - инте-
гральное выражение.
Проведем предварительный анализ. В оптимальном режиме
= 1 = 2,..., л; (2.178а)
дТ1Н
Т;
= Q-, / = 1,2, ...,л-1.
ОХ;
(2.1786)
От начальной температуры в слое 7} н зависит т, только этого
же слоя: 7}н входит в подынтегральную функцию - см. (2.176),
(2.177). Условие (2.178а) приведем к виду
dTiH
dr.
д Х'
= ^г~ f/(^ndx = 0.
d*/и x,_]
(2.179)
Напомним правило интегрирования определенного интеграла
по параметру а:
д db da *(а) df(x а)
£ [ /(x,a)dx = /((>)£-/(л)£ + [ ~—dx (2.180)
За о(а) da da о(а) da
От Т/н зависит переменная Т, входящая в подынтегральную
функцию f (х, 7), которую дифференцируем по 7} н как
сложную. Уравнение (2.179) примет вид
d х? х' df dT х ‘*
\f{x,T)dx = f ?L-^-dx = j fT(x,T)dx = 0, (2.181)
d/,H v. , v. , d/ dl;H r. ,
/H X,_i Х,_[ /Н X,_|
где из (2.177) получено дТ/дТщ = 1, a = df(x,T)/dT.
Возможность выполнения условия (2.181) следует из экстре-
мальной зависимости скорости обратимой экзотермической
реакции от температуры (рис. 2.75,о). Интегрирование функции
156
Рис. 2.75. Зависимость от температуры Т скорости обратимой экзотермической
реакции г (а) и функции fa (б)
fr проводится по адиабатической прямой на графике “Т-х".
Двигаясь по ней, скорость будет возрастать, а обратная ей вели-
чина f (х, Г) - уменьшаться, т. е. fr < 0 (рис. 2.75,6). По дости-
жении оптимальной температуры скорость реакции будет далее
уменьшаться, а /у >0, так что можно получить нулевое значе-
ние интеграла (2.181). Но для этого процесс обязательно должен
начинаться левее линии оптимальных температур, а заканчи-
ваться - правее.
Во втором условии оптимальности (2.1786) от х, зависят два
значения т - для z-го слоя (при каком значении х процесс в слое
надо заканчивать) и для (/ + 1)-го слоя (при каком значении х
процесс будет начинаться). Поэтому из (2.1786) следует
д£т,-
6х(-
Л/
dx.
+ 4^ = I' f^T^+ ^-X'i'f(x,T)dx = 0.
В этом выражении температура в (/ + 1)-м слое также зави-
сит от х(: Т = Tj+i n + Л7’ад(х - х,). Используя правило диффе-
ренцирования по параметру (2.188), преобразуем последнее вы-
ражение:
x'+i df dT
/(x/,T/K)-/(xj,T/+1>H) + f =
x ol aXj
Здесь dT/dXi = ЛТад, и поскольку f fj-dx = 0, третье слагае-
мое в последнем выражении равно нулю, так что получим
f(xh Tl¥) =f(xb Ti+l, н), или г (х„ TiK) = г (х„ 7}+1 н) (2.182)
- скорости реакции в конце предыдущего и в начале последую-
щего слоев равны. Это также возможно вследствие экстремаль-
ной зависимости г от Т (см. рис. 2.75,о). Процесс, заканчи-
157
вающийся в /-м слое при 7} к справа от оптимальной температу-
ры, должен начинаться при 7}+i н слева от нее. Как видим, оп-
тимальный режим в реакторе расположен вокруг линии опти-
мальных температур - вполне естественный результат.
Задача из многомерной свелась к одномерной. При заданных
71Н и %о выбирают некую степень превращения *| после первого
слоя. Затем последовательно рассчитывают начальную темпера-
туру Т2н во втором слое из (2.182); превращение во втором слое
Х2, интегрируя по х (2.181) до достижения нулевого значения
интеграла; 73|1 из (2.182) и х3 из (2.181) и так далее, вплоть до
хп. Если значение хйк совпадает с хк, то оптимальный режим
найден, если же нет, то ищут новое значение только одного
параметра Xj. На этом алгоритме построены задачи оптимиза-
ции многослойных реакторов окисления диоксида серы, синтеза
аммиака, конверсии оксида углерода и других.
Трубчатый реактор. Оптимизация режима в трубчатом
реакторе - не такая громоздкая задача. Фактически здесь один
регулируемый параметр - температура хладагента 7Х. Состав газа
и температура на входе обычно заданы. В большинстве практи-
ческих случаев Тх выбирают такой, чтобы максимальная темпе-
ратура в слое не превышала допустимой.
Кроме оптимизации режима возникают задачи оптимизации
основных конструктивных размеров реактора - диаметра и вы-
соты, размера зерен катализатора и др. Но это вопросы кон-
струирования реактора.
2.9. 3. Конструктивные элементы химических реакторов
Конструирование химического реактора направлено на обеспе-
чение необходимых условий протекания процесса в нем. Выбор
организации процесса, его режима был обсужден выше. Кон-
струкция реактора должна обеспечить реализацию этих режи-
мов. В реальном аппарате всегда имеются отклонения от устана-
вливаемых условий процесса.
Можно выделить два типа таких отклонений. Первый - ко-
лебания условий процесса - количеств потоков, состава исход-
ной смеси, давления, температуры. Обеспечение задаваемого
режима - задача регулирования условий процесса, связанная в
основном с автоматизацией производства. Другой тип отклоне-
ний (назовем их пространственными) связан с особенностями
конструкции реактора.
Неоднородности распределения потока по сечению реактора. О
них кратко было сказано в разд. 2.7.4 - входной поток не рас-
пределяется равномерно по сечению, и части объема реакцион-
ной зоны работают не в одинаковых условиях. Избежать этого
158
Ж 3
Рис. 2.76. Распределители потоков в химических реакторах. Пояснение в тексте
можно установкой специальных распределителей, некоторые из
которых показаны на рис. 2.76
Известно, что выходящая из трубы струя расширяется с уг-
лом раскрытия 12°. Чтобы обеспечить равномерное распределе-
ние вещества по сечению реактора, необходимо иметь очень
длинный конусообразный переход от входного патрубка (рис.
2.76,с). Его длину можно рассчитать, учитывая, что отношение
диаметров аппарата и входного патрубка равно пяти и более.
Поэтому устанавливают или “отбойную” пластину (рис. 2.76,6),
разбивающую входной поток, или систему конусов (рис. 2.76,в),
распределяющих поток по сечению, или профилированную сет-
ку (рис. 2.76,г), по которой поток плавно растекается по сече-
нию аппарата. Даже боковой ввод (рис. 2.76,6) не гарантирует
равномерного распределения. В месте резкого изменения гео-
метрии пространства, в котором движется поток (боковой ввод в
стенке аппарата), происходит отрыв потока от стенки. Общая
энергия потока состоит из кинетической энергии струи и стати-
ческого давления ее. Поскольку скорость и, соответственно,
кинетическая энергия струи большие, статическое давление ее
мало. Преобладают силы давления со стороны окружающей
среды и возникает течение в сторону струи. И если вдали от
входного патрубка, где струя “успокаивается”, движение потока
159
будет направлено к выходу из аппарата, у входного патрубка
скорость потока может быть направлена даже в обратную сторо-
ну (профиль скоростей по сечению аппарата показан в нижней
части рис. 2.76,д). Необходимы устройства, смягчающие отрица-
тельное влияние отрывных течений. Например, надо исключить
порог у входного патрубка.
Для распределения жидкости применяют также равномерную
ее раздачу по системе лотков со строгим поддержанием уровня
жидкости в них (рис. 2.76,е) или по системе труб с переменным
(увеличивающимся) размером отверстий (рис. 2.76,ж). Послед-
нее связано с уменьшением энергии потока по мере вытекания
его части. То же приходится делать при распределении газа че-
рез боковую поверхность труб, например при барботаже (рис.
2.76, з).
Разработка таких устройств производится методами аэрогид-
родинамического моделирования - исследованиями таких уст-
ройств на “холодных” (без реакций) физических моделях.
Смешение потоков, казалось бы, более простая задача. Но два
потока, направленные в одну трубу, перемешаются при турбу-
лентном течении на расстоянии 12, а то и 20 калибров
(диаметров) трубы. Это, во-первых, связано с большими затра-
тами. Представьте себе, что между слоями катализатора реакто-
ра окисления SO2 реакционная смесь охлаждается вводом хо-
лодного газа. Диаметр реактора 12 м. Можно оценить, что для
смешения потоков потребуется расстояние более 150 м. Во-
вторых, смешиваемые вещества могут образовывать взрывоопас-
ную смесь (аммиак с воздухом в производстве азотной кислоты,
углеводороды с воздухом во многих процессах органического
синтеза). В каких-то частях потока до полного перемешивания
могут локально образовываться взрывоопасные концентрации,
что, естественно, недопустимо. В-третьих, до полного смешения
потоков локально могут создаваться условия для нежелательных
реакций. Например, при смешении горячего пара с углеводоро-
дами в процессах их дегидрирования локальные перегревы, пока
вещества не перемешаются и температура потока не выровняет-
ся, приведут к крекингу углеводородов.
Ускорить смешение потоков (примеры приведены на рис.
2.77) возможно профилированием газохода в месте ввода потока
(труба Вентури - рис. 2.77,а), инжекцией одного скоростного
потока в другой (рис. 2.77,6), установкой специальных устройств
для энергичного, например в вихревом потоке, перемешивания
(рис. 2.77,в,г), подачей встречных потоков (рис. 2.77,6). Хоро-
шие результаты дают так называемые статические смесители
(рис. 2.77,е). В последнем примере в трубе установлены в ряд
160
е ж
Рис. 2.77. Смесители потоков в химических реакторах. Пояснение в тексте
винтообразные вставки. Каждая из них закручивает поток в раз-
ные стороны поочередно. Даже несмешивающиеся фазы в таком
устройстве не расслаиваются. Подача реакционной смеси в ре-
актор с мешалкой не гарантирует отсутствия локальных кон-
центрационных неоднородностей. Разбрызгивание жидкости
через форсунку (рис. 2.77,ж) создает распределенный многото-
чечный ввод реагента и интенсивное его перемешивание с
основной массой в аппарате.
Исследование и разработку устройств смешения также про-
водят с использованием методов аэрогидродинамического моде-
лирования.
2.9. 4. Схемы и конструкции промышленных химических реакторов
Промышленные реакторы нужно рассматривать по следующей
схеме: общий вид, объяснение его работы, описание процесса в
нем (используя полученные модели), распределение концентра-
ций и температуры, особенности и области применения. Про-
цессы, протекающие в реакторах, были рассмотрены ранее.
Здесь в основном обратим внимание на принципиальную орга-
низацию процессов в реакторах и их особенности.
Реакторы для гомогенных процессов (рис. 2.78) - емкостные
(рис. 2.78,д-е,и,к) или трубчатые (рис. 2.78,ж,з). Емкостные
аппараты - периодические и проточные - снабжены мешалка-
ми, конструкции которых разнообразны: пропеллерные (рис.
161
Рис. 2.78. Схемы реакторов для гомогенных процессов. Пояснение в тексте
2.78, а), лопастные (рис. 2.78,6), турбинные с центральной тру-
бой, обеспечивающие наиболее интенсивное перемешивание
(реактор Вишневского - рис. 2.78,в). Особый тип мешалок - для
вязких жидкостей (рис. 2.78,г,д). Температура в реакторах под-
держивается через рубашку (рис. 2.78,о,(^вставленными тепло-
обменниками в виде змеевика или “беличьего колеса” (рис.
162
2.78, е). Реакторы, изображенные на рис. 2.78,а и в, используют
во многих процессах органического синтеза, на рис. 2.78,6 - в
производстве красок, на рис. 2.78,г и д - в производстве поли-
меров. Реакторы, приведенные на рис. 2.78,а,6,г, предназначены
для периодических процессов. Исходные вещества загружают в
начале рабочего цикла и продукты выгружают после завершения
процесса, как показано на рисунке стрелками. Реакторы, изоб-
раженные на рис. 2.78,в,6, служат для проведения в них непре-
рывных процессов.
В трубчатом реакторе (рис. 2.78,ж) теплоноситель циркули-
рует в рубашке. Реакторы, схемы которых даны на рис. 2.78,ж
и з, используют в производстве 3-хлоропрена (рис. 2.78,ж), син-
теза гликоля (рис. 2.78,з). Трубчатые реакторы используют для
термического крекинга в нефтепереработке. Реактор в виде
змеевика (рис. 2.78,з) помещают в камеру горения; такие реак-
торы называют трубчатой печью.
Синтез НС1 из CI2 и Н2 проводят в полом пламенном реакто-
ре (рис. 2.78,и). К гомогенным твердофазным реакторам можно
отнести печь коксования (рис. 2.78,к). Сырье (уголь) загружают
в камеры коксования, обогреваемые снаружи дымовым газом,
циркулирующим по вертикальным отопительным каналам. Га-
зообразные продукты непрерывно удаляются.
Реакторы для гетерогенных процессов с твердой фазой (рис.
2.79). В простейшем реакторе (рис. 2.79,а) твердое вещество
загружают в реактор, а газ циркулирует через неподвижный
слой. В таком реакторе проводят многие процессы адсорбцион-
ной очистки газов и жидкостей, например очистку природного
газа от серосодержащих соединений (от “серы”). Вначале их все
гидрируют до H2S, который затем поглощают оксидом цинка:
ZnO + H2S = ZnS + Н2О. Поглощение H2S протекает в сравни-
тельно узкой зоне слоя, послойно. По мере отработки первых
слоев сорбента зона реакции продвигается дальше (рис. 2.80).
После появления “проскока” H2S (неполного его поглощения
из-за расходования сорбента) поглотитель заменяют.
Неудобство такого процесса - его периодичность. Можно,
конечно, дать возможность медленно “проваливаться” твер-
дым частицам через реактор наподобие перетекания песка в
песочных часах и добавлять свежий твердый реагент (рис.
2.79,6). Способ простой, но время пребывания твердых частиц
будет очень неравномерным - у стенок они будут задерживаться
намного дольше, чем по оси слоя. Равномерность времени пре-
бывания твердого материала обеспечивают механически. В реак-
торе, показанном на рис. 2.79,в, скребки с направляющими ло-
патками передвигают материал по полкам и пересыпают его с
одной полки на другую. Так устроен реактор обжига серного
163
Рис. 2.79. Схемы реакторов для гетерогенных процессов с твердой фазой. Пояс-
нение в тексте
Рис. 2.80. Изменение по длине слоя / и во времени t степени превращения твер-
дого х,. и степени поглощения (превращения) газообразного х реагентов в реак-
торе очистки природного газа от сероводорода в реакторе, показанном на рис.
2.79, а
164
колчедана. Передвигают материал также на транспортере (рис.
2.79,г). Удобен и распространен процесс непрерывного движе-
ния твердого материала во вращающейся наклонной трубе (рис.
2.79,3). Классическим примером такого реактора является вра-
щающаяся печь получения клинкера в цементном производстве.
Такого типа реактор - аммиачный нейтрализатор в производстве
двойного суперфосфата.
Химические процессы “газ-твердое” протекают много интен-
сивнее при дроблении твердого реагента. В описанных выше
реакторах это сделать практически невозможно. С уменьшением
размера частиц резко возрастает гидравлическое сопротивление
слоя, возрастает вероятность их слипания, комкования. Обойти
это ограничение можно в аппаратах со взвешенным слоем твер-
дых частиц - в псевдоожиженном (рис. 2.79,е) или фонтани-
рующем (рис. 2.79,эк1) слоях, с распылительным инжектировани-
ем твердого материала через специальную форсунку (рис.
2.79,з), в режиме пневмотранспорта (рис. 2.79,w), в котором
мелкие твердые частицы пролетают реактор вместе с газом.
Основные недостатки этих способов - эрозия стенок аппарата,
дробление частиц, унос пыли и загрязнение ею газового потока.
В потоке жидкости твердые частицы легче образуют одно-
родную смесь (суспензию) из-за более близких плотностей ком-
понентов, чем в системе “газ-твердое”. Поэтому нередко при-
меняют реактор с мешалкой, подобный изображенному на рис.
2.78,6 для гомогенного процесса. Такой реактор типичен для
кислотного разложения апатита.
Реакторы для газожидкостных гетерогенных процессов (рис.
2.81). Принципиально взаимодействие газа с жидкостью осу-
ществляют тремя способами: прямоточное или противоточное
движение сплошных потоков газа и жидкости; барботаж газа
через жидкость (газ диспергирован в объеме жидкости); раз-
брызгивание жидкости в газе (жидкость диспергирована в объе-
ме газа).
В трубчатом реакторе (рис. 2.81,а) жидкость стекает по стен-
кам трубок (на рисунке показана только одна трубка) и контак-
тирует со встречным или попутным потоком газа. Это наиболее
организованный процесс - строго поддерживается поверхность
контакта фаз, равная поверхности трубок. Потоки хорошо раз-
делены. Тепловой режим поддерживается регулированием тем-
пературы трубок. Такие реакторы используют в производствах,
где нужно точно выдерживать необходимый режим и быстро его
регулировать. Обычно это малотоннажные производства тонкого
органического и неорганического синтеза.
Более интенсивное взаимодействие фаз достигается в спут-
ном (движущемся в одном направлении) газожидкостном пото-
165
Рис. 2.81. Схемы реакторов для газожидкостных процессов (г - газ, ж - жид-
кость). Пояснение в тексте
ке (рис. 2.81,6). В зависимости от скорости потоков возможны
различные режимы течения. На схеме показаны: полное рас-
слоение фаз; раздельное течение с сильно возмущенной разви-
той поверхностью контакта фаз; хорошо перемешанный газо-
жидкостной поток. Указанные режимы наблюдаются последова-
тельно с возрастанием скорости потоков, особенно газа. Ско-
рость развитого газожидкостного потока составляет несколько
метров в секунду. Такие реакторы компактны даже при необхо-
димости большого времени реакции - их делают в виде верти-
кального или горизонтального змеевика, схематически показан-
ного на рис. 2.81,6. В них достигается очень высокий коэффи-
циент объемного массообмена - до 1,2 с-1. Такого типа реактор
используется в производстве полиэтилена и окислении этилена
в ацетальдегид.
166
Более распространены насадочные реакторы (рис. 2.81,в). В
аппарат засыпана насадка - сравнительно небольшие элементы,
по поверхности которых стекает жидкость, а в пространстве
между ними, как правило, противотоком движется газ. Насадка
- кольца или элементы другой формы размером (в среднем)
10 - 50 мм. Поверхность элементов и, следовательно, поверх-
ность контакта фаз составляют сотни квадратных метров в кубо-
метре слоя, и потому взаимодействие фаз достаточно интенсив-
но. Коэффициент объемного масообмена достигает 0,5 с-1. Он
ограничен тем, что жидкость стекает только под действием силы
тяжести. При достаточно большом газовом потоке последний
захватывает жидкость, препятствуя ее стеканию. Это - режим
“захлебывания”, хотя в узком интервале при нем наблюдается
аномально большое увеличение массообмена.
Простейшее взаимодействие жидкости и газа - барботаж по-
следнего через жидкость (рис. 2.81,г,д) и разбрызгивание жид-
кости в газе (рис. 2.81,е). Интенсивность взаимодействия фаз
при барботаже зависит от скорости всплытия пузырей и их раз-
мера. Скорость всплытия определена гравитационными силами
и потому ограничена. Размер пузырей можно варьировать в
ограниченных пределах - в свободном барботажном слое мелкие
пузыри сливаются, а крупные - неустойчивы и быстро распада-
ются. Объемный коэффициент массообмена в свободном барбо-
тажном слое, как правило, не превышает величины 0,3 с-*.
Мелкие пузыри, размер которых зависит от выходного от-
верстия в барботере, удается сохранить в тонком слое жидкости.
Это удобно сделать в многослойном реакторе как с переливны-
ми устройствами (рис. 2.81,ж), так и с ситчатыми провальными
распределителями потока - тарелками (рис. 2.81,з). В реакторе с
разбрызгивателем (рис. 2.81,е) мелкие капли более устойчивы в
размерах, но скорость их падения определена силами гравита-
ции и захватом потоком газа (особенно для мелких капель).
Массообмен между фазами можно интенсифицировать, если
жидкость диспергировать специальными форсунками: они зна-
чительно развивают поверхность контакта фаз и скорость их
движения. Но это же добавляет трудности в последующем сепа-
рировании газа и жидкости.
Реакторы для гетерогенно-каталитических процессов. Наиболее
распространены реакторы с неподвижным слоем катализатора
(рис. 2.82). Для адиабатического режима катализатор в виде час-
тиц различной формы засыпан в аппарат (рис. 2.82,а). Харак-
терный размер частиц (зерен катализатора) - 3-8 мм. Слой рас-
полагается на жесткой опорной решетке, выдерживающей вес
катализатора и перепад давления в слое. Вес загруженного ката-
167
Рис. 2.82. Схемы реакторов для гетерогенно-каталитических процессов с непо-
движным слоем катализатора (И - исходные вещества, П - продукты, X - теп-
лоноситель, Т - топливо, В - воздух, ДГ - дымовые газы). Пояснение в тексте
лизатора может составлять тонны и даже десятки тонн в круп-
нотоннажных производствах (серной кислоты, аммиака). Чтобы
мелкие зерна катализатора не проваливались и не закрывали
отверстия в опорной решетке, на нее обычно насыпают тонкий
слой крупнокускового материала, а сверху - катализатор. Ката-
168
лизатор насыпают “в навал”, после чего требуется тщательное
выравнивание слоя для обеспечения равномерного прохождения
через него реакционной смеси.
Высота слоя при протекании быстрых процессов очень не-
большая. Окисление метанола в формальдегид осуществляют в
слое серебряного катализатора толщиной в несколько сантимет-
ров, а окисление аммиака в производстве азотной кислоты - в
слое из нескольких (10 - 15) платиновых сеток (рис. 2.82,6). В
таких реакторах требуется особенно тщательное распределение
газа перед слоем.
В многотоннажных производствах с большим объемом пере-
рабатываемой смеси высота слоя и, следовательно, его гидрав-
лическое сопротивление велики. Для уменьшения энергетиче-
ских затрат катализатор располагают так, чтобы газ проходил в
радиальном направлении через слой в виде цилиндра (рис.
2.82,в) или как показано на рис. 2.82,г. Небольшая толщина и
большое поперечное сечение вытянутого вдоль аппарата слоя
позволяют в несколько раз уменьшить энергетические затраты
по сравнению с аппаратом с аксиальным ходом газа (рис.
2.82,а).
Последовательность адиабатических слоев используется в
многослойных реакторах (рис. 2.82,6). Тепло между слоями от-
водится в теплообменники или вводом холодного газа, как по-
казано на этом рисунке. Теплоносителем может быть или по-
сторонний компонент, не участвующий в реакции, или сама
реакционная смесь либо ее компоненты. Использование тепло-
ты реакции для нагрева исходной смеси и части последней для
охлаждения реагирующего газа показана на этом рисунке. В
целом процесс в реакторе протекает адиабатически, без отвода
тепла постороннему теплоносителю, но организация теплообме-
на между потоками внутри реактора создает необходимый тем-
пературный режим процесса.
Основное требование к процессу в адиабатическом слое: на
выходе из него реакция должна почти завершиться (превра-
щение - почти полное или равновесное). В противном случае
может произойти следующее. Катализатор в слое загружается “в
навал”, слой неоднороден по укладке зерен. Более плотная упа-
ковка зерен чередуется с менее плотной. Очевидно, что большая
часть газа будет проходить по пути с менее плотной упаковкой
зерен. Неоднородное распределение потока в слое приведет к
различному превращению в различных его частях, разному теп-
ловыделению, неоднородной температуре. Это внутреннее свой-
ство неподвижного зернистого слоя. Если процесс в слое близок
к завершению, то неоднородности превращения сглаживаются -
превратить больше, чем до равновесия, невозможно.
169
a
Рис. 2.83. Блочные катализаторы (а) и реакторы для них (б - реактор очистки
дымовых газов, в - автомобильный дожигатель)
Адиабатический процесс используют, если максимальный ра-
зогрев, определяемый величиной ЛТад, не превышает допусти-
мый для данного процесса. Обычно это процессы с небольшой
концентрацией исходного реагента - процессы каталитической
очистки: обезвреживание отходящих газов, очистка технологи-
ческих газов (например, очистка азотоводородной смеси от ок-
сида углерода). Адиабатический процесс используют также для
обратимых процессов, когда разогрев ограничен равновесием. В
промышленности это экзотермические процессы окисления
SO2, синтеза NH3, эндотермические процессы дегидрирования в
производстве мономеров синтетического каучука. Для полного
превращения в этих процессах используют многослойные реак-
торы.
В процессах каталитической очистки отходящих газов широ-
кое распространение получили блочные катализаторы (рис.
2.83). Их также называют катализаторами honey-comb (“пчели-
ные соты”)- Они представляют собой большой, во весь слой,
элемент, пронизанный насквозь тонкими каналами. Система
параллельных каналов обеспечивает малое сопротивление по-
току, возможность перерабатывать запыленные газы. Тонкие
стенки между каналами обеспечивают высокую степень исполь-
зования внутренней поверхности. Такие блоки изготавливают из
специального носителя или набирают из гофрированных метал-
лических пластин с нанесенным на них активным компонентом
170
(чаще - платиносодержащим как наиболее активным). Реакторы
с блочными катализаторами устанавливают в системах очистки
дымовых газов и автомобильных нейтрализаторах.
В большинстве случаев необходим отвод тепла непосред-
ственно из реакционной зоны. Это осуществляют в трубчатых
реакторах (рис. 2.82,е), по общему виду похожих на кожухо-
трубные теплообменники, - универсальный тип каталитическо-
го реактора. Обычно в трубки загружают катализатор, а в меж-
трубном пространстве циркулирует теплоноситель. Такие реак-
торы распространены во многих процессах основного органиче-
ского синтеза (получение формальдегида, фталевого ангидрида,
этиленоксида, анилина и др.). Отвод тепла из внутренней части
слоя, у оси трубок затруднен. Поэтому диаметр трубок невелик.
Для очень многих процессов он составляет 20 - 40 мм. Число
трубок зависит от производительности реактора и достигает
нескольких тысяч. Иногда даже превышает десять тысяч. В ка-
честве теплоносителей используют воду, кипящую воду, высоко-
температурное масло (трансформаторное), смесь расплавленных
солей и др. Для обеспечения теплотой эндотермических процес-
сов используют горячие дымовые газы - дегидрирование цикло-
гексанола в производстве капролактама, конверсия метана (рис.
2.82,ж). В последнем случае реактор похож не на кожухотруб-
ный теплообменник, а на трубчатую печь.
Отводить теплоту реакции из слоя катализатора можно не
только посторонним теплоносителем, но и свежей реакционной
смесью (рис. 2.82,з). В целом процесс протекает адиабатически,
но организация теплообмена между потоками позволяет устана-
вливать нужный температурный режим процесса. Реактор, на-
зываемый автотермическим, был рассмотрен в разд. 2.8.4. Осо-
бенность процесса в таком реакторе - возможность появления
неустойчивых режимов. Автотермические реакторы используют-
ся в синтезе аммиака и метанола.
В трубчатых реакторах трубки работают параллельно, и необ-
ходимо обеспечить равномерное распределение потока между
ними. Это достигают строгим выравниванием сопротивления
всех трубок при загрузке в них катализатора путем подсыпки
или удаления части катализатора.
Другая группа реакторов - со взвешенным слоем катализато-
ра - псевдоожиженным (кипящим) или восходящим (рис. 2.84).
При подаче реакционной смеси снизу слоя с достаточной ско-
ростью твердые частицы будут витать в потоке, не уносясь с
ним (рис. 2.84,а). В этом случае применяют частицы не крупнее
1 мм. Это обеспечивает полное использование их внутренней
поверхности. Циркулирующие частицы выравнивают температу-
ру в слое - процесс в нем протекает практически изотермиче-
171
Рис. 2.84. Схемы реакторов для гетерогенно-каталитических процессов со взве-
шенным слоем катализатора (И - исходные вещества, П - продукты, Ц - цик-
лон)
ски. Интенсивное движение частиц обеспечивает хороший теп-
лоотвод - коэффициент теплоотдачи от кипящего слоя более
чем на порядок превышает таковой от неподвижного слоя. По-
движность частиц дает возможность организовать течение твер-
дого материала через реактор, что существенно для процесса с
изменяющейся активностью катализатора. В процессе каталити-
ческого крекинга нефтепродуктов катализатор быстро “закоксо-
вывается”, теряет активность. Его непрерывно выводят из реак-
тора в регенератор (рис. 2.84,6), где происходит “выжиг” кокса
и восстанавливается активность катализатора. Его после этого
возвращают в реактор, обеспечивая непрерывность процесса.
Это система “реактор-регенератор”.
172
Перемешивание реакционной смеси в псевдоожиженном
слое приближает режим к идеальному смешению. Кроме того,
если скорость газа превышает скорость начала псевдоожижения,
то часть газа проходит слой в виде пузырей. Объемный коэффи-
циент массообмена между пузырями и остальной частью слоя
невысокий - не превышает 0,5 с"1. Фактически газ в пузырях
есть байпас реакционной смеси. Оба этих явления не способ-
ствуют высокой эффективности процесса в целом. Увеличить
массообмен можно, если разбить пузыри. Это делают специаль-
ной массообменной насадкой, например в виде проволочных
спиралей внешним размером в несколько сантиметров. Они
занимают 2-5% объема слоя. Насадка разбивает пузыри, уве-
личивая коэффициент массообмена до 3 с'1, тормозит переме-
шивание реакционной смеси в объеме, приближая режим к вы-
теснению. Другой способ заставить “работать” пузыри - доба-
вить в катализатор очень мелкую фракцию. Такая “пыль” попа-
дет в пузыри, где частично будет протекать реакция.
Циркуляция частиц в псевдоожиженном слое вызывает исти-
рание катализатора. Для очистки газа от пыли после реактора
устанавливают циклоны. В крупных реакторах каталитического
крекинга, размеры которых достигают диаметра 12 м и высоты
16 м, циклоны устанавливают непосредственно в корпусе реак-
тора, как показано на рис. 2.84,б.
Если изменить конфигурацию реактора (сделать его конусо-
образным), поток газа заставит катализатор циркулировать на-
правленно (рис. 2.84,в). Это фонтанирующий слой, вариант ки-
пящего.
Если скорость газового потока будет такой, что твердые час-
тицы будут захватываться им (скорость потока больше скорости
уноса), получим режим пневмотранспорта (рис. 2.84,г) и про-
цесс в восходящем потоке катализатора. Такая организация
процесса эффективна для быстрых реакций - время прохожде-
ния реакционной смеси в длинном узком реакторе небольшое.
Теплота реакции идет не только на нагрев (охлаждение) реак-
ционной смеси, но и на нагрев (охлаждение) летящего с ней
твердого катализатора, тепловая емкость которого в 300 - 600
раз больше тепловой емкости газа. Процесс протекает почти
изотермически. Отделив катализатор в циклоне, катализатор
можно нагреть или охладить в отдельном аппарате и вернуть в
реактор. Такая организация процесса оказалась очень эффек-
тивной в гидрокрекинге на новых цеолитных катализаторах.
173
Рассмотрение основных способов организации процесса в ре-
акторах не затрагивало вопросов построения их математических
моделей и анализа процессов с их помощью, конструктивных
элементов реакторов. Это можно сделать на основе предыду-
щего материала. Основное, что необходимо определить химику-
технологу при разработке или анализе реакторного процесса, -
это как лучше его организовать, предсказать его результаты,
предвидеть достоинства и трудности его реализации.
Глава 3
ХИМИКО-ТЕХНОЛОГИЧЕСКАЯ СИСТЕМА
3.1. ВВЕДЕНИЕ
3.1.1. Химико-технологический процесс
как химико-технологическая система
Химическое производство - совокупность машин, аппаратов и
других устройств, связанных между собой материальными тру-
бопроводами и паропроводами, линиями электрическими, тран-
спортными и связи (для информации и управления). Все они
взаимосвязаны и функционируют вместе, обеспечивая получе-
ние продукции и выполняя другие функции производства. Та-
кой объект называется системой.
Система - совокупность элементов и связей между ними,
функционирующая как единое целое.
Связи соединяют элементы между собой. По ним проходят
некие потоки. Входяший в элемент поток (их может быть
несколько) претерпевает изменение. Выходящий из элемента
поток (потоки) передается по связям в последующий элемент, в
котором происходит дальнейшее изменение потока. Говорят,
что связь передает информацию от одного элемента к другому (т. е.
информацию о состоянии потока, их связывающего), а эле-
мент меняет информацию о потоке (его состояние). И такая
система функционирует как единое целое. Для исследования
таких объектов, их свойств, особенностей функционирования
развита теория систем.
В химическом производстве элементы - это машины, аппара-
ты и другие устройства, связи - это материальные трубопрово-
ды, паропроводы и проч., которые соединяют машины, аппара-
ты, устройства. В элементах происходит превращение потоков
(изменение их состояния - разделение, смешение, сжатие, на-
грев, химические превращения и т.д.). По связям потоки
(материальные, тепловые, энергетические) передаются из одного
элемента в другой. Это позволяет представить химическое про-
изводство как химико-технологическую систему.
Химико-технологическая система (ХТС) - совокупность аппа-
ратов, машин и других устройств (элементов) и материальных,
175
тепловых, энергетических и других потоков (связей) между ни-
ми, функционирующая как единое целое и предназначенная для
переработки исходных веществ (сырья) в продукты.
Как было сказано, элемент изменяет состояние потока. Это
может быть отдельный аппарат (реактор, смеситель, абсорбер,
теплообменник, турбина и т. д.) или их совокупность, про-
изводящая какое-то изменение состояния потока. Отдельный
аппарат - элемент. Но каскад реакторов с теплообменниками и
смесителями потоков между ними тоже производит изменение
химического состава, и эту совокупность аппаратов также мож-
но представить как элемент ХТС. Степень детализации элемен-
та: один аппарат или совокупность нескольких аппаратов; со-
став такой совокупности зависит от задачи исследований
(определить те или иные показатели химико-технологического
процесса, определить особенности функционирования и т. д.).
С другой стороны, реакционный узел также можно предста-
вить как систему - совокупность реакторов, теплообменников,
смесителей (элементов) и потоков между ними (связей), функ-
ционирующую как единое целое. По отношению к ХТС в целом
это - подсистема как часть большой системы.
В зависимости от цели исследования не все аппараты будут
влиять на интересующие исследователей свойства ХТС. Если
цель исследований - определение производительности, выхода
продукта и другие материальные показатели, то теплообменни-
ки, насосы и другое оборудование, не изменяющее состав пото-
ков, можно не включать в ХТС, которая для этих целей будет
представлять анализируемое производство. Если цель исследо-
ваний - обеспечение производства энергией, то в систему вклю-
чают энергетическое оборудование как ее элементы.
Фактически исследование сложных ХТС сводится к изуче-
нию ее подсистем. Подсистемы могут быть выделены как по
масштабу, так и функционально. Реакционный узел - по мас-
штабу малая подсистема во всем технологическом процессе пе-
реработки сырья в продукты. Энергетическая подсистема по
масштабу охватывает все производство, но выполняет опреде-
ленную функцию. Тогда производство в целом можно предста-
вить как ХТС, в которой элементами являются исследованные
подсистемы. В дальнейшем термин ХТС будет применяться как
к производству в целом, так и к его частям, подсистемам. Эле-
мент таких ХТС был определен выше.
Потоки между элементами ХТС передают вещество, энергию,
информацию для управления процессами. Связь в теории си-
стем и поток в химико-технологическом процессе - синонимы.
Представив химическое производство как химико-техноло-
гическую систему, можно использовать теорию систем для его
исследования, получить научный метод его изучения
176
3.1.2. Системный анализ - метод исследования
химико-технологической системы
Исследование сложных химико-технологических систем с ис-
пользованием методов и средств теории систем получило назва-
ние системного анализа ХТС. В литературе используют также и
другой термин: (“flow-sheeting”) - метод исследования ХТС, пред-
ставляющей собой “таблицу (карту) потоков” (flow sheet).
Системный анализ - результат успешного применения к ис-
следованию и разработке ХТС опыта изучения, создания и экс-
плуатации химических производств с привлечением методов,
используемых в химических, физических и математических нау-
ках, моделировании, вычислительной математике, механике,
автоматическом управлении и других разделах науки, исполь-
зуемых в инженерно-химических исследованиях и разработках.
Несмотря на некоторую неопределенность и даже всеохват-
ность понятия системного анализа, можно установить пример-
ную последовательность этапов исследования и анализа ХТС:
1. Выделение элементов, которые определяют интересующие
или необходимые свойства ХТС.
2. Установление зависимостей выходных потоков от входных
для каждого элемента, т. е. получение математического описа-
ния его и определение свойств и особенностей. Поскольку в
элементах ХТС происходят превращения потоков, то их описа-
ние основывается главным образом на физико-химических и
физических закономерностях протекающих в них процессов.
3. Выделение связей между элементами, ответственных за
проявление интересующих свойств ХТС.
Таким образом определяется структура системы (ХТС) - со-
вокупность элементов и связей. Математические описания эле-
ментов создают основу количественных расчетов при исследо-
вании системы. Эти этапы требуют знаний о процессах и прак-
тического опыта.
4. Исследование ХТС - расчет показателей, определение
свойств (особенностей), изучение эволюции (развития, измене-
ния) ХТС для улучшения ее показателей и свойств. Здесь ис-
пользуются принципы и методы различных областей науки -
кибернетики, топологии, теорий информатики, игр, решений,
катастроф, факторного анализа. Большое значение в исследова-
нии сложных систем имеет накопленный опыт исследования
химических производств - так называемые “эвристические ре-
шения”, или эвристики.
Описание системы, состоящей из сотен элементов и связей, -
сложная совокупность алгебраических, дифференциальных и
интегральных уравнений. Поэтому основное средство системно-
го анализа - электронно-вычислительные машины, компьютеры.
177
3.2. ХИМИКО-ТЕХНОЛОГИЧЕСКАЯ СИСТЕМА
3.2.1. Состав и структура химико-технологической системы
Химическое производство состоит из десятков и сотен разно-
родных аппаратов и устройств, связанных между собой разнооб-
разными потоками. Исследовать его в целом при огромном
многообразии его составных частей - задача не только сложная,
но и малоэффективная. Представив химическое производство
как химико-технологическую систему, проведем дальнейшую
систематизацию частей производства, представленных в струк-
туре ХТС. Цель систематизации - выделить подсистемы ХТС
для их исследования и изучения. Будем выделять подсистемы по
двум признакам - функциональному и масштабному.
Функциональные подсистемы обеспечивают выполнение
функций производства и его функционирования в целом.
Технологическая подсистема - часть производства,
где осуществляется собственно переработка сырья в продукты,
химико-технологический процесс.
Энергетическая подсистема - часть производства,
служащая для обеспечения энергией химико-технологического
процесса. В зависимости от вида энергии: тепловая, силовая,
электрическая - может быть представлена соответствующая под-
система.
Подсистема управления - часть производства для
получения информации о его функционировании и для управ-
ления им. Обычно это - автоматизированная система управле-
ния технологическим процессом (АСУТП).
Примерно так же функциональные подсистемы представлены
в технической документации по производству. Напомним, что в
зависимости от цели исследований каждая из подсистем может
быть представлена несколькими видами. Совокупность функ-
циональных подсистем образует состав ХТС.
Масштабные подсистемы выполняют определенные функции
в последовательности процессов переработки сырья в продукты
как отдельные части химико-технологического процесса. Как и
в структуре математической модели процесса в реакторе (см.
рис. 2.6), масштабные подсистемы ХТС также можно системати-
зировать в виде их иерархической последовательности - иерар-
хической структуры ХТС (рис. 3.1).
В структуре ХТС минимальный элемент - отдельный аппарат
(реактор, абсорбер, ректификационная колонна, насос и про-
чее). Это - низший масштабный уровень I. Несколько аппара-
тов, выполняющих вместе какое-то преобразование потока, -
элементы подсистемы II масштабного уровня (реакционный
178
узел, система разделения многокомпонентной смеси и т. д.).
Совокупность подсистем второго уровня как элементы образуют
подсистему III уровня (отделения или участки производства,
например в производстве серной кислоты - отделения обжига
серосодержащего сырья, очистки и осушки сернистого газа,
контактное, абсорбционное, очистки отходящих газов). К этим
же подсистемам могут относиться водоподготовка, регенерация
отработанных вспомогательных материалов, утилизация отхо-
дов. Совокупность отделений, участков образует ХТС произ-
водства в целом. Описанное выделение подсистем условно. В
каких-то задачах выделение подсистем, элементов может быть
иным.
Иерархическая структура ХТС позволяет на каждом этапе со-
кратить размерность исследуемой задачи, а результаты изучения
подсистемы одного производства использовать в исследованиях
другого. Иерархическую последовательность масштабных под-
систем можно выделить также в функциональных подсистемах.
3.2.2. Элементы и связи химико-технологической системы
Проведем дальнейшую систематизацию элементов ХТС. В опи-
санной иерархической структуре отдельные аппараты или агре-
гаты предназначены для определенного изменения состояния
потока.
Классификация элементов ХТС проводится по их назначению.
Механические и гидромеханические элемен-
ты производят изменение формы и размера материала и его
перемещение, объединение и разделение потоков. Эти операции
179
осуществляются дробилками, грануляторами, смесителями, се-
параторами, фильтрами, циклонами, компрессорами, насосами.
Теплообменные элементы изменяют температуру
потока, его теплосодержание, переводят вещества в другое фазо-
вое состояние. Эти операции осуществляют в теплообменниках,
испарителях, конденсаторах, сублиматорах.
Массообменные элементы осуществляют межфаз-
ный перенос компонентов, изменение компонентного состава
потоков без появления новых веществ. Эти операции проводят в
дистилляторах, абсорберах, адсорберах, ректификационных ко-
лоннах, экстракторах, кристаллизаторах, сушилках.
Реакционные элементы осуществляют химические
превращения, кардинально меняют компонентный состав пото-
ков и материалов. Эти процессы происходят в химических реак-
торах.
Энергетические элементы осуществляют преобразо-
вание энергии и получение энергоносителей. К ним относят
турбины, генераторы, приводы для выработки механической
энергии, котлы-утилизаторы для выработки энергетического
пара.
Элементы контроля и управления позволяют
измерить параметры состояния потоков, контролировать со-
стояние аппаратов и машин, а также управлять процессами,
меняя условия их протекания. К ним относятся датчики
(температуры, давления, расхода, состава и т.д.), исполнитель-
ные механизмы (вентили, задвижки, выключатели и т.д.), а так-
же приборы для выработки и преобразования сигналов, инфор-
мационные и вычислительные устройства. Как правило, это
устройства сигнализации, системы автоматического регулирова-
ния, автоматическая система управления химико-технологи-
ческим процессом.
В каждом из перечисленных элементов могут протекать раз-
нообразные процессы и в каждый из них могут входить как со-
ставные части различные по назначению устройства. В реакци-
онный узел кроме реактора входят теплообменные аппараты и
гидромеханические устройства (смесители, распределители по-
токов). Классифицировать такой агрегат будем по его основно-
му назначению - реакционный элемент технологической под-
системы. Но в энергетической подсистеме возможна утилизация
теплоты реакции для подогрева воды в общей системе выработ-
ки энергетического пара. Тогда в энергетической подсистеме
реакционный узел будет теплообменным элементом, источник
тепла которого - результат химической реакции (сравните: в ог-
невом подогревателе тоже протекает химическая реакция - го-
рение, или окисление, топлива).
180
Как видим, в зависимости от изучаемой подсистемы один и
тот же элемент может иметь разное назначение. Котел-утили-
затор охлаждает поток в технологической подсистеме, он - теп-
лообменный элемент. В энергетической подсистеме котел-ути-
лизатор вырабатывает пар и потому он - энергетический элемент.
Возможно совмещение элементов по их назначению в одном
устройстве, например реактор-ректификатор: в нем одновре-
менно происходит и химическое превращение, и компонентное
разделение смеси (массообменный элемент).
Несмотря на относительность признаков назначения элемен-
тов ХТС, приведенная классификация элементов позволяет про-
водить исследования более систематично.
Классификация связей (потоков). Потоки между аппаратами
(связи между элементами) классифицируют по их содержанию:
Материальные потоки переносят вещества и мате-
риалы по трубопроводам различного назначения, транспортера-
ми и другими механическими устройствами.
Энергетические потоки переносят энергию в любом
ее проявлении - тепловую, механическую, электрическую, топ-
ливо. Тепловая энергия и топливо для энергетических элемен-
тов передаются обычно по трубопроводам (пар, горячие потоки,
горючие газы и жидкости), механическая энергия - также по
трубопроводам (в виде газов под давлением) или через вал дви-
гателей и другие элементы привода. Провода, силовые кабели
передают электрическую энергию.
Информационные потоки используются в системах
контроля и управления процессами и производством. Исполь-
зуются электрические провода и тонкие, капиллярные, трубки в
пневматических системах.
Структура связей. Последовательность прохождения потоков
через элементы ХТС определяет структуру связей и обеспечи-
вает необходимые условия работы элементов системы. Основ-
ные типы структуры связей показаны на рис. 3.2. Здесь прямо-
угольники представляют элементы, линии со стрелками - связи
и направления потоков.
Последовательная связь (схема 7 на рис. 3.2). Поток
проходит аппараты поочередно. Применение: последовательная
переработка сырья в разных операциях, более полная перера-
ботка сырья последовательными воздействиями на него, управ-
ление процессом путем необходимого управляющего воздей-
ствия на каждый элемент.
Разветвленная связь (схема 2 на рис. 3.2). После не-
которой операции поток разветвляется и далее отдельные пото-
ки перерабатываются различными способами. Используется для
получения разных продуктов.
181
1
Vb
Рис. 3.2. Связи в химико-технологической системе:
1 - последовательная; 2 - разветвленная; 3 - параллельная; 4, 5 - обводная (байпас)
простая (4) и сложная (5); 6 ~9- обратная (рециркуляционная) - рецикл полный (б, 9) и
фракционный (7, 8). простой (6) и сложный (S')
Параллельная связь (схема 3 на рис. 3.2). Поток раз-
ветвляется, отдельные части его проходят через разные аппара-
ты, после чего потоки объединяются. Если мощность некоторых
аппаратов ограничена, то устанавливают несколько аппаратов
параллельно, обеспечивая суммарную производительность всей
системы. Другое применение такой связи - использование пе-
риодических стадий в непрерывном процессе. В этом случае
поочередно работает один из параллельных аппаратов. После
завершения рабочего цикла одного аппарата поток переключают
на другой аппарат, а отключенный подготавливают к очередно-
му рабочему циклу. Так включены адсорберы с коротким сро-
ком службы сорбента. Пока в одном из них происходит погло-
щение, в другом сорбент регенерируют. Еще одно назначение
параллельной схемы - резервирование на случай выхода из
строя одного из аппаратов, когда такое нарушение может при-
вести к резкому ухудшению работы всей системы и даже к ава-
рийному состоянию. Такое резервирование называют “холод-
ным”, в отличие от резервирования, обусловленного периодич-
ностью процесса, - “горячего”.
182
Обводная связь, или байпас (схемы 4 и 5 на рис.
3.2). Часть потока, не поступая в аппарат, “обходит” его. Такая
схема используется в основном для управления процессом. На-
пример, в процессе эксплуатации теплообменника условия пе-
редачи теплоты в нем меняются (загрязнения поверхности, из-
менение нагрузки). Поддерживают необходимые температуры
потоков байпасированием их мимо теплообменника. Величину
байпаса р определяют как долю основного потока, проходящего
мимо аппарата: р = Vq/Vq (обозначения потоков показаны на
рис. 3.2). Различают простой (схема 4) и сложный (схема 5)
байпасы.
Обратная связь, или рецикл (схемы 6 - 9 на рис.
3.2). Часть потока после одного из аппаратов возвращается в
предыдущий. Через аппарат, в который направляется поток Ур,
проходит поток У больший, чем основной Vq, так что V =
= И)+ ^р- Количественно величину рецикла характеризуют двумя
величинами: кратностью циркуляции Кр = V/Vq и отношением
циркуляции R = Ур/У. Очевидно, R = (кр - 1)/Кр.
Если выходящий из аппарата поток разветвляется, и одна его
часть образует обратную связь (схема 6), то такая связь образует
полный рецикл - составы выходящего потока и рециклирующего
одинаковы. Такую схему используют для управления процессом,
создания благоприятных условий для его протекания. В цепных
реакциях скорость превращения возрастает по мере накопления
промежуточных активных радикалов. Если на вход реактора
вернуть часть выходного потока, содержащего активные радика-
лы, то превращение будет интенсивным с самого начала.
Возможен возврат (рецикл) части компонентов после системы
разделения Р (схема 7). Это - фракционный рецикл
(возвращается фракция потока). Широко применяется для более
полного использования сырья. В синтезе аммиака в реакторе
превращается около 20% азотоводородной смеси. После отделе-
ния продукта - аммиака - непрореагировавшие азот и водород
возвращают в реактор. При неполном превращении реакцион-
ной смеси в реакторе в схеме с фракционным рециклом дости-
гается полное превращение исходного вещества. Фракционный
рецикл используют также для полного использования вспомога-
тельных материалов. В производстве аммиака азотоводородная
смесь получается с большим содержанием СО2. Его абсорбиру-
ют раствором моноэтаноламина (МЭА), который быстро насы-
щается диоксидом углерода. Насыщенный раствор МЭА рецир-
кулирует через десорбер, где отделяется СО2 и восстановленный
моноэтаноламин возвращается в абсорбер. К фракционному
рециклу можно отнести схему 8. Свежая смесь нагревается в
теплообменнике теплом выходящего из реактора потока. Рецир-
183
купирует тепловая фракция потока (а не компонентная, как в
схеме 7).
Схемы 6 - 8 представляют собой простой рецикл, а схема 9 -
сложный.
Приведенные выше типы связей присутствуют практически
во всех ХТС, обеспечивая необходимые условия их функциони-
рования.
3.2.3. Модели химико-технологической системы
Исследование системы, в том числе ХТС, предполагает, что
вначале она будет представлена моделью. Уже из определения
системы как совокупности элементов и связей между ними
представляется целесообразным представить ее в виде схемы,
графически. С другой стороны, качественные и количественные
показатели ее функционирования могут быть отражены словес-
ным и математическим описаниями (моделями) происходящих в
них процессов (здесь понятие модели трактуется несколько ши-
ре, чем было строго определено в разделе “Математическое мо-
делирование”: описание процесса, его схема - также модели
ХТС). Модели ХТС можно разделить на две группы: описатель-
ные (в виде формул, уравнений) и графические (в виде схем и
других графических изображений). В каждой из названных
групп также можно выделить несколько видов моделей, разли-
чающихся по форме и назначению:
А. Описательные модели: химическая; операционная; мате-
матическая;
Б. Графические модели: функциональная; технологическая;
структурная; специальные.
Здесь перечислены не все виды моделей, применяемых при
исследовании ХТС, а только те, которые будут использованы
далее.
Химическая модель (схема) представлена основными реак-
циями (химическими уравнениями), которые обеспечивают пе-
реработку сырья в продукт.
Синтез аммиака из водорода и азота представлен одним хи-
мическим уравнением:
ЗН2 + N2 = 2NH3.
Производство аммиака из природного газа (метана) требует
проведения нескольких химических реакций:
СН4 + Н2О = СО + ЗН2 - конверсия метана с водяным паром;
СО + Н2О = СО2 + Н2 - конверсия оксида углерода;
ЗН2 + N2 = 2NH3 - синтез аммиака.
184
Получение серной кислоты из серы протекает через следую-
щие превращения:
S2 + 2O2 = 2SO2 - сжигание серы;
2S2 + 02 = 2SO3 - окисление диоксида серы;
SO3 + Н2О = H2SO4 - абсорбция SO3.
Последовательность химических взаимодействий удобно
представить и такой схемой, как, например, производство соды
Na2CO3 из поваренной соли NaCl и известняка СаСО3:
W
NaCl + NH3 + СО2 + Н2О = NaHCO3 + NH4C1
f I---------
2NaHCO3 = Na2CO3 + CO2 + H2O
I
2NH4C1 + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
CaO + H2O - Ca(OH)2
CaCO3 = CaO + CO2
Эти уравнения - химическая схема - показывают генераль-
ный путь превращения сырья в продукт. Но реализация этого
превращения не ограничивается только данными уравнениями -
необходимы еще стадии, обеспечивающие эти химические пре-
образования или детализирующие их. Они представлены в дру-
гих моделях процесса.
Операционная модель представляет основные стадии
(операции) переработки сырья в продукт, в том числе обеспечи-
вающие протекание основных превращений. Производство ам-
миака будет описано следующей операционной моделью.
1) Очистка природного газа от серосодержащих соединений
адсорбцией сероводорода, который мешает дальнейшим пре-
вращениям:
H2S + ZnO = ZnS + Н2О
(почему сера в природном газе оказалась в виде только серово-
дорода, будет объяснено при рассмотрении производства ам-
миака).
2) Конверсия метана с водяным паром. И природный газ
(СН4), и вода (Н2О) являются сырьем для получения одного из
185
компонентов для синтеза аммиака - водорода Н2. В этом пре-
вращении протекают одновременно две реакции:
СН4 + Н2О = СО + ЗН2; СО + Н2О = СО2 + Н2.
3) Конверсия оксида углерода с водяным паром (в преды-
дущем процессе оксид углерода СО не полностью превращается
в СО2 из-за равновесных ограничений):
СО + Н2О = СО2 + Н2.
После этого процесса достигается максимально возможное
извлечение водорода из исходного сырья - метана СН4 и воды
Н2О.
4) Получение азота N2 - второго исходного компонента для
синтеза аммиака. В современных схемах его получают из возду-
ха “выжиганием” из него кислорода:
ЗО2 + 2СН4 = 2СО + 4Н2О.
Это - наиболее простой способ освободить азот воздуха от
кислорода, тем более, что сжигание части природного газа все
равно необходимо для обеспечения теплом всего процесса. Про-
дукты горения - СО и Н2О - участники получения водорода.
5) Абсорбция диоксида углерода - удаление СО2, полученно-
го при получении водорода. Его поглощают раствором моноэта-
ноламина:
СО2 + 2RNH2 + Н2О = (RNH3)2CO3.
6) Очистка газа от оксида углерода СО. После конверсии СО
небольшое количество СО остается, и он мешает дальнейшим
превращениям. Освобождаются от него, превращая в метан:
СО + ЗН2 = СН4 + Н2О.
7) Синтез аммиака (после всех стадий получена чистая азото-
водородная смесь; примесь СН4, полученная в предыдущей ста-
дии, мала):
ЗН2 + N2 = 2NH3.
Химическая и операционная схемы дают первое описание и
представление о производстве и его основных стадиях. Для
дальнейшего рассмотрения ХТС удобнее использовать графиче-
ские модели.
Функциональная модель (схема) строится на основе хими-
ческой и операционной и наглядно отражает основные стадии
химико-технологического процесса и их взаимосвязи. Каждая из
них представлена прямоугольником, линии между ними - связи.
На рис. 3.3 показана функциональная схема производства ам-
миака, соответствующая приведенной выше операционной мо-
186
Рис. 3.3. Функциональная схема производства аммиака. Цифры на схеме соот-
ветствуют стадиям операционной модели (см. текст)
дели. Цифры на схеме соответствуют стадиям операционной
модели (стадии 2 и 4 совмещены, что будет объяснено при рас-
смотрении производства). Элементы функциональной схемы
соединены последовательно. На рис. 3.4 показана функцио-
нальная схема производства соды, построенная на основе ее
химического описания. Она сложнее предыдущей, с параллель-
ной и обратными связями.
Представление основных операций химико-технологического
процесса в виде функциональной схемы весьма удобно для его
понимания. Она дает общее представление о функционирова-
нии ХТС и служит предпосылкой для аппаратурного оформле-
ния и более детальной разработки ХТС.
Рис 3.4. Функциональная схема производства соды
187
Рис. 3.5. Функциональная схема синтеза аммиака:
А - синтез NH3; Б - выделение NH3; В компрессия и рециркуляция
Приведем еще одну функциональную схему - синтеза аммиа-
ка, т.е. рассмотрим подсистему 7 в производстве аммиака как
ХТС. Реакция водорода с азотом протекает не полностью из-за
ограничений по равновесию. Поэтому синтез аммиака включает
три стадии:
А. Синтез аммиака ЗН2 + N2 = 2NH3;
Б. Выделение аммиака;
В. Возврат непрореагировавших водорода и азота в реактор
(стадию А).
Функциональная схема показана на рис. 3.5. Схема с рецик-
лом.
Технологическая модель (схема) показывает элементы си-
стемы, порядок их соединения и последовательность технологи-
ческих операций. В технологической схеме каждый элемент
(агрегат, аппарат, машина) имеет общепринятое изображение,
соответствующее его внешнему виду. Связи изображены обычно
линиями со стрелками или даже в виде трубопроводов. Нередко
расположение аппаратов соответствует их примерной расстанов-
ке в цехе. На технологической схеме кратко могут быть приве-
дены данные о параметрах процесса.
На рис. 3.6 приведена несколько сокращенная технологиче-
ская схема синтеза аммиака. Азотоводородная смесь поступает в
реактор 7. Нагретая за счет теплоты экзотермической реакции
прореагировавшая реакционная смесь охлаждается в трех тепло-
обменниках. В первом из них 2 газ охлаждается водой - частич-
но используется теплота реакции. В теплообменнике 3 подогре-
вается газ, направляемый в реактор. Окончательное охлаждение
происходит в воздушном холодильнике 4. Это наиболее простое
и безопасное решение. Если охлаждать водой, вода может за-
грязняться, и необходимо создать сложную замкнутую систему
водооборота, работающую на чуть теплой воде. В охлажденном
газе конденсируется аммиак (частично), и его отделяют в сепа-
раторе 5. Жидкий аммиак собирается в сборнике 6 как продукт.
Охлаждение до температуры окружающей среды недостаточно
для полного выделения аммиака, и газ из сепаратора направ-
ляется в конденсационную колонну 8. В ней газ охлаждается до
-(2-J-3) °C, так что в нем остается 3-5% аммиака. Охлаждение
188
Рис. 3.6. Технологическая схема синтеза аммиака:
1 - колонна (реактор) синтеза NH3; 2 - водяной холодильник; 3 - теплообменник; 4 -
воздушный холодильник; 5 - сепаратор; 6 - сборник аммиака; 7 - циркуляционный ком-
прессор; 8 - конденсационная колонна; 9 - испаритель
осуществляют за счет испарения жидкого аммиака в испарителе
9 (подобно аммиачному холодильнику). Испаритель может быть
совмещен конструктивно с конденсационной колонной. В ней
же аммиак отделяют от газа и направляют в сборник. Холодный
газ затем подогревают в теплообменнике 3 и возвращают в ко-
лонну синтеза 7. Обеспечивают циркуляцию потока циркуляци-
онным компрессором 7. Перед ним добавляют в циркулирую-
щий реакционный газ свежую азотоводородную смесь. На рис.
3.6 пунктиром выделены элементы функциональной схемы на
рис. 3.5. Отметим, что элемент В циркуляции газа “встроен” в
элемент Б - выделение аммиака происходит перед и после цир-
куляционного компрессора.
Технологическую схему получают в результате научной раз-
работки данного способа производства, технологической и кон-
структивной проработки схемы, узлов и аппаратов. Следует от-
метить наглядность отображения конкретного производства,
дающую почти осязаемое представление о нем. Технологические
схемы используют как при эксплуатации производства, так и
при его проектировании. Они входят в проектную и техни-
ческую документацию каждого производства.
Структурная модель (схема) в отличие от технологической
включает элементы ХТС в виде простых геометрических фигур
189
Рис. 3.7. Структурная (о) и операторная (б) схемы синтеза аммиака. Обозначе-
ния - на рис. 3.6
(прямоугольников, кругов). Изображение аппаратов обезличено,
но значительно упрощается общий вид структуры ХТС. На рис.
3.7,а показана структурная схема синтеза аммиака - та же, что
на рис. 3.6. В ней представлен общий характер структуры ХТС,
легко прослеживается направленность потоков. Изображение
даже сложной ХТС весьма наглядно, в ней удобно менять поло-
жение элементов, “проигрывая” различные варианты разраба-
тываемой ХТС. Наглядность связей позволяет легко составлять
математическое описание, прослеживая связи между элемента-
ми, что существенно при автоматизированном проектировании.
Специальные модели (схемы) применяют при анализе и расче-
тах ХТС, используя специальный математический аппарат и
вычислительные методы. Поскольку они здесь не используются,
не будем их перечислять. Упомянем только об одной из
схем - операторной схеме. Если в структурной схеме все
элементы обезличены, то в операторной каждый элемент пред-
ставлен специальным обозначением, называемым “техноло-
гический оператор”. Принятые для них обозначения показаны
на рис. 3.8. Они помогают определить по схеме, какие преобра-
зования (“операции”) происходят с потоком в элементе. Опера-
торная схема синтеза аммиака показана на рис. 3.7,5 рядом со
структурной. Зная обозначения элементов, такую схему удобно
использовать при автоматизированных расчетах на ЭВМ - каж-
дому виду элемента соответствует определенная подпрограмма
(или блок) вычислительной системы.
190
а б ▼ в г
Рис 3.8. Технологические операторы:
а - химического превращения; б - массообмена; в - смешения; г - разделения; д - теп-
лообмена; е - сжатия, расширения; ж - изменения агрегатного состояния
Математическая модель (описание). Приведенные выше моде-
ли (описания, схемы) дают общее представление о ХТС. Для
количественных выводов о ее функционировании необходимо
иметь математическую модель. Как уже было определено, си-
стема - “совокупность элементов и связей...”, и ее модель будет
представлена двумя системами уравнений - для элементов и
связей.
В элементе происходит преобразование потоков. Математи-
ческая модель процесса в элементе устанавливает связь пара-
метров выходящих потоков Yk и Л-го элемента и входящих в
него Хк. Показатели потока - это его величина, состав (кон-
центрации), температура, давление, теплосодержание и другие
параметры. На состояние потока на выходе могут влиять неко-
торые параметры Uk, которые управляют процессом или меня-
ются в процессе эксплуатации. В общем виде
Yk = F(Xk,Uk). (3.1)
Черточки над Yk, Хк, Uk означают множество параметров
(концентрации, температура и другие). Уравнения (3.1) - мате-
матические модели реактора, абсорбера, компрессора и других
аппаратов и машин. Конечно, можно использовать математиче-
ские модели, например, реакторов, рассмотренные выше. Но
поскольку при расчете ХТС важно знать входные и выходные
параметры, то используют и другие модели, которые будут рас-
смотрены далее.
Связи в ХТС определяют, из какого элемента в какой пере-
дается поток. Поскольку передача потока происходит без его
изменения, то уравнения связи в общем виде выглядят так:
Xk = at_kYL, (3.2)
где а/_* = 1 для потока, выходящего из £-го элемента и входящего в к-й эле-
мент; a/_fc = 0, если между £-м и к-м элементами нет связи.
Для входящих в ХТС и выходящих из нее потоков использу-
ют обычно индекс “0” как обозначение внешней среды.
191
Система уравнений (3.1)-(3.2) довольно громоздка и решает-
ся, как правило, с помощью электронно-вычислительных ма-
шин.
3.3. СОСТОЯНИЕ ХИМИКО-ТЕХНОЛОГИЧЕСКОЙ
СИСТЕМЫ
3.3.1. Основные понятия и определения
Чтобы судить о свойствах ХТС, показателях ее функционирова-
ния, эффективности управления процессами в ней, необходимо
определить состояние ХТС.
Состояние, или режим, ХТС определяется параметрами
(показателями) потоков (связей) и состоянием аппаратов (эле-
ментов).
Параметры потоков - химические, физико-химические и фи-
зические данные о потоке. К ним относятся:
параметры состояния: количество потока в единицу времени
(расход), фазовый состав, химический состав, температура, дав-
ление, теплосодержание;
параметры свойств: теплоемкость, плотность, вязкость и
другие.
Параметры свойств потока могут быть определены из пара-
метров его состояния и свойств индивидуальных компонентов.
Для энергетических и информационных потоков могут быть
свои показатели (напряжение и сила тока, форма и интенсив-
ность управляющего сигнала и другие характерные показатели).
Для каждой цели исследования и вида ХТС (подсистемы) не-
обходимо использовать не все данные. Если интересно распре-
деление веществ по системе, то достаточно определить величину
потоков, их химический состав и, возможно, фазовый состав,
давление. Энергетические потери в ХТС будут зависеть от вели-
чины потоков и скорости их движения, их давления, плотности,
вязкости и, очевидно, теплосодержания.
Состояние элемента (аппарата, машины, агрегата) включает
данные, от которых зависит изменение в элементе показателей
потока. Это могут быть:
регулирующие воздействия, например температура хладагента,
отводящего тепло из реактора, или подача пара в паровую тур-
бину;
изменяющиеся в процессе эксплуатации характеристики аппа-
рата и условия процесса в нем, например изменение условий
процесса в реакторе вследствие дезактивации катализатора или в
теплообменнике из-за загрязнения его поверхности.
Соответствующие данные входят в описание элемента (3.1),
они были названы управляющими параметрами. Их влияние на
192
Рис. 3.9. К определению баланса массы и тепла в ХТС:
Т - теплообменник; Р - реактор; Д - система разделения
процесс в аппарате (элементе) определяется при изучении про-
цесса и проявляется при анализе ХТС как эффект преобразова-
ния в элементе входящего в него потока в выходящий.
Далее основное внимание уделим определению состояния
всех технологических потоков в ХТС, когда данные об измене-
нии потока в элементах заданы, а также известны параметры
потоков на входе в ХТС (или на выходе, если требуется опреде-
лить необходимые для этого параметры входных потоков).
Расчет ХТС - определение параметров потоков в ХТС задан-
ной структуры и заданного состояния ее элементов.
Очевидно, что при любых изменениях состояния потоков в
элементе ХТС, ее подсистеме или ХТС в целом должны соблю-
даться законы сохранения массы и энергии.
Пусть имеется ХТС, состоящая из теплообменника, реактора
и системы разделения (рис. 3.9). В ней пунктирными линиями
окружены как оболочкой один элемент - реактор (I), подсисте-
ма - реактор с теплообменником (II) и вся ХТС (III). В каждую
из этих “оболочек” какие-то потоки входят и какие-то выходят.
Внутри каждой оболочки происходят изменения входящих по-
токов в выходящие. Фактически каждая из “оболочек” есть под-
система ХТС. В соответствии с законами сохранения массы и
энергии в стационарном состоянии должны соблюдаться сле-
дующие соотношения для подсистем,как они были представле-
ны выше:
для всех потоков
£^у',вх — Х^у, вых> J j (3.3)
для каждого z-го компонента
Е^«у,вх + SGj£,hct ~ Х^’.вых» j к j для тепловой энергии (3-4)
ЕСу.вх + £Сл,ист = £Су,ВЫХ> j к j (3.5)
здесь GjBX, бу,вых - массы у-го входящего в “оболочку” и выходящего из нее
потоков; Gj->Bb,x - масса «-го компонента в у-м входящем и выходящем
193
потоках; G;*iI1CT - источник /-го вещества внутри “оболочки” в основном
вследствие химических превращений, которых может быть несколько (к - но-
мер источника); для образующихся веществ 6(*>ист > 0, для исчезающих
< 0, для нереагирующих — 0; Qj,™, Qj,»M - теплосодержание у-х
входящего и выходящего потоков; С*,Ист ~ источники теплоты внутри
“оболочки”, которыми могут быть химическая реакция, фазовые превращения
изменение импульса потока (сжатие, расширение)
Уравнения (3.3)-(3.5) есть балансы массы и теплоты для вхо-
дящих и выходящих потоков. Поэтому расчеты ХТС называют
балансовыми расчетами или просто балансами, различая мате-
риальный баланс (3.3)-(3.4) и тепловой баланс (3.5) химико-
технологической системы и ее частей.
Материальный и тепловой балансы должны соблюдаться
всегда, независимо от того, как протекают превращения потока
внутри “оболочек”-подсистем. В результате расчета ХТС долж-
ны соблюдаться соответствующие балансы между входящими и
выходящими потоками. Конечно, расчет каждого технологиче-
ского аппарата тоже основан на балансовых соотношениях -
см., например, структуру любой математической модели реакто-
ра. Но описание процесса в отдельном технологическом аппара-
те - задача сложная сама по себе. ХТС включает много разнооб-
разных аппаратов, сложным образом связанных друг с другом.
Расчет ХТС с использованием математических моделей процес-
сов в каждом аппарате становится весьма громоздкой задачей
даже для современных ЭВМ. Нередко при разработке ХТС нет
еще проектов технологических аппаратов и, значит, отсутствуют
математические модели. Кроме того, результат расчета ХТС -
балансы потоков, и нет необходимости включать в него детали
расчета отдельных аппаратов. Поэтому в расчетах ХТС, особен-
но разрабатываемых, используют иные подходы к составлению
математических моделей их элементов, основанные на балансо-
вых соотношениях.
3.3.2. Материальный баланс
Химический состав и количество многокомпонентной смеси
позволяют определить почти все ее свойства, рассчитать количе-
ство каждого компонента и, следовательно, производительность,
расход исходной смеси, количество отходов и многое другое.
Для расчета тепловых потоков также необходимы состав и ко-
личество материальных потоков. Поэтому материальный баланс
необходим при любых расчетах ХТС.
Будем оперировать в материальном балансе общим коли-
чеством вещества (величиной потока) и количеством компонен-
тов в потоке. Концентрации как доли компонентов в потоке
194
будем использовать реже. Поскольку материальный баланс
основан на законе сохранения массы, количества веществ и
величины потоков будем определять, как правило, в массовых
величинах, обозначаемых буквой G с необходимыми индексами.
Поскольку состояния потоков меняются в элементах, рас-
смотрим различные типы элементов и составление для них ма-
териального баланса между входными и выходными потоками.
Элемент без химических и фазовых превращений (тепло-
обменник, насос, дробилка). Естественно, что ни величина по-
тока, проходящего через такой элемент, ни количество компо-
нентов в потоке меняться не будут, и (7ВХ = СВЬ1Х, Gt вх = G, ВЬ1Х.
При рассмотрении только материального баланса такие элемен-
ты можно не включать в ХТС.
Смеситель объединяет два потока:
^1.вх + ^2,вх ~ ^вых>
(3.6)
641,вх + 6д,вх — бу.вых-
Здесь индексы 1 и 2 относятся к двум входным потокам, ин-
декс i - к /-му компоненту потока. Обозначим g\, gn и gn - мас-
совые концентрации /-го компонента соответственно в смешан-
ном и в двух входящих в смеситель потоках:
(3.7)
_ ^7/,вых _ ^7/1,вх + ^7/2,вх
67 вых 67/, ах + ^2,вх
Некоторые вопросы, связанные с размерностями величин,
используемых в расчетах ХТС, обсуждены в разд. 3.3.3. Опреде-
лив соотношение величин смешиваемых потоков a=Gi<вх /G2jBX,
преобразуем последнее равенство из (3.7):
_ ^7/1,вх / 672>вх + ^7/2,вх / 672<вх _
8‘ ~ <7,-вх /<72;ВХ +1 "
_ а^7/1,вх / 672вх + ^7/2,вх / 67, вх
а + 1
и получим связь весовых концентраций /-го вещества в смеши-
ваемых (gj\ и gf2) и выходящем (gj) потоках:
& = («&т + &?)/(« + В- (3.8)
195
Из уравнения (3.8) можно получить соотношения, в которых
надо смешать два потока, чтобы получить заданную концентра-
цию gj:
а = (gi - - &)• (3.9)
Последние выражения позволяют решать задачи, часто встре-
чающиеся в практике расчета ХТС. Имеется некоторый поток
G] вх с концентрацией /-го компонента gj\. Необходимо полу-
чить поток с концентрацией этого компонента g,. Сколько надо
добавлять другого потока С2,вх с концентрацией этого же ком-
понента в нем gn? Или: с какой концентрацией g^ надо добав-
лять второй поток, чтобы образующийся поток был определен-
ной величины (7ВЫХ ?
Делитель простой разделяет поток на два. Полагаем, что один
из выходящих из делителя потоков (пусть это будет 1-й) состав-
ляет долю а входного потока:
^1,вых — a^BxJ ^2,вых — (1 _ а)^вх-
Соответственно, разделятся по потокам все компоненты:
^71,вых аФ,вх> ^Д,вых (1 — a)i> ^вх- (3.10)
Реакционный элемент (реактор, реакторный узел), в котором
протекает химическое превращение. Изменение химического
состава реагирующей смеси описывается стехиометрическими
уравнениями. В разд. 2.2.1 были описаны правила и приемы их
составления: они должны быть стехиометрически независимы-
ми: количество их определяется соотношением (2.5); исключить
“лишние” можно методами линейной алгебры; целесообразно
выбирать такие уравнения, чтобы в левой части их стояло одно
и то же исходное вещество, ключевое; изменения количеств
всех реагентов в химическом превращении определяют через
степени превращения исходного вещества в стехиометрических
уравнениях. Поэтому рекомендуем внимательно прочитать разд.
2.2.1.
Напомним некоторые соотношения, необходимые при расче-
те ХТС:
R
количество /-го компонента N, = + X(^/Ov/yxy )5 (3.11)
у
В
концентрация/-го компонента С, = N, / (3.12)
к
парциальное давление компонента pj— PC,; (3.13)
R
селективность по /-му продукту S, = TV] рх,- / (3-14)
у
196
выход i-ro продукта Е, = N^qx, / (3.15)
(здесь В - число компонентов в потоке).
В этих формулах первое исходное вещество входит во все
стехиометрические уравнения и его стехиометрический ко-
эффициент в них Vy = -1. Для этого вещества заданы степени
превращения Xj в каждом стехиометрическом уравнении (всего
их - R). В уравнениях (3.14) и (3.15) предполагается, что i-й
компонент - продукт, для которого определяют селективность и
выход, образуется только в i-м стехиометрическом уравнении
(тогда Е, = Xj). Количества компонентов в этих формулах изме-
ряются в молях (обозначение N), как это традиционно принято
в химических науках.
При составлении материального баланса обычно задаются
степени превращения исходных веществ в стехиометрических
уравнениях как результат химического превращения в реакци-
онном элементе. Этим однозначно определяются количества
выходящих из элемента всех компонентов и далее можно опре-
делить другие показатели процесса (селективность, выход про-
дукта) и параметры потока (его количество, концентрации). Но
могут быть заданы и другие показатели химического превраще-
ния - количество продуктов, концентрации компонентов или их
выход, селективности. По (3.11) - (3.15) их можно пересчитать в
степени превращения и затем рассчитывать материальный ба-
ланс. Таких данных должно быть столько, сколько есть незави-
симых стехиометрических уравнений.
Стехиометрические уравнения с “массовы-
ми” стехиометрическими коэффициентам. В рас-
четах материального баланса реакционного элемента использу-
ют и другие формы записи химических превращений. Стехио-
метрические коэффициенты в химических уравнениях показы-
вают количества компонентов, вступающих в химическое вза-
имодействие. Традиционно эти количества измеряют в молях.
Но можно стехиометрические коэффициенты выразить в массо-
вых величинах, умножив “мольные” коэффициенты на мольную
массу. Например, при “мольном” выражении стехиометриче-
ских коэффициентов окисление диоксида серы выглядит так:
SO2 + 1/2О2 = S03.
Мольные массы S02 - 64, 02 - 32, S03 - 80, и это же уравне-
ние с “массовыми” стехиометрическими коэффициентами будет
выглядеть так:
64SO2 + 16О2 = 80SO3.
В такой записи очевиден материальный баланс: суммарная
масса исходных веществ равна массе продукта. Формулы (3.11)-
197
(3.12), (3.14)-(3.15) также можно использовать с “массовыми”
стехиометрическими коэффициентами. Естественно, что и дру-
гие переменные в них также имеют “массовую” размерность
(количества веществ G, а не N, концентрации g, а не С и др.).
Используя уравнение (3.11) с “массовыми” стехиометрическими
коэффициентами vy, можно сразу получить массовый баланс в
реакционном элементе.
Суммарное (брутто-) стехиометрическое
уравнение. В ряде случаев необходимо получить материаль-
ный баланс подсистемы и даже ХТС в целом, где протекает по-
следовательно ряд превращений. Рассмотрим пример: в произ-
водстве азотной кислоты определить количество HNO3, обра-
зующейся из 1 т аммиака. В химико-технологическом процессе
протекают следующие реакции:
окисление аммиака
4NH3 + 5О2 = 4NO + 6Н2О (3.16)
(для простоты объяснения полагаем, что NH3 полностью окис-
ляется до NO);
окисление оксида азота
2N0 + О2 = 2NO2; (3.17)
хемосорбция диоксида азота
3NO2 + Н2О = 2HNO3 + NO. (3.18)
В абсорбционную колонну подается кислород, и образую-
щийся оксид азота повторно окисляется до NO2 по реакции
(3.17).
Таким образом, образование азотной кислоты представлено
стехиометрическими уравнениями (3.16)-(3.18). Умножим пер-
вое из них на 1, второе - на 3, третье - на 2 и сложим их. Полу-
чим суммарное стехиометрическое уравнение (брутто-уравне-
ние):
4NH3 + 8О2 = 4HNO3 + 4Н2О. (3.19)
Конечно, такая реакция неизвестна. Но стехиометрическое
уравнение показывает, в каких соотношениях реагенты вступают
во взаимодействие друг с другом, и этому определению отвечает
уравнение (3.19). Умножим стехиометрические коэффициенты в
(3.19) на мольные массы соответствующих компонентов (NH3 -
17, 02 - 32, HNO3 - 63, Н20 - 18) и получим:
68NH3 + 256О2 = 252HNO3 + 72Н2О.
Из этого уравнения видно, что для производства 252 кг
HNO3 надо затратить 68 кг NH3, а на 1 т (1000 кг) HNO3 пойдет
198
68 - 1000/252 = 270 кг аммиака. Удобство записи суммарного
стехиометрического уравнения очевидно.
Равновесные химические реакции. Для балансо-
вых расчетов может быть принято, что реакция протекает до
равновесия. Тогда задается температура для такой равновесной
смеси. Следовательно, известна константа равновесия Кр, свя-
занная с концентрациями реагентов уравнением
АГр=ПСУ' или tfp=np,v/. (3.20)
i i
Концентрации компонентов можно записать в виде их зави-
симости от степени превращения, используя уравнения (3.11),
(3.12). Подставив их в (3.20), находим значения равновесной
степени превращения и из (3.12) - количества всех компонен-
тов. Для сложной схемы превращения число уравнений вида
(3.20) будет равно числу независимых стехиометрических урав-
нений.
Приведем пример расчета материального баланса в паровой
конверсии метана, полагая, что в ней достигается равновесие.
Протекают две реакции
СН4 + Н2О = СО + ЗН2; СО + Н2О = СО2 + Н2. (3.21)
Известны константы равновесия этих реакций - соответ-
ственно Api и Кр2. Для материального баланса воспользуемся
такими стехиометрическими уравнениями:
СН4 + Н2О = СО + ЗН2; СН4 + 2Н2О = СО2 + 4Н2. (3.22)
Второе из них получено сложением уравнений (3.21). При-
своим индексы компонентам: 1 - СН4, 2 - Н2О, 3 - Н2, 4 - СО,
5 - СО2. Степени превращения СН4: по первому уравнению -
X], по второму - х2; общая степень превращения метана х = Х[ +
+ х2. Исходная реакционная смесь состоит из СН4 и Н2О в ко-
личестве jV[ о и TV2 q. В соответствии с (3.11) получим количества
всех компонентов, выраженные через степени превращения
метана Х| и х2:
М = М о ~ М 0*1 - М 0*2 = М о(1 - *1 - х2);
N2 = о - М о*1 _ 2М qx2 = TV2 о - М о(*1 + 2х2);
М = ЗМ qXi + 47V, ох2 = М o(3*i + 4х2);
М = М о*ь Ns — М о*2-
Общее число молей LTV,- = о (1 + 2х\ + 2х2) + TV2 о-
Парциальные давления получим из (3.12) и (3.13). На-
199
пример, для метана
N( ЛГ,0(1-Х1-х2)
1 LN, Nl0(i + 2xi + 2x2) + W2o
1 - Xi - х2
1 + X + 2xi + 2x2
Здесь использовано принятое обозначение соотношения
“пар : газ” в исходной смеси X = N2 о/М о- Аналогично находят-
ся все Pi- В равновесии
„ Р1Р% Р2Х!(Зх! +4х2)3
Лр1 =------=------------------------------------------у,
Р\Р2 (1 — X] — х2)(Х - Xi - 2х2)(1 + X + 2xi + х2У
(3.23)
^р2 =
Р5Р1
Р4Р2
x2(3xi +4х2)
Xj(X - Xi - 2x2)
Заметим, что константы равновесия заданы для реакций
(3.21), а количества компонентов получены из других стехио-
метрических уравнений - (3.22). Из системы двух уравнений
(3.23) определяем xj и х2. Полученная система уравнений не
простая - выразив из второго уравнения системы х2 как функ-
цию X) и подставив в первое, получим алгебраическое уравнение
третьего порядка относительно хр Применение ЭВМ, конечно,
облегчает решение. Найдя xj и х2, рассчитываем состав прореа-
гировавшей смеси, потоки всех компонентов N,.
Элемент с фазовыми превращениями (конденсатор, испари-
тель) - рис. 3.10. В него подается поток жидкости или пара. При
заданных температуре и давлении происходит образование но-
вой фазы (пара или жидкости). Обе фазы находятся в равнове-
сии. Парциальное давление /-го компонента р, над многокомпо-
нентной жидкостью определяется законом Рауля:
Pi=P*i»i^, (3-24)
где pj(T,P) - парциальное давление компонента над чистой жидкостью, зави-
сящее от температуры Т и давления Р и потому известное для данных условий:
л/ж = ~ мольная доля компонента в
J J
жидкости, выраженная через массовое ее количество Gi ж и молекулярную массу Л/,-.
Парциальное давление компонента выразим через его моль-
ную долю п, п, мольное N, п и массовое Gf п содержание в паре:
n_ п /V,n п
Pi ~ _ >r - Р „ \~
X N j п 52 (G j п /Мj)
J J
(3.25)
200
Рис. 3.10. Аппарат фазовых превращений
Каждый компонент распределяется между двумя фазами, так
что G,n + С,ж = G,BX. Приравняв (3.24) и (3.25), получим:
* (С С \/М ^У,вх ^п)/Л/у]
Pi (Gi,BX -^inl/^i _ j
~P Gin/M' Y(Gjn/Mj) 5
i = \,...,B. (3.26)
Из системы (3.26) можно найти потоки всех компонентов в
паре б>пи далее - распределение их между двумя выходными
потоками. Система (3.26) - нелинейная и решается с помощью
ЭВМ.
Если конденсируется один компонент, как при отделении
1ЧНз от непрореагировавших N2 и Н2 в синтезе аммиака, то
(3.26) упрощается. Примем i = 1 для конденсирующегося ком-
понента. Для него pi = pi- Другие компоненты (i = 2, ..., В)
уходят с газовым потоком, так что
Gin = Gi<BX (или Nin = 7VIjBX, или Vin = Р<вх); i = 2, ..., В.
Сделаем следующие преобразования (3.25):
Р* =р = = р------^1п-------
YNjn £(^,ВХ-М,ВХ+МП)
J j
(здесь использовано условие Nin = NiBX для всех компонентов,
кроме первого, и потому под знаком суммы добавлено и вычте-
но М,вх)- Обозначив мольный поток на входе NBX =XNj,bx,
j
получим
* = p------^ln--------
1 ^вх-(^1,вх-Мп)
Перейдя к более принятым в технологии объемным расходам
по газу V, рассчитываемым при нормальных условиях, и прини-
201
мая газовую (паровую) фазу идеальной (И= 22,47V), получим из
последнего выражения:
Ип=—^тО'вх-И.вх)- (3.27)
Р-Ру
От объемных расходов можно перейти к массовым. Выход
жидкого компонента б1ж = (И,вх ~ Йп)Р1ж, где Р1Ж - его плот-
ность.
В более сложных случаях, как отмечено, приходится решать
систему нелинейных уравнений (3.26).
Массообменный элемент (абсорбер, адсорбер, десорбер), в ко-
тором контактируют два потока и обмениваются компонентами
реакционной смеси. В этом случае задается доля каждого ком-
понента а„ переходящая из одного потока в другой. Если ком-
понент не поглощается сорбентом, то для него а, = 0. Если сор-
бент не проходит через аппарат (например, загружен адсорбент
на срок его насыщения), то условно полагают, что поглощаемый
компонент выводится из системы при его поглощении или вво-
дится в нее при десорбции, т. е. существует выходящий из ХТС
или входящий в нее псевдопоток некоторых компонентов. В
самом общем случае полагаем, что 7-й компонент содержится в
обоих входных потоках (бд.вх и ^2,вх) и переходит (сорбируется,
десорбируется) из второго потока в первый:
GjX, вых ~ (щ,вх а/бд,вх, ^7/2,вых — (1 — а|)^72,вх- (3.28)
При таком описании процесса массообменный элемент, в
котором происходит покомпонентное разделение потока в за-
данном для каждого вещества соотношении, представляет собой
пропорциональный делитель. Задаваясь из каких-либо соображе-
ний степенью разделения компонентов в любом массообменном
аппарате (конденсаторе, ректификационной колонне, абсорбе-
ре), можно представить процесс в нем как в пропорциональном
делителе. Подход - формальный, но иногда он облегчает балан-
совые расчеты, особенно на первых этапах разработки ХТС,
однако требует от исследователя опыта расчета балансов для
химико-технологических процессов.
Такие подходы к описанию элементов ХТС различного наз-
начения на основе материального баланса особенно удобны при
разработке системы, когда данные об аппаратурном оформлении
не полны или отсутствуют. Даже если такие данные есть, то,
задаваясь режимом работы аппарата или агрегата, можно ис-
пользовать материальный баланс для описания изменения пото-
ков в элементах, что значительно упрощает расчет всей ХТС и
ее анализ.
202
3.3.3. Тепловой баланс
Разница тепловых энергий потоков, выходящих из элемента
ХТС и входящих в него, обусловлена подводимым теплом, теп-
лотой реакций и фазовых превращений, а также другими воз-
действиями на потоки. Из закона сохранения энергии подводи-
мое тепло Q расходуется на изменение внутренней энергии Л Я и
работу против внешних сил А:
Q = &U + A, (3.29)
где ли = 14 - t/| - изменение энергии поступательного и вращательного дви-
жения молекул, колебания атомов, движения электронов и др. между началь-
ным (t/|) и конечным (14) состояниями; А - работа против внешнего давления
и прочих внешних воздействий (электрического и др.), которые не учитывают-
ся в расчетах ХТС;
A^jp.dK. (3.30)
Элемент ХТС - система открытая, для которой р = const, и
(3.30) интегрируется: А = p(V2 - И) = pV2 - pV\. Теперь (3.29)
примет вид:
0 = (Я2 - и{) + (pv2 - pH) = <и2 + рУ2) - W + РИ).
Энтальпия системы Н = U + pV, и
Q = Н2 - Hr = ЛЯ = Явых - Явх. (3.31)
Энтальпии на входе Явх и выходе ЯВЬ|Х рассчитывают сумми-
рованием Ну всех i компонентов по J потоками: Я = ££Я,у.
j ‘
Изменение энтальпии в элементе ХТС учитывает все превраще-
ния потоков и воздействия на них. Такие расчеты успешно ис-
пользуют для определения состояния потоков ХТС.
Практически тепловое состояние потока контролируют тем-
пературой, и потому перейдем к “температурной” записи тепло-
вого баланса.
Теплоту Онагр, требуемую для изменения температуры среды
от 7\ до Т2 и равную соответствующему изменению ее энталь-
пии, найдем из термодинамического определения теплоемкости
ср=(дН/дГ)р.
Онагр = НТ1 - HTi = Т\срdT. (3.32)
Т\
Теплоемкость зависит от температуры (например, ср — а +
+ ЬТ) и называется дифференциальной. Интегральная форма
расчета разогрева не проста, поэтому используют среднеинте-
203
гральную теплоемкость
1 Г2
=-------- \cDdT
” Т — т 1 ”
и вместо уравнения (3.32) - более простое:
Онагр ~ с/>(^2 — )
(3.33)
Температура потоков в элементах ХТС изменяется за счет
внутренних источников (ОИст)> один из которых - химиче-
ские превращения. Теплота реакции qp равна изменению
энтальпии вследствие изменения химического состава реакци-
онной среды (qp = Нвых - Янх) и приведена в справочниках. Ес-
ли эта теплота пошла на нагрев реакционной среды, то, каза-
лось бы, легко рассчитать ее нагрев из условия qp = Снагр и
уравнения (3.33). Но поскольку Н зависит от температуры, то и
тепловой эффект зависит от Т, и такие данные приведены в
справочниках. При какой температуре следует брать Qp? Ведь Т
сложным образом меняется в процессе. Зависимость qp(T) есть
изменение ДЯ как в зависимости от химического состава, так и
от температуры. Если учесть изменение qp( Т) в процессе, а за-
тем использовать его в расчете разогрева по уравнению (3.33),
это приведет к вторичному его учету. Избежать этого можно,
если использовать правило: “эффект не зависит от пути”. Вос-
пользуемся следующей схемой процесса (рис. 3.11). Кривая ли-
ния изображает путь процесса, в котором протекает химическое
превращение и меняется температура от Т\ до /у Проведем
процесс по другому, гипотетическому пути в три этапа:
охладим исходную смесь до температуры 7”, забрав у нее тепло-
ту Q\ = Cj,j(7j -Т*); проведем при этой температуре реакцию,
теплота которой 9Р(Т”); нагреем образовавшуюся смесь теплом
Q1 ~ 91 + 9р- Результат должен быть такой же - конечная темпе-
ратура будет равна Ti и qi = ~Т*). Интегральные теп-
лоемкости исходной ср\ и конечной ср2 смесей в общем случае
различны.
Теплота реакции рассчитывается из термохимического урав-
А + vjB + ... = vrR + VyS + ... + Qp (-АЯр), (3.34)
представляющего собой стехиометрическое уравнение, в правую
часть которого добавлено слагаемое - тепловой эффект реакции
204
Рис. 3.11. Путь превращения в процессе (/) и гипотетиче-
ский (2)
Qp (изменение энтальпии Д//р). Теплота, выде-
лившаяся в реакции, зависит от Qp и глубины
протекания реакции - степени превращения х
исходного компонента. В уравнении (3.34) сте-
хиометрический коэффициент перед A v0 = 1 и qp = ОрЛд- Для
сложной реакции qp = Е((?р/Хд/) (индекс j относится к /-му
j
стехиометрическому уравнению).
Используемые в справочниках значения ср и Qp- удельные,
относящиеся к единице количества вещества. Теплоемкость
смеси ср - аддитивное свойство теплоемкостей составляющих ее
компонентов cpi :
ср = E(Qcp»). где С, - концентрации компонентов.
С учетом приведенных рассуждений и сделанных замечаний
уравнение теплового баланса (3.5) будет иметь следующие со-
ставляющие:
£?Bxi = ^вхср,вх (^1 _ Т );
£?ист = ^А,вх SIOP7(T )хду]; (3.35)
J
Свых = выхср,вых ^2 ~ Т ).
Наибольшие погрешности в расчет вносят следующие упро-
щения. Можно принять, что изменение Т мало отражается на
величине дЯр (и Qp соответственно). Это обусловлено возраста-
нием энтальпии всех реагентов с нагреванием. Допущение А//р~
» const означает также малое влияние температуры на разность
теплоемкостей исходной и прореагировавшей реакционных сме-
сей. Можно принять средние значения ДЯр(Ср) и ср (удельной
теплоемкости) в рабочем температурном интервале. Теплоем-
кость всей смеси - произведение Gcp - также мало различается
для входного и выходного потоков. Поэтому если пользоваться
массовыми величинами потоков, как в (3.35), то и удельные
теплоемкости можно принять мало меняющимися в процессе. В
синтезе аммиака, в котором ср компонентов (Н2, N2, NH3) раз-
личаются в несколько раз и в процессе значительно изменяется
их содержание, теплоемкость смеси меняется менее чем на 10%.
205
Рис 3.12 Реакторный узел окисления диоксида серы
Сделанные допущения тем справедливее, чем меньше измене-
ния объема (в газофазной реакции) и температуры в процессе. В
первом приближении можно принять:
С?вх Сцст ~ ^A.BxSCCpy-^A/),
j
(3.35а)
£?вых ~ ^2-
Здесь опущено Т*, поскольку при неизменности ср члены
уравнений с ним все равно сокращаются.
Приведем пример приближенного расчета температуры на
выходе из сложного по схеме реакторного узла окисления
диоксида серы (рис. 3.12). Реакционная смесь с начальной кон-
центрацией SO? Q проходит последовательно ряд теплообмен-
ников и ряд слоев катализатора, где происходит окисление.
Часть потока байпасом направляется между слоями. Известны
температуры и степени превращения в каждом слое. Расчет
температурного режима всех потоков - весьма громоздкая зада-
ча. Расчет температуры только выходящего потока Твык прове-
дем с помощью балансовых уравнений (3.5) и (3.35а). Потоки
газофазные, поэтому используем их объемы И
И^рТвх + Cp^Qpk ~ И^Т^ых-
После очевидного преобразования получим
^вых = ^вх + (СрО)/ср)хк,
или
Т’вых — + А^ад2Ск.
206
Разогрев реакционной смеси, несмотря на сложность струк-
туры реакторного узла, равен адиабатическому разогреву.
Для фазовых превращений (испарение, конденсация,
плавление, сублимация, растворение):
С? ист = НЛ^9фп) = 2(а/с/9фп)> (3-36)
/ /
где АС/ - количество z-го компонента, изменившего свое фазовое состояние;
а/ - его доля от общего количества 6>; #фП - удельная теплота фазового превра-
щения.
Общие замечания о выборе условий определения параметров
потоков и превращений аналогичны приведенным выше.
Быстрое (адиабатическое) сжатие или расширение
газов (в компрессорах, холодильных установках и др.) также
приводит к изменению температуры, рассчитываемой из урав-
нения адиабаты:
Тг/Т\ = (^/Р1)(Т’1)Л, (3.37)
где у = Cp/cv - показатель адиабаты.
Более полная информация о расчетах физико-химических и
теплофизических параметров потоков и процессов имеется в
соответствующей литературе.
3.3.4. Расчет состояния химико-технологической системы
После того как определены структура ХТС (элементы и связи
между ними), описание элементов (математические модели ап-
паратов или балансовые соотношения) и их состояние, парамет-
ры входных или выходных потоков (какие - зависит от поста-
новки задачи расчета), можно переходить к расчету состояния
ХТС (параметров потоков).
Подготовка данных - важнейший этап вычислений, от кото-
рого зависит достоверность конечных результатов.
Размерность используемых величин должна быть проверена на
их “совместимость” в балансовых уравнениях. Для материально-
го баланса удобно использовать размерность потоков в массовых
величинах (кг/ч, г/мин, т/ч и т. д.). Для характеристики хими-
ческой реакции традиционно используют измерения в молях.
Задаваемые концентрации могут иметь, например, размерности
[%] или [доля]. “Доля” бывает массовая, мольная или объемная;
численно они различаются. Размерность теплоемкости |Дж/(л х
хград)] различна для газа и жидкости - более корректны будут
соответственно размерности [Дж/(лг • град)] и [Дж/(лж град)].
Есть основной способ проверки правильности использования
размерностей: подставить в балансовое уравнение на место ве-
207
личин их размерности. Если размерности подобраны правильно,
то все слагаемые уравнения должны получиться одинаковой
размерности. В противном случае в каждый член уравнения
надо вводить пересчетные коэффициенты. Они описаны в разд.
2.9.1.
Покажем перерасчет размерностей на примере уравнений
теплового баланса (3.5) и (3.35а):
GB^pTl ^А.вхОру^А/ — ^выхср^2-
Заданы размерности его составляющих: G |кг/ч], сДкал/(моль-
• град)], Ср [кДж/кмоль], 7’[град], х^ - безразмерна. Подставля-
ем их в слагаемые уравнения:
+ ^А,вхОру ~' ^выхср^2
Г кг кал ] Г кг кДж ] Г кг кал
---------------град +-------=— = ------------------град .
[_ ч моль град J [_4 кмольJ 4 моль град J
Очевидно несовпадение размерностей членов уравнения.
Приведем их к одной размерности умножением членов уравне-
ния на следующие пересчетные коэффициенты:
1-й и 3-й: 0,239 [Дж/кал], \/М [г/моль], 1000 [г/кг];
2-й: 0,001 [Дж/кДж], \/М [кг/кмоль]
(здесь М - молекулярная масса). Уравнение примет вид (далее
приведены 1-й и 2-й члены, поскольку 3-й совпадает с 1-м):
GmcpTx 0,239 • 1000/А/+ G^mQvj xAjr 0,001/М = ... .
Размерность слагаемых
[кг кал Дж г моль!
---------------град —-----------+
ч моль • град кал кг г
[кг кДж Дж кмоль! _
ч кмоль кДж кг J
после сокращения будет одинаковой: [Дж/ч] + [Дж/ч] = ...
Последовательность расчета зависит от структуры ХТС.
Линейная структура - поток (потоки) проходит по-
следовательно один элемент за другим (см. рис. 3.2, а-г). Воз-
можны разветвления потока, параллельное прохождение эле-
ментов, байпасирование. Последовательность расчета очевидна.
На рис. 3.13 показан пример линейной ХТС, на которой прону-
мерованы аппараты (элементы) и потоки. Известно состояние
потока 0 на входе в систему, в первый по ходу элемент I. Вы-
числяют состояние потока 7 на выходе из него, который входит
208
Рис. 3.13. Линейная структура ХТС
в элемент II. Из его описания определяют состояние потока 2.
После его разветвления, определив входные условия в элемент
III (поток 5), продолжают такие же вычисления далее по ниж-
ней ветви схемы, а затем - по верхней. Расчет состояния си-
стемы линейной структуры проводится от входа в систему по-
следовательно от элемента к элементу по мере прохождения
потока.
Структура с рециклом (рис. 3.14, а). Состояние по-
тока на входе в элемент I зависит от входного потока О и со-
стояния потока 4 после ответвления его от потока 3 за элемен-
том II. Чтобы вести последовательный расчет, начиная от эле-
мента I, надо уже знать результат расчета последующего элемен-
та II, что невозможно. Общий подход к расчету состояния ХТС
с рециклом следующий. Разрывают связи рецикла, как показано
на рис. 3.14, б. Структура становится линейной с неизвестным
состоянием Хд 1 входного потока О{. Задают какие-то парамет-
ры его состояния и проводят расчет полученной линейной си-
стемы. Получают состояние потока 3 на выходе. В исходной
схеме на рис. 3.14, а часть этого потока (4) направляется в эле-
мент I, а в “разорванной” схеме состояния потоков О\ и 4
должны совпадать, т. е. У4 = Xgi. Если это не так, то задают
новые значения Хд i и расчеты повторяют до получения указан-
ного совпадения. Конечно, выполнить абсолютно точно равен-
ство Хд 1 и Y4 практически невозможно, поэтому стараются ми-
нимизировать разность между ними; А = | Xgi - У4 | <
< е, где е - точность расчета. Минимизация некой функции F =
= А есть типичная математическая задача оптимизации, и ее вы-
Рис. 3.14. Структура ХТС с рециклом: исходная (о) и вычислительная (б) схемы
209
Таблица 3.1. Материальный баланс двухступенчатой конверсии природного газа
под давлением 3 МПа
Первая ступень - конверсия паром в трубчатой печи
Компоненты газовой смеси Приход Выход из трубчатой печи конвертированного газа
природный газ, м3 водяной пар, м3 всего, кг м3 КГ
n2 13,8 17,25 13,8 17,25
сн4 945 — 675 321,32 229,51
с2н6 30 40,18 — —
С3н8 10,5 — 20,63 — —
со2 0,7 — 1,37 384,21 754,7
со — — — 331,68 414,6
Н2 — — — 2478,06 221,25
Н2О - 4000 3214,29 2901,31 2331,41
Всего 1000 4000 3968,72 6430,38 3968,72
Вторая ступень - конверсия паром и воздухом в шахтном реакторе
Компоненты газовой смеси Приход Выход конвертированного газа
I ступени, м3 воздух, м3 всего, кг м3 КГ
N2 13,8 1073,6 1359,25 1087,4 1359,25
сн4 321,32 — 229,51 20,73 14,81
со2 384,21 — 754,7 409,58 804,53
со 331,68 — 414,6 606,9 758,62
Н2 2478,06 - 221,25 2834,39 253,07
Н2О 2901,31 — 2331,41 3146,16 2528,15
О2 - 285,4 407,71 - -
Всего 6430,38 1359 5718,43 8105,16 5718,43
Таблица 3.2. Тепловой баланс (в кДж) узла окисления аммиака в производстве
азотной кислоты (на 1 т 100%-й HNO3)
Приход Расход
статья количество теплоты, кДж статья количество теплоты, кДж
С азотно-воздушной смесью Теплота реакции окис- ления аммиака 635,4 3883,2 С газами (на выходе из котла-утилизатора) 1390,7
Теплота окисления NO в NO2 (в котле- утилизаторе) 638,3 На производство пара В окружающую среду 3678,4 87,8
Всего: 5156,9 Всего: 5156,9
210
полняют с помощью ЭВМ Если рециклов несколько, то разры-
вают их все и минимизируют функцию F— "ЕЛ, или ее квадра-
тичную форму £ = где индекс / соответствует нумерации
рециклов. Для этого разработаны алгоритмы последовательности
разрыва связей (если их несколько), быстро сходящиеся методы
оптимизации, другие вычислительные процедуры и разработаны
специализированные вычислительные программы. Общая идея
их описана выше - разрыв связей и итерационные вычисления с
использованием методов оптимизации.
Форма представления состояния ХТС (материального и тепло-
вого балансов). Наиболее полная форма представления состоя-
ния ХТС - сводная таблица, в левой части которой перечисле-
ны, а затем просуммированы все статьи прихода (показатели
входных потоков), а в правой - все расходные статьи
(показатели выходных потоков). Подобные таблицы приводят
для отдельных элементов, подсистем и ХТС в целом Примеры
таких таблиц - табл. 3.1 и 3.2.
Достоинствами представления балансов в форме таблиц яв-
ляются полнота и точность представленного материала, удобство
практической работы с данными. Таблицы - основная форма
представления результатов балансовых расчетов, входящая обя-
зательно в техническую документацию производства.
Для быстрого обозрения результатов баланса по отдельным
элементам удобно нанесение на технологическую или структур-
ную схему ХТС отдельных показателей потоков.,как показано на
рис. 3.15, а для узла окисления аммиака. Такая форма удобна
для оперативного анализа результатов и в то же время достаточ-
но информативна.
Рис. 3.15. Технологическая схема узла окисления аммиака с показателями пото-
ков (а) и его тепловая диаграмма (6):
7 - реактор; 2 - котел-утилизатор
211
Другим способом является графическое оформление резуль-
татов балансов в виде диаграмм, наглядно передающих соотно-
шение между какими-то показателями потоков, как показано на
рис. 3.15, б для того же процесса. Ширина потоков между эле-
ментами примерно пропорциональна величине показателя. Та-
кие диаграммы используются скорее для демонстрационных
целей, нежели для количественного анализа процесса.
3.4. АНАЛИЗ ХИМИКО-ТЕХНОЛОГИЧЕСКОЙ СИСТЕМЫ
3.4.1. Задачи анализа химико-технологической системы
Анализ ХТС заключается в получении сведений о состоянии
ХТС, показателях ее эффективности и функционировании си-
стемы, а также о влиянии на эти данные химической схемы,
структуры технологических связей, свойств и состояния элемен-
тов и подсистем, условий эксплуатации. Фактически анализ
ХТС - получение показателей химического производства и хи-
мико-технологического процесса, приведенных в разд. 1.4. Ана-
лиз ХТС осуществляется при разработке и проектировании но-
вого химического производства, при эксплуатации действующего
производства, для сравнения различных вариантов реализации
процесса, при модернизации и реконструкции производства.
Первым шагом в анализе ХТС является определение ее со-
стояния, т. е. расчет ХТС, рассмотренный в предыдущих разде-
лах. Зная изменение состава и количества потоков, энергетиче-
ские расходы, можно провести и другие расчеты - эффектив-
ности использования сырья и энергии как технологических по-
казателей, экономических показателей, некоторых социальных
показателей, определяемых свойствами всех компонентов хими-
ко-технологического процесса, в том числе отходов производ-
ства. Эксплуатационные показатели определяются в основном
из реакции системы на те или иные возмущения в процессе
(изменение состава и количества сырья, энергетического обес-
печения, состояния аппаратов, включая выход из строя некото-
рого оборудования, а также воздействия на режимы отдельных
аппаратов и узлов). При этом необходимо учитывать, что ХТС
обладает свойствами, не присущими отдельным ее элементам,
что обусловлено взаимозависимостью их режимов.
3.4.2. Свойства ХТС как системы
Система, в том числе ХТС, функционирует как единое целое,
как совокупность взаимосвязанных элементов. Поэтому, во-
первых, химико-технологический процесс характеризуют рядом
показателей функционирования ХТС в целом и, во-вторых, мо-
212
гут появиться свойства системы, не присущие ее элементам.
Наиболее характерные из этих свойств рассмотрим далее.
Зависимость режима одного аппарата (элемента) от режимов
других. Свойство очевидное: изменение режима аппарата, т.е.
изменение состояния потоков, выходящих из него и входящих в
последующий, изменяет условия работы последнего. Изменение
условий работы последующего аппарата сказывается двояко:
влияет на эффективность процесса в нем и на эксплуатацион-
ные свойства аппарата.
Допустим, в производстве аммиака по какой-то причине в
реакторе метанирования для очистки азотоводородной смеси
(АВС) от остатков оксида углерода (СО + ЗН2 = СН4 + НгО)
уменьшилась степень гидрирования СО. Соответственно, АВС,
поступающая в отделение синтеза аммиака, будет содержать
больше СО и меньше СН4. Синтез аммиака осуществляется в
системе с рециклом (см. рис. 3.5). Уменьшение инертного ком-
понента СН4 в исходной смеси приведет к меньшему его на-
коплению в цикле синтеза и, следовательно, к увеличению пар-
циальных давлений азота и водорода. В связи с этим возрастет
скорость реакции и, соответственно, степень превращения АВС
в продукт. Это благоприятный эффект и проявится он сразу же,
как только такое изменение в метанировании произойдет. Но
СО - яд для катализатора синтеза аммиака. С увеличением со-
держания СО дезактивация катализатора будет происходить
быстрее, что ухудшает эффективность процесса во времени, по
мере отравления катализатора.
Режим аппарата может зависеть от режимов не только в
предыдущем, но и в последующем аппаратах. Это возможно, во-
первых, при наличии рецикла, когда поток согласно схеме пере-
дается в предыдущий аппарат. Во-вторых, обратное относитель-
но направления потока воздействие может иметь физическую
причину. Чаще всего это связано с изменением давления, кото-
рое распространяется во всех направлениях, в том числе и в
противоположном движению потока. Если гидравлическое со-
противление какого-либо узла возрастает, то увеличивается дав-
ление на входе в этот узел (при поддержании расхода потока
через него) и, следовательно, давление в предыдущем аппарате.
Может возникнуть и аварийная ситуация. Допустим, в системе,
работающей при высоком давлении, в одном месте произошел
резкий сброс давления. В предыдущем аппарате - реакторе -
находится зернистый слой катализатора. Его гидравлическое
сопротивление не позволило газу быстро пройти через реактор,
и на какое-то время перепад в слое резко увеличился. Опорные
решетки для катализатора обычно рассчитаны на его вес и пе-
репад давления при нормальной работе. Резкое уменьшение
213
давления после реактора в описанной ситуации вызвало много-
кратное, хотя и кратковременное, увеличение нагрузки на опор-
ную решетку. Этого было достаточно, чтобы она разрушилась.
Взаимосвязь условий работы элементов в системе необходимо
учитывать как в “штатном” режиме (при задаваемых условиях экс-
плуатации), так и в изменяющихся условиях эксплуатации.
Усовершенствование одного узла (элемента) улучшает эффек-
тивность ХТС в целом за счет выигрыша в другом узле системы.
Это свойство вытекает из предыдущего и обусловлено взаимоза-
висимостью режимов ХТС. Усовершенствование одного элемен-
та связано с определенными затратами в нем. Положим, в реак-
торе использован новый катализатор, увеличивающий селектив-
ность сложного химического превращения, точнее - умень-
шающий выход некоторых побочных продуктов реакции, коли-
чество которых незначительно. На общем выходе полезного
продукта это скажется мало. Новый, более дорогой катализатор
требует дополнительных затрат в реакционном узле. Но в си-
стеме очистки основные затраты связаны с удалением именно
малых количеств примесей. Уменьшение примесей приведет к
существенному уменьшению затрат на очистку от них и в ко-
нечном итоге - к уменьшению затрат в системе в целом.
Оптимальные режимы элемента одиночного и в системе могут
различаться. Подтвердить это положение можно, если найдется
пример, опровергающий противоположное утверждение: “опти-
мальные режимы элемента одиночного и в системе совпада-
ют”. Рассмотрим ХТС, состоящую из реактора и системы разде-
ления. Заданы производительность П = PqQx и состав сырья -
Со; Vq - количество необходимого сырья. Определим, при какой
степени превращения х затраты 3 будут минимальны. Они скла-
дываются из капитальных затрат и расходов на сырье:
3 = ^Скап + ЦсИ0, (3.38)
где Скап - стоимость капитальных вложений (на оборудование); Kt - коэффи-
циент окупаемости, показывающий долю стоимости оборудования, входящую в
затраты на производство продукции за определенное время, обычно за 1 год
(затраты также рассчитывают на 1 год; полагая, например, срок службы обору-
дования 5 лет, получаем коэффициент Kt = 0,2); Цс - стоимость единицы рас-
хода сырья; Уо = П/(Со х)
Одиночный реактор. Затраты на него зависят от его
объема. Для простоты рассматриваем вариант режима идеально-
го смешения и реакции первого порядка. Из описания процесса
в таком реакторе
х/т = Л( 1 - х)
получим т = (1 /к)[х/( 1 - х)] и объем реактора
vp= Иот = (И0/Л)[х/(1 -х)].
214
Рис. 3.16. К определению оптимального пре-
вращения для одиночного реактора (Хр) и
реактора в системе (ххтс)
Полагаем, что стоимость реактора
пропорциональна его объему: Скап =
= avp. Подставляя выражения для Уо и
Vp в (3.38), превратим его в зависи-
мость от х. Затраты на процесс в
одиночном реакторе Зр будут:
Зр= Л/(1 -х) + В/х. (3.39)
Коэффициенты А и В включают
все постоянные - к, a, Cq, Vq, К\ и
другие. Первое слагаемое в (3.39) -
капитальные затраты на реактор Зк- возрастает с увеличением
степени превращения: чем больше х, тем больше должны быть
объем реактора и затраты на него. Второе слагаемое - затраты
на сырье Зс. Чем больше х, тем полнее используется сырье и
тем его нужно меньше. Зависимости Зк, Зс и Зр показаны на
рис. 3.16 сплошными линиями. Видно существование некой
степени превращения Хр, при которой достигаются минималь-
ные затраты на единичный реактор (Зр).
Реактор в системе. К затратам на реактор (3.39) надо
добавить затраты на разделение Зд. Положим, что они пропор-
циональны примесям к продукту, т. е. количеству непрореаги-
ровавшего сырья РЬСо(1 - х). Не усложняя расчетную формулу,
примем простейший вариант: Зд = ZX1 - х), где D включает по-
стоянные в расчете Зд. Затраты на систему станут равны:
Зхтс = + - + 2>(1 - X).
1-х X
К затратам на реактор добавляются затраты на разделение -
прямая пунктирная линия на рис. 3.16, и оптимальная степень
превращения %хтс становится отличной от хр. В данном случае
*хтс > *р-
Рассмотренное свойство ХТС также обусловлено взаимодей-
ствием ее элементов.
Неоднозначность режимов и их устойчивость. Обратные связи,
имеющиеся в системе, могут привести к появлению неодно-
значности режимов и неустойчивости некоторых из них. Ранее
это было выявлено при рассмотрении автотермического реакто-
ра (см. разд. 2.8.3). Рассмотрим распространенную систему -
реактор с внешним теплообменником (рис. 3.17). Исходная ре-
акционная смесь нагревается в теплообменнике и поступает в
215
Рис. 3.17. Схема реактора с внешним
теплообменником
реактор. Выходящий из реак-
тора более горячий поток (об-
суждаем процесс с экзотер-
мической реакцией) охлаж-
дается, отдавая свое тепло
исходной реакционной смеси.
Очевидна обратная связь по
теплу между входящим и выходящим потоками. Обозначения
температур потоков показаны на рисунке. Пусть по каким-либо
причинам температура на выходе из реактора Тк повысилась.
Это может произойти из-за увеличения концентрации или
уменьшения нагрузки, или увеличения входной температуры 7q
- возможна любая внешняя причина. Источник возмущений -
кратковременный, и условия процесса быстро восстанавливают-
ся. Тем не менее увеличение Тк приведет к дополнительному
нагреву исходной реакционной смеси, и температура на входе в
реактор Тн возрастет. Последнее приведет к увеличению скорос-
ти реакции, тепловыделения в реакторе и дальнейшему возрас-
танию Тк, что еще больше усилит нагрев исходной смеси, и Т„
станет еще выше. Температура на выходе Тк увеличится допол-
нительно, и такая круговая последовательность взаимного на-
грева входного и выходного потоков может продолжаться далее
со значительным нарастанием температуры, даже если источник
первоначального возмущения убран. Если же возмущение ре-
жима привело к уменьшению температуры Тк, то будет проис-
ходить охлаждение системы. Описанная круговая последова-
тельность взаимного нагрева (или охлаждения) обусловлена
связью входящего и выходящего потоков - обратной связью
между ними, т. е. обусловлена внутренней структурой схемы и
является ее свойством.
Определим (dTBblx/dTBX)p и (dTBVOJ dTBX)T - чувствительности
выходной температуры Твых к входной Твх соответственно в ре-
акторе и в теплообменнике. Они обозначены на рис. 3.17 в
скобках и выбраны по направлению тепловой связи между эле-
ментами системы, показанной на рисунке стрелками. Произве-
дение чувствительностей (dTBUX/dTBX)p(dTBUX/dTBX)T покажет на-
растание температуры при однократном прохождении возмуще-
ния по линии “реактор-теплообменник”. При наличии обрат-
ной связи это повторяется многократно, и прогрессирующего
нарастания температуры не будет, если выполняется условие
(dTBblx/dTBX)p(dTBblx/dTB^ < 1; (3.40)
с каждым прохождением возмущения по линии обратной связи
это нарастание температуры будет все меньше и меньше, пока
216
не исчезнет. И если источник возмушения убран, то режим вер-
нется к первоначальному, он будет устойчив к возмущениям. В
противном случае, т. е. если неравенство (3.40) имеет обратный
знак, то возмущение будет постепенно возрастать, и режим си-
стемы не сможет самостоятельно вернуться к первоначальному,
он будет неустойчивым. Определение устойчивости режима,
соответствующее описанному поведению процесса, было дано в
разд. 2.5.4.
В первоначальных обозначениях температур потоков
(JTBbIX/JTBX)p = dTJdT„. (3.41)
Из-за сложности описания процесса в реакторе аналитиче-
ское выражение для dl\JdTH в общем случае получить не удается.
Теплообменник - противоточный с поверхностью теплооб-
мена Тт и коэффициентом теплопередачи Кт. Величина Vq и
теплоемкость ср потока после реактора не меняются, они одина-
ковы для исходной и прореагировавшей смесей. Поэтому дви-
жущая сила теплообмена равна разности температур входящего
и выходящего потоков, а количество тепла, переданного от од-
ного потока к другому, равно KrFT(TBiM. - FBX). Количество
тепла, пошедшего на нагрев исходной смеси, Vocp( TBbIX - То),
равно количеству тепла,переданному через поверхность тепло-
обменника, так что
К^вых — Tq) — Кт1\(Твых — Твх),
или в другом виде
^вых - То = Л(ТВЫХ - Твх), (3.42)
где А = K-tEJVoCp - параметр теплообменника.
Тепловой баланс (3.42) выполняется всегда, и можно про-
дифференцировать обе части этого уравнения по Твх:
(dTBblx/dTBX)T = Л[1 (dTBbBJdTBX\],
или
(JTBblx/JTBX)T = Л/(1 + А). (3.43)
Подставив (3.41) и (3.43) в (3.40), получим условие устойчи-
вости стационарного режима в системе “реактор-теплообмен-
ник”:
Д'» . 1 +-< ту-т,,
dT„ Л K,F, Тн-Т„'
В последней части этого выражения использована связь па-
раметра А и температур из (3.42). Такое же выражение было
получено для теплообменника любого типа - прямоточного, с
перекрестным движением фаз, при наличии байпаса, изменении
217
Рис. 3.18. К определению устойчивости процесса в
реакторе с внешним теплообменником
cl/K
dT,
уменьшать величину
параметров потока, т. е. условие устойчи-
вости, выраженное через температурный
режим, универсально.
Чем сильнее реагирует процесс в реак-
торе на начальную температуру (чем боль-
ше dT\Jdl\^, тем больше вероятность не-
выполнения условия устойчивости (3.44).
Чтобы оно выполнялось, необходимо по-
нижать интенсивность обратной связи,
параметра А. Обратная связь будет слабее,
если меньше теплоты передается в теплообменнике - малые
значения и FT, небольшой нагрев (ТИ - То) исходного потока.
Отметим следующее. Чувствительность выходной температу-
ры к входной dTBBn/dTBX в теплообменнике всегда меньше 1 -
см. (3.43). Невыполнение условия устойчивости (3.40) возмож-
но, если в реакторе (dTBUX/dTBX )р > 1. Это возможно, поскольку
скорость реакции и, следовательно, тепловыделение с темпера-
турой нарастают экспоненциально, нелинейно. Поэтому не-
устойчивые режимы могут возникнуть в нелинейных системах с
обратными связями.
Зависимость dTJdT^ от Тн для адиабатического процесса
имеет экстремальный характер (рис. 3.18, кривая Г). При малых
Тн процесс протекает вяло, превращения почти нет, температура
в реакторе близка к входной и dTJdTH близка к 1. С увеличени-
ем Тн температура на выходе из реактора и dTJdT^ возрастают.
При достаточно большой Тн в реакторе достигается полное пре-
вращение. В этом случае для необратимой реакции разогрев в
реакторе близок к величине адиабатического разогрева Л7"ад, и
потому на сколько увеличится Тп, на столько же увеличится 7^,
т. е. dTyJdT^ к 1. Если реакция обратимая, то максимальный
разогрев равен АТадХр, и из-за уменьшения хр с температурой
dTJdTn < 1 (кривая 2 на рис. 3.18).
Правая часть неравенства (3.44) представлена пунктирной
кривой 3. Можно определить интервал начальных температур Т\
- Ti, в котором условие (3.44) не выполняется, т. е. режим не-
устойчив. Вне этого интервала - область устойчивых режимов.
Не учитывая этого обстоятельства, можно столкнуться с не-
управляемостью процесса. Реактор окисления SO2 в произ-
водстве серной кислоты - многослойный аппарат с адиабатиче-
скими слоями катализатора и промежуточными теплообменни-
ками, в которых реакционная смесь нагревается перед ее по-
ступлением в первый слой. Первый слой и теплообменник пос-
218
Рис. 3.19. Система с фракционным рециклом
(к определению существования стационарных
режимов):
Р - реактор; Д - система выделения продукта; П
- продукт
ле него образуют систему “реактор-теплообменник”. Реакция в
слое протекает почти до равновесия, и режим устойчив - нахо-
дится в области начальных температур выше Т^. Снижение Тн
ниже этой границы приводит к неуправляемому прогрессирую-
щему понижению температуры и прекращению процесса. Вос-
становить прежний режим можно только с помощью посторон-
него вмешательства - огневым подогревателем, чтобы перейти
эту границу.
В реакционных системах очистки газов от примесей также
используют систему “реактор-теплообменник”. Концентрация
примесей может меняться, и возникает опасность самопроиз-
вольного неуправляемого или полного затухания процесса, или
резкого повышения температуры.
Существование режимов. Обратная связь в ХТС может при-
вести к тому, что некоторые режимы невозможно осуществить.
Это характерно для схемы с фракционным рециклом, состоящей
из реактора и аппарата выделения продукта (рис. 3.19). На вход
подается только исходное вещество в количестве Vq. После ре-
актора продукты полностью отделяются, а непрореагировавшие
вещества возвращаются в реактор. Общее количество вещества
на входе - VH, а степень превращения в реакторе - х. Режим
процесса - идеальное смешение - описывается уравнением:
Ин - Ин(1 - х) = Щ(1 - х)тр. (3.45)
Поскольку на вход реактора подается только исходное веще-
ство, то Q = 1. Поток на входе в реактор Ин складывается из
начального потока Vq и рециркулирующего Ин(1 - х):
Ин = Ио + Ин(1 - х), или Ин = V0/x.
Используя последнее выражение для Ин, преобразуем (3.45):
Ио = Л(1 - х)тр. Обозначим то = vp/Hb как условное время в реак-
торе для свежей смеси и получим:
х = (кто - 1)/(Лт0). (3.46)
Результат будет иметь смысл, т. е. х > 0, если &т0 > 1. Но ведь
можно выбрать такую температуру, т. е. значение к, или такое то
(vp или Ио), что будет кх$ < 1, а из (3.46) получим отрицательную
степень превращения, что невозможно. Причина такого нере-
ального решения заключается в следующем. Пусть нет рецикла.
219
Рис. 3.20. Химико-технологическая система с
возможностью колебательных режимов
(производство азотной кислоты)
При заданных условиях - к и то -
установится некоторое значение х в
реакторе. Теперь поставим колонну
разделения и непрореагировавший
компонент вернем в реактор. Увели-
чится нагрузка Ин и уменьшится степень превращения. В реак-
тор будет возвращаться еще больше исходного вещества. Если
Лто > 1, то установится новое значение х, определяемое из (3.46).
Если kxQ < 1, то рецикл будет нарастать, степень превращения
будет стремиться к нулю, все исходное вещество будет накапли-
ваться в системе (ведь выделяется и выходит из системы только
продукт) и Ин -> оо. Стационарного режима достигнуть не удаст-
ся. Конечно, реально Ин ограничено размерами и пропускной
способностью аппаратуры, но тем не менее практический ре-
зультат будет тот же: стационарного режима не существует.
Критическое значение Лто зависит от типа реактора и кине-
тики протекающей реакции. Проверить же систему с фракци-
онным рециклом на существование стационарного режима всег-
да целесообразно.
Колебательный режим может возникнуть в системе с двумя
обратными связями. Один из примеров - производство азотной
кислоты (рис. 3.20). Один из исходных потоков - воздух - сжи-
мается компрессором К и направляется в технологические аппа-
раты, обозначенные как подсистема А. На выходе отходящий
газ подогревается в теплообменнике ТО и направляется в тур-
бину Т, связанную валом с компрессором К для использования
энергии давления отходящих газов. Это - одна обратная связь
(показана стрелкой). Горячие газы после турбины нагревают
поток, направляемый в нее. Это - вторая обратная связь (также
показана стрелкой). Если по каким-либо причинам температура
перед турбиной Т повысится, то в теплообменнике ТО будет
некоторый дополнительный подогрев. Одновременно дополни-
тельная энергия в турбине будет передана через вал в компрес-
сор, и в систему поступит больше воздуха. Дополнительный
объем отходящих газов уменьшит температуру в теплообменни-
ке. Две обратные связи - через теплообменник и через вал, свя-
зывающий компрессор с турбиной, - влияют на температуру
перед компрессором противоположным образом. Но время об-
ратного действия у них различно: тепловая связь действует бы-
стро, а наполнение газом большого объема технологиче-
ского оборудования и поступление дополнительного газа в теп-
220
лообменник требуют большего времени. При некоторых услови-
ях рассогласования времен обратного воздействия эти воздей-
ствия могут оказаться в противофазе, что приведет к колеба-
ниям в подаче воздуха, что и наблюдалось на практике. Анализ
такой ситуации требует специального математического аппарата.
Последние три из рассмотренных случаев представляют со-
бой результат взаимодействия элементов в сложной системе,
приводящий к появлению качественно новых свойств ХТС, и
свидетельствуют о необходимости анализа функционирования
ХТС.
3.4.3. Эффективность использования материальных ресурсов
Основным показателем использования сырья (а также энергии,
вспомогательных материалов) является расходный коэффициент,
показывающий количество затраченного сырья (энергии, вспо-
могательных материалов) на производство единицы продукции.
Различают теоретический расходный коэффициент, определяе-
мый из стехиометрического уравнения реакции образования
продукта из исходных веществ при полном их превращении, и
практический (или просто “расходный коэффициент”), т. е.
реально достигнутый в производстве. Отношение их показывает
степень использования сырья. Итак:
, , количество затраченного сырья
расходный коэффи- = -------------------------------
циент количество продукции
теоретический расходный коэффициент
степень использова- = ------------------------------------
ния сырья расходный коэффициент
В разд. 3.3.2 было найдено общее уравнение получения
HNO3 из аммиака окислением последнего и дальнейшей аб-
сорбцией водой образовавшихся оксидов азота. С массовыми
стехиометрическими коэффициентами превращение описано
уравнением:
68NH3 + 256О2 = 252HNO3 + 72Н2О.
Теоретически 1 т 100%-й HNO3 можно получит из
1000 68/252 = 269,8 кг NH3. Это - теоретический расходный
коэффициент. Если учесть достигнутую избирательность окис-
ления NH3 до NO, равную 0,94, и дальнейшие потери около
0,5% (на неполноту абсорбции й др.), то получим реальный рас-
ходный коэффициент 288,4 кг NH3 на 1 т HNO3 и степень ис-
пользования сырья (аммиака) 93,6%.
Основные причины различия теоретического и реального
расходных коэффициентов: неполнота превращения исходного
221
вещества в продукт; образование побочных веществ; неполнота
выделения продукта; потери промежуточных компонентов и
продукта; наличие примесей в сырье, не идущих на образование
продукта; использование части сырья на вспомогательные цели.
Апатитовый концентрат содержит 39% фосфора (в пересчете
на Р2О5), остальное - минеральные примеси. При степени из-
влечения фосфора 98% на производство 1 т 100%-й Н3РО4 рас-
ходуется 1,9 т концентрата (в пересчете на Р2О3 - 2,6 т).
Теоретически на производство 1 т NH3 из природного газа по
реакциям
СН4 + 2Н2О = СО2 + 4Н2;
ЗН2 + N2 = 2NH3;
ЗСН4 + 6Н2О + 4N2 = ЗСО2 + 8NH3
необходимо затратить 494 м3 метана (природного газа). Реаль-
ный расходный коэффициент составляет более 1000 м3 на 1 т
NH3. Дополнительный расход метана связан со следующим:
значительная часть метана сжигается для выработки тепла, не-
обходимого для эндотермической реакции конверсии метана и
обеспечение температурного режима процессов; часть образо-
вавшегося водорода расходуется на очистку природного газа от
серосодержащих примесей и азотоводородной смеси от СО,
деструкцию высших углеводородов в природном газе до СН4;
конверсия метана из-за обратимости реакции протекает не пол-
ностью (потери).
Значения расходного коэффициента входят в техническую
(проектную и отчетную) документацию по производству. Еще
раз отметим, что расходный коэффициент определяют не только
по сырью, но и по другим расходуемым компонентам - по
энергии всех видов, по вспомогательным материалам.
3.4.4. Энергетическая и эксергетическая эффективность
химико-технологической системы
Тепловой коэффициент полезного действия. Состав энергетиче-
ских потоков в ХТС показан на рис. 3.21. Источниками энергии
являются входящие потоки, несущие энергию топлива Стопл,
электроэнергию £)эл, теплосырья (?СЬ1р и вспомогательных мате-
риалов £?мат, а также экзотермические реакции 0ЭК3. Их суммар-
ное количество - потребление, или затраты энергии £?затр- Из
системы энергия выводится с потоками продуктов - (?11род и
отходов производства - (?отх, с энергетическими потоками - QjH,
затрачивается на проведение эндотермических реакций - £?энд и
222
(Лопл ХТС °ДР9Д,
Оэл *4)ТХ
Осыр щ г
Оэнд п
^мат
(^пот .
(^экз
X.
Рис. 3.21. Состав энергетических потоков в ХТС
теряется естественным путем - £?nor. Из выходящих энергетиче-
ских потоков полезно используется £)эн в виде пара котлов-
утилизаторов, нагреваемых в теплообменниках-утилизаторах
внешних потоков (например, воды), энергии турбин и электро-
генераторов. Исходя из сказанного, энергетическую эффектив-
ность ХТС характеризуют тепловым коэффициентом полезного
действия - тепловым КПД цтепл:
Лтепл Сэн/Сзатр- (3.47)
В этом определении есть внутренние противоречия. Во-
первых, если энергетические потоки используются внутри си-
стемы, покрывая часть расходов, т. е. 0ЭН = 0, то т]тепл = 0. Во-
вторых, если энергетические потоки используются полностью
для выработки энергии, то в этом случае цтепл < 100% (есть
другие потоки, выводящие энергию из ХТС). И то, и другое -
не логично.
Более рационально коэффициент полезного действия - теп-
ловой КПД - представить как отношение полезно затраченного
тепла к суммарному его количеству, введенному в химико-
технологическую систему:
SCn,/ + Z(«l + а2Ппэ)бпэ,£
Л тепл = п л " ТГл ZT7; ’ (3.48)
£^/С?н + £С?экз р +
/ Р j
где ЕОп / - тепло, полезно затраченное на технологические цели и опреде-
i
ляемое из условий теоретического расхода для осуществления физических и
химических процессов, происходящих в элементах ХТС; сц, аг - доли тепла
вторичных энергоресурсов, генерированных в элементах ХТС (котлах-
утилизаторах) и расходуемых вне и внутри системы соответственно; 0Пэ,* -
тепло вторичных энергоресурсов, генерированное в k-м энергетическом эле-
менте ХТС; г]пэ - КПД преобразования тепла вторичных энергоресурсов, ис-
пользуемых внутри ХТС; Bi - расход топлива на технологические цели ХТС в 1-м
элементе; QH - низшая теплота сгорания топлива; Оэкз.р - теплота, выде-
ляющаяся при экзотермических и физических превращениях в р-м элементе
223
ХТС; QHj - тепло, подведенное в у'-й элемент ХТС с энергоносителями
(водяным паром различных параметров с ТЭЦ, горячей водой и др.).
Такой вид КПД более логичен, но в нем не учтено следую-
щее. Продукт обладает некоторым энергетическим потенциа-
лом, который будет использован в дальнейшем, при потребле-
нии продукта. В выражении (3.48) потенциал продукта опреде-
лен только как затраты на его образование (£(?п/) • Если про-
i
дукт образуется в результате протекания экзотермической реак-
ции, то энергетические затраты на него меньше, и цтепл умень-
шается независимо от потребительской ценности продукта. Та-
ким образом, тепловой КПД всегда хуже для экзотермической
реакции, чем для эндотермической.
Коэффициент полезного действия по полной энергии. Другой
подход использован при определении теплового потенциала
любого потока относительно окружающей среды. Он опреде-
ляется не только температурой потока, но и его химическим
составом - полной энергией I
+ (3-49)
состоящей из теплового потенциала потоков Iq и их химической
энергии /хим. Рассмотрим составляющие полной энергии. Окру-
жающая среда характеризуется температурой 7Ь и состоит из
веществ, устойчивых в ней. Потенциал потока относительно
такого состояния и определяет его полную энергию. Давление
здесь не учитывается, поскольку ХТС - открытая система,
соединенная с окружающей средой, имеющей постоянное дав-
ление Р.
Тепловая энергия потока Iq есть тепло, необходи-
мое для нагрева вещества потока от температуры окружающей
среды 7Ь до температуры потока Т. Удельная тепловая энергия iq
в общем виде вычисляется так:
Д1л Дсип Т
iq = J с ртвйТ + АТ/Пд + J с p,w.dT + кип J сp,rdT-
Д) Д1Л ^кип
Здесь учтены все фазовые переходы - плавление и испарение
(кипение), нагрев вещества в твердом, жидком и газообразном
виде. Если в интервале То - Т какие-то фазы отсутствуют, то
соответствующие слагаемые из (3.50) исключаются.
Химическая энергия потока /хим (удельная - /хим)
есть энергия образования компонентов технологических пото-
ков из веществ окружающей среды, называемых веществами
224
отсчета и являющихся с этой точки зрения энергетически пол-
ностью обесцененными соединениями. К таким веществами
относятся: в атмосфере - N2, О2, Аг и т. д.; в гидросфере - Н2О
и почти все элементы в виде растворимых солей; в литосфере -
слаборастворимые высшие оксиды (песок, кварциты и др.).
Список веществ отсчета постоянно уточняется специалистами.
Химическая энергия вещества складывается из известных теплот
образования этого вещества (А/7обр) и веществ отсчета (А^^бр)-а
также теплоты растворения вещества отсчета в среде АЯр
(образования бесконечно разбавленного раствора):
Аим — АМ>бр — (3.51)
Можно определить химическую энергию как энергию де-
вальвации веществ в энергетически обесцененные соединения.
Уравнения (3.49)-(3.51) выражают потенциал любого потока,
которым последний отличается от окружающей среды, или же
который представляет собой энергию (тепло), отдаваемую пото-
ком при переходе в состояние окружающей среды. Тогда эф-
фективность процесса по полной энергии потоков в нем, опре-
деляемая коэффициентом полезного действия (КПД) по полной
энергии г]эн, находится как отношение полных энергий полезных
потоков Е/Пол и выходящих из системы Е/затр:
Лэн ^Атол/^Датр- (3.52)
Из энергетического баланса следует: Е/затр = = ^4ых-
Ниже приведены химическая и тепловая энергии основных вы-
ходящих потоков коксовой батареи:
4им. МВт ч /9, МВт ч
Кокс * 11,05 0,62
Коксовый газ* 4,51 0,02
Пароводяная смесь после охлаждения коксового 0 0,54
газа
Потери на тушение кокса 0 0,62
Потери коксового газа 0,42 0
Тепловые потери 0 0,3
Итого 18,08
Звездочкой отмечены полезно используемые потоки: кокс -
продукт и коксовый газ, применяемый далее для выработки
энергии. Их полная энергия (полезная) Е/Пол = 16,2 мВт • ч, и
Пэн “ 0,9. Если учесть только энергию, вырабатываемую при
сжигании коксового газа (0ЭН = 4,51 + 0,02 = 4,53 мВт ч), то
получим тепловой КПД т]т « 0,25. Оценка энергетической эф-
225
фективности производства по г)эн представляется более состоя-
тельной.
Эксергетический коэффициент полезного действия. Оценка
полной энергии потока еще не позволяет однозначно судить о
возможности ее использования. Положим, из системы выходит
поток воды объемом 100 м3 с температурой 40 °C. Тепловая
энергия потока равна Iq = 8,4 - 106 кДж (принимаем То = 20 °C).
Это тепло трудно использовать: подогрев воды для ТЭЦ требует
очень больших теплообменников из-за малого градиента темпе-
ратур; для обогрева помещения необходимы по техническим
условиям более высокие температуры; таким образом, тепловую
энергию потока можно использовать разве только для обогрева
теплиц. Из другой системы выходит вода под давлением 3 атм с
температурой 130 °C в количестве 18 м3. Ее тепловая энергия
будет почти такая же (Iq = 8,3 • 106 кДж), но с ее помощью
можно выработать технологический пар с давлением 2 атм и
использовать для разных целей с учетом ее высокой температу-
ры. Очевидно, что энергетическая ценность этих двух потоков
различна, хотя тепловая энергия их одинакова. Поэтому далее
будем оценивать потоки по их полной энергии, используя опре-
деление работоспособности потока, его возможности совершать
полезную работу. Это позволяет сделать эксергетический метод.
Рассмотрим ХТС (рабочее тело, источник работы) и окру-
жающую среду как замкнутую систему. Обозначим: <7Н,
Тн и Йн, а также UK, SK, Рк, Тк и Ук - внутренняя энергия, эн-
тропия, давление, температура и объем рабочего тела в началь-
ном конечном состояниях соответственно. Такие же обозначе-
ния, но с нижним индексом “о” (ноль) относятся к среде. Тем-
пература То и давление Pq окружающей среды неизменны.
В такой системе состояние рабочего тела переходит в равно-
весное с окружающей средой, так что UK = f/oK = f/0, 5К = Л’о,
Рк = Ро, Т = То. В закрытой системе работа А может быть про-
изведена только за счет уменьшения внутренней энергии:
A = (UH- UK) + (U0H - U0K). (3.53)
В соответствии с первым законом термодинамики изменение
внутренней энергии среды (Ц)к - Uqh) происходит за счет рабо-
ты Aq, совершенной над ней (против давления среды), и пере-
данного ей тепла Qo, т. е.
= Qo + Ао. (3.54)
Рабочее тело совершает работу над средой, равную
Ao = PKVK - РнV» = Ро~ Л,Кн. (3.55)
Тепло, переданное среде при ее постоянной температуре То,
изменяет ее энтропию; Qo = Tq($ok - ^н)- Поскольку при про-
226
текании обратимых процессов в изолированной системе энтро-
пия ее не меняется (S + So = const), то
Оо = ВД - SK) = 7o(SH - Sb). (3.56)
Максимальная работа в изолированной системе Лтах будет
совершена, если ее состояние достигннет равновесия при про-
текании обратимых процессов. Подставив (3.54)-(3.56) в (3.53),
получим-
Апах = (ян - (4) - (Л)ИК - днад - 7b(SH - So) =
= (UH + PM - (^ + А)ад - 7o(SH - So).
Выражения в первых двух скобках есть энтальпия рабочего
тела в начальном (Нн) и конечном (Нк = Hq) состояниях;
т^тах = (Ян - Н0) - 7o(SH - So) = Е. (3.57)
Эту величину в 1956 г. З.Рант предложил называть эксергией.
Она определяет максимально возможную работу, которую может
совершить тело, переходя в состояние окружающей среды, т. е.
эксергия фактически есть потенциал рабочего тела. Для расче-
тов используют удельную эксергию е. Она включает в себя хи-
мическую ех и физическую еф (изменение температуры и давле-
ния) составляющие:
е — ех + вф. (3.58)
Первое слагаемое рассчитывают через химическую энергию
девальвации веществ рабочего тела в вещества отсчета [уравне-
ние (3.50)] и изменение энтропии этого перехода.
В физической составляющей еф изменение энтальпии проис-
ходит с изменением температуры
АЯ = ср(Т - То),
а изменение энтропии - с изменением Т и Р :
dT dP
dS = ср-- R-;
Т С „ р HP Т Р
AS=SH (Т, P)-S0(T0, Ро)= f dT-R [ — « ср In — -R In —.
7q 1 Ро Р У0 Л)
Физическая составляющая эксергии-
еф =cp(T-T0)-T0(cpln^-Rln-?-\ (3.59)
V '0 ЛМ
Используя формулы (3.50), (3.58), (3.59), можно рассчитать
эксергию входных (£вх) и выходных (£^ых) потоков. Эксергети-
227
ческий КПД будет равен:
Пэ = X ^пол /S ЕВх- (3.60)
Потери эксергии (максимально возможной работы) состоят
из потерь, связанных с необратимостью протекающих процессов
(D), и естественных потерь (Епт), вызванных взаимодействием
системы с окружающей средой и потерями потоков, так что
Пэ = (£вх — Е) — Епт)/Евх. (3.61)
Потери из-за необратимости процессов в ХТС (внутренние
потери) связаны с гидравлическими сопротивлениями, теплооб-
меном при конечной разности температур, массообменом при
конечной разности концентраций и др. К естественным
(внешним) относятся потери эксергии через тепловую изоля-
цию, с продуктами сгорания, выходящими из системы, с возду-
хом после воздушных холодильников, с водой после теплооб-
менников, с побочными продуктами химического процесса.
Рассмотрим источники потерь эксергии из-за необратимости
процессов в следующих аппаратах.
Теплообменник. Чтобы не усложнять выкладки, при-
нимаем теплообменник типа “конденсатор-кипятильник” (рис.
3.22). Температуры в нем ТИС11 и Тконд - постоянные с каждой
стороны теплообменной поверхности. Поскольку температура
каждого из потоков не меняется, то рассматриваем потери толь-
ко энтропии. Из определения для удельной энтропии ds =
=cpdT/T, и энтропия потока dS= McpdT/T. Произведение Мср =
= Q определяет тепловую емкость потока. Поскольку Т = const,
то А5 = Q( T - То)/ Т. Потери из-за необратимости процессов
составляют
В А^КОЦД — А*$ИСП
(в кипятильнике тепло потребляется, а в конденсаторе - выде-
ляется). Определяя A.?, как описано выше, получим
D = о[ГкТ~7’|,’1 - = ef А - /Ч • (1И>
\ •* конд ) \ * исп ) \ исп * конд J
Поскольку Тконд * Гисп, то процесс является необратимым.
Для уменьшения потерь выгодно процесс проводить для высо-
кокипящих жидкостей (большие ТИС|1 и Т^щ) и с близкими
температурами кипения. Аппаратурно это, конечно, менее вы-
годно - потребуются дорогое высокотемпературное оборудование
и большая поверхность теплообмена из-за малой движущей си-
лы А Т 7КОНД — ^исп-
В принятых условиях нет потерь тепла в рассматриваемом
теплообменнике, т. е. считается, что вся теплота конденсации
228
Жидкость
Пар
Рис. 3.22. Теплообменник типа.“кон- Пар
денсатор - кипятильник” ----“
пошла на испарение. Поэтому тер-
мический (тепловой) КПД этой Жидкость
системы близок к 100%. Различие
двух способов оценки КПД велико.
Реактор. Процесс в реакторе протекает изотермически
(Т = const), поэтому рассматриваем только химическую состав-
ляющую эксергии ех = АЯ - То А5Х. Изменение энтропии Л5Х
найдем из определения энергии Гиббса АС? = АЯ - 7А^, откуда
А5Х =(АЯ- АС?) Г и
тт АЯ — AC? То (
ех = ЛЯ - ---------= — АС? + ЛЯ 1---------- .
Л и rj-i rp< I у I
Энергия Гиббса характеризует отклонение системы от хими-
ческого равновесия, т. е. неравномерность процесса. Поэтому
потери в химическом реакторе составляют:
Я=(7Ь/7)ДС7. (3.63)
Очевидно, что для уменьшения потерь выгодны высокотем-
пературные процессы (высокая Т) и протекающие вблизи рав-
новесия (малое АС?). Аппаратурно это невыгодно.
Применение эксергетического метода при анализе ХТС имеет
особенности. Потенциал всех потоков (и, следовательно, их
ценность) выражен в тепловых единицах. Потребительская цен-
ность химического продукта, конечно, иная. В теплоэнергетике,
где потербительская ценность и энергетический потенциал по-
тока совпадают, эксергетический метод нашел свое первое и
наибольшее применение.
Из-за физико-химических ограничений в химической техно-
логии приходится перерабатывать разбавленные смеси. В произ-
водстве азотной кислоты на ее получение идет около 30% амми-
ачно-воздушной смеси. В синтезе аммиака превращается около
20% азотоводородной смеси. В процессах парциального окисле-
ния многих углеводородов более 90% смеси не участвует в пре-
вращениях. Эта часть потока нагревается и охлаждается, прохо-
дя через систему, и тем самым увеличивает эксергетические
потери. Поэтому и эксергетический КПД таких процессов ни-
зок (для производства HNO3 т]э = 22%, хотя NH3 почти полнос-
тью переходит в продукт). Это обстоятельство надо иметь в виду
при эксергетическом анализе ХТС, чтобы не абсолютизировать
результаты. Тем не менее, эксергетический анализ полезен как
один из видов анализа химического производства.
Есть применение эксергетического анализа, при котором его
результаты могут быть решающими: при выборе способа (из
229
нескольких альтернативных) получения продукта из одного и
того же сырья. Более эффективным в отношении использования
потенциала сырья, энергии и вспомогательных материалов будет
тот способ, при котором выше г]э.
3.4.5. Эффективность организации процесса
в химико-технологической системе
Химико-технологическую систему как отображение химического
производства будем характеризовать эффективностью организа-
ции процесса в ХТС. Для такой характеристики необходимо
выяснить, насколько режим процесса в ХТС приближается к
теоретически возможному и насколько рассматриваемая ХТС
оправдана экономически. Такой анализ в совокупности с оцен-
ками эффективности использования сырья и энергии является
частью характеристики химического производства, включающей
в себя многие показатели, перечисленные в разд. 1.5.
Предельная эффективность ХТС. Теоретический расходный ко-
эффициент по сырью (см. разд. 3.4.3) определен из условия полно-
го превращения исходного компонента в продукт. Особенности
термодинамики и кинетики протекающих в ХТС процессов могут
ограничить полную конверсию исходных веществ в продукты. К
ним относятся обратимость реакций и фазовые равновесия.
Для заданных условий процесса можно определить равновес-
ную (теоретически возможную) конверсию сырья, равновесные
концентрации компонентов в продуктах превращения и селек-
тивность химического процесса, а также равновесные концент-
рации компонентов в контактирующих фазах. Они и определят
предельные показатели химико-технологического процесса.
Предельная эффективность ХТС - это эффективность си-
стемы, в которой при принятой совокупности условий химико-
технологического процесса достигаются максимально возмож-
ные (предельные) значения конверсии сырья и селективности,
основанные на данной конкретной химической схеме превра-
щения исходного сырья.
Степень приближения к этим предельным показателям яв-
ляется характеристикой совершенства разрабатываемой ХТС.
Рассмотрим химическую схему высокотемпературного пре-
вращения кумола в а-метилстирол:
С6Н5СН(СН3)2
С6Н5СН2СН3 + сн4
С6Н6 + С3Н6
-^>С6Н5СН3 + С2Н4
С6Н5С(Сн5=СН2 + н2
-±^С6Н5СН=СН2 + сн4
230
Из схемы следует, что кроме а-метилстирола при проте-
кании побочных реакций из кумола образуются бензол, толуол,
стирол, метан, этилен, пропилен. Побочные продукты снижают
селективность процесса. При высоких температурах (530-600 °C)
на железооксидных катализаторах в условиях разбавления водой
(соотношение вода:газ к = 15ч-20) протекает преимущественно
реакция дегидрирования до а-метилстирола. Рассчитанные
для этих условий равновесные (теоретически возможные) сте-
пень превращения и селективность соответственно равны Хг =
=0,99 и 5^. = 0,98. Конверсия кумола в действующем произ-
водстве достигает хд = 0,5, а селективность по а-метилстиролу
Уд = 0,9. Используя значения конверсии и селективности в дей-
ствующем процессе и их предельные значения, можно опреде-
лить коэффициент эффективности реакторного узла дегидриро-
вания:
ХА „0^.0,9 ,
хт5т 0,99 0,98
Как видно, дальнейшее совершенствование реально дей-
ствующей технологии а-метилстирола возможно при использо-
вании высокоактивных и селективных катализаторов, которые
обеспечат повышение конверсии при сохранении селективности
процесса на достаточно высоком уровне.
Если превращение протекает селективно (необратимо), то
коэффициент эффективности, как он определен, будет совпа-
дать со степенью использования сырья.
Экономическая эффективность ХТС. Эффективность ХТС
определяется не только технологическими, но и экономически-
ми показателями.
Основные экономические критерии эффективности произ-
водства - приведенные затраты, себестоимость продукта, при-
быль, рентабельность.
Приведенные затраты состоят из полных текущих расходов на
производство продукта и части капитальных затрат, т. е. это есть
затраты на собственно производство продукта.
Себестоимость продукта включает в себя приведенные затра-
ты, оплату труда и дополнительные (непроизводственные) цехо-
вые и общезаводские расходы, т. е. полные затраты предприятия
на производство продукта.
Разность между ценой продукта (естественно, после его про-
дажи) и себестоимостью есть прибыль - важнейший показатель
эффективности производства.
Отношение прибыли к себестоимости - рентабельность про-
изводства.
231
Эти показатели являются категориями экономическими, они
рассчитываются специалистами по экономике и используются в
хозяйственной деятельности предприятия.
При разработке химико-технологического процесса исполь-
зуют, как правило, стоимостную его оценку в виде приведенных
затрат (Пз). Она включает:
условно-переменные затраты Зуп - стоимость сырья, вспомо-
гательных материалов и энергий;
условно-постоянные затраты Зук - часть стоимости капиталь-
ных затрат на оборудование.
Таким образом,
Пз = Зуп + Зук. (3.64)
Экономисты могут включать в приведенные затраты и другие
статьи расходов. Поэтому экономическая оценка ХТС, как она
будет представлена, используется только для сопоставления аль-
тернативных вариантов при разработке и анализе ХТС; такую
оценку удобнее назвать техно-экономическим анализом.
Исходный материал для техно-экономического анализа
включает: структурную (или технологическую) схему ХТС; на
ней должна иметься спецификация на все аппараты и по-
токи;
таблицу величин всех потоков, поступающих в ХТС (сырье,
вспомогательные материалы, пар, вода, топливо, электроэнер-
гия); вместо такой таблицы может быть выполнен материальный
и тепловой баланс (расчет) ХТС.
Исходная информация включает:
стоимость каждого входящего потока (сырья, пара, материа-
лов и т. д.); эти данные берутся из соответствующих справочни-
ков цен;
стоимость используемого оборудования (реакторов, колонн,
теплообменников и т. д.).
Конечно, не имея готового проекта производства, трудно
точно определить стоимость каждого аппарата. Поэтому прибе-
гают к оценкам стоимости оборудования будущего производства
на основе корреляционных зависимостей типа:
стоимость оборудования = базовая стоимость Fc,
где Fc - корректирующий фактор (поправка на материал, давление и т. д.).
Такие корреляции можно найти в специальной литературе
или их приходится получать из справочных данных по ценам
аналогичного оборудования.
232
Исходные материалы и информация могут быть систематизи-
рованы в двух таблицах, “шапки” которых имеют вид:
№ потока в схеме Наимено- вание потока Единица измерения Величина потока G„ Цена еди- ницы пото- ка Цп Стоимость потока Зуп
№ аппара- та в схеме Наимено- вание аппарата Характе- ристика аппарата (размер, мощность) Пример- ная стои- мость аппарата Цоб Коэффици- ент исполь- зования ап- парата Е Приведен- ная стои- мость аппа- рата Зук
Из наименования разделов понятно их содержание, но пояс-
ним последние два столбца. Стоимость потока (вещества,
энергии) определяют, исходя из его цены Цп и количества Gn,
потребляемого в единицу времени (обычно за год):
Зуп = ЦПОП. (3.65)
Стоимость оборудования - единовременные затраты. Они по-
степенно переносятся на стоимость продукции, исходя из срока
эксплуатации аппарата. Обычно этот коэффициент использова-
ния аппарата рассчитывают, исходя из годовых затрат на произ-
водство продукции. Он может быть индивидуален для каждого
типа аппарата и различаться на разных предприятиях. В хими-
ческой промышленности в среднем Е = 0,12 0,15. Приведен-
ная стоимость аппарата
Зук = £11 об (3.66)
есть часть капитальных затрат, входящая в приведенные затраты.
Суммарные затраты на все потоки есть условно-переменные
затраты Зуп = гДе индекс i относится к номеру пото-
i
ка. Суммарный расход на все аппараты есть капитальные вло-
жения Цкз = ЕПоб , а приведенная стоимость всех аппаратов
J
Зук =Z^jtUo6A: - Разделив приведенные затраты Пз на годовую
к
производительность, получим Пз на единицу продукции.
233
Такая техно-экономическая оценка разрабатываемой ХТС не-
точна. Но по мере разработки (уточнение схемы, детальная раз-
работка подсистем, аппаратурное оформление) расчет затрат
становится более точным. В литературе были опубликованы
данные по точности оценки затрат на производство продукта по
мере разработки ХТС. Для некоторых этапов получено:
Этап разработки ХТС Возможная точность оценки
приведенных затрат, %
Предварительная разработка ХТС
с корреляционной оценкой стоимости......+40
Определение основного аппаратурного
оформления .............................±25
Определение общих финансовых затрат
(предпроектная разработка)..............±12
Определение проектной стоимости..........±6
Детальный расчет затрат для конкретного
строительства............................±3
По мере разработки ХТС все в большей степени подключа-
ются экономисты для более полного и точного учета всех затрат.
Техноэкономический анализ в том виде, в каком он был пред-
ставлен выше, проводится в основном на первых двух этапах
разработки ХТС.
Доля различных видов затрат на производство зависит от ти-
па производства. Некоторые усредненные данные по подотрас-
лям химической промышленности приведены в табл. 3.4.
В общем объеме капитальных затрат машины, оборудование
и приборы составляют 30-40%, здания и сооружения - 50-55%,
транспортные средства - 3-4%.
Как видим, затраты в химическом производстве складывают-
ся в основном из трех статей: сырье, энергия всех видов, капи-
тальные вложения. Расходы по этим статьям в значительной
Таблица 3.4. Относительные значения составляющих себестоимости продукции (Л)
для различных подотраслей химической промышленности
Статьи затрат А в различных подотраслях
основ- ная химия азотная промыш- ленность пласт- массы красители, органические продукты лакокрасочная промышлен- ность
Сырье и материалы 55,0 31,2 71,5 61,4 38,2
Топливо и энергия 12,5 33,0 4,0 7,3 0,4
Содержание и экс- плуатация оборудова- ния 13,0 16,0 6,5 9,5 3,2
Основная и допол- нительная зарплата 3,8 3,7 4,3 4,4 1,3
Цеховые, заводские и другие расходы 15,7 14,3 13,7 17,4 6,9
234
степени зависят от степени конверсии сырья, селективности и
интенсивности процессов. В свою очередь эти показатели свя-
заны с особенностью термодинамики и кинетики химических
реакций, положенных в основу данной конкретной ХТС. Таким
образом, можно прийти к установлению глубокой связи между
затратами на процесс и основными термодинамическими и ки-
нетическими закономерностями.
3.5. СИНТЕЗ ХИМИКО-ТЕХНОЛОГИЧЕСКОЙ СИСТЕМЫ
3.5.1. Задачи синтеза химико-технологической системы
Синтез, или построение, ХТС заключается в определении
основных технологических операций и их последовательности,
выборе аппаратов и установлении связей между ними, опреде-
лении параметров технологических режимов отдельных аппара-
тов и системы в целом, обеспечивающих наилучшие условия
функционирования ХТС. Постановка задачи синтеза ХТС сле-
дующая.
Дано:
вид и качество продукта, который необходимо производить;
вид, состав и состояние исходных веществ (сырья);
основные стадии химико-технологического процесса перера-
ботки сырья в продукты и их характеристики;
возможные аппаратурные решения для осуществления хими-
ко-технологического процесса.
Определить:
элементный состав ХТС (аппараты, машины, устройства и
проч.) для переработки сырья в продукты;
структуру связей между элементами ХТС, обеспечивающими
последовательность стадий химико-технологического процесса и
функционирование всей системы;
режимы отдельных элементов и системы в целом, обеспечи-
вающие необходимые показатели производства и его эффек-
тивное функционирование.
При такой формулировке предполагается, что какие-то осно-
вы химико-технологического процесса уже заданы на ранней
стадии его проработки и их необходимо реализовать в некой
ХТС. Конечно, возможна корректировка данных предваритель-
ной проработки процесса, так что ХТС будет создаваться даже
на другой основе. Например, придется проработать использова-
ние альтернативного сырья или источника энергии, рассмотреть
иные стадии процесса или принципиально другое аппаратурное
оформление процесса. Тем не менее результат синтеза ХТС есть
235
основа для проектирования производства. И здесь, возможно,
потребуется проработка других вариантов ХТС, удовлетворяю-
щих требованиям, возникающим на стадии проектирования,
выполнения рабочих проектов оборудования и других состав-
ляющих частей производства. Это может быть связано с наличи-
ем или отсутствием необходимого оборудования и его стои-
мостью, возможностью или невозможностью транспортировки
оборудования с заводов-изготовителей, условиями строительно-
монтажных работ, условиями дальнейшей эксплуатации всей
системы.
Совокупность трех стадий - предварительной подготовки
данных, синтеза ХТС и проектирования производства - назы-
вают разработкой химико-технологического процесса или разра-
боткой технологии какого-либо продукта или процесса. Поэто-
му здесь синтез ХТС будем понимать шире, чем это было пред-
ставлено вначале, считая, что он включает в себя многие вопро-
сы разработки и создания или усовершенствования производ-
ства.
3.5.2. Подход к синтезу химико-технологической системы
Сопоставим два процесса - научный (получение новых знаний)
и инженерный (разработка и создание нового производства)
(рис. 3.23). По структуре своей они очень похожи, только моти-
вировки несколько различаются: в первом случае - любозна-
тельность, во втором - практическая необходимость. В обоих
процессах движущим началом является стремление к прогрессу,
развитию. Оба процесса состоят из аналогичных стадий, харак-
терных для творчества: поиск решений на каждом этапе, возврат
к предыдущим для нахождения новых, лучших и правильных
решений. Конечно, методическая и техническая базы различны
в разных объектах исследований, да и время на инженерную
разработку ограничено, жестко лимитировано. Но в обоих про-
цессах требуется сочетание науки и искусства - как в открытии,
так и в создании нового.
Основная цель инженерного процесса - создание производ-
ства жизненно важных материалов (новых или уже существую-
щих). Генерирование идей и последующая их реализация в про-
изводствах безусловно предусматривают не только полезность
продукции и эффективность производства, но и обеспечение его
экологической безопасности и комфортности в эксплуатации.
Поэтому фактически, по данным некоторых исследователей,
шанс на реализацию нового процесса на стадии его исследова-
ния составляет 1-3%, на стадии разработки - 10-25%, на стадии
опытно-промышленных установок - 40-60%. Добиться успеха в
236
Научный процесс
Инженерный процесс
Рис. 3.23. Синтез ХТС как творческий процесс
такой ситуации возможно, рассматривая десятки и сотни тысяч
(по оценкам экспертов) путей достижения конечной цели, т. е.
разработка процесса - действительно искусство (вспомните пер-
воначальный смысл слова “технология”), процесс творческий.
Можно сравнить искусство разработки процесса с творчеством
художника. Он начинает с набросков картины и ее модифика-
ций, только очерчивая контуры объектов. Инженер-технолог
начинает с рассмотрения альтернативных решений и представ-
ления функциональных схем. Художник добавляет на картине
детали объектов и краски. Инженер-технолог начинает прораба-
тывать аппаратурные решения, дополняет разработку количе-
ственными расчетами. Художник оценивает - удовлетворяет ли
его достигнутое. Инженер-технолог проводит экспертизу до-
стигнутого. Если “да”, идет дальнейшая детализация, если “нет”
- ищутся новые решения. Художник убирает одни детали и до-
бавляет другие. Инженер-технолог меняет состав и компоновку
аппаратов и узлов. Художник меняет структуру картины, техни-
ку ее исполнения. Инженер-технолог - структуру ХТС, ищет
нетрадиционные решения и новую технику разработки. Творче-
ский процесс усовершенствования разработки продолжается до
завершения работы. Знания фундаментальных основ и глубокое
237
понимание происходящих процессов, методы математического
моделирования и системного анализа сокращают процесс созда-
ния, синтеза ХТС. В литературе такой подход последовательного,
системного улучшения принимаемых решений назван инженерным
методом, т.е. является творческим инженерным процессом.
Эволюционный подход с использованием метода последова-
тельных приближений покажем на примере разработки произ-
водства азотной кислоты.
Сырье - аммиак и воздух (кислород воздуха). Химическая
схема и характеристики реакций следующие:
4NH3 + 5С>2 = 4NO + 6Н2О - реакция окисления аммиака
экзотермическая, протекает во внешнедиффузионной области
на платиновом катализаторе в виде сеток; температура 850-
900 °C; концентрация NH3 - 10%;
NO + 1/2 О2 = NOj - реакция газофазная, обратимая, экзо-
термическая;
2NO2 + Н2О + 1/2 О2 = 2HNO3 - гетерогенный (“газ-
жидкость”) химический процесс с дополнительным окислением.
На первом этапе представим ХТС, включающий элементы, в
которых происходят описанные превращения (рис. 3 24, а). Ам-
миак окисляется в адиабатическом реакторе 6. Газы после реак-
тора охлаждаются в холодильнике 8, чтобы как можно полнее
прошло окисление оксида азота в Диоксид в окислителе 9. В
схеме далее имеется абсорбционная колонна 11 для последую-
щих превращений.
Теперь можно взглянуть критически на первые “штрихи” или
“эскиз” разработки. Проводим экспертизу полученной ХТС, в
результате которой возникают следующие замечания.
1. Воздух сам (без нагнетания) в систему не пойдет.
2. Аммиак поступает в жидком виде, а дозировка низкоки-
пящей жидкости очень затруднена.
3. Адиабатический разогрев аммиачно-воздушной смеси «720
град., и чтобы обеспечить температуру процесса 850-900 °C, темпе-
ратура на входе в реактор должна быть не менее 130-180 °C.
4. Окисление NO - реакция экзотермическая, и после окис-
лителя газ нагреется, что ухудшит абсорбцию оксидов азота.
5. Высокотемпературные газы после реактора окисления ам-
миака целесообразно использовать для утилизации тепла с по-
лучением пара.
6. В реакторе окисления аммиака установлено оптимальное
соотношение NH3:O2 = 1:1,8, а суммарный расход кислорода
составляет два объема на один объем аммиака [см. уравнение
(3.19)], и при первоначальном 10%-м содержании аммиака в
воздухе кислорода будет недостаточно для третьей реакции.
238
Рис. 3.24. Эволюция ХТС (а, б, в) при разработке производства азотной кислоты:
/ - воздушный фильтр; 2 - компрессор; 3 - смеситель; 4 - испаритель; 5 - теплообмен-
ник; 6- реактор; 7- котел-утилизатор; 8 холодильник; 9 - окислитель; 10- холодильник-
конденсатор; 11 - абсорбционная колонна; 12 - отбелочная колонна
Эти замечания учтены во втором варианте ХТС (на рис. 3.24,
б). Сделаны соответствующие добавления к первому варианту: в
скобках стоят цифры, отмечающие, какое из замечаний учтено
этим добавлением. Из названий аппаратов и назначений связей
должно быть понятно, как учтены сделанные замечания.
Следующий критический взгляд на схему, следующая экспер-
тиза - и появляются новые замечания:
7. Катализатор очень чувствителен к загрязнениям, а воздух
не очищен.
8. Нерациональна установка отдельно подогревателя исход-
ной смеси 5 и холодильника нитрозных газов 8 со своими теп-
лоносителями и системой циркуляции в каждом.
9. В реакции окисления аммиака образуется довольно много
воды, и при охлаждении газов перед абсорбцией вода будет
конденсироваться в теплообменнике и частично поглощать ок-
сиды азота, образуя кислый конденсат.
10. В образующейся азотной кислоте будет растворено неко-
торое количество оксидов азота, продукт будет невысокого ка-
чества, желтоватого цвета и выделять оксиды азота.
239
Рис. 3.25. Этапы разработки промышленно-
го процесса
Третье решение (рис. 3.24, в) с
учетом замечаний 7-10 еще более
улучшает ХТС производства HNO3.
И такая эволюционная разработка
продолжается. Конечно, здесь все
показано схематично, разработка
прослежена не до конца - реаль-
ность много сложнее демонстраци-
онного материала, но логика и
искусство разработки на этом при-
мере прослежены.
И хотя выше говорилось об
“искусстве разработки”, тем не
менее можно представить схему
основных этапов разработки про-
мышленного процесса (рис. 3.25).
По общей направленности она
согласуется с “инженерным про-
цессом”. Эта схема отражает ре-
альную структуру работ: указанные
этапы в том или ином виде входят
в план работ по созданию процесса
и нередко являются основой пла-
ново-распорядительных докумен-
тов. В схеме выделены разделы -
научно-исследовательские работы
(НИР) и опытно-конструкторские
работы с проектированием (ОКР).
В отраслевых научно-
исследовательских и проектных
институтах, в соответствующих
подразделениях крупных фирм и
предприятий такое планирование работ есть основа их органи-
зации и деятельности.
Современная вычислительная техника и вычислительные ме-
тоды, казалось бы, могут помочь из многообразия типов аппара-
тов (элементов) и связей выбрать такие, которые образуют ХТС
с необходимыми показателями. Но это нереально (по крайней
мере в ближайшем будущем), так как система очень разнородна
по составу оборудования (реакторы, абсорберы, насосы и т.д.),
вариантов простого перебора невероятно много, велико количе-
ство требований к системе, многие показатели противоречивы.
240
Здесь используются некоторые наборы решений, обоснованных
теорией химико-технологических процессов, созданных на
основе инженерных проработок и проверенных практикой.
Этими решениями удается достичь лучших значений опреде-
ленных показателей ХТС, выполнить заданные требования к
ней. Среди них - максимальное использование сырьевых и
энергетических ресурсов, минимизация отходов, эффективное
использование оборудования. Поскольку эти требования долж-
ны всегда выполняться, назовем их принципами создания ХТС.
Совокупность приемов и алгоритмов, обоснованных и прове-
ренных решений, с помощью которых эти требования к ХТС
метут быть осуществлены и которые успешно применяются при
синтезе ХТС, назовем эвристиками. Они позволяют повысить
эффективность поиска решений, использовать имеющийся
опыт, накапливать опыт на будущее. Они же используются в
автоматизированных системах синтеза ХТС. Наиболее распро-
страненные из них рассмотрим далее.
3.6. СИНТЕЗ ХИМИКО-ТЕХНОЛОГИЧЕСКОЙ СИСТЕМЫ
И СЫРЬЕВЫЕ РЕСУРСЫ
3.6.1. Сырье в химическом производстве
Исходными веществами для производства промышленных про-
дуктов являются сырье, полупродукты и вторичное сырье. Пер-
вые из названных исходных веществ - основные, их называют
сырьевыми ресурсами.
Сырьевые ресурсы (сырье) - природные материалы, используе-
мые в производстве промышленных продуктов.
Промышленное сырье классифицируют: по проис-
хождению - минеральное, растительное и животное; по
запасам - невозобновимые и возобновимые; по хими-
ческому составу - неорганическое и органическое; по
агрегатному состоянию - твердое, жидкое и газообраз-
ное.
Минеральное сырье - это добываемые из земных недр полез-
ные ископаемые, которые при данном уровне развития техники
экономически эффективно могут быть переработаны в промыш-
ленности в требуемые продукты. Они залегают в литосфере
(твердой оболочке Земли) на глубине до 10 км и представлены
различными минеральными ассоциациями в виде осадочных,
изверженных и метаморфических горных пород. Многие эле-
менты входят в химический состав литосферы, но лишь восемь
241
из них составляют основную массу. Их примерное содержание в
% (мае.) следующее:
О - 47; Si - 28; Al - 9; Fe - 5; Са - 4; Na, К - по 3, Mg - 2.
Остальных элементов содержится менее 1%. Минеральное сырье
принято делить на три вида: рудное, нерудное и горючее.
Рудным минеральным сырьем называют горные
породы, из которых получают металлы. В ходе переработки
многих видов рудного сырья наряду с металлами производят
также химические продукты. Классическим примером является
получение серной кислоты при производстве меди, цинка, ни-
келя.
Нерудное минеральное сырье - это горные поро-
ды, используемые в производстве химических, строительных и
других неметаллических материалов и не являющиеся исходным
материалом для производства металлов. Галит (поваренная соль
NaCl) - нерудное сырье в производстве каустической соды
NaOH и хлора, серный колчедан (пирит FeS2) и сера - в произ-
водстве серной кислоты, апатит и фосфорит [группа фосфорсо-
держащих минералов, например Сац^РС^)^] - в производстве
фосфорной кислоты.
Горючее минеральное сырье содержит в своем со-
ставе углерод, поэтому его также называют углеродсодержащим.
К этому виду сырья относят угли, нефть, горючие сланцы, при-
родный газ. Они способны сгорать в кислородсодержащей среде
и потому служат источниками тепловой энергии. Из-за этого их
также называют топливным сырьем. Нефть - сложная смесь
алканов, цикланов и аренов - сырьевая база группы химических
производств, называемых нефтеперерабатывающими: бензина,
мазута, моторного и дизельного топлива. Природный газ ис-
пользуется как сырье в производстве удобрений, пластических
масс и других продуктов химической промышленности. Уголь,
природный газ, сланцы перерабатывают в разнообразные про-
межуточные продукты для процессов органического синтеза и
других химических производств. Интерес к углю как альтерна-
тивному нефти сырью для химической промышленности за по-
следние годы возрос - известны методы его превращения в
жидкие углеводороды (их смесь иногда называют
“искусственной нефтью”), моторное топливо. Горючее мине-
ральное сырье - основа для очень широкой гаммы продуктов
химических производств.
Растительное и животное сырье имеет происхождение, соот-
ветствующее его названию. Растительное сырье включает древе-
сину, картофель, подсолнечник, сахарную свеклу, хлопок, лен,
коноплю, отходы первичной обработки сельскохозяйственной
242
продукции - подсолнечную, хлопковую лузгу; животное сырье -
шерсть, кожу, жиры, отходы первичной обработки. Его перера-
батывают в продукты питания (пищевое сырье), в бытовые и
технические продукты. Растительное сырье подвергают следую-
щим видам переработки: использование его высокомолекуляр-
ных компонентов в неизменном или модифицированном виде
(производство пластмасс, волокон): пиролиз с получением газо-
образных и жидких продуктов (оксида углерода, водорода, мас-
ляных фракций); каталитическое, в частности ферментативное,
расщепление полимерных компонентов с образованием органи-
ческих продуктов (этанола, фурфурола, фенолов, кормового
белка и др.).
Воздух и вода. Не только литосфера является сырьевой базой
химической промышленности. Принимают (условно), что зем-
ная кора включает атмосферу до высоты 15 км, гидросферу и
литосферу. Воздух атмосферы и вода гидросферы также являют-
ся сырьем химической промышленности. Азот воздуха (его со-
держание около 79%) используют для производства аммиака,
кислород (около 21%) - во многих окислительных процессах.
Вода служит источником получения водорода и кислорода,
реагентом во многих химических процессах, при получении
кислот и щелочей. Ее применяют как вспомогательный матери-
ал для приготовления растворов твердых, жидких и газообраз-
ных веществ, в качестве абсорбента при очистке газов. Вода в
природе в чистом виде практически не существует, в ней всегда
растворены различные соли. Иод и бром получают из высоко-
концентрированных соляных растворов (рапы) морских заливов
(лагун).
Невозобновимое сырье не восстанавливается совсем или вос-
станавливается значительно медленнее, чем идет его использо-
вание человеком в обозримый период времени. К нему принад-
лежат полезные ископаемые. Использование этого сырья неиз-
бежно приводит к его исчерпанию. Уже сейчас очевидна огра-
ниченность ресурсов природной нефти несколькими десятиле-
тиями ее потребления современными темпами. Практически
исчерпаны природные запасы селитры как источника связанно-
го азота, и с начала нынешнего столетия его получают из сво-
бодного азота воздуха в виде аммиака.
Возобновимое сырье - это растительное и животное, некото-
рое минеральное (например, соли, осаждающиеся в озерах и
морских лагунах). Растениями земного шара методом фотосин-
теза ежегодно связывается 2-1011 т углерода Восстановление
возобновимого сырья идет с разной скоростью. Темпы расхода
возобновимого сырья должны соответствовать темпам его по-
требления. Иначе оно станет не возобновимым.
243
Полупродукты - вещества и материалы, являющиеся исход-
ными в производстве продуктов и полученные из природного
сырья в другом производстве.
Примерами служат аммиак в производстве азотной кислоты и
бензол в синтезе алкилбензолов. Названные полупродукты по-
лучают из природного сырья: аммиак - из природного газа, во-
ды и воздуха, а бензол - из нефти или угля. Продукты нефтепе-
реработки - исходные вещества для нефтехимической промыш-
ленности и производства органического синтеза. Масла, извле-
каемые из растительного сырья, используют в производстве мы-
ла, лакокрасочных материалов, вспомогательных веществ для
легкой промышленности.
Природные материалы как сырье претерпевают многоступен-
чатое превращение. На рис. 3.26 приведена схема использования
нефтяного сырья в производстве полимерных материалов, а на
рис. 3.27 отображены пути дальнейшего использования аммиа-
ка, полученного из природного сырья. В абсолютном боль-
шинстве производств исходные вещества для них - полупродук-
ты, как они были определены выше. Поэтому обычно и при-
родные материалы, и полупродукты называют первичным сырьем
Вторичное сырье - используемые в производстве вещества и
материалы, являющиеся невостребованными в других произ-
водствах. Источниками их являются отходы производства и от-
ходы потребления.
Отходы производства - остатки сырья и вспомога-
тельных материалов, которые утратили свои первоначальные
качества, а также продукты, не являющиеся целью производ-
ственного процесса (дополнительные продукты).
Отходы потребления - бывшие в употреблении ве-
щества и изделия, восстановление которых экономически неце-
лесообразно.
Основные пути их использования в промышленном произ-
водстве следующие: 1) извлечение, регенерация непрореагиро-
вавшего сырья и материалов и возврат в производство; 2) извле-
чение ценных компонентов как продуктов производства; 3) вы-
деление компонентов и придание им с помощью специальных
операций товарной ценности; 4) использование отходов как
исходных веществ и материалов в других производствах или
других отраслях промышленности.
Во всех случаях предполагается одно из двух назначений вто-
ричного сырья как исходного компонента:
вторичное сырье частично или даже полностью заменяет
первичное в каком-либо производстве;
На основе вторичного сырья создается новый химико-
технологический процесс, отличный от применяемого в произ-
водстве того же продукта на основе первичного сырья.
244
ИСХОДНОЕ НЕФТЯНОЕ СЫРЬЕ
Рис. 3.26. Использование нефтяного сырья в производстве полимерных мате-
риалов
245
Рис. 3.27. Использование синтетического аммиака
Очевидно, что вторичное сырье сберегает природные ресур-
сы. Классическим примером этого является полная замена при-
родной селитры на получаемую из аммиака, производимого из
природного газа и воздуха. Когда в 30-х годах возникла пробле-
ма обеспечения удобрениями посевов хлопчатника в Узбекиста-
не, было создано производство селитры из воды и воздуха. Во-
да - сырье для получения водорода электролизом. Воздух - сы-
рье для получения азота глубоким холодом. Вода - источник
энергии (электростанции) для этих энергоемких процессов.
Этого было достаточно, чтобы синтезировать аммиак, из него -
азотную кислоту и далее из аммиака и азотной кислоты - селит-
ру, ценное удобрение. До 30% серной кислоты производится из
отходящих газов цветной металлургии и процессов обессерива-
ния нефти.
Химический состав сырья обусловливает его применение в
различных отраслях и подотраслях промышленности. В хими-
ческой промышленности это производства неорганических про-
дуктов и производства нефтехимического и органического син-
теза.
Агрегатное состояние сырья определяет в основном методы
его транспортировки и подготовки к переработке.
Добываемое из недр Земли сырье кроме целевых компонен-
тов содержит бесполезные (пустая порода) и вредные примеси.
В большинстве случаев содержание примесей относительно ве-
лико, поэтому приходится проводить обогащение сырья: оно
необходимо для уменьшения затрат на переработку сырья,
улучшает качество продукта и уменьшает расходы на транспорт
сырья к месту производства. Основные методы обогащения и
подготовки сырья следующие.
Обогащение твердого сырья. Рассеивание (грохо-
чение) применяют для разделения твердой породы, содержа-
246
щей минералы различной прочности и образующей при измель-
чении зерна различного размера. Последовательное прохожде-
ние измельченного сырья через грохоты - сила с отверстиями
разных размеров - позволяет выделять фракции, обогащенные це-
левыми минералами. Применяют при обогащении фосфатных руд.
Гравитационное обогащение основано на различии
плотностей минералов и пустых пород. Их разделяют в опреде-
ленных средах: в тяжелой жидкости, в потоке воды или воздуха.
В зависимости от среды гравитационное разделение бывает
мокрым или сухим.
Электромагнитное и электростатическое
обогащение основано на различии магнитной проницаемос-
ти или электрической проводимости компонентов сырья. Про-
ходя на транспортере магнитное или электрическое поле, фрак-
ции разделяются. Применяют при разделении некоторых видов
рудного сырья.
Флотация (англ, to float - плавать на поверхности) - наи-
более широко применяемый способ обогащения. Он основан на
различной смачиваемости водой частиц минерального сырья. Во
флотационную машину поступает смесь воды и мелких частиц
обогащаемой руды - пульпа - и подается воздух. Гидрофобные
(не смачиваемые водой) частицы прилипают к пузырькам возду-
ха и выносятся вместе с ними на поверхность, образуя пену,
которая удаляется специальным устройством. В пульпу вводят
специальные добавки. Одни из них стабилизируют пузырьки,
предотвращают их разрушение в пене. Другие - флотационные
реагенты - изменяют смачиваемость частиц, образуя на их по-
верхности молекулярные гидрофобные или гидрофильные плен-
ки. Применяют для разделения полиметаллических сульфидных
руд, отделения пустой породы от нефелина и обогащения ка-
менных углей и многих минералов.
Термическое обогащение основано на различной
плавкости компонентов сырья. Например, при нагревании серо-
содержащей руды легкоплавкая сера раньше других компонен-
тов руды переходит в жидкое состояние и отделяется.
Химическое обогащение основано на различии хи-
мической активности компонентов сырья, в том числе по отно-
шению к определенным химическим реагентам. Происходит
химическая реакция с последующим выделением образо-
вавшегося соединения осаждением, испарением, плавлением и
т.д. Применяют для удаления балластных органических приме-
сей обжигом твердой породы.
Экстракция используется для извлечения целевых ком-
понентов из твердого и жидкого сырья. Это один из основных
методов извлечения редких металлов из минерального сырья.
247
Бензиновый конденсат
I Бензин
этан
пропан
н-бутан
пентан
газовый
бензин
Раствор
моноэтано
амина
Сера
На очистку
от серы
|~На осушку! „ |В магистральный
1 ' Iтрубопровод
Рис. 3.28. Блок-схема газоперерабатывающего завода:
1 - пункт приема газа; 2 - установка сепарации конденсата; 3, 4 - компрессоры; 5 - от-
бензинивающая установка; 6 - газофракционирующая установка; 7 - установка осушки газа;
8 - установка очистки от кислых газов; 9 - установка получения серы
Разделение жидких и газовых смесей. Жидкие и газовые смеси
разделяют, используя различие температур кипения, различие
растворимости, сорбционных, химических и других свойств
компонентов смеси. Наиболее широко разделение таких смесей
используют на нефтяных месторождениях. Нефть - смесь угле-
водородов с примесями кислородных, сернистых и азотистых
соединений - разделяют перегонкой на составные части, или
фракции, - бензин, лигроин, керосин, мазут и т.д. Сернистые
соединения бензиновой фракции удаляют каталитической гид-
роочисткой - в паровой фазе на катализаторе сернистые соеди-
нения гидрируют до сероводорода, который отделяется при
конденсации.
На нефтяных месторождениях вместе с нефтью добывается
нефтяной (попутный) газ, который представляет собой смесь
различных углеводородов, водяных паров, азота и некоторых
других компонентов. Транспортировать такой газ по трубопро-
водам практически невозможно - водяные пары и тяжелые уг-
леводороды конденсируются в трубах. Поэтому попутный газ
предварительно разделяют на газоперерабатывающем заводе,
функциональная схема которого представлена на рис. 3.28.
Более детально схемы и аппаратура подготовки сырья к пе-
реработке рассматриваются в литературе по процессам и аппа-
ратам химической технологии и конкретным промышленным
производствам.
3.6.2. Концепция полного использования сырьевых ресурсов
В большинстве химических производств затраты на сырье со-
ставляют значительную часть себестоимости продукции (см.
табл. 3.4). Концепция полного использования сырьевых ресур-
248
сов направлена на максимальный выход целевого продукта,
максимальное превращение сырья в используемые, полезные
продукты. Ниже приводятся некоторые методы достижения этой
цели.
Выбор схемы процесса - важнейший этап, на котором можно
добиться улучшения использования сырьевых ресурсов. Винил-
хлорид получают в две стадии - хлорирование этилена и даль-
нейший пиролиз образовавшегося дихлорэтана:
СН2=СН2 + С12 —> СН2С1=СН2С1 —>
-> СН2=СНС1 + НС1.
Избирательность каждой из стадий - около 95%, образуется
НС1 как отход. Выход винилхлорида по этилену - 90%, а по
второму исходному веществу, хлору, - 50%.
Перейдя к одностадийной схеме окислительного гидрохлори-
рования с заменой одного из продуктов - (С12) на другой (НС1)
СН2=СН2 + НС1 + О2 —> СН2=СНС1 + Н2О
с избирательностью 95%, удалось разработать процесс с 95%-м
выходом продукта по обоим исходным компонентам.
Избыток одного из реагентов - как правило, более дешевого и
доступного, а также возможность вернуть его в процесс. Ис-
пользуют два фактора влияния избытка реагента на увеличение
выхода продукта.
Термодинамический фактор заключается в том, что
избыток одного реагента увеличивает максимальное, равновес-
ное превращение другого. В паровой конверсии метана (СН4 +
+ Н2О = СО + ЗН2) стехиометрическое соотношение реагентов
СН4:Н2О = 1:1. В промышленных условиях (Р = 30 ат., Т =
= 900 °C) равновесная степень превращения СН4 для исходной
смеси указанного состава хр = 0,58. При соотношении
СН4:Н2О =1:4 (четырехкратный избыток Н2О) хр = 0,96. Это
соотношение использовано в промышленности.
Кинетический фактор обусловлен особенностями ме-
ханизма и кинетики протекающего процесса. В окислении ам-
миака 4NH3 + 5О2 = 4NO + 6Н2О стехиометрическое соотно-
шение реагентов О2:ЫНз = 1,25. Реакция протекает во внешне-
диффузионной области и лимитируется переносом аммиака -
его концентрация у поверхности катализатора мала. При сте-
хиометрическом соотношении реагентов также мала будет кон-
центрация кислорода. В этих условиях NH3 окисляется в основ-
ном до N2. Необходим избыток кислорода, чтобы он вытеснил
аммиак с поверхности катализатора, и тогда последний окис-
ляется преимущественно до NO. Необходим избыток кислорода,
249
0,5
0,3
0,1'
NO
HNO,
HNO-j
6
Обходящие
газы
Рис. 3.29. Зависимость равновесных парциальных давлений оксидов азота NOV
(Pnox) над раствором HNO3 от ее концентрации (Chnq3 ) (о) и схема ад-
сорбционной колонны (б)
чтобы он вытеснил аммиак с поверхности катализатора, и тогда
последний окисляется преимущественно до NO. Используя со-
отношение O2:NH3 = 1,8, создают большой избыток кислорода
у поверхности, что и обеспечивает избирательное окисление
аммиака. Именно это и определило содержание NH3 в аммиач-
но-воздушной смеси 10%.
Противоточный контакт фаз - известное решение, обеспечи-
вающее максимальную движущую силу процесса переноса.
Пример - противоточное движение теплоносителей в теплооб-
меннике. Другой пример - абсорбция оксидов азота. На рис.
3.29 показана зависимость равновесных парциальных давлений
оксидов азота над раствором HNO3 от концентрации последней.
Для максимального поглощения оксидов (минимальное давле-
ние их) жидкая фаза должна быть слабокислой. Это достигается
в абсорбере с противоточным движением фаз (также показан на
рис. 3.29). В верхней части абсорбера, куда подается вода, кон-
центрация кислоты минимальная, и отходящие газы содержат
мало оксидов азота. Поглощение происходит почти полностью.
Это характерно для всех сорбционных процессов.
Фракционный рецикл используют при неполном превращении
исходных реагентов. В системе разделения после реактора выде-
ляют непрореагировавшие реагенты и возвращают на перера-
ботку. Типичный пример - синтез аммиака, в котором после
конденсации и сепарации аммиака оставшуюся азотоводород-
ную смесь снова направляют в реактор (см. рис. 3.5, 3.6). Во
многих процессах нефтехимического синтеза образуется целый
ряд продуктов. Их разделяют в многоколонной системе, и выде-
ленный исходный компонент возвращают в систему вместе со
свежей смесью. В этих случаях при неполном Превращении
реагентов в реакторе общее превращение исходного компонента
в системе будет полным.
250
1 - абсорбционная колонна; 2 - рекуперативный теплообменник; J - десорбционная ко-
лонна; 4 - подогреватель; МЭА - моноэтанол амин; карб. МЭА - карбонизированный моно-
этаноламин
Регенерация с рециклом. Вспомогательный материал после
использования регенерируют и возвращают в процесс. Напри-
мер, в схеме очистки азотоводородной смеси от СО2 в произ-
водстве аммиака используют поглотитель - моноэтаноламин
(МЭА). После абсорбции СО2 раствором МЭА последний подо-
гревают и направляют в десорбер (рис. 3.30). В нем выделяется
СО2, и регенерированный раствор возвращают на абсорбцию.
В системе ректификации продуктов дегидрирования этилбен-
зола в стирол добавляют элементную серу в колонну отгонки
продукта для предотвращения полимеризации стирола. Тем не
менее полимеризация частично протекает. Ее продукты вместе с
серой накапливаются в кубовых остатках ректификации стирола
(КОРС). Серу регенерируют растворением в углеводородной
среде и последующей ее кристаллизацией при охлаждении до 5-
10 °C. Из полимерных продуктов термодеструкцией (моно-
меризацией) при повышенных температурах (400-450 °C) реге-
нерируют стирол. Реакционные циклы показаны на рис. 3.31.
Регенерация серы и стирола в таком процессе достигает 90-95%.
Утилизация отходов позволяет получить дополнительные по-
лезные продукты из побочных продуктов реакции, практически
всегда образующихся вместе с целевым продуктом (непро-
реагировавшие исходные вещества, дополнительные продукты
реакции и примеси, имеющиеся в сырье). В синтезе аммиака
часть циркулирующей азотоводородной смеси непрерывно вы-
водят из системы. Это связано с тем, что свежая азотоводород-
ная смесь содержит незначительное количество примесей, в
основном метан. Он не выводится с аммиаком и накапливается
в цикле. Чтобы избежать его значительного накопления, прихо-
дится часть потока выводить (как говорят, “необходима отдув-
ка”)- Эта часть небольшая и мало сказывается на полноте ис-
пользования сырья. В производстве аммиака используют воздух
как источник азота. С воздухом в азотоводородную смесь попа-
251
Сера
свежая
Продукты
дегидрирования I
этилбензола I
Стирол
товарный
Сера
КОРС
Стирол и
растворитель
Этилбензол
возвратный
Раствор
КОРС
Охлажденный
Fраствор КОРС
]чСера и_____
J*углеводород
Рис. 3.31. Блок-схема производства стирола с регенерацией реагентов:
/ - ректификация; 2 - растворение кубовых остатков ректификации стирола (КОРС) в
этилбензоле; 3 - охлаждение и кристаллизация серы; 4 - фильтрация серы; 5 - мономериза-
ция КОРС
дает аргон. Он также концентрируется в цикле синтеза, и его
концентрация в отдувке значительно выше, чем в воздухе. Вы-
деляя аргон из отходящего газа, получают дополнительный цен-
ный продукт.
В производстве экстракционной фосфорной кислоты много
отходов от минеральных составляющих апатита в виде CaSO4,
называемого фосфогипсом. Чаще всего его складируют в отва-
лы, занимающие большое пространство (апатита расходуется
более 2,5 т на 1 т продукта). В отличие от природного фосфо-
гипс, являющийся отходом производства фосфорной кислоты,
несколько загрязнен и имеет другую кристаллическую структу-
ру. Перекристаллизация и обработка паром этого отхода произ-
водства фосфорной кислоты позволяет получать разнообразные
строительные материалы. Почти весь апатит при этом превра-
щается в полезные продукты (вместо 38% в случае отсутствия
переработки фосфогипса).
Производство фенола и ацетона кумольным методом включа-
ет последовательные стадии синтеза изопропилбензола, гидро-
пероксида изопропилбензола и кислотного разложения послед-
него на фенол и ацетон:
С6Н5 + СН3СН=СН2 —А1С13 > С6Н5СН(СН3)2—°2 >
^СбН5С(СН3)2____H2SO4 >С(,Н5ОН + СН3СОСН3.
I
ООН
252
В этих превращениях образуется отход - фенольная смола в
количестве 100-200 кг на 1 т фенола. Большинство ценных ком-
понентов, содержащихся в фенольной смоле, можно перерабо-
тать в дополнительные товарные продукты или использовать в
основном технологическом процессе:
------► Производство фенола и ацетона
Фенольная смола (отход)
Г
1 идрирование фенольной своды
Ректификация гидрогенизата
4
Выделение товарных продуктов
Фенол | —► Этилбензол
—► а-Метилстирол
Изопропилбензол —► Ацетофенон
Товарные
продукты
Утилизация фенольной смолы позволяет извлечь до 85%
ценных химических продуктов. В этой схеме присутствует также
фракционный рецикл по изопропилбензолу.
Альтернативное сырье. Использование невозобновимого
сырья заставляет искать не только способы его полного исполь-
зования, но и другие сырьевые источники. Использование отхо-
дов других производств - одно из направлений расширения сы-
рьевых источников. Другое направление - альтернативные ис-
точники первичного сырья.
Получение сырья для нефтехимической промышленности в
основном базируется на двух ведущих процессах переработки
нефти - термическом пиролизе (этилен и другие низшие оле-
фины) и каталитическом риформинге (бензол и другие аромати-
ческие углеводороды). Нефтепереработка обеспечивает также
выработку таких важных продуктов, как моторные топлива
(бензин, дизельное топливо и др.). Относительная ограничен-
ность запасов нефти при высоких объемах ее добычи, ухудше-
ние качества нефти вновь открываемых месторождений и, как
следствие, значительный рост затрат на их разработку обуслов-
ливают изменение структуры и диверсификацию сырьевого ба-
ланса для получения моторных топлив и органического синтеза.
В этом отношении большую перспективу имеет уголь.
Уголь является наиболее распространенным углеродсодержа-
щим полезным ископаемым. Интерес к нему как к альтерна-
253
Сжиженные газы
Рис. 3.32. Основные направления переработки некоторых видов сырья, альтернативных нефти
тивному источнику сырья за последние годы возродился. Из-
вестны несколько методов, которые используются для превра-
щения угля в жидкие углеводороды и топливо. Наибольшее зна-
чение приобрели гидрогенизация угля и газификация до СО и
Н2 с последующим каталитическим синтезом углеводородов.
Существуют два основных направления переработки синтез-
газа. Первое - превращение синтез-газа в этилен и другие угле-
водороды, которые в свою очередь могут быть переработаны в
промышленно важные химические продукты. Второе направле-
ние - прямое превращение синтез-газа или метанола, получен-
ного из синтез-газа, в целевые продукты органического синтеза.
Моторные топлива и сырье для органического синтеза могут
быть получены также из битуминозных нефтей, сланцев, при-
родного газа (рис. 3.32). Переработка альтернативного сырья
выходит за рамки одной ХТС.
3.6.3. Комбинированные химико-технологические процессы
и комплексное использование сырья
Пример утилизации фосфогипса можно было бы отнести к ком-
бинированным производствам, в которых в двух технологиче-
ских системах получают более одного продукта. Но производ-
ство строительных материалов и изделий из фосфогипса связано
с производством фосфорной кислоты только одной связью - по
ней передается отход одного производства как сырье в другое.
Комбинированное производство, или комбиниро-
ванная химико-технологическая система, представляет собой
комплекс взаимосвязанных технологических процессов для про-
изводства одного или нескольких продуктов.
Характерным примером является совместное производство
карбамида CO(NH2)2 и аммиака NH3. Карбамид получают вза-
имодействием NH3 и СО2:
СО2 + 2NH3 = CO(NH2)2 + Н2О.
Оба исходных вещества образуются в аммиачном произ-
водстве:
СН4 + 2Н2О = СО2 + 4Н2;
ЗН2 + N2 = 2NH3.
Из 1 моля СН4 образуется 1 моль СО2 и 8/3 моля NH3. На
образование 1 моля карбамида расходуются 1 моль СО2 и 2 моля
NH3 (из 2 2/3 молей, получаемых в аммиачном производстве).
Таким образом, из 1 моля СН4 можно получить 1 моль карба-
мида и 2/3 моля аммиака. Оба технологических процесса объ-
единены не только линиями передачи СО2 и NH3, но и другими
255
Рис. 3.33. Схема получения хлорвинила в комбинированных производствах двух
типов (а, бу.
I - пиролиз; 2 - хлорирование этилена; 3 - пиролиз дихлорэтана; 4 - окислительное
гидрохлорирование этилена; 5 - разделение; 6 - гидрохлорирование ацетилена
вспомогательными связями - материальными и энергетически-
ми. Понятно, что можно организовать и две отдельные ХТС,
продукты одной из которых являются сырьем для другой. По-
этому грань между комбинированным производством и после-
довательностью отдельных производств условна.
Классифицируем комбинированные производства. Выделим
два типа этих производств. Первый, подобный описанному вы-
ше, - взаимосвязанные ХТС для производства двух и более про-
дуктов. Второй тип - комбинированные взаимосвязанные раз-
личные химико-технологические процессы (или ХТС), произво-
дящие один продукт. Пример - производство винилхлорида.
Исходным сырьем для него является этилен, получаемый пиро-
лизом нафты, основным процессом - хлорирование этилена.
Можно предложить два варианта комбинирования производства
второго типа. Первый вариант заключается в следующем. Эти-
лен разделить на два потока и один из них хлорировать. Выде-
ляющийся при этом хлороводород направить на окислительное
хлорирование этилена до винилхлорида (рис. 3.33, а). Другой
вариант основан на изменении условий пиролиза, при которых
можно получить в равных количествах этилен и ацетилен Эти-
лен хлорируют до винилхлорида, а выделяющийся НО направ-
ляют на гидрохлорирование ацетилена с получением также ви-
нилхлорида (рис. 3.33, б). В обоих вариантах почти вдвое со-
кращается расход одного из компонентов - хлора. При таком
комбинировании получают в двух связанных друг с другом раз-
личных химико-технологических процессах один и тот же про-
дукт. Кроме того, во втором варианте оба процесса получения
продукта технологически зависят от третьего - пиролиза нафты.
256
Более высоким уровнем комбинирования производств было
бы замкнутое производство. В него поступает сырье и
выходят только полезные, потребляемые продукты и полупро-
дукты для других производств. Вспомогательные материалы,
имеющиеся отходы химико-технологического процесса полнос-
тью используются для обеспечения процесса в замкнутых цик-
лах. Производств, полностью отвечающих определению замкну-
того, практически нет. Это связано со следующим.
Рассмотрение основных источников природного сырья пока-
зывает, что в большинстве случаев кроме необходимого компо-
нента в них содержатся другие ценные вещества. Например, в
железной руде часто присутствуют медь, титан, ванадий, ко-
бальт, цинк, фосфор, сера, свинец и другие редкие элементы. В
полиметаллических рудах содержится более 50 ценных элемен-
тов, в том числе олово, медь, кобальт, вольфрам, молибден,
серебро, золото, металлы платиновой группы. Часто сопут-
ствующие элементы обладают большей ценностью, чем основ-
ные, ради которых организовано производство. В природном
газе содержатся азот, гелий, сера, а в составе газообразного кон-
денсата - гомологи метана. В нефтях имеются различные соеди-
нения серы, и им сопутствуют газы, содержащие ценные угле-
водороды, а также пластовые воды, в которых находятся иод,
бром и бор.
Комбинированное химическое производство не решает до
конца проблемы использования всего вещественного (или ком-
понентного, элементного) потенциала сырья. Замкнутое произ-
водство нереально из-за многокомпонентное™ сырья. Полное
использование вещественного потенциала сырья возможно при
комплексной переработке сырьевых ресурсов,
обеспечиваемой многими отраслями промышленности.
Примером комплексного использования большинства состав-
ляющих компонентов минерального сырья является начатая в
химической промышленности переработка нефелиновых руд
Кольского полуострова. Она предусматривает получение апати-
тового, нефелинового, титаномагниевого и сфенового концент-
ратов и их последующую переработку в фосфорные и бесхлор-
ные калийные удобрения, глинозем, кальцинированную соду,
поташ, коагулянты, фтористые соли, портланд-цемент, извлече-
ние диоксида титана и соединений редких металлов. Более полный
перечень полезных продуктов, получаемых при комплексной пере-
работке апатит-нефелиновых руд, приведен на рис. 3.34.
Концепция полного использования сырья реализуется в
стремлении углубить переработку нефта и получить из нее мак-
симум целевых продуктов. Разработанные и применяемые ныне
технологические процессы переработки тяжелых остатков нефти
257
Рис. 3.34. Схема комплексной переработки апатит-нефелиновых руд
позволяют увеличить отбор светлых нефтепродуктов до 75-80%.
При этом расход нефти на 1 т последних сокращается почти в
полтора раза.
Комплексная переработка сырья - более перспективное на-
правление в решении концепции полного использования сырье-
вых ресурсов и выходит за рамки одной ХТС.
3.7. СИНТЕЗ ХИМИКО-ТЕХНОЛОГИЧЕСКОЙ СИСТЕМЫ
И ЭНЕРГЕТИЧЕСКИЕ РЕСУРСЫ
3.7.1. Энергия в химическом производстве
В химических производствах протекают разнообразные процес-
сы, связанные или с выделением энергии, или с ее затратой,
или со взаимными превращениями и переходами. Энергия за-
трачивается на подготовку сырья, осуществление химических
превращений, выделение продуктов, транспортировку материа-
лов, сжатие газа и т. д. Потребление разных видов энергии
в стоимостном выражении распределяется между процессами
химического производства следующим образом: в химических
реакциях - 5-40%, в массообменных процессах - 30-80%, в теп-
лообменных процессах - 60-90%.
Почти половина тепловой энергии на химических предприя-
тиях расходуется на получение таких энергоемких продуктов,
как химические волокна (10,5%), аммиак (9,5%), полимеры
(8,2%), каустическая сода (4,7%), капролактам (3,5%), карбамид
(3,5%), метанол (2,5%).
Энергоемкость химического производства (расход энергии на
единицу получаемой продукции) - один из важнейших показа-
телей эффективности производства. Энергию выражают в раз-
личных единицах (кДж, кВт-ч и др.), в том числе в единицах
условного топлива (1 кг твердого топлива или 1 м3 газообразно-
го с теплотой сгорания 29,3 МДж). Энергоемкость производств
отдельных продуктов нефтехимической промышленности, вы-
раженная в тоннах условного топлива (ТУТ) на получение тонны
продукта (ТУТ/т) составляет: этилен и пропилен - 2,8-3,6; стирол -
6,8; бутадиен - 7,2; полиэтилен и полипропилен - 3,9 ТУТ/т.
Основные виды энергии, применяемые в тех или иных хими-
ческих производствах, зависят от характера технологического
процесса.
Тепловая энергия может быть получена за счет сжига-
ния твердого, жидкого и газообразного топлива в различных
устройствах. Тепловая энергия применяется для осуществления
самых разнообразных процессов - нагрева, плавления, сушки,
выпаривания, дистилляции, тепловой десорбции, эндотермиче-
259
ских превращений. В качестве теплоносителей используют то-
почные газы, получаемые сжиганием топлива, водяной пар,
горячую воду и другие жидкости (масло, расплавы солей и
проч.).
Электрическая энергия применяется для проведения
электрохимических (электролиз растворов и расплавов), элек-
тротермических (плавление, нагревание, синтез при высоких
температурах), электромагнитных процессов. В промышлен-
ности осуществляют процессы, связанные с использованием
электростатических явлений, - осаждение пылей и туманов,
электрокрекинг углеводородов. Широко используется в хими-
ческой промышленности превращение электрической энергии в
механическую в электроприводах различных машин и механиче-
ских устройств (дробилки, измельчители, смесители, центрифу-
ги, вентиляторы, насосы, компрессоры).
Световая энергия в последнее время приобретает все
большее значение для проведения фотохимических реакций.
Фотоэлектрические явления, в которых происходит превраще-
ние световой энергии в электрическую, применяют для автомати-
ческого контроля и управления технологическими процессами.
Используют также энергию других видов излуче-
ний и атомных превращений для проведения радиа-
ционно-химических превращений и ядерно-химических реак-
ций.
В общем расходе топливно-энергетических ресурсов на неф-
теперерабатывающих и нефтехимических предприятиях на долю
органического топлива (природный газ, мазут, горючие отходы)
приходится 45%, тепловой энергии - 40% и электрической
энергии - 15%.
Источники энергии условно делятся на первичные и вторич-
ные.
Первичные источники энергии - источники,
энергетический потенциал которых является следствием при-
родных процессов и не зависит от деятельности человека. К ним
относятся: ископаемые горючие и расщепляющиеся вещества,
нагретые до высокой температуры воды недр Земли (термальные
воды), Солнце, ветер, энергия вод рек, морей, океанов. Среди
первичных источников энергии в химической промышленности
преобладают газообразное и жидкое топливо, т.е. тепло, полу-
чаемое от тепловых электроцентралей (ТЭЦ) и котельных уста-
новок самих предприятий.
Вторичные источники энергии - вещества, обла-
дающие определенным энергетическим потенциалом и являю-
щиеся побочными продуктами деятельности человека: отходя-
щие горючие органические вещества, горячие отработанные
260
теплоносители промышленных производств (газ, вода, пар),
нагретые вентиляционные выбросы, горячие и находящиеся под
давлением технологические потоки и др.
Первичные источники энергии подразделяются на невозоб-
новляющиеся и возобновляющиеся. К невозобновляющимся пер-
вичным источникам энергии относят ископаемые горючие ве-
щества (уголь, нефть, природный газ, сланцы); к возобновляю-
щимся - все источники энергии, являющиеся продуктами дея-
тельности Солнца и природных явлений и процессов на по-
верхности Земли: ветер, энергия воды рек, морей и океанов,
растительные продукты биологической деятельности (древесина
и другие растительные продукты), а также Солнце. В настоящее
время в промышленности используют главным образом невоз-
обновляющиеся источники энергии, преимущественно газовое и
жидкое топливо.
Энергетическая ценность источников энер-
гии определяется количеством энергии (в кВт-ч), которая мо-
жет быть получена при сжигании 1 кг или 1 м3 топлива. Энерге-
тическая ценность некоторых видов топлива приведена ниже
(для природного газа - в кВт-ч/м3, для остальных - в кВт-ч/кг):
Каменный уголь.............8,0
Кокс.......................7,2
Торф.......................4,0
Коксовый газ...............4,8
Природный газ.............10,8
Уран..................22,5-106
Целесообразность применения некоторых источников энер-
гии определяется не только их энергетической ценностью, но и
запасами их в природе, географическим положением, доступ-
ностью и некоторыми другими факторами.
3.7.2. Концепция полного использования энергетических ресурсов
Концепция полного использования энергетических ресурсов
направлена на минимизацию энергетических и тепловых затрат,
на полное использование их в процессе.
Регенерация тепла и энергии. В ряде случаев для проведения
процесса (например, в реакторе) необходимо нагреть поток, а
после этого охладить его. Можно входящий поток нагревать
теплом выходящего. Такая схема была представлена как вид
циркуляционной (см. рис. 3.2, поз. 8). Это решение будет наи-
более эффективным, если реакция экзотермическая. Подобные
схемы регенерации тепла широко распространены в промыш-
ленности. На рис. 3.35 представлена схема гидродеалкилирова-
ния толуола с максимальной регенерацией тепла. Горячие газы
261
Рис. 3.35. Химико-технологическая система гидродеалкилирования толуола с
максимальной регенерацией тепла:
1 - печь; 2 — реактор; 3 — толуольная колонна, 4 - стабилизирующая колонна; 5 - бен-
зольная колонна; 6 - разделитель фаз; 7 - компрессор
после реактора используются в кипятильниках колонн разделе-
ния и предварительного подогрева реакционной смеси. В этой
системе практически имеется только один подогреватель с по-
сторонним теплоносителем.
Тепло может быть использовано для получения пара в котле-
утилизаторе; пар затем используется как энергоноситель для
привода паровых турбин этого же производства (рис. 3.36, а)
или как теплоноситель в технологических целях.
Регенерацию энергии осуществляют в процессах, проте-
кающих под давлением. Исходный газ сжимается в компрессоре
и направляется в технологические аппараты. Оставшийся сжа-
тый газ направляется в газовую турбину, находящуюся на одном
валу с компрессором (рис. 3.36, б). Расходы на энергию для при-
вода компрессора в этом случае будут значительно уменьшены.
Утилизация тепла и энергии - тепло или энергия потока ис-
пользуется для выработки тепловых (пар, горячая вода), элек-
трических и других энергетических ресурсов, применяемых не в
самом производстве. Химическое производство использует
энергию для обеспечения химико-технологического процесса,
большая часть которой остается в виде энергии технологических
потоков (не считая энергии, потребляемой эндотермическими
процессами, потерь на термодинамическую необратимость про-
цессов и естественных потерь в окружающую среду). Энергия
может также выделяться при протекании экзотермических про-
цессов (реакций). Тепловую энергию потоков можно использо-
262
Рис. 3.36. Схемы регенерации тепла (а) и энергии (6) с дополнительным приво-
дом компрессора от паровой и газовой турбин соответственно:
К - компрессор; Д - основной электрический привод; ГТ и ПТ - газовая и паровая тур-
бины соответственно; КУ - котел-утилизатор; ХТП - химико-технологический процесс
вать, вырабатывая, например, пар в котлах-утилизаторах (рис.
3.37, а). Энергию давления можно использовать для привода
электрогенератора (рис. 3.37, б). Такие потоки, обладающие
определенной энергией, являются источниками вторичных
энергетических ресурсов. Они играют значительную роль в про-
мышленном производстве.
Альтернативные источники энергии. Традиционные источники
энергии - пар, горячие теплоносители, электроэнергия, выраба-
тываемые при потреблении топливных ресурсов. Перспек-
тивными являются легко возобновляемые и более дешевые ис-
точники, такие, например, как тепло, вырабатываемое атомными
котлами, солнечная энергия и др. Их применение специфично, но
в ряде случаев может реально привести к уменьшению расхода в
производстве более дефицитных топливных ресурсов.
Рис. 3.37. Схемы утилизации тепла потока с выработкой энергетического пара
(а) и энергии давления с выработкой электроэнергии в генераторе Г (б).
Остальные обозначения см. на рис. 3.36
263
н-бутан
н-бутан б
Бутадиен-1,3
Рис. 3.38. Схемы двухстадийного (а)
бутана в дивинил (бутадиен-1,3)
и одностадийного (б) дегидрирования н-
Замена химической схемы получения продукта - переход к
процессу с меньшим числом стадий. Это, как правило, сокра-
щает число нагревов и охлаждений потоков, затраты на преодо-
ление гидравлического сопротивления. Это видно на примере
производства бутадиена-1,3 (дивинила СН2=СН—СН=СН2). В
сложившейся технологии получения этого мономера превалиру-
ет способ двухстадийного дегидрирования бутана:
CH-j—СН2-СН2-СН3 —*1^->
->СНз—СН2-СН=СН2 —=И2—► СН2=СН—сн=сн2.
Реакции дегидрирования на обеих стадиях процесса
(получение «-бутана и бутилена) - эндотермические, каталити-
264
ческие - протекают с увеличением объема при повышенных тем-
пературах (550-600 °C) и давлении, близком к атмосферному,
или в вакууме. Схема двухстадийного получения бутадиена-1,3
приведена на рис. 3.38, а. Этот метод отличается сравнительно
высоким выходом целевого мономера (65%), но имеет ряд недо-
статков: необходимость разделения газовых смесей после каж-
дой ступени, повышенные капитальные вложения и энергетиче-
ские затраты.
В промышленности реализована альтернативная схема синте-
за бутадиена-1,3 одностадийным дегидрированием w-бутана.
При одностадийном процессе указанные реакции протекают
одновременно на катализаторе, который довольно быстро дезак-
тивируется вследствие покрытия его углистыми отложениями.
Возможна активация (регенерация) катализатора путем выжига
отложений. Дегидрирование осуществляют под вакуумом (0,05-
0,06 МПа) при температуре 580-600 °C в адиабатических реак-
торах регенеративного типа, в которых циклы дегидрирования и
регенерации катализатора чередуются. Соответственно, дегидри-
рование проходит последовательно в разных реакторах. Схема
процесса показана на рис. 3.38, б. Рабочий цикл катализатора -
короткий (несколько минут). Теплота, выделяемая при регене-
рации катализатора, аккумулируется им и используется в цикле
дегидрирования. Это экономит тепло, затрачиваемое на выход
на рабочий цикл и его поддержание. Условием эффективной
работы реакторов подобного типа является сбалансированность
теплот реакции и регенерации. В зависимости от мощности
производства число циклически работающих реакторов в уста-
новке составляет 5-8 аппаратов. Все переключения потоков
производятся автоматически, благодаря чему создается непре-
рывный поток исходных веществ и конечных продуктов. Более
короткая технологическая схема и сбалансированность теплот
отдельных стадий процесса значительно сокращают затраты
тепла и энергии.
3.7.3. Вторичные энергетические ресурсы
Вторичные энергетические ресурсы (ВЭР) - энергетический по-
тенциал продукции, отходов, дополнительных и промежуточных
продуктов, образующихся в технологических агрегатах, который
не используется в самом агрегате, но может быть частично или
полностью использован для энергоснабжения других произ-
водств.
Используя ВЭР, само производство, являющееся источником
ВЭР, не уменьшает свой расход энергии (тепла), но экономия
энергии достигается в других энергопотребляющих установках.
265
В зависимости от вида запасенной потоком энергии выделя-
ют следующие виды (группы) ВЭР.
Горючие (топливные) ВЭР - топливные вторичные
продукты и отходы, получаемые в технологическом процессе.
Они содержат, как правило, Н2, СО и другие горючие компо-
ненты. Примеры: продувочные газы производств аммиака и
метанола (содержат 70-85% Н2), отходящие газы производства
термического фосфора (80-85% СО), отходящие газы многих
производств в нефтепереработке и нефтехимии (содержат угле-
водороды, Н2).
Тепловые ВЭР - тепло отходящих газов, рабочих тел си-
стем охлаждения, отработанного пара и горячей воды, а также
тепло попутно вырабатываемого пара и нагреваемой воды
(например, в котлах-утилизаторах и экономайзерах).
ВЭР избыточного давления, или силовые, -
газы и жидкости, покидающие технологические агрегаты и обла-
дающие потенциальной энергией (находящиеся под давлением).
Использовать ВЭР непросто, так как они обладают низким
энергетическим потенциалом. Тем не менее их необходимо ути-
лизировать, так как количество их велико. В зависимости от
вида ВЭР их используют следующим образом.
Горючие ВЭР используют как котельно-печное топливо,
добавляют к основному топливу. Главная трудность их исполь-
зования - примеси, которые могут загрязнять окружающую сре-
ду, вызывать коррозию котельной аппаратуры, осаждаться на
поверхности водогрейных труб. Так, отходящие газы произвол
ства термического фосфора содержат соединения последнего,
которые могут попасть в атмосферу. Наличие влаги приводит к
образованию фосфорной кислоты и, как следствие, коррозионной
среды, что недопустимо для котельного и печного оборудования.
Тепловые ВЭР используют для получения тепла непо-
средственно, передавая его соответствующим теплоносителям
(подогревают потоки, вырабатывают пар). В зависимости от темпе-
ратуры их подразделяют на высоко- и низкопотенциальные.
Высокопотенциальные тепловые ВЭР (с температурой выше
120 °C) используют для выработки пара в котлах-утилизаторах.
Низкопотенциальные тепловые ВЭР (с температурой 50-
120 °C) используют в основном для работы энергетических
установок (подогрев воды для котельных установок). Основные
трудности их использования - большие капитальные затраты
из-за малой движущей силы (температурной) для передачи
тепла и загрязнения примесями. Эффективным является ис-
пользование низкопотенциальных тепловых ВЭР для получения
искусственного холода в абсорбционных холодильных машинах.
266
Силовые ВЭР (избыточного давления) исполь-
зуют в турбинах для привода рабочих машин и для выработки
электроэнергии.
Количественно энергетический потенциал ВЭР характеризу-
ют удельным q и общим Q выходами ВЭР:
удельный выход горючих ВЭР
Яг ~ тОгор>
удельный выход тепловых ВЭР
qT = m(Cf 7} - С2Т2) = mAh',
удельный выход ВЭР избыточного давления
Ял = тА\
общий объем выхода ВЭР
Овых Я™ ИЛИ Овых — Яч*,
где ft - удельный выход ВЭР, кДж на единицу продукции; т - удельное коли-
чество энергоносителя (твердого, жидкого или газообразного), кг или м3 на
единицу продукции или за единицу времени (например, за 1 ч - тогда <уч) рабо-
ты установки - источника ВЭР; Qrop - теплота сгорания горючих ВЭР, кДж/кг
или кДж/м3; Г, и С| - температура и теплоемкость энергоносителя на выходе из
элемента - источника ВЭР; 7) и с2 - температура и теплоемкость энергоноси-
теля при поступлении его в следующий технологический элемент ХТС; ДА -
изменение энтальпии энергоносителя между технологическими элементами
ХТС; Q - общий объем выхода ВЭР, кДж за рассматриваемый период (час,
месяц, год и т. д.); М - выпуск основной продукции или расход сырья, топлива
за рассматриваемый период, кг или м3; t - время работы установки (часов, если
использовано q4); А - работа изоэнтропного расширения, кДж за рассматривае-
мый период.
Для газообразных энергоносителей
А = h\ - А2,
где А], А2 - соответственно энтальпия газа перед расширением при давлении Р\
и температуре Г, и в конце изоэнтропного расширения до давления Р2 и тем-
пературы Т2, кДж/кг.
Температура Т2 в конце изоэнтропного расширения
Т2= 1WPJV-
где у - средний показатель изоэнтропы в интервале температур 71-Ti, опреде-
ляемый по истинным теплоемкостям газа.
Работа изоэнтропного расширения для жидкостей составляет:
л = (А - р2)/р,
где Р| и Pj - соответственно давления жидкого энергоносителя на выходе из
элемента ХТС и на входе в последующий (или Р2 - давление окружающей
среды при выбросе энергоносителя в атмосферу); р - плотность жидкости,
кг/м.
267
Определение выхода ВЭР на единицу товарной продукции
или единицу перерабатываемого сырья производится с целью
оценки эффективности решений по использованию вторичных
энергоисточников.
3.7.4. Энерготехнологическая система
Количество энергии, которое необходимо подвести на разных
стадиях химико-технологического процесса, определено его
режимом. Затраты энергии можно уменьшить путем регенера-
ции энергии между стадиями процесса и использования потен-
циала потоков в самом процессе. Но компенсировать полностью
затраты энергии не всегда удается по нескольким причинам.
Часть энергии теряется необратимо из-за природы почти всех
протекающих процессов - они термодинамически необратимы,
и диссипация энергии неизбежна. Например, необратимы затра-
ты на преодоление гидравлического сопротивления потоков в
аппаратах и трубопроводах. К системе подводится высокопотен-
циальная энергия, но в технологическом процессе образуется
много низкопотенциальных потоков, работоспособность кото-
рых ниже исходных, несмотря на содержащееся в них такое же
или даже несколько большее общее количество энергии (см.
эксергетический анализ в разд. 3.4.4). Часть тепла (энергии)
неизбежно теряется с общими тепловыми потерями. К ним от-
носятся испарение как средство поддержания температурного
режима (например, в градирнях и других подобных системах),
вывод неиспользуемых тепловых потоков, естественные тепло-
вые потери через изоляцию. Если использовать энергетический
(тепловой) потенциал оставшихся потоков для покрытия энерге-
тических (тепловых) расходов, то компенсировать полностью их
не удается, и дополнительное потребление неизбежно.
Недостающую энергию можно выработать в технологической
системе, потребляя топливо. Для этого необходимо в систему
включить энергетический узел как подсистему ХТС.
Химико-технологическая система, включающая энергетиче-
ский узел, потребляющий топливо и вырабатывающий энергию
для компенсации необратимых потерь с целью поддержания
технологического режима и обеспечения функционирования
ХТС, называется энерготехнологической системой.
Такая система не потребляет энергию извне, энергетически
она автономна, потребляя необходимое количество топлив;
Энергетический узел, вырабатывающий недостающую энергию
из подводимого топлива, является подсистемой ХТС. Приведем
два классических примера энерготехнологической системы.
268
Отходящие
газй
Воздух
Рис. 3.39. Энерготехнологическая схема производства азотной кислоты:
Р - реактор очистки; остальные обозначения см. на рис. 3.36
1. В современном производстве азотной кислоты под давле-
нием один из сырьевых компонентов - воздух - сжимается в
компрессоре и направляется в технологические аппараты. После
всех превращений остается практически только азот как отхо-
дящий газ под давлением меньшим, чем давление воздуха после
компрессора. Потенциал отходящего газа недостаточен, чтобы
полностью компенсировать затраты на сжатие исходного возду-
ха, хотя можно его использовать для частичного возмещения
затрат (см. рис. 3.36, б). Увеличить энергию отходящего газа как
рабочего тела турбины можно повышением его температуры.
Для этого в линию отходящего газа подают топливо - природ-
ный газ - и сжигают его с остатками кислорода. Это и есть
энергетический узел (рис. 3.39). Но его функции не только
энергетические, но и технологические. Подогрев газа нужен для
очистки его от остатков оксидов азота. Используя небольшой
избыток метана, создают восстановительную атмосферу в отхо-
дящем газе, и на катализаторе в реакторе очистки оксиды азота
восстанавливаются до азота После реактора очистки потенциал
горячего газа достаточен для привода компрессора воздуха с
помощью газовой турбины. После турбины очищенный газ мо-
жет быть направлен непосредственно в выхлопную трубу. В этой
схеме также использована регенерация тепла, сокращающая
расходы топлива.
2. Другой пример - энерготехнологическая схема в произ-
водстве аммиака, схематически показанная на рис. 3.40. Для
сжатия и циркуляции азотоводородной смеси на стадии синтеза
используют мощные турбокомпрессоры, требующие скоростного
привода (паровая турбина). Пар высоких параметров обычно
получают на ТЭЦ, и производство аммиака становится сильно
зависимым от нее. Избежать этого можно в энерготехно-
логической системе. Дымовые газы после трубчатой печи кон-
версии метана имеют температуру более 950 °C, и их можно
использовать для выработки пара высоких параметров, но их не
269
Конв.газ Вада Цр^ины
CH.
-Obsb,e
2 3 1 4
Воздух 1сн<’н2° 1сн4,воздух
Рис. 3.40. Энерготехнологическая схема производства аммиака:
1 - трубчатая печь конверсии метана; 2 - котел-утилизатор; 3 - горелка; 4 - паропере-
греватель
хватает для привода паровой турбины. Недостаток энергии вос-
полняют сжиганием дополнительного топлива в дымовом газо-
ходе после трубчатой печи, т.е. установкой энергетического узла
как элемента технологической схемы. Используют также тепло
технологического газа после второй, паровоздушной конверсии
метана. Тепла технологического газа, дымовых газов и дополни-
тельной горелки как энергетического узла достаточно, чтобы
отказаться от потребления энергии извне. Таким образом, про-
изводство аммиака стало автономным по энергии.
3.8. СИНТЕЗ ХИМИКО-ТЕХНОЛОГИЧЕСКОЙ СИСТЕМЫ
И ОТХОДЫ ПРОИЗВОДСТВА
3.8.1. Отходы химического производства
Любое производство, в том числе и химическое, имеет отходы.
Даже при полном использовании сырья и энергетически замк-
нутом производстве в нем имеют место необратимые потери,
причины которых были обсуждены в предыдущем разделе.
Отходы производства - невостребованная в получении про-
дукта часть компонентов производства.
По виду отходы подразделяются на материальные и тепло-
вые.
По источнику их образования отходы бывают:
технологические, образующиеся в основных технологических
процессах;
отходы вспомогательных материалов;
тепловые, образующиеся из-за неполноты использования
тепловых и энергетических ресурсов;
потери, связанные с несовершенством оборудования и нару-
шениями режима (утечки через неплотности, дополнительные
расходы при работе в неоптимальном режиме, при пуске и
останове агрегатов, в аварийных ситуациях).
270
По периодичности появления отходы могут быть:
постоянные, образующиеся равномерно во времени;
“залповые”, когда происходит кратковременный выброс в
аварийных ситуациях, при переключении режима, при пуске и
останове агрегатов.
В любом случае в ХТС должна быть предусмотрена защита
окружающей среды и обслуживающего персонала от вредных
воздействий отходов.
3.8.2. Концепция минимизации отходов
Эта концепция направлена на защиту окружающей среды; она
связана с экологической обстановкой в регионе, где расположе-
но производство, и с санитарно-гигиеническими условиями для
обслуживающего персонала. Реализация этой концепции в пер-
вую очередь связана с улучшением использования сырьевых и
энергетических ресурсов (соответствующие приемы были рас-
смотрены выше), а также включает в себя следующие специаль-
ные мероприятия.
Санитарная очистка и обезвреживание вы-
бросов предполагает установку подсистем ХТС, в которых
вредные (токсичные) примеси удаляются из выбрасываемых
потоков (санитарная очистка) или переводятся в нетоксичное
состояние (обезвреживание). В этих случаях содержание приме-
сей становится меньше допустимой нормы по вредному воз-
действию их на окружающую среду, и такие отходы можно
сбрасывать. Системы санитарной очистки и обезвреживания
могут представлять собой самостоятельные участки производ-
ства или подразделение предприятия, куда направляются отходы
с отдельных производств.
Уменьшение и замена вспомогательных по-
токов. Например, при охлаждении потоков до температуры
окружающей среды используют водяные холодильники. Они
подвержены коррозии (вода может разрушать аппаратуру из-за
наличия растворенных в ней солей и кислорода воздуха), что
приводит к возникновению аварийных ситуаций. Кроме того,
для охлаждающего агента - воды - требуется сложная система
очистки и отвода тепла от нее (утилизировать теплоту чуть теп-
лой воды нерационально). Замена водяных холодильников на
воздушные значительно упрощает систему охлаждения и
уменьшает вредные выбросы.
Замкнутый водооборот. Вода в довольно большом
количестве используется как вспомогательный материал в хими-
ческих производствах. Проходя через технологическую аппара-
туру, трубопроводы, она загрязняется и требует дорогостоящей
271
очистки. Используя замкнутый водооборот, исключают отходы
загрязненной воды. Хотя водооборот - один из примеров реге-
нерации вспомогательного материала с рециклом (см. разд.
2.6.2), он здесь выделен из-за большой ценности воды для жиз-
необеспечения.
Повышение надежности оборудования и
элементов ХТС, позволяющее исключить потери в виде
утечек и выбросов любых компонентов. Основные источники
такого рода потерь и плохо контролируемых отходов:
разрушение конструктивных элементов оборудования из-за
силовых воздействий (давления, трения, весовых нагрузок, воз-
действия внешней среды);
коррозионное разрушение элементов оборудования;
нарушение целостности соединительных деталей (фланцы,
разъемы) и уплотнительных устройств (сальники).
Мероприятия по их предотвращению:
использование совершенных конструкций;
подбор соответствующих конструкционных материалов,
устойчивых к имеющимся воздействиям (механическим, хими-
ческим);
соблюдение технологической дисциплины ведения процесса;
регулярный профилактический осмотр (диагностика) состоя-
ния оборудования и его ремонт;
прогнозирование возможных нарушений на основе диагно-
стики состояния и теории надежности систем.
Вообще говоря, кардинальным методом претворения в жизнь
концепции минимизации отходов было бы создание безотходно-
го производства. Этот термин прочно обосновался в литературе,
особенно популярной, для характеристики производств. Но
“безотходное производство” не есть “производство без отходов”,
ибо, как было показано выше, последнее противоречит второму
закону термодинамики: в необратимых процессах всегда имеет
место диссипация энергии, да и другие потери практически
неизбежны.
Понятие “безотходное производство” связано с понятием
экологической безопасности, т.е. безвредности производства для
окружающей среды, или, точнее, для экосферы определенного
региона, где это производство расположено. Надо иметь в виду,
что производство воздействует на окружающую среду не только
выбросами, но и самим своим присутствием: для его строитель-
ства отчуждается территория, и этим уже нарушается состояние
экосферы в регионе; для обеспечения производства создается
инфраструктура - жилые комплексы с их обеспечением, дороги
- это вносит еще большие возмущения в экосферу. И если эти
272
возмущения малы, т.е. не имеют заметного распространения за
пределы территории и не влекут за собой долговременных жиз-
ненно важных последствий (например, генетических измене-
ний), то такое производство можно считать безотходным или
малоотходным (четкую границу между этими видами произ-
водств провести, конечно, трудно, и она условна). Взаимодей-
ствием производства и экосистемы занимается раздел экологии
“промышленная экология”. Этому посвящена гл. 4 “Основы
промышленной экологии”, где подробнее рассмотрены методы
очистки и обезвреживания выбросов и уменьшения других воз-
действий химических производств на окружающую среду.
3.9. СИНТЕЗ ХИМИКО-ТЕХНОЛОГИЧЕСКОЙ СИСТЕМЫ
И ОБОРУДОВАНИЕ
3.9.1. Оборудование химического производства
Процессы в химическом производстве протекают в определен-
ных устройствах - машинах и аппаратах. Потоки между ними
передаются по трубопроводам и другими средствами. Потоки
регулируются запорной арматурой (вентилями, задвижками) и
другими устройствами. Контроль и управление осуществляются
с помощью датчиков, приборов и другой аппаратуры. Все это
размещается на строительных конструкциях - в зданиях, на
опорных устройствах, эстакадах. Все названные устройства и
конструкции создаются при строительстве производства и рас-
считаны на весь срок его существования, они называются
“капитальными вложениями”. Ремонт, замена изношенных и
вышедших из строя частей, конечно, предусмотрены, но затраты
на капитальные вложения делаются изначально и единовре-
менно.
По назначению капитальные вложения классифицируются
следующим образом.
А. Оборудование, предназначенное для осу-
ществления химико-технологического процесса.
1. Технологические аппараты для осуществления отдельных
процессов (реакторы, ректификационные колонны, абсорберы,
теплообменники, выпарные аппараты, фильтры, емкости и т.д.).
Аппараты в большинстве своем не содержат подвижных элемен-
тов, если не считать мешалок и других встроенных механиче-
ских приспособлений, обеспечивающих необходимый режим
протекания процесса в аппаратах.
2. Технологические машины для обеспечения технологиче-
ского процесса. Основной рабочий орган у них, как правило,
273
подвижный - насосы, вентиляторы, турбины, компрессоры,
транспортеры и др. с соответствующими приводами - уст-
ройствами, приводящими в действие рабочие органы машин
(турбины, электромоторы, двигатели).
3. Трубопроводы для передачи потоков газа, жидкости и их
смесей между аппаратами и машинами. По трубопроводам могут
передаваться и твердые вещества, обычно в виде взвесей
(пневмо- и гидротранспорт).
4. Регулирующая и запорная арматура - краны, вентили, за-
движки, заслонки.
5. Аппаратура контроля и управления включает в себя датчи-
ки состояния потоков, первичные преобразователи, показы-
вающие приборы, системы управления, исполнительные меха-
низмы.
Б. Строительно-монтажные конструкции,
предназначенные для размещения оборудова-
ния.
1. Здания и сооружения для размещения оборудования и ра-
бочего персонала.
2. Опорные конструкции вне зданий, фиксирующие и под-
держивающие оборудование производства, в основном аппараты
и машины.
3. Эстакады - опорные конструкции для трубопроводов при
значительной их протяженности.
Капитальные вложения (капитальные затраты) довольно зна-
чительны, и уменьшение их является одной из задач при разра-
ботке и проектировании производства. Целенаправленные тех-
нологические решения - организация процессов в отдельных
аппаратах и агрегатах, а также в ХТС в целом - могут изначаль-
но уменьшить расходы на оборудование. Некоторые приемы,
разрабатываемые в этих целях химиками-технологами, рассмот-
рены далее.
3.9.2. Концепция эффективного использования оборудования
Концепция направлена на минимизацию капитальных затрат на
технологическое оборудование путем создания условий проте-
кания в нем процессов с максимально возможной интенсив-
ностью.
Выбор процесса. Для минимизации капитальных затрат следу-
ет выбирать процесс более интенсивный, протекающий с боль-
шей скоростью. Одним из наиболее ярких примеров является
переход от алюмосиликатного катализатора гидрокрекинга угле-
водородов к цеолитному - скорость процесса была увеличена в
результате этого более чем в 300 раз. Вместо процесса в реакто-
274
ре большого объема с псевдоожиженным слоем организован
процесс в режиме вертикального пневмотранспорта катализато-
ра реакционной смесью (процесс в восходящем слое катализа-
тора). Реактор представляет собой трубу диаметром 250 мм и
высотой несколько десятков метров.
Оптимизация процесса - очевидный прием увеличения его
интенсивности.
Организация процесса в аппарате. Почти всегда возможно
один и тот же процесс провести разными способами: теплооб-
мен и контакт фаз - в противотоке или прямотоке; гетерогенно-
каталитическую реакцию - в неподвижном или движущемся
слое катализатора; разделение жидкостей - ректификацией или
дистилляцией и т.д. Один из примеров был приведен выше.
Переход на цеолитный катализатор гидрокрекинга углеводоро-
дов был осуществлен одновременно с новой организацией про-
цесса во взвешенном слое в виде восходящего потока катализа-
тора. Традиционный пример сокращения затрат на работу теп-
лообменника - использование противотока теплоносителей в
нем.
Контактирование газа с жидкостью может осуществляться
различными способами. Для газожидкостных процессов, ско-
рость которых лимитируется массообменом между фазами, спо-
соб их контакта небезразличен для процесса. В разд. 2.9.4 были
приведены максимальные объемные коэффициенты массообме-
на р: в барботажном слое р = ОДД),2 с"1, в насадочном аппара-
те-до 0,5 с"1, в газожидкостном потоке - до 1,2 с1. Если ско-
рость реакции большая (константа скорости первого порядка
более 2 с”1), то реактор с газожидкостным потоком будет более
компактным. Если сама реакция малоинтенсивна, то интенсив-
ный массообмен не увеличит общей интенсивности процесса.
Скорость превращения в процессе “газ-твердое” сильно за-
висит от размера частиц. Поэтому дробление твердого реагента
всегда благоприятно будет сказываться на интенсивности его
превращения Но мелкие частицы нельзя использовать в непо-
движном слое из-за большого сопротивления потоку, спекания
и слипания частиц, неоднородности течения газообразных ком-
понентов через слой. Однородные условия протекания процесса
создает псевдоожиженный слой. В производстве серной кислоты
из колчедана переход от обжига крупнокускового сырья в по-
лочных печах к обжигу в псевдоожиженном слое позволил уве-
личить интенсивность превращения в единице объема аппарата
в 20 раз.
Организация технологического процесса в подсистеме ХТС.
Здесь использовано свойство ХТС, заключающееся в том, что
усовершенствование одного элемента дает выигрыш в эффек-
275
Очищенный газ
Рис. 3.41. Схема очистки газа с дополнительным подогревом:
Т - рекуперативный теплообменник; Р - реактор нейтрализации оксидов азота; Г - го-
релка
тивности процесса, протекающего в системе, в целом. Некото-
рые решения общеизвестны. Например, замена периодического
процесса на непрерывный. В первом случае требуется дополни-
тельная аппаратура для накопления исходных компонентов и
продуктов, очистки периодических аппаратов, их циклического
пуска и останова. В непрерывном процессе такие обслужи-
вающие подсистемы не нужны.
Сокращает расходы на аппараты схема регенерации тепла ре-
акции, показанная на рис. 3.2 (поз. 8) и 3.17, вместо нагрева
потока перед реактором и последующего охлаждения его в от-
дельных теплообменниках. Но в ряде случаев такая схема может
потребовать очень больших теплообменников, когда разогрев в
реакторе небольшой и движущая сила в теплообменнике, равная
этому разогреву (см. рис. 3.17), мала. Эти условия характерны
для каталитической санитарной очистки газов - в этих процес-
сах концентрация очищаемого компонента мала и может коле-
баться. Теплообменник необходимо рассчитывать на минималь-
ную концентрацию, иначе процесс не будет автотермичен. По-
верхность теплообменника, рассчитанная на минимальную кон-
центрацию, будет в 2-3 раза больше, чем в “среднем” режиме.
Включим в систему узел сжигания топлива (рис. 3.41). Он вно-
сит дополнительные затраты в систему очистки. Но дополни-
тельный нагрев позволяет, во-первых, поддерживать постоян-
ную и желаемую разность температур в теплообменнике и, во-
вторых, уменьшить затраты на оборудование этой ХТС.
Конструктивные решения аппаратов, позволяющие уменьшить
объем его непроизводительных частей. Последние создают не-
обходимые условия протекания процесса: распределение пото-
ков, обеспечение жесткости конструкции, удобство монтажа и
т.д. Обычно каталитические реакторы представляют собой по-
лые аппараты с насыпанным зернистым слоем - так называемые
аксиальные аппараты (рис. 3.42, а). Но входное и выходное про-
странства занимают какую-то долю объема реактора. Располо-
276
a
Рис. 3.42. Реакторы с аксиальным (в) и радиальным (б, в) слоями катализатора
жив слой в виде цилиндра и направив поток через него в ради-
альном направлении (рис. 3.42, б - радиальный реактор), мож-
но: 1) сократить объемы пространства входа и выхода реактора,
создать более компактную конструкцию и 2) создать слой боль-
шего сечения для прохождения потока и меньшей толщины, что
сокращает энергетические расходы. Сопоставление однослой-
ных аксиального и радиального реакторов конверсии оксида
углерода в производстве аммиака показало следующее:
Тип реактора Гидравлическое Степень заполнения
сопротивление (усл. ед.) объема катализатором
Аксиальный......................1,0 0,36
Радиальный......................0,2 0,46
Больший эффект от использования объема реактора радиаль-
ного типа может быть достигнут в многослойных реакторах.
Многослойный реактор окисления SO2 - аксиального типа (см.
рис. 2.2). В нем расположены смесители и распределители пото-
ка, теплообменники; катализатор же, где происходят превраще-
ния, занимает только 7% объема реактора. В разработанной
конструкции реактора с радиальными слоями доля катализатора
возросла до 14%. Размеры реактора можно сократить почти
вдвое.
Радиальный ход газа можно создать в реакторе с нецилин-
дрическим слоем, в горизонтальном аппарате (см. рис. 3.42, в).
В общем объеме реактора выигрыш может быть небольшой. Но
горизонтальное расположение аппарата позволяет отказаться от
дорогостоящих опорной конструкции и оборудования для об-
служивания высокого аппарата. У некоторых реакторов стацио-
нарно установлен монтажный кран для замены катализатора и
ремонтных работ. При горизонтальном расположении аппарата
демонтаж можно делать с помощью подвижных средств. На-
пример, для замены катализатора и ремонта внутреннюю насад-
277
ку можно извлечь лебедкой или даже трактором. Уменьшение
затрат на вспомогательное оборудование очевидно.
Увеличение единичной мощности агрегата. Сделаем оценки
изменения затрат на оборудование при изменении мощности
производства. При неизменной интенсивности процесса в аппа-
рате его объем v пропорционален объему перерабатываемого
потока, т.е. его производительности П (мощности). Объем аппа-
рата примерно пропорционален кубу его линейного размера
/:П <vv«v/3. Затраты на аппарат 3, расход материала на его из-
готовление примерно пропорциональны квадрату его линейного
размера, поверхности корпуса, перегородок: Зоэ/2. Из этих со-
отношений получим ЗгоП2/3 (затраты, естественно, увеличи-
ваются с ростом производительности). Удельные затраты Зуд (на
единицу производительности) уменьшаются с увеличением про-
изводительности: Зуд = 3/ПоэП~1/3. Можно оценить уменьше-
ние удельных затрат при удвоении мощности: ЗуД(2П)/Зуд(П)»
« 0,8; затраты уменьшаются примерно на 20%. Реальная цифра
меньше и составляет 8-13%, так как с увеличением размера ап-
парата стенки его приходится делать толще для обеспечения
жесткости конструкции и появляются дополнительные элемен-
ты конструкции. Например, удельные затраты металла на реак-
тор окисления диоксида серы составляют:
Производительность реактора, тыс. т/год.120 180 360
Удельный расход металла, т/т продукта...1,43 1,3 1.15
Уменьшение удельных капитальных затрат составляет пример-
но 11 % при удвоении производительности. Но бесконечно наращи-
вать мощность невозможно. Появляются ограничения, диктуемые
машиностроительными предприятиями, связанные с транспорти-
ровкой крупногабаритного оборудования. Временная остановка
крупнотоннажного производства приводит к большим потерям про-
дукции и затратам на восстановление режима. Крупное произ-
водство вносит значительное возмущение в экологическое равно-
весие региона. Тем не менее увеличение мощности до разумных
пределов рационально для сокращения затрат на оборудование.
Приведены только некоторые приемы эффективного исполь-
зования оборудования, основанные на знании протекающих в
нем процессов. Чисто конструктивные решения могли бы про-
должить перечень приемов.
3.9.3. Совмещение процессов
Этот прием рассматривается отдельно от описанных выше при-
емов эффективного использования оборудования.
Совмещение процессов - осуществление разного типа химико-
технологических процессов в одном аппарате.
278
Рис. 3.43. Схема конструктивного совмещения реактора
окисления аммиака (Р) и котла-утилизатора (КУ):
АВС - аммиачно-воздушная смесь; НГ - нигрозине газы; П -
пар
Конструктивное совмещение - объединение
в одном корпусе разных элементов ХТС.
Один из примеров уже упоминался: много-
слойный реактор с адиабатическими слоями
катализатора и промежуточным теплообменом
(см. рис. 3.12). В одном корпусе расположены
реакторы (слои катализатора), теплообменни-
ки и смеситель потоков; такой аппарат можно
рассматривать и как реакционный узел
(многоэлементный реактор), и как пример
конструктивного совмещения элементов. Очевидно уменьшение
затрат на такой аппарат по сравнению с реакционным узлом,
состоящим из отдельных аппаратов.
Более характерен для конструктивного совмещения следую-
щий пример. Окисление аммиака осуществляется на платино-
идном катализаторе в виде нескольких сеток, после чего реак-
ционные газы охлаждаются в котле-утилизаторе (см. рис. 3.24).
Для равномерного распределения потока по сечению тонкого
слоя катализатора реактор должен иметь конусные объемы пе-
ред слоем катализатора и после него. Поставив реактор непо-
средственно на котел-утилизатор, можно уменьшить расходы на
аппараты (рис. 3.43), что и используется в современных произ-
водствах азотной кислоты.
Функциональное совмещение - совместное проведение двух
типов процессов, один из которых существенно влияет на фи-
зико-химические показатели другого. Такое совмещение про-
цессов осуществляется, например, в реакторе-ректификаторе,
реакторе-абсорбере. Совмещаемые в них процессы очевидны из
названий аппаратов. Непрерывное удаление ректификацией или
абсорбцией одного из компонентов реакционной смеси благо-
приятно влияет на протекание реакции. Можно выделить три
фактора, обусловливающих этот эффект.
Кинетический фактор. Удаление продукта реакции
повышает концентрацию исходного реагента в реакторе и тем
самым увеличивает скорость превращения. Сопоставим систему
реактора с ректификационной колонной (рис. 3.44, а) и реакто-
ра-ректификатора (см. рис. 3.44, б) для простейшего случая:
простая необратимая реакция А = R; реактор - идеального сме-
шения; система разделения - идеальная (полностью разделяет
компоненты). Система, показанная на рис. 3.44, а, была рас-
смотрена ранее (см. разд. 3.4.2). Степень превращения х в реак-
279
Продукт
Рис. 3.44. Схемы реактора (Р) с ректификационной колонной (РК) (с) и реак-
тора-ректификатора (б)
торе этой системы определяется из следующего уравнения [см.
также уравнение (3.46)]:
х = (кто - 1)/(Лг0). (3.67)
Процесс в реакторе-ректификаторе описывается уравнением
Го(1 -х) - Го =£CAvp, (3.68)
где к - константа скорости реакции; то = vp/Fb - условное время реакции (vp -
объем реактора, Ув - объем исходной реакционной смеси); х - степень превра-
щения; СА- концентрация компонента А в реакторе.
Поскольку из реактора непрерывно удаляется продукт R, то
Сд = 1, и из (3.68) получим
x = vp/r0 = ^0. (3.69)
Из (3.69) следует, что полное превращение в реакторе-
ректификаторе будет достигнуто при значении кт$ = 1. В систе-
ме реактор - ректификатор также достигается полное превраще-
ние - после разделения в ректификационной колонне прореаги-
ровавшей смеси из системы выходит только продукт реакции,
но это обеспечивается рециклом непрореагировавшего в реакто-
ре компонента А. Величина рециркуляционного потока =
= Vq/x, и при том же объеме реактора (Лгц ~ 1) величина х -> О,
Гц -> оо: соответственно, таким же должен быть объем системы
разделения. Ее можно уменьшить с одновременным увеличени-
ем объема реактора. Функциональное совмещение реактора с
ректификатором позволяет более эффективно использовать обо-
рудование.
Термодинамический фактор. Если протекает обра-
тимая реакция, то непрерывное удаление продукта сдвигает
равновесие в сторону большей конверсии исходных реагентов.
Максимальное превращение, которого можно достичь в реакци-
онном аппарате, лишь близко к равновесному при достаточно
большом объеме реактора. В реакторе-ректификаторе при не-
прерывном удалении продукта протекает только прямая реак-
280
Бензольный слой
кислотным
маточник
Рис. 3.45. Схемы функционального совмещения реакции с ректификацией:
а - синтез диметилового эфира малеиновой кислоты (1 - реактор, 2 - ректификатор, 3 -
фазоразделитель); б - синтез метилметакрилата (1 - реактор-ректификатор, 2 - дефлегматор,
3 - кипятильник)
ция. Степень превращения определяется также уравнением
(3.69) и может быть полной даже в аппарате конечного, сравни-
тельно небольшого объема. Реально полное разделение не до-
стигается, но эффект совмещения процессов весьма велик.
Взаимодействие малеинового ангидрида с этиловым спиртом
в синтезе диэтилового эфира малеиновой кислоты представлено
следующими стехиометрическими уравнениями:
СН —СО СН — СООС,Н,
II О + СпНсОН -> II
СН—Со сн—соос2н5
(а)
СН —соон
2 II
сн—соос2н5
СН—COOCJI. сн —соон
II 2 5 + II (Ь)
сн—соос2н5 сн—соон
сн—соон
II
сн—соон
+ с2н5он
сн—соон
II
сн—соос2н5
(с)
сн—соон
II +
сн—СООС2Н5
с2н5он
сн—СООС2Н,
II + Н2О
сн—соос2н5 2
(d)
Реакция протекает в среде бензола как растворителя в при-
сутствии катализатора - H2SO4. Вода препятствует глубокому
превращению малеинового ангидрида, и максимальная (равно-
281
весная) степень превращения равна 70%. В реакторе-рек-
тификаторе, показанном на рис. 3.45, а, вода непрерывно уда-
ляется, равновесие сдвигается в сторону большего превращения
продуктов, и выход эфира достигает 97%. Необходимость в по-
следующей химической очистке отпадает.
Фактор разделения. Рассмотрим его на примере син-
теза метилметакрилата. В процессе образуются примеси, ухуд-
шающие качество продукта. Совмещение реакции с ректифика-
цией, как показано на рис. 3.45, б, позволяет выводить из такого
аппарата примеси в виде сернокислотного маточника. Одновре-
менно выводится чистый продукт, а его выход увеличивается.
Как видим, совмещенные процессы представляют интерес
благодаря возможности более эффективно использовать обору-
дование и возможности провести процесс, который в иной си-
стеме не позволяет получить желаемое превращение.
3.9.4. Перестраиваемые химико-технологические системы
На заре развития химической промышленности создавались и
затем интенсивно развивались жизненно важные производства -
удобрений, продуктов переработки нефти и угля, моторного
топлива, синтетического каучука, пластических масс. Все они
стали крупнотоннажными, и номенклатура их продуктов ме-
няется незначительно. Но за последние десятилетия число наи-
менований необходимых продуктов химической промышлен-
ности многократно увеличилось. Материалы, обладающие осо-
быми свойствами, выпускаются в небольших количествах. Их
производство, как правило, малотоннажное, а номенклатура
обновляется примерно каждые 5 лет. Срок службы современной
химической аппаратуры больше и составляет 10-15 лет. Созда-
ние для каждого продукта отдельного производства становится
невыгодным - после наработки необходимого количества материа-
ла технологическое оборудование становится ненужным. Поэтому
и возникли перестриваемые производственные системы.
Перестраиваемая химико-технологическая система позволяет
на одном и том же оборудовании после его перенастройки
(изменения некоторых связей и режима процессов в аппаратах)
реализовывать различные химико-технологические процессы и
перерабатывать несколько видов сырья, производить различные
продукты.
Такие системы сначала возникли в металлообработке; меняя
последовательность прохождения заготовок через различные
станки и режимы их работы, получали в одном станочном парке
различные детали. Технологические режимы обработки устана-
вливали и поддерживали автоматически. За такими системами
282
закрепилось название “гибкие автоматизированные производ-
ственные системы” (ГАПС). Естественно было идею гибких
производственных систем применить в химической технологии.
Расширим понятие “гибкая ХТС”. В него включим и однопро-
дуктовые системы, устойчивые к изменению качества сырья,
характеристик аппаратов и других параметров процесса, т. е.
гибко реагирующие на изменение условий и требований к хи-
мико-технологическому процессу. Понятие “перестраиваемая
ХТС”будем относить к многономенклатурному производству,как
это определено выше. Ее представим следующим образом.
Имеется система аппаратов, соединенных различными связя-
ми. Для определенного химико-технологического процесса одни
связи открывают, другие - перекрывают. В результате задей-
ствуют одни и отключают другие аппараты. Устанавливают ре-
жимы аппаратов (температуры хладагентов, подача вспомога-
тельных материалов и др.). Таким образом создают ХТС для
заданного химико-технологического процесса. После прекраще-
ния выпуска одного продукта всю систему промывают и
“настраивают” на выпуск другого.
Эффективность перестраиваемой ХТС оцени-
вают из соотношения затрат на систему и выигрыша от ее экс-
плуатации.
Основные затраты таковы:
дополнительные условно-постоянные расходы на излишек
оборудования (не вся технологическая аппаратура, входящая в
состав перестраиваемой ХТС, задействована в данном конкрет-
ном процессе);
расходы на подготовку оборудования к смене процесса
(промывка), особенно существенные для химических произ-
водств, в которых остатки компонентов предыдущего процесса
“размазаны” по всей системе и могут повлиять на качество оче-
редного продукта.
Выигрыш заключается в следующем:
уменьшение условно-постоянных расходов за счет увеличе-
ния срока службы аппаратуры (при выпуске одного продукта
короткое время в себестоимость включают большую долю капи-
тальных вложений); уменьшение времени перехода на выпуск но-
вого продукта (аналогично сокращению времени строительства);
выигрыш у потребителя за счет более раннего использования
продукта:
стабильность производства при меняющейся конъюнктуре на
рынке товаров.
Построение перестраиваемой ХТС в общих чертах
представим следующими этапами предварительной технологи-
ческой проработки.
283
1) Классификация и систематизация методов получения про-
дуктов, которые предполагается производить в создаваемой
ХТС. Учитывают схожесть технологических операций и их ре-
жимов, взаимную совместимость (“неотравляемость”) компо-
нентов. По этим признакам объединяют, например, получение
хлорпроизводных этилена, солей фосфорной кислоты, опреде-
ленных видов красителей и т.д.
2) Систематизация аппаратурного оформления. Для вы-
бранного в предыдущем этапе набора производств устанавли-
вают частоту появления одинаковых (по назначению, мощ-
ности, условиям работы) аппаратов, определяют их набор для
реализации выбираемых химико-технологических процессов и
избыточность оборудования для каждого из них.
3) Определение связей в ХТС. Оставляют все возможные свя-
зи; на соединениях, не повторяющихся во всех процессах, уста-
навливают вентили.
Полученная ХТС дает возможность ее анализа для дальней-
шей разработки с привлечением техноэкономических оценок,
маркетинговых исследований.
3.10. ОДНОРОДНЫЕ ХИМИКО-ТЕХНОЛОГИЧЕСКИЕ
СИСТЕМЫ
В ХТС можно выделить подсистемы, состоящие из однородных
элементов (аппаратов) и предназначенные для проведения
определенной химико-технологической операции. К подсисте-
мам можно, например, отнести реакторный узел системы разде-
ления, теплообмена. В них протекает химическое превращение
или разделение многокомпонентной смеси или теплообмен
между многими потоками. Каждая из них состоит из одно-
родных аппаратов: реакторов, ректификационных колонн или
теплообменников. Синтез систем однородных элементов хорошо
разработан, имеется возможность автоматизированного по-
строения их; некоторые общие подходы рассмотрены далее.
3.10.1. Система химических реакторов
Реакторный узел - соединение нескольких реакторов - исполь-
зуют для оптимизации режима процесса (что было рассмотрено
в разд. 2.9.2) или ограничения единичного объема одного реак-
тора. Рассмотрим параллельное и последовательное соединения
реакторов и сопоставим их по интенсивности (общему объему,
необходимому для достижения одинаковой степени превраще-
ния хк или конечной концентрации Ск) и селективности про-
цесса в них (при протекании сложной реакции).
284
а б
Рис. 3.46. Системы последовательно (а) и параллельно (6) соединенных реакто-
ров идеального вытеснения
Системы л реакторов идеального вытеснения (рис. 3.46). Мате-
матически процесс в реакторе описывается уравнением dx/dx =
= г(х).
В системе последовательно соединенных реакторов их общий
объем Zvp, пропорционален сумме времен контакта т, в них:
Ivpl- = Из описания процесса в реакторе
Ет, = jdx / r(x) + jdx / г(х) +...+ f dx / r(x) = jdx / r(x),
ИЛИ
Evp/ = И) f dx I r(x). (3.70)
Из (3.70) также следует, что £vpI не зависит от того, как рас-
пределены объемы реакторов между собой.
В системе параллельно соединенных реакторов полагаем в
каждом из них одинаковую степень превращения, равную хк.
Следовательно, все т, = jdx / г(х)=х одинаковы, и
*0
SVp, = ЕИ/т, = = Vq $dx / r(x). (3.71)
Если в каком-то реакторе уменьшить степень превращения,
то в другом ее надо увеличить. Выигрыш т в первом из них бу-
дет меньше, чем его увеличение во втором: зависимость х(т) -
нелинейная, асимптотически растущая функция (см. рис. 2.45).
Поэтому равные т, дают максимальную интенсивность.
Как видно из уравнений (3.70) и (3.71), в обеих схемах реак-
торного узла интенсивность процесса одинакова (равные Xvfy) и
такая же, как в одном реакторе идеального вытесненияугив. Дей-
285
Рис. 3.47. Системы параллельно (а) и
последовательно (6) соединенных реакто-
ров идеального смешения и определение т в них (в, г)
ствительно, рассмотренные схемы реакторов идеального вытес-
нения можно представить как один такой реактор, разделенный
продольными или проницаемыми поперечными перегородками,
как схематически показано ниже соответствующих схем на рис.
3.46. Это не влияет на режим течения и, следовательно, показа-
тель процесса. Соответственно, селективность превращения для
сложных реакций в этих условиях будет также одинаковой. Но в
параллельной схеме поток распределен между реакторами, его
скорость в каждом из аппаратов меньше, чем в их последова-
тельности. Поэтому гидравлическое сопротивление и энергети-
ческие затраты в параллельной схеме меньше, чем в последова-
тельной.
Системы п реакторов идеального смешения (рис. 3.47). Для со-
поставления систем воспользуемся графическим методом опре-
деления условного времени в реакторе идеального смешения
(см. разд. 2.7.3 и рис. 1.54). Объемы параллельно соединенных
реакторов (рис. 3.47, а) с одинаковыми т, определим, как в
(3.71):
Svpi- = EKf-Tf- = тЕИ,- = . (3.72)
Такая схема работает так же, как один реактор идеального
смешения с тис = т. Необходимое условное время т определяется
как площадь соответствующего прямоугольника на графике
l/r(Q _ С (рис. 3.47, в).
286
В последовательной схеме (каскад реакторов - рис. 3.47, б)
Evp/ =ЕКот,-=К0Ет,-. (3.73)
Площадь под ступенчатой линией (рис. 3.47, г) равна ЕтЛ
Площадь под каждой ступенькой есть т, для соответствующего
реактора. Очевидно, что суммарные условное время и объем
реакторов в последовательной схеме меньше, чем в параллель-
ной или в одном реакторе. Чем больше число реакторов в кас-
каде, тем меньше Ет, в нем, приближаясь к тив в режиме идеаль-
ного вытеснения.
Математически процесс в реакторе при протекании реакции
первого порядка описывается уравнением (Сн - Q/т = кС, отку-
да
С1 - -
1 кСх 1 1 + ктх
т .Q-с2 2 кС2 С2 = — 2 1 + Хст2 (1 + Атт1 )(1 + Атс2)
с2 -с3 с С2 Q
кСт, " 1 + £т3 (1 + ^j)(l + *Т2)(1 + Лт3)
_ Ск — CK_i с - с°
" *СК к ща + лт,)
В случае реакторов одинакового объема (равных значений т)
Ск = Q)/(l +кт)п. Из этой формулы можно рассчитать т, объем
каждого реактора vp = Vqt и всех реакторов Xvpj = npQt. Ниже
приведены значения кт, пропорциональные Zvpj, для различного
числа п последовательных реакторов идеального смешения и
конечной степени превращения хк в них [одному реактору иде-
ального смешения (ИС) отвечает п = I, а реактору идеального
вытеснения (ИВ) - п = оо]:
Значения кт при разных п
1 (ИС) 2 3 5 7 ОО (ИВ)
0,1 0,Н1 0,109 0,107 0,106 0,105 0,104
0,5 1,010 0,910 0,780 0,744 0,715 0,693
0,9 9,010 6,260 3,400 2,920 2,670 2,300
Видно, что увеличение числа реакторов более 5 не сильно
уменьшает их объем, но увеличение числа фланцевых соедине-
ний, приводов мешалок, затрат энергии на них неоправданно
287
усложняет конструкцию реакторного узла и расходы на него.
Поэтому на практике обычно используют каскады из 3-5 реак-
торов смешения.
Увеличение п приближает режим к идеальному вытеснению,
и характер влияния числа реакторов в каскаде на селективность
процесса при протекании сложной реакции будет таким, как
характер изменения селективности при переходе от режима иде-
ального смешения к режиму идеального вытеснения (см. разд.
2.7.3); там же даны объяснения этого. Показатели процесса -
интенсивность и селективность - будут занимать промежуточное
положение между значениями этих показателей для крайних
режимов смешения и вытеснения.
Такие реакторные системы распространены для жидкофаз-
ных процессов.
3.10.2. Система разделения
Проблема создания однородной ХТС или ее подсистемы возни-
кает, когда надо разделить многокомпонентную смесь. Подбор
оптимальной схемы, дающей необходимый эффект разделения с
минимальными затратами, - задача многоэтапная и достаточно
громоздкая. Ведь необходимо выбрать последовательность ко-
лонн разделения, технологические связи между ними, сеть теп-
ловых потоков, обеспечивающих режим колонн разделения, а
также выбрать сами колонны и рассчитать их оптимальный ре-
жим. Прежде всего следует определить последовательность вы-
деления компонентов. Здесь очень удобно использовать некото-
рые эвристические приемы. Они получены обобщением резуль-
татов многочисленных автоматизированных расчетов систем
разделения и дают первое приближение структуры технологи-
ческой схемы. Таких приемов достаточно много, и в автомати-
зированном построении схемы, ее расчете и оптимизации они
позволяют получить желаемый результат достаточно быстро.
Рассмотрим некоторые из этих приемов.
Пусть требуется разделить ректификацией смесь N компо-
нентов. Для этого необходима N-\ колонна. Для построения
системы разделения используют следующие эвристические пра-
вила.
1. Разделять по порядку температур кипения компонентов.
Средние температуры будут либо повышаться, либо понижаться
от колонны к колонне, что создает наиболее благоприятные
условия для организации температурного режима. В противном
случае из-за скачков температур между колоннами потребуются
большие затраты то на нагрев, то на охлаждение.
288
Рис. 3.48. Схемы разделения трехкомпонентной смеси. Пояснение в тексте
2. Отделять в первую очередь избыточный компонент. Тогда
последующие разделения будут с меньшими потоками, с мень-
шими затратами.
3. Трудные разделения (близкие температуры кипения) про-
водить с минимальными количествами компонентов. При близ-
ких температурах кипения требуются многотарельчатые колон-
ны, поэтому лучше предварительно отделить остальные компо-
ненты и оставить минимальной поток, только трудно разделяе-
мые компоненты.
Пусть требуется разделить смесь трех компонентов: А, В и С.
Их содержание в исходной смеси - соответственно хА, хв и xq.
Температуры кипения - Т^п . Альтернативные
схемы разделения в соответствии с правилом 1 показаны на рис.
3.48 (здесь не показаны дефлегматоры и кипятильники, кото-
рые, конечно, есть у каждой колонны)- Дополнительные усло-
вия позволяют сделать выбор между ними:
хА > хв, хс - схема, показанная на рис. 3.48, а (в соответствии
с правилом 2);
хА < хр, хс - схема, показанная на рис. 3.48, б (правило 2);
близка к - схема, показанная на рис. 3.48, б
(правило 3).
Полученные по этим правилам схемы разделения можно да-
лее улучшать, используя особенности конкретной смеси и ее
компонентов, специфику оборудования и т.д.
3.10.3. Система теплообменников
В химико-технологическом процессе технологические и вспомо-
гательные потоки многократно нагреваются и охлаждаются. Це-
лесообразно тепло охлаждаемых потоков передавать нагревае-
289
Рис. 3.49. Диаграмма Q -Т для охлаждаемого (/) и
нагреваемого (2, 3) потоков
мым (в порядке регенерации тепла) и со-
кращать потоки отдельных теплоносителей.
При этом будет создана система теплооб-
менников, затраты на которую минималь-
ны. Задача выбора оптимальной системы
теплообменников формулируется следую-
щим образом. В некоторой ХТС имеется:
N горячих потоков, каждый из которых
охлаждают от температуры Тг 1 д до темпе-
ратуры Тг2д;
М холодных потоков, каждый из которых
нагревают от Тх до Тх 2,j-
Требуется создать систему теплообменников для обмена теп-
лом между потоками, дополнительных нагревателей и холо-
дильников, в которой затраты будут минимальны.
Как первоначальный вариант, ее создают с помощью эври-
стических правил. Для удобства их применения введем графиче-
ское изображение изменения теплосодержания потока в коор-
динатах “количество тепла, отдаваемого или принимаемого по-
током, Q - изменение температуры потока Т ” (рис. 3.49). Пря-
мая 1 относится к охлаждаемому потоку, кривая 2 - к нагре-
ваемому; Qr - количество тепла, отданное горячим потоком,
Qx - полученное холодным. Прямые начинают от оси ординат.
Наклон их зависит от величины и удельной теплоемкости пото-
ка. Стрелки показывают направление изменения состояния по-
токов. Далее будет удобней линию холодного потока заканчи-
вать на оси ординат - кривая 3 на рис. 3.49. Это связано с тем,
что противоточный теплообмен более целесообразен
Существует большое число эвристических правил для синтеза
системы теплообменников Здесь представим следующие.
Для выбора структуры системы:
1) использовать для теплообмена горячий поток с макси-
мальной начальной температурой и холодный - с максимальной
конечной; в противном случае труднее будет нагреть холодный
поток;
2) использовать для теплообмена горячий и холодный потоки
с наиболее высокими температурами.
Для выбора теплообменников:
3) выбирать противоточные теплообменники как более эф-
фективные;
4) проводить теплообмен до тех пор, пока разность темпера-
тур не достигнет минимально допустимой А 7^; в противном
случае резко возрастает размер теплообменника;
290
Рис. 3.50. К определению оптимальной системы теплообменников. Пояснение в
тексте
5) передавать максимально возможное количество тепла -
оно определяется или полным охлаждением (нагревом) одного
из потоков, или достижением Д7^п.
Применение этих правил покажем на примере синтеза си-
стемы теплообменников для двух горячих (Г] и Tj) и двух хо-
лодных (Xj и Х2) потоков. Диаграмма Q-Т для них показана на
рис. 3.50, а. В соответствии с правилом 1 проводим теплообмен
между потоками Г] и Хр Максимальное количество тепла, ко-
торое можно передать от Г1 к Xi - Q\ (правило 5). При этом по-
ток Xi будет полностью нагрет, но поток Г] охладится не пол-
ностью, только до температуры Тг 13. “Недоохлажденный” по-
ток обозначим Г3. Справа от диаграммы (см. рис. 3.50, а) пока-
зана схема потоков в первом теплообменнике.
Исключив потоки теплообменника 1, оставшиеся потоки (13,
Г2, Х2) опять покажем на диаграмме Q-Т (Г3 перемещен к оси
ординат; рис. 3.50, б). В следующий теплообменник 2 направля-
ем потоки Г2 и Х2 (правило 1). Максимальное количество пере-
291
данного тепла - Q7 (правило 5). Поток Г2 полностью охлажден,
поток Х2 нагрет полностью, но не от начальной температуры, а
от Тх 2 з- Образовался поток Х3 как первоначально подогревае-
мый поток Х2. Схема потоков теплообменника 2 показана спра-
ва от диаграммы Q-T(см. рис. 3.50, б).
Оставшиеся два потока (Г3, Х3) опять отображаем на диа-
грамме Q-T (рис. 3.50, в). Их направляем в теплообменник 3. В
нем полностью подогревается поток Х3 как часть Х2
(максимальное количество переданной теплоты Qj). Поток Г3
охлаждается только до 7} 14. Оставшуюся часть потока
(обозначен Г4) приходится охлаждать посторонним теплоноси-
телем в теплообменнике 4. Схема потоков теплообменников 3 и
4 - справа от диаграммы Q-T(см. рис. 3.50, в).
Теперь можно объединить все теплообменники в систему
(рис. 3.50, г). Если есть особенности и ограничения (невозмож-
ность контактирования каких-то потоков в теплообменнике по
условиям безопасности, отсутствие теплообменника выбранного
размера или для данных сред, очень большое различие величин
потоков и т. д.), вносятся соответствующие корректировки в
схему.
3.11. ЭКСПЛУАТАЦИЯ
ХИМИКО-ТЕХНОЛОГИЧЕСКОЙ СИСТЕМЫ
Разработка химико-технологической системы предусматривает
создание определенных условий ее функционирования. В ре-
альности при эксплуатации всегда имеются отклонения от про-
ектных условий. Возмущения вносят изменения количества и
качества сырья, постепенный износ аппаратуры, колебания в
подаче энергии, изменения погодных условий, даже квалифика-
ция обслуживающего персонала и многое другое. Поведение
химико-технологической системы в условиях реального произ-
водства, некоторые общие вопросы эксплуатации рассмотрены
далее.
3.11.1. Эксплуатационные свойства
химико-технологической системы
Значение критерия эффективности ХТС зависит не только от
структуры и параметров системы, но и от эксплуатационных
свойств ХТС, к которым можно отнести чувствительность,
управляемость, надежность и устойчивость.
Чувствительность ХТС - свойство системы изменять характе-
ристики ее функционирования при изменении условий и пара-
метров технологического режима элементов.
292
В химических производствах изменение температуры, давле-
ния, активности катализатора и других факторов существенно
влияет на технологические параметры процессов, протекающих
в элементах системы, нарушает нормальное функционирование
и приводит к изменению показателей эффективности. Рассмот-
рим взаимосвязь отклонений режима в адиабатическом реакторе
дегидрирования этилбензола в стирол с режимом работы ХТС
получения стирола. В данном процессе используется железо-
оксидный катализатор, который со временем теряет свою ак-
тивность. Понижение активности приводит к уменьшению вы-
хода стирола и необходимости повышения температуры дегид-
рирования. В этом случае требуется скорректировать режимы
работы теплообменников, пароперегревательной печи и ректи-
фикационных колонн, поскольку снижение конверсии исходно-
го этилбензола изменит состав реакционной массы. Следствием
падения активности катализатора будет сокращение выпуска
стирола - товарного продукта данного производства.
На технологические режимы элементов ХТС и показатели
системы в целом могут оказывать влияние износ оборудования
и такие внешние возмущения, как температура оборотной воды,
атмосферного воздуха и прочее. В летний период, например, с
повышением температуры воды после градирен ухудшаются
условия теплообмена во всех холодильниках и конденсаторах
ХТС. Поэтому часто приходится снижать нагрузки по сырью и
производительность технологических агрегатов по целевому
продукту.
Чувствительность ХТС характеризуют отношением измене-
ния какого-либо показателя функционирования системы или ее
элемента А И к изменению условий или параметра процесса \Х.
Подобный показатель встречался при исследовании устойчи-
вости процессов. Выбор показателя процесса Y и возмущенного
параметра X (“канала возмущения”) зависит от цели исследова-
ния или задачи анализа процесса. Чем меньше значение чув-
ствительности, тем более стабильно будет протекать процесс.
Создание ХТС с низкой чувствительностью к изменению
внутренних параметров и внешних возмущающих воздействий
очень важно для повышения качества функционирования хими-
ческих производств. Эти задачи решаются на стадии разработки
и проектирования ХТС.
Управляемость ХТС - свойство системы достигать желаемой
цели управления (получить заданный состав продукта, произво-
дительность, качество товарного продукта и т. д.) при ограни-
ченных возможностях управления, которыми располагает дан-
ная система в реальных условиях эксплуатации. Показатель
управляемости можно характеризовать так. В реальных условиях
293
имеют место изменения значений внутренних параметров про-
цессов и внешних условий эксплуатации. Эги изменения воз-
можны в каких-то пределах. Система будет управляема, если
имеется возможность при допустимых изменениях условий про-
цесса сохранить его показатели в заданных пределах.
Каждое проектируемое и создаваемое производство должно
быть управляемым. В связи с этим объективно возникает задача
совместного проектирования ХТС и соответствующей системы
автоматического управления процессами в ней.
Надежность ХТС - это свойство ХТС выполнять требуемые
функции, сохраняя во времени и в заданных пределах значения
установленных эксплуатационных показателей (производитель-
ности, качества продукции, расхода материальных и энергетиче-
ских ресурсов, требований по безвредности обслуживания и
безопасности для окружающей среды и др.). Прекращение вы-
полнения требуемых функций связано с отказами (выходом из
строя или существенным ухудшением функционирования) ка-
ких-то элементов ХТС. В соответствии с общей теорией надеж-
ности технических систем отказ вероятен в любом элементе
ХТС.
Проявление надежности может быть различным для отдель-
ного элемента и ХТС в целом. Выход из строя элемента приво-
дит к прекращению выполнения им требуемых функций, но не
обязательно - к таким же последствиям для ХТС. Возможно, что
посредством определенного изменения условий и режима рабо-
ты других элементов эксплуатационные показатели ХТС в це-
лом будут сохранены в допустимых пределах. С другой стороны,
отклонение от заданных показателей работы какого-либо эле-
мента ХТС без его выхода из строя может вызвать существенные
нарушения в работе других элементов и привести ХТС в нерабо-
тоспособное состояние. Известны случаи, когда усовершенство-
вания отдельных элементов ХТС и их режимов работы приводи-
ли к нарушению химико-технологического процесса в целом и
выходу из строя ХТС, даже к крупным авариям.
Показателями надежности являются среднее время функцио-
нирования ХТС между отказами его элементов или число таких
отказов и общее время простоя за определенный период.
Отказы ХТС и ее элементов могут возникать по различным
причинам:
ошибки на стадиях разработки, проектирования, изготовле-
ния, строительства, монтажа и наладки оборудования, связан-
ные с недостатком или неполным использованием сведений и
знаний о процессах, нарушением установленных правил и норм
работы на этих этапах;
294
нарушения условий и режима эксплуатации из-за ошибок об-
служивающего персонала или непредусмотренных и неконтро-
лируемых внешних воздействий;
изменения состояния оборудования, обусловленные есте-
ственными причинами (износ, старение, повреждения).
Отказы ХТС и ее элементов можно объединить в следующие
группы.
Проектно-конструкторский отказ возникает
вследствие несовершенства используемых методов разработки
химико-технологических систем и конструирования оборудова-
ния, нарушения установленных правил и норм проектирования
технологических систем, оборудования и инженерно-транспорт-
ных коммуникаций, а также ошибок проектировщика или кон-
структора.
Производственно-изготовительный отказ воз-
никает вследствие нарушения и несовершенства технологиче-
ских процессов изготовления, сборки и ремонта оборудования,
неудовлетворительного качества монтажа, профилактического
обслуживания, подготовки к пуску аппаратов, машин и трубо-
проводов, а также в результате ошибок специалистов, которые
участвуют в изготовлении, монтаже и ремонте оборудования.
Эксплуатационно-технологический отказ воз-
никает вследствие нарушения регламентированных значений
параметров химико-технологического процесса, правил и усло-
вий эксплуатации оборудования и инженерно-транспортных
коммуникаций, а также нарушений в системах водо-, тепло- и
электроснабжения производства; в результате повреждений и
естественных процессов старения и износа оборудования и
коммуникаций, влияния агрессивных перерабатываемых ве-
ществ и напряженных режимов (высокие температуры, давле-
ния) химико-технологического процесса; вследствие неисправ-
ной работы систем контроля, сигнализации, управления и за-
щиты; в результате непредусмотренных воздействий окружаю-
щей среды и ошибок обслуживающего персонала.
Отметим, что “человеческий фактор” - квалификация спе-
циалистов, разрабатывающих, создающих и эксплуатирующих
производство, - неизменно влияет на надежность ХТС, что за-
ставляет предъявлять повышенные требования к инженерам-
технологам и конструкторам.
Статистика по надежности различных производств дает такое
распределение отказов по вышеприведенным трем группам в их
общем числе: 40-50% - проектно-конструкторские, 30-40% -
производственно-изготовительные и 30-40% - эксплуатацион-
но-технологические.
Неполадки, вызывающие простои производства из-за ограни-
ченной надежности оборудования и ХТС, влекут за собой тяже-
295
лые экономические последствия. Потери, связанные с произ-
водственными неполадками, складываются из потерь прибыли
(вследствие прекращения производства продукции) и непроиз-
водительных затрат на остановку агрегата, ликвидацию послед-
ствий остановки, неплановый ремонт оборудования и пуск агре-
гата после устранения неполадок.
Как уже отмечалось, техноэкономические преимущества аг-
регатов большой мощности находятся в прямой зависимости от
надежности оборудования и эксплуатации.
Надежность ХТС должна обеспечить: безопасность работы
оборудования и обслуживающего персонала; регламентирован-
ное время непрерывной работы между плановыми остановками
на предупредительный ремонт и профилактику оборудования;
соблюдение норм по защите окружающей среды.
Устойчивость ХТС обусловлена наличием обратных связей в
сложных химико-технологических системах. Некоторые приме-
ры неустойчивых режимов (а к ним надо отнести и отсутствие
стационарных режимов, возникновение колебательных режи-
мов) были рассмотрены выше. Отметим также, что самовозгора-
ние и взрыв есть результат самопроизвольного перехода процес-
са в другой режим, несовместимый с установленным оборудова-
нием и технологическим процессом в нем, т. е. потеря устойчи-
вости стационарного процесса.
3.11.2. Управление химическим производством
Современное химическое производство - сложный комплекс,
состоящий из большого числа агрегатов, соединенных много-
численными связями, - сложная химико-технологическая си-
стема. Может показаться, что для достижения максимальной
эффективности процесса достаточно заранее определить опти-
мальный режим и строго придерживаться его. В реальных усло-
виях всегда имеют место возмущения условий процесса и изме-
нения его параметров.
Система автоматического регулирования (САР) позволяет
поддерживать заданный режим в элементах ХТС. Стабилизация
режима и показателей отдельного аппарата, единичного процес-
са является основной задачей САР. В самом общем случае САР
включает в себя (рис. 3.51) датчик Д, измеряющий значение
стабилизируемого параметра, устройство (прибор П), опреде-
ляющее способ воздействия на регулирующий параметр, и регу-
лятор с исполнительным механизмом Р, устанавливающий но-
вое значение регулирующего параметра. В приведенной схеме
стабилизируется температура на выходе из элемента Э (аппа-
рата) путем изменения расхода потока, поступающего в этот
296
Рис. 3.51. Схема системы автоматического регу-
лирования (САР):
Э - элемент ХТС; Д - датчик; П - регулирующий
прибор; Р - регулятор (исполнительный механизм)
элемент. Построение САР, выбор ее элементов и их настройка -
содержание специальной учебной дисциплины “Автоматизация
химических производств”. Эти процессы базируются на теории
управления. Хотя разработкой, созданием и эксплуатацией САР
занимаются специалисты в области автоматизации производств,
химик-технолог, владеющий процессами в химико-техно-
логической системе, может квалифицированно определить, ка-
кие показатели надо стабилизировать, какие параметры надо
измерять, при помощи каких - управлять процессом.
Отметим некоторые особенности управления химико-
технологическим процессом. Не все технологические показате-
ли, которыми необходимо управлять, доступны для непосред-
ственного и непрерывного измерения. Особенно трудно подда-
ются измерениям показатели состава и качества перерабаты-
ваемого сырья. Поэтому некоторые технологические показатели
определяют по результатам измерений других, связанных с ни-
ми показателей (косвенные измерения) или организуют анализ
периодически отбираемых проб продуктов (дискретные измере-
ния). В этих случаях требуется специальная предварительная
обработка результатов измерений для оценки по ним технологи-
ческих показателей, которые не поддаются прямому измерению.
Условия процесса изменяют (управляют ими), если возникли
отклонения контролируемого показателя. Тут нужно учесть сле-
дующее. Во-первых, управление будет эффективным, если кон-
тролируемый показатель чувствителен к условиям процесса. В
этом случае уже малые отклонения значений показателя про-
цесса вызовут реакцию системы регулирования на корректиров-
ку условий процесса. Во-вторых, при изменении условий про-
цесса его показатели изменяются не мгновенно - практически
всегда имеется некоторое запаздывание (требуется время на
прохождение потока от места его возмущения до точки измере-
ния, прогрев каких-то устройств между этими точками, запол-
нение объема аппаратуры веществом потока). Чем меньше такое
запаздывание, тем регулирование будет эффективнее.
Прямые измерения, быстрая и чувствительная реакция пока-
зателей процесса на возмущения, необходимые для эффективно-
го управления, не всегда выполнимы, и приходится создавать
более сложные системы автоматического регулирования. Пока-
жем это на примере адиабатического процесса в слое катализа-
тора.
297
Рис. 3.52. Стационарные профили температуры Т в слое катализатора при раз-
личных значениях начальной температуры Т„ (а), изменение во времени тем-
пературы ДГ на различной глубине слоя I (б) и схема САР - стабилизации Гк
(в)
Если реакция не завершается в слое, то температура на выхо-
де из него весьма чувствительна к изменениям условий и пара-
метров процесса (концентрации, нагрузки, активности катализа-
тора), и ее необходимо стабилизировать. Наиболее просто мож-
но управлять процессом, меняя температуру на входе в слой.
Казалось бы, выходная температура Тк может служить исходным
сигналом для соответствующего изменения входной температу-
ры Тн - на рис. 3.52, а показаны профили температур при двух
значениях Гн и видно симбатное изменение Гн и Гк. Но это
будет только в стационарных состояниях. Изменение во време-
ни температуры в слое более сложно.
Допустим, на вход стал поступать более горячий газ. На пер-
вых по ходу газа участках слоя увеличится скорость превраще-
ния. Дополнительная теплота и более горячего газа, и более
интенсивной реакции начнет прогревать начальные участки
слоя. Прогрев будет происходить сравнительно медленно - теп-
лоемкость слоя твердого катализатора в несколько сот раз
больше, чем газа. В последние участки слоя будет поступать
реакционная смесь с большей степенью превращения. Здесь
скорости реакции и, соответственно, тепловыделения вначале
станут меньше, и температура на выходе будет сначала пони-
298
Рис. 3.53. Функциональная схема АСУТП обжигового комплекса:
1 - бункеры колчедана; 2 - питатели; 3 - печи КС (кипящего слоя); 4 - вомуходувки;
5- циклоны; 6- электрофильтры; 7- вентилятор
жаться. И только по мере прогрева слоя Гк станет возрастать,
медленно приближаясь к более высокой, определенной стацио-
нарным состоянием. На рис. 3.52, б показана динамика измене-
ния температуры на разной глубине слоя. Внутри слоя темпера-
тура более чувствительна к входной, быстрее и, главное, сим-
батно реагирует на изменение Тн.
Из этих свойств следует схема САР, показанная на рис.
3.52, в. Регулирующий сигнал (PC на рисунке) поступает от дат-
чика температуры Т\, установленного внутри слоя. Устройство
управления У вырабатывает управляющий сигнал (УС) для при-
вода задвижки. Корректировка настройки устройства управле-
ния У проводится по стационарному значению выходной тем-
пературы Тк (корректирующий сигнал КС на рисунке). Как ви-
дим, локальные САР могут быть сложными по структуре.
Стабилизация режимных показателей химического производ-
ства приведет к установке множества локальных САР, относя-
щихся к элементарным процессам и не связанных между собой.
Такое решение задачи автоматизации управления производством
приемлемо только для несложных технологических процессов.
Для современных химических предприятий со сложной структу-
рой связей аппаратов такой подход не приводит к успеху.
Проиллюстрируем это на примере управления производством
обжигового газа. Его получают из колчедана в печах с кипящим
слоем. Процесс ведут в двух параллельных агрегатах, рабо-
тающих на общий коллектор. Схема такой системы показана на
рис. 3.53. Параллельная работа двух агрегатов должна обеспечи-
299
вать бесперебойную работу всей системы при возможных нару-
шениях в одном из агрегатов. Основной задачей управления
этим производством является поддержание общей производи-
тельности по обжиговому газу (Г3) и концентрации в нем
диоксида серы. Получаемое в каждом агрегате количество обжи-
гового газа (F| и F±) поддерживают расходом воздуха и К2), а
концентрацию SO2 (Qj и £?2) - расходом колчедана (Л/( и М2). У
каждого агрегата имеется по две локальные САР. Но при работе
может возникнуть ситуация, когда сократится подача колчедана
в одном из агрегатов (например, в первом) из-за нарушения
работы питателя. При поддерживаемой нагрузке по обжиговому
газу указанное нарушение приведет к уменьшению в нем кон-
центрации SO2. В таком случае необходима корректировка в
регуляторе расхода воздуха (К\) на изменение работы питателя
колчедана. В принципе возможна установка САР с такой кор-
ректировкой (так называемые многосвязные САР). Но умень-
шение нагрузки в первом агрегате приведет к уменьшению об-
шей нагрузки. Необходим переход на следующие управляющие
воздействия - увеличить и расход воздуха (К2), и колчедана (Л/2)
в другом агрегате. Если же изменения достаточно велики и не
удается достигнуть необходимых показателей по расходу и кон-
центрации, хотя элементы системы работоспособны, необходи-
мо скорректировать работу последующих подсистем, перераба-
тывающих обжиговый газ. САР, как она была определена выше,
со всеми этими задачами уже не справится. Как видим, при
управлении крупным технологическим комплексом возникают
проблемы, которые принципиально не сводятся к стабилизации
отдельных технологических параметров.
Автоматизированная система управления технологическим
процессом (АСУТП) - специальная подсистема химического
производства, управляющая всем производством со сложными
взаимодействиями между его элементами. В приведенном при-
мере она (показана на рис. 3.53) осуществляет все необходимые
взаимодействия между регулирующими параметрами и уст-
ройствами управления. Но задачей АСУТП является не только
организация многосвязного управления. Функции, выполняемые
АСУТП, можно разделить на несколько групп, представленных в
системе соответствующими автономными подсистемами.
Управляющие функции АСУТП включают в себя:
автоматическую стабилизацию режима, обеспечивающую регу-
лирование основных технологических параметров процесса и
своевременное снятие возмущений, возникающих в произ-
водстве; дистанционное управление регулирующими и запор-
ными органами; дистанционный пуск основных стадий произ-
водства и плановую его остановку.
300
Рис. 3.54. Структурная схема АСУТП Пояснение в тексте
Информационные функции АСУТП включают в
себя: централизованный сбор информации о параметрах техно-
логического процесса и состоянии оборудования: подготовку и
предоставление обработанной информации о технологическом
процессе и выдачу сигналов об отклонении параметров на мне-
мосхему, цифровую индикацию, шкальные приборы, цифробук-
венную печать и другие устройства отображения информации и
сигнализации.
Аварийная защита служит для предотвращения аварий,
возможных в результате отказов аппаратуры, механизмов, ма-
шин или ошибочных действий операторов, а также для дистан-
ционной аварийной остановки производства.
Вычислительные функции АСУТП заключаются в
математической и логической обработке информации в соот-
ветствии с заложенными программами (расчет оптимальных ре-
301
жимов работы и техноэкономических показателей, определение
отклонений основных технологических параметров, анализ пред-
аварийной и аварийной ситуаций); предоставлении обработан-
ной информации оператору и хранении ее в носителях инфор-
мации; выработке и выдаче управляющих воздействий на задат-
чики некоторых регуляторов.
В соответствии с описанными функциями АСУТП ее можно
представить в виде структурной схемы, приведенной на рис.
3.54. АСУТП - это комплекс технических средств, состоящий из
управляющего вычислительного комплекса (УВК), подсистем
для выполнения указанных функций, устройств связи с персо-
налом (операторами) и с объектом, каналов передачи информа-
ции, преобразователей и устройств ввода информации. Функ-
ционально к комплексу технических средств АСУТП относятся
также датчики сигналов физических величин, исполнительные
механизмы, регуляторы и другие устройства локальной автоматики.
Хотя, казалось бы, АСУТП с управляющей вычислительной
машиной может выполнить любые операции, участие человека -
оператора химического производства - достаточно активно.
Подготовленная и обобщенная информация о процессе позво-
ляет оператору принимать решения в условиях неопределен-
ности и в сложных ситуациях, находить компромиссные выхо-
ды. Но это требует высокой квалификации инженера-технолога.
3.11.3. Пуск и остановка химического производства
Между завершением строительства и началом эксплуатации су-
ществует ответственный этап пуска производства. Ему предше-
ствуют подготовительные операции, которые можно сгруппиро-
вать следующим образом:
1) проверка правильности монтажа оборудования и трубо-
проводов;
2) подготовка насосов, компрессоров и турбин (выверка со-
осности, испытание сальниковых уплотнений, проверка цирку-
ляции смазки и масляных затворов и др.);
3) пуск и испытание центробежных машин;
4) продувка промывка и испытание трубопроводов;
5) просушка огнеупоров технологических печей и футеровки
аппаратов;
6) загрузка катализаторов в реакторы;
7) заполнение водооборотной системы охлаждающей водой и
циркуляция в ней воды;
8) пробный пуск вентиляторов воздушных холодильников;
9) подготовка установки обессоливания питательной воды
для парогенераторов, котлов-утилизаторов;
10) разжигание технологических печей и парогенераторов;
11) наладка функциональных подсистем АСУТП;
302
12) другие подготовительные операции, которые разрабаты-
ваются для каждого конкретного производства.
Перечень операций и последовательность их выполнения
оформляются в виде сетевого графика и строго контролируются.
На проведение каждой операции разрабатывается инструкция,
учитывающая специфику оборудования, рекомендации завода-
изготовителя и проектной организации. В графике может быть
предусмотрено параллельное проведение некоторых операций,
что сокращает общее время подготовки к пуску производства.
По завершении подготовительных работ приступают к пуску
химико-технологического процесса, т. е. к технологическому
пуску химического производства. Пуск включает много стадий,
которые проводят в определенной последовательности по гра-
фику и строго контролируют. Перечень стадий пуска, их после-
довательность и длительность специфичны для каждого химико-
технологического процесса и определяются для конкретного
производства. Например, технологический пуск современного
производства аммиака занимает в среднем до 40 дней и включа-
ет в себя следующие этапы:
1) начало подачи сырья в печь первичного риформинга и
подъем температуры в печи (1 сут);
2) пуск воздушного компрессора и ввод технологического по-
тока в реактор вторичного риформинга (1 сут);
3) достижение заданной температуры в реакторе синтеза ам-
миака (4 сут);
4) начало подачи газового потока в абсорбер и стабилизация
работы системы удаления СО2 (2 сут);
5) пуск и стабилизация узла метанирования (3 сут);
6) пуск холодильной системы (4 сут);
7) достижение заданной низкой температуры в реакторе син-
теза аммиака (6 сут);
8) увеличение расхода газового потока при низкой темпера-
туре в реакторе синтеза аммиака (2 сут);
9) пуск и пробег компрессора синтез-газа (3 сут);
10) испытание на плотность затяжки фланцевых соединений
контура синтеза аммиака (3 сут);
11) активация катализатора синтеза аммиака (8 сут);
12) настройка агрегата и увеличение нагрузки до проектного
уровня (3 сут).
Здесь приведена только часть этапов пуска агрегата синтеза ам-
миака, но и она дает представление о сложности этого процесса.
В период пуска проявляется несовершенство технических
решений, принятых в проекте, недостатки строительно-мон-
тажных работ, неполадки оборудования. Все эти причины уве-
личивают сроки пускового периода. Из статистических наблю-
дений следует, что в крупнотоннажных производствах имеют
303
место следующие причины задержки пуска и их соотношение (в
%):
Ошибки проектирования..............10
Ошибки строительства...............20
Неполадки оборудования.............40
Ошибки операторов..................30
Отметим довольно значительную долю “человеческого фак-
тора” - ошибок операторов, что еще раз подтверждает необхо-
димость высокой квалификации работающего персонала. И хотя
в приведенном выше списке операций по подготовке и пуску
производства не отмечены подготовка операторов технологиче-
ского процесса и другого обслуживающего персонала, этап обу-
чения и повышения квалификации работников производства -
один из важнейших и обязательных этапов подготовки произ-
водства к эксплуатации. Современная система такой подготовки
включает детальное изучение процессов, оборудования, их экс-
плуатации, поведение в аварийных ситуациях, а также обучение
персонала на специальных тренажерах, имитирующих работу
реального производства.
3.11.4. Безопасность и диагностика химико-технологической системы
Неполадки и неисправности в ХТС. Химические производства все
более укрупняются и усложняются. За последние 30 лет мощ-
ности единичных агрегатов возросли в 3-6 раз. В состав совре-
менного производства аммиака входит более 200 единиц раз-
личного технологического и энергетического оборудования, а
протяженность трубопроводов измеряется десятками километ-
ров. Тенденция к созданию малотоннажных производств также
связана с усложнением процессов и ХТС.
Как уже отмечалось, для любого элемента ХТС вероятны на-
рушение его работоспособности, т. е. невозможность выполне-
ния в полном объеме его функций, неполадки и неисправности
оборудования и приборов. Под неполадкой подразумевается ми-
нимальное нарушение эксплуатационных качеств, а неисправ-
ность рассматривается как полная невозможность работы обо-
рудования, приборов или осуществления процесса. Например,
неполадки в химическом реакторе могут возникнуть при отло-
жении солей на поверхности теплообменных элементов. Произ-
водство в этом случае может продолжать функционировать при
пониженной нагрузке по сырью и соответствующей корректи-
ровке технологического режима в остальных элементах ХТС
Нарушение герметичности теплообменных трубок или фланце-
вых соединений приводит к попаданию хладагента в реактор
или реактантов в атмосферу. Возникшая неисправность потре-
бует остановки производства для проведения ремонтных работ.
304
Частота появления неисправностей и неполадок в химиче-
ских производствах зависит в большой мере от условий работы
оборудования, от свойств реактантов и вспомогательных мате-
риалов (коррозионная активность среды, образование осадка,
накипи, инкрустация оборудования и др.), от давления и темпе-
ратуры, от величин массовых и тепловых потоков, от механиче-
ских и гидромеханических воздействий (эрозия, вибрация, кави-
тация и др.). Неисправности технических средств АСУТП могут
быть причиной неплановой остановки производства и даже аварии.
Возникновение неисправностей в каталитическом крекинге
углеводородов связано с организацией процесса. Превращение
сырья происходит в кипящем слое катализатора, который реге-
нерируют в этом же реакторном блоке, выжигая коксовые отло-
жения. Циркулирующий катализатор обладает абразивными
свойствами, и реакторы работают в условиях сильной эрозии.
Особенно интенсивно изнашиваются перфорированные решет-
ки распределительных устройств, транспортные линии, перего-
родки реакционных зон, циклонные сепараторы, опускные тру-
бы и коллекторы охлаждающего змеевика, облицовка теплоизо-
ляционной футеровки. Из-за эрозии происходит разрушение
стенок аппаратов и коммуникаций.
Нарушение работоспособности оборудования не только ска-
зывается на эффективности всего производства, но и может
привести к аварийным ситуациям, вплоть до трудно устранимых
и даже необратимых последствий. Аварии в химических произ-
водствах часто сопровождаются взрывами и пожарами. Так, по-
падание горючих реактантов в атмосферу из-за нарушения гер-
метичности соединений и элементов оборудования может при-
вести к возгоранию и даже взрыву. По литературным данным,
причины аварий на химических производствах, сопровож-
дающихся взрывом, распределены следующим образом (в %):
Выход из-под контроля химической реакции........40
Повышение давления и температуры................20
Протекание побочных химических реакций..........15
Разложение продуктов.............................5
Возгорание оборудования.........................13
Выброс паров горючих веществ....................10
Повышение давления.............................8,3
Воспламенение от искры...........................5
Нарушения в аппаратах высокого давления........3,3
Ошибка оператора...............................3,3
Прочее...........................................16,8
Как видно, основной причиной взрывов является выход из-
под контроля химической реакции, т. е. нарушение режима в
реакторе. Многочисленные неполадки и неисправности вызва-
ны также превышением давления и температуры в технологиче-
ских аппаратах.
305
Почти все используемые в химических производствах ве-
щества оказывают разрушающее (коррозионное) воздействие на
материал оборудования. Коррозионная устойчивость оборудова-
ния и трубопроводов является важнейшим показателем, опреде-
ляющим их надежность, межремонтный пробег, затраты на ре-
монт. Поэтому разработке способов повышения коррозионной
устойчивости уделяется большое внимание, начиная с проекти-
рования и конструирования. Основные способы предотвраще-
ния коррозионного износа оборудования можно условно разде-
лить на три группы: подбор коррозионно-стойких конструкци-
онных материалов, применение защитных покрытий, использо-
вание химических противокоррозионных методов. Последнюю
группу способов используют, например, в первичной переработ-
ке нефтей, в которых содержатся агрессивные компоненты.
Обессоливание, обезвоживание и защелачивание нефти, ввод
ингибиторов коррозии в систему конденсации легких фракций
позволяет сократить число аварийных неплановых остановок и
увеличить межремонтный пробег атмосферно-вакуумных труб-
чатых установок (АВТ) до 1-1,5 лет. Даже вода может быть аг-
рессивным компонентом. В кипятильниках, паровых котлах из
воды выпадают содержащиеся в ней соли и осаждаются на теп-
лообменных поверхностях, что может вызывать их разрушение.
Предотвращение неполадок в ХТС. Видное место в сокраще-
нии неполадок и неисправностей ХТС отводится организацион-
но-техническим мерам. Основные среди них:
строгое соблюдение технологической дисциплины на всех
стадиях существования ХТС (строительство, пуск, эксплуатация,
профилактика); именно оно позволяет в первую очередь не до-
пускать возникновения аварийных ситуаций;
техническая диагностика ХТС: поскольку абсолютно исклю-
чить неисправности и неполадки невозможно и ряд факторов
воздействия на производство неконтролируем, то желательно
предвидеть возможность опасных ситуаций на производстве.
Диагностика неполадок в ХТС предполагает: обнаружение за-
рождающейся неисправности и выяснение ее причин: предска-
зание тенденции изменения процесса в сторону нарушения его
нормального течения; выбор способа предотвращения возни-
кающего нарушения.
Используются специальные технические, организационные и
математические методы. Здесь мы опишем их в самом обшем
виде, чтобы только иметь представление о специальном направ-
лении в технике - диагностике неполадок. Обнаружение и диаг-
ностика неполадок включает в себя:
сбор данных о параметрах процесса и состоянии оборудова-
ния и их изменении во времени;
306
Рис. 3.55. Схема ректификационной
установки с ситчатыми тарелками для
выделения стирола из реакционной
массы
анализ полученных данных
и распознавание тенденции их
выхода за пределы нормального
функционирования процесса и
оборудования.
Ответственный этап - сбор
данных, для чего используют
контрольные карты процессов,
фиксирующие как случайные,
так и неслучайные (вводимые
или планируемые) возмущения.
Выбор перечня изменений за-
висит от контролируемого объ-
екта. В него включают как пе-
ременные, контролируемые
приборами, так и данные опе-
раторов, основанные на орга-
нах чувств (зрении, слухе,
обонянии, осязании). Фикси-
руются также характеристики
процесса и проводится сопоставление их с приемлемыми усло-
виями работы. Данные обрабатывают с использованием специ-
ального математического аппарата статистики, распознавания
образов и принятия решений. Конечным результатом является
так называемое “дерево решений”, или логические шаги, кото-
рые нужно предпринять оператору при обнаружении непола-
док.
Как пример, на рис. 3.55 показана ректификационная ко-
лонна с ситчатыми тарелками для выделения стирола из реак-
ционной массы, а на рис. 3.56 - “дерево решений” для обнару-
жения неполадок в работе этой колонны. Анализ ситуации на-
чинают с объявления нежелательного события (на рис. 3.56 -
снижения производительности). Далее просматривают последо-
вательность событий, представленную графически “деревом
решений”, и находят комбинацию причин, вызвавших такое
нежелательное событие (на рисунке показана только часть
“дерева решений”, а жирными линиями показан просмотр при-
чин одной неполадки).
307
Ошибка в расчете
площади отверстия
—>Ошибка в расчете
переливного отверстия
—> Плохая установка отверстий
-^Забивка отверстий на тарелках
Некачественная
предшествующая очистка
-> Работа не в расчетных условиях
—> Коррозия тарелок
(увеличение отверстий)
-> Пенообразование
С сырьем поступают
посторонние вещества
—> Образование полимерного
осадка
—> Нормальные последствия
переработки сырья
-> Забивка переливного устройства
Рис. 3.56. “Дерево решений” при диагностике неполадок в ректификационной
колонне, показанной на рис. 3.55
Глава 4
ОСНОВЫ ПРОМЫШЛЕННОЙ ЭКОЛОГИИ
4.1. ОКРУЖАЮЩАЯ СРЕДА КАК СИСТЕМА
4.1.1. Общие понятия об экологии и промышленной экологии
Окружающей средой принято считать все, что нас окружает, с
чем мы прямо или косвенно связаны в своей жизни и деятель-
ности. Это целостная система взаимосвязанных природных и
созданных человеком объектов и явлений, включая физические,
химические, биологические и социальные. В широком смысле
слова окружающей средой следует называть нашу планету с ее
биосферой и космическое пространство, воздействующее на нас.
Однако, учитывая существующий уровень взаимодействия чело-
века и космоса, достаточно целесообразно и обоснованно под-
разумевать под окружающей средой лишь земную кору и био-
сферу.
Биосфера - оболочка Земли, в которой развивается жизнь ис-
ключительно разнообразных организмов, населяющих поверх-
ность суши, почву, нижние слои атмосферы, гидросферу. В
своей основе биосфера представляет собой результат взаимодей-
ствия живой и неживой материи. По последним данным, тол-
щина биосферы составляет 40-50 км. Она включает в себя ниж-
нюю часть атмосферы до высоты 25-30 км (до озонового слоя),
практически всю гидросферу и верхний слой литосферы до
5 км.
Современное учение о биосфере создал выдающийся русский
ученый В.И. Вернадский (1863-1945). Он доказал, что все три
оболочки Земли - атмосфера, гидросфера и литосфера - воеди-
но связаны живым веществом, которое непрерывно оказывает
воздействие на неживую природу, преобразуя и формируя облик
планеты. Согласно учению о биосфере к природе надо подхо-
дить как к единому целому, как к системе, все части которой
тесно связаны друг с другом.
Основой динамического равновесия и устойчивости биосфе-
ры является круговорот веществ и превращение энергии. Круго-
ворот слагается из множества процессов превращения и пере-
мещения веществ (таких, как круговорот воды на Земле, кисло-
309
Рис. 4.1. Схема круговорота некоторых веществ в экосистеме:
I - малый (биологический) круговорот веществ; II - большой (геологический) круговорот
веществ
рода, углерода, азота, минеральных веществ). На рис. 4.1 пока-
зана схема циркуляции кислорода, диоксида углерода и воды.
Живые существа поглощают кислород и выделяют СО2 и Н2О.
Другие отходы живых существ и они сами после их смерти как
конца существования индивидуальных организмов остаются на
поверхности Земли и попадают в почву. В замкнутой системе
такое однонаправленное движение веществ должно привести к
установлению устойчивых соединений и в конце концов - к
прекращению всяких превращений, термодинамическому рав-
новесию Однако Земля имеет мощную внешнюю подпитку в
виде энергии Солнца, которая не позволяет затихать процессам
превращения веществ на Земле.
310
Решающее значение в истории образования биосферы имело
появление на Земле так называемых автотрофных растений,
способных улавливать солнечную энергию и синтезировать ор-
ганическое вещество из минерального. Фотосинтез до
В.И. Вернадского рассматривался как собственно биологиче-
ский процесс, как процесс самоподдержания жизни путем улав-
ливания лучистой энергии Солнца. Он показал, что благодаря
фотосинтезу меняется весь облик Земли. Замкнутое движение
указанных веществ - их круговорот через процесс фотосинтеза -
показано на рис. 4.1.
Неорганические и органические соединения от всех живых
организмов и растений, попав на поверхность Земли и в почву,
также перерабатываются микроорганизмами и другими живыми
существами, например червями, в почвенном слое, называемом
гумусом, обеспечивая поставку растениям необходимых им эле-
ментов (на рис. 4.1 отмечены только N, Р и L как основа из-
вестных удобрений). Жизнь растений позволила замкнуть кру-
говорот веществ в природе и через почву.
Общая масса живого вещества Земли исчисляется сотнями
миллионов тонн и включает 500 тыс. видов растений и 1,5 млн
видов животных. Полагают, что биомасса микроорганизмов до-
стигает многих миллиардов тонн. Ежегодный прирост живого
вещества за счет фотосинтеза равен 8,8 10й т.
Описанный круговорот веществ на Земле, поддерживаемый
солнечной энергией, - круговая циркуляция веществ между
растениями, микроорганизмами, животными и другими живыми
организмами - называется биологическим круговоротом ве-
ществ, или малым круговоротом. Время полного обмена вещест-
ва по малому круговороту зависит от массы этого вещества и
интенсивности процессов его продвижения по циклу и оцени-
вается в несколько сот лет.
Кроме малого круговорота существует большой, геологиче-
ский круговорот. Часть веществ попадает в глубинные слои
Земли (через донные отложения морей или иным путем), где
происходят медленные превращения с образованием различных
соединений, минеральных и органических. Процессы геологи-
ческого круговорота поддерживаются в основном внутренней
энергией Земли, ее активного ядра. Эта же энергия способствует
выходу веществ к поверхности Земли. Тем самым большой
круговорот веществ замыкается. Он занимает миллионы лет.
На рис. 4.1 показан круговорот не для всех веществ и эле-
ментов. Круговорот веществ установился в результате длитель-
ной эволюции Земли. Установившееся Великое Равновесие при-
роды обеспечивает гармоничное равновесие между составляю-
311
щими системы - гидросферой, атмосферой, литосферой и био-
сферой и их частями.
В указанной на рисунке схеме человек выделен среди всех
живых организмов. Прочие живые организмы можно условно
назвать “пассивными”, т. е. они обеспечивают свое существова-
ние, потребляя только то, что необходимо для поддержания их
жизни и воспроизводства. Человек отличается от других живых
организмов своей активной деятельностью в биосфере. Ему не-
обходимо обеспечивать комфортность своего существования,
удовлетворять возрастающие потребности материальной жизни
и интеллектуального развития. Человечество активно использует
природные ресурсы - создает промышленность, сельское хозяй-
ство, развивает инфраструктуру, обустраивает быт.
На протяжении всего многовекового существования человек
соей деятельностью оказывает влияние на Великое Равновесие
природы. Сейчас вмешательство человека стало настолько
большим, что можно выделить еще одно глобальное движение
веществ, сравнимое с природными потоками биологического
круговорота. На рис. 4.1 это показано через промышленность.
Пока этот поток не замкнут. Пагубное воздействие изменения
равновесия на все живое может сказаться сразу, но может акку-
мулироваться и привести к губительным последствиям глобаль-
ного характера спустя значительное время. Человечество долгое
время полагалось на то, что природа сама залечивает нанесен-
ные ей раны и что природные ресурсы не могут быть исчерпа-
ны. К любым возобновляемым природным ресурсам следует
подходить как к единому целому, а не как к механической сум-
ме различных видов ресурсов и источников энергии. В этом и
состоит главная идея, требующая нового практического подхода
к природной среде, окружающей человека.
Наука, изучающая условия существования живых организ-
мов, их взаимосвязь друг с другом и со средой, в которой они
обитают, называется экологией. Слово “экология” происходит от
греческих слов oicos - дом и logos - наука. Этот термин был впер-
вые использован в 1866 г. биологом-дарвинистом Э.Геккелем.
Как научная дисциплина экология имеет более чем вековую
историю. Систематические экологические исследования начаты
только в XX веке, хотя вся история развития жизни на нашей
планете - это одновременно история экологических отношений.
Человек нарушал экологическое равновесие уже в тот отдален-
ный период, когда уничтожал леса, создавая поля и пастбища,
но эти нарушения носили локальный характер и не вызывали
глобальных последствий для всего живого на Земле. На каждом
этапе развития человеческого общества воздействие человека на
312
природу определялось состоянием производительных сил; оно
особенно возросло с появлением машинной технологии и до-
стигло максимума в период научно-технической революции.
Отрицательное воздействие развития производства на приро-
ду сводится к трем главным аспектам: истощению естественных
ресурсов, загрязнению окружающей среды и нарушению эколо-
гического равновесия и, как следствие, ухудшению условий
жизни людей. Очевидны два противоречия: с одной стороны -
природа должна быть сохранена во имя процветания челове-
чества, с другой - прогресс и процветание человечества невоз-
можны без интенсивной эксплуатации природной среды. На
современном уровне развития рост производительных сил не
только увеличивает наши возможности, но и уменьшает их,
снижая потенциал природных ресурсов. Поэтому, выбирая цели,
которые человечество хочет достичь, необходимо прогнози-
ровать их результативность по показателям экономического
подъема общества, его социального развития и сохранения ра-
бочего потенциала природных ресурсов.
В 1968 г. в Париже состоялась встреча ученых-экологов, на
которой впервые был поставлен вопрос о последствиях загряз-
нения окружающей среды и ответственности науки, производ-
ства и политики за состояние биосферы. Конференция ООН в
Стокгольме (Швеция) в 1972 г. приняла декларацию, содержа-
щую 26 принципов, которыми должны руководствоваться в
своей деятельности, направленной на охрану природы и рацио-
нальное использование природных ресурсов, все государства. На
этой конференции учрежден Всемирный день окружающей сре-
ды, который отмечается ежегодно 5 июня.
В настоящее время нет недостатка в прорицателях глобаль-
ной катастрофы, которую якобы готовит технический прогресс.
Предотвратить предрекаемый экологический кризис может и
должна разумная деятельность человека, основанная на глубо-
ком понимании естественных биотических циклов, обновляю-
щих и восстанавливающих природную среду.
Поэтому в экологии как науке о существовании живых ве-
ществ в природе выделено направление - промышленная эколо-
гия как раздел общей экологии, изучающей взаимосвязь, вза-
имодействие объектов хозяйственной деятельности человека
(предприятие, город, сельское хозяйство, гидротехническое со-
оружение и т. п.) с окружающей средой. Объем и влияние дея-
тельности человека на природу стало таким, что в качестве со-
ставляющей ее можно выделить техносферу, созданную челове-
ком. Предметом изучения промышленной экологии стала техно-
сфера как элемент всей экосферы, включающей гидросферу,
атмосферу, литосферу, биосферу и техносферу.
313
4.1.2. Масштабы потребления природных ресурсов
Современный научно-технический прогресс связан с постоян-
ным ускорением темпов потребления природных ресурсов и
развития производств.
Древнему человеку для удовлетворения всех жизненных по-
требностей было необходимо 18 химических элементов и их
сочетаний, к XVIII веку - 28, в XIX веке - 47, в начале XX ве-
ка - 59. Сейчас используется около 100 элементов и их соедине-
ний.
Ежегодно из недр извлекается при современном уровне про-
изводства 100 млрд т различных горных пород. К концу XX века
это количество возрастет до 600 млрд т. Наиболее быстро растет
использование минерального сырья. Если в нашей стране в
1960 г. на его долю приходилось около 50% общей массы по-
требляемых исходных материалов и продуктов, то теперь это
сырье становится абсолютно преобладающим. В США с 1940 г.
вовлечено в производство больше минеральных ресурсов, чем
всем человечеством за всю предыдущую историю.
Темпы использования запасов полезных ископаемых про-
должают нарастать. Так, за последние 20 лет потребление нефти
возросло в 4 раза. То же самое происходит с железными рудами,
фосфатами и другими минералами.
Из 200 видов полезных ископаемых наиболее активно ис-
пользуется 30. Однако из-за несовершенства технологии добычи
и переработки теряется почти половина металлов и третья часть
химического сырья. В целом прямой выход в технологической
цепи “сырье - целевой продукт” редко превышает 10%, т. е.
из каждой тонны природного сырья полезно используется лишь
100 кг и образуется до 900 кг различных отходов.
Сложившийся характер потребления сырьевых ресурсов при-
водит к неудержимому росту объема отходов. Огромное количе-
ство их попадает в атмосферу в виде пылегазовых выбросов и со
сточными водами в водоемы, что отрицательно сказывается на
состоянии окружающей среды. В атмосферу планеты ежегодно
выбрасывается более 300 млн т оксида углерода, более 50 млн т
углеводородов, около 200 млн т диоксида углерода, 53 млн т
оксидов азота, 200-250 млн т различных аэрозолей, 120 млн т
золы. Более всего загрязняют атмосферу теплоэнергетика, чер-
ная и цветная метллургия, химическая промышленность.
Стремительно увеличивается объем накопления твердых от-
ходов. В США годовой выход твердых отходов достигает
4,5 млрд т, в том числе 1 млрд т - промышленных; в странах
ЕЭС - 7,2 млрд т, в Японии - 1,3 млрд т. В нашей стране выход
золошлаковых отходов теплоэнергетики в 1980 г. превысил
100 млн т, а в 1990 г. - 140-150 млн т.
314
В промышленный оборот вовлекаются все новые виды по-
лезных ископаемых, к которым теперь предъявляются повы-
шенные требования. Нефть долгие годы была только топливом,
потом стала широко использоваться в химическом производстве,
а теперь - и в получении белковых веществ. Значительно рас-
ширилась сфера потребления металлов, особенно редких.
Потенциальной сферой добычи полезных ископаемых яв-
ляется для человека лишь оболочка земного шара в несколько
десятков километров, хотя за миллиарды лет своего существова-
ния наша планета создала огромнейшие запасы минеральных
ресурсов. Не все они пока доступны человеку. На глубине 10-
20 км определен средний химический состав земной коры. Две-
надцать элементов в сумме составляют 99,29%. Более всего в
земной коре содержится кислорода и кремния; другие ценные
элементы, имеющие промышленное значение, находятся в от-
носительно небольшом количестве. Ниже приведен средний
химический состав [в % (мае.)] земной коры на глубине 10-
20 км:
Кислород..........................49,13
Кремний...........................26,00
Алюминий...........................7.45
Железо.............................4,20
Кальций............................3,25
Натрий.............................2,40
Калий..............................2,35
Магний.............................2,35
Водород............................1,00
Титан..............................0,61
Углерод............................0,35
Хлор...............................0,20
Остальные..........................0,71
Природные ресурсы можно разделить на 3 группы: практиче-
ски невозобновляемые, возобновляемые в отдаленном будущем
и возобновляемые сравнительно быстро. Две первые группы -
это полезные ископаемые. В отличие от быстро возобновляемых
ресурсов, которые при правильной их охране становятся прак-
тически неистощимыми, полезные ископаемые - это как бы
“срочный вклад” природы. Их можно использовать только один
раз, после чего они исчезают.
К возобновляемым запасам относятся материалы раститель-
ного и животного происхождения. Эти биологические ресурсы
человечество может воспроизводить в течение жизни одного
поколения, в то время как для образования полезных иско-
паемых необходимо весьма длительное время и исключительное
сочетание благоприятной горно-геологической обстановки пла-
неты, которая может не повториться.
315
Возобновляемыми в отдаленном будущем можно считать го-
рючие ископаемые - нефть, уголь, торф, сланцы, а также неко-
торые природные соли. Но воссоздание месторождений - столь
длительный процесс, что полезные ископаемые почти все мож-
но считать “срочным вкладом” природы. К категории практиче-
ски невозобновляемых ресурсов относятся ископаемые магмати-
ческого происхождения - рудные, из которых получают метал-
лы, и некоторые нерудные (например, корунд, графит и т. д.).
В своей хозяйственной деятельности человек концентрирует
природные материалы, добывая их, а затем рассеивает. При
этом большая часть ресурсов рассеивается необратимо (на-
пример, углерод в процессе использования распыляется в зем-
ной коре и загрязняет атмосферу; железо в виде различных ме-
таллических изделий через процесс коррозии рассеивается по всей
планете и т. д.). Человек концентрирует (не рассеивает, а накапли-
вает) лишь драгоценные металлы - золото, платину и т. п.
Исключительно большие масштабы добычи полезных иско-
паемых привели к истощению самых богатых и наиболее до-
ступных рудных залежей. Более того, можно говорить об исто-
щении сырья в глобальном масштабе, если иметь в виду разве-
данные запасы, пригодные к эксплуатации при данном развитии
техники и уровне цен. Ниже приведен индекс обеспеченности
мировых потребностей в полезных ископаемых запасами про-
мышленной категории (отношение запасов по данным 1976 г. к
потребности на период 1976-2000 гг.) для металлов:
Алюминий.......6,2
Железо........5,1
Марганец......4,6
Титан..........4,4
Платина.......3,1
Молибден......2,2
Никель.........2,2
Олово.........1,5
Вольфрам......1,4
Медь..........1,4
Свинец........1,2
Ртуть.........0,9
Цинк..........0,9
Серебро.......0,6
Как видно из приведенных данных, олово, ртуть, цинк, се-
ребро могут быть исчерпаны к концу XX века или несколькими
десятилетиями позже. Понятно, что речь идет об относительном
исчерпании рудных запасов. Будут открыты новые запасы на боль-
шей глубине и на дне океана, будут разработаны экономически
эффективные методы использования более бедных залежей.
Отмеченные факты подтверждают тенденции к повышению
издержек производства и цен на минеральное сырье. Коренной
путь решения сырьевой проблемы предполагает разработку тех-
нологии, на основе которой обеспечиваются:
а) увеличение полноты и комплексности использования при-
родных ресурсов (отбирать максимальное число компонентов
при добыче полезных ископаемых и сокращать отходы на всех
этапах производственных процессов);
316
б) повторное использование отходов производства и потреб-
ления (регенерация отходов).
Регенерационное производство обеспечивает решение сразу
двух проблем: сокращение все возрастающего количества отхо-
дов и преодоление дефицита сырьевых ресурсов. В последние
годы регенерационное производство получает все более широ-
кое развитие.
Экономический анализ подтверждает приоритетность затрат
на создание регенерационных производств по сравнению с за-
тратами на добывающую промышленность.
4.1.3. Взаимодействие производства и окружающей среды
В процессе взаимодействия производства и окружающей среды
осуществляется обмен веществ между производственной и при-
родными сферами. Он называется антропогенным метаболиз-
мом.
Антропогенный метаболизм складывается из двух составляю-
щих: суммы индивидуальных обменов веществ всех людей на
Земле (биологическая часть) и суммы техногенных обменов ве-
ществ от технологических процессов (технологическая часть).
Последняя трактуется как обмен веществ и энергии между тех-
носферой и биосферой.
Технологический обмен - явление на Земле принципиально
новое и потому порождает немало проблем и противоречий в
системе общество - природа.
Любой технологический процесс начинается вводом исход-
ных веществ (сырья) и завершается в конечном итоге выводом
разнообразных готовых изделий и отходов. Иными словами,
система антропогенного обмена в целом включает ввод природ-
ных ресурсов, их переработку с использованием энергии и вы-
вод в окружающую среду отработанных веществ (производ-
ственных и бытовых отходов) и отслуживших свой срок готовых
изделий. Процесс этот носит линейный, незамкнутый и, следо-
вательно, конечный характер, поскольку возвращение отходов и
отработанных изделий в качестве исходного сырья все еще ско-
рее исключение, чем правило.
Обмен веществ в биосфере основан на других принципах.
Суммарный процесс движения веществ в биосфере носит замк-
нутый, цикличный характер, т. е. теоретически бесконечный
при постоянном потоке энергии от Солнца.
Современный объем и скорости антропогенного обмена, осо-
бенно в его технологической части, достигли уровня, при кото-
ром все отчетливее проявляется напряженность и на вводе
(сырьевые ресурсы), и на выводе из системы (отходы).
317
Рис. 4.2. Относительные расстояния в распространении отходов производства
В результате к настоящему времени со всей очевидностью
выявились четыре острейшие проблемы глобального характера:
охрана окружающей среды от загрязнения, обеспечение расту-
щего населения продуктами питания, обеспечение промышлен-
ности минеральным сырьем и проблемы энергетики.
Масштабы воздействия человека на окружающую среду
огромны. Интенсивному воздействию подвергаются все компо-
ненты окружающей среды, из которых наиболее важны для че-
ловека атмосферный воздух, пресная вода и почва.
Загрязнение окружающей среды - вывод из системы антропо-
генного обмена в природу всевозможных отходов, отбросов и
использованных (амортизированных) изделий.
Виды, источники и пути загрязнения окружающей среды
различны и многообразны: выбросы в атмосферу химических
соединений и смесей; слив в водную среду (реки, подземные
воды) всевозможных производственных отходов и сточных вод,
попадание в нее нефтяных продуктов; засорение почвы твер-
дыми отходами; повышение уровня ионизирующей радиации,
шума, вибрации, а также тепловые выбросы в атмосферу и вод-
ный бассейн. Большинство из названных источников загрязне-
ний относится и к химическим производствам. Из рис. 4.2 вид-
ны относительные расстояния в распространении отходов про-
изводства в окружающей среде.
318
Основное загрязнение атмосферы в нашей стране создают
шесть отраслей промышленности и автотранспорт. Их относи-
тельное участие в загрязнении атмосферы (%): теплоэнергети-
ка - 27,0; черная металлургия - 24,3; цветная металлургия -
10,5; нефтедобыча и нефтехимия - 15,5; автотранспорт - 13,3;
предприятия стройматериалов - 8,1; химическая промышлен-
ность - 1,3.
Как видно, теплоэнергетика и предприятия черной металлур-
гии поставляют более половины всех выбросов в атмосферу.
Выбросы от химических производств меньше по общему коли-
честву, но их разнообразие и высокая токсичность ставят хими-
ческую промышленность в ряд основных загрязнителей атмо-
сферы.
Для химических и нефтехимических предприятий характерно
наличие технологических и вентиляционных, организованных и
неорганизованных выбросов вредных веществ в атмосферу. К
технологическим относятся хвостовые выбросы технологических
процессов, выбросы при продувке оборудования, постоянно
действующие дыхательные трубы, периодически действующие
предохранительные клапаны, дымовые трубы технологических
печей. Технологические выбросы характеризуются высокой
концентрацией вредных веществ при небольшом объеме газо-
воздушной смеси.
К вентиляционным относятся выбросы общеобменной и
местной вытяжной вентиляции. С учетом объема вентиляцион-
ного воздуха валовое количество вредных веществ, содержа-
щихся в вентиляционных выбросах, часто превышает таковое в
технологических выбросах.
К организованным относятся выбросы, отводимые от мест
выделения системой газоотводов, что позволяет улавливать
вредные вещества в соответствующих установках.
Неорганизованные выбросы возникают за счет негерметич-
ности оборудования, коммуникаций, пробоотводников, канали-
зационных колодцев и др.
Самыми распространенными веществами, загрязняющими
атмосферу, являются: оксид углерода, диоксид углерода,
диоксид серы, оксиды азота, углеводороды, летучие растворите-
ли (ароматические углеводороды, спирты, эфиры, кетоны, гало-
генпроизводные углеводороды и др.), а также пыль.
Известно более 200 загрязняющих атмосферу вешеств, при-
чем по мере освоения новых технологических процессов их чис-
ло возрастает. В некоторых случаях влияние на окружающую
среду усиливается в результате образования в атмосфере под
воздействием солнечного света новых веществ из содержащихся
в выбросах.
319
Серьезные опасения вызывает загрязнение пресных вод, яв-
1яющихся и природным ресурсом деятельности человека,и од-
новременно жизненно необходимым благом. Так, в 1900 г. в
США использовалось только 6% водных ресурсов поверхностно-
го стока, в 1960 г. - 27, а в 1980 г. - свыше 50. Общее мировое
потребление воды в конце 60-х годов составило 560 км3, что
почти равно половине объема вод рек. При этом, в водоемы по-
ступило 440 км3 сточных вод, загрязнявших примерно 5500 км3
чистой воды.
В нашей стране возобновляемый речной сток составляет око-
ло 4700 км3 в год. Наиболее устойчивая величина стока, которая
может быть использована для водопотребления, составляет
1600 км3 в год, или 34% суммарных водных ресурсов. Водосток
имеет неравномерное распределение по территории страны.
Около 80% стока рек приходится на Сибирь и Дальний Восток,
в то время как почти 80% промышленного производства разме-
щено на Европейской части континента.
Промышленные предприятия, сельское хозяйство, транспорт
загрязняют водоемы всевозможными поверхностно-активными
веществами, солями, минералами, углеводородами, взвесями,
удобрениями и ядохимикатами.
Одним из опасных видов органического загрязнения воды
является загрязнение нефтью участка поверхности более 20 км2.
Такая пленка сокращает проникновение света, препятствует
фотосинтезу, снижая перенос кислорода и углекислого газа. Со
временем нефтяная пленка разлагается под действием солнечно-
го излучения, образуя высокотоксичные вещества.
Исключительно важной современной проблемой является со-
хранение почвы. Ежегодно в мире приходит в негодность при-
мерно 6-7 млн га почвы.
Немалые потери происходят из-за отчуждения пахотных и
других пригодных для сельскохозяйственного использования
земель под городскую застройку, прокладку дорог, промышлен-
ные площадки, свалки отходов и т. д.
В настоящее время для добычи 1 млн м3 полезных иско-
паемых отчуждается 8,6 га земли, при строительстве 1 км трубо-
проводов - 4 га, 1 км автодорог - 2 га.
Таким образом, экологические последствия деятельности че-
ловека сводятся к нарушению естественно протекающих про-
цессов в отдельных компонентах окружающей среды и во всем
их комплексе. Человек, его деятельность, непосредственно
влияющая на компоненты окружающей нас природы и руко-
творные объекты, образуют в тесной взаимосвязи эколого-
экономическую систему (ЭЭС), жизнедеятельность которой
320
невозможно рассматривать по отдельным компонентам в силу
теснейших взаимосвязей.
Известный эколог Барри Коммонер сформулировал основ-
ные законы, которые отражают взаимосвязь производственной
деятельности человека и окружающей среды: все связано со
всем; все должно куда-то деваться; природа знает лучше; ничто
не дается даром.
4.1.4. Контроль состояния окружающей среды
Основной физической характеристикой примесей в атмосфере
служит концентрация - количество вещества в единице объема
воздуха при нормальных условиях (обычно в мг/м3). Концент-
рация примесей определяет физическое, химическое и другие
виды воздействия их на окружающую среду и является основ-
ным параметром при нормировании допустимого содержания
примеси в атмосфере и водных объектах.
Предельно допустимые концентрации примесей в атмосфере
(ПДК) - это максимальная концентрация примесей в атмосфе-
ре, осредненная за определенное время, которая при периоди-
ческом воздействии или на протяжении всей жизни человека не
оказывает на него и на окружающую среду в целом вредного
действия, включая отдаленные последствия. Предельно до-
пустимые концентрации загрязняющих веществ регламентиро-
ваны Министерством здравоохранения России.
Если вещество оказывает на окружающую природу вредное
воздействие в меньших концентрациях, чем на организм чело-
века, то при нормировании исходят из порога действия этого
вещества на окружающую природу.
Выделяют два типа ПДК - максимально-разовые (ПДКраз) и
среднесуточные (ПДКсут). Первые относятся в основном к 20-30-
минутному интервалу времени и определяют степень кратко-
временного воздействия примеси на организм человека; вто-
рые - допустимую степень загрязнения воздуха в течение дли-
тельного периода без строгого фиксирования его продолжитель-
ности.
В нашей стране установлены ПДК для 200 вредных ингреди-
ентов. В табл. 4.1 приведены значения для некоторых из наибо-
лее распространенных примесей. В зависимости от токсичности
выделяют четыре класса опасности примесей.
Наибольшая концентрация каждого вредного вещества в
приземном слое не должна превышать максимально-разовой
предельно допустимой концентрации, т. е. С < ПДКраэ. При
одновременном присутствии в атмосфере нескольких вредных
321
Таблица 41 Значения предельно допустимых концентраций (ПДК) некоторых
веществ для атмосферного воздуха населенных пунктов
Вещество ПДК, мг/м3 Класс опасности
максимально- разовая среднесуточ- ная
Диоксид азота 0,085 0,085 2
Аммиак 0,2 0,2 4
Диоксид серы 0,5 0,05 2
3,4- Бенз(а)пирен — io-6 1
Взвешенные вещества (пыль) 0,5 0,05 3
Кислота серная 0,3 0,1 2
Метилмсркаптан 9 10~6 — 2
Ртуть металлическая — 3 10 4 1
Сероводород 0,008 0,008 2
Сероуглерод 0,03 0,005 2
Оксид углерода 3,0 1,0 4
Фенол 0,01 0,01 2
Фтористые соединения газообраз- 0,02 0,005 2
ныс
Хлор 0,05 0,05 3
веществ, обладающих однонаправленным действием, их безраз-
мерная суммарная концентрация должна удовлетворять условию
С1 + С2 + + сп < }
ПДК раз! ПДК раз 2 ПДК раз л
где С|, С2, ... , С„ - концентрации вредных веществ в атмосфере в одной и той
же точке местности, мг/м3; ПДКраз), ПДКраз2, ... , ПДКразл - максимально-
разовые предельно допустимые концентрации вредных веществ в атмосфере,
мг/м3.
Эффектом однонаправленного действия обладает ряд вред-
ных веществ, например: диоксиды серы и азота; диоксид серы и
сероводород; этилен, пропилен, бутилен и амилен; озон,
диоксид серы, формальдегид и др.
Предельно допустимые выбросы в атмосферу (ПДВ). Для каж-
дого источника загрязнений атмосферы устанавливается пре-
дельно допустимый выброс вредных веществ из условия, что
выбросы вредных веществ от данного источника в совокупности
с выбросами других источников города или иного населенного
пункта с учетом перспективы развития промышленных пред-
приятий и рассеивания вредных веществ в атмосфере не созда-
дут приземной концентрации, превышающей ПДК для населе-
ния, растительного и животного мира.
При установлении ПДВ для источника загрязнения атмосфе-
ры необходимо учитывать значения фоновых концентраций
вредных веществ в воздухе от остальных источников загрязне-
ния, действующих в данной местности. Устанавливают ПДВ на
322
основании расчета рассеивания примесей в атмосфере. В случае
нагретых выбросов из JV расположенных близко друг к другу
труб ПДВ можно рассчитать по формуле:
ПДВ =
(ПДК-Сф)//2
ArFmn
1удт
V N '
где Сф - фоновая концентрация в данном населенном пункте или городе, Н -
высота труб; V - объем дымовых газов, выбрасываемых в единицу времени;
Л 7 - перегрев газов относительно окружающего воздуха; А и г - коэффициен-
ты, характеризующие соответственно неблагоприятные климатические условия
и влияние рельефа (для ровной местности г = 1); F - коэффициент, опреде-
ляющий влияние осаждения примеси (для газов F — 1); т и п - вспомогатель-
ные параметры.
Установление ПДВ гарантирует население от возможного не-
благоприятного воздействия атмосферных загрязнений, посту-
пающих в приземный слой атмосферы от конкретного пред-
приятия. При этом основным нормативом остается ПДК, а ве-
личина ПДВ имеет вспомогательное значение, существенно
облегчая контроль за выбросами предприятия. Системы контро-
ля на предприятиях отслеживают источники выбросов и соблю-
дение ПДВ.
Предельно допустимые концентрации (ПДК) веществ в вод-
ных объектах - это концентрации веществ в воде, выше которых
вода становится непригодной для использования.
При поступлении в водные объекты нескольких веществ и с
учетом примесей, поступающих в водные объекты от вышерас-
положенных предприятий, как и в случае загрязнения атмосфе-
ры, должно выдерживаться условие
Q С2 С„
ПДК[ ПДК 2 " пдк„
В настоящее время органами санитарной службы установле-
ны ПДК в воде водоемов для более 400 различных веществ.
Правилами охраны поверхностных вод от загрязнения сточ-
ными водами запрещено сбрасывать в водные объекты сточные
воды, содержащие вещества, для которых не установлены ПДК.
Мониторинг окружающей среды. Мониторингом называется
система наблюдений, оценки и прогноза состояния окружаю-
щей природной среды. Цель мониторинга - выявление антропо-
генных загрязнений.
Мониторинг охватывает наблюдения за источниками и фак-
торами антропогенных воздействий - химическими, физически-
ми (излучение, тепловое загрязнение) и за эффектами, вызы-
ваемыми этими воздействиями в окружающей среде, и прежде
всего за реакцией биологических систем.
323
Система мониторинга может охватывать как локальные рай-
оны, так и земной шар (глобальный мониторинг для оценки
состояния биосферы). В СНГ разработана система мониторинга
на разных уровнях: глобальном, региональном и местном. Сеть
станций контроля загрязнения атмосферного воздуха включает
1500 станций, загрязнения внутренних водоемов - 3343 станции,
морского загрязнения - 1500 станций; организовано 2000 постов
для контроля загрязнения почвы.
4.1.5. Экономические последствия
загрязнения окружающей среды
Загрязнение окружающей среды обусловливает два вида затрат в
народном хозяйстве: затраты на предупреждение воздействия
(ущерба) загрязненной среды на отдельные объекты и затраты,
вызываемые самим воздействием (ущербом, причиняемым
окружающей среде соответствующими выбросами). Сумма этих
затрат выражает экономический ущерб, причиняемый народно-
му хозяйству загрязнением окружающей среды.
Укрупненную экономическую оценку годового ущерба от вы-
бросов загрязнений в атмосферу для любого источника можно
определить по формуле
Уа = уо/Л/,
где Уа - ущерб, руб/год; у - удельный ущерб от выбросов единицы условной
массы загрязняющих веществ, руб/усл. т; а - безразмерный показатель, харак-
теризующий относительную опасность загрязнения атмосферного воздуха над
территориями различного типа; f - безразмерная поправка, учитывающая ха-
рактер рассеивания загрязнений в атмосфере; М - приведенная условная масса
выброса загрязнения из источника, усл. т/год.
Все величины зависят от различных факторов, включая и
токсичность веществ.
Ущерб, причиняемый выбросами загрязнений в определен-
ный водоем, для любого источника (предприятия, населенного
пункта) определяется по аналогичному уравнению:
Ув = уоЛ/,
где Ув - ущерб, руб/год; у - удельный ущерб от сброса в водоем единицы
условной массы загрязняющего вещества, руб/усл. т; в - безразмерный показа-
тель, характеризующий относительную опасность загрязнения различных водо-
хозяйственных участков (например, для устья Сев. Донца - 3,70, а для устья
Енисея - 0,11); М - приведенная условная масса сброса загрязнений данным
источником, усл. т/год.
Может быть рассчитан также экономический ущерб от за-
грязнения и отчуждения, наносимого земельным ресурсам.
В большинстве промышленно развитых стран экономический
ущерб от загрязнения окружающей среды составляет 3-5% вало-
324
вого национального продукта, при этом расходы на мероприя-
тия по сокращению загрязнения достигли 1-3%. Капитальные
затраты на охрану окружающей среды в различных отраслях
промышленности достигают 5-20% от общих капитальных вло-
жений.
4.1.6. Основные принципы создания
безотходных производств
Рассмотрим основные понятия, которые потребуется использо-
вать при рассмотрении вопросов создания безотходных произ-
водств.
Отходы производства - остатки сырья, материалов и полу-
продуктов, образующиеся при получении заданной продукции,
которые частично или полностью утратили свои качества и не
соответствуют стандартам (техническим условиям). Эти остатки
после соответствующей обработки могут быть использованы в
сфере производства или потребления.
Отходы потребления - это непригодные для дальнейшего ис-
пользования (по прямому назначению) изделия производствен-
но-технического и бытового назначения (например, изношен-
ные изделия из пластмасс и резины, вышедший из строя ша-
мотный кирпич теплоизоляции печей и др.).
Побочные продукты образуются при физико-химической пе-
реработке сырья наряду с основными продуктами производства,
но не являются целью производственного процесса. Они в
большинстве случаев бывают товарными, на них имеются
ГОСТ, ТУ и утвержденные цены, их выпуск планируется. Чаще
всего это содержащиеся в сырье компоненты, не используемые
в данном производстве, или продукты, которые получаются при
добыче или обогащении основного сырья; их принято называть
попутными продуктами (например, попутный газ при добыче
нефти).
Вторичные материальные ресурсы (BMP) - совокупность отхо-
дов производства и потребления, которые могут быть использо-
ваны в качестве основного или вспомогательного материала для
выпуска целевой продукции.
Между производством и окружающей средой до сих пор до- -
минирует открытый тип связи. Производственный процесс на-
чинается с использования природных ресурсов и завершается
превращением их в средства производства, предметы потребле-
ния. За процессом производства следует процесс потребления,
после чего использованные продукты выбрасываются.
Таким образом, открытая система базируется на принципе
одноразового использования исходного материала природы.
325
Каждый раз производство начинается с использования некото-
рых новых природных ресурсов, и каждый раз потребление за-
канчивается выбросами отходов в окружающую среду. Как было
показано выше, весьма небольшая часть природных ресурсов
превращается в целевые продукты, большая часть их попадает в
отходы.
Биосфера функционирует по принципу встроенности систем:
каждая форма конструируется за счет деструкции других форм,
составляя звено всеобщего кругооборота вещества в природе.
Производственная деятельность вплоть до самого последнего
времени строилась по другому принципу - максимальной экс-
плуатации природных ресурсов и игнорирования проблемы де-
струкции отходов производства и потребления. Этот путь был
возможен лишь до тех пор, пока масштабы отходов не превы-
шали границ способности экологических систем к самовосста-
новлению.
Таким образом, назрела необходимость перехода к принци-
пиально новой форме связи между производством и окружаю-
щей средой - к замкнутым системам производства, предпола-
гающим возможно большую встроенность производственных
процессов во всеобщий круговорот вещества в природе.
При замкнутой системе производство строится, опираясь на
следующие фундаментальные принципы:
1) возможно более полное использование исходного природ-
ного вещества;
2) возможно более полное использование отходов производ-
ства и потребления (регенерация отходов и превращение их в
исходное сырье для последующих ступеней производства);
3) создание конечных продуктов производства с такими
свойствами, чтобы используемые отходы производства и по-
требления могли быть ассимилированы экологическими систе-
мами.
Сложившееся сегодня положение в области ресурсопотребле-
ния и масштабы промышленных выбросов позволяют сделать
вывод о том, что имеется только один путь решения проблемы
оптимального потребления природных ресурсов и охраны окру-
жающей среды - создание экологически безвредных технологи-
ческих процессов, или безотходных, а на первое время - мало-
отходных. Это единственный способ, подсказанный самой при-
родой.
В ноябре 1979 г. в Женеве на совещании по охране окру-
жающей среды в рамках Организации Объединенных Наций
(ООН) была принята “Декларация о малоотходной и безотход-
ной технологии и использовании отходов”. В соответствии с
326
Декларацией под безотходной технологией понимается такой
принцип функционирования промышленности и сельского хо-
зяйства региона, отрасли, а также отдельных производств, при
котором рационально используются все компоненты сырья и
энергия в цикле и не нарушается экологическое равновесие:
---» потребление
А
Сырьевые ресурсы-----> производство
---> отходы > Вторичные
ресурсы
Под малоотходным производством понимают такое производ-
ство, вредные последствия деятельности которого не превышают
уровня, допустимого санитарными нормами, но по техниче-
ским, экономическим, организационным или другим причинам
часть сырья и материалов переходит в отходы и направляется на
длительное хранение.
Конечно, концепция безотходной технологии в некоторой
степени носит условный характер. Под безотходной технологией
понимается теоретический предел, идеальная модель производ-
ства, которая в большинстве случаев может быть реализована не
в полной мере, а лишь частично (отсюда и малоотходная техно-
логия), но с развитием технического прогресса - со все боль-
шим приближением. Технологические процессы с минималь-
ными выбросами, при которых способность природы к само-
очищению в достаточной степени может предотвратить возник-
новение необратимых экологических изменений, называют
иногда “экологической технологией”, “малоотходными процес-
сами”, “безвредной технологией”. Однако название “безотход-
ная технология” получило наибольшее распространение. Связь
биосферы и техногенной деятельности человека показаны на
рис. 4.3.
Стратегия безотходной технологии исходит из того, что не-
используемые отходы производства являются одновременно не
полностью использованными природными ресурсами и источ-
ником загрязнения окружающей среды. Снижение удельного
выхода неиспользуемых отходов в расчете на товарный продукт
технологии позволит произвести больше продукции из того же
количества сырья и явится вместе с тем действенной мерой по
охране окружающей среды.
Биосфера дает нам природные ресурсы, из которых в сфере
производства получаются конечные продукты, при этом образу-
327
Биосфера
Биосфера
Рис. 4.3. Связь биосферы и техногенной деятельности человека
ются отходы. Продукты используются либо в сфере производ-
ства, либо в сфере потребления, и вновь образуются отходы.
Под отходами понимаются вещества, не обладающие на первых
порах потребительской ценностью. Во многих случаях при не-
обходимости после соответствующей обработки они могут быть
использованы как вторичное сырье (вторичные материальные
ресурсы) или как вторичные носители энергии (вторичные
энергоресурсы). Если по техническим или технологическим
причинам невозможно или экономически невыгодно перераба-
тывать отходы, то их необходимо выводить в биосферу таким
образом, чтобы по возможности не наносить вреда естественной
окружающей среде.
Можно составить следующий баланс по сферам производства
и потребления, исходя из закона сохранения материи:
R = - ф«) + s,
где А - расход природных ресурсов, кг/с; А - масса образующихся отходов в
сферах производства и потребления, кг/с; <рт - средний коэффициент исполь-
зования отходов, кг/кг; S - масса веществ, накапливающихся в сферах произ-
водства и потребления вследствие постоянного роста производства, кг/с.
Анализ балансового уравнения показывает, что снижение
удельного количества неиспользуемых отходов производства
328
Л(1 - <pm) и тем самым удельного расхода природных ресурсов R
возможно:
за счет уменьшения удельного выхода отходов производства Л;
за счет повышения коэффициента использования отходов <рт.
Выбор одного из путей зависит как от технологических воз-
можностей, так и от экономических условий. Первичная цель
безотходной технологии - настолько уменьшить выводимый в
единицу времени в биосферу поток массы неиспользованных
отходов, чтобы сохранялось естественное равновесие биосферы
и обеспечивалось сохранение основных природных ресурсов.
В создании безотходной технологии определились следующие
четыре принципа:
1) разработка и внедрение различных бессточных технологи-
ческих схем и водооборотных циклов на базе эффективных ме-
тодов очистки;
2) разработка и внедрение принципиально новых технологи-
ческих процессов, исключающих образование любых видов от-
ходов;
3) создание территориально-промышленных комплексов, т. е.
экономических районов, в которых реализована замкнутая си-
стема материальных потоков сырья и отходов внутри комплекса;
4) широкое использование отходов в качестве вторичных ма-
териальных и энергетических ресурсов.
Анализ существующей ситуации, расчеты и прогнозы на бу-
дущее убедительно показывают, что реализация безотходных
производств во всех отраслях промышленности возможна при
условии активного использования достижений науки и техники,
и в первую очередь химической технологии.
Особенность химической технологии состоит в том, что она
способна превратить в ресурсы не только свои собственные от-
ходы, но и отходы других производств. В связи с этим химия и
химическая технология способствуют решению таких коренных
проблем охраны природы, как комплексное использование
сырья и утилизация отходов, обезвреживание производственных
выбросов. В качестве примера можно указать на межотраслевую
роль методов химической технологии в решении экологических
проблем теплоэнергетики. Выше были приведены масштабы
выбросов диоксида серы и оксидов азота тепловыми электро-
станциями и ТЭЦ. Для очистки дымовых газов от этих вредных
компонентов применяют различные физико-химические спосо-
бы, в том числе сухие с использованием сорбентов и мокрые с
применением водных растворов щелочей и аммиака. Разработа-
ны способы очистки с одновременным получением минераль-
ных удобрений - нитратов и сульфатов аммония.
329
В промышленности широкое распространение получили ка-
талитические генераторы тепла (КГТ), в которых сжигание ор-
ганического топлива (газ, мазут) осуществляют на катализато-
рах. Использование этого приема химической технологии в теп-
лоэнергетике позволяет интенсифицировать процесс горения
топлива, снизить металлоемкость оборудования, приблизить
избыток воздуха к стехиометрическому и в сотни раз сократить
выбросы оксидов азота с продуктами сгорания.
Методы химической технологии положены в основу многих
безотходных технологий, разрабатываемых в металлургической
промышленности, в производстве строительных материалов и
других материалоемких отраслях народного хозяйства.
4.1.7. Экономическая эффективность безотходных производств
При проектировании химического производства практический
интерес представляет сравнение безотходной технологической
схемы с традиционной схемой получения данного продукта. Для
проведения такого анализа составляются эталонные проекты,
предназначенные для выработки и планирования технической
политики в области создания безотходной технологии. Понятие
“эталонный проект” подразумевает такую совокупность техно-
логических стадий в цикле “ресурсы - производство - потреб-
ление - ресурсы”, при которой обеспечивается замкнутое дви-
жение материальных и энергетических потоков.
В качестве показателей выбирают критерии, имеющие эко-
номическую значимость: общее или удельное количество отхо-
дов; взаимодействие соединений, входящих в состав отходов, с
элементами биосферы; распространение и трансформирование
отходов и т. д.
Эталонный проект создается не для отдельных предприятий
и отраслей, а для наиболее важных видов продукции: минераль-
ных удобрений, кальцинированной соды, пластмасс, мономеров
и т. д. В этом состоит его особенность по сравнению с обычным
проектированием.
При составлении эталонного проекта используют наиболее
совершенные технологические схемы получения той или иной
продукции. Переработка отходов, как вновь образующихся, так
и накопленных, должна осуществляться также с помощью наи-
более совершенных технологических процессов, не дающих вто-
ричных локальных циклов, усложняющих структуру общего
цикла “ресурсы - производство - потребление - ресурсы”.
При экономической оценке цикла имеет значение определе-
ние стоимости отходов, так как от этого зависит стоимость про-
дукции, получаемой при их переработке.
При оценке экономической эффективности безотходных
производств используют сложный критерий, каждый составной
330
Таблица 4.2. Эффективность капитальных вложений в безотходное производство
Показатель Варианты
1 | 2 3 4
Коэффициент использования сырья Ки Затраты на получение товарной продукции, усл. ед./год: 0,80 0,85 0,90 0,95
текущие (С) 0,80 0,82 0,84 0,87
капитальные (К) 0,75 0,90 1,10 1,30
Выход готовой продукции Т, % 100 105 ПО 117
Выброс токсичных веществ в окружающую среду В, % 100 70 40 25
Ущерб от загрязнения окружающей среды отхо- дами производства У*, усл. ед./год 0,15 0,09 0,06 0,03
Эффект потребления дополнительно полученной товарной продукции Э„от - 0,05 0,07 0,08
Эффект сокращения затрат на добычу сырья Э* Коэффициент эффективности капитальных вло- жений, рассчитанный: - 0,01 0,02 0,03
по реализации производства Экп 0,27 0,21 0,16 0,10
по народнохозяйственной эффективности Энх *В руб/руб товарного продукта. 0,066 0,105 0,109 0,104
элемент которого характеризует определенную сторону воздей-
ствия производства на народное хозяйство в целом.
Абсолютная экономическая эффективность т] безотходного
производства определяется по уравнению
Г.Э, - У
и = '------> max,
Зд
где Е/Э; = Э[ + Эг + Эз + Э4 + Э5 - сумма всех эффектов безотходного произ-
водства (Э] - эффект производства конечной продукции, полученной при
внедрении безотходного производства, а также более полного использования
исходного сырья; Э2 - эффект потребления конечной продукции, полученной
при внедрении безотходного сырья; Э3 - экономия затрат на разведку, добычу
и транспортирование отдельных ресурсов; Э4 - эффект комплексного развития
региона; Э5 - внешнеторговый эффект, учитываемый при сокращении импорта
или росте экспорта сырья, продуктов его переработки, конечного продукта);
У - размер ущерба от загрязнения окружающей среды отходами производства и
потребления; Зп - полные затраты на безотходное производство.
При наличии нескольких вариантов безотходного производ-
ства должен быть выработан вариант с максимальным коэффи-
циентом абсолютной экономической эффективности при рав-
ных затратах.
Рассмотрим эффективность капитальных вложений в безот-
ходное производство одного из химических продуктов (табл. 4.2).
Расход исходного сырья во всех вариантах принят одинаковым.
331
Из сравнения показателей видно, что коэффициент исполь-
зования сырья и исходных продуктов возрастает от 0,80 в пер-
вом варианте до 0,95 в четвертом. В качестве коэффициента
использования здесь принято отношение массы готового про-
дукта к массе сырья и исходных продуктов. Текущие затраты на
получение продукции возрастают незначительно, однако капи-
тальные затраты увеличиваются на 75%.
Внедрение малоотходного производства увеличивает выход
готовой продукции во втором варианте на 5%, в четвертом - на
17%. Выброс токсичных веществ значительно сокращается, со-
ответственно снижается и экономический ущерб от выбросов в
окружающую среду. Дополнительная продукция, произведенная
в результате более полного использования исходного сырья,
создает эффекты от ее потребления и сокращения затрат на до-
бычу сырья.
Эффективность капитальных вложений в безотходные произ-
водства Э определялась по уравнению
Э = (Ц - С)/К,
где Ц - цена продукции; С - себестоимость продукции (текущие затраты); К -
капитальные затраты по одному из вариантов.
Из сравнения вариантов видно, что по мере повышения сте-
пени извлечения ценных компонентов из исходного сырья,
уменьшения выбросов в окружающую среду, снижения ущерба
абсолютная экономическая эффективность рассматриваемых
производств с позиций отрасли, предприятия снижается. Со-
гласно существующей методике расчета, из рассматриваемых
вариантов для отрасли наилучшим будет первый, так как у него
наивысший коэффициент эффективности ЭК1, = 0,27. С позиций
народного хозяйства наиболее предпочтителен третий вариант
(Энх = 0,109).
4.2. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ
ХИМИЧЕСКИХ ПРОИЗВОДСТВ
4.2.1. Виды вредных воздействий
химических производств на биосферу
Химические производства являются одним из основных источ-
ников загрязнения биосферы. Неуклонный рост выработки раз-
личных химических веществ сопровождается, как правило, со-
ответствующим увеличением количества вредных отходов. В
результате в ряде центров химической и нефтехимической про-
мышленности наблюдается катастрофическое загрязнение водо-
емов, почвы, атмосферы.
332
Наиболее существенными источниками загрязнения окру-
жающей среды являются отходы, образующиеся при химико-
технологических процессах. К ним относятся: продукты побоч-
ных реакций, не находящие применения; продукты неполного и
чрезмерно глубокого превращения и полимеризации, а также
фильтры; промышленные воды и воды из абсорбционных уста-
новок очистки отходящих газов; отработанный воздух окисли-
тельных процессов; газы, не вступившие в реакцию (хлор, ам-
миак и др.) и т. д.
Окружающую среду загрязняют вспомогательные ве-
щества и материалы, применяемые в химико-техноло-
гических процессах: отработанные катализаторы; адсорбенты,
абсорбенты и растворители; осушающие агенты; воздух после
регенерации катализатора и пневмотранспорта продуктов; газы,
отсасываемые из аппаратов при создании разрежения; тара и
фильтровальные материалы, непригодные для повторного ис-
пользования и т. д.
Кроме того, в химических производствах источниками за-
грязнения окружающей среды являются механические
потери сырья, промежуточных и готовых про-
дуктов вследствие негерметичности оборудования и коммуни-
кации.
Вредным воздействием обладают сточные воды хими-
ческих производств. Основные химические производства
потребляют большое количество воды: на производство 1 т сер-
ной кислоты расходуется 70 м3 воды, 1 т кальцинированной
соды - 115 м3, 1т аммиака - 800 м3, 1т акрилонитрила -
1960 м3, 1 т ацетилена - 2800 м3. Непрерывное совершенствова-
ние технологии позволяет значительно сократить удельный рас-
ход воды. На старых нефтеперерабатывающих заводах расход
воды составлял 7-8 м3 на 1 т нефти, а на современных он достиг
всего 0,12-0,24 м3/т.
Сточные воды химических производств содержат значитель-
ное количество минеральных и органических примесей. В на-
стоящее время в промышленности используют различные эф-
фективные методы очистки сточных вод. Однако следует иметь
в виду, что очистка сточных вод не предотвращает загрязнения
водоемов, так как при сбросе даже очищенных вод требуется
многократно разбавлять их свежей водой. В противном случае
естественные водоемы будут заполняться водами, обедненными
кислородом и непригодными для жизни рыб. Необходимая
кратность разбавления очищенных сточных вод составляет для
нефтеперерабатывающей промышленности до 60 раз, целлюлоз-
но-бумажной - 20-40, для производства синтетического волок-
на - 10-15, синтетического каучука - до 2000, для минеральных
удобрений и азотной промышленности - 10 раз.
333
Последнее обстоятельство осложняется нарастающим дефи-
цитом природных ресурсов пресной воды. Отсюда одним из
основных направлений в снижении воздействия химических
производств на окружающую среду является перевод предприя-
тий на замкнутое водоснабжение, когда очищенные сточные
воды используются для технических целей на этом же или дру-
гом предприятии промышленного региона.
Негативное воздействие загрязнителей на биосферу следует
рассматривать прежде всего с точки зрения охраны здоровья и
благосостояния человека, а затем - защиты экологической це-
лостности природы. Под термином “воздействие на окружаю-
щую среду” необходимо понимать все те негативные послед-
ствия, которые вызывают промышленные выбросы при контакте
с человеком, животными и физической средой (воздухом, во-
дой, почвой, неодушевленными предметами), включая есте-
ственно-исторические, эстетические и психологические измене-
ния в природе.
Для правильного и полного понимания воздействия отходов
на биосферу необходимо знать механизм превращения соедине-
ний, первоначально содержащихся в отходах, механизм мигра-
ции вредных и токсичных соединений из мест складирования
отходов в окружающую среду и пути попадания этих загрязни-
телей непосредственно в организм человека и животных.
Многие газообразные химические соединения, попадая в ат-
мосферу, превращаются под действием водяных паров, кислоро-
да и солнечной радиации в другие, более токсичные вещества и
находятся в атмосфере в определенном равновесии с ее компо-
нентами. Воздействие любого загрязнителя непосредственно
зависит от его химических и физических свойств.
Оксиды азота в атмосфере не только присутствуют в виде NO
и NO2, но и превращаются в азотную кислоту, нитраты и орга-
нические нитросоединения, которые абсорбируются капельками
воды, образуя аэрозольные агломераты. Наличие в атмосфере
других газообразных соединений, например SO2, приводит к
еще более сложному механизму взаимодействия компонентов
окружающей среды. Как известно, в воздушной среде присут-
ствуют также и углеводороды, которые, вступая во взаимодей-
ствие с HNO3, НС1, О2, Н2СО3, СО2, образуют ряд вредных и
токсичных соединений, т. е. наблюдается явление синергизма -
усиления токсичного действия того или иного первоначального
загрязнителя. Поэтому, рассматривая воздействие промышлен-
ных выбросов на организм человека и живую природу, необхо-
димо учитывать весь сложный комплекс превращений отдель-
ных компонентов отходов в окружающей среде в токсичные и
334
Рис. 4.4. Схема образования тумана в районе нефтехимического комплекса
вредные химические соединения. На рис. 4.4 представлены
сложные процессы загрязнения атмосферного воздуха в районах
нефтехимических комплексов, включающие физические, хими-
ческие и фотохимические превращения компонентов выбросов.
Для определения степени токсичности того или иного хими-
ческого отхода используют общие критерии оценки:
токсичность по отношению к человеку, т. е. эффект непо-
средственного воздействия на здоровье людей;
токсичность по отношению к животным (домашним и ди-
ким);
свойства продуктов разложения (токсичность, устойчивость,
биоаккумулятивность);
синергетический эффект.
335
Химические отходы по своему воздействию на окружающую
среду подразделяются на особо токсичные, токсичные и не-
токсичные (безвредные).
К особо токсичным относятся отходы, содержащие ртуть,
свинец, кадмий, олово, мышьяк, таллий, бериллий, хром, сурь-
му, цианиды, фосфорорганические вещества, асбест, хлориро-
ванные растворители, фторхлоруглероды, полихлориды дифени-
лов, полициклические и ароматические углеводороды, пестици-
ды, а также радиоактивные отходы.
К токсичным веществам относятся соединения серы (SOJ,
азота (NOX) и оксид углерода (СО), выбрасываемые в атмосферу
в количествах, значительно превышающих предельно допусти-
мые концентрации.
Отходы, относящиеся к категории нетоксичных (фосфогипс,
галлитовые отходы, шлаки производства фосфора, отходы про-
изводства кальцинированной соды и др.) требуют огромных
земельных участков для их складирования. Отрицательное воз-
действие на природу, вызываемое этими отходами, состоит в
выщелачивании из них NaCl, фтористых и других вредных сое-
динений и проникновении последних в поверхностные и грун-
товые воды.
Воздействие химических соединений, содержащихся в отхо-
дах, на человека и живую природу происходит как прямым, так
и косвенным путем. Прямой путь - попадание вредных соеди-
нений в организм человека с воздухом и питьевой водой; кос-
венный путь - например, биологический. Вначале загрязнители
попадают в растения, поедаемые животными, а затем с пищей -
в организм человека. При этом с первоначальными соедине-
ниями происходят химико-биологические превращения, приво-
дящие к образованию новых, более или менее опасных для ор-
ганизма веществ.
Особую опасность представляют соединения, способные к
аккумулированию в пищевых цепях (или цепях питания - ряде
организмов, связанных друг с другом соотношением пища -
потребитель). Аккумулироваться соединения могут в любом
месте пищевой цепи, начиная с планктона и кончая организмом
человека (например, ртуть, ДДТ), а также передаваться по цепи.
По характеру воздействия на биосферу выбросы химических
производств можно разделить на организованные и неорганизо-
ванные.
К организованным относятся выбросы, которые отводятся в
атмосферу, водоемы и в почву с помощью специальных соору-
жений. Такими сооружениями могут быть системы очистки во-
ды, дымовые трубы, заводские факелы, печи сжигания шламов
336
и других отходов, патрубки вентиляционных систем, шламовые
площадки, илонакопители и т. д. Неорганизованными считают-
ся выбросы, которые невозможно объединить и отвести в ту или
иную среду. Таковыми могут быть утечки через неплотности в
аппаратах, трубопроводах и арматуре, испарение с поверхности
сточной жидкости в системах канализации и очистки сточных
вод, испарение продуктов из резервуаров и хранилищ, разлив и
залповые выбросы продуктов в атмосферу при продувках и про-
паривании аппаратов перед проведением ремонтных работ и др.
Организованные выбросы обычно характеризуются высокой
концентрацией токсичных компонентов. На современных хими-
ческих и нефтехимических предприятиях общее число органи-
зованных источников выбросов достигает 2000-4000, на каждый
из них оформляется специальный паспорт и ведется контроль за
ПДВ для данной местности.
Неорганизованные выбросы можно контролировать только
по предельно допустимым концентрациям, периодически или
систематически определяемым в различных пунктах заводской
территории и санитарно-защитной зоны.
Характеристика различных вредных выбросов, имеющих мес-
то на нефтехимических комбинатах, приведена в табл. 4.3.
Выбросы также различаются по объему, температуре, составу
и соотношению в них отдельных ингредиентов, по агрегатному
состоянию, классу опасности, концентрации, стабильности в
окружающей среде. От агрегатного состояния зависят стабиль-
ность и характер распространения вредных ингредиентов в ат-
мосфере, а также способы их улавливания и очистки.
Таблица 4.3. Распределение [% (об.)] вредных веществ в выбросах нефтехимиче-
ских комбинатов
Выбросы Угле- водо- роды H2S СО so2 NO, Фенолы NH3 Пыль
Организованные:
дымовые га- зы - 10 18-92 80 89 46-64 10 - 50
технологиче- ские (хвосто- вые) газы 0,6 51-66 7-50 11-19 36-54 15-73 24-78 89-100
вентиляци- онные газы 0,2 1-3 До 1 0,01 0,1-0.2 10-75 22-79 -
газы после абсорбции 54 15-32 31 0,6 - 4 4 -
Неорганизован- ные 45 23 - - - — - -
337
4.2.2. Водные ресурсы и химическая технология
Сырьевые и энергетические ресурсы были рассмотрены ранее
(разд. 3.6.1 и 3.7.1). Здесь обратим внимание на водные ресурсы,
поскольку вода - один из важнейших факторов жизни на Земле,
и к ней должно быть самое внимательное отношение.
Водные ресурсы. Развитие промышленности, перевод сельско-
го хозяйства на индустриальную основу, рост городов способ-
ствуют постоянному водопотреблению. Ежедневно человечество
расходует до 7 млрд т воды, что соответствует по массе общему
количеству полезных ископаемых, добываемых за год. Основ-
ными потребителями воды являются химическая, нефтехимиче-
ская, целлюлозно-бумажная отрасли промышленности, черная и
цветная металлургия, энергетика, мелиорация. В 1985 г. в нашей
стране на различные нужды было израсходовано 282 км3 воды, в
том числе промышленность потребила более 80 км3. Классифи-
кация воды по целевому назначению представлена на рис. 4.5.
Различают следующие разновидности технической воды.
Охлаждающая вода служит для охлаждения жидких и
газообразных продуктов в теплообменных аппаратах. Вода не
соприкасается с материальными потоками.
Технологическая вода подразделяется в свою очередь
на средообразующую, промывающую и реакционную. Средооб-
разующая вода используется для растворения и образования
пульп (суспензий) при обогащении, гидротранспорте продуктов
и отходов производства; промывающая вода - для промывки
газообразных (абсорбция), жидких (экстракция) и твердых про-
дуктов; реакционная - в качестве реагента, а также при азео-
тропной отгонке. Технологическая вода непосредственно кон-
тактирует с продуктами процесса.
Энергетическая вода используется при получении па-
ра (для питания парогенераторов) и как рабочее тело при пере-
даче тепла от источника к потребителю (горячая вода).
На предприятиях отечественной химической промышлен-
ности общее водопотребление достигло 9 км3/год. Около 74%
воды, используемой этой отраслью, расходуется на охлаждение
технологической аппаратуры. Остальное количество воды при-
меняется главным образом в технологических процессах полу-
чения продукции, выполняя функции химического реагента,
экстрагента, абсорбента, растворителя, реакционной среды,
транспортирующего агента, питательной воды в котлах-
утилизаторах.
На предприятиях нефтеперерабатывающей и нефтехими-
ческой промышленности основное количество воды (до 90-95%)
используется для охлаждения и конденсации перерабатываемых
338
Рис. 4.5. Классификация воды по целевому назначению
продуктов в теплообменной аппаратуре, в котлах-утилизаторах.
Примерно 5-10% воды этими предприятиями потребляется в
качестве растворителя или для промывки продукции.
Источник водных ресурсов - гидросфера, включающая воды
мирового океана, атмосферы, рек, озер, грунтовые воды. Объем
гидросферы составляет 1389 млн км3. Она занимает примерно
3/4 поверхности земного шара - 449,59 млн м2 (суша -
165,34 млн км2).
Из общего количества воды 1350 млн км3 (свыше 97,2%) -
океаническая вода. Баланс других источников (в км3) воды при-
веден ниже:
Полярные льды и ледники...........29 106
Грунтовые воды....................9,7 106
Вода в озерах.....................120 103
Вода в реках......................12- 103
Влага в почве.....................24 • 103
Влага в атмосфере.................13 103
Всего .............................39 • 106
Первыми источниками водоснабжения промышленных пред-
приятий служат поверхностные и грунтовые воды. К поверх-
ностным водам относятся реки, озера, искусственные водохра-
нилища и каналы. В первую очередь для промышленного по-
требления используются реки, объем стока которых в России
составляет около 4000 км3.
339
Качество воды и требования к ней. Природная вода недоста-
точно чистая и без соответствующей обработки не может быть
использована для промышленного водоснабжения. В 1 л прес-
ной воды, как правило, содержится около 1 г солей. В морской
воде их значительно больше: в водах Балтийского моря - 5 г/л,
Черного моря - 18 г/л, в океане - 35 г/л. Пресные и морские
воды различаются не только по суммарному содержанию солей,
но и по составу - соотношению в них хлоридов, сульфатов и
карбонатов (%):
Хлориды Сульфаты Карбонаты
Речная вода............7 13 20
Океаническая вода......89 10 1
Речные воды делятся на маломинерализованные (до 200 мг/л
соли), среднеминерализованные (200-500 мг/л), повышенной
минерализации (свыше 1000 мг/л). Воды большинства рек Рос-
сии относятся к первым двум группам. Наряду с солями вода
содержит некоторое количество сложных природных органиче-
ских соединений - гумусовых веществ. Содержание этих приме-
сей в речных водах 5—10 мг/л, в озерных - до 150 мг/л.
В водах содержится значительное количество твердых взве-
сей, коллоидных веществ и примесей биологического характера
(микроорганизмов, водорослей и др.).
Содержание растворенного кислорода в воде определяется ее
температурой и реакциями, протекающими в водной среде: фо-
тосинтеза (содержание кислорода увеличивается) и окисления
органических соединений - химического и микробиологическо-
го (содержание кислорода уменьшается). На 1 г сухого органи-
ческого вещества в среднем расходуется 1,5 г кислорода.
В зависимости от состава вод меняется pH. Для рек и озер
этот показатель колеблется в пределах 5,0-8,5.
Содержание различных примесей, как растворенных, так и
находящихся в виде взвеси в природных водах, обусловливает
образование отложений, накипи и шлама на поверхностях теп-
лообменной аппаратуры и парогенераторов, что приводит к их
коррозии и ухудшению теплообмена. В условиях работы обо-
ротных систем водоснабжения многократный нагрев воды до
40-45 °C и охлаждение ее в вентиляторных градирнях приводит
к потерям диоксида углерода и отложению на поверхностях теп-
лообменников и трубопроводов карбоната кальция в соот-
ветствии с реакцией
Са2+ + 2НСОз <—» СаСО34 + СО2? + Н2О.
Во избежание этого потери воды в различных производст-
венных циклах восполняются специально подготовленной под-
340
Таблица 4.4. Показатели качества воды в системах охлаждения
Показатели качества Рекомендуемые величины
в России в США
ВНИИ Водгео азотная промыш- ленность хлорная промыш- ленность
Температура, °C 25-40 28-30 25-30 -
Жесткость, мг-экв/л:
общая <7 1,5-2,5 5,5 —
карбонатная <2,5 1,5-2,5 <3 2,5-5,0
Щелочность, мг-экв/л 3-4 — 2-4 2,5
Общее содержание солей, мг/л 1300-2000 1200 800-1200 500
Окисляемость перманганатная, мг <20 <15 8-10 —
02/л
Химическое потребление кислоро- <200 — 70 75
да, мг О2/л Содержание, мг/л:
взвешенных веществ <50 20-30 10-20 5
масел и маслообразующих ве- <20 0,3 0 —
ществ
поверхностно-активных ве- Не нор- 0 0 —
ществ (ПАВ) анионов С1_ (хлоридов) мируется 150-300 До 350 150-300 500
анионов SO4' (сульфатов) 350-500 <500 350-500 200
анионов РО’’ (фосфатов) - <6 1,5-9,0 -
соединений азота в пересчете 6 <2,4 0,12-2.64 -
на ионы тяжелых металлов
растворенного кислорода — — 6-8 —
остаточного активного хлора До 1,0 — До 1,0 —
pH 6,5-8,5 6,5-8,5 6,5-8,5 6,5-8,5
питочной водой, качество которой должно удовлетворять опре-
деленным техническим требованиям. В табл. 4.4 указаны основ-
ные показатели качества воды, используемой для охлаждения
продуктов в теплообменных аппаратах.
Требования к питательной воде паровых котлов (парогенера-
торов) энерготехнологических процессов обусловлены необхо-
димостью предотвращения накипеобразования и коррозии по-
верхностей нагрева. К основным показателям качества пита-
тельной воды относятся: значение pH, общая жесткость, содер-
жание кремниевой кислоты, растворенного кислорода, свобод-
ной углекислоты, железа, меди и других соединений. Качество
питательной воды зависит от параметров генерируемого водяно-
го пара (табл. 4.5).
Требования к воде, используемой в качестве реагента, экс-
трагента, абсорбента и т.д., связаны с особенностями проводи-
341
Таблица 4.5. Требования к качеству питательной котельной воды
Показатели качества Типы котлов
жаротрубные (0.5-1,5 МПа) ВЫСОКОГО давления (5- 10 МПа) прямоточные (10-15 МПа) и прямоточные сверхкритиче- ского давления (21,5-30 МПа)
Обшая жесткость, мг-экв/л Содержание примесей, мг/л: 0,35 0,035 0,003
диоксид кремния Не нормиру- 0,7 0,02
ется
медь 0,5 0,05 0,005
марганец — — -
железо 1 0,05 0,01
кислород 1 0,3 0,01
нитраты и нитриты — — 0,02
pH 8-10 8-10 7-8,5
мых процессов и указываются в технологических регламентах
конкретных химических производств.
Природную воду перед использованием в производстве под-
вергают очистке различными методами в зависимости от харак-
тера примесей и требований, предъявляемых к воде.
Промышленная водоподготовка. Промышленная водоподго-
товка представляет собой совокупность физических и химиче-
ских операций, обеспечивающих очистку воды от механических
примесей, растворенных солей и газов. Основными операциями
являются: очистка от взвешенных примесей отстаиванием и
фильтрацией, умягчение и обессоливание воды, дегазация, обез-
зараживание.
Отстаивание крупных частиц осуществляется в не-
прерывнодействующих отстойниках большой емкости. От мел-
ких частиц освобождаются фильтрацией. Для осаждения колло-
идных частиц (мельчайших глинистых частиц и белковых ве-
ществ) их подвергают коагуляции путем добавки в воду коагу-
лянтов - сульфатов или двойных солей алюминия
(алюминиевые квасцы). Ион-коагулянт должен иметь заряд,
противоположный заряду коллоидной частицы, чтобы он мог
адсорбироваться на поверхности заряженной частицы; это при-
водит к коагуляции (слипанию) отдельных частиц и образова-
нию осадка
Умягчение и обессоливание воды относятся к
основным процессам водоподготовки, которые состоят в удале-
нии солей кальция, магния и других материалов. Различают
физические способы (термический, дистилляция, выморажива-
342
ние) и физико-химические методы (обратный осмос и ультра-
фильтрация, ионообмен) обессоливания и умягчения воды.
Наиболее широко в водоподготовке используется метод ион-
ного обмена на катионитах (КУ-23, КУ-78) и анионитах (АВ-17-
8, АВ-29П, АН-221). В основу катионного процесса умягчения
положены реакции обмена ионов натрия и водорода катионитов
на ионы Са2+ и Mg2+. Обмен ионов натрия называется Na-
катионированием, а ионов водорода - Н-катионированием:
Na2[Kj + Са(НСО3)2 Са[К] + 2NaHCO3;
Na2[Kl + MgSO4 Mg[K] + Na2SO4;
H2[K] + MgCl2<± Mg[K] + 2HC1;
H[K1 + NaCl Na[K] + НС1.
В ионообменном способе достигается полное обессоливание
воды. Реакции ионообмена обратимы, для восстановления об-
менной способности ионитов проводят процесс их регенерации
при помощи растворов поваренной соли (Na-катионитов) или
минеральных кислот (Н-катионитов):
Са[К] + 2NaCl Na2|Kl + СаС12;
Na[K] + НС1 Н[К] + NaCl.
Примером анионного обмена может служить реакция обмена
анионов ОРГ по уравнению
[А]ОН + НС1^± [А]С1 + Н2О.
Регенерацию анионита проводят раствором щелочей:
[А|С1 + NaOH [AJOH + NaCl.
Принципиальная схема обессоливания воды методом ионо-
обмена (катионирование и анионирование) показана на рис. 4.6.
Из воды сначала удаляются ионы кальция, магния и натрия в
Н-катионитовом фильтре, в котором на слое крупного кварце-
вого песка или измельченного керамзита расположен слой кати-
онита. Затем вода последовательно поступает в анионитовый
фильтр для удаления анионов и дегазатор, где удаляются и во-
ды растворенные диоксид углерода и кислород.
Дегазация осуществляется химическим или физическим
способами. Для удаления СО2 воду пропускают через фильтр,
заполненный гашеной известью, или добавляют к воде извест-
ковое молоко:
СО2 + Са(ОН)2 = СаСО3 + Н2О.
Кислород удаляется фильтрацией воды через слой железных
опилок или стружек.
343
6
5
Рис. 4.6. Схема установки для обессоливания воды с применением ионообмена
(отдельно показан катионитовый фильтр):
1 - катионитовый фильтр; 2 - анионитовый фильтр; 3 - дегазатор; 4 - сборник воды; 5 -
песок; 6- катионит
Физические способы дегазации состоят в нагревании воды в
вакууме или острым паром. В случае необходимости производят
обеззараживание воды с целью уничтожения болезнетворных
бактерий и окисления органических примесей хлорированием
(газообразным хлором, хлорной известью или гидрохлоратом
кальция).
Водооборотные циклы химических производств. Системы про-
изводственного водоснабжения делят на прямоточные, в
которых подаваемая от первичного источника вода после одно-
кратного использования отводится за пределы предприятия, и
оборотные, в которых отработанная вода подвергается ох-
лаждению, очистке и возвращается для последующего использова-
ния в этом же производстве, т. е. замыкается в цикле (обороте).
Существенный недостаток прямоточного водоснабжения -
необходимость сброса отработанных вод в водоемы. Эти си-
стемы используются только на старых предприятиях.
В оборотном водоснабжении вода от первичного источника
подается только для восполнения безвозвратных потерь в цикле
(в результате испарения, при очистке). Эта система позволяет
целесообразно решать задачи очистки и обработки воды, улуч-
шать ее качество и таким образом обеспечивает оптимальные
условия для эффективной работы оборудования.
344
Рис. 4.7. Замкнутая система оборотного водоснабжения:
1 - чистая вода; 2- вода после первичного использования, НС - насосная станция; П -
производство; К - камера приема добавочной воды или сброса воды; ВХ - воздушный
холодильник; Qo - количество отработанной (сточной) воды; Qn - количество воды, пода-
ваемой на производство; Опп _ количество воды, потерянной в производстве
Схема производственного оборотного водоснабжения пред-
приятия включает в себя комплекс сооружений, обеспечи-
вающих прием воды из водоема (водозабор), подачу ее потреби-
телям в необходимом количестве под требуемым давлением (на-
сосная и водопровод), очистку, обработку и охлаждение (очист-
ные сооружения). Системы оборотного водоснабжения подраз-
деляются на замкнутые, полузамкнутые и комбинированные.
В замкнутой системе (рис. 4.7) охлаждение технологи-
ческих потоков осуществляется оборотной водой в закрытых
теплообменных аппаратах. Оборотная вода охлаждается возду-
хом в закрытых оребренных радиаторах (радиаторной градирне).
В полузамкнутой системе (рис. 4.8) технологические
потоки охлаждают также в закрытых теплообменниках, но обо-
ротная вода охлаждается в градирне.
Рис. 4.8. Полузамкнутая система производственного водоснабжения:
1 - чистая вода; 2 - вода после первичного использования: О - охладитель воды; К -
камера приема добавочной воды или сброса воды; П - производство; НС - насосная стан-
ция; 0„ - количество воды, подаваемой на производство; Спп - потеря воды в производстве;
Qo - количество отработанной (сточной) воды; *7уН - потери воды на унос из охладителя;
9исп - потери воды на испарение в охладителе (градирня, брызгальный бассейн); </с6р -
количество воды, сбрасываемой из системы для освежения (продувка); Слоб - количество
воды, добавляемой в систему; Q„ - введение реагента для обработки воды
345
Рис. 4.9 Комбинированная система производственного водоснабжения:
1 - контур захоложенной воды с температурой 4-15 °C; // - контур оборотного воло
снабжения; АХ - цех аммиачных холодильников; О - охладитель оборотной воды контура II.
П - производство; НС - насосная станция; К - камера приема добавочной воды или сброса
воды, Со - количество отработанной сточной воды; Соб - количество оборотной произвол
ственной воды; Сдх _ количество оборотной воды, подаваемой в цех аммиачных холодиль-
ников; Сп - количество воды, подаваемой на производство; Сдоб ~ количество воды, добав
ляемой в систему, уисп - потери воды на испарение в охладителе (градирня, брызгальный
бассейн); дук - потери воды на унос из охладителя
В некоторых производствах по условиям технологического
процесса требуется обессоленная или умягченная вода. В этом
случае применяют комбинированную систему (рис.
4.9), в которой обессоленная или умягченная вода охлаждается
оборотной водой в закрытых теплообменниках, а оборотная
вода - в градирне.
Снижение температуры оборотной воды в градирне происхо-
дит за счет ее контакта с воздухом, перемещаемым вентилято-
ром. Теоретически возможный предел охлаждения воды в гра-
дирне - температура мокрого термометра (/м), которая зависит
от температуры окружающего воздуха и его относительной
влажности. Существуют диаграммы для определения значения
tM. Например, при температуре окружающего воздуха 30 °C и его
относительной влажности 60% предельная температура охлаж-
дения воды гов = 24 °C. В современных вентиляторных градир-
нях перепад температур нагретой /н и охлажденной воды дости-
гает Аг = /н - /ов = 6+7 °C.
В системе оборотного водоснабжения вода теряется на испа-
рение в градирне (в количестве капельный унос с охлаж-
дающим воздухом (И2) и сброс при продувке (Из). Потери вос-
полняются добавочной подпиточной водой в количестве
^дв = И, + И2 + Из.
Потери воды на испарение ориентировочно можно опреде-
лить по формуле
И, = kx\tVo,
где к\ - коэффициент, зависящий от температуры воздуха; АГ - разность темпе-
ратур нагретой и охлажденной воды, град; Йо - расход оборотной воды, м3/ч.
346
Коэффициент к\ имеет следующие значения для градирен:
Температура воздуха, °C О 1,0 20 30 40
Коэффициент к।....0,0010 0,0012 0,0014 0,0015 0,0016
Потери воды вследствие брызгоуноса
V2 = k2Vo,
где Jtj - коэффициент, равный для вентиляторных градирен с водоуловителями
0,002-0,005.
Расход воды на продувку системы Из зависит от производи-
тельности системы оборотного водоснабжения, карбонатной
жесткости добавочной воды, способа обработки воды и состав-
ляет 1-3% от расхода оборотной воды.
Эффективность системы оборотного водоснабжения опреде-
ляют двумя показателями:
коэффициентом использования оборотной воды
*об = К>/(ИО + Идв);
коэффициентом использования добавочной (свежей) воды
АПв = (Идв- Исб)/Идв,
где Vo - количество оборотной воды, м3/ч; - количество добавочной воды,
м3/ч; Кб - количество сточных вод (продувка), сбрасываемых в водоем, м3/ч;
К + Кв _ общее количество расходуемой воды, м3/ч.
На предприятиях химической промышленности в целом ко-
эффициент использования оборотной воды достигает значения
= 0,83, на передовых нефтеперерабатывающих и нефтехи-
мических производствах = 0,9+0,95.
Исходя из существующего уровня технологии,можно оценить
максимально возможный коэффициент использования оборот-
ной воды. В химической промышленности, где около 25% ис-
пользуемой воды расходуется в качестве растворителя и экс-
трагента, он соответствует значению 0,90-0,92.
В химической промышленности даже при повторном исполь-
зовании воды расход свежей воды велик и составляет в среднем
на 1 т продукции 50-130 м3, а в целлюлозно-бумажной про-
мышленности - 150-500 м3. Поэтому одной из главных задач
химической технологии является дальнейшее снижение водоем-
кости производств путем внедрения систем оборотного и после-
дующего использования воды, переход на водосберегающие
(бессточные) технологии.
Бессточные химические производства. К бессточным относятся
производства, в которых функционируют замкнутые системы
водоснабжения без сброса сточных вод в водоемы, с коэффици-
ентом использования свежей воды, равным единице.
347
При создании замкнутых систем водоснабжения на химиче-
ских предприятиях необходимо использовать следующие основ-
ные положения:
1) водоснабжение и канализация предприятия должны рас-
сматриваться как единая подсистема, включающая водоснабже-
ние, водоотведение и очистку сточных вод, обеспечивающую их
повторное использование;
2) в системе водоснабжения основным источником воды
должны быть очищенные сточные воды, а свежая вода из водо-
очистников должна использоваться только для особых целей и
восполнения потерь в локальных системах;
3) очистка сточных вод должна сводиться к регенерации от-
работанных технологических растворов и воды в локальных си-
стемах технологического водоснабжения с целью их повторного
использования в производстве;
4) должны использоваться такие методы регенерации техно-
логических растворов и воды, которые обеспечивают одновре-
менное извлечение ценных компонентов и доведение образую-
щихся отходов до товарного продукта или до вторичного сырья
при минимальных материальных и энергетических затратах.
При внутритехнологическом цикле вода вступает в непосред-
ственный контакт с перерабатываемыми продуктами. Очистка
циркулирующей воды осуществляется в локальных очиститель-
ных сооружениях, которые являются продолжением технологи-
ческих установок. На локальных установках очищаются сточные
воды, которые без очистки не могут быть направлены в системы
повторного или оборотного водоснабжения или на общезавод-
ские очистные сооружения. На этих установках, как правило, из
сточных вод извлекаются ценные примеси с использованием
регенерационных методов очистки: отстаивания, флотации, экс-
тракции, ректификации, дистилляции, адсорбции, ионного об-
мена, обратного осмоса и др. В ряде случаев на локальных уста-
новках осуществляется термическое обезвреживание сточных
вод.
Система внутритехнологического водооборота требует допол-
нительных капитальных и эксплуатационных затрат. Однако эти
затраты окупаются за счет снижения общих расходов на водо-
подготовку и извлечения ценных компонентов.
На рис. 4.10 показана схема внутритехнологического водо-
оборота в процессе промывки от катализаторной пыли и охлаж-
дения контактного газа на установке дигидрирования изопента-
на. Подобные схемы организации цикла воды характерны для
производств, где используются скрубберные установки очистки
газов.
348
Газ на переработку
Вода для Вода после
пополнения очистки
системы
Рис. 4.10. Схема внутритехнологического водооборота:
1 - скруббер очистки газа; 2- циркуляционный насос
Принцип максимального использования оборотного водо-
снабжения при оптимальном применении воздушного охлажде-
ния положен в основу схем бессточных нефтеперерабатывающих
заводов (рис. 4.11). На этих заводах очистка нефтепродуктов от
сернистых соединений осуществляется регенерируемыми реа-
гентами. Сернисто-щелочные сточные воды после обезврежива-
ния на установке карбонизации подаются совместно со стоками
ЭЛОУ (электрообессоливающая установка) на термическое
обессоливание. Полученный при обессоливании водный кон-
денсат направляется в водооборотный цикл. Из остатка выпари-
Свежая вода» 175
s
03
X
§
03
S
s
110
23?
93
, ,65
Узел
внутритехно-
. логического
на унос и водооборота
испарение ““Г”“
,, 370
Потери
18824,
.18487
Технологические
установки
S3
88_______
Потери на
производстве
660
1090
Продувочная! । о g
вода н
824 । w
ОчищеДная сточная^ода Сооружения очистки
сточных вод
Конденсат
65 h
Остаток после
выпаривания
Рис. 4.11. Схема использования воды на нефтеперерабатывающем заводе (циф-
ры показывают расход в м3/ч)
349
Таблица 4.6. Технико-экономические показатели нефтеперерабатывающих заводов
по содержанию очистных сооружений
Показатель НПЗ без стоков НПЗ со сбросом сточных вод
Расход воды на 1 т нефти, м3 0,13 0,26
Сброс сточных вод в водоем на 1 т нефти, м3 — 0,30
Расход оборотной воды на 1 т нефти, м3 13,2 16,5
Удельные капиталовложения, усл. ед. на 1 м3 489 500
СТОЧНЫХ вод Стоимость строительства очистных сооружений, усл. ед. 9,3 17,4
Себестоимость очистки 1 м3 сточных вод, усл. ед. 0,26 0,18
вания выделяется гранулированный технический хлорид натрия
(NaCl - 80%), который используется для регенерации Na-
катионитовых фильтров.
Постоянный солевой состав воды в системе технологического
водооборота поддерживается за счет вывода части воды на уста-
новку термического обессоливания в системе очистки сточных
вод и возврата очищенной воды в технологические установки.
Внедрение бессточных схем на нефтеперерабатывающих заводах
снижает удельные капиталовложения на 1 м3 сточных вод и
стоимость строительства очистных сооружений в 1,5-2 раза
(табл. 4.6) и предотвращает загрязнение водоемов.
Себестоимость очистки 1 м* (см. табл. 4.6) стоков в бессточ-
ной схеме выше, чем в сточной схеме за счет эксплуатационных
расходов на термическое обессоливание, термическую перера-
ботку нефтешламов и карбонизацию сернисто-щелочных сточ-
ных вод. Однако из-за меньшего расхода оборотной воды и от-
сутствия сброса сточных вод затраты на очистку воды в бессточ-
ной схеме незначительно отличаются от подобных затрат в
сточной схеме.
Примером бессточной технологии без загрязнения рек и во-
доемов может служить производство фосфора. Имеющиеся дан-
ные подтверждают, что очистка стоков заводов по производству
фосфора малоэффективна и не обеспечивает защиту водоемов
от загрязнения. В то же время установлено, что растворимые
примеси сточных вод не оказывают отрицательного влияния на
технологические процессы и на продукты производства. Отме-
ченные особенности и послужили основанием для бессточного
производства, схема которого показана на рис. 4.12. По этой
схеме добавка свежей воды из источника водоснабжения пред-
усматривается только для подпитки оборотной системы охлаж-
дения аппаратов, снабжения водой котельной и для бытовых
350
Свежая вода
Рис. 4.12. Схема потоков воды и водооборота в бессточном производстве фос-
фора (цифры показывают расход в м3/ч):
А - оборотная система охлаждения аппаратов; Б - оборотная система мокрой пылеубор-
ки; В - оборотная система газопылеочистки; Г - внутритехнологический цикл воды; п -
потери воды на испарение, унос
нужд. Продувочный сброс оборотной системы охлаждения и
сточные воды направляются для подпитки внутритехнологиче-
ского цикла воды, пылегазоочистки и пылеуборки. Локальная
очистка воды от аппаратов пылегазоочистки сводится к выделе-
нию взвесей и регенерации абсорбционных растворов. В от-
дельном цикле используются воды для мокрой пылеуборки.
Система повторного использования воды внутри промышленного
комплекса является высокоэффективным направлением в со-
кращении водопотребления и сброса сточных вод. Такой типич-
ной системой является бессточная система водоснабжения Пер-
вомайского промышленного комплекса. Основное предприятие
этого комплекса - химический комбинат, имеющий в своем
составе многотоннажное производство хлора и каустической
соды, пластических масс, химических средств защиты растений,
ряда продуктов органического синтеза.
351
Рис. 4.13. Схема потоков воды в бессточной системе водоснабжения городского
промышленного комплекса
Комплексная схема водоиспользования (рис. 4.13) включает
локальные водооборотные циклы с необходимыми локальными
очистными установками во всех крупных производствах: общие
сооружения и установки, в которых сточные воды в зависимости
от содержания в них загрязнений проходят соответствующую
очистку с целью повторного их использования в производстве, а
образующиеся отходы перерабатываются в товарную продукцию.
Эффективность использования воды в промышленном комплек-
се подтверждается приведенными ниже показателями:
Бессточная схема Обычная схема
Расход свежей речной воды, м3/сут..........30 176
в том числе на химическом комбинате.....4,5 150
Общий водооборот, тыс. м3/сут..............688 688
Сброс сточных вод в реку, тыс. м3/сут.......- 139,3
Возврат сточных вод в производство, %.....95,7 71,5
4.2.3. Классификация отходов
химической промышленности и методов их обезвреживания
Химическая промышленность образует огромное количество
различных отходов, которые можно классифицировать по агре-
гатному состоянию.
352
Твердые отходы - это отходы, получаемые в виде порошков,
пыли, слитков или затвердевшей массы. К этой группе относят-
ся огарки, зола, частицы пыли и сажи, отходы пластмасс и ре-
зины, отработанные катализаторы, остатки после обогащения
руд, твердые органические остатки, адсорбенты, некондицион-
ные продукты (каучук, волокна) и др.
При выборе метода переработки твердых отходов существен-
ную роль играют их состав и количество. Преобладают тенден-
ции, связанные с созданием мощных установок по комплексной
переработке больших количеств смесей твердых отходов. Полу-
чила развитие утилизация твердых отходов в агрегатах промыш-
ленности строительных материалов при получении кирпича,
керамзита, цемента и др.
Жидкие отходы состоят в основном из жидкой фазы и содер-
жат растворенные в воде или других растворителях соли, щело-
чи, кислоты, а также примеси взвешенных частиц. Содержание
взвешенных частиц не превышает обычно уровня, начиная с
которого происходит их осаждение. Жидкие отходы обладают
хорошей подвижностью, и их можно транспортировать насоса-
ми, применяемыми в химической промышленности. Концент-
рация растворимых веществ не должна превышать предел, при
котором начинается их кристаллизация из раствора при нор-
мальных условиях.
К этой группе отходов относятся прежде всего производ-
ственные сточные воды, загрязненные токсичными и ядовиты-
ми соединениями и требующие специальной обработки (воды,
содержащие кислоты, щелочи, хлориды, фториды, бромиды,
растворенные металлы, токсичные органические вещества и
т. д.); отработанные органические растворители и жидкости. В
некоторых случаях жидкие отходы представляют собой какой-
либо продукт, загрязненный небольшим количеством примесей.
К подобным отходам относятся отработанные масла, содержа-
щие продукты окисления, полимеризации и механические при-
меси.
Переработка жидких отходов осуществляется с помощью
многочисленных типовых процессов химической технологии:
адсорбции, осаждения, фильтрации, дистилляции и ректифика-
ции, экстракции, выпаривания, кристаллизации, термической
обработки, химической переработки. Иногда жидкие отходы
представляют собой многокомпонентную смесь, разделение ко-
торой затруднено и экономически нецелесообразно. В таком
случае отходы сжигают или закачивают в глубокие погло-
щающие горизонты земной коры.
Главными инженерными задачами при разработке установок
сжигания являются обеспечение полного сгорания отходов и
353
максимальная утилизация тепла, выделившегося при горении.
Главное преимущество методов термической обработки - отно-
сительная простота технологии, а недостаток заключается в
уничтожении всех веществ (включая полезные), содержащихся в
массе отходов. Поэтому при термической переработке возможна
утилизация только теплового потенциала отходов.
Процесс усложняется при термическом обезвреживании ор-
ганических отходов, содержащих соединения галогенов, фосфо-
ра, серы, азота. В этом случае в продуктах их сгорания могут
накапливаться хлороводород, оксиды серы и азота, и по-
этому возникает необходимость очистки перед выбросом газов в
атмосферу.
Газообразные отходы включают в себя газовые выбросы про-
мышленных печей и вентиляционных установок, сушилок, раз-
личные отходящие газы технологических установок. К этой
группе относятся продукты сгорания (дымовые газы) парогене-
раторов и печей; газы, обладающие сильным запахом, содержа-
щие дисперсные твердые частицы (пыль) или жидкие частицы в
виде тумана, а также газы с содержанием NOX, SO2, НС1, HF,
паров органических веществ и др.; паровоздушные смеси, за-
грязненные токсичными примесями.
При извлечении из газов полезных компонентов или для
обезвреживания применяют основные процессы химической
технологии, в том числе абсорбцию, адсорбцию, осаждение,
фильтрование, термическую переработку, хемосорбцию. Терми-
ческая переработка газообразных отходов заключается в дожига-
нии органических примесей, содержащихся в газах, до безвред-
ных продуктов сгорания Н2О, СО2, N2. Недостатком этих мето-
дов является уничтожение всех органических веществ, содержа-
щихся в газах. Поэтому их применяют в тех случаях, когда по
экономическим соображениям эти вещества нецелесообразно
выделять.
При производстве некоторых продуктов отходящие газы
представляют собой смеси углеводородов. Когда разделение та-
ких смесей экономически нецелесообразно, их используют в
качестве горючих вторичных энергетических ресурсов.
В случае малого содержания горючих компонентов в газооб-
разных отходах, когда экономически невыгодно использовать
метод прямого сжигания, широко применяют каталитическое
горение Процесс каталитического горения протекает в реакторах
с неподвижным или кипящим слоем катализатора при 200-
600 °C вместо 950-1100 °C при прямом сжигании.
Шламы представляют собой аморфные или мелкокристалли-
ческие массы, содержащие 20-80% воды и плохо транспорти-
354
руемые без предварительной обработки методами сушки, филь-
трования, вымораживания и др. К этой группе отходов относят-
ся остатки процессов фильтрации и седиментации; шламы, по-
лучаемые при нейтрализации или специальной обработке жид-
ких отходов; шламы и илы, получаемые в процессе биохими-
ческой очистки сточных вод. Сюда следует отнести также смо-
лы, кислые и вязкие гудроны, остаточные нефтепродукты, полу-
чаемые при переработке нефти, нефтяные шламы.
В переработке шламовых отходов используются процессы
фильтрования и центрифугирования, сушки, термического обез-
воживания, сжигания. При сжигании шламов, содержащих ор-
ганические и горючие вещества, выделяется высокопотенциаль-
ное тепло, которое обычно утилизируется. Выбор способа пере-
работки зависит от качества шлама и состава содержащихся в
нем компонентов.
4.2.4. Утилизация и обезвреживание твердых отходов
В химической и нефтехимической промышленности образуются
многочисленные твердые отходы, различающиеся по своему
происхождению и составу. Ввиду большого многообразия этих
отходов предложить обобщенную схему их утилизации и обез-
вреживания не представляется возможным, поэтому рассмотрим
основные методы применительно к многотоннажным отходам
производства.
Утилизация фосфогипса. Фосфогипс образуется как отход в
производстве фосфорной кислоты из природных фосфатов. При
разложении фосфатов серной кислотой в раствор переходит
фосфорная кислота и образуется труднорастворимый сульфат
кальция (фосфогипс):
Ca5F(PO4)3 + 5H2SO4 = 5CaSO4 + ЗН3РО4 + HF.
В зависимости от температуры и концентрации получаемой
кислоты сульфат кальция выделяется в форме дигидрата CaSO4 х
х 2Н2О (гипс), полугидрата CaSO4 0,5Н2О или безводной соли
CaSO4 (ангидрит). При получении экстракционной фосфорной
кислоты дигидратным способом образуется 7,5-8,4 т влажного
фосфогипса в пересчете на дигидрат. Фосфогипс (в пересчете на
сухое вещество) содержит до 94% CaSO4, а также в виде приме-
сей неразложившийся фосфат, неотмытую фосфорную кислоту,
полуторные оксиды, соединения стронция, различные микро-
примеси (редкоземельные элементы, Mo, Со, Мп, Zn), соедине-
ния фтора и др.
Основными примесями, препятствующими прямому исполь-
зованию фосфогипса вместо природного гипса в строительстве,
355
являются соединения фтора и Р2О5. В России и странах СНГ в
настоящее время в отвалах находится более 40 млн т фосфогип-
са и ежегодно образуется около 10 млн т этого отхода. Фосфо-
гипс помимо загрязнения окружающей среды наносит большой
экономический ущерб, поскольку до 10% себестоимости фос-
форной кислоты приходится на затраты по его транспортировке
и хранению. Шламохранилища занимают огромные площади
земель, необходимых сельскому хозяйству.
В нашей стране и за рубежом разработано несколько направ-
лений использования фосфогипса, ниже приводится их эконо-
мическая эффективность в расчете на 1 т отхода:
Область использования Экономический эффект, руб/т
Производство гипсовых вяжущих.........................+3,5
Производство портланд-цемента (в качестве добавок)....+2,5
Производство серной кислоты и цемента................ -8.6
Производство серной кислоты и извести.................-6,6
Производство сульфата аммония.........................-22,2
Сельское хозяйство..........»....................... +6,4
Процесс получения гипсовых вяжущих из фос-
фогипса обычно состоит из двух стадий: очистка фосфогипса от
соединений фтора и фосфора и последующая дегидратация
CaSO4 • 2Н2О до CaSO4 - 0,5Н2О. Дегидратацию осуществляют
путем обжига в печах при температуре 150-170 °C либо в авто-
клавах при 120-170 °C. Технология получения вяжущих освоена
в промышленном масштабе, в настоящее время по этому методу
перерабатывается в мире 3 млн т фосфогипса и производится
1,9 млн т вяжущих материалов.
На рис. 4.14 представлена структурная схема технологическо-
го процесса получения строительного гипса из фосфогипса.
В производстве цемента фосфогипс гранулируют и
подсушивают в барабанных сушилках до содержания гигроско-
пической влаги около 5%. Использование фосфогипса умень-
шает расход топлива в производстве цемента, повышает произ-
водительность печей и качество цементного клинкера.
В производстве серной кислоты и цемента
высушенный фосфогипс смешивают с глиной, песком и коксом
и обжигают при 1200-1400 °C. При обжиге протекают следую-
щие реакции:
CaSO4 + 2С = CaS + 2СО2; CaS + 3CaSO4 = 4СаО + 4SO2.
Процесс может быть описан суммарной реакцией:
2CaSO4 + С= 2СаО + 2SO2 + СО2.
В процессе применяют небольшой избыток углерода (20-30%
от стехиометрического) для компенсации его расхода на побоч-
ные реакции.
356
а б в
Рис. 4 14. Схема получения гипсовых вяжущих из фосфогипса (а, б, в - вариан-
ты)
Образующийся диоксид серы направляется на окисление до
SO3, который далее абсорбируется водой с получением серной
кислоты.
В производстве серной кислоты и извести
фосфогипс восстанавливают коксом или продуктами конверсии
природного газа:
CaSO4 + 2С = CaS + 2СО2; CaSO4 + ФСО = CaS + 4СО2;
CaSO4 + 4Н2 = CaS + 4Н2О.
Сульфид кальция обрабатывают водой, а полученную суспен-
зию - диоксидом углерода:
CaS + Н2О + СО = H2S + СаСО3.
Полученный сероводород окисляется до диоксида серы:
H2S + 1,5О2 = SO2 + Н2О.
Разработаны способы, основанные на взаимодействии пред-
варительно приготовленного (NH4)2CO3 с фосфогипсом или на
непосредственном контактировании газообразных NH3 и СО2.
357
Фосфогипс
(NH4)2SO4 г—-. (NH4)2CO3
<------------1 Карбонизация к--------- --
раствор I—l—- Г
„ „ , ,СаСО3(тв)
<----—--- 1 Прокаливание I
на карбонизацию» -p— , I
Концентрат
редкоземельных
/2аО с примесями
Растворение Np| p| '
CaCl, раствор
------' I
Карбонизация |--------
элементов
CaCO3 осадок
CO2 I------*------1
< —z 1 Прокаливание I
на карбонизацию». r . l
CaO
очищенная
Рис 4.15. Схема комплексной переработки фосфогипса
Разработана схема комплексной переработки фосфогипса в
сульфат аммония, оксид кальция и концентрат редкоземельных
элементов (рис. 4.15). Метод основан на том, что СаО, получен-
ный из осадка СаСОз, растворяется в аммониевых солях, а ред-
коземельные элементы остаются в осадке. Прокаливание СаСОз
проводят при 1000 °C, полученный оксид кальция обрабатывают
раствором NH4C1 с получением раствора СаС12 и осадка редко-
земельных элементов. Аммонизированный раствор СаС12 насы-
щается СО2 для выделения СаСО3 и регенерации NH4C1.
В сельском хозяйстве фосфогипс используется для
гипсования солонцовых почв. При внесении в такие почвы
фосфогипса (6-7 т на 1 га) происходит образование сульфата
натрия, который легко вымывается. Фосфогипс рекомендуется
применять в качестве местных удобрений. Использование тако-
го удобрения экономически оправданно при отсутствии дальних
перевозок (до 500 км). Использование фосфогипса не требует
очистки от Р2О5, поскольку эта примесь играет положительную
роль при внесении в почву.
Потребность в нашей стране в серосодержащих удобрениях
составляет более 2 млн т/год.
Среди других методов переработки фосфогипса перспек-
тивным является извлечение из него элементной серы путем
восстановления при температуре 1100-1200 °C.
358
Утилизация пластмасс и эластомеров. Технологические отходы
пластических масс и эластомеров образуются в отраслях, зани-
мающихся синтезом и переработкой этих продуктов. По статис-
тическим данным, в производстве этих отходов образуется от 5
до 35%.
Длительное время захоронение в почву и сжига-
ние были наиболее распространенными способами уничтоже-
ния отходов пластмасс и эластомеров. Тепло, выделяющееся при
сжигании, использовалось для генерирования водяного пара.
Однако при сжигании происходит образование сажи от непол-
ного сгорания полимеров, выделение токсичных газов и, как
следствие, повторное загрязнение воздушного бассейна.
К основным способам утилизации отходов пластических масс
относятся: термическое разложение путем пиролиза; деполиме-
ризация с получением исходных низкомолекулярных продуктов
(мономеров, олигомеров); вторичная переработка.
Пиролиз полимеров осуществляется при температурах
800-1100 °C и позволяет получить высококалорийное топливо,
сырье и полупродукты, используемые в различных технологиче-
ских процессах, а также мономеры для синтеза полимеров. При
пиролизе отходов полиэтилена (Т = 740 °C) образуются полез-
ные продукты: этилен (25%), метан (16%), бензол (12%), пропи-
лен (10%).
Установка термического пиролиза включает дробилку, шне-
ковый питатель, печь пиролиза, скруббер для промывки пирога-
за, холодильник, ректификационную колонну разделения угле-
водородов и камеру сжигания отходящих газов. В случае пере-
работки поливинилхлорида предусматривается скруббер для
поглощения НС1. Печь пиролиза отходов представляет собой
обогреваемую вертикальную цилиндрическую камеру, в которой
измельченные пластмассовые отходы перемещаются под дей-
ствием силы тяжести вниз, а продукты пиролиза из верхней
части печи направляются на переработку.
Разработаны процессы каталитического гидро-
крекинга для превращения полимерных отходов в бензин и
масла.
Процессу деполимеризации с получением мономеров
подвергают только те виды пластмасс, которые распадаются при
сравнительно низких температурах (300-450 °C). К таким поли-
мерам относятся полистирол и его сополимеры, полиакрилаты.
Пиролиз полистирола сопровождается получением 50-70% исход-
ного стирола, при термическом разложении полиметилметакрилата
выход газообразного метилметакрилата достигает 91-96%.
Наиболее эффективным способом утилизации отходов поли-
мерных материалов является их вторичная (а в некоторых
359
случаях многократная) переработка. Освоены процессы
переработки вышедшей из употребления полиэтиленовой плен-
ки в трубы для сельского хозяйства и изделия менее ответствен-
ного назначения, а также во вторичную пленку. Технологиче-
ский процесс получения вторичной полимерной пленки заклю-
чается в подготовке исходного сырья (использованной пленки),
гранулировании и смешении полученных гранул с первичным
полиэтиленом с последующим получением пленки обычными
методами.
4.2.5. Утилизация и обезвреживание жидких отходов
Среди многочисленных жидких отходов на химических и нефте-
химических предприятиях преобладают сточные воды, различ-
ные углеводородные растворители и загрязненные органические
вещества.
Сточные воды загрязнены неорганическими и органическими
соединениями, поступающими с заводов соответствующего
профиля - основной химической промышленности, нефтехими-
ческой и нефтеперерабатывающей промышленности, органиче-
ского синтеза, красителей и пигментов, лаков и красок, целлю-
лозно-бумажной промышленности и др. Обобщенная схема об-
разования сточных вод на химических предприятиях представ-
лена на рис. 4.16.
Выбор метода очистки сточных вод зависит прежде всего от
характера примесей. Наиболее часто употребляемые приемы
очистки сточных вод можно объединить в такие группы:
1) для очистки от суспензированных и эмульгированных
примесей - отстаивание, флотация, фильтрация, осветление,
центрифугирование (для грубодисперсных частиц); коагуляция,
флотация, электрические методы осаждения (для мелкодисперс-
ных и коллоидных частиц);
2) для очистки от неорганических соединений - дистилля-
ция, ионообмен, обратный осмос, ультрафильтрация, реагентное
осаждение, методы охлаждения, электрические методы;
3) для очистки от органических соединений - экстракция,
абсорбция, флотация, ионообмен, реагентные методы (регене-
рационные методы); биохимическое окисление, жидкофазное
окисление, парофазное окисление, озонирование, хлорирова-
ние, электрохимическое окисление (деструктивные методы);
4) для очистки от газов и паров - отдувка, нагрев, реагентные
методы;
5) для уничтожения вредных веществ - термическое разложе-
ние.
360
Таблица 4.7. Эффективность методов очистки сточных вод
Метод очистки Удаляемые примеси Степень очистки, %
Биохимическая очистка:
одноступенчатая Органические соединения, нефтспродук- 55-90
ТЫ
двухступенчатая То же 93-99
Отгонка Аммиак 85-95
Ионообмен Азот- и фосфорсодержащие соединения 80-92
Электроди ал из Растворенные вещества 10-40
Адсорбция углем Органические соединения 90-98
Фильтрация Взвешенные вещества 60-90
Обратный осмос Растворенные вещества 65-95
Дистилляция То же 90-98
Очистку сточных вод от соединений фосфора осуществляют с
помощью сульфатов алюминия и железа. Освобождение стоков
от соединений азота (аммиака, нитритов и нитратов) произво-
дится методами абсорбции и ионообмена (аммиак).
Эффективность различных методов очистки сточных вод по-
казана в табл. 4.7.
Как видно из таблицы, для очистки сточных вод в боль-
шинстве случаев используются типовые процессы химической
технологии (или их сочетание), которые изучаются в курсе
“Основные процессы и аппараты химической технологии”. По-
этому обратим внимание на особенности биохимического и хи-
мического окисления примесей в сточной воде.
Метод биологической очистки сточных вод основан на способ-
ности гетеротрофных микроорганизмов использовать в качестве
источников питания разнообразные органические соединения,
подвергая последние биохимическим превращениям. Использо-
вание свойств адаптации бактерий активного ила позволяет
успешно решать вопросы биологической очистки стоков воды
химических производств, содержащих сложные органические
соединения неприродного происхождения.
Контактируя с органическими веществами, микроорганизмы
частично разрушают их, превращая в воду, диоксид углерода,
нитрит- и сульфат-ионы и др. Другая часть вещества идет на
образование биомассы. Разрушение органических соединений
при помощи микроорганизмов называют биохимическим окис-
лением. Окисление органических веществ происходит избира-
тельно, поэтому некоторые соединения разрушаются легко,
другие - медленно или совсем не окисляются.
Известны аэробные и анаэробные методы биохимической
очистки сточных вод. Аэробный метод основан на исполь-
361
Товарный продукт
Товарный Отходящие
выбросы воды
Рис. 4.16. Схема образования сточных вод в химическом производстве
зовании аэробных групп микроорганизмов, для жизнедеятель-
ности которых требуются постоянный приток кислорода и тем-
пература 20-40 °C. При изменении кислородного и температур-
ного режимов меняются состав и число микроорганизмов, а
соответственно и эффективность очистки стоков. В случае
анаэробной очистки микроорганизмы культивируются в
активном иле или биопленке, биохимические процессы проте-
кают без доступа кислорода. Этот метод используют главным
образом для обезвреживания осадков.
Биохимическая очистка с точки зрения организации безот-
ходного производства не может считаться универсальной, так
как поступающие со сточными водами ценные органические
вещества не извлекаются, а перерабатываются в избыточный ил,
также требующий обезвреживания. Однако это пока единствен-
ный метод, который обеспечивает очистку сточных вод до пока-
зателей, позволяющих использовать их в оборотных системах
охлаждения. Сооружения биологической очистки химических
предприятий могут иметь различные технологические схемы,
которые выбирают в зависимости от характеристик посту-
пающих в них сточных вод.
За критерий выбора технологической схемы очистных соору-
жений принимается обеспечение требований к качеству очи-
щенных сточных вод и условие минимизации приведенных за-
трат.
Наиболее часто используется схема, приведенная на рис.
4.17. Сточные воды поступают первоначально в усреднительные
емкости 1, а затем в смесительную камеру 5. Сюда же поступают
хозяйственно-бытовые сточные воды из накопителя 2, а также
условно чистая вода. Накопитель хозяйственно-бытовых сточ-
ных вод 2 играет роль усреднителя, поскольку эти воды имеют
переменный характер загрязнения (разлив продуктов, уборка
производственных помещений и т. д.). Смешанный сток посту-
пает в аэротенк 4, куда подается воздух. Иловая смесь из аэро-
тенка направляется во вторичный отстойник 5, где очищенная
вода отделяется от активного ила и направляется в водоем или
на подпитку водооборотных систем (после соответствующей
доочистки). Активный ил из вторичных отстойников возвра-
щается в аэротенк в виде возвратного ила, а частично в виде
избыточного ила направляется на обработку.
Термоокислительные методы обезвреживания сточных вод. В
термоокислительных методах обезвреживания органические
примеси в сточных водах окисляются кислородом воздуха при
повышенной температуре до безвредных продуктов (Н2О, СО2).
К этим методам относятся: пламенный (“огневой”), жидкофаз-
ное окисление, парофазное каталитическое окисление.
363
Условно чистая вода
Возвратный активный ил активный ил
Рис. 4.17. Схема биологической очистки сточных вод химических производств:
1 - усреднительные емкости; 2 - накопитель хозяйственно-бытовых сточных вод; J -
смесительная камера; 4 - аэротенк; 5 - вторичный отстойник
Выбор метода обезвреживания зависит от объема сточных
вод, их состава и теплотворной способности, экономичности
процесса и требований к очищенным стокам. По теплотворной
способности загрязненные стоки делятся на сточные воды, спо-
собные гореть самостоятельно за счет содержащихся в них орга-
нических веществ, и воды, термоокислительное обезвреживание
которых возможно только с вводом топлива (при теплотворной
способности стоков ниже 8400 кДж/кг).
Огневой метод обезвреживания сточных вод является
универсальным и характеризуется высокой степенью очистки
сточных вод (98-99,9%). В этом методе сточная вода вводится в
распыленном состоянии в высокотемпературные продукты сго-
рания топлива (900-1000 °C). Вода испаряется, а органические
примеси сгорают, образуя продукты полного сгорания (СО2,
Н2О). Минеральные примеси при этом образуют твердые или
расплавленные частицы, которые удаляются из камеры печи.
Недостатком метода является высокий расход топлива на ис-
парение воды и перегрев пара до 900-1000 °C. В связи с этим
огневой метод рекомендуется использовать в следующих случаях:
1) при большом количестве сточных вод, содержащих высо-
котоксичные органические примеси, обезвреживание которых
другими методами невозможно или экономически невыгодно;
2) при наличии горючих вторичных энергоресурсов, которые
могут быть использованы вместо топлива.
В огневом методе используются печи различных типов: ка-
мерные, шахтные, циклонные, с псевдоожиженным слоем. Наи-
более эффективны циклонные печи (рис. 4.18), в которых бла-
годаря вихревому характеру газового потока интенсифицируется
тепло- и массообмен между каплями сточной воды и горячими
продуктами сгорания топлива. В этих печах сравнительно про-
364
3
Жидкие
отходы
Рис. 4.18. Схема установки для сжигания горючих
жидких отходов:
1 - воздуходувка; 2 - питающее устройство; 3 -печь
Рис. 4.19. Схема установки огневого обезврежи-
вания сточных вод:
1 - нагнетательный насос; 2 - циклонный реактор; 3
- парогенератор (котел-утилизатор); 4 - струйный аппа-
рат; 5 - циркуляционный насос; 6 - емкость; 7 - капле-
отделитель; 8 - дымовая труба
сто решается вопрос о выгрузке плава солей. Недостатком цик-
лонных печей является большой унос солевой массы потоком
газа.
На рис. 4.19 представлена схема установки огневого обезвре-
живания сточных вод, включающая циклонный реактор 2, паро-
генератор (котел-утилизатор) 3 и струйный аппарат 4. Продукты
сгорания из реактора поступают в камеру охлаждения парогене-
ратора. Наличие эжектора позволяет исключить дымосос. Цир-
куляционный носос 5 используется для подачи раствора мине-
ральных веществ из емкости 6 в реактор 2 и в струйный аппарат
4. Пройдя каплеотделитель 7, очищенные газы поступают в ды-
мовую трубу 8 и из нее в атмосферу. На некоторых установках
используют для утилизации тепла водогрейные котлы, водоам-
миачные абсорбционные холодильные машины и циклоны для
сухой очистки газа от каплеуноса.
365
вода
Рис. 4.20. Схема установки жидкофазного окисления:
1 - сборник; 2- насос; 3 - теплообменник; 4- печь; 5- реактор; 6- сепаратор
Установка по огневому обезвреживанию сточных вод харак-
теризуется следующими показателями:
Производительность по сточным водам, м3/ч..................2,5
Расход природного газа. м3/ч...............................600
Удельный расход газа, м3/ч.................................240
Удельная нагрузка циклонной печи по сточным водам, т/(м3 ч).1,18
Тепловое напряжение циклонной печи, МВт/м3.................2,46
Температура продуктов сгорания на выходе из циклона, °C.......900-1000
В процессе обезвреживания сточных вод, содержащих орга-
нические соединения серы, хлора, нитросоединения, образуются
SO2, SO3, Р2О5, НО, Ог, (NO)X. Вещества эти могут взаимодей-
ствовать с образованием новых, более токсичных соединений,
что необходимо иметь в виду при удалении отходящих газов в
окружающую среду.
Метод жидкофазного окисления основан на окис-
лении органических веществ, растворенных в сточной воде,
кислородом воздуха при температуре 100-350 °C и давлении 2-
28 МПа. Повышение давления ускоряет процесс и глубину
окисления вследствие увеличения растворимости в воде кисло-
рода. Жидкофазное окисление осуществляется как на катализа-
торах, так и без них. В качестве катализаторов используются
металлы (Pt, Pd, Си, Zn, Мп), нанесенные на оксид алюминия
или активированный уголь.
Принципиальная схема установки жидкофазного окисления
органических соединений, содержащихся в сточной воде, пока-
зана на рис. 4.20.
Загрязненная вода из сборника 1 насосом 2 подается в си-
стему обезвреживания горючих соединений. Вода нагревается в
366
теплообменнике 3 и в печи 4, в которой сжигается природный
газ. После отделения воды в сепараторе 6 газы выбрасываются, а
очищенная вода охлаждается в теплообменнике 3, нагревая за-
грязненный поток.
В методе парофазного каталитического
окисления используется гетерогенное каталитическое окис-
ление кислородом воздуха летучих органических соединений,
находящихся в сточных водах. Процесс окисления интенсивно
протекает в присутствии медно-хромовых, медно-цинковых,
медно-марганцевых катализаторов. При высокой температуре
(350-400 °C) большинство органических веществ подвергается
полному окислению (98,5-99,9%).
Применение парофазного окисления наиболее целесообразно
в случае вывода технологического потока в виде пара, направ-
ляемого в конденсаторы (из выпарных аппаратов, ректификаци-
онных колонн, сушильных камер и т. д.). В данном процессе
могут быть использованы конструкции реакторов, характерные
для гетерогенно-каталитических процессов.
4.2.6. Утилизация и обезвреживание газообразных отходов
В группе газообразных отходов наибольшую долю составляют
отходящие технологические газы, продукты сгорания из печей и
парогенераторов, выбросы загрязненного воздуха из вентиляци-
онных систем. Газы содержат многочисленные соединения, в
состав которых помимо углеводорода и водорода могут входить
кислород, сера, азот, галогены.
Очистка выбрасываемых в атмосферу газов от этих соедине-
ний может быть достигнута их сжиганием при высоких тем-
пературах (900-1000 °C), однако такой способ требует больших
затрат первичного топлива, что особенно нерентабельно при
обезвреживании газов с малым содержанием вредных веществ. В
связи с этим получила применение каталитическая
очистка, осуществляемая при более низкой температуре (до
300-400 °C). Рассмотрим примеры каталитической очистки раз-
личных газовых выбросов.
Каталитическая очистка газов от органических веществ. Наи-
более часто применяется следующая принципиальная схема
очистки. Очищаемые газы проходят отбойники и циклоны для
отделения конденсата и взвешенных частиц, захваченных газо-
вым потоком. Затем газы нагревают в рекуперативных теплооб-
менниках и в подогревателе до температуры реакции и направ-
ляют в реактор. Автотермическое проведение процесса возмож-
но при содержании горючих примесей 5-10 г/м3 (адиа-
батический разогрев таких смесей 150-300 град ), при меньшем
367
содержании необходим подвод тепла от постороннего источни-
ка. Очищенные газы охлаждают и выбрасывают в атмосферу.
Активные компоненты катализаторов, используемых для
очистки отходящих газов, можно разделить на три группы: бла-
городные металлы, сплавы и оксидные системы. Катализаторы
должны окислять более 90% (об.) СО и углеводородов в широ-
ком интервале температур (250-800 °C) в присутствии воды
(около 15%) и не должны отравляться соединениями серы. Наи-
более распространены платиновые катализаторы вследствие
способности их ускорять самые различные реакции превраще-
ния органических соединений в окислительных и восстанови-
тельных средах (окисление, гидрирование).
Для обезвреживания газов используются и более дешевые
таблетированные катализаторы на основе оксидов неплатиновых
металлов (Ni, Си, Сг, Мп).
В производстве изопрена дегидрированием изопентана обра-
зуются отходящие газы, в которых помимо азота, кислорода и
диоксида углерода содержатся углеводороды С1-С5. Для их
очистки используется платиновый катализатор АП-56 (Pt-
AI2O3). При двухступенчатой очистке газа с содержанием орга-
нических соединений 4,5% (об.) на этом катализаторе конверсия
достигает 96-100% при температуре 260-350 °C, объемной ско-
рости 50000 ч"1 и 1,5-2,0-кратном избытке воздуха.
При глубоком окислении примесей выделяется тепло, коли-
чество которого зависит от природы окисляемых веществ и
концентрации их в очищаемых газах. Реактор с утилизацией
тепла и стационарным слоем катализатора для очистки венти-
ляционных выбросов от токсичных органических веществ, кото-
рые превращаются в диоксид углерода и воду, показан на рис.
4.21.
Загрязненный воздух отсасывается из помещения цеха или от
технологического оборудования через канал 1 вентилятором 3.
Пройдя через огнепреградитель 2, загрязненный воздух под дав-
лением до 3000 Па направляется в межтрубное пространство
рекуператора 4, где предварительно нагревается теплом уходя-
щих газов до 200 °C. Нагретый воздух поступает в смесительно-
проточный воздухоподогреватель 6, где его температура повы-
шается до 250-400 °C за счет смешения с продуктами сгорания
природного газа, подаваемого в горелку 5. Обезвреженный в
слое катализатора воздух поступает в трубы рекуператора 4, от-
дает тепло загрязненному воздуху и выбрасывается через вы-
ходную трубу 8 в атмосферу или используется в качестве су-
шильного агента или теплоносителя в технологическом про-
цессе.
368
Рис. 4.21. Схема реакторов для каталитического обезвреживания газовоз-
душных выбросов, содержащих органические примеси, пропускной способ-
ностью 5 тыс. м3/ч («) и 10-25 тыс. м3/ч (6):
1 -трубопровод; 2 - огнепреградитель; 3 - центробежный вентилятор; 4 - рекуператор;
5 - горелка струйного типа; 6 - смесительно-проточный воздухоподогреватель; 7 - катализа-
тор; 8- выходной трубопровод; 9, 10- каналы; 11 - межтрубное пространство рекуператора;
12 - горелка; 13 - насадка; 14 - выходной трубопровод
Недостатками реакторов со стационарным слоем катализато-
ра и утилизацией тепла при обезвреживании газов с небольшим
содержанием органических примесей является сложность и ме-
таллоемкость конструкции. От всего объема реакторного узла на
долю катализатора приходится менее 5%, а остальной объем
занимают теплообменник и различные распределительные уст-
ройства и т. п.
Новые возможности открывает использование каталитиче-
ских реакторов обезвреживания газов с нестационарным режи-
мом. Одним из способов реализации нестационарного режима
может быть переключение направления подачи газа в слое ката-
лизатора (рис. 4.22).
Катализатор в реакторе 1 предварительно прогревают пото-
ком газа, для чего служит пусковой подогреватель 2. После
прогрева слоя обезвреживаемый газ подается с низкой темпера-
турой в направлении, указанном сплошными стрелками, для
чего в блоке 3 открывают клапаны 5 и 6, закрывают клапаны 4 и
7. Газ проходит реактор сверху вниз. Холодный газ нагревается в
горячем слое катализатора, охлаждая первые по ходу газа
участки слоя. В сечении слоя, где газ достаточно прогрелся,
протекает экзотермическая реакция окисления примесей (зона
реакции), и температура в слое повышается. Со временем зона
реакции продвигается к выходу из слоя (вниз). Изменение тем-
пературного профиля в слое показано на графике на рис. 4.22.
369
Рис. 4.22. Схема установки обезвреживания газовых выбросов в нестационар-
ном режиме и изменение во времени (t\ ... Г4) температуры Т по длине / слоя
катализатора:
1 - каталитический реактор; 2 - пусковой подогреватель; 3 - блок переключающих кла-
панов (4-7). Сплошные и пунктирные стрелки - направление потока в разные циклы про-
цесса
Когда горячая зона реакции приближается к выходу из слоя
(время /4 на графике), направление потока газа в реакторе ме-
няют на противоположной, для чего закрывают клапаны 5 и 6 и
открывают клапаны 4 и 7. Поток газа будет направлен как пока-
зано на рис. 4.22 пунктирными стрелками (снизу вверх в слое).
Холодный поток опять попадает в прогретую часть слоя катали-
затора, и горячая зона реакции будет продвигаться в противопо-
ложном направлении (вверх). Когда зона реакции приблизится
к выходу из слоя, направление потока в реакторе опять меняют
на противоположное. Таким образом удается сохранить запа-
сенное в слое тепло в подвижной горячей зоне реакции и пере-
рабатывать газ с низкой входной температурой. Эффективность
применения нестационарного режима в реакторе обезврежива-
ния (табл. 4.8) обусловлена экономией капитальных вложений
за счет исключения теплообменной аппаратуры и эксплуатаци-
онных затрат от сокращения расхода топлива.
Описанный нестационарный метод обезвреживания газов
требует очень надежной системы управления процессом и до-
статочно сложной, если концентрация удаляемых компонентов
370
Таблица 4.8. Сравнительные показатели установок обезвреживания газов
Показатель Стационарный режим Нестационар- ный режим
Расход газа, нм3/4 16500 16500
Концентрация примесей, г/м3 5-10 5 10
Время цикла, мин — 40-100
Капитальные затраты, уел. ед. 1,0 0,23
Удельные эксплуатационные затраты, усл. ед. 1,0 0,33
Расход топлива, МДж/ч 3,0 -
меняется во времени. Кроме того, в момент переключения на-
правления движения газа происходит залповый выброс вредных
веществ из части объема системы, через который поступал ис-
ходный газ до переключения и из которого необезвреженные
вещества будут выдуваться после переключения.
Каталитическая очистка газов от оксидов азота. В химической
промышленности выбросы оксидов азота с отходящими газами
имеют место в производстве азотной кислоты и при сжигании
топлива в топках технологических печей. Образование оксидов
азота в топках происходит в результате окисления азота воздуха
при высоких температурах:
N2 + О2 = 2NO - 180 кДж/моль.
Концентрация образовавшихся оксидов азота NOX зависит от
температуры и избытка воздуха в зоне горения. Оба этих факто-
ра (повышенная температура и избыток воздуха) благоприят-
ствуют их образованию. При сжигании природного газа в про-
дуктах сгорания при избытке воздуха а = 1,2 образуется NOX в
количестве 0,3-0,4 г/м3, а при а = 1,05 - в количестве 0,1-
0,15 г/м3.
В промышленной практике для обезвреживания газов при-
меняются методы каталитического восстановления оксидов азо-
та природным газом (при Т > 500 °C) или аммиаком (при Т <
< 500 °C) до молекулярного азота и воды.
Суммарные реакции высокотемпературного про-
цесса восстановления оксидов азота природным газом можно
представить в виде
СН4 + 4NO2 = СО + 4NO + 2Н2О + 574,4 кДж;
СН4 + 4NO = СО2 + 4N2 + 2Н2О + 11646 кДж.
В качестве катализаторов в процессе применяются металлы
Pt, Pd, Ni, Си, Cr, Fe и сплавы Ni-Cr, Cu-Cr, Zn-Cr и другие,
нанесенные на оксид алюминия, силикагель. В производстве
азотной кислоты хвостовые газы обезвреживаются на катализа-
торе АПК-2 (AI2O3 с 2% Pd). Процесс восстановления NOX в
371
Отходящие газы,
содержащие NOX
Па^э
400 С
6.Н
Очищенные газы
в атмосферу
Рис. 4.23. Энерготехнологическая схема высокотемпературного обезвреживания
отходящих газов от оксидов азота NOX:
1 - камера сгорания; 2 - реактор; 3 - компрессор; 4 - турбина; 5 - электрогенератор; 6 -
котел-утилизатор
реакторе осуществляется при температуре 720-770 °C и объем-
ной скорости газа 15000-25000 ч-1. Остаточное содержание ок-
сидов азота 0,002-0,008% (об.) достигается при избытке природ-
ного газа относительно стехиометрического.
В качестве восстановителя в высокотемпературном процессе
может также использоваться водород:
NO2 + Н2 = Н2О + NO + 18469 кДж;
NO + Н2 = Н2О + 0,5N2 + 332,5 кДж.
В энерготехнологической схеме обезвреживания отходящих
газов от оксидов азота (рис. 4.23) предусматривается утилизация
избыточного тепла процесса на газотурбинной установке и в
котле-утилизаторе. В этой схеме природный газ (СНд) и воздух
подаются в таком количестве, чтобы весь кислород воздуха был
израсходован на горение метана в камере сжигания и нагрев
отходящих газов до необходимой температуры. Но природный
газ подается в небольшом избытке - несгоревший СН4 в реакто-
ре 4 восстанавливает оксид азота до N2. Энергия горячих газов
используется в турбине для привода воздушного компрессора и
в котле-утилизаторе для получения пара.
Низкотемпературный процесс каталитического
восстановления оксидов азота аммиаком до молекулярного азота
протекает при 200-350 °C:
4NH3 + 6NO = 5N2 + 6Н2О + 1810,6 кДж;
8NH3 + 6NO2 = 7N2 + 12Н2О + 2734 кДж.
372
Рис. 4.24. Схема очистки дымовых газов от оксидов азота:
1 - дымовая труба; 2 - перегородка; 3 - смеситель аммиака с дымовыми газами; 4 - блок
дозирования аммиака; 5 - реактор
В качестве катализатора селективного восстановления NOX
используют Pt, MgO, V2O5, CuO, Cr2O5, оксиды других метал-
лов. На алюмованадиевом контакте АВК-10М при объемной
скорости очищаемого газа 15000 ч1, 20%-м избытке воздуха
достигаются степень очистки 98-96% и остаточное содержание
оксидов азота 0,002-0,003% (об.). На рис. 4.24 представлен вари-
ант схемы очистки отходящих продуктов сгорания.
Дымовой газ, поступающий в нижнюю часть дымовой трубы
1, несколько охлаждается (до 200 °C) и смешивается с аммиаком
в смесителе 3. Необходимое количество аммиака регулируется
дозатором 4. Газ с аммиаком поступает в реактор 5, в котором
оксиды азота восстанавливаются аммиаком до азота. Очищен-
ные (точнее, обезвреженные) дымовые газы возвращаются в
дымовую трубу 1 и выбрасываются в атмосферу. Перегородка 2
разделяет очищенный и неочищенный газы. Расход аммиака на
очистку 1000 н. м3 газа при исходном содержании NOX 0,1%
составляет 0,85-0,9 кг.
4.2.7. Утилизация и обезвреживание шламов
химических производств
Шламы относятся к распространенным видам отходов химиче-
ских и нефтехимических производств. Нефтяные шламы обра-
зуются при переработке нефти за счет твердых примесей, при-
сутствующих в исходной нефти. На тонну перерабатываемой
нефти выход шламов достигает 7-10 кг, всего в шламонакопите-
373
Продукты горения
Рис. 4.25. Схема установки для сжигания нефтяных шламов:
1 - шнековый насос; 2- печь с псевдоожиженным слоем; 3 - теплообменник; 4 - возду-
ходувка; 5 - циклон
лях предприятий накоплено более 5 млн нефтешламов. Шламы
содержат 10-56%(мас.) нефтяных продуктов, 30-85%(мас.) воды
и 13-46%(мас.) твердых примесей.
При хранении в шламонакопителях такие отходы расслаи-
ваются с образованием верхнего слоя (водная эмульсия нефте-
продуктов), среднего слоя (загрязненная нефтепродуктами и
взвешенными частицами вода) и нижнего слоя (твердая фаза,
пропитанная нефтепродуктами).
Разработаны многочисленные способы переработки нефтя-
ных шламов и утилизации содержащихся в них нефтепродуктов:
предварительное обезвоживание, термическая сушка обводнен-
ного шлама и переработка нефтепродуктов совместно с исход-
ной нефтью, газификация обезвоженного или частично обезво-
женного шлама; сжигание в виде эмульсии и использование
тепла вторичных энергоресурсов; утилизация шламов в произ-
водстве строительных материалов (керамзита).
Наиболее распространенным способом утилизации шлама яв-
ляется сжигание его в печах с псевдоожиженным слоем (рис. 4.25).
Шлам шнековым насосом 1 подается в реактор 2. Вместе с
ним вводится природный газ с воздухом, обеспечивающим го-
рение. Псевдоожижение в реакторе создается воздухом, пода-
ваемым снизу. Продукты горения охлаждаются в теплообменни-
ке 3 воздухом, поступающим после теплообменника в реактор.
Зола частично отделяется в теплообменнике и выводится из
него. Основная масса золы отделяется от дымовых газов в цик-
лоне 5. Для сжигания шламов с большим содержанием (до 70%)
механических примесей применяют многоподовые печи и вра-
щающиеся печи барабанного типа.
374
При сжигании нефтешлама требуется дополнительно расхо-
довать топливо, что удорожает процесс. Поэтому высокая сте-
пень утилизации тепла служит основным направлением повы-
шения эффективности установок.
4.2.8. Обезвреживание особо токсичных
и радиоактивных отходов
Особо токсичные отходы. Соединения, составляющие группу
особо токсичных отходов, были охарактеризованы выше в разд.
4.2.1. Следует обратить внимание, что во всех случаях стадия
обезвреживания особо токсичных отходов является заключи-
тельной и ей предшествует извлечение из отходов полезных
компонентов. В регенерации ценных веществ используются раз-
личные физико-химические методы - выпарка, адсорбция,
ионообмен, экстракция, осаждение, ультрафильтрация и др. В
большинстве методов физико-химической обработки отходов
образуются новые твердые или шламообразные остатки, кото-
рые не представляют ценности и должны быть ликвидированы
как особо токсичная часть отходов
Среди методов ликвидации особо токсичных отходов наи-
большее распространение получили полигоны захоронения,
шламохранилища, захоронение или закачка в глубинные под-
земные скважины и сжигание.
Полигоны захоронения отходов представляют со-
бой наземные сооружения, в задачу которых входит предвари-
тельная подготовка высокотоксичных отходов и захоронение их
земляной засыпкой. В состав полигонов могут включаться печи
сжигания с утилизацией тепла. Полигоны захоронения распола-
гаются вдали от населенных пунктов. При их размещении учи-
тывают состав и физико-химические свойства отходов и приме-
няют меры по предотвращению загрязнения грунтовых вод
(бетонирование, гидроизоляция накопителей отходов).
Распространенным методом обезвреживания являются ней-
трализация и обработка одних отходов други-
ми с получением труднорастворимых соедине-
ний. Такой прием используют при обработке отходов, содер-
жащих соединения мышьяка, сульфидными отходами с образо-
ванием нерастворимых сульфидов мышьяка.
Используют обезвреживание особо токсичных
отходов отверждением, которое включает в себя пре-
вращение токсичных компонентов в нерастворимые соединения
и формирование блоков (агломератов), из которых токсичные
примеси не могут выщелачиваться водой. Отверждение исполь-
зуется для обезвреживания отходов, содержащих тяжелые метал-
375
лы, ртуть и токсичные шламы и осадки. Отверждение отходов
обеспечивает их безопасное хранение на полигонах и предот-
вращает загрязнение грунтовых вод; осуществляется оно добав-
кой вяжущих компонентов (цемента, извести), битума, парафи-
нов, органических полимеров, силикатных материалов.
Получил распространение также метод капсулирова-
н и я, когда токсичный отход покрывается пленкой инертного
материала (например, остекловывание). Материал капсул дол-
жен иметь высокую коррозионную стойкость в среде отходов
грунтовых вод и способствовать длительному хранению на по-
лигоне захоронения.
При захоронении отходов в глубинных гори-
зонтах используют существующие скважины или бурят спе-
циально на глубину от нескольких сот метров до 4000 м. Закач-
ку осуществляют ниже уровня грунтовых вод в водоносные слои
рассолов, не имеющих практической ценности. При выборе
места скважин учитывается геологическая характеристика по-
глощающего горизонта (пористость, проницаемость, герметич-
ность и т. д.). Разрабатываются также меры по защите артезиан-
ских вод и формы контроля эксплуатации скважин.
Сжигание и пиролиз применяют для ликвидации
жидких и твердых особо токсичных отходов. В этих методах
достигается уменьшение объема отходов до 85%. Для сжигания
используют промышленные печи различных конструкций: ка-
мерные, шахтные, барабанные, циклонные и с псевдоожи-
женным слоем.
Радиоактивные отходы представляют собой самостоятельную
группу отходов. Главное отличие их состоит в том, что они на-
ходятся в состоянии ядерной нестабильности и испускают
ионизирующие излучения, которые действуют на живые орга-
низмы и другие биологические материалы.
Радиоактивные отходы принято классифицировать по ряду
признаков.
По агрегатному состоянию различают жидкие,
твердые и газообразные радиоактивные отходы. К жидким отхо-
дам помимо истинных растворов относят коллоидные растворы,
суспензии и пульпы. К. газообразным кроме собственно газов
относят аэрозоли, дымы и туманы.
К твердым отходам помимо собственно радиоактивных ве-
ществ относят материалы, содержащие поглощенные ими ра-
диоактивные вещества или подвергшиеся облучению с появле-
нием у них так называемой вторичной, или наведенной, радио-
активности.
По уровню удельной активности радиоактивные
отходы разделяют на три категории: низкой (<1 • 10~5 Ки/л),
376
средней (от 1 10“5 до 1 Ku/л) и высокой (>1 Ku/л) удельной
активности. В радиохимической промышленности распростра-
нены первые две категории отходов, отходы высокой актив-
ности характерны для атомных электростанций (АЭС).
Отходы первой категории радиационно опасны только при
попадании внутрь организма человека, и поэтому должны быть
локализованы таким образом, чтобы в результате миграции по
биологическим цепям они не могли попасть в организм челове-
ка в опасных количествах. Вторая категория отходов опасна и
как источник внешнего облучения, в связи с чем необходима
также защита от проникающего излучения.
По источникам происхождения различают: техно-
логические отходы радиохимических производств, имеющие
сравнительно постоянные количественные и качественные ха-
рактеристики (объем, состав, активность); отходы не технологи-
ческие, к которым относят стоки санпропускников, стоки от
дезактивации помещений и т. п.
В радиохимической технологии имеет место образование всех
видов отходов: газообразных, жидких и твердых. Радиоактивные
газы и аэрозоли возникают в результате облучения газов и аэро-
золей воздуха. Источником жидких радиоактивных отходов яв-
ляются любые растворы, рудные пульпы, содержащие радиоак-
тивные элементы. К твердым радиоактивным отходам относятся
шламы, тара для хранения и перевозки радиоактивных веществ,
подвергшиеся воздействию радиоактивного облучения, отрабо-
танные ионообменные смолы и адсорбенты.
В настоящее время разработаны технологические схемы пе-
реработки радиоактивных отходов с различной степенью актив-
ности, которые гарантируют безопасность для человека и окру-
жающей среды.
Для очистки воздуха от радиоактивных газов
и аэрозолей используются методы: фильтрация на тканях из
тонковолокнистых полимеров (волокна перхлорвинила 1,5—
2,5 мкм) и насадочных фильтрах, абсорбция растворами, ад-
сорбция на твердых сорбентах. Эффективность очистки газовых
потоков достигает 99,9%.
Выбор схемы переработки жидких радиоак-
тивных отходов зависит от их удельной активности, объе-
ма и качественного состава как по радиоактивным элементам,
так и по другим компонентам. Наиболее распространены такие
методы, как дистилляция, осадительные методы, коагуляция и
ионный обмен. Простым и надежным методом обработки жид-
ких отходов является упаривание, позволяющее концентриро-
вать радиоактивные вещества в небольшом объеме кубового
остатка. Многократное выпаривание позволяет снизить актив-
ность жидкости на 99,9%.
377
Удаление радиоактивных взвешенных ве-
ществ осуществляется коагуляцией, при которой активность
жидкости уменьшается на 97-98%.
В последние годы используются для очистки радиоактивных
отходов методы электродиализа, кристаллизации, флотации.
Для переработки жидких высокоактивных отходов наиболее
рациональными признаны выпаривание, отверждение (остекло-
вывание) и захоронение в геологические формации. Жидкие
среднеактивные отходы подвергают отверждению по методу
битумирования (с предварительным выпариванием растворов) и
направляют на захоронение. Низкоактивные отходы обрабаты-
ваются с помощью химического осаждения, выпаривания и це-
ментирования с последующим захоронением.
Пункты захоронения формируются на достаточном удалении
от населенных мест на территории, не имеющей перспектив
хозяйственного или другого использования. Наиболее благопри-
ятна для этих целей холмистая местность, так как исключается
попадание радиоактивных веществ в грунтовые воды. Надеж-
ность захоронения радиоактивных отходов обеспечивается
строительством “саркофагов” из железобетонных конструкций.
Глава 5
ХИМИЧЕСКИЕ ПРОИЗВОДСТВА
5.1. ВВЕДЕНИЕ
Химические производства будем рассматривать как примеры
реализации основных положений теории химических процессов
и реакторов и химико-технологических систем. Выбраны две
группы производств: органических и неорганических продуктов.
Из всей обширной гаммы органических производств выбрана
химическая переработка нефти и прослежены пути получения
из сложной природной смеси ряда продуктов. Основное здесь -
разделение и химические превращения компонентов сложной
смеси. На примере производств этилбензола и стирола показан
выбор оптимального реактора. Обоснование и построение ори-
гинальной энерготехнологической схемы продемонстрировано
на примере производства стирола. Анализ тепловой эффектив-
ности сделан для производства этилена пиролизом бензинов.
Хорошо изученные процессы в производстве неорганических
веществ рассмотрены с иной точки зрения: физико-химическое
обоснование технологических схем, процессов и аппаратов от-
дельных стадий производства. Некоторые данные о произ-
водствах приведены в описательном виде, поскольку эти произ-
водства были обсуждены в предыдущих разделах. Также с при-
влечением предыдущего материала может быть сделан деталь-
ный анализ процессов - например, выбор системы разделения
продуктов алкилирования бензола или смеси ароматических
углеводородов, образующихся при каталитическом риформинге;
выбор схемы теплообмена в системе “двойное контактирова-
ние/двойная абсорбция” в производстве серной кислоты; опре-
деление возможных путей обеспечения экологической безопас-
ности производств и др.
Материал этой главы поможет сопоставить теоретические
положения с имеющейся практикой, проверить и закрепить
знания, полученные при изучении предыдущих глав.
379
5.2. ХИМИЧЕСКАЯ ПЕРЕРАБОТКА НЕФТИ
5.2.1. Общая характеристика нефтехимического комплекса
Нефти различных месторождений заметно отличаются по фрак-
ционному составу - содержанию легких, средних и тяжелых
дистиллятов. Большинство нефтей содержит 15-25% бензиновых
фракций, выкипающих до 180 °C, и 45-55% фракций, перего-
няющихся до 300-350 °C.
Основные химические элементы, входящие в состав нефти, -
углерод (82-87%), водород (11-14%), сера (0,1-7%), азот (0,001-
1,8%), кислород (0,5-1%).
Общее содержание алканов (парафины) в нефтях достигает
30-50%, циклоалканов (циклопарафины, нафтены) - от 25 до
75%. Арены (ароматические углеводороды) содержатся, как пра-
вило, в меньшем количестве по сравнению с алканами и цикло-
алканами (10-20%).
Соотношения между группами углеводородов придают неф-
тям различные свойства и оказывают влияние на выбор метода
переработки нефти и номенклатуру получаемых продуктов.
Нефть является основным источником сырья для нефтепере-
рабатывающих заводов при получении моторных топлив, масел
и мазута. Нефть и продукты ее переработки служат также сы-
рьем для синтеза многочисленных химических продуктов: по-
лимерных материалов, пластических масс, синтетических каучу-
ков и волокон, спиртов, растворителей и др. В перспективе
большая часть нефтепродуктов (особенно энергетических топ-
лив) может быть замещена альтернативными энергоносителями,
в то время как замена нефтяного сырья в качестве источника
получения нефтехимических продуктов мало вероятна. Более
того, доля нефти, используемой в нефтехимических произ-
водствах, в ближайшие годы в мире возрастет до 8% и по про-
гнозам в 2000 г. достигнет 20-25%. В связи с этим происходит
интеграция нефтеперерабатывающей и нефтехимической про-
мышленности и формирование нефтехимических комплексов.
Комбинирование нефтепереработки (первичная переработка,
каталитический крекинг, риформинг) с нефтехимическими про-
цессами (пиролиз, синтез мономеров, производство пластмасс и
др.) значительно расширяет возможности выбора оптимальных
схем глубокой переработки нефти, повышает гибкость произ-
водственных систем для получения моторных топлив или неф-
техимического сырья, способствует увеличению их рентабель-
ности. В настоящее время имеется большое число процессов и
их комбинаций, которые потенциально могут обеспечить глуби-
ну переработки нефти вплоть до 100%. Выбор структуры нефте-
380
Сера
Нефть
Гудрон
Очищенный
о-ксилол
л-ксилол
м- ксилол
1 Бензин
—!— низко-
Крекинг-
бензин
Реформит J.
Риформинг
-бензин
Алкилат
о Бензин
о высокб-
Т^октано-
вый
Бензин-рафинат
9
т
Смола
пиролизная
10
Бензол
Бензол
Рис. 5.1. Структура нефтехимического комплекса:
1 - первичная переработка нефти (в установках АВТ); 2 - вакуумная перегонка мазута (в
установках ВТ); 3 - гидроочистка вакуумного газойля; 4 - каталитический крекинг газойля;
5 - гидроочистка бензина; 6 - риформинг бензина; 7 - разделение риформата; 8 - компаун-
дирование (смешение); 9 - пиролиз бензина; 10 - переработка пиролизной смолы; 11 -
разделение газа пиролиза; 12 - алкилирование бензола; 13 - производство стирола; 14 -
производство полистирола; 75 - производство полиэтилена; 16 - производство полипропи-
лена; ВСГ - водосодержащий газ
химического комплекса зависит от регионального и общего
спроса на нефтепродукты, от природы нефти, экологических
факторов. Структура одного из вариантов нефтехимического
комплекса показана на рис. 5.1.
5.2.2. Первичная перегонка нефти
Существуют первичные и вторичные методы переработки неф-
ти. Первичными являются процессы разделения нефти на фрак-
ции перегонкой, вторичные процессы - это деструктивная
(химическая) переработка нефти и очистка нефтепродуктов
(фракции перегонки различаются интервалом температур кипе-
ния компонентов).
381
Углеводородный газ
ный газойль
Тяжелый
Маловязкая
Неконденсированные газы и
водяной пар в вакуумную систему
масляная
фракция
Рис. 5.2. Схема установки первичной
масляная):
1 - теплообменник; 2 - трубчатая печь; 3 - холодильник, конденсатор-холодильник; 4 -
атмосферная колонна; 5- отгонная колонна; 6- газосепаратор; 7- вакуумная колонна
Тяжелое
Мазут диз.топливо
_ диз.топливо
ПаР Т 3^
Вязкая
масляная
. , фракция
А Гудрон
[егкий
ензин
перегонки нефти (АВТ топливно-
К первичной перегонке относят процессы атмосферной пере-
гонки нефти и вакуумной перегонки мазута. Их назначение
состоит в разделении нефти на фракции для последующей их
переработки или использования как товарных продуктов. Пер-
вичную перегонку осуществляют соответственно в атмосферных
трубчатых (АТ) и вакуумных трубчатых (ВТ) или атмосферно-
вакуумных трубчатых (АВТ) установках.
На установках АТ осуществляют неглубокую переработку
нефти с получением бензиновых, керосиновых, дизельных
фракций и мазута. Установки ВТ предназначены для углубления
переработки нефти. Получаемые в них из мазута газойлевые,
масляные фракции и гудрон используют в качестве сырья в
процессах вторичной переработки нефти для производства сма-
зочных масел, кокса, битума и других нефтепродуктов.
Принципиальная схема установки АВТ первичной перегонки
нефти показана на рис. 5.2. Ниже приведен состав (в %) про-
дуктов перегонки западносибирской нефти на установке АВТ-6
(мощность по перерабатываемому сырью 6 млн т/год):
Газ........................ 1,1
Фракции, °C:
до 62............... 4,1
62-85....................2,4
85-120...................4,5
120-140.................3,0
140-180.................6,0
180-240.................9,5
240-350................. 19,0
350-460................. 21,0
Гудрон.....................28,4
Потери.....................1,0
382
Углеводородный газ состоит преимущественно из про-
пана и бутанов, которые в растворенном виде содержатся в по-
ступающей на переработку нефти. Пропан-бутановую фракцию
используют для производства индивидуальных углеводородов на
газофракционирующих установках в качестве бытового топлива.
Бензиновые фракции (62-180 °C) служат сырьем во
вторичных процессах изомеризации, каталитического рифор-
минга с целью производства индивидуальных ароматических
углеводородов (бензола, толуола, ксилолов), высокооктановых
компонентов автомобильных и авиационных бензинов; их при-
меняют в качестве сырья пиролиза при получении этилена.
Керосиновые фракции (120-240 °C) используются как
топливо для реактивных двигателей в виде осветленного керо-
сина и для производства лаков и красок (уайт-спирит).
Дизельные фракции (140-340 °C) служат дизельным
топливом и сырьем для получения жидких парафинов депара-
финизацией.
Мазут - остаток атмосферной перегонки нефти - использу-
ется как котельное топливо и в качестве сырья во вторичных про-
цессах переработки (каталитический крекинг, гидрокрекинг).
Гудрон - остаток вакуумной переработки мазута - подвер-
гается деасфальтизации, коксованию с целью углубления пере-
работки нефти и используется в производстве битума.
В последнее время нефть перерабатывается на комбиниро-
ванных установках, сочетающих процессы первичной перегонки
нефти с термическими и каталитическими процессами. Комби-
нированные установки требуют меньших капиталовложений,
чем раздельные установки эквивалентной мощности. Они эко-
номичнее и по эксплуатационным затратам, так как более ра-
ционально используют тепло потоков и вследствие этого расхо-
дуют меньше первичного тепла, воды и электроэнергии. В оте-
чественных установках ЛК-6У комбинируется перегонка нефти
с гидроочисткой, каталитическим риформингом и газофракцио-
нированием. Мощность этих установок по переработке нефти
составляет 6 млн т/год.
5.2.3. Каталитический риформинг углеводородов
Основные цели каталитического риформинга углеводородов в
нефтехимическом комплексе следующие:
1) превращение низкооктановых бензиновых фракций в ка-
тализат - высокооктановые компоненты бензина;
2) превращение бензиновых фракций в катализат, из которо-
го выделяют ароматические углеводороды - бензол, толуол,
этилбензол, изомеры ксилола.
383
Каталитический риформинг проводят в среде водорода при
высоких температурах (480-530 °C), сравнительно низких давле-
ниях (2-4 МПа) и с применением специальных катализаторов. В
процессе образуется избыточное количество водорода, которое
выводится в виде водородсодержащего газа (до 80% Hj) и ис-
пользуется для процессов гидрирования.
Каталитический риформинг - сложный химический процесс,
в котором протекают реакции, приводящие к образованию аро-
матических углеводородов:
дегидрирование шестичленных нафтенов
дегидроизомеризация пятичленных нафтенов
дегидроциклизация (ароматизация) парафинов
н-С6Н
+ 4Н 2;
изомеризация парафинов и ароматических углеводородов
н-С6Н]4 -> изо-СбН]4;
Основные реакции каталитического риформинга - дегидри-
рование нафтенов и дегидроциклизация парафинов - протекают
со значительным тепловым эффектом. Теплота дегидрирования
метилциклогексана в толуол при рабочей температуре 800 К
384
составляет 2212 кДж/кг, а дегидрирования «-гептана в толуол -
2539 кДж/кг.
Основные реакции ароматизации в процессе риформинга со-
провождаются изомеризацией и гидрокрекингом углеводородов.
Теплота реакций изомеризации невелика, а гидрокрекинг про-
текает с выделением тепла, которое частично компенсирует эн-
дотермический эффект основных реакций риформинга.
Реакции ароматизации являются высокотемпературными.
Температура процесса риформинга зависит от применяемого
катализатора и достигает 740-800 К.
Исходя из термодинамики, в процессе риформинга повыше-
ние давления препятствует ароматизации сырья. Однако высо-
кое давление водорода оказывается необходимым для насыще-
ния непредельных углеводородов в побочных реакциях крекин-
га. В случае низкого парциального давления водорода на по-
верхности катализатора происходит уплотнение ненасыщенных
углеводородов с образованием кокса. Повышенное давление и
избыток водорода в процессе препятствуют коксообразованию.
Высокое парциальное давление водорода достигается циркуля-
цией водородсодержащего газа, получаемого в ходе риформинга.
Мольные соотношения циркулирующего водородсодержа-
щего газа и жидкофазного углеводородного сырья находятся в
пределах от 6:1 до 10:1. Увеличение содержания водорода за счет
повышения кратности циркуляции повышает расход энергии на
компримирование циркулирующего газа и расход топлива в
трубчатой печи для подогрева этого газа. Оптимальная концент-
рация водорода в циркулирующем газе составляет 80-90% (об.).
В каталитическом риформинге применяют гетерогенные би-
функциональные катализаторы. Эти катализаторы содержат ме-
таллы (платину, платину и рений, платину и иридий), которые
катализируют реакции дегидрирования и гидрирования. Носи-
телем катализаторов служит промотированный галогенами ок-
сид алюминия, обладающий кислотными свойствами и катали-
зирующий реакции изомеризации и крекинга углеводородов. На
катализаторах риформинга протекают также реакции дегидро-
циклизации парафиновых углеводородов. В отечественной про-
мышленности используют алюмоплатиновые катализаторы
АП-56 и АП-64, которые содержат соответственно 0,65% и 0,64%
платины, нанесенной на Y-AI2O3.
Каталитический риформинг, основные реакции которого эн-
дотермические, осуществляют в адиабатических реакторах. Ре-
акторный блок промышленных установок риформинга обычно
состоит из трех или четырех последовательно работающих реак-
торов с промежуточным подогревом парогазовой смеси в печи.
Технологическая схема установки риформинга представлена на
385
Рис. 5.3. Схема установки каталитического риформинга:
1 - сырьевой насос; 2 - циркуляционный компрессор; 3 - теплообменник; 4 - многока-
мерная трубчатая печь; 5 - реакторы; 6 - воздушный холодильник; 7 - водяной холодиль-
ник; 8 - сепаратор; 9 - стабилизационная колонна; 10 - адсорбер-осушитель
рис. 5.3. Работа установки характеризуется следующими показа-
телями:
Катализатор......................................АП -64
Температура на входе в реактор, °C...............480
Перепад температуры в реакторе, град..............60
Давление, МПа....................................3,5
Объемная скорость, ч_|...........................1,5
Кратность циркуляции............................1800
Содержание нафтенов в сырье, % (мае.)............ 36
Выход катализата, % (мае.)....................... 77
Содержание ароматических углеводородов
в катализате, % (мае.)........................... 64
На установках риформинга с производительностью по бензо-
лу 600 тыс. т в год адиабатический реактор с аксиальным прохо-
дом реакционной смеси имеет внутренний диаметр корпуса 3 м
и высоту 9,4 м. Корпус изготовлен из углеродистой стали, внут-
ренняя футеровка толщиной 0,15 м выполнена из жароупорного
торкрет-бетона. Перепад давлений достигает 1,6 МПа. Для уста-
новок мощностью 1 млн т сырья в год снижение гидравличе-
ского сопротивления достигается использованием реакторов с
цилиндрическим слоем катализатора и радиальным ходом газа.
По мере работы катализатор в реакторе риформинга дезактиви-
руется продуктами уплотнения (коксом), поэтому периодически
проводится его окислительная регенерация.
В установках риформинга применяют печи различной кон-
струкции. Наибольшей эффективностью обладают вертикальные
печи с двухсторонним облучением змеевика. Циркуляцию водо-
родсодержащего газа осуществляют с помощью центробежных
386
Очищенные ароматические углеводороды
Рис. 5.4. Схема установки экстракции ароматических углеводородов:
1 - экстракционная колонна; 2- колонна для отпарки растворителя; 3 - холодильники;
4 - емкости; 5 - печь; 6 - колонна для очистки адсорбентом (глиной); 7 - бензольная ко-
лонна; 8 - толуольная колонна; 9 - ксилольная колонна
компрессоров с приводом от электродвигателя или паровой тур-
бины.
Катализат процесса риформинга перерабатывают по схеме
нефтехимического комплекса по двум альтернативным ва-
риантам:
получение автомобильного бензина;
получение ароматических углеводородов (бензол, толуол,
этилбензол, изомеры ксилола).
При осуществлении первого варианта дополнительно прово-
дится стабилизация бензина, связанная с удалением газов - про-
пана и бутана. Во втором варианте ароматические углеводороды
выделяют из катализата избирательными растворителями. Наи-
более часто применяют для этой цели диэтиленгликоль, триэти-
ленгликоль и сульфолан. В последнее время используют N-
метилпирролидол, который обладает повышенной избиратель-
ностью и позволяет получить ароматические углеводороды по-
вышенной концентрации. Схема экстракции ароматических
углеводородов представлена на рис. 5.4.
Освобожденная от растворителя неароматическая часть ката-
лизата называется рафинатом и представлена смесью парафино-
вых углеводородов нормального и изостроения: изопарафины -
51,7%, «-парафины - 36,5%, нафтены - 10,7%, ароматические
углеводороды - 1,1%. Рафинат используют как сырье процесса
пиролиза в производстве олефинов или при получении раство-
рителей для различных отраслей народного хозяйства.
387
Смесь ароматических углеводородов разделяют ректификаци-
ей с получением товарного бензола, толуола, этилбензола и fl-
ксилола. Изомеры м- и л-ксилола разделить ректификацией
практически невозможно, поэтому используют значительную
разницу в их температуре замерзания (соответственно минус
47,9 °C и плюс 13,3 °C) для их разделения низкотемпературной
кристаллизацией. Технологическая схема довольно сложная, а
использование холода существенно удорожает разделение изо-
меров ксилола. В последнее время низкотемпературная кристал-
лизация заменена на десорбционное разделение на цеолитах.
В промышленности реализован процесс, именуемый
“Парекс”, который осуществляется в адсорбере с неподвижным
слоем цеолита при 150-180 °C и давлении 0,8-1,0 МПа. Коэф-
фициент разделения п- и м-ксилола на цеолитах равен 3,75, что
подтверждает большую способность к адсорбции и-ксилола.
В качестве десорбента в процессе “Парекс” используют п-
диэтилбензол. Экстракт, полученный после десорбции, пред-
ставляет собой смесь и-ксилола и десорбента - и-диэтилбензола,
л-Ксилол (ТКИ11 = 138 °C) легко отгоняется от л-диэтилбензола
(Гкип = 183,6 °C) вследствие значительной разности температур
кипения этих углеводородов. Десорбент циркулирует в замкну-
том контуре: десорбция - отгонка - десорбция.
5.2.4. Производство низших олефинов пиролизом углеводородов
Низшие олефины (этилен и пропилен) занимают ведущее место
по потреблению в нефтехимическом синтезе. Наиболее много-
тоннажным является производство этилена, за ним следуют про-
пилен, бутилены.
Производство этилена достигает 30 млн т в год и постоянно
растет. На основе этилена производят этиловый спирт, поли-
этилен, стирол, винилхлорид, этиленхлорид и др.
Пропилен служит исходным сырьем в производстве изопро-
пилового спирта, акрилонитрила, полипропилена, глицерина,
изопропилбензола, н-бутилового спирта.
В настоящее время основным процессом получения низших
олефинов является пиролиз углеводородного сырья, проводи-
мый с целью производства этилена. Одновременно при пироли-
зе получают другие олефины - пропилен, бутилены и бутадиен.
В этом процессе образуются жидкие продукты (смола пироли-
за), которые содержат такие ценные углеводороды, как изопрен,
циклопентадиен, бензол, толуол, ксилолы, стирол и нафталин.
Пиролиз представляет собой процесс глубокого расщепления
углеводородного сырья под воздействием высоких температур.
Парафиновые, нафтеновые и высшие олефиновые углеводороды
термодинамически нестабильны при повышенных температурах.
Первичные реакции расщепления парафинов могут идти в двух
388
направлениях: разрыв цепи по связи С—С с образованием не-
предельного и предельного углеводородов; дегидрирование
(разрыв связей С—Н). Применительно к пропану можно запи-
сать реакции образования олефинов:
СН3СН2СН3 -> СН2=СН2 + СН4;
СН3—СН2 СНз -> СНз—СН=СН2 + Н2.
Первое направление реакций термодинамически более веро-
ятно, поскольку энергия разрыва связи С—С меньше, чем связи
С-Н
Реакции по обоим направлениям протекают с поглощением
тепла и увеличением объема. Следовательно им благоприят-
ствуют высокие температуры и низкие давления. Понижение
парциального давления углеводородов в процессе пиролиза до-
стигается разбавлением исходного сырья водяным паром
Вторичные реакции, протекающие при пиролизе, весьма
многочисленны: изомеризация парафиновых цепей, нафтеновых
циклов и алкильных групп алкилароматических углеводородов;
циклизация и дегидроциклизация олефинов с шестью и более
атомами углерода; циклизация диенов; полимеризация олефи-
нов и диенов; конденсация ароматических углеводородов. В
результате всех этих реакций образуются многочисленные цен-
ные вещества, входящие в состав пиролизной смолы. Вторичные
реакции в противоположность реакциям расщепления идут с
выделением тепла и уменьшением объема, поэтому их протека-
нию благоприятствуют повышение давления и сравнительно
невысокие температуры. Кроме указанных продуктов при пиро-
лизе образуются продукты уплотнения - кокс. Для снижения
коксобразования пиролиз проводят с добавлением водяного
пара.
В настоящее время в качестве сырья пиролиза наиболее часто
используют прямогонный бензин и бензин-рафинат. Условия
проведения процесса и выходы продуктов пиролиза бензинов
при наиболее благоприятных режимах приведены в табл. 5.1.
Химико-технологическая система получения этилена включа-
ет следующие подсистемы (установки):
пиролиз углеводородов;
компримирование газа пиролиза;
удаление тяжелых углеводородов;
осушка газа пиролиза на цеолитах;
разделение газа пиролиза (фракционирование);
удаление сероводорода, диоксида углерода и ацетилена из га-
за пиролиза.
Блок-схема ХТС производства этилена и пропилена из бен-
зина изображена на рис. 5.5. Бензин и рециркулирующий этан
389
Таблица 5.1. Условия проведения процесса и состав продуктов пиролиза бензинов
Показатель | Прямогонный бензин | | Бензин-рафинат
Интервал выкипания сырья, °C 52-163 58-126
Температура пиролиза, °C 840 830
Разбавление водяным паром, % (мае.) 50 50
Продолжительность реакции, с 0,48 0,6
Выход, % (мае.)
Н2 1,1 1,0
сн4 15.4 13,7
С2Н2 0,4 0.4
с2н4 26,3 26,4
С2н6 3,8 3,1
С3н4 0,6 0,4
С3н6 16,1 15,2
СзН8 0,5 0,5
С4н6 4,6 3,8
С4н8 4,6 7,0
С4Ню — 0,1
Продукты глубокого распада и уплотнения 26,6 28,4
(пиролизная смола), % (мае.)
поступают на пиролиз. Продукты пиролиза (пирогаз) направля-
ются на стадию первичного фракционирования, где легкая и
тяжелая смолы отделяются от газа пиролиза. Последний на-
правляется на компримирование. Газ пиролиза очищают от се-
роводорода и диоксида углерода, одновременно отделяются тя-
желые фракции (С5 и выше). После осушки газ пиролиза посту-
пает на разделение. В современных установках перед разделени-
ем газ подвергают глубокому охлаждению и выделяют водород и
метан. Этан-этиленовая фракция подвергается очистке от аце-
тилена методом селективного гидрирования и разделения на
этилен с концентрацией 99,9% и этан. Последний возвращается
на пиролиз.
Пропан-пропиленовая фракция подвергается разделению на
пропан и пропилен. Пропан направляется на пиролиз или на
получение сжиженного бытового газа, а пропилен с концентра-
цией 99,9% поступает на производство полипропилена или
других нефтехимических продуктов.
Фракция С4 направляется на специальные установки для вы-
деления бутиленов и бутадиена.
При пиролизе бензинов образуется до 20-30% жидких про-
дуктов (смолы пиролиза). На установках мощностью 300 тыс.
т/год этилена (ЭП-300) жидких продуктов получается до 250-
300 тыс. т/год. Вследствие этого их нельзя рассматривать как
отход и важно комплексно использовать для получения ценных
продуктов. В настоящее время пиролиз рассматривается как
один из основных источников бензола, ксилолов, циклопента-
390
Фракции С5‘
и выше
Бензин
[Продукты!
I пиролиза*!-—
Газ J
пиролиза!
Легкая | и | тяжелая
смолы на переработку
Пирогаз
на очистку
4
7
Этан
Этилен товарный
Водород
Метан
Этан-этиленовая| L I
* фракция I । -| Г
П ропан -«------
Бытовой газ
(пропан)
Пропилен •<-------
товарный (99,9%)
Метан! С4-С4
и выше
| Бутан-бутиленовая
фракция *
10
9
Рис. 5.5. Схема получения низших олефинов (этилена и пропилена):
1 - пиролиз; 2 - первичное фракционирование; 3 - компримирование; 4 - выделение
тяжелых углеводородов; 5 - очистка пирогаза от сероводорода и диоксида углерода; 6 -
сушка; 7 - охлаждение и выделение водорода; 8 - разделение газа пиролиза; 9 - очистка от
ацетилена и разделение этана и этилена; 10 - очистка от метилацетилена н разделение
пропана и пропилена
диена, циклопентена, изопрена, стирола, нафталина, нефтепо-
лимерных смол, сырья для производства технического углерода,
растворителей. Получение ряда химических продуктов из смолы
пиролиза успешно конкурирует с традиционными процессами
их получения. В настоящее время в нашей стране около 20%
бензола вырабатывается из смолы пиролиза. Себестоимость пи-
ролизного бензола в 1,3-1,5 раза ниже, чем при получении его
каталитическим риформингом. За счет этого себестоимость эти-
лена также снижается на 20-30%.
В легкой смоле пиролиза бензинов образуется: бензола - до
6-7%, толуола - до 4-5%, ксилолов - до 2%, стирола - около 1%
от количества исходного сырья.
Легкая фракция смолы пиролиза (температура кипения менее
70 °C) содержит до 30% циклопентадиена и 10% изопрена. Тя-
желая смола (температура кипения >190 °C) в своем составе
имеет нафталин и конденсированные ароматические углеводо-
роды. Квалифицированная переработка смолы пиролиза с выде-
лением указанных веществ представляет самостоятельную весь-
ма сложную подсистему в ХТС получения этилена. Смолу пиро-
391
Бензин (1109,3)
~г
Пиролиз
I
Продукты Этан
Тяжелая
смола (58)
Г
Переработка
смолы
— > Этилен (300)
— ► Пропилен (149)
— ► Пропан (8,2)
— ► Фракция С4 (115,7)
— ► Водород (18,3)
— ► Метановая
фракция (181,3)
— ► Ацетилен (3,9)
,—► Метилацетилен (5,9)
— ► Топливный газ (39)
— ► Топливный газ (41)
— ► Фракция С5 (41)
— ► Бензол (95)
' —► Ксилолы (19)
— ► Сольвент (10)
—► Бифенил (4)
—► Пиропласт (20)
I—► Пиропласт (24)
'—► Сырье для
технического углерода (34)
Рис. 5.6. Схема переработки бензина на установке пиролиза ЭП-300. Цифры -
количество сырья и продуктов (тыс. т/г)
лиза разделяют на фракции, каждая из которых затем подверга-
ется переработке. Из фракции до 70 °C извлекают изопрен и
циклопентадиен; фракция 70-130 °C гидрируется, после чего из
нее выделяют бензол, в том числе бензол, образовавшийся при
гидродеалкилировании толуола. Из фракции 130-190 °C после
предварительного гидрирования выделяют ксилолы и сольви-
нит. Из этой же фракции получают и светлые полимерные смо-
лы, которые применяются для лаковых покрытий. Из тяжелой
смолы можно выделить нафталин, получить мягчители для ре-
зины.
Схема переработки бензина на установке ЭП-300 приведена
на рис. 5.6.
Пиролиз углеводородов осуществляют в трубчатых печах,
представляющих собой змеевиковые реакторы с внешним обо-
гревом. Установка пиролиза включает печной блок, состоящий
из печей пиролиза бензина и этана, закалочно-испарительных
аппаратов (ЗИА), узла дозакалки (дополнительное быстрое ох-
392
Рис. 5.7. Схема печного блока пиролиза:
1 - закалочно-испарительные аппараты; 2 - паросборники; 3 - теплообменники; 4 -
печь пиролиза бензина; 5 - печь пиролиза этана
лаждение) пиролиза циркулирующим котельным топливом в
теплообменнике. Принципиальная схема печного блока пред-
ставлена на рис. 5.7.
Бензин из сырьевых емкостей подается в теплообменник 3,
где подогревается потоком циркулирующего котельного топлива
до 120 °C. Подогретое сырье поступает в змеевики верхней низ-
котемпературной зоны конвекции печи 4, где оно нагревается
до 157 °C и частично испаряется. На выходе из верхней конвек-
ционной зоны бензин смешивается с водяным паром (паром
разбавления), смесь с температурой 185 °C поступает в зону
высокотемпературной конвекции, где нагревается до 545 °C и
затем направляется в зону радиации, где осуществляется пиро-
лиз при 830-850 °C.
Этановая фракция, выделяемая из продуктов пиролиза в от-
делении газоразделения, подогревается в теплообменнике 3 во-
дяным паром до 60 °C и поступает на пиролиз в печь 5, где
смешивается с водяным паром разбавления. Количество пара
разбавления составляет 50-60% от расхода бензина и 30-40% от
расхода этана.
Современное производство этилена ЭП-300 включает 16 пе-
чей для пиролиза бензина и две печи для пиролиза этана. Печи
объединены по две общим газоходом и дымовой трубой. Каждая
печь имеет свою систему утилизации тепла дымовых газов и
393
пирогаза, состоящую из экономайзера, двух закалочно-испа-
рительных аппаратов 1 и двух паросборников 2. В ЗИА проис-
ходит закалка и охлаждение пирогаза до 350-450 °C. За счет
утилизации тепла пирогаза в них вырабатывается водяной пар
высокого давления (12 МПа).
Дальнейшее охлаждение пирогаза до 180 °C осуществляется в
узле дозакалки при впрыске циркулирующего котельного про-
дукта. Дозакалка проводится в смесителе непосредственно перед
колонной фракционирования.
Питательная вода для ЗИА с установки химической подго-
товки поступает в конвекционную секцию пароперегревателя,
где нагревается до 190 °C. Затем она подается в конвекционную
секцию печей пиролиза и с температурой 330 °C поступает в
барабан-паросборник, откуда вода поступает в ЗИА, а водяной
пар с давлением 12 МПа - в радиантную секцию пароперегрева-
теля, обогреваемую (облучаемую) непосредственно горелками,
где перегревается до 540 °C, и далее - в заводской коллектор.
Вырабатываемый пар используется для привода паровых турбин
компрессоров пирогаза.
Печи пиролиза бензина установок ЭП-300 - четырехпоточ-
ные с вертикальным однорядным расположением змеевика
двухстороннего облучения. Каждый змеевик состоит из восьми
труб диаметром 125 и толщиной стенки 95 мм, общая его длина
75 м. Материал труб - сталь Х25Н20, максимально допустимая
температура стенки 1040 °C. Производительность печи по бен-
зину - 10,5 т/ч, теплопроизводительность печи 62,5 ГДж/ч, в
том числе радиантной секции - 29 ГДж/ч.
Экономичность этиленового производства в большой степени
зависит от тепловой эффективности пиролизной установки,
основными процессами в которой являются пиролиз и охлажде-
ние пирогаза.
Тепловые затраты на пиролиз включают в себя: подогрев
сырья и воды от температуры окружающей среды до кипения,
испарение их, нагрев парогазовой смеси до конечной темпера-
туры (температура пиролиза) и эндотермическое расщепление
углеводородов. Реакция разложения углеводородов имеет тепло-
вой эффект 1000-2500 кДж/кг сырья в зависимости от состава и
глубины разложения. Всего для процесса пиролиза затраты
тепла составляют 3800-6300 кДж/кг сырья.
В процессе пиролиза полезным является только тепло, идущее
на компенсацию эндотермического эффекта реакций разложения.
Следовательно, тепловой КПД процесса (ц) можно выразить так:
и = Qp/О = Ор/(Ор + Ос + Ов),
где Q - общее количество тепла, подведенное в процессе; Qp - теплота разло-
жения углеводородов; Сс - тепло, идущее на нагрев сырья; £?в - тепло, расходу-
емое на нагрев воды, ее испарение и перегрев водяного пара.
394
Таблица 5.2. Тепловой КПД процесса пиролиза бензина
Температура пиролиза, °C Значения л (%) при разбавлении паром [% (мае.)] 20 | 40 | 60 | 80
750 800 850 30,0 25,0 22,0 19,0 28,5 24,0 21,0 18,5 27,0 23,0 20,0 17,0
Значение Q зависит от вида сырья, температуры процесса и
разбавления паром.
С ростом температуры пиролиза и количества разбавительного
пара увеличивается удельный расход тепла. Это приводит к сниже-
нию теплового КПД процесса, что подтверждают данные табл. 5.2
Тепловая эффективность процесса пиролиза зависит от ис-
пользования тепла (регенерации) пирогаза после трубчатой пе-
чи. В данном случае тепло пирогаза представляет собой вторич-
ные энергетические ресурсы установки. Проанализируем тепло-
вую эффективность пиролизной установки. В общем виде КПД
установки (г;уСТ) можно представить следующим образом:
Пуст ( Qp + Орет)/ Ообпо
где £>рсг - регенерированное тепло; ()обц1 - суммарное тепло, затраченное на
нагрев всех технологических потоков установки.
Значение Собщ определяется из уравнения:
Собш BQH ^hcGc + ААВП(7ВП + Айзв(7зв + АЛОТПб0Т|| + £?эл,
где В - расход топлива на печи пиролиза; Q„ - низшая теплота сгорания топли-
ва; Дй - разность энтальпий; G - расходы соответствующего компонента; члены
уравнения ДЛС<7С, ДйвпСвп, /\hiRG-№, 5.hm„Gm„ представляют собой количество
тепла, внесенного с сырьем, разбавительным водяным паром, закалочной во-
дой, паром, подаваемым в отпарные колонны и другие аппараты, рэл - расход
электролитической энергии, преобразованной в тепловую и внесенной в техно-
логические потоки насосами, газодувками, компрессорами
Определим тепловые потоки и экономичность типовой пиро-
лизной установки. Пиролиз бензина производится при соотно-
шении пархырье, равном 0,5:1, и температуре 850 °C (на выходе
из змеевика печи). Для нагрева парогазовой смеси и термиче-
ского разложения углеводородов требуется 4810 кДж/кг сырья.
Принимаем, что топливом является метановодородная фракция
с установки газоразделения с QH = 49700 кДж/кг, температура
уходящих дымовых газов = 400 °C и потери в печи на излу-
чение - 5% от теплотворной способности топлива. При этих
условиях КПД печи равен:
Он + ?в + — 0?ух + ?изл)
ц =---------------------------= 0,75,
Ообщ
где qB и <?т - теплота, подведенная в печь с воздухом и топливом; q^ - потери
тепла с уходящими газами; ?изл - потери тепла на излучение.
395
Рис. 5.8. Диаграмма удельных тепловых потоков пиролизной установки:
I - тепло, выделившееся при сгорании топлива; If - тепло, подведенное с разбавитель-
ным паром; II/ - общее количество тепла, подведенное в пиролизную установку; IV - тепло
на компенсацию эндотермического эффекта реакции пиролиза; V - потерн на излучение от
печи; VI - тепло, использованное в КУ; VII - потери тепла с дымовыми газами; VIII -
теплосодержание пирогаза на выходе из печи; IX - тепло, использованное в ЗИА; X - тепло-
содержание пирогаза на выходе из ЗИА; XI - тепло, использованное в МТ; XII - теплосо-
держание пирогаза после колонны-охладителя; XIII - тепло, отданное циркуляционной
воде; XIV- тепло, уходящее с подсмольной водой; XV- тепло, уходящее с пирогазом
При найденном значении КПД печи на 1 кг бензина требует-
ся В = 0,128 кг топлива.
Диаграмма удельных тепловых потоков установки представ-
лена на рис. 5.8. От сгорания топлива в печь вносится BQH =
= 6410 кДж (тепловой поток I) и с водяным паром - 1340 кДж
(поток II). В случае отсутствия подогрева сырья и отсутствия
водяной закалки Дйс(?с = 0 и Айзвбзв = 0. Величина Дйотп6отп
мала и ею в расчетах можно также пренебречь. Таким образом,
если на установке пиролиза тепло пирогаза не регенерируется,
то тепловой КПД установки составит
Л / =-----— ---------= 0,16.
BQh + АйвпС7вп
При использовании тепла пирогаза в закалочно-испа-
рительном аппарате (ЗИА) для выработки пара высокого или
среднего давления при охлаждении с 850 до 400 °C КПД уста-
новки значительно повышается:
П// =- Ср+<2зиа = 0,44.
+ Лйвп(7вг|
При принятых параметрах на каждый килограмм пиролизуе-
мого бензина образуется в ЗИА 1,6 кг водяного пара. В случае
использования тепла уходящих дымовых газов при охлаждении
их от 400 до 200 °C в котле-утилизаторе (КУ) или экономайзере
КПД установки составит:
QP +0ку
ц п. =---------------= 0,25 .
BQh + Айвп(7вг|
Как видно, регенерация тепла уходящих дымовых газов также
существенно повышает КПД установки пиролиза. При исполь-
396
зовании тепла пирогаза и в ЗИА, и в КУ коэффициент полезно-
го действия установки пиролиза (тепловой КПД) составит:
GP + Озиа + Ску = 0^3
вп
П/и
После ЗИА пирогаз охлаждается впрыском масла до темпера-
туры 200 °C. Тепло, воспринятое маслом при этой температуре,
легко утилизируется для выработки пара или нагрева питатель-
ной воды в масляном теплообменнике (МТ), и тогда имеет мес-
то дальнейший рост эффективности установки:
<?р + Озиа + Оку + Омт
BQh + &hBnG вп
П/и
Приведенные расчеты убеждают в том, что при утилизации
тепла пирогаза и продуктов сгорания топлива как вторичных
энергетических ресурсов (ВЭР) возможно достичь существенно-
го роста эффективности пиролизных установок. Дальнейшее
повышение тепловой экономичности связано со значительными
техническими трудностями, поскольку неутилизированное тепло
находится на низкотемпературном уровне. Основное количество
тепла теряется с дымовыми газами (630 кДж) и с пирогазом
(2200 кДж), что видно из диаграммы потоков (см. рис. 5.7). Ис-
пользование дымовых газов при температуре ниже 200 °C в
большинстве случаев технически затруднительно и неэкономич-
но, и утилизация их тепла практически не осуществляется.
Тепло, выделяющееся при охлаждении пирогаза от 100-120 °C
до 80 °C, может быть использовано для генерирования холода в
абсорбционных холодильных машинах (АХМ). При охлаждении до
80 °C из пирогаза конденсируется около 60% водяных паров и воз-
вращается тепло в количестве около 910 кДж/кг. В случае приме-
нения АХМ повышается степень регенерации тепла на установке
пиролиза и возрастает тепловой КПД до 73%.
Проведенный анализ тепловой схемы пиролизной установки
показывает, что из подведенного тепла (7750 кДж) в печи пиро-
лиза полезно используется 16%, в закалочно-испарительном
аппарате - 28%, в котле-утилизаторе - 9%, в масляном теплооб-
меннике - 10%, а 37% тепла теряется в основном с пирогазом и
дымовыми газами, а также на излучение в окружающую среду.
Утилизация тепла вторичных энергоресурсов увеличивает КПД
установки пиролиза в 4 раза.
Приближенно тепловой КПД пиролизной установки нахо-
дится как сумма КПД отдельных процессов:
Пуст — Ппир + Ппечи + Пку + Пзна + Пмт,
где т]ку, ПзИа» Л мт - абсолютные КПД процессов охлаждения, т. е. отношения
тепла, полезно воспринятого соответственно в КУ, ЗИА и МТ, к общему коли-
честву тепла, подведенного к установке.
397
Практически значения г)пир находятся в пределах 14-40%.
Регенерация тепла позволяет получить г]уст = 25+70% в зависи-
мости от сырья и степени утилизации вторичных энергоресур-
сов.
5.2.5. Производство этилбензола и диэтилбензола
Этилбензол С6Н5С2Н5 используют в промышленности в основ-
ном как сырье для синтеза стирола. Большую часть этилбензола
получают алкилированием бензола этиленом и значительно
меньшее его количество выделяют сверхчеткой ректификацией
из продуктов риформинга прямогонного бензина.
Реакция алкилирования может протекать как в газовой, так и ‘
в жидкой фазах. В настоящее время наиболее широко распро-
странен жидкофазный процесс с хлоридом алюминия в качестве
катализатора. Катализатор подготавливают отдельно растворе-
нием хлорида алюминия в бензоле при добавлении хлороводо-
рода или хлорэтила (промоторы). Образуется катализаторный
комплекс, который затем взаимодействует с этиленом:
Катализаторный комплекс готовят в отдельном аппарате и
периодически вводят в реактор алкилирования.
Алкилирование осложнено побочными реакциями (крекинг,
полимеризация). Среди них наибольшее значение имеет образо-
вание полиалкилированных ароматических углеводородов. В
результате в продуктах реакции содержится смесь моно-, ди-,
три-, тетра- и более алкилированных этилбензолов. Выбирая
оптимальное соотношение бензола и этилена в исходном сырье-
вом потоке, можно получить максимальный выход моноэтил-
бензола, однако совсем исключить образование полиэтилбензо-
лов нельзя.
Реакция алкилирования обратима, поэтому полиалкилбензо-
лы под влиянием хлорида алюминия реагируют с бензолом,
образуя этилбензол:
С6Н5(С2Н5)2 + С6Н6 2С6Н5—С2Н5.
398
Таблица 5.3. Термодинамически равновесный состав реакционной массы в процессе
алкилирования бензола этиленом
Мольное соотношение С2Н„.С6Н6 Содержание в алкилате, % (мае.)
бензола этилбензо- ла диэтил- бензола триэтил- бензола тетраэтил- бензола
0,2:1 75,6 22,9 1,5 0,02
0,4:1 56,0 38,0 5,7 0,20 —
0,6:1 40,6 46,8 11,9 0,72 0,02
0,8:1 28,6 50,1 19,4 1,77 0,09
1,0:1 19,6 49,3 27,3 3,57 0,25
Эта реакция переалкилирования позволяет фактически всему
этилену и бензолу, поступившим в реактор, превратиться в
этилбензол. Равновесные содержания алкилбензолов представ-
лены в табл. 5.3.
На процессы алкилирования и переалкилирования оказы-
вают влияние такие главные факторы: концентрация катализа-
тора (хлорида алюминия), концентрация промотора (НС1), тем-
пература, время контакта, мольное соотношение этилена и бен-
зола, давление.
Технологические схемы действующих производств не имеют
принципиальных различий; одна из них показана на рис. 5.9. В
ней можно выделить реакционный узел (аппараты 7, 2) и си-
стемы выделения продукта ректификацией (колонны 7), подго-
товки свежего (б) и нейтрализации отработанного (5) катализа-
тора, очистки хвостовых газов (4, 5).
Рис. 5.9. Схема процесса алкилирования бензола этиленом:
1 - реактор алкилирования; 2 - отстойник; 3 - узел промывки алкилата; 4 - узел кон-
денсации н абсорбции бензола из хвостовых газов; 5 - нейтрализатор хвостовых газов; 6 -
реактор приготовления катализатора; 7 - ректификационные колонны Потоки: Б - бензол;
Б(р) - рециркулирующий бензол; Эт - этилен; ЭБ - этилбензол; ДЭБ - диэтилбензол на
абсорбцию и приготовление катализатора; К - катализатор; Кк - катализаторный комплекс
(рецикл); Отх.- отходы нейтрализации катализаторного комплекса
399
Процесс алкилирования бензола этиленом проводится в по-
лом реакторе колонного типа в режиме барботажа. Одновремен-
но с алкилированием осуществляется и реакция переалкилиро-
вания полиэтилбензолов. В реактор вводятся потоки бензола,
полиэтилбензолов, свежего и рециркулирующего катализаторно-
го комплекса, газообразного олефина. Отвод теплоты реакции
осуществляют за счет испарения бензола в реакторе и отвода его
паров с последующей конденсацией и рециркуляцией. Темпера-
тура процесса составляет 80-130 °C и ее поддерживают регули-
рованием давления в реакторе (0,1-0,6 МПа) - от него зависит
температура испарения.
Показанный в реакции (5.1) катализаторный комплекс час-
тично растворен в реакционной смеси и присутствует также в
виде отдельной фазы. В ней образуются более сложные ком-
плексы, не активные в реакции алкилирования. При недоста-
точно интенсивном перемешивании фазы катализаторного ком-
плекса и реакционной смеси могут расслаиваться в реакторе
(комплекс почти вдвое тяжелее алкилата), что отрицательно
сказывается на процессе - ухудшается растворение активной
части комплекса в реакционной смеси, большая часть активного
комплекса переходит в неактивный, накапливаются полимерные
образования. Поэтому барботаж этилена как способ перемеши-
вания должен быть организован таким образом, чтобы исклю-
чить застойные зоны в реакторе и обеспечить хорошее раство-
рение активной части катализатора в реакционной смеси. Для
этого был разработан алкилатор, схема которого показана на
рис. 5.10, а. В нем газ распределяется по сечению реактора че-
рез множество маленьких форсунок. Свежий бензол и катализа-
тор вводят через отдельный штуцер в середину газового потока
этилена. Тем самым обеспечивается быстрое диспергирование и
контакт реагентов. Рециркулирующие бензол и катализаторный
комплекс вводят по касательной вдоль корпуса (рис. 5.10, б),
что способствует размыванию застойных зон у днища реактора.
Более чистый алкилат отбирается из верхней части реактора и
отстаивается от катализаторного комплекса, который возвра-
щается в реакционную зону.
Время контакта в реакторе при заданной температуре опре-
деляется скоростью наиболее медленного процесса - переалки-
лирования. При 130 °C оно составляет около 60 мин. В этих
условиях обеспечивается полная конверсия этилена и достигает-
ся равновесный состав реакционной смеси, который зависит от
исходного соотношения олефин : бензол. Обычно используют
мольное соотношение олефин:бензол = 1:(2-^3). При этом реак-
ционная масса имеет состав [% (мае.)]: бензол - 45-56; этилбен-
зол - 36-41; полиалкилбензолы - 8-12. Расход бензола на тонну
400
Рис. 5.10. Реактор алкилирования бензола этиленом:
а - общий вид; б - схема ввода рециркулирующего потока
этилбензола составляет 0,8 т, этилена - 0,26 т, хлорида алюми-
ния - 4-6 кг. Съем этилбензола с единицы реакционного объема
достигает 200 кг/(м3 • ч).
При рециркуляции катализаторного комплекса происходит
снижение его активности ввиду накопления тяжелых углеводо-
родов и смол. Это не только снижает выход этилбензола, но и
повышает расход катализатора AICI3. В результате с установки
вынуждены выводить большое количество катализаторного ком-
плекса. Отводимый из системы отработанный катализаторный
комплекс разлагают водой:
AICI3 + ЗН2О = А1(ОН)з + ЗНС1.
Углеводородный слой, образовавшийся после обработки ка-
тализаторного комплекса водой, смешивают с кислым алкила-
том и направляют на разделение продуктов, а водный слой вы-
водят из системы.
Обработка продуктов реакции описанным способом приводит
к образованию большого количества сточных вод (10-12 м3 на
1 т этилбензола). Кроме того, образовавшийся хлороводород
вызывает коррозию аппаратуры и трубопроводов и приводит к
необходимости использования дорогостоящих сплавов.
Для очистки сточных вод сначала проводят отправку органи-
ческих примесей, затем добавляют к воде известковое молоко и
полиакриламид. Скоагулировавший осадок обезвоживают на
фильтр-прессах и передают на утилизацию. Осветленную воду
выводят на установку биохимической очистки или передают на
восполнение потерь воды в других производствах (например, в
производстве стирола).
Разделение алкилата осуществляют на трехколонном ректи-
фикационном агрегате. Первая колонна, предназначенная для
401
Рис. 5.11. Схема высокотемпературного гомогенного алкилирования бензола
этиленом:
1 - реактор алкилирования; 2 - реактор переалкодирования; 3 - испаритель; 4 - конден-
сатор; 5- сепаратор; 6- абсорбер; 7- котел-утилизатор (парогенератор)
отгонки бензола, имеет около 20 тарелок и работает при атмо-
сферном давлении. Во второй колонне (60 тарелок) получается
концентрированный этилбензол (99,8%). Третья колонна служит
для отделения полиалкилбензолов от смолы, она снабжена 40-
50 тарелками и работает при остаточном давлении 5,3 кПа
(40 мм рт. ст.).
Фирма “Monsanto” (США) внедрила процесс гомогенного
высокотемпературного алкилирования бензола этиленом. Харак-
терными особенностями процесса являются подача очень малого
количества катализатора и отсутствие рециркуляции катализа-
торного комплекса, проведение процесса при температуре выше
150 °C. Катализатор используется однократно и выводится из
системы. Наряду с реактором алкилирования имеется отдельный
реактор переалкилирования. Принципиальная технологическая
схема процесса приведена на рис. 5.11.
В реактор 1 подаются реагенты и катализатор. Тепло реакции
используется для генерирования водяного пара в парогенераторе
7. Это существенно улучшает экономические показатели про-
цесса. Алкилат поступает в реактор переалкилирования 2, туда
же подаются рециркулирующие полиалкилбензолы. Смесь нахо-
дится в реакторе в течение времени, необходимого для достиже-
ния равновесия. Выходящий из реактора 2 продукт осво-
бождается от газообразных компонентов в испарителе 3 за счет
снижения давления и далее направляется на промывку водой.
Пары через конденсатор 4 и сепаратор 5 поступают в абсорбер
6, где промываются бензолом. Жидкая фаза из абсорбера воз-
вращается в реактор, а газ отдувается и передается в топливную
сеть. Ввиду меньшего расхода хлорида алюминия в данном про-
цессе понижена коррозионность реакционных сред, и аппараты
изготовлены из углеродистой стали, покрытой торкрет-бетоном.
402
По данной технологии осуществляется производство этилбензо-
ла с единичной мощностью в 750 тыс. т в год.
Диэтилбензол получают диспропорционировани-
ем этилбензола:
Положение второй метильной группы в диэтилбензоле пока-
зано в скобках, так как образуется равновесная смесь изоме-
ров - о-, м- и л-диэтилбензола в соотношении при 400 К
0,28:0,51:0,21. Равновесное превращение диэтилбензола равно
0,37. Образуются также полиалкилбензолы.
Схема процесса включает в себя две основные системы - ре-
акционный узел и систему разделения (рис. 5.12).
Катализаторный комплекс аналогичен комплексу для алки-
лирования бензола и обладает теми же недостатками - расслое-
ние с реакционной средой, дезактивация алкилбензолами. По-
этому длительное его пребывание в реакторе и недостаточно
интенсивное перемешивание снижают интенсивность процесса
и ухудшают качество продукта. В реакторе смешения необходи-
мое время пребывания составляет более 50 мин. Из-за распреде-
ления времени пребывания реакционной смеси в таком реакто-
ре часть ее пребывает в нем достаточно долго. Проис-
ходит непрерывное испарение бензола. Все это приводит к по-
вышенному образованию полиалкилбензолов.
Рис. 5.12. Схема синтеза диэтилбензола диспропорционированием этилбензола:
1 - реактор приготовления катализатора; 2 - трубчатый реактор; 3 - отстойник; 4 - узел
отмывки катализата; 5 - ректификационные колонны; 6 - колонна выделения и осушки
бензола. Потоки: ЭБ - этилбензол; ДЭБ - диэтилбензол; Б - бензол; ЭБ(р) - рециркули-
рующий этилбензол; К - катализатор; Кк - катализаторный комплекс (рецикл); Отх,- отхо-
ды нейтрализации катализаторного комплекса; ПАБ - полиалкилбензолы
403
Равновесие же может быть достигнуто практически за 8-
12 мин (в зависимости от концентрации катализатора и темпе-
ратуры). Это можно реализовать в режиме идеального вытесне-
ния в реакторе в виде трубы. Поскольку течение в нем довольно
медленное (около 1 см/с при длине реактора 12-15 м), то поток
легко расслаивается - образуются паровая фаза и две жидкие.
Специальные вставки-смесители, показанные на рис. 2.76, е,
предотвращают расслоение, и в реакторе движется хорошо пе-
ремешанный парожидкостной поток. Тем самым предотвра-
щается образование заметных количеств полиалкилбензолов, и
выход диэтилбензола увеличивается на 6-7%. Для уменьшения
дезактивации катализаторного комплекса кубовая жидкость из
первой колонны системы разделения возвращается в реактор с
содержанием полиалкилбензолов не выше 12-14%.
Хорошо рассчитанная бензольная ректификационная колон-
на с некоторыми усовершенствованиями позволяет получить
еще один ценный продукт - бензол высокой чистоты.
5.2.6. Производство стирола
Стирол СбН5СН=СН2 - один из важнейших продуктов нефте-
химии, сырье для получения полимеров (полистирол, синтети-
ческий каучук) и сополимеров (ударопрочный полистирол на
основе акрилонитрила и бутадиена). Производство стирола -
крупнотоннажное, единичная мощность современных агрегатов
составляет 150-300 тыс. т стирола в год. Основным промышлен-
ным способом производства стирола является в настоящее вре-
мя дегидрирование этилбензола. Перспективным может быть
получение стирола из фракции Cg пиролизной смолы.
Дегидрирование этилбензола в стирол протекает по реакции:
Реакция - эндотермическая и протекает с увеличением объ-
ема. Соответственно с повышением температуры и снижением
парциального давления углеводорода увеличивается степень
превращения этилбензола в стирол. При давлении 0,1 МПа эта
зависимость выглядит так:
Температура дегидрирования, К....700 800 900 1000
Равновесная степень превращения..0,055 0,21 0,53 0,83
Для увеличения глубины превращения сырье разбавляют во-
дяным паром, что эквивалентно снижению давления реагирую-
404
щей смеси. Так, при 900 К равновесная степень дегидрирования
этилбензола в стирол в зависимости от разбавления водяным
паром возрастает следующим образом:
Мольное соотношение Н2О:СбН5СН=СН2 0 5 10 20
Равновесная степень дегидрирования.0,53 0,77 0,85 0,90
В промышленности используют разбавление водяным паром
в соотношении пар:газ = (15ч-20):1 и реакцию проводят при
температуре 830-900 К. Катализаторы приготавливают на основе
оксида железа с добавками К и Сг. На них протекают также
побочные превращения, ток что реакцию дегидрирования мож-
но представить такой схемой:
-----► с6н5сн=сн2 + н2
стирол
* с6н6 + с2н4
бензол
с6н5с2н5 -
этилбензол
—► с6н5сн3 + сн4
толуол
Н2
—► С6Н6 + С2Н6
бензол
* 7С + СН4 + ЗН2
Избирательность по стиролу составляет около 98%. Кроме
реакции распада на катализаторе образуются углистые отложе-
ния. Водяной пар, подаваемый на разбавление, не только сдви-
гает равновесие, но и газифицирует углистые отложения на по-
верхности катализатора. Протекает непрерывная регенерация
катализатора, и срок его службы составляет 1,5-2 года.
Обратимую эндотермическую реакцию проводят адиабатиче-
ски в неподвижном слое катализатора. Диаграмма “Т-х” такого
процесса в однослойном реакторе показана на рис. 5.13 (линия
/). Процесс в двухслойном реакторе с распределением пара
между слоями (линия 2 на рис. 5.13) позволяет увеличить сте-
пень превращения. Использование реактора с радиальными
слоями катализатора существенно сокращает его гидравлическое
сопротивление. Реакционная смесь после реактора поступает на
разделение. Тепло реакционной смеси регенерируют.
405
Рис. 5.13. Диаграмма “Г-Т’ реакции дегидри-
рования этилбензола:
Кривые Хр - равновесные степени превращения: X
- соотношение пар : газ; 1 - режим процесса в одно-
слойном реакторе; 2 - режим процесса в двухслойном
реакторе
На рис. 5.14 приведена технологическая схема дегидрирова-
ния этилбензола. Исходный этилбензол смешивается с рецикло-
вым с установки ректификации и с водяным паром и испаряет-
ся в теплообменнике 2. Пары перегреваются в теплообменнике
4 до 500-520 °C. Испаритель 2 обогревается дымовыми газами, а
перегреватель 4 - контактным газом, выходящим из реактора 3.
Пары алкилбензола и воды смешивают перед реактором с пере-
гретым водяным паром с температурой 700-730 °C. Перегретый
пар генерируется в пароперегревательной печи 1, где сжигаются
топливо из заводской сети и водородсодержащий газ из отделе-
ния дегидрирования. Температура смеси на входе в слой катали-
Рис. 5.14. Схема дегидрирования этилбензола в стирол:
/ - пароперегревательная печь; 2 - испаритель этилбензола; 3 - реактор дегидрирова-
ния; 4 - подогреватель этилбензола; 5 - подогреватель воды; 6 - пенный аппарат; 7 - воз-
душный холодильник; 8 ~ сепаратор; 9- разделитель фаз. Потоки: ЭБ - этилбензол (свежий
и рецикл); Н2, СН4 - горючие газы в топливную сеть; ДГ - дымовые газы; К - конденсат;
ПД - продукты дегидрирования
406
Рис. 5.15. Схема ректификаци-
онного выделения и очистки
стирола:
Б - бензол; Т - толуол; ЭБ -
этилбензол; Ст - стирол; КОРС -
кубовые остатки ректификации
стирола; 1-4 - ректификационные
колонны (см. текст)
затора 600-640 °C, на
выходе она понижается
на 50-60 °C вследствие
протекания эндотерми-
ческой реакции дегидри-
рования. Тепло контакт-
ных газов последователь-
но рекуперируется в теп-
лообменнике 4 и котле-
утилизаторе 5. Насыщен-
ный водяной пар из кот-
ла-утилизатора использу-
ется для разбавления
этилбензола. Контактный газ поступает в пенный аппарат 6, где
дополнительно охлаждается до 102 °C и очищается от катализа-
торной пыли. Охлаждение и конденсация воды и углеводородов
из контактного газа проходит в воздушном холодильнике 7 и
далее - в водяном и рассольном конденсаторах (на схеме не
показаны). В сепараторе 8 отделяются газообразные продукты
реакции как горючие ВЭР. Углеводороды отделяют от воды в
разделителе фаз 9 и направляют на ректификацию. Водный слой
поступает в пенный аппарат 6 и после очистки от растворенных
углеводородов (она не показана) подается на питание котла-
утилизатора 5 и далее - в рецикл. Избытки воды направляют на
биологическую очистку.
Углеводородный конденсат содержит следующие продукты
реакции:
Содержание, % Ткт
Бензол (Б)...................~2 80,1
Толуол (Т)...................-2 110,6
Этилбензол (ЭБ)..............38 136,2
Стирол (Ст)..................58 146,0
Здесь же приведены температуры кипения 7КИП компонентов.
В соответствии с правилами разделения многокомпонентной
смеси (см. разд. 3.10.2) построена схема разделения конденсата
(рис. 5.15). Этилбензол и стирол - близкокипящие жидкости,
поэтому сначала от них отделяют в колонне 1 бензол и толуол.
Их разделяют в колонне 2. Этилбензол отделяют от стирола в
407
колонне 3 и возвращают на дегидрирование как рецикл. Стирол
проходит дополнительную очистку в ректификационной колон-
не 4. Поскольку он легко димеризуется, то очистку проводят в
условиях разрежения при температуре не выше 120 °C и с до-
бавлением ингибитора - серы. Кубовые остатки ректификации
стирола (КОРС) можно регенерировать, как описано в разд.
3.8.2.
Эффективность тепловой схемы агрегата дегидрирования
этилбензола может быть оценена с помощью теплового КПД
(цт), который определяется из соотношения:
Лт ~ СтехнЛОт 0п)>
где Отехн = Оэ + Са + Оку + Опп (Сэ ~ эндотермический эффект реакции дегид-
рирования; 0а - тепло нагрева, испарения и перегрева паров алкилбензола;
Оку - тепло, отданное контактным газом в котле-утилизаторе; Qnn - теплота
перегрева водяного пара в печи); QT - тепло от сгорания топлива; Оп ~ тепло,
подведенное с насыщенным паром от ТЭЦ.
В промышленных агрегатах дегидрирования этилбензола теп-
ловой КПД, как правило, не превышает 28-33%. Анализ пока-
зывает, что главная причина низкой тепловой эффективности
связана с отсутствием рекуперации тепла низкотемпературного
контактного газа. Действительно, в традиционных схемах тепло-
та конденсации паров воды и углеводородов не используется и
теряется в окружающую среду с потоком воздуха в воздушных
конденсаторах и с оборотной водой. Диаграмма тепловых пото-
ков в агрегате дегидрирования этилбензола (рис. 5.16) под-
тверждает, что значительная доля подведенного с топливом
тепла теряется в окружающую среду при охлаждении и конден-
сации контактного газа в холодильнике-конденсаторе 7 и сепа-
раторе 8 (рис. 5.14).
Значительно улучшить использование энергетического по-
тенциала процесса можно в энерготехнологической системе.
Пример такой системы в производстве стирола интересен тем,
что он вытекает из физико-химического анализа условий реак-
ции дегидрирования. Как отмечено выше, разбавление этилбен-
зола водяным паром преследует две цели: сдвинуть равновесие
реакции вправо и создать условия непрерывной регенерации
катализатора. Сам же водяной пар в реакции не участвует; его
приходится получать испарением воды и потом отделять от про-
дуктов реакции конденсацией. Несмотря на регенерацию тепла
потоков, испарение и нагрев, охлаждение и конденсация - про-
цессы в производстве термодинамически необратимые, и энер-
гетический потенциал используется далеко не полностью.
Такое же влияние на процесс, как и водяной пар, может ока-
зать и другой компонент, например СО2. Он инертен в реак-
408
VI
Рис. 5.16. Диаграмма тепловых потоков в агрегате дегидрирования этилбензола:
I - потери с дымовыми газами пароперегревательной печи; II - компенсация эндотер-
мической реакции дегидрирования; III - нагрев этилбензольной шихты; IV - испарение
этилбензола; V - генерирование водяного пара; VI - потери в окружающую среду с охлаж-
дающим воздухом и хладагентом
На сепарацию
Рис. 5.17. Энерготехнологическая схема производства стирола:
I - топка; 2 - реактор-окислитель; 3 - газовая турбина; 4, 6 - реакторы дегидрирования;
5- теплообменник; К - компрессор; Г - генератор
ции, т. е. может быть разбавителем, и способствует регенерации
катализатора, взаимодействуя с углистыми отложениями. Полу-
чают СО2 сжиганием топливного газа. Продукты горения явля-
ются энергоносителем. Это дополнительное свойство разбавите-
ля позволяет создать энерготехнологическую схему производства
стирола, основная часть которой показана на рис. 5.17.
Природный газ сжигают в печи 1, а горючие газы, образую-
щиеся в технологическом процессе, - в каталитическом реакто-
ре-окислителе 2. Образующаяся смесь газов с температурой
1050 °C направляется в газовую турбину 3 для привода компрес-
сора и выработки энергии. Далее газы с температурой 750 °C
смешиваются с этилбензолом и направляются в реакционный
409
узел, состоящий из двух реакторов (4, 6). Разбавление этилбен-
зола такое же, как в традиционном процессе с паром. Промежу-
точный нагрев реагирующей смеси осуществляют в теплообмен-
нике 5 горячими газами. Образующиеся продукты направляются
в систему сепарации. Ее схема отлична от ХТС с использовани-
ем водяного пара, поскольку различаются компоненты разде-
ляемой смеси. Но в данном случае это не принципиально. В
системе сепарации горючие газы возвращаются в энергоузел
системы, а углеводородная смесь направляется на ректифика-
цию. В энерготехнологической схеме есть еще ряд узлов - для
нагрева этилбензола, воздуха, топливного газа, использующих
тепло нагретых потоков. Последние необходимы, чтобы сбалан-
сировать тепловые потоки всей ХТС. На рис. 5.17 они не приве-
дены, здесь внимание сосредоточено на основной части энерго-
технологического узла. Приведенная схема дегидрирования
этилбензола позволяет увеличить энергетический КПД почти
вдвое - до 70%.
5.2.7. Производство полиолефинов и полистирола
Среди выпускаемых промышленностью полимерных материалов
большое значение имеют полиолефины - полиэтилен и поли-
пропилен. Удачное сочетание в полиолефинах механической
прочности, химической стойкости, хороших диэлектрических
показателей, низкой газо- и влагопроницаемости, а также лег-
кость переработки в изделия всеми известными способами, низ-
кая стоимость и доступность сырья позволили полиолефинам
занять первое место в мире среди продуктов химической про-
мышленности.
Производство полиолефинов в большинстве развитых стран
начало развиваться с середины 50-х годов и к настоящему време-
ни достигло больших масштабов. Ниже приведена структура
потребления полиэтилена и полипропилена в промышленности
США (%):
Полиэтилен Полиэтилен Полипропилен
низкой плотности высокой плотности
Формованные изделия.... 1,0 40,0 4,0
Экструзионные изделия.. 6,5 0,5 0,1
Волокна . — — 31,0
Литые изделия 10,0 24,5 36,0
Трубы 2,0 9,5 0,1
Пленки и листы 65 6,5 5,0
Провод и кабель 6,0 3,5 2,0
Прочие изделия 9,5 15,5 21,8
Полиэтилен [—СН2—СНг—]я представляет собой карбоцеп-
ной полимер этилена. Молекулярная масса полиэтилена в зави-
410
симости от метода и режима полимеризации колеблется от де-
сятков тысяч до нескольких миллионов. Полиэтилен - кристал-
лический полимер: при температуре 20 °C степень кристаллич-
ности полимера достигает 50-90% в зависиости от метода полу-
чения.
В настоящее время существует три основных промышленных
метода получения полиэтилена:
1) полимеризация этилена при высоком давлении (100—
350 МПа); процесс протекает при температуре 200-300 °C в рас-
плаве в присутствии инициаторов (кислорода, органических
пероксидов); такой полиэтилен называют полиэтиленом высо-
кого давления (ПЭВД) или полиэтиленом низкой плотности
(ПЭНП);
2) полимеризация этилена при низком давлении (ниже
2,0 МПа) с использованием металлоорганических катализато-
ров; полимеризация протекает при температуре около 80 °C в
суспензии (в среде органического растворителя); такой поли-
этилен называют полиэтиленом низкого давления (ПЭНД) или
полиэтиленом высокой плотности (ПЭВП);
3) полимеризация этилена при давлении 3-4 МПа и темпера-
туре 150 °C в растворе с использованием в качестве катализато-
ров оксидов металлов переменной валентности. Получаемый в
этом случае полиэтилен называют полиэтиленом среднего дав-
ления (ПЭСД).
Полиэтилен низкого давления (ПЭНД) получают
в присутствии катализаторов Циклера-Натта по аналогии с тех-
нологией полипропилена. Наибольшее распространение полу-
чил каталитический комплекс на основе диэтилалюминийхло-
рида Д1(С2Н5)2С1 и тетрахлорида титана TiC14.
Полимеризация этилена осуществляется в реакторе емкост-
ного типа при давлении 0,2-0,5 МПа и температуре 60-80 °C.
Концентрация катализатора в бензине примерно 1 кг/м3, сте-
пень конверсии этилена достигает 98%, а содержание полимера
в суспензии на выходе из реактора около 100 кг/м3. Отвод выде-
ляющегося тепла реакции полимеризации (3600 кДж/кг) затруд-
нен по сравнению с производством полипропилена, а поэтому
осуществляется за счет частичного испарения растворителя,
который после конденсации и охлаждения вновь возвращается в
реактор. Реакторы изготавливаются из нержавеющей стали или
углеродистой стали с защитным (лаковым) покрытием. Схема
реакторного узла с теплосъемом показана на рис. 5.18.
Химико-технологическая система при производстве ПЭНД
включает в себя функциональные подсистемы, подобные тем,
которые имеются и в случае получения полипропилена. Приме-
няемая аппаратура и режимы обработки суспензии полимера
411
полиэтилена
Рис. 5.18. Схема полимеризации этилена при низком давлении:
1 - реактор; 2 - холодильник; 3 - циклон; 4 - насос; 5 - газодувка
после реактора в производстве полипропилена (описаны выше)
и полиэтилена низкого давления практически не отличаются
друг от друга.
Полиэтилен высокого давления получают в тех-
нологическом процессе, состоящем из стадий смешения свежего
этилена с возвратным газом и кислородом, двухступенчатого
сжатия газа, полимеризации этилена, разделения полиэтилена и
непрореагировавшего этилена, поступающего в рецикл, и грану-
ляции продукта. Для окраски, стабилизации и наполнения по-
лиэтилен-гранулят поступает на стадию конфекционирования,
где осуществляется его сухое смешение с добавками, последую-
щее плавление и повторная грануляция.
На рис. 5.19 приведена принципиальная технологическая
схема установки синтеза полиэтилена при высоком давлении.
Этилен с установки газоразделения под давлением 1-2 МПа и
при температуре 10-40 °C подается в ресивер /, где в него вво-
дится возвратный этилен низкого давления и кислород, исполь-
зуемый в качестве инициатора. Смесь сжимается компрессором
промежуточного давления 2 до 25-30 М Па, соединяется с пото-
ком возвратного этилена промежуточного давления, сжимается
компрессором реакционного давления 3 до 150-300 МПа и на-
правляется в трубчатый реактор 4. В реакторе происходит поли-
меризация этилена при температуре 200-320 °C.
Образовавшийся в реакторе расплавленный полиэтилен с не-
прореагировавшим этиленом (конверсия этилена в полимер 10-
30%) непрерывно выводится из реактора через дросселирующий
клапан и поступает в отделитель низкого давления 10. Этилен
возвратный промежуточного давления из отделителя 5 проходит
аппараты охлаждения 6 и сепарации 7, где охлаждается до 30-
412
Рис. 5.19. Схема полимеризации этилена при высоком давлении:
/ - ресивер; 2 - компрессор промежуточного давления; 3 - компрессор реакционного
давления; 4 - трубчатый реактор; 5 - отделитель промежуточного давления; 6, 12 - холо-
дильники; 7, 13 - циклоны; 8 - емкость для инициатора; 9 - дозировочный насос; 10 -
отделитель низкого давления; II - экструдер; 14 - компрессор для рециркулирующего эти-
лена; 15 - емкость для модификатора; Т - теплоноситель
40 °C и где отделяется низкомолекулярный полиэтилен, и затем
подается на всасывание компрессора 3. В отделителе низкого
давления 10 при давлении 0,1-0,5 МПа и температуре 200-
250 °C из полиэтилена выделяется растворенный этилен
(возвратный газ низкого давления), который через аппараты
охлаждения 12 и сепарации 13 поступает в компрессор 14 и да-
лее на смешение со свежим этиленом. Расплавленный полиэти-
лен из отделителя низкого давления 10 поступает в экструдер
11, а из него в виде гранул - на конфекционирование (окраску
и дополнительную обработку).
Расходы этилена и энергоресурсов на 1 т гранулированного
ПЭВД составляют:
Этилен, кг .......................1030
Охлаждающая вода, м3 ........... 160-180
Пар водяной, т...................0,65
Электроэнергия, кВт-ч..........1000-1200
Трубчатые реакторы-полимеризаторы, используемые в уста-
новках большой производительности, состоят из последователь-
413
но соединенных теплообменников типа “труба в трубе” с диа-
метром труб 50-100 мм; длина реакционной зоны в трубчатом
реакторе достигает 1000-1200 м. В качестве теплоносителя для
подогрева этилена и отвода тепла реакции применяют перегре-
тую воду с температурой 190-230 °C, которая поступает в меж-
трубное пространство противотоком к этилену и потоку реакци-
онной массы.
Полипропилен
— СН,—СН
I
сн3
представляет собой продукт
п
полимеризации ненасыщенного углеводорода - пропилена.
Макромолекула полипропилена состоит из элементарных зве-
ньев, регулярно чередующихся вторичных и третичных атомов
углерода. Каждый третичный атом углерода является асиммет-
рическим. Макромолекула полипропилена может иметь одну из
двух возможных конфигураций:
а) изотактическая структура - все группы СН3 находятся по
одну сторону от плоскости цепи
— СН,—СН —СН,—СН—СН2—СН —СН,—СН— ;
2 I 2 I I I
сн3 сн3 сн3 сн3
б) синдиотактическая структура - группы СНз располагаются
строго последовательно по разные стороны от плоскости цепи
СН3 СН3
— СН,—СН —СН,—СН—СН,—СН —СН,—СН— .
2 I 2 I
сн3 сн3
Изотактические и синдиотактические полимеры объединяют-
ся под общим названием стереорегулярных полимеров. Кроме
того, в полипропилене имеются участки цепи со стереоблочной,
или атактической структурой, при которой группы СНз распо-
лагаются беспорядочно:
СН3 СН3 СН3
— СН2— СН — СН—СН — СН—СН — СН—СН — .
СН3
Стереоизомеры полипропилена существенно различаются по
механическим, физическим и химическим свойствам. Полипро-
414
пилен, выпускаемый в промышленности, представляет собой
смесь различных структур, соотношение которых зависит от
условий проведения процесса. Наиболее ценным материалом
является полимер с молекулярной массой 80000-200000 и со-
держанием изотактической части 80-95%.
Содержание в полимере изотактической части зависит от
применяемых для полимеризации катализаторов. На практике
полимеризацию пропилена, как правило, проводят в при-
сутствии каталитического комплекса, который состоит из ди-
этилалюминийхлорида AKCjHs^Cl и трихлорида титана TiC13
(катализатор Циглера-Натта).
Соотношение компонентов в каталитической системе влияет
как на скорость полимеризации, так и на стереоспецифичность.
При мольном соотношении А1(С2Н5)С1:Т1С1з = 2:1 проявляется
максимальная активность катализатора, а при соотношении,
превышающем 3:1, - наибольшая стереоспецифичность.
С повышением температуры увеличивается скорость реакции
полимеризации, молекулярная масса при этом понижается. По-
лимеризацию проводят обычно в области температур 50-100 °C,
когда образующийся полимер не растворяется в реакционной
среде.
Продолжительность процесса зависит от количества вводи-
мого катализатора и концентрации мономера. Время проведения
процесса сокращается с повышением концентрации мономера и
содержания катализатора. Изменение времени полимеризации
не оказывает влияния на молекулярную массу полимера и соот-
ношение аморфной (атактической) и кристаллической (изо-
тактической) фаз.
При полимеризации пропилена в качестве растворителей
обычно применяют насыщенные углеводороды, например гек-
сан, гептан, бензин и др. Растворители в процессе служат одно-
временно осадителями для образовавшегося полипропилена.
Полимеризация пропилена протекает с выделением тепла,
тепловой эффект составляет около 58,7 кДж/моль. Тепло поли-
меризации отводится через водяную рубашку реактора без при-
менения специальных методов отвода тепла (кипение раствори-
теля, циркуляция газа и др.).
Производство полипропилена может осуществляться как пе-
риодическим, так и непрерывным способами. Экономически
более выгодными являются непрерывные процессы получения
полипропилена.
Химико-технологическая система производства полипропи-
лена (рис. 5.20) состоит из следующих функциональных под-
систем: приготовление катализаторного комплекса из диэтил-
алюминийхлорида и треххлористого титана; полимеризация про-
415
Рис. 5.20. Схема производства полипропилена:
1 - смеситель катализаторного комплекса; 2, 11 - промежуточная емкость, 3 - полиме-
ризатор; 4- холодильник; 5, 9- сборник суспензии; б, 10- центрифуги; 7- подогреватель;
8- аппарат разложения катализатора; 12- вакуум-гребковая сушилка
пилена; удаление непрореагировавшего мономера из реакцион-
ной массы; разложение катализаторного комплекса; промывка
полимера от остатков катализатора; отжим растворителя; сушка
полипропилена; окончательная обработка полипропилена; реге-
нерация растворителя.
Приготовление катализаторного комплекса осуществляется
смешением 5%-го раствора A1(C2Hs)2C1 в бензине с порошкооб-
разным Т1С13 в смесителе 1. Суспензия катализатора поступает в
промежуточную емкость 2, из которой дозируется в полимериза-
тор 3. Полимеризатор представляет собой аппарат с мешалкой
объемом 10 м3, снабженный рубашкой для охлаждения и обо-
грева (во время запуска) и холодильником-конденсатором 4. В
полимеризатор при работающей мешалке непрерывно подаются
жидкий пропилен, катализаторный комплекс и бензин.
Продолжительность пребывания реакционной смеси в поли-
меризаторе при температуре 70 °C и давлении 0,1 МПа состав-
ляет около 6 ч. Степень конверсии пропилена достигает 98%. В
полимеризатор дозируются реагенты в следующем соотношении
(в мае. ч.):
Пропилен.......................................100
Катализатор (AlL3:TiCl3 = 3:1)...9
Бензин.........................225
416
Из полимеризатора продукт в виде суспензии выгружается в
сборник суспензии 5, при этом уровень в полимеризаторе под-
держивается постоянным. В сборнике за счет снижения давле-
ния до атмосферного происходит сдувка растворенного в бензи-
не непрореагировавшего пропилена и разбавление суспензии
бензином до соотношения полимер:бензин = 1:10 (мае. ч.).
Разбавленная суспензия обрабатывается на непрерывно дей-
ствующей центрифуге 6 раствором изопропилового спирта в
бензине [концентрация 25% (мае.)]. При этом происходит час-
тичное разложение компонентов катализаторного комплекса
спиртом с переводом их в форму алкоголятов. Разложение ката-
лизатора завершается в аппарате 8 при интенсивном перемеши-
вании суспензии подогретым в подогревателе 7 до 60 °C рас-
твором изопропилового спирта в бензине (фугатом). Суспензия
полимера через сборник 9 подается на вторичную промывку и
отжим в центрифугу 10.
Отмытый полипропилен подают в емкость 11 и сушилку с
кипящим слоем 12, в которой при температуре 95 °C горячим
азотом высушивают до остаточного содержания бензина 0,1%.
Высушенный полипропилен поступает на грануляцию и упа-
ковку.
Непрореагировавший пропилен, растворитель, промывные
растворы поступают на регенерацию и возвращаются в цикл. Во
всех аппаратах после реактора поддерживается инертная атмо-
сфера путем подачи азота. Азот рециркулирует по контуру, под-
вергаясь регенерации.
Обобщенные расходные показатели производства полипро-
пилена в расчете на 1 т гранулированного полимера приведены
ниже:
Пропилен, кг.......................................1125
Растворитель (бензин), кг...............25
Изопропиловый спирт, кг.................4
Диэтилалюминийхлорид, кг...............2,4
Трихлорид титана, кг...................1,2
Водяной пар, кг........................3200
Охлаждающая вода, м3...................400
Азот, м3................................70
Электроэнергия, кВт-ч..................500
В производстве полипропилена на 1 т товарного изотактиче-
ского полимера образуется около 8 кг атактического полипро-
пилена.
Одним из основных направлений совершенствования техноло-
гии полипропилена является разработка более активных катали-
тических комплексов, которые можно было бы вводить в малом
количестве. При этом отпадает необходимость в стадиях про-
мывки полимера и регенерации промывного раствора, что
417
значительно сокращает энергозатраты, упрощает схему и повы-
шает экономичность производства.
Полистирол
получают полимериза-
п
цией ненасыщенного углеводорода - стирола.
По объему производства полистирольные пластики занимают
третье место после полиэтилена и поливинилхлорида. Выработ-
ка полистирола превышает 10 млн т в год. Полистирол находит
применение практически во всех основных отраслях народного
хозяйства, включая производство электрооборудования, радио-
аппаратуры, мебели, упаковки, предметов домашнего обихода.
Полистирол - термопластичный материал с высокими ди-
электрическими показателями. Он химически стоек, водостоек,
бесцветен. Однако полистирол имеет низкую механическую
прочность и невысокую теплостойкость. В связи с этим прово-
дят модификацию свойств полистирола, которая направлена на
улучшение его перерабатываемое™, повышение ударопроч-
ности, огне- и атмосферостойкости, прозрачности. Улучшение
качества и придание требуемого комплекса свойств полистиролу
достигается путем введения различных добавок, а также спосо-
бом химической модификации (блочная и привитая сополиме-
ризация). Получение полистирольных пластиков с новыми ка-
чественными характеристиками расширяет сферу их примене-
ния в промышленности.
В промышленности полимеризацию стирола осуществляют
главным образом в блоке, эмульсии и суспензии:
1) блочная полимеризация стирола с неполной конверсией
мономера (непрерывный способ);
2) суспензионная полимеризация стирола (периодический
способ);
3) блочно-суспензионная (эмульсионная) полимеризация
стирола (периодический способ).
В настоящее время используется несколько вариантов блоч-
ной полимеризации стирола с неполной конверсией мономера.
На рис. 5.21 представлена схема процесса с неполной конверси-
ей стирола в каскаде реакторов с перемешиванием. Химико-
технологическая система состоит из следующих функциональ-
ных подсистем: полимеризация стирола; удаление и ректифика-
ция непрореагировавшего мономера; грануляция полистирола.
418
Рис. 5.21. Схема блочной полимеризации полистирола в каскаде реакторов с
перемешиванием:
1 — емкость для стирола; 2- теплообменники; 3-5- полимеризаторы (реакторы); 6 - хо-
лодильники; 7 - насосы; 8 - вакуум-камера; 9 - экструдер с гранулятором
Из емкости 1 стирол дозировочным насосом 7 подается через
теплообменник предварительного подогрева 2 на полимериза-
цию. Полимеризация стирола происходит последовательно в
трех реакторах. В первом реакторе (5) процесс протекает при
ПО - 120 °C и реакционная смесь выходит с содержанием около
30% полимера; во втором реакторе (4) процесс полимеризации
проходит при 125 - 135 °C до конверсии мономера 60%; закан-
чивается процесс в третьем реакторе каскада (5) при 140 -
150 °C при суммарной конверсии 80 - 85%. Тепло реакции по-
лимеризации снимается через рубашку реактора, испарением
мономера и охлаждением конденсата в обратном холодиль-
нике 6.
Передача реакционной массы из одного полимеризатора в
другой и далее в вакуум-камеру 8 осуществляется насосами 7. В
вакуум-камере удаляется при остаточном давлении 2,0 - 5,3
кН/м2 (15 - 40 мм рт. ст.) непрореагировавший стирол. Пары
стирола поступают на регенерацию и затем мономер вновь воз-
вращается в емкость 1 и смешивается с исходным сырьем. Рас-
плав полистирола из вакуум-камеры 8 поступает в экструдер 9 и
на грануляцию
Одним из существенных недостатков процесса с неполной
конверсией мономера является образование стирольного кон-
денсата при отгонке непрореагировавшего стирола.
Утилизация конденсата осуществляется по одному из вариантов:
1) очистка ректификацией с получением стирола со стан-
дартными показателями качества;
419
2) полимеризация стирола с получением полистирола для из-
делий менее ответственного назначения.
Производство полистирола в рассматриваемом случае входит
в состав нефтехимического комплекса, поэтому имеется воз-
можность совместить стадию очистки конденсата с ректифика-
цией массы дегидрирования стирола (см. разд. 5.2.6). Такое со-
вмещение процессов обеспечивает снижение энергетических
затрат на очистку и исключает установку дополнительного обо-
рудования в ХТС по производству полистирола.
5.3. ПРОИЗВОДСТВО УДОБРЕНИЙ
5.3.1. Общая структура производства удобрений
Производство минеральных удобрений - одна из важнейших
подотраслей химической промышленности. Во всех странах ми-
ра их ежегодно выпускается более 100 млн т. Основные пита-
тельные элементы - азот, фосфор и калий. Количество их рас-
считывают по действующему веществу - соответственно N, Р2О5
и К2О. Их содержание в выпускаемых удобрениях составляет в
среднем 38 - 42%. Полноценное питание растений включает
также добавки микроэлементов (Mg, В, Мп, Zn и др.).
Азотные и фосфорные удобрения производят через аммиак,
серную и фосфорную кислоты. Калийные удобрения - непо-
средственно из минерального сырья (в основном сильвинита).
Примерная схема производства минеральных удобрений показа-
на на рис. 5.22. Минеральные удобрения содержат одно дей-
ствующее вещество (простые удобрения) или несколько
(сложные удобрения). Последние различаются содержанием и
соотношением в них действующих веществ:
Удобрение Марка (NiPjOs^O)
Аммофос.................................. 11:48:0
Аммофоска.............................. 10:15:17
Диаммофос............................... 18:47:0
Нитрофос................................. 23:17:0
Нитрофоска.............................. 12:12:12
Нитроаммофос............................. 23:23:0
Нитроаммофоска.......................... 14:14:16
Сложные удобрения готовят смешением простых удобрений
или нейтрализацией аммиаком соответствующих кислот. Основ-
ная масса удобрений производится в гранулированном виде. Все
большее значение приобретает выпуск ЖКУ - жидких ком-
плексных удобрений.
Аммиак, серная, азотная и фосфорная кислоты - основные
полупродукты для получаемых удобрений. Они же используются
420
Рис. 5.22. Схема производства минеральных удобрений
и для многих других целей. Их производства являются удачны-
ми примерами развития теоретических основ процесса, научно-
го обоснования технологических и инженерных решений, при-
менения многих положений рассмотренных выше теорий хими-
ческих процессов, реакторов и химико-технологических систем.
Производства названных продуктов будут рассмотрены далее.
5.3.2. Производство серной кислоты
Производство минеральных удобрений (суперфосфата, сульфата
аммония), а также разложение фосфатного сырья являются
крупнейшими потребителями серной кислоты. Высокая химиче-
ская активность и относительно небольшая стоимость производ-
ства обусловили очень широкое применение серной кислоты
почти во всех отраслях промышленности (рис. 5.23).
Сырьевая база производства серной кислоты - серосодержа-
щие соединения, из которых можно получить диоксид серы. В
промышленности около 80% серной кислоты получают из при-
родной серы и железного (серного) колчедана. Значительное
место занимают отходящие газы цветной металлургии, полу-
чаемые при обжиге сульфидов цветных металлов и содержащие
диоксид серы. Некоторые производства используют как сырье
сероводород, образующийся при очистке серы в нефтеперера-
421
Рис. 5.23. Применение серной кислоты
ботке. Первой стадией технологического процесса является об-
жиг серосодержащего сырья для получения диоксида серы. При
получении серной кислоты из отходящих газов стадия обжига
входит в состав другого производства.
Функциональная схема производства серной кислоты. Химиче-
ская схема включает в себя реакции:
обжиг серного колчедана 4FeS2 + 1102 = 2Ре2Оз + 8SO2
или серы S2 + 2Ог = 2SO2;
окисление диоксида серы SO2 + 1/2Ог = SO3;
абсорбция триоксида серы SO3 + Н2О = H2SO4.
Исходные вещества - минеральное сырье - содержат приме-
си, и потому функциональная схема (рис. 5.24) включает в себя
стадию очистки газа после обжига. Первая стадия - обжиг -
специфична для каждого вида сырья, и далее она будет рассмот-
рена для колчедана и серы как наиболее распространенных ис-
422
Рис. 5.24. Функциональные схемы производства серной кислоты из серы (о) и
серного колчедана (б):
1 - обжиг серосодержащего сырья; 2 - очистка и промывка обжигового газа; 3 - окисле-
ние SO2; 4 - абсорбция SO3
ходных веществ. Стадии окисления и абсорбции в основном
одинаковы в разных способах получения серной кислоты. По-
следовательное рассмотрение указанных стадий (подсистем ХТС
производства серной кислоты) проведем с позиций принципиаль-
ных технологических, аппаратурных и режимных их решений.
Обжиг серосодержащего сырья. Обжиг колчедана (пирита) яв-
ляется сложным физико-химическим процессом и включает в
себя ряд последовательно или одновременно протекающих ре-
акций:
термическая диссоциация
газофазное горение серы
горение пирротина
2FeS2 = 2FeS + S2;
S2 + 2О2 = 2SO2;
4FeS + 7O2 = 2Fe2O3 + 4SO2.
Суммарная реакция:
4FeS2 + I1O2 = 2Fe2O3 + 8SO2. (5.1)
При небольшом избытке или недостатке кислорода образует-
ся смешанный оксид железа:
3FeS2 + 8O2 — Fe3O4 + 6SO2.
Термическое разложение пирита начинается уже при темпе-
ратурах около 200 °C и одновременно воспламеняется сера. При
температурах выше 680 °C интенсивно протекают все три реак-
ции. В промышленности обжиг ведут при 850 - 900 °C. Лимити-
рующей стадией процесса становится массоперенос продуктов
разложения в газовую фазу и окислителя к месту реакции. При
этих же температурах твердый компонент размягчается, что спо-
собствует слипанию его частиц. Эти факторы определили спо-
соб проведения процесса и тип реактора.
423
Рис. 5.25. Реакторы обжига колчедана:
о - полочный (1 - корпус, 2 - полки для колчедана. 3 - вращающиеся скребки, 4 - ось
привода скребков); б - печь кипящего слоя (1 - корпус, 2 - теплообменник). Стрелки внут-
ри аппаратов - движение твердого колчедана в реакторах
Сначала использовали полочный реактор (рис. 5.25,о). Кол-
чедан располагается на полках и воздух проходит через непо-
движные слои. Естественно, колчедан - кусковой (тонко из-
мельченный создавал бы значительное гидравлическое сопроти-
вление и мог легко слипаться, что создавало бы неоднородное
горение). Чтобы сделать обжиг непрерывным процессом, твер-
дый материал передвигается специальными гребками, вра-
щающимися на валу, расположенном по оси аппарата. Лопатки
гребков перемещают куски колчедана по тарелкам поочередно
от оси аппарата к его стенкам и обратно, как показано на ри-
сунке стрелками. Такое перемешивание одновременно предот-
вращает слипание частиц. Свежий колчедан непрерывно по-
дается на верхнюю полку. Огарок также непрерывно выводится
с низа реактора. Механический реактор обеспечивает интенсив-
ность процесса, измеряемую количеством колчедана, проходя-
щего через единицу сечения реактора, - не более 200 кг/(м2 ч).
В таком реакторе движущиеся скребки в высокотемпературной
зоне усложняют его конструкцию, создается неодинаковый тем-
пературный режим по полкам, трудно организовать отвод тепла
из зоны реакции. Трудности теплосъема не позволяют получить
обжиговый газ с концентрацией SO2 более 8 - 9%. Основное
ограничение - невозможность использования мелких частиц, в
424
Рис. 5.26. Технологическая схема обжига колчедана:
1 - тарельчатый питатель; 2 - печь (реактор) кипяшего слоя; 3 - котел-утилизатор; 4 -
циклоп; 5 - электрофильтр
то время как для гетерогенного процесса основной способ уско-
рения скорости превращения - дробление частиц.
Мелкие частицы можно перерабатывать в кипящем (псевдо-
ожиженном) слое, что реализовано в печах КС - кипящего слоя
(рис. 5.25,6). Пылевидный колчедан подается через питатель в
реактор. Окислитель (воздух) подается снизу через распредели-
тельную решетку со скоростью, достаточной для взвешивания
твердых частиц. Их витание в слое предотвращает слипание и
способствует хорошему контакту их с газом, выравнивает темпе-
ратурное поле по всему слою, обеспечивает подвижность твер-
дого материала и его переток в выходной патрубок для вывода
продукта из реактора. В таком слое подвижных частиц можно
расположить теплообменные элементы. Коэффициент теплоот-
дачи от псевдоожиженного слоя сравним с коэффициентом теп-
лоотдачи от кипящей жидкости, и тем самым обеспечены эф-
фективные теплоотвод из зоны реакции, управление его темпе-
ратурным режимом и использование тепла реакции. Интенсив-
ность процесса повышается до 1000 кг/(м2 • ч), а концентрация
SO2 в обжиговом газе - до 13-15%. Основной недостаток печей
КС - повышенная запыленность обжигового газа из-за механи-
ческой эрозии подвижных твердых частиц. Это требует более
тщательной очистки газа от пыли - в циклоне и электрофиль-
тре. Подсистема обжига колчедана представлена технологи-
ческой схемой, показанной на рис. 5.26.
Состав обжигового газа определяется из стехиометрического
уравнения (5.1). Выразим начальное Кн и конечное VK коли-
чества компонентов в газе и его объем V через степень превра-
щения кислорода х.
n2 о2 so2
Ki.... 1 - Со Со
VK.... 1 - Со Со(1 - х) тСох
425
Здесь Со - начальная концентрация кислорода (в воздухе
Со = 0,21); т - соотношение стехиометрических коэффициентов
перед SO2 и О2 в уравнении реакции окисления [для реакции
(5.1) т = 8/11]. Объем начального и конечного количеств ком-
понентов в газе И составляет соответственно 1 и 1 - Со х (1-/п).
Концентрация диоксида серы а в обжиговом газе равна
д Кк тСох
V 1 - Сох(1 - т)
(здесь VK относится к SO2), откуда
х ° / С0
т + а(1 - т)
и можно получить связь концентраций кислорода b и диоксида
серы а:
Ь = ^= ч = С0 - -П - Со(1 - /и)] (5.3)
V 1 — — т) fn
(5.2)
(здесь VK относится к О2). При обжиге колчедана в избытке воз-
духа уравнение (5.3) примет вид
b = 0,21 - 1,3а. (5.4)
В действительности содержание кислорода несколько мень-
ше, чем определяется по балансовому уравнению (5.4), посколь-
ку часть его расходуется на окисление примесей в сырье, имеет
место частичное окисление серы до SO3, которая удаляется при
очистке газа. Практически можно использовать уравнение
b = 0,21 - 1,4а. (5.4а)
Поддержание высокой концентрации SO2 в обжиговом газе
печи КС позволяет лучше использовать тепловой потенциал
реакции горения. Добавление воздуха после обжига позволяет
снизить температуру газа и получить необходимые концентра-
ции SO2 и О2 перед реактором окисления. Сера - легкоплавкое
вещество: температура плавления 113 °C. Перед сжиганием ее
расплавляют, используя пар, получаемый при утилизации теп-
лоты ее горения. Расплавленная сера отстаивается и фильтрует-
ся для удаления имеющихся в природном сырье примесей и
насосом подается в печь сжигания. Сера горит в основном в
парофазном состоянии. Чтобы обеспечить ее быстрое испаре-
ние, необходимо ее диспергировать в потоке воздуха. Для этого
используют форсуночные и циклонные печи. Первые оборудо-
ваны горизонтальными форсунками для тонкого распыления
жидкости. В циклонной печи жидкая сера и воздух подаются
426
Рис. 5.27. Зависимость адиабатической температуры горения серы Т от кон-
центрации образующегося SO2
Рис. 5.28. Технологическая схема сжигания серы:
1 - фильтр серы; 2 - сборник жидкой серы с погружным насосом; 3 - печь сжигания;
4- котел-утилизатор
тангенциально и за счет вихревого движения достигается дис-
пергирование жидкости и перемешивание двух потоков. Мелкие
капли быстро испаряются, и сера в парообразном состоянии
сгорает. Горение протекает адиабатически, и температура зави-
сит от концентрации образующегося SO2 (рис. 5.27). Теплота
горения серы 11325 кДж/кг, и температура в печи - более
1000 °C. Этих условий достаточно для испарения жидкой серы
(теплота испарения 288 кДж/кг, температура кипения 445 °C).
Печь сжигания работает в комплексе со вспомогательным обо-
рудованием для плавления и фильтрования серы и котлом-
утилизатором для использования тепла реакции (рис. 5.28).
При горении серы по реакции I/2S2 + О2 = SO2 часть кисло-
рода эквимолярно переходит в диоксид серы, и потому суммар-
ная концентрация О2 и SO2 постоянна и равна концентрации
кислорода Со в исходном газе (о + b = Со), так что при сжига-
нии серы в воздухе
b = 0,21 - а. (5.5)
Газ от сжигания серы богаче кислородом, чем от сжигания
колчедана.
Промывка газа после обжига. Газы обжига колчедана содержат
в виде примесей соединения фтора, селена, теллура, мышьяка и
некоторые другие, образующиеся из примесей в сырье. Есте-
ственная влага сырья также переходит в газ. При горении об-
разуется некоторое количество SO3 и, возможно, оксиды азота.
Эти примеси приводят или к коррозии аппаратуры, или к
отравлению катализатора, а также сказываются на качестве про-
дукта - серной кислоты. Их удаляют в промывном отделении,
упрощенная схема которого приведена на рис. 5.29. В первой
промывной башне 7 обжиговый газ охлаждается от 300 - 500
до 60 - 70 °C и улавливаются остатки пыли. Башня полая, чтобы
427
Рис. 5.29. Схема промывного отделения производства серной кислоты:
/, 2- промывные башни; 3 - мокрый электрофильтр, 4- сушильная башня
избежать забивания насадки твердым осадком (пылью), и оро-
шается 50 - 60%-й серной кислотой для частичного поглощения
химических примесей. Разбавленная кислота образует в башне
сернокислотный туман с развитой поверхностью, что способ-
ствует лучшей абсорбции примесей. Обеспыленный газ отмы-
вается 15 - 20%-й кислотой от соединений As, F, Se во второй
промывной башне 2 с насадкой. Частички тумана укрупняются,
что облегчает их удаление вместе со сконденсировавшейся вла-
гой в последующем мокром электрофильтре 3. Это необходимо,
поскольку капли тумана содержат растворенные примеси и вы-
зывают сильную коррозию оборудования. Окончательное удале-
ние остатков влаги осуществляется в сушильной башне 4, оро-
шаемой концентрированной серной кислотой - хорошо из-
вестным осушающим агентом. Очищенный газ поступает в тур-
богазодувку, обеспечивающую его транспортировку через си-
стему. Такое расположение нагнетателя рационально вдвойне:
во-первых, в него не попадают корродирующие вещества и, во-
вторых, стадии обжига и промывки находятся под небольшим
разрежением, что способствует больше засасыванию воздуха в
систему, чем выбросам грязных и токсичных газов в атмосферу.
Окисление диоксида серы. Реакция
SO2 + 1/2О2 = SO3 (5.6)
является обратимой, экзотермической, протекает на катализаторе с
уменьшением объема. Тепловой эффект реакции при температуре
500 °C Ср = 94,2 кДж/моль. Константа равновесия Кр [атм“°>5]
зависит от температуры и в интервале 400 - 700 °C равна
lgAp = 4905/7-4,6455. (5.7)
Согласно закону действующих масс, при равновесии
Кр= fs°3 P - , (5-8)
^□2, р Д/ , р
где PSO3 р, р, Pq2 р - парциальные давления соответствующих компонен-
тов в состоянии равновесия, атм.
428
б
т
Рис. 5.30. Зависимость равновесной степени окисления SO2XpOT температуры Т
для газа разного состава (о) и давления Р (ff):
а: Р = 0,1 МПа; / - а = 14k, b = 11%; 2 - а = 8%, Ь = 9%; 3- а = 10%, * = 6,7%;
б: а = 8%, Ъ = 9%; 4- Р = 0,1 МПа; 5- Р = 0,5 МПа; 6-Р= 1 МПа
(5 9)
Р “
Равновесную степень превращения диоксида серы хр получим из
стехиометрического уравнения (5.6) и условия равновесия (5.8):
1 - 0,5ахр
Р(Ь - 0,5аХр)
Выражение 1 - 0,5аХр показывает относительное изменение
(уменьшение) объема реакционной смеси. Уравнение (5.9)
определяет хр в неявном виде и решается подбором. Зависимос-
ти хр от температуры, состава реакционной смеси, получаемой
при обжиге колчедана, и давления показаны на рис. 5.30. Необ-
ходимые степени превращения (около 99%) достигаются при
температурах 400 - 420 °C. Давление не сильно влияет на Лр’,
поэтому в промышленности процесс проводят при давлении,
близком к атмосферному.
Катализаторы окисления SO2 готовят на основе оксида вана-
дия (V2O5) с добавкой щелочных металлов, нанесенных на ок-
сид кремния. Скорость реакции г описывается уравнением Бо-
рескова-Иванова:
^SO2
ЛР°2 PSO2+^'PSo3
^о3
(5.10)
1 -
где к = Аоехр(-£/АТ) - константа скорости реакций; А' = 0,8 - константа;
Ро , PSO2 , Pso3 - парциальные давления соответствующих компонентов, атм.
Компоненты реакционной смеси взаимодействуют с катали-
затором и образуют соединения, которые, собственно, и катали-
зируют реакцию. Состав и свойства, в том числе каталитиче-
ские, образующихся соединений меняются с температурой.
429
Рис. 5.31. Зависимость константы
скорости к окисления SOj от темпе-
ратуры Т в кинетической области на
мелком зерне катализатора (7) и на
промышленном зерне катализатора
(2); Е\, Ег, Еу - энергии активации в
разных температурных областях
Сложным образом меняется с
температурой энергия акти-
вации Е протекаюшей на них
реакции окисления, что по-
казано на рис. 5.31.
На промышленном зерне катализатора окисление тормозится
переносом реагентов в порах катализатора. Исследования пока-
зали, что наблюдаемую скорость превращения можно с доста-
точной точностью описать уравнением (5.10), но наблюдаемые
значения константы скорости и энергии активации будут иными
(линия 2 на рис. 5.30). Например, для катализатора СВД:
Т, К..................... <713 От 713 до 803 >803
Е, кДж/моль............... 197 58,6 0
Температурные границы и значения Е в них для разных ката-
лизаторов могут различаться. Для катализаторов И К-1-6 и СВД
Е = 126 кДж/моль при Т < 693 К. Это - низкотемпературные
катализаторы. Активность промышленных катализаторов при
температурах ниже 680 К весьма мала, а выше 880 К происходит
их термическая дезактивация. Поэтому рабочий интервал тем-
ператур эксплуатации большинства катализаторов - 680-880 К, а
степень превращения в реакторе, определяемая нижней грани-
цей этого интервала, составляет 98%.
Зависимость скорости превращения от температуры харак-
терна для обратимой реакции-(см. разд. 2.3.1 и рис. 2.18). Рас-
считанные из уравнения (5.10) оптимальные температуры 7()П1
показаны на рис. 5.32. В промышленности приближение к тео-
ретической Топт осуществляют в многослойном реакторе с ади-
абатическими слоями катализатора и промежуточным отводом
тепла (см. рис. 2.2). Охлаждение между слоями осуществляют в
теплообменниках или поддувом холодного газа (обычно только
первого слоя). Наиболее распространенная схема реактора пока-
зана на рис. 5.33.
Начальная концентрация перерабатываемого газа выбирается
так, чтобы режим процесса находился в пределах рабочих тем-
ператур катализатора. Большое значение Е при Т < 713 К при-
водит к резкому уменьшению скорости реакции с понижением
температуры. Чтобы адиабатический процесс в первом слое мог
интенсивно развиваться, начальная температура должна быть не
430
Рис. 5.32. Диаграмма “ Т-х” окисления SO2:
Хр - равновесные степени превращения; Гопт
- оптимальная температура; Гмин, Тмакс - грани-
цы рабочей области катализатора; Т„ - начальная
температура в слое катализатора; а - начальные
концентрации SO2, % (об.^и соответствующие им
линии адиабатического процесса в слое
ниже 713 К. Ее называют “температурой зажигания” (для низ-
котемпературных катализаторов она ниже). На диаграмме “Т-х”
адиабатический процесс представлен прямой линией. Наклон ее
определен величиной адиабатического разогрева Д7ад = V[}a/cp.
Для окисления SO2 приближенно ДТад = 28,2 град на 1% SO2.
Чем больше ДТад (или начальная концентрация SO2 - а), тем
больше разогрев (см. адиабаты на рис. 5.31 для разных значений
о). Процесс может развиваться до равновесия, и максимальная
(равновесная) температура не должна превышать допустимую.
На рис. 5.32 это соответствует начальной концентрации SO2
7-8%. Низкотемпературный катализатор позволяет поднять
концентрацию до 9-10%. Температуры в остальных слоях опре-
деляют из оптимизации режима реактора (см. разд. 2.9.2).
При выборе режима процесса в реакторе проверяют его
устойчивость - первый слой с теплообменником после него есть
система “реактор с внешним теплообменником”, рассмотрен-
ная в разд. 3.4.2. При некоторых условиях режим в такой си-
стеме может быть неустойчивым.
Абсорбция триоксида серы - последняя стадия процесса, в ко-
торой образуется серная кислота. Взаимодействие SO3 с Н2О
SO3 + Н2О = H2SO4 (5.11)
протекает достаточно интен-
сивно как в жидкой, так и в
газообразной (паровой) фазах.
Кроме того, H2SO4 может рас-
творять в себе SO3, образуя
олеум. Этот продукт удобен для
транспортировки, поскольку он
не вызывает коррозии даже
обычных сталей. Растворы сер-
Рис. 5.33. Схема реактора окисления SO2:
1 - слои катализатора; 2 - промежуточ-
ные теплообменники; 3 - смеситель; 4 -
внешний теплообменник; Хг - ввод холодно-
го газа
431
Рис. 5.34. Температуры кипения растворов H2SO4 в Н2О и SO3 в H2SO4 и состав
пара над растворами в %
ной кислоты чрезвычайно агрессивны. Олеум является основ-
ным продуктом сернокислотного производства.
Равновесие “газ-жидкость” для системы “H2O-H2SO4-SO3”
представлено на рис. 5.34. Особенностью этой системы является
то, что в широком интервале концентраций раствора H2SO4 в
паровой фазе присутствуют почти чистые пары воды (левая
часть графика), а над олеумом (раствор SO3 в H2SO4) в газовой
фазе преобладает SO3 (правая часть графика). Одинаковый со-
став жидкой и паровой фаз (азеотропная точка) будет при кон-
центрации серной кислоты 98,3%. Если SO3 поглощать раство-
ром с меньшей концентрацией, то реакция (5.11) будет проте-
кать и в паровой фазе - будет образовываться туман серной
кислоты, который уйдет из абсорбера с газовой фазой. А это - и
потери продукта, и коррозия аппаратуры, и выбросы в атмосфе-
ру. Если SO3 абсорбировать олеумом, то поглощение будет не-
полным.
Из этих свойств следует двухстадийная (двухбашенная) схема
абсорбции (рис. 5.35). Газ, содержащий SO3, после реактора
проходит последовательно олеумный I и моногидрата ый 2 аб-
сорберы. Другой компонент реакции (Н2О) подается противото-
ком в моногидратный абсорбер. За счет интенсивной циркуля-
ции жидкости (абсорбента) в ней можно поддерживать близкую
к оптимальной концентрацию H2SO4 - 98,3% (увеличение кон-
центрации за проход жидкости не более 1-1,5%). Техническое
название такой кислоты - моногидрат, откуда и название абсор-
бера. Концентрационные условия абсорбции обеспечивают пол-
ное поглощение SO3 и минимальное образование сернокислот ~
432
Рис. 5.35. Схема отделения абсорбции в производстве серной кислоты:
1 - олеумный абсорбер; 2 - моногидратный абсорбер; 3 - холодильники; 4 - сборники
кислоты; 5- брызгоотделитель
ного тумана. Кислота из моногидратного абсорбера поступает в
олеумный. В нем циркулирует 20%-й раствор SO3 в H2SO4, ко-
торый частично отбирается как конечный продукт - олеум.
Кислота из предыдущего абсорбера - моногидрат - также может
быть продуктом.
Образование серной кислоты и абсорбция триоксида серы -
экзотермические процессы. Их тепло снимается в оросительных
теплообменниках 3 на линии циркуляции жидкости в абсорбе-
рах. При температуре менее 100 °C SO3 поглощается практиче-
ски на 100%. Диоксид серы практически не абсорбируется.
Система двойного контактирования и двойной абсорбции
(ДК/ДА). Несмотря на довольно большую степень превращения
- 98%, мощные сернокислотные системы, производящие до 540 т
продукта в сутки, ежечасно выбрасывают в атмосферу более
300 кг диоксида серы. Исходя из данных по равновесию реак-
ции окисления SO2, увеличить степень превращения можно
снижением температуры в последних слоях ниже 610 К или по-
вышением давления более 1,2 МПа. Возможность снижения
температуры ограничена активностью имеющихся катализато-
ров, повышение давления усложняет инженерное оформление
процесса, и потому эти методы пока не получили промышлен-
ного применения.
Эффективным способом увеличения степени превращения в
обратимой реакции является удаление ее продукта. Функцио-
нальная схема такого способа показана на рис. 5.36. Подсистема
получения сернистого газа (обжиг серосодержащего сырья)
принципиально не меняется. Полученный сернистый газ час-
тично окисляется в первом реакторе, после чего в первой (про-
433
Воздух
Н?О. Н2О.
Рис. 5.36. Функциональная схема производства серной кислоты по методу
“двойное контактирование - двойная абсорбция”:
I - получение SO2, 2 - промывка обжигового газа; 3, 5- первая и вторая системы окис-
ления SO2; 4. 6 - первая и вторая системы абсорбции
межуточной) ступени абсорбции из него удаляется SO3. Далее
оставшийся SO2 окисляется во втором реакторе, и газ направ-
ляется на вторую абсорбцию. В отсутствие SO3 окисление SO2
во втором реакторе будет более полным.
В этой схеме для проведения реакции окисления также ис-
пользуют многослойные реакторы с промежуточными теплооб-
менниками, но реакционную смесь приходится нагревать дваж-
ды - в первом реакторе и после ее охлаждения для промежуточ-
ной абсорбции SO3 - перед вторым реактором. Нагрев осу-
ществляется за счет тепла реакции в промежуточных теп-
лообменниках, как в реакторе в схеме одинарного окисления
(рис. 5.33). Но во второй ступени окисляется низкоконцентри-
рованный газ, теплоты реакции недостаточно, и для нагрева
реакционной смеси необходимы теплообменники с большой
поверхностью. Увеличить количество выделяющегося тепла
можно за счет увеличения начальной концентрации SO2. По-
этому в системах ДК/ДА используют газ, содержащий не менее
10% SO2. Во избежание перегрева катализатора в первом слое
температура на входе не должна превышать 695 К, для чего ис-
пользуют низкотемпературные катализаторы. Кроме того, для
нагрева газа во втором реакторе частично используют теплоту
реакции, выделяющуюся в первом реакторе.
Технологическая схема стадий окисления и абсорбции в си-
стеме ДК/ДА представлена на рис. 5.37. На первой стадии окис-
ления использован трехслойный реактор 7. Концентрация SO2 в
поступающем газе - 9,5-10,5%. Степень превращения на выходе
из реактора 90-95%. Промежуточная абсорбция SO3 включает
олеумный 2 и моногидратный 3 абсорберы. После них газ со-
держит только 0,6-1% SO2. Для его нагрева до температуры ре-
акции (690-695 К) используют теплообменник после второго
слоя реактора 7. Реакторы первой и второй ступени окисления
конструктивно объединены в одном корпусе (на рис. 5.36 они
показаны отдельно). Степень превращения оставшегося SO2
составляет примерно 95%, общая степень превращения 99,6-
99,8%. Сравним: если бы не было промежуточной абсорбции, то
степеннь превращения оставшихся 1 - 0,6% SO2 в присутствии
SO3 не превысила бы 50%. Небольшое количество образовав-
434
Рис. 5.37. Технологическая схема стадий контактирования и абсорбции в систе-
ме “двойное контактирование - двойная абсорбция”:
1. /// - первая и вторая ступени окисления SO; 11, IV - первая и вторая системы аб-
сорбции SO водой; 1 - реактор (первая и вторая ступени окисления, расположенные в
одном корпусе, показаны отдельно); 2 - олеумный абсорбер; 3 - моногидратный абсорбер;
4 - выносные теплообменники реактора; 5 - холодильники кислоты
шегося SO3 полностью поглощается во втором моногидратном
абсорбере 3.
Как видим, количество непревращенного SO2 (и, следова-
тельно, выбросов в атмосферу) в системе ДК/ДА уменьшается
почти в 10 раз по сравнению с системой однократного контак-
тирования. Но для этого приходится поверхность теплообмен-
ников увеличивать в 1,5 - 1,7 раза.
5.3.3. Производство аммиака
Азот широко распространен в природе, он является одним из
основных элементов белковых тел - животных и растений. В
основном он находится в атмосфере в виде свободных молекул.
Подсчитано, что над 1 га поверхности Земли находится около 80
тыс. т азота. Но растения не могут непосредственно усваивать
атмосферный азот. Для их питания необходимы неорганические
соединения, растворимые в воде или в слабых кислотах. Мине-
ральное сырье очень ограниченно используется для производ-
ства азотных удобрений. Главным сырьевым источником остает-
ся азот атмосферы. Перевод азота из свободного (молекуляр-
ного) состояния в химически связанную форму определил на-
звание области химической технологии - “производство (или
технология) связанного азота”.
Из нескольких способов связывания молекулярного азота
воздуха в виде азотсодержащих соединений основным стал ам-
миачный метод - получение аммиака из азота и водорода: N2 +
435
Г Производство! [Микробиологические] [ Полимерные!
I лаков J I технологии JJj материалы J
Азотная
кислота
(инеральные
удобрения
АММИАК
Г Взрывчатые]
[ вещества ]
[ Карбамид
[ Металлургия]
[Полимеры] [Животноводстве]
Аммиачная
селитра
Рис. 5.38. Использование аммиака в промышленности
+ ЗН2 = NH3. Теоретические основы синтеза аммиака были
заложены в исследованиях Ф.Гарбера в Германии в 1904-1907 гг.
и там же в 1913 г. К.Бош создал первую промышленную
установку.
В отличие от азота водород в молекулярном виде почти не
встречается в природе, но в связанном виде - вода и органиче-
ское сырье (нефть, газ) - его запасы весьма велики. Из воды
водород извлекали через газификацию угля (2С + О2 = 2СО -
газификация, СО + Н2О = СО + Н2 - конверсия СО) и элек-
тролизом воды. В настоящее время основным источником водо-
рода являются природный газ (СН4) и вода - из обоих компо-
нентов извлекают Нг- Получаемый аммиак стал практически
единственным источником связанного азота для многих других
производств азотсодержащих соединений. Ежегодное потребле-
ние аммиака составляет десятки миллионов тонн в год. Его ис-
пользование не ограничено производством удобрений. Основ-
ные пути переработки NH3 представлены на рис. 5.38.
Функциональная схема производства аммиака. Химическая
схема включает следующие реакции:
паровая конверсия метана СН4 + Н2О = СО + ЗН2;
конверсия оксида углерода СО + Н2О = СО2 + Н2;
синтез аммиака N2 + ЗН2 — 2NH3.
Все реакции каталитические, здесь записаны только основ-
ные стехиометрические уравнения. Функциональные технологи-
ческие подсистемы включают в себя очистку природного газа от
436
Рис. 5.39. Функциональная схема производства аммиака:
/ - очистка природного газа от серосодержащих соединений, 2 - конверсия метана; 3 -
конверсия оксида углерода; 4 - очистка от оксидов углерода; 5 - синтез аммиака
серосодержащих соединений, которые являются каталитически-
ми ядами, и очистку азотоводородной смеси от оксидов углеро-
да. Функциональная схема производства аммиака представлена
на рис. 5.39. В ней не показана подсистема получения элемен-
тарного азота - вместо нее стоит знак вопроса. При дальнейшем
рассмотрении показанных подсистем будет обоснован способ
выделения азота из воздуха.
Очистка природного газа от серосодержащих соединений. При-
родный газ содержит примеси серосодержащих соединений -
меркаптаны (RSH), тиофен (гетероциклическое соединение
C4H4S), сероуглерод (CS2), сульфиды (R2S), сероводород (H2S) и
др. Кроме того, газ одорируют - добавляют этилмеркаптан, об-
ладающий сильным запахом. Одорирование придает специфиче-
ский запах природному газу (метан - газ без запаха). Это де-
лается в целях безопасности - утечка взрывоопасного газа
должна ощущаться окружающими. Содержание серы невелико,
в среднем - несколько десятков мг/м3. Но сера в любом виде
отравляет катализаторы, используемые в производстве аммиака.
Ее содержание не должно превышать 0,5 мг S/m3.
Для очистки от малых количеств примесей эффективны
сорбционные методы, но различные компоненты удаляются
разными, специфичными сорбентами. Чтобы избежать много-
ступенчатой сорбционной сероочистки, все серосодержащие
соединения сначала “приводят” в одно состояние - их гидриру-
ют до сероводорода:
RSH + Н2 = H2S + R; C4H4S + 4Н2 = H2S + С4Н10;
CS2 + 4Н2 = H2S + СН4 и т. д.
Водород для гидрирования в виде азотоводородной смеси
имеется в производстве аммиака. Его добавляют до 15%. Ко-
бальт-молибденовый катализатор активен в этих реакциях при
670 К. Выходящий из реактора гидрирования газ содержит серу
только в виде H2S и направляется в абсорбер, в котором и про-
исходит собственно очистка газа. Технологическая схема очист-
437
Рис. 5.40. Технологическая схема очистки природного газа от серосодержащих '
соединений:
1 - огневой подогреватель; 2 - реактор гидрирования; 3 - абсорберы; АВС - азотоволо-
родная смесь
ки природного газа от серы показана на рис. 5.40. Поглотитель
сероводорода - оксид цинка ZnO:
ZnO + H2S = ZnS + H2O.
Полная, или статическая, сероемкость промышленного по-
глотителя при 670 К составляет 28% от его массы. Поглощение
серы пористым зерном происходит послойно (рис. 5.41, л) и
описывается моделью “с невзаимодействующим ядром” процес-
са “газ-твердое”. Абсорбер - однослойный реактор с неподвиж-
ным слоем зернистого поглотителя. Зона реакции (сорбции)
занимает только часть высоты слоя, которая продвигается по
слою по мере насыщения сорбента серой (рис. 5.41,6). Когда
концентрация на выходе превышает допустимую (примерно
через 2-3 месяца), поток переключают на другой абсорбер, а
отработанный поглотитель заменяют свежим. Поскольку при
этом не весь сорбент насыщен (ненасыщенная часть заштрихо-
вана на рисунке), то фактическая, или динамическая, сероем-
кость составляет 15 - 18%.
Конверсия метана. Взаимодействие метана с водой протекает
на никельсодержащем катализаторе и представлено двумя обра-
тимыми реакциями:
СН4 + Н2О^±СО + ЗН2 - Qr, (5.12)
СО + Н2О^±СО2 + Н2 + Q2. (5.13)
Первая из них - эндотермическая, вторая - экзотермическая.
Температура будет по-разному влиять на их равновесие: благо-
приятно - для первой и отрицательно - для второй реакций.
Поскольку сначала надо обеспечить наиболее полное превраще-
ние метана, то температуру процесса целесообразно повышать.
При этом равновесие второй реакции сдвигается влево. Конвер-
сия метана протекает с увеличением объема, а потому низкое дав-
ление будет способствовать более полному превращению метана.
438
о ZnO ZnS
О О оо
------->г
Рис. 5.41 Поглощение сероводорода оксидом цинка:
а - насыщение во времени таблетки поглотителя серой (зачернено) - данные радиогра-
фии; 6 - изменение по длине слоя / и во времени t концентрации HjS (Ср ) и степени
насыщения поглотителя а сероводородом
Итак, высокая температура и низкое давление термодинами-
чески выгодны для конверсии метана. Но эти условия могут
быть невыгодны для технологического процесса в целом. Ко-
нечная стадия - синтез аммиака - протекает при высоком дав-
лении (30 МПа). Затраты энергии А на сжатие газа от давления
Pi до Р? составляют
А = —Y—nRT[l -(P2/A)(y-1)/yL
у - 1
где у - показатель политропы.
Затраты энергии пропорциональны объему газа - числу мо-
лей п. При полном превращении метана и СО образуется 4 моля
водорода, к которым добавляется стехиометрическое количество
азота - 4/3 моля. Если конверсию метана провести при термо-
динамически выгодных условиях, при атмосферном давлении,
то в дальнейшем необходимо сжать более пяти объемов азотово-
дородной смеси. Энергетические затраты будут меньше, если
конверсию провести при промежуточном давлении, сжимая
только метан (водяной пар поступает под давлением). Тогда
существенно уменьшится энергия сжатия пятикратного объема
азотоводородной смеси. Детальные техноэкономические расчеты
показали, что на стадии конверсии оптимальным будет давление
4 МПа.
Влияние давления на равновесие конверсии метана представ-
лено в табл. 5.4.
Увеличение давления до 4 МПа при стехиометрическом со-
отношении пар : газ X = 2:1 не позволяет достичь полного пре-
вращения даже при температуре 1300 К (вторая колонка табли-
439
Таблица 5.4. Равновесные степени превращения метана хр при различных темпера-
турах Т, соотношениях пар : газ X и давлениях Р
т, к Равновесные степени превращения CH4 -
Р = 0,1 МПа; X = 2 : 1 Р = 4 МПа*; Х = 2: 1 Р = 4 МПа; Х = 4 : 1 Р = 3,3 МПа*; 1 = 4:1**
900 0,74 0,19 0,30 -
1000 0,91 0,33 0,50 0,64
1100 0,997 0,54 0,74 0,87
1200 0,999 0,75 0,92 0,97
1300 -1 0,91 0,99 0,994
•Давление на выходе второй ступени конверсии метана
**С добавлением воздуха перед шахтным конвертором
цы). Двухкратный избыток водяного пара (X = 4:1) позволит
достичь почти полного превращения: хр = 99% (третья колонка
таблицы). Такой начальный состав реакционной смеси исполь-
зован в промышленности.
Теперь рассмотрим аппаратурно-технологическую реализа-
цию выбранных условий конверсии метана. Как следует из рав-
новесных данных, необходима высокая температура процесса.
Катализатор в этих условиях весьма активен, и равновесие до-
стигается быстро. Поэтому достигаемое в реакторе превращение
можно с достаточной точностью определить из равновесных
данных. Конверсия метана - реакция эндотермическая: тепло-
вой эффект взаимодействия метана с водой по уравнению
(5.12) Qi =-206,4 кДж/моль и превалирует над экзотермиче-
ским эффектом другого этапа |см. уравнение (5.13)] Q2 =+41,0
кДж/моль. Необходимое тепло можно подвести через стенки
обогреваемых труб, в которых находится катализатор и протека-
ет реакция, т. е. осуществить процесс в трубчатом реакторе,
или, как его называют, трубчатой печи. Обогрев осуществляется
сжиганием природного газа в факельных инжекционных горел-
ках, расположенных в верхней части межтрубного пространства.
Дымовые газы с температурой 1200-1300 К отводятся из нижней
части реактора. Температура, необходимая для полного превра-
щения метана, - 1300 К, а металл, из которого сделаны трубки,
допускает нагрев не выше 1180-1200 К. Максимальная темпера-
тура в слое (на выходе) будет, естественно, ниже: 1080-1100 К.
Превращение метана не превышает 75% (см. табл. 5.4).
Необходима вторая ступень конверсии. Она представлена
адиабатическим реактором, или, как его называют, шахтным
конвертором. Стенки его футерованы внутри высокотемпера-
турным материалом - бетоном - для предохранения корпуса от
перегрева. Необходимую температуру создают тем, что в реактор
подают воздух. Часть метана сгорает в кислороде воздуха, и тем-
440
Рис. 5.42. Технологическая схема конверсии метана:
1 - трубчатая печь; 2 - шахтный конвертор; 3 - котел-утилизатор; 4 - смеситель; 5-7 -
подогреватели
пература повышается до 1230 - 1280 К. Но с воздухом вводится
и азот, необходимый для синтеза аммиака, так что шахтный
конвертор выполняет еше и функцию выделения азота из возду-
ха. Этим разрешен вопрос на рис. 5.39 о подсистеме получения
элементного азота. Технологическая схема конверсии метана
приведена на рис. 5.42.
Количество подаваемого воздуха должно быть таким, чтобы
соотношение водород : азот было стехиометрическим для син-
теза аммиака, равным 3:1. Расчет ведем на единицу объема ме-
тана:
образуется - 4 объема;
необходимо N2 - 1,33 объема, или воздуха - 1,33/0,79 = 1,69
объема (0,79 - содержание Nj в воздухе);
с воздухом вводится кислорода - 0,21 • 1,69 = 0,354 объема;
для “выжигания” кислорода в соответствии со стехиометри-
ческим уравнением 2С>2 + СН4 = СО2 + 2Н2О расходуется 0,177
объема СН4.
С учетом этого дополнительного количества метана на вход
первой ступени конверсии - трубчатого реактора 7 - подается
1,177 объема СН4 и 4,7 объема Н2О (соотношение пар : газ -
=4:1), а на вторую ступень - в шахтный конвертор 2 - 1,69 объ-
ема воздуха. Температура после шахтного конвертора 1230 -
1280 К и давление - 3,3 МПа из-за гидравлического сопротив-
ления реакторов. И разбавление реакционной смеси инертным
газом - азотом, и уменьшение давления способствуют сдвигу
равновесия вправо. Равновесные степени превращения метана
441
для состава такой смеси приведены в последнем столбце табл.
5.4. Состав сухого газа после шахтного реактора:
Н2 - 57-58%; N2 - 22-23%; СО - 12-12,5%; СО2 - 7,5-8%;
СН4 - 0,3%.
Содержание водяного пара в газе - 35-39%.
Тепло реакционной смеси после реактора утилизируется в
котле-утилизаторе 3.
Конечно, процесс можно провести только в шахтном конвер-
торе. Аппаратурно это выгодно: теплота сгорания природного
газа выделяется внутри реактора, и ее использование для под-
держания режима эндотермической реакции будет наиболее
полным (в трубчатом реакторе необходимо преодолеть термиче-
ское сопротивление стенки и зернистого слоя катализатора).
Поскольку количество азота должно быть дозировано, а тепла
подвести надо достаточно много, то кислорода воздуха не хвата-
ет. В реактор подают воздух, обогащенный кислородом. Одно-
ступенчатая парокислородовоздушная конверсия метана была
распространена ранее. Но в ней труднее эффективно утилизи-
ровать тепло реакционной смеси и отделить продукты горения.
Оптимизация схемных решений превалирует над оптимизацией
процесса в реакторе. Современные производства аммиака вклю-
чают двухступенчатую конверсию метана.
Конверсия СО. Высокая температура на стадии конверсии ме-
тана не позволяет использовать потенциал СО для получения
водорода. Избирательную конверсию СО при низких температу-
рах, исключающую обратное протекание реакции (5.12), прово-
дят, используя специфическое действие катализатора. Селек-
тивными катализаторами конверсии СО являются железохромо-
вый и медьсодержащий. Первый активен в области температур
600 - 700 К, второй более активен при 480 - 530 К, но дезакти-
вируется при более высоких температурах.
Конверсия СО - обратимая экзотермическая реакция:
СО + Н2О^±СО2 + Н2 + 41 кДж.
Подобно окислению SO2 реакцию проводят в реакторе с
адиабатическими слоями катализатора и промежуточным охлаж-
дением между ними. Технологическая схема с промежуточным
котлом-утилизатором приведена на рис. 5.43; здесь же - диа-
грамма “Т-х”. В первом слое (реакторе) загружен более термо-
устойчивый железохромовый катализатор, а во втором - высо-
коактивный медьсодержащий. Соотношение пар : газ = (0,6 -е-
+ 0,7): 1 и поддерживается увлажнителем. Остаточное содержа-
ние СО составляет 0,3 - 0,5%.
442
Рис. 5.43. Технологическая схема конверсии СО и диаграмма “Т-х”:
I - увлажнитель; 2 - реактор с железохромовым катализатором; 3 - котел-утилизатор;
4 - реактор с медьсодержащим катализатором; Хр - равновесная степень превращения СО;
ломаная линия - режим процесса
В некоторых схемах промежуточное охлаждение осуществля-
ют впрыском конденсата, и за счет испарения воды температура
между слоями снижается. Одновременно увеличивается соотно-
шение пар : газ, т. е. избыток одного из реагентов, и необходи-
мая степень превращения достигается при более высоких темпе-
ратурах. Такая схема могла быть применена в случае загрузки в
оба слоя железохромового катализатора.
Очистка от оксидов углерода. Конвертированный газ содержит
17-18% СО2 и 0,3-0,5% СО. Первая примесь - балласт для син-
теза аммиака, вторая - яд для катализатора. Диоксид углерода
абсорбируют 19-21%-м водным раствором моноэтаноламина
NH2CH2CH2OH (МЭА-очистка):
2RNH2 + Н2О + CO2£±(RNH3)2CO3. (5.14)
Поглощение СО2 (карбонизация раствора МЭА) - обратимый
процесс. С повышением температуры равновесие сдвигается
влево, т. е. возможна регенерация сорбента. Технологическая
схема МЭА-очистки включает в себя два основных аппарата -
абсорбер и десорбер (рис. 5.44).
Над чистым МЭА-раствором равновесное давление СО2 ма-
ло, поэтому газ и жидкость подают противотоком. Абсорбер -
вертикальный газожидкостной реактор насадочного или тарель-
443
Рис. 5.44. Технологическая схема очистки от СО2 (МЭА-очистка) и СО
(метанирован ие):
1 - абсорбер; 2 - десорбер; 3 - кипятильник; 4 - теплообменники; 5 - реактор метани-
рования (К - катализатор, Т - теплообменник); 6 - холодильники; МЭА - моноэтаноламин,
МЭА' - не полностью регенерированный МЭА, карб. МЭА - карбонизированный МЭА
чатого типа, разделенный на две секции. Газ сначала проходит
нижнюю секцию абсорбера, где происходит поглощение основ-
ного количества СОг- Эта секция орошается не полностью
(грубо) регенерированным раствором. В верхней секции, оро-
шаемой тонко регенерированным (чистым) МЭА-раствором,
происходит доочистка, и газ выходит с остаточным содержанием
СО2 не более 0,03%(об.). Температура абсорбции не выше 330 К.
Насыщенный раствор, содержащий углекислоты 80-100 г/л,
нагревается в рекуперативных теплообменниках и тремя пото-
ками направляется в десорбер. Тепло на десорбцию подается
через паровой кипятильник. Чистый раствор отбирают в ниж-
ней части десорбера, грубо регенерированный - из середины
колонны. Эти потоки после охлаждения направляются в абсор-
бер. Десорбция происходит при температуре 380-390 К. Такая
схема “регенерации с рециклом” позволяет выделить в чистом
виде примесь и исключить постоянное потребление сорбента
(только на компенсацию потерь). Чистый СО2 используют в
других производствах (карбамид, твердая углекислота и др.).
Раствор МЭА не поглощает оксид углерода, и выходящий газ
содержит СО. Как примесь его не выделяют, а превращают в
метан, безвредный для катализатора и инертный в процессе
444
синтеза аммиака. Реакцией, обратной конверсии метана (мета-
нирования), -СО дезактивируют как катализаторный яд. Газ пос-
ле МЭА-очистки подогревают и направляют в реактор, содер-
жащий никелевый катализатор (показано на рис. 5.44). На нем
также гидрируются остатки СО2:
СО + ЗН2 = СН4 + Н2О; СО2 + 4Н2 = СН4 + 2Н2О.
Содержание СО мало, и адиабатический разогрев составляет
несколько десятков градусов. Это позволяет использовать од-
нослойный реактор. В очищенном газе, поступающем на син-
тез аммиака, - синтез-газе - содержание СО не должно превы-
шать 20 • 1(Г6 об. долей (20 ppm - миллионных долей). Суммар-
ное содержание метана (непревращенного и образовавшегося в
метанировании) в синтез-газе составляет около 1%.
Синтез аммиака протекает в соответствии с реакцией
N2 + 3H2^22NH3 + 103,6 кДж. (5.15)
Реакция обратимая, протекает с выделением тепла и умень-
шением объема. Согласно принципу Ле-Шателье, при пониже-
нии температуры и повышении давления равновесие реакции
сдвигается в сторону увеличения содержания аммиака. Азотово-
дородно-аммиачная смесь - не идеальный газ, и константа рав-
новесия реакции Кр сложным образом зависит от температуры Т
и давления Р. В справочной литературе приведены точные фор-
мулы для расчета Кр и данные по равновесию. Для прибли-
женных расчетов в области температур 600-900 К и давлений
20-40 МПа можно воспользоваться аппроксимирующим уравне-
нием
1пАр =-29,44 + \ТШ/Т- 0,41пР;
здесь Кр определена для стехиометрического уравнения (5.15); размерности:
ПК],/» [ат].
Если исходная стехиометрическая смесь содержала 1 моль N2
и 3 моля Н2, то при равновесной степени превращения хр оста-
нется (1 - Хр) молей N2 и 3(1 - Хр) молей Н2, образуется
2хр молей NH3, а общий объем уменьшится и станет равным
(4-2%р) молей. Объемные концентрации станут равными соот-
ветственно (1-Хр)/(4-2хр), 3(1-хр)/(4-2хр) и 2хр/(4-2хр). Равнове-
сие реакции опишем уравнением
к = PNH3 _ 42 (2-Хр)2 х2
Р PN2^h2 З3 р2 (1-*р)4’
L 2 JpaBH
откуда можно найти равновесные степени превращения, приве-
денные в табл. 5.5.
445
Таблица 5.5. Равновесные степени превращения хр стехиометрической азотоводо-
родной смеси в аммиак
Температура, К Хр при давлениях Р (МПа)
0,1 I | Ю 30 100
600 0,0810 0,140 0,61 0,78 0,89
700 0,0024 0,036 0,33 0,57 0,78
800 0,0008 0,012 0,15 0,36 0,63
900 0,0003 0,005 0,07 0,21 0,47
Реакция протекает на катализаторе - пористом железе с до-
бавками стабилизирующих и промотирующих элементов (А1, К,
Са и др.). Он активен и термически устойчив в области темпе-
ратур 650-830 К. Поэтому промышленно важная область давле-
ний синтеза, при которых степень превращения будет более
20%, - выше 20 МПа. Техноэкономическое обоснование про-
цесса показало, что оптимальной будет реализация процесса
при 30-32 МПа. Повышение давления резко увеличивает затра-
ты на оборудование и компрессию, понижение давления увели-
чивает затраты, связанные с малым выходом аммиака. Эти усло-
вия используются в современных агрегатах производства аммиа-
ка. Далее при анализе процесса в системе синтеза будем исполь-
зовать не традиционную степень превращения азотоводородной
смеси Хр, а концентрацию аммиака z в реакционной смеси, ко-
торые связаны соотношением
Z = х/(2 - х).
Для смеси, содержащей i инертов,
О - ‘)х
2 - (1 - i)x
Как видим, величина z меньше значения х. Концентрация
лучше характеризует состояние потока (его состав, скорость
превращения, возможность выделения продукта и т. д.).
При выбранных температуре и давлении достигается далеко
не полное превращение в реакторе - выходящий газ содержит
около 16% NH3 (степень превращения 27-28%). Для полноты
использования азотоводородной смеси применяют рецикл -
после реактора отделяют продукт (аммиак), а непрореагиро-
вавшие Н2 и N2 возвращают в реактор. Эта схема была описана
ранее (см. разд. 3.2.3, рис. 3.6). Аммиак выделяют конденсацией
сначала в воздушном холодильнике, а затем - в конденсацион-
ной колонне при температуре минус 2-5 °C. Тем не менее пол-
ностью выделить аммиак не удается, и на входе в реактор синте-
за содержание аммиака составляет 3%.
446
(5.16)
(5.17)
Рис. 5.45. Циркуляционная схема для расчета отдувки:
1 - реактор; 2 - система выделения продукта
В поступающей реакционной смеси содержится до 1,4% инерта
(СН4 и Аг, попадающий с воздухом). Не выводясь с продуктом,
инерты будут накапливаться в рецикле. Содержание их в циркули-
рующем газе поддерживают на уровне 16% путем вывода (отдувки)
части газа. Объем сбрасываемого газа найдем из материального
баланса циркуляционной схемы (рис. 5.45). Поступающий газ со-
держит io, асбрасываемый (и циркулирующий) - /с инертов. Син-
тез-газ объемом Vq, поступающий в систему, выходит из нее в виде
аммиака в количестве 6ам и отдувки объемом Vc.
Массовый баланс по азотоводородной смеси между входя-
щим и выходящими потоками:
И0(1 - 10)У = Сам + ис(1 - 0Y, (5.18)
где у - плотность стехиометрической смеси Hj и Nj.
Массовый баланс по инерту между входящим (синтез-газ) и
выходящим (отдувка) потоками:
ИО4)=ИС/С. (5.19)
Перед реактором смешиваются два потока: свежий синтез-газ
(Ио) и циркулирующий (И|( - Ис). Количество образовавшегося в
реакторе аммиака (?ам при степени превращения азотоводород-
ной смеси х:
сам = [ Ио(1 - 10) + (Иц - Ис)(1 - /с)]ух. (5.20)
Из балансовых уравнений (5.18) и (5.19), используя уравне-
ние (5.20) для производительности реактора по аммиаку (?ам,
получим объемы отдувки и рецикла:
IZ /сом IZ _ (Ио -Ис)(1-х)
Ис ^^НоАс» (5-21) /1 • \ (5-22)
О - ic)x
Степень превращения в реакторе находим через изменение
концентраций аммиака в нем:
* = *kUk)-*hUh)> (5-23)
где xK(zK), xh(zh) - степени превращения азотоводородной смеси при конечной
ZK и начальной Zh концентрациях аммиака, полученные из уравнения (5.17) при
содержании инерта ic.
447
Рис. 5.46. Диаграмма режима про-
цесса в реакторе синтеза аммиака:
1 - равновесные концентрации; 2 - опти-
мальные температуры; 3 - процесс в многослой-
ном реакторе; 4, 5 - процесс в трубчатом реак-
торе (одинарные и двойные трубки соответ-
ственно)
Расчеты по уравнениям (5.21)
- (5.23) при описанном выше
режиме процесса (значениях iq, ic,
ZH, *к) показали: отдувка состав-
ляет около 8% от потока свежего
синтез-газа, а циркулирующий поток в три с лишним раза
больше его. Расход синтез-газа на тонну аммиака составляет
2600 нм3. В современном агрегате аммиака мощностью 1360
т/сут циркулирующий поток составляет около 450 тыс. нм3/ч.
Реакция синтеза аммиака - обратимая экзотермическая, по-
этому необходим отвод тепла из реакционной зоны, чтобы тем-
пература была близка к оптимальной теоретической - кривая 2
на рис. 5.46. Это реализуют или в трубчатом реакторе с охлаж-
дением, или в многослойном реакторе с промежуточным тепло-
обменом. Схемы реакторов показаны на рис. 5.47.
В трубчатом реакторе тепло из реакционной зоны отводится
к свежей реакционной смеси. Катализатор располагают в меж-
трубном пространстве. Газ поступает в трубки (рис. 5.47,а), на-
гревается и по выходе из них поворачивает противотоком в слой
катализатора. На рис. 5.47 приведен также профиль температур
в реакторе, а на рис. 5.46 в координатах “ T-z” - режим процесса
в слое. Такой автотермический реактор был рассмотрен ранее
(см. разд. 2.8.4). Слой катализатора в нижней части может силь-
но охлаждаться. Более равномерный профиль в слое можно по-
лучить, изолировав часть трубок. На рисунке выделена более
широкой линией изолированная часть трубок и пунктиром по-
казано изменение профиля температур.
Такой же эффект достигнут использованием трубок Фильда
(двойных) - рис. 5.46,6. Газ поступает во внутренние трубки,
затем заворачивает в кольцевое пространство между внутренни-
ми и наружными трубками. Проходя его, газ нагревается от слоя
катализатора и одновременно отдает часть тепла газу, находя-
щемуся во внутренних трубках. Нагрев происходит более плав-
но, что улучшает режим в слое. Процесс регулируют изменени-
ем начальной температуры Тн в слое путем подвода части хо-
лодного газа непосредственно перед слоем. В автотермическом
реакторе возможна неоднозначность режима и его неустойчи-
вость (см. разд. 2.8.4). Поэтому пределы изменения Тн ограни-
чены.
448
a
Рис. 5 47. Схемы реакторов синтеза аммиака и профили температур в них:
а - с простыми противоточными трубками; б - с двойными трубками (трубками Филь-
да); в - многослойный
В многослойном реакторе (рис. 5.46,в) процесс проводится
адиабатически в нескольких слоях с промежуточным охлажде-
нием. Компактность конструкции реактора достигается, если
температуру между слоями снижать вводом холодного газа. Ре-
гулируя величину поддува, приближают режим к теоретическо-
му. Оптимизация режима процесса в реакторе проводится ана-
логично тому, как было описано для реактора с промежуточны-
ми теплообменниками. Такая конструкция реактора получила
распространение в последнее время.
Во всех типах реакторов предварительный нагрев газа проис-
ходит в теплообменнике потоком, выходящим из слоя катализа-
тора. Все элементы реактора - слои катализатора, теплообмен-
ники, смесители - располагаются в одном корпусе высокого
давления. Поступающий холодный газ проходит в узком коль-
цевом пространстве вдоль стенок, предохраняя их от нагрева.
Это важно для сохранения прочности корпуса, несущего нагруз-
ку от высокого давления. Общий вид трубчатого и многослойно-
го реакторов показан на рис. 5.48. Внешне современные реакто-
ры - вертикально стоящие цилиндрические аппараты с внут-
ренним диаметром 2400 мм, толщиной стенок 265 мм, высо-
той 19,4 м. Поэтому их называют колоннами синтеза аммиака.
Энерготехнологическая система в производстве аммиака. Сжа-
тие природного газа и технологического воздуха до 4,5 МПа,
449
4 Выход
I газа
а
б
Рис. 5.48. Общий вид реакторов синтеза аммиака:
а - многослойный с радиальными слоями; б - с теплообменными двойными трубками
Фильда; 1 - корпус; 2 - теплообменник; 3 - катализатор; 4 - трубка Фильда
сжатие азотоводородной смеси до 32 МПа, ее циркуляция в
подсистеме синтеза осуществляется с помощью мощных
турбокомпрессоров. Кроме того, в энергетической системе
имеется еще ряд машин. Общее потребление энергии состав-
ляет 880-900 кВт - ч/т NH3. Ключевым является компрессор
синтез-газа с частотой вращения вала около 11000 об/мин, по-
требляющий более половины энергии всего производства ам-
миака. Применение для привода этого компрессора электродви-
гателя практически невозможно. Поэтому использована паровая
турбина. Ее энергоноситель - пар с высокими параметрами:
давление до 10 МПа и температура 720 - 740 К. Для привода
других компрессоров используют также паровые турбины на
450
Пар на турбины
Воздух
Природный
газ—>—
Вода >
В дымовую*
*труОу ;
j/ IL, , т
.Дымовые газы из
трубчатой печи
Рис. 5.49. Энерготехнологическая система агрегата синтеза аммиака:
1 - газоход после трубчатой печи; 2 - паросборник; 3 - дополнительная горелка; 4, 5 -
котлы-утилизаторы (после шахтного конвертора метана и после конверсии СО соответ-
ственно); 6- вспомогательный котел
энергоносителях с меньшими параметрами. Покрытие потреб-
ляемой мощности возможно либо за счет подвода энергии со
стороны, либо за счет использования собственных энергоноси-
телей, в частности энергетического водяного пара.
В производстве аммиака имеются высокопотенциальные тех-
нологические потоки: конвертированный газ и дымовые газы
после конверсии метана. Но их энергии и потенциала недоста-
точно для образования пара с высокими параметрами. Необхо-
дим дополнительный высокотемпературный источник энергии.
Им является вспомогательный котел с огневым обогревом, уста-
новленный в газоходе после трубчатой печи, - дополнительный
энергетический узел (рис. 5.49). Пар, получаемый в котлах-
утилизаторах в линиях технологических потоков и в дополни-
тельном котле, собирается в паросборнике и оттуда распреде-
ляется на паровые турбины - приводы компрессоров. Таким
образом, производство аммиака становится автономным по
энергетическому пару, но для его выработки, используя свои
вторичные энергетические ресурсы, потребляет также дополни-
тельное количество топлива - природного газа. Такая схема
обеспечения производства энергией и есть энерготехнологиче-
ская система.
451
5.3.4. Производство азотной кислоты
В 1914 г. разработан и в 1916 г. в г. Юзовка (ныне Донецк) пу-
щен в эксплуатацию цех азотной кислоты на основе аммиака
коксового газа. Разработка велась под руководством русского
инженера И.И.Андреева. Сейчас получение азотной кислоты из
аммиака - основной способ ее производства.
Функциональная схема производства азотной кислоты. Сырьем
является синтетический аммиак, кислород воздуха и вода. Про-
текают следующие реакции:
окисление аммиака кислородом воздуха
4NH3 + 5О2 = 4NO + 6Н2О + Q{; (5.24)
доокисление оксида азота до диоксида азота
2NO + О2 = 2NO2 + Q2; (5.25)
поглощение NO водой с образованием азотной кислоты
3NO2 + Н2О = 2HNO3 + NO + 03. (5.26)
Одновременно с третьей реакцией проводят вторую, так что
весь NO2 можно превратить в HNO3. Все реакции экзотермиче-
ские.
Исходя из химической схемы (5.24) - (5.26), функциональная
схема будет включать подсистемы окисления аммиака, после-
дующее охлаждение газов [реакция (5.24) протекает при высо-
кой температуре], окисление оксида азота и абсорбцию образо-
вавшихся нитрозных газов водой (рис. 5.50) Построение ХТС
производства азотной кислоты было рассмотрено в разд. 3.5.2.
Здесь остановимся на физико-химическом обосновании отдель-
ных стадий производства.
Окисление аммиака - сложная необратимая экзотермическая
каталитическая реакция. Аммиак окисляется до N2 и NO. Пре-
вращение описывается двумя независимыми стехиометрически-
ми уравнениями:
4NH3 + 5О2 = 4NO + 6Н2О + 904 кДж; (5.27)
4NH3 + ЗО2 = 2N2 + 6Н2О + 1269 кДж. (5.28)
Катализатор - платина или платинопалладийродиевый сплав
(содержание Pt 81-92%). Температура процесса 1100-1200 К. В
этих условиях практически не образуется закись азота N2O. Из-
за обратимости экзотермической реакции (5.25) ее равновесие
при температуре окисления аммиака сдвинуто влево, и диоксид
азота также отсутствует.
Схема превращения отличается от системы стехиометриче-
ских уравнений (5.27) - (5.28) - реакция окисления аммиака
452
Рис. 5.50. Функциональная схема производства азотной кислоты:
I - окисление аммиака; 2- охлаждение газа; 3 - окисление оксида азота; 4- абсорбция
включает в себя четыре частные реакции (этапа):
(5-29)
Эта схема была установлена экспериментально: подавая
только NO на катализатор, наблюдали образование азота и кис-
лорода по реакции 2NO = N2 + О2; подавая смесь NH3 и NO,
наблюдали образование N2 по реакции 4NH3 + 6NO = 5N2 +
+6Н2О. Такая схема превращения дает экстремальную зависи-
мость выхода оксида азота от времени превращения (рис. 5.51).
Реакция - быстрая, протекает во внешнедиффузионной об-
ласти. Поскольку скорость лимитируется переносом тепла и
вещества между потоком и поверхностью катализатора, то нет
необходимости развивать его внутреннюю поверхность, и
он представляет собой сетку, сплетенную из металлической
проволоки диаметром 0,09 мм. Время контакта составляет
(1+2)-10”4 с. Аммиак за это время полностью окисляется, так что
выход NO совпадает с селективностью реакции по оксиду азота.
При учете внешнедиффузионного переноса
P1(G - Cln)/V1 = р2(С2 - C2n)/v2 = г (С1п, С2п), (5.30)
где нижние индексы 1 и 2 относятся соответственно к NH3 и О2; рь р2 - ко-
эффициенты массопереноса между потоком и поверхностью; С], С2 - концент-
рации потоке; Cin, С2п - концентрации на поверхности; vi = 4, v2 = 5 - сте-
хиометрические коэффициенты; г (С]п, С2п) - скорость реакции.
Полагая Pi = Рг и стехиометрическое соотношение NH3:O2 =
= 1:1,25, получим из (5.30) соотношение С)п : Сгп = 1:1,25.
Во внешнедиффузионной области концентрации исходных
веществ на поверхности намного меньше, чем в объеме. У по-
верхности будет мало как NH3, так и Ог- В этих условиях окис-
ление будет протекать в основном до азота. Необходим значи-
тельный избыток кислорода у поверхности, чтобы вытеснить с
нее аммиак. Тогда его окисление будет более глубоким - до NO.
453
Рис. 5.51. Зависимость выхода оксида азота
Eno от времени контакта т при окислении
аммиака при давлениях 0,1 МПа (7) и 0,7
МПа (2)
Рис. 5.52. Влияние соотношения O2:NH3 на
выход оксида азота ENo в окислении аммиака
Рис. 5.53. Влияние температуры Т на выход
оксида азота Eno в окислении аммиака при
давлениях 0,1 МПа (/) и 0,7 МПа (2)
Влияние соотношения О2 : NH3 в потоке на выход NO показано
на рис. 5.52. При соотношении О2 : NH3 более 1:1,8 селектив-
ность процесса практически не меняется. Из (5.30) можно полу-
чить, что при Cin = 0,01 Ci у поверхности будет более чем 50-
кратный избыток О2, что и обеспечивает высокую селективность
реакции. Соотношение О2 : NH3 = 1 : 1,8 отвечает содержанию
в аммиачно-воздушной смеси 10% NH3, что и принято в про-
мышленности.
Давление усиливает разложение NO до N2 по этапу 3 в схеме
(5.29) и тем самым уменьшает максимальный выход NO с 97-
98% при 0,1 МПа до 95-96% при 0,7 МПа, хотя скорость пре-
вращения увеличивается (см. рис. 5.51). Соответственно, для
проведения процесса при 0,1 МПа необходимо 8-12 катализа-
торных сеток, а при 0,7 МПа - 5-6 сеток. Влияние температуры
на максимальный выход NO имеет экстремальный характер
(рис. 5.53) и с повышением давления температура максимально-
го выхода NO увеличивается.
Хотя давление уменьшает выход NO, процесс в промышлен-
ности проводят под повышенным давлением. Получил широкое
распространение разработанный в России процесс под давлени-
454
Рис. 5.54. Схема получения азотной кислоты под единым давлением (с) и при
двух давлениях (б):
1 - воздушный компрессор; 2 - система окисления аммиака; 3 - компрессор нитрозных
газов; 4 - система абсорбции нитрозных газов
ем 0,73 МПа (рис. 5.54,а). Оно выбрано из условий оптималь-
ности ХТС в целом. Увеличение давления значительно улучшает
абсорбцию [реакция (5.26)]: вместо 6-8 абсорбционных колонн,
используемых при атмосферном давлении, при 0,7 МПа доста-
точно одной колонны. Уменьшаются габариты остального обо-
рудования. При повышенном давлении можно создать энерго-
технологическую систему, замкнутую по энергетике. Последние
разработки - схема при двух давлениях (система АК-72) (рис.
5.54,6). Окисление проводят при 0,4 - 0,45 МПа, затем нитроз-
ный газ сжимают до 1 - 1,2 МПа перед абсорбцией. Очевидно,
что условия для основных процессов - окисления и абсорбции -
лучше, чем при едином давлении, хотя это требует использова-
ния специального компрессора, работающего с нитрозным
(сильно корродирующим) газом (при едином давлении исполь-
зуют только воздушный компрессор).
Реакторы окисления аммиака для двух описанных схем
представлены на рис. 5.55. Катализатор в виде сеток 4 натянут
внутри корпуса. Во избежание провисания сеток под ними на
опорной решетке вертикально установлены кольца. Аммиак
смешивают с воздухом или в выносном смесителе, или в верх-
ней части реактора, подавая аммиак равномерно через кольце-
вую щель. Высокая конусная часть реактора служит для равно-
мерного распределения потока по сечению - слой сеток очень
тонкий и не может сам выравнивать поток. Поскольку абсолют-
но равномерное распределение потока не реализуется, то исполь-
зуют увеличенное число сеток - 10-12 при давлении 0,7 МПа.
455
6
Рис. 5.55. Реакторы окисления аммиака в системах под единым давлением
0,73 МПа (с) и при двух давлениях - система АК-72 (б):
1 - корпус; 2 - смеситель; 3 - распределитель; 4 - катализаторные сетки; 5 - котел-
утилизатор; 6 - взрывная мембрана; АВС - аммиачно-воздушная смесь; НГ - нитрозные
газы
При высокой температуре платина частично испаряется в ви-
де оксида PtO2. Потери составляют 0,16 г Pt/т HNO3 (при 1200
К). Для улавливания платины под сетки кладут поглотитель на
основе СаО. Безвозвратные потери снижаются до 0,07 г Pt/т
HNO3.
Тепло газов после окисления аммиака используют для выра-
ботки пара в котле-утилизаторе. Конструктивно он совмещен с
реактором.
Окисление оксида азота - гомогенная обратимая экзотермиче-
ская реакция:
2NO + O2<*2NO2 + 180,6 кДж. (5.31)
При температурах ниже 400 К равновесие практически пол-
ностью сдвинуто в сторону образования NO2. Реакция может
протекать везде - в трубопроводах, теплообменниках и в других
аппаратах.
Установлено, что кинетическая модель отвечает стехиомет-
рии реакции:
-*2^о2- <532>
Как видно, давление значительно ускоряет реакцию, что
также говорит в пользу его повышения в ХТС. Реакция протека-
ет не очень быстро. Потому устанавливают окислитель - полый
аппарат, обеспечивающий необходимое время пребывания ре-
акционной смеси для завершения реакции.
456
Рис. 5.56. Реактор (абсорбционная колонна)
получения азотной кислоты:
1 - ситчатые тарелки; 2 - теплообменные элемен-
ты; 3 - брызгоотбойники
Реакция окисления NO - экзотер-
мическая. Необходимо дополнитель-
ное охлаждение нитрозного газа. При
охлаждении конденсируется вода - ее
образуется в 1,5 раза больше, чем по-
дано аммиака. Конденсирующаяся
вода будет взаимодействовать с нит-
розным газом, образуя азотную кисло-
ту. Целесообразно сократить время
контакта газа с водой, поэтому ис-
пользуют специальный скоростной
теплообменник-конденсатор. В нем
образуется 30%-я кислота. Ее направ-
ляют в соответствующее этой кон-
центрации сечение абсорбционной
колонны.
Абсорбция оксидов азота- Диоксид
азота взаимодействует с водой по схе-
ме
Отходящий
газ Д
2NO2 + Н2О = HNO3 + HNO2; 3HNO2 = HNO3 + 2NO.
Образующаяся по первой реакции азотистая кислота нестой-
ка и сразу разлагается с выделением части NO в газовую фазу.
Суммарно абсорбция представлена уравнением
3NO2 + Н2О = 2HNO3 + NO + 73,6 кДж. (5.33)
Взаимодействие NO2 с Н2О - реакция быстрая, так что почти
достигается равновесие между HNO3 в жидкости и NO2 в газе.
Последующее окисление NO (и в газовой, и в жидкой фазах)
протекает медленнее. Необходимо определенное время для его
завершения и пространство, где будет протекать окисление
NO. Реакция (5.33) - гетерогенная газожидкостная, а реакция
(5.31) - гомогенная. Поэтому реактор образования азотной кис-
лоты - абсорбционная колонна с переливными ситчатыми та-
релками (рис. 5.56). Пространство между тарелками работает
как газофазный окислитель основного количества выде-
лившегося NO. Барботаж в невысоком (на тарелке) слое жид-
кости обеспечивает интенсивный массообмен с газом, способ-
ствуя поглощению компонентов газовой смеси и тем самым
образованию HNO3 и жидкофазному окислению NO. Можно
457
считать, что в абсорбционной колонне протекает превращение,
описываемое следующим брутто-уравнением:
4NO2 + 2Н2О + О2 = 4HNO3. (5.34)
Из общего балансового уравнения превращения NH3 в HNO3
4NH3 + 8О2 = 4HNO3 + 4Н2О
видно, что на 1 объем NH3 расходуется 2 объема кислорода. На
стадии окисления аммиака подается 1,8 объема О2 с воздухом.
Остальной кислород (воздух) надо подавать в абсорбционную
колонну для полноты окисления NO.
С понижением температуры поглощение NO2 улучшается.
Для отвода теплоты реакции на тарелках установлены плоские
змеевиковые холодильники с циркулирующей в них водой.
Повышение давления способствует поглощению NO2 и уве-
личению концентрации образующейся кислоты: 47-49%-я
HNO3 при 1 ат, 58% - при 7 ат, до 62% при 11 ат.
Энерготехнологическая система в производстве азотной кисло-
ты. После абсорбции отходящие газы содержат 0,1% оксидов
азота и должны быть очищены. При атмосферном давлении и
низкой температуре образуется димер диоксида азота N2O4 - газ
буро-желтого цвета. Поэтому выходящий из трубы неочищен-
ный нитрозный газ получил название “лисий хвост”. Атмосфер-
ные осадки, захватывая оксиды азота, образуют кислотные
дожди.
Очистку газов от оксидов азота осуществляют каталитиче-
ским восстановлением их до N2. Восстановителем может слу-
жить аммиак, который дозируют в газы после абсорбции перед
реактором-нейтрализатором. Восстановителем может служить
также метан (природный газ). Последний удобно использовать
при организации энерготехнологической системы.
Газы после абсорбции находятся под повышенным давлени-
ем, потенциал которого можно использовать в газовой турбине
для привода воздушного компрессора. Но энергии отходящих
газов как рабочего тела турбины недостаточно для сжатия возду-
ха до давления на входе в систему. Во-первых, имеют место
потери давления на преодоление гидравлического сопротивле-
ния в аппаратах и трубопроводах, и отходящие газы имеют дав-
ление несколько меньшее, чем на входе. Во-вторых, объем от-
ходящего газа также меньше необходимого - почти весь кисло-
род расходуется на образование продукта. Энергию рабочего
тела можно увеличить, если его нагреть. Для этого в технологи-
ческую систему вводят энергетический узел - горелку природно-
го газа (рис. 5.57). Высокая температура (1000 - 1050 К) позво-
ляет провести нейтрализацию оксидов азота на палладиевом ка-
458
Рис. 5.57. Энерготехнологическая система в производстве азотной кислоты:
1 - компрессор; 2 - технологические аппараты; 3 - теплообменник; 4 - газовая горелка;
5 - реактор каталитической очистки; 6 - газовая турбина
тализаторе и затем использовать потенциал давления и темпера-
туры очищенного газа в турбине, которая устанавливается на
одном валу с компрессором. Затрачивая топливо в горелке,
можно полностью освободиться от использования энергии со
стороны для основного потребителя энергии в системе - воз-
душного компрессора. Концентрация остаточного кислорода в
газе после абсорбции и количество природного газа выбирают
такими, чтобы в газе после горелки было достаточно метана и
была восстановительная атмосфера. Этим условиям отвечают
10%-й избыток СЩ и соотношение СН4 : О2 = 0,55. После ка-
талитической очистки концентрация оксидов азота понижается
с 0,1% (об.) до 0,002 - 0,008% (об.).
Производство азотной кислоты - хороший пример реализа-
ции многих положений теории реакторов и химико-
технологических систем. Многие вопросы организации процесса
в этом производстве были рассмотрены ранее: построение ХТС
(разд. 3.5.2), избыток компонента в реакторе и противоток в
абсорбере (разд. 3.6.2), стехиометрические уравнения и схема
превращения (разд. 2.2.1 и 2.2.3), конструктивное совмещение
аппаратов и реактор с радиальным потоком реагентов (разд.
3.9.1), энерготехнологическая система (разд. 3.7.4), автоколеба-
ния в ХТС (разд. 3.4.2), балансовые расчеты ХТС (разд.3.3.2).
Материал этих разделов целесообразно привлечь при рассмот-
рении производства азотной кислоты.
5.3.5. Производство фосфорной кислоты
Фосфорная кислота Н3РО4 является важнейшим промежуточ-
ным продуктом в производстве концентрированных фосфорсо-
держащих удобрений. Кроме того, фосфорная кислота использу-
ется в производстве различных технических солей, разнообраз-
ных фосфорорганических продуктов, в том числе инсектицидов,
459
полупроводников, активированного угля (сульфоуголь для уда-
ления накипи и умягчения воды), ионообменных смол, для соз-
дания защитных покрытий на металлах. Очищенная, или так
называемая пищевая, Н3РО4 используется в пищевой промыш-
ленности, для приготовления кормовых концентратов, фарма-
цевтических препаратов.
Фосфатное сырье включает в себя группу фосфатных руд -
апатитов и фосфоритов, представляющих собой сложную смесь
минералов, содержащих от 3-5 до 25-30% Р2О5 Основное коли-
чество фосфора входит в минералы апатитовой группы. Их об-
щая формула ЗСаз(РО4)2 • СаХ, где X представлен фтором, хло-
ром или гидроксил-ионом. Наиболее распространен фторапатит
ЗСаз(РО4)2 • СаРг или Са5(РО4)зР. Фосфор извлекают разложе-
нием минерального сырья. В настоящее время наибольшее рас-
пространение получило кислотное разложение руд, содержащих
более 25% Р2О5. Фосфорная кислота образуется непосредствен-
но при растворении руды, т. е. прямым извлечением, экстрак-
цией соединений фосфора. Отсюда название продукта - экс-
тракционная фосфорная кислота (ЭФК). Из более бедных руд
получают термическую фосфорную кислоту. Процесс основан
на восстановлении фосфора из природных фосфатов коксом
при высоких температурах и дальнейшем получении Н3РО4 из
фосфора.
Функциональная схема производства ЭФК. Сложность состава
исходного сырья, которое не может быть унифицировано, при-
водит к существованию ряда вариантов технологических схем
его переработки. Одним из хорошо исследованных является
сернокислотное разложение апатитового концентрата, получае-
мого обогащением хибинской апатит-нефелиновой руды и со-
держащего около 39% Р2О5. Его разложение - гетерогенная ре-
акция “жидкость-твердое”:
Ca5(PO4)3F + 5H2SO4 + 5лН2О = ЗН3РО4 +
+ 5CaSO4 лН2О1 + HFT. (5.35)
Примеси - Са и F - сразу выделяются в реакторе. Первая
выпадает в осадок в виде гипса (CaSO4), вторая уходит в газо-
вую фазу в виде фтористого водорода HF. Функциональная схе-
ма (рис. 5.58) включает разложение измельченного сырья в ре-
акторе (экстракторе), фильтрацию твердого осадка, упаривание
фосфорной кислоты до товарной концентрации и очистку отхо-
дящих газов. Твердый отход получил название “фосфогипс”.
При промывке отходящих газов водой фтористый водород улав-
ливается в виде кремнефтористоводородной кислоты ^SiFg.
460
Апатит
Воздух
H,SOj.
УХ4 '
FL
В атмосферу
1ГН75
H2Sil6
Фосфогипс
В атмосферу
гЧ1 Д"70
слота ______________►И IL-0
Фосфорная Чг
кислота н ро^ H^iF(
Рис. 5.58. Функциональная схема производства экстракционной фосфорной
кислоты:
1 - реактор разложения апатита (экстрактор); 2 - вакуум-фильтр; 3 - сборник фильтра-
тов; 4 - колонна выпарки фосфорной кислоты; 5 - система очистки газов
Сернокислотное разложение апатита. На скорость превраще-
ния по реакции (5.35) влияет отвод продуктов реакции - ионов
Са2+ и РО^ от поверхности частиц в раствор, и чем меньше
концентрация Са2+ в растворе, тем скорость растворения будет
больше.
Одновременно с растворением апатита происходит образова-
ние твердого CaSO4, который плохо растворим. Связывание
Са2+ в CaSO4, т. е. выделение его из раствора, будет увеличивать
скорость растворения. Казалось бы, увеличение концентрации
серной кислоты, т. е. ионов SO^ , - фактор благоприятный. Но
SO^- вызывает осаждение Са2+ не только в виде отдельной
фазы в растворе, но и на поверхности частиц апатита. Обра-
зующаяся корка CaSO4 сначала замедляет растворение, а затем
блокирует поверхность, и растворение практически прекращает-
ся. Поэтому есть некая оптимальная концентрация CaSO4, при
которой степень извлечения фосфора из сырья будет макси-
мальной (рис. 5.59). Этим предъявляются жесткие требования к
концентрации H2SO4 в реакторе: строгое ее поддержание и од-
нородность по объему реактора.
Реактор разложения представляет собой последовательность
секций с интенсивным перемешиванием реагентов в каждой из
них и перетоком между ними. Один из вариантов показан на
рис. 5.60. Перемешивание должно предотвратить расслоение на
461
Рис. 5.59. Зависимость степени извлечения фосфора от избытка ионов
Са2+ и SO2*
Рис. 5.60. Схема реактора разложения апатита (экстрактора):
1-8- секции реактора; 9- циркуляционный насос; Ж - мешалки
твердую и жидкую фазы. В первой половине секций происходит
в основном растворение апатита. Остальные секции работают
как дозреватель, в них формируются кристаллы CaSO4. Между
последней и первой секциями организован интенсивный рецикл
(кратность циркуляции достигает 20 и более). Его назначение:
устранить локальные пересыщения в зоне ввода реагентов;
подать в первую секцию кристаллы CaSO4 как центры кри-
сталлизации, облегчающие связывание Са2+ в самом начале
растворения;
создать однородные условия в секциях для растворения
сырья и роста кристаллов (перемешивание в объеме всего реак-
тора).
Чтобы создать благоприятные условия сначала для растворе-
ния, когда надо иметь балансовую концентрацию ионов SO^-,
а затем - для формирования кристаллов при небольшом из-
бытке SO4 , целесообразна распределенная подача серной кис-
лоты - во вторую и шестую секции, как показано на рис. 5.58.
Степень разложения апатита достигает 97% и выше, образуются
крупные кристаллы, облегчающие их отделение фильтрацией
Образование продукционной фосфорной кислоты включает в
себя отделение осадка CaSO4 (фосфогипса) и концентриро-
вание кислоты. В зависимости от условий разложения образу-
ются кристаллы CaSO4 • 2НгО (дигидрат) или CaSO4 0,5Н?О
(полугидрат). В дигидратном процессе температура 343-353 К и
концентрация фосфорной кислоты 25-35% (в пересчете на
Р2О5); в полугидратном соответствующие показатели равны 358-
378 К и 35-40%.
462
Фосфогипс отделяют на вакуум-фильтре ленточного или ка-
русельного типа. Фильтрат направляют на выпаривание, где
концентрация кислоты увеличивается до 52-54% (в пересчете на
Р2О5). Это и есть продукционная кислота. При выпаривании из
кислоты удаляется 80-90% фтора в виде HF. Отходящие из ре-
актора и из узла выпаривания фторсодержащие газы в системах
очистки поглощаются с образованием кремнефтористоводород-
ной кислоты.
На одну тонну продукта (в пересчете- на Р2О5) образуется бо-
лее 2,5 т трудноперерабатываемого CaSO4. С ним теряется сер-
ная кислота - ее эффективная промышленная регенерация из
фосфогипса до сих пор не разработана. Фосфогипс используют
для производства гипсовых вяжущих, добавок к цементу, строи-
тельных изделий, в сельском хозяйстве - для гипсования солон-
чаковых почв. Большая часть фосфогипса складируется в отва-
лы.
ЗАКЛЮЧЕНИЕ
Выше были даны основы химической технологии как науки и
как способа производства. Многообразие химических превра-
щений и многостадийность протекающих процессов обусловли-
вают большое разнообразие технологических и конструктивных
решений в различных производствах. Тем не менее можно вы-
делить основные направления в химической технологии, кото-
рые в настоящее время являются перспективными для ее даль-
нейшего развития.
В области химической технологии как науки:
развитие методов математического моделирования на основе
глубокого изучения химических и физических основ проте-
кающих процессов, их распространение на новые объекты хи-
мической технологии. К ним относятся превращения в много-
компонентных многофазных системах с переменными свой-
ствами, быстропротекающие и высокоинтенсивные процессы,
процессы биотехнологии и др. Неменьшее значение здесь имеет
применение специального математического аппарата - такого,
как теория перколяции, теория катастроф, фрактальный анализ
и др.;
системный анализ ХТС, распространяемый на перестраи-
ваемые химико-технологические системы, их надежность, дина-
мику сложных ХТС. Значительное внимание уделяется технике
синтеза и анализа ХТС - создание интеллектуальных систем
автоматизированного проектирования (САПР), экспертных си-
стем;
развитие экспериментальных методов получения исходной
прецизионной информации о явлениях в химико-техно-
логическом процессе - создание автоматизированных систем
научных исследований (АСНИ) для физико-химических
изысканий, изучения кинетики превращений, неравновесных и
нестационарных явлений, механики потоков;
изучение динамики химико-технологического процесса на
всех уровнях его проявления - молекулярные взаимодействия,
464
макрокинетика, процессы в аппаратах и их совокупности. Сюда
же можно отнести и управление химико-технологическим про-
цессом, которое есть не только его регулирование, но и его ор-
ганизация, диагностика состояния, прогнозирование возможных
ситуаций, создание эффективного режима;
развитие теории высокоинтенсивных процессов - в высоко-
скоростных и турбулентных потоках, в высоко- и низкотемпера-
турной плазме, в подвижных многофазных системах;
развитие теории гибких производственных систем, имеющих
перестраиваемую структуру, включающих многофункциональ-
ные элементы, обеспечивающие многоассортиментность выпус-
каемой продукции, и обладающих устойчивостью в различных
реальных ситуациях.
Химическая технология как способ производства
имеет следующие тенденции развития, прослеживаемые в рабо-
те многих передовых предприятий и производственных фирм:
поиск новых видов сырья для производства существующих
продуктов, в том числе вовлечение в переработку отходов про-
изводств как вторичного сырья;
нахождение новых способов производства существующих
продуктов (новые катализаторы, альтернативные технологии -
биотехнология и др.);
переработка отходов производства (сопутствующих продук-
тов) в полезные продукты и изделия;
поиск новых путей переработки сырья, обеспечивающих
полное использование сырьевых ресурсов, например комплекс-
ная переработка сырья;
сокращение потребления топливно-энергетических ресурсов
и использование альтернативных источников энергии (солнеч-
ной и др.);
вовлечение принципиально новых технологий (генная инже-
нерия) и методов их разработки (экспертные системы);
использование новых конструкционных материалов (для ра-
боты при высоких температурах, давлениях и в агрессивных
средах, специальных полимерных материалов);
обеспечение безопасности химических производств (защита
окружающей среды, безотходные и малоотходные производства,
безаварийность эксплуатации).
Химическая технология способствует также решению
следующих важных задач:
создание новых материалов (синтетические полимерные ма-
териалы, пищевые продукты, биологически активные препара-
ты);
465
обеспечение жизнедеятельности человека (производство ма-
териалов для сельского хозяйства, продуктов питания, расшире-
ние энергетических и материальных ресурсов из растительного
сырья);
использование методов химической технологии в нехимиче-
ских отраслях промышленности. Сюда можно отнести создание
химических аккумуляторов тепла, производство материалов для
электроники, продовольственных товаров, разработку специаль-
ных материалов для медицины и материалов, используемых при
освоении космоса, и т. д. В настоящее время потребность нехи-
мических отраслей промышленности в методах химической тех-
нологии значительно возрастает.
Указанные перспективные направления развития химической
технологии очерчены схематично и могут, конечно, со временем
меняться, но из сказанного видно, как важна эта наука и как
глубоко она проникла во все области созидательной деятель-
ности современного человека.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Амелин А.Г. Общая химическая технология. М.: Химия, 1977. 400 с.
Бесков В.С., Флокк В. Моделирование каталитических процессов и реакто-
ров. М.: Химия, 1991. 253 с.
Васильев Б.Т., Отвагина М.И. Технология серной кислоты. М.: Химия, 1985.
385 с.
Кафаров В.В., Макаров В.В. Гибкие автоматизированные производственные
системы в химической промышленности. М.: Химия, 1990. 320 с.
Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая техноло-
гия. М.: Высшая школа, 1990. 520 с.
Лебедев Н.Н. Химия и технология основного органического и нефтехимиче-
ского синтеза. М.: Химия, 1981. 605 с.
Лейтес И.Л., Сосна М.Х., Семенов В.П. Теория и практика химической
энерготехнологии. М.: Химия, 1988 . 280 с.
Мухленов И.П. Общая химическая технология, ч. 1, 2. М.: Высшая шко-
ла, 1984. 255 и 263 с.
Позин М.Е. Технология минеральных удобрений. Л.: Химия, 1983. 335 с.
Расчеты химико-технологических процессов/Под ред. И.П.Мухленова. Л.: Хи-
мия, 1982. 247 с.
Смирнов Н.Н., Волжинский А.И., Плесовских ВА. Химические реакторы в
примерах и задачах. СПб.: Химия, 1994. 276 с.
Справочник азотчика. М.: Химия, ч. 1, 1986. 511 с.; ч. 11, 1987. 462 с.
Стадницкий Г.В., Родионов А.И. Экология. М.: Высшая школа, 1988. 272 с.
Степанов В.С. Анализ энергетического совершенства технологических про-
цессов. Новосибирск: Наука, 1984. 273 с.
Фролов Ю.Г, Белик В.В. Физическая химия. М.: Химия, 1993. 464 с. Хими-
ко-технологические системы/Под ред. И.П.Мухленова. М.: Химия, 1986. 423 с.
Химмельблау Д. Обнаружение и диагностика неполадок в химических и неф-
техимических процессах/Пер. с англ. Под ред. Ю.М. Левина. Л.: Химия, 1983.
351 с.
МАТЕРИАЛЫ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО КУРСУ
“ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
И ОСНОВЫ ПРОМЫШЛЕННОЙ ЭКОЛОГИИ”
На кафедре “Общая химическая технология” РХТУ им. Д.И. Менделеева
разработан и создан комплекс учебных программ для ЭВМ, основное наз-
начение которого — компьютерная поддержка практических занятий по
курсу “Общая химическая технология” и родственных с ним.
Комплекс представляет собой систему проблемно-ориентированных
программ для автоматизации сложных вычислений, причем интеллек-
туальная нагрузка по постановке задачи и анализу результатов исследо-
вания процессов перенесена на пользователя-обучающегося.
Подготовка к вычислительному эксперименту и его проведение
представляет собой этап обучения и включает: сбор физико-
химических данных (работа со справочной литературой); выбор про-
грамм из комплекса и порядка расчета (формулировка задачи и обосно-
вание модели процесса); определение коэффициентов уравнений, реша-
емых в программах (определение параметров процесса, развитие навыков
работы с величинами разной размерности); интерпретация результатов
(расчет показателей процесса на основе результатов вычислений).
Работа с программным комплексом ведется в диалоговом режиме,
программы включают в себя краткий учебный материал, методические
указания и инструкции пользователя.
Результаты расчетов выводятся на экран монитора как в табличном,
так и графическом виде, но оформление результатов расчета предостав-
ляется обучающемуся с целью закрепления навыков создания техни-
ческой документации.
Предусмотрена защита от ошибочных и несанкционированных дей-
ствий, причем в большинстве случаев пользователь должен определить
причину отказа вычислений (неправильная размерность введенных
величин, несогласованность задаваемых параметров, невозможность
протекания процесса при заданных условиях и т. д.).
Комплекс программ предоставляет следующие возможности:
- проведение вычислительного эксперимента и численного анализа
процессов;
- как выполнение отдельных вычислительных задач, так и форми-
рование сложных комплексных заданий;
- организация гибкой последовательности задач в соответствии с
этапами обучения и подготовкой обучаемого.
Комплекс включает следующие программы.
РАВНОВЕСИЕ - расчет химического равновесия в многокомпо-
нентной смеси со сложной схемой превращения.
ЗЕРНО - расчет процесса в пористом зерне катализатора в форме
шара, цилиндра или пластинки. Предусмотрена возможность расчета
при протекании простых (обратимых и необратимых) и сложных
(параллельная, последовательная и последовательно-параллельная
схемы) реакций. Рассчитываются профили концентраций в зерне, сте-
пень использования внутренней поверхности и селективность процесса
(для сложных реакций).
ГЕТЕРОГЕННЫЙ ПРОЦЕСС - обработка экспериментальных дан-
ных в лабораторной работе по исследованию гетерогенного процесса
468
“газ-твердое” с корректировкой данных на изменение состава газа в
эксперименте и определение области протекания процесса.
РЕАКТОР - расчет процесса в химическом реакторе. Предусмотрена
возможность выбора режима потока (идеальное смешение или идеаль-
ное вытеснение), теплового режима (изотермический, адиабатический
или политропический), типа протекающей реакции (простая или слож-
ная реакция с параллельной, последовательной или последовательно-
параллельной схемой превращений), вида кинетической зависимости.
ГЕТЕРОГЕННЫЙ РЕАКТОР - расчет процесса в реакторах с гете-
рогенной реакцией типа “газ-твердое”. Предусмотрены расчеты в про-
точном и периодическом единичном реакторах, в каскаде реакторов; в
режимах смешения (“кипящий слой”) и вытеснения (“адсорбер”); с
учетом полидисперсности твердого материала и изменения в реакторе
концентрации газообразного реагента в течение процесса.
ОКИСЛЕНИЕ ДИОКСИДА СЕРЫ - все расчеты по процессу: рав-
новесие в реакции окисления диоксида серы, скорость реакции и ее
зависимость от температуры, оптимальные температуры, превращение
в слое и необходимое время контакта в изотермическом и адиабати-
ческом режимах, определение активности катализатора по лаборатор-
ным данным, оптимизация режима разрабатываемых и действующих
многослойных реакторов с различными схемами промежуточного
охлаждения. Расчеты могут проводиться для процессов как в непо-
движном, так и в псевдоожиженном слоях катализатора (режимы иде-
ального вытеснения и идеального смешения).
ТРУБЧАТЫЙ РЕАКТОР - расчет профилей температур и концент-
раций в трубчатом реакторе с неподвижным слоем катализатора для
процессов окисления этилена в этиленоксид, метанола в формальдегид,
нафталина во фталевый ангидрид, паровой конверсии метана, синтеза
аммиака, дегидрирования циклогексанола. Предлагается одномерная
или двухмерная (с радиальным переносом) модель процесса. Предо-
ставлена возможность изменять параметры и условия процесса, прово-
дить секционирование реактора.
ТРЕНАЖЕР - управление процессами в производстве азотной кис-
лоты. В программе проводится технологический расчет производства и
вносится какое-то нарушение в режим. Предоставляется возможность
выявить место и причину нарушения режима, способ его устранения и
восстановить нормальный режим.
SPT-XTC - расчет материального баланса химико-технологической
системы (ХТС). Пользователь вводит данные о ХТС (состав аппаратов,
их соединения - схему ХТС, режим работы аппаратов), сведения о
протекающих процессах и нагрузке на системы. Программа рассчиты-
вает материальный баланс по всем аппаратам ХТС.
Имеются две вспомогательные программы.
ПАРАМЕТРЫ - расчет теплофизических свойств смеси по данным
его компонентов и параметров массо- и теплопереноса в зернистом
слое. Программа используется при моделировании процессов в непо-
движном слое катализатора.
ЛИНЕЙНЫЕ УРАВНЕНИЯ - решение системы линейных алгеб-
раических уравнений (полезна для некоторых технологических расчетов) и
аппроксимация данных степенным многочленом (полезна при градуировке
измерительных устройств и обработке экспериментальных данных).
469
Специальная разработка:
БИБЛИОГРАФИЯ - библиографическая картотека; позволяет соз-
давать, хранить, классифицировать, сортировать, провести быстрый
поиск информации по любой маске и печатать введенную информа-
цию; основное применение - личная или профессиональная
(тематическая) библиография.
* * *
Издательский центр РХТУ им. Д.И. Менделеева выпустил следую-
щие учебные пособия по курсу “Общая химическая технология и осно-
вы промышленной экологии”:
Автоматизированная система расчетных работ в общеинженерных
курсах по химической технологии. Бесков В.С., Давидханова М.Г., Ца-
рев В.И.//1997.
В пособии даны подробные описания программ для ЭВМ, исполь-
зуемых в практических занятиях по курсу “Общая химическая техноло-
гия”, и указания по работе с ними.
Автоматизированный расчет материальных балансов химико-
технологических систем. Бесков В.С., Вяткин Ю.Л., Павлова Н.З., Ка-
ращук А. М.,Семенов Г.М. .//1999.
В пособии описаны расчеты материальных балансов химических про-
изводств на ЭВМ с использованием программного комплекса SPT-XTC,
даны указания по работе с комплексом, представлены примеры и задачи.
Физико-химические закономерности химических процессов. Бесков
В.С., Сучкова Е.В., Игнатенков В.И., Павлова Н.З., Федосеев А.П.,
Сажин В.Б., Ванчурин В.И.//1999.
В пособии рассмотрены физико-химические закономерности хими-
ческих процессов применительно к курсу «Общая химическая техноло-
гия». Приведены определения и методы расчета стехиометрических,
термодинамических и кинетических закономерностей, а также основных
показателей химических процессов, представлены примеры и задачи.
Химические реакторы. Бесков В.С., Игнатенков В.И., Сучкова Е.В.,
Павлова Н.З., Федосеев А.П.//1999.
В пособии изложены принципы и методы расчета, необходимые для
проектирования реакторов различных типов, проиллюстрированы об-
щие закономерности реакционных процессов химической технологии,
основы теории, расчета и выбора химического реактора и параметров
проведения процесса, представлены примеры и задачи.
Химико-технологические системы. Бесков В.С., Игнатенков В.И.,
Сучкова Е.В., Федосеев А.П., Давидханова М.Г.//1999.
В пособии изложены методы расчета материального и теплового ба-
лансов химико-технологических систем, представлены примеры и задачи.
Информация о Российском химико-технологическом университете
им. Д.И. Менделеева имеется в сети Интернет:
http:Wwww.muctr.edu.ru
В сайте университета имеется страничка кафедры “Общая химиче-
ская технология" с информацией об учебно-методической работе ка-
федры по развитию и обеспечению учебного процесса по курсу
“Общая химическая технология” и родственным с ним.
Учебное издание для вузов
Бесков Владимир Сергеевич
Сафронов Валентин Семенович
ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
И ОСНОВЫ ПРОМЫШЛЕННОЙ ЭКОЛОГИИ
Редактор Л.И. Галицкая
Технический редактор АЛ.Шелудченко
Корректоры М.В.Черниховская, Э.В. Назидзе
Оригинал-макет подготовлен в издательстве
ИБ № 3127
Подписано в печать 8.07.99. Формат 60 х 88 1/16
Бумага газетная Гарнитура Таймс. Печать офсетная
Усл.печл. 28,91- Усл. кр.-отт. 28,91. Уч.-издл. 28,21
Тираж 2000 экз. Заказ 2220 . С.06
Изд. № 4233. ЛР 010172 от 17.01.97
Ордена “Знак Почета” издательство “Химия”
107076 Москва, Стромынка 21, корп. 2
Отпечатано в Производственно-издательском
комбинате ВИНИТИ,
140010, г. Люберцы, Московская обл.,
Октябрьский пр-т, 403
Тел. 554-21-86