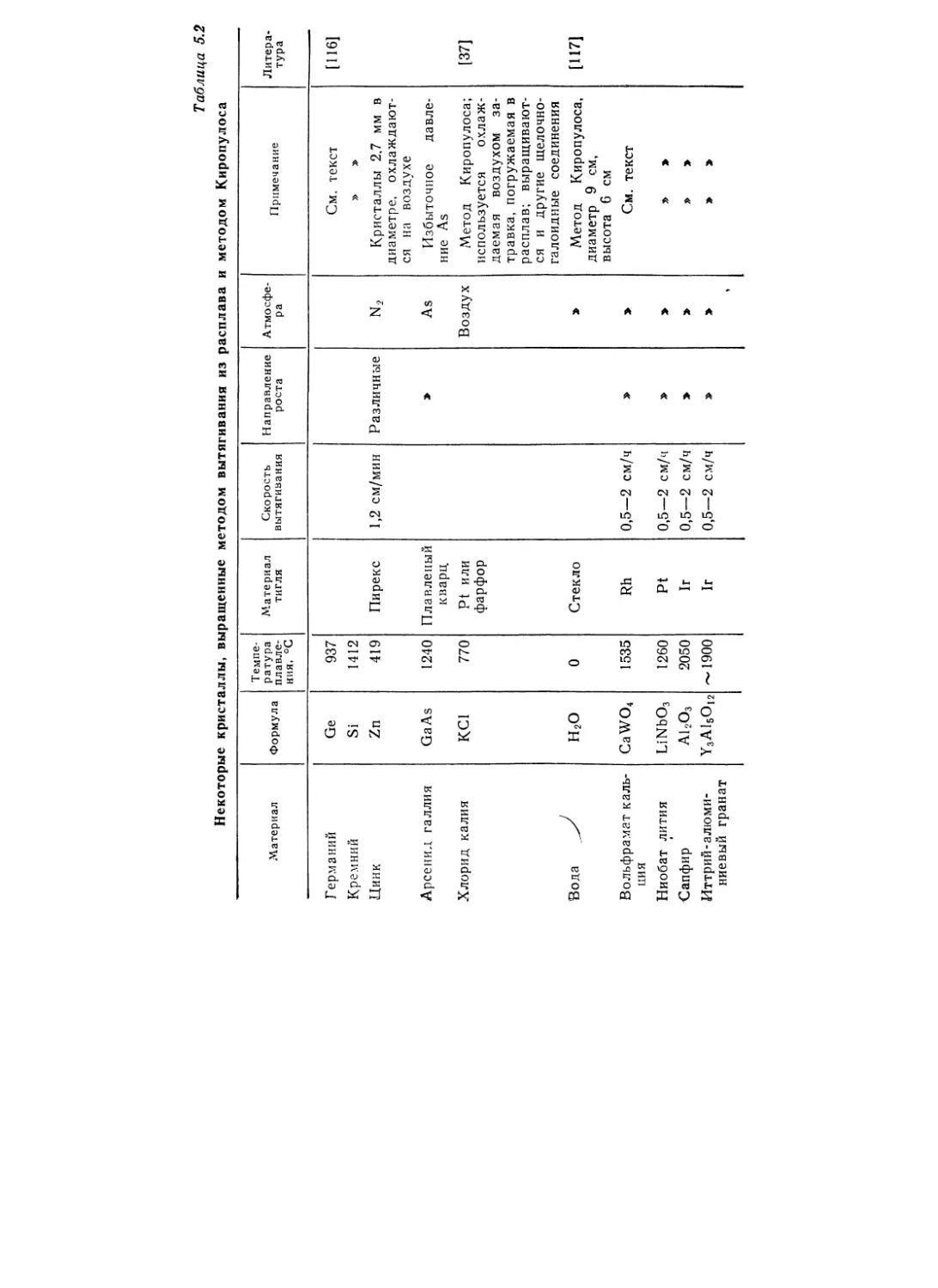
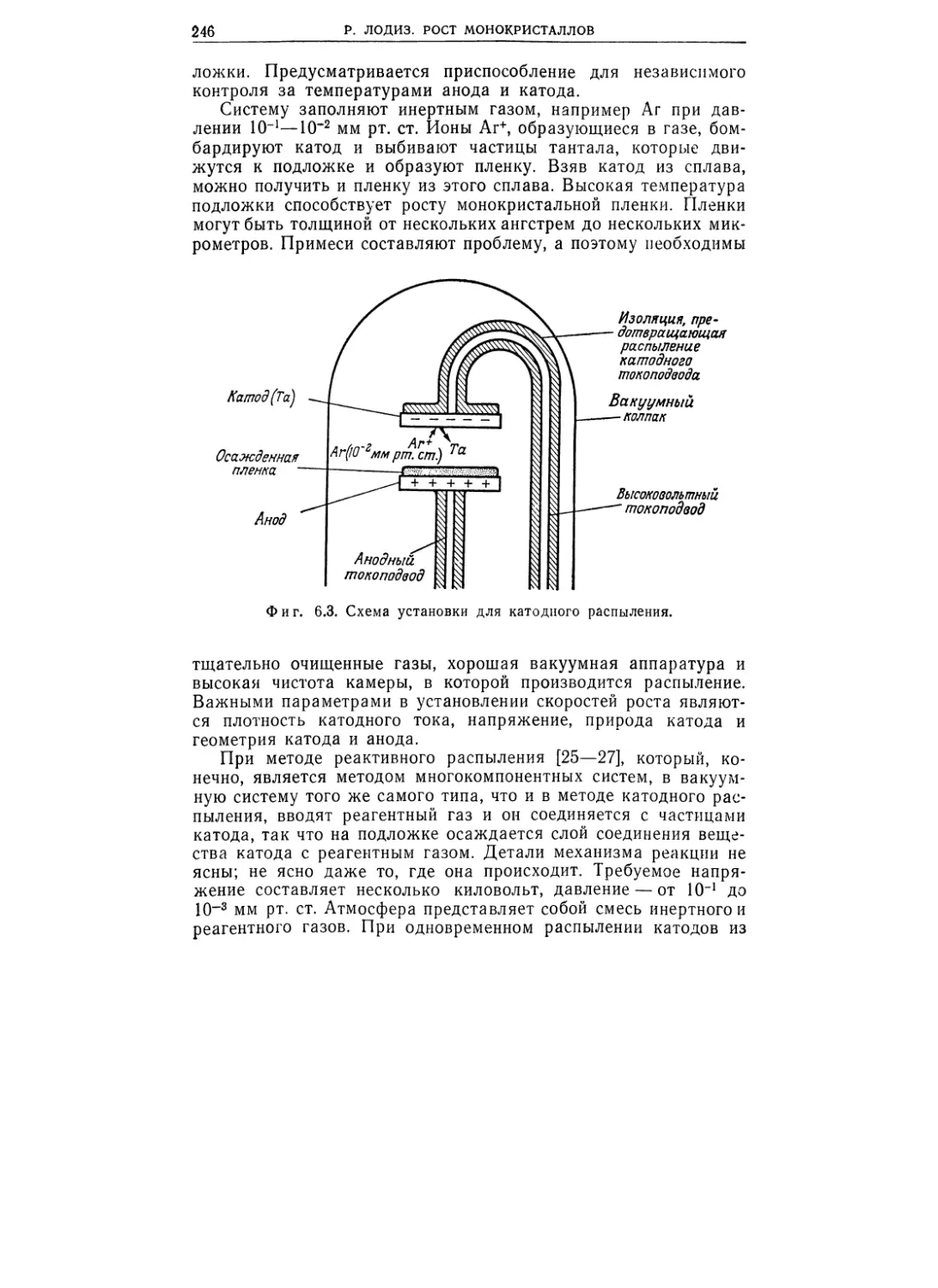
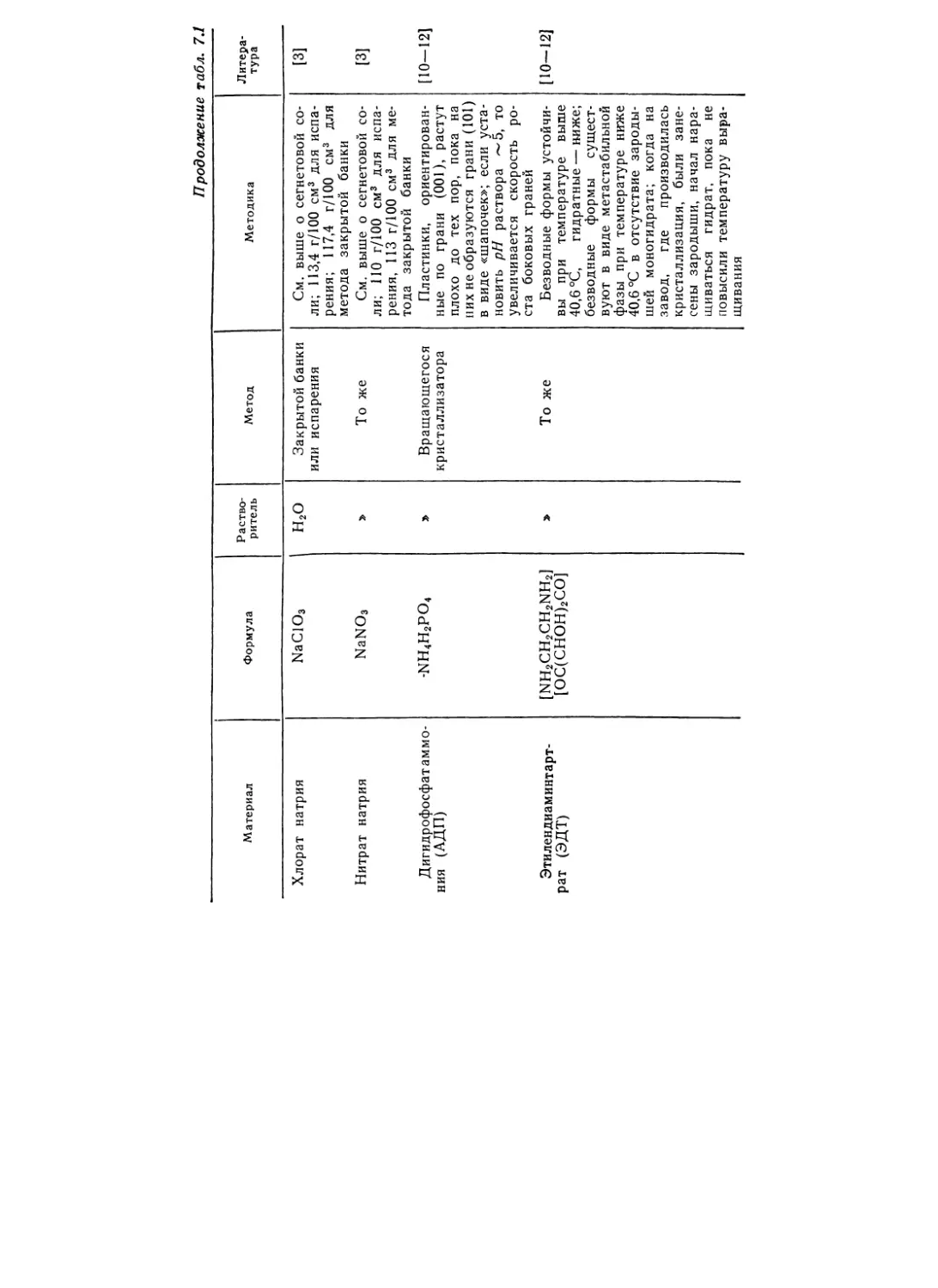
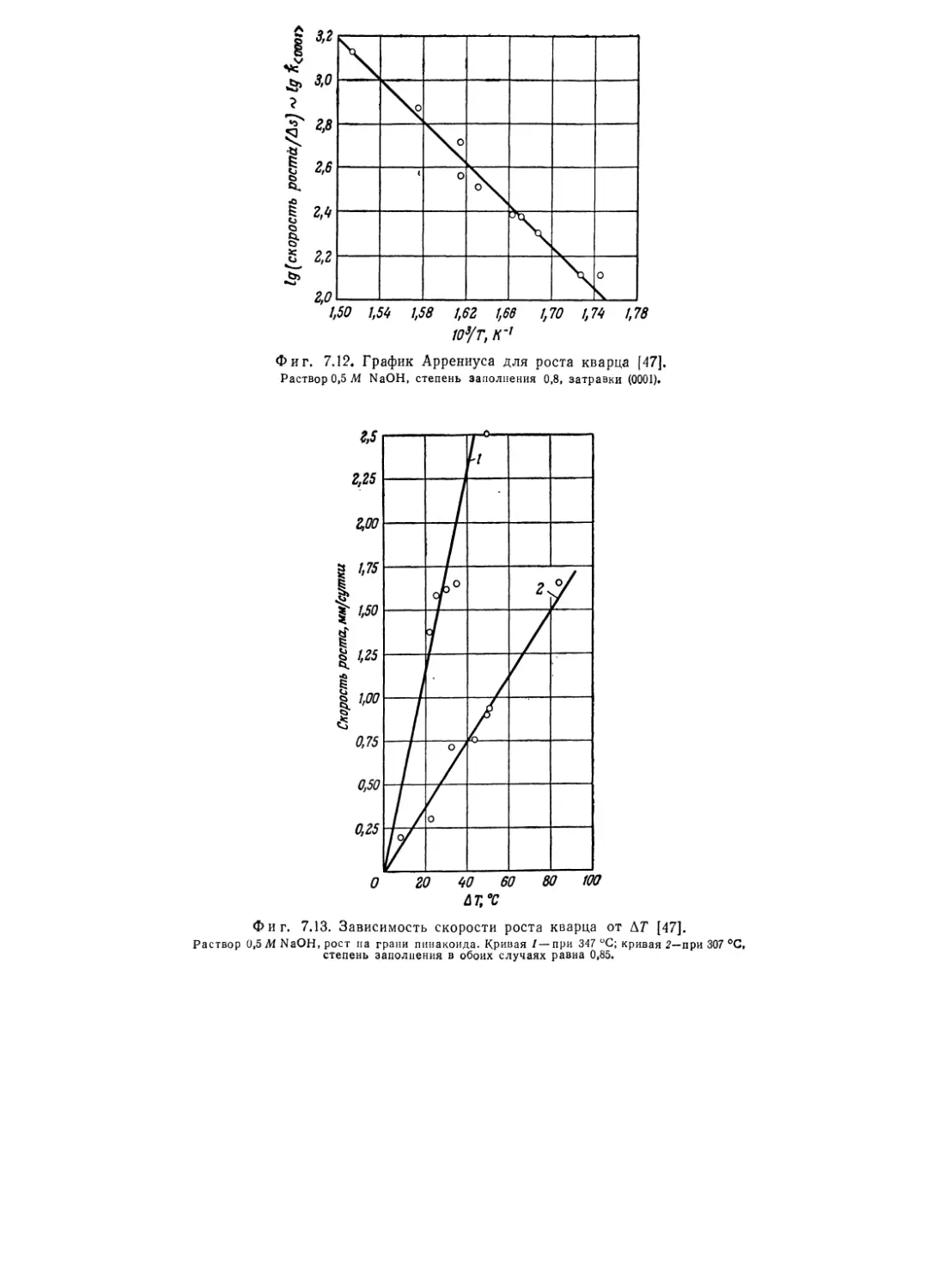
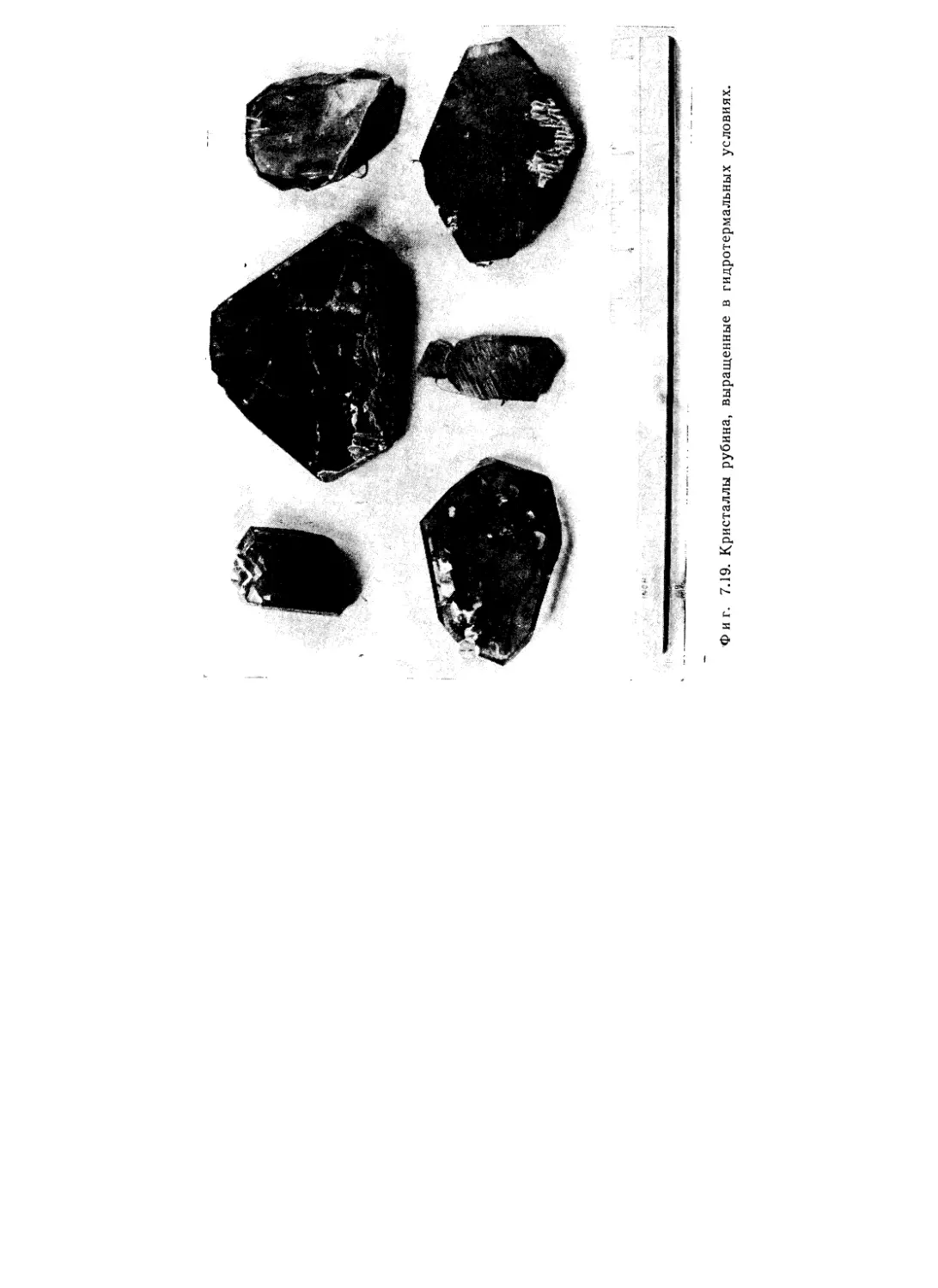
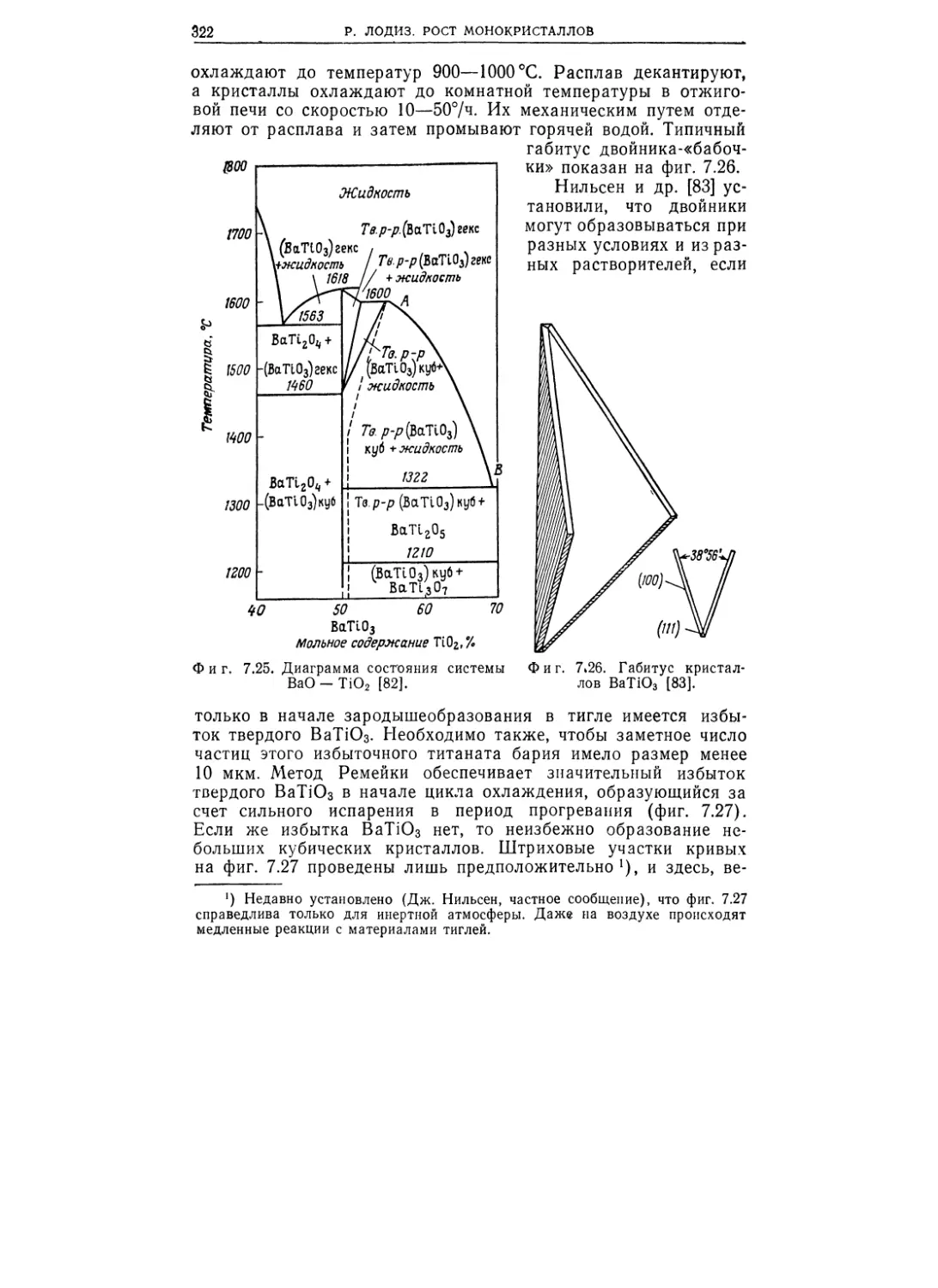
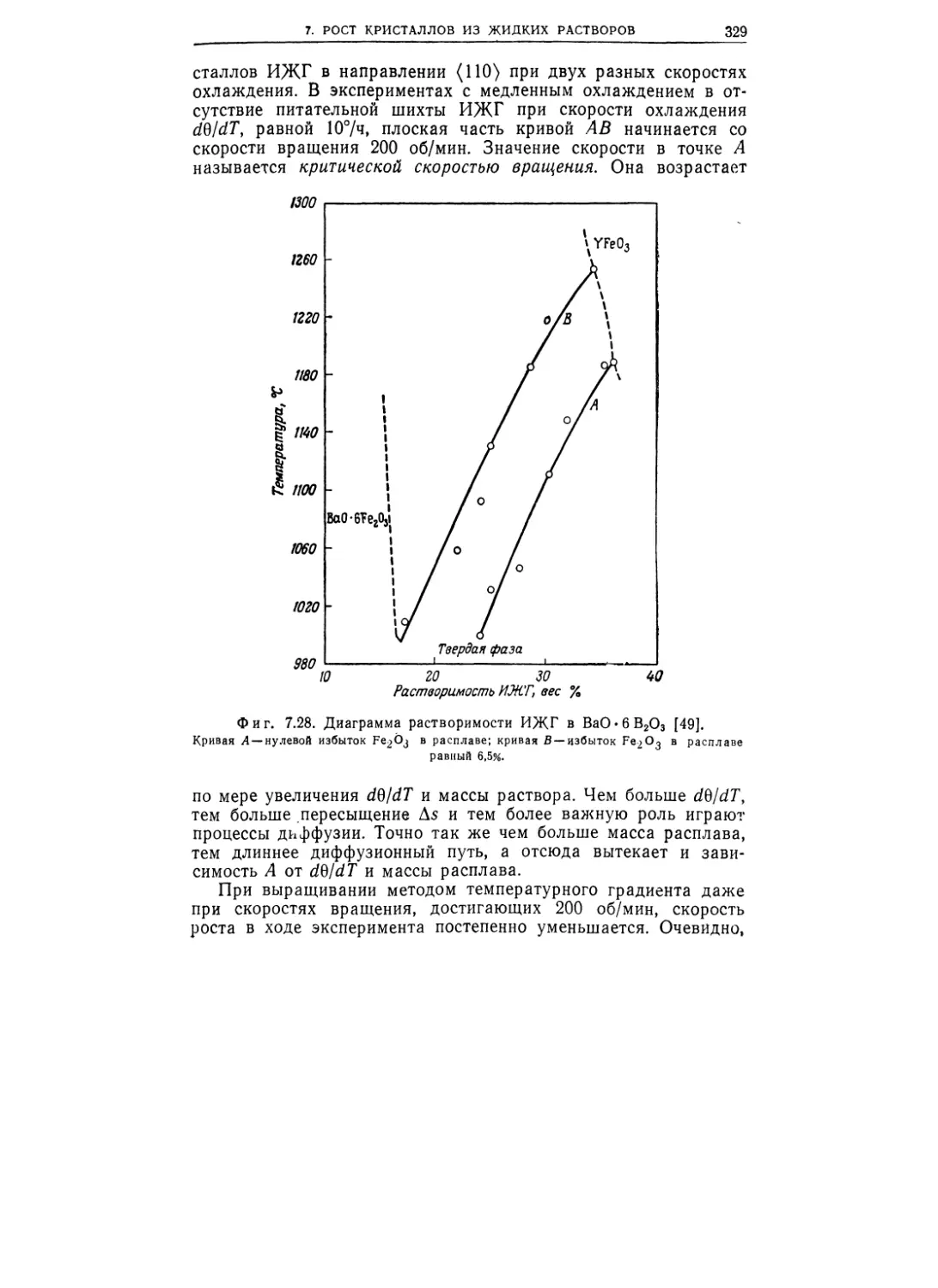
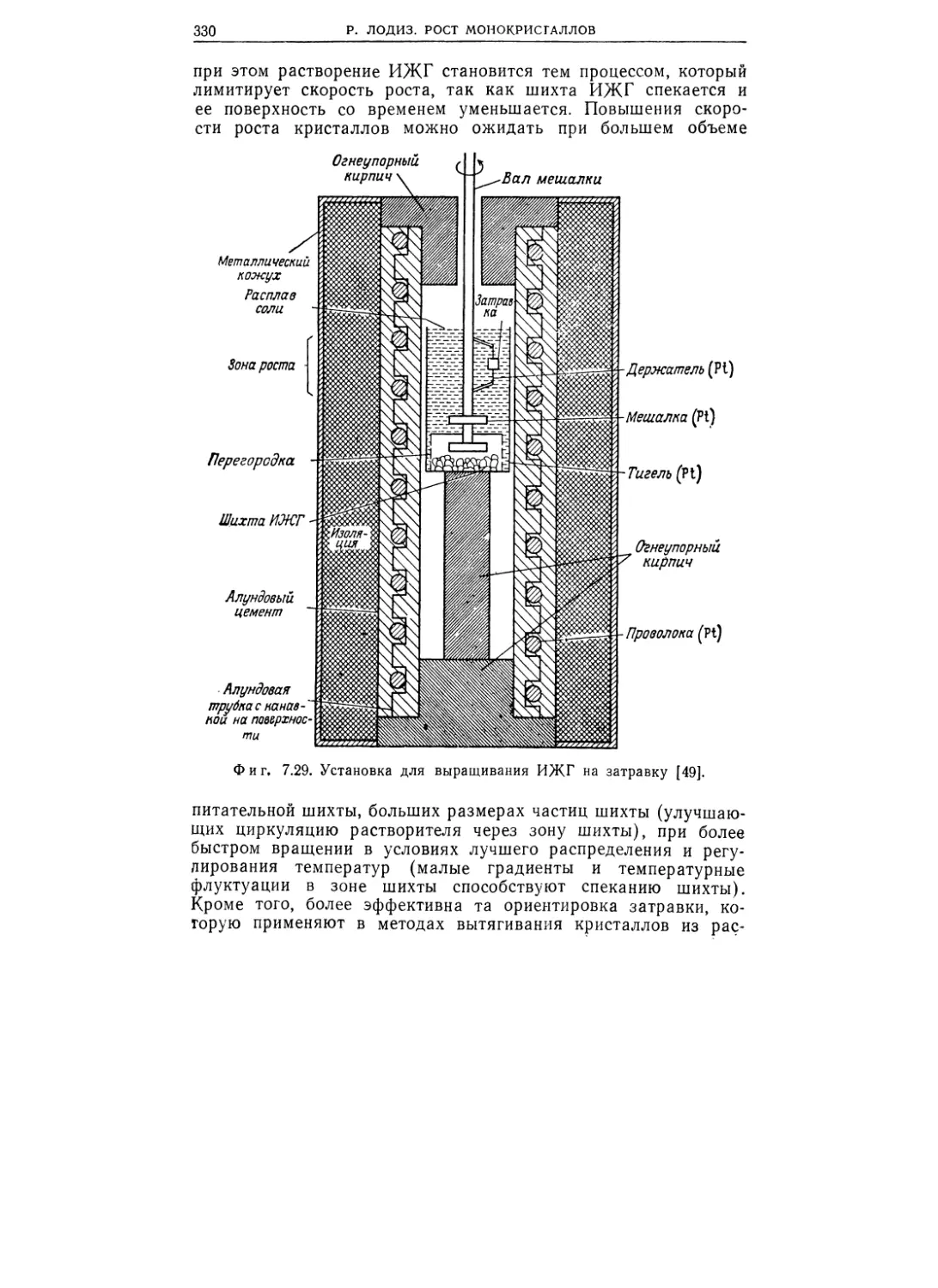
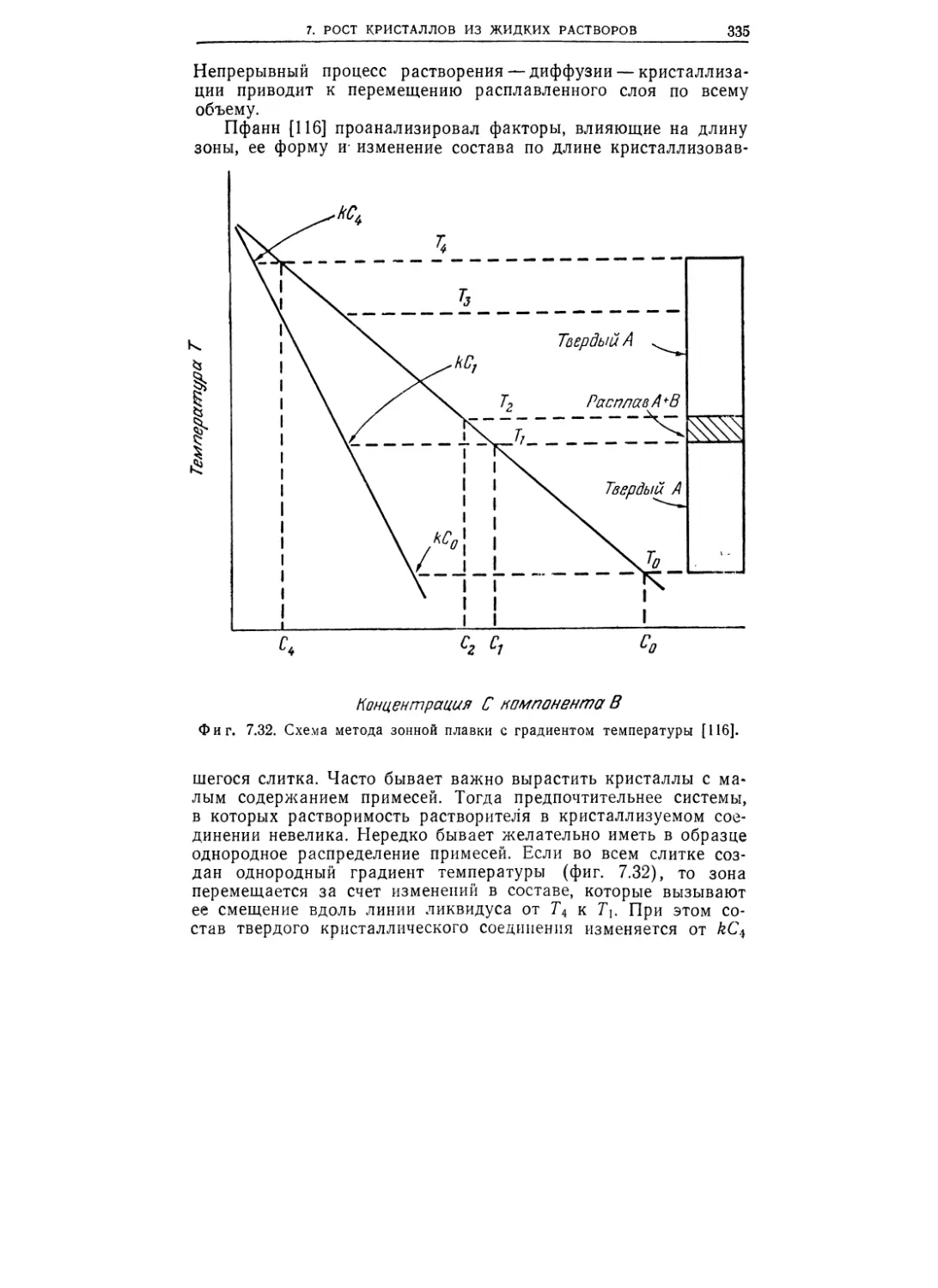
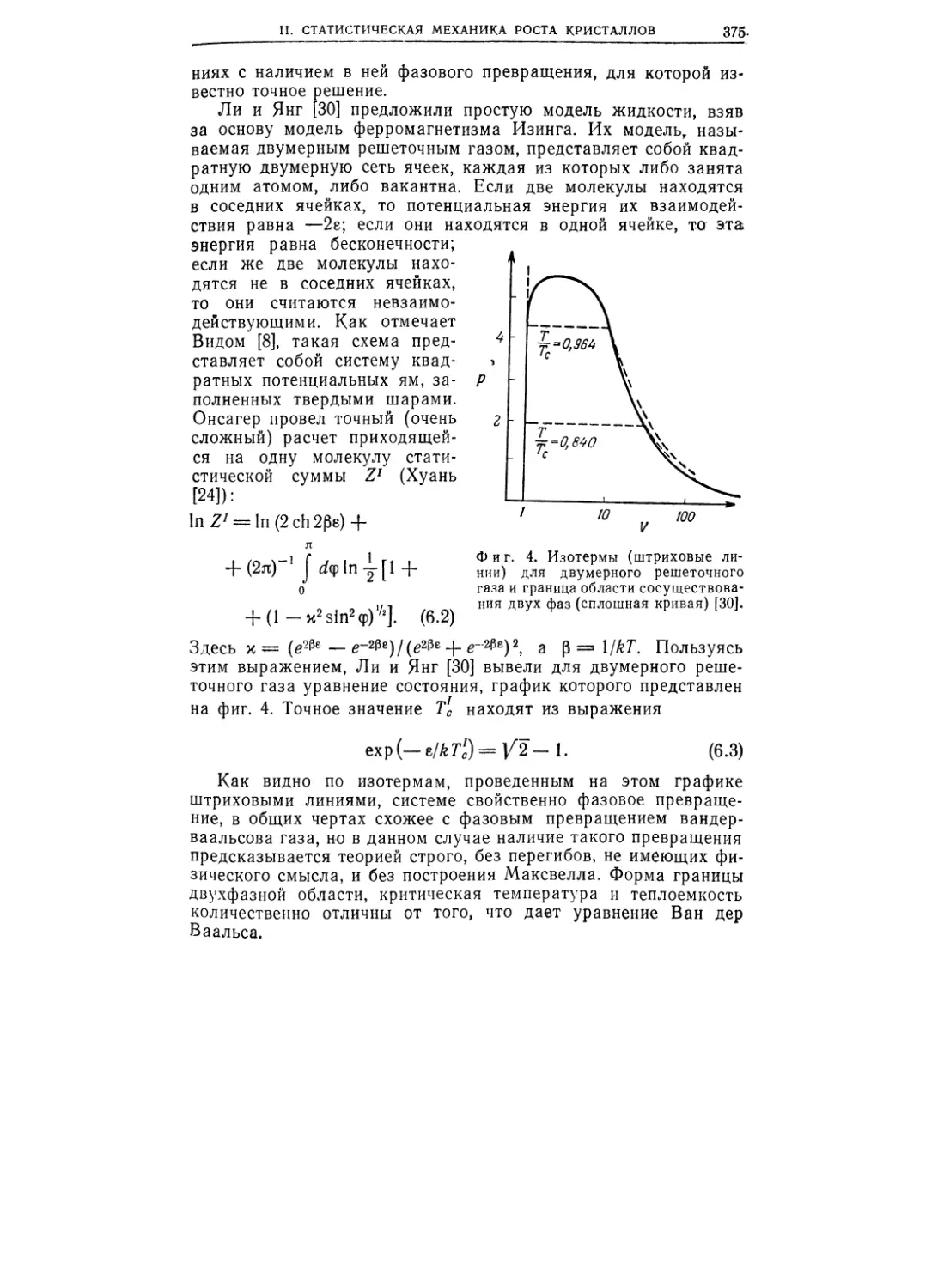
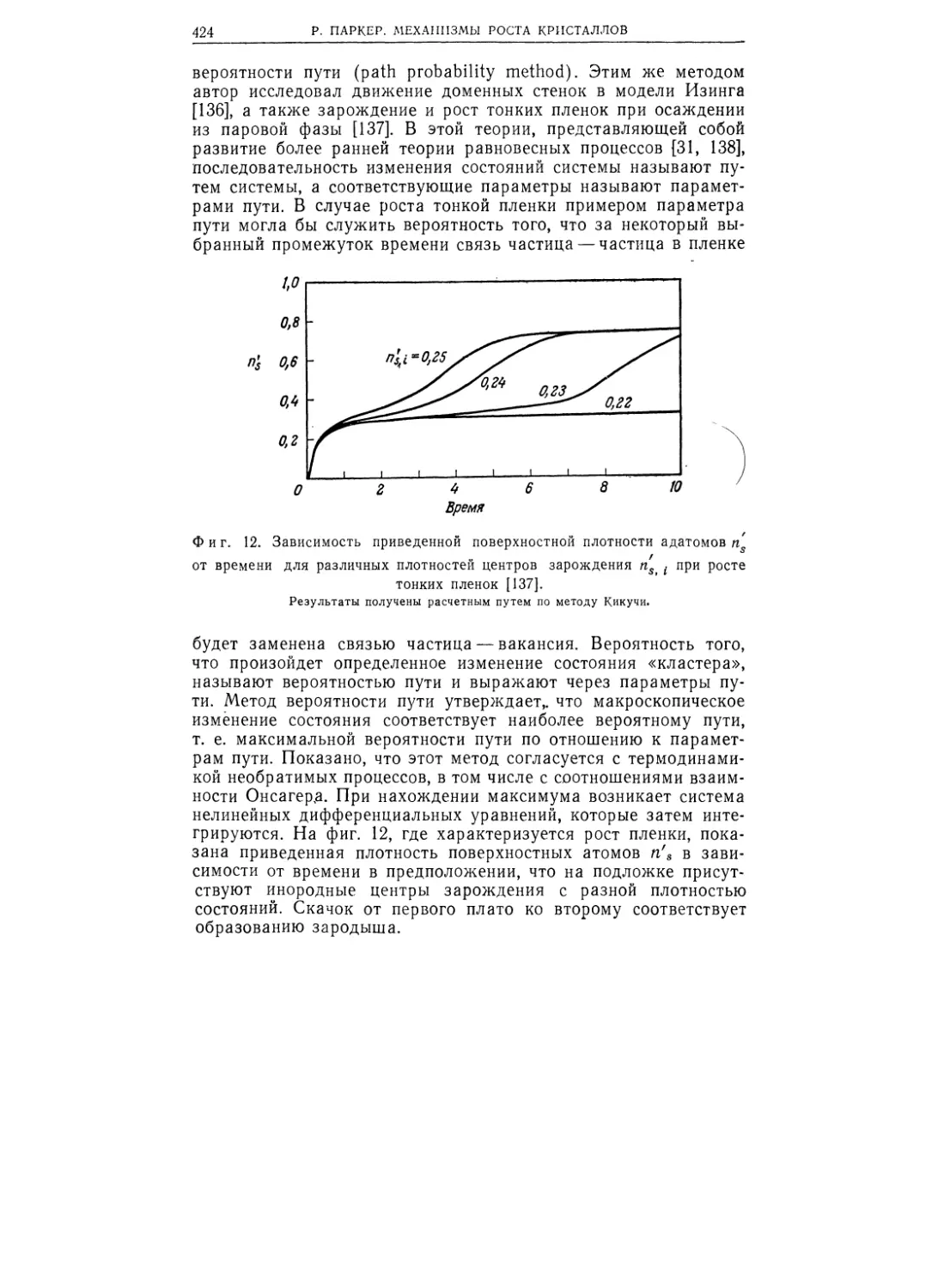
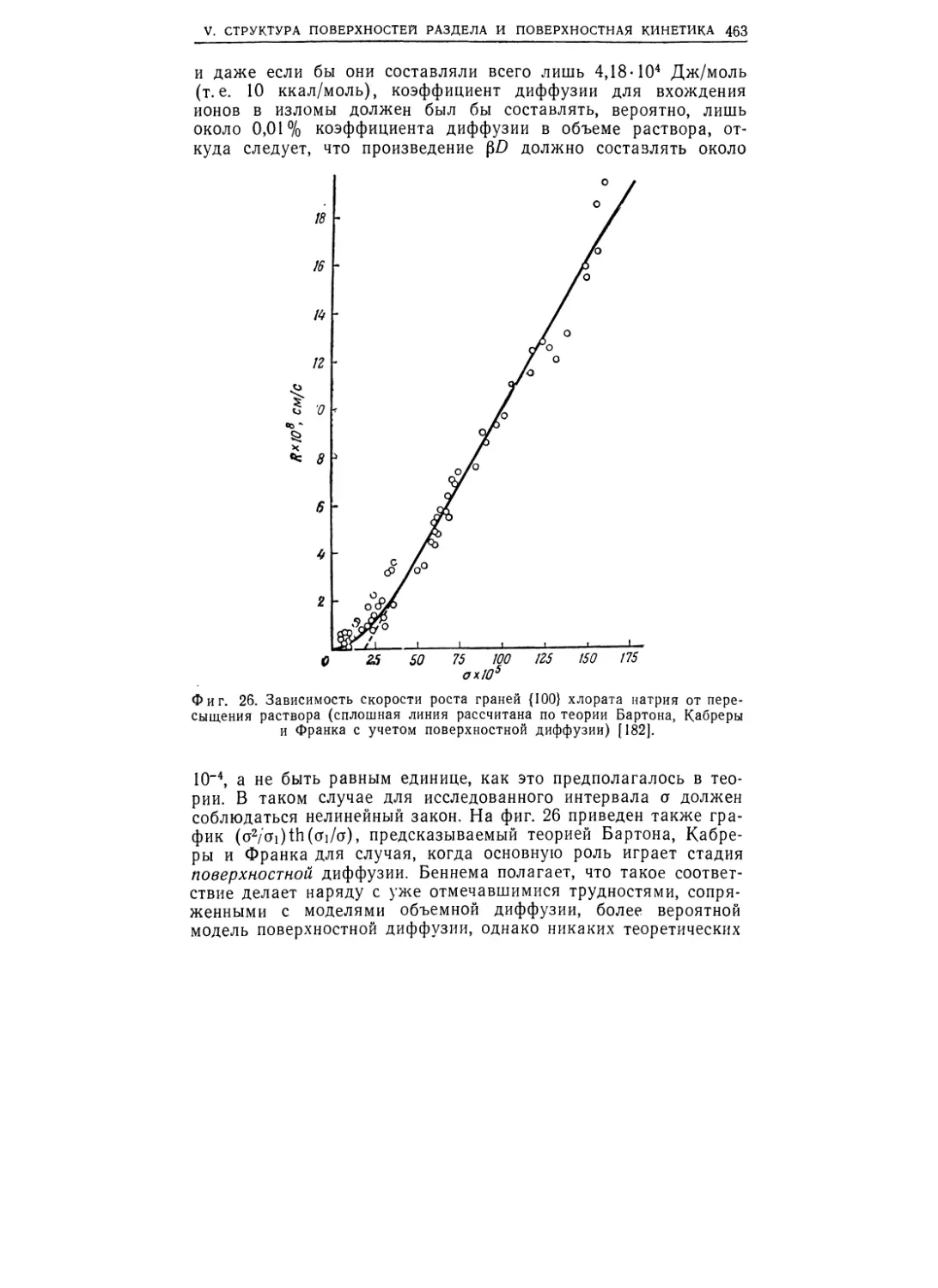
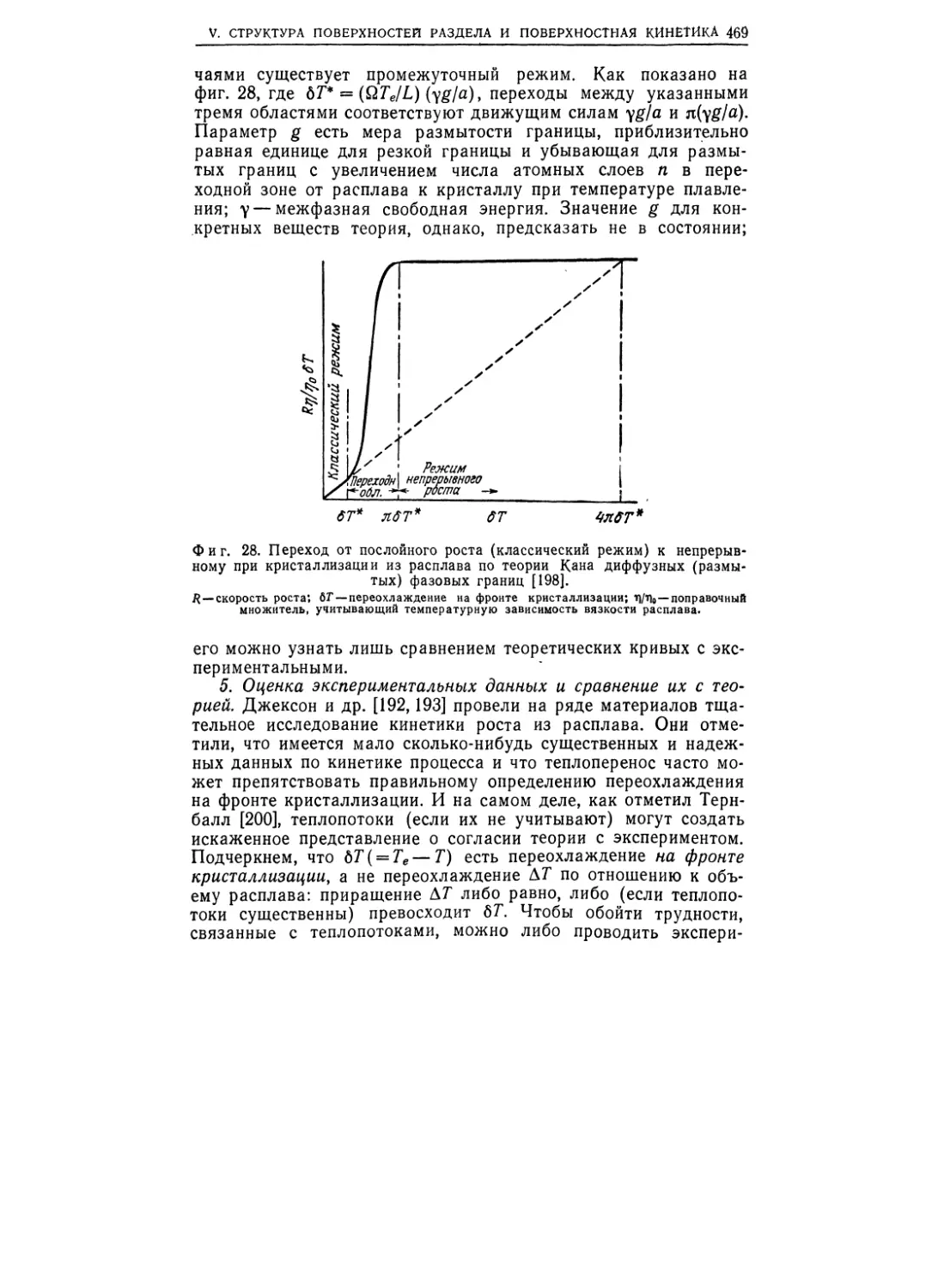
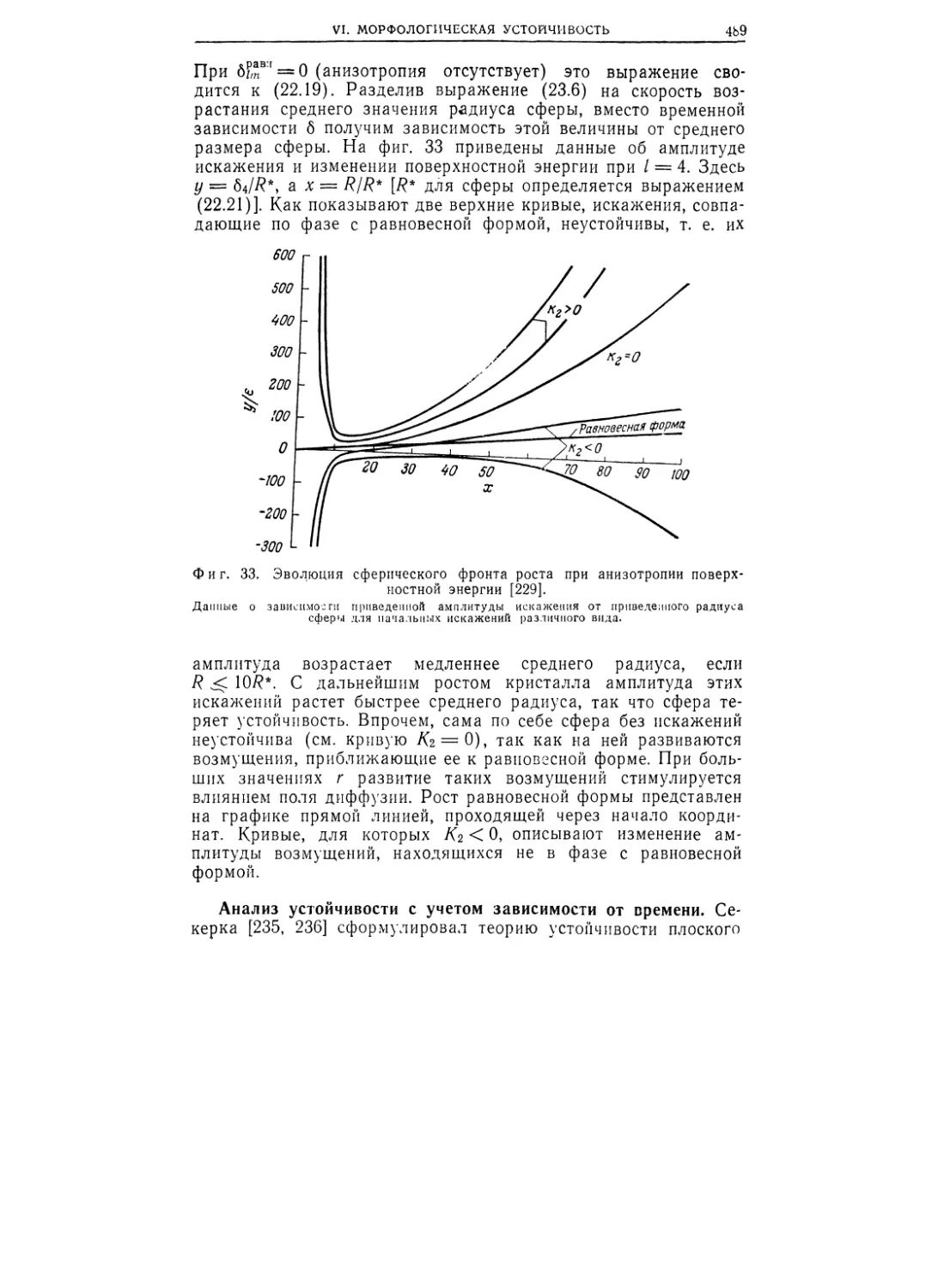
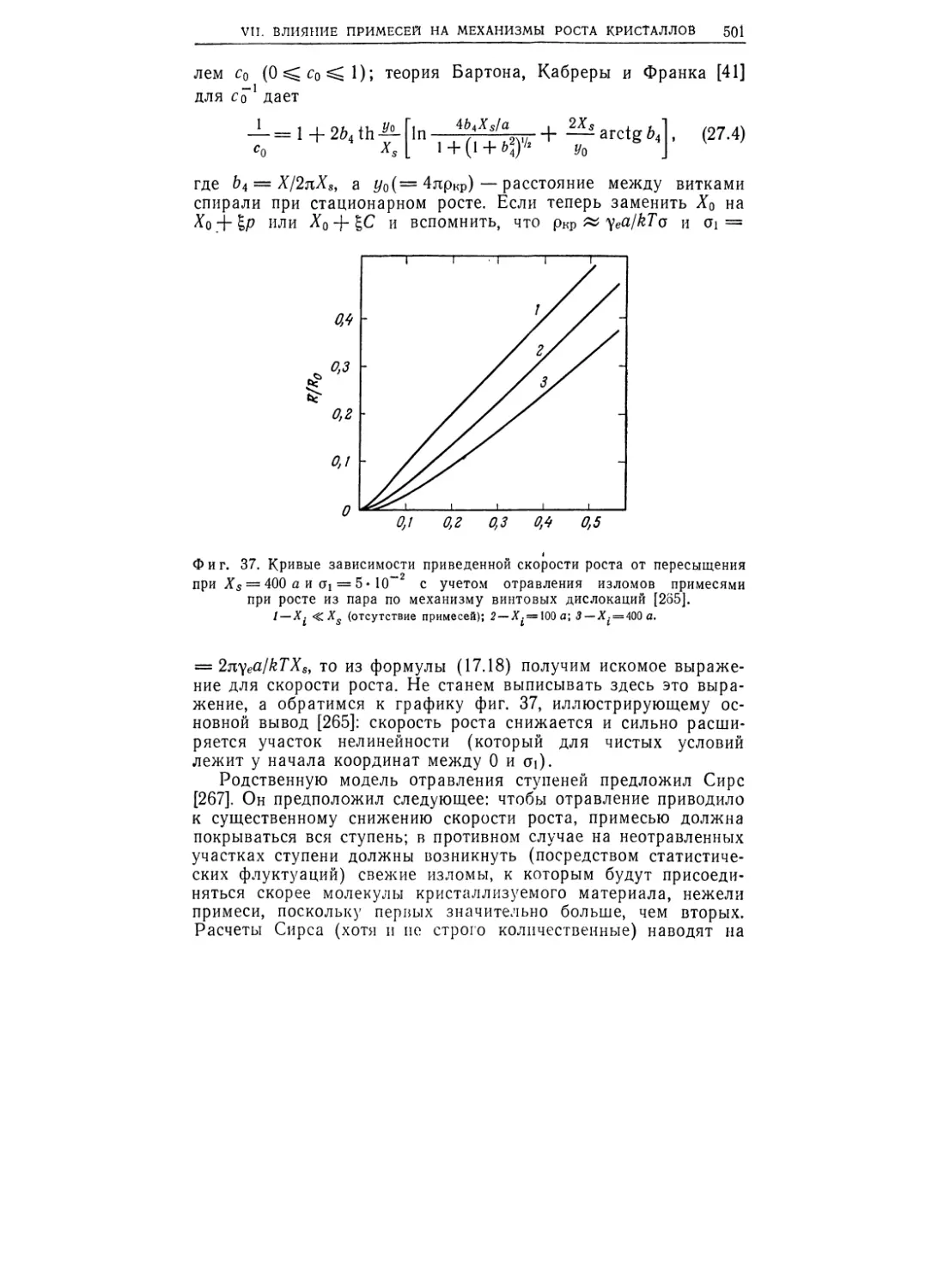
Текст
THE GROWTH
OF SINGLE CRYSTALS
R. A. LAUDISE
BELL TELEPHONE LABORATORIES
MURRAY HILL, NEW JERSY
PRENTICE-HALL, INC.
ENGLEWOOD CLIFFS, NEW JERSY
1970
CRYSTAL GROWTH MECHANISMS:
ENERGETICS, KINETICS AND TRANSPORT
R. L. PARKER
NATIONAL BUREAU OF STANDARDS,
WASHINGTON, D. C.
SOLID STATE PHYSICS, VOLUME 25
ACADEMIC PRESS
NEW YORK AND LONDON
1970
Р. ЛОДИЗ, Р. ПАРКЕР
РОСТ
МОНОКРИСТАЛЛОВ
Перевод с английского
под редакцией
д-ра физ.-мат. наук А. А. ЧЕРНОВА
и канд. хим. наук А. Н. ЛОБАЧЕВА
ИЗДАТЕЛЬСТВО «МИР»
МОСКВА 1974
УДК 532.78+548Л
В книге рассматриваются основы теории роста кристаллов
и важнейшие методы выращивания монокристаллов, применяе-
мых в науке и технике, в частности В полупроводниковой элек-
тронике и лазерной технике.
Книга рассчитана на специалистов по выращиванию кри-
сталлов, а также на студентов старших курсов и аспирантов
физических, физико-технических, химических и геологических
специальностей.
Редакция литературы по физике
П 20403-349
Л 041(01)—74 60“73 ©
Перевод на русский язык, «Мир» 1974
РЕДАКТОРОВ ПЕРЕВОДА
Хорошо известно, что за последние 25 лет число публикаций
по росту монокристаллов и кристаллических пленок растет экс-.
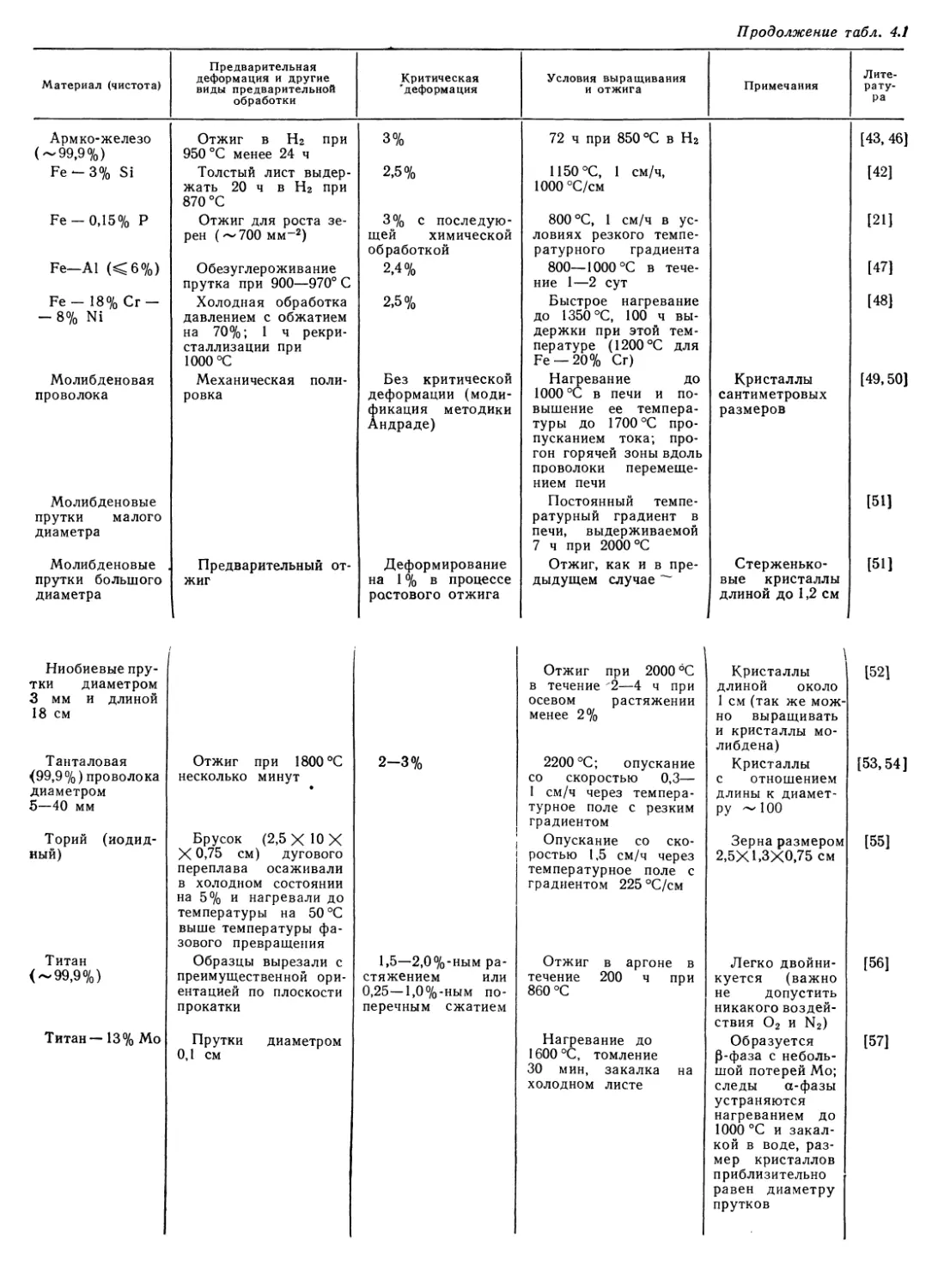
Потенциально, причем удвоение печатной продукции происхо-
дит каждые 5 лет, тогда как для физики в целом для такого
удвоения требуется, по разным данным, 10—15 лет.
' Большинство публикаций посвящено практическим вопро-
сам выращивания кристаллов. К сожалению, многие из них
основаны на методе проб и ошибок, при котором сначала ценой
большого труда и затраты времени находят технологию выра-
щивания кристалла, а уже затем стремятся понять те процессы
роста и образования дефектов, которые протекают в установке.
Такая ситуация имеет не только субъективные, но и объектив-
ные причины, связанные со множеством взаимосвязанных фи-
зических и химических факторов, влияющих на рост кристалла
гораздо сильнее, чем на имеющиеся в обиходе измерительные
приборы. В этой обстановке монографии, суммирующие совре-
менный опыт в области роста кристаллов, становятся чрезвы-
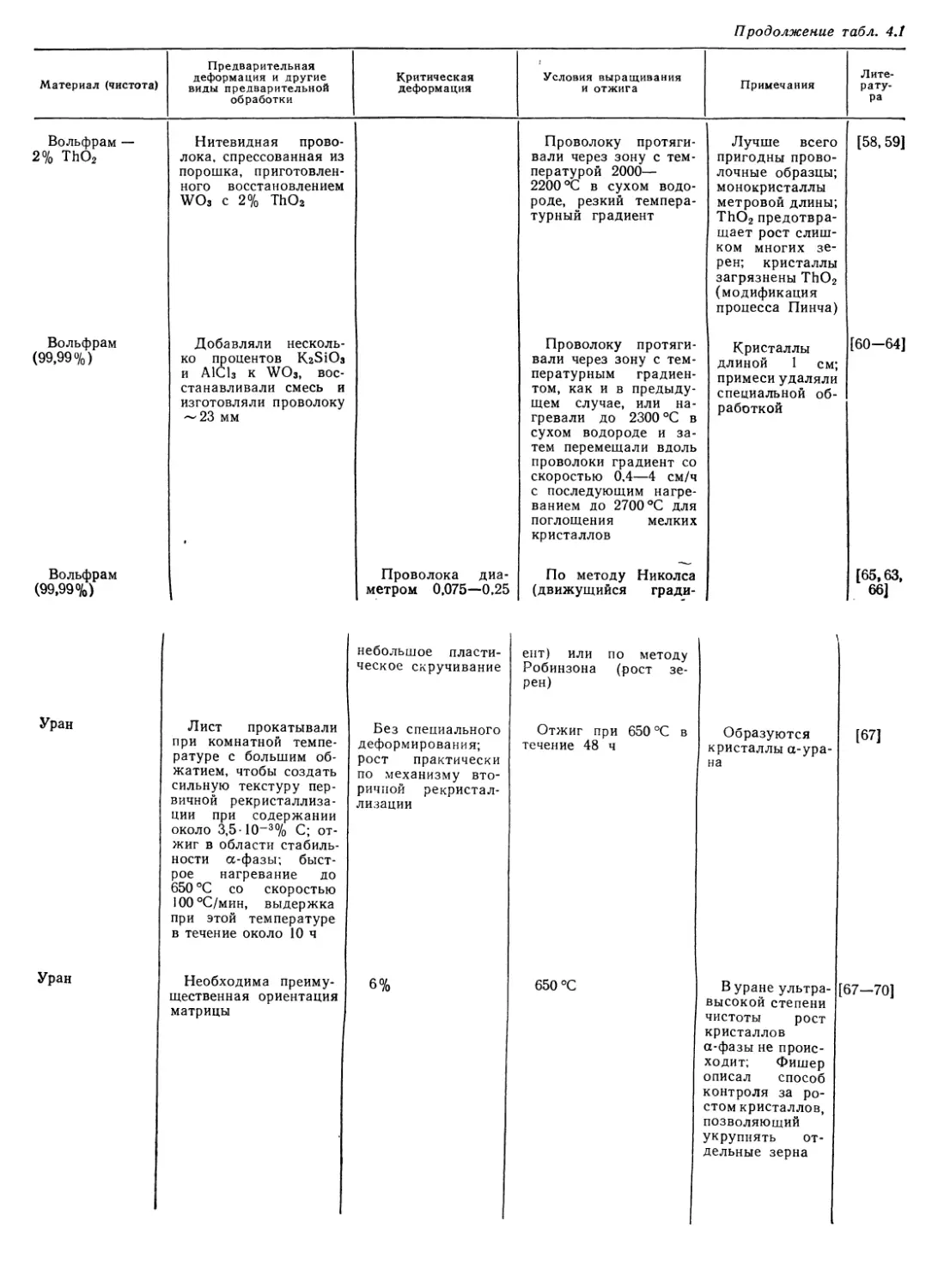
чайно необходимыми. Особенно важно в настоящее время свя-
зать фундаментальные процессы роста кристаллов с технологи-
ческими приемами выращивания. Прямая связь не всегда еще
видна при современном уровне знаний, однако попытки уста-
новить ее там, где это возможно, должны постоянно и смело
предприниматься. Издание книги известных американских спе-
циалистов Р. А. Лодиза и Р. Л. Паркера нам представляется
заметным продвижением по этому пути. Экспериментатор-
практик Р. А. Лодиэ и теоретик Р. Л. Паркер (который выпол-
нил в свое время также прекрасные экспериментальные работы
по нитевидным кристаллам) хорошо дополняют друг друга
именно с точки зрения единства науки и практики. Поэтому из-
дательство и редакторы решили предложить читателям моно-
графию Р. А. Лодиза и монографический обзор Р. Л. Паркера
вместе, под одной обложкой, хотя писались обе книги незави-
симо. Мы рады возможности поблагодарить авторов за согла-
сие на такое объединение и за содействие нашей работе.
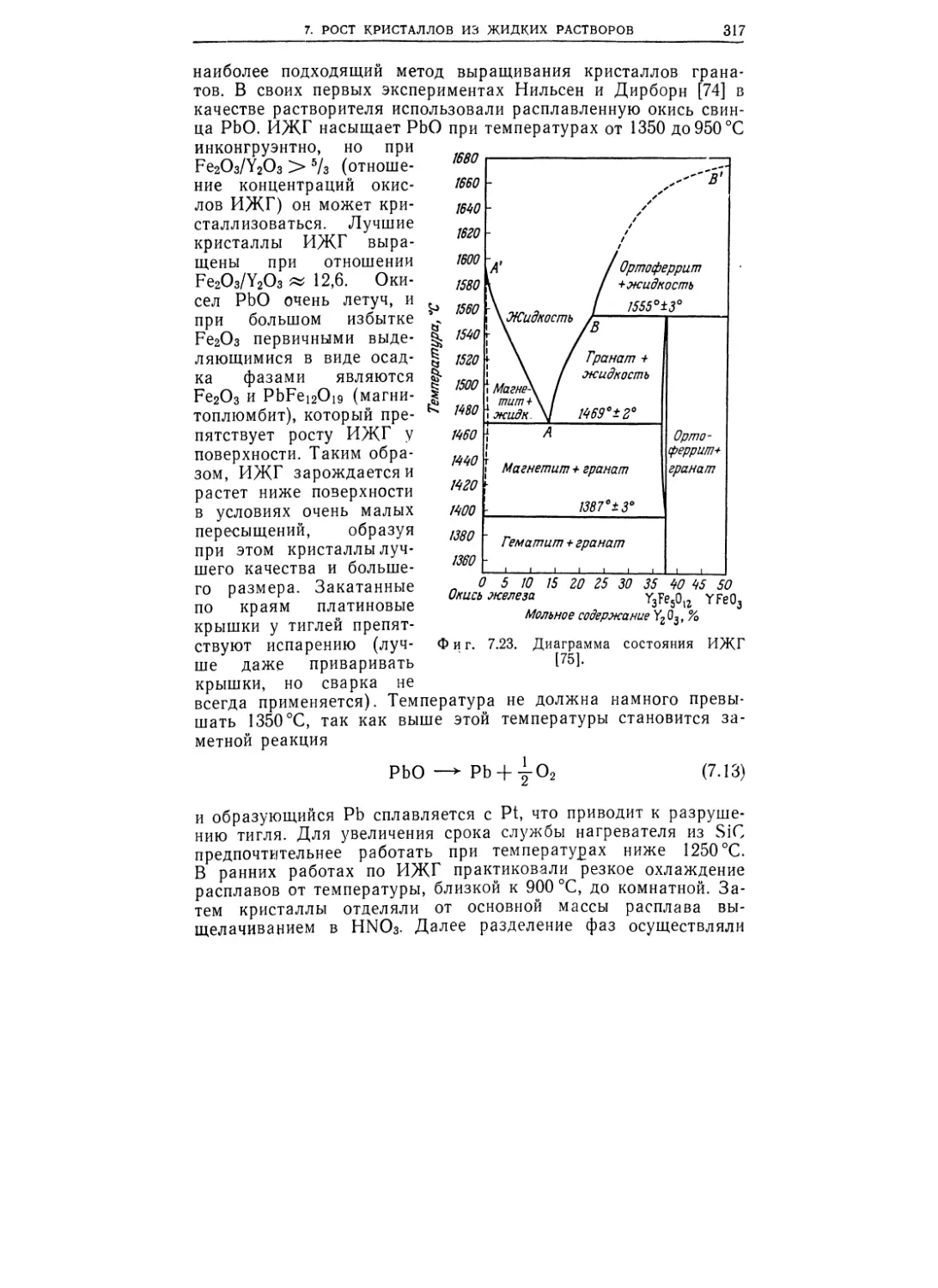
Фундаментальные аспекты проблемы роста кристаллов со-
средоточены в первых трех главах монографии Р. А. Лодиза и
6
ПРЕДИСЛОВИЕ РЕДАКТОРОВ ПЕРЕВОДА
в обзоре Р. Л. Паркера. Р. А. Лодиз сосредоточил внимание на
качественном изложении азов науки о росте кристаллов, не
стремясь к последовательному математическому описанию
процессов кристаллизации и их количественному анализу.
Р. Л. Паркер адресует свой обзор тем, кто уже знаком с этими
азами. Он кладет во главу угла по возможности строгое опи-
сание тех физических явлений роста, которые имеют более или
менее адекватные, но все же сравнительно простые модели. Об-
зор Р. Л. Паркера, по нашему мнению, является наилучшим
современным обзором по теории кристаллизации.
Таким образом, читатель найдет в книге двух авторов из-
ложение фундаментальных проблем кристаллизации на «двух,
уровнях», что несомненно расширяет сферу действия этой книги.
Здесь рассматриваются термодинамические движущие силы
кристаллизации, дефекты кристаллов, зарождение кристаллов,
строение поверхностей кристаллов в равновесии и в процессе
кристаллизации, кинетика процессов на этой поверхности и в
объемах прилегающих к ней фаз, термодинамически равновес-
ное и неравновесное распределение примесей, образование форм
роста кристаллов и их устойчивость, возникновение дефектов
при росте монокристаллов. Все эти вопросы обсуждаются на
основе как теоретических, так и, в несколько меньшей мере,
экспериментальных результатов.
Другой стороне проблемы роста кристаллов—практической,
посвящены 4—7 главы монографии Р. А. Лодиза. Автор изла-
гает здесь материал таким образом, чтобы вооружить читателя
логикой выбора наиболее подходящего метода для выращива-
ния нужного кристалла. В основе такой логики лежит физико-
химическая сущность явлений роста, которая и сделана стерж-
нем изложения. Р. А. Лодиз обсуждает все основные методы и
методики выращивания — из расплавов, растворов и газовой
фазы (в том числе с участием химических реакций), а также
путем рекристаллизации в твердой фазе и полиморфных пре-
вращений. Изложение основных методов выращивания следует
единой для всей книги схеме: 1) физико-химические основы и
общая характеристика метода, показания и противопоказания
для его использования, 2) аппаратура, обычно в виде принци-
пиальных схем и 3) способы получения конкретных кристаллов
них характеристики. Осуществляя эту схему, автор концентри-
рует внимание прежде всего на качественном описании явлений
роста кристалла и дает ориентировочные численные параметры
процёсса. Технологические приемы также увязываются с про-
цессами роста и образования дефектов. Весь этот обширный,
в известной степени энциклопедический материал изложен ин-
тересно, ясно, очень по-деловому и с большим педагогическим
мастерством, Автор не стремится к скрупулезному описанию
ПРЕДИСЛОВИЕ РЕДАКТОРОВ ПЕРЕВОДА
7
технических деталей существующих установок. Их читатель
найдет в книге Вильке [1]. Элементарные сведения по лабо-
раторной технике роста кристаллов и точные описания ряда экс-
периментов собраны в вышедшей недавно книге коллектива
венгерских авторов под редакцией Тарьяна и Матраи [2]. Нако-
нец, подробный анализ роста и выращивания кристаллов из вод-
ных низкотемпературных растворов имеется в книге Петрова,
Трейвуса и Касаткина [3] и вышедшем недавно втором, расши-
ренном почти вдвое издании [4] книги Маллина [5]. Последние
результаты в области гидротермального синтеза отражены в
сборниках [5, 6], а в области роста из расплава — в сборнике
[7]. Наиболее свежим изданием, в котором затронуты все проб-
лемы роста монокристаллов являются пять томов цахкадзор-
ской конференции [8].
Не все разделы книги Р. А. Лодиза и Р. Л. Паркера равно-
значны. В частности, у Р. А. Лодиза не вполне удачно пред-
ставлена проблема структуры поверхности кристалла (разд. 3.3
и 3.14). Трудно согласиться с трактовкой «эффекта грани»
в разд. 3.12, основанной на предположении о решающей роли
поверхностной энергии и влияния на нее примесей. В действи-
тельности, как показано в последние годы [9—10] ’), явление свя-
зано с одновременным существованием на фронте роста сингу-
лярных и атомно-шероховатых поверхностей, нуждающихся для
роста в существенно разных переохлаждениях. В изложение
Р. Л. Паркера изредка вкрадывается реферативно-компилятив-
ный стиль. Р. А. Лодиз недостаточно отразил результаты ис-
следований советских специалистов. Последний недостаток ре-
дакторы старались уменьшить, указывая литературу в своих
примечаниях. Эти недочеты, однако, не умаляют большого зна-
чения предлагаемой книги, подытоживающей результаты ис-
следований по росту кристаллов за последние 10—15 лет.
Редакторы и переводчики надеются, что выпускаемая книга
будет полезной как молодым специалистам, недавно работаю-
щим в области кристаллизации, так и опытным ученым — физи-
кам, химикам, инженерам и техникам, сталкивающимся с ро-
стом кристаллов.
Книгу Р. А. Лодиза перевели: Л. Н. Демьянец (гл. 1, 2),
В. А. Кузнецов (гл. 3—5 и предисловие автора к английскому
изданию) и И. П. Кузьмина (гл. 6, 7), а статью Р. Л. Парке-
ра— А. м. Мельникова (гл. 1—3, 6, 8 и предисловие Р. Л. Пар-
кера к русскому изданию) и Е. И. Гиваргизов (гл. 4, 5, 7).
А. Чернов
А. Лобачев
*) См. также статью X. С. Багдасарова [8, стр. 6].
8 йреДйсловйе редактор^ перевода
ЛИТЕРАТУРА
1. Вальке К. Т., Методы выращивания кристаллов, Л., 1968.
2. Laboratory Manual on Crystal Growth, eds. t Tarjan, M. Matrai, Buda*
pest, 1972.
3. Петров T. Г., Трейвус E. Б., Касаткин A. H.t Выращивание кристаллов
из растворов, Л., 1967.
4. Mullin W., Crystallization, 2-nd edition, London, 1972 (есть перевод 1-го
издания: Дж Маллин, Кристаллизация, М., 1965).
5. Гидротермальный синтез кристаллов, ред. А. Н. Лобачев, М., 1968.
6. Исследование процессов кристаллизации в гидротермальных условиях,
ред. А. Н. Лобачев, М., 1970.
7. Рост и дефекты металлических кристаллов, ред. Д: Е. Овсиенко, Киев,
1972.
8. IV Всесоюзное совещание по росту кристаллов, Ереван, 1972.
9. Brice С., JourrL Crystal Growth, 6, 205 (1970).
10. Чернов А. А., Кристаллография, 16, 842 (1971).
I
P. лодиз
РОСТ
МОНОКРИСТАЛЛОВ
ПРЕДИСЛОВИЕ АВТОРА
К РУССКОМУ ИЗДАНИЮ
О содержании, целях книги и об обстановке, в которой она
появилась, уже говорилось в предисловии к английскому из-
данию. Автору особенно приятно, что «Рост монокристаллов»
теперь будет издан на русском языке. Советские ученые уже
давно находятся на переднем крае исследований по росту кри-
сталлов, и автор многое почерпнул из их работ. Хочется на-
деяться, что они найдут эту книгу полезной. Автор особенно
хотел бы поблагодарить А. А. Чернова, А. Н. Лобачева и их
коллег по Институту кристаллографии АН СССР Е. И. Гивар-
гизова, Л. Н. Демьянец, В. А. Кузнецова, И. П. Кузьмину,
А. М. Мельникову за перевод книги. Кроме того, автор благо-
дарен ряду читателей английского издания, которые указали
на ошибки, 'исправленные при переводе. Особенно удачно, что
этот перевод выходит в свет вместе с «Механизмами роста кри-
сталлов» Р. Л. Паркера. Надо надеяться, что вместе эти работы
дадут адекватную картину современной теории, методик и прак-
тики. В связи с этим хотелось бы обратить внимание читателя
на обзор «Рост кристаллов» Р. А. Лодиза, Дж. Р. Каррузерса
и К. А. Дженсона (в книге Annual Review of Materials Science,
eds. R. Huggins, R. Bube and R. Roberts, Vol. 1, Palo Alto,
Calif., 1971, p. 253), который посвящен последним результатам,
появившимся после выхода книги «Рост монокристаллов».
Р. А. Лодиз
ИЗ ПРЕДИСЛОВИЯ АВТОРА
К АНГЛИЙСКОМУ ИЗДАНИЮ
Эта книга !) предназначена для всех желающих выращивать
монокристаллы, — как для тех, кто считает выращивание кри-
сталлов своей основной профессией, так и для тех, кто хочет
получить кристаллы для исследования их свойств и приходит
к необходимости выращивать их самому. Предполагается, что
читатель знаком с основами физической химии, но это не обя-
зательно, особенно если читатель обратит серьезное внимание
на гл. 2 и 3 и приведенные в них ссылки.
Книгу можно использовать в следующих направлениях:
1. Как основной или факультативный курс для оканчиваю-
щих или окончивших ВУЗ по отделению материаловедения.
В сочетании с соответствующей учебной лабораторной или ис-
следовательской работой его можно использовать для подго-
товки лиц с редкой и крайне необходимой специальностью —
«рост кристаллов».
2. Как руководство для специалиста по росту кристаллов.
В гл. 1—3 материал суммирован на основе понятий кристал-
лического состояния, термодинамики и кинетики в общем виде,
а не в конкретной форме, пригодной для практической повсе-
дневной работы. В остальных главах обсуждаются основные
методы, причем материал организован таким образом, чтобы
помочь специалисту по росту кристаллов логически выбрать ме-
тод выращивания и последовательно рассмотреть теоретические
основы каждого метода, насколько это возможно в настоящее
время.
3. Как справочное пособие по методам выращивания разных
материалов. Рассмотрена теория каждого из основных методов,
описано оборудование, обсуждены методики и описано выращи-
вание типичных кристаллов.
Если читатель сочтет за лучшее не читать книгу от корки
до корки, мы советуем прочесть или хотя бы бегло просмот-
реть вводный материал к главе, в которой описывается особен-
но интересующий его метод или кристалл.
9 Книга Лодиза. — Прим. ред.
12
ИЗ ПРЕДИСЛОВИЯ АВТОРА К АНГЛИЙСКОМУ ИЗДАНИЮ
Эта книга не энциклопедия. Необходимость быть кратким,
дать критический обзор положения дел, включение подготови-
тельного материала и попытка представить методологию выра-
щивания кристаллов как логичную, внутренне связанную область
знания заставили автора отказаться от попыток описать каждый
из когда-либо выращенных кристаллов, хотя большинство мате-
риалов, ценных на сегодняшний день для практических и ис-
следовательских целей, нашли отражение в книге. Тем не
менее просмотр периодической литературы перед началом
экспериментальной работы остается необходимым.
Главы 1—3 написаны с точки зрения требований специа-
листа по выращиванию кристаллов. Если ваши основные
интересы лежат в области исследования совершенства кристал-
лов, термодинамики или теории кристаллизации, необходимо
ознакомиться с более полными работами по этим предметам.
Любая работа — это в значительной степени продукт той
обстановки, в которой она выполнялась. Предложенная книга
в значительной степени является результатом более чем деся-
тилетнего участия в работах фирмы «Белл телефон лейборато-
риз» по выращиванию монокристаллов для исследовательских
и практических целей. Представленные материалы и иллюстра-
ции в подавляющем большинстве подобраны на основании
опыта. Осуществляя такой отбор, я сожалел, что незнаком со
многими хорошими работами в других лабораториях и потому
мог упустить некоторые из них. Я не предполагал давать оценки
значения работ и не принадлежу к числу историков науки.
Длинные исторические разделы опускались, если они не были
полезны по существу дела. Ссылки главным образом пресле-
дуют цель подвести читателя к богатой палитре современных
материалов, которые не нашли достаточного отражения в тек-
сте, а не дать окончательное суждение по приоритетным воп-
росам.
Разделы книги критически просмотрели некоторые мои кол-
леги, предложения которых принесли мне неоценимую пользу.
Р, А, Лодиз
Мюррей-Хилл, шт. Нью-Джерси
!
МОНОКРИСТАЛЛЫ
Кристаллы интересовали человека своей красотой и ред-
костью с доисторических времен, но широкое использование
они получили главным образом благодаря нуждам физики твер-
дого тела, которой кристаллы требовались как материалы для
исследования и изготовления приборов.
В задачу настоящей книги входит рассказать о том, как вы-
ращивать кристаллы, и изложить основные представления о со-
вершенстве кристаллических материалов, термодинамике, ки-
нетике процессов роста, теории различных методов, требую-
щиеся тому, кто хочет стать грамотным «ростозиком».
Гл. 1 посвящена вопросам распознавания кристалличности
материала и определения совершенства кристаллов. В гл. 2—3
обсуждается термодинамика и кинетика кристаллизации, тогда
как в остальных главах детально рассматриваются различные
способы выращивания кристаллов и особенности роста кон-
кретных материалов.
1.1. ЧТО ТАКОЕ КРИСТАЛЛ?
Вещество может существовать в трех агрегатных состоя-
ниях— твердом, жидком и газообразном. В газообразном со-
стоянии молекулы отстоят друг от друга на сравнительно боль-
шое расстояние (около 3-10~9м при атмосферном давлении).
При столь большом взаимном удалении молекулы сравнительно
слабо взаимодействуют друг с другом и потому свободно пере-
мещаются в любом направлении. Следовательно, газ характе-
ризуется очень малой вязкостью и стремится полностью запол-
нить сосуд любого размера и любой формы, в который он
заключен. Молекулы в газах располагаются практически совер-
шенно хаотично. В жидкостях же молекулы* (или атомы) от-
стоят друг от друга на расстояние около I0-10 м, и, следователь-
но, они взаимодействуют друг с другом гораздо сильнее, чем
в газах. Таким образом, жидкость обладает более высокой вяз-
костью и не стремится целиком заполнить сосуд, в котором она
находится. В жидкости существует ближний порядок, но он
14
Р. ЛОДИЗ. РОСТ монокристаллов
распространяется на расстояния не более нескольких атомных
диаметров от данного атома. В твердом теле промежутки между
атомами приблизительно такие же, как и в жидкостях, но
взаимодействие атомов сильнее. Так, атомы в твердом теле со-
вершают только колебательные движения с крайне малой ам-
плитудой около неподвижных положений равновесия. Поэтому
твердые тела сохраняют свою форму, обладают жесткостью и
механической прочностью. Вместе с тем кристаллическое твер-
дое тело характеризуется дальним порядком, распространяю-
щимся на много атомных диаметров. Если внутреннюю энергию
кристаллического твердого тела повысить путем нагревания,
то при определенной для данного давления температуре оно
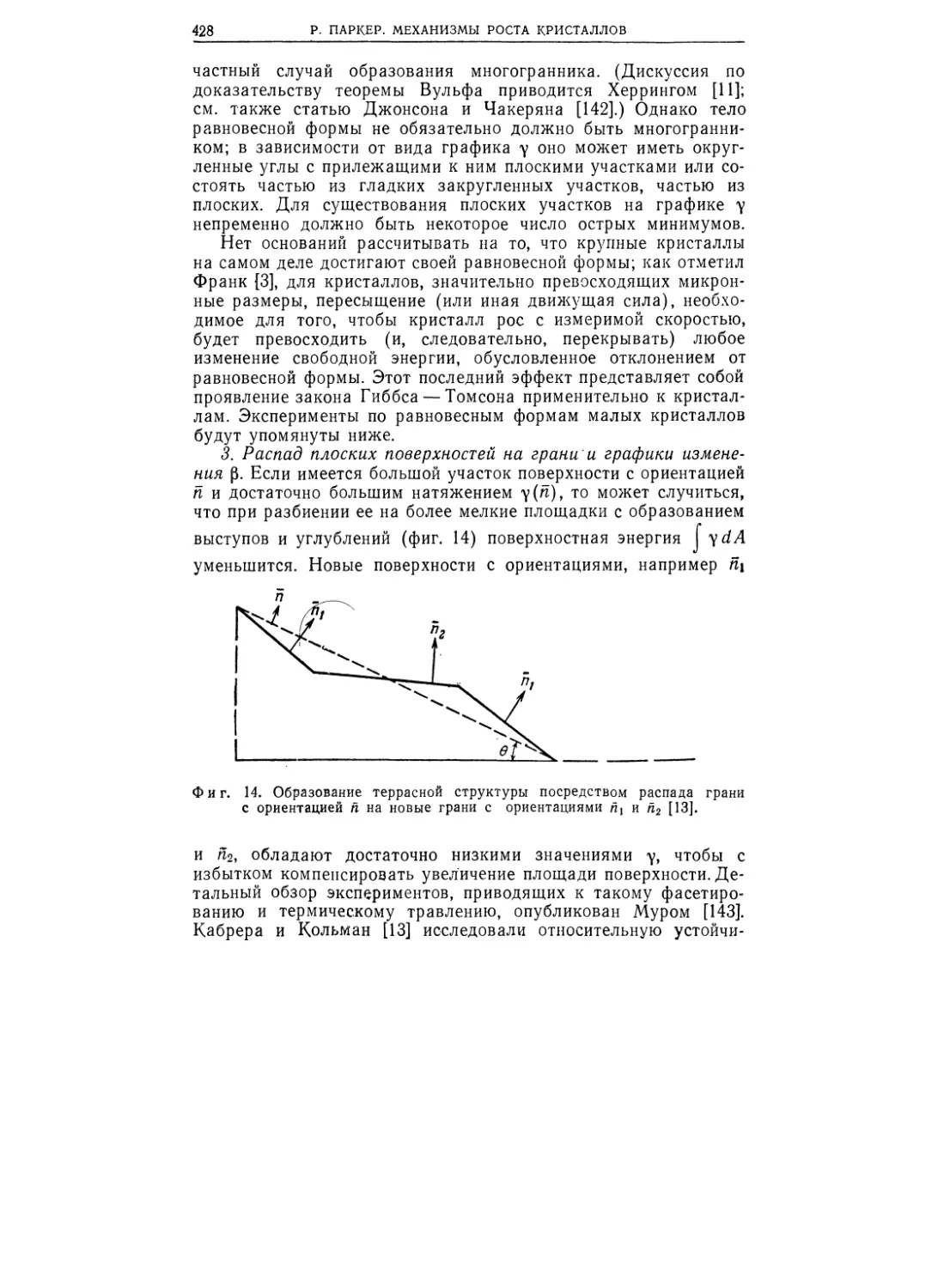
а , б в
Фиг. 1.1. Схематическое строение газа (а), жидкости (б) и твердого
тела (в).
начинает плавиться. В редких случаях наступает сублимация
в газообразное состояние. Дальнейшее возрастание внутренней
энергии приведет к испарению материала. При заданной тем-
пературе газ или пар данного вещества находится в равновесии
с его твердой фазой при определенном давлении. Таким об-
разом, если говорить о внутренней энергии того или иного ве-
щества, то его внутренняя энергия в газообразном состоянии
больше, чем в жидком, а в жидком больше, чем в твердом
состоянии.
Есть еще один класс материалов, часто называемых аморф-
ными твердыми веществами (стекла, воск, смолы); у них столь
большая вязкость, что они ведут себя практически подобно
твердым телам. Такие материалы не обладают характерными
температурами плавления и, подобно жидкостям, отличаются
наличием ближнего порядка. Такие вещества часто удобно трак-
товать как переохлажденные жидкости.
На фиг. 1.1 схематически изображено строение газа, жид-
кости и твердого тела. Аморфные вещества имеют такое же
строение, как и жидкости. Представление о разнице между
кристаллическим твердым телом и жидкостью поможет соста-
Т. МОНОКРИСТАЛЛЫ
15
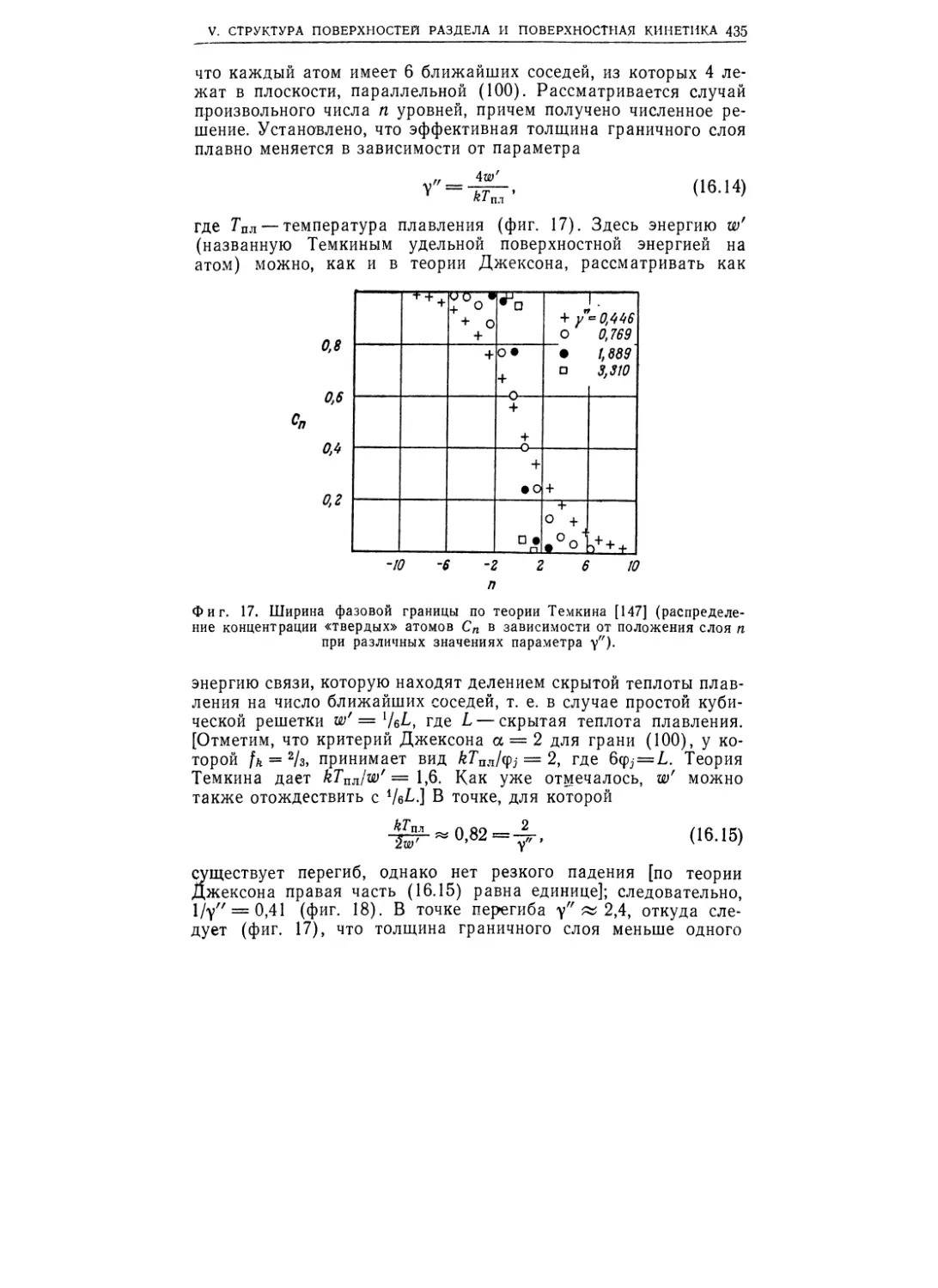
вить график радиального распределения (фиг. 1.2), на котором
число атомов нанесено в зависимости от расстояния до дан-
ного атома для твердой (кристаллической) (а) и жидкой (б)
фаз калия. В кристалле высокая степень упорядочения наблю-
дается даже на расстояниях между атомами, превосходящих
показанные на фиг. 1.2 удаления, в то время как в жидкости
(или в аморфном твердом теле), как можно видеть, суще-
ствует лишь ближний порядок.
Фиг. 1.2. Радиальное распределение атомов калия в кристаллическом (а)
и жидком (б) состояниях (1 А= 1О”10 м) [1].
Интересно, что имеется целый класс материалов, называе-
мых жидкими кристаллами [2], которые по своим свойствам
занимают промежуточное место между жидкостями и кристал-
лами. Такие вещества обладают текучестью подобно жидкостям,
но. в отличие от истинных жидкостей они изотропны не по всем
своим свойствам. Один способ трактовки жидких кристаллов
состоит в том, чтобы рассматривать последние как обладающие
одно- или самое большее двумерным упорядочением, в то время
как для истинных кристаллов характерен порядок во всех трех
измерениях.
Остановимся вкратце на природе упорядоченного располо-
жения атомов в кристалле. Подробнее с этой стороной дела
можно ознакомиться по учебникам Бюргера [3] или Липсона и
Кокрена [4]. Кристалл можно охарактеризовать, описав распо-
ложение или распределение образующих его атомов. Их рас-
положение часто описывают посредством понятия элементарной
16 Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
ячейки, т. е. воображаемого параллелепипеда из атомов кри-
сталла, многократным переносом (трансляцией) которого мож-
но охарактеризовать порядок расположения всех атомов в кри-
сталле. Повторную трансляцию как движение определенного
рода можно охарактеризовать неким вектором. За начало век-
тора, описывающего трансляцию, можно выбрать любую точку
внутри кристалла, удобную для решения поставленной задачи.
Если ее выбрать как некоторую произвольную опорную точку
в повторяющемся узоре, то периодическая трансляция воспро-
изведет, разумеется, эту опорную точку, равно как и все дру-
гие точки системы, в виде регулярного трехмерного распреде-
ления точек в пространстве. Такое изображение представляет
собой точечную пространственную решетку. Сетку, или линей-
ную решетку, можно охарактеризовать, указав длину и на-
правление трех основных линий сетки, т. е. размеры, или пе-
риоды, решетки и форму элементарной ячейки. Нужно под-
черкнуть, что точечная решетка дана нам природой, а линей-
ной решеткой мы пользуемся ради удобства. Геометрически
мыслимо лишь строго определенное число всевозможных раз-
мещений точек в пространстве, или атомов в кристалле. Такие
размещения можно описать 14 пространственными решетками
Бравэ или 32 кристаллографическими классами, или точечными
группами-, 32 класса такой симметрии дополнительно делятся
на 230 пространственных групп. По одной из простейших клас-
сификаций кристаллы делят на следующие 7 систем: кубиче-
скую, тетрагональную, гексагональную, ромбическую, моноклин-
ную, триклинную и тригональную. Эти системы показаны на
фиг. 1.3.
Как оказалось, кристаллы удобно описывать, пользуясь ме-
тодами аналитической геометрии и выбирая оси, называемые
кристаллографическими (показаны на фиг. 1.3 пунктирными
линиями). Оси обычно направляют по ребрам элементарной
ячейки. Разработаны разные способы выражения положения пе-
ресечения плоскостей кристалла с кристаллографическими осями.
Самым универсальным из них надо признать систему Миллера.
Миллеровские индексы плоскости представляют собой числа,
обратные отрезкам, которые плоскости отсекают на кристал-
лографических осях1)- Индексы Миллера обычно выбирают в
виде целых чисел, а если числа, обратные отсекаемым отрез-
кам, получаются дробными, то от дробей освобождаются при-
ведением к общему знаменателю. Индексы плоскости всегда
*) Таким образом, положение плоскости во всех системах, кроме гекса-
гональной, задается тремя индексами. В гексагональной же системе исполь-
зуют четыре индекса, хотя уже трех достаточно для однозначной идентифи-
кации конкретной плоскости. Дополнительный индекс часто обозначают точ-
Крй- Таким образом, обозначение (1120) эквивалентно символу (11-0).
1. монокристаллы
17
заключают в скобки той или иной формы. Их формы имеют
следующее значение:
(100) — конкретная плоскость 100, т. е. плоскость, отсекаю-
щая на кристаллографических осях отрезки 1, оо, оо (парал-
лельная двум осям);
Гексагональная
Кубическая
Тетрагональная
Триклинная
а$Ъ*с
Моноклинная
a + btc
a = y =
Ромбическая
(орторомбическая)
а±Ь*с
a--=J3~ у=90°
Тригональная
(ромбоэдрическая)
а=Ь«с
а=/3=у?9(Г
Фиг. 1.3. Кристаллографические системы.
{100} — все плоскости в кристалле, эквивалентные плоско-
сти (100) (совокупность плоскостей {100} описывает кристалл
данной формы или габитуса; {100} иногда называют символОхМ
простой формы);
[100] — направление, параллельное линии, которая проведена
из начала координат к точке с координатами 1, 0, О1); (100)—
все направления в кристалле, эквивалентные направлению [100].
Определенные плоскости в кристалле иногда считаются при-
надлежащими одной и той же зоне. Все плоскости, параллельные
9 В кубической сингонии это будет направление, перпендикулярное п,л'
скости (100).
18
Р. ЛОДИЗ. РОСТ монокристаллов
данному направлению, и составляют зону; направление, кото-
рому они параллельны, называют осью зоны.
Наряду с описанием симметрии кристалла посредством
трансляции часто при определении симметрии пользуются опе-
рациями вращения и отражения.
Так, кристаллы могут иметь цент-
ры инверсии, оси вращения и
плоскости отражения. В кристал-
ле с центром инверсии свойства
структуры одинаковы как на век-
торном расстоянии г от данной
точки, так и на векторном рас-
стоянии —г. В кристалле с осью
вращения структура воспроизво-
дится при повороте на угол
360°М, где п = 2, 3, 4 или 6.
Структура имеет плоскость отра-
жения, если одна ее половина со-
пряжена с другой, как с зеркаль-
ным отражением. Кристалл на-
зывают монокристаллом, если в
нем нет макроскопических обла-
стей, разориентированных одна
относительно другой более чем на
несколько градусов. Впрочем,
даже такое широкое опреде-
ление можно оспаривать.
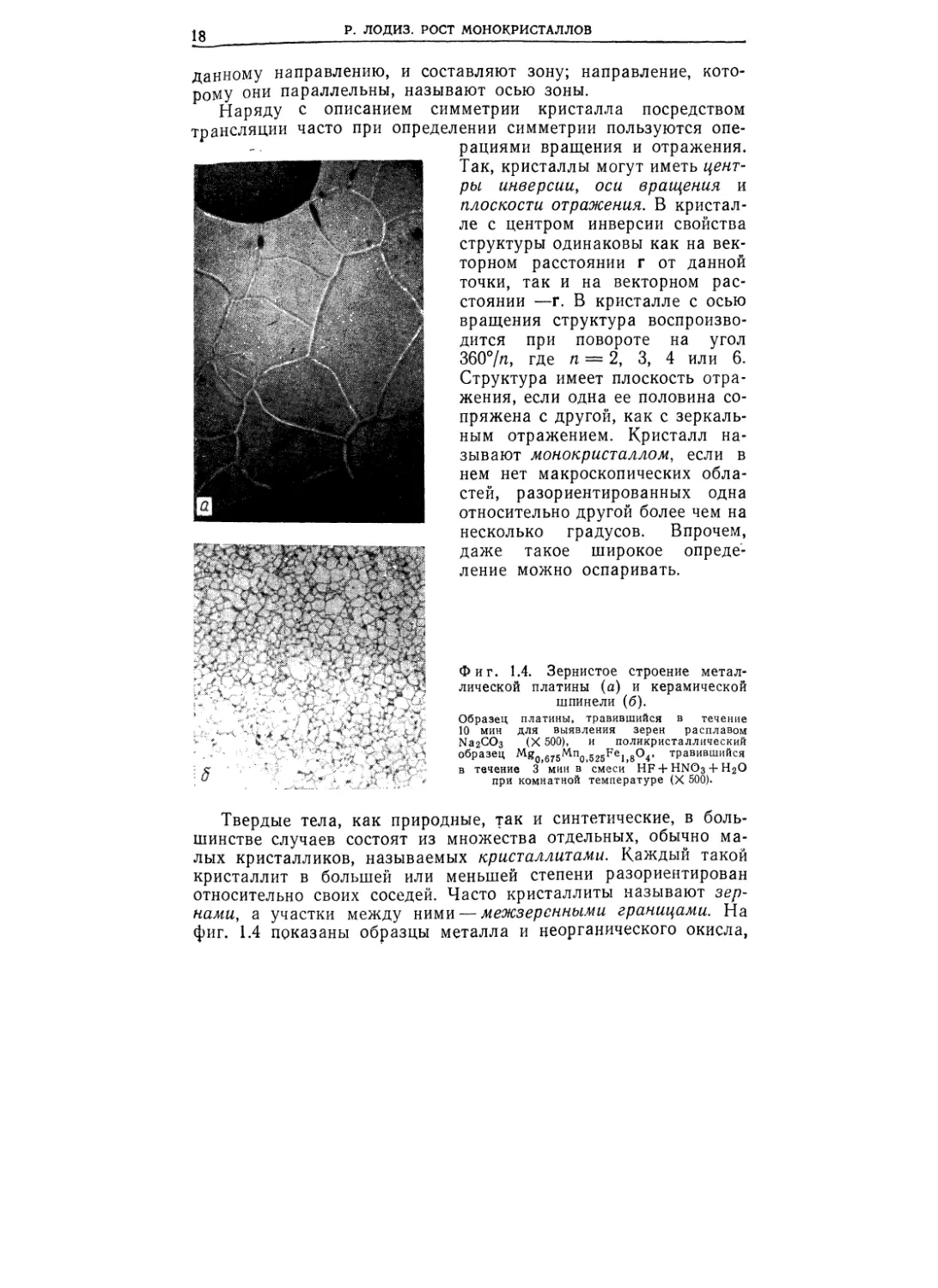
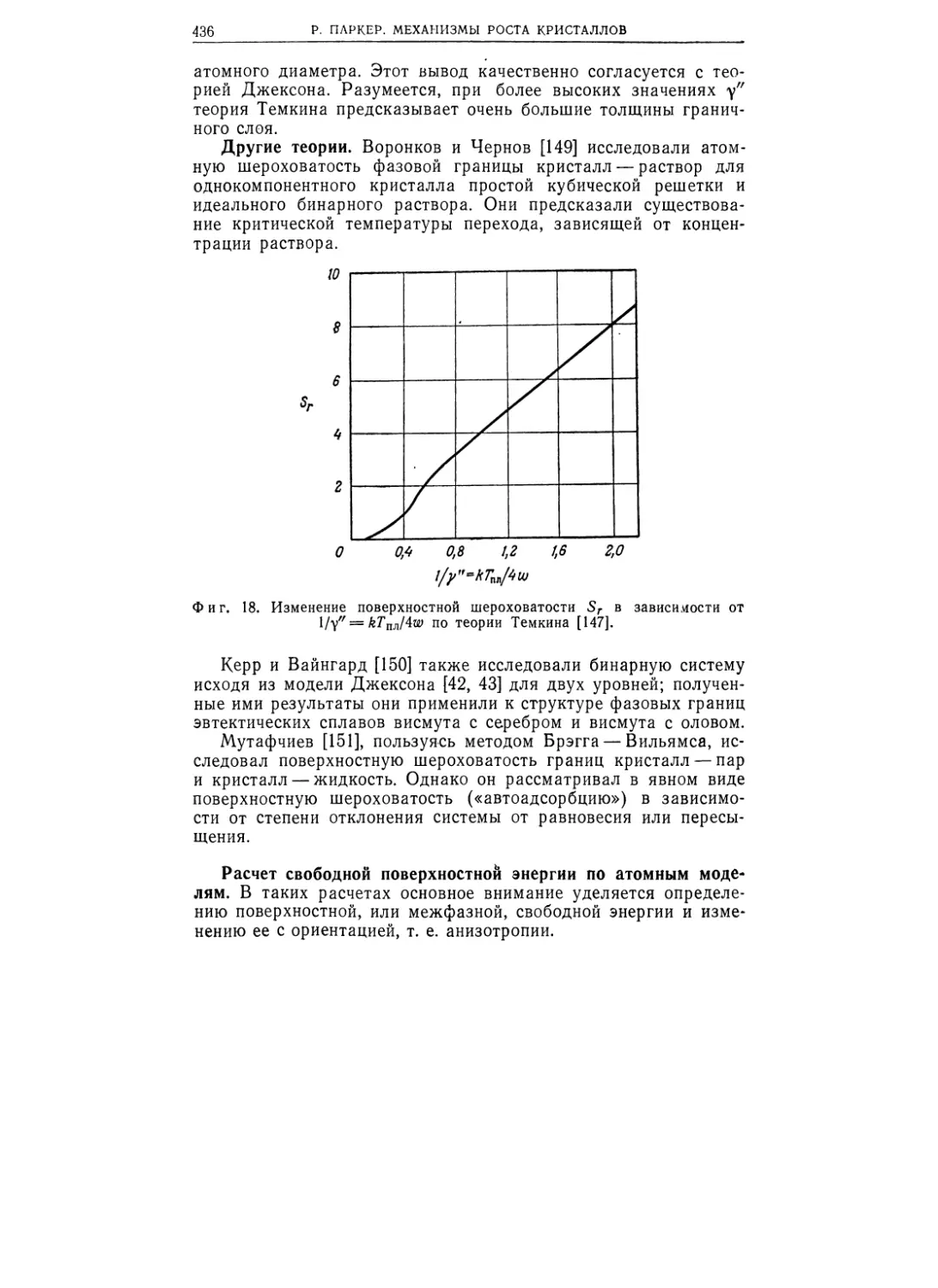
Фиг. 1.4. Зернистое строение метал-
лической платины (а) и керамической
шпинели (б).
Образец платины, травившийся в течение
10 мин для выявления зерен расплавом
Na2CO3 (X 500), и поликристаллический
образец Mg0j675Mn0525Fe1>8O4, травившийся
в течение 3 мин в смеси HF + HNO3 + H2O
при комнатной температуре (X 500).
Твердые тела, как природные, так и синтетические, в боль-
шинстве случаев состоят из множества отдельных, обычно ма-
лых кристалликов, называемых кристаллитами. Каждый такой
кристаллит в большей или меньшей степени разориентирован
относительно своих соседей. Часто кристаллиты называют зер-
нами, а участки между ними — межзеренными границами. На
фиг. 1.4 показаны образцы металла и неорганического окисла,
т. МОНОКРИСТАЛЛЫ
19
зерна в которых выявлены травлением. В случае неорганиче-
ских окислов и солей такие поликристаллические материалы
обычно называют керамикой.
Главная задача настоящей книги состоит в том, чтобы рас-
смотреть и обсудить способы выращивания монокристаллов.
Трудно дать точное определение того, что надо разуметь под
монокристаллом, но обычно под этим понимают кристаллит,
либо найденный в природном поликристаллическом образовании
и выделенный из него, либо специально выращенный. Такой
кристаллит должен иметь достаточные размеры, чтобы пред-
ставлять эстетическую, техническую или научную ценность. Нас
же здесь интересуют специально выращенные монокристаллы
размером не менее 1 мм3, поскольку такая величина есть нижний
предел, устанавливаемый практическими возможностями работы
с ним и проведения большинства измерений.
Остальная часть данной главы посвящена краткому обзору
методов, используемых для выявления кристалличности мате-
риала. Такие исследования предполагают определение характе-
ра и концентрации несовершенств (дефектов) в кристаллах.
Эта область знаний (охватывающая также изучение некристал-
лических и поликристаллических материалов) становится в
настоящее время самостоятельной дисциплиной, называемой ха-
рактеризацией материалов1). Вещество полностью охарактери-
зовано, когда идентифицированы все образующие его атомы
и определено их положение в решетке2). Для достижения та-
кой цели используются самые разнообразные методы. В осталь-
ной части настоящей главы можно описать только некоторые
из них, не рассчитывая на нечто большее. Трудно, однако, пе-
реоценить важность «характеризации» как для ростовика, так
и для потребителя кристаллов. Однако недостаточное внима-
ние со стороны последнего к этой области заставляет ростовика
брать на себя все больше и больше ответственности за поло-
жение дел с «характеризацией». Последняя не сводится, напри-
мер, просто к измерению проводимости и подвижности в полу-
проводнике, как бы ни были важны эти параметры с точки зре-
ния потребителя кристаллов и в приборах и для понимания
физических основ поведения материала. При характеризации ма-
териала, т. е. идентификации и определении положения обра-
зующих его атомов, подобные измерения важны в совокупности
4) Вопросы характеризации материалов рассматриваются в книге [89],
подготовленной к печати Комиссией по характеризации материалов Нацио-
нального исследовательского совета Национальной академии наук США.
2) Это определение предполагает, что нет такого вещества, которое
было бы когда-нибудь охарактеризовано полностью, но многие вещества уда-
валось охарактеризовывать в такой степени, какая означает фундаменталь-
ное понимание хотя бы некоторых его свойств.
20
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
с другими измерениями. Во всяком случае типом и положением
составных атомов вещества определяются полупроводниковые
и, разумеется, все прочие свойства материала.
1.2. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ВЫЯВЛЕНИЯ
КРИСТАЛЛИЧНОСТИ
Главный признак, по которому все кристаллические твердые
тела отличают от аморфных, — это наличие дальнего порядка
в расположении атомов. Большая часть кристаллов плавится
при определенной температуре и часто имеет плоские правиль-
ные наружные грани (последнее зависит главным образом от
способа выращивания). Углы между такими гранями (меж-
гранные), как правило, имеют строго определенную величину
(закон Стено), чем можно пользоваться для идентификации.
Некоторые кристаллы раскалываются правильным образом,
т. е. их можно разбить по ряду гладких плоских поверхностей,
параллельных друг другу на протяжении всего кристалла. Кри-
сталл, обладающий плоскостью спайности, обычно раскалы-
вают, процарапав сначала канавку параллельно такой плоскости,
а затем резко, но не сильно стукнув его с обратной стороны,
предварительно введя в такую канавку лезвие острого ножа
или бритвы. Легко раскалываются слюда, нитрат натрия, арсе-
нид галлия, хлористый натрий. Другое свойство, иногда при-
сущее кристаллам, — прозрачность в видимой части спектра. По-
ликристаллические материалы обычно бывают полупрозрач-
ными или матовыми из-за рассеяния света на пустотах вдоль
межзеренных границ или на других участках, а также из-за
двойного лучепреломления *). Все эти свойства часто считаются
признаками кристалличности. Однако нагревание вещества,
может привести к его разложению, полиморфным превращениям
и расстекловыванию. Тогда все упомянутые признаки, кроме
дальнего порядка, не всегда сохраняются у всех кристаллов, а
некоторые такие свойства начинают проявляться и у аморфных
веществ. Таким образом, обычно надежнее идентифицировать
материал как кристаллический по тому или иному одному при-
знаку, являющемуся непосредственной мерой его дальнего атом-
ного порядка.
Все кристаллические материалы (кроме принадлежащих к
кубической сингонии), в том числе и жидкие кристаллы, опти-
чески анизотропны, т. е. действие света на кристалл зависит от
направления, в котором свет проходит через кристалл. Эта
9 Поликристаллическая керамика, например AI2O3, может быть прозрач-
ной, если ее уплотнить в достаточной мере, чтобы в ней не оставалось пустот.
I.- МОНОКРИСТАЛЛЫ
21
особенность служит основой удобного и мощного способа об-
наружения кристалличности вещества и изучения степени со-
вершенства его строения, т. е., иными словами, характеризации
прозрачных материалов.
Самым удобным прибором для проведения подобного ана-
лиза служит петрографический (поляризационный) микроскоп,
который оказывается неоценимым орудием ростовика. О приемах
работы с этим прибором, особенно при идентификации кристал-
лов, говорится во многих учебниках [5—10]. Петрографическими
методами можно исследовать как порошковые образцы, так и
крупные монокристаллы.
Часто петрография в обязательном порядке дополняет при
изучении кристаллов рентгеновские методы. На некоторые воп-
росы, например о симметрии и ориентации кристаллов, петрогра-
фия иногда дает более убедительный ответ, чем рентгеногра-
фическое исследование. Однако самым мощным средством изу-
чения порядка в минералах служит дифракция рентгеновских
лучей.
Реальные кристаллы никогда не бывают совершенными, т. е.
полностью упорядоченными и свободными от примесей. Однако
приступать к изучению проблемы полезно с рассмотрения со-
вершенного кристалла. В данной книге неуместно было бы пу-
скаться в подробное рассмотрение существующих методов рент-
геноструктурного анализа, но без ряда замечаний о них здесь не
обойтись. Поскольку промежуток между атомами в кристалле
соизмерим с длиной волны рентгеновских лучей, кристалл на
пути их распространения действует подобно трехмерной дифрак-
ционной решетке. Основные уравнения выведены Лауэ и Брэг-
гом. Последний трактовал дифракцию рентгеновских лучей как
отражение от атомных плоскостей. Один вариант уравнения
Брэгга гласит, что
nX = 2dsin0, (1.1)
где п — порядок отражения (и = 1, 2, 3, ...); X — длина волны
падающего излучения; d — промежуток м<жду атомными пло-
скостями (межплоскостное расстояние), от которых происходит
отражение; 0 — угол между падающим лучом и отражающей
атомной плоскостью. Поскольку при отражении выполняется за-
кон Снеллиуса *), а коэффициент преломления рентгеновских лу-
чей для всех веществ очень близок к единице, угол между отра-
женным лучом и атомной плоскостью также равен 0.
При изучении кристаллов методами дифракции рентгенов-
ских лучей определяют: 1) наличие кристалличности, 2) струк-
туру, 3) ориентацию кристаллов, 4) степень совершенства и
*) По закону Снеллиуса, sin t/sin г = п, где i — угол падения, г — угол
отражения, п — коэффициент преломления.
22
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
5) периоды решетки (а отсюда и состав, поскольку периоды ре-
шетки зависят от состава). Если два кристалла А и В взаимно
растворимы друг в друге, а периоды их решеток представляют
собой линейные функции состава, то соблюдается закон Вегар-
да1), а состав определяют непосредственно по результатам из-
мерения периодов решетки твердого раствора. Перейдем теперь
к вопросам о выявлении кристалличности и об определении
степени совершенства, кратко остановившись при этом на воз-
можностях измерения периодов решетки в той мере, в какой
это связано с характеризацией материалов, поскольку об опре-
делении структуры, ориентации и периодов решетки обстоятель-
но говорится во многих работах [3, 4, 12—15]. В последующих
разделах описаны четыре класса рентгеновских методов, наи-
более подходящих для доказательства кристалличности, а в
разд. ‘1.4 рассматриваются способы изучения совершенства.
Методы вращения
Если использовать монохроматическое рентгеновское излуче-
ние, то уравнение (1.1) будет удовлетворяться для дискретных
углов, образующихся при вращении кристалла относительно
пучка. В некоторых вариантах методов вращения перемещают
и пленку таким образом, чтобы зарегистрировать отражения и
затем без труда их расшифровать. Такие методы используются
главным образом для определения структуры кристаллов, но
они полезны также и для установления их ориентации. Методы
вращения детально описаны Барретом и Массальским [15].
Методы порошка
Если рентгеносъемку проводить в излучении с сильными мо-
нохроматическими компонентами, взяв образец, состоящий из
множества крошечных, хаотично распределенных кристаллов,
то уравнение (1.1) все же будет соблюдаться и без вращения
образца, так как отдельные кристаллики окажутся в благо-
приятствующей отражению ориентации. Самый распространен-
ный порошковый метод — это метод Дебая — Шерера [16, 17].
Из кристаллического порошка изготовляют цилиндрический
стержень менее 0,5 мм в диаметре. Свернутую цилиндром плен-
ку для регистрации отраженных лучей помещают в камеру, где
4) Закон Вегарда можно выразить в виде а = ад+ив(ав— аА), где
а — период решетки кристалла, представляющего собой твердый раствор В в
Л; а а—период решетки компонента Д; ав — период решетки компонента В;
пв — мольная доля компонента В в кристалле. Гшнейдер и Вайнярд [11] об-
стоятельно проанализировали отклонения от закона Вегарда и объяснили их.
1. монокристаллы
23
отраженные плоскостями решетки лучи из падающего на об-
разец коллимированного рентгеновского пучка пересекают
пленку в виде серии дуг, образуя так называемые кольца Де-
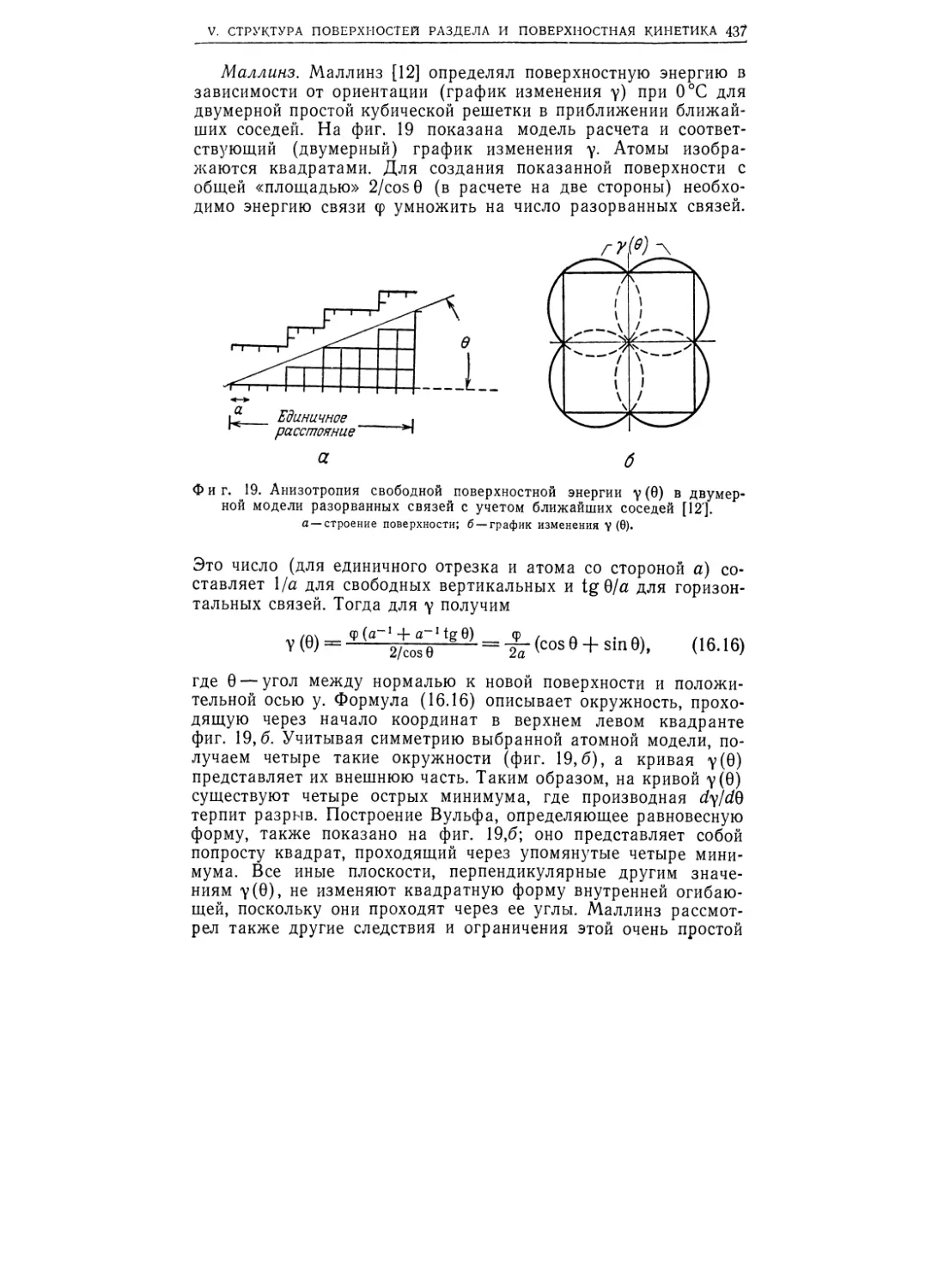
бая— Шерера (фиг. 1.5). Анализ этих колец позволяет оценить
размер зерен-кристаллитов в поликристаллическом образце.
Когда размер кристаллов превосходит приблизительно 10-4 см,
кольца состоят из отдельных пятен, как показано на фиг. 1.5.
При размерах зерен приблизительно от 10~4 до 10~5 см линии
весьма резкие, а когда этот размер меньше примерно 10-5 см,
линии уширяются и размываются. Дифракционная картина от
жидкого или аморфного твердого образца состоит из отдельных
размытых полос, тогда как картина отражений от кристалли-
ческого твердого тела характеризуется большим числом четких
')
Фиг. 1.5. Дебаеграммы порошковых образцов кристаллического а-кварца
(сверху) и стекловидной окиси кремния (внизу).
полос. На фиг. 1.5 приведены типичные картины дифракции
рентгеновских лучей от а-кварца (кристаллическая форма ЗЮг)
и стекловидной окиси кремния. Обычно на дебаеграммах аморф-
ных твердых тел более двух-трех размытых полос не бывает.
Дифракция рентгеновских лучей — обычный способ распознава-
ния кристаллов и стекол. Анализ Фурье распределения интен-
сивностей на дебаеграммах жидкостей и аморфных твердых тел
позволяет вычислять распределения, подобные показанным на
фиг. 1.2.
Для определения размеров зерна прибегают также к коли-
чественным измерениям уширения линий на рентгенограммах
Дебая — Шерера. На ширину линий оказывают влияние также
дефекты упаковки и напряжения, но путем тщательного изме-
рения уширения линий такие несовершенства можно исследо-
вать по крайней мере полуколичественно {18]. Аномальность ин-
тенсивности отражений возможна также и в тохм случае, когда
кристаллиты в поликристаллическом образце ориентированы
закономерно.
В современных порошковых исследованиях часто пользуются
дифрактометрами, в которых детекторами излучения служат
не пленки, а счетчики квантов [15]. Все более широкое при-
менение находит камера Гинье, отличающаяся от камеры
24
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Дебая—Шерера наличием монохроматора, главным образом
потому, что она обладает более высоким разрешением и позво-
ляет определять межплоскостные расстояния с большей точ-
ностью [15, 19].
Методы Лауэ
Если поперечник монокристалла больше диаметра пучка
(обычно около 1 мм), то его закрепляют на пути прохождения
пучка рентгеновских лучей с широким диапазоном длин волн,
так что каждая серия плоскостей отражает лучи со своей дли-
ной волны, удовлетворяющей уравнению (1.1). Отраженные
лучи регистрируются на плоской пленке, расположенной перпен-
дикулярно падающему пучку. Эти лучи проявляются в виде гео-
метрически правильных совокупностей пятен. Такие геометриче-
ские картины не возникают, когда кристаллиты в материале
меньше, чем размер пучка. Если макроскопические области ма-
териала разориентированы одна по отношению к другой, то пят-
на разбиваются на ряд близко расположенных точек. Этим поль-
зуются для изучения совершенства кристаллов по методу Шуль-
ца, речь о котором еще пойдет ниже.
Малоугловое рассеяние
Ближний порядок в кристалле заставляет рентгеновские
лучи отклоняться при отражении, например, в установке, по гео-
метрии подобной камере Дебая —Шерера, всего на несколько
градусов от оси пучка. Таким малоугловым рассеянием поль-
зуются для изучения мелких включений (~10~8 см) в кристал-
лах, малых медленно меняющихся деформаций и упорядочения
в жидкостях и стеклах. Малоугловое рассеяние успешно исполь-
зуют [20—23] для исследования кластерообразования в жидко-
стях при температурах, близких к температуре затвердевания, и
изучения структуры растворов. Для изучения флуктуаций с
амплитудами больше 10~6 см прибегают к рассеянию света, тогда
как малоугловое рассеяние рентгеновских лучей позволяет ис-
следовать более слабые флуктуации. Оно особенно ценно при
изучении упорядочения в жидкостях, стеклах и растворах. Хотя
к малоугловому рассеянию почти не прибегают для определения
кристалличности, этот способ удобен для выявления начальной
стадии кристаллизации (расстекловывания) в аморфных веще-
ствах.
1.3. НЕСОВЕРШЕНСТВА В КРИСТАЛЛАХ
Несовершенства в кристаллах можно подразделить на две
категории: химические и физические. К химическим дефектам
1. МОНОКРИСТАЛЛЫ
25
относят наличие в кристалле инородных атомов или вакансий1).
Физические дефекты охватывают деформации, дислокации, гра-
ницы зерен, плоскости двойникования и дефекты упаковки.
Если примесный атом занимает позицию, в которой до этого
находился атом кристалла, то говорят о примеси замещения.
Примесный атом может также разместиться между атомами,
находящимися в узлах решетки, и тогда говорят о примеси внед-
рения (междоузельные атомы). Если атомы в той или иной обла-
сти кристалла смещены из своего идеального положения, гово-
рят, что кристалл деформирован. Деформацию могут вызвать
химические дефекты, когда посторонний атом не точно соответ-
ствует решетке и смещения частично снимаются деформацией,
связанной с такими дефектами. Напряжение и термическая об-
работка часто вносят деформацию в кристалл.
Вакансии
Вакансии — это «дырки», т. е. вакантные узлы, в кристалли-
ческой решетке, обусловленные отсутствием атомов. Существуют
Фиг. 1.6. Двумерное схематическое изображение идеального кристалла (а),
примесного атома замещения (б), примесного атома внедрения (в), дефекта
Шоттки (г) и дефекта Френкеля (д).
когда некоторые атомы или ионы сместились в междоузельные
положения, оставив свои прежние места свободными, и дефекты
Шоттки, когда в кристалле нет атомов, которые могли бы за-
полнить вакантные позиции. Упоминавшиеся нами дефекты
схематично представлены на фиг. 1.6. Увеличение числа вакан-
сий усиливает беспорядок и соответственно повышает энтропию.
Поэтому, как можно показать (см. например, [24]), доля
9 Некоторые авторы считают вакансии физическими несовершенствами:
1ля нас это различие не имеет большого значения.
26
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
вакантных положений Xvb кристаллической решетке выражается
в виде
Xv = e~^°^kT, (1.2)
где AGV— изменение свободной энергии Гиббса при образова-
нии одной вакансии, k — постоянная Больцмана, а Т — абсолют- »
ная температура. Таким образом, при всех температурах выше
абсолютного нуля вакансии стабильны во всяком кристалле.
Значение AGV можно узнать, измерив долю Xv (путем сопостав-
ления рентгеновской плотности с пикнометрической) в функции *
температуры. В отдельных случаях &GV можно оценить по энер-
гиям связи и другим соображениям. Вакансии встречаются даже
в элементах и стехиометрических соединениях (дальтонидах), но
их концентрация обычно выше в нестехиометрических соедине-
ниях (бертолидах), для которых взятая со знаком минус отри-
цательная свободная энергия образования —AGV больше из-за
более легкой компенсации заряда (о компенсации заряда гово-
рится в разд. 2.5). В нестехиометрических соединениях «избы-
точные» атомы могут находиться либо в узлах решетки, либо
в междоузлиях.
Дислокации
Как известно, существуют дислокации двух основных ви-
дов— краевые и винтовые. На фиг. 1.7 в двух измерениях изоб-
ражена краевая дислокация. Простоты ради шары, изображаю-
щие атомы, не показаны. Атомы должны находиться во всех
точках пересечения линий на фиг. 1.7. Можно представить себе,
что введение лишней плоскости атомов АВ в верхнюю поло-
вину кристалла привело к его деформации. Плоскости в верхней
половине кристалла стали ближе друг к другу, чем в нормаль-
ном равновесном положении (деформация сжатия), тогда как
плоскости в нижней половине отстоят друг от друга дальше, чем
в нормальном состоянии (деформация растяжения). Таким обра-
зом, у дислокации кристалл сильно напряжен. На фиг. 1.8
изображена в трех измерениях краевая дислокация, показанная
на фиг. 1.7. Такую конфигурацию можно создать умозрительно
введением лишней плоскости АВВ'А' или посредством сдвига
кристалла за счет сжатия перпендикулярно плоскости CDEF при
одновременном растяжении перпендикулярно GCFH. Линию АА'
называют дислокационной линией. Она служит границей между
неизмененной частью кристала и частью, где произошло сколь-
жение. Скольжение—это сдвиг части кристалла параллельно
самой сеое вдоль плоскости в кристалле. Плоскость ACFA',
вдоль которой происходило смещение, называют плоскостью
сдвига или плоскостью скольжения. Величину и направление
1. МОНОКРИСТАЛЛЫ
27
смещения характеризуют вектором Бюргерса В (фиг. 1.8)
[25—27]. В случае краевой дислокации вектор В образует пря-
мой угол с дислокационной линией *).
Если кристалл смещается так, что направление сдвига и,
следовательно, направление вектора Бюргерса параллельны
дислокационной линии, то возникающий дефект называют вин-
товой дислокацией (фиг. 1.9). Здесь АА'— дислокационная ли-
ния. Эту дислокацию можно представить себе как следствие
нажатия на A&CD при одновременном оттягивании AEFG. Каж-
дую атомную плоскость, проходящую через AA'f можно считать
плоскостью скольжения.
Фиг. 1.7. Краевая дисло-
кация, схематически пока-
занная в двух измерениях.
Фиг. 1.8. Краевая дислокация, схемати-
чески показанная в трех измерениях.
Кроме двух рассмотренных элементарных дислокаций, воз-
можны смешанные дислокации с вектором Бюргерса В проме-
жуточного направления между перпендикуляром и параллелью
к дислокационной линии. Дислокации образуются при деформи-
ровании кристаллов под воздействием физических усилий, тер-
мической обработки и т. д. Как показано дальше, дислокации
образуются в процессе выращивания кристаллов всегда, если
не создавать особых условий.
Некоторые дислокации образуются в результате конденсации
вакансий. Действительно, вакансии часто перемещаются так,
что возникают дислокации, но не все дислокации образуются в
результате конденсации вакансий. Равновесная плотность дис-
локаций в кристаллах обычных размеров при комнатной
9 Вектор В более строго определяют как невязку при обходе по кон-
туру Бюргерса, т. е. по существу сравнивают реальней кристалл с идеаль-
ным, эквивалентным ему во всех других отношениях [26—28].
28
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
температуре не превышает одну на кристалл. Это можно пока-
зать следующим образом [24].
Изменение свободной энергии Гиббса в ходе того или иного
процесса в кристалле, ведущего к образованию дефекта, дается
выражением
AG = п \HV- Т (ASC + п AS,), (1.3)
в котором п есть число дефектов, \Н0 — энтальпия образования
дефекта, ASC— конфигурационная энтропия, или энтропия сме-
щения, связанная с образованием п дефектов, &SV — колебатель-
Ф и г. 1.9. Винтовая дислокация в трехмер-
ном изображении [28].
ная энтропия, образую-
щаяся вследствие смеще-
ния ближайших соседей
под действием дефекта,
Т — абсолютная темпера-
тура. Чтобы дефект был
устойчивым, приращение
AG должно быть отрица-
тельной величиной. Таким
образом, T(ASC + nASv)>
> nAHv, поскольку ASC
превалирует над ASV и
\HV. Следовательно, для
малых чисел п точечные
дефекты термодинамиче-
ски устойчивы. Однако
энтальпия, связанная с
образованием дислока-
ции, велика, а энтропия мала и потому дислокации, как правило,
термодинамически неустойчивы. Таким образом, можно вы-
растить бездислокационные кристаллы, но нельзя получить
безвакансионные кристаллы. Вакансии нарушают равновесие
зарядов в кристалле. Катионная вакансия, например, означает
избыток отрицательного заряда в кристалле. Атомы замещения
с иным зарядом, чем у замещенного в данном узле атома, равно
как и атомы внедрения, также способны нарушить равновесие
зарядов. Таким образом, концентрации вакансий, атомов внед-
рения или соответствующих атомов замещения связаны надле-
жащими условиями равновесия, следующими из закона дей-
ствующих масс, что позволяет иногда снизить концентрацию де-
фектов одного вида ценой повышения концентрации дефектов
другого.
Межзеренные границы
Если угол между соседними кристаллитами мал, то возни-
кающая при этом малоугловая межзеренная граница состоит из
выстроившихся в ряд дислокаций [29]. На фиг. 1.10 схематически
1. монокристаллы
29
показана двумерная чисто наклонная граница АВ. Как легко
видеть, разориентация достигается введением ряда краевых ди-
слокаций, показанных в виде перевернутых букв Т. Подобным
же образом винтовые дислокации образуют малоугловые меж-
зеренные границы кручения [30].
Краевые дислокации могут образовываться при пластиче-
ском изгибе кристалла, обычно располагаясь при этом, как по-
казано на фиг. 1.11, а. На этом графи-
ке показаны плоскости решетки кри-
сталла непосредственно после изгиба
(а) и после перемещения дислокаций
(б). Для ускорения движения дисло-
каций обычно требуется отжиг, при-
чем некоторые дислокации взаимно
уничтожаются (аннигилируют), когда
они сходятся вместе в процессе движе-
ния. Атомы сохраняют свои нормаль-
ные положения в плоскостях, посколь-
ку дислокации перестраиваются, пере-
ползая в плоскости, перпендикулярной
плоскости чертежа на фиг. 1.11. Такая
перестройка происходит посредством
движения вакансий в плоскости сколь-
жения. Возникающая картина напоми-
нает многоугольники (полигоны), так
что кристалл называют полигонизован-
ным, а возникновение малоугловых
межзеренных границ в ходе любого
процесса объединяют понятием поли-
гонизация. В некоторых кристаллах
поверхность представляет собой мо-
заику областей, каждая из которых
полностью совершенна, но слегка раз-
ориентирована по отношению к соседним. Если разориентация
между отдельными областями мала и их размеры малы, то такие
области называют мозаичными блоками. Обычно считают, что
мозаичные блоки имеют размеры от нескольких сотен до не-
скольких тысяч периодов решетки с разориентировкой на не-
сколько угловых минут. Если размер и разориентация больше,
то их считают зернами, ограниченными обычными малоугловыми
границами. Таким образом, между мозаичными структурами и
структурами, характеризующимися обычными малоугловыми
межзеренными границами, имеется непрерывный ряд состояний
упорядочения.
При определенных условиях вакансии могут перемещаться в
кристалле и скапливаться с образованием неполной (частичной)
р-р р-
о—о-
о—о-
о-ф-
о-
О-
о-
о-
о-
о-
о-4
0-4-
-ф-ф-ф
A А--О
о- А
А—о—о
HHI
к-4-0
-4 4-4 j-4 4 А-о
-(►-
-о-
-о-
-0-0-
-О—О-
чык4-
-0-4-
ч> фф-
ф—4—о-
-0—0-
-А—А-
о-
4
М)-}-о -4
э~о! А А - А
Ф-о! А А-А-
4ч >1 j> 4-( ►-
-ф-oj—Ф-ф“
-4-о] -ф-Ф~
ф-ф-<
ч|- А-А-<
А-<
-А—о—4
А • А А
А-А- А
Tj
-А-ч
-о-ч
-А-о
-о—о
-А—о
А-А
А-ф
-о-г*
-4-h
5
Фиг. 1.10. Мало угловая
межзеренная граница [29].
30
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
дислокации. Такая граница, как уже отмечалось, может быть
следствием скопления дислокаций, а если углы между грани-
цами зерен достаточно велики, то образуется поликристалл. Та-
ким образом, можно говорить о непрерывности перехода по
степени уменьшения порядка от идеального совершенного кри-
сталла к поликристаллическому материалу. О генезисе дислока-
ций и их роли при выращивании кристаллов говорится в гл. 3.
Подобным же образом может существовать последователь-
ность упорядоченных состояний от совершенного кристалла до
стекла. Если обратиться, например, к расстекловыванию, то по
мере протекания этого процесса дальний порядок возрастает до
Фиг. 1.11. Движение дислокаций при полигонизации после изгиба (а) и
после перемещения (б) [31].
тех пор, пока образующееся твердое вещество не станет явно
кристаллическим. Частично упорядоченные стекла, такие, как
пирокерамика, в которых степень упорядочения регулируют до-
бавлением зародышеобразующих катализаторов или управляе-
мой термической обработкой, стали важной статьей промышлен-
ной продукции.
Двойники
Важную роль в кристаллах играют еще два типа несовер-
шенств — двойники и дефекты упаковки. «Составные» кристал-
лы, в которых отдельные части связаны друг с другом опреде-
ленным кристаллографическим образом, называют сдвойнико-
ванными кристаллами. Двойниковые кристаллы называют про-
стыми двойниками, если они состоят из двух определенным об-
разом ориентированных частей, и сложными двойниками, если
они состоят из нескольких частей. В контактных двойниках два
кристалла встречаются вдоль определенной плоскости, называе-
мой плоскостью сопряжения. В некоторых случаях два индиви-
дуальных кристалла связаны отражением в плоскости решетки,
общей для обоих кристаллов. Такую плоскость называют пло-
скостью двойникования, причем она может совпадать или не со-
впадать с плоскостью сопряжения.
В полисинтетических двойниках картина двойникования по-
вторяется, а плоскостей двойникования имеется несколько. Если
1. МОНОКРИСТАЛЛЫ
31
обычный двойник изобразить в виде А \В, где А и В суть обла-
сти разной ориентации, связанные двойниковыми отношениями, а
|—символ плоскости двойникования, то А | В | А | В... будет
обозначать полисинтетический двойник.
В некоторых двойниковых кристаллах части двойника связа-
ны поворотом вокруг определенного кристаллографического
направления. Такое направление называют осью двойникова-
ния.
Двойниковые кристаллы можно классифицировать по спо-
собу их образования. Двойники, образовавшиеся в процессе
выращивания, называют двойниками роста. Двойники могут воз-
никать и при механической деформации, например при скольже-
нии одной части кристалла кальцита или нитрата натрия относи-
тельно другой по плоскости скольжения.
Если вещество данного химического состава может существо-
вать в разных модификациях, то такие структурные модифика-
ции называют полиморфами. Если полиморфные модификации
являются зеркальным отражением друг друга, то их называют
энантиоморфами. Каждая полиморфная модификация стабильна
при определенных условиях. У пары полиморфных модификаций
данного вещества в координатах давление — температура обыч-
но есть линия, вдоль которой они сосуществуют; при переходе
через эту линию одна модификация превращается в другую.
Примером может служить превращение
573° С
а‘КВарЦ о’ЫТГа Р'КВаРЦ-
При переходе а-кварца в 0-кварц превращение обычно начинает-
ся во многих центрах. На фиг. 1.12 показана [31] проекция
атомов кремния на плоскость (0001) для низкотемпературного
а-кварца (а), высокотемпературного 0-кварца (б) и возможного
продукта охлаждения 0-кварца до температур ниже 573 °C (в).
Надо отметить, что 0-кварц имеет более высокую симметрию,
чем а-кварц, и если переход начинается в двух точках
(фиг. 1.12, в) по обе стороны от плоскости АВ, то следствием
станет двойникование с плоскостью двойникования АВ, на кото-
рой встречаются растущие участки. Такой двойник, на ориента-
цию которого влияет структура материала, из которого он
образуется, называют дофинейским двойником. В кварце двой-
никование по дофинейскому закону называют электрическим
двойникованием, поскольку оно сопровождается изменением
пьезоэлектрических свойств. Двойники повернуты друг относи-
тельно друга на 180° вокруг одного из направлений (0001). Оси
кристаллов параллельны, но полярность электрических осей
обратная. Дофинейское двойникование не влияет на оптические
свойства кварца.
32
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Другой тип двойникования в кварце и других материалах
называют оптическим двойникованием, поскольку такие двойни-
ки можно выявить в поляризованном свете (оптическое двойни-
кование влияет и на электрические свойства кварца). При опти-
ческом двойниковании (иногда его называют двойникованием
по бразильскому закону) в кварце сдвойникованные участки
связаны друг с другом отражением от одной из плоскостей
{1120}. Кристаллические оси снова параллельны, но электри-
ческая полярность имеет обратный знак, а поляризованный свет
вращается в двух областях в противоположных направлениях.
Фиг. 1.12. а-кварц (а), p-кварц (б) и дофинейский двойник (в) [31].
Двойникование, которое можно выявить изменением направле-
ния электрического поля, называют электрическим двойникова-
нием, тогда как двойникование, обнаруживаемое при изучении в
скрещенных поляроидах, называют оптическим двойникованием.
Кристаллы, у которых отсутствует центр симметрии, являются
пьезоэлектрическими. У большинства пьезоэлектрических кри-
сталлов наблюдается электрическое двойникование, а у других
кристаллов без центра симметрии возникает оптическое двойни-
кование.
Дефекты упаковки
Кристаллические структуры можно построить хотя бы умо-
зрительно укладкой слоев. Существует ряд несовершенств, ко-
торые возникают в кристаллах той или иной симметрии при
нарушении порядка укладки слоев. Полиморфные модификации
карбида кремния мржно мыслить себе как стопки двойных слоев
атомов кремния и углерода, уложенных в разной последователь-
ности. Такие двойные слои состоят из плотноупакованного слоя
гексагональной симметрии атомов кремния и слоя уложенных
непосредственно над ними атомов углерода. Эти слои можно
уложить друг на друга в трех разных ориентациях, обозначав-
1. МОНОКРИСТАЛЛЫ
33
мых буквами А, В и С (фиг. 1.13). Когда слои уложены в по-
следовательности АВСАВСАВС, повторяющейся через весь
кристалл, образуется полиморфная кубическая модификация,
называемая p-SiC. Есть другие возможные способы укладки
слоев. Например, при последовательности укладки АВСА поли-
морфную модификацию называют SiC-III или S1C-4H; при по-
следовательности АВСАСВ соединение называют SiC-II или
SiC-6H.
Фиг. 1.13. Структура (3-SiC.
Цифрами 4 и 6 указаны числа слоев в повторяющейся пачке,
а буква Н означает гексагональную структуру [32—34]. Поли-
морфные модификации, отличающиеся только порядком укладки
слоев, называют политипными. Замечательна регулярность по-
рядка упаковки в отдельных политипных модификациях. В моди-
фикации SiC-I или SiC-15-R слои уложены в последовательности
АВСВАСАВАСВСАСВ. Таким образом, повторяющийся период
охватывает 15 слоев; структура этого соединения ромбоэдриче-
ская.
Строго говоря, понятие политипии должно было бы относить-
ся к кристаллам с решеткой одной и той же структуры, но отли-
чающимся последовательностью укладки слоев. Так, 4-Н и 6-Н
суть политипы SiC, тогда как 4-Н и 15-R— его полиморфы.
Известен политип SiC под названием 87^;сообщалось [35] о су-
ществовании его политипа 270-R.
В политипных модификациях часто наблюдаются нарушения
последовательности укладки слоев, в результате чего образуется
2 Зак. 718
34
Р. ЛОДИЗ. РОСТ монокристаллов
тонкая прослойка материала одной структуры между слоями
материала другой структуры. Например, в кубических кристал-
лах ZnS (сфалерит) слои уложены в последовательности АВС,
тогда как в гексагональной модификации ZnS (вюрцит) соблю-
дается порядок АВ. Если в кристалле ZnS структура характе-
ризуется последовательностью АВСАВАВС, то подчеркнутый
участок будет дефектом упаковки, т. е. отдельным макроскопи-
чески протяженным слоем гексагональной модификации ZnS
в кубическом кристалле ZnS. Часто дефекты упаковки встре-
чаются в виде ряда параллельных слоев одного политипа
в другом.
Если такие слои имеют макроскопическую толщину, то, изу-
чая форму или морфологию кристалла, можно обнаружить сра-
стание двух типов, причем для каждой области будет харак-
терна морфология, присущая политипу в данной области. В не-
которых кристаллах углы между гранями превосходят 180°
(входящие углы) и больше углов между гранями в смежных
политипных областях. Для описания срастания политипных ве-
ществ иногда пользуются прилагательным «синтактное».
Мы уже говорили выше о плоскостях двойникования. Можно
характеризовать такую плоскость соответствующим дефектом
упаковки. В сфалерите это будет АВС\СВА, где вертикальной
черточкой обозначена плоскость двойникования.
Вицинальные грани
При определении ориентации грани кристалла посредством
оптического гониометра иногда обнаруживают ее незначитель-
ное отклонение от «правильного» положения (разориентацию).
Такие грани называют вицинальными гранями. На вопрос о том,
принадлежат ли они к слегка разориентированным граням с
малыми Миллеровскими индексами или же к граням с боль-
шими индексами, по ориентации близким к граням с малыми
индексами, пока не дано однозначного ответа. По-видимому,
данные рентгенографических исследований [36—38] свидетель-
ствуют о том, что такие грани не являются плоскостями с ма-
лыми индексами, однако такие данные нельзя признать исчер-
пывающими. Не исключено, что полное объяснение будет най-
дено при изучении малоугловых межзеренных границ.
Другие несовершенства
Когда атомы растворяются в кристаллической решетке с об-
разованием твердого раствора, они либо хаотично замещают
атомы в узлах решетки, либо хаотично внедряются в ее междо-
узлия, либо же размещаются в решетке тем или иным упоря-
I. монокристаллы
35
доченным способом. Если атомы замещения или внедрения рас-
полагаются в решетке весьма упорядоченно, то говорят о под-
решетках таких атомов, степень упорядочения в которых можно
исследовать методами рентгенографии и электронной микро-
скопии. Отсюда очевидна возможность существования в подоб-
ной подрешетке многих таких несовершенств, которые присущи
обычной решетке.
В минералогической литературе для описания кристалла,
характеризующегося разориентацией из-за радиационного рас-
пада, пользуются прилагательным метамиктный. Этим терми-
ном обычно характеризуют минералы, столь сильно разло-
жившиеся под действием природной радиации, что они по
существу стали аморфными твердыми веществами. Такие же не-
совершенства в кристаллических материалах можно создать пу-
тем искусственного облучения.
1.4. МЕТОДЫ ИЗУЧЕНИЯ СОВЕРШЕНСТВА
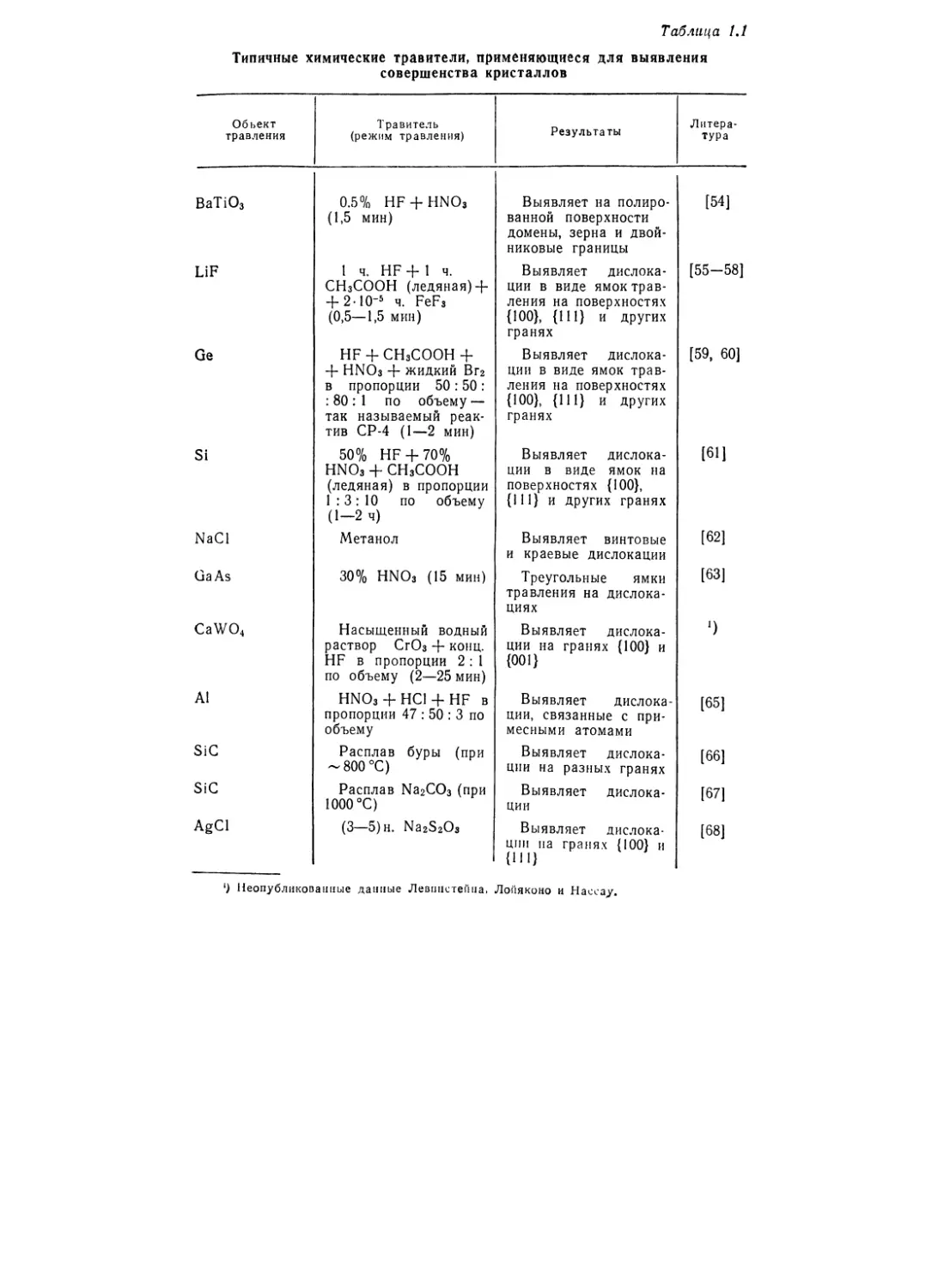
КРИСТАЛЛОВ
Рентгеновские методы
Теоретически в случае больших совершенных кристаллов
область углов отражения должна составлять по порядку вели-
чины несколько угловых секунд, а интенсивность отражений
должна быть пропорциональной структурному фактору. Но для
большей части кристаллов характерна область углов отражения
в несколько угловых минут, а интенсивность отражений пропор-
циональна квадрату структурного фактора. Это расхождение
объясняется тем, что кристаллы в большинстве случаев несовер-
шенны и состоят из крошечных участков, разориентированных
друг относительно друга из-за наличия дислокаций, границ зе-
рен и мозаичных блоков.
Таким образом, дифракция рентгеновских лучей дает спо-
соб определения совершенства кристаллического материала и
даже позволяет составить картину размещения отдельных дис-
локаций. Расскажем теперь вкратце о современных наиболее
распространенных рентгеновских методах, рекомендуя обра-
щаться для более полного ознакомления с предметом к лите-
ратуре последних лет [39—41, 15].
1. Двукристальный спектрометр. Интегральная интенсив-
ность излучения, отраженного кристаллом с ориентацией под
околобрэгговским углом, и ширина пика сильно зависят от со-
вершенства кристалла. Это совершенство изучают, смещая
кристалл тем или иным способом на малый угол и реги-
стрируя при этом отражения. Самые ценные сведения дает
2*
36
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
использование двух кристаллов. Характеристическое рентгенов-
ское излучение отражается под брэгговским углом от опорного
кристалла к исследуемому образцу (фиг. 1.14). Отражающие
плоскости исследуемого кристалла обычно устанавливают па-
раллельно плоскостям опорного кристалла.
Фиг. 1.14. Двукристальный спектрометр для исследования совершенства
кристаллов [37].
Если интенсивность отражения представить как функцию
«угла качания» 0, то получим кривую, подобную показанной на
фиг. 1.14. Мерой совершенства служит ширина пика. Этим спо-
собом пользовались для ис-
следования а-кварца, крем-
ния, вольфрама и других
материалов [37, 42, 43].
Исследуемый кристалл
Пленка
v Точечный источник
рентгеновского излучения
со сплошным спектром
Фиг. 1.15. Метод Шульца для иссле-
дования совершенства кристаллов [43].
2. Метод Шульца. При
исследованиях по методу
Шульца [44] монокристаль-
ный образец помещают под
углом около 25° к почти па-
раллельному пучку белого
рентгеновского излучения
(фиг. 1.15). На пленке обра-
зуется несколько обычных
пятен Лауэ примерно того
же размера, что и образец, и той же формы. Каждое такое пятно
образовано отражением от участков в кристалле со слабой раз-
ориентацией.
Практически метод Шульца, вероятно, является простейшим
рентгеновским методом изучения совершенства, поскольку он
не требует очень сложной аппаратуры, обходится без специ-
ального ориентирования кристалла, а длительность экспозиции
1. МОНОКРИСТАЛЛЫ
37
может не превышать 3 мин. Правда, этому методу присуще
малое пространственное и угловое разрешение.
3. Метод обратного отражения по Бергу — Баррету. Схема-
тически этот метод иллюстрируется на фиг. 1.16. На пленке
Отраженный
кристалл
Фиг. 1.16. Метод обратного отражения по Бергу — Баррету для исследо-
вания совершенства кристаллов [43].
дислокации проявляются в виде более темных участков, потому
что область вокруг дислокаций деформирована, а деформиро-
ванные участки сильнее отражают рентгеновские лучи.
4. Метод прямого прохождения (дифракции) по Бергу —
Баррету. В данном случае дифрагировавший пучок проходит
через кристалл, а участки с дислокациями проявляются на плен-
ке в виде темных пятен, поскольку дифракция в таких областях
выражена сильнее (фиг. 1.17).
Коллимированный
рентгеновский пучок
I Исследуемый
кристалл
Фиг. 1.17. Метод прямого прохождения (дифракции) по Бергу — Баррету
для исследования совершенства кристаллов [43].
5. Метод аномального прохождения (по Борману). В иссле-
дованиях данным методом регистрируют как проходящий, так
и отраженный пучки. Участки с дислокациями сильнее ослаб-
ляют оба пучка (фиг. 1.18).
6. Метод Лэнга. Для исследований по методу Лэнга требу-
ется такая же в общих чертах экспериментальная установка,
как и при исследованиях методом прямого прохождения по
Бергу — Баррету. Сильно коллимированный узкий пучок рент-
геновских лучей пропускают через кристалл, регистрируя на
38
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
пленке брэгговские отражения от параллельных плоскостей,
приблизительно перпендикулярных грани образца. Перемещая
одновременно пленку и образец, можно снять полную «карту»
дислокационной сетки. Дислокации выявляются как области
с повышенной отражающей способностью из-за обусловленного
ими перераспределения энергии между многократно отражен-
ными первичным и продифрагировавшим пучками. В итоге на
пленке возникает темное изображение дислокаций. Изменяя
должным образом угловую ориентацию кристалла, можно опре-
делить дислокационную сетку в трех измерениях.
Отраженный ,
v пучок
Коллимированный ' '
пучок монохромати-
ческого рентгеновского ; /
излучения / *
---1-----------/ Проходящий.
пучок
ух С тЛ ’
[ Исследуемый Пленка
кристалл
Фиг. 1.18. Метод аномального прохождения по Борману [43].
7. Измерение периодов решетки. Многие виды несо-
вершенств в кристалле изменяют периоды решетки в его микро-
скопических областях. Такие изменения периодов можно легко
определить по методу Бонда [13], позволяющему измерить меж-
плоскостные расстояния с точностью до нескольких десяти-
тысячных долей процента. Поскольку объем, в котором излуче-
ние дифрагирует, очень мал (1 X 0,025 X 0,005 мм), можно ис-
следовать изменение периодов решетки от точки к точке и гем
самым изучать стехиометрические вариации в кристалле [14].
8. Рентгеновский интерферометр. Самым чувствительным
средством обнаружения малых нарушений в макрообластях
кристалла служит недавно созданный рентгеновский интерферо-
метр [45].
С помощью двукристального спектрометра и рентгеновского
интерферометра можно выявить разориентации порядка 0,01
угловой секунды, тогда как метод Шульца пригоден для иссле-
дования малоугловых границ зерен и разориентаций в диапазоне
от нескольких минут до нескольких градусов. Исследования ме-
тодами обратного и прямого прохождения по Бергу — Баррету,
аномального прохождения по Борману, а также по методу Лэнга
в сочетании с рентгеновской интерферометрией проводят для
составления «карт» дислокационных сеток и даже для исследо-
1. монокристаллы
39
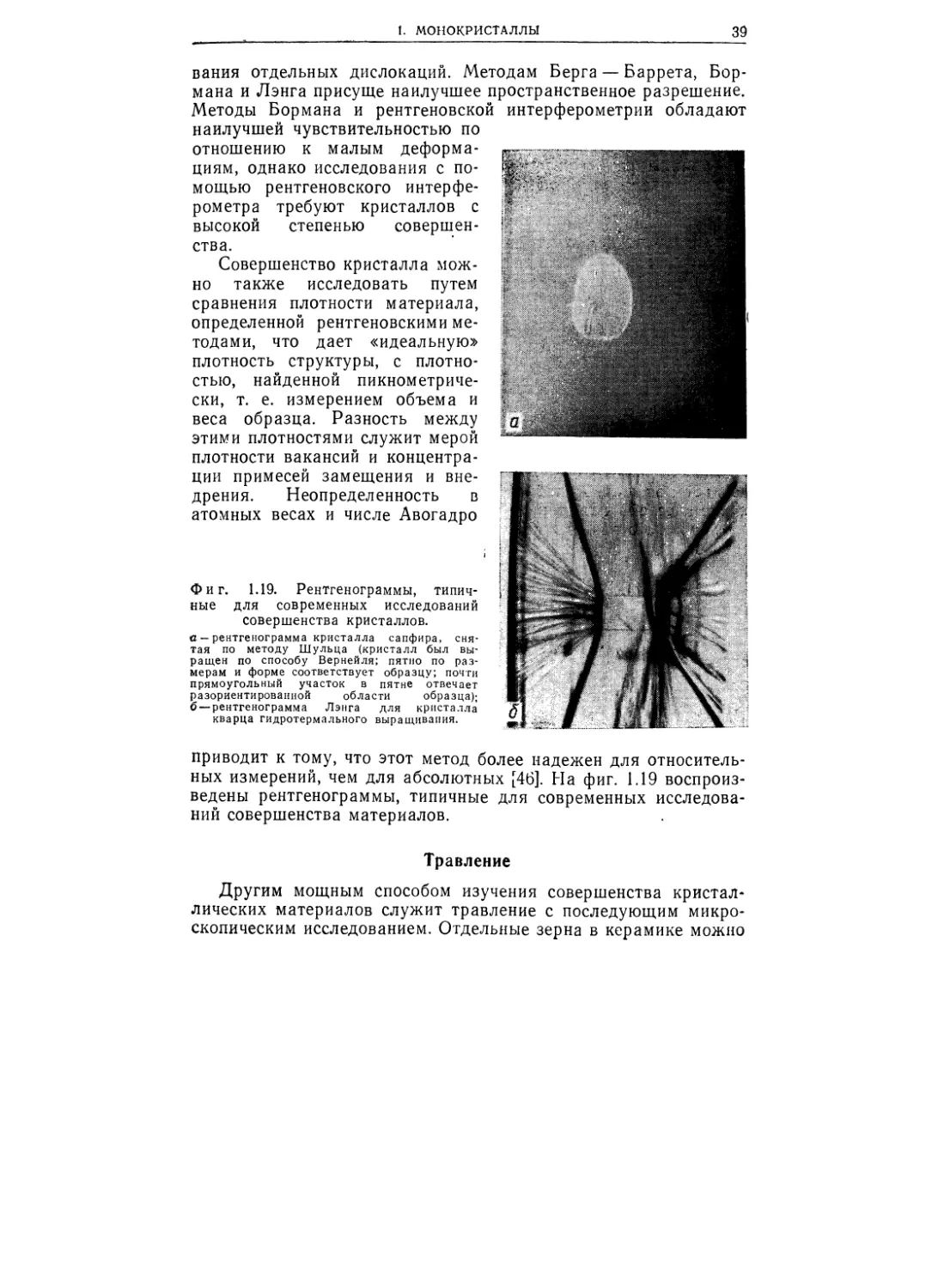
вания отдельных дислокаций. Методам Берга — Баррета, Бор-
мана и Лэнга присуще наилучшее пространственное разрешение.
Методы Бормана и рентгеновской интерферометрии обладают
наилучшей чувствительностью по
отношению к малым деформа-
циям, однако исследования с по-
мощью рентгеновского интерфе-
рометра требуют кристаллов с
высокой степенью совершен-
ства.
Совершенство кристалла мож-
но также исследовать путем
сравнения плотности материала,
определенной рентгеновскими ме-
тодами, что дает «идеальную»
плотность структуры, с плотно-
стью, найденной пикнометриче-
ски, т. е. измерением объема и
веса образца. Разность между
этими плотностями служит мерой
плотности вакансий и концентра-
ции примесей замещения и вне-
дрения. Неопределенность в
атомных весах и числе Авогадро
Фиг. 1.19. Рентгенограммы, типич-
ные для современных исследований
совершенства кристаллов.
а — рентгенограмма кристалла сапфира, сня-
тая по методу Шульца (кристалл был вы-
ращен по способу Вернейля; пятно по раз-
мерам и форме соответствует образцу; почти
прямоугольный участок в пятне отвечает
разориентированиой области образца);
б — рентгенограмма Лэнга для кристалла
кварца гидротермального выращивания.
приводит к тому, что этот метод более надежен для относитель-
ных измерений, чем для абсолютных [46]. На фиг. 1.19 воспроиз-
ведены рентгенограммы, типичные для современных исследова-
ний совершенства материалов.
Травление
Другим мощным способом изучения совершенства кристал-
лических материалов служит травление с последующим микро-
скопическим исследованием. Отдельные зерна в керамике можно
40
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
обнаружить при помощи соответствующих растворителей или
травителей, действующих избирательно на материал. Таким спо-
собом можно сделать видимыми малоугловые межзеренные
границы и даже отдельные дислокации. Кроме того, травление
часто выявляет дисперсные включения и вторичные фазы.
Границы зерен представляют собой участки, где обычно
скапливаются примеси, дислокации и деформации. Примеси и
деформированные участки влияют на растворимость и, что еще
важнее, на скорость растворения, благодаря чему травитель из-
бирательно1 воздействует на межзеренные границы. Подобным
же образом травление протекает интенсивнее на дислокациях,
потому что дислокации окружены деформированными обла-
стями. Некоторые травители характеризуются тем, что их дей-
ствие на вещество не зависит от присутствия примесей или де-
формаций. Они называются полирующими травителями. Ими
пользуются для равномерного удаления поверхностных слоев
перед исследованием свойств материала. Часто перед полирую-
щим травлением приходится тщательно шлифовать или полиро-
вать поверхности с помощью набора все более тонких абразивов.
В некоторых случаях полировка достигается одновременным
травлением и механическим истиранием. Такой способ иногда
называют химической шлифовкой. Если полирующее травление
не дает достаточно гладкой поверхности, то иногда прибегают
к химической шлифовке, используя травитель, который без
механического истирания обычно действует на образец избира-
тельно.
Выбор последовательности полирующих агентов более сло-
жен, чем кажется на первый взгляд. Конечно, это верно, что по-
верхностные нарушения можно удалить полирующим травите-
лем или некоторыми методами, рассматриваемыми ниже, но
экспериментальные трудности значительно меньше, если можно
ограничиться механической шлифовкой и полировкой, обеспе-
чив минимальность повреждения. Одна из часто возникающих
при шлифовании трудностей состоит в возможности образования
слоя Билби [47]. Даже в тех случаях, когда поверхность поли-
руют с легким нажимом и при хорошем охлаждении, на ней есть
выступы, испытывающие большую нагрузку. Выделяющейся на
таких участках теплоты трения часто хватает для того, чтобы
расплавить материал на глубину в несколько атомных слоев.
Под действием поверхностного натяжения такой расплавившийся
слой размазывается до затвердевания, заглаживая впадины на
поверхности с образованием аморфного или поликристалличе-
ского поверхностного слоя. Хрупкий материал способен под дей-
ствием полировки разрушиться или выкрошиться, прежде чем
оплавиться, но если полирующий агент плавится раньше кри-
сталла, то он способен расплавиться и растечься по поверхности.
1. МОНОКРИСТАЛЛЫ
41
Когда полируемый материал способен окисляться, разлагаться
или взаимодействовать с полирующим агентом, то вследствие
протекания таких реакций на отдельных горячих участках по-
верхности последняя будет загрязнена продуктами реакции. По-
этому при выборе способа полирования и полирующих агентов
нельзя пренебрегать ролью теплоты, выделяющейся при трении.
Эти рассуждения показывают, что механическому резанию, ха-
рактерному для металлографического полирования, следует от-
давать предпочтение перед оптическим полированием, которое
сопряжено с размазыванием. Методики, используемые для высо-
коклассной полировки стеклянных поверхностей, нельзя слепо
переносить на кристаллы. В стеклах образование слоя Билби ча-
сто выгодно, тогда как в случае кристаллов оно, как правило,
весьма нежелательно.
Недавние исследования [48, 49] показали, что полировка по
крайней мере тугоплавких материалов не обязательно связана
с образованием слоя Билби. Так, по механизму Билби полировка
путем плавления полируемого материала может быть эффектив-
ной только в том случае, когда температура плавления полиро-
вального порошка выше, чем у полируемого материала. Но, как
показывают наблюдения, соотношение таково лишь в случае
легкоплавких материалов. Сэмюэльс [50] показал, что на неко-
торых полированных плоскостях, которые выглядят совершенно
гладкими в обычном свете, существуют поверхностные царапины,
наблюдаемые средствами фазовоконтрастной микроскопии. Та-
ких царапин, вероятно, не должно было бы быть, если бы поли-
ровка происходила по механизму Билби. Рабинович [48, 49] при
исследовании материалов на профилометре до полировки и после
нее установил, что полировку истиранием нельзя считать обыч-
ным механизмом. Он объясняет полирование как следствие уда-
ления атомов с выступов на поверхности. Эти атомы сильно сме-
щаются в процессе полирования вниз и легко отрываются после
снятия нагрузки вследствие упругой отдачи. Вероятно, механиз-
мом Рабиновича объясняется полирование тугоплавких материа-
лов, но по крайней мере для легкоплавких веществ все еще зна-
чительна вероятность действия механизма Билби.
Подготовку поверхностей проводников без их заметного по-
вреждения осуществляют методами электролитического полиро-
вания и электроискровой обработки [51]. Поверхности с мини-
мальными повреждениями можно получать также, разрезая
кристаллы нитяной пилой с использованием обычного растворе-
ния и химических реакций.
После того как поверхность соответствующим образом под-
готовлена, кристалл подвергают действию травителя, который
так или иначе избирательно воздействует на деформированные
участки, области с высоким содержанием примесей или зоны с
42
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
дислокациями. Выбор травителя для того или иного кристалла
почти полностью относится к области эмпиризма. Часто трави-
тель содержит окисляющие агенты и растворители для образую-
щегося окисла. Таким образом, видимо, правильнее говорить о
травителе как о реагенте, взаимодействующем с кристаллом, чем
как о растворителе.
Истинный механизм действия травителя, благодаря которому
он либо равномерно снимает материал, либо воздействует пре-
имущественно на дислокации, остается в большинстве случаев
неясным. Однако ряд травителей простого химического состава
изучен довольно обстоятельно и механизм их действия хорошо
раскрыт. Такие исследования дают веские основания полагать,
что механизм действия по крайней мере некоторых химически
более сложных травителей одинаков. Так, Гилман и др. [52], а
также Сирс [53], изучавшие механизм травления кристаллов LiF
водным раствором FeF3, обнаружили, что срыв атомов с поверх-
ности начинается в местах выхода дислокаций на поверхность.
Это объясняется тем, что из-за упругой деформации и деформа-
ции в ядре дислокации атомы здесь слабее связаны друг с дру-
гом. Роль фторида железа заключается в преимущественном по-
давлении перемещения ступеней по поверхности сравнительно
с возникновением новых ступеней у дислокации. Отсюда раство-
рение в ямках перпендикулярно поверхности кристалла идет
быстрее растворения параллельно этой поверхности. Молекулы
FeF3 химически адсорбируются в изломах ]) на ступенях, где они
образуют сильные связи с ионами F~. Когда же ионов Fe3+ (или
ионов А13+, аналогично действующих) нет, ямки травления не
возникают. При молярной же концентрации Fe3+, меньшей при-
мерно 10’7, ямки травления имеют незначительную глубину. Та-
ким образом, травитель во многих случаях содержит примеси,
роль которых заключается в преимущественной адсорбции или
хемосорбции на изломах ступени. В табл. 1.1 дан неполный пере-
чень травителей, применяющихся для изучения совершенства
кристаллов.
В некоторых случаях для выявления дислокаций можно ис-
пользовать неодинаковую летучесть деформированных и не де-
формированных областей, на чем основан так называемый ме-
тод термического травления. Кристалл нагревают, причехМ диф-
ференциальная сумблимация или дифференциальная реакция с
участием газовой фазы приводит к выявлению особенностей по-
верхности.
Ямки травления часто ограничены плоскими поверхностями,
соответствующими граням кристалла с малыми индексами. Та-
*) О роли ступеней и изломов в процессе роста говорится в гл. 3, а на
фиг. 3.2 схематически изображены типичные ступени и изломы.
Таблица 1,1
Типичные химические травители, применяющиеся для выявления
совершенства кристаллов
Обьект травления Травитель (режим травления) Результаты Литера- тура
ВаТЮз 0.5% HF + HNO, (1,5 мин) Выявляет на полиро- ванной поверхности домены, зерна и двой- никовые границы [54]
LiF 1 ч. HF + 1 ч. СНзСООН (ледяная)+ + 2-10-5 ч. FeF3 (0,5—1,5 мин) Выявляет дислока- ции в виде ямок трав- ления на поверхностях {100}, {111} и других гранях [55-58]
Ge HF + СНзСООН + + HNO3 + жидкий Вг2 в пропорции 50 :50 : :80: 1 по объему — так называемый реак- тив СР-4 (1—2 мин) Выявляет дислока- ции в виде ямок трав- ления на поверхностях {100}, {111} и других гранях [59, 60]
Si 50% HF + 70% HNO3 + СНзСООН (ледяная) в пропорции 1:3:10 по объему (1-2 ч) Выявляет дислока- ции в виде ямок па поверхностях {100}, {111} и других гранях [61]
NaCl Метанол Выявляет винтовые и краевые дислокации [62]
Ga As 30% HNO3 (15 мин) Треугольные ямки травления на дислока- циях [63]
CaWO4 Насыщенный водный раствор СгОз + конц. HF в пропорции 2 : 1 по объему (2—25 мин) Выявляет дислока- ции на гранях {100} и {001} ')
Al HNO3 + НС1 + HF в пропорции 47 : 50 : 3 по объему Выявляет дислока- ции, связанные с при- месными атомами [65]
SiC Расплав буры (при -800 °C) Выявляет дислока- ции на разных гранях [66]
SiC Расплав Na2CO3 (при 1000 °C) Выявляет дислока- ции [67]
AgCl (3—5)н. МагЗгОз Выявляет дислока- ции на гранях {100} и {1Н} [68]
*) Неопубликованные данные ЛевпцстеГша, Лопяконо и Нассау.
44
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
П родолжение
Объект травления Травитель (режим травления) Результаты Литера- тура
CaF2 • ЗСа3Р2О8 (апатит) Конц, щавелевая или лимонная кислота, 60— 70 °C Выявляет дислока- ции на базисной грани [69]
СаСОз (каль- цит) 90%-ная муравьиная кислота; 15 с Выявляет места вы- хода дислокаций на плоскости спайности [70]
кие грани могут быть полезны при определении симметрии и
ориентации кристалла, обнаружении в кристалле двойников и
идентификации грани кристалла.
Задача установления соответствия той или иной ямки трав-
ления отдельной дислокации окончательно не решена. Такое
однозначное соответствие полностью продемонстрировано толь-
ко на нескольких веществах для определенных кристаллографи-
ческих плоскостей, протравленных особыми травителями. Рас-
скажем теперь о некоторых применявшихся приемах установ-
ления связи ямок травления с дислокациями.
1. Пластическое деформирование. Гилман и Джонстон [52,55,
58] с успехом исследовали отдельные дислокационные линии в
LiF. После некоторого деформирования образцов они наблю-
дали ямки травления вдоль линий скольжения. После дополни-
тельного деформирования кристалл снова подвергали травле-
нию. Тогда вдоль полосы скольжения1) выявлялись новые ямки
травления меньшего размера, в то время как старые ямки про-
травливались дальше, но в них начинало образовываться плос-
кое дно. Отсюда был сделан вывод, что ямки травления, наблю-
давшиеся после первого травления, выявляют отдельные дисло-
кации, которые под действием повторного нагружения мигри-
руют к точкам, в которых они обнаруживаются при вторичном
травлении. Развитие плоского дна в первичных ямках при пов-
9 Многие кристаллы можно частично деформировать путем трансляци-
онного сдвига, или смещения части кристалла как единого целого по отноше-
нию к соседней части. Линия пересечения поверхности скольжения с внеш-
ней поверхностью кристалла носит название полосы скольжения. Детальное
изучение скольжения обычно показывает, что полоса скольжения представ-
ляет собой пачку атомных плоскостей, каждая из которых сдвинута по
отношению к соседней. В своей совокупности такие смещения создают картину
макроскопически наблюдаемого сдвига. Это макроскопическое смещение от-
дельных плоскостей идентично уже упоминавшемуся скольжению.
1. МОНОКРИСТАЛЛЫ
45
торном травлении служило доказательством того, что такие
ямки уже утратили связь с дислокациями. Этим методом Гил-
ман и др. [58] проследили за движением отдельных дислокаций
и определили скорость их перемещения в зависимости от прило-
женного напряжения.
Подобные же исследования провел Дорендорф [71] на по-
верхностях германия. В его экспериментах перемещение дисло-
каций вызывалось отжигом деформированного образца.
2. Подсчет ямок травления вдоль малоугловой межзеренной
границы. Как уже отмечалось, малоугловую наклонную границу,
подобную показанной на фиг. 1.10, можно рассматривать как
ряд параллельных краевых дислокаций одного знака. Расстоя-
ние между дислокациями D связано с углом поворота 0 одной
части кристалла относительно другой и вектором Бюргерса
уравнением
О = |. (1.4)
которое справедливо для углов 0 < 15°. Таким образом, если
расположение дислокаций удовлетворяет этому условию, то та-
кие ямки, вероятно, связаны с дислокациями. Среднее расстоя-
ние между ямками измеряют под микроскопом, угол поворота
определяют путем рентгеновского исследования, а модуль век-
тора Бюргерса вычисляют из кристаллографических соотноше-
ний. Воспользовавшись этой методикой, Фогель [60] показал,
что ямки травления на гранях {100} германия, выявляемые
травителем СР-4 (см. табл. 1.1), сопряжены с дислокациями.
Модуль вектора Бюргерса оценивали при этом следующим обра-
зом: поскольку, как было показано, малоугловая граница (~Г)
представляет собой чисто наклонную границу, краевые дислока-
ции должны располагаться в ней параллельно оси наклона. Та-
ким образом, дислокационная линия должна иметь направле-
ние [100]. Как показал Рид [30], энергия взаимодействия строя
дислокаций одного знака с параллельными векторами Бюргерса
достигает минимума, когда дислокации располагаются в плос-
кости, перпендикулярной векторам Бюргерса. Так как границы
лежат в плоскостях (011), векторами Бюргерса должны быть
кратчайшие трансляции, перпендикулярные (011). Отсюда
В = 2/2я0 = 4 • 10”10 м (половина расстояния между плоско-
стями {100}). Это значение согласуется с векторами Бюргерса,
экспериментально измеренными при скольжении.
В том случае, когда контактная плоскость образует угол 0
с плоскостью симметрии, возникает асимметричная наклонная
граница, что заставляет видоизменять уравнение (1.4). Для
46
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
границы кручения уравнение (1.4) также видоизменяется, но ос-
новы расчета остаются неизменными.
3. Плотность дислокаций в пересекающихся границах. На-
клонные границы часто пересекаются в форме буквы Т или L.
Если границы относятся к чисто наклонным, то сумма углов
наклона 0, встречающихся при движении по контуру вокруг
такого пересечения, должна быть равна нулю. Таким образом,
плотность дислокаций в ответвлениях пересекающихся границ
должна выражаться простым соотношением. Например, как по-
казали Пфанн и Ловелл [72], для плоскостей (001) решетки
германия соблюдаются следующие соотношения:
для L-пересечения
Рл + Рв = 0. (1-5)
для Т-пересечения
Рд + Рв + Рс = 0- (1-6)
Здесь р — плотность дислокаций, а Л, В и С — индексы ответ-
влений от точки пересечения. Протравливание реактивом СР-4
показало, что распределение дислокаций удовлетворяет уравне-
ниям (1.5) и (1.6). Подобное согласие эксперимента с теорией
служит весьма веским доводом в пользу того, что ямки травле-
ния действительно связаны с дислокациями.
4. Корреляция с другими измерениями. Связь ямок травле-
ния с дислокациями часто устанавливают путем изучения дис-
локаций другими способами. «Карту» распределения дис-
локаций можно получить, как уже говорилось, посредством
рентгеновских исследований. Когда локализация дислокаций
подтверждается данными изучения ямок травления, это служит
доводом в пользу допущения о прямой связи ямок травления
с дислокациями. Подобным же образом для изучения совершен-
ства можно воспользоваться данными прямого наблюдения по-
верхностей кристалла, а также оптической и электронной микро-
скопии, сравнивая их с результатами исследования того или
иного материала методом травления. Речь о всех таких методах
еще пойдет дальше.
Детально разработан метод оценки совершенства монокри-
сталлов кремния путем травления [74]. Документированы фото-
графиями типичные ямки и особенности травления, обуслов-
ленные дислокациями, малоугловыми и большеугловыми гра-
ницами зерен, скольжением, двойниками, поликристаллической
природой материала. Описаны в деталях травители, порядок
их приготовления, процесс травления и способы обработки ре-
зультатов.
Т. МОНОКРИСТАЛЛЫ
47
Декорирование
Нельзя забывать о том, что выявление ямок травления, рент-
генографические исследования и многие другие методики изу-
чения совершенства обычно дают только двумерную картину
поверхности исследуемого кристалла. Сведения о трехмерной
дислокационной сетке можно, конечно, получить, используя ме-
ханическую полировку после травления или делая рентгенов-
ские снимки в нескольких ориентациях, но это связано с рядом
экспериментальных трудностей. В то же время прямую инфор-
мацию о дислокациях в объеме кристалла дает декорирование.
Оно состоит в обработке кристалла с целью заставить то или
иное вещество осадиться вдоль дислокаций в виде наблюдае-
мых частиц. Дело в том, что примеси проявляют тенденцию
Таблица 1.2
Типичные методики декорирования,
используемые для выявления совершенства кристалла
Объект декориро- вания Методика Результаты Литера- тура
Si Выпарить водный раствор Cu(NO3)2 на поверхности кристалла, отжечь в течение 30 мин в Нг при 950 °C, зака- лить и исследовать под ми- кроскопом через инфра- красный электронно-оптиче- ский преобразователь Выявляет дислока- ции благодаря избира- тельному осаждению меди [61]
AgBr и AgCl Отжечь и выдержать на свету — кристаллы должны быть очень чистыми; вести наблюдение методом на про- хождение Выявляет дислока- ции благодаря оса- ждению коллоидально- го серебра [75]
NaCl или КС1 Кристалл, содержащий ~ 1 % AgCl, прокалить в Нг при 650 °C в течение 2—3 ч; наблюдать в микроскопе по темнопольной методике Выявляет дислока- ции благодаря осажде- нию коллоидального галогенида серебра [76, 77]
CaF2 Выпарить слой Ag, от- жечь в Нг (например, 3 ч при 1200°C), исследовать под ультрамикроскопом Выявляет дислока- ции благодаря осажде- нию серебра [79, 80]
NaCl и KBr Выдержать кристалл в ва- куумированной трубке, со- держащей галогенид золота, 2—3 ч при 500°C Выявляет дислока- ции благодаря оса- ждению золота [81]
48
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
к сегрегации вдоль дислокаций, а с этим связано избирательное
действие травителя и изменения интенсивности рассеяния рент-
геновских лучей в некоторых системах. Поскольку примеси ча-
сто диффундируют к дислокациям, перед травлением полезно
проводить отжиг, ускоряющий такую диффузию. Фактически
некоторые травители оказывают свое действие только на кри-
сталлы, содержащие определенные примеси. В случае прямого
наблюдения дислокаций методом декорирования примесь вводят
в кристалл в процессе роста или посредством диффузии после
выращивания. Трудность, связанная с отжигом для ускорения
диффузии и растворения, заключается в том, что отжиг может
повлиять на совершенство кристалла. Перечень ряда методик
декорирования применительно к различным материалам приве-
ден в табл. 1.2. В целях исследования декорированных кристал-
лов веществ, непрозрачных в видимом свете, можно прибегнуть
к помощи инфракрасной или электронной микроскопии.
Прямое наблюдение поверхности
Наблюдение поверхности кристалла при небольшом увеличе-
нии или даже невооруженным глазом часто выявляет особенности
структуры, обусловленные несовершенствами кристалла. Так,
наличие входящих углов на поверхности кристалла свидетель-
ствует о двойниковании. Как мы увидим в гл. 3, в процессе
роста часто образуются спиральные террасовидные холмики.
Геометрия таких поверхностных структур дает сведения о со-
вершенстве кристалла. Например, простые спирали часто свя-
заны с одиночными винтовыми дислокациями, а измерение оп-
ределенных характеристик спирали можно использовать для
определения вектора Бюргерса. Детали возможных поверхност-
ных структур рассматриваются в гл. 3. В целях изучения топо-
логии поверхности Голанский [82, 83] с большим успехом при-
бегал к многолучевой интерферометрии.
Электронно-микроскопические наблюдения
Для некоторых веществ с большими межплоскостными рас-
стояниями можно наблюдать индивидуальные плоскости решет-
ки, и даже в материалах с малыми межплоскостными расстоя-
ниями можно видеть дислокации непосредственно на картине,
возникающей в электронном микроскопе. Косвенным путем
дислокации можно выявлять на картинах муара, когда два
тонких слоя материала с близкими межплоскостными расстоя-
ниями накладываются один на другой и исследуются на прохож-
дение,
1. МОНОКРИСТАЛЛЫ
49
Обычный способ наблюдения дислокаций в электронном
микроскопе основан на неодинаковой дифракции электронного
луча в деформированных и недеформированных участках.
В принципе можно исследовать совершенство любого мате-
риала, который допускает изготовление без разрушения тонких
образцов, прозрачных для электронного луча с энергией около
100 кэВ и не разрушающихся под действием электронов. Для
большинства материалов нужная толщина образцов составляет
10-7 м [85]. Если кристалл близок к совершенству (с угловой раз-
ориентацией ~10‘* 2 3 * *рад) и имеет достаточную толщину (~10"7м
для германия), то благодаря электронной дифракции в нем бу-
дут образовываться линии Кикучи [86,87] с шириной, пропорцио-
нальной искривлению кристаллической плоскости. Следователь-
но, картины линий Кикучи полезны при изучении качества кри-
сталлов высокой степени совершенства 1).
Автоионно-микроскопические наблюдения
Ионный проектор (автономный микроскоп) способен разре-
шать отдельные атомы на острие металлической проволоки.
Проволока служит катодом с сильным электрическим -полем у
его конца. Испускаемые ею ионы дают изображение на флуо-
ресцирующем экране. Увеличение, пропорциональное отношению
расстояния до экрана к радиусу кривизны острия, можно до-
вести до 106, что дает разрешение порядка 2-Ю*9 -м, позволяю-
щее легко видеть отдельные атомы2). Однако такое исследова-
ние пока возможно только для немногих весьма тугоплавких
материалов. Автоионная микроскопия позволяет наблюдать ва-
кансии, междоузлия, примесные атомы и дислокации [88], но ее
возможности пока ограничены только исследованиями туго-
плавких металлов3).
1.5. ПОЧЕМУ НАС ИНТЕРЕСУЮТ КРИСТАЛЛЫ?
Монокристаллы широко используются в научных исследова-
ниях. Как мы видели, можно считать, что все истинно твердые
тела — кристаллы. Поэтому изучение кристаллов образует ос-
нову знаний физики и химии твердого состояния. Для многих
исследований можно пользоваться поликристаллическими, а не
!) Необычайно эффективным средством исследования кристаллических
поверхностей стал растровый электронный микроскоп [90].
2) Точнее, до 2-10~10 м. — Прим. ред.
3) Обстоятельнее с возможностями исследований с помощью ионного
проектора читатель может ознакомиться по сб. «Автоионная микроскопия»
(изд-во «Мир», 1971) или монографии Э. Мюллера и Т. Цоня того же на-
звания (изд-во «Металлургия», 1972). — Прим, ред.
50
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
монокристальными образцами, но часто без крупных моно-
кристаллов не обойтись. В поликристаллических образцах есть
межзеренные границы. Если исследователь хочет получить дан-
ные о каком-то объемном свойстве материала и измеряет это
свойство на поликристаллическом образце, то во многих случаях
он измерит характеристику межзеренных границ, а не массив-
ного материала. Замечательным примером, когда существенно
иметь монокристальный материал, может служить электропро-
водность полупроводников, которая особенно чувствительна к
наличию примесей. Примеси стремятся сегрегировать на грани-
цах зерен. Поэтому определение всех свойств полупроводников,
зависящих от проводимости, почти всегда должно проводиться
на монокристаллах. Другое распространенное проявление дей-
ствия границ зерен и связанных с ними пустот сводится к рас-
сеянию света, что часто делает монокристаллы необходимыми
при оптических исследованиях.
Многие свойства кристаллов зависят от кристаллографиче-
ского направления, в котором производят измерения, так как
пространственное расположение образующих кристалл атомов
обычно не одинаково для всех направлений. Следовательно, при
определении зависящей от направления характеристики на по-
ликристаллическом образце, в котором кристаллиты ориенти-
рованы случайным образом, исследователь будет измерять ус-
редненную характеристику, не проявляющую зависимости от
направления.
Монокристальные материалы находят важное практическое
применение в технике. Например, на монокристаллах гораздо
легче добиться повышенной частотной стабильности и снижения
акустических потерь, чем на поликристаллических материалах.
Поэтому элементы контроля частоты делают из монокристаллов
пьезоэлектрических соединений (кварца). Требования к прово-
димости и подвижности диктуют применение монокристалъных
полупроводников в транзисторах. Серьезные новые потребности
в монокристаллах для исследовательских и прикладных целей
порождены созданием лазеров и мазеров. Монокристаллы раз-
личных веществ находят применение при изготовлении техниче-
ских устройств и приборов для научных исследований следую-
щего назначения:
1) транзисторы: Si, Ge, GaAs;
2) туннельные диоды, параметрические диоды, сигнальные
светодиоды: GaAs;
3) тензодатчики: Si, Ga(AsP);
4) СВЧ-ограничители и настраиваемые фильтры; иттрий-же-
лезистый гранат;
5) лазеры: CaWO4, CaF2, иттрий-алюминиевый гранат, рубин,
GaAs, InP, InSb, InAs, Ga(AsP);
Т. МОНОКРИСТАЛЛЫ
51
6) электромеханические преобразователи: кварц, сегнетова
соль, дигидрофосфат аммония, CdS, GaAs;
7) фильтры и генераторы: кварц;
8) оптические приборы: CaF2, кварц, LiF, кальцит;
9) детекторы излучения: антрацен, КС1, Si, GaAs, Nal, акти-
вированные Tl; Ge, активированный Li; триглицинсульфат, ба-
риестронциевый ниобат;
10) ультразвуковые усилители: CdS;
11) промышленные подшипники: сапфир;
12) режущие и абразивные материалы: сапфир, алмаз, SiC;
13) выпрямители: Si и Ge;
14) лазерные модуляторы, гармонические генераторы, пара-
метрические устройства: KDP, LiNbO3, LiTaO3, бариестронцие-
вый ниобат, бариенатриевый ниобат;
15) электролюминесцентные устройства: СаР, GaAs,
Ga(As,P).
Есть еще одна причина, почему мы интересуемся кристалла-
ми. С доисторических времен человек ценил монокристальные
драгоценные камни за их красоту. Микрофотографии снежных
кристаллов с конца XIX в. не перестают доставлять людям удо-
вольствие. Каждому, кто вырастил или исследовал монокри-
сталл, знакома радость открытия симметрии и красок неодушев-
ленной природы.
2
РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
2.1. КЛАССИФИКАЦИЯ ПРОЦЕССОВ РОСТА
Уже само выражение «равновесие при росте кристаллов» в
известном смысле противоречиво. При равновесии кристаллы не
растут. И все же прежде чем приступить к изучению кинетики
того или иного процесса, важно приобрести некоторые знания
о равновесии, отвечающем данному процессу. Термодинамика
равновесных состояний может в значительной степени пролить
свет на процессы выращивания кристаллов, а анализ равновес-
ности, отклонение от которой ведет к росту, помогает нам про-
вести очень полезную классификацию процессов роста.
Рост кристаллов представляет собой гетерогенную химиче-
скую реакцию одного из следующих типов: а) твердая фаза —►
кристалл, б) жидкая фаза—► кристалл или в) газ —► кристалл.
Такая реакция возможна в системе, в которой помимо следов
загрязнений или специально введенных в малых концентрациях
активаторов 1) имеется только один компонент2), а именно кри-
сталлизуемый материал. Выращивание в таких условиях назы-
вается здесь однокомпонентной кристаллизацией. Рост может
происходить и в системе с высокой концентрацией примеси или
введенного активатора; в этом случае подлежащий кристалли-
зации материал растворен в растворителе3) или образуется
в результате химической реакции. Такой рост наблюдается в
системе, где кроме компонента, образующего кристалл, есть еще
другой компонент или другие компоненты. Этот случай назы-
вается здесь многокомпонентной кристаллизацией. Подобное
деление полезно при анализе теорий роста и классификации ме-
тодик роста, хотя между одно- и многокомпонентным ростом
и нет четкой границы, выраженной в виде определенной кон-
центрации второго компонента.
9 Под активатором (dopant) здесь понимается примесь, которая спе-
циально вводится в кристаллы, чтобы наделить их нужными механическими,
электрическими или оптическими свойствами.
2) Понятие компонент употребляется нами в том смысле, в каком его
сформулировал Гиббс в своем правиле фаз [1] (см. разд. 2.6).
3) Это означает, что концентрация активатора достаточна, чтобы его
можно было считать растворителем.
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
53
Наше рассмотрение ограничивается однокомпонентным ро-
стом, т. е. выращиванием в условиях низких концентраций акти-
ватора и примеси, без специального добавления других компо-
нентов, действующих как растворитель или реагирующих с кри-
сталлизуемым компонентом. При многокомпонентном росте
добавочным компонентом может быть либо нежелательная при-
месь, присутствующая в большом количестве, либо активатор,
если он необходим в большом количестве для создания нужной
его концентрации в выращенном кристалле. Однако чаще всего
дополнительный компонент вводят по той или иной причине,
связанной с самим процессом выращивания. Обычно его вво-
дят специально, чтобы понизить температуру плавления или
усилить летучесть выращиваемого материала.
Выращивать кристаллы при температурах ниже температуры
их плавления или вообще при возможно более низкой темпе-
ратуре приходится по следующим причинам:
1) чтобы избежать нежелательных полиморфных превраще-
ний;
2) чтобы избежать высокого давления пара при температу-
ре плавления;
3) чтобы избежать инконгруэнтного плавления;
4) чтобы избежать разложения;
5) чтобы избежать сильной растворимости примеси при вы-
сокой температуре;
6) чтобы расширить экспериментальные возможности или
сделать ведение процесса более удобным;
7) чтобы понизить концентрацию вакансий и, следовательно,
плотность дислокаций или предотвратить возникновение боль-
ших термических напряжений, т. е. подавить образование мало-
угловых границ зерен;
8) чтобы добиться такого распределения примеси, какое не-
возможно при высоких температурах (например, из-за улетучи-
вания примеси).
Низкотемпературное выращивание обычно достигается введе-
нием компонента, понижающего температуру плавления (выра-
щивание из раствора) или повышающего летучесть (выращива-
ние из газовой фазы). При многокомпонентном росте возникают
трудности с растворимостью второго компонента в кристалле,
диффузией образующего кристалл компонента к поверхности
раздела или других компонентов от поверхности раздела.
Итак, процессы роста можно классифицировать по следую-
щей схеме:
I. Рост однокомпонентных систем
А. Твердая фаза —► твердая фаза
1. Деформационный отжиг (снятие напряжений).
54
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
2. Расстекловывание.
3. Полиморфное превращение.
Б. Жидкость-> твердая фаза
1. Консервативные процессы:
а) прямое затвердевание (метод Бриджмена — Сток-
баргера);
б) охлаждаемая затравка (метод Киропулоса);
в) вытягивание (метод Чохральского).
2. Неконсервативные процессы:
а) зонная плавка (горизонтальная, вертикальная, по
методу плавающей зоны, на подвижной подставке);
б) метод Вернейля (плавление в пламени, плазме,
электрической дуге).
В. Газ -> твердая фаза
1. Сублимация — конденсация.
2. Напыление.
II. Рост из многокомпонентных систем
А. Твердая фаза —► твердая фаза
1. Осаждение из твердого раствора.
Б. Жидкость -> твердая фаза
1. Рост из раствора (испарение, медленное охлаждение, с
температурным перепадом):
а) водные растворители;
б) органические растворители;
в) солевые расплавы (растворители);
г) растворители в гидротермальных условиях;
д) прочие неорганические растворители.
2. Выращивание посредством реакции (в тех же средах,
что и выше, но с изменением температуры или кон-
центрации) :
а) химические реакции;
б) электрохимические реакции.
В. Газ твердая фаза
1. Выращивание посредством обратимых реакций (изме-
нение температуры или концентрации):
а) процессы по Ван Аркелю (осаждение на раскален-
ной нити).
2. Выращивание посредством необратимых реакций:
а) эпитаксиальные процессы.
Подробнее речь о перечисленных способах выращивания кри-
сталлов пойдет дальше.
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
65
2.2. РАВНОВЕСИЕ И РОСТ КРИСТАЛЛОВ
Прежде чем приступить к рассмотрению кинетики того или
иного процесса, необходимо сначала изучить относящееся к
нему равновесие. При выращивании кристаллов важно знать
следующее:
1) Какая твердая фаза стабильна?
2) Как велика ее растворимость, т. е. какова константа рав-
новесия при ее образовании?
3) Какова растворимость других компонентов в стабильной
твердой фазе?
В случае роста кристаллов из однокомпонентных систем
важно знать ответы на первый и третий вопросы (если нужно
вырастить активированные кристаллы). Чтобы шел тот или иной
процесс кристаллизации, обычно необходимо, чтобы выращивае-
мый кристалл был термодинамически стабильной твердой фазой
при давлении и температуре кристаллизации. Встречаются слу-
чаи, когда твердая фаза образуется или кристалл вырастает и
в метастабильных условиях. В таких условиях термодинамика
равновесных процессов не имеет силы, но мы оставим такие про-
цессы за рамками нашего рассмотрения.
2.3. РАВНОВЕСИЕ МЕЖДУ ТВЕРДЫМИ ФАЗАМИ
В ОДНОКОМПОНЕНТНЫХ СИСТЕМАХ
При выращивании кристаллов посредством деформационного
отжига сначала материал пластически деформируют нагруже-
нием или путем термической обработки, при которой деформа-
ции в материале возникают вследствие чередования растяжения
и сжатия под действием температурного градиента или быстрого
изменения температуры. Затем осторожным нагреванием мате-
риала деформацию отжигают, обычно в изотермических усло-
виях, без резкого изменения температуры. В процессе такого
отжига недеформированные монокристальные участки растут за
счет деформированных, благодаря чему зерно укрупняется. Для
всякого равновесного процесса AG = 0, где AG есть изменение
свободной энергии Гиббса. Для самопроизвольных процессов
AG < 0. Для любого процесса
AG = AH — TAS; (2.1)
отсюда для любого равновесного процесса
АН = Т AS, (2.2)
где АН — изменение энтальпии, AS — изменение энтропии и
Т — абсолютная температура. В большинстве процессов выра-
щивания кристаллов образующийся продукт характеризуется
66
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
более высокой степенью упорядочения, чем исходные материа-
лы1), т. е. изменение энтропии AS обычно есть отрицательная
величина, так что изменение энтальпии АЯ тоже отрицательно.
Таким образом, кристаллизация обычно представляет собой
экзотермический процесс.
Для всякого процесса
А/7 = АД + А (ро), (2.3)
где АД — изменение внутренней энергии в системе, А(ри) —из-
менение произведения давления на объем, и
АД — q — w (2.4)
(q — теплота, подводимая к системе, a w— работа, совершае-
мая системой). Таким образом, когда кристаллический материал
деформируют в изотермических условиях, можно сформулиро-
вать следующие положения:
состояние 1 состояние 2
недеформированный материал->деформированный материал,
(2.5)
Д£’1->2 = ^ — q, (2.6)
где w — работа деформирования, a q — выделившаяся теплота
(w > q). Поскольку изменение A(/w) пренебрежимо мало,
имеем
ДЯ1->2 = A£i->2, (2.7)
AGi_>2 = ^ — q — TAS. (2.8)
При низких температурах можно пренебречь произведением
TAS, что дает2)
— q. (2.9)
Следовательно, деформирование кристалла не может быть в
отличие от отжига спонтанным .процессом. При отжиге темпера-
туру повышают только для ускорения процесса. Из-за слож-
ности оценки w трудно провести количественный расчет равно-
весия для процессов деформационного отжига. Составлены
оценки упругой энергии вокруг одиночной дислокации, поверх-
ностной энергии границ зерен [2], но весьма нелегко рассчитать
энергетику сложной системы несовершенств в деформированном
поликристаллическом материале.
*) Очевидным исключением служит рост в процессе полиморфного пре-
вращения, когда симметрия образующегося продукта может быть и выше и
ниже, чем у исходного материала.
2) В разд. 4.2 уравнение (2.9) выводится и обсуждается в более точном
Виде.
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
57
При росте кристаллов в процессе расстекловывания стекол
движущаяся сила создается метастабильностыо стекла по отно-
шению к кристаллу.
В идеальной системе энтальпия расстекловывания при задан-
ной температуре Т выражается в виде
\HD = АНпл +ДСР (Тпл - Г), (2.10)
где А//пл — изменение энтальпии кристаллизации при темпера-
туре плавления, ДСР — изменение удельной теплоемкости при
постоянном давлении, Тпл— температура плавления1). Уравне-
ние (2.10) соблюдается только в том случае, когда Д//пл слабо
зависит от температуры или когда разность (Гпл — Т) мала.
Другие термодинамические функции можно оценить подста-
новкой Д//р вместо А// в соответствующем уравнении; для рас-
стекловывания, например, она дает
AG = AHD—T AS. (2.11)
При равновесии расстекловывание не происходит, потому что
стеклообразное состояние неустойчиво в отличие от кристал-
лического; таким образом, для расстекловывания имеем
AHD=£ TAS. (2.12)
При росте в процессе или аллотропных2), пре-
вращений возможен двоякий полиморфизм — обратимый и не-
обратимый. При обратимом полиморфизме две формы находят-
ся в обратимом равновесии в точке превращения вдоль линии
перехода в координатах давление — температура. Превращение
идет при температуре ниже точки плавления с присущей ему
характерной теплотой перехода. При необратимом полиморфиз-
ме одна форма всегда термодинамически неустойчива, т. е. одна
из полиморфных модификаций неустойчива по отношению к
другой при всех температурах ниже точки плавления. Темпера-
тура перехода лежит выше точки плавления, причем метаста-
бильную полиморфную модификацию можно сохранить только
быстрой закалкой от высокой температуры (примером может
служить белый и красный фосфор). Теплота перехода связана
с переходом метастабильной формы в устойчивую, но реакция
необратима и кривой перехода не существует. Такое поведение
называют монотропией.
Кривая перехода, или инверсии, дает зависимость давления
от температуры перехода; в случае обратимого полиморфизма
*) В системах, в которых образуется кристаллическая фаза, температура
плавления известна, тогда как в других системах она подлежит определению.
2) Под аллотропией обычно понимают полиморфизм элементов.
68
Р. ЛОДИЗ. РОСТ монокристаллов
она удовлетворяет уравнению Клапейрона
dp _ ЬН
dT ГДЕ 1
где А// и AV— изменения энтальпии и объема при полиморф-
ном переходе. Уравнение (2.13) можно проинтегрировать, а
кривую перехода иногда удается ^построить на основе термоди-
намических данных. На фиг. 2.1 приведена кривая перехода ал-
маз — графит [3].
Фиг. 2.1. Диаграмма состояния системы графит — алмаз [3] [1 мегапаскаль
(МПа) = 10 кгс/см2].
Полиморфные превращения подразделяются на три следую-
щие категории [4]:
1. Превращения с незначительным изменением симметрии
(нереконструктивные). При превращении одной формы в дру-
гую сохраняется та же общая структура, координация и связи,
но меняются такие детали структуры, как углы между связями.
Обе формы обычно принадлежат к одной и той же кристалло-
графической системе. Медленным подходом к температуре пре-
вращения нередко удается полностью перевести монокристалл
одной полиморфной модификации в монокристалл другой без
растрескивания, двойникования или возникновения других ма-
кронесовершенств, хотя такому превращению часто сопутствуют
метастабильность и двойникование по дофинейскому закону.
Примером может служить превращение а-кварца в его
р-форму.
2. Превращения со значительным изменением симметрии (ре-
конструктивные). Сохраняется координация, но меняется сим-
метрия. В процессе превращения химические связи *) нару-
*) Нельзя, по-видимому, исключать процессы разрыва или хотя бы ча-
стичного ослабления связи в элементарном акте и при превращениях первой
категории, — Прим. pedt
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
59
шаются и реконструируются; нередко следствием такой пере-
стройки бывают политипия и дефекты упаковки. Полностью
перевести монокристалл одной полиморфной модификации в
другую трудно, но можно. При превращениях данной категории
обычна метастабильность. В качестве примера можно привести
превращение ZnS (сфалерит)—ZnS (вюрцит).
3. Превращения со значительными структурными изменения-
ми (реконструктивные). Меняются координация и система свя-
зей. Структуры полиморфных модификаций неодинаковы, так
что по энергии и плотности они различаются гораздо сильнее,
чем при превращениях первых двух категорий. Метастабиль-
ность все еще возможна, но менее вероятна, чем в первых двух
случаях ’). Примером может служить превращение алмаз — гра-
фит.
Фазовые переходы первой и второй категорий осуществить
легко, тогда как превращения третьей категории часто тре-
буют наличия растворителя или затравочного кристалла. За-
травочные кристаллы часто представляют собой sine qua non * 2)
для роста кристаллов. Затравочный кристалл — кристалл кри-
сталлизуемого материала, вводимый в систему, в которой дол-
жен происходить рост в условиях, отвечающих росту на затрав-
ке. Существует безошибочный способ проверки того, что данный
материал устойчив в данной совокупности условий. Если а-фаза
превращается в p-фазу при определенных значениях давления
и температуры, то есть основания полагать, что р устойчивее а;
однако у нас еще нет уверенности в том, что другая фаза у не
будет в этих условиях устойчивее р. Если кристаллы у-фазы
есть в наличии, то можно проверить, пойдет ли реакция у-фа-
за-* p-фаза вправо при заданных давлении и температуре. Та-
кой опыт, однако, нельзя провести, если у-фазы в наличии нет
или если о существовании таковой ничего неизвестно (!). При-
нято считать, что наиболее устойчивая из известных устойчивых
при данной температуре и данном давлении фаз и будет устой-
чивой фазой с минимальной свободной энергией.
Для многих полиморфных превращений с незначительнььм
изменением симметрии (первая категория) высокотемператур-
ная форма характеризуется большим объемом и более высокой
!) Если под метастабильностью понимать способность одной из моди-
фикаций длительное время существовать в области термодинамической устой-
чивости другой, то вопреки автору метастабильность проявляется при пре-
вращениях третьей категории ярче, чем при переходах второй категории, не
говоря уже о первой. Та же последовательность отмечается дальше и самим
автором. — Прим. ред.
2) Необходимое условие.
60
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
симметрией по сравнению с низкотемпературной, тогда как пре-
вращению низкотемпературной формы в высокотемпературную
соответствует по принципу Ле-Шателье положительная произ-
водная dpIdT (например, а-кварц/р-кварц, а-кристобалит/р-кри-
стобалит). Поскольку
dp _ AS
ДУ ’
удивление может вызвать то, почему изменение AS может быть
положительной величиной, когда высокотемпературная форма
имеет более высокую симметрию. Это объясняется тем, что
приращение AS состоит из двух слагаемых: конфигурационной
энтропии ASC (хаотичность), которая отрицательна для данного
процесса, потому что в высокосимметричной форме упорядоче-
ние больше, и колебательной энтропии ASV, которая имеет по-
ложительное значение, потому что в данном процессе возра-
стают объем тела, а с ним и амплитуда колебаний атомов около
их равновесных положений в решетке. Суммарный эффект при
превращениях, аналогичных переходу а-кварца в p-кварц, де-
лает AS положительной величиной.
Большое влияние на структуру сплавов часто оказывают по-
лиморфные превращения, протекающие в таких многокомпо-
нентных системах в процессе охлаждения. Важным примером
может служить хорошо известное мартенситное превращение.
Твердость закаленной стали обусловлена полиморфным превра-
щением аустенита в мартенсит. Мартенсит представляет собой
не равновесную, а только кратковременную промежуточную фа-
зу, образующуюся раньше таких низкотемпературных равновес-
ных фаз, как перлит. Перлит, однако, не представляет собой
полиморфную модификацию мартенсита, так что мартенситные
структуры способны сохраняться даже в метастабильных усло-
виях. Мартенситоподобные превращения встречаются во многих
других сплавах.
2.4. РАВНОВЕСИЕ МЕЖДУ ТВЕРДОЙ ФАЗОЙ
И ЖИДКОСТЬЮ В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ
При росте по реакциям жидкость — твердая фаза важной
характеристикой равновесия фаз является зависимость темпера-
туры плавления от давления. При плавлении производная
dp/dT есть положительная величина при положительном значе-
нии AV и отрицательная при отрицательном значении AV. Для
процесса плавления AS есть величина положительная, и, как сле-
дует из равенства (2.2), теплота плавления А/7 также положи-
тельна. Таким образом, плавление представляет собой эндотер-
мический процесс.
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
61
При равновесии ДО = 0; поэтому из уравнения (2.2) полу-
чаем
т — А7У
7 Рави — Д5 »
(2.15)
где Грани — температура плавления. Поскольку как Д//, так и ДЗ
суть однозначные функции температуры, при постоянном давле-
нии есть только одна температура плавления, при которой бу-
дет удовлетворяться уравнение (2.15); следовательно, темпера-
тура плавления (или равновесная температура для любого
другого фазового перехода первого рода1) будет строго опреде-
ленной величиной для любого данного давления.
Если из 1 грамм-атома вещества его доля а существует
в виде фазы 1, а остальная доля (1 — а) —в виде фазы 2, то
G = aG{ + (1 —- a) G2. (2.16)
Общая свободная энергия G достигнет максимального значения
при а = 1, если Gj > G2 (Gj и G2 суть удельные свободные энер-
гии фаз 1 и 2), и при а = 0, если Gi < G2. Энергия G не зависит
от доли а, если G\ = G2 (это другой способ выражения того хо-
рошо известного факта, что равновесие не зависит от количе-
ства двух присутствующих фаз). Изложенное выше справедливо
для всех фазовых переходов первого рода. В случае равновесия
между твердой фазой и жидкостью это означает сохранение по-
стоянной температуры плавления все время, пока существуют
обе фазы.
Нельзя твердую поверхность нагреть до температур выше
температуры плавления вещества {перегрев) без расплавления,
но сравнительно легко довести чистую жидкость без затвердева-
ния до температур гораздо ниже температуры затвердевания
{переохлаждение). Однако при наличии затравки уже очень
незначительное переохлаждение вызывает рост. В действитель-
ности к переохлаждению и прибегают при выращивании кристал-
лов. Об экспериментальном определении температур плавления
говорится в монографии [5].
9 Фазовый переход первого рода — это переход, сопровождающийся
скачкообразным изменением свободной энергии в зависимости от Т или р
при температуре или давлении такого превращения. Это означает, что при
наличии скачкообразного изменения термодинамических функций (SG/ST) р==
= —S, (<5G/6p)t = V или 6(б/Т)/6(1/Г) = Н фазовый переход будет пере-
ходом первого рода. Обычно при таких фазовых переходах первого рода,
как плавление, испарение и обратимые полиморфные превращения, термо-
динамические функции S, V и Н претерпевают скачкообразное изменение
при температуре перехода. Фазовому превращению отвечают изменения эн-
тропии и объема и теплота перехода. Если при переходе скачкообразно ме-
няются вторые производные свободной энергии, то такой переход относят к
переходам второго рода. Примером может служить переход из парамагнит-
ного состояния в ферромагнитное.
62
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
2.5. КОЭФФИЦИЕНТ РАСПРЕДЕЛЕНИЯ
Еще одной важной стороной равновесности при выращивании
кристаллов по механизму жидкость — твердая фаза является
растворимость следовых количеств примесей или активаторов в
твердой фазе. В данном разделе речь пойдет о важной количе-
ственной характеристике, каковой служит коэффициент распре-
деления, или коэффициент разделения. Как уже отмечалось, в
процессе роста в идеальной однокомпонентной системе не может
быть ни примесей, ни активаторов. Не исключено, что вопрос о
коэффициенте распределения нам следовало бы отложить до
тех пор, пока речь не зайдет о росте в многокомпонентных систе-
мах. Но при значительном содержании других компонентов в
системе ростовые проблемы предстают в совершенно ином свете,
чем при наличии в ней только следовых количеств примесей.
Поэтому «следовую» ситуацию целесообразно рассмотреть как
составную часть однокомпонентного роста. Не ясно, где проходит
граница между одно- и многокомпонентным ростом по концен-
трации второго компонента. Но ясно, что рост из раствора,
когда кристалл является растворимым веществом, а мольная
доля растворителя выше мольной доли растворенного вещества,
относится к выращиванию из многокомпонентной системы. Даже
понятия растворитель и растворенное вещество часто употреб-
ляются совершенно произвольно, причем более легкоплавкий ма-
териал обычно считается растворителем. Мы же станем посту-
пать логичнее, считая растворимым веществом тот материал,
мольное содержание которого в системе меньше. Во многих слу-
чаях это будет устойчивая твердая фаза. Если отвлечься от кон-
центрационного переохлаждения !), то концентрацию других ком-
понентов в такой системе можно будет полагать достаточно ма-
лой и позволяющей считать ее однокомпонентной.
При подобных обстоятельствах можно полагать, что раство-
римость присутствующего в следовом количестве второго компо-
нента в твердой фазе дается уравнением
д, _ as (равп)
/<0 — >
а1 (равн)
где k0 — коэффициент равновесного распределения, или коэффи-
циент разделения, для данного материала (второго компонента),
а/(рапн) — его равновесная активность в жидкой фазе и отрави) —
его равновесная активность в твердой фазе. Таким образом, ko
есть не что иное, как константа разделения при селективной
экстракции или константа обыкновенного равновесия, когда речь
*) Концентрационное переохлаждение рассматривается в разд. 3.12 на*,
стоящей книги.
1 РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
63
идет о таком равновесии:
вещество в растворе в жидком состоянии (ai)
вещество в растворе в твердом состоянии (as). (2.18)
Разбавленные растворы достаточно близки к идеальным, что
позволяет определить kQ в виде
ао=££(рав н) , (219)
(равн)
где С5(Равн) и С;(равн) — равновесные концентрации, т. е. концен-
трации на границе раздела твердая фаза/жидкость’)• Коэффи-
циент распределения /г0 можно определить также через соответ-
ствующие мольные доли Хфавн) и А^равн). Чтобы величина k0 при-
няла равновесное значение, необходимо, чтобы не было ни роста
кристалла, ни его растворения. Обычно при малых скоростях ро-
ста &о ~ £эфф, где йЭфф — эффективный коэффициент распределе-
ния, выражаемый в виде
*.ФФ = -§^. (2.20)
(ист)
Здесь С8(ист) и С((ИСт) суть истинные концентрации в двух фазах.
Сцист) есть концентрация в объеме жидкой фазы на достаточ-
ном удалении от растущей поверхности кристалла, где можно
9 Здесь предполагается, что при низких скоростях, когда концентрация
в объеме жидкой фазы равна концентрации у растущей грани, состояние
системы лучше всего описывается посредством равновесной константы рас-
пределения k0. Этой константой можно пользоваться и при более высоких
скоростях, когда концентрация в объеме жидкой фазы уже не равна кон-
центрации на границе раздела фаз, если только в определении (2.19) кон-
центрацию С/(равн) заменить истинной концентрацией в жидкой фазе у фрон-
та кристаллизации, обозначаемой через С^ист.ф к).
Трудность заключается в том, что данных о С\ист.ф. к)почти никогда не
имеется. К тому же адсорбция и хемосорбция примесей на растущей поверх-
ности кристалла создают дополнительные трудности. Например, считают, что
несколько неодинаковый «захват» примесей различными гранями даже при
низких скоростях обусловлен разной концентрацией адсорбированных при-
месей на этих гранях. Холл [6] предположил, что кристалл растет в резуль-
тате быстрого распространения моноатомных слоев, захватывающих атомы
адсорбированной примеси, которым неизбежно приходится диффундировать
обратно к новой поверхности раздела. Согласно этой точке зрения, для до-
стижения истинного равновесия требуются столь низкие скорости, чтобы
диффузия в твердой фазе успевала выравнивать в ней концентрационные
градиенты. Чернов [7] провел более строгий анализ движения ступени и за-
хвата примеси, рассмотрев диффузию захваченной примеси через новый слой
как в жидкость, так и в твердую фазу. Каррузерс [8], учтя синусоидальные
колебания скорости роста и явления адсорбции, предложил модель, объяс-
няющую полосчатое распределение фосфора в кристаллах кремния, выращен-
ных по методу Чохральского.
64
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
пренебречь концентрационными градиентами. Коэффициент 6Эфф
зависит от скорости роста, коэффициента диффузии данного мате-
риала в расплаве и ширины диффузионного слоя. Если k^> 1,
то Сз(равн) > так что концентрация примеси или актива-
тора близко к растущему кристаллу бывает меньше. Таким об-
разом, общая масса расплава или раствора будет богаче при-
месью или активатором, чем примыкающая к растущему кри-
сталлу область. В этих условиях примесь или активатор станет
диффундировать к кристаллу. И наоборот, если 60< 1, примесь
или активатор будет диффундировать от растущего кристалла.
Для идеальных или почти идеальных растворов уравнение (2.19)
будет справедливо даже тогда, когда в растворе существуют кон-
центрационные градиенты; в этом случае С\равн) в уравнении
(2.19) надо заменить концентрацией непосредственно перед
фронтом роста. Поскольку концентрацию вблизи растущего кри-
сталла определить трудно, часто удобнее пользоваться уравне-
нием (2.20). Надо подчеркнуть, что 6Эфф-*&о, когда С/(Ист)->
->С/(равн) (потому ЧТО В боЛЫПИНСТВе случаев Cs(Hct) ~ С^равн)),
т. е. когда концентрация в объеме жидкости равна концентрации
в жидкости у поверхности раздела. Толщина диффузионного
слоя зависит от вязкости расплава и скорости перемешивания;
следовательно, и &Эфф будет зависеть от скорости перемешивания
(речь об этом еще пойдет в гл. 3). Скорость кристаллизации за-
висит еще и от кристаллографического направления,, если по-
верхностная свободная энергия зависит от ориентации (см.
разд. 3.3). Когда скорость роста ограничивается диффузией
(подробнее об этом говорится в разд. 3.3), концентрационный
профиль поперек диффузионного слоя и толщина последнего
различны для граней, растущих с неодинаковыми скоростями.
Таким образом, концентрации С(ИСт-ф. к) для граней разной ори-
ентации неодинаковы, а коэффициент 6Эфф зависит от кристалло-
графической ориентации1). Систему можно считать достаточно
близкой к равновесной, а коэффициент 6Эфф равным kQ, если из-
меренное значение k не зависит от интенсивности перемешива-
ния, кристаллографического направления и скорости роста. Уди-
вительно, что именно такая картина наблюдается во многих си-
стемах даже при довольно больших скоростях кристаллического
роста.
Величина k0 может сильно зависеть от концентрации других
примесей в системе. Примесь или активатор может входить в ре-
шетку путем замещения или внедрения. В первом случае при-
месь по ионному или атомному радиусу должна быть близкой
4) Адсорбция тоже способна определенным образом повлиять на зави-
симость £0фф от направления.
5. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
65
к замещаемому элементу. Если примесный атом отличается по
радиусу от атома решетки не более чем на ±15%, то замещение
протекает довольно легко, а при условии равенства зарядов у за-
мещающего атома и атома решетки коэффициент k0 часто близок
к единице. Замещение затрудняется, если заряды неодинаковы.
В работе Нассау и Лойяконо [9] по коэффициентам распределе-
ния редкоземельных металлов в CaW04 обсуждаются эффекты,
которые, по-видимому, можно считать типичными для ионных
решеток. Если Са2+ замещается двухвалентным положительным
катионом, то общая электронейтральность сохраняется. Однако
при атомной концентрации Nd3+ в расплаве 1—2% коэффициент
распределения Nd3+ в CaWO4 равен 0,28. Соединение, образую-
щееся при введении Nd3+, имеет формулу Са,+3x/2Nd3+<I)x/2(WO4)
где Ф — вакансия Са. Образование вакансий Са энергетически
невыгодно, вследствие чего коэффициент ko для неодима мал,
хотя радиус Nd3+ (1,04-10“10 м) близок к радиусу Са2+ (0,99X
X Ю“10 м). Коэффициент распределения значительно возрастает,
если заряд компенсируется не путем образования вакансии1), а
посредством добавления однозарядного положительного иона.
Если в расплав ввести одновременно ионы Nd3+ и Na+,
то образующийся при этом кристалл отвечает формуле
Ca(i_2a:)NdxNaxWO4. В подобных случаях при атомной концентра-
ции Na+ в расплаве 15% коэффициент k0 для Nd3+ равен 0,8.
Как показано на фиг. 2.2, коэффициент ko для Nd3+ сильно зави-
сит от радиуса и концентрации компенсирующего катиона с ва-
лентностью 4-1- Легко видеть, что максимальный эффект дости-
гается в случае наибольшей близости ионных радиусов компен-
сирующих ионов и Са2+. Подобным образом коэффициент ko для
Na+ или любого другого одновалентного положительного иона за-
висит от размера, заряда и концентрации компенсируемого ка-
тиона, например Nd3+. В таких относительно сложных решетках,
как CaWO4, компенсации заряда можно добиться различными
путями. Например, при активации ионами Nd3+ можно добавлять
ионы Nb5+. В этом случае формулу образующегося при замеще-
нии кристалла можно записать в виде Ca(1_X)NdxW(i_x)NbxO4, по-
тому что происходит одновременное замещение ионов W6+ иона-
ми Nb6+ и ионов Са2+ ионами Nd3+. Коэффициент распределения
для Nd3+ опять будет зависеть от размера, заряда и концентра-
ции пятивалентных катионов Nb5+, компенсирующих избыточный
заряд Nd3+ замещением ионов W6+. Точно так же и для Nb5+
!) Все еще, разумеется, должна существовать конечная концентрация
вакансий, которую можно вычислить рассмотренными в гл. 1 методами, но
Даже при температуре плавления она будет незначительной по сравнению с
Ф при умеренных концентрациях Nd3+ в отсутствие однозарядных катионов.
ее
Р. ЛОДИЗ, РОСТ МОНОКРИСТАЛЛОВ
коэффициент ко будет зависеть от размера, заряда и концентрации
ионов, компенсирующих заряд Nd3+ путем замещения ионов Са2+.
Несколько иная ситуация складывается тогда, когда актива-
тор или примесь занимает в решетке междоузельные положения.
Примером структуры, в которой некоторые ионы могут разме-
щаться в междоузлиях, служит а-кварц. В его структуре имеют-
0,9
Атомная концентрация ионов щелочного металла
в расплаве, %
Фиг. 2.2. Коэффициент равновесного распределения kQ ионов Nd3+ в CaWO4
в зависимости от концентрации компенсирующих ионов щелочных металлов
при атомной концентрации Nd3+ в расплаве 1—2% (цифрами у кривых
указана разница между ионными радиусами Са2+ и компенсирующих ионов) [9].
ся параллельные оси с спиральные каналы диаметром около
10“10 м, образованные структурными силикатными тетраэдрами.
Следовательно, ионы Li+, Na+, Mg2+ и Са2+ способны сравни-
тельно легко вмещаться в междоузлия решетки. Однако и для
всякого междоузельного атома необходима компенсация заряда.
Таким образом, если в решетку кварца входит Li+, то формулу
можно представить в виде Si(i— хм) ПхФхмОг, где Ф — вакансия
кремния. Следовательно, коэффициент ko для Li+ (радиусом
0,68-10"10 м) мал. Он больше для Na+, потому что ионный радиус
Na+ (0,94-10“10 м) ближе к размеру междоузельных «дыр» в ре-
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
67
шетке, тогда как для К+ коэффициент kQ меньше, поскольку его
радиус (1,33-10"10 м) плохо согласуется с размером пустот.
В структуру кварца способен входить алюминий, где он заме-
щает Si4+ (при определенных условиях ионы алюминия рас-
полагаются также в междоузлиях). Таким образом, если в
растворе, из которого выращивают кварц, присутствуют, напри-
мер, одновременно ионы А!3+ и Li+, то благодаря взаимной ком-
пенсации заряда коэффициенты й0 для них обоих станут больше.
Вопросы о коэффициентах распределения примесей для кварца
были рассмотрены Лодизом и др. [10].
В идеальной системе А—В при температурах близких к тем-
пературе плавления А, коэффициент &о(в), если концентрация
активатора или примеси В мала, связан с температурами плав-
ления компонентов А и В соотношением
/1 1 \
In (В) ~ р 1'т т/’ (2.21)
где АЯв — мольная теплота растворения В в А. Уравнение (2.21)
можно вывести как частный случай уравнения Вант-Гоффа [ура-
внения (2.32)], если предположить независимость А// от темпе-
ратуры. Такое предположение справедливо для температур,
близких к температуре плавления. В области применимости
уравнения (2.21) логарифм коэффициента распределения линей-
но зависит от величины, обратной абсолютной температуре, так
что А// можно вычислить по наклону кривой lg kQ в функции 1/Т.
С помощью некоторых приближений [11] уравнение (2.21) можно
представить в следующей более простой форме:
А7’ = (1 ^о) д/у Х1 (равн)* (2.22)
Здесь АТ есть понижение температуры затвердевания чистого
вещества, а Х/(Равп)—равновесная мольная доля растворенного
вещества в жидкой фазе. Уравнение (2.22) предполагает, что kQ
не зависит от концентрации и температуры; в противном случае
можно воспользоваться значением kQ) найденным экстраполяцией
к бесконечному разбавлению.
Термонд [11] показал, что уравнения (2.21) и (2.22), в кото-
рых фигурирует коэффициент kQ, справедливы не только в слу-
чае разбавленных идеальных жидких и твердых растворов, но
также и в случае, когда раствор неидеален, коэффициент рас-
пределения мал, а энтальпия и избыток энтропии раствора не
зависят от температуры.
Дополнительно коэффициент распределения в неравновесных
условиях рассматривается в гл. 3 после обсуждения кинетики
роста кристаллов.
68
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
2.6. ДИАГРАММЫ СОСТОЯНИЯ И ПРАВИЛО ФАЗ
Коэффициенты распределения и многие другие фазовые со-
отношения удобно представлять графически, в виде диаграмм
состояния. Разумеется, диаграммы состояния и правило фаз
применимы только к системам в состоянии равновесия. В данном
разделе рассматриваются общие положения, касающиеся пра-
вила фаз и диаграмм состояния. Систему называют гомогенной,
если все макроскопические части системы имеют одни и те же
химические и физические свойства. Примерами могут служить
кристаллическое твердое тело, жидкость, газ или смесь газов.
В гетерогенной системе физические свойства и состав различны
в разных макроскопических участках. Примеры гетерогенных
систем — твердое вещество в равновесии со своим расплавом,
насыщенный раствор в присутствии избытка растворенного ве-
щества, две несмешивающиеся жидкости или жидкость в равно-
весии со своим паром.
Под фазой понимают часть системы, гомогенную на всем
своем протяжении и физически отделенную от других фаз чет-
кими границами. Число компонентов системы — это минимальное
число химических составляющих, которое нужно выделить для
описания состава всех присутствующих фаз. На фиг. 2.3 показан
пример простой диаграммы состояния, или графического изобра-
жения равновесных соотношений между различными фазами и
определенными интенсивными переменными, такими, как состав,
температура и давление. Интенсивная переменная — это пере-
менная, не зависящая от количества присутствующей фазы, тогда
как экстенсивная переменная (например, масса) зависит от ко-
личества вещества. На диаграмме фиг. 2.1 есть две фазы (алмаз
и графит), а число компонентов равно единице (углерод). Заме-
тим, что вдоль линии равновесия можно менять независимо
только одну переменную (либо давление, либо температуру) без
потери в системе той или иной фазы (незначительное уменьше-
ние количества фазы не означает потерю фазы). Таким образом,
система имеет одну степень свободы. Вдоль линии равновесия
систему определяет задание одной переменной. Гиббс вывел ко-
личественное соотношение, называемое правилом фаз, которое
выражает связь между числом степеней свободы в равновесии F,
числом компонентов С и числом фаз Р в виде
F = C — P-\-2. (2.23)
Это соотношение соблюдается, когда в качестве интенсивных
переменных выбраны давление, температура и состав. Если вы-
браны другие переменные, такие, как магнитное, электрическое
или гравитационное поле, то к числу 2 нужно прибавить число
вновь введенных переменных.
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
69
О коэффициентах распределения можно судить по полной
диаграмме состояния для бинарной системы соответствующих
компонентов. Различные фазовые соотношения, которые могут
Фиг. 2.3. Диаграммы состояния двойных систем.
существовать между двумя компонентами А и В, иллюстрируют-
ся на фиг. 2.3. Кривая ликвидуса на фиг. 2.3, а дает темпера-
туру, при которой начинается затвердевание расплава, в зависи-
мости от состава, тогда как кривая солидуса характеризует
температуру, при которой начинается в зависимости от состава
плавление твердой фазы. Горизонтали /—2 и 3—4 представляют
собой линии связи жидкости данного состава с находящейся
70
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
с ней в равновесии твердой фазой того же состава. На фиг. 2.3, а
компоненты Л и В полностью растворимы друг в друге как в
твердом, так и в жидком состоянии. При затвердевании твердая
фаза стремится оттеснить более легкоплавкий компонент В, т. е.
в данном случае к^В) < 1, а £0(а) > 1. Фазовые соотношения, по-
казанные на фиг. 2.3, а, типичны для изоструктурных соедине-
ний, атомы которых характеризуются близкими размерами. Та-
кие соединения называются изоморфными.
На фиг. 2.3,6 охарактеризованы фазовые соотношения, когда
Л и В не полностью смешиваются друг с другом в твердом со-
стоянии. Для концентраций от чистого Л до концентрации, соот-
ветствующей точке 2, устойчивой фазой является твердый рас-
твор В в Л. Ликвидус 1—2 и солидус 1—3 сохраняют те же зна-
чения, что и прежде. При концентрациях В между точкой 2 и
чистым компонентом В устойчив твердый раствор Л в В. Соли-
дусом и ликвидусом соответственно будут линии 4—5 и 2—5.
Линии 3—6 и 4—7 суть кривые экстракции. Это означает, напри-
мер, что линия 3—6 характеризует растворимость В в твердом
компоненте Л, причем ниже линии 3—6 компонент В выпадает
в твердом состоянии из твердого раствора. Точка 2, называемая
эвтектической точкой, характеризует температуру и состав, при
которых оба компонента А и В находятся в равновесии с распла-
вом. Расплав эвтектического состава 2 при затвердевании дает
непосредственно твердую эвтектику того же состава. Если об-
ласть твердых растворов узка, линия ликвидуса сливается с ли-
нией солидуса, как показано на фиг. 2.3, в. Поведение, аналогич-
ное показанному на фиг. 2.3,6, будет наблюдаться, когда компо-
ненты Л и В незначительно различаются по структуре и имеют
почти одинаковые ионные радиусы; если же компоненты Л и В
сильно отличаются друг от друга, то можно ожидать фазовых
соотношений, показанных на фиг. 2.3, в.
Хотя фазовые соотношения на диаграмме фиг. 2.3, г характе-
ризуют образование соединения АВ, легко видеть, что в этих
условиях систему Л—В можно представить как совокупность
двух подсистем А—АВ и АВ—В, в которых возможно образова-
ние эвтектик. Таким образом, каждая из подсистем на фиг. 2.3, г
подобна системе на фиг. 2.3,6. В некоторых случаях температура
плавления соединения, образовавшегося согласно диаграмме
фиг. 2.3, г, может превышать температуры плавления обоих ком-
понентов Л и В. Говорят, что соединение АВ плавится конгру-
энтно; это означает, что твердая фаза АВ находится в равнове-
сии с расплавом одинакового состава.
На фиг. 2.3,6 иллюстрируется инконгруэнтное плавление сое-
динения АВ. Оно плавится при температуре !) с образованием
4) Инвариантная точка, температура которой Ti и состав / характери-
зуют перитектику.
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
71
твердой фазы компонента В и расплава, состав которого по сра-
внению с АВ богаче компонентом А. Соединение АВ может кри-
сталлизоваться только в области 1—2 из расплава, который бо-
гаче состава АВ по компоненту А. Диаграмма на фиг. 2.3, д
предполагает отсутствие твердого раствора; ясно, что в случае
образования твердого раствора эта диаграмма должна стать
аналогичной диаграммам на фиг. 2.3,6 Е' г.
Когда мы рассматриваем коэффициенты распределения в
практически однокомпонентных системах с малыми концентра-
циями дополнительных компонентов, мы не выходим за пределы
областей, по концентрации близких к Л, В или АВ в чистом виде.
Коэффициент распределения можно определить из диаграммы
состояния, а саму диаграмму иногда можно построить на основе
термодинамических данных, если таковые имеются.
Для дальнейшего изучения диаграмм состояния читателю ре-
комендуется обратиться к стандартным пособиям [1, 12, 13];
тройные системы рассмотрены Мазингом [14]1).
2.7. КОНСЕРВАТИВНЫЕ ПРОЦЕССЫ
Концентрация примеси или активатора сильно зависит от
того, как протекает затвердевание в процессе выращивания кри-
сталла из жидкой фазы. Рост кристалла называют консерватив-
ным, если общее количество материала в двух фазах (жидкой и
твердой) остается постоянным, т. е. материал не добавляется
извне и не удаляется из той или другой фазы [11]. Примером мо-
гут служить многие процессы нормальной кристаллизации2) [15].
При нормальной кристаллизации посредством консервативного
процесса в начальный период роста весь материал представляет
собой жидкую фазу и твердая фаза кристаллизуется из жидко-
сти на определенной поверхности в пересыщенном растворе.
В итоге граница раздела между твердой и жидкой фазами пере-
мещается через расплав контролируемым образом. В таких
’) Обзор по вопросу применения диаграмм состояния при выращивании
кристаллов дан в работе [23].
2) Мы ограничим понятие «нормальной кристаллизации» ростом из си-
стемы жидкость — твердая фаза, в которой через расплав движется един-
ственная граница раздела между жидкой и твердой фазами. Все способы
нормальной кристаллизации относятся к неконсервативным процессам. На-
пример, в процессе роста может происходить испарение. И наоборот, все
процессы консервативного роста не относятся к способам нормальной кри-
сталлизации. Расплав можно охлаждать в условиях такого нерегулярного
температурного профиля, что зародышеобразование будет происходить одно-
временно во многих местах. Тогда поликристаллическая масса образуется в
консервативных условиях, но не путем нормальной кристаллизации. Подоб-
ным же образом неконсервативный рост может происходить как в условиях
нормальной кристаллизации, так и без нее.
72
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
условиях сравнительно легко предвидеть распределение приме-
си или активатора.
При нормальной кристаллизации рост в идеале инициируется
в единственном месте расплава путем его более сильного охлаж-
дения в этом месте по сравнению с любой другой областью. За-
рождение в этой начальной точке дает кристалл, на котором
о ъ
<z>
_________
д
I \Жидкостъ
Твердая
фаза
Фиг. 2.4. Консервативные процессы выращивания кристаллов.
происходит все последующее наращивание. Обычное устройство
для такого выращивания представляет собой тигель с кониче-
ским дном. В тигель помещают расплав и опускают его через
зону с температурным градиентом так, чтобы затвердевание на-
чалось в самой вершине конуса (фиг. 2.4, а). Затем по мере опу-
скания тигля граница раздела между твердой и жидкой фа-
зами перемещается через расплав. Обычно у оконечности тигля
зарождается один кристалл. Если же образуется несколько заро-
дышей, то в дальнейшем на поверхности раздела доминирует
кристалл, растущий быстрее всех других. В некоторых случаях
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
73
перед началом роста на дно тигля помещают затравку. В этом
случае необходима осторожность, чтобы не расплавить затравку
до того, как начнется рост. Этот метод обычно называют мето-
дом Бриджмена — Стокбаргера. В одном из вариантов этого ме-
тода вдоль тигля создают такой температурный градиент, чтобы
дно тигля находилось в самом холодном месте, а весь объем
расплава оставался при температуре выше температуры плавле-
ния. Затем температуру всего тигля понижают при одновремен-
ном поддержании градиента, что инициирует рост в конической
части тигля, распространяющийся затем на весь тигель. Другой
консервативный процесс — выращивание кристаллов вытягива-
нием по методу Чохральского (фиг. 2.4,6). Сначала весь мате-
риал находится в тигле в расплавленном состоянии. Тепловой
режим подбирают таким образом, чтобы расплав находился
практически в изотермических1) условиях с очень небольшим
отрицательным градиентом над расплавом. Затем в расплав вво-
дят затравку так, чтобы она слегка касалась расплава и распла-
вилась на небольшом участке в целях сохранения поверхности
кристалла чистой и подавления паразитных зародышей. После
этого затравку начинают медленно вытягивать из расплава. Если
подобрать подходящий температурный профиль и должную ско-
рость вытягивания, то граница раздела между твердой и жидкой
фазами установится немного выше уровня расплава, потому что
поверхностное натяжение станет поддерживать маленький стол-
бик жидкости над расплавом. В некоторых случаях температур-
ный профиль устанавливают так, чтобы кристалл рос непосред-
ственно на поверхности расплава или даже несколько ниже его
уровня. По мере роста затравку медленно вытягивают (часто —
вращая ее при этом).
В другом варианте консервативного выращивания посред-
ством нормальной кристаллизации затравку погружают в тигель
(фиг. 2.4, в), создавая при этом такой температурный профиль
(часто охлаждением затравки через держатель), чтобы рост про-
исходил только на поверхности раздела затравка — расплав.
Весь расплав охлаждается с сохранением температурного гра-
диента, показанного на фиг. 2.4, в. При благоприятных условиях
почти весь расплав можно высадить на затравке в виде моно-
кристалла. Этот способ называют методом Киропулоса.
Обычный способ кристаллизации слитков (фиг. 2.4, г) также
можно считать процессом консервативного роста посредством
нормальной кристаллизации. Теплота отводится через стенки
4) Рассматриваемые в связи с фиг. 2.4 температурные профили идеали-
зированы. Как выяснится дальше, многие тонкие и важные стороны про-
цессов выращивания зависят от особенностей температурного профиля. Де-
тали ростовых методик и соответствующие источники указываются в после-
дующих главах.
74
Р. ЛОДИЗ. РОСТ монокристаллов
изложницы, благодаря чему на них и начинается зародышеобра-
зование. Хотя обычно слиток не бывает монокристальным, в бла-
гоприятных условиях через весь расплав проходит единственный
фронт затвердевания.
Консервативный рост посредством кристаллизации, которая
не относится к нормальной, иллюстрируется на фиг. 2.4, д. Из-за
нерегулярной формы температурного профиля рост в данном
случае инициируется во многих точках, так что кристаллизация
происходит на многих поверхностях раздела между двумя фа-
зами.
Во всех консервативных процессах выращивания кристалла,
когда условия обеспечивают равновесное распределение примеси,
это распределение удовлетворяет следующему дифференциаль-
ному уравнению [11]:
d In Xi , «
d In k
(2.24)
Здесь Xi есть атомная доля примеси или активатора в жидкой
фазе, Ni — общее количество примеси в жидкой фазе, a kQ — ко-
эффициент равновесного распределения примеси или активатора,
когда концентрации выражены через атомные доли.
Это уравнение справедливо для всех процессов консерватив-
ного роста кристаллов, но им трудно пользоваться, когда про-
цесс не относится к случаям нормальной кристаллизации. Для
подобного процесса обычно нет данных о доле расплава, все еще
остающегося в жидком состоянии к моменту затвердевания дан-
ного участка расплава. Долю закристаллизовавшегося расплава
при затвердевании данного участка трудно определить даже в
случае нормальной кристаллизации по способу Киропулоса или
при отливке слитков. Уравнением (2.24) проще всего пользо-
ваться при выращивании кристаллов методами Бриджмена —
Стокбаргера и Чохральского, потому что тогда в процессе роста
легко определить в любое время долю затвердевшего вещества
из простых геометрических соображений. На фиг. 2.5 иллюстри-
руется распределение примеси в твердой фазе при консерва-
тивной кристаллизации в зависимости от доли закристаллизовав-
шегося вещества для разных значений £Эфф [16].
График фиг. 2.5 построен по соотношению
Cs = ktiCQl(l-g)k°-\ (2.25)
которое справедливо, когда &Эфф « *)*> здесь Cs — концентрация
примеси в твердой фазе, COz— исходная концентрация в жидкой
!) Это выражение эквивалентно допущению, что при данной скорости
роста обеспечивается полное перемешивание в жидкой фазе и что диффузией
в твердом состоянии можно пренебречь [15].
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
75
фазе, a g — доля затвердевшего расплава. Соотношение (2.26)
в той или иной форме выводилось различными авторами [15]; оно
дает решение дифференциального уравнения (5.24) в предполо-
Фиг. 2.5. Концентрация примеси в твердой фазе при консервативном росте
как функция доли закристаллизовавшегося расплава [15].
концентрациями. Как показано ниже, это распределение примеси
в корне отлично от распределения, наблюдающегося при некон-
сервативных процессах.
При том или ином консервативном процессе содержание при-
месей можно контролировать, отрезая загрязненный участок
кристалла, переплавляя оставшуюся чистую часть и вновь
76
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
подвергая ее перекристаллизации. Подобным неоднократным
удалением грязных концов можно получать весьма чистые мате-
риалы или добиться какого-то особого распределения примеси.
Главный недостаток такого процесса — неэкономное расходова-
ние материала, поскольку всякий раз приходится отрезать и пу-
скать в отбросы загрязненный конец кристалла или его часть
с нежелательным распределением примеси.
2.8. НЕКОНСЕРВАТИВНЫЕ ПРОЦЕССЫ
В неконсервативных процессах материал можно вводить в
расплавленную зону или выводить из нее посредством любого
процесса, кроме кристаллизации [11]. Один из путей, посредством
которого система перестает быть консервативной, состоит в уле-
тучивании паров. Все твердые и жидкие тела характеризуются
равновесным давлением паров. Но когда давление низкое или
когда система относится к закрытым, так что испарение сравни-
тельно небольшого количества вещества приводит к установле-
нию равновесного давления пара, рост кристалла становится
консервативным по отношению к улетучиванию. Рост будет кон-
сервативным по отношению к улетучиванию паров и в том слу-
чае, когда приняты те или иные меры для поддержания равно-
весного давления пара за счет какого-то источника, каким не
может быть ни расплав, из которого растет кристалл, ни сам та-
кой кристалл. Обычный способ ведения неконсервативного про-
цесса роста заключается в том, что вводимое вещество распла-
вляют в зоне плавления в процессе кристаллизации.
Примером особенно мощного неконсервативного процесса, ис-
пользуемого для очистки и выращивания монокристаллов, служит
зонная плавка, изобретенная Пфанном [16]. При горизонталь-
ной зонной плавке материал находится в лодочке, как показано
на фиг. 2.6, а, где поддерживают такой температурный про-
филь, чтобы создать узкую расплавленную зону. Эту зону до-
вольно медленно перемещают вдоль лодочки, чтобы осуществить
очистку от примеси или в отдельных случаях гомогенизировать
состав. К зонной плавке часто прибегают и для выращивания
монокристаллов. Если требуется дальнейшая очистка, то рас-
плавленную зону возобновляют на переднем конце лодочки и
процесс повторяют (делают еще один проход). Можно произве-
сти затравливание, поместив затравку в переднюю часть лодочки
и образуя зону таким образом, чтобы не расплавить затравку
полностью.
Подлежащий перекристаллизации слиток можно расположить
и вертикально (фиг. 2.6,6). Такой метод плавающей зоны [17—
20] не требует тигля для расплава, что устраняет возможность
попадания из него загрязнений в расплав. Расплавленная зона,
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
77
которую обычно создают посредством индуктора или лучевого
нагрева, удерживается на месте силами поверхностного натяже-
ния. Не обязательно, чтобы подлежащий перекристаллизации
слиток имел такой же диаметр, как и выращиваемый кристалл.
Если расплавленная зона удерживается стационарно на одном
месте, а плавящийся подлежащий перекристаллизации слиток
«подают» в нее, в то время как растущий кристалл вытягивают
Фиг. 2.6. Неконсервативные процессы выращивания кристаллов*
из нее, то диаметр кристалла будет зависеть от отношения ско-
ростей подачи и вытягивания. Этот способ выращивания назы-
вают методом наращивания пьедестала или методом выталкива-
ния кристалла. Его можно считать вариантом метода вытягива-
ния или метода плавающей зоны. На фиг. 2.6, в показана одна из
разновидностей данного метода.
На фиг. 2.6, г иллюстрируется процесс выращивания кристал-
лов расплавлением в пламени (метод Вернейля). При этом спо-
собе выращивания на поверхности затравки с помощью пламени,
плазмы или сфокусированного излучения от мощного источника
света создается наплыв расплава, удерживаемый на месте по-
верхностным натяжением. В него подсыпают порошковый мате-
риал или добавляют расплавленные капельки. Если источником
78
Р. ЛОДИЗ. РОСТ монокристаллов
нагрева служит пламя, то порошок подают в пламя через трубки
с газом. К газу можно добавлять летучие соединения нужного
вещества, которые, взаимодействуя с пламенем, образуют рас-
плавленные капельки. Во всех случаях затравку вытягивают
Фиг. 2.7. Распределение примеси в твердой фазе при неконсервативной
кристаллизации по методу зонной плавки по длине перекристаллизованного
образца L, выраженной в длинах зоны I для различных значений &Эфф [15].
с такой скоростью, чтобы сохранять постоянными величину и
положение наплыва.
Дифференциальное уравнение, которое описывает распреде-
ление примеси, возникающее при неконсервативном росте из
жидкой фазы, записывается в виде
in X/ . X sm Xsf dNSm
dAnNi ‘ dNT
(2.26)
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
79
где Х8т — мольная доля примеси в расплавленном твердом веще-
стве на плавящейся границе раздела между жидкой и твердой
фазами, XSf — мольная доля примеси в кристаллизующейся твер-
дой фазе на фронте кристаллизации, Ni — общее число молей
компонентов в жидкой фазе, Nsm — общее число молей компо-
нентов в плавящейся твердой фазе [11].
В особом случае зонной плавки, когда выращенный кри-
сталл и плавящийся слиток имеют одинаковый диаметр, кон-
центрация примеси Cs в любой точке слитка после зонного ра-
финирования выражается в виде [15]
Cs = Co(s)[l-(l-^o)^(L/Z)L (2.27)
где Co(s) — исходная концентрация в стержне; L — расстояние,
пройденное зоной, / — ее длина. В уравнении (2.27) предпола-
гается, что жидкость и твердая фаза имеют одинаковую плот-
ность1). На фиг. 2.7 [15] показано распределение примеси, кото-
рое следует из соотношения (2.27) для разных значений 6эфф и
которое справедливо при условии ^эфф — ^о2). На фиг. 2.8 [15]
иллюстрируется влияние последовательных проходов на распре-
деление примеси при зонной очистке при условии 6Эфф = 0,5 ~ kQ.
Распределение примеси после одного прохода будет таким же,
как при всяком другом неконсервативном процессе, в ходе кото-
рого остаются постоянными объем расплава, поперечное сечение
растущего кристалла и концентрация примеси в материале, ко-
торый переходит в расплавленную зону. Этим критериям обычно
удовлетворяют методы, показанные на фиг. 2.6. Распределение
примесей после последовательных проходов зоны (для = 0,5
оно показано на фиг. 2.8) должно удовлетворять уравнению
(2.27) и в том случае, когда объем расплава и поперечное сече-
ние кристалла остаются постоянными, а фигурирующая в этом'
уравнении концентрация примеси в твердой фазе определяется
предшествующей перекристаллизацией. Эти критерии выпол-
няются при всех методах, показанных на фиг. 2.6, кроме метода
Вернейля. В последнем случае требуется порошковая шихта, а
при измельчении выращенного кристалла имеющееся распреде-
ление примеси нарушается. На практике при методе Вернейля
требуется столь тонко размельченная шихта, что пригодными
оказываются лишь очень легкие порошки, полученные обжигом.
Из сравнения фиг. 2.5 с фиг. 2.7 легко видеть, что консерва-
тивные процессы по распределению примеси сильно отличаются
9 Пфанн [15] рассматривает условия применимости уравнения (2.27) в
случае неравенства плотностей твердой и жидкой фаз.
2) Это равноценно предположению о том, что скорость роста обеспечи-
вает полное смешивадие в жидкой фазе, а диффузия в твердом состоянии
пренебрежимо мала [15].
80
Р. ЛОДИЗ. РОСТ монокристаллов
от неконсервативных. Консервативная перекристаллизация дает
более низкую концентрацию примеси (при &эфф < 1) в большем
объеме кристалла, нежели тот или иной неконсервативный про-
цесс. Но если ставится задача проведения дальнейшей очистки,
Фиг. 2.8. Распределение примеси в твердой фазе при неконсервативной
кристаллизации по методу зонной плавки по длине перекристаллизованного
образца L, выраженной в длинах зоны /, для разного числа проходов п при
&эфф = [15].
то закристаллизовавшийся в последнюю очередь и потому паи-
более загрязненный конец кристалла (при £эфф < 1) приходится
перед новой перекристаллизацией отрезать и пускать в отходы.
Выращивание чистых кристаллов путем последовательного отре-
зания их концов с оттесненной примесью сопряжено с рядом за-
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
81
груднений и неэкономным расходованием материала, поскольку
исходная заготовка должна иметь гораздо большую величину,
чем требующийся кристалл. Преимущество неконсервативного
процесса (когда осуществим переплав) заключается в том, что
повторную перекристаллизацию легко осуществлять (например,
увеличением числа проходов при зонной очистке), добиваясь при
этом заметного повышения степени чистоты. В целях обеспече-
ния равномерности распределения примеси по большому объему
кристалла с успехом используется, например, неконсервативное
зонное выравнивание, рассматриваемое далее в разд. 5.5.
2.9. РАВНОВЕСИЕ МЕЖДУ ГАЗОМ И ТВЕРДОЙ ФАЗОЙ
В ОДНОКОМПОНЕНТНЫХ СИСТЕМАХ
Материал, выращиваемый в системе газ — твердое тело, дол-
жен обладать достаточно высоким давлением пара. Если давле-
ние пара недостаточно высоко, можно использовать комплексо-
образователи или другие реагенты для создания летучих соеди-
нений, при разложении которых образуется нужное вещество.
В таких случаях рост идет уже из многокомпонентной системы,
о чем речь пойдет несколько дальше. Для практического выра-
щивания из газовой фазы при температурах ниже температуры
плавления не требуется, чтобы давление было равно атмосфер-
ному. Процесс роста кристаллов называют сублимацией, если
в одной части системы испаряется твердый материал, а в другой
он конденсируется из газа. Не обязательно материал испарять из
твердого состояния. Например, в окрестности тройной точки1)
возможно испарение жидкой фазы с последующей быстрой кон-
денсацией пара и образованием твердой фазы в другой части
системы. Поскольку нас интересует рост кристаллов, ограничим-
ся анализом равновесия между газом и твердой фазой.
Давление пара связано с теплотой сублимации уравнением
Клаузиуса — Клайперона
d In р _
dr ~ RT2 ’
где Т — абсолютная температура, р — давление, Д/7 — теплота
сублимации, R — газовая постоянная. Это уравнение выведено
в предположении, что пар ведет себя как идеальный газ и что
мольный объем газа велик по сравнению с мольным объемом
твердого тела. Уравнением (2.28) описывается также давление
пара над жидкостью, если пар подчиняется законам идеального
газа и мольный объем пара намного больше, чем жидкости.
9 Тройная точка — инвариантная точка, характеризующаяся единствен-
ным давлением и единственной температурой, при которых в однокомпонент-
НОЙ системе сосуществуют твердая, жидкая и газообразная фазы,
82
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
2.10. РОСТ ИЗ РАСТВОРА
До настоящего времени при нашем рассмотрении различных
процессов мы придерживались того порядка, который был ука-
зан в изложенной в начале главы схеме их классификации.
Мы рассмотрели равновесия твердая фаза — твердая фаза,
жидкость — твердая фаза и газ — твердая фаза при выращива-
нии кристаллов из однокомпонентных систем. В только что упо-
мянутой схеме предполагается, что подобным же образом можно
описать и равновесия в многокомпонентных ростовых системах.
Последние в свою очередь естественным образом подразделяют-
ся независимо от агрегатного (будь то твердого жидкого или
Фиг. 2.9. Диаграмма состояния двойной системы с полем выращивания
из раствора.
газообразного) состояния среды на два других широких класса
систем роста: 1) из раствора и 2) посредством химического взаи-
модействия.
Поскольку условия равновесности зависят от принадлежно-
сти к тому или другому из этих двух классов в большей степени,
чем от природы среды, рассмотрим рост из многокомпонентных
систем в свете такого их деления.
При росте кристаллов из раствора самой важной равновес-
ной характеристикой надо считать растворимость. Если раство-
ренное вещество имеет умеренную концентрацию, если исполь-
зуется один растворитель, а концентрации других примесей или
активаторов малы1) и если, наконец, растворимость раствори-
теля в кристалле пренебрежимо мала, то мы в таком случае
имеем дело с тем полем двойной диаграммы состояния, которое
помечено на фиг. 2.9 буквами аир. Буквой А на этом графике
обозначен подлежащий выращиванию кристалл. Диаграмма
!) При таких условиях основная «примесь», конечно, — сам растворитель.
$, РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
83
Жидкость (раствор)* твердая фаза
(Область пересыщенных
растворов)
----Кривая
насыщения
Область ненасыщенных
растворов
Жидкость (раствор)
фиг. 2.9 построена в предположении, что Л и В не образуют ни-
каких соединений. Легко видеть, что диаграмма состояния
фиг. 2.9 подобна диаграмме фиг. 2.3, в, если не считать того, что
эвтектика теперь расположена ближе к В, что свидетельствует о
возможности существования разбавленных растворов, в которых
А будет устойчивой фазой. Если бы компоненты А и В образо-
вывали соединения или твердые растворы, то в таком случае
оказались бы уместными выводы, изложенные в связи с диа-
граммами фиг. 2.3,6 и г.
Типичная зависимость растворимости от температуры пред-
ставлена на фиг. 2.10, где аир имеют те же значения, что и
прежде. Кривая раствори-
мости дает концентрацию
насыщенного раствора,
т. е. раствора, находяще-
гося в равновесии с твер-
дой фазой, в зависимости
от температуры. Область
над этой кривой представ-
ляет собой область пере-
сыщенных растворов, т. е.
растворов с концентра-
циями растворенного ве-
щества выше равновес-
ной. Пересыщение As оп-
ределяется в виде разно-
сти С — SpaBH, где с —
истинная концентрация, а
<$равн — равновесная растворимость. Пересыщенные растворы не-
устойчивы, а когда пересыщение достаточно велико, растворен-
ное вещество осаждается или образует спонтанные зародыши в
растворе или на стенках контейнера. Если в раствор ввести ку-
сочек кристалла растворенного вещества {затравочный кри-
сталл), то даже при незначительном пересыщении избыток
растворенного вещества начнет осаждаться на нем, пока кон-
центрация не снизится до концентрации насыщения. Однако без
затравки чистые пересыщенные растворы, несмотря на их тер-
модинамическую неустойчивость, иногда способны сохраняться в
спокойном состоянии весьма длительное время.
Область под кривой растворимости на фиг. 2.10 характери-
зует ненасыщенный раствор, т. е. раствор с концентрациями ра-
створенного вещества меньше равновесной.
Процесс растворения твердого вещества А представляет со-
бой частный случай химического равновесия, описываемого
реакцией
^4$ * ^раствор (2.29)
t
1
Фиг. 2.10. Кривая изменения растворимос-
ти в зависимости от температуры.
с константой равновесия
1а]равн
fal$ (равн)
(2.30)
где [а]Равн есть равновесная активность в условиях насыщения
раствора, а [а]8(Равн)— равновесная активность твердой фазы.
Обычно выбирают стандартное состояние, чтобы активность
твердого вещества равнялась единице; тогда К = [л]равН. Кон-
центрацию можно выражать в разных единицах; удобства ради
выберем мольные доли, потому что в этом случае данное урав-
нение можно распространить на системы с несколькими компо-
нентами.
Активность компонента связана с его мольной долей со-
отношением
(2.31)
где и — коэффициент активности. Данный компонент подчиняет-
ся закону Рауля1), если коэффициент активности равен единице;
если коэффициент активности отличается от единицы, но остается
постоянным, то компонент подчиняется закону Генри. В идеаль-
ных растворах и растворитель, и растворенное вещество под-
чиняются закону Рауля. Энтальпия и объем раствора равны
сумме энтальпий и объемов растворителя и растворенного веще-
ства. Это означает, что теплота смешения и изменение объема
при растворении равны нулю. В то же время энтропия не равна
сумме энтропий компонентов, потому что энтропия возражает
из-за дополнительной неупорядоченности, возможной в ра-
створе2). В неидеальных разбавленных растворах растворенное
вещество подчиняется закону Генри, тогда как растворитель —
закону Рауля.
Компонент, мольная доля которого близка к единице, обычно
считают растворителем. В промежуточной области (область кон-
центрированных растворов) не соблюдаются ни закон Рауля, ни
закон Генри, а оценку коэффициента рч, обычно сильно завися-
щего от концентрации, производят по экспериментальным дан-
ным. К сожалению, многие растворы, применяемые для выращи-
вания кристаллов, достаточно концентрированы. Поэтому часто
рискованно проводить расчеты на основе предположения о сла-
бом взаимодействии между частицами растворенного вещества.
9 По закону Рауля р = роХ, где р —давление пара вещества над его
раствором; р0— давление пара чистого вещества; X — его мольная доля. По
закону Генри р = kX, где р — давление пара вещества над его раствором,
X — мольная доля вещества, k — постоянная.
2) Д8см = — R(Xa 1пХа + Хв 1пЛв), где ASCM — идеальная энтропия
смешения (в отсутствие взаимодействий растворитель — растворитель, рас-
творенное вещество — растворенное вещество или растворитель —растворен-
ное вещество), а Ха и Хв— мольные доли смешиваемых компонентов.
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
85
(2.33)
Такое взаимодействие явно должно играть большую роль, по-
тому что в растворе, предназначающемся для выращивания кри-
сталла, концентрация достаточно велика.
Температурная зависимость растворимости выражается урав-
нением Вант-Гоффа
dlnK _ ДЯ ,9Ч9ч
dT ~ RT2 ’
которое применительно к растворам преобразуется к виду
d In 1а]равн А
dT ~ RT2
где АЯа— изменение парциальной мольной энтальпии раство-
ренного вещества А в растворителе В. Изменение парциальной
мольной энтальпии есть изменение энтальпии, происходящее при
переходе одного моля чистого вещества А в раствор, объем кото-
рого настолько велик, что его концентрация при этом заметным
образом не отклоняется от насыщающей. В растворе, подчиняю-
щемся закону Рауля, вместо активности компонента А можно
подставить ХА*
При выращивании из раствора константа равновесия связана
с изменением стандартной свободной энергии в процессе роста
AG0 уравнением
AG°=--/?7Чп [а]равн, (2.34)
потому что
AG° = — RTlnK, (2.35)
где К есть величина, обратная К в уравнении (2.30) для роста,
поскольку
AG = AG° + /?TlnQ, (2.36)
где Q = [п]”^, AG представляет собой изменение свободной
энергии в процессе роста, [п]ист — истинная активность А в пере-
сыщенном растворе.
Изменение AG представляет собой движущую силу роста; его
можно выразить в виде
AG = RT In -^11рав" , (2.
1^1ист
где [п]Равп есть активность компонента А в насыщенном растворе,
а через [п]ИСт обозначена истинная активность компонента А.
Если коэффициент активности ц 1 или в интересующей нас об-
ласти ц не зависит от концентрации, то в уравнениях (2.33) и
(2.37) активности можно заменить мольными долями. Таким
образом, отношение [а]равн/[а]ист в уравнении (2.37) часто можно
заменить отношением 5равн/^ист, где spaBH есть равновесная рас-
творимость при насыщении, а сист—концентрация пересыщенного
86
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
раствора. Отношение сИст/$Равн часто называют относительным
пересыщением или степенью пересыщения. Таким образом, из
данных о зависимостях растворимости можно узнать термоди-
намические функции, а по этим функциям вывести зависимости
растворимости. Термодинамике растворов посвящен ряд стан-
дартных пособий, например [21, 22], и здесь она больше не
рассматривается. Вопросы, связанные с использованием различ-
ных растворителей при выращивании кристаллов из растворов,
анализируются в гл. 7, посвященной подробному рассмотрению
способов выращивания кристаллов конкретных веществ.
При кристаллизации с использованием равновесия между
жидкостью и твердой фазой процесс роста может быть как кон-
сервативным, так и неконсервативным. К выращиванию из
раствора можно приспособить большую часть консервативных
способов, показанных на фиг. 2.4. Однако в процессе роста из ра-
створа часто приходится понижать температуру, чтобы поддер-
живать пересыщение1), потому что основная задача при выра-
щивании из раствора сводится к помещению отдельных участков
системы в зону, где раствор будет пересыщенным, и потому что
температура насыщения в процессе кристаллизации меняется
с изменением концентрации растворенного вещества. Поскольку
из раствора кристаллизуется чистое растворенное вещество, со-
став раствора и температура изменяются, что нередко делает
уравнения, выведенные для распределения примеси при консер-
вативном выращивании, неприменимыми. Если нет неограничен-
ной растворимости в твердой фазе растворенного вещества в
растворителе (диаграмма фиг. 2.3, а), то раствор рано или поздно
достигнет той области составов, где образуются эвтектика или
какие-то другие фазы и где нельзя выкристаллизовывать только
одно растворенное вещество. Однако выращивать небольшие
кристаллы из большой массы раствора можно по методикам,
показанным на фиг. 2.4 (с заменой на этом графике слова
«жидкость» словом «раствор»), медленно понижая темпера-
туру фронта кристаллизации. При этом уравнения, описы-
вающие распределение примеси при консервативном процессе
выращивания, часто могут служить хорошими приближениями.
Нельзя забывать, что диффузия, связанная с ростом из поли-
компонентой системы, создает дополнительные трудности (гл. 3)
и обычно заставляет вести процесс с пониженными скоростями
роста. Конечно, расчеты распределения примеси более просты,
если рост происходит на единственной границе раздела между
твердой и жидкой фазами, т. е. если процесс в многокомпонент-
4) Подобного затруднения можно избежать при изотермических методах
выращивания из раствора, которые будут рассматриваться дальше в настоя-
щей главе и в гл. 7.
I. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
87
ной системе можно уподобить нормальной кристаллизации.
Вероятно, консервативное выращивание из раствора удобнее
всего вести по схеме, показанной на фиг. 2.11, а, которая почти
одинакова со схемой фиг. 2.4, в. В данном случае пересыщение
достигается медленным охлаждением раствора. Для предотвра-
щения спонтанного зародышеобразования полезно (но не обяза-
тельно) затравку поддерживать при более низкой температуре,
чем раствор. Распределение примеси можно рассчитать непо-
средственно методами, выведенными для консервативного роста,
но с учетом того, что температура кристаллизации меняется по
мере осаждения растворенного вещества на кристалле. Измене-
ние температуры кристаллизации приводит к изменению кон-
станты и, следовательно, делает невозможным прямое рас-
пространение уравнений и графиков, описывающих однокомпо-
нентный консервативный рост, на консервативное выращивание
из многокомпонентной системы. Однако часто либо константа kQ
слабо зависит от температуры, либо интервал охлаждения не-
значителен. В таких случаях можно пользоваться с некоторыми
поправками или даже без них выражениями для распределения
примеси в однокомпонентных системах.
Если кристаллы выращивают из многокомпонентной системы
посредством того или иного неконсервативного процесса вида
твердая фаза — жидкость, то можно непосредственно пользо-
ваться методиками, приведенными на фиг. 2.6, с заменой полей
жидкой фазы полями раствора. В любом случае растворенное
вещество переходит из источника в раствор при более высокой
температуре, чем температура кристаллизации на затравке.
Точка, где происходит растворение, обозначена на фиг. 2.6 циф-
рой /, а область роста — цифрой 2. Если при зонной плавке в
многокомпонентной системе создать температурный градиент,
постоянный по всему слитку, как это показано на фиг. 2.11,6,
то зона сможет перемещаться самопроизвольно. Этот метод
называют методом зонной плавки с градиентом температуры [22]
(этот способ рассматривается дальше в разд. 5.5). На фиг.
2.11, в и г показаны два других распространенных способа кон-
сервативного выращивания кристаллов из раствора. На фиг.
2.11,в источник растворяемого вещества (иногда называемый
шихтой) отделен значительным расстоянием от затравки, кото-
рая находится при более низкой температуре. На фиг. 2.11, г
насыщение достигается путем испарения. Часто неконсерватив-
ный процесс выращивания из раствора ведется при постоянной
температуре, и тогда все уравнения и графики, определяющие
неконсервативный рост из однокомпонентной системы, непосред-
ственно применимы ко всем рассматриваемым здесь методам
выращивания из раствора, кроме выращивания посредством ис-
парения. В последнем случае йз-за потери растворителя меняется
88
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
концентрация раствора, что необходимо учитывать при расчете
распределения примеси внесением поправки на этот эффект.
Рост может происходить как из жидкого, так и из твердого
или газообразного растворов. Выделение в твердой фазе, или
экстрация, часто наблюдается в сплавах и легко распознается по
структуре сплавов. Обычно такие процессы протекают медленно
из-за диффузии в твердом состоянии. При условии достижения
равновесия за приемлемое время все рассуждения в этом случае
остаются такими же, как и для жидкой среды.
Неконсервативный
Неконсервативный
Неконсервативный
W//A Твердая фаза | | Жидкая фаза
Фиг. 2.11. Некоторые консервативные и неконсервативные процессы выра-
щивания кристаллов из раствора.
Многокомпонентный рост из газовой фазы обычно представ-
ляют как рост посредством химического взаимодействия. Однако
четко выраженной границы между выращиванием из раствора
при сильном взаимодействии растворителя с растворенным ве-
ществом и выращиванием посредством химического взаимодей-
ствия нет. Часто для повышения растворимости тугоплавкого
вещества в раствор добавляют компоненты, которые реагируют
с ним или образуют комплексы. Такие агенты обычно называют
минерализаторами. Минерализатор повышает растворимость
благодаря образованию новых ассоциатов растворенного веще-
ства, отличающихся от существующих в чистом растворителе.
Обычно такой рост считают ростом из раствора, но, если взаи-
модействие между растворенным веществом и минерализатором
достаточно сильное, такой процесс можно считать ростом по-
средством химического взаимодействия. Роль чистого растворщ
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
теля можно считать фактически сводящейся к роли комплексо-
образователя по отношению к растворенному веществу, обеспе-
чивающего образование сольватов, переводящих данное веще-
ство в раствор. Рост из многокомпонентной системы в газовой
фазе принято считать ростом посредством химического взаимо-
действия, тогда как рост из жидкой фазы даже при наличии ми-
нерализатора принято трактовать как выращивание из раствора,
если только рост не обусловлен явно необратимыми химическими
реакциями.
2.11. РОСТ ПОСРЕДСТВОМ ХИМИЧЕСКОГО
ВЗАИМОДЕЙСТВИЯ
Возьмем химическую реакцию в газовой фазе общего вида
аА + ЬВ ... gG + hH
(2.38)
где G — твердый кристаллический продукт, монокристаллы кото-
рого намечается вырастить, а другие продукты реакции и реа-
генты представляют собой газы. Константа равновесия такой
реакции запишется в виде
[<вИ[в];ави...
(2.39)
где символ [ ]Равн означает равновесную активность. Поскольку
активность твердого соединения G можно считать равной еди-
нице и поскольку активности газовых фаз можно приравнять
давлениям, постольку
К
(Рн)равн ' ’ ‘
(п„\Ь
Л/равн ' Я'равн
(2.40)
где взяты равновесные давления реагентов и продуктов реакции.
Обычно целесообразно брать достаточно высокие концентрации
летучих ассоциатов, чтобы обеспечить быстрый перенос веще-
ства к растущему затравочному кристаллу. Для этого требуется
малое значение К. Но часто удобнее испарять вещество G в
одной ^асти системы и кристаллизовать в другой. При выращи-
вании этим способом равновесие обычно смещают разностью
температур или концентраций реагентов. В целях содействия
испарению вещества G прибегают к повышению равновесных
концентраций А и В, для чего требуются малые значения Д’.
В случае легкой обратимости реакции константа К должна быть
близкой к единице. Но поскольку
А0° = -/?Пп/<, (2.41)
где AG° — стандартная свободная энергия образования про-
дуктов реакции в их стандартном состоянии из реагентов в
90
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
(2.43)
росте
(2.37)
(2.44)
стандартном состоянии, полезная реакция должна обычно ха-
рактеризоваться малыми значениями ДО0. Поскольку такие зна-
чения по большей части протабулированы и поскольку активно-
сти можно неплохо аппроксимировать давлениями, при выра-
щивании из газовой фазы посредством химической реакции часто
можно заранее выбрать систему на основе термодинамических
соображений1).
При росте посредством химического взаимодействия соблю-
дается уравнение (2.36), где Q определяется выражением
с. [G]gcTt^CT...
KrlC- ’
в котором символ [ ]ист означает истинную активность. Хорошим
приближением к уравнению (2.42) служит соотношение
п (рн)яст • '
ЫсТЫсТ--
где вместо активностей взяты истинные давления. При
кристаллов посредством химической реакции уравнение
преобразуется к виду
где AG— движущая сила реакции, а отношение К/Q есть аналог
относительного пересыщения или его степени. Температурная
зависимость К определяется уравнением (2.32). При А//>,0
(эндотермические реакции) можно добиться, чтобы испарение
происходило в горячей области системы, а кристаллизация в
более холодной. Если А//<0, то реакция будет смещаться из
холодной зоны в горячую. Изменение А// определяет темпера-
турную зависимость К и требующийся для выращивания темпе-
ратурный перепад между зонами испарения и кристаллизации.
При больших перепадах температуры можно достичь заметных
скоростей роста при малых значениях |А//|, но в случае слиш-
ком больших значений | \Н | требуются столь малые перепады
температуры для подавления избыточного зародышеобразова-
ния, что контроль за температурой трудно осуществить. Если
константа довольно велика, то реакция, приводящая к росту
кристалла, практически необратима, так что процессы переноса
мало что дают, но выращивание посредством реакции в паровой
фазе, как это показано в гл. 6, довольно часто используется на
практике.
!) По вопросу стехиометрии, областей ее существования и ее роли в
процессах роста кристаллов см. [24].
2. РАВНОВЕСИИ ПРИ РОСТЕ КРИСТАЛЛОВ
91
Если реакция протекает в жидкой или твердой фазе, то урав-
нение (2.39) преобразуется к виду
К ~ ИлН^)4 5--- (2,45)
при условии, что система близка к идеальной и вместо актив-
ностей можно пользоваться мольными долями X. Существуют
немногие реакции в жидкой фазе с константой Л, близкой к еди-
нице, которые пригодны для выращивания кристаллов, так что
рост посредством химических реакций чаще всего проводится в
газовой фазе1). Известен ряд рекомендаций по использованию
реакций с большими значениями константы /<, которые, однако,
рассматриваются не здесь, а в гл. 7. Для реакций же в твердом
состоянии требуется много времени для установления равнове-
сия, поскольку такие реакции проходят с участием твердофазной
диффузии.
Иногда кристаллы выращивают посредством особых реакций
электрохимического характера. Общая форма константы равно-
весия будет такой же, как в уравнении (2.45). Однако анализ
электродных процессов обнаруживает ряд характерных преиму-
ществ, присущих выращиванию кристаллов посредством электро-
химической реакции (см. разд. 7.2). В случае осаждения металла
типичная реакция на катоде имеет вид
Мп+ + пе~-+М. (2.46)
Если реагенты и продукты реакции находятся в стандартном со-
стоянии, то сумма потенциалов электродных реакций дает стан-
дартный электродный потенциал Е°, связанный с константой рав-
новесия соотношением
= (2.47)
где п — число участвующих в реакции электронов, — число
Фарадея, R — газовая постоянная, а Г—абсолютная температура.
Легко показать, что
AG°=-n^£°. (2.48)
Обычно одна из главных трудностей при выращивании кри-
сталлов посредством химического взаимодействия заключается
в том, что контроль пересыщения должен устранять спонтанное
зарождение. Если не прибегать к помощи транспортных реакций,
то компоненты приходится брать в таком количестве, при кото-
ром не возникает большого пересыщения, способного привести
к спонтанному зародышеобразованию. Если константа К зна-
чительно отличается от единицы, то этого трудно добиться,
4) Пожалуй, точности ради следовало бы сказать, что при 1 в жид-
кофазной системе процесс роста обычно считают выращиванием из раствора.
92
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
особенно в жидкофазных системах, где диффузия протекает мед-
ленно, а времена смешения значительны. При выращивании же
посредством электрохимической реакции электроны можно счи-
тать существенными реагентами, концентрация которых высока
лишь на электроде, где и требуется осаждение и где происходит
рост кристалла. Поэтому с точки зрения контроля за образова-
нием зародышей электрохимические реакции выгоднее.
Если нужно создать большой градиент концентрации того
или иного активатора (например, в полупроводниковых диодах),
то определенные преимущества дает проведение низкотемпера-
турного процесса, поскольку при низких температурах твердо-
фазная диффузия пренебрежимо мала. Если взять затравку
(подложку), содержащую примесь, и проводить выращивание
в низкотемпературных условиях, то активатор станет диффун-
дировать медленно, что приведет к значительному снижению его
концентрации там, где начался рост. Большие концентрацион-
ные градиенты можно также создавать, вводя активатор в паро-
вую фазу в процессе роста. Таким образом, парофазные про-
цессы особенно полезны тогда, когда стоит задача наращивания
тонких слоев с заданными свойствами. Этот способ носит назва-
ние эпитаксиального 9 роста кристаллов.
Выращивание посредством реакции может быть как консер-
вативным, так и неконсервативным процессом, но, как правило,
применяют неконсервативные процессы, особенно когда нужны
крупные кристаллы.
2.12. РОСТ МЕТАСТАБИЛЬНЫХ ФАЗ
Иногда можно вырастить кристаллы вещества в условиях
его термодинамической неустойчивости. Пока достигнуты незна-
чительные успехи по выращиванию крупных кристаллов тех или
иных материалов в метастабильных условиях, но если такую
методику довести до 'практической целесообразности, то она
сулит так много преимуществ, что заслуживает того, чтобы
здесь хотя бы в общих чертах остановиться на ней. Если высо-
котемпературную полиморфную модификацию можно вырастить
непосредственно в условиях, когда она метастабильна, то при-
обретают силу все преимущества низкотемпературного роста,
перечисленные в разд. 2.1. Разумеется, процесс значительно
легче провести экспериментально тогда, когда полиморфную
модификацию высокого давления удается выращивать при низ-
ких давлениях, при которых она неустойчива. Если при темпера-
туре выращивания скорость фазового перехода
метастабильная фаза—> стабильная фаза (2.49)
*) Полнее эпитаксия определена в разд. 3.9с
2. РАВНОВЕСИЕ ПРИ РОСТЕ КРИСТАЛЛОВ
93
мала, то иногда удается получить неустойчивую фазу в процес-
се роста, чтобы перевести ее быстрой закалкой до обычных ус-
ловий в метастабильное состояние, скорость реакции (2.49) в
котором практически равна нулю. Иногда фазовые переходы в
более устойчивое состояние проходят ступенчато, через после-
довательность все менее метастабильных фаз (правило ступеней
Освальда). Это позволяет
«замораживать» ту или
иную метастабильную про-
межуточную фазу. Если в
насыщенный раствор ввести
затравку метастабильной
формы, то она может ока-
зать столь сильное ориента-
ционное влияние на процесс
роста, что в результате ста-
нет расти метастабильная
модификация. На фиг. 2.12
иллюстрируется взаимо-
связь между растворимостя-
ми полиморфных модифика-
ций при фазовом переходе.
На этом графике кривая
АВС характеризует раство-
Ф и г. 2.12. Растворимость полиморфных
модификаций в окрестности температуры
фазового перехода.
римость одной полиморфной
модификации (а), а кривая DBE — растворимость другой фор-
мы (р). Точка В при температуре Т\ и растворимость Si харак-
теризуют точку перехода при данном давлении. Растворимость
p-формы в области ее неустойчивости DB больше растворимости
«-модификации при тех же температурах. Подобным же обра-
зом в области ВС растворимость «-модификации больше рас-
творимости p-формы. Таким образом, если в области устойчи-
вости a-формы раствор насыщен этой формой, то он не насыщен
P-формой. Однако раствор, который характеризуется составом
и температурой, отвечающими точке F, будет пересыщен обеими
модификациями. В этом случае можно вырастить p-форму на
Р-затравке в области a-фазы1), если создать пересыщение, до-
статочное для роста p-фазы на p-затравке, без спонтанного за-
рождения a-модификации. Если p-фаза осаждается первой (по
правилу ступеней Освальда), то можно даже вызвать зарожде-
ние p-фазы в области стабильности a-фазы без затравки.
В разд. 7.3 рассматривается интересный пример роста метаста-
бильной фазы этилендиаминтартрата.
*) В гл. 3 показано, что для спонтанного зарождения требуется более
высокое пересыщение, чем для выращивания на затравке.
8
КИНЕТИКА РОСТА КРИСТАЛЛОВ
3.1. ЛИМИТИРУЮЩАЯ СТАДИЯ ПРОЦЕССА
В гл. 2 нами были рассмотрены ростовые равновесия. В на-
стоящей главе мы рассмотрим скорость, с которой происходит
рост кристаллов. Кинетика изучает скорость процесса или реак-
ции, в том числе все влияющие на нее факторы, в тесной связи
с путями реакции, или ее механизмом1). Химическая реакция
и процесс роста кристалла состоят из нескольких стадий. Если
скорость одной из них гораздо меньше скорости других, то такая
лимитирующая стадия и определит полную скорость процесса.
Если же скорости нескольких стадий почти одинаковы, то резуль-
тирующая скорость процесса определяется всеми ими. Такая
реакция называется последовательной. Лимитирующая стадия
и механизм кристаллизации зависят от условий в процессе вы-
ращивания и от способа кристаллизации.
3.2. ДИФФУЗИЯ
Диффузия часто играет важную роль при росте кристаллов
из многокомпонентных систем. Диффундирующий к растущей
кристаллической грани материал может быть усвоен ею или
отторгнут. Ясно, что растущая поверхность служит стоком для
компонента, образующего кристалл. Она захватывает или от-
тесняет примесь или активатор в зависимости от того, больше
или меньше единицы эффективный коэффициент распределения
^эфф- При выращивании из раствора или посредством химиче-
ской реакции растворитель и продукты реакции, не участвую-
щие в построении кристалла, отталкиваются поверхностью.
В обоих случаях, как показано на фиг. 3.1, у поверхности раз-
дела возникает такой градиент концентрации, что с удалением
от границы раздела концентрация возрастает для вещества, ус-
ваивающегося растущим кристаллом, и убывает для отталкивае-
мых компонентов. Особенности распределения примеси или ак-
тиватора в непосредственной близости от растущей поверхности
зависят от наличия адсорбированного слоя и ряда других фак-
торов и здесь нами не затрагиваются. Скорость диффузии опи-
*) По вопросу кинетики роста кристаллов см. книгу [32].
$. К,ИНВТИКА РОСТА КРИСТАЛЛОВ
95
сывается законами Фика. Первый закон Фика гласит, что
dcj
(3.1)
где Ji есть поток i-ro компонента, Di — коэффициент диффузии
(который здесь предполагается не зависящим от направления)
и dcijdx — градиент концентрации в направлении диффузии (в
данном случае в направле-
нии х). Такими же уравне-
ниями описывается диффу-
зия в направлениях у и г.
Знак минус показывает, что
диффузия направлена в сто-
рону убывания концентра-
ции. Площадь при опреде-
лении потока f-ro компо-
нента предполагается пер-
пендикулярной направлению
диффузии. Поскольку Ji есть
векторная величина, для
вычисления J{ в любом на-
правлении, отличном от на-
правления избранной оси,
Расстояние
Фиг. 3.1. Концентрационные градиенты
вблизи растущего кристалла.
можно пользоваться зако-
нами сложения векторов. Первый закон Фика обычно справед-
лив для стационарных условий, когда концентрация f-ro компо-
нента не меняется во времени.
Если стационарности не существует, то диффузию удобнее
описывать вторым законом Фика, гласящим, что
дс> / д2с.- д2с} д2с- \
dt 1 \ дх2 1 ду2 1 dz2 / v 7
где Di не зависит от концентрации, t — время. В случае диффу-
зии только вдоль одного направления уравнение (3.2) сводится
к виду
(3.3)
Решение уравнений (3.1) — (3.3) для наиболее распростра-
ненных геометрических конфигураций приведено в ряде книг
(см., например, [1,2]). В большей части задач по росту кристал-
лов коэффициент диффузии считается не зависящим от направ-
ления, если речь не идет о диффузии в твердом состоянии, когда
среда часто бывает анизотропной. В связи с ростом кристаллов
чаще всего рассматривают две задачи практического значения:
о диффузии к шару, который служит моделью кристаллика или
96
Й. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
зародыша, и о диффузии к плоской поверхности при описании
выращивания на плоской затравке. Очень часто затравка рас-
сматривается как бесконечная плоскость, а краевая диффузия
в направлениях не по нормали к этой плоскости не учитывается.
3.3. ПОВЕРХНОСТИ КРИСТАЛЛОВ
Важную стадию процессов выращивания кристаллов как из
моно-, так и из многокомпонентных систем образует поверхно-
стная реакция. Она может состоять из целого ряда подреакций,
но даже безотносительно к особенностям последних геометрия
растущей поверхности будет играть важную роль.
Фиг. 3.2. Частично укомплектованная атомарно-гладкая поверхность кри-
сталла.
Рассмотрим сначала частично укомплектованную атомарно-
гладкую поверхность (фиг. 3.2), представляющую собой идеа-
лизацию в том смысле, что кристалл предполагается свободным
от внутренних дефектов, а атомы представляются в виде куби-
ков. Все атомы одинаковы и плотно упакованы, так что у всякого
атомд есть шесть ближайших соседей. Последние соприка-
саются с центральным атомом по граням куба. Кроме того,
каждый атом имеет во второй координационной сфере 12 сосе-
дей, соприкасающихся с ним по ребрам куба и в третьей сфере
8 соседей, соприкасающихся с ним по углам куба. Новый атом
присоединяется к кристаллу в энергетически наиболее выгодной
позиции. Если учесть, что при образовании «связей» в рассмат-
риваемой нами идеализированной модели высвобождается энер-
гия, то энергетически наиболее выгодной позицией следует счи-
тать ту, где присоединившийся атом образует наибольшее число
з. кинетика роста кристаллов
97
связей. Здесь мы подразумеваем ковалентные или вандервааль-
совы связи. В случае же ионных гетерополярных связей необ-
ходимо, как мы увидим дальше, учитывать еще и силы отталки-
вания. Ряд атомов, составляющих плоскость ABCD (фиг. 3.2),
образует ступень. Таким образом, последняя возникает при ча-
стичной укомплектованности атомарно-гладкой грани. Атомы
ABCDEFGH образуют излом на ступени, который, таким обра-
зом, возникает при частичной укомплектованности ряда ато-
мов. Если учитывать только число ближайших соседей, то наи-
более благоприятной позицией для присоединения нового атома
служит именно излом на ступени (атом 1 на фиг. 3.2), так как
здесь образуются связи с гремя ближайшими атомами (по гра-
ням куба на расстоянии а от его центра, где а — ребро куба).
Следующей по энергетической выгодности позицией для присое-
динения атома является торец ступени (атом 2), поскольку
здесь образуются связи с двумя ближайшими атомами. Нако-
нец, наименее благоприятным положением для присоединения
атомов при учете только первых ближайших соседей является
одиночный атом на гладкой поверхности (атом 3). Учет атомов
во второй координационной сфере приводит к некоторым энер-
гетическим различиям для эквивалентных в остальном атомов.
В изображенном на фиг. 3.2 «кристалле» атом 3 имеет 4 вторых
ближайших соседа (по граням куба на расстоянии а]/2 от
центра куба); атом 4 — три таких соседа и атом 5 — два соседа.
Таким образом, хотя атомы 3, 4 и 5 все имеют по одному бли-
жайшему соседу, число образуемых ими связей уменьшается в
последовательности атомов 3, 4, 5. Поскольку при образовании
связей выделяется энергия, легкость присоединения атомов
уменьшается в той же последовательности 3, 4, 5. Подобным
же образом можно рассмотреть влияние атомов второй коорди-
национной сферы на такие атомы, как атом /, который имеет
трех первых ближайших соседей, или атом 2, имеющий двух
таких соседей. Влияние атомов третьей координационной сферы
(соприкасающихся с центральным атомом по углам куба на
удалениях а ]/3 от его центра) и атомов более удаленных коор-
динационных сфер проявляется не столь заметно, но в общих
чертах аналогично рассмотренному выше случаю. Предполагая,
что силы связи обратно пропорциональны квадрату расстояния
от центра куба, и считая, что ребро куба имеет длину а, силы
связи можно записать в следующем виде:
для атома в первой координационной сфере ~ 1/а;
для атома во второй координационной сфере ~ 1/2а;
для атома в третьей координационной сфере ~ 1/За.
Все сказанное выше относится к кристаллам с положи-
тельной энергией связи. Однако в случае гетерополярных или
98
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
ионных кристаллов типа Д+В” возникают осложнения, ибо при
приближении заряженного иона к поверхности кристалла он
может притягиваться ионами противоположного знака и одно-
временно отталкиваться ионами того же знака. Рассмотрим
присоединение атома А+ к гладкой поверхности А*В~. Атом А+
будет присоединяться к ней в позиции над атомом В~ с выиг-
рышем энергии, пропорциональным 1/а. Однако теперь все
атомы А+ из второй координационной сферы станут отталкивать
присоединенный атом с силой, пропорциональной п/2а (п — чис-
ло соседних атомов во второй координационной сфере). Подоб-
ным же образом его ближними соседями в третьей координа-
ционной сфере окажутся только атомы В', которые станут при-
тягивать наш атом Л+ с силой, пропорциональной пг/За, где
т — число таких соседних атомов в третьей сфере. Таким обра-
зом, при адсорбции атома А+ на гладкой поверхности А+В~ ос-
вобождается энергия (без учета взаимодействия А+ с атомами,
расположенными за третьей координационной сферой)
£ = 7(‘-т + т)' <3-4>
где а — коэффициент пропорциональности. Для атомов 3, 4 и
5 (фиг. 3.2) получим соответственно
+ <3-5>
<3-6>
-4+т)=£- <37>
Отсюда видно, что вероятность присоединения *) атомов 3 и 5
больше, чем атома 4. Коссель [3] и Ван Хук [4] вычислили
(в предположении, что молекулярные силы убывают быстрее,
чем как квадрат расстояния), что в гетерополярном кристалле
Еб > Е4 > Ез. Аналогичные вычисления для разного числа ато-
мов во второй и третьей координационных сферах можно сде-
лать и для атомов 1 и 2. При этом позиция атома 1 останется
энергетически наиболее выгодной, а атом 2 по-прежнему оста-
нется на втором месте. Важным следствием таких вычислений
будет вывод о том, что зарождение всякого нового слоя должно
начинаться с присоединения атома в позиции 5. Для иных струк-
тур, очевидно, потребуются новые расчеты.
Изложенные выше рассуждения проще всего провести для
атомарно-гладкой поверхности. Но часто грани кристаллов, осо-
*) Без последующего отрыва, ибо присоединение само по себе часто проис-
ходит неизбирательно, а частота отрывов из разных положений действительно
определяется прочностями связей (3.5) — (3.7). — Прим. ред.
3. кинетика роста кристаллов
99
бенно с большими индексами, бывают шероховатыми или сту-
пенчатыми. Качественно неизбежность образования шерохова-
тых граней можно пояснить с помощью фиг. 3.3. Сетка атомов
здесь изображает плоскость (001) кубического кристалла АВ.
Атомы 1—3—5—7—9—И—13 лежат на линии пересечения плос-
кости (111) с плоскостью (001). Эта линия целиком составлена
из атомов В, как и вся грань (111). Такая грань характеризует-
ся высокой поверхностной энергией, поскольку каждый атом В
имеет две ненасыщенные связи. Но если кристалл ограняется
шероховатой поверхностью, линия пересечения которой с плос-
костью (001) составлена из атомов 1—2—3—4—5—6—7—8—
Фиг. 3.3. Грань (001) кубического кристалла АВ.
9—10—11—12—13, то поверхностная энергия такой грани иног-
да уменьшается. Отсюда легко понять (перейдя к трехмерной
решетке), что в рассматриваемом примере грань (111) будет
стремиться стать шероховатой.^ На атомарно-шероховатой по-
верхности постоянно присутствует много ступеней, благоприят-
ствующих росту. Регулярная ступенчатая структура на поверх-
ности реального кристалла, видимо, не сохраняется, но шерохо-
ватость обеспечивает наличие многих мест, способствующих росту..
Проблема зарождения новой ступени на атомарно-гладкой
поверхности кристалла относится к числу тех, которые при-
влекли к себе большое внимание.,Как уже отмечалось, на такой
поверхности зарождение новой ступени энергетически менее вы-
годно, чем рост на уже существующей ступени или изломе. Тем
не менее всякий раз, когда предыдущая ступень «дорастает» до
края кристалла, должна зарождаться новая ступень. Количе-
ственные расчеты показывают, что для зарождения новой сту-
пени на атомарно-гладкой поверхности требуются большие
пересыщения или переохлаждения. С другой стороны, кристал-
лы растут уже при низких пересыщениях или переохлаждениях
100
р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
[5]. Для этого нужна не исчезающая в процессе роста, или по-
вторимая, ступень. Такие повторимые ступени всегда имеются
на шероховатой грани. Что касается роста атомарно-гладких
граней при низких пересыщениях, то эта проблема длитель-
ное время оставалась неясной. Пониманию механизма роста
таких граней способствовали представления о винтовых дис-
локациях [6] (фиг. 3.4), ге-
Ф и г. 3.4. Спираль роста, обословлен-
ная винтовой дислокацией.
нерирующих на поверхности
не исчезающую в процессе
роста ступень, а также экс-
периментальные данные о
существовании таких ступе-
ней на выращенных кристал-
лах (в разд. 3.7 рассматри-
вается количественная зави-
симость скорости роста на
винтовых дислокациях от
пересыщения). Высота сту-
пеней для большей части
материалов обычно равна
многим периодам ячейки,
благодаря чему ступени ча-
сто видны невооруженным
глазом. Ниже показано, что
теория коалесценции, разработанная Кабрерой и Франком, объ-
ясняет генезис макроскопических ступеней.
Первым количественный анализ свободной поверхностно?!
энергии кристаллических граней провел Вульф [7]. В дальней-
шем его углубил и расширил Херринг [8].
Гиббс в 1878 г. [9] показал, что форма маленького кристал-
ла, находящегося в равновесии с раствором, должна удовлет-
ворять условию минимума где (Tj — удельная межфаз-
ная поверхностная энергия грани i (поверхностная энергия на
единичную площадь грани), А — площадь этой грани. Если рост
(или растворение) осуществляются в сильно неравновесных ус-
ловиях, форма кристалла также будет отличаться от равновес-
ной. Удельную межфазную поверхностную энергию иногда на-
зывают капиллярной постоянной, а чаще межфазным поверх-
ностным натяжением. Вульф предложил простой метод изо-
бражения зависимости в в кристалле от направления. На
фиг. 3.5 изображена так называемая диаграмма Вульфа для
гипотетического кристалла. Она дает в полярных координатах
главное сечение приблизительно сферической поверхности, изо-
бражающей полную зависимость свободной поверхностной энер-
гии от направления. Расстояние от центра пропорционально
энергии с в данном направлении. Если в каждой точке диа-
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
101
граммы провести плоскости, перпендикулярные соответствую-
щим радиусам-векторам в этих точках, то заполненный точками,
достижимыми из начала координат без пересечения какой-либо
из плоскостей, объем будет подобен равновесной форме кри-
сталла. Чтобы убедиться в этом, вообразим, что маленький сфе-
рический зародыш разращивается достаточно долго, пока не
образуется равновесная форма. Если при этом появляется част-
ная форма, например грань АВ на фиг. 3.6, а, скорость роста
Фиг. 3.5. Полярная диаграмма свободной поверхностной энергии кристалла
(по Вульфу).
которой, пропорциональная отрезку 1—2, больше, чем другой
(например, грани ВС, скорость роста которой пропорциональна
расстоянию 3—4), то площадь быстро растущей грани будет
уменьшаться в процессе роста (А'В' <ЛВ), а площадь мед-
ленно растущей станет увеличиваться (В'С' > ВС). В конечном
итоге быстро растущая~грань выклинится. Сказанное иллюстри-
руется схемой на фиг. 3.6. В реальном кристалле выклинивание
или, наоборот, разрастание граней определяется их геометриче-
ским расположением друг относительно друга и соотношением
скоростей роста. Однако в подавляющем большинстве случаев
грань, площадь которой увеличивается по мере роста, характери-
зуется меньшей скоростью роста по сравнению с гранью, площадь
поверхности которой убывает. Таким образом, при выращивании
кристалла в близких к равновесным условиях расстояние от
центра на фиг. 3.5 и 3.6, а пропорционально как натяжению а,
102
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
так и скорости роста. Замкнутая фигура наименьшего объема,
которая образована плоскостями, перпендикулярными радиу-
сам-векторам в точках пересечения граней с полярной диаграм-
мой свободной поверхностной энергии (фиг. 3.5), представляет
собой равновесную форму кристалла, включающую грани
с наименьшими скоростями роста. Так как остроконечным
впадинам на диаграмме свободной поверхностной энергии со-
ответствуют, вообще говоря, самые короткие радиусы-векторы
(отвечающие граням с низкими натяжениями), грани кристалла
будут возникать в местах пересечения радиуса-вектора с остро-
конечной впадиной или седловой точкой на диаграмме Вульфа.
Фиг. 3.6. Промежуточные формы растущего кристалла.
Объем, занятый достижимыми из центра без пересечения какой-
либо из плоскостей точками, представляет собой форму, обес-
печивающую наименьшую свободную поверхностную энергию.
Равновесная форма чаще всего реализуется на маленьких
кристаллах. Так как существенное изменение формы может про-
исходить только вследствие перемещения значительных масс
кристалла на заметное расстояние, необходимая для этого энер-
гия значительно превышает выигрыш, достигаемый за счет
уменьшения поверхностной энергии.
Херринг [8] обратил внимание на важность сопоставления
для крупных кристаллов поверхностных энергий соседних форм,
даже если ни одна из последних не совпадает с гранями мини-
мальной поверхностной энергии на диаграмме Вульфа. Херринг,
проанализировавший диаграмму Вульфа для подобных сосед-
них конфигураций, пришел к следующим важным выводам:
1. Если данная макроскопическая поверхность кристалла не
совпадает по ориентации с частью поверхности равновесной
формы, то такая поверхность всегда будет иметь макроступен-
чатую структуру (CD на фиг. 3.6, б)1), свободная поверхностная
*) Эта ситуация осуществляется только тогда, когда равновесная форма
кристалла имеет остроконечные вершины и ребра. — Прим, ред.
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
103
энергия которой меньше, чем у плоской поверхности. Если же
выбранная грань встречается на равновесной форме, то макро-
ступенчатая структура перестает быть устойчивой.
2. Если поверхность свободной энергии на диаграмме Вуль-
фа остается за пределами сферы, касательной к поверхности в
точке пересечения радиуса-вектора с этой поверхностью, то со-
ответствующая поверхность, или «грань», кристалла должна
быть искривленной. Если же поверхность свободной энергии ле-
жит где-то внутри такой сферы, то поверхность кристалла ана-
логична упоминавшейся в первом случае макроступенчатой
структуре.
3. В местах пересечения плоских граней поверхностную
энергию можно снизить посредством округления двугранных
углов. Подобное округление, как правило, столь незначительно,
что остается почти необнаруженным, но оно тем больше, чем
меньше площадь (объем в трехмерном пространстве) между по-
верхностью Вульфа и сферой, касательной к пересекающимся
граням 9-
Надо отметить, что с приближением температуры кристалла
к температуре его плавления кристаллическая поверхность ста-
новится все более и более шероховатой. Поэтому представления
о преимущественных местах присоединения атомов и идеализи-
рованная диаграмма Вульфа, по всей вероятности, утрачивают
правомерность при выращивании с температурами, близкими к
температуре плавления. Построения подобного рода более на-
дежны в применении к процессам роста из раствора.
Донней и Харкер [10] предприняли попытку выявлять грани
с минимальными поверхностными энергиями путем прямых вы-
числений ретикулярной плотности атомов в различных сечениях
кристалла. Плотноупакованным граням действительно присущи
минимальные значения свободной поверхностной энергии, од-
нако необходимо учитывать направленный характер связей в
кристалле и особенности взаимного расположения атомов, что
особенно важно в случае негомеополярных связей в кристаллах,
образуемых атомами не одного элемента. Определенного про-
гресса в учете этих факторов добились Хартман и Пердок
[11] в теории цепей периодических связей * 2). Разработанный ими
метод предусматривает разбиение всякого кристалла на цепи
периодических связей в предположении, что кристалл быстрее
всего растет в направлении цепей сильнейших связей.
’) Вопросы морфологической стабильности рассматриваются далее в
статьях [33—38].
2) Periodic bond chain (РВС).
104
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
• 3.4. ПРОЦЕССЫ ПРИ ВЫРАЩИВАНИИ КРИСТАЛЛА
ИЗ РАСТВОРА
Как уже отмечалось, рост кристалла представляет собой
сложный процесс, состоящий из ряда последовательных стадий.
Одна или несколько из таких стадий и определяют наблюдаю-
щуюся скорость роста. Природа таких стадий зависит от ха-
рактера системы, в которой происходит рост. В многокомпо-
нентной системе рост идет из раствора, причем нередко раство-
рение и рост осуществляются в пространственно разобщенных
зонах сосуда. В таких системах число стадий бывает наиболь-
шим. В качестве таких стадий надо назвать (в порядке их про-
текания) следующие:
Р1. Растворение.
Р2. Перенос растворенного вещества.
РЗ. Диффузия1) через обедненную зону у границы раздела
кристалл/раствор.
Р4. Частичная или полная десольватация, а также обра-
щение реакций с помощью минерализатора (см. ниже).
Р5. Диффузия !) растворителя, минерализатора и примесей
от растущей поверхности.
Р6. Десорбция примесей, растворителя или компонентов
минерализатора с кристаллической поверхности.
Р7. Адсорбция или хемосорбция на поверхности затравки
частиц, образующих кристалл.
Р8. Двумерная диффузия !) адсорбированных или хемосор-
бированных частиц к ступени.
Р9. Частичная десольватация2) или обращение реакции с
помощью минерализатора.
РЮ. Присоединение частицы к ступени.
Р11. Диффузия !) от растущей поверхности компонентов
растворителя или минерализатора (дополнительно освобождаю-
щихся на стадии Р9).
Р12. Одномерная диффузия1) частиц вдоль ступени к из-
лому.
Р.13. Частичная десольватация2) или обращение реакции с
помощью минерализатора.
Р14. Присоединение частицы в изломе.
Р15. Диффузия компонентов растворителя или минерализа-
тора от кристаллической поверхности.
Р16. Рассеяние теплоты кристаллизации, которое может
происходить отдельными порциями после каждой стадии при-
соединения. Если среди перечисленных стадий есть эндотерми-
9 А также связанные с диффузией процессы.
а) А также связанные с десольватацией процессы.
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
105
ческие процессы, то они сопряжены с поглощением теплоты кри-
сталлизации.
Сам процесс растворения может слагаться из следующих по-
следовательных стадий:
Д1. Отрыв из излома.
Д2. Одномерная диффузия частицы от излома.
ДЗ. Частичная сольватация или реакция с минерализато-
ром.
Д4. Диффузия растворителя или минерализатора к раство-
ряющейся кристаллической поверхности.
Д5. Отрыв частицы от ступени.
Д6. Двумерная диффузия частицы по поверхности от сту-
пени.
Д7. Частичная сольватация или реакция с минерализато-
ром.
Д8. Диффузия растворителя или минерализатора к раство-
ряющейся поверхности.
Д9. Десорбция частицы с поверхности.
ДЮ. Диффузия через обогащенную растворенным вещест-
вом зону у растворяющейся поверхности.
Д11. Частичная или полная сольватация или реакция с ми-
нерализатором.
Д12. Диффузия растворителя или минерализатора к раство-
ряющейся грани.
Д13. Поглощение теплоты растворения, которое может про-
исходить порциями после каждой стадии отрыва частицы.
В общем случае последовательность стадий при росте и раст-
ворении точно неизвестна. В частности, для большинства систем
неизвестно и то, осуществляются ли некоторые стадии процесса,
например Р4, Р9, Р13, последовательным образом.
Не все из перечисленных здесь стадий возможны в конкрет-
ных системах, но обычно не составляет труда, руководствуясь
перечнем Р1-Р16 и Д1-Д13, выявить возможные стадии в дан-
ной системе. Проанализируем теперь подробные отдельные ста-
дии и раскроем в следующем разделе их роль при росте, отве-
чающем различным типам равновесия.
Если для осуществления роста не требуется предваритель-
ного растворения, например при. выращивании посредством ох-
лаждения насыщенного раствора, стадии растворения (Р1) и
переноса материала (Р2) отсутствуют. Варьируя геометрию сис-
темы, можно подобрать такие условия, при которых влияние
растворения на скорость роста перестанет быть существенным.
В ряде случаев для этого достаточно сильно увеличить площадь
поверхности растворяющейся твердой фазы (питающего веще-
ства). Перенос вещества обеспечивается диффузией, конвек-
цией, механическим перемешиванием раствора, а также потоком.
106
Р. ЛОДИЗ. РОСТ монокристаллов
порожденным разностью давлений. Объемная диффузия (РЗ)
уже была рассмотрена в разд. 3.2.
В системе'растворитель — растворенное вещество растворе-
ние происходит благодаря взаимодействию между этими ком-
понентами. В определенный период роста реакция взаимодей-
ствия раствора с кристаллом должна изменить направление на
обратное с переходом к десольватации растворенного веще-
ства. В таких системах нередко используют дополнительные
компоненты, такие, как комплексообразователи, которые взаи-
модействуют с растворенным веществом активнее, чем с раство-
рителем. Такие дополнительные компоненты, повышающие раст-
воримость благодаря образованию новых форм растворяемого
вещества в растворе, отличных от существующих в чистОхМ раст-
ворителе, обычно называются минерализаторами. Реакция по-
следних с растворяемым веществом должна быть, разумеется,
обратимой. Вполне вероятно, что растворенное вещество не обя-
зательно десольватируется, или освобождается от минерализа-
тора, за один этап. Подобным же образом логично допустить,
что присоединение растворенного вещества к кристаллической
поверхности проходит не за одну стадию. Как было показано в
разд. 3.3, присоединение атома к кристаллической грани может
сопровождаться образованием одной связи (адсорбция или хе-
мосорбция), двух связей (присоединение к ступени) или трех
связей (присоединение в изломе ступени) ])- Можно предполо-
жить, что с увеличением числа связей растворенной частицы
собственного вещества с кристаллической поверхностью умень-
шается число ее связей с минерализатором или растворителем,
так что координационное число частицы в процессе кристалли-
зации остается постоянным. Именно по этой причине мы выде-
лили десольватацию (обращение реакции с помощью минера-
лизатора) в качестве отдельных стадий Р4, Р9 и Р13 в общей
последовательности кристаллизационных процессов. Всякий
раз десольватация сопровождается образованием дополнитель-
ных связей частицы с кристаллической поверхностью (стадии
Р7, РЮ и Р14). Разумно предположить, что различные диффу-
зионные процессы, благодаря которым растворенная частица
перемещается к правильными положениям на поверхности,
всегда предшествуют образованию дополнительной связи с по-
верхностью (стадии РЗ, Р8 и Р12). Подобньгм же образом
объемная диффузия от растущего кристалла компонентов раст-
ворителя или минерализатора, которые необходимо удалить,
4) В разд. 3.3 мы исходили из кубической модели атомов, образующих
кристалл. В реальных кристаллах число ближайших соседей часто отличается
от шести, благодаря чему присоединение атома к поверхности может сопро-
вождаться образованием более чем одной связи, присоединение к ступени —
более чем двух связей и т. д.
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
107
всегда сопровождает десольватацию (стадии Р5, Р11 и Р15).
Если место присоединения собственных частиц на кристалличе-
ской поверхности блокировано адсорбированным или хемосор-
бированным атомом примеси, то для того, чтобы связь могла
сформироваться, последний приходится оттеснять (стадия Р6).
Стадия, аналогичная Р6, может наступать вслед за стадией Р9
или Р13.
Возникает интересный вопрос о том, к каким процессам сле-
дует отнести образование первой связи между растворенной
частицей и кристаллической поверхностью — к адсорбции или
хемосорбции. Вероятно, в том случае, когда растворенная час-
тица близко подходит к кристаллической грани, возникшая связь
практически аналогична связям в объеме кристалла и, следова-
тельно, процесс можно классифицировать как хемосорбцию.
Если же частица находится от кристаллической грани на рас-
стоянии, недостаточном для возникновения химической связи
(раковина из растворителя или минерализатора способна стери-
чески воспрепятствовать сильному сближению), она может удер-
живаться на поверхности вандерваальсовыми силами; такой
процесс следовало бы описывать как адсорбцию. И все же в
конце концов связь между частицей и кристаллом станет обыч-
ной связью внутри кристалла. Это может произойти на после-
дующих этапах роста, вероятно, при встраивании частицы в из-
ломе (Р12).
Процесс растворения мы также разделили на ряд этапов
(Д1—Д13). Во многих случаях они носят обратный характер по
отношению к стадиям роста, но последовательность этих стадий
и их число при растворении иные, чем для стадий Р1—Р15. Мы
хотим, таким образом, подчеркнуть, что последовательность и
число стадий как при росте, так и при растворении окончательно
еще не установлены. Однако для всех этапов роста Р1—Р15
можно хотя бы умозрительно предположить обратные им стадии
растворения. Если такая обратимость существует в действи-
тельности, то механизм и лимитирующие процессы для роста и
растворения должны быть одинаковыми, а уравнения скоростей
их полностью идентичными, если не считать перемены знака. Сле-
довательно, рост и растворение должны быть взаимно обрат-
ными процессами. Однако большая часть экспериментов пока-
зывает, что они не обратимы. Одной из причин служит то, что
адсорбированные примеси, активаторы, компоненты раствори-
теля или минерализатора препятствуют росту и, наоборот, уско-
ряют растворение!).
9 Рост и растворение существенно отличаются также по морфологии
поверхностей кристалла — средняя плотность ступеней при растворении, по-
видимому, гораздо выше, чем при росте. — Прим. ред.
108
Р. ЛОДИЗ. РОСТ монокристаллов
Надо отметить, что рост при высоких пересыщениях или
растворение при высоких недосыщениях не требует наличия сту-
пеней и изломов на кристаллической поверхности.
3.5. ПРОЦЕССЫ РОСТА ПРИ ОТКЛОНЕНИИ
ОТ РАЗЛИЧНЫХ УСЛОВИЙ РАВНОВЕСИЯ
При кристаллизации в однокомпонентной системе но меха-
низму полиморфных превращений в силу идентичного химиче-
ского состава обеих фаз диффузия в нашем обычном понимании
не может лимитировать скорость роста. Но если структурные
изменения при фазовом переходе значительны, то атомам не-
обходимо переместиться на большое расстояние при образовании
новой структуры и эта «микродиффузия» может стать лимити-
рующей стадией процесса. Полиморфные превращения обычно
представляют собой переходы первого рода, для которых ско-
рость реакции пропорциональна концентрации вещества, претер-
певающего в данный момент полиморфное превращение. Кон-
станта скорости обычно изменяется с температурой по закону
Аррениуса
k = ае~ь*т, (3.8)
где k — константа скорости, а и b суть константы в первом при-
ближении (Ь — энергия активации), R — газовая постоянная,
Т — абсолютная температура. Резкое изменение наклона кривой
зависимости log k от 1/Г свидетельствует о двух механизмах
роста, действующих в разных температурных областях. Пред-
экспоненциальный множитель а также может зависеть от темпе-
ратуры. Подробнее зависимость константы скорости от темпера-
туры обсуждается в работах по химической кинетике [12—14].
На фиг. 3.7 схематично изображена энергия устойчивой и не-
устойчивой фаз. Чем выше энергетический барьер между ними,
тем больше энергия активации ДЕ* и тем меньше при данной
температуре скорость превращения. С повышением температуры
константа k возрастает, но если при этом система выйдет йз
области термодинамической устойчивости 0-фазы, то, разумеется,
эта фаза не сможет образовываться. Если энергетический барьер
между модификациями настолько велик, что скорость превра-
щения очень мала и a-фаза способна длительное время суще-
ствовать в неравновесных условиях, говорят о ее метастабиль-
ности.
Зарождение устойчивой модификации в твердой фазе, как
правило, не встречает затруднений, поскольку эпитаксиальное
зарождение обычно протекает легко. С другой стороны, это об-
стоятельство имеет свои недостатки, так как быстрое образова-
ние многих центров кристаллизации при полиморфном переходе
затрудняет получение монокристалла.
3., КИНЕТИКА РОСТА КРИСТАЛЛОВ
109
Диффузия не участвует и при росте в чисто однокомпонент-
ной системе расплав — кристалл, так как фазы в данном случае
имеют тоже одинаковый состав. В реальных же условиях при-
ходится учитывать диффузию примесей. Так как рост происхо-
дит почти при температуре плавления, растущая поверхность,
вероятно, всегда атомарно-шероховата и обязательно содержит
ступени и изломы. Присоединение частицы к грани и двумерную
диффузию к месту встраивания в кристалл можно рассматривать
как возможные лимитирующие стадии. Однако в большинстве
ДЕ* ^неустойчивая Барьер
1 I фаза)
z Л '
(устойчивая I ДЕ
фаза) J ।
Фиг. 3.7. Энергетический барьер при фазовом превращении.
систем эти процессы протекают, по-видимому, быстрее, чем от-
водится теплота плавления. Последняя отводится от растущей
поверхности посредством теплопроводности, конвекции и излу-
чения. В зависимости от условий эксперимента, физических
характеристик и геометрии системы теплота отводится либо
посредством всех перечисленных выше процессов, либо несколь-
кими из них в том или ином сочетании. Например, излучение
практически не играет никакой роли при температурах роста
ниже 800—1000 °C. При выращивании кристаллов металлов или
родственных им по характеристикам материалов (полуметаллов)
вытягиванием из расплава важную роль играет теплопровод-
ность вдоль выращиваемого образца.
При температурах выше 800—1000 °C излучение уже дает за-
метный вклад в теплоотвод, который особенно значителен при
выращивании кристаллов, прозрачных в спектральной области
вблизи максимума на кривой излучения абсолютно черного тела
при температуре выращивания. В этом случае кристалл пред-
ставляет собой своеобразный «светопровод», через который
но
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
теплота «утекает» от растущей поверхности. При выращивании
из расплава совершенство кристалла во многом определяется
формой поверхности роста. Последняя в свою очередь контро-
лируется распределением тепловых потоков в кристалле, рас-
плаве и окружающем пространстве. Поэтому знание процессов
теплопередачи обязательно при выборе оптимальных условий
кристаллизации в конкретной установке.
Строго говоря, кристаллизацию в присутствии воздуха или
инертного газа следовало бы рассматривать как рост в много-
компонентной системе, но на практике система считается одно-
компонентной, если газ не взаимодействует с выращиваемым
кристаллом. В случае выращивания в однокомпонентной системе
из собственного пара (система газ — кристалл) диффузии при-
надлежит важная роль. Газовая среда по сравнению с кристал-
лом столь сильно разрежена, что для поддержания постоян-
ного роста необходим приток строительных частиц к растущей
поверхности из большого объема вокруг кристалла. Средняя
длина свободного пробега, или среднее расстояние, которое
молекула в газе преодолевает до столкновения с другой моле-
кулой, определяет скорость движения частиц в газе к растущей
поверхности. Средняя длина свободного пробега достаточно
точно дается выражением
'•=,>’ (3.9)
где к— средняя длина свободного пробега, р — общее давление,
а — константа, d — диаметр атома или молекулы. Из формулы
видно, что чем выше давление, тем меньше X. Поток частиц ср,
приходящийся на поверхность растущей кристаллической грани
единичной площади, есть функция длины А, и парциального дав-
ления частиц. При выращивании из газовой фазы трудно обеспе-
чить столь же высокие скорости роста, как в других однокомпо-
нентных системах, поскольку этому препятствует диффузия, так
что высокие значения ср сказываются недостижимыми. Повы-
шение парциального давления не решает задачи, поскольку при
этом уменьшается длина X. Лимитирующей стадией при кристал-
лизации рассматриваемого характера могут быть только та-
кие процессы из числа Р1—Р16, в которых не участвуют ни рас-
творитель, ни минерализатор. Растворение при этом следует за-
менить испарением. В атмосфере нереакционного газа в число
возможных лимитирующих факторов следует включить и диф-
фузию последнего от поверхности растущего кристалла. К на-
стоящему времени, как мы увидим ниже, наилучшее соответ-
ствие между экспериментальными данными и теориями роста
кристаллов достигнуто в случае их выращивания из газовой
фазы.
3. кинетика роста кристаллов
111
В многокомпонентных системах связанные с диффузией ста-
дии Pl—Р16 способны играть важную роль при росте по меха-
низмам превращения всех фаз (твердой, жидкой и газовой) в
твердую фазу. Таким образом, каждая из стадий Pl—Р16 может
оказаться существенной во всех случаях. При твердофазной кри-
сталлизации диффузия протекает медленно и часто имеет пер-
востепенное значение. Контролировать рост в таком случае труд-
но, так как в твердой фазе всегда найдется много мест для спон-
танного зарождения.
При росте из многокомпонентной системы в условиях равно-
весия между жидкостью или газом и твердой фазой скорость
диффузии уже не столь мала, но она все еще, как правило, как-
то участвует в стадии, лимитирующей скорость кристаллизации.
К тому же почти всегда важную роль играют реакции на
межфазной границе. Если бы диффузия в объеме была един-
ственным таким лимитирующгм фактором, то скорость роста
кристалла во всех направлениях должна была бы быть одина-
ковой и кристалл приобретал бы сферическую форму.
Ясно, что особенности стадий Р1—Р16 и Д1—Д13 зависят от
системы, в которой идет рост. Так, стадии, связанные с раство-
рителем или минерализатором при выращивании из раствора,
уступают место стадиям, связанным с реагентами, при росте по-
средством химической реакции. Вместо теплоты кристаллизации
или растворения (рост из раствора) при твердофазном одно-
компонентном росте приходится рассматривать теплоту превра-
щения или расстекловывания, а при росте из расплава или
пара — теплоту плавления или сублимации. При росте посред-
ством химической реакции в многокомпонентных системах теп-
лоту кристаллизации заменяет теплота реакции.
Обычно применительно к однокомпонентным или почти
однокомпонентным системам пользуются понятием «переохлаж-
дение», а к многокомпонентным — «пересыщение». Переохла-
ждение АГ определяется соотношением АТ = Тист — ТраВн,
где Уист есть действительная температура, а Травн— равновес-
ная температура (температура плавления). Пересыщение As
определяют как As = сИст — spaBH, где сИст есть действительная
концентрация, a spaBH— равновесная растворимость. В газовых
системах As = рист — Рравн (Рист— действительное давление пара
в системе, а рравн — равновесное давление). Определить пере-
сыщение при химических реакциях гораздо сложнее (это де-
лается с учетом конкретных условий эксперимента). Для одно-
значного определения движущей силы роста при химической
реакции часто пользуются относительным пересыщением, как
оно было определено в разд. 2.10 и 2.11. Оно играет важную
роль и в теориях роста кристаллов.
112
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
3.6. РОСТ КРИСТАЛЛА
КАК ПОСЛЕДОВАТЕЛЬНАЯ РЕАКЦИЯ
Рост кристаллов охватывает много промежуточных стадий, и
почти всегда некоторые из них протекают с сопоставимыми ско-
ростями. Это значит, что конечная скорость роста определяется
всеми такими стадиями. Если слить воедино все стадии на гра-
ницах раздела и предположить, что наблюдаемая скорость роста
определяется только объемной диффузией и реакциями на меж-
фазных границах, то можно вывести уравнение скорости кри-
сталлизации.
Если равновесие на межфазной границе устанавливается
быстро и поверхностные процессы не лимитируют скорости рос-
та, то последняя определяется только объемной диффузией, ско-
рость которой описывается первым законом Фика:
= (3.10)
at ах ’ ' 7
где dmfdt — диффузионное приращение массы растущей поверх-
ности за единицу времени, dcfdx — градиент концентрации в
перпендикулярном к поверхности направлении, D — коэффи-
циент диффузии. А — площадь растущей поверхности.
Обозначив через о толщину диффузионного слоя, через св —
концентрацию в объеме раствора и через спов — концентрацию
непосредственно у растущей поверхности, уравнение (3.10) мож-
но переписать в виде
-^-==^(^-Спов). (3.11)
Обозначив далее через 5? линейную скорость кристаллизации на
поверхности и учтя, что
(3.12)
где р — плотность кристалла, перепишем уравнение (3.11) в виде
Z= ^пов)’ (3.13)
При постоянной толщине в отношение D/в удобно заменить кон-
стантой скорости диффузии kdi после чего уравнение (3.13) за-
пишется в виде
^==~~(^В £пов)« (3.14)
Это уравнение справедливо даже в том случае, когда скорость
реакции на межфазной границе не столь велика, как скорость
диффузии. Если же поверхностная реакция протекает гораздо
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
113
(3.15)
быстрее диффузии, то спов = £равн, где Сравн — рявновесняя кон-
центряция.
Если скорости химического взяимодействия ня межфязной
грянице принядлежит решяющяя роль, то для гетерогенной ре-
якции первого порядкя спряведливо соотношение
din _и л (
— ^//1 (^пов ^равн
где ki — «константя скорости поверхностных процессов». Произ-
ведя соответствующую подстановку, получим
= (^пов ^равя)* (3.16)
Константа в общем случае зависит от кристаллографического
направления роста. Уравнение (3.16) справедливо и в том слу-
чае, когда скорость диффузии сопоставима со скоростью поверх-
ностных процессов. Если же скорость диффузии значительно
превышает скорость таких процессов, то сПов = св.
В случае последовательных реакций концентрацию сПОв мож-
но исключить при переходе от уравнения (3.12) к уравнению
(3.14); тогда
= p[(i/M + (i/W) <Сб ~ Срав“)‘ (3‘17)
Уравнение (3.17) справедливо, когда диффузия и поверхностные
процессы протекают как две последовательные стадии с сопо-
ставимыми скоростями. В уравнении (3.17) скорость зависит,
разумеется, от направления. При больших значенияхk{ это урав-
нение сводится к уравнению (3.14), а при больших значениях
kd — к уравнению (3.16). Если ki и kd имеют постоянные значе-
ния при всех условиях конкретного эксперимента, то
—+ —= 4,
kd kt k
$ = -сравн). (3.19)
Можно допустить, что kd и ki не зависят ни от концентрации,
ни от давления в широких пределах изменения последних, но
изменяются с температурой. Их температурная зависимость, по
крайней мере в первом приближении, выражается урявнениями
Аррениуся
kd = ade~SE*/RT, (3.20)
= (3.21)
114
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
где ad и Gi суть в первом приближении константы, не зависящие
от температуры, а A£j и A£J — энергии активации соответ-
ственно диффузии и гетерогенной реакции (поверхностных про-
цессов). Поскольку A£j обычно составляет около 10 кДж/моль,
а величина А£7 значительно больше, зависит от температуры
сильнее. Очень часто k подчиняется уравнению Аррениуса в
широкой области экспериментальных условий.
3.7. ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ
НА МЕЖФАЗНОЙ ГРАНИЦЕ
Одна из основных трудностей при анализе кинетики роста
кристаллов связана с решением дифференциальных уравнений,
описывающих последовательный рост. Решение такой задачи
весьма сложно при одновременном анализе более чем двух ста-
дий, но особенно большие трудности возникают при рассмотре-
нии процессов на межфазной границе, где стадии реакции труд-
но поддаются экспериментальному изучению1).
Подробный исторический анализ идей в области исследова-
ния кинетики реакций здесь, по-видимому, не уместен. Кабрера
и Франк первыми сформулировали теорию, объясняющую непре-
рывность роста — даже при низких пересыщениях. Они рассмат-
ривают дислокации как источник невырождающихся ступеней
спиральной формы. Их работы [6, 15—19] учитывают и более
ранние теоретические исследования Странского и Фольмера.
Этим представлениям наиболее близко соответствует рост плот-
ноупакованных граней с малыми индексами при выращивании
кристалла из собственного пара при температурах гораздо ниже
температуры плавления. Диффузия при этом не учитывается.
Многие положения теории можно распространить и на более
сложные системы, но основные концепции наиболее полно раз-
работаны именно для подобных условий. Грань с малыми индек-
сами при температуре существенно ниже температуры плавления
остается атомарно-гладкой. Рост таких граней из собственного
пара в однокомпонентной системе можно представить содержа-
щим следующие стадии:
1) присоединение атома к поверхности (адсорбция или хемо-
сорбция);
2) двумерная диффузия атома к ступени;
3) присоединение атома к ступени;
4) одномерная диффузия вдоль ступени к излому;
5) присоединение у излома.
*) Современные представления о стабильности межфазной границы и
о форме кристалла (морфологической стабильности) в значительной мере
базируются на работе Маллинса и Секерки [39].
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
115
При испарении эти стадии следуют в обратном порядке. При
равновесии скорость испарения равна скорости конденсации.
Ясно, что рост возможен лишь в том случае, когда скорость кон-
денсации превосходит скорость испарения.
Если плотность изломов превосходит плотность ступеней, а
скорость двумерной диффузии атома по поверхности соизмерима
со скоростью его одномерной диффузии вдоль ступени, то чет-
вертую и пятую стадии можно исключить из числа лимитирую-
щих факторов. Полагая, что энергия образования излома па
ступени равна приблизительно !/ю энергии испарения1), Франк
вычислил, что при минимальных температурах, обеспечивающих
достаточное для роста кристалла давление пара, изломы на сту-
пени образуются через три-четыре атома.
Двумерная диффузия атома по поверхности и, вероятно, его
одномерная диффузия вдоль ступени должны идти с большими
и сопоставимыми скоростями. По оценке Франка, энергия акти-
вации двумерной диффузии на плоской грани составляет оксло
V20 энергии, необходимой для перевода атома из излома в поло-
жение изолированного атома на поверхности. Таким образом,
одномерная диффузия вдоль ступени и присоединение атома в
изломе обычно не сдерживают скорости роста. Можно показать,
что при давлении пара около 1СН1 МПа (10-10 кгс/см2) среднее
расстояние, которое атом успевает преодолеть в процессе дву-
мерной диффузии до испарения с поверхности, составляет не-
сколько сотен атомных диаметров. Следовательно, атомы посту-
пают к изломам главным образом благодаря поверхностной диф-
фузии, а не прямо из пара.
Таким образом, можно сделать вывод, что при наличии по-
стоянно действующего источника ступеней скорость роста сдер-
живается адсорбцией атомов из пара и их диффузией к ступеням
по поверхности. Когда ступень достигнет края кристалла, необ-
ходима новая ступень. Ее образование начинается с адсорбции
или хемосорбции одиночного атома на поверхности и разви-
вается путем присоединения к нему соседних атомов как к «ост-
рову» на кристаллической грани. Средний «радиус» зародыша г,
с достижением которого такой островок начинает разрастаться,
находят из условия, что вероятность присоединения атома равна
вероятности его отрыва. Это дает
$oY
kT In а ’
(3.22)
9 Эта оценка вытекает из сравнения общей энергии связей атомов на
ступени и в изломе с энергией атомов внутри кристалла. Энергии связей
вычисляют исходя из числа атомов и расстояний до них в первой, второй и
третьей координационных сферах по методу, аналогичному изложенному в
разд. 3.3.
116
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
где So — площадь, занимаемая атомом в слое, у — удельная сво-
бодная краевая энергия зародыша (зависит от его ориентации);
k — постоянная Больцмана; а — относительное пересыщение,
равное отношению давления пара р в системе к его равновес-
ному давлению р0 (а = р/ро). Островок радиусом больше г ста-
нет разрастаться, а при меньших размерах сокращаться.
Уравнение (3.22) представляет собой разновидность уравне-
ний, выводимых для критического размера жидких капель при
их зарождении в паровой фазе. Формирование нового слоя за-
висит от флуктуаций адсорбированных молекул, образующих
зародыш критического размера. Скорость образования таких
зародышей Г выражается формулой
Г = — е-А^кТ, (3.23)
50
где Z — скорость поступления молекул в узлы кристаллической
решетки на поверхности, S — площадь поверхности при условиях
эксперимента, Ло — половина полной краевой свободной энергии
зародыша (энергия активации зародышеобразования). Вели-
чину До вычисляют по формуле
<3-24)
где ср — удвоенная энергия края, приходящаяся на один атом.
Если ограничиться рассмотрением только ближайших соседей,
то ср составляет приблизительно 1/б атомной энергии испарения.
Из уравнений (3.23) и (3.24) можно определить то значение
а, которое необходимо для образования островков со скоростью
Г, составляющей несколько микрометров в месяц. Как следует из
кинетической теории газов, даже при заметных давлениях ско-
рость Z не может значительно превышать 1013с“1. Для кристал-
ла миллиметровых размеров отношение S/s0 не может быть
больше 1014, составляя, как правило, 109. Отсюда легко вычис-
лить, что предэкспоненциальный множитель в уравнении (3.23)
должен быть порядка 1027 —1022; следовательно, чтобы скорость
роста Г составляла около 1 мкм/мес, Ina должен быть равен
хотя бы (ср/6Г)2/90. Отсюда видно, что при разумных значениях
kT отношение р/ро должно быть не менее 25—50% !). Фольмер
и Шульце [5] показали, что при пересыщениях выше 1% ско-
рость роста иода возрастает пропорционально пересыщению и
измеряется десятыми долями миллиметра в час. Такие же высо-
кие скорости роста с их линейной зависимостью от пересыщения
*) Образование зародышей на посторонних адсорбированных частицах
или поверхностных дефектах структуры кристалла может происходить при
существенно меньших пересыщениях. — Прим. ред.
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
117
наблюдались и для других веществ. Подобный же расчет был
проведен еще в 1935 г. Беккером и Дёрингом [20], а затем и дру-
гими авторами. Однако именно Кабрера и Франк первыми по-
казали, что при наличии на грани с малыми индексами спираль-
ной дислокации необходимость в образовании зародыша отпа-
дает, причем при низких пересыщениях такая скорость роста
может достигать конечного значения и должна быть пропорцио-
нальной пересыщению.
При наличии винтовой дислокации процесс роста протекает
как вращение ступени вокруг точки ее соединения с дислока-
цией. Таким образом, кристалл представляет собой как бы один-
единственный геликоидальный слой (фиг. 3.4). Естественно, что
на поверхность кристалла могут выходить несколько винтовых
дислокаций; рост на них может происходить независимо или в
условиях их взаимодействия, что зависит от их векторов Бюр-
герса и расстояний между ними.
Ступень на грани с выходом одной дислокации будет прямой
в условиях равновесия между кристаллом и средой и почти пря-
мой при низких пересыщениях. В пересыщенной среде ступень
продвигается вперед со скоростью и0. При условии, что ступень
остается практически прямой, скорость и0 можно вычислить по
формуле
v0 = 2(a— l)XsZp, (3.25)
где Xs — средняя длина свободного пробега атома по поверх-
ности до момента его испарения; р — коэффициент, обычно рав-
ный приблизительно единице1); / — частота соударения атомов
с узлами решетки на поверхности при равновесии пара с кри-
сталлом.
Справедливость уравнения (3.25) можно доказать следую-
щими рассуждениями. Лишь половина всех атомов, которые
падают на поверхность в примыкающей к данной ступени диф-
фузионной зоне протяженностью Х8, достигает этой ступени за
счет диффузии. Точно так же половина атомов из примыкающей
к ступени зоны протяженностью 2XS попадает в зону протяжен-
ностью Xs, так что ступени достигнет только 1/4 их числа. Следо-
вательно, общее число всех атомов, достигающих ступени с одной
стороны, определится как сумма
zx?
-2^ = ZXs. (3.26)
71=1
9 При росте из растворов, при росте в ходе химических реакций и во-
обще в многокомпонентных системах, а также в системах из крупных не-
сферических молекул коэффициент |3 может быть очень малой величиной,
лимитирующей скорость роста [41—44]. — Прим. ред.
118
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Это число необходимо удвоить, так как атомы диффундируют к
ступени с двух сторон. При равновесии с поверхности испарится
тоже 2ZXS атомов. Если давление пара в системе превышает
равновесное, то скорость продвижения ступени будет опреде-
ляться избытком «поступающих» атомов по сравнению с испа-
ряющимися. Этот избыток учитывается в уравнении (3.25) мно-
жителем (а—1). Множитель р отличается от единицы в том
случае, когда изломы значительно удалены друг от друга или
когда вероятность удержания атома у излома существенно от-
личается от единицы.
а 6
Фиг. 3.8. Развитие спирали.
Прямая ступень со временем искривляется, как это схемати-
чески изображено на фиг. 3.8. На этом рисунке (б) показан вид
на дислокацию сверху на разных стадиях роста. Линия I отве-
чает началу роста конфигурации, изображенной на фиг. 3.8, а,
причем буквой а указан излом. В процессе роста ступень дви-
жется в направлении, показанном стрелкой, и приобретает кон-
фигурацию, обозначенную линией 2. На последующих стадиях
появляются конфигурации 3, 4 и 5. В конечном счете образуется
спираль, по форме близкая к Архимедовой спирали. Атомы при-
соединяются по всей длине ступени с одинаковой скоростью, но
угловая скорость спирали у центра больше. Скорость продвиже-
ния ступени с радиусом закругления рА по Франку равна
v = Vo(I--^Z). (3.27)
где ркр — радиус закругления зародыша критического размера.
Скорость роста рассматриваемой поверхности определяет-
ся как произведение числа витков спирали, проходящих через
данную точку поверхности за единичное время, на высоту сту-
пени d.
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
119
Франк показал, что при незначительном пересыщении
$ = pdz-^, (3.28)
где
а = а — 1 (3.29)
и
а| = 10у4^7’- (3.30)
При значительном пересыщении
$ = ₽dZa. (3.31)
Таким образом, при низком пересыщении зависимость скорости
роста от пересыщения — параболическая, а при высоком — ли-
нейная.
Переход от параболической к линейной зависимости проис-
ходит тогда, когда расстояние между витками спирали стано-
вится меньше 2XS и между ними возникает конкуренция из-за
молекул, поступающих из пара. Вычисления показывают, что в
случае иода такой переход должен совершаться приблизительно
при 10%-ном пересыщении. Это хорошо согласуется с экспери-
ментальными данными Фольмера и Шульце.
3.8. ДВИЖЕНИЕ СТУПЕНЕЙ
Все вышесказанное относится к росту в стационарном ре-
жиме. Рост кристалла до установления стационарного режима
и устойчивость скорости роста при небольших возмущениях рас-
сматриваются в так называемой «кинематической» теории роста
кристаллов [18].
Кабрера создал кинематическую теорию движения ступени
на основе представлений Лайтхилла и Уайтхэма [21], сформули-
рованных ими при анализе транспортного потока по магистра-
лям. Когда скорость роста зависит от плотности ступеней, теория
описывает профиль кристалла и скорость изменения расстояний
между ступенями в процессе роста. Подобно тому как на пере-
груженной магистрали возникают транспортные пробки, на рас-
тущей поверхности возникают скопления ступеней. Такими скоп-
лениями ступеней объясняются видимые (иногда невооружен-
ным глазом) высокие ступени на выращенных кристаллах
(фиг. 3.9). Предпринимались попытки проанализировать другие
возможные ситуации, когда скорость роста зависит не только
от плотности ступеней, но и от других факторов, например ад-
сорбции примесей, но количественный анализ таких ситуаций
очень сложен. На фиг. 3.10, а изображено поперечное сечение
кристалла со ступенями и скоплениями ступеней. Обычно высота
Фиг. 3.9. Фазовоконтрастная микрофотография круглой спирали роста на кри-
сталле SiC (политип 6Н).
Высота спирали, измеренная методом двухлучевой интерференции, равна (15 ± 1) •~10—10м.
С левой стороны показано образование замкнутых петель (почти круглой формы) двумя
дислокациями противоположного знака. На правой половине видна гиперболическая кривая
пересечения двух круглых неравномерно развитых спиралей (Х500).
Скорость роста
Малая Большая
ступеней
ступени или
скопления
ступеней ।—Г*
ступени
Высота
скопления
Фиг. 3.10. Поперечное сечение растущего кристалла со ступенями (а)
И образование спирали при слиянии скоплений ступеней (б).
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
1£1
ступени приблизительно равна периоду решетки кристалла, в то
время как высота скопления ступеней может достигать макро-
скопических размеров. Именно такие группы ступеней мы обыч-
но имеем в виду, когда говорим о «ступенях» и спиралях на кри-
сталлах1)- Ступени и скопления ступеней движутся в направле-
нии, перпендикулярном направлению роста грани, благодаря
чему скорость роста последней определяется как произведение
средней скорости распространения ступени на высоту ступени
или средней скорости скопления на высоту скопления, разделен-
ных на среднее расстояние соответственно между ступенями или
скоплениями. Если первоначально ступени равномерно распре-
делены по поверхности, то их группирование может произойти
только в том случае, когда скорость роста одной из них по ка-
кой-то причине снизилась, так что последующие ступени ее до-
гоняют. Если скопление уже существует, то ступени стремятся
оторваться от него (ступень 1 на фиг. 3.10,а), но при этом они
догоняют предшествующее скопление (ступень 4 на фиг. 3.10, а).
Это объясняется тем, что скорость движения ступени зависит от
площади кристаллической поверхности, с которой молекулы диф-
фундируют к ступени. Так как ступень 1 имеет большую приле-
гающую к ней террасу, она способна обогнать ступени 2 и 3, на
которые молекулы поступают с небольших прилегающих к ним
террас. Ступень 4 имеет большую террасу за собой, но она не
может перегнать медленнее продвигающуюся ступень 3.
Если по тем или иным причинам движение одной из ступеней
замедляется, за ней начинает образовываться сгущение ступе-
ней. Одной из причин замедления движения ступени может
стать адсорбция примесей на поверхности.
Надо заметить, что наличие спирали на поверхности кри-
сталла еще не является доказательством того, что кристалл ра-
стет на дислокации с самого начала. Как отметил Ланг [22],
спиральные ступени могут возникнуть при коалесценции двух
сгущений ступеней, как это изображено на фиг. 3.10,5. На ста-
дии 1 (на фиг. 3.10,6) формируется сгущение одиночных ступе-
ней. На этапе 2 образуется второе скопление ступеней. Форма
скоплений 1 и 2 искривляется из-за их неравномерного продви-
жения по поверхности. Последнее может быть следствием либо
локальных флуктуаций пересыщений, либо адсорбции примесей.
На стадии 3 оба скопления ступеней сливаются в спираль.
Описанный механизм объясняет возникновение спиралей на
кристаллах, выращенных при высоких пересыщениях, когда
*) Торцы макроступеней, представляющих собой скопления элементар-
ных ступеней, не имеют, вообще говоря, ориентации, отвечающей граням с
простыми индексами Миллера, в то время как существуют «истинные» макро-
ступени, торцы которых представляют собой кристаллографические грани с
простыми индексами [41, 45—48]. — Прим. ред.
122
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
преобладает механизм образования зародышей и для роста не
требуется существование самовоспроизводящегося источника
ступеней. Однажды возникнув по рассмотренному механизму,
спираль в дальнейшем действует как самовоспроизводящаяся
ступень.
Образование дислокационных спиралей при низких пересы-
щениях может инициироваться микро- и макроскопическими
примесями, например пылью. Джексон [23] отметил, что при
обычном выращивании кристалла концентрация вакансий в нем
недостаточна, чтобы инициировать зарождение дислокационных
петель, петель частичных дислокаций или дискообразных скоп-
лений вакансий. Однако при закалке кристалла от температур,
близких к температурам плавления, возникает пересыщение
вакансий, достаточное для зарождения дислокаций. Таким обра-
зом, если действует дислокационный механизм роста и исполь-
зуются незакаленные затравки, то дислокации не могут возник-
нуть путем агрегирования вакансий.В ряде случаев образование
дислокаций инициируется растворимыми примесями. Заметим,
однако, что плотность дислокаций в кристаллах, выращиваемых
в тщательно контролируемых условиях, практически не зави-
сит от концентрации в растворе растворимых примесей, в том
числе при таких концентрациях последних, которые достаточны
для возникновения концентрационного переохлаждения и даже
ячеистой структуры (об образовании ячеистой структуры
говорится в разд. 3.13). Возникновение дислокаций могут вызы-
вать термические напряжения, но опять-таки известе^ рост кри-
сталлов по дислокационному механизму даже при максимально
низких температурных градиентах, так что, по-видимому, терми-
ческие напряжения нельзя считать единственной причиной воз-
никновения дислокаций. Методом исключения Джексон пришел
к выводу, что в отсутствие других факторов дислокации за-
рождаются скорее всего на инородных частичках, например ча-
стицах пыли. Поскольку практически невозможно полностью
избежать загрязнения пылью кристаллизационной среды, гомо-
генное зарождение при росте кристалла встречается, по-види-
мому, крайне редко, а в большинстве случаев преобладает гете-
рогенное зарождение на частицах пыли.
3.9. ОБРАЗОВАНИЕ ЗАРОДЫШЕЙ
Без затравки рост кристалла начинается с образования заро-
дыша. Если зародыш образуется на чужой поверхности, напри-
мер на стенке сосуда, или на инородном теле, например на
частичках пыли, зарождение называется гетерогенным. Если
подложка (поверхность, на которой происходит зародышеобра-
зование) по своему строению и межатомным расстояниям по-
3. кинетика роста кристаллов
123
хожа на кристалл, то процесс роста будет напоминать рост на
собственной затравке. Такой процесс называется эпитаксиаль-
ным ростом !). Если же зарождение происходит не на поверхно-
сти, а в объеме жидкости, то оно называется гомогенным.
Известно, что давление пара над каплей малого размера
выше, а растворимость таких капель больше, чем равновесное
давление и растворимость для более крупных капель.
Если радиус сферической капли г возрастает с добавлением
dn молей жидкости на бесконечно малую величину dr, то при-
рост площади поверхности капли составит
4л (г + dr)2 — 4лг2 = 8лг dr. (3.32)
При этом прирост свободной поверхностной энергии равен
AGS = 8лг dr в, (3.33)
где о — поверхностное натяжение. Свободная энергия перехода
dn молекул в каплю составит
kGT = RT\пdn, (3.34)
где Pd — давление пара над каплей, Рр— давление пара над
плоской поверхностью. При равновесии AGs = AGt; следова-
тельно,
dn=-^-dr, (3.35)
где v — молярный объем. '
Приравняв выражения (3.33) и (3.34) и подставив dn, полу-
чим уравнение Кельвина [4], связывающее давление пара Pd
над каплей с давлением пара Рр над плоской поверхностью за-
висимостью
(3.36)
Такое же уравнение связывает растворимость частиц с их раз-
мером:
ЯТ1п4*- = -^- (3.37)
Ор г
Здесь Sd — растворимость мелкого кристаллика, Sp — раствори-
мость плоской поверхности, а — поверхностное натяжение, v —
молярный объем, г —радиус кристаллика. При более строгом
анализе уравнения (3.37) нужно учесть еще зависимость поверх-
ностного натяжения в кристалле от направления, а также внести
поправки, учитывающие наличие углов и граней в кристалле
*) Понятие «эпитаксия» применяется также к росту тонкой пленки на
подложке собственного материала. В частности, под «эпитаксиальным ростом»
часто понимают процессы выращивания тонких пленок посредством химиче-
ских транспортных реакций.
124
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
несферической формы. Эти эффекты становятся существенными
лишь для очень малых кристалликов. Например, для воды [фор-
мула (3.36)] при г=10'4см отношение PdIPp ~ 1,001, а при
r= 10'6 см имеем PdJPp ~ 1,11. Из уравнений (3.36) и (3.37)
следует, что кристаллики малого размера метастабильны и, если
в системе имеются кристаллы крупнее, то они будут расти за
счет мелких.
В некоторых случаях зарождение можно рассматривать как
процесс слияния частиц в системе. Образования из таких частиц
представляют собой предшественников достаточно крупного за-
родыша, способного в дальнейшем разрастаться. Таким образом,
если в той или иной среде образуется зародыш вещества А, то
существует семейство реакций
mA Ат, (3.38)
где т пробегает ряд значений. Когда т и константа равновесия
реакции достаточно велики, зародыш станет разрастаться; в про-
тивном же случае он может вновь раствориться. Образования,
слишком маленькие по своим размерам, чтобы разрастаться при
умеренных пересыщениях, иногда называются дозародышами.
Большинство из них никогда не доживает до стадии роста, но
иногда, то ли благодаря статистическим флуктуациям пересыще-
ния, то ли благодаря локальному повышению энергии, способ-
ствующему росту (например, царапание лабораторного стакана
перемешивающей палочкой, использование ультразвука и т. д.),
некоторые из них превращаются в зародыш. Чем выше пересы-
щение, тем больше средний размер дозародыша и'тем выше ве-
роятность его превращения (благодаря статистическим флуктуа-
циям) в зародыш. При достаточной выдержке всегда существует
конечная вероятность того, что при данном пересыщении возник-
нет зародыш. Естественно, что в присутствии пыли зарождение
носит, как правило, гетерогенный характер и протекает сравни-
тельно легко. При царапании сосуда мешалкой в раствор могут
попадать частички стекла, что делает вероятность образования
центров кристаллизации больше. В действительности присут-
ствие тех или иных частиц при зародышеобразовании в большин-
стве случаев неизбежно.
3.10. ВЛИЯНИЕ СКОРОСТИ РОСТА НА КОНСТАНТУ
РАСПРЕДЕЛЕНИЯ
Кристаллизация в присутствии активатора или примеси (или
рост в любой многокомпонентной системе) сопровождается сег-
регацией (см. разд. 2.5), подчиняющейся уравнению
k as (равн) cs (равн)
а1 (равн) С1 (равн)
(3.39)
3. КИНЕТИКА роста КРИСТАЛЛОВ
125
где £о — константа (коэффициент) равновесного распределения,
Д/(равн) — равновесная активность примеси в жидкой фазе,
^з(равн) — ее равновесная активность в кристалле. В большинстве
случаев (особенно при низких концентрациях) активности можно
заменить концентрациями. Даже при умеренных скоростях роста
концентрация примеси у растущего кристалла, как правило, от-
лична от ее концентрации в объеме. Поэтому целесообразно
ввести эффективную константу (коэффициент) распределения
&Эфф [24, 25] в виде отношения
1 __ cs (ист)
Эфф~ С/(ИСТ)
(3.40)
Здесь с«(ист) и с/(ист) — истинные концентрации примеси в кри-
сталле и жидкости. Бартон и др. [24] показали, что
*эфф = ko(l + k°)e-w™ ' (ЗЛ0
где 91 — скорость роста рассматриваемой грани, t — толщина
диффузионного слоя, D — коэффициент диффузии в текущий мо-
мент времени. Если заменить а/(равн) активностью (или прибли-
женно концентрацией) примеси в жидкой фазе в непосредствен-
ной близости от растущей поверхности, то уравнение (3.39) будет
справедливо даже при быстром росте кристалла *). Для при-
месей, отталкиваемых кристаллом (kQ < 1), концентрация С/(Ист)
непосредственно у растущей поверхности должна превышать
концентрацию в объеме. Следовательно, &Эфф > причем по
мере ускорения роста концентрация примеси у поверхности воз-
растает, а &Эфф приближается к единице. Подобным же образом
легко показать, что в случае k0 > 1 справедливо неравенство
kQ > ^эфф > 1, а коэффициент &Эфф стремится к единице по мере
ускорения роста. В общем случае чем выше вязкость жидкой
фазы, тем меньше коэффициент диффузии; чем интенсивнее пе-
ремешивание раствора, чем ниже содержание примесей в нем
или чем выше коэффициент диффузии примеси и собственных ча-
стиц, тем меньше толщина диффузионного слоя и градиент кон-
центрации в таком слое.
Отметим, что если на растущей грани имеется адсорбирован-
ный слой активирующей или посторонней примеси, то концен-
трация с/(ист) вблизи межфазной границы будет больше, чем в
*) Это утверждение неправильное, так как при достаточно быстром
росте равновесие по отношению к распределению примесей между кристал-
лом и прилегающим к нему слоем среды может и не достигаться. Свиде-
тельство тому можно усмотреть в секториальном строении кристаллов, вы-
растающих в условиях сильного перемешивания. В общем случае под k0
в формуле (3.41) следует понимать неравновесный кинетический коэффициент
распределения примеси [49—52]. — Прим. ред.
126
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
объеме жидкой массы, и £эфф будет больше kQ (kQ определяется
без учета адсорбированного слоя) независимо от того, kQ < 1
или k0 > 1!). При увеличении скорости появятся градиенты кон-
центрации, обусловленные диффузией, что может оказать влия-
ние на концентрацию в адсорбированном слое. В таких условиях
зависимость &эфф от скорости может быть весьма сложной.
3.11. КОНЦЕНТРАЦИОННОЕ ПЕРЕОХЛАЖДЕНИЕ
В многокомпонентной системе растущий кристалл отталки-
вает посторонние компоненты, которые скапливаются перед рас-
тущей поверхностью. Если константа распределения данного
компонента k меньше единицы, то его концентрация у растущей
поверхности будет выше его концентрации в объеме. Наоборот,
при k > 1 компонент поглощается кристаллом и его концентра-
ция у растущей поверхности будет ниже концентрации в объеме.
Таким образом, при k> 1 диффузионный поток компонента на-
правлен из жидкой фазы к кристаллу, а при k < 1 —в обратном
направлении. Как правило, в многокомпонентной системе k
больше единицы для частиц, формирующих кристалл, и меньше
единицы для растворителя. Коэффициенты распределения других
примесей могут иметь любые значения. При очень медленном
росте, осуществляющемся в почти равновесных условиях, влия-
ние диффузии пренебрежимо мало. Однако во многих случаях
диффузия очень важна. Представив в такой системе концентра-
цию примеси как функцию расстояния от поверхности кристалла
(фиг. 3.11), легко видеть, что из-за отталкивания примеси ее
концентрация у поверхности раздела фаз выше ее концентра-
ции в объеме жидкой фазы сь На фиг. 3.12 изображена диаграм-
ма состояния системы кристалл — примесь. Сопоставляя кривую
ликвидуса на фиг. 3.12 и состав из фиг. 3.11, легко построить,
как на фиг. 3.13, график изменения температуры плавления у
растущей поверхности в зависимости от расстояния для разных
составов. Как легко видеть, температура плавления уменьшается
с приближением к поверхности кристалла. Пунктирные линии АВ
и А'В изображают два разных температурных градиента в рас-
творе. При большем градиенте АВ нигде перед фронтом кри-
сталлизации нет переохлаждения; при меньшем градиенте А'В
перед этим фронтом есть область переохлаждения СВ с тенден-
цией к кристаллизации. В области СВ существует концентра-
ционное переохлаждение [26]* 2). Легко видеть, что большие тем-
пературные градиенты, легко достижимые, например, при вытя-
’) Подробнее об адсорбции говорится в разд. 2.5.
2) Представления о концентрационном переохлаждении были сформули-
рованы Г. П. Иванцовым в 1951 г. [53]. — Прим. ред.
Фиг. 3.13. Температура плавления как функция расстояния (концентра-
ционное переохлаждение).
128
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
гивании кристаллов из расплава, ’ослабляют тенденцию к кон-
центрационному переохлаждению.
Особенно остро проблема концентрационного переохлажде-
ния встает в том случае, когда растущая поверхность (или пло-
скости, которыми она огранена) по ориентации сильно отли-
чается от граней, возникающих в почти равновесных условиях.
В подобном случае форма фронта роста легко изменяется и на
нем возникают выступы (см. ниже), ограненные поверхностями
равновесных форм (или по крайней мере гранями с меньшей
удельной поверхностной энергией). При этом гребни выступов
будут находиться в зоне больших переохлаждений (пересыще-
ний), чем углубления между ними. Поэтому скорость роста вы-
ступов будет выше, что и вызывает самопроизвольный дендрит-
ный рост.
Концентрационное переохлаждение, естественно, не играет
большой роли в чистых или почти чистых расплавах (например,
при выращивании кристаллов большей части полупроводников
и окислов неорганических веществ). Однако диффузия и кон-
центрационное переохлаждение могут доставлять неприятности
при высоких концентрациях активаторов (например, при произ-
водстве диодов по методу Есаки [27]) и при выращивании инкон-
груэнтно плавящихся окислов неорганических материалов и дру-
гих соединений, у которых максимальная температура плавле-
ния не соответствует нужной стехиометрии и у которых кристалл
и расплав сильно различаются по составу. Перемешивание рас-
плава уменьшает толщину диффузионного слоя, снижая вероят-
ность возникновения зоны концентрационного переохлаждения.
Но как показал Хэрл [28], концентрационное переохлаждение
возможно даже в перемешиваемых расплавах. При kQ < 1 кон-
центрация примеси или активатора перед кристаллической по-
верхностью возрастает по мере роста и достигает стационарного
уровня Со. Развивая представления Бартона и др. [24], рассмат-
ривавших зависимость &эфф от скорости перемешивания, Хэрл
[28] вывел уравнение, связывающее возникновение концентра-
ционного переохлаждения со скоростью перемешивания.
3.12. ОБРАЗОВАНИЕ ФАСЕТОК
Возникновение фасеток роста в ряде случаев объясняется
избирательной адсорбцией на той или иной кристаллографиче-
ской грани [29]. В этом случае удельная межфазная поверхност-
ная энергия уменьшается, так как процесс не может протекать
при положительном значении AG. Если адсорбция примеси при-
ведет к снижению о для грани с определенной ориентацией, то
для этой ориентации на диаграмме Вульфа возникнет угловая
точка. Следовательно, в соответствии со сказанным в разд. 3.3
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
129
плоская граница в данном направлении будет устойчивее сту-
пенчатой. При выращивании из расплава, в частности вытяги-
ванием кристалла, граница раздела расплав — кристалл часто
искривляется, как на фиг. 3,14, а, следуя форме изотермы,
соответствующей температуре плавления. Если адсорбция воз-
можна по одному из направлений {а}, то в таком направлении
образуется гладкая «фасетка» а — b 1). Гладкий участок будет
иметь такую протяженность, при которой выполняется условие
о cos 0 = аа, где о — свободная поверхностная энергия чистой
грани, оа — свободная поверхностная энергия грани с адсорби-
рованными примесями. Как видно из фиг. 3.14, б, площадь грани
Жидкость
Фиг, 3.14. Граница раздела расплав — кристалл при образовании фасеток.
уменьшается по мере того, как поверхность раздела расплав —
кристалл становится более выпуклой. Площадь грани стано-
вится меньше и при уменьшении угла между направлением ро-
ста и направлением {а}. Образование фасеток затрудняется,
когда изотерма имеет вогнутую форму, поскольку в этом слу-
чае возникающие плоские участки попадают в зону перегрева.
Механизм адсорбции на фасетках предполагает более ин-
тенсивный захват ими примесей в случае их роста. Чаще всего
так и обстоит дело. Однако не всегда связь между содержа-
нием примесей и развитием фасеток прямая. Дикхоф [30] изучал
фасетки {111} на кристаллах германия при их выращивании по
Чохральскому и установил усиление захвата ими примеси. Он
согласен с тем, что &Эфф возрастает (в случае &эфф < 1) по мере
снижения температуры кристаллизации, как это и должно быть,
поскольку для роста плоских участков требуются более высокие
!) Фасетка может формироваться у а — b и без примесей по механиз-
му, рассмотренному в разд. 3.3. Возникнув, она может характеризоваться
ббльшим коэффициентом распределения примесей, чем соседние направления.
130
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
переохлаждения (необходимое возрастание ^эфф очевидно из
рассмотрения типичной диаграммы состояния, подобной, напри-
мер, диаграммам на фиг. 2.3,а или б). Хотя такой механизм и
возможен в действительности в отдельных случаях, более об-
щий характер имеет, видимо, адсорбционный механизм [30]. Об-
разование фасеток может быть связано и с концентрационным
переохлаждением. В данном направлении явно необходимы
дальнейшие исследования.
3.13. ОБРАЗОВАНИЕ ЯЧЕИСТОЙ СТРУКТУРЫ [29J
В условиях концентрационного переохлаждения устойчивость
присуща либо ячеистой, либо дендритной структуре. Если на
гладкой границе расплав — кристалл при наличии зоны кон-
центрационного переохлаждения возникает выпуклый выступ
(фиг. 3.15), то вершины выступов D станут проявлять тенден-
цию к продвижению в расплаве до точек D, где температура
равна температуре плавления. Линия АВ отвечает действитель-
ной температуре раствора, а линия СВ — температуре плавления
сообразно диаграмме состояния. Иными словами, фазовая гра-
ница будет стремиться «врастать» в раствор, чтобы снять кон-
центрационное переохлаждение (область DB — зона концентра-
ционного переохлаждения). Но поскольку поверхность пере-
стала быть плоской, диффузия вдоль боковых сторон способна
подводить растворенное вещество, чтобы устранить концентра-
ционное переохлаждение в областях DF. Форма поверхности кри-
сталла на участках DF самопроизвольно изменится таким обра-
зом, чтобы диффузия вдоль боковых сторон выступов обеспечи-
вала «снятие» концентрационного переохлаждения. Цостав
вдоль DF самопроизвольно придет в соответствие с диаграммой
состояния для данного температурного профиля. Форма ячеек
зависит от температурного градиента, диффузионного поля (раз-
личия концентраций и коэффициента диффузии) и значений сво-
бодной поверхностной энергии в различных направлениях по
поверхности раздела расплав — кристалл. По Тиллеру [29] по-
верхность с увеличением температурного градиента часто при-
обретает характерные морфологические признаки, изображен-
ные на фиг. 3.15,6. При очень высоких переохлаждениях у
фронта кристаллизации ячеистый рост сменяется дендритным,
или папоротникообразным, с длинными выступами в виде вет-
вей, пронизывающих расплав. Морозные узоры на оконных стек-
лах— прекрасный пример дендритов.
Образование ячеистой или дендритной структуры наблюда-
лось при выращивании кристаллов из расплавов1), когда при-
Ч Теория роста кристаллов из расплава рассматривается в работе Дже-
ксона [40].
3. КИНЕТИКА РОСТА КРИСТАЛЛОВ
131
меси образуют водные и неводные растворы, и из газовой фазы
при наличии диффузионного поля. В сообщениях более давних
времен иногда говорилось о неплоских гранях, похожих на «бу-
Форма растущей
поверхности
— Расстояние
Фиг. 3.15. Ячеистый рост.
Ровная
поверхность
_ о °
°о оо
Оо
Дендриты
лыжную мостовую» или усыпанных холмиками роста. Холмики
роста иногда ограняются плоскими гранями.
3.14. КОРРЕЛЯЦИИ С ЭНТРОПИЕЙ
Джексон [31] отметил зависимость между формой поверхно-
стей роста на макроскопических кристаллах и энтропией их
плавления AS (AS = Lf/kT^t, где L/ —скрытая теплота плавле-
ния, k — постоянная Больцмана, ТПл — температура плавления).
Взяв за основу разбиения энтропию AS, можно наметить четыре
следующих класса материалов:
1) AS < 1: изометричный рост, при котором ячейки и ден-
дриты образуются только в присутствии примеси;
132 Р. лодиз. РОСТ монокристаллов
2) 2<AS<C4: рост фасеток, ограненных «псевдодендри-
тами», при достаточной концентрации примесей;
3) AS 4: всегда образуются фасетки;
4) AS 10: как правило, сферолитный рост.
Обнаруженная Джексоном корреляция представляется вполне
естественной. Она сводится к тому, что, чем меньше AS, тем
глаже поверхность роста. Большие значения AS отвечают высо-
кой степени беспорядка, т. е. шероховатости на поверхности ро-
ста с конечной тенденцией к. образованию дендритов, фасеток
и сферолитов. Сферолитный рост (иными словами, радиальный
рост многих кристаллов из одного центра) чаще всего встре-
чается у полимеров, развитие фасеток —у неорганических и
органических веществ (у последних с короткими цепочками).
Подобную корреляцию целесообразнее было бы устанавливать
не по равновесной энтропии AS, а по энтропии реального про-
цесса роста AS *, если бы таковая была известна.
4
РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ
ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ
4.1. МЕТОДЫ ТВЕРДОФАЗНОГО ВЫРАЩИВАНИЯ
КРИСТАЛЛОВ
В гл. 1—3 были изложены основные представления, которые
заложили фундамент для анализа конкретных методов выра-
щивания кристаллов, что и составляет содержание остальной
части книги. В последующих главах материал излагается со-
гласно предложенной нами классификации методов кристалли-
зации. В каждой главе приводятся общие сведения и теоретиче-
ские положения по конкретным методам выращивания, если
они не были изложены раньше. Затем говорится о применении
того или иного метода (а также о необходимом оборудовании,
если оно не стандартное) для выращивания конкретных типич-
ных кристаллов с кратким упоминанием о других кристаллах,
которые удалось вырастить такими методами.
Настоящая глава посвящена анализу твердофазных процес-
сов выращивания кристаллов, часто объединяемых понятием
рекристаллизации. В ней рассматриваются методы рекристал-
лизации как в одно-, так и в многокомпонентных системах,
поскольку независимо от числа компонентов методика и основ-
ные трудности, встречающиеся при выращивании кристаллов
этим путем, во многом сходны. К тому же методы рекристал-
лизации в многокомпонентной системе получили столь ограни-
ченное применение, что выделять их в самостоятельную главу
нецелесообразно.
Существуют пять основных твердофазных методов выращи-
вания кристаллов:
1) рекристаллизация посредством отжига деформации («де-
формационный отжиг»);
2) рекристаллизация при спекании;
3) рекристаллизация при полиморфных превращениях;
. 4) кристаллизация при расстекловывании;
5) рекристаллизация с выпадением преципитатов (growth by
exsolution).
Общие представления об этих методах были изложены в
разд. 2.3.
Остановимся на главных преимуществах твердофазных ме-
тодов выращивания кристаллов. Эти методы позволяют
вести процессы выращивания при низких температурах без
134
Р. ЛОДИЗ. РОСТ монокристаллов
дополнительных компонентов (о преимуществах низкотемпера-
турного роста говорится в разд. 2.1); форма растущего кристал-
ла устанавливается заранее, что позволяет легко выращивать
проволоку, фольгу и т. д.; нередко без труда удается управлять
ориентацией кристаллов. Нужную ориентацию кристаллу при-
дают, изгибая образец так, чтобы его монокристальная область
была правильно ориентирована относительно осей образца. Не-
прерывное прорастание монокристальной области в остальную
часть образца приводит к образованию монокристалла. Еще
одно преимущество рассматриваемых методов (не относящееся к
рекристаллизации с выпадением преципитатов) состоит в том,
что в процессе выращивания распределение примесей и других
дополнительных компонентов в растущем кристалле не ме-
няется и остается таким же, как и в исходном материале, если,
разумеется, не учитывать относительно медленных процессов
диффузии в твердом состоянии. Главный же их недостаток за-
ключается в высокой плотности потенциальных центров твердо-
фазной кристаллизации, трудностях управления зародышеобра-
зованием и, следовательно, выращивания крупных монокри-
сталлов.
4.2. РЕКРИСТАЛЛИЗАЦИЯ В ПРОЦЕССЕ
ДЕФОРМАЦИОННОГО ОТЖИГА
Общие сведения
Если на твердое тело действует какая-либо сила, то оно де-
формируется, т. е. его отдельные участки смещаются относи-
тельно соседних. Из-за межатомного притяжения возникают
противодействующие усилия, которые препятствуют деформа-
ции и стремятся восстановить первоначальную форму образца.
Такие усилия в деформированном теле называют напряжением.
Пространственное изменение твердого тела (изменение формы
или внутреннего строения) под действием приложенных извне
сил называют деформацией. Удлинение (под действием силы
растяжения) или сокращение (под действием силы сжатия)
называют продольной деформацией. Деформацию иногда харак-
теризуют относительным изменением размера образца. Усилию,
отнесенному к единичной площади, соответствует относительное
удлинение (выражаемое в процентах).
При всестороннем сжатии меняется объем тела; относитель-
ное изменение первоначального объема называют объемной де-
формацией. Если к телу приложено скалывающее усилие, то
расстояние, на которое сдвинулись друг относительно друга
слои, отстоящие друг от друга на единичное расстояние, назы-
вают деформацией сдвига. На фиг. 4.1 показано действие ека-
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 135
лывающего (сдвигового) усилия, приложенного к телу. Закон
Гука гласит, что напряжение пропорционально деформации,
пока не превзойден предел упругости, т. е. пока усилия не слиш-
ком велики, так что после их снятия тело восстанавливает свою
первоначальную форму.
Коэффициент пропорциональности между напряжением и де-
формацией для продольной деформации называется модулем
Юнга У; следовательно,
у „Г/Л
1 е/1 ’
(4.1)
где F — сила, создающая деформацию (—F есть противодей-
ствующая сила), А — площадь, е — удлинение, I — длина образ-
Ф и г. 4.1. Скалывающие уси-
лия, приложенные к телу.
Фиг. 4.2. Зависимость удлинения от
растягивающего усилия.
ца. Для большинства технических материалов модуль Юнга из-
вестен. При очень точных вычислениях нужно учитывать зави-
симость У от структуры, степени совершенства, состояния по-
верхности, чистоты, температуры, направления (в монокристал-
лах) и т. д., но при обычных вычислениях можно пользоваться
справочными данными [1—3].
Если построить зависимость F = f(e) для какого-нибудь ма-
териала, то, как показано на фиг. 4.2, закон Гука выполняется
лишь на участке до точки а. При больших усилиях материал
после снятия напряжения не восстанавливает свою первона-
чальную форму, т. е. пластически деформируется. С переходом
за точку b (предел текучести) образец начинает значительно
удлиняться и для сохранения деформации на постоянном уровне
растягивающее усилие приходится снижать. После растяжения
образца до определенной степени в точке с (точки а, b и с
обычно располагаются друг к другу ближе, чем показано на
фиг. 4.2) материал способен выдерживать возрастающую
136
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
нагрузку вплоть до точки d, после чего он разрушается в точке
е. Деформация при росте кристаллов в процессе деформацион-
ного отжига обычно ограничена участком ab, который должен
иметь достаточную протяженность, но все же сравнительно да-
леко отстоять от точки е, чтобы допускать экспериментальное
осуществление такого отжига. Для создания нужной движущей
силы рекристаллизации напряжение на участке ab (функция У)
тоже должно быть достаточно большим. Приближенные значе-
ния модуля Юнга, предела упругости и предела прочности при
комнатной температуре для наиболее распространенных мате-
риалов можно узнать из справочников. Когда полных данных
нет, приближенной мерой предела упругости может служить
прочность материала при растяжении. Для неметаллических ма-
териалов (за исключением хлористого серебра и хлористого тал-
лия) предел прочности обычно настолько близок к пределу
упругости, что длительно деформировать их кристаллы практи-
чески невозможно.
Деформационным отжигом чаще всего пользуются для выра-
щивания кристаллов металлов. Исходным материалом обычно
служит затвердевшая в изложнице заготовка. Такая отливка
представляет собой поликристаллическую массу. Зародыши об-
разуются либо хаотично у стенок изложницы, либо в какой-то
определенной области расплава в зависимости от температур-
ного градиента при охлаждении. Поэтому зерна могут иметь
либо произвольную, либо, преимущественную ориентацию. Если
слиток предназначается для изготовления прутка, тонкого или
толстого листа, проволоки и т. д., то следующей операцией
должно быть деформирование металла. Когда материал меха-
нически деформируют, возникает пластическая деформация, ме-
няется форма зерен, возникают дислокации и иногда двойники,
наблюдаются сдвиги. Очень часто существенно меняются проч-
ность и твердость, особенно если материал обрабатывают при
температуре гораздо ниже температуры рекристаллизации. Та-
ким образом, холодная обработка приводит к деформационному
упрочнению (нагартовыванию) материала. Среди способов об-
работки металлов обычны прокатка, волочение, ковка и экстру-
дирование. На фиг. 4.3 показана структура исследуемого образ-
ца после его вытягивания в проволоку.
Многие исследования по рекристаллизации и укрупнению
зерна были проведены на алюминии. Низкой температуре плав-
ления алюминия (660° С) соответствует и низкая температура
его рекристаллизации, что облегчает проведение экспериментов.
Зерна на поверхности металлов обычно выявляют травлением.
Зернистую структуру алюминия-выявляют травлением в плави-
ковой кислоте. Как видно из фиг. 4.3, зерна в проволоке после
волочения ориентированы таким образом, что их длинные оси
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 137
располагаются по направлению протяжки. Если материал под-
вергают деформации в определенном направлении, то и кри-
сталлиты обычно вытягиваются в том же направлении !). К тому
же деформация обычно способствует частичному упорядоче-
нию по направлению разориентированных до этого кристалли-
Ф и г. 4.3. Дебаеграмма вытянутого в проволоку сплава 4% Мо — 79% Ni —
— 17%Fe (отражение на малых углах).
В отсутствие преимущественной ориентации (текстуры) каждое кольцо на дебаеграмме
должно было бы иметь одинаковую интенсивность по всей окружности.
тов. Плоскости скольжения и направления скольжения стремят-
ся принять ориентацию, параллельную направлению деформиро-
вания. Такая преимущественная ориентация называется тексту-
рой. Последняя часто сохраняется при последующей рекристал-
лизации.
Один из способов получения поликристаллического образца
с высокой степенью ориентации кристаллитов состоит в том, что
*) Удлинение зерен выявляется даже травлением, но такое удлинение
еще не служит доказательством предпочтительной ориентации, или текстуры,
для установления которой нужны рентгеновские исследования.
138
Р. ЛОДИЗ. РОСТ монокристаллов
монокристалл подвергают обработке. При этом отдельные кри-
сталлиты имеют очень близкую кристаллографическую ориенти-
ровку, поскольку она определяется ориентацией исходного мо-
нокристалла. Если кристалл обрабатывается таким образом, что
нагрузка прикладывается фактически в одном или немногих
направлениях, то получаются поликристаллы с высокой сте-
пенью ориентации зерен. В таких случаях говорят о четкой тек-
стуре.
Образец, подвергнутый пластической деформации, стано-
вится сильно напряженным, благодаря чему в нем образуется
большой запас «упругой энергии». Из уравнения (2.9) видно,
что изменение свободной энергии при деформировании кри-
сталла приблизительно равно совершенной работе за вычетом
энергии, выделившейся в виде теплоты. Эта свободная энергия
обычно служит главным источником движущей силы рекристал-
лизации при деформационном отжиге.
Большая доля упругой энергии сосредоточивается в скопле-
ниях дислокаций у границ зерен. Свободная поверхностная энер-
гия границ зерен тоже вносит свой вклад в общую свободную
энергию. Подобно тому как для малых частиц характерна вы-
сокая растворимость и высокое давление паров, малым кри-
сталлитам присуща большая поверхностная энергия. Однако та-
кой вклад в движущую силу рекристаллизации играет важную
роль только в случае очень маленьких кристаллитов. К тому
же энергия границ зерен зависит от их взаимной ориентации.
Кристаллиты с малой энергией границ, обусловленной их благо-
приятной ориентацией, проявляют тенденцию к разрастанию за
счет неблагоприятно ориентированных соседних кристаллитов.
Поэтому движущая сила рекристаллизации AG при деформа-
ционном отжиге выражается в виде
bG = w-q + Gs + M^ (4.2)
где w — работа, затраченная либо на умышленное деформиро-
вание, либо на обработку материала при его изготовлении (боль-
шая доля w приходится на границы зерен), q — выделившаяся
теплота, Gs — свободная поверхностная энергия, AG0 — раз-
ность между свободными энергиями зерен данного образца с
существующим набором ориентаций и зерен какой-то иной ори-
ентации. При сокращении площади зерен в материале умень-
шается запас его свободной энергии. Деформированный обра-
зец термодинамически неустойчив в отличие от недеформирован-
ного. При комнатной температуре скорость снятия деформаций
обычно очень мала. С повышением температуры возрастает под-
вижность атомов и амплитуда^колебаний атомов около узлов
решетки, что заметно ускоряет снятие деформаций. Цель отжига
и состоит в таком ускорении. Таким образом, в процессе отжига
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 139
зерна укрупняются, происходит первичная рекристаллизация,
причем этот процесс протекает тем быстрее, чем выше темпе-
ратура.
Росту зерен способствует когерентность атомов по обе сто-
роны растущих границ и мешают примеси в решетке и на гра-
ницах. Количественно оценить эти влияния трудно. Ясно, однако,
что для роста зерен атомы должны двигаться; при прочих рав-
ных условиях рост идет легче, еслгх на границе имеется на-
столько точное совпадение, или когерентность, атомов, что для
роста требуется лишь их небольшое перемещение. Примеси же,
препятствующие движению в решетке или через границы, ме-
шают росту.
Иногда при промышленном производстве материала в нем
возникают достаточно большие деформации, отжиг которых при-
водит к значительному укрупнению зерен. Но чаще для выра-
щивания крупных кристаллов требуется предварительная де-
формация материала в лабораторных условиях с его последую-
щим отжигом1). Как правило, требуются даже несколько цик-
лов деформирования и отжига. Если исследовать зависимость
скорости роста зерен от длительности отжига (фиг. 4.4), она
быстро убывает со временем, поскольку с укрупнением зерна
движущая сила быстро ослабевает. Такие процессы называют
первичной рекристаллизацией, нормальным или непрерывным
ростом, нормальным укрупнением зерна или коалесценцией.
Но иногда при продолжительном нагреве отдельные зерна
начинают расти за счет других. В итоге весь образец может ока-
заться состоящим всего из двух-трех крупных зерен. Такой про-
цесс называют вторичной рекристаллизацией. Исходную мелко-
зернистую матрицу получают первичной рекристаллизацией.
Рост нескольких крупных кристаллов, иногда называемый чрез-
мерным, неравномерным или аномальным ростом зерен, рассмат-
ривается несколько дальше. Рост отдельных зерен может про-
исходить и посредством укрупнения уже существующих или
вновь образующихся зерен, которые растут в процессе отжига.
При твердофазном росте можно произвести «затравливание»
ввариванием в поликристаллический образец крупного зерна,
которое станет расти за счет соседних небольших зерен.
Рост зерен происходит благодаря перемещению межзерен-
ных границ, а не посредством захвата наиболее подвижных
*) Без предварительного деформирования движущая сила рекристалли-
зации создается деформациями, возникающими при изготовлении материала,
свободной поверхностной энергией, малыми размерами частиц и ориентацион-
ными эффектами. Рост кристаллов в процессе отжига такого образца лучше,
вероятно, отнести к методам выращивания при спекании, хотя этим понятием
обычно пользуются применительно к неметаллам, исходные деформации в
которых, как правило, малы.
Фиг. 4.4. Рост зерен в алюминии в зависимости от длительности отжига [4, 5],
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 141
атомов или молекул, как при росте по механизмам жидкость —
кристалл (ЖК) или пар — кристалл (ПК). При этом движущая
сила роста черпается из избыточной свободной энергии границ
зерна. Граничная энергия может рассматриваться как своеобраз-
ное межфазное натяжение между кристаллитами; укрупнение
зерен уменьшает это натяжение. Отсюда ясно, что рост зерен
за счет многочисленных малых зерен должен происходить бы-
стро, тогда как рост за счет отдельных зерен лишь немного
меньшего размера должен протекать медленно. Рост крупного
зерна за счет маленьких иллюстрируется на фиг. 4.5. Если через
0s/s обозначить межфазное натяжение между малыми зернами,
а через os/l — между малым и большим зернами, то справед-
ливо следующее неравенство:
A^s/lcts/l < kAs/s^sis, (4.3)
где Aj4S/5 — изменение площади границ между зернами малого
размера и ДЛ5/^—изменение площади границ между малым и
большим зернами. Если предположить, что зерна имеют округ-
лую форму и что диаметр большого зерна равен Z), то
ДЛ5/5 = ^-м (4.4)
и
ДЛз/ь = лДП, (4.5)
142
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
где и —число малых зерен, соприкасающихся с большими зер-
нами. Если же d— средний диаметр маленького зерна, то
„„ (4.6)
d d
поскольку в числителе стоит длина окружности, проведенная
через центры малых зерен, a D d. Подстановка соответствую-
щих значений в уравнение (4.3) дает следующее условие роста
зерна:
2о" о и d
D > slL-. (4.7)
Qs/s
Смит [6] и Бюргерс [5] тоже вывели уравнение (4.7)!).
Приведенные уравнения не предполагают анизотропии по-
верхностных энергий. В действительности же межзеренные гра-
ницы характеризуются значениями о, зависящими от ориентации
зерен и положения плоскости границы относительно зерен. Гра-
ницы могут быть либо большеугловыми, либо малоугловыми,
характеризоваться разным взаимным поворотом и наклоном.
При росте крупных кри-
сталлов важна подвиж-
ность границы, скорость
движения которой & оп-
ределяется формулой [5]
(4.8)
А
где R — радиус кривиз-
ны границы, о—межфаз-
ная энергия и М — под-
вижность. Площадь гра-
ницы уменьшается при
движении по направле-
нию радиуса кривизны,
как это показано на фиг.
4.6. В зависимости от
формы поверхности зерен перемещение границы может вклю-
чать их сдвиг, или скольжение, а также движение дислокаций.
Если для этого требуется движение отдельных атомов, то при
температурах, далеких от температуры плавления, процесс бу-
дет протекать медленно.
Наличие тонкозернистой четкой текстуры с отдельными бо-
лее крупными кристаллами, обладающими незначительной раз-
f) Остальная часть данного раздела в значительной степени опирается
на обзоры Бюргерса [5] и Оста [7].
Фиг. 4.6. Движение границы, обусловлен-
ное ее кривизной [4, 5].
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 143
ориентацией, способствует вторичной рекристаллизации. Если
материал характеризуется четкой текстурой, то большая часть
кристаллов обладает определенной преимущественной ориента-
цией. Таким образом, движущая сила рекристаллизации обус-
ловлена снятием деформации, разностью размеров зерен и раз-
личием ориентации растущих кристаллов, так что в уравнении
(4.2) параметры w, Gs и AG0 все имеют большие значения.
В частности, даже после рекристаллизации энергия Gs и прира-
щение Дб0 все еще достаточно велики, чтобы создать значи-
тельную движущую силу. Следствием развитой текстуры бывает
рост лишь отдельных кристаллов под действием направленной
движущей силы.
Не исключено, что во многих случаях рост зерен происходит
и без образования новых центров кристаллизации. Ими служат
уже существующие зерна. Действительно, одна из задач управ-
ления кристаллизацией посредством деформационного отжига
заключается в предотвращении роста во многих местах потен-
циального зародышеобразования. Однако при определенных
условиях отжига наблюдается зарождение новых зерен и
именно такие зерна растут впоследствии за счет поглощения со-
седних. Один способ анализа такой ситуации состоит в том,
чтобы рассмотреть те участки в решетке, которые в конечном
итоге могут стать твердофазными аналогами зародышей. Для
этого локальный участок (дозародыш) должен становиться
больше и достигнуть таких размеров, когда он уже станет играть
роль зародыша. Движущая сила подобного процесса роста зерен
обычных размеров создается разной их ориентацией и неодина-
ковыми размерами. В деформированной кристаллической мат-
рице у границ зерен, где обычно происходит зародышеобразова-
ние, дополнительным важным источником движущей силы слу-
жит разность внутренних энергий, обусловленная неодинаковой
плотностью дислокаций. Поэтому участки, относительно свобод-
ные от дислокационных сеток, будут расти за счет областей
с высокой плотностью дислокаций. В полигонизованных *) образ-
цах существуют бездислокационные участки, отличающиеся от
соседних по ориентации, которые способны стать быстрорасту-
щими зародышами. Принято думать, что инкубационным пе-
риодом зародышеобразования в некоторых системах служит
время, требующееся для генерирования дислокаций в деформи-
рованной области, которые нужны при последующей полигони-
зации. На фиг. 4.7 изображена схема образования нового зерна
на межзеренной границе. На фиг. 4.8 показаны способные к росту
участки, порождающие полигонизацию. Как известно, примеси
задерживают движение границ зерен и тем самым препятствуют
*) Полигонизация рассматривалась в разд. 1.3.
144
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
росту образующихся или уже существующих зародышей. При-
меси, препятствуя движению дислокаций, способствуют их ло-
кализации и образованию участков с высокой и низкой плотно-
стями дислокаций, помогая тем самым росту дозародышей.
Образующиеся в некоторых системах новые зародыши обычно
быстро растут за счет существующих кристаллитов и часто рас-
пространяются на большую часть
образца. По достижении таки-
ми зародышами определенных
размеров их преимущество по
движущей силе роста перед су-
ществовавшими с самого начала
кристаллитами сходит на нет. Эго
объясняется тем, что зародыши
стали соизмеримыми с зернами,
за счет поглощения которых
росли. Теперь уже их рост не
дает по сравнению с ростом пре-
жних кристаллитов никакого вы-
игрыша в снятии деформаций.
Чтобы обгонять по скорости ро-
ста своих соседей, подросшие
зародыши должны обладать бо-
лее благоприятной ориентацией
по сравнению со старыми зер-
нами. Это особенно верно для
материалов с сильно развитой
текстурой. В таких образцах поч-
Ф и г. 4.7. Схема образования за-
родыша на межзеренной границе.
ти все прежние зерна сильно
ориентированы. Поэтому вновь
образующийся зародыш с выиг-
рышной ориентацией имеет большое преимущество в отношении
дальнейшего роста.
На практике при деформационном отжиге предварительно
проводят ряд экспериментов, чтобы подобрать оптимальную, или
критическую, деформацию, необходимую для образования в про-
цессе отжига одного или самое большее нескольких зерен. Как
правило, достаточна деформация в пределах 1 —10%. Критиче-
скую деформацию контролируют обычно с точностью не выше
±0,25%. Критическую деформацию для того или иного мате-
риала определяют на конических образцах, поскольку под дей-
ствием растягивающего усилия в них автоматически возникает
градиент деформации. При последующем отжиге можно выявить
область наилучшего роста и вычислить в ней деформацию по
площади поперечного сечения и растягивающему усилию. Как
показано на фиг. 4.9, отжиг очень часто осуществляют опускц-
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 145
нием образца через зону температурного градиента (аналогично
методу перекристаллизации по Бриджмену — Стокбаргеру, рас-
сматриваемому в разд. 5.3, но с обратным градиентом) из хо-
лодной зоны в горячую. В той части образца, которая первой
входит в горячую зону, начинается ускоренный рост зерен, ко-
торый при оптимальных условиях способен привести к разви-
тию единственного зерна по всему поперечному сечению. Чтобы
ускорить начальное зарождение, участок А (фиг. 4.9) иногда
предварительно перед отжигом сильно деформируют (например,
путем сжатия).
Дислокации разместились
по малоугловым границам
Бездислокационная область
может разрастаться за счет
областей с дислокациями
Фиг. 4.8. Полигонизация.
Как уже отмечалось, наличие текстуры обычно способствует
рекристаллизации, хотя иногда, если растущий кристалл ориен-
тирован в двойникующем положении по отношению к текстуре,
он не растет за счет тонкозернистой матрицы. Это объясняется
тем, что для определенных двойникующих положений ориента-
ционная движущая сила минимальна. Двойникование и «вклю-
чения» с различными ориентациями наблюдаются очень ча-
сто. Двойникование присуще материалам с малой энергией
дефектов упаковки. Если встречаются отдельные кристаллиты
гораздо более крупных размеров, чем соседние, то они образуют
«включения», потому что в процессе роста растущие зерна не
способны их поглотить. Когда матрица настолько мелкозерни-
ста, что отжиг даже недеформированного образца приводит к
укрупнению зерен, в начальный период, пока движущая сила
значительна, будут расти многие зерна. В то же время на
146
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
последующей стадии роста движущая сила станет недостаточ-
ной, чтобы вызвать разрастание какого-либо одного зерна за
счет его соседей. По Бюргерсу [5] оптимальный поперечник зер-
на обычно составляет 0,1 мм.
Двойникованием иногда управляют, повышая энергию де-
фекта упаковки введением примесей или выбором матрицы с
сильно развитой текстурой. Такая матрица «пожирается» кри-
сталлитом, ориентация решетки которого не столь сильно отли-
чается от ориентации матрицы, чтобы сделать двойникование
возможным и не столь близ-
Направление<
движения |
Мелкие
зерна
Моно-
кристальное
зерно
Температура
Фиг. 4.9. Отжиг в поле температур-
ного градиента.
ка к последней, чтобы сделать
движущую силу поглощения
матрицы слишком малой.
Неметаллические кристал-
лы выращивать посредством
деформационного отжига го-
раздо сложнее, чем кристаллы
металлов, главным образом из-
за того, что их трудно дефор-
мировать пластически. Дефор-
мация обычно приводит к по-
явлению трещин, что ограни-
чивает рост зерен размерами,
которые возможны в процессе
отжига с движущей силой, об-
условленной главным образом
разницей величины частиц (в
процессе спекания). Высокая
чистота способствует укрупне-
нию зерен и препятствует образованию такой структуры, кото-
рая нужна в процессе вторичной рекристаллизации. В некото-
рых случаях, когда материал обладает высокой степенью чисто-
ты, крупные кристаллы образуются при первичной рекристал-
лизации. Трудности с деформированием неметаллов часто
делают такой способ единственно возможным.
Установлено [7], что максимальный размер зерен пропорцио-
нален толщине образца. Это объясняется тем, что в местах вы-
хода границ зерен на поверхность образуются канавки терми-
ческого травления [8]. На фиг. 4.10,а показана такая канавка,
образовавшаяся на границе ABCD между зернами. Термические
канавки образуются при температурах, обеспечивающих высо-
кую подвижность поверхностных атомов. Движущая сила'их
образования создается благодаря сокращению площади межзе-
9 Двойникование может происходить, когда двойник по ориентации
ближе к текстуре, чем последняя к растущему кристаллу.
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 147
ренных границ, которое происходит при возникновении канавок.
Большая величина межфазной свободной энергии границ зерен
обычно делает образование канавок термического травления
легким делом при температурах, близких к температуре плав-
ления. Такие канавки обычно закрепляют границы зерен, по-
скольку их уход от канавок должен был бы сопровождаться
увеличением площади этих границ, по крайней мере до тех пор,
пока граница С'4 не составит с нормалью СА угол больше 0
(фиг. 4.10,6). Другие условия перемещения границы рассмотрел
Маллинз [8], который к тому же вывел формулу, показывающую,
что рост зерен замедляется с
приближением их размера к
толщине образца. Качественно
это легко проиллюстрировать
следующими рассуждениями:
как только размер зерна до-
стигает толщины образца,
большая часть зерен должна
вый'1И на поверхность, где их
дальнейший рост будет сдер-
живаться собственными канав-
ками термического травления.
Но даже при этих условиях
отдельные зерна способны про-
должать расти за счет сосед-
них, если их удельная поверх-
ностная энергия меньше (на
Фиг. 4.10. Канавки термического тра-
вления.
несколько процентов), чем у поглощаемых ими соседей. В зави-
симости от направления удельная поверхностная энергия изме-
няется на несколько процентов, благодаря чему даже в тонких
образцах с канавками термического травления благоприятнее
всего ориентированные зерна способны поглощать своих со-
седей.
Миграция малоугловых границ зерен — особенно мощное
средство выращивания кристаллов посредством рекристалли-
зации. Этот метод применяется почти исключительно к метал-
лам, но иногда им можно пользоваться и для неметаллов.
В большинстве случаев кристаллы, выращиваемые из расплава
или паровой фазы, как правило, обладают заметной мозаич-
ностью или малоугловыми границами зерен. Свободная энергия
у безмозаичного образца меньше, чем у образца с мозаичной
структурой, что благоприятствует исчезновению мозаичности:
если в очень чистом мозаичном кристалле в процессе отжига
образуются безмозаичные зерна, то такие зерна обычно легко
разрастаются за счет остального материала. Свободные от мо-
заичности зерна можно создать деформированием небольшого
148
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
участка и последующим рекристаллизационным отжигом. Если
наварить безмозаичный кристалл на мозаичный образец, то
можно осуществить контроль за ориентацией образующегося
безмозаичного материала.
Оборудование для деформационного отжига
Деформационный отжиг не требует специального оборудо-
вания, кроме стандартного, имеющегося в металлургической
лаборатории. Для этого необходимы отжиговые печи, обеспечи-
вающие различные температурные градиенты и скорости охлаж-
дения или нагрева в разных атмосферах. Как правило, тре-
буются приспособления для прокатки образцов, их деформи-
рования путем сжатия, растяжения, кручения, а также для
вытягивания проволоки.
Вопросы обработки металлов достаточно подробно освещены
в специальной литературе [9, 1].
В случае металлов исходный материал еще при изготовле-
нии часто подвергают предварительной обработке, которая вли-
яет на характер последующего роста кристаллов. Исходным ма-
териалом служат отливки (слитки), поковки, прокат, проволока
и т. д. С особенностями таких заготовок, а также с необходи-
мым при выращивании кристаллов лабораторным оборудова-
нием рекомендуется ознакомиться по специальным пособиям и
тематическим обзорам [1, 9—16].
Рост кристаллов в процессе деформационного отжига
1. Алюминии. Благодаря низкой температуре отжига алюми-
ния рост его кристаллов в процессе деформационного отжига
изучен довольно полно. В исходном алюминии размер зерна
должен составлять около 0,1 мм. По Бакли [17], первые опыты по
росту кристаллов в процессе деформационного отжига относятся
еще к 1912 г. Карпентер и Элам [18] первыми полностью описали
условия роста кристаллов алюминия при деформационном от-
жиге. Чтобы снять остаточные деформации в исходном мате-
риале и обеспечить требуемый размер зерен, они отжигали при
550°С алюминий 99,6%-ной чистоты. Они предварительно де-
формировали недеформированный мелкозернистый алюминий с
обжатием на 1—2%, а затем отжигали его, постепенно нагревая
от 450 до 550 °C со скоростью 25°С/сут. Иногда проводился
окончательный часовой отжиг при 600 °C [17].
В ряде случаев зародышеобразование при отжиге' происхо-
дит преимущественно на поверхности образца. Грэхем и Мад-
дин [19] полагают, что зародыши в алюминии приурочены к
скоплениям дислокаций под поверхностной окисной пленкой.
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 149
Стравливание поверхностного слоя на глубину около 100 мкм
после создания критической деформации предотвращает по-
верхностное зародышеобразование.
После первичного отжига проводят так называемый восста-
новительный отжиг при более низкой температуре в целях
уменьшения числа зерен и ускорения их роста при последующем
деформационном отжиге. Такой отжиг в течение 4 ч при 320 °C
с последующим нагревом образца до 450 °C и выдержкой в те-
чение 2 ч при этой температуре позволяет выращивать кристал-
лы длиной до 15 см в проволоке диаметром 1 мм [20].
Наилучшие результаты дает, однако, отжиг в поле темпе-
ратурного градиента. Для тонких прутков удовлетворительные
результаты обеспечивает продольный градиент в печи около
20°С/см [21]. При отжиге листов и изделий иной формы необхо-
димо контролировать еще и радиальные градиенты температуры
в нескольких точках поперечного сечения, чтобы предотвратить
зародышеобразование.
В алюминии чистотой свыше 99,99% напряжение, по-види-
мому, снимается главным образом благодаря полигонизации
и образованию малоугловых границ зерен, а не посредством
рекристаллизации. Поэтому градиентный отжиг приводит к не-
значительному росту кристаллов; Неожиданно выяснилось, что
отжиг в изотермических условиях способствует росту кристаллов
в должным образом деформированном алюминии высокой чи-
стоты [22]. Следы лития (~0,04%) и железа (~0,035%) спо-
собствуют легкой рекристаллизации алюминия, вероятно, бла-
годаря закреплению дислокаций и предотвращению полигони-
зации [23].
Развитая текстура тоже помогает росту кристаллов алюми-
ния. Ломмель [24] (см. также [7]) приготовлял алюминий для ре-
кристаллизации холодной прокаткой при температурах, близ-
ких к температуре жидкого азота, за которой следовал отжиг
при 640 °C в течение 10 с с последующей закалкой в воде. Такой
образец состоял из зерен размером до 2 мм и был сильно тек-
стурирован. Затем полоску предварительно деформировали и
отжигали протягиванием через поле температурного градиента.
После этого образец нагревали до 640 °C. Кристаллы достигали
длины ~ 1 м.
Монокристальные полоски алюминия высокой чистоты шири-
ной до 2,5 см Лейли и Перкинс [25] сравнительно легко приго-
товляли чередованием операций деформирования и отжига. Де-
формации были незначительными, чтобы подавить образование
новых зародышей. Отжиг проводили при 640 °C.
В случае слабой текстурированности исходного образца алю-
миния предсказать ориентацию образующегося при отжиге
монокристалла нельзя. При наличии же текстуры ориентация
Таблица 4.1
Кристаллы, выращенные посредством деформационного отжига
Материал (чистота) Предварительная деформация и другие виды предварительной обработки Критическая дефор- мация Условия выращивания и отжига Примечания Лите- рату- ра
Алюминий Отжиг сильно на- 1—3%-ным растя- Медленное нагрева- [18, 19]
(99,6%) Алюминий клепанного образца при 550 °C несколько часов (основные при- меси Fe и Si; листы толщиной 3 мм и ши- риной 2,5 мм или ци- линдры диаметром 2,5 см) Проволока жением (деформа- цию измеряли с точ- ностью ±0,25%; электрополировкой удаляли поверхно- стный слой на глу- бину 75 мкм) 4%, «возврат» ние до 450—550 °C со скоростью 15—20°С/сут Нагревание до 450 °C Монокристаллы [20]
(99,5%) Алюминий (99,99%) Полоса (1,2 см X XI мм X 5 см) Пруток (3 ммХбсм) Для подавления по- лигонизации специаль- но вводили 0,04% Li или 0,035% Fe при 320 °C в течение 4 ч за 1 ч и выдержка 2 ч при этой температуре (в условиях темпера- турного градиента) 10 см/мин через печь с градиентом (осе- вым и радиальным) температуры Продольный градиент 20 °С/см При обработке как для 99,6%-ного алю- миния тенденция к по- лигонизации сильнее, чем к росту длиной 15 см и в поперечнике 1 мм [33] [21] [22, 23]
Алюминий (99,993%) Холодная прокатка с большим обжатием при —196 °C и отжиг 10 с при 640 °C с закалкой в воде; сильная тек- стура, способствующая ростовому отжигу; зер- но в поперечнике не- сколько миллиметров Критическая де- формация 4 см/ч через печь с температурным гра- диентом 100°С/см; на- гревание до 640 °C Кристаллы длиной ~1 м [24]
Алюминий (99,99%) Чередование дефор- мирования и отжига до образования зерен 5 мм в поперечнике Недостаточная, чтобы вызвать за- рождение новых зерен Выращивание при 640 °C посредством принудительной мигра- ции межзеренных гра- ниц Листы шири- ной до 2,5 см [25, 34, 35]
Алюминий <0,5% Ag) 15 мин при 500 °C 2% 6,5 см/ч — 90 °С/см [7]
Алюминий (4,5% Си, 1,3% Si, 4,2% Ge, 4,5% Mg, s,6% Ag) Мгновенный отжиг при температуре на 10 °C ниже ТПл сплава 1,25% На 10—30 °C ниже Тпл сплава, 0,5 см/ч, резкий температурный градиент [36]
Медь Деформацион- ный отжиг часто приводит к двой- никованию из-за малой энергии дефектов и двой- никовых границ (такие же труд- ности возникают с Pb, Ag и дру- гими г.ц.к.-метал- лами) [32]
Продолжение табл. 4.1
Материал (чистота) Предварительная деформация и другие виды предварительной обработки Критическая дефор- мация Условия выращивания и отжига Примечания Лите- рату- ра
Медь Отожженную мед- ную полосу прокаты- вали с обжатием на 90% при комнатной температуре Без специального деформирования; рост практически по механизму вто- ричной рекристал- лизации Медленное нагрева- ние до 1000—1040 °C с выдержкой несколько часов [7]
Медь (электро- литическая) Холодная прокатка с обжатием на 95%; от- жиг при 600 °C в тече- ние 10 ч, чтобы силь- но текстурировать; вы- травливание участков с неблагоприятной ори- ентацией Без специального деформирования; рост практически по механизму вто- ричной рекристал- лизации Отжиг при темпера- туре ~ГПЛ (72 ч при 1030 °C) [37]
Золото Холодная прокатка Без специального Нагревание после Обычный де- [38]
:Си — до 1 % Zn Си-0,2% А1 Си-0,1 % Cd Си-0,1 % О Ni — 1 % Мп Fe- 30-100% Ni Некоторые соста- вы в системе Fe—Ni—Си Возможно, Pt с обжатием на 80— 95%, чтобы сильно текстурировать деформирования; рост практически по механизму вто- ричной рекристал- лизации первичной рекристал- лизации формационный отжиг приводит к двойникованию (как и в других г.ц.к.-материа- лах); трудности с выращиванием кристаллов вы- соколегирован- ных сплавов
Железо <<99,99%) Необходимо обезуг- лероживание до уров- ня С 0,1% С отжигом 3%-ным растяже- нием; лучше, если критическая дефор- Отжиг при темпера- туре ниже 910 °C, за- тем выдержка при [39-41]
Железо
(+99,99%)
Железо (99,9%)
в атмосфере влажно-
го Н2; нужны зерна в
поперечнике ~0,1 мм;
оптимальное обжатие
при прокатке прибли-
зительно на 50% в ва-
кууме; прутки после’
холодной обработки
давлением нагреть до
700 °C и закалить в
воде
Добавить 0,035% С;
в менее чистом желе-
зе нужна концентра-
ция 0,01% С; можно
присадить 0,03% Si, но
нельзя допускать обез-
углероживания при ро-
стовом отжиге; наугле-
роживать 4 ч ацетиле-
ном при 920 °C
Горячекатаную мяг-
кую сталь (лист тол-
щиной 3,18 мм или
пруток диаметром
12,7 мм) обезуглеро-
дить при 950 °C и вы-
держать 48 ч в Н2; мед-
ленно охладить или
выдержать 2 недели
при 750 °C в атмосфе-
ре влажного Н2
мация локализована
в малом объеме ма-
териала; малая ско-
рость деформации
(~0,01 %/ч) предо-
храняет от образо-
вания полос Людер-
са и неоднородно-
сти деформации;
превышение преде-
ла текучести зат-
рудняет равномер-
ное деформирова-
ние; поверхностный
слой снимать элект-
рополировкой или
травлением
2%, если 0?06% С
5%, если 0,02 7о С
3%, если 0,035% С
3%
880 °C в Н2 в течение
72 ч, полезен отжиг в
условиях температур-
ного градиента (о кон-
струкции печи см. [42])
Углерод необходимо
сохранять достаточно
долго, чтобы не допу-
стить полигонизации,
но удалить из конеч-
ного продукта
72 ч при 880 °C
Обычный де- формационный отжиг ведет к полигонизации [43.44]
[71,45]
Продолжение табл. 4.1
Материал (чистота) Предварительная деформация и другие виды предварительной обработки Критическая 'деформация Условия выращивания и отжига Примечания Лите- рату- ра
Армко-железо (-99,9%) Отжиг В Нг при 950 °C менее 24 ч 3% 72 ч при 850 °C в Нг [43, 46]
Fe — 3% Si Толстый лист выдер- жать 20 ч в Нг при 870 °C 2,5% 1150 °C, 1 см/ч, 1000 °С/см [42]
Fe —0,15% Р Отжиг для роста зе- рен (~ 700 мм-2) 3% с последую- щей химической обработкой 800 °C, 1 см/ч в ус- ловиях резкого темпе- ратурного градиента [21]
Fe—Al «6%) Обезуглероживание прутка при 900—970° С 2,4% 800—1000 °C в тече- ние 1—2 сут [47]
Fe - 18% Сг — -8% Ni Холодная обработка давлением с обжатием на 70%; 1 ч рекри- сталлизации при 1000 °C 2,5 % Быстрое нагревание до 1350 °C, 100 ч вы- держки при этой тем- пературе (1200 °C для Fe —20% Сг) [48]
Молибденовая Механическая поли- Без критической Нагревание до Кристаллы [49,50]
проволока Молибденовые прутки малого диаметра ровка деформации (моди- фикация методики Андраде) 1000 °C в печи и по- вышение ее темпера- туры до 1700 °C про- пусканием тока; про- гон горячей зоны вдоль проволоки перемеще- нием печи Постоянный темпе- ратурный градиент в печи, выдерживаемой 7 ч при 2000 °C сантиметровых размеров [51]
Молибденовые . Предварительный от- Деформирование Отжиг, как и в пре- Стерженько- [51]
прутки большого диаметра жиг на 1 % в процессе ростового отжига дыдущем случае вые кристаллы длиной до 1,2 см
Ниобиевые пру-
тки диаметром
3 мм и длиной
18 см
Отжиг при 2000 °C
в течение 2—4 ч при
осевом растяжении
менее 2%
Танталовая (99,9 %) проволока Отжиг при 1800 °C несколько минут 2—3% 2200 °C; опускание со скоростью 0,3—
диаметром 5—40 мм Торий (иодид- ный) Титан (-99,9%) Брусок (2,5 X Ю X X 0,75 см) дугового переплава осаживали в холодном состоянии на 5% и нагревали до температуры на 50 °C выше температуры фа- зового превращения Образцы вырезали с преимущественной ори- ентацией по плоскости прокатки 1,5—2,0%-ным ра- стяжением или 0,25—1,0%-ным по- перечным сжатием 1 см/ч через темпера- турное поле с резким градиентом j Опускание со ско- ростью 1,5 см/ч через температурное поле с градиентом 225 °С/см Отжиг в аргоне в течение 200 ч при 860 °C
Титан—13% Мо Прутки диаметром 0,1 см Нагревание до 1600 °C, томление 30 мин, закалка на холодном листе
Кристаллы
длиной около
1 см (так же мож-
но выращивать
и кристаллы мо-
либдена)
Кристаллы
с отношением
длины к диамет-
ру ~100
Зерна размером
2,5X1,3X0,75 см
Легко двойни-
куется (важно
не допустить
никакого воздей-
ствия О2 и N2)
Образуется
p-фаза с неболь-
шой потерей Мо;
следы а-фазы
устраняются
нагреванием до
1000 °C и закал-
кой в воде, раз-
мер кристаллов
приблизительно
равен диаметру
прутков
152]
[53,54]
[55]
[56]
[57]
Продолжение табл. 4.1
Материал (чистота) Предварительная деформация и другие виды предварительной обработки Критическая деформация Условия выращивания и отжига Примечания Лите- рату- ра
Вольфрам — Нитевидная прово- Проволоку протяги- Лучше всего [58, 59]
2% ThO2 лока, спрессованная из порошка, приготовлен- ного восстановлением WO3 с 2% ThO2 вали через зону с тем- пературой 2000— 2200 °C в сухом водо- роде, резкий темпера- турный градиент пригодны прово- лочные образцы; монокристаллы метровой длины; ThO2 предотвра- щает рост слиш- ком многих зе- рен; кристаллы загрязнены ThO2 (модификация процесса Пинча)
Вольфрам Добавляли несколь- Проволоку протяги- Кристаллы [60-64]
(99,99%) Вольфрам (99,99%) ко процентов KzSiOs и А1С1з к WO3, вос- станавливали смесь и изготовляли проволоку ~23 мм Проволока диа- метром 0,075—0,25 вали через зону с тем- пературным градиен- том, как и в предыду- щем случае, или на- гревали до 2300 °C в сухом водороде и за- тем перемещали вдоль проволоки градиент со скоростью 0,4—4 см/ч с последующим нагре- ванием до 2700 °C для поглощения мелких кристаллов По методу Николса (движущийся гради- длиной 1 см; примеси удаляли специальной об- работкой [65,63, 66]
Уран
Уран
небольшое пласти- ческое скручивание ент) Роби] рен) или шона по методу (рост зе-
Лист прокатывали при комнатной темпе- ратуре с большим об- жатием, чтобы создать сильную текстуру пер- вичной рекристаллиза- ции при содержании около 3,510~3% С; от- жиг в области стабиль- ности a-фазы; быст- рое нагревание до 650 °C со скоростью 100°С/мин, выдержка при этой температуре в течение около 10 ч Без специального деформирования; рост практически по механизму вто- ричной рекристал- лизации Отжиг при 650 °C в течение 48 ч Образуются кристаллы а-ура- на [67]
Необходима преиму- щественная ориентация матрицы 6% 650 °C В уране ультра- высокой степени чистоты рост кристаллов a-фазы не проис- ходит; Фишер описал способ контроля за ро- стом кристаллов, позволяющий укрупнять от- дельные зерна [67-70]
158
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
растущего кристалла должна быть определенным образом свя-
зана с текстурой, которая способствует росту. По-видимому, хо-
роший рост наблюдается только при определенной ориентации
текстуры, поскольку во многих случаях ориентация текстуры
такова, что ни одна из возможных ориентаций монокристалла не
обеспечивает достаточной движущей силы для поглощения дан-
ным кристаллом исходной матрицы. Скорость роста монокри-
Фиг. 4.11. Крупный кристалл алюминия, выращенный посредством дефор-
мационного отжига.
сталла в алюминии достаточно высока при отклонении ориен-
тации текстуры от направлений (111) не более чем на 40° [26].
Кристаллы алюминия посредством деформационного отжига
выращивались и другими исследователями [27—30]. В табл. 4.1
указаны условия проводившегося ими отжига.
На поверхности образцов часто встречаются мелкие кри-
сталлы, оставшиеся непоглощенными в процессе монокристаль-
ного роста. Это двойники или небольшие разориентированные
участки, разделенные малоугловыми границами зерен. Такие
кристаллы образуются либо при слишком большом первона-
чальном размере зерен (из-за длительного или высокотемпера-
турного предварительного отжига), либо при недостаточно
продолжительном или низкотемпературном окончательном рос-
товом отжиге (из-за недостатка времени для поглощения по-
верхностных кристаллов),
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 159
Кристаллы, тщательно выращенные в процессе деформацион-
ного отжига, отличаются удивительным совершенством. Так как
для алюминия характерны большие энергии плоских структур-
ных дефектов упаковки и двойниковых границ, отжиг ведет к
образованию кристаллов без двойников. Гинье и Тенневэн [31]
исследовали рентгеновским методом кристаллы алюминия, вы-
ращенные путем особо тщательного деформационного отжига,
и не обнаружили в них блоков с' заметной разориентацией. В ти-
пичных случаях кристаллы алюминия, выращенные посредством
деформационного отжига, имеют разориентацию блоков менее 1'.
В исходных материалах чистотой выше 99,997% образования
субструктуры избежать труднее. Как правило, в них наблю-
дается разориентация порядка нескольких градусов. Отсутствие
закрепляющих примесей, вероятно, облегчает полигонизацию.
На фиг. 4.11 показан кристалл алюминия, выращенный посред-
ством деформационного отжига.
2. Медь. В меди при деформационном отжиге проявляется
тенденция к образованию двойников, по-видимому, благодаря
малой энергии дефектов упаковки [32].
Однако вторичная рекристаллизация позволяет вырастить
кристаллы меди удовлетворительного качества. Напомним, что
под вторичной рекристаллизацией подразумевается рост в мат-
рице нескольких зерен, образовавшихся при первичной рекри-
сталлизации. Вторичная рекристаллизация осуществляется от-
жигом деформированных образцов в области температур выше
температуры первичной рекристаллизации. Как правило, вто-
ричную рекристаллизацию меди проводят следующим об-
разом. \
1. Отожженную полоску меди прокатывают при комнатной
температуре в одном направлении с обжатием приблизительно
на 90%.
2. Образцы медленно нагревают в вакууме до 1000—1040 °C
и выдерживают при этой температуре 2—3 ч.
Первая операция приводит к образованию четкой текстуры,
которая поглощается одним или несколькими кристаллами в
процессе нагревания и выдержки в вакууме. Очень быстрое на-
гревание в ходе этой операции приводит к образованию двой-
ников. Иногда перед началом вакуумного отжига образец спе-
циально исследуется и зерна с нежелательной ориентацией
удаляют травлением (если они на поверхности образца) пли ме-
ханически (если они расположены близко к краю полосы).
В кристаллах меди, выращенных и отожженных при оптималь-
ных условиях, субграницы по методу Шульца (см. разд. 1.4) не
обнаруживаются [6]. В табл. 4.1 приводятся дополнительные дан-
ные о режиме выращивания кристаллов меди.
160
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
3. Железо. Эдварс и Пфейль [17, 71], вероятно, первыми
вырастили кристаллы железа методом деформационного отжига.
Этим способом удается выращивать кристаллы железа удовлет-
ворительного качества, но условия выращивания сильно зави-
сят от чистоты исходного материала. Железо с содержанием
свыше 0,05% углерода (мягкая сталь) не рекристаллизуется.
Для рекристаллизации требуется его обезуглероживание в вос-
становительной атмосфере (до концентрации углерода ~0,01 %).
Проще же взять армко-железо или железо вакуумного пере-
плава (99,99%). Оптимальный размер зерен в исходном мате-
риале составляет около 0,1 мм. Как правило, образцы предвари-
тельно прокатывают с обжатием на 50% и затем реформируют
(~ на 3%) растяжением [7]. Для лучшего контроля за образо-
ванием зародышей целесообразно локализовать область крити-
ческой деформации [40]. После создания критической деформа-
ции поверхностные слои стравливают или удаляют электрополи-
ровкой. Затем образец отжигают 72 ч при 880—900 °C. Отжиг
в поле температурного градиента, по-видимому, улучшает ка-
чество материала [39, 42]. Иногда после окончания ростового от-
жига поверхностный поликристаллический слой образца необхо-
димо стравить, чтобы выявить крупные кристаллы.
В очень чистом железе (существенно выше 99,99%) отчетливо
проявляется тенденция (как и в случае алюминия) к полигониза-
ции, благодаря чему выращивание крупных кристаллов прихо-
дится проводить специальными технологическими приемами. Ча-
ще всего в этом случае в металл добавляют углерод и затем
образцы отжигают в восстановительной атмосфере, чтобы
удалить большую часть углерода из выращенных кристал-
лов [7].
По-видимому, существует тенденция к росту сдвойникован-
ных кристаллов с преимущественной ориентацией. Аллен и др.
[41] отметили преобладание направлений, близких к (011). Кри-
сталлы с заданной ориентацией выращивались по методу Фудзи-
вары [27, 39, 72]. В этом методе один конец образца, в котором
предварительно создана критическая деформация, помещают в
отжиговую печь с температурным градиентом. Через некоторое
время рост прерывают и образец разрезают таким образом, что-
бы монокристальное зерно с нужной ориентацией превалировало
на поверхности роста. Затем образец изгибают так, что это
«затравочное» зерно в процессе последующего отжига вызывает
развитие нужной ориентации в остальном объеме стержня. Спе-
циальные технологические приемы позволяют выращивать кри-
сталлы с требуемой ориентацией по всему объему образца: уда-
лось даже вырастить стержень, содержащий всего лишь два
монокристалла [73]. В табл. 4.1 обобщены способы выращива-
ния кристаллов железа.
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 161
4. Другие материалы. Однофазные алюминиевые сплавы очень
легко кристаллизуются в процессе деформационного отжига.
Их кристаллизация являет собой наглядный пример твердофаз-
ного роста в многокомпонентной системе. Некоторые другие
многокомпонентные системы, в которых проводилось выращи-
вание кристаллов, перечислены в табл. 4.1. Поскольку при
отжиге плавление не происходит, то исключена и сегрегация от-
дельных компонентов, благодаря чему выращенные монокристал-
лы сохраняют состав исходного слитка. Достаточно полная ре-
кристаллизация достигается только при высоких температурных
градиентах во время ростового отжига, причем градиент дол-
жен быть тем выше, а скорость роста тем ниже, чем больше кон-
центрация сплавообразующих элементов. В сплавах алюминия
с цинком при содержании последнего в интервале 6—15% по-
лигонизация мешает росту, если не присадить к ним, скажем,
0,15% железа [22]. Количество железа, необходимое для подав-
ления полигонизации в сплавах очень чистых алюминия и цин-
ка, гораздо выше, чем в случае чистого алюминия [7].
Монокристаллы в вольфрамовой проволоке легко выращи-
ваются по методу Пинча [59, 17]. Проволоку протягивают, пере-
матывая с одной катушки на другую, через печь при температуре
около 2500 °C. Продавленная через фильеру проволока лучше
холоднотянутой, так как она не нуждается в предварительном
деформировании. При скоростях роста до 3 м/ч в отожженной
проволоке образуются монокристальные участки большой длины.
В табл. 4.1 обобщены условия выращивания кристаллов различ-
ных не рассмотренных здесь материалов посредством деформа-
ционного отжига.
4.3. ВЫРАЩИВАНИЕ КРИСТАЛЛОВ ПОСРЕДСТВОМ
СПЕКАНИЯ
Под спеканием подразумевается нагревание плотного поли-
кристаллического тела. В процессе спекания движущая сила
роста зерен создается главным образом следующими источни-
ками: 1) остаточными деформациями [эд в уравнении (4.2)];
2) ориентационными эффектами [Gs в уравнении (4.2)]; 3) влия-
нием размера зерен [Дб0 в уравнении (4.2)].
В неорганических материалах более важными источниками
надо считать, по-видимому, ориентационные эффекты и влияние
размера зерен, потому что большие (неразрушающие) деформа-
ции в них невозможны. Понятие спекание обычно употребляется
для описания процессов роста зерен в неметаллах. Если же рост
зерен протекает при нагревании поликристаллического металли-
ческого тела, то процесс обычно рассматривается как своеобраз-
ный деформационный отжиг, при котором образцы деформируют
не специально, а в самом процессе изготовления исходного
t>. ЛОДЙЗ. Рост МОНОКРЙСТАЛЛОЙ
(62
материала. Следовательно, ряд металлических систем, рост зе-
рен в которых можно по формальным признакам рассматривать
как спекание, фактически уже был рассмотрен в разд. 4.2. По-
этому в настоящем разделе обсуждение ограничивается спека-
нием одних неметаллов, хотя в ряде случаев упоминаются и
металлы.
Кристаллы гранатов размером до 5 мм удавалось выращи-
вать спеканием поликристаллического порошка иттрий-желези-
стого граната Y3Fe50i2 при температурах выше 1450 °C [74].
Образование довольно крупных зерен медно-марганцевого
феррита наблюдалось Харрисоном [75]. Посредством спекания
выращивали довольно крупные кристаллы ВеО [76], А12О3 [77] и
Zn [78, 7]. В общем пока что спеканием эффективнее всего вы-
ращиваются кристаллы в неметаллических системах. Не исклю-
чено, что это объясняется меньшей изученностью воможностей
выращивания кристаллов металлов посредством спекания из-за
наличия иных эффективных способов. Бурке [79] установил, что
неорганические керамические материалы гораздо пористее ме-
таллов и что поры подавляют рост всех зерен, кроме отдельных,
которые и разрастаются в пористом материале до больших раз-
меров. Присадки, например MgO к А12О3 [80] или Ag к Au [78],
способны препятствовать спеканию, но они могут и ускорять
рост зерен, как это происходит, например, при присадке ZnO к
Zn [78]. Механизм действия этих присадок не ясен. Несомненно
влияние первоначального размера зерен. Спекание мелкозерни-
стой окиси алюминия А12О3 проходит с трудом, но «затравки»
несколько помогают росту [7].
Спекание под давлением называется горячим прессованием.
Этот процесс обычно используют для уплотнения керамических
материалов. При производстве последних большой размер зе-
рен, как правило, нежелателен, поскольку множество мелких
кристаллов обеспечивают характерную для керамики изотроп-
ность свойств. При горячем прессовании давление должно быть
достаточно большим, чтобы обеспечить уплотнение материала, а
температуру выбирают таким образом, чтобы, с одной стороны,
обеспечить необходимую скорость исчезновения пор, а с дру-
гой, — она не должна быть столь высокой, чтобы вызвать замет-
ную миграцию границ зерен. Горячее прессование особенно
эффективно для MgO и А12О3. Постепенное повышение темпера-
туры в процессе прессования может приводить к заметному ро-
сту зерен при спекании, в результате чего часто образуются моно-
кристаллы, которые могут оказаться полезными. Остаточные
деформации w в уравнении (4.2) можно увеличить до уровня,
достигаемого ими при деформационном отжиге. При горячем
прессовании продольное сжатие или растяжение часто более
эффективно, чем всестороннее давление. Лодиз [81] наблюдал
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 163
рост зерен ZnWO4 при отжиге с одновременным сжатием, а Сел-
лерс и др. [82] по аналогичной методике выращивали кристаллы
AI2O3 объемом до 7 см3.
При выращивании посредством деформационного отжига
значение w в уравнении (4.2) обусловлено деформацией, остаю-
щейся в образце из-за дефектов, образовавшихся при пластиче-
ском деформировании материала, после снятия деформирующего
усилия. Из фиг. 4.2 видно, что остаточное напряжение на образце
после снятия деформирующего усилия должно быть гораздо
меньше Fb. Если предел упругости не превзойден (как правило,
неметаллы тогда разрушаются), то сила, создающая wf может
приблизиться к Fa. Поскольку Fa « Fb, a Fb вносит малый вклад
в w после снятия деформирующего усилия, деформация w будет
больше в том случае, когда усилие поддерживается на образце
и в процессе отжига. Этот метод для металлов может быть даже
более эффективным, чем деформационный отжиг, а для неметал-
лов является по существу единственным. Такой подход был
использован Лодизом [81] при выращивании кристаллов ZnWO4,
а также Селлерсом и др. [82] для AI2O3.
Вообще говоря, спекание малоэффективно в целях выращи-
вания кристаллов. Кристаллизация здесь не является само-
целью, а анализируется лишь для изучения процессов, протекаю-
щих при спекании, причем отдельные кристаллы образуются бо-
лее или менее случайно при изготовлении керамики.
4.4. РОСТ КРИСТАЛЛОВ ПРИ ПОЛИМОРФНЫХ
ПРЕВРАЩЕНИЯХ
Чтобы вырастить монокристалл нужной модификации в про-
цессе полиморфного превращения, необходима соответствующая
методика для предварительного получения исходной полиморф-
ной модификации в виде монокристалла. Таким образом, поли-
морфный переход по существу представляет собой второй этап,
следующий за первоначальным выращиванием. Как показывает
практика, когда можно, целесообразнее сразу выращивать нуж-
ную полиморфную модификацию. Тем не менее известен ряд
примеров, когда посредством полиморфного превращения уда-
валось выращивать монокристаллы. Некоторые основные пред-
ставления о полиморфных превращениях были изложены в
разд. 2.3. Для осуществления фазового перехода необходимо
варьировать давление или температуру, а иногда и оба эти пара-
метра одновременно. Обычно изменяют температуру при нор-
мальном давлении1).
*) Наиболее важное для практики исключение составляет переход гра-
фит — алмаз. Однако и в этом случае, по всей вероятности, рост монокри-
сталлов в большинстве случаев происходит из раствора.
164
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Если полиморфные превращения связаны с незначительным
изменением симметрии (см. разд. 2.3), часто возможно провести
монокристалл через фазовый переход без возникновения поли-
кристаллов, двойников, больших деформаций и других дефек-
тов 9. В случае же переходов, связанных со значительным из-
менением симметрии, часто возникают дефекты упаковки и
политипия; при этом нельзя даже гарантировать сохранение
монокристальности образца. Без растворителей такие системы
обычно метастабильны. Таким образом, чем больше различаются
между собой по структуре две фазы, тем труднее вырастить мо-
нокристалл твердофазным способом. Обычно температуру под-
держивают постоянной вдоль всего кристалла, а подъем и пони-
жение температуры осуществляется для всей печи в целом. При
этом часто наблюдается зарождение новой фазы одновременно
во многих точках матрицы, что приводит к образованию двойников
или поликристаллов. Ясно, что гораздо целесообразнее было бы
инициировать зарождение новой фазы в каком-либо одном месте,
а затем обеспечивать возникшему зародышу главную роль в
создании фазовой границы между модификациями. Таким
образом, хотя это и не принято, но полиморфный переход эффек-
тивнее осуществлять методом, аналогичным методу Бриджме-
на— Стокбаргера при выращивании кристаллов из расплава
(см. разд. 5.3). Кристалл, помещенный в одном конце печи, сле-
довало бы перемещать через зону с температурным градиентом
или же двигать печь относительно неподвижного кристалла.
Обычно сначала выращивается высокотемпературная моди-
фикация, а затем медленным снижением температуры вызы-
вается зарождение полиморфной модификации, устойчивой при
нормальных условиях. Иногда с помощью закалки удается сохра-
нить высокотемпературную полиморфную модификацию в обла-
сти стабильности низкотемпературной. Если скорость перехода
высокотемпературной полиморфной модификации в низкотемпе-
ратурную невелика, то первая может сохраняться при комнат-
ной температуре неопределенно долго. Примером может слу-
жить алмаз.
Железо
При атмосферном давлении в железе происходят следующие
фазовые превращения [1]:
910 °C 1400 °C 1539 °C
а ч —у < А -<—* расплав.
9 Рост совершенного ограненного монокристалла в теле другой поли-
морфной модификации исследован для ряда органических кристаллов (окси-
гидроантрацен, гексахлорэтан, парадихлорбензол, глутаровая кислота) в ра-
ботах А. Н. Китайгородского, Ю. В. Мнюха и их сотр. [114—118].
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 165
Таким образом, a-Fe невозможно получить при температуре
выше 910 °C, а высокотемпературные модификации трудно охла-
дить ниже температуры фазового превращения с сохранением
монокристальности. Протягиванием с нужной скоростью прово-
локи через область с температурным градиентом удавалось вы-
ращивать монокристаллы a-Fe по механизму превращения
у —► a [83, 49].
Уран
Для урана при атмосферном давлении характерны следую-
щие фазовые превращения [1]:
-670 °C ИЗО °C
а ч —р ~ > расплав.
Мерсье и др. [84] выращивали кристаллы a-фазы из исходной
p-фазы, пропуская ее через печь с температурным градиентом,
но кристаллы были низкого качества. Весьма совершенные кри-
сталлы удавалось выращивать отжигом дефектных кристаллов
a-фазы с критической деформацией при температуре ниже тем-
пературы фазового превращения.
Кварц
При атмосферном давлении для SiO2 наблюдаются следую-
щие фазовые превращения [85]:
573 °C 867° С 1470 °C
a-кварц ч^-- > p-кварц ч- тридимит ч=^
< ~ > кристобаллит -> расплав.
Известно несколько метастабильных форм тридимита и кри-
стобаллита [85]. Кварц имеет также несколько метастабильных
полиморфных модификаций [86]. К тому же при высоких давле-
ниях существуют по крайней мере две полиморфные фазы SiO2—
коэсит и стишовит [86]. Последние обнаружены в метастабиль-
ном состоянии при обычных условиях и, следовательно, могут
быть выращены при повышенных температурах и давлениях и
затем закалены с сохранением их структуры Бинормальных усло-
виях. Во многих случаях, особенно когда переход через кривую
фазового равновесия проведен без соблюдения достаточных
предосторожностей, образуются не качественные кристаллы, а
двойники или даже поликристаллический материал.
Значительные усилия были направлены на решение пробле-
мы раздвойникования a-кварца посредством твердофазного
превращения. В монографии Классен-Неклюдовой [87] рассмат-
риваются виды двойников кварца и процессы раздвойникова-
ния. Проблему раздвойникования исследовали и другие авторы
[88—92, 119*].
166
Р. ЛОДИЗ. РОСТ монокристаллов
Один из предложенных методов [92] заключается в нагрева-
нии сдвойникованной пластинки до температуры выше темпера-
туры превращения с последующим медленным охлажде-
нием p-кварца до температуры ниже температуры инверсии.
Если при этом зародышеобразование a-фазы начнется в одной
точке, то можно надеяться на образование крупного несдвойни-
кованного кристалла. Более надежный метод состоит в отжиге
пластинки при температуре ниже температуры превращения
а—► р, причем образец подвергают действию скручивающего на-
пряжения. Затем пластинку медленно охлаждают до комнатной
температуры. В итоге можно получить образцы со свободной от
двойников областью, охватывающей всю площадь пластинки.
Для такого процесса нужны напряжения ~2 кгс/мм2. Способ-
ность кварца к раздвойникованию анизотропна [92]. Кристалло-
графическая ось с направляется перпендикулярно длинному
ребру пластинки, а крутящий момент прикладывается по отно-
шению к ее длинной оси.
Эффективность кручения при монокристаллизации зависит
от ориентации кристалла, но знак прикладываемого крутящего
момента (по часовой стрелке или против часовой стрелки) не
играет существенной роли. Пластины, использованные Томасом
и Вустером [92], имели типичные размеры 45X30X4 мм, а де-
формирование обычно длилось 3 ч. Скручивающее напряжение
поддерживается и при охлаждении кристаллов. Наблюдаемый
эффект не зависгт от того, была ли действительная температура
выше или ниже температуры превращения а — 0. Ориентация
кварцевой пластинки задается тремя ориентационными углами,
показанными на фиг. 4.12. Полезные в пьезоэлектрических при-
ложениях оси обозначают также буквами X, Y и Z [8G], сохраняя
обозначения а и с за обычными кристаллографическими осями.
Как видно из фиг. 4.12, Х(а) есть электрическая ось. Некоторые
авторы совмещают Y с осью а. [86]. Углы <р и 0 определяют нор-
маль к пластине, ф — угол поворота пластины от выбранного
исходного положения вокруг ее нормали. Буквой Р на фиг. 4.12
указано направление перпендикуляра к пластине, a L — направ-
ление длинной оси пластины. На фиг. 4.13 иллюстрируется лег-
кость раздвойникования для пластин при ф = 0 [92]. При темпе-
ратуре 450 °C длина радиуса-вектора обратно пропорциональна
раздвойниковывающему крутящему моменту.
Поскольку скорость и направление движения двойниковой
границы не зависят от знака прикладываемого напряжения,
можно заключить [92], что скорость движения двойниковой гра-
ницы должна зависеть от квадрата приложенного напряжения.
Упругая энергия есть функция квадрата напряжения (или де-
формации), благодаря чему двойниковая граница движется так,
что кристалл подвергается максимально возможной деформации
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 167
при данном деформирующем усилии, т. е. так, чтобы запасенная
в ней упругая энергия была максимальной. Детальный анализ
условий достижения этой энергией максимума позволяет пред-
сказать ориентационную зависимость легкости монокристалли-
зации при скручивании [92].
Раздвойниковывание скручиванием и другие полиморфные
твердофазные превращения под действием напряжений возмож-
ны только тогда, когда полиморфные модификации структурно
С
I
Фиг. 4.13. Легкость раздвой-
никования кварца в зависи-
мости от ориентации.
близки, так что превращение не требует образования или раз-
рыва связей, а одна форма достаточно отличается от другой по
запасу упругой энергии.
Кристаллы LaA103, выращенные по методу Чохральского,
двойникуются при температуре фазового перехода кубической
модификации в ромбическую (~ 435 °C) [93]. При этом превали-
руют двойниковые плоскости системы {100}. Как оказалось, раз-
двойникование возможно при сжатии кристаллов гексагональ-
ной формы по направлению (111). Соединение Ba2NaNb50i5,
представляющее большой интерес как материал для нелиней-
ной оптики, легко двойникуется при переходе через температуру
фазового превращения тетрагональной модификации в ортором-
бическую при 260 °C. Если по направлению (100) орторомбиче-
ской ячейки при температуре ~250 °C приложить давление око-
ло 7 МПа (70 кгс/см2), то двойники легко удаляются [94].
168
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Сегнетоэлектрики
В обычных диэлектриках поляризация и электрическое поле
связаны линейной зависимостью. Зависимость между поляриза-
цией и электрическим полем в случае сегнетоэлектриков иллю-
стрируется на фиг. 4.14. В общем случае направление спонтан-
ной поляризации не сохраняется постоянным во всем кристалле,
причем кристалл разбивается на ряд доменов, внутри которых
электрические диполи ориентированы
Фиг. 4.14. Зависимость поляризации от
приложенного поля для сегнетоэлектриче-
ских материалов.
в одном направлении, но
от домена к домену это
направление меняется.
Усиление приложенного
поля ведет к переориен-
тации всех доменов, как
это показано на фиг. 4.14,
и в точке А кристалл ста-
новится монодоменным.
Экстраполяцией Р до ну-
левого значения поля
можно определить спон-
танную поляризацию, т. е.
поляризацию, существую-
щую в домене без поля.
С ослаблением электри-
ческого поля поляриза-
ция убывает до уровня
остаточной поляризации
без поля. Чтобы снять остаточную поляризацию, нужно перепо-
ляризовать около половины кристалла, что достигается
приложением поля противоположного знака (коэрцитивная
сила).
Для проявления сегнетоэлектричества необходимы два усло-
вия: 1) отсутствие в кристалле центра симметрии, что допускает
образование электрического диполя, и 2) наличие двух равно-
весных состояний диполя, разделенных энергетическим барье-
ром, т. е. возможность для атома в кристалле занимать два по-
ложения и переходить из одного в другое под действием элек-
трического поля.
Отсутствием центра симметрии характеризуется 21 класс
симметрии. Из них 20 относятся к пьезоэлектрическим, т. е. к со-
единениям с такой симметрией, которые поляризуются под дей-
ствием механической деформации. Из пьезоэлектрических классов
10 относятся к пироэлектрическим, т. е. охватывают вещества,
обладающие спонтанной поляризацией. Поляризация обычно
обнаруживается по поверхностному заряду, величина кото-
рого изменяется при нагревании. Эти изменения легко обнару-
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 169
живаются, а сами такие кристаллы называют пироэлектриками.
Сегнетоэлектрики образуют часть класса спонтанно поляризо-
ванных пироэлектриков. Из сказанного следует, что выполнение
первого из упоминавшихся критериев можно предсказать исходя
из структурных данных, а соблюдение второго критерия уста-
навливается экспериментально.
Движение сегнетоэлектрических доменов представляет собой
особый тип твердофазного превращения, ранее рассматривав-
шийся как полиморфный и в некоторой степени аналогичный
исчезновению электрических двойников. При температуре Кюри
сегнетоэлектрические свойства исчезают и наблюдается истин-
ное полиморфное превращение.
При высоких температурах для поляризации сегнетоэлектри-
ческих доменов требуются более слабые приложенные поля, что
можно часто наблюдать при изучении кристаллов в скрещенных
поляроидах.
Триглицинсульфат принадлежит к моноклинной сингонии и
при температурах ниже 49 °C представляет собой сегнетоэлек-
трик. В кристаллах, выращенных из водных растворов, обычно
присутствуют двойники. В поляризованном свете двойники не
наблюдаются, потому что оптические оси должны быть парал-
лельными по обе стороны двойниковой границы. Однако эти
двойники (сегнетоэлектрические домены) можно выявить трав-
лением. Под действием электрического поля 1,2—2,4 кВ/см, при-
ложенного к плоскостям, перпендикулярным оси &, образуются
несдвойникованные кристаллы. Триглицинсульфат отличается от
сегнетовой соли ЫаКСдНдОв^НгО тем, что после монодомениза-
ции домены вновь появляются через несколько суток [87].
Ориентацию доменов под действием электрического поля
иногда называют поляризацией, причем это относится к боль-
шинству сегнетоэлектриков. В некоторых случаях поле, необхо-
димое для ориентации, может превышать напряжение пробоя
(например, для LiNbOs), и в таких случаях достичь поляризации
на стандартном оборудовании не удается, если не считать экспе-
риментов при температурах, близких к точке Кюри. Однако
монодоменный материал можно приготовить специальными
приемами, например поляризацией с жидкими электродами при
температурах ниже точки Кюри [95] или монодоменизацией в
процессе выращивания по методу Чохральского [96].
Не исключено, что в некоторых несегнетоэлектриках можно
избежать электрического двойникования выращиванием кристал-
лов в электрическом поле, а в сегнетоэлектриках ориентировать
домены деформированием. То же самое надо сказать об ориен-
тации ферромагнитных доменов под действием магнитного
поля, так что останавливаться здесь на этом нет необходи-
мости.
170
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Полиморфные превращения при высоком давлении
Для большинства полиморфных превращений при высоких
давлениях характерны высокие скорости фазовых переходов и,
как правило, их неконтролируемость. Это связано с громозд-
костью аппаратуры для создания высоких давлений и ее трудной
приспособляемостью для проведения эксперимента с контроли-
руемым зародышеобразованием.
При первых исследованиях в данной области обычно доволь-
ствовались установлением фазовых границ и получением новых
фаз. Для таких работ, как правило, было достаточно мелкокри-
сталлических порошков, в связи с чем никаких попыток выра-
щивания монокристаллов не предпринималось. Неудивительно,
что по способу полиморфных превращений при высоких давле-
ниях не было получено монокристаллов заметного размера. Тем
не менее имеет смысл рассмотреть системы, в которых были по-
лучены керамические и мелкокристаллические образцы, так как
эти работы, несомненно, явятся фундаментом будущего синтеза
монокристаллов.
1. Алмаз. Диаграмма состояния графит—алмаз была при-
ведена в разд. 2.3 (см. также разд. 7.5). Интересно отметить,
что при температурах, близких к комнатной, алмаз устойчив уже
при относительно невысоких давлениях (~1 ГПа). Однако при
низких температурах скорость превращения графита в алмаз
чрезвычайно мала. Чтобы ускорить переход, повышают темпе-
ратуру, причем для сохранения алмаза в поле устойчивости не-
обходимо соответственно повысить давление. Об аппаратуре для
создания сверхвысоких давлений говорится в работах [97, 98].
До последнего времени не было аппаратуры, пригодной для
создания (в поле устойчивости алмаза) достаточно высоких дав-
лений при температурах, обеспечивающих заметную скорость
прямого перехода графита в алмаз. Впервые алмаз удалось син-
тезировать с использованием катализатора [100, 98]. Роль по-
следнего сводилась к ускорению перехода при достаточно низких
температурах и «умеренных» давлениях. Мелкие алмазы удава-
лось получать разложением карбоната лития при высоких дав-
лениях, однако в целом все семейство найденных катализаторов
представляло собой растворители углерода, так что рост алмаза
практически происходил из раствора. С наибольшим успехом
использовались такие катализаторы-растворители, как хром,
марганец, кобальт, никель и палладий. Источником углерода
обычно служит графит, но испытывались и другие материалы,
в том числе арахисовое масло (!). Катализатор плавится и обра-
зует тонкие прослойки между фазами, в которых и происходит
перенос вещества. Помимо этого катализатор может способство-
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 171
вать зарождению алмаза. Поскольку успешный рост алмаза осу-
ществлен кристаллизацией из раствора, подробнее он рассмат-
ривается в гл. 7. В настоящее время разработана аппаратура
для синтеза алмаза без растворителя, хотя наиболее крупные
алмазы были получены при наличии растворителя. Однако ис-
пользование температурных градиентов, специально ориентиро-
ванного «керамического» исходного материала, затравок и т. д.,
вероятно, позволит достичь дальнейших успехов в получении бо-
лее крупных алмазов без катализаторов. Трудности при синтезе
алмаза — в основном экспериментального характера1).
Давление, МПа
Фиг. 4.15. Граница устойчивости
(кривая перехода) коэсита.
2. Нитрид бора. Нитрид бора (боразон) имеет такую же
электронную конфигурацию, как и углерод. Известные две слои-
стые модификации BN [100, 101]. При давлении 4,5 ГПа и 1700 °C
BN превращается в твердую и плотную кубическую модифика-
цию со структурой типа цинковой
обманки (боразон) [102, 103]. Бо-
разон интересен как абразивный
и режущий материал, который в
некоторых применениях может
оказаться лучше алмаза. По спо-
собам и трудностям выращива-
ния монокристаллов BN боразон
можно уподобить алмазу.
3. Кремнезем. Устойчивая при
высоком давлении полиморфная
модификация SiO2, известная как
коэсит, была впервые получена
Коэсом [104] при температуре
750 °C и давлении 3,5 ГПа. Ис-
ходной шихтой при этом служил
метасиликат натрия или ка-
лия с добавкой различных
минерализаторов, например
(NH4)2HPO4, NH4C1 или KBF4.
Рост происходил из тонкого слоя
раствора на поверхности шихты. Коэсит обнаруживался и в раз-
личных метеоритах. Кривая его устойчивости в координатах
давление — температура была определена Бойдом и Инглендом
[105] (фиг. 4.15). Коэсит можно получить из чистого а-кварца
при температурах выше 1200 °C и соответствующем давлении;
9 Исследовательской группой фирмы «Дженерал электрик» выращен
алмаз весом в несколько карат, по своему качеству относящийся к драго-
ценным камням [120].
172
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
при более низких температурах приходится добавлять минера-
лизаторы (Н2О или др.).
Известны две другие полиморфные модификации кварца,
устойчивые при высоких давлениях: кеатит [106], полученный при
380—585 °C и 0,35—1,20 ГПа в присутствии щелочи, и стишовит
(см. [107]), полученный при 1200—1400 °C и 16 ГПа. Стишовит
встречается в природе в некоторых метеоритных кратерах. Не-
сколько соединений со структурами, аналогичными SiO2(BPO4,
MnPO4, GaPO4, А1РО4 и BeF2), также имеют полиморфные мо-
дификации, как у SiO2 [108].
4. Другие материалы. Полиморфные превращения при высо-
ких давлениях происходят во льду, в NH3, CBr4, CS2, Р, щелоч-
ных металлах, Bi [109—111]. В работах по высоким давлениям
в качестве калибровочных точек по давлению часто используют
аномалии удельного сопротивления в точке фазового перехода.
Рост монокристаллов характеризуется трудностями уже рас-
смотренного характера.
4.5. РАССТЕКЛОВЫВАНИЕ
При нагревании многих стекол наблюдается локальная ре-
кристаллизация. Такой процесс называется расстекловыванием.
Обычно этого явления стараются избежать, для чего составы
стекол подбирают с таким расчетом, чтобы подавить процессы
расстекловывания. Но в ряде случаев составы стекол выбирают
специально с целью ускорить расстекловывание. Такие стекла
содержат зародышеобразующие агенты, так что в процессе по-
следующего контролируемого расстекловывания создаются кри-
сталлические области в матрице. Размеры образующихся кри-
сталлитов очень малы даже в случае полного расстекловывания.
Из технически важных материалов подобного рода надо назвать
пирокерамы. До сих пор не сообщалось о специальном выращи-
вании кристаллов путем расстекловывания, однако при соответ-
ствующем контроле такая возможность осуществима. Предпри-
нимались немногочисленные попытки выращивать монокристал-
лы на затравку из стеклообразующих расплавов. Из таких
расплавов трудно вырастить кристаллы путем гомогенного за-
рождения, так как при переохлаждениях, необходимых для роста
зародышей, вязкость расплава столь велика, что упорядочение
структуры становится невозможным. Однако Барнс (неопубли-
кованные данные) считает возможным рост кристаллов в при-
сутствии затравки при достаточно высоких температурах, когда
вязкость достаточно низка. Кристаллы предпочтительнее выра-
щивать из однокомпонентных систем, так как в этом случае
отпадают трудности, связанные с диффузией. Для одиокомпо-
4. РОСТ КРИСТАЛЛОВ В ПРОЦЕССЕ ТВЕРДОФАЗНОГО ПРЕВРАЩЕНИЯ 173
нентных расплавов, которые считаются стеклообразующими,
весьма привлекателен способ вытягивания кристалла на за-
травку. Примером расплава с высокой вязкостью, в котором
стеклование препятствует кристаллизации, может служить рас-
плав селена. Однако при повышении температуры плавления (с
повышением давления) [112] или при введении специальных до-
бавок, приводящих к разрыву связей в цепочках и, следова-
тельно, к уменьшению вязкости, удается выращивать монокри-
сталлы {113].
4.6. РОСТ ПРИ МНОГОКОМПОНЕНТНЫХ
ТВЕРДОФАЗНЫХ РЕАКЦИЯХ
Рост в процессе выделения в твердой фазе, или экстрак-
ции,— один из важнейших примеров роста в многокомпонентных
системах. Несмотря на чрезвычайную важность фазовых выде-
лений для свойств и структуры сплавов, проблема контроля за-
родышеобразования столь сложна, что до настоящего времени
выращивание монокристаллов таким путем не удавалось осу-
ществить.
Кристаллы некоторых веществ удавалось выращивать из мно-
гокомпонентных систем посредством деформационного отжига.
В частности, этим способом были получены монокристаллы
твердых растворов А1—М, где М — Ag, Си, Zn, Si, Ge и Mg;
Си—М, где М— Zn, Al, Cd, Ni, Мп и Fe, и Fe—М, где М — Si,
Al, Сг и Ni. Этому способу присуще то преимущество, что рас-
пределение второго компонента в объеме образца не меняется
в процессе роста кристаллов. Условия роста таких кристаллов
указаны в табл. 4.1 (см. также разд. 4.2).
3
РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА
В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ
5.1. ВВЕДЕНИЕ
Выращивать кристаллы в однокомпонентной системе по мно-
гим причинам предпочитают из расплава. По существу такое
выращивание представляет собой контролируемую кристаллиза-
цию, т. е. более простой и легче управляемый процесс, нежели
другие методы выращивания. По-видимому, рост по механизму
жидкость—►кристалл (ЖК) представляет собой самый распро-
страненный процесс промышленного выращивания монокристал-
лов. Этот метод начали изучать раньше других (не считая кри-
сталлизации из водных растворов) и исследовали, по-видимому,
интенсивнее всего. Может показаться, что метод выращивания
из расплава способен удовлетворить все потребности ученых и
практиков в кристаллах, но это, разумеется, неверно, так как
многие вещества не удается выращивать из их собственных чи-
стых расплавов. Это может объясняться следующими причи-
нами:
1. Материал разлагается еще до расплавления или плавится
инконгруэнтно.
2. Вещество сильно возгоняется до своего расплавления или
у него слишком велика упругость пара при температуре плав-
ления.
3. Нужная полиморфная модификация структурно неустой-
чива в соприкосновении с расплавом, а в результате твердофаз-
ных переходов качественные кристаллы в данной модификации
не получаются.
4. Температура плавления столь высока, что выращивание
кристаллов из расплава практически невозможно.
5. Условия выращивания не допускают введения того или
иного активатора в кристалл.
Но если таких причин нет, то экспериментатор обращается в
первую очередь к* способам выращивания из расплава. Общие
основы выращивания кристаллов из расплава уже рассматрива-
лись в гл. 2 и 3. Как отмечалось, разделение систем на одно- и
многокомпонентные применительно к выращиванию из расплава
в некоторых «граничных» случаях несколько условно. Тем не
менее такая классификация полезна. Строго говоря, рост в од-
нокомпонентной системе не должен включать никаких систем, в
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 175
которых присутствуют какие-либо другие компоненты или слу-
чайные примеси и активаторы. Но, поскольку все материалы со-
держат примеси, такая точка зрения полностью исключает рост
в однокомпонентной системе из числа реальных процессов. По-
этому необходимо четко представлять себе, что под выращива-
нием в многокомпонентных системах подразумевается рост,
когда второй компонент вводится специально с целью снижения
температуры плавления кристаллизуемого материала (такой
процесс обычно называется ростом из раствора). На практике
понятие «рост в однокомпонентной системе» допускает присут-
ствие примесей и активаторов, но при условии, что концентрация
их достаточно низка, чтобы диффузионные процессы не имели
решающего значения.
В идеальном случае выращивание из однокомпонентного
расплава можно проводить с довольно высокими скоростями
(диффузия не лимитирует скорости кристаллизации) и получать
довольно чистые кристаллы (поскольку дополнительные компо-
ненты отсутствуют и не создают загрязнения). В простейших
случаях все, что необходимо знать для выращивания, ограничи-
вается температурой плавления материала. Поэтому рост из
расплава есть основной метод выращивания кристаллов. В дан-
ной главе и рассматриваются этот метод и близкие к нему
другие методы.
5.2. НЕКОНТРОЛИРУЕМАЯ КРИСТАЛЛИЗАЦИЯ
Простейший способ выращивания кристаллов по ЖК-меха-
низму — неконтролируемая кристаллизация расплава. Трудность
состоит в том, что конечный продукт, как правило, представ-
ляет собой тонкозернистую поликристаллическую массу с от-
дельными монокристальными включениями разных размеров.
Типичным примером служат металлические отливки. Иногда
удается идентифицировать монокристаллические зерна подхо-
дящего размера и выделить их из общей массы для исследова-
ний. Обычно для этого используют стандартные металлографи-
ческие методы исследования, в том числе полировку и соответ-
ствующее травление. Но поскольку первоначальное зарождение
происходит случайно, крупные кристаллы попадаются редко.
Действительно, когда обнаруживаются крупные кристаллиты,
это дает основание полагать, что данное вещество должно до-
статочно легко образовывать монокристаллы при некотором усо-
вершенствовании методики выращивания из расплава. Все ос-
тальные методы преследуют цель добиться контролируемого
зарождения с тем, чтобы затравкой для последующего роста
служил один или хотя бы несколько зародышей. Поэтому в по-
добных методах используется контролируемый температурный
176
Р. ЛОДИЗ. РОСТ монокристаллов
градиент, позволяющий локализовать зону максимального пере-
охлаждения расплава на небольшом участке у зародыша, при-
чем в большинстве случаев все они предусматривают искусствен-
ные затравки.
5.3. МЕТОД БРИДЖМЕНА —СТОКБАРГЕРА
И ДРУГИЕ АНАЛОГИЧНЫЕ МЕТОДЫ
Особенно удобный способ регулирования переохлаждения,
необходимого для образования монокристалла, первым предло-
жил Бриджмен [1]. В дальнейшем его усовершенствовал Сток-
баргер [2, 3], и он получил название метода Бриджмена—Сток-
баргера, но иногда его называют методом Таммана [4] или Обре-
имова и Шубникова [5]1). Бакли [6] приводит историческую
справку о разработке данного метода и разбирает отдельные
его варианты, предложенные разными авторами. Многие такие
варианты он связывает с именами предложивших их авторов.
Здесь же этот метод вместе со всеми его вариантами рассматри-
вается как единое целое без ссылок на отдельные аспекты исто-
рического характера. Метод Бриджмена—Стокбаргера описы-
вается во многих пособиях по росту кристаллов [7, 8] и детально
обсуждается в монографиях по выращиванию кристаллов кон-
кретных материалов [9—11].
Суть метода Бриджмена—Стокбаргера состоит в том, чтобы
создать зарождение на единственной границе между расплавом
и кристаллом и проводить кристаллизацию в поле температур-
ного градиента. Кристаллизуемый материал обычно находится в
цилиндрическом тигле (фиг. 5.1, а и б), а тигель опускают через
поле температурного градиента (фиг. 5.1, з) или нагреватель
поднимают вдоль тигля. В некоторых случаях тигель неподвижно
закрепляют в печи, сконструированной так, что температурный
градиент в ней близок к постоянному, и затем дают печи остыть
(фиг. 5.1, и). Естественно, что в печи существует зона с почти
постоянным градиентом (ab на фиг. 5.1,/с), как это требуется при
выращивании посредством охлаждения. В обоих случаях изо-
терму, перпендикулярную оси тигля, заставляют перемещаться
через него достаточно медленно, чтобы граница кристалл—рас-
плав успевала следовать за ней. Как правило, в начале экспе-
римента все содержимое тигля расплавляется и при первом за-
рождении образуется несколько кристалликов. Превалирование
4) Не исключено, что Тамман или Обреимов с Шубниковым первыми вве-
ли в практику данный способ. Тогда по справедливости его, вероятно, надо
было бы называть методом Таммана или Обреимова — Шубникова (как это
делается в некоторых европейских публикациях). Мы пользуемся названием
«метод Бриджмена — Стокбаргера» как более распространенным.
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 177
на границе раздела кристалл—расплав одного из таких кристал-
ликов обеспечивается тем или иным из перечисляемых ниже спо-
собов.
1. Дно тигля делают коническим (фиг. 5.1,6), так что перво-
начально переохлаждается только малый объем расплава.
Вид сверху ЖЗ
Вид сбоку ЬжжД
Фиг. 5.1 Формы тиглей и лодочек, используемых при выращивании кри-
сталлов методом Бриджмена — Стокбаргера и аналогичными методами.
В итоге образуется только один зародыш. Если же возникнет не-
сколько зародышей, то один из них (с наиболее благоприятной
ориентацией) станет доминировать на всей границе раздела.
2. Тигель изготавливают с капиллярным концом (фиг. 5.1,в).
Расплав первоначально переохлаждается в очень маленьком
объеме. Если в капилляре образуется несколько кристалликов,
то велика вероятность, что с продвижением фронта кристалли-
зации через капилляр один из них вырастет и заполнит всю по-
верхность раздела.
178
Р. ЛОДИЗ. РОСТ монокристаллов
3. Конец тигля конической формы соединяют с основным
объемом тигля тонким капилляром (фиг. 5.1,г). Этому варианту
присущи преимущества обоих первых способов.
4. На конце тигля конической формы (фиг. 5.1,5) предусмат-
ривают одно-два расширения, которые соединяются друг с дру-
гом и с тиглем капиллярами. Ясно, что число таких расширений
с капиллярными переходами может быть и больше двух. Такая
конструкция тигля обеспечивает первоначальное зарождение в
очень малом объеме (у конусного окончания) и способствует
отбору монокристального участка из расширения в качестве
затравки при прорастании через капилляр.
Ясно, что конфигурациями, аналогичными изображенным на
фиг. 5.1,а—5, можно воспользоваться и при выращивании в от-
крытых лодочках (иногда такой способ называют методом Чал-
мерса) (фиг. 5.1,е и ж), В этом случае чаще пользуются гори-
зонтальными, а не вертикальными печами. Превалирование мо-
нокристалла на границе раздела кристалл—расплав зависит от
исходной ориентации зародившихся первыми кристалликов и
наклона границ зерен между ними. Эти моменты так и не стали
предметом сколь-либо подробного исследования в практике про-
мышленного выращивания кристаллов по методу Бриджмена—
Стокбаргера, потому что всегда можно эмпирически подобрать
форму тигля, градиент температуры и скорость,опускания тигля
(или скорость охлаждения печи) так, чтобы во всех случаях до-
биться образования монокристалла или хотя бы крупных моно-
кристальных участков в объеме тигля. Однако нужно иметь в
виду, что в подобных случаях должно преобладать гетерогенное
зарождение на стенках тигля, так что при прогнозировании
ориентации зародышей могут оказаться полезными теории гете-
рогенного зарождения. Подобным же образом способны принести
пользу при определении вероятности превалирования монокри-
стальных зерен на поверхности раздела и теории, рассматри-
вающие энергию границ зерен в зависимости от их ориентации.
Само собой разумеется, что при выращивании кристаллов
по методу Бриджмена—Стокбаргера можно было бы прибегать
к специальному затравливанию, помещая монокристальную за-
травку в конце тигля и подбирая такой температурный профиль
в печи, чтобы подобная затравка не расплавилась. Но экспери-
ментально это часто выливается в утомительную процедуру,
поскольку в обычной установке Бриджмена — Стокбаргера тем-
пература неизвестна и регулируется с недостаточной точностью,
а следить визуально за затравкой не позволяют непрозрачные
тигли и стенки печи. Можно, конечно, сделать тигли и трубки из
плавленого кварца и снабдить последние специальными желоб-
ками на поверхности для проволочных нагревателей сопротивле-
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 179
ния, как это делается при кристаллизации из газовой фазы (см.
разд. 6.4), что позволит проводить и визуальные наблюдения,
особенно полезные в предварительных экспериментах.
Обычная трудность при выращивании кристаллов по методу
Бриджмена—Стокбаргера заключается в необходимости обес-
печить очень небольшой температурный градиент вдоль тигля.
Дело в том, что при этом расплавы многих веществ заметно пе-
реохлаждаются до начала кристаллизации. Если в расплаве
можно создать достаточно высокое переохлаждение, а темпе-
ратурный градиент довольно мал, то часто весь образец может
оказаться охлажденным до уровня ниже температуры плавления
до появления первого кристаллика. Зарождение в таких усло-
виях приводит к очень быстрому росту в остальной части рас-
плава и неизбежному образованию мелких кристаллов плохого
качества. Большие же температурные градиенты гарантируют
начало зарождения до того, как весь расплав переохладится.
В этом случае рост протекает в контролируемых условиях, ко-
гда изотерма, соответствующая температуре плавления, переме-
щается по образцу.
Оборудование
Для выращивания кристаллов по методу Бриджмена—Сток-
баргера необходимо следующее оборудование.
1. Тигель (или лодочка) нужной формы и из материалов,
соответствующих кристаллизуемому веществу, газовой среде, в
которой проводится рост, и температуре выращивания.
2. Печь, обеспечивающая создание нужного температурного
градиента.
3. Приборы и оборудование для измерения и регулирования
температуры, а в некоторых случаях и для программного изме-
нения температуры, а также приспособления для опускания
тигля.
Тигель нужно делать из таких материалов, которые не взаи-
модействуют с расплавом при температурах роста. Важно так-
же, чтобы закристаллизовавшееся вещество не приставало к
стенкам тигля, что позволяет свести к минимуму деформации в
кристалле и дает возможность извлекать выращенный кристалл
без разрушения тигля. Тиглям показанных на фиг. 5.1, а—д кон-
фигураций присуще то преимущество, что их легко закрыть
крышкой, что позволяет иногда выращивать кристаллы веще-
ства с повышенной упругостью пара и регулировать состав га-
зовой атмосферы без дополнительного усложнения установки.
Труднее контролировать испарение вещества и регулировать со-
став атмосферы в открытых лодочках. Но последние обладают
180
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
тем преимуществом, что обычно позволяют наблюдать за гра-
ницей раздела кристалл—расплав.
Тигли делают из пирекса, викора, плавленого кварца, глино-
зема, благородных металлов, графита и других материалов. Пи-
рекс (размягчается при ~600 °C), викор (при ~ 1000 °C) и плав-
леный кварц (при ~ 1200 °C) используются при выращивании
кристаллов только легкоплавких веществ. При надлежащей кон-
струкции печи тигли из этих материалов позволяют визуально
наблюдать за процессом роста. Из них можно делать и разъем-
ные изложницы, упрощающие извлечение выращенных кристал-
лов. Но часто разрушение тиглей и изложниц не встречает
возражений экономического порядка. Глинозем, обожженный с
различными связующими добавками, используется при выращи-
вании кристаллов алюминия. В графитовых тиглях выращивают
кристаллы металлов, трудно образующих карбиды, и ряда неме-
таллических веществ. В бескислородной атмосфере графит вы-
держивает нагревание до 2500°C. При использовании графито-
вых тиглей через печь обычно требуется пропускать инертный
газ. Об использовании тиглей из благородных металлов гово-
рится в разд. 4.2, 5.4, 7.3 и 7.4. Для неактивных веществ иногда
используются керамические тигли и тигли из обычных металлов.
В отдельных случаях тигли приходится делать из карбидов и
даже монокристальных фторидов.
Чтобы избежать возникновения деформаций в кристаллах
веществ, смачивающих тигель, иногда используют так называе-
мые «мягкие изложницы», например контейнеры из очень тон-
кой, легко деформируемой платины; и даже если расплав сма-
чивает такую изложницу, то последняя легко деформируется в
процессе усадки кристалла при его затвердевании и не создает
в нем деформаций. Если стенки такой изложницы столь тонки,
что не способны удержать расплав, ее можно поместить в тигель
из более прочного материала. Иногда пространство между двумя
контейнерами целесообразно заполнить мягким материалом, на-
пример пеноглиноземом.
При выращивании кристаллов по методу Бриджмена—Сток-
баргера в печи создают температурные градиенты двух видов.
Если изотерму перемещают по тиглю посредством снижения об-
щей температуры печи, температурный градиент должен иметь
форму, изображенную на фиг. 5.1,ц. В печи с проволочным элек-
тронагревателем самая горячая зона при равномерном располо-
жении обмотки приходится на середину печи с температурным
профилем, как на фиг. 5.1,к. Участок ab в такой печи имеет
почти линейный градиент температуры и может использоваться
во всех случаях, где требуется такой градиент. При выращива-
нии кристаллов посредством опускания тигля (или подъема печи
относительно тигля) обычно лучше иметь две изотермические
6. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 181
области с перепадом температуры между ними, что позволяет
отжечь кристалл сразу после выращивания без высоких терми-
ческих напряжений, возникающих при чрезмерных перепадах
температуры. Такая печь идеальной конструкции должна иметь
две температурные зоны с минимальным теплообменом между
ними. Зоны нужно разделить теплоизоляцией и обеспечить неза-
висимое регулирование температуры в них. Чтобы гарантиро-
вать изотермичность в каждой зоне, внутренние стенки печи
рекомендуется делать из материала с высокой теплопроводно-
стью. Тигли же лучше изготовлять из материалов с низкой теп-
лопроводностью, поскольку температурные градиенты в них оп-
ределяются практически распределением температуры в печи
(однако по практическим соображениям это требование не вы-
полняется, так как тигли приходится изготовлять из материалов,
которые должны удовлетворять ряду других требований и которые
поэтому почти всегда обладают довольно высокой теплопровод-
ностью). Две зоны в печи разделяют экранирующей перего-
родкой, нередко из листовой платины, с размерами, допускаю-
щими установку тигля. При достаточно низких температурах
иногда допустимо использование каркаса из стекла или плав-
леного кварца, на который наматывают ленточный или проволоч-
ный нагреватель сопротивления так, чтобы он позволял вести
визуальные наблюдения через прозрачный тигель или лодочку.
При горизонтальном выращивании по методу Бриджмена —
Стокбаргера конструкция печи должна удовлетворять таким же
требованиям. В некоторых случаях возможен индукционный
нагрев, что еще больше упрощает визуальное наблюдение.
Обычно всю шихту в лодочке (кроме, может быть, затравки)
расплавляют сразу, но в некоторых случаях через лодочку пе-
ремещают расплавленную зону небольшой ширины. Такой
способ рассматривается в разд. 5.5 в связи с зонной плавкой
(рекристаллизацией). Конструкция печи, индукционные нагре-
ватели, способы измерения и регулирования температуры об-
суждаются в разд. 4.2, 5.4 и 7.4.
Иногда целесообразно охлаждать коническое дно или капил-
лярный конец тигля. Чтобы обеспечить теплоотвод, с охлаждае-
мым участком приводят в соприкосновение один конец спе-
циального стержня из материала с большой теплопроводностью,
выводя другой его конец в холодную зону печи или за пределы
последней. «Точечное охлаждение» можно осуществлять направ-
ленной струей холодного газа (в простейшем случае воздуха).
В крайних случаях участок наружной поверхности тигля приво-
дят в соприкосновение со змеевиком или блоком водяного ох-
лаждения.
При обычном способе опускания тигля последний под-
вешивают на проволоке или цепочке, приводимой в движение
182
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Фиг. 5.2. Способ опускания тигля.
посредством звездочки, соединенной с часовым электродвигате-
лем (фиг. 5.2). Часовой механизм через зубчатую передачу обес-
печивает необходимую скорость опускания тигля. Постоянство
скорости выдерживается за время в несколько часов с точностью
не выше ±0,1%. Более высокой точности можно достигнуть про-
тивовибрационным монтажом установки, исключающим передачу
тиглю сотрясений. Передача тиглю движения посредством жест-
кого крепления, например стержня, тоже способствует устране-
нию случайных колебаний тигля. Если требуется направленный
теплоотвод, то такой стер-
жень можно присоединить
ко дну тигля. Более точного
регулирования скорости опу-
скания тигля (естественно,
ценой удорожания и услож-
нения оборудования) можно
добиться с помощью специ-
альной установки для вытя-
гивания кристаллов (про-
мышленного изготовления).
Чтобы выровнять асиммет-
рию температурного поля в
печи, иногда рекомендуется
вращать тигель в ходе вы-
ращивания. В промышлен-
ных установках механизм
для опускания тигля часто
имеет вид вращающегося хо-
дового винта (как в токар-
пригодны для метода Бридж-
мена— Стокбаргера. При горизонтальном выращивании по
Бриджмену — Стокбаргеру можно приспособить и оборудование,
используемое для прогона зон в установках для зонной очистки.
О способах вытягивания кристаллов речь пойдет дальше в
разд. 5.4, а об установке для зонной плавки говорится в
разд. 5.5.
Ост и Чалмерс [12] показали, что блочность (lineage) в кри-
сталлах, выращиваемых в лодочках, можно ослабить, отклонив
межфазную границу кристалл—расплав из перпендикулярного
оси лодочки положения. Так как малоугловые границы зерен
(полосчатость) могут образовываться в результате коалесцен-
ции дислокаций, снижение плотности последних приведет и к
ослаблению полосчатости. Дислокации перемещаются преиму-
щественно перпендикулярно границе роста. Следовательно, если
последняя не перпендикулярна оси лодочки (по Осту и Чалмерсу,
«наклонная межфазная граница»), то дислокации «выклинятся»
ном станке), и такие установки
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 183
из кристалла, так и не создав высокой плотности, необходимой
для взаимодействия и образования малоугловых границ зерен.
По той же причине выпуклая по отношению к кристаллу меж-
фазная граница лучше, чем вогнутая1). Все сказанное справед-
ливо, конечно, и для других способов выращивания по ЖК-ме-
ханизму. Чалмерс [13] и Флейшер с Девисом [14] выращивали в
лодочке кристаллы с искусственной границей зерен (бикристал-
лы), используя две затравки с разной ориентацией. Кристалл с
иной ориентацией, чем у затравки, можно вырастить, изогнув
соответствующим образом желоб, соединяющий затравку с ос-
новным объемом расплава.
Выращивание кристаллов некоторых веществ
По методу Бриджмена—Стокбаргера чаще всего выращи-
вают кристаллы веществ трех классов — металлов, полупровод-
ников и галогенидов щелочных и щелочноземельных металлов.
В промышленности этим методом шире всего кристаллизуют ма-
териалы последнего класса. Первую свою работу Бриджмен
проводил на висмуте [1]. В последующие годы этим методом вы-
ращивали главным образом кристаллы металлов. Стокбаргер
[2] показал, что этим способом можно выращивать кристаллы
LiF и СаБг. Разработанный им способ заложил фундамент под
широкое промышленное выращивание галоидных кристаллов оп-
тического назначения. Открытие лазеров предъявило более стро-
гие требования к оптическому качеству галоидных кристаллов и
повысило спрос на активированные галогениды щелочноземель-
ных металлов с весьма слабым рассеянием света. Гуггенхейм
[15] разработал способы ослабления рассеивающей способности
у фторидов и регулируемого активирования добавками редкозе-
мельных металлов с нужной валентностью.
Полупроводниковые кристаллы выращивают в горизонталь-
ных лодочках по тому или иному варианту метода Бриджмена—
Стокбаргера. Кристаллы многих органических соединений можно
вырастить как в горизонтальных лодочках, так и обычным спо-
собом.
Металлы и полупроводники. Висмут был тем металлом, кри-
сталлы значительных размеров которого удалось вырастить впер-
вые [1]. Висмут плавится при 271 °C, так что его кристаллы
можно выращивать в пирексовых тиглях. Бриджмен с успехом
*) Выпуклая граница фронта кристаллизации к тому же препятствует
зарождению на стенках, так как более всего продвинувшаяся в распЛав часть
кристалла дальше всего удалена от стенок. Это предотвращает образование
новых кристалликов на пути дальнейшего роста главного кристалла,
Кристаллы, выращивавшиеся по методу Бриджмена — Стокбаргера J)
Таблица 5,1
Материал Фор- мула Темпера- тура плавления, °C Материал тигля Градиент Скорость охлаждения (опускания тигля) Атмосфера Примечания Литература
Бромистое серебро AgBr 434 Пирекс, кварц 10°С/см и более (1—5 мм/ч) С12 (промыв- ка НС1 или НВг) Указана степень ак- тивации и т. д. (кварц, видимо, лучше пирек- са) [Ю81
Аргон Аг -189,4 Стекло 5 °С/мм (1мм/мин) Аг Поликристаллы диа- метром 4 мм [109]
Золото Ап 960,5 Графит ~5°С/см «Малая» n2 Монокристаллы дли- ной до 8 мм [ИО]
Медь Си 1083,2 Графит ~12°С/см (От 5 до ~20 см/ч) Вакуум Кикучи-линии свиде- тельствуют о высоком совершенстве [20]
Никель -Литий Ni Li 1455 179 Рекристал- лизованная окись А12О3 Сталь, не- ржавеющая сталь (0,1—0,2мм/ч) 2-30 °С/ч » Аг Без затравки (дру- гие варианты см. в [106], другие легко- плавкие вещества при- ведены в [107]) [1111 [112-114]
'Флюорит CaF2 1392 Та, Fe или Ni Не приведен (10 мм/ч) Вакуум Специальная мето- дика удаления СаО (см. разд. 5.3) [115]
Флюорит CaF2 1392 С «Большой» (~1 мм/ч) » [3]
Фтористый литий LiF 870 Pt Не приведен Не приведена Воздух (ва- куум лучше) [31
’) Смакула [7] приводит источники (но не обобщает условия выращивания) для 100 с лишним материалов, включая органические сое-
лине н ия.
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДПОКОМПОНЕНТНОЙ СИСТЕМЕ 185
выращивал кристаллы диаметром до 2,2 см со скоростью 4 мм/ч.
Очень мелкие кристаллы можно выращивать со скоростями до
60 мм/ч. В большинстве работ по выращиванию кристаллов ме-
тодом Бриджмена — Стокбаргера экспериментальные условия
сообщаются недостаточно подробно. При описании условий роста
необходимо обязательно приводить следующие данные: 1) о рас-
пределении температуры в тигле (хотя бы о величине градиента
в печи); 2) о скорости движения фронта кристаллизации (в
увязке со скоростью опускания тигля или со скоростью охлаж-
дения); 3) об ориентации выращенного кристалла (при использо-
вании затравки — и об ее ориентации); 4) о чистоте исходных
материалов; 5) о стехиометрии, содержании примесей, совер-
шенстве выращенных кристаллов; 6) экспериментальные данные
общего характера (материал тигля, точность поддержания тем-
пературы, встретившиеся специфические трудности и т. д.).
В публикуемых статьях все эти моменты довольно редко осве-
щаются с необходимой тщательностью. В случае висмута, на-
сколько известно автору, наиболее совершенные монокристаллы
были выращены в горизонтальных лодочках (неопубликованные
данные Верника и Бюлера, 1960) по описанной ими ранее тех-
нологии [16]. Из-за легкоплавкости висмута и слабости связей
перпендикулярно оси с висмут очень легко повреждается. За-
калка выращенных кристаллов в холодной воде приводит к рез-
кому увеличению числа дислокаций, легко выявляемых травле-
нием [17]. Повреждения возникают из-за неодинаковой усадки
(и, вероятно, смачивания) при охлаждении в процессе выращи-
вания в вертикальном тигле. По методу Бриджмена — Стокбар-
гера выращивали кристаллы и других легкоплавких веществ,
упоминаемых в табл. 5.1.
В качестве примера сравнительно тугоплавкого металла,
кристаллы которого выращивались методом Бриджмена — Сток-
баргера, можно назвать медь (ТПл = 1083°C). Установка для
выращивания кристаллов тугоплавких материалов обычно имеет
довольно сложное устройство. Окисление, как в случае меди, за-
ставляет проводить выращивание в вакууме, что, как правило,
значительно усложняет экспериментальные трудности [18, 19].
Механизм опускания нередко приходится помещать частично
внутри вакуумной камеры, а нагревательные элементы либо тре-
буют больших токов (графит или карбид кремния), либо легко
окисляются (вольфрам или молибден). Верник и Девис [20] раз-
работали простую установку для вакуумного выращивания
кристаллов тугоплавких металлов. Тигель представляет собой
разъемную графитовую изложницу (фиг. 5.3), заключенную
внутри фарфоровой трубки, которую можно откачивать и мон-
тировать вместе с тиглем для опускания через область темпе-
ратурного градиента. Градиент в печи составлял без фарфоровой
186
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
трубки около 12°С/см, скорость опускания равнялась 5 см/ч,
вакуум лучше 25 мкм рт. ст. По такой методике удавалось без
труда выращивать кристаллы размером около 9,5 X 3,2 X 90 мм.
Тигель можно опускать даже вручную (прерывисто) прибли-
зительно на 2,5 см каждые 10—20 мин. Исходный медный
Графитовый
/ тигель
Печь
Закрытая
--- трубка,
защищающая
от сквозняков
ь
Фиг. 5.3. Выращивание меди методом
Бриджмена — Стокбаргера [20].
стержень имел чистоту
+ 99,999%, а исследование
выращенных кристаллов
спектральным методом не
обнаружило в них загряз-
нений. Чистота графита пре-
вышала 99,75%. Лауэграм-
мы подтвердили монокри-
стальность всего образца.
Совершенство кристаллов
изучалось методами ми-
кроэлектронографии. Нали-
чие или отсутствие линий
Кикучи на электронограм-
мах служило критерием со-
вершенства кристаллов. Бы-
ло показано, что материал,
закристаллизовавшийся пер-
вым, по качеству был самым
неудовлетворительным. По-
видимому, это общая черта
прг выращивании по методу
Бриджмена — Стокбаргера
без затравки, поскольку
переохлаждение достигает
максимума к моменту на-
чала кристаллизации. Дру-
гие металлы, кристаллы которых выращивали методом Бридж-
мена—Стокбаргера, указаны в табл. 5.1.
Выращивание простых полупроводниковых кристаллов вер-
тикальным методом Бриджмена — Стокбаргера практикуется
редко главным образом потому, что такие вещества, как крем-
ний и германий, при затвердевании расширяются на несколько
процентов по объему. Цилиндрический тигель, используемый в
вертикальном варианте метода Бриджмена — Стокбаргера, не
позволяет растущему кристаллу расширяться, что обычно при-
водит к возникновению больших напряжений. Электрические
характеристики большинства полупроводников особенно сильно
зависят от степени совершенства кристалла, а напряжения, воз-
никающие при выращивании вертикальным методом Бриджме-
на— Стокбаргера, часто достаточны для генерации дислокаций
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 187
и в ряде случаев даже приводят к образованию малоугловых
границ зерен, что сильно ухудшает характеристику кристаллов.
Если же полупроводниковый материал летуч или если исполь-
зуется активатор с высокой упругостью пара, то легкость исполь-
зования закрытой системы в вертикальном варианте метода
Бриджмена — Стокбаргера может выдвинуть этот метод в чи-
сло наиболее приемлемых для получения полупроводниковых
кристаллов. То обстоятельство, что форма выращенного кри-
сталла определяется формой тигля, с экономической точки зре-
ния оказывается преимуществом при последующем разрезании
кристаллов, так как позволяет при промышленном выращивании
получать кристаллы стандартной формы и размеров. Для полу-
чения ненапряженных кристаллов некоторых соединений приме-
нялись порошковые формы, или «мягкие формы» [21]1). Многие
трудности, связанные с напряжениями в вертикальном варианте
метода Бриджена — Стокбаргера, отпадают при выращивании в
открытой лодочке в горизонтальной печи [22, 23].
Монокристаллы PbS, PbSe и РЬТе были получены в верти-
кальных тиглях [24], а кристаллы GaAs были выращены в гори-
зонтальной лодочке, запаянной в кварцевый контейнер при дав-
лении As, равном нескольким миллиметрам ртутного столба
[25]. Монокристаллы Ge специальных форм выращиваются в
графитовых изложницах. Кристаллизация в лодочках занимает
важное место в производстве германия, так как процесс имеет
много общего с очисткой зонной плавкой и активацией методом
зонного выравнивания.
Неметаллы. Метод Бриджмена — Стокбаргера часто приме-
няется для выращивания кристаллов органических веществ с
низкими температурами плавления, причем обычно исполь-
зуются стеклянные тигли. Перечисление всех органических ве-
ществ, выращенных этим методом, здесь было бы излишним.
Триумфом метода Бриджмена — Стокбаргера было выращи-
вание фторидов. К совершенству и оптическому качеству лазер-
ных материалов предъявляются самые жесткие требования. Ос-
новной вклад в развитие технологии выращивания фторидов
высокого качества для лазеров внес Гуггенхейм [15, 26]. До его
работ основные трудности были связаны с контролем рассеиваю-
щих центров и валентного состояния редкоземельных актива-
торов.
Среди выращенных кристаллов были фториды Cr, Мп, Со, Ni,
Zn, Y, La, Tb, Са. Наиболее полно исследована, по-видимому,
кристаллизация CaF2. Гуггенхейм особо подчеркивает, что для
4) Покрытие внутренней поверхности тигля позволяет получать практи-
чески бездислокационные участки кристаллов в несколько квадратных санти-
метров. — Прим, ред,
188
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
получения CaF2 наивысшего качества необходимо предотвратить
образование СаО. Исходный реактив должен быть совершенно
сухим и свободным от поверхностных окислов. Для этого реко-
мендуется исходный порошок CaF2 выдерживать 18 ч при 800 °C
в атмосфере осушенной HF. Если в исходном материале имеется
влага или она попадает в систему в процессе роста, то в выра-
щенном кристалле образуются частицы СаО по реакции
CaF2 + Н2О -+ 2HF2 + СаО, (5.1)
которые резко увеличивают рассеяние лазерного пучка и ката-
строфически повышают порог возбуждения лазерного излучения.
Плавиковая кислота подавляет эту реакцию и может медленно
реагировать с СаО, удаляя следы последнего из исходного реак-
тива. Поэтому кристаллы фторида кальция, выращенные ранее,
являются шихтой, практически не содержащей СаО, для после-
дующих опытов. Более рациональный способ получения исход-
ного материала без примеси СаО — обработка СаС12 в HF:
СаС12 + 2HF -> CaF2 + 2НС1. (5.2)
Полученный таким образом CaF2 совершенно не содержит оки-
слов, вызывающих рассеяние.
Атмосфера, в которой производится выращивание, должна
быть очищена от окислителей и тщательно осушена. Этим тре-
бованиям удовлетворяет аргон, пропущенный через активирован-
ный уголь, охлаждаемый жидким азотом. Еще лучшие резуль-
таты были получены с гелием, диффундирующим через плавле-
ный кварц. Для этой цели особенно хороша система стеклянных
капилляров для очистки Не, предложенная Мак-Афи [27] и обла-
дающая большой пропускной способностью.
Особенно чувствительной проверкой метода может служить
выращивание кристаллов CaF2: Sm2+. Примесь Sm2+ дает интен-
сивную зеленую окраску даже при концентрациях ниже
0,05 мол.%. В присутствии же окислителей Sm2+ переходит в
бесцветную примесь Sm3+
Чтобы предотвратить переохлаждение расплава, температур-
ный градиент должен составлять [15] по крайней мере 7°С/см
для CaF2 и около 30°С/см для LaF3. Обычно при выращивании
фторидов скорости опускания составляли от 1 до 5 мм/ч. В ряде
случаев валентность редкоземельных элементов в выращенных
кристаллах удавалось изменить последующим электролитиче-
ским восстановлением [28, 29]. На фиг. 5.4 показана схема аппа-
рата Гуггенхейма для выращивания кристаллов CaF2 методом
Бриджмена — Стокбаргера.
Фонг [30] подробно исследовал действие у-лучей на фториды,
активированные редкими землями,.и использовал этот метод для
образования, например, примеси Dy2+ в CaF2.
б. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 189
В табл. 5.1 указан ряд типичных кристаллов, выращенных
методом Бриджмена—Стокбаргера. Табл. 5.1, естественно, не
полна, так как имеются публикации о получении этим способом
нескольких тысяч разных кристаллов. Но в большинстве случаев
Привод
с регулируемой
скоростью
HF,He,H2
Контрольная
термопара
Радиационный
' экран из Pt
- Стальной зажим
Алундовая трубка
___Кабель питания
Платиновая
трубка
со стенками
.Вывод Ns I
Жтолщиной
0,75 мм
Фторид
Платиновый
вкладыш
Платиновый
-радиационный
экран
Алундовая
вата
Металлический
корпус
Алунд
Платиновый тигель
Настенками
'толщиной 0,75 мм
Платиновая
трубка, приварен-
ная к тиглю
Платановый
•радиационный
щиток
Алунд
Фиг. 5.4. Выращивание фторида кальция методом Бриджмена — Стокбар-
гера [15].
сообщается очень мало подробностей и табл. 5.1 следует рас-
сматривать лишь как иллюстрацию примерных условий и мате-
риалов, исследованных к настоящему времени.
5.4. МЕТОД ЧОХРАЛЬСКОГО И АНАЛОГИЧНЫЕ
МЕТОДЫ
Метод вытягивания из расплава, впервые введенный в прак-
тику Чохральским [31], позволяет устранить механическое влия-
ние тигля на выращиваемый кристалл. На фиг. 5.5,а показана
схема выращивания по методу Чохральского, а на фиг. 5.6 при-
веден снимок типичной установки для вытягивания. Один из
190
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
главных недостатков метода — необходимость в тигле, который
часто является источником загрязнений. Ниже мы рассмотрим
некоторые варианты метода, которые исключают эту трудность.
Механизмы для вращения
и вытягивания
Державка^
Затравка
Тигель
|*> Индуктор или другой
Р нагреватель
Расплав
Проволока
Перетяжка
Затравка
Выращенный
кристалл
Самопроизвольно
закристаллизовавшаяся
поликристалла ческая
масса
Монокристалл
Керамическая подставка
Фиг. 5.5. Конфигурации, используемые в методе Чохральского.
а
в
Для успешного использования метода Чохральского необходимы
следующие условия:
1. Кристалл (или кристалл с активатором) должен плавиться
конгруэнтно, без разложения. Если кристалл плавится инкон-
груэнтно, его иногда удается вырастить из расплава такого со-
става, где кристалл является устойчивой фазой. Но это уже
рост из многокомпонентной системы, и ему свойственны все
трудности, характерные для кристаллизации из растворов. Кри-
сталлизация такого типа будет рассмотрена в гл. 7. Если про-
дуктами разложения являются газы, можно использовать гер-
В. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОПЁНТНОЙ СИСТЕМЕ
метичную аппаратуру. Установившееся в ней равновесное дав-
ление продуктов разложения подавит разложение.
2. Кристалл не должен реагировать с тиглем и атмосферой,
установившейся в процессе вытягивания. Герметичная аппара-
Ф и г. 5.6. Установка для выращивания методом Чохральского кристаллов
LiNbO3, CaWO4 и др.
тура позволяет поддерживать нейтральную (инертную), окисли-
тельную или восстановительную среду.
3. Температура плавления кристалла должна быть дости-
жима с помощью используемых нагревателей и должна быть
ниже температуры плавления тигля.
4. Аппаратура должна обеспечивать регулирование скорости
вытягивания в соответствии с градиентами температуры в зоне
образования монокристалла.
Очень важным преимуществом метода вытягивания является
возможность наращивания на затравку в строго контролируемых
192
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
условиях. Строгий контроль возможен потому, что затравка
и выращенный кристалл видны во время выращивания, так что
экспериментатор может визуально наблюдать за процессом
роста и корректировать его, руководствуясь совершенством кри-
сталла. Кроме того, при наличии ориентированных затравок
легко осуществить выращивание в любом заданном направле-
нии. Если нет затравки, легко вызвать спонтанное зарождение
на проволоке (фиг. 5.5,6). Образующуюся поликристаллическую
массу некоторое время наращивают, а затем ее диаметр умень-
шают (делают «перетяжку») либо путем незначительного повы-
шения температуры, либо путем увеличения скорости вытягива-
ния. На практике увеличение скорости вытягивания трудно ис-
пользовать для получения перетяжки, так как при этом затравка
часто отрывается от расплава. В суженном кристалле граница
раздела, как правило, формируется одним монокристалликом.
Затем диаметр кристалла увеличивают, и в результате происхо-
дит рост монокристалла. В особо трудных случаях кристаллик
необходимо отбирать из закристаллизованной в предваритель-
ном опыте поликристаллической массы и использовать его как
затравку в последующих экспериментах. При большом выборе
затравок лучше начинать кристаллизацию на затравке сравни-
тельно небольшого диаметра (фиг. 5.5,в) и затем медленно уве-
личивать диаметр кристалла до требуемого размера снижением
температуры. Первоначальное зарождение обычно легче кон-
тролировать на затравках малой площади. Если образовался
кристалл плохого качества, то легко расплавить закристаллизо-
вавшийся объем так, чтобы не потерять всю затравку, и начать
рост снова.
Чохральский [31] первым применил метод вытягивания для
выращивания кристаллов легкоплавких металлов, таких, как
олово, свинец, цинк. На фиг. 5.5,а показана схема типичной уста-
новки для такого вытягивания. В течение многих лет метод ис-
пользовался для конгруэнтно плавящихся соединений всех клас-
сов, но, вероятно, наиболее широкое его применение лежит в
области полупроводников. Тил и Литтл [32] первыми получили
монокристаллы германия и кремния, и их работа явилась осно-
вой для получения полупроводниковых кристаллов этих веществ
с высокими характеристиками для научных и технических целей.
Метод вытягивания сегодня занимает важное место в промыш-
ленной технологии полупроводников. Нассау и Вэн Ютерт [33]
применили метод вытягивания к неорганическим веществам,
представляющим интерес как лазерные матрицы, и Нассау в
ряде статей [34, 35] описывает способы выращивания и свойства
CaWO2^Nd. Некоторые стороны метода рассмотрены в книге [8].
Интересным методом, близким к методу Чохральского, яв-
ляется метод Киропулоса [36, 37]. В расплав, находящийся в
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В
ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 193
соответствующем тигле, вводится затравка. Но затравку не вы-
тягивают из расплава, а кристалл растет на затравке за счет
того, что изотерма, соответствующая температуре плавления ве-
щества, перемещается от затравки вниз по тиглю (фиг. 5.7). Это
часто достигается простым охлаждением затравки через держа-
тель, который обеспечивает большой теплоотвод с поверхности.
В другом варианте метода тигель
перемещается в зоне температур-
ного градиента или снижается
температура печи, создающей со-
ответствующий температурный
градиент вблизи затравки. Метод
Киропулоса отличается от мето-
да Чохральского лишь следую-
щим:
1. Метод Киропулоса более
— Державка
Расплав
пригоден ДЛЯ выращивания кри- Фиг. 5.7. Метод Киропулоса.
сталлов с большим отношением
диаметра к высоте, тогда как метод Чохральского — для крис-
таллов с большим отношением высоты к диаметру.
2. При методе Чохральского легче контролировать направ-
ление роста и размер кристаллов.
3. При методе Киропулоса проще оборудование, поскольку не
производится вытягивание кристалла.
Оборудование
Для выращивания по методу Чохральского необходима сле-
дующая аппаратура:
1. Средства для нагрева расплава и регулирования темпе-
ратуры расплава и температурных градиентов.
2. Средства для содержания расплава.
3. Аппаратура для закрепления, вращения и вытягивания
затравки.
4. Аппаратура для регулирования газовой среды, если воз-
дух не пригоден в качестве атмосферы выращивания.
Основными средствами нагрева являются индукционный на-
грев и нагреватели сопротивления. Для индукционного нагрева
требуется либо достаточно высокая проводимость расплава или
тигля, чтобы обеспечить индукционную связь с высокочастот-
ным полем, либо приемник индукционных токов для связи с вы-
сокочастотным полем. Последний и разогревает тигель с веще-
ством. На обычно используемой частоте 450 кГц мощность, не-
обходимая для нагрева кварцевого тигля объемом 50 см3 в
графитовом приемнике индукционных токов до температуры
плавления Ge (937°C), составляет 5 кВт (обычно применяются
194
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
10-кил оваттные генераторы, обеспечивающие индукционную
связь с полем практически без потерь). Такая же частота при-
годна для нагревания неорганических веществ в металлических
тиглях, но для нагрева такого же размера иридиевого тигля, за-
полненного иттрий-алюминиевым гранатом, до температуры
плавления последнего (~ 1900°C) может потребоваться мощ-
ность до 20 кВт. В некоторых случаях используется вспомога-
тельный нагреватель, чтобы «довести» вещества до темпера-
туры, при которой их проводимость уже становится достаточной
для индукционной связи с высокочастотным полем.
Для диэлектриков могут использоваться высокие частоты
(так называемая область нагревания диэлектриков), например
получаемые в диатермических установках. Даже для материа-
лов с не очень высоким удельным сопротивлением, таких, как
Si, на частотах 3—5 МГц облегчается согласование сопротивле-
ний и отпадает необходимость в предварительном нагреве. Кроме
того, на таких частотах уменьшаются механические осцилляции
ширины зоны при зонной очистке (разд. 5.5).
Рабочий индуктор, который обычно выполняется из медной
трубки, в методе Чохральского, как правило, делают в виде ци-
линдрической спирали с равномерно расположенными витками,
хотя иногда, когда требуется специального вида распределение
температуры, используются индукторы особой формы (такие ин-
дукторы имеют особенно важное значение в зонной плавке).
Индукторы охлаждаются циркулирующей по ним водой, а си-
стемы водяного охлаждения предусматриваются в промышлен-
ных радиочастотных генераторах. Вопросы высокочастотного на-
грева рассматриваются в работах [38, 39].
Очень важно так настроить генератор, чтобы его внутреннее
полное сопротивление было равно полному сопротивлению всей
системы индуктор — приемник индукционных токов — тигель.
Обычно это достигается изменением емкости в колебательном
контуре или изменением полного сопротивления радиочастотного
трансформатора, связанного с генератором. Если вблизи гене-
ратора требуется проводить точные высокочастотные измерения,
то необходимо обеспечить максимальную экранировку от излуче-
ния, чтобы исключить помехи. Возможны также высокочастот-
ные ожоги тканей тела, которые особенно трудно поддаются ле-
чению. Необходимо следить, чтобы пальцы не оказались слу-
чайно вблизи индуктора.
Контролировать температуру при индукционном нагреве
можно, например, при помощи термопар, расположенных либо
вблизи тигля с расплавом, либо непосредственно в нем. Э. д. с.
термопары используется для регулирования мощности генера-
тора. Типичные регуляторные схемы описаны в работах [38, 39],
и такие регуляторы изготовляются промышленностью. Для за-
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 195
щиты от радиочастотных наводок термопарный датчик поме-
щается в заземленный корпус. В другом способе регулирования
температуры используется схема, поддерживающая постоянную
мощность в индукторе. Такие схемы описаны Симпсоном [38] и
выпускаются промышленностью. Регулятор мощности компенси-
рует колебания сетевого напряжения, но, конечно, не может
обеспечить постоянства температуры при изменении теплоотвода.
При температурах ниже 1200°C термопары с автоматическими
потенциометрами (всегда имеющимися в продаже) обеспечи-
вают точность порядка ±2 °C за период в несколько часов. Ис-
пользуя систему обратной связи [38], которая поддерживает
постоянную входную радиочастотную мощность при постоянстве
выходного напряжения термопары (иными словами, компенси-
рует колебания сетевого напряжения), можно достичь точности
±1°С.
Следует иметь в виду, что при соответствующих тепловых
условиях нерегулярная конвекция может вызвать флуктуации
температуры до ± 10—30° (разд. 5.4) даже при очень совершен-
ном внешнем контроле. При температурах выше 1200 °C труд-
ности возрастают, так как срок службы обычных термопар со-
кращается, а применение радиационных пирометров затруднено
флуктуациями испускания и поглощения излучения в материа-
лах, оказывающихся на пути луча зрения. Температуру можно
оценить оптическим термометром, направленным на поверхность
расплава или на стенки тигля, но для определения истинной тем-
пературы может потребоваться коррекция на испускательную
способность (для регулирования коррекция не требуется). Тем
не менее нескорректированные пирометрические температуры по-
лезны в том смысле, что их можно сравнивать в дальнейших
экспериментах, если условия последних идентичны. Интересны
«двухцветные» пирометры, в которых температура оценивается,
например, путем сравнения интенсивности двух разных длин
волн. Это уменьшает (но не исключает полностью) необходи-
мость введения поправки на испускательную способность, и
данные такого пирометра можно использовать для регулирова-
ния температуры. Рабин и Ван Ютерт [40] при выращивании ту-
гоплавких веществ использовали прибор, измеряющий погло-
щение радиочастотного излучения, для поддержания постоянной
высокочастотной мощности.
Нагреватели сопротивления рассмотрены в разд. 4.2 и 5.3.
Наиболее распространенные материалы для изготовления
тиглей — плавленый кварц, графит и благородные металлы.
Двуокись кремния не обеспечивает индукционной связи с высо-
кочастотным полем, поэтому приходится использовать графито-
вый приемник индукционных токов (см. фиг. 5.5, г). Если
расплав электропроводен, то приемник высокочастотных токов
196
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
нагревает вещество только до температуры плавления, а в даль-
нейшем расплав обеспечивает индукционную связь с полем1);
если расплав не электропроводен, то он на протяжении всего
эксперимента нагревается приемником индукционных токов.
Приемники индукционных токов обычно изготавливают из гра-
фита. Чтобы предохранить тигель и приемник индукционных то-
ков от окисления, их необходимо поместить в инертную атмос-
феру. Как правило, для этого используются трубы из плавленого
кварца, которые к тому же позволяют визуально наблюдать за
ростом кристалла. Область применения тиглей из SiO2 ограниче-
на ~ 1000 °C. В тиглях из окиси германия можно выращивать
кристаллы как германия, так и кремния. Однако из-за более
высокой температуры плавления Si серьезной проблемой оказы-
вается взаимодействие его с тиглем, а примесь кислорода в
выращенных кристаллах препятствует достижению собственного
сопротивления (см. ниже).
Графитовые тигли обеспечивают индукционную связь и при-
годны при более высоких температурах (до 2500 °C), чем тигли
из SiC>2, при условии, что газовая среда не окислительная. Тигли
из благородных металлов обеспечивают связь с полем и совер-
шенно инертны; области их применения:
Pt, 1500 °C, окислительная и восстановительная атмосфера;
Pt — 20% Ir, 1700 °C, окислительная и восстановительная
атмосфера;
1г, 2100 °C, частичное испарение — заметное испарение при
1000—1500 °C из-за образования летучих окислов.
Рабин и Ван Ютерт [41] увеличили срок службы иридиевых тиг-
лей,. напыляя в пламени ZrO2 по их внешней поверхности. Это
сильно снижает улетучивание иридия.
К бестигельным методам, в которых полностью устраняется
проблема тигля, относятся метод плавающей зоны (разогрев
обеспечивается индукционным нагревателем, радиационным на-
гревателем или фокусированным световым пучком) и метод Вер-
нейля с его модификациями. Эти методы будут рассмотрены в
разд. 5.5 и 5.6.
Механизм для вытягивания кристалла должен обеспечивать
постоянный равномерный подъем и вращение без вибрации. Не-
обходимо предусмотреть возможность опускания или поднятия
кристалла вручную с тем, чтобы можно было начинать рост на
4) Приемник индукционных токов из проводящих материалов частично
экранирует расплав от индукционного поля. Если требуется связь поля не-
посредственно с расплавом, лучше применять предварительный нагрев без
приемника (т. е. использовать нагрев пламенем и т. д.) и использовать тигли
из диэлектриков,
В. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 197
соответствующем уровне. Обычно скорость роста составляет от
10 мм/ч до 10—15 см/ч, а скорости вращения — от нескольких
оборотов до нескольких сот оборотов в минуту. Более низкие
скорости вытягивания применяются для труднокристаллизуемых
материалов. В многокомпонентных системах скорость роста мо-
жет составлять несколько десятков микрометров в час (гл. 7).
Очень высокие скорости применяются при получении дендритов
и дендритной ленты (сантиметры и десятки сантиметров в ми-
нуту; см. разд. 5.8).
Выращивание кристаллов — общие положения
Одна из задач вытягивания — обеспечить такое соответствие
между скоростью вытягивания и тепловыми условиями, чтобы
происходил непрерывный рост без отрыва затравки от расплава.
Такие дефекты, как дислокации, полосчатость, поликристалли-
ческий рост, однажды возникнув, часто распространяются во
вновь нарастающие слои, а поэтому очень важно брать затравку
наивысшего качества. Форма и совершенство выращенного кри-
сталла в первую очередь определяются тепловыми градиентами
по диаметру тигля в непосредственной близости от затравки и
градиентами, перпендикулярными границе роста. Этими же фак-
торами определяется вообще возможность получения монокри-
сталла. Влияние различных параметров при выращивании кри-
сталлов методом вытягивания исследовал Родес [11]. Нижеизло-
женное частично заимствовано из его анализа. Температурный
градиент, перпендикулярный границе роста, определяется сле-
дующими факторами:
1. Расположением нагревателей. При индукционном нагре-
ве — формой индуктора, положением тигля в нем, материалом
и размерами тигля и приемника индукционных токов; при
использовании нагревателей сопротивления — геометрией нагре-
вателей и положением тигля относительно них.
2. Теплоотводом в окружающее пространство. На него
влияют близость тигля к краю индуктора или к краю печи, тем-
пература помещения (наличие сквозняка может привести к ка-
тастрофическим неоднородностям), размеры и теплопроводность
кристалла, температура патрона, в котором зажат кристалл, и
эффективность теплового контакта с патроном и другими ча-
стями подъемного механизма (когда необходимы большие гра-
диенты, используются охлаждаемые водой держатели), излуча-
тельная способность поверхности расплава, отражательная
способность стенок печи, оптический путь светового излучения,
выходящего из печи, которые определяют тепловые потери за
счет радиации. При необходимости иметь малые температур-
ные градиенты можно использовать тепловые экраны вокруг
198
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
растущего кристалла и отражатели (как правило, платиновые),
которые способствуют уменьшению тепловых потерь за счет
радиации.
3. Глубиной расплава в тигле. Этим фактором часто пре-
небрегают, но если тигель заполнен лишь частично, его стенки
над расплавом играют роль тепловых экранов.
4. Скоростью вытягивания и скрытой теплотой плавления.
Чтобы усреднить радиальную асимметрию теплового поля и
обеспечить перемешивание, если вводится активатор, кристалл
обычно вращают. Из этих же соображений часто вращаю! и ти-
гель. Кроме того, если расплав реагирует с материалом тигля,
например при выращивании Si в тиглях из SiC>2, то тигель и
кристалл иногда вращают с одинаковой скоростью. Тем самым
достигается усреднение асимметрии теплового поля без переме-
шивания расплава, которое способствовало бы реакции распла-
ва с тиглем.
При некоторых условиях вращения тигля и затравки в рас-
плаве возникают локальные, плохо смешиваемые друг с другом
области, так называемые ячейки [42]. Возникающая таким путем
плохая смешиваемость может приводить к распределению при-
месей в кристаллах, отличному от того, что ожидалось.
На начальной стадии процесса, в момент введения затравки
в расплав, температуру последнего устанавливают немного выше
температуры плавления. Тем самым оплавляют небольшой учас-
ток затравки, чтобы быть уверенным, что рост начнется на чис-
той поверхности. Выращивание начинают, снижая температуру
расплава за счет уменьшения мощности. Экспериментатор точно
определяет момент начала вытягивания кристалла на основе лич-
ного опыта. Осторожно регулируя режим печи, экспериментатор
увеличивает диаметр до требуемого. В конце опыта кристалл,
как правило, выводят из расплава, для чего увеличивают либо
температуру последнего, либо скорость вытягивания. Если резкий
тепловой удар приводит к образованию в кристалле дефектов, то
рекомендуется охлаждать кристалл в контакте с расплавом или
использовать тепловые экраны как печь для отжига in situ.
Важно не допускать резких изменений диаметра кристалла,
так как это часто приводит к образованию дефектов. Для пред-
варительных экспериментов часто достаточно регулировать тем-
пературу в печи с точностью до ±2°. Точность поддержания тем-
пературы ±0,5° (достижимая без особых усложнений)-обычно
достаточна для всех кристаллов, кроме объектов, требующих
максимальной однородности. Совершенно ясно, что чем точнее
поддерживается температура, тем выше качество кристаллов.
Слихтер и Бартон [43] показали, что температурные флуктуации
вблизи границы раздела кристалл — расплав порядка 1 °С/с мо-
гут приводить к изменениям в скорости роста ~ 0,045 мм/е.
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 199
Кроме контроля за температурой необходим соответствующий
контроль за скоростью потока газа через печь, скоростью вытя-
гивания и вращения кристалла. Но количественная информация
о том, с какой точностью необходимо осуществлять такой кон-
троль, немногочисленна. По мере того как уровень расплава в
тигле в ходе выращивания кристалла снижается, необходимо
корректировать либо температуру, либо скорость вытягивания,
чтобы скомпенсировать изменение тепловых условий.
Наряду с вакуумом при выращивании кристаллов с низкой
упругостью пара используются защитные атмосферы Не, Аг, Н2
и N2. При высоких мощностях индукционного нагревателя (та-
кие мощности требуются, например, при вытягивании Si) в раз-
реженной атмосфере N2 часто наступают пробои. При таких про-
боях образуется химически активный N, вступающий в реакцию
со многими металлами (в качестве примера снова можно при-
вести Si). Кристаллизация в вакууме дает определенные пре-
имущества перед кристаллизацией в атмосфере газов с точки
зрения загрязнений, поскольку часто трудно бывает достать газ
требуемой степени чистоты. Давление 10-5 мм рт. ст. активного
газа эквивалентно давлению в 0,1 МПа инертного газа, ио содер-
жащего одну часть активной газовой примеси на 108 частей
инертного газа. Правда, низкое давление, ~10~5 мм рт. ст.,
трудно поддерживать при высоких температурах. Для этого не-
обходимы мощные насосы. В вакууме нежелательные примеси с
повышенной упругостью пара удаляются за счет испарения из
расплава.
Для получения кристаллов с низкой концентрацией дефектов
нужно на протяжении всего процесса выращивания сохранять
плоской границу раздела кристалл — расплав. Для этого необхо-
димо, чтобы изотермы были практически перпендикулярными
направлению роста, и требуется тщательный контроль тепловых
потоков как вдоль тигля, так и в перпендикулярном направлении.
Рид [44] проанализировал тепловые потоки в излучающих ци-
линдрах из Ge, Сг2О3 и W применительно к выращиванию кри-
сталлов этих материалов. Родес [11] вывел уравнения, связываю-
щие форму межфазной границы с наиболее важными парамет-
рами процесса, и далее мы следуем его теории. Если основной
тепловой поток входит в растущий кристалл снизу, а радиаль-
ный тепловой поток незначителен, изотермы будут перпендику-
лярными направлению роста. Такая ситуация описывается урав-
нениями
(5.4)
200
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
где Т — температура, х — расстояние вдоль кристалла, г — ра-
диальное расстояние, k — константа. Теплота кристаллизации
должна течь в направлении от расплава к кристаллу и рассеи-
ваться за счет теплоотдачи через кристалл к подъемному меха-
низму и за счет излучения к стенкам или в окружающую среду.
----Тепловой потоп
-----Изотермы
Скоростью рассеивания этой
теплоты определяется мак-
симально возможная ско-
рость роста кристалла. При
контролируемом выращива-
нии граница роста непод-
вижна. Это означает, что
скорость роста равна ско-
рости вытягивания. Хотя в
принципе радиальный гра-
диент температуры dTIdr
должен быть незначитель-
ным, в действительности это
положение нарушается,
поскольку выращиваемый кристалл отдает тепло в окружающую
среду. На фиг. 5.8 показано положение изотерм при обычном
выращивании методом вытягивания. На фиг. 5.8, а изображена
ситуация в случае индукционного нагрева вещества в проводя-
щем тигле без применения тепловых экранов. В этом случае
тепло поступает от индуктора с тиглем и расплавом, а% тепло-
вые потери кристалла достаточно высоки. В случае выращивания
с радиочастотным нагревом, но с использованием тепловых
экранов или при выращивании в печах сопротивления, когда ти-
гель полностью находится в печи, радиальные тепловые потери
растущего кристалла могут быть сильно снижены. На фиг. 5.8, а
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 201
буквой А обозначены тепловые потери с поверхности расплава,
главным образом за счет радиации, буквой В — радиальные теп-
ловые потери от сторон выращиваемого кристалла (также глав-
ным образом за счет радиации), буквой С — тепловые потери
вдоль кристалла, главным образом за счет теплопроводности.
Изотермы на фиг. 5.8, а вогнуты относительно расплава.
Если условия эксперимента таковы, что тепловой поток в обла-
сти Л направлен к растущему кристаллу (из-за наличия экранов
или если кристалл расположен глубоко в печи сопротивления)
(фиг. 5.8,6), то Т2 снижается по сравнению с фиг. 5.8, а и меж-
фазная граница становится выпуклой. Посмотрим, какова вели-
чина теплового потока в различных точках поперечного сечения
кристалла на небольшом расстоянии от поверхности роста
(фиг. 5.8,в и г). Предположим, что тепловой поток к кристаллу
(Qin) через поверхность роста на фиг. 5.8, в и г одинаков
(Qin есть сумма теплового потока из расплава и теплоты кри-
сталлизации). Тогда, если имеется радиальный теплоотвод в
окружающую среду (Qr), тепловой поток по оси кристалла в
центре (Qc) будет больше, чем у края кристалла (Qe), а изо-
терма Ti и межфазная граница примут вогнутую форму
(фиг. 5.8, в). Если же в радиальном направлении тепло подво-
дится из окружающей среды (QE> Qc), то изотерма Т} и меж-
фазная граница будут выпуклыми. Таким образом, при Qr = 0
Qe = Qc и межфазная граница плоская. Влияние тепловых экра-
нов на форму поверхности роста сводится в сущности к регули-
рованию QE-
Интересно проанализировать детальнее тепловые потоки, со-
ставляющие Qin (в кал/с):
Qin = QL + QM, (5.5)
где Ql — скрытая теплота кристаллизации, a Qm— тепловой
поток из расплава. Величину QL можно найти по формуле
d х
Ql=APsL-^-, (5.6)
где А — площадь внешней поверхности кристалла, ps — его плот-
ность, L — теплота кристаллизации и dxjdt — скорость роста
(в первом приближении равна скорости вытягивания). Величина
Qm дается формулой
где Ki — коэффициент теплопроводности жидкости (предпола-
гается отсутствие конвекции; в противном случае нужно вве-
сти поправки в величину /С, учитывающую эту конвекцию),
(dT/dx)i — температурный градиент в жидкости. Величина
202
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Qin — это также тепловой поток по кристаллу, который можно
вычислить по формуле
(5.8)
Здесь К$ — коэффициент теплопроводности кристалла, а
(dTfdx)s — температурный градиент в кристалле. Подставляя
эти выражения в уравнение (5.5), получаем
-^Ш]- (5л0)
Уравнение (5.10) описывает влияние режима роста и характери-
стик материалов на скорость кристаллизации. Если скорость
вытягивания превышает величину dxjdt, вычисленную по фор-
муле (5.10), то кристалл отрывается от расплава. Если она ниже
этого значения, то площадь поперечного сечения кристалла на-
чинает увеличиваться.
Согласно Родесу [11],
(5.11)
где Qi —тепловые потери с границы роста за счет теплоотдачи,
a Q2 — тепловой поток к границе роста от нагревателей в си-
стеме. Следовательно, площадь сечения кристалла находится в
обратной зависимости от скорости вытягивания и возрастает
при уменьшении Qi.
Согласно формуле (5.10), допустимая скорость роста макси-
мальна при градиенте (dTldx)b приближающемся к 0 (при от-
рицательном градиенте (dTjdx)i жидкость может переохлаж-
даться, что приведет к быстрому продвижению межфазной гра-
ницы и дендритному росту). Таким образом,
Итак, величина (йх/Л)макс .зависит от градиента в кристалле.
Максимальные градиенты возникают при искусственном увели-
чении теплоотвода от растущего кристалла^цапример при охлаж-
дении водой держателя кристалла. Но высокие скорости роста,
достигаемые при этом, как правило, невыгодны, поскольку каче-
ство кристаллов, выращенных при таких условиях, оставляет
желать много лучшего.
Слихтер и Бартон [43] детальнее проанализировали распре-
деление температуры при выращивании Ge. Используя одномер-
ное приближение, рассматривая вращающийся кристалл боль-
Б. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 203
шого диаметра и пренебрегая радиальными температурными
градиентами, они показали, что
(5.13)
где I — температуропроводность (£ = kfpiCp, причем k — коэф-
фициент теплопроводности, Ср — удельная теплоемкость при по-
стоянном давлении и р/— плотность жидкости), a Vx — сумма
скорости нормального потока жидкости и скорости роста. Слих-
тер и Бартон решили уравнение (5.13), полагая, что а) при
х = 0 (поверхность раздела кристалл — расплав) Т = Тпл,
б) градиент dTjdx в кристалле постоянен и в) конец кристалла,
Фиг. 5.9. Распределение температуры при выращивании кристаллов мето-
дом Чохральского [43].
являющийся затравкой, находится при постоянной температуре.
В результате они получили температурный профиль, изображен-
ный на фиг. 5.9. Здесь а — толщина диффузионного слоя. Пере-
мешивание уменьшает а.
Кроме теплообмена на границе роста обычно в расплаве
происходит массообмен, который усложняет общую картину
теплопереноса (см. разд. 2.5 и 3.10). По мере увеличения темпе-
ратуры кристаллизации возрастает роль теплообмена за счет
радиации. Рид [44], Биллиг [45] и Вилкокс с Фалмером [46] про-
анализировали роль радиации и вывели уравнения теплопере-
носа для процессов, в которых радиация является важным фак-
тором.
Вне диффузионного слоя а перенос вещества обеспечивается
в основном за счет движения жидкости. Даже в том случае, ког-
да массоперенос в диффузионном слое можно не рассматривать
204
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
(в очень чистых однокомпонентных системах), теплопередача
через диффузионный слой будет затруднена в силу того обстоя-
тельства, что в этом слое перемешивание жидкости не эффек-
тивно. Для Ge показано, что градиент (dT/dx)s постоянный и не
зависит от dxldt при скоростях роста менее 3,6 см/ч. При этом
он равен приблизительно 150°С/см. В Si [47, 48], несмотря на
более высокую температуру плавления (1412 °C, а не 937 °C, как
у Ge), градиент примерно такой же (125—150°С/см).
Фиг. 5.10. Распределение температуры в методе Чохральского при разных
. скоростях роста [43].
Слихтер и Бартон [43] вычислили (dTldx)i, положив
(dTldx)s = 150 °C и приняв скорость вращения равной
100 об/мин. Их результаты представлены на фиг. 5.10. Количе-
ство тепла, которое необходимо отвести от кристалла, зависит
от скорости роста, так как от последней зависит поток выделяю-
щейся скрытой теплоты кристаллизации. Чем выше скорость, тем
меньше должен быть градиент в расплаве. Скорость роста мак-
симальна, когда градиент в расплаве равен нулю. Естественно,
вращение кристалла способствует перемешиванию. Кохран [49]
показал, что вращающийся диск действует подобно вентиля-
тору, «подтягивая» жидкость в центре (фиг. 5.11) таким образом,
что вблизи границы роста поток оказывается ламинарным. Госс
и Адлинпон [50] установили, что при скоростях вращения 30—
60 об/мин образуется устойчивый водоворот расплава. Заметим,
что в некоторых случаях при увеличении диаметра кристалла
можно получить большие скорости роста [50], так как по мере
увеличения диаметра кристалла усиливается перемешивание
б. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕПТНОЙ СИСТЕМЕ 205
(при постоянной скорости вращения). Однако при больших диа-
метрах обычно труднее контролировать форму межфазной гра-
ницы и, следовательно, труднее обеспечить высококачественный
Направление
вытягивания
Фиг. 5.11. Потоки жидкости при
перемешивании в методе Чо-
хральского.
рост, если не снижать скорости.
Для получения кристаллов высокого качества важное значе-
ние имеет постоянство тепловых условий в ходе выращивания.
Изменения градиента температу-
ры приводят к колебаниям мгно-
венной скорости роста, поскольку
фронт кристаллизации стремится
к совпадению с изотермой, со-
ответствующей температуре плав-
ления. Поэтому необходимо обес-
печивать предельно точное регу-
лирование температуры. Анало-
гичные изменения условий про-
исходят и при снижении уровня
расплава в тигле и при изме-
нении диаметра и длины кри-
сталла.
Кроме перечисленных факто-
ров возможны кратковременные
флуктуации температуры рас-
плава, связанные, как показали
Мюллер и Вильгельм [51], с не-
однородной (неустойчивой) теп-
ловой конвекцией. Вилкокс и Фалмер [46] проанализировали
экспериментальные данные, полученные при вытягивании кри-
сталлов CaF2, и получили результаты, по-видимому справедли-
вые почти при любой конструкции установки для вытягивания.
Хэрл [52] и Коул с Вайнгардом [53] также отметили наличие тем-
пературных флуктуаций в расплавах и проанализировали их,
считая, что они вызываются циркуляцией жидкости.
На фиг. 5.12 [54] показаны температуры, измеренные неза-
щищенной термопарой Pt/Pt — 20% Rh, расположенной на 1 мм
ниже поверхности расплава по центру тигля, нагреваемого в
печи сопротивления. Вилкокс с Фалмером и другие авторы по-
лучили аналогичные кривые изменения температуры со временем
при индукционном нагреве расплава. Такие колебания нельзя
отнести за счет флуктуаций в регулировании температуры, так
как и в экспериментах Вилкокса с Фалмером и в экспериментах
Бернса применялись довольно сложные регуляторы, а флуктуа-
ции температуры в точке расположения датчика регулятора со-
ставляют малую долю флуктуаций температуры в расплаве,
наблюдавшихся вблизи межфазной границы. Вилкокс и Фалмер
показали, что флуктуации температуры уменьшаются по мере
206
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
удаления от межфазной границы. Величина флуктуаций воз-
растает с увеличением температуры роста, с увеличением тем-
пературного градиента в расплаве и с возрастанием температур-
ного градиента над расплавом. Во всех случаях эксперименталь-
ные наблюдения удается объяснить нерегулярной конвекцией !).
Флуктуации температуры расплава вблизи межфазной границы
вызывают флуктуации скорости роста. Таким образом, при на-
личии таких флуктуаций истинная скорость роста может быть в
несколько раз ниже или выше скорости вытягивания. Изменения
скорости приводят к изменениям коэффициента распределения
примесей и активаторов. Давно известно «полосчатое?> измене-
ние сопротивления в полупроводниках, выращиваемых методом
Фиг. 5.12. Зависимость температуры от времени в расплаве KNbO3—КТаО3
при разности температур между верхом и дном, равной 10 аС [54].
Чохральского; Мюллер и Вильгельм [51] всесторонне рассмот-
рели эту проблему.
Складывается впечатление, что многие дефекты в кристаллах,
выращенных методом вытягивания, возникают из-за кратковре-
менных флуктуаций температуры, почти всегда существующих в
таких системах. Эта проблема заслуживает дальнейшего изуче-
ния, и как минимум во всех статьях, касающихся метода вытя-
гивания из расплава, должна содержаться информация относи-
тельно постоянства температуры вблизи границы кристалл —
расплав. Мюллер и Вильгельм [51] наблюдали аналогичные
флуктуации при выращивании кристаллов InSb зонной плавкой,
и это позволяет предполагать существование подобных темпе-
ратурных флуктуаций, обусловленных нерегулярной конвекцией,
в большинстве методов выращивания кристаллов из жидкой
фазы в одно- и многокомпонентных системах и даже при выра-
щивании кристаллов из газовой фазы.
На фиг. 5.13 изображена схема, поясняющая механизм нере-
гулярной конвекции, ответственной за тепловые флуктуации.
*) Вилкокс и Фалмер использовали термин Турбулентная конвекция, но
нерегулярная конвекция, по-видимому, более точный термин, так как числа
Рейнольдса для турбулентной области не приводятся и даже не нужны, что-
бы объяснить наблюдающиеся эффекты.
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 207
Конвекция возникает в нагретом расплаве, когда жидкость на-
чинает подниматься вблизи нагретых стенок и опускаться вблизи
центра. Чем выше Д7\ разница температур между дном и по-
верхностью жидкости, тем сильнее конвекция. Выделим мыслен-
но небольшие объемы жидкости Vi, V2, Е3, поднимающиеся
к поверхности. На поверхности эти объемы охлаждаются глав-
ным образом вследствие излучения в окружающую среду. Ско-
рость их охлаждения будет зависеть от тепловых условий над
расплавом. Температурный градиент, сквозняки, скорость газо-
вого потока через систему и т. д.— все это будет влиять на ох-
лаждение выделенного объема. Когда объем охладится на-
столько, что его плотность станет достаточно большой, он опу-
стится и заменится другим объемом жидкости. Таким образом,
уменьшение или полное устранение
градиента в расплаве и над ним, сквоз-
няков и т. д. приведет к уменьшению
тепловых флуктуаций. Другой способ
снижения флуктуаций — энергичное
перемешивание расплава, достаточно
сильное по сравнению со случайными
конвективными вариациями. Однако,
как показано на фиг. 5.14 [46], обыч-
ные скорости перемешивания, как пра-
вило, недостаточны для сильного пре-
вышения над уровнем конвекции. По-
Фиг. 5.13. Механизм не-
регулярной конвекции.
этому иногда лучшим решением про-
блемы оказывается изменить тепловую обстановку за счет
улучшения конструкции печи и использования тепловых отра-
жателей.
Регулярные неоднородности в виде плоских областей, разли-
чающихся показателем преломления, удельным сопротивлением
и другими характеристиками, обычно называются полосча-
тостью^. Полосчатость в отсутствие примесей или активаторов
может быть обусловлена также изменениями в стехиометрии.
Если она вызвана нерегулярной конвекцией, то полосы ориенти-
рованы параллельно границе роста (перпендикулярно направ-
лению роста, как показано на фиг. 5.15,а). В условиях концен-
трационного переохлаждения возникают грани, ячеистая по-
верхность и в предельном случае рост становится дендритным
(см. разд. 3.11 — 13 и 5.8). В этом случае полосчатость часто
параллельна направлению роста, как показано на фиг. 5.15. Для
снижения концентрационного переохлаждения создают большие
4) В советской литературе полосчатость, параллельную фронту роста,
называют часто зонарным строением, а неоднородность, перпендикулярную
ему, — ячеистой структурой. — Прим. ред.
208
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
градиенты температуры на границе раздела кристалл — рас-
плав. Наоборот, чтобы подавить нерегулярную конвекцию, не-
обходимы минимальные градиенты температуры. Поэтому в
Фиг. 5.14. Влияние перемешивания на нерегулярную конвекцию [46].
системе, в которой существует одновременно и нерегулярная
конвекция, и концентрационное переохлаждение, изменение
температурного градиента может оказаться неэффективным для
Направление роста
а
Полосчатость обусловлена
регулярной конвекцией
Направление роста
6
Полосчатость обусловлена
ячеистым ростом
Фиг. 5.15. Возникновение полосчатости.
образования свободных от полосчатости кристаллов. Если же
система поддерживается в таких условиях, что верхняя зона
расплава горячее нижней, то конвекция не может существовать
при любых значениях температурного градиента. Такая геомет-
рия возможна при выращивании методом Бфиджмена — Сток-
баргера, к которому и следует обращаться, когда проблема по-
досчатости существенна,
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 209
Как показали Ютек и Флеминге [55], магнитные поля порядка
1000 Гс уменьшают нерегулярную конвекцию настолько, что
полосчатость уже не наблюдается в кристаллах олова, медно-
алюминиевого сплава и активированного теллуром антимонида
индия, выращенных методом Чохральского, при условии что
градиенты температуры также минимальны. Когда проводящий
материал движется в магнитном поле, возникает торможение.
Оно сводится к увеличению вязкости, что ведет к подавлению
конвекции. Торможение пропорционально произведению оц, где
о — удельная электропроводность расплава, а ц— его магнит-
ная восприимчивость. Для большинства расплавов величины о
и ц не известны, а поэтому трудно предсказать, будут ли магнит-
ные поля эффективными для снижения полосчатости, например,
в окислах. Следует указать, что в антимониде индия эффекты
проявлялись и в низких полях ~200 Гс, так что этот метод,
несомненно, заслуживает дальнейших исследований и может ока-
заться полезным в очень многих случаях1).
Другая причина образования дефектов при методе вытягива-
ния из расплава — напряжения, возникающие при быстром ох-
лаждении кристалла до комнатной температуры. Такие напря-
жения могут быть вызваны температурными градиентами в ис-
пользуемой установке для вытягивания или тем, что кристалл
слишком быстро извлекается из системы и сразу охлаждается
до комнатной температуры. В этих условиях температура раз-
ных частей кристалла будет неодинаковой. В результате возник-
нут различия в размерах областей, выделенных в разных ча-
стях кристалла. Если эти различия приведут к упругой деформа-
ции, то они исчезнут, когда кристалл попадет в изотермические
условия. Если же при высокой температуре возникнет неодно-
родная пластическая деформация, то весь кристалл при охлаж-
дении до комнатной температуры может оказаться неравномерно
упруго напряженным. Если в результате деформации возникнут
дислокации или границы зерен, то эти дефекты останутся при
комнатной температуре и повторный отжиг кристалла после
того, как он был охлажден до комнатной температуры, может
оказаться не очень эффективным. Лучше отжигать кристаллы,
начиная с температуры роста, без предварительного охлажде-
ния их до комнатной температуры.
4) Уитт и Гейтос [138] разработали методы травления, обеспечивающие
высокое разрешение, которые оказались особенно подходящими для выявле-
ния полосчатости в кристаллах, выращенных по методу Чохральского. Они
показали, что полосчатость практически устраняется, если обеспечить полную
симметрию теплового поля, например вращая тигель при невращающейс^
затравке,
Таблица 5.2
Некоторые кристаллы, выращенные методом вытягивания из расплава и методом Киропулоса
Материал Формула Темпе- ратура плавле- ния, °C Материал тигля Скорость вытягивания Направление роста Атмосфе- ра Примечание Литера- тура
Германий Ge 937 См. текст [1161
Кремний Si 1412 » »
Цинк Zn 419 Пирекс 1,2 см/мин Различные n2 Кристаллы 2,7 мм в диаметре, охлаждают- ся на воздухе
Арсенид галлия GaAs 1240 Плавленый кварц » As Избыточное давле- ние As
Хлорид калия KC1 770 Pt или фарфор Воздух Метод Киропулоса; используется охлаж- даемая воздухом за- травка, погружаемая в расплав; выращивают- ся и другие щелочно- галоидные соединения [37]
Вода H2O 0 Стекло » Метод Киропулоса, диаметр 9 см, высота 6 см [1171
Вольфра?лат каль- ция CaWO4 1535 Rh 0,5—2 см/ч » См. текст
Ниобат лития LiNbO3 1260 Pt 0,5—2 см/ч » » »
Сапфир AloO3 2050 Ir 0,5—2 см/ч » » » >
Иттрий-алюми- ниевый гранат Y3A15O12 — 1900 Ir 0,5—2 см/ч » » »
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 211
1. Выращивание кристаллов полупроводников методом Чох-
ральского. Чохральский [31] первым стал вытягивать кристаллы
из расплава и применил этот метод к металлам. С 1917 г. и
вплоть до работы Тила и Литтла [32] метод применялся глав-
ным образом к металлам. Но необычайный успех метода и его
широкое распространение были вызваны работой Тила и Литтла.
В самом деле, можно сказать, что вся полупроводниковая про-
мышленность (которая сама дала мощный толчок исследованию
твердого тела в других областях, в том числе и выращиванию
кристаллов) не могла бы развиваться и не могла бы сегодня
существовать без монокристаллов высокого качества, обеспечи-
ваемых методом вытягивания из расплава. В качестве типичных
примеров мы детальнее остановимся на выращивании кристал-
лов Si и Ge. Другие полупроводники и условия их выращивания
приведены в табл. 5.2.
Германий (ТПЛ = 937ОС) в принципе должен расти легче,
чем кремний (ТПл = 1412°С), из-за его более низ-кой темпера-
туры плавления. Расплавы германия обычно содержатся прямо
в графитовых тиглях, которые являются одновременно и прием-
никами индукционных токов при индукционном нагреве. При
этом карбиды германия не образуются, а растворимость С в Ge
при температуре плавления незначительна. Индукционный на-
грев применяется чаще всего, так как в печах сопротивления
выше вероятность загрязнения расплава. Для выращивания
очень чистого Ge используется исходный материал наивысшей
чистоты, полученный зонной плавкой. Бор — особенно вредная
примесь в полупроводниках четвертой группы, где он действует
как электрический акцептор. Поскольку его коэффициент рас-
пределения в Si близок к единице, он не оттесняется при обыч-
ной зонной плавке или при выращивании методом вытягивания.
Загрязнение бором из графитовых тиглей может оказаться
серьезной проблемой. Но для ядерных применений выпускается
графит, почти свободный от бора, и он имеется в форме тиглей.
Бор, первоначально присутствующий в исходном реактиве Si,
можно удалить зонной плавкой в присутствии паров воды [56],
которые селективно окисляют бор. Окисел же удаляют путем
испарения. На фиг. 5.16 показано устройство для выращивания
кристаллов Ge и Si методом вытягивания из расплава. Нагрев
печи обеспечивается 10-киловаттным генератором, работающим
на частоте 450 Гц, который нагревает графитовый приемник ин-
дукционных токов. Температуру измеряют термопарой Pt/Pt —
10% Rh в молибденовом колпачке, установленной в нужной точке
приемника. Для создания требуемой атмосферы через трубу из
плавленого кварца с герметичными латунными концевыми флан-
цами, охлаждаемыми водой, пропускают поток газа. Затравку
зажимают в патроне на валу из нержавеющей стали, который
212
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
вводится в камеру через уплотнение с тефлоновой прокладкой.
Вал и двигатель, обеспечивающий вращение, монтируются на
платформе над установкой для вытягивания. Платформа подни-
мается и опускается ходовым винтом, приводимым в движение
вращающейся гайкой, вращение которой обеспечивается двига-
телем с регулятором. Вал с закрепленной на нем затравкой
также вращается двигателем с регулятором. Объем расплава
составляет около 100 см3. Кристаллы могут выращиваться со
скоростью от 10-4 до 10-2 см/с. При скоростях ниже 10-4 см/с
Кристалл
Графитовый
токоприемник
Кварцевый
вкладыш.
Расплав
Риток
нагревателя
-Кварцевая
трубка
Фиг. 5.16. Схема установки для выращивания кристаллов Si методом вы-
тягивания из расплава.
флуктуации скорости роста, связанные с несовершенством при-
способления для вытягивания и недостаточно точным регулиро-
ванием температуры, а также с нерегулярной конвекцией, ста-
новятся сравнимыми с заданной скоростью роста. При скоро-
стях, приближающихся к 10-2 см/с, монокристаллы не
образуются, так как градиент в кристалле {dT!dx}s недостаточ-
но велик. Охлаждая кристалл, можно, вероятно, достичь боль-
ших скоростей роста. Иногда, действительно, дендриты спе-
циально выращивают в аналогичных условиях (разд. 5.8), за-
давая высокие скорости. Газ, в котором выращивают кристалл,
обычно впускают сверху и выпускают через дно печи. Таким
образом, холодный газ обтекает растущий кристалл сверху, уве-
личивая градиент (dT!dx)s. Кристаллы германия можно выра-
щивать в атмосфере Н2, Не, Аг или N2, но газ должен быть
очищен от окислителей, углеводородов-и воды.
Коэффициенты распределения для большого числа активато-
ров и примесей, представляющих интерес для электроники, при-
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОПЕНТИОЙ СИСТЕМЕ 213
ведены в табл. 5.3 *). Важно, чтобы для активации использова-
лись реактивы полупроводниковой чистоты, так как в против-
ном случае активаторы сами часто становятся важным источни-
ком загрязнений.
Таблица 5.3
Коэффициенты распределения различных примесей
Растворимая примесь Si Ge Тип проводимости
В 0,8 17 p
А1 0,002 0,073 p
Ga 0,008 0,087 p
In 4- 10“4 0,001 p
Р 0,35 0,08 n
As 0,30 0,02 n
Sb 0,023 0,003 n
Если коэффициент распределения активатора (или примеси)
сильно отличается от единицы, то его концентрация в расплаве
в процессе роста изменяется и в кристалле, выращенном мето-
дом вытягивания, будет градиент концентрации активатора. Од-
нородность выращенного кристалла можно улучшить, если объем
расплава сделать значительно больше, чем объем выращивае-
мого кристалла. Один из вариантов такого способа — метод пла-
вающего тигля Левертона [59]. Для поддержания постоянного
состава расплава можно в процессе вытягивания кристалла в
расплаве плавить стержень соответствующего состава. Концен-
трацию активатора можно также выравнивать по всему объему
выращенного кристалла зонной переплавкой (разд. 5.5).
Кристаллы кремния сложнее выращивать, чем кристаллы
германия, так как отсутствуют действительно инертные тигли.
С графитом Si реагирует, образуя карбиды кремния, а с благо-
родными металлами — сплавы, почему эти материалы и непри-
годны для тиглей. Самый лучший тигель — из плавленого квар-
ца. Для нагрева можно использовать печи сопротивления, но
чаще используется индукционный нагрев и графитовый приемник
индукционных токов. Кремний медленно реагирует с плавленым
кварцем:
Si(o + SiO2W 2SiO(g), (5.14)
а окисел SiO заметно летуч (~10 мм рт. ст. при 1412 °C [60]).
Кроме того, плавленый кварц обычно загрязнен бором, который
растворяется в расплаве по мере разрушения тигля и, внедряясь
в решетку Si, действует как акцептор. Кислород заметно
[57, 58], а также Дж. Каррузерс (частное сообщение).
214
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
растворяется в расплаве кремния и может также входить в ре-
шетку Si, вредно влияя на электрические свойства. Для получе-
ния Si с высоким (собственным) удельным сопротивлением при-
ходится прибегать к бестигельным методам (разд. 5.5). Тем не
менее методом вытягивания можно получать кристаллы кремния
с сопротивлением, удовлетворяющим многим практическим це-
лям, и этот метод имеет преимущество перед бестигельными ме-
тодами (поскольку он проще) во всех случаях, когда получаемые
вытягиванием кристаллы по удельному сопротивлению, време-
нам жизни носителей и их подвижности удовлетворяют предъ-
являемым требованиям. Если не считать более высокой темпе-
ратуры плавления и большей химической активности кремния, то
условия роста и методика выращивания кристаллов Si анало-
гичны таковым для Ge. Правда, при выращивании Si вращение
тигля особенно необходимо для того, чтобы уменьшить разли-
чие между скоростью движения стенок тигля и расплава и тем
самым снизить скорость реакции (5.14).
Бездислокационные кристаллы Si и Ge впервые были выра-
щены Дэшем [61]. Недавно были получены бездислокационные
кристаллы и таких соединений, как GaAs. По-видимому, это
наиболее совершенные кристаллы из когда-либо полученных.
Следует уточнить, что под бездислокационными кристаллами
подразумеваются кристаллы, не имеющие дислокаций, выявляе-
мых травлением и декорированием. Вполне возможно (хотя и
не обязательно), что дефекты могут быть выявлены другими ме-
тодами. Кристаллы, конечно, не свободны от вакансий и, будучи
очень чистыми, не свободны все же от химических примесей. Тем
не менее работу Дэша, безусловно, следует считать заметной
вехой на пути управления свойствами твердотельных материа-
лов. Для получения бездислокационного материала используется
следующая методика.
1. Исходный диаметр затравки (1—2 мм) должен быть мень-
ше, чем обычно используется в методе вытягивания, так чтобы
в ней было лишь малое число дислокаций. Кроме того, в затрав-
ке малого диаметра возникают меньшие тепловые напряжения
в момент первого контакта ее с расплавом. Уменьшение же теп-
ловых напряжений снижает вероятность образования дислока-
ций. Можно также сузить растущий кристалл до 1—2 мм, а за-
тем осторожно расширить. В суженной части число дислокаций
будет незначительным. Важно, чтобы протяженность суженной
области была достаточно большой, чтобы вероятность выхода
дислокаций на поверхность кристалла до момента увеличения
его диаметра была максимальной.
2. Угол между плоскостями скольжения {111} и направле-
нием роста должен быть большим. Дислокации, образовавшиеся
при пластической деформации Si и Ge} концентрируются в пло-
б. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 215
скостях скольжения {111}. Если направление роста может быть
выбрано под большим углом к плоскостям {111}, то любые ди-
слокации, присутствующие в кристалле, будут иметь тенденцию
дорастать до поверхности и исчезать по мере удлинения кри-
сталла.
3. Дэш высказал предположение, что можно облегчить дви-
жение дислокаций к поверхности, обеспечив соответствующий
запас вакансий, которые способствовали бы переползанию ди-
слокаций. Для этого нужно создать в кристалле вакансионное
пересыщение и предотвратить диффузию вакансий к поверхности.
Этому способствует закалка. При выращивании это невозможно
осуществить, но хорошие результаты дает быстрое выращива-
ние в условиях большого температурного градиента, особенно
на первых стадиях, когда осуществляется сужение. Установлено,
что такой прием содействует переползанию дислокаций.
Интересно подчеркнуть, что если получены бездислокационные
кристаллы материалов с ковалентными связями, то зарождение
новых дислокаций в них сильно затруднено. Дэш показал, что
тепловые напряжения, возникающие в бездислокационном
кристалле Ge при кратковременном выведении его из расплава
с последующим погружением, не создают каких-либо дислока-
ций. Вероятно, новые дислокации значительно легче образуются
при наличии уже существующих. Например, в кристалле
с плотностью дислокаций 103 см~2 после его выведения из рас-
плава и последующего погружения плотность дислокаций воз-
растает более чем до 106 см~2. Некоторые полупроводники, вы-
ращенные методом вытягивания, и условия их роста приведены
в табл. 5.2.
2. Выращивание диэлектриков и металлов методом Чохраль-
ского. Хотя метод вытягивания из расплава впервые был при-
менен для металлов, а его промышленный успех связан с полу-
проводниками, в последние годы наибольшие успехи он принес,
пожалуй, в области выращивания кристаллов тугоплавких оки-
слов и солей, являющихся диэлектриками. Такие исследования
в значительной степени вызваны большой потребностью в кри-
сталлах для лазеров и во вспомогательных лазерных материа-
лах для модуляторов и генераторов гармоник.
Первым веществом такого типа, выращиванием которого ин-
тенсивно занимались, был вольфрамат кальция CaWO4 (шеелит),
широко исследовавшийся как матрица для лазерных материа-
лов. Нассау и Ван Ютерт [33] первые сообщили о выращивании
методом вытягивания кристаллов, относящихся к структурному
типу шеелита, а Нассау с соавторами [34, 62, 63] в ряде статей
описали условия выращивания и активации редкоземельными
элементами. Кульминационным моментом этой работы явилось
216
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
создание твердотельного лазера непрерывного действия с крайне
низким порогом возбуждения, в котором в качестве активного
иона использован Nd3+. Компенсация заряда обеспечивалась
контролируемым введением Na+ [64].
Вольфрамат кальция можно выращивать в установке для
вытягивания с индукционным нагревом, аналогичной описанной
для выращивания полупроводников. Его точка плавления 1570 °C,
и потому наиболее подходящий материал для тигля — иридий.
В этом случае кристаллы можно выращивать в атмосфере воз-
духа, соответственно отпадает необходимость регулировать га-
зовую среду. Приблизительная скорость вытягивания 5—20 см/ч.
Оптимальное направление роста — перпендикулярное граням
(НО) и (100).
При этом необходимо брать исходные материалы высокой
степени чистоты, а лучшие по качеству кристаллы были полу-
чены из исходных материалов, очищенных зонной плавкой, или
при использовании в качестве исходного сырья кристаллов, ра-
нее выращенных методом вытягивания. В отсутствие тепловых
экранов межфазная граница кристалл — расплав вогнута, как
показано на фиг. 5.8,а. Если используются тепловые экраны, то
поверхность расплава может быть плоской, что в конечном
счете проявляется в улучшении качества кристаллов.
Нассау [62] подробно изучил коэффициенты распределения
щелочных и редкоземельных металлов. Поскольку ионы Nd3+
занимают положения ионов Са2+, необходима компенсация за-
ряда (разд. 2.5), и Нассау определил зависимость &Nd3+ и
&Na+ — коэффициентов распределения Nd3+ и Na+ — от кон-
центрации ионов Nd3+ и Na+. Полученные в этой работе резуль-
таты позволяют регулировать концентрацию Nd3+ и Na+ и их
отношение в выращенном кристалле.
Кристаллы многих изоморфных соединений со структурой
шеелита и родственных им составов вырастил Ван Ютерт с
сотрудниками [65—67].
После того как было показано [68], что кристаллы LiNbOa
сравнительно легко можно выращивать методом вытягивания и
что высокие нелинейные оптические коэффициенты и показатель
преломления этих кристаллов позволяют успешно их использо-
вать для генерации гармоник и параметрических экспериментов,
к ним был проявлен большой интерес. То обстоятельство, что
температура Кюри близка к температуре плавления, усложняет
процессы поляризации, но в настоящее время легко получают
монодоменные кристаллы [69]. Лернер и др. [70] первыми опи-
сали диаграмму состояния системы Li2O—Nb2Og, которая дает
точную информацию о составе расплава и твердой фазы в ок-
рестности LiNbO.3. Максимальная температура плавления отв$-
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 217
чает составу с 48,6 мол. % Li2O; при любом другом составе про-
дукты кристаллизации отличаются по составу от расплава (т. е.
вещество плавится инконгруэнтно, но перитектической точки
нет). Фаза, имеющая стехиометрию Liij0oNbi,oo03, может быть
закристаллизована только из расплава, сильно обогащенного
Li2O. Кроме того, кристаллы, вытягиваемые из расплава с со-
держанием Li2O, отличным от 48,6 мол.%, будут иметь перемен-
ный состав. Это можно объяснить тем, что коэффициенты рас-
пределения Nb и Li равны единице только при 48,6 мол. % Li2O.
Более того, серьезной проблемой будут также флуктуации со-
става кристалла, связанные с флуктуациями температуры, ско-
рости роста и с нерегулярной конвекцией. Изменения состава
особенно неприятны, поскольку наиболее интересные характе-
ристики, такие, как температура Кюри, показатели преломле-
ния, температура фазового перехода и др., сильно зависят от
состава. Выращивание из расплава с 48,6 мол. % Li2O и при низ-
ких температурных градиентах в значительной мере уменьшает
эти неоднородности. В принятых сейчас методиках используется
индукционный нагрев, выращивание проводится в платиновых
тиглях на воздухе и скорости роста составляют 0,5—2 см/ч.
Барий-натриевый ниобат (Ba2NaNb50i5), как и LiNbO3, срав-
нительно легко можно выращивать вытягиванием [71], а по ве-
личине нелинейных оптических коэффициентов и по устойчиво-
сти к лазерному воздействию он превосходит LiNbO3. Методика
и проблемы стехиометрии те же, что и при выращивании кри-
сталлов LiNbO3.
Легко выращивается методом вытягивания танталат лития
[68]. Он особенно интересен как модулятор для лазеров и как
пьезоэлектрик.
Распространение метода вытягивания на вещества с высо-
кими температурами плавления в принципе возможно, если
удается применить бестигельную методику. Ван Ютерт [72] ус-
пешно применил метод, в котором расплав находился в закри-
сталлизованной ячейке такого же состава. Типичная установка
показана на фиг. 5.17. В одном из вариантов такого метода [72]
применяется плотно намотанный индуктор, который нагревает
шихту марганцевого феррита, находящуюся внутри него. Про-
межутки между витками индукционной спирали заделываются
алундовым цементом. Исходное вещество сначала приходится
расплавлять кислородно-водородной горелкой. В расплавлен-
ном же состоянии вещество обеспечивает связь с индукционным
полем, достаточную для поддержания требуемой температуры.
Охлаждаемые водой витки индукционной спирали удерживают
от расплавления прилегающий к ним слой шихты, который
приобретает форму тигля. В этом «тигле» и находится рас-
плав.
218
Р. ЛОДИЗ. РОСТ монокристаллов
Одним из последних крупных успехов метода вытягивания
явилось выращивание материалов с температурами плавления
выше 2000 °C, осуществленное Ф. Р. Чарватом и его сотрудни-
ками. В настоящее время разработаны стандартные методики
выращивания и сапфира (ГПл = 2015°С), и иттрий-алюминие-
вого граната (Tnjl — 1970°C) [73—75]. Для нагрева иридиевых
тиглей используется как индукционный нагрев, так и нагрев
кислородно-водородным пламенем. Рабин и Ван Ютерт [41] не-
давно показали, что срок службы иридиевых тиглей заметно
Расплав
Твердый
марганцевый
феррит
Обожженный
бокситовый
цемент
Водоохлаждаемый
медный виток
индуктора (квадрат-
ного сечения)
о 7 о
В од о охлаждаемый медный стакан,
припаянный к трем нижним виткам
индуктора
Фиг. 5.17. Бестигельное вытягивание кристаллов [72].
увеличивается, если на их наружную поверхность напылить ме-
тодом распыления в пламени тугоплавкое вещество, например
окись циркония. В работе Бардсли и Коккейна [76] анализи-
руется роль концентрационного переохлаждения и влияние теп-
ловых экранов на снижение дефектов в кристаллах тугоплав-
ких окислов при выращивании их методом Чохральского.
Испарение расплава выдвигает серьезные проблемы при вы-
тягивании кристалла. Один из путей решения этой проблемы —
применение установок с обогреваемыми стенками, подобных
установке Гремелмайера [77]. Метц с соавторами [78] указали
способ наиболее эффективного снижения испарения расплава:
необходимо подобрать несмешивающийся с расплавом нелету-
чий материал, который плавал бы на его поверхности. Для этой
цели они с успехом использовали В2О3 при вытягивании РЬТе и
PbSe. Этот метод, получивший название жидкостного капсула-
рования, использован также при выращивании GaAs, GaP и дру-
гих материалов [79]. При этом над расплавом В2О3 поддержи-
вается повышенное давление инертного газа, которое обеспечи-
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 219
вает контакт слоя «жидкой капсулы» с расплавом. Таким обра-
зом, этот слой действует как «поршень» и равновесное давление
летучих компонентов расплава устанавливается между распла-
вом и этим «поршнем».
Многие авторы предлагали использовать инертные газы без
применения «жидкостного капсулирования» для подавления ис-
парения расплава. При умеренных давлениях газа ожидаемые
эффекты обычно проявляются слабо и только при давлениях
инертного газа, превышающих давление летучих компонентов.
При тех давлениях, при которых еще справедлив закон Даль-
тона или когда изменения объема конденсированных фаз малы,
можно ожидать только уменьшения скорости испарения.
В другом варианте бестигельного метода используется фоку-
сированное излучение, плазма или электрическая дуга в каче-
стве источника нагрева, а плавящийся материал сам играет
роль тигля. Некоторые из указанных источников нагрева рас-
сматриваются в разд. 5.6. Возможно сочетание таких источников
с бестигельным методом Ван Ютерта [72]. В практической ра-
боте для поддержания расплава иногда удобны различные ва-
рианты метода «холодной ванны». «Холодная ванна» — это ох-
лаждаемые водой площадки, на которых находится расплав,
причем слой материала, непосредственно контактирующий с
площадкой, остается нерасплавленным. Такие методы широко
используются в металлургических процессах, но что касается
выращивания кристаллов, то пока что известен только один
пример их применения в этой области [80].
В табл. 5.2 приведены и другие материалы, в том числе ме-
таллы, выращенные методом вытягивания. Впрочем, эта таб-
лица может служить лишь иллюстрацией и не претендует на
полноту.
5.5. МЕТОДЫ ЗОННОЙ ПЛАВКИ
Зонную плавку, по-видимому, считают в основном методом
очистки. Для этой цели она впервые была использована Пфан-
ном в 1952 г. [81] и с тех пор является основным методом очистки
полупроводников. Мы не будем останавливаться на вопросе о
применении зонной плавки для очистки. В этом аспекте метод
подробно освещен в многочисленных статьях, обзорах и в пре-
красной книге [81]. Но зонная плавка может использоваться как
метод выращивания монокристаллов, и даже в процессе очистки
часто образуются монокристаллы. Движующуюся зону приме-
няли для получения монокристаллов Капица [22] и позже Ан-
драде и Роско [23]. Роль зоны сводилась при этом (и до сих пор
сводится при выращивании кристаллов) к образованию гра-
диента температуры вблизи границы роста. На долю же Пфанна
220
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
выпала реализация и развитие возможностей такой зоны как
распределителя растворенных веществ. Возможность одновре-
менно с выращиванием регулировать содержание примесей, ко-
нечно, преимущество зонной плавки.
Затравка Кристалл Лодочка
/ -^Расплав / у \
оии Нагреватель Расплав
а
•Кристалл Г
Затравка
б
сг ^7 сг
Затравка Расплав Кристалл
г
Фиг. 5.18. Конфигурации, используемые в зонной плавке.
На фиг. 5.18,а и б схематически показаны конфигурации,
обычно применяемые при зонном плавлении. На фиг. 5.18,а изо-
бражен горизонтальный вариант зонной плавки. Зона начи-
нается с левой стороны образца. Если необходимо получить мо-
нокристалл, то в левом конце лодочки можно поместить моно-
кристальную затравку. Последнюю частично оплавляют, чтобы
получить чистую поверхность роста, а затем зону перемещают
вправо. Для легко кристаллизуемых веществ затравка может и
не потребоваться. При индукционном нагреве связь с полем мо-
жет осуществляться расплавом, лодочкой или специальным
приемником индукционных токов. К другим способам нагрева
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 221
относится радиационный нагрев от элементов сопротивления,
электронная бомбардировка, сфокусированное излучение лам-
пы большой мощности или солнца. Естественно, при горизон-
тальной зонной плавке материал контейнера должен быть сов-
местимым с расплавом. Если расплав и не реагирует с лодочкой,
то в результате смачивания выращенный кристалл может при-
клеиваться к ее стенкам. В результате из-за неодинакового сжа-
тия при охлаждении возникают напряжения и, кроме того, кри-
сталл трудно извлечь из лодочки. Этих трудностей иногда
удается избежать, если использовать деформирующиеся или
мягкие лодочки. Если левый конец лодочки заострить, то моно-
кристалл часто зарождается и в отсутствие затравки. Чтобы
спровоцировать зарождение монокристалла, используют тигли
разных геометрий, аналогичные применяемым в методе Бридж-
мена — Стокбаргера.
При зонной плавке очень удобно осуществлять многократные
проходы, а при необходимости движение зоны можно скоррек-
тировать так, чтобы «затравочная» часть слева оставалась не-
расплавленной. Нередки случаи, когда в процессе очистки мно-
гократным прохождением зоны размер зерен увеличивается и
сверхочистка заканчивается образованием монокристалла.
На фиг. 5.18,6 представлена схема метода плавающей зоны.
Первое описание метода дано в работе [82], но он, по-видимому,
разрабатывался независимо и другими авторами [56, 83]. Пер-
воначально метод использовался для очистки кремния. В этом
методе расплавленная зона удерживается в вертикально распо-
ложенном образце за счет поверхностного натяжения. Метод яв-
ляется бестигельным, а поэтому химическое взаимодействие с
лодочкой не представляет серьезной проблемы.
Поскольку лодочка отсутствует, она уже не может обеспечи-
вать связь с индукционным полем, и поэтому нагрев должен
осуществляться за счет индукционной связи непосредственно с
расплавом (при условии, что он достаточно электропроводен),
или за счет радиационного нагрева от нагревателей сопротивле-
ния или приемника индукционных токов, или за счет фокусиро-
вания излучения источника лучистой энергии. В ряде случаев,
когда трудно осуществить связь с высокочастотным полем, для
материалов с высоким сопротивлением лучше использовать вы-
сокочастотный индукционный нагрев. Эффективным может ока-
заться некоторое перемешивание расплава за счет независимого
вращения обоих концов образца в противоположных направле-
ниях. Если образец недостаточно плотный, расплав стремится
заполнить пустоты (капиллярный эффект) и становится трудно
регулировать ширину зоны. Чтобы избежать этого, необходим
материал, предварительно полученный зонной плавкой, литьем,
спеканием или горячим прессованием.
222
Р. ЛОДИЗ. РОСТ монокристаллов
Условия устойчивости зоны изучены Хейвангом и Циглером
[84] и Хейвангом [85]. Хейванг исходил из следующих предпо-
ложений: единственными активными силами являются поверх-
ностное натяжение и силы тяжести, расплав полностью смачи-
вает кристалл, изменения объема при плавлении незначительны,
межфазные границы плоские и перпендикулярны оси образца
и силе веса. Результаты Хейванга представлены на фиг. 5.19,
Фиг. 5.19. Условия стабильности зоны [85].
где X — параметр, пропорциональный максимальной длине
зоны I и равный
K = lVdgia, (5.15)
ар — величина, пропорциональная диаметру прутка г:
р — г Уdg/o. (5.16)
В уравнениях (5.15) и (5.16) величина d— плотность жидкости,
g— ускорение силы тяжести, о — поверхностное натяжение.
Можно показать, что при увеличении диаметра прутка X дости-
гает ~2,7. Таким образом, если бы длину зоны можно было
контролировать п.ри малых значениях I, то для г не было бы ни-
какого предела. На практике же при 1> г контролировать
длину зоны трудно. Если принять, что зона устойчива при I х- г,
то единственное требование будет таким [85]:
l=~y^d~g. (5.17)
Если отношение в/d достаточно велико, как у легких металлов
типа А1, у которых d мало, или у более плотных металлов с вы-
сокими температурами плавления, таких, как железо или титан,
у которых о большое, то величина / будет достаточно большой
и можно реально осуществить метод плавающей зоны. Для мно-
гих материалов с низким отношением o/d, например для легко-
6. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЁНТНОЙ СИСТЕМЕ 223
плавкие плотных неорганических веществ, значение I получается
столь низким, что использовать метод плавающей зоны трудно.
Низкочастотные электромагнитные поля в сочетании с соот-
ветствующей конструкцией высокочастотного индуктора позво-
ляют создавать постоянно действующую на расплавленную об-
ласть и направленную вверх силу и за счет этого достигать
больших значений /, чем следует из формулы (5.17). Метод под-
держки материала в гравитационном поле без механического
контакта называется левитацией. Высокочастотная левитация
возникает в результате взаимодействия приложенного высоко-
частотного электромагнитного поля с полем, индуцированным
вихревыми токами в расплаве. В случае Si левитация стано-
вится возможной при ~5 МГц, но при 500 кГц левитационная
сила значительно выше. Левитационная сила F дается выра-
жением
F-HI, (5.18)
где Н—магнитное поле, индуцированное в расплаве высокоча-
стотным полем, / — ток в расплаве. Величины F, Н и I взаимно
перпендикулярны (фиг. 5.18,6), и их направление соответствует
правилу правой руки. Анализ ситуации с учетом индукционных
токов довольно сложен, поскольку точное положение и величина
вихревых токов зависят от потоков жидкости, которые вызваны
ими в расплаве, и от конвекции. Естественно, эти потоки пере-
мешивают расплав и являются важным фактором перемешива-
ния жидкости при индукционном нагреве. Левитацию можно
вызвать также, пропуская постоянный ток через расплаз (для
чего к краям образца прикладывается напряжение) и помещая
расплавленную зону в магнитное поле — между полюсами по-
стоянного магнита или электромагнита, как это показано на
фиг. 5.18,г. Такую конструкцию можно использовать при бести-
гельной горизонтальной зонной плавке. Один из вариантов зон-
ного выравнивания — метода, позволяющего достичь равномер-
ного распределения активатора в кристалле, показан на фиг.
5.18,в. Концентрация в исходной зоне равна Ci, а окончатель-
ная концентрация постоянна по всему образцу и равна С2. Дру-
гие методы, используемые при выращивании кристаллов, опи-
саны Пфанном [81]. В табл. 5.4 приведены различные кристаллы,
выращенные зонной плавкой, и условия их кристаллизации.
Зонная плавка с температурным градиентом рассматривается
в гл. 7.
Электронно-лучевое плавление иногда целесообразно исполь-
зовать при выращивании кристаллов высокотемпературных ме-
таллов методом плавающей зоны. Поскольку электроны легко
рассеиваются, необходимо генерировать электронный пучок и
плавление проводить в вакууме. Для успешного плавления, как
224
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Таблица 5.4
Некоторые кристаллы, выращенные методом зонной плавки1)
Материал Темпера- тура плавления, °C Лодочка Скорость движения зоны Примечания Лите- ратура
Германий 942 Плавленый кварц, покры- тый графитом 0,1—5 см/ч [Н8]
Германий 942 То же ~0,1 см/ч Отражате- ли и малая скорость ро- ста улучша- ют качество [Н9]
Арсенид галлия 1240 Плавленый кварц или окись крем- ния, покры- тые пироли- тическим гра- фитом 1,25—5 см/ч Плотность дислокаций -100 см-2 [120]
Вольфрам 3370 Медный ре- актор, охлаж- даемый во- дой, и плаваю- щая зона 0,2—4 см/мин Электроду- говое и элек- тронно-луче- вое плавле- ние [121] [122] [123]
’) О применении зонной плавки для очистки других материалов и в некоторых слу-
чаях для выращивания кристаллов см. работу [81].
правило, необходимо иметь начальный вакуум в рабочей камере
порядка 10-6 мм рт. ст. Необходимость создания вакуума и свя-
занные с этим операции являются существенным недостатком
электронно-лучевого нагрева в методе плавающей зоны. Однако
этот способ имеет большое преимущество, так как на образец
можно подавать энергию значительно большей плотности, чехМ
при индукционном нагреве, и за счет этого можно сравнительно
легко плавить очень тугоплавкие материалы. Для материалов
с низкой электропроводностью существуют различные экспери-
ментальные приемы, как правило усложняющие метод. В боль-
шинстве работ метод использовался для зонной очистки веще-
ства, а не для выращивания, но нам кажется, что не очень зна-
чительные улучшения в управлении процессом позволят успеш-
но использовать его для выращивания многих веществ, очистка
которых уже проводится.
б. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 225
Схема типичной установки для электронно-лучевого плавле-
ния приведена на фиг. 5.20.
Источник электронов обычно представляет собой простой
проволочный катод прямого накала в форме кольца, охваты-
вающего образец. В некоторых случаях вместо одного ставится
несколько электронных эмиттеров. К материалу для электрон-
ных эмиттеров предъявляются следующие требования: 1) у него
должна быть подходящая работа выхода (т. е. поток электронов
должен быть достаточно большим
2) в условиях эксперимента он не
должен химически реагировать с
окружающей средой, 3) он дол-
жен иметь достаточно низкую
упругость пара, чтобы не загряз-
нять образец, и 4) он должен
быть достаточно прочным, чтобы
сохранять форму при рабочих
температурах. Идеальный мате-
риал — вольфрам, а идеальная
ситуация такая, когда электрон-
ный эмиттер и образец идентич-
ны по составу. Отражательные
пластины изготавливаются из ту-
гоплавких проводников, часто из
тантала; на них подают нулевой
или отрицательный потенциал,
чтобы улучшить фокусировку
пучка на образец. С помощью
г±
[
электрических или магнитных по-
лей можно отклонять пучок; со-
при обычных напряжениях),
Вакуумный
колпак^
Ф и г. 5.20. Установка для элек-
тронно-лучевого плавления.
ответствующие теория и методики
хорошо известны [86]. На образец для улучшения фокусировки
подается постоянное напряжение. Температура регулируется
изменением тока бомбардировки образца, температуры ка-
тода или бомбардирующего напряжения (разности потенциалов
между анодом, т. е. образцом, и катодом). Чаще всего темпера-
туру контролируют потоку эмиссии. Ток эмиссии легко измерить,
пропуская его через резистор с известным сопротивле-
нием и измеряя падение напряжения. Аппаратура для элек-
тронной бомбардировки выпускается промышленностью и опи-
сывается в книге [86]. Если образец в твердом состоянии не элек-
тропроводен, а расплав электропроводен, то можно установить
электрический контакт с расплавом и тогда плавление стано-
вится возможным. Если кристаллический образец не электро-
проводен при умеренных температурах, то можно вдоль образца
226
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
нанести проводящую полоску, чтобы иметь возможность осу-
ществлять бомбардировку до того момента, пока температура
образца не достигнет уровня, при котором сам материал стано-
вится проводником.
В число веществ, полученных в виде кристаллов, входят
вольфрам, рений, молибден и тантало-ниобиевые и молибдено-
рениевые сплавы [86]. В качестве исходных материалов необхо-
димо иметь поликристаллические стержни высокой плотности.
Если плотность стержня недостаточна или если велико газовы-
деление, то трудно поддерживать зону.
Большие возможности электронно-лучевого плавления туго-
плавких материалов еще далеко не полностью реализованы.
Интересным вариантом метода электронно-лучевого плавле-
ния, пригодным для выращивания кристаллов непроводящих
материалов, является метод полого катода, иначе называемый
методом «холодного катода» [87]. Этот метод основан на само-
стоятельном газовом разряде постоянного тока, создаваемом
в полом катоде кольцевой формы, окружающем рабочую зону.
При давлении Аг, Ог и других газов в несколько миллиметров
ртутного столба и при напряжении на катоде в несколько кило-
вольт испускаемые катодом электроны ионизируют газ и обра-
зуют проводящую плазму. Ток в плазме достигает нескольких сот
миллиампер, причем анодОхМ может служить любая удобная
заземленная деталь системы. Таким образом, в отличие от тра-
диционного электронно-лучевого плавления в рассматриваемом
случае нагреваемый материал не обязательно должен быть элек-
тропроводящим, чтобы замыкалась электрическая цепь. Прида-
вая внутренней стороне катода соответствующую форму, можно
сфокусировать электроны и образующиеся ионы на образец и
добиться его плавления. Хороший материал для катода — не-
ржавеющая сталь. Хотя катод частично охлаждается циркули-
рующей внутри него водой, наилучшие результаты, по-видимому,
получены при температурах катода, лежащих лишь немного
ниже температуры красного каления. В этом смысле термин
«холодный» катод не совсем правилен. Для плавления матери-
алов с температурами плавления, намного превышающими
2200—2500 °C, нержавеющая сталь не годится и требуются дру-
гие материалы. Для поддержания плазмы необходимы низкие
давления газа, причем достаточно легко ионизирующегося (а не
высокий вакуум, как при обычном электронно-лучевом плавле-
нии). Этот газ выполняет еще одну положительную роль, по-
давляя разложение расплавляемого материала. Такая мегодика
успешно использовалась [87] для выращивания монокристаллов
сапфира, иттрий-алюминиевого граната и других веществ мето-
дом плавающей зоны. Она, по-видимому, весьма перспективна
б. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 227
при выращивании очень тугоплавких непроводящих веществ,
таких, как карбиды, бориды, нитриды (см. разд. 5.6)!).
5.6. ДРУГИЕ БЕСТИГЕЛЬНЫЕ МЕТОДЫ
Как мы видели, существенным препятствием в использова-
нии равновесия жидкость — кристалл при выращивании кри-
сталлов может оказаться химическое взаимодействие расплава
с контейнером и плавление последнего. Это обстоятельство ста-
новится особенно существенным в случае выращивания кри-
сталлов с высокими температурами плавления, так как если
здесь химическое взаимодействие отсутствует, то верхний предел
ставится плавлением тигля. Частично проблема решается при-
менением вольфрамовых тиглей (Гпл = 3370°C) и тиглей из
карбидов и нитридов (Гцл более 4000°C). Тем не менее, по-ви-
димому, самым высокотемпературным материалом, успешно вы-
ращенным с применением тигля, является сапфир (ТПл =
= 2015°С), полученный методом вытягивания из расплава в
иридиевом тигле (Тпл = 2554°C), с которым расплав практиче-
ски не вступает в химическую реакцию (см. разд. 5.4). Если
отсутствие химического взаимодействия между расплавом и тиг-
лем считается критерием успешного выращивания кристаллов,
то необходимо выяснить, можно ли практически найти тигель,
устойчивый при более высоких температурах. Одним из решений
проблемы является, как мы видели, метод плавающей зоны.
Однако часто бывает трудно обеспечить высокую тепловую энер-
гию в зоне, необходимую для плавления тугоплавких материа-
лов. В первую очередь это относится к непроводящим расплавам
(здесь нельзя применить высокочастотный нагрев) и к распла-
вам, прозрачным в инфракрасной и видимой частях спектра
(нельзя использовать радиационный нагрев с помощью нагре-
вателей сопротивления или сфокусированным излучением лампы,
электрической дуги или солнца). Один из способов улучшить
подвод тепловой энергии — увеличить отношение поверхности
расплава к его объему. Это легко достигается тем, что на по-
верхности затравки или поликристаллической массы создают
наплыв расплавленного материала (фиг. 5.21, а). Он удержи-
вается на затравке или поликристаллическОхМ образце силами
поверхностного натяжения. Другие бестигельные методы выра-
щивания представляют собой различные варианты этого способа.
Пламенное плавление
В методе пламенного плавления жидкий наплыв создают на
вершине затравочного кристалла, а источником тепла служит
9 Методом полого катода удалось вырастить кристаллы карбидов с тем-
пературой плавления, лежащей выше 3500 °C [140].
228
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
пламя (фиг. 5.21,6). Исходная шихта вводится в виде порошка
в поток газа, поступающего в печь, а затравочный кристалл
выводят из пламени с такой скоростью, чтобы толщина жидко-
го наплыва оставалась постоянной. Впервые метод был описан
Затравка
(или поликристал-
ла ческая масса)
Расплав
Фиг. 5.21. Бестигельные варианты метода Вернейля.
а
Вернейлем [88] и использован для выращивания сапфира. Пер-
вое время метод применялся для выращивания драгоценных
кристаллов. Во время второй мировой войны потребность в тер-
мостойких монокристаллах, особенно в сапфире, как в материа-
лах для подшипников и часовых камней, повысила интерес к
этому методу, и с тех пор этим методом были выращены моно-
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 229
кристаллы около сотни материалов1). Метод обладает всеми
преимуществами и недостатками, которые были перечислены,
когда говорилось о выращивании кристаллов в однокомпонент-
ной системе жидкость — кристалл. Кроме того, он обладает пре-
имуществами бестигельного метода, правда, с некоторыми огра-
ничениями, связанными с необходимостью удержания жидкого
слоя на затравке (хотя детальный расчет высоты слоя рас-
плава и не проводился, он должен быть аналогичным вычисле-
нию длины расплавленной зоны в методе плавающей зоны). То
обстоятельство, что действию тепловой энергии подвергается
большая поверхность, облегчает плавление тугоплавких веществ.
Однако малая толщина расплавленного слоя и в силу этого его
малая теплоемкость приводят к тому, что скорость роста сильно
зависит от флуктуаций температуры и трудно обеспечить равно-
мерное, не полосчатое, распределение активатора. Колебания
скорости роста приводят также к изменениям показателей пре-
ломления и к возникновению внутренних напряжений. Кроме
того, кристаллизуемый материал должен быть химически устой-
чивым в условиях, существующих в пламени. Часто возникают
экспериментальные трудности с подготовкой исходного порошка,
вводимого в газовый поток, и его подведением к расплаву.
В общем при таком методе велики температурные градиенты и
трудно обеспечивать постоянство температуры пламени и ско-
рости подачи порошка.
Аппаратура и методика. При выращивании кристаллов ме-
тодом пламенного плавления важны следующие моменты:
1. Получение и отбор затравки.
2. Конструкция горелки.
3. Приготовление порошка и его подача.
Поскольку успех данного метода определяется в первую оче-
редь аппаратурой и технологическими приемами, мы проанали-
зируем пункты 1—3 подробнее.
Затравки можно отбирать из природных кристаллов или
выращивать другими методами, но чаще всего затравочные кри-
сталлики выращивают в предварительных опытах по пламен-
ному плавлению. Налравив пламя горелки на огнеупорную под-
ставку, можно получить на ней наплыв расплава, а затем под-
ставку постепенно опускают и расплав затвердевает. При этом
обычно образуется поликристаллический продукт (хотя во
4) Степанов и его сотрудники [141, 142] были первыми, кто начал выра-
щивать кристаллы заданной формы металлов и неорганических соединений.
В настоящее время хорошо освоена технология получения монокристаллов
сапфира плоского, круглого и кольцевого сечения (лент, стержней и трубок)
методом вытягивания с использованием формообразователя с капиллярным
питанием [143, 144].
230
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
многих случаях возникает и монокристалл), но если уменьшить
поперечное сечение расплава (снизив скорость подачи порошка
или увеличив скорость снижения подставки), то всю границу
роста часто захватывает один кристаллик. После этого диаметр
расплавленной зоны увеличивают и продолжают рост моно-
кристалла. Процедура аналогична образованию перетяжки в ме-
тоде вытягивания из расплава. Выращенный кристалл можно
в последующих опытах использовать как затравку целиком или
разрезать на более мелкие затравки. Затравки отбираются по
степени совершенства. Для получения кристаллов очень высо-
кого качества необходимо исключить затравки, имеющие мало-
угловые границы зерен и напряжения. При нынешнем уровне
техники не имеет смысла уделять особое внимание дислокациям.
Кристаллы, выбранные в качестве затравок, перед опытом ориен-
тируют, поскольку совершенство структуры большинства мате-
риалов зависит от направления, а во многих случаях от этого
зависит и сама возможность получения монокристалла.
Конструкция горелки весьма значительно усовершенствова-
лась со времен Вернейля. Во всех технологических работах при-
меняется кислородно-водородное пламя. Применялись и смеси
кислорода с ацетиленом и светильного газа с кислородом, но
это не дало большого успеха, так как в этих случаях трудно по-
лучить чистое пламя. Если необходимы более высокие темпера-
туры, можно использовать фтор или другие сильные окисли-
тели, но работ в этом направлении пока что приведено мало.
Первостепенное значение имеет чистота газа и постоянство га-
зового потока, поскольку при больших флуктуациях температуры
образуются плохие кристаллы. Кислород и водород нельзя сме-
шивать до момента их воспламенения, поэтому все конструкции
горелок сводятся к устройству трубок, подводящих раздельно О2
и Н2 в зону воспламенения. В простейшем случае (фиг. 5.21, в)
имеются две концентрические трубки, причем по внутренней по-
ступает кислород и шихта, а по внешней — водород. Широкое
распространение получил вариант, в котором внутрь большой
трубы встроены несколько трубок малого диаметра. Кислород и
шихта подводятся через маленькие трубки, а водород поступает
через пространство между ними. Такая конструкция (она часто
фигурирует под названием «многотрубная горелка») обеспечи-
вает большой фронт пламени с очень однородной температурой,
что важно при выращивании кристаллов большого диаметра.
Наиболее значительным новшеством в конструкции горелок после
оригинальной работы Вернейля является, пожалуй, трехконусная
горелка, предложенная Меркером [89]. В ней используются три
концентрические трубки; по внутренней трубке поступает водо-
род, а по двум внешним — кислород. В результате образуется
острый факел пламени, что бывает необходимо на начальных
6. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕИТНОЙ СИСТЕМЕ 231
этапах эксперимента, когда в наличии нет затравок, и при про-
мышленном выращивании стержней малого диаметра. Стержни
сапфира малого диаметра представляют большой промышлен-
ный интерес, поскольку их очень удобно разрезать при произ-
водстве часовых камней и приборных подшипников. Горелка
создает сильно окислительное пламя, и это важно при выращи-
вании легко восстанавливающихся материалов, таких, как окись
никеля. Поскольку пламя сильно обогащено кислородом, темпе-
ратура его в трехконусной горелке несколько ниже, чем в го-
релках других типов. Это оказывается преимуществом, когда вы-
ращиваются кристаллы с низкими температурами плавления, но
ограничивает возможности конструкции, при выращивании ве-
ществ с температурами плавления намного выше, чем у сапфира.
Метод Вернейля очень полно описан в работах [90, 91]. Для
выращивания сапфира необходим исходный порошок, состоящий
из однородных частиц диаметром в несколько микрометров.
Этим требованиям удовлетворяет шихта из тщательно прока-
ленных при 1000 °C квасцов. Вообще шихту нужного качества
лучше всего получать именно прокаливанием, так чтобы хими-
чески связанная вода и ряд других летучих компонентов изго-
нялся при довольно низких температурах, еще недостаточных
для спекания порошка. Для сапфира оптимальное направление
роста составляет угол 60° с осью с и скорости роста могут до-
стигать нескольких десятков сантиметров в час.
Методы, близкие к пламенному плавлению, — плазменный
и дуговой нагрев
Имеется несколько методов, близких к методу пламенного
плавления, но отличающихся от него тем, что нагрев осуще-
ствляется не пламенем. Ряд авторов объединяет эти методы под
названием модифицированные методы Вернейля. В таких мето-
дах используются: 1) радиационный нагрев; 2) плазменный
нагрев; 3) световой нагрев.
При радиационном нагреве применяется либо индукционная
связь, либо нагреватели сопротивления. Кекк с соавторами [92]
индуктивно нагревали металлический тепловой излучатель. Что-
бы предотвратить его окисление при рабочих температурах, они
использовали инертный газ. Диккинсон и Филд [93] использовали
тепловой излучатель с нагревателем сопротивления. Тем самым
значительно упрощается экспериментальное оформление опыта,
поскольку отпадает необходимость в оборудовании для индук-
ционного нагрева и соответствующей регулирующей аппаратуре.
Чтобы избежать окисления нагревателя, Диккинсон и Филд так-
же использовали инертную атмосферу. Радиационный нагрева-
тель частично снимает ограничение, существующее в методе
232
Й. ЛОДЙЗ. РОСТ МОНОКРИСТАЛЛОВ
пламенного плавления, а именно требование химической устой-
чивости выращиваемого материала в пламени. Но тогда, если
необходимы очень высокие температуры, окислительная газовая
среда недопустима, поскольку становится сложной проблемой
окисление нагревателей. Можно поместить радиационный нагре-
ватель в оболочку, изолировав его от растущего кристалла, и
регулировать среду внутри оболочки. Так делается при нагре-
вании посредством электродугового источника света. Методом
Вернейля с радиационным нагревом выращены кристаллы фер-
ритов нескольких разных композиций.
Плазменный нагрев как метод впервые разработал Рид [94].
О методе полого катода, в котором также используется плазма,
говорилось в разд. 5.5. Промышленные плазменные горелки по-
стоянного тока применялись при выращивании кристаллов и
раньше [91], но Рид первым использовал как источник нагрева
индукционно связанную плазму. Плазменное состояние рассмат-
ривается как четвертое состояние материи, характеризующееся
тем, что с атомов газа частично или полностью удалены элек-
троны. Температура в плазме может быть очень высокой, дости-
гая многих тысяч градусов. Плазмы образуются при ионизации
атомов в пламени или при электрических разрядах. Обычный
пример плазмы — электрическая дуга между двумя электро-
дами, возникающая при электрическом разряде (как в сварочном
аппарате). Нагрев с помощью электрической дуги известен с
тех пор, как появилась возможность получать сильные электри-
ческие токи. Плазменные горелки постоянного тока стали выпу-
скаться промышленностью с середины 50-х годов, и способы
введения в горелки исходных порошковых материалов хорошо
отработаны. Широко известен следующий способ применения го-
релки: ее направляют на холодную поверхность, и подаваемый
в пламя материал затвердевает в виде мелкозернистой керамики.
Такой метод называется пламенным распылением, он хорошо
описан в литературе. В модифицированном варианте такая го-
релка может заменить факел в методе Вернейля. На фиг. 5.22
показана плазменная горелка постоянного тока. В общем она
действует так: между электродами зажигают дуговой разряд
постоянхчого тока, и сильная струя газа сквозь дугу «отдувает»
плазму от электродов. При обычной электросварке одним из
электродов служит сам рабочий объект и плавление вещества
невозможно, если он не проводящий. Плазменная горелка
устраняет это ограничение. Обычное рабочее напряжение в плаз-
менной горелке постоянного тока составляет 10—100 В при силе
тока от нескольких сотен до нескольких тысяч ампер. Как со-
общают, удается достигнуть температур около 15 000 °C. Прав-
да, часто оказывается довольно трудно стабилизировать газовый
поток. В худшем случае плазма полностью «выдувается» из
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 233
пространства между электродами и разряд гаснет, в лучшем —
дело ограничивается флуктуациями интенсивности плазмы и
блужданиями ее в пространстве. Введение в горелку воды ста-
билизирует плазму, но при этом плазма неизбежно становится
«грязной» и тем самым сводится на нет основное преимущество
плазменного нагрева — чистая газовая атмосфера в зоне роста
Фиг. 5.22. Плазменная горелка постоянного тока [91].
и возможность ее регулирования по желанию экспериментатора.
Ведь плазменный нагрев и ценен в основном тем, что в противо-
положность пламенному нагреву позволяет поддерживать либо
окислительные, либо восстановительные, либо нейтральные усло-
вия. Более удовлетворительные результаты дает способ стабили-
зации плазмы в магнитных полях. Поскольку плазма представ-
ляет собой поток проводящего электрический ток газа между
электродами, на нее может оказывать действие магнитное поле
и, изменяя соответствующим образом конфигурацию поля, мож-
но придавать разряду нужную форму. Подробно такое взаимо-
действие рассматривается в магнитной гидродинамике. Подоб-
ного рода исследования в настоящее время проводятся в целядг
234
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
найти способы изоляции высокотемпературной плазмы для кон-
тролируемого термоядерного синтеза. Хотя магнитная стабили-
зация и весьма перспективна, при выращивании кристаллов она
еще редко применяется. Стабилизация плазмы при выращива-
нии кристаллов осуществляется главным образом за счет регу-
лирования скорости и направления газового потока между элек-
тродами. Если потоку придать круговое движение так, чтобы
в центре вонзикала область низкого давления, иными словами,
образовался вихрь, то плазма должна быть устойчивой в этой
области. Вихревая стабилизация особенно удобна в индукцион-
ных плазмах. В горелках же постоянного тока чаще всего при-
меняется стабилизация «газовым чехлом». В такой горелке элек-
трическую дугу зажигают между вольфрамовым катодом и по-
лым, охлаждаемым водой анодом. Дуговой разряд не выходит
за пределы камеры, а «газовый чехол», протяженность которого
значительно превышает диаметр камеры, препятствует ее кон-
такту со стенками. На фиг. 5.22 показана именно такая горелка.
Плазмы в горелках такой конструкции могут действовать в атмо-
сфере Н2, N2, Аг, Не и О2, но, как показал опыт, в окислительной
обстановке довольно трудно поддерживать дугу длительное
время. Следует признать, что до сих пор имеется мало сведений
относительно получения кристаллов высокого качества с по-
мощью плазменных горелок постоянного тока в тех случаях,
когда их нельзя было бы вырастить с большей легкостью дру-
гими методами. Тем не менее в принципе горелки постоянного
тока, по-видимому, весьма перспективны.
В более поздней работе Рида [94] рассматривается плазма
переменного тока. Особое преимущество такого рода горелок
в том, что они безэлектродные и тем самым исключаются загряз-
нения из электродов. Цилитинкевич [95] и Кобин с Вилбаром
[96] ранее использовали горелки переменного тока, которые тре-
бовали электродов, но они не были намного лучше горелок по-
стоянного тока. На фиг. 5.23 показана типичная индукционная
безэлектродная плазменная горелка переменного тока. Рид [94]
и Бауэр с Филдом [91] исследовали разные конструкции горе-
лок. По существу все горелки состоят из кварцевой трубки с
одним открытым концом и с впуском для газа на другом и индук-
ционной спирали вокруг этой трубки для индукционной связи.
Осуществить нагрев с одноатомными газами труднее, но в слу-
чае многоатомных газов или одноатомных с примесью много-
атомных большие количества тепла получить легко. Входные
отверстия для газа нужно делать так, чтобы поток был направ-
лен по касательной к окружности трубы. В газе возникнет вихрь,
который будет способствовать вихревой стабилизации. В области
частот от 5 до 3000 МГц можно поддерживать плазму в С)2, NO,
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 235
СО2, Не, Ar, SO2 и в воздухе. Чтобы зажечь плазму, в высоко-
частотное поле обычно приходится вводить заземленный уголь-
ный стержень или проволочную петлю. При этом образуются
ионы, необходимые, чтобы газ стал проводящим. Возникает
плазма, и устройство переходит в режим самостоятельного раз-
ряда. Бауэр и Филд [91] описали различные конфигурации горе-
лок, в том числе и с емкостной связью. Высокочастотным плаз-
менным нагревом можно выращивать кристаллы сравнительно
тугоплавких окислов, таких, как сапфир, но на сегодняшний день
по качеству они уступают кристаллам сапфира, полученнььм бо-
лее распространенными ме-
тодами.
Если вещество заметно
поглощает свет на длинах
волн, на которых излучают
мощные лампы, то образец
можно расплавить, фокуси-
руя на него такое излучение.
Подобные методы обычно
называют световым нагре-
вом. До недавнего времени
лучшими лампами счита-
лись электродуговые уголь-
ные лампы и главная труд-
ность метода заключалась в
нестабильности и коротком
Латунная крышка и трубка
с тангенциальными газовыми
соплами
Плазма
Кварцевая
трубка
сроке службы таких тепло- фиг< 5.23. Высокочастотная плазмен-
вых источников. В работаю- ная горелка.
щей электродуговой лампе
угольные электроды сгорают со скоростью в несколько де-
сятков сантиметров в час. Из имеющихся в настоящее время
ламп удобнее всего, по-видимому, театральные проекцион-
ные лампы типа используемых в проекторах в открытых
кинотеатрах. В таких лампах предусмотрена автоматическая по-
дача угольных стержней, и ЛаРуе и Халден [97] успешно приме-
няли сфокусированный пучок света таких ламп при выращива-
нии кристаллов (фиг. 5.24). Однако угольные электроды в конце
концов сгорают, и пока их заменяют новыми, выращивание пре-
рывается, в результате чего получаются кристаллы с сильными
неоднородностями. Одно из решений проблемы — взять два ду-
говых источника для нагрева кристалла и на время замены
электродов в одном из них включать другой. Это снижает не-
однородности, но не исключает их полностью, поскольку остают-
ся тепловые флуктуации в момент таких переключений. Удач-
ная геометрия для двух тепловых источников обеспечивается в
так называемой двойной раковине, описанной Плотцем [91].
236
Р. ЛОДЙЗ. РОСТ МОНОКРИСТАЛЛОВ
Типичная система состоит из двух «раковин», установленных
так, чтобы фокусировать излучение на образец. Каждая «рако-
вина» состоит из двух параболических рефлекторов с отверстиеАм
в центре. Снаружи каждого из рефлекторов (близко к отвер-
стию) устанавливается источник света, а свет последнего фоку-
сируется на некотором расстоянии от другого рефлектора.
Недавно появились высокотемпературные вольфрамовые лам-
пы с большим сроком службы (например, мощностью 2,5 кВт
и со сроком службы до 1500 ч). Применение таких ламп должно
Фиг. 5.24. Метод светового нагрева с дуговым источником света [97].
устранить многие трудности, присущие обычным источникам,
использующим электроды. Последние достижения в методах фо-
кусировки теплового излучения описаны в книге [98]. С лампами
такого типа обе «раковины» могут работать одновременно, по-
скольку отпадает необходимость в переключении их при сгора-
нии угольных электродов. Свет двух «раковин», сфокусирован-
ный на образце, позволяет достичь температуры выше 2500 °C.
При этом, естественно, легко контролировать атмосферу вокруг
образца, окружив его соответствующей прозрачной оболочкой.
Такой способ, по-видимому, наиболее перспективен из всех ва-
риантов метода Вернейля с точки зрения обеспечения чистоты
кристаллизационного объема при высоких температурах, при-
чем экспериментально это достигается довольно, просто.
В табл. 5.5 приведен ряд кристаллов, выращенных методом
светового нагрева.
При выращивании методом Вернейля и аналогичными мето-
дами кристаллы подвергаются влиянию высоких температурных
градиентов. Отжиг выращенных кристаллов помогает сильно
5. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 237
Таблица 5.5
Некоторые кристаллы, выращенные методом Вернейля
и методом светового нагрева
Материал Формула Темпера- тура плавления, °C Примечания Литера- тура
Корунд, сапфир Рубин А12О3 А12О31 Сг 2040 В разных направле- ниях; луч- ше всего под углом 60° к оси с Метод Вернейля [124-127]
Магний-алюминиевая шпинель MgAl2O4 2130 То же [128]
Муллит 3Al2O3-2SiO2 1810 » » [129]
Шеелит CaWO4 1530 » » [130, 131]
Рутил Окись циркония Окись иттрия Магнезиальная (несте- хиометричная) шпи- нель TiO2 ZrO2 Y2O3 MgFe2O4 1830 2700 2400 Выше 1200 » » » » » » Метод светового нагрева [132, 133] [134] [135 [136
Никелевый феррит NiFe2O4 Выше 1200 То же [137]
уменьшить напряжения. Кристаллы1)? выращиваемые в промы-
шленных условиях, напряжены и легко раскалываются еще до
отжига в газовых печах. Напряжения уменьшаются, если ис-
пользовать такую систему нагревателей, которая позволила бы
проводить отжиг без охлаждения кристалла до комнатной тем-
пературы. Если нагреватели расположить так, чтобы уменьшить
градиенты в печи, напряжения уменьшатся еще больше. Есте-
ственно, для выращивания методом плавающей зоны могут быть
приспособлены такие тепловые источники, как дуговые лампы и
лампы накаливания.
5.7. ДРУГИЕ МЕТОДЫ ВЫРАЩИВАНИЯ
ИЗ РАСПЛАВА
Метод дифференциального вытягивания можно рассматри-
вать как модификацию либо метода вытягивания, либо метода
плавающей зоны, либо метода Вернейля. Принцип метода
!) Кристаллы, выращенные методом Вернейля и аналогичными спосо-
бами и не имеющие плоскогранной морфологии, часто называются булями
(что в переводе с французского означает шар).
238
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
показан на фиг. 5.25, и его целесообразно применять, когда тре-
буется бестигельная методика. При таком методе телесный угол
для подвода энергии больше, чем в методе плавающей зоны, и
возможен лучший контроль,
чем в методах типа Вернейля !).
6.8. ВЫРАЩИВАНИЕ ДЕНДРИТОВ
Фиг, 5.25. Метод дифференциаль-
ного вытягивания.
раз, когда температура перед
В некоторых случаях тре-
буется специально выращивать
кристаллы, морфология кото-
рых характеризуется удлинен-
ными и ветвистыми выступа-
ми. Такие кристаллы обычно
называются дендритами. В
разд. 3.11—3.14 уже отмеча-
лось, что дендритный рост воз-
можен в условиях высокого
концентрационного переохлаж-
дения. Как правило, всякий
фронтом кристаллизации значи-
тельно ниже равновесной температуры, вероятен рост дендри-
тов. Это может объясняться следующими причинами:
1. Важную роль играет диффузия, и расплав вблизи фронта
роста сильно обогащен примесями, активаторами или раствори-
телем. Это — концентрационное переохлаждение (разд. 3.11).
2. Скорость роста настолько высока, теплота кристаллизации
так велика или теплоотвод настолько слабый, что кристалл не
в состоянии быстро рассеивать теплоту кристаллизации. В таких
условиях межфазная граница будет значительно теплее приле-
гающей жидкости и в результате рост будет дендритным.
На фиг. 5.26, а показано распределение температуры при
нормальном росте, а на фиг. 5.26,6 — распределение, когда об-
разуются дендриты по описанному механизму. На фиг. 5.26, а
переохлаждение перед межфазной границей незначительно; на
фиг. 5.26, б оно выше и соответственно этому боковые отростки
в области межфазной границы могут расти легче, чем прилегаю-
щие к ней участки. В результате такие отростки, обусловленные
ступенями роста, гранями, краевыми участками ячеек при ячеи-
стом росте и т. д., быстро врастают в расплав. Дендритный рост
возможен не только для металлов и при равновесии жидкость—
кристалл, но встречается при любых обстоятельствах, когда вы-
полняется условие 1 или 2. Для полноты картины на фиг. 5.26, в
9 См. также хороший обзор Фишера [139] по вопросу выращивания из
расплава под давлением электролюминесцентных полупроводников.
б. РОСТ КРИСТАЛЛОВ ИЗ РАСПЛАВА В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ 239
мы изобразили распределение температуры при концентрацион-
ном переохлаждении. Здесь концентрации примеси, активатора
или растворителя вблизи межфазной границы выше, чем в объ-
еме расплава. Примеси сни-
жают температуру плавления,
поэтому область перед фрон-
том кристаллизации оказыва-
ется сильно переохлажденной.
Вагнер [99], Боллинг и Тил-
лер [100] и Темкин [101] деталь-
но рассмотрели условия обра-
зования дендритов, а Биллиг
[45] и Беннет с Лонгини [102]
впервые вырастили дендриты
в контролируемых условиях.
Наиболее полно изучен, ве-
роятно, Ge. Кристаллы со
структурой типа алмаза, такие,
как Ge, выращивают следую-
щим образом:
1. Обычно берут затравку
из предварительно выращен-
ного дендритного кристалла.
Затравка из дендрита необхо-
дима потому, что такой кри-
сталл, будучи правильно выра-
щен, всегда сдвойникован. При
правильной ориентировке плос-
кость двойникования обеспе-
чит постоянную ступенчатость
межфазной границы, при ко-
торой рост будет происходить
с высокой скоростью (см., на-
пример, работы [103—105]).
2. После установления теплового равновесия температуру
расплава снижают на 15—20 °C.
3. Через несколько секунд начинают вытягивание с высокой
скоростью (10 см/с).
Типичным продуктом такого процесса является лентовидный
кристалл с гладкими гранями и зубчатыми краями в несколько
метров длиной, несколько десятых миллиметра толщиной и
меньше сантиметра шириной. Такие кристаллы имеют опреде-
ленные преимущества в полупроводниковой технике (например,
отпадает операция разрезания объемного кристалла), и в па-
тентной литературе этому вопросу уделяется большое внимание.
в
Фиг. 5.26. Распределение темпера-
туры при выращивании дендритов.
6
РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
6.1. ВВЕДЕНИЕ
Выращивание кристаллов из паров, или, как говорят иначе,
из газовой фазы, в однокомпонентной системе имеет довольно
ограниченное применение и в целом ряде способов настолько
аналогично выращиванию в моногокомпонентной системе, что мы
в этой главе будем рассматривать сразу и то и другое. К выра-
щиванию из газовой фазы прибегают и для получения больших
кристаллов, и для получения тонких пленок на кристаллах,
выращенных другими методами. Последний метод обычно на-
зывают эпитаксиальным выращиванием из газовой фазы
(разд. 6.5). Одно из преимуществ методов выращивания из газо-
вой фазы заключается в том, что при таких методах очень часто
оказывается возможным заранее рассчитать константы равно-
весия предполагаемых реакций и их температурную зависимость
(разд. 2.11). Методы выращивания по механизму пар —кри-
сталл можно систематизировать следующим образом:
1. Методы выращивания в однокомпонентных системах,
а) методы сублимации — конденсации;
б) методы распыления;
в) методы ионного внедрения.
2. Методы выращивания в многокомпонентных системах,
а) выращивание при обратимых реакциях;
б) выращивание при необратимых реакциях.
Среди методов выращивания в однокомпонентных системах
только методы распыления нашли широкое применение при вы-
ращивании кристаллов, но и их в основном используют для по-
лучения эпитаксиальных пленок. Методы сублимации — конден-
сации имеют ограниченное применение, поскольку довольно
мало таких веществ, у которых упругость пара была бы доста-
точно высокой для роста. Вообще говоря, можно вводить допол-
нительные компоненты, связывающие нелетучие соединения в
летучие комплексы; в этом случае рост осуществляется в про-
цессе реакции. Ионное внедрение, строго говоря, нельзя считать
методом выращивания. Это скорее способ активации уже выра-
щенных кристаллов.
Росту кристаллов из газовой фазы гГосвящены работы Брен-
нера [1] (металлы), Бредли [2] (органические вещества), Рей-
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
241
нольдса [3] (сульфиды), Гленга и Вейжды [4] (кремний), О’Кон-
нора [5] (SiC)1), Мейсона [6] (образование льда) и Энтела [7]
(соединения III—V групп). Кроме того, о выращивании из газо-
вой фазы кристаллов полупроводниковых соединений много го-
ворится в книге под редакцией Грабела [8] и о выращивании
кристаллов основных соединений — в книге под редакцией Па-
уэлла и др. [9]. Для ознакомления с общими вопросами роста из
газовой фазы можно рекомендовать также монографию Ше-
фера [10]; в книге под редакцией Френкомба и Сато [11] много
полезной информации по получению монокристаллических пле-
нок, а при написании этой главы автор в значительной степени
пользовался обзором Эллиса [12]2).
При выращивании кристаллов из газовой фазы в одноком-
понентных системах не возникает проблем, связанных с приме-
сями и диффузией и обусловленных дополнительными компо-
нентами, но обычно требуются более высокие температуры.
В многокомпонентны* * же системах кристаллы обычно растут
при более низких температурах, и поэтому такой метод приго-
ден для получения кристаллов низкотемпературных полиморф-
ных модификаций и веществ, испаряющихся инконгруэнтно. Он
применяется также там, где по условиям эксперимента невоз-
можно создать температуры, необходимые для роста кристаллов
в однокомпонентных системах.
6.2. СУБЛИМАЦИЯ - КОНДЕНСАЦИЯ
При выращивании кристаллов методом сублимации — кон-
денсации обычно применяют два типа систем: замкнутые и про-
точные. В первом случае используют запаянную ампулу или
установку для испарения в вакууме. В типичном варианте ме-
тода системы замкнутого типа (фиг. 6.1, а) транспортируемое
вещество помещают в ампулу (обычно из плавленого кварца)
и откачивают ее (если вещество инертно по отношению к воз-
духу, то откачка и не обязательны). Иногда ампулу после от-
качки заполняют до определенного давления газом, препят-
ствующим разложению, или инертным газом. Если реакция
между газом и транспортируемым веществом существенна, то
метод правильнее рассматривать как метсд реактивного пере-
носа. Наличие инертного газа улучшает перенос, поскольку его
конвекция способствует движению сублимированных частиц в
направлении зоны роста. Но так как средняя длина свободного
9 Кроме того, ряд глав, посвященных выращиванию кристаллов SiC из
газовой фазы, имеется в книге под редакцией О’Коннора и Смилтенсена [13].
*2) Хороший обзор физико-химической стороны процессов газового пере-
носа опубликован Джеффом [83].
242
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
пробега частиц сублимата зависит от давления, в высоком ва-
кууме обычно обеспечивается лучший перенос. Эксперимен-
тально установлено, что иногда инертные газы-носители помо-
гают, а иногда и мешают процессам роста. Газы-носители так-
же часто изменяют морфологию образующихся кристаллов1).
В литературе имеется очень много таблиц давления насыщен-
ных паров разных веществ. В табл. 6.1 перечислены некоторые
кристаллы, выращенные методами сублимации — конденсации
с использованием замкнутых и проточных систем. Для обеспе-
чения нужной температуры и градиента используют обычного
Горячая
зона
Холодная
зона
Нагреваемая
подложка
Шихта
Зона роста
q Вакуумный
колпак
Нагреваемый
' током испаоитель
Горячая Холодная
зона зона
Инертный ~
газ _______________________Ц__
Шихта Зона роста
К насосу
Фиг. 6.1. Выращивание методом сублимации и конденсации.
а —метод замкнутой системы; б — вакуумное испарение; в —метод проточной системы.
типа горизонтальные и вертикальные трубчатые печи и обычные
регуляторы и регистрирующие приборы.
С точки зрения технологии наибольший интерес представ-
ляет, вероятно, выращивание кристаллов SiC методом переноса
в однокомпонентной системе. Метод Лели [19, 20], которым по-
лучают кристаллы SiC, по существу основан на сублимации.
Порошкообразный SiC нагревают в инертной атмосфере до
температуры около 2500°C. В центре массы порошка образуются
пластинчатые кристаллы а-SiC. Если исходный SiC имеет вид
полого цилиндра [20], в который вставлен полый цилиндр из по-
9 Возможно, что некоторые из этих эффектов обусловлены процессами
в газовой фазе, аналогичными концентрационному переохлаждению. При
выращивании из газовой фазы концентрационное переохлаждение может
иметь место и в много- и в однокомпонентной системах. В однокомпонентных
системах в силу того, что градиент концентрации обусловлен диффузией или
конвекцией, парциальное давление в некоторых частях системы может пре-
вышать равновесное парциальное давление над твердым веществом при тем-
пературах ниже рассматриваемых. Такую ситуацию в паре можно рассмат-
ривать как аналогичную концентрационному переохлаждению. Вопрос о кон-
центрационном переохлаждении при выращивании кристаллов иода из газо-
рой фазы анализируется в работе Рида и Ляфлера [14].
Таблица 6.1
Некоторые кристаллы и пленки, выращенные методом сублимации —
конденсации и методом катодного распыления
Вещество Температура сублимации, °C Температура конденсации, °C Газ Литера- тура
Cd 320—330 (проточная или замкнутая систе- ма) 250-290 Вакуум, Аг [1, 15, 16]
Zn 375—475 (проточная или замкнутая систе- ма) 350 380 Аг, Не [15, 17]
CdS1) 1150—1200 (проточ- ная или замкнутая си- стема) 1100 Аг [18, 3]
ZnS1) 1550—1600 (проточ- ная или замкнутая си- стема) 1475-1500 Аг [18, 3]
SiC > 2500 (проточная или замкнутая систе- ма) <2500 Инертная атмосфера [19, 20]
Ta Электронно-лучевой нагрев (вакуумный ис- паритель), вероятно, выше 2000 700 В основном поликристал- лические плен- ки 10“6мм рт. ст. [21]
Al > 1000 (ТПл=660) <600 Вакуум [22]
Be 1100—1200 (иногда электронно-лучевой на- грев) Ниже Гпл, главным обра- зом поликри- сталлические пленки » [22]
Co, Ni, Fe > 1500 То же » [22]
*) Значительная диссоциация в паровой фазе; рост может происходить в многоком-
понентной системе за счет обратимых реакций,
Вещество Напряжение при распылении, В Ток, мА (диаметр катода 2,5 см) Температура конденсации, °C Давление Аг, мм рт. ст. Литера- тура
РЬ 1000 1000 В основном поликри- сталличе- ские пленки при —195 ~зо- ю~3 [23, 24]
А1 1500 2-10 -195±300 (27-73)- 10“3 [24]
Си 1500 9,5 -195 59- 10~3 [24]
V3Ga 2250 10,5 1000 100- ю-3 [23, 24)
244
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Продолжение
Вещество Катод Реагентный газ (реактивное распыление) Литература
TaN Та N [25]
ТаС Та СО, сн4 [25]
Та2О5 Та о2 [25]
SnO2 Sn о2 [26]
SiO2 Si О2 или Н2О [26]
NbO Nb о2 [25]
ZrO2 Zr О2 [25]
Силикаты Al (мулит) Сплавы Al—Si 02 [25, 27]
ристого графита (фиг. 6.2), то размеры вырастающих кристал-
лов увеличиваются. Графитовый цилиндр помогает сохранять
форму шихгы и ограничивает начальное зародышеобразование.
Фиг. 6.2. Выращивание SiC методом сублимации — конденсации.
Зародышами выращиваемых кристаллов служат нитевидные
кристаллы SiC, прорастающие сквозь графитовую стенку. Мор-
фологию и электрические свойства выращенных таким методохм
кристаллов исследовал Гамильтон [20]. Проблемы, связанные с
полиморфизмом, образованием дефектов упаковки и полити-
пией в SiC, рассматриваются в разд. 1.3.
На фиг. 6.1,6 приведена схема установки для вакуумного на-
пыления. Особенно хорошие результаты вакуумное напыление
дает при выращивании эпитаксиальных пленок металлов. В ус-
тановке типа показанной на фиг. 6.1,6 нужную температуру
6. РОСТ КРИСТАЛЛОВ ЙЗ ПАРОВ
245
часто получают пропусканием тока через полоску испаряемого
металла. Конечно, возможны и многие другие способы нагрева,
например близко расположенным нагревателем сопротивления
(нитью накала), высокочастотный нагрев, нагрев фокусирован-
ным излучением, электронным пучком и т. д. Часто предусмат-
ривают и нагреватель для подложки. В настоящее время можно
получить очень высокий вакуум (10-9—10“12 мм рт. ст.), а для
исследований физики поверхности разработаны способы обеспе-
чения чистых условий эксперимента (адсорбированный поверх-
ностный слой тоньше мономолекулярного). Все это должно дать
толчок дальнейшему развитию метода вакуумного напыления.
В настоящее время обычно работают при давлениях порядка
10~6 мм рт. ст. В табл. 6.1 указан ряд кристаллов и пленок, по-
лученных методом вакуумного напыления.
В проточных методах используются открытые трубки
(фиг. 6.1, в) и поток инертного газа через систему несет испаряю-
щиеся частицы к зоне роста. В табл. 6.1 указаны некоторые
кристаллы, выращенные в проточных системах. Здесь тоже
используют обычные трубчатые печи и т. д. Выращивание кри-
сталлов на затравке пока трудно обеспечить в методах, исполь-
зующих проточные трубы, и применяется в основном вакуумное
напыление. Но при методе вакуумного напыления поток веще-
ства к подложке довольно мал, так что выращивание кристаллов
заметного объема обычно требует много времени.
6.3. РАСПЫЛЕНИЕ
Распыление широко применяют для получения поликристал-
лических и аморфных пленок, но при соответствующем контроле
можно получить и монокристаллические пленки. Основное пре-
имущество метода состоит в том, что кристаллизация пленки
может происходить при более низких температурах, чем при
обычном росте за счет сублимации — конденсации, так как испа-
рение осуществляют с помощью электрического поля, а не путем
нагревания. Использовали три основных метода: катодное рас-
пыление (и вариант метода, называемый катодным распылением
с геттерированием), реактивное распыление и ионное внедрение
(которое скорее является методом активации выращенных кри-
сталлов, чем методом выращивания кристаллов).
На фиг. 6.3 приведена схема установки для катодного рас-
пыления [28]. Между катодом и анодом поддерживается по-
стоянное напряжение в несколько тысяч вольт. Катод делают
из распыляемого вещества, а анодом служит подложка. Для по-
лучения пленок нужной внешней формы используют соответ-
ствующие маски, а анод можно снабдить держателем для под-
246
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
ложки. Предусматривается приспособление для независимого
контроля за температурами анода и катода.
Систему заполняют инертным газом, например Аг при дав-
лении 10-1—10“2 мм рт. ст. Ионы Аг+, образующиеся в газе, бом-
бардируют катод и выбивают частицы тантала, которые дви-
жутся к подложке и образуют пленку. Взяв катод из сплава,
можно получить и пленку из этого сплава. Высокая температура
подложки способствует росту монокристальной пленки. Пленки
могут быть толщиной от нескольких ангстрем до нескольких мик-
рометров. Примеси составляют проблему, а поэтому необходимы
Катод (Taj
Анод
Осажденная
пленка
Анодный
токоподвод
Высоковольтный
’ токоподвод
Изоляция, пре-
- дот вращающая
распыление
катодного
токоподвода
Вакуумный
колпак
Фиг. 6.3. Схема установки для катодного распыления.
Аг(10'гмм pm.cmh
тщательно очищенные газы, хорошая вакуумная аппаратура и
высокая чистота камеры, в которой производится распыление.
Важными параметрами в установлении скоростей роста являют-
ся плотность катодного тока, напряжение, природа катода и
геометрия катода и анода.
При методе реактивного распыления [25—27], который, ко-
нечно, является методом многокомпонентных систем, в вакуум-
ную систему того же самого типа, что и в методе катодного рас-
пыления, вводят реагентный газ и он соединяется с частицами
катода, так что на подложке осаждается слой соединения веще-
ства катода с реагентным газом. Детали механизма реакции не
ясны; не ясно даже то, где она происходит. Требуемое напря-
жение составляет несколько киловольт, давление — от 10-1 до
10-3 мм рт. ст. Атмосфера представляет собой смесь инертного и
реагентного газов. При одновременном распылении катодов из
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
247
разных материалов можно приготовить многокомпонентные
пленки. Метод реактивного распыления дает возможность кри-
сталлизовать многие соединения, так как металлы обычно легко
распылить, а ионы неметаллических соединений можно ввести
в виде реагентного газа.
При распылении с геттерированием [23, 24], прежде чем на-
чинается образование пленки за счет катодного распыления, из
газа за счет реактивного распыления удаляются (геттерируются)
химически активные составляющие. Такой метод дает пленки
очень высокой чистоты. В типичной установке для напыления с
геттерированием в системе кроме обычной подложки, анода,
имеется второй анод. Этот анод имеет форму экрана, окружаю-
щего катод и подложку. Сначала подложку закрывают заслон-
кой, чтобы предотвратить осаждение пленки, и все химически
активные газы внутри экрана удаляют за счет поглощения в ме-
талле, распыленном из катода и осевшем на стенках сосуда.
В результате этого давление химически активных газов в системе
можно уменьшить до 10~10 мм рт. ст. Чтобы достичь такого дав-
ления в обычной системе, требуются сложные насосы и длитель-
ное обезгаживание. После геттерирования заслонку отводят и
катод распыляют на подложку. Выделение газов из стенок со-
суда сдерживается напыленными слоями металлических соеди-
нений. Экран делают плотно прилегающим к катоду и аноду, так
что диффузия примесей из остальной части системы затруднена.
Рабочее напряжение обычно составляет 1,0—1,5 кВ при токах
2—10 мА. Сначала систему откачивают до ~10-6 мм рт. ст. и
при температуре приблизительно на 50° выше температуры осаж-
дения производят обезгаживание подложки. Вообще говоря, не-
обходимо независимое регулирование температуры подложки.
В качестве газа обычно используют Аг, и реактивного распыле-
ния в течение 15 —30 мин обычно достаточно, чтобы очистить
атмосферу. Стойрер и Хозер [24] на стадии разложения исполь-
зовали давление Аг в интервале (31 -4- 185) • 10-3 мм рт. ст. До
сих пор специального упора на выращивание монокристаллов не
делалось, и это потребует, вероятно, более высоких температур
подложки и применения монокристальных подложек. Распыле-
ние с геттерированием дает возможность изучать механизмы
роста кристаллов в сверхчистых условиях, а также получать
сверхчистые пленки.
В методе ионного внедрения ионы, ускоренные в постоянном
электрическом поле, бомбардируют подложку, которая служит
катодом. Они разрушают ее, и скорость диффузии в поврежден-
ном слое увеличивается. Если после этого или заранее ввести в
систему газ, то его компоненты могут диффундировать в под-
ложку. Таким образом можно обеспечить уровни активации,
обычно не достижимые за счет тепловых диффузионных прочее-
248
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
сов. В некоторых случаях сами ионы могут участвовать в желае-
мом изменении электрических свойств подложки.
В табл. 6.1 перечислен ряд материалов, пленки которых полу-
чены методами распыления.
6.4. ВЫРАЩИВАНИЕ КРИСТАЛЛОВ
ПУТЕМ ОБРАТИМЫХ РЕАКЦИЙ
Теория. Как было показано в разд. 2.11, если константа рав-
новесия реакции приблизительно равна единице (ДО0 « 0) и со-
ответствующим образом зависит от температуры (об этом можно
судить, вычислив АТ/°), то возможна обратимая транспортная
реакция. Это относится к многокомпонентным системам, и такой
рост может происходить при температурах значительно ниже
тех, которые нужны для процессов роста в однокомпонентной
системе.
Основные условия успешного проведения транспортной реак-
ции таковы:
1. Нужно выбрать химическую реакцию, в которой нужная
фаза была бы единственным устойчивым твердым продуктом
реакции в интересующей нас области температур и парциальных
давлений газовых составляющих.
2. Свободная энергия должна быть близкой к нулю. Это га-
рантирует обратимость процесса и дает уверенность в том, что
при равновесии присутствуют значительные количества реаги-.
рующих веществ и продуктов реакции. Если концентрация реаги-
рующих веществ и продуктов реакции слишком мала, то будет
трудно получить нужный поток вещества от источника в область
кристаллизации. Это особенно справедливо для процессов в
замкнутых системах, где перенос обеспечивается за счет конвек-
ции и диффузии. Во многих случаях могут возникнуть обычные
проблемы, связанные с ростом в многокомпонентных системах,
такие, как концентрационное переохлаждение, влияние граней и
образование дендритов. Такие явления часто наблюдаются при
выращивании кристаллов из газовой фазы в многокомпонентных
системах, но их мало анализировали.
3. Величина Д/7° должна быть отличной от нуля, чтобы рав-
новесие можно было сместить в направлении образования кри-
сталлов в зоне роста и в обратную сторону в зоне испарения за
счет разности температур между зонами. Таким образом, вели-
чиной АЯ° определяется разность температур АТ. Разность АТ
не должна быть слишком малой, иначе будет трудно регулиро-
вать температуру. Если разность АТ слишком велика (что при
обычных значениях А//0 бывает довольно редко), то могут по-
требовать столь низкие температуры в холодной зоне, что про-
цессы кристаллизации будут заторможены (с экспериментальной
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
249
точки зрения в горячей зоне очень желательна температура, не
превышающая температуру размягчения SiO2, т. е. ~1100 °C).
Но большая разность АГ способствует конвективному переносу.
4. Для выращивания в приемлемые сроки кристаллов хоро-
шего качества необходимы контроль за зародышеобразованием
и достаточно быстрая кинетика роста. Поэтому на основании
одних только термодинамических данных о равновесии заранее
ничего сказать нельзя. Обычно этому способствуют высокие тем-
пературы около затравки (для увеличения поверхностной под-
вижности) и достаточно большие разности кТ (для обеспечения
заметной конвекции).
Реакцию выбирают на основании термодинамических данных,
собранных, например, Бруэром [29], Келли [30], Коухлином [31]
и Глеснером [32]. Полезны также уже имеющиеся знания (часто
бывает достаточно интуиции) по общей химии и летучести воз-
можных реагирующих веществ, продуктов реакции и т. д. В мо-
нографии Шефера [10] собрано много данных о транспортных
реакциях, имеющих общее значение в неорганической химии, ко-
торые можно непосредственно использовать при выращивании
кристаллов. Если величина AG0 для предварительно выбранной
реакции неудовлетворительна, то ее часто оказывается возмож-
ным изменить путем последующего добавления других реагирую-
щих веществ. Часто приходится проводить приблизительные
оценки на основании термодинамических данных для аналогич-
ных соединений. Приведем пример Седжела [33].
Предположим, что нужно вырастить Y2O3. Рассмотрим
реакцию
Y2O3 (S) + ЗС12 (g) YCI3 (^) + у О2 (g). (6.1)
Взяв соответствующие термодинамические данные [29] для реак-
ции (6.1), можно найти величину AG0 при 1000 К:
AGioook = 59,4 ккал/моль, (6.2)
что соответствует константе равновесия
lg /’Сюоо к = “ 13,0. (6.3)
Равновесие реакции (6.1) смещено слишком далеко влево для
практического выращивания кристаллов. Если же заменить С12
на В1*2 или I2, то положение будет еще хуже, так как AG0 для
YBr3 и YI3 больше, чем AG0 для YC13 (меньше отрицательная
свободная энергия), в результате чего AG0 для реакций, анало-
гичных реакции (6.1), будет даже больше при замещении С12
на Вг2 и 12. Интуитивно это очевидно даже в отсутствие термо-
динамических данных, если принять во внимание, что YBr3 и
YI3 менее устойчивы, чем YC13. Мы должны искать реакцию
250
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
с отрицательной свободной энергией, которую можно было бы
добавить к реакции (6.1). Подходящая реакция такова:
СО + уО2«=* СО2) (6.4)
AGiooo к = - 46,7. (6.5)
Таким образом, возможная транспортная реакция имеет вид
Y2o3 ы + 3CO(g) + ЗС12 (g) 2YC13 (g) + ЗСО2 (g), (6.6)
AGiooo к = 59,4 + 3 (- 46,7) = - 80,7. (6.7)
Теперь равновесие смещено слишком вправо. Но если вспомнить,
что отрицательные свободные энергии для YBr3 и YI3 меньше, то
аналогичные (6.6) реакции с Вг2 и 12 будут, очевидно, отвечать
большим AG0. Отсюда для реакции
Y2O3 (5) + 3CO(g) + 3Br2 {g) +=* 2YBr3 {g} + ЗСО2 (g} (6.8)
получаем
AGioook = 27 ккал/моль.
Хотя величина AG0 = 27 ккал/моль не так близка к нулю, как
хотелось бы, это значение приводит к парциальному давлению
YBr3 порядка 103 МПа при общем давлении —0,1 МПа. В дру-
гих системах с парциальным давлением такого порядка перенос
был успешным. При анализе мы пренебрегли некоторыми ослож-
няющими дело обстоятельствами. Например, нужно учесть дан-
ные о парциальном давлении YBr3, так как образование твер-
дого YBry может привести к осложнениям. Подобным же обра-
зом затруднение может вызвать и образование YOBr. Чтобы
определить требуемое значение АГ, необходимы также данные
для других температур или оценки на основе А/7. Тем не менее
проведенный выше разбор показывает, как много могут здесь
сказать термодинамические данные. При любых других методах
выращивания кристаллов в многокомпонентной системе такие
прогнозы почти невозможны.
Многие вопросы кинетики роста кристаллов из газовой фазы
довольно подробно рассмотрены в книге Шефера [101. В случае
выращивания кристаллов путем обратимых реакций процесс
переноса можно разделить на три отдельные стадии:
1) гетерогенная реакция на исходном твердом веществе;
2) перенос летучих компонент газом;
3) гетерогенные обратимые реакции в том месте, где обра-
зуются кристаллы.
В методах выращивания из газовой фазы особенно важное
значение имеют процессы, связанные с переносом, тогда как про-
цессы, связанные с третьей стадией, являются общими для мно-
гих других методов и рассмотрены ранее (гл. 3), а процессы,
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
251
связанные с испарением, часто влияют на скорость тривиаль-
ным образом. Поэтому мы подробнее остановимся на процессах
переноса. Интересно отметить, что при выращивании кристал-
лов в любых многокомпонентных системах там, где стадия рас-
творения имеет место в одной части системы, а стадия роста —
в другой, растворенные компоненты нужно транспортировать из
одного места в другое. Как мы увидим в гл. 7, процессы, анало-
гичные рассматриваемым здесь, протекают в водных растворах,
расплавах солей и гидротермальных растворах.
В принципе возможны три режима газового переноса.
1. При давлениях менее 10-4 МПа средняя длина свободного
пробега атомов в газовой фазе сравнима с размерами обычной
аппаратуры или превышает их, так что атомными или молеку-
лярными столкновениями можно пренебречь. Скорость переноса
будет определяться скоростью движения атомов, которая, со-
гласно элементарной кинетической теории, дается формулой
= (б.э)
где V—среднеквадратичная скорость, R — газовая постоянная,
Т — абсолютная температура и М — молекулярный вес. Если все
определяется скоростью переноса, то в качестве идеализирован-
ной схемы процесса можно использовать простую трубку
(фиг. 6.4). Поскольку можно считать, что при низких давлениях
Испаренный. —**
из шихты —-
материал —►
Изоне
кристаллизации
Фиг. 6.4. Схема процесса, в котором скорость роста лимитируется пере-
носом.
газ подчиняется закону идеального газа, скорость переноса 5?,
выраженная в атомах в секунду на единицу площади попереч-
ного сечения трубки, дается выражением
$ = (6.10)
где р — давление. Комбинируя (6.9) и (6.10), получаем
—Р)/ RrM •
(6.11)
В принципе формула (6.11) относится к случаю, когда кристалл
растет из коллимированного молекулярного пучка.
2. При рабочих давлениях от 10~4 до 0,3 МПа перенос в газе
происходит в основном за счет диффузии. Такой процесс описи-
252
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
вается законом Фика (разд. 3.2), и при постоянном градиенте
концентрации коэффициент диффузии будет уменьшаться с рос-
том общего давления. Для большинства газов коэффициенты
диффузии хорошо известны и главные трудности связаны с оцен-
кой градиента концентраций.
3. При давлениях порядка 0,3 МПа и более первостепенное
значение в движении газа приобретает тепловая конвекция.
Область же перехода от диффузионного переноса к конвекцион-
ному, как указал Шефер, часто определяется геометрией аппа-
ратуры.
На практике при выращивании кристаллов из газовой фазы
перенос почти всегда определяется диффузией и именно этим
Зона Диффузионный^ Зона
испарения "* путь конденсации
г 1
Фиг. 6.5. Схема процесса, в котором скорость роста лимитируется диффузией.
ограничивается скорость роста. Поэтому, чтобы убедиться в «хо-
рошем поведении» системы, часто вычисляют скорость диффу-
зионного переноса и сравнивают ее с действительной скоростью
переноса. Далее мы следуем анализу, выполненному Шефе-
ром [10].
На фиг. 6.5 представлена идеализированная схема замкнутой
системы, на основе которой можно анализировать диффузион-
ный перенос вещества. Мы считаем, что скорость роста опреде-
ляется диффузией вдоль оси трубки. Аналогичным образом рас-
сматривается радиальная диффузия, например, при выращива-
нии кристаллов на раскаленной проволоке [34, 35]. Рассмотрим
реакцию общего вида
+ /^(g), (6.12)
где увеличение температуры способствует смещению реакции
вправо, т. е. испарение вещества А происходит при более высо-
кой температуре (Т2), чем его конденсация (TJ. Если при по-
вышении температуры реакция смещается влево, то области
испарения и конденсации на фиг 6.5 меняются местами. Если
число молей газообразных реагирующих веществ не равно числу
молей газообразных продуктов реакции (k j) в формуле
(6.12), то в силу требования постоянства давления по всей длине
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
253
трубки возникнет поток газа. Этот поток наряду с диффузией и
обеспечивает перенос вещества в трубке. Легко показать [10],
что число молей транспортируемого вещества пА определяется
уравнением
котором скорость
лимитируется кон-
векцией.
Фиг. 6.6. Схема процес-
са, в
роста
i Dqt А п
Па ~ i sRT ^Рс'
где D — коэффициент диффузии смеси, q — площадь попереч-
ного сечения диффузионного участка, s — его длина, t — длитель-
ность эксперимента и АРс = Рс2— Ра, причем Рс2 — парциаль-
ное давление С в области 2, а Рс\ — парциальное давление С в
области 1. Выражение (6.13) выведено для случая, когда пото-
ком, связанным с неравенством k Ф j, можно пренебречь. Можно
показать, что такое приближение справедливо почти во всех ус-
ловиях [10].
Коэффициент диффузии Do при общем давлении в 0,1 МПа и
Т = 273° известен для целого ряда пар газов [10], а для других
температур и давлений его можно вычи-
слить по полуэмпирической формуле
С-Д-Ш1’. (6.14)
Vp к 273/
В отсутствие других данных для боль-
шинства не содержащих водорода систем
приемлемое значение для DQ составляет
0,1 см2/с.
Шефер рассмотрел реакции, вклю-
чающие более двух летучих компонентов,
и вывел соответствующее видоизменен-
ное уравнение, аналогичное формуле
(6.13).
При сильной тепловой конвекции кар-
тина значительно сложнее. Простой слу-
чай, в котором можно провести анализ, показан на фиг. 6.6. Вся
трубка, кроме области, где стрелкой указана температура
находится при температуре TY
Шефер [10] показал, что
i ( 4,7гЧ MJ
nA=-\PcPBKa4\—^S-
где Рвнач — начальное парциальное давление В, г — радиус
трубки, lw — длина зоны при температуре Г2, Мв — молекуляр-
ный вес В, т) — вязкость газа, t — время, / — общая длина пути
газа. Ясно, что анализ процесса переноса в обычной горизонталь-
ной трубке будет гораздо сложнее. При таких условиях заклю-
ченное в фигурные скобки выражение в формуле (6.15) можно
(6.13)
(6.15)
254
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
определить эмпирически и использовать как «постоянную труб-
ки». Сравнение уравнений (6.14) и (6.15) показывает, что в слу-
чае диффузии скорость переноса пропорциональна величине
i/P, а в случае конвекции — давлению Р. Таким образом, выска-
занное нами ранее утверждение о том, что при низком давлении
перенос определяется диффузией, а при высоком — конвекцией,
подтверждается. Действительно, измерив зависимость скорости
переноса от давления, можно установить, чем определяется ско-
рость процесса — диффузией, конвекцией или комбинацией того
и другого.
При выращивании из газовой фазы часто оказывается про-
блемой контроль за образованием зародышей, особенно когда
нужно получить кристаллы больших размеров. Эпитаксиальные
пленки обычно выращиваются без особых трудностей с регули-
рованием образования зародышей. Это объясняется тем, что
требуемая толщина пленки невелика, скорость роста может быть
небольшой и нет нужды в больших пересыщениях, при которых
возможно образование зародышей не только на подложке (за-
травке). Когда же нужно получать кристаллы больших разме-
ров, скорости роста должны быть выше (чтобы получить кри-
сталл нужного объема достаточно быстро), требуется большее
пересыщение и становятся проблемой гомогенное образование
зародышей и их образование на стенках («спонтанное зароды-
шеобразование»). Шольц и Клюков [36] показали, что при выра-
щивании кристаллов из газовой фазы такое зародышеобразова-
ние можно сильно уменьшить путем периодического изменения
температуры в ходе выращивания. Допустим, пары переносятся
из зоны с температурой Т2 в зону с температурой 7\, причем
Т2>Т{. В отсутствие затравок разность АГ = Т2—Т[ должна
быть сначала достаточно большой для зарождения в объеме
среды или на стенках кристаллов, на которых происходит даль-
нейший рост. В идеальном случае для получения кристалла наи-
больших размеров лучше всего, если образуется только один
зародыш. Практически же число растущих зародышей должно
быть невелико. При достаточно больших значениях АГ, обеспе-
чивающих нужные на практике скорости роста, часто образуются
дополнительные зародыши. Если же в ходе выращивания изме-
нять АГ со временем так, что в течение некоторого времени
Г! > Г2, то небольшие кристаллики будут снова испаряться, в
результате чего останется несколько больших кристаллов. Если
Г'2 — Г1 > Г{ — Гг, то в среднем за достаточное время пересыще-
ние будет все еще положительным и будет происходить рост.
Среднее по времени пересыщение можно также сделать положи-
тельным даже при условии, что Т2 — Т\ Г[ — Го, если интер-
вал времени, в течение которого Г{ > Г£ меньше, чем интервал
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
255
времени, в течение которого Т2 > 7\. В статье Шольца и Клю-
кова [36] описывается различная аппаратура для обеспечения
колебаний температуры и указываются температура и длитель-
ность циклов, которые приводят к значительному увеличению
размеров кристалла a-Fe2O3, выращиваемых из газовой фазы.
Такая методика, по-видимому, применима и при других спосо-
бах выращивания в многокомпонентных системах, особенно при
выращивании из раствора в расплаве и гидротермальном выра-
щивании, где спонтанное образование зародышей доставляет до-
вольно много хлопот.
Типичные системы
1. Кристаллизация на раскаленной проволоке. Метод обрати-
мого процесса переноса в замкнутой системе, по-видимому, пра-
вильно было бы называть методом Ван-Аркеля и Де-Бура [37].
Целью их работы было получение чистых тугоплавких металлов,
но их метод часто позволяет получать очень хорошие монокри-
сталлы. Метод иногда называют кристаллизацией на раскален-
ной проволоке; его схема изображена на фиг. 6.7 в применении
к Zr. Реакция
450 °C
Zr(s) + 2I2(g) Zrl4(g) (6.16)
смещается вправо при понижении температуры. Проволоку
(часто из вольфрама) нагревают до 1200 °C пропусканием тока.
Чтобы предотвратить ее окисление и образование ZrO2, из си-
стемы нужно удалить воздух. Парциальное давление паров 12 и
Zrh регулируют, контролируя температуру сосуда. За счет тепло-
вого излучения проволоки (а также дополнительным нагрева-
телем, если необходимо) исходный цирконий, которым покрыты
стенки реакционного сосуда, нагревается до температуры 450 °C,
при которой реакция (6.16) сдвигается вправо. При обычно ис-
пользуемых давлениях Zrl4 переносится за счет конвекции и
диффузии к раскаленной проволоке, где реакция (6.16) смещена
влево с выпадением циркония в осадок. Осадок часто поликри-
сталлический, но всегда чище исходного циркония, причем обыч-
но образуется несколько больших кристаллов. Подобный же про-
цесс Ван-Аркель и Де-Бур использовали для получения Ti. Ли-
тература (см., например, [35, 37—41]) по получению чистых ме-
таллов методом раскаленной проволоки слишком обширна, что-
бы приводить ее здесь, но нужно указать, что к числу металлов,
получаемых таким методом, относятся W, Мо, Zr, Ni, Си, Fe, Hf,
Nb, Ta, Th, V, Pt, Ir, Айи U [10, 42]. Кристаллы часто получаются
небольшими, но улучшение контроля, без сомнения, должно
увеличить их размер. Некоторые преимущества может дать при-
256
Р. ЛОДИЗ. РОСТ монокристаллов
менение монокристаллической проволоки из нужного материала
(полученной, например, методом деформационного отжига), а
также тщательный контроль за температурой и давлением газов.
Заметные результаты дало бы создание заданных температур-
ных градиентов вдоль проволоки или такое программирование
температуры проволоки, которое обеспечило бы образование
одного зародыша для всего последующего роста. Метод не дол-
жен ограничиваться металлами и может оказаться пригодным
для любых обратимых реакций, в которых нужное твердое со-
единение образуется при более высокой из двух температур.
К вакуумной
системе
Зле кт роды
Увеличить размеры кристаллов, может быть, поможет перио-
дическое изменение температуры проволоки [36] (разд. 6.4), при-
водящее к испарению излишних зародышей.
2. Другие процессы. Выращивание кристаллов путем' обра-
тимой реакции чаще всего проводят в закрытой горизонтальной
трубке (фиг. 6.1,а). Если перенос происходит за счет реакции,
обеспечивающей рост при более высокой температуре, то зона
испарения, естественно, не горячее зоны роста.
Наилучшим примером выращивания кристаллов таким мето-
дом может служить, по-видимому, выращивание кристаллов со-
единений II—VI групп, скажем ZnS и CdS. Сульфид кадмия
CdS часто приводят как пример соединения, получаемого субли-
мацией. Но при переносе значительна диссоциация и потому
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
257
более реальной для процесса является реакция
CdS(s) Cd(g)+S(g). (6.17)
Кзизек и Рейнольдс [3, 43] указывают следующие условия выра-
щивания кристаллов CdS: температура выращивания— 1000 °C;
атмосфера — пары H2S (~1 атм); аппаратура — запаянная
кварцевая трубка и горизонтальная трубчатая печь; длитель-
ность реакции — 48ч-72ч. Исходная порошкообразная шихта
служит местом образования зародышей для роста, так что дви-
жущей силой процесса являются флуктуации температуры и раз-
ница в размерах тонко измельченного порошкообразного исход-
ного вещества и больших выросших кристаллов. Как это ни уди-
вительно, такой метод позволяет без каких-либо особых мер
получать кристаллы CdS объемом в 1 см3 [43]. Таким же мето-
дом, но при температуре в зоне роста, равной 1150 °C, можно
получать кристаллы ZnS.
Грин и др. [44] видоизменили метод Кзизека и Рейнольдса:
они сначала испаряют CdS (~ 950 °C) или ZnS (~ 1160 °C) в
H2S, а затем проводят сублимацию в вакууме. Такая двойная
сублимация улучшает чистоту выросших кристаллов. Рост про-
исходит в Аг или H2S (~ 1 атм) при перепаде температуры, рав-
ном ~50°. Горячая зона (испарения) находится при темпера-
туре около 1575 °C, а подложкой для образования зародышей в
холодной зоне служит пластинка из плавленого кварца.
Кристаллы CdS всегда обладают структурой типа вюрцита.
Кристаллы же ZnS представляют собой сфалерит, если они по-
лучены ниже ~ 1020 °C, и вюрцит, если они получены при более
высокой температуре. В кристаллах ZnS проблемой являются
дефекты упаковки и политипные модификации. Имеется сооб-
щение, что КС1 стабилизирует структуру типа сфалерита [45].
Пайпер и Полик [18] получили хорошие результаты по выра-
щиванию больших кристаллов CdS из газовой фазы с исполь-
зованием некоторых элементов геометрии, применяемой при вы-
ращивании из расплава по Бриджмену — Стокбаргеру. Этот ме-
тод иллюстрируется схемой фиг. 6.8. Здесь указаны условия,
использованные Калдисом и Видмером [46], которые применили
перенос в парах иода для выращивания кристаллов Cd4GeSe
путем реакции
Cd4GeS6 (S) + 6I2 (g) 4CdI2 (g) + Gel4 (g) + 6S(g). (6.18)
Кроме CdS и Cd4GeS6 в аппаратуре с подобной геометрией
можно выращивать многие другие соединения, в том числе
ZnSe [47]. Преимущество конструкции состоит в том, что раз-
ность температур между исходным веществом и затравкой
остается довольно постоянной в ходе всего процесса роста, и
в том, что начальное образование зародышей происходи г в кони-
258
Р. ЛОДИЗ. РОСТ монокристаллов
ческо?[ части у вершины ростовой ампулы. Поэтому, если вначале
несколько зародышей образуют несколько мелких кристаллов, то
к моменту дорастания фазовой границы до участка ампулы с
максимальным диаметром всю межфазную границу почти навер-
няка займет лишь один из этих кристаллов. В таком случае, по-
скольку величина АГ почти постоянна, весьма велика вероят-
ность того, что далее будет происходить лишь рост образовав-
шегося монокристалла. Таким методом Калдис и Видмер [46]
стабильно выращивали кристаллы ZnSe длиной до 12 мм по-
средством реакции
ZnSe(s) + 2I2 (g) Znl4(g)+S(g) (6.19)
и кристаллы Cd4GeS6 длиной до 24 мм. Кристаллы ZnSe с раз-
мерами 20X15X15 мм выращивались за 36 дней.
3
I
£
/5
10
5
786788 790 792 794 796
Температура, °C
Фиг. 6.8. Метод Калдиса и Видмера [47] для выращивания Cd4GeS6.
Соединения элементов III и V групп часто выращивают по-
средством обратимых реакций в замкнутых системах, используя
галогены в качестве транспортирующего агента. Для соедине-
ний AinBv прямую сублимацию обычно не применяют, так как
они разлагаются при температуре плавления и давление паров
элементов V группы значительно больше давления паров эле-
ментов III группы. Вакуумным же напылением с использованием
методики трехтемпературной печи были получены тонкие пленки
InSb и GaAs [7]. В более распространенном методе выращивания
из газовой фазы [7] применяют обратимую транспортную реак-
цию в закрытой реакционной ампуле, используя в качестве реа-
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
259
тентов С12 или 12. Из газовой фазы удобно выращивать кристал-
лы фосфидов, поскольку при этом отпадает необходимость в под-
держании высоких равновесных давлений при температуре плав-
ления Выбор методов выращивания для соединений AinBv
определяется тем, нужны ли тонкие пленки или массивные кри-
сталлы, а также требуемыми электрическими свойствами. От
методики выращивания могут очень сильно зависеть электрон-
ные характеристики кристаллов. В особенности это относится к
электролюминесцентным свойствам. Вообще здесь можно исхо-
дить из того, что в однокомпонентной системе образуются более
чистые кристаллы, а выращивание в многокомпонентных систе-
мах дает преимущество низких температур. Но в действитель-
ности обычно не удается детально объяснить, почему, например,
фосфид галлия, выращенный из раствора, обладает лучшими
электролюминесцентными свойствами, нежели полученный дру-
гими способами.
Транспортная реакция, типичная для соединений AnlBv, за-
писывается в виде [7]
г.
3InCl(g) 2As(g) ч » InCl3 + 2InAS(s), (6.20)
* 2
Аналогичные реакции протекают, по-видимому, при кристал-
лизации большинства других соединений AlnBv, причем хлор
может быть заменен иодом, по крайней мере в некоторых систе-
мах. Типичные условия роста таковы:
(транспортирующий агент) Температура роста» С
InAs (CI) 725
InAs (I) 650
GaP (I) 1050
При этом указывают, что давление галогена не имеет очень
большого значения.
При разработке технологии выращивания кристаллов мето-
дом обратимых транспортных реакций предварительные опыты
лучше проводить с геометрией, приведенной на фиг. 6.1, а после
того как такие эксперименты показали, что перенос нужной фазы
обеспечивается, можно перейти к геометрии фиг. 6.8.
Если при поисковых исследованиях не хватает термодинами-
ческих данных, то можно исходить из того, что, как показывает
опыт, переносу обычно способствуют более высокие температуры
и давления паров иода, а также из того, что величина АГ должна
быть довольно значительной. При этом для первых прикидок
можно рекомендовать следующие условия: Т = 1000 °C (заве-
домо ниже температуры размягчения кварца), а концентрация
12— ~5 мг на 1 см3 объема ампулы. Соответствующее давление
паров 12 значительно меньше 3 атм, так что кварц его легко
выдержит. Подходящее значение АГ составляет ~ 100 °C или
Кристаллы, выращиваемые посредством реакции в газовой фазе [12]
Таблица 6.2
Кристалл Реакция Система !) Литература
Железо Медь Fe(s) + 2HCl(g) Cu(s) + 2HI(g) 1000 °C 730 °C FeC12(g) "1" ^2(g) CuI2(g) + H2(g) Замкнутая, точная про- [10, 48]
650 °C To же [Ю]
Кобальт Co(s> + 2HBr(g) 900 °C 650 °C C°Br2(g) + H2(g) [10, 48]
Никель Кремний Ni(s) + 2HBr(g) Si(s) + 4HCI(g) 1000 °C 740 °C NiBr2(g) + H2(g) SiC14(g) + 2H2(g) » » Проточная [Ю, 48] [49, 50]
1200 °C
Арсенид ггллия 2GaAs(s) + 6HCl(g) 2GaCl3(g) + As2(g) + 3H2(g) Замкнутая
[51]
Сапфир А12Оз Al«) + H2OW AI2O3(s) + A1W 1400 °C A1°(g) + H2(g) 3AlO(g) Проточная ( полнительных циях см. разд. о до- реак- 6.5) [52] [53, 54]
1900 °C A12°3 (s) + 2H2 (g)<i900 »C А12°(в) 2H2°(g) Замкнутая [55]
A12O3(S) + 6HCl(g) 1150 °C 2AlCl3(g) + 3H2O(gj Проточная [56]
Окись берил- лия ВеО BeO(s) + ^2(g) 1500 °C Be(g) + H2°(g) Замкнутая [57]
Двуокись крем- ния SiO2 SiO2(s)+2CO(g) + 4HCl(g) 1200 °C SiCl4(g)+2H2(g)+2CO2(g) [58, 59]
>
Фосфид галлия GaP 2GaP(s) + H2O(g) 1100 °C 1050 °C Ga2O(g) + p2(g) + H2(g) Проточная [60, 61]
Арсенид галлия GaAs GaAs(s)+-|-I2(g) ПОР °C 900 °C GaI3(g) + As(g) Замкнутая [62, 63]
2GaAs(s) + 3ZnCl(g) 1100 °C 900 °C 2GaCl3(g) + 2Asjg) + 3Zti(gj
Точная реакция не известна, может включать в себя реак- цию диспропорционирования типа (6.20). Материал может быть активирован катионами в транспортирующем реагенте. В каче- стве транспортирующих реагентов используются также HgCl2, СаС12, SnCl2, А1С13, MgCl2
Фосфид галлия GaP Подобная реакциям для GaAs [62, 63]
Фосфид-арсенид галлия GaPxAsi-x Процессы, подобные процессам Исходное вещество GaPxAst-x для GaAs [62, 63]
О Реакции в замкнутой системе обратимы; реакции в проточной системе часто необратимы (см. разд. 4 и 5).
2) Стехиометрия летучего окисла алюминия точно не известна.
262
Р. ЛОДИЗ. РОСТ монокристаллов
менее. Предварительные опыты удобно проводить в печи с откры-
той прорезью, позволяющей видеть ампулу во всю длину, и с
мощной лампой для освещения. Такая установка позволяет на-
блюдать за переносом в ходе опыта и при этом измерять темпе-
ратуру и АТ. Если нужно начать процесс заново, то в любое
время материал можно перегнать обратно. Особенно удобна для
прямого наблюдения за процессом роста печь в виде трубки из
кварцевого стекла с канавкой для обмотки проволочного нагре-
вателя сопротивления. Чтобы уменьшить охлаждение такой печи,
обусловленное конвекцией, трубку часто помещают внутрь дру-
гой кварцевой трубы, большего диаметра. Для уменьшения ра-
диационных потерь наружную трубу иногда частично покрывают
(напылением в вакууме) тонкой пленкой золота. Когда опти-
мальные условия роста определены, дальнейшие опыты лучше
проводить в непрозрачных печах без прорезей, чтобы обеспечить
однородность температуры по оси печи. В табл. 6.2 указан ряд
материалов, в том числе некоторые тройные халькогениды, кото-
рые Холоньяк, Джилсон и Бивакьюа [62, 63] получили путем
транспорта иодидов. Успехи этих авторов в выращивании хоро-
ших кристаллов таких сложных соединений свидетельствуют в
пользу обратимых газово-транспортных реакций вообще и тран-
спорта галогенидов в частности. В табл. 6.2 включены соедине-
ния, полученные посредством обратимых реакций в замкнутой
системе, и кристаллы, полученные посредством (обычно) необра-
тимых реакций в проточной системе (см. разд. 6.5). Ряд других
соединений, выращенных посредством переноса иодидов, рас-
сматривается в работе Нитше [64] 9.
Удобным реагентом для переноса многих металлов, образую-
щих летучие карбонилы, может служить окись углерода. На-
пример, кристаллы никеля можно выращивать посредством
реакции
80 °C
Ni(s) + 4CO(g) Ni(CO)4 (g). (6.21)
Реакция разложения Ni(CO)4 в проточной системе уже давно
применяется для получения сверхчистого никеля (процесс
Монда — Лангера [65]). При проведении же такой реакции в
замкнутой системе (что вообще рекомендуется для выращива-
ния кристаллов с применением карбонилов вследствие токсич-
ности последних) тонко измельченный порошкообразный ни-
кель помещают в один конец ампулы, заполненной окисью
углерода СО, и вводят ее в печь с температурным градиентом.
Источник находится при температуре около 80 °C, а кристаллы
9 Особенно полные данные об условиях роста, реакциях и кристаллах,
выращенных методом химического газового переноса, приводятся в работе
Нйтше [84].
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
263
образуются на стенках трубки или на подходящей подложке
при температуре около 200°C. Аналогичным образом получают
кристаллы «карбонильного» железа.
Для осуществления переноса часто используют обратимые
реакции диспропорционирования. Наиболее важное значение
они имеют, пожалуй, при получении тонких монокристалличе-
ских слоев полупроводников Si и Ge на полупроводниковых
подложках1)- Такой метод обычно называют эпитаксиальным
Идеализированное
распределение
концентрации Аз
Идеализированное
распределение
концентрации В
Действительная \
концентрация As'
£
/ Действительная
концентрация В
I
г»
Переход
Фиг. 6.9. Распределение примесей в р — п-переходе.
ростом, и он дает ряд преимуществ, характерных для метода
выращивания из газовой фазы. В технологии полупроводников
часто требуется вырастить кристалл с резким (или вообще
каким-либо заданным) профилем распределения концентрации
одной или нескольких примесей в кристалле. Например, в слу-
чае р — n-перехода требуется в кристалле обеспечить как мож-
но более резкий переход от р- к n-типу с плоской границей.
Так, поскольку активированный бором Si относится к p-типу, а
активированный мышьяком — к n-типу проводимости, жела-
тельно распределение примесей в переходе, названное на
фиг. 6.9 идеализированным. Такой резкий градиент, конечно, не-
возможно получить, но для большинства существующих приборов
9 Не исключено, что перенос галогенидов соединений III—V групп, опи-
сываемый уравнением (6.20), также связан с реакцией диспропорциониро-
вания.
264
Р. ЛОДЙЗ. РОСТ МОНОКРИСТАЛЛОВ
приемлемы профили, названные здесь действительными. Однако
для многих устройств желательно иметь профили, более резкие,
чем на фиг. 6.9. Выращивание из газовой фазы дает следующие
преимущества с точки зрения управления профилем:
1. Температура при выращивании может быть достаточно
низкой, так что в полученном кристалле профиль не изменится
из-за диффузии в твердом состоянии.
2. Концентрацию активаторов в газовой фазе можно резко
изменять (если активаторы или их соединения летучи) такими
простыми способами, как открывание заслонки или изменение
температуры резервуара с активатором.
3. Рост может протекать очень медленно, и за ним можно
наблюдать визуально, что позволяет получать очень тонкие
слои. Из-за очень медленного роста приходится даже брать
подложку (затравку, на которой производится выращивание
с одновременной активацией), полученную другими методами.
4. При помощи специальных масок можно выращивать
слои, по-разному активированные в разных частях подложки;
нанося и удаляя маски в разных последовательностях, можно
получать сложные трехмерные распределения монокристалли-
ческого вещества со сложными профилями концентраций. Та-
кие методы, при которых во время диффузии применяют маски,
играют важнейшую роль в технологии монолитных электрон-
ных схем.
Маринейс [66] описал систему, где в запаянной кварцевой
ампуле иод, реагируя с германием, транспортирует его в виде
иодида и последний осаждается в виде эпитаксиальной пленки
в результате реакций диспропорционирования. Аналогичными
методами выращиваются кристаллы многих полупроводнико-
вых материалов, в том числе Ge, GaAs, GaP и сплавов GaAs
с GaP [реакция (6.20) —типичный пример].
Эпитаксиальный рост кремния идет по реакции
1100 °C
Sil4(g)+ Si(s) *==? 2SiI2(g). (6.22)
При этом Sil4 можно получать прямо в системе за счет реак-
ции Si с 12. На фиг. 6.10 [67] показана типичная схема экспери-
мента. Концентрация 12 [4] составляет 12—48 мг/см31). При-
меси переносят с помощью реакций типа
2B(s) + 3I2(g) 2BI3<g). (6.23)
В нормальных условиях величина AG0 для иодидов В, Р, As и
Sb ближе к нулю, чем для иодидов Al, In и Ga (в том и дру-
9 При таких высоких заполнениях Ь нужно соблюдать осторожность,
ибо эти давления 12 близки к пределу прочности кварцевых ампул.
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
265
гом случаях она отрицательна). Это означает, что в случаях
Al, In и Ga [67] реакция, аналогичная реакции (6.23), не будет
смещена слишком далеко влево при активировании. Обычный
способ активации — предусмотреть нужную концентрацию ак-
Термопара -
Керамическая
трубка
Витки
нагревателя
температуры
Асбест —
Стержень
из кварца
Кремниевая
подложка
Реакционная
трубка
из кварца
Шихта (St)
Кварцевая
вата
Фиг. 6.10. Тиш.чаая схема эксперимента для выращивания Si с использо-
ванием реакций диспропорционирования Sil2 [44].
тиватора в исходном материале. Такой способ вполне эффек-
тивен для В, Р, As и Sb; концентрация в выращенном кри-
сталле, как правило, примерно такая же, как и в исходном Si,
и может составлять от 5-Ю16 до 2-1020 см-3. Из активирован-
ного материала удобно выращивать р — n-переходы. Вот типич-
ный метод такого выращивания. В соответствующую печь вводят
ампулу с материалом zz-типа, материалом p-типа и подложкой
(затравкой). Распределение температуры устанавливают так,
266
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
чтобы на подложку осаждался материал p-типа (мате-
риал р-типа находится при температуре Г2, подложка — при
температуре 7\ и материал п-типа— при То; 72>Ti^>To, и
транспорт происходит от Т2 к Л). Затем ампулу передвигают
таким образом, чтобы материал p-типа и подложка были при
7\, а материал п-типа— при Т2. Транспорт будет происходить
от материала n-типа (сначала испарится тонкий слой р-типа,
образовавшийся на материале n-типа) к подложке.
Методом, подобным методу для Si, получают эпитаксиаль-
ные слои германия [68, 66].
В этом случае используется реакция
500 °C
Qe(s) + Gel4 (g) -<0"-о(?- 2GeI2(g). (6.24)
либо в открытой, либо в проточной системе, причем скорость,
как было показано, зависит от плотности 12. При плотностях 12,
равных 0,03 мг/см3, скорости роста составляют 5—10 мкм/сут, а
при плотностях иода, равных 30 мг/см3, скорости роста дости-
гают больших значений, ~ 24 000 мкм/сут (хотя и при плохом
качестве кристалла). Приемлемое качество при скоростях
роста ~100 мкм/сут можно получить при плотностях 12 по-
рядка 5 мг/см3. Среди нежелательных примесей, присутствую-
щих в кристалле, есть и транспортирующий агент, как вероят-
но, в большинстве веществ, полученных кристаллизацией из
газовой фазы. В кристаллах Ge была найдена примесь 12 по-
рядка 1014— 1015 см"3. Как и должно быть, скорость роста (так
же как и коэффициенты распределения 12 и других при-
месей) зависит от кристаллографического направления, причем
^<2п> ~ &<но) > &<in> ~ ^<1оо). Активирование кристаллов можно
осуществлять, либо используя активированный исходный Ge,
либо вводя в систему активаторы в виде элементов и в виде
иодидов.
Литература по вопросам получения эпитаксиальных пленок
Ge, Si и других полупроводников весьма обширна, так что мы
сошлемся лишь на очень хорошие обзоры [8, 69].
6.5. РОСТ КРИСТАЛЛОВ
ЗА СЧЕТ НЕОБРАТИМЫХ РЕАКЦИЙ
Введение
Процессы, рассматриваемые в этом разделе, точнее было бы
назвать процессами в проточной системе, ибо очень часто их
термодинамика не настолько хорошо известна, чтобы можно
было быть уверенным в их необратимости, хотя практически
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
267
используется лишь одно направление реакции. Таким образом,
те процессы, в которых химически активные вещества не ис-
пользуются повторно (по причинам, связанным с термодинами-
кой, или из практических соображений), естественно, попадают
вместе в один раздел и будут рассматриваться здесь.
Типичные системы
Условия выращивания целого ряда веществ с использова-
нием процессов в проточной системе указаны в табл. 6.2. Са-
мый простой процесс такого типа — выращивание кристаллов
Pd посредством следующей реакции разложения [70, 71]:
PdCl2(g) * Pd(s) + Cl2(g). (6.25)
Твердый PdCl2 в кварцевой трубке помещают в печь с тем-
пературным градиентом и нагревают до температуры, при ко-
торой становится заметным давление пара (~ 900 °C, что выше
Тпл). Над PdCb пропускают медленный ток Аг, и в высокотем-
пературной области печи происходит реакция образования Pd.
Получающиеся кристаллы имеют вид шестиугольных и тре-
угольных пластинок и длинных нитевидных монокристаллов,
прямых или закрученных в спираль.
Выращиванием из газовой фазы очень удобно получать ни-
тевидные кристаллы. Это монокристаллы, которые часто содер-
жат одну-единственную винтовую дислокацию (см. гл. 7, разд.
5, где рассматривается метод выращивания по механизму
П—Ж—Т, который дает возможность получать кристаллы, не
содержащие винтовых дислокаций). Ядро дислокации обычно
проходит вдоль оси нитевидного кристалла. Такие монокри-
сталлы с очень низкой плотностью дислокаций представляют
особый интерес при изучении влияния дислокаций на свойства
кристаллов. Например, из-за малой плотности дислокаций ни-
тевидные кристаллы обнаруживают необычайно высокую проч-
ность на разрыв [47].
Процессы в проточной системе применяются для получения
эпитаксиальных слоев. Так, силан SiH4 пиролизуют согласно
реакции [72, 73]
SiH4(g) -> Si(s) + 2H2(g) (6.26)
на нагреваемой подложке из Si при температурах от 950 до
1250 °C. Если давление силана превышает приблизительно 1 мм
рт. ст., то в газовой фазе происходит гомогенное разложение,
но при низких давлениях гетерогенные реакции на подложке
вполне можно контролировать. Химически активные транспорт-
ные вещества, такие, как SiH4, нужно использовать, конечно, с
осторожностью. Их реакционная способность (в случае SiH4 —
268
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
особенно с окислителями) такова, что процесс взрывоопасен.
При промышленном производстве эпитаксиальных слоев Si в
проточных системах, по-видимому, шире всего применяется
реакция восстановления галогенидов водородом. Обобщенная
реакция такова [74—78]:
SiH4_xYx (g) + (х - 2) Н2 (g) Si(s) + xHY(g), (6.27)
где Y — галоген, a x принимает значения от 1 до 4. Путем вос-
становления водородом удается получать кристаллы объемом
Водяная
завеса
Фильтр (стеклянная
фритта)
Палладизированный
алунд
Расходомер
Спирт,
Н20
и сухой лед
Кварцевый
держатель
Активированный / $1С14
vsonb Жидкий N2
Пластинка (Si)
§ Индуктор
Вставка малого
\ сопротивления
в держатель
для S’
Нг
Н2
Жидкий N2
Фиг. 6.11. Типичная схема эксперимента по выращиванию Si с использо-
ванием реакции восстановления галогенидов [49].
более 1 см3. Активирование осуществляют, вводя, например,
BCl3(g) и PCl5(g) в зону реакции.
Тейрер [49] описал способ получения эпитаксиальных слоев
посредством реакции
SiCl4 (g) + 2Н2 (g) Si(s) + 4HCl(g), (6.28)
Устройство его печи приведено на фиг. 6.11.
Подложкой служит монокристалл Si, который нагревают
приблизительно до 1270 °C. При более низких температурах
вследствие малой поверхностной подвижности на подложке
рост оказывается поликристаллическим. В типичных условиях,
когда мольное соотношение SiCI4 — Н2 равно 0,02, а скорость
потока водорода составляет 1 л/мин, эпитаксиальные пленки
6. РОСТ КРИСТАЛЛОВ ИЗ ПАРОВ
269
толщиной 8 мкм на подложке площадью 40 см* 2 получаются за
5 мин. Активирование осуществляется введением активаторов
в виде подходящих соединений с достаточно высокой лету-
честью !).
Изучение механизма и кинетики некоторых реакций в газо-
вой фазе [49, 79—81] показывает, что написанные нами простые
реакции верны лишь в общем и целом, а реакции, протекаю-
щие фактически на промежуточных стадиях, во многих случаях
значительно сложнее.
Выращивание кристаллов тугоплавких веществ в проточной
системе получило значительное развитие благодаря работам
Шефера [53, 54], вырастившего таким путем сапфир2). При этом
использовалась реакция
2AlCl3(g) + 3H2(g)+3CO2(g) -> Al2O3(s)+3CO(g)+3HCl(g) (6.29)
в условиях, когда константа равновесия К очень велика3). Ин-
тересно, что, несмотря на это, удается контролировать образо-
вание зародышей на затравке и выращивать материал с малой
плотностью дислокаций. В более поздних публикациях сообща-
лось [55], что выращены кристаллы рубина весом свыше 50 г.
Успех, очевидно, обусловлен следующими факторами.
1. Температура затравки довольно велика (1700—1800°C),
так что поверхностная подвижность осаждающихся частиц вы-
сока.
2. Использованы довольно большие скорости течения газов
через систему (1000 см/с) и умеренные давления (9 мм рт. ст.).
Время прохождения через аппаратуру достаточно мало, так что
протекающая там реакция была неполной и при умеренных
давлениях, несмотря на большую величину константы Л, было
возможно поддерживать реакцию близко от равновесия.
Если описанный метод окажется пригодным и для выращи-
вания других веществ, то ограничение AG0 0 будет, пожалуй,
не очень жестким.
Галогенный транспорт в замкнутой системе широко исполь-
зуется для выращивания кристаллов CaAs, GaP и GaAsxPi-x
[62, 63]. Реакции, по-видимому, протекают согласно уравне-
нию (6.20), но, впрочем, детальные сведения отсутствуют и
возможны реакции типа приведенных в табл. 6.2. В число
9 При получении эпитаксиальных слоев полупроводниковых материалов
особенно выгодной оказалась так называемая «геометрия роста с малым за-
зором» [85, 86].
2) В статьях [87, 88] описываются эпитаксиальные пленки граната, полу-
ченные методом химического осаждения паров.
3) Может оказаться, что для реакции, лимитирующей скорость роста,
константа К невелика. Это означает, что реакция, определяющая скорость
роста, не совпадает с предполагаемой.
270
Р. ЛОДИЗ РОСТ МОНОКРИСТАЛЛОВ
транспортных реагентов входят ZnCl2, CuCl2, SnCl2, MgCl2,
HgCl2, AICI3, SbCl3, Cl2 и I2. Выращиваются как эпитаксиальные
пленки, так и объемные кристаллы (выращивание которых
требует нескольких недель). Исходным веществом обычно
служат GaAs, GaP и GaAsxPi-x, перенос происходит из горячей
в холодную часть трубки, причем в зависимости от катиона
транспортирующего агента можно получать кристаллы или п-
или p-типа. Получены кристаллы лазерного качества.
В проточной системе с использованием реакции толуола и
SiCl4 на раскаленной проволоке был выращен карбид кремния
[13], и наличие подобных методов позволяет надеяться, что
удастся получать большие кристаллы этого сверхтугоплавкого
материала с заданными свойствами. Кендалл [82] использовал
процессы в проточной системе, происходящие на раскаленной
нити, для получения SiC в результате газового крекинга. Нить
была сделана из графита, а ее температура достигала
~ 2000 °C. Наилучшие кристаллы оказалось возможным полу-
чить в системе SiCU — толуол при соотношении этих компонен-
тов 20:1. На нити диаметром 250 мкм легко удавалось полу-
чить кристаллы низкотемпературной модификации SiC длиной
до 0,6 мм,
7
РОСТ КРИСТАЛЛОВ
ИЗ ЖИДКИХ РАСТВОРОВ
7.1. ВВЕДЕНИЕ
Разные методы выращивания кристаллов в многокомпо-
нентных системах, содержащих жидкую фазу, имеют так много
общего, что естественно все их рассматривать в одной главе.
Поскольку при таких методах сверх кристаллизующейся фазы
всегда имеются дополнительные компоненты, им присущи все
недостатки, связанные с ростом в многокомпонентных системах
(см. гл. 2, особенно разд. 2.10). Но эти методы дают и опреде-
ленное преимущество, связанное с низкими температурами про-
цессов (см. разд. 2.1). Поскольку кристаллы выращиваются из
многокомпонентной жидкости, их рост во всех случаях можно
рассматривать как кристаллизацию из раствора. И действи-
тельно, основные различия разных методов носят технический,
а не принципиальный характер и связаны с типом применяе-
мого растворителя. В конце главы мы остановимся также на
некоторых других методах, тесно примыкающих к методам вы-
ращивания из растворов.
Методы выращивания удобно рассматривать, взяв за основу
используемый растворитель, так как и оборудование, и область
применимости, и проблемы, и подход—все это в значительной
степени определяется выбором растворителя. Но нужно иметь
в виду, что более правильно было бы, по-видимому, классифи-
цировать методы по способу создания пересыщений. Тогда мы
получим следующий перечень методов:
I. Изотермические методы (методы постоянной температуры)
А. Испарение растворителя или снижение растворимости
путем добавления другого растворителя (используется
главным образом при выращивании кристаллов из водных
растворов и из раствора в расплаве).
Б. Перепад температуры (используют главным образом при
выращивании в гидротермальных условиях, из водных
растворов и из растворов в расплаве; сюда относится так-
же метод зонной плавки с градиентом температуры,
когда зону температурного градиента перемещают вдод^
Образца).
272
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
В. Химическая или электрохимическая реакция (исполь-
зуются в основном при выращивании из водных ра-
створов) .
II. Неизотермические методы (с изменением температуры)
А. Медленное охлаждение (применяют главным образом
при выращивании из водных растворов, из растворов в
жидких металлах и из растворов в расплавах).
Б. Зонное плавление при наличии температурного градиента,
когда градиент приложен ко всему образцу.
Любой из рассматриваемых в этой главе растворителей
(или любой другой применяемый в тех же целях) можно ис-
пользовать для выращивания кристаллов любым из перечис-
ленных методов. В предыдущих главах мы отмечали, что разли-
чия между ростом в процессе реакции (разд. 2.11) и ростом из
раствора довольно условны и что, например, рост в процессе
газовой реакции при AG ~ 0 аналогичен росту из раствора в
присутствии комплексообразователя (минерализатора) (разд. 7.3).
Преимущество изотермических методов заключается, естествен-
но, в лучшем контроле за любыми зависящими от темпера-
туры свойствами кристалла. Если нужная фаза устойчива в
узкой температурной области, то ее получение в изотермиче-
ском процессе более вероятно. Если коэффициент распределе-
ния примесей, активаторов или компонентов зависит от темпе-
ратуры, то изотермический процесс будет давать более однород-
ные кристаллы. Основное преимущество процессов медленного,
охлаждения связано с меньшей характерной длиной диффузион-
ного переноса, позволяющей получать нужные скорости роста
без сложных систем регулирования и без дорогостоящей
аппаратуры.
Методы испарения растворителя или снижения раствори-
мости за счет добавления другого растворителя имеют тот не-
достаток, что, если коэффициент распределения примесей и про-
чее зависит от концентрации растворителя, то возникает пробле-
ма неоднородностей в кристаллах. Введение другого раствори-
теля столь же трудно контролировать, как и химическую реак-
цию, и поэтому иногда приходится прибегать к таким ухищре-
ниям, как выращивание из геля.
При использовании методов температурного перепада воз-
никают проблемы диффузионного переноса и растворения кри-
сталла, тогда как химическая и электрохимическая реакции
трудно поддаются контролю. В вышеприведенном перечне мы
указали растворители, которые сейчас чаще всего применяют
при выращивании данным методом. Подробнее методы разби-
раются в соответствующих разделах главы. Температурное
7. РОСТ кристаллов из жидких РАСТВОРОВ
273
циклирование1), которое до настоящего времени не находило
широкого применения при выращивании из растворов, может
оказаться очень полезным как способ ограничения спонтанного
образования зародышей (см. разд. 6.4).
7.2. ВЫРАЩИВАНИЕ ИЗ ВОДНЫХ РАСТВОРОВ
Выращивание кристаллов из водных растворов — это, по-ви-
димому, самый старый метод их получения. В самом деле, та-
кой метод применяется при самых разнообразных производ-
ственных процессЖ получения кристаллических продуктов от
пищевого сахара до сульфата меди. Процессы подробно иссле-
дованы в химической и технической литературе с теоретиче-
ской точки зрения, с точки зрения практики и используемого
оборудования [1]. Но в таких процессах ставится цель получе-
ния экономически высокого выхода однородного кристалличе-
ского продукта, причем обычно требуются совсем небольшие
размеры кристаллов. Обычно стремятся обеспечить постоянные
размеры кристаллических частиц, совершенству же образую-
щихся кристаллов редко придают какое-либо значение, а круп-
ные кристаллы в таких процессах не получают никогда. Рост
кристаллов в таких технологических процессах происходит в
условиях спонтанного образования зародышей или за счет за-
травливания, причем затравками служат частицы порошков.
Таким образом, подобные процессы не имеют прямого отноше-
ния к выращиванию больших монокристаллов высокой степени
совершенства.
Практически вся литература по выращиванию больших кри-
сталлов из раствора приблизительно до 1950 г. охвачена в книге
Бакли [2]. Книги Хольдена и Сингера [3], а также Хольдена и
Томсона [4], хотя и рассчитаны на учащихся средней школы,
относятся к самым новым и ценным работам (см. также Пет-
ров и др. [5]).
При выращивании из водных растворов, так же как и во
всех других методах выращивания из растворов, задача со-
стоит в том, чтобы достичь пересыщения раствора без спон-
танного образования зародышей, а затем установить нужное
пересыщение и тем самым соответствующие скорости роста,
при которых уже возможен контролируемый рост на затравке
4) При циклическом изменении температуры в системе со множеством
кристаллов происходит постепенное укрупнение кристалликов путем разраста-
ния наиболее крупных за счет мелких [125]. Это так называемое «созревание»
происходит даже на кристаллах размером в несколько миллиметров и, по-
видимому, не имеет своей причиной действие поверхностной энергии (см.
[126—128]. Укрупнение кристаллов в режиме колеблющейся температуры было
использовано В. А. Тимофеевой при выращивании иттрий-алюминиевого гра-
ната [129]. — Прим. ред.
274
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
кристалла нужной степени совершенства. Методы различаются
способом создания пересыщения в растворе (см. разд. 7.1). На
фиг. 7.1 приведена кривая зависимости растворимости от тем-
пературы для большинства веществ при обычных условиях.
Кривая получена, конечно, на основании диаграммы состояния
— НгО и представляет собой часть
разреза при постоянном давлении. В
большинстве случаев указанная зави-
симость описывается уравнением Вант
Гоффа, так что
d In s _ МТ
dT — RT2 >
где s — растворимость (выражаемая
в большинстве случаев в атомных до-
лях) , Т — абсолютная температура,
Д/7 — теплота растворения, R — газо-
вая постоянная. Для эндотермической
реакции наклон кривой температурной
зависимости растворимости положите-
лен, как на фиг. 7.1. Если же реак-
ция экзотермическая, то наклон кри-
вой отрицателен (так называемая ретроградная растворимость'),
но выращивание методами, перечисленными в разд. 7.1,
все-таки возможно; правда, при этом в методе II, А выра-
щивание производится при повышении температуры, а в мето-
де 1,Б — при температурах, превышающих температуру рас-
растворенное вещество
Фиг. 7.1. Зависимость рас-
творимости от температуры
для большинства веществ.
(7.1)
творения.
При выращивании из раствора исследуемая фаза должна
быть устойчивым твердым продуктом, что может потребовать
экспериментальных исследований фазового равновесия. Неже-
лательными фазами часто оказываются гидраты, гидроокиси
или оксигидроокиси. Вообще гидролиз не слишком широко рас-
пространен при повышенных температурах; поэтому, если на-
блюдается образование гидроокисей или оксигидроокисей, можно
рекомендовать кристаллизацию при более высоких температу-
рах. Если образуются гидраты, то более высокие температуры
также часто способствуют стабилизации нужной фазы.
Фазовые равновесия и методы определения растворимости
в воде при обычных условиях рассмотрены Р. Волдом и М. Вол-
дом [6], и имеются стандартные таблицы растворимостей [7, 8].
В случае других, отличных от воды растворителей, очевидно,
не потребуется сильно изменять рассматриваемые здесь ме-
тоды при условии, что области существования растворителей
в виде жидкой фазы, их давления паров и растворяющие свой-
ства подобны свойствам воды.
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
275
Если растворимость в чистой воде слишком мала, как это
часто бывает в случае неионизированных соединений с кова-
лентной связью, таких, как органические соединения, то можно
применить другие, например органические, растворители. Если
же растворимость слишком велика (что приводит к образова-
нию очень вязких растворов), то можно использовать смеси
растворителей, например смесь спирта с водой. Если темпера-
турная зависимость растворимости либо слишком крута (не-
значительные температурные флуктуации вызывают спонтан-
ное зародышеобразование), либо недостаточно крута (при вы-
ращивании путем медленного охлаждения отлагаются малые
количества вещества, а при выращивании методом температур-
ного градиента градиент должен быть слишком большим), то
тоже можно использовать другой растворитель или смесь ра-
створителей.
Если растворимость в данном растворителе слишком мала,
то в некоторых случаях ее удается увеличить введением комп-
лексообразователя. В гидротермальных исследованиях и гео-
химической литературе такие комплексообразователи обычно
называют минерализаторами. В условиях, отличных от гидро-
термальных, комплексообразователи имеют довольно ограни-
ченное применение, но в принципе они могут оказаться очень
эффективными для выращивания в обычных условиях кри-
сталлов, как правило, требующих высоких температур, слож-
ных растворителей и высоких давлений. Комплекс должен быть
достаточно устойчивым и существовать в достаточно высокой
концентрации для того, чтобы увеличить растворимость, но он
не должен быть настолько устойчивым, чтобы образовать ста-
бильную твердую фазу. Перспективным представляется при-
менение неорганических кислот, особенно плавиковой HF (ко-
торая образует комплексные фтористые соединения), для вы-
ращивания тугоплавких фторидов и сульфидов (образующих
комплексные сульфиды) для выращивания кристаллов суль-
фидов.
Относительные скорости роста различных кристаллографи-
ческих граней часто зависят от того, какие атомы адсорбиро-
ваны на данной грани. Таким образом, скорости роста могут
сильно зависеть от примесных ионов и от pH среды. Подобным
же образом морфология и совершенство кристаллов очень чув-
ствительны к примесям. Это особенно относится к таким мето-
дам выращивания, как рост из водных растворов, который про-
исходит при сравнительно невысоких температурах,когда адсорб-
ция и хемосорбция происходят сравнительно легко. Классическим
примером примеси, позволяющей выращивать высокого каче-
ства кристаллы, может служить, пожалуй, РЬ2+, который спо-
собствует росту хороших кристаллов NaCl (см. табл. 7.1).
Таблица 7Л
Типичные кристаллы, выращенные из водных растворов
Материал Формула Раствори- тель Метод Методика Литера- тура
Алюмокалиевые квас- цы KA1(SO4)2- 12Н2О Н2О Вращающегося кристаллизатора Насыщенный при 48 °C раствор охлаждается со скоростью ~0,2°/сут в тече- ние нескольких недель [4]
Хромокалиевые квасцы KCr(SO4)2- 12Н2О То же Приблизительно то же са- мое, что и для алюмокалие- вых квасцов 14}
Хлорат натрия NaClO3 Насыщенный при 51 °C раствор охлаждали со ско- ростью ~0,2с/сут в течение нескольких недель [41
Кристаллогидраты сульфата никеля NiSO4 • 6Н2О NiSO4-7H2O » » Охлаждение, начиная с 50—35 °C, приводит к полу- чению гексагидрата; при охлаждении, начиная с тем- пературы ниже 35 °C, обра- зуется гептагидрат [41
Сегнетова соль (тарт- рат калия — натрия) KNaC4H4O6 • 4Н2О Подобна квасцам; легко дегидратируется, должна храниться в плотно закры- тых сосудах [4]
Каменная соль
Сегнетова соль (тарт- рат калия — натрия) KNaC4H4O6 • 4Н2О »
Алюмокалиевые квас- цы KA1(SO4)2- 12Н2О
Хромокалиевые квас- цы KCr(SO4)2 • 12Н2О
Натрий надборнокис- NaBO3
лый 1
Испарения Насыщенный солевой рас- твор, содержащий 0,1% H2S04 + 0,l°/o Pb(NO3)2, ис- паряют в течение 12 ч при температуре, равной 75 °C; получаются кристаллы куби- ческого облика размером 6 мм (с содержанием 2,7 - •10~4 РЬ); без РЬ2* обра- зуются непрозрачные гидраты [91
Закрытой банки или испарения Приготавливают раствор, содержащий 130 г/100 см3 Н2О, нагревают до полного растворения и выращивают кристаллы методом испаре- ния или готовят раствор, со- держащий 134 г/100 см3 Н2О, нагревают его до полного растворения и выращивают кристаллы в закрытой банке [31
То же См. сказанное выше о сег- нетовой соли; 20 г/100 см3 для испарения, 24 г/100 см3 для метода закрытой банки (31
т» » См. сказанное выше о сег- нетовой соли; 60 г/100 см3 для испарения, 65 г/100 см3 для метода закрытой банки [3]
См. выше о сегнетовой со- ли; 50 г/100 см3 для испаре- ния, 52 г/100 см3 для метода закрытой банки [31
Продолжение табл, 7.1
Материал Формула Раство- ритель
Хлорат натрия NaClO3 Н2О
Нитрат натрия NaNO3 »
Дигидрофосфат аммо- ния (АДП) -NH4H2PO4 »
Этилендиаминтарт- рат (ЭДТ) [NH2CH2CH2NH2] [OC(CHOH)2CO]
Метод
Закрытой банки
или испарения
То же
Вращающегося
кристаллизатора
То же
Методика
См. выше о сегнетовой со-
ли; 113,4 г/100 см3 для испа-
рения; 117,4 г/100 см3 для
метода закрытой банки
См. выше о сегнетовой со-
ли; ПО г/100 см3 для испа-
рения, 113 г/100 см3 для ме-
тода закрытой банки
Пластинки, ориентирован-
ные по грани (001), растут
плохо до тех пор, пока на
них не образуются грани (101)
в виде «шапочек»; если уста-
новить pH раствора ~5, то
увеличивается скорость ро-
ста боковых граней
Безводные формы устойчи-
вы при температуре выше
40,6 °C, гидратные — ниже;
безводные формы сущест-
вуют в виде метастабильной
фазы при температуре ниже
40,6 °C в отсутствие зароды-
шей моногидрата; когда на
завод, где производилась
кристаллизация, были зане-
сены зародыши, начал нара-
щиваться гидрат, пока не
повысили температуру выра-
щивания
Литера-
тура
[31
[3]
[10-12]
[10-12]
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
279
Ямамото [13] указывает более двадцати примесей, которые из-
вестны своим влиянием на рост кристаллов NaCl, КС1, КВг,
KI, RbCl, NH4CI, LiCl-H2O, K2SO4 и KNO3. Если никак не
удается вырастить кристаллы высокого качества из водных рас-
творов (особенно когда выросшие-кристаллы мутны), то нужно
попробовать ввести примесь. Наиболее эффективны, по-види-
мому, многозарядные катионы, способные создавать сильную
поляризацию, которые легко адсорбируются и хемосорбируются.
Вращающийся кристаллизатор Хольдена
Для выращивания кристаллов путем медленного охлаждения
удобнее всего, по-видимому, вращающийся кристаллизатор
Хольдена [4] (фиг. 7.2). Насыщенный или почти насыщенный
Фиг. 7.2. Вращающийся кристаллизатор Хольдена.
раствор вводят в резервуар при температуре 7Y Для удобства
раствор переносят обычно при температуре, несколько превы-
шающей температуру насыщения. К держателю прикрепляют
соответствующим образом ориентированные затравки. Затрав-
ками обычно служат осколки кристалла. Их удобно закреплять,
вставляя в пластиковые изоляционные трубки, натянутые на
кончики держателей.
Получение кристаллов для затравок часто доставляет много
хлопот. Иногда при охлаждении кристаллы образуются на стен-
ках и на мешалке вращающегося кристаллизатора, и их можно
использовать в качестве затравок в последующих опытах.
280
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Другой способ получения затравок — путем испарения раствори-
теля (см. ниже). Для получения затравочных кристалликов
можно испарять раствор на часовом стекле или в чашке Петри.
В закрытой банке (см. ниже) можно выращивать кристаллы и
без затравки. Зарождение будет происходить на стенках и на
дне сосуда, и из полученных кристаллов можно выбрать или
вырезать монокристаллические затравки. Иногда имеет смысл в
закрытой банке подвесить нитку для образования на ней заро-
дышей, ибо рост кристаллов на ней не будет ничем ограничи-
ваться.
Держатели в кристаллизаторе Хольдена удобно делать из
вольфрама, не взаимодействующего со многими растворами.
Проверять насыщение в водном растворе часто - можно, опу-
ская в раствор вблизи его поверхности небольшой кристаллик
и наблюдая при соответствующем освещении за оптическими
свилями, которые обусловлены изменениями показателя пре-
ломления раствора, соответствующими градиентам концентра-
ции вблизи кристалла, не находящегося в равновесии с рас-
твором. Если видны токи, идущие вниз, то это означает, что
жидкость вблизи кристалла плотнее, чем вдали от него, т. е.
кристалл растворяется (раствор не насыщен); если же видны
восходящие токи, то это означает, что вдали от кристаллика
жидкость плотнее, чем вблизи, и он растет (раствор пересы-
щен). В зависимости от результата такой проверки темпера-
туру можно изменить и тем самым приблизить систему к со-
стоянию равновесия.
Температуру поддерживают на заданном уровне при помощи
различных нагревательных устройств с регуляторами. Обычно
используют погруженный в раствор нагреватель сопротивления
ножевого типа (а иногда также и электроплитку). В качестве
вспомогательного периодически работающего нагревателя мож-
но использовать инфракрасную лампу, сфокусированную на
раствор. Датчиком температуры обычно служит ртутный тер-
морегулятор, хотя используют и более совершенные датчики.
Объем кристаллизатора зависит от размера выращиваемых
кристаллов. Чтобы уменьшить влияние диффузии, обычно при-
ходится медленно вращать кристаллодержатель, а чтобы не
возникали завихрения, направление вращения меняют через
каждые несколько секунд. Полное описание роста в кристалли-
заторе Хольдена дается в работе Хольдена и Томсона [4].
Пересыщение создается медленным охлаждением, az ско-
рость охлаждения определяется системой. Обычно скорость со-
ставляет 0,1—1,5°С/сут. Для задания нужной скорости охлаж-
дения используют регулятор с эксцентриком и с приводом от
электродвигателя, но обычно бывает достаточно один раз в день
хстзновить контрольную точку ртутного терморегулятора на
1. РОСТ КРИСТАЛЛОВ Из ЖИДКИХ РАСТВОРОВ
281
определенное положение. Ясно, что такой рост происходит не
в изотермических условиях, а поэтому любая характеристика
кристалла, зависящая от температуры, не остается постоянной
в продолжение всего опыта. Если температуру снижать ступе-
нями, то скорость роста не будет постоянной и не будут по-
стоянными характеристики кристалла, зависящие от скорости.
Соединение крышки с резервуаром уплотняют так, чтобы
предотвратить испарение, а вал мешалки часто вводят через
ртутный затвор (фиг. 7.2).
Примеры кристаллов, полученных по методу вращающегося
кристаллизатора, приведены в табл. 7.1.
Метод закрытой банки
Более простой метод, в котором используется медленное
охлаждение, — метод закрытой банки, лучше всего описанный
Фиг. 7.3. Выращивание кристаллов в закрытой банке.
Хольденом и Зингером [3]. Это, пожалуй, самый простой спо-
соб выращивать кристаллы и достаточно дешевый для прове-
дения большого числа параллельных опытов. Насыщенный рас-
твор нагревают до температуры, несколько превышающей тем-
пературу насыщения, и выливают в банку с завинчивающейся
крышкой, куда вводят прикрепленную к нити затравку
(фиг. 7.3). Затравки получают способами, указанными ранее.
Банку закрывают крышкой и охлаждают до комнатной тем-
пературы. Если растворимость достаточно высока и охлаждение
происходит достаточно медленно, на затравке обычно вы-
растают хорошо образованные кристаллы. В этом методе
282
Р. ЛОДИЗ. РОСТ монокристаллов
скорость охлаждения, конечно, больше, чем в методе вращаю-
щегося кристаллизатора, а перемешивание раствора невозмож-
но, но простота метода все же делает его весьма привлекатель-
ным, особенно в предварительных работах и там, где нужны
кристаллы небольших размеров.
Метод закрытой банки легко применить для выращивания
кристаллов за счет испарения. Методика такая же, как раньше,
за исключением того что затравку подвешивают на проволочном
держателе (фиг. 7.3). Держатель полностью погружен в рас-
твор, так что в поверхностном слое раствора, который во время
испарения, конечно, заметно пересыщен, нет подложки для об-
разования зародышей. Вместо того чтобы закрывать банку
плотной крышкой, ее накрывают куском ткани (закрепленным
у края сосуда резиновым кольцом), который, задерживая пыль,
не препятствует испарению. Сначала рост происходит за счет
медленного охлаждения, но после того, как температура рас-
твора достигает комнатной, дальнейший рост осуществляется
за счет испарения. Если нужно, чтобы испарение происходило
с большей скоростью или чтобы кристаллы росли при более
высокой температуре, банку можно нагреть (с помощью электро-
плитки, водяной бани или водяного термостата). При таком
способе выращивания очень удобна термостатированная ком-
ната, но в подвалах многих зданий температура часто вполне
достаточно стабильна для того, чтобы в значительной степени
улучшить рост.
Если выращивание за счет испарения необходимо вести при
повышенных температурах, а скорость роста нужно ограничить,
то можно взять колбу с пробкой, через которую пропущена стек-
лянная трубка, вытянутая в капилляр нужного диаметра. Во
всех методах выращивания за счет испарения проблемой яв-
ляется чрезмерно интенсивное образование зародышей у по-
верхности раствора. Иногда применяют вазелиновое масло, по-
крывающее внутренние стенки банки как раз над поверхностью
раствора и препятствующее образованию кольца паразитных
кристаллов, зарождающихся здесь и растущих в направлении
верхней части банки. Такой рост обусловлен тем, что раствор
поднимается за счет капиллярных сил по кристалликам и за-
тем испаряется в верхней части кольца зародышей. Если рас-
творимость не соответствует нужной величине или если ско-
рость испарения слишком велика или слишком мала, то
вместо воды можно взять другой растворитель или смесь раст-
ворителей.
В табл. 7.1 указан ряд кристаллов, выращенных путем мед-
ленного охлаждения и испарения раствора. В книге Хольдена
и Зингера [3] дается много разных способов выращивания кри-
сталлов. При выращивании за счет медленного охлаждения и
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
283
испарения применяются различные другие варианты [2], и число
возможных видоизменений (по большей части тривиальных)
практически безгранично, так что мы здесь на этом не оста-
навливаемся.
Метод температурного перепада
О выращивании кристаллов методом температурного пере-
пада впервые сообщили Крюгер и Финк [2, стр. 49]. Один из
вариантов их установки показан на фиг. 7.4. В бак для рас-
творения вводят избыток растворенного вещества (исходного
Фиг. 7.4. Выращивание кристаллов методом температурного перепада.
материала), и раствор за счет конвекции и за счет переме-
шивания при помощи механической мешалки циркулирует
между баком для растворения и баком для выращивания. В на-
чале процесса в обоих баках обычно устанавливают одинаковую
температуру (нагревательным элементом может служить на-
греватель ножевого типа, термостат, электроплитка и т. д.) и
пробуют раствор в баке для выращивания до тех пор, пока он
не станет насыщенным. Затем слегка повышают температуру
в баке для выращивания (7\ > Т2) и вводят затравку. За-
травку можно получить одним из способов, указанных ранее.
Раствор будет ненасыщенным, за счет чего будут удалены по-
врежденный поверхностный слой затравки, поверхностные и
объемные зародыши и т. д. Затем температуру 7\ постепенно
понижают (Г2> 71) до тех пор, пока не установят нужное зна-
чение ДГ = Т2—Соединительные трубки между баками
служат теплообменниками (теплый раствор входит в нижнюю
трубку и выходит из верхней трубки), так что целесообразно
предусмотреть нагреватели вокруг нижней трубки и водяную
284
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
рубашку вокруг верхней. Имеет смысл обеспечить вращение
затравки, как и в методе вращающегося кристаллизатора, или
перекачивание раствора. Для этой цели удобен перистальтиче-
ский насос, в котором жидкость гонится за счет периодического
обжатия пластиковой трубки, так что движущиеся части не
контактируют с раствором. При помощи фильтров в верхней
трубке можно задерживать небольшие нерастворенные частицы,
а, кроме того, иногда в середине верхней трубки приходится
устанавливать третью температурную равновесную камеру.
Если конвекцию как движущую силу циркуляции желательно
исключить, то можно сделать так, чтобы по нижней трубке
раствор тек из бака для растворения в бак для выращивания,
а по верхней —в обратном направлении.
Уолкер и Комен [10] описали промышленную установку
для выращивания методом температурного перепада кристал-
лов дигидрофосфата аммония (АДП) и этилендиаминтартрата
(ЭДТ), применяющихся в качестве пьезоэлектрических элемен-
тов. На фиг. 7.5 показан один из вариантов их аппаратуры.
Бак 1 (первый слева) служит кристаллизатором, причем затравки
вращаются, как в методе вращающегося кристаллизатора.
Бак 2 (второй слева) служит для насыщения раствора, а бак
3 (крайний справа)—«перегреватель»; в баке 3 раствор
нагревается до температуры, на несколько градусов превышаю-
щей температуру его насыщения, для растворения всех возмож-
ных зародышей. Раствор перекачивают из бака 3 в бак 2, где
он быстро охлаждается (тепловая масса раствора в баке 3
очень большая) и в изотермических условиях за счет пере-
сыщения, определяемого разностью температур АТ = Т2 — Ти
происходит рост кристаллов. Из бака 1 в бак 2 и из бака 2 в
бак 3 раствор подается самотеком. Подробнее условия выра-
щивания приведены в табл. 7.4.
Интересной проблемой при выращивании кристаллов ЭДТ
в промышленной установке было образование «наростов» [15].
Сначала рост производили при температуре, равной 38°C. Про-
цесс при данной температуре был хорошо освоен, как вдруг
на растущих кристаллах стали появляться паразитные «наро-
сты» другого соединения. Вскоре после этого «наросты» начали
появляться и в опытах по выращиванию, проводимых в лабо-
ратории, расположенной в нескольких километрах от завода.
Исследования показали, что «наросты» имет&т состав ЭДТ-1Н2О,
устойчивы при температурах ниже 40,6°C, а нужная фаза
(ЭДТ) — выше этой температуры. При температуре на несколь-
ко градусов ниже границы перехода ЭДТ является метаста-
бильной фазой, и ее можно выращивать при этой температуре
лишь в том случае, если в растворе нет никаких зародышей фа-
зы ЭДТ-1Н2О. Коль скоро зародыши ЭДТ-1Н2О существовали,
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
285
они были случайно занесены сотрудниками, работавшими и на
производственной установке, и в лаборатории, где и послужи-
ли зародышами для образования ЭДТ-1Н2О. Проблему решили,
подняв температуру процесса выше 40,6 °C и исключив воз-
можность контакта растущего кристалла ЭДТ с влажной окру-
жающей средой. Этим случаем навеян сюжет одного хорошо
Фиг. 7.5» Установка Уолкера и Комена.
известного научно-фантастического романа [16], в котором опи-
сывается бедственное положение человеческого общества после
открытия новой полиморфной модификации льда, температура
плавления которой близка к 25 °C.
Появление синтетического кварца в значительной степени
ослабило промышленный интерес к кристаллам ЭДТ и АДП,
но методы их получения легко применить для промышлен-
ного производства других кристаллов, растворимых в воде1)-
*) Все больший интерес (как нелинейные оптические материалы) приоб-
ретают растворимые в воде йодаты [152].
286
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Соответствующие производственные возможности отвечали по-
лучению свыше 18 тонн ЭДТ в год. Методы медленного охлаж-
дения также пригодны, и они использовались для получения
ЭДТ и АДП [2].
Колб [17] показал, что Se образует комплексы с S2" и что
небольшие кристаллы тригонального Se можно выращивать из
раствора Na2S при медленном охлаждении и при испарении.
Это — пример комплексообразования, повышающего раствори-
мость (см. разд. 7.2).
Другие методы — общие сведения
Имеются сообщения и о многих других вариантах метода
температурного перепада (важный пример — зонное плавление
с температурным градиентом, описанное в разд. 6), но, как и
в методе медленного охлаждения, все видоизменения обычно
соответствуют лишь прихоти экспериментатора или имеющемуся
в наличии оборудованию, а не научно обоснованным требова-
ниям, и потому здесь мы их не будем рассматривать. Путем
испарения на часовых стеклах или в чашках Петри можно вы-
ращивать не только затравки, но и небольшие кристаллы.
1. Химические реакции. Способ выращивания кристаллов в
ходе химических реакций в водной среде оказался менее эф-
фективным. Дело в том, что очень трудно избежать пересыще-
ний, достаточных для начала спонтанного зародышеобразова-
ния. Такой способ перспективен для веществ, для которых
растворимость в воде настолько мала, что их практически невоз-
можно выращивать путем медленного охлаждения, испарения
или температурного перепада. Таким образом, в случае ионных
соединений мы имеем дело с веществами, для которых очень
мало произведение растворимостей Кр. Рассмотрим почти не-
растворимое соединение АВ, растворимость которого можно
считать обусловленной главным образом ионами. Другими сло-
вами,
ABS А+ + В", (7.2)
а произведение растворимости имеет вид
КР=(А+)(В-) (7.3)
(круглые скобки обозначают концентрацию соответствующих
ионов). Рост за счет реакции может начаться при смешении
водных растворов растворимых солей АС и DB. Но в большин-
стве случаев локальные значения произведения (А1’) (В-) будут
превышать значения /Ср, необходимые для спонтанного образо-
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
287
вания зародышей1). По этой причине попытки вырастить кри-
сталлы таким способом почти всегда неизбежно приводят к
получению мелких кристаллов или порошкообразных кристалли-
ческих материалов. Ясно, что любой метод, в котором раствор
АС прямо добавляют к раствору DB или наоборот, обречен
на неудачу. Но могут оказаться эффективными методы, в кото-
рых растворы АС и DB добавляют к чистой воде, содержа-
щей затравку, так как при этом можно легко избежать боль-
ших локальных превышений величины Др. Скорости роста в та-
ких методах будут, вероятно, небольшими, поскольку скорость,
Фиг. 7.6. Выращивание кристаллов посредством химических реакций.
с которой АВ можно доставить к растущей затравке, ограничи-
вается величинами допускаемых пересыщений, не приводящих
к спонтанному образованию зародышей, и, следовательно, будет
невелика, ибо Кр мало2). Но возможно, что заслуживают изуче-
ния методы, иллюстрируемые схемами фиг. 7.6.
2. Выращивание кристаллов в геле. По-видимому, легче всего
управлять ростом кристаллов при выращивании их за счет ре-
акции в водных растворах, если в качестве кристаллизационной
среды использовать гель. Впервые кристаллизацию в гелях на-
чал серьезно исследовать Лизеганг [18]. Он пытался объяснить
периодичность образования осадков, встречающуюся в природе
9 Если, например, — (А+)о(В~)о — равновесное значение произведе-
ния растворимостей, а А* = (А+) (В-) — его истинное значение в данном
месте системы, то величина А* — КР эквивалентна абсолютному пересыще-
нию в растворах (С— Со), а (А* — Кр)!р — относительному пересыщению
(С — Со) /Со. — Прим. ред.
2) Наиболее существенным фактором, ограничивающим скорости в таких
реакциях, может быть просто очень низкая плотность кристаллизующихся
элементов в растворе. — Прим. ред.
288
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
и в лабораторных условиях, которая носит теперь его имя
(кольца Лизеганга). Другие ранние работы были выполнены
Бредфордом [19], Холмсом [20], Освальдом [21] и Рейлихом [22].
Интерес к гелю в качестве среды для выращивания кристаллов
в значительной степени вызван недавними работами Хениша
и др. [23]. Гель представляет собой среду, обеспечивающую опре-
деленные преимущества при выращивании за счет реакции, так
как здесь требуется, чтобы величина Др была превышена только
Фиг. 7.7. Выращивание кристаллов в геле.
локально в той области, где происходит рост1). Вообще го-
воря, возможны две разные геометрии выращивания в гелях.
Они показаны на схемах фиг. 7.7 для случая выращивания
тартрата кальция (СаС4Н40б). Реакция между хорошо раство-
римой винной кислотой и хлоридом кальция приводит к полу-
чению нерастворимого СаС4Н40в:
Н2С4Н4О6 + СаС12 —> СаС4Н4О6 (s) + 2НС1. (7.4)
При подкислении растворимого силиката образуется гель
кварца:
Н+ + Slot* SiO2 (гель) + Н2о. (7.5)
Силикагель, по-видимому, лучше рассматривать как гидратиро-
ванную SiO2 или гидратированную кремниевую кислоту; он
образует как бы каркас, в котором находится вода. Это жела-
тинообразное соединение обеспечивает идеальную для диффу-
*) Вопрос о локальном обеспечении водной среды для растущего кри-
сталла при методе выращивания в геле рассматривается в статье [153].
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
289
•зии ионов среду и используется для разделения химически ак-
тивных ионов до момента реакции между ними. В типичном
эксперименте, проводимом по схеме, изображенной на фиг. 7.7, а.
раствор силиката натрия (в работе Хениша и др. [23, 24] его
удельный вес составлял 1,06 г/см3 и менее) смешивают с раство-
ром, например, 0,8—2 W Н2С4Н4О6 и оставляют при постоянной
температуре до образования геля. Затем поверх геля наливают
раствор 1,0 М СаС12. Он поставляет ионы Са2+, реагирующие с
Н4С40б~ у поверхности раздела гель — раствор и внутри геля
с образованием слабо растворимого тартрата кальция. Кроме
того, раствор предохраняет гель от высыхания в ходе роста
кристаллов. Но, как было установлено, в случае схемы фиг. 7.7, а
величина /С* *) максимальна у поверхности раздела между ге-
лем и раствором и кристаллы будут образовываться в присут-
ствии большого избытка ионов Са2+.
Схема фиг. 7.7, б лучше, так как здесь ионы Са2+ и С4Н4О6-
диффундируют навстречу друг другу с противоположных сто-
рон U-образной трубки и величина К* максимальна в какой-то
точке внутри геля. Кроме того, максимум величины К* здесь
более резкий, чем в схеме фиг. 7.7, а, поскольку теперь образо-
вание зародышей локализовано в гораздо более узкой области
(и если в этой области помещена затравка, то рост происходит
только на ней). В случае схемы фиг. 1.1.6 гель получают сна-
чала из очень слабокислых растворов. Скорость образования
кристаллов зависит от следующих факторов:
1) от плотности геля (влияющей на коэффициент диф-
фузии ионов 2);
2) от концентрации реагирующих веществ в геле;
3) от концентрации реагирующих веществ, продиффун-
дировавших в гель;
4) от температуры, длины диффузионного пути и т. д.
Кристаллы с размерами от миллиметра до сантиметра об-
разуются за период от нескольких дней до нескольких недель.
В табл. 7.2 указан ряд кристаллов, выращенных из геля. Лучше
всего, пожалуй, изучен рост кристаллов тартрата кальция. Сде-
ланы некоторые выводы относительно механизма роста. По об-
щему мнению, [23, 24, 27, 28], справедливо следующее:
1. Внутри геля пересыщение больше, чем в свободном рас-
творе в отсутствие роста, вызывающего отвод вещества3).
9 Величина К* есть произведение фактических концентраций, возведен-
ных в ту же самую степень, что и в КР. Когда К* > КР, происходит оса-
ждение.
2) Наилучшие кристаллы образуются, по-видимому, в гелях малой плот-
ности.
3) Это положение часто высказывается, но оно еще не доказано. Убеди-
тельных доказательств никем не представлено.
290
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Таблица 7.2
Некоторые кристаллы, выращенные в геле кремневой кислоты
Соединение Система Лите- ратура
Тартрат кальция Винная кислота + хлорид кальция [23]
Вольфрамат кальция Вольфрамат натрия + хлорид каль- ция [23]
Йодид свинца Ацетат серебра йодид калия + ацетат свинца Уксусная кислота + нитрат серебра [23]
Хлорид меди (одновалентной) CuCl + НС1 (разбавление) [26]
2. Рост может продолжаться и в тех случаях, когда кристалл
достигает размеров, вызывающих разрыв геля, но при этом
характеристики растущих кристаллов ухудшаются.
3. Благоприятные условия для роста кристаллов создаются
в любой среде, облегчающей управление процессом диффузии,
но наилучшие результаты получаются в средах с развитой по-
верхностью, в частности в гелях.
4. Гель может тормозить образование зародышей, воздей-
ствуя на диффузионный слой у растущей поверхности или на
турбулентные и конвекционные потоки в жидкости, но убеди-
тельные эксперименты по выяснению его роли в таких процес-
сах еще не проведены.
Одним словом, возможности геля как среды для роста кри-
сталлов в процессе реакции до сих пор фактически не вы-
яснены как с точки зрения практики выращивания отдельных
кристаллов, так и с точки зрения новых благоприятных усло-
вий, которые она предоставляет для исследования механизма
роста. Подобным же образом не исследованы возможности
ускорения процессов диффузии в гелях и через полупроницае-
мую мембрану (фиг. 7.6, а) и управления этими процессами при
помощи электрического поля.
3. Электрохимические реакции. Процесс роста кристалла в
ходе электрохимической реакции менее исследован, чем про-
цесс роста из гелей1), но такой метод выращивания, по-види-
мому, даже более перспективен. При этом необязательно приме-
нять водные растворы; для выращивания кристаллов соедине-
*) Это относится к практической стороне выращивания, а не к исследо-
ванию механизма процесса. Электрокристаллизации посвящена обширная
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
291
ний, реагирующих с водой или обладающих таким восстанови-
тельным потенциалом, что во время реакции возможно разложе-
ние воды, целесообразно использовать неводные среды. Наиболее
обычными соединениями, осаждаемыми в поликристаллическом
состоянии из водных растворов, служат металлы. Типичный
пример — медь, которая образуется согласно следующей реак-
ции, протекающей у катода:
Си волн + 2е~ —► Cu(S). (7.6)
Электрохимические реакции такого типа можно рассматривать
как особый случай роста при химической реакции с участием
электронов. Среди преимуществ, которыми они обладают по
сравнению с большинством других реакций кристаллизации в
водных растворах, можно назвать следующие:
1. «Концентрация» электронов легко контролируется зада-
нием определенной плотности тока на электроде, где происходит
осаждение.
2. Высокая «концентрация» электронов на электроде-затравке,
который и является той областью, где желателен рост.
3. Контролируя напряжение во время осаждения, можно про-
извести разделение и очистку.
4. Возможен непрерывный процесс с «растворением» у анода
и ростом у катода.
Если не считать требований, чтобы отсутствовало взаимодей-
ствие кристаллизуемого вещества с водой и чтобы напряжение
не разлагало воду, то основной недостаток метода состоит, по-
жалуй, в том, что для непрерывного роста в простейших схе-
мах потребуется, чтобы осаждаемый материал обладал элек-
тропроводностью.
Из сказанного ясно, что идеальными материалами для вы-
ращивания посредством электрохимических реакций были бы
металлы. Исследования свойств металлических кристаллов,
выращенных при температурах, столь далеких от температур их
плавления, дали бы много ценных сведений, и такие кристаллы
литература (см., в частности, работу [130]). Ряд важных результатов о ме-
ханизме кристаллизации получен К. М. Горбуновой, Ю. М. Полукаровым с
сотрудниками [131—137]. В последние годы в Болгарии Р. Каишеву и Е. Бу-
левскому с сотрудниками удалось именно этим методом впервые прямо за-
регистрировать образование элементарных двумерных зародышей на поверх-
ности бездислокационных кристаллов серебра в растворе AgNO3 и измерить
линейную энергию обрамляющих их ступеней (2,1-10"13 Дж/см) [138, 139].
Им же удалось измерить обменный ток на элементарной ступени
(~106 атом/с в расчете на один узел решетки) и, исследуя движение от-
дельной элементарной ступени, показать, что поверхностная диффузия для
электрокристаллизации в концентрированных растворах несущественна [140].—
Прим. ред.
292
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
легко было бы выращивать на монокристальной затравке
(электроде). Остается лишь удивляться, что, хотя этот метод
иногда и используется для изучения механизма электрохимиче-
ского осаждения, его почти совершенно игнорировали как метод
выращивания кристаллов *). Перлофф и Уолд [29] выращивали
кристаллы МоО2 электрохимическим восстановлением при
675 °C системы 1\а2МоО3-|-МоОз. Механизмы роста исследова-
лись, например, в работах [30—32].
7.3. ВЫРАЩИВАНИЕ В ГИДРОТЕРМАЛЬНЫХ УСЛОВИЯХ
Метод выращивания в гидротермальных условиях тесно при-
мыкает к методу выращивания из водных растворов при ком-
натной или близкой к комнатной температуре. Когда экспери-
менты по выращиванию кристаллов при комнатной температуре
не дают положительных результатов вследствие малой раство-
римости или из-за необратимой реакции исследуемого соедине-
ния с растворителем, естественно попытаться выращивать кри-
сталлы из раствора, используя растворитель большей раство-
ряющей силы или растворитель, не реагирующий необратимо
с выращиваемым соединением. Как мы видели выше, одно из
решений этой проблемы состоит в использовании при комнат-
ной температуре неводных растворителей. Ранее рассмотрено
еще одно возможное решение, заключающееся в подборе ком-
плексообразователя (минерализатора), образующего в растворе
дополнительные частицы (первоначально там не присутствовав-
шие) и увеличивающего за счет этого общую растворимость.
Введение минерализатора может быть очень эффективным при
условии, что образующиеся комплексы не являются устойчивой
твердой фазой. Третье решение этой проблемы — увеличить
растворимость исследуемого соединения, проводя процесс вы-
ращивания при температурах выше комнатной. При выращива-
нии в гидротермальных условиях и температура и давление
значительно выше нормальных и, как правило, применяются
минерализаторы, а растворителем обычно служит вода. Выра-
щивание кристаллов из растворов в расплавах солей (см.
разд. 7.4) характеризуется изменением растворителя, использова-
нием более высоких температур и применением минерализато-
ров. Обзоры по гидротермальному росту кристаллов и исполь-
зующемуся в этих условиях оборудованию имеются в литера-
туре [33—35, 154].
Первыми интерес к гидротермальному росту кристаллов
проявили геологи. Они установили, что в природе множество
9 Электрокристаллизация широко применяется для нанесения поликри-
сталлическцх покрытий. — Прим. ред.
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
293
минералов образовалось в водной среде при высоких темпера-
турах и давлениях, и пытались воспроизвести эти условия в
лаборатории, чтобы подтвердить теории генезиса минералов.
Первые эксперименты были посвящены изучению фазовых
равновесий между компонентами, входящими в минеральные
ассоциации. В таких экспериментах не пытались выращивать
кристаллы, так как при построении диаграмм состояния можно
обойтись микрокристаллами. Де Сенармон [36] и Специа [37]
первыми попытались получить макрокристаллы в системе
SiO2 — Н2О, в которой они вырастили монокристаллы а-кварца.
В связи с важным значением пьезоэлектрических элементов из
кварца гидротермальные системы, содержащие а-кварц, были
после этого достаточно подробно изучены, и значительная часть
наших сведений о гидротермальном синтезе кристаллов почерп-
нута из этих исследований.
Методика, применяемая при выращивании большинства кри-
сталлов, аналогична разработанной для кварца и состоит в сле-
дующем: довольно тонко измельченные кусочки а-кварца (ших-
та) помещают на дно сосуда-реактора, а в верхней части ре-
актора— зоне роста подвешивают соответствующим образом
ориентированные монокристальные затравочные пластинки
а-кварца. Определенную часть свободного объема реактора,
обычно равную 0,8 (степень заполнения 0,8), заполняют щелоч-
ным раствором, например, 0,50 М NaOH. Реактор помещают в
печь так, чтобы его большая ось была вертикальна, и нагре-
вают, причем нижнюю часть реактора, в которой происходит
растворение, нагревают изотермически до более высокой тем-
пературы, чем верхнюю часть —зону роста, в которой темпера-
тура также поддерживается постоянной. Внутри реактора ча-
сто предусматривают перфорированный металлический диск, на-
зываемый «перегородкой», отделяющий зону растворения от
зоны роста и способствующий локализации градиента Т.
При повышении температуры уровень раствора поднимается,
давление растет и в конце концов при некоторой температуре,
не превышающей критическую температуру воды (374°C), со-
суд целиком заполняется жидкой фазой1). Поэтому в случае
разбавленных растворов плотность растворителя приблизитель-
но равна степени заполнения. Давление определяется темпера-
турой, распределением температур и исходной степенью запол-
нения сосуда. При температуре в зоне растворения, равной
400 °C, и в зоне роста, равной 350 °C, и давлении ~200 МПа
4) Даже выше 374 °C система, вероятно, все еще остается жидкой, так
как критическая точка в системе SiO2—ИагО—НгО не была достигнута.
И даже в системах, находящихся выше критической точки, где среда, по оп-
ределению, газообразна, по своей плотности, растворяющей способности П
многим другим свойствам она более похожа на жидкость.
294
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
можно получить заметные скорости роста. При таких условиях
раствор насыщается при температуре, равной 400 °C, и за счет
конвекции переносится в зону роста, где растворимость меньше
и он оказывается пересыщенным. Затравочные пластинки с ос-
новными гранями (0001) растут со скоростью приблизительно
1 мм/сут в направлении (0001). Для гидротермального выра-
щивания кристаллов с использованием описанной выше аппа-
ратуры нужны следующие условия:
1. Необходимо подобрать растворитель, давление и темпе-
ратуру, при которых кристалл термодинамически устойчив и
достаточно растворим, чтобы получить нужные пересыщения,
обеспечивающие заметные скорости роста; при этом не должно
быть чрезмерно интенсивного зародышеобразования на стенках
или в объеме сосуда. Для веществ, кристаллизация которых
изучена к настоящему времени, обычно достаточна раствори-
мость в пределах 2—5%.
2. Необходимо обеспечить достаточно большое отношение
полной площади поверхности растворяемой шихты к полной
площади поверхности всех затравок с тем, чтобы растворение
не ограничивало скорости роста (обычно это отношение должно
быть равным примерно пяти).
3. Необходимо обеспечить достаточно большую величину
(др1дТ)р, т. е. температурного коэффициента плотности рас-
твора при его постоянной средней плотности, которая при Соот-
ветствующем температурном перепаде обеспечит столь интен-
сивную конвекцию раствора, что она не будет лимитировать
скорость роста.
4. Температурный коэффициент растворимости (ds/dT)$
должен иметь величину, которая при соответствующем темпе-
ратурном перепаде обеспечит получение нужных пересыще-
ний *).
5. Необходим реактор, способный без чрезмерной коррозии
выдерживать повышенные температуры и давления.
Таким образом, мы видим, что основные трудности при гид-
ротермальном выращивании кристаллов связаны:
1) с конструированием герметичных некорродируемых реак-
торов;
2) с прогнозированием растворяющей способности раствора
и скоростей роста;
4) Иногда в качестве шихты можно использовать метастабильную моди-
фикацию растворяемого соединения. В этом случае рост будет происходить
даже в отсутствие температурного перепада (метастабильная фаза имеет
более высокую растворимость, чем стабильная фаза), но рост прекратится,
когда шихта превратится на месте в стабильную фазу. В некоторых давних
(неудачных) попытках выращивания кварца в качестве шихты использовали
кварцевое стекло.
1. РОСТ КРИСТАЛЛОВ из жидких РАСТВОРОВ
295
3) с тем, что для выращивания кристаллов достаточно боль-
шого размера нужно много времени, причем за процессом ро-
ста невозможно наблюдать визуально1).
Оборудование
Ввиду того что технические требования к оборудованию
здесь не совсем обычны, имеет смысл несколько подробнее
остановиться на конструкции автоклава, [35]. На фиг. 7.8 при-
ведена схема установки для кристаллизации а-кварца. Авто-
клав представляет собой полый цилиндр из стали или спе-
циального высокотемпературного сплава, достаточно прочный,
чтобы выдерживать давления и температуры в намеченных
условиях эксперимента. Цилиндр обычно закрывают затвором,
в котором использован принцип «некомпенсированной площади»,
предложенный Бриджменом [38]. На фиг. 7.8 изображен так
называемый «модифицированный затвор Бриджмена», который,
как установлено, обычно удовлетворительно работает при дав-
лениях свыше 50 МПа. Давлениям ниже 60 МПа удовлетво-
ряют затворы с прокладками, типа изображенных на фиг. 7.9,
представляющие собой видоизменение конструкции, предложен-
ной Мори и Ниггли [39], и позволяющие использовать вкладыши
из благородных металлов.
В видоизмененном затворе Бриджмена давление, развиваю-
щееся в автоклаве, через поршень передается уплотнительным
поверхностям, которые первоначально имеют чрезвычайно ма-
лую площадь соприкосновения. В результате давление на уплот-
няющих поверхностях значительно превышает давление в со-
суде, так как наибольшая часть площади поршня не имеет под-
держки.
С возрастанием давления в автоклаве увеличивается, причем
гораздо быстрее, давление на уплотняющих поверхностях, и
поэтому на них происходит, как говорят, «самоуплотнение».
Из-за упругой деформации уплотнительного кольца первона-
чальная линия контакта, конечно, превращается в поверхность
контакта, но даже в предельном случае, когда обе уплотняю-
щие поверхности соприкасаются полностью, затвор остается
все еще самоуплотняющимся, так как он не поддерживается
всей поверхностью хвостовика поршня. Таким образом, дости-
жимые давления ограничиваются прочностью автоклава на
разрыв.
*) Для того чтобы наблюдать за процессом роста, использовали просве-
чивание гамма-лучами, но разрешающая способность при этом недостаточна,
а метод очень сложен. (Камера, позволяющая наблюдать за процессами роста
при Т « 200 °C и давлении Р ~ 30 МПа, создана в Институте кристалло-
графии АН СССР [141]. — Прим, ред.)
296
Р. ЛОДЙЗ. РОСТ МОНОКРИСТАЛЛОВ
В автоклаве, изображенном на фиг. 7.9, затвор не само-
уплотняющийся. Поскольку внутреннее давление не способст-
вует увеличению давления в уплотнении, отсутствует и избы-
ток давления в прокладке. В противовес изложенному выше
Хвостовик
—- плунжера
Установочный
’ винт
----Контргайка
Упорная
шайба
__Основная
гайка
----Корпус
Уплотняющее
кольцо
""— Плунжер
-—- Затравки
- Перегородка
Шихта
Фиг. 7.9. Автоклав Мори для вы-
ращивания кристаллов в гидротер-
мальных условиях.
Фиг. 7.8. Модифицированный
автоклав Бриджмена для выра-
щивания кристаллов в гидротер-
мальных условиях.
давление в прокладке создается за счет приложенного вращаю-
щего момента при закрывании сосуда, а поэтому при довольно
низких давлениях может произойти утечка, если давление в ав-
токлаве превысит давление в прокладке.
Чистота кристаллов, выращиваемых в гидротермальных ус-
ловиях, составляет особую проблему. С одной стороны, низка
температура роста и концентрация дополнительных компонентов
(минерализатора и нежелательных примесей, но не воды) в мно-
гокомпонентной системе. Это обеспечивает очень чистые усло-
вия роста. Однако активность воды высока, так что иногда в
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
297
выросшем кристалле оказываются примеси ионов Н+ и (ОН)~,
а также Н2О [40, 41]. Предварительная очистка вещества обычно
затруднена (в отличие от роста кристаллов из расплава, где
возможна зонная очистка). Проблемой является и взаимодей-
ствие с материалом сосуда. Из растворов NaOH кварц можно
выращивать в стальных автоклавах без вкладышей, так как при
этом образуется минерал акмит Na2O-Fe2O3-4SiO2, покрываю-
щий стенки защитной пленкой. Для большинства же других ве-
ществ требуются вкладыши из благородных металлов. Автокла-
вы типа Мори легко снабдить вкладышем, но, ввиду того что
затвор в них не самоуплотняющийся, они не используются при
давлениях, значительно превышающих 60 МПа, если не считать
автоклавов очень малого диаметра. Затворы Бриджмена из
благородных металлов не разработаны, и поэтому при высоких
давлениях в большинстве случаев выращивание проводят в труб-
ках из благородных металлов, помещенных в автоклавы без
вкладышей. Объем трубки подбирается, насколько это практи-
чески возможно, близким к объему сосуда, а пространство ме-
жду трубкой и сосудом заполняется до такой степени, чтобы
давление в исследуемых условиях уравновешивалось давлением
внутри трубки. Трубки заваривают дуговой сваркой и запол-
няют с помощью шприца через небольшое отверстие в верхней
части трубки, которое заваривается последним. При окончатель-
ном заваривании трубку обычно приходится охлаждать, чтобы
испарение раствора не мешало сварке. Вообще уравнение со-
стояния жидкости в трубке неизвестно, но большинство минера-
лизаторов и растворенных веществ понижают давление, так что
соответствующая такому же давлению степень заполнения для
чистой воды меньше, чем для раствора (в гидротермальном ме-
тоде широко используют данные Кеннеди [42] о зависимости
давление —объем — температура для чистой воды) 9- Таким
образом, давление раствора в трубке меньше давления, созда-
ваемого водой между трубкой и стенками автоклава при всех
температурах, не превышающих рабочую температуру. Наличие
в системе температурного градиента еще более усложняет об-
становку, но в большинстве случаев можно удовлетворительно
оценить эксперименты при уравновешенном давлении по средней
температуре. Выгоднее, чтобы разность объемов трубки и авто-
клава была мала [43], так как тогда достаточно лишь слегка де-
формировать трубку, чтобы сильно изменить давление. Такой
деформации, не вызывающей разрушения трубки, достаточно,
чтобы выровнять давление в трубке и давление между трубкой и
стенками автоклава.
4) См. также [142].
298
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Фазовые равновесия и растворимость
При систематическом подходе к гидротермальному синтезу
отдельных соединений нужно начинать с изучения фазовых рав-
новесий и растворимости. Можно, конечно, сразу приступать к
экспериментам по выращиванию, взяв описанные выше уста-
новки и выбрав соответствующие растворители и условия и на-
деясь на благоприятный исход, но, как показывает опыт, систе-
матический подход в конечном счете почти всегда приводит к
цели быстрее.
Сплющено
и сварено
Капсула
(Pt или Au)
Н20 или раствор
минерализатора
Порошок или
кристаллы
Фиг. 7.10. Автоклав Таттла [44].
Внутренний диаметр 6 мм, наружный диаметр 30 мм, длина 200 мм-
Фазовые равновесия и растворимости удобнее всего изучать,
пользуясь промышленным автоклавом Таттла с холодным затво-
ром. Такой автоклав показан на фиг. 7.10 вместе с капсулой из
благородного металла, в которой содержатся исследуемые веще-
ство и раствор. При изучении фазовых равновесий навески ком-
понент, которые нужно исследовать, вводят в капсулу, сделан-
ную из трубки благородного металла (Pt, Au или Ag) путем за-
плющивания и заваривания одного ее конца. Для сварки удо-
бен аппарат микродуговой сварки с заостренными графитовыми
электродами. Нужный объем исследуемого раствора (воды или
воды с соответствующим минерализатором) вводят в капсулу с
помощью микробюретки, соединенной с медицинской иглой, или
шприцем. Затем открытый конец капсулы з^плющивают и зава-
ривают. Для заплющивания конца капсулы удобно пользоваться
трехкулачковым патроном, таким, как в токарном станке, ибо
1. РОСТ кристаллов ИЗ ЖИДКИХ РАСТВОРОВ
299
он позволяет заплющивать часть трубки длиной меньше диа-
метра, а также дает возможность применять трубки диаметром,
более близким к внутреннему диаметру автоклава. Автоклав
закрывают и накачивают до нужного давления. Передающей дав-
ление жидкостью обычно служит вода, а насосом — мультипли-
катор с пневматическим приводом. Давление воздуха, подавае-
мого к мультипликатору, контролируют при помощи игольча-
того вентиля и таким образом устанавливают и поддерживают
постоянным давление воды. Затем автоклав нагревают до нуж-
ной температуры (при помощи трубчатой печи, которую можно
надвигать на автоклав) и выдерживают более длительное время,
чем нужно для установления равновесия. Затем температуру
снижают и автоклав охлаждают в потоке воздуха или закали-
вают в воде. Содержимое капсулы изучают рентгенографически,
под петрографическим микроскопом и другими способами. В ре-
зультате определяют устойчивую фазу в одной точке диаграммы
Р— Т — состав. Чтобы определить всю диаграмму состояния,
процесс повторяют. Если взвешенные монокристаллы или кри-
сталлы помещены в капсуле в условия, где данная фаза устой-
чива, а флюидная фаза представляет собой только жидкость или
только газ, то мерой растворимости будут служить потери веса.
Однако особое внимание нужно уделить тому, чтобы избежать
превышения заданной температуры в период нагревания, потери
вещества до взвешивания или взвешивания вещества, выпавшего
в осадок во время закаливания. Во многих системах раствори-
мость подчиняется уравнению Вант-Гоффа и линейно зависит от
плотности раствора [45, 34]. Тип присутствующих частиц часто
бывает возможно выяснить, учитывая отношение растворимости
к концентрации минерализатора [46, 41]!). Иногда температур-
ный коэффициент растворимости (ds!dT)p отрицателен (так на-
зываемая ретроградная растворимость), и тогда приходится вы-
ращивать кристаллы в условиях обратного температурного пе-
репада.
Кинетика, кварц
Исследование кинетики роста [47] и выращивание кристаллов
проводилось в автоклавах типа показанных на фиг. 7.8. Для
промышленного производства кварца [48] используют большие
автоклавы размером 300 X 25 см. Автоклав такого типа показан
на фиг. 7.11. При изучении скоростей роста за скорость роста
обычно принимают приращение толщины затравки, деленное на
1) В Советском Союзе проводятся широкие исследования фазовых рав-
новесий и растворимости в гидротермальных условиях; см., например, [143—
147]. — Прим. ред.
300
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
длительность эксперимента. Как показали исследования кварца,
основные факторы, влияющие на скорость роста, таковы:
1. Природа и концентрация минерализатора.
2. Степень заполнения автоклава при комнатной температуре
0 = ^. (7.7)
св
где Краств — объем раствора при комнатной температуре и
Усв — свободный объем автоклава, т. е.
Vo - S Vi’ (7.8)
где Vq — внутренний объем автоклава и 21Л — суммарный
объем всех твердых материалов в автоклаве (затравки, рамки,
Фиг. 7.11. Промышленный авто-
клав для выращивания кристал-
лов в гидротермальных условиях
и выращенные в нем кристаллы
кварца.
перегородки, шихты и т. д.). Про-
цент заполнения f равен
f = 100d. (7.9)
Величина d приблизительно рав-
на плотности, т. е. обратна удель-
ному объему раствора в области
существования одной жидкой
фазы.
3. Температура кристаллиза-
ции.
4. Разность температур (ДГ)
между зонами растворения и
кристаллизации.
5. Процент открытой площа-
ди в перегородке.
6. Ориентировка затравок.
7. Отношение площади по-
верхности растворения к площа-
ди растущей поверхности.
Как установлено при изуче-
нии кварца, взаимосвязь пере-
менных 1—7 описывается про-
стым уравнением скорости роста:
^hki = akhkl\s, (7.10)
где —скорость роста в опре-
деленном кристаллографическом
направлении, khM— константа скорости в этом направлении,
As — пересыщение и а — коэффициент, обеспечивающий нуж-
ную размерность. Хотя процесс можно описать простым урав-
нением для скорости, это не свидетельствует о простоте меха-
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
301
низма роста. Зависимость от переменных 1—7, описываемую
уравнением (7.10), довольно легко объяснить следующим обра-
зом:
1. Природой и концентрацией минерализатора определяется
пересыщение As. В растворах NaOH с концентрацией от 0,5
до 5 М минерализатор не оказывает влияния на khki- Для мине-
рализаторов же, отличающихся от (ОН)~, величина khki должна,
по-видимому, зависеть от типа минерализатора.
2. Степень заполнения влияет на положение и наклон кривой
растворимости и тем самым воздействует в основном на пересы-
щение As. В растворах NaOH с плотностью d от 0,65 до 0,87 сте-
пень заполнения влияет только на пересыщение As.
3. От температуры кристаллизации зависит khki. В растворах,
содержащих ионы (ОН)“ и (СОз)“, величина khki подчиняется
уравнению Аррениуса, как это можно видеть из фиг. 7.12. Энер-
гия активации, вычисленная на основании графика Аррениуса,—
порядка 20 ккал/моль (для разных направлений роста имеются
некоторые различия [47]). Это несколько больше, чем величина
АЕ для чисто диффузионного процесса.
4. Величина АТ влияет только на As. Как показано на
фиг. 7.13, величина Sthki линейно изменяется с АТ в пределах
области, где As линейно зависит от АТ.
5. При изменении процента открытой площади в перегородке
в пределах 2—50% скорость роста изменяется так, как пока-
зано на фиг. 7.14. Но когда исследовали влияние степени откры-
тия перегородки на температуру кристаллизации и на АТ путем
измерения внутренних температур с помощью термопар малой
теплоемкости, то нашли, что наблюдающиеся изменения скоро-
сти можно объяснить изменениями Т и АТ [47]. Это указывает
на то, что конвективная циркуляция раствора достаточно интен-
сивна и не лимитирует скорости роста. Площадь отверстий в пе-
регородке обычно составляет 5—10%, основная роль перего-
родки заключается в том, чтобы локализовать температурный
градиент так, чтобы зоны роста и растворения находились в
изотермических условиях. Тогда все кристаллы в зоне роста
растут с одной и той же скоростью и не происходит кристалли-
зации в зоне шихты.
6. Ориентация затравки оказывает большое влияние на ско-
рость роста (фиг. 7.15), воздействуя на khki, как и можно было
ожидать в случае таких нецентросимметричных кристаллов, как
кварц.
7. Скорость роста не зависит от отношения площади поверх-
ности растворения к площади растущей поверхности при условии,
что оно больше 5. Таким образом, когда поверхность растворе-
ния достаточно велика, скорость роста не лимитируется раство-
рением [47].
103/Т, К~'
Фиг. 7.12. График Аррениуса для роста кварца [47].
Раствор 0,5 М NaOH, степень заполнения 0,8, затравки (0001).
Фиг. 7.13. Зависимость скорости роста кварца от АГ [47].
Раствор 0,5 М NaOH, рост па грани пинакоида. Кривая 1 — при 347 °C; кривая 2—при 307 °C,
степень заполнения в обоих случаях равна 0,85.
Фиг. 7.14. Зависимость скорости роста кристаллов кварца от процента от-
крытой площади в перегородке [49].
Раствор 0,5 N NaOH, 350°С, ДТ « 27 °C, степень заполнения 0,8. Кривая / — верхний кристалл
в зоне роста; кривая 2 —нижний кристалл в зоне роста.
Фиг. 7.15. Зависимость скорости роста кристаллов кварца от ориентировки
затравки [33].
Раствор 0,5 М NaOH, степень заполнения 0,8, ~ 360 °C, ДТ«40°С.
304
Р. ЛОДИЗ. РОСТ монокристаллов
В заключение можно сказать, что наиболее очевидный вывод,
который можно сделать в результате исследования кварца и
менее детального исследования других кристаллов [50], таков:
лимитирующий скорость роста процесс включает в себя стадии,
протекающие у растущей поверхности, но так как реакция по-
следовательна, измеряемая скорость может определяться более
чем одной стадией процесса. Короче говоря, рост кварца и,
вероятно, все другие процессы гидротермального роста в отно-
шении своего механизма аналогичны росту из водных раство-
ров при нормальных условиях.
Совершенство кристаллов
Совершенство кристаллов, выращенных в гидротермальных
условиях, подробно не изучалось, но можно привести некоторые
имеющие общее значение результаты, полученные при выращива-
нии кварца. Во-первых, гидротермальное выращивание—идеаль-
ный метод получения низкотемпературных полиморфных моди-
фикаций. Если при высокой температуре устойчива нежелатель-
ная полиморфная модификация, то иногда можно, получив ее
одной из общепринятых методик выращивания (из расплава,
из газовой фазы, из раствора в расплаве и т. д.), прийти затем
к нужной фазе путем рекристаллизации в твердом состоянии.
Но, как мы видели в гл. 4, превращение в твердом состоянии ча-
сто приводит к образованию политипных модификаций, дефектов
упаковки, малоугловых границ зерен и к росту поликристал-
лов. При гидротермальном методе эти проблемы отпадают, по-
скольку непосредственно кристаллизуется нужная фаза. Так, для
а-кварца это наиболее совершенный метод получения. Однако
рост должен происходить при температуре ниже 573 °C, темпе-
ратуры перехода а-кварца в р-кварц. При выращивании в об-
ласти более высоких температур получают другие модификации,
такие, как кристобалит и тридимит.
Подобным же образом кубический ZnS с низкой плотностью
дефектов упаковки и без политипных модификаций легко обра-
зуется при гидротермальной кристаллизации [51] в условиях, да-
леких от превращения кубической модификации в гексагональ-
ную (при 1080 °C).
Правда, при выращивании в гидротермальных условиях в ка-
честве устойчивых фаз могут образоваться гидраты и оксогидро-
окиси. Например, сапфир (AI2O3) приходится выращивать при
температуре выше 400 °C, чтобы избежать образования диаспора
(АЮОН). Примеси иона водорода (протона), ОН и Н2О из
воды и (ОН)- из минерализаторов могут быть причиной дефек-
тов в соединениях, полученных в гидротермальных условиях.
3 гидротермальном кварце [40] и Y3Fe50i2 (иттрий-железистый
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
305
гранат, ИЖГ [52]) наблюдали сильную полосу поглощения при-
близительно в области 3 мкм, соответствующую частоте по-
лосы ОН. Концентрацию ионов Н+ можно уменьшить (Н+ рас-
полагается вблизи кислорода в решетке, приводя к увеличению
поглощения ОН), уяснив себе механизм компенсации заряда,
связанный с их внедрением. Например, в кварце ион водорода
в междоузлиях может компенсировать заряд:
1) ионов А13+, замещающих ионы Si4+ (Al — примесь в шихте
природного кварца);
2) ионов Na+, замещающих ионы Si4+ (Na+ входит из мине-
рализатора NaOH);
3) ионов Fe2+ или Fe3+, замещающих ионы Si4+ (Fe входит
из стального автоклава).
Таким образом, уменьшение в системе концентрации любого
из элементов, заряд которых компенсирует ион Н+, приведет и к
уменьшению концентрации ионов Н+ в кристалле. В промышлен-
ной технологии выращивания кварца было найдено более удоб-
ным вводить ион, прямо влияющий на коэффициент распреде-
ления ионов Н+. Таким ионом является Li+. В присутствии ионов
Li+ и особенно соединения LiNO2 концентрация ионов Н+ в
кварце уменьшается более чем в 5 раз [53]. Концентрация Li+
в кристалле более или менее постоянна (в пределах довольно
низкой точности анализа следов примесей), как и концентрации
других возможных компенсирующих зарядов ионов. Очевидно,
что IJNO2 адсорбируется на поверхности растущего кристалла,
не захватываясь самим кристаллом, и не пропускает ионы Н+
или (ОН)~. Поскольку акустические потери в материале про-
порциональны концентрации ионов Н+, а для пьезоэлектрических
применений требуется материал с малыми акустическими поте-
рями, выращивание в присутствии IJNO2 имеет важное практи-
ческое значение.
В случае ИЖГ заряд ионов Н+ компенсируется, по-видимому,
ионами Са2+ (примесь в минерализаторах КОН и NaOH и в
затравках, выращенных из раствора в расплаве) или ионами
Na+ (из минерализатора NaOH [52]). Концентрация ионов Не-
значительно уменьшается при выращивании из растворов КОН
и при высокой чистоте затравок. Ион Н+ увеличивает ширину
ферромагнитной резонансной линии в этом материале и приво-
дит к нежелательному поглощению в области длин волн лазер-
ного излучения, так что уменьшение концентрации такого иона
представляет значительный интерес.
На однородность выращенных в гидротермальных условиях
кристаллов влияют флуктуации скоростей роста, вызванные из-
менениями условий роста внутри автоклава. Например, в кварце
можно простым глазом увидеть периодические слои в кристал-
лах, активированных Fe. Слои параллельны растущей грани и
306
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
ность температур между дном
разность наряду с большим
Фиг. 7.16. Неоднородности в
гидротермальных кристаллах квар-
ца, выявленные рентгеновским об-
лучением.
расстояние между ними приблизительно соответствует росту в
течение суток. Такие флуктуации, вероятно, связаны с плохим
контролем температуры при изменении напряжения в течение
суток и с колебаниями температуры окружающего воздуха. Ин-
тересно, что при помощи термопар с малой теплоемкостью
можно обнаружить быстрые (секунды и минуты) и довольно
заметные (0,5—2°) колебания температуры в верхней части гид-
ротермальных реакторов, связанные с нерегулярной конвекцией.
Приводят ли такие флуктуации к неоднородностям меньшего
масштаба, пока неизвестно. В гидротермальных процессах
трудно подавить турбулентную конвекцию, так как для получе-
ния необходимого при росте пересыщения нужна большая раз-
и верхней частью автоклава. Эта
температурным коэффициентом
плотности раствора при постоян-
ном давлении (др/дТ)р для боль-
шинства гидротермальных рас-
творов приводит к быстрой кон-
векции. Эта конвекция обычно
нерегулярна и, по-видимому, ча-
сто носит турбулентный характер.
Она убыстряет рост по сравне-
нию с большинством многоком-
понентных систем, но не способ-
ствует очень однородному ро-
сту.
На фиг. 7.16 показаны неод-
нородности в гидротермальном
кварце, облученном рентгенов-
скими лучами. Полосы обуслов-
лены изменением концентрации ионов А13+ и Na+. Ионы Al-f-Na
приводят к образованию центров окраски, которые выявляются
при облучении рентгеновскими лучами (аналогично дымчатому
кварцу).
И в природном и в синтетическом кварце наблюдались ямки
травления, связанные с выходом дислокаций или с примесными
включениями трубчатого типа [54].
Выращивание других соединений
Кроме кварца, гидротермальным методом выращено множе-
ство других соединений. В табл. 7.3 указан ряд кристаллов, по-
лученных таким методом.
1. Сапфир. Вторым после кварца материалом, кристаллы
которого в гидротермальных условиях оказалось возможным в$-
1. POGT КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
307
Таблица 7.3
Некоторые кристаллы, выращенные в гидротермальных условиях
Соединение Растворитель Температура кристаллизации, °C АТ, °C Заполне- ние, Скорость роста, мм/сут Литера- тура
SiO2 1 М NaOH 380 50 82 2 [48]
А12О3 1 м к2со3 490 50 80 0,25 [55]
ZnO 5М КОН 350 10 85 0,25 [50]
¥зРеБО12 20 М КОН 350 10 88 0,125 [52]
YbFeO3 20 М КОН 350 10 88 0,125 [56]
ZnS 5 М NaOH 350 10 85 0,05 [51, 57]
6
5
4
3
г
I
съ
ч
102
8
6
5
Ь
3
г
ю
1 1
i 1 I _1
9 - 1 1 1 1 i 4 °
1 1 1 1 1 1 X ।
1 Io о 1 о 1 о
Гиб б сип ' А1(0Н)3 7_ Бемит ALOOH Диаспор ’ АЮ0Н 7_ Лк унд г°з
О 100 200 300 400 500 600
Температура, °C
Фиг. 7.17. Диаграмма состояния системы А12О3 — Н2О [55].
Штриховые участки кривых получены экстраполяцией. Кружки —кристаллы корунда,
крестики —кристаллы диаспора (то и другое в растворе Na2CO3).
растить практически любых размеров, был а-корунд (А12О3,
сапфир [55]). Известная и ранее диаграмма состояния системы
А12О3—Н2О (фиг. 7.17) в некоторой своей части была повтор-
но исследована в присутствии минерализатора NaOH. Исследо-
вания показали, что выращивание корунда нужно производить
308
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
при температурах выше 400°C, так как реакция
AI2O3 (тв> корунд) + Н2О < * 2А1ООН(тв. диаспор)
(7.Н)
смещена вправо ниже приблизительно 400 °C. Можно предполо-
жить, что при увеличении давления воды температура дегидра-
тации А12О3 возрастает. В присутствии щелочных минерализа-
торов фазовая граница изменяется незначительно. В более позд-
них работах по изучению растворимости [45] показано, что из-за
о I___I___I___I---!---1---1--!——-----!----’
иго UUO U60 U80 500 520 540 560 580 600 620
Температура, °C
Фиг. 7.18. Растворимость сапфира в растворе 3,4 М Na2CO3 при давле-
нии ~ 1,4 • 108 Па [45].
малых растворимостей невозможно осуществить выращивание в
чистой воде и рост будет очень медленным в растворах, содер-
жащих ионы (ОН)-, так как наклон кривой растворимости в
растворах с ионами (ОН)" дает возможность создать значи-
тельные пересыщения As лишь при больших значениях ДГ, при
которых температура в зоне растворения будет нереально вы-
сокой. Результаты изучения растворимости показали также, что
проведенные ранее синтезы кристаллов в растворах с минера-
лизаторами в виде ионов (СО3)2" (фиг. 7.18) были успешными
потому, что кривая растворимости имеет достаточно большой на-
клон, обеспечивающий при средних значениях ДГ получение
нужных для роста пересыщений. Поскольку необходимы инерт-
ные условия, приходится использовать вкладыши или ампулы
из благородного металла (обычно Ag). Кристаллы рубина можно
вырастить в присутствии в растворе растворимых солей хрома.
В первых работах использовали бихромат-ион. Очень крупные
Фиг. 7.19. Кристаллы рубина, выращенные в гидротермальных условиях.
310
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
по масштабу исследования по росту сапфира с большим успехом
были проведены Р. Р. Моншампом, Р. С. Патбахом и
Дж. В. Нилсеном [68]. На фиг. 7.19 показаны кристаллы, выра-
щенные в их лаборатории. Некоторые трудности вызывает обра-
зование в выращенных кристаллах пузырьков и свилей.
В табл. 7.3 указаны конкретные условия роста кристаллов.
2. Иттрий-железистый гранат. Иттрий-железистый гранат
Y3Fe50i2 (ИЖГ) обычно выращивают из расплава (см. разд. 7.4),
но гидротермальный способ дает некоторые преимущества.
В этом случае легче контролировать рост на затравку и он про-
исходит при более низкой температуре (которая не способствует
образованию Fe2+), чем рост из раствора в расплаве. Исследо-
вана диаграмма состояния системы Ре20з— У20з— Н2О в при-
сутствии различных минерализаторов и определены некоторые
условия конгруэнтного насыщения растворов [59]. Выращивание
значительно упрощается, если отношение Ре20з/У20з в растворе
в условиях кристаллизации ИЖГ, как и в твердом соединении,
равно 5/3. Сравнительно легко можно вырастить большие высо-
кокачественные кристаллы граната, магнитные характеристики
которых и пропускание в инфракрасной области соответствуют
лучшим образцам гранатов, выращенных из раствора в рас-
плаве (о совершенстве кристаллов ИЖГ см. выше). Условия
роста приведены в табл. 7.3.
3. Окись цинка. Простой метод выращивания кристаллов
ZnO — кристаллизация из газовой фазы, но таким методом
обычно получают лишь небольшие вытянутые по оси с иголки
или ориентированные по оси а пластинки. Контролируемый же
рост больших кристаллов осуществить трудно. При выращива-
нии из раствора в расплаве получают тонкие пластинки, огра-
ненные плоскостями (0001) — (0001). Самые большие кристал-
лы ZnO были получены гидротермальным методом [50, 60].
Была определена диаграмма состояния ZnO — Н2О и показано,
что она не меняется в присутствии ионов (ОН)" [51]. Исследо-
вана растворимость ZnO в растворах с различными минерали-
заторами [61] и из растворов NaOH, КОН и NH4C1 выращены
кристаллы ZnO. Наиболее совершенные кристаллы получены в
растворах КОН [62]. Присутствие ионов Li+ подавляет дендрит-
ный рост на гранях (0001) — (0001). Очевидно, катион адсорби-
руется на гранях (0001) и (0001), уменьшая их удельную сво-
бодную поверхностную энергию таким образом, что на диа-
грамме Вульфа в направлениях (0001) и (0001) появляются вы-
ступы, а не впадины, присутствующие, когда нет ионов Li+ [63].
Кристаллы ZnO обычно растут с избытком Zn в междоузлиях и
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
311
поэтому оказываются полупроводниками n-типа. Ион Li+ ведет
себя как акцептор; следовательно, меняя концентрацию ионов
Li+ в растворе, где идет рост, можно изменять и концентрацию
их в выросшем кристалле в пределах от 10~6 до 2-10-5. При
этом удельное сопротивление кристаллов изменяется от 1,5 до
109 Ом-см. Пьезоэлектрические свойства кристаллов ZnO, вы-
ращенных в гидротермальных условиях, такие же, как и у кри-
сталлов, полученных из газовой фазы [63, 52]. Условия выращи-
вания указаны в табл. 7.3.
7.4. ВЫРАЩИВАНИЕ КРИСТАЛЛОВ
ИЗ РАСТВОРОВ В РАСПЛАВАХ СОЛЕЙ
Наиболее широко распространенным методом выращивания
в многокомпонентных системах является, по-видимому, кри-
сталлизация из растворов в расплавах солей, ибо если как сле-
дует поискать, то почти всегда можно подобрать для данного
кристалла растворитель в виде расплавленной неорганической
соли. По вопросам выращивания кристаллов методом из рас-
твора в расплаве имеются обзоры [49, 64]. При выращивании
кристаллов в расплавленных неорганических солях, флюсах или
расплавленных металлах используют высокую растворимость
кристаллов тугоплавких соединений в неорганических солях и
окислах при температурах, превышающих температуру плавле-
ния последних. В число обычных растворителей, используемых
в виде расплавленных солей, входят KF, PbO, В2О3 и их смеси.
Обычно поступают так: компоненты в количестве, достаточном
для образования кристалла, растворяют при температуре, не-
сколько превышающей температуру насыщения, а затем тигель
(обычно из платины) медленно охлаждают. Рост происходит на
спонтанно образовавшихся зародышах. Когда соответствующий
цикл охлаждения завершен, иногда оказывается возможным
вынуть тигель из печи, слить избыток расплава и механическим
путем извлечь полученные кристаллы. Но чаще приходится от-
делять (выщелачиванием) затвердевший расплав от образовав-
шихся кристаллов с помощью растворяющего расплав и не дей-
ствующего на кристаллы растворителя. В качестве таких раство-
рителей часто пользуются сильными неорганическими кислотами.
Ясно, что выращивание кристаллов на затравках значительно
расширит возможности и повысит ценность метода выращивания
из раствора в расплаве, но до сих пор все исследования по
росту, за малым исключением [65, 129], проводились в отсут-
ствие специально введенных затравок.
Впервые выращивать кристаллы из растворов в расплавах
солей начали французские и немецкие химики приблизительно
в конце прошлого столетия (см., например, [66]). Эти первые
312
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
работы были стимулированы возможностями тогда только что
появившихся электрических печей, но дальнейшие исследования
носили случайный характер, пока не возникла потребность в кри-
сталлах тугоплавких соединений, заставившая в 1950 г. неко-
торых исследователей, в частности Ремейку [67], вновь обра-
титься к этому методу. Ремейка вырастил кристаллы ВаТЮ3
из расплава KF, и после того метод использовали для получения
монокристаллов нескольких сотен соединений, представляющих
интерес для науки и техники. Основные преимущества и недо-
статки метода связаны с ростом в многокомпонентных систе-
мах. Особенно трудно может оказаться контролировать при-
меси, если компоненты расплава растворимы в растущем кри-
сталле. Кроме того, расплавленные соли часто более вязкие,
чем большинство растворителей, поэтому могут возникнуть
большие трудности, связанные с диффузией.
Оборудование
При выращивании из растворов в расплавах солей необхо-
димы платиновые тигли. Для изучения растворимости, фазо-
вых равновесий и для небольших по масштабу опытов по выра-
щиванию кристаллов пригодны платиновые тигли емкостью
150 см3. При выращивании же, например, больших кристаллов
гранатов применяют тигли емкостью до нескольких литров. Осо-
бенности работы с платиной подробно рассмотрены в книге
Уилсона [68]. Особенно важно избежать восстановительных ус-
ловий в присутствии таких катионов, как Bi3+ и РЬ2+. Дело в
том, что при восстановлении таких катионов до соответствующих
металлов происходит сплавление последних с платиной и в ре-
зультате образуются сплавы, имеющие низкую температуру
плавления, что приводит к разрушению платинового тигля.
Большинство работ по выращиванию кристаллов из раствора
в расплаве проводилось при температурах ниже ~ 1300 °C, так
что возможность расплавления платины была исключена. При
более высоких температурах можно, конечно, использовать тигли
из Rh или 1г.
Для нагревания обычно применяют обыкновенные муфель-
ные печи сопротивления. С нагревателем из SiC такие печи ис-
пользуют до температур ~ 1400 °C. С помощью регуляторов
типа «включено—выключено» или пропорциональных регулято-
ров температура поддерживается с точностью ±2°. Как пра-
вило, такая точность вполне достаточна. При необходимости же
более точного контроля температуры применяют трансформа-
торы с насыщающимися сердечниками или более сложные регу-
ляторы. Описание печей и регуляторов можно найти в книге
[69]. Ясно, что устанавливать скорость охлаждения, меньшую чем
Фиг. 7.20. Схема небольшой печи для выращивания кристаллов из раствора
в расплаве.
Фиг. 7.21. Печь для промышленного выращивания кристаллов из раствора
в расплаве. -
314
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
скорость изменения температуры за счет неточного регулирова-
ния, бесполезно. Например, когда в течение часа температура
меняется в пределах ±2°, не имеет смысла задавать скорость
охлаждения, равную 0,5°/ч. В том случае, когда необходимо
определенное распределение температуры в печи, используют
керамическую трубу с намотанным на нее нагревателем из кан-
таловой проволоки или из другого подобного сплава с высоким
сопротивлением (пригодны также Pt и сплавы Pt—Rh и Pt—Ir).
Сделав несколько выводов в разных точках обмотки печи, можно
менять температурный градиент. Если растворитель летуч, то
тигель необходимо снабдить платиновой крышкой, которая при-
варивается к нему или закатывается по краям. Чтобы ускорить
установление равновесия и выровнять радиальную неоднород-
ность температурного поля, во время роста часто применяют
вращение тигля. Установки для выращивания кристаллов из
раствора в расплаве показаны на фиг. 7.20 и 7.21.
Фазовые равновесия и растворимость
Самое трудное при выращивании кристаллов из растворов в
расплавах — выбрать хороший растворитель. К растворителю
предъявляются следующие требования:
1. В условиях роста растворяемое вещество должно быть
устойчивой твердой фазой.
2. Растворимость должна быть в пределах 10—50%.
3. Необходим заметный температурный коэффициент раство-
римости (~1 вес. %/10°), чтобы можно было медленно охлаж-
дать расплав (при выращивании в изотермических условиях с
температурным градиентом, а также при выращивании за счет
испарения расплава это требование имеет меньшее значение).
4. Летучесть должна быть мала (это требование отпадает
при использовании закрытых или заваренных тиглей).
5. Растворитель не должен взаимодействовать с платиной
(это требование отпадает при использовании других материалов
для тиглей, но материалов, пригодных для этой цели, очень
мало).
6. Растворитель должен обладать низкой растворимостью в
выращиваемых кристаллах (растворитель меньше загрязняет
кристаллы, если у кристалла и растворителя имеется общий
ион).
7. Должен обеспечиваться «хороший» рост кристаллов при
приемлемых скоростях кристаллизации (форма границы роста,
скорость роста и т. д. обычно зависят от растворителя). Осо-
бенно важное значение здесь имеет малая вязкость.
При выборе растворителя часто оказываются полезными
общие сведения из химии, например такие:
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
315
1. Кислотные окислы должны быть хорошими растворите-
лями для кристаллов основных окислов (и наоборот), если толь-
ко образующиеся соли не являются устойчивыми твердыми фа-
зами в условиях роста.
2. Комплексообразователи должны быть хорошими раство-
рителями, если только образующиеся соединения не представ-
ляют собой устойчивых твердых фаз.
3. Снижению вязкости расплава могут способствовать ка-
тионы, разрывающие молекулярные цепочки.
В выборе растворителя обычно руководствуются интуицией и
аналогиями с известными системами. В этом отношении осо-
бенно полезна статья [70], где собраны данные исследований
фазовых равновесий. Анализ типа диаграмм состояния, наибо-
лее подходящих для выращивания кристаллов, проводится в
книге [49].
Вопрос определения диаграмм состояния достаточно широко
освещен в литературе [70], так что здесь можно на этом не оста-
навливаться. Предварительные сведения о зависимости темпе-
ратуры плавления от состава часто можно получить с помощью
высокотемпературного микроскопа, а более точные измерения
проводят путем дифференциального термического анализа. Мно-
гие диаграммы состояния были определены исследованием за-
каленных расплавов. Растворимости иногда можно определять,
просто измеряя вес, теряемый образцом. Общих и систематиче-
ских исследований растворимости довольно мало. Можно ука-
зать работу [71], посвященную вопросу о влиянии кислотности
расплава на растворимость циркона и фенакита.
Рост кристаллов при медленном охлаждении раствора;
типичные примеры
1. Гранат. Исследованию кристаллизации иттрий-желези-
стого граната (ИЖГ) посвящено, вероятно, больше работ, чем
любым другим кристаллам, выращиваемым методом раствора в
расплаве. Ферромагнитные свойства Y3Fe50i2 открыли Берто и
Форра [72] и Геллер и Гиллео [73], а потребность в монокри-
сталлах этого соединения и изоморфных ему структур стимули-
ровала развитие исследований по росту кристаллов в лабора-
ториях всего мира. Как и во всех случаях при выращивании из
раствора в расплаве, прежде всего нужно знать соответствую-
щую диаграмму состояния. Диаграмму состояния системы
Ре2О3 — Y2O3 впервые исследовали Нильсен и Дирборн [74].
Строго говоря, из-за реакции восстановления
3Fe?O3 -> 2Fe3O4 + } О2 (7.12)
316
Р. ЛОДИЗ. РОСТ монокристаллов
систему нужно рассматривать как систему трех компонент:
Fe2O3, Fe3O4 и YFeO3.
Ван Хук [75] исследовал такую систему в кислородной среде
при некоторых давлениях и показал, что качественно верна
модель тройной системы, представленная на фиг. 7.22. Линия пе-
ресечения изобары кислорода 2-104 Па с поверхностями ликви-
находящихся в равновесии
с разными кристалличес-
дуса определяет составы расплавов,
Fe203
Фиг. 7.22. Пространственная модель диа
граммы состояния ИЖГ [75].
кими фазами в воздуш-
ной среде. Следует ука-
зать, что, хотя проекции
каждого из трех отрезков
Л'Л, АВ и ВВ' в системе
Fe3O4—Fe2O3—YFeO3 пря-
молинейны, сама линия
А'АВВ' не является пря-
мой. На фиг. 7.23 пред-
ставлено сечение трех-
мерной диаграммы по
указанной изобаре в том
виде, как ее определил
Ван Хук. Она имеет вид
бинарной диаграммы с
«эвтектикой» в точке Л и
«перитектикой» в точке
В. Точки «эвтектики» и
«перитектики» в действи-
тельности представляют
собой места пересечения
изобары воздушной сре-
ды с инвариантными гра-
ничными кривыми трой-
ной системы. Ван Хук
определил изобару для давления О2, равного 105 Па, и «изо-
бару» для давления О2, соответствующего равновесию с СО2.
Это исследование фазового равновесия показывает, что гра-
нат плавится инконгруэнтно при 1555 °C и оказывается устой-
чивой фазой только в области Л—В фиг. 7.23. Составы, соот-
ветствующие точкам Л и В на фиг. 7.23, являются исходными со-
ставами; истинные составы этих расплавов, несомненно, харак-
теризуются недостатком кислорода, как и выросшие кристаллы
граната. Следовательно, концентрация ионов Fe2+ в выросших
кристаллах граната должна зависеть от температуры и давле-
ния О2. Ввиду инконгруэнтного плавления и проблем, связанных
с восстановлением, уже давно установлено, что метод выращива-
ния из раствора в расплаве при более низких температурах —
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
317
наиболее подходящий метод выращивания кристаллов грана-
тов. В своих первых экспериментах Нильсен и Дирборн [74] в
качестве растворителя использовали расплавленную окись свин-
ца РЬО. ИЖГ насыщает РЬО при температурах от 1350 до 950 °C
инконгруэнтно, но при
Ре2Оз/У2О3 > 5/3 (отноше-
ние концентраций окис-
лов ИЖГ) он может кри-
сталлизоваться. Лучшие
кристаллы ИЖГ выра-
щены при отношении
Ре20з/¥20з « 12,6. Оки-
сел РЬО очень летуч, и
при большом избытке
Ре20з первичными выде-
ляющимися в виде осад-
ка фазами являются
Fe2O3 и PbFei20i9 (магни-
топлюмбит), который пре-
пятствует росту ИЖГ у
поверхности. Таким обра-
зом, ИЖГ зарождается и
растет ниже поверхности
в условиях очень малых
пересыщений, образуя
при этом кристаллы луч-
шего качества и больше-
го размера. Закатанные
по краям платиновые
крышки у тиглей препят-
ствуют испарению (луч-
ше даже приваривать
1680
1660
1640
1620
1600
1580
1560
1540
1520
1500
1480
1460
1440
1420
1400
1380
1360
1 Л
Г Магнетит + гранат
Орто-
ферршп+
гранат
1387° ±3°
Ггматит * гранат
-J__।__। । ।
п 0 5 10 15 20 25 30 35 40 45 50
Окись железа Y3Fe50l2 YFe03
Мольное содержание Y2 0$, %
Фиг. 7.23. Диаграмма состояния ИЖГ
[75].
крышки, но сварка не
всегда применяется). Температура не должна намного превы-
шать 1350 °C, так как выше этой температуры становится за-
метной реакция
РЬО — РЫ-уО2
(7.13)
и образующийся РЬ сплавляется с Pt, что приводит к разруше-
нию тигля. Для увеличения срока службы нагревателя из SiC
предпочтительнее работать при температурах ниже 1250 °C.
В ранних работах по ИЖГ практиковали резкое охлаждение
расплавов от температуры, близкой к 900 °C, до комнатной. За-
тем кристаллы отделяли от основной массы расплава вы-
щелачиванием в HNO3. Далее разделение фаз осуществляли
318
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
магнитным методом при температурах выше и ниже соответ-
ствующих температур Кюри.
Окись свинца отнюдь не идеальный растворитель при выра-
щивании граната. Нильсен [76] изменил состав растворителя
РЬО, добавив к нему 57 мольных % PbF2. Это уменьшило вяз-
кость расплава, увеличило растворимость ИЖГ, исключило
магнитоплюмбит как соосаждаемую фазу и дало возможность
проводить выращивание при более низких температурах. Од-
нако гранат все еще насыщал раствор инконгруэнтно, а высокая
летучесть PbF2 создавала экспериментальные трудности. Ли-
нарес [77] установил, что гранат конгруэнтно насыщает раство-
ритель состава ВаО — 0,6 В2О3. Дополнительные преимущества
этого растворителя состоят в малой упругости пара в исследуе-
мой системе, в большей плотности кристаллов ИЖГ, чем рас-
творителя (в связи с чем рост чаще происходит под поверх-
ностью), растворитель не содержит РЬ2+, так что исключена
опасность образования вредных паров свинца и восстановления
РЬ2+ до металлического свинца. Ван Ютерт с сотрудниками [78]
в своих экспериментах с большим успехом использовали раство-
ритель состава РЬО — PbF2 — В2О3. Они нашли, что небольшие
добавки таких двухвалентных положительно заряженных ка-
тионов, как Са2+, уменьшают число образующихся зародышей и
увеличивают размеры выращиваемых кристаллов. Для выращи-
вания больших кристаллов граната используется шихта следую-
щего примерного состава:
Y2O3 - 1694 г
Fe2O3 — 2397 г
СаО - 4 г
РЬО- 6021 г
PbF2 - 4926 г
В2О3 — 279 г
Кристаллы гранатов выращивают из шихты вышеуказанного
состава в интервале температур 1300—950 °C, используя метод
медленного охлаждения (скорость охлаждения ~0,5°/ч). Ниже
950 °C гранат заметно растворяется, а поэтому при достижении
этой температуры расплав выливают из тигля через отверстие,
которое проделывают в тонкой платиновой диафрагме, вварен-
ной в стенку тигля, используя при этом печь, подобную изобра-
женной на фиг. 7.21. Чтобы в образовавшихся кристаллах гра-
ната не возникали термические напряжения, кристаллы затем
охлаждают in situ. Полезно применять вращение тигля в печи,
так как при этом ускоряется процесс растворения в период
установления равновесия и выравнивается асимметрия тепло-
вого поля во время роста. Небольшой отрицательный перепад
7. РОСТ кристаллов из жидких РАСТВОРОВ
319
температуры (~2,5°), установленный так, чтобы дно тигля было
самым холодным, способствует локализации роста и увеличе-
нию размеров кристаллов. Обычно используют тигли с разме-
рами 200X250 мм и толщиной стенок 1,5 мм. Ток кислорода
через печь охлаждает выпускную трубку, удаляет из печи пары
свинца, создает отрицательный градиент температуры и препят-
ствует восстановлению РЬ2+. Типичные кристаллы, выращенные
этим методом, показаны на фиг. 7.24.
Фиг. 7.24. Кристаллы ИЖГ, выращенные из раствора в расплаве в пла-
тиновом тигле.
Подобные же результаты получили при выращивании иттрий-
алюминиевого граната (ИАГ), активированного Nd(Y3Al50i2:
: Nd), используя шихту следующего состава:
Y2O3 - 720 г
А12О3 - 1220 г
Nd2O3 - 253 г
РЬО - 3556 г
PbF2 - 4346 г
В2О3 — 279 г
Совершенство кристаллов, выращенных из растворов в рас-
плавах солей, очень подробно не изучалось. В сравнительно
вязких многокомпонентных расплавах, где процессы диффузии
затруднены и где легко может произойти концентрационное пе-
реохлаждение расплава, кристаллы обычно содержат включения
320
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
расплава, имеет место дендритный рост, появляются воронкооб-
разные формы роста и наблюдается слоистый рост. Как прави-
ло, в наиболее широко используемых методах кристаллизации
не наблюдается больших температурных градиентов вблизи
растущей поверхности, которые могли бы уменьшить концентра-
ционное переохлаждение. Включения расплава (часто парал-
лельные растущим граням) обычны для кристаллов ИЖГ и
ИАГ. Материал наивысшего качества обычно образуется на по-
следних стадиях процесса охлаждения, когда большие поверх-
ности растущих граней способствуют уменьшению пересыщения.
Неоднородный цикл охлаждения, с очень медленным охлажде-
нием в начале процесса, направленным на уменьшение пересы-
щения, в период, когда площадь поверхности роста еще очень
мала, должен повысить совершенство кристаллов. Меньшие ско-
рости охлаждения в начале процесса будут также уменьшать
число зародышей и тем самым увеличивать средний размер рас-
тущих кристаллов. Для уменьшения числа присутствующих за-
родышей может оказаться полезным температурное циклирова-
ние (см. разд. 6.4) с чередованием роста и растворения, так как
в период нагревания небольшие зародыши полностью раство-
ряются. В результате образуется больше крупных кристаллов.
Железо в окисленном состоянии, отличающемся от Fe3+,
сильно ухудшает магнитные свойства ИЖГ и его пропускание
в области 1,14 мкм [79]. В выращиваемых кристаллах на оки-
сленное состояние железа могут оказать влияние примеси, ком-
пенсирующие заряд. Двухвалентные положительно заряженные
примеси увеличивают коэффициент распределения Fe4+:
Са(распл) “Г Г^(распл) Са(Полож Fe) “F Г^(полож Fe), (7.14)
тогда как четырехвалентные положительно заряженные примеси
увеличивают коэффициент распределения Fe2+:
Si(paciM) “F Р'^(распл) 31(Полож Fe) “F Р^полож Fe)« (7.15)
Вуд и Ремейка [79] исследовали эти реакции, используя погло-
щение света в области 1,14 мкм, которое, как было показано,
пропорционально концентрации ионов железа с валентностью,
не равной трем. Ионы Са2+ и Si4+—обычные примеси, попадаю-
щие в кристаллы из исходного реактива и из футеровки му-
фельной печи. Показано, что, как и должно быть, гранат, акти-
вированный Са2+, имеет p-тип проводимости, тогда как гранат,
активированный Si, — n-типа. Получающиеся кристаллы граната
характеризуются самыми малыми значениями проводимости, са-
мыми высокими значениями оптического пропускания и самыми
низкими величинами ферромагнитного резонанса, когда на одну
молекулу УзРе5О12 приходится 0,006 атомов Si4+. Таким обра-
Т. РОСТ кристаллов ИЗ ЖИДКИХ РАСТВОРОВ
321
зом, ионы Si4+, очевидно, компенсируют ионы Fe4+, образую-
щиеся за счет реакции с не поддающимися контролю следами
Са2+ или за счет каких-либо других процессов.
2. Титанат бария. Метатитанат бария д виде его кубической
модификации известен с 1942 г. [80] как интересный диэлектри-
ческий материал1)- Потребность в больших кристаллах куби-
ческой модификации этого соединения для исследований се-
гнетоэлектричества послужила стимулом в развитии работ по
выращиванию таких кристаллов. Согласно Мертцу [81], соот-
ветствующие фазовые превращения таковы:
Жидкость (конгруэнтное плавление)
гексагональная (несегнетоэлектрическая) фаза !--60 °с>
кубическая типа перовскита (несегнетоэлектрическая)
, 120 °C
фаза ------>
тетрагональная (сегнетоэлектрическая) фаза --°-с >
орторомбическая (сегнетоэлектрическая) фаза ~8-° с->
ромбоэдрическая (сегнетоэлектрическая) фаза.
Превращение гексагональной фазы в кубическую сопровож-
дается деформацией, образованием двойников и поликристал-
лов; поэтому для выращивания желательно использовать
метод, который позволял бы прямо получать кристаллы кубиче-
ской модификации. Рейз и Рой [82] определили соответствую-
щую область диаграммы состояния ВаО—ТЮ2 (фиг. 7.25) и по-
казали, что температура перехода кубической модификации в
гексагональную снижается при добавлении TiO2 и что куби-
ческая фаза ВаТЮз является равновесной фазой в области
концентраций TiO2 от 55 до 69%. Линц (см. разд. 5.4) получил
кубическую модификацию BaTiO3 методом вытягивания из рас-
плава, содержащего около 5% избытка TiO2 относительно со-
става, отвечающего стехиометрии BaTiO3. Однако большинство
ранних работ по BaTiO3 выполнено на кристаллах, полученных
по методу Ремейки [67] из раствора в расплаве KF. Применяли
другие растворители, в том числе ВаС12 и BaF2, но KF ока-
зался лучше, так как, во-первых, он не очень сильно взаимо-
действует с Pt; во-вторых, плотность Ba'TiO3 больше плотности
KF, а поэтому затруднено зарождение кристаллов у поверх-
ности раздела воздух — расплав, и, в-третьих, KF легко выще-
лачивается водой. По стандартной методике Ремейки, расплав
KF, содержащий 30 вес.% BaTiO3 — 70 вес. % KF, в течение
8 ч нагревают в тигле с герметично закатанной крышкой от
1150 до 1200 °C. Затем печь сравнительно быстро (20—50°С/ч)
<) См. также [148, 149]. — Прим. ред.
322
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
охлаждают до температур 900—1000 °C. Расплав декантируют,
а кристаллы охлаждают до комнатной температуры в отжиго-
вой печи со скоростью 10—50°/ч. Их механическим путем отде-
ляют от расплава и затем промывают горячей водой. Типичный
'1600 Л
Жидкость
(ВаТЮ3)гекс
^жидкость
1618
В
BciTtgO^ +
-(ВаТ103)ку6
Тл/7-д(ВаТЮ3) гекс
Те./7-/7 (ВаТЮ3) гекс
1 То. /7-/7 (ВаТЮ3)
куб + жидкость
1322
(ВаТ103)куб-
' жидкость
1563
ВаП20^ +
-(ВаТЮ3)гекс
1460
Те. р-р (ВаТ103)куб +
BclT1205
1210
габитус двойника-«бабоч-
ки» показан на фиг. 7.26.
Нильсен и др. [83] ус-
тановили, что двойники
могут образовываться при
разных условиях и из раз-
ных растворителей, если
1800
1700
1600
I
| 1500
1
1400
1300
1200
40 50 60 70
BclTlOj
Мольное содержание Т102, 7*
Фиг. 7»26. Габитус кристал-
лов BaTiO3 [83].
Фиг. 7.25. Диаграмма состояния системы
BaO —TiO2 [82].
только в начале зародышеобразования в тигле имеется избы-
ток твердого BaTiO3. Необходимо также, чтобы заметное число
частиц этого избыточного титаната бария имело размер менее
10 мкм. Метод Ремейки обеспечивает значительный избыток
твердого ВаТЮз в начале цикла охлаждения, образующийся за
счет сильного испарения в период прогревания (фиг. 7.27).
Если же избытка BaTiO3 нет, то неизбежно образование не-
больших кубических кристаллов. Штриховые участки кривых
на фиг. 7.27 проведены лишь предположительно 9, и здесь, ве-
’) Недавно установлено (Дж. Нильсен, частное сообщение), что фиг. 7.27
справедлива только для инертной атмосферы. Даже на воздухе происходят
медленные реакции с материалами тиглей.
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
323
роятно, в кристаллах ВаТЮз, особенно при повышенных тем-
пературах, должны присутствовать какие-то твердые растворы
других фаз. В работах Де Вриза и Сирса [86, 87] довольно под-
робно рассматривается образование зародышей и рост кри-
сталлов-двойников и указывается, что двойник-«бабочка» обра-
зуется, вероятно, в том случае, когда кристаллы, ограненные
плоскостями (100), двойникуются по плоскости *(111). Такой
двойник будет иметь входящие углы, которые будут выклини-
ваться, проходя через образование «бабочки». Первоначальный
зародыш, вероятно, представляет собой кубик, расколовшийся
так, что открывается плоскость (111), и если в расплаве нет
достаточно малых частиц BaTiO3, которые обеспечивали бы
появление открытых плоскостей (111), то ступени, необходимые
для зарождения двойника, не могут образоваться.
Условия, в которых выращивают ряд других кристаллов из
раствора в расплаве при медленном охлаждении, приведены
в табл. 7.4.
Выращивание в процессе испарения
Метод испарения расплава дает преимущества, обусловлен-
ные изотермическим ростом. Если соединение устойчиво в дан-
ном расплаве в узкой температурной области, так что метод
Таблица 7.4
Типичные кристаллы, выращенные из растворов в расплавах солей
Соединение Формула Растворитель Метод Условия Примечания Лите- ратура
Иттрий-же- лезистый гра- нат (ИЖГ) Y3Fe50i2 РЬО Медленное охлаждение Установить равнове- сие при 1370 °C; охла- ждать со скоростью 1—5 °С/ч Кристаллы размером до нескольких санти- метров; первым кри- сталлизуется магнето- плюмбит, У можно за- менить другими ред- кими землями; см. разд. 3 и 4 о других методах [74]
Титанат ба- рия BaTiO3 KF Испарение и охлаж- дение Установить равнове- сие при 1200 °C; охла- ждать со скоростью 20—40 °С/ч до ~ 850 °C, слить рас- плав; промыть Н2О Пересыщение ча- стично обусловлено ис- парением KF; двойни- ки типа «бабочка» [67]
Титанат ба- рия BaTiO3 TiO2 Вытягива- ние из расплава 2) TiO2/BaO > 1 в рас- плаве Рост на затравках, наросший слой толщи- ной до нескольких см [88]
Иттрий-алю- миниевый гра- нат (ИАГ) y3ai5012 РЬО—PbF2 Медленное охлаждение Установить равнове- сие при 1150 °C; охла- ждать со скоростью 4—5 °С/ч до 750 °C Кристаллы размером несколько см; см. гл. 5, разд. 4 о выращива- нии методом Чохраль- ского [89]
Сапфир или окись галлия а120э Ga2O3 PbF2 То же Установить равнове- сие при 1200 °C; охла- ждать до 900 °C со скоростью 3°С/ч Пластинки размером до 1 см; метод приме- ним для крайних чле- нов; приводит к обра- [64]
Ниобат нат- NaNbO3 NaF—Nb2CO3 » » Установить равнове- зованию в твердом растворе модификации р-А120з [90]
Пластинки с разме-
рия Окись берил- ВеО Li2O—МоО3 Испарение сие при 1300 °C; охла- ждать до 200 °C со скоростью 20 °С/ч Разные, см. литера- рами 1X1X3 мм Кристаллы размером [91,92]
лия Окись маг- MgO или PbF2 PbF2 и медлен- ное охлаж- дение; ме- тод темпе- ратурного градиента Испарение туру Температура выше до 2 см Кристаллы размером [74]
ния Сапфир А120з PbF2 Медленное 1150 °C Установить равнове- до 2 см Пластинки размером [64]
Окись ни- NiO PbF2 охлаждение То же сие прн 1400 °C; охла- ждать до 900 °C со скоростью 1 °С/ч Установить равнове- до 3 см Кристаллы размером [64]
келя «Окись ба- ВаО • 6Fe2O3 Ыа2СОз » » сие при 1200 °C; охла- ждать до 900 °C со скоростью 3°С/ч Установить равнове- до 0,5 мм Кристаллы размером [93]
рия и железа» сие при 1375 °C; охла- ждать до 1100 °C со скоростью 0,75 °С/ч до 1,2 см
’) Так как состав расплава отличается от состава твердой фазы, метод лучше рассматривать как выращивание на затравку из ра-
сплава (см. разд. 7.4).
Соединение Формула
Берилл Be Al2Si6Oi6
Алюминат магния MgAl2O4
Ванадат иттрия YVO4
Цирконат свинца PbZrO3
Феррит маг- ния MgFe2O4
Разные окислы HfO2, TiO2, ThO2, CeO2, YCrO3 и A12O3
Редкоземель- ные ортофер- риты RFeO3, R — редкие земли
П родолжение табл. 7.4
Растворитель Метод Условия Примечания Лите- ратура
Li2O—МоОз В2О3 или PbO—PbF2 Медленное охлаждение Установить равнове- сие при 975 °C; охла- ждать до 790 °C со скоростью 6 °С/ч Происходит рост на затравку [94]
PbF2 Испарение Температура выше 1450 °C Кристаллы размером до 2 см [74]
V2O5 Медленное охлаждение Установить равнове- сие при 1200 °C; охла- ждать со скоростью 3°С/ч до 900 °C Кристаллы размером до 2 мм [64]
PbF2 или РЬС12 Испарение Температура 1200 °C Кристаллы размером до 0,3 мм [95]
PbP2O7 Медленное охлаждение Установить равнове- сие при 1310 °C; охла- ждать со скоростью 4,3 °С/ч до 900 °C Кристаллы размером до 3 мм [96]
PbF2 или Bi Fa + B2O3 Испарение Испарение при 1300 °C Кристаллы размером 1 —10 мм [97]
PbO Медленное охлаждение Установить равнове- сие при 1300 °C; охла- ждать со скоростью 30°С/ч до — 850 °C «Небольшие» кри- сталлы [98]
7, РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
327
медленного охлаждения непригоден, то кристалл иногда вы-
ращивают путем испарения при условии, что расплав имеет до-
статочно высокую упругость пара. Если соединение испаряется
инконгруэнтно, то после того, как определенная часть его испа-
рится, другая фаза может оказаться устойчивой и начнет кри-
сталлизоваться. Если коэффициент распределения активатора
или примеси сильно зависит от температуры, то выращивание
в изотермических условиях имеет значительные преимущества,
но если коэффициент распределения в значительной степени
зависит от состава расплава, стехиометрии, концентрации акти-
ваторов или примесей, то выращивание за счет испарения мо-
жет давать менее однородные кристаллы.
Вполне вероятно, что некоторые из процессов роста, напри-
мер, в расплавах KF и РЬО вызываются испарением расплава.
Рой [99] использовал расплавы (Na, ЮгО-ЗВ^Оз, галогенидов и
РЬО для выращивания кристаллов TiO2_x, Cr2O3, (А1, Сг)2О3,
VO2 и 1п2О3 путем изотермического испарения расплавов при
температурах 1500—1100 °C.
Гродкиевич и Нитти [97] выращивали кристаллы HfO2, TiO2,
ThO2,. СеО2, YbCrO3 и А12О3 за счет испарения распл-ава при
температуре 1300 °C. Условия роста приведены в табл. 7.4. Ви-
тинг [100] выращивал методом испарения кристаллы MgFe2O4
из расплава PbF2.
Выращивание кристаллов на затравках
При выращивании кристаллов на затравках, а не за счет
спонтанного зародышеобразования можно управлять ориенти-
ровкой, скоростью роста, совершенством кристаллов и содер-
жанием в них примесей. Кроме того, в одном из своих вариан-
тов он имеет все преимущества роста в изотермических усло-
виях. Несмотря на явные преимущества метода кристаллизации
на затравках, из раствора в расплаве таким методом выраще-
но очень мало кристаллов. Это, вероятно, обусловлено главным
образом тем, что скорости роста очень малы, так как в любой
многокомпонентной системе и тем более в расплавах затруд-
нена диффузия. При неуправляемом случайном образовании за-
родышей скорости, вероятно, тоже невелики, но их не так
просто измерить, они обычно неизвестны, и экспериментатор
обычно не придает особого значения их малой величине. Кроме
того, для выращивания кристаллов на затравках требуется бо-
лее сложное оборудование, чем для выращивания на спонтанно
возникших зародышах.
Возможны, однако, три способа кристаллизации с примене-
нием затравок, причем первые два доведены до практического
применения:
328
Р. ЛОДИЗ. РОСТ монокристаллов
1. Выращивание путем медленного охлаждения раствора б
присутствии затравки.
2. Выращивание на затравку, расположенную в холодной
части системы, при избытке кристаллизуемого вещества (ших-
ты), находящегося в контакте с растворителем в более горячей
части системы. Такой метод подобен гидротермальной кристал-
лизации, и его иногда называют выращиванием по способу
температурного градиента или методом Крюгера — Финке [14].
3. Выращивание на затравку в условиях пересыщения, соз-
даваемого испарением растворителя.
Основное преимущество методов 1 и 3 состоит в том, что
для них не нужны стадии растворения и в некоторых случаях
диффузионный путь может быть короче. Наилучшие кристаллы
из имеющихся к настоящему времени выращены методом 1.
Каких-либо попыток выращивания кристаллов методом 3, на-
сколько известно автору, не предпринималось. Преимущество
методов 2 и 3 в том, что выращивание производится в изотер-
мических условиях. Это помогает осуществить рост в системах,
где нужная фаза устойчива только в пределах узкой темпера-
турной области и где коэффициент распределения активатора,
примеси или компонентов (в случае нестехиометрических
соединений) зависит от температуры. В таких случаях более одно-
родные кристаллы дают методы 2 и 3. Но когда растворитель
испаряется инконгруэнтно или коэффициент распределения за-
висит от концентрации растворителя, метод испарения не дает
кристаллов столь же однородных, как и выращенные по способу
температурного градиента. Метод температурного градиента
используют для выращивания больших кристаллов, так как
тогда размеры кристалла не ограничиваются общим количеством
растворенного в растворителе вещества.
Методом роста на затравке пользовался целый ряд исследо-
вателей, в том числе Миллер [101], выращивавший кристаллы
KNbO3, Рейнольдс и Гуггенгейм [102], кристаллизовавшие фер-
риты, Линарес [103], вырастивший кристаллы ИЖГ, и Кестид-
жян [104], тоже выращивавший кристаллы ИЖГ. Полнее же
всего этот метод изучен, пожалуй, в работе Лодиза с сотруд-
никами [34], которые выращивали кристаллы ИЖГ, используя
растворитель ВаО-6В2О3. Температурная зависимость раство-
римости ИЖГ в расплаве ВаО-6В2О3 показана на фиг. 7.28,
а на фиг. 7.29 приведено устройство стандартной печи. Иссле-
довались возможности выращивания кристаллов путем мед-
ленного охлаждения раствора и методом температурного гра-
диента. Вращение производилось в течение 30 с по часовой
стрелке, а последующие 30 с — против часовой стрелки. На
фиг., 7.30 показано, как влияет скорость вращения на рост кри-
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
329
сталлов ИЖГ в направлении (ПО) при двух разных скоростях
охлаждения. В экспериментах с медленным охлаждением в от-
сутствие питательной шихты ИЖГ при скорости охлаждения
dQldT, равной 107ч, плоская часть кривой АВ начинается со
скорости вращения 200 об/мин. Значение скорости в точке А
называется критической скоростью вращения. Она возрастает
Фиг. 7.28. Диаграмма растворимости ИЖГ в BaO*6B2O3 [49].
Кривая Д —нулевой избыток Fe2Oj в расплаве; кривая В —избыток Fe2O3 в расплаве
равный 6,5%.
по мере увеличения dQ/dT и массы раствора. Чем больше dtydT,
тем больше .пересыщение As и тем более важную роль играют
процессы диффузии. Точно так же чем больше масса расплава,
тем длиннее диффузионный путь, а отсюда вытекает и зави-
симость А от dtydT и массы расплава.
При выращивании методом температурного градиента даже
при скоростях вращения, достигающих 200 об/мин, скорость
роста в ходе эксперимента постепенно уменьшается. Очевидно,
330
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
при этом растворение ИЖГ становится тем процессом, который
лимитирует скорость роста, так как шихта ИЖГ спекается и
ее поверхность со временем уменьшается. Повышения скоро-
сти роста кристаллов можно ожидать при большем объеме
питательной шихты, больших размерах частиц шихты (улучшаю-
щих циркуляцию растворителя через зону шихты), при более
быстром вращении в условиях лучшего распределения и регу-
лирования температур (малые градиенты и температурные
флуктуации в зоне шихты способствуют спеканию шихты).
Кроме того, более эффективна та ориентировка затравки, ко-
торую применяют в методах вытягивания кристаллов из рас-
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
331
плава. Такая ориентировка допускает существование большого
градиента температуры вблизи границы роста. Это препятст-
вует возникновению концентрационных переохлаждений, обра-
зованию включений расплава, появлению дендритных и ворон-
кообразных форм роста, вызывающих особые трудности при
кристаллизации в расплавах, высокая вязкость которых при-
водит к удлинению диффузионного пути частиц вблизи границы
роста. Кестиджян [104] продемонстрировал некоторое улучше-
ние качества кристаллов при вытягивании ИЖГ из раствора
в расплаве, а в работе Ван Хиппела [88] сообщаются условия
Линца для выращивания кристаллов ВаТ1О3 при избытке ТЮ2.
Фиг. 7.30. Зависимость скорости роста кристаллов ИЖГ от скорости вра-
щения затравки [49].
На кривые указана скорость охлаждения.
В табл. 7.4 указан ряд кристаллов, выращенных из расплава,
вместе с наиболее важными для роста параметрами. Нетрудно
видеть, что во многих случаях не всегда имеется достаточно
сведений даже о таких основных параметрах, как скорость
охлаждения.
7.5. РОСТ КРИСТАЛЛОВ ИЗ РАСТВОРОВ
В РАСПЛАВЛЕННЫХ МЕТАЛЛАХ
Метод выращивания кристаллов из раствора, при котором
в качестве растворителя используются расплавленные металлы,
как и другие процессы выращивания из растворов, имеет свои
преимущества и свои недостатки. Монокристаллы многих ме-
таллов и полупроводников выращены таким методом. Ранее
(разд. 4.4) уже говорилось о применении расплавов переходных
металлов в качестве растворителей графита при кристаллиза-
ции алмаза. При кристаллизации алмаза пересыщение создают
за счет растворения метастабильной в условиях опыта фазы
(графита), более растворимой, чем устойчивая в условиях
опыта кристаллизуемая фаза (алмаз).
332
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Наиболее широко метод выращивания из растворов в рас-
плавленных металлах в настоящее время применяется, вероят-
но, для получения кристаллов полупроводниковых соединений
III—V групп, особенно GaP, для которого растворителем часто
служит Ga. Рост происходит при достаточно низких темпера-
турах, где мала летучесть As и Р, которая сильно затрудняет
выращивание кристаллов из расплава. Растворитель особенно
удобен тем, что он не вводит в систему примесей и плавится
при низкой температуре.
Область А
Фиг. 7.31. Схема метода выращивания кристаллов GaP за счет эпитаксии
в жидкой фазе, или «метода качающейся лодочки».
Один из самых первых и самых простых методов выращи-
вания кристаллов GaP из раствора описан Вольфом и др.
[105, 106] (см. также [107]); GaP, выращенный из расплавлен-
ного Ga, сыграл важную роль в исследованиях по электролю-
минесценции, так как он дает парные спектры с большим чис-
лом резких линий [108].
Расплавленный Ga, содержащий 5—10 ат.% фосфора, по-
мещают в откачанную ампулу из кварцевого стекла, заваривают
и медленно, со скоростью 3—5°/ч охлаждают, начиная с тем-
ператур 1000—1275 °C и заканчивая охлаждение при темпера-
турах на 200—300 °C ниже исходной температуры для выра-
щивания. В некоторых случаях расплав помещают в тигли из
AIN, BN и А12О3, расположенные внутри кварцевой ампулы,
которую затем заваривают. Начиная с температур 900—700 °C,
система охлаждается быстрее. Полученные кристаллы извле-
кают из расплава механическим путем и путем выщелачи-
вания в концентрированной НС1. Выращенные кристаллы
представляют собой в основном пластинки, ограненные по пло-
скости {111}, с максимальным размером до 1 см (когда рост про-
исходит из расплава весом около 50 г [108]).
В последние годы наиболее высокий выход электролюминес-
ценции на GaP был получен на кристаллах, выращенных из
раствора в Ga, причем полупроводниковые диоды были изго-
товлены методом эпитаксиального выращивания в жидкой
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
333
фазе, или методом качающейся лодочки. Такой метод исполь-
зовали для выращивания GaAs и GaP [109—112]. При выра-
щивании GaP методом жидкофазной эпитаксии почти насыщен-
ный раствор GaP (в жидком Ga) приводят в контакт с затравкой
из GaP (подложкой), а изменение температуры программи-
руют так, чтобы создать пересыщение, при котором на за-
травке растут сравнительно тонкие, нужным образом активиро-
ванные слои. На фиг. 7.31 изображена типичная схема при-
меняемой аппаратуры.
Кроме GaAs и GaP, метод качающейся лодочки использо-
вали для выращивания эпитаксиальных слоев Ge [109] и ИЖГ
[ИЗ]. Растворителями обычно служат:
GaP Ga ( + Те->п-тип; + Zn->р-тип)
GaAs Sn ( + Sn ->п-тип; 4-Zn->p-тип)
Ge In (4-Ga->р-тип)
ИЖГ(¥зЕе5О12) PbO, PbF2 и другие расплавы. Подлож-
кой служит иттрий-алюминиевый гранат.
Для лодочек обычно применяют следующие материалы:
графит — для Ge, BN — для GaP и Pt — для ИЖГ.
Для иллюстрации опишем способ получения GaAs. Вначале,
когда область А (фиг. 7.31) ниже области В, в лодочку в об-
ласти А помещают смесь Sn—GaAs, а в области В укрепляют
затравочную пластинку из GaAs. Графитовую лодочку устанав-
ливают в центре зоны с постоянной температурой в печи соот-
ветствующей конструкции. Лодочку нагревают приблизительно
до 640 °C и выдерживают при этой температуре, чтобы GaAs
растворился в Sn. Затем лодочку наклоняют так, чтобы об-
ласть В оказалась ниже области А. При контакте с подложкой
раствор, вероятно, должен быть слегка ненасыщенным. Тогда
в результате растворения затравки удаляется поврежденная
часть поверхности, и при некоторых условиях это способствует
тому, чтобы граница роста была плоской1). Печь охлаждают
в течение приблизительно 30 мин от 640 до 500 °C, затем рас-
твор декантируют и вынимают подложку с образовавшимся на
ней активированным эпитаксиальным слоем.
Соответствующие циклы нагревания для других соединений
таковы [109]:
GaAs из Ga — контакт с затравкой при 900 °C, охлаж-
дение до 400 °C в течение 30 мин, де-
кантирование.
Ge из In — контакт с затравкой при 500 °C, охлаж-
дение до 400 °C в течение 30 мин.
9 В идеальном случае растворитель должен быть для подложки поли-
рующим травителем.
334
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
Ge из Sn—Pb—контакт с затравкой при 400 °C, охлаж-
дение до 300 °C в течение 10 мин. '
GaP из Ga — контакт с затравкой при 1100 °C, охлаж-
дение до 700 °C в течение 40 мин [ПО].
Можно думать, что метод жидкофазной эпитаксии будет на-
ходить все более широкое применение при выращивании кри-
сталлов из растворов. Логическим продолжением метода выра-
щивания с использованием жидких металлических растворите-
лей служит зонная плавка с градиентом температуры, которая
рассматривается в разд. 7.6. Смакула [114] приводит список
ряда других кристаллов, выращенных из растворов в жидких
металлических растворителях.
7.6. ЗОННАЯ ПЛАВКА С ГРАДИЕНТОМ
ТЕМПЕРАТУРЫ
Зонная плавка с градиентом температуры была предло-
жена Пфанном и впервые применена им одновременно к очи-
стке и к выращиванию кристаллов [115, 116]. Суть ее в том, что
благодаря наличию температурного градиента по всему об-
разцу проходит подвижная узкая зона растворителя. На
фиг. 7.32 показана схема метода зонной плавки с градиентом
температуры вместе с соответствующей диаграммой состояния.
На диаграмме состояния Л — растворяемое вещество (выращи-
ваемый кристалл), а В — растворитель. Допустим, что у нас
имеется тонкий слой твердого растворителя В между двумя
блоками чистого растворяемого вещества А. Поместим всю си-
стему в поле температурного градиента так, чтобы температура
слоя превышала самую низкую температуру плавления в рас-
сматриваемой системе, а самая высокая температура остава-
лась ниже температуры плавления выращиваемого кристалла
Д. В этих условиях слой будет растворять в себе некоторое
количество компонента А и толщина его будет увеличиваться.
Если при этом Т\ < Т2 < Г3 < Т4, то зона перемещается в на-
правлении 1\. Когда она окажется в области Т2 — Г3, у более
холодной поверхности раздела будет происходить растворение
А, продолжающееся до тех пор, пока не установится соответ-
ствующая равновесная концентрация С3, отвечающая линии лик-
видуса. Растворение А у более горячей поверхности продол-
жается до установления концентрации С2 (С2>С3). Возник-
ший градиент концентрации вызывает диффузию компоненты А
в направлении более холодной поверхности раздела, где рас-
твор становится пересыщенным (переохлажденным) и при
концентрации компонента В, равной &С3 (где k — коэффициент
распределения), происходит кристаллизация компонента А.
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
335
Непрерывный процесс растворения — диффузии — кристаллиза-
ции приводит к перемещению расплавленного слоя по всему
объему.
Пфанн [116] проанализировал факторы, влияющие на длину
зоны, ее форму и- изменение состава по длине кристаллизовав-
Температура Т
Концентраиия С компонента В
Фиг. 7.32. Схема метода зонной плавки с градиентом температуры [116].
шегося слитка. Часто бывает важно вырастить кристаллы с ма-
лым содержанием примесей. Тогда предпочтительнее системы,
в которых растворимость растворителя в кристаллизуемом сое-
динении невелика. Нередко бывает желательно иметь в образце
однородное распределение примесей. Если во всем слитке соз-
дан однородный градиент температуры (фиг. 7.32), то зона
перемещается за счет изменений в составе, которые вызывают
ее смещение вдоль линии ликвидуса от Т4 к 7\. При этом со-
став твердого кристаллического соединения изменяется от
336
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
до йСь При уменьшении градиента температуры кристалл бу-
дет более однородным, но скорость движения зоны будет мень-
ше. Зону можно поддерживать почти при постоянной темпера-
туре в течение всего полного прохода с помощью кольцевого
нагревателя в обычной установке для зонной очистки, пере-
мещая нагреватель [и зону, содержащую раствор (Д-}-В)]
вдоль слитка. Тем самым обеспечивается высокий градиент тем-
пературы вблизи поверхностей плавления и кристаллизации,
способствующий быстрому росту и получению обычно более
однородных кристаллов. Это — один из вариантов метода зон-
ного выравнивания примесей. К числу монокристаллов, выра-
щенных методом зонной плавки с температурным градиентом,
относятся GaAs (растворитель Ga) [117], а-SiC (растворитель
Сг) [118], германий (растворитель РЬ) [116] и GaP (раствори-
тель GaAs) [119, 120].
Типичные условия и результаты выращивания представлены
в работе Плескета и др. [120] по кристаллизации GaP. Эти ав-
торы перемещали зону (Ga + GaP) вдоль слитка из GaP с по-
мощью передвижного нагревателя. Такой метод представляет
собой усовершенствованный метод Бродера и Вольфа [119] и
иногда называется методом движущегося растворителя. Неболь-
шую затравку GaP помещают на дно цилиндрического тигля
из BN с острым концом. Сверху идет слой Ga толщиной 6 мм,
а еще выше —плотный поликристаллический слиток GaP. Ти-
гель в откачанной запаянной кварцевой ампуле вводят в печь
сопротивления, позволяющую регулировать крутизну профиля
изменения температуры. Печь снабжена одновитковым радиа-
ционным нагревателем, который обеспечивает создание локаль-
ного резкого температурного градиента и расплавленной зоны
(Ga + GaP), перемещаемой вдоль образца. Зону устанавли-
вают при температуре около 1160 °C (которая соответствует
концентрации около 10 вес.% GaP в Ga). Скорость перемещения
зоны вверх по слитку составляет около 4 мм/сут; в других
процессах роста из раствора, где скорость снижена из-за про-
цессов диффузии (таких, как рост в водных растворах, распла-
вах и гидротермальный рост), она примерно того же порядка.
Таким методом выращены кристаллы размером до 5 см.
7.7. КОМБИНИРОВАННЫЕ МЕТОДЫ ВЫРАЩИВАНИЯ
ПО МЕХАНИЗМУ ПАР — ЖИДКОСТЬ — КРИСТАЛЛ
В многокомпонентных системах в равновесии может участ-
вовать более двух фаз. Рост по механизму пар — жидкость —
кристалл (П — Ж — К), который описали Вагнер и Эллис
[121], — единственный известный пример такого рода, но вполне
возможно представить себе такие процессы, как превращение
7. РОСТ КРИСТАЛЛОВ ИЗ ЖИДКИХ РАСТВОРОВ
337
жидкость — жидкость — кристалл (где две жидкости не смеши-
ваются) и др. Рост по механизму пар — жидкость — кристалл
иллюстрируется схемой фиг. 7.33, на которой показан способ
выращивания кристаллов Si. Осаждение из пара осуществляют
за счет реакции диспропорционирования иодида (см. разд. 6.4)
2 Sil2 (g) •< * SH4 (g) -f- Si(pacTB)
(7.16)
или восстановления SiCl4 водородом (см. разд. 6.4)
SiCl4 (g) + 2H2 (g) 4HCl(g) + Si(pacTB). (7.17)
Жидкая фаза представляет собой раствор Si в Au. Реакция
в газовой фазе не приводит прямо к образованию кристалла,
Комплексы Si
в паровой (разе
Жидкий ,
-^раствор Si
Растущий
" 'монокристалл Si
Кремниевая подложка
Фиг. 7.33. Рост по механизму П — Ж — К.
а получается лишь жидкий раствор кремния. Из жидкого же
раствора растет кристалл:
81(раств) Si(S). (7.18)
Условия осаждения из газовой фазы (скорость потока, скоро-
сти реагирующих веществ, температура и т. д.) обычно такие
же, как и при кристаллизации из газовой фазы с использова-
нием тех же реакций (гл. 6, разд. 4). Например, при восста-
новлении SiCl4 водородом скорость потока обычно составляет
1000 см3/мин, а мольные .отношения SiCl4/H2 достигают значе-
ний, равных 0,02. Температура жидкой капли изменяется от
875 до 1200 °C, что соответствует растворимости Si в золоте в
интервале 55—70 ат.% [122]. Энергия активации процесса
П — Ж — К составляет 7,5 ккал/моль, тогда как при выращи-
вании из газовой фазы на кремниевой подложке она равна
338
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
приблизительно 31 ккал/моль1). Скорость роста приблизитель-
но в 5 раз превышает скорость роста из газовой фазы (около
10 мкм/мин) в аналогичных условиях. Очевидно, жидкая по-
верхность в отличие от поверхности твердого монокристалла
идеально атомно-шероховата, так что реакция пар — жидкая
фаза происходит гораздо легче, чем аналогичная реакция пар —
кристалл. При кристаллизации из жидкой фазы (реакция жид-
кость— кристалл) относительно легко получить большой тем-
пературный градиент у растущей поверхности и уменьшить
концентрационное переохлаждение. Механизм начальной ста-
дии не вполне ясен, но инициировать рост легко. На чистую
поверхность грани {111} монокристальной пластинки из кремния
помещают небольшую крупинку золота и нагревают до 950°C,
где она образует капельку жидкого сплава Au — Si. Затем в си-
стему вводят пары исследуемого соединения и начинается рост
нитевидных кристаллов. Капелька расплава остается все время
на вершине нитевидного кристалла, и в определенных условиях
могут возникать более сложные формы, чем одиночная нить.
Небольшой процент золота захватывается растущим нитевид-
ным кристаллом и, в конечном итоге, если кристалл достаточно
длинный, оно полностью расходуется.
Кроме Si, описываемым методом выращивают и другие по-
лупроводники, в том числе Ge, GaAs, GaP и Ga(AsP) [123, 124],
но большие объемные кристаллы до настоящего времени не
удавалось вырастить. Обширный обзор по механизму и выра-
щенным материалам составлен Вагнером [14]. Для образования
жидкой капли должны быть выполнены соответствующие усло-
вия:
1. Капля должна быть жидкой при соответствующих значе-
ниях температуры и концентрации растворяемого соединения.
2. Капля должна смачивать подложку.
3. Вещество, образующее каплю, не должно в больших кон-
центрациях захватываться растущим кристаллом.
4. Вещество не должно реагировать ни с одним из компо-
нентов газовой фазы, кроме растворяемого соединения.
Золото используют в качестве растворителя и при выра-
щивании Ge, a Ga — при выращивании GaAs. Механизм роста
П—Ж — К действует, как выяснилось, и в некоторых других
системах, в том числе в таких, как a-AI2O3, SiC и ВеО, где
морфология нитевидных кристаллов характеризуется наличием
у них округлых вершин. Выращенные кристаллы не содержат
9 По данным работ [150, 151], скорость роста нитевидного кристалла
квадратично зависит от пересыщения, кинетический коэффициент составляет
1,6-10“4 см/с при Т == 1010°C, а его энергия активации равна приблизительно
48 ккал/моль. — Прим, ред.
7. РОСТ кристаллов из жидких РАСТВОРОВ
339
дислокаций (чем отличаются от обычных нитевидных кристал-
лов, в которых обнаруживаются единичные винтовые дислока-
ции). Таким механизмом роста объясняется отсутствие «скру-
чивания Эшелби» [25] в некоторых нитевидных кристаллах. Дей-
ствительно, как показывают все новые и новые исследования
по выращиванию кристаллов методом П — Ж — К, нитевидные
кристаллы растут преимущественно по механизму П — Ж — К,
а механизм спирального дислокационного роста — весьма ред-
кое явление [14] *).
Потенциальные возможности метода П — Ж — К далеко еще
не исчерпаны. Путем осаждения, например, Au на Si с после-
дующим ростом по механизму П — Ж — К можно получать
электронные микросхемы. Изменяя состав газовой фазы, полу-
чают полупроводниковые гетеропереходы.
*) В отсутствие дислокаций рост, безусловно, должен либо идти на
атомно-шероховатой поверхности, либо предполагать какой-либо другой
источник ступеней роста (например, зарождение но периферическому контуру
вершины нитевидного кристалла). Установлено, однако [150], что скорость
роста нитевидных кристаллов в процессе П—Ж—К квадратично зависит от
пересыщения, как это должно было бы быть при дислокационном росте.
Исследование дислокационной структуры этих кристаллов в работе [150] не
проводилось. — Прим. ред.
ЛИТЕРАТУРА
К главе 1
1. Thomas D. Е., Gingrich N. S., Journ. Chem. Phys., 6, 411 (1938).
2. Brown G. H„ Shaw W. G„ Chem. Rev., 57, 1049 (1957).
3. Buerger M. J., X-Ray Crystallography, Wiley, New York, 1942 (есть пере-
вод: Бюргер M. Дж., Рентгеновская кристаллография, ИЛ, 1948).
4. Lipson Н., Cochran W., The Determination of Crystal Structures, Cornell
Univ. Press, 3rd ed., Ithaca, N. Y., 1966 (есть перевод: Липсон Г., Кок-
рен В., Определение структуры кристаллов, ИЛ, 1956).
5. Wohlstrom Е. Е., Optical Crystallography, 4th ed., Wiley, New York, 1969.
6. Hartshorne N. H., Stuart A., Crystals and Polarizing Microscope, Arnold,
London, 1960.
7. Hartshorne N. H., Stuart A., Practical Optical Crystallography, Arnold,
London, 1964.
8. Blass F. D., An Introduction to the Methods of Optical Crystallography,
Holt, Rienhart and Winston, New York, 1961.
9. Winchell A. N., Winchell H., The Microscopical Characters of Artificial Inor-
ganic Solid Substances, Academic Press, N. Y., 1964 (есть перевод: Вин-
челл А. Н., Винчелл Г., Оптические свойства искусственных минералов,
изд-во «Мир», 1967).
10. Ford W. Е., Dana’s Textbook of Mineralogy, 4th ed., Wiley, New York,
1958.
11. Gschneidner K. A., Vineyard G. H., Journ. Appl. Phys., 33, 3444 (1962).
12. Wood E. A., Crystal Orientation Manual, Columbia Univ. Press, New York,
1963.
13. Bond W. L„ Acta Cryst., 13, 814 (1960).
14. Barns R. L., Mater. Res. Bull. 2, 276 (1967).
15. Barrett C. 3., Massalski T. B., Structure of Metals, McGraw-Hill, New York,
1966.
16. Azaroff L. 1Л, Buerger M. J., Powder Method in X-Ray Crystallography,
McGraw-Hill, New York, 1958.
17. D’Eye R. W. M., Wait E., X-Ray Powder Photography in Inorganic Che-
mistry, Academic Press, New York, 1960.
18. Bennil W. A, Geibe I. G., в книге Methods of Experimental Physics, Vol. 6,
eds. K. Lark-Harowitz, V. A. Johnson, Academic Press, New York, 1959,
p. 203.
19. Kikuta 3., Kohra K., Sugita У., Japan Journ. Appl. Phys., 5, 1047 (1966).
20. Brady G. W., Petz J. /., Journ. Chem. Phys., 34, 332 (1961).
21. Debye P.t Journ. Chem. Phys., 31, 680 (1959).
22. Zimm В. H., Journ. Phys. Chem., 54, 1306 (1950).
23. Frisch H. L., Brady G. W., Journ. Chem. Phys., 37, 1514 (1962).
24. Swalin R. A., Thermodynamics of Solids, Wiley, New York, 1962, p. 218.
25. Burgers J. M., Konikl. Ned. Akad. Wetenschap., 42, 293, 378 (1939).
!) Литература, отмеченная звездочкой, добавлена редактором перевода. —
Прим. ред.
ЛИТЕРАТУРА
341
26. Frank F. C., Phil. Mag., 42, 809 (1951).
27. Van Bueren H., Imperfections in Crystals, North-Holland, Amsterdam, 1960,
p. 45 (есть перевод: Ван Бюрен, Дефекты в кристаллах, ИЛ, 1962).
28. Read W. Т., Jr., Dislocations in Crystals, McGraw-Hill, New York, 1953
(есть перевод: Рид В. А., Дислокации в кристаллах, ИЛ, 1957).
29. Buergers J. М., Proc. Phys. Soc., 52, 23 (1940).
30. Read W. T., Jr., в книге Methods of Experimental Physics, Vol. 6A, eds.
K. Lark-Harowitz, V. A. Johnson, Academic Press, New York, 1959, p. 322.
31. Berry L. G., Mason B., Mineralogy, Freeman, San Francisco, 1959, p. 137.
32. Ramsdell L. S., Am. Mineralogist, 29, 431 (1944).
33. Ramsdell L. S., Am. Mineralogist, 30, 519 (1945).
34. Ramsdell L. S., Am. Mineralogist, 32, 64 (1947).
35. Жданов Г. С., Минервина 3. В., ЖЭТФ, 17, 3 (1947).
36. Terpstra Р., Codd L. W., Crystallometry, Academic Press, New York, 1961.
37. Bond W. L., Andrus J., Am. Mineralogist, 37, 622 (1952).
38. Шубников А. В., Бруновский Б., Zs. Krist., 77, 337 (1931).
39. Direct Observation of Imperfections in Crystals, eds. J. B. Newkirk,
J. H. Wernick, New York, 1962 (есть перевод: Прямые методы исследова-
ния дефектов в кристаллах, изд-во «Мир», 1965).
40. Weissmann S., Am. Scientist, 51, 193 (1963).
41. Warren В. E., Progr. Metal Phys., 8, 147 (1959).
42. Batterman B. W., Journ. AppL Phys., 30, 508 (1959).
43. Webb W. W., в книге Direct Observations of Imperfections in Crystals, eds.
J. B. Newkirk, J. H. Wernick, Wiley, New York, 1962, pp. 31, 32, 37.
44. Schulz L. G., Trans. AIME, 200, 1082 (1954).
45. Bonse U., Hart M., Zs. Phys., 190, 455 (1966).
46. Smakula A., Kalnajs J., Sils V., Phys. Rev., 99, 1747 (1955).
47. Bowden F. P., Tabor D., The Friction and Lubrication of Solids, 3rd ed.,
Oxford Univ. Press, New York, 1964.
48. Rabinowicz E., Friction and Wear of Materials, Wiley, New York, 1965.
49. Rabinowicz E., Sci. Am., 218 (6), 91 (1968).
50. Samuels L. E., Metallographic Polishing by Mechanical Methods, Pitman,
London, 1967.
51. Hall R. C., Metal Progr., 70, 78 (1956).
52. Gilman J. J., Johnston W. G., Sears G. W., Journ. Appl. Phys., 29, 747
(1958) (есть перевод: Гилман Дж., Джонстон У., Сирс Дж., в сб. «Эле-
ментарные процессы роста кристаллов», ИЛ, 1959, стр. 249).
53. Sears G. W., Journ. Chem. Phys., 32, 1317 (1960).
54. Tennery V. J., Anderson F. R., Journ. AppL, Phys. 29, 755 (1958).
55. Gilman J. J., Johnston W. G., Journ. Appl. Phys., 27, 1018 (1956).
56. Gilman J. J., Johnston W. G., Metal. Progr., 71, 76 (1957).
57. Gilman J. J., Johnston W. G., в книге Dislocations and Mechanical Proper-
ties of Crystals, Wiley, New York, 1957, p. 116 (есть перевод: Дислокации
и механические свойства кристаллов, ИЛ, 1960, стр. 82).
58. Johnston W. G., Gilman J. J., Journ. Appl. Phys., 30, 129 (1959).
59. Vogel F. L., Jr., et al., Phys. Rev., 90, 489 (1953).
60. Vogel F. L., Acta Met., 3, 245 (1955).
61. Dash W. С., в книге Growth and Perfection of Crystals, Wiley, New York,
1958, p. 361 (есть перевод: Дислокации и механические свойства кристал-
лов, ИЛ, 1960, стр. 436).
62. Amelinckx S., Acta Met., 2, 849 (1954).
63. Faust J. W., Compound Semiconductors, Vol. 1, Reinhold, New York, 1962,
p. 445.
64. Hall R. C., Metal Progr., 70, 78 (1956).
65. Hendrickson A. A., Machlin E. S., Acta Met., 3, 64 (1955).
66. Amelinckx S., Strumane G., Silicon Carbide — A High Temperature Semi-
conductor, Pergamon, New York, 1960, p. 162.
342
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
67. Horn F. Н., Phil. Mag., 43, 1210 (1952).
68. Jones D. A., Mitchell J. W.y Phil. Mag., 2, 1047 (1957).
69. Lovell L. C., Acta Met., 6, 775 (1958).
70. Keith R. E., Gilmann J. J., Acta Met., 8, 1 (1960).
71. Dorendorf H., Zs. Angew. Phys., 9, 513 (1957).
72. Pfann W. G., Lovell L. C., Acta Met,, 3, 512 (1955).
73. Pfann W. G„ Vogel F. L., Jr., Acta, Met., 5, 377 (1957).
74. ASTM-F47-64T, 1967 Book of ASTM Standards, Part 8, ASTM, Philadelphia,
1967, p. 527.
75. Hedges J. M., Mitchell J. W., Phil. Mag., 44, 223 (1953).
76. Amelinckx S. W.f van der Vorst G. R., Dekeyser W., Phil. Mag., 46, 450
(1955).
77. Amelinckx S., Strumane R.t Acta Met., 8, 312 (1960).
78. Amelinckx S., Acta Met., 7, 650 (1959).
79. Bontinck W., Dekeyser IF., Physica, 22, 595 (1956).
80. Bontinck W., Amelinckx S., Phil. Mag., 2, 94 (1957).
81. Barber D. J., Harvey К. B., Mitchell J. W., Phil. Mag., 2, 704 (1957),
82. Tolansky S., Introduction of Multiple Beam Interferometry, Longmans,
London, 1955.
83. Tolansky S., Surface Microtopography, Wiley, New York, 1960.
84. Oster G., Nishijima Y., Sci. Am., 208 (5), 54 (1963).
85. Mitchell J. W., в книге Direct Observation of Imperfections in Crystals,
Wiley, New York, 1962, p. 3 (есть перевод: Прямые методы исследования
дефектов в кристаллах, изд-во «Мир», 1965).
86. Kikuchi S., Proc. Imp. Acad. Japan., 4, 271 (1928).
87. Heidenreich R. D., Fundamentals of Transmission Electron Microscopy,
Wiley, New York, 1964, p. 189 (есть перевод: Хейденрайх P., Основы про-
свечивающей электронной микроскопии, изд-во «Мир», 1966).
88. Muller Е. U7., в книге Direct Observation of Imperfections in Crystals, Wi-
ley, New York, 1962, p. 77 (есть перевод: Прямые методы исследования
дефектов в кристаллах, изд-во «Мир», 1965).
89. Characterization of Materials, Washington, 1967.
90. Thornton D. R., Scanning Electron Microscopy, London, 1968.
К главе 2
1. Findlay A., Campbell A. N.t Smith N. O., The Phase Rule and Its Appli-
cations, Dover, N. Y., 1951.
2. Swalin R. A., Thermodynamics of Solids, Wiley, New York, 1962, p. 91, 200.
3. Strong H. M., в книге Progress in Very High Pressure Research, eds.
F. P. Bundy,W. R. Hibbard, H. Strong, Wiley, New York, 1961,
p. 192.
4. Smith F. G., Physical Geochemistry, Addison-Wesley, Reading, Mass., 1963,
p. 74.
5. Weissberger A., Physical Methods of Organic Chemistry, 3rd ed., Part I,
Wiley, New York, 1959.
6. Hall R. N., Journ. Phys. Chem., 57, 836 (1953).
7. Чернов А. А., в сб. «Рост кристаллов», т. 3, Изд-во АН СССР, 1961.
8. Carruthers J. R., Canad. Met. Quart., 5 (1), 55 (1963).
9. Nassau К., Loiacono G. M., Journ. Phys. Chem. Solids, 24, 1503 (1963).
10. Laudise R. A., Ballman A. A., King J. C., Journ. Phys. Chem. Solids, 26,
1305 (1965).
11. Thurmond C. D., в книге Semiconductors, eds. N. B. Hannay, Reinhold,
New York, 1959, p. 145 (есть перевод: «Полупроводники», ИЛ, 1962,
стр. 142).
ЛИТЕРАТУРА
343 >
12. Hansen М., Constitution of Binary Alloys, 2nd ed., McGraw-Hill, New
York, 1958 (есть перевод: Хансен M., Андерко К., Структуры двойных;
сплавов, Металлургиздат, т. I и II, 1962).
13. Levin Е. М., Robbins С. R., McMurdie Н. F., Phase Diagrams for Ceramists,
ACS, Columbus, Ohio, 1964.
14. Masing G., Ternary Systems, Dover, N. Y., 1944.
15. Pfann W. G., Zone Melting, 2nd ed., Wiley, New York, 1966 (есть перевод:
Пфанн В., Зонная плавка, изд-во «Мир», 1970).
16. Pfann W. G., Trans. AIME, 194, 747 (1952’) (есть перевод: в сб. «Герма*-
ний», ИЛ, 1955, стр. 92).
17. Keck R. Н., Golay М. J. Е., Phys. Rev., 89, 1297 (1953).
18. Etneis R., Zs. Naturforsch., 9a, 67 (1954).
19. Theuerer H., пат. США 3060123, 23/X 1962 г. (заявка 17/XII 1952 г.).
20. Theuerer H., Trans. AIME, 206, 1316 (1956).
21. Kubachewski O., Evans E., Metallurgical Thermochemistry, 4th ed., Perga-
mon, N. Y., 1967.
22. Pfann W. G., Trans. AIME, 203, 961 (1955).
23. Nielsen J. W., Monchamp R. P.. в книге The Use of Phase Diagrams in
Ceramic Glass and Metal Technology, vol. 3, ed. A. M. Alper, New York,
1970.
24. Albers W., Haas C., Phillips Technical Rev., 30, 82, 107, 142 (1969).
К главе 3
1. Jost W., Diffusion in Solids, Liquids, Gases, New York, 1960.
2. Crank J., Mathematics of Diffusion, New York, 1956.
3. Kossel W., Nachr. Gess. Wiss. Gottingen, Math. Physik. KI. 135 (1927);
Ann. Physik, 21, 457 (1934); 33, 651 (1938).
4. Van Hook, Crystallization— Theory and Practice, New York, 1961, p. 73, 92.
6. Volmer M., Schultze W., Zs. Physik. Chem. (Leipzig) A156, 1 (1931).
6. Frank F. C., Disc. Farad. Soc., 5, 48 (1949).
7. Wulff G., Zs. Krist, 34, 449 (1901).
8. Herring C., Phys. Rev., 82, 87 (1951).
9. Gibbs J. W., The Collected Works, Vol. 1, London, 1928, p. 55.
10. Donnay J. D. H., Harker D., Am. Mineralogist, 22, 446 (1937).
11. Hartman P., Perdok W. G., Acta. Cryst., 8, 49, 521, 525 (1955).
12. Glasstone G., Laidler K., Eyring H., The Theory of Rate Processes, New
York, 1941.
13. Slater N. B., Theory of Unimolecular Reactions, Ithaca, N. Y., 1959.
14. Frost A. A., Pearson R. G., Kinetics and Mechanism, New York, 1953.
15. Frank F. С., в книге Growth and Perfection of Crystals, eds. R. H. Dore-
mus, B. W. Roberts, D. Turnbull, New York, 1958, p. 411.
16. Burton W. K., Cabrera N„ Disc. Farad. Soc., 5, 33 (1949).
17. Frank F. C., Advan. Phys., 1, 91 (1952).
18. Cabrera V., Coleman R. К, в книге The Art and Science of Growing Cry-
stals, ed. J. J. Gilman, New York, 1963, p. 3 (есть перевод: Теория и прак-
тика выращивания кристаллов, М., 1968).
19. Carbera V., Vermilyea D. А., в книге Growth and Perfection of Crystals,
eds. R. H. Doremus, B. W. Roberts, D. Turnbull, New York, 1958, p. 393.
20. Becker Von R., Doring W., Ann. Physik, 24, 719 (1935).
21. Lighthill M. J., Whitham G. B„ Proc. Roy. Soc., A229, 281, 317 (1955).
22. Lang A. R., Journ. Appl. Phys., 28 (4), 497 (1957).
23. Jackson K. A., Phil. Mag., 7, 1117, 1615 (1962).
24. Thurmond C. D., в книге Semiconductors, ed. N. B. Hannay, New York, 1959,
p. 145.
25. Pfann W. G., Zone Melting, Wiley, New York, 2nd ed., 1966 (есть пере-
вод первого издания: Пфанн В., Зонная плавка. М., I960);
344
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
26. Rutter J. W., Chalmers В., Can. Journ. Phys., 31, 15 (1953).
27. Esaki L., Phys. Rev., 109, 603 (1958).
28. Hurle D. T. J., Solid State Electron., 3, 37 (1961).
29. Tiller W. А., в книге The Art and Science of Growing Crystals, ed.
J. J. Gilman, New York,. 1963, p. 277.
30. Dikhoff J. A. M., Solid State Electron., 1, 202 (1960).
31. Jackson К. А., в книге Crystal Growth, ed. H. S. Peiser, New York, 1967,
p. 17.
32. Strickland-Constable R. F., Kinetics and Mechanism of Crystallization,
New York, 1968.
33. Cahn J. W., Sekerka R. F.t в книге Crystal Growth, New York, 1967.
34. Coriell S. R., Parker R. L., в книге Crystal Growth, New York, 1967.
35. Tarshis L. A., Tiller W. А., в книге Crystal Growth, New York, 1967.
36. Kotler G. R., Tiller W. А., в книге Crystal Growth, New York, 1967.
37. Kotler G. R., Tiller W. A., Seidenstickers R. G., в книге Crystal Growth,
New York, 1967.
38. Williamson R. B., Chalmers В., в книге Crystal Growth, New York, 1967.
39. Mullins W. W., Sekerka R. F., Journ. Appl. Phys., 34, 323 (1963); 35, 444
(1964).
40. Jackson К. А., в книге Progress in Solid State Chemistry, vol. 4, ed.
H. Reiss, New York, 1967.
41*. Чернов А. А., УФН, 73, 277 (1961).
42*. Bennema P., Journ. Crystal Growth, 5, 29 (1969).
43*. Гиваргизов E. И., в книге IV Всесоюзное совещание по росту кристал-
лов, т. 2, Ереван, 1972, стр. 18.
44*. Богданов В., Русинова Р., Будевски Е., в книге IV Всесоюзное совещание
по росту кристаллов, т. 2, Ереван, 1972, стр. 11.
45*. Тихонова А. А., в книге IV Всесоюзное совещание по росту кристаллов,
т. 2, Ереван, 1972, стр. 85.
46*. Лаврентьева Л. Г., Захаров И. С., Ивонин И. В., Красильникова Л. М.,
в книге IV Всесоюзное совещание по росту кристаллов, т. 2, Ереван,
1972, стр. 70.
47*. Волков А. Ф., Панков Н. С., в книге IV Всесоюзное совещание по росту
кристаллов, т. 2, Ереван, 1972, стр. 180.
48*. Bennema Р., van Rosmalen R., в книге IV Всесоюзное совещание по росту
кристаллов, т. 2, Ереван, 1972, стр. 66.
49*. Леммлейн Г. Г., Секториальное строение кристалла, М., 1948.
50*. Чернов А. А., УФН, 100, 277 (1970).
51*. Мелихов И. В., в книге IV Всесоюзное совещание по росту кристаллов,
т. 2, Ереван, 1972, стр. 263.
52*. Воронков В. В., в книге IV Всесоюзное совещание по росту кристаллов,
т. 4, Ереван, 1972, стр. 110.
53*. Иванцов Г. 77., ДАН СССР, 83, 573 (1952).
К главе 4
1. Metals Handbook, 8th ed., Vol. 1, 1961; Vol. 2, 1964, ASM, Metals Park,
Novelty, Ohio.
2. Shaffer P. T. В., в книге High Temperature Materials — Materials Index,
Plenum Press, New York, 1964.
3. Samsonov G. V., в книге High Temperature Materials — Properties Index,
Plenum Press New York, 1964.
4. The Art and Science of Growing Crystals, Wiley, New York, 1963 (есть
перевод: Теория и практика выращивания кристаллов, изд-во «Метал-
лургия», 1968).
5. Burgers W. G., в книге [4], р. 417.
6. Smith С. S., Trans. AIME, 175, 15 (1951),
ЛИТЕРАТУРА
345
7. Aust К. Т', в книге [41, р. 452.
8. Mullins W. Г., Acta Met., 6, 414 (1958).
9. Sachs G., Van Horn K. R., Practical Metallurgy, ASM, Cleveland, 1940.
10. Muhlenbruch C. W., Testing of Engineering Materials, Van Nostrand, Prin-
ceton, N. J., 1944.
11. Muhlenbruch C. W., Experimental Mechanics and Properties of Materials,
Van Nostrand, Princeton, N. J., 1955.
12. Paschkis V., Persson J., Industrial Electric Furnaces and Applications, Wi-
ley, New York, 2nd ed., 1960.
13. Trinks W., Mawhinney M. H., Industrial Furnaces, Vol. I, 4th ed., 1951;
Vol. II, 2nd ed., 1942; Wiley, New York.
14. Langton L, L., Radio Frequency Heating Equipment, Pitman, London,
1949.
15. May E,, Industrial High Frequency Electric Power, Wiley, New York, 1950.
16. Temperature — Its Measurement and Control in Science and Industry,
Vol. 1, 2, 1962; Vol. 3, 1963, Reinhold, New York.
17. Buckley H. E., Crystal Growth, Wiley, New York, 1951, p. 92 (есть пере-
вод: Бакли Г., Рост кристаллов, ИЛ, 1954).
18. Carpenter Н. С. Н., Elam С. F., Proc. Roy. Soc., 100, 329 (1921).
19. Graham C. D., Maddin R., Journ. Inst. Metals, 83, 169 (1955).
20. Багарятский Ю. А., Колонцова E. В., Кристаллография, 4 (6), 935 (1959).
21. Honey combe R. W. K., Met. Rev., 4, 1 (1959).
22. Montuelle J., Compt. Rend., 248, 1174 (1959).
23. Montuelle J., Chaudron G., Compt. Rend., 240, 1167 (1955).
24. Lommel J. M., Trans. AIME, 218, 374 (1960).
25. Leighly H. P., Jr., Perkins F. C., Trans. AIME, 218, 379 (1960).
26. Beck P. A., Sperry P. R., Journ. Appl. Phys., 21, 150 (1950).
27. Fujiwara T., Journ. Sci. Hiroshima Univ., A9, 227 (1939).
28. Fujiwara T., Ichiki T., Journ. Phys. Soc. Japan, 10, 468 (1955).
29. Tiedema T. J., Acta Cryst., 2, 261 (1949).
30. Hagg G., Karlsson N.t Acta Cryst., 5, 728 (1952).
31. Guinier A., Tennevin J., Progr. Metal Phys., 2, 177 (1950).
32. Carpenter H. С. H., Tamura S., Proc. Roy. Soc., 113, 28 (1927).
33. Williamson G. K., Smallman R. E., Acta Met., 1, 487 (1953).
34. Beck P. A., Sperry P. R., Hu H., Journ. Appl. Phys., 21, 420 (1950).
35. Aust К. T., Dunn C. G., Trans. AIME, 209, 472 (1957).
36. Gane H., Bull. Inst. Met., 4, 94 (1958).
37. Parthasarathi M. N., Beck P. A., Trans. AIME, 212, 821 (1958).
38. Barret C. S., Massalski T. B., Structure of Metals, 3rd ed., McGraw-Hill,
New York, 1966.
39. Stein D. F., Low J. R.t Jr., Trans. AIME, 221, 744 (1961).
40. Holden A. V., Holloman J. H., Trans. AIME, 185, 179 (1949).
41. Allen H. P., Hopkins В. E., McLennan J. E., Proc. Roy. Soc., A234, 231
(1956).
42. Dunn C. G,, Honken G. C., Metals Progr., 64, 71 (1953).
43. Talbot J., Inst, de Recherche de la Siderurgie Rept. Series A, No. 137
(1956).
44. Talbot J., Compt. Rend., 251, 243 (1960).
45. Gensamer M., Mehl R. F., Trans. AIME, 131, 372 (1938).
46. Stone F. G., Trans. AIME, 175, 908 (1948).
47. Yamamoto M., Miyasawa R., Sci. Rept. Res. Inst. Tohoku Univ., A6, 333
(1954).
48. Legett R. D., Read R. E., Paxton H. Г., Trans. AIME, 215, 679 (1959).
49. Andrade E. N. da C., Proc. Roy. Soc., A163, 16 (1937).
50. Tsien L. C., Chow У. S., Proc. Roy. Soc., A163, 19 (1937).
51. Chen N. K., Maddin R., Pond R.t Trans. AIME, 191, 461 (1951).
52. Maddin R., Chen N, K., Trans. AIME, 197, 1131 (1953).
346
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
53. Nichols М. И., Phys. Rev., 94, 309 (1954).
54. Seraphim D. P., Budnick J. I., Ittner N. B.t III, Trans. AIME, 218, 527
(1960).
55. Armstrong P. E., Carlson 0. N., Smith J. E., Journ. Appl. Phys., 30, 36
(1959).
56. Churchman A. T., Proc. Roy. Soc., 226, 216 (1954).
57. Spachner S. A., Rostoker W., Trans. AIME, 215, 463 (1959).
.58. Smithells C. J., Tungsten, Chapman and Hall, London, 1952.
.59. Pintsch J., Gross Jahrb. Radiotech. Elektrotechnik, 15, 270 (1918).
60. Rieck G. D., Acta Met., 6, 360 (1958).
• 61. Swalin R. A., Geisler A. H.t Journ. Inst. Metals, 86, 129 (1958).
62. Millner T., Acta Tech. Acad. Sci. Hung., 17, 67 (1957).
• 63. Nichols M. H., Phys. Rev., 57, 297 (1940).
64. Hughes F. L., Levinstein H., Kaplan R., Phys. Rev., 113, 1023 (1959).
(65. Gifford F. E., Coomes E. A., Journ. Appl. Phys., 31, 235 (1960).
• 66. Robinson J., Journ. Appl. Phys., 13, 647 (1942).
(67. Lacombe P., de Libanati A. N., Calais D.t Compt. Rend., 249, 2769
(1959).
168. Lacombe P., et al., Journ. Inst. Met., 89, 358 (1961).
69. Cahn R. W., Acta Met., 1, 176 (1953).
770. Fisher E. S., Trans. AIME, 209, 882 (1957).
771. Edwards C. A., Pfeil L. H., Journ. Iron Steel Inst., 1, 129 (1924).
772. Dohi S., Yamoshita T., Mem. Defense Acad. Yokosuka, 2 (2) (1957).
773. Dunn C. G., Trans. AIME, 185, 72 (1949); Cold Working of Metals, ASM,
Cleveland, Ohio, 1949, p. 121.
74. Van Uitert L. G., Swanekamp F. W., Haszko S. E., Journ. Appl. Phys.,
30, 363 (1959).
75. Harrison D. E., Research, 12, 395 (1959).
76. Duwez P., Odell F., Taylor J. L., Journ. Am. Ceram. Soc., 32, 1 (1949).
77. Wilder D. R., Fitzsimmons F. S., Journ. Am. Ceram. Soc., 38, 66 (1955).
78. Burke J. E., Atom Movements, ASM, Cleveland, Ohio, 1951, p. 209.
79. Burke J. E., в книге Proc, of the Conference on Kinetics of High Tempera-
ture Processes, MIT Technical Press, Cambridge, Mass. 1959, p. 109.
80. Coble R. L., Journ. Appl. Phys., 32, 793 (1961).
81. Laudise R. А,, в книге Crystal Growth, ed. H. S. Peiser, Pergamon, New
York, 1967, p. 5.
82. Sellers D. J., et al., Journ. Am. Ceram. Soc., 50, 217 (1967).
83. McKeehan L. W., Nature, 119, 705 (1927).
84. Mercier J., Calais D., Lacombe P., Compt. Rend., 246, 110 (1958).
85. Levin E. M., Robbins C. R., McMurdie H. F., Phase Diagrams for Cera-
mists, American Ceramic Society, Columbus, Ohio, 1964, p. 84.
86. Clifford F., Dana’s System of Mineralogy, Vol. Ill, Wiley, 7th ed., N. Y.,
1962.
87. Классен-Неклюдова M. В., Механическое двойникование кристаллов,
Изд-во АН СССР, 1960.
88. Шубников А. В., Цинзерлинг Е. В., Ж. Крист., 83, 243 (1932).
89. Clifford F., Am. Mineralogist, 31, 58 (1946).
90. Wooster W. A., Wooster N., Nature, 157, 405 (1946).
91. Thomas L. A., Rycroft J. L., Fielding E. A., Nature, 157, 405 (1946).
92. Thomas L. A., Wooster W. A., Proc. Roy. Soc., A208, 43 (1951).
93. Fay H., Brandie C. D., в книге Crystal Growth, Pergarnon, 1967, p. 51.
94. Van Uitert L. G., Rubin J. J., Bonner W. N., IEEE Journ. Quantum Elec-
tronics, QE4, 662 (1968).
95. Wemple S. H., DiDomenico M.t Camlibel L, Appl. Phys. Lett., 12, 209
(1968).
96. Nassau K., Levinstein H. J., Loiacono G. M., Journ. Phys. Chem. Solids.,
27, 983, 989 (1966).
ЛИТЕРАТУРА
347
97. Bundy F. P., в книге Modern Very High Pressure Techniques, Butterworth,
London, 1962 (есть перевод: Современная техника сверхвысоких давле-
ний, изд-во «Мир», 1964).
98. Hall Н. Г, Rev. Sci. Instr., 31, 125 (1960).
99. Bundy F. P., et al., Nature, 176, 51 (1955).
100. Pease R. S., Acta Cryst., 5, 356 (1952).
101. Herold A., Marzluf B., Perio P., Compt. Rend., 246, 1866 (1957).
102. Wentorf R. H., Jr., Journ. Chem. Phys., 26, 956 (1957).
103. Wentorf R. H., Jr., Journ. Chem. Phys., 34, 809 (1961).
104. Coes L„ Jr., Science, 118, 131 (1953).
105. Boyd F. R., England J. L., Journ. Geophys. Res., 65, 749 (1960).
106. Keat P. P., Science, 120, 328 (1954).
107. Chao E. С. T., et al., Journ. Geophys. Res., 67, 419 (1962).
108. Dachille F., Roy R., Zs. Krist., Ill, 459 (1959); Journ. Am. Ceram. Soc.,
42, 78 (1959).
109. Bridgman P. W., The Physics of High Pressure, London, 1949 (есть пере-
вод: П. Бриджмен, Физика высоких давлений, М.—Л., 1951).
ПО. Hamann S. D., Physico-Chemical Effects of Pressure, New York, 1957.
111. Bradley R. S., High Pressure Physics and Chemistry, Vol. 1 and 2, Aca-
demic Press, New York, 1963.
112. Harrison D. E., Journ. Appl. Phys., 36, 1680 (1965).
113. Keezer R. C., Wood C., Moody J. W., Crystal Growth, ed. H. S. Peiser,
Pergamon, New York, 1957, p. 119.
114*. Китайгородский А. И„ Мнюх Ю. В., Асадов Ю. Г., Механизм и кине-
тики кристаллизации, Минск, 1964, стр. 360.
115*. Мнюх Ю. В., Мусаев Н. И., Китайгородский А. И., ДАН СССР, 174 (2),
345 (1967).
116. Асадов Ю. Г., Кристаллография, 12 (4) (1967).
117*. ГГетропавлов Н. Н., Мнюх Ю. В., Кристаллография, 16 (3), 643 (1971).
118*. Мусаев Н. И., Мнюх Ю. В., Кристаллография, 15 (3) 555 (1970).
119*. Цинзерлинг Е. В., Искусственное двойникование кварца, Изд-во АН
СССР, 1961.
120. New York Times, May 29, 1971, p. 1.
К главе 5
1. Bridgman P. W., Proc. Am. Acad. Arts Sci., 60, 303 (1925).
2. Stockbar ger D. C., Rev. Sci. Instr., 7, 133 (1936).
3. Stockbar ger D. C., Disc. Farad. Soc., 5, 294, 299 (1949).
4. Tammann G., Metallography, New York, 1925, p. 26.
5. Обреимов И. В., Шубников А. В., Zs. Phys., 25, 31 (1924).
6. Buckley Н. Е., Crystal Growth, Wiley, New York, 1951 (есть перевод:
Бакли F., Рост кристаллов, ИЛ, 1954).
7. Smakula A., Einkristalle, Berlin, 1962, рр. 214, 238.
8. Gilman J. J., в книге The Art and Sciene of Growing Crystals, New York,
1963, pp. 214, 314, 343, 365, 381, 410 (есть перевод: Теория и практика вы-
ращивания кристаллов, М., 1968).
9. Tanenbaum М., в книге Solid State Physics, vol. 6, Part A, New York,
1959, p. 86.
10. Lawson W. D., Nielsen S., в книге Preparation of Single Crystals, Butter-
worths, London, 1958, p. 14 (есть перевод: в сб. «Процессы роста и выра-
щивание монокристаллов», ИЛ, 1963, стр. 11).
11. Rhodes R. G., Imperfections and Active Centers in Semiconductors, New
York, 1964, p. 125.
12. Aust К. T., Chalmers B., Can. Journ. Phys., 36, 977 (1958).
13. Chalmers B., Proc. Roy. Soc., A175, 100 (1940).
348
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
14. Fleischer R. L., Davis R. S, Trans. AIME, 215, 665 (1959).
15. Guggenheim H„ Journ. Appl. Phys., 32, 1337 (1961); 34, 2482 (1963).
16. Wernick J. H., Benson K., Dorsi D., Journ. Metals, 9, 996 (1957).
17. Lovell L. C, Wernick J. H., Journ. Appl. Phys., 30, 234 (1959).
18. Nix F. C., Rev. Sci. Instr., 9, 426 (1938).
19. Siegel S., Phys. Rev., 37, 537 (1940).
20. Wernick J. H., Davis H. M., Journ. Appl. Phys., 27, 149 (1956).
21. Rowland P. R., Trans. Farad. Soc., 47, 193 (1951).
22. Капица FL, Proc. Roy. Soc., Al 19, 358 (1928).
23. Andrade E. N. da C., Roscoe R., Proc. Phys. Soc., 49, 152 (1937).
24. Lawson W. D., Journ. Appl. Phys., 22, 1444 (1951); 23, 495 (1952).
25. Edmund J. T., Brown R. F., Cunnell F. A., Services Electron. Res. Lab.
Tech. Journ., 6, 123 (1957).
26. Guggenheim FL, Journ. Phys. Chem., 64, 938 (1960).
27. McAfee К. B., Journ. Chem. Phys., 28, 218 (1958).
28. Guggenheim H. J., Kane J. V., Appl. Phys. Letters, 4, 172 (1964).
29. Fong F. K, Journ. Chem. Phys., 41, 2291 (1964).
30. Fong F. K, Journ. Chem. Phys., 41, 245 (1964).
31. Czochralski J., Zs. Phys. Chem., 92, 219 (1917).
32. Teal G. K., Little J. B., Phys. Rev., 78, 647 (1950).
33. Nassau K., Van Uitert L. G., Journ. Appl. Phys., 31, 1508 (1960).
34. Nassau K., Broyer A. M., Journ. Am. Ceram. Soc., 45, 474 (1962); Journ.
Appl. Phys., 33, 3064 (1962).
35. Johnson L. F., Nassau K, Proc. IRE, 49, 1704 (1961).
36. Kyropoulos S., Zs. f. Anorg. Chem., 154, 308 (1926).
37. Kyropoulos S, Zs. f. Phys., 63, 849 (1930).
38. Simpson P. G., Induction Heating, New York, 1960.
39. Brown H. G., Hoyler C. N., Bierwith R. A., Theory and Applications of
Radio Frequency Heating, Princeton, N. J., 1947.
40. Rubin J. J., Van Uitert L. G., Journ. Appl. Phys., 37, 2920 (1966).
41. Rubin J. J., Van Uitert L. G., Mater. Res. Bull., 1, 211 (1966).
42. Carruthers J. R., Nassau K., Journ. Appl. Phys., 39, 5205 (1968).
43. Slichter W. P., Burton J. А., в книге Transistor Technology, vol. I, Prin-
ceton, N. J., 1958, p. 107.
44. Reed T. В., в книге Crystal Growth, New York, 1967, p. 39.
45. Billig E., Proc. Roy. Soc., A229, 346 (1955).
46. Wilcox W. R., Fullmer L. D., Journ. Appl. Phys., 36, 2201 (1965).
47. Dash W. С., в книге Growth and Perfection of Crystals, New York, 1958,
p. 31.
48. Edwards W. D., Can. Journ. Phys., 38, 439 (1960) -
49. Cochran W. G., Proc. Cambr. Phil. Soc., 30, 365 (1934).
50. Goss A. J., Adlington R. E., Marconi Rev., 22, 18 (1959).
51. Muller A., Wilhelm M., Zs. Naturforsch., 19a, 254 (1964).
52. Hurle D. T. J., Phil. Mag., 13, 305 (1966).
53. Cole G. S., Winegard W. C., Can. Met. Quart, 1, 29 (1962).
54. Ballman A. A., Journ. Am. Ceram. Soc, 48, 112 (1965).
55. Utech H. P., Flemings M. C., Journ. Appl. Phys, 37, 2021 (1966).
56. Theuerer H. C„ Trans. AIME, 206, 1316 (1956).
57. Thurmond C. D., в книге Proc, of the Conference on Properties of Elemental
and Compound Semiconductors, New York, 1959, p. 12'1.
58. Trumbore F. A., Bell. System Tech. Journ, 39, 205 (1960).
59. Leverton W. F., Journ. Appl. Phys, 29, 1241 (1958).
60. Schafer FL, Homie R., Zs. f. Anorg. Allgem. Chem, 263, 261 (1950).
61. Dash W. C, Journ. Appl. Phys, 31, 736, 2275 (1960).
62. Nassau K., Loiacono G. M., Journ. Phys. Chem. Solids, 24, 1503 (1963).
63. Nassau K., Journ. Phys. Chem. Solids, 24, 1511 (1963).
64. Johnson L. F., et al, Phys. Rev, 126, 1406 (1962).
ЛИТЕРАТУРА
349
65. Van Uitert L. G., Rubin J. J., Bonner W. A., Journ. Am. Ceram. Soc., 46,
512 (1963).
66. Van Uitert L. G., Preziosi S., Journ. Appl. Phys., 33, 2908 (1962).
67. Preziosi S., Soden R. R., Van Uitert L. G., Journ. Appl. Phys., 33, 1893
(1962).
68. Ballman A. A., Journ. Am. Ceram. Soc., 48, 112 (1965).
69. Nassau K., Levenstein H. J., Loiacono G. M., Journ. Phys. Chem. Solids,
27, 983 (1966).
70. Lerner P., Legras C., Dumas J. P., Journ. Cryst. Growth., 3 (4), 231 (1968).
71. Van Uitert L. G.t Rubin J. J., Bonner W. A., IEEE Journ. Quantum Elec-
tronics, QE4, 622 (1968).
72. Monforte F. R., Swanekamp F. W., Van Uitert L. G., Journ. Appl. Phys.,
32, 959 (1961).
73. Charvat F. R., Nestor 0. H., Smith J. C., Semiannual Techn. Rep., Con-
tract No. 4132 (00), ARPAN 306-62, Union Carbide, Linde Division, Speed-
way Laboratories, Indianapolis, 1965.
74. Paladino A. E., Roiter B. D., Journ. Am. Ceram. Soc., 47, 465 (1964); 49,
51 (1966).
75. Linares R. C., Solid State. Commun., 2, 229 (1964).
76. Bardsley W., Cockayne В., в книге Crystal Growth, New York, 1967, p. 109.
77. Gremmelmaier R., Zs. f. Naturforsch., Ila, 511 (1956).
78. Metz E. P. A., Miller R. C., Mazelsky J., Journ. Appl. Phys., 33, 2016
(1962).
79. Mullin J. B., et al., Journ. Cryst. Growth., 3—4, 281 (1968).
80. Reed T. B., Pollard E. R., Journ. Cryst. Growth, 2, 243 (1968).
81. Pfann W. G., Zone Melting, 2nd ed., New York, 1966 (есть перевод:
Пфанн В., Зонная плавка, изд-во «Мир», 1970).
82. Keck Р. Н., Golay М. J. Е., Phys. Rev., 89, 1297 (1953).
83. Emeis R., Z. Naturforsch, 9a, 67 (1954).
84. Heywang W.t Ziegler G., Zs. f. Naturforsch., 9a, 561 (1954).
85. Heywang W., Zs. f. Naturforsch., Ila, 238 (1956).
86. Introduction to Electron Beam Technology, New York, 1962.
87. Class W.y Nestor H. R., Murray G. T., в книге Crystal Growth, New York,
1967, p. 75.
88. Verneuil A., Compt. Rend., 135, 791 (1902); 151, 1063 (1911).
89. Merker L., FIAT Rept. No. 1001 (1947).
90. Попов С. К., в сб. «Рост кристаллов», т. 2, М., 1959, стр. 140.
91. Bauer W. Н., Field W. G., в книге The Art and Science of Growing Crys-
tals, New York, 1963, p. 398 (есть перевод: Теория и практика выращи-
вания кристаллов, М., 1968).
92. Keck Р. Н., et al., Rev. Sci. Instr., 25, 298 (1954).
93. Dickinson S. K.t Field W. G., 1956, в книге The Art and Science of Grow-
ing Crystals, New York, 1963 (есть перевод: Теория и практика выра-
щивания кристаллов, М., 1968).
94. Reed Т. В., Journ. Appl. Phys., 32, 821, 2534 (1961).
95. Zilitinkovich S. J., Telegr. i Telef. b. Provod., 9 (6), 51 (1928).
96. Cobine J. D.t Wilbur D. A., Journ. Appl. Phys., 22, 835 (1951).
97. De LaRue R. E., Halden F. A., Rev. Sci. Instr., 31, 35 (1960).
98. Thermal Imaging Techniques, New York, 1964.
99. Wagner R. S., в книге Metallurgy of Elemental and Compound Semicon-
ductors, New York, 1961.
100. Bolling G. F.f Tiller W. A., Journ. Appl. Phys., 32, 2587 (1961); в книге
Metallurgy of Elemental and Compound Semiconductors, New York, 1961.
101. Темкин Д. E., Кристаллография, 7, 3 (1962).
102. Bennett A. L, Longini R. L., Phys., Rev., 116, 53 (1959).
103. Holmes P. J., в книге Metallurgy of Elemental and Compound Semicon-
ductors, New York, 1961.
350
Р. ЛОДИЗ. РОСТ монокристаллов
104. John Н. F.t Faust J. W., в книге Metallurgy of Elemental and Compound
Semiconductors, New York, 1961.
105. Seidensticker R. G.t Hamilton D. R.t Journ. Phys. Chem. Solids, 24, 1585
(1963).
106. Schadler W. H.t в книге The Art and Science of Growing Crystals, Wiley,
N. Y, 1963, p. 344 (есть перевод: Теория и практика выращивания кри-
сталлов, М, 1968).
107. Goss A. J., в книге The Art and Science of Growing Crystals, New York,
1963, p. 314 (имеется перевод: Теория и практика выращивания кри-
сталлов, М, 1968).
108. Berry С., West W., Moser F.t в книге The Art and Science of Growing
Crystals, Wiley, N. Y, 1963, p. 226 (есть перевод: Теория и практика
выращивания кристаллов, М, 1968).
109. Stansfield D., Phil. Mag., 1, 934 (1956).
110. Elam C. F., Proc. Roy. Soc., 112, 289 (1926).
111. Pearson R. F, Brit. Journ. Appl. Phys., 4, 342 (1953).
112. Bowles J. S, Trans. AIME, 189, 44 (1951).
113. Champier G., Compt. Rend., 243, 657 (1956).
114. Hash H. C, Smith C. S, Journ. Phys. Chem. Solids, 9, 113 (1959).
115. Степанов И. В., Феофилов П. П., в сб. «Рост кристаллов», т. 1, М, 1957,
стр. 229.
116. Hoyem A. G., Tyndall Е. Р. Т, Phys. Rev., 33, 81 (1929).
117. Jona F., Scherrer P., Helv. Phys. Acta, 25, 35 (1952).
118. Pfann W. G, Olsen К. M., Phys. Rev., 89, 322 (1953).
119. Bennett D. C., Sawyer B., Bell. System Tech. Journ., 35, 637 (1956).
120. Richards J. L., Journ. Appl. Phys., 31, 600 (1960).
121. Carlson R. G.t Journ. Electrochem. Soc., 106, 49 (1959).
122. Schadler H. W., Trans. AIME, 218, 649 (1960).
123. Geach G. A., Jones F. O, Journ. Less Common Metals, 1, 56 (1959).
124. Попов С. К., Изв. АН СССР, сер. физич., 10 (5—6), 505 (1946).
125. Alexander A. E., Journ. Chem. Educ, 23, 418 (1946).
126. Verneuil A, Nature, 32, 177 (1904); Ann. Chim. Phys, 3, 20 (1904).
127. Икорникова H. Ю., Попова А. А, ДАН СССР, 106 (3), 460 (1956).
128. Farben I. G„ FIAT, Rev. Ger. Sci. Rept. No. 655 (1945).
129. Bauer W. H., Gordon Moore С. H., Journ. Am. Ceram. Soc, 33, 140
(1950).
130. Gillette R. H., Rev. Sci. Instr, 21, 294 (1950).
131. Zerfoss S. L. R., Johnson L. R., Imber O, Phys. Rev, 75, 320 (1949).
132. Alexander A. E, Journ. Chem. Educ, 26, 254 (1949).
133. Merker L., Trans. AIME, 202, 645 (1955).
134. Halden F. A, Sedlacek R., Rev. Sci. Instr, 34, 622 (1963).
135. Lefever R. A, Rev. Sci. Instr, 33, 769, 1470 (1962).
136. Halden F. А, в книге Thermal Imaging Techniques, New York, 1964, p. 193.
137. Poplawsky P. P.t в книге Thermal Imaging Techniques, New York, 1964,
p. 269.
138. Witt A, Gatos H., Journ. Electrochem. Soc, 4, 511 (1969).
139. Fischer A. G., Journ. Electrochem. Soc, 117, 41C (1970).
140. Storey R. H., Laudise R. A, Journ. Cryst. Growth, 6, 261 (1970).
141. Материалы 1-го совещания по получению полупроводниковых монокри-
сталлов способом Степанова и перспективам их применения в приборо-
строении, Л, 1968.
142. Степанов А. В., в сб. «Проблемы современной кристаллографии», изд-во
«Наука», 1973.
143. La Belle Н. Е., Mlavsky А. /, Nature, 216, 574 (1967).
144. Chalmers В., La Belle Н. Е., Mlavsky А, /, в книге Crystal Growth, eds.
R. A. Laudise, J. B. Mullin, B. N. Mutaftschiev, Amsterdam, 1971, p. 84.
145*. Леммлейн Г, Г., Секториальное строение кристалла, М, 1948.
ЛИТЕРАТУРА
351
К главе 6
1. Brenner S. S., в книге The Art and Science of Growing Crystals, ed.
J. J. Gilman, New York, 1963, p. 30 (есть перевод: Теория и практика вы-
ращивания кристаллов, М., 1968).
2. Bradley R. S., в книге The Art and Science of Growing Crystals, ed.
J. J. Gilman, New York, 1963, p. 55.
3. Reynolds D. С., в книге The Art and Science of Growing Crystals, ed.
J. J. Gilman, New York, 1963, p. 62.
4. Glang R., Wajda E. S., в книге The Art and Science of Growing Crystals,,
ed. J. J. Gilman, New York, 1963, p. 80.
5. O'Connor J. R., в книге The Art and Science of Growing Crystals, ed,
J. J. Gilman, New York, 1963, p. 93.
6. Mason B. J.t в книге The Art and Science of Growing Crystals, ed. J. J. Gib
man, New York, 1963, p. 119.
7. Antell G. R., в книге Compound Semiconductors, Vol. I, eds. R. K. Willar-
son, H. L. Goering, New York, 1962, p. 288.
8. Metallurgy of Elemental and Compound Semiconductors, Vol. 12, ed. O. Gru-
bel, New York, 1961.
9. Vapor Deposition, eds. C. F. Powell, J. H. Oxley, J. M. Blocker, New York,
1966.
10. Schafer H.f Chemical Tansport Reactions, New York, 1964.
11. Single Crystal Films, eds. M. H. Francombe, H. Sato, New York, 1964.
12. Ellis W. С., в книге Techniques of Metals Research, ed. R. F. Bunshah,
Vol. I, Part 2, New York, 1968.
13. Silicon Carbide —A High Temperature Semiconductor, eds. J. R. O’Connor,
J. Smiltens, New York, 1960.
14. Reed T. B., LaFleur W. J., Appl. Phys. Letters, 5, 191 (1964).
15. Sears G. W., Acta Met., 3, 367 (1955).
16. Price P. B., Phil. Mag., 5, 473 (1960); Journ. Appl. Phys., 32, 1746 (1961).
17. Coleman R. V., Sears G. W., Acta Met. 5, 131 (1957).
18. Piper W. W., Polich S. J., Journ. Appl. Phys., 32, 1278 (1961).
19. Lely J. A., Ber. Deut. Keram. Ges., 32, 229 (1955).
20. Hamilton D. R., в книге Silicon Carbide —A High Temperature Semicon-
ductor, eds. J. R. O’Connor, J. Smiltens, New York, 1960, p. 67.
21. Marcus R. B., Journ. Appl. Phys, (в печати).
22. Holland L., Vacuum Deposition of Thin Films, London, 1963, p. 671.
23. Theuerer H. C., Hauser J. J., Journ. Appl. Phys., 35, 554 (1964).
24. Theuerer H. C., Hauser J. J., Trans. AIME, 233, 588 (1965).
25. Schwartz H., в книге Transactions of the 10th National Vacuum Sympo-
sium, New York, 1963, p. 325.
26. Sinclair W. R., Peters F. G., Stillinger D. W.t Koonce S. E., Journ. Electro-
chem. Soc., 112, 1096 (1955).
27. Williams J. C., Sinclair W. R., Koonce S. E., Journ. Am. Ceram. Soc., 46,
161 (1963).
28. Berry R. W., Bell Lab. Record, 41, 46 (1963).
29. Brewer L., в книге The Chemistry and Metallurgy of Miscellaneous Mate-
rials, ed. L. I. Quill, New York, 1950.
30. Kelley К. K., U. S. Bur. Mines Bull., 383 (1935).
31. Coughlin J. P., U. S. Bur. Mines Bull., 542 (1954).
32. Glassner, Alvin, The Thermochemical Properties of Oxides, Chlorides and
Fluorides to 2500 K, Argonne National Laboratory Rept. 5750, 1957.
33. Sagal M. W., неопубликованный отчет, Bell Telephone laboratories, 1966.
34. Oxley J. H., Blocker J. M., Journ. Electrochem. Soc., 108, 460 (1961).
35. Lustman B., Kerze F., The Metallurgy of Zirconium, New York, 1955.
36. Scholz H., Kluckow R., в книге Crystal Growth, ed. H. S. Peiser, New
York, 1967, p. 475.
352
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
37. van Arkel А. Е., de Boer J. Н., Zs. f. Anorg. Allgem. Chem., 148, 345
(1925).
38. van Arkel A. E., Metallwirtschaft, 13, 405 (1934).
39. Campbell I. E., Jaffee R. I., Blocker J. M., Garland J., Gonser W. B., Trans.
Journ. Electrochem. Soc., 93, 271 (1948).
40. Schafer H., Jacob H., Etzel K., Zs. f. Anorg. Allgem. Chem., 286, 42 (1956).
41. Чижиков Д. M,, Гринько A. M., Журн. неорг. химии, 4 (5), 979 (19o9).
42. Rolsten R. F., Iodide Metals and Metal Iodides, New York, 1961.
43. Czyzak S. J., Craig D. J., McCain С. E., Reynolds D. C., Journ. Appl. Phys.,
23, 932 (1952).
44. Greene L. C., Reynolds D. C., Czyzak S. J., Baker W. M., Journ. Chem.
Phys., 29, 1375 (1958).
45. Samelson H., Brophy V. A., Journ. Electrochem. Soc., 108, 150 (1961).
46. Kaldis E., Widmer R., Journ. Phys. Chem. Solids, 26, 1697 (1965).
47. Kaldis E., Journ. Phys. Chem. Solids, 26, 1701 (1965).
48. Brenner S. S, Journ. Appl. Phys., 27, 1484 (1956); Acta Met., 4, 62 (1956).
49. Theuerer H. C., Journ. Electrochem. Soc., 108, 649 (1961).
50. Mark A., Journ. Electrochem. Soc., 108, 880 (1961).
51. Moest R. R., Shupp B. R., Journ. Electrochem. Soc., 109, 1061 (1962).
52. Webb W. W., Forgeng W. D., Journ. Appl. Phys., 28, 1449 (1957).
53. Schaffer P. S, Journ. Am. Ceram. Soc., 48, 508 (1965).
54. Schaffer P. S, Vapor Phase Growth of Ruby Monocrystals, Semiannual
Technical Report, Contract No. NONR-4574 (00)-1 ARP A Order № 306,
Office of Naval Research, Physical Services Division, Karlington, February
1966, Lexington Laboratories, Cambridge, Mass.
55. DeVries R. C., Sears G. W., Journ. Chem. Phys., 31, 1256 (1959).
56. Kerrigan J. V., Journ. Appl. Phys., 34, 3408 (1963).
57. Edwards P. L., Happel R. J., Jr., Journ. Appl. Phys., 33, 943 (1962).
58. Tung S. K.t Caffrey R. E., Trans. Met. Soc. AIME, 233, 572 (1965).
59. Steinmaier W., Bloem J., Journ. Electrochem. Soc., Ill, 206 (1964).
60. Frosch C. J., Journ. Electrochem. Soc., Ill, 180 (1964).
61. Thurmond C. D., Frosch C. J., Journ. Electrochem. Soc., Ill, 184 (1964).
62. Holonyak N. Jr., Jillson D. C., Bevacqua S. F., в книге Metallurgy of Ele-
mental and Compound Semiconductors, ed. J. B. Schroder, Vol. 15, New
York, 1962, p. 49.
63. Holonyak N., Jr., Trans. AIME, 230, 276 (1964).
64. Hitsche R., в книге Crystal Growth, ed. H. S. Peiser, New York, 1967, p. 215.
65. Thorpe’s Dictionary of Applied Chemistry, eds. J. F. Thorpe, M. A. Whiteley,
Vol. II, New York, 4th ed, 1961, p. 357.
66. Marinace J. C., IBM Journ. Res. Develop, 4, 248 (1960).
67. Wajda E. S., Glang R., в книге Metallurgy of Elemental and Compound
Semiconductors, Vol. 12, ed. R. O. Grubel, New York, 1961, p. 229.
68. Maunail J. C., Baker W. E., Compton D. M. J., в книге Metallurgy of Ele-
mental and Compound Semiconductors, Vol. 12, ed. R. O. Grubel, New
York, 1961, p. 271.
69. Compound Semiconductors, Vol. I, eds. R. K. Willardson, H. L. Goering,
New York, 1962.
70. Riebling E. F., Webb W. W., Science, 126, 309 (1957).
71. Webb W. W., Journ. Appl. Phys, 36, 214 (1965).
72. Kagdis W. A., Journ. Electrochem. Soc, 109, 71C (1962).
73. Joyce B. A., Bradley R. A., Journ. Electrochem. Soc, 110, 1235 (1963).
74. Sangster R. C, Maverick E. F., Croutch M. L., Journ. Electrochem. Soc,
104, 317 (1957).
75. Allegretti J. E., Schombert D. J., Schaarschmidt E., Waldman J., в книге
Metallurgy of Elemental and Compound Semiconductors, Vol. 12, ed.
R. O. Gruble, New York, 1961, p. 255.
76. Litton F. B., Anderson H. C, Journ. Electrochem. Soc, 101, 287 (1954).
ЛИТЕРАТУРА 353
77. McCarty L. V., Journ. Electrochem. Soc., 106, 1036 (1959).
78. Herrick C. S., Krieble J. G., Journ. Electrochem. Soc., 107, 111 (1960).
79. Monchamp R. R., McAleer W. J., Pollak P. /., Journ. Electrochem. Soc., Ill,
879 (1964).
80. Miller K. J., Grieco M. J., Journ. Electrochem. Soc., 110, 1252 (1963).
81. Steinmaier W., Phillips Res. Rept., 18, 75 (1963).
82. Kendall J. T., в книге Silicon Carbide —A High Temperature Semiconductor,
eds. J. R. O’Connor, J. Smiltens, New York, 1960, p. 67.
83. Jeffes J. H. E., Journ. Cryst. Growth, 3—4, 13 (1968).
84. Nitsche R., Fort. Minerol., 44, 231 (1967).
85. Nicoll F. FL, Journ. Electrochem. Soc., 110, 1165 (1963).
86. Hoss P. A., Murray L. A., Riviera J. J., Journ. Electrochem. Soc., 115
(1968).
87. Mee J. E., Archer L.t Meade R. H.t Hamilton T. N., Journ. Appl. Phys., 10,
289 (1967).
88. Mee J. E., IEEE Trans, on Magnetics, 3-MAG, 190 (1967).
К главе 7
1. Van Hook A., Crystallization — Theory and Practice, New York, 1961, p. 209.
2. Buckley H. E., Crystal Growth, New York, 1951, p. 43 (имеется перевод:
Г. Бакли, Рост кристаллов, ИЛ, 1954).
3. Holden A., Singer Р., Crystals and Crystal Growing, New York, 1960.
4. Holden A., Thompson R. H., Growing Crystals with a Rotary Crystallizer,
New York, 1964.
5. Petrov T., Treivus E., Kasatkin A., Growing Crystals from Solution, New
York, 1969 (см. T. E. Петров, E. Б. Трейвус, А. Б. Касаткин, Выращи-
вание кристаллов из растворов, Л., 1967).
6. Void R. D., Void М. J., в книге Techniques of Organic Chemistry, Vol. 1,
Part I, ed. A. Weissberger, New York, 1949, ch. 7.
7. Linke W. F., Solubilities of Inorganic and Metal Organic Compounds
(Revision of Seidell’s Solubilities), Vol. 2, Princeton, N. J., 1965.
8. Stephen H., Stephen T., Solubilities of Inorganic Compounds, 5 Vols., New
York, 1963.
9. Gibbs W. E., Clayton W., Nature, 113, 492 (1924).
10. Walker A. C., Kohman G. T., Trans. Am. Inst. Elec. Eng., 67, 565 (1948).
11. Walker A. C„ Bell. Labs. Record, 25, 357 (1947).
12. Holden A. N., Disc. Faraday Soc., 5, 312 (1949).
13. Yamamoto T., Bull. Inst. Phys. Chem. Res. (Tokyo), 17, 1278 (1938).
14. Wagner R. S., в книге Whisker Technology, ed. A. P. Levite, New York,
1969.
15. Kohman G. T., Bell. Lab. Record, 28, 13 (1950).
16. Vonnegut K., Jr., Cat’s Cradle, New York, 1963.
17. Kolb E. D.t The Physics of Selenium and Tellurium, New York, 1969,
155 p.
18. Liesegang R. E., Zs. Physik. Chem. (Leipzig), 88, 1 (1914).
19. Bradford S. С., в книге Colloid Chemistry, ed. J. Alexander, New York,
1926, p. 790.
20. Holmes H. N., в книге Colloid Chemistry, ed. J. Alexander, New York,
1926, p. 796.
21. Ostwald W., Zs. Phys. Chem., 27, 365 (1897).
22. Rayleigh (Lord), Phil. Mag, 38, 738 (1919).
23. Henisch H. K., Dennis J., Hanoka J. L, Journ. Phys. Chem. Solids, 26, 493
(1965).
24. Henisch H. K., Hanoka J, I., Dennis J., Journ. Electrochem. Soc., 112, 627
(1965).
354
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
25. Eshelby J, Dt) Journ. Appl. Phys., 24, 176 (1953k
26. O'Connor J. J., DiPietro M. A., Armington A, F., Rubin B., Nature, 212,
68 (1966).
27. Dennis J.t Henisch H. K.t Journ. Electrochem. Soc., 114, 263 (1967).
28. Wakim F. G., Henisch H. K., Atwater H., Journ. Phys. Chem., 42, 2619
(1965).
29. Perloff D, S., Wold А., в книге Crystal Growth, ed. H. S. Pelser, New
York, 1967, p. 361.
30. Harrison J. A., Rangarajon S. K.t Trisk H. R., Journ. Electrochem. Soc.,
113, 1120 (1966).
31. Damojanovic A., Plating, 52, 1017 (1965).
32. Price P. B., Vermilyea D. A, Webb M. B., Acta Met., 6, 524 (1958).
33. Ballman A., Laudise R. А., в книге The Art and Science of Growing Crys-
tals, ed. J. J. Gilman, New York, 1963, p. 231.
34. Laudise R. А., в книге Progress in Inorganic Chemistry, Vol. Ill, ed.
F. A. Cotton, New York, 1962, p. 1.
35. Laudise R. A., Nielsen J. W., в книге Solid State Physics, Vol. 12, eds.
F. Seitz, D. Turnbull, New York, 1961.
36. de Senarmont H., Ann. Chim. Phys., 32, 129 (1851).
37. Spezia G.t Acad. Sci. Torino Atti, 40, 254 (1905).
38. Bridgman P. W.t The Physics of High Pressure, London, 1949 (имеется
перевод: И. Бриджмен, Физика высоких давлений, М.-Л., 1951).
39. Morey G. W., Niggli Р.у Journ. Am. Chem. Soc., 35, 1086 (1913).
40. King J, C., Wood D. L., Dodd D. M., Phys. Rev. Letters, 4, 500 (1960).
41. Laudise R, A., Kolb E. D„ Endeavour, 28 (105), 114 (1969).
42. Kennedy G. C., Am. Journ. Sci., 248, 540 (1950).
43. Monchamp R. R.t Puttbach R. C.t Nielsen J. W., Journ. Cryst. Growth,
2, 178 (1968).
44. Roy R., Tuttle O. F.t Phys. Chem. Earth, 1, 138 (1956).
45. Barns R. L.t Laudise R. A., Shields R. M., Journ. Phys. Chem., 67, 835
(1963).
46. Marshall D. J., Laudise R. А., в книге Crystal Growth, ed. H. S. Peiser,
New York, 1966, p. 557.
47. Laudise R. A., Journ. Am. Chem. Soc., 81, 562 (1959).
48. Laudise R. A., Sullivan R. A., Chem. Eng. Progr., 55, 55 (1959).
49. Laudise R. А., в книге The Art and Science of Growing Crystals, ed.
J. J. Gilman, New York, 1963, p. 252, 261.
50. Kolb E. D., Laudise R. A., Journ. Am. Ceram. Soc., 49, 302 (1966).
51. Laudise R. A., Batman A. A., Journ. Phys. Chem., 64, 688 (1960).
52. Kolb E. D.t Wood D. L., Spencer E. G., Laudise R. A., Journ. Appl. Phys.,
38, 1027 (1967b).
53. Ballman A. A., Laudise R. A., Rudd D. W., Appl. Phys. Letters, 8, 53
' (1966).
54. Nielsen J. W., Foster F. G., Am. Mineralogist, 45, 299 (1960).
55. Laudise R. A., Ballman A. A., Journ. Am. Chem. Soc., 80, 2655 (1958).
56. Kolb E. D., Wood D. L., Laudise R. A., Journ. Appl. Phys., 39, 1362
(1968).
57. Laudise R. A., Kolb E. D., DeNeufville J. P.^ Am. Mineralogist 50, 382
(1965).
58. Monchamp R. R.t Puttbach R. C., Hydrothermal Growth of Large Ruby
Crystals, ASD Project No. 8-132, AF Contract 33 (657) 10508, September
1964.
59. Laudise R. A., Kolb E. D., Journ. Am. Ceram. Soc., 45, 51 (1962).
60. Monchamp R. R.t Puttbach R. C., Nielsen J. №., Hydrothermal growth of
Zinc Oxide Crystals, Final Report for Contracts AF33 (657)-8795 and
AF33(615)-2228 Technical Report AFML-TR-67-144, Air Force Materials
Laboratory, Wright-Patterson Air Base, Ohio, June 1967, pp. 119, 143.
ЛИТЕРАТУРА
355
61. Laudise R. A., Kolb E. D.y Am. Mineralogist, 48, 642 (1963).
62. Laudise R. A., Kolb E. D.y Caporaso A. J., Journ. Am. Ceram. Soc., 47, 9
(1964).
63. Kolb E. D., Coriell A. S., Laudise R. A., Hutson A. R., Mater. Res. Bull.,
2, 1099 (1967).
64. White E. A. D.y в книге Techniques of Inorganic Chemistry, eds. H. B. Jonas-
sen, A. Weissberger, New York, 1965, p. 31.
65. Laudise R. A., Linares R. C.y Dearborn E. F., Journ. Appl. Phys. Suppl.,
33, 1362 (1962).
66. Hautefeuille P.y Perrey A., Compt. Rend., 106, 1800 (1888).
67. Remeika J. P., Journ. Am. Chem. Soc., 76, 940 (1954).
68. Wilson C. L.y в книге Comprehensive Analytical Chemistry, eds. C. L. Wil-
son, D. W. Wilson, New York, 1959, p. 27.
69. Paschkis V., Persson J., Industrial Electric Furnaces and Applications,
Vol. 1, New York, 1960, p. 295.
70. Levin E. M.y Robbins C. R.t McMurdie H. F., Phase Diagrams for Cera-
mists, Columbus, Ohio, 1964.
71. Ballman A. A., Laudise R. A., Journ. Am. Ceram. Soc., 48, 130 (1965).
72. Bertaut F.y Forrat F.y Compt. Rend., 242, 382 (1956).
73. Geller S.y Gileo M. A., Acta Cryst., 10, 239 (1957).
74. Nielsen J. W.y Dearborn E. F.y Journ. Phys. Chem. Solids, 5, 202 (1958).
75. Van Hook H. J., Journ. Am. Ceram. Soc., 44, 208 (1961); Single Crystal
Growth of Garnet Type Oxides, Parts 1 and 2, AF(19) (604)5511, prepar-
ed for Electronics Research Directorate, U. S. Air Force, Bedford, Mass.,
January 1961.
76. Nielsen J. W.y Journ. Appl. Phys., 31, 51S (1960).
77. Linares R. C., Joui^n. Am. Ceram. Soc., 45, 307 (1962).
78. Grodkiewicz W. H.y Dearborn E. F.y Van Uitert L. G.y в книге Crystal
Growth, ed. H. S. Peiser, New York, 1967, p. 441.
79. Wood D. L.y Remeika J. P.y Journ. Appl. Phys., 37, 1232 (1966).
80. Laudise R. А., в книге The Art and Science of Growing Crystals, ed.
J. J. Gilman, New York, 1963, p. 259.
81. Mertz W. J„ Phys. Rev., 76, 1221 (1949).
82. Rase D. E.y Roy R., Journ. Am. Ceram. Soc., 38, 102 (1955).
83. Nielsen J. W., Linares R. C.y Koonce S. E.y Journ. Am. Ceram. Soc., 45,
12 (1962).
84. Karan C., Skinner B. J.y Journ. Chem. Phys., 21, 2225 (1953).
85. Karan C.y Journ. Chem. Phys., 22, 957 (1954).
86. De Vries R. C., Journ. Am. Ceram. Soc., 42, 457 (1961).
87. De Vries R. C., Sears G. W.y Journ. Chem. Phys., 34, 618 (1961).
88. Von Hippel A., Tech. Rept. 178, Laboratory for Insulation Research, M. I.T.,
March 1963, p. 44.
89. Lefever R. A.y Torpy J. W.y Chase A. B., Journ. Appl. Phys., 32, 962
(1961).
90. Cross L. E., Nicholson B. J.y Phil. Mag., 46, 453 (1955).
91. Austerman S. B.y Доклад на Международной конференции по ВеО, Сид-
ней, Австралия, 1963, статья № 54.
92. Kelly J. W.y Доклад на Международной конференции по ВеО, Сидней,
Австралия, 1963, статья № 56.
93. Gambino R. J.y Leonhard F. J.t Journ. Am. Ceram. Soc., 44, 221
(1961).
94. Lefever R. A.y Chase A. B., Sodon L. E., Am. Mineralogist, 47, 1450
(1962).
95. Jona F.y Shirane G.y Pepinsky R.y Phys. Rev., 97, 1584 (1955).
96. Wickham D. G.y Journ. Appl. Phys., 33, 3597 (1962).
§7- Grodkiewicz W. H.y Nitti D. J., Journ. Am. Ceram. Soc., 49, 576 (1966).
98. Remeika J. P.y Journ. Am. Chem. Soc., 78, 4259 (1956).
356
Р. ЛОДИЗ. РОСТ МОНОКРИСТАЛЛОВ
99. Crystal Growth, ed. Н. S. Peiser, New York, 1967, p. 505.
100. Витина Л. M., Вестник Московского Университета, серия II (химия),
20 (4), 54 (1965).
101. Miller С. Е., Journ. Appl. Phys., 29, 233 (1958).
102. Reynolds G. F., Guggenheim H., Journ. Phys. Chem., 65, 1655- (1958).
103. Linares R. C., Journ. Appl. Phys., 35, 433 (1964).
104. Kestigian M., Journ. Am. Ceram. Soc., 50, 165 (1967).
105. Wolff G., Keck P. H., Broder J. D., Phys. Rev., 94, 753 (1954).
106. Wolff G., Herbert R. A., Broder J. D., Semiconductors and Phosphors,
New York, 1958, p. 463.
107. Miller J. F.t в книге Compound Semiconductors, Vol. 1, eds. R. K. Wil-
lardson, H. L. Goering, New York, 1962, p. 200.
108. Thomas D. G., Gershehzon M., Trumbore F. A., Phys. Rev., 133, A269
(1964).
109. Nelson H., RCA Rev., 24, 603 (1963).
110. Lorenz M. R., Pilkuhn M., Journ. Appl. Phys., 37, 4094 (1966).
111. Trumbore F. A., Kowalchik M., White H. G.t Journ. Appl. Phys., 38, 1987
(1967).
112. Logan R. A., White H. G., Trumbore F. A., Appl. Phys. Letters, 10, 206
(1967).
113. Linares R. C., Journ. Cryst. Growth № 3—4, 443 (1968).
114. Smakula A., Einkristalle, Berlin, 1962, p. 154.
115. Pfann W. G., Trans. AIME, 203, 961 (1955).
116. Pfann W. G., Zone Melting, New York, 1966, p. 254 (имеется перевод!
В. Пфанн, Зонная плавка, изд-во «Мир», 1970).
117. Mlavsky А. Weinstein М., Journ. Appl. Phys., 34, 2885 (1963).
118. Griffiths L. В., Mlavsky A. L, Journ. Electrochem. Soc., Ill, 805
(1964).
119. Broder J. D., Wolff G. A., Journ. Electrochem. Soc., 110, 1150 (1963).
120. Plaskett T. S., Blum S. E., Foster L. M., Journ. Electrochem. Soc., 114,
1303 (1967).
121. Wagner R. S, Ellis W. C., Trans. AIME, 233, 1053 (1965).
122. Wagner R. S., Doherty C. J., Journ. Electrochem. Soc., 113, 1300 (1967).
123. Barns R. L., Ellis W. C., Journ. Appl. Phys., 36, 2296 (1965).
124. Wolfe С. M., Nuese C. J., Holonyak N.t Journ. Appl. Phys., 36, 3790
(1965).
125*. Гордеева H. В., Шубников А. В., Кристаллография, 12, 2, 131 (1967).
126*. Бажал И. Г., Кристаллография, 14, 1106 (1969).
127*. Бажал И. Г., Куриленко О. Д., Палаш. Е. Н., Теоретические основы хи-
мической технологии, 3, 931 (1969).
128*. Бажал И. Г., Исследование механизма рекристаллизации в диперсных
системах, автореферат диссертации па соискание ученой степени доктора
технических наук, Институт коллоидной химии и химии воды, АН УССР,
Киев, 1972.
129*. Тимофеева В. А., Дохновский И. Б., Кристаллография, 16, 616 (1971).
130*. Beckris J., Razymney О. М., fundamental Aspects of Electrocrystallization,
New York, 1967, p. 155.
131*. Горбунова К. M., Рост кристаллов, т. 1, М., 1957, стр. 48.
132*. Полукаров Ю. М„ Феклисов Г. А., Электрохимия, 3, 323 (1967).
133*. Горбунова К. М., в книге Физико-химические проблемы кристаллизации,
Алма-Ата, 1969, стр. 41.
134*. Полукаров Ю. М., Гамбург Н. Д., Семенова 3. В., в книге Физико-хими-
ческие проблемы кристаллизации, Алма-Ата, 1969, стр. 147.
135*. Ткачик 3. А., Горбунова К. М., Севастьянов Э. С., Электрохимия, 5, 351
(1969).
\36*.Ткачик 3. А., Горбунова К. М., Севастьянов Э. С., Электрохимия, 5,
1125 (1969).
ЛИТЕРАТУРА
357
-Л_*
137*. Ткачик 3. А., Горбунова К. М., в книге Электрохимические процессы
при электрокриеталлизации и анодном растворении металлов, М., 1969,
стр. 88.
138*. Каилиев Р., Будевски Е., Contemp. Phys., 8, 489 (1967).
139*. Будевски Е., Бостанов В., Витанов Т., Стоинова 3., Коцева А., Каи-
шев Р., Электрохимия, 3, 856 (1967).
140*. Бостанов В., Русинова Р., Будевски Е., в книге Труды IV Всесоюзного
совещания по росту кристаллов (механизм и кинетика роста кристал-
лов), ч. II, Ереван, 1972, стр. 11.
141*. Икорникова И. Ю., Лобачев А. И., Васенин А. Р., Егоров В. М., Анто-
шин А. В., в книге Исследование процессов кристаллизации в гидротер-
мальных условиях, М., 1970, стр. 212.
142*. Вукалович М. П., Таблицы термодинамических свойств воды и водяного
пара, 6-е и 7-е изд., М., 1965, 1967.
143*. Равич М. И., Боровая Ф. М., Журн. неорг. химии, 8, 1 (1963); 9, 4
(1964); 13, 7 (1968).
144*. Самойлович Л. А., Летчиков Л. Н., ДАН СССР, 180, 6 (1968).
145*. Самойлович Л. А., Новожилова Ж. В., в книге Минералогическая тер-
мометрия и барометрия, М., 1965, стр. 67.
146*. Икорникова Н. Ю., Егоров В. М., в книге Гидротермальный синтез кри-
сталлов, М., 1968, стр. 58.
147*. Икорникова И. Ю., Егоров В. М., Васенин А. Р., ДАН СССР, 192, 407
(1969).
148*. Br/л Б. М., Гольдман И. М„ ДАН СССР, 46, 154 (1945).
149*. Вул Б. М., Электричество, 3, 12 (1946).
150*. Гиваргизов Е. И., Чернов А. А., Кристаллография (1973), в печати.
151*. Гиваргизов Е. И., в книге Труды IV Всесоюзного совещания по росту
кристаллов (механизм и кинетика роста кристаллов), ч. 11, Ереван,
1972, стр. 18.
152. Kurtz S. К., Bergman J. G., Perry Т. Т., Bull. Amer. Phys. Soc., 13, 388
(1968).
153. Hanoka J. /., Journ. Appl. Phys. 40, 2694 (1969).
154. Laudise R. А., в книге Crystal Growth, ed. H. S. Peiser, Pergamon, New
York, 1967, p. 3.
Р. ПАРКЕР
МЕХАНИЗМЫ
РОСТА КРИСТАЛЛОВ
ЭНЕРГЕТИКА, КИНЕТИКА,
ПРОЦЕССЫ
ПЕРЕНОСА
ПРЕДИСЛОВИЕ АВТОРА
К РУССКОМУ ИЗДАНИЮ
Я считаю честью и удовольствием для себя написать преди-
словие к русскому изданию моего обзора «Механизмы роста
кристаллов», опубликованного по-английски в 25 томе серии
«Физика твердого тела». Этот обзор был написан с точки зре-
ния физика и имел целью изложить физические основы для по-
нимания процессов роста кристаллов. Поставив такую задачу,
я должен был сконцентрировать внимание на фундаментальных
вопросах и пройти мимо множества публикаций, касающихся
технологии и аппаратуры, сведения о которых читатель может
найти в обстоятельной книге Лодиза «Рост монокристаллов».
Выращивание кристаллов и исследования по росту кристал-
лов развиваются в последние годы небывалыми темпами, так
что теперь этим проблемам посвящается больше 1000 публика-
ций в год. Хотя многие из них посвящены практическим вопро-
сам роста конкретных материалов, необходимо иметь в виду, что
действительное понимание приходит лишь при детальном ана-
лизе отдельных сторон процесса, а именно переноса массы, по-
верхностной кинетики, устойчивости, гидродинамики, а также
множества других факторов, разбираемых в моем обзоре. Хо-
чется надеяться, что этот обзор будет способствовать такому
пониманию. Известно, без сомнения, что во многих научно-ис-
следовательских институтах и университетах Советского Союза,
особенно в Институте кристаллографии в Москве, ведутся фун-
даментальные, высококачественные исследования по кристалли-
зации. Тем более мне приятно поблагодарить А. А. Чернова и
А. Н. Лобачева и их коллег из этого института Е. И. Гиварги-
зова, Л. Н. Демьянец, В. А. Кузнецова, И. П. Кузьмину и
А. М. Мельникову за перевод моей работы.
Р, Л. Паркер
ВВЕДЕНИЕ
ОБЩИЕ ЗАМЕЧАНИЯ
Цель, которую я преследую в данном обзоре — рассмотреть
с точки зрения физика и систематизировать те крайне раз-
личные явления, которые понимаются под кристаллизацией.
В частности, в нем предпринята попытка провести физическую
канву, позволяющую разобраться в механизмах этих явлений.
Эта канва основывается на применении статистической меха-
ники, термодинамики, кинетической теории и особенно теории
переноса к исследованию кристаллизации. При составлении об-
зора предпочтение отдавалось тем работам, в которых содер-
жатся экспериментальные или расчетные количественные оценки
процессов, происходящих в четко определенных условиях. В об-
зоре не отражены многочисленные теоретические работы, содер-
жащее столько произвольно заданных параметров, что их под-
бор позволяет добиться совпадения рассчитанных значений
почти с любыми экспериментальными данными; не нашло здесь
отражения и множество описаний чисто качественных экспери-
ментов и экспериментов, поставленных в неопределенных усло-
виях. Методы и аппаратура для выращивания кристаллов в
обзоре не затрагиваются. Не рассматриваются также исследо-
вания превращений в твердой фазе и исследования кристалли-
зации полимеров, потому что они представляют собой две
самостоятельные большие отрасли знаний.
Проблема кристаллизации находится на стыке нескольких
областей науки в том смысле, что вклад в ее решение вносили
и вносят ученые и инженеры разных специальностей: специали-
сты по физике твердого тела, минералоги, кристаллографы, фи-
зико-химики, математики, инженеры-химики, металлурги и,
видимо, ученые многих других направлений. Столь же различны
издания, в которых публикуются результаты исследований по
росту кристаллов, факультеты университетов и отделы научно-
исследовательских учреждений, проводящие такие исследования.
Обзор неизбежно отразит это разнообразие взглядов, однако
вначале хотелось бы рассмотреть проблему, насколько это воз-
можно, с более общей точки зрения.
Обзор состоит из восьми глав, в каждой из которых проблемы
кристаллизации рассматриваются с точки зрения отдельных
362
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
разделов физики. Вначале анализ проводится на основе пред-
ставлений более общих физических дисциплин, т. е. термодина-
мики и статистической механики, а затем обсуждаются более
узкие вопросы, например массоперенос и гидродинамика. В каж-
дой главе обсуждение проводится в порядке усложнения — от
простейшей формы или морфологии, рассматриваемой при про-
стейших условиях, к более сложным формам и более сложным
условиям.
Уже стало обыкновением считать кристаллизацию скорее ис-
кусством, нежели наукой. Как будет видно из обзора, скорость,
с которой искусство превращается в науку, за последние 15 лет
значительно возросла, однако отдельные части науки о кристал-
лизации не всегда еще связаны между собой и описать кристал-
лизацию как единый, цельный процесс невозможно. Устано-
вление такой связи должно стать целью дальнейших иссле-
дований.
НЕПРЕРЫВНЫЕ И СКАЧКООБРАЗНЫЕ ПРЕВРАЩЕНИЯ
Можно хотя бы мысленно представить себе, что с пониже-
нием температуры для всех молекул жидкости одинаково, по-
степенно и непрерывно устанавливается дальний порядок с даль-
нейшим переходом в кристаллическое состояние. Подобный же
процесс можно представить себе и для кристаллизации из пара
или из раствора.
Однако все наблюдения и эксперименты показывают, что
процесс кристаллизации, напротив, происходит только в малой
части пространства, занимаемого системой, а именно на поверх-
ности раздела между уже существующим кристаллом (зароды-
шем или затравкой) и маточной средой. Скачкообразность или
пространственная неоднородность процесса выражается в том,
что кристаллизующаяся система состоит из двух разных частей,
соприкасающихся друг с другом — из жидкой маточной среды
и кристалла.
Такой прерывный характер фазового перехода отвечает тер-
модинамическому описанию плавления, конденсации и выделе-
ния новой фазы как переходов первого рода, т. е. таких превра-
щений, при которых происходит изменение объема и теплосо-
держания (существует скрытая теплота перехода). Существова-
ние скрытой теплоты отражает резкое возрастание энтропии S
при плавлении, т. е. свидетельствует, как нам известно, об уве-
личении беспорядка. Отсюда следует резкое изменение наклона
кривой, описывающей зависимость свободной энергии Гиббса G
от температуры Т при постоянном давлении р, так как
(дй/дТ)р = —S. Таким образом, существует еще и разрыв ма-
тематического характера, а именно разрыв непрерывности нак-
ВВЕДЕНИЕ
363
лона функции Гиббса, который возникает при пересечении функ-
ций Гиббса двух фаз и отражает пространственную несплош-
ность этих фаз с разными энтропиями и разными удельными
объемами (см. также гл. I).
Непрерывное с точки зрения термодинамики фазовое превра-
щение (превращение второго рода, когда производные первого
порядка от G непрерывны) может происходить одновременно
во всем объеме (однородно), хотя это и не обязательно. Как
показал Тернбалл [1], примером такого пространственно-одно-
родного превращения могут служить некоторые превращения
типа порядок — беспорядок, в частности переход в сверхпрово-
дящее состояние.
ПРОЦЕССЫ ПЕРЕНОСА;
МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ
Итак, процесс кристаллизации пространственно неоднороден
и происходит лишь в некоторой части кристаллизующейся си-
стемы, а именно на поверхности раздела фаз. Следовательно,
кристаллизующееся вещество должно перемещаться к этой по-
верхности из объема жидкой маточной среды, а при росте из
расплава от фронта роста должна отводиться теплота кристал-
лизации. Эти процессы называют процессами переноса. Они
^образуют вместе с процессами, происходящими на самой поверх-
ности раздела фаз, полную совокупность процессов, определяю-
щих рост кристаллической затравки или зародыша. Анализ ме-
ханизма роста кристаллов должен касаться обеих названных
сторон явления и к тому же еще процессов зарождения кри-
сталлов. Как показал Мотт [2], процессы переноса, в том числе
и перенос тепла и диффузию вещества, обычно можно рассмат-
ривать макроскопически. Поверхностные процессы, напротив,
связаны с атомной структурой.
Скорость превращения в данной конкретной системе опреде-
ляется скоростью самых медленных процессов, каковыми могут
быть и процессы переноса, и поверхностные процессы, и те и
другие вместе, да еще во взаимодействии друг с другом. При
росте из расплава теплота кристаллизации отводится либо че-
рез кристалл, либо через переохлажденный расплав. В первом
случае распределение температуры устойчиво по отношению к
искажениям формы фронта кристаллизации. Во втором случае,
если кинетические процессы на поверхности раздела фаз идут
достаточно быстро, то распределение температуры неустойчиво,
поскольку движущая сила кристаллизации на возмущенном
участке тогда тем больше, чем сильнее он выступает в переох-
лажденный расплав. Подобным же образом при росте из пере-
сыщенного раствора поверхность становится неустойчивой при
364
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
быстрых поверхностных процессах по той же причине. На обра-
зовавшихся выступах часто возникают новые бугорки, а все
вместе развиваются в разветвленное образование, называемое
дендритом.
ПЛОСКИЕ ГРАНИ
Плоские грани часто, но далеко не всегда, наблюдаются на
Кристаллах, растущих из различных маточных сред. Как пока-
зал Франк [3, 4], образование плоских граней при росте кри-
сталлических многогранников нельзя объяснить, не вводя пред-
ставления о ступеньках (слоях) роста, которые распространяют-
ся тангенциально от их источников. И хотя в поле диффузии пе-
ресыщение около участка поверхности, находящегося у ребра
или вершины многогранника, больше, чем в середине грани, в
действительности такой участок не растет быстрее. Таким обра-
зом, нет «локального» граничного условия, которое было бы
вполне корректно. Самым типичным источником ступенек слу-
жит дислокация или группа дислокаций. Подробно слоистый
рост анализируется в гл. V. Однако для задачи о росте огра-
ненных кристаллов, форма которых определяется действием ис-
точников слоев, не найдено решения, учитывающего одновре-
менно перенос в объеме среды и кинетические явления на по-
верхности раздела фаз и не использующего локальное граничное
условие. Отыскание такого решения сопряжено с огромными
трудностями1). Кристалл не превращается в дендрит, сохраняя
гранную форму, видимо, из-за сильного влияния поверхностных
процессов.
С другой стороны, многие вещества и системы образуют не-
ограненные кристаллы; для них, возможно, справедливо локаль-
ное условие. Рост таких кристаллов подробно рассмотрен в
гл. III, посвященной задаче Стефана.
МОРФОЛОГИЯ КРИСТАЛЛОВ
Как уже можно догадываться, проблема определения формы
или морфологии кристаллов очень сложна. При ее разрешении,
вообще говоря, приходится учитывать взаимодействие между
процессами переноса и кинетическими явлениями на поверхности
раздела фаз, а также решать вопрос о морфологической устой-
чивости (гл. VI). Фантастическое богатство форм снежинок
убедительно свидетельствует о сложности этой задачи.
*) На реальных гранях практически всегда имеется достаточно много
ступеней, испущенных источниками слоев. Поэтому скорость роста в данной
точке даже послойно растущей поверхности можно определить через локаль-
ное пересыщение и локальную плотность числа ступеней (см. [323]).—
Прим. ред.
ВВЕДЕНИЕ 365
Форма кристалла отражает, несомненно, кристаллическую
структуру и характер взаимодействия между атомами, однако
влияние этих факторов на форму кристалла осуществляется бла-
годаря кинетическим явлениям на поверхности; при выяснении
морфологии эти явления следует рассматривать вместе с про-
цессами переноса. Предмет частых обсуждений — традиционная
равновесная форма (форма, свободная энергия которой мини-
мальна) — редко сохраняется под действием упоминавшихся не-
равновесных процессов, влияющих на форму кристалла, прежде
всего по той причине, что в пересыщенной среде эффект Гибб-
са— Томсона относительно мал для кристаллов с размерами,
превышающими несколько микрометров. К тому же, как показал
Херринг [6], при незначительном изменении предположений, на
основе которых рассчитывается равновесная форма, последняя
существенно меняется.
I
ТЕРМОДИНАМИКА ФАЗОВЫХ ПРЕВРАЩЕНИЙ;
ФЕНОМЕНОЛОГИЧЕСКИЙ ПОДХОД
1. ВВЕДЕНИЕ
Мне представляется, что статистическая механика, которая
посвящена предсказанию поведения систем, состоящих из мно-
жества молекул, есть самая общая дисциплина из тех, на кото-
рых основывается наука о росте кристаллов. Однако мы начнем
рассмотрение с термодинамики, которая позволит нам охарак-
теризовать предмет науки о росте кристаллов и установить дви-
жущие силы кристаллизации. Разумеется, термодинамика рав-
новесного состояния не может дать ответа на интересующие нас
вопросы: какова скорость присоединения молекул к кристаллу
при данном значении движущей силы и где они присоединяются,
т. е. какова форма кристалла. На эти вопросы отвечает теория
процессов переноса и теория кинетических явлений, происходя-
щих на поверхности раздела фаз.
Термодинамика, далее, не может объяснить (т. е. предска-
зать, не используя произвольно заданных параметров) суще-
ствование или происхождение фазовых превращений. Как заме-
тил Уленбек [7], диаграммы состояния, показывающие кривые
плавления, испарения и сублимации, а также тройную и крити-
ческую точки, настолько привычны для нас, что мы не находим
нужным объяснять их; мы забываем при этом, что они не были
выведены из более общих принципов или что температуру плав-
ления, например, нельзя определить из общих принципов. От-
сутствие достаточных теоретических оснований подобного ро-
да— одна из причин того, что учение о росте кристаллов до сих
пор остается отрывочным и состоит из не очень сильно связан-
ных друг с другом кусков (современное состояние возможностей
предсказания поведения некоторых разреженных газов проана-
лизировал Видом [8]: см. также гл. II).
2. ТЕРМОДИНАМИКА РАВНОВЕСИЯ ОБЪЕМОВ ФАЗ
Термодинамика фазовых равновесий — это тот раздел термо-
динамики, в котором рассматриваются фазовые превращения
веществ, например сублимация, плавление и испарение. Для
реального вещества экспериментально определяют в координа-
тах р, V и Т (давление, объем и температура) поверхность, ха-
I. ТЕРМОДИНАМИКА ФАЗОВЫХ ПРЕВРАЩЕНИЙ
367
рактеризующую его состояние (фиг. 1); заштрихованные обла-
сти поверхности представляют собой участки, где находятся в
равновесии две фазы. Начала термодинамики (первое и второе)
в применении к таким поверхностям говорят нам о том, как
связаны друг с другом при обратимом превращении изменения
таких характеристических функций, как внутренняя энергия U,
гиббсова свободная энергия G и объем. При расчетах фазовых
превращений особенно полезна характеристическая функция
Фиг. 1. Диаграмма состояния в координатах р, V и Т с кривыми сублима-
ции (/), плавления (2) и испарения (5) [23].
Гиббса G = Н — TS = U-\-pV—TS (Н — энтальпия, S — эн-
тропия) [9], поскольку
dU-=TdS-pdV -Y^iV^dnj, dG = V dp - S dT + dn{. (2.1)
Независимыми переменными здесь служат р, Т и р/, pj пред-
ставляет собой химический потенциал /-й компоненты, присут-
ствующей в количестве tij молей. Для обратимого изотермо-изо-
барического процесса в однокомпонентной системе dG = 0, т. е.
G постоянно и принимает минимальное значение. Следовательно,
уравнения, описывающие кривые сублимации, плавления и испа-
рения (линии пересечения заштрихованных поверхностей равно-
весия фаз с плоскостями постоянного объема), выводят уравни-
ванием молярных функций Гиббса соответствующих фаз. На-
клоны кривых сублимации, плавления и испарения описываются
уравнением Клаузиуса — Клапейрона
do ДЯ
</Г=ТдТ’ (2.2)
368
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
выводимым из соотношения (2.1). Здесь Д/7— разность моляр-
ных энтальпий, a AV — разность молярных объемов двух сосу-
ществующих фаз.
Подобные фазовые превращения представляют собой пре-
вращения первого рода, так как они сопровождаются измене-
нием объема и теплосодержания (скрытой теплоты превраще-
ния). Первые производные G [(dG/dT)j> = —S и (dGJdp)T= + V]
при таких превращениях меняются скачкообразно. Беспорядок
Фиг. 2. Температурная зависимость свободной энергии Гиббса G кристалла
(сплошная кривая) и расплава (штриховая кривая) при разных давлениях
(.Pi < Рг< Рз) [28].
Тпл —температура плавления при давлении
при этом резко возрастает, как это происходит, например, при
плавлении кристалла. Пользуясь правилом фаз Гиббса, можно
Показать, что есть только одна точка, в которой возможно одно-
временное существование трех фаз — твердой, жидкой и газо-
образной.
Тот факт, что фазовое превращение при постоянном давлении
имеет скачкообразный характер и что оно происходит при по-
стоянной температуре, можно «объяснить», заметив, что усло-
вие dG = 0 есть принцип минимальности: вещество переходит в
то состояние, в котором функция Гиббса G минимальна. При
заданном давлении и Т < Гпл (Лтл — температура плавления)
функция Гиббса G для твердой фазы меньше, чем для жидкой;
при Т> Тпл выполняется обратное соотношение (фиг. 2). Если
процесс плавления проводится обратимо, то вещество должно
плавиться при температуре Гпл(р), когда функции G для обеих
фаз одинаковы. [Напомним, что S = —(dGldT)p] Из всего из-
ложенного вырисовывается представление об устойчивости
I. ТЕРМОДИНАМИКА ФАЗОВЫХ ПРЕВРАЩЕНИЙ
369
фазы: устойчива та фаза, у которой свободная энергия меньше.
Задают термодинамический вопрос: «Почему при низких темпе-
ратурах кристалл устойчивее жидкости?» Это все равно, что
спрашивать о том, почему диаграммы состояния имеют прису-
щий им вид. Мы кратко обсудим этот вопрос в гл. II (см. также
работы Тернбалла [9] и Темперли [10])1)-
Влияние других химических веществ, вводимых в систему,
учитывается в уравнении (2.1) химическими потенциалами pj.
В этом случае анализ диаграммы состояния усложняется [9].
При равновесии химический потенциал каждой компоненты во
всей системе одинаков.
3. ТЕРМОДИНАМИКА ПОВЕРХНОСТЕЙ
РАЗДЕЛА ФАЗ
Классический подход. Образование одной фазы внутри дру-
гой или на другой предполагает образование поверхности новой
фазы или поверхности раздела между фазами; определение энер-
гии этих поверхностей может составить значительную часть за-
дачи. В последние годы получил существенное развитие термо-
динамический подход к решению этой задачи, хотя расчет по-
верхностных энергий, так же как и объемных, был в основных
чертах развит Гиббсом еще в XIX в. Классические результаты
можно обобщить, заметив, что обратимая работа, совершаемая
поверхностью раздела между двумя жидкостями аире по-
верхностным натяжением у при своем расширении на dA, рав-
на— ydA\ следовательно, уравнение (2.1) преобразуется теперь
к виду
dU = ТdS — ра dVa — dV^ + Z Ц/ + Y dA. (3.1)
Отсюда можно показать [9], что если поверхность раздела между
фазами аир имеет главные радиусы кривизны и /?2, то дав-
ления в этих двух фазах ра и р$ связаны друг с другом соот-
ношением
р£> — Ра = Y » (3-2)
наконец, химический потенциал цр, г внутри сферической капли
радиусом г будет равен оо + Гр(2у/г), если считать постоян-
ным объем Гр (молярный объем фазы Р), т. е. р,и»г превосходит
химический потенциал в объеме цр, оо на величину Гр(2у/г).
Поверхностное натяжение у (работа образования поверхно-
сти единичной площади) численно равно напряжению на по-
верхности (сила на единицу длины) для поверхности раздела
двух жидкостей, но не для поверхности раздела твердой и
1) См. также работу [28]. — Прим, ред.
370
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
жидкой фаз. Для ограненного кристалла с линейным размером I
и объемом V, у которого поверхностное натяжение может за-
висеть от ориентации, аналог приведенного выше уравнения
запишется в следующем виде (Тернбалл [9], Херринг [11]):
d У1 vA
= + <3-3)
Здесь — сумма произведений поверхностных натяжений
граней на площади этих граней (точное определение у см. в
гл. V). Геометрическое построение равновесной (т. е. имеющей
минимальную для данного объема сумму формы опреде-
ляется теоремой Вульфа [11].
Поверхностное напряжение. В твердых телах напряжение на
поверхности fij и поверхностное натяжение связаны соотноше-
нием (см., например, [12])
А/ = М + -^» гДе G/=l>2. (3.4)
Здесь — деформации и — символ Кронекера. В отличие
от у производная dy/d&ij и напряжение fa могут быть как поло-
жительными, так и отрицательными величинами. Некоторые
последние достижения термодинамики поверхностей изложены в
следующих обзорах и оригинальных работах: 1) в прекрасном
обзоре Маллинза [12] проводится очень ясный анализ напряже-
ний на поверхности и влияния температуры на поверхностную
энергию и структуру поверхности; 2) Кабрера и Кольман [13],
а также Кабрера [14] рассматривают термическое фасетирова-
ние с точки зрения построения Вульфа наряду с напряжениями
на поверхности и в объеме кристаллов малых размеров;
3) Франк [15] обсуждает геометрию полярных диаграмм поверх-
ностного натяжения; 4) Кан и Хилиард [16] разработали термо-
динамику шероховатых поверхностей с учетом «градиента энер-
гии»; 5) Чернов [17] пишет об устойчивости вершин кристалла и
профилей ступенчатых поверхностей. Некоторые из этих вопросов
обсуждаются в гл. V.
4. термодинамика неравновесных процессов
Процессы переноса, сопровождающие рост кристаллов, бу-
дут рассмотрены в последующих главах. Дифференциальные
уравнения, описывающие поток тепла, диффузию вещества и
гидродинамику, хорошо известны и основаны на надежных эк-
спериментальных данных. Их можно рассматривать также как
раздел термодинамики неравновесных процессов [18], которая в
I. ТЕРМОДИНАМИКА ФАЗОВЫХ ПРЕВРАЩЕНИЙ
371
отличие от термодинамики равновесных процессов занимается
предсказанием скоростей изменений, происходящих при стацио-
нарных необратимых процессах.
Этот раздел термодинамики основывается на понятии об
обобщенных потоках Jm (например, потоке тепла) и силах Fn
(например, разности температур), а также на системе связы-
вающих их линейных уравнений
~ 2 Lmn, grad Fn. (4.1)
п
Предполагается, что уравнения линейны, если система нахо-
дится в состоянии, достаточно близком к равновесному. Коэффи-
циенты Lmn определяются из эксперимента. Если выбрать силы
и потоки правильно (это не всегда легко сделать для процесса,
предполагающего учет скорости потока энтропии: см., например,
монографию Кристиана [19]), то, как показал Онсагер [20],
Lmn === Дтп- Это существенно новая информация, не содержа-
щаяся в исходных уравнениях переноса. Соотношениями Онса-
гера имеет смысл пользоваться только тогда, когда в системе
действуют по меньшей мере две силы или два потока и когда
существует некоторое взаимодействие между этими эффектами,
например, когда вещество диффундирует при наличии одновре-
менно градиентов концентрации и температуры.
Другую часть общей теории, существенную при рассмотре-
нии процессов кристаллизации, образует теорема о минималь-
ной скорости возрастания энтропии [18]. Она требует, чтобы в
стационарном состоянии скорость возрастания энтропии была
минимальной. К этому минимальному значению вполне приме-
ним вариационный принцип, аналогичный используемому в тер-
модинамике равновесных процессов принципу Гиббса о мини-
мальности свободной энергии. К сожалению, можно показать,
что этот «принцип», хотя и применявшийся некоторыми исследо-
вателями к изучению роста кристаллов, может привести к не-
верным результатам при описании совсем простых систем (дис-
куссия Кана и Маллинза к статье Киркалди [22]). С другой сто-
роны, дифференциальные уравнения переноса можно записать в
вариационной форме и получить из них действительно верные
результаты.
II
СТАТИСТИЧЕСКАЯ МЕХАНИКА РОСТА КРИСТАЛЛОВ;
ТЕОРЕТИКО-ФИЗИЧЕСКИЙ АНАЛИЗ ПРОБЛЕМЫ
Как уже отмечалось, задача статистической механики рав-
новесия сводится к выводу равновесных свойств макроскопиче-
ских молекулярных систем из законов молекулярной динамики
(см., например, монографию Хуаня [24]). Расчет скоростей ро-
ста кристалла, несомненно, выходит за рамки равновесной ста-
тистической механики. Такие расчеты ведутся на основе либо
теории переноса, либо кинетической теории, либо же статисти-
ческой механики неравновесных процессов.
Тем не менее адекватная теория должна предсказывать от-
носительную устойчивость различных фаз одного и того же ве-
щества и образование одной фазы в другой [9], или, говоря
словами Кристиана [19], причины превращения и механизмы пре-
вращения. Ясно, что превращение будет происходить в том на-
правлении и с такой скоростью, которые обусловлены разностью
свободных энергий Гиббса в действительном и равновесном со-
стояниях системы. А такие энергии часто известны из экспери-
мента. Но в принципе — какая фаза более устойчива и как это
можно предсказать, задаваясь лишь силами взаимодействия
между атомами?
5. СТАТИСТИЧЕСКАЯ МЕХАНИКА
РАВНОВЕСНОГО СОСТОЯНИЯ
Применение методов равновесной статистической механики к
той или иной системе можно свести к вычислению (правда,
иногда очень сложному) статистической суммы для этой систе-
мы. Статистическая сумма канонического ансамбля опреде-
ляется следующим образом:
(5-1>
где А/”— число частиц одного сорта в системе, h — постоянная
Планка, k — постоянная Больцмана, E(N)—полная (механиче-
ская) энергия системы в рамках классической механики и
dr(N) —элемент объема в фазовом пространстве.
II. СТАТИСТИЧЕСКАЯ МЕХАНИКА РОСТА КРИСТАЛЛОВ
373
Давление дается выражением
p = kT^J_, (5.2)
а свободная энергия Гиббса — выражением
Q=-kT\nZ + pV. (5.3)
Для системы с дискретными уровнями энергии интеграл (5.1)
заменяется суммой по всем энергетическим уровням системы,
т. е. 5ехр(—ENii/kT).
i
6. ПРИМЕНЕНИЕ МЕТОДОВ СТАТИСТИЧЕСКОЙ МЕХАНИКИ
РАВНОВЕСНОГО СОСТОЯНИЯ К ФАЗОВЫМ ПРЕВРАЩЕНИЯМ
Исследования фазовых превращений статистическими мето-
дами изложены в огромном количестве публикаций. Обзор ли-
тературы, опубликованной по этой теме до 1955 г., принадле-
жит Темперли [10]; ссылки на более поздние работы приводит
Уленбек [7, 25]; см. также статьи Видома [8] и Коэна [26].
Конденсация газов и паров. 1. Ван дер Ваальс первым по-
пытался рассчитать отклонение поведения газа при больших
плотностях от поведения идеального газа, которое описывается
уравнением pV = NkT. Уравнение Ван дер Ваальса (см., на-
пример, работы Видома [8] и Кана [27]) имеет вид
_ NkT ( N \2
Р V-Nbi V j •
(6.1)
Это уравнение, как известно, содержит два члена, отсутствую-
щих в уравнении состояния идеального газа: член — Nbi, учи-
тывающий конечность объема молекул, и член aJ/V/V)2, опи-
сывающий силы притяжения между молекулами; 6Zi и Ь\ суть
постоянные, характерные для данного газа. Согласно этому
уравнению, изотермы, изображенные в координатах р и V
(фиг. 3) и соответствующие температуре ниже Tvc (изотерма,
соответствующая этой температуре, имеет горизонтальную ка-
сательную в одной точке), содержат участок с перегибом, отра-
жающий нефизическое уменьшение объема с уменьшением дав-
ления. Поведение реальной системы на участке с перегибом опи-
сывается горизонтальной прямой, вдоль которой пар находится
в равновесии с жидкой фазой. Положение этой прямой опреде-
ляется построением Максвелла: площади обоих заштрихованных
участков должны быть одинаковыми. Уравнение Ван дер Ваальса
позволяет правильно оценить как порядок величин и тепло-
емкости, так и форму двухфазной области, показанную
374
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
на графике штриховой линией, но не обеспечивает точного коли-
чественного совпадения с экспериментом. Это уравнение можно
вывести из приближенного выражения функции распределения,
в котором учитывается только влияние взаимодействия молекул
на поступательное движение, а вращательное движение и внут-
реннее возбуждение молекул во внимание не принимаются (см.,
например, монографию Морса [28]).
Фиг. 3. Вандерваальсовы изотермы [показаны критическая изотерма, фа-
зовое превращение, построение Максвелла и граница (штриховая) области
сосуществования двух фаз].
2. Как второй пример рассмотрим двумерную решеточную
модель газа, т. е. модель Изинга. Эта модель представляет со-
бой двумерное множество атомных магнитных диполей, распо-
ложенных в узлах квадратной решетки. Диполи способны ори-
ентироваться только параллельно или антипараллельно друг
другу; в первом случае энергия взаимодействия между ближай-
шими диполями равна нулю, а во втором она составляет <р/2.
Этой простой системе свойствен фазовый переход в ферромаг-
нитное состояние, что означает существование при температу-
рах ниже Т=^Т!С спонтанной намагниченности, которая при
Т> Тс исчезает. Точный расчет для такой системы проведен Он-
сагером [29], который вывел функцию распределения и нашел
температуру превращения Тс- Модель Изинга, очевидно, пред-
ставляет собой единственную модель в двух или более измере-
II. СТАТИСТИЧЕСКАЯ МЕХАНИКА РОСТА КРИСТАЛЛОВ
375<
ниях с наличием в ней фазового превращения, для которой из-
вестно точное решение.
Ли и Янг [30] предложили простую модель жидкости, взяв
за основу модель ферромагнетизма Изинга. Их модель, назы-
ваемая двумерным решеточным газом, представляет собой квад-
ратную двумерную сеть ячеек, каждая из которых либо занята
одним атомом, либо вакантна. Если две молекулы находятся
в соседних ячейках, то потенциальная энергия их взаимодей-
ствия равна —2е; если они находятся в одной ячейке, то эта
энергия равна бесконечности;
если же две молекулы нахо-
дятся не в соседних ячейках,
то они считаются невзаимо-
действующими. Как отмечает
Видом [8], такая схема пред-
ставляет собой систему квад-
ратных потенциальных ям, за-
полненных твердыми шарами.
Онсагер провел точный (очень
сложный) расчет приходящей-
ся на одну молекулу стати-
стической суммы Z1 (Хуань
[24]):
In Z' = ln(2ch2₽e) +
Фиг. 4. Изотермы (штриховые ли-
нии) для двумерного решеточного
газа и граница области сосуществова-
ния двух фаз (сплошная кривая) [30].
Л
+ (2л)"' рФ1п|[1 +
о
+ (1-x2sin2<p),/!]. (6.2)
Здесь (е2Ре —е~2№)/(е2№ + е_’2Ре)2, а р= \lkT. Пользуясь
этим выражением, Ли и Янг [30] вывели для двумерного реше-
точного газа уравнение состояния, график которого представлен
на фиг. 4. Точное значение Т!с находят из выражения
ехр(—е/*Г') = /2- 1.
(6.3)
Как видно по изотермам, проведенным на этом графике
штриховыми линиями, системе свойственно фазовое превраще-
ние, в общих чертах схожее с фазовым превращением вандер-
ваальсова газа, но в данном случае наличие такого превращения
предсказывается теорией строго, без перегибов, не имеющих фи-
зического смысла, и без построения Максвелла. Форма границы
двухфазной области, критическая температура и теплоемкость
количественно отличны от того, что дает уравнение Ван дер
Ваальса.
376
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
3. Пока нет строгого решения уравнения состояния трехмер’
ного решеточного газа, но многие его свойства у критической
точки определены посредством численных расчетов [31]. Некото-
рые такие расчетные характеристики, в частности форма гра-
ницы двухфазной области, критическая изотерма и удельная
теплоемкость, хорошо согласуются с экспериментальными дан-
ными [8].
Кристаллизация жидкостей и плавление кристаллов. Надо
еще раз подчеркнуть, что теории равновесных процессов в при-
менении к кристаллизации и конденсации не занимаются выяс-
нением кинетики и механизма превращений. Этим объясняется
пренебрежение на данном уровне такими понятиями, как за-
рождение и рост, и, напротив, широкое употребление понятия
«коллективного» процесса, т. е. такого статистического процес-
са, при котором частицы уже нельзя считать невзаимодействую-
щими или слабо взаимодействующими, а взаимодействие рас-
сматривать как небольшое возмущение. При таком процессе
взаимодействие частиц играет главную роль и должно учиты-
ваться с самого начала, как в модели Изинга. Примерами кол-
лективных процессов могут служить кристаллизация и плавле-
ние [31]. При фазовом превращении весь ансамбль рассма-
тривается как «коллектив», а превращение в свою очередь
вчитается гомогенным. (Конечно, при зарождении и росте
только малая доля всех молекул — те из них, которые находятся
на поверхности — в данный момент времени участвует в кинети-
ческих процессах.)
Теории равновесных процессов широко применялись для рас-
четов структуры жидкостей и их кристаллизации. Из обзорных
трудов по теории кристаллизации следует упомянуть работы
Темперли [10], Уббелоде [33], Браута [34] и Видома [8]. Ограни-
чимся здесь обсуждением только двух таких теорий.
1. Теория Л еннарда-Джонса и Девоншира [35]. В этой мо-
дели плавления кристалла все его атомы считаются находящи-
мися на своих местах в кристаллической г. ц. к. решетке. При
нагревании некоторые атомы перемещаются в междоузлия,
вследствие чего возрастают беспорядок и энтропия. Предпола-
гается, это энергия, необходимая для такого перемещения ато-
ма, тем меньше, чем больше число смещенных атомов. Кристалл
считается расплавившимся, когда беспорядок достигает макси-
мума (одинаковое заполнение узлов и междоузлий). Расчеты
проводились применительно к аргону. Потенциал отталкивания
был выбран ~1/г12, а потенциал притяжения—~1/г6, где
г — расстояние между атомами. Расчетные изотермы приве-
дены на фиг. 5 [36]. На этом графике отчетливо видно фазо-
вое превращение. Теория правильно предсказывает изменения
ю
Фиг. 5. Изотермы, полученные по теории плавления Леннарда-Джонса
и Девоншира [36].
Показаны фазовое превращение и построение Максвелла.
Фиг. 6. Изотерма для системы из 108 молекул (твердых шаров) [39].
—объем плотноупакованной структуры.
378
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
энтропии и объема при плавлении аргона, а также кривую плав-
ления Гпл(р) (см., однако, статью Хендерсона и Баркера [37]
и замечания Франка и Зегера в книге [38]).
2. Машинный расчет Олдера и Уэйнрайта [39]. Эти авторы
исследовали уравнение состояния системы частиц в виде твер-
дых шаров, притяжение между которыми отсутствует. Расчет
произведен путем решения системы уравнений движения клас-
сической механики для 32 и 108 частиц, находящихся в ящике,
на стенках которого заданы периодические граничные условия.
Объем ящика менялся от 1,2 Vo до 2,0 Vo (Vo — объем струк-
туры с плотной упаковкой). Давление оценивали по скорости
-изменения количества движения частиц при столкновении со
стенкой. Найденная зависимость p(V) (фиг. 6) состоит из двух
отдельных перекрывающихся ветвей. В состоянии, описывае-
мом нижней ветвью, каждая частица зажата в своем положе-
нии окружающими соседями (расширенная область ближнего
порядка); в состоянии же, описываемом верхней ветвью, ча-
стицы могут меняться местами с соседями (жидкая фаза). Из
этих кривых следует, что в такой системе возможно превраще-
ние менее плотной фазы в более плотную.
Статистический расчет структуры поверхности. /. Поверхност-
ное плавление, шероховатость и модель Изинга, Вслед за Ли и
Янгом [30] Бартон и Кабрера [40] (см. также статью Бартона
и др. [41]) обнаружили, что найденное Онсагером решение для
модели ферромагнетизма по Изингу приложимо при анализе
фазовых превращений двумерных молекулярных структур.
Бартон и Кабрера предполагали рассчитать, как с ростом
температуры увеличивается шероховатость поверхности
кристалла, которая вначале была плотноупакованной. Они
рассматривали грань (100) кристалла с простой кубической
решеткой, считая ее идеально гладкой (т. е. не содержащей
вакансий) при температуре Т = 0. Потенциальная энергия вза-
имодействия между двумя ближайшими атомами считалась
равной ср, т. е. по ср/2 на атом. Если же тот или иной поверхност-
ный атом расположен выше соседнего на один или несколько
периодов решетки, то одна связь с ближайшим соседним атомом
считается порванной, так что подобная конфигурация обладает
избыточной энергией ср/2 на атом. Мера шероховатости поверх-
ности Sr определяется следующим образом: Sr = (U—U0)IUQt
где С7о(=ф/2) и U — удельные потенциальные энергии соответ-
ственно идеально гладкой грани и реальной поверхности. Ясно,
что Sr ~ 0 для гладкой грани и Sr > 0 в реальном случае. Эта
двумерная структура с двумя уровнями точно соответствует мо-
дели Изинга, и, следовательно, ей свойственно свое фазовое пре-
вращение («поверхностное плавление») при температуре Из
II. СТАТИСТИЧЕСКАЯ МЕХАНИКА РОСТА КРИСТАЛЛОВ
379
уравнения (6.3) эта температура определяется для квадрат-
ной решетки выражением ^Г^/ф = 0,57 (заметим, что ф/2 = е).
(Нельзя забывать, что объемное плавление вещества есть фазо-
вое превращение первого рода, тогда как «поверхностное пла-
вление» Изинга — превращение второго рода.) Степень шерохо-
ватости Sr находят дифференцированием выражения (6.2); при
температуре Т Т/ шероховатость Sr = 4ехр(—2ф/£Т), т. е. на
идеально гладкой поверхности адсорбированы отдельные атомы,
а ступени и скопления атомов отсутствуют. Действительно,
ехр(—2qfkT) есть вероятность перехода одного атома в состоя-
ние адсорбции на поверхности, поскольку адсорбированный атом
имеет на четыре свободные связи больше, чем атом в правиль-
ном положении, а энергия каждой связи равна ф/2. [Пара адсор-
бированных атомов имеет шесть лишних свободных связей, и
тогда Sr пропорциональна ехр(—Зср/^Т).] Авторы показали
[40, 41], что температура Т!с в общем случае много выше (экспе-
риментальной) температуры объемного плавления кристалла.
Таким образом, термодинамически даже вблизи температуры
плавления ступени на плотноупакованных гранях должны от-
сутствовать. Возможное влияние окружающей среды при ана-
лизе не учитывалось.
2. Шероховатость поверхности кристалла, соприкасающе-
гося с расплавом. Исследуя задачу о шероховатости поверх-
ности, подобную той, которую решали Бартон и Кабрера,
Джексон [42, 43] рассмотрел и среду, примыкающую к поверх-
ности кристалла. В качестве модели они выбрали плоскую по-
верхность, соприкасающуюся с собственным паром или распла-
вом. К этой поверхности поодиночке присоединяются атомы из
среды При этом зависимость изменения свободной энергии от
числа уже занятых мест на поверхности определялась в при-
ближении Брэгга — Вильямса, причем учитывались связи атома
лишь с ближайшими соседями. Такой расчет аналогичен рас-
чету свободной энергии смешения в теории «идеального рас-
твора» (см., например, стр. 174 и 204 в [19]). По расчетам нор-
мированное изменение свободной энергии при присоединении к
Поверхности одного атома выражается так:
Д6 aN Л
N
лг-^л]
-4г1п
\n~na
[ "а
(6.4)
Здесь То—равновесная температура, N — число мест на по-
верхности и Na — число занятых мест. Параметр am (L/kT0)fk
зависит от скрытой теплоты процесса L и кристаллографиче-
ского фактора fk (frcCl), величина которого показывает, какая
часть всех близлежащих соседей данного атома расположена в
плоскости, параллельной рассматриваемой кристаллической
380
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
грани. На графике функции (6.4) видно (фиг. 7), что при
свободная энергия минимальна только тогда, когда
поверхность наполовину покрыта адсорбированными атомами,
т. е. когда она шероховата. Если же 2<^а^оо, то справедливо
обратное утверждение: минимальная энергия соответствует
Фиг. 7. Изменение свободной энергии &Gs/NkT0 при присоединении NA мо-
лекул к поверхности с N свободными местами в зависимости от степени за-
полнения (согласно теории шероховатости поверхности [43]).
гладкой поверхности с небольшим числом адсорбированных
атомов. Если кристалл окружен газом, то параметр а обычно
велик (поскольку L велико); если же кристалл граничит с ра-
сплавом, то параметр а часто бывает меньше двух. Таким об-
разом, возможность «поверхностного плавления» зависит пре-
жде всего от окружающей среды, причем оно может происхо-
дить вблизи температуры объемного плавления (см. также
гл. V) 9.
9 Расчет в приближении Брэгга — Вильямса для двухуровневой модели
дает картину, правильную лишь качественно. Более строгйе расчеты [147,
322*] ведут к большим значениям а, начиная с которых поверхность должна
быть гладкой. — Прим. ред.
II. статистическая механика роста кристаллов
381
7. СТАТИСТИЧЕСКАЯ МЕХАНИКА
НЕРАВНОВЕСНЫХ ПРОЦЕССОВ
Для понимания неравновесных процессов роста кристаллов
существенны законы теплопроводности, диффузии вещества и
гидродинамики. Эти законы обычно усганавливаются в виде
феноменологических соотношений, находимых из эксперимента
(примером может служить закон Фика),причем коэффициенты
в этих соотношениях также устанавливают из опытных данных.
Между тем такие законы переноса можно вывести из уравне-
ния переноса Больцмана статистической механики неравновес-
ных процессов (см., например, работу Хуаня [24]). Кроме того,
пользуясь понятиями столкновения и средней длины свобод-
ного пробега, из этих уравнений можно строго вывести коэф-
фициенты переноса (вязкость, теплопроводность и коэффи-
циент диффузии), по крайней мере для газа в состоянии, близ-
ком к равновесному. Можно показать, что для газа из молекул
с массой т как теплопроводность, так и вязкость приблизитель-
но пропорциональны (ткТуЩа2, где а — диаметр молекулы [24].
Вопрос о вычислении этих коэффициентов для жидкостей рас-
смотрен Райсом [45].
Ill
ЗАДАЧА СТЕФАНА: МАТЕМАТИКО-ФИЗИЧЕСКИЙ АНАЛИЗ
ПРОЦЕССОВ ПЕРЕНОСА, СОПРОВОЖДАЮЩИХ
РОСТ КРИСТАЛЛА
8. ВВЕДЕНИЕ
Как уже отмечалось, весь опыт и все наблюдения свидетель-
ствуют о том, что кристаллизация представляет собой не гомо-
генный, а гетерогенный процесс. Молекулы жидкой фазы не
превращаются в молекулы кристалла во всем объеме и посте-
пенно, хотя такое представление и сргласуется с теорией, не-
редко развиваемой так, как это было сделано в гл. II. Напротив,
в кристаллическое состояние переходят совокупности молекул в
разных местах жидкой фазы, образуя центры кристаллизации.
Эти центры, или зародыши, затем разрастаются благодаря про-
цессам переноса до значительных размеров.( Молекулы, осаж-
дающиеся на поверхность зародыша, поступают из той или иной
отдаленной области раствора или пара, а при кристаллизации
расплава теплота, выделяющаяся при присоединении молекул
к кристаллу, должна как-то отводиться от поверхности раздела
фаз. Процессы переноса рассматриваются в настоящей главе,
а процессы зарождения — в гл. IV. (Разумеется, если в систему
ввести затравку, то процесс переноса молекул на такую затрав-
ку может начаться сразу же без всякого дополнительного за-
родышеобразования в объеме жидкой фазы^Скорость фазового
превращения в конкретном случае определяется либо процессом
зарождения, либо процессом переноса. Другими факторами, ли-
митирующими скорость превращения, могут быть так называе-
мые кинетические процессы на поверхности раздела фаз — пере-
мещения отдельных молекул, в результате которых молекулы
переходят из своего положения в жидкой фазе вне поверхности
раздела кристалл — жидкость на относительно постоянное место
на поверхности кристалла. Различные механизмы, лежащие в ос-
нове поверхностной кинетики, рассматриваются в гл. V, хотя об
использовании различных законов этрй кинетики для установле-
ния граничных условий в задачах о переносе упоминается и в
настоящей главе.
Под названием задачи Стефана объединен целый класс за-
дач о переносе, основанных на дифференциальном уравнении
диффузии с подвижной или свободной границей^ Сам Стефан
изучал скорость утолщения льда в полярных морях [46]. Теплота
кристаллизации образующегося там льда отводится через слой
III. ЗАДАЧА СТЕФАНА
383
твердой фазы и отбирается холодным воздухом с температурой
предположительно ниже температуры замерзания воды. С утол-
щением слоя льда отводить теплоту от фронта кристаллизации
становится все труднее, благодаря чему утолщение ледяного
покрова замедляется, что делает этот процесс нестационарным.
1 Главная сложность изложенной задачи состоит в том, что поло-
жение границы фаз неизвестно; оно зависит от времени и под-
лежит определению в ходе решения. По-видимому, все задачи
о росте кристаллов, будь то стационарные или нестационарные
процессы и независимо от того, известно или неизвестно движе-
ние межфазовой границы, удобно рассматривать как задачи
Стефана. Действительно, как уже упоминалось, следующие за-
дачи рассматриваются как стефановские: задачи о потоке тепла
в перегретом расплаве (выращивание кристаллов по Бриджме-
ну, по Чохральскому и по Чалмерсу; кристаллизация льда; за-
твердевание отливок); задачи о потоке тепла в переохлажденном
расплаве (подобные задачи часто встают при исследовании
дендритного роста); задачи о диффузии вещества (рост кри-
сталлов из раствора, из пара в присутствии инертного газа, из
расплава в присутствии примеси или из раствора в расплаве) 7
Сказанное не означает, что другие факторы и процессы (кри-
сталлографическая анизотропия, поверхностная кинетика или
зарождение) не играют никакой роли в процессе кристаллиза-
ции: просто, прежде чем рассматривать процесс кристаллизации
в целом, следует выяснить, какова в данном конкретном случае
роль теплопередачи и диффузии вещества.
Задачи Стефана можно классифицировать по следующим (не
обязательно взаимно исключающим друг друга) признакам:
а) известна или не известна форма образующегося кристалла;
б) сохраняется ли эта форма при росте или растворении; в) из-
вестны ли скорость перемещения фронта кристаллизации и за-
висимость этой скорости от времени; г) известны ли температура
и концентрация на поверхности раздела фаз; д) есть ли для
этой задачи точное аналитическое, приближенное аналитическое
или численное решение; е) устойчива ли форма роста при ее
незначительных искажениях; ж) переохлаждена или не пере-
охлаждена жидкость; з) учтены или не учтены дополнительные
факторы, например величина свободной поверхностной энергии,
поверхностная кинетика (отклонения температуры и концентра-
ции на поверхности раздела фаз от локально равновесных зна-
чений в зависимости от скорости роста), гидродинамические
эффекты (перемешивание и конвекция), присутствие примеси,
действие эчектрических и магнитных полей, а также механиче-
ских колебаний.
/ В дискуссии по статье Уилкокса и Дьюти [48] Хорвей [52]
разделил задачи Стефана на три группы в соответствии с тем,
384
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
какие из следующих трех параметров известны: форма фронта
кристаллизации, температура (концентрация) на фронте, ско-
рость кристаллизациии В традиционной формулировке задачи
форма и температура считаются заданными, а скорость подле-
жит вычислению. Модифицированная задача Стефана, иначе
называемая обратной, посвящена расчету температуры фронта
кристаллизации при заданных форме фронта и скорости его
перемещения. Последний вариант задачи — определение формы
фронта, если известна его температура и еще скорость фронта
в какой-нибудь его точке, например на вершине дендрита.
I Задачи Стефана принадлежат, как будет видно далее, к наи-
более сложным граничным задачам математической физики
из-за двух обстоятельств. Во-первых, положение границы, на ко-
торой должны быть заданы краевые условия, неизвестно, а оп-
ределение ее положения есть часть задачи. Во-вторых, отвечаю-
щая задаче система уравнений нелинейна, так что решение для
нее нельзя найти посредством суперпозиции» Некоторые вопросы
существования и единственности решения'задачи обсуждаются
в монографии Фридмана [49]. Обзор литературы, посвященной
задаче Стефана, включающий как чисто математические, так
и многочисленные физические работы, составлен Банкоффом [50];
ценные обзоры принадлежат Карслоу и Егеру [51], а также
Хорвею [52].
9. ЗАДАЧА СТЕФАНА В ЧИСТОМ ВИДЕ;
РАЗЛИЧНЫЕ ФОРМЫ РОСТА
Плоскость. 1. Жидкость при температуре выше точки плавле-
ния. Решение задачи о направленной (с плоским фронтом роста)
кристаллизации первым опубликовал Стефан [46], хотя известны
утверждения [53], что первым ее решил Нейман. Предположим,
что жидкость в большом объеме находится при одинаковой
температуре 7поо>71Пл (Лтл — точка плавления). Пусть, далее,
в момент времени t = 0 температура плоской поверхности жид-
кости мгновенно понижается до температуры Т = 0. Тогда урав-
нения теплопроводности в изотропном кристалле и расплаве
запишутся в лабораторной системе координат с осью х, направ-
ленной по нормали к охлаждаемой поверхности, следующим об-
разом:
д2Т. \ дТ
(9-1)
д2Т дТ
м
Здесь х — температуропроводность (см2/с); xL = KdpcL,
xs = Kslpcs, где Ks и Kl — теплопроводности, cL, cs — удельные
Ш. ЗАДАЧА СТЕФАНА
385
теплоемкости и р — плотность обеих фаз. Гидродинамические
эффекты, обусловленные неодинаковостью плотностей, здесь не
учитываются (они анализируются в разд. 10). Температура по-
верхности раздела кристалл — расплав с координатой х = Х(/)
предполагается равной температуре плавления:
TL(X) = TS(X) = Тпл. (9.3)
Условие непрерывности теплового потока имеет вид
дТ Q дТг dX
(9.4)
где L — скрытая теплота плавления. [Именно уравнение (9.4)
вносит нелинейность в систему, хотя дифференциальные урав-
нения (9.1) и (9.2) линейны. Можно показать [51], что
откуда и следует нелинейность.] Наконец, запишем граничные
условия нашей задачи:
при X 00, (9.6)
ts-+o при X -*0 (9.7)
и начальные условия
X = 0 при t = 0, (9-8)
TL = T L OO при t = 0. (9-8')
Прежде чем искать решение этой системы уравнений, за-
метим, что, пользуясь соображениями размерности, можно за-
писать
' TL(x, t) = TL(Sl), (9.9)
где
= (9.10)
Продифференцировав (9.9) и (9.10) и подставив полученные
выражения в уравнение (9.1), получим вслед за Франком [54]
д2Т L _ SL drL
~ds[ 2 dSL ’
(9.H)
Полагая т) = dTL)dSL и производя интегрирование, находим [51]
Г / S, \
TL (Sl) ~ TL(оо) = — J x\(z)dz = - Л1 erfc(-^, (9.12)
Sl
где Al — постоянная, а
оо
1 — erf (х) = erfc (х) = j -^-ехр (- £2) dg.
X
Таким образом, распределения температуры выражаются сле-
дующими формулами:
в расплаве
X
f\'/2
= Г —• Л1 erfc
ОО 1
2М'1г\’
(9.13)
в кристалле
X
Ts = Bl erf ------п- .
[2(xs0'/J
Взяв граничное условие (9.3) при х = X, получим
X
(9.13')
• X
2(х£/)'^
Следовательно, расстояние X пропорционально f1*, т. е.
X = 2Xj (%st)'12,
В, erf -----п-
[2(V)/2J
= Тпл = const.
(9.14)
(9.15)
— T^ — Ai erfc
где Xi — «константа роста». Подстановка (9.15), (9.13) и (9.13z)
в условие непрерывности (9.4) дает следующее выражение, свя-
зывающее Xi с физическими характеристиками вещества Кь,
Ks, %s> Тпл, cs, а также со степенью перегрева расплава
е _____ Гпл)ехр( hl) _______
erf X, ~ csTnn '
Таким образом, при заданном значении М температуры кри-
сталла и расплава выражаются такими формулами:
и
(^-^)егГск2(^о|/г].
erfc [X, (xs/x£)‘/q
(9.17)
(9.17')
Проверка показывает, что соотношения (9.17) и (9.17z) удов-
летворяют условиям (9.6) — (9.8); нам уже известно, что они
удовлетворяют уравнениям (9.1) — (9.4). В качестве подходя-
щего примера расчета процесса можно рассмотреть замерзание
воды. Преобразуем шкалу температур таким образом, чтобы
III. ЗАДАЧА СТЕФАНА
387
точка плавления льда приходилась на 5 °C; пусть температура
охлаждаемой поверхности х = 0 равна О °C (на 5 °C ниже точки
плавления льда), а начальная температура всего объема воды
на 2 °C выше точки его плавления. — Тпл = 2. Тогда, учиты-
вая, что KL = 0,00144, xL = 0,00144 см2/с, Ks = 0,0053, xs =
= 0,0115 см2/с, Lp — 307 Дж/см3, из уравнения (9.16) для за-
данных температур получим X] = 0,121 [51]. Таким образом, за
время 1,48-103 с образуется слой льда толщиной 1 см, а за
время 1,48-105 с, т. е. почти за 42 ч — слой толщиной всего
10 см. (Ход плавления полубесконечного объема вполне анало-
гичен ходу кристаллизации: см. монографию Карслоу и Еге-
ра [51].)
2. Плоский фронт кристаллизации-, переохлажденный рас-
плав. В этом случае [51] начальная температура всего объема
расплава ниже температуры плавления (Гго < 7"Пл) и уже при
t = 0 начинает образовываться тонкий слой кристалла, тем-
пература которого во всех точках равна 7ПЛ, так что теплоот-
вод через кристалл отсутствует, и все тепло отбирается рас-
плавом, который от этого нагревается. В соответствии с этим
условие (9.7) заменяется условием
Ts = Tan при 0<х<Х(0; (9.18)
в остальном система уравнений, отвечающая новой задаче, сов-
падает с системой (9.3) — (9.8), но только теперь Тж < Тал.
Решение системы выражается следующими формулами:
X = 2X2(xl/)v\ (9.19)
Тз=Тлл, (9.20)
TL = Тх + erf с Г-*-^1. (9.21)
Константа роста л2 находится здесь решением уравнения
л 2 Q
Л2е 2 erfc Х2 = (Тпл - TJ . (9.22)
При переохлаждении воды на 1,3 °C имеем 7,2 = 0,12, так что
кристаллизация протекает с теми же скоростями, что и в преды-
дущем примере.
3. Плоский фронт кристаллизации с постоянной скоростью
[46, 51, 55]. Поинтересуемся условиями, необходимыми для того,
чтобы кристаллизация шла с постоянной скоростью (dX/dt =
= const), а не замедлялась с течением времени (dXIdl =
= A,2xl‘z’Z~'/2) , как в предыдущем случае. Если расплав находится
при температуре плавления Тал (частный случай уже рассмо-
388
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
тренной первой ситуации), то скорость будет постоянной, если
температуру на поверхности х = 0 не поддерживать неизменной,
как в предыдущих случаях, а постепенно снижать. При кристал-
лизации расплава в таких условиях со скоростью
<9-23)
температуры в кристалле и расплаве выразятся следующим
образом:
С=7’пл + -^[1-exP(xsmi^-mix)] (9.24)
И
Г£=ГПЛ, (9.25)
где т\ — постоянная.
Это решение требует, чтобы переохлаждение при х = 0 воз-
растало со временем экспоненциально. Надо заметить, что та-
кая задача представляет собой обратную, или модифицирован-
ную, задачу Стефана в том смысле, что закон перемещения
фронта роста здесь задан, а не считается искомым, тогда как
температура на границе х — 0 неизвестна. Форма и темпера-
тура поверхности раздела фаз, конечно, заданы.
4. Плоский фронт кристаллизации', краевое условие на внеш-
ней границе объема [56—55]. Эта задача аналогична первой рас-
смотренной нами задаче, но с тем отличием, что условие (9.7)
заменяется теперь одним из следующих условий:
Ts=f1(t) при х = 0;
\ ох /х=0
/ дТс\
Ьг = ^(0, 0~/з(01-
\ ох /х=о
(9.26а)
(9.266)
(9.26в)
Здесь fi, f2 и f3 суть произвольные функции времени, a h — ко-
эффициент теплопередачи. Взяв, например, граничное условие
(9.26а) и использовав метод разложения в ряд, находим
у dn [Х2п (/)] _ ТПл - f, (/) . (9 27)
(2n)lv.^dtn nsLps/Ks
Отсюда положение поверхности раздела фаз X(t) находится
в виде бесконечного ряда его производных. Такой способ бо-
лее удобен при решении обратной, или модифицированной, за-
дачи, когда закон перемещения фронта роста задан, а темпе-
ратура на границе области подлежит определению. Аналогич-
ные результаты получаются и при условии (9.266) или (9.26в).
III. ЗАДАЧА СТЕФАНА
389
Шар. /. Переохлажденный расплав. Задачу о кристаллиза-
ции шара первым решил Рик [59] (неопубликованная диссер-
тация, см. также [60]). Эту задачу иначе решили также Иван-
цов [61], Зенер [62] и Франк [54]. Рассмотрим рост шарообраз-
ного кристалла первоначально исчезающе малого размера из
переохлажденного расплава с температурой ТПЛ. Скрытая
теплота кристаллизации в данном случае отводится в расплав.
В сферической системе координат уравнение теплопроводности
выразится в виде (г —радиус)
f д2Т. 2 дТ.\ дТ.
y'L Vdr*- + 7 ~дг~ I= ~дГ •
(9.28)
Все граничные условия, кроме одного, здесь те же, что и для
плоского фронта кристаллизации; исключение же составляет
условие
Ts = Tn„ при 0 </?(/). (9.29)
Произведя такую же замену, как и прежде [TL(r,t)= TL(SL),
где SL = г%Г'/7-,/2], получим следующие выражения для положе-
ния фронта и для температуры в расплаве:
/? = 2Лз(%£/)1/2, (9.30)
L 00 exp (— erfc Л3
f (x,A,/s / г2 \ л,/! / г \)
X । £ 7 ехр---------------------erfc (------п-Н. (9.31)
Константу Хз определяют из уравнения
Лз^ (б-** - Хзл'/2 erfc Л3) = у cL Тпп ~ Г°° . (9.32)
2. Рост шара из переохлажденного расплава с постоянной
скоростью. Чтобы кристаллизация шара шла с постоянной ско-
ростью [63], скрытую теплоту кристаллизации необходимо от-
водить как в расплав, так и внутрь шара. Теплоотвод внутрь
шара приведет к его нагреванию; следовательно, температура
как в объеме шара, так и на его поверхности должна быть в от-
личие от предыдущего случая ниже температуры плавления.
Если это до некоторой степени искусственное условие выпол-
няется1), то на первых порах после начала кристаллизации
температура на поверхности кристалла возрастает пропорцио-
нально времени. 9
9 Заметим, что поверхностная кинетика, которая по крайней мере на
начальных стадиях роста может приводить к выполнению подобного крае-
вого условия, здесь не принимается во внимание.
390
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
3. Кристаллизация шара от периферии к центру [57]. Рас-
сматривается сферическая капля расплава радиуса R, находя-
щаяся первоначально при температуре плавления. Поверхность
капли быстро охлаждают. Для таких условий решена как пря-
мая (задана температура поверхности капли), так и обратная
(задан закон перемещения фронта кристаллизации) задача
Стефана. В частности, обратная задача решена аналитически
для двух случаев, а именно для утолщения кристаллического
слоя пропорционально времени, когда положение поверхности
раздела фаз y(t) определяется выражением
y(t) = R-^ (9.33)
а также для кристаллизации с убывающей скоростью, когда
y(t) = R-^, (9.34)
где pi и р2 суть постоянные. Аналитическая зависимость тем-
пературы наружной поверхности кристаллизующегося шара от
времени t найдена путем разложения в ряд [57], подобно тому
как это сделал Любов при упоминавшемся расчете направлен-
ной кристаллизации. Для прямой задачи найдено только при-
ближенное решение в предположении, что температура поверх-
ности шара 7п.ш(<^пл) остается постоянной. При таком усло-
вии скорость кристаллизации приближенно находят из урав-
нения
<9-35)
Лэнгфордом [55] рассмотрен случай плавления шара с постоян-
ной скоростью; его результаты согласуются с данными, полу-
ченными Любовым.
Цилиндр (бесконечный, прямой, круговой). /. Пересыщенный
раствор (или переохлажденный расплав). Приступая к анализу
роста цилиндрического кристалла из пересыщенного раствора,
надо прежде всего ввести понятия, используемые в задаче о пе-
реносе вещества, которая представляет собой математический
аналог задач о теплопередаче. В самом деле, уравнение диф-
фузии вещества в растворе записывается в цилиндрических ко-
ординатах г и ф с учетом зависимости концентрации от вре-
мени t аналогично уравнению (9.2) (см., например, моногра-
фию Кранка [65]) в следующем виде:
№ = = D + г_, . (9 де)
Здесь C(r,t)—концентрация кристаллизующегося вещества в
растворе, a D — коэффициент диффузии (см2/с). Предположим,
III. ЗАДАЧА СТЕФАНА
391
что на поверхности кристалла соблюдается условие локального
равновесия, так что на ней по аналогии с предположением (9.3)
концентрация принимает равновесное значение
С (/?, О = Со, (9.37)
в то время как при г -> оо концентрация пересыщенного рас-
твора равна Соо, т. е., как и в условии (9.6),
С(оо,/) = СМ. (9.37')
Уравнение непрерывности для присоединения вещества к кри-
сталлу на перемещающейся границе раздела фаз запишется
подобно условию непрерывности (9.4) в виде
<9-з8>
Здесь Ст — концентрация растворенного вещества в кристалле
(г/см3). Радиус цилиндра вновь считается исчезающе малым
при t = 0.
Выполняя вычисления, аналогичные процедуре (9.9) — (9.17),
находим распределение концентрации в растворе в виде (см.
работы Рика [59], Зенера [62], Франка [54], Иванцова [61], а
также монографию Карслоу и Егера [51])
с _ с = (Со - С„) {Ei [- (У//?)2]) f9 39)
Ei[-^]
где
оо
— Ei (— х) = J u~le~u du,
X
Ei (- Ад) + S = 0, (9.40)
S = r°°Zr° . (9.41)
A! = 2A4(Z)/)‘/2. (9.42)
В качестве конкретного примера рассмотрим рост кристалла
хлористого натрия из водного раствора [65, 66]. Если положить
Соо—Со=О,О2 г/см3, Ст = 2,5 г/см3, Со~0,50 г/см3, то 5^0,01.
При S<£C1 уравнение (9.40) можно заменить приближенным
уравнением X2 (0,577 + In X2) = —S, откуда находим Х4~0.05.
Учитывая, что 7)^2-10-5 см2/с, получаем, чго цилиндрический
кристалл радиусом 1 см вырастает за 5-Ю6 с, т. е. за 2 мес
(влияние поверхностной кинетики, перемешивания и конвек-
ции, разумеется, в расчет не принималось). Сравнивая этот
результат с ростом из расплава (см. рассмотренный пример
кристаллизации льда), можно заметить, что рост из раствора
происходит гораздо медленнее главным образом потому, что
коэффициенты диффузии очень малы по сравнению с коэффи-
392
к ПАРКЕР, МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
циентами температуропроводности (это, конечно, не единствен-
ная причина, поскольку скорость ограничивается также по-
верхностными процессами, обусловленными наличием плоских
граней).
2. Кристаллизация цилиндра от периферии к центру [57,67].
Этот случай аналогичен уже рассмотренному случаю шара,
кристаллизующегося от периферии к центру, в котором обрат-
ная и прямая задачи Стефана решаются путем разложения в
ряды. Для обратной задачи, в которой фронт кристаллизации
у(0 перемещается внутрь цилиндра по закону Рз(^о—04 Рас‘
пределение температуры внутри цилиндра при t<to описы-
вается выражением Ei [r2/a3(0 — 0L в котором to = R3/fy Рз и а3
суть постоянные, a R— наружный радиус.
Эллипсоид. Переохлажденный раствор; сохранение формы
роста. До работ Хэма [68—70] считалось, что несферическая ча-
стица, например эллипсоид, растущая в диффузионном поле,
своей формы не сохраняет, т. е. становится все более эксцент-
ричной, потому что отношение большего размера частицы к
меньшему увеличивается под действием локального влияния
диффузии (см., например, сборник [71]). Но, как показал Хэм,
эллипсоид может удовлетворять уравнению диффузии, учиты-
вающему зависимость от времени. (Хэм не исследовал устойчи-
вость этой формы роста по отношению к малым ее искажениям;
этот вопрос обсуждается в гл. VI.) Общий путь решения со-
стоит в том, что из тех же соображений размерности, что и при
преобразовании (9.9), вводятся приведенные переменные. За-
тем уравнение диффузии записывается в эллиптических коор-
динатах и, наконец, находится решение уравнения, выраженное
через переменную, которая принимает постоянное значение на
поверхности эллипсоида. Это решение должно удовлетворять
двум граничным условиям на поверхности эллипсоида (условиям
для потока и концентрации вещества) и одному условию на
бесконечности.
В эллипсоидальной системе координат £i, £2 и £з приведен-
ные переменные
и=хГ\ v = yt~\ w = zf~'/2 (9.43)
записываются следующим образом:
1 ^2^3
ab
III. ЗАДАЧА СТЕФАНА
393
Здесь gi > а > g2 > Ь > g3 > 0; а и & — постоянные. Следуя
Морсу и Фешбаху [72], преобразуем уравнение (9.36) к виду
1 yi / & дС \_______ D уч д / hxh2h3 дС '
МА "^7.
(9.45)
Здесь hi (угловые масштабы) представляют собой известные
функции h. Координата gi принимает на поверхности эллип-
соида с главными полуосями длиной \£Q — a ) t , (g0 — b ) t
и go/,/2 постоянное значение go. Решение, зависящее только от
gi, удовлетворяющее уравнению (9.45) и принимающее значе-
ние Со на такой эллипсоидальной поверхности и значение
на бесконечности, выражается формулой
C(gI) = C0 + (Cco-C0){l (9.46)
где
оо
f (li) = / [(Z2 - а2) (/2 _ 62)Г’/2 dt.
5.
Чтобы определить go, обращаются к условию постоянства пото-
ков на границе фаз:
1 (Сг - Со) (go) = - D (Сто - Со) (^г)5=|о • (9-47)
Здесь Ст, как и прежде, есть плотность диффундирующего ве-
щества в выделяющейся фазе. Как показал проведенный Хэ-
мом [70] анализ, эллипсоидальный фронт кристаллизации пере-
мещается пропорционально /1/2 (то же самое верно и для сфе-
рического, цилиндрического и плоского фронтов, координатные
системы для которых представляют собой частные случаи
эллиптической системы координат). Надо заметить еще и то,
что решением задачи служит эллипсоид с любым отношением
полуосей а н Ь. Таким образом, если рост лимитируется диф-
фузией, то при одной и той же концентрации исходного ра-
створа сохраняется форма любых эллипсоидальных частиц.
К этому выводу мы еще вернемся при изучении дендритного
роста. Частный случай кристаллизации эллипсоида — рост эл-
липсоида вращения (сфероида) рассмотрели Хорвей и Кан [73],
а также Иванцов [74].
Параболоидальные дендриты. Под «дендритом» понимают
кристалл в форме дерева, или с признаками древовидности,
прежде всего ветвления. Параболоидальными называют денд-
риты, для которых форму вершин стволов и ветвей с некото-
рой степенью приближения можно считать параболоидальной.
394
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
1. Кристаллизация параболоида вращения из переохлаж-
денного расплава. В исследовании, ставшем классическим,
Папапетру [75] предположил, что вершина дендрита имеет
форму параболоида вращения. Иванцов [61, 63] первым решил
уравнение диффузии с граничными условиями на движущейся
параболоидальной поверхности. Как он показал, если поверх-
ность дендрита изотермична и его вершина перемещается впе-
ред с постоянной скоростью, то форма параболоида вращения
удовлетворяет дифференциальному уравнению и граничным
условиям задачи. Наряду с. этим Иванцов рассчитал еще и рас-
пределение температуры в расплаве.
Метод Иванцова, подробно рассмотренный Хорвеем и Каном
[73], состоит в том, чтобы найти решение нелинейного диффе-
ренциального уравнения сохранения теплоты или вещества на
движущейся границе [см. уравнение (9.4)], удовлетворяющее
также уравнению диффузии (9.1) и граничным условиям (9.3),
(9.6) и (9.7). Обще решение уравнения (9.4) содержит пять
произвольных постоянных и одну произвольную функцию, кото-
рые определяются из граничных условий, из уравнения (9.1) и
из соотношений, связывающих постоянные. Для дендрита, ра-
стущего в направлении оси г, распределение температур в рас-
плаве выражается формулой
^(g)-^ Ei[-vp<g/2xJ
7’пл-гоо еЧ-°рЛ] '
Здесь Too — температура расплава при бесконечно большом г,
рг — радиус кривизны вершины параболоида, v — постоянная
скорость роста, xL— температуропроводность расплава; функ-
ция Ei протабулирована [76] [при малых х функция
Ei(—x)«0,577+lnx], а
z — vt
Г \2 . / г — и/
м +1 / J
Величина vp(/2xL определяется из уравнения
ciAT™~ ~vPt pxn
2хд CXP
(9.49)
L
Как и в случае эллипсоида, решение задачи о росте парабо-
лоида определяет величину произведения урь а не значения
каждой из этих величин в отдельности. Следовательно, при
одинаковых температурных условиях осуществляется одна из
двух возможностей: либо медленно растет тупая игла, либо
быстро растет острая игла (температура на поверхности и
внутри обеих игл равна температуре плавления). Выражение
III. ЗАДАЧА СТЕФАНА
395
(9.49) Иванцов привел также в виде, отвечающем росту из рас-
твора [63, 77].
2. Кристаллизация эллиптического параболоида из переох-
лажденного расплава. Хорвей и Кан [73] обобщили метод Иван-
цова [61], применив его к расчету роста параболоида с эллипти-
ческим сечением. На фиг. 8 приведена связь безразмерной
скорости роста 2Q = ир</хь с формой (т. е. с отношением полу-
осей) эллиптического сечения; параметр А2 зависит от безраз-
Ф и г. 8. Зависимость приведенной скорости роста 2Q от приведенного
переохлаждения Uf для ряда значений эллиптичности Л2 при росте эллип-
тических параболоидов из переохлажденного расплава [73].
мерной степени переохлаждения Uf=cL(Tnn—Too)/А. Оказывает-
ся, что для параболического цилиндра (А2 = 0) скорость Q
меняется при малых переохлаждениях приблизительно пропор-
ционально U2f (см. ниже), а для иглы с круговым сечением
приблизительно пропорционально t/f’2. Как и прежде, извест-
но лишь произведение up*.
Другие формы роста. 1. Цилиндр с параболическим сечени-
ем. Хорвей и Кан [73], а также Иванцов [74] исследовали задачу
о кристаллизации цилиндра с параболическим сечением, рас-
тущего с постоянной скоростью из расплава в направлении оси
параболы. Эту конфигурацию можно рассматривать как дву-
мерный частный случай трехмерного дендрита; она представ-
ляет собой вырожденный эллипсоид. Поверхность, по предпо-
ложению, имеет температуру плавления. Решая задачу, можно
определить только произведение ypz (произведение скорости на
396
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
радиус кривизны вершины); как и в трехмерном случае,
-Г (Тпл - TJ = (пр')'1г ер' erf с (р')\ (9.50)
где p'=vpt/2KL (так называемое число Пекле Q).
2. Многогранники и многоугольники. Кристаллизацию пра-
вильных многоугольников, куба и октаэдра из пересыщенного
раствора исследовал Зегер [78], а из переохлажденного рас-
плава— Иванцов [63]. Зегер, в частности, ограничился рассмот-
рением кристаллизации с постоянной скоростью при очень ма-
лых концентрациях и пользовался стационарным уравнением
диффузии
V2C = 0. (9.51)
Поскольку предполагается, что скорость роста грани постоянна
как во времени, так и вдоль поверхности грани, правая часть
условия непрерывности потока (9.4) или (9.38) остается по-
стоянной, а концентрация, напротив, меняется вдоль поверх-
ности кристалла; этим рост гранной формы отличается от роста
других уже рассмотренных форм. Разность между максималь-
ной концентрацией на углу квадрата и минимальной концент-
рацией в середине стороны квадрата составляет примерно 3,5%
от значения интеграла нормальной составляющей градиента
концентрации1). Грубая оценка показывает, что концентрация
у вершины отличается от концентрации в центре грани куба
примерно на 2,5—3%. Иванцов [63], также исследовавший кри-
сталлизацию с очень малой линейной скоростью, установил, что
при росте из расплава центр грани — самый горячий участок, а
вершина — самый холодный. Этот результат качественно со-
гласуется с выводами Зегера. Однако Иванцов учел зависи-
мость температуры поверхности кристалла от времени, что за-
трудняет установление количественного соответствия его рас-
четов с данными Зегера.
3. Иглы иной (не параболоидальной) формы. Фишер [79] (см.
также [80] или [52]) исследовал кристаллизацию цилиндра со
сферической вершиной радиусом рь растущего вдоль своей оси
со скоростью v из переохлажденного расплава. Используя при-
ближенное выражение для распределения температуры и пола-
гая, что выделение скрытой теплоты примерно равно тепло-
отводу, автор получил (см., например, работу Хорвея [52]) вы-
ражение
^(Та.ш-Тх) = ^-, (9.52)
') То есть произведения нормальной составляющей градиента на длину
грани. — Прим. ред.
Ш. ЗАДАЧА СТЕФАНА
397
в котором через Гп. ш обозначена считающаяся неизвестной
температура поверхности раздела фаз на вершине иглы. Иван-
цов [63] исследовал кристаллизацию иглы в форме карандаша
и иглы квадратного сечения при росте с постоянной скоростью
из переохлажденного расплава и определил считавшуюся неиз-
вестной температуру вершины в функции скорости роста. Ре-
зультат, полученный Иванцовым, хорошо согласуется с расчетом
Фишера для цилиндра с полусферической вершиной.
Хорвей [52] в своем весьма подробном анализе модифициро-
ванной задачи Стефана (форма и скорость роста заданы, а
температура поверхности кристалла считается неизвестной)
исследовал кристаллизацию ци-
линдра со сфероидальной вер-
шиной. Включив рассмотренную
Фишером форму как частный
случай и решив задачу более
точно, он нашел,- что коэффи-
циент перед ур;/2хь в выражении
(9.52) равен 0,94, а не 1,0.
4. Прочие формы роста. Уил-
кокс [48] исследовал так назы-
ваемую «форму Чохральского»,
т. е. форму поверхности раздела
фаз при выращивании кристалла
методом Чохральского (фиг. 9).
Предполагалось, что кристалли-
зация идет с постоянной скоро-
стью, расплав перегрет, а темпе-
ратура фронта кристаллизации
Фиг. 9. Схема выращивания
кристаллов вытягиванием из ра-
сплава по Чохральскому.
постоянна и равна температуре
плавления. Численный расчет показал, что поверхность кристал-
ла вогнута, форма ее близка к параболоиду, а кривизна зави-
сит от условий теплообмена кристалла с окружающей
средой.
Хорвей [52] провел детальный численный расчет кристалли-
зации пластины с эллиптической вершиной (двумерный слу-
чай).
10. УСЛОЖНЕННАЯ ЗАДАЧА СТЕФАНА;
РАЗЛИЧНЫЕ ФОРМЫ
Имеется несколько типов усложняющих факторов, которые
можно ввести в уже рассмотренную «чистую» задачу Стефана.
Разумеется, усложнения вводятся для того, чтобы привести
выбранную модель в более точное соответствие с действитель-
ностью; среди таких факторов надо назвать следующие: влия-
398
Р. ПАРКЕР, МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
ние кинетических явлений или поверхностной энергии на тем-
пературу движущейся границы раздела фаз, концентрацию на
ней и форму этой границы; влияние гидродинамических пото-
ков в расплаве, растворе или паре (перемешивание или естест-
венная конвекция из-за разности плотностей) на условия теп-
лопередачи или диффузии; влияние примесей на температуру
поверхности раздела фаз или на концентрацию на ней и ее
форму; совместное действие потоков тепла и вещества при
росте из концентрированных растворов; наконец, влияние сило-
вых полей, приложенных к кристаллизующейся системе. По-види-
мому, кинетические явления на фронте кристаллизации, поверх-
ностная энергия и наличие примеси, особенно вместе с их зави-
симостями от кристаллографической ориентации, относятся к
наиболее важным из перечисленных усложняющих факторов.
Как уже отмечалось, задача Стефана даже в чистом виде
представляет собой довольно сложную граничную задачу мате-
матической физики. Введя в рассмотрение хотя бы один из пе-
речисленных процессов, можно получить задачу, для которой
нельзя найти точного решения. Гораздо более подробный ана-
лиз поверхностной кинетики, влияния примесей и течения
жидкости еще станет предметом последующего рассмотрения.
Здесь же мы обсудим эти эффекты в духе задачи Стефана,
т. е. их влияние на краевые условия и сами уравнения пере-
носа.
Плоскость, сфера, цилиндр. 1. Влияние примеси. Как уже от-
мечалось, теплоперенос и диффузия вещества описываются оди-
наковыми дифференциальными уравнениями (9.1) и (9.36), ре-
шения которых должны удовлетворять сходным граничным ус-
ловиям (9.3), (9.4), (9.37) и (9.38). До сих пор в задачах
рассматривался только один из двух процессов переноса. При
исследовании направленной кристаллизации считалось, что кри-
сталл растет из чистого расплава. При решении же задачи о
кристаллизации цилиндра из пересыщенного раствора тепловые
эффекты не учитывались. Но, как показал Франк [54], характер
роста может определяться совместным действием обоих процес-
сов переноса. В частности, расплав, из которого растет кристалл,
может содержать примесь в таком количестве, что она, накап-
ливаясь на фронте кристаллизации, приведет к снижению на
нем температуры плавления.’ При кристаллизации из раствора
температура у фронта роста может из-за выделения теплоты
кристаллизации повыситься настолько, что равновесная кон-
центрация там изменится. При одновременном учете обоих про-
цессов значения температуры и концентрации, входящие в гра-
ничные условия, меняются, хотя форма граничных условий ос-
тается прежней. Уравнения переноса также сохраняют свой вид,
III. ЗАДАЧА СТЕФАНА
399
если верно предположение о независимости коэффициентов D
и х от температуры и состава среды.
Франк [54] исследовал кристаллизацию шара, растущего из
переохлажденного расплава по закону в присутствии при-
меси, которая снижает Гпл на поверхности раздела фаз на ве-
личину KiCs, где Cs есть концентрация примеси в расплаве у
фронта роста, a Ki — постоянная. Таким образом, требуется
одновременно решить четыре уравнения: 1) константы роста Ат
и Кс связаны соотношением, учитывающим, что они описывают
перемещение одной и той же сферической поверхности:
= АСП’Л; (Ю.1)
2) понижение температуры плавления на поверхности шара
7п.ш равно
^п.ш = ^пл KiCs\ (10.2)
3) уравнение (9.32) и 4) его аналог для роста из раствора, где
константы роста вЫраж^ад через температуру и концентрацию
на поверхности шара. Как доказал Франк, эту систему уравне-
ний можно решить графически с помощью прибора с градуи-
рованными шкалами.[Как показывает решение задачи для кон-
кретного числового примера, даже если концентрация примеси
в объеме расплава невелика, то примесь все же способна на-
капливаться у фронта кристаллизации в заметном количестве,
поскольку коэффициент диффузии мал. В итоге равновесная
температура у фронта роста существенно понизится, что при-
ведет к снижению эффективного переохлаждения и в свою оче-
редь замедлит рост кристалла. Такая ситуация складывается,
когда кристалл слабо захватывает или вовсе не захватывает
примесь. При этом анализе предполагалось, что концентрация
примеси или «растворителя» невелика. Подобным же образом
можно проанализировать другой предельный случай — рост из
раствора. Однако решение такой задачи показывает, что по-
правка, учитывающая изменение температуры вследствие вы-
деления теплоты кристаллизации, в общем мала по сравнению
с поправкой, вносимой в решение задачи о росте из расплава
при учете влияния примеси.
Задачи, подобные рассмотренной Франком, исследовал
Иванцов [63, 77, 81]- В частности, он решил задачу о кристал-
лизации бинарного сплава из перегретого расплава для плос-
кого фронта [81]. Им проведен такой же анализ для кристалли-
зации сплава со сферическим фронтом роста из переохлажден-
ного расплава [77]. В обоих случаях фронт перемещался со
скоростью, пропорциональной /1/2. Решая задачу о направлен-
ной кристаллизации, подобную классической задаче Стефана q
400
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
росте из чистого расплава, Иванцов нашел, по-видимому, не
решая количественно самосогласованную задачу, результат, со-
впадающий с данными, полученными Франком для сферы: из-
за малой подвижности примеси ее концентрация у фронта роста
возрастает, так что равновесная температура там снижается.
В качестве примера Иванцов взял случай, когда тугоплавкий
компонент сплава легче переходит в кристаллическое состояние
(это эквивалентно ситуации, рассмотренной Франком, когда у
поверхности кристалла возрастает концентрация легкоплав-
кого компонента, слабо переходящего в кристалл). В итоге
перед фронтом кристаллизации формируется слой расплава с
концентрацией легкоплавкого компонента выше равновесной,
который вследствие этого оказывается переохлажденным, хотя
на большом удалении от поверхности кристалла расплав пере-
грет, а температура на самой этой поверхности остается равно-
весной. Это явление обнаружили независимо от Иванцова и
Франка Раттер и Чалмерс [82], назвавшие его концентрацион-
ным переохлаждением в отличие от обычного переохлаждения,
связанного с понижением температуры. Речь о проведенном
этими авторами анализе устойчивости формы кристалла еще
пойдет ниже.
Любов и Темкин [83] тоже исследовали задачу о направлен-
ной кристаллизации сплава в формулировке, предложен-
ной Иванцовым [81], однако они не учитывали распределение
температуры и ограничились анализом распределения примеси,
предположив, что закон перемещения фронта известен пол-
ностью, вплоть до константы роста. Ими было рассчитано рас-
пределение примеси в кристалле при движении фронта кри-
сталлизации со скоростью, пропорциональной /,/2 и t.
2. Учет влияния различия плотностей твердой и жидкой
фаз. Гидродинамические потоки в расплаве или пересыщенном
растворе могут иметь различное происхождение: так, тепловая
конвекция возникает из-за различия плотностей разных участков
среды, которое в свою очередь вызвано неоднородностью тем-
пературы; неоднородность концентрации тоже приводит к появ-
лению разности плотностей и соответственно концентрационных
токов; гидродинамические потоки создаются путем принуди-
тельного перемешивания; они сопровождают кристаллизацию и
в том случае, когда плотность кристалла отлична от плотности
жидкой среды. О тепловой конвекции и концентрационных токах
говорится в гл. VIII. Различие плотностей жидкой и твердой
фаз легко учесть в рамках задачи Стефана; его влияние на рост
кристалла рассматривается в настоящей главе подробнее, чем
в гл. VIII.
Ясно, что при кристаллизации из расплава, когда для обра-
зования кристалла данного объема обычно требуется на не-
III. ЗАДАЧА СТЕФАНА
401
сколько процентов больший объем расплава, должен существо-
вать поток жидкой фазы по направлению к кристаллу. Этот по-
ток вещества может влиять на распределение температуры, да-
ваемое решением задачи Стефана.
Подобный эффект в случае плоского фронта затвердевания
исследовали Карслоу и Егер [51], а также Хорвей [84]; последний
к тому же проанализировал влияние эффекта на кристаллиза-
цию цилиндра и шара из переохлажденного расплава. Видоиз-
мененное уравнение теплопроводности (9.1) в этом случае за-
пишется следующим образом:
дтт дтг Г д2тг п дТ.]
-^ + u-^ = KL ---------------(10.3)
dt dr L L dr2 1 r dr J v '
Здесь n = 0 для плоского фронта, n = 1 для цилиндра и п =
= 2 для шара; и — радиальная скорость течения жидкости.
Движение жидкости, которая считается несжимаемой, описы-
вается двумя дополнительными уравнениями: уравнением непре-
рывности
г-"^(г"-Ы) = 0 (10.4)
и уравнением Навье — Стокса
du . du Г d2u . (duldr и \1 1 dp
dt * dr L dr2 \ r r2 /J p£ dr ’ v '
где p — давление жидкости, рь — ее плотность, a v — кинема-
тическая вязкость.
Хорвей показал, что взятое в квадратные скобки выражение
в уравнении (10.5) равно нулю, следовательно, поток не за-
висит от вязкости v; кроме того, движение жидкости потенци-
ально. Наряду с условием (9.4) должно выполняться условие
баланса масс на фронте кристаллизации:
рЛт = р4тг-“<< <10-6>
Здесь ps — плотность кристалла. Решение сформулированной
задачи показало, что все три рассмотренные формы растут по
закону R = 20(хьО,/г- Константа роста 0 в случае плоского
фронта выражается в виде 0 = (1 + е)-10'; 0' находится реше-
нием уравнения с£(Т1пл—Т1^) = Ал'/ф'е13' erfc(0'), полностью со-
впадающего по форме с уравнением (9.22); параметр е, отра-
жающий различие плотностей твердой и жидкой фаз, равен
(ps/рь) — 1- Хорвей показал, что 0 для шара и цилиндра слабо
зависит от параметра е при малых его значениях.
Из решения задачи, однако, следует, что давление жидкости
при направленной кристаллизации очень велико, поскольку на-
чальная скорость жидкости (при t = 0) бесконечно велика,
402
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
так же как и скорость фронта кристаллизации при /->0. При по-
следующем уменьшении скорости от этой бесконечной величины
поток ослабевает, приводя к некоторым высоким (положитель-
ным) давлениям, откуда следует неприменимость предположе-
ния о несжимаемости жидкости. Совершенно иным оказался
характер изменения давления при кристаллизации цилиндра и
шара: давление около кристаллов такой формы может прини-
мать отрицательные значения, что может привести к кавитации
и зарождению новых центров кристаллизации. Подобные дина-
мические явления исследованы также Гликсманом [85] преиму-
щественно для больших скоростей кристаллизации (см. также
гл. VIII).
3. Прочие эффекты. Влияние кинетических явлений на по-
верхности раздела фаз в рамках задачи Стефана исследовал
Любов [86]; он рассмотрел, как отражается на одномерных теп-
ловых потоках охлаждение поверхности раздела кристалл — рас-
плав до температуры ниже точки плавления. Чернов и Любов
[87], а также Гликсман и Шефер [88] исследовали кристаллиза-
цию сферы, учитывая при этом кинетические явления на границе
фаз.
Косгроув [89] исследовал влияние электрического поля на
лимитируемый диффузией рост сферы из заряженных частиц, со-
держащихся в растворе. Действие поля сводится к тому, что
оно способствует осаждению с одной стороны сферы большего
количества вещества, чем с другой, вследствие чего сфера, про-
должая разрастаться по радиусу, смещается как целое.
Формы дендритов — параболоидальные и прочие. 1. Влияние
поверхностной энергии и кинетических явлений на поверхности
раздела фаз. Как уже отмечалось, решение задачи о кристал-
лизации параболоидального дендрита, полученное Иванцовым
[61], а также Хорвеем и Каном [73], содержит неопределенность:
известно лишь произведение скорости продвижения вершины
дендрита v на радиус кривизны вершины рь а не их значения по
отдельности. Это означает, что в одном и том же переохлажден-
ном расплаве могут либо быстро расти острые иглы, либо мед-
леннотупые. Приближенный учет влияния поверхностной энергии
или кинетических явлений на поверхности раздела фаз позволяет
ввести масштаб длины или скорости кристаллизации, а также
приблизить постановку задачи к реальной ситуации.
Приступая к анализу влияния поверхностной энергии, Тем-
кин [90] использовал в качестве исходного полученное Иванцо-
вым [61] решение «основной» задачи о параболоиде вращения
при росте с постоянной скоростью v [см. (9.49)]. В этом расчете
поверхность дендрита считалась изотермичной, а температура
ее предполагалась равной температуре плавления. Влияние по-
III. ЗАДАЧА СТЕФАНА
403
верхностной энергии на распределение температуры состоит в
том, что, согласно уравнению Гиббса — Томсона, участок кри-
сталла, ограниченный поверхностью с большей кривизной (ра-
диус кривизны порядка 10~2 мм или меньше), плавится при бо-
лее низкой температуре:
2у„,Г (оо)
Гпл(р) = Гпл(оо)--пл; (10.7)
Здесь Гпл(оо) — температура плавления кристалла с плоской по-
верхностью; Тил (р) — температура плавления кристалла с по-
верхностью, радиус кривизны которой равен р; у8ь — поверхно-
стное натяжение (свободная поверхностная энергия) поверхно-
сти раздела кристалл/расплав; р8—плотность кристалла. Кроме
поверхностной энергии, Темкин включил в рассмотрение кине-
тические явления на поверхности раздела фаз, которым соот-
ветствует линейная зависимость скорости роста от переохлаж-
дения на фронте кристаллизации. Рассматриваемые в гл. V ки-
нетические явления на поверхности раздела фаз — это молеку-
лярные процессы, определяющие, какой должна быть степень от-
клонения температуры этой, поверхности от равновесной, чтобы
скорость перехода молекул йз расплава в кристалл приобрела
данное значение. Линейная зависимость скорости роста от пере-
охлаждения выражается следующим образом:
^ = К[-Гп.ш+Гпл(р)]. (10.8)
Здесь vN — скорость роста по нормали к рассматриваемому эле-
менту поверхности; К — постоянная, называемая линейным ки-
нетическим коэффициентом; Гп.ш — истинная температура по-
верхности в данной точке. Поверхность параболоида вращения
г(х, у) описывается уравнением z = (р^/2) — (х2 + y2)/2pt, где
pt — радиус кривизны вершины, перемещающейся со ско-
ростью v. Температура на поверхности раздела фаз должна,
следовательно, подчиняться новому граничному условию, сфор-
мулированному Темкиным в следующем виде:
Лт. ш (г) — Л1л(°°)
3
vrT (оо)
'SL пл v 7___________________________
/2 ps/.pjl - Z/P/]’/2
- | [2(1 - 2/P<)]-‘\ (10.9)
Теперь следует решить сформулированную таким образом зада-
чу Стефана, чтобы выяснить, существует ли самовоспроизводя-
щаяся форма роста и, если существует, то какова она. Если
параболоид, по нашему представлению, является единствен-
ной формой роста, удовлетворяющей условию постоянства
404
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
температуры на фронте кристаллизации, то форма, удовлетво-
ряющая условию (10.9), не может быть параболоидом. Тем не
менее для простоты расчетов Темкин принимает в качестве
первого приближения, что форма роста представляет собой па-
раболоид вращения. Вместе с тем предполагается, что при ма-
лых степенях переохлаждения исходного расплава справедливо
уравнение Лапласа. В итоге он получает соотношение
ехр Ei = (^(°°> ~ Т-} . (10.10)
2“i \2xlI \ ) [i + Vp. + Msl/’Pi]
где хь — температуропроводность расплава, a L\ и Ь2 суть по-
стоянные. Уравнение (10.10) отличается от уравнения (9.49)
прежде всего тем, что знаменатель правой части уже не равен
единице, так что при одинаковых радиусах кривизны и одина-
ковых степенях переохлаждения исходного расплава скорость
роста в последнем случае меньше скорости, определяемой из
уравнения (9.49). Это объясняется эффективным снижением
температуры поверхности, т. е. уменьшением движущей силы
роста, происходящим частично из-за снижения температуры пла-
вления над кривой поверхностью [см. уравнение (10.7)], частич-
но из-за того, что некоторая доля переохлаждения «отбирается»
кинетическими явлениями, т. е. служит движущей силой кинети-
ческих реакций на поверхности раздела фаз. В итоге движущая
сила теплопереноса становится меньше. Ясно, что уравнение
(10.10) сводится к уравнению (9.49), если пренебречь влиянием
поверхностной энергии, положив ySL = 0, и если предположить,
что кинетические процессы протекают с большой скоростью, т. е.
/( —► оо (при конечном значении скорости роста поверхность раз-
дела фаз не переохлаждена). Левую часть уравнения (10.10) мо-
жно при vpt/^HL 0,003 заменить приближенным выражением
(цр//2хь)0’83, и тогда из условия dvldpt = § находится макси-
мальная СКОРОСТЬ рОСТа Цдоакс* В независимых, но близких по со-
держанию работах Темкина [90] и Боллинга и Тиллера [91] пред-
полагается, что на деле реализуется только скорость уМакс, но до
сих пор это предположение не получило четкого подтверждения.
2, Влияние примеси на рост дендритов. Кристаллизацию па-
раболоида и близких к параболоидам форм из расплава с при-
месью исследовали Темкин [92], а также Боллинг и Тиллер [91].
Прежде чем изложить их исследования, заметим, что как реше-
ния, полученные Иванцовым [61], а также Хорвеем и Каном [73]
для основной задачи о росте параболоида из расплава, так и
решение Темкина, учитывающее влияние кинетических явлений
на фронте роста и влияние кривизны параболоида, легко пере-
формулировать таким образом, чтобы они описывали кристалли-
зацию из разбавленного раствора (об этом уже говорилось при
III. ЗАДАЧА СТЕФАНА
405
анализе кристаллизации цилиндра). Единственное отличие со-
стоит в том, что при эквивалентных движущих силах [приведен-
ное переохлаждение (cl/L) (Тпл(оо) — Too) или приведенное пе-
ресыщение S = (Соо — Cq)/(Ct — Со)] и одинаковых радиусах
кривизны вершины дендрита скорость роста из разбавленного
раствора гораздо меньше скорости роста из расплава, посколь-
ку, как уже было показано, коэффициент диффузии вещества
обычно в несколько сотен раз меньше, чем коэффициент темпе-
ратуропроводности. К тому же следует ожидать, что по аналогии
с выводом, полученным Франком для кристаллизующегося шара,
тепловые эффекты при росте из разбавленного раствора должны
быть слабыми, так что ими можно пренебречь. Тем не менее
может случиться, что влияние примеси на кристаллизацию из
расплава будет, как и при росте шара, довольно значительным
и не допускающим пренебрежения им, так как накопление при-
меси перед фронтом роста снизит равновесную температуру кри-
сталлизации, уменьшив тем самым степень эффективного пере-
охлаждения, т. е. движущую силу явлений теплопереноса.
Темкин [92] исследовал одновременное действие тепловых и
диффузионных процессов при кристаллизации бинарного сплава
в форме параболоида вращения. Он нашел решение основной
задачи о параболоиде, удовлетвЬряющее одновременно уравне-
нию (9.49), переформулированному применительно к росту из
раствора [77], и уравнению (10.10) для задачи теплопроводно-
сти [90]. Во втором уравнении в отличие от первого были учте-
ны поверхностная энергия и кинетические процессы на фронте
кристаллизации. Степень снижения температуры плавления в
разбавленном сплаве и коэффициент сегрегации были заданы;
кроме того, дендрит, обладающий «максимальной скоростью»,
полученный при решении тепловой задачи, считался единствен-
но реализующимся. Используя в качестве примера разбавлен-
ные сплавы свинца в олове, Темкин выяснил, что при заданной
исходной температуре расплава даже небольшое содержание
примеси способно привести к снижению скорости роста на не-
сколько порядков. Этот смешанный анализ задачи, использую-
щий к тому же непроверенное представление о максимальной
скорости, можно, вероятно, рассматривать только как первое
приближение решения поставленной задачи.
Боллинг и Тиллер [91] в своем исследовании параболоидаль-
ных форм роста также пользовались представлением о макси-
мальной скорости кристаллизации. Эти авторы подробно сопо-
ставили теоретические результаты с экспериментальными дан-
ными по росту КС1 и уксусной кислоты из раствора.
3. Влияние различия плотностей фаз на дендритный рост.
Хорвей [84] показал, что различие плотностей твердой и жидкой
фаз слабо влияет на рост параболоидального дендрита. Дело
406
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
в том, что скорость перемещения дендрита считается постоян-
ной; если не учитывать различия плотностей [73], то скорость
равна и, а различие плотностей приводит к притоку расплава
к кристаллу со скоростью sv и, следовательно, скорость v исход-
ной задачи просто заменяется произведением (1 + е)и, напри-
мер в уравнении (9.49).
Прочие формы роста. Данный раздел посвящен разбору ре-
шений задачи Стефана для более сложных форм.
1. Нитевидные кристаллы. Кристаллы нитевидной формы
обычно бывают тонкими, длинными и прямыми. Существует не-
сколько механизмов их роста [93]. Одна из моделей, примени-
мая к росту нитевидных кристаллов из чистого пара в отсут-
ствие инертного газа или другого газа, замедляющего рост бла-
годаря появлению диффузии, предложена Сирсом [94] и рассчи-
тана с разной степенью точности в работах Диттмара и Нейма-
на [95], Блейкли и Джексона [96], Гомера [97,98], Рута и Хирса
[99], а также Симмонса и др. [100]. Точный расчет для этой мо-
дели первыми выполнили Симмонс и др. [100]. Согласно модели
Сирса, нитевидные кристаллы растут на подложке. Атомы пара
падают на боковые стенки нитевидного кристалла и там адсор-
бируются. Затем такие адсорбированные атомы диффундируют
по боковой стенке к вершине нитевидного кристалла и осаж-
даются там на ловушках, например на ступенях, источником ко-
торых служит винтовая дислокация. К тому же предполагается,
что атомы не диффундируют к подложке или от нее и не встраи-
ваются в кристалл на боковых стенках нитевидного кристалла,
а количество атомов, осаждающихся на вершине кристалла не-
посредственно из пара, не может обеспечить его рост, так как
площадь вершины мала по сравнению с площадью боковых сте-
нок. Задача состоит в том, чтобы найти зависимость длины ни-
тевидных кристаллов I от времени /.
Хотя по существу эта задача одномерная, уравнение диффу-
зии, описывающее диффузию по боковой поверхности нитевид-
ного кристалла, отличается от обычного уравнения диффузии и
записывается в виде
^ = Ds^_i+r. (10.11)
dt 6 дх2 7
Здесь ns = ns(x, t) — концентрация адсорбированных атомов,
х—расстояние от подложки, ts — время жизни атома в адсор-
бированном состоянии, Ds — коэффициент поверхностной диффу-
зии адатомов и У' —скорость осаждения из пара. Член ns/Ts в
этом уравнении представляет собой скорость реиспарения. На-
ряду с этим уравнением должны выполняться следующие гра-
ничные условия: вещество, достигающее вершины, осаждается
III. ЗАДАЧА СТЕФАНА
40/
там; концентрация на вершине равна равновесной; поток к под-
ложке отсутствует. В качестве начального условия принимается,
что в момент t = 0, когда «впускается» пар, плотность числа ад-
сорбированных атомов одинакова вдоль всей поверхности. Для
задачи (10.11) с граничными и начальным условиями методом
итераций получено численное решение [101], и в результате най-
дена зависимость длины кристалла от времени и распределение
концентраций. Сравнение результатов точного расчета (сплош-
ная линия) с рядом вычисленных ранее приближений прово-
дится на фиг. 10.
Фиг. 10. Зависимость приведенной длины I от приведенного времени / в слу-
чае вырап ивания нитевидных кристаллов из пара при конкретных значе-
ниях степени пересыщения и начальной длины [101].
Сплошная кривая — данные точного численного расчета; X —экспоненциальное прибли-
жение; □ — приближение Диттмара — Неймана; А — приближение Кертиса.
2. Форма кристалла при росте в таммановской трубке. Фор-
му поверхности раздела фаз и скорость кристаллизации по
Тамману исследовали Любов [86], Берлад [102—104] и многие
другие [105—107] (см. также [47]). Кристаллизация в трубке
Таммана представляет собой с точки зрения задачи Стефана
весьма сложную конфигурацию. Первоначально она была ис-
пользована для того, чтобы получить сведения о кинетических
явлениях на поверхности раздела фаз. Речь об этом еще пой-
дет дальше. Трубка Таммана — это длинная, обычно стеклянная
трубка, закрытая с одной или с обеих сторон и содержащая пе-
реохлажденный расплав. Трубка погружена в термостатирован-
ную жидкость. В одном конце находящегося в трубке пере-
охлажденного расплава каким-либо спосбоом инициируют кри-
сталлизацию, причем кристалл растет вниз (или вверх) по трубке.
403
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Путем измерения положения поверхности раздела кристалл—
расплав в разные моменты времени (это измерение часто
проводится непосредственно в процессе роста оптическими
методами) находят скорость кристаллизации при различных
температурах термостата. Рассмотрим теперь вопрос о том,
можно ли полученные таким путем данные считать фундамен-
тальными или измеряемые величины испытывают неконтроли-
руемые искажения из-за влияния трубки.
Если поток тепла вдоль оси трубки постоянен по ее сечению
(одномерен) и если не учитывать такие дополнительные фак-
торы, как кинетические явления на поверхности раздела фаз или
влияние поверхностной энергии и примеси, и считать несуще-
ственным как каталитическое, так и любое другое влияние сте-
нок трубки, то для исследования кристаллизации переохлаж-
денного расплава в трубке можно воспользоваться решением
классической одномерной задачи Стефана, взяв уравнения (9.19)
и (9.22). При выполнении сделанных предположений фронт кри-
сталлизации плоский, тепловой поток полностью заключен в пе-
реохлажденном расплаве и, согласно уравнению (9.19), ско-
рость кристаллизации dX/dt пропорциональна Следова-
тельно, кристаллизация в трубке Таммана нестационарна, так
что скорость роста не может принимать постоянного значения.
Как уже отмечалось при обсуждении уравнения (9.23), скорость
направленной кристаллизации постоянна только в том случае,
когда от расплава с начальной температурой, равной температу-
ре плавления, отбирают тепла больше, чем его поступает при
постоянной температуре к поверхности х = 0; для этого темпе-
ратура граничной поверхности должна снижаться с течением
времени экспоненциально. Поскольку в экспериментах с трубкой
Таммана это условие не выполняется, постоянство скорости кри-
сталлизации свидетельствует либо о нарушении одномерности
теплового потока, либо о заметном влиянии каких-либо из уже
перечисленных выше факторов, либо о том и другом одновре-
менно. Поэтому целесообразно попытаться найти количествен-
ное решение трехмерной (или двумерной при условии цилиндри-
ческой симметрии) задачи Стефана для трубки Таммана, по-
тому что без такого решения вряд ли можно предсказать форму
поверхности раздела фаз и скорость’ кристаллизации. Впрочем,
из эксперимента можно определить нижнюю границу значений
кинетического коэффициента, основываясь на том, что переохла-
ждение поверхности раздела фаз 6Т XT. Некоторого успеха
в исследовании плоского фронта, перемещающегося с постоян-
ной скоростью, добился Хиллинг [105], рассчитавший к тому же
температурные градиенты для трубок со стенками различной
толщины. Аналогичные вычисления провели Майклс и др. [108].
Любов [86] проанализировал одномерную задачу с граничными
tit. ЗАДАЧА СТЕФАНА
409
условиями, учитывающими кинетические явления на поверхно-
сти раздела фаз. Не исключено, конечно, что кинетические явле-
ния на поверхности раздела фаз идут столь медленно, что на
них целиком расходуется переохлаждение расплава, не остав-
ляя ничего на поддержание потока тепла; иными словами, за
единичное время теплоты кристаллизации выделяется так мало,
что для ее отведения достаточно иметь пренебрежимо малые
градиенты температур. Однако такая ситуация не относится к
классу задач Стефана. Речь о ней еще пойдет в главе, посвя-
щенной кинетическим явлениям на поверхности раздела фаз.
11. НЕКОТОРЫЕ ПРИБЛИЖЕННЫЕ РЕШЕНИЯ
ЗАДАЧИ СТЕФАНА
Ниже дан лишь беглый обзор методов приближенного реше-
ния задачи Стефана, поскольку центр тяжести наших интересов
лежит в области получения или попыток получения точных ре-
шений. Весьма подробный обзор многочисленных приближен-
ных аналитических методов д^ан Банкоффом [50]. Здесь же бу-
дут рассмотрены приближения на основе уравнения Лапласа.
Плоский фронт кристаллизации, расплав при температуре
плавления. При направленной кристаллизации, когда теплота
кристаллизации отводится через кристалл толщиной X(t) =
= 2Zi (xsO'12 и когда расплав находится при температуре плав-
ления, уравнение (9.16) преобразуется к следующему (точному)
виду:
л/1 erf л,, = —«-Тпл. (11.1)
Ln 12
Напомним, что температура плавления ГПл отсчитывается здесь
в такой системе, что на твердой поверхности при х = 0 она рав-
на нулю. Если «приведенная температура» csTnjl/L, которая
представляет собой движущую силу кристаллизации, много
меньше единицы, то уравнение (11.1) можно приближенно за-
писать вслед за Карслоу и Егером [61] в таком виде:
с Т
(11-2)
(например, для льда csTnJL = 0,012, если на поверхности х = 0
поддерживается температура —2 °C). Приближенное выраже-
ние (11.2) можно получить иначе, если предположить, что вме-
сто точного уравнения (9.2) распределение температур в кри-
сталле подчиняется уравнению Лапласа
V2rs = 0. (11.3)
410
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Решение уравнения (11.3), подчиняющееся условиям Ts = Тпл
при х = X и Ts = 0 при х = 0, имеет вид
Ts = ^. (11.4)
Наложим на выражение (11.4) условие (9.4), связывающее теп-
ловые потоки на границе фаз, и не обращая внимания на то, что
решение (11.4) уравнения (11.3) не учитывает зависимости от
времени, получим в результате интегрирования соотношение
;Г = 4Л^/, (Ц .5)
где Л? дается выражением (11.2). Если расплав перегрет или
переохлажден, так что градиент температуры в нем, как уже от-
мечалось, отличен от нуля, то решение уравнения Лапласа в
расплаве не удовлетворяет условию ограниченности темпера-
туры при х = оо, так как единственное решение задачи, допу-
скающее существование потока тепла в расплаве при направлен-
ной кристаллизации, представляет собой линейную функцию х.
Распределение температур в расплаве в частном случае TL =
= Тпл подчиняется уравнению Лапласа.
Рост шара в пересыщенном растворе. Уравнение Лапласа
применимо к расчету кристаллизации шара, если движущие силы
малы; решение уравнения для такой конфигурации удовлетворя-
ет граничному условию на бесконечности, которое не выполня-
лось для плоского фронта кристалла при росте из пересыщен-
ного раствора (или переохлажденного расплава). В случае ша-
рообразного кристалла выражения (9.31) и (9.32) запишутся
через величины, характеризующие рост из раствора, следую-
щим образом [109]:
с_с = {Со - Cool {(R/r) exp [- (Asr/7?)2] - Л5л'/г erfc j
exp [- A?] - Л5л'/! erfc (A5)
И
2Zs {1 - A exp erfc [A5]J = S. (11.7)
Здесь 5 = (С» — С»)/(Ст —Co) есть «приведенное пересыще-
ние», a Coo, Co и CT суть соответственно концентрация примеси
на бесконечности, на поверхности шара (равновесная по пред-
положению) и внутри шара. Если 5 1, то Аз 1 и соотноше-
ние (11.7) приводится к виду
Приближенное выражение (11.8) можно вывести иначе, пред-
положив, что в растворе вместо точного уравнения диффузии
Ill, ЗАДАЧА СТЕФАНА
411
выполняется уравнение Лапласа
W? = (^ + |£)c = 0. (11.9)
Решение уравнения (11.9), удовлетворяющее граничным усло-
виям при г = R и г = оо, имеет вид
С-Соо = (С0-См)4-
Как и раньше, пользуясь условием для потоков концентрации
D^L=(Cr-c”’^' (1|11)
получаем зависимость /?2 = где квадрат задан при-
ближенным выражением (11.8). Легко показать, что выражение
(11.6) сводится к (11.10) при Xs <С 1 и (Xgr/7?) 1. Последнее
условие не выполняется при г > R, так что в этом случае
(11.10) не служит достаточно хорошим приближением для
(11.6).
Рост цилиндра иЗ\ пересыщенного раствора. Уравнение Лап-
ласа в этом случае можно использовать только тогда, когда мо-
жно обойтись без условия на бесконечности C(oo,f) = С», по-
скольку решение уравнения Лапласа в форме In (г) принимает
там бесконечно большое значение. Условие на бесконечности
следует заменить условием вида С» = С(/?х), где RK = R/vK
(Z—константа роста, v — числовой коэффициент и R — радиус
цилиндра). Приближенные выражения находят так же, как и
для шара.
Как видно из приведенных примеров, если безразмерные
движущие силы много меньше единицы, то точное решение за-
дачи Стефана можно заменить решением уравнения Лапласа.
Однако это решение должно удовлетворять другому граничному
условию при большом удалении от фронта роста, отличному
от исходного условия, причем это новое условие может не быть
известно заранее. У поверхности растущего кристалла оба ре-
шения достаточно хорошо совпадают, чтобы давать одно и то
же значение скорости роста.
12. НЕКОТОРЫЕ ВОПРОСЫ, СВЯЗАННЫЕ
С ЗАДАЧЕЙ СТЕФАНА
Хорвей [52] перечислил ряд задач, стоящих перед исследо-
вателями в этой области. Их можно сформулировать (в поста-
новке тепловой задачи) следующим образом:
а) установить все изотермические поверхности, сохраняющие
форму при росте по закону /,/г;
412
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
б) установить все изотермические поверхности, сохраняющие
форму при росте со скоростью, пропорциональной /;
в) найти какие-либо изотермические поверхности, сохраняю-
щие форму при росте по законам, отличающимся от пропорцио-
нальности /1/2 и t\
г) исследовать рост кристалла, имеющего форму гантели
и другие формы (например, форму тора); исследовать изменение
этих форм со временем, их устойчивость по отношению к рас-
щеплению или к преобразованию в форму с другой топологией
(в отличие от устойчивости по отношению к слабым возмуще-
ниям, которая очень существенна и рассматривается в гл. VI).
Этот список задач можно продолжить дальше, предусмотрев
в нем хотя бы следующие:
д) задача о спектре форм (исследование форм, которые не
сохраняются, но меняются медленно, например задача о росте
эллипсоида, у которого отношение большей полуоси к меньшей
есть заданная простая функция времени или размера);
е) задача о кристаллизации дендрита: неопределенность ме-
жду v и рг остается важнейшей проблемой; не выяснено, как на
бесконечности могут существовать две температуры (в расплаве
и кристалле);
ж) учет влияния кинетических явлений на поверхности раз-
дела фаз, поверхностной энергии и их анизотропии.
IV
ОБРАЗОВАНИЕ ЗАРОДЫШЕЙ
13. ВВЕДЕНИЕ
Как уже отмечалось, кристаллизация (например, затверде-
вание расплава пли конденсация пара) обычно не протекает
однородно во всем объеме метастабильной фазы. Напротив, то
здесь, то там в кристаллизационной среде или в материнской
фазе возникают небольшие частицы новой фазы, которые за-
тем разрастаются [9]. Зародышеобразование — это акт возник-
новения очень малых частиц новой фазы в маточной среде.
Рост представляет собой процесс, посредством которого такие
частицы достигают макроскопических размеров. Нас в первую
очередь интересует проблема роста, в связи с чем здесь дается
лишь довольно беглый обзор классической теории образования
зародышей (со ссылками в первую очередь на недавние обзор-
ные публикации) с рассмотрением некоторых особо интересных
современных аспектов данной проблемы.
Как отметили Кан и Хиллиард [НО], Гиббс [111] различал
два пути, по которым могут проходить фазовые превращения,
причем метастабильные фазы, которые, как полагают, возникают
в среде, препятствуют развитию этих превращений. В первом
случае превращение бесконечно мало по степени, но распростра-
нено по большому объему; во втором случае, называемом заро-
дышеобразованием, степень превращения велика, однако оно
сильно локализовано, как, например, образование капли в пере-
сыщенном паре. Первый путь превращения до Кана и Хиллиар-
да был изучен слабо (см. об этом ниже), в то время как образо-
вание зародышей исследовано всесторонне. Из недавних обзо-
ров на эту тему сошлемся на публикации Тернбалла [9], Хирса
и Паунда [112], Кристиана [19], Ульмана и Чалмерса [113], Фе-
дера и др. [114], Нильсена [115], Уолтона [116] и Пэшли
[И7]1).
14. КЛАССИЧЕСКАЯ ТЕОРИЯ ОБРАЗОВАНИЯ
ЗАРОДЫШЕЙ
Гомогенное зарождение жидких капель в паровой фазе; тер-
модинамический подход. Хотя нас интересует прежде всего рост
4) См. также новейший обзор Пэшли в сб. Recent Progress in Surface
Science, Vol. 3, New York — London, 1970, p. 23. — Прим, nepee.
414
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
кристаллов, все же рассмотрим сначала зарождение жидких ка-
пель из пересыщенного пара, поскольку эта задача в некотором
смысле является простейшей, иллюстрируя в то же время глав-
ные особенности процесса. Последуем анализу Кристиана [19].
Предполагается, что к очень малым капелькам применим тер-
модинамический подход и что поверхности капелек имеют рез-
кую границу. Сначала рассмотрим чисто гомогенное зарождение,
предположив, что отсутствуют какие-либо инородные частицы
или поверхности, которые могли бы служить катализаторами
для зарождения — в таком случае оно называлось бы гетеро-
генным. (Надо заметить, что эта терминология довольно
неудачна в том смысле, что гомогенным зарождением называют
фазовое превращение, которое протекает гетерогенно, т. е. в от-
дельных точках маточной среды; вместо понятия «гетерогенное
зарождение», по-видимому, лучше было бы пользоваться поня-
тием «каталитическое зарождение».) Рассмотрим прежде всего
термодинамику таких капель, а затем перейдем к кинетике их
образования посредством «гетерофазных» флуктуаций.
Возникновение небольшой капли радиусом г при давлении
пара р, характеризующегося равновесным давлением ро (при
температуре Г), сопровождается гиббсовым изменением свобод-
ной энергии системы AG, которое состоит из следующих двух
вкладов:
AG = AG06 + AGhob-
(14.1)
Здесь AG06 есть изменение свободной энергии при конденсации;
для идеального газа эта величина, отнесенная к одиночному
атому, составляет —feTln(p/p0) (она выводится из изменения
свободной энергии идеального газа при изотермическом сжатии);
для сферической капли радиусом г получаем (—4/злг3/^) X
Х&Г1п(р/ро), где vl—атомный объем жидкости (считается по-
стоянным). Вклад AGnon равен просто 4№уЬу, где yLv — сво-
бодная энергия поверхности раздела жидкость — пар. Отсюда
AG = 4nr2yLlz - kT\n-^-.
(14.2)
При достаточно малых г первый член превалирует, что делает
AG положительной величиной; при достаточно больших г основ-
ную роль играет второй член, и тогда AG есть отрицательная
величина. Обозначим максимальное значение АО через AGKp;
оно представляет собой активационный барьер для зарождения;
в этом случае
Гкр kT In (р/р0) ’
(14.3)
IV. ОБРАЗОВАНИЕ ЗАРОДЫШЕЙ
415
следовательно,
ЛГ _ >6(v')2y1v
а°кР - 3 [kT In (Р/Ро)]2 •
(14-4)
Капелька, или зародыш, размером г < гКр будет проявлять тен-
денцию к испарению, а размером г>гКр — к росту, поскольку
в любом из этих случаев свободная энергия AG будет умень-
шаться. Следовательно, гКр есть «критический» радиус зарожде-
ния. Если (р/ро) 1, то AG станет возрастать с увеличением
г при всех обстоятельствах, т. е. критического размера капельки
нет, так что все капельки будут неустойчивыми относительно
испарения.
Флуктуации. Предполагается, что флуктуации («гетерофаз-
ные флуктуации») создают из молекул пара димеры, тримеры
и агрегаты более высокого порядка (независимо от того, пере-
сыщен пар или нет) [19,118], однако такие образования имеют
очень малые времена жизни, а их концентрации будут тем
меньше, чем больше размеры. Эти флуктуации аналогичны из-
вестным флуктуациям плотности в газе или концентрации в рас-
творе. Фольмер принял как одно из приближений, что на рас-
пределение зародышей (по размерам) не оказывает существен-
ного влияния последующее разрастание группировок, дости-
гающих или превосходящих критический размер гКр. Предпола-
гается также, что основной процесс состоит из длинного ряда
бимолекулярных реакций: одна молекула соединяется с другой,
образуя димер, затем к димеру присоединяется еще одна моле-
кула и т. д.; кроме прямых, необходимо учитывать и обратные
реакции; две группировки с числом молекул п(п> 1) не взаи-
модействуют.
Чтобы рассчитать распределение зародышей (которое также
можно считать больцмановским), предположим, что зародыши
из п атомов, число которых составляет Nn, образуют «разбав-
ленный раствор» в мономолекулярном паре. Тогда энтропия
смешения Sm представляет собой энтропию Nv парообразных
молекул из общего числа N' частиц и зародышей, входя-
п
щих в то же число N', т. е. N' = Nv + следовательно,
п
$т —
(И.5)
П
Изменение 6G свободной энергии этой системы в результате
того, что зародыш из п—1 молекул превращается при присо-
единении еще одной молекулы пара в зародыш из п молекул,
складывается из членов, содержащих 6Ж, 8N' и 8Nn, согласно
416
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
соотношению (14.5), а также из членов, учитывающих измене-
ние объемной и поверхностной свободных энергий. Если, как
предположил Фольмер, распределение зародышей соответствует
равновесному состоянию, то SG = 0 и
(14.6)
где \Gn определяется выражением (14.2) в соответствующей
форме, а именно &Gn = /г2/зуь^т]— nkT\n(p/po), причем множи-
тель т] = (36л)1/з(ц;)2/з относится к сфере. Поскольку, согласно
предположению, общее число зародышей очень мало, соотноше-
ние (14.6) можно приближенно записать в виде
^п«^ехр(-^-), (14.7)
где А/’—общее число молекул. Как уже отмечалось, Фольмер
полагал, что это распределение зародышей справедливо лишь
при п < /гкр, в то время как при п > /гкр их число падает до
нуля (здесь /гКр-—число молекул в зародыше критического ра-
диуса ГКр).
В рассматриваемом случае скорость зарождения / опреде-
ляется частотой 9оОкр, с которой одиночные молекулы соударя-
ются и соединяются с критическими зародышами площадью
ОКр; эта скорость пропорциональна плотности потока молекул
9о, площади Окр и числу Nn, причем вместо \Gn берется
A GKp*
/ ДбКп \
1 = q0OKpNn = Nq0OKP exp --(14.8)
или, иначе, скорость образования зародышей в единичном
объеме
' ^ехр{ I (14.9)
Nvl vl Ч 3(£П3[1п(р/р0)]2 J
Из кинетической теории газов известно, что qQ = р)
Выражение (14.9) чрезвычайно сильно зависит от отношения
р/ро- Отсюда возникает представление о критическом пересыще-
нии: это такое отношение р/ро, при котором величина, выражае-
мая формулой (14.9), становится измеримой.
Поправка Беккера и Деринга [119]. Беккер и Деринг [119]
уточнили анализ Фольмера, сняв его предположение о том, что
функция распределения описывается формулой (14.7) до /гкр,
а затем равна нулю; фактически зародыши критического раз-
мера могут с равной вероятностью и расти и растворяться, и
даже зародыши закритических размеров могут с некоторой
IV. ОБРАЗОВАНИЕ ЗАРОДЫШЕЙ
417
Вероятностью растворяться. В теории Беккера и Деринга реша-
ется система дифференциальных уравнений, описывающих ста-
ционарное распределение. Конечное решение иллюстрируется
кривыми на фиг. 11, а выражение для скорости зарождения
отличается от соотношения (14.9) множителем (1//гкр)Х
X (Лбкр/ЗлйТ)1/2, т. е. скорость образования зародышей в еди-
ничном объеме выражается следующим образом:
/ _ «А, У' ( -«-(.'Н |
Nvl vltiKp \ 3nkT / I 3 (kT)3 [In (p/po)]2 J
В сравнении с экспоненциальным членом поправочный множи-
тель в общем случае несуществен, ибо лежит в пределах от 1 до
-100.
Фиг. 11. Распределение зародышей по величине (по числу образующих
их молекул п) в теориях зарождения Фольмера (кривая /) и Беккера — Де-
ринга (кривая 2) [19].
Эксперименты с камерой Вильсона [9] показали, что в слу-
чае капелек воды и бензола вклад свободной поверхностной
энергии достигает приблизительно 13% объемной; это довольно
хорошо согласуется с теорией.
Переход пар — кристалл. Выражение для скорости образо-
вания кристаллических зародышей из пересыщенного пара лишь
слегка отличается от соотношения (14.9) в предэкспоненциаль-
ной части при условии, что соответствующий фактор формы т)
включен в выражение для ДСкр. Кристаллический зародыш с
минимальной поверхностной энергией в общем случае не будет
418
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
иметь сферическую форму, его форма определяется теоремой
Вульфа, поэтому зародыш может быть и многогранником.
Зарождение кристаллов в жидкой фазе. Образование кри^
сталлических зародышей в жидкой фазе отличается от проана-
лизированного выше случая прежде всего тем, что вместо ча-
стоты соударений газовых молекул qQ берут в соответствии с
теорией абсолютных скоростей реакции частоту vi, с которой
атом преодолевает энергетический барьер Aag* на границе ме-
жду жидкостью и кристаллическим зародышем, содержащим
п атомов. Частота vi определяется в виде
V1 = voexp(— -^А-), (14.10)
где vo — частота основных колебаний атомов. Известна [9,19]
формула
J _ дг I \
h якр \ Зл&Г /
где теперь Д^* не зависит от /г, ПкР — число поверхностных
атомов в зародыше, a vo приблизительно равно kTfh.
Формула (14.11) в приближенном варианте для металлов
(см., например. Кристиан [19]) записывается так (/ есть число
зародышей, образующихся ежесекундно в 1 см3):
/« 1033ехр(---(14.12)
где член /\ag± взят равным энергии активации для вязкого
течения.
Здесь
(14,11)
где ysl — свободная энергия границы жидкость — кристалл, а
g^-g^\S(Tnn- Т) = -^-ЬГ
1 пл
(Тпл — температура плавления, Т — температура жидкости,
L — скрытая теплота плавления, AS — энтропия плавления).
Считается, что эксперименты по затвердеванию капелек рту-
ти [9] хорошо согласуются с соотношением (14.11), хотя абсо-
лютные значения ySL, необходимые для полной проверки соотно-
шения (14.11), вообще говоря, неизвестны.
Нестационарное зарождение. Спрашивается, сколько времени
понадобится для установления рассмотренного выше распреде-
ления зародышей, если в системе неожиданно изменятся давле-
ние и температура. Зельдович и Френкель [318*, 319*] (см. моно-
IV. ОБРАЗОВАНИЕ ЗАРОДЫШЕЙ
419
графию Кристиана [19]) проанализировали эту задачу и дали
приближенное аналитическое решение на основе системы диф-
ференциальных уравнений, использованных в теории Беккера —
Деринга. Эта теория сложна; в результате получается одномерное
уравнение диффузии с наложенным силовым полем, называемое
уравнением Фоккера — Планка. Полученное Зельдовичем ре-
шение этого уравнения имеет следующий вид:
It~I ехр (— т'/О- (14.13)
По этой формуле нестационарная скорость зарождения It при-
ближается со временем к стационарному значению /, причем
т' « n^Dc, a Dc есть величина, подобная коэффициенту диф-
фузии, которая пропорциональна числу поверхностных молекул
зародыша и частоте соударений. В случае образования зароды-
шей жидкости из пара время т' может составлять всего лишь
несколько микросекунд, однако при превращениях жидкость —
кристалл, когда энергетический барьер kag± может оказаться
значительным, время т' может быть горазде больше.
Гетерогенное зарождение. Гетерогенное, или каталитическое,
зарождение может происходить в том случае, когда в паре или
в жидкости имеется твердая поверхность или примесная части-
ца; на поверхности такого инородного тела может образоваться
зародыш. В этом случае свободная энергия поверхности разде-
ла катализатор — среда уменьшается на некоторую величину,
а соответствующий выигрыш свободной энергии способствует
образованию зародыша (т. е. он образуется при более низких
критических пересыщениях или переохлаждениях, чем в случае
гомогенного зарождения). В большинстве жидкостей обычно
присутствуют инородные частицы и потому гетерогенное за-
рождение происходит часто. Принято считать, что при образова-
нии зародышей жидкой фазы из пара на плоских твердых
поверхностях зародыш представляет собой часть сферы, назы-
ваемой сферическим куполом; его характеризуют краевым уг-
лом 0, который он образует с подложкой. Тогда (см., например,
обзор Тернбалла [9]) из геометрических соображений выводится
следующая формула для критической свободной энергии:
где ДО» = (—кТ/^)\п(р/р0), f(0) = (2 + cos0) (1 — cos 0) 2/4. Ясно,
что при 0 -> 0 (случай полного смачивания подложки жидкостью)
/(0) и Дбкр стремятся к нулю, т. е. барьер зарождению отсут-
ствует.
Для подложек иных форм, например для отверстий или
полостей, зарождение (при данном значении краевого угла)
420
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
может происходить даже легче, чем в упомянутом выше случае.
Иными словами, зародыш данного объема может уменьшить
энергию поверхности раздела катализатор — маточная среда на
большую величину [9].
В этом случае стационарная скорость зарождения жидкой
фазы из пара определяется формулой (14.9а), в которой вме-
сто AGKp подставлена AGkP из соотношения (14.14). Кроме того,
теперь вместо N, полного числа молекул в системе, нужно взять
№, число молекул, контактирующих с инородным телом. Анало-
гично изменяется формула (14.11) для зарождения твердой
фазы на инородных поверхностях в жидкости.
15. НЕКОТОРЫЕ СОВРЕМЕННЫЕ РАЗРАБОТКИ
В ТЕОРИИ ЗАРОЖДЕНИЯ
Гетерогенное зарождение из пара и роль поверхностной
диффузии. Паунд и др. [120] (см. [112]) рассмотрели процесс
поверхностной диффузии в связи с гетерогенным образованием
куполообразных зародышей из пара на подложках. В этом слу-
чае множитель qQ в формуле, аналогичной формуле (14.9а), опре-
деляется поверхностной диффузией, поскольку конденсация из
пара непосредственно в зародыши, как оказалось, играет отно-
сительно малую роль. Формула для скорости зарождения при-
нимает вид
__ a sin6 In (р/р0) Г 3 j’/2 2 (2kG^ —\G*SD —\GSKA
'SD — 8ЛЙ/П f (6) Y vkT J P exp \ kT ) ’
(15.1)
где AGsd — свободная энергия активации поверхностной диф-
фузии, АОдес — свободная энергия десорбции адатомов, ysv —
свободная энергия поверхности раздела пар — кристалл, а АСкр
определяется формулой (14.14) с заменой yLV натяжением ysy.
Наконец, ©—частота попыток покинуть данную'позицию, а —
длина диффузионного скачка присоединяющегося адатома.
Из других примеров катализа под действием различных
форм подложек отметим ступень на подложке. В этом случае
изменение AG, определяемое формулой (14.14), уменьшается
из-за того, что ступень увеличивает площадь поверхности раз-
дела катализатор — среда, существенно не изменяя, однако,
краевого угла 0 или площади поверхности раздела пар — заро-
дыш. Хирс и Паунд [112] рассмотрели также случай, когда за-
родыш образуется на стыке двух плоскостей, образующих дву-
гранный угол произвольной величины.
Из других возможных форм зародыша рассмотрим моно-
атомный диск на подложке. По Хирсу и Паунду [112] такая фор-
IV. ОБРАЗОВАНИЕ ЗАРОДЫШЕЙ
421
ма зародыша может иметь предпочтение перед куполообразной
в том случае, когда свободная энергия фазовой границы пар —
зародыш достаточно анизотропна (см. в гл. V графики для у).
Свободная энергия образования такого зародыша радиусом г
и высотой h определяется выражением
ДО = 2лгуе, Slz + яг2 (ysv + Ysx — Yxv) + nr2hAG0, (15.2)
где \GV — та же величина, что и в знаменателе соотношения
(14.14), ySx, yxv— поверхностные энергии границ кристалл —
подложка и пар — подложка, a ye,sv — новый параметр — сво-
бодная энергия ступени на единицу ее длины. Как и для дру-
гих зародышей, AGKp определяют, находя максимум выражения
(15.2) относительно г.
Здесь же можно отметить, что недавние исследования с по-
мощью ионного проектора [121—123] гетерогенного зарождения
паров металлов на вольфрамовом острие показали следующее:
образование зародышей не начинается до тех пор, пока не воз-
никнет адсорбционный слой с эквивалентной толщиной не менее
монослоя — это наблюдение расходится с положенным в основу
хгеории представлением о разбавленной поверхностной среде.
/ Поверхностные зародыши, содержащие от одного до десяти
атомов. Как отмечает Уолтон [124], во многих случаях с холод-
ной подложкой гетерогенное зарождение из пара должно про-
исходить путем образования очень малых критических зароды-
шей, содержащих, видимо, до 10 атомов (т. е. таких зародышей,
присоединение к которым одного атома делает разрастание бо-
лее вероятным, чем распад). Тогда предположение о том, что
поверхностная энергия столь малого зародыша определяется
так же, как и для (макроскопической) жидкой капли, становится
менее пригодным. Для критических зародышей, состоящих из
двух, трех или четырех атомов, возможное число конфигураций
атомов на подложке ограничено. В предельном случае высокого
пересыщения критический зародыш может состоять из одного
атома, т. е. пара ассоциированных атомов скорее будет расти,
нежели распадаться. При более низких пересыщениях вероят-
ность распада такой пары возрастет — тогда для обеспечения
устойчивости потребуется еще один атом, следовательно, кри-
тический зародыш будет состоять из двух атомов и будет
образовываться треугольный кластер из трех атомов с двумя свя-
зями на атом. Этот кластер может к тому же оказаться энерге-
тически выгодным (с точки зрения эпитаксии) на кристал-
лической подложке с ориентацией (111). Для каждого интер-
вала температур подложки, соответствующих данному критиче-
скому размеру зародыша, можно выписать уравнение скорости
422
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
зарождения для критического зародыша из пкр атомов. Надо
отметить, что пкр должно определяться методом проб и ошибок
одновременно с экспериментальными наблюдениями кристалло-
графической ориентации пленки [125].
Динамическое зарождение. Чалмерс [126], а также Хант и
Джексон [127] проанализировали зарождение кристаллов из пе-
реохлажденной жидкости в динамическом режиме. Это означает
возбуждение относительного движения различных частей са-
мой жидкости или жидкости относительно сосуда. Методы
возбуждения — действие ультразвуковых волн, одиночных звуко-
вых импульсов, трение (царапание) по границе жидкость — со-
суд, кавитация. Происходящие при этом явления отличны от то-
го случая, когда в жидкости возникают малые кристаллы из-за
обламывания вершин тонких дендритов подвижным расплавом.
Хант и Джексон [127] изучали роль кавитации при зарожде-
нии кристаллов в переохлажденной воде и в бензоле. Как
оказалось, возникающие в жидкости пузырьки стимулируют за-
рождение не в момент своего рождения, а при захлопывании.
В момент захлопывания могут возникать огромные положитель-^
ные и отрицательные давления (до 10 ГПа), способные изменить
температуру затвердевания в такой степени, чтобы произошло
гомогенное зарождение. По такому же кавитационному ме-
ханизму, надо полагать, происходит и зарождение при цара-
пании.
Фактор времени. Кортни [128] выполнил машинные расчеты
инкубационных периодов (точнее, временных зависимостей) для
определения концентрации зародышей в пересыщенном водяном
паре. Вместо того чтобы использовать единственное уравнение
Фоккера — Планка с аналитическим приближением для ряда
бимолекулярных реакций, Кортни решил около 100 независи-
мых дифференциальных уравнений, описывающих эти бимоле-
кулярные реакции. Типичный результат для водяного пара при
пересыщении р!р$= 10 и температуре —40° С оказался следую-
щим: критическому зародышу, состоящему из 43 молекул, по-
требуется около 1 мкс, чтобы достичь 95%-ного уровня стацио-
нарных концентраций.
Бакл и Уббелоде [129] изучали затвердевание аэроозлей из
переохлажденных жидких капелек галогенидов щелочных ме-
таллов. Они пришли к выводу, что в ряде экспериментов время
наблюдений может быть сопоставлено скорее с периодом за-
держки зарождения, нежели с величиной, обратной стационар-
ной частоте зарождения. Эта оценка, однако, сильно зависит
от принятой при расчете величины свободной энергии фазовой
границы.
IV. ОБРАЗОВАНИЕ ЗАРОДЫШЕЙ
423
Диффузные фазовые границы при зарождении, спинодальное
разложение. 1. Диффузные фазовые границы. Кан и Хиллиард
[16, ПО] (см. также работы Бурке [130], а также Ульмана и Чал-
мерса [113]) рассмотрели случай, когда в отличие от классиче-
ской теории зарождения предполагается, что фазовая граница
между зародышем и средой не резкая, а размытая. Они, в ча-
стности, исследовали зарождение в системах из двух компонен-
тов с ограниченной смесимостью. Свободная энергия такой не-
сжимаемой жидкости, обнаруживающей флуктуации состава С,
складывается из двух частей: удельной (на единицу объема)
свободной энергии однородной жидкости состава С и градиент-
ной энергии, обусловленной градиентами состава; этот послед-
ний член может уменьшаться, если фазовая граница становится
более размытой [ср. с формулой (16.9)]. Анализ уравнения Эй-
лера, содержащего VC, показывает, что при низких пересыще-
ниях зародыш обладает однородным составом и резкой фа-
зовой границей, как в классической модели. С возрастанием
пересыщения работа образования критического зародыша стано-
вится меньше, чем в классической теории, а фазовая граница
все более размывается. Для такой системы, известной под на-
званием спинодальной, в точке перегиба на кривой зависимости
свободной энергии от состава работа образования критического
зародыша убывает до нуля.
2. Спинодальное разложение. Как показал Кан [131], в пре-
делах спинодального участка, т. е. для составов между двумя
точками перегиба на графике зависимости свободной энергии
от состава, существует иной, совершенно новый класс фазовых
превращений (на такую возможность гораздо раньше ссылался
Гиббс). Эти превращения носят непрерывный характер, они
малы по величине, но занимают протяженную область; термо-
динамического барьера на пути их возникновения не существует.
Теория сводится к анализу устойчивости пространственных
компонент Фурье флуктуации состава; установлено, что решение
неустойчиво по отношению к флуктуациям состава, длины волн
которых превосходят некоторое критическое значение АКр, по-
скольку в этом случае увеличение градиентной (поверхностной)
энергии меньше, чем убывание объемной свободной энергии.
Статистическая механика и зарождение. Физическая теория
молекулярных агрегатов как некий подход к проблеме зароды-
шеобразования с точки зрения статистической механики впер-
вые была использована Френкелем и Биджлом (см. Френкель
[132]). Хилл [133] и Стиллингер [134] в последнее время продол-
жали развивать эту теорию.
Кикучи [135] разработал метод статистической механики для
необратимых кооперативных процессов, названный им методом
424
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
вероятности пути (path probability method). Этим же методом
автор исследовал движение доменных стенок в модели Изинга
[136], а также зарождение и рост тонких пленок при осаждении
из паровой фазы [137]. В этой теории, представляющей собой
развитие более ранней теории равновесных процессов [31, 138],
последовательность изменения состояний системы называют пу-
тем системы, а соответствующие параметры называют парамет-
рами пути. В случае роста тонкой пленки примером параметра
пути могла бы служить вероятность того, что за некоторый вы-
бранный промежуток времени связь частица — частица в пленке
Фиг. 12. Зависимость приведенной поверхностной плотности адатомов ns
от времени для различных плотностей центров зарождения ns i при росте
тонких пленок [137].
Результаты получены расчетным путем по методу Кикучи.
будет заменена связью частица — вакансия. Вероятность того,
что произойдет определенное изменение состояния «кластера»,
называют вероятностью пути и выражают через параметры пу-
ти. Метод вероятности пути утверждает,, что макроскопическое
изменение состояния соответствует наиболее вероятному пути,
т. е. максимальной вероятности пути по отношению к парамет-
рам пути. Показано, что этот метод согласуется с термодинами-
кой необратимых процессов, в том числе с соотношениями взаим-
ности Онсагерд. При нахождении максимума возникает система
нелинейных дифференциальных уравнений, которые затем инте-
грируются. На фиг. 12, где характеризуется рост пленки, пока-
зана приведенная плотность поверхностных атомов n's в зави-
симости от времени в предположении, что на подложке присут-
ствуют инородные центры зарождения с разной плотностью
состояний. Скачок от первого плато ко второму соответствует
образованию зародыша.
V
СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА
И ПОВЕРХНОСТНАЯ КИНЕТИКА
16. РАВНОВЕСНЫЕ СТРУКТУРЫ ПОВЕРХНОСТЕЙ
РАЗДЕЛА
Введение. Как отметил Херринг [139], теорию поверхностей
или фазовых границ можно разбить на три части в зависимо-
сти главным образом от того, какую область физики желательно
использовать для оценки поверхностных структур твердых тел.
Вот эти три части: макроскопическая теория, атомная, или ато-
мистическая, теория, электронная теория.
Макроскопическая теория представляет собой приложение
термодинамики равновесных и неравновесных процессов к изу-
чению поверхностей. Этот феноменологический подход, так же
как и в термодинамическом анализе объемных систем, не посту-
лирует никаких моделей и использует лишь немногие гипотезы
о детальной природе поверхностей раздела.
Атомные, или атомистические, теории опираются на атомные
модели поверхностных структур и рассматривают атомы как
сферы, которые притягивают соседей в кристаллической решетке
короткодействующими центральными силами!); перемещения
атомов рассматриваются как диффузионные процессы. Исполь-
зуются классическая механика и кинетическая теория.
Электронная теория представляет собой приложение кванто-
вой механики к системе многих тел (под которыми понимают
электроны и ионы в кристалле), причем поверхностные эффекты
рассчитываются в объемной системе.
Иной подход к анализу этой проблемы состоит, как отметили
Кабрера и Кольман [13], в классификации поверхностей на ос-
нове графика зависимости свободной поверхностной энергии у (0)
от ориентации грани; этот подход детально обсуждается ниже.
Поверхности подразделяются на три типа: сингулярные, вици-
нальные и несингулярные (или диффузные).
Сингулярными считаются поверхности, которым на графике
у(0) соответствует острый минимум.
Вицинальными считаются поверхности с ориентациями в не-
посредственной близости от сингулярных.
Все прочие ориентации относятся к несингулярным поверх-
ностям.
*) Имеются также работы по атомной структуре поверхностей ионных
кристаллов [320"]. — Прим. род.
426
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Мы будем иметь дело со всеми тремя типами поверхностей,
рассматривая их, однако, только с макроскопических и атоми-
стических позиций и не касаясь электронной теории (см. книгу
Гатоса [140], а также замечания Херринга [139] и Юречке [141]).
В настоящем разделе мы ограничимся анализом равновес-
ных структур; кинетике, т. е. отклонениям от равновесия, посвя-
щены разд. 17—20. Исследование равновесных поверхностных
структур служит отправной точкой для изучения кинетики, и к
тому же оно остается в силе и для достаточно малых отклонений
от равновесия.
Термодинамика поверхностей: феноменологический подход.
/. Поверхностное натяжение у. Рассмотрим термодинамическое
определение поверхностного натяжения твердых тел, называе-
мого иногда свободной поверхностной энергией. Поверхностное
натяжение у определяется [11, 12] для плоских поверхностей как
обратимая работа dW, которую необходимо совершить для со-
здания путем расчленения тела единичной площадки dA при по-
стоянных температуре Г, объеме V и химических потенциалах
цл т. е.
dr
(16.1)
Поверхностное натяжение — это величина, которая в случае
жидких поверхностей численно равна у, однако в общем случае
твердых тел отличается дэт у. Как уже отмечалось в гл. I, для
твердого тела оно моЯсет быть положительной отрицательной
или нулевой величиной [12].
2. Полярная диаграмма для у, теорема Вульфа. Считается,
что поверхностное натяжение, или свободная поверхностная
энергия у, будучи вычерчена как полярная диаграмма в зави-
симости от кристаллографической ориентации поверхности,
должно в общем случае меняться с ориентацией и отражать
симметрию кристалла. Двумерный вариант такой диаграммы
схематически изображен на фиг. 13. На графике показан ряд
острых минимумов (точки, в которых первая производная испы-
тывает разрыв).
У кристалла при 0 К острые минимумы должны наблюдаться
для всех рациональных ориентаций (т. е. для таких, для кото-
рых Миллеровские индексы рациональны). При Т > ОК многие
из этих минимумов под действием тепловых колебаний размы-
ваются, а остается лишь некоторое конечное число острых ми-
нимумов [И].’
Теорема Вульфа определяет равновесную форму кристалла,
имеющего данный график у(п), где п — единичная нормаль к
рассматриваемой грани. Равновесной считается такая форма,
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 427
которой соответствует минимум уЛ по всему кристаллу, т. е. при
постоянном объеме
J y(n)dA принимает минимальное значение. (16.2)
В однокомпонентной системе следует искать минимум полной
свободной поверхностной энергии кристалла. Ясно, что для жид-
Фиг. 13. Диаграмма свободной поверхностной энергии у кристалла и по-
строение Вульфа [11].
/ — полярная диаграмма свободной поверхностной энергии; 2 —плоскости, перпендикуляр-
ные радиусам-векторам этой диаграммы; 3 — равновесный многогранник.
кости, где у(п) = у = const, равновесной формой служит сфе-
ра— она обладает минимумом поверхности при заданном объе-
ме. Кристалл же будет стремиться ограняться по возможности
большим числом граней п с малыми у(п). Теорема Вульфа уста-
навливает, что, имея график у(й), необходимо через конец каж-
дого радиуса-вектора провести перпендикулярную ему плоскость;
тогда тело, ограниченное внутренней огибающей этих плоско-
стей, т. е. тело, образованное всеми точками, которых можно
достичь исходя из начала и не пересекая указанных плоскостей,
обладает минимальной поверхностной энергией. Построение
Вульфа иллюстрируется также диаграммой фиг. 13, где показан
428
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
частный случай образования многогранника. (Дискуссия по
доказательству теоремы Вульфа приводится Херрингом [11];
см. также статью Джонсона и Чакеряна [142].) Однако тело
равновесной формы не обязательно должно быть многогранни-
ком; в зависимости от вида графика у оно может иметь округ-
ленные углы с прилежащими к ним плоскими участками или со-
стоять частью из гладких закругленных участков, частью из
плоских. Для существования плоских участков на графике у
непременно должно быть некоторое число острых минимумов.
Нет оснований рассчитывать на то, что крупные кристаллы
на самом деле достигают своей равновесной формы; как отметил
Франк {3], для кристаллов, значительно превосходящих микрон-
ные размеры, пересыщение (или иная движущая сила), необхо-
димое для того, чтобы кристалл рос с измеримой скоростью,
будет превосходить (и, следовательно, перекрывать) любое
изменение свободной энергии, обусловленное отклонением от
равновесной формы. Этот последний эффект представляет собой
проявление закона Гиббса — Томсона применительно к кристал-
лам. Эксперименты по равновесным формам малых кристаллов
будут упомянуты ниже.
3, Распад плоских поверхностей на грани'и графики измене-
ния р. Если имеется большой участок поверхности с ориентацией
п и достаточно большим натяжением у(п), то может случиться,
что при разбиении ее на более мелкие площадки с образованием
выступов и углублений (фиг. 14) поверхностная энергия j ydA
уменьшится. Новые поверхности с ориентациями, например щ
Фиг. 14. Образование террасной структуры посредством распада грани
с ориентацией п на новые грани с ориентациями и п2 [13].
и п2, обладают достаточно низкими значениями у, чтобы с
избытком компенсировать увеличение площади поверхности. Де-
тальный обзор экспериментов, приводящих к такому фасетиро-
ванию и термическому травлению, опубликован Муром [143].
Кабрера и Кольман [13] исследовали относительную устойчи-
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 429
вость некоторой бесконечной плоской поверхности к разбиению
на микрограни (или фасетки). На фиг. 15,а построен график из-
Фиг. 15. Удельная (приходящаяся на единичную площадь) свободная
энергия базовой поверхности (3 (р) для нескольких возможных преобразо-
ваний неустойчивой поверхности [р = 0 и р = р0 —особые (с угловыми точ-
ками) ориентации] [13].
менения удельной (приходящейся на единичную площадь) сво-
бодной энергии базовой поверхности
₽(p)=(1+p2)‘/2y(p) (16.3)
в зависимости от наклона
Р=-^ (16.4)
для кристаллической поверхности, описываемой функцией
z = z(x, у). (16.5)
Угдовые точки при р = 0 и р = р$ соответствуют сингулярным
поверхностям. Кабрера и Кольман [13] продемонстрировали,
как, вычерчивая касательные к кривой Р(р), можно определить
устойчивые ориентации. На фиг. 15,6 все ориентации между
р = 0 и pQ = 0 устойчивы. На фиг. 15, в все ориентации в
430
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
интервалах 0 — pi и р2 — ро неустойчивы, однако все ориентации
в интервале pi — р%, а также в точках р = 0 и pQ устойчивы. На
фиг. 15,г устойчивы только р = 0 и Pq. (Хирс [144] показал, что
при других формах зависимости 0(р) графики могут приводить
к иному типу распада.)
4. Химический потенциал и функции у (0). Классическая фор-
мула Гиббса — Томсона определяет увеличение химического по-
тенциала малых жидких капелек с уменьшением их размера. За-
пишем эту формулу в виде
А ГЛ ( 1 1 1 \
Ац = Йу •
(16.6)
Для кристаллов с у = у(0) Херринг [11] вывел (см. Маллинз
[12]) следующую обобщенную формулу химического потенциала
в некоторой точке Р:
Ац (P) = Q
(16.7)
где
(16.8)
В формулах (16.6) — (16.8) Ki и К2 суть главные кривизны в
точке Р; Pi и /?2— соответствующие радиусы кривизны; Q —
атомный объем; 01 и 02 — соответствующие углы по отношению к
точке Р. Новыми членами формул являются вторые производ-
ные от у. Для равновесной формы химический потенциал, опре-
деляемый формулой (16.7), должен, разумеется, быть одинако-
вым во всех точках поверхности: в противном случае свободная
энергия могла бы снизиться посредством перераспределения.
[В угловых точках формула (16.7) теряет смысл, поскольку там
вторые^ производные не существуют.] Чернов [17] проанализиро-
вал связь между формулой (16.7) и теоремой Вульфа.
5. Неоднородные системы; диффузные фазовые границы. Как
уже отмечалось в гл. IV, посвященной .зарождению, Кан и Хил-
лиард [16] (см. также работу Видома [145]) исследовали термо-
динамику неоднородных систем; они, в частности, показали, что
энергию фазовой границы можно понизить, если допустить, что
концентрация или плотность вещества на ней изменяется не
скачком, а постепенно. Для доказательства они выбрали в
качестве переменной состав С и разложили удельную (приходя-
щуюся на молекулу) локальную свободную энергию неоднород-
ной системы G(C) в ряд Тейлора относительно точки Go, т. е.
удельной (приходящейся на молекулу) свободной энергии рас-
твора с однородным составом С. Отсюда они получили, что
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 431
свободная энергия G' малого объема неоднородной системы вы-
ражается в виде
G' = Nv J [Go + % (VC)2 + ... ] dV, (16.9)
v
где Nv — число молекул в единичном объеме, V — объем и
ов'о>
Из формулы (16.9) следует, что свободную энергию малого
объема неоднородного раствора можно выразить как сумму двух
слагаемых — свободной энергии однородного раствора и члена
градиентной энергии, зависящего от локального состава. Если
распространить эту теорию на плоскую фазовую границу между
двумя сосуществующими фазами аир составов Са и для
компонентов А и В, то окажется, что удельная свободная энер-
гия фазовой границы
оо
y = Nv / [AG (С) + х (-^)2] dx, (16.11)
— оо
где AG(C)—отнесенная к стандартному состоянию свободная
энергия равновесной смеси аир, определяемая как AG(C) =
= G0(C) — [Сцв(С) + (1 — С)ца(С)]. Здесь и суть удель-
ные (приходящиеся на молекулу) химические потенциалы ком-
понентов А и В. Чем шире фазовая граница, т. е. чем более она
размыта, тем меньше в формуле (16.11) член градиентной энер-
гии n(dC/dx)2, однако это уменьшение сопровождается повыше-
нием неравновесности состава у фазовой границы и, следова-
тельно, увеличением первого члена. Из условия минимума сле-
дует, что
Са
y = 2Nv j [xAG(C)]'/2dC. (16.12)
СР
Для распространения этого термодинамического соотношения на
конкретные системы необходимо сделать определенные предпо-
ложения относительно и и AG.
Структура и энергетика атомистических моделей. Введение.
Как уже отмечалось, атомистический подход состоит в том, что
строят различные атомные модели поверхностей или фазовых
границ, делают предположения о характере сил взаимодействия
атомов и рассчитывают энергетику и кинетику явлений на основе
классической механики, статистической механики, кинетиче-
ской теории и теории переноса. Настоящий раздел посвящен в
основном структурам и энергетике атомистических моделей.
432
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Чтобы создать модель поверхностной структуры, необходимо
провести, исходя из определенной геометрии этой структуры, не-
которые физические расчеты, которые согласуются с ней и пред-
сказывают ее некоторые измеряемые характеристики. Идеаль-
ной модели не существует вообще: правильнее всего было бы не
постулировать модель, а рассчитать все свойства ab initio1),
исходя из функций состояния и зная межатомные силы. Для та-
ких сложных систем многих тел, какими являются кристаллы
или граничные слои кристалл — жидкость, методы статистиче-
ской механики, разумеется, мало что дают. Широкое использо-
вание моделей, как это имеет место в работах по механизмам
роста кристаллов, служит до некоторой степени свидетельством
ограниченности наших познаний в этой области. Будь в наших
руках микроскоп с разрешением 10~9 см, который к тому же не
вносил бы искажений в наблюдаемый процесс, необходимость
в создании все новых и новых моделей резко пошла бы на убыль.
Модельные расчеты должны давать численные предсказания
измеряемых величин; к тому же с учетом произвольности и не-
доработанности большинства моделей результаты таких расчетов
нужно стремиться сделать устойчивыми по отношению к не-
большим изменениям выбранной модели. Иными словами, не-
обходимо стремиться к тому, чтобы отделить предсказания мо-
дели, которые имеют общее значение, от выводов, справедливых
лишь для данной конкретной модели (что редко делают). Кроме
того, порой трудно доказать, что данная модель есть единствен-
ная модель, способная объяснить экспериментальные факты. На-
конец, встает извечный вопрос: чему отдать предпочтение — про-
стой, обеспечивающей строгое решение нереальной модели или
же сложной, допускающей лишь приближенные решения, но
зато реальной модели?
1лМодели поверхностной шероховатости, В таких моделях
основной вопрос сводится к тому, каким образом изменяется кон-
центрация поверхностных вакансий или адсорбированных по-
верхностью атомов (адатомов) по мере повышения температуры.
Этот вопрос существен, поскольку атомно-гладкая поверхность,
как принято считать (по крайней мере в модели Косселя), спо-
собна расти лишь в том случае, когда на ней образовались сту-
пени; следовательно, возникновение, число и характер движения
этих ступеней имеет первостепенное значение для расчета ско-
ростей роста кристаллов. В другом случае, а именно для атом-
но-шероховатых поверхностей нужды в ступенях нет (иначе
говоря, предполагается, что ступени существуют повсюду) и ме-
ханизм роста сильно упрощается. Различные модели поверхност-
ной шероховатости отличаются одна от другой в зависимости от
С самого начала. — Прим, перев.
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 433
того, какой принимается толщина поверхностного слоя, в кото-
ром, как полагают, образуются вакансии, а также от природы
среды.
Теория Онсагера [29], а также Бартона и Кабреры [40]. Эти
расчеты уже частично обсуждались в гл. II. Модель основана на
двумерной квадратной решетке с двумя уровнями, т. е. рас-
сматривается исходная поверхность и слой адсорбированных
на ней молекул. Расчет дает строгое решение. Для квадратной
решетки с четырьмя ближайшими соседями
ьт1
-^-«0,57, (16.13)
где <р — энергия взаимодействия двух ближайших соседей, Т!К9 —
критическая температура поверхностного плавления, которая,
как принято считать, в случае плотноупакованных (сингуляр-
ных) поверхностей металлов превосходит температуру плавле-
ния объемного материала. Анализ поверхностной шероховато-
сти показывает, что при Т <С Т«р на поверхности существуют
лишь одиночные атомы, но отнюдь не их группировки и не сту-
пени.
В этом расчете не учитывается взаимодействие поверхности
с внешней средой (жидкостью или паром). Предполагается, что
любые адатомы выходят из самого поверхностного слоя.
Теория Джексона [42, 43]. Эта теория также обсуждалась в
гл. II. Она основана на модели с двумя уровнями и использует
приближение Брэгга — Вильямса для анализа поверхностного
слоя, контактирующего со второй фазой (с расплавом) в со-
стоянии равновесия. Предполагается, что система находится при
температуре равновесия — при температуре плавления (в слу-
чае контакта кристалла с его расплавом) или близко к темпе-
ратуре плавления (при контакте кристалла с паром); поэтому
вопрос о том, будет ли поверхность шероховатой (когда она на-
половину покрыта адатомами) или гладкой (с малым числом
адатомов) в зависимости от температуры, не исследуется. Ше-
роховатость исследуется в зависимости от скрытой теплоты
превращения L и от относительной энергии связи атома с бли-
жайшими соседями в данной плоскости.
Джексон установил, что в случае контакта с паровой фазой
плотноупакованные грани должны быть, вообще говоря, глад-
кими; однако при контакте с расплавом структура поверхности
сильно зависит от природы вещества (подробнее об этом гово-
рится в разд. 19, посвященном поверхностной кинетике при ро-
сте из расплава). Джексон отметил, что макроскопически на-
блюдаемая морфология фазовых границ расплав — кристалл в
434
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
однокомпонентных системах часто согласуется с этой моделью.
Будучи, однако, приближенной, теория Джексона способна зна-
чительно завысить критическую температуру по сравнению со
строгим решением Онсагера [146, 147].
Теория Маллинза [148]. Маллинз [148] разработал теорию
поверхностного плавления, основываясь на модели Бартона —
Кабреры, но используя при этом более простой метод Брэгга —
Вильямса и решая задачу с тремя возможными уровнями (т. е.
Фиг. 16. Кривые изменения поверхностной шероховатости Sr в зависи-
мости от приведенной температуры kT/ф по теории Маллинза (сплошная) и
"' ’ " по теории Бартона и Кабреры (штриховая) [148].
учитывая и адатомы, и вакансии). Рассматривается грань (100)
простой кубической решетки, причем энергия одной атомной
связи между ближайшими соседями принимается равной <р/2. По-
лученный Маллинзом график для поверхностной шероховатости
(т. е. числа параллельных поверхности связей на молекулу) при-
веден на фиг. 16; этот результат довольно близок к данным, по-
лученным Бартоном и Кабрерой. Сходный с ними вывод сделан
и относительно поверхностного плавления. И в теории Маллинза
взаимодействием поверхностного слоя с внешней средой прене-
брегается.
Теория Темкина [147]. Темкин исследовал по методу Брэг-
га-Вильямса равновесную структуру границы кристалл — рас-
плав для плоскости (100) простой кубической решетки, считая,
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 435
что каждый атом имеет 6 ближайших соседей, из которых 4 ле-
жат в плоскости, параллельной (100). Рассматривается случай
произвольного числа п, уровней, причем получено численное ре-
шение. Установлено, что эффективная толщина граничного слоя
плавно меняется в зависимости от параметра
где ТПл — температура плавления (фиг. 17). Здесь энергию w'
(названную Темкиным удельной поверхностной энергией на
атом) можно, как и в теории Джексона, рассматривать как
п
Фиг. 17. Ширина фазовой границы по теории Темкина [147] (распределе-
ние концентрации «твердых» атомов Сп в зависимости от положения слоя п
при различных значениях параметра у").
энергию связи, которую находят делением скрытой теплоты плав-
ления на число ближайших соседей, т. е. в случае простой куби-
ческой решетки w'={lsL, где L — скрытая теплота плавления.
[Отметим, что критерий Джексона а = 2 для грани (100), у ко-
торой fk = 2/з, принимает вид йТ’пл/ф; = 2, где 6<pj = L. Теория
Темкина дает kTn^wf =1,6. Как уже отмечалось, w' можно
также отождествить с Ve^.] В точке, для которой
jg^0,82=^, (16.15)
существует перегиб, однако нет резкого падения [по теории
Джексона правая часть (16.15) равна единице]; следовательно,
1/у" = 0,41 (фиг. 18). В точке перегиба у" № 2,4, откуда сле-
дует (фиг. 17), что толщина граничного слоя меньше одного
436
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
атомного диаметра. Этот вывод качественно согласуется с тео-
рией Джексона. Разумеется, при более высоких значениях у"
теория Темкина предсказывает очень большие толщины гранич-
ного слоя.
Другие теории. Воронков и Чернов [149] исследовали атом-
ную шероховатость фазовой границы кристалл — раствор для
однокомпонентного кристалла простой кубической решетки и
идеального бинарного раствора. Они предсказали существова-
ние критической температуры перехода, зависящей от концен-
трации раствора.
Фиг. 18. Изменение поверхностной шероховатости в зависимости от
1/у" = kTwJbw по теории Темкина [147].
Керр и Вайнгард [150] также исследовали бинарную систему
исходя из модели Джексона [42, 43] для двух уровней; получен-
ные ими результаты они применили к структуре фазовых границ
эвтектических сплавов висмута с серебром и висмута с оловом.
Мутафчиев [151], пользуясь методом Брэгга — Вильямса, ис-
следовал поверхностную шероховатость границ кристалл — пар
и кристалл — жидкость. Однако он рассматривал в явном виде
поверхностную шероховатость («автоадсорбцию») в зависимо-
сти от степени отклонения системы от равновесия или пересы-
щения.
Расчет свободной поверхностной энергии по атомным моде-
лям. В таких расчетах основное внимание уделяется определе-
нию поверхностной, или межфазной, свободной энергии и изме-
нению ее с ориентацией, т. е. анизотропии.
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 437
Маллинз. Маллинз [12] определял поверхностную энергию в
зависимости от ориентации (график изменения у) при О °C для
двумерной простой кубической решетки в приближении ближай-
ших соседей. На фиг. 19 показана модель расчета и соответ-
ствующий (двумерный) график изменения у. Атомы изобра-
жаются квадратами. Для создания показанной поверхности с
общей «площадью» 2/cosO (в расчете на две стороны) необхо-
димо энергию связи ср умножить на число разорванных связей.
Фиг. 19. Анизотропия свободной поверхностной энергии у (0) в двумер-
ной модели разорванных связей с учетом ближайших соседей [12'].
а —строение поверхности; б —график изменения Y (©)•
Это число (для единичного отрезка и атома со стороной а) со-
ставляет l/а для свободных вертикальных и tg Q/a для горизон-
тальных связей. Тогда для у получим
V (0) = ф(а~ХзёЧе9) = i <cos 0 +sin °)’ (16-16)
где 0 — угол между нормалью к новой поверхности и положи-
тельной осью у. Формула (16.16) описывает окружность, прохо-
дящую через начало координат в верхнем левом квадранте
фиг. 19,6. Учитывая симметрию выбранной атомной модели, по-
лучаем четыре такие окружности (фиг. 19,6), а кривая у(0)
представляет их внешнюю часть. Таким образом, на кривой у(0)
существуют четыре острых минимума, где производная dy/dft
терпит разрыв. Построение Вульфа, определяющее равновесную
форму, также показано на фиг. 19,6; оно представляет собой
попросту квадрат, проходящий через упомянутые четыре мини-
мума. Все иные плоскости, перпендикулярные другим значе-
ниям у(0), не изменяют квадратную форму внутренней огибаю-
щей, поскольку они проходят через ее углы. Маллинз рассмот-
рел также другие следствия и ограничения этой очень простой
438
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
модели: если учитывать более дальнодействуюицие силы, то
должно появиться больше острых минимумов; трехмерный слу-
чай дает 8 сфер (по аналогии с четырьмя сферами для двумер-
ного случая). Эти выводы следуют из теоремы Херринга, соглас-
но которой любая теория связи с конечным радиусом действия
сил притяжения между парами равноотстоящих атомов в ре-
шетке должна дать график изменения у, состоящий из сфериче-
ских участков.
Расчеты Кабреры и Кольмана [/3] вслед за Черновым [/7].
Как уже говорилось, график функции 0(р) = у(р) (1 + р2)Ч
введенной в рассмотрение Кабрерой, можно использовать для
предсказания устойчивости той или иной грани к превращению
ее в структуру с выступами и впадинами. Если наклон кристал-
лической поверхности р = —dzjdx, то отношение
представляет собой плотность ступеней на кристаллической по-
верхности (здесь h — высота ступени). Если 0(р) разложить
в ряд
Р(р) = &о + ^ + 4р2+ •••> (16.18)
то первый член выражает- поверхностную энергию грани малых
индексов, Ь{ — энергию образования ступеней, а Ь2— энергию
взаимодействия между ступенями. II Ьо, и Ь\ суть положитель-
ные величины, тогда как Ь2 может быть либо положительной,
либо отрицательной величиной в зависимости от того, отталки-
ваются или притягиваются ступени. Первые два члена соответ-
ствуют графику изменения у, состоящему, как уже отмечалось,
из сферических участков, и графику изменения 0(р) в виде
прямой линии. Причины, вызывающие взаимодействие ступе-
ней, рассмотрены Маллинзом [12], а также Грубером и Маллин-
зом [152]. Одна из них (как мы увидим ниже) состоит в тенден-
ции ступеней образовать изломы, что понижает свободную
энергию ступеней; если ступени сближаются, то возможности
для образования изломов (если избегать перекрытия) ограничи-
ваются, что увеличивает свободную энергию в функции расстоя-
ния между ступенями, т. е. вызывает их отталкивание. Маллинз
рассматривает это отталкивание как аналог силы, с которой
молекула, высокополимера сопротивляется спрямлению, сопро-
вождающему ее растяжение (в данном случае ступень сопроти-
вляется убыли конфигурационной энтропии, вызываемой боко-
вым сжатием).
Грубер и Маллинз [/52]. Эти авторы исследовали анизотро-
пию поверхностной энергии при температурах выше ОК, рассчи-
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 439
тывая просто конфигурационный эффект шероховатости ступе-
ней, т. е. учитывая термически генерируемые изломы на ступе-
нях. Предполагается, что ступени энергетически не взаимодей-
ствуют (т. е. что притяжение или отталкивание между ними при
ОК отсутствует), но они при этом должны быть ограничены по
ширине. Результаты расчета для ступени [011] на грани (100)
Фиг. 20. Анизотропия поверхностной энергии в модели шероховатых сту-
пеней [152].
Изменения Ф (отношения свободной энергии одиночной шероховатой ступени к энергии
одиночной прямой ступени) в зависимости от ориентации поверхности (угол 0) при раз-
личных значениях температуры Т (пропорциональной 1/0") для ступени [01TJ на грани (100)
г. ц. к.-кристалла.
г. ц. к.-кристалла, полученные матричным методом, приведены на
фиг. 20. Здесь 0 — усредненная ориентация поверхности с уче-
том террас между ступенями, так что чем больше 0, тем ближе
ступени друг к другу, тем более они спрямлены и, следова-
тельно, тем меньше их свободная энергия отличается от
энергии прямых (при 0 К) ступеней (т. е. ордината Ф на фиг. 20
приближается к единице). При уменьшении р" — некоторого па-
раметра, обратно пропорционального температуре, — разность
энергии при 0К и свободной энергии при Тк увеличивается (т.е.
при повышении температуры возникают изломы). Для иссле-
дования устойчивости ступеней вычерчивали график зависимо-
сти Otg0 от tg0; график получился выпуклым (т. е. ступени
отталкиваются). Таким образом, согласно этой модели, разбиения
440
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
на грани не происходит, однако на равновесной форме могут
появиться округленные участки.
Маккензи и др. [753]. Эти авторы детально разработали гео-
метрическую теорию числа разорванных связей атомов с сосе-
дями первого и второго порядка, приходящегося на единичную
площадь в кубическом кристалле; рассматривается атомно-глад-
кая поверхность, образующаяся при расчленении кристалла. Как
отметили эти авторы, график изменения у должен состоять из
участков сфер, проходящих через начало координат. При учете
только ближайших сосе-
дей в г.ц.к.-кристалле был
получен график измене-
ния у, изображенный на
фиг. 21 [показан единич-
ный стереографический
треугольник, причем на-
тяжение у (210) счита-
лось равным единице].
Бенсон и Юн [154]. Эти
авторы дали обзор расче-
тов поверхностной энер-
гии атомногладких гра-
ней кристаллов инертных
газов и простых ионных
кристаллов; такие расче-
ты имели в основе моде-
ли парных взаимодейст-
вий между атомами или
Фиг. 21. Анизотропия поверхностной
энергии для г.ц.к.-кристалла в трехмерной
модели разорванных связей с учетом бли-
жайших соседей [значение у(210) принято
равным единице] [153].
ионами с учетом возможных изменений положения поверхност-
ных атомов относительно их положения в объеме посредством
релаксации. Были сформулированы различные предположения
о характере сил взаимодействия и учтены взаимодействия со
всеми ионами или атомами в решетке. Таким образом, в теорию
были введены решеточные суммы, которые оказались весьма
сложными. На основе модели атомных колебаний были рассчи-
таны температурные зависимости поверхностной энергии. На-
пример, в случае аргона при 0 К поверхностные энергии для
граней {111}, {100} и {110} оказались равными соответственно
19,70, 20,34 и 21,34 эрг/см2.
Сундквист [/55]. Этот автор экспериментально исследовал
равновесные формы небольших (~10~3 мм) частиц ряда г. ц. к.
металлов при нагревании тонких пленок на инертной подложке.
Эти формы были образованы плоскими гранями, которые соеди-
нялись округленными участками. Значения у, полученные в за-
висимости от ориентации, группировались вокруг средних
значений с отклонениями порядка 16%. Существуют, однако, не-
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 441
Фиг. 22. Модель кристаллической
поверхности со ступенями и адато-
мами.
Повторимый ход (или рост на ступенях
по Косселю) происходит в позиции А.
которые сомнения по поводу интерпретации этих результатов
(см. [152, 156]). Эксперименты по определению у(0) обсужда-
лись также Шьюмоном и Робертсоном [157].
Модель роста кристаллов по Косселю [158]. Коссель предпо-
ложил, что кристалл растет посредством повторимого хода, или
повторимого процесса осажде-
ния молекулы в позицию А
на фиг. 22. Если учитывать со-
седей первого и второго поряд-
ков, то в позиции А энергия
связи молекулы с кристаллом
выше, чем в позиции С, и зна-
чительно выше, чем в В. Для
молекулы В вероятность де-’
сорбции гораздо выше.
Ступенями называют неод-
нородности сингулярной по-
верхности, показанные на
фиг. 22. При этом требуется
ответить на два важных во-
проса: как возникают ступени?
Какова их структура или фор-
ма? Отложим вопрос о воз-
никновении ступеней до даль-
нейшего обсуждения источни-
ков ступеней, отметив здесь
только то, что, по расчетам
Бартона и Кабреры [40], на
поверхности кристалла присут-
ствуют лишь . одиночные ада-
томы и отсутствуют их скопления, так что образования ступеней
по механизму поверхностного плавления не происходит. Разу-
меется, могут существовать равновесные формы из плоских уча-
стков и ступеней, например вицинальные поверхности (мы видели
это по расчетам поверхностной энергии). Однако в соответствии
с теорией роста кристаллов эти поверхности в условиях роста
должны быстро выклиниваться, оставляя позади себя сингуляр-
ную поверхность, на которой для продолжения роста требуется
возникновение новых ступеней. Таким образом, на сингулярных
поверхностях должны существовать источники ступеней.
Бартон и др. [41] показали, что в отличие от плоской грани
ступени, будучи при 0 К прямыми, по мере повышения темпера-
туры, задолго до точки плавления, испытывают «плавление», т. е.
становятся шероховатыми; это «плавление» состоит в образова-
нии многочисленных изломов или (входящих) углов в ступенях.
442
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Этот же результат до них был получен Френкелем [159]. Сту-
пень в среднем следует направлению плотной упаковки и содер-
жит равное число положительных п+ и отрицательных п_ изло-
мов. Если 2rik и q — вероятности соответственно присутствия или
отсутствия излома в данном месте ступени, то, как следует из
принципа детального равновесия,
2L = e-wikT 06 19)
и
2п4 + <7=1. (16.20)
Здесь w — энергия, необходимая для образования излома. От-
сюда Хо = al^rih и, следовательно, среднее расстояние между
изломами
X0 = |-a{e»/fer + 2}, (16.21)
где а — расстояние между атомами. Можно показать также, что
в условиях равновесия ступень должна иметь постоянное сред-
нее направление, т. е. быть в среднем прямой линией; напро-
тив, в неравновесных условиях ступень должна искривляться.
Если ступень наклонена к направлению плотной упаковки под
малым углом 0, то из геометрических соображений следует, что
число изломов увеличивается и будет определяться соотноше-
нием
Хо(0)=Хо[1 -4(^-)2е2]. (16.22)
Рассматривая в качестве примера ступень (11) на грани (111)
г. ц. к.-кристалла и учитывая только соседей первого порядка,
получаем w = 7гф = 712^, где ф — энергия взаимодействия бли-
жайших соседей, a W— теплота испарения. Для типичных ве-
ществ и температур ф ~ 4kTt т. е. Хо ~ 4а (один излом на каж-
дые четыре межатомных расстояния в решетке). Ниже показано,
что такая плотность ступеней достаточно велика, чтобы ступень
действовала как непрерывный сток для адатомов в процессе
роста кристаллов1).
Другая особенность модели Косселя состоит в том, что она
предполагает присутствие на поверхности адсорбированных ато-
мов; они были также учтены Бартоном и Кабрерой [40] в рас-
четах поверхностной шероховатости. Плотность адатомов дается
выражением [41]
ns = rtoe_a,s/fer, (16.23)
9 Вообще говоря, возможны и случаи малой плотности изломов; см.,
например, [324]. — Прим. ред.
V. СТРУКТУРА ПОВЕРХНОСТЕЙ раздела и поверхностная КИНЕТИКА 443
в котором «о имеет порядок поверхностной плотности атомов,
a ws — энергия испарения из излома на поверхность (т. е. энер-
гия, необходимая для перехода атомов из положения адсорбции
на изломе в положение адсорбции на поверхности). Время жиз-
ни Ts адатома определяется выражением
J-=v2e"®^r, (16.24)
где частота попыток преодолеть потенциальную яму при испаре-
нии V2 имеет порядок частоты атомных колебаний, a ws — энер-
гия испарения адатома с поверхности (позиция В на фиг. 22)
в паровую фазу. Отметим, что W = w^ + wSt т. е. общая энергия
испарения представляет собой сумму энергий переходов излом —
поверхность и поверхность — пар. Аналогичные соотношения [13]
были выведены для концентрации и времени жизни поверхност-
ных вакансий, причем такие вакансии также могут участвовать
в процессах переноса при росте кристаллов, если их подвижность
достаточно высока.
Спиральная дислокационная ступень Франка [160]. Франк
[160] (см. также [41]) высказал гипотезу, что винтовые дислока-
ции могут служить существенными источниками ступеней на
кристаллических поверхностях. Если дислокация имеет компо-
ненту вектора Бюргерса, перпендикулярную поверхности, то пе-
ресечение такой дислокации с поверхностью ведет к возникнове-
нию ступени. Как оказалось, этот особый источник ступеней
очень важен в процессах роста кристаллов. Ступень закреплена
в точке пересечения дислокации с поверхностью, однако по мере
присоединения адатомов к изломам ступень может переме-
щаться, образуя (как мы увидим ниже) спираль. В условиях
равновесия ступень остается прямой. В остальном модель
Франка повторяет модель Косселя.
Модель Странского и Каишева [161]. Эти авторы исследо-
вали, учитывая соседей первого и второго порядков, равновес-
ную форму кристаллов, последовательно убирая все атомы,
связанные с решеткой слабее, чем в положении полукристалла
(позиция А на фиг. 22), или в положении «повторимого хода».
Если учитывать только соседей первого порядка, то оказы-
вается, что у г. ц. к.-кристаллов равновесная форма образуется
гранями {111} и {100}, а в о. ц. к.-структуре — только {НО}. Если
к тому же учесть соседей второго порядка, то дополнительно
появляются грани {110} для г. ц к.- и {100} для о. ц. к.-решеток.
Теория периодических цепей связи (ПЦС). Эта морфологи-
ческая теория имеет в своей основе кристаллохимические
444
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
представления. Она была распространена на кристаллы, выра-
щенные из разбавленных растворов, особенно на кристаллы не-
органических соединений. Наблюдая за волокнистыми кристал-
лами, например асбеста, у которых цепочки с сильной связью
вытянуты параллельно оси волокон, Хартман и Пердок [162]
(см. также работу Хартмана [163]) пришли к выводу, что кри-
сталлы должны расти быстрее всего в направлении наиболее
сильной химической связи. Кристалл будет расти в заданном
направлении только тогда, когда в его структуре имеется обор-
ванная цепочка сильных связей. Кристаллические грани класси-
фицируются по трем типам: F— гладкие грани, параллельные
по меньшей мере двум ПЦС-векторам; S— ступенчатые грани,
параллельные одному ПЦС-вектору; К — шероховатые грани,
для которых не находится ни одного параллельного ПЦС-век-
тора1). ПЦС-векторы имеют направления вдоль ребер куба2).
Следовательно, грани куба {100} относятся к F-типу, грани
{110} — S-типу и {111}—К-типу. Скорости роста возрастают в
последовательности F-+S-+K. Эта теория качественно, по-ви-
димому, согласуется со многими наблюдениями, однако у нее
отсутствует ясная термодинамическая или кинетическая основа.
То же самое относится и к более ранним теориям Бравэ, Дон-
нея, а также Харкера и Нигли.
Источники ступеней. Для роста сингулярных граней необхо-
димы те или иные источники ступеней. Зачастую такими
источниками служат дислокации; ими могут стать также места
соприкосновения между кристаллом и его контейнером или под-
ставкой, границы зерен между двумя соприкасающимися кри-
сталлами различной ориентации, инородные макроскопические
частицы, двойники, двумерные зародыши, а в случае испарения
или растворения края кристаллов и краевые дислокации.
17. ПОВЕРХНОСТНАЯ КИНЕТИКА ПРИ РОСТЕ
КРИСТАЛЛОВ ИЗ ПАРОВОЙ ФАЗЫ. ТЕОРЕТИЧЕСКИЕ
И ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
Теория Бартона, Кабреры и Франка [41]. Эта теория зани
мает центральное положение в области роста из паровой фазы,
но она существенна также для роста из разбавленного раствора
и до некоторой степени для роста из расплава.
1. Подвижность и средняя длина пробега адатомов. Как уже
говорилось [см. формулу (16.23)], на поверхности кристалла, кон-
*) Подробнее об этом см. в книге Б. Хонигмана «Рост и форма кри-
сталлов», ИЛ, 1961. — Прим, перев.
2) Имеется в виду простая кубическая решетка или решетка типа NaCl.-—
Прим, перев.
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 445
тактирующего с собственным паром, присутствуют адсорбиро-
ванные атомы или молекулы с концентрацией ns и энергией об-
разования ws<Z W, где W— теплота испарения. Благодаря теп-
ловым колебаниям частиц в их потенциальных ямах существует
некоторая вероятность того, что адатомы перейдут в пар; время
жизни Ts есть величина, обратная этой вероятности, которая оп-
ределяется формулой (16.24). Вместе с тем существуют потен-
циальные барьеры для касательного перемещения частиц по по-
верхности — наглядно это можно проследить на модели по-
верхности из пробочных шариков. Следовательно, для перехода
частицы из одного «сидячего» положения в другое необходима
Фиг. 23. Схематическое изображение потенциальной энергии адатома
в различных позициях на поверхности кристалла [167].
Положение полукристалла —это излом (повторимая позиция на ступени).
энергия активации. На фиг. 23 схематически показаны потен-
циальные уровни поверхности кристалла. Время т, необходимое
для перехода адатома скачком из одной равновесной позиции
в другую, выражается следующим образом:
l = v<e-^, (17.1)
где Us есть энергия активации поверхностной диффузии; у'—
некоторая частота, близкая по порядку величины к V2, т. е.
~1012—1013 с-1. Формула Эйнштейна для беспорядочного блуж-
дания записывается в виде
Ds = ^~, (17.2)
где Ds есть коэффициент поверхностной диффузии, а а — рас-
стояние между соседними позициями. (Мы опускаем здесь мно-
житель ’Д в формуле Эйнштейна, чтобы обеспечить согласие
с расчетами Бартона, Кабреры и Франка.) Таким образом,
Ds = av'e~u^kT. (17.3)
446
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Среднее перемещение атомов в адсорбированном состоянии оп-
ределяется соотношением
X2s = Dsxs-, (17.3')
подставив сюда соотношение (16.24), получим
/ tf' \'k Г jjJ — и
Х. = а(-) (17.4)
где коэффициент (v'M)72, по-видимому, не слишком отличается
от единицы. Грубую оценку Xs в случае (плотноупакованной)
грани (111) можно получить, учитывая энергию взаимодействия
Ф только между ближайшими соседями; тогда w's = Зф = W/2\
полагая теперь Us малым по сравнению с ws, получаем Xs ~
« ае3<₽/2АГ, что при q/kT = 4 дает Xs 400 а, т. е. около 10~5см.
Отметим, что в этом случае Х8 ж 1ООХо, где Хо —среднее рас-
стояние между изломами на ступени.
2. Движение одиночной прямолинейной ступени. В модели
Косселя процесс роста описывается следующей схемой:
пар <-> адсорбированный атом
адсорбированный атом <-> ступень
движение вдоль ступени <-> излом.
Вероятность прямой конденсации атома из пара в излом или
в ступень мала, поскольку площадь поверхности, приходящаяся
на ступени, невелика (имеются в виду относительно малая плот-
ность ступеней, вицинальные грани). Поскольку плотность из-
ломов, как уже отмечалось, достаточно велика, диффузия адато-
мов вдоль ступени к излому не может быть лимитирующей
стадией. Диффузионный закон Фика (для одномерного диффу-
зионного потока вдоль оси у, перпендикулярной к ступени) за-
писывается в виде
is=-Ds^- = Dstis^, (17.5)
где js — поток по поверхности, п3— действительная и п3о— рав-
новесная поверхностная концентрация адатомов, ip = о—os =
= а — а3 [здесь а= (р/ро)—относительное пересыщение пара,
р — однородное давление пара над поверхностью, р0 — равно-
весное давление], о(= а— 1) — пересыщение пара, as = п3/пз0—
относительное поверхностное насыщение, <js(= as—1) — поверх-
ностное пересыщение. Запишем также выражение для общего
потока атомов jv из пара на поверхность:
/0 = (a-as)-^=-ML. (17.6)
Это выражение вытекает из следующих соотношений: число ато-
мов, покидающих поверхность, равно п3/т3 = а3пз0/х3-, число ато-
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 447
мов, достигающих поверхности, равно anso/rs, т. е. в а раз больше
nsolxs, т. е. числа атомов, попадающих на поверхность или испа-
ряющихся с нее при равновесии. Если предположить, что дви-
жением ступени можно пренебречь и что устанавливается ста-
ционарное состояние, то из условия сохранения адатомов сле-
дует
^is = iv> (17.7)
или
(17'8)
Если принять, что скорость обмена адатомов с изломами очень
велика, то можно ожидать, что относительное поверхностное на-
сыщение около ступени соответствует равновесию (т. е. а3 = 1
при у = 0); вдали от ступени as принимает свое максимальное
значение (as = a при у—>оо). С учетом этих граничных значе-
ний решение уравнения (17.8) имеет вид
(17.9)
следовательно, поток в направлении ступени при у = 0 равен
Л = -0Ло-£. (17.10)
Скорость ступени vx равна —ДМо, где 1/п0 — площадь, занимае-
мая одной частицей. Следовательно,
^ = 2(yv2/^-W, (17.11)
где W = ws + Ws, а множитель 2 введен с учетом потоков с двух
сторон от ступени. Видно, что скорость ступени не зависит от ее
кристаллографического направления.
Чтобы предусмотреть случаи, когда предположения, исполь-
зованные при выводе соотношения (17.11), не выполняются для
тех или иных материалов (например,, для молекулярных ве-
ществ в отличие от моноатомных), Бартон, Кабрера и Франк[41]
ввели в правую часть формулы (17.11) два дополнительных мно-
жителя р и Со, каждый из которых меньше или равен единице.
Если число изломов на ступени недостаточно велико, т. е. если
условие Xs XQ не выполняется, то cQ < 1; если же обмен ада-
томов или молекул между адсорбционным слоем и изломами
происходит недостаточно быстро (что возможно, например, когда
существует стерическое препятствие встраиванию молекулы
в излом), в результате чего равновесная концентрация на
448
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
ступени не поддерживается, то р< I1). Проанализировано не-
сколько предельных случаев для расчета Cq. В одном из них,
когда Xs <С Хо и к тому же диффузия вдоль ребра ступени про-
исходит настолько медленно, что ею можно пренебречь, решение
диффузионной задачи для изолированных изломов в ступени
имеет вид
где у'= 1,78. Рассмотрен также случай, когда диффузия вдоль
ребра ступени, характеризующаяся коэффициентом DSt проис-
ходит столь быстро, что непосредственной диффузией с поверх-
ности в излом можно пренебречь. Общий случай весьма сложен
и требует оценок относительных интенсивностей диффузионных
потоков вдоль ребра ступени и с поверхности к ступени.
3. Движение прямых параллельных ступеней. Уравнение
(17.8) можно решить для случая, когда имеется ряд параллель-
ных ступеней, отстоящих друг от друга на одинаковое расстоя-
ние уо, причем на каждой ступени os = 0, как это предполага-
лось при выводе формулы (17.9). Результат расчета дает
= 2pc0aXsv2e-^rth(-^7). (17.13)
При больших расстояниях между ступенями эта формула сво-
дится к (17.11), если не учитывать множителей р и с0- Расчет с0
опять-таки сложен.
4. Движение круговой ступени. Решение аналога уравнения
(17.8) для круговой ступени радиусом р дает в случае малых
пересыщений
V (р) = о00(1 (17.14)
где и» определяется формулой (17.11), а критический радиус
двумерного зарождения
О4 * * 7 *-15)
Здесь уе— краевая энергия (двумерного) зародыша, отнесен-
ная к одной молекуле.
Бартон, Кабрера и Франк показали также, что для ряда кон-
центрических окружностей получается то же самое выражение
(17.14), но Voo определяется по формуле (17.13).
4) Коэффициент р, отражающий скорость элементарных актов кристал-
лизации на ступени, должен, следовательно, вводиться не прямо в выраже-
ние скорости ступени, а в краевое условие, связывающее поток и пересыще-
ние на ступени [17]. Другой способ введения р дает иной результат для
скорости эшелона ступеней (см. ниже). — Прим. ред.
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 449
5. Винтовая дислокация, спираль роста и скорость роста. На
всякой кристаллической поверхности, первоначально даже по-
крытой (в силу геометрической необходимости) участками вы-
соких индексов со ступенями, по истечении некоторого проме-
жутка времени ступени постепенно исчезают; такая поверхность
в конце концов превратится в кристаллическую грань, ограни-
ченную плотноупакованной плоскостью, причем для ее роста
необходим источник ступеней. Франк [160] предположил, что
некоторые дислокации в кристаллах, до того изучавшиеся глав-
ным образом в связи с механическими свойствами кристаллов, а
именно винтовые дислокации (хотя и необязательно чисто вин-
товые: достаточно того, чтобы дислокация имела ненулевую ком-
поненту вектора Бюргерса, нормальную грани), могут служить
непрерывным источником ступеней для роста кристаллов на
плотноупакованных поверхностях.
По мере того как атомы оседают на такой ростовой ступени,
она начинает закручиваться, поскольку конец ее закреплен на
дислокации. Скорость движения ступени не зависит от ориен-
тации (если Хо <С Xs), благодаря чему все ее точки, кроме при-
легающих к дислокации, перемещаются с одной и той же ли-
нейной скоростью; в итоге возникает некоторая спираль, обра-
зующая на кристаллической грани невысокий конус. Спираль
закругляется до тех пор, пока кривизна в центре не достигнет
1/ркр [см. формулу (17.14)], после чего вся спираль «вращается»,
сохраняя свою форму.
Стационарная спираль принимает приближенно форму архи-
медовой спирали; в полярных координатах такая спираль описы-
вается формулой
г = 2Ркр0. (17.16)
В центре она имеет нужную кривизну. Таким образом, с каж-
дым витком ступень перемещается на 4лркр, затрачивая на это
время 4лрКр/^оо = 2л/со, где со — угловая скорость вращения спи-
рали. Тогда нормальная скорость роста кристалла R выразится
в виде
т\_ Л® ___ Ло^® _ /17 1 7\
4лркр ’ И'*1'?
где а — высота ступени (т. е. компонента вектора Бюргерса по
нормали к грани), a Q — объем молекулы. Исходя из соотно-
шений (17.13), где yQ = 4лрКр, и (17.15), а также принимая, что
для малых о справедливо 1п(1 + о) « о, получаем закон Бар-
тона, Кабреры и Франка
£ = ₽CoQnov2exp(-^)-<th(^), (17.18)
450
t>. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
где
а‘— kTXs •
Если о oi, то получим параболический закон
R ~ а2;
если же о > оь то линейный
R~a.
(17.19)
(17.20)
(17.21)
В случае параболического закона расстояние между ступенями
4лрКр значительно превышает Xs, так что диффузионные поля
соседних ступеней не перекрываются [как это следует из выра-
жения (17.9)]. Соответственно адатомы, попадающие на кри-.
сталлическую поверхность на расстояниях от ближайшей сту-
пени, значительно больших .XSf скорее всего испарятся еще до
того, как достигнут ступени; тогда скорость роста оказывается
ниже, чем дает линейный закон. Величину (o/oi)th(oi/o) можно
рассматривать как некий «коэффициент конденсации» для спи-
рально-диффузионной задачи: она равна единице при больших о
(когда расстояние между ступенями мало) и убывает до нуля
пропорционально о при малых о (когда расстояние велико). Член
an0V2 exp (—W/kT) выражает полный поток конденсации, кото-
рый, будучи умножен на соответствующий коэффициент кон-
денсации, дает скорость роста кристалла (без учета попра-
вочных множителей 0 и Со). Заметим, что /iov2exp(—W/kT) =
= po(2ntnkT)-{/2 — это поток конденсации или испарения в усло-
виях равновесия [41].
В более общем случае, когда на поверхность кристалла вы-
ходит несколько винтовых дислокаций, возможен ряд вариантов.
Прежде всего заметим, что одна дислокация может обеспечить
рост всей кристаллической грани. В случае двух дислокаций
противоположного знака, но с равными по модулю нормальными
компонентами вектора Бюргерса будут генерироваться замкну-
тые петли; рост возможен лишь в том случае, когда расстояние
между дислокациями d > 2ркр. В случае двух дислокаций оди-
накового знака при d > 2ркр скорость роста будет такой же, как
и при наличии одной дислокации. Если же d <Z 2ркр, то возмож-
ны два случая: 1) d *С 2ркр — скорость вращения спиралей со
вдвое больше, чем для одиночной спирали; 2) d меньше 2ркр, но
не во много раз — активность пары лежит в интервале между
одной, и двумя активностями одиночной спирали. Наконец, при
определенных конфигурациях в распределении дислокаций эти
результаты можно обобщить для многих дислокаций. Группа
дислокаций мощностью s (избыточное число винтовых дислока-
ций одинакового знака) будет характеризоваться активностью,
до |s| превосходящей активность одиночной дислокации, если
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 451
расстояние между витками сохраняется достаточно большим
по сравнению с Xs. Однако скорость роста кристалла R в лю-
бом случае не может превзойти значения, определяемого ли-
нейным законом для одиночной дислокации, и не может быть
меньше, чем следует из параболического закона для одиночной
дислокации, кроме сбалансированных групп (т. е. характери-
зующихся s = 0), у которых расстояние между витками меньше
2рКр (см. выше). Результирующая активность будет равна ак-
тивности наиболее мощной группы.
Скорости роста по классической теории поверхностного за-
рождения. Представим себе, что под действием статистических
флуктуаций адатомов на плотноупакованной поверхности кри-
сталла возникает дискообразный кластер (см. гл. IV). Прове-
дем теперь более обстоятельный анализ системы кластер —
подложка из одного и того же материала. Скорость двумерного
зарождения определяется формулой [112, 144]
ISD = Z®'nh (17.22)
где фактор неравновесности Зельдовича Z имеет значение ~ 10~2;
о' — частота, с которой зародыш докритических размеров, ко-
торому недостает одного атома до стабильного состояния, прев-
ращается в критический зародыш (фактически со' равна частоте,
с которой отдельные адатомы присоединяются к докритическим
кластерам); Пг — концентрация этих докритических частиц. Ча-
стоту со' можно оценить по формуле
а>' = 2пг'ап^3е~и^кТ, (17.23)
т. е. как произведение числа адатомов 2nr*ans, непосредственно
примыкающих к дозародышу радиусом г*, на частоту попыток V3
по преодолению диффузионного барьера для присоединения к
кластеру и на вероятность ехр (—UslkT) преодоления такого
барьера. Концентрация п, определяется формулой
= п0е"локрЛг) (17.24)
где AGKp находят из соотношения (15.2) приравниванием нулю
поверхностного члена:
лу!
(17.25)
Здесь — краевая энергия на единичную длину, а
ДО₽ = -^1П(^)- <17-26)
452
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
При оценке о/ по формуле (17.23) существует несколько неоп-
ределенных моментов, в том числе касающихся поверхностных
подвижностей (особенно это относится к Ua). Мы принимаем
а/ ~ 108. Тогда для п0 = 105 формулы (17.22) и (17.24) дают
/50 = 10г| exp [— Mtr7-,na(p/pj) ] (‘7-27>
Скорость зарождения, а следовательно, и скорость роста очень
сильно зависит от а = p/pQ. Ниже некоторого критического пе-
ресыщения Окр = акр—1 скорость роста по существу равна
нулю. Пусть, например, минимальная наблюдаемая скорость ро-
ста кристалла составляет 1 атомный слой за 1000 с, причем кри-
сталлическая грань имеет площадь 1 см2. Тогда принимая, что
один зародыш обеспечивает рост монослоя, получаем: Isd &
ж 1 • 10“3 с”1. Полагая yeh « ^/2 и q>/kT « 4, получим, что 10“3 =
= 1021 ехр {—(л/4) (ср/^Г)2[1/1п(р/ро)]}, или ехр [—4л/1п(р/р0)] =
= ехр(—55), т. е. 1п(р/р0) ~ 0,23; следовательно, (р/р0)= 1,26,
или пересыщение составляет 26%. Ясно, что при пересыщении
1% скорость роста должна быть пренебрежимо малой. Тот
факт, что кристаллы, как известно, растут с измеримыми ско-
ростями даже при малых отклонениях от равновесия, привел
Франка [160] к заключению, что такие кристаллы несовершенны
и что при их росте винтовые дислокации служат источниками
ступеней.
Дальнейшее развитие теории роста из паровой фазы. Рост
нитевидных кристаллов. 1. Диффузия поверхностных вакансий.
Кабрера и Кольман [13] отметили, что на поверхности кристалла
существуют вакансии в концентрациях, по меньшей мере столь
же высоких, как и адатомы, и что эти вакансии наряду с адато-
мами участвуют в переносе вещества по поверхности. Хирс [144],
основываясь на модели поверхностной структуры для грани
(111) г. ц. к-решетки показал, что отношение потока адатомов /ад
к потоку поверхностных вакансий JBaK составляет
/ад 1 2ф + -Едеф Зфг
7^7 = Т ехР [ йт
(17.28)
где (р — энергия связи ближайших соседей; Едеф— энергия де-
формации, обусловленная смещением соседних атомов при об-
мене местами между вакансией и атомом; фг— уменьшение энер-
гии связи вследствие релаксации вблизи вакансионного узла.
Если предположить, что Едеф > Зфг, то из соотношения (17.28)
следует, что, например, для (ф/£Т) = 4 поток поверхностных ва-
кансий пренебрежимо мал по сравнению с потоком адатомов.
Хирс [144] обсуждал также основания для довольно больших
предэкспоненциальных множителей, полученных в ряде экспери-
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 45З
ментов [164] по поверхностной диффузии. Такие большие значе-
ния можно объяснить [165], предположив, что длина скачка а в
формуле (17.3) значительно превосходит межатомные расстоя-
ния. Согласно этой гипотезе «горячих атомов», у активирован-
ных атомов время релаксации слишком велико, чтобы они успе-
вали растратить избыток своей энергии. Иное объяснение связы-
вает большие предэкспоненциальные множители с энтропийными
эффектами, предполагающими влияние различных колебатель-
ных частот v на поверхностную концентрацию атомов и коэффи-
циент поверхностной диффузии. Детальный обзор новейших ре-
зультатов по поверхностной диффузии составили Джостейн и
Уинтерботтом [166].
2. Движение одиночной ступени: новые результаты. Как уже
отмечалось в гл. III, рост кристаллов в общем случае сводится
к проблеме движения некоей границы — это необходимо учиты-
вать в дифференциальных уравнениях, описывающих поток ве-
щества или тепла. В формуле (17.8) теории Бартона, Кабреры и
Франка отсутствует член, учитывающий скорость, хотя эти ав-
торы и предложили критерий, основанный на средней длине
пробега Xs до реиспарения. Хирс [144] учитывает член, содержа-
щий скорость в диффузионном уравнении (исходя, однако, по-
прежнему из стационарных условий). Полученный им результат
гласит, что решение Бартона, Кабреры и Франка (17.9) спра-
ведливо, когда
ns~nso < 1, (17.29)
т. е. когда на поверхностную концентрацию накладывается уело-
вие, непременно выполнимое, если ns/no 1. По формуле
(16.23), где (энергия перехода атома из излома на поверх-
ность) составляет обычно 3<р для грани (111), a (q/kT) = 4,
получаем (ns/n0) ~ ехр (—12) <С 1.
Хотя Бартон, Кабрера и Франк ввели два поправочных ко-
эффициента р и Со [см. формулу (17.13)], все еще остается один
множитель, который считался этими авторами равным единице.
Речь идет о коэффициенте конденсации [167] aft для перехода
пар -> адсорбционный слой; этот множитель появляется в фор-
мулах (17.13) и (17.18), если crnoV2exp(—ITikT~) заменить выра-
жением аларо(2л/п&7')~,/2. Коэффициент ай меньше единицы,
если молекулы при соударении с поверхностью отражаются от
нее; ал может быть меньше единицы и в случае сложных моле-
кул, если учесть вращательные степени свободы и стерические
ограничения. Кабрера [168] и Цванциг [169] рассчитали ай на
основе классической механики по одномерной пружинной модели
с сосредоточенными массами, получив, что для атома, налетаю-
щего на подобные ему атомы, коэффициент ай равен единице.
В последнее время Гудмен и др. провели расчет по трехмерной
454
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
модели. Новейший обзор на эту тему составлен Триллин-
гом [170].
3. Параллельные ступени; спиральный рост. Чернов [17] под-
черкнул, что расчет Бартона, Кабреры и Франка для формы и
скорости вращения спирали зависит от механизма роста только>
через скорость ступени vx и, следовательно, должен быть при-
ложим не только к росту из пара, но и к росту из раствора и
расплава (разумеется, при условии что общая модель послой-
ного роста на плотноупакованных гранях остается в силе).
В любом случае формула для vx будет иной, чем в модели Бар-
тона, Кабреры и Франка для паровой фазы, поскольку процессы
переноса у ступеней неодинаковы.
Кабрера и Левин [171] провели более строгий расчет расстоя-
ния между ступенями: вместо 4лркр (как это было в исходной
теории) они получили значение = 19ркр. Этот результат при-
водит к увеличению cq в формуле (17.19); действительно,
Z KI Ag
что несколько понижает (при данном о) коэффициент конденса-
ции (o/oi)th (oi/o) и, следовательно, уменьшает скорость роста
при низких о г< (Ji (как этого и следовало ожидать: чем больше
расстояние между ступенями, тем больше вероятность повтор-
ного испарения адатомов). При о oi скорость роста R не ме-
няется. Фактически Бартон, Кабрера и Франк [41] уже до этого
рассмотрели уточненную форму спирали взамен архимедовой,
получив yQ = 4л (1 + 3_,/2)ркР ~ 20ркр. Кабрера и Левин учиты-
вали к тому же влияние энергии упругих деформаций кристалла
в окрестности дислокации на форму спирали; это особенно
важно в случае испарения, когда возникает асимметрия роста
и испарения, поскольку энергия деформации дислокаций препят-
ствует росту и благоприятствует испарению.
Хирс и Паунд [112, 172, 173], а также Хирс [144], исследуя
расстояния между ступенями, генерируемыми неким источником
(первоначально [172, 173] рассматривался случай испарения, а
источником ступеней служил край кристалла), пришли к вы-
воду, что при о О1 ступени, входящие в эшелон конечной ши-
рины (т. е. сравнительно удаленные от дислокационного источ-
ника), обнаруживают тенденцию к ускорению своего движения.
Это ускорение продолжается до тех пор, пока расстояние между
ступенями не станет равным yQ ж 6XS и, следовательно, коэф-
фициент конденсации а= (o/oi)th(oi/o) приблизится к 73. Од-
нако лежащие в основе этих выводов аргументы, по-видимому,
не вполне ясны.
4. Эффект самоторможения. Кабрера и Кольман [13] отме-
тили, что поверхностное пересыщение ов у первого витка спи-
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 455
рали [которое в случае простой архимедовой спирали влияет
на ее кривизну в начальной точке, а также на расстояние между
ее витками; см. формулы (17.15) и (17.16)] может оказаться
вопреки первоначальному предположению ниже пересыщения а
в объеме пара. Это объясняется поверхностно-диффузионными
потоками (от центра) к первому витку, в результате чего в
центре спирали os < ст. Этот эффект самоторможения можно
приблизительно рассчитать, если в выражении (17.15) заме-
нить In а ж о пересыщением os, причем можно найти, решив
диффузионное уравнение непрерывности (17.8), обобщенное на
двумерный случай круговой ступени радиусом р0. Тогда
ZeT In [1 + (?s (Ро)] = Аро(ро) 1_1 И 7 ЧП
£Г1п[1+а] “ Др /о(Ро/^)‘ U
Здесь поверхностное пересыщение в центре спирали прини-
мается равным о, /о представляет собой функцию Бесселя мни-
мого ^аргумента, а Др — химические потенциалы, удовлетворяю-
щие условию (17.31). Полагая Дц1 = \9£lye/hXs, где уе— крае-
вая энергия на 1 см (те же рассуждения относятся и к простой
архимедовой спирали, если 19 заменить произведением 4л), по-
лучим из соотношения (17.31) и определения /0 (помня, что
Дцо = 19Йуе/Лро) следующую формулу:
( Ро \3= Api
\2XS) 2Ар •
Для больших пересыщений, т. е. Дц >> Дць имеем р0 <С Xs. Сле-
довательно, скорость роста, определяемая в виде R =
= /?m(2Xs/po)th(po/2As), где Rm — максимальная скорость ро-
ста, принимает при больших Др вид
= - 4(^гУ/з] • (17.33)
Как отметил Кабрера, с увеличением Др скорость роста R
очень медленно приближается к Rm. Этот результат отличается
от полученного ранее: при о >> oi, соответствующем большому
Др, было (o/oi)th(oi/o) [1 — 1/2(ni/o)2]. Физический смысл за-
ключается в следующем: с увеличением пересыщения Дц спи-
раль должна по Бартону, Кабрере и Франку закручиваться в
большей степени — пропорционально 1/Дц, в то время как здесь,
согласно анализу Кабреры, эффективное значение Дцо увеличи-
вается не столь быстро. Таким образом, скорость роста с повы-
шением Др здесь возрастает медленнее.
5. Рост нитевидных кристаллов. Рост нитевидных кристаллов
из пара по механизму поверхностной диффузии уже обсуждался
(гл. III) в рамках задачи Стефана. Основная модель, разу-
меется, сходна с моделью Бартона, Кабреры и Франка для
456
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
поверхностной диффузии к ступени, причем в данном случае сту-
пень расположена на вершине нитевидного кристалла, куда вы-
ходит винтовая дислокация. Простая теория (см., например
[94, 95]) предсказывает, что длина кристалла сначала увеличи-
вается со временем экспоненциально, поскольку площадью сбора
молекул служит весь нитевидный кристалл. Когда длина кри-
сталла становится большой по сравнению с XSi он продолжает
расти пропорционально времени, причем площадь сбора по-
стоянна по величине и
Фиг. 24. Модель роста
нитевидного кристалла с
учетом анизотропии кри-
сталла по коэффициенту
захвата адатомов на сту-
пени [174].
Адатомы захватываются заштри-
хованными (ступенчатыми) участ-
ками.
следует за вершиной нитевидного кри-
сталла. Строгая теория [101] показы-
вает, что отклонения от простой тео-
рии могут позволить в принципе из-
мерить по отдельности Ds и ts, хотя
поверхностное зарождение на боковых
гранях нитевидных кристаллов может
решающим образом изменить картину.
Обычно удается определить лишь
Х8 = (£)sTe) \
Швёбель [174] предложил модель
роста нитевидных кристаллов из пара
по механизму поверхностной диффу-
зии, причем эта модель обходится без
винтовых дислокаций. 20 концентриче-
ских ярусов, образующих коническую
структуру, принимают атомы из пара
с постоянной скоростью, причем по-
вторного испарения не происходит.
Все атомы, ударяющиеся о боковые
стенки этих ярусов, перемещаются к
ступеням посредством поверхностной
диффузии и встраиваются в решетку только на ступенях.
В отличие от модели Бартона, Кабреры и Франка предпола-
гается, что ступень (горизонтальный участок на фиг. 24)
захватывает с разной эффективностью адатомы, поступающие
к ней снизу или сверху. Это различие может быть обусловлено
различными координациями адатомов у ступени, хотя сумма
вероятностей захвата равна единице. Именно эта анизотропия
захвата приводит к анизотропии движения ступеней. Теория
Швёбеля не учитывает диффузионные поля или концентрацион-
ные градиенты и носит чисто геометрический характер. Предпо-
лагается, что подвижность адатомов на боковых гранях выше, чем
на ступенях, однако никаких других уточнений не проводится.
Затем автор численно решает 20 зацепляющихся дифферен-
циальных уравнений непрерывности и получает высоту каждого
яруса в функции времени. Установлено, что при доста-
точном различии коэффициентов захвата первоначально ко-
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 457
нический кристалл может быстро превратиться в заостренный
«ус», а длина его становится экспоненциальной функцией вре-
мени. Даже в том случае, когда исходное образование представ-
ляет собой очень тупой конус, содержащий всего лишь один за-
родыш цилиндрической формы, такая структура заостряется.
Образование макроступеней при росте из пара (без учета
образования кинематических волн). Формула (17.11) для (тан-
генциальной) скорости движения одиночной ступени не содер-
жит множителя, который учитывал бы ее высоту: выражение
Voo = —js/fiQ просто предполагает, что ступень имеет единичную
высоту. Однако на очень высокой ступени плотность изломов
будет небольшой, поскольку она представляет собой по суще-
ству плотноупакованную кристаллическую грань; мы уже рас-
сматривали вопрос о том, каким путем в условиях равновесия
террасная структура, образованная плотноупакованными гра-
нями, может (благодаря взаимному притяжению ступеней)
трансформироваться, понижая общую свободную поверхност-
ную энергию. Следовательно, такая ступень может служить для
адатомов стоком, если на ней образуются вторичные ступени
благодаря поверхностному зарождению [175].
Помимо эффекта распада плоской поверхности с образова-
нием макроступеней источником высоких ступеней может слу-
жить попросту дислокация с большим вектором Бюргерса Ь.
Поскольку, однако, энергия упругих напряжений дислокации
пропорциональна Ь2, подобные дислокации будут проявлять тен-
денцию к распаду на ряд параллельных дислокаций с относи-
тельно малым вектором Бюргерса, если только не образуется
дислокация с полым ядром, способная снять энергию этих де-
формаций [176]. Из других механизмов образования макросту-
пеней назовем движение кинематических волн и группирование
ступеней под действием примесей (эти механизмы обсуждаются
ниже).
Чернов [17] исследовал форму профиля макроступени, кото-
рая питается адатомами как с вершины торца, так и от основа-
ния. Он предположил, что макроступень достаточно шероховата,
чтобы обойтись без (элементарных) ступеней для своего роста.
В результате развивается S-образный профиль, ибо ступень на-
висает у вершины и выпячивается у основания из-за близости
примыкающих граней.
Экспериментальные исследования роста кристаллов из паро-
вой фазы. Пока еще проведено относительно немного количе-
ственных исследований кристаллизации из паровой фазы, в ко-
торых скорость роста R измеряли в функции пересыщения а
при разных температурах, а опыты проводили в чистых условиях;
458
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
особенно мало исследований, в которых тщательно следят за
топографией поверхности. Существует, однако, множество на-
блюдений предсказанных спиралей роста; кроме того, часто
оказывается, что реальные кристаллы растут с измеримыми
скоростями при гораздо более низких пересыщениях, чем это
должно было бы следовать из теории образования зародышей.
Детальный обзор экспериментальных наблюдений подобного
рода проведен Хирсом и Паундом [112], а также Хейером [177].
Отметим здесь три последние тщательно выполненные экспери-
ментальные работы: Хейера [178], Швёбеля [179] и Бетге [180].
Хейер [178] оптическим путем измерял зависимость R от о на
кристаллах уротропина, арсенолита и иода при их росте в отка-
чанных запаянных стеклянных трубках. Для всех трех веществ
наблюдались две последовательные стадии: «бездефектный» и
«дефектный» рост. Вторая стадия заключалась в том, что по
достижении кристаллом определенного размера на его гранях
появлялись обнаружимые дефекты, а скорость роста подчиня-
лась линейному закону; на первой стадии, когда кристалл был
еще невелик, действовал квадратичный закон. Эти результаты
согласуются с предсказаниями Бартона, Кабреры и Франка [41],
если предположить, что появление видимых дефектов соответ-
ствует существенному повышению плотности дислокаций, при-
чем расстояния между ступенями оказываются меньше или срав-
нимыми с Xs. Измеренные коэффициенты конденсации оказа-
лись, вообще говоря, меньше единицы даже в линейной области,
что может свидетельствовать о влиянии инородного газа в си-
стеме.
Швёбель [179] изучал конденсацию атомов золота на моно-
кристаллах золота, пользуясь микровесами в сверхвысоком ва-
кууме. Эффективный коэффициент конденсации изменялся от
единицы при температуре около 900 К почти до нулевых значе-
ний при 1200 К; автор считает, что этот результат находится в
разумном соответствии с моделью Бартона, Кабреры и Франка
[41] для поверхностной диффузии адатомов к ступеням. При
этом, однако, предполагалось, что с изменением температуры
расстояние между ступенями остается постоянным, чего не дол-
жно быть, если источниками ступеней служат винтовые дисло-
кации. Другая интересная работа Швёбеля [181] посвящена
детальному изучению морфологии выращенных из пара кристал-
лов золота; в частности, как показали электронно-микроскопи-
ческие исследования по методу реплик, центры роста имеют
треугольную форму; отсюда следует, что их ступени не служат
абсолютным стоком для атомов золота, а вероятность захвата
зависит от ориентации ступени. Швёбель полагает далее, что
энергия активации поверхностной диффузии в таком случае не
должна сводиться только к энергии активации перемещения U9—
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 459
она должна включать также энергию для отрыва атома со сту-
пени и перевода его на (гладкую) поверхность кристалла.
Бетге [180] изучал топографию поверхностей роста и испаре-
ния на гранях скола NaCl по методу декорирования золотом;
этот метод весьма чувствителен для выявления моноатомных
спиральных ступеней, образующихся вокруг винтовых дислока-
ций при испарении. Наблюдалось также, что на (гладких) уча-
стках, удаленных от ступеней в такой степени, что там разви-
вается достаточное недосыщение, возникают (по механизму
поверхностного зарождения) дискообразные углубления моно-
атомной высоты.
18. ПОВЕРХНОСТНАЯ КИНЕТИКА
ПРИ РОСТЕ ИЗ РАСТВОРОВ
Бартон, Кабрера и Франк [41]. При росте из паровой фазы
расчет потока вещества проводится по схеме: 1) пар—>поверх-
ность кристалла —► ступень—► вдоль ребра ступени к излому.
Другие потоки, параллельные указанным: 2) пар —► излом;
3) среда (т. е. пар)—► ступень-> излом; 4) среда —► поверхность—►
—> излом. Первый поток характерен для случая «чистого» роста
из паровой фазы: он обеспечивает основной перенос вещества.
Однако при росте из раствора может случиться, что одна или не-
сколько стадий в первой схеме обладают существенно большим
сопротивлением (т. е. при данной движущей силе скорость пере-
носа мала); тогда могут стать более эффективными остальные
три потока. Ясно, что поток, который будет определять рост кри-
сталла из раствора, зависит от соотношения коэффициентов
поверхностной Ds и объемной D (т. е. в среде) диффузии, а так-
же от соответствующих концентраций вещества и от морфологии
ступеней и изломов. К сожалению, не все эти параметры доста-
точно хорошо известны.
Бартон, Кабрера и Франк [41] в своей теории роста из рас-
творов выбрали в качестве основного второй поток, т. е. непо-
средственное осаждение вещества из среды в излом, полагая
тем самым, что диффузионная подвижность на (гладкой) по-
верхности и вдоль ребра ступени очень мала. Рассматривается
следующая геометрия: на поверхности кристалла существует
ряд параллельных ступеней, удаленных друг от друга на рас-
стояние r/о, а расстояние между изломами в ступенях составляет
Хо- При такой схеме диффузионная задача довольно сложна;
она решается приближенно в предположении, что диффузионные
поля характеризуются равновесной концентрацией в самих
изломах и простираются от изломов по радиусу на расстоя-
ние Хо. Вокруг каждой ступени существуют полуцилиндрические
поля, простирающиеся до г = у$\ на них накладываются
460
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
полусферические поля радиусом г — Хо вокруг каждого излома.
Наконец, вдоль оси z (по нормали к кристаллу) на полуцилиндр
г = z = yQ накладывается плоское диффузионное поле, прости-
рающееся до z = 6Кр (толщина неперемешиваемого раствора у
поверхности кристалла, точнее говоря, толщина пограничного
концентрационного слоя). Рассматривая поток через одну полу-
сферу, находим для скорости роста ступени
ооо = £>С0а-Я-уХ°'- (18.1)
А О
где а(Ао) — пересыщение на расстоянии г = Хо от излома, Со—
равновесная концентрация в растворе [не смешивать с коэффи-
циентом Со в формуле (17.12)]. Приравнивая три ряда диффузи-
онных потоков — полусферического, полуцилиндрического и пло-
ского, получаем следующее соотношение между а при z = бКр
(это пересыщение в объеме среды) и о(Хо):
а(Х0) ( 2яа (6кр - у0) 2а / Уо \\~1 ,1ОП.
-v-=(‘+----------ss— + х'"Ы) (18'2’
Используя выражения (17.16) и (17.17) для скорости роста спи-
рали, которая, как предполагается, сохраняет свои свойства и
здесь, находим
о DCqQclg (Xq) DC0QkTa2 (XQ) (18 3)
2Х0рКр 2XoYe
где рнр = yed/kTo(XQ) [ср. с формулой (17.15) для низких пере-
сыщений] и уо = 4лркр, как и прежде. При достаточно низких
пересыщениях о(Х0) расстояние уо будет большим, так что лога-
рифмический член в соотношении (18.2) должен доминировать;
тогда соотношение между о(Х0) и о будет приблизительно ли-
нейным и, следовательно, скорость роста по формуле (18.3)
подчиняется параболическому закону. (Отметим, что параболи-
ческий характер зависимости имеет здесь несколько иное проис-
хождение, чем в случае роста из пара: там он был обусловлен
реиспарением адатомов, диффундирующих по поверхности меж-
ду широко разнесенными ступенями; здесь же поверхностная
диффузия не учитывается, однако при увеличении расстояния
между ступенями уменьшается число изломов, приходящееся на
поверхность единичной площади.) При высоких пересыщениях
главную роль в соотношении (18.2) играет второй член, по-
скольку уо в таких случаях мал по сравнению с SKpJ тогда
a2(X0) ~ о, т. е. налицо линейный закон.
Чернов [17]. Чернов также исследовал рост кристаллов из
раствора, анализируя диффузионное поле, связанное с эшело-
ном параллельных ступеней. И он считал основным поток веще-
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 461
ства из объема среды к ступеням и изломам, пренебрегая тем
самым поверхностной диффузией. Учитывалась также диффузия
вдоль ребра ступени к изломам, однако в отличие от Бартона,
Кабреры и Франка Чернов не анализировал диффузионные поля
вокруг отдельных изломов. Вместо этого он принимал, что поток
молекул к ступеням подчиняется линейному закону и описы-
вается формулой
D-^-=fi(C-C0), (18.4)
где С—концентрация раствора, Со — равновесная концентрация,
г — (цилиндрическая) координата вокруг ступени, а кинетиче-
ский коэффициент 0 тем больше, чем выше концентрация изло-
мов. На фиг. 25 изображены диффузионные поля согласно ана-
Фиг. 25. Диффузионные поля параллельных ступеней при росте кристаллов
из раствора [17].
Показаны линии потоков и изоконцентрационные линии.
лизу Чернова; предполагается, что на кромке пограничного слоя
бКр концентрация С = Со постоянна и равна концентрации в
объеме раствора С^. Далее уравнение Лапласа для этой си-
стемы решается методом конформных отображений. Результат
для скорости роста по механизму винтовых дислокаций имеет
вид
d _ _______________а2_______________ (18 5)
4уе 1 + fta/D) In [(дкр<т'р/аст) sh (а/а'р)] ’
где <Ткр = 4йув/А7’дкр, а уе — свободная краевая энергия, прихо-
дящаяся на поверхность единичной площади. Произведение fia
рассматривается Черновым как коэффициент диффузии веще-
ства через фазовую границу кристалл — раствор; в качестве гру-
бого приближения принимается 0а ~ D (коэффициенту диффу-
зии в объеме раствора). Предсказывается, что при очень низких
пересыщениях, т. е. при условии о С оКр, опять-таки справедлив
462
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
параболический закон ~ о2. При больших о эта зависимость
практически линейна.
Хотя здесь рассматривались диффузионные поля в объеме
раствора, надо отметить, что характерные размеры использован-
ных при расчете величин, например 10“7 см для Хо, 10"5 см для
Уо и 10-3—10-5 см для бкр, вообще говоря, довольно малы по сра-
внению с размерами обычно изучаемых кристаллов. Следова-
тельно, эти характерные размеры довольно малы по сравнению
с макроскопическими диффузионными полями вокруг кристал-
лов. Принято считать, что микроскопические поля, с которыми
мы здесь имеем дело, относятся к проблемам поверхностной ки-
нетики и могут, как мы видели, оказывать существенное сопро-
тивление росту (законы а2). Разумеется, в общем случае необхо-
димо учитывать и макро-, и микроскопические диффузионные
поля.
Эксперименты Беннемы [182]. Для проверки изложенных
выше теорий Беннема провел тщательное экспериментальное
исследование роста монокристаллов алюмокалиевых квасцов и
хлората натрия из водного раствора. Для определения скорости
роста кристалл подвешивали в пересыщенном растворе на ана-
литических весах. На фиг. 26 приведены результаты для хлората
натрия. Согласно проведенным оценкам, в этих условиях пара-
метр оКр из расчетов Чернова составлял ~ 10“5, т. е. должен
быть справедлив линейный закон. Если линейный вариант фор-
мулы (18.5) экстраполировать к значению R = 0, то прямая
должна пересекать ось о не в начале координат, а в точке о =
= 10“4 (по теоретическим данным); фактически же пересечение
наблюдалось при 2-10'4 (фиг. 26). Кроме того, наклон пря-
мой согласуется с теоретическим значением £>QCo/6Kp- В дан-
ном случае 6Кр оценивается по законам гидродинамики (см.
гл. VIII). Оказалось, однако, что, когда 6Кр в условиях экспе-
римента уменьшили (повышением скорости перемешивания)
приблизительно вдвое, скорость роста не изменилась, хотя теоре-
тически для линейного закона она должна была бы измениться
в той же степени. [Аналогично наклон экспериментальной кри-
вой оказался в соответствии с теорией Бартона, Кабреры и
Франка, однако и там поведение 6Кр расходилось с формулой
(18.3), которая дает для наклона то же самое выражение
£>C0Q/6Kp.] В связи с этим Беннема предположил, что принятое
Черновым приближение 0а = D в отношении кинетического ко-
эффициента на стадии переноса раствор — ступень может быть
неоправданным. Энергия активации для вхождения иона в излом
складывается из энергии дегидратации изломов и энергии дегид-
ратации ионов. Эти энергии, взятые вместе, составляют по Бен-
неме от 6,27-Ю4 до 12,5-104 Дж/моль (от 15 до 30 ккал/моль),
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 463
и даже если бы они составляли всего лишь 4,18-104 Дж/моль
(т. е. 10 ккал/моль), коэффициент диффузии для вхождения
ионов в изломы должен был бы составлять, вероятно, лишь
около 0,01% коэффициента диффузии в объеме раствора, от-
куда следует, что произведение $D должно составлять около
Фиг. 26. Зависимость скорости роста граней {100} хлората натрия от пере-
сыщения раствора (сплошная линия рассчитана по теории Бартона, Кабреры
и Франка с учетом поверхностной диффузии) [182].
10"4, а не быть равным единице, как это предполагалось в тео-
рии. В таком случае для исследованного интервала о должен
соблюдаться нелинейный закон. На фиг. 26 приведен также гра-
фик (а2/сГ1)th (cri/cr), предсказываемый теорией Бартона, Кабре-
ры и Франка для случая, когда основную роль играет стадия
поверхностной диффузии. Беннема полагает, что такое соответ-
ствие делает наряду с уже отмечавшимися трудностями, сопря-
женными с моделями объемной диффузии, более вероятной
модель поверхностной диффузии, однако никаких теоретических
464
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
оценок 01 или поверхностных подвижностей он не приводит1).
Поэтому надо полагать, что процесс дегидратации иона склады-
вается из двух стадий: одна протекает на поверхности, а дру-
гая— на изломе. . ~ ;
Спирали роста. Из многочисленных наблюдений спиралей
роста, проводившихся как в процессе самого роста, так и по
его завершении, мы отметим исследования Форти [183] и Нью-
кирка [184] на Cdl2 и Козловского [185] на 0-метилнафталине.
Кроме того, еще до введения Бюргерсом (в 1939 г.) понятия вин-
товой дислокации Хекк в 1936—1937 гг. [186, 187] наблюдал спи-
рали на кристаллах парафина. Наконец, множество блестящих,
картин спиралей на SiC приведено в книге Вермы [188].
Эксперименты Доремуса [189]. Этот автор исследовал рост
ионных кристаллов из пересыщенных разбавленных водных рас-
творов, обращая особое внимание на механизмы процессов в
области фазовых границ. Он экспериментировал с осаждением
множества очень мелких (микронных и субмикронных) кристал-
лов, например сульфата бария, где возможно определять лишь
некую среднюю (по размерам и ориентации) скорость роста, ин-
терпретируя свои результаты на основе измерений электропро-
водности остаточного раствора. Задача состояла в том, чтобы
объяснить, почему поток J растворенного вещества, отнесенный
к площади поверхности частиц, выражается формулой
J = b3(Cs^CQ)nt (18.6)
где Ь3 — постоянная, Со — равновесная концентрация, a Cs —
концентрация на фазовой границе (она предполагается равной
исходной объемной концентрации раствора Соо, уменьшенной, од-
нако, на величину, соответствующую уже осажденному мате-
риалу; иными словами, предполагалось, что осаждение частиц
лимитируется процессами на фазовой границе, причем диффузия
из среды к поверхности кристалла происходит достаточно бы-
стро); п — чаще всего целое число (2, 3 или 4 в зависимости от
характера экспериментальной системы). Были рассмотрены две
модели, обе предполагающие стехиометричность протекающи/\г
на поверхности реакций. Согласно первой, два адсорбированных
иона противоположных знаков объединяются на поверхности
кристалла в присутствии третьего иона (по аналогии с газофаз-
*) Теория, одновременно учитывающая и объемную и поверхностную
диффузию, развита в работе Гилмера, Гера, Кабреры [Gilmer G. Н., Gher R.,
Gabrera N., Journ. Cryst. Grouth, 8, № 1, 79 (1971)], а одновременное действие
поверхностной диффузии к ступеням и теплоотвод от них описаны в сбор-
нике Б. И. Бирмана и Б. Л. Тимана («Рост кристаллов», т. 5, изд-во «Наука»,
1965, стр. 118). — Прим. ред.
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 465
ными реакциями), причем образуется нейтральная молекула, ко-
торая может затем диффундировать к излому на ступени; пред-
полагается, что скорость присоединения таких молекул к сту-
пени велика. Согласно второй модели, находящиеся в адсорб-
ционном слое на поверхности кристалла ионы обоих знаков
попеременно, как противоположные заряды, присоединяются к
изломам. Для одновалентных электролитов первая модель пред-
сказывает значение п = 3, вторая — п = 2. Коэффициенты ско-
ростей реакции, по-видимому, довольно сложны и этой теорией
не учитываются, а вместо этого рассматриваются вероятности
соударений.
Сводки других исследований по осаждению мелких частиц
приводятся в обзоре Нанколласа и Парди [190] и в книгах Ниль-
сена [115] и Уолтона [116].
Электрокристаллизация. При электроосаждении металлов,
которое можно рассматривать как низкотемпературный вариант
Фиг. 27. Смещение гидратированной оболочки в окрестности иона (за-
штрихован) при электроосаждении [191].
а —у плоской поверхности, б—у ступени, в — в углу.
роста металлических кристаллов из раствора, решающую роль
играет стадия переноса заряда от диффундирующего иона к ме-
таллическому кристаллу. Чтобы сделать возможным такой пере-
нос, гидратированная оболочка из молекул должна хотя бы
частично сместиться. Энергия активации такого смещения может
быть значительной и к тому же может изменяться в зависимости
от точки кристалла, в которой происходит смещение (фиг. 27).
Конвей и Бокрис подсчитали (см. [191]), что теплота активации
прямого переноса к гладкой поверхности гораздо меньше, чем в
случае прямого переноса к ступени или к излому. Поэтому
первой стадией процесса скорее всего следует считать перенос
466
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
к поверхности. Затем частично гидратированный адсорбирован-
ный ион должен продиффундировать по поверхности к ступени и,
наконец, к излому, теряя молекулы воды в каждой из поворот-
ных точек. Неизвестно, какая стадия процесса (перенос заряда,
диффузия по поверхности или присоединение к излому) является
лимитирующей 1).
19. ПОВЕРХНОСТНАЯ КИНЕТИКА
ПРИ РОСТЕ ИЗ РАСПЛАВА
Модель Джексона. Модель Джексона [42, 43] поверхностной
шероховатости кристалла, контактирующего с собственным рас-
плавом, уже была изложена в гл. II и дополнительно обсужда-
лась в разд. 16, посвященном структуре фазовой границы. Основ-
ной параметр этой модели а определяется в виде (L/kTG)fkt где
TQ — равновесная температура (температура плавления при ро-
сте из расплава), L — скрытая теплота плавления, а кристалло-
графический фактор fk 1 (в модели ближайших соседей это
есть доля общей энергии связей, приходящаяся на взаимодей-
ствие молекулы с другими молекулами во вновь образующемся
слое, параллельном рассматриваемой плоскости). Если а < 2, то
фазовая граница шероховата и, следовательно, кристалл для сво-
его роста не нуждается в ступенях; при а > 2 имеем гладкую
фазовую границу, что делает ступени необходимыми для роста
(см. фиг. 7).
В работе Джексона и др. [192], а также Джексона [193] все
вещества разбиваются на три группы в зависимости от энтропий
их плавления LlkTQ с приведением существенных эксперимен-
тальных доводов в пользу предложенной модели фазовой гра-
ницы. К группе веществ с очень малой энтропией плавления
относится большинство металлов, а также ряд соединений, напри-
мер четырехбромистый углерод СВг4 с LlkT$ = 0,8. Прямые на-
блюдения [192] фронта кристаллизации СВг4 из расплава пока-
зывают, что он строго следует за изотермой, как того и следо-
вало ожидать для шероховатых фазовых границ. Аналогично
ведут себя и металлы: при их росте из переохлажденных рас-
плавов образуются дендриты, что свидетельствует о шерохова-
тости фронта кристаллизации, движение которого лимитируется
*) В работах Булевского, Каишева и их сотрудников по электрокристал-
лизации серебра было впервые зафиксировано образование зародышей моно-
атомной высоты, из данных по зарождению и спиральному росту получены
значения линейной энергии ступеней [321*], а в последнее время определены
кинетические коэффициенты кристаллизации; показано, что для использо-
ванных концентрированных водных растворов AgNO3 решающую роль играет
не поверхностная или объемная диффузия, а акты присоединения частиц се-
ребра к ступеням. — Прим. ред.
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 467
теплоотводом. К группе веществ с промежуточными значениями
LlkTQ (2,0—4,0) относится большинство неорганических и орга-
нических кристаллов. В этом случае разные грани в зависимости
от величины fk могут обладать морфологией, характерной либо
для шероховатой, либо для гладкой фазовых границ; примером
служит полуметалл висмут с (LlkT$) = 2,4: его кристаллы могут
расти и в форме дендритов, и с хорошо сформированными гра-
нями. Примером вещества третьей категории (с большой энтро-
пией плавления) служит салол (LlkT$= 7); фронт кристаллиза-
ции этого вещества сильно анизотропен и покрыт гранями, при-
чем перепад температур на фронте может достигать нескольких
градусов.
Обзоры Джексона и др. Джексон и др. [192, 193] составили
недавно обзор существующих теорий поверхностной кинетики
при росте кристаллов из расплава, тщательно проанализировав
экспериментальные результаты в данной области. Ниже кратко
излагается содержание этих обзоров.
1. Теория шероховатой фазовой границы, или теория нор-
мального роста. Эта теория, впервые предложенная Вильсоном
[194] и развитая в дальнейшем Джексоном и Чалмерсом [195],
предполагает, что процессы плавления или затвердевания про-
исходят одновременно и независимо и что рост или плавление
могут происходить в любой точке кристаллической поверхности.
Предполагается также, что процессы плавления и затвердевания
относятся к разряду активационных, причем разность их энер-
гий активации и есть скрытая теплота плавления. Та_ким обра-
зом, общая скорость продвижения фазовой границы R при тем-
пературе Т определяется разностью скоростей затвердевания /?3
и плавления /?Пл; следовательно,
R = R3 - Япл = R°3e-Q^T - R°B„e-Q^kr. (19.1)
Разность соответствующих энергий активации Q3 и (?Пл состав-
ляет скрытую теплоту плавления, отнесенную к одной моле-
куле, т. е.
<Эпл-<Эз = £. (19.2)
При температуре равновесия Те получим R пл Ir°3 = eLlkTe, Обозна-
чая ДГ = Те—Т и полагая L8T/kTTe <С 1, находим
R = R°3e-Q*/kT-^. (19.3)
Q
т. е. линейный закон роста. Если переходы атомов через фазовую
границу описываются так же, как и диффузионное перемещение
в объеме, то Q3 — энергия активации для таких переходов и
я» av4, где а — длина скачка, a v4—частота атомных колебаний.
468
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Отсюда av4 exp (—Qa/kT) = DJa, где Di — коэффициент диффу-
зии для перехода через фазовую границу; теперь выражение
(19.3) принимает форму, предложенную Хиллигом и Тернбал-
лом [196]:
я-т-гт57'. <19-4>
где AS = L)Te.
2. Рост по механизму винтовых дислокаций. Хиллиг и Терн-
балл [196] отметили, что формулу (19.4) необходимо умножить
на ант <. 1, если не все узлы кристаллической поверхности спо-
собны к росту. В случае механизма винтовых дислокаций а пред-
ставляет собой долю поверхностных узлов на ступенях архиме-
довой спирали, образующейся при выходе винтовой дислокации
на поверхность. Если предположить, что расстояние между изло-
мами на ступени невелико (т. е. сравнимо с межатомным рас-
стоянием а) и что к ступени присоединяются только атомы, от-
стоящие от нее не более чем на а, то ант = а/4лркр, т, где
4лркр, т есть расстояние между ступенями. Поскольку
Ркр. т= дзагд (19.5)
где ye, sb — краевая свободная энергия на поверхность единичной
площади, a Q— объем молекулы, постольку
_ aASdT .
а№ 4луеrSLa ’
теперь воспользовавшись соотношением (19.4), получим
(19.6)
4nQkTKsL
т. е. квадратичный закон роста [196].
5. Рост по механизму двумерного зарождения. Формула для
скорости роста кристаллов из расплава по механизму двумер-
ного зарождения имеет следующий общий вид [105,193,197,198]:
R = Kxe~KilTbT (19.7)
Разные теории дают разные выражения для параметров Ki и Кг,
однако принято считать, что множитель 1/бГ в показателе экспо-
йенты перекрывает все иные температурные зависимости.
4. Скорость роста кристаллов в модели размытой фазовой
границы [198, 199]. По этой модели при малых движущих силах
AGy = —LdT/QTe фазовая граница расплав — кристалл переме-
щается послойным механизмом путем последовательного отло-
жения слоев при движении ступеней, а при больших движущих
силах — непрерывным образом; между этими предельными слу-
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 469
чаями существует промежуточный режим. Как показано на
фиг. 28, где дТ* = (QTe/L) (yg/a), переходы между указанными
тремя областями соответствуют движущим силам yg/a и n(yg/a).
Параметр g есть мера размытости границы, приблизительно
равная единице для резкой границы и убывающая для размы-
тых границ с увеличением числа атомных слоев п в пере-
ходной зоне от расплава к кристаллу при температуре плавле-
ния; у — межфазная свободная энергия. Значение g для кон-
кретных веществ теория, однако, предсказать не в состоянии;
Фиг. 28. Переход от послойного роста (классический режим) к непрерыв-
ному при кристаллизации из расплава по теории Кана диффузных (размы-
тых) фазовых границ [198].
Я — скорость роста; 6Г—переохлаждение на фронте кристаллизации; Л/Ло—поправочный
множитель, учитывающий температурную зависимость вязкости расплава.
его можно узнать лишь сравнением теоретических кривых с экс-
периментальными.
5. Оценка экспериментальных данных и сравнение их с тео-
рией. Джексон и др. [192,193] провели на ряде материалов тща-
тельное исследование кинетики роста из расплава. Они отме-
тили, что имеется мало сколько-нибудь существенных и надеж-
ных данных по кинетике процесса и что теплоперенос часто мо-
жет препятствовать правильному определению переохлаждения
на фронте кристаллизации. И на самом деле, как отметил Терн-
балл [200], теплопотоки (если их не учитывают) могут создать
искаженное представление о согласии теории с экспериментом.
Подчеркнем, что ЪТ( = Те—Т) есть переохлаждение на фронте
кристаллизации, а не переохлаждение АТ по отношению к объ-
ему расплава: приращение АТ либо равно, либо (если теплопо-
токи существенны) превосходит 6Т. Чтобы обойти трудности,
связанные с теплопотоками, можно либо проводить экспери-
470
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
менты в капиллярных трубках при подходящих условиях [105]
(см., однако, обсуждение опытов Таммана с капиллярами в
гл. III и работы Берлада [103,104], а также Кирстисинга [106],
который показал, что трубки сами по себе сильно влияют на
скорости роста), либо воспользоваться методом тепловых волн
[201], либо же, наконец, исследовать материалы с низкой теку-
честью (характеризующиеся малой скоростью роста при высо-
ких переохлаждениях).
Джексон и др. пришли к выводу, что для металлов отсут-
ствуют данные, которые можно было бы надежно интерпретиро-
вать, что объясняется частично трудностями с устранением теп-
попотоков и частично неопределенностями, характерными для
метода тепловых волн. При кристаллизации воды теплопотоки
могут быть лимитирующим фактором на всех стадиях роста,
если речь идет о росте в направлениях, параллельных базисной
плоскости льда; что же касается роста по нормали к ней (вдоль
оси г), то оказалось, что для 6Т от 0,03 до 0,07°C справедлив
экспоненциальный закон, тогда как в интервале 0,07—0,3 °C со-
блюдается квадратичный [приблизительная пропорциональность
(67)2]. В случае органических соединений неопределенность в от-
ношении вязкости расплава усугубляет сомнения при интерпре-
тации большинства данных. Для три-а-нафтилбензола был по-
лучен экспоненциальный закон с показателем (—1/767). Для
салола и глицерина (оба эти вещества исследованы с особой
тщательностью) значительный разброс результатов по скоро-
стям роста обусловлен, по-видимому, примесями и прочими
эффектами. Для двух неорганических веществ — бисиликата нат-
рия и бисиликата калия — получены линейные законы для зави-
симости «приведенной» скорости роста от переохлаждения. [Тер-
мин «приведенная» в данном случае означает, что учитывалась,
температурная зависимость вязкости и что построение прово-
дили по строгой формуле (19.1) без предположения
(L67/fe77e)< 1.]
Джексон и др. отметили также, что перехода от послойного
механизма роста к нормальному в том виде, как его предсказы-
вает теория Кана [199] или ее модификация [193], фактически не
наблюдается. При этом, однако, они указали, что коэффициент
при (б7)2 в формуле (19.6) для материалов, подчиняющихся
квадратичному закону, с теорией не согласуется; то же самое
относится и к коэффициентам и Къ в формуле (19.7).
Результаты новейших исследований. Алфинцев и Овсиенко [197]
измеряли зависимость скорости роста кристаллов Ga и Bi от пе-
реохлаждения на фронте кристаллизации. Для_недеформирован-
ных кристаллов Ga с ориентациями (001) и (111) наблюдались
кинетические законы типа (19.7): R = 70 ехр (—3900/767) м/с
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 471
для (001) и Л = 54 600 ехр(—11 000/TST) м/с для (111). Для
грани (_1Н) деформированного Ga наблюдался закон типа
(19.6): R = 4,2-10"3(ST)2 м/с, как того и следовало ожидать, по-
скольку при деформировании должны были образоваться дисло-
кации. Для Bi наблюдался закон типа (19.6). Для обоих ве-
ществ коэффициенты параболического закона по порядку вели-
чины совпадали с предсказанными формулой (19.6). И для Ga,
и для Bi наблюдался резко ограненный фронт кристаллизации.
Проводилось сравнение с теорией Кана [199], причем расчет
толщины фазовой границы дал значение, близкоё к двум атом-
ным слоям.
Джеймс [202] методом тепловых волн исследовал кинетику
поверхностных процессов при росте кристаллов льда по нормали
к базисной грани. При переохлаждениях от 0 до 2-10"3 С (суще-
ственно более низких, чем в предыдущих исследованиях) ско-
рость роста подчинялась закону R = (1 ± 0,5) • 10_1бТ1’3±0>2; та-
кая зависимость, по-видимому, не согласуется ни с линейным за-
коном, характерным для механизма винтовых дислокаций, ни
с квадратичным для двумерного зарождения.
20. КИНЕМАТИЧЕСКАЯ ТЕОРИЯ РОСТА КРИСТАЛЛОВ
Кинематические волны. Франк [203], а также Кабрера и Вер-
мили [204] предложили более общий подход при анализе движе-
ния ступеней на поверхности кристалла; при этом они восполь-
зовались более ранней теоретической работой Лайтхилла и Уайт-
хэма [205], посвященной проблемам движения транспорта по
загруженным магистралям и наводнений в реках.
Пусть на кристаллической поверхности у(х) имеются ступени
равной высоты h. Число ступеней в некоторой точке на единицу
длины в направлении х обозначим через/?, назвав его плотностью
ступеней. Обозначим через q поток ступеней, определив его как
их число, проходящее через данную точку за единицу времени.
Тогда наклон ду]дх запишется в виде
^ = -hk, (20.1)
а скорость роста в направлении у как
^t=hq- (20.2)
Основное предположение теории состоит в том, что поток ступе-
ней зависит только от их плотности, т. е.
q = q(k\ (20.3)
То, что поток и на самом деле будет зависеть от расстояния
между ступенями, т. е. от плотности (равно как и от других
472
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
параметров), очевидно; ступени, сильно удаленные друг от
друга, будут развивать максимальную скорость; по мере сбли-
жения ступеней их диффузионные поля перекрываются и движе-
ние будет замедляться, как это и наблюдается при росте по
спиральному механизму. Продифференцировав наклон (20.1)
по t, а скорость роста (20.2) по х, получим с учетом условия
непрерывности (в данном случае закона сохранения числа сту-
пеней), что
4?+# = »- (20.4)
Определив скорость кинематической волны как c{k) = dqjdky
найдем из соотношения (20.4) следующее нелинейное дифферен-
циальное уравнение:
+ # = (20.5)
Из уравнения (20.5) следует, что в плоскости xt вдоль линии
с наклоном dxjdt = c(k) = dq/dk плотность ступеней k (и, сле-
довательно, q) постоянна. Такая линия называется характери-
стикой. Кинематическая волна — это участок кристаллической
поверхности с постоянной плотностью ступеней k (и постоянным
потоком q), который перемещается со скоростью c(k) = dx/dt.
Состав волнового пакета со временем меняется: одни ступени
заменяются другими, поскольку волновая скорость с = dqldk
необязательно совпадает со скоростью ступеней v = qIk. Термин
«кинематический» здесь используют потому, что фундаменталь-
ное уравнение (20.4) не учитывает никаких «динамических» фак-
торов (например, законов механики, движущих сил, диффузион-
ных полей).
Профили кристаллической поверхности. Франк [203] дока-
зал две теоремы, связывающие кинематическую теорию с про-
филями кристаллической поверхности при росте или растворе-
нии.
Первая теорема заключается в следующем: точки данной
ориентации на некоторой кристаллической поверхности движутся
в пространстве по прямолинейной траектории, так что dyldx =
==. ду/дх + (dy/dt) (dt/dx)-, тогда из соотношений (20.1) и (20.2)
следует, что
Эта величина вдоль характеристики dxldt постоянна, поскольку
постоянны k и q. Соотношение у = y(x,t) определяет некоторую
поверхность, составленную из характеристик, которые имеют
прямолинейные проекции как на плоскость xt, так и на плос-
V. СТРУКТУРА ПОВЕРХНОСТЕЙ РАЗДЕЛА И ПОВЕРХНОСТНАЯ КИНЕТИКА 473
кость ху\ следовательно, характеристики, лежащие на поверхно-
сти //(%,/), прямолинейны.
Вторая теорема гласит следующее: если построить полярную
диаграмму обратных скоростей роста, измеренных по нормали
к поверхности кристалла, то прямолинейная траектория некото-
рой точки данной ориентации на указанной поверхности будет
параллельна нормали к полярной диаграмме в точке этой ори-
ентации. На фиг. 29 [144] иллюстрируется развитие кристалличе-
ской формы во времени; видно, что некоторые ориентации посте-
пенно исчезают. Франк и Айвес [206] изучали растворение Ge, а
Фиг. 29. Профиль кристаллической поверхности по данным кинематиче
ской теории [144].
а —изменение q~^ (q— поток ступеней) в зависимости от ориентации для кубического
кристалла (схема); б —профили поверхности.
Айвес [207] растворение LiF; как оказалось, ход растворения
согласуется с обеими теоремами Франка.
Ударные волны. На фиг. 30 [203] приведена типичная кривая
для показано также, что же именно происходит с эшело-
ном ступеней в случае такой зависимости q(k). Из соотношения
с = (dx/dt) = (dq/dk) следует, что при малых k величина dq/dk
у характеристик больше, благодаря чему их наклон в коорди-
натах t — x меньше (фиг. 30); следовательно, характеристики в
левой (хвостовой) части эшелона сходятся и, как показано на
фиг. 30, плотность k ступеней претерпевает разрыв. По Франку
такой разрыв можно уподобить ударной волне в термодинамике;
как можно показать, он движется со скоростью с = (?2 —?i)/
/(&2 — &i), где параметры q и k характеризуют участки на про-
филе поверхности, непосредственно прилежащие к точке раз-
рыва по обе стороны от нее (фиг. 30). Как отметил Франк, что-
бы ведущий край эшелона был резким (что желательно при со-
здании ямок травления), производная (d2qld№) должна быть
положительной величиной (это случай, обратный изображенному
474
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
на фиг. 30). Франк предположил, что такой эффект вызывается
примесями (см. гл. VII).
Чернов [17] продолжил исследования ударных волн; в част-
ности, он разработал теорию их трансформации во времени;
были получены выражения для интервалов времени, необходи-
Фиг. 30. Трансформация эшело-
на ступеней по данным кинема-
тической теории [203].
Показаны кривая зависимости q (fe),
характеристика x — t, распределение
плотности ступеней fe (х, t) и разви-
вающиеся профили поверхности с угловой
точкой на хвостовой части профиля.
мых для развития и исчезновения
ударных волн.
Некоторые новейшие разра-
ботки кинематической теории.
1. Маллинз и Хирс [208] разрабо-
тали детальную микроскопиче-
скую кинематическую теорию,
выписав в явном виде систему
дифференциальных уравнений,
каждое из которых соответствует
движению одной ступени. Оказа-
лось, что эта теория согласуется
с франковской «непрерывной» те-
орией, где q рассматривается как
непрерывная функция k. Получе-
ны некоторые новые выводы от-
носительно поведения конечных
эшелонов ступеней, хвостовая
часть которых, как оказалось,
разбивается на эшелон с двойны-
ми ступенями.
2. Бартини и др. [209] экспери-
ментально исследовали оптиче-
скими методами профиль поверх-
ности кристаллов р-метилнафта-
лина при их росте из спиртовых растворов; утверждается, что
методика обладает чувствительностью 38 А (около двух перио-
дов решетки данного вещества). Профили кинематических волн
наблюдались непосредственно. Эти профили имели гладкий
округленный ведущий край и острую угловую точку на хвосто-
вой части, как показано на фиг. 30; это качественно согласуется
с теорией Франка.
Кроме того, наблюдался новый вид кинематических волн,
прямо противоположный только что рассмотренному: скорость
отдельных ступеней увеличивалась по мере их сближения
(d2qldk2 есть положительная величина). Чернов и Будуров [210]
интерпретировали их как «диффузионно-кинематические волны»,
которые прямо обусловлены наличием диффузии в окружающей
среде.
VI
МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ
21. ВВЕДЕНИЕ
Основная задача теории морфологической устойчивости со-
стоит в том, чтобы выяснить, устойчива ли данная конкретная
форма кристалла, растущего из расплава, раствора или пара,
по отношению к малым искажениям. Теоретический анализ
устойчивости проводится по следующей схеме: предполагается,
что форма кристалла слегка искажена, и выясняется, усили-
вается это искажение или же сходит на нет.
Это иная задача, чем задача о сохранении формы роста, цель
которой сводится к тому, чтобы выяснить, сохраняется ли в про-
цессе роста форма кристалла и соответствующие уравнения. Как
было показано в гл. III, посвященной анализу задач Стефана,
сохранение формы в процессе кристаллизации просто означает,
что кристалл данной формы увеличивается в размере без изме-
нения геометрии, а распределение температуры и концентрации
около него удовлетворяет в процессе всего роста одним и тем же
уравнениям переноса и граничным условиям.
В своей классической работе Маллинз и Секерка [211] ввели
в теорию роста кристаллов понятие о количественной оценке
устойчивости формы роста. До появления этой статьи считалось,
что общий вид формы, сохраняющейся при росте, — это иссле-
дованный Хэмом [68, 69] эллипсоид, хотя устойчивость такого
эллипсоида не была изучена. Необходимость исследования ус-
тойчивости вызвана тем, что кристаллы часто растут в виде
дендритов. Дендриты, или древовидные кристаллы, состоящие
из центрального ствола, первичных, вторичных и т. д. ветвей,—
частое явление как в природе, так и в лабораторных исследо-
ваниях. Рост дендритов служит ярким примером неустойчивости
эллипсоидальной и полиэдрической форм роста, проявляющейся
при определенных условиях.
Аналогичный анализ устойчивости проводится в гидродина-
мике (см., например, монографии Ландау и Лифшица [212], Чан-
драсекара [213], Лина [214], Доннели и др. [215], Стюарта [216]).
Чтобы установить момент перехода от ламинарного течения к
турбулентному, к известной стационарной скорости потока
добавляют малую нестационарную скорость и затем, рассма-
тривая линеаризованное дифференциальное уравнение, которому
476
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
подчиняется эта добавка, выясняют, увеличивается она со вре-
менем или же убывает. Примером задачи о неустойчивости ско-
рости течения может служить задача, решенная Боллом [217],
который исследовал перенос вещества через границу газ — жид-
кость с учетом как потока жидкости, так и диффузионного
переноса вещества. Оба эти процесса, а именно диффузия и кон-
векция, принимались во внимание и в классической задаче Бе-
кара (см., например, монографию Чандрасекара [213]; см. также
гл. VIII), посвященной исследованию устойчивости течения на-
греваемой снизу жидкости.
22. ЗАДАЧА О МОРФОЛОГИЧЕСКОЙ УСТОЙЧИВОСТИ
В ЧИСТОМ ВИДЕ; РАЗЛИЧНЫЕ ФОРМЫ РОСТА
Шар. Ради удобства дальнейшего изложения повторим здесь
приведенное в гл. III доказательство того, что вместо точного
уравнения диффузии, учитывающего зависимость от времени,
можно взять уравнение Лапласа. Точное уравнение диффузии
для шара имеет вид
dC^i} = DVC, (22.1)
где C(r,t) есть концентрация, a D — коэффициент диффузии.
При этом должны выполняться следующие граничные условия:
<^(00,0 = ^ (22.2)
и
С (R, t) = C0. (22.3)
Здесь предполагается, что концентрация на поверхности шара
радиуса R равна равновесной концентрации Со. Скорость кри-
сталлизации находится из условия непрерывности потока
= (22.4)
где Ст — концентрация растворенного вещества в выделяющейся
фазе (плотность кристалла). Как было показано в гл. III и как
можно проверить подстановкой, решение задачи (22.1) — (22.4)
имеет вид
Г(г а г - (С° ~ ехр “ X5lt'/2 erfc
( , ) 00 ~ exp (-%2)-%5^ erfc %-
(22.5)
где
/? = 2X5(D/),/s (22.6)
И
2Ц[1 -n1^5exp(Aj)erfc(X5)] = S = (C0O-C0)/(Cr-C0). (22.7)
VI. МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ
477
х
[^Здесь erf с х = 1 — erf х; erf (х) = (2/л'1г) J ехр ( — и2) du;
о
d (erfz)/dz = + 2n-l/ierf (—z2).j Величина S есть мера движущей
силы кристаллизации. При S < 1 (движущая сила мала) из вы-
ражения (22.7) следует, что Х35 < 1, так что (22.7) преобразуется
к виду
Х5-(4)'/а. (22.8)
Следовательно, если (Хъг/R) «С 1, то выражение (22.5) прини-
мает следующий вид:
С-См = (С0 — Ст)-~-. (22.9)
Теперь распределение концентраций (22.9) удовлетворяет как
уравнению Лапласа \РС = 0, так и условиям (22.2) и (22.3). Та-
ким образом, пока S < 1, поле концентраций и градиент кон-
центрации на поверхности растущего шара, определяемые урав-
нением Лапласа, совпадают с решением точного уравнения
(22.1), учитывающего зависимость от времени. К тому же у по-
верхности шара удовлетворяется условие (Xsr//?)<C 1.
Итак, чтобы исследовать возмущения на сферической поверх-
ности кристалла, следует предположить, что при небольших воз-
мущениях поле концентраций около искаженной сферы все-таки
верно описывается уравнением Лапласа. На поверхности шара,
однако, должно выполняться граничное условие Гиббса — Том-
сона; кроме того, С — Сх при г = оо и = (S/2)'\
Пусть на сферическую поверхность радиусом R наложено ма-
лое возмущение с амплитудой б. В сферических координатах г,
0 и ф это запишется в виде
/•(0, Ф) = /?-|-бУ,,„(0,ф). (22.10)
Здесь (б//?) < 1, а У/,п— сферические функции, т. е.
АУ/т s (sin 0 diy) + -^20- -д^-] Yim = — l(l+l) Ytm.
(22.10')
Согласно условию Гиббса — Томсона, равновесная концентрация
Со, s (локальное равновесие) на искаженной поверхности выра-
жается формулой
Со, де, <p) = C04-C0rD/<', (22.11)
где Со — равновесная концентрация у плоской поверхности
раздела фаз, Гр( = yQ'/^gZ’) — коэффициент поверхностного
478
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
натяжения, К' — кривизна поверхности, у — свободная поверхно-
стная энергия, Q'— молярный объем кристалла, Rg — газовая
постоянная.
Можно показать [211], что кривизна слабо искаженной сферы
описывается следующим выражением:
^(0,Ф) = |[1 (22.12)
Из соотношений (22.10'), (22.11) и (22.12) получим для равно-
весной концентрации на поверхности искаженной сферы следую-
щее выражение:
Co,s(e, ф)=с0[1 +^ + (/ + 2)(/-П-Ц^-
(22.13)
Теперь необходимо найти решение уравнения Лапласа, сводя-
щееся к выражению (22.13) на поверхности вида (22.10) и при-
нимающее значение Сот при г = оо; такое решение имеет вид
С (г, 0, ф) = А + *1^. + Сте> (22.14)
где А3 и Вз суть постоянные. Это решение дает при г—»оо;
в силу соотношения (22.10') оно удовлетворяет уравнению Лап-
ласа
T’f'dr [г2~дг] + «Г (sin 0эо) С== 0 (22.14')
и равно равновесной концентрации (22.13) на поверхности
(22.10) при условии, что
Лз = /?(с0 + -^^-Соо) (22.15а)
И
В3 = Rl+1 [4 (С0 + - cj + Со (/+2) (1-1) Ь-]. (22.156)
Значения А3 и В3 находят приравниванием коэффициентов при
одинаковых Yim и членов, не содержащих Yim, в выражениях
(22.13) и (22.14). Таким образом,
(Сп-С )Д + 2СПГП
С (г, 0, ф) = См + -5-2-+
{(c0-coe)/?4c0rD/?!-1/(/+ 1)} &у1т
“Г fi+i •
Чтобы рассчитать скорость нарастания возмущения, найдем про-
изводную по времени от функции (22.10) и возьмем следующий
аналог условия непрерывности (22.4), справедливый при малых
VI. МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ
479
возмущениях:
dr dR . df> Y — D дС I
V==4i=~di + ~dtlm CT-CQiS dr |возм.пов
(22.17)
Тогда скорость нарастания возмущения выразится следующим
образом:
Г С — С С Г
+ [(/ - I) -----------------[I (/ + I)2 - 4]J 6Ylm], (22.18)
где СОд {= Coif 1 + (2Гд//?]} есть равновесная концентрация по
Гиббсу — Томсону на поверхности невозмущенной сферы. При-
равнивая коэффициенты при одинаковых Yim в выражениях
(22.17) и (22.18), получаем скорость изменения амплитуды 1-й
гармоники возмущения в виде [211]
D н _ 1) г С Г
6 (0 = -(С -с \R~ - -R^- U +0(Z + 2) Sz. (22.19)
Здесь Сконц[= (Coo — Co,r)/R] есть градиент концентрации на не-
возмущенной сферической поверхности. Положительный член в
правой части выражения (22.19), пропорциональный градиенту,
благоприятствует росту амплитуды /-й гармоники, а отрицатель-
ный член, пропорциональный поверхностной энергии, способ-
ствует убыванию ее амплитуды. Амплитуды всех гармоник, для
которых выражение в квадратных скобках положительно, воз-
растают; номера этих гармоник удовлетворяют неравенству:
(/+ 1) (/+ 2) + 2 <-р-~— (Сх- Со). (22.20)
D
Все гармоники более высокого порядка (с меньшей длиной вол-
ны) должны затухать. Данному значению I соответствует опре-
деленный радиус сферы /?Кр(/)> по достижении которого Z-я гар-
моника становится устойчивой (т. е. сфера теряет устойчивость).
Согласно (22.20), такой радиус удовлетворяет соотношению
RKp (0 = [-(/ +1)2(z + 2) + I ] /?‘ш> (22.21)
в котором /?ш{ = 2Г/)/[(Соо — Со)/Со]} есть радиус шарообразного
критического зародыша, рассчитанный на основе теории зарож-
дения [см. гКр в уравнении (14.3)]. Наименьшая длина радиуса,
до достижения которой ни одна гармоника не развивается, соот-
ветствует номеру / = 2. Когда радиус такого зародыша только
что превзошел то амплитуда второй (/ = 2) гармоники начи-
нает возрастать. Этот радиус /?кр (2) = так что при 10%-ном
480
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
пересыщении /?Кр(2)~ 10-6 (при типичном значении Гр =
= 10'7 см). Заметим, что искажение с Z = 1 просто увеличивает
радиус сферы.
Таким образом, шар микронных размеров, растущий в поле
диффузии, обычно неустойчив, если стабилизирующее действие
оказывает только поверхностная энергия.
Этот весьма важный результат [211] позволяет со всей опре-
деленностью сделать тот вывод, что, по-видимому, все ранее (в
гл. III) рассмотренные формы, сохраняющиеся при росте, в дей-
ствительности неустойчивы. Таким образом, весь вопрос о мор-
фологии кристаллов, например как образуются кристаллы с
большими плоскими гранями, остается открытым. Полученный
результат применим также к росту шара из переохлажденного
расплава (затвердевание), поскольку, как показали Маллинз и
Секерка [211], задачи о переносе тепла и вещества формально
эквивалентны. Интересно отметить, что при растворении или
плавлении шарообразная форма устойчива, так как градиент
концентрации бКОнц меняет знак и правая часть равенства (22.19)
всегда отрицательна.
Цилиндр. Кориелл и Паркер [109] распространили вывод
Маллинза и Секерки для сферы на рост цилиндра. Это, по-види-
мому, следующий по простоте случай. К тому же ряд кристал-
лов имеет форму, близкую к цилиндрической (ветви дендри-
тов, нитевидные кристаллы). Эти авторы рассмотрели искаже-
ния формы цилиндра как в поперечном сечении, так и вдоль его
образующей. Возмущенное сечение описывалось формулой г —
= 7? + где k — положительное целое число. Оказалось, что
цилиндр, как и шар, устойчив по отношению к искажениям та-
кого вида, пока его радиус меньше критического радиуса /?Кр, и
неустойчив, когда его радиус превосходит /?Кр- Однако в данном
случае отношение критического радиуса устойчивости цилиндра
к радиусу критического зародыша не равно семи; критический
радиус для гармоники с номером k = 2 удовлетворяет теперь
соотношению
₽КР(2) = [1 + 6А]/ГЦ, (22.22)
в котором Лл. = — */2 In (v2X2), М — константа роста, In v2 =
= 0,5772 (постоянная Эйлера).
Таким образом, отношение 7?Кр/7?ц зависит в отличие от слу-
чая шара от относительного пересыщения на бесконечности S,
так как при S <С 1 справедливо равенство (0,577 + In Л,2) =— S
[см. рассуждения после вывода выражения (9.42)]. Заметим, что
критический радиус двумерного зародыша /?ц равен по опреде-
лению Го/[(Соо — Со)/Со]. Если рассматривать одновременно воз-
мущения сечения цилиндра (цилиндр с продольными желоб-
VL МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ
481
Фиг. 31. Зависимость критического
радиуса /?кр цилиндрического кри-
сталла, растущего в поле диффузии,
от волнового числа kz (согласно
теории морфологической устойчи-
вости) [109].
Цилиндр с радиусом больше /?кр неустой-
чив по отношению к искажениям поверх-
ности с волновым числом k-
ками) и искажения образующей г вида exp [i(kz/R)z], где kz —
действительное положительное, но не обязательно целое число
(песочные часы), то задача заметно усложняется. На фиг. 31
приведены данные об измене-
нии отношения /?кР//?ц в зави-
симости от kz для разных зна-
чений k\ во всех случаях Ах-
= 4 (т. е. S« 0,0015). Ци-
линдр неустойчив по отноше-
нию к искажению конкретного
вида (k,kz), если его приве-
денный радиус равен или
превосходит отношение 7?кр//?ц,
приведенное на графике. В ча-
стном случае только продоль-
ных искажений (песочные ча-
сы) с большой длиной волны
(0,6 kz 1) цилиндричес-
кая поверхность всегда неус-
тойчива, потому что такое ис-
кажение уменьшает отношение
площади поверхности цилинд-
ра к его объему. При kz < 0,6
член, отражающий влияние
диффузии, меняет знак, так что
поле диффузии оказывает ста-
билизирующее действие. В
этом необычном случае об-
ласть устойчивости цилиндра
расположена выше кривой /?Кр
(штриховая кривая на фиг. 31),
а область неустойчивости ни-
же этой кривой.
Направленная кристаллиза-
ция сплава. Маллинз и Секер-
ка [218], Секерка [219] и Во-
ронков [220] исследовали ус-
тойчивость плоской поверхности раздела кристалл — расплав при
кристаллизации разбавленного сплава таким же методом, каки
Маллинз с Секеркой [211]. Предполагалось, что в движущейся
системе координат, связанной с фронтом кристаллизации (ско-
рость кристаллизации постоянна и равна у), соблюдаются ста-
ционарные уравнения диффузии и теплопроводности. Градиент
температуры в расплаве направлен к поверхности кристалла
(температура расплава тем выше, чем дальше от поверхности
482
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
кристалла мы находимся). Как и прежде, предполагается, что на
поверхности раздела фаз выполняется условие локального рав-
новесия, однако теперь учитывается зависимость температуры
поверхности от содержания примеси около нее. Выяснилось, что
рост или подавление возмущений формы плоского фронта опре-
деляется действием трех факторов. Поверхностная энергия, каки
прежде, оказывает стабилизирующее действие и сглаживает воз-
мущения. Градиент температуры около выступа или впадины
также приводит к их исчезновению, потому что в данном случае
в отличие от уже рассмотренных случаев кристаллизации шара
и цилиндра температура расплава повышается с удалением от
поверхности кристалла. Напротив, градиент концентрации рас-
творенного вещества с коэффициентом распределения kQ, возни-
кающий из-за оттеснения примеси фронтом кристаллизации (см.
гл. VIII), способствует дальнейшему нарастанию возмущений.
Если не учитывать влияния поверхностной энергии, которое мо-
жет быть мало по сравнению с влиянием градиента темпера-
туры, то условие устойчивости поверхности раздела фаз можно
записать так:
поверхность устойчива, если
~^(g' + g) + m'Gc<0-,
(22.23)
поверхность неустойчива, если 4
- 7 (S' + g) + m'Gc > 0.
Здесь g' = (Ks/K) Gts\ g = (Kl/K) GtL\ Gts и GtL — градиент тем-
пературы в_ кристалле и в расплаве; Ks, Kl — температуропро-
водности; К= 72(/<s + ^l); Gc — градиент концентрации в рас-
плаве около неискаженной поверхности кристалла, Gc =
= (CooV/D)[{l — kQ)/kQ]\ Соо — концентрация примеси в объеме
расплава; kQ — равновесный коэффициент распределения; v —
скорость кристаллизации; т' — наклон линии ликвидуса на диа-
грамме состояния. Условие (22.23) аналогично, но не идентично
предложенному Тиллером и др. [221] критерию концентрацион-
ного переохлаждения (КП):
поверхность устойчива, если
— GfL + m'Gc < 0’>
(22.24)
поверхность неустойчива, если v
— GfL + tn'Gc > 0.
Смысл критерия КП понятен из фиг. 32: истинная температура
в расплаве, изображенная сплошной линией, может быть меньше
температуры ликвидуса из-за накопления примеси перед фрон-
VI. МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ
483
том роста. В результате там формируется область концентраци-
онного переохлаждения (заштрихована). Условие (22.24) есть
условие равенства двух наклонов на поверхности раздела фаз1).
Как уже говорилось, критерий КП подтвержден экспериментами
Уолтона и др. [222], а также Тиллера и Раттера [223] (см. [80]).
Условие (22.23) отличается от критерия (22.24) тем, что оно со-
держит градиент температуры в кристалле, который связан с по-
током в расплаве через скрытую теплоту плавления L и скорость
перемещения фронта роста v. Таким образом, плоский фронт
может быть неустойчивым в отсутствие КП и устойчивым при
наличии КП.
Фиг. 32. Схема возникновения концентрационного переохлаждения перед
плоским фронтом кристаллизации [80].
В заштрихованной области истинная температура ниже температуры ликвидуса.
Если учесть влияние поверхностной энергии, то критерий устой-
чивости сильно усложняется [218,219]. В предельном случае, от-
вечающем большим скоростям роста, стабилизирующее влияние
поверхностного натяжения превосходит возмущающее действие
примеси.
В независимом исследовании данной задачи Воронков [220]
пришел к тем же выводам [к уравнению (22.23)], что и Маллинз
с Секеркой [218].
Темкин [224, 225] исследовал скорость увеличения полусфери-
ческого выступа на плоском фронте кристаллизации разбавлен-
ного бинарного сплава. Но, как показали Маллинз и Секерка
[218], исследование поведения выступа специфической формы
еще не позволяет сформулировать критерий устойчивости пло-
ского фронта роста по отношению к произвольному возмущению.
23. ИССЛЕДОВАНИЕ УСТОЙЧИВОСТИ
С УЧЕТОМ ДОПОЛНИТЕЛЬНЫХ ФАКТОРОВ
Поверхностная диффузия. Кориелл и Паркер [226] исследо-
вали влияние поверхностной диффузии* на устойчивость цилиндра
*) Наклоны прямых АВ и AV на фиг. 32. — Прим, ред.
484
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
и шара при росте из пересыщенного раствора или из пересы-
щенного пара в присутствии инертного газа. Влияние поверх-
ностной диффузии на устойчивость шара рассмотрели Николз и
Маллинз [227], а на устойчивость плоского фронта кристаллиза-
ции— Шьюмон [228]. Как оказалось, поверхностная диффузия
способствует устойчивости этих форм роста. Дело в том, что
благодаря эффекту Гиббса — Томсона равновесная концентра-
ция над поверхностью с большой кривизной превышает равно-
весную концентрацию над плоской поверхностью, так что вдоль
поверхности кристалла возникает градиент концентрации, благо-
даря которому при наличии поверхностной диффузии вещество
переносится от выступа к плоскому участку. В итоге выступ
утрачивает устойчивость, а исходная форма роста становится
более устойчивой.
Чтобы решить задачу о поведении возмущения вида
exp(rfecp), наложенного на поверхность кругового цилиндра
(с образованием в результате гофрированной колонны), нужно
просто к прежнему члену [109], характеризующему обусловлен-
ный объемной диффузией поток, алгебраически прибавить поток
вещества, связанный с диффузией по поверхности. Тогда
/?кР(*) __ 1 J
Яц 2 1
4Р
* А
R Л
(23.1)
Здесь А'=1Ч-Лх^(Аг+1) и Р= (Сг-С0>л)Й’М№(^4-1)/РС0;
на поверхности цилиндра С0,д = Со + С0Гр/К, где Со — равновес-
ная концентрация кристаллизующегося вещества у плоской
поверхности кристалла; Ds — коэффициент поверхностной диф-
фузии; Q — объем в расчете на одну молекулу (остальные обо-
значения прежние). Ясно, что чем больше отношение DsID, тем
больше критический радиус кривизны возмущения. Согласно чи-
сленной оценке [226], проведенной для роста из пара в присут-
ствии инертного газа, устойчивость поверхности под действием
поверхностной диффузии возрастает в 40 раз, т. е. критический
радиус искажения /?кр(3) возрастает с 1,1-10“6 до ~4,6-10”5 см.
Аналогичные результаты получены при анализе устойчиво-
сти шара [226,227]. Из численного примера, приведенного Ни-
колзом и Маллинзом, следует, что критический радиус искаже-
ния возрастает примерно в 100 раз, а именно с 10“5 до 10“3 см.
Поверхностная кинетика. 1. Устойчивость шара с учетом по-
верхностной кинетики. Кан [229], а также Кориелл и Паркер
[230] исследовали влияние кинетических явлений на поверхности
раздела фаз на устойчивость шара при росте в поле диффузии,
отказавшись тем самым от предположения о существовании ло-
кального равновесия, принимавшегося в предыдущих работах.
VI. МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ
485
Прочие предположения, т. е. предположения об изотропности
свободной поверхностной энергии и о справедливости уравнения
Лапласа (движущие силы кристаллизации малы), остались в
силе. Кориелл и Паркер рассмотрели как линейную, так и ква-
дратичную зависимости скорости роста от пересыщения. Оказа-
лось, что чем медленнее поверхностные процессы, тем устойчивее
форма роста.
Отличие от случая, когда поверхностная кинетика несуще-
ственна, состоит в изменении краевого условия для потока; те-
перь это условие (для роста из расплава) при линейной поверх-
ностной кинетике имеет вид
Здесь v — скорость роста кристалла; Гп.ш — температура поверх-
ности раздела фаз; То — равновесная температура [для искрив-
ленной поверхности согласно уравнению (10.7)]; К— линейный
кинетический коэффициент; Ks и Kl— температуропроводности;
и TL(r, 0,ф)—соответственно температуры в кристал-
ле и расплаве, сложным образом зависящие от К. Далее Ко-
риелл и Паркер [230] пользовались критерием относительной
устойчивости
6/д =1
R/R
(23.3)
из которого находится величина радиуса кристалла Rr, при кото-
ром возмущение растет с той же скоростью, что и сам кристалл;
при больших значениях радиуса возмущение растет быстрее.
[Критерий абсолютной устойчивости, сводящийся к равенству
правой части (23.3) нулю, определяет условия, когда возмуще-
ние вообще не усиливается.] Оказывается, что минимальное зна-
чение Rr(l) отвечает значению I = 3; действительно, возмущение
сферы с / = 1 означает просто увеличение ее радиуса; возмуще-
ние с Z = 2 превращает сферу в эллипсоид, неустойчивый абсо-
лютно, но устойчивый относительно. Эти выводы справедливы
при /<-*оо (бесконечно быстрая поверхностная кинетика).
В предельном случае К ->0 (бесконечно медленная кинетика)
критический радиус минимален при бесконечно большом /, а в
реальном случае (конечное К) — при некотором конечном зна-
чении /. Радиус Rr примерно обратно пропорционален кинетиче-
скому коэффициенту, если последний мал. Близкие к изложен-
ным результаты получены и для квадратичной зависимости ско-
рости роста от переохлаждения.
Численная оценка произведена на примере кристаллизации
салола, кинетические процессы у которого протекают очень мед-
ленно [198]. По теории Кориелла и Паркера [230] шарообразный
486
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
кристалл салола при росте из расплава, переохлажденного на
5° С, должен сохранять форму до тех пор, пока его радиус не
достигнет 0,5 см; без учета же кинетических процессов полу-
чается 10“4 см. Величина 0,5 см согласуется с наблюдаемыми на
опыте размерами устойчивых плоских граней кристаллов салола
(порядка нескольких сантиметров).
Другой любопытный теоретический вывод состоит в том, что
даже при исчезающе малой поверхностной энергии сферический
фронт роста может быть относительно устойчивым, если только
кинетический коэффициент конечен.
Кан [229] провел качественный анализ устойчивости шара
при росте из пересыщенного раствора со скоростью, пропорцио-
нальной пересыщению. Используя уравнения (22.16), (22.17) и
(23.2), переформулированные для роста из раствора, и не учи-
тывая возмущений и влияния кривизны поверхности, Кан пока-
зал, что
dR _ К (£оо Ср) /ПО
dt ~ 1 + (KCTR/D) *
Здесь К — линейный кинетический коэффициент, a D — коэффи-
циент диффузии в маточной среде. Из этого уравнения следует,
что прихмалых значениях радиуса R скорость роста кристалла
лимитируется кинетическими процессами на его поверхности и
выражается формулой R — К(Соо — Со), а при достаточно боль-
ших размерах кристалла (большие значения R) скорость роста
лимитируется диффузией; тогда уравнение (23.4) приобретает
вид R = —D (CQ — Соо)/RCTi т. е. радиус кристалла возрастает
пропорционально /,/2. В первом случае сферическая поверхность
устойчива, так как, с одной стороны, концентрация в растворе
у фронта роста Cs примерно равна Соо и там отсутствуют гради-
енты концентрации, которые приводили бы к возмущающему
действию диффузии. С другой стороны, стабилизирующее влия-
ние поверхностного натяжения сохраняется. Во втором случае,
как уже было показано, сферическая поверхность неустойчива.
Переход от одного закона роста к другому происходит при
RCTR/D 1, так что сфера должна быть устойчивой, пока ее ра-
диус не достигнет значения R ж D/KCT.
2. Устойчивость плоского фронта кристаллизации бинарного
сплава с учетом поверхностной кинетики. Таршис и Тиллер [231],
Зайденстиккер [232] и Джексон [193] исследовали морфологиче-
скую устойчивость плоского фронта кристаллизации сплава при
условии, что градиент температуры на фронте роста направлен
в сторону кристалла. В этих работах, как и в анализе Маллинза
и Секерки [218], учитывается влияние примеси и кривизны по-
верхности (поверхностной энергии); к тому же в них предпола-
гается, что скорость кристаллизации v одинакова по всему
vt. морфологическая устойчивость
48?
фронту и пропорциональна переохлаждению. Найденное реше-
ние удовлетворяет стационарным уравнениям диффузии и тепло-
проводности, уравнению непрерывности потока вещества и гра-
ничному условию, наложенному на температуру поверхности
раздела фаз. Джексон и Зайденстиккер установили, что харак-
тер кинетических явлений на поверхности кристалла не влияет
на область устойчивости, но влияет на спектр Фурье развиваю-
щихся возмущений в области неустойчивости. Таршис и Тиллер,
пользуясь численными методами, выяснили, что характер кине-
тических явлений влияет не только на спектр Фурье возмущенной
формы, но и на область неустойчивости, и даже им определяется
сама возможность возникновения неустойчивости. Столь боль-
шое расхождение выводов может объясняться различием исход-
ных предположений: в двух первых работах [232, 193] градиенты
температур считались постоянными, а Таршис и Тиллер пола-
гали, что эти градиенты меняются при изменении кинетического
коэффициента.
3. Прочие исследования устойчивости с учетом поверхностной
кинетики. Котлер и Тиллер [233] исследовали устойчивость ци-
линдра по отношению к возмущениям как вдоль цилиндра, так
и в поперечном сечении с учетом градиента температуры (кри-
сталлизация из переохлажденного расплава) и концентрации
примеси; наряду с этим они принимали во внимание кинетиче-
ские явления на поверхности и ее кривизну. Ими рассчитана за-
висимость длины волны наиболее быстро растущих возмущений
вдоль оси цилиндра от переохлаждения и линейного кинетиче-
ского коэффициента.
Шьюмон [228] исследовал движение возмущенного плоского
фронта кристаллизации из пересыщенного раствора с учетом
линейной поверхностной кинетики на этом фронте. Было устано-
влено, что при заданном градиенте концентрации примеси устой-
чивость возмущения определяется влиянием противодействую-
щих друг другу факторов — потока вещества и поверхностной
энергии —и не зависит от кинетического коэффициента. Впро-
чем, если градиент концентрации может меняться, то при любом
малом кинетическом коэффициенте градиент концентрации об-
ращается в нуль, а фронт роста становится устойчивым.
Чернов [234] подошел к исследованию устойчивости совер-
шенно иначе. Он провел качественный анализ формы много-
угольного кристалла, растущего из пересыщенного раствора.
Взяв за отправную точку расчеты Зегера [78], согласно которым
пересыщение на краю грани такого кристалла максимально, а в
ее цнтре минимально, Чернов предположил, что это непостоян-
ство концентрации вдоль грани компенсируется линейным кине-
тическим коэффициентом так, что скорость роста поддерживает-
ся одинаковой во всех точках грани. Этот коэффициент заметно
488
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
меняется при малых отклонениях ориентации участка грани от
плотноупакованной поверхности. Чернов установил, не решая
точно уравнения Лапласа для искаженной формы, что искаже-
ния определенного вида, а именно впадины в центре грани, исче-
зают из-за анизотропии кинетического коэффициента, если их
размеры меньше некоторого критического размера, достигаю-
щего в приведенном случае ~ 1 мм. Если же кинетический коэф-
фициент изотропен, то, согласно этой теории, такая устойчивость
к искажениям большого масштаба не должна наблюдаться, во-
преки количественным результатам, полученным Корнеллом и
Паркером [230] для сферы1).
Анизотропное поверхностное натяжение. Кан [229] провел ко-
личественный анализ влияния слабой анизотропии поверхностно-
го натяжения на морфологическую устойчивость шарообразного
кристалла при росте из пересыщенного раствора. Малые откло-
нения полярной диаграммы поверхностной энергии у от сферы
записываются в виде суммы сферических функций с коэффи-
циентами 8/т. Все эти коэффициенты малы, кроме 8оо, который
отражает среднее значение поверхностной энергии и нормирован
к двум. Тем же способом, что и Маллинз с Секеркой [211], Кан
получил выражение концентрации на слегка искаженной сфери-
ческой поверхности [аналог выражения (22.13)]. Равновесная
форма кристалла находится из условия постоянства равновесной
концентрации Гиббса — Томсона Со, s вдоль искаженной поверх-
ности. Оказывается, что это есть слегка искаженная сфера.
В обозначениях уравнения (22.10) это запишется следующим об-
разом:
6/АВН = - (/ + 2)(7- 1) • (23-6)
Отсюда можно выразить концентрацию на поверхности кристал-
ла через I вместо 8/т» получив выражение, очень похожее на
выражение (22.13). Скорость изменения амплитуды возмущения
со временем находится так же, как и раньше:
^1т Г(СТО-СО 2Гр1
dt ~ (СТ-СО.*)*2 [1 Со * J 1т
~^(/+l)(/ + 2)(6Zm-6/T’)]. (23.6)
О Большие кристаллы при медленной изотропной поверхностной кине-
тике устойчивы по Кориеллу и Паркеру лишь относительно, но не абсолютно
(см. стр. 485). В действительности же на опыте фиксируется, по-видимому,
наступление абсолютной неустойчивости. Подробнее этот вопрос обсуждается
в [323*]. — Прим, ред.
VI. МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ
489
При бЕ*в:г = 0 (анизотропия отсутствует) это выражение сво-
дится к (22.19). Разделив выражение (23.6) на скорость воз-
растания среднего значения радиуса сферы, вместо временной
зависимости 6 получим зависимость этой величины от среднего
размера сферы. На фиг. 33 приведены данные об амплитуде
искажения и изменении поверхностной энергии при / = 4. Здесь
у = 6JR*, а х = R/R* [/?* для сферы определяется выражением
(22.21)]. Как показывают две верхние кривые, искажения, совпа-
дающие по фазе с равновесной формой, неустойчивы, т. е. их
Фиг. 33. Эволюция сферического фронта роста при анизотропии поверх-
ностной энергии [229].
Данные о зависимоеги приведенной амплитуды искажения от приведенного радиуса
сферы для начальных искажений различного вида.
амплитуда возрастает медленнее среднего радиуса, если
R 10/?*. С дальнейшим ростом кристалла амплитуда этих
искажений растет быстрее среднего радиуса, так что сфера те-
ряет устойчивость. Впрочем, сама по себе сфера без искажений
неустойчива (см. кривую Т<2 = 0), так как на ней развиваются
возмущения, приближающие ее к равновесной форме. При боль-
ших значениях г развитие таких возмущений стимулируется
влиянием поля диффузии. Рост равновесной формы представлен
на графике прямой линией, проходящей через начало коорди-
нат. Кривые, для которых /<2 < 0, описывают изменение ам-
плитуды возмущений, находящихся не в фазе с равновесной
формой.
Анализ устойчивости с учетом зависимости от времени. Се-
керка [235, 236] сформулировал теорию устойчивости плоского
490
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
фронта, отказавшись от принятого Маллинзом и Секеркой [218]
предположения о стационарности уравнений диффузии и тепло-
проводности и использовав вместо них уравнения общего вида,
учитывающие зависимость температуры и концентрации от вре-
мени. Достаточно сложный метод расчета состоит в том, что не-
линейное граничное условие непрерывности потоков линеари-
зуется путем представления температуры и концентрации в виде
суммы большой величины, удовлетворяющей стационарным
уравнениям, и малой величины, зависящей от времени. Затем
применяются преобразование Лапласа и преобразование Фурье.
Чтобы вывести условие устойчивости для бинарного сплава, ко-
торое должно учитывать как тепловое, так и концентрационное
поля, при отыскании решения пришлось предположить стацио-
нарность теплового поля. Найденное таким образом условие
устойчивости согласуется с уже рассмотренным критерием Мал-
линза и Секерки [218], полученным в стационарном приближе-
нии.
Точное решение задачи с учетом зависимости от времени по-
лучено для плоского фронта кристаллизации из раствора при
постоянной температуре [236]. Проведено сравнение результатов
с данными, полученными как без учета зависимости от времени,
так и в предположении справедливости уравнения Лапласа.
Условие устойчивости по отношению к возмущению с длиной
волны X, оказавшееся одинаковым во всех трех случаях, запи-
сывается следующим образом:
X < Zo = 2л
(23.7)
Однако эти три метода предсказывают совершенно различное
поведение возмущения с заданной длиной волны в зависимости
от времени; так, эти расчеты дают разные значения длины волны
и скорости роста амплитуды наиболее быстро растущего возму-
щения, хотя при достаточно больших величинах отношения D/V
эти значения сближаются. Наконец, выполнен численный расчет
изменения возмущения поверхности раздела фаз определенной
формы [большой центральный выступ, сопровождаемый другими,
уменьшающимися по мере удаления от этого центра; конфигу-
рация описывается функцией (sin х)/х]; оказывается, что от по-
добного возмущения по поверхности может распространяться
волновое возмущение.
Дельвес [237, 238], также предложивший теорию направлен-
ной кристаллизации бинарного сплава с учетом зависимости от
времени, нашел те же условия устойчивости, что и Маллинз с
Секеркой [218].
Vi. МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ
491
24. ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
МОРФОЛОГИЧЕСКОЙ УСТОЙЧИВОСТИ
Количественное сравнение с теорией. Харди и Кориелл [239,
240] измерили скорость роста (или исчезновения) возмущений
на цилиндрическом кристалле льда, растущем из дистиллиро-
ванной воды при малых переохлаждениях. Измеренные скорости
сравнивались со скоростями, рассчитанными по теории морфо-
логической устойчивости [109]. Ось цилиндра была перпендику-
лярна грани базиса, направление роста — параллельно послед-
ней; кинетический коэффициент, соответствующий росту в этом
направлении, как известно, довольно велик, так что переохла-
ждение, отбираемое кинетическими процессами, пренебрежимо
мало. Поскольку переохлаждения и скорости кристаллизации в
этих экспериментах малы, стационарное приближение, использо-
ванное в расчетах, справедливо. Условие устойчивости, отвечаю-
щее эксперименту, выводится из условия, сформулированного
Корнеллом и Паркером [109]; следует только ввести обозначения,
соответствующие тепловой задаче, и внести изменения и допол-
нения, учитывающие конечные размеры сосуда. В итоге полу-
чается следующее условие устойчивости:
№ zrz n [fe2 + ^2-1]In(^)(//K + ^S/^) /пл „
~ D ’ ( °
где
2№г)
и
21М
Здесь Ка и Ik — функции Бесселя мнимого аргумента; Рь— ра-
диус сосуда (цилиндрического); Ks и Кь— температуропровод-
ности (остальные обозначения прежние).
Параметры, стоящие в левой части условия (24.1), измерены
на опыте, тогда как характеристики в правой его части можно
рассчитать, если известна свободная поверхностная энергия
границы лед —вода и, следовательно, 7?’= ЛмУхд/^Д^пл ~ Л)
(Lv— скрытая теплота плавления единичного объема) и если
к тому же известна температура термостата Ть. Можно, наобо-
рот, рассчитать \Sl из условия (24.1) и сравнить это значение
со значениями, найденными другими способами. На фиг. 34
Фиг. 34. Морфологическая неустойчивость первоначально гладкого ледя-
ного цилиндра (г = 0,053 см), растущего в толщину в воде, переохлажденной
на 0,095 °C, в моменты времени t = 0 (a); t = 8,52 • 103 с (b), t = 13,02 • 103 с (с);
1 = 14,82- 103 с (d) [239].
VI. МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ
493
воспроизведены фотографии цилиндрического кристалла льда с
возмущениями при ДГ = —0,095 °C. Некоторые измеренные пара-
метры (d, %z, R, R) и вычисленные на их основе значения поверх-
ностной энергии, которая оказалась равной в среднем
16-10~3 Дж/м2, приведены в табл. 1 [240]. По результатам иссле-
дований зародышеобразования [241] значения ySL составили
Таблица 1
Данные о росте цилиндрического кристалла льда
д, см см R, см Л-106, см'с Як-1 О?/6)(б/я) Y-103, Дж/м
0,0032 0,052 0,182 5,49 22,2 16,4 11,6
0,0030 0,057 0,168 6,00 19,0 12,3 19,3
0,0095 0,055 0,154 5,90 18,0 12,2 16,1
0.0072 0,052 0,135 6,25 16,8 10,6 17,1
0,0031 0,062 0,185 5,92 19,2 14,0 17,0
20-10“3 Дж/м2 при —40°C и 24-10~3 Дж/м2 при 0°С. Такое соот-
ветствие надо признать вполне удовлетворительным, особенно
если учесть, что величина у, полученная из теории морфологиче-
ской неустойчивости, есть результат усреднения по всем плоско-
стям, параллельным оси с, в то время как значение, полученное
из данных по зарождению, связано также с другими плоско-
стями.
Эксперименты типа «да —нет». Как уже упоминалось, крите-
рий морфологической устойчивости, выведенный Маллинзом и
Секеркой, сводится к критерию концентрационного переохлажде-
ния Тиллера и др. [221] [см. формулу (22.24)], если считать спра-
ведливым грубое предположение о равенстве градиентов тем-
пературы в кристалле и расплаве и не учитывать влияния
поверхностной энергии. Следовательно, экспериментальная про-
верка критерия концентрационного переохлаждения, проведен-
ная Уолтоном и др. [222], подтверждает в тех пределах, в каких
справедливы сделанные предположения, и теорию морфологиче-
ской неустойчивости плоского фронта кристаллизации разбав-
ленного сплава, предложенную Маллинзом и Секеркой. На
фиг. 35 видно, что существует довольно резкая граница, отде-
ляющая область устойчивости (отсутствие ячеек) от области не-
устойчивости (фронт разбит на ячейки). Наклон этой границы,
согласно соотношению (22.24), выражается формулой
Gtj , с
~г=т<24-2)
494
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
где kQ — равновесный коэффициент распределения примеси. Под-
ставляя в эту формулу параметры, измеренные при кристаллиза-
ции сплава олова со свинцом, для коэффициента диффузии свин-
ца в жидком олове получаем значение 2,0-10~5 см2/с. Непосред-
ственное измерение коэффициента диффузии [243] с температур-
ными поправками, внесенными Уолтоном и др. [222], дает
Фиг. 35. Морфологическая неустойчивость плоского фронта кристаллиза-
ции разбавленного сплава.
Зависимость исходной концентрации свинца в олове, выше которой возникают ячейки,
от отношения градиента температуры к скорости роста; получена в работе [222]; X — ячейки
есть; □ —ячейки исчезают; Д —пустулы; Q —ячеек нет.
2,0-10~5 см2/с. Оба значения хорошо согласуются друг с другом,
хотя формула (24.2) приближенная и к тому же для измерения
подставляемых в нее параметров был использован метод декан-
тации [243], сопряженный с известными трудностями.
Качественные наблюдения морфологической неустойчивости.
Аракава [244] фотографировал последовательные стадии роста
и развития неустойчивости маленьких ледяных-дисков при их
росте параллельно плоскости базиса на поверхности переохла-
жденной воды. Такие диски остаются круглыми, пока их диаметр
не достигает 1—2 мм. Затем на краю диска развиваются много-
численные (сотни) выступы. Сначала ось шестого порядка не
VI. МОРФОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ 495
проявляется, но при дальнейшем росте одни выступы растут
быстрее других, так что гексагональная симметрия становится
заметной. Уиллиамсон и Чалмерс [245] также зафиксировали на
фотографиях поведение ледяных дисков, прикрепленных к краю
подложки.
Многие работы посвящены наблюдению дендритного роста,
существование которого качественно подтверждает идею морфо-
логической неустойчивости. Из этих работ следует упомянуть
классическую работу Папапетру [75], прекрасные фотографии
снежинок, сделанные Накайей [5], работы Мейсона, также ис-
следовавшего лед [246, 247], обзор Тиллера [248] и монографии
Чалмерса [80] и Саратовкина [249].
VII
ВЛИЯНИЕ ПРИМЕСЕЙ НА МЕХАНИЗМЫ
РОСТА КРИСТАЛЛОВ
25. ВВЕДЕНИЕ
Влияние примесей на рост кристаллов проявляется весьма
многообразно. Примеси в малых концентрациях влияют иначе,
чем в больших. Эффекты могут быть равновесными, неравновес-
но-стационарными и нестационарными. В одних случаях при-
меси ускоряют рост кристаллов, в других замедляют его. При-
меси влияют на растворение, плавление и испарение. Укажем
на ряд других эффектов: кристаллографические (статические,
структурные эффекты); кинетические или динамические; адсорб-
ционные (касаются фазовых границ с различными изотермами
адсорбции); одни примеси неподвижны на фазовых границах,
другие перемещаются; атомарные, молекулярные или ионные
примеси образуют скопления в системах, причем более крупные
из этих скоплений (но все еще субмикронных размеров) обра-
зуют примесные фазы. Примеси влияют на изломы, ступени,
скопления ступеней и кинематические волны; примеси вызывают
электрические эффекты на границах раздела, влияют на по-
верхностную и межфазную энергию и, следовательно, на вероят-
ности зародышеобразования.
Перечисленные эффекты чаще всего перекрываются, тем не
менее мы решили здесь выделить две отдельные проблемы:
1) влияние примесей на сам процесс роста;
2) количество и распределение примеси, захваченной кри-
сталлом в процессе роста.
При анализе второй проблемы предполагается, что скорость
роста кристаллов и равновесная диаграмма состояния в общем
случае известны; рассчитываются эффекты оттеснения и диффу-
зии примесей, учитываются перемешивание среды, неустойчи-
вость фронта кристаллизации, определяется влияние этих факто-
ров на реальный коэффициент распределения примеси в кри-
сталле (см., например, обсуждение вопросов концентрационного
переохлаждения в гл. VI, посвященной морфологической устой-
чивости). В этих расчетах мы обычно избегаем трактовок на
атомно-молекулярном уровне, ограничиваясь макроскопическим
(феноменологическим) анализом. Эта часть предмета за послед-
нее время неоднократно обсуждалась в литературе. Сошлемся
здесь на книги и обзоры Чалмерса [80], Пфанна [250, 251], Зифа
VII. ВЛИЯНИЕ ПРИМЕСЕЙ НА МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ 497
и Уилкокса [252] и Хэрла [253]. Основное внимание, однако, мы
уделим влиянию примесей на сам процесс роста, и здесь на пер-
вый план при анализе влияния примесей на изломы, движение
и распределение ступеней, на скорости роста будут, вообще
говоря, выдвигаться атомно-молекулярные модели. Что касается
второй проблемы, то такие эффекты обсуждаются в связи
с конвекционными потоками в гл. VIII (см. [254]). Мы здесь не
будем анализировать огромное' количество преимущественно
качественных наблюдений по влиянию примесей, например, на
секториальное строение кристаллов, образование структур типа
«песочных часов» [255] или на изменение габитуса (см. [255—
258]). В задачу настоящего раздела входит выборочный обзор
важнейших результатов по указанной тематике.
26. РОСТ БИНАРНЫХ ЦЕПЕЙ
Рост бинарной цепи, или одномерного кристалла,— по-види-
мому, наиболее фундаментальная проблема из тех, которые от-
носятся к росту в присутствии примесей. Несмотря на длитель-
ную историю исследований примесных эффектов, эта проблема
была решена с учетом обратной реакции лишь в самое последнее
время [259, 260]; точно так же задержалось решение в равной
степени фундаментальной, хотя и совершенно отличной по содер-
жанию проблемы классической механики — соударения атома с
концом (однокомпонентной) одномерной цепи [168, 169]. В дан-
ной задаче с примесью рассматривается цепь, состоящая из мо-
лекул двух типов. Предполагается, что концы цепи находятся в
некоей матрице, которая также состоит из молекул двух сортов
(1 и 2). Цепь способна расти, присоединяя поступающие из
среды молекулы либо сорта 1, либо же сорта 2; частота этого
события зависит от того, присоединяется ли молекула сорта 1
или же сорта 2, и еще от того, присутствует ли на конце цепи
молекула сорта 1 или сорта 2. Таким образом, существуют 4 ча-
стоты или скорости присоединения (i = 1 или 2; / = 1 или 2),
причем стоящий справа индекс относится к присоединяющейся
молекуле. Частота укорочения цепи путем отрыва концевой ча-
стицы зависит от того, отрывается ли частица сорта 1 или сорта
2, и от того, принадлежит ли предпоследняя от конца частица к
сорту 1 или сорту 2. Таким образом, существуют 4 частоты или
скорости отрыва 04 Конец цепи будет удлиняться или укорачи-
ваться, подчиняясь законам случайных процессов. Если цепь на-
ходится в равновесии с маточной средой, то среднее смещение
ее конца равно нулю, однако этот конец будет перемещаться с
конечной (положительной или отрицательной) средней ско-
ростью, если среда пересыщена или недосыщена.
498
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Вслед за Лоритценом и др. [260, 261] определим числа запол-
нения и Pv+i как числа цепей в системе длиной в (v+ 1)
частиц, оканчивающихся соответственно частицей / и частицами
i и / в последней и предпоследней позициях. Тогда для скоро-
стей изменения этих чисел во времени dNy+ildt и dPv+ i/dt
можно записать дифференциальные уравнения вида
= 2 “ S PZ/p*+1 - X aik + J 0'^+2- (26-1)
i i k k
Уравнение (26.1) дает суммарную скорость изменения числа
цепей, состоящих (в длину) из v-j- 1 частиц и имеющих на конце
частицу /. Член S a^Nv представляет собой скорость образова-
ния таких цепей путем присоединения частицы / ко всем цепям
с длиной v, в том числе к тем, которые оканчиваются на i = 1
и на i — 2. Член — S fi^Pv+i выражает убыль таких цепей пу-
i
тем отрыва концевой частицы / от всех цепей длиной v + 1,
у которых предпоследнее место на конце занимает частица /,
причем суммирование проводится опять-таки по I. Член
— Мн 2 uik характеризует убыль таких цепей вследствие их
k
роста, т. е. добавления новой частицы любого типа. Член
2 P^v+2 представляет собой скорость образования таких цепей
k
путем отрыва частиц k (обоих сортов 1 и 2) от всех цепей с
длиной v + 2, у которых предпоследнюю на конце позицию за-
нимает частица /. Аналогичное дифференциальное уравнение
записывается для Pv+i.
Решая эти зацепляющиеся уравнения для стационарных
условий, определяют числа заполнения. Затем находят парциаль-
ные потоки Sv и Sv через а, ₽ и искомые числа заполнения. На-
конец, определяют общий поток, или скорость роста, Sr = 2 sV
i. /
и состав цепей fj, т. е. долю частиц / в цепи.
Для распространения этого расчета на конкретную систему
необходимо знать константы и рЧ Лоритцен и др. [260] сде-
лали это для идеального раствора из парафиновых молекул двух
сортов — С24Н50 и С20Н54, для которых член свободной энергии,
учитывающий поверхностную энергию у твердой фазы, обуслов-
лен различием длин молекул, которые образуют полоски или
цепи материала, кристаллизующегося на подложке промежуточ-
ной толщины. На фиг. 36 приведены полученные машинным рас-
четом кривые зависимости ST от температуры для значения по-
верхностной энергии 8-10~3 Дж/м2 и различных концентраций
VII. ВЛИЯНИЕ ПРИМЕСЕЙ НА МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ 499
Фиг. 36. Изменение полного потока
в кристаллическую фазу Sr в зависи-
мости от температуры для шести кон-
центраций С2бН54 в С24Н50 по теории
бинарных цепей (у = 8 • 10~3 Дж/м";
Ф= 1) [260].
раствора (от 0 до 1,0). Видно, что общий поток меняется с тем-
пературой почти линейно, причем наклон кривых практически
не зависит от состава, т. е. скорость роста пропорциональна кон-
центрации и зависит только
от степени переохлаждения,
соответствующей этой кон-
центрации. Рассчитывался
также состав цепей f для
всех концентраций раство-
ра и для St = 0 (равновес-
ная диаграмма состояния) и
St У= 0 (кинетическая<«диа-
грамма состояния»). Для
выбранных условий и ве-
ществ значения f оказались
очень близкими.
Теорию многокомпонент-
ных цепей развивали Лорит-
цен и др. [261], а также Чер-
нов [262, 263]. К тому же
Чернов и Льюис [264] прове-
ли очень интересное моде-
лирование (или имитацию)
роста бинарных одно-, дву-
и трехмерных кристаллов
на вычислительной машине.
Моделирование одномерных
кристаллов подтвердило
правильность проведенного
Черновым [259] анализа ро-
ста одномерной цепочки в
разбавленном бинарном растворе. Для двумерного случая был
исследован порядок распределения частиц по узлам решетки
в зависимости от пересыщения для кристалла с составом 50/50.
27. ОТРАВЛЕНИЕ ИЗЛОМОВ В ПРОЦЕССЕ
СЛОИСТО-СПИРАЛЬНОГО РОСТА
Как уже отмечалось в гл. V, теория Бартона, Кабреры и
Франка [41] предполагает наличие достаточного числа изломов
ступени, куда встраиваются продиффундировавшие по поверхно-
сти адатомы. Если эти изломы, адсорбируя, например, молекулы
примесей, перестают быть активными точками роста, то суммар-
ная скорость движения ступеней, а следовательно, и скорость
роста кристалла могут уменьшаться. Чернов [17, 265, 266] полу-
500
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
чил полуколичественные оценки для этого эффекта; с этой целью
рассчитывалась изотерма адсорбции лэнгмюровского типа для
примесей, адсорбируемых изломами, и затем использовались
формулы Бартона, Кабреры и Франка для «множителя эффек-
тивности» <?о [см. рассуждения при выводе формул (17.12) и
(17.13)]. Оказалось, что скорость движения ступени снижается,
когда среднее расстояние между (активными) изломами Хо пре-
восходит среднюю длину диффузионного пробега Xs.
Пусть среднее расстояние между изломами на ступени в чи-
стой системе составляет Хо (в типичном случае 5—10 периодов
решетки) ’). Тогда для роста из паровой фазы в присутствии
примеси с парциальным давлением pi изотерма лэнгмюровской
адсорбции в одномерном варианте описывается формулой
Xi = X0 + lp{, (27.1)
где В — постоянная, X, — среднее расстояние между активными
(«неотравленными») изломами. Формулу (27.1) можно вывести,
если учесть, что одномерное «покрытие» 6ю=(1 — Хо/Х{) =
= lpi/(lpi + Хо). Чернов с помощью статистической механики
выразил приближенно g через энергию адсорбции w" в изломе и
через другие параметры в виде [266]
f _ a (kT)'11 ew"!kT
ёпар
где т и Vi — соответственно масса и колебательная частота при-
месной молекулы в изломе. При w" — 4,18-104 Дж/моль и
Vi ~ 1012 с-1 получаем оценочное значение
Up = 0,075а (Н/м2)"1. (27.3)
Следовательно, при давлении примесного газа 133 Н/м2 (1 мм
рт. ст.) отравление будет уже значительным. Аналогичные вы-
ражения можно получить и для идеального раствора: Xi =
= Xq + £растС и £Раст ~ Ю5а. Таким образом, концентрации при-
меси С ж 10-4 уже достаточно для существенного отравления
изломов. Ясно, что при достаточно высоких давлениях парооб-
разной примеси или высоких концентрациях ее в растворе ско-
рость роста может снизиться до нуля; при изотермах адсорбции
другого типа и результат может быть иным.
Если число изломов на ступени недостаточно велико, то нор-
мальная скорость роста в окрестности винтовой дислокации от-
личается от идеального случая (когда изломов много) множите-
9 См. примечание на стр. 442. — Прим. ред.
VII. ВЛИЯНИЕ ПРИМЕСЕЙ НА МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ 501
лем с0 (O^co^l); теория Бартона, Кабреры и Франка [41]
для со*1 дает
— =1 + 2Mh-Mln
«лм + 2^arct 61(
н(1 + ^ у0 ё
(27.4)
где b4 = X/2nXs, а у0( = 4лркр) — расстояние между витками
спирали при стационарном росте. Если теперь заменить XQ на
Хо + lp пли Х0 + £С и вспомнить, что ж yea/kT(j и он =
Фиг. 37. Кривые зависимости приведенной скорости роста от пересыщения
при Xs = 400 а и си = 5 • 10~2 с учетом отравления изломов примесями
при росте из пара по механизму винтовых дислокаций [265].
/ — Х^ < Xs (отсутствие примесей); 2 — Х\ = 100а; 3 — Х^ = 400 а.
= 2nyealkTXs. то из формулы (17.18) получим искомое выраже-
ние для скорости роста. Не станем выписывать здесь это выра-
жение, а обратимся к графику фиг. 37, иллюстрирующему ос-
новной вывод [265]: скорость роста снижается и сильно расши-
ряется участок нелинейности (который для чистых условий
лежит у начала координат между 0 и сн).
Родственную модель отравления ступеней предложил Сирс
[267]. Он предположил следующее: чтобы отравление приводило
к существенному снижению скорости роста, примесью должна
покрываться вся ступень; в противном случае на неотравленных
участках ступени должны возникнуть (посредством статистиче-
ских флуктуаций) свежие изломы, к которым будут присоеди-
няться скорее молекулы кристаллизуемого материала, нежели
примеси, поскольку первых значительно больше, чем вторых.
Расчеты Сирса (хотя и по строго количественные) наводят на
502
Г>. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
мысль о том, что изложенную теорию Чернова можно усовер-
шенствовать, если учесть динамические эффекты конкуренции
молекул двух упоминавшихся компонентов за изломы; однако
расчет Чернова должен быть справедлив для предельного слу-
чая малых скоростей роста, когда установилось адсорбционное
равновесие.
Чтобы объяснить снижение скоростей роста в разбавленных
растворах под действием примесей, Близнаков [268] также поль-
зовался изотермой Лэнгмюра. Только он рассматривал нор-
мальный, а не ступенчатый механизм роста. Предполагалось,
что нормальная скорость роста складывается из двух частей:
1) нормальной скорости роста для тех участков кристаллической
поверхности, которые целиком свободны от примесей, причем
эта скорость помножается на долю свободной поверхности
(1—0); 2) скорости роста «примесных»участков, помноженной
на степень покрытия 0. При этом предполагается, что коэффи-
циент 0 относится к факторам лэнгмюровского типа. Оказалось,
что для ряда систем эта модель дает результаты, согласующиеся
(по нормальным скоростям роста) с экспериментом. Однако, как
отметил Чернов [17], при таком анализе не учитывается факт
слоистого роста граней путем движения ступеней.
28. РОСТ КРИСТАЛЛОВ САХАРОЗЫ ИЗ РАСТВОРА,
ТОРМОЖЕНИЕ СТУПЕНЕЙ
Элбон и Даннинг [269] изучали влияние малых добавок ра-
финозы на скорость движения ступеней при росте кристаллов
сахарозы из водного раствора. При концентрациях ~10-3 рафи-
ноза вдвое снижает скорость роста грани (100) сахарозы при
малых (~1°/о) пересыщениях раствора, однако этот эффект по-
степенно сходит на нет и скорость роста в функции концентра-
ции примеси приближается к нулю, по-видимому, лишь асимпто-
тически. По предположению этих авторов, молекулы рафинозы
адсорбируются на ступенях (по-видимому, на изломах, хотя
концентрация изломов для чистого кристалла в этой теории не
фигурирует); если длина участка ступени между двумя адсор-
бированными молекулами сахарозы меньше диаметра критиче-
ского зародыша dKp( = 2pKp), то участок ступени будет затормо-
жен и не должен перемещаться (речь об этом еще пойдет ниже
[204]). Предполагается, что в этом случае суммарная, или сред-
няя, скорость движения ступени пропорциональна доле незатор-
моженного участка (сумме всех отрезков ступени с длинами
r^dicp), помноженной на соответствующую вероятность, т. е.
= (4₽ - р4Р + р)/кр,
(28.1)
VII. ВЛИЯНИЕ ПРИМЕСЕЙ НА МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ 503
где R и Ro суть скорости роста соответственно в присутствии
примесей и без примесей; р— отнесенная к межатомному рас-
стоянию вероятность того, что на ступени нет адсорбированной
молекулы рафинозы, так что Са = 1—р— концентрация адсор-
бированных молекул, отнесенная к межузельному расстоянию на
ступени. Число адсорбированных молекул Са и, следовательно,
Фиг. 38. Данные об изменении приведенной скорости роста в зависимости
от —1g р при различных коэффициентах пересыщения а, иллюстрирующие
влияние примеси рафинозы на рост кристаллов сахарозы из водного рас-
твора (случаю отсутствия примесей соответствует —1g р=0) [269].
вероятность р связаны с количеством Со рафинозы в растворе
изотермой адсорбции Фрейндлиха
С а = АС'о/п. (28.2)
Было установлено, что формула (28.2) согласуется с экспери-
ментом, если предположить, что концентрация Са пропорцио-
нальна измеренному в опыте снижению скорости роста А/? =
= Ro — R. Согласно соотношению (28.1), график зависимости
lg (R/Ro) от lg Р должен быть приблизительно прямой линией с
наклоном dKp (фиг. 38). Полученные таким образом значения
dKp колеблются в пределах от 1,6 до 11,8 долей диаметра моле-
кул в зависимости от а или о. Пользуясь соотношением ркр =
= = yealkTc, можно рассчитать энергии ступеней.
504
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Даннинг и др. {270] связывали сильно различающуюся эффек-
тивность уменьшения разными примесями скорости ступеней
при росте кристаллов сахарозы с молекулярной структурой той
или иной примеси. Наиболее эффективны, по-видимому, моле-
кулы тех примесей, структура которых, как можно ожидать,
обеспечивает им более прочную адсорбцию.
29. ТОРМОЖЕНИЕ СТУПЕНЕЙ (ПРОДОЛЖЕНИЕ)
Эффект торможения (закрепления) ступеней примесями был
исследован также Кабрерой и Вермили [204]. По их модели на
поверхности кристалла существуют крупные неподвижные ча-
стицы примесей, которые, встречаясь со ступенью, закрепляют
ее, т. е. останавливают ее движение. Незакрепленные части сту-
пени выгибаются и могут соединиться позади примеси (т. е.
пройти по другую сторону от нее) лишь в том случае, когда (ло-
кальный) радиус кривизны ступени р равен или превосходит ра-
диус кривизны критического зародыша рКр в данных условиях.
Если непосредственно перед фронтом ступени примесные мо-
лекулы распределены равномерно со средним промежутком
г(г> 2рьр), то ступени могут протискиваться сквозь примесный
барьер. Если же z < 2ркр, то ступень закрепляется. По теории
Бартона, Кабреры и Франка [41], скорость роста для искривлен-
ной ступени меньше, чем для прямой [см. формулу (17.4)]:
(29.1)
Следовательно, для полукруглой ступени радиусом z/2 получим
v = vQO(\—2pKp/z). Чтобы узнать точное значение средней ско-
рости, необходимо проинтегрировать по всем радиусам р сту-
пеней, протискивающихся сквозь барьер («частокол») из приме-
сей. Кабрера и Вермили дали (без доказательства) приближен-
ную формулу
которая дает правильный ход изменения при z = 2рир и 2 = оо.
Если непосредственно перед фронтом ступени примеси обра-
зуют двумерную решетку с межатомным промежутком z и плот-
ностью d, то z = d_1/2 и, следовательно,
V = Уоо(1 — 2pKpd1/2)1/2.
(29.2х)
Предположим далее, что примеси оказываются «захоронен-
ными» (т. е. перестают быть эффективными), если ступень про-
ходит сквозь частокол, и что на поверхность поступают из окру-
жающей среды новые примеси с плотностью потока Ji. Тогда
VII. ВЛИЯНИЕ ПРИМЕСЕЙ НА МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ §05
непосредственно перед ступенью, движущейся со скоростью vt
имеем
= (29.3)
где k — плотность ступеней. Объединив уравнения (29.3) и
(29.2'), получим уравнение 5-го порядка относительно v/vx, ко-
торое име« решение (т. е. ступени будут двигаться) лишь в том
случае, когда 2ркр (Ji/kVao)1/2 < 0,54, т. е. когда поток ступеней
в беспримесной системе
14Р2крЛ. (29.4)
Для малых значений о радиус ркр пропорционален 1/<т, a kv^,
определяется линейным или параболическим законом; следова-
тельно, существует минимальное пересыщение для роста, опре-
деляемое условием
(У^
-7- = const или -т-= const. (29.5)
Л Ji v
Прайс и др. [271] исследовали влияние крупных молекул примеси
на рост нитевидных кристаллов серебра при электролизе. Кри-
сталлы росли с вершины. Как оказалось, при каждой концентра-
ции Сг примеси желатины, введенной в электролит, существует
критическая движущая сила, ниже которой нитевидные кристал-
лы не образуются. В этих экспериментах критическая движущая
сила пропорциональна плотности тока /с. В рамках простой
диффузионной теории предполагалось, что поток примесей к
вершине нитевидного кристалла пропорционален концентрации
примеси в объеме раствора Сг. Экспериментальные результаты
удовлетворяли формуле Ic = const С'К которая совпадает с ус-
ловием (29.5), в котором роль о и Л играют соответственно
1С и Ci. Таким образом, теория Кабреры и Вермили подтверж-
дается экспериментально.
Ван Дамме [272] исследовала влияние ионов ферроцианида
на растворение NaCl и интерпретировала эти результаты в рам-
ках несколько видоизмененной теории Кабреры — Вермили. Для
разных концентраций примеси Сг было измерено критическое не-
досыщение оКр, ниже которого растворение NaCl прекращается.
Предполагалось, что малые добавки ферроцианида не влияют
на растворимость основного вещества и что процесс описы-
вается равновесной (лэнгмюровской) изотермой адсорбции, а
не формулой (29.3), в которой поток примеси учитывается как
существенный фактор. Таким образом, при нулевой скорости ро-
ста формула (29.2') дает <y^p/d = const, т. е.
2 ,
ф_=_^=0, (29.6)
^кр, оо ^кр, ОО
506
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
где Окр.оо — критическое недосыщение для максимального по-
крытия (0=1). В случае лэнгмюровской изотермы 0 =
= Cil{ilKa + Ci), где Ка— постоянная, получаем
_2 Л Ь- W.2 ' ’ 2 ’ /
®кр ^£''а*^кр, оо ^кр. оо
эта формула согласуется с экспериментами. Кроме того, адсорб-
ция ферроцианида на очень малых кристаллах NaCl была изме-
рена непосредственным образом. Измеренные таким путем по-
крытия не более чем в 10 раз отличались от тех, которые сле-
дуют из формулы (29.6') при известной растворимости.
30. КИНЕМАТИЧЕСКИЕ ВОЛНЫ И РОЛЬ ПРИМЕСЕЙ
ПРИ РАСТВОРЕНИИ; ОБРАЗОВАНИЕ ЯМОК ТРАВЛЕНИЯ
Хьюлетт и Янг [273] обнаружили, что их наблюдения за обра-
зованием ямок травления в кристаллах меди допускают удовлет-
ворительное истолкование на основе кинематической теории [13,.
203, 204, 274]. Поверхности высокосовершенных кристаллов
(плотность дислокаций 2-102—103 см-2) с ориентацией вблизи
(111) подвергали анодному травлению в растворах НС1 при
плотностях тока от 5 до 30 мА/см2, причем растворы содержали
примесь НВг в концентрациях от 0,03 до 1,0 М. Ямки травления
образовывались на выходах дислокаций (это уже было хорошо
известно [275]). Профили ямок травления в зависимости от вре-
мени измеряли с помощью интерференционного микроскопа. По
построенным профилям ступеней у(х) определяли плотности
ступеней k(x) = (-}-\/h)dy/dx, где h — высота элементарной сту-
пени. Из семейства кривых k(x), построенных для разных мо-'
ментов времени, авторам удалось вывести (при постоянном зна-
чении k) зависимости х от времени, т. е. определить траектории
движения точки с постоянной плотностью ступеней. Экспери-
менты показали, что такие траектории представляют собой пря- -
мые линии, как того требует теорема Франка из теории кинема- ;
тических волн (см. гл. V).
Затем на основе кинематической теории [см. уравнение
(20.5)] определяли наклон dx/dt траектории точки с плотностью
ступеней k в виде
<3»-»
(Это и есть скорость кинематической волны.) Здесь д[ = q(k)] —
поток ступеней, выражающийся как число ступеней, проходящих
за секунду через некоторую точку, где число ступеней на санти-
метр составляет k. По графику зависимости измеренных накло-
VII. ВЛИЯНИЕ ПРИМЕСЕЙ НА МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ 5Q7
k
нов от k определяется интеграл q = J cdk, откуда получают
fc,
основную (искомую) кривую зависимости поток — плотность
ступеней q = q(k). Это было проведено при трех содержаниях
примеси Вг~ (фиг. 39). Видно, что на характер кривых поток —
плотность сильно влияет концентрация примеси в растворе.
Фиг. 39. График зависимости потока ступеней q от плотности ступеней k
при анодном растворении кристалла Си в 6М НС1 с плотностью тока
5мА/см2, иллюстрирующий влияние примеси НВг [273].
А —О,ОЗМ; В —0,25 М; С —1,0 М.
Форма этих кривых хорошо согласуется с предсказаниями Фран-
ка [203] и Кабреры [274]. Кабрера [274] (см. также [13]) отнес
кривую А к типу I и отметил, что эта кривая имеет фактически
форму, предсказанную теорией винтовых дислокаций для пре-
дельного случая высокой чистоты. Кривая С, отнесенная к типу
II, была предсказана Франком [203] и Кабрерой [274]. Для нее
характерна положительная кривизна (d2qldk2 > 0) при малых k.
Указанная форма кривой объясняется тем, что число частиц, ад-
сорбированных непосредственно перед ступенью, зависит от
времени и, следовательно, сопротивление движению этой сту-
пени зависит от интервала времени после прохождения предыду-
щей ступени. Таким образом, чем больше разнесены ступени
(т. е. чем меньше й), тем меньше скорость ступеней qfk, и наобо-
рот; следовательно, производная d2qldk2 есть положительная ве-
личина.
Другое следствие из кривой q(k) [273] состоит в образовании
разрывов плотности ступеней у ведущего и хвостового краев
508
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
эшелона. Как показал Франк, в случае отрицательной производ-
ной d2qld№ при растворении профиль эшелона ступеней харак-
теризуется пологим ведущим краем и угловой точкой у хвоста;
для положительной производной d2qfdk2 получается обратная
картина. В последнем случае, когда угловая точка впереди, об-
разуется ямка травления с четкой периферией, что благоприят-
ствует наблюдению ее в микроскопе. И в самом деле, Хьюлетт
и Янг убедились в том, что кривым типа I соответствуют ямки
травления с размытой периферией; в случае же добавления при-
месей (тип II, кривая С на фиг. 39) образуются ямки с резкими
контурами.
31. МАКРОСКОПИЧЕСКИЕ ЧАСТИЦЫ
В КАЧЕСТВЕ ПРИМЕСЕЙ
Условия, при которых небольшие инородные частицы с раз-
мерами, превышающими молекулярные, захватываются или от-
тесняются фронтом кристаллизации, исследованы, по-видимому,
гораздо меньше, чем случай с примесями молекулярных разме-
ров. Тем не менее эта проблема очень важна; как показали
эксперименты Тернбалла [9] по зарождению, в большинстве
жидкостей присутствует, по-видимому, множество инородных
макроскопических частиц. Джексон [276] предположил, что эти
частицы могут быть основной причиной возникновения дислока-
ций при выращивании кристаллов из расплава.
Ульман и др. [277] провели эксперименты по кристаллизации
ряда органических веществ, в том числе салола, в который
(преднамеренно) вводились инородные частицы различных ве-
ществ (Zn, MgO, алмаза и др.) с размерами приблизительно
от 1 до 100 мкм. Макроскопические наблюдения показали, что
при достаточно низких скоростях кристаллизации частицы почти
всех исследованных материалов оттеснялись фронтом кристал-
лизации. Если скорость кристаллизации превосходила некото-
рую критическую величину (в типичном случае несколько ми-
кронов в секунду), то частицы захватывались кристаллом. Эта
критическая скорость зависела от состава примесной частицы и
кристаллизуемого вещества, но не зависела от размеров частиц,
если они были меньше 15 мкм. По теории, разработанной этими
авторами, сила, достаточная для оттеснения частицы, возникает
в том случае, когда поверхностная энергия границы кристалл —
частица превосходит сумму энергий границ расплав — частица
и расплав — кристалл. Однако при достаточно высокой скорости
роста жидкость в узком зазоре между частицей и фронтом кри-
сталлизации не успевает продиффундировать или вытечь, вслед-
ствие чего частица замуровывается. Тот факт, что зависимость
коэффициента захвата от размеров частиц не наблюдается, ав-
VII. ВЛИЯНИЕ ПРИМЕСЕЙ НА МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ 509
торы объясняют присутствием на поверхности всех твердых ча-
стиц очень мелких (~0,03 мкм) неоднородностей, которые и
определяют размерный масштаб процессов, протекающих на
фронте кристаллизации.
Чернов и Мельникова [278, 279] независимо от Ульмана ис-
следовали с теоретической точки зрения очень близкую задачу
роста из раствора и из расплава. Они рассчитали распределение
концентрации при росте из раствора в присутствии постороннего
шара у фронта кристаллизации. Уменьшение пересыщения в
узком промежутке между шаром и фронтом кристаллизации
ведет к возникновению на этом месте углубления, которое ча-
стично сглаживается благодаря анизотропии кинетических коэф-
фициентов. Но, как правило, существует критическое значение
a^R, такое, что при меньших значениях a^R образуется глубо-
кая ямка или включение (либо происходит захват частицы);
здесь а4 — расстояние от центра шара до поверхности кристалла,
a R — радиус шара. При линейной зависимости скорости роста
от пересыщения это критическое значение a^R, однако, не зави-
сит от скорости роста.
Чернов и Мельникова [279] исследовали также ситуацию при
росте из расплава, уделяя основное внимание расчету тепловых
потоков. Если температуропроводность шара больше температу-
ропроводности расплава, то получается такой же результат, как
и для роста из раствора. Таким образом, как отметили Чернов
и Мельникова [278], полученные ими выводы не согласуются с
наблюдением Ульмана и других исследователей.
VIII
ГИДРОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
32. ВВЕДЕНИЕ
Мы уже рассматривали, особенно в гл. III, вопросы о том, как
на кристаллизацию влияет тепло- и массоперенос, предполагая
при этом, что такой перенос к поверхности раздела фаз или от
нее осуществляется только посредством теплопроводности и
диффузии по отдельности или одновременно. Другой, совершенно
иной способ переноса теплоты или вещества — это конвекция,
при которой теплота или вещество, содержащиеся в жидкости,
переносятся из одной ее точки в другую гидродинамическим по-
током. Такой поток, вообще говоря, должен влиять на рост кри-
сталлов из текучей среды, т. е. из раствора, пара и расплава.
В свою очередь жидкую среду приводят в движение различные
силы, такие, как: а) разность плотностей кристалла и жидкости,
приводящая к конвективному тепло- и массопереносу, сопро-
вождающему продвижение фазовой границы в жидкость; б) не-
одинаковая плотность самой жидкости, порожденная градиен-
тами температуры и концентрации, которая в поле тяжести при-
водит в свою очередь к возникновению естественного конвек-
ционного потока; в) принудительная конвекция, когда переме-
шиванием жидкости создается поток, омывающий кристалл.
Влияние таких конвекционных потоков обычно сводится к
разрушению протяженных полей диффузии в маточной среде.
Их сменяют диффузионные поля, сосредоточенные в относи-
тельно узком пограничном слое толщиной б, так что пересыщен-
ный объем оказывается теперь совсем близко к поверхности
раздела. Диффузия идет через этот пограничный слой, поэтому
концентрационный и температурный градиенты около поверхно-
сти кристалла имеют более высокие значения, чем в отсут:
ствие гидродинамического течения. Возрастают и скорости роста,
если только рост лимитируется не одними кинетическими явле-
ниями на фронте.. Другим примером может служить сегрегация
примеси на фронте кристаллизации, вызывающая ее накопление
в расплаве перед фронтом. Образующаяся из такого загрязнен-
ного расплава часть кристалла имеет повышенное содержание
примеси. Диффузия примеси в расплав от фронта кристаллиза-
ции может привести к некоторому снижению ее концентрации в
этой области, уменьшая тем самым количество примеси в кри-
сталле. Однако гидродинамическое перемешивание расплава
VIII. ГИДРОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
611
способно гораздо сильнее снизить концентрацию примеси у
фронта кристаллизации, поскольку диффузионный слой при та-
ком перемешивании становится гораздо тоньше, так как его
толщина определяется толщиной гидродинамического погранич-
ного слоящем., например, [251, 252]).
Хотя гидродинамические эффекты во многих случаях кристал-
лизации играют не менее важную роль, чем теплопроводность и
диффузия, все же количественных исследований в этой области
проведено, по-видимому, несравненно меньше, чем по диффу-
зионной задаче Стефана и другим аналогичным задачам. [Впро-
чем, к исследованию влияния перемешивания на некоторые кри-
сталлизационные процессы часто прибегают в химической про-
мышленности (см., например,[280, 281]).] Такую недооценку мож-
но объяснить несколькими причинами. Во-первых, если в опытах
жидкая фаза специально не перемешивается, то о возможности
естественной конвекции часто забывают. Во-вторых, если суще-
ствование потоков жидкости при росте кристалла и учитывалось,
то громоздкость дифференциальных уравнений удерживала ис-
следователей от попыток определить аналитически или хотя бы
полуколичественно распределение таких потоков. В-третьих, в
опытах по росту кристаллов часто невозможно наблюдать за
распределением потоков жидкости, особенно если последняя
непрозрачна.
В настоящей главе мы рассмотрим исследования влияния по-
токов жидкости на тепло- и массоперенос, отдавая предпочте-
ние при этом количественным результатам. По аналогии с си-
стематикой задач Стефана разобьем работы, посвященные дан-
ной проблеме, на группы, приняв за основу классификации
форму или геометрию системы; такая классификация часто
употребляется в литературе по гидродинамике, теплопроводно-
сти и диффузии (основная литература: Ландау и Лифшиц [212],
1/ольдштейн [282], Шлихтинг [283], Эккерт и Дрейк [284]; см.
уакже журнал [285]).
33. ОБТЕКАНИЕ ПЛОСКОЙ ПЛАСТИНЫ
Рассматривая рост кристалла с плоскими гранями либо из
перемешиваемого или проточного пересыщенного раствора, либо
при его перемещении относительно раствора, ряд исследователей
выбрали в качестве приближения гидродинамическую задачу о
пограничном слое, возникающем в параллельном потоке при об-
текании полубесконечной плоской пластины. К исследованиям
подобного рода относятся работы Карлсона [286], Беннемы [182]
и Брайса [287].
Главным средством исследования распределения потоков
жидкости служат в принципе уравнения Навье — Стокса (см.
512
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Ландау и Лифшиц [212], Шлихтинг [283]). Это сложные нелиней-
ные уравнения движения,, точные решения которых известны
только для особых случаев (потоки в трубе и около вращаю-
щегося диска, очень медленное обтекание шара). Как показал
Прандтль, когда поток жидкости обтекает твердые тела, в слое
жидкости, прилегающем к их поверхности и называемом погра,
ничным слоем, возникают большие градиенты скорости течения.
Рассматривая движение жидкости в этом слое, следует учиты-
вать трение (вязкость); вне пограничного слоя трением можно
пренебречь. Такой приближенный анализ позволяет упростить
уравнения движения жидкости в пограничном слое, которые все
Фиг. 40. Гидродинамический пограничный слой при обтекании плоской
пластины [283].
еще остаются нелинейными. В случае стационарного двумерного
потока несжимаемой жидкости с постоянными характеристиками
эти уравнения имеют следующий вид:
ди . ди 1 dp . д2и /Qrt
= + (ЗЗЛ)
= 0. (33.2)
дх 1 ду v 1
Здесь и и v — составляющие скорости потока по осям х и у;
v — кинематическая вязкость, v — ц/рь; ц — вязкость; рь — плот-
ность; считается, что давление р известно из решения для по-
тенциального течения невязкой жидкости. При обтекании пла-
стины (фиг. 40) dpldx = 0 и граничные условия: и = v = 0 при
у = о, и = «оо при у = оо. Точное решение этой задачи все еще
сопряжено со значительными трудностями; первым ее решил
методом разложения в ряд Блазиус (см. [283]). Приведем здесь
лишь результат, полученный в [284] более простым методом,
основанным на использовании уравнения количества движе-
ния пограничного слоя. Распределение скоростей описывается
VIII. ГИДРОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
513
в этом приближении формулой
«оо 2d 2 \ & ) ’
(33.3)
р которой толщина пограничного слоя б определяется следую-
щим образом:
6 4,64
х (Rej'/2
(33.4)
(число Рейнольдса Rex = «ooX/v). В этом приближении б — рас-
стояние от пластины, при котором и = их-, в действительности
и приближается к их асимптотически. В точном выражении
(33.4) для б, при котором и = 0,99«от, стоит коэффициент ~5,0
вместо 4,64. По формуле (33.4) толщина пограничного слоя
равна нулю у края пластины, встречающего поток, и возрастает
пропорционально х'/г с удалением от этого края.
Для определения потока тепла к пластине или от нее сна-
чала выводится уравнение энергетического баланса для элемен-
тарного объема жидкости. Это уравнение в принципе следует
решать совместно с уравнениями Навье — Стокса. Более простой
его вариант в приближении пограничного слоя записывается в
следующем виде:
I дТ дТ\ К. д2Т /ди\2
с,р\и~я—h v -ч— = — -5-S- + v Нг- • (33.5)
\ дх ' ду / р ду2 ' \ ду / ' ’
Здесь Кб — теплопроводность жидкости, a cLP — ее удельная
теплоемкость при постоянном давлении. Кроме граничных усло-
вий, связанных с уравнениями (33.1) и (33.2), должны выпол-
няться еще и граничные условия, связанные с уравнением
(33.5), а именно Т = Тп.ш при у = 0 и Т = Тх при у — оо. Если
свойства жидкости не зависят от температуры, то поле скоростей
не связано с полем температур, так что можно сначала найти
решение уравнений (33.1) и (33.2), а затем решить линейное
уравнение (33.5) относительно Т(х, у). Польхаузен (см. [283])
получил точное решение уравнения (33.5), использовав решения
уравнений (33.1) и (33.2). Если тепловой пограничный слой 6t
тоньше гидродинамического пограничного слоя б, то приближен-
ное решение имеет вид
где
т тпш
Тп.ш
2 6/ 2 \ d; / *
(33.6)
Ь _ 1
6 1,026 (Рг)'/з *
(33.7)
Здесь число Прандтля Pr = v/хб; температуропроводность
Кб = KlIplClp. Поток тепла через поверхность нагретой
514
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
пластины единичной площади выражается в виде
<?=44г(Г«>“Гпш); <зз-8>
Воспользовавшись выражениями (33.7) и (33.4), можно записать
Q = 0,332/Q (Тп - Гп.ш) (Рг)7’, (33.9)
т. е. поток Q обратно пропорционален корню квадратному из
расстояния от данной точки до края, встречающего поток. Заме-
тим, что, согласно (33.7), в вязкой жидкости, т. е. при Рг 1000,
толщина теплового пограничного слоя составляет меньше ‘/ю
толщины гидродинамического пограничного слоя. Для воды при
комнатной температуре Рг « 7; для многих газов критерий Рг
близок к единице. Для жидких металлов Рг <С 1 (например, для
ртути при комнатной температуре Рг а; 0,02), но тогда формула
(33.9) уже неприменима.
Если происходит перенос вещества, например при росте из
разбавленного раствора или при растворении, то [282] поток ве-
щества <3вещ выражается формулой [286]
(?вещ = 0.332D (См - Cs) (Sc)7’ , (33.10)
где Sc = v/D — число Шмидта; D — коэффициент диффузии рас-
творенного вещества; Са — концентрация на поверхности; Сх—
концентрация на бесконечности. В случае диффузии простых
молекул в воде критерий Sc есть число порядка единицы. Тогда
толщина диффузионного пограничного слоя Sc запишется в соот-
ветствии с формулами (33.7) и (33.4) в виде
= <ЗЗЛ»
или = 4,5£>7’v7’«m72-v73. Брайс [287], Карлсон [286] и Беннема
[182] пользовались этими формулами для толщины диффузион-
ного пограничного слоя около плоской пластины при истолкова-
нии результатов измерения скоростей роста кристаллов в пере-
мешиваемом растворе с известной скоростью протекания
Брайс [287] проанализировал роль диффузионного погранич-
ного слоя при росте кристаллов из раствора и, в частности, во-
прос о том, каким образом следует учитывать существование
этого слоя при определении зависимостей скорости роста кри-
сталла от пересыщения из экспериментальных данных. Зависи-
мость скорости роста от пересыщения можно записать, по край-
ней мере при линейной и квадратичной кинетике, в виде
Q = Л (Cs - С0)л, (33.12)
VIII. ГИДРОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
515
где Са— концентрация на поверхности раздела фаз, Со — равно-
весная концентрация, Q — скорость роста, а А и п суть постоян-
ные при заданной температуре. С другой стороны,
Q = D C~^Cs (33.13)
[при таком определении 6С вместо коэффициента 4,5 в выраже-
нии (33.11) нужно взять коэффициент 3,0]; следовательно,
пг + (тГ = с«-с»' <33'14>
Для уравнения (33.14) возможны два предельных случая: 1) ко-
гда мсжно пренебречь влиянием пограничного слоя (6С—*0),
т. е. когда рост кристалла лимитируется поверхностной кинети-
кой; 2) когда определяющая роль принадлежит влиянию погра-
ничного слоя (6с~►оо). Ясно также, что с приближением тол-
щины 6с к нулю, т. е. с усилением перемешивания, наблюдаемая
скорость роста Q возрастает, асимптотически приближаясь к не-
которой величине (см., например, [281]). Если оба члена в левой
части (33.14) одинаковы по порядку величины, то, поскольку
толщина 6с пропорциональна н^'/2 [см. выражение (33.11)], ско-
рость роста при постоянном значении (Соо — Со), записанная в
виде произведения Qu~'12, должна быть пропорциональной QI/n
при некотором значении п, соответствующем показателю сте-
пени в выражении зависимости скорости кристаллизации от пе-
ресыщения на фронте роста (33.12). (Этот вывод основан на
предположении, что толщина 6С постоянна по поверхности, хотя
гидродинамический анализ показывает, что она меняется, при-
нимая на краю пластины минимальное значение, равное нулю.)
Данные, полученные Мак-Кэйбом и Стивенсом [288] при экспе-
риментальном исследовании роста CuSO4-5H2O из водного рас-
твора, согласуются с выражением (33.14) при п = 2.
Беннема [182], также пользовавшийся формулой (33.11) для
интерпретации измеренных им скоростей роста кристаллов алю-
мокалиевых квасцов и хлората натрия из растворов, установил,
что 6с ® IO’2 см. Однако изменение скорости перемешивания
раствора не привело к изменению скорости роста, на основании
чего Беннема заключил, что рост полностью лимитируется по-
верхностными процессами в соответствии с моделью поверхност-
ной диффузии, предложенной Бартоном, Кабрерой и Франком
[41], а не объемной диффузией, как это предполагалось в пред-
ложенной Черновым [17] модели, согласно которой скорость ро-
ста зависит от 6с.
Как отметил Карлсон [286], поскольку толщина пограничного
слоя 6с меняется пропорционально х'1а, скорость массопереноса
у края пластины, встречающего поток раствора, получится
516
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
бесконечно большой (если только роль кинетических явлений на
поверхности раздела фаз несущественна). С учетом этого он вы-
сказал предположение, что более подходящей моделью может
служить пластина, температура (или концентрация) в разных
точках которой различна, так что скорость переноса тепла (или
вещества) будет постоянной. В такой постановке задачу тепло-
проводности решили Фэйдж и Фолкнер [282]; оказалось, что пре-
вышение температуры пластины над температурой объема
жидкости пропорционально х1/з. При росте из раствора отклоне-
ние концентрации на поверхности пластины от концентрации в
объеме также пропорционально х1/з. В итоге на некотором рас-
стоянии х от края пластины концентрация на ее поверхности
упадет до равновесной. Карлсон предположил, что при весьма
малых скоростях протекания раствора именно на таком расстоя-
нии от края образуются дефекты в крупных кристаллах ADP
(«свили»), Существует и другая трудность, состоящая в том, что
концентрация на поверхности Cs, входящая в уравнение поверх-
ностной кинетики [уравнение (33.12)], меняется с движением по
поверхности, так что скорость роста также оказывается перемен-
ной величиной, зависящей от х. Как уже упоминалось, здесь
следует брать нелокальное граничное условие.
Полуэмпирические соотношения [подобные уравнению
(33.10)] для кристаллизации, растворения и плавления, связы-
вающие критерии Рейнольдса, Прандтля и Шмидта, с одной сто-
роны, с критериями Нуссельта и Шервуда (последние два про-
порциональны скоростям соответственно теплопередачи и диф-
фузии),— с другой, обсуждаются в монографии Маллина [281] и
в работах, на которые он ссылается в этой монографии.
34. ВРАЩАЮЩИЙСЯ ДИСК И УСТАНОВКА ЧОХРАЛЬСКОГО
Бартон и др. [254] исследовали влияние потока жидкости на
распределение примеси в кристаллах, которые выращивались из
расплава с примесью или специально введенной добавкой по ме-
тоду Чохральского (см. также статью Бартона и Слихтера [289]).
Как оказалось [254], задача о потоках, которые возникают в рас-
плаве при вращении цилиндрического кристалла, погруженного
своим концом в расплав, аналогична задаче о вращающемся
диске, погруженном в жидкость. Задача о вращающемся диске
была исследована Карманом и Кокреном (см. [283]); это одна
из тех немногочисленных задач, для которых известно точное
решение уравнений Навье — Стокса. Задача о диске в свою оче-
редь близка к задаче о действии центробежного насоса, в кото-
ром слой жидкости около диска переносится параллельно его
поверхности силами трения, а затем выбрасывается наружу под
действием центробежной силы. На место отброшенной жидкости
VIII. ГИДРОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
617
поступает другая, подтягиваемая к вращающемуся диску вдоль
оси системы. Ясно, что поток в данном случае трехмерен и что
все три его составляющие (касательная, радиальная и осевая)
не равны нулю. Скорость осевого потока, направленного к диску,
быстро спадает вблизи него, так как здесь возникают радиаль-
ное и касательное течения. Толщина гидродинамического погра-
ничного слоя, соответствующего этой задаче, т. е. слоя жидко-
сти, который «несет» на себе диск, вращающийся с угловой ско-
ростью (о, приближенно выражается следующим образом [283]:
НЯ’- <34-»
В этом слое на расстоянии х от диска скорость и осевого потока,
направленного по нормали к диску, описывается приближенным
выражением
u = 0,51o’W. (34.2)
Чтобы найти толщину диффузионного пограничного слоя бс для
разбавленного раствора с концентрацией С, следует записать
уравнение сохранения вещества, которое в системе координат,
неподвижной относительно поверхности диска, имеет в стацио-
нарном состоянии вид
о-г?--(“ + ^-37=° <34-3»
(vg — скорость роста). При этом граничные условия запишутся
в виде
С->СХ при х->оо (34.4)
и
(Cs-CT)vg + D^ = 0 при х = 0. (34.5)
Последнее соотношение представляет собой условие сохранения
количества растворенного вещества на поверхности раздела фаз,
где концентрация равна Cs; Ст — его концентрация в твердой
фазе. Решая эту систему для значений и, описываемых форму-
лой (34.2), получаем, что при х = 0 концентрация С = Cs; сле-
довательно,
6*00
Cs~CT
= | ехр{~[Х + адМХ
о
(34.6)
где В = (0,51/3) a X = VgXfD. Чтобы определить бс,
предположим, что в пределах слоя толщиной дс полная скорость
осевого потока в точности равна скорости роста vg и что С = Соо
при х = бс. Таким образом, возникает диффузионная задача,
618
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
подобная описываемой уравнением (34.3) при и = 0; ее реше-
ние имеет вид
С --с- =ехр -/(б₽-х)1. (34.7)
©о Т J
Вычисление этого выражения при х = 0 с использованием соот-
ношения (34.6) и его численного интегрирования дает толщину
диффузионного пограничного слоя
. (34.8)
Если предположение о локальном равновесии на поверхности
раздела фаз справедливо, то равновесный и эффективный коэф-
фициенты распределения примеси определяются соответственно
следующим образом: k0 = Ct/Cs и &эфф = Ст/Сх. Тогда из урав-
нения (34.7) при х — 0 имеем
*эфф = k0 + [exp {- (оХ/^)>] 0 ~ *о) ’ (34'9)
где толщина 6С выражается формулой (34.8). Эффективный ко-
эффициент распределения может принимать любое значение
между kQ и единицей. При полном перемешивании (6С—>0)
кЭфф—*£0; без перемешивания (6С —»оо) рост лимитируется диф-
фузией и &Эфф приближается к единице. Бартон и др. [290] про-
вели экспериментальное исследование роста легированного сурь-
мой германия по методу Чохральского. На фиг. 41 представлены
полученные ими данные вместе с результатами расчета по фор-
муле (34.9) (сплошные кривые на графике). Коэффициент диф-
фузии D, полученный сопоставлением теории и эксперимента,
имеет приемлемую величину. Зиф и Уилкокс [252], взяв значения
&эфф, измеренные посредством различных методик, и известные
значения D, вычислили по формуле (34.9) толщину 6С, которая
в зависимости от способа и интенсивности перемешивания ле-
жала в интервале от 1 до 10-3 см.
Теорию теплоотвода и диффузии от вращающегося диска
уточнили Спэрроу и Грегг [291]; в таком виде она была исполь-
зована Эмануэлем и Оландером [292] (см. также [252]). В част-
ности, выражение (34.8) было распространено на системы с лю-
бым числом Шмидта Sc = v/D, хотя это выражение и является
неплохим приближением при Sc > 1. Эмануэль и Оландер [292]
исследовали растворение в воде кристаллов бензойной кислоты
и других веществ с большими числами Шмидта, добившись хо-
рошего согласия с теорией.
Экспериментальные (по большей части качественные) иссле-
дования потоков жидкости при выращивании кристаллов по
Чохральскому проводились разными авторами. Чаще всего это
VIII. ГИДРОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
610
были модельные опыты с водой, глицерином и т. д. Как правило,
такие исследования качественно подтверждают существование
восходящих потоков жидкости в направлении к поверхности вра-
щающегося кристалла. Однако при часто применяющемся одно-
временном вращении кристалла и тигля распределение потоков
Фиг. 41. Зависимость эффективного коэффициента распределения при-
меси &Эфф от скорости роста vg при выращивании кристаллов германия,
легированного сурьмой, по Чохральскому при разных скоростях враще-
ния [290].
Экспериментальные данные: • —со=57 об/мин; О—со= 144 об/мин; Д—со=1440 об/мин;
соответствующие им сплошные кривые —теоретические результаты; / —(5с/£ = 165 с/см;
^—бс/Л = 104 с/см; 3—6JZ)=33 с/см.
жидкости носит иной и более сложный характер; еще сложнее
картина распределения потоков при тепловой конвекции, возни-
кающей под действием градиента температуры (этот случай по-
дробно анализируется ниже в связи с выращиванием кристаллов
в горизонтальной лодочке). Исследования гидродинамики при
росте по Чохральскому были проведены, в частности, Госсом и
Эддингтоном [293], Туровским и Мильвидским [294], Робертсоном
[295] (последний установил, что существует минимум скорости
вращения кристалла, при которой формируется восходящий по-
ток жидкости), Каррузерсом [296], который исследовал тепловую
520
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
конвекцию в связи с радиальным распределением примеси
(см. также [252]). На схемах фиг. 42, заимствованных у Карру-
зерса, видно, насколько сложным может быть распределение
6 2 25 об/мин
потоков при тепловой кон-
векции и вращении. Уил-
кокс и Фулмер [297] на-
блюдали турбулентный
поток (а не ламинарный,
как в перечисленных ис-
следованиях) , возникаю-
щий под действием боль-
ших вертикальных темпе-
ратурных градиентов при
выращивании кристаллов
CaF2 по Чохральскому
в области температур
1400—1500 °C.
Хэрл [298] воспользо-
вался гидродинамической
теорией Бартона и др.
[254] для расчета концен-
трационного переохлаж-
дения при выращивании
кристаллов по Чохраль-
скому (см. также [299]).
Брайс [287] также пользо-
вался этой теорией для
истолкования скоростей
роста кристаллов из рас-
твора при постоянном за-
данном пересыщении по-
добно тому, как это дела-
лось в уже рассмотренном
случае плоской пластины.
Дополнительный анализ
Фиг. 42. Схема распределения потоков
жидкости при выращивании кристаллов
по Чохральскому в модельном опыте с про-
зрачной жидкостью при тепловой конвек-
ции в отсутствие вращения (а), при вра-
щении кристалла (б, в) и при вращении
тигля (г, д) [296].
гидродинамики вращающегося диска был проведен Левичем
[300], который отметил, что предположение о ламинарности по-
тока справедливо вплоть до Re^lO4. Он же рассмотрел задачу
о диске в турбулентном потоке.
35. обтекание шара
Как уже указывалось, гидродинамическую задачу об обтека-
нии шара радиусом R потоком со скоростью v для очень малых
чисел Рейнольдса (Re = 2vRlv 1) точно решил Стокс, а сама
она носит теперь название задачи Стокса. Соответствующая за-
VIII. ГИДРОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
521
дача о переносе вещества к сфере или от нее решена Левичем
[300]. При такой конфигурации область, в которой поток жидко-
сти искажен, сравнима по величине с размером шара, что не
позволяет говорить о гидродинамическом пограничном слое. Тем
не менее если коэффициент диффузии мал (Sc > 1), то суще-
ствует диффузионный пограничный слой. Следовательно, урав-
нение конвективной диффузии [т. е. аналог уравнения (33.5),
записанный применительно к массопереносу] можно решать в
приближении пограничного слоя, воспользовавшись распределе-
нием скоростей, найденным Стоксом. Согласно такому решению,
Поток
Фиг. 43. Области с разными механизмами массопереноса при очень медлен-
ном обтекании шара (обтекание по Стоксу) [301].
поток вещества к поверхности шара выражается формулой [300]
у D(Cqo Cs)/ 3v у/з___________________sin 0___ /35
1,15 [16DR2/ [0 —1/2 (sin 20)]1/з ’ '
Здесь Cs — концентрация на поверхности шара, которая счи-
тается постоянной, а 0 — угол с вершиной в центре шара, отсчи-
тываемый от точки набегания. Поток вещества максимален в
точке набегания 0 = 0 и убывает, обращаясь в нуль, в точке
0 = л на корме шара. Зих и Нейман [301], проанализировавшие
эту задачу подробнее, установили, что уравнение (35.1) не впол-
не справедливо в кормовой части шара, так как толщина диффу-
зионного слоя там сравнима с размером шара. Авторы выделили
пять областей, различающихся по механизму массопереноса, как
показано на фиг. 43. В области 1 концентрация постоянна, а об-
ласть 2 — диффузионный пограничный слой. В области 3 отно-
шение конвекционного потока вещества к диффузионному боль-
ше, чем это принято в приближении пограничного слоя, так что
здесь расчет массопереноса проводился иначе. Проанализирован
массоперенос и в областях 4 и 5. Как оказалось, поток вещества
к корме шара опять очень мал. (Заметим, что условию Re = 1
соответствует движение шара диаметром 1 мм в воде со
522
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
скоростью ~1 мм/с.) Нильсен [115] исследовал процесс осажде-
ния при одновременном действии конвекции и диффузии.
Гэллоуэй и Сэйдж [302,303] составили обзор работ, посвя-
щенных исследованию переноса вещества к шару или от него
при числах Re до 10б с охватом явления отрыва линий тока от
поверхности шара, а также области турбулентности. Эти авторы
установили полуэмпирическую зависимость коэффициента пере-
носа от угла, числа Рейнольдса и других параметров.
36. ЕСТЕСТВЕННАЯ ТЕПЛОВАЯ КОНВЕКЦИЯ
И РОСТ КРИСТАЛЛОВ В ГОРИЗОНТАЛЬНОЙ ЛОДОЧКЕ
Ютек и др. [304—307], Коул и Вайнгард [308], Хэрл [309, 310],
а также Хэрл и др. [311] исследовали потоки жидкости в длин-
ных горизонтальных сосудах (лодочках) при выращивании кри-
сталлов из расплава. Такие потоки, возникающие без перемеши-
вания или иного вносимого извне перемещения, называются
естественной, или тепловой, конвекцией и обусловлены разли-
чием плотностей и действием сил тяготения.Ч4звестны теоретиче-
ские исследования родственных задач, в том числе задач о кон-
вективном переносе тепла от нагретой вертикальной пластины
[284], о переносе тепла между двумя близко расположенными
вертикальными пластинами [312] и о переносе тепла между
двумя подогреваемыми снизу горизонтальными пластинами [213]
(классическая задача Рэлея — Бенара). Однако частный случай
тепло- и массопереноса в длинном горизонтальном сосуде, тем-
пература жидкости на концах которого различна, по-видимому,
теоретически не исследован. Некоторое представление о рас-
пределении потоков в таком сосуде при естественной конвекции
дает модельный опыт, поставленный Россби [313]. В этом опыте
прозрачный сосуд с прозрачной жидкостью помещали на гори-
зонтальном алюминиевом бруске, который служил основанием
контейнера. Вдоль этого бруска создавали градиент темпера-
туры. Распределение потоков было видно по движению взвешен-
ных частиц алюминия. По дну контейнера шел поток от холод-
ного конца к более теплому, затем у нагретого конца он подни-
мался, шел по поверхности от горячего конца к холодному и там
опускался; кроме того, по всей длине контейнера существовали
потоки, опускающиеся от поверхности вниз. Слой жидкости на
дне был холоднее, чем у поверхности контейнера. На фиг. 44
[306] схематически представлены такие же потоки, которые на-
блюдались визуально в горизонтальной лодочке с прозрачным
расплавом хлористого натрия при скорости потоков около
2,5 см/с. Наряду с ними видны и ячейки с восходящими и нисхо-
дящими потоками. При продольных градиентах температуры
около 30°С/см наблюдаемые потоки были по большей части
VIII. ГИДРОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
523
турбулентными, что можно было заметить на киноленте по дви-
жению маленьких посторонних частиц [306]. Турбулентный ха-
рактер движения регистрировался также по случайным колеба-
ниям температуры, фиксируемым погруженной в жидкость тер-
мопарой. Подобные колебания температуры наблюдали до этого
Коул и Вайнгард [308], приписавшие их влияние тепловой кон-
векции. Распределение потоков жидкости при кристаллизации
металлов нельзя наблюдать визуально, однако в расплаве Sn
наблюдались подобные же случайные колебания температуры,
если ее градиенты превосходили 1,1°С/см. Колебания темпера-
туры в жидких металлах можно подавить, накладывая магнит-
ное поле напряженностью (4—6) • 10“2 Г, которое устраняет [213]
вихревые потоки, тормозя движения проводящего расплава. Это
Фиг. 44. Схема распределения потоков в горизонтальной лодочке с гори-
зонтальным градиентом температуры по данным модельного опыта с про-
зрачной жидкостью [306].
торможение можно рассматривать [307] как следствие повыше-
ния вязкости или возникновения «магнитной вязкости». Такая
вязкость превосходит собственную вязкость жидкости, если чи-
сло Хартмана М, выражаемое формулой
М* = -^(ЦН1У, (36.1)
велико по сравнению с единицей (р, — магнитная проницаемость,
Н — напряженность магнитного поля, о — электропроводность,
рь — плотность, I — характерный размер). Если турбулентности
уже нет, то для подавления сохранившегося ламинарного тече-
ния необходимо наложить еще более сильное магнитное поле.
Остановку ламинарного течения при напряженности порядка
1,2-10“l Т можно заметить по исчезновению вертикального гра-
диента температуры (вверху температура самая высокая), кото-
рый создается благодаря циркуляции жидкости по всей лодочке
(фиг. 45).
Было показано также [304,305], что, подавляя колебания тем-
пературы в расплаве InSb путем наложения магнитного поля,
можно предотвратить образование перпендикулярных направ-
лению роста примесных полос в кристаллах InSb, легированных
теллуром. Флуктуации температуры [314] приводят к флуктуа-
циям скорости роста, а следовательно, и концентрации.
t>. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Как известно (см., например, [212]), к безразмерным пара-
метрам, характерным для тепловой конвекции, относятся число
Прандтля Рг = v/xl и число Грасхофа
(36.2)
Здесь / — характерный размер, 0/ — коэффициент линейного рас-
ширения, g — ускорение силы тяжести, Д7— характерная раз-
ность температур. Однако, по-видимому, не существует соотно-
Ф и г. 45. Влияние магнитного поля на флуктуации температуры и на
вертикальный градиент температуры.
Горизонтальная лодочка с жидким оловом при наличии горизонтального градиента тем
пературы [307J.
шения, из которого следовало бы, какому числу Грасхофа соот-
ветствует установление турбулентности (поскольку характерная
скорость отсутствует, то нет и определенного числа Рейнольдса).
В классической задаче Бенара число Gr имеет порядок 50 000,
но там турбулентность возникает из-за распада ячеек, а в гори-
зонтальной лодочке распределение потоков, как уже было пока-
зано, совершенно иное (см. [315], а также дискуссию по [315]).
Хэрл [309, 310] и Хэрл и др. [311] наблюдали независимо от
Ютека колебания температуры в горизонтальной лодочке, а так-
же подавление этих колебаний и одновременно с ними примес-
ных полос наложением магнитного поля на проводящий легиро-
ванный расплав. Однако некоторые колебания, наблюдавшиеся
Хэрлом, носили правильный синусоидальный характер в отличие
VIH. ГИДРОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
525
от колебаний, которые наблюдал Ютек. Период колебаний ока-
зался пропорциональным длине лодочки. Причина такой разно-
речивости наблюдаемых явлений неясна. Хэрл объяснил сину-
соидальные колебания избыточной устойчивостью, понятие о ко-
торой ввел Чандрасекар [215]; такие колебания наблюдались до
этого во вращающейся установке Бенара с жидкой ртутью.
37. ПОТОКИ ЖИДКОСТИ, ВОЗНИКАЮЩИЕ
ИЗ-ЗА РАЗЛИЧИЯ ПЛОТНОСТЕЙ КРИСТАЛЛА И РАСПЛАВА
Потоки такого происхождения уже рассматривались в гл. III
в связи с задачами Стефана. Теоретическое исследование этих
потоков провел Хорвей [84,316], использовавший результаты тео-
ретической работы Шамбре [317] и экспериментального исследо-
вания кристаллизации никеля из переохлажденного расплава,
проведенного Уолкером [44]. Если начальный радиус зародыша
равен нулю [84], то фронт кристаллизации перемещается пропор-
ционально f/a. Хорвей [316] показал, что напор жидкости создает
при t = 0 бесконечное отрицательное давление на поверхности
шарообразного зародыша с нулевым начальным размером. По-
этому он рассмотрел более реальный случай, когда зародыш
имеет конечный размер, учтя при этом зависимость температуры
плавления от давления. Расчет приводит все же к очень большим
отрицательным давлениям; предполагается, что в результате про-
исходит кавитация и, как следствие, зарождение, наблюдавшееся
в экспериментах Уолкера.
ЛИТЕРАТУРА
1. Turnbull D., в книге Advances in Materials Research in NATO Nations,
Oxford, 1963, p. 55.
2. Mott N. F., Disc. Farad. Soc., 5, 11 (1949) (есть перевод: Новые иссле-
дования по кристаллографии и кристаллохимии, сб. 1 «Рост кристаллов»,
ИЛ, 1950, стр. 15).
3. Frank F. С., в книге Growth and Perfection of Crystals, New York, 1958,
p. 3.
4. Frank F. С., в книге Encyclopedic Dictionary of Physics, Oxford, 1961,
Vol. 2, p. 208.
5. Nakaya U., Snow Crystals, Harvard Univ. Press, Cambridge, Mass., 1954.
6. Herring C., Phys. Rev., 82, 87 (1951).
7. Uhlenbeck G. E., Ford G. W., Lectures in Statistical Mechanics, Am. Math.
Soc., Providence, Rhode Island, 1963.
8. Widom B., Science, 157, 375 (1967).
9. Turnbull D., Solid State Phys., 3, 225 (1956).
10. Temperley H. N. V., Changes of State, Cleaver-Hume, London, 1956.
11. Herring С., в книге Structure and Properties of Solid Surfaces, Chicago,
Illinois, 1953, p. 5.
12. Mullins W. W., в книге Metal Surfaces: Structure, Energetics and Kinetics,
Cleveland, Ohio, 1963, p. 17.
13. Cabrera N,, Coleman R. V., в книге The Art and Science of Growing
Crystals, New York, 1963, p. 3. (есть перевод: Теория и практика выра-
щивания кристаллов, изд-во «Металлургия», 1968, стр. 9).
14. Cabrera Н., в книге Solid Surfaces, Amsterdam, 1964, р. 320.
15. Frank F. С., в книге Metal Surfaces: Structure, Energetics and Kinetics,
Cleveland, Ohio, 1963, p. 1.
16. Cahn J. W., Hilliard J. E., Journ. Chem. Phys., 28, 258 (1958).
17. Чернов А. А., Успехи физич. наук, 73, 277 (1961).
18. DeGroot S. R., Mazur P., Non-Equilibrium Thermodynamics, Amsterdam,
1962.
19. Christian J. W., The Theory of Transformations in Metals and Alloys, Ox-
ford, 1965.
20. Onsager L., Phys. Rev., 37, 405; 38, 2265 (1931).
21. Tiller W. A., Journ. Appl. Phys., 34, 3615 (1963).
22. Kirkaldy J. S., в книге Decomposition of Austenite by Diffusional Proces-
ses, New York, 1962, p. 39. .
23. Zemansky M. W., Heat and Thermodinamics, New York, 1943.
24. Huang K., Statistical Mechanics, New York, 1963.
25. Uhlenbeck G. E., et al., Statistical Physics, New York, 1963,
ЛИТЕРАТУРА
527
26. Cohen Е. G. D., в книге Fundamental Problems in Statistical Mechanics,
Vol. II, New York, 1968.
27. Kahn В., в книге Studies in Statistical Mechanics, Amsterdam, Vol. 3,
1965, p. 289.
28. Morse P. M., Thermal Physics, New York, 1964 (есть перевод: Морс Ф. М.,
.Теплофизика, изд-во «Наука», 1967).
29. Onsager L., Phys. Rev., 65, 117 (1944).
30. Lee T. D., Yang C. N., Phys. Rev., 87, 410 (1952).
31. Domb C„ Adv. Phys., 9, 149 (1960).
32. Liquids: Structure, Properties, Solid Interactions, ed. T. J. Hughel, Amster-
dam, 1965.
33. Ubbelohde A. R., Melting and Crystal Structure, London — New York,
1965 (есть перевод: Уббелоде 4., Плавление и кристаллическая струк-
тура, изд-во «Мир», 1969).
34. Brout R., Phase Transition, New York, 1965.
35. Lennard-Jones J. E., Devonshire A. F., Proc. Roy. Soc., A169, 317 (1938);
Al70, 464 (1939).
36. DeBoer J., Proc. Roy. Soc., A215, 4 (1952).
37. Henderson D., Barker J. A., Molecular Phys., 14, 587 (1968).
38. Phase Stability in Metals and Alloys, eds. Rudman P. S., Stringer J.,
Jaffee R. L, New York, 1967, p. 554, 572.
39. Alder B. J., Wainwright T. E., Journ. Chem. Phys., 27, 1208 (1957);
Wood W. W., Jacobson J. D., Journ. Chem. Phys., 27, 1207 (1957).
40. Burton W. K., Cabrera N., Disc. Farad. Soc., 5, 33 (1949) (есть перевод:
Новые исследования по кристаллографии и кристаллохимии, сб. I «Рост
кристаллов», ИЛ, 1950, стр. 31).
41. Burton W. К., Cabrera V., Frank F. С., Trans. Roy. Soc., A243, 299 (1951)
(есть перевод: Элементарные процессы роста кристаллов, ИЛ, 1959,
стр. 11).
42. Jackson К. А., в книге Growth and Perfection of Crystals, eds. R. H. Do-
remus, B. W. Roberts, D. Turnbull, New York, 1958, p. 319.
43. Jackson K. 4., в книге Liquid Metals and Solidification, Cleveland, Ohio,
1958, p. 174.
44. Walker J. L., в книге Physical Chemistry of Process Metallurgy, Pt. 2, ed.
G. R. St. Pierre, New York, 1961, p. 845.
45. Rice S. 4., в книге Liquids: Structure, Properties, Solid Interactions, ed.
T. J. Hughel, Amsterdam, 1965, p. 51.
46. Stefan J., Ann. Phys. Chem., (n. F.), 42, 269 (1891) [Ann. Phys., 278].
47. Morris P. J., Kirtisinghe D., Strickland-Constable R. F., Journ. Crystal
Growth, 2, 97 (1968).
48. Wilcox W. R., Duty R. L.t Journ. Heat Transfer, 88c, 45 (1966).
49. Friedman 4., Partial Differential Equations of Parabolic Type, Englewood
Cliffs, N. J., 1964.
50. Bankoff S. G., Adv. Chem. Eng., 5, 75 (1964).
51. Carslaw H. S., Jaeger J. C., Conduction of Heat in Solids, London and
New York, 1959 (есть перевод: Карслоу Г., Егер Д., Теплопроводность
твердых тел, изд-во «Наука», 1964).
52. Хорвей Г., Ипж.-физич. журн., 8, 779 (1965).
53. Weber Н., Die Partiellen Differential-Gleichungen der Mathematischen
Physik, Vol. 2, Braunschweig, 1901.
54. Frank F. C, Proc. Roy. Soc., A201, 586 (1950).
528
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
55. Langford D., Quart. Appl. Math., 24, 315 (1967).
56. Любов Б. Я., ДАН СССР, 68, 847 (1949).
57. Любов Б. Я., Ройтбурд А. Л., Темкин Д. Е, в сб. «Рост кристаллов»,
т. 3, Изд-во АН СССР, 1961, стр. 68.
58. Борисов Б. Т., Любов Б. Я., Темкин Д. Е., ДАН СССР, 104, 223 (1955).
59. Rieck, Thesis, 1924.
60. Huber A., Zs. angew. Math. Meeh., 19, 1 (1939).
61. Иванцов Г. 77, ДАН СССР, 58, 567 (1947).
62. Zener С., Journ. Appl. Phys., 20, 950 (1949).
63. Иванцов Г. П., в сб. «Рост кристаллов», т. I, Изд-во АН СССР, 1957,
стр. 98.
64. Crank L, The Mathematics of Diffusion, London — New York, 1956.
65. Bunn C. W., Disc. Farad. Soc, 5, 132 (1949) (есть перевод: Новые иссле-
дования по кристаллографии и кристаллохимии, сб. I «Рост кристаллов»,
ИЛ, 1950, стр. 98).
66. Humphreys-О wen S. Р. F.t Disc. Farad. Soc., 5, 144 (1949) (есть перевод:
Новые исследования по кристаллографии и кристаллохимии, сб. I «Рост
кристаллов», ИЛ, 1950, стр. 106).
67. Темкин Д. Е, Инж.-физич. журн, 5, 89 (1962).
68. Ham F. S, Journ. Phys. Chem. Solids, 6, 335 (1958).
69. Ham F. S, Journ. Appl. Phys, 30, 1518 (1959).
70. Ham F. S, Quart. Appl. Math, 17, 137 (1959).
71. Growth and Perfection of Crystals, eds. R. H. Doremus, B. W. Roberts,
D. Turnbull, New York, 1958.
72. Morse P. M., Feshbach H., Methods of Teoretical Physics, New York, 1953
(есть перевод: Морс Ф. М., Фешбах Г., Методы теоретической физики,
ИЛ, 1960).
73. Horvay G., Cahn J. W., Acta Met, 9, 695 (1961).
74. Иванцов Г. П., в сб. «Рост кристаллов», т. 3, Изд-во АН СССР, 1961,
стр. 75.
75. Papapetrou A, Zs. Kristallogr, 92, 89 (1935).
76. Jahnke Е., Emde F., Losch F., Tables of Higher Functions, New York,
1960 (есть перевод: Янке E., Эмде Ф., Леш Ф., Специальные функции,
изд-во «Наука», 1964).
77. Иванцов Г. 77, ДАН СССР, 83, 573 (1952).
78. Seeger A, Phil. Mag, 44, 1 (1953).
79. Fisher J. С., неопубликованная работа.
80. Chalmers В., Principles of Solidification, New York, 1964 (есть перевод:
Чалмерс Б., Теория затвердевания, изд-во «Металлургия», 1968).
81. Иванцов Г. 77, ДАН СССР, 81, 179 (1951).
82. Rutter J. IF, Chalmers В., Canad. Journ. Phys, 31, 15 (1953).
83. Любов Б. Я., Темкин Д. Е, в сб. «Рост кристаллов», т. 3, Изд-во АН
СССР, 1961, стр. 59.
84. Horvay G., в книге Proc. 4th Natl. Cong. Appl. Meeh. ASME, 1962, p. 1315.
85. Glicksman M. E., Acta Met, 13, 1231 (1965).
86. Любов Б. Я , в сб. «Рост кристаллов», т. 5, изд-во «Наука», 1965, стр. 100.
87. Чернов А. А, Любов Б. Я., в сб. «Рост кристаллов», т. 5, изд-во «Наука»,
1965, стр. 11.
88. Schaefer R. J., Glicksman М. Е., Journ. Crystal Growth, 5, 44 (1969).
ЛИТЕРАТУРА
529
89. Cosgrove G. J., Acta Met., 13, 1209 (1965).
90. Темкин Д. И., ДАН СССР, 132, 1307 (1960).
91. Bolling G. F., Tiller W. A., Journ. Appl. Phys., 32, 2587 (1961).
92. Темкин Д. E, Кристаллография, 7, 446 (1962).
93. Nabarro F. R. N., Jackson P. J., в книге Growth and Perfection of Crys-
tals, eds. R. N. Doremus, B. W. Roberts and D. Turnbull, New York, 1958,
p. 13.
94. Sears G, W„ Acta Met., 3, 361 (1955).
95. Ditimar W., Neumann K., Zs. Electrochem., 64, 297 (1960).
96. Blakely J. M., Jackson K. A., Journ. Chem. Phys., 37, 428 (1962).
97. Gomer R., Journ. Chem. Phys., 28, 457 (1958).
98. Gomer R.t Journ. Chem. Phys., 38, 273 (1963).
99. Ruth V., Hirih J. P„ Journ. Chem. Phys., 41, 3139 (1964).
100. Simmons J. A., Parker R. L., Howard R. E., Journ. Appl. Phys., 35, 2271
(1964).
101. Simmons J. A., Oser H., Coriell S. R., в книге Crystal Growth, ed.
H. S. Peiser, Suppl. Journ. Phys. Chem. Solids, Oxford, 1967, p. 255.
102. Berlad A. L.t Gen. Dynamics/Astronaut. Rept., Jan. 1963.
103. Berlad A. L., в книге Proc. Heat Trans. Fluid Meeh. Inst., 1964, Stanford,
California, 1964, p. 100.
104. Berlad A. L., Journ. Chem. Phys., 40, 282 (1964).
105. Hillig W. В., в книге Growth and Perfection of Crystals, New York, 1958,
p. 350.
106. Kirtisinghe D., Strickland-Constable R. F., Nature, 204, 465 (1964).
107. Tammann G., The States of Aggregation, Princeton, N. J., 1925.
108. Michaels A. S, Brian P. L. T., Sperry P. R., Journ. Appl. Phys., 37, 4649
(1966).
109. Coriell S. R., Parker R. L., Journ. Appl. Phys., 36, 632 (1965).
110. Cahn J. W„ Hilliard J. E., Journ. Chem. Phys., 31, 688 (1959).
111. Gibbs J. W., Collected Works, Vol. 1, Yale Univ. Press, New Haven, Con-
necticut, 1948.
112. Hirth J. P.t Pound G. M., Progr. Mater. Sci., 11, 1 (1963) (есть перевод:
Хирс Д., Паунд F.t Испарение и конденсация, изд-во «Металлургия»,
1966).
113. Uhlmann D. R., Chalmers B.t Ind. Eng. Chem., 57 (9), 19 (1965).
114. Feder J., Russell К. C., Lothe J.t Pound G. M., Advan. Phys., 15, 111
(1966).
115. Nielsen A. E., Kinetics of Precipitation, Oxford, 1964.
116. Walton A. G., The Formation and Properties of Precipitates, New York,
1967.
117. Pashley D. W.t Advan. Phys, 14, 327 (1965).
118. Volmer M.t Weber A., Zs. Phys. Chem, 119, 277 (1926).
Ц9. Becker R.t Doring W„ Ann. Phys, 24, 719 (1935).
120. Pound G. M., Simnad M. T., Yang L., Journ. Chem. Phys, 22, 1215
(1954).
121. Hardy S. C„ в книге Crystal Growth, ed. H. S. Peiser, Suppl. Journ. Phys.
Chem. Solids, Oxford, 1967, p. 287 (есть перевод: Проблемы роста кри-
сталлов, изд-во «Мир», 1968, стр. 323).
530
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
122. Gretz R. D., Pound G. M.t в книге Condensation and Evaporation of So-
lids, eds. E. Rutner, P. Goldfinger, J. P. Hirth, New York, 1964, p. 575.
123. Moazed K. L., Pound G. M., Trans. AIME, 230, 234 (1964).
124. Walton D., Phil. Mag., 7, 1671 (1962).
125. Rhodin T. N.t Walton D., в книге Single-Crystal Films, eds. H. H. Fran-
come, H. Sato, New York, 1964, p. 31 (есть перевод: Монокристаллические
пленки, изд-во «Мир», 1966, стр. 44).
126. Chalmers В., в книге Liquids: Structure, Properties, Solid Interactions, ed.
T. J. Hughel, Amsterdam, 1965, p. 308.
127. Hunt J. D., Jackson K. A., Journ. Appl. Phys., 37, 254 (1966).
128. Courtney W. G.t Journ. Chem. Phys., 36, 2009 (1962).
129. Buckle E. R., Ubbelohde A. R., Proc. Roy. Soc., A261, 197 (1961).
130. Burke J., The Kinetics of Phase Transformations in Metals, Oxford, 1965.
131. Cahn J. W., Acta Met., 9, 795 (1961) [есть перевод: Успехи физич. наук,
91, 677 (1967)].
132. Френкель Я. И., Кинетическая теория жидкостей, Изд-во АН СССР,
1945, стр. 424.
133. Hill Т. L.t Statistical Mechanics, New York, 1956 (есть перевод: Хилл T.f
Статистическая механика, ИЛ, 1960).
134. Stillinger F. Н., Jr., Journ. Chem. Phys., 47, 2513 (1967).
135. Kikuchi R., Ann. Phys., 10, 127 (1960).
136. Kikuchi R„ Ann. Phys., 11, 328 (1960).
137. Kikuchi R., в книге Crystal Growth, ed. H. S. Peiser, Suppl. Journ. Phys.
Chem. Solids, Oxford, 1967, p. 605 (есть перевод: Проблемы роста кри-
сталлов, изд-во «Мир», 1968, стр. 343).
138. Kikuchi R., Phys. Rev., 81, 988 (1951).
139. Herring С., в книге Structure and Properties of Thin Films, eds. C. A. Neu-
gebauer, J. B. Newkirk, D. A. Vermilyea, New York, 1959, p. 527.
140. Solid Surfaces, ed. H. C. Gatos, Amsterdam, 1964.
141. Juretschke H. J., в книге Structure and Properties of Thin Films, New
York, 1959, p. 538.
142. Johnson C. A., Chakerian G. D., Journ. Math. Phys., 6, 1403 (1965).
143. Moore A. J. W., в книге Metal Surfaces: Structure, Energetics and Kine-
tics, Cleveland, Ohio, 1963, p. 155.
144. Hirth J. P., в книге Energetics in Metallurgical Phenomena, ed. W. M. Muel-
ler, Vol. II, New York, 1965, p. 1.
145. Widom B., Journ. Chem. Phys., 43, 3892 (1965).
146. Cabrera N., в книге Growth and Perfection of Crystals, New York, 1958,
p. 324.
147. Темкин Д. E., в сб. «Механизм и кинетика кристаллизации», изд-во
«Наука и техника», Минск, 1967, стр. 86.
148. Mullins W. W.t Acta Met., 7, 746 (1959).
149. Воронков В. В., Чернов А. А., в книге Crystal Growth, Suppl. Journ.
Phys. Chem. Solids, Oxford, 1967, p. 179.
150. Kerr H. W., Winegard W. С., в книге Crystal Growth, Suppl. Journ. Phys.
Chem. Solids, Oxford, 1967, p. 179.
151. Mutajtschiev В., в книге Adsorption et Croissance Cristalline, Colloq.
Intern. Centre Natl. Rech. Sci. (Paris), No. 152, 1965, p. 231.
152. Gruber E. E., Mullins W. W., Journ. Phys. Chem. Solids, 28, 875
(1967)
ЛИТЕРАТУРА
531
153. Mackenzie J. К., Moore A. J. W., Nicholas J. F., Journ. Phys. Chem. So-
lids, 23, 185 (1962).
154. Benson G. C., Yun K. S., в книге The Solid-Gas Interface, ed. E. A. Flood,
New York, 1967, p. 203.
155. Sundquist В. E., Acta Met., 12, 67 (1964).
156. Winterbottom W. L.t Gjostein N. A., Acta Met., 14, 1033, 1041 (1966).
157. Shewmon P. G.t Robertson W. M.t в книге Metal Surfaces: Structure, Ener-
getics, and Kinetics, ASM, Cleveland, Ohio, 1963, p. 67.
158. Kossel W., Nachr. Gesell. Wiss. Gottingen, Math.-Phys. KI, 135 (1927).
159. Френкель Я. И., ЖЭТФ, 16, 39 (1946).
160. Frank F. C.t Disc. Farad. Soc., 5, 48 (1949) (есть перевод: Новые иссле-
дования по кристаллографии и кристаллохимии, сб. I «Рост кристаллов»,
ИЛ, 19S0, стр. 41).
161. Stranski I. N., Kaischew R., Zs. Kristallogr., 78, 373 (1931).
162. Hartman P., Perdok W. G.t Acta Cryst., 8, 49, 521, 525 (1955).
163. Hartman P.t в книге Physics and Chemistry of the Organic Solid State,
eds. D. Fox, M. M. Labes, A. Weissberger, New York, 1963, p. 369.
164. Gjostein N. А., в книге Metal Surfaces: Structure, Energetics and Kinetics,
ASM, Cleveland, Ohio, 1963, p. 99.
165. Choi J. Y., Shewmon P. G.t Trans. AIME, 230, 123 (1964).
166. Gjostein N. A., Winterbottom W. L.t в книге Fundamentals of Gas-Surface
Interactions, eds. H. Saltsburg, J. N. Smith, M. Rogers, New York, 1967,
p. 42.
167. Knacke O.t Stranski I. N.t Progr. Met. Phys., 6, 181 (1956) (есть перевод:
Успехи физики металлов, т. III, Металлургиздат, 1960, стр. 222).
168. Cabrera N.t Disc. Farad. Soc., 28, 16 (1959).
169. Zwanzig R. W., Journ. Chem. Phys., 32, 1173 (1960).
170. Trilling L.t в книге Fundamentals of Gas-Surface Interactions, eds. H. Salts-
burg, J. N. Smith, M. Rogers, New York, 1967, p. 392.
171. Cabrera N., Levine M. M., Phil. Mag., 1, 450 (1956) (есть перевод: Эле-
ментарные пр’оцессы роста кристаллов, ИЛ, 1959, стр. 152).
172. Hirth J. P.t Pound G. M.t Journ. Chem. Phys., 26, 1216 (1957) (есть пере-
вод: Элементарные процессы роста кристаллов, ИЛ, 1959, стр. 191).
173. Hirth J. P.t Pound G. М., Acta Met., 5, 649 (1957) (есть перевод: Эле-
ментарные процессы роста кристаллов, ИЛ, 1959, стр. 217).
174. Schwoebel R. L.t Journ. Appl. Phys., 38, 1759 (1967).
175. Cabrera N.t в книге Structure and Properties of Solid Surfaces, eds.
R. Gomer, C. S. Smith, Chicago, 1953, p. 294.
176. Frank F. C., Acta Cryst., 4, 497 (1951).
177. Heyer H., Angew. Chem., 78, 130 (1966).
178. Heyer H.t в книге Crystal Growth, ed. H. S. Peiser, Suppl. Journ. Phys.
Chem. Solids, Oxford, 1967, p. 265.
179. Schwoebel R. L.t в книге Solid Surfaces, ed. H. C. Gatos, Amsterdam,
1964, p. 356.
180. Bethge H.t в книге Crystal Growth, ed. H. S. Peiser, Suppl. Journ. Phys.
Chem. Solids, Oxford, 1967, p. 623 (есть перевод: Проблемы роста кри-
сталлов, изд-во «Мир», 1968, стр. 295).
181. Schwoebel R. L.t Journ. Appl. Phys., 38, 672 (1967).
182. Bennema P.y в книге Crystal Growth, ed. H. S. Peiser, Suppl. Journ. Phys.
Chem. Solids, Oxford, 1967, p. 413,
532
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
183. Forty A. J., Phil. Mag., 43, 377 (1952).
184. Newkirk J. В., Acta Met., 3, 121 (1955).
185. Козловский M. И., в сб. «Рост кристаллов», т. 3, Изд-во АН СССР, 1961,
стр. 137.
186. Heck С. М„ Phys. Rev., 51, 686 (1937).
187. Growth and Perfection of Crystals, eds. R. H. Doremus, B. W. Roberts,
D. Turnbull, New York, 1958, p. 6.
188. Verma A. R.t Crystal Growth and Dislocations, London, 1953 (есть пере-
вод: Варма A. P., Рост кристаллов и дислокации, ИЛ, 1958).
189. Doremus R. Н., Journ. Phys. Chem., 62, 1068 (1958).
190. Nancellas G. N., Purdie N., Quart. Rev., 18, 1 (1964).
191. Bockris J. OfM.t Razumney G. A., Fundamental Aspects of Electrocrystalli-
sation, New York, 1967.
192. Jackson K. A., Uhlmann D. R.t Hunt J. D., Journ. Cryst. Growth, 1, 1
(1967) (есть перевод: Проблемы роста кристаллов, изд-во «Мир», 1968,
стр. 27).
193. Jackson К. A.t Progr. Solid State Chem., 4, 53 (1967).
194. Wilson H. A., Proc. Cambr. Phil. Soc., 10, 25 (1898).
195. Jackson K. A., Chalmers B.t Canad. Journ. Phys., 34, 473 (1956).
196. Hillig W. B.t Turnbull D., Journ. Chem. Phys., 24, 914 (1956) (есть пере-
вод: Элементарные процессы роста кристаллов, ИЛ, 1959, стр. 293).
197. Алфинцев Г, А., Овсиенко Д. Е., в книге Crystal Growth, ed. Н. S. Peiser,
Suppl. Journ. Phys. Chem. Solids, Oxford, 1967, p. 757.
198. Cahn J. Г., Hillig W. B.t Sears G. W., Acta Met., 12, 1421 (1964) [есть
перевод: Успехи физич. наук, 91, 691 (1967)].
199. Cahn J. W., Acta Met., 8, 554 (1960) [есть перевод: Успехи физич. наук,
91, 677 (1967)].
200. Turnbull D.t Journ. Phys. Chem., 66, 609 (1962).
201. Kramer J. J., Tiller W. A., Journ. Chem. Phys., 42, 257 (1965).
202. James D. W., в книге Crystal Growth, ed. H. S. Perser, Suppl. Journ.
Phys. Chem. Solids, Oxford, 1967, p. 767.
203. Frank F. С., в книге Growth and Perfection of Crystals, eds. R. H. Dore-
mus, B. W. Roberts, D. Turnbull, New York, 1958, p. 411.
204. Cabrera Vermilyea D. А., в книге Growth and Perfection of Crystals,
eds. R. H. Doremus et al., New York, 1958, p. 393.
205. Lighthill M. J.t Whitham G. B., Proc. Roy. Soc., A229, 281, 317 (1955).
206. Frank F. C., Ives M. B.t Journ. Appl. Phys., 31, 1996 (1960).
207. Ives M. B.t Journ. Appl. Phys., 32, 1534 (1961).
208. Mullins W. W.t Hirth J. P.t Journ. Phys. Chem. Solids, 24, 1391
(1963).
209. Бартини Г. P.t Дукова E. Д., Коршунов H. П., Чернов А. А., Кристалло-
графия, 8, 758 (1963).
210. Чернов А. А., Буду ров С. И., Кристаллография, 9, 388 (1964).
211. Mullins W. W., Sekerka R. F.t Journ. Appl. Phys., 34, 323 (1963) (есть
перевод: Проблемы роста кристаллов, изд-во «Мир», 1968, стр. 89).
212. Ландау Л. Д., Лифшиц Е. М., Механика сплошных сред, Гостехиздат,
1954.
213. Chandrasekhar S., Hydrodynamics and Hydromagnetic Stability, London
and New York, 1961.
ЛИТЕРАТУРА
533
214. Lin С. С., The Theory of Hydrodynamic Stability, London and New York,
1955.
215. Non-Equilibrium Thermodynamics, Variational Techniques and Stability,
eds. R. J. Donnelly, R. Herman, I. Prigogine, Chicago, Illinois, 1966.
216. Stuart J. T.t Appl. Meeh. Rev., 18, 523 (1965).
217. Ball J. G., Himmelblau D. M., Adv. Chem. Phys., 13, 267 (1967).
218. Mullins W. W.t Sekerka R. F.t Journ. Appl. Phys., 35, 444 (1964) (есть
перевод: Проблемы роста кристаллов, изд-во «Мир», 1968, стр. 106).
219. Sekerka R. F.t Journ. Appl. Phys., 36, 264 (1965).
220. Воронков В. В., ФТТ, 6, 2984 (1964).
221. Tiller W. A., Jackson К. A., Rutter J. W.t Chalmers B.t Acta Met., 1, 428
(1953).
222. Walton D.t Tiller №. A., Rutter J. W., Winegard W. C., Trans. AIME,
203, 1023 (1955).
223. Tiller W. A., Rutter J. №., Canad. Journ. Phys., 34, 96 (1956).
224. Темкин Д. E.t ДАН СССР, 133, 174 (1960).
225. Темкин Д. Е., в сб. «Кристаллизация и фазовые переходы», Изд-во АН
БССР, 1962, стр. 249.
226. Coriell S. R., Parker R. L., Journ. Appl. Phys., 37, 1548 (1966).
227. Nichols F. A., Mullins W. №., Trans. AIME, 233, 1840 (1965).
228. Shewmon P. G., Trans. AIME, 233, 736 (1965).
229. Cahn J. W., в книге Crystal Growth, ed. H. S. Peiser, Suppl. Journ. Phys.
Chem. Solids, Oxford, 1967, p. 681 (есть перевод: Проблемы роста кри-
сталлов, изд-во «Мир», 1968, стр. 127).
230. Coriell S. R.t Parker R. L.t в книге Crystal Growth, ed. H. S. Peiser,
Suppl. Journ. Phys. Chem. Solids, Oxford, 1967, p. 703 (есть перевод:
Проблемы роста кристаллов, изд-во «Мир», 1968, стр. 146).
231. Tarshis L. A., Tiller W. А., в книге Crystal Growth, ed. Н. S. Peiser,
Suppl. Journ. Phys. Chem. Solids, Oxford, 1967, p. 709 (есть перевод:
Проблемы роста кристаллов, изд'-во «Мир», 1968, стр. 1,57).
232. Seidensticker R. G.t в книге Crystal Growth, ed. Н. S. Peiser, Suppl.
Journ. Phys. Chem. Solids, Oxford, 1967, p. 733 (есть перевод: Проблемы
роста кристаллов, изд-во «Мир», 1968, стр. 197).
233. Kotler G. R., Tiller W. А., в книге Crystal Growth, ed. Н. S. Peiser, Suppl.
Journ. Phys. Chem. Solids, Oxford, 1967, p. 721 (есть перевод: Проблемы
роста кристаллов, изд-во «Мир», 1968, стр. 178).
234. Чернов А. А., Кристаллография, 8, 87 (1963).
235. Sekerka R. F.t в книге Crystal Growth, ed. Н. S. Peiser, Suppl. Journ.
Phys. Chem. Solids, Oxford, 1967, p. 691.
236. Sekerka R. F., Journ. Phys. Chem. Solids, 28, 983 (1967).
237. Delves R. T.t Phys. Stat. Solidi, 16, 621 (1966).
238. Delves R. T., Phys. Stat. Solidi, 17, 119 (1966).
239. Hardy S. C., Coriell S. R.t Journ. Appl. Phys., 39, 3505 (1968).
240. Hardy S. C., Coriell S. R.t Journ. Cryst. Growth, 3/4, 569 (1968).
241. Dufour L., Defay R., Thermodynamics of Clouds, New York, 1963.
242. Spittle J. A., Hunt M. D., Smith R. W., Journ. Inst. Metals, 93, 234
(1965).
243. Jost №., Diffusion in Solids, Luquids, Gases, New York, 1952.
244. Arakawa K., Journ. Glaciol., 2, 463 (1955).
634
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
245. Williamson R. В., Chalmers В., в книге Crystal Growth, ed. Н. S. Peiser,
Suppl. Journ. Phys. Chem. Solids, Oxford, 1967, p. 739.
246. Mason В. I., The Physics of Clouds, London — New York, 1957.
247. Mason B. J., в книге The Art and Science of Growing Crystals, ed.
J. J. Gilman, New York, 1963, p. 119.
248. Tiller W. A, Science, 146, 871 (1964).
249. Саратовкин Д. Д., Дендритная кристаллизация, Металлургиздат, 1957,
стр. 127.
250. Pfann W. G., Solid State Phys., 4, 423 (1957).
251. Pfann W. G., Zone Melting, 2nd ed., New York, 1966 (есть перевод:
Пфанн В., Зонная плавка, изд-во «Мир», 1970).
252. Fractional Solidification, eds. М. Zief, W. R. Wilcox, Vol. I, New York,
1967.
253. Hurle D. T. J., Progr. Mat. Sci., 10, 79 (1963).
254. Burton J. A., Prim R. C., Slichter W. P., Journ. Chem. Phys., 21, 1987
(1953).
255. Buckley H. E., Crystal Growth, New York, 1951 (есть перевод: Бакли Г.,
Рост кристаллов, ИЛ, 1954).
256. Van Hook A., Crystallisation Theory and Practice, New York, 1961.
257. Hartman P., в книге Adsorption et croissance cristalline, Colloq. Intern.
Centre Natl. Rech. Sci. (Paris), № 152, 1965, p. 477.
258. Adsorption et croissance cristalline, colloq, Intern. Centre Natl. Rech. Sci.
(Paris), No. 152, 1965.
259. Чернов А. А., в книге Adsorption et croissance cristalline, Colloq. Intern.
Centre Natl. Rech. Sci. (Paris), № 152, 1965, p. 283.
260. Lauritzen J. I., Jr., Passaglia E., DiMarzio E. A., Journ. Res. NBS, 71A,
245 (1967).
261. Lauritzen J. L, Jr., DiMarzio E. A., Passaglia E., Journ. Chem. Phys., 45,
4444 (1966).
262. Чернов А. А., в книге Crystal Growth, ed. H. S. Peiser, Suppl. Journ.
Phys. Chem. Solids, Oxford, 1967, p. 25.
263. Чернов А. А., ДАН СССР, 170, 580 (1966).
264. Chernov A. A., Lewis J., Journ. Phys. Chem. Solids, 28, 2185 (1967).
265. Чернов А. А., в сб. «Рост кристаллов», т. 3, Изд-во АН СССР, 1961, стр. 47.
266. Чернов А. А., в книге Adsorption et croissance cristalline, Colloq. Intern.
Centre, Natl. Rech. Sci. (Paris), № 152, 1965, p. 265.
267. Sears G. W., Journ. Chem. Phys., 29, 1045 (1958).
268. Bliznakov G., в книге Adsorption et croissance cristalline, Colloq. Intern.
Centre Natl. Rech. Sci. (Paris), № 152, 1965, p. 291.
269. Albon N., Dunning W. J., Acta Cryst., 15, 474 (1962).
270. Dunning W. J., Jackson R. W., Mead D. G., в книге Adsorption et croissance
cristalline, Colloq. Intern. Centre Natl. Rech. Sci. (Paris), № 152, 1965,
p. 303.
271. Price P. B., Vermilyea D. A., Webb M. B., Acta Met., 6, 524 (1958).
272. Van Damme M. А., в книге Adsorption et croissance cristalline, Colloq.
Intern. Centre. Natl. Rech. Sci. (Paris), № 152, 1965, p. 433.
273. Hulett L. D., Jr., Young F. W., Jr., Journ. Phys. Chem. Solids, 26, 1287
(1965).
274. Cabrera N., в книге Reactivity of Solids, ed. J. H. de Boer, Amsterdam,
1961, p. 345.
ЛИТЕРАТУРА
635
275. Young F. W., Jr., Hulett L. D., в книге Metal Surfaces: Structure, Energe-
tics and Kinetics, ASM, Cleveland, Ohio, 1963, p. 375.
276. Jackson K. A., Phil. Mag., 7, 1615 (1962).
277. Uhlmann D. R., Chalmers B., Jackson K. A., Journ. Appl. Phys., 35, 2986
(1964).
278. Чернов А. А., Мельникова A. M., Кристаллография, 10, 791 (1965).
279. Чернов А. А., Мельникова A. M., Кристаллография, 10, 800 (1965).
280. Bamforth A. W., Industrial Crystallisation, London, 1965.
281. Mullin J. W., Crystallisation, London — Washington, 1961.
282. Modern Development in Fluid Dynamics, ed. S. Goldstein, Vol. I, II, Lon-
don — New York, 1938.
283. Schlichting H., Boundary Layer Theory, New York, 1955 (есть перевод:
Шлихтинг Г., Теория пограничного слоя, изд-во «Наука», 1969).
284. Eckert Е. R. G., Drake R. M.,Jr., Heat and Mass Transfer, New York,
1959.
285. Intern. Journ. Heat Mass Transfer.
286. Carlson А., в книге Growth and Perfection of Crystals, eds. R. H. Dore-
mus, B. W. Roberts, D. Turnbull, New York, 1958, p. 421.
287. Brice J. C., Journ. Crystal Growth, 1, 161 (1967).
288. McCabe W. L., Stevens R. P., Chem. Eng. Progr., 47, 168 (1951).
289. Burton J. A., Slichter W. P., в книге Transistor Technology, eds. H. E. Brid-
gers, J. H. Scaff, J. N. Shive, Vol. I, Princeton, N. J., 1958, p. 71.
290. Burton J. A., Kolb E. D., Slichter W. P., Struthers J. D., Journ. Chem.
Phys., 21, 1991 (1953).
291. Sparrow E. M., Gregg J. L., Journ. Heat Transfer, 81, 249 (1959).
292. Emanuel A. S., Olander D. R., Intern. Journ. Heat Mass. Transfer, 7, 539
(1964).
293. Goss A. Adlington R. E., Marconi Rev., 22, 18 (1959).
294. Туровский Б. M., Мильвидский M. Г., Кристаллография, 6, 759 (1961).
295. Robertson D. S., Brit. Journ. Appl. Phys., 17, 1047 (1966).
296. Carruthers J. R., Journ. Electrochem. Soc., 114, 959 (1967).
297. Wilcox W. R., Fullmer L. D., Journ. Appl. Phys., 36, 2201 (1965).
298. Hurle D. T. J., Solid-State Electron., 3, 37 (1961).
299. Bardsley W., Callan J. M., Chedzey H. A., Hurle D. T. J., Solid-State
Electron., 3, 142 (1961).
300. Левин В. Г., Физико-химическая гидродинамика, Физматгиз, 1959.
301. Sih Р. Н., Newman J., Intern. Journ. Heat Mass Transfer, 10, 1749 (1969).
302. Galloway T. R., Sage В. H., Intern. Journ. Heat Mass Transfer, 10, 1195
(1967).
303. Galloway T. R., Sage В. H., Intern. Journ. Heat Mass Transfer, 11, 539
(1968).
304. Utech H. P., Sc. D. Thesis, Mass. Inst. Technol., Cambridge, Mass., 1965.
305. Utech H. P„ Flemings M. C., Journ. Appl. Phys., 37, 2021 (1966).
306. Utech H. P., Brower W. S., Early J. G., в книге Crystal Growth, ed.
H. S. Peiser, Suppl. Journ. Phys. Chem. Solids, Oxford, 1967, p. 201.
307. Utech H. P., Flemings M. С., в книге Crystal Growth, ed. H. S. Peiser,
Suppl. Journ. Phys. Chem. Solids, Oxford, 1967, p. 651 (есть перевод:
Проблемы роста кристаллов, изд-во «Мир», 1968, стр. 236).
308. Cole G. S., Winegard W. С.. Journ. Inst. Metals. 93, 153 (1965).
536
Р. ПАРКЕР. МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
309. Hurle D. Т. J., Phil. Mag., 13, 305 (1966) (есть перевод: Проблемы роста
кристаллов, изд-во «Мир», 1968, стр. 209).
310. Hurle D. Т. J.t в книге Crystal Growth, ed. Н. S. Peiser, Suppl. Journ.
Phys. Chem. Solids, Oxford, 1967, p. 659 (есть перевод: Проблемы роста
кристаллов, изд-во «Мир», 1968, стр. 221).
311. Hurle D. Т. J.t Gillman J.t Harp J.t Phil. Mag., 14, 205 (1966).
312. Batchelor G. K., Quart. Appl. Math., 12, 209 (1954).
313. Rossby H. T.t Deep Sea Res., 12, 9 (1965).
314. Muller A., Wilhelm M.t Zs. Naturforsch., 19a, 254 (1964).
315. Dropkin D.t Somerscales E., Journ. Heat Transfer, 87, 77 (1965).
316. Horvay G., Intern. Journ. Heat Mass Transfer, 8, 195 (1965).
317. Chambre P. L., Quart. Journ. Meeh. Appl. Math., 9, 224 (1956).
318*. Френкель Я. И., Кинетическая теория жидкостей, Изд-во АН СССР, 1945.
319*. Зельдович Я. Б., ЖЭТФ, 12, 525 (1942).
320*. Lacmann R.t в сб. Springer Tracts in Modern Physics, 44, 1 (1968).
321*. Kaischew R., Budevski E., Contemp. Phys., 8, 489 (1967).
322*. Jackson К. A., IV Всесоюзное совещание по росту кристаллов. Содержание
докладов, дополнительный том, Изд-во АН Арм. ССР, Ереван, 1972,
стр. 7.
323*. Чернов А. А., Кристаллография, 16, 842 (1971).
324*. Воронков В. В., Кристаллография, 15, 13 (1970).
СОДЕРЖАНИЕ
Предисловие редакторов перевода .................................. 5
Р. ЛОДИЗ.
РОСТ МОНОКРИСТАЛЛОВ
Предисловие автора к русскому изданию.............................10
Из предисловия автора к английскому изданию.......................11
1. Монокристаллы .................................................13
1.1. Что такое кристалл......................................13
1.2. Экспериментальные методы выявления кристалличности . . 20
1.3. Несовершенства в кристаллах.............................24
1.4. Методы изучения совершенства кристаллов.................35
1.5. Почему нас интересуют кристаллы?........................49
2. Равновесие при росте кристаллов................................52
2.1. Классификация процессов роста...........................52
2.2. Равновесие и рост кристаллов............................55
2.3. Равновесие между твердыми фазами в однокомпонентных си-
стемах .................................................... 55
2.4. Равновесие между твердой фазой и жидкостью в однокомпо-
нентной системе.............................................60
2.5. Коэффициент распределения...............................62
2.6. Диаграммы состояния и правило фаз.......................68
2.7. Консервативные процессы.................................71
2.8. Неконсервативные процессы ..............................76
2.9. Равновесие между газом и твердой фазой в однокомпонент-
ных системах.............................................. 81
2.10. Рост из раствора.......................................82
2.11. Рост посредством химического взаимодействия............89
2.12. Рост метастабильных фаз................................92
3. Кинетика роста кристаллов . . .........................£4
3.1. Лимитирующая стадия процесса............................94
3.2. Диффузия ...............................................94
3.3. Поверхности кристаллов..................................96
3.4. Процессы при выращивании кристалла из раствора .... 104
3.5. Процессы роста при отклонении от различных условий равно-
весия .....................................................108
3.6. Рост кристалла как последовательная реакция......112
3.7. Последовательность реакций на межфазной границе . . . .114
3.8, Движение ступеней......................................119
3.9. Образование зародышей..................................122
638
СОДЕРЖАНИЙ
3.10. Влияние скорости роста на константу распределения . . . . 124
3.11. Концентрационное переохлаждение........................126
3.12. Образование фасеток....................................128
3.13. Образование ячеистой структуры.........................130
3.14. Корреляции с энтропией.................................131
4. Рост кристаллов в процессе твердофазного превращения .... 133
4.1. Методы твердофазного выращиванйя кристаллов...........133
4.2. Рекристаллизация в процессе деформационного отжига . . .134
4.3. Выращивание кристаллов посредством спекания...........161
4.4. Рост кристаллов при полиморфных превращениях..........163
4.5. Расстекловывание ........................................172
4.6. Рост при многокомпонентных твердофазных реакциях . . . 173
5. Рост кристаллов из расплава в однокомпонентной системе . . . .174
5.1. Введение................................................ 174
5.2. Неконтролируемая кристаллизация.................. . 175
5.3. Метод Бриджмена — Стокбаргера и другие аналогичные ме-
тоды .......................................................176
5.4. Метод Чохральского и аналогичные методы..................189
5.5. Методы зонной плавки.....................................219
5.6. Другие бестигельные методы...............................227
5.7. Другие методы выращивания из расплава...........237
5.8. Выращивание дендритов....................................238
6. Рост кристаллов из паров.........................................240
6.1. Введение.................................................240
6.2. Сублимация — конденсация.................................241
6.3. Распыление...............................................245
6.4. Выращивание кристаллов путем обратимых реакций .... 248
6.5. Рост кристаллов за счет необратимых реакций..............266
7. Рост кристаллов из жидких растворов..............................271
7.1. Введение.................................................271
7.2. Выращивание из водных растворов..........................273
7.3. Выращивание в гидротермальных условиях...................392
7.4. Выращивание кристаллов из растворов в расплавах солей . .311
7.5. Рост кристаллов из растворов в расплавленных металлах . .331
7.6. Зонная плавка с градиентом температуры...................334
7.7. Комбинированные методы выращивания по механизму пар —
жидкость — кристалл ........................................336
Литература..........................................................340
Р. ПАРКЕР.
МЕХАНИЗМЫ РОСТА КРИСТАЛЛОВ
Предисловие автора к русскому изданию............................ 360
Введение..........................................................361
Общие замечания.............................................361
Непрерывные и скачкообразные превращения....................362
Процессы переноса; морфологическая устойчивость.............363
Плоские грани...............................................364
Морфология кристаллов ......................................364
содержание 539
I. Термодинамика фазовых превращений: феноменологический подход 366
1. Введение....................................................366
2. Термодинамика равновесия объемов фаз.......................366
3. Термодинамика поверхностей раздела фаз.....................369
4. Термодинамика неравновесных процессов......................370
II. Статистическая механика роста кристаллов: теоретико-физический
анализ проблемы .................................................372
5. Статистическая механика равновесного состояния..............372
6. Применение методов статистической механики равновесного со-
стояния к фазовым превращениям..............................373
7. Статистическая механика неравновесных процессов .... 381
III. Задача Стефана: математико-физический анализ процессов переноса,
сопровождающих рост кристалла......................................382
8. Введение................................................382
9. Задача Стефана в чистом виде; различные формы роста . . 384
10. Усложненная задача Стефана; различные формы.............397
11. Некоторые приближенные решения задачи Стефана .... 409
12. Некоторые вопросы, связанные с задачей Стефана..........411
IV. Образование зародышей.........................................413
13. Введение................................................413
14. Классическая теория образования зародышей...............413
15. Некоторые современные разработки в теории зарождения . . 420
V. Структура поверхностей раздела и поверхностная кинетика . . . 425
16. Равновесные структуры поверхностей раздела...................425
17. Поверхностная кинетика при росте кристаллов из паровой фазы.
Теоретические и экспериментальные результаты.................444
18. Поверхностная кинетика при росте из растворов .............. 459
19. Поверхностная кинетика при росте из расплава .............. 466
20. Кинематическая теория роста кристаллов..............471
VI. Морфологическая устойчивость ... 475
21. Введение................................................... 475
22. Задача о морфологической устойчивости в чистом виде: раз-
личные формы роста.....................................476
23. Исследование устойчивости с учетом дополнительных факторов 483
24. Экспериментальные исследования морфологической устойчивости 491
VII Влияние примесей на механизмы роста кристаллов...........496
25. Введение............................ . . . . . . 496
26. Рост бинарных цепей....................................497
27. Отравление изломов в процессе слоисто-спирального роста . . 499
28. Рост кристаллов сахарозы из раствора, торможение ступеней 502
29. Торможение ступеней (продолжение)......................504
30. Кинематические волны и роль примесей при растворении; обра-
зование ямок травления...................................506
31. Макроскопические частицы в качестве примесей...........508
540
СОДЕРЖАНИЕ
VIII. Гидродинамические эффекты....................................510
32. Введение.................................................510
33. Обтекание плоской пластины........................511
34. Вращающийся диск и установка Чохральского................516
35. Обтекание шара...........................................520
36. Естественная тепловая конвекция и рост кристаллов в гори-
зонтальной лодочке...........................................522
37. Потоки жидкости, возникающие из-за различия плотностей кри-
сталла и расплава ... 525
Литература....................................................526
УВАЖАЕМЫЙ ЧИТАТЕЛЬ!
Ваши замечания о содержании книги, ее оформлении, каче-
стве перевода и другие просим присылать по адресу: 129820,
Москва, И-ПО, ГСП, 1-й Рижский пер., д. 2, изд-во «Мир».