Текст
PHYSICAL CHEMISTRY
OF SURFACES
THIRD EDITION
ARTHUR W. ADAMSON
Department of Chemistry,
University of Southern California
Los Angeles, California
A WILEY-INTERSCIENCE PUBLICATION
JOHN WILEY AND SONS
NEW YORK LONDON SYDNEY TORONTO
А. АДАМСОН
ФИЗИЧЕСКАЯ
ХИМИЯ
ПОВЕРХНОСТЕЙ
Перевод с английского
канд. хим. наук И. Г. АБИДОРА
под редакцией
канд. физ.-мат. наук 3. М. ЗОРИНА
канд. физ.-мат. наук В. ДА. МУЛЛЕРА
с предисловием
чл.-корр. АН СССР Б. В. ДЕРЯГИНА
V/A'. *:МГ. '
ИЗДАТЕЛЬСТВО «МИР»
МОСКВА 1979
УДК 541.1
Книга —в настоящее время единственное в мировой литературе
издание, в котором излагаются основные теоретические закономерности
современной физической химии дисперсных систем и поверхностных явлений.
Широта охвата проблемы, новизна материала и мастерское изложение
вопросов позволяют использовать книгу и как монографию для научных
работников и инженеров, деятельность которых связана с физико-химией
поверхностей и многочисленными прикладными направлениями коллоидной
химии, адгезией, адсорбцией, флотацией и т. п., и в качестве учебного
пособия для преподавателей, 'аспирантов и студентов высших учебных
заведений.
Редакция литературы по химии
2603040000
20503-077
А 041(01)-79
Copyright © 1976 by John Wiley and Sons, Inc. All
rights reserved. Authorized translation from English
language edition, published by John Wiley and Sons, Inc.
77-79 © Перевод на русский язык, «Мир», 1979
Предисловие к русскому переводу
Книга Адамсона «Физическая химия поверхностей» посвящена
бурно развивающейся в последние десятилетия науке о поверхностных
явлениях. Необходимость в публикации такой книги несомненна. За
последние 20 лет издано довольно много монографий и учебников по
коллоидной химии но, по существу, ни одной монографии, широко и
обоснованно трактующей науку о поверхностных явлениях. Между тем
физическая химия поверхности неотделима от науки о коллоидах и, кроме
того, включает такие важные области, как капиллярность, адсорбция,
катализ, электродные процессы, трение и прилипание. Издававшиеся
в СССР монографии Адама* и Райдила** устарели и, кроме того, в
них почти не рассматриваются многие важные области этой науки.
В данной книге представлены практически все основные разделы
учения о поверхностных явлениях, включая прикладные направления.
Естественно, что не все разделы развиты одинаково. Особое внимание
обращено на мономолекулярные слои на различных — твердых и
жидких— подложках, явления на поверхности твердых тел, включая
адсорбцию газов и паров. Сжато, но на высоком научном уровне
изложена теория электроповерхностных явлений, эмульсий и пен. Несколько
более кратко рассматривается область силы дальнодействия и
связанные с этим вопросы устойчивости коллоидов. К каждому разделу даны
интересные задачи. Все это, безусловно, потребовало большого труда и
оказалось возможным только благодаря глубокой эрудиции автора.
Можно с полным основанием сказать, что книга Адамсона уникальна,
другой такой по охвату области поверхностных явлений сейчас нет.
Книга, несомненно, явится ценнейшим учебным пособием для
студентов и аспирантов университетов и технологических институтов и
станет настольной книгой физико-химиков, имеющих дело со столь
разветвленной и бурно прогрессирующей наукой о поверхностных явлениях.
Отмечая высокий научный уровень книги, нельзя во всем
согласиться с точкой зрения автора; это, в частности, касается вопроса о том,
где рациональнее использовать понятие поверхностного натяжения —
на жидких поверхностях раздела или твердых, тогда как только в
первом случае имеется реальное операционное определение этого понятия.
*Адам Н. К. Физика и химия поверхностей. Пер. с англ.—М.: ОГИЗ, 1947.
** Райдил Э. Химия поверхностных явлений. Пер. с аш\л. — Л.: ОНТИ, Химтеорет-
издат, 1936.
6
Предисловие к русскому переводу
На наш взгляд, недостаточно освещены в разделе, посвященном
прилипанию, фундаментальные исследования этой широкой области
явлений, весьма далеко ушедшие от чисто термодинамической трактовки.
В книге недостаточно полно освещены работы советских ученых. Чтобы
до некоторой степени заполнить этот пробел, редакторы перевода
приводят дополнительную литературу к большинству глав книги.
С любезного согласия автора нами написано дополнение, в котором
рассматривается расклинивающее давление жидких прослоек и его
применение при трактовке коллоидов.
Б. Дерягин
Студентам — бывшим, теперешним
и будущим
Предисловие
По своему характеру это издание во многом сходно с предыдущим,
и я надеюсь, что им по-прежнему будут пользоваться как учебным
пособием студенты старших курсов и аспиранты, усвоившие обычный
курс физической химии. Хотелось бы также, чтобы это, третье, издание
книги оказалось полезным химикам-специалистам как введение в
такую область физической химии, которой обычно уделяется мало
внимания, и чтобы приведенный библиографический список помог им
ориентироваться в обширном потоке литературы.
В первом варианте книги (1960 г.) основное внимание уделялось
классическим трудам известных научных школ Америки и Европы,
работам таких выдающихся ученых, как Н. К. Адам, Е. Ридил,
Дж. Шульман, Дж. Мак-Бэн, В. Гаркинс и И. Лэнгмюр.
За прошедшие годы многое изменилось, и, чтобы книга сохранила
статус учебного пособия, в ней должны были найти отражение
новейшие достижения науки. Это, в частности, касается процессов
растворения поверхностей, явлений, связанных с краевыми углами, и до
некоторой степени новых физических методов исследования поверхностей.
Теория физической адсорбции стала более сложной. Важная роль
отводится разработке статистической термодинамики адсорбции.
Большое внимание в этом издании уделяется исследованию
молекулярных механизмов с применением таких новых мощных физических
методов, как ДМЭ, ДБЭ, ОЭС. Во всех главах я старался по
возможности охватить результаты наиболее важных новых исследований,
однако число публикуемых в настоящее время работ настолько велико,
что какие-то упущения неизбежны, и я заранее прошу за них
извинения. Добавлены новые упражнения ко всем главам, порядок
расположения упражнений приведен в соответствие с общим планом глав. В
результате объем книги увеличился примерно на 10%; она стала
довольно объемистой.
Будущее физической химии поверхностей представляется
чрезвычайно интересным. По-видимому, значительно расширятся исследования
возбужденных состояний молекул, находящихся на поверхностях
раздела. Области гомогенного и гетерогенного катализа должны
сблизиться, как только станет возможным получать катализаторы с
заданной структурой поверхности. Химия и физика поверхностей все шире
будут использоваться в молекулярной биологии.
8
Предисловие
Жаль только, что молекулярная химия и феноменологическая
химия поверхностей скорее всего станут относительно независимыми
дисциплинами. Первая, как магнит, будет притягивать исследователей из
всех областей физической химии поверхностей, зато вторая, оставаясь
одной из фундаментальных дисциплин, станет играть существенную
роль при решении множества прикладных проблем. Не желая
способствовать такому разделению, я считал преждевременным проводить
его в этой книге. Я не сторонник системы единиц СИ и считаю ее
неудачной; во всяком случае, в физической химии применять эту систему
единиц довольно неудобно.
Большая часть работы по подготовке этого издания проводилась во
время приятного пребывания в Гавайском университете. Я весьма
признателен химическому факультету и профессору Р. Л. Пексоку за
гостеприимство. Приношу глубокую благодарность моим
многочисленным коллегам, любезно предоставившим мне свои статьи. Я серьезно
отношусь к их отзывам и предложениям и в значительной мере
руководствуюсь ими.
Я в неоплатном долгу перед студентами Патриком Ху и Джеймсом
Тсе и коллегами У. Уэйдом и Видой Славсон, прочитавшими
корректуру книги и устранившими множество ошибок и опечаток. Моя жена
Вирджиния также провела много времени за чтением корректуры,
поэтому книга (если не сам ее предмет) в значительной мере
принадлежит и ей.
Артур У. Адамсон
Лос-Анджелес, Калифорния
Апрель, 1976 г.
ГЛАВА I
Капиллярность
1. Поверхностное натяжение и поверхностная свободная энергия
Тема данной книги, как следует из ее названия, — физическая
химия поверхностей. Напомним, хотя это достаточно очевидно, что мы
всегда имеем дело с поверхностями раздела между двумя фазами и что
в общем случае на свойства этой поверхности влияют изменения в
любой из двух контактирующих фаз.
В соответствии с тремя состояниями вещества (твердое, жидкое,
газообразное) можно выделить следующие типы поверхности раздела:
газ — жидкость,
газ — твердое тело,
жидкость — жидкость,
жидкость — твердое тело,
твердое тело — твердое тело.
Необходимым общим условием стабильного существования
поверхности раздела между двумя фазами является положительное значение
свободной энергии образования поверхности раздела: будь она
отрицательной или нулевой, случайные флуктуации вызывали бы непрерывное
расширение поверхности и в конце концов привели бы к полному
диспергированию одного материала в другом. Примерами поверхностей
раздела, свободная энергия которых в расчете на единицу площади
такова, что дисперпфующим силам не оказывается какого-либо
противодействия, являются поверхности раздела между двумя разреженными
газами, двумя смешивающимися жидкостями или твердыми телами.
Даже в случае двух несмешивающихся жидкостей присутствие
соответствующего третьего компонента может так влиять на свободную
энергию межфазной поверхности, что происходит самопроизвольное
эмульгирование (см. разд. ХП-5).
Понятие «капиллярность» относится к поверхностям раздела,
которые достаточно подвижны для образования равновесной формы.
Наиболее характерными примерами являются мениски и капли,
образованные жидкостями на воздухе или в другой жидкости, и тонкие пленки,
например пленка, образующая мыльный пузырь. Поскольку
капиллярность связана с равновесными конфигурациями, учение о
капиллярности занимает определенное место в общей системе термодинамики и
рассматривает макроскопическое и статистическое поведение
поверхностей раздела, а не детали их молекулярной структуры.
Свободная энергия, отнесенная к единице площади поверхности,
эквивалентна поверхностному натяжению, определяемому как сила,
действующая на единицу длины. Концепции поверхностной свободной
энергии и поверхностного натяжения иллюстрируют два следующих
примера. Рассмотрим сначала мыльную пленку, натянутую на проволочную
рамку, одна сторона которой подвижна (рис. 1-1). Как показывает
опыт, на подвижный элемент действует сила, направление которой про-
10
Глава I
\\\^^^^
Рис. 1-1.
тивоположно направлению, показанному на схеме стрелкой. Если
величину этой силы, отнесенную к единице длины, обозначить у, то работа,
совершаемая при смещении подвижного элемента на расстояние dx,
равна
Работа =yldx. (1-1)
Уравнение (1-1) можно записать также как
Работа =ydA, (1-2)
где dA — ldx — изменение площади поверхности. Обычно работу
изменения поверхности выражают либо в эрг/см2, либо в дн/см;
размерности обеих единиц одинаковы.
Во втором примере рассматривается мыльная пленка, образующая
пузырь. R этом случае у удобнее выразить в виде энергии, отнесенной
к единице поверхности. В отсутствие полей, например гравитационного
поля, мыльный пузырь имеет сферическую форму, которая
характеризуется минимальной площадью поверхности для данного объема,
ограниченного этой поверхностью. Рассмотрим мыльный пузырь радиуса г,
показанный на рис. 1-2. Общая поверхностная свободная энергия
пузыря равна 4пг2у. Если радиус пузыря уменьшить на drt то изменение
поверхностной свободной энергии составит 8nrydr. Поскольку при сжатии
пузыря поверхностная энергия уменьшается, тенденция к сжатию
должна компенсироваться разностью давлений на пленку АР, так чтобы
работа против давления ДР4яг2йг была в точности равна уменьшению
поверхностной свободной энергии. Таким образом,
AP4nr2dr=8nrydr (1-3)
или
ДР = 2у/г. (1-4)
В результате мы приходим к важному выводу: чем меньше пузырь,
тем больше разность между давлением воздуха внутри пузыря и
снаружи. Этот вывод легко проверить экспериментально, соединив
пузыри общей воздушной линией, как показано на рис. 1-3. Такая система
неустойчива: меньший из двух пузырей сжимается, а больший
расширяется. Заметим, однако, что меньший пузырь не будет сжиматься
бесконечно. После того как его радиус станет равным радиусу трубки, он
начнет увеличиваться, пока радиусы обоих пузырей не станут равными.
Рис. 1-2
Капиллярность
11
suS?
Рис. 1-3. Экспериментальное подтверж- 1 I
дение уравнения Юнга — Лапласа. ■ '
Это конечное состояние, показанное пунктирными линиями, является
механически равновесным.
Следует отметить, что обычно у определяют как поверхностное
натяжение одинарной поверхности раздела. Поэтому при описании мыльных
или других двусторонних пленок в уравнениях (1-1) и (1-2) вместо у
лучше использовать величину 2у.
Приведенные примеры показывают, что равновесные поверхности
можно описывать, используя либо концепцию поверхностного
натяжения, либо математически эквивалентную ей концепцию поверхностной
свободной энергии. (В одном из упражнений в конце этой главы
предлагается вывести уравнение (1-4), исходя из представления о
поверхностном натяжении.) Эта математическая эквивалентность сохраняется
во всех капиллярных явлениях. Как отмечается в разд. П-2, подобную
двойственность можно предполагать и на молекулярном уровне, так
что решение вопроса, какая из двух концепций — поверхностное
натяжение или поверхностная свободная энергия, является более
приемлемой— дело вкуса. В данной книге эти два термина обычно
используются как равнозначные.
Термин «поверхностное натяжение» является более ранним; он
возвращает нас к старым представлениям о том, что поверхность
жидкости как бы стянута своего рода оболочкой. Однако при этом может
сложиться ошибочное впечатление, что при растяжении поверхности
жидкости молекулы, находящиеся на поверхности, переходят в более
напряженное состояние. Из термина «поверхностная свободная энергия»
следует только, что для образования дополнительной поверхности, т. е.
для переноса молекулы из объема фазы в поверхностный слой,
требуется определенная работа. По этой причине, а также вследствие того, что
термин «поверхностная свободная энергия» легче связать с обычным
языком химической термодинамики, автор считает, что следует отдать
предпочтение именно этому понятию.
2. Уравнение Юнга —Лапласа
Уравнение (1-4) является частным случаем более общего
соотношения— основного уравнения капиллярности, полученного в 1805 г. Юн-
гом [1] и Лапласом [2]. В общем случае для описания искривленной
поверхности необходимо вводить два радиуса кривизны. Если
поверхность сферическая, радиусы равны, но для других поверхностей это
обычно не так. На рис. 1-4 показан небольшой участок поверхности
произвольной кривизны с двумя радиусами R\ и R*2. Выбранный уча-
*3десь, по-видимому, уместно вкратце остановиться на определении радиуса
кривизны. Два радиуса кривизны для некоторой произвольно искривленной поверхности
получают следующим образом. В рассматриваемой точке восстановим нормаль к
поверхности и затем пересечем поверхность некоторой плоскостью, содержащей нормаль.
В общем случае линия пересечения плоскости с поверхностью представляет собой кри-
12
Глава I
сток поверхности достаточно мал, так что величины R\ и R2 можно
считать постоянными. Если поверхность смещается наружу на небольшое
расстояние, изменение ее площади равно
AA=(x + dx)(y-\-dy)—xy=xdy-\-ydx,
а работа, затраченная на образование дополнительной поверхности,
определяется как
Работа =у (xdy + ydx).
Разность внутреннего и внешнего давлений, действующих на
поверхность, равна АР. Работа, совершаемая этой разностью давлений при
смещении площадки ху на расстояние dz, составляет
Работа=APxydz
Поскольку рассматриваемые треугольники (рис. 1-4) подобны,
(x + dx)/(Ri-\-dz)=x/Ri или dx=xdz/Rt
вую с радиусом кривизны, равным радиусу окружности, касательной к линии в
рассматриваемой точке. Второй радиус кривизны получают при пересечении поверхности
второй плоскостью, также содержащей нормаль, но перпендикулярной первой
плоскости. При этом образуется вторая линия пересечения и соответственно второй
радиус кривизны
Если первую плоскость вращать вокруг нормали, то первый радиус кривизны
пройдет через некоторый минимум, называемый основным радиусом кривизны.
Второй основной радиус кривизны соответствует радиусу кривизны во второй плоскости,
образующей прямой угол с первой плоскостью. Рис. 1-4 и уравнение (1-7) получены
при совершенно произвольной ориентации первой плоскости, поэтому радиусы R\ и
R2 не обязательно являются основными радиусами кривизны. Однако разность
давлений АР не может зависеть от способа выбора R\ и R2, и, следовательно, сумма
(\/Ri-\-l/R2) не зависит от того, как ориентирована первая плоскость (хотя,
безусловно, вторая плоскость всегда расположена под прямым углом к первой).
Чаще всего при изучении капиллярных явлений имеют дело с фигурами
вращения, а для них можно записать явные выражения для Ri и R2, выбрав плоскость 1
так, чтобы она проходила через ось вращения. Например, на рис. 1-10, a Ri попадает
в плоскость листа, т. е. дает кривизну профиля в рассматриваемой точке, что
позволяет описать R\ простым выражением из аналитической геометрии для кривизны
линии:
1/^=07(1+0'2)8/*. (1-5)
где у' и у" — первая и вторая производные по х Радиус R2 должен находиться в
плоскости, перпендикулярной плоскости рисунка, и, так же как для других фигур
вращения, его находят, продолжая нормаль к профилю до пересечения с осью вращения,
как показано на рис. 1-10, а. Согласно рис. 1-10,6, радиус R2 в точке профиля с
координатами х, у определяется уравнением l/#2=sin ф/jc, а так как tgcp равен у',
получаем следующее выражение для R2:
l/Rz=y'/x(l+y'*y>K (1-6)
Капиллярность
13
Рис. 1-5. Схема опытов с цилиндрическими
мыльными пленками.
(y + dy)/(R2+dz)=y/R2 или dy=ydz/R2.
Если поверхность находится в механическом равновесии, обе
определенные выше работы должны быть равны. Приравнивая их и
подставляя в полученное выражение dx и dy, получаем окончательный
результат:
AP=Y(l/*i + l/*a).
(Ь7)
Уравнение (1-7) представляет собой основное уравнение теории
капиллярных явлений, и оно широко используется в данной главе.
Если радиусы кривизны равны, т. е. поверхность сферическая,
уравнение (1-7) сводится к уравнению (1-4). Для плоской поверхности оба
радиуса бесконечны и, следовательно, АР равна нулю. Таким образом,
на обеих сторонах плоской поверхности давления равны.
3. Некоторые опыты с мыльными пленками
Существует ряд относительно простых опытов с мыльными
пленками, которые могут служить красивой иллюстрацией некоторых
применений уравнения Юнга — Лапласа. О двух таких опытах уже
говорилось выше. Если пренебречь гравитационными эффектами, пленку,
растянутую на рамке (как на рис. 1-1), можно считать плоской, поскольку
давление по обеим ее сторонам одинаково. Рис. 1-3 показывает
наличие зависимости между давлением внутри сферического мыльного
пузыря и радиусом его кривизны; ЛР можно измерить непосредственно,
присоединив к системе какой-либо манометр.
Пленки интересной формы получают, раздувая мыльный пузырь
между двумя полыми цилиндрами, как показано на рис. 1-5. На
рис. 1-5, а верхний цилиндр соединен с атмосферой, так что давление
по всей пленке одинаково и АР должна быть равна нулю. Хотя
поверхность пленки явно изогнута, уравнение (1-7) тем не менее не
нарушается. На рис. 1-5, а показаны два радиуса кривизны пленки, причем один
14
Глава I
j Рис. I-б. Схема разделения длинной цилиндрической мыльной
\^^+^~^ пленки на два пузырька.
из них (R\) располагается в плоскости листа, а другой (R2) —в
плоскости, образующей с ней прямой угол. Радиусы Ri и R2 равны по
величине, но противоположны по знаку, поскольку это радиусы кривизны
разных сторон пленки. В результате они в уравнении (1-7)
компенсируют друг друга.
Нестабильность цилиндрических пленок. В превосходной небольшой монографии
Бойса (1890 г.) [3] обсуждается еще одно важное свойство квазицилиндрических
пленок. Сформируем две такие пленки — одну вогнутую, а другую выпуклую (рис.
1-5, б); при этом в первой пленке ДР меньше, чем во второй. Если такие пленки
соединить воздушной линией, воздух из выпуклой пленки будет выдуваться в вогнутую,
и после установления равновесия обе пленки станут почти цилиндрическими. Однако
если цилиндрические пузыри более длинные, как на рис. 1-5, в, то при открывании
кранов соединительной воздушной линии наблюдается противоположный эффект:
суженный пузырь сжимается, а вытесненный из него воздух еще больше раздувает
второй пузырь. Такое изменение поведения цилиндрических пленок происходит в том
случае, когда длина пленки в 1,5 раза больше ширины.
Важным следствием этого эффекта является существование критической длины
цилиндрической пленки, при превышении которой пленка становится нестабильной, что
приводит к образованию шейки на одном конце пленки и появлению выпуклости на
другом ее конце, как показано на рис. 1-6. Критическая длина равна периметру
основания цилиндра. Таким образом, цилиндрическая пленка, длина которой больше
критической, немедленно делится на два пузыря, маленький и большой. Так же ведут
себя и цилиндрические столбики жидкости, например струя, вытекающая из
круглого сопла. Фотографии такой струи [4], приведенные на рис. 1-7, наглядно
показывают, как в результате образования шеек струя дробится на чередующиеся маленькие
и большие капельки.
Теперь вернемся к пленке, натянутой на проволочную рамку. Если рамка не
плоская, а изогнутая, то условие равновесия пленки, т. е. требование минимальной
поверхности, соответствует также требованию нулевой суммарной кривизны (т. е.
1/£л = 1/#2). Математически эквивалентные проблемы возникают иногда при
анализе механических напряжений, и рамка соответствующей формы с мыльной пленкой
может служить в качестве аналогового прибора для решения аналитических проблем,
трудно преодолимых иным путем.
4. Капиллярное поднятие
А. Предварительное обсуждение
В первом приближении явление капиллярного поднятия легко
интерпретировать на основе уравнения Юнга — Лапласа. Если жидкость
смачивает стенку капилляра, ее поверхность должна быть параллельна
стенке и, следовательно, в целом поверхность жидкости должна иметь
вогнутую форму. Разность давлений на поверхности раздела
жидкость— газ определяется уравнением (1-7), причем ее знак таков, что
давление в жидкости меньше, чем в газовой фазе. В этой связи
полезно запомнить, что оба радиуса кривизны (когда они имеют один и тот
Капиллярность
15
Рис 1-7. Образование сужении и капель в струе
жидкости [4]. (Публикуется с разрешения автора)
же знак) всегда расположены на той стороне поверхности раздела, где
давление больше,
Если сечение капилляра круглое и его радиус не слишком велик,
мениск имеет форму почти правильной полусферы (рис. 1-8). При этом
оба радиуса кривизны равны радиусу капилляра, и уравнение (1-7)
приводится к виду
ДР=27/г, (1-8)
где г — радиус капилляра. Обозначим h высоту мениска над плоской
поверхностью жидкости (для которой ДР равна нулю). Тогда в
уравнении (1-8) ДР должна быть равна падению гидростатического давления
в столбике жидкости, находящейся в капилляре. Таким образом, ДР =
= Apgh, где Др — разность плотностей жидкой и газовой фаз, a g—
ускорение свободного падения. Теперь уравнение (1-8) переходит в
Apgh=2ylr (Щ
или
a2=2y/Apg=rh. (I-10)
Величина а, определяемая уравнением (1-10), называется капиллярной
постоянной (некоторые авторы определяют а выражением a — y/Apg,
что иногда приводит к недоразумениям).
Рис. 1-8. Капиллярное
поднятие (капилляр показан в
увеличенном масштабе).
Рис. 1-9. Капиллярное опускание.
У
wm
а б
Рис. 1-10. Мениск в капилляре как фигура вращения.
Капиллярность
17
Аналогичное уравнение получается и для жидкости, не смачивающей
стенки капилляра, т. е. для жидкости, у которой угол контакта со
стенками (краевой угол) равен не нулю, а 180°. Однако теперь мы имеем
дело с капиллярным понижением, при этом мениск в капилляре
является выпуклым, a h соответствует глубине понижения мениска (рис. 1-9).
На рис. 1-10 показан несколько более общий случай, когда жидкость
контактирует со стенками круглого цилиндрического капилляра под
некоторым углом 0. Если мениск все еще имеет сферическую форму, то,
как следует из простых геометрических соображений, i?2 = >7cos0, и, так
как R\ = R2, уравнение (1-9) принимает следующий вид:
Apgh=2ycosQ/r. (I-11)
Б. Точные решения задачи о капиллярном поднятии
При точной математической трактовке капиллярного поднятия
необходимо принимать во внимание отклонение формы мениска от
сферической, т. е. в каждой точке мениска кривизна должна соответствовать
уравнению AP=Apgy, где у— превышение точки над плоской
поверхностью жидкости. Это условие можно сформулировать, записав
уравнение Юнга — Лапласа в произвольной точке (х9 у) мениска и заменив
Ri и /?2 на соответствующие выражения из аналитической геометрии,
приведенные в сноске в разд. 1-2. Предполагается также, что сечение
капилляра является круглым и, следовательно, мениск имеет форму
фигуры вращения, как показано на рис. 1-10. Радиус R\ лежит в
плоскости листа, а /?2 — в перпендикулярной плоскости. Таким образом,
Ар*А=ТЙГ/(1 +У'шГ/* + У'/х(1+у")1Ь], (1-12)
где y'=dy/dx и y"=d2y/dx2.
Из уравнения (1-12) можно получить точное выражение для общего веса W
столбика жидкости. Пусть р=у' и, следовательно, y"=pdpldy. Тогда уравнение (1-12)
можно записать как
2у/а* = (pdpldy)l(\ + р2)3/2 +р/х(1+ р*)11*. (1-13)
Формально W определяется уравнением
г
Г=*2Др£я ^xydx, (I-14)
о
которое после замены у на соответствующее выражение, найденное из уравнения
(1-13), переходит в
W = 2лу Г [xdpl{\ + р2)3/2 + pdx/(l + Р2)1/21 • (!"!5)
Подынтегральное выражение последнего уравнения равно полному дифференциалу
хр/(1+р2) 1/2; соответственно запишем решение уравнения (1-15):
Г = 2яу ~ттг (Мб)
Ч0+Р2)1/2 .Uo.p-O.
По определению p=dyjdx, поэтому, если #=r, p=tgq>, где ф=90° — 0. Подставляя
эти пределы, получаем
W = 2rtrYcos9< (I-17)
Отметим, что уравнение (1-17) в точности соответствует уравнению, которое
можно записать, предполагая, что мениск «висит» на стенках капилляра и столбик удео-
живается вертикальной составляющей поверхностного натяжения ycos9, умноженной
на периметр сечения капилляра 2яг. Таким образом, и в этом случае наблюдается
математическая идентичность концепций «поверхностного натяжения» и
«поверхностной свободной энергии».
Уравнение (1-17) является точным, однако при его использовании требуется
определять общий вес жидкости в капилляре, что обычно трудно выполнимо на
практике. Гораздо чаще измеряют высоту h дна мениска.
2—1421
18
Глава I
К сожалению, точное решение общего уравнения (1-12)
относительно h — обычно используемого экспериментального параметра —
получить невозможно. Приближенные решения, обеспечивающие
достаточную степень точности, получены лишь для 8 = 0. Последнее
ограничение, вообще говоря, не является слишком жестким, поскольку обычно
в экспериментальных условиях 6 воспроизводится плохо, за
исключением случая, когда 0 = 0.
Приближенные решения получены в двух формах. Первое решение,
данное лордом Рэлеем [5], представляет собой аппроксимацию в виде
степенного ряда. Вывод этого ряда здесь не приводится, но для почти
сферического мениска, т. е. для r<^h, при разложении функции
отклонения от сферичности r/h получаем уравнение
а2=г(Л + г/3—0,1288r2/A-f0,1312rW...)» (Ы8)
в котором первый член соответствует простому уравнению (1-10), а
второй— учитывает вес мениска, имеющего, как предполагают,
сферическую форму (см. разд. 1-13, упражнение 3), а последующие члены
являются поправками на отклонение формы мениска от сферической.
Башфорт и Адаме [6] применили совершенно иной подход, который
был затем углублен Сагденом [7]. Если рассматривается фигура
вращения, в точке пересечения мениска с его осью (т. е. на дне мениска
при капиллярном поднятии) оба радиуса кривизны должны быть
равны. Обозначим радиус кривизны Ь, а возвышение произвольной точки
поверхности мениска над точкой пересечения — г, где z = y—ft. Тогда
уравнение (1-7) можно записать как
7(1/Я| + 1/Ла)=Ар^ + 2т/6. (1-19)
Таким образом, при г = 0 ДР = 2у/6, а при любом другом значении z
изменение АР равно A gz. Преобразуем уравнение (1-19) так, чтобы
оно содержало только безразмерные параметры:
1/(/?!#) + sin ф/(х/6) =р (г/Ь) + 2, (1-20)
где 7?2 заменено на x/sincp, а безразмерный параметр р определяется
выражением
р=Др£Й2/7 = 2&2/а2. (1-21)
В случае сплющенных фигур вращения, например сидящая капля,
пузырек под пластинкой и мениск в капилляре, р имеет положительное
значение, в случае продолговатых фигур, например висящая капля или
сидящий пузырек, р имеет отрицательное значение.
Башфорт и Адаме решили уравнение (1-20) (заменив Ri на
соответствующее выражение из аналитической геометрии) с помощью числен-
Таблица 1-1
Решение уравнения (1-20) для р = 80
Ф, град
5
10
20
30
40
50
60
70
80
90
х/Ь
0,08159
0,14253
0,21826
0,26318
0,29260
0,31251
0,32584
0,33422
0,33872
0,34009
z/b
0,00345
0,01133
0,03097
0,05162
0,07204
0,09183
0,11076 J
0,12863
0,14531
0,16067
| ф, град
100
НО
! 120
130
140
150
160
170
х/Ь
0,33889
0,33559
0,33058
0,32421
0,31682
0,30868
0,30009
0,29130
z/b
0,17458
0,18696
0,19773
0,20684
0,21424
0,21995
0,22396
0,22632
Капиллярность
19
Таблица 1-2
Решение уравнения Юнга — Лапласа для капиллярного поднятия
при краевом угле, равном нулю
(Значения r/Ь, соответствующие г/а от 0,00 до 2,29)
г/а
0,00
0,10
0,20
0,30
0,40
0,50
0,60
0,70
0,80
0,90
1,00
1,10
1,20
1,30
1,40
1,50
1,60
1,70
1,80
1,90
2,00
2,10
2,20
0,00
1,0000
0,9968
9869
9710
9498
9236
8936
8606
8249
7875
7490
7098
6704
6315
5929
5545
5179
4822
4480
4152
3843
3546
3267
0,01
9999
9960
9856
9691
9474
9208
8905
8571
8212
7837
7451
7059
6665
6276
5890
5508
5142
4787
4446
4120
3813
3517
3240
0,02
9998
9952
9842
9672
9449
9179
8873
8536
8175
7798
7412
7020
6625
6237
5851
5471
5106
4753
4413
4089
3783
3489
3213
0,03
9997
9944
9827
9652
9424
9150
8840
8501
8138
7759
7373
6980
6586
6198
5812
5435
5070
4719
4380
4058
3753
3461
3186
0,04
9995
9935
9812
9631
9398
9120
8807
8466
8101
7721
7334
6941
6547
6160
5774
5398
5034
4686
4347
4027
3723
3432
3160
0,05
9992
9925
9796
9610
9372
9090
8774
8430
8064
7683
7295
6901
6508
6122
5736
5362
4998
4652
4315
3996
3683
3403
3134
0,06
9988
9915
9780
9589
9346
9060
8741
8394
8026
7644
7255
6862
6469
6083
5697
5326
4963
4618
4283
3965
3663
3375
3108
0,07
9983
9904
9763
9567
9320
9030
8708
8358
7988
7606
7216
6823
6431
6045
5659
5289
4927
4584
4250
3934
3633
3348
3082
0,08
9979
9893
9746
9545
9293
8999
8674
8322
7950
7568
7177
6783
6393
6006
5621
5252
4892
4549
4217
3903
3603
3321
3056
0,09
9974
9881
9728
9522
9265
8968
8640
8286
7913
7529
7137
6744
6354
5968
5583
5216
4857
4514
4184
3873
3574
3294
3030
Таблица 1-3
Значения г/6, соответствующие г/а больше 2,00
г/а
2,0
3,0
4,0
5,0
6,0
0,0
0,384
149
056
020
006
0,1
355
133
051
018
006
0,2
327
119
047
017
005
0,3
301
107
043
015
004
0,4
276
097
039
014
004
0,5
252
088
035
012
003
0,6
229
081
031
010
003
0,7
206
074
028
009
003
0,8
185
067
025
008
002
0,9
166
061
022
007
002
ного интегрирования (эта чрезвычайно трудоемкая работа была
выполнена до появления быстродействующих цифровых ЭВМ). Результаты
расчета авторы опубликовали в виде таблиц величин х/b и z/b для
близких значений р и <р. При данном значении р кривая зависимости
z/b от х/b дает профиль определенного тела вращения,
удовлетворяющий уравнению (1-20). В табл. 1-1 воспроизводятся (в сокращенном
виде) результаты расчета для р = 80. Заметьте, что х/b достигает
максимума при ф = 90°. Таким образом, если краевой угол равен нулю,
поверхность мениска является тангенциальной к стенке капилляра и,
следовательно, {x/b)mSiX = r/b. Соответствующее значение г/а равно (/*/&) УР/2.
Таким же способом Сагден составил таблицы значений r/b в
зависимости от г/а. Данные Сагдена приведены в табл. 1-2 и 1-3.
Как пользуются этими таблицами, по-видимому, целесообразнее
всего показать на конкретном примере. При измерении поверхностного
натяжения бензола получены следующие данные:
радиус капилляра 0,0550 см;
плотность бензола 0,8785; плотность возл\.\-!
0,0014 (обе плотности измерены при 20СС);
следовательно, Др = 0,8781 г/мл:
высота капиллярного поднятия 1,201 см.
2*
20
Глава I
С помощью уравнения (1-10) (a2 = rh) рассчитываем в первом
приближении величину капиллярной постоянной а\. Далее определяем
отношение г/а\ и по табл. 1-2 находим соответствующее значение r/b. В
рассматриваемом примере а\ = 1,201 -0,0550 = 0,0660; следовательно, /*/#! =
= 0,0550/0,2569 = 0,2142. После этого по табл. 1-2 находим г/&! = 0,9855.
Поскольку на дне мениска b равно R\ и /?2, уравнение
a2=bh (I-22)
является точным. Из приведенного выше r/b\ получаем первое
приближенное значение Ь, т. е. Ь\ = 0,0550/0,9855 = 0,05590. Подставляя это
значение Ъ в уравнение (1-22), получаем второе приближенное значение а,
т. е. a|=&i/i = 0,05590-1,201 =0,06710. В данном случае нет
необходимости во втором цикле последовательного приближения. Если же это
необходимо, вычисляем г/а2, по табл. 1-2 находим r/b2 и т. д.
Поверхностное натяжение бензола, соответствующее полученному здесь
значению а2 = 0,06710, равно 28,88 дн/см (при 20 °С).
Паддэй с соавторами [8] и Лэйн [9] пересчитали таблицы Баш-
форта— Адамса и Сагдена. Лэйн дает точные аналитические
выражения функции (b/r) от (г/а), что, в частности, позволило уточнить
значения, приведенные в табл. 1-3. Наконец, Эриксон [10] опубликовал
проведенные на ЭВМ расчеты площадей несферических поверхностей
раздела.
В. Экспериментальные особенности метода капиллярного поднятия
Метод капиллярного поднятия обычно считают наиболее точным
потому, что, во-первых, для него разработана довольно точная теория и,
во-вторых, его экспериментальные переменные можно тщательно
контролировать. Однако это своего рода дань традиции: в настоящее время
с методом капиллярного поднятия вполне конкурируют и даже
превосходят его другие методы.
Экспериментальные особенности метода капиллярного поднятия, по-
видимому, лучше всего обсуждаются в работах Ричардса и Карвера
[11] и Гаркинса и Брауна [12]. Для наиболее точной работы
необходимо, чтобы жидкость полностью смачивала стенки капилляра и, таким
образом, не было неопределенности, вводимой краевым углом. Как
правило, используют стеклянные капилляры, которые прозрачны и к тому
же смачиваются большинством жидкостей. Стекло должно быть очень
чистым, но даже в таком случае целесообразно использовать
отступающий мениск. Капилляр следует устанавливать строго вертикально.
Радиус его необходимо тщательно измерить, он должен быть одинаковым
по всей длине капилляра. Сечение капилляра может отклоняться от
круга не более чем на несколько процентов.
По определению h — высота капиллярного поднятия над поверхностью, для
которой АР равна нулю, т. е. над плоской поверхностью жидкости. На практике же h
измеряют относительно поверхности жидкости в широкой трубке или кювете (рис.
1-8). Капиллярное поднятие может быть заметным и в относительно широких
трубках. Так, в кювете радиусом 1,6 см поднятие воды составляет 0,04 мм, при радиусе
2,7 см оно равно всего 0,0009 мм.
Основные особенности метода капиллярного поднятия можно
суммировать следующим образом. Метод считается одним из лучших и
наиболее точных прямых методов и дает погрешность всего несколько
сотых процента. Однако по практическим соображениям угол смачивания
должен быть равен нулю, и необходимы довольно большие объемы
растворов. Если используются стеклянные капилляры, щелочность
растворов не должна превышать некоторого предельного значения. Различные
варианты метода капиллярного поднятия рассмотрены в работах [13]
и [16].
Капиллярность
21
Рис. 1-11. Метод максимального давления
в пузырьках.
5. Метод максимального давления в пузырьках
Этот метод, как показано на рис. 1-11, заключается в медленном выдувании
пузырьков в исследуемую жидкость. Пузырьки выдувают инертным газом с помощью
трубки, частично погруженной в жидкость. На рисунке показано также, что, если
трубка небольшая, растущий пузырек предположительно представляет собой часть
сферы. Радиус пузырька минимален, когда пузырек является в точности
полусферическим. В этот момент он равен радиусу трубки, и, поскольку радиус пузырька
минимален, ДР достигает максимального значения, определяемого уравнением (1-4). Если
жидкость смачивает трубку, пузырек формируется на ее внутренней стенке и г
соответствует внутреннему радиусу трубки. В этом случае экспериментально измеряют
максимальное давление газа в трубке, при котором пузырьки еще не могут
отрываться. Возвращаясь опять к рис. 1-11, отметим, что, поскольку конец трубки находится
на некотором расстоянии t ниже свободной поверхности жидкости,- АРтах
определяется как Ртах—Pt, где Ртах — измеряемое максимальное давление, a Pt — давление,
отвечающее гидростатическому давлению L
Если АРтах выразить через соответствующую высоту столба жидкости, т. е.
APmax=Apg/i, то указанное соотношение становится идентичным уравнению (1-10),
описывающему простое капиллярное поднятие.
Важно четко представлять себе, что рассмотренный подход применим только для
достаточно узких трубок. Значительные отклонения от простого уравнения (1-10)
наблюдаются уже при г/а, равном 0,05. Более реальная ситуация показана на рис. 1-12.
Здесь максимальное давление не достигается до тех пор, пока ф не станет
значительно больше 90°.
Как и в случае капиллярного поднятия, Сагден [17] рассчитал поправочные
коэффициенты для рассматриваемого метода, пользуясь таблицами Башфорта и Адамса.
Поскольку пузырек также имеет форму фигуры вращения, уравнение h=a2/b+z
является точным. Здесь Ь — значение Ri=R2 в нижней точке, a z— расстояние ОС. Это
уравнение просто констатирует, что ДР, выраженная через высоту столба жидкости,
равна сумме гидростатического давления и изменению давления на поверхности
раздела. С помощью простого преобразования его можно привести к виду
r/X = (r/b)+<r/a)(z/b)($/2)y2>
(1-23)
где р задается уравнением (1-21) и X—a2/h. Любому данному значению г/а
соответствует множество значений r/Х, отвечающих различным Р и ф. Используя равенство
г/6*=(/7а)(2/Р)1/2, Сагден вычислил r/b для ряда значений г/а и р. С помощью
используемого значения р и соответствующего значения r/b были найдены величины zfb и
гIX [по уравнению (1-23)]. Поскольку r/Х пропорционально давлению в пузырьке, г/Х
для данного г/а проходит через максимум при изменении р. Для каждого принятого
значения rfa Сагден табулировал максимальное значение r/Х. Полученные величины
приведены в табл. 1-4 в виде зависимости Х/r от г/а.
Рис. 1-12.
22
Глава I
Таблица 1-4
Поправочные коэффициенты для метода максимального давления
в пузырьках
(Минимальные значения Х/r, соответствующие г/а от 0 до 1,50)
г/а
0,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,0
1,1
1,2
1,3
1,4
1,5
0,00
1,0000
0,9934
9737
9419
9000
8484
7920
7312
6718
6179
5703
5290
4928
4611
4333
4085J
0,01
9999
9920
9710
9382
8952
8429
7860
7252
6660
6129
5659
5251
4895
4582
4307
0,02
9997
9905
9682
9344
8903
8374
7800
7192
6603
6079
5616
5213
4862
4553
4281
0,03
9994
9888
9653
9305
8853
8319
7739
7132
6547
6030
5573
5176
4829
4524
4256
0,04
9990
9870
9623
9265
8802
8263
7678
7072
6492
5981
5531
5139
4797
4496
4231
0,05
9984
9851
9592
9224
8750
8207
7616
7012
6438
5933
5489
5103
4765
4468
4206
0,06
9977
9831
9560
9182
8698
8151
7554
6953
6385
5885
5448
5067
4733
4440
4181
0,07
9968
9809
9527
9138
8645
8094
7493
6894
6333
5838
5408
5032
4702
4413
4157
0,08
9958
9786
9492
9093
8592
8037
7432
6835
6281
5792
5368
4997
4671
4386
4133
0,09
9946
9762
9456
9047
8538
7979
7372
6776
6230
5747
5329
4962
4641
4359
4109
Эту таблицу используют так же, как табл. 1-2 и 1-3 в случае капиллярного
поднятия. В качестве первого приближения принимают простое уравнение (1-10). Это
дает первую аппроксимацию капиллярной постоянной а\. Далее получают г\а\, после
чего по табл. 1-4 находят соответствующее значение Xjr. Из определения X (X=a2/h)
получают вторую аппроксимацию капиллярной постоянной а2 и т. д. Подобные
расчеты выполнили также Джонсон и Лэйн [17а].
Точность определения по методу максимального давления в пузырьках достигает
нескольких десятых процента. Угол смачивания может быть любым (необходимо
только знать, какой радиус трубки, внутренний или внешний, используется в
эксперименте); достаточно лишь приблизительно знать плотность жидкости (если трубки
сдвоенные); измерения могут проводиться быстро. Скорость роста пузырьков,
по-видимому, должна составлять около 1/с. Таким образом, данный метод является
квазидинамическим и характеризует натяжение свежеобразованных поверхностей
раздела жидкость — воздух. Поэтому его нецелесообразно применять для изучения
старения поверхностей. Если исследуются чистые жидкости, влияние
поверхностно-активных веществ должно быть сведено к минимуму. Рассматриваемый метод пригоден для
дистанционных измерений, и его можно использовать для определения поверхностного
натяжения жидкостей, с которыми трудно работать, например расплавов
металлов [8].
6. Метод взвешивания капель
Это довольно точный и, возможно, наиболее распространенный
лабораторный метод измерения поверхностного натяжения на границе
раздела жидкость — воздух и жидкость — жидкость. Методика
измерения заключается в следующем (рис. 1-13): на конце трубки формируют
капли и собирают капающие капли в контейнер до тех пор, пока
можно будет достаточно точно определить вес, приходящийся на одну
каплю.
Метод взвешивания капель известен давно. Тэйт [19] писал о нем
еще в 1864 г., и простое выражение для определения веса капли W
получило известность как закон Тэйта:
W=2nry. (I-24)
Здесь опять появляется старая концепция «поверхностного натяжения»,
поскольку уравнение (1-24) легче всего вывести, пользуясь
представлением о том, что максимальная сила, удерживающая каплю, равна
поверхностному натяжению, умноженному на длину окружности кончика
трубки.
Капиллярность
23
Рис. 1-13. Метод взвешивания капель
казаны в увеличенном масштабе).
[капля и капилляр по- F
Фактически на практике получают вес W'y который меньше
«идеального» значения W. Причина этого становится понятной при детальном
наблюдении процесса образования капли (рис. 1-14). Вследствие
механической нестабильности образующейся цилиндрической шейки (см.
разд. 1-3) появляются маленькие капли; в любом случае очевидно, что
фактически падает только часть капли, достигшая точки
нестабильности,— до 40% жидкости может оставаться на кончике трубки.
Математически эта ситуация описана Данкеном [20], который составил также
таблицы значений поправочных коэффициентов f, полученных, по-видимому, с
точностью около 1%. Чаще, однако, пользуются рядом эмпирических значений /,
приведенных в работе Гаркинса и Брауна [12]. Параметры, от которых зависит /, можно
найти путем анализа размерностей.
В общем случае суммарный вес капли w (не обязательно критического размера)
отличается от веса, рассчитываемого по закону Тэйта, и его можно выразить в виде
функции радиуса трубки г, капиллярной постоянной а и объема капли V:
w = 2nryg (г, а, V).
(1-25)
Поскольку функция g должна быть безразмерной, ее необходимо выразить через
безразмерные соотношения, например
w = 2лф (г/а, г/И/з). (1-26)
В точке отрыва w максимален и равен W. Это требование в принципе дает
возможность записать некоторое дополнительное уравнение, которое в комбинации с
уравнением (1-26) позволяет исключить одно из безразмерных соотношений.
Гаркинс и Браун [12] пришли к выводу, что фактический вес капли
W следует представлять в виде
W'=2stryf9 (I-27)
где /=я|?(г/а) =8(r/V1/s). Справедливость этого уравнения авторы
подтвердили экспериментально, определяя вес капель воды и бензола,
образующихся при выдувании из капилляров, кончики которых имели
различные радиусы. Зная величины у (найденные методом капилляр-
и«йХ
Рис. 1-14. Высокоскоростное фотографирование падающей капли.
24
Глава 1
Таблица 1-5
Поправочные коэффициенты для метода взвешивания капли
,//'■
0,00
0,30
0,35
0,40
0,45
0,50
0,55
0,60
0,65
0,70
f
(1,0000)
0,7256
0,7011
0,6828
0,6669
0,6515
0,6362
0,6250
0,6171 1
0,6093
r/V /3
0,75
0,80
0,85
0,90
0,95
1,00
1,05
1,10
1,15
1,20
f
0,6032
0,6000
0,5992
0,5998
0,6034
0,6098
0,6179
0,6280
0,6407
0,6535
г/И/з
1,225
1,25
1,30
1 1,35
1,40
1,45
1,50
1,55
1,60
f
0,656
0,652
0,640
0,623
0,603
0,583
0,567
0,551
0,535
а В этом столбце значения / рассчитаны с меньшей точностью, чем в других
столбцах.
ного поднятия), а следовательно, и соответствующие значения а,
можно определить /. Величины /, полученные при различных r/V1^,
приведены в табл. 1-5.
Измерения рекомендуется проводить при значениях r/Vl/* от 0,6 до
1,2, где / меняется наиболее медленно. Таблицу применяют следующим
образом. Из экспериментального значения т, массы одной капли, и
плотности жидкости определяют объем капли V и рассчитывают r/V1^
В таблице находят соответствующее значение / и с помощью
выражения
y=mg/2nrf (I-28)
получают скорректированное значение поверхностного натяжения.
Следует заметить, что поправка не только довольно велика, но и что для
данного радиуса кончика капилляра она зависит от природы жидкости.
Таким образом, было бы неправильно считать, что при использовании
капилляров с кончиками одинаковых размеров веса капель двух
жидкостей соотносятся между собой как поверхностные натяжения этих
жидкостей.
При использовании метода взвешивания капель весьма важно применять трубки
с полированными торцами, не содержащими каких-либо трещин и зазубрин. Если
жидкость не смачивает капилляр, г равен внутреннему радиусу. С летучими жидкостями
следует работать в закрытой системе, чтобы исключить потери вследствие испарения;
одна из таких систем описана в работе [12]. Капли должны формироваться
медленно, хотя фактически это необходимо только на последней стадии роста,
непосредственно перед отрывом; даже если длительность роста капли равна 1 мин, ошибка
составляет всего 0,2%. Вообще же точность определения этим методом достигает 0,1%.
Некоторые варианты метода взвешивания капель рассмотрены Брауном и Мак-Корми-
ком [21]. В работе [22] описана установка для работы с агрессивными жидкостями.
Метод взвешивания капель, безусловно, можно применять и для
определения поверхностного натяжения на границе раздела жидкость —
жидкость. При этом капли одной жидкости образуются в объеме
другой жидкости. Для обработки данных пригодны те же уравнения, хотя
следует помнить, что W и т в этом случае обозначают вес и массу
капли минус вес и массу вытесненной жидкости. Рассматриваемый
метод можно применять также и для растворов, однако, поскольку он
является динамическим, его нельзя рекомендовать для систем, в которых
равновесное поверхностное натяжение устанавливается медленно.
7. Метод отрыва кольца
Метод отрыва кольца распространен довольно широко.
Заключается он в следующем: определяется сила отрыва кольца или петли из
проволоки от поверхности жидкости. Данный метод, как и метод взве-
Капиллярность
25
К весам
Рис. 1-15. Метод отрыва кольца.
шивания капель (разд. 1-6) и один из вариантов метода пластинки
Вильгельми, принадлежат к одной большой группе методов. Автором
метода отрыва кольца обычно считают дю Ноя [23]. Как и во всех
методах этой группы предполагается, что в первом приближении сила
отрыва равна поверхностному натяжению, умноженному на периметр
поверхности отрыва. Таким образом, для кольца, показанного на рис. 1-15,
Wo6ux=WK+4nRyy (1-29)
где WK— вес кольца.
Гаркинс и Джордэн [24] показали, что уравнение (1-29) обычно
дает большую погрешность, и ввели в него эмпирический поправочный
коэффициент, который находится почти так же, как в методе
взвешивания капель. В данном случае, однако, имеется одна дополнительная
переменная, и поэтому поправочный коэффициент f теперь зависит от
двух безразмерных отношений. Таким образом,
f=4lp=f{RzlV, R/r), (1-30)
где р — «идеальное» поверхностное натяжение, рассчитанное по
уравнению (1-29), а V — объем мениска. Таблицы Гаркинса и Джордэна
суммированы графически на рис. 1-16. Как видно из этого рисунка,
исходное уравнение (1-29) может давать погрешность до 25%. В работе
[25] таблицы Гаркинса и Джордэна распространены в область более
высоких плотностей жидкости и более низких значений у. Довольно
сложная детальная теория метода отрыва кольца, разработанная
Б. Фрейдом и Г. Фрейдом [26], дает расчетные значения /, которые
согласуются с эмпирическими величинами в пределах точности
эксперимента, составляющей около 0,25%.
Точность экспериментального определения силы отрыва кольца может быть
достаточно высокой. Гаркинс и Джордэн для определения максимальной силы,
приложенной к кольцу, применяли цепные весы, однако в более широко используемом
варианте тензиометра, как иногда называют этот прибор, измерения проводят с помощью
более компактных торзионных весов. Экспериментатор должен обратить особое
внимание на следующие моменты. Перед опытом необходимо определять вес сухого
кольца, обычно изготавливаемого из платины. Кольцо должно поддерживаться в горизон-
0 1,0 2,0 3,0 4,0 5,0
Рис. 1-16. Поправочные кривые для метода R^/V
отрыва кольца.
26
Глава I
тальном положении (показано, что отклонение от горизонтали на 1° дает погрешность
в 0,5%, а при отклонении на 2,1° погрешность составляет 1,6%). Необходимо
применять специальные меры предосторожности, чтобы исключить возмущение
поверхности вблизи критической точки отрыва. Для удаления поверхностных загрязнений,
например жиров, перед опытом кольцо обычно прокаливают на горелке. Чтобы
обеспечить чистоту исследуемой поверхности, рекомендуется заполнять кювету доверху и
затем сливать часть жидкости через край кюветы.
Необходимо, чтобы краевой угол был равен или почти равен нулю, иначе
результаты измерений окажутся заниженными. Это было обнаружено при работе с
растворами поверхностно-активных веществ, адсорбция которых на кольце приводит к
изменению его смачивания, и при измерении натяжения на поверхности раздела
жидкость — жидкость. В таких случаях можно использовать тефлоновое или
полиэтиленовое кольцо [27]. Если исследуется монослой, может потребоваться поправка
на увеличение поверхности при отрыве кольца. Соответствующие расчеты приведены
в работе [28].
8. Метод пластинки Вильгельми
Обсуждавшиеся до сих пор методы требуют более или менее
табулированных решений или введения поправочных коэффициентов в
соответствующие «идеальные» уравнения. В то же время метод,
предложенный Вильгельми [29] в 1863 г., не требует каких-либо поправок и
очень прост в использовании.
Известно, что тонкая пластинка, например предметное стекло или
платиновая фольга, удерживает мениск. Вес пластинки, измеряемый
(г«
W
Воздух
Отсос
Рис. 1-17. Установка для измерения временной зависимости поверхностного
натяжения [33].
Требуемый уровень свежей поверхности устанавливают с помощью воздушной и вакуумной
линий. Буквой W обозначена пластинка, подвешенная на электровесах фирмы «Cahn» с выходом
на самописец.
Капиллярность
27
Рис. 1-18.
как статически, так и при отрыве, при этом меняется в точном
соответствии с «идеальным» уравнением (краевой угол предполагается равным
нулю):
Wt
общ
--wan+yp,
(1-31)
где Н^общ — измеряемый вес, №Пл — вес сухой пластинки, р— периметр
пластинки. Схема экспериментального оборудования показана на
рис. 1-17. Методики измерения силы отрыва пластинки и кольца, по
существу, идентичны. Однако в первом случае не требуется никаких
поправок и уравнение (1-31) соблюдается с точностью 0,1% [30—32].
В настоящее время, вероятно, более широко используется другая
методика. Уровень жидкости поднимают до тех пор, пока она не коснется
пластинки, подвешенной на весах (часто на самопишущих
электровесах, как показано на рис. 1-17), и регистрируют увеличение веса.
Расчет производится по общему уравнению
у co&Q=Ш/р, (1-32)
где AW — изменение веса пластинки (т. е. сила, действующая на
пластинку при контакте ее с жидкостью) и р — периметр пластинки.
Краевой угол, если он не равен нулю, можно определить в том же
эксперименте [33]. Интегрирование уравнения (1-13) (с учетом того, что #2
бесконечно велик и, следовательно, второй член справа равен нулю)
дает
(hlaf=\ — s'ne,
(1-33)
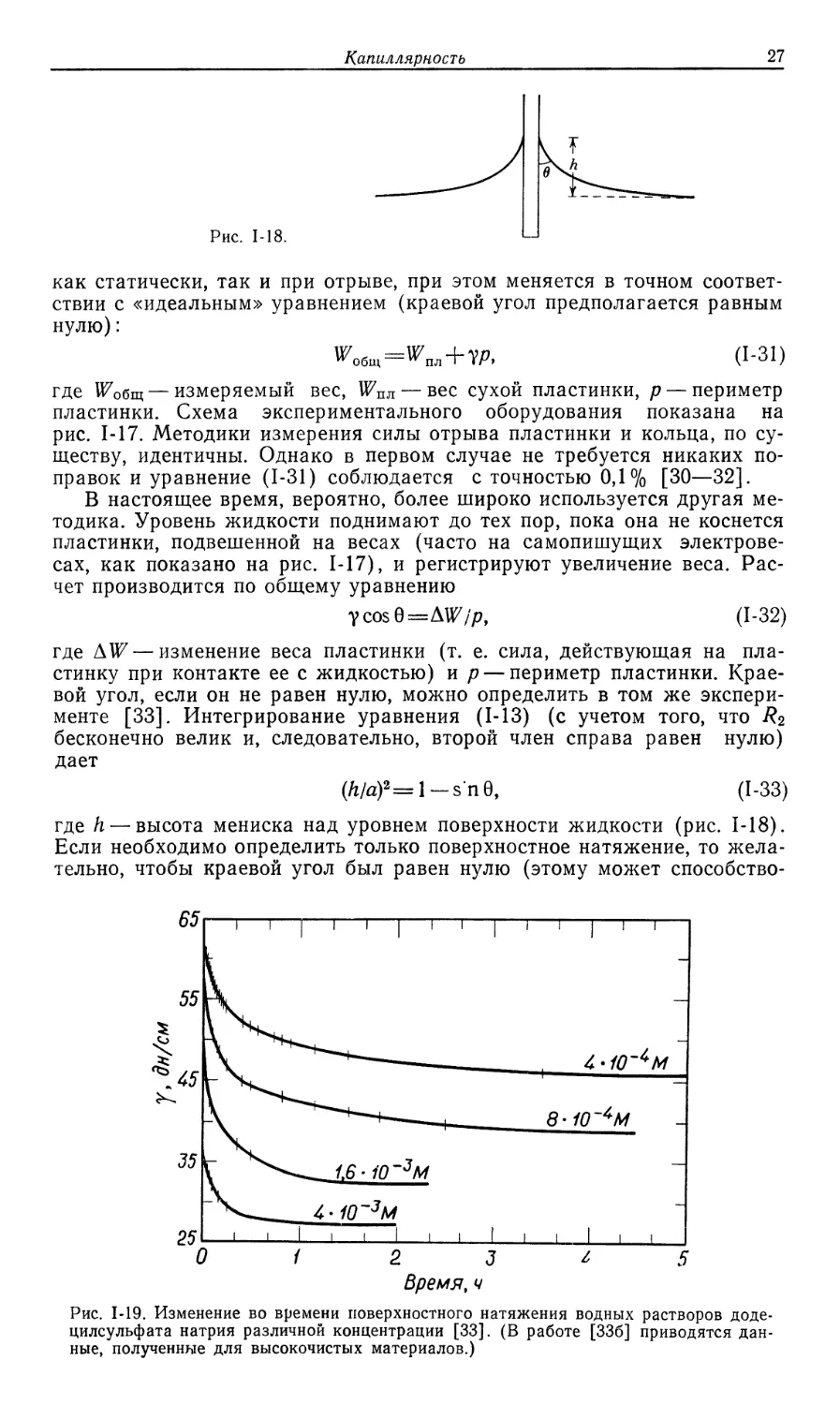
где h — высота мениска над уровнем поверхности жидкости (рис. 1-18).
Если необходимо определить только поверхностное натяжение, то
желательно, чтобы краевой угол был равен нулю (этому может способство-
Рис. 1-19. Изменение во времени поверхностного натяжения водных растворов доде-
цилсульфата натрия различной концентрации [33]. (В работе [336] приводятся
данные, полученные для высокочистых материалов.)
28
Глава I
вать некоторая шероховатость пластинки). Метод пластинки Вильгель-
ми применялся, в частности, Ньюмэном и Тэннером [33], следившими
за изменением во времени поверхностного натяжения водных растворов
додецилсульфата натрия. Результаты измерений, приведенные на
рис. 1-19, показывают, что в данной системе происходит медленное, но
значительное изменение поверхностного натяжения.
В одном из вариантов описанной выше методики пластинку
подвешивают таким образом, что она частично погружается в жидкость.
В этом случае при определении изменения веса под действием мениска
учитывают уменьшение веса пластинки в жидкости. Эта методика
особенно удобна при изучении адсорбции на поверхности жидкости или
монослоев по изменению поверхностного натяжения. Применение этого
варианта метода Вильгельми подробно рассмотрено Гэйнсом [34].
9. Методы, основанные на определении формы неподвижных капель
или пузырьков
Под действием поверхностных сил маленькие капельки и пузырьки
стремятся принять сферическую форму. Гравитационные силы в этих
случаях оказывают сравнительно слабое влияние, так как нарушения,
обусловленные этими силами, зависят от объема, уменьшающегося
пропорционально кубу линейного размера, а действие поверхностных сил
зависит от площади поверхности капли (или пузырька),
уменьшающейся пропорционально квадрату линейного размера. Однако, когда
действие гравитационных и поверхностных сил соизмеримо, по форме
капли или пузырька в принципе можно определять поверхностное
натяжение. На рис. 1-20 показаны капли различных форм, для которых
применимо уравнение (1-19).
Обычно каплю или пузырек формируют в таких условиях, чтобы они
не подвергались каким-либо возмущающим воздействиям, и измеряют
их размеры, например по фотографии капли. Таким способом можно
наблюдать изменение поверхностного натяжения во времени; точность
определения составляет несколько десятых процента.
Л. Метод висящей капли
Капля, свисающая с кончика капилляра (или прилипший к нему
пузырек), вытягивается по мере своего роста, поскольку изменение
гидростатического давления становится соизмеримым с давлением,
обусловленным кривизной верхушки капли. Как и для мениска, в данном случае
уравнение (1-12) принято записывать в несколько видоизмененной фор-
6
Рис. 1-20. Формы сидящих и
висящих капель и пузырьков:
а) висящая капля, б) сидящая
капля, в) висящий пузырек,
г) сидящий пузырек.
Капиллярность
29
ме (1-20); причем, когда рассматривается капля, безразмерный
параметр формы р имеет отрицательное значение. Обычно р
непосредственно не измеряют, поскольку этот параметр связан с другими
параметрами, определить которые легче.
Андреас и др. [35] показали, что наиболее удобно измеряемой
величиной, характеризующей форму висящей капли, является S = ds/de. Как
показано на рис. 1-20, de — диаметр экватора капли, a ds — диаметр,
измеренный на расстоянии de от нижней точки капли. Трудно измеряемый
параметр размера Ь в уравнении (1-20) комбинируется с р, и вместо
этих параметров подставляется величина Н=—${de/b)2. Таким
образом,
у=-ДР£#ур=—ApgdI/p {djbf=A9gd2e/H. (I-34)
Соотношение между зависящей от формы величиной Я и
экспериментально измеряемой, также зависящей от формы величиной «S
определено эмпирически с использованием висящих капель воды. Серию
довольно точных значений 1/# для различных величин S получили Ни-
дерхаузер и Бартел [36] (см. также работу Фордхэма [37]). Расчеты
проводились с использованием уравнения (1-20) путем численного
интегрирования с помощью таблиц Башфорта и Адамса [6]. Были
рассчитаны также таблицы, дополняющие таблицы Башфорта и Адамса.
Результаты этого расчета для р=—0,45 приведены в табл. 1-6.
Значения 1/# в зависимости от S = dslde даны в табл. 1-7. Авторы
подчеркивают, что по практическим соображениям размер трубки должен быть
таким, чтобы г/а не превышало 0,5. В табл. 1-7 включены также
результаты расчета \/Н для 5 от 0,3 до 0,67, недавно опубликованные Штауф-
фером [38].
Андреас и соавторы измерили этим методом изменение во времени
поверхностного натяжения растворов стеарата натрия. На рис. 1-21
показана типичная последовательность изменения формы капли раствора
стеарата. Как и в растворе додецилсульфата натрия (рис. 1-19), в
данном растворе также имеет место значительное изменение
поверхностного натяжения.
Метод висящей капли используется очень широко, поскольку он
требует только небольших количеств жидкости и может применяться при
высоких температурах и для химически активных материалов. При
использовании точного оптического прибора точность определения состав-
Таблица 1-6
Решение уравнения (1-20) при Р=—0,45
ф
0,099944
0,199551
0,298488
0,396430
0,493058
0,588070
0,681175
0,772100
0,860590
0,946403
1,029319
1,109130
1,185644
1,258681
1,328069
1,393643
1,455242
х/Ь
0,099834
0,198673
0,295547
0,389530
0,479762
0,565464
0,645954
0,720657
0,789108
0,850958
0,905969
0,954013
0,995064
1,029190
1,056542
1,077347
1,091895
z/b
0,004994
0,019911
0,044553
0,078600
0,0121617
0,0173072
0,232352
0,298779
0,371635
0,450175
0,533649
0,621322
0,712480
0,806454
0,902619
1,000413
1,099333
ф
1,512702
1,565856
, 1,614526
1,658523
1,697641
1,731653
1,760310
1,783338
1,800443
1,811310
1,815618
1,813050
1,803321
1,786207
1,761593
1,729517
1 1,690226
х/Ь
1,100530
1,103644
1,101667
1,095060
1,084311
1,069933
1,052460
1,032445
1,010466
0,987123
0,963039
0,938868
0,915293
0,893023
0,872791
0,855344
0,841424
z/b
1,198946
1,298886
1,398856
1,498630
1,598044
1,697000
1,795458
1,893432
1,990986
2,088223
2,185279
2,282314
2,379495
2 476982
2,574912
2,673373
2,772393
СЗ
о
s
о
£1
Я*
51
а> s
CQ щ
si
о к
ss О
S >>
X С
а> о
* *
о; ...
ж х
3 о
Я Ои
н я
2 u
х а>
* Й
о, я
а> S
CQ
О
С
ев
а.
=3
СО
Я
S
я*
X
ГО
СО СО тр т*< h- СМ "* О ^ О COOOCMt^CO -ФОЭСО—< h- COCOOOCMTt* -ч 00 CM "^ Ю —>0>
OlOCOt^-CM *^ю—'CMt^- О—'С7500СО GO CO 00 Oi CM IN-OOOO^O CO 00 ^ CO CM OCO
СО^СО^Ю OtOOOON CO —< —« CO -*f CO 00 CM О) Ю ^- CO —' CM CO 00 (N ^ С) О) OOO)
0500СОСМЮ CN^^OOlO "^ЮЬОЮ ^OOCDtrh -*ЮЬО)-< тГ СО CM CO О ЮО
ЮОСОСМОО ЮСМО)СО^ (NOOONlO "Ф CM — О О) ОО^СОЮЮ ^ГСОСОСМСМ —i ~
СОСОЮЮ-Ф «^^COCOCO C0C0CMCMCM CMCMCMCM—<
CM IN- О Is- —- Ю Tt* О CM Is- 00 Th CO h-CM C0ON03O 00 Ю CM rf CO Ot^OCDt OO
NCDON CO -^COCOThOO
hNCO -Ф О О Is- «* CMCO—'—«CM ОСМ-^СМЮ О ^
rf CO t4-CO 05 Ю "чГ CO —« IN CO CO 00 CM CO (MONCOlO Ю CO 00 О CM Ю 00 CM CO ~> CO —«
CO—'COCMOO lOWON^ IMOCONIO ^<N —005 00 IN CD CO Ю 4tf« CO 00 CM CM —' ~
cdcdioio-* ^"-^co"со со со со'см"см см cm'cm cm"cm"-*" S~SSS~ ^S^S^^ _ *-,*-*
Oi^COOO) O) —< rt< CM 00 OOCOO)OCM r*< О СО Ю —• "^00 —'OCO О ^f —< —• Г-» —< CO
O5C0COCMCM NOC0 00CN О00Ю00- ^NOONCO C^-Ю ^ О) 1П О) СО ^ 05 00 О —■
О TJ< О CO CO rf Ю СО CO CM СО 00 СО 00 "^Н -нООЮ^Ю СО *Ф 00 h- CM —- Ю CO rf О) 00O5
O00CMOCM 00IN05C0O 0000OC000 ^QOONtO CDNOOOCO CO O) CO h- —• CO —
N-hNCOO) ЮС^ОМО (МОО)ЬЮ Tf CO —• О О) ООЬСОСОЮ -f СО СО СМ СМ ~-*~~
сосоюю^ ^ -^ со со со со со" см смем см см см см — —• —. ~ч ~-. — —. —. — —« — —
СО Is- —'00—I LOIN^OOOO
оо^ооосо -*« со со rt- in
юсо-^сосм t^ -^f о —■ ^
to со со-^ со — о см со см
I--CMIN00O) CDOOONIO
OrhlOCD^
CO O) — 050
t-~ t^. rt< «^ O)
О О CM ЮО)
CO —< 05 t— Ю
rh ОС0 О) 00
О) Ю IN IN 00
Ю CM О) OO h-
•4f CO — О О)
CM h* CO — Ю
CO ^ t4- IN 00
CO CO CO Ю O)
IN. 0O O) i-i CO
oo Ь- со СО Ю
CO 00 CO О CM
IN О "Ф CO CM
00 CM О) ОЮ
CO О CO 00 CM
"чГ **f CO CM CM
CO O)
OOO
coco
t*- со
г-* CM
СООЮЮ'Ф -^^f^COCO C0C0CMCMCM CM CM CM CM —
IO IN CO h- 00 CO—'0)h-CM OONrhlOOO ЮОО-нОО CO C^ h- b- —« Г^-СОЮСО—* "^00
CO — ^f CM CO Tf CO Ю CM Ю Ю —' 00 CM О 00 CO IN 05 CM O) "4f — Ю CM CO Ю Ю CO CO —< CO
—-"00050000 О "^f IN CO IN 00 IN —■ — *чГ 00 ^ О) СО СО Ю CM Ю СО С*- Ю 00 Ю СО О 00 00
-H00O00 05 lOCO^OO^f CM CM "*H ^- — CO CO О 05 OO 00 О) О CM ^ NOThOOCO Г-- CM
CO CM 00 CO О) СО СО О IN Ю CO —« 0> t^- CO rf CO CM О O) OONNCOIO ^ Tf CO CM CM —' -4
СОСОЮЮ^ -*^tCOCO COCOCMCMCM CMCMCMCM— —« -и —^ —* ^-. »-н ^- r-, ^ ^-4 —<,-.
CO—-O5C0CM Tf^hCDOOt^ lOt^.0505^ t^-OOCO—<CO lNC0r^O5CM CM0000O5C0 ЮО
^^Ю05-* NOOOCO^ CO Ю CO CO CM 00 CO IN ~ CO CO Ю CO "^f CO CO О CO О О CM Ю
t^CO^OOlO СО^Ю—'О OicDQNO) (NN-нЮСО Ю —< CO —' "^ CM Ю — CM CO COCO
СОСОЮСМСО 00 CO IN —^ IN- ^f rf Ю OO CM OO *sf CM О О) О) О -н СО Ю 00 ^н ю С75 СО 00 СО
oocooo^t-o сосоооою со *-н 05 in со TfcocM—но) оооо^сою
со'со'^ю'ю'ю'4 ^"^^сооо со со см" см" см см" см см" см ~ rS~~S^S~S
—н ^- О) ~ СМ Г^ СО Ю —* СМ О) -Ф О) СО CM ONOOW Ю Ю СО СО О) ->^^00О5 О) тН
СМСМ-^ОЮ С0С000СОСО ОО —( СО СМ Ю О "^ О) rf —* -ef CO -^ rh О СО СО 00 00 Tf COCO
т^ФОЮС^ С^- Ю CM CO CO OCOlN^^f t^-OCOCOIN- Ю О СМ О) СМ О) — h» IN —' 00 00
CMOOOCOf- — 050000) NCDNOTf О) CO CO —* О О—• CM CO CO 00 CM Ю O) rj* 00 CO
О5С0О5ТГО INCO — OOlO CO—<O500CO "Г CO CM —< О OiOOt^COiO "^fTfOOCMCM — -M
СОСОЮЮЮ 'Ф ^ ^ 00 Co" CO Co" CM См" CM См" CM CM CM CM ~S~~St-*~S ^н^-Г^-Г-_^_ ^ ^_
—<COO) ~<0
CO 1С CSJ Ю О
-нЮчОсОО
00 CO -* О —i
С)^05Ю —
^ IN t— CM CO
CO —'00 —« О)
—<СО ОСМ СО
ю см coco —-
t>. -^ -^оо со
CM IN СО Ь- СМ
СО 00 00 О) О)
СМ ЮЮО О)
О) 00 О) СМ Ю
С^ —. О5 00 СО
^ со со со со
СМ СО —< IN IN
—< COCO IN IN
—i IN ^ Ol —'
LO CO CM — О
CO 00 h- "^ CO
Ю О) О IN- O)
—' — CO"*4 со
0)00 C^ СОЮ
ЮЮ^(МОО
CO CM Ot-- О)
CO 00 Tf CO CO
05 СМ СО О Tf
'чг ^ со со см
со см
юсм
COCO
О) rf
сосоююю ^-^^fcoco сососмсмсм смсмсмсмсм
СО 00 00 Ю СО rf 05 СО СО -н СО СО СО —< Ю 05ЮСО —00 СМ 05 00 СО СО
СО "si* 00 "Г 00 СО СМ — 00 Ю О) Ь- —« 00 rf Ю 05 г^ СМ СО СМОСОЮ*-^
О) I4-- СМ 00 1-- Ю t^ 05 IN О СОЮ'ФГ-.Ю Ю СО 00 05 ОО Ю050)Ю1^
C000O5"^Tf ООЮЮОО4^1 ^-^ О —< СО Г*- ОЮОЮСОСМ СМСМСОЮ^
О "4f О) Ю —< IN "чГ —' 00 СО "^ СМ О 00 СО Ю СО СМ —' О О) 00 IN СО Ю
СО О5С000 О Ю СМ
коосдюю г- —«
СО ^ О 05 СМ 00 00
OCONOlO О) "Ф
ю-^f со со см —' -^
t>- <£>\Л1Ыо ^f^f^rcoco сооооосмем смсмсмсмсм
Г-- 00 t^~ СМ —«
СО 05О5 00 —
ОО О) 050СО
05 СО СО О5 00
ОЮ ОЮ —
0)0 —* ^IN
СМ 1^ Г>- 00 СМ
OOO IN CO ^f
СМ 00 00 — СО
00 "чГ1 — О) СО
СМ СМ 00 0)0
t^. 00 Ю IN —
Ю Ю CM -4f —н
со см со ю О)
^г см ооо со
О СО 00 IN —'
О О О О О)
^окюсо
ю "чг см —« о
—I O00 О) IN
CN -* О CO IN
Ю 00 00 СО "чГ
СО СО -"чГ СО 00
О5 00 Г- СО Ю
СО00 СО 05Ю 05Ю
ООЮЮ^О О) О
О —< со Ю оо coco
—ч ^ 1^- — Ю О Ю
Ю *чГ СО СО СМ СМ —
INCOCOIOIO Tt* "Ф "4f СО 00 СОСОСОСМСМ СМСМСМСМСМ
О — СМ СО-^ ЮСОГ^ООО) О—'СМСО^ Ю СО IN 00 05 О — СМ СО rf
СО СО СО СО СО СО СО СО СО СО -Ф-ф Tf rf тг ^^rf ■vfsf ЮЮЮЮ Ю
lOCONQOOi O—•
юююю ю со со
OOOOO OOOOO OOOOO OOOOO OOOOO OOOOO OO
— ООООО ООООО ООООО ООООО ООООО ООООО ООООО ООО
OCDCOCOCOCO СОСОСОСОСО 0000000000 0000000000 S S -о s S S S s S S CDCDCDCDCD О) CD CD
О СО ОС S CD СЛ 4^ СО Ю »— О СО 00 S CD СП 4s» CO tO — О СО 00 S CD СП 4s» CO tO — О СО ОО S CD СЛ 4*» СО Ю
СО СО СО СО СО СО
О — tOCO 4^ СЛ
СЛ СП СП СЛ CD CD
ОС СО ОС 00 О 45»
СГ 4а» 00 -41 4*» СО
СО СО СО 45» 45»
OS S ООО —
S О© СО — СО
— — 4s» tOCO
— О О — 00
4s» 45» 45» 4s» 4s»
to со ел cd oo
CD СОЮ CD —
О — -J CD CD
oo toocn
4s. СЛ СЛ СЛ СЛ СЛ CD CD CD О)
CD — tO 4s» CD 00OtO45»S
SCOCOSCn 4s. 4s. СЛ SO
oostocn о ел ел 4s. 4s.
tOCDOOCH — O00O —О
CO — 4s» S О
4b. CD CD 4s. CO
СЛ 00 CO CO S
О — CD 4s» СЛ
OOO — ——
oo oo "со ~vD "со о о"—
С0 05000Ч ь-сло
4s» S — 00 CD CD CO СЛ
SCOSOCO 00CDO
— С045»СОСЛ 4s» S —
со со со coco со
О — tOCO 4s. СП
4s. 4s. 4s. 4s. СЛ СП
ОС СО 00 00 О СО
CO COCO 4s. 45»
CD S 00 О —
CD О) 00О tO
О CDC0 О —
CO 45» CO S — 00 CO CO — — 45»
42*. 4b. 4s» 4s. 45»
toco ел cd oo
4s. S — СЛ О
S S CO 45. ►—
tO S 4s. СЛ СЛ
45» СЛСЛ СЛ СЛ
CO — Ю 45» CD
ел»— оослео
45» 4s» О 45». O)
CD tO 00-41 45»
СЛ О CD CD CD
00 О tO 4s» CD
tO tOCO СЛ 00
CD СЛ CO — О
СЛ 4s. О) 00 СЛ
oo *- — >
CD SS S 00
CO — 4s» S О
to sco — о
О to О) 4* S
45» tO S 00 45»
00 00 00 CO CO
CO CD CO CO S
— CO 00 45» to
СЛ CO tO CO 4s.
45» CO tO — Ю
OO —
— СП О
to ело
CD tOCO
CO 00 CD
CO CO CO CO COCO
О — tO C0 45i.Cn
со со со со со 45»
S CD CO 00 COCO
CD 45» О CD 00 CO
со со со со 45»
CD S 00 CO —
45» СП S 00O
CD 00 —- 00 CD
СП 00О5 tO —
4s. 4*. 4i. 4s. 45»
tOCO 4s» CD S
CO CD CO 45» 00
4s. СЛ СЛ СЛ СП
CO О tO 45» 0>
CO CO ОЭСО —
4s»4s»COOCD COOoCOSS , ,
45»4s»0) — СЛ OOOOOCO ►— — ООСЛ —
ел о о cd О)
ООО tO 4s. О)
oo — ю сл
sen to cos
CD S S S S
00 — 4s» O) CO
CO 4s.O 00 S
ел cd cocd s
со ел s 45» 45»
о о ;~j-\~
oo oo oo"co"cd ooo
tOCDCOCOCD ОСЛСО
0004S.OOO 00ОСЛ
cocDSO>cn ел со s
CDS — — — 0> —4s»
CO CO CO COCO
— tO 00 45» СП
to to to to со
CO CO COCO 4s»
CD S 00 CD О
CO 45» CD S CO
4^. 45» 4s. 4s» 45»>
tOCO 45» CD S
toon oo to s
4s» СП СЛ СЛ СЛ
со о to 45- ел
Ю 00 4s» — СО
СО — О) СО СО
СП СП CD CD CD
S СО — 45» CD
00 00 COO СО
S 4*» — SCO
CD S S S S
00 —CO CD CO
S tO 00 СЛ 45»
— о to oo s
I'X., |,X^ 1%,,/ \\^ >^ v«v FT-* 4—' J ^*J ^»»W »■>• 'и-'* WW «.>»• ^l *^* V-* ft— ' 4*»/ ww WW -s^s 4»»*' >*ч* -»*д *■>»,/ WW W i ft—
CDcDOOCOtO OO S О CD CD ►— — Сл СЛ — CO — CD CO CO S 4=» — S CO — О tO 00 S
45» О CD CD 00 S S tO 45» 00 CD tO 00 00 CD 4*» 00 CD CO 4s» 00 CO tO CO 00 СЛ 00 00 — S
OO — — —
00 00 00 CO CO
юсл со to cd
СЛ S — CD 45»
tO CO tO CO CD
СЛ CD tOCO CO
О 45» CD
45» CD —
45* СЛ —
CD S ►£>.
COCOCOCOCO 0000000045». 4s. 4s» 45» 45» 45»
- — — tO tO0045»CD00 OOOS —СЛ О CD CO О 00 CD CD S 00 — 4s» CO СЛ tO—
Э00СОЮ OO CD 00 45» 4s- 00 00 tO — CD 00 СЛ О — — 00 45» О СЛ О S СЛ CD CO 00
•CDCn45». О S ОС CD CD CD О — CD 00 О CD О S — CD 00 — tO S tO 4s» О CD О
OO — — •
— о s to s
со sen s s
со ю ел
S СЛ CD
CO CO COCO CO
— tO CO 4s» СП
OO OO —
COCO CO CO 45»
CD S 00 CO О
— to со ся s
4s» 4s. 4s. 45» 45»
— CO 45» СЛ S
CO tO СЛ CD 4s.
CD 45» 00 S tO
45» СЛ СЛ СЛСЛ
ooo toco сл
CO 45» — 00 CD
tO COCO 4s» tO
\_^/ 4_^ «^^ v_^ i —— l\^ <>,/*/ \^ » ^| >*»■ «.>• \«/» NJb»> FT— v^/ p»— ■ \s*> W« *T— 14— fT— w V»W
CDCDOCCDtO S СЛ S tO tO CD 45» 00 S tO tOCOC04s»tO CO 4*. CD CO S
CO tO CD CO О COCD4S.0045» CO CO СЛ 45» О CD CD CO tO 00 4s» S — tO CD
СЛСЛ CD O) CD
s со —сося
45» 45» 45» CD 00
CO 45» CD CO S
CDS S S S
OOOCO CD 00
to sto о oo
CO OCO — 00
О О CO CO CD
oo o ——
oo oo оо"со"со "со о о
»-* ел oo — сл сосооо
C004S.COCD CD-S Ю
OOOCOCDCO COCDO
C00045»tO — J) О
ОО О ——
СОСОСОСОСО СОСОООС045» 45»45»45»4s»45» 45»СЛСЛСЛСЛ СЛСЛОО)0> CDSSSS ОООО Оо"со"сО ЪЪо
О —ЮСОСЛ CDS00CDO — СО 45» СЛ S 00O —ООСЛ SCO — СО СЛ SOCOOlOO —45»О0 —СЛ COCOS
CDCOCDCDO О — tO 45» CD 00 — 4s» 00 to S CO CD CD 4s» CO tO Ю 4s» CD CO 4s» О S СЛ СП S О CD CO tO CO S
CD CD 00 CD — CD 45» CD — О CO — 4s. CO S S CO CD CD 4s» О 4s. 00 — 4s. CO 45» tO 4s» CO CO СП 00 О — tO CD СЛ
tO tO CD — CD SSO —tO SOOCOtOtO tOCDCDOOCD 4^00tO45»S О 00 00 О CO 45» СЛ S Ю О S 00 О
OO O ——
COCOCOCOCO COCOCO0045» 4s.45»45»45»45» 45»СПСЛСЛСЛ CnCHCDCDO) O^SSSS 00 00 Oo"co"cO "coo"©
О — tO CO 45» CnSOOCOO — tO 4s. СЛ S 00 О — СО СП SCO — ООСЛ SOtOCnOO »— J5.s]»- 4i. OOtOS
00000000CD CO О — Ю 4s» SCDCOCD--» CD — 00 4s» tO —OO — 45» S^—S4s»CO l0 45»StOCO OOCOCO
CDCO4S.CO00 — 00 — CO tO tOSOCOCD b-cn->jcO— OICOCDCDO 00CO4s.4s»CO t04i»0
О S S 4s» — — OOCO —CD OCDO*»»45» 45» О СЛ CD CO — CD 4s. CO — S — CD Ю О 05 »P»» О
COCO 00 CO —
— CO SO 00
OO O — •—
COCOCOCOCO 00COCOO04S» 4s.4s.4s»45»4s» 45»СЛСЛСЛСЛ CnCnCDCDCD CDCDSSS OOOOOO Co"cO "(OOO
O —tO0045» CnCDOOCOO — tO 4s» СП CD 00 О — CO СП CD 00 О tO СЛ S CD tO СЛ СО О 45» S О 45» 00 Ю CD
S S S S 00 OOCOO —CO СЛ 00 — СЛ CO 45» О CD CO О CO 00 00 CO — CncDCn — О СО —45.00СЛ 4»» СЛ 00
О —tOC045» CnCDOOCOO — tO 4s» СП CD 00 О — CO СЛ CD 00 О tO СЛ S CD tO СЛ СО О 4s» S О 4s» 00 tO С
SSSS00 OOCOO —CO СЛ 00 — СЛ CO 45»OCDCOO CO0000CD»— СЛСОСЛ»— О СО —45.00СЛ 4»»СЛС-
cocoooooo ел to со s cd oo on s ел oo cd — cotooo tocncDOoco — ^ooo^- oo — о со сл totocn
OCOSCOCD 4а»00СЛ00— CD 00 00 — О 00 00 4s» tO 4s» CD tO 00 О tO CO CD tO S — — О S 4> to S ЬО CO
oo o — >
COCOCOCOCO COC0COCO45». 45» 45» 4s» 4s» 4s» rfs» 45» СЛ СП СЛ СЛ СЛ CD О) 05 CDCDSSS 00 00 00 CD CO CO О О
О —tOC045» CHCDSCOO —t04s»CnO) 00 CO — CO 4s. CD 00 О tO 4s. S CD tO 4»» S О CO S О 45» 00 tO CD
CDCDCD05S SOOCOOtO 4s» S О 4s» 00 CO 00 4s» — CO S CD CD S CO tO CD tO CO S CD S О СЛ — О — 4*»
OOCOOOOOO 4s» — to CD 45» CD tO 4s. — CO — CD S СП О СО СЛ CD G> CD S CO 4*» — tO S CO CD tO S tO О О
004s»0000CD COCOtOtO*-* tO CO 45» »— 4s» CD0004*» 00CDtO4*»CD O>00—tOtO SOCOOOCD COtOCO
3£
Глава 1
Рис. 1-21. Изменение формы висящей капли
раствора стеарата натрия во времени [35].
/—Юс, 7=71,9; 2 — 60 с, V==58,2; 3 — 120 с, 7=54,4; 4 -
1800 с, 7=39,2.
ляет несколько десятых процента. Штауффер [38] отмечает, что для
капель с малым значением 5 наблюдается заметное увеличение
погрешности измерений.
Б. Метод сидящей капли или пузырька
Как показано на рис. 1-20, и сидящая капля, и сидящий пузырек
симметричны, однако для определения поверхностного натяжения чаще
используют каплю, и далее речь пойдет именно о ней. Портер [39],
пользуясь таблицами Башфорта и Адамса [6], рассчитал разность
/\ = h2/2r2 — а2/2г2, где г — экваториальный радиус, h — расстояние от
верхушки до экваториальной плоскости (рис. 1-20). Зависимость Д от
h/r довольно точно можно описать с помощью эмпирического
уравнения
А =0,3047 (А3//-3) (1 — 4/iV). (I-35)
Техника эксперимента и более полное описание метода даны в работе
Вилера и др. [40]. Считается, что точность определения указанным
методом достигает 0,2%.
Уравнение (1-35) предполагает использование довольно больших
капель и к тому же не учитывает возможность неоднородности по
контуру капли, обусловленной, например, неравномерным смачиванием и
приводящей к отклонению формы капли от фигуры вращения.
Альтернативный метод, предложенный Смолдерсом и Дуйвисом [41], менее
чувствителен к размеру капли. Из определения р [уравнение (1-21)]
следует, что
y=&pg»$. (I-36)
Непосредственно Ъ определить трудно, однако в таблицах Башфорта и
Адамса [6] приведены значения (хе/Ь) как функции р, и поэтому
уравнение (1-36) можно записать как
V = Apgx*/lf (р)]2, xjb=f (P), (1-37)
где хе — экваториальный радиус капли (рис. 1-20). Поскольку хе можно
измерять довольно точно, проблема сводится к определению р. Этот
параметр находят сравнением профиля капли с рядом табличных
профилей для различных значений р. Зная р, из этих же таблиц находят
/(Р) и затем по уравнению (1-37) рассчитывают у. Точность
определения составляет 0,1%.
Нуттинг и Лонг [42] использовали обсуждаемый метод при
изучении изменения поверхностного натяжения растворов лаурата натрия во
Капиллярность
33
времени. Полученные результаты подобны приведенным на рис. 1-19
для додецилсульфата натрия. Метод удобен также для измерения
поверхностного натяжения расплавов металлов. Так, авторы работы [43]
с помощью рентгеновских теневых снимков сидящих капель определяли
поверхностное натяжение расплавов железа при 1450 °С и содержании
углерода 0,1—5% y=1600— 100X (Содержание углерода, %). Если
исследуются непрозрачные жидкости, например металлы, h трудно
определять оптическими методами. В этих случаях обычно используют
методику Кембола [44]; так, Роберте [45] применил ее для измерений
на ртути.
Если капли или пузырьки достаточно велики, ситуация упрощается, поскольку
достаточно только одного радиуса кривизны (того, который находится в плоскости
рисунка). При этом уравнение (1-12) принимает следующий вид:
Apgy = Yto7(i +y'2f/2h (1-38)
ИЛИ
2y/a* = {pdp/dy)/(\ -fp2)3/2,
где p = dy/dx. Интегрирование дает
у*1а2 = —1/(1 + Р2?'2 -f постоянная (1-39)
Поскольку h — это расстояние от верхушки капли до ее экваториальной плоскости,
то, если y = h, p = oo. Таким образом,
у2/а2 — Л2/а2 = —1/(1 _|_ p2)V2.
Кроме того, /?=0 при у=0 и, следовательно, h2ja2=\ или h=a, и в итоге
7 = Др£Л2/2. (1-40)
В это очень простое уравнение не входит величина краевого угла, поскольку здесь
рассматривается только конфигурация между экваториальной плоскостью и вершиной
капли.
Интересным вариантом метода сидящей капли является метод
вращающейся капли. Он очень удобен для измерения небольших
поверхностных натяжений на границе раздела жидкость — жидкость.
Рассмотрим каплю жидкости Л, подвешенной в жидкости В. Если плотность А
меньше плотности Ву то при вращении всей системы, как показано на
рис. 1-22, жидкость А идет к центру, образуя каплю на оси вращения.
По мере увеличения скорости вращения капля вытягивается, поскольку
центробежная сила все больше противодействует поверхностному
натяжению, стремящемуся свести к минимуму поверхность раздела. В конце
концов сферическая капля А деформируется в продолговатый
эллипсоид. При достаточно высокой скорости вращения капля похожа на
вытянутый цилиндр.
Общий анализ рассматриваемой системы трудоемок, хотя и не
слишком сложен. Однако предельный случай — образование сильно
вытянутой, практически цилиндрической капли интерпретировать довольно
просто. Рассмотрим часть вытянутого цилиндра объемом V=nr
а
(—и—jt—)
6
Рис. 1-22.
3—1421
34
Глава I
(рис. 1-22,6). На каждый элемент объема действует центробежная
сила со2гДр, где со — скорость вращения, а Ар — разность плотностей
жидкостей. Соответственно потенциальная энергия элемента на расстоянии
г от оси вращения равна со2г2Ар/2, а общая потенциальная энергия
цилиндра длиной / составляет
/о
/ \ (ы2г2кр/2) 2nrdr = nw?Apr*0l/4.
о
Свободная энергия поверхности раздела равна 2пг$1у. Таким образом,
суммарную энергию капли можно записать в виде
£=яо)2Дрг«;//4 + 2яг0/7=со2Арг§К/4 + 2Vy/r0,
так как V = nrll. Полагая dE/drQ = 0, мы получаем
(1-41)
со2Арг§
Уравнение (1-41) известно как уравнение Воннегута [47].
Вэйд и др. [48] применили метод вращающейся капли для
изучения систем с чрезвычайно низким поверхностным натяжением. Метод
позволяет легко и точно измерить величины порядка 0,001 дн/см.
10. Динамические методы измерения поверхностного натяжения
Методы капиллярного поднятия, пластинки Вильгельми, висящей
или сидящей капли или пузырька, по существу, являются равновесными
методами, так как в них анализируются поверхности, находящиеся в
покое. Как видно из предыдущих разделов, эти методы можно
использовать для контроля иногда обнаруживаемых в растворах медленных
изменений поверхностного натяжения. Однако для изучения старения
поверхностей и исследования релаксационных эффектов при очень
малых временах необходимы динамические методы. Различные методы
отрыва в принципе являются динамическими, поскольку в критической
точке (в момент отрыва) происходит расширение поверхности, однако
точный возраст поверхности при этом определить очень трудно. Это
удается сделать, только используя обсуждаемые ниже методы.
А. Поточные методы
Струя, вытекающая из некруглого отверстия, механически
нестабильна и в конечном итоге разрывается на капельки (см. разд. 1-3).
В основном нестабильность такой струи связана с отклонением ее
первоначального сечения от окружности, что приводит к возникновению
колебаний сечения (когда эллиптическое сечение струи становится
круглым, с жидкостью переносится соответствующее количество движения).
См. рис. 1-23.
Впервые математическая теория колебаний в струе была развита
Рэлеем в 1879 г. Бор предложил более строгую теорию, которая
позднее была уточнена Сатерлэндом [49]. Согласно Сатерлэнду,
_4рра(1+370у24г2)
уарр — 6А2 (1 + 5л2г2/ЗА,2) ' К '
где р — плотность жидкости, v — объемная скорость, X — длина волны,
г — сумма максимального и минимального полудиаметров, Ь — их
разность. Требуемые для расчета параметры струи определяют оптически.
Обычно эти параметры близки к следующим значениям: толщина
струи ~0,03 см, объемная скорость ~1 см3/с, длина волны А,~0,5 см.
Капиллярность
35
Рис. 1-23. Колебания в
эллиптической струе.
В первом приближении возраст поверхности в данной узловой точке в
точности равен расстоянию от отверстия, деленному на линейную
скорость струи. В приведенном примере возраст поверхности составляет
около 1 мс на длину волны.
На рис. 1-24 приведены некоторые данные по зависимости
поверхностного натяжения от возраста поверхности растворов энантовой
кислоты [50]. Раствор, выходящий из объема струи на поверхность,
по-видимому, имеет поверхностное натяжение примерно вдвое меньше
поверхностного натяжения чистой воды. Замедленность в достижении
равновесия может объясняться тем, что для диффузии
поверхностно-активного вещества на поверхность требуется время, хотя в данном
случае лимитирующим фактором, по-видимому, является скорость
химического процесса.
Если возраст поверхности меньше 5 мс, необходимо вводить
поправку, учитывающую тот факт, что поверхностная скорость жидкости в
насадке равна нулю и требуется несколько длин волн, чтобы она
возросла до скорости струи. Поправочные коэффициенты табулированы в
работах [51, 52].
СО
85h
60\-
55[-
50
45h
сп
Отверстие D ®
Отверстие Е л
Отверстие F о
L__L_
0,025
0,005 0,010 0.0 f5 0,020
Возраст поверхности, с
Рис. 1-24. Изменение поверхностного натяжения водных растворов энантовой кислотьз
различной концентрации во времени [50].
36
Глава I
Метод колеблющейся струи не пригоден для исследования
поверхностей раздела жидкость — воздух, которые стареют в течение десятых
долей секунды. Эта задача решается с помощью метода, основанного
на зависимости формы падающего столбика жидкости от его
поверхностного натяжения. Поскольку с увеличением расстояния от насадки
h гидростатическое давление и, следовательно, линейная скорость струи
возрастают, в соответствии с требованием материального баланса
площадь сечения столбика должна уменьшаться. Действие поверхностного
натяжения проявляется в противодействии сокращению сечения
столбика. Этот метод, разработанный Эдисоном и Элиотом [53], подробно
обсуждается в работе Гарнера и Мина [54].
Б. Капиллярные волны
Длина капиллярных волн на поверхности жидкости, наполняющей
глубокий сосуд, зависит от поверхностного натяжения. Согласно теории
Кельвина [55],
у2=^Я/2я + 2я7/рХ,
(1-43)
у=Я3р/2щ;2 _ gX2p/4n2,
где v — скорость распространения волны, К — длина волны, т — период
капиллярной волны. Для воды минимальная скорость распространения
волн при Л,, равной 1,7, 0,1 и 105 см, составляет примерно 0,8, 2,4 и
142 км/ч соответственно.
Экспериментально капиллярные волны измеряются как стоячие
волны, и может показаться, что эта система является статической.
Однако отдельные элементы жидкости в приповерхностном слое
совершают почти круговое движение, а поверхность попеременно
растягивается и сжимается. В результате этого даже в чистой жидкости
наблюдается затухание волн. В растворах или на поверхностях, покрытых
пленкой, в которых переходные состояния натяжения и сжатия поверхности
сопровождаются значительными локальными изменениями
поверхностного натяжения и переносом вещества между поверхностными слоями,
затухание значительно больше. Обзор новых работ по капиллярным
волнам можно найти в статье Лукассена и Хансена [56]. Более
детально метод капиллярных волн рассматривается в гл. III, здесь же
отметим только, что по дисперсии коэффициента затухания (т. е. по
изменению его с частотой) можно изучать поверхностные релаксационные
процессы.
11. Некоторые другие проявления капиллярности
Существование поверхностного натяжения проявляется самым
различным образом; именно этим обстоятельством, а также важностью
этого явления объясняется обилие различных методик оценки
поверхностного натяжения. Наиболее точные и употребительные методики мы
уже рассмотрели, остановимся еще на двух интересных проявлениях
действия поверхностных сил.
Рассмотрим поведение пузырька (или капли несмешивающейся
жидкости) в вязкой жидкости, например в жидком полимере. Поместим
эту систему в пробирку, быстро вращающуюся вокруг своей
продольной оси. Как показано в разд. 1-9, Б, в этих условиях пузырек (или
капля) вытягиваются до тех пор, пока сила, обусловленная
центробежным ускорением, не уравновесится поверхностным, или
межфазным, натяжением [57].
Капиллярность
ЗГ
Рис. 1-25. Деформация капли силиконового масла в касторовом масле под лепсгзием
электрического поля [58].
В переменном ноле (частота 60 Гц) капля вытягивается, а в постоянном — сплющивается Слева:
напряженность поля увеличивается снизу вверх, достигая величины порядка 2 кВ'см Справа:
деформация и разрыв капли в постоянном поле. Кадры сняты через интервалы 0,1 с.
Интересное и перспективное применение нашли системы, свободные
от действия сил тяжести и центробежного поля. В отсутствие
гравитационного и центробежного полей жидкая капля имеет совершенную
сферическую форму. В частности, такую форму принимают капли
расплавленного металла; после затвердевания они образуют идеальные
шарики. В настоящее время эта методика испытывается в Космической
лаборатории США.
Как и гравитационное поле, электрическое поле также вызывает
деформацию капель жидкости. При этом равновесная форма
определяется соотношением между электрической напряженностью на
поверхности раздела и поверхностным натяжением [55]. На рис. 1-25 показаны
профили капли силиконового масла, взвешенной в касторовом масле и
подвергающейся воздействию переменного и постоянного электрических
полей. При достаточно высокой напряженности поля деформация
становится настолько сильной, что капля разрывается.
12. Величины поверхностных натяжений,
измеренные различными методами
Результаты определения поверхностного натяжения чистой
жидкости не должны зависеть от используемого метода измерения. Так
фактически и обстоит дело, хотя из-за сложности математической
обработки результатов исследования этих сложных явлений могут наблюдаться
кажущиеся различия. Исследование растворов динамическими
методами, в том числе и отрывными, нередко дает завышенные значения. Этот
вопрос детально обсуждается в работе Пади и Рассела [59]. Отметим
также, что аналогичные трудности возникают и при измерении натяже-
38
Глава I
ния на поверхности раздела между двумя частично смешивающимися
жидкостями.
Данные, приведенные в табл. 1-8, дают наглядное представление о
величинах поверхностного натяжения наиболее часто изучаемых
поверхностей раздела и могут использоваться в качестве справочного
материала при решении задач. Для полноты картины в таблицу
включены также величины поверхностного натяжения редко используемых на
практике веществ или необычных состояний вещества (например,
расплавленных металлов). Таблица дает представление о диапазоне
изменения поверхностного натяжения: кроме того, в ней даны ссылки на
соответствующую литературу. Несмотря на то что приведенные в
таблице значения отбирались критически, их нельзя рассматривать как наи-
Таблица 1-8
Поверхностное натяжение в различных системах
Жидкость
Температура, °С
V, Дн/см
Жидкость
Температура, °С
Поверхности раздела типа жидкость — пар
Водаа
Органические соединения
Йодистый метилен6
Диметилсульфоксидв
Пропиленкарбонатг
Диметиланилинд
Нитрометане
Бензола
Толуол3
Хлороформа
Пропионовая кислотаа
Масляная кислотаа
Четыреххлористый угле-
рода
Низкокипящие
соединения
4 Не3
н2и
Агк
СН*
г2
°2
Металлы
Hga
Na°
Вап
SnP
Соли
BiClg
ксю*
KNCS*
20
25
30
20
20
20
20
20
20
30
20
25
20
20
25
1 К
20 К
20 К
75 К
90 К
по к
85 К
77 К
20
25
30
130
720
332
271
368
175
72,88
72,14
71,40
67,00
43,54
41,1
36,56
32,66
28,88
27,56
28,52
26,67
26,69
26,51
26,43
0,365
2,01
3,54
9,41
11,86
13,71
14,84
16,48
486,5
485,5
484,5
198
226
543,8
66
81
101,5
Бутилацетатж
Нонана
Метанола
Этанола
Октана
Гептана
Перфторметилцикло-
гексана
Перфторгептана
Перфторпентана
сгН6
Хем
N20
С1|
NOCla
Agc
CuT
ptT
Fe<
NaNO£
К2СГ2О j
Ba(N03)y2
20
20
20
20
20
20
20
20
20
180,6 К
163 К
182,5 К
-30
— 10
20
1100
Т. пл.
1680
Т. пл.
Т. пл.
308
397
595
Капиллярность
39
Продолжение табл. 1-8
Жидкость
Температура, °С
V, Дн/см
Жидкость
Температура, °С
V, Дн/см
Поверхности раздела типа жидкость — жидкость
Жидкость 1 — вода
я-Бутиловый спиртщ
Этилацетатщ
Энантовая кислотащ
Бензальдегид4
Жидкость 1 — ртуть
Вода3
Этанолщ
я-Гексанщ
Жидкость 1 — фторпо-
лимер
Бензолщ
20
20
20
20
20
25
20
20
25
1,8
6,8
7,0
15,5
415
416
389
378
7,8
Нитробензол0
Бензолщ
Четыреххлористый
углеродщ
я-Гептанщ
я-Гептанщ
Бензол3
Водан
20
20
20
20
20
20
25
Jasper J. J, J Phys. Chem. Ref. Data, 1, 841 (1972).
Grzeskowiak R , Jeffery G. H., Vogel A. I., J. Chem. Soc, 1960, 4728.
Clever H. L., Snead С. С, J. Phys. Chem., 67, 918 (1963).
Bernett M. K., Jarvis N. L., Zisman W. A., J. Phys. Chem., 66, 328 (1962).
Cm. [11].
Snead C. C, Clever H. L., J. Chem. Eng. Data, 7, 393 (1962).
Griffin J. В , Clever H. L.t J. Chem. Eng. Data, 5, 390 (1960).
Atkins K. R., Narahara Y., Phys. Rev., 138, A437 (1965).
Григорьев В. И, Руденко Н. С, Журн. эксп. и теор. физ., 47, 92 (1964).
Stansfield D , Proc. Phys. Soc, 72, 854 (1958).
Leadbetter A. J., Taylor D. J., Vincent В., Can. J. Chem., 42, 2930 (1964).
Leadbetter A. J., Thomas H. E., Trans. Far. Soc, 61, 10 (1965).
Chao M. S., Stenger V. A., Talanta, 11, 271 (1964) [through Chem. Abstr., 60, 4829 {
Cm. [22].
Addison C. C, Coldrey J. M., Halstead W. D., J. Chem. Soc, 1962, 3868.
Cahill J. A., Kirchenbaum A. D. J. Inorg. Nucl. Chem., 26, 206 (1964).
Lauerman I., Metzger G., Sauerwald F., Z. Phys. Chem., 216, 42 (1961).
Allen B. C, Trans. Met. Soc AIME, 227, 1175 (1963).
Title J., Kelly /. C, Brit. J. Appl. Phys., 14, No. 10, 717 (1963).
Jaeger F. M.t Z. Anorg. Chem., 101, 1 (1917).
Frame J. P., Rhodes E., Ubbelohde A. R., Trans. Faraday Soc, 55, 2039 (1959).
Cm. [18].
Donahue D. J., Bartell F. E., J. Phys. Chem., 56, 480 (1952).
Girifalco L. A., Good R J , J Phys. Chem., 61, 904 (1957).
Butler E. В., J Phys. Chem., 67, 1419 (1963).
Fowkes F. M., Sawyer W. M., J. Chem. Phys., 20, 1650 (1952).
25,2
35,0
45,0
50,2
378
357
57
(1964)].
более точные справочные величины. Наконец, в указанной в таблице
литературе можно найти дополнительные сведения о поверхностном
натяжении жидкостей, включенных в таблицу, и их аналогов при
различных температурах.
13. Упражнения
1. Выведите уравнение (1-4), используя концепцию «поверхностного натяжения».
(Рассмотрите сферу, составленную из двух полусфер. Определяемая сила,
стремящаяся разделить половинки сферы, обусловленная ДР, уравновешивается поверхностным
натяжением вдоль линии соединения.)
2. На рис. 1-26 показаны капилляры различной конструкции. Во всех случаях
диаметр капиллярной части один и тот же. Все капилляры, кроме второго слева,
изготовлены из стекла. Слева показано равновесное капиллярное поднятие воды. Нарисуйте
на каждом рисунке мениски, соответствующие а) поднятию по чистому сухому
капилляру и б) уровню, до которого отступает вода после засасывания до конца
капилляра. Во всех случаях мениски можно считать сферическими.
38
Глава I
Рис. 1-26.
Рис. 1-27.
^Т
3. Покажите, что второй член в уравнении (1-18) действительно соответствует
весу мениска. (Мениск имеет форму полусферы.)
4. Поверхностное натяжение жидкости, смачивающей стекло, измеряют,
определяя высоту А/г между уровнями двух менисков в U-образной трубке. Внутренний
радиус узкой части трубки равен rb а широкой — r2 (>2>''i). Известны следующие
данные: A/i=l,90 см, ri = l,00 мм, г2= 1,00 см, р = 0,95 г/мл при 20°С. Рассчитайте
поверхностное натяжение жидкости, а) используя простейшую теорию капиллярного
поднятия и б) соответствующие поправки из табл. 1-2 и 1-3.
5. Соответствуют ли размеры капель, показанных на рис. 1-21, действительным?
Если не соответствуют, рассчитайте коэффициент уменьшения или увеличения.
6. Каплю воды помещают между двумя большими расположенными
параллельно друг другу пластинками, как показано на рис. 1-27. Жидкость смачивает обе
поверхности. На рисунке показано поперечное сечение капли и пластинок и осевая линия.
Капиллярная постоянная а и диаметр капли d значительно больше расстояния х
между пластинками.
а). Выведите уравнение для силы, действующей на обе пластинки;
сформулируйте разумные допущения, пренебрегая эффектами второго порядка. Помните, что АР
изменяется не только в зависимости от х, но и в зависимости от площадей
различных поверхностей раздела.
б) Рассчитайте величину этой силы при температуре 20 СС, если объем капли
равен 2,00 мл и л;=1,00 см. Примечание. Это упражнение иллюстрирует один из
механизмов действия адгезионных сил в клеевых соединениях (см. разд. IX-8).
7. Выведите уравнение (1-6).
8. Тонкостенную капиллярную трубку радиусом 0,02 см заполняют водой при
20 °С до тех пор, пока на конце капилляра не образуется отрывающаяся капля (рис.
1-28). а) Рассчитайте общий вес воды в системе, б) Капиллярную трубку опускают в
чашку с водой и после этого медленно поднимают почти до отрыва. Как в этом случае
выглядит система? Каков уровень мениска по сравнению со случаем а) и какова
форма нижней поверхности? С помощью вашего рисунка рассчитайте вес воды,
остающейся в капилляре после его отрыва. Точное решение не требуется, достаточно только
первого приближения. (Прежде чем решать эту задачу, полезно ознакомиться с работой
[59].)
9. Методом взвешивания капли определяют поверхностное натяжение
органической жидкости. Наружный диаметр капилляра равен 0,60 см, внутренний — 0,02 см;
вес 20 капель составляет 0,80 г; плотность жидкости равна 0,95 г/см3; смачивание
капилляра жидкостью полное. Рассчитайте поверхностное натяжение жидкости,
используя соответствующий поправочный коэффициент.
ь*л
Рис. 1-28.
Капиллярность
41
V
Рис. 1-29. L _J
10. Выведите уравнение капиллярного поднятия между параллельными
пластинками с учетом веса мениска. Считайте, что краевой угол равен нулю, мениск имеет
цилиндрическую форму и краевые эффекты пренебрежимо малы.
11. Исходя из простых соображений, выведите уравнение капиллярного поднятия
между двумя пластинами бесконечной длины, наклоненными по отношению друг к
другу под углом 0 и контактирующими с поверхностью жидкости (рис. 1-29).
Считайте, что краевой угол равен нулю и мениск имеет круглое сечение.
Напомним, что, как и в упражнении 6, площадь поверхности жидкости зависит от
ее положения.
12. Различные авторы приводят следующие значения поверхностного натяжения
К)-4 М раствора олеата натрия при 25 °С: а) метод капиллярного поднятия: у==
=43 дн/см; б) метод взвешивания капель: y=50 дн/см и в) метод сидящей капли:
Y = 40 дн/см. Объясните, чем вызвано различие между приведенными значениями.
Какое значение поверхностного натяжения должно быть наиболее надежным и почему?
13. Выведите уравнение (1-33).
14. Используя уравнения, приведенные в работе [9], рассчитайте r/Ь для г/а,
равного 0,50; 1,00; 2,00 и 3,00. Сравните полученные вами результаты с
соответствующими данными в табл. 1-2 и 1-3.
15. При температуре плавления нафталина 82 °С расплавленный нафталин и вода
имеют одинаковую плотность. Предложите два метода определения поверхностного
натяжения в системе нафталин — вода. Обоснуйте выбор и покажите, что эти методы
достаточно просты в исполнении и дают результаты с точностью не менее 1%.
16. В разделе 1-9, Б (метод висящей капли) отмечалось, что по практическим
соображениям желательно, чтобы радиус кончика капилляра отвечал соотношению
г/а ^0,5. Обсудите причины этого условия. Каковы вообще факторы, определяющие
практический диапазон размеров капель?
17. Используя табл. 1-6, рассчитайте для висящей капли 5 и 1/Я при (3=—0,45.
(Учтите, что значения х/b в табл. 1-6 достигают максимума, когда х соответствует
экваториальному радиусу.) Сравните результаты проведенного вами расчета с
соответствующими величинами в табл. 1-7.
18. Капля некоторой жидкости плотностью 0,80 г/см3 характеризуется
следующими параметрами: р=—0,45 и с?е=0,50 см. а) Рассчитайте поверхностное натяжение
капли, б) Рассчитайте профиль капли от нижней точки до торца капилляра,
предполагая, что Г//а=0,55, где rt — радиус капилляра.
19. Используя данные табл. 1-5 и соответствующие определения, найдите
соотношение между ft rla и r/Vlte и постройте зависимость f от г/а.
20. С помощью табл. 1-1 рассчитайте r/b и г/а для мениска жидкости,
смачивающей капилляр. Параметр формы мениска Р считайте равным 80.
21. Капля жидкости плотностью 2,5 г/см3 покоится на плоской, полностью не
смачиваемой поверхности. На границе зоны контакта угол между каплей и
поверхностью равен 9 (напоминаем, что G измеряется в жидкой фазе). Высота капли над
поверхностью равна 0,45 см, ее экваториальный диаметр составляет 1,50 см, а
параметр формы |3=80 (см. табл. 1-1). а) Рассчитайте поверхностное натяжение
жидкости, б) Рассчитайте краевой угол 6.
22. Согласно элементарной формуле, максимальное давление пузырька равно
Ртах = 2у/г, где г — радиус поперечного сечения круглой трубки, а Р — давление с
поправкой на гидростатическое давление, соответствующее глубине погружения
трубки. Используя соответствующую таблицу, покажите, что при расчете у по данной
формуле с ошибкой не больше 5% можно использовать максимальный радиус
трубки. Поверхностное натяжение жидкости и плотность считайте равными 30 дн/см и
1,10 г/см3 соответственно.
23. Жидкость плотностью 2,5 г/см3 образует в металлическом капилляре мениск,
форма которого соответствует |3 = 80. Краевой угол равен 30°, капиллярное поднятие
составляет 0,074 см. Используя данные табл. 1-1, рассчитайте поверхностное
натяжение и радиус капилляра.
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Адам Н. К., Физика и химия поверхностей, М., ОГИЗ, 1947.
Aveyard R., Haydon D. A., An Introduction to the Principles of Surface Chemistry,
Cambridge University Press, 1973.
42
Глава I
Davies J. Т., Rideal E. K., Interfacial Phenomena, 2nd ed., Academic Press, New York,
1963.
Gaines G. L„ Jr., Insoluble Monolayers at Liquid-Gas Interfaces, Interscience, New York,
1966.
Harkins W. D., The Physical Chemistry of Surface Films, Reinhold, New York, 1952.
van Olphen Я, Mysels K. /., Physical Chemistry: Enriching Topics from Colloid and
Surface Science, Theorex (8327 La Jolla Scenic Drive), La Jolla, California, 1975.
Partington J. R., An Advanced Treatist of Physical Chemistry, Vol. II, Longmans, Green,
New York, 1951.
Семенченко В. К-, Поверхностные явления в металлах и сплавах, М., ОГИЗ, 1957.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Young Т., Miscellaneous Works, Peacock G., ed., Murray J., London, 1855, Vol. I,
p. 418.
2. de Laplace P. S., Mechanique Celeste, Supplement to Book 10, 1806.
3. Бойс Ч., Мыльные пузырьки, ПГ. Научное кн-во, 1919.
4. Rumscheit F. D., Mason S. G., J. Colloid Sci., 17, 266 (1962).
5. Lord Rayleigh (Strutt J. W.), Proc. Roy. Soc. (London), A92, 184 (1915).
6. Bashforth F., Adams J. C., An Attempt to Test the Theories of Capillary Action,
University Press, Cambridge, England, 1883.
7. Sugden S., J. Chem. Soc, 1921, 1483.
8. Padday J. F., Pitt Л, J. Colloid Interface Sci., 38, 323 (1972).
9. Lane /. E., J. Colloid Interface Sci., 42, 145 (1973).
10. Erikson T. A., J. Phys. Chem, 69, 1809 (1965).
11. Richards T. W., Carver E. K„ J. Am. Chem. Soc, 43, 827 (1921).
12. Harkins W. D., Brown F. E., J. Am. Chem. Soc, 41, 499 (1919).
13. Уразовский С. C.j Цветаев П. М., Коллоид, журн. 11, 359 (1949).
14. Edwards P. R., J. Chem. Soc, 1925, 744.
15. Jones G., Ray W. A., J. Am. Chem. Soc, 59, 187 (1937).
16. Heller W., Cheng M, Greene B. W. J. Colloid Interface Sci, 22,179 (1966).
17. Sugden S, J. Chem. Soc. 1922, 858; 1924, 27.
17a. Johnson C. H. /, Lane J. E., J. Colloid Interface Sci, 47, 117 (1974).
18. Addison C. C, Coldrey J. M., J. Chem. Soc, 1961, 468.
19. Tate Т., Phil. Mag. 27, 176 (1864).
20. Dunken Я, Ann. Phys, 41, 567 (1942).
21. Brown R. C, McCormick H., Phil. Mag, 39, 420 (1948).
22. Addison C. C, Addison W. E., Kerridge D. Я, Lewis /, J. Chem. Soc, 1955, 2262.
23. Lecomte du Nouy P., J. Gen. Physiol, 1, 521 (1919).
24. Harkins W. D., Jordan H. F., J. Am. Chem. Soc, 52, 1751 (1930).
25. Fox H. W., Chrisman С. Я, Jr., J. Phys. Chem, 56, 284 (1952).
26. Freud В. В., Freud H. Z, J. Am. Chem. Soc, 52, 1772 (1930).
27. Krynitsky J. A., Garrett W. D., J. Coll. Sci, 18, 893 (1963).
28. van Zeggeren F., de Courval C, Goddard E. D., Can. J. Chem, 37, 1937 (1959).
29. Wilhelmy L, Ann. Phys, 119, 177 (1863).
30. Ruyssen R., Rec Trav. Chim, 65, 580 (1946).
31. Jordan D. O, Lane J. £, Australian J. Chem, 17, 7 (1964).
32. Davies J. Т., Rideal E. K., Interfacial Phenomena, Academic Press, New York,
1961.
33a. Neumann A. W., Tanner W., Tenside, 4, 220 (1967).
33b. Kloubek /, Neumann A. W., ibid., 6, 4 (1969).
34. Gaines G. L, Jr., Insoluble Monolayers at Liquid-Gas Interfaces, Interscience, New
York, 1966.
35. Andreas J. M., Hauser E. A., Tucker W. В., J. Phys. Chem. 42, 1001 (1938).
36. Niederhauser D. O, Bartell F. E., Report of Progress — Fundamental Research on the
Occurrence and Recovery of Petroleum, Publication of the American Petroleum
Institute, The Lord Baltimore Press, Baltimore, 1950, p. 114.
37. Fordham S., Proc. Roy. Soc. (London), A194, 1 (1948).
38. Stauffer С. Е., J. Phys. Chem, 69, 1933 (1965).
39. Porter A. W., Phil. Mag, 15, 163 (1933).
40. Wheeler O. L, Tartar H. V., Lingafelter E. C, J. Am. Chem. Soc, 67, 2115 (1945)
41. Smolders C. S, Duyvis E. M., Rec Trav. Chim, 80, 635 (1961)
42. Nutting G. C, Long F. A., J. Am. Chem. Soc, 63, 84 (1941).
43. Kosakevitch P., Chatel 5, Sage M., CR, 236, 2064 (1953)
44. Kemball C, Trans. Faraday Soc, 42, 526 (1946).
45. Roberts N. K., J. Chem. Soc, 1964, 1907.
46. Princen Я. M.f Zia I. Y. Z., Masson S. G, J. Colloid Interface Sci, 23, 99 (1967)
4/. Vonnegut В., Rev. Sci. Inst, 13, 6 (1942).
48. Cayias J. L., Schechter R. S., Wade W. Я, Adsorption at Interfaces, Mittal К L ed
ACS Symposiurn Series, 8, 234 (1975); Cash L., Cayias J. L., Fournier G.f MacAllis-
ter D., Schares Т., Schechter R. 5, Wade W. H., J. Colloid Interface Sci. in press
Капиллярность
43
4Э. Sutherland К. L.t Australian J. Chem., 7, 319 (1954).
50. Hansen R. S.t Wallace T. C, J. Phys. Chem., 63, 1085 (1959).
51. Netzel D. A, Hoch G.f Marx T. /., J. Colloid Sci., 19, 774 (1964).
52. Hansen R. S., J. Phys. Chem., 68, 2012 (1964).
53. Addison C. C, Elliott T. A., J. Chem. Soc, 1949, 2789.
54. Garner F. H., Mina P., Trans. Faraday Soc, 55, 1607 (1959).
55. Lord Kelvin (Thomson W.), Phil. Mag. 42, 368 (1871).
56. Lucassen Л, Hansen R. S., J. Colloid Interface Sci., 22, 32 (1966).
57. Gaines G. L.t Jr., Polymer Eng., 12, 1 (1972).
58. Torza S., Cox R. G., Mason S. G., Phil. Trans. Roy. Soc (London), 269, 295
(1971).
59. Sentis M. H., J. Phys. Radium, 6, 571 (1887).
ГЛАВА II
Природа и термодинамика жидких поверхностей
раздела
1. Однокомпонентные системы
Как ясно показано в гл. I, поверхностное натяжение y является
вполне определенным свойством поверхностей раздела между двумя
жидкими фазами, характеризуемым точно измеримой величиной. Если
жидкие фазы представляют собой чистые вещества с нормальной
вязкостью, его равновесное значение достигается очень быстро.
Динамическими методами найдено, что поверхностное натяжение чистых
жидкостей достигает равновесного значения в течение одной миллисекунды
или еще быстрее [1]. Согласно расчетам, приведенным в этом разделе,
большая часть свободной поверхностной энергии относится к
поверхностному слою толщиной порядка всего нескольких молекулярных
диаметров.
А. Термодинамические характеристики поверхности чистой
жидкости
На рис. II-1 изображена гипотетическая система: ящик со
скользящей крышкой, заполненный некоторой жидкостью. Материал крышки
должен быть таким, чтобы межфазное натяжение между ним и
жидкостью было равно нулю. Если при сдвигании крышки поверхность
жидкости увеличивается на afA, то при этом необходимо совершить работу
ydA. При постоянных температуре и давлении эта работа обратима и,
следовательно, соответствует увеличению свободной энергии системы
(более детально термодинамика поверхностей рассматривается в разд.
XIV-12):
dG=ydA. (II-1)
Полная свободная энергия системы состоит из суммы молярной
свободной энергии, умноженной на число молей жидкости, и поверхностной
свободной энергии Gs, равной свободной поверхностной энергии на
единицу площади, умноженной на общую площадь поверхности. Таким
образом,
Gs=y = (dG/d\)T9p. (II-2)
Поскольку описанный выше процесс обратим, связанная с ним теплота
соответствует изменению поверхностной энтропии:
dq=TdS = TSsdA, (II-3)
где Ss — поверхностная энтропия, отнесенная к одному квадратному
сантиметру поверхности.
Из равенства (дС/дТ)Р——S следует, что
(dGs/ffT)p = —Ss (II-4)
Природа и термодинамика жидких поверхностей раздела
45
Рис. Н-1.
JSSSSSSSSSSSSSSSSS^SSSS^h»
у/////////////////////////////// У\
или [с учетом уравнения (П-1)]
dy/dT=—Ss.
(П-5)
Наконец, полная поверхностная энтальпия, отнесенная к квадратному
сантиметру, #5, равна
HS=GS+TSS. (П-6)
Часто Hs и поверхностная энергия Es неразличимы и могут хорошо
аппроксимировать друг друга. Поэтому уравнение (Н-6) можно
представить как
или
FS = GS + TSS
Es=y — Tdy/dT.
(П-7)
(И-8)
Полная поверхностная энергия Es обычно больше поверхностной
свободной энергии. Нередко Es более информативна, чем две другие
поверхностные величины, или по крайней мере легче связывается с
молекулярными моделями.
Далее, по мере изложения материала мы выведем и другие
термодинамические соотношения, а пока ограничимся еще только одной
величиной— поверхностной удельной теплоемкостью Cs (иногда
различают Ср и Су):
Cs^dfrldT. (II-9)
Поверхностное натяжение большинства жидкостей с увеличением
температуры уменьшается почти линейно (рис. И-2). Для
преобразовании?
Рис. Н-2. Зависимость поверхностного натяжения и полной свободной поверхностной
энергии ССЦ от температуры [2].
46
Глава II
ния этой почти линейной зависимости в строго линейную предложено
много алгебраических выражений. Этвешу [3] приписывают старое и
известное соотношение
yV^=k{Tc—Г), (И-10)
где V— молярный объем. Исходя из этого соотношения, можно
ожидать, что при критической температуре поверхностное натяжение
становится равным нулю. По-видимому, однако, межфазная граница
становится диффузной при несколько более низкой температуре. Поэтому в
уравнении (П-10) Рамзей и Шилдс [4] заменяют Тс на (Тс—6). В
любом случае константа k почти одинакова для большинства жидкостей
и составляет приблизительно 2,1 эрг/град. Другое выражение для
температурной зависимости поверхностного натяжения, предложенное в
1894 г. Ван-дер-Ваальсом и впоследствии уточненное Гуггенгеймом
[5], имеет следующий вид:
y=t{l-TlTcy. (П-11)
Для многих органических жидкостей п равно 11/9, а для металлов оно
близко к единице [5].
Размерность константы k в уравнении (П-10) нередко вызывает недоразумения.
По смыслу величина y^"^соответствует поверхностной свободной энергии, отнесенной
к одному молю. Может показаться, что она имеет размерность энергии, деленной на
моль /з? и> следовательно, размерность k — эрг/град-моль"/3. Однако член «моль ^»
не имеет смысла, поскольку символ «моль» не имеет никакого отношения к размерности
и указывает лишь на то, что мы имеем дело с числом молекул, равным числу Авогад-
ро. Само число Авогадро является до некоторой степени произвольной величиной
(зависящей, например, от того, какая система (метрическая или неметрическая)
использована для определения молекулярных весов). Поэтому, чтобы получить рациональное
определение k, его необходимо отнести к одной молекуле. Это дает &/=2,9«
•10-16 эрг/град-молекула. Леннард-Джонс и Корнер [7] подчеркивают, что уравнение
(П-10) довольно естественно получается из простой статистико-механической теории
жидкостей. При этом k' равна постоянной Больцмана (1,37-10~16), умноженной на
коэффициент порядка единицы.
Конечно, уравнения (П-10) и (П-11) являются приблизительными.
Кан и Хиллиард [8] детально проанализировали их и показали, что
уравнение (П-11) описывает также неведение регулярных растворов
при температурах, не слишком близких к критической.
Еще одно полуэмпирическое соотношение предложено Сагденом [9]:
Р=Му1'*/Ьр, (Н-12)
где Р — величина, которую автор назвал парахором, М —
молекулярный вес жидкости и Др — плотность жидкости минус плотность пара.
Парахор можно рассматривать как молярный объем с поправкой на
эффект сжатия, обусловленный межмолекулярными силами. Для данного
вещества величина парахора практически почти не зависит от
температуры.
В первом приближении парахор является аддитивным свойством атомов или
функциональных групп и в этом отношении подобен молярной поляризации.
Сравнивая экспериментальное значение Р с различными расчетными величинами, можно,
например, определить формулу изомерного органического соединения Обзор
литературных данных по парахорам органических соединений опубликован в работе [10] (см.
также работу [11] и предыдущие статьи). Следует однако отметить, что в
действительности парахор не является строго аддитивной величиной. Кроме того,
современные спектроскопические и кристаллографические методы в значительной мере
устраняют потребность в использовании парахора.
Б. Полная поверхностная энергия Es
Если изменения плотности и, следовательно, молярного объема с
температурой очень малы, то из уравнений (П-10) и (11-11) следует,
что Es почти не зависит от температуры. Уравнение (11-11) с п = 1
фактически можно записать как
у=Е<(1-Т/Те), (II-13)
Природа и термодинамика жидких поверхностей раздела
47
откуда видно, что при ОК поверхностное натяжение и поверхностная
энергия становятся равными. При температурах, не слишком близких
к критичесргой, поверхностная энергия жидкостей обычно зависит от
температуры, хотя, как показано на рис. Н-2, Es в конечном итоге
падает, так как значение Es должно стать нулевым при критической
температуре.
Анализ табл. Н-1 показывает, что величины поверхностного
натяжения и Es варьируют в широком диапазоне. Более целесообразно,
однако, сравнивать между собой величины Es\ рассчитанные в единицах
энергии на моль. Площадь поверхности одного моля сферических
молекул радиуса г равна
A=4nN0 (ЗМ/4ярЛ/0)2/з, (Н-14)
где Л/о — число Авогадро. Поскольку на поверхности находится только
около одной четверти площади сферических молекул, преобразуем с
учетом этого уравнение (П-14):
A=fNl0W2fs (см2/моль), (II-15)
где V — молярный объем, а / — стерический фактор, величина которого
близка к единице. Тогда
Е*'=АЕ*. (II-16)
Как видно из табл. П-1, величины Es/ варьируют значительно меньше,
чем у или Es.
Пример. По данным, приведенным в табл. Н-1, рассчитаем Es и Es/ для
железа. Сначала находим £'s= 1880—1808 (—0,43) =2657 эрг/см2.
Далее, оценивая V^7,1 см3/моль и принимая / равным единице,
рассчитываем: Л=(6,02-1023)1/з(7,1)2/з =3,Ы08 см2/моль, и отсюда Esr =
= 2657X3,1-108/4,13-107 = 20 100 кал/моль.
Состояние молекулы, находящейся в поверхностном слое, можно
рассматривать как промежуточное между состояниями в паровой фазе
и в объеме жидкости. Скапский [12] провел следующий простой
анализ. Если рассматривать взаимодействие молекулы только с
ближайшими соседями, то ее энергия определяется выражением
£«'=(#08/2) (п.-/*,), (II-17)
Таблица Н-1
Зависимость поверхностного натяжения от температуры
Жидкость
Не
N2
Этанол
Вода
NaNOa
C7F?4
Бензол
«-Октан
Натрий
Серебро
Медь
Железо
У, ЭрГ/см2
0,308
9,71
22,75
72,75
116,6
15,70
28,88
21,80
202
879
1300
1880 1
Темп., °С
2,5 К
75 К
20
20
308
20
20
20
97
1100
1535
1535
dV/dT
—0,07
—0,23
—0,086
—0,16
—0,050
—0,10
—0,13
—0,10
—0,10
—0,184
—0,31
-0,43
эрг/см2
0,47
26,7
46,3
120
146
45,0
67,0
51,1
239
1132
1721
2657
кал/моль
8,7
585
1340
1780
2150
2610
2680
2920
4002
10900
13000
20100
Литература
13
14
мкт
мкт
15
16
МКТ
МКТ
17
18
19
19
£' , кал/г-ион.
Перфторметилциклогексан.
48
Глава II
где е — энергия взаимодействия, щ и ns — число соседних молекул в
объеме и на поверхности жидкости соответственно. Исходя из этого,
энергия испарения должна быть равна &щ/2. Для плотноупакованных
сфер n,i = 12 и ns = 9, так что Es/ должно составлять одну четвертую
энергии испарения. (Это не совсем точно, так как не учитывается Д)
Полученная таким образом поверхностная энергия металлов несколько
меньше ожидаемой. Однако для всех соединений, включенных в табл.
II-1, от гелия до железа, изменение поверхностной энергии в расчете на
квадратный сантиметр зависит почти одинаково от изменения сил
межмолекулярного взаимодействия и изменения плотности упаковки или
размера молекул.
В. Изменение давления пара над искривленной поверхностью
Одним из важнейших термодинамических соотношений является
соотношение, описывающее влияние кривизны поверхности на молярную
свободную энергию вещества. Это влияние, по-видимому, легче всего
оценить, используя введенное Юнгом и Лапласом [см. уравнение
(П-7)] представление о существовании перепада давления АР на
поверхности раздела фаз. Согласно законам термодинамики, изменение
механического давления при постоянной температуре приводит к
изменению молярной свободной энергии:
AG=fl/dP. (II-18)
Если молярный объем V считать постоянным и заменить ДР на
выражение (1-7), то уравнение (П-18) примет вид
AG>=yV(l/Ri + l/R2). (IM9)
Обычно свободную энергию вещества связывают с упругостью его
паров. Считая пар идеальным газом, можно записать G' = G'°+RTlnP.
В результате для сферической поверхности радиуса г получаем
RT In (Р/Р°) = 2yV/r, (II-20)
где Р° — нормальная упругость паров жидкости и Р — наблюдаемое
давление над искривленной поверхностью. Уравнение (П-20), часто
называемое уравнением Кельвина, как и уравнение Юнга — Лапласа,
является основным соотношением физической химии поверхностей.
Для капель жидкости АР — величина положительная, и поэтому в
их присутствии упругость паров больше нормальной. Для воды,
например, Р/Р° равно —1,001 при г=10~4 см, 1,011 при г=10~5 см и 1,114
при г=10~6 см. Повышенная упругость паров экспериментально
проверена для маленьких (радиуса порядка 0,1 мкм и выше) капель воды,
дибутилфталата, ртути и других жидкостей [20]. Это явление дает
простое объяснение способности паров к пересыщению. Образование новой
жидкой фазы протекает в несколько стадий: образующиеся вначале ас-
социаты (кластеры) могут затем расти или агрегироваться в капельки,
которые в свою очередь могут вырастать до макроскопических
размеров. В отсутствие пыли или других посторонних поверхностей, на
которых указанная последовательность может нарушаться, энергия
активации, образования жидкой фазы на ранних стадиях соответствует
увеличению свободной энергии, обусловленному кривизной поверхности (см.
разд. VIII-2).
Чтобы искусственно можно было вызвать выпадение осадков, необходимо прежде
всего, чтобы облако было пересыщенным. Введение сухого порошкообразного льда
способствует образованию кристалликов льда. Если же в пересыщенное облако
вводят мелкие кристаллики йодистого серебра или других соединений, то на их
поверхности происходит конденсация воды.
Природа и термодинамика жидких поверхностей раздела
49
Хотя справедливость уравнения (Н-20) подтверждена
экспериментально для маленьких капель, при проверке применимости его для
жидкостей, находящихся в капиллярах, в которых должно иметь место
понижение давления паров, получены настораживающие расхождения.
По данным Шерешевского и др. [21], в капиллярах радиусом несколько
микрон уменьшение упругости паров воды и органических жидкостей,
например толуола, в 10—80 раз больше предсказываемого уравнением
Кельвина. Дело приняло неожиданный оборот после 1960 г., когда Фе-
дякин, Дерягин и другие выступили с утверждением, что вода,
сконденсированная в узких капиллярах, имеет аномальные свойства. Одно
время считалось, что открыта новая форма воды — аномальная вода, или
поливода. В настоящее время, однако, все согласны с тем, что
наблюдавшиеся отклонения обусловлены присутствием тех или иных
загрязнений [22] (см. также разд. VI-2). Детальный обзор литературы по
данному вопросу дан в работе Эверета, Гэйнса и Макэлроя [23]. Все
эти авторы подчеркивают, что экспериментального подтверждения
уравнения Кельвина до сих пор не получено!
Г. Влияние кривизны на поверхностное натяжение
Из термодинамической теории Толмэна [24] следует, что при
большой кривизне поверхности величина собственно поверхностного
натяжения должна меняться в соответствии с уравнением
Y/Y° = l/(l+26/r)f (II-21)
где б — постоянная порядка 10~8 см (см. разд. П-2Б). Так, для 6/г = 0,1,
y/y° = 0,83 и т. д.
Эта зависимость имеет важное значение только при очень
маленьких радиусах капель. В частности, ее следует учитывать в теории
образования зародышей при оценке избыточной поверхностной энергии
кластеров (см. разд. VIII-2). Общий недостаток уравнений типа (П-21)
заключается в следующем: при их выводе, по существу безмодельном
и полуэмпирическом, капля рассматривается как непрерывная среда,
хотя рассматриваемое влияние становится значительным только тогда,
когда кривизна капли становится соизмеримой с молекулярными
размерами.
Д. Влияние давления на поверхностное натяжение
Поверхностное натяжение связано с давлением следующим
термодинамическим соотношением:
(dy/dP)Aj=(dV/d\)PJt (II-22)
где А — площадь поверхности. Другими словами, влияние давления
связано с изменением молярного объема при переходе молекулы из
объема жидкости в поверхностный слой. Это изменение имеет
положительное значение, и поэтому влияние давления должно сводиться к
увеличению поверхностного натяжения.
К сожалению, повышая давление, воздействующее на поверхность
жидкости, мы неизбежно вводим в систему второй компонент,
например какой-либо инертный газ. При этом плотность вещества в газовой
среде возрастает и, кроме того, на поверхности адсорбируется
некоторое количество газа, формально соответствующее изменению его
объема AVa:
AVa = —TRT/Pt (П-23)
где Г — число молей газа, адсорбированного на единице площади
поверхности. Общее изменение объема при изменении площади
поверхности AV равно сумме AVa и AVS. Таким образом,
ду/дР = —TRT/P + AVS. (П-24)
4—1421
50
Глава II
Данные, полученные Эриксоном [26], показывают, что для
большинства газов доминирует адсорбционный член (т. е. фактически эти
данные дают полезную информацию об адсорбционных свойствах
системы), и лишь для гелия поверхностное натяжение воды и я-гексана
действительно увеличивается с давлением. Этот же вопрос рассматривают
Массуди и Кинг [26а].
Е. Влияние других факторов
В ряде работ изучено влияние электрических и магнитных полей на
поверхностное натяжение. Рассматривая действие сильных
электрических полей на воду и растворы солей, Шмид [27] пришел к выводу, что
в воде атомы водорода выступают наружу (см. также работу [28]).
Магнитные поля вплоть до 10 кГс меняют поверхностное натяжение
жидкостей всего на несколько процентов [29].
Одним из не совсем обычных факторов, действующих на
поверхностное натяжение, является вращение. Борнеас и Бабутиа [30] нашли,
что поверхностное натяжение вращающейся жидкости увеличивается.
Этот эффект, по-видимому, является вполне реальным.
2. Структура поверхностей раздела
Как уже отмечалось, поверхностную свободную энергию можно
рассматривать как работу переноса молекулы из объема жидкости на
поверхность. Возникновение этой работы связано с тем, что внутри
фазы сумма сил, действующих на молекулу, равна нулю, тогда как при
движении молекулы к поверхности эти силы становятся
несбалансированными. Зная функцию потенциальной энергии взаимодействия
между молекулами, можно рассчитать полную поверхностную энергию (см.
обсуждение уравнения (П-17), а также следующие разделы). Если же
зависимость потенциальной энергии от температуры известна, то
можно найти также поверхностную свободную энергию.
Результирующая сила, действующая на молекулу вблизи
поверхности, направлена внутрь фазы. Спрашивается: каким образом, эта сила
может проявляться в виде поверхностного натяжения? Некоторой
аналогией этой задаче может служить изображенное на рис. П-3
механическое устройство, в котором сила веса преобразуется в силу горизон-
тального-^атяЖения. Ясно, что для жидкости растяжение поверхности
приводит к переносу молекул из объема в поверхностный слой.
Следующий интересный вопрос — какова глубина поверхностного
слоя или области заметно несбалансированных сил? Прежде всего она
зависит от радиуса действия межмолекулярных сил. Если только на
/поверхности жидкости не присутствуют ионы, взаимодействие молекул
в основном обусловлено так называемыми вандерваальсовыми силами
(см. разд. VI-1). Силы этого типа уменьшаются пропорционально
приблизительно седьмой степени расстояния между молекулами, и,
следовательно, для данной молекулы имеет значение только взаимодействие
с одним-двумя слоями ближайших соседей. Иными словами, силы,
действующие на молекулу, симметричны уже на расстоянии нескольких
молекулярных диаметров от поверхности. Толщина поверхностного слоя
имеет тот же порядок. Эту оценку толщины поверхностного слоя под-
Рис. П-3. Механический аналог поверхностного
натяжения.
Природа и термодинамика жидких поверхностей раздела 51
тверждает слабая степень эллиптичности отраженного света при угле
падения, равном брюстеровскому углу [31] (см. разд. 1П-ЗГ). (Это
утверждение требует уточнения; см. разд. XIV-5.)
Следует также помнить, что тонкий поверхностный слой находится
в турбулентном состоянии. Поскольку жидкость равновесна со своим
паром, то ясно, что существует двусторонний сбалансированный
перенос молекул из газовой фазы на поверхность (бомбардировка
поверхности и конденсация) и обратно (испарение). Из кинетической теории
газов известно, что число молей, соударяющихся с 1 см2 поверхности,
равно
При комнатной температуре для паров, насыщенных относительно
жидкой воды, Z составляет около 0,02 моль/см2-с или около 1,2-1022
молекул/см2 • с. В равновесных условиях скорость испарения должна быть
равна скорости конденсации, отличающейся от Z на множитель немного
меньше единицы (так называемый коэффициент конденсации). Таким
образом, на каждом квадратном сантиметре поверхности воды
ежесекундно принимается и отдается по 1,2-1022 молекул. На площадку в
10 А2, соответствующую площади, занимаемой одной молекулой воды,
за одну секунду падает 1,2-107 молекул, и, следовательно, время жизни
молекулы на поверхности должно быть порядка десятой доли
микросекунды.
Между поверхностным слоем и смежными слоями также имеет
место перенос молекул. При комнатной температуре коэффициент
диффузии большинства жидкостей примерно равен 10~5 см2/с. Коэффициент
диффузии D связан с временем / и суммарным смещением х
уравнением Эйнштейна
D=x'2/2t. (Н-26)
Если принять х равным расстоянию, например, 100 А, то t составляет
около 10~6 с; таким образом, благодаря броуновскому движению
имеет место очень быстрый взаимный обмен между поверхностью и
прилегающим к ней слоем жидкости.
Итак, из сказанного выше следует, что на молекулярном уровне
«покоящаяся» поверхность жидкости фактически находится в сильно
возмущенном состоянии, при котором молекулы без конца «снуют»
между поверхностью и газовой и жидкой фазами. Средняя плотность
поверхностного переходного слоя непрерывным образом меняется от
плотности жидкой к плотности паровой фаз, и под микроскопом с
соответствующим увеличением поверхность должна была бы выглядеть как
бы в дымке.
На поверхности твердых тел между молекулами, без сомнения,
может существовать бок лое натяжение (которое может быть и
анизотропным), связанное с растяжением или сжатием данного участка
поверхности. Возможно, это обусловлено относительной неподвижностью
твердых поверхностей. Подобное явление наблюдается и в тонких
мыльных пленках, толщина которых может составлять всего 100 А.
Растяжение или сжатие пленки приводит к соответствующему изменению
межмолекулярных расстояний и энергии взаимодействия молекул.
Справедливости ради следует отметить, что даже для нормальной
поверхности раздела между жидкостью и паром можно привести
доводы в пользу концепции поверхностного «натяжения» (см., например,
статьи Брауна [32] и Гернея [33]). Однако, поскольку концепции
поверхностного «натяжения» и поверхностной «энергии» математически
идентичны, вопрос о том, какая из этих концепций является более
«реальной» применительно к поверхности жидкости, представляется в
4*
S2
Глава II
какой-то мере философским вопросом. Разумеется, предметом
дискуссии является не физическая реальность поверхностного натяжения как
измеряемой силы, действующей параллельно поверхности (ясно, что
при растяжении поверхности совершается работа), а лишь вопрос, не
может ли быть плодотворным представление о том, что свойства
поверхности жидкости определяются энергией переноса молекулы из
объема жидкости на поверхность.
Автор полагает, что при выборе концепции необходимо учитывать,
меняются или не меняются межмолекулярные расстояния при
изменении величины поверхности. Так, для жидкостей, природа поверхности
которых не зависит от ее размеров, концепция поверхностной энергии
представляется более предпочтительной. Для тонких пленок и твердых
поверхностей могут оказаться необходимыми сведения о натяжении
поверхности. При этом поверхностную свободную энергию и
поверхностное (возможно, анизотропное) натяжение рассматривают как две
различные величины. Последний вопрос более полно обсуждается в гл. V.
За исключением некоторых особо указанных случаев, в данной книге
поверхностное натяжение и поверхностная свободная энергия
используются как равнозначные понятия.
А. Дальнейшая разработка термодинамики
поверхностного слоя
Рассмотрим жидкость, находящуюся в равновесии с ее паром. На
границе раздела объемные фазы аир переходят друг в друга не
резко, а постепенно, как показано на рис. П-4, т. е. граница раздела
представляет собой область плавного изменения плотности и локального
давления. Поскольку межфазный слой не имеет четко определенных
границ, при математическом анализе целесообразно ввести условную
разделяющую поверхность [34]. Далее, принимая, что объемные фазы
остаются однородными вплоть до разделяющей поверхности, определим
экстенсивные параметры (G, £, S, п и т. д.). Фактические величины
параметров для всей системы в целом несколько отличаются от их
суммы для двух объемных фаз, и эту разность — положительную или
отрицательную— относят к поверхностному слою. При рассмотренных выше
допущениях справедливы следующие соотношения:
Объем: V = Va+V*.
внутренняя энергия: Е=Еа-\-Е$-\»Е°.
Энтропия: S=S<* + S$ + SG.
Число молей: щ =п? + rfi. + nf.
(П-27)
(И-28)
(И-29)
(11-30)
Верхний индекс а использован для обозначения поверхностных
величин, рассчитанных при условии, что объемные фазы остаются неизмен-
Условная
разделяющая
поверхность
(Расстояние по нормали
к поверхности)
Рис. П-4
Природа и термодинамика жидких поверхностей раздела
53
ными вплоть до выбранной математической разделяющей поверхности.
В общем случае при отклонении от равновесия
dE=7dS+^!M«i — VadV«—PWV+ydA + C^ + C^ (II-31)
где с\ и с2 — две кривизны разделяющей поверхности (т. е. два
обратных радиуса кривизны), a Ci и С2 — постоянные. Два последних
члена уравнения (П-31) можно записать в виде
^(Cl + C2)d(ci + c2)±-L(Ci-C2)d(ci-c2).
Эти члены плюс ydA описывают влияние изменения площади и
кривизны разделяющей поверхности на энергию системы. Общий эффект не
должен зависеть от выбранного положения разделяющей поверхности.
Это условие позволяет наложить некоторое ограничение на С\ и С2.
Так, обычно принимают, что С\+С2 = 0. Разделяющую поверхность,
соответствующую этому частному условию, называют поверхностью натя-
оюения.
Если кривизна мала по сравнению с толщиной поверхностной
области, d(c\—с2)=0 (это равенство справедливо для плоской и для
сферической поверхностей) и уравнение (Н-31) сводится к выражению
dE=TdS + 2i МЛ« — VadV«—P&dV* + ydA. (11-32)
i
И поскольку
G=E—TS + P*Va + PPV*, (П-33)
где G — свободная энергия Гиббса, получаем
dG=— SdT + % frdni+VW + VtdPfi + ydA. (II-S4)
(Уравнение (П-34) получено дифференцированием уравнения (П-33) с
последующим совместным его решением с уравнением (И-32).) В
условиях равновесия для данного ряда величин 5 и щ энергия должна быть
минимальна и, следовательно,
_рсууа _ ppdl/p + yd а=о. (11-35)
Однако
dV=0=dVa+dW, (II-36)
и, таким образом,
(Р« —PP)dV« = YdA. (11-37)
Такое же уравнение получается для двух объемных фаз, разделенных
мембраной, находящейся под действием натяжения у. Если
поверхностный слой смещается на расстояние dt, то
dA=(ct-L-cJAdt, (II-38)
и так как
dV«=Adt=—dV*, (И-39)
то
(pa _ рр) Adt=y(ct + c2) Adt (И-40)
или
АР=Т(с1 + с8). (П-41)
Уравнение (П-41) эквивалентно уравнению Юнга — Лапласа (1-7).
Все вышесказанное может служить введением в более строгую
термодинамику поверхностного слоя. Рассматриваемый метод в основном
54
Глава II
был разработан еще Гиббсом [34] и затем уточнен Толмэном [35].
Теория дает также следующее дополнительное соотношение:
о а
у= j'(P«— p)dx+ Г(РР—p)dx, (И-42)
—а 6
где х — расстояние по нормали к поверхности, а точки а и —а лежат
в двух объемных фазах соответственно. Для плоской поверхности Ра=
= РР, и, следовательно,
а
(P—p)dx. (II-43)
Здесь Р — объемное давление, одинаковое в обеих фазах, а р —
локальное давление, меняющееся при прохождении через межфазную
границу.
Теперь вернемся к вопросу о локализации разделяющей
поверхности. Вообще говоря, поверхность, определяемая условием (d+C2)=0,
такова, что рассчитанные в предположении неизменности объемных фаз
вплоть до разделяющей поверхности значения па-\-п$ не равны
фактической величине п. Это означает, что даже если мы имеем делосодним-
единственным чистым веществом, на поверхности имеется некоторый
избыток Г этого вещества, не равный нулю (Г может быть
положительной или отрицательной величиной). Хотя это условие удобно для
математических расчетов, интуитивно оно не нравится, и Кирквуд и Бафф
[37] и Бафф [38] обсуждают другой вариант размещения
разделяющей поверхности, для которого Г = 0. Рассмотренные положения
разделяющей поверхности сдвинуты относительно друг друга на расстояние
порядка диаметра молекулы. Поэтому различия между этими
поверхностями не имеют особого значения, если только речь не идет о сильно
искривленных поверхностях.
Б. Расчет энергии и свободной энергии поверхности жидкости
Основной задачей термодинамики является вывод
феноменологических соотношений, справедливость которых определяется самими
законами термодинамики. Для применения этих соотношений в конкретных
случаях и получения количественных результатов необходимо
задаться соответствующей моделью или делать дополнительные
предположения. Например, используя уравнение Ван-дер-Ваальса, можно
провести полуэмпирический анализ изменения Р в уравнении (П-43) в
зависимости от расстояния до межфазной границы. Таким путем Толмэн
[35] смог оценить поверхностный избыток воды при 20 °С, который
оказался положительным и относительно поверхности натяжения
составил примерно Ю-8 г/см2.
Статистическая термодинамика жидких поверхностей разработана
довольно глубоко и подробно рассматривается во многих работах (см.,
например, [39]). В общем случае, если для системы известны все
возможные энергетические уровни ей их статистические веса gv, то можно
вычислить сумму по состояниям Q:
Q=S^-V*r (Ц.44)
Средняя энергия системы составляет
8=-
2Ni 2**"
-8,/АГ
(Н-45)
Природа и термодинамика жидких поверхностей раздела
55
или в расчете на моль
E=RT2d\nQ/dT. (II-46)
Свободная энергия Гельмгольца равна
Л=— /?TlnQ, (I1-47)
Из этого выражения можно найти G и у.
Большим преимуществом статистического подхода является то, что
он позволяет получать выражения для Q и других термодинамических
величин исходя из моделей, построенных на основе самых общих
допущений относительно сил взаимодействия между молекулами (см.,
например, разд. XIV-ЗБ). Теоретический анализ жидкостей представляет
собой очень трудную задачу. Чаще всего принимается модель «твердых
сфер», в которой предполагается, что жидкость состоит из жестких
сфер заданного размера а, взаимодействующих между собой с
некоторой энергией е. Рейсе и др. [40] рассмотрели изменение свободной
энергии системы жестких шаров при введении в нее сферических
полостей и рассчитали поверхностное натяжение модельной жидкости.
Полученные ими результаты предполагают также наличие связи между
поверхностным натяжением и сжимаемостью жидкости, что вполне
разумно [41].
Эйринг и др. [42] разработали другую статистико-механическую модель, которая
предполагает, чго структура жидкости подобна структуре твердого тела. Число дырок,
или вакансий, определяется разностью между плотностью жидкости и плотностью
твердого тела. Молекулы, расположенные рядом с дырками, ведут себя подобно
молекулам газа. Таким образом, жидкость описывается суммами по состояниям,
соответствующим этим двум состояниям вещества (т. е. твердому и газообразному),
причем статистический вес этих функций зависит от плотности жидкости. Для простого
твердого тела, в котором имеют место только колебания атомов в решетке, и
идеального газа суммы по состояниям известны с достаточной точностью, и это
позволяет избежать трудностей, связанных с нахождением сумм по состояниям для
реальной жидкости. Для некоторых простых жидкостей эта модель дает вполне
удовлетворительные результаты.
Полная статистико-механическая теория предполагает детальное
описание энергетических состояний ei с помощью волновой механики, а
эта задача исключительно трудна. Более приемлемый подход основан
на использовании радиальной функции распределения g{r), которая
дает вероятность нахождения молекулы на расстоянии г от данной
молекулы. Эту функцию можно получить экспериментально, например из
данных по рассеянию рентгеновских лучей на жидкости. Кроме того,
необходимо знать потенциальную функцию 8(г), характеризующую
взаимодействие между двумя отдельными молекулами. Кирквуд и
Бафф [37] показали, что
ее
V=(n/8)p^g(r)s'(r)r*dr, (II-48)
о
оо
Es=—(я/2) Р2 Г g(r)B (r) r*dr, (II-49)
о
где р — среднее число молекул в единице объема, a e'(r)=ds(r)/dr.
В качестве потенциальной функции е(г) широко используют удобное и
довольно удачное уравнение Леннарда-Джонса:
е (г) =4е0 Г(а/г)в-(а/г)"], (И-50)
где 8о — потенциальная энергия в минимуме (рис. И.5) и a —
эффективный диаметр молекул. Внутреннее давление и энергия жидкости
также являются функциями g(r) и е(г), и в одной из недавно опублико-
56
Глава II
e0L
Рис. П-5. Функция потенциальной энергии
взаимодействия двух молекул по Леннарду-
Джонсу.
ванных работ [43] эти величины, определенные экспериментально,
были использованы для расчета постоянных so и 0 в уравнении (П-50).
Затем по уравнениям (П-48) и (П-49) можно было рассчитать у и Es.
Например, расчетные и экспериментальные значения у для аргона при
84,3 К равны соответственно 15,1 и 13,2 эрг/см2, а для азота при 77 К
они составляют 11,5 и 8,9 эрг/см2. Расчетные и экспериментальные
значения Es согласуются несколько хуже.
Подобный подход используется также при рассмотрении свободной
энергии межфазной поверхности раздела (см. разд. VII-5B). Важно
отметить, что все статистико-механические теории дают лучшие
результаты при рассмотрении одноатомных молекул или по крайней мере
сферически симметричных молекул, так как проблема применения
функций g(r) и е (г) с учетом угловой взаимной ориентации молекул
чрезвычайно трудна. Кроме того, асимметричные молекулы могут быть в
высокой степени ориентированы на поверхности, и, таким образом,
функции g(r, углы) для объема и поверхности жидкости отличаются
друг от друга. Тем не менее использование метода Скапского [12]
(см. разд. П-1Б) для высокоструктурированных жидкостей с
водородными связями дает вполне удовлетворительные результаты [44].
3. Ориентация на поверхностях раздела
Прежде чем перейти к обсуждению свойств и термодинамики
поверхностей раздела растворов, необходимо рассмотреть один весьма
важный вопрос, а именно вопрос об ориентации молекул на
поверхности раздела типа жидкость — воздух и жидкость — жидкость.
Представление об ориентации асимметричных молекул на
поверхности в настоящее время общепринято и вряд ли требует специальной
аргументации. Интересно, однако, рассмотреть вкратце историю этой
концепции. Гарди [45] и Гаркинс [46] уделили много внимания
«силовым полям», возникающим вокруг молекул. По мнению авторов,
интенсивности этих полей существенно зависят от полярности и особенностей
структуры жидкости и ориентация является проявлением принципа
«наименее резкого изменения силовых полей». В соответствии с этим
принципом на поверхности раздела молекулы должны
ориентироваться так, чтобы обеспечить по возможности наиболее постепенный
переход из одной фазы в другую. Если вместо «силового поля» читать
«энергия взаимодействия», то этот принцип можно перефразировать на
том вполне разумном основании, что молекулы обычно
ориентируются так, чтобы энергия их взаимодействия была максимальна.
Первая количественная теория адсорбции органических веществ на
жидких поверхностях была развита Лэнгмюром [47], предложившим
Природа и термодинамика жидких поверхностей раздела
57
Рис. П-6.
О-Н
н-с-н
н
а
н
н-с-н
О-Н
5
принцип независимого поверхностного действия, аналогичный
принципу парахора Сагдена (разд. П-1А). По Лэнгаюруу поверхностная
свободная энергия молекулы аддитивно складываетс&из локальной
свободной поверхностной энергии ее частей. Рассмотрим применение этого
принципа для выяснения возможной ориентации молекул этанола на
поверхности воды (рис. П-6,а и б). В первом случае поверхность
покрыта гидроксильными группами, поверхностная энергия которых,
найденная экстраполяцией данных для воды, должна составлять примерно
190 эрг/см2. Во втором случае поверхностная энергия должна быть
примерно равна поверхностной энергии углеводородов, т. е.
~50 эрг/см2 (см. табл. П-1). Разность между полученными
величинами составляет 140 эрг/см2 или около 30-10-14 эрг/молекула. Поскольку
kT имеет величину порядка 4-10-14 эрг/молекула, множитель Больцма-
на ехр(—e/kT), соответствующий ориентации, показанной на
рис. П-6, б, должен равняться ~105. Таким образом, основная
ориентация молекулы спирта должна соответствовать рис. П-6, б. Этот вывод
подтверждается тем, что фактическое поверхностное натяжение этанола
равно 22 эрг/см2 и не очень отличается от поверхностного натяжения
углеводородов. Принцип Лэнгмюра сейчас в той или иной форме
(нередко в неявном виде) применяется довольно широко.
Гаркинс [46] также приводит доводы в пользу существования
ориентации молекул на поверхностях раздела, исходя из представления о
работе адгезии между двумя фазами. Работа адгезии определяется
выражением
^ав=Та+Тв—Tab- (И"51)
Как показано на рис. П-7, a, wae характеризует работу, необходимую
для разделения одного квадратного сантиметра поверхности раздела
АВ на две поверхности раздела А и В типа жидкость — пар.
Аналогично работа когезии для чистой жидкости равна
«>aa = 2Ya. (П-52
что соответствует обратимой работе разрыва столбика жидкости
(рис. П-7,б).
шМ
а
Рис. П-7. К определению работ адгезии (а) и
когезии (б).
Li^
ггп
58
Глава II
Таблица 11-2
Работа адгезии и когезии в различных системах
Поверхность раздела
жидкость—воздух
Октан
Октанол
Энантовая кислота
Гептан
Работа
когезии
44
55
57
40
Поверхность раздела
жидкость—жидкость
Октан — вода
Гептан — вода
Октанол — вода
Октен — вода
Энантовая кислота —
вода
Работа
адгезии
44
42
92
73
95
В табл. И-2 приведены работы когезии и адгезии для ряда
жидкостей. Эти данные показывают, что для самых разнообразных
органических жидкостей работа когезии почти одинакова. Следовательно,
можно предполагать, что поверхности этих жидкостей сходны по своей
природе и образованы преимущественно углеводородными группировками.
Такие же низкие значения характерны для работы адгезии чистых
углеводородов к воде. Три последних наиболее высоких значения оуав
относятся к поверхности раздела между водой и полярно-неполярным
веществом. Отсюда следует вполне обоснованный вывод, что на таких
поверхностях раздела полярные концы органических молекул
ориентированы к воде.
Конечно, в настоящее время имеется масса непосредственных
доказательств существования поверхностной ориентации. Многие из них
приведены в тех главах, где рассматриваются поверхностные пленки и
адсорбция. Каменски и др. [48] в большой серии статей о
поверхностном потенциале (разд. III-3B) жидкостей отмечает особенности
поверхностной ориентации молекул в чистых жидкостях и растворах. Решив
совместно уравнения (П-4) и (П-15), Гуд [49] рассчитал молярную
поверхностную энтропию ряда жидкостей и установил, что для полярных
жидкостей поверхностная энтропия приблизительно на 3 кал/К -моль
меньше, чем для неполярных. Эту разницу автор приписывает
уменьшению числа возможных ориентации полярных молекул на поверхности
по сравнению с неполярными молекулами.
В заключение отметим, что применение концепции работы адгезии
сопряжено с некоторыми осложнениями (см. разд. III-2), особенно
когда одной из фаз является твердое тело (см. разд. Х-8).
4. Поверхностное натяжение растворов
В этом разделе основное внимание уделено изменению
поверхностного натяжения бинарных систем в зависимости от их состава. Влияние
других переменных, таких, как давление и температура, в данном
случае подобно влиянию аналогичных переменных, наблюдаемому для
чистых веществ, и поэтому здесь не рассматривается. Межфазное
натяжение несмешивающихся жидкостей обсуждается также в разд. II1-2.
При рассмотрении поверхностных свойств идеальных и почти
идеальных растворов используют довольно простую теорию,
предложенную Гуггенгеймом [50]. Ниже следует упрощенное изложение этой
теории. Свободную энергию отдельного компонента можно записать в виде
Gi=kT]nai9 (II-53)
где щ— абсолютная активность, которую в свою очередь можно
записать как
at=Ntgi9 (II-54)
где М —мольная доля (для чистой жидкости Nt равно единице), a gt
получается из выражения для суммы по состояниям Qt [уравнение
Природа и термодинамика жидких поверхностей раздела
59
(И-44)]. Если поверхность чистой жидкости 1 рассматривать как
двумерную фазу, молекулярное состояние которой соответствует gf, то ее
поверхностное состояние можно выразить уравнением
yiGi = — kT In (aj/flj) (11-55)
или
exp(-yioi/kT)=gi/gl9 (И-56)
где 0i — площадь, занимаемая одной молекулой. Таким образом,
работа переноса молекулы на поверхность выражается также как AG в
уравнении (П-53).
Такие же соотношения справедливы для отдельных компонентов
раствора:
exp (—yaJkT) =Nigi/Nlgl (И-57)
exp (-ya2lkT)=N2g2lNlgl (II-58)
где Ns — мольная доля компонента в поверхностной фазе. Уравнения
(Н-57) и (П-58) можно решить относительно Nf и N$ соответственно
и затем подставить в равенство Ni + N2=l. Приняв о-=0\ = 02, получаем
exp (—ya/kT) = Nigi/gl + N2g2/g*21 (11-59)
что вместе с уравнением (П-56) дает
е-уа/кт=^±егУ1а/кт + N2e-wfkT. (II-60)
Гильдебранд и Скотт [51] обобщили уравнение (Н-60), не прибегая к
предположению, что о\ = 02-
Гуггенгейм [50] распространил свой подход также на регулярные
растворы, т. е. растворы, для которых
RT In ft =—cc/V*, RT In f2 =—aN*, (II-61)
где / — коэффициент активности. Позже теория Гуггенгейма для
регулярных растворов была критически пересмотрена и упрощена Хоуром
и Мельфордом [52]. Очень простое выражение для таких регулярных
растворов дают Пригожий и Дефэ [53]:
Т = 11#1 + Т2ЛГ2-Рад. (П-62)
где р — полуэмпирическая константа. На рис. П-8, а приведены данные
для практически идеальных растворов [51]: сплошные кривые 2, 3 и 6
соответствуют попытке описать данные с помощью уравнения (Н-60);
кривая 4 рассчитана также по уравнению (Н-60), но здесь а
подбиралась как чисто эмпирическая постоянная; кривая 5 рассчитана по
общему уравнению Гильдебранда и Скотта [51] с а\фо2. Используя
решеточную модель, Дефэ, Пригожий и др. [55] рассмотрели самые
разнообразные типы неидеальных растворов с учетом взаимодействия
молекул различных размеров.
Еще один пример поведения растворов дает рис. П-8, б, на котором
приведены экспериментальные данные для смеси расплавленных солей
[56] и соответствующие кривые (пунктирные линии), рассчитанные по
уравнению (И-62). Для таких систем Гэйнс [57] с успехом применяет
уравнения Дефэ — Пригожина.
Рассматривая жидкость как систему твердых сфер, Рейсе и Майер [58], вывели
следующее выражение для поверхностного натяжения расплавленной соли:
у - (kT/Ала*) [\2у/(1 -у) + 18^/(1 -г/2)], (П-63)
где г/=яа3р/б, а а и р — диаметр и концентрация сфер соответственно. Теория Рейс-
:а — Майера, а также теория, разработанная Эйрингом и др. [42], применяются и для
растворов.
60
Глава II
NaNO,
1,0 0,8 0,6 0,4 0,2 0
Концентрация изооктана, мол доли
0 0,25 0,50 0,75 1,00
Концентрация, мол доли
NaNO,
1 *
0 20 СО 60 80 100
Концентрация с2н5он,%
$.60
f-40
с4^
20
i | i
2 Лаурилсульфат
натрия-нр
О 0,01 0,02
Концентрация, моль/л
0 12 3 4 5
Концентрация, моль/л
Рис. П-8. Типичные кривые зависимости поверхностного натяжения смесей от их
состава.
а) Изооктан — н-додекан, 30 °С: /—линейная зависимость; 2 —кривая для идеального
раствора, рассчитанная при о=48,6. Изооктан — бензол, 30 °С: 3 — расчетная кривая для идеального
раствора, а=35,4; 4 — расчетная кривая для идеального раствора с эмпирическим значением
о"=П2,5; 5 —расчетная кривая с несимметричными значениями о\ 0*1 = 136 и а2=45. Изооктан —
циклогексан, 30 °С: 6 — расчетная кривая для идеального раствора с о=38,4; 7 — расчетная кри-
о
вая с эмпирическим значением 0= 109,3 (значения а даны в А2/молекула [54].)
б) Изотермы поверхностного натяжения при 350 °С для систем (Na— Rb)N03 и (Na—Cs)N03
[56]. Пунктирные кривые рассчитаны по уравнению (П-62), см. [56].
в) Вода — этанол, 25 °С.
г) Типичный пример водного раствора коллоидного электролита.
д) Раствор хлористого натрия, 20 °С.
В простой полуэмпирической теории, предложенной Эберхартом [59],
принимается, что поверхностное натяжение бинарного раствора является линейной функцией
состава поверхностного слоя, т. е.
y-Nfr+Nfa, (II-64)
и что распределение двух компонентов между раствором и поверхностным слоем со-
Природа и термодинамика жидких поверхностей раздела
61
ответствует простому закону распределения:
S12 = KJK2 = (Л^)/(Л^/ЛГ2). (И-65)
Алгебраические преобразования дают
P = l-S12(p/r), (П-66)
где
P = (Y — V1MY2 — Yi)
Уравнение (П-66) вполне удовлетворительно описывает самые
разнообразные двухкомпонентные системы.
Мы рассмотрели поверхностное натяжение систем различных типов,
и теперь целесообразно обсудить несколько более детально очень
важную систему — водные смеси. Если поверхностное натяжение отдельных
чистых жидкостей заметно различается, как, например, в смесях типа
спирт—вода, добавление к воде небольшого количества второго
компонента (спирта) обычно приводит к значительному уменьшению ее
поверхностного натяжения (рис. П-8,в). Как показано в следующем
разделе, этот эффект можно объяснить избирательной адсорбцией спирта
на поверхности раздела. Для разбавленных водных растворов
органических веществ применимо полуэмпирическое уравнение Шишковского
[60]:
у/у0=*1-В\п(1+С/а), (II-67)
где 7о — поверхностное натяжение воды, В — постоянная, характерная
для данного гомологического ряда, а — постоянная, характерная для
данного соединения, и С — концентрация. Это уравнение выводится в
предположении, что адсорбция на поверхности жидкости описывается
уравнением Лэнгмюра (см. упражнение 7, а также разд. IX-1А и
XIV-3).
Характер зависимости поверхностного натяжения от состава
раствора, показанный на примере системы этанол — вода, становится
наиболее ярко выражен для растворов высокомолекулярных соединений
полярно-неполярного типа, например различных детергентов. Как
показано на рис. П-8, г, в этом случае уменьшение поверхностного натяжения
имеет место уже при очень низких концентрациях, после чего
зависимость поверхностного натяжения от концентрации становится слабой.
Вполне вероятно, что такое поведение растворов связано с тенденцией
полярно-неполярных веществ к образованию агрегатов, или мицелл (см.
разд. Х1-5Б).
Наконец, для водных растворов электролитов, например NaCl — Н20
(рис. 11-8,(9), наблюдается увеличение поверхностного натяжения с
ростом концентрации.
5. Термодинамика бинарных систем. Уравнение Гиббса
Теперь мы переходим к очень важной теме — к термодинамическому
рассмотрению изменения поверхностного натяжения растворов в
зависимости от их состава. Впервые такое рассмотрение провел Гиббс [34].
Позднее Гуггенгейм и Адам [61] упростили теорию Гиббса и привели
ее в более удобную форму.
А. Определение поверхностного избытка
Как и в разд. И-2А, удобно считать, что две объемные фазы акр
являются однородными вплоть до некоторой условной разделяющей
поверхности 5 (рис. И-9). Ограничим обе фазы плоскостями,
соответствующими нулевым концентрациям С\ и С2. Система находится в
равновесии, причем это условие не налагает каких-либо ограничений на
положение разделяющей поверхности S. Как и раньше, вычислим раз-
62
Глава II
Рис. Н-9.
личные экстенсивные величины, характеризующие поверхностный слои,
и сравним их с соответствующими величинами для системы в целом.
Примем, что площадь сечения, показанного на рис. Н-9, равна
единице. Тогда фазы однородны вплоть до S, количество i-ro компонента
в поверхностном слое равно
хС? + (а—х)С$. (П-68)
Здесь расстояния х и а относятся к плоскостям А и В, расположенным
достаточно далеко от разделяющей поверхности там, где поведение
растворов определяется свойствами объемных фаз. Общее количество
компонента i в области между плоскостями А и В равно
xCf + (a — x)C$ + Tf, (И-69)
где Г? —поверхностный избыток на единицу площади*.
Когда фаза (3 является газообразной, величиной Cf можно
пренебречь и выражения (П-68) и (П-69) переходят в
xCf и xCf + Tf.
Если теперь произвольно выбрать другую разделяющую поверхность,
например S' на расстоянии х' от S, то очевидно, что
x'Ci + Tf=xCi + Tf, (II-70)
поскольку общее количество i-ro компонента между А и В не зависит
от локализации поверхности раздела. (В уравнении (П-70) индекс а
опущен за ненадобностью.) Следовательно,
(Г7'-Г?)/С, =*-*', (П-71)
или
■Г?)/С1=(ГГ-Г?)/С2 = и т. д.
(И-72)
или в общем случае
07' - Г?)/*, = (Г?' - TJ')/NJt (П-73)
где N — мольная доля, или
rfNl — rfNJ=Tf,Ni -TfNj. (П-74)
Поскольку S и У расположены совершенно произвольно, уравнение
(П-74) может быть верным, только если каждая из его частей в
отдельности равна некой константе:
Г/Л^ — Г? Nj =const. (И-75)
* Поверхностный избыток является алгебраической величиной. Если он
положителен, то вблизи поверхности данный компонент присутствует в избытке, если же он
отрицателен, то концентрация компонента на поверхности ниже, чем в объеме фазы.
Иногда поверхностный избыток называют поверхностной плотностью.
Природа и термодинамика жидких поверхностей раздела
63
Б. Уравнение Гиббса
После того как мы ввели понятие поверхностного избытка^ можно
приступить к выводу третьего основного уравнения физической химии
поверхностей [первыми двумя являются уравнения Лапласа (1-7) и
Кельвина (Н-20)], известного как уравнение Гиббса.
При небольшом обратимом изменении энергии системы dE имеем
dE=dE« + dEV + dE° =
=TdS« + 2 \iidnf-PadVa + TdS* +
+ 2 Mnf_pPdi/3 + TdSG + ^ M*7 + VdA, (И-76)
поскольку
d£* = TdSa + J M«?— PadV (Ib77>
и
d£P=TdS* + ^ щЛ# - P4V,
следовательно,
dfcr = rdSa + ^ ix.dn? + yd A. (H -78)
Если теперь энергию, энтропию и количество компонентов увеличивать
от нуля до некоторого определения, значения, сохраняя Г, А
(площадь), ла. постоянными, то уравнение (П-78) переходит в следующее
общее уравнение:
£*=7S° + 2M?+YA, (И-79)
дифференцирование которого дает
d£^ = rd5<J + 50dr + 2M^ + 2^^ + TrfA + Ad7. (II-80)
Сравнивая последнее уравнение с уравнением (П-78), получаем
0=S°dT + ]ynUlii+ AdY (П-81)
или в расчете на единицу поверхности
d у=—S°dT - ^ ?ad ц,. (П-82)
Для двухкомпонентной системы при постоянной температуре
уравнение (П-82) сводится к выражению
йу = — Г?4Ч — Г№2. (П-83)
Поскольку Г? и Г? определены относительно произвольно выбранной
разделяющей поверхности, в принципе последнюю можно подобрать
такой, чтобы Г? = 0 (более детально это условие обсуждается ниже).
В этом случае
Ц = -{ду/д1х2)т (П-84)
пли
Tl=—(a/RT)(dy/da), (II-85)
где а —активность растворенного вещества; верхний индекс 1 при Г
означает, что для выбранной поверхности раздела Га=0. Таким
образом, если dy/da — отрицательная величина, как, например, на рис. П-8, в;
Т° имеет положительный знак и соответствует фактическому избытку
растворенного вещества на поверхности. Если же dy/da —
положительная величина (рис. 11-8,(3), то Г£ обозначает дефицит растворенного
зещества на данной поверхности.
64
Глава II
В. Другие способы расположения разделяющей поверхности
Используя уравнение Гиббса — Дюгема, уравнению (11.83) можно
придать другой вид*:
^1^1+^2^2 = 0. (И-86)
Последнее уравнение позволяет исключить djxi из уравнения (П-83).
В результате получаем
-dy = dii2 [Г?-(ЛГЯДО i) Г?]. (П-87)
Выражение в квадратных скобках не должно зависеть от выбора
положения поверхности раздела, и, таким образом, мы опять приходим к
заключению, сформулированному в виде уравнения (П-75).
На рис. П-10 приведена детализированная картина возможного
изменения концентрации на поверхности раздела жидкость — пар.
Рисунок иллюстрирует условие, обозначаемое верхним индексом 1, т. е.
условие, согласно которому Г? = 0. Разделяющая линия проведена таким
образом, чтобы две площади, заштрихованные сплошными линиями,
были равны между собой и, следовательно, поверхностный избыток
растворителя был равен нулю. Расположенная справа от разделяющей
поверхности площадь, заштрихованная пунктирными линиями, минус
заштрихованная такая же площадь слева от разделяющей поверхности
в этом случае соответствует положительному избытку растворенного
вещества.
Величину Га можно определить как избыток или недостаток
компонента 2 в поверхностном слое площадью 1 см2 по сравнению с числом
молей компонента в некотором объеме раствора, содержащем такое же
число молей растворителя, что и поверхностный слой.
Очевидно, таким же образом можно определить и Г|. Теперь Г£ полагается
равным нулю, а Г| представляет собой избыток компонента 1 в поверхностном слое
площадью 1 см2 относительно числа молей этого компонента в некотором объеме
раствора, содержащем такое же число молей растворенного вещества, что и поверхностный
слой
Разделяющая поверхность может также располагаться таким образом, что
алгебраическая сумма площадей, показанная на рис. П-10 справа от разделяющей линии,
будет равна сумме площадей, находящихся слева от этой линии. Обозначим Г^
поверхностные избытки, определенные таким способом. Здесь Г^—избыток 1-го
компонента в поверхностном слое площадью 1 см2 относительно этого компонента в
объеме раствора, содержащем в сумме такое оюе число молей всех возможных
компонентов, что и поверхностный слой.
Аналогично символом Г^ обозначим избыток числа солей i-го компонента в
поверхностном слое по сравнению с числом молей этого компонента в растворе, масса
которого равна массе поверхностного слоя. Наконец, ГУ является избытком числа
молей i-ro компонента в поверхностном слое по сравнению с числом молей этого
компонента в таком же объеме раствора, как и объем поверхностного слоя.
На этой стадии, безусловно, полезен численный пример. Предположим, что мы
имеем раствор спирта в воде, причем мольная доля спирта составляет 50%. Возьмем
достаточно глубокий срез поверхностного слоя, захватывающий и некоторый объем
раствора, как, например, на рис. П-10. Предположим, что на срезе поверхностный
* Уравнение (П-86) можно получить с помощью уравнения (П-77) таким же
образом, как и уравнение (П-78).
dE=TdS + SdT—PdV—VdP+^ra^ + ^M";.
0=SdT—VdP + ^ttidHi.
В результате для двухкомпонентной системы при постоянной температуре и давлении
получаем
n^Hi—— n2dn2 или Л^ф.г = — N2d\i2.
Природа и термодинамика жидких поверхностей раздела
65
Рис П-10. Схема определения по-
зерхностного избытка
растворенного вещества.
Растворитель
Растворенное
вещество
-**%
слой занимает А см2 и содержит 10 моль воды и 30 моль спирта. Нам понадобятся
также некоторые дополнительные данные, а именно молекулярные веса воды и
этанола— 18 и 46 соответственно, а также молярные объемы воды и спирта—18 и
58 см3/моль соответственно.
Различные поверхностные избытки для данной системы определяются следующим
образом.
Случай 1. Т\
Поверхностный слой:
Сравниваем с объемом раствора,
содержащим:
Избыток:
В итоге: П=20/А
Случай 2. Т\
Поверхностный слой:
Сравниваем с объемом раствора,
содержащим:
Избыток:
В итоге: Г?=—20/А
Случай 3. Г? и Г^
Поверхностный слой:
Сравниваем с объемом раствора,
содержащим 40 моль компонентов:
Избыток:
В итоге: Г^=—10/А и Г^=10/А
м
,М
Случай ^. ГГ и Г2Л
Поверхностный слой:
Сравниваем с объемом раствора,
общая масса которого равна
1560 г.
Такая область в объеме раствора
содержала бы:
Избыток:
10 моль воды
10 моль воды
Рм
В итоге: rf=—14.4/А и 1Т=5,6/А
10 моль воды
30 моль воды
—20
10 моль воды
20 моль воды
—10
10 моль воды
180 г воды
24,4 моль воды
440 г воды
—14,4 г моль
260 г
30 моль спирта
10 моль спирта
20
30 моль спирта
30 моль спирта
0
30 моль спирта
20 моль спирта
10
30 моль спирта
1380 г спирта
24,4 моль спирта
1120 г спирта
5,6 моль
260 г
Рассчитать Ti и Г2 предлагаем читателю.
Следует отметить, что поверхностные избытки подчиняются соотношению
ВД + ЯаГ^О, (Ц.88)
где Р определяется способом выбора положения разделяющей поверхности. Так, для
Г.. Р равно единице, для Г^1 Р» равно молекулярному весу Mit а для Г Р{ равно
молярному объему V*.
Решая совместно уравнения (Н-88) и (Н-87), получаем
-dy/diii=rt(l+PiNi/P^.
(И-89)
5—1421
66
Глава II
Концентрация спирта, мол. доли
Рис. 11-11. Поверхностные избытки в системе вода — этанол [61].
В целом свойства поверхностного слоя можно описать следующим общим уравнением:
-dY/d|i. = ri = r^(l + N2/N1)=r™ (1 + ММ/ММ (П-90)
или
-N^y/d^ = ^хГ1 » rf = (AJ/AIJ if = (F/^) rjf f (Ц-91)
где
M = tf ^ + W2M2 и F= Л^ + ЛГ2У2.
Рис. 11-11 иллюстрирует изменение поверхностных избытков различных типов в
зависимости от состава раствора. Обратите внимание, что при приближении N2 и Ni к
единице Г2 я Г? не стремятся к нулю. Почему?
Г. Термодинамика поверхностных явлений с использованием
концепции поверхностной фазы
При изучении поверхностных явлений используется также
термодинамический метод, развитый Гуггенгеймом [62]. В этом методе вместо
условной разделяющей поверхности рассматривается реально
существующий переходный слой, обладающий определенным объемом и
ограниченный определенными плоскостями, например А А и В В на рис. 11-9,
расположенными в фазах а и р не слишком далеко от реальной
поверхности раздела. Введение такого слоя позволяет избежать применения
разделяющей поверхности Гиббса, представление о которой является
в какой-то мере искусственным.
Определенный таким образом поверхностный слой 5 толщиной т
и объемом Vs = tA обладает нормальными термодинамическими
свойствами, за исключением давления. В то время как в объемных фазах а
и р давление изотропно, в поверхностной фазе его величина зависит
от направления. Сила, действующая на единичную площадку в
плоскости, параллельной поверхности, равна давлению в сосуществующих
фазах. В то же время сила, действующая на единичную площадку,
перпендикулярную поверхности, при смещении площадки от АА к ВВ
меняется. Интегрирование локальных значений давления по всей
толщине поверхностной фазы в соответствии с уравнением (П-43) дает
поверхностное натяжение.
Природа и термодинамика жидких поверхностей раздела
67
Термодинамические соотношения, получаемые методом Гуггенгейма,
подобны соотношениям, приведенным в разд. П-5Б; так,
dE*=TdSs — /Ws + 2Мл? + ydA, (И-92)
где индекс s использован для того, чтобы отличить полученные таким
способом поверхностные величины от .величин, найденных методом Гиб-
бса с помощью разделяющей поверхности. Интегрируя уравнение
(Н-92) при постоянных Г, Р и т. д. и затем сравнивая результат с этим
же уравнением, получаем
dT =SdT+VdP — ^ rfdfij, (11-93)
где экстенсивные величины отнесены к единице поверхности. При
постоянных температуре и давлении уравнение (П-93) сводится к тому
же виду, что и уравнение (П-83). Отсюда, используя соотношение Гиб-
бса — Дюгема, получаем уравнение
-dy=d\i2 [Ц - (NjNd Г?], (Н-94)
аналогичное уравнению (Н-87). Наконец, сравнение уравнений (И-94)
«и (П-84) приводит к
Т\=Ыг(Т\№г-Т\1Ы1). (П-95)
Величины Г| и I\s являются произвольными, поскольку они зависят от
произвольного положения верхней и нижней границ. Однако их
комбинация в уравнении (П-95) дает однозначную величину, не зависящую
от положения плоскостей, ограничивающих поверхностную фазу.
Д. Другие соотношения термодинамики поверхностных явлений
До сих пор -мы в основном говорили о важнейшем фено;менологиче-
ском уравнении термодина;мики многокомпонентных систем — уравнении
Гиббса. Конечно, имеется и много других полезных термодинамических
уравнений. Многие из них приведены в работе [63]. К термодинамике
Поверхностных явлений мы еще вернемся в разд. XIV-12, а пока имеет
смысл дополнительно привести несколько соотношений, применимых
главным образом для растворов.
Используя обозначения Гиббса для величин, относящихся к
разделяющей поверхности, запишем выражение для свободной энергии:
G°=E°—TS°y (II-96)
из которого следует, что
dGa =dE°—TdSa—SadT. (И-97)
Решая это уравнение совместно с уравнением (П-78), получаем
d&=—S<'dT + %ikldn? + ydA. (II-98)
i
В то же время для всей системы (включая объемные фазы)
dG=—SdT — PdV + ^\iidni + ydk. (II-99)
Таким образом,
lHT§r)i>?' (П-100)
У
=(1г)г„,- <«-"»>
68
Глава II
Интегрирование уравнения (Н-98) при постоянных интенсивных
величинах Г, jiii и y Дает
G*=2!VZ? + VA (П-102)
или
G"=Y + J>*r?f (II-103)
i
где экстенсивные величины отнесены к единице поверхности. Обратите
внимание, что в отличие от чистых жидкостей [см. уравнение (Н-2)]
Для раствороз Ga, т. е. избыточная удельная поверхностная свободная
энергия, обычно не равна у. Такое равенство возможно только в
маловероятной ситуации, когда на поверхности не происходит адсорбции и,
таким образом, величины Га равны нулю. (Некоторые авторы
используют вполне допустимое определение GG=AG—уА- В этом случае в
выражении, соответствующем уравнению (II-103), у не появляется. (См.
работу [63].)
При использовании описанного в разд. П-5Г метода поверхностной
фазы получают уравнения, аналогичные приведенным. Следует помнить,
однако, что Vsф0 и что теперь
qs=As + PVs (II-104)
и
HS=ES + PVS9
где А — свободная энергия Гельмгольца.
6. Экспериментальная проверка уравнения Гиббса.
Прямые измерения величин поверхностных избытков
Фундаментальная работа Гиббса, исследовавшего равновесие
гетерогенных систем, была опубликована еще в 1875 г., однако только много
лет спустя физико-химики, работающие в области поверхностных
явлений, поняли важность применения уравнения Гиббса в
экспериментальных исследованиях.
Экспериментальной проверкой уравнения Гиббса занимались многие
исследователи. Один из методов, который неоднократно пытались
использовать для экспериментальной проверки уравнения, заключается
в следующем. Через раствор пропускают пузырьки газа и собирают
образующуюся пену в отдельном сосуде. Концентрация раствора,
полученного из осевшей пены, должна отличаться от концентрации
исходного раствора на величину, соответствующую поверхностному избытку
растворенного вещества. Этот метод требует, однако, точной оценки
удельной поверхности пузырьков, и положительных результатов он
не дал.
В связи с этим уместно вкратце обсудить вопрос: оправдана ли
вообще проверка уравнения Гиббса или какого-либо другого
термодинамического соотношения? Во-первых, могут сказать, что проводить такую
проверку не имеет смысла, поскольку это равносильно проявлению
сомнения в справедливости самих законов термодинамики, а уж они-то,
конечно, верны! Автор полагает, что, хотя в отдельных случаях такая
критика справедлива, в общем она неправильна. Законы
термодинамики являются феноменологическими законами, связывающими
наблюдаемые или экспериментально определяемые величины. И если из этих
законов выводятся более тонкие заключения, то не всегда ясно, чему
действительно соответствует та или иная переменная. Этот вопрос,
в частности, возникает в связи с интерпретацией данных по краевым
углам, при обсуждении понятия «поверхностное натяжение» примени-
Природа и термодинамика жидких поверхностей раздела 69"
тельно к твердым телам (см. разд. VII-5A), а также при определении
понятия «компонента» в многокомпонентной системе. Во-вторых,
термодинамические выводы могут включать очень серьезные логические
построения, и не исключена возможность проникновения в них
неточностей, которые не привлекут внимания до тех пор, пока
экспериментальные расхождения не заставят пересмотреть эти выводы. Кроме того,,
нередко проверка термодинамического соотношения показывает, что
исследуемое явление гораздо сложнее, чем предполагалось.
Л. Микротомный метод измерения поверхностных избытков
В методе, разработанном Мак-Бэном и др. [64]1 для определения
поверхностных избытков, с помощью прибора, называемого
микротомом, с поверхности раствора отбирается очень тонкий слой. Микротом
состоит из острого ножа, закрепленного чуть ниже поверхности на
суппорте, установленном на рельсах. При быстром движении ножа с
поверхности снимается тонкий слой раствора, который поступает в
имеющийся в ноже резервуар. Слой раствора толщиной ~0,1 мм,
снимаемый с ~ 1 м2 поверхности, весит всего несколько граммов. Если С —
концентрация раствора и АС — разность концентраций исходного
раствора и раствора, отобранного микротомом, выражены в граммах
растворенного вещества в расчете на 1 г воды, то
ri-(AC/A)[a;/(l +C+AQ], (11-105)
где А — площадь, с которой отобран раствор и w — вес отобранного
раствора в граммах.
Для водных растворов я-толуидина, фенола и я-гексановой кислоты
экспериментальные данные и величины, рассчитанные по уравнению
Гиббса (П-85), согласуются в пределах 10%. Интересно, что с
увеличением концентрации Г^ стремится к предельной величине,
соответствующей плотному монослою растворенных молекул, лежащих плоско
на поверхности. Для водных растворов хлористого натрия, для
которых отношение ду/дС — величина положительная, получен
предсказываемый теорией поверхностный дефицит. Иначе говоря, можно считать,
что на поверхности солевого раствора имеется слой чистой воды
глубиной т:
T = 1000rj//n, (IM06)
где m — моляльная концентрация раствора. Величина т составляет
несколько ангстрем и уменьшается с ростом концентрации соли.
Б. Измерение поверхностного избытка методом меченых атомов
В свое время микротомный метод явился вершиной
экспериментальной техники, и полученные с его помощью результаты дали ответ не на
один важный вопрос. Этот метод, однако, нельзя отнести к обычным
методам определения поверхностных избытков, и, кроме того, по
результатам измерений поверхностного натяжения во многих случаях трудно'
получить достоверные значения т. Действительно, если в системе нельзя
исключить присутствие загрязнений, отличающихся высокой
поверхностной активностью, если в результате гидролитического или другого
равновесия растворенное вещество может существовать в нескольких
формах, а также если рассматриваются ионные поверхностно-активные
вещества, усложняющие электрическую структуру поверхностного слоя,
интерпретация данных по поверхностным натяжениям может быть
чрезвычайно затруднена.
Интересный метод определения поверхностных избытков
разработали Саллей, Диксон и др. [65]. Исследуемое поверхностно-активное ве-
70
Глава II
иТ^Детектор
II Рис. II-12. Схема установки для измерения поверхност-
уг ных избытков методом меченых атомов.
щество метят радиоизотопом «со слабой р-активностью, например 14С
или 35S. Далее при помощи детектора, установленного вблизи
поверхности раствора, как показано на рис. П-12, измеряют уровень
радиоактивности. Поскольку область действия таких р-излучателей мала,
измеренная таким способом радиоактивность соответствует самой
поверхности и очень тонкому слою раствора (около 0,06 мм для 14С).
Полученные авторами данные для растворов анионного агента
аэрозоль OTN (ди-я-октилсульфосукцинат натрия
С8Н17ООССН2СН (NaS03) COOC8Hi7, меченного 35S, приводят к выводу,
что измерять только лишь поверхностное натяжение недостаточно.
^Установлено, что измеренные поверхностные избытки согласуются со
значениями, рассчитанными по уравнению Гиббса, если предполагать,
*что на поверхности адсорбируется только недиосоциироозанная кислота,
образующаяся при гидролизе натриевой соли. Интерпретировать эти
данные можно двояко.
1. Поверхностно-активным веществом является соль. Активность
соли равна (aNa+) (ax-). Пренебрегая эффектами, связанными с
коэффициентами активности, получаем
Г2=—(1 /2RT) dy/d In С. (II-107)
U. Поверхностно-активным веществом является недиссоциированная
кислота НХ. При этом Снх должна быть пропорциональна С, а не С2,
поскольку при используемых низких концентрациях рН остается
постоянным и равным рН растворителя. Следовательно,
Tz = —(l/RT)dy/dlnC. (11-108)
-Экспериментальные значения Гг приблизительно согласуются со
значениями, рассчитанными по уравнению (П-108), и совсем не соответствуют
здвое меньшим неличинам, предсказываемым уравнением (П-107).
Данный пример иллюстрирует отмеченное но введении к этому разделу
значение экспериментальной проверки термодинамических уравнений.
В рассмотренном случае для определения состава поверхностного слоя
необходимо учесть не два, а три компонента (NaX, HX и Н20 или NaX,
NaOH и Н20). Вообще же, если вещества распределяются между
двумя фазами, причем один из компонентов одной фазы образуется в
результате реакции между .компонентами другой фазы, число
компонентов, определяющих состав поверхностного слоя, увеличивается [66].
В рассматриваемом методе можно использовать и другие слабые
(3-излучатели, например 14С и 3Н. Особенно удобно использовать тритие-
|?ую (3Н) метку, поскольку р-излучение трития характеризуется такой
низкой энергией, что поправка на радиоактивность объема раствора
очень мала. Таджима и др. [67]: использовали тритиевую метку для
измерения адсорбции додецилсульфата натрия на поверхности раздела
раствор — воздух. Как показывает рис. П-13, полученные результаты
очень хорошо согласуются со значениями, рассчитанными по данным
измерения поверхностного натяжения теперь уже по уразнению (П-107)
(с учетом коэффициента активности). Таким образом, в данном случае
поверхностно-активной является соль, а не продукты гидролиза. Более
позднее исследование [68] с использованием 0,1 М хлористого натрия
в качестве сглаживающего электролита, как и ожидалось, дало резуль-
Природа и термодинамика жидких поверхностей раздела
71
Рис. И-13. Проверка
уравнения Гиббса методом
меченых атомов для водных
растворов додецилсульфата
натрия [67].
Точки соответствуют
экспериментальным значениям Г£? Q j 2, 3 4- 5 6
сплошная кривая рассчитана по »
уравнению Гиббса. АНГПивНОС/ПЬ- Ю, М
таты, согласующиеся с уравнением (II-108), поскольку концентрация
Ха+ в таких условиях остается практически постоянной. Растворы стеа-
рата натрия ведут себя подобно растворам аэрозоля OTN, в которых
адсорбируемым на поверхности веществам является недиссоциирован-
ная кислота.
Стейджер и Аниансон [70] для измерения поверхностных
концентраций использовали эффект отдачи тяжелых атомов. Другим
примером применения метода меченых атомов служат работы Шиноды и Ито
[71 ]|, изучавших адсорбцию ионов кальция на поверхности водных
растворов додецилсульфата натрия с помощью радиоактивного кальция,
и Рефельда [72], исследовавшего адсорбцию насыщенного тритием
додецилсульфата «атрия на границе раздела полимер — раствор.
Вышеприведенный материал показывает, что прямые измерения
адсорбции поверхностно-активных материалов никак нельзя
рассматривать как простые упражнения по «проверке» второго закона
термодинамики: они дают информацию о химической природе
адсорбированных веществ, которую трудно получить иначе.
В заключение приведем пример того, как метод меченых атомов помог
окончательно разрешить запутанную ситуацию. Ранние данные [73] показали, что, хотя с
увеличением концентрации поверхностное натяжение растворов лаурилсульфоновой
кислоты вначале убывает, равновесная кривая зависимости поверхностного натяжения
от концентрации проходит через минимум. Поскольку в минимуме наклон кривой
равен нулю, согласно уравнению (П-85), Г J также равен нулю. В то же время низкое
поверхностное натяжение (~30 дн/см2) в минимуме означает, что на поверхности
имеется поверхностно-активное вещество. Позднее подобное парадоксальное
поведение наблюдалось и для растворов лаурилсульфата натрия. В конце концов
выяснилось, что это отклонение связано с присутствием некоторого количества примеси лау-
рилового спирта. В изящном исследовании с использованием тритированного спирта
Нильсон [74] показал, что по мере увеличения концентрации лаурилсульфоната
натрия лауриловый спирт сначала концентрируется в поверхностном слое (см. в разд.
III-8 обсуждение эффекта «проникания»), а затем, когда концентрация поверхностно-
активного вещества становится достаточно большой, возвращается в объем раствора.
Этим и объясняется появление минимума поверхностного натяжения. По-видимому,
рассматриваемый эффект обусловлен солюбилизацией (см. разд. Х1-5Б) спирта
агрегатами или мицеллами, образующимися при некоторой определенной концентрации
детергента. Если использовать тщательно очищенный додецилсульфат натрия [75],
минимум поверхностного натяжения исчезает.
В. Эллипсометрический метод измерения поверхностных избытков
Техника эллипсометрии специально рассматривается в разд. Ш-ЗГ;
здесь же достаточно отметить только, что этот метод позволяет
рассчитать толщину адсорбированной пленки то эллиптичности света,
отраженного от поверхности, покрытой пленкой. Зная толщину пленки т,
по соотношению Г = т/У, где V — (Молекулярный объем, можно
рассчитать Г. Молекулярный объем оценивают либо с -похмощью молекулярных
моделей, либо по плотности соответствующей жидкости.
72
Глава II
поплавок
мембрана
Растворитель Р Раствор
Рис. И-14. Ванна ПЛАВМ.
Смит [76] в исследовании адсорбции я-пентана на ртути определял
поверхностное натяжение и эллипсометрические толщины пленок в
зависимости от равновесного давления. После этого величину Г можно
было рассчитать либо по уравнению Гиббса (П-22), либо исходя из т.
Оба способа очень хорошо согласуются между собой.
7. Гиббсовские монослои
Если при добавлении какого-либо растворимого вещества
поверхностное натяжение жидкости снижается, то, согласно уравнению
Гиббса, это вещество должно адсорбироваться на поверхности. При
достаточной адсорбции на поверхности образуется мономолекулярный слой
растворенного вещества. Например, приходящаяся на одну молекулу
площадь, соответствующая предельному значению Т\ на рис. Н-13,
равна 52,0 А2, что приблизительно отвечает величине, ожидаемой для
плотноупакованного слоя ионов додецилсульфата. Таким образом,
разумно считать, что Г представляет собой двумерную концентрацию
поверхностно-активного вещества в мономолекулярной пленке.
Такой монослой можно рассматривать как пленку, в которой
развивается давление, равное
" г растворитель г раствор* \"~ * ^/
Давление в пленке (или «двумерное» давление) имеет размерность
дина/сантиметр и может быть измерено непосредственно. Так, если кювету
(рис. Н-14) разделить тонкой резиновой мембраной на два отделения
и одно из них заполнить растворителем, а другое — раствором, то на
поплавок, прикрепленный к верхнему концу мембраны, будет
действовать некоторая вполне измеримая сила. В кювете ПЛАВМ* [77]
используется очень тонкая резиновая гофрированная мембрана,
практически не оказывающая сопротивления при смещении. Мембрана легко
выгибается и полностью выравнивает гидростатическое давление
между двумя отделениями. Таким образом, сила, действующая на
поплавок, обусловлена исключительно поверхностным натяжением растворов
и появляется в результате того, что смещение поплавка в направлении
поверхности с более высоким поверхностным натяжением приводит к
понижению общей свободной поверхностной энергии системы. Эту силу
можно измерить непосредственно, определив силу, которую
необходимо приложить к закрепленному на торсионной проволоке рычагу,
чтобы удержать поплавок на месте.
В приведенном выше объяснении я возникает как разность двух
поверхностных натяжений, но физически проявляется как сила,
действующая на единицу длины барьера, разделяющего две поверхности.
Модель двух разделенных подвижным барьером поверхностей, на
одной из которых имеются не проходящие за барьер адсорбированные
молекулы растворенного вещества, оказалась очень плодотворной.
Молекулы адсорбционной пленки обладают двумерной поступательной
энергией, и давление в пленке я можно рассматривать как результат
бомбардировки барьера этими молекулами, точно так же как давление
* Поккельс — Лэнгмюр — Адам — Вильсон — Мак-Бэн.
Природа и термодинамика жидких поверхностей раздела
73
газа можно рассматривать как следствие бомбардировки молекулами
стенок сосуда. Приведенная интерпретация я позволяет провести очень
удобное и конструктивное сопоставление двумерных систем с
трехмерными; такая интерпретация представляется наиболее обоснованной,
если речь идет о монослоях совершенно нерастворимых веществ (см.
следующую главу).
Однако это не единственно возможный подход. В другой модели,
также весьма удобной при исследовании нерастворимых монослоев, для
которых в кювете ПЛАВМ не требуется резиновая мембрана, барьер
рассматривается как полупроницаемая мембрана, через которую
может проходить вода (вода, конечно, проходит под барьером), но не
проходят молекулы пленки. Тогда поверхностный слой может
рассматриваться как относительно концентрированный раствор с осмотическим
давлением я08, приложенным к мембране.
Необходимо помнить, что обе эти концепции являются
модельными и что для их обоснования использовались нетермодинамические
понятия. Хотя данные модели позволяют определить я математически,
«двумерный» газ нельзя рассматривать как физическую реальность,
а раствор, для которого рассчитывается осмотическое давление, не
однороден по -составу и его средняя концентрация зависит от
предполагаемой глубины поверхностного слоя.
Л. Закон идеального двумерного газа
В разбавленных растворах взаимодействие между молекулами
растворенного вещества не имеет существенного значения (т. е. в таких
растворах выполняется закон Генри) и зависимость поверхностного
натяжения от концентрации линейная (по крайней мере для
неэлектролитов). Таким образом,
у=у0-ЬС, (II-ПО)
где yo — поверхностное натяжение чистого растворителя, или
я=6С. (И-111)
Далее, согласно уравнению Гиббса,
_dy/dC=TlRT/C. (II-112)
Как следует из уравнения (Н-110), —ду/дС равно Ь, и, таким образом,
уравнение (П-112) принимает вид
n=Y\RT (И-113)
или
яа=£7, яЛ=#Г, (II-114)
где а и А—соответственно площадь, приходящаяся на молекулу и моль
растворенного вещества. Уравнение (II-114) аналогично закону
идеального газа, и очевидно, что в разбавленных растворах пленка
адсорбированного вещества подчиняется уравнению состояния двумерного
идеального газа. На рис. П-15, а показана зависимость я от С для ряда
водных растворов спиртов. Как видно из рисунка, при низких
концентрациях я увеличивается линейно с ростом С. Соответственно рис. П-15, г
показывает, что при малых я величина nA/RT действительно
приближается к единице.
Приведем несложный расчет, показывающий, как по данным,
приведенным на рис. П-15, а, построить зависимость, показанную на
рис. П-15, в (или на рис. П-15, г). Уравнение (И-112) можно записать
как
uo го о. to 60
о yAd/молекула
1,0
i i..._i_ l i i i l i i i I i—I
W 20
uzt дн/см
JO
Рис. 11-15. Данные по поверхностному натяжению растворов нормальных спиртов и
обработка данных по уравнению Гиббса [78].
/ — бутиловый спирт, 2 — амиловый спирт; 3 — гексиловый спирт, 4 — гептиловый спирт; 5 — окти-
ловый спирт; 6 — теоретическая кривая для нормального спирта, ведущего себя на поверхности
как идеальный двумерный газ.
Природа и термодинамика жидких поверхностей раздела
,75
или при 25 °С v=4llfi/[dji/d(\nC)]A*.
Для я-бутилового спирта я равно 15,4 дн/см при С = 0,1020 и 11,5 дн/см
при С = 0,0675. Наклон кривой между этими двумя точками равен
Дя/Д1п С. Следовательно, в расчете на молекулу
а= (11,5- 15,4)Л-2669- (-2,28)] =411,6/(3,9/0,41)=43А*/молекула.
В этой точке я равно (11,5+15,4)/2 или 13,5 дн/см.
Уравнение (П-114) можно применять, например, для определения
молекулярного веса белков. С помощью «соответствующей методики
;(см. разд. III-12) белок распределяется по поверхности в виде
нерастворимой пленки, предположительно состоящей из неразвернутых
молекул. При очень низких концентрациях эта система описывается
законом двумерного -идеального газа. Зная вес белка в пленке и площадь,
которую она занимает, находят поверхностную плотность до/А. Далее
измеряют давление в пленке я и по формуле
M=wRT/n\ (И-116)
,(которая выглядит совершенно так же, как соответствующее
выражение для трехмерного газа) рассчитывают молекулярный вес белка. Этим
способом Гуасталла [79] нашел, что молекулярный вес яичного
альбумина равен 40 000, что согласуется с результатом, полученным
методом ультрацентрифугирования. В то же время молекулярный вес
гемоглобина оценен в 12 000, что примерно в 6 раз меньше
общепринятого значения.
Пример. На одном из графиков, приведенных в работе [79], видим,
что при 25 °С поверхностное давление лленки, содержащей 0,05 мг/м2
яичного альбумина, составляет ~3-10-3 дн/ом. Следовательно,
Af =(5- 10"б/Ю4) (8,31 • 107.298)/3.10"3=41 000.
Б. Неидеальные двумерные газы
Отклонение поведения гиббсовских монослоев от закона идеального
двумерного газа наглядно проявляется на графике зависимости nA/RT
от я, приведенном на рис. П-15, г. Как видно из этого рисунка,
отклонение пленок ряда нормальных спиртов от идеальности возрастает по
мере увеличения давления, тогда как при низких значениях я
достигается предельное значение nA/RT, равное единице. В то же время кривые,
доказанные на рис. П-15, в, сходны с аналогичными кривыми для газов
при температуре выше критической и при высоком давлении.
Такое сходство наводит на мысль использовать уравнение,
примененное Амага для газов при высоком давлении. В двумерной форме это
уравнение имеет следующий вид:
n(A—A*)=qRT, (IM17)
где А0 — исключенная площадь в расчете на 1 моль, a q — параметр,
характеризующий интенсивность когезионных сил. Преобразуем
уравнение (11-117) в линейную форму:
nA/RT=(A°/RT) л + q. (II-118)
Последнее уравнение довольно хорошо описывает ход кривых на
?ис. П-15, г при значениях я выше 5—10 дн/см. Предельная площадь,
приходящаяся на одну молекулу спирта, о0 составляет около 22 А2
а почти не зависит от длины углеводородной цепи. Этого можно было
ожидать в том случае, если молекулы спирта в конце концов
ориентируются перпендикулярно поверхности. Для неидеальных двумерных га-
76
Глава II
60
1
40
20
10'
1
2
J
4
5"
5
I i Г
^T
i i i i i
J—i i i t и
Концентрация додецилсулырата натрия, моль/л
Рис. II-16. Межфазное натяжение в системе углеводород—вода в зависимости от
концентрации додецилсульфата натрия (25 °С) [75].
/ — «-гептадекан— вода; 2 —•• н-декан — вода; 3 — «-октан — вода, 4 — 1-метилоктан — вода; 5 —
«-гексан — вода; 6 — 1-метилгексан — вода.
зов предложены и другие уравнения состояния, вообще говоря,
аналогичные уравнениям состояния обычных газов. Фольмер и Манерт [80]
к закону идеального газа добавили только поправку на исключенную
поверхность
я(Л—A°)=RT. (11-119)
Разумеется, можно применять и двумерную модификацию уравнения
Ван-дер-Ваальса:
(я + а/Л2) (Л —A°)=RT. (11-120)
Адсорбция может протекать, конечно, и на поверхности раздела
типа жидкость — жидкость. На рис. П-16 показано уменьшение
поверхностного натяжения различных поверхностей раздела между
/калканами и водой с увеличением концентрации додецилсульфата натрия [75].
Для расчета значений Т\ было использовано уравнение (И-107).
Наконец, на жидкой поверхности пленка может образовываться
также в результате адсорбции из паров, а не из раствора. На рис. П-17
показано уменьшение поверхностного натяжения воды в присутствии
различных углеводородных паров; здесь Р° —давление насыщенных
паров углеводорода, т. е. равновесное давление паров жидкого чистого
углеводорода. Активность углеводорода определяется давлением его
паров, соответственно уравнение Гиббса принимает вид
—dv=dn=VRTd\nP (II-121)
(чтобы упростить выражение, точное обозначение Г£ здесь заменено на
Г). Далее по уравнению
r=(l/RT)dn/dlnP, (IH 22)
аналогичному уравнению (11-115), рассчитываем Г. Теперь уже
экспериментальные данные можно выразить в виде обычных кривых
зависимости я от а или по от я (рис. П-18). Полученные кривые показывают,
что пленки адсорбированного пентана ведут себя как неидеальный
двумерный газ.
Природа и термодинамика жидких поверхностей раздела
77
Рнс. Н-17. Снижение поверхностного натяжения воды при адсорбции углеводородов
(15°С) [81].
; — к-пентан; 2 — 2,2,4-триметилгептан; 3 — w-гексан; 4 — н-гептан; 5 — к-октан.
100 200 J00 400
а,Аг/адсорбиоо8анная молекула пвнтана,
?ис. II-18. Адсорбция пентана на воде [82].
Экспериментальные данные по адсорбции газов выражают также
в виде зависимостей Г от Р, т. е. в виде изотерм адсорбции (рис. П-19).
Вид этих изотерм обсуждается в разд. VII-5A. Таким образом,
уравнение Гиббса устанавливает связь между изотермами адсорбции и
двумерными уравнениями состояния. Например, уравнение (П-67)
соответствует изотерме адсорбции
Т=аС/(\ + ЬС) (II-123)
1где а и b — постоянные), которая представляет собой одну из
возможных форм адсорбционного уравнения Лэнгмюра (см. разд. IX-1A).
В. Осмотическая модель
В начале этого раздела указывалось, что я можно связывать с
разностью осмотических давлений поверхностных слоев, состоящих из
адсорбционной пленки и чистого растворителя. Этот подход полезно раз-
78
Глава II
Рис. II-19. Изотермы адсорбции я-пента-
на и «-октана при 15°С [81].
Пунктирная кривая показывает
гипотетическую изотерму при Р/Р°>1; стрелками
обозначены значения Г, соответствующие
монослою.
работать несколько глубже. Такое рассмотрение можно было бы
начать с уравнения (Н-59), однако вместо него мы используем другое
приближение.
Напомним вкратце, что осмотическое давление обычного раствора —
это давление, которое необходимо приложить к раствору, чтобы
давление паров растворителя увеличилось до давления паров чист/ого
растворителя. Используя уравнение (П-18), осмотическое давление ji0s
можно определить следующим образом:
RT ln(a;/flff)= Г VV*P=tt0SV1, (II-124)
где «1 — активность растворителя. Обычно предполагают, что
сжимаемостью раствора можно пренебречь, и поэтому интеграл заменяют
произведением TiosVu где Vi — молярный объем. Для идеальных растворов
отношение а\/а°} равно мольной доле растворителя Ni. В разбавленных
растворах —\r\N\ аппроксимируется ,V2, которая в свою очередь лри-
близительно равна n2/ni. Учет этих приближений в уравнении (П-124)
приводит к предельному соотношению
n0SVi = (njnj RT или jcosV =n.2RT. (II-125)
Предположим теперь, что глубина поверхностного слоя равна т,
площадь А и объем — Vs. Объем поверхностного слоя Vs, чистого
растворителя равен
1Л=/г*%. (11-126)
Для смеси растворителя и адсорбированного вещества можно записать
Vs=nlVi + nlV2i (II-127)
где Vi и Vi предполагаются постоянными. Мольная доля
растворенного вещества в поверхностном слое составляет
N\ =пЦ(п\ + nl)=n\Vj[n^Vi -n\ (V2- V,)], (II-128)
[чтобы можно было исключить п{, были использованы уравнения
(П-126) и (П-127)]. Осмотическое давление в рассматриваемом
поверхностном слое приблизительно равно
n0SVi=RTNl (11-129)
и если считать, что осмотическое давление приложено к
полупроницаемому барьеру, то давление в пленке равно осмотическому давлению,
0,5 1,0
Р/Р°
Природа и термодинамика жидких поверхностей раздела 79
; множенному на глубину поверхностного слоя, в котором оно
развивается, т. е.
я=я05т. (11-130)
Решая уравнения (П-128) и (П-129) совместно с уравнением (П-130),
получаем
n=xRTnl/lniQVi-nl(V2~Vi)l (11-131)
Итак, nf° VJx в точности равно площади поверхности А и, более
того, отношения VJx и VJx также имеют размерность площадь/моль.
Если поверхностный слой считать одномолекулярным по толщине, то
VJx и V2/X переходят в молярные площади Л J и Л£, и, таким образом,
уравнение (П-131) принимает следующий вид:
n=RTny[\—nl(Al—A°1)] (11-132)
или после преобразования с учетам гого, что Л=А/л|,
nlA—(A*—A°)]=RT. (II-133)
Далее, если Л° пренебрежимо мала по сравнению с А°2, уравнение
(11-133) переходит в уравнение, использованное Булем [83]| при
изучении белковых пленок. По существу, это уравнение эквивалентно
уравнению (Н-119), описывающему поведение неидеального двумерного
газа.
Приведенный выше /вывод дан в наиболее удобном для расчетов
виде, хотя для этого пришлось сделать очень значительные, а иногда
и не совсем точные допущения. Тем не менее рассмотрение
поверхностного слоя как 'своеобразного раствора позволяет применить наши
знания в области физической химии растворов при оценке ассоциирования,
межионного взаимодействия и других эффектов, связанных с
неидеальностью поверхностного слоя. По мнению автора, еще одно
преимущество этого подхода заключается в том, что в нем подчеркивается роль
растворителя как части поверхностного слоя, тогда как при
использовании двумерных уравнений состояния подложка рассматривается
исключительно как инертная плоская поверхность, на которой свободно
движутся молекулы адсорбированного вещества, что, конечно, не совсем
верно. В действительности широко используемый Фоуксом [84]
подход, основанный на осмотической модели, является не более
эмпирическим, чем подход, базирующийся на концепции неиде^льного
двумерного газа.
Выражения, алгебраически эквивалентные приведенным, можно
получить и без привлечения концепции поверхностного раствора [85].
Вместо этого можно рассматривать поверхностные избытки,
определяемые по методу Гиббса, при этом разделяющая поверхность всегда
располагается таким образом, чтобы сумма поверхностных избытков была
равна постоянной величине. В качестве последней обычно принимается
максимальное значение Г .
Г. Правило Траубе
Поверхностные натяжения растворов органических соединений
одного гомологического ряда, например R(CH2)nX, характеризуются
определенными закономерностями. Траубе [86]! показал, что при
добавлении каждой СН2-груш1ы концентрация, необходимая для получения
определенного поверхностного натяжения, уменьшается приблизительно
в 3 раза. Это правило хорошо иллюстрирует рис. Н-15, б, на котором
последО'Ъзтельные кривые разделены почти равными интервалами в
0,5 единицы но шкале lg С.
80
Глава II
Поучительную интерпретацию этого уравнения дал Лэнгмюр [87].
Работа переноса W одного моля растворенного вещества из объема
раствора в поверхностный слой описывается выражением
W =RT In (Cs/C) =RT In (Г/тС), (II-l 34)
где Cs — поверхностная концентрация, равная Г/т, а т — глубина поверх-
постного слоя. Для соединений с длиной цепи п и п—1 разность работ
переноса составляет
Wn-Wn-i =ЯГ In [(ГутедГ^/тС,,.,)] (И-135)
По правилу Траубе, если Cn_i/Cn = 3, то уп = Уп-и и в первом
приближении можно предполагать, что поверхностные концентрации также
равны между собой. Если это так, то
Wn—Wn^=RTIn3=640 кал/моль. (П-136)
Величину 640 кал/моль можно рассматривать как работу переноса
одной СН2-группы из объема раствора в поверхностный слой.
Поскольку работа переноса одной такой группы не зависит от длины цепи,
разумно предположить, что все СНг-группы находятся на поверхности в
одинаковых условиях, т. е. что цепи лежат на поверхности.
Последнее заключение, несомненно, является слишком упрощенным.
Вполне вероятно, что правило Траубе отражает удачное стечение
нескольких обстоятельств. Так, в частности, молекулы с длинной
углеводородной цепью, вероятно, закручены в клубок, средний размер которого
определяется случайными термическими колебаниями и
взаимодействием углеводородных групп [88]. Более детально этот вопрос
обсуждается в разд. Ш-6Б.
Если известна зависимость поверхностного натяжения раствора не только от
состава, но и от температуры, то с помощью соответствующих термодинамических
соотношений (см., например, [55]) можно рассчитать энтальпию и энтропию адсорбции.
Так, авторы работы [89] рассчитали энтальпию адсорбции для ряда нормальных
спиртов и показали, что приращение энтальпии на одну СНг-группу составляет
470 кал/моль.
Д. Некоторые дополнительные замечания
Важно помнить, что «е существует принципиального различия
между адсорбированными пленками, сформированными либо нанесением
монослоев нерастворимых веществ, либо путем адсорбции из газовой
или жидкой фазы. Различие, которое действительно существует,
заключается только в методике получения экспериментальных данных.
Если исследуются гиббсовские монослои, имеют дело с довольно
растворимыми веществами и провести прямые измерения Г не так уже
легко. Поэтому измеряют изменение поверхностного натяжения и с
помощью уравнения Гиббса находят Г. В нанесенных монослоях
растворимость материала обычно так низка, что его концентрацию в растворе
трудно измерить, но зато здесь можно непосредственно определить
величину Г как количество вещества, нанесенного на единицу
поверхности. Поверхностное натяжение также можно измерить прямым
методом. Если рассматривается адсорбция, Г находят по ухменьшению
концентрации (или давления) адсорбата и, следовательно, в этом случае
известны как Г, так и концентрация или (если изучается адсорбция
газов) давление. Однако поверхностное натяжение твердого тела обычно
измерить невозможно. Таким образом, в адсорбционных исследования*
обычно из трех величин уу Г и С или Р удается измерить только две.
Деление материала книги производится в соответствии с типами
величин, измеряемых экспериментально. В основном именно так он
распределяется в литературе. В гл. III обсуждаются нанесенные монослои,
а в последующих главах рассматриваются вопросы, связанные с адсорб-
Природа и термодинамика жидких поверхностей раздела
81
иней из растворов и адсорбцией газов. Независимо от деления по
экспериментальным методам исследования выводы о природе подвижных
адсорбированных пленок (их структуре и уравнениях состояния)
имеют общее значение. В заключение отметим, что приведенное в этой
главе обсуждение гиббсовских монослоев никак нельзя считать
полным. Совершенно не затронуты такие вопросы, как, например,
контактные потенциалы растворов или адсорбция на поверхностях раздела
типа жидкость — жидкость. Эти вопросы целесообразно рассмотреть
позднее.
8. Упражнения
1. При 20°С для метанола ду/дТ=—0,096 дн/см-К. Рассчитайте Es и Es'.
Необходимые сведения о физических свойствах метанола возьмите из справочника.
2. По данным упражнения 1 рассчитайте Ss и Ss' для метанола для 20 °С.
Проведите такой же расчет для «-октана (соответствующие данные приведены в табл. II-1).
Сравните и обсудите полученные результаты.
3. Рассчитайте давление паров воды в капилляре радиусом 1 мкм (краевой угол
примите равным нулю). Выразите полученный результат в виде процента отклонения
от нормального значения при 25 °С.
4. Завершите не законченный в разд. П-5В расчет П и Гг .
5. Покажите, что уравнение (И-105) действительно определяет величину Г£.
6. Толщина эквивалентного слоя чистой воды т на поверхности 3 М раствора
хлорида натрия составляет около 1 А. Рассчитайте поверхностное натяжение этого
раствора, предполагая, что поверхностное натяжение растворов солей меняется с
концентрацией линейно. Влиянием изменения коэффициентов активности можно пренебречь.
7. Выведите уравнение (П-67) из уравнения (П-123).
8. Для водных растворов и-гексилового спирта при 12 °С Познер и др. [78]
получили следующие данные:
Концентрация, моль/л
я, дн/см
Концентрация, моль/л
я, дн/см
0,00062
2,3
0,00343
9,4
0,00081
2,5
0,00490
13,4
0,00125
3,9
0,00686
16,3
0,00172
5,7
0,00980
19,4
0,00250
7,9
Постройте графики, аналогичные приведенным на рис. Н-15.
9. Постройте соответствующую уравнению (Н-60) кривую зависимости
поверхностного натяжения от состава для смесей этанол — вода при 25 °С и сравните ее с
экспериментальной кривой.
10. Рассчитайте S12 для смесей этанол — вода по уравнению (Н-66), используя
экспериментальные данные, полученные для этих смесей при 25 °С.
11. Установлено, что под действием паров углеводорода с различным
относительным давлением поверхностное натяжение воды при 25 °С меняется следующим
образом:
Р/Р° 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90
я, дн/см 0,22 0,55 0,91 1,35 1,85 2,45 3,15 4,05 5,35
Рассчитайте и постройте зависимость я от о (в А2 в расчете на молекулу) и Г от
Р/Р°. Смачивает ли углеводород воду (см. Г81])?
12. Выведите уравнение состояния (т. е. соотношение между я и а) для
адсорбционных пленок поверхностно-активных электролитов 1:1 и 1:3. Коэффициент
активности электролита примите равным единице. Считайте, что раствор достаточно
разбавлен и поэтому зависимость поверхностного натяжения от концентрации линейна,
а также что поверхностно-активным веществом является сам электролит (а не продукт
его гидролиза).
13. Предлагается следующий тип вечного двигателя. В закрытом устройстве,
показанном на рис. П-20, давление паров над плоской поверхностью выше, чем над ме-
Рис. П-20.
\,'//// // // // // А
I/ , / , / , S у У у / у S у
6—1421
82
Глава II
Таблица П-3
Система изооктан — бензол
Концентрация
изооктана,
мол. доли
0,000
0,186
0,378
0,483
Поверхностное
натяжение,
Дн/см |
27,53
1 23,40
21,21
20.29
Концентрация
изооктана,
мол. доли
0,583
0,645
| 0,794
1,000
Поверхностное
натяжение,
дн/см
19,70
19,32
18,74
17,89
ниском [уравнение (П-20)]. Поэтому по направлению, отмеченному стрелками,
должен был бы идти поток пара. При этом жидкость испаряется с плоской поверхности,
конденсируется в мениске и по капилляру стекает обратно в основной объем
жидкости. Попутно пар вращает колесо с лопастями, т. е. совершает механическую работу.
а) Какому из законов термодинамики — первому или второму — противоречит
предложенная схема? Обоснуйте свое заключение, б) Проведите соответствующий анализ
(не прибегая к первому или второму закону термодинамики как таковому) и
покажите, что все или некоторые из приведенных утверждений ошибочны и что это
устройство работать не будет.
14. Изменение поверхностного натяжения водного раствора с концентрацией
растворенного вещества описывается уравнением у=72—500 С (С<0,05 моль/л).
Рассчитайте значение константы k для изменения поверхностного избытка растворенного
вещества с концентрацией. Известно, что Y\—kC. Температура системы равна 25°С.
15. В табл. П-3 приведены величины поверхностного натяжения для растворов
изооктан — бензол при 30 °С. Рассчитайте Г?, П, V? и Г^ для различных
концентраций и постройте кривую зависимости этих величин от мольной доли соответствующего
компонента в растворе. Растворы считайте идеальными.
16. Изучая адсорбцию ди(я-октил)сульфосу«цината, меченного 35S, Солли [65]
получил следующие данные. Первоначальная активность поверхности 2,50 см3 раствора
с концентрацией 0,800-Ю-8 моль/см3 составляла 300 имп/мин. Измерения проводились
в чашечке радиусом 1,50 см, радиус трубки счетчика составлял 2,5 см. (В исследуемой
системе поверхностно-активные вещества адсорбируются довольно медленно, поэтому
измерение первоначальной активности проводили до того, как на поверхности
адсорбируется заметное количество вещества.) Равновесная активность поверхности
составляла 2000 имп/мин, а активность раствора, выпаренного в той же чашечке до тонкого
слоя, равнялась 2,4-104 имп/мин. Рассчитайте поверхностный избыток в молях на
квадратный сантиметр.
17. Выведите уравнение (П-22), пользуясь первым и вторым законом
термодинамики и связанными с ними определениями.
18. При 20 °С монослой белка, содержащий 0,80 мг белка на квадратный метр,
дает уменьшение поверхностного натяжения, равное 0,035 эрг/см2. Рассчитайте
молекулярный вес белка.
19. Два следующих утверждения кажутся взаимоисключающими и на первый
взгляд соответствуют парадоксальной ситуации, а) В равновесной системе при
постоянных температуре и давлении химический потенциал вещества должен быть одним
и тем же во всех точках системы. Поэтому, если мы имеем жидкость с плоской
поверхностью, находящуюся в равновесии с ее паром, то химический потенциал в
поверхностном слое должен быть таким же, как в объеме жидкости, и для переноса
молекулы из объема в поверхностный слой не требуется работы, б) Для переноса
молекулы из объема жидкости в поверхностный слой необходимо совершить работу,
поскольку перенос означает увеличение поверхности и, следовательно, свободной
энергии системы.
Обсудите эти утверждения и устраните кажущееся противоречие (см. [85]).
Таблица 11-4
Адсорбция паров воды на ртути при 25 °С
Давление паров
воды, атм
0
ыо-3
3
4
5
6
Поверхностное
натяжение, дн/см
483,5
483
482
481
477 ,
467
Давление паров
воды, атм
7,5
10
15
20
25
Поверхностное
натяжение, дн/см
459
450
442
438
436
Природа и термодинамика жидких поверхностей раздела
83*.
20. В табл. Н-4 приведены данные Николаса и др. [90] по поверхностному
натяжению ртути при 25 °С, находящейся в контакте с парами воды при различных
давлениях. Рассчитайте изотерму адсорбции воды на ртути и постройте зависимость Г от А
21. Поверхностное натяжение жидкого висмута при 550 К составляет 380 эрг/см2,
его критическая температура оценивается в 4620 К. Используя уравнение (П-16)г
рассчитайте для висмута Es'\ все принятые допущения обоснуйте.
22. Используя данные, приведенные на рис. Н-8, а, и уравнение (П-60),
рассчитайте зависимость поверхностного натяжения смесей циклогексана и бензола от состава,
23. Выведите уравнение, устанавливающее связь между теплотой испарения капли
жидкости радиусом г.
24. Используя принцип Лэнгмюра о независимости поверхностного действия,
проведите качественные расчеты и выясните, каким концом — полярным или
неполярным— этанол должен ориентироваться по отношению к ртутной фазе на поверхности
раздела этанол — ртуть
25. Значения S в уравнении (П-66) для двух смесей расплавленных солей
составляют
5kN03, NaNO.3^2»11' ScsNOg, NaNOg = 2>93 (при 350 °C).
Поверхностное натяжение чистых KN03, NaN03 и CsN03 равно 112, 117 и 96 дн/см
соответственно. Рассчитайте поверхностное натяжение а) раствора KN03 и NaiNOa, в
котором мольная доля NaN03 составляет 25%, б) раствора KN03 и CsN03, в
котором мольная доля CaN03 равна 25%.
26. Объясните, почему на рис. II-11 при приближении N2 к единице Т\ не
стремится к нулю, как другие величины Г2.
27. Оцените поверхностное натяжение ртути при 25 °С, используя приведенные в
справочниках значения энергии испарения и критической температуры и считая, что
жидкая структура состоит из плотно упакованных сфер.
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Defay R., Prigogine I., Bellemans A., Everett D. H., Surface Tension and Adsorption,
Longmans, Green and Co., London, 1966.
Фаулер Р., Гуггенгейм Э.> Статистическая термодинамика, пер. с англ., М., И. Л.,
1949.
Наг kins W. D., The Physical Chemistry of Surfaces, Reinhold, New York, 1952.
Hildebrand J. H., Scott R. L., The Solubility of Nonelectrolytes, 3rd ed., Van Nostrand-
Reinhold, Princeton, New Jersey, 1950.
Lewis G. N., Randall M., Thermodynamics, 2nd ed. (revised by Pitzer K. S., Brewer L.),
McGraw-Hill, New York, 1961.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Netzel D. A., Hoch G., Marx T. L, J. Colloid Sci., 19, 774 (1964).
2. Wolf /(. L., Physik und Chemie der Grenzflaschen, Springer-Verlag, Berlin, 1957.
3. Edivos R.f Wied Ann., 27, 456 (1886).
4. Ramsay W.f Shields /., J. Chem. Soc, 1893, 1089.
5. Guggenheim E. A., J. Chem. Phys., 13, 253 (1945).
6. Grosse A. V.t J. Inorg. Nucl. Chem., 24, 147 (1962).
7. Lennard-Jones J. E., Corner /., Trans. Faraday Soc, 36, 1156 (1940).
8. Cahn У. W., Hiliard J. E., J. Chem. Phys., 28, 258 (1958).
9. Garner F. В., Sugden S., J. Chem. Soc, 1929, 1298.
10. Quayle O. R., Chem. Rev., 53, 439 (1953).
11. Grzeskowiak R„ Jeffery G. #., Vogel A. /., J. Chem. Soc, 1960, 4719; Exner O.,
Nature, 196, 890 (1962).
12. Skapski A. S., J. Chem. Phys., 16, 386 (1948).
13. Atkins K. R., Narahara Y„ Phys. Rev., 138, A437 (1965).
14. Stansfield D., Proc. Phys. Soc, 72, 854 (1958).
35. Addison C. C., Coldrey J. M., J. Chem. Soc, 1961, 468.
16. Griffin /. В., Clever H. L., J. Chem. Eng. Data, 5, 390 (1960).
17. Addison С. С, Addison W. E., Kerridge D. H., Lewis J., J. Chem. Soc, 1955,
2262.
18. Lauermann L, Metzger G., Sauerwald F., Z. Phys. Chem., 216 42 (1961)
!9. Allen В. С, AIME Trans., 227, 1175 (1963).
20. LaMer V. /Cv Gruen R., Trans. Faraday Soc, 48, 410 (1952).
21. Folman M., Shereshefsky J. L., J. Phys. Chem., 59, 607 (1955)
22. Chem. and Eng. News, July 16, 1973, p. '13.
23. Everett D. #., Haynes J. M., McElroy P. J., Sci. Prog., Oxf 59, 279 (1971)
24. Tolman R. C, J. Chem. Phys., 17, 333 (1949).
25. Lewis G. N., Randall M., Thermodynamics and the Free Energy of Chemical
Substances, McGraw-Hill, New York, 1923, p. 248.
84
Глава II
26. Eriksson /. С, Acta Chem. Scand., 16, 2199 (1962).
26a. Massoudi R., King A. D., Jr., J. Phys. Chem., 78, 2262 (1974).
27. Schmid G. M., J. Electrochem. Soc, 109, 852 (1962).
28. Adamson A. W., Dormant L„ J. Am. Chem. Soc, 88, 2055 (1966).
29. Piccardi G., Ric. Sci., 29, 1252 (1959).
.30. Borneas M., Babutia I., CR., 249, 1036 (1959).
.31. Raman C. V., Ramdas L. A., Phil. Mag., 3, No. 7, 220 (1927).
32. Brown R. C, Proc. Phys. Soc, 59, 429 (1947).
33. Gurney C, Proc Phys. Soc, A62, 639 (1947).
34. Gibbsl. W., The Collected Works of J. W. Gibbs, Longmans, Green, New York, 1931,
Vol 1, p. 219.
35. Tolman R. C., J. Chem. Phys., 16, 758 (1948); 17, 118 (1949).
36. Bakker G., Z. Phys. Chem., A171, 49 (1934).
37. Kirkwood J. G., Buff F. P., J. Chem. Phys., 17, 338 (1949).
38. Buff F., «The Theory of Capillarity», in Handbuch der Physik, Vol. 10, S. Flugge and
Marburg, Eds., Springer-Verlag, Berlin, 1960.
39 Хилл T, Статистическая механика, М., ИЛ, 1960.
40. Reiss И, Frisch Я. L., Hefland E., J. Chem. Phys., 32, 119 (1960).
41. Мацсг S. W., J. Phys. Chem., 67, 2160 (1963).
42. Ree T. S., Ree T. K., Ree Т., Eyring H., J. Chem. Phys., 41, 524 (1964).
43. Shoemaker P. D., Paul G. W., Marc de Chazal L. E., J. Chem. Phys., 52, 491
(1970)
44. Luck W. A. P., Disc. Far. Soc, 43, 115 (1963).
45. Hardy W. В., Proc. Roy. Soc. (London), A88, 303 (1913).
46. Harkins W. D., Z. Phys. Chem., 139, 647 (1928); The Physical Chemistry of Surface
Films, Reinhold, New York, 1952.
47. Langmuir I., Colloid Symposium Monograph, The Chemical Catalog Company, New
York, 1925, p. 48.
48. Kamienski B, Paluch M., Bull. Acad. Polon. Sci., 13, 643 (1965); Kamienski В.,
MtodnikaT., Electrochim. Acta, 8, 651 (1963).
49. Good R. J., J. Phys. Chem., 61, 810 (1957).
50. Guggenheim E. A., Trans. Faraday Soc, 41, 150 (1945).
51. Hildebrand J. H., Scott R. L., Solubility of Nonelectrolytes, Reinhold, New York, 1950,
Chap. 21.
52. Hoar T. P., Melford D. A., Trans. Faraday Soc, 53, 315 (1957).
53. Prigogine I., Defay R., J. Chim. Phys., 46, 367 (1949).
54. Evans H. В., Jr., Clever H. L., J. Phys. Chem., 68, 3433 (1964).
55. Defay R., Prigogine I., Bellemans A., Everett D. H., Surface Tension and Adsorption,
Longmans, Green and Co., London, 1966.
56. Gertozzi G., Sternheim G., J. Phys. Chem., 68, 2908 (1964).
57. Gaines G. L.f Jr., Trans. Faraday Soc, 65, 2320 (1969).
58. Reiss H., Mayer S. W., J. Chem. Phys., 34, 2001 (1961).
59. Eberhart J. G., J. Phys. Chem., 70, 1183 (1966).
60. von Szyszkowski В., Z. Phys. Chem., 64, 385 (1908); Meissner H. P., Michaels A. S.,
Ind Eng. Chem., 41, 2782 (1949).
61. Guggenheim E. A., Adam N. K., Proc. Roy. Soc (London), A139, 218 (1933).
62. Guggenheim E. A., Trans. Faraday Soc, 36, 397 (1940).
63. Everett D. H., Pure Appl. Chem., 31, 579 (1972).
64. McBain J. W., Humphreys C. W., J. Phys. Chem., 36, 300 (1932); McBain J. W.,
Swain R. C., Proc Roy. Soc. (London), A154, 608 (1936).
05. Salley D. J., Weith A. J., Jr., Argyle A. A., Dixon J. K., Proc. Roy. Soc. (London),
A203, 42 (1950); Dixon J. K., Judson С. М., Salley D. /., Monomolecular Layers,
Publication of the American Association for the Advancement of Science, Washington,
D C, 1954, p. 63
66. Gibbs /. W., The Collected Works of J. W. Gibbs, Longmans, Green, New York, 1931,
Vol I, p. 63
67. Tajima K., Muramatsu M., Sasaki Т., Bull. Chem. Soc. Japan, 43, 1991 (1970).
68. Tajima K-, Bull. Chem. Soc Japan, 43, 3063 (1970).
69. Sekine K., Seimiya Т., Sasaki Т., Bull. Chem. Soc. Japan, 43, 629 (1970).
70 Steiger N. H., Aniansson G., J. Phys. Chem., 58, 228 (1954).
71. Shinoda К, Но К, J. Phys. Chem., 65, 1499 (1961).
72. Rehfeld S. J., J. Colloid Interface Sci., 31, 46 (1969).
73. McBain J. W., Wood L. A., Proc. Roy. Soc (London), A174, 286 (1940).
74. Nilsson G., J. Phys. Chem., 61, 1135 (1957).
75. Rehfeld S. J., J. Phys. Chem., 71, 738 (1967).
76. Smith Т., J. Colloid Interface Sci., 28, 531 (1968).
77. McBain J. W., Vinograd /. R., Wilson D. A., J. Am. Chem. Soc, 62, 244 (1940);
McBain J. W., Ford T. F„ Wilson D. A., Kolloid-Z., 78, 1 (1937).
78. Posner A. M., Anderson J. R., Alexander A. E.f J. Colloid Sci., 7, 623 (1952).
79. Guastalla J., CR, 208, 1078 (1939).
80. Volmer M., Mahnert P. Z. Phys. Chem., 115, 239 (1925); Volmer M., ibid., 115, 253
Природа и термодинамика жидких поверхностей раздела
85
ъ\. Hauxwell F., Ottewill R. Я., J. Colloid Interface Sci., 34, 473 (1970).
?2. Cutting С L., Jones D. C, J. Chem. Soc, 1955, 4067; Blank M., Ottewill R. #.,
J. Phys. Chem., 68, 2206 (1964).
S3. Bull H. В., Advan. Protein Chem., 3, 95 (1947).
84 Fowkes F. M., J. Phys. Chem., 68, 3515 (1964) и предыдущие статьи.
55. Lucassen-Reynders E. #., van den Tempel M., Proc. IVth Int. Cong. Surface Active
Substances, Brussels, 1964, vol. II, Overbeek J. Th. G., ed., Gordon and Breach, New
York, 1967, p. 779.
86 Traube L, Ann., 265, 27 (1891).
87. Langmuir L, J. Am. Chem. Soc, 39, 1848 (1917).
88. Rowland F.t Bulas R., Rothstein E., Eirich F. R., Ind. Eng. Chem., p. 46, September
1965.
89. Nearn M. R„ Spaull A. J. В., Trans. Far. Soc, 65, 1785 (1969).
90 Nicholas M. E., Joyner P. A., Tessem B. M., Olson M. D., J. Phys. Chem., 65, 1373
(1961).
ГЛАВА III
Пленки на жидких поверхностях
1. Введение
Имеется 'множество доказательств того, что малорастворимое
вещество, нанесенное на поверхность раздела жидкость — воздух,
растекается в тонкую и в большинстве случаев мономолехулярную пленку.
Хотя *в принципе рассматриваемые системы описываются такими же
термодинамическими зависимостями, как гиббсовские мочослои,
полностью метод Гиббса к ним применить нельзя, так как концентрацию
малорастворимого вещества в растворе измерить чрезвычайно трудно.
Однако, как правило, концентрация раствора как такозая не интересует
исследователей и даже возможность расчета ее изменения по
уравнению Гиббса используется мало. Основной упор при изучении пленок
малорастворимых веществ делается на прямые измерения величин,
характеризующих собственно поверхность раздела.
Исследования пленок 'малорастворимых веществ на жидких
поверхностях имеют интересную историю. В своей монографии Гэйнс [1]
напоминает, что еще Плиний старший и Плутарх знали об
успокаивающем действии масла на бурное море. В 1774 г. Бэнджамин Франклин
дал более количественную характеристику этому явлению: он нашел,
что одной чайной ложки масла достаточно, чтобы успокоить пруд
площадью ~0,2 га. Позднее, в 1890 г. Рэлей [2] установил, что
хаотическое движение кусочков камфоры на поверхности воды прекращается,
если на поверхность воды нанести олеиновую кислоту в количестве,
достаточном для образования пленки толщиной всего лишь около 16 А.
Это позволило оценить 1максимальный размер молекулы олеиновой
кислоты и ее молекулярный вес и, таким образом, установить
минимальное значение числа Авогадро. По порядку величины полученное
значение числа Авогадро оказалось правильным.
Приблизительно в то же время Поккельс [3] обнаружила
возможность регулирования площади пленки с помощью подвижного барьера.
Она, в частности, показала, что поверхностное натяжение пленки
изменяется лишь до тех пор, пока удельная поверхность пленки не
уменьшится до ~20 А2 на молекулу (точка По-ккельс). В 1889 г. Рэлей [4]
пришел к выводу, что, очевидно, в точке Поккельс молекулы пленки
касаются друг друга. Согласно концепции, развитой Рэлеем,
поверхностная пленка состоит из «плавающих» на поверхности молекул, которые
слабо взаимодействуют между собой до тех пор, пока они не вступают
р 'непосредственный контакт друг с другом. Сжатие пленки в точке
Поккельс приводит к уменьшению полной свободной энергии системы.
В результате образуется дополнительная поверхность, т. е.
поверхностное натяжение уменьшается.
Из этих ранних экспериментальных исследований стало ясно, что
при действии /мономолекулярной пленки на плавающий барьер
развивается вполне измеримая сила. Свободно плавающая на поверхности
петля из нитки растягивается и принимает форму окружности, если
Пленки на жидких поверхностях
87
Рис. III-1. Пленочные весы Лэнг-
мюра [6].
внутри ее содержится некоторое количество поверхностно-активного
вещества. Физически это означает, что молекулы пленки расталкивают
петлю, служащую ограничивающим барьером.
Дево [5] нашел, что при растекании пленки легкий тальковый
порошок выталкивается с поверхности жидкости и что одни пленки
легко разрушаются воздушной струей, тогда как другие кажутся довольно
жесткими.
В 1917 г. Лэнгмюр [6]! разработал новый экспериментальный метод
изучения мономолекулярных пленок. В предложенном им приборе с
одной стороны плевки находится жесткий, но подвижный барьер, а с
другой стороны — плавающий барьер (рис. III-1). Просачиванию
пленки по краям плавающего барьера препятствуют струйки воздуха,
выходящие из небольших сопел. Этот прибор позволяет непосредственно
измерять силу, действующую на плавающий барьер, и, таким образом,
найти я — давление в пленке (см. разд. П-7). Лэнгмюр подтвердил
наблюдение Поккельс, что поверхность можно очистить от пленки, просто
перемещая подвижный барьер, находящийся в постоянном контакте с
поверхностью. При движении подвижного барьера позади него остается
свежая поверхность чистой воды. Плавающий барьер соединен с
подвеской призмы весов, с помощью которых можно определять силу,
действующую на этот барьер. Барьеры изготавливаются из бумаги,
покрытой парафином, защищающим ее от смачивания водой.
Лэнгмюр настоятельно подчеркивал важность исследования пленок
чистых веществ, а не различных природных масел, использовавшихся
раньше. Он показал, что для пальмитиновой, стеариновой и церотино-
вой кислот предельная площадь в точке Поккельс одинакова и
составляет 21 А2 на молекулу. (В табл. III-1 приведены общепринятые
названия различных углеводородов, наиболее часто упоминаемых в этой
главе.)
Тот факт, что изменение длины углеводородной цепи от 16 до 26
атомов углеводорода не влияет на предельную площадь, может означать,
что в точке Поккельс молекулы ориентированы вертикально. Объем
молекулы пальмитиновой кислоты, рассчитанный из молекулярного
веса и плотности кислоты, составляет 495 А3; на поверхности жидкости
одна молекула занимает только 21 А2, следовательно, ширина
молекулы равна —-4,5 А, а длина — 23 А. Таким образом, исследуя
мономолекулярные пленки, можно получать информацию как о форме и
ориентации, так и о размерах молекул.
Имеется множество прямых и косвенных (разд. П-3) свидетельств
того, что в пленке полярные концы молекул направлены к воде, а
углеводородные хвосты — к воздуху. В то же время экспериментальные
данные, полученные при исследовании гиббсовских монослоев
(разд. П-7), говорят о том, что небольшие молекулы стремятся
расположиться на поверхности плоско. Ниже будет показано, что ориентация
88
Глава III
Принятые названия длинноцепочечных соединений
Таблица III-1
Формула
Тривиальное название
Женевская номенклатура
с10н21соон
СцНгзОН
С„Н23СООН
С11Н250Н
Ci2H25COOH
Ci3H270H
С13Н27СООН
СиНгдОН
C15H3iCOOH
С16Н330Н
С16Н33СООН
С17Н350Н
с17н35соон
С18Н370Н
С8Н17СН=СН (СН2) 7СООН
C8Hi7CH = СН (СН2) 7СООН
СНз (СН2) 7СН=СН (СН2) 8ОН
СНз (СН2) 7СН = СН (СН2) 8ОН
С18Н37СООН
С19Н390Н
С19Н39СООН
С20Н41ОН
с21н45соон
СНз (СН2) 7СН = СН (CH2), iCOOH
СНз(СН2)7СН=СН(СН2)иСООН
C25H5iCOOH
Ундекановая кислота
Ундекановый спирт
Лауриловая кислота
Лауриловый спирт, до-
дециловый спирт
Тридециловая кислота
Тридециловый спирт
Миристиновая кислота
Тетрадекановый спирт
Пальмитиновая кислота
Цетиловый спирт
Маргариновая кислота
Гептадециловый спирг
Стеариновая кислота
Октадециловый спирг
Элаидиновая кислога
Олеиновая кислота
Олеиновый спирт
Элаидиновый спирт
Нонадециловая кислота
Нонадециловый спирт
Арахиновая кислота
Эйкозиловый спирт, ара-
хоновый спирт
Бегеновая кислота
Эруциновая кислота
Брасидиновая кислота
Церотиновая кислота
Ундекановая кислота
Ундеканол-1
Додекановая кислота
Додеканол-1
Тридекановая
кислота
Тридеканол-1
Тетрадекановая
кислота
Тетрадеканол-1
Гексадекановая
кислота
Гексадеканол-1
Гептадекановая
кислота
Гептадеканол-1
Октадекановая
кислота
Октадеканол-1
транс-9-
Октадекановая кислота
^мс-9-Октадекановая
кислота
^мс-9-Октадеценол
т/?а«с-9-Октадеценол
Нонадекановая
кислота
Нонадеканол-1
Эйкозановая кислота
Эйкозанол-1
Докозановая кислота
цис-13-Докозеновая
кислота
транс-13-Докозеновая
кислота
Гексакозановая
кислота
Примечание. Обратите внимание, что обычно кислоты, содержащие четное число атомов
углерода, имеют специальное название. Это связано с тем, что эти
кислоты встречаются в жирах растительного и животного происхождения.
молекул на поверхности зависит не только от химического состава, но
и от других переменных, например от давления в пленке я.
В заключение этого краткого исторического очерка отметим, что
особенно большое внимание уделялось исследованию монослоев в 20—
30-х годах. Усилиями Лэнгмюра, Адама, Гаркинса и Ридила теория
монослоев стала точной и зрелой научной дисциплиной. В
послевоенные годы число работ еще более возросло, однако по темпам развития
эта область науки значительно уступает большинству других
направлений. Кроме того, эти исследования в меньшей степени связаны с
крупными исследовательскими центрами. Существует мнение, что явления,
происходящие на поверхностях твердых тел, понять легче, чем явления,
происходящие на поверхностях жидкостей, и поэтому исследователи
основное внимание уделяют именно поверхности твердых тел. Однако
эти области в действительности неотделимы друг от друга, и
достижения в одной области стимулируют развитие другой. Например, широкое
использование всех видов молекулярной спектроскопии для изучения
Пленки на жидких поверхностях
89
поверхностей твердых тел способствовало применению этих методов
лри исследовании поверхностей жидкостей.
Наконец, необходимо сделать некоторые замечания относительно
принятой нами терминологии. Выражения пленка и мономолекулярная
пленка до сих пор использовались почти как равнозначные. Строго
говоря, пленка — это слой вещества, растекающегося по поверхности,
причем толщина этого слоя достаточно мала, и поэтому
гравитационными эффектами в нем можно пренебречь. Мономолекулярная пленка,
или, короче, монослой,— это пленка, толщина которой соответствует
размеру всего одной молекулы. Соответственно бислойная, или
дуплексная, пленка — это пленка, толщина которой достаточна для
образования двух независимых поверхностей раздела (например, жидкость —
пленка и пленка — воздух), характеризуемых собственным
поверхностным натяжением. Вещество, помещенное на поверхность раздела может
также образовать линзу, т. е. толстый слой определенных размеров,
форма которого обусловлена силами притяжения. На реальных
поверхностях возможны комбинации различных пленок и линз; так, вещество,
помещенное на поверхность воды, может расширяться с образованием
монослоя, а остающийся избыток может собираться в линзу.
2. Растекание одной жидкости по поверхности другой
Прежде чем приступить к основной теме этой главы, а именно к
обсуждению поведения и свойств пленок, растекшихся на жидких
подложках, целесообразно обсудить проблему растекания вещества по
поверхности жидкости в более широком плане. Существуют некоторые
общие закономерности, определяющие в принципе возможность
растекания одной жидкости по другой, и это явление интересно уже само
по себе.
А. Критерии растекания
Если на поверхность жидкости поместить некоторое количество
вещества таким образом, чтобы вначале образовался слой заметной
толщины (рис. 111-2), то дальнейшее превращение слоя может идти двумя
путями. Характер превращения пленки лучше всего характеризует так
называемый коэффициент растекания.
При постоянных температуре и давлении небольшое изменение по-
зерхностной свободной энергии системы, показанной на рис. III-2,
описывается полным дифференциалом.
dG=(dG/dAA) dAA + (dG/dAAB) dAAB + (dG/dAB) dAB, (III-1)
но
dAB=— dAA=dAAB,
где индексами А и В обозначены подложка и нанесенная жидкость
соответственно, а
(dG/dAA)=yA и т. д.
Коэффициент —(dG/дАв)площадь характеризует изменение свободной
энергии при растекании пленки жидкости В по жидкости А и
называется коэффициентом растекания В на А. Таким образом,
5в/а =?а—Тв—Tab- (П1-2)
Коэффициент SB/A имеет положительный знак, если растекание
сопровождается уменьшением свободной энергии, т. е. является самопроиз-
90
Глава HI
вольным. Из определений работы адгезии и когезии [уравнения (П-51)
и (П-52)] видно, что коэффициент растекания равен разности между
работой адгезии А к В и работой когезии В
SB/A=WAB-WBB. (III-3)
Процесс, описанный уравнениями (Ш-2) и (II1-3), соответствует
растеканию в системе, изображенной на рис. Ш-2, с образованием толстой
или дуплексной пленки В. Такая пленка сразу же, как правило,
образуется при помещении одной жидкости на поверхность другой, если
5в/а — величина положительная. Вообще говоря, быстрое растекание
пленки обычно наблюдается, когда жидкость с низким поверхностным
натяжением наносится на поверхность жидкости с высоким
поверхностным натяжением. В табл. Ш-2 приведены некоторые данные по
растеканию в различных системах. Как видно из таблицы, бензол и
спирты с длинными цепями должны растекаться на воде, тогда как CS2
и CH2I2 должны оставаться на ней в виде линзы. Исключение
составляет ртуть, на поверхности которой, как показывает анализ табличных
данных, почти все жидкости растекаются с образованием пленки.
Можно ожидать, что жидкость с высоким поверхностным натяжением не
будет растекаться по поверхности жидкости со значительно более
низким поверхностным натяжением, поэтому во всех подобных случаях,
приведенных в табл. Ш-2, 5А/В имеет отрицательный знак.
Здесь возникает некоторое осложнение. Поверхностные натяжения
жидкостей А и В в уравнениях (Ш-2) соответствуют поверхностным
натяжениям чистых жидкостей. Однако, если две жидкости находятся
в контакте, они взаимно насыщаются и, таким образом, уА изменяется
до Ya(B), а ув — до vb(a)- Это означает, что при определении
коэффициента растекания следует учитывать, что данная фаза насыщена по
отношению к веществу или фазе, символ которой стоит в скобках. Тогда
соответствующий коэффициент растекания можно записать как 5В(А)/а(в).
Если бензол наносят на воду, то
SB/A=72,8 — (28,9+ 35,0) =8,9, (Ш-4)
SB(A)/A=72,8-(28,8+35,0)=9,0, (Ш-5)
5В(А)/А(в)=62,2-(28,8-Ь35,0)^-1,6. (Ш-6)
Следовательно, конечный коэффициент растекания является
отрицательным. Таким образом, если на поверхность воды нанести бензол,
сначала он быстро растечется по поверхности воды, а после взаимного
насыщения стянется в линзу. Поверхность воды, однако, не останется
чистой: поверхностное натяжение воды снизится до 62,2, что
соответствует гиббсовскому 'монослою для насыщенного раствора бензола в воде
(иначе говоря, соответствует пленке бензола, находящейся в
равновесии с насыщенными парами бензола).
Только что описанная ситуация довольно характерна для систем,
включающих воду. Коэффициент растекания на воде жидкостей с
низким поверхностным натяжением сначала имеет положительное
значение, а затем почти нулевое или даже становится отрицательным. Это
происходит из-за того, что поверхностное давление я гиббсовского мо-
кослоя достаточно велико, чтобы уменьшить поверхностное натяжение
воды до значения меньше суммы двух других величин, входящих в
уравнение (Ш-2). Таким образом, в условиях равновесия органические
жидкости обычно образуют на поверхности воды монослой,
сосуществующий с линзой, в которую собирается избыток жидкости.
Коэффициент растекания Sb<a)/a можно определить с помощью
прямых измерений. Ряд значений Sb(A)/a содержится в работе Зисмана
и др. [9а] (см. упражнение Ш-2).
Пленки на жидких поверхностях
91
Таблица П1-2а
Коэффициенты растекания жидкостей на воде при 20 °С
Жидкость В
Изоамиловый спирт
н-Октиловый спирт
Гептальдегид
Олеиновая кислота
Этиловый эфир пеларгоновой
кислоты
л-Цимол
Бензол
Толуол
Изопентан
SB/A. эрг/см2
44,0
35,7
32,2
24,6
20,9
10,1
8,8
6,8 i
9,4
Жидкость В
Нитробензол
Гексан
Гептан (30°С)
Дибромэтан
о-Монобромтолуол
Сероуглерод
Моноиодбензол
Бромоформ
Йодистый метил
5В/А' эрг/см2
3,8
3,4
0,2
—3,2
—3,3
—8,2
—8,7
-9,6
—26,5
Таблица III-26
Коэффициенты растекания жидкостей на ртути [7]
Жидкость В
Йодистый этил
Олеиновая кислота
Сероуглерод
я-Октиловый спирт
SB/A. эрг/см2
135
122
108
102
Жидкость В
Бензол
Гексан
Ацетон
Вода
5В/А' ЭРГ/Ш2
99
79
60
—3
Таблица Ш-2в
Начальные и конечные коэффициенты растекания на воде (эрг/см2) [7, 8]
Жидкость
Изоамиловый спирт
Бензол
Сероуглерод
н-Гептиловый спирт
CH2I2
^В
23,7
28,9
32,4
27,5
50,7
VB(A)
23,6
28,8
31,8
?А(В)
25,9
62,2
^АВ
5
35
48,4
7,7
41,5
SB(A)
44
8,9
—7
40
—27
5В(А)/5А(В)
-2,7
—1,6
-9,9
—5,9
—24
SA(B) I 5A(B)/SB(A)
1
-54
—78,9
-89
—56
—73
—1,3
—68,4
Таблица Ш-2г
Начальные и конечные коэффициенты растекания жидкостей на ртути (эрг/см2)а
Жидкость
В
Вода
Бензол
я-Октан
*в
72,8
28,8
21,8
?В(А)
(72,8)
(28,8)
(21,8)
VA(B)
448
393
400
Vab
415
357
378
5В(А)
—3
99
85
SB(A)/SA(B)
—40
7
0
SA(B)
—817
—813
—841
SA(B)/5B(A)
-790
—721
—756
Приводятся данные работы [9] для равновесных поверхностных давлений на ртути.
Значительные успехи достигнуты -в теории межфазного натяжения.
Теория дает приближенное уравнение, аналогичное уравнению (П-48),
однако вместо радиальной функции распределения, обычно неизвестной
2ля систем, приведенных в табл. II1-2, здесь используется средняя
глотность. Как показано на рис. III-3, работу или свободную энергию
:астяжения поверхности раздела двух жидкостей А и В можно
рассматривать как сумму работ переноса молекул А и В на
соответствующие поверхности раздела фаз жидкость — пар, т. е. ya+Yb, за вычетом
92
Глава III
7
1
Ж5
0 q"
Q-Q-OOQj
5сй
1
Г/
5000
'
Жидкость 1
Жидкость Z
Гг
Рис. II1-3. Модель Гуда—Фоукса для
расчета межфазного натяжения [11].
взаимодействия молекул на межфазной границе. Из уравнения (Н-51)
следует:
Тлв=Та + 7в—^ав- (П-51)
Для теоретического расчета yab необходимо знать работу разделения
двух фаз доав. Эту работу можно найти, если известна энергия
взаимодействия молекул А и В. В приближении среднегеометрического
потенциала взаимодействия
[см. уравнение (П-48)] Джирифалко и Гуд [8] получили
Vab=Ya + Yb- 2Ф (YaYb)1/2, (Ш-7)
где Ф — некоторая функция молярных объемов обеих жидкостей; ее
эмпирические значения лежат в интервале от 0,5 до 1,15. Уравнение
(Ш-7) можно вывести также, используя подход Скапского, т. е.
учитывая только взаимодействия молекулы с ее ближайшими соседями
[см. уравнение (П-17)] [10].
Как известно, межмолекулярные силы могут иметь различную
природу (дисперсионные, диполь-дипольные взаимодействия, образование
водородных связей и т. д., см. разд. VI-1). Важно, однако, что силы,
которые вносят основной вклад во взаимодействие типа А—А или
В—В, могут не быть в такой же мере ответственны за взаимодействия
типа А—В. Рассмотрим, например, систему вода — углеводород. В воде
энергия межмолекулярного взаимодействия ew(r) в основном
определяется водородными связями, вклад которых во взаимодействие вода —
углеводород 8wh(0 отсутствует. С учетом этого запишем уравнение
(Ш-7) в более общем виде:
Yab=Ya + Yb - 2Ф (YaYb )г/*> (Ш-8)
где 7а и yb — поверхностные натяжения, которые имели бы
жидкости А и В, если бы их потенциальная энергия определялась только
теми силами межмолекулярного взаимодействия, которые вносят
основной вклад во взаимодействие между А и В [11 —14]. Фоукс [11]
предполагает, что для углеводородов ги(г) и, следовательно, г^н(г)
определяются только дисперсионным взаимодействием. Таким образом, для
системы вода — углеводород уравнение (Ш-8) переходит в уравнение
Ywh=Yw + Yh-2(YwYh)V2, (Ш-9)
в котором Ф аппроксимируется единицей, a Yw—вклад дисперсионных
сил в поверхностное натяжение воды. Как видно из табл. Ш-3,
уравнение (Ш-9) очень хорошо описывает ряд систем, если принять, что
7^ =21,8 эрг/см2 при 20 °С [15]. Полученная таким способом величина
Пленки на жидких поверхностях
93
Таблица III-3
Расчет Yw ПРИ 20°с П5]
Углеводород
--Гексан
--Гептан
н- Октан
«-Декан
н-Тетрадекан
Циклогексан
Декалин
Светлое масло
VH, эрг/см2
18,4
20,4
21,8
23,9
25,6
25,5
29,9
28,9
VWH' эрг/см2
51,1
50,2
50,8
51,2
52,2
50,2
51,4
51,3
yd
21,8 )
22,6
22,0
21,6
20,8
22,7
22,0
21,3 J
г, эрг/см2
• 21,8±0,7
7^» по существу, является эмпирической. Гуд [13] оценивает ее
истинное значение приблизительно на 2 эрг/см2 ниже.
В теории Гуда — Фоукса рассчитывается работа разделения межфазной границы
с образованием поверхностей двух чистых жидкостей, и естественно, что в уравнениях
(III-7) и (III-8) фигурируют Ya и Yb, а не Ya(B) и Yb(a>. Если жидкости А и В
представляют собой растворы, то при рассмотрении процесса разделения можно принять, что
образуются гипотетические поверхности А и В такого же состава, что и
соответствующие объемные фазы. Согласно Гуду [13], в этом случае
Тав=£а+£в-2(£аЫ1/2- (Ш-Ю)
Для двухкомпонентных растворов величины g аппроксимируются выражениями
(Ш-11)
£b=Ni,bYi + W2,bY2>
где Yi и Y2 — поверхностные натяжения чистых жидкостей, a Ni — мольная доля
компонента i в растворе.
Дальнейшее обсуждение теорий межфазного натяжения дано в разд. VII-5B. Здесь,
однако, можно сделать некоторые замечания относительно этих теорий. В работах
[16, 17] поднят вопрос о правильности использования при расчете о>ав уравнения
(Н-51), предполагающего постоянство структуры и состава двух жидких фаз вплоть
до межфазной поверхности и их неизменности на всех стадиях процесса разделения.
Если бы в обратимом процессе разделения удалось определить плотность
поверхности и изменения ее состава при разделении, то в аналог уравнения (III-7) вместо Ya
и ув пришлось бы подставить Ya(b> и Yb(a>. Проблема становится особенно ясной, если
уравнение (Ш-10) применить к поверхности раздела раствор — пар, т. е. если В —
паровая фаза. Поскольку gB при этом равно нулю, уравнение (III-10) принимает вид
Y^b=(ya)=^a, что явно неверно. Тот факт, что уравнение Джирифалко — Гуда
(Ш-7) и другие уравнения подобного типа удивительно хорошо описывают
экспериментальные данные, может быть обусловлен своего рода взаимной компенсацией
погрешностей при выводе.
В работе [10] поставлен вопрос об основном допущении, заложенном в
уравнении (II1-9): действительно ли взаимодействие вода — углеводород обусловлено
только дисперсионными силами? Имеются довольно веские доказательства того, что
взаимодействие первого слоя молекул углеводорода с водой в значительной мере
определяется сильным полярным взаимодействием [19—21]. Высокое межфазное натяжение
з системе вода — углеводород и соответственно низкую работу адгезии [рассчитанную
по уравнению (П-51)] можно объяснить, несколько модифицировав концепцию Yw
В обратимом процессе разделения двух фаз на поверхности воды остается пленка
углеводорода, толщина которой близка к монослою. Поэтому силы, против которых
совершается большая часть работы разделения, определяются взаимодействием пленка—
углеводород, а не вода — углеводород. Эффективное значение yw» т. е. Yw-
соответствует поверхностному натяжению на границе пленка — воздух. Последнее
приблизительно равно межфазному натяжению в системе углеводород — воздух, и, таким
образом, можно ожидать, что Yw (==<<Yw>>) приблизительно равно 20 эрг/см2.
Уравнению (Ш-7) предшествовало эмпирическое соотношение
TAB = I VA(B) — YB(A) I , (IfI~12)
известное как правило Антонова [22]. Это правило приблизительно соблюдается для
большого числа систем, но сейчас известно и много исключений. Гаркинс [23] ука-
94 Глава III
зывает, что если бы правило Антонова было строгим, то Sb(A)/a(b>, где В — жидкость
с меньшим поверхностным натяжением, было бы равно нулю. Это, однако,
противоречит экспериментальным данным (см. табл. 1П-2в). Правило Антонова объясняется
очень просто. Пусть на поверхности жидкости А имеется адсорбированная пленка или
гиббсовский монослой вещества В (в жидком состоянии имеющего более низкое
поверхностное натяжение, чем А). Если считать, что пленка имеет свойства жидкости В,
то Ya(b> представляет собой эффективное межфазное натяжение дуплексной пленки,
равное Yab+Yb(A). Обратите внимание, что почти такая же картина рассматривалась
при обсуждении Yw
Ранее отмечалось, что равновесные коэффициенты растекания обычно имеют
отрицательное значение. Поэтому при нанесении на жидкость А избыточного количества
вещества В в равновесных условиях гиббсовский монослой сосуществует с объемной
фазой (или линзой, если В — жидкость), в которой остается избыток В. Однако, если
А — твердое тело (см. гл. VII), на поверхности нередко образуются стабильные
толстые или дуплексные пленки; другими словами, краевой угол между жидкостью и
твердым телом равен нулю. Еще одно исключение — стабильное растекание с
образованием дуплексных пленок в присутствии на поверхности раздела масло — вода
третьего сильно адсорбирующегося компонента. Так, олеат натрия даже в очень низкой
концентрации уменьшает межфазное натяжение между парафиновым маслом и водой с
41 до 7,2 дн/см. Лэнгмюр показал [25], что на поверхности раздела раствора
поверхностно-активного вещества, образующего гиббсовский монослой типа двумерного
газа, масляные пленки растекаются с образованием дуплексных пленок (см. разд. 1Н-6Б).
Б. Кинетика процессов растекания
Изучение процесса растекания представляет самостоятельный
интерес. Уже давно было замечено [26]1, что волна, связанная с
растеканием, ограничена областью, непосредственно примыкающей к периметру
расширения растекающегося вещества. Так, если поверхность воды
посыпать тальком или каким-либо другим инертным порошкам и затем
добавить каплю масла, то тальк выталкивается растекающимся маслом
и собирается в виде гребня на периферии пленки, но в дальнейшем
остается совершенно спокойным. Таким образом, при растекании
«движущая сила» локализована на периферии поверхности раздела между
Маслом и водой. Эту силу, вероятно, лучше всего рассматривать как
стационарное смещение молекулярных колебаний по поверхности
раздела, которое приводит к довольно быстрому результирующему
движению. Кэри и Ридил [27] нашли, что скорость растекания олеиновой
кислоты на воде составляет около 20 см/с. Дэвис и Ридил [30]
цитируют работу, в которой показано, что скорость растекания
пропорциональна S (вероятно, SB/a) и обратно пропорциональна вязкости
жидкой фазы. Ахмад и Хансен [28]! измерили скорость растекания
олеиновой кислоты на тонких слоях глицерина и установили следующую
зависимость:
*2 = (2fct/T))f, (III-13)
где х — смещение фронта пленки (в опытах по одномерному
расширению) за время t\ п — поверхностное давление; h — толщина подложки
и т] — вязкость подложки. В уравнение (III-13) входит толщина
подложки /г, поскольку движущая сила —dnjdx уравновешивается трением
пленки о подложку. Для подложек толщиной больше ~0,2 см эта
зависимость не выполняется. Авторы работы {29] нашли, что скорость
растекания различных спиртов на водных подложках («бесконечной»
глубины) фактически пропорциональна —dnjdx и слабее чем обратно
пропорционально зависит от вязкости подложки.
При температуре не выше критической чистые кристаллические твердые
материалы растекаются очень медленно [30]. Этот процесс в определенной степени
коррелирует с тем, в каком состоянии — твердом, жидком или газообразном — находится
образующийся монослой вещества (см. разд. III-4). Скорость растекания от кристалла
определяется контуром пересечения кристалла с поверхностью жидкости и, возможно,
кристаллографической гранью и может зависеть от направления. При этом силы,
действующие по контуру пересечения кристалла, могут быть несбалансированными, что
приводит к довольно быстрому вращению частицы, например камфоры, помещенной
на поверхность чистой воды.
Пленки на жидких поверхностях
95
Вопрос о скоростях растекания имеет важное значение при использовании моно-
.лоев для контроля испарения (см. разд. III-9). В то же время при работе точных
подшипников, например в часовых механизмах, необходимо, чтобы маленькая капля
:мазки оставалась на месте, а не растекалась по всем поверхностям. Зисман и др.
"31] показали, что скорость растекания можно увеличить или уменьшить введением
небольших количеств примесей; в частности, сильноадсорбируемые
поверхностно-активные вещества могут формировать пленки, по которым масло не растекается.
Отмеченная выше зависимость скорости растекания от вязкости подложки
показывает, что пленки действительно сильно взаимодействуют с объемом жидкой фазы и
их нельзя рассматривать просто как группу молекул, свободно движущихся в
двумерном пространстве. Это обстоятельство осложняет интерпретацию вязкости монослоев
разд. III-3B). Кроме того, существует так называемый эффект Марангони,
заключающийся в переносе вещества из объема жидкой фазы, стимулированном градиентом
поверхностного натяжения. Известный (кстати сказать, почерпнутый из библии)
призер — образование винных «слез» в стеклянном бокале. Если по стенке бокала
стекает капля воды, вино в этом месте начинает наползать на стенку. Испарение спирта из
задменисковои пленки приводит к увеличению поверхностного натяжения, что в свою
?чередь вызывает появление поверхностного потока и сопровождающего его объем-
лого потока по стенке бокала. В результате на стенке образуется винная капелька,
которая стекает обратно в бокал. Когда летучий компонент увеличивает
поверхностное натяжение раствора, наблюдается обратный эффект, т. е. отступание трехфазной
границы раствора. Эти эффекты (а их известно очень много) рассматриваются в
обзоре Штернлинга и Скривена [32].
В. Линзы
Равновесную форму линз, плавающих на поверхности жидкости, рассматривали
Лэнгмюр '[25], Миллер [33], Донагью и Бартел [34]. На рис. II1-4 показан профиль
масляной линзы, плавающей на воде. Три поверхностных натяжения, имеющихся в
zaHHoft системе, можно представить силами, уравновешивающими друг друга. Баланс
:ил выражается треугольником Ньюмана:
7А(в) cos у=Yb(a) cos p + yAb cos a. (Ill-13a)
Донагью и Бартел проверили это уравнение для нескольких систем спирт — вода.
Для очень больших линз достигается предельная толщина too. Лэнгмюр [25] вы-
нел уравнение
&=—2SpA/£pBAp, (Ill-136)
ззязывающее эту толщину с коэффициентом растекания и плотностями жидкостей рл
z рв. Фактически же из-за сжимающего действия линейного натяжения f на перифе-
?пи линзы (точка / на рис. II1-4) наблюдаемая толщина t может быть значительно
5элыне too. Для парафинового масла / равно около 6 дн.
Принсен и Мейсон [35] расширили и обобщили анализ возможных форм конту-
гов линз. Авторы рассмотрели линзы, образующиеся на поверхности раздела между
Ьзумя несмешивающимися жидкостями.
3. Экспериментальные методы исследования
мономолекулярных пленок
Когда И'меют дело с пленками нерастворимых веществ, обычно
концентрацию вещества в растворе экспериментально измерить не удается,
зато Г в данном случае — просто количество материала, нанесенного на
гдиницу поверхности. Кроме того, вместо поверхностного натяжения
часто с помощью пленочных весов измеряют непосредственно
поверхностное давление я. Могут определяться и другие величины: контактные
гтэтенциалы, 'поверхностные вязкости и т. д. Ниже описаны способы
определения ряда этих величин.
Л. Методы определения я
Поверхностное давление я, согласно определению, представляет со-
Г эй разность поверхностных натяжений чистого растворителя и
растворителя с нанесенной пленкой. Поэтому в принципе найти я можно
: помощью любого метода измерения поверхностного натяжения.
Однако большинство этих методов являются капиллярными, и по тем или
96
Глава III
Рис. 111-4. Профиль линзы на воде.
иным причинам они мало пригодны для изучения поверхностей,
покрытых пленками. Принципиальное исключение составляет только метод
пластинки Вильгельми (разд. 1-8), который очень хорошо подходит для
пленок на поверхности жидкостей [36] и позволяет измерять низкие
поверхностные натяжения с точностью до 0,01 дн/см.
При использовании метода пластинки Вильгельми, по-видимому, лучше всего
применять методику с частично погруженной пластинкой и определять либо изменение
высоты пластинки над уровнем поверхности при постоянном ее весе, либо изменение
веса при постоянном положении пластинки. В последнем случае
я=Аш/7, (III-14)
где Аау — изменение веса пластинки, измеренного, например, с помощью весов (см.
рис. 1-17), и р — периметр пластинки. Пластинки изготовляют из тонкого стекла,
платины и слюды.
Этот метод имеет два недостатка. Во-первых, таким способом непосредственно
измеряют у или изменения у, а не я. В результате любой температурный дрейф или
случайные примеси приводят к изменениям у, что может быть ошибочно приписано
изменению поверхностного давления. Во-вторых, в то время как для чистых
жидкостей обеспечить нулевой краевой угол обычно не так уж трудно, при изучении
поверхностей, покрытых пленками, это не всегда удается, поскольку
поверхностно-активное вещество, образующее пленку, может адсорбироваться на пластинке. Уменьшению
краевого угла может способствовать шероховатость пластинки. Литературу по
методическим вопросам использования метода пластинки Вильгельми можно найти в
обзоре Гэйнса [37]. Однако установка для измерений с помощью пластинки
Вильгельми относительно проста и дешева и может давать столь же точные результаты, как и
описываемые ниже пленочные весы.
Поверхностное давление я очень часто измеряют непосредственно с
помощью пленочных весов. Как схематически показано на рис. III-1,
в осно-ве метода лежит прямое измерение горизонтальной силы, которая
действует на поплавок, отделяющий пленку от поверхности чистого
растворителя. Сам Лэнгмюр использовал примитивные весы; с тех пор
пленочные весы были значительно усовершенствованы и во многих
лабораториях превратились в прецизионный прибор, позволяющий
измерять поверхностные давления с точностью до сотых долей дины на
сантиметр. Различные -методы измерения поверхностного давления
подробно рассмотрены в работах Гэйнса [1, 37].
Современные пленочные весы (общий вид) показаны на рис. III-5. Ванна
представляет собой мелкий прямоугольный лоток длиной 50—100 см и шиоиной ~25 см,
изготовленный из латуни, нержавеющей стали, стекла или тефлона. Для очистки
поверхности жидкости и работы с пленкой необходимо, чтобы уровень воды находился
выше края ванны (как показано на рис. III-5, б). Поэтому, если лоток изготовлен из
металла или стекла, его следует покрыть парафином, лаком и т. п., чтобы
обеспечить большой краевой угол. Конечно, перед работой необходимо тщательно очищать
установку от поверхностно-активных загрязнений [38].
Стойка весов сдвинута приблизительно на одну треть длины ванны от одного из ее
концов. На стойке закреплены торсионная проволока, зеркальце и система подвески
поплавка. Сам поплавок изготавливается либо из тонкой парафинированной или
покрытой пластиком полоски слюды, меди или платины, либо из тефлоновой полоски
и свободно плавает на поверхности. Щели по концам полоски герметизируются
барьерами из тонкой золотой или пластиковой фольги, которые не мешают движению
поплавка, но предотвращают утечку пленки. Поплавок связан с торсионной проволокой
жесткой проволокой, через которую к поплавку прикладывается уравновешивающая
Пленки на жидких поверхностях
97
в
Рис. III-5. Современные пленочные весы.
/ — контроль закручивания торсионной проволоки; 2 —привод подвижного барьера; 3 — держатель
барьера; 4 — ванна; 5 — барьер; 6 — поплавок; 7 — зеркальце; 8 — коромысло для калибровки;
9 — стойка; 10 — торсионная проволока; // —барьеры из золотой фольги; 12 — проволочный
держатель зеркальца; 13 — контроль уровня подвижного барьера; 14 — направляющая; 15 — винтовая
передача.
сила. Положение поплавка контролируется с помощью проволочного держателя с
зеркальцем, прикрепленного ко второй торсионной проволоке. Любое перемещение
вызывает поворот поплавка зеркальца и может быть точно измерено по смещению пятна
отраженного света.
Второй важной частью пленочных весов является скользящий барьер, который
опирается на пару держателей, расположенных по обеим сторонам ванны. Держатели
могут перемещаться по направляющим по всей длине ванны с помощью длинного
винтового привода. Держатель удерживается в вертикальном положении квадратной
рейкой 13, действующей как дополнительная направляющая (рис. Ш-5, в).
При точной работе поверхностные весы помещают в воздушный термостат и все
контрольные операции осуществляют снаружи. Обычно измерения проводят по
следующей методике. Ванну заполняют жидкостью, служащей подложкой, и всю систему
приводят в термодинамическое равновесие. По обеим концам ванны укладывают ряд
длинных стержней, служащих подвижными барьерами (обычно используют латунные
или стеклянные стержни квадратного сечения, покрытые парафином или другим гидро-
фобизатором). Затем с помощью этих барьеров очищают поверхность жидкости перед
и за поплавком. Для этого барьер подводят к стойке весов, опускают его таким
образом, чтобы он касался краев ванны. Барьер толкает перед собой пыль и другие
загрязнения, которые могут находиться на поверхности. Эту процедуру повторяют
многократно, используя каждый раз новый барьер. После очистки поверхности
проверяют нулевую точку поплавка, после чего наносят вещество, образующее пленку.
Обычно само вещество, образующее на поверхности пленку, не взвешивают,
поскольку оно весит всего несколько десятых микрограмма, хотя иногда это делают.
Чаще исследуемое вещество растворяют в каком-нибудь летучем растворителе,
например в бензоле или петролейном эфире, и на поверхность жидкости перед поплавком
наносят из пипетки определенное количество этого раствора. После того как раство-
7-1421
98
Глава HI
гд гг м
ot A\ /молекула
Б
а
в г
Рис. Ш-6.
А — изотермы монослоев стеариновой кислоты при 25 °С [40]: / — непрерывное сжатие со ско-
о о
ростью 2,43 А2/мин; 2 — непрерывное сжатие со скоростью 0,213 А2/мин; 3 — медленное ступенчатое
сжатие вручную. Б — возможная конфигурация монослоев стеариновой кислоты (кружочки
изображают полярные карбоксильные группы, а прямые линии — углеводородные хвосты): а — нормаль-
о о
ная пленка, о*=21 А2/молекула; б — метастабильная пленка, а<21 А2/молекула, в и г —
возможные способы инверсии (приводящие к коллапсу монослоя) [40].
ритель улетучится, на поверхности между поплавком и барьером, оттянутым к концу
ванны, остается пленка исследуемого вещества. Барьер постепенно передвигают
вперед, определяя в каждой точке поверхности давление по углу, на который необходимо
закрутить торсионную проволоку, чтобы поплавок оставался в нулевом положении.
Полученные данные обычно представляют в виде зависимости я от а.
В ряде работ сделаны попытки автоматизации приборов для измерения
поверхностного натяжения с помощью пластинки Вильгельми и определения поверхностного
давления. На автоматических весах можно осуществить равномерное сжатие пленки
при постоянной скорости движения барьера или измерять изменение площади пленки
во времени при постоянном поверхностном давлении, что необходимо в кинетических
исследованиях. Автоматические весы для исследования поверхностных явлений на
жидких поверхностях описаны в монографиях Гэйнса [1, 37]. В таких весах вместо
традиционной торсионной проволоки можно использовать специальные датчики и
оптические следящие устройства; согласно [39], чувствительность этих элементов
достигает Ю-4 дн/см.
При работе с монослойными пленками необходимо остерегаться следующих
ошибок. Не следует брать слишком много поверхностно-активного вещества, так как
монослой может не сформироваться полностью и на поверхности будут плавать пятна
нерастекшегося материала; это же относится к веществам с низкой скоростью
растекания. ^Необходимо тщательно следить за тем, чтобы пленка не просачивалась за
подвижный барьер и поплавок, особенно при высоких поверхностных давлениях. В
обычной методике зависимость я от а получают путем сжатия монослоя, и, таким
образом, кривые, приведенные, например, на рис. Ш-6, отвечают движению справа налево
Если пленку сжимать медленно, то уже приблизительно при 15 дн/см она коллапси-
рует, т. е. вещество пленки начинает переходить в трехмерное состояние. При высоких
скоростях сжатия я—а-изотерма может уйти в далекую метастабильную область до
50 дн/см. Возможный механизм коллапса показан на рис. 111-6,6. Кинетическая
задержка при коллапсе обусловлена энергетическим барьером процесса перехода в
инвертированное состояние; этим и объясняется существование мета стабильной пленки.
Пленки на жидких поверхностях
99
Если поверхностно-активное вещество предварительно растворяют в летучем
растворителе, этот раствор следует наносить на поверхность медленно, чтобы он не
успевал достигать стенок ванны прежде, чем испарится весь растворитель. На
вопросы, всегда ли полностью испаряется растворитель и влияет ли выбор растворителя на
кривые л—о*, однозначно ответить трудно [1, 41, 42, 42а].
Б. Поверхностные потенциалы
Обычно одновременно с определением зависимости я от а измеряют
контактный, или поверхностный, потенциал. При этом, по существу,
находят вольта-потенциал между поверхностью жидкости и поверхностью
металлического зонда.
Разработаны два метода определения поверхностного потенциала.
В персом (рис. III-7) используется металлический зонд, покрытый
а-излучателем, например Ро или ^Ат (около 1 мКи). В результате
иониза<ции под действием излучения воздух в зазоре между зондом
и поверхностью жидкости становится достаточно проводящим, что
позволяет непосредственно определить разность потенциалов между
зондом и поверхностью. Измерения проводят с помощью чувствительного
1альванометра, служащего нуль-индикатором в цепи стандартного
потенциометра. В качестве .второго электрода Е можно использовать
хлор-серебряный электрод. Обычно желательно сравнивать потенциал
поверхности, покрытой пленкой, с потенциалом чистой поверхности.
Описаны методики последовательного или одновременного определения
этих потенциалов [43, 44].
Другой метод, не требующий применения сверхвысокоомного
вольтметра и пригодный также для измерений потенциала на поверхности
раздела жидкость — жидкость, известен как метод вибрирующего
электрода [1, 45]. Блок-схема установки с вибрирующим
электродом показана на рис. Ш-8. На вибратор с сегнетовой солью или
магнит громкоговорителя подается ток звуковой частоты. Генерируемые
колебания механически передаются на небольшой диск, установленный
параллельно поверхности приблизительно на 0,5 мм над ней.
Колебания диска приводят к соответствующим колебаниям емкости
воздушного зазора, в результате чего во второй цепи возникает переменный ток,
амплитуда которого зависит от разности потенциалов з зазоре. Этот
сигнал усиливается и подается в наушники. С помощью потенциометра
сигнал компенсируют, до тех пор пока звуковой сигнал в наушниках
не исчезнет. Данный метод позволяет измерять поверхностные
потенциалы с точностью до ~0,1 мВ. По точности он несколько лучше
метода полониевого электрода, хотя и более чувствителен к различного
рода помехам.
Обычно поверхностный потенциал не пытаются интерпретировать
как потенциал одной поверхности. Как правило, вместо этого
рассматривают разность поверхностных потенциалов чистой подложки и
подложки, покрытой пленкой. Эту разность А У приписывают пленке и
качественно рассматривают ее как аналог конденсатора. Разность
потенциалов AV между двумя проводящими пластинами, удаленными друг
от друга па расстояние d и несущими заряд плотностью сг, в
соответствии с формулой, приписываемой Гельмгольцу, равна
АУ=4пос1/0, (ПИ 5)
РО
-©■
*
Рис. III-7. Измерение поверхностных потенции- сС " ^Ры \—ь-
лов с помощью полониевого электрода (£ — \sJ;s;sssj;sssssssr777\ MM
электрод сравнения, G — гальванометр).
100
Глава III
Генератор
звуковой
частоты
Сегнетова
соль
\ Усилитель
i
bss;/w;;s/""/.
Й Ч-iHl
К
Рис. II1-8. Измерение поверхностных потенциалов с помощью вибрирующего электрода.
где D — диэлектрическая проницаемость. Фактически в данном случае
предполагается, что разделение заряда, обусловленное наличием
эффективного дипольного момента (л,, моделируется параллельными
пластинами конденсатора (рис. III-9). Если на квадратном сантиметре
содержится п таких диполей (возможно, соответствующие Г молекулам
полярного вещества на 1 см2 пленки), то ad=ned = nii и уравнение
(III-15) переходит в _
Al/=4n|xn/D = 4nnpicose. (Ill-16)
Обычно принимают, что D равна единице и |i=|!Cos8, где Э—угол
наклона диполей к нормали. Гаркинс и Фишер [46} обращают вынимание
на эмпирический характер приведенной интерпретации. Эти авторы
предпочитают учитывать только то, что АУ пропорциональна
поверхностной концентрации Г, и считают, что коэффициент
пропорциональности представляет собой некоторую количественную характеристику
пленки. Такой подход вполне разумен, 'поскольку, как сейчас известно,
поверхность воды структурирована и вещество, образующее пленку,
меняет структуру поверхности [21]. Такие структурные изменения
поверхности подложки должны сопровождаться изменением его вклада
э поверхностный потенциал, и поэтому величины AV нельзя полностью
и безоговорочно относить к молекулам пленки.
Сравнение (II1-16) является слишком упрощенным, даже если не принимать во
внимание то, что в нем вовсе не учитываются структурные изменения в подложке.
Реальные молекулы представляют собой дискретные частицы, которые поляризуются
•под, действием поверхностных зарядов и поверхности подложки. Мак-Дональд и Бар-
jioy [47] приводят более полное уравнение:
bV = 4nn[a(4nq + F)+'$,]/D, (III-17)
где q — плотность заряда адсорбата, а — поляризуемость адсорбата и F —
напряженность электрического поля поверхности подложки.
Тем не менее уравнение (III-16) позволяет довольно просто
интерпретировать влияние поверхностного давления и состава подложки на
величины AV и поэтому широко используется. Хотя интерпретация
абсолютных значений AV представляется до некоторой степени спорной,
такие измерения чрезвычайно полезны в качестве независимого способа
определения концентрации молекул в пленке (например, при контроле
скорости химической реакции или растворения) и прочерки
однородности пленки. Если при измерении потенциала в различных районах
пленки наблюдаются флуктуации А1/, то можно предполагать существова-
яие в пленке двух различных фаз.
з
Рис. Ш-9.
Пленки на жидких поверхностях
101
Интерпретацию значений AV осложняет следующее обстоятельство: растворитель
может адсорбироваться на металлическом электроде, а это приводит к изменению его
собственного вольта-потенциала. Поэтому все измерения AV необходимо проводить
в одинаковых условиях. Однако сделать это не так просто, особенно если само
образующее пленку вещество легко летуче [48]. Бьюиг и Зисман [49] нашли, что
углеводороды, например гексан, оставляют на металлических поверхностях прочную
пленку, которая значительно меняет поверхностные потенциалы металлов. Обычно
электрод рекомендуется предварительно достаточно долго выдерживать в условиях,
соответствующих условиям проведения эксперимента.
Камински [50] использовал вибрирующий электрод для определения атмосферных
загрязнений.
В. Поверхностная вязкость
Уже само (название этого раздела показывает, что изложенный в
нем материал охватывает далеко не всю реологию поверхностей.
Отчасти это обусловлено тем, что полный спектр реологических свойств,
включая изменение вязкоэластичных свойств во времени и их
зависимость от скорости сдвига, еще «е достаточно разработан. Вообще
реология поверхностей связана со специфическими опытами, полная
интерпретация которых довольно туманна. К такого рода вопросам
относится и проблема затухания капиллярных воли, которая, однако,
обсуждается в конце этой главы (разд. III-15).
Рассматривают два типа вязкости — продольную и сдвиговую. Для
трехмерных систем первому типу соответствует объемная вязкость,
связанная со скоростью перехода жидкости или твердого тела в состояние
текучести при наложении изотропного давления. Продольная вязкость
пленок х определяется аналогичным образом:
Ay=xj^d\/dt9 (III-18)
т. е. 1/и — относительное изменение площади в единицу времени на
единицу приложенного поверхностного давления.
Один из методов измерения х описан в работе ван ден Темпеля и др. [51].
Исследуемая поверхность расширяется с помощью двух барьеров, раздвигаемых с такой
скоростью, чтобы относительная скорость расширения dlnA/dt была постоянной.
Растяжение пленки приводит к увеличению поверхностного натяжения, измеряемого с
помощью пластинки Вильгельми, расположенной посредине между двумя барьерами, где
жидкость остается неподвижной. Этот метод был использован для исследования
реологических свойств растворов поверхностно-активных веществ, но он, по-видимому,
пригоден и для нерастворимых монослоев.
Равновесная величина, соответствующая х, называется модулем
поверхностной упругости Е и определяется выражением
E=dy/d\nA. (III-I9)
Сжимаемость пленки К равна \jE. Объемная вязкость — довольно
неопределенно толкуемое свойство жидкости или твердого тела — имеет
небольшое практическое значение, в то время как К и £, вероятно,
наиболее важные реологические параметры поверхностей раздела и
пленок, поскольку поверхности часто подвергаются продольным или
сдвиговым 'напряжениям. Они и рассматриваются в дальнейшем в связи
с капиллярными -волнами (разд. Ш-15) и пенами (разд. III-9).
I- ' ■!
^t/+4z/
Рис. Ш-10.
102
Глава III
Хотя в химии -поверхностей сдвиговая вязкость пленок r\s имеет
меньшее практическое значение, чем продольная вязкость,
исследованию г]6' посвящено значительно больше работ. Возможно, объясняется
это важностью сдвиговой вязкости в случае жидкостей. Ньютоновское
определение двумерной сдвиговой вязкости аналогично ее определению
для трехмерного случая. Если два линейных элемента поверхности (так
же как две элементарные площадки в трехмерной системе) движутся
относительно друг друга при градиенте скорости dv/dx, как показано на
рис. 111-10, то сила, действующая на линейные элементы, равна
f=ifldv/dx9 (III-20)
где / — длина элемента.
Как и в методе Пуазейля, применяемом для жидкостей, r)s можно
измерить, определив скорость течения пленки через узкий канал при
двумерном давлении Ау. Схема прибора для измерения двумерной
сдвиговой вязкости приведена на рис. Ш-11,а. Барьеры движутся с
такой скоростью, чтобы разность давлений в «пленке была постоянной.
Уравнение для вязкого потока в узком канале можно вывести
следующим образом. Сила вязкости, действующая на линии, расположенные
на расстоянии х от оси канала длиной / (рис. 111-11,6), равна
f^=2ifldv/dx. (III-21)
Эта сила уравновешивается силой, возникающей в результате действия
градиента двумерного давления на длине 2х:
f = 2xAy. (III-22)
Приравняем сумму сил нулю и найдем dv:
dv=— ( Ay//t]5) xdx. (111-23)
Интегрирование этого уравнения при условии, что v = 0 при x=d дает
1>=(Ду/2т)*/) (d2—х2), (Ш-24)
где d( = a/2)—полуширина канала. Поток пленки через канал dA/dt
равен
d
2 I vdx.
о
После подстановки v из уравнения (Ш-24) и интегрирования получаем
dA/dt=-|- (Дvd*jy\4) (III-25)
или
т|J=А уад/12/ (dA/dt). (Ш-26)
Впервые уравнение (III-26) было дано в работе Майерса и Гар-
кинса [52]. Позднее Гаркинс и Кирквуд [53] уточнили его, добавив
плен, учитывающий сопротивление лежащего под пленкой раствора,
имеющего вязкость ц:
* = шХад -"П/я- (Ш-27)
Применение этого метода описано в работах [54—56]. Вязкость пленок
обычно составляет Ю-2—Ю-4 г/с или поверхностных пуаз. Приведем
такой пример: при перепаде поверхностного давления 10 дн/см пленка
вязкостью 0,01 поверхностных пуаз течет через щель шириной 0,1 см
и длиной 5 см со скоростью 2 см2/с В этом случае поправочный член
в ура-внении (Ш-27) пренебрежимо мал.
Пленки на жидких поверхностях
103
Подвижные
карьеры
Рис. Ш-11. Поверхностный вискозиметр канального типа [235].
а) вид сверху в увеличенном масштабе [235]; б) вид канала в увеличенном масштабе- / — пленка
поверхностно-активного вещества под давлением Рх; 2 — пленка поверхностно-активного вещества
под давлением Р2
Канальный вискозиметр дает абсолютные значения вязкости и позволяет
учитывать влияние подложки на течение пленки. Однако на нем нельзя проводить
измерения ни при постоянном поверхностном давлении (поскольку необходим градиент
давления), jhh при постоянной скорости сдвига. В этом отношении более выгоден второй
основной метод определения вязкости пленок, принцип которого был предложен
Плато [57]. В данном методе определяется затухание колебаний крутильного маятника,
дискового или кольцевого. Схема поверхностного вискозиметра с крутильным
маятником приведена на рис. II1-12. Гэйнс [1] дает следующее уравнение:
= (т//4:
bi«)V. (-V
Х0
4я2+Я2 -" 4Л2+Я2,
rl-
(Ш-28)
где а —радиус диска или кольца; Ь — радиус поверхности, покрытой (круглой)
пленкой: X и Я0 — натуральные логарифмы отношения последовательных амплитуд в при-
104 Глава III
Нить подвеса
J Рис. Ш-12. Поверхностный вискозиметр с
крутильным маятником [1].
сутствии и в отсутствие пленки соответственно; / — момент инерции маятника.
Торсионная постоянная т определяется выражением
где Ра — период колебаний маятника на воздухе. Из данных по затуханию колебаний
крутильного маятника можно найти также модуль поверхностного сдвига G8,
определяемый как отношение напряжения сдвига к деформации сдвига:
о-_wh(± _■£.)[*£» _«*+•!]. (ш.зо)
где Р и Р0 — периоды колебаний маятника в присутствии и в отсутствие пленки
соответственно.
Шехтер и др. [58] затратили много усилий на разработку вискозиметра, в
котором используется сила тяги, возникающая при вращении подложки. В этом
вискозиметре пленка помещается в крутильный кольцевой канал, образованный
концентрическими цилиндрами, и приводится в движение путем вращения концентрической ванны
с жидкостью. Проблема влияния сопротивления подложки во вращающихся приборах
теоретически чрезвычайно сложна. Гудрич '[59] показал, однако, что в случае
вращающегося кольца, образованного цилиндрами с острыми кромками,
контактирующими с поверхностью жидкости, теоретический анализ становится вполне реальным.
Детальный анализ методов, в которых используется крутильный маятник, дан в
работе Шоугла '[60]. Автор попытался решить теоретически трудную проблему учета
влияния подложки и, придя к выводу, что разделять вязкости пленки и подложки не
имеет смысла, ввел понятие «относительная вязкость» (т1*)геь определяемая
выражением
(ПЧге1=Г^/< (Ш-31)
где iff— поверхностная вязкость, измеренная в присутствии пленки, а
т^—поверхностная вязкость, измеренная на чистой поверхности. С относительной вязкостью
связаны характеристическая вязкость поверхности
(V)sp = №)rel-1 (III-32)
и приведенная вязкость поверхности
W)red = W)sp/r, (Ш-33)
где Г — поверхностная концентрация. Реология поверхности рассматривается в
монографии Гэйнса [1].
Вязкость пленок интересно сравнить с вязкостью обычных
жидкостей. При выводе уравнения вязкости для трехмерной жидкости
линию / на рис. III-10 следует заменить (плоскостью, перпендикулярной
плоскости /страницы, и вместо / в уравнении (III-20) подставить
площадь этой .плоскости. Если в действительности вязкость пленки
относится к толщине т, то площадь рассматриваемой плоскости можно
записать как h. Тогда соотношение между вязкостью пленки,
рассматриваемой как слой обычной трехмерной жидкости, r\f и двумерной
вязкостью r\s имеет вид
ri^=ri/T. (III-34)
Типичная толщина пленки составляет 20 А, и, следовательно, обычное
значение r)s, равное ~10-3 поверхностных пуаз, соответствует %
порядка 10-3/_(2-10~7), или 5000 пуаз. Следовательно, такие
поверхностные пленки имеют консистенцию жира.
Инерционный
диск с
1Ч\"\У1^
Лиск
Ванна
Пленки на жидких поверхностях
105
Приведенный выше расчет проливает свет на одну из
современных проблем реологии поверхностей. Теоретическое моделирование
вязкости пленок приводит к величинам в 106 раз меньше наблюдаемых
экспериментально [61, 61а]'. Возможно, экспериментальная
феноменология не соответствует предположениям, заложенным в уравнениях
(111-27) и (111-28), т. е. в эксперименте измеряется совсем не то, что
было задумано. Возможно также, что вследствие взаимодействия
полярных частей молекул, образующих пленку, с подложкой все
измеренные значения поверхностной вязкости фактически относятся к
подложке. Этот вопрос обсуждается в разд. 1П-6Д.
Г. Оптические свойства монослоев
Детальный анализ поведения света, проходящего через поверхность
раздела или отраженного от нее, в принципе позволяет определить
толщину неоднородной области, показатель преломления и коэффициент
поглощения этой области и их зависимость от длины волны. Все
вопросы, связанные с эллипсометрией, рассматриваются только в общих
чертах; более полное обсуждение оптических свойств монослоев
читатель может найти в различных статьях и монографиях [62—64].
Плоскополяризованный свет, падающий на поверхность под
некоторым углом, можно разделить на две компоненты — параллельную и
перпендикулярную плоскости падения. Эти две компоненты
отражаются по-разному, и поэтому отраженный пучок становится эллиптически
поляризованным. В частном случае, когда, например, угол падения
равен углу Брюстера, т. е. arctgn, где п — показатель преломления
подложки, отражается только перпендикулярная компонента. При этом
предполагается, что поверхность раздела между жидкостью и воздухом
выражена очень резко. В этих условиях обычный (неполяризованный)
свет становится полностью плоскополяризованным. Раман и Рамдас
нашли, что для чисто водных поверхностей описанная картина
отражения света является почти правильной. Обнаруженная слабая
эллиптичность отраженного света указывает на существование переходной
области толщиной приблизительно в одну молекулу — это еще одно
свидетельство конечной толщины поверхностного слоя.
На рис. III-13 приведена схема типичного эллипсометрического
эксперимента. Монохроматический пучок света (в последнее время в
качестве источника монохроматического света иногда используют
небольшой лазер) сначала плоско поляризуется, а затем падает на
исследуемую поверхность раздела. (В общем случае угол падения света не
равен углу Брюстера для чистой поверхности.) Отраженный пучок
является эллиптически поляризованным. Пройдя через компенсатор, он
опять становится плоскополяризованным. Чтобы определить угол
поляризации, настраивают анализатор таким образом, чтобы детектор
показывал полное гашение света. Итак, экспериментально измеряют угол
поляризатора р и угол анализатора а. Эти величины дают
необходимую информацию, а именно сдвиг фаз А между параллельным и пер-
О Источник Детектор О
\ceema, у
}£\Поляризатор /pS
\^ АнашаторСф/
Рис. 111-13. Схема эллипсометрической уста- \ /^Компенсатор
новки [1]. \ /
неполяризованный свет; плоско- ^/
поляризованный свет; эллиптически яллм „-«.,
поляризованный свет. ПОвВрКНОСШЬ
106
Глава HI
пендикулярным компонентами и изменение отношения амплитуд этих
компонент tgi|):
Д== 2р + л/2 и ур=а.
Если поверхность чистая, Д и г|) непосредственно связаны с
комплексным показателем преломления поверхностного слоя ns = ns(l—iks),
где ns — обычный показатель преломления, a ks — показатель
ослабления света, или действительный коэффициент экстинкции. Если на
поверхности присутствует пленка с другим показателем преломления я/,
то А и я)) связаны с ns, щ и толщиной пленки. Этот метод очень
чувствителен и позволяет определять пленки со средней толщиной около
0,2 А, или всего около 0,05 монослоя.
Арчер и др. [64] вывели очень полезные соотношения для пленок
менее плотных, чем компактный монослой:
Д=Д—ady
t^ + pd.
(Ш-35)
(Ш-36)
Величины Д и г|9 относятся к чистой поверхности, а Д и ф — к пленке,
покрывающей поверхность; d — толщина пленки; а и р— постоянные,
определяемые углом падения луча, щ и ns и длиной волны света.
При исследовании разреженных монослоев толщине пленки и ее
показателю преломления уделяют мало внимания. Показатель
преломления является важной оптической характеристикой пленки, но не
представляет особой ценности как физико-химическая характеристика.
Толщина пленки определяется прежде всего поверхностной концентрацией,
■ 0,3Г
85100 132 150 о 200 250
6, А*/молекула
Рис II1-14 Пленки стеариновой кислоты на ртути [65].
Пленки на жидких поверхностях
Рис. Ш-15. Различные способы обеспечения достаточного взаимодействия светового
луча с монослоем [1].
а — монослой осаждается на прозрачные пластинки и анализируется на пропускание; б —
монослой осаждается на отражающие пластинки и анализируется в режиме отражения; в — монослой
осаждается на прозрачный материал и анализируется с помощью многократного внутреннего
отражения; г — зеркала, расположенные над и под поверхностью раздела, многократно
пропускают световой пучок через монослой на жидкой подложке.
хотя, согласно современным представлениям, она в значительной мере
зависит и от структурной переориентации подложки. Желательно
определять толщину пленки также «с помощью каких-либо независимых
измерений. На рис. III-14 показаны некоторые экспериментальные
результаты, полученные для пленок стеариновой кислоты на ртути.
Большой интерес представляет также толщина последовательно
нанесенных монослоев на твердых подложках (разд. III-16), пленок
адсорбированных паров на твердых поверхностях (разд. XIII-5) и мыльных
пленок (разд. ХИ-9). Во всех этих случаях наряду с эллипсометриеи
важным оружием в руках исследователя становится и
интерферометрия.
Свет, отраженный от передней и задней поверхностей пленки,
проходит различные расстояния, и в результате появляется
интерференционная картина. В случае мыльных пленок или таких пленок, у которых
показатель преломления больше, чем у подложки, свет, отраженный
от передней поверхности, меняет фазу на обратную (поскольку п
больше 1), тогда как фаза света, отраженного от задней поверхности,
не меняется. Этот метод используется для изучения пленок,
нанесенных на твердую подложку [66, 67]}; о его применении для определения
толщины мыльных пленок говорится в разд. ХИ-9.
Ценные сведения о свойствах нерастворимых монослоев может дать
адсорбционная спектроскопия; в настоящее время используется
главным образом видимая область. Однако тонкие пленки поглощают хмас-
ло, и поэтому необходимо каким-либо способом усилить этот эффект.
Гэйнс [1] описывает несколько методов усиления взаимодействия
светового пучка с монослоем, схематически иллюстрируемых рис. Ш-15.
Один из этих методов (рис. Ш-15, г) предназначен для исследования
разреженных монослоез in situ путем многократного отражения света
от зеркал, расположенных выше и ниже поверхности раздела [68].
При исследовании пленок на поверхностях твердых тел довольно
широко используется инфракрасная спектроскопия (см. разд. ХШ-4А).
Однако к МЮНОСЛОЯ1М на жидких подложках этот метод применить очень
трудно. В то же Бремя на растянутых монослоях можно измерять
флуоресцентную эмиссию. Соответствующая аппаратура описана в работах
Твита и др. [69]' и Троспера и др. [70], изучавших методом флуорес-
108
Глава 111
центной спектроскопии слои хлорофилла. Особенности флуоресценции
на пленках, нанесенных на поверхности твердых тел, а также другие
процессы, обусловленные переходом молекул в возбужденное состояние,
рассматриваются в работах [70а] и [706].
Д. Ультрамикроскоп
В 1930 г. Цохер и Штибель [71]' обнаружили, что при освещении
пленки расходящимся пучком света в микроскопе отчетливо видны
неоднородные участки. Пятна нерастекшегося материала или агрегаты
выглядят как блестящие точки на темном фоне монослоя. Особенно
эффектная картина наблюдается при сжатии газообразной -пленки в
области перехода в жидкое состояние: двумерные коллоидные частицы
жидкой пленки вспыхивают, как яркие звездсчки. Адам [72] несколько
упростил ультрамикроскоп, использовав для фокусировки света
конденсор. Относительно недавно Бруун [73] исследовал этим методом
коллапсированные пленки.
Е. Электронная микроскопия и дифракция электронов
Райе и др. [74]| сумели перенести растянутые монослои я-гексатри-
аконтановой кислоты (С3е) на коллодиевую пленку, армированную
сеткой, и затем теневым методом получили очень интересные электронные
микрофотографии, показанные на рис. III-16. На этих фотографиях
видны ступеньки толщиной 50 А, соответствующей длине
углеводородной цепи. В другом методе получения электронных микрофотографий
пленка переносится на предметное стекло. Значение результатов этих
исследований обсуждается в следующем разделе. Для изучения
пленок, правда, также только перенесенных на подложку [76],
применяется и дифракция электронов. Метод дифракции медленных электронов
обсуждается в связи с адсорбцией газов в разд. V-6B.
Ж. Другие методы
Так же как и гиббеовские монослои (разд. Н-6Б), адсорбированные
пленки можно изучать методом меченых атомов. На растянутых
монослоях in situ проведено несколько экспериментальных работ такого
рода. Гэйнс [77] нашел, что для меченой стеариновой кислоты этот
метод дает такие же результаты, что и метод переноса пленки на
слюдяную пластинку (см. разд. 111-16). Спинк [78]; подробно исследовал
эффективность переноса (определялся коэффициент переноса)
меченной 14С стеариновой кислоты на различные твердые подложки. Кук и
Райе [79], опять же с помощью меченой стеариновой кислоты,
показали наличие неоднородности на участках больших 35 А2 на молекулу.
Чувствительность метода ядерного магнитного резонанса,
по-видимому, еще недостаточна, чтобы его можно было применять для
изучения растянутых 'монослоев, хотя для исследования эмульсий (которые
характеризуются большой поверхностью) он приемлем (разд. ХП-3).
Для пленок должен быть пригоден метод электронного спинового
резонанса с использованием спиновых меток, однако до сих пор этот
метод применялся только для коллоидных систем [80]. В литературе не
сообщается о попытках измерить поверхностную проводимость,
магнитную восприимчивость и поверхностную диффузию. Наконец,
определенный интерес представляет реологический метод, заключающийся в
исследовании картины течения монослоя при его переносе от одной
поверхности к другой с помощью вращающегося цилиндра [81]'.
Пленки на жидких поверхностях
109
Рис. III-16. Электронные микрофотографии монослоев «-гексатриаконтановой кислоты
-ри 15, 20, 25 и 40 дн/см. Для сравнения показаны также микрофотографии
поверхности чистой и коллапсированной пленок [74].
4. Состояния мономолекулярных пленок
Само название этого раздела 'ставит вопрос: что понимают под «со-
гтояниями» монослоев и как они определяются? Ответить на него мож-
о так. Во-первых, в поведении пленок различных типов наблюдаются
-гастолько ясные различия, что по аналогии с обычным веществом
их можно разделить .на газообразные, жидкие и твердые. Во-вторых
это уже более произвольное толкование), подтипы поведения моно-
:лоев часто называются и определяются как то или иное состояние.
Сложность поведения монослоев, несомненно, обусловлена тем, что все
: эразующие пленку молекулы относятся к типу полярно-неполярных.
~элярные концы молекул (или головки) сильно взаимодействуют с
ПО Глава III
21 25 43 47 600 2300
в,Аг/молекула
Рис. III-17. Схема состояний монослоев.
водной подложкой и могут структурироваться водородными связями,
ионной атмосферой ,и т. п., тогда как неполярные части (или х;восты)
взаимодействуют только друг с другом, причем несколько другим
путем. Как будет видно из дальнейшего, поведение монослоев в
значительной мере можно объяснить, объединяя результаты раздельного
анализа этих двух типов взаимодействия, рассматриваемых как
независимые.
На рис. Ш-17 -приведена диаграмма, иллюстрирующая различные
типы поведения монослоев, которые можно описать следующим
образом.
1. Газообразные пленки (G). Пленка подчиняется уравнению
состояния более или менее идеального газа; площадь, приходящаяся на одну
молекулу, велика по сравнению с фактической площадью молекулы;
пленка может неограниченно расширяться, не претерпевая фазовых
изменений. Как и в случае обычного вещества, это состояние всегда
достигается при достаточно больших площадях, приходящихся на
молекулу, хотя на практике иногда даже при таких низких
поверхностных давлениях, как 0,001 дн/см, это состояние может все же не
реализоваться.
2. Жидкие пленки (L). Существование таких пленок явно связано
с коллективным взаимодействием между молекулами. Степень этого
взаимодействия, вообще говоря, может быть различной. При
экстраполяции на нулевое поверхностное давление кривые я—о жидких
пленок дают площади больше (иногда в несколько раз), чем площади
соответствующего сечения молекул, что указывает на рыхлость и
неупорядоченность структуры этих пленок.
а. Растянутые жидкие пленки (Li). Различают по крайней мере два
типа L-пленок. Первый тип Адам [82]! и Гаркинс [7] назвали
растянутыми жидкими пленками или Li-пленками. При экстраполяции к
нулевому я Li-пленки, состоящие из молекул с одной цепью,
характеризуются площадью около 50 А2 (см., например, кривую Ь на рис. Ш-17).
По сравнению с обычной жидкостью растянутые пленки обладают
довольно высокой сжимаемостью. По-видимому, они однофазны и не
содержат каких-либо островков или пятен, различимых, например,
путем зондирования поверхностного потенциала. При низких давлениях
Пленки на жидких поверхностях
111
Li-пленки совершают характерный переход первого рода в
газообразное состояние. Сжатие этих пленок приводит к довольно быстрому, но
не мгновенному переходу в пленку с более высокой сжимаемостью.
Область высокой сжимаемости, называемая промежуточной областью
(/), рассматривается ниже.
б. Конденсированные жидкие пленки (L2). При сжатии пленки
промежуточного типа наблюдается область постепенного перехода к
линейной зависимости я—о с относительно низкой сжимаемостью.
Пленка, находящаяся в этой области, называется конденсированной жидкой
пленкой, /,2-пленкой [7]| или пленкой с «плотноупакованными
головками, перегруппировавшимися при сжатии» [63]. При низких
температурах последовательность L2—/—Li может перейти в кривую,
характерную для пленки типа L2, которая либо переходит в газообразное
состояние, либо неограниченно расширяется, не обнаруживая точек излома
(кривая е на рис. III-17), как если бы она находилась при
температурах -выше критической. Адам назвал такие пленки «растянутыми
паровыми пленками», поскольку к моменту завершения расширения они
относятся скорее к пленкам типа G, а не L\.
В предельном случае сжимаемость пленок типа Li может быть столь
же низкой, как у твердых пленок. При этом экстраполяция линейной
части кривой я—а на нулевое поверхностное давление дает площадь
около 22 А2 (что на 20% больше площади сечения углеводородной
цепи). Так ведут себя, в частности, пленки цетилового спирта, хотя
реологически они выглядят жидкими.
3. Твердые пленки (S). Некоторые пленки, например пленки
жирных кислот на воде, характеризуются совершенно линейными
зависимостями я—а, которые при экстраполяции на нулевое давление дают
площадь 20,5 А2. Сжимаемость таких пленок мала и близка к
сжимаемости твердого вещества, что наряду с низкой предельной площадью,
вероятно, указывает на плотную упаковку углеводородных цепей.
Пленки этого типа ведут себя как вполне твердое тело. Так, если
поверхность посыпать тальком, то -можно наблюдать, что целые куски пленки
движутся как единое целое. При низких давлениях 5-пленки иногда
могут переходить в 12-пленки (кривая / на рис. Ш-17).
Приведенная классификация является сильно упрощенной и к тому
же предполагает гораздо лучшее, чем наше теперешнее, знание
реологических свойств пленок различных типов. Однако она позволяет
систематизировать данные -и дает наглядное представление о свойствах
мономолекулярных пленок. Вещества, имеющие структуру более сложную,
чем спирты или кислоты с неразветвленными углеводородными цепями,
проявляют менее резко выраженные свойства. При очень низких
давлениях они могут быть газообразными, а при высоких давлениях
наблюдаются явные признаки того, что они находятся в жидком или
пластичном состоянии.
Различные состояния мономолекулярных пленок более детально
обсуждаются в разд. III-6, здесь добавим только несколько замечаний об
их природе. Как указано выше, переход Lt—G явно является переходом
первого рода, и не только потому, что на кривых я—о имеются точки
излома (на рис. Ш-17, соответствующие прямым линиям в области,
очерченной пунктиром), но и потому, что с этим переходом связана
скрытая теплота испарения. Кроме того, имеются свидетельства, что в
ьтой области пленка существует в виде пятен двух различных фаз.
Поверхностный потенциал пленок L\- и G-типа одинаков по всей по-
?ерхности пленки, однако при движении зонда над пленкой,
находящейся в состоянии Li—G-перехода, появляются интенсивные
флуктуации. Аналогичные флуктуации наблюдаются и при измерении
эллиптичности отраженного светового пучка, скользящего по поверхности
пленки и последовательно пересекающего островки конденсированной
Глава III
флуктуации
AVuJi
<У, Аг/молекула
Рис. Ш-18. Изменения V и [i в
зависимости от состояния
монослоя. Миристиновая кислота на
0,01 н. соляной кислоте.
фазы, окруженные газообразной пленкой [50]. Как отмечается в
предыдущем разделе, ультрамикроскопический анализ также показывает,
что в переходной области пленка неоднородна.
На рис. Ш-18 показано общее изменение поверхностного
потенциала ДУ и расчетного эффективного дипольного момента \i в зависимости
от g — площади пленки, приходящейся на молекулу. Из рисунка видно,
что при переходе от состояния / -к состоянию L{ AV непрерывно
уменьшается, тогда как \х остается почти постоянным. Из этого можно
сделать Цывод, что, несмотря на сильное изменение плотности
поверхности, средняя ориентация полярной части молекул остается почти
постоянной. Таким образом, на кривой \х—а фазовый переход первого
рода в области / не проявляется. Однако, как показано в разд. II1-6,
коллективное взаимодействие здесь все же присутствует и проявляется
либо в виде перехода второго рода, либо в образовании молекулярных
кластеров. При нагревании расширение пленки L2—/—Li происходит
настолько резко, что для многих простых длинноцепочечных соединений
давление и температуру «полурасширения» принято считать
характеристиками материала.
Кроме переходов L—G, аналогия с трехмерными системами
подкрепляется возможностью применения к пленкам правила фаз. Грисп
[83] сформулировал это правило следующим образом:
F=C—Pb — (PS— 1). (Ш-37)
В этом выражении F— число степеней свободы; C = Cb + Cs, где Сь —
число равновесных компонентов во всей системе, Cs — число
компонентов на поверхности; Ps — число поверхностных фаз; Рь — число
объемных фаз. Предполагается, что общее давление и температура являются
постоянными и, таким образом, F равно дополнительному числу
степеней свободы сверх этих двух. Так, для нерастворимого монослоя,
в котором в равновесии находятся жидкая Li и газовая фазы, С =
= 1 + 1=2, Р* = 2 и F = 0.
5. Соответствие между я и трехмерным давлением
Прежде чем приступить к более детальному рассмотрению
поведения монослоев, целесообразно обратить внимание читателя на
существование определенного соответствия между величинами я и обычным
давлением в трех изхмерениях. Например, можно считать, что, хотя я
имеет размерность силы на единицу длины, в действительности
давление распределено по толщине пленки. В такой интерпретации
Р=я/т, (Ш-38)
где т — толщина пленки. Поскольку для монослоев т имеет значение
порядка 10 А, то, если я=1 дн/ом, Р=107 дн/см2, т. е. умножая я на 10.
Пленки на жидких поверхностях
113
получаем эквивалентное трехмерное давление в атмосферах.
Приведенное значение не является таким уж высоким; например, давление
двумерного пара при переходе Li—G составляет несколько десятых дины
на 1 см, что соответствует объемному давлению в несколько атмосфер.
Сжимаемость твердой 5-пленки составляет 5-10~4 (дн/см)-1, или
~5-10~5 атм-1, т. е. по порядку величины вполне отвечает
сжимаемости обычной жидкости или твердого тела.
Правильность приведенных значений Р подтверждают результаты,
полученные при использовании концепции осмотического давления
{разд. II-7B). И конечно, уравнение (III-38) следует из уравнения
(Н-43), если считать, что постоянное давление в пленке
распространяется на область толщиной 2а=т.
Проведенное в этом разделе качественное обсуждение соответствия
между я и Р может быть полезным при рассмотрении физической
природы различных состояний монослоев. Понятно, что даже весьма
слабые силы в несколько дин или несколько десятых дины, измеряемые с
помощью пленочных весов, соответствуют давлениям в сотни и тысячи
атмосфер применительно к эффекту сжатия на молекулярном уровне.
Как показывает проведенный выше анализ, поверхностные давления
и сжимаемости газообразных, жидких и твердых монослоев должны
быть близки аналогичным величинам для соответствующих объемных
фаз. Настораживает, однако, резкое расхождение теоретических и
экспериментальных значений вязкости монослоев (см. разд. III-3B),
которые примерно в 106 раз больше ожидаемых значений.
б.Дальнейшее рассмотрение состояний мономолекулярных пленок
А. Газообразные пленки
О газообразных пленках ранее мы говорили только в связи с гиб-
бсовскими монослоями (разд. П-7), поэтому целесообразно более
глубоко обсудить также модель двумерного поверхностного раствора.
Напомним, что в этой .модели поверхностное давление выводится из
разности осмотических давлений между поверхностью, содержащей
второй компонент, и поверхностью чистого растворителя; при этом
предполагается, что осмотическое давление действует на глубину т.
Оригинальные идеи по обоснованию осмотической модели принадлежат Тер-
Минася<н-Сарага и Пригожину [84]. Некоторые из этих идей были в
дальнейшем развиты Фоуксом [85]'. В осмотической модели
газообразная пленка рассматривается как разбавленный раствор поверхностно-
активного вещества в воде. Для того чтобы найти осмотическое
давление, можно использовать исходную форму уравнения (П-125),
согласно которому
noi=-(RT/V±)lnNi9 (III-39)
где Vi — молярный объем растворителя, N± — его мольная доля в
поверхностном слое. Если толщина этого слоя равна т, то V/т имеет
размерность молярной площади и уравнение (III-39) можно записать в
виде
n = —(kT/o°1)\nNi (III-40)
или
п=— (kT/ai) hi
л?°2 —М°8 —о?)
где щ — число молей i-то вещества в 'поверхностном слое, приходящееся
на единицу площади. Если поверхностный раствор рассматривать как
8—1421
114
Глава HI
однородную среду, то т можно принять равным размеру молекулы, и,
таким образом, aj и о\ становятся приблизительно равными
соответственно площадям молекул растворителя и вещества, образующего
пленку. Если подложкой служит вода, aj равна площади молекулы
воды, т. е. составляет (примерно 9,7 А2, и, таким образом, п\ известно; о%
можно оценить или рассматривать как эмпирический параметр, а пг —
известная поверхностная концентрация поверхностно-активного
вещества. Данные для пленок газообразного типа можно обрабатывать с
помощью либо уравнения (Ш-40), либо соответствующего уравнения для
неидеального двумерного таза. Оба эти уравнения основаны на простых
моделях, не совсем точных в деталях, и, по мнению автора, их не
следует принимать слишком буквально.
В модели двумерного раствора переход Li—G представляет собой
просто переход от разбавленной фазы, содержащей избыток воды, к
фазе, обогащенной ловерхностно-активным веществом, т. е. переход между
взаимно насыщенными фазами в системе, характеризующейся
определенным интервалом растворимости. В этом случае, по-видимому, все
же удобнее рассматривать картину двумерной конденсации пара в
жидкость, особенно в связи с тем, что в ней интуитивно предполагается
возможность использования модифицированного уравнения
Клапейрона:
dn/dT=:AH/TAA, (III-41)
где ЛА — разность значений а (выраженная в см2/моль) для фаз L\
и G; АН— скрытая теплота испарения (эрг/моль). В табл. III-4
приведены типичные значения упругостей паров ряда двумерных жидкостей.
Скрытые теплоты испарения для ряда тридекановой, миристиновой, пен-
тадекановой кислот также являются вполне характерными и
составляют 2, 3,2 и 9,5 ккал/моль соответственно. Поскольку как в G-, так и
в Li-фазе полярные карбоксильные группы сольватированы, скрытая
теплота испарения приписывается главным образом притяжению
между углеводородными хвостами. В связи с этим вполне понятно, почему
скрытые теплоты двумерного испарения пленок значительно меньше
скрытых теплот испарения соответствующих объемных фаз.
Б. Растянутые жидкие пленки
Состояние Li наблюдается преимущественно для длинноцепочечных
соединений с сильнополярными группами, например кислот, спиртов,
амидов и нитрилов. Экстраполяция кривых я—а на нулевое значение
л дает значения а в интервале от 40 до 70 А2 в зависимости от природы
соединения. На рис. III-19 показаны некоторые характерные данные
для пентадекановой кислоты [86]; соответствующие температуры
полурасширения этих пленок приведены в кн. Адама .[82]. Вопрос о
Таблица III-4
Поверхностные давления парообразных пленок при 15 °С [82]
Вещество
Тридекановая кислота
Миристиновая кислота
Пентадекановая кислота
Пальмитиновая кислота
Нитрил маргариновой
кислоты
Тетрадециловый спирт
Этиловый эфир
маргариновой кислоты
я, дн/см
0,31
0,20
о,п
0,039
0,11
0,11
о,ю
Вещество
Этиловый эфир
стеариновой кислоты
Лауриловая кислота
Додециловый спирт
Этиловый эфир
пальмитиновой кислоты
я, дн/см
0,033
Выше
критической
температуры
»
»
Пленки на жидких поверхностях
115
26 30
J4 38 42 46 50
<7, А2-/молекула.
Рис. Ш-19. Зависимости я—-о* для монослоев пентадекановой кислоты при рН 2 [86].
том, как лучше сформулировать уравнение состояния растянутого
жидкого монослоя, до сих пор остается открытым. Такие монослои
являются сплошными, обладают текучестью (и в этом смысле подобны
жидкости), и в то же время среднее межмолекулярное расстояние в
них значительно больше, чем в обычных жидкостях. Плотность
типичной трехмерной жидкости приблизительно на 10% ниже плотности
соответствующего твердого материала, тогда как жидкий растянутый
монослой может существовать даже в том случае, если площадь,
приходящаяся на одну молекулу, вдвое больше площади, занимаемой
молекулой в твердом моно'слое.
Li-состояние удобно интерпретировать <с помощью модели Миттель-
мана и Палмера [87], согласно которой растянутая двумерная
жидкость рассматривается как промежуточное состояние между
газообразной пленкой, в которой все молекулы лежат на поверхности, и
конденсированной пленкой, в которой все они ориентируются
перпендикулярно поверхности. Далее предполагается, что различные возможные
конфигурации характеризуются статистическим распределением. Энергия
конфигурации описывается выражением
г = (л + ы))а1'+г\ (Ш-42)
где naU — работа против поверхностного давления, а — ширина цепи,
V — длина цепи на поверхности, w — работа адгезии группы СН2 к
воде (она, вообще говоря, мала) и г—работа вращения связи С—С
(около 800 кал/моль). Вероятность каждой конфигурации определяется
формулой Больцмана:
р =k ехр [—(ли/' + е')/*Т]. (Ш-43)
Тогда средняя площадь, приходящаяся на одну молекулу, равна
о=в„
а ]>] /' ехр [—(каГ + s')/kT\
о
/
J] ехр [_(ла/Че')/*Л
о
(Ш-44)
где оп — площадь полярной группы. Это уравнение хорошо согласуется
с наблюдаемой зависимостью я от а для Li-пленки олеиновой кислоты
6*
J16
Глава III
L
|c ^>1 Рис. 111-20
и позволяет предсказать влияние поверхностного давления на
химическую активность двойных связей (разд. Ш-11). Сейчас эта теория
уточнена, однако в ней не учитываются изменения энтропии и не
предполагается возможность фазового перехода между состояниями Li и G.
Несколько другая модель приводит к следующей разновидности двумерного
уравнения Ван-дер-Ваальса [88]:
(я + а/о2) [о (1 — о0/о)2] = kT. (Ш-45)
Здесь предполагается, что пленка состоит из множества подвижных дисков
диаметром d. Поправочный множитель (1—ог0/а)2 берется из статистической теории [89]
двумерной жидкости, состоящей из твердых дисков с сг0=я^2/4. Коэффициент а,
характеризующий взаимное притяжение молекул, записывается в виде a=neoQ, где п—
число групп СН2 (дисков), а е — мера энергии взаимодействия между соседними
группами СН2. Уравнение (Ш-45) хорошо описывает экспериментальные данные, и
поэтому эта модель заслуживает дальнейшей проверки.
Одно из первых уравнений состояния для пленок принадлежит Лэнгмюру [25]. Он
заметил, что пленки масла, растекшегося на монослоях жирных кислот, дают очень
похожие п—сг-кривые, и пришел к выводу, что в Li-состоянии пленка является
связанной благодаря силам притяжения между углеводородными хвостами. При этом
полярные группы взаимодействуют друг с другом слабо и ведут себя подобно
молекулам газа. Таким образом, для полярных групп
ng(o — o°)~kT,
тогда как для углеводородной части поверхностное давление равно
^о == 7 вода — Твода-масло Тмасло •
Принимая, что n = TCo+TCg) получаем
(л - л0) (о - о°) = kT. (Ш-46)
•Разделение пленки, по существу, на две независимые части, нормальную «маслопо-
добную» и газообразную, состоящую из полярных головок, является довольно
искусственным и кажется не особенно оправданным в связи с аномально высокой
вязкостью Li-пленок (разд. III-3C).
Некоторые чисто эмпирические уравнения состояния предложили Юра и Гаркинс
[90].
В. Промежуточные пленки и Ь2-плечки
Адам [82] и Лэнгмюр [25] рассматривают 12-пленки как
полутвердые пленки, содержащие то и пи иное количество воды между
полярными группами. При сжатии вода выдавливается из пленки до
тех пор, пока не получается твердая пленка. В тех случаях, когда
полярные группы молекулы велики, предполагается, что они
укладываются в шахматном порядке, т. е. при сжатии может происходить
перестройка пленки. Гаркинс . [7] .считает, что сжимаемость пленки
типа L2 определяется числом водородных связей между полярными
группами и молекулами растворителя.
Для £2-пленок зависимость я—а почти линейна и ее можно представить
уравнением типа
а=Ь-ал. (Ш-47)
Если а мало, сжимаемость пленки имеет почти постоянное значение, обычно порядка
10-3—10-2.
Пленки, которые подчиняются уравнению (Ш-47) вплоть до
низких давлений, обычно проходят через переход L2—/ при средних
давлениях, если несколько повысить температуру или заменить поверх-
Пленки на жидких поверхностях
117
Рис. Ш-21.
о-ю—'пси
ностно-активное вещество на его аналог с более короткой цепью.
В первом приближении введение в углеводородную цепь более одной
группы ОН2 приводит к сдвигу среднего поверхностного давления,
соответствующего переходу L2—/, который эквивалентен изменению
температуры на 5 градусов. По мнению Лэнгмюра [25], переход
L2—/, включает разрыв /^-пленки на кластеры, или «мицеллы». Эти
мицеллы достаточно малы, чтобы вести себя как неидеальный газ, й в
то же время обладают заметной упругостью паров. В свою очередь
они могут диссоциировать, переходя в более неупорядоченное
состояние L\. Если для этого состояния принять модель Миттельмана и
Палмера [87], получается общая картина переходов между
состояниями, изображенная на рис. Ш-21.
Поверхностное давление /-пленки Лэнгмюр принимает равным сумме давления в
фазе L\ в точке / (рис. III-22) и давления совокупности мицелл, каждая из которых
состоит из Ь мономерных единиц. 1
Таким образом,
я = я/я + Яу
(Ш-48)
Образование мицелл заканчивается в точке R (рис. III-22); мицеллы ведут себя до-
добно неидеальному газу, подчиняющемуся уравнению (11-119). С учетом этого
допущения получаем
*>J>Oj (0R—Oj)/(G—Gj) =kT.
(Ш-49)
По оценке Лэнгмюра, для миристиновой кислоты 6^10, а скрытая теплота
диссоциации мицелл, рассчитанная по упругости их паров и температурному коэффициенту
упругости паров, составляет 9 ккал.
Гаркинс и Бойд [86] подвергли мицеллярную модель критике на
том основании, что если мицеллы действительно существуют, то
объяснить изменение энергии мицеллярных пленок при расширении
можно, только допустив, что размер их меняется. Другое объяснение
свойств /-пленок заключается в том, что в точке / система постепенно-
теряет вращательные степени свободы до тех пор, пока в точке R
молекулы совсем не перестают вращаться. Подобное предположение уже
было высказано Кирквудом [91]. Однако эта модель до сих пор
является спорной, поскольку монослои 4-нитро-я-терфенила не
обнаруживают признаков перехода в /-состояние, хотя вращение их молекул
явно затруднено [92].
Г. Твердые пленки
Пленки 5-типа отличаются высокой плотностью и имеют вид либо^
жесткой, либо пластичной фазы. Большинство жирных кислот и
спиртов дают пленки этого типа при достаточно низких температурах или
Рис. IIU22.
118
Глава III
при наличии достаточно длинных углеводородное цепей. В этом
случае уравнение состояния имеет довольно простой вид:
а=Ь—ая, а ^0,02. (Ш-50)
Для жирных кислот предельное значение а равно 20,5 А2, т. е. больше
соответствующего значения 18,5 А2, рассчитанного из структуры
трехмерного кристалла. Одно время предполагалось, что цепи одинаково
отклонены от вертикали на 26°. При таком угле наклона не
исключена также возможность взаимного пересечения зигзагообразных
углеводородных цепей. Однако, как отмечалось в работах [93, 94],
площадь 20,5 А2 на молекулу можно получить и без предположения о
наклоне цепей, а лишь исходя из предпочтительной упаковки
карбоксильных групп на поверхности. Расчет энергии электростатического
взаимодействия плотноупакованных диполей показывает, что она
может быть положительной или отрицательной — в зависимости от
геометрии решетки [95]. Однако общий вывод сводится к тому, что
вклад электростатического взаимодействия всегда мал по сравнению
с вкладом сил притяжения между углеводородными хвостами.
Этой стройной картине противоречат наблюдения Раиса и др. {74],
опубликовавших электронные микрофотографии пленок я-гексатриа-
контановой кислоты, на которых отчетливо видны отдельные островки
пленки (рис. III-16). Эта кислота -с 36 атомами углерода в цепи дает
такие же я—о-кривые, как стеариновая кислота. Экстраполируя
я;—а-кривую на нулевое я, получаем а2=20,4 А2, что обычно
рассматривается как свидетельство существования однородной
структуры с плотной упаковкой. Возникают два вопроса. Во-первых, не
образуются ли островки в процессе переноса и подготовки пленки для
снятия электронных микрофотографий [78, 96, 97]? Если островная
структура является реальным фактом, то существующие
представления о структуре и сжимаемости пленки необходимо пересмотреть.
И во-вторых, к чему приведет такой пересмотр?
Сложные эфиры, спирты и другие углеводородные соединения
дают в общем несколько большие площади в расчете на одну
молекулу, чем жирные кислоты. Получено довольно много данных,
предполагающих возможность различных фазовых переходов в твердых
лленках (см. [1,7,98—100]).
Д. Реология монослоев
Мы не будем рассматривать здесь массу экспериментальных и
теоретических данных, накопленных в этой области, тем более что все
9то читатель может найти в монографии Жоли [101].
Экспериментальные данные, приведенные на рис. III-23, получены с помощью
банального вискозиметра -и относятся к спиртам с длинными
углеводородными 'цепями. Заметьте, что при переходе от состояния
растянутой жидкости к конденсированному состоянию поверхностная вязкость
возрастает в 100 раз. Измерение поверхностной вязкости в данном
•случае осложняется тем, что для двух более легких спиртов при
высоких давлениях вязкость сильно зависит от скорости сдвига. Возможно,
это связано с неньютоновским характером пленки: для тех же
спиртов метод колеблющегося диска [103] дает значения поверхностной
вязкости, отличающиеся от приведенных на рис. 111-23 более чем в
10 раз. Вязкость пленок зависит также от температуры, при этом
кажущаяся энергия активации составляет от 10 до 15 ккал/моль.
Вязкость длинноцепочечных алифатических соединений весьма
чувствительна к природе полярных групп. У жирных кислот вязкость
обычно меньше, чем у соответствующих спиртов и тем более аминов.
Важное значение имеет рН подложки. В кислой среде длинноцепочеч-
Пленки на жидких поверхностях
119
340
^* I
S 20,0\-
1
? 15.0 \
I ю,о \
I ,
1 sjo\-
Oft
а
i
к
-о
!
!.
1 0,001
I 8
I
0.1
8
6
5
4
3
Ofll
8
6
5
4
t 6
6
5
4
3\-
0,0002
*-с16н33он
«-с14нг9он
J_
I
18 20 22
24 26 28 30
<7, А2/'молекула
«-С14Нг9ОН
«-С1бН33ОН
Я-С16Н37ОН
I l I I
О 2 4 6 8 10 12 14 16 18202224
Поверхностное давление, дн/см
Рис. Ш-23.
лТ^,7тЛКрИВЫе ДЛЯ ДлинноЦвпочечных спиртов на 0,01 н. серной кислоте при 20 °С; б - соответ-
(С^раз^ешен^ Am" oS5? в™)*0"" ПР" ОТНОСИтельно низкой «орости потока (0,02 см^/с) [102].
ные амины ионизуются, что приводит к расширению пленки и
значительному снижению ее вязкости. Так же должны вести себя и пленки
жирных кислот -на щелочных подложках. Тот факт, что эти пленки
обладают значительной жесткостью [102], объясняется присутствием
примесей многозарядных катионов (см. следующий раздел).
Пленки полимерных веществ и биологических материалов
рассматриваются в очень многих работах. Такие пленки обладают
вязко-эластичными свойствами и напоминают трехмерные гели. Различные
реологические коэффициенты для этих пленок можно найти,
анализируя релаксацию маятника, отклоненного от равновесной точки.
Реологические свойства пленок очень сильно зависят от их структуры
Так, фазовые переходы, не обнаруживаемые на кривых я—о, могут
120
Глава 111
приводить к резкому изменению наклона кривой зависимости вязкости
от я. Ряд таких перегибов наблюдается даже на кривых, полученных,
казалось бы, для простых пленок длинноцепочечных жирных
кислот [101].
В настоящее время реология поверхностей бурно развивается, хотя
положение в этой области остается очень тяжелым.
Экспериментальные данные, как правило, ненадежны: они зависят от опытности
исследователя и типа используемой аппаратуры и, кроме того, весьма
чувствительны к примесям. Нет уверенности в том, что краевые
эффекты не оказывают сильного влияния и не приводят к большим
погрешностям в определении расчетных вязкостей. Не совсем ясно,
как учитывать влияние подложки. Наконец, очень смущает тот факт,
что поверхностные вязкости примерно в 10б раз больше значений,
рассчитываемых из объемных свойств веществ, образующих пленку
(см. разд. Ш-ЗВ). Если расхождение обусловлено реальными
свойствами пленки (а не является экспериментальной ошибкой), то,
по-видимому, это означает, что полярные группы образуют единую
структуру (например, через водородные связи) и, будучи ограниченными в
очень тонком слое вблизи границы раздела, просто не могут свободно
двигаться относительно друг друга.
Е. Влияние водной подложки на свойства монослоев
Наиболее сильное влияние на свойства монослоев часто оказывает
рН подложки. Примером могут служить монослои жирных кислот.
В щелочной среде эти вещества ионизуются, что приводит к
взаимному отталкиванию заряженных полярных групп. Пленка переходит в
газообразное состояние или в состояние растянутой жидкости при
значительно более низкой температуре, чем в кислой среде [104]. При
этом поверхностный потенциал падает, поскольку противоионы,
находящиеся вблизи полярной головки (рис. III-24), индуцируют диполи,
ориентация которых противоположна ориентации диполей,
существовавших в кислой среде. Подобная ситуация имеет место и в случае
монослоев длинноцепочечных аминов -на кислых подложках [105].
Оба примера проиллюстрированы рис. 111-25. Влияние среды связано
не только с рН. Как показано на рис. III-26, в 0,01 М растворе
гидроокиси тетраметиламмония монослои стеариновой кислоты сильно
растянуты, тогда как в 0,01 М растворе гидроокиси лития они весьма
плотны (ср. с рис. III-5); КОН и NaOH влияют на состояние пленки
слабо. Ясно, что очень важную роль здесь играет природа противо-
иона.
На свойства монослоев чрезвычайно сильное влияние оказывает присутствие в
растворе электролитов, ионы которых могут образовывать с молекулами пленки
нерастворимые соединения. Так, даже при совсем небольших концентрациях (10~4 М)
двузарядных ионов и низком рН пленки жирных кислот распадаются на пятна
металлического вида. Такие пленки значительно более конденсированы, чем исходные
монослои жирных кислот [107, 108]. Взаимодействию ионов металлов с
ионизованными пленками Себба и др. [109] нашли интересное применение. Взбивая в такой систе-
ri-C-H
Н-С-Н
Na+
Рис. Ш-24.
Пленки на жидких поверхностях
121
Рис. III-25. Изменение
поверхностного потенциала монослоев я-нонадеци-
ламина (/) и стеариновой кислоты
(2) в зависимости от рН [105].
6 8 10 12 /4
рН
ме пену, можно селективно выделить из раствора и концентрировать следы металлов
и других ионов. Этот процесс Себба назвал ионной флотацией.
В ионизованных пленках важную роль играет межионное притяжение молекул
пленки с вводимыми электролитами, которое сопровождается изменением потенциала
пленки (см. разд. II1-14). Большой интерес представляют также реакции в
монослоях и между монослоями и подложками. Этот вопрос обсуждается в разд. III-11 -
Ж. Молекулярная структура и тип образуемой пленки
Монослои соединений с неразветвленными углеводородными
цепями, .например спиртов, кислот и т.п., могут находиться в различных
состояниях в зависимости от длины цепи и температуры (см.
разд. III-4). В случае длинных цепей или при низкой температуре
образуются твердые пленки или пленки типа L2. К L\~ и G-пленкам
приводят укорочение цепи или повышение температуры. Как уже
отмечалось, введение одной группы СН2 приблизительно эквивалентно
J2
2А
16\-
8\-
L
р
V
_|
—1
j\
1
г
Ч£
L
Г"
Чу/
1
-J
~н
20
40
60
80
100
б, А /молекула
эпс П1-26 я—0-Изотермы стеариновой кислоты на подложках 0,01 М ХОН и 0,09 М
XG при 26 °С [106].
. х — ион тетраметиламмония, 2) X — Na+, 3) X — К+, 4) X — Li+.
122
Глава III
изменению температуры на 5 градусов. Ионизованные пленки имеют
пониженные температуры фазового перехода, т. е. температуры, «иже
которых образуются пленки типа 5 и L2, а выше — растянутые
пленки. Слабо диссоциированные соли с многозарядными ионами
характеризуются повышенными температурами фазового перехода.
Соединения, содержащие большие массивные полярные концевые
группы, чаще образуют пленки типа L2, чем пленки типа 5. При этом
экстраполированные значения площади, занимаемой молекулой при
нулевом давлении, и сжимаемость выше, чем для типичных твердых
пленок. В молекулах поверхностно-активных соединений, например
олеиновой кислоты и других ненасыщенных соединений, у-оксикислот,
лактонов и т.д., может быть не одна, а несколько полярных грушг.
В таких случаях, как правило, образуется растянутая пленка, обычно
типа Lu поскольку, для того чтобы преодолеть силы взаимного
притяжения между полярными центрами и поставить цепи в вертикальное
положение, необходимо значительное поверхностное давление. В то же
время молекулы таких поверхностно-активных веществ, как сложные
эфиры, .например тристеарилглицерид, тетразамещенный пентаэритрит
и т. п., могут содержать более чем одну углеводородную цепь. Такие
соединения ведут себя подобно жирным кислотам и дают либо
конденсированные, либо растянутые пленки в зависимости от длины цепи и
температуры. Насколько важна природа углеводородной части
молекулы, хорошо видно из следующего. Брассидиновая кислота (транс-\2-
докозеновая кислота) с неразветвленной углеводородной цепью дает
конденсированную пленку, тогда ,как эруковая кислота (^ис-докозено-
бая кислота), у которой разветвленная цепь, образует очень
растянутую пленку [110].
Бернет и Зисман [111] исследовали свойства монослоев фторированных жирных
кислот. Хотя углеводородные цепи этих соединений содержат от 17 до 23 атомов
углерода, они образуют пленки L2-, а не £-типа. Вероятно, это связано с трудностью
плотной упаковки массивных фторированных цепей. В то время как для исходных
жирных кислот AV пленок — величина положительная, для фторированных
соединений АV — отрицательная и довольно большая (до 0,9 В) величина. Объясняется это
образованием больших диполей, обращенных отрицательным концом наружу.
Как и можно было ожидать, пленки таких сложных соединений, как
стеролы, белки и полимеры, обладают менее четко выраженными
фазовыми свойствами. Их подразделяют на преимущественно твердые,
преимущественно жидкие и аморфные. Более подробно такие пленки
рассматриваются в разд. Ш-12.
7. Термодинамика монослоев
Рассматривая монослой как отдельную фазу, находящуюся в
равновесии с подложкой, можно получить очень .красивые и полезные
термодинамические соотношения для монослоев. Для этой цели в равной
степени можно использовать как концепцию межфазного
поверхностного осмотического давления, так и гиббсовские представления о
поверхностных избытках. Удобнее, видимо, все же подход Гиббса.
Анализ можно было бы начать с определения Аа по уравнению
(П-96) (см. [112]), однако целесообразнее использовать другое
(столь же приемлемое) определение:
A*a=E6—TSa—yA. (III-51)
Введем еще одно определение:
G*°=A*° + PVe,
и, так как Va=0, получаем уравнение типа (П-98):
dG*°=-S°dT+ ^ iiidnf—Ady. (Ш-52)
Пленки на жидких поверхностях
123
Теперь запишем выражения для парциальных моляльных величин:
[wU-V- &U*-*- (t),4v=7" <'"-53)
где, к примеру, А; — парциальная моляльная площадь, аналогичная
парциальному моляльному объему; .площадь, приходящуюся «а одну
молекулу, мы будем записывать как а*. При постоянных температуре и
nf уравнение (111-52) сводится к выражению
dG*«=—Ady (Ш-54)
или
d\ii=—Aidy=Aidnt (III-55)
если используются парциальные моляльные величины. Обратите
внимание, что [I? равно обычному химическому потенциалу \цу поскольку
монослой находится в равновесии с объемной частью системы.
Теперь введем понятие о коэффициенте активности. Прежде всего
необходимо определить какое-либо стандартное состояние. Для этого
удобно использовать наше предположение о том, что при достаточно
низких я пленка подчиняется закону двумерного идеального газа.
В качестве стандартного состояния примем состояние
гипотетической идеальной газообразной пленки при поверхностной
концентрации, равной единице, т.е. при Г°=1 или я° = ./?Г. Теперь растянем
пленку до давления я*:
Пленка (в стандартном состоянии) = Пленка (я*),
я*
A(i=fAdn=RTIn я*- RT In RT (Ш-56)
ztO=zRT
ИЛИ
|1*=ц° + Я71пГ*. (Ш-57)
Поскольку в пленке имеется только один компонент, то в обозначениях
Гиббса Ai=A. Если я* достаточно мало, реальная пленка имеет те же
Лия, что и идеальный газ. Теперь сожмем реальную пленку от
давления я* до я, при этом пленка займет площадь А:
Пленка (реальная, при я*)=Пленка (реальная, при я).
Изменение свободной энергии для этого процесса равно
я
Д(л=|я—|л* = \ Айл.
я*
Решая (III-58) совместно с (Ш-57), получим
я
р =JLt° + RT In Г* + Г Adn.
я*
Теперь можно определить коэффициент активности у°
ix^ii*+ RT \п(уаГ).
Из полученного выражения следует, что
я
lnva=— 1пГ + 1пГ* + (1//?Г) ^Adn.
я*
(Ш-58)
(III-59)
(III-60)
(Ш-61)
124
Глава III
Заметьте, что для пленок, подчиняющихся закону идеального газа, уа
равен единице. Уравнение (II1-61) в дифференциальной форме имеет
вид
diny* _ a in г ,_ 1 (Ш62)
dn dn l rRT
Поскольку dlnT — —din А, первый член в правой части этого
уравнения равен коэффициенту сжимаемости пленки [уравнение (Ш-19)],
взятому с обратным знаком, и уравнение (Ш-62) можно записать как
d\ny° А /ттт /?о\
-Ж-=ЯТ-*- <Ш-63>
Гершфельд и Патлак{113] получили уравнение (III-63) другим путем.
Упражнение. Чтобы можно было оценить уа с помощью уравнения (III-61),
необходимо, чтобы зависимость л—ст была измерена до достаточно низких значений я, при
которых пленка уже ведет себя как идеальный двумерный газ. Такие данные редко
имеются в распоряжении исследователя. Однако уравнение (III-61) можно
использовать в том случае, когда поведение пленки описывается уравнением (П-119), т. е.
п(о—o°)=kT. При этом уравнение (Ш-61) переходит в
In v0 = In (Я°УГ) + ™°/kT (Ш-64)
(напомним, что я*<я). Теперь, принимая а0=25 А2 в расчете на молекулу, можно
определить уа, скажем, для зх= 10 дн/см. При 25°С яа°=2,5-10-14 эрг, a no°[kT =
=0,608. Из уравнения (Ш-64) получаем 1:ра =1,183 или 7*= 3,26.
Иной термодинамический формализм развит в серии статей Лукассен-Рейндерс
[114]. В них рассматривается модель, в которой поверхностный слой состоит из
растворителя и раствора вещества, образующего монослой. Локальный химический
потенциал записывают в виде
tf'+RT In (yfxt),
где Xi — мольная доля /-го вещества. Кроме химического потенциала компонента в
объеме, в поверхностный потенциал включается работа образования поверхности, т. е.
R = rf's + RT In (v? xf) + я!|. (Ш-65)
В качестве стандартного принимается состояние компонента на «чистой»
поверхности, не содержащей других компонентов; xf определяется выражением ГУГтах, где
Гтах — максимально достижимая концентрация вещества в монослое. Для
разбавленных монослоев эта модель приводит к довольно простому уравнению состояния.
При этом принимают iii = \ii's, где индекс 1 относится к растворителю, Yi—1> a А\
оценивают по размеру молекул растворителя.
Чтобы приспособить эту модель к смешанным монослоям, позднее вместо
предположения о существовании Гщах было принято условие 2Л*Г* = 1. Полагая в первом
приближении, что [Xi = jj,?'s, для двухкомпонентного (по рассматриваемой модели —
трехкомпонентного) монослоя получаем
пАх = RT In
1+ ЛПГ2+Г3)
-«Tlntf. (Ш-66)
1 — -^2^-2 -™з1 3
Модель допускает ряд аналогий с обычной теорией растворов, как, например, пред-
полож
фазы.
положение о возможности изменения Yi B зависимости от состава поверхностной
8. Смешанные пленки
Остановимся вкратце на смешанных манослоях. Прежде всего
рассмотрим свойства пленок смесей веществ, каждое из которых само по
себе способно образовать монослой. Такие пленки могут существовать
как в виде идеального поверхностного раствора (например, пленки
двух сходных длинноцепочечных жирных кислот [115]), так и в виде
смеси двух взаимно нерастворимых компонентов (например, поливи-
Пленки на жидких поверхностях
125
н
НСН
\
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
\
но о
(^ЗА^)
Стеариновая
кислота
н
нсн
н /
не—сн
н \
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
\
нсн
/
нсн
V
но о
(jispT)
Изостеариновая
кислота
н
н нсн н
нсн н 1 н нсн
нсГУ^><Ч '
И\^с нс^сн Ur/
___.S__\_-L-/- S-«№-
ооо £#Лг
р
||
0
( 95.0А2 )
Три-п-крезилфосфат
Рис. III-27. Расположение молекул стеариновой кислоты, изостеариновой кислоты и
три-я-крезилфосфата на поверхности раздела вода—воздух [115].
нилацетат и поливиниловый спирт [83]). Кроме того, в смешанных
пленках возможно образование стехиометрических соединений.
Гаркинс и Флоренс [116] исследовали смешанные пленки спиртов,
кислот и аминов. Они нашли, что обычно раствор двух пленок L-типа
дает смешанную пленку того же типа. При смешении с пленкой S-типа
пленка L\ становится более конденсированной. При добавлении спирта
з пленку кислоты площадь пленки сокращается больше чем при
введении кислоты с цепью такой же длины. Это указывает на наличие
специфических сил притяжения между молекулами или на начало химиче-
:хого взаимодействия между этими двумя соединениями с
образованием нового соединения, хотя Гэйнс [1, стр. 290] считает, что ни
растворение монослоев, ни испарение через монослои не согласуются с
ннкими-либо количественными теориями.
Взаимодействие в смешанных пленках может сильно зависеть от их
:труктуры. Так, элаидиловый спирт (граяс-9-октадецениловый спирт) с
пепью линейной .конфигурации дает более конденсированную пленку,
чем tywc-изомер — олеиловый спирт, с разветвленной цепью. В смесях
1:1) с цетиловым спиртом граяоизомер дает высококонденсирован-
126
Глава III
50
45 h
$
t>
V*
«%
<ъ
$
<ъ
^
40
.§
0,
?
£f
<o
§
V
£.
^>
^
4U
35
30
2b
20
15
10
5\-
| , | | | ; | ■ ,- r | | - ,
L - Усредненная расчетная кривая
/I
L 14
\- \\\
1 1 *
J
■~1—1—1—
-^
ч
-^
^т-^—f 1
0 10 20 30 40 50 60 70 80 90 o 100 110 120 130 140 150
<7, Аг/молекула,
Рис. III-28. я—а-Изотермы стеариновой кислоты (У), три-/г-крезилфосфата (2) и их
эквимолярной смеси (3) и расчетная усредненная кривая (4) [115].
ные пленки, в то время как смешанные пленки с ^мс-изомером
характеризуются большими площадями, чем можно было бы ожидать, исходя
из суммы площадей пленок чистых компонентов. Вообще говоря,
заранее предсказать свойства смешанной пленки чрезвычайно трудно. Уже
отмечалось, что стеариновая и изостеариновая кислоты образуют почти
идеальную смесь. В то же время смесь стеариновой кислоты и такого
же по молекулярному весу, но очень объемистого три-я-крезилфосфата
(рис. Ш-27) при низких давлениях ведет себя так, словно поверхность
пленки определяется размерами последнего, а при высоких давлениях
органический фосфат как бы выжимается пленкой стеариновой кислоты,
при этом площадь пленки уменьшается (рис. III-28). Предельные
варианты смешанных пленок — идеальный раствор и совершенно несме-
шивающиеся соединения — интерпретируются легко. В обоих случаях
при постоянном я площадь должна быть аддитивной величиной, или
*ср=*1*; + *2< (Ш-67)
где о[ и а® — площади, приходящиеся на одну молекулу, в
соответствующих чистых монослоях при данном я. Свободную энергию смешения
xi молей пленки (1) при я + х2 молей пленки (2) при я=
=Смешанная пленка при я
можно определить следующим образом [118].
Сначала растянем пленки по отдельности до некоторого низкого
давления я*, при этом в соответствии с уравнением (II1-58) изменение
свободной энергии составляет
Л .1
AG*°2=—xi i Atdn—х2 I A2dn.
,1 U
Давление я* достаточно мало, чтобы пленки вели себя как идеальные.
Таким образом,
AG*min =RT (xi In Xi + x2 In x2).
Пленки на жидких поверхностях
127
Теперь опять сожмем пленку до давления я:
я
AG*x2=^Ai2dn.
я*
Общее изменение свободной энергии во всем цикле составляет
я
AG*a = Г (Л12—а:1Л1 — х2А2) dn + RT (x± In xt + л:2 In x2), (Ш-68)
я*
а избыток свободной энергии, таким образом, равен
я
AG*? = Г (i4ia—*A —х2Л2) Лгс. (Ш-69)
я*
Гудрич [118] показал, что для различных смесей кривые
зависимости AG*£ от концентрации во многом напоминают аналогичные кривые
для неидеальных растворов. Приведенный подход в дальнейшем был
развит в работах Гэйнса [119] и Каденхеда и Демхака [120].
Описан еще один тип взаимодействия в монослоях — так
называемая пенетрация, или проникание, в процессе которой более или менее
поверхностно-активный компонент подложки входит в растянутый
монослой. В некоторых случаях при этом наблюдается значительное
разбавление монослоя. Так, монослои длинноцепочечных аминов и стеро-
лов заметно расширяются, если подложка содержит растворенные
низкомолекулярные кислоты или спирты, например уксусную .кислоту.
Обзор ранних работ по пенетрации содержится в статье Ридила '[121].
В очень многих работах исследуется пенетрация цетилсульфата натрия
и подобных поверхностно-активных (ПАВ) соединений в пленки
биологических материалов. Годард и Шульман [122] считают, что цетил-
сульфат натрия образует с пленками дигитонина и эйкозиламина
комплексы (1:1). Используя водный раствор хлористого натрия в
качестве подложки, чтобы уменьшить растворимость ПАВ, Петика и др.
[123], а также Фоукс [124] изучали пенетрацию в пленки цетилового
спирта додецилсульфата натрия. Фоукс [125], кроме того, работал со
смешанными монослоямл цетилового спирта и цетилсульфата натрия,
используя хлористый натрий для уменьшения растворимости ПАВ.
Лукассен-Рейндерс [126] применила уравнение типа (III-66) для
описания таких смешанных систем, как лаурат натрия — лауриновая
кислота.
Имеется ряд работ по реологии смешанных пленок. Для полностью несмешиваю-
щихся пленок можно ожидать усреднения обратных вязкостен, т. е. текучестей.
Вероятно, это относится и к идеальным смесям. Пэтил и Кэтти [127] наблюдали довольно
регулярные (хотя и сильно зависящие от скорости сдвига) изменения вязкости в
смесях сякргъв с длшгйъгшг д'егоштг. Реология" смесей подробно рассматривается Жоли
[Ю1].
Смешанные пленки образуются также ,и при абсорбции
органических паров пленкой. Монослои стеариновой кислоты сильно
абсорбируют гексан до предельного соотношения 1 : 1 [128]. Если
поверхностную плотность считать дополнительной переменной, при этом
получаются изотермы, напоминающие изотермы адсорбции газов на твердых
телах.
9. Скорости испарения через мономолекулярные пленки
Определенный интерес вызывает уменьшение скорости испарения
подложки в результате покрытия поверхности пленкой. Большинство
работ в этой области выполнено на пленках, растекшихся на водных
128
Глава III
подложках. В таких случаях вследствие низкой растворимости ПАВ
активность воды практически не меняется: пленка влияет только на
скорость испарения, но никак не влияет на равновесную упругость
водяных паров.
Для определения скорости испарения воды через пленку применяют
следующую методику. Над пленкой помещают коробку, закрытую
снизу шелковой сеткой и содержащую порошкообразный осушитель,
обычно хлористый литий. Коробку устанавливают на 1—2 мм выше
исследуемой поверхности .и измеряют изменение ее веса до и после
нанесения пленки. Скорость поглощения воды выражают в виде m/t A, т.е. в
г/см2-с. Эта величина пропорциональна (Cw—Cd)/R, где Cw и Са —
равновесные концентрации водяных паров над водой и осушителем
соответственно и R — диффузионное сопротивление цепи между
поверхностью и сеткой. Качественно R можно рассматривать как сумму ряда
сопротивлений, соответствующих различным диффузионным градиентам
в системе
•*4>бщее "^поверхность \ ^пленка Т" ^осушитель =='*м) i ^пленка
Здесь Ro представляет собой диффузионное сопротивление в
отсутствие пленки. Скорость испарения можно описать уравнением
r = A(Cw-Cd) [(t/m)f-(t/m)w]9 (Ш-70)
где г — удельное сопротивление испарению (с/см), а индексы f к w
относятся к поверхности с пленкой и без нее соответственно.
Для определения относительного уменьшения скорости испарения
часто над исследуемой поверхностью пропускают поток сухого газа.
Это довольно точный метод. Скорость испарения контролируют по
содержанию -воды в пробе, отбираемой в средней части пленки.
Используя в качестве газа-носителя Не и помещая соответствующий датчик
для определения состава газа по изменению теплопроводности, можно
осуществлять непрерывный контроль скорости испарения [129].
На рис. Ш-29 показано несколько типичных кривых, полученных
Ла-Мером и др. [130]. При высоких поверхностных давлениях скорость
испарения может уменьшаться на 60—90%—очень значительный
эффект. Подобнее же результаты получены для различных жирных
кислот и их эфиров [131]. На скорость испарения довольно сильно влияют
также алкоксипропанолы и алкоксибутанолы {132].
Получение воспроизводимых и надежных данных по скорости испарения через мо-
нослойные пленки является серьезной проблемой. Как показывает рис. Ш-29, б,
удельное сопротивление испарению г сильно зависит от природы соединений, образующих
пленку. Например, тщательная очистка я-октадеканола приводит к сильному
увеличению г его пленок [133J. Такая зависимость объясняется, возможно, тем, что
поверхностно-активные вещества способны растворять некоторое количество воды, при этом
в монослоях образуются «карманы», или «каналы». Барнес [134] объяснил
экспериментальные данные с помощью модели, в которой предполагается, что транспорт воды
идет через поры в монослое, возникающие вследствие теплового движения.
Из температурной зависимости г можно найти кажущуюся энергию активации
испарения. Для длинноцепочечных спиртов вклад одной группы СНг составляет около
200 кал/моль. Правда, энергия активации зависит от давления, что до некоторой
степени позволяет отнести ее к процессу образования пор в плотном монослое 1[135].
Одной из проблем, возникающих при детальном анализе процесса испарения,
является значительное охлаждение поверхности испаряющейся воды. Джарвис [136] нашел,
что разность температур между непокрытой и покрытой пленкой (но обдуваемой
потоком воздуха) поверхностями составляет 5 градусов. Майзелс [137] также
проявляет озабоченность по этому поводу.
Важность исследований такого рода не вызывает сомнений. По
оценке Ла-Мера [135], только на западе США из водохранилищ ежегодно
испаряется около 20-109 м3 воды. Первые попытки использовать
монослои для уменьшения испарения воды в водохранилищах были сделаны
Мзнсфильдом [138] в Австралии. С тех пор довольно успешные
испытания были проведены и в ряде других районов.
10
15 20 25 30 35 40
жу дн/см
30 35
яг, дн/см
Рис. III-29. Влияние длины алкильной цепи «-спиртов на сопротивление испарению
воды при 25 °С (а) и влияние растворителя пленки на сопротивление испарению (б)
[130].
Обозначения- /) G8OH — н-гексан; 2) G8OH — керосин; 3) Ci6OH — н-гексан; 4) CiSOH — керосин;
5) Ci6OH — бензол; 6) Ci6OH наносится в твердом виде без растворителя.
9—1421
130
Глава III
Во всех этих опытах использовался технический цетиловый спирт,
обеспечивающий удовлетворительное соответствие между удельным
диффузионным сопротивлением и скоростью растекания пленки. Очень
важно, чтобы используемое поверхностно-активное вещество обладало
высокой скоростью растекания. Пленка должна не только быстро
формироваться при -нанесении на поверхность, но и противостоять действию
ветра .и быстро восстанавливаться при повреждениях, вызываемых
волнами и лодками. Требуется также, чтобы пленка обладала достаточной
биологической стойкостью, не нарушала экологических условий в
водохранилищах, в частности не мешала аэрации воды.
10. Скорость растворения монослоев
Скорость растворения монослоев представляет собой интересный,
нередко практически важный вопрос. Так, скорость растворения
определяет скорость потери вещества в монослоях, используемых для конт-
. роля испарения воды. Эта проблема тесно связана с вопросом о том,
находится ли нерастворимый монослой в равновесии с лежащим под
ним объемом воды. В случае растворов поверхностно-активных
веществ (гл. I, рис. 1-19) растворение пленки — по существу, процесс,
обратный медленному старению или установлению равновесного
поверхностного натяжения.
Если давление пленки поддерживать постоянным, то обычно после
короткого начального периода система описывается уравнением
k=\*e-kt (III-71)
или iB дифференциальной форме
(dn/dt)K=—kn, (III-72)
где п — число молей поверхностно-активного вещества в пленке. Как
отмечает Тер-Минасян-Сарага '[139], это выражение можно
рассматривать как описание процесса стационарной диффузии. Модель
растворения пленки по механизму стационарной диффузии приведена на
рис. 111-30. Предполагается, что пленка находится в равновесии с
раствором, расположенным непосредственно под ней и имеющим
концентрацию С/. В соответствии с уравнением (III-60) можно записать
K=y*r/Cf. (III-73)
Концентрация в равновесном подслое принимается достаточно низкой,
и, следовательно, изменениями коэффициента активности здесь можно
пренебречь. Скорость-определяющей стадией процесса растворения
считается диффузия через тонкий неподвижный слой раствора
толщиной б. Согласно закону Фика,
dn/dt=—ADdC/dx=-(n/T) (D/6) (Cf—C), (Ш-74)
где, как и раньше, я=АГ; D — коэффициент диффузии и С —
концентрация поверхностно-активного вещества в объеме раствора. В начале
процесса С значительно меньше С/ и, следовательно,
k=DCf/6T =Dy°/8K. (III-75)
В общем случае коэффициент активности у0 связан с поверхностным
давлением уравнением (Ш-61), и отсюда можно рассчитать
зависимость k от поверхностного давления. В частности, используя уравнение
(III-63), получаем
d In k/dn = A/RT— x. (III-76)
Гершфельд и Патлак [113] проверили последнее уравнение для
монослоев лауриновой .кислоты и цетилового спирта и нашли, что оно
удовлетворительно описывает экспериментальные данные.
Пленки на жидких поверхностях
131
Рис. Ш-30. Модель растворения
пленки по механизму стационарной
диффузии [140].
\Воздух шпдиищшш
1 ^>и!'тХ \°f'
{Вода >» J t
1 \ ■
• Л Л А
Раствор
>
Диффузионный механизм обычно дает верхний предел скорости
растворения монослоев. В общем случае перенос вещества из пленки в
лежащий под ней слой раствора может идти через химический актива-
ционный барьер, и, хотя при этом уравнение (Ш-72) по-прежнему
описывает скорость растворения, значение k теперь меньше рассчитанного
по диффузионному механизму. Случай сочетания химического и
диффузионного процессов рассмотрен в работе Хансена [141].
К счастью, при исследовании монослоев растворение протекает настолько
медленно, что можно без особых хлопот изучать свойства равновесных пленок, хотя многие
пленки, по ^существу, нестабильны. Гэйвс [1] отмечает, что равновесная растворимость
стеариновой кислоты составляет 3 мг/л и что пленки, содержащие всего лишь десятую
часть того количества кислоты, которое может быть растворено, можно изучать, не
обращая внимания на возможность растворения. Значительный барьер, по-видимомут
имеется и для растворения белковых пленок. Нередко, однако, растворение может
быть серьезной проблемой, особенно при работе с низкомолекулярными веществами
или заряженными монослоями.
Упражнение. Если для водного раствора стеариновой кислоты принять, что D^
» 10~6 см2/с, С/ « 3 мг/л или~10-8 моль/см3 при Г==7-10-10 моль/см2 и б = 10~3 см,
то в соответствии с уравнением (III-75) k должна составлять около 0,01 с-1.
Фактически скорость растворения значительно ниже. Похоже, что скорость процесса в целом
определяет скорость химической реакции, а не диффузии.
11. Реакция в мономолекулярных пленках
Реакции в мономолекулярных пленках являются довольно
интересным объектом исследования не только потому, что в монослоях можно
изучать многие обычные химические реакции (при этом, конечно,
необходимо, чтобы одно из реагирующих веществ образовывало
монослой), но и потому, что, меняя поверхностное давление, можно
контролировать ориентацию молекул в пространстве и тем самым
специфически влиять на эти реакции. Некоторые протекающие в пленках про-
цессы представляют особый интерес из-за сходства с процессами в
биологических системах. Один из первых обзоров по данной теме
опубликован Дэвисом -[142]. В разд. III-13 упоминается одно из возможных
новых направлений в этой области, а именно исследование быстрых
реакций и релаксационных процессов.
Л. Кинетика реакций в пленках
Изучать реакцию в пленках методами, которые используются для
исследования реакций в объемных системах, обычно неудобно, а иногда
и невозможно. Использовать для этой дели химические анализы также
9*
132
Глава III
трудно и неудобно, поскольку, даже если одно из реагирующих веществ
находится в растворе, в реакции участвует только малая его часть
(в лучшем случае микромоль). Конечно, проведение таких анализов
становится практически возможным при использовании меченых
атомов. Собранные с поверхности пленки анализируют также методом
инфракрасной спектроскопии [143]. Измерения in situ можно
проводить, если в результате реакции меченое вещество входит или выходит
с поверхности раздела или если образующее пленку вещество,
например, хлорофилл [144], обладает характерным спектром поглощения,
меняющимся в ходе реакции.
В большинстве исследованных систем пленка реагирует с
некоторым веществом в растворе, как, например, при гидролизе эфирных
монослоев и окислении ненасыщенных длинноцепочечных кислот водными
растворами перманганата. В результате реакции вещество,
образующее пленку, может измениться (и при этом площадь пленки,
приходящаяся на одну молекулу, станет совсем другой) или может
разделиться на растворимые в воде фрагменты. Очевидно, что за ходом реакции
можно следить, контролируя либо изменение площади при постоянном
поверхностном давлении, либо изменение давления при постоянной
площади пленки (почти так же, как при исследовании гомогенных
газовых реакций); в обоих случаях параллельно можно проводить
измерения поверхностного потенциала.
Прежде чем вывести некоторые кинетические уравнения, целесообразно доказать
следующую лемму. Рассмотрим некоторое свойство системы Р, которое является
аддитивным свойством компонентов, т. е.
Р = Рапа + РвПв> (Ш-77)
где Ра и Рв— значения P в расчете на моль компонентов А и В; Ла и л в— число
молей каждого компонента. Если первоначально имеется только вещество Айв ходе
реакции оно частично вытесняется веществом В, причем стехиометрически один моль
А заменяется b молями В, то Р определяется выражением
Р = ЬРвп°А + (РА- ЬРВ) лА. (Ш-78)
Если принять, что эти изменения обусловлены реакцией, которая протекает до
полного завершения, и обозначить Рапа через Р° и ЬРътгк через Р00, получим
*а/"а =•' (р ~ рс°)/(ро - р™). (Ш-79)
Представляют интерес следующие случаи.
Случай 1. Химическая реакция протекает при постоянном
поверхностном давлении, и образуется растворимое вещество. При этом
А°°=0 и
пА/п°А = А/А° (Ш-80)
Если пленка взаимодействует с одним из компонентов раствора,
концентрация которого поддерживается, по существу, постоянной, то имеет
место реакция первого порядка:
пА=п%г*'. (III-8I)
Следовательно,
А=А°ег*' (Ш-82)
Случай 2. Химическая реакция протекает при постоянном давлении,
при этом образуется нерастворимое вещество, остающееся в монослое.
Обычно принимают, что площадь пленки является аддитивной
величиной, т. е. общая площадь пленки равна сумме площадей, которые
могли бы занять реагирующие и образующиеся соединения по
отдельности. Если изменение площади, обусловленное химической реакцией,
Пленки на жидких поверхностях
133
не слишком велико, это допущение может быть удовлетворительным,
хотя, как показало обсуждение смешанных монослоев в разд. Ш-8,
при этом нельзя исключить возможность серьезной ошибки. Однако,,
если это допущение приемлемо, то
/iA/ni=(A—A-)/(A°—A00). (III-83)
Если лимитирующей является первая стадия и ее скорость
определяется постоянной концентрацией реагирующего вещества, растворенного
в подложке, то опять мы имеем реакцию первого порядка:
(А— А°°)/( А0—А°°) =erkt. (III-84)
Случай 3. Химическая реакция протекает при постоянной общей
площади пленки, а я меняется. Формально в этом случае можно
записать уравнение, подобное уравнению (III-84):
(к—я°°)/(д°—я00) =егм . (Ш-85)
При этом подразумевается, что при постоянной площади
поверхностное давление является аддитивной функцией состава. Строго говоря,
такое допущение возможно только для смесей идеальных двумерных
газов или смешанных пленок, которые подчиняются уравнению (III-50)
с постоянными а я Ьу линейно меняющимися с концентрацией, однако
эти условия выполняются довольно редко.
Случай 4. Измеряется изменение поверхностного потенциала во
времени. В соответствии с уравнением (III-16) AV=4nn\x/D и,
следовательно,
ААУ=4яяА[хА=аА/2А. (Ш-86)
Поскольку число молей аддитивно, то произведение АДУ также
должно быть аддитивной величиной при условии, что в ходе реакции для
каждого вещества а остается постоянным. Последнее условие
означает, что эффективный дипольный момент и, следовательно, ориентация
молекул каждого вещества остаются неизменными, а это вполне
допустимо при постоянном поверхностном давлении. Тогда для реакции
первого порядка
(АДУ— А°°Д V°°)/( А°Д V0 — А°°Д Vе0) =e~kT. (III-87)
Б. Кинетика образования и гидролиза эфирных монослоев
Примером щелочного гидролиза служит омыление а-моностеарил-
глицерида [145]; образующийся при этом глицерин растворяется, а
анион стеариновой кислоты образует с а-моностеарилглицеридом
смешанную пленку. Реакция омыления описывается уравнением (III-84) с
k = k'[OH-]\ кажущаяся энергия активации составляет 10,8 ккал/моль.
Дэвис [146] исследовал процесс, обратный омылению, — лактонизацию
Рис. 111-31. Скорость лактонизации y-окси-
стеариновой кислоты при различных поверх- ^ дн/гм
ностных давлениях. ь,ип/см
134
Глава III
h-OH
hOH
о—
о
н
и т.д.
-о—
Рис. III-32. Возможные ориентации
молекул у-оксистеариновой кислоты.
Y-оксистеариновой кислоты (на кислотных подложках). Как показали
отдельные опыты, при постоянном л; для смешанных монослоев AV
является линейной функцией состава, что позволяет использовать
модифицированное уравнение (III-'87). Реакция лактонизации имеет первый
порядок, ее константа скорости пропорциональна концентрации ионов
водорода и зависит от поверхностного давления (рис. III-31).
Изменение k в зависимости от я можно объяснить, предположив, что y-OKcvi-
стеариновая кислота может иметь различные конфигурации
(рис. 111-32), причем, так же как в теории Миттельмана и Палмера
(разд. Ш-6Б), вероятность каждой возможной конфигурации
определяется больцмановским множителем. Автор рассчитал стерический
фактор как функцию я, предполагая, что в реакции могут участвовать
только конфигурации с окси-группой на поверхности. Кроме того, по
температурной зависимости стерического фактора удалось объяснить
зависимость энергии активации от я. Согласно Дэвису,
k=yzperEi*T> (Ш-88)
где ф — переменный стерический фактор. Следовательно,
—d In k/d (1 IT) =E/R — d In cp/d (1 /T)
ЕКЛЖ=Е + ЕСТ. (HI 89)
Александер и др. [147] провели серию работ по исследованию скорости
гидролиза монослоев сложных эфиров на щелочных подложках. Авторы нашли, что гидролиз
эфиров типа RCOOR' с длинным R и коротким R'b сжатых пленках типа S идет
довольно медленно, а в пленках с низким давлением он протекает значительно быстрее.
При длинных R' гидролиз протекает очень быстро. Эти наблюдения качественно
можно объяснить тем, что при коротком R' (этил) при сжатии короткая цепь
выталкивается под поверхность (рис. III-33, а) и, таким образом, экранирует эфирную группу
от действия гидроксил-иона. Если обе углеводородные цепи достаточно длинные,
более вероятна конфигурация, показанная на рис. 111-33, б. Это приводит не только к
тому, что эфирная группа остается легко доступной для подложки, но и к тому, что
при увеличении поверхностного давления эфирная группа подвергается некоторой
деформации, и в результате энергия активации гидролиза уменьшается. С точки зрения
Миттельмана и Палмера (разд. 1П-6Б), это означает, что состояние L\ более активно,
чем состояние 5. Изменение расположения молекул эфира при различных давлениях
качественно подтверждается сравнением экспериментальных значений AV со
значениями, ожидаемыми теоретически (см., однако, разд. Ш-ЗБ). Шульман [148]
наблюдал аналогичное поведение системы при разложении различных сложных эфиров
панкреатином. Полученные данные автор также объясняет наличием различных
конфигураций, вероятность которых зависит от поверхностного давления.
Многочисленные примеры гидролиза, включая гидролиз глицериновых эфиров и
другие поверхностные реакции, рассмотрены в работе Ридила [149].
Дэвис и Ридил [150] попытались разработать более совершенную
теорию гидролиза сложных эфиров, в частности монослоев ионов моно-
цетилсукцината. Отправной точкой в этой теории является следующее
предположение: поскольку поверхность раздела заряжена, локальная
концентрация гидроксил-ионов не может быть такой же, как в объеме
подложки. Поверхностный слой рассматривается как объемная фаза
толщиной 10 А. С помощью уравнения Доннана авторы рассчитали
фактические концентрации ионов моноцетилсукцината и гидроксильных
Пленки на жидких поверхностях
135
■/
н-с-н
н-^с-н
/
н-с-н
х=о
/
н-с-н
Ч U ^
\v
>-н
н'
н-
н-
/
\
н-
/
-Л
\
/
н-с-н
:с-н н-с-н
/
/
н-с-н
У
с
II
0
£
Рис. II1-33. Ориентации молекул сложных эфиров в монослоях.
ионов и оценили коэффициенты активности. Дзвис и Ридил исследовали
также влияние хлористого натрия на скорость гидролиза. Полученные
результаты сопоставлены с теоретической оценкой. Расчетные
концентрации в поверхностном слое были довольно высоки (1—3 моль/л),
и, поскольку из-за ориентационных эффектов этот слой определенно не
изотропен, теория, по-видимому, носит полуэмпирический характер.
В то же время совершенно очевидно, что гидроксил-ионы
электростатически выталкиваются из заряженной пленки моноцетилсукцината, что
можно приблизительно оценить с помощью доннановского соотношения.
(В разд. Ш-14 дана более изящная теория заряженных монослоев.)
Оценим для примера доннановский эффект при я=10 дн/см для
пленки, занимающей 55 А2 на молекулу. Номинальная концентрация
моноцетилсукцината в пленке составляет 3,0 моль/л. Доннановский
эффект возникает вследствие того, что активности хлористого натрия,
или упрощенно [Na+][OH-], в объемной и поверхностной фазах равны.
[Na+ЫОН-Ь = [Na+]s[OH"L (Ш-90)
или
С2=(3,0 + х)х, (Ш-91)
где С — объемная концентрация гидроокиси натрия и х— ее
концентрация в поверхностном слое (при условии электронейтральности
поверхностной фазы с 3 молями моноцетилсукцинат-ио'нов связано
3 моля Na+). Таким образом, если С=0,1, то # = 0,0033, а если С= 1,0,
то л; = 0,3. Следовательно, десятикратное увеличение С приводит к
почти стократному возрастанию х и скорости реакции. Примерно такая же
зависимость наблюдается и на опыте.
В. Реакции с участием двойной связи
Изучен еще один тип реакции — реакция окисления двойной связи.
Миттельман и Палмер [87] обнаружили, что на разбавленном
растворе перманганата площадь пленки триолеина при 8 дн/см меняется с
течением времени, как показано на рис. Ш-34. Первоначальное
увеличение площади (участок кривой 1), по мнению авторов, обусловлено
реакцией
—СН2—СН=СН-СН2 > — СН2-СНОН—СНОН—СН2—
которая сопровождается возрастанием степени фиксации средней части
молекулы в поверхностном слое. Последующее быстрое уменьшение
площади (участок II), по-видимому, связано с делением окисленной
136
Глава HI
J: ■ Рис. Ш-34. Окисление триолеинового
О 400 монослоя на поверхности водного рас-
Время,мин твора перманганата.
молекулы на два относительно растворимых соединения, а
окончательное медленное уменьшение (участок III) обусловлено своего рода
полимеризацией. Первоначальная реакция имеет псевдопервый порядок
и описывается уравнением (Ш-83); константа скорости этой реакции
пропорциональна концентрации перманганата.
Константа скорости, как установлено, падает с увеличением
поверхностного давления. Качественно этот эффект можно объяснить,
рассчитав изменение вероятности «нахождения двойной связи на
поверхности (метод описан в разд. 1И-6Б). Эда [151] исследовал окисление
других кислот с длинными углеводородными цепями. Марсден и Ридил
[110] нашли, что при перманганатном окислении монослоев эруковои
и брассидовой кислот (цис- и граяс-форма соответственно) образуется
только диоксикислота, хотя в растворе эта реакция является более
стереоспецифической.
На практике изучение реакций, продукты которых остаются в пленке (как в
рассмотренной выше реакции), осложняется тем обстоятельством, что площади
реагирующих и образующихся веществ не являются аддитивными, т. е. образуется
неидеальная смешанная пленка. Джилби и Александер [152], исследуя окисление пленок
ненасыщенных кислот на перманганатных подложках, нашли, что смешанные пленки
ненасыщенной кислоты и диокислоты (промежуточный продукт окисления)
действительно далеко не идеальны. Авторы смогли интерпретировать данные для олеиновой и
эруковои кислот с учетом отдельно определенных поправок на отклонение свойств
смешанных пленок от идеальных.
Реакция олеиновой кислоты и триолеина с I или С1 приводит к таким же
изменениям площади смешанной пленки, как реакция окисления. Это говорит о том, что
добавки I и С1, как и введение двух ОН-групп, повышают гидрофильность
углеводородов.
Г. Другие химические реакции
Реакциям в пленках посвящено очень много работ, мы рассмотрели только
немногие из них. Другими примерами таких реакций являются реакции полимеризации,
например полимеризация альдегида стеариновой кислоты [154], фотохимические
процессы и различные биологические реакции. К фотохимическим реакциям, в частности,
относятся разложение монослоев стеариланилида светом длиной волны 240 нм [155],
фотохимическое превращение пленок эргостерола в витамин D [156], различные
фотохимические реакции монослоев белков [159], фоторазложение и тушение
флуоресценции в монослоях хлорофилла [144, 158]. В очень интересной работе Виттена [159]
описано частичное уменьшение площади смешанных пленок трипальмитина и цис-тио-
индигового красителя вследствие изомеризации последнего в транс-форму под
действием ультрафиолетового излучения. Субмонослоиные пленки ненасыщенных жирных
кислот и их сложных эфиров на силикагеле подвергаются самоокислению со
скоростью более низкой, чем скорость аналогичной реакции в гомогенном растворе
(самоокисление сопровождается хемилюминесценцией) [159а].
12. Белковые и полимерные пленки
А. Общие свойства и структура пленок
Исследовать белковые и другие полимерные пленки сложно как
экспериментально, так и теоретически. Экспериментальное их изучение
затруднено из-за того, что, хотя и природные, и синтетические полипеп-
Пленки на жидких поверхностях
137
мг/ме
мг/ме
Рис. Ш-35. Белковые пленки [165].
я —глиадин, рН 5,9; б —яичный альбумин на 35%-ном сульфате аммония.
тиды обычно водорастворимы, равновесные пленки на поверхности
используемых подложек образуются очень медленно и на практике их
приходится получать методом растекания. На поверхность подложки
белковый раствор наносят либо в виде пленки, медленно стекающей
по палочке, которая касается поверхности Г160], либо в виде капель,
или очень медленно подают с помощью шприца [161—163]. Некоторая
часть белка неизбежно теряется вследствие смешивания с подложкой,
а остальная часть образует пленку, на которой можно проводить
обычные измерения я—cr-кривых. Если пленку не сжимать до давлений
выше ~'20 дн/см, обычно получаются вполне обратимые изотермы;
при слишком большом сжатии возможна необратимая коагуляция
белка (см., например, [164]).
На рис. Ш-35 и Ш-36 приведены некоторые данные для монослоев
глиадина, яичного альбумина и поли-у-метил- l -глутамата. При очень
низких поверхностных давлениях пленки ведут себя подобно
идеальному двумерному газу; Бул [166] нашел, что такие пленки очень хорошо
описываются уравнением (П-133). Начиная с того момента, когда а
составит ~1 м2/мг (или ~17 А2 на аминокислотную группу), л:
быстро возрастает и при о около 5—10 А2 на группу пленка коллапсирует.
С увеличением поверхностного давления сжимаемость полипептидных
пленок [см. уравнение (Ш-19)] обычно возрастает {162, 168].
Поверхностный потенциал рассматриваемых пленок нередко мало меняется с
поверхностным давлением (см. рис. Ш-37), что означает увеличение
вертикальной составляющей дипольного момента при уменьшении я
(рис. Ш-35). Изотермы некоторых полипептидов включают почти гори-
ПМГ//яНгО
'5 0 ю 15 го
А, Аг/'аминокислотная группа.
25
Рис. Ш-36. Изотермы поли-у-метил-ь-глутамата, наносимого на поверхность в виде
растворов с различным соотношением содержания растворителей хлороформ—пиридин
[lei].
а — 93% пиридина; 6 — 77% пиридина; в—100% хлороформа.
138
Глава III
А, А /аминокислотная группа
Рис. II1-37. Свойства полипептидных монослоев на поверхности раствора соляной
кислоты, рН 3, 20 °С.
а — поли-у-метил-Ь-глутамат; б — поли.у-этил-Ь-глутамат, в — поли-'у-бенэил-Ь-глутамат; г — по-
ли-0,Ь-лейцин: д — поли-О-аланин; е — поли-Э-а-амино-н-бутиловая кислота; ж — поли-Ь-норва-
лин, з — поли-Ь-норлейцин.
зонтальное плато, отражающее своего рода фазовый переход
(рис. Ш-37). Наконец, вид изотермы может в очень большой степени
зависеть от типа используемой подложки (рис. III-36) и концентрации,
при которой пленка растекается [168].
Теоретическая интерпретация в данном случае сильно осложнена
из-за неопределенности структуры пленок. Вообще говоря, понятно, что
растекшиеся белковые пленки состоят из полимерных молекул, в
значительной мере развернутых и вытянутых, т. е. имеющих (3-форму [169],
причем полярные группы соединены водородными связями с
молекулами воды в подложке, а боковые цепи в зависимости от их природы
ориентированы либо вверх, либо вниз (рис. Ш-38). При определенных
условиях растекания на поверхности может сохраниться также
некоторая часть исходной спиральной а-структуры (рис. III-39). Присутствие
а-спиралей проявляется в определенных особенностях инфракрасных
спектров поглощения коллапсированных пленок [170]. Не исключено,
однако, что спиральная конфигурация белковых молекул может
восстанавливаться в процессе коллапса. Важным дополнительным
свидетельством действительного присутствия а-спиралей в монослоях
является то, что скорость дейтериевого обмена пленки с подложкой слишком
низка для пленки с развернутыми молекулами [167]. Эти
наблюдения и обнаруженная с помощью методов дифракции электронов
R Н О Н
ч / ■■ I
Wv
Н Н R О
Рис. Ш-38.
Пленки на жидких поверхностях
139
Воздух^
[Вода
Воздух^
[Вода
_
-р-Форма s Неполярная
< боковая цепь
Нашивная % Полярная
форма <Ь боковая цепь
Рис. III-39. Схематическое изображение белковых молекул на поверхности
раздела [163].
а — полностью развернутая молекула; б — частично развернутая молекула.
кристалличность сколлапсированных пленок привели к совершенно
иной картине, показанной на рис. 111-40. Как теперь считают, белковая
пленка состоит из интактных а-спиральных молекул, образующих
второй, третий и т.д. слои при сжатии.
Окончательно вопрос о структуре белковых пленок еще не решен.
Следует помнить только, что белковые пленки не могут находиться в
равновесии с растворенным белком (см. упражнение 8), так как,
вероятно, существует некоторый барьер, предположительно структурный,
препятствующий растворению молекул пленки при сжатии.
При очень низких поверхностных давлениях в белковой пленке
вполне могут существовать развернутые молекулы, и Зингер [171]
считает, что в таких условиях применима теория Флори — Хаггинса для
полимерных растворов. В этой теории молекула полимера
рассматривается как цепь из п звеньев (аминокислотных остатков в случае
белков), каждое из которых обладает определенной гибкостью,
характеризуемой числом z. Для жесткой цепи z равно 2, а для гибкой цепи оно
может достигать 4. При плотной упаковке один сегмент цепи занимает
площадь Ь, средняя площадь пленки, приходящаяся -на сегмент,
равна а. Длинная гибкая цепь, предоставленная самой себе, не является
ни полностью развернутой, ни полностью свернутой. 0«на находится в
некотором промежуточном состоянии, скорее всего почти развернутом.
При сжатии цепь становится более компактной; при этом
конфигурационная энтропия уменьшается. Таким образом, как я, так и z
должны зависеть от давления.
Зингер дает следующее уравнение (в упрощенной форме):
л:=—(kT/b) {In (1 -b/a) — l(n—l)/n] (г/2) In (1 — 2b/zo)}. (111-92)
На рис. 111-41 приведены данные для яичного альбумина; сплошная
линия рассчитала по уравнению (111-92) с 2=2,015. При низком я
3
дит в бислой. А
Рис. 111-40. Полипептидный монослой в виде це- F~ _ ______
почки спиралей; при сжатии монослой перехо- / К^*
ЛИТ R биЛЛПЙ А О
140
Глава III
8 °А \ ■]
о/у ^^^.^ "1
н ^^"—^J Рис. II1-41. Проверка уравнения Зингера:
яичный альбумин на поверхности 35%-ного рас-
2 '—-Jz ' ' ' 1 1 твора сульфата аммония (область низкого
о 10 12 14 давления). Сплошная линия — эксперименталь-
А'10 ная кривая.
уравнение (III-92) сводится к закону идеального двумерного газа, а
при г = 2 — к уравнению (III-40).
Фриш и Симха [172] разработали более общую теорию, в которой
учитывается вероятность того, что часть полимерной цепи погружена в
водную фазу. (В отсутствие этого эффекта полученное авторами
уравнение сводится к уравнению Зингера.) В теориях Зингера и его
последователей, по существу, используются стохастические методы, в
которых последовательно учитываются всевозможные конфигурации
полимерных молекул. Чтобы упростить картину, эти авторы полагают, что
центры адсорбции (и прилегающий раствор) образуют некоторую про-
Рис. III-42. Адсорбционные петли на кубической решетке (вид на поверхность снизу).
Пленки на жидких поверхностях
141
стую геометрическую решетку. На рис. III-42 изображена квадратная
решетка центров, рассматриваемая как бы из глубины раствора, и
отдельные типы конфигурации полимер-ной молекулы, образующей
погруженные в раствор петли. Рисунок взят из работы Зильберберга
[173], который исследовал влияние различных структурных
ограничений (например, неспособность отдельных центров поверхности или
сегментов полимера к адсорбции) на адсорбционное равновесие.
Б. Реакции белковых пленок
В литературе имеются некоторые данные о взаимодействиях в
смешанных белковых пленках. Примером может служить проникание
поверхностно-активных веществ в смешанные пленки глиадина и
холестерина [174] и образование ассоциативных комплексов в смешанных
пленках стеринов и канцерогенных углеводородов. Дервишан [176]
исследовал также ряд случаев стехиометрического взаимодействия
смесей биологических материалов (в разд. III-8 обсуждаются возможные
осложнения, возникающие при интерпретации таких опытов). В
интересной серии работ Гайдушека и Доути [177] показано, что антитела
Вассермана проникают в 1 : 1-смешанный монослой кардиолипина и
холестерина значительно быстрее, чем человеческий глобулин. Витамин
Кь компонент хлоропластов, взаимодействует в смешанных пленках с
хлорофиллом а слабо, однако он эффективно тушит
флуоресценцию [178].
Большой интерес вызывает вопрос о том, сохраняют ли ферменты в
монослоях каталитическую активность. Имеющиеся по этому поводу
данные являются противоречивыми. Каплан [179] нашел, что каталаза,
нанесенная на поверхность в виде монослоя и затем сжатая в нить,
сохраняет способность к каталитическому разложению перекиси
водорода. Чисмэн и Шуллер [180] сомневаются, что в этих опытах пленки
действительно были образованы развернутыми молекулами. Авторы
нашли, что пепсиновые монослои, осажденные на бумагу путем
отсасывания подложки через фильтровальную бумагу, не сохраняют
активность. По данным Хаяши [181] в смешанной пленке с альбумином
пепсин может катализировать гидролиз последнего. Ферментативная
активность перенесенных трипсиновых пленок зависит от доли развернутых
молекул в пленке [162].
Кроме различных химических взаимодействий, исследовались также
реакции фотохимического и радиационного разложения. Расширение
монослоев яичного альбумина под действием ультрафиолетового
излучения Каплан и др. [179, 182] объясняют вероятным разрушением
связей более прочных, чем относительно слабые связи (главным образом
водородные), разрывающиеся при растекании. Смит [183] исследовал
инактивацию пленок каталазы и бычьего сывороточного альбумина
рентгеновским излучением; Хатчинсон [184] изучал инактивацию
этого же белка медленными электронами. Огенстайн и Рэй [185]
описали влияние ультрафиолетового и рентгеновского излучения на
ферментативную активность трипсиновых монослоев.
В. Белковые пленки на поверхностях раздела типа вода — масло
Интерес к белковым пленкам, безусловно, прежде всего связан с
биологическими проблемами. Работа с монослоями на поверхности
вода — воздух показывает, что, хотя спиральная структура белковых
молекул в таких слоях может нарушаться, большинство связей не
разрушается и сохраняется некоторая биологическая активность. В живых
системах поверхности раздела относятся главным образом к типу
142
Глава III
Ю 20 30 40
А, ^/аминокислотная группа
50
Рис. Ш-43. Свойства монослоев поли-ОЬ-фенилаланина на поверхностях раздела
вода—петролейный эфир и вода—воздух [195].
Поверхности раздела, / — .воздух — вода; 2 — масло — вода.
вода — масло, поэтому в ряде работ исследовались пленки именно на
таких поверхностях.
Александер и др. [186] изучали различные природные и
синтетические полипептиды на поверхностях раздела простой эфир — вода,
бензол— вода и т.п. На этих поверхностях пленки сильно растянуты по
сравнению с пленками на поверхности раздела вода — воздух, однако,
как показано на рис. Ш-43, и здесь имеется точка резкого возрастания
вязкости и упругости пленки. Дэвис [187] исследовал на поверхности
раздела вода — петролейный эфир пленки гемоглобина, сывороточного
альбумина, глиадина и полимерных синтетических полипептидов. Целью
работы было определение поведения биологически важных групп
e-NH2. Автор пришел к выводу, что при сжатии пленки эти группы
выталкиваются в масляную фазу.
Кривые зависимости я от а для таких систем все еще описываются
уравнением (111-92). При этом, правда, приходится использовать
большие значения z, что указывает на большую гибкость цепи.
Предположительно это связано с тем, что в присутствии масляной фазы
ослабляется когезия между боковыми гидрофобными цепями белковой
молекулы.
Г. Другие биологически важные пленки
Монослои разнообразных биологически важных материалов
исследуются довольно широко. Упомянем только некоторые сравнительно
недавние работы. В обзоре Кейденхеда [188] рассматриваются пленки
Пленки на жидких поверхностях
143
синтетических фосфолипидов, причем особое внимание уделяется
взаимодействию с холестерином—важным компонентом клеточных
мембран. Работа Гэйнса [189] посвящена монослоям биологически важных
хинонов (участвующих в фотосинтезе и других процессах переноса
энергии).
В настоящее время разработаны методики получения очень тонких
пленок или мембран в воде, т. е. систем типа вода — пленка — вода.
Так, раствор липида, занесенный на проволочную рамку, погруженную
в воду, образует пленку, которая, утончаясь, последовательно
окрашивается в различные интерференционные цвета; в конце концов
образуется черная пленка толщиной от 60 до 90 А [190]. Липидные пленки
напоминают мыльные пленки на воздухе (см. разд. ХН-9) и, что очень
важно, могут служить моделью биологических мембран. Эта модель
обсуждается, например, в работе Гуда [191].
Поверхности могут активно индуцировать свертывание крови.
В последнее время проводятся широкие исследования синтетических
материалов, не вызывающих образования тромбов. Такие материалы
используются для хирургического восстановления кровеносных
сосудов '[192]. По-видимому, в этом случае важно, чтобы на поверхности
искусственного сосуда прочно адсорбировалась пленка защитного
белка. На взаимодействие клеточных стенок большое влияние может
оказывать также структура воды [194].
Д. Полимерные пленки
Как указывалось выше, пленки высокомолекулярных полимеров по
своим физическим свойствам часто сходны с -белковыми пленками.
Общий вид я—tx-кривых в обоих случаях одинаков, и теоретические
подходы, рассмотренные в разд. Ш-12А, применимы к полимерным
пленкам так же, как к белковым. При средних давлениях я—а-кривые
полимерных пленок почти линейны или относятся к типу L2.
Экстраполяция этих кривых из области умеренных давлений на нулевое
давление дает значения площади, пригодные для характеристики пленки.
Эта площадь (часто ее относят к одному сегменту полимерной
молекулы; при этом, как правило, приводят также давление, при котором
пленка коллапсирует), величина Ь, служащая подгоночным параметром
в уравнении (III-92) или в каком-либо другом подобном уравнении, и,
возможно, сжимаемость-—вот, пожалуй, вся информация (обычно
табулируемая), которая используется для описания свойств полимерных
пленок. Большая часть работ, посвященных этому вопросу,
рассматривается в обзоре КрйспЕг[196] и более позднем сжатом обзоре Эйриха
и др. [197], поэтому здесь мы остановимся только на некоторых
последних результатах исследований.
Многие полимеры, по-видимому, образуют пленки с плоской
конфигурацией молекул. Так, различные сложные полиэфиры [198] дают
экстраполированные значения удельной поверхности около 2,5 м2/мг,
что, согласно расчету, соответствует площади 60—70 А2 на сегмент или
толщине монослоя 3—5 А. То же самое характерно и для монослоев
поливинилацетата, однако монослои поливинилбензоата ведут себя
совершенно иначе [199]. Поливинилбензоат дает очень компактный
монослой с экстраполированной а = 9 А2 на мономер, соответствующей
толщине пленки около 20 А. Сжимаемость такой пленки очень близка к
сжимаемости пленки стеариновой кислоты, т. е. около 0,006 см/дн, тогда
как сжимаемость обычных полимерных пленок составляет ~0,02—
0,1 см/дн. По-видимому, для пленок поливинилбензоата характерна
плотная упаковка бензольных колец. Авторы работы {200] исследовали
144
Глава III
пленки стереорегулярных полиметилметакрилатов и установили, что
изотактические и синдиотактические пленки имеют совершенно разные
я—сг-кривые*.
13. Пленки на поверхностях типа жидкость — жидкость
и неводных поверхностях
В последние годы все больше внимания уделяется пленкам на
поверхностях раздела типа жидкость — жидкость (чаще всего типа
^вода—жидкость). Некотлры-е работы в этой интересной области были
рассмотрены в предыдущих разделах, посвященных белковым и
полимерным пленкам. Хатчинсон [201] описывает ряд опытов на пленках
кислот с неразветвленными цепями и спиртов на поверхностях раздела
вода—бензол, вода — циклогекса-н и вода — См'Нзо. Во всех случаях
спирты (гексиловый, октиловый, дециловый и додециловый) давали
более конденсированные пленки, чем кислоты (масляная, капроновая,
каприловая и лауриловая), с экстраполированной площадью молекулы
в плотном монослое 20 А2. Правило Траубе (разд. Ш-7Г) к этим
системам не применимо, что указывает <на непараллельную ориентацию
молекул на поверхности раздела. Данные по адсорбции спиртов на
поверхности раздела вода — октан описываются уравнением (П-67)
или (П-133), при этом, однако, с увеличением длины цепи площадь
молекулы в плотном монослое возрастает, поэтому можно
предположить, что ориентация не является строго вертикальной [202]. Как
правило, при данном поверхностном давлении площадь пленок спиртов
и кислот на исследованных поверхностях раздела больше, чем на
границе вода — воздух. (Этого, собственно, можно было ожидать, поскольку
неполярный растворитель стремится уменьшить когезию между
углеводородными цепями.) Однако давление, при котором происходит
переход газообразной пленки в конденсированную фазу, более низкое,
возможно потому, что значительная боковая адгезия между полярными
группами при высоком сжатии с избытком компенсирует уменьшение
когезии между углеводородными хвостами. Исследования заряженных
монослоев на поверхностях раздела масло—вода вкратце обсуждаются
в следующем разделе.
Что касается техники эксперимента, то здесь следует отметить несколько
используемых методов. Во-первых, для прямого измерения поверхностного давления в
системах типа жидкость — жидкость можно применять соответствующим образом
модифицированные пленочные весы [203, 204]; однако при этом необходимо помнить о
возможности утечки по барьеру. Поскольку очень часто пленкообразующий материал
растворим в масляной фазе, поверхностное натяжение можно измерять при
различных концентрациях. Для определения поверхностного натяжения Хатчинсон [205]
применяет метод сидящего пузырька, тогда как другие авторы используют метод
кольца или пластинки Вильгельми [206] (см. разд. 1-8). Брукс и Петика [207]
разработали пленочные весы с ванной, снабженной приспособлениями для очистки поверхности
раздела и сжатия межфазной пленки; для измерения у и, следовательно, я
использована гидрофобная пластинка Вильгельми. Авторы утверждают, что весы очень
хорошо работают при фиксированной площади поверхности раздела, когда поверхностное
давление поднимается путем добавления поверхностно-активного материала, однако
при высоком поверхностном давлении растекание пленки не всегда является полным.
Межфазные потенциалы в таких системах измеряются с помощью вибрирующего
электрода [208]; в полярной масляной фазе возможны прямые измерения с помощью
высокоимпедансного вольтметра [208а]. Для определения вязкости пленки применяют
крутильный маятник [187] (см. также [209]).
*Представим себе, что полимер типа (—СН2—CHR—)п растянут таким образом,
что углеводородный скелет молекулы вытянулся в плоскую зигзагообразную цепь. При
этом атом водорода и группа R могут лежать по одну или по разные стороны
плоскости молекулы. В изотактическом полимере все группы R находятся по одну
сторону плоскости; в синдиотактическом полимере группы R располагаются попеременно
то по одну, то по другую сторону плоскости; атактический полимер характеризуется
случайным расположением групп R.
Пленки на жидких поверхностях
145
В настоящее время опубликовано довольно много работ, в которых
рассматриваются пленки на поверхности раздела ртуть — воздух.
Многие из этих работ обсуждаются в обзоре Смита [65], который
охватывает как технику, так и результаты эксперимента.
Эллисон и Зисман [204] исследовали монослои полимерного поли-
метилсилоксана и белка зеина на таких подложках, как светлое
минеральное масло, я-гексадекан и трикрезилфосфат. В работе Джарвиса
и Зисмана [210] обсуждается качественная картина растекания ряда
фторированных органических соединений «а разнообразных
поверхностях раздела типа жидкость — воздух; для некоторых систем с гиб-
бсовскими монослоями приводятся я—а-зависимости.
14. Заряженные пленки
А. Уравнение состояния заряженной пленки
В последние годы все шире исследуются свойства заряженных
пленок, например пленок жирной кислоты «а щелочных подложках или
пленок солей четвертичного аммония, и разрабатывается их теория. Как
указывается в разд. 1П-11Б, один из подходов к таким системам
состоит в том, что поверхностный слой рассматривается как тонкая
объемная фаза, ионный .состав которой одределяется доннановским
равновесием. Картина электрических силовых линий в заряженном монослое
дана на рис. III-44 [211]. В плоскости CD, проходящей через ионные
группы, поле является переменным, тогда как в растворе уже на
небольшом расстоянии от этой плоскости дискретные заряды действуют
почти так же, как однородная заряженная поверхность. Доннановский
подход, по-видимому, наиболее оправдан, если ио-ны из раствора
проникают в собственно область CD и фактически могут находиться
между плоскостями CD и АВ.
Напомним, что эффект Доннана приводит к вытеснению
одноименно заряженных ионов подложки из зоны заряженной поверхности и
концентрированию здесь ионов с противоположным знаком заряда.
Перераспределение ио-нов обусловливает появление доннановского
потенциала i|)d. Для пленки, состоящей из положительно заряженных
поверхностно-активных ионов S+, можно записать
сТ/с+^ё-**'*7 (Ш-93)
и
c7lc-=№kT, (III-94)
где с+ и с~ — концентрации поверхностно-неактивных ионов, индекс 5
обозначает, что данная концентрация относится к межфазному слою
толщиной т. Перемножая оба уравнения, получаем требуемое условие
равновесия c+c~ = csCs (коэффициентами активности пренебрегаем).
Поскольку с+=с~ = с (с — объемная концентрация симметричного
Рис. Ш-44. Электрические силовые линии заряженного монослоя [210].
10—1421
146
Глава HI
электролита), в случае нерастворимого поверхностно-активного иона
это условие упрощается:
с2 =cfc7. (Ш-95)
Для сохранения электронейтральности 'необходимо, чтобы в
межфазной области Cs= (5+) +с£, и, таким образом, уравнение (III-95)
переходит в
(S+)=c2/ct-c+ (III-96)
или, если использовать уравнение (III-93)*, в
(S+)Me^D/kT-e~e^/kT)c=2csh(e^>D/kT). (III-97)
Далее, учитывая, что (S+) = 1000 Г/t (Г — поверхностный избыток,
моль/см2) или (S+) = 1000-1016/Мт<7 (о — площадь в А2 на молекулу),
решаем уравнение (III-97) относительно i|)d:
yD=(kT/e)arcsh( 1000- l016/2Nxoc). (111-98)
Это уравнение можно упростить, предположив, что т, представляющее
собой глубину, на которой происходит разделение ионов, в точности
равно 1/х, толщине ионной атмосферы в теории Дебая — Хюккеля
(разд. IV-2). Если рассматривается электролит типа 1:1,
к=(8ne2N/1 OOODhTyW*.
Если заменить в уравнении (Ш-98) т на 1/х и подставить численные
значения (для воды при 20 °С), получим следующее значение tyD в
милливольтах:
\|)D = 25,2arcsh(2- 134/ас1/»). (Ш-99)
Используя уравнение (П-129), можно рассчитать донна.новский
вклад в поверхностное давление:
n^V, =RTNl=RTn\lnl (III-100)
или
nos=RT(nl/A). (IIH01)
Общее число молей в поверхностном слое определяется выражением
САт/1000, где С — сумма концентраций всех присутствующих ионов.
C=(S+) + cf i-cr=(S+) + 2cch(etyD/kT). (ПИ02)
Фактически нас интересует избыточная концентрация:
Cnet=(S+) + 2с [ch (e^fDlkT) -1 J. (Ш-103)
Решая совместно это уравнение с уравнением (Ш-101), получаем
я=ЯЛу+ (^Pj [ch (erifolkT)-1] (ИМ 04)
Второй член этого уравнения и есть доннановский вклад в
поверхностное давление, т. е.
я* =(w) fch №о№)-\ ]. (ИМ 05)
Для воды при 20 °С, опять-таки принимая т=1/х и используя
уравнение (Ш-99), имеем
nD = 1,52с1/» [ch arc sh (2 -134/го1/») — 1 ]. (Ill-106)
*Напомним, что shx="2"Ce*—е~х) и chx=-2(ex-{-e~x).
Пленки на жидких поверхностях
147
Рис. II1-45. я—а-Кривые пленки
Ci8H37N(CH3) з на поверхности раствора
NaCl при 21 °С [211].
Если (2-134/ас1/2) достаточно велико (около 4), уравнение (III-106)
упрощается:
jtD==kT/o— 1,52с1/».
Включая вклад от (S+), получаем
лИонов=2*7,/а— 1,52с1/!. (ПИ 07)
В рассмотренной теории предполагается, что поверхностный заряд
распределен по толщине т=1/и. 'В другом предельном случае можно
считать, что заряд равномерно размазан по плоскости CD, а проти-
воионы образуют диффузную часть двойного слоя (см. разд. IV-4); при
этом потенциал, обычно его называют потенциалом Гуи, равен
i|)G=50,4arcsh(134/ac1/2). (Ill-108)
Расчет опять проводился для системы вода — электролит (1:1) при
20 °С, if© выражен в милливольтах. Полученное выражение мало
отличается от г|)д, даваемого уравнением (III-99). Так, если (1. ч<--
равно 2 (например о=67 А2 на молекулу и концентрация ионов в
подложке равна 1 моль/л), то г|зс = 73 мВ, а ^d='53 mB. Доннановский
потенциал \|)D и должен быть меньше, поскольку при его выводе
предполагалось, что межфазный заряд распределен по толщине т, а не
сконцентрирован на плоскости.
Как будет показано в разд. IV-2, образования двуслойной
системы, связанной с поверхностью, потенциал которой равен некоторой
величине -фо, на единицу площади расходуется свободная энегрия
яв=6,10с1/»[сЬ(еф0/ЛГ) -1] (III-109)
(опять же для системы вода — электролит (1:1) при 20 °С). Решая
совместно уравнения (III-109) и (III-108), получаем*
пе=6,1 Ос1/* [ch arc sh (134/ас1/2) _ l ]. (Ц1- 11 о)
Дэвис [211] вывел аналогичное уравнение, предполагая, что \fG и <ф0
тождественны.
Это предположение проверялось при обработке данных для
монослоев Ci8H37N(CH3)3 на водном растворе хлористого натрия. На
рис. III-45 приведена зависимость поверхностного давления от площади
в этой системе. При площади 85 А2 на молекулу и с=0,01 моль/л
фс, рассчитанный по уравнению (III-108), составляет 177 мВ.
Подставляя это значение в качестве гр0 в уравнение (Ш-109), получаем
значение Пе около 9 дн/см. Поскольку измеряемое поверхностное давле-
*ch arc sha=yi+a2.
20
X 15
•§ 10
К
vs^
50 100
^/длинноцепочечный, ион
150
10*
148
Глава III
200
160
«Q /20
^ 80
40
-2,0 -1,5 -1,0 -0,5 0 0,5
Цс
Рис 111-46. Зависимость i|) от концентрации хлористого натрия для монослоев
CI8H37N(CH3)J [211].
Сплошная линия рассчитана по теории Гуи; точками показаны значения функции, рассчитан-
о
ные по экспериментальным данным / — i|>AB из ЛУ; 2 — 1|>0 из (бя/6 Т) 85 А2; 3 — г|) из Я — а-кри-
БОЙ.
ние составляет 5,5 дн/см, давление в гипотетической ионизованной
пленке равно —3,5 дн/см, т. е. предполагается, что
•^пленки = ^е + ft0.
Зная величину я0, далее можно рассчитать значения г|)0 для различных
концентраций соли. Результаты этого расчета приведены на рис. Ш-46.
Сплошная линия представляет a|)G, рассчитанный по уравнению Гуи
{III-108), а точки соответствуют экспериментальным данным. Как
видно из рисунка, во всем диапазоне концентраций "фо и i|)G, по существу,
одинаковы.
Насколько допустима обработка данных по приведенным выше
уравнениям, сказать трудно. Член я0 вводится только на основании
предположения, что пленка является двойной (см. разд. 1П-6Б);
реальное поверхностное давление (в отличие от давления растекания толстой
пленки) для углеводородов — величина положительная, а не
отрицательная. Если предполагать, что jc0 имеет только положительные
значения, то данные рис. 111-45 можно обрабатывать по уравнению
(III-106), базирующемуся на доннановской модели. В обеих теориях не
учитывается влияние коэффициента активности (т. е. взаимное
притяжение ионов и их дискретность). По-видимому, этими эффектами
пренебрегать нельзя. Так, Сиэрс и Шульман [212] нашли, что л—о-кривые
пленок стеариновой кислоты на растворах МОН в значительной мере
зависят от того, является ли М ионом Li+, Na+ или К+.
При достаточно большой величине 134/ас1^ уравнение (III-110)
приводится к виду
ne=2kT/o—69l&2. (Ill-Ill)
Это уравнение похоже на уравнение (Ш-107), основанное на
доннановской модели. Если неионизованная часть пленки ведет себя как
идеальный газ, то к уравнению (III-111) добавляется еще слагаемое kT/o:
^пленки =3kT/G— 6, ltf/2. (ИМ 12)
Уравнение (III-112) приблизительно описывает свойства пленки
четвертичной аммониевой соли, нанесенной на поверхность раздела
масло—вода [213]. Правда, авторы работы [213а] нашли, что при
низких с предельное значение па равно 2kT.
Пленки на жидких поверхностях
149
Б. Межфазные потенциалы
Для .ионизованной пленки Кэсси и Палмер [214] предлагают
уравнение
AV = 12я|ы/о = 12n\i0/o -J- г|)АВ
(ИМ 13)
(множитель 12 появляется здесь в связи с тем, что [х выражено в мил-
лидебаях, а — в ангстремах в квадрате «а заряд, a AV — в
милливольтах).
Тогда
(др/дс)с=(др0/до)с+ (1/12я) 1(д(о^АВ)/да)с)
12я (д2~\1/дод In с) = [д2 (otyAB)/dod In с].
Из уравнения (III-108) следует
12я (д^/дод In с)=— kT/e.
(Ill-114)
(Ш-115)
Данные Дэвиса хорошо согласуются с последним уравнением, если
концентрация соли меньше 0,1 М. При более высоких концентрациях,
как установлено в работе [215], имеются значительные отклонения,
которые к тому же специфически зависят от природы аниона
растворенного электролита. Эти отклонения авторы объясняют тем, что при
высоких концентрациях противоионы входят в поверхностный слой и
предположение о заряженной плоской поверхности явно становится
неприемлемым; в этих условиях доннановский подход дает лучшие
результаты.
Проблема межфазных потенциалов детально анализируется Дэви-
сом и Ридилом [216]. На рис. Ш-47 схематически изображено
изменение гальвани-потенциала ср при прохождении через поверхность
раздела масло — вода. В случае адсорбции на поверхности положительных
ионов при пересечении межфазной границы ф возрастает до
максимума, но затем опять уменьшается вследствие того, что отрицательный
двойной слой пристраивается к поверхности в масляной фазе. Если
электролит растворяется в масляной фазе очень слабо, толщина этого
двойного слоя становится очень большой и он формируется медленно.
В этом случае (то же самое справедливо и для поверхности раздела
типа вода — воздух) вибрирующий электрод находится внутри
двойного слоя и AV, по существу, соответствует изменению пограничного
потенциала фазы Дг|) и, таким образом, непосредственно отвечает
природе адсорбированной пленки. Однако, если растворимость
электролита в масляной фазе вполне заметна, двойной слой является тонким и
образуется быстро, и поэтому вибрирующий электрод находится в
области, обладающей свойствами масляной фазы в объеме. Теперь
измеряемое изменение потенциала электрода равно Аф, и, если раствори-
Рис. III-47. Изменение гальвани-потенциала
при прохождении через поверхность
раздела масло—вода [216].
Расстояние —**
150
Глава III
мость образующего пленку вещества невелика, оно зависит от природы
объемных фаз. В этом случае AV мало и в основном определяется
природой присутствующих электролитов, а не материалом пленки, т. е. в
такой системе фактически измеряется потенциал электрохимического
элемента.
15. Капиллярные волны
О капиллярных волнах, т. е. волнах, свойства которых
определяются в основном поверхностными силами, а не силами тяжести,
вскользь упоминалось в разд. 1-1 ОБ. В последнее время интерес к
этому явлению значительно возрос, поскольку стало ясно, что, изучая его,
можно получить полезную информацию о релаксационных свойствах
пленок, адсорбированных на жидких поверхностях раздела. Эта область
исследований еще не достигла достаточно высокого уровня развития, и,
к сожалению, мы вынуждены ограничиться только кратким
изложением основных представлений.
Математическая теория, по крайней мере в ее современной форме,
довольно сложна, поскольку наряду с основными уравнениями
движения она включает специальные граничные условия, в частности
учитывает, что поверхность может обладать вязко-упругими свойствами.
В общем случае элемент жидкости должен удовлетворять двум типам
уравнений сохранения. К первому типу относится уравнение сохранения
массы:
ди/дх + ди/ду=0,
(III-116)
где х и у — горизонтальная и вертикальная координаты элемента
(рис. III-48), а и и v — их производные по времени, т.е. скорости
движения элемента. Уравнение (III-116) можно вывести, если потребовать,
чтобы сумма всех потоков через единичный куб в направлениях х и у
равнялась нулю. Второе условие сохранения требует, чтобы все силы в
системе уравновешивались (т.е. энергия сохранялась). Это условие
можно записать в виде пары уравнений, известных как уравнения
Навье — Стокса:
pdu/dt + риди/дх + pvdu/dy = —дР/дх + т|Ды (III-117)
я
pdv/dt + pudv/дх + pvdv/ду = —дР/ду -j- Ц Ау—pg, (III-117)
(1) (2) (3) (4)' (5) (6)
kv+dv
U + dlL
Рис. III-48.
Пленки на жидких поверхностях
151
где р — плотность. Три левых члена этих уравнений являются
инерционными членами, т. е.
Сила =d (mv)/dt =mdv/dt -f- vdm/dt,
если масса не остается постоянной; член (1) соответствует компоненту
mdu/dt, а члены (2) и (3) — vdm/dt. Член (4) дает силовую
составляющую, обусловленную градиентом давления; член (5) учитывает
вязкое трение; член (6) соответствует гравитационной силе. На
поверхности имеют место следующие граничные условия: вертикальная
компонента давления равна давлению в газовой фазе плюс лапласовское
давление (уравнение (1-7) или у/г для плоской волны), а
горизонтальная компонента давления определяется скоростью изменения
поверхностного натяжения с изменением площади, т. е. dy/дА. Для чистой
жидкости ду/дК принимается равной нулю, а для поверхности,
покрытой пленкой, этот член пропорционален поверхностной упругости,
определяющей релаксационные свойства пленок, из-за которых может
возникать фазовый сдвиг. Принято считать, что проскальзывание между
поверхностным слоем и подложкой, а также аномалии вязкости
отсутствуют.
Для экспериментального исследования капиллярных волн обычно
используют колеблющуюся полоску, генерирующую, по существу,
синусоидальные волны. В этом случае решения уравнений (III-116) и
(III-117) имеют вид
u=Uiexp(iwt) + U2exp(2iwt).. ,
(ПИ 18)
v=Vi exp (iwt) + У2 ехР (2iwt)... .
Объединяя эти выражения с уравнениями сохранения и вводя
граничные условия, находят соотношения, из которых и определяются
коэффициенты U и V. Приведенный краткий вывод взят из работы ван ден
Темпеля и Рита [217]. Ранее теория капиллярных волн была
разработана Гудричем [218] и независимо от ван ден Темпеля Хансеном [219].
Решения не удается получить в замкнутой форме, они представляются
последовательными приближениями, как, например, в работе Маяна и
Хансена [220]. Два недавних обзора по данной теме принадлежат Лу-
кассен-Рейндерс и Лукассену [221] и Хансену и Ахмаду [222].
В строгой математической теории капиллярных волн детально
разобраться довольно трудно, и Гаррет и Зисман [223] дали простое, но
полезное приближение. Если силами тяжести можно пренебречь,
уравнение (1-45) приводится к виду
v2=2ny/pk. (ИМ 19)
Амплитуда цуга волн, генерируемых бесконечно длинным линейным
источником, затухает экспоненциально с расстоянием от источника:
A=Ajrk*a (III-120)
По Гудричу коэффициент затухания k определяется выражением
Д>=8яг]а)/37, (Ш-121)
где со — частота колебаний. Исследование зависимости коэффициента
затухания от поверхностного давления обеспечивает чувствительную
индикацию структурных изменений, хотя детально разобраться в этих
данных весьма трудно. (Не забывайте, что пока еще очень трудно
интерпретировать экспериментальные значения вязкости пленок, а это
гораздо более простая величина, чем k.)
Рис. II1-49 показывает, что с изменением поверхностного
давления k может меняться очень сложным образом, хотя я—а-кривая
152
Глава III
200 300
а%Аг/молекула,
Рис. II1-49. Зависимость коэффициента затухания волн пленок полидиметилсилоксан
гептадекана на поверхности воды от молекулярной площади пленки при 25 °С.
структурирована относительно слабо, т. е. на ней нет ярко выраженных
экстремумов. Эти результаты лучше коррелируют не с вязкостью
пленки, а с ее упругостью. Качественно они объясняются последовательным
изменением структуры пленки в зависимости от степени образования
водородных связей с находящейся в подложке водой и
упорядоченности молекул поверхностно-активного вещества. Обратите внимание на
чувствительность k к частоте; детальное изучение дисперсии k дает
информацию о характерных временах релаксации различных структур
в пленке.
Хансен и соавторы использовали в качестве источника колебаний магнит
громкоговорителя, приводящий в движение (вверх — вниз) стержень, торец которого
касается поверхности, а чувствительным элементом детектора служит патрон с кристаллом
звукоснимателя. Для генерации линейных волн Зисман и др. [223] применяют
электромеханический преобразователь, соединенный с длинным ножом. Картину стоячих
волн визуально наблюдают с помощью стробоскопического освещения.
16. Пленки, осажденные на поверхности твердых тел
А. Надстроенные пленки
Большой интерес вызывают пленки, осажденные на поверхности
твердых подложек, например на стеклянные или металлические
пластинки. Так, если стеклянную пластинку поднимать через монослой сте-
арата бария на воде, то, как показано на рис. III-50, к пластинке
прилипает пленка, гидрофобная поверхность которой ориентирована
наружу. Поверхность пластинки, покрытой пленкой, гидрофобна, причем в
значительно большей степени, чем поверхность самого стеарата бария.
Если затем пластинку погружать обратно через поверхность,
покрытую пленкой, то на ней «спиной к спине» осаждается второй слой.
Последовательные слои, надстроенные этим методом, Блоджет [224]
Пленки на жидких поверхностях
153
Рис. Ш-50.
назвала F-пленками. Такие пленки обладают либо гидрофобной, либо
гидрофильной поверхностью в зависимости от направления, в котором
пластинка в последний раз проходила через монослой. Аналогично
надстроенные пленки, состоящие из одинаково ориентированных
монослоев, называют Х-пленками. Судя по интерференционным полосам,
такие пленки могут включать сотни монослоев.
Последовательно (нанесенные монослои, по-видимому, не
обязательно обладают фиксированной ориентацией. В ставшем классическим
исследовании надстроенных Х- и F-пленок стеарата бария с помощью
рентгеновских лучей Эхлерт [225] пришел к выводу, что внутренняя
ориентация в обоих типах пленок одинакова. Предполагается, что
У-структура более стабильна.
Надстроенные пленки детально обсуждаются Гэйнсом [1], поэтому
здесь упомянем только несколько наиболее существенных работ.
Исследуя оптические свойства надстроенных пленок, Бейтмен и Ковингтон
[226] заключили, что в мультислоях стеарата бария на стеклянной
пластинке, покрытой хромом, оси цепей находятся в наклонном
положении, причем с увеличением поверхностного давления угол наклона
уменьшается. С помощью инфракрасной абсорбционной спектроскопии
Эллис и Паули [227] определили состав мультислоев опять же
стеарата бария, полученных из монослоев на подложках, содержащих
небольшие количества ионов тяжелых металлов. Кун и др. [706]
использовали надстроенные пленки для получения чрезвычайно интересных
данных о процессах, протекающих в возбужденных состояниях (см.
также книгу ван Олфена и Майселса, указанную в общем списке
литературы к данной главе).
Б. Монослои
Гэйнс [1] различает «активные» и «неактивные» осажденные
пленки. В пленках первого типа слой воды, первоначально находящийся
между пленкой и пластинкой, быстро выдавливается, тогда как
в пленках второго типа1 вода остается. Поэтому активные
пленки прочно держатся на пластинке, а неактивные нередко могут
переноситься назад на поверхность воды. Спинк [78] утверждает, что
осажденные пленки стеариновой кислоты обычно покрывают такую же
площадь, как монослои на поверхности воды, т. е. коэффициент
переноса равен приблизительно единице. Пленки, осажденные на слюде и
различных металлических поверхностях, стабильны, но те же
пленкообразующие вещества, осажденные на кремнезем или стекло, стремятся
агрегироваться в кристаллические домены, возможно, потому, что
удерживающаяся на поверхностях этих материалов пленка воды
154
Глава III
предотвращает непосредственное взаимодействие полярных головок с
твердым телом.
Как уже говорилось, осажденные монослои стеарата бария могут
быть чрезвычайно гидрофобными; так, Лэнгмюр наблюдал пленки,
которые .не смачивались ни водой, ни органическими жидкостями [228].
Позднее Зисман и др. [229] нашли, что «вытянутые» пленки, т. е.
пленки, сформированные вытягиванием пластинки из раствора или
расплава соединения типа RX с длинной цепью, часто не смачиваются
этим соединением в жидком виде. Такие пленки называют автофоб-
ными. Как и Лэнгмюр, авторы объясняют автофобность тем, что
внешняя поверхность, состоящая из плотноупакованных метальных групп,
образует слой, который действует так, как будто его поверхностное
натяжение намного меньше поверхностного натяжения
соответствующего жидкого соединения. Объяснение Зисма-на можно
сформулировать, пользуясь понятием «критического поверхностного натяжения»,
рассматриваемым в разд. VI1-4Д. Осажденные монослои таких
соединений RX-типа, как жирные кислоты и амины, могут удерживаться
исключительно прочно, об этом свидетельствуют, например, опыты по
стиранию пленок [230] (см. также разд. УП-4Д), а также устойчивость
пленок при испарении их в высоком вакууме [231]. Природа
подложки, конечно, имеет важное значение; так, поверхностный потенциал
пленок жирных кислот, осажденных на поверхность NiO (с которой
они, несомненно, взаимодействуют химически), меняется при переходе
от цепей с нечетным числом атомов углерода к цепям с четным числом
атомов углерода, тогда как при использовании инертной подложки,
например платины, такого эффекта не наблюдается. Углеводороды с
четным числом атомов углерода, например гексан, образуют на
поверхностях металлов прочные «монослои» [49]. Это показывает, насколько
рискованным было бы утверждать, что пленки, осажденные из
раствора, не содержат следов растворителя, если последний является очень
летучим.
Установлено [223], что монослои, осажденные на слюду и
различные металлические пластинки, можно переносить с одной твердой
подложки на другую. Вначале предполагалось, что перенос
осуществляется в результате поверхностной диффузии молекул по мостикам,
возникающим в точках контакта двух твердых тел. Позднее, однако,
были получены некоторые данные, говорящие о возможности переноса
молекул через паровую фазу [234].
17. Упражнения
1. По данным Зисмана и др. '[9а], для гептанола-1 на воде при 20 °С 5В/а =
= 36,9 дн/см, yb = 26,1 дн/см. Рассчитайте Yab.
2 Один из прямых методов определения Sb/a состоит в следующем. Инертный,
или «передающий», монослой наносится в ванну пленочных весов, затем на
поверхность помещается капля жидкости В и измеряется поверхностное давление системы
Fb/a (А — жидкость в ванне). Покажите, что .Fb/a = «Sb/a. «Передающий» монослои
должен быть инертным, т. е. он должен не смешиваться с В, а действовать просто
как среда, передающая поверхностное давление, создаваемое каплей В.
3. Используя уравнение Джирифалко — Гуда и принимая Ф равным единице,
рассчитайте Yab в упражнении 1.
4. Даны следующие поверхностные и межфазные натяжения при 20 °С:
Поверхность раздела у Поверхность раздела у
Воздух —вода 72 Ртуть —вода 415
Воздух — валериановая Ртуть — валериановая
кислота 25 кислота 329
Воздух — гексан 18 Ртуть —гексан 378
Воздух — ртуть 485 Вода — гексан 50
а) Должна ли валериановая кислота растекаться на поверхности раздела ртуть —
вода?
Пленки на жидких поверхностях
155
б) Если она растекается, то как при этом ориентируются полярные группы: к
воде или к ртути? Объясните почему.
5. Пользуясь понятиями работы адгезии и когезии, выведите выражение для
коэффициента растекания вещества С на поверхности раздела двух жидкостей А и В.
6. Выведите закон идеального двумерного газа как аналог закона идеального
трехмерного газа в простой кинетической теории газов.
7. Используя метод Миттельмана и Палмера (разд. Ш-6Б), рассчитайте для
олеиновой кислоты теоретическую кривую зависимости k/k° от я. В данном случае k° —
предельная (максимальная) константа скорости окисления олеиновой кислоты на
поверхности водного раствора перманганата. Считайте, что двойная связь реагирует с
максимальной скоростью, когда она находится на поверхности, и вовсе не реагирует
вне поверхности.
8. По данным Дэвиса [211], при 21,5 °С пленки лаурата натрия и лауровой
кислоты, для которых а равны соответственно 70 и 50 А2/молекула, десорбируются со
скоростями, относящимися друг к другу как 6,70 : 1. Рассчитайте я|?о (потенциал
плоскости CD на рис. Ш-44).
9. Как, согласно уравнению Гиббса, должно было бы меняться поверхностное
натяжение в зависимости от концентрации, если бы уравнение состояния монослоя имело
вид no = 3kT?
10. При каких физических ограничениях или допущениях можно ожидать
выполнения кинетического закона
(AV— AV°°)/(A7°— ДУ°°)=е-*'?
11. Выведите уравнение (III-66).
12. С помощью уравнения (111-46) рассчитайте я—а-кривую для монослоя
поверхностно-активного вещества В, нанесенного на воду А. Примите, что для
углеводородной части 5в(А)/5А(В) равно —11 дн/см, а а0 составляет 12 А2/молекула.
13 Используя теорию Гуда — Фоукса, рассчитайте Ywh для углеводорода,
поверхностное натяжение которого при 20 °С составляет 29 дн/см. Таким углеводородом
может быть бензол. Сравните полученный результат с экспериментальными значениями
Ywh и объясните имеющиеся расхождения.
14. Рассчитайте для пленки белка с типичным молекулярным весом 35 000
ожидаемое увеличение растворимости при возрастании я на 1 дн/см. Результаты расчета
еще раз показывают, что белковые пленки не находятся в равновесии с белком,
растворенным в подложке.
15. Выведите уравнение (Ш-40) из уравнения (III-92), приняв и обосновав
соответствующие приближения и допущения.
16. Известно, что при наличии некоторого количества растворенной миристиновол
кислоты я-октан, растекаясь на поверхности воды, образует дуплексную пленку.
Поверхностное давление такой пленки равно 14 дн/см. Сколько миллиграммов миристи-
новой кислоты приходится на один квадратный сантиметр поверхности, если считать,
что на границе раздела масло — вода кислота действует так же, как газовая пленка?
Поверхностное натяжение октана равно 25 дн/см, межфазное натяжение в системе
октан — вода составляет 53 дн/см, концентрация подложки 0,01 н.. температура 25 °С.
17. Какое соотношение Ya и Yb дает уравнение Джирифалко — Гуда (уравнение
(III-7) с Ф = 1), если первоначальный коэффициент растекания жидкости В на
жидкости А равен нулю?
18. Допустим, что водный раствор адсорбируется на поверхности раздела ртуть —
вода согласно уравнению Лэнгмюра:
х/хт = ЬС/(\ +ЬС),
где Хщ — максимально возможное количество адсорбирующегося вещества. Примем
также, что если С = 0,2 М, х/хт = 0,5. Пренебрегая влиянием коэффициента
активности, рассчитайте межфазное натяжение на границе ртуть — раствор при С=0,1 М.
Предельная площадь пленки составляет 20 А2 на молекулу, температура 25 °С.
19. Углы аир (рис. II1-4) для линзы я-гептилового спирта на воде равны 67 и
16° соответственно. Поверхностное натяжение насыщенного водного раствора спирта
28,8 дн/см; межфазное натяжение между двумя жидкостями 7,7 дн/см, поверхностное
натяжение «-гептилового спирта 26,8 дн/см. Рассчитайте величину угла у. Какое
уравнение, (III-7) или (III-12), лучше описывает приведенные данные? Рассчитайте
толщину бесконечной линзы я-гептилового спирта на воде.
20. Время от времени возникает интерес к утверждениям, что в опытах по
прониканию, в которых в монослой на поверхности раствора поверхностно-активного
вещества проникает другое поверхностно-активное вещество, пленочные весы измеряют
поверхностное натяжение больше 72 дн/см. Означает ли это, что поверхностное
натяжение смешанного монослоя отрицательно? Если да, то каков физический смысл
отрицательного поверхностного натяжения? Обсудите этот вопрос.
21. При 20 °С поверхностное давление пленки миристиновой кислоты составляет
10 дн/см при а=23 А2/молекула. Предельное значение а при высоких давлениях
можно принять равной 20 А2/молекула. Рассчитайте поверхностное давление, которое
можно было бы ожидать, исходя из уравнения (III-40). Чему равен коэффициент
активности воды в поверхностном слое согласно этой модели?
156
Глава III
22. Покажите, при каких ограничениях уравнения (Ш-99) и (III-108) совпадают.
23. Докажите правильность вывода, следующего из уравнения (III-61).
24. Оцените у° для монослоя три-я-крезилфосфата при сг=30 А2/молекула.
Используйте уравнение (Ш-61) и данные, приведенные на рис. III-28: температуру
примите равной 25 °С. Считайте, что при а больше 140 А2/молекула пленка является
идеальной.
25. До какого значения сг должна в соответствии с моделями Доннана и Гун
растекаться на 0,02 М NaOH пленка жирной кислоты с поверхностным давлением
5 дн/см? Примите, что углеводородная часть пленки ведет себя как идеальный газ, а
температура равна 20 °С.
26. В первом разделе этой главы упоминается эксперимент Бенджамина
Франклина. Оцените по результату этого опыта приблизительное значение числа Авогадро;
поясните ваш расчет. Полученный результат является заниженным. Можно ли было
бы получить более точный ответ, если бы Франклин провел более аккуратные
измерения?
27. Согласно уравнению (Ш-7) (с Ф = 1), жидкость с низким поверхностным
натяжением растекается на поверхности жидкости с высоким поверхностным
натяжением, только если ее коэффициент растекания отрицателен. Верно ли это утверждение?
28. Пленка с вязкостью 0,02 поверхностных пауз течет под давлением 8 дн/см
через щель шириной 0,5 см со скоростью 0,3 см2/с. Рассчитайте линейную скорость
пленки в центре щели.
29. Матиевич и Петика измерили поверхностные натяжения растворов октановой
кислоты на 0,1 М NaOH при 20 °С и с помощью уравнения Гиббса рассчитали
соответствующие п—а-кривые для ионизованного монослоя. Авторы измерили также
поверхностные давления октановой кислоты на 0,1 н. НС1 при 20 °С.
я, дн/см
]2,6
9,72
7,43
5,72
4,00
3,43
2,57
2,00
3,71
1,54
а, А2/молекула
На 0,1 н. NaOH
33,8
56,3
81,7
108
155
197
На 0,1 н. НС1
33,8
—
42,2
49,2
56,3
—
70,5
84,5
141
197
Постройте зависимость язаряда от а, где л3аРяда — составляющая поверхностного
давления ионизованного монослоя, обусловленная наличием заряженных частиц в
монослое. Рассчитайте и постройте на том же графике зависимости jxd и по для
моделей Доннана и Гуи. Обсудите вкратце различия между этими тремя зависимостями.
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Адам Н. К-, Физика и химия поверхностей, М., ОГИЗ, 1947.
Advances in Chemistry, No. 43, American Chemical Society, Washington, D. C, 1964.
Advances in Protein Chemistry, Academic Press, New York, 1954.
Bamford C. H., Elliott A., Hanby W. E., Synthetic Polypeptides, Academic Press, New
York, 1956.
Davies J. Т., Rideal E. K., Interfacial Phenomena. Academic Press, New York, 1963.
Gaines G. L., Jr., Insoluble Monolayers at Liquid-Gas Interfaces, Interscience, New York,
1966.
van Otphen #., Mysels K. J., Physical Chemistry: Enriching Topics From Colloid and
Surface Chemistry, Theorex (8327 La Jolla Scenic Drive), La Jolla California,
1975.
Retardation of Evaporation by Monolayers: Transport Processes, LaMer V. K., ed.,
Academic Press, New York, 1962.
Surface and Colloid Science, Matijevic E., ed., Vol. 5, Wiley-Interscience, 1972.
Techniques of Surface and Colloid Chemistry, Good R. J., Patrick R. L., Stromberg R. R.,
eds., Marcel Dekker, 1972.
Verwey E. J. W., Overbeek J. Th. G., Theory of the Stability of Lyophobic Colloids,
Elsevier, New York, 1948.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Gaines G. L., Jr., Insoluble Monolayers at Liquid-Gas Interfaces, Interscience, New
York, 1966.
2. Lord Reyleigh, Proc. Roy. Soc. (London), 47, 364 (1890).
Пленки на жидких поверхностях
157
3. Pockels Л., Nature, 43, 437 (1891).
4. Lord Reyleigh, Phil. Mag., 48, 337 (1899).
5. Devaux #., /. Phys. Radium, 699, No. 2, 891 (1912).
6. Langmuir I., J. Am. Chem. Soc, 39, 1848 (1917).
7. Harkins W. D., The Physical Chemistry of Surface Films, Reinhold, New York, 1952,
Chap. 2.
8. Girifalco L. A., Good R. J., J. Phys. Chem., 61, 904 (1957).
9. Bartelt F. E., Case L. 0., Brown H., J. Am. Chem. Soc, 55, 2769 (1933).
9a. Pomerantz P., Clinton W. C, Zisman W. A., J. Colloid Interface Sci., 24, 16 (1967);
Timons С. О., Zisman W. A., ibid, 28, 106 (1968).
10. Adamson A. W., Advan. Chem., 43, 57 (1964).
11. Fowkes F. M.t Advan. Chem., 43, 99 (1964).
12. Fowkes F. M., J. Colloid Interface Sci., 28, 493 (1968).
13. Good R. J., Ind. Eng. Chem., 62, 54 (1970).
14. Melrose J. C, J. Colloid Interface Sci., 28, 403 (1968).
15. Fowkes F. M., J. Phys. Chem., 67, 2538 (1963).
16. Adamson A. W., J. Phys. Chem., 72, 2284 (1968).
17. Padday J. F., Uffindell N. D., J. Phys. Chem., 72, 1407 (1968); см. также [18].
18. Fowkes F. M., J. Phys. Chem., 72, 3700 (1968).
19. Ottewill R. H., Thesis, University of London, Queen Mary College, 1951; см. также
[20].
20. Hauxwell F., Ottewill R. H.t J. Colloid Interface Sci., 34, 473 (1970).
21. Orem M. W., Adamson A. W., J. Colloid Interface Sci., 31, 278 (1969).
22. Antonow G., J. Chim. Phys., 5, 372 (1907).
23. Harkins W. D., Colloid Symposium Monograph, Vol. VI, The Chemical Catalog
Company, New York, 1928, p. 24.
24. Cupples H. L., J. Phys. Chem., 48, 75 (1944); Fox W., J. Phys. Chem., 48, 158
(1944); Antonow G., J. Phys. Colloid Chem., 52, 969 (1948); Prigogine L,
Delay R, Bull. Soc. Chim. Beiges, 59, 255 (1950).
25. Langmuir /., J. Chem. Phys., 1, 756 (1933).
26. Reynolds О, Works, 1, 410; Brit. Assoc. Rept., 1881.
27. Cary A., Rideal E. K., Proc. Roy. Soc. (London), A109, 301 (1925).
28. Ahmad J., Hansen R. S., J. Colloid Interface Sci., 38, 601 (1972).
29. Sucio D. G., Smigelschi O., Rtickenstein E., J. Colloid Interface Sci., 33, 520
(1970)
30. Davies J. Т., Rideal E. K., Interfacial Phenomena, Academic Press, New York,
1961.
31. Bernett M. K-, Zisman W. A., Advan. Chem., Ser. 43, 332 (1964); Bascom W. D.,
Cottington R. L., Singleterry C. R., ibid., p. 355.
32. Sternling C. V., Scriven L. E., A. I. Ch. E. J., December 1959, p. 514.
33. Miller N. F., J. Phys. Chem., 45, 1025 (1941).
34. Donahue D. J'., Bartell F. E., J. Phys. Chem., 56, 480 (1952).
35. Princen H. M., Mason S. G, J. Colloid Sci., 20, 246 (1965).
36. Princen Я. М., J. Colloid Sci., 18, 178 (1963).
37. Gaines G. L., Jr., Surface Chemistry and Colloids, (MTP International Review of
Science), Kerker M., ed., Vol. 7, University Park Press, Baltimore, 1972.
38. Mysels K. /., Florence А. Т., Clean Surfaces: Their Preparation and Characterization
for Interfacial Studies, G. Goldinger ed., Marcel Dekker, New York, 1970.
39. Gershfeld N. L., Pagano R. E., Friauf W. S., Fuher J., Rev. Sci. Inst., 41, 1356
(1970).
40. Rabinovitch W., Robertson R. F., Mason S. G.} Can. J. Chem., 38, 1881 (1960).
41. Walker D. C, Ries H. E., Jr., Nature, 203, 292 (1964).
42. Gaines G. L., Jr., J. Phys. Chem., 65, 382 (1961).
42a Ries H. E., Jr., Nature Phys. Sci., 243, 14 (1973).
43. Bergeron J. A., Gaines G. L., Jr., J. Colloid Interface Sci., 23, 292 (1967).
44. Plaisance M„ Ter-Minassian-Saraga L., CR, 270, 1269 (1970).
45. Kinioch C. D., McMullen A. I., J. Sci. Inst., 36, 347 (1959).
46. Harkins W. D., Fischer E. K., J. Chem. Phys., 1, 852 (1933).
47. MacDonald J. R., Barlow С A., J. Chem. Phys., 43, 2575 (1965) и предыдущие
статьи.
48. Blank M., Ottewill R. H., J. Phys. Chem., 68, 2206 (1964).
49. Bewig K. W., Zisman W. A., J. Phys. Chem., 68, 1804 (1964).
50. Kamienski В., Bull. Acad. Polon. Sci. Ser., 13, 231 (1965).
51. van Voorst Vader F., Erkens Th. F., van den Tempel M„ Trans. Faradav Soc, 60
1170 (1964).
52. Myers R. J., Harkins W. D., J. Chem. Phys., 5, 601 (1937).
53. Harkins W. D., Kirkwood J. G., J. Chem. Phys., 6, 53 (1938).
54. Nutting G. C, Harkins W. D., J. Am. Chem. Soc, 62, 3155 (1940).
55. Ewers W. E., Sack R. A., Australian J. Chem., 7, 40 (1954).
56. Hansen R. S„ J. Phys. Chem., 63, 637 (1959).
57. Plateau J., Phil. Mag., 38, No. 4, 445 (1869).
158
Глава III
58. Mannheimer R. /., Schechter R. S., J. Colloid Interface Sci., 32, 225 (1970)
и предыдущие статьи.
59. Goodrich F. С, Allen L. H., Chatterjee A. K., Proc. Roy. Soc. (London), A320, 537
(1970). Cm. J. Phys. Chem., 79, 2122 (1975).
60. Tschoegl N. W., Kolloid Z, 181, 19 (1962).
61. Blank M.f Britten Л 5., J. Colloid Sci., 20, 789 (1965).
61a. Cooper E. R., Mann J. A., J. Phys. Chem., 77, 3024 (1973).
62. Bouhet C, Ann. Phys., 15, 5 (1931).
63. McCrackin F. L., Passaglia E., Stromberg R. R., Steinberg H. L, J. Res. Nat. Bur.
Std., A67, 363 (1963).
64. Archer R. J., Ellipsometry in the Measurement of Surfaces and Thin Films,
Passaglia E., Stromberg R. R., Kruger J., eds.; Nat. Bur. Std., Misc. Publ. No. 256, 1964,
p. 255.
65. Smith Т., Advan. Colloid Interface Sci., 3, 161 (1972).
66. Blodgett К. В., Langmuir L, Phys. Rev., 51, 964 (1937).
67. Hartman R. E., J. Opt. Soc. Am., 44, '192 (1954).
68. Tweet A. G., Rev. Sci. Inst., 34, 1412 (1963).
69. Tweet A. G., Gaines G. L., Jr., Bellamy W. D., J. Chem. Phys, 40, 2596 (1964).
70. Trosper Т., Park R. В., Sauer K., Photochem. Photobiol., 7, 451 (1968).
70a. Weiss L. W., Evans T. R., Leermakers P. A., J. Amer. Chem. Soc, 90, 6109 (1968)
и приведенные там ссылки.
706. Kuhn Я, Mobius D., Bucher Я, Physical Methods of Chemistry, Weissberger A,
Rossiter B, eds. Vol. I, part IIIB, Chapter VII, p. 577, Wiley-Interscience, New
York, 1972.
71. Zocher Я, Stiebel F., Z. Phys. Chem, 147, 401 (1930).
72. Adam N. K., Trans. Faraday Soc, 29, 90 (1933).
73. Bruun Я, Arkiv. Kemi, 8, 411 (1955).
74. Ries H. E., Jr., Kimball W. A.f Proceedings of the Second International Congress of
Surface Activity, Vol. I, 1957, p. 75; Ries H. E., Jr., Walker D. C, J. Colloid Sci,
16,361 (1961).
75. Sheppard E., Bronson R. P., Tcheurekdjian N., J. Colloid Sci, 19, 833 (1964).
76. Germer L. Я, Storks К. H., J. Chem. Phys, 6, 280 (1938).
77. Gaines G. L., Jr., J. Colloid Sci, 15, 321 (1960).
78. Spink J. A., J. Colloid Interface Sci, 28, 9 (1967).
79. Cook H. D., Ries H. E., Jr., J. Phys. Chem, 60, 1533 (1956).
80. Povich M. J., Mann J. A., Kawamoto A., J. Colloid Interface Sci, 41, 145 (1972).
81. Ries H. E., Jr., CR Veme Congres International'de la Detergence, Vol. II, Ediciones
Unidas, S. A, Barcelona, 1969, p. 443.
82. Адам Н. К, Физика и химия поверхностей, М, ОГИЗ, 1947.
83. Crisp D. /, Surface Chemistry, Butterworths, London, 1949, p. 17.
84. Ter-Minassian-Saraga L„ Prigogine I., Mem. Serv. Chim. Etat, 38, 109 (1953).
85. Fowkes F. M.f J. Phys. Chem, 66, 385 (1962).
86. Harkins W. D., Boyd E., J. Phys. Chem, 45, 20 (1941); Boyd G. E., J. Phys. Chem,
62, 536 (1958).
87. Mittelmann R., Palmer R. C, Trans. Faraday Soc, 38, 506 (1942).
88. Smith Т., J. Colloid Interface Sci, 23, 27 (1967).
89. H elf and E., Frisch Я, Lerowitz J. L, J. Chem. Phys, 34, 1037 (1961).
90. Jura G., Harkins W. D., J. Chem. Phys, 12, 113 (1944).
91. Kirkwood J. G., Surface Chemistry, Publication of the American Association for the
Advancement of Science, No. 21, 1943, p. 157.
92. Cadenhead D. A., Demchak R. /, J. Chem. Phys, 49, 1372 (1968).
93. Void M. J., J. Colloid Sci, 7, 196 (1952).
94. Kipling J. J., N orris A. D., J. Colloid Sci, 8, 547 (1953).
95. Phillips M. C, Cadenhead D. A., Good R. J., King H. F., J. Colloid Interface Sci,
37, 437 (1971).
96. Pankhurst K. G. A., J. Phys. Chem, 59, 480 (1955).
97. Sheppard E., Bronson R. P., Tcheurekdjian N., J. Colloid Chem, 20, 755 (1965).
98. Joly Af, J. Colloid Sci, 5, 49 (11950).
99. Dervichian D. G., Surface Chemistry, Butterworths, London, 1949, p. 47.
100. Stallberg-Stenhagen S., Stenhagen E., Acta Chem. Scand, 3, 1035 (1949).
101. Joly M., Surface and Colloid Science, Matijevic E, ed. Vol. 5, Wiley-Interscience,
1972.
102. Jarvis N. L., J. Phys. Chem, 69, 1789 (1965).
103. Fourt L., Harkins W. D., J. Phys. Chem, 42, 897 (1938).
104. Adam N. K., Miller J. G. F., Proc. Roy. Soc. (London), 142, 401 (1933).
105. Beits J. J., Pethica B. A., Trans. Faraday Soc, 52, 1581 (1956).
106. Goddard E. D., Kao O., Kung H. C, J. Colloid Interface Sci, 24, 297 (1967).
107. Goddard E. D., Ackilli J. A., J. Colloid Chem, 18, 585 (1963).
108. Spink J. A., J. Colloid Sci, 18, 512 (1963).
109. Rice N. W., Sebba F., J. Appl. Chem. (London), 15, 105 (1965); Sebba F., Nature,
184, 1062 (1959).
Пленки на жидких поверхностях
159
ПО. Marsden J., Rideal Е. К., J. Chem. Soc, 1938, 1163; Adam N. К., Proc. Roy. Soc,
(London), AI01, 516 (1922).
111. Bernett M. K., Zisman W. A., J. Phys. Chem., 67, 1534 (1963).
112. Gershfeld N. L, Techniques of Surface and Colloid Chemistry, Good R. J.,
Patrick R. L., Stromberg R. R., eds., Marcel Dekker, 1972.
113. Getshfeld N. L., Patlak C. S., J. Phys. Chem., 70, 286 (1966).
114. Lucassen-Reynders E. H., van den Tempel M., Proceedings of the IVth
International Congress on Surface Active Substances, Brussels, 1964, Overbeek J. Th. G., ed.,
Vol. II, Gordon and Breach, New York, 1967; Lucassen-Reynders E. H., J. Colloid
Interface Sci., 42, 554 (1973); 41, 156 (1972).
115. Ries H. E.f Jr., Cook H. D., J. Colloid Sci., 9, 535 (1954).
116. Harkins W. D., Florence R. Т., J. Chem. Phys, 6, 847 (1938); Florence R. Т., Har-
kins W. D., J. Chem. Phys., 6, 856 (1938).
117. Ries H. E., Jr., Cook D. H., J. Colloid Sci., 9, 535 (1954); Boyd G. E., Vaslow F.,
J. Colloid Sci., 13, 275 (1958).
118. Goodrich F. C, Proc. Inter. Congr. Surface Activity 2nd, London, 1957, 1, 85
(1957).
119. Gaines G. L., Jr., J. Colloid Interface Sci., 21, 315 (1966).
120. Cadenhead D. A., Demchak R. J., ibid, 30, 76 (1969).
121. Rideal E. K., J. Chem. Soc, 1945, 423.
122. Goddard E. D., Schulman J. H., J. Colloid Sci, 8, 309 (1953).
123. Anderson P. J., Pethica B. A., Trans. Faraday Soc, 52, 1080 (1956).
124. Fowkes F. M„ J. Phys. Chem, 66, 385 (1962).
125. Fowkes F. M., J. Phys. Chem, 67, 1982 (1963).
126. Lucassen-Reynders E. #, J. Colloid Interface Sci, 42, 563 (1973).
127. Patil G. S., Katti S. S., J. Colloid Interface Sci, 30, 219 (1969).
128. Dean R. В., Hayes K. E., J. Amer. Chem. Soc, 73, 5583 (1954).
129. Walker D. C, Rev. Sci. Instr, 34, 1006 (1963).
130. LaMer V. K., Healy T. W., Aylmore L. A. G, J. Colloid Sci, 19, 676 (1964).
131. Rosano H. L., LaMer V. K, J. Phys. Chem, 60, 348 (1956).
132. Katti S. S., Sansara S. D., J. Colloid Interface Sci, 32, 361 (1970).
133. Costin I. S., Barnes G. Г, J. Colloid Interface Sci, 25, 584 (1967).
134. Barnes G. Т., Quickenden T. I., Saylor J. E., J. Colloid Interface Sci, 33, 236
(1970).
135. LaMer V. /C, Healy T. W., Science, 148, 36 (1965).
136. Jarvis N. L., J. Colloid Sci, 17, 512 (1962).
137. Mysels /C. /, Science, 129, 38 (1959).
138. Mansfield W. W., Nature, 175, 247 (1955).
139. Ter-Minassian-Saraga L, J. Chim. Phys, 52, 181 (1955).
140. Gersnfeld N. L., Techniques of Surface and Colloid Chemistry, Good R. J,
Patrick R. L, Stromberg R. R, eds. Marcel Dekker (1972).
141. Hansen R. S., J. Colloid Sci, 16, 549 (1961).
142. Davies J. Т., Advan. Catalysis, 6, 1 (1954).
143. Bagg /, Abramson M. В., Fishman M., Haber M. D., Gregor H. P., J. Am. Chem.
Soc, 86, 2759 (1964).
144. Bellamy W. D., Gaines G. L, Jr., Tweet A. G, J. Chem. Phys, 39, 2528 (1963).
145. Jellinek H. H. G., Roberts M. H., J. Sci. Food Agri, 2, 391 (1951).
146. Davies J. Т., Trans. Faraday Soc, 45, 448 (1949).
147. Alexander A. E., Schulman J. Я, Proc. Roy. Soc. (London), A161, 115 (1937);
Alexander A. E., Rideal E. K., Proc. Roy. Soc. (London), A163, 70 (1937).
148. Schulman J. H., Trans. Faraday Soc, 37, 134 (1941).
149. Rideal E. K., Proc. Roy. Soc. (London), 209, 431 (1951).
150. Davies J. Т., Rideal E. K., Proc. Roy. Soc. (London), A194, 417 (1948).
151. Eda K., J. Chem. Soc. (Japan), Pure Chem. Sect, 73, 260 (1952).
152. Gilby A. R.f Alexander A. E., Australian J. Chem. 9, 347 (1956).
153. Nasini A. G., Mattel G, Gazz. Chim. Ital, 70, 635 (1940).
154. Бреслер Ю., Талмуд Д., Юдин М., ЖФХ, 14, 801 (1940).
155. Rideal Е. /С, Mitchell J. S.f Proc. Roy. Soc. (London), A159, 206 (1937).
156. Fosbinder R. J., Proc. Roy. Soc. (London), A139, 93 (1933).
157. Mitchell J. S., Rideal E. /C, Proc. Roy. Soc. (London), A167, 342 (1938).
158. Tweet A. G, Gaines G. L, Jr., Bellamy W. D., J. Chem. Phys, 41, 1008 (1964)
159. Whitten D. G., J. Amer. Chem. Soc, 96, 594 (1974).
159a. Slawson V., Adamson A. W., Mead J., Lipids, 8, 129 (1973); Slawson V., Adam-
son A. W., Lipids, in press.
160. Trurnit H. J., J. Colloid Sci, 15, 1 (1960).
161. Loeb G. /., Baier R. E., J. Colloid Interface Sci, 27, 38 (1968).
162. Augenstine L. G., Ghiron C. A., Nims L. F., J. Phys. Chem, 62, 1231 (1958).
163. Birdi K. S., Kolloid-Z. Z. Polymere, 250, 222 (1972).
164. MacRitchie F., J. Colloid Sci, 18, 555 (1963).
165. Bull H. В., J. Amer. Chem. Soc, 67, 4 (1945).
166. Bull H. В., J. Biol. Chem, 185, 27 (1950).
167. Malcolm B. R., Proc. Roy. Soc, A305, 363 (1968).
160
Глава III
168. Blank M.t Lucassen /., van den Tempel M., J. Colloid Interface Sci., 33, 94
(1954).
169. Cheesman D. F.f Davies /. Т., Advan., Protein Chem., 9, 439 (1954).
170. Loeb G. L, Baier R. E., J. Colloid Interface Sci., 27, 33 (1968).
171. Singer S. J., J. Chem. Phys., 16, 872 (1948).
172. Frisch H. L., Simha R., J. Chem., Phys., 27, 702 (1957).
173. Silberberg A., J. Phys. Chem., 66, 1872 (1962).
174. Schulman J. #., Rideal E. K., Proc. Roy. Soc. (London), B122, 29 (1937).
175. Davis W. W., Krahl M. E., Clowes G. H. A., J. Am. Chem. Soc, 62, 3080 (1940).
176. Dervichian D. G., in Surface Phenomena in Chemistry and Biology, Danielli J. F.,
Pankhurst K. G. A., Riddiford A. C, eds., Pergamon, New York, 1958.
177. Geiduschek P., Doty P., J. Am. Chem. Soc, 74, 3110 (1952).
178. Gaines G. L., Jr., Tweet A. G., Bellamy W. D., J. Chem. Phys., 42, 2193 (1965).
179. Kaplan J. G., J. Colloid Sci., 7, 382 (1952).
180. Cheesman D. F.t Schuller #., J. Colloid Sci., 9, 113 (1954).
181. Sobotka H., Rosenberg S., Monomolecular Layers, Publication of the American
Association for the Advancement of Science, Washington, D. C, 1954, p. 175.
182. Kaplan J. G., Andrews D, H., Eraser M. J., J. Colloid Sci., 9, 203 (1954).
183. Smith C. L., Arch. Biochem. Biophys., 50, 322 (1954).
184. Hutchinson F., Radiat. Res., 1, 43 (1954).
185. Augenstine L. G., Ray B. R., J. Phys. Chem., 61, 1380 (1957).
186. Alexander Л. E., Teorell Т., Trans. Faraday Soc, 35, 727 (1939); Cumper C. W. N.t
Alexander A. E„ Trans. Faraday Soc, 46, 235 (1950).
187. Davies J. Т., Biochem. J., 56, 509 (1954).
188. Cadenhead D. A., Recent Prog. Surface Sci., 3, 169 (1970).
189. Gaines G. L., Jr., J. Colloid Interface Sci., 28, 334 (1968).
190. Mueller P., Rudin D. O., Tien H. Т., Wescott W. C, J. Phys. Chem., 67, 535
(1963).
191. Good R. J., J. Colloid Interface Sci., 31, 540 (1969).
192. Baier R. E., Surface Chemistry of Biological Systems, Plenum Press, p. 235, 1970;
см. J. Biomed. Res., 9, 327 (1975).
193. Vroman L., Adams A. L., J. Biomed. Mater. Res., 3, 43 (1969).
194. Drost-Hansen W., Fed. Proc, 30, 1539 (1971).
195. Bamford C. H., Elliott A., Hanby W. E., Synthetic Polypeptides, Academic Press,
New York, 1956.
196. См. Surface Phenomena in Chemistry and Biology, Danielli J. F., Pankhurst K. G. A.,
Riddiford A. C, eds., Pergamon, New York, 1958.
197. Rowland F., Bulas R., Rothstein E., Eirich F. R., Ind. Eng. Chem., September 1965,
p. 46.
198. Lee W. M., Stromberg R. R.f Shereshefsky J. L., J. Res. Natl. Bur. Std., 66A, 439
(1962).
199. Ries H. E., Jr., Beredjick N., Gabor J., Nature, 186, 883 (1960).
200. Beredjick N., Ahlbeck R. A., Kwei T. K., Ries H. E., Jr., J. Polymer Sci., 46, 268
(1960).
201. Hutchinson E., J. Colloid Sci., 3, 219 (1948); Sobotka H., ed., Monomolecular Layers,
Publication of the American Association for the Advancement of Science,
Washington, D. C, 1954, p. 161.
202. Jasper J. J., van Dell R. D., J. Phys. Chem., 69, 481 (1965).
203. Askew F. A., Danielli J. F.f Trans. Faraday Soc, 36, 785 (1940).
204. Ellison A. H., Zisman W. A., J. Phys. Chem., 60, 416 (1956). '
205. Hutchinson E., J. Colloid Sci., 3, 219 (1948).
206. Cheesman D. J., Arkiv Kemi, Mineral. Geol., B22, No. 1, 8 (1946).
207. Brooks J. H., Pethica B. A., Trans. Faraday Soc, 60, 208 (1964).
208. Davies J. Т., Trans. Faraday Soc, 48, 1052 (1952).
208a. Mingins J., Zobel F. G. R., Pethica B. A., Smart C, Proc Roy. Soc. Lond., A324,
99 (1971).
209. Davies J. Т., Mayers G. R. A., Trans. Faraday Soc, 56, 691 (1960).
210. Jarvis N. L., Zisman W. A., J. Phys. Chem., 63, 727 (1959).
211. Davies J. Т., Proc. Roy. Soc (London), A208, 224 (1951).
212. Sears D. F., Schulman J. H., J. Phys. Chem., 68, 3529 (1964).
213. Davies J. Т., Rideal E. K., Interfacial Phenomena, Academic Press, New York,
1963.
213a. Robb L D., Alexander A. E., J. Colloid Interface Sci., 28, 1 (1968).
214. Cassie A. B. D., Palmer R. C, Trans. Faraday Soc, 37, 156 (1941).
215. Davies J. Т., Rideal E. K., J. Colloid Sci., Suppl. No. 1, 1954, p. 1.
216. Davies J. Т., Rideal E. K., Can. J. Chem., 33, 947 (1955).
217. van den Tempel M., van de Riet R. P., J. Chem. Phys., 42, 2769 (1965).
218. Goodrich F. C, Proc Roy. Soc. (London), A260, 503 (1961).
219. Hansen R. S., Mann J. A., Jr., J. Appl. Phys., 35, 152 (1964).
220. Mann J. A., Jr., Hansen R. S., J. Colloid Sci., 18, 805 (1963).
221. Lucassen-Reynders E. H., Lucassen J., Advan Colloid Interface Sci., 2, 347
Пленки на жидких поверхностях
161
222. Hansen R. S., Ahmad J., Prog. Surface Membrane Sci., 4, 1 (1971).
223. Garrett W. D., Zisman W. A., J. Phys. Chem., 74, 1796 (1970).
224. Blodgett К. В., J. Am. Chem. Soc, 57, 1007 (1935).
225. Ehlert R. C, J. Colloid Sci., 20, 387 (1965).
226. Bateman J. В., Covington £. /., J. Colloid Sci., 16, 531 (1961).
227. Ellis /. W., Pauley J. L., J. Colloid Sci., 19, 755 (1964).
228. Langmuir /., J. Franklin Inst., 218, 143 (1934).
229. Shafrin E. G., Zisman W. A., J. Phys. Chem., 64, 519 (1960).
230. Levine 0., Zisman W. A., J. Phys. Chem., 61, Г188 (1957).
231. Gaines G. L., Jr., Roberts R. W., Nature, 197, 787 (1963).
232. Timmons C. O., Zisman W. A., J. Phys. Chem., 69, 984 (1965).
233. Rideal E. K., Tadayon J., Proc. Roy. Soc. (London), A225, 346, 357 (1954).
234. Young /. E., Aust. J. Chem., 8, 173 (1955).
235. Criddle D. W., in Rheology, F. R. Eirich ed., Vol. Ill, Academic Press, New York,
i960, p. 432.
11—1421
ГЛАВА IV
Электрические свойства поверхностей
1. Введение
Обсуждение электрических явлений на поверхностях раздела фаз в
этой главе ограничено определенными, хотя и несколько
произвольными рамками. В частности, здесь мы постараемся не углубляться в такие
специальные области, как коллоидная химия, электрохимия или физика
металлов и полупроводников. Нас будут интересовать, во-первых,
причины появления электрических зарядов на поверхностях раздела и
следствия, вытекающие из этого факта, и, во-вторых, природа
потенциалов, возникающих на границах раздела фаз. Даже при этих
ограничениях нам все же придется обращаться к различным специальным
работам, «о, разумеется, охватить всю литературу, относящуюся к
обсуждаемым вопросам, мы и не будем пытаться.
За время, прошедшее после выхода в свет второго издания этой
книги, в исследовании электрических свойств поверхностей достигнуты
большие успехи. В частности, сделаны (некоторые важные теоретические
обобщения. Появилось также много экспериментальных работ по
измерению сил, связанных с двойным электрическим слоем (см. гл. VI).
В последнее время при исследовании поверхностей твердых тел,
находящихся в контакте с растворами электролитов, широко применяются
современные спектроскопические методы. Кроме того, все шире
используются твердые тела, поверхности которых характеризуются четко
выраженной структурой и определенной степенью чистоты (см. гл. V).
2. Двойной электрический слой
Важная группа электрических явлений связана с распределением
ионон в растворе в присутствии электрического поля. Начнем с
рассмотрения плоской поверхности, несущей однородно распределенный
заряд и находящейся в контакте с раствором, который содержит
положительные и отрицательные ионы. Предположим, что поверхность
заряжена положительно. Электрический потенциал на поверхности
примем равным гро. По мере продвижения в глубь раствора потенциал
уменьшается. Необходимо найти закон изменения потенциала с
расстоянием от поверхности. В любой точке раствора потенциал г|э
определяет потенциальную энергию zety иона в электрическом поле, где
z — валентность иона и е — заряд электрона. Вероятность нахождения
иона в некоторой точке пропорциональна множителю Больцмана
e-ze^/kT^ Аналогичная ситуация наблюдается в том случае, когда
молекулы газа находятся в поле сил тяжести, в котором потенциальная
энергия молекулы равна mgh. Изменение концентрации с высотой
определяется известным выражением
n=nQe-mgh/kTf (IV-1)
где по — концентрация на нулевой высоте.
Электрические свойства поверхностей
163
Для раствора электролита, содержащего два вида ионов с равными,
но противоположными по знаку зарядами -\-z и —г, можно записать
аналогичные выражения:
П=%егеШТ и n+ = fheru*/kTe (IV-2)
Здесь, однако, возникают некоторые дополнительные (по сравнению с
рассмотренной системой — газ в поле сил тяжести) осложнения.
Во-первых, положительные заряды отталкиваются от поверхности,
тогда как отрицательные притягиваются к ней, и, во-вторых, система в
целом должна быть электронейтральной, так что вдали от поверхности
п+ = гг. Однако вблизи поверхности отрицательные ионы находятся в
некотором избытке по сравнению с положительными, и, таким
образом, в слое раствора вблизи поверхности имеется некоторый отличный
от нуля суммарный заряд, который компенсируется равным, но
противоположным по знаку зарядом поверхности. В-третьих, на локальный
потенциал влияет локальная плотность заряда, и, следовательно,
необходимо учитывать взаимосвязь между этими двумя величинами.
Плотность суммарного заряда р в любой точке выражается
уравнением
р=2е (п+—п)=—2nQze sh (zetykT) (I V-3)
(см. примечание в разд. Ш-14).
Интегрируя р по расстоянию от 0 до бесконечности, получаем
суммарный избыточный заряд в растворе, отнесенный к единице площади
поверхности. Этот заряд равен по величине, но противоположен по
знаку плотности заряда на поверхности а:
а=— Cpdx. (IV-4)
Таким образом, вблизи поверхности раздела образуется двойной слой
зарядов; одна часть этого слоя локализована на плоскости поверхности,
а вторая в виде диффузного слоя распространяется в глубь раствора.
Полученные уравнения дополняются теоремой, выражаемой
уравнением Пуассона, которая связывает дивергенцию градиента
электрического потенциала в данной точке с плотностью заряда в этой же
точке:
V2i|;=—4np/D, (IV-5)
где V2 — оператор Лапласа (д2/дх2+д2/ду2 + д2/дг2) и D —
диэлектрическая проницаемость среды.
Различные решения уравнений (IV-3) и (IV-5) даны в работах Гуи
[1], Чепмена [2] и Дебая и Хюккеля [3]. Для наших целей можно
воспользоваться обобщениями, сделанными в работах Фервея и Овербека
[4] и Кройта [5]. Наиболее известной теорией, по-видимому, является
простая теория Дебая — Хюккеля, в которой рассматривается влияние
межионного притяжения в растворах электролитов. Подстановка
уравнения (IV-3) в уравнение (IV-5) дает
V2i|> = (8m0ze/D) sh (zety/kT). (IV-6)
Предположим далее, что zety мало по сравнению с kT, и разложим
экспоненты в уравнении (IV-6) в ряды. Если при этом ограничиться
только их первыми членами, то в результате получим
V 2я|) = 8nn0z2e2ty/DkT=А|?. (I V-7)
Если в системе имеются ионы с различными зарядами,
^={Ane2lDkT) ^ ntzl (IV-8)
i
11*
164
Глава IV
Решение уравнения (IV-7) для ионов одного типа, например /, имеет
вид
yj(r)=(Zje/Dr)er*r
Ы описывает падение потенциала с расстоянием г от центра данного
иона. Величина к связана с размером ионной атмосферы вокруг
каждого иона; обратную величину 1/х обычно -называют радиусом ионной
атмосферы. Следует добавить, что работа заряжения ионной атмосферы
вокруг иона дает вклад в свободную энергию иона и обычно
выражается в виде зависимости коэффициента активности от концентрации.
Мы не будем здесь подробно останавливаться на теории межионного
взаимодействия; она детально рассматривается в монографии Харнеда
и Оуэна [6].
Гуи и Чепмен теоретически исследовали систему, состоящую из
плоской заряженной поверхности и образующегося вблизи нее
диффузного двойного слоя. В этом случае V2i|) можно заменить на d2ty/dx2,
поскольку я|) теперь является функцией только расстояния по нормали
к поверхности. Чтобы уравнения не были слишком громоздкими,
введем следующие обозначения:
y=zety/kT и y0=zety0/kT. (IV-9)
Решая совместно уравнения (IV-2) и (IV-3), получаем простое
выражение:
d2y/dx2=Y2shyt (IV-10)
Интегрирование этого выражения при заданных граничных условиях
(у=0 и dy/dx = 0 при x = oo) дает
dy/dx=—2xsh(jf/2). (IV-11)
Повторно интегрируя при дополнительном граничном условии (у=Уо
лри х=0), в итоге получаем
еуп =1 +1 +^ i)e rtV-19)
^о/2 + j __ (^0/2 _ j) е-юс \1У ")
(см. упражнение IV-1).
Обычно при анализе этого уравнения энергию удобно выражать в
электронвольтах (1эВ= 1,602-10~12 эрг, или 23,06 ккал/моль), а
потенциал я|) — в милливольтах (тогда zety равно г|э, умноженному на z).
При 25 °С kT равно 25,69 мВ. Теперь приступим к анализу частных
случаев уравнения (IV-12).
При #о<С1 (или для однозарядных ионов при комнатной
температуре i|)0<C25) уравнение (IV-12) приводится к виду
<ф=<1|у>-*\ (IV-13)
Таким образом, в этом случае 1/х равно расстоянию, на котором
потенциал в е раз меньше его значения на поверхности. На этом же
расстоянии находится и центр «тяжести» пространственного заряда.
Поэтому плоскость на расстоянии х=1/к определяет эффективную
толщину диффузного двойного слоя.
Если #о>1 и #>1/>с, уравнение (IV-12) переходит в
у=(Ш/ге)е-"*. (IV-14)
Это означает, что на большом расстоянии от поверхности потенциал
описывается уравнением, аналогичным (IV-13), однако предэкспонен-
циальный множитель AkTjze при этом не зависит от фактического
значения яро- При комнатной температуре это кажущееся значение я|)0 Для
одновалентных ионов составляет 100 мВ.
Электрические свойства поверхностей
16S
Рис. IV-1. Зависимости для диффузного двойного слоя [7].
Теперь, когда найдено решение для я|), можно использовать
уравнение (IV-2) для определения вида зависимости п+ и гг от
расстояния. На рис. IV-1 приведены кривые, показывающие изменение г|) в
зависимости от расстояния и концентрации. Из уравнения (IV-4)
находим также соотношение между а и у0:
со оо
а = — Г pdx =(£>/4я) Г (d^/dx2) dx = —(£>/4я) (d^/dx)x==0> (I V-15)
о 6
Подстановка в последнее соотношение {dty/dx)x=0 из уравнения
(IV-11) дает
o=(2nQDkT/n)V2 sh (y0/2). (I V-16)
С уравнением (IV-16), правда решенным относительного при 20°С и
D = 80, мы уже встречались в гл. III [уравнение (III-108) ]. При малых
у о уравнение (IV-16) упрощается до
а=£уд|у4я. (IV-17)
Это выражение аналогично формуле Гельмгольца для плоского
конденсатора (см. разд. Ш-ЗБ), поэтому при малых потенциалах
диффузный двойной слой можно рассматривать как электрический
конденсатор с расстоянием между пластинами, равным 1/х. При больших
потенциалах а резко увеличивается с ростом «ф0 и емкость двойного слоя
также возрастает.
Рис. IV-1 иллюстрирует некоторые особенности зависимостей,
описываемых уравнениями Гуи — Чепмена. Так, чем выше концентрация
электролита, тем быстрее потенциал падает с расстоянием (рис. IV-1, б),
поскольку х возрастает. Рис. IV-l,e показывает, что при данной
эквивалентной концентрации толщина двойного слоя уменьшается с
увеличением валентности. Рис. IV-l,a выражает соотношение между
поверхностной плотностью заряда а и потенциалом поверхности г|;0 для
0,001 М электролита 1 : 1. Как в,идно из 'рисунка, при низких аро эти две
166
Глава IV
величины пропорциональны друг другу и, таким образом, двойной слой
ведет себя подобло конденсатору с постоянной емкостью. Наконец,
рис. IV-1, г и д показывают влияние концентрации электролита и
валентности на кривые заряд — потенциал.
3. Теория Штерна
Применение разработанной Гуи и Чепменом теории двойного слоя,
с основными положениями которой мы познакомились в предыдущем
разделе, при малых значениях кху когда яро велико, сопряжено с
непреодолимыми трудностями. Например, при гро, равном 300 мВ, уо
составляет 12, .и если Со, скажем, равно Ю-"3 моль/л, то локальная
концентрация отрицательных ионов вблизи поверхности, -согласно уравнению
(IV-2), должна быть С~= 10~3е12=160 моль/л! Объясняется это
прежде всего тем, что в теории Гуи — Чепмена используется
предположение о точечности зарядов и, следовательно, не учитываются размеры
ионов.
Теоретически описать систему, включающую реальные ионы, трудно.
Поэтому Штерн [8] предложил разделить область вблизи поверхности
и а две части, одна из которых состоит из ионов, адсорбированных на
поверхности и образующих внутренний плотный слой, а вторая —
соответствует диффузному слою Гуи. В первом приближении изменение
потенциала с расстоянием Можно представить так, как показано на
рис. IV-2.
Трудным моментом в теории Штерна является оценка того, в какой
степени ионы входят в плотный слой и до какой величины л|эв
уменьшается вследствие этого потенциал а|). Штерн предположил, что
адсорбция на поверхности возможна только на определенном числе мест
(примерно такой же подход используется в теории адсорбции полимеров,
разд. 1П-12Б). Точно так же и в объеме раствора вблизи поверхности
имеется определенное число мест, доступных для ионов. Далее Штерн
принимает, что в обеих областях доля мест, занятых ионами,
определяется выражением Больцмана. Если число доступных мест на
поверхности! обозначить So, то oo = zeSo, а отношение числа занятых мест к
числу свободных мест составляет as/(oo—Gs). В разбавленном растворе
это отношение в точности равно мольной доле растворенного вещества
Ns. Штерн считает, что отношения числа занятых и свободных мест
Слой Штерна
Внутренняя плоскость
Гельмгольца (IHP)
Диффузный слой
Внешняя плоскость
Гельмгольца (ОНР)
Рис. IV-2. Двойной слой по Штерну
(см. упражнение 4).
Электрические свойства поверхностей
167
для поверхности и жидкой фазы связаны следующим образом:
os/(o0-os) =Nse^+*),kT, (IV-18)
где г|ъ — потенциал на границе раздела между слоями, а ср —
дополнительный потенциал, обусловленный хемосорбцией. Тогда плотность
заряда в плотном слое составляет
as/o0 = [Nse<r2e^+(pykT] /[ 1 + N&-("*+№}. (IV-19)
Для разбавленных растворов и «е слишком больших потенциалов
вторым слагаемым в знаменателе можно пренебречь.
В плотном слое толщиной б градиент потенциала dty/dx
приблизительно равен (л|)0—г|>в)/6, и, следовательно,
cr5=(D74n6)(i|;0-%). (IV-20)
Емкость плотного слоя £>74п6 можно оценить, исследуя
электрокапиллярные свойства системы (см. разд. IV-9). В общем случае локальная
диэлектрическая проницаемость D' может отличаться от
диэлектрической проницаемости растворителя. За плотным слоем расположен
диффузный слой Гуи, описываемый уравнениями (IV-12) и (IV-15), где
аро заменено на -фб. Общая поверхностная плотность заряда 0 равна
сумме gs и gg для двух слоев, а общую электрическую емкость
поверхности раздела можно представить формулой для двух последовательно
соединенных конденсаторов:
1/C = 1/CS+1/CG. (IV-21
В концентрированных растворах Со, согласно уравнению (IV-17),
равное /)х/4я, становится достаточно велико и, таким образом, C=Cs.
В целом эта теория не такая уж спорная, как может показаться на первый взгляд.
Описанные в разд. IV-8 исследования электрокинетических явлений показывают, что
диффузный слой состоит из неподвижного слоя (хотя и определяемого несколько
иначе, чем плотный слой Штерна) и подвижного слоя. Теория Штерна позволяет учесть
конечность размеров молекул и некулоновские силы (вандерваальсовы и
специфического взаимодействия), которые могут возникать между поверхностью и
ближайшими молекулами растворенного вещества. Имеются и другие пути учета этих факторов.
Например, в теории межионного взаимодействия конечность размеров молекул
учитывается обрезанием поля на радиусе, соответствующем расстоянию максимального
сближения, которое рассматривается как сумма двух ионных радиусов. Спарнэй [9,
10] модифицировал уравнение (IV-3), введя в него связанный объем иона, т. е. объем
вокруг данного иона, недоступный для любого другого иона.
Возвращаясь к теории Штерна, отметим, что образование двойного слоя в какой-
то мере сходно с обычной адсорбцией. Это сходство отражается некулоновским
потенциалом Ф в уравнении Штерна. Если электрический потенциал равен нулю, уравнение
(IV-8) приобретает вид, весьма схожий с изотермой адсорбции Лэнгмюра (см. разд.
VIII-1). Некоторые особенности строения двойного слоя рассматриваются также в
разд. IV-6.
Таким образом, теория Штерна является физически разумной попыткой
исправить явные недостатки в модели Гуи — Чепмена. Однако и в этой теории, в свою
очередь имеются некоторые проблемы; вкратце они обсуждаются в разд. IV-6.
4. Свободная энергия диффузного двойного слоя
Приведенный ниже расчет свободной энергии диффузного двойного
слоя в принципе довольно сложен, и, если .необходимо глубже вникнуть
в суть дела, имеет смысл обратиться к монографиям Фервея и Овер-
бека [4], Кройта [5] или Харнеда и Оуэна [6]. Качественно для
решения этой задачи требуется рассчитать обратимую электростатическую
работу процесса:
Заряженная поверхность + Незаряженная поверхность +
+Диффузный двойной —► -(-Нормальный раствор
слой ионов незаряженных частиц (IV-22)
168
Глава IV
Определить эту работу можно, например, с помощью уравнения Гиббса
[уравнение (П-83)] в следующем виде (см. также разд. IV-9A):
dGs (=dy) = _ ^ Г,^,=-od%. (IV-23)
Здесь принимается, что заряд двойного слоя уравновешивается только
зарядом, адсорбированным на поверхности и изменение
электрохимического потенциала равно изменению фо. Интегрируя уравнение
(IV-23), получаем
Фо
Электр =Gry„ = - j G<h|V (I V-24)
0
Далее, используя уравнение (IV-16), находим электростатическую
свободную энергию в расчете на 1 см2 диффузного двойного слоя:
Gryu=-(8n0kT/y) [ch (y0/2)-1]. (IV-25)
Обычным в теории Дебая — Хюккеля влиянием межиолного
притяжения здесь пренебрегают как эффектом второго порядка по сравнению
с изменением G с расстоянием до поверхности.
Следует отметить, что GryH не совпадает с общей
электростатической энергией двойного слоя, отличаясь от последней энтропийным
членом. Этот член можно записать как разность энтропии ионов, более
или менее случайно расположенных в объеме раствора, я энтропии
ионов в двойном слое. Очень похожий математический
аппарат используется и для расчета электростатической части свободной
энергии, обусловленной межионным взаимодействием. То
обстоятельство, что бгуи — величина отрицательная, несмотря на положительное
значение энтропийного члена, может рассматриваться как следствие
превалирующего влияния вклада энергии адсорбции или концентрации
ионов вблизи заряженной поверхности.
5. Отталкивание между двумя плоскими двойными слоями
Если два одинаковых плоскопараллельных двойных слоя сближаются друг с
другом, то между ними возникают силы отталкивания. Эти силы оказывают важное
влияние на устойчивость мыльных пленок и стабилизацию коллоидных частиц,
препятствуя коагуляции последних (см. разд. VI-4B). На рис. IV-3 показана зависимость
потенциалов г|) сближающихся двойных слоев от расстояния х. (Расстояние между
пластинками равно 2d.) На рис. IV-3 показано также, как должно выглядеть изменение
суммарного потенциала в пространстве между слоями.
Как указывает Лэнгмюр [11], результирующая сила, действующая на каждую
плоскость, может быть представлена в виде суммы силы, обусловленной осмотическим
давлением (поскольку концентрации ионов вблизи поверхности раздела отличаются от
Рис. IV-3. Два взаимодействующих двойных слоя.
Электрические свойства поверхностей
169
концентрации в объеме раствора), и силы, связанной с электрическим полем. Во всех
точках пространства между слоями результирующая сила должна быть постоянной,
и, поскольку в средней точке градиент поля dty/dx равен нулю, результирующая сила
в этой точке определяется только осмотическим давлением. Если раствор
разбавленный, то
(Пос„)полн = Р = nm6kT - [«„ (/"♦*"Г + Г"**'*7") - 2«0] kT. (I V-26)
Последний член этого уравнения соответствует поправке на осмотическое давление
раствора, tyM — потенциал средней точки. При больших if уравнение (IV-26) легко
упростить до
P = nofer/V"\ (IV-27)
Об определении сил отталкивания между двумя плоскими двойными слоями
подробно говорится в книге Кройта [5] и статье Майсельса и Джонса [12]. Интегрируя
уравнение (IV-11) с новыми граничными условиями и решая его совместно с
уравнением (IV-27), получаем
Р = (2nlKdfn0kT = (я/2) D (kT/ed)* (IV-28)
или для воды при 20 °С
Р = 8,90 • 10-7<22 дн/см2. (IV-29)
Потенциальная энергия двух взаимодействующих пластин определяется выражением
d
ed = — 2 ( Pdd = 1,78-Ю-6/d эрг/см2. (IV-30)
oo
Приведенная теория ограничивается большими $м и xd>~3. Для значительных
расстояний между поверхностями, когда \|?м мало, а взаимодействие является слабым,
Кройт [5] приводит уравнение
ва = (64n0kT/K) y*e-2*d9 (IV-31)
где
7 = (^o/2__I)/(^o/2 + 1).
6. Природа различных частей «двойного» слоя
В теории Штерна «двойной» слой делится на две области или два
слоя зарядов. Первый соответствует плотному, или адсорбированному,
слою, а второй — диффузному слою, или слою Гуи. Ниже будет
показано, что в двойном слое можно выделить некоторые дополнительные
области.
Сначала рассмотрим золь иодида серебра, находящийся в
равновесии с насыщенным раствором. Концентрации ионов серебра и иода
в растворе фактически равны, хотя сами частицы благодаря
преимущественной адсорбции ионов иода заряжены отрицательно. Если теперь
концентрацию Ag+ увеличить в 10 раз (.например, добавив нитрат
серебра), то в соответствии с выражением
pi=kT In C/C0 (IV-32)
термодинамический потенциал ионов серебра возрастает на 57 мВ
(25°С). В результате на поверхности адсорбируется некоторое число
ионов Ag+. Правда, этих ионов не так уж много (в моляр,ной шкале),
и, кроме того, они смешиваются с другими .ионами Ag+, находящимися
на поверхности, становясь неотличимыми от последних. Таким образом,
химический потенциал Ag+ в иодиде серебра фактически не меняется.
В то же время суммарный, или электрохимический, потенциал Ag+ в
обеих фазах должен быть одинаков (см. разд. IV-11), а если это
условие выполняется, то поверхностный потенциал увеличивается на 57 мВ.
Тогда изменение яро можно непосредственно рассчитать по
уравнению (IV-32), и в рассмотренном случае -фо увеличивается «а +57 мВ.
Поскольку концентрацию Ag+ в растворе можно легко менять на мно-
170 Глава IV
го порядков, соответственно -фо может меняться на сотни милливольт.
В этом случае Ag+ называют потенциал-определяющим ионом.
Измеряя э. д. с. ячейки с электродом серебро/иодид серебра, можно
определить концентрацию Ag+ до и после добавления нитрата серебра и,
таким образом, найти наряду с изменением потенциала поверхности
также поверхностный заряд {13].
Для белков и биологически активных веществ
потенциал-определяющим ионом, как правило, является Н+, так как степень
диссоциации их кислотных и основных групп зависит от рН раствора. Если
руководствоваться определением, данным в разд. IV-3, то ясно, что
ионы Н+ и Ag+ сами по себе не являются частью штерновского слоя.
Более того, не обязательно, чтобы потенциал-определяющий ион входил
в состав коллоидной частицы. Так, С1~ является
потенциал-определяющим ионом для золей золота, по-видимому, потому, что он образует
прочные хлоридные комплексы с атомами, находящимися -на
поверхности частиц золя. Представляется вполне разумным считать, что такие
потенциал-определяющие ионы полностью покидают раствор и, десоль-
ватируясь, вступают в тесную химическую связь с твердым телом.
Хотя теория Штерна позволяет интерпретировать адсорбцию
С1~-ионов на золоте с помощью некулоновского потенциала ср в
уравнении (IV-18), ее трудно применить к системе Ag+/noA^]; серебра,
поскольку теперь не совсем ясно, как определить поверхностные центры.
Чтобы обойти эти трудности, внутренний слой десольватированных
потенциал-определяющих ионов рассматривают как отдельный слой, а
слой Штерна — как второй слой по меньшей мере частично сольватиро-
ванных ионов, довольно прочно удерживаемых электростатическими и
неспецифическими (например, вандерваальсовыми) силами.
Если адсорбция достаточно сильная, то время жизни иона в штер-
новском слое довольно велико (см. разд. XIV-2) ;и в направлении по
нормали к поверхности ион можно считать неподвижным. Здесь
возникает также вопрос о тангенциальной подвижности ионов или об их
сопротивлении сдвигу. Кажется правде подобным, что ионы и
окружающий их раствор в слое Штерна сцеплены довольно жестко и что сам
слой также неподвижен и характеризуется высоким сопротивлением
сдвигу. Поскольку эта тангенциальная неподвижность определяется
всей средой в целом и прежде всего растворителем, нет оснований
считать, что плоскость скольжения в точности совпадает с границей слоя
Штерна и, как предполагается на рис. IV-4, может быть локализована
на некотором расстоянии от этой границы. Потенциал в этой
плоскости скольжения известен как ^-потенциал и играет важную роль в
электрокинетических явлениях, обсуждаемых в разд. IV-8.
Итак, обобщим картину структуры двойного слоя, используя в
качестве конкретного примера золь золота. В растворе смешанного
электролита (содержащего, скажем, хлорид и нитрат натрия) в двойном
слое такого золя возможны и в некоторых случаях экспериментально
различимы следующие плоскости. Сначала идет внутренний слой
десольватированных химически адсорбированных
потенциал-определяющих ионов С1~. За ним следует штерновский слой, содержащий
главным образом ионы Na+, частично адсорбированные благодаря
электростатическим силам и частично сольватированые, что приводит к
уменьшению потенциала от я|)0 до грв. Несколько дальше располагается
плоскость скольжения, на которой а|э равен электрокинетическому
потенциалу £, и, наконец, от этой плоскости, отстоящей от поверхности
на расстояние б, простирается область слоя Гуи, заселенная диффузно
распределенными положительными и отрицательными ионами с
некоторым избытком первых.
Согласно предложенной модели, i|)0 может весьма сильно меняться
при воздействии потенциал-определяющих ионов, вплоть до перемены
Электрические свойства поверхностей
171
Рис. IV-4. Общее изменение потенциала
с расстоянием вблизи поверхности с
прилегающим слоем
потенциал-определяющих ионов (см. упражнение 4).
Потенциал-определяющий слой
Слой Штерна
.tys Диффузный слой
^Плоскость скольжения
i
i
i
i
знака, а наличие слоев Штерна и Гун всегда приводит к уменьшению
абсолютной величины потенциала. На самом деле различие между
внутренним и штерновским слоями проведено здесь более резко,
чем это позволяют сделать имеющиеся данные. При этом четче
вырисовывается особая роль сил химического взаимодействия,
определяющих яро. Следует отметить, однако, что обычно авторы, работающие в
данной области, не проводят столь резкого различия между
внутренним и штерновским слоями.
7. Дальнейшее развитие теории двойного слоя
Как отмечалось в разд. IV-3, модель Штерна устраняет трудности, возникающие
из-за пренебрежения конечными размерами ионов в теории Гуи — Чепмена. Эта модель
позволяет модифицировать теорию двойного слоя с учетом размеров ионов. Спарнэй
[9] разработал теорию, в которой учитываются исключенные объемы ионов, т. е.
объемы вокруг отдельных ионов, недоступные для других ионов. Уравнение (IV-2)
заменяется на уравнения
п+ = п0е-У [1 - (S++ +7+) (л+ - п0) - (Я+- + V+) (гГ - п0)], (IV-33)
п- = п0еУ [1-(В~ +V-) (/Г -я0) - (В+- н V-) (л+- л0)],
где В*' — объем_вокруг иона /, недоступный для ионов i, a__V —парциальный ионный
объем Обычно V мал по сравнению с В, и если пренебречь V, то получим следующую
модификацию уравнения (IV-3) (для отрицательно заряженной поверхности):
1
-2~(*+-
. п") = -я0 [1 + п0 (Д++ + £+-)] sh у ■
+ n2QB++ sh (2y) — п\ (В++ - В") еУ1* sh (у/2).
Следовательно, при В++ = В— = В+~ и малом у опять получается уравнение (IV-3).
Качественно введение поправки на конечный объем ионов приводит к увеличению
протяженности двойного слоя.
Еще одним усложнением теории двойного слоя является выделение в слое Штерна
так называемой внутренней плоскости Гельмгольца (здесь используется формула
конденсатора Гельмгольца). Эта плоскость располагается на поверхности штерновского
слоя адсорбированных ионов и внешней плоскости Гельмгольца, проходящей через
центры следующего слоя ионов, с которого начинается диффузный слой. Внутренняя
и внешняя плоскости Гельмгольца, сокращенно обозначаемые как IHP и ОНР
соответственно (рис. IV-2), дальше рассматриваются в разд. IV-9B. В серии статей
Левина и др. [14] исследовано влияние дискретности заряда, приводящее к тому, что
локальный потенциал Штерна, который определяет адсорбцию ионов, фактически не
равен среднему потенциалу и отличается от последнего на величину «потенциала самих
ионов», что, в частности, приводит к взаимному отталкиванию адсорбированных ионов.
Теория предсказывает, что при увеличении я|з0 потенциал ОНР может проходить через
максимум. Рассмотренный эффект действительно проявляется в электрокапиллярных
явлениях (см. также упражнение 6).
К сожалению, мы вынуждены ограничиться лишь беглым обзором теории
двойного слоя, так как более подробное обсуждение чрезмерно увеличило бы объем
книги. Вообще говоря, доказать правильность отбора отдельных эффектов и корректность
их учета в различных моделях чрезвычайно трудно. Обзоры по теории двойного
электрического слоя можно найти в монографиях Делахея [15] и Спарнэя [10].
172
Глава IV
8. Дзета-потенциал
Существует ряд электрокинетических явлений, для которых
характерно движение раствора относительно заряженной поверхности или
наоборот. В электрическом поле наличие заряженной поверхности
проявляется в действии на раствор (некоторой силы, и, наоборот, при
движении заряженной поверхности относительно раствора индуцируется
электрическое поле. В обоих случаях между двойным слоем и средой
имеется плоскость скольжения, и результаты измерений можно
интерпретировать как .изменение плотности заряда до этой плоскости. Строго
говоря, ^-потенциал не является потенциалом межфазной границы,
поскольку он развивается целиком внутри жидкой фазы; его можно
рассматривать как разность потенциалов в практически однородной
среде между точкой на некотором расстоянии от поверхности и точкой
на плоскости сдвига.
Классификация различных электрокинетических эффектов
приведена в табл. IV-1.
Таблица IV-1
Классификация электрокинетических явлений
Наложение потенциала
Генерация потенциала
Характер относительного движения твердой поверхности
и раствора электролита
Движение раствора вдоль
неподвижной поверхности
(например, стенки или
поверхности измерительной
ячейки)
Электроосмос
Потенциал течения
Движение поверхности
(например, коллоидной
частицы) относительно
неподвижного раствора
Электрофорез
Седиментационный
потенциал
А. Электрофорез
Движение заряженных частиц в растворе с заданным градиентом
потенциала представляет собой .наиболее известное
электрокинетическое явление. Обычно его характеризуют скоростью движения частиц.
Когда в роли частиц выступают ионы небольших молекул, движение
частиц в поле называется ионной проводимостью; если же движущиеся
частицы достаточно велики, как, например, белковые молекулы, мы
имеем дело с так называемым электрофорезом.
Подвижность небольших ионов, т. е. их скорость в расчете на
единичный градиент потенциала, или их эквивалентную проводимость,
можной найти по результатам определения чисел переноса с помощью
ячейки Гитторфа и данным по проводимости. Подвижность ионов
можно измерить и непосредственно, применив метод подвижной границы.
Для ионов, т. е. частиц с точно известным зарядом, скорость
движения определяется выражением.
v=zmX, (IV-34)
где X — напряженность поля в электростатических единицах и со —
собственная подвижность (для сферы в соответствии с законом Стокса
(й=1/ьпг\г). Если X имеет размерность В/см, то
v=ze(uX/300=zuX9 (IV-35)
где и— электрохимическая подвижность. Из определения
эквивалентной проводимости X следует, что
X=Fuz, (IV-36)
где F — число Фарадея.
Электрические свойства поверхностей
173
Таким образом, измеряя скорость движения небольших ионов в
электрическом поле, обычно определяют величину их подвижности,
после чего, используя закон Стокса или связанные с ним уравнения,
оценивают их эффективные размеры. Если частицы велики и их общий
заряд неизвестен, скорость движения можно связать с ^-потенциалом.
Рассматривая диффузный двойной слой вплоть до плоскости
скольжения как своего рода конденсатор с параллельными пластинами, можно
записать
a=Dt/4iiT, (IV-37)
где т — эффективная толщина двойного слоя от плоскости
скольжения в глубь раствора (если £ отождествить с я|)б, то, как видно
из рис. IV-4, т=1/х. Сила, действующая на один квадратный сантиметр
поверхности, равна <тХ. В стационарном состоянии она
уравновешивается силой трения r\v/x, где ц — вязкость раствора.
v=oXx/r\ =Хто/300г1, (IV-38)
(коэффициент 1/300 вводится для того, чтобы перевести X в В/см), или
v=WX/4wr\. (IV-39)
Таким образом, скорость в расчете на единичный градиент
напряженности поля пропорциональна ^-потенциалу, или, другими словами,
произведению от, иногда называемому электрическим моментом на
единицу поверхности.
Экспериментально измерение электрофоретической подвижности
коллоидных частиц -не удается свести к простым измерениям
проводимости, поскольку на фоне электролита, обладающего значительной
проводимостью, трудно заметить изменение проводимости, связанное с
подвижностью введенных в раствор больших частиц (эффект
сглаживания). Подвижность таких частиц можно определить с помощью
метода подвижной границы или непосредственно наблюдая под
микроскопом движение частиц в электрическом поле.
Полная теория электрофоретической подвижности [5, 16], конечно, учитывает и
ряд других осложнений. На эффективную вязкость диффузного двойного слоя влияет,
в частности, движение ионов этого слоя под действием поля X. Это явление
называется «электрофоретическим торможением». Коротко его можно сформулировать
следующим образом. Поскольку суммарный заряд жидкой части двойного слоя имеет знак,
противоположный знаку поверхности, эти ионы в целом движутся относительно
раствора в направлении, противоположном движению поверхности. В свою очередь эти
ионы увлекают за собой растворитель, и, таким образом, возникает локальное
движение среды в направлении, противоположном движению заряженной частицы или
поверхности. В результате наблюдаемая скорость равна скорости, рассчитываемой из
приближенной теории, за вычетом локальной скорости среды.
Существует также релаксационный эффект, обусловленный движением частицы,
от которой несколько отстает двойной слой, что опять-таки приводит к торможению
движения частицы. Некоторые исследователи полагают, что область двойного слоя
обладает некоторой проводимостью; это же4 относится и к поверхности самой частицы.
Количественно оценить эффект в данном случае трудно, поскольку надежные
измерения ^-потенциала можно провести только для непроводящих частиц.
Б. Электроосмос
Электроосмос, или электроэндоосмос, — явление, дополняющее
электрофорез. Последний наблюдается в том случае, когда на систему
налагают поле X; при этом поверхность ,или частица движется
относительно неподвижного (в лабораторных координатах) растворителя.
Если, однако, заряженная поверхность фиксирована, то при наложении
поля движется диффузный двойной слой, а за ним увлекается и
раствор. Для трубки радиусом г, стенки которой обладают определенным
^-потенциалом и соответствующей плотностью зарядов, уравнения
174
Глава IV
Пористая
ОЙ, перегородка
fiL
Рис. IV-5. Капиллярный метод измерения осмотического давления.
(IV-38) и (IV-39) остаются в силе, причем под v теперь понимается
скорость движения диффузного слоя.
Электроосмос можно использовать для экспериментального
определения ^-потенциала. Схема соответствующего прибора изображена на
рис. IV-5. Исследуемый пористый материал помещается в виде
перегородки между двумя плоскими электродами, на которые налагается
сильное электрическое поле. Перенос жидкости через перегородку
можно определять, контролируя движение пузырька воздуха в
капиллярной трубке, обеспечивающей движение жидкости в обратном
направлении. Для того чтобы при 25 °С и яр0= 100 мВ обеспечить
скорость течения воды в 1 см/с, требуется поле напряженностью 1500 В/см.
Простая й ясная теория этого и других электрокинетических
явлений была предложена Смолуховским [17]. Объемный поток
жидкости V (см3/с) в трубке радиусом г определяется линейной скоростью
движения жидкости в трубке:
V = 7V2V
или
V=rKDX/4y\.
(IV-40)
(IV-41)
В то же время, если мы имеем дело с пористой диафрагмой (радиус
пор должен быть больше толщины двойного слоя), разделяющей два
резервуара с жидкостью и установленной, как показано на рис. IV-6,
Z.
Порастая И
перегородка
\
~^
Z7
\
Отдельная пора в разрезе
1Ди<р<рузный
слой
womoK жидкости
Рис. IV-6. Прибор для измерения осмотического давления.
Электрические свойства поверхностей
175
то обратный путь ж.идкости проходит по центру каждого капилляра
или поры. Как видно из приведенной на рис. IV-6 диаграммы потоков,
раствор в центре поры и у стенок движется в противоположных
направлениях. При наложении поля возникает электроосмотический
поток, и некоторое время происходит перенос жидкости через диафрагму,
что приводит к появлению разности уровней в вертикальных трубках.
По мере увеличения перепада гидростатического давления противоток
растет, пока наконец не устанавливается стационарное
гидростатическое давление, при котором противоток жидкости в центре поры в
точности равен потоку у стенок. Давление Р связано с противотоком
уравнением Пуазейля:
V (противоток) =яг4Р/8т|/, (IV-42)
где / — длина трубки. Из уравнений (IV-40) и (IV-41) следует, что
стационарное давление равно
P = 2£DE/jir2, (IV-43)
где Е—X/ и равно общему приложенному потенциалу,
при 25°С
и=7,8-Ю-3Х£ (см/с),
Р=4,2-10-8Е£/г* (см рт. ст.),
Для воды
(IV-44)
(IV-45)
где потенциал выражен в вольтах, а длина — в сантиметрах. Например,
при £, равном 100 мВ, и общем потенциале 1 В в капилляре радиусом
1 мкм развивается давление 1 см рт. ст.
В. Потенциал течения
При пропускании раствора через трубку индуцируется некоторый
потенциал, называемый потенциалом течения, т. е. возникает ситуация,
обратная электроосмосу. Теория этого эффекта также разработана
Смолуховским [17]. В ламинарном потоке скорость течения на
расстоянии х от центра трубки равна
v=P(r*—x2)/4i\l. (IV-46)
Двойной слой сосредоточен в области х=г—т. Подставляя это
равенство в уравнение (IV-45) и пренебрегая величиной т2, получаем
Vd=xrp/2qf. (IV-47)
В результате ток, обусловленный движением жидкости, описывается
выражением
i=2nrovd (IV-48)
или
*=лг%тР/т|/. (IV-49)
Если удельная проводимость раствора равна &, то проводимость
жидкости в капиллярной трубке составляет C=nr2k/l. В соответствии с
законом Ома потенциал течения Е равен i/C. Решая эти уравнения
совместно с уравнением (IV-37), находим
Е=таР/г]£ (IV-50)
или
Е=£Р£>/4ят]£. (IV-51)
Более подробный вывод этого соотношения дается в монографии [5].
•При измерении потенциала течения, как и при исследовании
других электрокинетических явлений, трудно получать воспроизводимые
176
Глава IV
результаты. В установку для измерения потенциала течения обычно
входят устройство для пропускания жидкости под давлением через
пористую перегородку или капилляр и пара помещенных в раствор по
разные стороны от перегородки электродов для измерения Е [5, 8,
18, 19].
У жидкостей с очень низкой проводимостью развиваются довольно
значительные потенциалы течения, что чревато серьезными
последствиями. Так, например, при быстрой подаче потока топлива в
реактивных самолетах возможно искрение.
Г. Седиментационный потенциал
При вынужденном движении заряженных частиц относительно среды, например
под действием центробежных сил, возникает седиментационный потенциал Е. Этот
электрокинетичесний эффект изучен менее всего. Выражение, связывающее Е с £ и
другими параметрами в поле центробежных сил, имеет вид
Е = iP„Jk) (DC/бял) (©2/2) (#1 - R\), (I V-52)
где Cm — кажущаяся масса диспергированного вещества в одном кубическом
сантиметре*, со — угловая скорость центрифуги, а /?2 и R\ — расстояния от оси вращения
двух точек, между которыми измеряется седиментационный потенциал.
Д. Дальнейшее развитие теории электрокинетических явлений
Можно показать, что при электроосмосе
С этим выражением согласуется приписываемое Саксену [21] давно известное
равенство отношения V/i при нулевом давлении и отношения потенциала течения к
давлению Е/Р при нулевом токе. Более глубокое рассмотрение взаимосвязи
электрокинетических процессов и общую феноменологическую теорию электрокинетических и
гидродинамических явлений можно найти в работах Мазура и Овербека [22] и Лоренца
[23]. Эта теория представляет собой важный пример применения соотношений
взаимности Онзагера.
Поскольку в электрокинетических исследованиях часто применяются пористые
перегородки, в получаемые данные необходимо вводить поправку на поверхностную
проводимость. Обычно это делают, сравнивая электрическое сопротивление перегородки
в растворе с сопротивлением, которое имела бы система, если бы вместо
перегородки были установлены не связанные между собой трубки с соответствующей длиной и
поверхностью. Следует, однако, подчеркнуть, что, если используются решетки из
капилляров, эта процедура приводит к слишком низким значениям ^-потенциала [24].
Е. Общие соображения относительно связи между дзета-потенциалом
и устойчивостью коллоидов
Измерения ^-потенциалов на самых разнообразных поверхностях
раздела между твердым телом и раствором далеко не всегда дают
согласующиеся между собой результаты. Очевидно, на ^-потенциал
сильное влияние может оказывать адсорбция примесей в штерновском слое.
На рис. IV-7 приведены некоторые данные для поверхности раздела
пирекс — вода [5]. Как и можно было ожидать, с увеличением
концентрации электролита ^-потенциал падает, что связано с
последовательным уменьшением -ф в неподвижном слое.
В зависимости от концентрации Ag+ и 1~ ^-потенциал йодистого
серебра может быть как положительным, так и отрицательным, меняясь
в интервале ±75 мВ. Из этого факта следует, что три замене
потенциал-определяющего иона знак ^-потенциала может меняться на
обратный. Обычно золи металлов характеризуются отрицательными £-потен-
циалами, которые не коррелируют с их работами выхода или стандарт-
*Другими словами, масса вещества минус масса вытесненной им жидкости.—
Прим. ред.
Электрические свойства поверхностей
177
150
100
50
•
%
»
•
•
" **<
^
—
' —
~""^»
■""^^*
Sta.
>-
к-
«-— ,.
КОН
-KN<
-Ba(NO
h>
i
J>2
m Л»
La(N03)2
— •
-_•.
>
I
<3Q
с:
О 50 100 150 200
Концентрация, мкэкв./л
Рис. IV-7. Дзета-потенциал на поверхности раздела пирекс—водный раствор
электролита.
ными электродными потенциалами. Отсутствие такой корреляции, по-
видимому, связано с наличием на поверхности дипольного слоя окислов
[5]. На ^-потенциал сильное влияние может оказывать специфическая
адсорбция ионов, как, например, рассмотренная ранее адсорбция С1~-
ионов на золях золота.
Структура двойного слоя в значительной мере определяет
стабильность дисперсий коллоидных частиц. Обычно считают, что в
присутствии поверхностного заряда лиофобные золи стабилизуются. Прежде
чем коалесцировать, две частицы должны сблизиться и преодолеть
отталкивание между их двойными слоями (см. разд. IV-5). Поэтому
изменение г|)о оказывает заметное влияние на стабильность таких золей. Это,
в частности, наблюдается при титровании 1~-ионов нитратом серебра,
когда сразу после добавления некоторого избытка ионов серебра
происходит коагуляция иодида серебра. В табл. IV-2 приведены данные,
взятые из работы Бертона [25], которые ясно показывают связь между
устойчивостью и ^-потенциалом золя золота в растворе, содержащем
добавки А13+.
Эффективность действия электролита на стабильность коллоидной
системы обычно характеризуют порогом коагуляции, равным
концентрации (например, ммоль/л), при которой через определенный
промежуток времени происходит коагуляция. Так, при переходе от одно- к
дву- и затем к трехзарядным ионам эффективность электролита
возрастает примерно в 10 и 100 раз. Влияние заряда, возможно, частично
связано с уменьшением толщины двойного слоя, но в основном
обусловлено большей адсорбцией многозарядных частиц в штерновском
слое [11]. Это проявление влияния валентности электролита известно
Таблица IV-2
Коагуляция золя золота
Концентрация А13+,
экв/лхЮб
0
21
42
70
Электрофоретическая подвижность,
CM2/B-CX106
3,30 (к аноду)
1,71
0
0,17 (к катоду)
1,35
Стабильность
Неограниченная
Коагулирует за 4 ч
Коагулирует
самопроизвольно
Коагулирует за 4 ч
Коагулирует не полностью
за 4 дня
12—1421
178
Глава IV
как правило Шульце — Гарди. Ионы с одинаковым зарядом также
располагаются по эффективности в определенном порядке, образуя так
называемые ряды Гофмейстера, в которых пороги коагуляции (или
обратные эффективности) меняются пропорционально радиусу гидрат-
ной оболочки иона.
Исходя из более общих соображений, можно считать, что
коагуляция наступает сразу после того, как силы отталкивания между
частицами становятся меньше сил вандерваальсового притяжения. Для
макрочастиц интегральный вандерваальсо© потенциал обратно
пропорционален квадрату расстояния между их поверхностями (см. разд. VI-3A)
и сравним с энергией отталкивания двойных слоев. Левин и Бел [14]
используют этот подход, для того чтобы согласовать разработанную
ими теорию слоя Штерна с эмпирическим правилом Шульце—Гарди.
9. Электрокапиллярность
Давно известно, что форма искривленной поверхности ртути,
находящейся в контакте с раствором электролита, зависит от степени ее
электризации [26]. Первое обширное исследование этого явления
проведено Липпманом еще в 1875 г. [27]. Схема установки Липпмана
показана на рис. IV-8.
Качественно поведение столбика ртути в капилляре можно описать
следующим образом. Первоначально поверхность ртути заряжается
положительно. По мере увеличения потенциала заряд поверхности
уменьшается. При этом высота столбика ртути (и, следовательно, ее
поверхностное натяжение) возрастает, проходит через максимум и
затем снова уменьшается. Кривая зависимости поверхностного
натяжения ртути от потенциала в первом приближении имеет форму
параболы (рис. IV-9). Подобные кривые называются электрокапиллярными
кривыми. Электрокапиллярный максимум ртути находится в области
потенциала —0,48 В (в растворе «инертного» электролита, например
карбоната калия, по нормальному каломельному электроду).
Левую половину электрокапиллярной кривой обычно называют
восходящей или анодной ветвью, а правую половину — нисходящей или
катодной ветвью. Как отмечается ниже, левая ветвь
электрокапиллярной кривой чувствительна к природе аниона электролита, а правая —
чувствительна к природе присутствующих катионов. Изменение
состава растворителя может влиять на общую форму и расположение
кривой, тогда как введение в раствор добавок влияет главным образом на
среднюю часть кривой.
Необходимым условием корректности электрокапиллярных
измерений является идеальная поляризуемость ртути или других
металлических поверхностей, т. е. очень важно, чтобы через поверхность раздела
не проходил ток. Важно также, чтобы не протекали никакие химические
реакции и электрокапиллярный эффект был целиком связан с
изменениями потенциала на поверхности раздела и соответствующими
изменениями в адсорбированном слое.
Рис. IV-8. Установка Липпмана для наблюдения
электрокапиллярного эффекта.
Электрические свойства поверхностей
179
1
I
420\
400\
380
360
34-0
320
300\
28о\
260\
pw'i п 1 ч'Т"гп 1 I I | |
УлГН
t NaCl/ /
Г KCNSJlNaBr/
[- 'KI
Mill I—L.L..I. 1 ' ' 1 1 1
a H
у ]
\ A
\ J
\ ~i
i i i i i i i 11
/
/
/
^
^
\
x
^
\
~Ti
у
C15 0,S 0,4 0,2 0,0-0,2 -0,4-0,6-0,8 -1,0 -1,2 -1,4
0 0,5 1,0 1,5 2,0
Отрицательный поляризующий
потенциал, в
420
h Х^Т^
400
K£i&>,4\
^
J00
360
Ч
"1—i—г
0
/
^4
4.
-I 1 1 I I l_
tfi
Iй9
^ 0,8
0,7
0,6
' /^
fr
-
1 1
4
\
.1 1 1
+0,2 0 -0,2 -0,4 -0,6 -0,8
0 0,5 1,0 1,5 2,0
Потенциал, В
Рис. IV-9. Электрокапиллярные кривые [61].
а —адсорбция анионов [28]; б —адсорбция катионов [5]: 7 — 0,5 М раствор Na2S04; 2 — тот же
раствор с добавкой 0,1 М сульфата тетраметиламмония; 3 — тот же раствор с добавкой 0,75 М
сульфата тетраэтиламмония; в — влияние замены растворителя [32]; г — адсорбция
неэлектролитов [61]: 1— 1 М пропионовая кислота; 2 — Na2S04; 3 — насыщенный раствор масляной кислоты.
Используя теории плотного и диффузного слоев, рассмотренные в
первых разделах этой главы, можно оценить, в какой степени
изменение потенциала на поверхности раздела ртуть — раствор
электролита связано с изменением адсорбции различных ионов. Более того,
электрокапиллярный метод позволяет непосредственно оценить
изменение свободной энергии поверхности раздела. Далее с помощью
уравнения Гиббса можно рассчитать поверхностные избытки, а из кривой
зависимости поверхностного натяжения от потенциала найти
поверхностную плотность заряда. В результате представляется
возможным непосредственно определять основные параметры двойного слоя.
Таким образом, казалось бы, ничем не примечательный
электрокапиллярный эффект становится мощным методом исследования структуры
межфазной области поверхностей раздела типа металл — раствор.
Л. Термодинамика электрокапиллярного эффекта
Основными уравнениями теории электрокапиллярности являются
уравнение Липпмана [27]
(<Эу/<ЭЕ)ц=— a (IV-53)
и связанное с ним уравнение
(d^/3E%=-(da/dE)=C,
(IV-54)
где Е — приложенный потенциал; а — величина заряда поверхности
раздела со стороны раствора, приходящаяся на 1 см2; С —
дифференциальная емкость двойного слоя; нижний индекс показывает, что со-
12*
180
Глава IV
став раствора (и металлической фазы) поддерживается постоянным.
Имеется несколько более или менее эквивалентных выводов
уравнения электрокапиллярности (IV-53); все они обсуждаются в работе
Грэхэма [28]. Сам Липпман основывает свой вывод на предположении,
что поверхность раздела является аналогом плоскопараллельного
конденсатора и что обратимая работа изменения поверхности и ее заряд
связаны соотношением
dG=ydA + Aydq, (IV-55)
где q— общий заряд поверхности; Аф — разность потенциалов; второй
член справа, очевидно, выражает работу увеличения заряда
конденсатора. Интегрирование уравнения (IV-55) при постоянных 7 и Аф дает
G=yA + Ayq. (IV-56)
Повторно дифференцируя это уравнение и сравнивая полученный
результат с уравнением (IV-55), получаем
0=Ady + qd(Aq>). (IV-57)
Поскольку q/A = a, то проведя соответствующую перегруппировку
(IV-57), приходим к уравнению (IV-53).
При строгом подходе, учитывающем природу адсорбированного
слоя, используется общая термодинамическая схема вывода
уравнения Гиббса (разд. П-5Б) с той только разницей, что теперь в
рассмотрение вводятся электрохимические потенциалы и поверхностные
избытки ионных компонентов [14, 29—31]. Здесь же приводится
упрощенный вывод по Грэхэму и Витнею [31]. В соответствии с первым и
вторым законами термодинамики поверхностная энергия системы и
поверхностные избытки связаны между собой соотношением (П-78),
которое в данном случае можно записать в виде
dEs=TdSs + 2^idm! + ydA. (IV-58)
i
Кроме того,
lLi=(dE/dmi)Stv,mj.A (IV-59)
или в расчете на 1 моль
^i=dE/dni. (IV-60)
Поскольку мы имеем дело с фазами, заряд которых может меняться,
химический потенциал системы \\i необходимо заменить на
электрохимический потенциал |ыг. Основная проблема здесь состоит в том, что
концентрации отдельных ионов в растворе не являются действительно
независимыми переменными. Кроме того, при изменении количества
заряженных частиц на поверхности в соответствии с требованием
сохранения электронейтральности меняется также количество электронов
в металлической фазе. Для 1-го заряженного компонента можно
записать
дЕ1дщ=^ + г#е, (IV-61)
где \хе— электрохимический потенциал электронов в системе. Тогда
уравнение Гиббса (П-82) принимает вид
dy^—S'dT—^T^-yjfi^e' (IV"62)
i I
Теперь электрохимический потенциал можно выразить через
химический \ii и электрический потенциал (см. разд. IV-11):
djT^d^+ZfFdq,, (IV-63.
Электрические свойства поверхностей
181
где dy — изменение электрического потенциала фазы (для
незаряженных компонентов 2* = О, и, таким образом, химический и
электрохимические потенциалы равны). Поскольку металл а и раствор р находятся
при некоторых постоянных потенциалах фа и фр, компоненты внутри
каждой фазы группируются в соответствии с потенциалами этих фаз.
Вводя уравнение (IV-63) в уравнение (IV-62) и учитывая это
ограничение, получаем
i i i
-F ^ ГЛЛрЭ + F J) ГЛЛр*+F £ ГЛЛр« (IV-64)
f / *
При выводе уравнения (IV-64) необходимо помнить, что, поскольку
электроны сосредоточены только в металлической фазе, d\ie =
= d\Le—Fdq>a. После сокращения и объединения членов уравнение
(IV-64) принимает следующий вид:
dy = ^S^dT-F^Tizid(^-r)-^Tidiii-^izidiie (IV-65)
i i i
или, учитывая требование электронейтральности,
с с+1
2Г,г,=Г„ dy=—SsdT—od №—<(<*) —£ Гid^. (IV-66)
В последнем уравнении верхний индекс суммы с обозначает
суммирование по всем компонентам, кроме электронов. Величина F^jTiZi в урав-
i
нении (IV-65) идентична a — избытку заряда на поверхности раздела
со стороны раствора. В общем случае, однако, это не всегда так,
поскольку Г зависит от расположения разделяющей поверхности. Для
полностью поляризованной поверхности раздела (здесь это выражение
означает, что в обеих частях системы нет никаких адсорбированных
ионов) вопрос расположения разделяющей поверхности становится
тривиальным, и можно использовать уравнение (IV-66). При
постоянных температуре и составе это уравнение переходит в уравнение Лип-
пмана (IV-53). Следует, однако, заметить, что Е в уравнении (IV-53)
относится к разности потенциалов, измеряемой внешним прибором,
тогда как Аф — разность потенциалов между двумя исследуемыми
фазами. Вообще говоря, эти величины имеют различные значения; однако,
поскольку в общем случае они отличаются друг от друга на некоторую
постоянную, зависящую от типа электродов сравнения и других
элементов системы, их изменения можно считать равными и, таким
образом, й(Аф) можно заменить на dE.
Проанализируем теперь зависимость у от концентрации
электролита. Для системы с одним электролитом Грэхэм ,[28] дает следующие
уравнения:
dy =_adE"—(r+/v+) d\i (IV-67)
и
dy=—adE+—(r./v.)dji, (IV-68)
где v+ и v_ — число ионов данного знака, приходящееся на молекулу
электролита. Выбор одного из этих двух уравнений определяется
ионом, относительно которого обратим электрод сравнения. При
постоянном Е уравнения (IV-67) и (IV-68) можно привести к<виду
r+=-v+(dyfdtL)E- (IV-69)
182
Глава IV
И
Г_=— v_(dy/dii)E+. (IV-70)
Наконец, применяя обычное выражение Гиббса, описывающее
концентрационную зависимость поверхностного натяжения растворов
нейтральных веществ, приходим к выражению
Г,=-(<ЭТ/Ф;)е. (IV-71)
В рассмотренном случае, как и при выводе уравнений (IV-69) и
(IV-70), предполагается, что разделяющая поверхность локализована
таким образом, чтобы ГраСтворителя было равно нулю. Такой выбор
может привести к занижению роли растворителя в плотном слое Штерна.
Если же разделяющую поверхность расположить так, чтобы нулю был
равен поверхностный избыток ионов металла, то значения Г для
остальных компонентов меняются в зависимости от мольной доли этих
компонентов в растворе.
Б. Экспериментальные методы
Различные экспериментальные электрокапиллярные методы можно
разделить на две группы, в одной из которых измеряется
поверхностное натяжение при различных потенциалах, в другой —
непосредственно измеряется либо заряд, либо емкость двойного слоя.
Разработанный Липпманом [27] капиллярный электрометр,
изображенный на рис. IV-8, является классическим прибором, который до сих
пор играет очень важную роль. Электрометр Липпмана состоит из
вертикальной трубки, соединенной с емкостью для ртути. Нижний конец
трубки заканчивается тонким, обычно коническим, капилляром
диаметром порядка 0,05 мм. Для контроля за мениском в капилляре
используют какой-нибудь оптический прибор, например катетометр. Система
включает также сосуд с раствором, в который погружен капилляр,
электрод сравнения и потенциометрическую цепь, служащую для
наложения на электроды регулируемого напряжения. На описанном
приборе измеряют высоту столбика ртути как функцию потенциала Е.
Для точного определения поверхностного натяжения по высоте
столбика ртути важно, чтобы раствор полностью смачивал капилляр и,
таким образом, краевой угол между ртутью и стеклом был равен 180°.
В этом случае мениск является полусферическим и величину у можно
рассчитать по уравнению (1-11).
Обычно мениск в капилляре подводят к некоторой фиксированной
точке, меняя высоту столбика ртути или давление газа [32]. Более
или менее подробные описания капиллярного электрометра можно
найти в работах [33—36]. В настоящее время измерения на капиллярном
электрометре обычно совмещают с емкостными измерениями, которые
(будут описаны ниже.
Электрокапиллярные кривые для твердых металлов измеряют,
контролируя изменение краевого угла на трехфазной границе газ —
раствор — металл в зависимости от потенциала [37, 38]. Однако
интерпретация полученных результатов очень осложняется необходимостью
учета влияния поверхностного натяжения твердого тела (см. разд. VII-5).
Плотность поверхностного заряда а можно измерять
непосредственно с помощью прибора, схематически изображенного на рис. IV-10.
Через раствор пропускается стационарный поток свободно падающих
капелек ртути. Поскольку поверхность ртути заряжена положительно,
при отрыве капли через внешнюю цепь на ртутный электрод на дне
сосуда проходит поток электронов. Описанный прибор был разработан
еще Липпманом, а позднее аналогичный прибор использовался также
Грэхэмом [39]. Если общий заряд, проходящий через систему.
Электрические свойства поверхностей
183
=N§b
Рис. IV-10. Прибор Липпмана для прямого определения
поверхностного заряда.
разделить на число капель и затем еще на поверхность каждой капли,
то получим 0. Смещая потенциал капающего электрода и измеряя
изменение тока, можно получить зависимость а от Е. При этом
необходимо учитывать соответствующие изменения поверхностного
натяжения и, следовательно, размера капли.
В работе Грэхэма i[39] описан метод прямого определения емкости
двойного слоя с помощью специального моста. При применении этого
метода добиваются, чтобы капли формировались медленно и с
равномерной скоростью. Поскольку емкость системы зависит от размера
капли, балансировка моста остается постоянной. Измеряется интервал
времени между моментом падения предыдущей капли и моментом,
когда емкость последующей капли достигает заданного значения. Если
принять, что капля имеет сферическую форму и растет с постоянной
скоростью, можно найти ее площадь в момент измерения и затем
рассчитать емкость единицы поверхности.
Следует отметить, что интегральная емкость двойного слоя
определяется выражением К=а/Ег, где а рассчитывается по то<ку капающего
электрода или по уравнению (IV-53), а Ег — потенциал относительно
точки электрокапиллярного максимума, или э. к. м. (при этом
предполагается, что Ег равен разности потенциалов на поверхности раздела).
Дифференциальная емкость, определяемая уравнением (IV-54), и
интегральная емкость связаны следующим выражением:
С=К+Е- (дК/дЕ%. (I V-72)
В. Электрокапиллярные свойства ртути в водных растворах
Форму электрокапиллярной кривой легко рассчитать, принимая, что
двойной слой ведет себя подобно конденсатору с постоянной
емкостью С. В этом случае двойное интегрирование уравнения (IV-54) дает
Y=Ymax-4-C(E02- (IV-73)
Отметим, кстати, что величина, называемая рациональным
потенциалом г|)г, соответствует значению Ег поверхности раздела ртуть — вода
(без добавок электролита), и, таким образом, в общем случае при
использовании нормального каломельного электрода сравнения г|)г=Е +
+ 0,480 В.
Уравнению (IV-73) соответствует парабола, и электрокапиллярные
кривые действительно имеют почти параболическую форму. Поскольку
для некоторых электролитов, например для сульфата и карбоната
натрия, Етах и Ymax почти совпадают, обычно считают, что в этих системах
эффекты специфической адсорбции отсутствуют и
t^max представляет
собой постоянную (Етах = —0,480 В), характеризующую поверхность
раздела ртуть — вода. Для большинства других электролитов имеет
184
Глава IV
Таблица IV-3
Характеристики двойного электрического слоя в электрокапиллярном максимуме
Электролит
NaF
NaCl
KBr
KI
NaSCN
K2CO3
NaOH
Na2S04
Концентрация,
моль/л
1,0
0,001
1,0
0,1
1,0
0,01
1,0
6M I
1,0
0,5
1,0
0,5
Emax' B
—0,472
—0,482
—0,556
—0,505
-0,65
—0,54
-0,82
—0,59 |
—0,72
—0,48
—0,48
-0,48
<mx
0,008
—0,002
—0,076
—0,025
—0,17
—0,06
—0,34
—Q,U 1
—0,24
0,00
0,00
0,00 J
Сли' мк1<л/см2
3,6
1,1
10,6
0,6
15,2
из
14,0
—2,2
Мала
»
место сдвиг максимума потенциала, и г|?тах принимают равным (Етах—
—0,480) В. Некоторые значения этих величин приведены в табл. IV-3
[28]. Обширная информация по электрокапиллярным свойствам
поверхностей раздела ртуть — водные растворы приведена в работе Гуи
[40], хотя многие дополнительные сведения по данной теме можно
найти и во многих других работах, цитируемых в данном разделе.
На рис. IV-11 показано изменение интегральной емкости в
зависимости от Е. Хорошее согласие данных, рассчитанных по результатам
определения поверхностного натяжения и найденных методом прямого
определения емкости, подтверждает правильность рассмотренных
термодинамических соотношений. Как показано на рис. IV-12, при сдвиге
потенциала в сторону отрицательных значений дифференциальная
емкость в целом также уменьшается. Кроме того, вблизи Emax на кривой
дифференциальной емкости может наблюдаться максимум или
минимум.
В точке электрокапиллярного максимума dyfdE и а (но не С)
равны нулю, следовательно, ri"ax/v+ = r^ax/v_. Поскольку
dp = v.dfx. + v+4i+, (IV-74)
из уравнений (IV-69) и (IV-70) следует, что
dYmax№ =
(IV-75)
\ 40
1
5
-«г 30
е-
§20
1
S m
' e
_
:
-
"T"
0
e
—L
®
1 г
8
-1 L
1 1 1 1 Г 1 г i j
• / 1
© 1 A
0.
®Ош
A
1 1 1 1 1 1 1 il
i
0,8 0,6 0A 0,2 0 -0,2 -0A -0B -0,8 -1,0 -1,2 -1A
Потенциал относительно э.х.м.,В
Рис. IV-11. Зависимость интегральной емкости двойного слоя от потенциала для 0,1 н
раствора сульфата натрия [28].
/ — по результатам измерения дифференциальной емкости; 2 — из электрокапиллярных кривых;
3 — по результатам прямых измерений.
Электрические свойства поверхностей
185
Рис. IV-12. Зависимость дифференциальной
емкости двойного электрического слоя от
потенциала Ег в водных растворах хлорида
натрия при 25°С [28].
1—l—I—I—I—l—l—г
п—i—г
ojm н
Ь,о/м
ОА О -0,4 -0,8 -1,2 '1,6 -2,0
Потенциал, В
На рис. IV-13 и в табл. IV-3 приведены данные Грэхэма по
электрокапиллярным свойствам ртути в различных электролитах. Как видно
из этих данных, хотя в электрокапиллярном максимуме заряды
адсорбируются на поверхности ртути мало, здесь тем не менее имеет место
заметная адсорбция нейтральной соли. Последовательность анионов,
расположенных в порядке увеличения степени адсорбции, подобна
ряду Гофмейстера, характеризующему коагулирующую способность
электролитов, что указывает на возможность специфической адсорбции
ионов на ртути. Обрабатывая электрокапиллярные кривые с помощью
уравнений (IV-69) и (IV-53), нетрудно найти поверхностные избытки
отдельных ионов (Г-i, Г-) и а. Более подробно этот вопрос
рассматривается в статье Грэхэма [28].
/4
12 \
10 \
11
1 6\
II 4
2
п
_ I I I I
/
- /
- /
/
/
- /
- /
_ /
/
" /
~ J KN03°
-' /
/ NaCl/
Г/ /у
1 1
fKbr,
1 I I I I I l
КС П$р^
/кВг
/ ^^°к1
/и,М
f/NaCNS
уРУЛ
0fl1M
i i i i i I i
l I I
I I I
KI
I I
тп
J
А
А
А
~\
А
-\
j I
О 0,1 0,2
Рис. IV-13. Зависимость Г™хиот irmax [28].
0,3
0,4
186
Глава IV
Плоскость
Гельмгольца, <Pf
Поверхность -
металла,^!
Плоскость Гуи, %
Сольватированные
катионы
Специфически
адсорбированные
анионы
Нормальная
структура воды,
6=78,5
Первый слой воды,
е = 6
Второй слой воды,
e=J2
€=6—" I—е=32
Рис. IV-14. Подробная модель двойного слоя [41].
Данные по дифференциальным емкостям (например, приведенные
на рис. IV-12) прояснили многие специфические эффекты, возникающие
вблизи заряженной поверхности раздела. Особенности структуры
двойного слоя иллюстрирует рис. IV-14. На поверхности раздела мо*
гут присутствовать химически адсорбированные ионы, в данном случае
анионы, имеющие тот же знак, что и поверхность металла. Анионы
эти дегидратированы, и через их центры проходит внутренняя
плоскость Гельмгольца (IHP). Слой Штерна образуется главным образом
электростатически адсорбированными катионами, через центры
которых проходит внешняя плоскость Гельмгольца (ОНР). Обратите
внимание, что большая часть поверхности раздела занята молекулами
воды, даже на сильно заряженной поверхности раздела концентрация
адсорбированных ионов довольно мала: обычно один ион на — 100 А2.
Электрические свойства поверхностей
187
В поверхностном слое молекулы растворителя сильно ориентированы,
и в результате их эффективный дипольный момент довольно велик.
Хотя схемы, подобные изображенной на рис. IV-4, весьма
наглядны, к ним следует относиться осторожно. Как указывается в одной из
последних глав (гл. XIII, разд. ХП1-4Б), поверхность жидкости может
быть неоднородной в том смысле, что ее структура нарушается
адсорбированными частицами. Поверхность ртути также, по-видимому,
разумнее представлять себе в виде покрытой рябью, а не гладкой
плоскости. Внутренняя и внешняя плоскости Гельмгольца являются
просто плоскостями, характеризующими поверхность раздела с
усредненными электрическими свойствами. Если бы удалось измерять
локальные потенциалы, то оказалось бы, что они меняются в широких
пределах в зависимости от точки измерения, например вблизи
адсорбированного иона или в слое, в котором имеются только молекулы
растворителя.
Г. Влияние растворенных незаряженных веществ
и природы растворителя
На расположение и форму всей электрокапиллярной кривой сильное влияние
оказывает изменение природы раствора. Это хорошо иллюстрируют приведенные на рис.
IV-9, в данные для 0,01 н. спиртово-водных растворов соляной кислоты и этилового
спирта [31, 32]. Рассчитанная по уравнению (IV-71) адсорбция этанола на
поверхности ртути всегда положительна, и ее зависимость от состава раствора напоминает
аналогичную зависимость для поверхности раздела раствор — воздух.
Гуи провел обширное исследование влияния различных добавок на
электрокапиллярные свойства ртути. В частности, изучалось влияние добавок жирных кислот (см.,
например, рис. IV-9, г), аминов, спиртов, галогенидов и т. д. к 0,5 М раствору
сульфата натрия. Максимум адсорбции совпадает с э. к. м. или находится рядом с ним.
Батлер [43] объясняет этот эффект тем, что для замены молекулы воды с
поляризуемостью aw на молекулу органической жидкости с поляризуемостью а0 в
электрическом поле требуется затратить определенную работу: в э. к. м. эта работа (и,
следовательно, адсорбция воды) минимальна. Более подробное рассмотрение этих вопросов
можно найти в обзоре Фрумкина и Дамаскина [44].
Д. Другие электрокапиллярные системы
Электрокапиллярные свойства различных металлов, за исключением ртути,
исследовались не систематически, и для них имеются только разрозненные данные. Фрум-
кин и сотр. [45] измерили электрокапиллярные кривые на амальгамах таллия и
кадмия — менее инертных металлов, чем ртуть. Общий эффект введения этих металлов
в ртуть сводится к сдвигу максимума кривой вправо. Термодинамика адсорбции
растворенного металла на поверхности раздела рассмотрена в работе Кёнига [30].
Электрокапиллярные кривые для жидкого таллия аналогичны электрокапиллярным кривым
для ртути, и опять максимумы на этих кривых сдвинуты вправо. Эта и другие системы,
включая расплавы солей, подробно обсуждаются в книге Делахея [15]. В недавно
опубликованной работе [46] исследуется адсорбция на поверхности раздела Hg (In)—
раствор электролита.
Е. Разность потенциалов между двумя фазами
Здесь уместно остановиться на вопросе, возникающем в связи с оценкой разности
потенциалов между двумя фазами. Более подробно этот вопрос обсуждается в
следующем разделе; сейчас же он интересует нас только в связи с электрокапиллярной
кривой. Заманчиво было бы считать, что поскольку в электрокапиллярном максимуме
а равняется нулю, то и разность потенциалов между двумя фазами в этой точке
равна нулю. Если бы это было так, абсолютная разность потенциалов между ртутью и
водой составляла бы 0,48 В (относительно нормального каломельного электрода).
Нельзя, однако, ожидать, что потенциал электрода в точке э. к. м. в точности ра*
вен потенциалу раствора, поскольку разность потенциалов между металлом и
раствором зависит от природы растворителя. Дело в том, что на потенциалы границы
раздела металл — раствор оказывают влияние дипольные молекулы растворителя и другие
факторы, имеющие не просто электростатическую природу.
188
Глава IV
10. Заряженные поверхности раздела твердое тело — жидкость
За время, прошедшее после второго издания этой книги,
опубликовано большое число работ, в которых исследуются свойства
заряженных поверхностей раздела твердое тело — жидкость. По сравнению с
системой ртуть — жидкость здесь возникают свои проблемы. В таких
системах межфазное натяжение невозможно измерить
непосредственно, и электрокапиллярные кривые получают косвенными методами. Для
решения этой задачи используют два принципиально разных подхода.
Во-первых, если твердое тело обладает достаточной
электропроводностью, его можно исследовать как обычный электрод (см. разд. IV-11 Г).
Для измерения емкости межфазной области в зависимости от
потенциала, природы электролита и т. д. существует множество
разнообразных методов. Во-вторых, твердое тело может находиться в растворе
в виде тонкой суспензии, образующей, по существу, коллоидную фазу.
В этом случае абсолютный межфазный потенциал непосредственно
измерить нельзя, его можно менять на определенную величину, задавая
концентрацию потенциал-определяющего иона. Кроме того, с помощью
электрофоретических измерений можно определить дзета-потенциал и
по нему приблизительно оценить межфазный потенциал. Наконец, если
диспергированное твердое тело имеет достаточную удельную
поверхность, можно непосредственно определять количество адсорбированных
электролитов и других веществ.
А. Поверхность раздела электрод — жидкость
Здесь мы рассмотрим лишь некоторые типичные
экспериментальные данные. На рис. IV-15 показаны кривые зависимости
дифференциальных емкостей от потенциала для поликристаллического железного
электрода в растворе перхлората натрия. Эти кривые рассчитаны из
осциллограмм изменения потенциала электрода во времени (в
микросекундном масштабе) после наложения импульса напряжения. Пик А
приписывается адсорбции молекул воды, а пик В — химическим
процессам, протекающим при выделении водорода.
Большой интерес представляет потенциал, при котором заряд на
поверхности раздела равен нулю (этот потенциал называют точкой
нулевого заряда или т. н. з.). В работе Бокриса и др. [48] (см. также
Бокрис и Редди [49]) сравниваются три метода определения т. н. з.
(как следует из уравнения (IV-53), т. н. з. также соответствует
потенциалу максимума электрокапиллярной кривой). Используя адсорбат с
мечеными атомами, можно непосредственно измерить адсорбцию даже
на электродах с малой поверхностью. В т. н. з. адсорбция нейтральных
Рис. IV-15. Кривые зависимости дифференциальной емкости от потенциала для поли-
кристаллического железа в растворе перхлората натрия при рН 6,6 [47].
Электрические свойства поверхностей
189
веществ должна быть максимальна (или минимальна). При этом
межфазная емкость должна проходить через минимум. Интересно
отметить, что в т. н. з. трение на поверхности раздела металл — раствор
электролита максимально. Все три метода дают приблизительно
одинаковые значения т. н. з. для каждого из четырех исследованных
металлов (Ag, Au, Ni и Pt).
Б. Поверхность раздела галогенид серебра — жидкость
Большинство работ по исследованию поверхностей раздела
галогенид серебра — жидкость проведено на коллоидных суспензиях. Методы
получения монодисперсных золей галогенидов серебра хорошо
разработаны [10], и поэтому можно использовать вполне определенные
поверхности раздела. Некоторые данные показывают, что заряд этих
поверхностей раздела и его зависимость от концентрации ионов
серебра и галогена в растворе в значительной мере определяются
полупроводниковой природой галогенидов серебра. Так, при наличии дефектов
(см. гл. V) в твердой фазе может существовать диффузный двойной
слой.
Коагуляция золей галогенидов серебра определяется балансом сил
притяжения и отталкивания. Этот вопрос подробно обсуждается в
гл. VI.
11. Типы потенциалов и смысл понятия «разность потенциалов
между двумя фазами»
А. Различные типы потенциалов
В этой и предыдущей главах неоднократно говорилось, что
существуют различные виды потенциалов, и в данном разделе мы рассмотрим
взаимосвязь между ними. Следует сразу же отметить, что некоторые
типы разностей потенциалов являются физически измеримыми
величинами, которые можно определить экспериментально, тогда как другие
типы, о которых говорят более неопределенно, носят описательный
характер и не могут быть определены опытным путем.
Не представляет труда, например, определить разность
потенциалов между двумя точками в вакууме; это можно сделать, определив
работу, расходуемую в соответствии с законом Кулона на перенос
элементарного заряда из одной точки в другую. Аналогично потенциал
некоторой точки в пространстве оценивается работой переноса заряда
в эту точку из бесконечности. Этот способ используется при
определении вольта-потенциала ф, который является, по существу, потенциалом
внешней точки, находящейся вблизи поверхности фазы, и практически
применим для расстояний до 10~3 см. Согласно определению, вольта-
потенциал равен работе переноса элементарного заряда из
бесконечности в точку вблизи поверхности, умноженной на 1/е*. Точно так же
разность потенциалов между двумя точками, находящимися в данной
фазе, можно определить как работу, необходимую для переноса
элементарного заряда из одной точки в другую. В качестве примера
можно взять ^-потенциал, представляющий собой разность потенциалов
между раствором и плоскостью скольжения заряженных частиц.
Электростатический потенциал внутри фазы, т. е. умноженная на
1/е работа переноса элементарного заряда в данную фазу из бесконечно
удаленной точки в вакууме, называется гальвани-потенциалом или
внутренним потенциалом и обозначается ф. Соответственно разность
электростатических потенциалов между двумя фазами равна Аф. Если
*3десь и далее е — заряд электрона.— Прим. перев.
190
Глава IV
Рис. IV-16. Вольта-потенциалы t|?, гальвани-потенциалы ф и скачки поверхностного
потенциала % в двухфазной системе [50].
попытаться измерить Аф вещества при перенесении заряда из
бесконечно удаленной точки в вакууме в фазу вещества, то работа эта будет
складываться, во-первых, из работы переноса заряда на внешнюю
точку на поверхности, соответствующей вольта-потенциалу, и, во-вторых,
из работы переноса заряда через межфазную границу внутрь фазы,
определяемой скачком потенциала на поверхности %. Соотношение между
Ф, г|) и х (см. рис. IV-16) имеет очень простой вид:
Ф=Х + Ч> (IV-76)
Первым различие между этими потенциалами отметил Ланге [50].
К сожалению, как говорилось, ф нельзя непосредственно
экспериментально измерить. Основная трудность состоит в том, что в процессе
переноса пробный заряд (электрон или ион) должен сохранять свою
физическую индивидуальность, т. е. практически оставаться
неизменным. Для переноса некоторой реальной заряженной частицы через
поверхность требуется затратить определенную работу, однако, кроме
электростатической работы, в нее войдет также «химическая» работа,
связанная с действием сил Ван-дер-Ваальса, обменных сил, сил
изображения и т. д. Имеется несколько теоретических оценок %. Для
поверхности раздела вода — вакуум Фервей [51] (см. также [49]) дает
значение —0,5 В. Физической моделью, использованной для этой
оценки, служила поверхность, состоящая из молекул воды,
ориентированных водородными концами наружу.
Электрохимический потенциал \if определяется как суммарная
работа переноса частиц i из вакуума в фазу а и, следовательно,
поддается экспериментальному определению. Электрохимический потенциал
можно разделить на химическую работу juf, т. е. химический потенциал,
и электростатическую работу zietf*".
(А?=|А? + 2,вф«,
i? =
-.ll? + zie(y« + ^). (IV-77)
Поскольку \|)а можно измерить экспериментально, удобно ввести еще
реальный потенциал а?:
один потенциал
или
а?=\1Т + г^а
Hi
=а?+^/Д
(IV-78)
(IV-79)
Таким образом, \iif оц и г|з — экспериментально определимые величины,
а поверхностный скачок потенциала %, химический потенциал \х и
разность гальвани-потенциалов между двумя фазами Аф=фр—фа измерить
экспериментально не представляется возможным. Однако точно
определить \ii удается далеко не всегда: практически трудно поставить
такой эксперимент, в котором единственным процессом был бы перенос
Электрические свойства поверхностей
191
заряженного компонента из одной фазы в другую. Обычно в
обратимом процессе электронейтральность сохраняется, и поэтому имеет
место перенос по крайней мере пары компонентов, т. е. положительного
и отрицательного ионов. При этом экспериментально определяется
сумма изменений их электрохимических потенциалов. Большой
практический интерес представляет система из двух фаз, идентичных по
составу. В этом случае разность электрохимических потенциалов
компонента i определяется выражением
V$—1ft=zie (фР—фа) =zte (г|>Р—я|Я), (IV-80)
поскольку теперь \Xi=\i? и хр=Ха*-
Наконец, разность вольта-потенциалов между двумя фазами и есть
тот поверхностный потенциал, о котором говорилось в гл. III:
АУ=г|)Р—г|>«. (IV-81)
В следующем разделе будет введен еще один потенциал, а именно
термоэлектронная работа выхода Ф. Величина еф соответствует работе
удаления электрона с верхнего заполненного уровня в металле в
некоторую внешнюю точку на поверхности. Можно записать
еФ=1х+ех. (IV-82)
Хотя некоторые типы потенциалов, как, например, разность галь-
вани-потенциалов между двумя фазами, не поддаются
непосредственному экспериментальному определению, их изменения иногда можно
связать с некоторыми экспериментальными величинами. Так, при
исследовании электрокапиллярных явлений принимают, что наложение
потенциала Е на межфазную границу приводит к соответствующему
изменению Аф, т.е. dE=d(Acp). Следует также отметить, что
практикуемое разделение электрохимического потенциала заряженного
компонента на химическую и электрохимическую составляющие нельзя
считать безупречным и в термодинамических расчетах его
использовать, строго говоря, не обязательно. Так, Бренстед [52] и Гуггенгейм
[53] в качестве общей характеристики заряженных компонентов
используют зависимость их свободной энергии от величины
электрического поля. Более подробное рассмотрение различных потенциалов можно
найти в работах Батлера [54], Адама [55], де Бура [56]. В статье
Кейса [57] приведены некоторые экспериментальные значения
реальных потенциалов и дана оценка %.
Б, Вольта-потенциалы, разности поверхностных потенциалов
и термоэлектронная работа выхода
Термоэлектронную работу выхода для металлов можно измерить
довольно точно, и этому вопросу посвящена масса литературы. Любой
металл самопроизвольно испускает электроны, поскольку они
стремятся выйти во внешнее пространство значительно энергичнее, чем
положительно заряженные ионы металла. В конце концов достигается
такое равновесное состояние, при котором на металле накапливается
достаточно положительных зарядов, чтобы предотвратить дальнейшую
утечку электронов. Однако, если металлическую нить зарядить
отрицательно, возникнет поток электронов от нити к аноду. Скорость
испускания электронов сильно зависит от температуры, и по этой
зависимости можно рассчитать Ф [58]. Величину Ф можно найти также, зная
*Строго говоря, при различных потенциалах две отдельные фазы не могут быть
идентичными по химическому составу. Однако, поскольку для изменения
электростатического потенциала 1 см3 раствора на 1 В потребовалось бы всего около 10-17
молей электронов или ионов, вносимая этим условием ошибка ничтожна мала.
192
Глава IV
со
I
!
Вакуум
Расстояние
от металла 1
см
I
Вакуум
Расстояние
от металла 2
Рис. IV-17. Схема возникновения
разности поверхностных потенциалов AV.
температурный коэффициент фотоэлектронной эмиссии и длиноволно-
вую границу фотоэмиссии. Как показывают результаты этих
измерений, ф определяется энергией электрона, а не его свободной энергией.
Если два разнородных металла а и |3 привести в контакт друг с
другом, то, как показано на рис. IV-17, между ними моментально
возникнет^ поток электронов, направленный от металла с более низкой
работой выхода к металлу с более высокой работой выхода. Поток
электронов существует до тех пор, пока электрохимические потенциалы
* электронов jLie в обоих металлах не станут равными
ре=е(Фа +t*) =—е (ФР + фР). (IV-83)
При этом разность вольта-потенциала AV, называемая в этой книге
поверхностным или контактным потенциалом, определяется как
AV=i|)a—-ф6=фР—ф«. (IV-84)
жПоскольку AV развивается целиком в пространстве между двумя
фазами, на нее не влияет нёопрЖел^^ (фазовых границ.
Для пленок на поверхности жидкости AV измеряется
непосредственно, а не через работы выхода электронов. Однако, поскольку
адсорбированная пленка оказывает сильное влияние на AV, она должна влиять
и на Ф. Изменение AV при адсорбции газов на металлах исследуют,
непосредственно определяя изменение работы выхода. В настоящее
время этот способ используют очень широко (см. разд. V-бБ). Многие
ранние работы Лэнгмюра по хемосорбции на металле, возможно,
стимулировались пониманием практической важности изучения влияния
адсорбированных газов на работу вакуумных ламп.
Особым классом систем, для которых поверхностные эффекты
играют очень важную роль, являются полупроводники. Обсуждение
поверхностных свойств полупроводников не входит в нашу задачу, хотя
иногда нам придется ссылаться на данные, полученные на
полупроводниковых материалах. Многие сведения о свойствах поверхностей
полупроводников можно найти в сборнике по электрохимии
полупроводников, изданном под редакцией Холмса [59].
В. Электрохимические и электродные потенциалы
Подробно рассматривать теорию электрохимических и электродных
потенциалов мы здесь не будем, однако краткое изложение основ ее
может быть полезным читателю, поскольку эта теория имеет
непосредственное отношение к теме этой книги.
Снова обратимся к доннановскому равновесию (разд. 1Н-11Б и
III-14) и построим его теорию на основе представления об
электрохимических потенциалах. В системе, изображенной на рис. IV-18, два
раствора электролита I и II, содержащие растворитель S и ионы М4* и А~,
Электрические свойства поверхностей
193
Nn+
М +
>^а__
И
А"
S
гемдр
_L
ша
А-
М*
S
Рис. IV-18. Равновесие Доннана.
Л
разделяются мембраной, проницаемой для всех компонентов раствора, за
исключением компонента Nn+, присутствующего только в растворе I.
Условия равновесия и электронейтральности определяются
следующими соотношениями:
М-м = Им,
"Й-Д1
(IV-85)
п (№+)г + (М+)1 =(А")1(М+)1 =(М+)И. (IV-86)
Поскольку по обеим сторонам мембраны концентрации растворителя
различны, в системе устанавливается разность осмотических давлений.
Если предположить, что растворы являются идеальными, уравнения
(IV-85) можно записать в виде
RT In (М+)1 + Fcpi =RT In (M+)" + Fq>", (IV-87)
RT In (A")1—Fcp1 =RT In (A")»—Fq>»f (IV-88)
RT In (S)1 + P*VS=RT In (S)" + P"VS9 (IV-89)
(в уравнениях (IV-87) и (IV-88) членами PVi можно пренебречь).
Решая совместно уравнения (IV-87) и (IV-88), получаем
(M+)'(A-)i =(M+)"(A7i. (IV-90)
Уравнения (IV-90) и (IV-86) дают соотношение
(M+)4(M+)i + n (№+1)Ч =(M+)"(A~)», (IV-91)
которое описывает распределение ионов в системе. Из уравнений
(IV-87) и (IV-88) находим также, что
Аф=ф1-Фн=(RT/F)In[(M+)"/(M+)i] =(RT/F)In[(A")V(A")»J, (IV-92)
где Аф — потенциал Доннана. Наконец, из уравнения (IV-89)
следует, что
*ocm=(P1-Pu)=(RT/Vs) In (S)"/(S)i.
(IV-93)
где Яосм — осмотическое давление.
Теперь вкратце обсудим теорию электродных потенциалов. Одно время известное
уравнение Нернста выводили, исходя из представления о «давлении раствора»
металла в электроде. Однако лучше его получать, рассматривая непосредственно
суммарное изменение химического состава при переносе электрического заряда, равного
одному фарадею F, и приравнивая электрическую работу изменению свободной
энергии. Так, для ячейки
Zn'/pacTBop, содержащий Zn2+ и Ag+/Ag/Zn"
суммарная химическая реакция описывается уравнением
1 1
~2-Zn + Ag+ =-2~ Zn2+ +Ag
И
-ре=^а|~4"^п-^+4"^п2+»
(IV-94)
(IV-95)
(IV-96)
13—1421
194
Глава IV
где верхние индексы относятся к соответствующим фазам. Уравнение (IV-96) можно
привести к более простому виду:
FE = А^0 - RT In [a%2+/aAg+]. (IV-97)
При более строгом выводе этого уравнения учитывается, что, если химические
потенциалы равны, разность электрохимических потенциалов электронов на концах цепи
Zn' и Zn" равна Дф и, следовательно, Е. Таким образом,
7е "Ус = - F №" - <P'J = -FE ■ (IV-98)
Поскольку электроны находятся в равновесии,
й=7?П, Ve=JeS. (IV-99)
Кроме того, внутри каждого электрода существует равновесие между электронами,
ионами и атомами металла:
"Г »г> +^П = "Т ^!п• (IV-100)
i3f++#*=■?& (iv-ioi)
Следовательно,
-FE = 41-4" & -"Й& + 4" Я"2+ • (IV-102)
Равновесие устанавливается и между ионами металла в твердой и жидкой фазах,
т. е.
й!п2+=(4^, 4|+==^. (iv-i03)
Поскольку
подставляя уравнение (IV-103) в уравнение (IV-102), получаем уравнение (IV-96).
Этот метод, часто используемый Гуггенгеймом [53], кажется сложным, однако в
запутанных ситуациях он может оказаться очень действенным.
Г. Необратимые электродные процессы
Одним из важных и довольно общих явлений, наблюдаемых в
электрохимических системах, является эффект перенапряжения,
заключающийся в следующем: чтобы пропустить через электрохимическую
ячейку более или менее заметный ток, на электроды нередко приходится
наложить потенциал, превышающий их обратимый потенциал. На
рис. IV-19 приведена простая схема системы для измерения
перенапряжения. Через исследуемый электрод в цепи Е\—Ех пропускается
нужный ток, а затем с помощью потенциометрической цепи Ех—Ек,
подключаемой к электроду сразу же после прохождения тока
вращающимся коммутатором или тиратронным переключателем, измеряют
изменение потенциала Ех.
Эффекты перенапряжения в первом приближении можно разделить
на три больших класса в зависимости от того, чем обусловлено
перенапряжение.
I. При прохождении тока на электроде протекает химическая
реакция, что приводит к соответствующему локальному накоплению или
потере вещества в смежном растворе. Это явление, называемое
концентрационной поляризацией, может играть серьезную роль в
электрохимических системах; его, однако, можно исключить, интенсивно
перемешивая раствор.
П. При протекании заметного тока возникает перенапряжение,
обусловленное омическим падением потенциала в растворе. Оно не
имеет особого значения при малой силе тока, а в дальнейшем может
быть сведено к минимуму с помощью цепи Ех—Ек> в которой электрод
Электрические свойства поверхностей
195
Рис. IV-19. Схема установки для измерения
перенапряжений.
/С- коммутатор
л- потенциометр
Eh представляет собой зонд, расположенный вблизи Ех со стороны,
противоположной электроду Е\. Для устранения омического
перенапряжения разработан также коммутаторный метод.
III. Наибольший интерес, конечно, представляет перенапряжение,
связанное с замедленностью какого-либо этапа самой электронной
реакции, что, как правило, обусловлено существованием некоторого ак-
тивационного барьера. В общем случае эти три вида перенапряжения
различаются по скорости спада перенапряжения при выключении
поляризующего тока: омический ток прекращается мгновенно;
концентрационная поляризация спадает медленно по сложному закону; актива-
ционная поляризация часто уменьшается экспоненциально.
Далее мы будем рассматривать только третий тип
перенапряжения. Большинство электродов, включающих металл и его ион в
растворе, являются достаточно обратимыми, и для того, чтобы вызвать на
них заметное перенапряжение, требуются высокие плотности тока.
Активационную поляризацию исследуют прежде всего в связи с
газовыми электродами, в частности водородным электродом. В этом случае
довольно малый ток (несколько мкА/см2) может привести к
значительному перенапряжению реакции выделения водорода, в ходе которой
обычно образуются пузырьки, видимые невооруженным глазом.
Величина перенапряжения меняется почти от нуля для платинированной
платины (и 0,09 В для гладкой платины) до 0,78 В на ртути.
Первый закон кинетики электродных процессов, сформулированный
Тафелем в 1905 г. [60], гласит, что перенапряжение г\ меняется с
ростом плотности тока в соответствии с уравнением
г)=а—ЫШ9 (IV-104)
причем г] — отрицательная величина для катодных процессов и
положительная для анодных.
Этот закон можно вывести следующим образом. Рассмотрим
активируемую реакцию:
О (окисленное состояние) 4-e~"=R (восстановленное состояние). (IV-105)
Скорость этой реакции в прямом направлении равна
где AGf
,оф
Rf=lf=(kT/h)e-AGf /RT(0), (IV-106)
■ стандартная свободная энергия активации. Аналогично
13*
196
Глава IV
скорость обратной реакции определяется выражением
Rb = ib=(kT/h) e-AG°*/RT (R) (IV-107)
Теперь предположим, что AG^ можно разделить на химическую и
электрическую составляющие, причем потенциал электрода влияет
только на последнюю, т. е. предположим, что
AG?* = (AGH™+aF(9M-Vs). (IV-108)
Коэффициент а, обычно его называют коэффициентом переноса [49],
означает, что только часть разности потенциалов между металлом и
раствором вносит вклад в энергию активации. В результате
if=(kT/h)e~ [(ЛС?ИхимН e-WRT) (фм-фз) (0). (IV-109)
Уравнения типа (IV-109) известны как уравнения Батлера — Фольме-
ра [49]. В условиях равновесия прямой и обратный токи равны, т.е.
i°f=ib=ia. Согласно уравнению (IV-109), кажущийся ток обмена i°
равен
i°=(kT/h)e- [(AcrW«V(aF/*r) (ф«-ф°*)] (О), (IV-110)
где фм—Ф§—равновесная разность потенциалов на электроде. Решая
совместно уравнения (IV-109) и (IV-110), получаем
if = i°e~ {aF/RT) (ФМ-фм) =lV- (aF/RT) Л< (IV- HI)
Уравнение (IV-111) можно записать в виде
In i =ln i°—(aF/RT) 4 (IV-112)
и затем привести к уравнению Тафеля.
В более строгой теории предполагается, что скоростьопределя-
ющей стадией является восстановление О в R (при потенциале фг
относительно раствора) на внешней плоскости Гельмгольца. Это приводит
к зависимости i° от .величины ф2 и, следовательно, от любых изменений
в двойном электрическом слое. Такой подход (естественно, связанный
с обсуждаемыми в данной главе вопросами) позволяет дать более или
менее детальную интерпретацию кинетических схем электродных
реакций.
Определение а ,по наклону экспериментальных кривых, построенных
по уравнению Тафеля, может помочь выяснению скоростьопределяю-
щей стадии электродного процесса. Так, если в реакции восстановления
воды до выделения газообразного водорода медленной стадией
является реакция Н30+ с металлом М, приводящая к образованию
поверхностных атомов водорода, то можно ожидать, что а равен около 1/2. Если
же замедленной стадией является рекомбинация двух поверхностных
атомов водорода с образованием Нг, т. е. реакция второго порядка, то
<х равняется 2 [49].
12. Упражнения
1. Покажите, что уравнение (IV-12) можно привести к эквивалентной форме:
l+e-**thfc0/4)
у = 2\п
l_*-**thfo0/4)
(IV-113)
2. Выведите уравнение (IV-14).
3. Выведите уравнение (III-109) (покажите, что численный коэффициент в этом
уравнении равен 6,10).
4. На рис. IV-2 наклои кривой «ф — х возрастает при переходе от штерновского
слоя к диффузному, тогда как на рис. IV-4 наклон этой кривой уменьшается. Только
одна из этих двух ситуаций может считаться правильной! Какая и почему?
Электрические свойства поверхностей
Л97"
5. Выведите из уравнений Гуи — Чепмена общее уравнение дифференциальной
емкости диффузного двойного слоя. Постройте зависимость поверхностной плотности
заряда <т от этой емкости. Покажите, что при указанных условиях полученное вами вы-
ражение сводится к простой формуле Гельмгольца [уравнение (IV-17)].
6. Используя теорию Гуи — Чепмена, оцените производную
(dijyd In n0)a-
Найдите, при каких условиях эта производная должна быть равна —kT/e. Есин и
Марков установили экспериментально, что этот коэффициент может быть меньше
—kT/e. Этот эффект рассматривается как проявление дискретности заряда на
поверхности [10]. На каких представлениях основан этот вывод?
7. Круглая металлическая пластина площадью 5 см2 установлена на расстоянии d
параллельно поверхности при температуре 25 °С.
а) Предполагая, что на поверхности раздела жидкость — воздух а|)0==60 мВ,
рассчитайте г|э как функцию расстояния х по нормали к поверхности со стороны газовой
фазы. Считайте, что в 1 см3 воздуха содержится 106 ионов. (При этом расчете
пластину можно не принимать во внимание.) Постройте полученную зависимость.
б) С помощью уравнения (IV-31) рассчитайте энергию отталкивания пластины от
раствора при d=2 см, предполагая, что гр0 пластины также равен 60 мВ. Приемлемы
ли допущения, заложенные в уравнении (IV-31), в данном случае? Ответ обоснуйте.
в) Рассчитайте вклад поверхности раздела жидкость — воздух в поверхностный
потенциал, если пластина используется в качестве зонда для измерения
поверхностного потенциала и находится на расстоянии 1 мм от поверхности.
8. Используя приближение Лэнгмюра для отталкивания двойных слоев,
рассчитайте, при каком размере частиц, находящихся в воде на расстоянии 100 А друг от
друга, энергия отталкивания их двойных слоев равна kT. Температура воды 20 °С.
9. Для воды при 25 °С уравнение (IV-39) имеет следующий вид:
Е = 12,9о/*.
В каких единицах должны выражаться £, v и X?
10. Как отмечалось в разд. IV-8B, потенциалы течения могут представлять
серьезную проблему в реактивной технике. Предположим, что через систему под
давлением 20 атм прокачивается углеводородное топливо, диэлектрическая проницаемость
которого равна 10, вязкость — 0,02 пз. Потенциал между трубой и топливом равен,
например, 150 мВ, концентрация ионов в топливе эквивалентна Ю-8 М NaCl. Оцените,
используя разумные и необходимые допущения, потенциал течения, развиваемый в
системе. (Обратите внимание на размерности величин.)
11. Подтвердите расчетом численный пример, иллюстрирующий уравнение (IV-44),
12. Подтвердите расчетом утверждение, сделанное в сноске к уравнению (IV-80).
13. Рассчитайте ожидаемый потенциал течения Е для чистой воды, текущей
через кварцевую трубку под давлением 10 атм при 25 °С. Дзета-потенциал примите
равным 150 мВ.
14. Примем, что соль MX (типа 1:1) адсорбируется на поверхности раздела
ртуть — вода в соответствии с уравнением Лэнгмюра
x/xm = bc/(l +bc),
где хт — максимально возможная величина адсорбции, */л;т = 0,5 при с=0,2 М.
Пренебрегая влиянием коэффициента активности, оцените межфазное натяжение на
границе ртуть — вода в электрокапиллярном максимуме в 0,01 М растворе соли при
температуре 25 °С.
15. Хотя результат этого упражнения и не имеет точного физического смысла,
рассчитайте ^-потенциал иона натрия, если при 25 °С его эквивалентная проводимость
в воде составляет 50 см2/экв-Ом.
16. Рассчитайте приблизительно кривую плотность заряда— ipr по приведенной
на рис. IV-11 зависимости интегральной емкости от Е*. Точки на рис. IV-И получены
тремя независимыми экспериментальными методами. Объясните, какие данные дает
каждый из методов и как нужно обрабатывать эти данные, чтобы получить кривую
зависимости а от г(>г. О чем говорит совпадение результатов измерений, проведенных
тремя методами? Означает ли это, что г|)г действительно равен абсолютной разности
потенциалов?
17. Выведите следующее уравнение, полезное при исследовании
электрокапиллярных явлений:
Г+ = —v+a(dE7^)Y.
18. Спарнэй [9] отмечает, что, если учитывать первую гидратную оболочку ионов,
величины исключенных объемов В++, В— и Вх- могут быть довольно велики (до
нескольких сотен А3). Предположим, что в 0,01 М растворе 1 : 1-электролита г|?о равен
25 мВ, а i|? описывается уравнением (IV-12). Используя уравнение (IV-3),
рассчитайте р как функцию х. Проведите также расчет по уравнению (IV-3) при В++=500 А3,
В —= 200 А3 и В+- = 300 А3.
198
Глава IV
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Bockrls J. O'M., Reddy А. К. N. Modern Electrochemistry, Plenum Press, New York,
1970.
Butler J. A. V. Electrical Phenomena at Interfaces Methuen, London, 1951.
Делахей Л., Двойной слой и кинетика электродных процессов, М., Мир, 1967.
Grahame D. С., Chem. Rev., 41, 441 (1947).
Guggenheim Е. A., Thermodynamics, Interscience, New York, 1949.
Харнед Г., Оуэн Б., Физическая химия растворов электролитов, М., ИЛ, 1952.
Kortiim G., Treatise on Electrochemistry, Elsevier, New York, 1965.
Кройт F. P., Наука о коллоидах, М., ИЛ, 1955.
Overbeek J. Th. G., Advances in Colloid Science, Vol. Ill, Interscience, New York,
1950.
Sparnaay M. J., The Electrical Double Layer, Pergamon Press, New York, 1972.
Verwey E. J. W., Overbeek L Th, G., Theory of the Stability of Lyophobic Colloids,
Elsevier, New York, 1948.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Gouy G, J. Phys., 9, No. 4, 457 (1910); Ann. Phys., 7, No. 9, 129 (1917).
2. Chapman D. L.f Phil. Mag., 25, No. 6, 475 (1913).
3 Deb ye P, Huckel E., Phys. Z., 24, 185 (1923); Debye P., Phys. Z., 25, 93 (1924)
4 Verwey E. J. W., Overbeek J. Th. G., Theory of the Stability of Lyophobic Colloids
Elsevier, New York, 1948.
5 Кройт Г. Р., Наука о коллоидах, М., ИЛ, 1955.
6 Харнед Г, Оуэн Б., Физическая химия растворов электролитов, М., ИЛ, 1955
7. Mysels К. /., An Introduction to Colloid Chemistry, Interscience, New York,
1959.
8. Stern 0., Z. Elektrochem., 30, 508 (1924).
9. Sparnaay M. J., J. Electroanal. Chem., 37, 65 (1972).
10. Sparnaay M. J., The Electrical Double Layer, Pergamon Press, New York,
1972.
11. Langmuir L, J. Chem. Phys., 6, 873 (1938); Defay R.f Sanfeld A., J. Chim. Phys.,
60, 634 (1963).
12 Mysels K. /., Jones M. N., Disc. Faraday Soc, 42, 42 (1966).
13 Lifklema L, Overbeek J. Th. G., J. Colloid Sci, 16, 595 (1961).
14. Levine S., Bell G. M., J. Colloid Sci, 17, 838 (1962); J. Phys. Chem, 67, 1408
(1963).
15. Делахей П., Двойной слой и кинетика электродных процессов, М, «Мир», 1967.
16. Overbeek J. Th., Advances in Colloid Science, Vol. Ill, Interscience, New York, 1950,
p. 97.
17. von Smoluchowski N., Bull. Int. Acad. Polon. Sci., Classe Sci. Math. Nat., 1903,
184.
18. Lorenz P. В., J. Phys. Chem., 57, 430 (1953).
19. Davies J. Т., Rideal E. K., Interfacial Phenomena, Academic Press, New York,
1963.
20. Rutgers A. J, Nagels P., Nature, 171, 568 (1953).
21. Saxen U., Wied Ann., 47, 46 (1892).
22. Mazur P, Overbeek J. Th. G., Rec. Trav. Chim., 70, 83 (1951).
23. Lorenz P. В., J Phys. Chem., 57, 430 (1953).
24 Overbeeek J. Th. G., Wijga P. W. O., Rev. Trav. Chim., 65, 556 (1946).
25. Burton E. F., Phil Mag., 11, No. 6, 425 (1906); 17, 583 (1909).
26. Henry W., Nicolson's J., 4, 224 (1801).
27. Lippmann G, Ann Chim. Phys., 5, 494 (1875).
28. Grahame D. C, Chem. Rev., 41, 441 (1947).
29 Frumkin A , Z. Phys. Chem., 103, 55 (1923).
30 Koenig F. O., J. Phys. Chem., 38, 111, 339 (1934).
31. Grahame D. C., Whitney R. В., J. Amer Chem. Soc, 64, 1548 (1942).
32 Parsons R., Devanathan M. A. V., Trans Faraday Soc, 49, 673 (1953).
33 Koenig F. О, Z Phys. Chem., 154, 454 (1931).
34. Hansen L. A., Williams J. W., J. Phys Chem., 39, 439 (1935).
35. Grahame D. C., Larsen R. P., Poth M A., J. Amer. Chem. Soc, 71, 2978 (1949)
36. Hills G. /., Payne R., Trans. Faradav Soc, 61, 317 (1963).
37 Craxford S. R.t McKay H. A. C., J. Phys. Chem., 39, 545 (1935).
38 Frumkin A., «Couche Double», Acta Sci., No. 373 (1936).
39. Grahame D. C.t J. Amer. Chem. Soc, 63, 1207 (1941).
40. Gouy G.f Ann. Phys., 6, 5 (1916); 7, 129 (1917).
41. Bockris J. O'M., Devanathan M. A. V, Muller K., Proc Roy. Soc. (London) 274 55
(1963). "
42. Bewig K. W., Zisman W. A., J. Phys. Chem., 68, 1804 (1964).
Электрические свойства поверхностей
199
43. Butler J. A. V., Proc. Roy. Soc. (London), A122, 399 (1929).
44. Фрумкин А. Н., Дамаскин В. В., в кн. «Некоторые проблемы современной
электрохимии», под ред. Дж. Бокриса, М., «Мир», 1967.
45. Frumkin A., Gorodetzkaja A.f Z. Phys. Chem., 136, 451 (1928); Frumkin A., Cir-
ves F. J.t J. Phys. Chem., 34, 74 (1930).
46. Narayan R., Hacker man N.t J. Electrochem. Soc, 118, 1426 (1971).
47. Vaidyanathan H., Hacker man N., Electrochimica Acta, 16, 2193 (1971).
48. Bockris J. O'M., Argade S. D., Gilead E., Electrochimica Acta, 14, 1259 (1969).
49. Bockris /. O'M., Reddy A. K. N., Modern Electrochemistry, Plenum Press, New York,
1970.
50. Lange E., Koenig F. O., Handbuch der Experimentalphysik, Vol. 12, Part 2, Leipzig,
1933, p. 263.
51. Verwey E. J. W., Rec. Trav. Chim., 61, 564 (1942).
52. Brensted J. N.. Z. Phys. Chem., A143, 301 (1929).
53. Guggenheim E. A., Thermodynamics, Interscience, New York, 1949; J. Phys. Chem.,
33, 842 (1929); 34, 1540 and 1758 (1930).
54. Butler J. A. v., Electrical Phenomena at Interfaces, Methuen, London, 1951.
55. Адам H. К., Физика и химия поверхностей, М., ОГИЗ, 1947.
56. de Boer J. H., Electron Emission and Adsorption Phenomena, Macmillan, New York,
1935.
57. Case В., Hush N. 5., Parsons R., Peover M. E., J. Electroanalyt. Chem., 10, 360
(1965).
58. Adam N. K., Physical Chemistry, Oxford University Press, London, 1958; see also
Ref. 56.
59. Holmes P. J., ed., The Electrochemistry of Semiconductors, Academic Press, New
York, 1962.
60. Tafel /., Z. Phys. Chem., 50, 641 (1905).
61. Reis Т., Introduction a la Chimie-Physique des Surfaces, Vol. I, Dunod, Paris, 1952,
p. 216.
ГЛАВА V
Поверхности твердых тел
1. Введение
А. Поверхностная подвижность твердых тел. Спекание
Твердое тело, по определению, обладает жесткостью и способно
сопротивляться приложенному давлению. Хотя в принципе поверхность
твердого тела должна характеризоваться свободной поверхностной
энергией и величиной полной энергии, очевидно, что обычные
капиллярные методы, опирающиеся на измерения свойств равновесных или
эквипотенциальных поверхностей, описываемых уравнением Лапласа,
в данном случае мало эффективны. Под действием приложенных сил
твердое тело упруго деформируется, и все же его форма больше
зависит от предыстории, чем от сил поверхностного натяжения.
В действительности многие тела, обычно рассматриваемые как
твердые, обладают заметной пластичностью и могут, хотя и очень
медленно, течь. В таких случаях применимы те или иные разновидности
капиллярных методов. Например, при температуре, близкой к точке
плавления, тонкая медная проволока укорачивается (даже при
небольшой нагрузке), и по усилию, при котором скорость деформации
равна нулю, оказалось возможным рассчитать [1] поверхностное
натяжение меди (1370 дн/см). Более того, процессы спекания только
потому и возможны, что металлы и другие твердые тела
характеризуются некоторой объемной и поверхностной подвижностью. Если,
например, порошкообразный металл прогреть при температуре немного
ниже точки плавления (обычно это делают под некоторым давлением),
частицы металла сплавятся (рис. V-1). Хотя, по-видимому, основной
движущей силой этого процесса является поверхностное натяжение
(а не приложенное давление), сам механизм спекания довольно
сложен. Во-первых, не все атомы на поверхности находятся в одинаковых
условиях; те из них, которые находятся на острых выступах и
шероховатостях, богаче энергией, чем атомы с нормальным числом
ближайших соседей, и, следовательно, обладают избыточной поверхностной
энергией и относительно высокой подвижностью. Кроме того,
поскольку при наличии выступов микроскопического и молекулярного
масштаба реальная площадь первоначального контакта между зернами
мала, весьма вероятно, что даже при слабом внешнем давлении
развиваются локальные давления, превышающие предел текучести, в
результате чего микровыступы подвергаются некоторой пластической
деформации.
Помимо этого, при температурах спекания обычно становятся
заметными как объемная, так и поверхностная диффузия. Так, при
температуре несколько ниже точки плавления наблюдается сглаживание
царапин на поверхности серебра [2] и исчезновение зазора между
шариками меди и серебра и плоскими поверхностями этих же металлов
[3]. Понятие «нагревание», конечно, является относительным.
Связующие шейки между небольшими шариками льда, касающимися друг
друга, образуются уже при —10 °С, и детальное изучение кинетики это-
Поверхности твердых тел
201
Рис. V-1. Схема спекания порошкообразного
металла.
го процесса показывает, что в зависимости от условий определяющую
роль здесь может играть как объемная, так и поверхностная
диффузия [4, 5]. Спекание металлов подробно рассматривается в обзорах
Герринга [6] и Кучинского ,[7].
Теперь полезно оценить возможную подвижность поверхностных
атомов твердого тела. Прежде всего рассмотрим равновесие типа
испарение— конденсация. Согласно кинетической теории газов (см. разд. П-2),
число молекул, ударяющихся о поверхность площадью 1 см2, равно
Для насыщенных паров воды при комнатной температуре Z
составляет около 1022 молекул/см2-с и в состоянии равновесия равно числу
молекул, испаряющихся в 1 с, т. е. скорости испарения. Отсюда можно
заключить, что среднее время жизни молекулы на поверхности
раздела вода — пар равно примерно 1 мкс. У очень малолетучего твердого
тела, например вольфрама, упругость паров которого при комнатной
температуре оценивается величиной 10~40 атм, Z падает до 10~17
атомов/см2-с, а среднее время жизни атома на поверхности возрастает до
приблизительно 1032 с! Даже для значительно более летучих, но еще
достаточно тугоплавких твердых тел (а к ним относятся большинство
металлов и солей) времена жизни при комнатной температуре очень
велики. Что же касается спекания, то времена жизни здесь имеют
относительное значение. Например, при 725 °С упругость паров меди —
величина порядка 10"8 мм рт. ст. [8], что приводит к расчетному
времени жизни около 1 ч. У легкоплавких твердых тел, например льда и
различных твердых органических соединений, времена жизни атомов
на поверхности сравнимы с временами жизни соответствующих
переохлажденных жидкостей.
Подобная картина возникает и при рассмотрении скоростей
диффузии. Так, при 725 °С коэффициент самодиффузии меди в объеме
составляет около К)-11 см2/с [9]. Используя уравнение Эйнштейна
Ъ=х2№ (V-2)
(где х — среднее броуновское смещение за время t), получаем, что для
смещения атома на расстояние 100 А требуется около 0,1 с. Поскольку
кажущаяся энергия активации самодиффузии меди составляет около
54 ккал/моль, при комнатной температуре это время возрастает до
1027 с! В химии поверхностей поверхностная диффузия нередко играет
более важную роль, чем объемная диффузия. Поверхностная диффузия
меди становится заметной в районе 700 °С [10] и вследствие ее низкой
(по сравнению с объемной) энергии активации проявляется в
широком интервале температур. Методом эмиссионной микроскопии (см.
разд. V-6B) показано, что поверхностная миграция становится
заметной уже при температуре, вдвое меньшей той температуры, при
которой начинается ощутимое испарение с поверхности твердого тела.
Наконец, вблизи точки плавления поверхностный слой твердого тела по
свойствам может весьма напоминать жидкость [11].
Таким образом, существует очень большое число разнообразных по
своей природе твердых поверхностей. Твердые тела, плавящиеся при
202
Глава V
температуре значительно выше комнатной, считаются тугоплавкими.
Поверхностные атомы таких тел относительно неподвижны, хотя они
и колеблются около равновесных или квазиравновесных положений;
состояние поверхности тугоплавких тел в высокой степени зависит от
предыстории твердого тела, и его нельзя исследовать обычными
капиллярными методами. При температурах, близких к точке
плавления, твердые тела характеризуются поверхностной подвижностью,
проявляющейся в виде обмена поверхностного слоя атомами с паровой
фазой и внутренним объемом и особенно в виде тангенциальной
подвижности атомов в поверхностном слое.
Б. Влияние предыстории на состояние твердых поверхностей
Относительная неподвижность поверхностных атомов тугоплавких
твердых тел приводит к сильной зависимости поверхностной энергии
и других физических свойств от предыстории твердого тела.
Поверхностная энергия чистого скола кристалла, как правило, ниже энергии
шлифованной поверхности кристалла и поверхности, подвергнутой
термообработке. Чрезвычайно сильное влияние на свойства
поверхности, в частности, оказывает полировка. Следует отметить
принципиальную разницу между полировкой и шлифовкой. Шлифовку проводят
материалом более твердым, чем обрабатываемая поверхность, тогда
как полировальный материал относительно мягок (например, красный
полировальный порошок или окись железа) и его наносят на основу из
мягкого материала, например кожу или ткань.
Важным методом изучения поверхностного слоя твердых тел является метод
дифракции электронов. С помощью дифракции медленных электронов можно
исследовать область твердого тела толщиной всего в несколько десятков ангстрем, т. е.
получать дифракционные картины в основном поверхностного слоя [12, 13]. Этим
методом показано, например, что на молекулярном уровне шлифовка приводит прежде
всего к механическому истиранию поверхности без глубокого изменения ее
кристаллической структуры, тогда как в результате полировки поверхности образуется
довольно глубокий и практически аморфный слой, обычно называемый слоем Бейльби. \
Бейльби обнаружил, что такие слои под микроскопом выглядят аморфными и в це1"
лом напоминают пленки вязких жидкостей — они не только равномерно покрывают
поверхность, но и затекают в разного рода неровности, например трещины и
царапины [14, 15]. Позднее Райзер '[16] пришел к выводу, что слои Бейльби фактически
являются микрокристаллическими, но размер этих микрокристаллов так мал, что
получаемая интерференционная картина близка к картине, наблюдаемой для аморфного
материала.
При удалении полированного слоя распылением (например, используя образец
в качестве катода при газовом разряде) постепенно появляется дифракционная
картина, характерная для кристаллического материала. На образце полированного
вручную золота дифракционная картина кристаллического золота появляется вновь после
удаления слоя глубиной около 20 А, хотя следы слоя Бейльби прослеживаются до
глубины около 500 А. На полированном вручную никеле диффузные кольца исчезают
на глубине 40 А, а на никелевой пуле, выпущенной из пистолета с нарезным
стволом,— на глубине 150 А [17]. Микрокристаллический, или аморфный, слой не
стабилен и подвергается старению. Это, в частности, показывают опыты Кокрейна [18].
Автор осаждал на никеле тонкий слой золота, полировал его, затем удалял и
исследовал поверхность методом дифракции электронов. При этом первоначальная
характерная диффузная картина постепенно сменялась на дифракционную картину
кристаллического золота. Оплавленные стеклянные поверхности, по-видимому, быстро расстек-
ловываются, и их поверхностный слой является скорее кристаллическим, чем
аморфным [19].
Работы по трению (см. гл. X) показывают, что в точках контакта поверхностей,
трущихся друг об друга, локальная температура легко достигает температуры
плавления более низкоплавкого материала, и вполне вероятно, что полированный слой
образуется в результате размягчения, а возможно даже, и кратковременного плавления
поверхности металла [20]. Это означает, что полировальные материалы должны быть
мягкими, но более тугоплавкими, чем полируемый материал.
На природу поверхностного слоя металлов влияет также и холодная обработка.
Например, если поверхность железа, меди или алюминия подвергнуть сначала
механической полировке, а затем электрополировке в растворе фосфорной или хлорной
кислоты, то диффузная дифракционная картина, характерная для слоя Бейльби,
сменяется картиной, характерной для кристаллического металла или его окисла [21].
Поверхности твердых тел
203
По-видимому, электрополированные поверхности имеют почти нормальную кристалли-
ческую_структуру.
i Влияние предыстории на состояние поверхности связано также с существованием
поверхностных дефектов^ Реальные кристаллы не являются совершенными; они могут
либо состоять из микрокристаллических доменов, ограниченных плоскостями
скольжения, либо включать в нормальную кристаллическую решетку множество дефектов.
Шажнейшими дефектами поверхностного слоя являются избыточные и недостающие
слои атомов и (очень часто) винтовые или ступенчатые дислокации [22, 23]. Такие
дефекты оставляют на поверхности следы, и их можно изучать разнообразными спо-
собами^В некоторых случаях дислокации занимают до 20% объема кристалла [24],
и энергия, накопленная в них, превышает поверхностную энергию кристалла. Обычно
число выходов дислокаций на поверхность составляет 105—106/см2.
Шее вышесказанное показывает, насколько природа твердой поверхности зависит
от ее предыстории^ Далее (см. разд. V-4B) мы обсудим, как под действием таких
факторов, как адсорбция, распределение дефектов поверхности может до некоторой
степени обратимо меняться, так что далеко не всегда можно считать, что положение
поверхностных атомов строго фиксировано, даже если речь идет о тугоплавких
металлах. Наконец, следует напомнить, что поверхности твердых тел очень легко
загрязняются. Насколько важно, чтобы поверхность была чистой, и насколько легко она
загрязняется, можно убедиться, работая с жидкой ртутью, на которой возможно прямое
измерение поверхностного натяжения. ^Определять загрязнения на твердых
поверхностях гораздо труднее, и теперь, когда разработаны новые методы очистки поверхности
с применением сверхвысокого вакуума, необходимо пересмотреть всю химию твердых
поверхностей — эту старейшую область физической химии. \
Прежде чем перейти к рассмотрению методов определения поверхностных свойств
твердых тел и обсуждению получаемых результатов, целесообразно коротко
остановиться на некоторых теоретических вопросах, связанных с величиной поверхностной
энергии твердых тел. Этому посвящены два следующих раздела.
2. Термодинамика кристаллов
А. Поверхностное натяжение и свободная поверхностная энергия
Поверхностное натяжение твердого тела не обязательно равно
поверхностному напряжению; этим твердое тело отличается от жидкости.
Как подчеркивает Гиббс [25], поверхностное натяжение равно работе,
расходуемой на образование единицы площади поверхности (и,
другими словами, его можно назвать свободной поверхностной энергией, см.
разд. 1-1 и П-2), тогда как поверхностное напряжение включает
работу растяжения поверхности. Мысленно процесс образования свежей
поверхности одноатомного вещества можно разделить на две стадии. На
первой стадии твердое тело или жидкость делятся на части с
образованием новой поверхности; при этом атомы на поверхности
фиксируются в тех же положениях, которые они занимали, находясь в
объемной фазе. На второй стадии атомы в поверхностном слое
перегруппировываются и перемещаются в конечные равновесные положения. В
жидкости обе стадии протекают одновременно, тогда как в твердых телах
вторая стадия может идти очень медленно вследствие неподвижности
атомов поверхностного слоя. Таким образом, поверхностный слой
твердого тела можно растянуть или сжать, просто увеличивая или
уменьшая расстояние между атомами, не изменяя их числа.
В гл. II свободная поверхностная энергия и поверхностное
напряжение рассматривались как эквивалентные понятия и определялись
как энергия дополнительного образования единицы поверхности. Теперь
желательно дать независимое определение поверхностного напряжения.
Если поверхность рассечь плоскостью, нормальной к ней, то, чтобы
атомы по обеим сторонам сечения остались в их прежних равновесных
положениях, необходимо приложить к ним некоторую внешнюю силу.
Общая величина этой силы, приходящаяся на единицу длины, и есть
поверхностное напряжение, а половина суммы двух поверхностных
напряжений по взаимно перпендикулярным направлениям на плоскости
сечения равна среднему поверхностному напряжению. (Аналогично одна
треть суммы трех основных напряжений в объеме жидкости равна ее
гидростатическому давлению.) Для жидкости или изотропного твердо-
204
Глава V
i flfc#/ i
Г" " I i
i
Шг
I . J_J Рис. V 2.
го тела оба поверхностных напряжения равны между собой, однако
этот вывод не распространяется на неизотропные твердые тела или
кристаллы. Обозначим ti и t2 частные значения поверхностного
напряжения неизотропного тела (в двух взаимно перпендикулярных
направлениях). Шаттлуорс [26] определяет соотношение между
свободной поверхностной энергией и поверхностным напряжением следующим
образом. Если принять, что площадь поверхности анизотропного тела
увеличивается в двух выбранных направлениях на величины dA\ и dA2
(рис. V-2), то общее увеличение свободной энергии определяется
обратимой работой против соответствующих поверхностных напряжений, т. е.
т4 =GS + At (dG'/dA,) и т2=GS + А2 (dGs/dA2), (V-3)
где Gs — свободная энергия, приходящаяся на единицу площади. Если
твердое тело изотропно, то два уравнения (V-3) сводятся к одному:
t=d(y =Gs + AdGsldA. (V-4)
Для жидкостей последний член в уравнении (V-4) равен нулю и,
таким образом, t=Gs (или х=у, поскольку мы используем Gs и у как
взаимозаменяемые величины). Это относится и к твердым телам, если
изменение их площади dA происходит так, что равновесная
конфигурация всегда остается одной и той же. Таким образом, растяжение
проволоки в обратимых условиях приводит к выходу внутренних атомов
на поверхность, что необходимо для того, чтобы увеличение
поверхности не сопровождалось изменением ее удельных свойств. Если, однако,
растяжение совершается в условиях, при которых не обеспечивается
полное равновесие, поверхностное напряжение отличается от у на
величину, зависящую от времени и произведения AdGs/dA.
Поверхностное напряжение твердого тела можно рассчитать с помощью
уравнений (V-3) и (V-4). В работе [26] такая оценка была сделана для кристаллов твердых
инертных газов и щелочных галогенидов при 0К (см. разд. V-3B). Так, например,
согласно расчетным данным, для NaCl у составляет 155 эрг/см2, тогда как т имеет
отрицательное значение —130 дн/см. По мнению Даннинга [22], отрицательное т
означает, что небольшие кристаллы подвергнуты положительной объемной деформации (т. е.
несколько увеличены в объеме). Однако Никольсон [27], измерив постоянные решетки
небольших кристаллов NaCl, пришел к выводу, что они должны характеризоваться
положительными значениями т. Поскольку теоретические расчеты основываются на
многочисленных допущениях, результаты их могут оказаться неверными. В то же
время можно предполагать, что растягивающие напряжения в небольших кристаллах
снимаются в результате образования дислокаций. Под действием сжимающего поверх-
\—7
1 I , . , ОО ОООО ОООО ОО
1 ООООООООООООООО
I Т Т Т Т I ООООООООООООООО
а 6 в
Рис. V-3. Возникновение поверхностного напряжения в области дислокаций по Гер-
рингу [22].
Поверхности твердых тел 205
ностного напряжения (отрицательное т) кубический идеальный кристалл подвергается
деформации (рис. V-3, а), эквивалентной деформации при приложении растягивающих
усилий к каждой вершине куба. Это напряжение может сниматься при возникновении
дислокаций, на которых недостает отдельных линий атомов (рис. V-3, б), или
образовании многочисленных вакансий на поверхности граней (рис. V-3, в) [28]. Таким
образом, вполне вероятно, что появление дефектов на неравновесной поверхности может
быть обусловлено не только выходом на поверхность объемных дефектов, но и
неравенством величин свободной поверхностной энергии и поверхностного напряжения.
Способность поверхности освобождаться от неравновесных напряжений очень сильно
зависит от температуры. Бертон и Кабрера [29] вводят соответствующую
характеристическую температуру Тс. Только при температуре выше Тс поверхностные атомы
могут «подниматься» на грани кристалла, создавая тем самым неоднородности
молекулярного масштаба. Тс — это своего рода поверхностная температура плавления; она
приблизительно равна половине объемной температуры плавления и, вполне
вероятно, связана с таммановской температурой, при которой спекание начинает идти с
заметной скоростью.
Б. Равновесная форма кристалла
Проблема равновесной формы кристаллов является чрезвычайно
интересной. Поскольку для разных граней свободная поверхностная
энергия обычно имеет различные значения, возникает вопрос, какую
форму должен иметь кристалл данного объема, чтобы его суммарная
свободная поверхностная энергия была минимальна. Общее
квазигеометрическое решение этой проблемы, данное Вульфом [30], можно
проиллюстрировать с помощью следующего геометрического построения.
Рассмотрим кристалл, разные плоскости которого характеризуются
рядом значений свободной поверхностной энергии. Из некоторой точки
в направлениях, перпендикулярных плоскостям кристалла, проведем
ряд векторов длиной, пропорциональной свободной поверхностной
энергии соответствующей плоскости. Далее, на конце каждого вектора
построим нормальную к нему плоскость. Теперь можно найти
геометрическую фигуру, гранями которой являются участки плоскостей, которые
образуются при пересечении только соседних плоскостей. На рис. V-4
этот метод использован для построения равновесной формы двумерно-
0,32
в
\
\
>
г
Рис. V-4. Конформации гипотетического двумерного кристалла.
а — имеются только плоскости (10), полная поверхностная энергия кристалла площадью 1 см2
составляет 4-1-250=1000 эрг; б—имеются только плоскости (11), полная поверхностная энергия
кристалла площадью 1 см2 составляет 4-1-225=900 эрг; в — форма кристалла определена по
методу Вульфа, полная поверхностная энергия кристалла площадью 1 см2 составляет 4-0,32-250+
+4-0,59-225=851 эрг; г — нахождение равновесной формы кристалла по Вульфу в предположении,
что поверхность кристалла образуется только плоскостями (10) и (11).
к\Рч
\ УК Н
" X XX А
1 \/ чх i
i \ \ / i
\у
206
Глава V
го кристалла, для которого Yio и yh равны соответственно 250 и
225 эрг/см. Заметьте, что в образовании равновесной формы участвуют
плоскости обоих типов. При данных поверхностных натяжениях огра-
нение кристалла плоскостями (10) по углам квадрата, образованного
плоскостями (11), приводит к уменьшению периметра кристалла и
соответственно к выигрышу свободной энергии образования его
поверхности. К этому вопросу мы еще вернемся в упражнении V-4.
Теорему Вульфа можно сформулировать следующим образом:
внутри равновесного кристалла существует некоторая точка, расстояния от
которой hi до плоскостей i пропорциональны yit Эта теорема и была
использована при построении рис. V-4.
Герринг [31], хотя и соглашается с построением Вульфа, считает маловероятным
образование кристаллов с резко очерченными ребрами. По его мнению, в реальных
условиях ребра могут сглаживаться небольшим равновесным радиусом кривизны.
Позднее Бенсон и Паттерсон [32] дали аналитическое доказательство теоремы
Вульфа, решив в общем случае задачу о минимуме свободной энергии многогранника.
Теорема Вульфа объясняет, почему наблюдаемые полости неправильной формы в
природных солях [33] и металлах [34] при нагревании приобретают равновесную
форму. Достаточно малые кристаллы неправильной формы при отжиге также принимают
равновесную форму [35].
На габитус кристалла влияет также кинетика роста кристалла и другие
неравновесные эффекты. Поэтому грани реальных кристаллов могут и не соответствовать
равновесным формам, определяемым теоремой Вульфа. Например, если стабильная или
сингулярная плоскость (100) шлифуется, скажем, под небольшим углом, то
образуются плоскости, номинально описываемые индексом (xll), где х — большое число.
Локальное уменьшение свободной энергии при этом возможно, только если эти
плоскости превратятся в ступеньки, образуемые гранями (100) и (010). Существует
общий критерий возможности такого спонтанного локального перехода [36].
В. Уравнение Кельвина
Уравнение Кельвина [уравнение (П-20)], связывающее увеличение
упругости паров с кривизной поверхности и, следовательно, размерами
малых капелек жидкости, можно применить и к кристаллам. Таким
образом,
RT\nP/po = 2y7/r. (V-5)
Поскольку реальные кристаллы имеют форму многогранников,
поверхности которых характеризуются разным поверхностным натяжением,
возникает вопрос, какие значения у и г следует использовать при этом.
Как отмечалось в предыдущем разделе при обсуждении рис. V-4,
теорема Вульфа утверждает инвариантность уг-/гг- для всех граней. Поэтому
результат, даваемый уравнением (V-5), не должен зависеть от выбора
грани. В случае, рассмотренном на рис. V-4, в качестве г можно взять
либо г10, либо г\\, представляющие собой радиусы окружностей,
вписанных в фигуры, образуемые гранями (10) и (11) (см. также
работу [37]). Уравнение (V-5) можно применить также для описания
растворимости кристаллов (см. разд. VIII-2).
Если кристаллы относительно симметричны, в уравнение (V-5)
можно подставлять усредненные значения г и у. Если сжимаемость
кристалла обозначить (3, то изменение давления на поверхности раздела можно
выразить уравнением
—рДР=A V/V0 = 3 Дг/г. (V-6)
Решая его совместно с уравнением (1-8), получаем
Аг =—2Py/3. (V-7)
Поверхности твердых тел
207
3. Теоретические оценки поверхностной энергии
и свободной поверхностной энергии
А. Кристаллы с ковалентными связями
Теоретические методы расчета величины поверхностной энергии в
силу ряда причин зависят от типа рассматриваемого твердого тела.
Возможно, простейшим примером твердого тела является кристалл с
ковалентными связями, узлы которого заняты атомами (поскольку
здесь нет необходимости учитывать дальнее взаимодействие). Хорошим
примером расчета этого типа может служить оценка поверхностной
энергии алмаза. По Гаркинсу [38] при ОК поверхностная энергия
равна половине энергии разрыва всех связей, проходящих через 1 см2
поверхности, т. е.
Fs—— Е и
Как видно из рис. V-5, на котором приведена элементарная ячейка
алмаза, при расщеплении кристалла по плоскости, параллельной
плоскости (111), разрываются три связи. Зная расстояние между
плоскостями (111) (2,32 А) и плотность алмаза (3,51 г/см3), находим, что
число связей, приходящихся на 1 см2, составляет 1,83-1015 и, поскольку
энергия связей в алмазе равна 90 ккал/моль, поверхностная энергия
плоскости (111) равна 5650 эрг/см2. Для плоскости (100) такой же
расчет дает величину 9820 эрг/см2. Температура кристалла,
изображенного на рис. V-3, равна 0К, поэтому полученные значения соответствуют
также свобощок поверхностной энергии плоскостей (100) и (III) при
этой температуре.
По оценке Гаркинса, критическая температура Тс приближается к
6700 К. В соответствии с уравнением (П-10) это позволяет считать, что
при 25 °С энтропийной поправкой можно пренебречь, и, таким образом,
приведенные цифры приблизительно отвечают свободной
поверхностной энергии при комнатной температуре. Строго говоря, эта оценка
может быть неточной, поскольку в ней не учитывается деформация
поверхности (см. разд. ЗБ, В).
Б. Кристаллы инертных газов
Во многих случаях свойства твердого тела определяются главным
образом вандерваальсовыми и кулоновскими силами. Если узлы
решетки заняты атомами или одноатомными ионами, ориентационный
эффект отсутствует и поверхностную энергию можно рассчитать без
особых затруднений.
Рассмотрим более или менее детально кристаллы инертных газов,
для которых методика расчета довольно проста и не требует громозд-
Рис. V-5. Структура алмаза [38]. 3,560А
208
Глава V
е—е—е—е—е—е—в—ег=з
Плоскость
е—е—е—е сетия
и
е—е—е—е—е—е—е—е—е
Рис. V-6. К расчету взаимодействия молекул кристалла инертного газа через
разделяющую поверхность [39].
кого описания. Кристаллы инертных газов имеют гранецентрированную
кубическую решетку, которую можно рассматривать как простую
кубическую решетку с чередующимися вакантными узлами. Основная
проблема теперь состоит в том, чтобы рассчитать суммарную энергию
взаимодействия частей кристалла, на которые кристалл разделен
плоскостью, например, показанной пунктирной линией на рис. V-6. Другими
словами, как и в случае алмаза, при ОК поверхностная энергия
фактически равна избыточной потенциальной энергии молекул вблизи
поверхности.
Расчет проводят в два этапа. Сначала делят кристалл на две части,
удерживая атомы в их прежних положениях, и таким образом
получают основной вклад Es/ в поверхностную энергию. После этого
рассчитывают уменьшение этой величины, обусловленное последующим
переходом поверхностного слоя в его равновесное состояние. Таким
образом,
ES=ES'—ES". (V-8)
Как следует из рис. V-6, если расстояние между плоскостями равно
а, 2а и т. д., взаимодействие между парами плоскостей определяется
величинами а, 2а и т.д. Таким образом, энергия взаимодействия
плоскости с индексом I с поверхностью кристалла равна
2и'=2&(г),
(V-9)
где и'— поверхностная энергия в расчете на атом, находящийся на
поверхности, и е (г)—зависимость потенциальной энергии от
расстояния г между двумя атомами.
Для аппроксимации г(г) предложены различные функции; в клас- щ
сической теории Шаттлуорса [39] г (г) определяется выражением
e(r)=Xrs— |аг'. (V-10)
Первый член этого выражения дает энергию взаимного отталкивания
атомов, и, так как 5^ 12, он существен только на небольших
расстояниях. Второй член соответствует вандерваальсовому притяжению; t
приблизительно равно 6 (экспериментальные значения s и t получают из
вириальных коэффициентов инертных газов). Сумму, выраженную
уравнением (V-9), следует брать по всем межатомным расстояниям.
Расстояние от данного атома до некоторой точки в решетке составляет
d=(x2 + y2 + z*)V2,
где х, у и z равны т\а, т^а и тга; а — постоянная простой кубической
решетки; т — целые числа. Таким образом,
d =a K+ml+т^/2. (V-11)
Поверхности твердых тел
209
В результате уравнение (V-9) переходит в
—2u'=Xcrs 2 */К+ml + ml)s'2 -
(m1+m2+ms) четн., />1
-|ur< 2 l/(ml + ml-miy*. (V-12)
(ш1+/п2+тз) четн., />1
Поскольку каждый второй узел является вакантным, используются
только четные значения mi + m2 + m3. Численный результат
суммирования зависит от показателей степеней в е(г). В общем случае
уравнение (V-12) можно записать в виде
—2иг=В8Ха^—В,1ха-'. (V-13)
Аналогично энергия испарения ео равна
—2е0 = Яа-* 2 ^/(ml+ml+m2^2—
(т1+т2+тз) четн
-риг' 2 l/(tnl+mt + miyv (V-14)
(шх+тг+тз) четн
или
—2е0=AsXa's— А^аг1. (V-15)
Поскольку при суммировании каждый атом учитывался дважды,
суммы в этих уравнених дают удвоенные значения искомых величин.
Дифференцируя уравнение (V-15), получаем условие, при котором атом
находится в своем равновесном положении:
sAsXa's=tAt\ia-t. (V-16)
Исключая из уравнений (V-13), (V-15) и (V-16) Xa~s и [хат*, получаем
u'=s0(sBt/At-tBs/As)/(s-t). (V-17)
Если пренебречь взаимодействием данного атома со всеми атомами, за
исключением соседних, отношение В/А становится равным отношению
числа «ближайших соседей» атома, находящегося на поверхности, к
числу «ближайших соседей» атома, находящегося внутри кристалла.
В этом случае расчет по уравнению (V-17) дает такой же результат,
что и по уравнению (П-17).
Теперь нетрудно провести полный расчет поверхностной энергии Es'
кристалла инертного газа. Для этого достаточно умножить и! на число
атомов, приходящихся на единицу поверхности рассматриваемой
плоскости кристалла.
Шаттлуорс рассчитал энергию деформации решетки Es" в
предположении, что плоскость поверхности движется относительно
примыкающей (к ней внутренней плоскости до тех пор, пока не займет
энергетически наиболее выгодное положение. Оказалось, что увеличение
первого межплоскостного расстояния достигает нескольких процентов.
Позднее Бенсон и Клакстон [40] провели этот расчет для первых пяти
слоев на ЭВМ и нашли, что с увеличением расстояния от поверхности
деформация быстро падает: она составляет 3,р% для первого слоя и
только 0,04% для пятого. Кроме того, более тщательный расчет
показал, что для инертных газов поправка Es" к значениям Es/ очень
мала— всего приблизительно 1%. Авторы работы [40] провели расчетt
также для потенциальной функции с учетом сил отталкивания:
е(г)=&г-'/Р—сг\ (V-18)
Это, однако, мало повлияло на расчетные значения у. Результаты Бен-
сона и Клакстона [для потенциальной функции 6-12 Леннарда-Джонса,
уравнение (V-10)] приведены в табл. V-1.
14—1421
210
Глава V
Таблица V-1
Поверхностная энергия кристаллов инертных газов при 0 К
Инертный
газ
Ne
Аг
Кг
Хе
Еисп> эРг/атом
4,08.10-14
13,89
19,23
26,87
Е6, зрг/см2
(100)
21,3
46,8
57,2
67,3
(ПО)
20,3
44,6
54,5
64,1
(Ш)
19,7
43,2
52,8
62,1
Es , эрг/см2
жидк
15,1
36,3
В работе [39] с помощью уравнения (V-4) рассчитаны также
поверхностные напряжения кристаллов инертных газов. Получены
отрицательные величины, по абсолютному значению составляющие около
одной десятой поверхностной энергии.
В. Ионные кристаллы
1. Поверхностная энергия при ОК. История этого вопроса является
слишком длинной и запутанной. Поэтому здесь мы дадим ее только в
кратком изложении. Классическая процедура расчета ловерхностной
энергии ионных кристаллов в целом напоминает описанную выше
методику расчета для кристаллов инертных газов. Правда, в ионных
кристаллах узлы заняты заряженными атомами, и в этом случае для
потенциальной энергии необходимо использовать более сложные функции.
Если в гранецентрированной кубической решетке кристалла щелочного
галогенида некоторый ион принять за начало координат, то все ионы
того же знака имеют координаты с четной суммой /ni+m2+m3, а
противоположно заряженные ионы — с нечетной суммой. Как и в случае
кристаллов инертных газов, на первой стадии расчета вычисляется
.потенциальная энергия взаимодействия двух половинок кристалла,
разделенного некоторой плоскостью скола. Здесь также проводится
суммирование по всей решетке, однако при этом для разных ионов исполь-,
зуются различные функции для потенциальной энергии. Первые
расчеты такого рода проведены были Борном и др. [41].
Леннард-Джонс, Тейлор и Дент [42—44] усовершенствовали
методику расчета, допустив возможность деформации 'поверхности.
Рассчитанное ими значение Es для плоскости (100) хлорида натрия при
0К составляет 77 эрг/см2. Позднее Шаттлуорс [89] получил
величину Es, равную 155 эрг/см2.
В дальнейшем теория поверхностей ионных кристаллов развивалась
в нескольких направлениях. В последнее время наибольшее
распространение получила теория Хаггинса и Майера [45], в которой
используется более точная потенциальная функция, имеющая вид
*и (') = Wa/r - Ct ;./r6 - аи/г* + bb.bje-^ (V-19)
где первый член справа дает энергию кулоновского взаимодействия
между ионами / и }, следующие два члена соответствуют вандервааль-
совому притяжению, проявляющемуся в виде диполь-дипольного и ди-
поль-квадрупольного взаимодействий, а последний член характеризует
взаимное отталкивание электронов. Как выяснилось, хотя вандервааль-
совы члены не оказывают существенного влияния на полную энергию
решетки кристалла, член, характеризующий диполь-дипольное
взаимодействие (обратно пропорциональный г6), вносит 20—30%-ный вклад в
поверхностную энергию [39, 46]. Результаты расчетов, проведенных
для металлов с многозарядными ионами, например CaF2, CaO и т. д.,
весьма чувствительны к виду используемой потенциальной функции.
Поверхности твердых тел
211
Так, в зависимости от вида потенциальной функции Бенсон и Мак-Ин-
тош [47] получили для плоскости (100) кристалла MgO значения
поверхностной энергии в диапазоне от —298 до 1362 эрг/см2!
Вторым и очень важным вопросом при расчете поверхностной энергии ионных
кристаллов является определение деформации решетки в несимметричном поле вблизи
поверхности. В общем случае эта проблема поддается точному теоретическому
анализу с большим трудом. Ее можно упростить, предполагая, что деформация
ограничивается перемещением ионов по нормали к плоскости поверхности. Этот подход был
принят в работах Фервея [48], а затем и Бенсона и др. [49]. На рис. V-7 приведены
расчетные смещения для первых пяти плоскостей грани (100) хлорида натрия.
Поправка на деформацию поверхности Es' составляет приблизительно 100 эрг/см2 или
около половины величины самой поверхностной энергии Es. Приведенный на рис. V-7
график смещения ионов показывает тенденцию к образованию ионных пар. Мольер и
Странский [50] считают, что необходимо учитывать также возможность образования
ионных пар в результате латерального смещения.
Вследствие произвольности выбора потенциальной функции и учета
влияния деформации поверхности теоретические значения
поверхностной энергии ионных кристаллов являются довольно неопределенными.
В табл. V-2 приведены некоторые энергетические характеристики
поверхностей ионных кристаллов, взятые из работы Бенсона и Юна [53].
Проверить эти данные экспериментально трудно (см. разд. V-5).
Исходя из общих соображений, можно было бы ожидать, что
поверхностная энергия твердого тела заметно выше поверхностного натяжения
жидкости. Настораживает, однако, что приведенное в табл. V-2
значение поверхностной энергии плоскости (100) хлорида натрия составляет
158 эрг/см2, тогда как поверхностное натяжение расплавленной соли
равно 190 эрг/см2 [39]. Вообще говоря, экстраполяция поверхностного
натяжения расплавленной соли на комнатную температуру с помощью
какой-либо полуэмпирической теории, например приведенной в работе
0.10
i
i
41
I
I
-0J0
0J0
Грань (fOO)HaCl
Положительные -|
ионы
А
4. V —/ X-
9
У
Ъ
Т"-**^.
Отрицательные
ионы
F=F=W-4
Рис. V-7. Равновесная конфигурация первых пяти слоев грани (100) NaCl [49].
Смещения выражены в единицах а. Положительная величина смещения означает, что частица
движется по нормали от поверхности. Направления и величины дипольного момента показаны
стрелками. Для отрицательных ионов длины стрелок соответствуют одной десятой дипольного
момента.
14*
212
Глава V
Таблица V-2
Расчетные величины поверхностной энергии ионных кристаллов
при О К (эрг/см2) [53—55]
Дристалл
LiF
LiCl
NaF
NaCl
NaBr
Nal
KC1
RbCl
CsCl
CaO
MgO
CaF2
£S'
288,7
251,4
265,9
210,9
192,2
170,5
175,3
166,0
Плоскость (100)
ES"
146,4
144,7
49,5
52,7
54,0
52,5
34,0
28,4
Es
142
107
216
158
138
118
141
138
509—879
360—924
Плоскость (111)
ES'
962,3
599,2
711,7
469,7
413,4
348,8
367,3
337,3
256,6
es"
394,6
259,1
156,4
115,6
109,2
97,3
69,6
60,0
37,7
Es
568
340
555
354
304
252
298
277
219
1082
[52], по-видимому, является более надежной процедурой, чем расчет
поверхностной энергии ионного кристалла.
2. Поверхностные напряжения и энергия ребер. Подставив в уравнение (V-4)
соответствующие суммы для всей кристаллической решетки, Шаттлуорс '[39] нашел, что
поверхностные напряжения т плоскости (100) кристаллов щелочных галогенидов
являются отрицательными и составляют несколько сотен дин на сантиметр. Полученные
ранее Леннардом-Джонсом и Тэйлором [42], Леннардом-Джонсом и Дентом [43]
величины являются положительными и достигают нескольких тысяч дин на сантиметр.
Очевидно, что расчет поверхностного напряжения еще менее точен, чем расчет
поверхностной энергии.
Решеточные суммы можно приспособить и для оценки энергии ребер, например
потенциальной энергии взаимодействия двух кубических кристаллов, имеющих общее
ребро. Энергия ребер k выражается в эргах на сантиметр. По данным Леннарда-Джон-
са и Тэйлора [42], величина k для различных щелочных галогенидов составляет около
10~5 эрг/см. Согласно более недавней оценке [56], энергия ребра, образованного
плоскостями (100) хлорида натрия, равна 3-Ю-6 эрг/см. Как и величины поверхностных
напряжений, эти данные можно рассматривать только как предварительные.
Г. Молекулярные кристаллы
Молекулярные кристаллы — это кристаллы, узлы решеток которых
заняты целыми молекулами, а не атомами или одноатомными ионами.
К таким кристаллам относится большинство твердых тел, включая
многочисленные соли с молекулярными ионами, например BaSO*,
большая часть неионных органических соединений, например С02 и
Н20, и все органические соединения. Теоретическая интерпретация
поверхностных свойств молекулярных кристаллов довольно трудна:
необходимость учитывать относительно дальнодействующие вандервааль-
совы силы (см. гл. VI) и возможность деформации поверхности
вследствие переориентации 'поверхностных молекул.
Из числа молекулярных тел наиболее изучен лед. Приведенные в
обзоре Флетчера [56а] расчетные значения поверхностного натяжения
льда (100—120 эрг/см"2, см. [566]) вполне сопоставимы с
экспериментальным значением 109 эрг/см2 [56в]. Имеется много данных,
указывающих на то, что начиная с —35 °С на поверхности раздела лед —
пар существует квазижидкий слой, толщина которого возрастает с
температурой [56а, 56г, 56д].
Д. Металлы
Методика расчета поверхностной энергии металлов развивается в
двух совершенно различных направлениях. Первое направление,
основы которого заложены Скапским, в общих чертах описано в
Поверхности твердых тел
213
разд. II-1 Б. В своей простейшей форме методика расчета включает
предположение о простой пропорциональности между поверхностной
энергией и энергией испарения. При этом учитывается соотношение
между числом ближайших соседей атома в объеме и на поверхности
кристалла. Этот способ позволяет обойти теоретически сложный
вопрос точного расчета когезионных сил в металле, но он не учитывает
деформации поверхности. Этот, по существу, эмпирический метод дает
довольно точные результаты и является весьма полезным. Мак-Кензи
и др. {57] применил метод Скапского для оценки поверхностной
энергии плоскостей с различными миллеровскими индексами. С этим
методом связана также статистико-механическая теория Рейса и др. [58]
(см. также работу [59]).
В другом методе расчета поверхностной энергии металлов используется следующая
модель: свободные электроны помещены в ящик, стенки которого представляют собой
поверхность металла. Таким образом, данный подход является квантово-механическим
и фактически не зависит от типа кристаллической решетки. В простейшем варианте
теории, развитой Брагером и Жуховицким [60], предполагается, что стенки ящика
непроницаемы для электронов. Это означает, что электронные волны образуют на
стенках узлы и, следовательно, являются стоячими. Указанное требование исключает
определенное число других возможных состояний электронного газа, и кинетическая
энергия, соответствующая энергии точек поворота, дает поверхностную энергию. Уравнение
Брагера и Жуховицкого приводится к виду
Es = 56400 (p/Z)4/3, (V-20)
где р — плотность металла, Z — его атомный номер. Получаемые значения Es (эрг/см2)
в два-три раза выше экспериментальных величин для различных металлов.
Хуанг и Уилли [61] модифицировали теорию Брагера и Жуховицкого, приняв, что
барьер имеет конечную высоту и, таким образом, часть электронов может проникать
через него. Полученные этими авторами расчетные значения превышают
экспериментальные всего на 50%. Хайтингтон [62] пересмотрел эту теорию еще раз и
попытался устранить имеющиеся в ней внутренние противоречия; рассчитанные им величины
вдвое меньше экспериментальных. Ясно, что в принципе возможно лучшее согласие
теории с экспериментом. Некоторые аспекты этой проблемы обсуждаются в обзоре
[63]. По-видимому, в данном случае требуется более точный расчет собственной
энергии двойного электрического слоя у поверхности и разработка микроскопической
теории, в которой учитывались бы структурные изменения поверхностного слоя.
Как и поверхности ионных кристаллов и кристаллов инертных газов, поверхность
металла должна быть деформированной. Бертон и Юра [64] теоретически оценили
ожидаемое увеличение межплоскостных расстояний на поверхностях различных
металлов.
4. Факторы, влияющие на поверхностную энергию
и поверхностное натяжение реальных кристаллов
А. Влияние измельчения
Исследователи, работающие в области химии поверхностных
явлений, очень часто заинтересованы в получении тонкодисперсных
твердых тел, обладающих высокой удельной поверхностью. Поэтому имеет
смысл рассмотреть вкратце иллюстративный численный пример,
показывающий изменение поверхностных свойств твердого тела в
зависимости от размера его частиц. Результаты расчета мы будем
относить к 1 г хлорида натрия плотностью 2,2 г/см3. Предположим, что
кубический кристалл весом 1 г с поверхностной энергией 150 эрг/см2 и
энергией ребер 3-Ю-6 эрг/см последовательно делится на все меньшие
кубики. В табл. V-3 указаны число таких кубиков, их удельная
поверхность и поверхностная энергия, длина и энергия ребер.
Как видно из таблицы, поверхностная энергия становится
значительной, только если частицы меньше 1 мкм или если их удельная
поверхность больше нескольких квадратных метров. Энергия ребер
начинает играть важную роль только у очень маленьких частиц.
Конечно, в данной оценке предполагается, что кубическая решетка при
дроблении не искажается.
214
Глава V
Таблица V-3
Зависимость удельной поверхностной энергии от размера частица
Длина ребра, см
0,77
0,1
0,01
0,001
Ю-4 (1 мкм)
Ю-6 (100 А)
Суммарная
площадь, см2
3,6
28
280
2,8.103
2,8-104
2,8.106
Суммарная длина
ребер, см
9,3
550
5,5-104
5,5-106
5,5-108
5,5-1012
Поверхностная
энергия, эрг/г
540
4.2.103
4.2.104
4,2.10*
4,2.10е
(0,1 кал)
4,2.Ю8
(10 кал)
Энергия ребер,
эрг/г
2,8.Ю-5
1,7.10-з
0,17
17
1,7.103
1,7.107
(0,4 кал)
1 г NaCl, ES = loQ эрг/см2, 6=3-КН5 эрг/см.
Б. Отклонения от идеальных условий
Приведенный выше численный пример является настолько
идеализированным, что любое согласие экспериментальных данных с
результатами этого расчета вряд ли можно рассматривать иначе, чем
случайное совпадение. Здесь имеет смысл перечислить различные
причины, осложняющие теоретическую оценку.
а. Приведенные цифры, полученные расчетным путем для плоскости (100) при
0К, по указанным в предыдущем разделе причинам являются весьма
неопределенными.
б. Для того чтобы получить поверхностную энергию при комнатной температуре,
необходимо в Е8 внести интегральную поправку, учитывающую вклад поверхности С*
в теплоемкость кристалла [см. уравнение (V-26)]. Эту поправку трудно рассчитать
теоретически, но известно, что для тугоплавких веществ она должна быть мала.
Оценить поверхностную свободную энергию с помощью третьего закона термодинамики
путем Шт€ГЩ№ШЖЯ №КА№Ш№7& чрезвычайно трудно, и едва ли можно надеяться
на высокую точность расчета.
в. Согласно теореме Вульфа, многогранник — наиболее стабильная форма
кристалла, поэтому удельная поверхностная энергия равновесного кристалла представляет
собой среднюю энергию различных равновесных граней.
г. Очевидно, что любая равновесная поверхность не является гладкой. Темперли
[65] подчеркивает, что, хотя при данной кажущейся площади общая поверхностная
энергия действительно минимальна, если поверхность плоская, для обеспечения
минимума энергии требуется маловероятная перегруппировка, тогда как минимум энергии
шероховатой поверхности (с острыми или волнистыми выступами высотой порядка
нескольких сотен ангстрем) обеспечивается оптимальным соотношением между
поверхностной энтропией и энергией. Бертон и Кабрера [29] придерживаются того же
мнения, но исходят они из совершенно других представлений. Эти авторы считают, что
на молекулярном уровне шероховатость может быть равновесной только при
температуре, превышающей некоторую поверхностную температуру плавления. В любом
случае, однако, величины удельной поверхности и поверхностной энергии твердого
тела должны быть выше приведенных в табл. V-3.
д. Рассматривая неравновесные кристаллы, необходимо учитывать еще несколько
дополнительных факторов. Условия эксперимента могут влиять на свойства даже
совершенных плоскостей скола. В частности, селективная адсорбция некоторых
компонентов маточной жидкости может приводить к изменению габитуса кристалла,
сдерживая рост определенных плоскостей. Так, при кристаллизации хлорида натрия из
растворов, содержащих мочевину, вместо кубических кристаллов образуются октаэд-
рические. Форма мелких кристаллов серебра, отожженных на воздухе, отличается от
формы кристаллов, обработанных в азоте, что, по-видимому, связано с адсорбцией
кислорода [36]. Кроме того, как отмечалось в разд. V-2B, вследствие заметной
поверхностной подвижности плоскости, ориентация которых близка к равновесной, могут
спонтанно образовывать ступенчатые или шероховатые поверхности.
е. Плоскости реальных кристаллов могут быть незавершенными и
несовершенными по многим причинам. Неравновесное напряжение поверхности может сниматься
поверхностными дефектами. Как показано на рис. V-8, на поверхности могут иметься
выступы, незавершенные плоскости, ступеньки, дислокации и т. д. Соответственно,
кроме идеальной энергии удаления поверхностного атома или иона, в поверхностную
энергию должны вводиться различные дополнительные члены, учитывающие положение
рассматриваемого элемента кристалла внутри угла, на внутренней стороне, на ребре
Поверхности твердых тел
215
,^ЖУу$
Рис. V-8. Типы поверхностных дислокаций [66].
и т. д. В работе Странского [67, 68] приведено несколько дюжин различных
положений атомов или ионов на поверхности и дана оценка энергии удаления этих атомов
и ионов с поверхности; полученные значения варьируют чрезвычайно сильно. Даннинг
[69] подчеркивает, что адсорбированные молекулы меняют энергию и распределение
центров адсорбции, причем степень этого влияния зависит от поверхностной
подвижности адсорбированных молекул.
ж. Кроме указанных факторов, на свойства поверхности кристалла значительное
влияние могут оказывать шлифовка, спекание или полировка; таким образом,
предварительная механическая обработка кристалла может иметь очень важное значение.
В свете всего сказанного представляется сомнительным, чтобы расчетные значения
поверхностной энергии твердых тел можно рассматривать даже как оценочные
величины. По перечисленным выше причинам одно и то же вещество, полученное
различными способами, может иметь различные значения Е*, а разные
экспериментальные методы (см. разд. V-5) могут давать различные значения Е*.
В. Дислокации
Вообще говоря, теория дислокаций — это область физики твердого
тела и непосредственного отношения к теме данной книги она не имеет,
тем не менее мы коротко, в общих чертах, рассмотрим применение этой
теории в химии поверхностей. По-видимому, наиболее простыми
типами дефектов являются дефекты, образованные избыточными, или
внедренными, атомами, — дефекты Френкеля {70] и дефекты,
образованные недостающими атомами или вакансиями, — дефекты Шоттки [71].
Такие точечные дефекты играют важную роль в диффузии и
электрической проводимости в твердых телах, а также при внедрении солей в
первичные решетки частиц иной валентности [72]. Термодинамически
существование дефектов определяется энергией и энтропией их
образования. Эта ситуация напоминает образование изолированных дырок
и блуждающих атомов на поверхности. Дислокации в свою очередь
можно рассматривать как организованную совокупность точечных
дефектов; дислокации представляют собой дефекты решетки и играют
важную роль в механизме пластической деформации твердых тел.
В отличие от точечных дефектов образование дислокаций
обусловливается не столько термодинамическими требованиями, сколько
механизмом возникновения зародышей и роста кристалла (см. разд. VIII-4).
.. Ju—,
X X ' *
А С В
Рис. V-9. Схема краевой дислокации.
• • •
216
Глава V
Рис. V-10.
а — винтовая дислокация [74]; б — сдвиг, приводящий к образованию винтовой дислокации [144].
Сдвигается элемент над плоскостью ABCD. Винтовая дислокация AD параллельна вектору
сдвига.
Образованием дислокаций в основном обусловлено несовершенство
поверхностей.
Один из главных типов дислокаций — краевая, или линейная,
дислокация. Схема образования краевой дислокации показана на рис.У-9.
На этом рисунке представлено сечение решетки кристалла с одной
избыточной полуплоскостью (перпендикулярной плоскости рисунка).
Ниже плоскости скольжения АВ кристалл растянут, а выше ее — сжат.
Линия, находящаяся в плоскости скольжения и проходящая через
точку С (перпендикулярно плоскости рисунка), называется линией
дислокации. Дислокация выходит на поверхность в виде ступеньки. Сила,
действующая на поверхность выше АВ, приводит к скольжению одной
части решетки относительно другой, что отражается на виде
поверхности кристалла. При непрерывном движении С влево линия
дислокации выйдет на поверхность и решетка верхней части тела примет
нормальный вид. Этот процесс весьма напоминает движение сложенного
пледа, который тянут за нижние складки.
Рассмотренную краевую дислокацию можно охарактеризовать,
проведя вокруг точки С против часовой стрелки цепь, насчитывающую
одно и то же число узлов решетки в положительном и отрицательном
направлении вдоль каждой оси или ряда. Если кристалл совершенный,
эта цепь, называемая цепью Бюргерса [73], замкнута, а при наличии
дислокации она разомкнута. Разрыв цепи Бюргерса и отличает
дислокацию от точечного дефекта. Соединив концы цепи Бюргерса, получим
некоторый вектор Ь, называемый вектором Бюргерса. Длина и
направление (угол) вектора Бюргерса определяются величиной и типом
дислокации.
На рис. V-10, a [74] и V-10, б показан другой тип дислокации, а
именно винтовая дислокация. Каждый кубик на верхнем рисунке —
это атом или узел решетки. Дислокацию этого типа хорошо имитирует
надрезанный ластик, одна часть которого смещена относительно
другой. Если в некоторой плоскости кристалла возникает сдвиг,
спиральная дислокация может быть следствием скольжения по любой
плоскости, содержащей линию сдвига АВ (рис. V-10, б). По своей природе
Поверхности твердых тел
217
Рис. V-11. Винтовая дислокация в кристалле карборунда [75].
деформация вокруг винтовой дислокации является преимущественно
сдвиговой. Это хорошо видно на рис. V-10, а, на котором показан сдвиг
единичного элемента кубической решетки относительно других
элементов в направлении вектора скольжения. Конечно, в реальном
кристалле винтовые и краевые дислокации могут взаимодействовать
друг с другом. На рис. V-11 показана микрофотография типичных
винтовых дислокаций, образованных на поверхности кристалла
карборунда.
Плотность дислокаций обычно выражают числом линий дислокаций,
пересекающих единичную площадку в кристалле. Это число колеблется
от 108/см2 для «хорошего» кристалла до 1012/см2 для металлов,
подвергнутых холодной обработке. Таким образом, расстояния между
дислокациями составляют в среднем 102—104 А, т. е. каждый элемент
поверхности кристалла размером больше 100 А содержит по крайней мере
одну дислокацию. В среднем один из тысячи атомов, расположенных на
поверхности кристалла, находится вблизи дислокации. Согласно
теории упругости, увеличение потенциальной энергии решетки вблизи
дислокации пропорционально |Ь|2. Ядро,или линия,дислокации находится
в чрезвычайно напряженном состоянии. Химический потенциал
вещества здесь настолько высок, что вещество может покидать дислокацию,
оставляя за собой полость. Фрэнк [76] связывает модуль жесткости jx,
поверхностное натяжение и вектор Бюргерса Ъ выражением
r=^2/8ji2Y, (V-21)
где г — радиус полого цилиндра. Кристалл, растущий в растворе,
может быть особенно склонен к образованию полых дислокаций,
вероятно, вследствие относительно низкого межфазного натяжения
между твердым телом и жидкостью. Адсорбированные газы могут
настолько снижать у, что дислокации выходят на поверхность во многих
местах [69]. При травлении кристаллов вещество удаляется
преимущественно из центров дислокаций, что приводит к образованию ямок
травления. Таким способом можно проявлять дислокации и затем
подсчитывать их число под микроскопом. Обычно выходов дислокаций на
поверхность может быть весьма много В результате однородность по-
218
Глава V
верхности серьезно нарушается, и она становится весьма чувствительной
к характеру предварительной обработки. Неоднородность поверхности
сильно отражается на исследуемых поверхностных явлениях, например
адсорбции. Кроме того, поверхностные дислокации играют важную роль
в кинетике таких поверхностных процессов, как рост кристаллов и
каталитические реакции.
Г. Неоднородность поверхности
Итак, полная поверхностная энергия твердого тела зависит от его
дисперсности. Средняя удельная поверхностная энергия данного
вещества также может быть переменной величиной и может отличаться
от своего идеального значения. Остается только подчеркнуть, что и
среднее значение Es описывает реальную поверхность неадекватно.
Если поверхность твердого тела разделить на участки
молекулярного масштаба и последовательно проанализировать их, то окажется,
что локальные значения Es будут сильно варьировать. Распределение
значений Es можно описать приведенной функцией распределения
f(Es). Средняя поверхностная энергия Es определяется выражением
оо
2Г*=Г/(Е*)ЛБ*. (V-22)
о
Уравнение этого типа еще нам понадобится при обсуждении адсорбции
(гл. XIV, разд. XIV-14). Более детальное статистическое описание
распределения поверхностной энергии можно было бы обеспечить с
помощью коррелятивной функции, дающей распределение локальных
значений Es как функции расстояния от данного участка i с поверхностной
энергией Е]ш
Следует отметить, что статистическая теория дает только
приблизительное макроскопическое описание поверхности и не отражает такие
особенности молекулярной картины, как дефекты, дислокации и т. д.
Это позволяет при рассмотрении поверхностных явлений в реальных
системах в какой-то мере использовать термодинамические методы.
5. Экспериментальная оценка поверхностной энергии
и свободной поверхностной энергии
Экспериментальных методов определения величины поверхностной
энергии и свободной поверхностной энергии довольно мало. К тому
же многие из них пригодны только для определенных твердых тел или
частных условий эксперимента. Единственным общим методом
является полуэмпирический метод оценки поверхностного натяжения твердого
тела по поверхностному натяжению жидкости. Данные, полученные с
помощью немногочисленных прямых измерений (см. разд. V-1A), и
результаты работ по изучению зародышеобразования (разд. VIII-3)
показывают, что вблизи температуры плавления поверхностное натяжение
твердого тела на 10—20% выше поверхностного натяжения жидкости.
Это приблизительно соответствует отношению теплоты сублимации к
теплоте испарения жидкости. С помощью уравнения типа (И-10)
(гл. II) величину, определенную при температуре плавления, можно
экстраполировать на другую температуру.
А. Методы, основанные на непосредственном проявлении сил
поверхностного натяжения
При обсуждении явления спекания (разд. V-1A) отмечалось, что
при температуре, близкой к точке плавления, твердое тело может в
какой-то мере течь; в этих условиях твердое тело ведет себя подобно
вязкой жидкости, скорость течения которой пропорциональна прило-
Поверхности твердых тел
219
16
1U
% /2
^
I
I
I
<5
ю
б\-
4h
2h
1 л
Г D
Г о
1 1-1
h
1 1 1 1
W20°C
970
920
i
•
joj.
J
/1
/
/
/
/
/ 1
/ 1
ZA
i J
-2
0 50 iOO 150
Напряжение, дн/см2хЮ~5
Рис. V-12. Зависимость скорости деформации золотой
0,00254 см от напряжения при различных температурах [77].
проволоки толщиной
женному напряжению. Как показывает рис. V-12, при ~1000°С и
малых нагрузках зависимость скорости деформации (относительное
удлинение в единицу времени) золотой проволоки толщиной 2,54-10~3 см
от напряжения (приложенная нагрузка на единицу площади) почти
линейна [77]. Считается, что скорость деформации при нулевой
нагрузке обусловлена поверхностным натяжением металла и,
следовательно, напряжение, соответствующее нулевой скорости деформации,
должно в точности уравновешивать силу поверхностного натяжения по
окружности проволоки. Используя этот метод, Удин и др. [1]
установили, что поверхностное натяжение меди вблизи точки ее плавления
равно 1370 дн/см, а Александер и др. [77] нашли, что при 1000 °С
поверхностное натяжение золота составляет 1300—1700 дн/см.
Интересно, что при длительном нагревании под малой нагрузкой на
проволоке появляются чередующиеся сужения и расширения. То же самое
происходит и с длинными столбиками жидкости (разд. 1-3). По
данным Гринхила и Мак-Дональда [78] при ~50°С поверхностное
натяжение твердого парафина приближается к 50 дн/см, тогда как
поверхностное натяжение жидкого парафина составляет ~25 дн/см.
Менее прямой метод оценки поверхностного натяжения основан на изменении
параметров решетки малых кристаллов. Полученные этим методом данные [27] для
окиси магния и хлорида натрия уже рассматривались в разд. V-2A. Следует отметить,
что эти данные относятся к неравновесному поверхностному напряжению, а не к
поверхностному натяжению.
Остроумно использовав измерения краевого угла на прессованной отожженной
смеси медных и свинцовых гранул, Бэйли и Уоткинс [79] сумели оценить
поверхностное натяжение меди и поверхностное натяжение на границе раздела свинец — медь.
Для меди и свинца при 800 °С поверхностное натяжение, согласно данным работы
[79], равно 1800 и 340 дн/см соответственно. Это исследование имеет отношение
также к проблеме смачивания меди свинцовым припоем.
Поверхностное натяжение кристаллов иногда можно непосредственно определять
по работе их расщепления. В частности, слюда имеет настолько хорошо выраженные
плоскости спайности, что ее можно расщеплять на большие листы толщиной в доли
миллиметра. Ороуэн [80], рассматривая свойства слюды, приводит следующее
уравнение:
Ьу = ТЧ/2Еу
(V-24)
где Т — напряжение в расщепляемом листке толщиной х и Е — модуль упругости. По
существу, в уравнении (V-24) поверхностная энергия двух образуемых поверхностей
220
Глава V
приравнивается к упругой энергии этих поверхностей. Процесс расщепления обратим
не полностью, поэтому получаемые здесь величины являются только
приблизительными. Интересно, что поверхностное натяжение слюды на воздухе и в вакууме
составляет 375 и 4500 эрг/см2 соответственно. Первая величина, по-видимому, соответствует
работе когезии двух поверхностей с адсорбированными на них пленками воды.
Относительно недавно Гилман ,[81] и Уэствуд и Хитч [82]
применили метод расщепления к большому числу разнообразных кристаллов.
Ими были изучены следующие соли LiF (100, 340), MgO (100, 1200),
CaF2 (111, 450), BaF2 (111, 280), CaC03 (001, 230), Si (111, 1240),
Zn (0001, 105), Fe (3% Si) (100, около 1360) и NaCl (100, ПО) (в
скобках приведены соответственно плоскости расщепления и наиболее
вероятные значения поверхностного натяжения). Авторы отмечают, что
полученные ими данные лучше всего согласуются с результатами
оценки поверхностной энергии по очень простой теории Борна и Штерна,
предложенной в 1919 г., в которой учитываются только кулоновские
члены и взаимное отталкивание жестких сфер. Уэствуд и Хитч считают,
что, поскольку эксперименты по расщеплению не полностью обратимы,
реально они характеризуют энергию разрыва связей или вклад в
поверхностную энергию только взаимодействия ближайших соседей без
учета нарушения структуры поверхности. В частности, величина,
полученная для хлорида натрия, настолько мала, что возникает вопрос,
не переоценивается ли в современной довольно сложной теории вклад
вандерваальсового взаимодействия.
Б. Оценка поверхностной энергии и свободной поверхностной
энергии по теплоте растворения
Данные, представленные в табл. V-3, показывают, что для частиц
размером порядка 1 мкм полная поверхностная энергия может
составлять несколько десятых калории на грамм. При разрушении
твердого тела в процессе растворения поверхностная энергия проявляется
в виде избыточной теплоты растворения. Ее можно измерить,
определив с помощью точного калориметрического метода небольшую
разность между теплотой растворения грубозернистого и
мелкокристаллического материала.
Превосходными примерами тщательных измерений этого типа
служат работы Липсетта и др. [83] и Бенсона [51, 84], определявших
теплоту растворения хлорида натрия. Детально ознакомиться с этими
работами, особенно с методикой эксперимента, лучше всего по
оригинальным статьям. Точность калориметрических измерений
характеризует следующий пример: при растворении 1,2 г порошкообразного
хлорида натрия температура в калориметре меняется всего на 0,014 °С;
при этом учитывают поправки на теплоту испарения воды в ампулу для
образца после его разгерметизации и теплоту, выделяющуюся при
перемешивании раствора. По данным Липсетта и др. [83], теплота
растворения мелкокристаллической соли на 16 кал/моль выше, чем у
крупнокристаллической соли, для которой теплота растворения равна
928 кал/моль. Размер частиц у полученных сублимацией
мелкокристаллической фракции был равен 1 мкм. Следовательно, удельная
поверхностная энергия хлорида натрия равна 400 эрг/см2.
В повторном определении поверхностной энергии хлорида натрия,
проведенном Бенсоном и др. [51, 84], удельная поверхность
порошкообразных образцов находилась, несомненно, более надежным
способом, а именно газоадсорбционным методом БЭТ (см. разд. XIV-5).
Полученная величина Es = 276 эрг/см2 представляется наиболее
точной; в этой работе, кроме того, использовались образцы с различным
размером частиц, что позволило провести дополнительную проверку
результатов определений-
Поверхности твердых тел
221
Брунауэр и соавторы провели аналогичные исследования на СаО и Са(ОН)г [85]
и на гидрате силиката кальция тоберморите [86]. При 23 °С соответствующие
величины поверхностной энергии составляют 1310, 1180 и 386 эрг/см2. Значительно раньше
Гаук и Арчибальд [87] нашли, что разность теплот растворения в кислоте грубо- и
тонкоизмельченной окиси магния равна 888 кал/моль. Окись получали дегидратацией
гидроокиси магния, однако размер частиц в этой работе, к сожалению, не определяли.
Позднее Юра и Гарлэнд [88] приготовили подобный образец и нашли, что его
удельная поверхность по адсорбции азота (см. разд. XIV-5) составляет 86 м2/г. Объединив
эти два результата, авторы установили, что при комнатной температуре Еа равна
1090 эрг/см2. Юра и Гарлэнд измерили также теплоемкость тонко- и
крупнодисперсного материалов при различных температурах — вплоть до очень низких. Найденные
значения разностей теплоемкости АСР были затем использованы для расчета
изменения поверхностной энергии с температурой.
Температурную зависимость АСР формально можно использовать и для расчета
поверхностной энтропии и свободной поверхностной энергии по уравнениям
т
Щ = #298К + 0/А> f ACPdT> (V-25)
298К
Т
5* = (1/А) f ACpdln7\ (V-26)
о
qs = Hs — TSS. (V-27)
Черточки над буквами показывают, что величины усреднены по уравнению (V-22) с
заменой в последнем Е8 на соответствующие термодинамические величины.
Этим способом найдено, что Hs меняется от 1040 эрг/см2 при 0 К до 1090 эрг/см2
при 298 К и что в том же температурном интервале G* уменьшается от 1040 до
1000 эрг/см2.
Теоретические оценки поверхностной энергии, обсуждавшиеся в разд. V-3B, и ее
найденное значение (1040 эрг/см2) удовлетворительно согласуются между собой.
Однако правомочность применения термодинамических соотношений типа (V-25) и (V-26),
по-видимому, все же остается проблематичной. Система тонкодисперсных частиц не
может быть термодинамически равновесной (термодинамически равновесным может
быть лишь монокристалл), и вряд ли поверхностные слои мелких кристаллов, порознь
находящихся в состоянии равновесия и характеризующихся определенной формой и
известным содержанием дефектов и дислокаций, в дальнейшем обладают такой же
равновесной конфигурацией. Даже если при температуре приготовления порошка
поверхность и находится в равновесном состоянии, неподвижность атомов поверхности
при температурах от 0 К до комнатной приведет к отсутствию непрерывного и
обратимого изменения конфигурации поверхности, необходимого для удержания ее в
равновесии при изменении температуры.
Полученное значение энтропии скорее всего относится к частной, несомненно
неравновесной, конфигурации поверхности. Аналогичный вопрос поднят и в работе
Бауэра [89]. В наиболее общем виде проблему можно сформулировать следующим
образом. Действительно ли экспериментальные поверхностные эффекты при измерении
теплот растворения и тешюемкостей являются экстенсивными характеристиками, не
зависящими от размера и формы кристаллов? Используя различные по размеру частиц
фракции тонкодисперсного хлорида натрия, полученного методом испарения, Паттер-
сон и др. '[90] нашли, что вклад поверхности в низкотемпературную теплоемкость
меняется приблизительно пропорционально удельной поверхности порошка,
определенной по адсорбции газа. Такие же измерения было бы интересно провести и на
образцах хлорида натрия, полученных другими методами.
Ряд подобных вопросов возникает и при термодинамическом анализе
адсорбционного равновесия на тонкодисперсных материалах, поверхности которых явно не
могут быть равновесными. Эти вопросы более подробно обсуждаются в разд. VI1-3.
В заключение отметим, что, согласно некоторым теоретическим оценкам
теплоемкости порошков при низких температурах ;[91], вблизи абсолютного нуля основной
вклад в кажущуюся поверхностную теплоемкость очень маленьких частиц (около
100 А) может давать поступательное и вращательное движение самих частиц.
В. Определение относительных поверхностных натяжений
по равновесным формам кристалла
В разд. V-2B указывается, что для данного ряда поверхностных
натяжений различных плоскостей кристалла теорема Вульфа
устанавливает определенную равновесную форму кристалла, характеризующуюся
минимумом свободной энергии. При отжиге вблизи температуры плав-
222
Глава V
ления небольшие кристаллы постепенно приобретают равновесную
форму; аналогично небольшие воздушные полости в массе вещества
в этих условиях принимают равновесную форму «отрицательных»
кристаллов. Отметим, что при образовании «отрицательных» кристаллов
вероятность случайного загрязнения поверхности раздела между
твердым телом и воздухом уменьшается.
Некоторые примеры равновесия этого типа приводились в разд. V-2B.
Так, например, Нельсон и др. [34], используя метод равновесной
полости, нашли, что для меди при 600 °С, алюминия при 550 °С и
молибдена при 2000 °С отношения yioo/yho составляют соответственно 1,2; 0,98 и
1,14; для алюминия при 450 °С отношение уюо/уш равно 1,03. При
исследовании автоэлектронной эмиссии (разд. V-6B) кончики
металлических образцов также стремятся к равновесной огранке. В работе [92]
показано, что в этих условиях форма кончиков хорошо согласуется с
рассчитанной теоретически.
Сандквист ([35], исследуя небольшие кристаллы металлов, заметил, что для них
характерно образование довольно скругленных форм. Автор пришел к выводу, что
для таких металлов, как серебро, золото, медь и железо, поверхностные натяжения
различных плоскостей кристалла различаются не более чем на 15%. Эти наблюдения
подкрепляются теоретическими расчетами Герринга [31], показавшего, что при
некоторых условиях у-кРивые (кривые Вульфа) в полярных координатах должны включать
сглаженные участки (которые являются частями сферических поверхностей),
встречающиеся в точках возврата. В зависимости то температуры равновесная форма может
быть скругленной или полиэдрической. Приведенные здесь результаты были получены
при таких температурах, когда поверхностная подвижность, по-видимому, достаточно
высока. Как отмечалось в разд. V-1A, вполне возможно, что при температуре, близкой
к точке плавления, поверхностный слой твердого тела ведет себя подобно жидкости.
Г. Влияние изменения поверхностной энергии твердого тела
на его физические свойства
Имеет смысл упомянуть еще некоторые связанные с поверхностными свойствами
твердого тела вопросы, которые здесь подробно не рассматриваются, поскольку они
обсуждаются в других разделах. Прежде всего речь пойдет об определении
поверхностного натяжения на границе раздела твердое тело — жидкость по растворимости
(разд. VII-2) и по данным о зародышеобразовании (разд. VIII-3). Изменение, или
разность, свободных поверхностных энергий на границе раздела твердое тело — пар
можно находить также из данных по адсорбции газов (разд. VIII-3), а
соответствующие разности поверхностных энергий — по данным о теплотах смачивания (разд.
VTI-3). Измерения краевых углов дают разность поверхностных энергий на
поверхностях раздела твердое тело — пар (разд. VII-4). В гл. IV количественно оценивается
влияние потенциала на свободную энергию поверхности раздела твердое тело —
раствор электролита.
1. Расширение твердого тела при адсорбции. При поглощении газа или жидкости
многие твердые тела заметно увеличивают свой объем. В определенных условиях
адсорбция паров пористыми телами описывается определенным соотношением между
относительным линейным расширением (выраженным в процентах) и поверхностным
давлением адсорбированного вещества [93]. Последнее рассчитывается по изотерме
адсорбции с помощью уравнения Гиббса. Как показано в разд. XIV-6,
я = (постоянная) 1 z/dlnP, (V-28)
где я — поверхностное давление, v — объем адсорбированного пара, Р — упругость
пара. В работе [94] подтверждается справедливость этого линейного соотношения для
ряда инертных газов, адсорбированных на пористом стекле. Автор работы [94] вывел
уравнение
(дп/дУ)т = -^К,
где V — объем пористого материала и К—■ объемный модуль упругости адсорбента.
2. Предел прочности твердых тел на растяжение. Большинство поверхностей
твердых тел покрыто небольшими трещинками, по всей вероятности обусловленными
присутствием на поверхности таких дефектов, на которых предел прочности на
растяжение падает ниже теоретического значения. Так, по оценке Странского 1[95],
теоретический предел прочности на растяжение для хлорида натрия составляет 200 кГ/мм2.
Предел прочности на растяжение, соответствующее разрывающему напряжению т,
Поверхности твердых тел
223
можно связать с работой когезии 2у, предположив, что силы между двумя
разделяющими плоскостями действуют только на расстоянии, не превышающем d:
2y = dx. (V-30)
Поляни [96] принимает d равным около 10 А. следовательно, для хлористого натрия
т должно приближаться к 2-107-190=4-109 дн/см2, или около 40 кГ/мм2. В
зависимости от условий реальный предел прочности на растяжение для поверхности
каменной соли может составлять всего сотую или тысячную часть теоретического значения.
Странский нашел, что при растяжении измеряемый предел прочности напряжения
кристаллов каменной соли заметно возрастает с уменьшением их размеров. Максимальные
значения, близкие к теоретическим, получены для кристаллов с размерами ребер
порядка 0,02 мм. Если поверхность кристалла покрыта насыщенным раствором, из
которого могут осаждаться микрокристаллы, то его предел прочности на растяжение
значительно снижается. Однако при добавлении некоторого количества мочевины
такого снижения не наблюдается.
Общеизвестно, что стекло легко раскалывается по царапине. Однако и
поверхность стекла, не содержащая глубоких царапин, покрыта множеством тонких трещин
[97, 98]. На свежетянутом стекле первоначально имеются довольно высокие
растягивающие напряжения, которые со временем быстро уменьшаются.
Ввиду заметного влияния поверхностных трещин на предел прочности при
растяжении (см. также соотношение (V-30)) связь между пределом прочности и
фактическим поверхностным натяжением очевидна. Не удивительно, что определяемые
экспериментально значения предела прочности при растяжении сильно зависят от
окружающих условий. Это влияние может осуществляться хотя бы посредством изменения
поверхностного натяжения твердого тела. В общем случае любое уменьшение
поверхностного натяжения твердого тела должно также приводить к уменьшению
наблюдаемого предела прочности при растяжении. Так, предел прочности стекла в воде
меньше, чем на воздухе; точно так же предел прочности слюды на воздухе ниже, чем
в вакууме i[99].
6. Методы определения структуры и состава поверхности
В последнее десятилетие для определения структуры и состава
поверхностей, как чистых, так и покрытых адсорбционным слоем, все
больше и больше применяются оптические, дифракционные и
спектроскопические методы. Этому в значительной мере способствует
массовое производство ультравакуумного оборудования, необходимого для
получения чистых поверхностей, и совершенных измерительных систем.
Разработано так много новых методов, что, по-видимому, полезно хо-
Таблица V-4
Методы исследования структуры, состава и возбужденных состояний поверхности
Электромагнитное излучение36
СМРИ ФЭС
\
АСМРИ ЭСМРИ ЭСХА
i /1
РС1
ГС УФЭС Pel
>эс
Электроны3
ДБЭ
ДМЭ
оэс
спп
ехпэ
сти
ссэд
ДЭРС
Положительные ионыг
мсви
инс
АИМ
Электрическое полед
ДЭЭП
СМРИ — спектроскопия мягкого рентгеновского излучения; АСМРИ — адсорбционная
спектроскопия мягкого рентгеновского излучения; ЭСМРИ — эмиссионная спектроскопия мягкого
рентгеновского излучения; РСТС — рентгеновская спектроскопия тонкой структуры спектров поглощения. _
ФЭС — фотоэлектронная спектроскопия; ЭСХА — электронная спектроскопия для химического
анализа; УФЭС — ультрафиолетовая фотоэлектронная спектроскопия; РФЭС — рентгеновская
фотоэлектронная спектроскопия.
ВДБЭ—дифракция быстрых электронов; ДМЭ — дифракция медленных электронов; ОЭС—
оже-электронная спектроскопия, СПП — спектроскопия потенциала появления; СХПЭ —
спектроскопия характеристических потерь энергии; СТИ — спектроскопия тормозного излучения; ССЭД —
спектроскопия стимулированной электронами десорбции, ДЭРС — дифракция электронов в
режиме сканирования.
ГМСВИ — масс-спектрометрия вторичных ионов; ИНС — ионно-нейтрализационная
спектроскопия; АИМ — автоионная спектроскопия.
дДЭЭП—дифракция электронов, эмитированных полем.
224
Глава V
ismJ^ /
Рис. V-13. Схема формирования изображения в оптическом микроскопе (а),
просвечивающем электронном микроскопе (б), сканирующем электронном микроскопе (в)
[100].
Оптический микроскоп; 1 — источник света; 2—конденсор; 3— образец; 4— объектив; 5 —
проецирующие линзы или окуляр; 6 — получаемое изображение.
Просвечивающий электронный микроскоп: / — электронная пушка; 2 — конденсор; 3— первая
диафрагма; 4 — образец; 5 — объектив; 6 — вторая диафрагма; 7 — промежуточная линза; 8 —
проецирующие линзы; 9 — оконечная диафрагма; 10 — получаемое изображение.
Сканирующий электронный микроскоп: 1 — электронная пушка; 2 — первая диафрагма; 3 — первый
конденсор; 4 — вторая диафрагма; 5 — второй конденсор; 6 — третья диафрагма; 7 — сканирующие
катушки; 8 — оконечный конденсор; 9 — оконечная диафрагма; 10 — коллектор электронов; 11 —
образец; 12 — сигнал, формирующий изображение сканиоуемого участка.
тя бы в общих чертах описать некоторые из них. В табл. V-4
перечислены современные методы исследования структуры и состава
поверхности.
Микроскопия (рис. V-13)
Обычная оптическая микроскопия (огранка поверхности, развитые
дислокации, как, например на рис. V-11).
Электронная микроскопия (картина поверхности с разрешением дс
10 А). Электроны пропускаются через образец.
Поверхности твердых тел
225
Сканирующая электронная микроскопия (картина поверхности с
разрешением до 50—100 А). Сфокусированный пучок электронов
отклоняют с помощью магнита и сканируют по поверхности образца,
подобно пучку электронов, пробегающему строку за строкой на экране
телевизионной трубки. Детектируются вторичные электроны,
интенсивность сигнала модулирует синхронно сканирующий пучок электронов
в электронно-лучевой трубке (т. е. фактически в телевизионной трубке).
Эллипсометрия (см. разд. Ш-ЗГ). Измерение толщины пленки по
изменению поляризации светового пучка; применяется для
исследования пленок толщиной до 1 А.
Дифракция и рассеяние
Дифракция медленных электронов (ДМЭ) (см. разд. V-6B).
Моноэнергетические электроны (1—500 эВ) падают (обычно нормально) на
поверхность; дифракция упруго рассеянных электронов проявляется в
виде пятен на фосфоресцирующем экране.
Дифракция быстрых электронов (ДБЭ). Электроны в диапазоне
18—25 кэВ также можно использовать для определения структуры
поверхности. Чтобы исключить слишком глубокое проникание электронов
в образец, используют скользящий, а не нормально падающий пучок
(см. [101]).
Автоэлектронная эмиссия (см. разд. V-6B). Электроны, излучаемые
остро отточенным заряженным кончиком металла, идут по прямой к
экрану электронно-лучевой трубки, действующему как анод. Возможно
разрешение с точностью 30—50 А различных участков поверхности,
например кристаллических граней, излучающих электроны с разной
интенсивностью, в соответствии с их работой выхода. Этим методом
можно измерять также работу выхода.
Автоионная эмиссия (см. разд. V-6B). Как и в случае
автоэлектронной эмиссии, имеется заряженное металлическое острие, правда теперь
заряженное положительно. Молекулы газовой фазы, например гелия,
ионизуются в поле вблизи поверхности. Положительно заряженные
ионы отталкиваются полем острия к отрицательно заряженному экрану.
Разрешение настолько велико, что возможно определение положений
отдельных атомов.
Рассеяние ионов (см. разд. V-бГ). На поверхность падает
сфокусированный пучок ионов определенной скорости (т. е. энергии). Можно
изучать как дифракцию, так и неупругое рассеяние.
Спектроскопия
Спектроскопия в инфракрасной области. Это хорошо отработанный
метод исследования состава поверхности и протекающих на ней
химических процессов; широко используется для исследования адсорбции.
О применении ИК-спектроскопии, а также спектроскопии
комбинационного рассеяния (КРС) для изучения поверхностей говорится в гл. XIII.
Спектроскопия в видимой и ультрафиолетовой областях. Эти
методы рассматриваются в гл. XIII.
Электронный спиновый резонанс и ядерный магнитный резонанс
(см. гл. XIII).
Оже-спектроскопия (см. разд. V-бД). Электроны обычно энергией
от 2 до 3 кэВ выбивают внутренние электроны; при переходе
электронов на вакантный уровень либо возникает рентгеновское излучение,
либо происходит передача энергии к другому злектрону в атоме (эффект
Оже). Такие оже-электроны являются моноэнергетическими, и оже-
спектр является характеристикой атомов. Падающий возбуждающий
15—1421
226
Глава V
пучок направлен под очень острым углом к поверхности, так что оже-
электроны излучаются главным образом поверхностными атомами.
Фотоэлектронная спектроскопия (см. разд. V-6E). Принятое
сокращенное название метода — ЭСХА (электронная спектроскопия для кхи-
мического анализа). Под действием рентгеновского излучения
выбиваются внутренние электроны. Эти электроны являются
моноэнергетическими, и получаемый спектр характеризует атомы и их валентное
состояние.
Масс-спектрометрия вторичных ионов (МСВИ). Если энергия
пучка падающих электронов превышает 3 кВ, образуются вторичные
ионы, которые можно детектировать масс-спектрометрически (см. [102]).
Другие методы
Поверхностная проводимость. Если исследуемое соединение
относится к классу полупроводников, поверхностная проводимость в очень
большой степени зависит от природы и числа поверхностных состояний
(см. [103]).
Некоторые из перечисленных выше методов описываются в данной
главе, а более подробно с ними можно познакомиться по монографии
[104]. Следует отметить, что, хотя различные методики измерений
рассматриваются раздельно, обычно экспериментальная установка
представляет собой сверхвакуумную камеру, оснащенную разнообразными
источниками и детекторами, что позволяет проводить различные
измерения на одном и том же образце.
Наконец, разобраться в принятой системе обозначений может
помочь табл. -V-4, в которой все методы классифицированы по природе
зонда, используемого для исследования поверхности (свет или другое
электромагнитное излучение, электроны и т. д.).
А. Сканирующая электронная микроскопия
Этот метод настолько эффективен и так широко применяется, что
его следует рассмотреть немного подробнее. Как указано во введении
к разд. V-6, в сканирующей электронной микроскопии поверхность
сканируется фокусированным пучком электронов, а контролируется
интенсивность потока вторичных электронов. Сигнал детектора
вторичных электронов моделирует растр электронно-лучевой трубки, луч
которой развертывается синхронно с фокусированным пучком
электронов. Каждая точка растра (т. е. поверхности, формирующей
изображение) электронно-лучевой трубки (фактически телевизионной
трубки) соответствует некоторой точке на поверхности образца. Яркость
изображения меняется пропорционально интенсивности потока
вторичных электронов из соответствующей точки на поверхности. Как и в
телевизоре, качество изображения зависит от интенсивности сигнала
(контрастность изображения обеспечивается тем, что интенсивность
сигнала можно менять) и от числа линий развертки (чем больше
линий, тем лучше разрешение).
В сканирующем электронном микроскопе контрастность
изображения регулируется в широком диапазоне; в результате детали
поверхности могут наблюдаться как в виде очень темных, так и в виде очень
светлых участков. Изображения отличаются также глубиной
фокусировки; четко видны как очень глубокие, так и очень высокие точки
поверхности. В результате даже довольно шероховатые поверхности
дают удивительно ясные и объемные изображения [100]. На рис. V-14
показано для примера очень четкое изображение мелких кристалликов
NaCl, полученное методом сканирующей электронный микроскопии.
Поверхности твердых тел
227
Рис. V-14. Фотография микрокристаллов NaCI, полученная с помощью сканирующего
электронного микроскопа. (С разрешения д-ра Р. Ф. Бэйкера.)
Б, Дифракция медленных электронов
Уже вскоре после того, как был разработан метод дифракции
электронов, стало ясно, что, как и рентгеновские лучи, электроны
относительно высокой энергии (скажем, 50 кэВ) дают информацию о
периодичности в объеме кристалла, тогда как электроны низкой энергии
(около 100 эВ), проникающая способность которых составляет всего
несколько атомных диаметров, должны давать информацию о
структуре поверхности твердого тела. Первая опубликованная
экспериментальная работа (Дэвиссон и Джермер [105], 1927 г.) была выполнена на
пределе чувствительности. В этой работе не удалось полностью
преодолеть значительные экспериментальные трудности по генерации пучка
моноэнергетических электронов и детектированию их рассеяния. Еще
большим препятствием было отсутствие в то время сверхвысоковаку-
умной техники. Даже при остаточном давлении 10_6 мм рт. ст.
поверхность покрывается монослоем адсорбированного газа примерно за 1 с,
и, чтобы быть уверенным в том, что поверхность чистая, необходимо
снизить давление до 10~10 мм. рт. ст.
Отработка техники эксперимента в значительной степени
осуществлена МакРэем и сотр. [106]. Схема современной экспериментальной
установки для измерения дифракции медленных электронов показана
на рис. V-15 [104]. Электроны, излучаемые раскаленной нитью,
получают одинаковое ускорение и ударяются о кристалл перпендикулярно
его поверхности. Рассеяние электронов может быть как упругим, так
и неупругим. В диффракционных исследованиях используют только
упруго рассеянные электроны. В установке, показанной схематически
на рис. V-15, имеется несколько сеток. Потенциал первой сетки
соответствует потенциалу кристалла; вторая сетка — отражающая, через нее
проходят только те электроны, которые обладают первоначальной
энергией (неупруго рассеянные электроны более низкой энергии задержи*
ваются); третья положительно заряженная сетка ускоряет
проходящие через нее электроны и направляет их на флуоресцентный экран
Получающуюся дифракционную картину можно регистрировать фото
графически.
15*
228
Глава V
Рис. V-15. Схема установки для измерения дифракции медленных электронов [104].
/ — кристалл; 2 — сетки; 3 — смещение; 4 — аноды; 5 — катод; 6 — регулировка накала нити; 7 —
линия переменного тока; 8— ток эмиссии; 9 — ток нити; 10 — напряжение, ускоряющее иучок
электронов; // — электронная пушка; 12 — фокусировка пушки; 13 — нормальное положение; 14 —
экранирующее положение.
Дифракция электронов, по существу, не отличается от дифракции
света на решетке. Условие Лауэ для пучка, падающего по нормали к
ловерхности (рис. V-16), можно записать как
a cos a=111%, (V-31)
где а — постоянная решетки по данному направлению на поверхности,
П\ — целое число, % — длина волны электрона. Для обычной двумерной
решетки атомов для второго направления с постоянной решетки b
также
Ьсоъ$=пг%. (V-32)
Дифракционная картина состоит из небольшого числа пятен,
симметричное расположение которых соответствует геометрии решетки атомов
о
U—^ J Рис. V-16.
Поверхности твердых тел
229
Рис V-17. Дифракционная картина,
полученная на чистой поверхности (110) никеля при
использовании электронов энергией 76 эВ,
стрелкой указано положение пятна 00
(вверху); модель плоскости (НО) объемноцентри-
рованного кристалла (внизу) [106].
на поверхности. На рис. V-17 показана полученная МакРэем дифрак-
тограмма поверхности никеля, образованной плоскостями (ПО). При
уменьшении или увеличении энергии электронного пучка дифрактограм-
ма (например, приведенная на рис. V-17) расширяется или сжимается.
Эта картина прежде всего обусловлена первым слоем атомов,
поскольку проникающая способность электронов с низкой энергией невелика
(а в методе дифракции быстрых электронов пучок падает на
поверхность под очень небольшим углом); здесь, однако, может проявляться
и слабое рассеяние электронов на втором или третьем слое.
Казалось бы, что структура чистой поверхности, например
монокристалла металла, должна просто повторять объемную кристаллическую
структуру. Это, однако, не обязательно так. Напомним, что в галогени-
дах щелочных металлов ионы поверхностного слоя смещаются
по-разному (рис. V-7). Считают, однако, что структура поверхности
«соответствует» структуре объема материала и что обе структуры следует
описывать в одинаковых терминах. Как показано на рис. V-18, а,
поверхностная структура (1X1) характеризуется такой же периодичностью
или состоит из таких «элементов», что и соответствующая
кристаллографическая 'плоскость объемной структуры. Если чередующиеся ряды
атомов сдвинуты по отношению друг к другу, то, как видно из
рис. V-18, б, структура поверхности характеризуется индексом С(2Х1),
где С обозначает наличие центрального атома. На рис. V-18, в показан
ряд структур, выведенных из структуры плоскости (111).
Метод дифракции медленных электронов (ДМЭ) в основном
применяют для изучения структуры поверхности. Однако определить струк-
Tvpy поверхности не всегда легко, даже если известно, какая
кристаллографическая плоскость образует исследуемую грань кристалла.
Дело в том, что картина ДМЭ не просто повторяет картину структуры
поверхности. Дифрактограмма скорее соответствует обратной решетке,
т. е. на ней отображаются только повторяющиеся расстояния и
различные углы между ними. Обычно одной и той же картине ДМЭ отвечает
230
Глава V
О О о-
<? 0"
■О
+
F Г
—6-
+
6—6-
а
-о-
-Q
+
О 6
+
<?—о
-о
*•••©•••• рис V-18. Поверхностные структуры.
• •<§)• •©••• а _ СТруКТура (1X1) на поверхности (100) гранецентриро-
• ® • • *®t • • <§) • ванного кристалла [107]; б — поверхностная структура С
^'' ч>- (2X1) того же кристалла [107]. В обоих случаях элементар-
О • • fti^e * *® с * ® ные ячейки кристалла показаны сплошной линией, а атомы
• (5) • • vtsr'# • (5) • второго слоя плюсами, затененные кружки (б) обозначают
w ^ атомы, сдвинутые относительно равновесных положений в
\2П /"'7 ® * • <§)••• объеме; в — поверхностные структуры на подложке, харак-
о Ч/ ^У . ~ л теризующейся центральной симметрией шестого поряд-
-уу^ w кч [108].
га
более чем одна возможная структура поверхности, и при расшифровке
дифр^ктограмм необходимо учитывать не только положение пятен на
дифракционной картине, но и их интенсивность. При расчете
необходимо принимать во внимание также возможность многократного
рассеяния (см., например, работы ,[103, 104, 109]).
Большинство исследований с применением ДМЭ проведено на
кристаллах различных элементов — металлах, кремнии, германии, и для
этих же кристаллов были предприняты попытки провести теоретический
расчет поверхностных свойств. Так, по теоретической оценке Бертона
и Юры [107], на гипотетической поверхности (100) Аг свободная
энергия перехода от структуры (1X1) к структуре С(2X1) выражается
уравнением
AG =4,83 — 0,0592Т (эрг/см2). (V-33)
При температуре выше 81,5 К структура С(2Х1) становится более
стабильной. Подобные, но менее точные расчеты были сделаны и для
металлов. Из этих работ следуют два важных вывода: во-первых,
переход от одной поверхностной структуры к* другой может происходить и
без какого-либо изменения объемной фазы и, во-вторых, разность
энергий альтернативных поверхностных структур может быть не очень
велика, а разность свободных энергий может заметно зависеть от тем-
Поверхности твердых тел
231
пературы. Вероятное следствие второго вывода — возможность
изменения структуры поверхности при адсорбции некоторых примесей.
Более подробно этот вопрос обсуждается в гл. XIV и XV.
В. Автоэлектронная и автоионная микроскопия
Автоэлектронный микроскоп был изобретен Мюллером [ПО] в
1936 г., но только недавно этот прибор и его усовершенствованные
варианты стали играть действительно важную роль в исследовании
структуры поверхностей. Подробно автоэлектронная микроскопия
рассматривается в обзорах Гомера [1111 и Эрлиха [112] и в монографии [104].
В настоящее время сам метод и его теория развиты довольно
глубоко. Здесь же даются только самые элементарные сведения. Некоторые
вопросы автоэлектронной микроскопии, непосредственно связанные с
хемосорбцией, обсуждаются в гл. XV.
Схема автоэлектронного микроскопа очень проста (рис. V-19) [111].
Острие из тугоплавкого металла, например вольфрама, тщательно (и
часто безуспешно!) подвергается электрополировке до образования
почти полусферического кончика радиусом около Ю-5 см. Между этим
острием и полусферическим флуоресцентным экраном создается
разность потенциалов примерно в 10 000 В. Если радиусы кривизны острия
и экрана равны а и 6, то поле Fa на кончике можно рассчитать
следующим образом. Напряженность поля F убывает обратно
пропорционально квадрату расстояния, поэтому F должно быть равно kr~2.
Суммарную разность потенциалов между кончиком и экраном можно записать
как
ь
V= Г Fdr = -k(l/b— 1/а). (V-34)
а
Если lib пренебрежимо мало по сравнению с 1/а, то k = aV и Fa = V/a.
Таким образом, в данном случае Fa составляет 109 В/см. Эта очень
высокая напряженность поля эквивалентна 10 В/А. Ее достаточно для
того, чтобы «вытянуть» электроны из металла и затем направить их с
ускорением по радиальным линиям к флуоресцентному экрану.
Центрами эмиссии здесь служат отдельные атомы. Различные грани
кристалла сильно отличаются по эмиссионной способности, так как она
зависит от плотности упаковки и работы выхода. Поскольку коэффициент
усиления b/а очень велик (порядка 106), то, казалось бы, на экране
можно увидеть отдельные атомы. На практике, однако, разрешение
ограничивается кинетической энергией движения электронов в металле
под прямыми углами к направлению эмиссии и достигаемое разрешение
составляет около 30—50 А. Тем не менее в электронном микроскопе
видны удивительные картины; различные кристаллические плоскости,
Рис. V-19. Схема одного из типов
автоэлектронного микроскопа [111].
Е — стеклянная оболочка; 5 — флуоресцентный
экран; М — металлический отражатель; А —
анодный ввод; Г —эмиттер; С —узел ввода
эмиттера; V — трубка для соединения с
вакуумной системой.
232
Глава V
Рис. V-20. Миграция азота, осажденного на поверхность вольфрама при 20 К. По мере
повышения температуры образца пятно осажденного азота (его первоначальное
положение показано в верхней левой части рисунка) селективно расползается по
различным граням [113].
образующие поверхность острия, чередуются в виде темных и светлых
участков. На рис. V-20 показано влияние миграции атомов азота по
поверхности на эмиссию различных граней.
Мюллер [114] предложил еще одну, кстати, очень простую
модификацию автоэлектронного микроскопа — так называемый ионный
микропроектор. В этом приборе острие заряжено положительно, в
результате молекула газа, приближаясь к нему, теряет электрон и
образующийся ион, ускоряясь, движется радиально к флуоресцентному экрану
и ударяется о него. В настоящее время ионные микропректоры чаще
всего заполняются, гелием, хотя можно использовать и другие газы.
В первых исследованиях автоионного эффекта наблюдалась в
основном индуцированная полем эмиссия адсорбированных на поверхности
атомов, например водорода. Автоионный микроскоп в принципе сходен
с автоэлектронным микроскопом и отличается только наличием
устройств, обеспечивающих низкое, но контролируемое давление гелия и
охлаждение острия.
Автоионная микроскопия также представляет собой весьма
развитый метод. Подробное описание его можно найти в монографии
Мюллера и Цонга [116]. Достоинством автоионной микроскопии является
использование очень низких температур, в результате чего достигается
разрешение всего в несколько ангстрем, и, таким образом, могут быть
видны отдельные атомы. На рис. V-21, заимствованном из работы [117],
приведена микрофотография вольфрамового острия, полученная
методом автоионной спектроскопии. Светлые пятна — отдельные атомы
вольфрама — расположены в соответствии с геометрией различных
Рис. V-21. Эмиссия ионов на чистом вольфраме [113].
Рис. V-22. Расположение адсорбированных атомов ксенона на поверхности модели
вольфрамового острия, построенной из жестких шариков [117].
234
Глава V
В отсутствие поля
кристаллографических плоскостей острия. Локальная напряженность
отдельных плоскостей, например (ПО) и (211), недостаточна для
ионизации гелия при данном напряжении, и поэтому эти атомы не видны
на флуоресцентном экране. На рис. V-22 изображена модель упаковки
шарообразных атомов вольфрама на приблизительно полусферическом
острие [117]. Эта модель показывает, что для получения округлого
кончика необходимо использовать плоскости с высоким индексом
Миллера. Эти плоскости обладают низкой плотностью упаковки атомов, что
часто приводит к образованию на поверхности впадин, или карманов.
Различные типы плоскостей не только с разной эффективностью
ионизуют гелий (выступающие атомы являются наиболее эффективными),
но и, очевидно, должны характеризоваться различной адсорбционной
способностью. Этот аспект применения автоионной микроскопии более
детально обсуждается в разд. ХУ-2Г.
Хотя автоионная микроскопия позволяет эффективно наблюдать расположение
атомов поверхности и отдельных адсорбированных атомов и их перемещение,
определять энергетические свойства поверхности этим методом не представляется
возможным. В этом отношении автоионная микроскопия уступает автоэлектронной. Основное
уравнение автоэлектронной эмиссии, выведенное Фаулером и Нордхеймом [118],
описывает влияние приложенного поля на скорость эмиссии электронов. На рис. V-23
приведена упрощенная схема эмиссии электронов поверхностью металла. В отсутствие
поля энергетический барьер, соответствующий работе выхода Ф, предотвращает утечку
электронов из зоны Ферми. При наложении поля высота этого барьера уменьшается
пропорционально расстоянию и составляет Ф—V, где V=xF (F — напряженность
поля, В/см). Теперь становится возможным квантсво-механический процесс туннелиро-
вания электронов. Если электрон находится в ящике с конечной высотой
потенциального барьера, вероятность туннельного выхода такого электрона из ящика Р
составляет
/
Р = constехр [—(г^/п1/*/*) Г (Ф - Vf/2dx\, (V-35)
где т — масса электрона и / — ширина барьера, равная Ф/F. После интегрирования в
указанных пределах получаем следующее приближенное уравнение:
Р = const ехр l—WW^/h) Ф3/2/Л, (V-36)
которое можно привести к более удобному для обработки экспериментальных данных
виду:
i/V* = Л ехр (-£Ф3/2/У), (V-37 *
где i — полный ток эмиссии; V — приложенное напряжение; А и В — постоянные,
зависящие от Ф и геометрии системы. Квадратичная зависимость i от V в уравнение
(V-37) вытекает из более детального рассмотрения процесса эмиссии с учетом
скорости, с которой электроны достигают поверхности. Однако важнейшим следствием
уравнения (V-37) является экспоненциальная зависимость эмиссионного тока от 1/V и
Поверхности твердых тел
235
возможность нахождения работы выхода по коэффициенту в показателе экспоненты.
В настоящее время техника эксперимента находится на таком высоком уровне,
что можно наблюдать эмиссию электронов одного-единственного атома (например,
измеряя интенсивность отдельного пятна) в зависимости от V и, таким образом,
находить работу выхода отдельного атома. Можно определять также изменение работы
выхода адсорбции атома на активном центре поверхности. Так, в результате
адсорбции азота на вольфраме работа выхода плоскости («100) уменьшается с 4,71 до 4,21 В
[112]. Фактически при этом почти на атомном уровне определяется изменение
поверхностного потенциала АК [119] (см. разд. Ш-ЗБ). Отсюда можно сделать интересные
выводы относительно величины и направления диполя, создаваемого
адсорбированным атомом. Например, азот, адсорбированный на плоскости (100) вольфрама,
по-видимому, является отрицательным концом образующегося при этом поверхностного
диполя, тогда как при адсорбции на плоскости (111) возникает обратная ситуация, т. е.
он несет положительный заряд. Более подробно этот вопрос обсуждается в
монографии Гомера [120] (см. также [104]). Некоторые сведения о применении
автоэмиссионных методов для исследования хемосорбции даны также в гл. XV.
Наблюдая с помощью ионного микроскопа соотношение между поверхностями
различных граней, можно получить также некоторую информацию об относительных
поверхностных натяжениях различных плоскостей кристалла. В заключение следует
также отметить работу Бреннера [121], в которой показано, что при адсорбции
кислорода на иридии снижается преимущественно поверхностная энергия наиболее
выступающих на поверхности иридия граней (ПО) и (113).
Г. Рассеяние ионов
Если пучок моноэнергетических ионов массой М; упруго
рассеивается на атомах поверхности массой Ма (рис. V-24), то в соответствии с
законом сохранения импульса и энергии
' cos 9 + (г2 — sin2 6)1/а
.-[;
Еи (V-38)
где Es — энергия рассеянных ионов; £* — их первоначальная энергия;
г=Ma/Mi. При 6 = 90° уравнение (V-38) приводится к виду
Es-^TWE- (V"39)
Как следует из уравнений (V-38) и (V-39), энергия рассеянных ионов
в значительной мере определяется массой рассеивающих атомов 5 на
поверхности. Изучая энергию рассеянных ионов, можно провести своего
рода масс-спектрометрический анализ состава поверхности. Пример
полученного таким образом спектра показан на рис. V-25. Для анализа
поверхности можно использовать как ионые, так и молекулярные
пучки, правда, для определения Ei последних необходимо дополнительно
иметь селектор скоростей частиц.
Уравнения (V-38) и (V-39) связывают рассеивающую способность
атомов поверхности с их массой Ма. Интересные данные можно полу-
Анализатор
7>
Пучок
f рассеянных ионов
Пучок первичных
ионов
(масс-селективный) ^^
Кристалл
—Ж..
Рис. V-24. Схема опыта по рассеянию ионов [122].
236
Глава V
{20 160
Ef,9B *~
Рис. V-25. Спектр ионов Ni+, рассеянных под углом 90° на поверхности галогенида
никеля. Энергия падающих ионов равна 300 эВ [123].
чить также, изучая зависимость интенсивности рассеянных ионов от
угла рассеяния. В настоящее время стало еще более ясно, что
поверхностные атомы не могут свободно скользить вдоль поверхности, хотя
и могут двигаться по нормали к ней. Этс означает, что при рассеянии
нормальная составляющая скорости падающего ионного или
молекулярного пучка не меняется. Анализ данных (например, приведенных на
рис. V-26 [104]) показывает, что интенсивность рассеянных частиц
резко возрастает при угле отражения, равном углу падения, т. е.
рассеяние, по существу, является зеркальным. Следует напомнить, что, если
бы кинетическая энергия рассеянных частиц не оставалась неизменной,
т. е. если бы столкновение их с поверхностью было неупругим, угловое
распределение интенсивности рассеянных частиц было бы совсем иным.
В предельном варианте, когда падающая молекула прилипает к
поверхности и испаряется только через некоторое время, «забывая» о
направлении падения, наиболее вероятным становится «рассеяние» по
нормали к поверхности. При этом вероятность рассеяния уменьшается
пропорционально косинусу угла относительно нормали. В промежуточных
случаях между падающей частицей и поверхностью может происходить
некоторый, хотя и неполный обмен вращательной и колебательной
энергией. Экспериментальные данные, приведенные «а рис. V-26,
показывают, что в отличие от Н2 молекулы D2 и HD способы к обмену
вращательной энергией с поверхностью; острый максимум углового
распределения, характерный для Н2, для двух других молекул почти не
наблюдается. Неспособность Н2 эффективно обмениваться
вращательной энергией, по-видимому, обусловлена относительно высокой
энергией разделения возбужденных вращательных состояний в этой молекуле.
Исследование неупругого рассеяния может быть весьма полезным
при исследовании механизма гетерогенного катализа. По степени
зеркальности отражения молекул можно судить об их временах жизни на
поверхности. Нередко траектория частиц, образующихся в ходе
химической реакции, коррелирует с траекторией пучка падающих молекул.
Изучая реакционное рассеяние, можно получить информацию о
механизме поверхностной реакции.
Д. Оже-спектроскопия
Основной принцип метода Оже описан в вводной части разд. V-6.
Энергия оже-электронов определяется энергией связей, в образовании
которых участвуют эти электроны. Предположим, что под действием
Поверхности твердых тел
237
Рис. V-26. Угловое распределение
интенсивности молекулярных пучков Н2, D2 и HD,
рассеянных пленкой ориентированного (111)
серебра [104].
Z0 40 60 80
Угол отражения У>,град.
падающего пучка электронов (или рентгеновских лучей) вылетает
/(-электрон и в образующуюся вакансию падает Li-электрон. В
результате выделяется энергия EK—ELl. Если оже-электрон вначале
находился на уровне Ьпъ его кинетическая энергия определяется как (Ек—
EL1)—ELUi' Наиболее вероятным является переход L\—К, и в общем
случае спектр энергии оже-электронов представляет собой ряд (Ек—
ELl)—Ei, где индексом i обозначен внешний уровень, с которого
выбрасывается электрон. Оже-спектроскопия дает информацию главным
образом аналитического характера, т. е. оже-спектры используются
чаще всего для определения состава поверхности.
Обычно оже-спектроскопию и ДМЭ применяют вместе, поскольку
аппаратурное оформление обоих методов в принципе одинаково.
Чтобы вклад поверхностных атомов в измеряемый спектр был
максимальным, в оже-спектроскопии необходимо использовать электроны,
падающие на поверхность под малым углом скольжения. Модулируя
напряжение на замедляющей сетке (рис. V-15), можно получать на
детекторе сигнал, соответствующий электронам только определенной
энергии. На рис. V-27 показан дифференциальный спектр грани (НО)
вольфрама. Обратите внимание, как очищается поверхность вольфрама
при удалении примесей углерода и кислорода. Более подробные
сведения по оже-спектроскопии можно найти в обзоре Смита [125].
Е. Фотоэлектронная спектроскопия
В фотоэлектронной спектроскопии моноэнергетические
рентгеновские лучи выбивают с исследуемой поверхности электроны
внутренних оболочек (электроны Is, 2s, 2p и т.д.). Кинетическая энергия
вылетающих электронов равна ео—еь гДе ео — энергия рентгеновских
квантов, 8г — энергия электрона на £-м уровне. Энергия испускаемых
поверхностью электронов определяется с помощью электронного
спектрометра, позволяющего получать спектры как первичных
фотоэлектронов, так и оже-электронов. Этот метод более точен, чем оже-спектро-
238
Глава V
Рис. V-27. Оже-спектр
кристалла W до {!)
ионной бомбардировки
при 1300°С [125].
грани (110)
и после (2)
и прогрева
скопил, поскольку энергия электронов определенного типа зависит от
валентного состояния атома. Так, при изменении валентного состояния
атома серы с —2 до +6 энергия ионизации увеличивается; при этом
химический сдвиг 15-электронов превышает 5 В. Аналогичный эффект
наблюдается и на окисленной поверхности алюминия (рис. V-28).
В работе [126а] приведен пример применения фотоэлектронной
спектроскопии для анализа поверхности фторуглеродных полимеров. Этот
хметод чаще всего используют в аналитических целях, и поэтому обычно
его называют электронной спектроскопией для химического анализа
или сокращенно ЭСХА.
1АЦ0)
Рис. V-28. Пики А1(0) и А1(Ш) на спектре ЭСХА поверхности алюминия [126].
а — свсжешлифованный образец; б — тот же образец после пятидневной выдержки на воздухе
при комнатной температуре — видно увеличение отношения А1(Ш)/А1(0) вследствие окисления
поверхности.
Поверхности твердых тел
239
Поскольку исходное рентгеновское излучение должно
характеризоваться высокой проникающей способностью, для усиления вклада в
измеряемый спектр поверхностных атомов разработана специальная
методика. Так, например, исследуемую поверхность бомбардируют
рентгеновскими лучами, направленными к ней под малым углом
скольжения.
7. Реакции на поверхностях твердых тел
Проблема гетерогенных реакций является очень интересной и в то
же время весьма сложной; совершенно ясно, что поверхность раздела
фаз играет важную роль в таких реакциях. В данном разделе мы
обсудим основные особенности химических реакций, протекающих на
поверхностях твердых тел; гетерогенным каталитическим реакциям
посвящена отдельная глава (гл. XV).
Простейшим примером реакций, в которых одним из реагирующих
компО(Нвнто«в является твердое тело, вероятно, служит растворение
твердого тела (см. разд. XIII-3B). Растворение металла в кислоте,
кремнезема в плавиковой кислоте и легкорастворимой соли в воде —
это прежде всего поверхностные процессы, протекающие со скоростью,
прямо пропорциональной удельной поверхности твердого тела. Если
имеет место еще и химическая коррозия, то скорость растворения
зависит также от концентрации реагирующего вещества. Скоростьопре-
деляющей стадией процесса растворения может быть как химическая
реакция на поверхности (например, при растворении кремнезема), так
и диффузия вещества из поверхностного слоя (например, при
растворении хорошо растворимой соли).
Реакции твердого вещества с жидкостью или газом, приводящие к
образованию второго твердого вещества, например
CuS04 • 5Н20 = CuS04 • Н20 + 4Н20, (V-40)
6Fe203=4Fe304 + 02, (V-41)
СаС03 = СаО + С02, (V-42)
считаются более сложными. Поведение таких систем сильно зависит
от взаимной растворимости двух твердых фаз. Если они взаимно
растворимы, как, например, в реакции (V-41), реакция не сопровождается
образованием новой фазы, в противном случае реакция не всегда
может быть самоинициирующейся. Еще Фарадей [127] заметил, что
правильные кристаллы карбоната, сульфата или фосфата натрия могут
храниться годами не выветриваясь, однако стоит только нанести на
поверхность кристалла царапину, как сразу же на линии или в точке
повреждения начнется выветривание, которое постепенно охватит весь
кристалл. Однако на очень сильно прогретых или «спеченных»
образцах извести или штукатурного гипса вода практически не оставляет
следов. Известно множество примеров, когда поверхность раздела двух
твердых фаз движется настолько регулярно и медленно, что развитие
процесса можно контролировать непосредственно. Такие реакции
называются топохимическими. Так, при восстановлении окиси меди
водородом реакция начинается с образования красного пятна, которое
быстро расширяется [128, 129]; при разложении кристаллов селенита
CaS04-2H20 граница реакции проходит равномерным фронтом через
весь кристалл [130]. В самом общем случае события развиваются
следующим образом: сначала появляются пятна или зародыши новой
фазы, которые быстро распространяются по поверхности кристалла, далее
фронт медленно движется в глубь твердого тела со скоростью,
различной для разных граней.
Поучительное объяснение реакций рассматриваемого типа дает
Лэнгмюр [127]. Он указывает, что эти реакции, несомненно, протека-
240
Глава V
ют на поверхности раздела двух твердых фаз. Таким образом, когда
одна из твердых фаз практически отсутствует, скорость реакции очень
мала. Кроме того, скорости прямой и обратной реакции зависят от
общей площади поверхности раздела двух твердых тел, причем в
условиях равновесия они должны быть равны друг Другу. Это
соответствует термодинамическому выводу, что для реакций типа описываемых
уравнениями (V-40) — (V-42) константа равновесия определяется
только давлением газа и не зависит от количества двух твердых фаз.
Далее Лэнгмюр отмечает, что, например, в случае реакции (V-42)
двуокись углерода легче выделяется из области вблизи границы
раздела карбонат кальция — окись кальция, чем из объема карбоната
кальция. В результате поверхность раздела в этой реакции движется
линейно. Совершенно иная ситуация имеет место в реакции (V-41).
Кислород легче выделяется из объема Fe203, чем из смешанного слоя,
образуемого на границе раздела Fe203—Fe304. Поэтому в ходе реакции
кислород постепенно выделяется из различных точек объема Fe203, и
в результате образуется твердый раствор двух окислов.
Реакции, протекающие на поверхности раздела двух твердых фаз,
должны быть явно автокаталитическими по своей природе. Сначала
из-за отсутствия необходимой поверхности раздела скорость реакции
мала, но затем по мере накопления продукта реакции она ускоряется
все больше и больше. Например, термическое разложение азида
свинца имеет явно выраженный автокаталитический характер [131].
В присутствии адсорбированной воды индукционный период этой
реакции увеличивается; покрытие поверхности азида серебром приводит к
обратному эффекту [132]. Разложение окиси серебра протекает тем
быстрее, чем больше образовалось серебра. В то же время серебро,
образующееся при разложении цианамида серебра, собирается в
кристаллиты, отнюдь не катализирующие процесс разложения [133].
Двуокись марганца катализирует разложение хлората кальция
предположительно вследствие образования соответствующей поверхности
раздела. Стабильность взрывчатых веществ обычно рассматривается в
руководствах по топохимии; сильное влияние на стабильность таких
веществ могут оказывать внешние факторы. Примером может служить
разложение азида бария под действием света [134]. К топохимическим
реакциям относится также полимеризация в твердом состоянии [135].
Наконец, определенный интерес представляют так называемые топо-
тактические реакции между твердыми телами, в которых
образующийся продукт (или продукты) принимает кристаллическую форму
исходного реагирующего кристалла [136].
Кинетика реакций, протекающих с образованием новой фазы,
осложняется тем, что эта фаза может затруднять доступ реагирующих
веществ друг к другу. Такая ситуация возникает в случае коррозии и
реакций потускнения. Так, при коррозии металла в кислороде
возрастающая толщина окисного слоя приводит к все большему
сопротивлению протеканию реакции. Обычно скорость окисления описывается
либо логарифмическим
y=ki\g(k2t+k3)i (V-43)
либо параболическим
y*=kit + k2, (V-44)
либо (если реакция не затруднена) -простым линейным
y=kt или y=ki-{-k2t (V-45)
законом. (В этих уравнениях у — толщина пленки, a k, k\, k2 и къ —
постоянные.) Окисление легких металлов, например натрия, кальция или
магния, протекает в соответствии с уравнением (V-45), низкотемпера-
Поверхности твердых тел
241
турное окисление железа подчиняется уравнению (V-43), а
высокотемпературное окисление описывается уравнением (V-44). Скорость
окисления зависит от того, насколько образующееся окисное покрытие
способно защищать металл от дальнейшего окисления i[137]. Если, как,
например, при окислении легких металлов, объем окисного слоя
меньше объема израсходованного на его образование металла, окисное
покрытие, как правило, является пористым и не обладает -защитными
свойствами. В результате скорость окисления остается постоянной. По
мнению Эванса [137], логарифмический закон объясняется
дискретным механическим разрушением пленки образующегося соединения.
При коррозии тяжелых металлов объем образующегося окисла больше
объема израсходованного металла. И хотя при этом наблюдается
тенденция к образованию (плотного покрытия, при слишком большом
различии в объемах в системе возникают сжимающие напряжения,
которые могут приводить к расслаиванию или другим механическим
повреждениям защитного слоя.
Наконец, к параболическому закону приводит предположение об
образовании однородного защитного слоя продукта реакции, в котором
скорость диффузии одного или обоих реагирующих веществ должна
быть ограничена, что в конечном итоге и определяет скорость всего
процесса окисления [138]. Так, в частности, установлено, что при
взаимодействии серебра с жидкой серой серебро диффундирует через
образующийся слой сульфида серебра, и поэтому реакция, вероятней
всего, протекает на границе Ag2S—S, а не Ag—Ag2S ([139]. Обычно
при параболическом законе наблюдается экспоненциальная
зависимость константы скорости k\ от температуры, что связывают с
диффузионным характером процесса. Гомес [140], однако, подчеркивает, что
в подавляющем большинстве случаев величины энергии активации,
рассчитанные из температурной зависимости, лишены смысла.
Исследования скорости роста окисных пленок на разных
плоскостях металлов, например (100), (101), (ПО) и (311) меди [141],
проведенные эллипсометричеокими методами, показали сильную
зависимость скорости окисления от индекса поверхности. Более того, пленка,
образуемая на плоскости (311) меди, оказалась анизотропной, что
проявляется в зависимости ее кажущейся толщины от угла поляризации
относительно нормали к поверхности пленки [141].
Итак, продукты коррозии образуют на поверхности защитное
покрытие, предотвращающее активное участие металла в реакции.
Например, алюминий, который по своей химической природе должен был
бы активно взаимодействовать с водой, можно использовать для
изготовления кухонной посуды. Если, однако, окисное покрытие
алюминия повреждается, то он проявляет ожидаемую реакционную
способность. Так, поверхность амальгамированного алюминия активно
взаимодействует с водой, а плотно свернутая алюминиевая фольга,
предварительно смоченная раствором нитрата или хлорида ртути, может
даже раскаляться добела в ходе реакции окисления.
С практической точки зрения основным в коррозии, возможно,
является то, что коррозионные процессы протекают на поверхностях
раздела типа твердое тело — вода, где важную роль играют различные
электрохимические факторы.
8. Упражнения
1. Предположим, что поверхностное натяжение плоскости (10) двумерного
кристалла, изображенного на рис. V-4, составляет 250 эрг/см. При каких поверхностных
натяжениях плоскости (11) кристалл имеет равновесные формы, приведенные на
рис. V-4, а и б? Подробно мотивируйте ваши выводы.
2. Поверхностное натяжение кристалла некоторого вещества, имеющего
кубическую решетку, составляет уюо=150 эрг/см2, упо=120 эрг/см2 и Y2io=Yi2o =
= 120 эрг/см2. Методом Вульфа определите равновесную форму кристалла на плоско-
16-1421
242
Глава V
сти ху. (Если плоскость листа совпадает с плоскостью ху, то все указанные
плоскости перпендикулярны плоскости листа и построение Вульфа сводится к двумерной
форме. В этом случае Yioo=Yoio и т. д.)
3 Имеется гипотетический двумерный кристалл с простой квадратной решеткой;
Yio=200 и Yn = 100 эрг/см. С помощью метода Вульфа определите, из каких ребер—
(10) или (11)—состоит равновесная форма кристалла. Чтобы проверить вывод,
рассчитайте непосредственно энергию ребер в обоих случаях.
4. По мнению Бикермана [142], уравнение Кельвина неприложимо к кристаллам,
поскольку совершенные кристаллы независимо от их размера ограничиваются
плоскими гранями, радиус кривизны которых бесконечен. На молекулярном уровне это
означает, что, поскольку молекулярные силы являются короткодействующими, локальное
равновесие между конденсацией и испарением на некоторой плоскости кристалла не
должно зависеть от размера этой плоскости, т. е. размера кристалла
Это утверждение противоречит основному выводу разд. V-2B. Обсудите данное
противоречие. Здесь есть над чем серьезно подумать.
5. Равновесное сечение кубического кристалла имеет форму правильного
равностороннего восьмиугольника, образованного чередующимися плоскостями (100) и (111).
Рассчитайте отношение Yioo/Yin-
6. Согласно Бимеру и Максвеллу [143], полоний имеет простую кубическую
решетку с а = 3,34 А. Методом Гаркинса оцените поверхностную энергию плоскостей
(100) и (111). Энергию испарения примите равной 40 ккал/моль.
7. Приблизительно рассчитайте поверхностную энергию на квадратный сантиметр
твердого криптона (расстояние между наиближайшими соседями равно 3,97 А) а) для
плоокостей (100), (ПО) и (111), учитывая взаимодействие только между
наиближайшими соседями, и б) для плоскости (100), учитывая взаимодействие всех
молекул в пределах, когда сумма т\-\-т\-\-т\ равна или меньше 8. Сравните результаты
расчета с величинами, приведенными в табл. V-1.
8. Рассчитайте поверхностную энергию плоскости (100) радона при 0 К,
принимая, что энергия испарения радона равна 35« 10—14 эрг/атом, а кристаллографический
радиус атома составляет 2,5 А. Предположите, что кристаллическая структура
радона такая же, как и других инертных газов. Сопоставьте полученный результат с
результатами аналогичных расчетов для других инертных газов.
9. Учитывая взаимодействие только с наиближайшими соседями и считая, что
рассматриваемый элемент имеет кубическую гранецентрированную решетку, оцените
поверхностную энергию, приходящуюся на один атом, если а) атом находится на
плоскости (111) и б) атом расположен рядом со ступенькой, частично образованной
плоскостью (111) (например, в положении 8 на рис. V-8). Энергию испарения примите
равной 50 ккал/моль.
10 По данным рис. V-12 рассчитайте поверхностное натяжение золота при
1020°С.
11. Избыток тепла, выделяющегося при растворении двух образцов (А и Б) тон-
код'исперсного хлорида натрия, равен 20 и 9 кал/г соответственно. Удельная
поверхность образцов оценивалась путем подсчета под микроскопом числа частиц при
известном весе образца. Оказалось, что число частиц в 1 г образца А в 12 раз больше,
чем в образце Б Одинаковы ли величины удельной поверхностной энергии для обоих
образцов? Если не одинаковы, то рассчитайте их отношение.
12 Методом ДМЭ исследуется плоскость (111) элемента, кристаллизующегося в
плотноупакованную гранецентрированную решетку. Покажите, как должна выглядеть
симметричная дифрактограмма этой плоскости. При рассмотрении можете
ограничиться только дифракцией первого порядка на наиближайших соседях.
13. Выведите уравнения (V-31) и (V-32).
14. Выведите уравнение (V-39).
15 Покажите, что дефекты Френкеля и Шоттки не могут образовать дислокацию.
16. Исследуя автоэлектронную эмиссию поверхности вольфрама, Эрлих и
сотрудники получили линейную зависимость \g(i/V2) от 104/V, соответствующую уравнению
Фаулера — Нордхейма. Для чистой поверхности вольфрама наклон этой зависимости
равен —2,50; следовательно, расчетное значение Ф составляет 4,50 В. Шесть минут
спустя после напуска в систему небольшого количества азота наклон кривой изменился
до —2,35. Рассчитайте Ф для поверхности, частично покрытой азотом.
17. При исследовании потускнения поверхности некоторого металла получена
параболическая зависимость, описываемая уравнением (V-44) с k2=0. Толщина пленки
у измерялась при различных температурах через фиксированные промежутки времени.
Оказалось, что измеряемая таким способом толщина пленки экспоненциально меняется
с температурой и соответствующая d\ny/d(\/T) кажущаяся энергия активации равна
10 ккал/моль. Покажите, что, если k\ пропорциональна коэффициенту диффузии, эта
энергия активации характеризует диффузионный процесс.
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Боуден Ф. П., Тейбор Д., Трение и смазка, М., Машгиз, 1960.
Bradley R. S., «Nucleation in Phase Changes», Quart. Rev. (London), 5, 315 (1951).
Бакли Г., Рост кристаллов, М., ИЛ, 1954.
Поверхности твердых тел
243,
Eley D. D., ed., Adhesion, The Clarendon Press, Oxford, 1961. Passaglia E., Strom-
berg R. R., Kruger /., eds., Ellipsometry in the Measurement of Surfaces and Thin
Films, National Bureau of Standards Miscellaneous Publication 256, Washington, D. C,
1964.
Ewald P. P., Juretschke H., Structure and Properties of Solid Surfaces, University of
Chicago Press, Chicago, 1953.
Френкель #. И., Кинетическая теория жидкостей М. — Л., Изд-во АН СССР, 1945.
Garner W. Е., Chemistry of the Solid State, Academic Press, New York, 1955.
Gomer R., Advan. Catalysis, 7, 93 (1955).
Gomer R., Field Emission and Field Ionization, Harvard University Press, Cambridge,
1961.
Gould R. S., Gregg S. /., The Surface Chemistry of Solids, Reinhold, New York,
1951.
Harklns W. D., The Physical Chemistry of Surface Films, Reinhold, New York, 1952.
Mutter E. W., Tsong Т. Т., Field Ion Microscopy, American Elsevier Publishing Co., Inc.,
New York, 1969.
Properties of Surfaces, ASTM Special Technical Publication No. 340, 1963.
Рид В. Г., Дислокации в кристаллах, М., Металлургиздат, 1957.
Somorjai G. Л., Principles of Surface Chemistry, Prentice-Hall, Inc., Englewood Cliffs,
New Jersey, 1972.
Thornton P. R., Scanning Electron Microscopy, Chapman and Hall Ltd., 1968. См.
Scanning Electron Microscopy: Systems and Applications 1973, The Institute of Physics,
London, 1973.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Udin Н., Skater A. /., Wulff /., J. Metals, 1, No. 2; Trans. AIME, 186 (1949).
2. Chalmers В., King R., Shuttleworth R., Proc. Roy. Soc. (London), A193, 465
(1948).
3. Kuczynski G. C., J. Metals., 1, 96 (1949).
4. Hobbs P. V., Mason B. J., Phil. Mag., 9, 181 (1964).
5. Jellinek H. H. G., Ibrahim S. H., J. Colloid Interface Sci., 25, 245 (1967).
6. Herring C, in Structure and Properties of Solid Surfaces, Gomer R., Smith С S.,
eds., University of Chicago Press., Chicago, 1953, p. 1.
7. Kuczynski G. C., Acta Met, 4, 58 (1956).
8. Hersh H. N., J. Amer. Chem. Soc, 75, 1529 (1953).
9. Cohen G., Kuczynski G. C, J. Appl. Phys., 21, 1339 (1950).
10. MenzelE., Z. Phys., 132, 508 (1952).
11. Fletcher N. H., Phil. Mag., 7, No. 8, 255 (1962).
12. Germer L. H., in Frontiers in Chemistry, Burk R. E., Grummitt O., eds., Vol. IV,
Interscience, New York, 1945.
13. Germer L. H.f MacRae A. V., J. Appl. Phys., 33, 2923 (1962).
14. Beilby G., Aggregation and Flow of Solids, Macmillan, New York, 1921.
15. French R. C, Proc. Roy. Soc. (London), A140, 637 (1933).
16. Raether G., Z. Phys., 124, 286 (1948), and preceding papers.
17. Gregg S. /., The Surface Chemistry of Solids, Reinhold, New York, 1951.
18. Cochrane W., Proc. Roy. Soc. (London), A166, 228 (1928).
19. Bishop F. L., Jr., Phys. Rev., 62, 295 (1942).
20. Боуден Ф. П., Тэйбор Д., Трение и смазка, М., Машгиз, 1960.
21. Trillat J. /., CR, 224, 1102 (1947).
22. Dunning W. J., in Adhesion, Eley D. D., ed., Oxford University Press, 1961.
23. Adamson Л. W., American Society of Testing and Materials, Special Technical
Publication No. 340, 1962, p. 32.
24. Bailey J. E., Hirsch P. В., Phil. Mag., 5, 485 (I960).
25. Gibbs J. W., The Collected Works of Gibbs J. W., Longmans, Green, New York, 1931,
p. 315.
26. Shuttleworth R., Proc. Phys. Soc. (London), 63A, 444 (1950).
27. Nicolson M. M.} Proc. Roy. Soc. (London), A228, 507 (1955).
28. Herring C, J. Appl. Phys., 21, 437 (1951).
29. Burton W. K, Cabrera N., Discuss. Faraday Soc, 5, 33 (1949).
30. Wulff G., Z. Krist, 34, 449 (1901).
31. Herring C, Phys. Rev., 82, 87 (1951).
32. Benson G. C, Patterson D., J. Chem. Phys., 23, 670 (1955).
33. Mutter H. G.t Z. Phys., 96, 307 (1935).
34. Nelson R. S., Marzey D. J., Barnes R. S., Phil. Mag., 11, 91 (1965)
35. Sundquist В. Е., Acta Met., 12, 67, 585 (1964).
36. Mullins W. M., Phil. Mag., 6, 1313 (1961).
37. Dunning W. J., in Structure of Surfaces, Fox D., Labes M. M., Weissberger A eds
Wiley-Interscience, New York, 1963.
38. Harkins W. D.t J. Chem. Phys., 10, 268 (1942).
39. Shuttleworth R., Proc. Phys. Soc. (London), A62, 167 (1949); A63 444 (1950)
40. Benson G. C, Claxton T. A., Phys. Chem. Solids, 25, 367 (1964). '
16*
244
Глава V
41. Born М., Heisenberg W.t Z. Phys., 23, 388 (1924); Born M., Mayer J. E., Z. Phys.,
75, 1 (1932).
42. Lennard-Jones J. E., Taylor P. A., Proc. Roy. Soc. (London), A109, 476 (1925).
43. Lennard-Jones J. E.f Dent B. M., Proc. Roy. Soc. (London), A121, 247 (1928).
44. Dent В. М., Phil. Mag., 8, No. 7, 530 (1929).
45. Huggins M. L., Mayer J. E., J. Chem. Phys., 1, 643 (1933).
46. van Zeggeren F., Benson G. C.t J. Chem. Phys., 26, 1077 (1957).
47. Benson G C, Mcintosh R.t Can. J. Chem. 33, 1677 (1955).
48 Verwey E. /. W., Rec. Trav. Chim., 65, 521 (1946).
49. Benson G. C., Freeman P. I., Dempsey E., Advan. Chem. Ser., No. 33, American
Chemical Society, 1961, p. 26
50 Moliere K.t Rathje W., Stranski I. N.t Discuss. Faraday Soc, 5, 21 (1949); Mo-
Here K.t Stranski I. N., Z. Phys. 124, 429 (1048).
51. Benson G. C, Schreiber H. P., van Zeggeren, Can. J. Chem., 34, 1553 (1956).
52. Reiss H., Mayer S. W., J. Chem. Phys., 34, 2001 (1961).
53 Бенсон Г., Юн К., в кн. «Межфазовая граница газ — твердое тело», под ред.
Э Флада, М, «Мир», 1970. Benson G. С, Claxton Т. A., J. Chem. Phys., 48, 1356
(1968).
54. Benson G. С, J. Chem. Phys., 35, 2113 (1961).
55 Benson G. C., Claxton T. A, Can. J. Phys., 41, 1287 (1963).
56. Schreiber H. P., Benson G. C., Can. J. Phys., 33, 534 (1955).
56a. Fletcher N. #., Rep. Progr. Phys., 34, 913 (1971).
566. de Reuck A. U. S., Nature, 179, 1119 (1957).
56b. Ketcham W. M.} Hobbs P. V., Phil. Mag., 19, No. 162, 1161 (1969).
56r. Jellinek H. H. G., J. Colloid Interface Sci., 25, 192 (1967).
56д. Orem M. W., Adamson A. W., J. Colloid Interface Sci., 31, 278 (1969).
57. MacKenzie J. K., Moore A. J. W.f Nicholas J. F., J. Phys. Chem. Solids, 23, 185
(1962).
58 Reiss Я.. Frisch H. L, Hefland E.} Lebowitz J .L., J. Chem. Phys., 32, 119 (1960).
59. Schonhorn H., J. Phys. Chem, 71, 4878 (1967).
60. Brager A., Schuchowitsky A., Acta Physiochim. (USSR), 21, 13, 1001 (1946).
61. Huang K., Wyllie G„ Proc. Phys. Soc. (London), A62, 180 (1949).
62. Huntington H. В., Phys. Rev., 81, 1035 (1951).
63. Ewald P. P., Juretschke H., in Structure and Properties of Solid Surfaces, Gomer R.,
Smith С S., eds., University of Chicago Press, Chicago, 1952, p. 82.
*B4. Burton J. J., Jura G„ J. Phys. Chem., 71, 1937 (1967).
€5. Temperley H. N. V., Proc. Cambridge Phil. Soc, 48, 683 (1952).
66. Brunauer S., Pure Appl. Chem., 10, 293 (1965).
67. Stranski I. N., Z. Phys. Chem., 136, 259 (1928).
-68. Harkins W. D.} The Physical Chemistry of Surface Films, Reinhold, New York,
1952.
159. Dunning W.J, J. Phys. Chem , 67, 2023 (1963).
70. FrenkelJ., Z Phvs., 35, 652 (1926).
71. Wagner C.} Schottky W., Z Phys. Chem., 1 IB, 163 (1930).
72. Kruger F. A., Wink H. J., Phys. Chem. Solids, 5, 208 (1958).
73 Burgers J. M, Proc Phys Soc (London), 52, 23 (1940).
74. Frank F. C., Discuss Faraday Soc, 5, 48 (1949).
75. Verma A. R} Phil Mag., 42, 1005 (1951).
76. Frank F. C., Acta Cryst., 4, 497 (1951).
77. Alexander B. H., Dawson M. H., Kling H. P., J. Appl. Phys., 22, 439 (1951).
78. Greenhill E. В., McDonald S. R., Nature, 171, 37 (1953).
79. Baileu G. L. J., Watkins H. C., Proc. Phys. Soc. (London), B63, 350 (1950)
80. Orowan £., Z. Phys., 82, 235 (1933); Bailey A. I., Proc. Intern. Congr. Surface
Activity, 2nd, Vol. Ill,"p. 406 (1957).
81. Gilman J. J., J. Appl. Phys, 31, 2208 (1960).
82 Westwood A. R. C, Hitch Т. Т., J. Appl. Phys., 34, 3085 (1963).
83. Lipsett S. G, Johnson F. M. G., Maass O., J. Amer. Chem. Soc, 49, 925, 1940
(1927); 50, 2701 (1928).
84. Benson G. C., Benson G. W., Rev Sci. Instr., 26, 477 (1955).
85. Brunauer 5, Kantro D. L, Weise C. H, Can. J. Chem., 34, 729 (1956).
86. Brunauer S., Kantro D. L., Weise C. H.t Can. J. Chem, 37, 714 (1959).
87. Giauque W. F., Archibald R. C., J. Amer. Chem. Soc, 59, 561 (1937).
88. Jura G., Garland C. W., J. Amer. Chem. Soc, 74, 6033 (1952); 75, 1006 (1953)
89. Bauer S. H, J. Amer. Chem. Soc, 75, 1004 (1953).
90. Patterson D, Morrison J. A., Thompson F. W., Can. J. Chem., 33, 240 (1955)
91. Jura G., Pitzer К S., J. Amer. Chem. Soc, 74, 6030 (1952).
92. Drechsler M, Nicholas J. F„ J. Phys. Chem. Solids, 28, 2609 (1967).
93. Bangham D H., Fakhoury N., J. Chem. Soc, 1931, 1324; Proc. Roy. Soc (London)
A147, 152, 175 (1934). V ''
94. Yates D. J.C, Proc. Roy. Soc (London), A224, 526 (1954).
95. Stranski I N , Ber., 75B, 1667 П942).
96. Polanyi M., Z. Phys., 7, 323 (1921).
Поверхности твердых тел
245
97. Griffith А. Л., Phil. Trans.' Roy. Soc. (London), A221, 163 (1920).
98. Hynd W. C, Sci. J. Roy. Coll. Sci., 17, 80 (1947).
99. Obreimoff J. W., Proc. Roy. Soc. (London), A127, 290 (1930); см. также [90].
100. Baker F. L., Princen L. H., Encyclopedia of Polymer Science and Technology,
Vol. 15, Wiley, New York, 1971, p. 498.
101. Leggett M. R., Armstrong R. A., Surface Sci., 24, 404 (1971).
102. Jurela Z., Atomic Collision Phenomena in Solids, Palmer D. W, Thompson M. W.,
Townsend P. D., eds., American Elsevier Publishing Co., New York, 1970.
103. Sparnaay M. J., J. Radioanal. Chem., 12, 101 (1972).
104. Somerjai G. A., Principles of Surface Chemistry, Prentice-Hall, Inc., Englewood
Cliffs, N. J., 1972.
105. Davisson C. L, Germer L. #., Phys. Rev., 30, 705 (1927).
106. MacRae A. U., Science, 139, 379 (1963); Germer L. H., MacRae A. U.f J. Appl. Phys.,
33, 2923 (1962).
107. Burton J. J., Jura G., Structure and Chemistry of Solid Surfaces, Somorjai G., ed.,
Wiley, New York, 1969.
108. Somorjai G. A., Szalkowski F. J., J. Chem. Phys., 54, 389 (1971).
109. Farnsworth H. E„ Advan. Catalysis, 15, 31 (1964).
110. Muller E. W., Z. Phys., 37, 838 (1936).
111. Gomer R., Advan. Catalysis, 7, 93 (1955).
112. Ehrlich G., Advan. Catalysis, 14, 255 (1963).
113. Ehrlich G., Hudda F. G., J. Chem. Phys., 35, 1421 (1961).
114. Muller E. W., Z. Phys., 120, 261 (1942).
115. Ehrlich G., J. Appl. Phys., 15, 349 (1964); Ehrlich G., Hudda F. G., J. Chem. Phys.,
36, 3233 (1962).
116. Muller E. W., Tsong Т. Т., Field Ion Microscopy, American Elsevier Publishing Co.,
Inc., 1969.
117. Ehrlich G., Advan. Catalysis, 14, 255 (1963).
118. Fowler R. H., Nordheim L. W., Proc. Roy. Soc. (London), A112, 173 (1928).
119. Delchar T. A., Ehrlich G.f J. Chem. Phys., 42, 2686 (1965).
120 Gomer R., Field Emission and Field Ionization, Harvard University Press,
Cambridge, Mass., 1961.
121. Brenner S. S., Surface Sci., 2, 496 (1964).
122. Brongersma H. H., Mul P. Af., Chem. Phys. Lett., 14, 380 (1972).
123. Brongersma H. H., Mul P. M., Surface Sci., 35, 393 (1973).
124. Somorjai G. A., Szalkowski F. J., Advan. High Temp. Chem., 4, 137 (1971).
125. Smith Т., J. Appl. Phys., 43, 2964 (1972).
126. Instrument Products Division, E. I. du Pont de Nemours Co., Inc.
126a. Dwight D. W., Riggs W. M., J. Colloid Interface Sci., 47, 650 (1974).
127. Langmuir L, J. Amer. Chem. Soc, 38, 2221 (1916).
128. Wright C. R. A., Luff A. P., Rennie E. #., J. Chem. Soc, 1879, 475.
129. Harkins W. D., The Physical Chemistry of Surface Films, Reinhold, New York,
1952.
130. Renzema T. S., J. Appl. Phys., 23, 1412 (1952).
131. Reitzner B.t J. Phys. Chem., 65, 948 (1961).
132. Reitzner В., Kaufman J. V. R., Bartell F. E., J. Phys. Chem., 66, 421 (1962).
133. Powden F. P., Montague-Pollock H. Af., Nature, 191, 556 (1961).
134. Jacobs P. W. M.} Tompkins F. C, Verneker V. R. P., J. Phys. Chem., 66, 1113
(1962).
135. Hirshfield F. L., Schmidt G. M. J., J. Polymer Sci., 2(A), 2181 (1964).
136. Glasser L. S. D., Glasser F. P., Taylor H. F. W., Quart. Rev., 16, 343 (1962).
137. Evans U. R.t J. Chem. Soc, 1946, 207.
138. Cohn G., Chem. Rev., 42, 527 (1948).
139. Мотт Н. Ф., Генри Р. В., Электронные процессы в ионных кристаллах, М., ИЛ,
140. Gomes W., Nature, 192, 865 (1961).
141. Cathcart /. V., Epperson J. E, Peterson G. F., Acta Met, 10, 699 (1962); Ellipso-
metry in the Measurement of Surfaces and Thin Films, Passaglia E., Stromberg R. R.,
Kruger J., eds., Natl. Bur. Std. (U. S.), Misc. Publ., 256 (1964).
142. Bikerman J. J., Phys. Stat. Sol., 10, 3 (1965).
143. Beamer W. H., Maxwell C. R, J. Chem. Phys., 17, 1293 (1949).
144. Рид В. Г., Дислокации в кристаллах, М., Металлургиздат, 1957.
ГЛАВА VI
Дальнодействующие силы
1. Силы, действующие между атомами и молекулами
Имеется множество доказательств того, что поверхностные явления
связаны с силами, действующими между атомами и молекулами, и в
частности с асимметрией, или разбалансом, этих сил на поверхности
раздела. Поэтому расчеты поверхностной энергии твердых тел
основываются на функции потенциальной энергии взаимодействия между
атомами, равной интегралу силы взаимодействия по расстоянию.
Аналогичным образом рассчитывается поверхностная энергия жидкостей,
только теперь вместо модельной кристаллической решетки
используется радиальная функция распределения (разд. П-2Б). Качественно
ориентация частиц на поверхностях жидкостей ('разд. II-3) также
определяется межмолекулярными силами. Большая часть данной главы
посвящена преимущественно электростатическим силам, возникающим
при взаимодействии ионов.
В этой главе кратко рассматриваются оановные типы сил,
проявляющиеся в самых разнообразных системах. Вообще говоря, межатомные
силы имеют малый радиус действия, не будь этого, энергия части
вещества зависела бы от ее макроскопического размера и было бы
невозможно, например, протабулировать молярную энтропию
образования вещества, не указывая масштаб эксперимента. С другой стороны,
по ряду причин силы взаимодействия через различные поверхности
раздела или между ними могут иметь довольно большой радиус действия.
Настоящая глава, собственно, и посвящена обсуждению этой
противоречивой ситуации.
Как известно, в химических взаимодействиях основную роль игра-
югг электрические силы, которые в первом приближении можно
разделить на силы отталкивания и силы притяжения. В этой главе
рассматриваются два типа сил отталкивания: силы кулоновского
отталкивания между одноименно заряженными ионами и универсальные силы,
которые возникают при тесном сближении любых двух атомов. О силах
последнего типа уже упоминалось в разд. V-3. При этом для их
описания использовались два различных выражения: экспоненциальное и
степенное (в разд. V-3 принималось, например, что сила отталкивания
обратно пропорциональна межатомному расстоянию в двенадцатой
степени). Вообще говоря, эффект отталкивания обусловлен несклонностью
электронных облаков двух атомов к взаимному перекрыванию.
Поскольку волновые функции включают экспоненциальный радиальный член,
выражение, описывающее влияние отталкивания, должно быть скорее
экспоненциальным, чем степенным. В любом случае этот эффект
играет важную роль только на расстояниях порядка атомных диаметров и
очень сильно убывает с увеличением расстояния.
Рассмотрение межатомных и межмолекулярных сил проще всего
начать с закона Кулона, согласно которому сила, возникающая при
Дальнодействующие силы
247
взаимодействии двух точечных зарядов q\ и q2, в вакууме
определяется выражением
f=Mz/*?> (VI-1)
где х — расстояние между зарядами (в системе СГС диэлектрическая
проницаемость вакуума равна единице). Потенциальная энергия
взаимодействия е= / fdx в этом случае составляет
z=qi4z/x- (VI-2)
Потенциал V заряда q определяется как
V=q/x. (VI-3)
При этом подразумевается, что пробный заряд противоположного
знака q0 на расстоянии х от заряда q имеет потенциальную энергию
—qq0/x. Если q — величина отрицательная, то и V также имеет
отрицательное значение.
Теперь рассмотрим молекулу с дипольным моментом \х. В такой
молекуле заряды q+ и q~ находятся на расстоянии d, что и дает диполь-
ный момент \i=qd. При постоянном потенциале диполь не проявляет
себя каким-либо образом, поскольку поле действует на оба заряда
одинаково, но в противоположных направлениях. Если же имеется
градиент потенциала или поля, напряженность которого определяется
выражением F=dV/dx, то влияние поля (на диполь проявляется в чистом
виде. Потенциальная энергия диполя в поле равна
z(ii,F)=-Vq + {V—§- *) q=-liF. (VI-4)
И наоборот, наличие диполя приводит к появлению потенциала. На
расстояниях, больших по сравнению с d, потенциальная энергия точечного
заряда в поле диполя составляет
е(<70, ц)=0*/*2)<7о (VI-5)
и, таким образом, потенциал диполя равен
V(li)=li/x2. (VI-5a)
Напряженность поля диполя соответственно определяется выражением
F(fx)=2jx/jc3. (VI-6)
(Потенциалы и напряженности поля обычно приводят с
положительным знаком; энергия взаимодействия заряда или диполя имеет знак
минус, если частицы притягиваются, и знак плюс, если они
отталкиваются.)
Два диполя взаимодействуют друг с другом через их поля; энергия
этого взаимодействия составляет
s(pi, ix) =-jx-^- =-2,ДО. (VI-7)
Уравнение (VI-7) записано для диполей, расположенных на одной
прямой, так сказать, «конец к концу». В жидкостях тепловое движение
стремится привести диполи в относительно неупорядоченное состояние,
тогда -как взаимодействие диполей способствует их выстраиванию в
ряды. Кеезом в 1912 г. разработал статистическую теорию диполыных
систем, во многом сходную с теорией молекулярной поляризации.
Согласно теории Кеезома,
* (V, v)cv=-2vMZkTx\ (VI-8)
Таким образом, энергия ориентационного притяжения системы диполь-
ных частиц убывает обратно пропорционально шестой степени расслоя-
248
Глава VI
ния между диполями. Напомним, однако, что при выводе уравнения
(VI-8) расстояние между диполями предполагалось значительно
больше d.
Если вещество, состоящее из неполярных атомов или молекул,
поместить в поле, то в результате поляризующего действия поля частицы
временно приобретают некоторый дипольный момент и начинают
взаимодействовать друг с другом. Величина индуцированного дипольного
момента |иИНд составляет
Иинд=^, (VI-9)
где а — поляризуемость (в системе СГС эта поляризуемость имеет
размерность объема). Как следует из уравнения (VI-4),
e(a,F}=-(iimA)(F) = -^-aF\ (VI-10)
(Коэффициент 1/2 вводится потому, что, строго говоря, энергия
взаимодействия определяется интегралом J£ iLmadF.) Индуцированный
диполь образуется практически мгновенно (по сравнению с характерными
временами движения молекул), поэтому потенциальная энергия
взаимодействия диполя и поляризующегося вещества не зависит от
температуры:
е(щсс) = lTa^J = -2a^/x\ (VI-11)
Усредняя взаимодействие по всем возможным ориентациям диполя, Де-
бай (1920 г.) получил следующее конечное выражение:
8(fi,a) = -ajii2/x6. (VM2)
В качестве упражнения не трудно показать, что энергия
взаимодействия поляризуемой молекулы с зарядом ze равна
8 (a, ze) = — (ze)2a/2x\ (VI-13)
Нигде выше в расчет не принимались так называемые силы Ван-дер-
Ваальса, которые считаются основными силами притяжения при
взаимодействии незаряженных и не обладающих дилолшым моментом
атомов и молекул. А ведь Аг, СО и N2, молекулы которых близки по
размеру, характеризуются довольно близкими теплотами испарения и,
следовательно, почти одинаковой энергией межмолекулярного притяжения.
В 1930 г. Лондон [1, 2] показал, что существует еще один тип
электрических сил межатомного взаимодействия, которые следует
охарактеризовать более подробно. Эти силы стали известны как
дисперсионные силы или силы Лондона—Ван-дер-Ваальса. Дисперсионные силы
являются силами притяжения. Они возникают вследствие того, что
даже нейтральные атомы представляют собой системы колеблющихся
зарядов вследствие наличия положительного ядра и отрицательно
заряженных электронов. Теорию Лондона вкратце можно изложить
следующим образом. Энергия атома 1 в поле F равна
e(x)= --g-o^F2,
следовательно,
F = 2^Jx\ (VI-14)
где \х,2 — средний дипольный момент (или, точнее, его
среднеквадратичное значение) осциллятора, образованного системой электронов и ядра
второго атома. Теперь поляризуемость атома выразим как сумму
квадратов промежуточных дипольных моментов всех возбужденных состоя-
Дальнодействующие силы
249
ний, деленных на энергию этих состояний. Ограничиваясь наибольшим
членом для атома 2 можно записать
а2 ^ (ed)Vhv0J (VI-15)
где (ей)2 — заряд электрона, умноженный на смещение (эта величина
в точности раета \л\; hvo — приблизительно равно энергии ионизации.
Таким образом, энергия ато>ма 1 в усредненном поле диполя атома 2
составляет
e(x) = —l-hv0aia2/x* (VI-16)
(коэффициент 3Д получен при более строгом выводе).
При тех же допущениях энергия взаимодействия двух различных
атомов описывается выражением [3]
8(*)=—I- . ^ , . , (VI-17)
— + — ) '
где hv\ и hv2— характеристическая энергия (в первом приближении
энергия ионизации) атомов 1 и 2. В работе [4] дано более удобное
соотношение:
е(*) = ^^2 ТГГ9 (V-18)
где п\ и п2— числа электронов на внешних оболочках атомов; х —
расстояние между атомами, А; е(х)—энергия взаимодействия, ккал/моль;
а — поляризуемость, А3. Широко используется также другое
выражение, полученное Кирквудо-м и Мюллером:
е(х) =—бтс2 , а^2 . , (VI-19)
v ; ai/Xi+a2/x2 * v
где m —масса электрона, с — скорость света, xi и %2 — диамагнитные
восприимчивости [5,6].
При небольших расстояниях или -в случае молекул с более
сложным распределением зарядов справедливо общее выражение
г(х)=— CiX-6—C2x~s — C3x~10—.... (VI-20)
Уравнения (VI-17) — (VI-19) дают только С\, т. е. ограничиваются лишь
диполь-дипольным взаимодействием. Второй член уравнения (VI-20) с
постоянной С2 определяется диполь-квадрупольным взаимодействием
(квадруполь можно представить в виде (—q\) — (q2) •— (—qi), где
заряд q2 вдвое больше заряда qu а член, включающий С3, обусловлен
диполь-октупольным и квадруполь-квадрупольным взаимодействием.
По оценке Фонтана [7], Сь С2 и С3 составляют соответственно 1400, 3000 и
7900 для Аг и 1750, 5800 и 24 000 для Na; при использовании этих значений в
уравнении (VI-20) х должно выражаться в ангстремах, а г(х) получается в единицах kT
при 25 °С.
Обсуждавшееся в предыдущей главе уравнение (V-19) состоит из
нескольких не зависящих от температуры потенциалов. Первый член,
стоящий справа, характеризует кулоновское взаимодействие, второй—
диполь-дипольное и дисперсионное взаимодействие, третий — диполь-
квадрупольное взаимодействие, и, наконец, последний —
экспоненциальное отталкивание. В табл. VI-1, взятой из работы [8], приведены
приблизительные оценки взаимодействий типа диполь—диполь (\i—|х),
диполь— индуцированный диполь (\х—а) и индуцированный диполь —
индуцированный диполь (а—а) для некоторых молекул. Последнее, чи-
250
Глава VI
Таблица VI-1
Вклад различных типов взаимодействия в общую энергию
взаимодействия нейтральных молекул [56]а
Молекула
Не
Аг
СО
НС1
NH3
Н20
1018 [х, заряд
(ед. СГСЭ)-см
0
0
0,12
1,03
1,5
1,84
1024 а, СМЗ
0,2
1,6
1,99
2,63
2,21
1,48
/iv0, эВб
24,7
15,8
14,3
13,7
16
18
\l-\X.
0
0
0,0034
18,6
84
190
1060 фГб, эрг-смб
jlx—а
0
0
0,057
5,4
10
10
а—а
1,2
48
67,5
105
93
47
аСм. также работу [8].
б Один электронвольт (эВ) соответствует 1,602* 10—12 эрг (или 23 ккал/моль).
Рассчитано для 20 °С.
сто дисперсионное, взаимодействие играет очень важную роль даже
для высокополярных молекул.
Значительный вклад в исследования дисперсионных сил вносит
спектроскопия молекул, связанных силами Ван-дер-Ваальса, т. е. молекул
типа Аг2, 02—02, Аг—N2 и т. п. Энергия связи в таких молекулах,
конечно, очень мала: составляет всего несколько калорий на моль [9].
Рассмотренные межмолекулярные силы (за исключением кулонов-
ских сил, действующих между изолированными зарядами),
по-видимому, не играют важной роли «а расстояниях, больших нескольких
диаметров молекул. И тем не менее, как показано в следующем разделе,
имеется много данных, подтверждающих возможность дальнего
взаимодействия на поверхностях и в коллоидных системах. Факт
существования дальнодействия объясняется одной важной особенностью
дисперсионных сил, а именно их приблизительной аддитивностью.
Качественно аддитивность объясняется тем, что дисперсионное взаимодействие
связано со сравнительно небольшими возмущениями движения
электронов и поэтому многие такие возмущения могут «складываться без
серьезного взаимного влияния. Некоторые вытекающие из этого следствия,
а также более подробное рассмотрение теории диспер'сионного
взаимодействия даны в разд. VI-3.
2. Качественные данные, указывающие на существование
дальнодействующих сил
Хенникер [10], Китченер [11], Дерягин [12] и позднее Дрост-Хан-
сен [13] (здесь можно назвать совсем немного имен) по крупицам
собирали данные, свидетельствующие о существовании
дальнодействующих сил или, другими слонами, об образовании толстых поверхностных
слоев, структура которых отличается от структуры объемной фазы.
Многие так называемые доказательства являются косвенными и
умозрительными и, следовательно, слабыми. Нельзя, конечно, надеяться,
что такие данные, будучи собранными все вместе, могут служить
достоверными аргументами. Тем не менее существование многих
своеобразных явлений вызывает определенный интерес. К тому же некоторые
эффекты, связываемые с проявлением дальнодействующих сил, как
будто не вызывают сомнений. Некоторые из подобных эффектов
исследовались количественно; этим работам и посвящен следующий раздел.
С проблемой дальнодействующих сил до некоторой степени связан
вопрос об «аномальной» воде (или поливоде), вкратце рассмотренный
Дальнодействующие силы
251
в разд. VI-4B. История «аномальной» воды — наглядный пример того,
что в контакте с большой поверхностью малые количества вещества
могут проявлять необычные свойства вследствие загрязнения.
А. Данные, указывающие на существование глубокой
поверхностной ориентации
Изучение адсорбции ясно показало (гл. XIV), что, прежде чем
адсорбированная пленка приблизится по своим свойствам к объемной
фазе, она должна стать полимолекулярной (см. гл. XIV). Большое
впечатление производят данные по пленкам, адсорбированным из паровой
фазы при давлениях, приближающихся к упругости насыщенного пара
Р°. В ставшей теперь уже классической статье Дерягина и Зорина [14]
показано, что пленки определенных полярных жидкостей,
адсорбированных на стекле, при Р° достигают предельной толщины около 100 А.
Таким образом, на стеклянной подложке толстая пленка приобретает
способность сосуществовать в равновесии с объемной жидкостью.
Позднее была измерена толщина подобных толстых пленок и определены
краевые углы в различных системах типа пленка — жидкая фаза —
твердая подложка [15]. Как отмечается далее в разд. VII-5, такие
пленки должны иметь структуру, отличную от структуры объемной фазы.
Известно, что некоторые жидкости обладают способностью к
образованию ориентированных структур типа «жидких кристаллов». В этом
отношении особенно примечательно такое соединение, как я-азоанизол.
Жидкий я-азоанизол характеризуется двойным лучепреломлением или,
другими словами, определенно является анизотропным. Интересно, что
направление анизотропии жидкости в очень большой степени зависит
от природы стенок содержащего ее сосуда. Пленка жидкости я-азоани-
зола, размазанная по стеклянной пластинке и затем прогретая выше
температуры перехода изотропной жидкости в анизотропную, при
охлаждении приобретает некоторую преимущественную ориентацию. При
температуре, превышающей на несколько градусов точку плавления,
толстые пленки длинноцепочечных жирных кислот глубиной в
несколько сотен молекул также проявляют свойства анизотропной жидкости.
Большой интерес представляют данные Шерешевского и соавторов
(см. разд. П-1В) по упругости паров жидкостей в капиллярах. Судя по
этим данным, можно предполагать, что на расстояниях порядка
микрона стенки капилляра способны индуцировать в структуре жидкости
какие-то изменения. К сожалению, история аномальной воды (разд.
VI-4B) показывает, что необычно низкая упругость паров в капиллярах
может быть обусловлена и загрязнениями.
Исследования пленок длинноцепочечных соединений на поверхностях
металлов методом дифракции электронов и рентгеновских лучей
показывают, что при температуре выше точки плавления объемной
жидкости слои толщиной в 100 молекул являются структурированными.
Вообще говоря, температура плавления и другие физические свойства
относительно толстых пленок могут значительно отличаться от
характеристик соответствующих объемных жидкостей [16] (см. разд. Ш-16).
По имеющимся данным, тонкие пленки жидкостей обладают
аномальной вязкостью. Опыты по сдуванию плевки струей воздуха
показывают, что вязкость пленок смазочных масел толщиной несколько тысяч
ангстрем в 10 раз выше объемной вязкости [17]. Найдено [18], что
вязкость воды в очень тонких капиллярах на 40% больше объемной
вязкости воды. В то же время исследованные методом сдувания тонкие
пленки полидиметилсилоксана характеризуются пониженными
значениями вязкости [18а]. Следует, однако, отметить, что к данным,
полученным методом сдувания, необходимо относиться осторожно. (См.
работу [19] и обсуждение, приведенное в работе [13].)
252
Глава VI
Судя по диэлектрическим свойствам и спектрам ЯМР, структура
толстых пленок воды, адсорбированной на окиси алюминия и других
твердых телах, нарушена на значительную глубину (см. [13]).
Эти и многие другие более или менее косвенные проявления
эффектов специфического дальнодействия поверхностей ставят вопрос о
существовании каких-то сил или возбужденных состояний нового типа,
способных к специфическому взаимодействию на доаольно больших
расстояниях. По мнению автора, хотя многие из этих эффектов
дальнодействия являются физически реальными, они, вероятнее всего,
обусловлены возмущениями, передаваемыми от молекулы к молекуле. В
некоторых случаях, когда мы имеем дело с очень небольшими объемами
жидкости, к аномальным результатам могут приводить и растворенные
в жидкости загрязнения. Однако, как будет видно из дальнейшего
обсуждения, дальнодействующие силы все же вполне реальны.
Б. Кажущееся дальнее взаимодействие между макромолекулами
Прежде чем приступить к количественному анализу дальнодействия
(разд. VI-3), имеет смысл рассмотреть некоторые данные,
позволяющие предположить наличие такого взаимодействия между коллоидными
частицами и макромолекулами. Попутно мы хотели бы показать также,
как осторожно необходимо интерпретировать поведение таких систем.
Имеются веские доводы в пользу того, что коллоидные частицы, по-
видимому, каким-то образом «чувствуют» друг друга на больших
расстояниях. Так, пластинчатые частицы окиси железа (РегОз) и окиси
вольфрама (золи гидратированной W03) располагаются в
определенном порядке в горизонтальных слоях, разделенных слоями воды
толщиной не менее 8000 А [20, 21]. Образование этих «шиллеровских»
радужных слоев предполагает наличие какого-то дальнего
взаимодействия между коллоидными пластинкам.и. Характер броуновского
движения указывает на существование сил притяжения дальнего радиуса
действия [22].
Аналогичные явления часто наблюдаются в растворах, содержащих
крупные и сильно асимметричные частицы. Чрезвычайно интересно
ведут себя растворы вируса табачной мозаики. Сам вирус является
белковой частицей приблизительно цилиндрической формы длиной около
3420 А и диаметром 150 А [23]. Растворы, содержащие 1 или 2% этого
вируса, разделяются на две жидкие фазы, и более концентрированный
из этих двух слоев обладает кристаллической упорядоченностью [24].
Вирусные частицы выстраиваются в линии, параллельные друг другу
(с отклонением всего в несколько минут), хотя между ними
находится слой растворителя толщиной не менее 500 А. В то же время данные
рентгеноструктуриого и других методов анализа показывают отсутст-
Рис. VI-1. Положительные (а) и отрицательные (б) тактоиды вируса табачной
мозаики [24].
Дальнодействующие силы
253
вие какого-либо упорядочения вирусных частиц в верхнем, более
разбавленном слое, в котором среднее расстояние между частицами
превышает 1500 А.
Интересно также то, что в верхнем растворе могут находиться
отдельные тактоиды (периодические структуры) нижнего раствора,
имеющие форму мяча для игры в регби. В рассматриваемой системе
наблюдаются также отрицательные тактоиды, т. е. пятна верхнего
раствора в нижнем растворе. Оба типа тактоидов показаны на рис. VI-1.
Как видно из этого рисунка, в положительном тактоиде и растворе,
окружающем отрицательный тактоид, вирусные частицы выстраиваются
параллельно друг другу. Равновесная форма тактоидов является
асимметричной, что явно связано с анизотропией поверхностного натяжения
и других их свойств.
Хотя к растворам вируса табачной мозаики применимы некоторые
современные представления о дальнодействующих силах (см. разд.
VI-3), при интерпретации свойств этих растворов необходимо
учитывать также энтропийные факторы, рассматриваемые ниже. Кроме
того, имеются данные, указывающие на образование линейных димеров
даже в очень разбавленных растворах [25]. Если окажется, что в
более концентрированных растворах увеличивается степень ассоциации
вирусных частиц, то схему, представленную на рис. VI-1, придется
модифицировать.
Тактоиды наблюдаются и в растворах некоторых минералов,
образующих глины, например в растворах монтмориллонитов. При этом
пластинчатые кристаллы минерала образуют слои, в равновесных
условиях разделенные промежутками до 100 А в зависимости от
концентрации электролита в водной фазе между слоями минерала [26].
Сложная ситуация имеет место и при образовании гелей. В
предельных случаях гель может содержать до 90% растворителя и все же
оставаться твердым или по крайней мере сохранять исключительно
высокую вязкость. На первый взгляд образование таких гелей доказывает
существование взаимодействия на больших расстояниях между гельоб-
разующими молекулами. Но здесь опять встает вопрос, не образуется
ли в данном случае волокнистая или ячеистая сеть, построенная из
элементов, скрепленных короткодействующими силами, или же мы имеем
дело также с прямым проявлением каких-то сил, обладающих
большим радиусом действия.
В. Энтропийные факторы в случае сильно асимметричных молекул
Результаты изучения свойств систем, подобных растворам вируса табачной
мозаики, стимулировали проведение теоретического исследования статистического поведения
сильно асимметричных частиц. Обычно при фазовом переходе первого рода
(например, переходе жидкость — пар) основную роль играют силы притяжения между
молекулами В уравнении Ван-дер-Ваальса это отражается членом a/V2:
(Р +a/V2) (V—b)=RT. (VI-21)
В действительности этот член представляет силы, объединяемые под общим
названием вандсрваальсовы (разд. VI-1).
Напомним, что решение уравнения Ван-дер-Ваальса приводит к выводу о
существовании максимума и минимума давления на определенных изотермах, например
приведенной на рис. VI-2. Штриховая линия на этом рисунке соответствует переходу
жидкость— пар (и обратно). Отметим попутно, что упругость паров жидкости при
данной температуре можно найти, проведя штриховую линию таким образом, чтобы
заштрихованные площади были равны.
Онзагер [27] показал, что, если частицы очень асимметричны, равновесие между
разбавленной и более концентрированной фазами может установиться и в отсутствие
сил притяжения между частицами. Математически теория Онзагера сложна, но
простое качественное объяснение может быть полезным. Сложнее всего при этом решить
вопрос о связанном объеме частиц, т. е. об объеме вокруг данной частицы, который не
может быть занят другими частицами. Точнее связанный объем определяется как
объем вокруг данной частицы или молекулы, в котором не может находиться центр дру-
254
Глава VI
Рис. VI-2 Изотерма Р—V, соответствующая
уравнению Ван-дер-Ваальса.
гой такой же частицы. У сферических частиц связанный объем вчетверо больше
объема самих частиц, т. е. связанный объем соответствует объему сферы, радиус которой
равен диаметру сферической частицы. Аналогично связанный объем свободно
вращающихся цилиндрических частиц вчетверо больше объема, внутри которого
вращается цилиндрическая частица. Таким образом, для цилиндра длиной / и радиусом г
связанный объем Vs приблизительно составляет -у/3.
Рассмотрим теперь состоящий из таких продолговатых цилиндрических частиц
газ, первоначально разреженный настолько, что в нем возможно свободное вращение
частиц. В этом случае в уравнении Ван-дер-Ваальса Ь следует заменить на VSy и в
отсутствие сил притяжения между частицами это уравнение переходит в
P(V — Va) = RT.
(VI-22)
При сжатии газа свободное вращение затрудняется. При достаточно сильном сжатии
частицы стремятся упаковаться таким образом, чтобы было возможным только
вращение вокруг продольной оси. Изменение состояния газа, состоящего из
цилиндрических частиц, в процессе сжатия схематически показано на рис. VI-4. Очевидно, что как
только свободное вращение станет затрудненным, связанный объем цилиндрических
частиц начнет постепенно падать вплоть до величины, приблизительно равной объему
самой цилиндрической частицы, т. е. до Va. Для таких асимметричных частиц, как
вирус табачной мозаики, Va составляет лишь около 10~4 Vs. Можно ожидать, что,
как только средний объем, приходящийся на частицу V, станет меньше Vs, параметр
Ъ в уравнении Ван-дер-Ваальса изменится с Vs на Va (рис. VI-5, а). Если Ь
уменьшается быстрее, чем V, то может оказаться, что при уменьшении V величина (V—Ь)
растет. В этом случае зависимость Р—V выглядит, как показало на рис. VI-5, б.
По причинам, аналогичным упомянутым в связи с рис. VI-2, трудно ожидать,
чтобы при сжатии система проходила через максимум и минимум давления. Скорее всего
при некотором давлении Р', показанном на рис. VI-5, б штриховой линией, произойдет
фазовый переход первого рода. Скрытая теплота этого фазового перехода связана с
изменением энтропии, а не с изменением потенциальной энергии системы. Таким
образом, в случае сильно асимметричных частиц действительно можно предсказать
расслоение равновесной системы на разбавленную и более концентрированную фазы, не
привлекая к рассмотрению силы, действующие между частицами и тем более какие-
либо силы дальнего радиуса действия.
В приведенном выше объяснении используется представление о связанном объеме
как об одном из основных параметров уравнения Ван-дер-Ваальса и других
уравнений этого типа. К подобным выводам приводит и формальный статистико-механиче-
ский анализ систем сильно асимметричных частиц [28]; правда, в таком анализе
теоретические выкладки являются чрезвычайно сложными.
Рис. VI-3. Связанные
объемы сферической (а) и
цилиндрической (б)
молекулы.
/
Л'
\
\
7\
у-
v:_>
Дальнодействующие силы
255
Рис. VI-4. Ориентация цилиндрических
молекул при сжатии газа.
/ -
Я 1
Рис. VI-5. Зависимость b от V для газа сильно асимметричных молекул и
соответствующая изотерма Р—V.
Таким образом, тенденция растворов сильно асимметричных частиц к расслоению
на две довольно разбавленные фазы сама по себе не указывает на существование
каких-то сил нового типа. Тем не менее имеются данные, свидетельствующие о том,
что в этих системах дальнодействующие силы играют активную роль (см. разд. VI-4).
3. Дальнодействующие силы
Суммирование элементарных взаимодействий частицы вещества,
например коллоидной частицы, с молекулой или другой частицей
приводит к силам, в значительной мере определяющим поверхностные и
коллоидные свойства различных систем. Какие-либо иные
принципиально новые силы в этом разделе не рассматриваются. В настоящее
время считают, что эффекты дальнодействия обусловливаются либо
взаимодействием двойных электрических слоев, либо дисперсионным
взаимодействием. Оба типа взаимодействия связаны с
распространяющимися между частицами полями, стационарными или осциллирующими.
В этом разделе вкратце рассматривается также распространение
короткодействующего взаимодействия (типа взаимодействия диполь —
индуцированный диполь) от атома к атому. По своему конечному
результату этот эффект можно отнести к эффектам дальнего взаимодействия.
А. Дисперсионные, или вандерваальсовы, силы
Полную энергию взаимодействия атома с полубескомечной
пластиной (рис. VI-6) можно найти, суммируя взаимодействие этого атома
со вюеми атомами пластины. При этом считают, что все силы
аддитивны. Строго говоря, это предположение не является абсолютно
правильным, однако обычно в расчетах такого рода оно вполне приемлемо.
Более того, если расстояния между рассматриваемым атомом и
атомом на поверхности значительно больше диаметра атома,
суммирование заменяют тройным интегрированием. (Примером может служить
работа де Бура [29], в которой для описания взаимодействия между
256
Глава VI
Рис. VI-6. К расчету вандерваальсового
взаимодействия поверхности с цепочкой молекул.
отдельными атомами используется простое выражение (VI-16).)
Следуя уравнению (VI-20), можно записать
г(х) = — Cjx\ (VI-23)
где Ci принимается равным-^/iv0a2. Поскольку потенциал ионизации и
поляризуемость соответственно составляют около 1 эВ и 10~24 см3 (см.
табл. VI-1), С\ должна иметь величину порядка 10~60 эрг-см6/атом.
Тройное интегрирование приводит к изменению вида зависимости
энергии взаимодействия от х. Введя величину п, число атомов
пластины на кубический сантиметр, получаем
« (^ом-пластина = — (я/6) nCjX*. (VI-24)
Сила, притягивающая атом к пластинке, равна производной энергии
взаимодействия г(х) по х. Теперь при желании можно рассчитать
энергию взаимного притяжения двух пластин. Для этого необходимо
только провести интегрирование выражения (VI-24) по толщине
второй пластины. Энергия взаимодействия двух пластин меняется
пропорционально х~2\
е (^)пл,сти„,-пл,стина = -(^/12) (я2^/*2) (VI-25)
или
е Мпластина-пл 1сти„д = —(1 /1 2Я) (Н/Х~), (VI-26)
где Н (эта величина* известна как постоянная Гамакера [30]) равяа
я2я2Сь Следует отметить, что Н включает величину (па)2 или (а/К)2,
где V— молекулярный объем. Для большинства элементов последнее
отношение приблизительно равно 0,1 и, следовательно, постоянная
Гамакера составляет ~10~13 эрг. Для двух квадратных пластин
шириной d
8 ikT = -(200/Т) (d/xf. (VI-27)
Таким образом, энергия взаимодействия двух пластин, разделенных
расстоянием, соизмеримых с их шириной, сравнима с энергией
теплового движения этих пластин.
В табл. VI-2 приведены результаты интегрирования уравнения
(VI-23) для различных макроскопических систем. Обратите внимание,
что в примерах 4 и 6 энергия взаимодействия обратно
пропорциональна первой степени расстояния.
"Постоянную Гамакера чаще обозначают буквой Л.
Дальнодействующие силы
257
Таблица VI-2
Вандерваальсово взаимодействие между двумя макроскопическими объектами*1
Система
Закон взаимодействия
Номер
уравнения
1. Две бесконечные
пластины
2. Две пластины конеч-
вой толщины б
3. Две сферы радиусом а
4. Случай 3, х<а
5. Две сферы радиусом
ах и а2
6. Сфера радиусом ах и
пластина бесконечной
толщины
~(1/12л)(Я/**)
— (Я/12л) [1/х2 + \/{х + 2б)2 — 2/(х + б)2]
(-Я/6) [2/(s2 -4) +2/s2 + In (-^Г^)]
— аЯ/12л;
/г//гл/ 2fllfl2 1 2giQ2 ,
" («/Ь) | £2 _ (fli f a2)2 + ^2 _ (% __ аа)2 +
+ 1п
я2
J}
-(Я/12)[2/*'+2/(х'+2)
+ 2 1п*7(*'+2)]
VI-26
VI-28
VI-29
VI-30
VI-31
VI-32
В уравнениях, приведенных в таблице, приняты следующие обозначения: х — кратчайшее
расстояние между поверхностями объектов; s=R/a, где R — расстояние между центрами сфер,
и x'=x/2ai.
Теоретически диэлектрическая проницаемость, поляризуемость и
отражение света тесно связаны между собой. И не удивительно
(постфактум), что дисперсионное взаимодействие описывается различными,
не похожими друг на друга теориями. В настоящее время широкое
распространение получила теория Лифшица [31], согласно которой
дисперсионное взаимодействие обусловлено флуктуирующими
электромагнитными полями атомов, определяющими также отражательную
способность вещества. По Лифшицу, сила притяжения двух
макроскопических пластин друг к другу описывается выражением
f (*) = (яАс/480х*) [(D0- 1)/(D0+ \)\\=Blx\
(VI-33)
где х — расстояние между поверхностями пластин, D0 — средняя
диэлектрическая проницаемость, приблизительно равная квадрату
показателя преломления света для данного материала, и <р—• некоторая
функция диэлектрической проницаемости, приблизительно ра!вная
единице. Следует отметить, что это уравнение дает обратную х3
зависимость энергии от расстояния, тогда как, согласно уравнению (VI-26),
эта энергия взаимодействия должна быть обратно пропорциональна х2.
Сила дисперсионного взаимодействия определяется
распространением осциллирующих электромагнитных полей в веществе, или, другими
словами, взаимным обменом атомов виртуальными фотонами.
Следовательно, можно считать, что осциллирующие электромагнитные поля
распространяются со скоростью света в рассматриваемой среде. При
частоте 1015 с-1, приблизительно соответствующей v0 в уравнении
(VI-16), за один период свет проходит около 1000 А. Таким образам,
атомы, разделенные расстоянием больше 1000 А, можно считать не
совпадающими по фазе.
Это явление известно как эффект запаздывания, а уравнение (VI-33)
дает силу запаздывающего дисперсионного взаимодействия.
17—1421
258
Глава VI
Более классический подход Казимира и Полдера [33] дает энергию
запаздывающего взаимодействия между двумя атомами, определяемую
выражением
б (jc) = — (23hca2/8n2x7). (VI-34)
Следовательно, энергия взаимодействия двух пластин равна
8 (х)=—(23hc/24Qnx3) ^ щп1% (VI-35)
где суммирование проводится по ©сем видам атомов, имеющихся в
системе. Используя уравнение Клаузиуса-Мосотти, можно овязать сумму,
входящую в уравнение (VI-35), с диэлектрической проницаемостью ео.
После подстановки ео- и дифференцирования уравнение (VI-35)
переходит в уравнение
/ (х) =(207Ac/1280jiV) [(е0— 1)/(е0 + ?)12, (VI-36)
очень близкое к выражению (VI-33). Более подробное рассмотрение
современной теории дисперсионного взаимодействия можно найти в
статье Мак-Лечлана [34].
В заключение отметим, что, хотя в принципе природа
дисперсионного взаимодействия достаточна понятна, разработать точную теорию
дисперсионных сил оказалось довольно трудно, и в настоящее время
существуют только приблизительные или модельные теории,
построенные на основе волновой механики. Обычно энергию дисперсионного
взаимодействия считают обратно пропорциональной шестой степени х,
однако при малых расстояниях в нее входят также члены более
высокого порядка [см. уравнение (VI-20)], а при больших расстояниях
обратная степень снова возрастает вследствие эффекта запаздывания.
Как будет показано в разд. VI-4, экспериментально измерить силы
дисперсионного взаимодействия также трудно. Исследователи,
работающие в этой области, считают вполне удовлетворительным, если
расчетные и экспериментальные данные согласуются в пределах одного
порядка.
Б. Взаимодействие двойных электрических слоев
Два одинаковых плоских двойных электрических слоя
отталкивают друг друга. Приближенная теория взаимодействия двойных слоев
изложена в разд. IV-5. Здесь также рассматривается важная для
коллоидной химии система — две сферические частицы, окруженные
двойными электрическими слоями. Согласно Фервею и Овербеку [35],
энергия отталкивания двух частиц, радиус которых соизмерим с толщиной
двойного слоя 1/х (см. разд. IV-2), приблизительно составляет
б (х)=(Dm|)20/s) e~* <*-*>, (VI-37)
где s определено в табл. VI-2 и х=%а.
При выводе последнего уравнения принималось, что потенциал гр0
(см. теорию Гуи — Чепмена) остается постоянным. Уравнение (VI-37)
является приближенным, вероятно, в той же степени, что и уравнения,
описывающие дисперсионное вазимодействие. И все же эти уравнения
служат исключительно полезной основой для полуэмпирической
интерпретации многих коллоидных явлений, некоторые из них рассмотрены
в разд. VI-4.
В. Распространение взаимодействия типа диполь —
индуцированный диполь
Взаимодействие такого рода возникает, например, при образовании
на поверхности слоя адсорбированных атомов. Если на поверхности
содержатся поверхностные заряды, каждый из которых имеет величину
Дальнодействующие силы
259
ze (где формально z может соответствовать заряду атома на полярной
поверхности), то, согласно уравнению (VI-5), энергия взаимодействия
адсорбируемого поляризуемого атома с поверхностью равна
е01 =—(ze)2a/2d* =—[{zefl2d\ (a/d3), (VI-38)
где d — расстояние между атомом и поверхностью; индуцированный ди-
польный момент атома составляет zeajd2, что соответствует равному,
но противоположному по знаку заряду zeajd3, индуцированному на
атоме вдоль оси, нормальной к поверхности. В присутствии второго слоя
атомов поле заряда zen/d3 индуцирует в этом слое некоторый дипольный
момент, в результате чего энергия взаимодействия между смежными
атомами первого и второго слоя составляет
е12 =—\(ze?j2d\ (cc/d3)3. (VI-39)
Распространение взаимодействия в последующих слоях задается
общим выражением
eu«+i>=e(i_1M(a/d8)2. (V1-40)
Зависимость 8 от расстояния между атомом и поверхностью х
приблизительно описывается экспоненциальным выражением
8(x)=e06T^, (VI-41)
где
a = -(l/d0)\n(a/d3)\ (VI-42)
и d0 — диаметр атома. При малых расстояниях исходное уравнение
(VI-12) является не совсем точным, и, следовательно, расстояние d
можно рассматривать как эффективную величину, меньшую чем dQ.
Таким образом, распространение взаимодействия типа
диполь—индуцированный диполь приводит к экспоненциальной, а не обратной
кубической зависимости е(х) от х. Как и в случае дисперсионного
взаимодействия, энергия взаимодействия диполь — индуцированный диполь
определяется поляризуемостью вещества, однако отличительной
особенностью взаимодействия данного типа является то, что оно зависит
только от поляризуемости адсорбированных частиц. В разд. Х1У-7Г
рассматривается применение уравнения (VI-41) в теории физической
адсорбции. Вообще же приведенная теория показывает, как
распространение короткодействующего взаимодействия может приводить к
дальнодействию.
Г. «Гидрофобное» взаимодействие
Термин «гидрофобное взаимодействие» или «гидрофобная связь»
обозначает усиление взаимодействия между двумя частицами в
присутствии растворителя, если взаимодействие типа растворитель — частица
слабее взаимодействия типа растворитель — растворитель. В качестве
простой иллюстрации рассмотрим погруженные в воду две пластины из
гидрофобного или покрытого слоем масла гидрофильного материала.
Поверхностная энергия разделенных пластин в расчете на квадратный
сантиметр составляет 2EHw, где EHw — поверхностная энергия
границы раздела углеводород — вода. Если пластины плотно прижимают
друг к другу так, чтобы они слиплись, эта межфазная энергия
исчезает. Таким образом, в системе имеется прижимающая сила,
соответствующая выигрышу энергии в 2Ehw, которая стремится сблизить
пластины. Вспоминая разд. И-3, отметим, что, если пластины сильно полярны
по своей природе, энергия взаимодействия поверхности с водой должна
быть очень мала и, следовательно, сила, прижимающая пластины друг
к другу, также должна быть мала. Это соответствует
экспериментальным наблюдениям, показывающим, что в воде углеводородные моле-
17*
260
Глава VI
кулы стремятся ассоциировать, тогда как у полярных молекул такое
стремление отсутствует. Существующие теории гидрофобного
взаимодействия носят преимущественно модельный характер. Основное
внимание в них уделяется разности энергии воды вблизи гидрофобного
вещества и в окружающей воде (см. работу [36] и приведенные в ней
ссылки).
Выигрыш энергии, обусловленный сближением двух пластин, тесно
связан с энергией, определяемой уравнением (VI-25). Правда, теперь
необходимо учесть присутствие новой фазы, а именно растворителя.
Дисперсионное взаимодействие между телами 1 и 2, погруженными в
среду 3, определяется соответствующей постоянной Гамакера НХЪ2-
В работе [37] показано, что
Я132 = Я12-(Я134- Я23~Я3з). (VI-43)
Таким образом, если рассматриваются чисто дисперсионные силы, Н{г2
больше #12 при условии, что #33> (#1з+#зз). (См. также упражнение
8.)
4. Экспериментальное подтверждение существования
дальнодействующих сил
А. Прямое измерение вандервааяьсового притяжения
дальнего радиуса действия
Предпринят ряд попыток непосредственно измерить предсказываемое
теорией дальнее дисперсионное взаимодействие двух параллельных
пластин. Так, авторы работ [38—40] определяли либо силу
взаимодействия двух параллельных стеклянных или кварцевых пластинок, либо
силу взаимодействия плоской пластинки со сферической линзой [39].
При расстояниях около 1 мкм измеряемая сила равнялась примерно
0,01 дн (в расчете на 1 см2). Вполне понятно, что такого рода
эксперименты осуществлять трудно. Поверхности должны быть совершенно
гладкими, на них совершенно не должно быть пыли и не должно быть
заметного электростатического заряда. Кроме того, поскольку при
сближении поверхностей сила взаимодействия быстро возрастает, чтобы
избежать сцепления поверхностей, балансирующая система должна
обладать значительным возвращающим моментом. Овербек, Спарнэй и др.
[38], применяя довольно жесткую пружину, измеряли расстояние по
изменению емкости плоскопараллельного конденсатора. В работе Деря-
гина и соавторов чувствительные весы с обратной связью обеспечивают
необходимую возвращающую силу без ухудшения чувствительности.
Приведенные на рис. VI-7 некоторые результаты измерений силы
между двумя плоскими кварцевыми пластинками показывают, с одной
стороны, высокую точность измерений, а с другой стороны, трудность
надежного определения закона, описывающего зависимость силы от
расстояния между пластинками. Экспериментальным данным лучше
всего удовлетворяет прямая (штриховая линия на рис. VI-7),
соответствующая закону я-3,73. Однако в пределах вероятной
экспериментальной ошибки эти же данные можно описать и законами х~к (сплошная
линия) и х~э (штрих-пунктирная линия), хотя в последнем случае
согласие все же несколько хуже. Более точные результаты получены при
измерении взаимодействия кварцевой сферы с кварцевой пластинкой
(рис. VI-8) [41]. Для данной геометрии системы сила незапаздываю-
щего взаимодействия определяется выражением
/(jc)=#a/6x2 (VI-44)
{ср. с уравнением (VI-32)], тогда как в случае запаздывающего
взаимодействия
f(x)=2nBa/3x3 (VI-45)
Дальнодействующие силы
-'А
-1,6
-18
^-2,0
-2,2
-и
-2,6
43 42 -4,/ 40
Рис. V1-7. Взаимное притяжение двух плоских кварцевых пластинок [39]
прямая, удовлетворяющая экспериментальным данным, наклон равен — 3.73.
прямая, удовлетворяющая данным при наклоне — 4,0; аналогичная прямая с наклоном — 3,00,
••• граница вероятной ошибки эксперимента.
[ср. с уравнением VI-33)]. Наклон экспериментальной кривой,
приведенной на рис. VI-8, очень близок к —3,0, а величина, соответствующая
В, весьма близка к предсказываемой теорией запаздывающего
взаимодействия.
Позднее была показана справедливость теории и для незапаздыва-
ющего взаимодействия. Тэйбор и др. [42] смогли измерить силу
притяжения двух взаимно пересекающихся цилиндров (эквивалент сферы и
плоской поверхности). Цилиндры были покрыты молекулярногладкими
сколотыми пластинками мусковита. На расстояниях 50—100 А
соблюдалось уравнение (VI-44), а на больших расстояниях —уравнение
(VI-45). Полученные в этих опытах постоянные Н и В
удовлетворительно согласуются с теорией.
Б. Отталкивание двойных электрических слоев
Во многих случаях вандерваальсово притяжение уравновешивается взаимным
отталкиванием двойных электрических слоев. Такого рода явления описываются общей
теорией, известной как теория ДЛФО (Дерягин, Ландау, Фервей и Овербек).
Очень хорошим примером приложения этой теории язляется коагуляция лиофоб-
ных коллоидов. Золь такого рода состоит из заряженных частиц, на поведение
которых влияет как взаимное отталкивание двойных слоев, так и взаимное
вандерваальсово притяжение. От того, какое из взаимодействий преобладает, зависит, насколько
легко и, следовательно, быстро сближаются частицы, т. е. насколько быстро произойдет
их слипание. В работе Фервея и Овербека [35, 43] рассматривается взаимодействие
двух сближающихся сферических коллоидных частиц. Объединяя соответствующие
уравнения, авторы построили серию кривых зависимости суммарной потенциальной
энергии от расстояния между частицами. На рис. VI-9 приведены такие кривые для
г1)0=25,6 мВ (т. е. tyo=kT/e при 25 °С). При низкой ионной силе раствора, которая
определяет величину х, во всем диапазоне расстояний, за исключением очень малых,
преобладающую роль играет отталкивание двойных слоев. При значительном
увеличении х достигается другой предельный случай, когда на всех расстояниях происходит
262
Глава VI
25
50
й,нм
100 200 300
&
-00
-0.5
-w
-1,5
9\.
О \
9 \
V-
4
-2Д
-3,0
J I I L
i i i i I
-5,5
-5,0
Ig d (см)
-4.5
Рис. VI-8 Притяжение между плоской пластинкой и шаром радиусом 413,5 см (/)
и 83,75 см (77) Пластина и шар изготовлены из плавленного кремнезема Наклон
сплошных линий равен —3,00 [41].
только притяжение частиц Существует критическая область значений %, в которой при
расстоянии, приблизительно равном диаметру частицы, имеется небольшой минимум
потенциальной энергии глубиной около —crkT.
Приведенные на рис VI-9 кривые показывают качественно, почему увеличение
ионной силы раствора способствует коагуляции. Полную потенциальную энергию двух
пластин приблизительно можно описать, объединяя уравнения (VI-33) и (VI-17):
е (л-)11ОЛН = (64/10АГ/х)72е-2хх —(1/12я) Н/х2. (VI-46)
Если в качестве условия быстрой коагуляции принять отсутствие барьера, то это, соб-
сгвепно, означает, что при некотором значении х е(х) = 0 и de(x)/ax = 0. Отсюда
после подстановки соответствующего выражения для х [уравнение (IV-8)] в уравнение
(VI-46) получаем, что быстрая коагуляция наступает при концентрации частиц,
равной
пп =
2?32
ехр (4)
£№Г5у*
e4i-
1
(VI-47)
Таким образом, эквивалентные концентрации z—z-электролита, вызывающие
коагуляцию золя, для электролитов 1:1, 2:2 и 3-3 должны относиться как 1 : 7г6 • 7з6 или
100:1,6:0,13. Это приблизительно соответствует экспериментальным данным,
выражаемым правилом Шульце — Гарди (влияние валентности иона на его коагулирующую
способность). Вообще говоря, многозарядные ионы проявляют тенденцию к
повышенной специфической адсорбции, и, таким образом, их коагулирующая способность в
значительной мере зависит от того, насколько при адсорбции уменьшаются "ф0 и
толщина двойного слоя.
Оценки постоянной Гамакера по результатам измерения скоростей коагуляции
приблизительно согласуются с теоретическими значениями. При таких расчетах пред-
Дальнодействующие силы
263
Потенциальная
энергия взаимодействия (эрг, к Т)
WO**
жт
но-*
20кТ
Ot5-fO~f2
ЮкТ
1кТ
2
-ЮкТ
-0,5-to''2
-20КТ
Рис. VI-9. Влияние концентрации электролита на потенциальную энергию
взаимодействия двух сферических частиц [35].
полагается, что частицы коагулируют в результате диффузии, причем в момент
сближения энергия активации должна быть достаточна для преодоления энергетического
барьера типа показанного на рис. VI-9. Высоту этого барьера оценивают по скорости
коагуляции. Параллельно находят дзета-потенциал коллоидных частиц
(предполагается, что при сближении частиц дзета-потенциал не меняется). Данных по высоте
энергетического барьера и дзета-потенциалу, собственно, достаточно для нахождения
постоянной Гамакера |[44—46].
Еще один способ оценки постоянной Гамакера заключается в измерении
осмотического давления воды в суспензиях пластинчатых частиц, образующих так
называемые шиллеровские слои (см. разд. VI-2B). Этот метод применялся, например, при
изучении суспензий монтмориллонита [47].
Равновесная толщина мыльной пленки определяется суммарным действием по
крайней мере трех сил. Во-первых, поверхности раздела пленка — воздух являются
заряженными и, следовательно, взаимное отталкивание двойных электрических слоев
приводит к появлению направленного наружу давления. Во-вторых, дальнодействую-
щее вандерваальсово притяжение приводит к существованию сжимающего давления;
количественно этот эффект соответствует взаимному притяжению двух пластин,
разделенных расстоянием, равным толщине пленки (см. также упражнение VI-6), и
описывается уравнением (VI-26). В-третьих, если пленка связана с объемной жидкой
фазой, из пленки можно отсасывать жидкость и, таким образом, менять в ней
гидростатическое давление. Конечно, при этом следует учитывать, что любое возмущение
структуры пленки может отразиться на ее толщине и, следовательно, балансе указанных
давлений.
Измеряя равновесную толщину пленки в зависимости от ионной силы раствора
(т. е. в зависимости от взаимного отталкивания двойных слоев) и приложенного
извне гидростатического давления, можно одновременно проверить как теорию
отталкивания двойных электрических слоев, так и теорию дальнодействующих сил
притяжения. Обзор по данной теме см. в статье Майсельса [19].
Наконец, постоянную Гамакера можно оценить также, используя данные по
межфазному натяжению [48] (см. разд. VII-5B).
В. Аномальная вода
Нельзя не остановиться, хотя бы кратко, на проблеме, приковавшей пристальное
внимание специалистов по химии поверхностей и коллоидной химии в 1966—1973 гг.
Эта история началась с сообщения о необычных свойствах жидкостей, особенно воды,
264
Глава VI
помещенных в узкие капилляры. В 1955 г. Шерешевский и сотрудники (см. разд. 1MB)
обнаружили, что в капиллярах жидкости обладают неожиданно низкой упругостью
паров. Однако фактическим началом в цепи событий, связанных с «аномальной»
водой, можно считать статью Федякина (1962 г.), за которой вскоре последовала серия
статей, написанных в сотрудничестве с Дерягиным (полный перечень публикаций,
посвященных данному вопросу, за период вплоть до 1970—1971 гг. см. в [49]).
В этих работах сообщались поразительные сведения. Вода, сконденсированная из
паровой фазы в кварцевых или пирексовых капиллярах диаметром от 10 до 100 мкм,
имела плотность 1,4 г/см3, повышенную вязкость — примерно в 10 раз выше, чем у
нормальной воды; низкую и не резко выраженную точку замерзания; очень сложный
ход зависимости термического коэффициента расширения в области температур от
—40 до 20 °С; высокое поверхностное натяжение (около 75 дн/см); необычный спектр
ЯМР и, что очень важно, пониженную по сравнению с нормальной водой упругость
паров. Различные экспериментальные оценки молекулярного веса показали, что
молекулярный вес воды в капилляре равен 180, что соответствует (Н20)ю. Последний
результат плюс данные по упругости паров означают, что вода может существовать
в некоторой новой молекулярной форме, в которой она стабильнее обычной воды.
Более того, пары, переконденсированные в капилляр через трубку, прогретую до 700—
800 °С, сохраняют свои необычные свойства. По оценке, теплота испарения такой
воды составляла 6 ккал/моль (тогда как для нормальной воды она равна примерно
10 ккал/моль).
Авторы назвали новую форму воды «аномальной водой» или «водой II». Хотя
большинство работ по «аномальной воде» было опубликовано в СССР в 1962—1965 гг.,
западные ученые по-настоящему этой проблемой заинтересовались только после
посещения Дерягиным Англии и США в 1966 и 1967 гг. Вокруг аномальной воды
возникла бурная полемика. Было совершенно непонятно, каким образом природа сумела
так долго утаивать существование формы воды более стабильной, чем та, которая
нам известна? Может быть, полученные данные ошибочны? (С самого начала автор
этой книги придерживался мнения, что данные, вероятнее всего, верны, но в их
интерпретацию вкралась какая-то ошибка и они вряд ли доказывают существование
новой сверхстабильной формы воды.)
В течение 1968 г. опыты Дерягина и сотрудников были повторены в различных
лабораториях Англии и США и в основном подтвердились. Правительственные фонды
этих стран оказали исследователям аномальной воды сильную поддержку. История
аномальной воды проникла на страницы популярной литературы. Шли разговоры о
получении литров аномальной воды для всевозможных технических нужд.
Изучение аномальной воды продолжалось Первые инфракрасные спектры,
полученные в 1969 г. [50], оказались не похожими на спектры всех известных веществ,
и было высказано предположение о гексагональной полимерной структуре аномальной
воды. Полимерную воду было предложено называть «поливодой». Особенно
популярным это название стало в США. Была разработана и соответствующая теория.
Методом ППДП (полное пренебрежение дифференциальным перекрыванием) было
«установлено существование и охарактеризована» молекулярная структура поливоды
(соответственно было предложено еще одно название—«циклическая вода») [51]. В
работе [52] была представлена схема связей в полимерных субъединицах. Большинство
докладов на Национальном симпозиуме по коллоидной химии (США) в 1970 г. было
посвящено аномальной воде (все эти работы можно найти в соответствующем выпуске
журнала Journal of Colloid and Intesface Science за 1971 г.).
В конце 1969 г. появились первые предвестники будущего шквала опровергающих
данных. Полученные данные подрывали идею о существовании новой, стабильной
формы воды. Провести анализ имевшихся микроколичеств аномальной воды было
чрезвычайно трудно. Однако с помощью новых методов, описанных в разд. V-6, оказалось
возможным осуществить элементный анализ образцов, выдавленных из капилляра на
плоскую подложку. Поворотным событием в истории аномальной воды стала работа,
опубликованная в начале 1970 г. Авторы ее обнаружили высокое содержание примесей
в исследованных образцах, ИК-спектры которых совпадали с полученными ранее ИК-
спектрами аномальной воды [53]. Теперь все становилось на свои места. И раньше
имелись данные, свидетельствующие о том, что аномальная вода содержит примеси.
Однако общепринятым было мнение, что, если одни исследователи получают
загрязненные материалы, это еще не доказывает, что другие исследователи не могут
получать чистые препараты. Все попытки получить аномальную воду в больших
количествах оказались безуспешными. Все больше внимания стало привлекать то необычное
обстоятельство, что для получения аномальной воды необходимы свежетянутые
капилляры. Если до сих пор считалось, что свежая поверхность обладает особыми
каталитическими свойствами, необходимыми для образования поливоды, то теперь
становилось все яснее, что вода выщелачивает свежую стеклянную или кварцевую
поверхность и загрязняется примесями.
Оглядываясь назад, необходимо отмести массу научных (порой и анекдотичных)
подробностей, связанных с аномальной водой. Эта история закончилась в 1974 г.,
когда Дерягин и сотр. [54] опубликовали честную и смелую статью, в которой
сообщалось, что аномальная вода представляет собой смесь, включающую коллоидные и
молекулярно-растворенные примеси.
Дальнодействующие силы
265
Рассказанная здесь история аномальной воды является хорошим примером
реакции науки на заявку о большом открытии и того, как это открытие подтверждается
или опровергается. Из этой истории следует ряд уроков. Основная проблема
заключалась не в данных, которые были вполне реальными, а в их интерпретации. При этом
в какой-то мере игнорировались как некоторые не очень заметные, но смущающие
обстоятельства, так и пределы возможного, устанавливаемые законами
термодинамики. Мы должны усвоить, что в химии такие дисциплины, как спектроскопия и
волновая механика, в лучшем случае позволяют лишь подтвердить и глубже понять то,
что установлено другими методами.
5. Упражнения
1. Выведите уравнение (VI-24) из уравнения (VI-23), выполнив необходимое
тройное интегрирование.
2. Рассчитайте все численные коэффициенты в уравнении (VI-46) для двух
пластинчатых частиц при гр0=25,7 мВ в К)-3 М растворе 1 : 1 электролита при 25 °С. По
мнению Цохера, равновесное расстояние между шиллеровскими слоями определяется
равновесием между энергией взаимного отталкивания двойных слоев и потенциальной
энергией частиц в гравитационном поле земли. Принимая плотность W03 равной
7 г/см3 и толщину пластинок равной 700 А, рассчитайте равновесное расстояние
между пластинками, расположенными друг над другом.
3. Выведите уравнение (VI-38).
4. Обычный способ корректировки уравнения (VI-17), с тем чтобы в нем
учитывалось изменение энергии взаимного притяжения частиц в присутствии растворителя,—
это замена Н на (Hu-\-Hss—2H\S), где индекс 1 относится к частице, as — к
растворителю. При этом для расчета постоянной Гамакера берутся соответствующие
поляризуемости и концентрации. Справедливость этого метода можно доказать, используя
анализ, сходный с примененным з упражнении 6. Сформулируйте это доказательство
(обычно его приписывают Гамакеру, см. [37]).
5. Для вещества, состоящего из атомов двух видов, постоянная Гамакера
рассчитывается путем замены п2а2 на (Tifaf-f «lal+2ni/i2aia2). Объясните, почему такую
замену можно считать правильной. Рассчитайте Я для льда, принимая поляризуемость
Н и О равной 0,67-Ю-24 и 3,0-Ю-24 см3 соответственно. Рассчитайте силу,
действующую на толстые пластины льда, удаленные друг от друга на 100 А, а также на
ледяные шарики радиусом 1 мкм, находящиеся на расстоянии 100 А друг от друга.
6. В разд. VI-4B утверждается, что в результате вандерваальсового
взаимодействия на тонкую пленку действует когезионное давление, равное отнесенной к одному
квадратному сантиметру силе взаимного притяжения двух пластин из того же
материала, что и пленки, которые удалены друг от друга на расстояние, равное толщине
пленки. Представьте себе длинный брусок такого материала; площадь поперечного сечения
этого бруска постоянна (рис. VI-10). Разрежем брусок пополам и отодвинем
половинки друг от друга на расстояние d, равное толщине пленки. После этого отрежем
от внешних концов половинок по пластинке толщиной d. Одну из этих пластинок
вставим в щель между половинками. От исходного состояния теперь система отличается
наличием между половинками тонкого изолирующего слоя. Последовательно
проанализируйте конечные и промежуточные состояния системы и покажите, что исходное
утверждение является правильным. (Для анализа необходимы только следующие до-
-ЧЙ
-ЧЙг*-
-Hdh*-
Рис. VI-10.
г
I
(I I
/1
266
Глава VI
Рис. VII1.
пущения: 1) аддитивность взаимодействий и 2) ограниченность радиуса их действия.)
7. Используя данные, приведенные на рис. VI-8, рассчитайте постоянную В в
уравнении (VI-45). Сравните полученный результат с теоретическим значением В; во и Ф
примите равными 2,1 и 0,35 соответственно.
8. Согласно некоторым теоретическим оценкам [53], постоянную Гамакера можно
представить как среднее геометрическое
Яи = (Я11^м),/«. (VI"48)
Выведите выражение для #i32 в уравнении (VI-43), в котором были бы исключены
члены типа Hij.
9. Потенциал -ф0 и постоянная Гамакера двух сферических частиц радиусом 100 А
составляют 25,7 мВ и 3-Ю-15 эрг соответственно. Частицы находятся в 0,001 М
растворе 1 : 1 электролита при 25 °С. Рассчитайте &(х) как функцию х в случае
взаимного отталкивания двойных слоев и вандерваальсового притяжения. Постройте
полученные вами зависимости и найдите по ним суммарную потенциальную энергию
взаимодействия частиц.
10. В работах Дерягина (см. дополнение и ссылки в работах [11] и [54])
используется величина, называемая автором расклинивающим давлением пленки.
Расклинивающее давление можно определить как механическое давление, которое необходимо
приложить к объемной фазе, чтобы привести ее в равновесие с данной пленкой, состоящей
из того же вещества, что и объемная фаза.
Рассмотрите ситуацию, изображенную на рис. VI-11, когда два образованных в
жидкости воздушных пузырька, разделенных тонкой пленкой, прижимаются друг к
другу. Рассчитайте расклинивающее давление пленки при лапласовском давлении Р
в воздушных пузырьках.
11. Данные, приведенные на рис. VI-7, получены для кварцевых пластинок
площадью 1 см2. Оцените величину расклинивающего давления (см. упражнение 10) для
двух пластинок, удаленных друг от друга на 0,1 мкм. Положительной или
отрицательной является полученная вами величина? Дайте подробное объяснение.
12. По данным Дерягина и Зорина, при 25 °С и относительной упругости паров
0,98 адсорбированная вода образует на кварце пленку толщиной 40 А. Рассчитайте
расклинивающее давление этой пленки (см. упражнение 10) и определите его знак.
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Glasstone S., Textbook of Physical Chemistry, Van Nostrand, New York, 1946.
van Olphen H.f Mysels K. /., ed., Physical Chemistry: Enriching Topics from Colloid and
Surface Science, Theorex (8327 La Jolla Scenic Dr.), 1975.
Овербек Дж., В кн. «Наука о коллоидах», под ред. Кройта Г. Р., М. ИЛ, 1955.
Ргос. 2nd Intern. Congr. Surface Activity, Butterworths, London, 1957.
Sparnaay M. J., The Electrical Double Layer, in the «International Encyclopedia of
Physical Chemistry and Chemical Physics», Everett D. H., ed., Vol. 4, Pergamon Press.
New York, 1972.
Verwey E. J. W„ Overbeek J. Th. G., Theory of the Stability of Lyophobic Colloids,
Elsevier, Amsterdam, 1948.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1 Glasstone S, Textbook of Physical Chemistry, Van Nostrand, New York, 1946.
p. 298.
2 London F., Z. Phys. Chem., Bll, 222 (1930).
3. Munn R. L, Trans. Faraday Soc, 57, 187 (1961).
4. Slater J. C, Kirkwood J. G., Phys. Rev., 37, 682 (1931).
Дальнодействующие силы
267
5. Muller A., Proc. Roy. Soc. (London), A154, 624 (1936).
6 Crowell A. D, in «The Solid-Gas Interface», Flood E. A., ed., Marcel Dekker, New
York, 1967.
7. Fontana P. R., Phys. Rev., 123, 1865 (1961); see also ibid., 125, 1597 (1962).
8 Adamson A. W„ Textbook of Physical Chemistry, Academic Press, New York, 1973,
p. 323.
9. Ewing G. E., Accts. Chem. Res., 8, 185 (1975).
10. Henniker J. C, Rev. Mod. Phys., 21, 322 (1949).
11. Kitchener J. A., Endeavor, 22, 118 (1963).
12. Deryaguin B. V., Pure Appl. Chem, 10, 375 (1965).
13. Drost-Hansen W., Ind. Eng. Chem, 61, 10 (1969).
14. Derjaguin B. V., Zorin Z. M, Proc. 2nd Int. Congr. Surface Activity (London), 2,
145 (1957).
15. Tadros M. E.f Ни Р., Adamson A. W.f J. Colloid Interface Sci, 49, 184 (1974).
16. Karagounis G, Helv. Chim. Acta, 37, 805 (1954).
17. Deryaguin B. V., Karassev V. V., 2nd Int. Conf. Surface Activity, 3, 531 (1957).
18. Churayev N. V., Sobolev V. D., Zorin Z. M., Discuss Far. Soc, 213 (1971).
18a. Deryaguin B. V., Karasev V. V., Lavygin I. A., Skorokhodov I. L, Khromova E. N.,
Spec. Discuss. Faraday Soc. 98, No. 1 (1970).
19. Mtjsels K. /., J. Phys. Chem, 68, 3441 (1964).
20. Bergmann P., Low-Beer P, Zocher tf, Z. Phys. Chem, A181, 301 (1938).
21. Levine S., Trans. Faraday Soc, 42B, 102 (1946).
22. Hachisu S., Furusawa K, Sci. Light (Tokyo), 12, No. 1, 157 (1963); see Chem. Abstr,
61, 65g (1964).
23. O'Konski С. Т., Haltner A. /, J. Amer. Chem. Soc, 78, 3604 (1956).
24. Bernal J. D, Fankuchen L, J. Gen. Physiol, 25, 111 (1941).
25 O'Konski С. Т., Applequist J. В., Nature, 178, 1464 (1956).
26 Blackmore A. V., Miller R. D., Soil Sci. Soc. Amer. Proc, 25, 169 (1961); Blackmo-
re A. V., Warkentin B. P., Nature, 186, 823 (1960).
27. Onsager L, Ann. N. Y, Acad. Sci, 51, 627 (1949).
28 Flory P. J., Abstracts of Papers, 128th Meeting of the American Chemical Society,
Minneapolis, 1955.
29. de Boer J. #, Trans. Faraday Soc, 32, 10 (1936); Polanyi M., London F., Natur-
wiss, 18, 1099 (1930).
30. Hamaker H. C, Physica, 4, 1058 (1937).
31. Лившиц Е. М, ЖЭТФ, 29, 94 (1955).
32. van den Tempel M, Advan. Colloid Interface Sci, 3, 137 (1972).
33. Casimir H. B. G, Polder D., Phys. Rev, 73, 360 (1948).
34. McLachlan A. D., Mol. Phys, 7, 381 (1963—1964).
35. Verwey E. J. W., Overbeek J. Th. G., Theory of the Stability of Lyophobic Colloids,
Elsevier, Amsterdam, 1948.
36 Hermann R. В., J. Phys. Chem, 79, 163 (1975).
37. Bargeman D., van Voorst Vader F.f J. Electroanal. Chem, 37, 45 (1972).
38 Black W., de Jongh J. G. V., Overbeek J. Th. G., Sparnaay M. /, Trans. Faraday
Soc, 56, 1597 (1960) and preceeding papers.
39 Abrikossova I. I., Derjaguin B. V., Proc. 2nd Intern. Congr. Surface Activity, But-
terworths, London, Vol. Ill, 1957, p. 398; Derjaguin B. V., Abrikossova I. L, Phys.
Chem. Solids, 5, 1 (1958); Derjaguin B. V.t Abrikossova /. /, Lifshitz E. M., Quart.
Rev. (London), 10, 292 (1956).
40. Kitchener J. A., Prosser A. P., Proc. Roy. Soc. (London), A242, 403 (1957).
41. Rouweler G. C. /, Overbeek J. Th. G, Trans. Faraday Soc, 67, 2117 (1971).
42. Tabor D., J. Colloid Interface Sci, 31, 364 (1969); Tabor Z), Winterton R. H. S.,
Proc. Roy. Soc, A312, 435 (1969).
43. Verwey E. J. W., Overbeek J. Th. G, Trans. Faraday Soc, 42B, 117 (1946).
44. Otiewill R. //., Watanabe A., Kolloid-Z, 173, 7 (1960).
45. Parfitt G. D, Picton N. Я, Trans. Faraday Soc, 64, 1955 (1968); Parfitt G. D.,
Wharton D. G, Proc. Brit. Ceramic Soc, p. 13, 1969.
46. Force C. G, Matijevic E., Kolloid-Z, 224, 51 (1968).
47. Barclay L, Herrington A., Ottewill R. Я, Kolloid-Z, 250, 655 (1972).
48. Fowkes F. M., Ind. Eng. Chem, 56, 40 (1964).
49. Allen L. C., J. Colloid Interface Sci, 36, 554 (1971).
50. Lippincott E. R., Stromberg R. R., Grant W. Я, Cessac G. L, Science, 164, 1482
(1969).
51. Allen L. C., Kollman P. A., Science, 167, 1443 (1970); note, however, Nature, 233,
550 (1971).
52. Linnett J. W., Science, 167, 1719 (1970).
53. Rousseau D. L.} Porto S. P. S., Science, 167, 1715 (1970).
54. Deryaguin B. V.f Zorin Z. M., Rabinovich Ya. L, Churaev N. V., J. Colloid Interface
Sci, 46, 437 (1974).
55. Дерягин Б. В., Коллоид, журн, 17, 207 (1955).
56. Hirschfelder J. О., Curtiss С. F.} Bird R. В., Molecular Theory of Gases and Liquids,
Wiley, New York, 1964, p. 988.
ГЛАВА VII
Поверхность раздела твердое тело—жидкость.
Краевой угол
1. Введение
Явления на поверхностях твердых тел очень разнообразны, и их
рассмотрению отведена большая часть этой книги. В силу
необходимости весь материал распределен по нескольким главам, расположенным
по возрастающей степени сложности — от явлений, в которых
возможна относительная идеализация и на этой основе более или менее
детальный анализ роли твердого тела, к явлениям, с трудом
поддающимся даже эмпирической интерпретации. Так, в гл. IV поверхность
твердого тела служит прежде всего местом расположения заряженных
частиц, взаимодействующих со смежным -раствором электролита. В гл.
V рассматриваются относительно простые твердые тела и
рассчитываются их поверхностные свойства на границе раздела твердое тело—газ.
В гл. VI обсуждаются различные типы сил и дается трактовка
дальнодействия. Здесь твердое тело опять-таки играет роль бесструктурной и
довольно неспецифичеокой фазы. Эта глава посвящена поверхностям
раздела типа твердое тело — жидкость, для которых изменения или
разности величин поверхностной энергии или свободной поверхностной
энергии имеют более важное значение, чем обычно не поддающиеся
определению абсолютные величины. В гл. IX обсуждаются явления,
происходящие на границе раздела твердое тело — жидкость и
осложненные присутствием растворенного в жидкости компонента.
Отдельные разделы физической химии поверхности твердых тел, как
правило, имеют свойственную только им феноменологию и
специфическую технику эксперимента. Соответственно представления и теории,
используемые для интерпретации явлений, происходящих на
поверхностях твердых тел, обычно отличаются ограниченностью. Избежать
разделения химии поверхностей твердых тел на изолированные
дисциплины невозможно да и нежелательно. Наиболее обособленными темами
в этой книге, по-видимому, являются адсорбция газов и катализ. В то
же время между отдельными разделами химии поверхностей,
безусловно, существует взаимосвязь, и, в частности, поэтому в этом разделе
для обсуждения краевых углов на твердых поверхностях оказалось
необходимым привлечь некоторые представления об адсорбции паров,
более подробно рассматриваемой позднее. Автор стремился построить
книгу таким образом, чтобы для понимания любого обсуждаемого
вопроса не требовалось изучения какой-либо последующей главы.
Именно поэтому в этом разделе вводятся некоторые представления теории
физической адсорбции.
2. Определение величины свободной поверхностной энергии
по изменению растворимости
Этот раздел, по существу, является продолжением разд. V-5, преимущественно
посвященного прямой оценке энергетических характеристик поверхностей раздела типа
твердое тело — газ. Хотя некоторые из описанных там методов в принципе применимы
Поверхность раздела твердое тело — жидкость
269
и для поверхностей раздела твердое тело — жидкость, при исследовании последних
приходится опираться в основном на описываемый ниже эффект Кельвина и
рассматриваемые в гл. VIII данные по зародышеобразованию.
Для кристалла уравнение Кельвина можно записать как
RT\na/a0 = 2yV/rt (VII-1)
где у — межфазное натяжение данной грани; г — радиус соответствующей вписанной
окружности (см. разд. V-2B); а — активность, определяемая, например, как
растворимость твердого тела. Если кристалл в целом находится в равновесии, то межфазное
натяжение и свободную энергию его поверхности можно считать равными.
Как следует из уравнения (VII-1), растворимость небольших кристаллов должна
быть выше, чем растворимость более крупных кристаллов. Естественно, что в таком
случае масса мелких кристалликов со временем должна перекристаллизоваться в один
кристалл. Вот почему после прогрева мелкокристаллические осадки становятся
крупнозернистыми. Строго говоря, уравнение (VII-1) должно относиться только к
монокристаллу, находящемуся в равновесии с насыщенным раствором Энюстюн и Тур-
кевич [1] показали, однако, что растворимость массы неоднородных по размеру
кристаллов определяется фракцией наиболее мелких кристаллов.
Если умеренно растворимая соль диссоциирует на у+ положительных ионов М и
v- отрицательных ионов А, растворимость 5 определяется выражением
S = [M]/v+=[A]/v-. (VII-2)
Пренебрегая коэффициентом активности, активность соли в растворе можно
представить в виде
а = [M]v+ [Af- = Sv++V~ {v4)v+ (v-)v~. (VII-3)
Подставляя последнее выражение в уравнение (VII-1), получаем
RT (v+ + v-) In (S/S0) = 2yV/r. (VII-4)
Большинство работ по исследованию эффекта Кельвина выполнено на
неорганических солях. Результаты таких исследований отличаются довольно плохой
воспроизводимостью, а порой и противоречат друг другу. Подробный обзор этих работ
читатель может найти в статье Энюстюна и Туркевича [1], здесь же мы отметим только
некоторые результаты. В 1923 г. Дандон и Макк [2] определили величины
межфазного натяжения ряда слаборастворимых солей. Например, для BaS04 была получена
величина 1250 эрг/см2. Авторы отнесли эту величину к частицам размером 0,1 мкм,
но вполне вероятно, что в их опытах растворимость определялась еще более мелкими
частицами. Авторы работ [3, 4] пришли к выводу, что при уменьшении размера
частиц до 0,1 мкм растворимость сульфата бария остается неизменной. По данным
Энюстюна и Туркевича, наиболее вероятное значение межфазного натяжения SrS04 в
растворе составляет 85 эрг/см2.
В этом отношении найденная в работе [5] величина межфазного натяжения
хлорида натрия в спирте 171 эрг/см2, вероятно, является довольно надежной. Во всяком
случае она согласуется с величиной поверхностной энергии хлорида натрия в воде
276 эрг/см2, найденной по теплоте растворения (разд. V-5B).
В заключение отметим, что, хотя методика экспериментального определения
поверхностного натяжения по растворимости имеет под собой довольно прочную
основу, применимость уравнения Кельвина к избыточной растворимости небольших
ионных кристаллов фактически является только предположительной и не доказана, как в
случае капелек жидкости. Термодинамический смысл результатов измерений
растворимости в присутствии неоднородного и неравновесного набора кристаллов не вполне
ясен Не разрешен также вопрос о роли других факторов, например двойных
электрических слоев, предположительно связанных с поверхностью кристалла. Последний
эффект Кнапп [6] (см. также [7]) описывает уравнением
RT In (S/S0) = 2yV/r - qW/8nDr* (VII-5)
в предположении, что частица обладает фиксированным двойным слоем с зарядом q.
С рассмотренным методом в какой-то мере связан интересный способ оценки
межфазного натяжения между твердым телом и его расплавом, предложенный Скапским и
др. [8]. Если в капилляр ввести некоторое количество расплава и затем охлаждать
его, то при затвердевании граница между жидким и затвердевшим расплавом
проходит по мениску, в описанных случаях полусферическому. Снижение температуры
затвердевания в капилляре Т относительно нормальной температуры затвердевания Тт
описывается выражением
Т = Тт- 2TmySLlrqfis, (VI1-6)
где qf — удельная теплота плавления, ps — плотность твердой фазы. Определенная
этим методом величина межфазного натяжения в системе лед •— вода равна
26 эрг/см2. Метод краевого угла на границе зерен (см. разд. V-5A) и опыты по
морфологической стабильности цилиндрической поверхности [10] для этой же системы
дают значения 33 и 22 эрг/см2 соответственно.
270
Глава VII
3. Определение разностей поверхностной энергии и свободной
поверхностной энергии из данных по теплоте смачивания и адсорбции
А. Теплота смачивания
Процесс смачивания чистого твердого вещества жидкостью обычно
сопровождается выделением тепла. Теплоту смачивания можно
записать в виде
qeu=Es-ESL, (VII-7)
где Е — полная поверхностная энергия (см. разд. И-1А) поверхности
раздела, указываемой нижними индексами, определяется аналогично
работе адгезии [уравнение (П-51)]:
EAlSL)=WsL-T(dWSL/ffT)=Es + EL-ESL. (VII-8)
Поскольку рассматриваемая система включает только
конденсированные фазы, между энтальпией и энергией нет никакого различия, по
крайней мере их разность мала (более строгий вывод содержится в
работе [11]).
Теплота смачивания калориметрически определяется как теплота,
выделяемая при смачивании чистого твердого образца или порошка
исследуемой жидкостью. Методика измерения теплот смачивания
подробно описана несколькими авторами [12—15] (см. также разд. XIV-4).
Поскольку измеряемые величины имеют порядок всего нескольких
сотен эрг на квадратный сантиметр, в опытах необходимо использовать
тонкодисперсные образцы с известной абсолютной площадью
поверхности, оцененной каким-либо независимым способом, обычно по
адсорбции газа.
Некоторые данные по теплотам смачивания приведены в табл. VII-1.
Полярные твердые соединения характеризуются высокими теплотами
смачивания полярными жидкостями и более низкими теплотами
смачивания неполярными жидкостями. Неполярные твердые соединения,
например графой или тефлон, дают низкие теплоты смачивания, мало
зависящие от природы этих соединений. Чессик и др. [20] нашли, что
отношение теплот смачивания данным растворителем к теплоте
смачивания водой почти не зависит от природы твердого вещества. В то же
время Цеттлемойер [16] отмечает линейную зависимость между
теплотой смачивания данного тела и дипольным моментом смачивающей
жидкости.
Здесь, правда, имеются некоторые сложности. Смачивание сажи,
например, сильно зависит от степени окисления ее поверхности. Хили
и др. [21] показали, что теплота смачивания сажи водой меняется про-
Таблица VII-1
Теплоты смачивания (кал/см2) при 25 °С
Твердое тело
Ti02 (рутил)
А1203
Si02
BaS04
Графой
Тефлон 6
! н20
550а
400-600*
400—600в
4906
32а
6*
с2н5он
400а
ПОз
«-Бутиламин
ЗЗОз
106а
СС14
2405
2706
2206
Н-СбН14
135а
100в
100в
103d
47^
Данные работы [16].
Данные работы [17].
вДанные работы [18] (<7СМ сильно зависит от размера частиц и условий обезгаживания).
гДанные работы [19].
Поверхность раздела твердое тело — жидкость
271
порционально доле гидрофильных центров, определяемых по изотермам
адсорбции воды. Теплота смачивания окислов, таких, как ТЮг или
Si02, может меняться от образца к образцу в зависимости от характера
предварительной обработки и удельной поверхности [18]. Тонко
измельченный кварц имеет вдвое меньшую теплоту смачивания в расчете
на квадратный сантиметр, чем крупнозернистый материал [22].
Предполагается, что дробление и помол приводят к образованию аморфной
поверхности.
Представляет интерес также разность теплот смачивания чистой по-
поверхности и поверхности, предварительно покрытой
адсорбированной пленкой той же жидкости, которой смачивается образец. Как
показано в разд. XIV-4, эту разность можно связать с теплотой
адсорбции пленки.
Б. Определение изменения поверхностной энергии
и свободной поверхностной энергии из адсорбционных данных
KaiK оказалось, измерить изменение свободной поверхностной
энергии твердого тела значительно легче, чем экспериментально найти ее
абсолютное значение. Методика измерений и обработка
экспериментальных данных в первом случае являются вполне четкими и имеют под
собой надежную термодинамическую базу. Правда, физический смысл
изменения свободной поверхностной энергии не всегда ясен. Этот
вопрос рассматривается ниже и в разд. VII-5.
Существует два основных метода определения изменения свободной
поверхностной энергии твердого тела. Изменение свободной
поверхностной энергии определяют, во-первых, измеряя поверхностное давление
пленки вещества, адсорбированного на поверхности твердого тела, и,
во-вторых, измеряя краевой угол на линии границы раздела трех фаз,
одна из которых твердая. Эти методы рассмотрены в разд. VII-4 и
VII-5.
На поверхности раздела твердое тело-—газ всегда имеется то или
иное количество адсорбированного газа или пара. Если давление пара
приближается к давлению насыщенных паров, то адсорбция довольно
велика и может достигать или даже превышать величину,
соответствующую заполнению монослоя. Этот тип адсорбции, при которой пары
находятся вблизи давления насыщения, называется физической
адсорбцией. Силы, обусловливающие физическую адсорбцию, по своей
природе близки к силам, действующим в процессе конденсации, и связаны
с обсуждавшимися в гл. VI «вандерваальсовыми» силами. Данному
вопросу, довольно подробно рассматриваемому в гл. VI, посвящено
огромное число работ.
Теперь остановимся на том, как в принципе по данным об
адсорбции можно найти изменение свободной поверхностной энергии в
системе твердое тело — газ. На рис. VII-1 показана типичная изотерма
адсорбции (физической), представляющая собой зависимость
адсорбированного количества v вещества (выраженного в данном случае в
сантиметрах кубических приведенного к нормальным условиям газа на
грамм твердого тела) от относительного давления Р/Рс (где Р —
фактическое давление газа, а Р° — давление его насыщенных паров, т. е.
упругость паров чистого жидкого адсорбата пр.и постоянной
температуре.
Количество адсорбированного газа v связано с Г, поверхностным
избытком на квадратный сантиметр, следующим выражением:
r=v/v02 (VII-9)
где у°=22 400 см3/моль при нормальных условиях и 2 — удельная по-
272
Глава VII
то
^
5
^ 1000
а
500
1 I | I I I | I I Г
Кислород
v 0,001 0,002 0,005 -j
ill! I I I I i I i i i I
0 OJ 0,3 0,5 0/ 0,9
P/pO
Рис. VII-1. Адсорбция кислорода на окиси титана при 78 К [104].
верхность твердого тела, выраженная в ивадратных сантиметрах на
грамм. Используя уравнение Гиббса [уравнение (П-85)], можно
записать
dy==—TRTd\na. (VII-10а)
Если рассматривается идеальный газ, в этом соотношении активность
заменяется на давление, т. е.
dy = -ГRTd In P (VII-106)
или
n = —\dn=RT[Yd\nP, (VII-11)
где я -
J J
поверхностное давление. Следовательно,
л =
--Уз-Узу = (ВТ/*2^ги1]пР
(VII-12)
rf=ys — ysvo'-
ро
-JrT/v^^vc
vd In P.
(VII-13)
Уравнения (VII-12) и (VII-13) дают термодинамическую оценку
изменения свободной энергии поверхности раздела фаз при адсорбции. Как
показано в разд. VII-5A, для пленок, адсорбированных на твердых
поверхностях, типичные значения я достигают 100 эрг/см2.
Здесь имеется некоторая тонкость. С одной стороны, изотермы адсорбции чаете
представляются вполне обратимыми, т. е. их адсорбционные и десорбционные ветви
идентичны. С другой стороны, обычно твердое тело не является равновесным
кристаллом и имеет довольно неоднородную поверхность. Поэтому ys и ySv трудно
определить как индивидуальные величины. По-видимому, удобнее всего рассматривать я—
наиболее надежно определяемый в случае обратимой адсорбции параметр — просто
как изменение свободной энергии поверхности раздела^ твердое тело — газ,
интерпретируя это изменение в зависимости от вида используемой модели.
Выражение для поверхностного давления можно подвергнуть некоторым
преобразованиям, подробно обсуждаемым в разд. XIV-12. В частности,
п-Т (dn/dT) = Hs - HSVt (VII-14
Поверхность раздела твердое тело— жидкость
273
где индекс SV относится к твердому телу, покрытому адсорбированной пленкой
(находящейся в равновесии с газообразным адсорбатом при давлении Р). Уравнение
(VII-14) аналогично уравнению (П-8) для однокомпонентной системы.
Как уже отмечалось выше (см. разд. VII-3A), теплоту омачивания можно
отнести как к смачиванию чистой твердой поверхности qs, см. так и к смачиванию
твердого тела, на поверхности которого находится адсорбированная пленка, qsv, cM. Если
адсорбированная пленка находится в равновесии с насыщенными парами адсорбата
(т. е. если упругость паров равна Р°), то теплота смачивания обозначается qSVOt См#
Из этих определений следует, что
^,см —^к,см = я —^(Лг/йГ) —ГАЯ0, (VIM5)
где последний член равен числу молей адсорбированного вещества (на квадратный
сантиметр поверхности), умноженному на молярную энтальпию испарения жидкого
адсорбата (см. [11]).
Приведенные рассуждения относительно адсорбции газов применимы и к
адсорбции из растворов. Более подробно этот вопрос рассматривается в гл. IX.
4. Явления, связанные с возникновением краевого угла
А. Краевые углы
Известно, что в большинстве случаев жидкость, нанесенная на
твердое тело, не растекается, а остается в виде капли, контактирующей с
твердой фазой под определенным углом. Схематически это изображено
на рис. VII-2. Как видно из этого рисунка, капля на поверхности
твердого тела напоминает линзу на поверхности жидкости (рис. III-4).
Анализируя систему твердое тело — капля, с помощью довольно простого
вывода можно прийти к очень полезному соотношению, известному как
уравнение Юнга.
Предположим, что при небольшом смещении жидкости поверхность,
покрытая каплей, увеличивается на АА. При этом изменение свободной
поверхностной энергии системы AGS составляет
AG*=AA(ysl — Ysvo) + AAYLl,cos(e—AG). (VII-16)
В условиях равновесия
limAG*7AA=0
ДА-»0
Vsl-Vsvo + YlvCOs9=0* (VII-17)
или
Vlv/cos9=y5vo- ySL> (VIM 8)
что вместе с определением работы адгезии [уравнение (Н-51)] дает
^v=Tlk(1+cos6). (VII-19)
Уравнение (VIM7) и есть известное уравнение Юнга,
сформулированное Юнгом в 1805 г** [23]. Эквивалентное уравнение (VIM9) было
получено в алгебраическом виде Дюпре (1869 г.) из определения работы
адгезии. По существу, уравнения (VIM7) и (VII-19) являются одним
и тем же уравнением (т. е. уравнением Юнга и Дюпре), выраженным
Твердое тело Рис. vii-2.
* Можно показать, что независимо от макроскопических размеров системы Л6/АА
ведет себя как дифференциал второго порядка и при АА—>-0 также падает до нуля.
** Согласно Юнгу, «в условиях равновесия на угловые частицы действуют три
силы: одна в направлении только поверхности жидкости, вторая вдоль общей
поверхности твердого тела и жидкости и третья в направлении открытой поверхности
твердого тела».
18—1421
274
Глава VII
в различных обозначениях (правда, автор работы [25]
придерживается иного мнения).
Важно помнить, что в рассматриваемой системе все фазы
находятся во взаимном равновесии. В частности, обозначение Ysv° указывает
на необходимость равновесия между поверхностью твердого тела с
насыщенными парами жидкости при давлении Р°. Следовательно,
поверхность должна быть покрыта адсорбированной пленкой, поверхностное
давление которой равно л° (см. разд. VII-ЗБ). Таким образом
yLV cos 6=ys - ySL - я°. (VII-20)
Впервые на различие между ys и Ysv° обратили внимание,
по-видимому, Бэнгхэм и Разук [26], а особое внимание ему уделили Гаркинс и
Ливингстон [27]. Бартелл и др. [28] ввели в употребление еще одну
величину — адгезионное натяжение А, определяемое как
Aslv=Ysvo—ySL == yLV cos 6. (VII-21)
В этом выражении, как и в уравнении (VII-19), индекс SLV означает,
что в работу адгезии и адгезионное натяжение входит у3у0, а не ys-
Если краевой угол больше 90°, говорят, что жидкость не смачивает
твердое тело. В таком случае капли жидкости относительно легко
движутся по поверхности и сами по себе не входят в капилляры и поры.
В то же время считают, что жидкость полностью смачивает твердое
тело, только если краевой угол равен нулю. Если 9 равен нулю,
уравнение (VII-17) перестает выполняться и тогда баланс величин
свободной поверхностной энергии определяется коэффициентом растекания
(см. разд. III-2A):
Sl/s(V) =Ysvo—yLv— Vsl- (VII-22)
Иначе говоря, в такой ситуации адгезионное натяжение становится
равным yLV, и его можно записать как KSLV.
Приведенные выше определения предназначены прежде всего для интерпретации
краевого угла в системе твердое тело — жидкость — газ. Образование краевого угла
имеет место и в системе твердое тело — жидкость — жидкость, в которой обе
жидкости взаимно не смешиваются. Для таких систем применимы те же соотношения,
необходимо только обратить особое внимание на определение степени взаимного
насыщения. Таким образом, для трехфазной системы, состоящей из твердого тела и жидкостей
А и В, уравнение Юнга имеет вид
уАВ COS &SAB = ySA(B)—ySA(B) = ASAB> (VII-23)
где Osab — угол, измеренный в жидкости А; в скобках приведены компоненты,
которыми насыщены фазы, указанные перед скобками. При строгом анализе номенклатура
обозначений становится еще более сложной. Здесь же мы просто предполагаем, что А
и В насыщены относительно твердого тела, и считаем само собой разумеющимся, что
обе фазы на соответствующей поверхности раздела являются взаимно насыщенными.
Пренебрегая эффектами взаимного насыщения и решая совместно уравнения (VI1-23)
и (VII-21), находим
Asa — Asb = Уев — Уэа ■•= A sab- (VII-24)
Если при использовании уравнения (VII-24) получается адгезионное натяжение,
соответствующее 0 = 0, то это указывает на возможность растекания в исследуемой
системе. В этом случае полученный результат лучше всего выражать через /С, т. е.
коэффициент растекания. Таким образом, адгезионное натяжение является
унифицированным параметром, характеризующим как краевой угол, так и явление растекания.
Формально в более строгой форме уравнение (VII-24) имеет следующий вид:
ASAV— AsBV = ASAB + (^SV(B) —n>SV{A)) + fasB(A) — ^SA(B))f (VII-25)
где, например, лбв(А) — поверхностное давление или уменьшение свободной
поверхностной энергии на поверхности раздела твердое тело — жидкость В, насыщенная
относительно А.
Физический смысл уравнения Юнга понять не так просто. Этот
вопрос поднимается в разд. VII-5. Здесь же мы ограничимся только
констатацией факта, тем более, что в данном разделе основная наша
цель — ©вести обозначения, удобные для обработки экспериментальных
данных.
Поверхность раздела твердое тело— жидкость 275
Рис. VII-3. Метод наклоняющейся пластинки
Б. Измерение краевого угла
Обзор работ по данной теме опубликован Ньюмэном и Гудом [28а].
В 1925 г. Адам и Джессоп [29] предложили один из наиболее
точных способов измерения краевого угла. В настоящее время этот метод,
известный как метод наклоняющейся пластинки, считается
классическим. На рис. VII-3 показана схема прибора для определения краевого
угла.
Пластинка из твердого материала шириной в несколько сантиметров погружается
в жидкость. С помощью точного манипулятора угол наклона пластинки меняется до
тех пор, пока поверхность жидкости не станет совершенно плоско? вплоть до
поверхности пластинки. Фоуск и Гаркинс [30] значительно усовершенствовали этот метод,
применяя, в частности, те же меры предосторожности и методики, которые
используются в пленочных весах (см. разд. Ш-ЗЛ). При измерении краевых углов, как и при
измерении поверхностного давления, ни в коем случае нельзя допускать загрязнения
поверхности.
Далеко не всегда исследователь располагает достаточно большим
образцом изучаемого твердого материала и достаточным объемом
жидкости, необходимыми для измерения краевого угла по методу
наклоняющейся пластинки. В таких случаях для определения краевых углов,
как правило, используют каплю жидкости или газовый пузырек (рис.
VII-4). Зисман и др. [31] рассматривают каплю, сидящую на
поверхности образца, под горизонтальным микроскопом с гониометрической
шкалой, позволяющей непосредственно измерять краевой угол. Лежа
и Поли«г [32] сажают каплю или пузырек на отражающую
(зеркальную) поверхность и фотографируют их пэд небольшим углом. При этом
угол встречи прямого и отраженного изображения равен удвоенному
краевому углу. Оттевил [33] разработал метод «прижатого пузырька»,
в котором пузырек, контактирующий с твердой поверхностью,
формируйся^ капли
Сидящий пузырек
Рис VI1-4 Определение краевого угла на сидящих каплях или п\зырьках
18*
276
Глава VII
Is! Видоискатель
Стеклянная
ячейка
Шприц
^Стеклянная трубка
Источник
СветоЛ
фильтр\
света
Натекание
Промежуточное
состояние
Оттекание
Рис. VI1-5. Метод «прижатого» пузырька [33]
£тся с помощью микрометрического шприца, как показано на рис. VII-5.
Краевой угол пузырька на исследуемой поверхности можно измерять
.либо по фотографии его профиля, либо с помощью гониометрического
телемикроскопа [34]. Используя этот метод, можно относительно легко
раздувать или отсасывать пузырек и, таким образом, свободно
получать углы натекания и оттекания. Случайное загрязнение
поверхностей здесь сведено к минимуму, и, кроме того, снимается вопрос о рав-
яовесии открытой поверхности твердого тела с насыщенными парами
жидкости. Однако, если 8 мал, удержать пузырек на месте может быть
довольно трудно.
Ньюмэн [35] приспособил метод пластинки Вильгельми (разд. 1-8)
для измерения краевых угло>в с точностью 0,1° (точность определения
угла другими методами 1°). Как показано на рис. VII-6, при конечном
0 мениск на частично погруженной пластинке поднимается на конечную
высоту 1г. Этот процесс описывается уравнением
sin 9 = 1 — pgh2j2y = 1 — (А/а)2, (VII-26)
Рис. VII-6 Измерение краевого угла по Ньюмэну.
Поверхность раздела твердое тело— жидкость
277
Ц I I I ! ! I 1 I I I
20 30 40 50 60
Т°С
Рис. VII-7. Температурная зависимость 9 для различных н-алканов на стеклянной
пластине с силиконовым покрытием [36].
/ — гексадекан; 2 — тетрадекан; 3 — додекан; 4 — декан.
где а — капиллярная постоянная [урав-нение (1-10)]. При
соответствующем освещении граница мениска является довольно резкой (если 8
не слишком мал) и h можно измерить с помощью
микроскопа-катетометра. Этот метод очень удобен для нахождения температурной
зависимости краевого угла. На рис. VII-7 приведены кривые, показывающие
изменение 6 для различных нормальных углеводородов на стекле в
интервале температур ~20—70 °С.
Краевой угол можно также непосредственно определить по форме сидящей
капли. Так, если изображенная на рис. VII-4 капля имеет сферическую форму [37, 38], то
tg 9/2= Л/г. (VII-27)
В методе Бикермана [39] используется другой подход — измеряется диаметр капли
известного объема.
Может оказаться, что твердый материал, на котором хотелось бы измерить
краевой угол, является порошкообразным и его невозможно спрессовать в компактный
образец с достаточно гладкой поверхностью. В этом случае ни один из описанных
методов не применим. В методе, предложенном Бартеллом и др. [40], порошок
прессуется в пористую таблетку и измеряется капиллярное давление, развиваемое в ней
исследуемой жидкостью.
Если эту таблетку рассматривать как пучок капилляров со средним радиусом г,
то из уравнения Лапласа следует, что
АР = 2yLV (cos 0)/r, (VII-28)
где АР— зависящее от 6 давление, необходимое для вдавливания или для
предотвращения проникания жидкости в таблетку. Для смачивающей жидкости
APo = 2Viy,„/r. (VII-29)
Таким образом, измеряя давление, необходимое для предотвращения проникания
смачивающей жидкости в таблетку, можно найти эффективный радиус капилляров г.
Решая совместно уравнения (VII-28) и (VI1-29), получаем для несмачивающей жидкости
cos 0 = (ДР/АРо) (Ylv.o/Ylv) • (VII-30)
В. Неоднородные поверхности
Приведенный вывод уравнения для краевого угла эмпирически
можно распространить и на твердое тело с неоднородной поверхностью.
Неоднородность поверхности может быть обусловлена двумя причинами.
Во-первых, поверхность твердого тела может быть шероховатой.
Такая поверхность характеризуется коэффициентом шероховатости г, т. е.
отношением истинной площади поверхности к ее кажущейся площади.
Тогда
Аналогичным образом можно определить и AASV.
278
Глава VII
В результате уравнение (VII-18) принимает следующий вид:
cose, = rcos9HCT (VII-31)
Уравнение (VII-31) было получено в 1948 г. одновременно
несколькими авторами [41—43]; позднее Гуд [44] дал его более строгий вывод.
Обратите внимание, что если краевой угол меньше 90°, то
шероховатость уменьшает 0, если же 6 больше 90°, то шероховатость
увеличивает его.
Во-вторых, поверхность может быть составной, т. е. состоять из
небольших участков различной природы. Если считать, что равновесный
краевой угол практически определяется достаточно большими
макроскопическими неоднородностями, a AASb и ДА5у являются
эффективными величинами, то для участков двух сортов, доля которых на всей
поверхности составляет /i и /2, получаем
Ylv,cos9c=/1 (ySlv-ySlL) + f2(ys2v-Vs2L) (VII-32)
или
cos e,=/! cos et+f2 cos e2. (vn-зз)
Уравнение (VII-33) находит интересное применение при исследовании
дырчатых, или сетчатых, материалов. В этом случае /2 — доля
открытой поверхности, Ys2i/ равно нулю и Ys2v равно просто yLV. При этом
соотношение (VII-33) видоизменяется:
cos 6, =Д cos 9t — /2. (VII-34)
Венцель [41], Бакстер и Касси [45] и Деттр и Джонсон [46] нашли,
что на парафинированных металлических сетках, текстильных
изделиях и тисненных полимерных поверхностях с различными f2 капли воды
действительно ведут себя примерно так, как предсказывает уравнение
(VII-34).
Рассматриваемый вопрос, конечно, представляет непосредственный интерес для
разработчиков водозащитных тканей. При этом примером может служить
«разработанная» природой структура перьев птиц [45]. Главный стержень пера по обе стороны
покрыт шипами, на каждом из которых в свою очередь имеется множество тонких
волокон. На одной стороне шипа волокна служат зубцами, а на другой — крючочками,
так что два смежных ряда волокон зацепляются и образуют упругую высокопористую
решетку. Для птичьих перьев /2 составляет ~0,5; при этом кажущийся краевой угол
равен ~ 150° (оттекание), тогда как истинный краевой угол приближается к 100°.
При большом краевом угле и достаточно шероховатой поверхности жидкость
может запирать на поверхности пузырьки воздуха, что, как показано на рис. VI1-8, дает
эффект сложной поверхности. В этом случае уравнение (VI1-34) переходит в
cos 0каж = г/х cos 0i — /2. (VII-35)
На рисунке справа показан один из возможных механизмов захвата воздуха. Если
при движении жидкости по неровностям поверхности локальный или истинный
краевой угол 0/ остается неизменным, то при больших 0* поверхность может двигаться под
таким входящим углом, при котором она одновременно пересекает два выступа
поверхности, запирая между ними воздух.
Рис. VI1-8. Край капли на шероховатой поверхности.
Поверхность раздела твердое тело — жидкость
279
Следует подчеркнуть, что приведенные в этом разделе уравнения
являются полуэмтшрическими и носят модельный характер. Отнюдь не
ясно, например, что следует усреднять в уравнении (VII-33),
рассматривая составную поверхность: cos8, 0 или какую-то другую функцию
8. Коэффициент г также неадекватно характеризует шероховатость
поверхности. Это прежде всего топологический вопрос. Так, поверхность,
покрытая параллельными бороздками, ведет себя совершенно иначе,
чем поверхность, покрытая ямками.
Г. Гистерезис при измерениях краевых углов
Нередко обнаруживается, что при натекании и оттекании жидкости
краевые углы могут быть совершенно различными: хрестоматийный
пример — вид дождевой капли на грязном оконном стекле. Это
различие может быть довольно большим. Так, для воды на поверхностях
минералов угол натекания иногда на 50° больше угла оттекания, а для
ртути на стали эта разность достигает даже 154°. Если необходимо,
чтобы краевой угол был как можно меньше, то в системе
целесообразно установить угол оттекания.
Причины гистерезиса можно разбить на три группы. Во-первых,
вполне очевидно, что загрязнение поверхности твердого тела или
жидкости должно способствовать гистерезису. Предположим, например, что
поверхность твердого тела первоначально загрязнена некоторым
количеством масла. При контакте с водой значительная часть масла
растечется по ее поверхности, в результате освобождающаяся от воды
поверхность твердого тела при измерении угла оттекания имеет более
низкое значение я или более вьисокое значение ysv, чем свежая
поверхность, на которую вначале натекала жидкость. Анализ уравнения
(VII-18) показывает, что при этом угол оттекания становится меньше
угла натекания. Работая с графитом и тальком, Фоукс и Гаркинс [30]
показали, что тщательная очистка поверхностей жидкости и твердого
170 г
Рис. VI1-9. Зависимость краевых
углов воды от шероховатости
поверхности теломера тетрафторэти-
лена и метанола [47].
50
J L
10 9876543Z10
■*—Число термообработок
Шероховатость поверхности-->
280
Глава VII
тела практически устраняет гистерезис. По данным этих авторов, если
жидкость чистая, а твердое тело нерастворимо и имеет чистую гладкую
поверхность, гистерезис краевого угла вообще отсутствует.
Во-вторых, эффекты гистерезиса определенно связаны с
шероховатостью поверхностей. В работе Деттра и Джонсона [47] обобщены
собственные и литературные данные по гистерезису краевого угла. На рис.
VII-9 приведены типичные данные этих авторов для воды на
политетрафторэтилене. Обратите внимание, что только угол натекания здесь
ведет себя так, как требует уравнение (VII-31). Однако в системах с
6<90° угол натекания также возрастает с г, что противоречит
уравнению (VII-31). Когда вследствие захвата воздуха поверхность начинает
вести себя как составная, угол натекания резко возрастает.
Деттр и Джонсон [47] (см. также работу Гуда [44]) рассмотрели модель
поверхности, покрытой синусоидальными бороздками (см. рис. VII-8), концентрическими с
каплей сферической формы (т. е. влияние силы тяжести в данном случае не
учитывается). Минимизация свободной поверхностной энергии (которая, согласно уравнению
Юнга, определяет локальный краевой угол) приводит к конфигурации капли с
кажущимся краевым углом 0Г, соответствующим уравнению (VII-31). При
последовательном изменении формы капли постоянного объема вследствие движения ее фронта
через выступы поверхности свободная энергия системы проходит через максимум.
Фактическая высота энергетических барьеров при этом довольно мала, но все же наличие
этих барьеров позволяет предполагать, что причиной гистерезиса в данной системе
является недостаточность макроскопической колебательной энергии капли для их
преодоления. Более количественные, но в общем такие же по смыслу аргументы в пользу
рассматриваемой модели приводят Бикерман [39], Шаттлуорс и Бэйли [43] и Шварц
и Минор [48].
Джонсон и Деттр [49], рассмотрев модель гетерогенной составной поверхности,
пришли примерно к таким же выводам, что и авторы работы [44]. Ранее аналогичный
анализ, правда только качественный, провел Пиз :[50]. На рис. VII-10 приведены
полученные Деттром и Джонсоном [51] данные по гистерезису краевого угла воды на
пластинках, частично покрытых Ti02 и хлоридом триметилоктадециламмония. Как
видно из рисунка, в этой системе гистерезис является значительным и в общем
оказывается почти таким, каким он должен быть на составной поверхности. Гистерезис
в отсутствие Ti02 приписывается неполной адсорбции гидрофобизующего агента и его
присутствию на поверхности в виде пятен (см. рис. III-16!).
По мнению автора книги, концепция макроскопического барьера свободной
энергии, по-видимому, дает достаточно адекватное объяснение гистерезиса, если масштаб
гетерогенности не намного меньше размера самой капли. Энергетические барьеры,
возникающие на микроскопических неоднородностях поверхности, легко преодолеваются
70
60
50
§ 40
30
$20
Г~П
W
Щ *
L*\
л
f
1 L_
~гт
\
—-L
il '
Оттекайте
I |l^ T !■■
1 1 Т"
Натекание
J 1 L_
~\ 1 1
н
—\
\ J
\
\
—1 1 *1
/Oh
О 5 10 15 гО 25 30 35 40 45 50
Число обработок
Рис. VII-10. Зависимость смачиваемости водой стекла, покрытого окисью титана и
обработанного затем раствором хлорида триметилоктадециламмония, от числа
обработок 1,1%-ным раствором полидибутилтитаната [51].
Поверхность раздела твердое тело— жидкость
281
'OfiOOl 0,001 Ofif q0J
Концентрация гексадекано/ia, %
1.0
Рис. VII-11. Проверка уравнения Юнга [53].
Значения y0<:osQ Для парафинового масла при соответствующих концентрациях
поверхностно-активного вещества рассчитаны по известным величинам поверхностного натяжения водных
растворов и поверхностей раздела между водными растворами и маслом. Зависимость YqcosB OT кон'
центрации гексадеканола в масле. Исследуется парафиновое масло на силикагеле,
содержащем 4% Si02. Выдержка: 3 ч; температура: 25 °С; у О=30,3 дн/см.
под воздействием небольшой вибрации, неизбежной в любой лаборатории. В таких
системах гистерезис обусловливается либо, как отмечено выше, загрязнениями
поверхности, либо другими причинами, обсуждаемыми ниже.
Третьей установленной причиной гистерезиса, по-видимому,
является поверхностная неподвижность в макромолекулярном масштабе.
Известно [52], что на агаровом геле йодистый метилен обнаруживает
значительный гистерезис (66° против 30°), который явно нельзя объяснить
шероховатостью поверхности или ее химической неоднородностью
(агаровые нити покрыты водой). На поверхности геля имеются и
неподвижные участки. Если движение трехфазной границы тормозится
подложкой (а такое торможение, собственно, и предполагается при измерении
вязкости пленок, см. разд. III-3B), то возникает барьер для движения
трехфазной границы. В результате краевой угол является
неравновесным, и для смещения трехфазной границы требуется дополнительное
усилие. Для образования равновесного угла в системе жидкость —
поверхность твердого тела необходимо, чтобы пленка адсорбированных
паров была подвижна. Если жидкость содержит поверхностно-активное
вещество-, то причиной гистерезиса может быть низкая подвижность,
проявляющаяся либо в виде медленной десорбции с поверхности
раздела твердое тело — жидкость в раствор, либо в виде замедленного
образования за трехфазной линией равновесной адсорбированной
пленки на поверхности твердого тела. Такого рода гистерезис
наблюдается в системе силикагель — парафиновое масло (гексадеканол)
(ряс. VII-11) [53]. Подобные явления, по-видимому, возможны и при
измерении краевых углов на растянутых (и, следовательно,
анизотропных) полимерных пленках [54].
Д. Результаты измерений краевых углов
Из всего сказанного выше ясно, что в литературе должны
приводится самые разнообразные значения краевых углов. Поэтому данные,
собранные в табл. VII-2, можно рассматривать только как
ориентировочные. Более старые данные получены в основном при изучении туго-
282
Глава VII
плавких и относительно полярных твердых тел, а более новые— при
изучении низкоэнергетических полимерных поверхностей.
Бартелл и др. [55], исследуя главным образом твердые материалы
типа графита и стибнита, обнаружили определенную регулярность
краевых углов различных жидкостей. Авторы, правда, были смущены тем
фактом, что большинство органических жидкостей смачивает такие
материалы. Зисман и др. [56] провели обширные исследования краевых
углов ряда гомологичеоких органических жидкостей на полимерах с
низкой поверхностной энергией. В табл. VII-2 включены некоторые
данные по температурной зависимости краевого угла и поверхностным
давлениям адсорбированных паров л° при упругости насыщенных
паров Р°.
Таблица VII-2
Краевые углы при 20—25 °С
Углы натекания
Жидкос1ь (у, эрг/см2)
Твердое тело
9, град
dQ/dT,
град/К
nsv,
ЭРГ/СМ2
Ртуть (484)
Вода (72)
СН212 (67)
Формамид (58)
CS2 (-35е)
Бензол (28)
Пропанол (23)
«-Декан
л-Октан (21,6)
Тефлон
Стекло
я-Гексатриаконтан
Парафин
Тефлон
ПГа
Полипропилен
Полиэтилен
Кожа человека
Нафталин
Стибнит
Графит
Графой
Пиролитический углерод
Стеариновая кислота1"
Золото
Платина
Иодид серебра
Стекло
Тефлон
Парафин
Тальк
Полиэтилен
ПГ
Полиэтилен
Леде
Тефлон
/г-Гексатриаконтан
Парафин
Графит
Тефлон
Парафин
Тефлон
Тефлон
150
128—148
111
ПО
112
108
98
108
108
103
96
94
93
78
90
756
88в
84
86
82
72
80
66
40
17
Мал
85
61
60
53
46
40д
92
75
35
46
42
0
0
43
22
40
35
32
30
26
26
—0,05
—0,02
—0,01
—0,11
-0,13
43
19
59
228
98
-20Д
—0,06
—0,01
0,35
—0,11
-0,
—0,
8,8
-1,0
1,8; з,о
I
Поверхность раздела твердое тело — жидкость
283
Продолжение
Краевые углы в системах типа твердое тело—жидкость—жидкость
Твердое тело
Стибнит
Окись алюминия
Тефлон
и-Гексатриаконтан
Ртуть
Стекло
Жидкость 1
Вода
Вода
Вода
Бензиловый спирт
Вода
Парафиновое
масло
Вода
Ртуть
Жидкость 2
Бензол
Бензол
я-Декан
Вода
«-Декан
Вода
Бензол
Галлий
Краевой угол
130
22
~180
30
— 180
30
— 1005
~о
Литература
55
55
79
80
79
80
81
82
аСополимер политетрафторэтилена и гексафторпропилена.
"Неочищенная от природных жиров.
вМонокристалл.
гПленка Лэнгмюра — Блоджетт, нанесенная на медь.
дПолучено путем графического интегрирования данных, приведенных в работе [73].
Приблизительно при —10 °С.
Хотя для многих систем, приведенных в табл. VII-2, характерен
значительный гистерезис краевого угла, в большинстве опубликованных
работ, как правило, содержатся сведения только об углах натекания.
Значительный вклад в рациональное упорядочение данных по
краевым углам внесли Зисман и сотрудники. Они нашли, что для
гомологических жидкостей cos0 (угол натекания) обычно предста;вляет собой
монотонную функцию yL, и предложили следующее уравнение:
cos QSLV =a-byL = 1 - Р (Yl - Ъ)- (VII-36)
На рис. VII-12 приведены кривые зависимости cos0 от уь для
различных рядов жидкостей на тефлоне (политетрафторэтилен) [56]. При
определенном значении yL, называемом Зисманом критическим поверх-
w
0,8
0,6
со
§ 0,4
0,2
0,1
0 Ю 20 30 40 50
\
Рис. VI1-12. Кривые Зисмана для краевых углов различных жидкостей на тефлоне
[56].
/ — RX; 2 — алкилбензолы; 3 — «-алканы; 4 — диалкилэфиры; 5 — силоксаны; 6 — различные
полярные жидкости.
о
в
ф
•
D
А
/
2
3
4
5
6
ю84
Глава VII
Критическое поверхностное натяжение ус (дн/см) при 20°с
Ю 20 30 40 50
1 1 1 1 1 1 1 1 1 I
S3
1с
I
«о С
!»'
I о
к
^с с,
N,
81!
в
-CF,
1
—CF2H
|| | ' | FCFH-CH,-
f ~CF2— I CF2—CH2
-CF2- — CFa—CFH
Фторирование 1
U 1 1 1 U j
—CH3 —СН3 —СН2— 1 ^OKrrrr
—снг— —сн—
^Гидрирование
П 1 [
—сан—снг— | =са2
—cct2—сн—
Хлорирование> 1
—снон—сн2—
—С02— СН2— ,—СНгтг
АичН! 1 II III
-cLono -с(м°гЬ| tcom-™]
1—(101) 1
U Кристалл I Монослой | Полимер
Рис. VII-13. «Спектры» смачиваемости ряда низкоэнергетических поверхностей [80].
ностным натяжением ус, все прямые экстраполируются на нулевое 8.
Поскольку экстраполяция на 9=0 дает приблизительно одно и то же
значение ус, автор предположил, что 7с является величиной,
характеризующей данное твердое тело. Так, для тефлона ус, по-видимому,
определяется выходящими на поверхность CF2-rpynnaMH и принимается
равным приблизительно 18 эрг/см2.
Представление о критическом поверхностном натяжении позволяет
анализировать данные по смачиванию и сделать более или менее
надежные оценки (в основном интерполяционного характера) для новых
систем. Величины Yc для поверхностей различной природы
схематически обобщены на рис. VII-13 [59]. Обычно (3 в уравнении (VII-36)
приблизительно равен 0,03—0,04. Это позволяет, используя приведенные
на рис. VII-13 величины ус, оценивать с помощью уравнения (VII-36)
краевые углы в различных системах.
Как показывает практика, влияние температуры на краевой угол обычно не очень
велико. В табл. VI1-2 включены некоторые значения dQ/dT. Как правило, dQ/dT
приблизительно составляет —ОД град/К, однако для системы CS2 на поверхности льда
этот коэффициент имеет положительное значение. Довольно большое изменение
краевого угла с температурой наблюдается в системах типа Li—L2—S (см. работу [85]).
По температурному коэффициенту 0 можно рассчитать теплоту смачивания.
Дифференцируя уравнение (VII-18), получаем
</см = Esv - ESL = EL cos 9 - TyLd cos Q/dT. (VII-37)
Величины, входящие в обе части этого уравнения, можно определить
экспериментально по данным о теплотах смачивания и по данным о краевых углах. В принципе это
позволяет осуществить термодинамическую проверку уравнения Юнга. Правда,
осуществить такой эксперимент на практике довольно трудно, и к настоящему времени
в этом направлении сделана только одна предварительная попытка [19]. Обратите
внимание, что при 0, близких к 90°, т. е. при малых cos0, определяющую роль в
уравнении (VII-37) играет член с dcosQ/dT.
Величины л;0, поверхностного давления адсорбированных паров (тех жидкостей,
для которых измерены краевые углы), в литературе встречаются крайне редко.
Необходимые для расчета л° по уравнению (VII-13) адсорбционные данные в этом случае
нельзя получить обычным объемным методом (см. гл. XIV). Как известно, объемный
метод требует применения порошкообразных образцов (в которых адсорбция
достаточно велика), а в этом случае капиллярная конденсация между частицами приводит
к искажению изотерм адсорбции при давлениях выше ~0,9 Я0 [86]. В тр же время
Поверхность раздела твердое тело — жидкость
285
го
80
100
Декалин
о
Йодистый
метилен
Рис. VII-14. Краевые углы (натекания) смесей йодистого метилена и декалина на
полиэтилене [89].
40 60
05ъем%
данные по краевым углам обычно относятся к гладким макроскопическим поверхностям
твердых тел, и нет никакой уверенности в том, что свойства таких поверхностей
сохраняются такими же, как и в порошкообразных образцах. Более точные и надежные
результаты можно получить гравиметрическим методом (см. гл. XIV), в котором
количество адсорбированного вещества определяется непосредственно взвешиванием.
Для получения достаточной поверхности адсорбента можно использовать пачки из
200—300 тонких листков исследуемого материала [87]. Однако наиболее приемлема
в данном случае, вероятно, эллипсометрия: этот метод позволяет измерять толщину
адсорбированной пленки (см. разд. Ш-ЗГ) на той же гладкой и макроскопической
поверхности, на которой измеряется краевой угол. Влияние капиллярной конденсации
здесь исключается. Большинство приведенных в табл. VI1-2 значений л° получено
именно этим методом, причем л° и соответствующие краевые углы относятся к идентичным
поверхностям.
Обычно считают, что, если жидкость не смачивает поверхность, зх° можно
пренебречь. Однако, как видно из табл. VI1-2, нередко я0 составляет ощутимую долю
поверхностного натяжения жидкости (и может даже значительно превышать его).
Дальше этот вопрос обсуждается в разд. VII-5.
Влияние состава твердого тела на краевые углы исследовалось рядом авторов, в
частности Деттром и Джонсоном [51] (см. рис. VII-10). Эллисон и Зисман [88]
измерили краевые углы воды и различных органических жидкостей на полимерных
производных полиэтилена с различной степенью замещения —СН2-групп хлором и фтором.
Авторы получили нелинейную зависимость cosO от состава поверхности, только
приблизительно подчиняющуюся уравнению (VII-33). Правда, для некоторых систем
зависимость cosO — состав, выраженный в атомных процентах, почти линейная.
На краевой угол заметное влияние оказывает и состав жидкости; при этом
нередко наблюдаются регулярные зависимости типа приведенной на рис. VII-14 (обратите
внимание также на работу [69]) Разумеется, в присутствии растворенных
поверхностно-активных веществ краевой угол может меняться чрезвычайно сильно. Мы уже
говорили о системе гексадеканол в парафиновом масле на 4%-ном силикагеле в
качестве твердого тела (см. рис VII-11). Резкое увеличение \о cos 9 хорошо совпадает с
штриховой кривой, рассчитанной по полученным независимым способом данным:
A wo = yw —Уо-w-
Если считать, что поверхность силикагеля имеет практически такую же структуру, что
и поверхность воды, и отличается от последней лишь макроскопической жесткостью,
т. е. что Awo—Agei-w, то становится вполне ясно, каким образом на краевые углы
на самых разнообразных поверхностях влияет адсорбция поверхностно-активных
веществ.
Для обработки данных по влиянию поверхностно-активных веществ на краевые
углы воды Зисман и др. [90] в основном используют уравнение (VI1-36), т. е.
учитывают лишь уменьшение уь- Ясно, однако, что в данном случае важную роль играет и
адсорбция на двух других поверхностях. Именно поэтому не все величины YlCOsO
остаются постоянными, как можно было бы ожидать, если бы поверхностно-активное
вещество только снижало уь- Фоукс и Гаркинс [30] использовали изменение yi<cose
для расчета поверхностного давления при адсорбции «-бутилового спирта на
поверхностях раздела между водными растворами и такими твердыми телами, как парафин,
графит и тальк. Вводимое этими авторами неявное допущение о полной неизменности
поверхности раздела твердое тело — пар вряд ли можно признать корректным. Иссле-
286
Глава VII
дуя систему водный раствор дециламина — платина, Рач и Бартелл [91] непосред-
венно оценили адсорбцию дециламина на поверхности раздела платина — раствор и
затем использовали данные по адсорбции и краевым углам для того, чтобы с помощью
уравнения Юнга найти изменение свободной энергии на поверхности раздела твердое
тело — пар. Оказалось, что вследствие адсорбции дециламина изменение свободной
энергии открытой поверхности платины можег достигать 40 эрг/см2 [91]. Описанные
Зисманом и др. [56] аЕтофобные системы (см. разд. Ш-16Б) также указывают на
потенциальную важность природы пленки, адсорбированной на поверхности раздела
твердое тело — пар. Чтобы провести полное исследование трехфазной системы,
необходимо отдельно измерить адсорбцию поверхностно-активного вещества на всех трех
поверхностях раздела, что делается далеко не всегда.
5. Некоторые теоретические аспекты явлений,
связанных с образованим краевого угла
А. Термодинамика уравнения Юнга
Уравнение Юнга — уравнение (VII-18)—часто упоминалось в
предыдущем разделе. Любопытно, однако, что серьезная
экспериментальная проверка этого уравнения никогда не проводилась (если не
принимать во внимание работу [53] (разд. VII-ЗГ), поскольку поверхность
силикагеля, содержащего большое количество воды, вообще говоря, не
является поверхностью жесткого твердого тела). Проблема, конечно,
заключается в том, что измерить поверхностное натяжение твердого
тела сложно. Фоукс и Сойер [93] попытались проверить
экспериментально уравнение Юнга на примере системы жидкость —
стеклообразный фторуглеродный полимер. При этом они предположили, что
поверхностное натяжение стекла не отличается от поверхностного натяжения
его расплава, степень полимеризации которого меньше его же жидких
менее полимеризованных фракций. Однако исследование зародышеоб-
разования показывает, что межфазное натяжение между твердой и
жидкой фазами одинакового состава является вполне ощутимым, и
вряд ли это не проявилось в данном случае.
Бикерман [94] критикует вывод уравнения (VII-18), поскольку в
нем не учитывается вертикальная составляющая yLi равная YbSin6. Эта
составляющая является вполне реальной; на мягких поверхностях по
периферии капли образуется круглый гребень (см., например, работу
[46]). На более твердых поверхностях такого видимого влияния этой
составляющей не наблюдается, но определенное напряжение на
трехфазной границе, по-зидимому, все же возникает. Толщину линии
трехфазной границы, на которой локализована эта сила, оценить трудно,
однако если она молекулярного размера, то вертикальная
составляющая должна приводить к напряжениям, приближающимся к пределу
прочности даже очень жестких твердых тел. Поэтому, по мнению
автора, краевой угол определяется соотношением поверхностных
напряжений, а не величин свободной поверхностной энергии, что для
неравновесных твердых тел не одно и то же (см. разд. V-2).
Термодинамических доказательств того, что уравнение Юнга
представляет собой условие термодинамического равновесия на границе
трех фаз, включая несжимаемое твердое тело, не так уж мало (см.,
например, работу Джонсона [95]). Второй вопрос (попутно решаемый
в таких доказательствах)—это вопрос о возможности минимизации
полной свободной энергии системы при краевых углах, отличающихся
от краевого угла изолированной трехфазной границы. Этот вопрос
чрезвычайно важен при анализе поведения системы с краевым углом в
гравитационном поле, когда минимизация полной свободной
поверхностной энергии осложняется необходимостью аналитического решения
задачи о форме поверхности деформируемой капли. Простейший
пример такой системы — бесконечная капля — опять же приводит к
уравнению Юнга [92]. Лежа и Полинг [32] опубликовали тревожные ре-
Поверхность раздела твердое тело — жидкость
287
зультаты (с весьма убедительными фотографиями), показывающие, что
различие между краевыми углами воздушных пузырьков, сидящих на
поверхности раздела луцит — вода и прилипших к этой поверхности и,
следовательно, по-разиому подвергающихся воздействию силы тяжести,
может достигать 12°. Подобный неожиданный, если исходить из
уравнения Юнга, эффект наблюдали также Арон и др. [96] (см. также
разд. Х-4). Ломас [97] показал, что решение уравнения Лапласа для
наклонной капли приводит к различным краевым углам на переднем и
заднем фронте капли. Автор этой книги считает, что уравнение Юнга
на самом деле дает краевой угол на трехфазной границе, но только в
микроскопическом масштабе, тогда как измеряемый макроскопический
краевой угол в действительности зависит от геометрии системы,
определяемой силами тяжести.
При проверке уравнения Юнга, как и при проверке уравнения Гиб-
бса (см. разд. П-6), возникает еще один довольно общий вопрос: в
какой мере сохраняется смысл величин ysv и ysL в реальных системах?
Если, например, вертикальная составляющая yL, равная YLsin9,
приводит к значительному микроскопическому нарушению твердого тела,
то поверхностные свойства последнего в области трехфазной границы
не должны быть такими же, как на остальной поверхности. Опять же
большинство твердых тел обладает гетерогенными поверхностями (см.
разд. V-4B), для которых смысл величин ysv и ysL не вполне ясен.
Термодинамически данный вопрос можно решить двумя способами:
сравнивая теплоты смачивания с величинами, рассчитанными из
температурной зависимости краевого угла, либо сравнивая наблюдаемое
влияние растворенного поверхностно-активного вещества на краевой
угол с эффектом, рассчитанным по результатам независимых
адсорбционных измерений на всех трех поверхностях раздела.
Поскольку во все уравнения, описывающие трехфазную границу,
ysv и ysL всегда входят в виде разности, вполне вероятно, что именно
эта разность (адгезионное натяжение) является тем параметром,
который определяет свойства трехфазной границы. Изотерму адсорбции
паров на твердом теле можно представить в виде кривой, показанной
на рис. VII-1. Асимптотический бесконечный рост адсорбции при
приближении к давлению насыщенных паров означает, что при Р° твердое
тело находится в равновесии с жидкостью. Дерягин и Зорин [73]
отмечают (см. также [92]), что в трехфазной системе изотерма
адсорбции должна пересекать линию Р° и, как показано на рис. VII-15, имеет
область неустойчивости. Интегрирование уравнения Гиббса до первого
пересечения дает
го
n°=ys—ysvo=kT f TdlnP. (VII-38)
Рис. VII-15. Зависимость толщины адсорбированной Р1
пленки от давления [92]. Р
288
Глава VII
В то же время для бесконечно толстой и, следовательно, дуплексной
пленки можно записать
оо
/=Vs-Y5L-YL = *rJrdln/>. (VII-39)
г=о
Вычитая уравнение (VII-38) из уравнения (VII-39), получаем
оо
Узуо- (Ysl -f Yl) =ЬТ j Yd In P = A/, (VII-40)
r=ro
где А/ соответствует всей заштрихованной площади на рис. VII-15.
Отметим также, что А/ в точности равен коэффициенту растекания SLsv,
т. е.
A/=YL(cos9— 1). (VII-41)
Хотя интеграл А/ выражается через разность величин свободной
поверхностной энергии, он определяется независимо от каждой из этих
величин. Таким образом, наличие краевого угла можно рассматривать
как следствие способности к сосуществованию двух состояний —
объемной жидкости и тонкой пленки.
Б. Полуэмпирические модели.
Уравнение Джирифалко — Гуда — Фоукса — Юнга
В 1957 г. Джирифалко и Гуд [98] предложили модель, чрезвычайно
стимулиро'вавшую исследования явлений, связанных с образованием
краевых углов (см. разд. III-2A). Если считать, что две находящиеся
в контакте фазы взаимно полностью нерастворимы, имеют
одинаковый молярный объем и взаимодействуют только посредством вандер-
ваальсовых сил, причем постоянные взаимодействия подчиняются
правилу среднего геометрического (т. е. в уравнении (VII-23) CitAB=
= (CijAaCi,Bb)1/2), to межфазное натяжение (или, точнее, межфазная
энергия) в этой системе должно подчиняться уравнению:
Уав=Уа + YB-2 (VaYbY'*- (VH-42
Объединяя урав/нение (VII-42) с уравнением Юнга, получаем
соотношение [98]
cos 0=_1 -,- 2 (y5/Yl)1/2-^/Yl, (VH-43)
где член —JisvlyL дает поправку на адсорбцию паров на поверхности
твердого тела. (Действительно, так как краевой угол является
равновесным свойством, твердое тело должно находиться в равновесии с
насыщенными (при Р°) парами жидкости.) Обычно этим членом
пренебрегают в основном из-за отсутствия соответствующих данных;
имеются, правда, указания на то, что при больших 6 он всегда пренебрежимо
мал.
Если членом —п%у!уь в уравнении (VII-43) пренебречь, то cos8
должен быть линейной функцией 1/Yyl- Действительно, данные,
полученные для различных жидкостей на тефлоне, неплохо ложатся на прямую
линию в координатах cos9—1Ууь [99]. Позднее Гуд [98]
усовершенствовал эту модель, введя в потенциальную функцию дополнительный
член, учитывающий дипольное взаимодействие.
Фоукс [100] ввел еще одно очень полезное допущение. Он замети.-.
что, если жидкость полярная (например, если это вода) основной вклг!
в энергию межмолекуляриого взаимодействия, обусловливающего ве-
Поверхность раздела твердое тело— жидкость
289
-30
* -40
-5,0
Рис. VII-16. Форма капли на- -/,0 0 /,0 2,0
наклонной поверхности [97] х ММ
личину yL, вносят водородные связи и различные дюпольные
взаимодействия, которые не играют важной роли на поверхности раздела,
скажем, вода — углеводород. По мнению Фоукса, взаимодействие фаз через
такие поверхности раздела осуществляется в основном за счет
дисперсионных сил. Исходя из этого, автор привел уравнение (VII-42) к виду
Уав=Уа + Ув-2(Уа У*в)У\ (VII-44)
где yd — эффективное поверхностное натяжение, обусловленное ван-
дерваальсовой составляющей межфазного натяжения. Для предельного
углеводорода (Н) принимается, что уйн^=ун, и следовательно, для воды
(W) расчетное значение у^ составляет 22 эрг/см2; для ртути Yh =
= 200 эрг/см2. Далее предполагается, что для данного вещества A ydA
имеет одно и то же значение на любой поверхности раздела АВ. Это
позволяет рассчитывать значения yd для других жидкостей и оценивать
поверхностное натяжение между двумя полярными жидкостями.
Теперь уравнение (VII-43) переходит в
cos6=-l +2(Y£ ydL)1/2/yL (VII-45)
(член — nsv/уь по-прежнему опускается). Уравнение (VII-45) можно
называть уравнением Джирифалко—Гуда—Фоукса—Юнга. Согласно
этому уравнению, если у исследуемой жидкости у^=уь, критическое
поверхностное натяжение Зисмана соответствует у*. Рассмотренная
модель объясняет, почему, например, вода, будучи полярной
жидкостью, по отношению к углеводородам ведет себя так, как будто ее
поверхность является неполярной (это не означает, конечно, что
полярное взаимодействие не играет важной роли при контакте воды и
углеводорода, см. разд. XIV-12B).
В довольно обстоятельном обзоре Фоукса [101] величины yd
связываются с дисперсионным взаимодействием (см. гл. VI) и,
следовательно, с постоянными Гамакера.
Вернемся к вопросу, имеем ли мы достаточно оснований, чтобы пренебречь
величиной лДгв уравнениях (VII-43) и (VII-45). Прежде всего можно показать, что
модель Джирифалко — Гуда теоретически применима и при больших значениях n°sv [92].
Пользуясь данными табл. VI1-2, проведем ряд иллюстративных расчетов. Рассмотрим
систему я-октан — тефлон, для которой 0=26° и ysyo =Ij8 эрт/сы2. Принимая V* = У1
и отбрасывая член — п*у1уь, находим Ys = 19,5. Если отброшенный член учесть, то в
19—1421
290
Глава VII
результате ys станет равным 21,2 эрг/см2, т. е. почти на 2 эрг/см2 выше. Величина
1,8 эрг/см2, вероятно, занижена, поскольку в ней не учтена часть изотермы адсорбции,
соответствующая низкому давлению.
Если мы примем для тефлона «обычное» значение yd, равное 19,5 эрг/см2, и
попробуем рассчитать уL для воды из данных по краевым углам, то окажется, что результат
расчета весьма заметно зависит от выбранного значения 9. Пренебрегая л%у, мы
получим для воды при 9=98, 112 и 115° следующие значения yf} 49,3; 26,0 и 22,1 эрг/см2.
Если же в расчет включить член с я^у, то yL составит соответственно 64,2; 37,1 и
32,5 эрг/см2. Следовательно, во всех трех случаях член —л^у/уь оказывает довольно
большое влияние.
Именно поэтому как в уравнение (VII-43), так и в его аналог уравнение (VII-45)
обычно входит поправочный член л£у1уь> учитывающий давление адсорбированной
пленки. Важность этого члена можно оценить, сопоставив вводимую им поправку с
cos9. В большинстве приведенных в табл. VII-2 примеров л^у/уь колеблется в
интервале от 0,1 до 0,3. Соответствующая этим величинам поправка к 0 составляет от 25
до 45° при малых 0 и от 5 до 10° при 0, близком к 90°.
Полезность представления о критическом поверхностном натяжении и важность
уравнения (VI1-45) не вызывают сомнений. Желательно только, чтобы уравнения для
Yc и cos0 были представлены в виде, в котором л^у не будет игнорироваться.
Необходимо только лучше понять термодинамические и структурные свойства
адсорбированных пленок и пограничного слоя на поверхности раздела жидкость — твердое тело.
В работе Ньюмэна и др. [101а], где этот вопрос обсуждается несколько более
подробно, дано соответствующее «уравнение состояния».
В. Модель, учитывающая потенциальную функцию
и нарушение структуры пленки
Еще один, уже совершенно иной подход к рассматриваемым явлениям
заключается в исследовании возможных форм изотерм адсорбции, получаемых с помощью
уравнения (VII-41). В разд. XIV-7 довольно подробно обсуждается предположение Поляни
(1914 г.) о том, что адсорбция возникает вследствие сжатия паров в потенциальном
поле твердого тела е(х) и что при достаточной силе сжатия происходит конденсация
жидкого адсорбата. Обозначим поле, необходимое для конденсации паров, г0(х), тогда
e0 = kT \nP°'/P, (VII-46)
где Р0' — давление пара над жидкой пленкой. Если весь объем адсорбированного
вещества отнести к конденсированному жидкоподобному слою, то Г—x/d3, где d —
размер молекулы, подобранный таким образом, чтобы d3 был равен объему молекулы.
Холси и др. [102] задают г(х) уравнением (VI-24), но для наших целей удобнее
использовать экспоненциальную потенциальную функцию е0 = £0е-аху определяемую
уравнением (VI-41). При этом уравнение (VI1-46) принимает следующий вид:
kT In Р°'/Р = гЧ~ах\ Г = x/d3. (VII-47)
Подстановка этих соотношений в уравнение (VII-11) дает соответствующее
аналитическое выражение для л (см. работу [92]).
Изотерма адсорбции, соответствующая уравнению (VII-47) (рис. VII-1), не
может объяснить природу краевого угла. Способность жидкой пленки сосуществовать
с объемной жидкостью в условиях образования краевого угла показывает, что под
действием твердого тела структура жидкости в пленке меняется. Эмпирически это
изменение структуры учитывается эффективной упругостью Р0', отличной от Р°.
Эффективная упругость паров Р0' представляет упругость насыщенных паров, которую
имела бы нормальная жидкость, если бы ее структура была такой же, как структура
пленки. Такое структурное возмущение должно релаксировать с увеличением толщины
пленки, что можно описать экспоненциальным выражением
kT In po'/po = pe~a\ (VII-48)
где Р° — упругость паров объемного жидкого адсорбата.
Решая совместно уравнения (VII-47) и (VII-48), получаем
kT In РУР =■ гЧ'ах - §е~ах (VII-49)
Теперь эта изотерма имеет форму, показанную на рис. VII-15, причем х0 определяется
условием г0е~~ах°=$е~аХо-Используя уравнение (VII-49) в качестве подынтегральной
функции в уравнении (VII-40), получаем
А/ = (е%*3) е~ах° (1/д — 1 /а). (VII-50)
Как следует из уравнения (VII-41), только при условии, что А/<0, краевой угол
имеет вполне определенное значение. Из уравнения (VI1-50) видно, что это условие
выполняется лишь тогда, когда поле адсорбционного потенциала ослабевает быстрее,
чем релаксирует структура жидкости.
Поверхность раздела твердое тело — жидкость
291
Р/Р°=0,37
Рис. VII-17. Адсорбция воды на пиролитическом углероде (с 10%-ной добавкой Si)
при 21,5 °С [68].
1 — (е°/£Г)ехр(—ах), 2 — ($/kT)exp(—ах)', 3 — разностная кривая, соответствующая уравнению
(VII-49); Л — экспериментальные данные.
На рис. VI1-17 показаны результаты проверки уравнения (VII-49) по эллипсомет-
рическим данным для адсорбции воды вблизи Р° на гладкой поверхности кремния,
покрытого пиролитическим углеродом [68]. Подстановка найденных таким образом
параметров уравнения (VII-41) дает расчетный краевой угол 72°, что соответствует
экспериментальному значению.
Параметр нарушения структуры Р должен включать не только энергетический, но
и энтропийный член (во всяком случае нет никаких причин, почему бы это было не
так), и, следовательно, можно записать: р = р0—sT. Тогда изменение энтропии
вследствие адсорбции (по отношению к объемной жидкости) имеет вид AS°=sexp (—ах). Из
выражения Р = Ро—sT следует, что существует некая критическая температура Гс =
= Po/s, при которой краевой угол стремится к нулю [79]. Например, в системе я-ок-
тан — тефлон расчетное значение Тс, соответствующее данным по адсорбции и
краевым углам, составляет 174 °С.
В этой связи возникает еще один интересный вопрос: что происходит, когда
толстая адсорбированная пленка (например, пленка жидкости на стекле [73] или
адсорбированная при Р° пленка воды на пиролитическом углероде [68]) покрывается
объемной жидкостью? Сохраняет ли, в частности, толстая межфазная пленка при
погружении твердого тела в жидкий адсорбат свою толщину и структуру, образуя поверхность
раздела с объемной жидкостью, или же свойства пленки монотонно меняются от
поверхности твердого тела к жидкости? Этот вопрос, по-видимому, еще не.изучен, хотя
его решение имело бы важное значение для проблем, связанных с течением жидкостей
и выбором оптимальных моделей для адсорбции из растворов (см разд. IX-1).
6. Упражнения
1. По данным Дандона и Мака, растворимость частиц CaF2 размером 0,3 мкм
на 18% выше нормальной растворимости CaF2. Рассчитайте межфазное натяжение в
системе CaF2 — вода.
2. Найдите кажущийся радиус частиц SrS04, растворимость которых на 3% выше
нормальной. Межфазное натяжение при 25 °С считайте равным 85 эрг/см2. Приравняв
поверхностное натяжение поверхностной энергии, оцените увеличение теплоты
растворения SrS04 (кал/г) за счет поверхностной энергии.
3. Для системы вода —графит получены следующие данные: энергия адгезии при
25 °С равна 280 эрг/см2, поверхностное натяжение "воды при 20; 25 и 30 °С составляет
72,8; 72,0 и 71,2 эрг/см2 соответственно; краевой угол при 25 °С равен 90°.
Рассчитайте для 25 °С: а) теплоту смачивания графита водой; б) адгезионное натяжение
воды и графита: в) работу адгезии в системе вода —графит и г) коэффициент
растекания воды на графите.
19*
292
Глава VII
4. Рассчитайте теплоту смачивания тефлона я-деканом при 25 °С, если известно,
что краевой угол равен 32° и dQ/dT равно —0,12 град/°С.
5. С помощью соответствующего термодинамического цикла покажите, что член
TAHV действительно должен входить в уравнение (VII-15).
6. Для системы н-декан — тефлон получены следующие оценочные значения л:0:
0,82 эрг/см2 при 15 °С и 15,4 эрг/см2 при 70 °С [77]. Рассчитайте разность теплот
смачивания я-деканом чистого и покрытого равновесной при Р° адсорбированной пленкой
1 см2 тефлона при 25 °С.
7. Выведите уравнение (VII-26). Рекомендуется прибегнуть к методике,
использованной при выводе уравнения (1-15).
8. Интегрируя второй раз уравнение (VII-26), выведите уравнение для профиля
мениска в методе Ньюмэна. Постройте этот профиль в координатах у/а—х)а, где у—
вертикальный подъем точки мениска (над плоской поверхностью жидкости), х —
расстояние точки от пластинки и а — квадратный корень из капиллярной постоянной. (На
этой кривой можно расположить все возможные профили мениска независимо от
величины краевого угла.)
9. Работая с пористой таблеткой из прессованной сажи, Бартелл и др. [40]
получили следующие данные по капиллярным давлениям. Бензол, который смачивает
сажу, характеризуется капиллярным давлением 6200 г/см2. Капиллярное давление воды
равно 12 000 г/см2, при вытеснении воды бензолом развивается давление 5770 г/см2.
Рассчитайте краевые углы в системах вода — сажа и вода — бензол — сажа, а также
адгезионное натяжение поверхности раздела бензол — сажа.
10. По данным Бартелла и др. [103], давление, необходимое для вытеснения
воздуха водой из смоченного водой минерала барита, составляет 1,02 -105 дн/см2; бром-
нафталин (А) вытесняет воздух при давлении 5,7* 103 дн/см2, а воду — при давлении
5,2-104 дн/см2. Поверхностное натяжение А равно 44 эрг/см2, а межфазное натяжение
в системе вода — А составляет 46 эрг/см2. Рассчитайте кажущийся радиус пор в барите,
краевой угол между баритом и Л и между баритом, водой и А. Рассчитайте также
адгезионное натяжение между водой и баритом, между А и баритом, работы адгезии
этих двух жидкостей к бариту и относительные давления растекания.
11 Используя данные табл. VII-2, оцените краевой угол бензола на стибните и
соответствующее адгезионное натяжение.
12. С помощью данных, приведенных в табл. VII-2, оцените краевой угол галлия
на стекле и соответствующее адгезионное натяжение. При 25 °С межфазное
натяжение в системе галлий — ртуть составляет 37 эрг/см2, а поверхностное натяжение
галлия равно приблизительно 700 эрг/см2.
13 При 25 °С краевой угол я-декана на тефлоне равен 35°. Поверхностное
давление адсорбированного я-декана на тефлоне может достигать 9 эрг/см2. Оцените вклад
поверхностного давления в 9, т. е. рассчитайте 0 или К при условии, что поверхностное
давление адсорбированной пленки равно нулю, а все остальные свойства поверхностей
раздела являются такими же.
14. Для системы вода — твердый нафталин при 25 °С получены следующие данные:
краевой угол — 90°; поверхностное натяжение и поверхностная энергия воды — 72 и
200 эрг/см2 соответственно; энергия адгезии воды к нафталину — 290 эрг/см2.
Рассчитайте а) энергию смачивания 1 см2 поверхности кристаллов нафталина водой, б)
работу адгезии воды к нафталину, в) адгезионное натяжение воды на нафталине и
г) коэффициент растекания воды на нафталине. Адсорбцией паров воды на твердом
нафталине во всех этих случаях можно пренебречь. Далее, д) начертите изотерму
адсорбции воды на нафталине, обратив особое внимание на область Р/Р° от 0,3 до 1,0.
Отразите основные особенности изотермы адсорбции для рассматриваемой системы.
15. Покажите, что адсорбированный монослой должен подчиняться уравнению
состояния двумерного идеального газа, если у—у0—ЬС, где С — концентрация раствора
поверхностно-активного Еещества, у и у0— поверхностное натяжение раствора и
чистого растворителя соответственно.
16. По данным Фоукса и Гаркинса, краевой угол воды на парафине при 25 °С
равен 111°. Поверхностное натяжение 0,1 М раствора бутиламина составляет
-56,3 дн/см; краевой угол этого раствора на парафине равен 92°. Рассчитайте при
разумных допущениях поверхностное давление бутиламина, адсорбированного на
поверхности раздела парафин — вода.
17. Объединяя уравнение, описывающее лапласовское давление, развиваемое в
мениске между твердым телом и его расплавом, с уравнением Клапейрона, можно
получить уравнение, весьма похожее на (VII-6). Выведите это выражение и сравните его
с уравнением (VII-6). [см. Everett H., Trans. Faraday. Soc, 57, 1541 (1961)].
18. Пользуясь соответствующими данными из табл. 1-8, с помощью простого
уравнения Джирифалко — Гуда и затем его модификации, предложенной Фоуксом
[уравнение (VII-33)], рассчитайте межфазное натяжение в системе вода — ртуть.
19. Имеются следующие данные:
Поверхностное натяжение Краевой угол на тефлоне ... ._
0 оС 20 °С ^и J() ,рад '
«-Октан 23,8 21,8 30 —0,125
«-Декан 26,1 23,9 <Ю —0,10
Поверхность раздела твердое тело— жидкость
293
Рассчитайте a) Es для я-октана и я-декана, б) Е* —критическую поверхностную
энергию для тефлона в приближении Зисмана; в) Es для тефлона, используя простое
уравнение Джирифалко — Гуда (эта величина рассчитывается так же. как ELS для
поверхности раздела я-октан — тефлон; г) краевой угол я-гексадекана на тефлоне при
170 °С с помощью соответствующих интерполяций и экстраполяции (экспериментальное
значение краевого угла равно 48°).
20. Получены следующие данные и сделаны следующие допущения: /) при 25 °С
поверхностное натяжение я-гексадекана и я-декана составляет 28 и 24 эрг/см2
соответственно; 2) поверхностное натяжение смеси этих углеводородов — линейная функция
мольной доли компонентов, т. е. смесь ведет себя как некоторый жидкий углеводород
со средней длиной цепи; 3) величина критического поверхностного натяжения для
тефлона и полиэтилена равна 20 и 30 эрг/см2 соответственно, а для сополимера является
линейной функцией ее состава; 4) краевой угол я-гексадекана на тефлоне равен 46°
и независимо от состава сополимера все зиомановокие cos 9 — у-кРивые параллельны.
Рассчитайте а) краевой угол 50%-ной смеси я-гексадекана и я-декана на
сополимере тефлон — полиэтилен (50:50); б) длину цепи углеводорода, имеющего на 60%-ном
полимере такой же угол, как в случае (а); в) предельное содержание тефлона в
полимере, на котором я-декан еще способен растекаться; ответьте на вопросы а) и в),
учитывая на этот раз коэффициент шероховатости; фактор шероховатости поверхности
полимера равен 1,1.
21. При 100 °С поверхностное натяжение натрия и ртути равно 220 и 460 эрг/см2,
а их краевые углы на стекле составляют 66 и 143° соответственно. Оцените при
соответствующих допущениях поверхностное натяжение стекла. Подробно объясните
методику расчета.
22. Предположим, что одним из запланированных экспериментов экипажа
космического корабля является измерение краевых углов для нескольких систем (чтобы
проверить, насколько они могут измениться в отсутствие сил тяжести). Обсудите ряд
пригодных и непригодных для решения этой задачи методов.
23. При полете космического корабля к Луне обнаруживается странный дефект.
По программе после некоторого периода свободного полета должен включиться
двигатель, питаемый топливом из отдельного бака. Однако при включении зажигания
воспламенения топлива не произошло. В ходе интенсивных консультаций специалист по
химии поверхностных явлений высказал пугающую догадку, что топливо плохо
смачивает стенки бака и что в условиях космического полета в отсутствие сил тяжести
топливо собирается в шар, не контактирующий со стенками бака, как показано на
рис. VII-18, а. В то же время для нормального функционирования системы
необходимо, чтобы жидкость располагалась в баке так, как показано на рис. VIII8, б
Инженерам срочно потребовалось выяснить, при каких операционных или
физических свойствах системы условия, отвечающие рис VII-18, б, окажутся более
стабильными. Тот же специалист построил график, приведенный на рис. VII-18, в, на
котором fi и f2 обозначают определенные функции времени работы двигателя и
поверхностных характеристик бака и топлива соответственно. Бак предположительно имеет
сферическую форму.
Какими соображениями руководствовался специалист по химии поверхностных
явлений? Какой вид имеют функции fr и f2? Рассчитайте пограничную кривую между
условиями «нормальная подача топлива» и «отсутствие подачи топлива». Что должен
делать экипаж космического корабля?
К насосу
К насосу
Топливо
не подается
Нормальная
подач си
топлива*
^-0^ +
Рис. VII-18.
294
Глава VII
24 При 25 ° краевой угол этиленгликоля на парафине равен 83°. Поверхностное
натяжение и yL этиленгликоля составляют 48,3 и 28,6 дн/см соответственно. Для
воды эти величины равны 72,8 и 22,1 дн/см. Пренебрегая поверхностными давлениями
адсорбированных пленок я°у, рассчитайте из приведенных данных краевой угол воды
на парафине.
25 Каково критическое поверхностное натяжение кожи человека? Найдите все
необходимые данные и постройте зисмановскую зависимость краевого угла кожи от
поверхностного натяжения водно-спиртовой смеси (обратите внимание на работу [69]).
26. По рис. VII-16 оцените параметры е°, (3, а и а и рассчитайте А/ и cosG.
27. Исходя из краевого угла я-пропанола на тефлоне, рассчитайте для «-пропано-
ла yL а) с учетом и б) без учета n^L. Поверхностное натяжение тефлона у примите
равным 19,5 дн/см.
28 Рассчитайте для нафталина величину yL , считая, что между водой и
нафталином существует только дисперсионное взаимодействие.
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Advances in Chemistry, No. 43, American Chemical Society, Washington, D. C, 1964.
Davies J. Т., Rideal E. K., Interiacial Phenomena, Academic Press, New York, 1963.
De\ay R , Prigogine I., Surface Tension and Adsorption, Wiley, New York, 1966.
Johnson R. E, Jr., Dettre R. Я, Surface and Colloid Science, Vol. 2, Matijevic E., ed ,
Wiicy-Interscience, New York, 1969.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Enustiin В. V., Turkevich /, J. Amer. Chem. Soc, 82, 4502 (1960).
2 Dundon M. L, Mack E., J. Amer. Chem. Soc, 45, 2479 (1923); Dundon M. L,
J. Amer. Chem Soc, 45, 2658 (1923).
3. Balarew D., Kolloid Z, 96, 19 (1941); 97, 300 (1941).
4. Cohen E., Blekkingh J. J. A., Jr., Z. Phys. Chem, 186, 257 (1940).
5. van Zeggeren F., Benson G. C, Can. J Chem., 35, 1150 (1957).
<6 Knapp L. F., Trans. Faraday Soc, 18, 457 (1922).
7. Buckley H. E, Crystal Growth, Wiley, New York, 1951.
8 Skapski A , Billups R., Rooney A , J. Chem. Phys., 26, 1359 (1957).
9 Ketcham W. M.t Hobbs P. V., Phil. Mag., 19, 1161 (1969).
10. Hardy S. C, Coriell S. R.f J. Cryst. Growth, 5, 329 (1969).
11. Melrose J. C, J. Colloid Interface Sci., 24, 416 (1967).
12 Makrides А С, И acker man N., J. Phys. Chem., 63, 594 (1959).
13. Whalen J. W., Advances in Chemistry, Series, No. 33, American Chemical Society,
Washington D. C, 1961, p. 281; J. Phys. Chem., 65, 1676 (1961).
14. Boyd G. E., Harkins W. D., J. Amer. Chem. Soc, 64, 1190 (1942).
15 Zettlemoyer A. C, Chessick J. J., Advan. Chem. Ser, No. 43, p. 88 (1964).
16. Zettlemoyer A. C, Ind. Eng. Chem, 57, 27 (1965).
17. Harkins W D., The Physical Chemistry of Surfaces, Reinhold, New York, 1952.
18 Wade W. H., Hackerman N., Advances in Chemistry Series, No. 43 American
Chemical Society, Washington, D. C, 1964, p. 222.
19 Whalen /. W., Wade W. H.t J. Colloid Interface Sci, 24, 372 (1967).
20. Chessick /. /., Zettlemoyer A. C, Healey F. H, Young G. /, Can. J Chem, 33, 251
(1955)
21. Healey F. H., Yung-Fang Yu, Chessick J. J., J. Phys. Chem, 59, 399 (1955).
22. Venable R. /-., Wade W. H, Hackerman N., J. Phys. Chem, 69, 317 (1965).
23 Young T, Miscellaneous Works, Vol. I. Peacock I. G, ed , Murray, London, 1855,
p 418
24 Dupre A, Theorie Mecanique de la Chaleur, Paris, 1869, p 368.
25 Melrose J. C, Advances in Chemistrv Series, No. 43, American Chemical Society,
Washington, D C, 1964, p. 158.
26 Bangham D. H, Razouk R. L, Trans Faraday Soc, 33, 1459 (1937); Chem Abstr,
45, 9956 (1951).
27 Harkins W. D., Livingston H. /C, J. Chem. Phys , 10, 342 (1942).
28 Bartell F. E, Bartell L. 5, J. Amer. Chem. Soc, 56, 2205 (1934).
28a. Neumann A. W., Good R. J, Surface Colloid Techniques, Vol. 1, Plenum Press, New
York, 1976.
29. Adam N. K., Jessop G, J. Chem Soc, 1925, 1863
30 Fowkes F. M., Harkins W. Z), J. Amer. Chem Soc, 62, 3377 (1940).
31 Bigelow W. C, Pickett D. L., Zisman W. A., J. Colloid Sci, 1, 513 (1946);
Johnson R. E.} Dettre R. Я, op. cit, 20, 173 (1965).
32. Leja /, Poling G. W., Preprint, International Mineral Processing Congress, London,
April, 1960.
Поверхность раздела твердое тело — жидкость
295
33. Ottewill R. Н., private communication; see also Gaudin А. Af, Flotation, McGraw-
Hill, New York, 1957, p. 163.
34. Adamson A. W.} Shirley F. P., Kunichika К. Т., J. Colloid Interface Sci., 34, 461
(1970).
35. Neumann A. W., Renzow D., Z. Phys. Chemie Neue Folge, 68, 11 (1969); Funke W.,
Hellweg G. E. H., Neumann A. W., Angew. Makromol. Chemie, 8, 185 (1969).
36. Neumann A. W., Z. Phys. Chem. Neue Folge, 41, 339 (1964).
37. Bartell F. E„ Zuidema H. H., J. Amer. Chem. Soc, 58, 1449 (1936).
38. Rehbinder P., Lipetz M., Rimskaja M., Taubmann A., Kolloid-Z., 65, 268 (1933).
39. Bikerman J. /, Ind. Eng. Chem., Anal. Ed., 13, 443 (1941).
40. Bartell F. E., Walton C. W., Jr., J. Phys. Chem., 38, 503 (1934); Bartel F. E.,
Whitney C. E., J. Phys. Chem., 36, 3115 (1932); Bartell F. E., Osterhof H. /, Colloid
Symposium Monograph, The Chemical Catalog Company, New York, 1928, p. 113.
41 Wenzel R. N., Ind. Eng. Chem, 28, 988 (1936); J. Phys. Colloid Chem, 53, 1466
(1949).
42. Cassie A. B. D„ Discuss. Faraday Soc, 3, 11 (1948).
43. Shuttleworth R., Bailey G. L. /, Discuss. Faraday Soc, 3, 16 (1948).
44. Good R. J., J. Amer. Chem. Soc, 74, 5041 (1952); Eick /. D., Good R. /,
Neumann A. W., J. Colloid Interface Sci, 53, 235 (1975).
45. Baxter S., Cassie A. B. D., J. Textile Inst, 36, T67 (1945); Cassie A. B. D.,
Baxter S., Trans. Faraday Soc, 40, 546 (1944).
46. Dettre R. #, Johnson R. E., Jr., Symp. Contact Angle, Bristol, 1966.
47. Dettre R. H., Johnson R. E., Jr., Advances in Chemistry, No. 43, American Chemical
Society, Washington, D. C, 1964, p. 112, 136. См. [44].
48. Schwartz A. M., Minor F. W„ J. Colloid Sci, 14, 584 (1959).
49. Johnson R. E., Jr., Dettre R. H., J. Phys. Chem, 68, 1744 (1964).
50. Pease D. C, J. Phys. Chem, 49, 107 (1945).
51. Dettre R. H., Johnson R. E., Jr., J. Phys. Chem, 69, 1507 (1965).
52. Michaels A. S., Lummis R. C, private communication.
53. Michaels A. S., Dean S. W„ Jr., J. Phys. Chem, 66, 1790 (1962).
54. Good R. /, Kvikstad J. A., Bailey W. O, J. Colloid Interface Sci, 35, 314 (1971)
55. Bartell F. E., Osterhof H. /, Colloid Symposium Monograph, The Chemical Catalog
Company, New York, 1928, p. 113.
56. Zisman W. A., Advances in Chemistry, No. 43, American Chemical Society
Washington, D. С 1964.
57. International Critical Tables, Vol. IV, McGraw-Hill, New York, 1928, p. 434.
58. Livingston H. /C, J. Phys. Chem, 48, 120 (1944).
59. Fox H. W., Zisman W. A., J. Colloid Sci, 7, 428 (1952).
60. Dann /. R., J. Colloid Interface Sci, 32, 302 (1970).
61. Ни Р., Adamson A. W., unpublished results.
62. Whalen J. W, Vacuum Microbalance Techniques, Czanderna A. W, ed. Vol. 8,
Plenum Press, 1971.
63. Petke F. D.f Ray B. R., J. Colloid Interface Sci, 31, 216 (1969).
64. Schonhorn H, J. Phys. Chem, 70, 4086 (1966).
65 Schonhorn H., Nature, 210, 896 (1966).
66. Zettlemoyer A. C, J. Colloid Interface Sci, 28, 343 (1968).
67. Schonhorn tf, Ryan F. W., J. Phys. Chem, 70, 3811 (1966).
68. Tadros M. E., Ни P., Adamson A. W., J. Colloid Interface Sci, 49, 184 (1974).
69. Adamson A. W., Kunichika K., Shirley F., Orem M., J. Chem. Ed, 45, 702 (1968).
70. El-Shimi A., Goddard E. D., J. Colloid Interface Sci, 48, 242 (1974).
71. Jones J. В., Adamson A. W., J. Phys. Chem, 72, 646 (1968).
72. Koutsky J. Л, Walton A. G., Baer E., Surface Sci, 3, 165 (1965).
72a. Boyd G. E., Livingston H. K., J. Amer. Chem. Soc, 64, 2383 (1942).
73. Derjaguin B. V., Zorin Z. M., Proc. 2nd Intern. Congr. Surface Activity, London,
1957, Vol. II, p. 1'45.
74. Fox H. W., Hare E. F., Zisman W. W. Л, J. Phys. Chem, 59, 1097 (1955); Levi-
ne O, Zisman W. A , J. Phys. Chem, 61, 1068, 1188 (1957).
75. Good W. R., J. Colloid Interface Sci, 44, 63 (1973).
76. Sutula С L, Hautala R., Dalla Betta R. A., Michel L. A., Abstracts, 153rd Meeting,
American Chemical Society, April, 1967.
77. Fox H. W., Zisman W. Л, J. Colloid Sci, 5, 514 (1950).
78. Newmann A. W., Haage G., Renzow D., J. Colloid Interface Sci, 35, 379 (1971).
79. Adamson A. W., J. Colloid Interface Sci, 44, 273 (1973).
80. Shafrin E. G, Zisman W. A. J. Phys. Chem, 64, 519 (1960).
81. Bascom W. D., Singleterry С R., J. Phys. Chem, 66, 236 (1962).
82. Peper Я, Berch J., J. Phys. Chem, 68, 1586 (1964).
83. Butler E. В., J. Phys. Chem, 67, 1419 (1963).
84. Good R. /, Givens W. G, Tucek С S., Advances in Chemistry, No. 43, American
Chemical Society, Washington, D. C, 1964.
85. Phillips M. C, Riddiford A. C, Nature, 205, 1005 (1965).
86 Wade W. H., Whalen J. W., J. Phys. Chem, 72, 2898 (1968).
87. Blake T. D.t Wade W. H., J. Phys. Chem, 75, 1887 (1971).
296
Глава IV
88. Ellison A. Я., Zisman W. A., J. Phys. Chem., 58, 260 (1954).
89. Baszkin A., Ter-Minassian-Saraga L., J. Colloid Interface Sci., 43, 190 (1973).
90. Bernett M. K., Zisman W. A., J. Phys. Chem., 62, 1241 (1959).
91. Ruch R. J., Bartell L. S., J. Phys. Chem., 64, 513 (1960).
92. Adamson A. W., Ling L> Advances in Chemistry, No. 43, American Chemical Society,
Washington, D. C, 1964.
93. Fowkes F. M., Sawyer W. M., J. Chem. Phys., 20, 1650 (1952).
94. Bikerman J. /., Proc. 2nd Intern. Congr. Surface Activity, London, 1957, Vol. Ill,
p. 125.
95. Johnson R. £., Jr., J. Phys. Chem., 63, 1655 (1959).
96. Арон Я. Б., Френкель Я. И., Журн. эксп. и теор. физ., 20, 453 (1950).
97. Lomas H., J. Colloid Interface Sci., 33, 548 (1970). Princen H. M., ibid.. 36, 157
(1971); Lomas H.f ibid., 37, 247 (1971).
98. Girifalco L. A., Good R. J.} J. Phys. Chem., 61, 904 (1957). Good R. J., Advances
in Chemistry, No. 43, American Chemical Society, Washington, D. C, 1964, p. 74.
99. Good R. J., Girifalco L. A., J. Phys. Chem., 64, 561 (1960).
100. Fowkes F. M., J. Phys. Chem., 67, 2538 (1963); Advances in Chemistry, No. 43,
American Chemical Society, Washington, D. C, 1964, p. 99.
101. Fowkes F. M., Chemistry and Physics of Interfaces, Ross S., ed. ,American Chemical
Society, 1971.
101a. Neumann A. W., Advances in Colloid and Interface Science, 4, 105 (1974);
Neumann A. W., Good R. J., Hope C. J., Sejpal M., J. Colloid and Interface Science,
49 291 (1974).
102. Halsey G. D., J. Chem. Phys., 16, 931 (1948).
103. Bartell F. E, Jennings H. Y., J. Phys. Chem., 38, 495 (1934).
104. Arnold J. R.t J. Amer. Chem. Soc, 71, 104 (1949).
ГЛАВА VIII
Образование новой фазы.
Зародышеобразование и рост кристаллов
1. Введение
Изучение кинетики и механизма образования новой фазы, например
при конденсации пара, замерзании жидкости или осаждении
растворенного вещества из раствора, представляет собой довольно трудную, но
очень интересную и важную задачу. Отметим, что, хотя теория зароды-
шеобразования экспериментально подтверждена прежде всего для
систем, включающих поверхность раздела между твердой и паровой
фазами, до сих пор ее важнейшим приложением остается оценка
свободной энергии поверхностей раздела между твердыми телами и
жидкостями.
В общем случае в отсутствие посторонних осаждающих
поверхностей процесс возникновения новой фазы развивается следующим
образом. Сначала молекулы образуют небольшие кластеры, которые
постепенно растут, пока не превращаются в более или менее крупные
капельки или кристаллики. Наконец, вследствие продолжающегося
роста капелек или кристаллитов или их коалесценции новая фаза
становится видимой невооруженным глазом. Если давление пара немного
больше давления насыщенного пара или если допускается небольшое
переохлаждение жидкости, новая фаза не образуется. Давление пара
может значительно превысить равновесное, но это не приведет к каким-
либо изменениям, по>ка, наконец, при определенном давлении не
начнется интенсивное образование мелких капелек, в результате чего пар
становится непрозрачным и превращается в туман. Растворы или
жидкости также могут быть значительно пересыщены или переохлаждены.
Например, очень чистую воду можно охлаждать до —40 °С, и только
после этого произойдет ее самопроизвольное замерзание. Явления
подобного рода Фаренгейт наблюдал еще в 1714 г. [1].
Сопротивление образованию новой фазы явно связано с избыточной
поверхностной энергией небольших кластеров, что затрудняет их рост.
Если та»кие кластеры малы, их называют зародышами [2]; если же они
достаточно велики и могут рассматриваться как предшественники
новой фазы, их называют ядрами. В последние годы механизму и
кинетике зародышеобразования уделялось довольно много внмания. Успехи,
достигнутые в этой области, вкратце отражены в следующих разделах.
Последовательное образование плоскостей в процессе роста
кристалла из паровой фазы или расплава также включает процесс
зародышеобразования. Кроме того, форма, или габитус, растущего кристалла
часто определяется химическими свойствами поверхности.
2. Классическая теория зародышеобразования
Одним из основных параметров в теории зародышеобразования
является свободная энергия образования кластеров, с которой связан ряд
важных термодинамических соотношений. Рассмотрим процесс
пА (газ, Р)=Ап (небольшие капли жидкости). (VIIM)
298
Глава VIII
В отсутствие влияния поверхностного натяжения AG данного процесса
равно изменению свободной энергии при переносе п молей вещества из
паровой фазы с активностью или давлением Р в жидкую фазу,
характеризующуюся активностью или давлением Р°, т. е.
£±G = -nkT\nPlP\ (VIII-2)
Поскольку поверхностная энергия капли равна 4лг2у, действительное
значение AG составляет
AG=— nkT In x + 4яг2у, (VIII-3)
где х = Р/Р°. Если плотность и молярный объем жидкости
соответственно равны р и М/р, то уравнение (VIII-3) можно записать следующим
образом:
AG=—(4/3) пгд (plM) RT lnx+4nr2y. (VIII-4)
Члены этого уравнения по-разному зависят от г и к тому же при х
больше единицы имеют противоположные знаки. Поэтому кривая
зависимости AG от г проходит через максимум. Пример такой
зависимости для воды при 0°С с х=4 показан на рис. VIII-1 [3]. В максимуме
г=гс и d(AG)/dr=01 следовательно,
RT \nx=2yM/rcp=2yV/rc.
(VIII-5)
Как видно из рис. VIII-1, свободная энергия, затрачиваемая на
образование капли радиусом гс, имеет максимальное положительное
значение, поэтому радиус, соответствующий точке максимума, называется
критическим радиусом. В приведенном примере критический радиус
равен около 8 А и капля критического размера содержит всего около
90 молекул воды. Уравнение (VIII-5), по форме совпадающее с
уравнением Кельвина [уравнение (П-20)], дает равновесную упругость
паров капель радиусом гс.
Решая совместно уравнения (VIII-4) и (VIII-5), получаем
выражение ДЛЯ AGmax
ЛОтах = 4ягс2Т/3.
(VIII-6)
К вькводу о том, что AGmax рашо одной трети свободной поверхностной
энергии всего ядра, пришел еще Гиббс [4]. Исключая гс, приходим к
другой форме этого выражения:
AGmax= 16jtY3M2/[3p2 (RT In xf
(VIII-7)
Уравнение (VIII-7) приложимо также к кристаллам, хотя в этом
случае малые изменения числовых коэффициентов сильно отражаются на
<v>
§*
^ -
§
ч
е>
^3
24
20
16
I?
Я
4
0
/~\
/ \
/ \
/ \ \
/ \
/ \
/ \
/ \
/ \
/ \
> \
1 1 1 1 1 1 1—1—1—L 1 1 ill
6 Q8 10 12 14 Рис. VIII-1. Зависимость AG от размера
Г, А капли [3].
Образование новой фазы
299
результатах расчета, поскольку микрокристалл может иметь
несферическую форму.
Динамику образования капель при давлениях, близких к Р°, можно
представить себе следующим образом. При Р<.Р° свободная энергия
образования кластера быстро возрастает с его размером. Хотя в этих
условиях в принципе могут существовать кластеры любых размеров,
все кластеры, за исключением мельчайших, очень редки и их число
подвергается случайным флуктуациям. (Кстати, при Р>Р°
аналогичным образом флуктуирует число зародышевых ядер размером меньше
гс.) Когда ядро достигает критического размера, любая благоприятная
флуктуация приводит к его бесконечному росту. Экспериментально
измеряемое максимальное давление пересыщения отвечает такому
давлению, при котором 'начинается массовый перенос ядер через
критическую точку, что приводит к образованию тумана из капелек жидкости.
Как следует из вышесказанного, суть проблемы заключается в
оценке скорости образования ядер критического размера. Первая, правда,
не совсем строгая статистическая теория образования зародышей
новой фазы была предложена Беккером и Дерингом [5, 6]. В этой
теории рассматривается упрощенная стационарная картина, согласно
которой среднее число зародышей, состоящих из 2,3,4, ..., N молекул, во
времени не меняется, хотя и зависит от внешних условий. Очевидно,
что для зародышей каждого размера устанавливается баланс
скоростей испарения и конденсации. Применив изящную методику
интегрирования, авторы смогли оценить поток I, равный скорости образования
зародышей, содержащих п молекул, из зародышей, содержащих (п—1)
молекулу. Полный вывод выражения для / довольно трудоемок, хотя
и не сложен [1,3, 5—7].
Конечное уравнение Беккера и Деринга довольно просто получить
с помощью следующего качественного рассуждения. Поскольку для
ядер любого размера поток / принимается одинаковым, его можно
связать со скоростью образования кластеров из двух молекул, т. е. с
частотой соударений молекул Z (число соударений в кубическом
сантиметре за секунду) в кинетической теории газов.
В стационарном случае Z определяет скорость образования или
поток критических зародышей. При этом необходимо только учесть
следующее: чтобы зародыш образовался, частицы должны обладать
свободной энергией активации, равной положительной энергии
образования зародыша. Дополнив Z членом e~AGmax/kT, получаем
приблизительное выражение для /:
I=Zexp(-kGmlJkT). (VIII-8)
В более точном уравнении, полученном Беккером и Дерингом, вместо
Z стоит более сложная функция:
I=(Z/ne) (ДОтах/З^Г)'/2 ехр(-ДОт11/*Г), (VIII-9)
где пс — число молекул в зародыше критического размера. Однако,
поскольку предэкспоненцнальныи множитель в этом уравнении численно
приблизительно равен Z, а экспоненциальные члены уравнений (VIII-8)
и (VIII-9) просто одинаковы, точное и приблизительное уравнения
дают сходные результаты.
Подставив в уравнение (VIII-9) выражение для ДОтах [уравнение
(VIII-6)] и соответствующее выражение для Z, заимствованное из
кинетической теории газов, получаем
/=2я2а2 (RT/M)V2 ехр [— 16лу2М 2/ЗйТр2 (RT In х)2], (VIII-10)
где о — эффективное сечение молекулы и п — число молекул пара в
одном кубическом сантиметре. Поскольку Z приблизительно равно
300
Глава VIII
1023 Р2 (где Р — давление, мм рт. ст.), уравнение (VIII-10) можно
привести к более простому виду:
/= 1023Р2 ехр [—17,5V2y*/T3 (lnx)2], (VIIH1)
где / — число зародышей/см3-с. Примерный вклад различных членов
этого уравнения в величину / показывает табл. VIII-1, в которой даны
соответствующие оценки для воды при 0°С. Принимая К = 20 см3/моль,
Y=72 эрг/см2 и Р°=4,6 мм рт. ст., получаем
/=2- 102Vexp[—118/(lnx)2]. (VIIM2)
Числа, приведенные в таблице, наглядно показывают быстрый рост /
с увеличением х. Обычно этого достаточно для определения
критического давления пересыщения, при котором In/ равен некоторой
произвольно выбранной величине, например единице.
Таблица VIII-1
Решение уравнения (VII1-12) для различных величин х
X
1,0
1,1
1,5
2,0
3,0
3,5
4,0
4,5
In х
0
0,095
0,405
0,69
1,1
1,25
1,39
1,51
118/(1пл-)->=Л
0
1,ЗЫ04
720
246
95,5
75,5
61,5
51,8
е-А
0
Ю-5700
Ю-зю
Ю-107
Ю-42
10-зз
Ю-26,7
Ю-22,5
/, ЧИСЛО
ядер/см»* • с
1
1Q-O680
Ю-286
Ю-82
ю-17
2. Ю-8
0,15
103
При исследовании пересыщения паровой фазы непосредственно
давление пара Р меняют редко. Гораздо чаще прибегают к охлаждению,
т. е. изменению Р°. Если температура, при которой давление
насыщенного пара соответствует фактическому давлению Р, равна Го, то при
любой температуре Г относительная упругость пара Р/Р°=х
определяется выражением
1п* = (ДВД)(1/Г-1/Г0), (VIII-13)
где AHV— скрытая теплота испарения. Из этого выражения и из
уравнения (VIII-5) следует, что
Д7 = Г0 — Г=2yMT0/rckHvp = 2yVT0/rcAHv. (VIII-14)
Уравнения (VIII-14) и (VIII-6) позволяют связать AGmax с AT.
Аналогичные уравнения можно записать и для переохлажденного расплава.
Только теперь AHV заменяют на теплоту плавления Д#/, ах — на
отношение давления паров жидкости и твердого тела. Как и при
изменении давления пересыщенного пара Р, скорость зародышеобразования
в расплаве сильно зависит от степени переохлаждения и для AT
существует довольно резкая граница, отвечающая его критическому
значению.
При достаточно низкой температуре расплава зародыши новой фазы
являются скорее кристаллическими, чем жидкими. Теория
зародышеобразования в расплавах подробно изложена в обзорной работе [1].
В общем эта теория подобна теории образования капель жидкости в
паровой фазе, но в расплавах скорость роста зародышей в различных
направлениях может различаться, и это необходимо учитывать (см.
также разд. VIII-4).
Образование новой фазы
301
Основные уравнения, описывающие образование зародышей в
конденсированной фазе, обычно расплаве, выводят так же, как и
уравнения, описывающие зародышеобразование в паровой фазе. При этом
наиболее существенному изменению в уравнении (VIII-8)
подвергается частотный множитель. Вместо пара, молекулы которого свободно
сталкиваются между собой, теперь имеется плотная жидкая фаза.
Поэтому скорость роста кластеров в конденсированной фазе Тернбул и
Фишер [8] связывают с процессом диффузии. Теория зародышеобра-
зования в конденсированных фазах подробно излагается в
оригинальной литературе, мы же ограничимся качественным выводом конечного
уравнения этой теории. Рассмотрим зародыши кристалла,
образующиеся в переохлажденном расплаве. Очевидно, что скорость, с которой к
зародышу добавляются отдельные молекулы, определяется частотой
прыжков молекул из положений, занимаемых ими в жидкости, на
поверхность зародыша. Такие прыжки мало чем отличаются от прыжков
молекул в процессе диффузии, и, как следует из теории абсолютных
скоростей, их частота равна частотному множителю kT/h (h—
постоянная Планка), умноженному на экспоненциальный множитель,
выключающий свободную энергию активации диффузии. Полное число прыжков
в одном кубическом сантиметре жидкости за одну секунду равно
Z=n (kT/h) exp (—AGD/kT), (VIII-I5)
где п — число молекул жидкости в кубическом сантиметре. И в этом
случае, используя теорию стационарного ансамбля, получаем
уравнение, аналогичное уравнению (VIII-8):
I=n(kT/h) exp(—AGD/kT) exp(—AGmJkT). (VIII-16)
Для тех жидкостей, которые имеют умеренную текучесть при
температуре, близкой к точке плавления, предэкспоненциальный множитель
в уравнении (VIII-16) примерно равен 1033/см3-с. В результате
уравнение (VIII-16) принимает следующий вид:
/= 1033 exp {-AGmJkT)y (VIII-17)
где AGmax определяется выражением (VIII-7) или его
модифицированным вариантом, в котором допускается несферическая форма
кристаллов.
Еще одним важным следствием теории зародышеобразования в
расплавах и растворах является то, что с изменением степени
переохлаждения скорость образования зародышей проходит через максимум.
Чтобы убедиться в этом, исключим гс из уравнения (VIII-16) и уравнения
для жидкости, аналогичного выражению (VIII-14). При этом получаем
зависимость
I=(nkT/h)e-A'kT9
в которой __ (VIII-18)
A =AGD + (4яу/3) (2VyT0/AHfAT)\
Принимая dl/dT равным нулю, получаем для максимальной скорости
образования новой фазы следующее выражение:
(У-W (3-y)=(4ny/3AHD) (2yV/AHf)\ (VIII-19)
где AHD — энергия активации диффузии и у=Т0/Т. Качественно эти
результаты можно объяснить тем, что, хотя с увеличением степени
переохлаждения концентрация зародышей возрастает, скорость их роста
уменьшается из-за увеличения энергии активации диффузии или, в
сущности, из-за увеличения вязкости среды. В частности, образование
стекол при охлаждении обусловлено настолько быстрым прохождением
302
Глава VIII
области температур со значительной скоростью зародышео-бразования,
что новая фаза просто не успевает образоваться в заметном
количестве.
Для пересыщенного или переохлажденного раствора приведенные
уравнения несколько видоизменяются. Так, в уравнении (VIII-5) х—
отношение фактической активности растворенного вещества к
активности насыщенного раствора. Для раствора неэлектролита x=S/S0, где
5 — концентрация, а для раствора электролита х определяется
уравнением (VII-3). Кроме того, если раствор пересыщенный, в уравнение
(VIII-14) входит молярная теплота растворения A#s.
Изложенная в этом разделе простая макроскопическая теория зародышеобразова-
ния содержит потенциально опасные допущения и математические приближения. Так,
например, она предполагает, что небольшие кластеры представляют собой части
объемной фазы. Внимательно рассмотрев это допущение, Кан и Хиллиард [9] пришли к
выводу, что по мере уменьшения степени пересыщения объемной фазы поверхность
кластеров становится все более и более диффузной. С этим вопросом связаны также
такие важные вопросы, как, например, оценка межфазного натяжения на сильно
искривленных поверхностях [10, 11] и расположение поверхности натяжения (см. рис.
II-2A).
В принципе образование и рост зародышей должны происходить при любом
пересыщении растворов и паров. Длительность и критическое отношение пересыщения
определяются произвольно как условия того, что, с точки зрения наблюдателя,
процесс протекает достаточно быстро. Как следует из данных табл. VIII-1, скорость
образования зародышей / меняется со степенью пересыщения настолько быстро, что
даже ошибка на несколько порядков в предэкспоненциальном множителе [например,
уравнения (VIII-12)] не имеет особого значения. Однако положение стало гораздо
серьезнее, когда в 1962 г. Лот и Паунд [12] дополнительно ввели два (до сих пор не
учитывавшихся) множителя, эквивалентных увеличению скорости зародышеобразова-
ния в 1020 (!) раз. При этом авторы просто предполагали, что приведенное выше
выражение для AGmax является неполным и должно включать члены, определяемые
изменением энтропии переноса и вращения молекул. Эгот вопрос подробно обсуждается
в работах Ориани и Сандквиста [11] и Даннинга [1]. В свое время для его выяснения
пришлось прибегнуть к довольно тонкому статистико-термодинамическому анализу, и
в конце концов после некоторого периода неопределенности оказалось, что
первоначальная теория (которая неплохо согласуется с экспериментальными данными)
является правильной. Анализ Дерягина [13] подтверждает этот вывод (см. также работу
[13а]).
3. Результаты экспериментальных исследований процессов
зародышеобразования
Однокомпонентные системы. Как и можно было ожидать, легче
всего интерпретируются данные по зародышеобразова'нию в паровой фазе.
Вообще, такие экспериментальные данные неплохо согласуются с
теорией Беккера и Деринга. Так, используя камеру Вильсона с
адиабатически расширяющейся атмосферой насыщенного пара, Фолмер и Флуд
[14] установили, что при 261 К критическая величина х для воды со-
ставлят 5,03. В то же время расчетное значение х при In//,
приблизительно равном единице, составляет 5,14. Зандер и Дамкелер [15]
нашли, что для воды как критическая величина х, так и ее
температурная зависимость находятся в разумном согласии с теорией.
Вопросам теории зародышеобразования и их экспериментальной
проверке посвящен обзор Хигучи и О'Конски [16]. Особое внимание
в этой работе уделено применению метода турбулентной струи и
обобщению имеющихся экспериментальных данных. В табл. VIII-2
приведены некоторые данные Хигучи и О'Конски [16] и Фолмера и Флуда
[14] по критическим давлениям пересыщения паров различных
жидкостей. Как видно из таблицы, расчетные и экспериментальные данные
согласуются довольно хорошо. По мнению Ла-Мера и Паунда [17],
это означает, что использование макроскопического поверхностного
натяжения допустимо даже для ядер, т. е. даже для кластеров радиусом
всего около 10 А. Это противоречит уравнению Толмэна,
устанавливающему связь поверхностного натяжения с размером капель. Как под-
Образование новой фазы
303
Таблица VIII-2
Критическое пересыщение паров различных жидкостей
Вещество
Вода
Меганол
Этанол
tf-Пропанол
Изопропанол
я-Бутанол
Нитрометан
Этилацетат
Дибутилфталат
Триэтиленгликоль
Температура,
275
264
261
270
273
270
265
270
252
242
332
324
Y, эрг/см2
77,0
24,8
24,0
25,4
23,1
26,1
40,6
30,6
29,4
42,8
Критические значения х
наблюдаемые
4,2
4,85
5,0
3,0; 3,2
2,3
3,0
2,8
4,6
6,0
8,6—12
26—29а
27—37а
расчетные
4,2
4,85
5,1
1,8
2,3
3,2
2,9
4,5
6,2
10,0
Величины межфазного натяжения зародышей рассчитаны с помощью различных уравнений
по данным, полученным методом турбулентной струи [161.
черкивается в разд. II-1 Г, теория Толмэна предполагает непрерывность
среды, и, следовательно, для очень малых капель эта теория не
является точной. То же самое мож'но сказать и о теории Беккера и Деринга,
поскольку в ней используется уравнение (VIII-5). Тем не менее может
оказаться, что удельная поверхностная энергия мало меняется с
уменьшением размеров кластеров. Бенсон и Шатлуорс [18] показали, что
даже для кристаллитов, содержащих всего 13 молекул, Е3 только на 15%
ниже соответствующей величины, полученной для плоской поверхности.
Однако надежность таких расчетов оценить трудно. Уолтон [19],
допустив возможность значительного искажения структуры кристалла,
нашел, что поверхностная энергия кристалла КС1 с ребром, состоящим из
четырех ионов, увеличивается на 35%. По существу, именно
предположение об идентичности микро- и макроскопических межфазных
натяжений положено в основу расчета поверхностного натяжения твердого
тела по данным о зародышеобразовании. Конденсация из чистых
пересыщенных паров (т. е. не содержащих даже инертных газов) плохо
согласуется с теорией [20], возможно, вследствие отсутствия
термического равновесия.
Теперь обратимся к зародышеобразованию в расплавах. Обычно
опыты по переохлаждению жидкостей проводят на небольших каплях;
работая с большими объемами жидкости, трудно быть уверенным в
отсутствии примесей и трудно избежать влияния посторонних
поверхностей. В первом приближении максимально возможная степень
переохлаждения АГтах составляет примерно 0,18 температуры плавления [3].
Это приблизительное правило проверено на внушительном числе
металлов, в том числе на алюминии, германии, олове, свинце, висмуте, меди,
серебре, золоте, марганце, железе, кобальте, никеле, палладии и
платине. Для ртути и галлия, температуры плавления которых необычайно
низки, отношение Г/Гтах составляет около 0,25. Для жидких
неметаллов Т/Тт&х колеблется значительно больше, но обычно это отношение
находится в интервале от 0,1 до 0,2; для воды, например, Г/Гтах=0,14,
что соответствует ДТ,= 40°. Стэйвли и др. [21, 22] с помощью
уравнения (VIII-16) рассчитали поверхностное натяжение для различных
неорганических и органических веществ и пришли к выводу, что
отношение молярного поверхностного натяжения [уравнение (II-16)] к Д#/
приблизительно постоянно и составляет около 0,3, но при низких
величинах Тщах оно проявляет тенденцию к уменьшению. По оценке Мейсо-
304
Глава VIII
на [23], сделанной по результатам опытов по переохлаждению капель
воды, поверхностное натяжение между льдом и водой рав'но
приблизительно 22 эрг/см2. Это вполне соответствует величине поверхностного
натяжения (26 эрг/см2), найденной по изменению температуры
плавления в капилляре (см. разд. VII-2), и теоретической оценке (10 эрг/см2)
Гернея [24]. По данным работы [25], поверхностное натяжение я-геп-
та- и я-о.ктадекана и я-тетракозана составляет 7,2; 9,6 и 8,3 эрг/см2
соответственно.
Вещества, для которых критическая температура переохлаждения
соответствует большим AT, могут вести себя так, как предсказывает
уравнение (VIII-19), т. е. /тах может быть настолько мало, что при
прохождении соответствующей /тах температурной области новая фаза не
успевает образоваться и система переходит в стеклообразное состояние.
При этом фактически исследуется изменение скорости зародышеобра-
зования в той температурной области, в которой она сильно зависит
от вязкости жидкости. Опыты такого рода с салолом, бензофенолом и
т. д. описаны Френкелем [7] и Даниловым [26]. В этой связи
представляет интерес метод «теплового проявления» зародышей. Жидкость
выдерживают при заданной температуре до тех пор, пока в ней
постепенно не накопится некоторое количество зародышей, и далее быстро
нагревают до температуры чуть ниже Г0. В этих условиях новые
зародыши не образуются, зато уже имеющиеся быстро растут и
превращаются в видимые кристаллики.
Растворы. Явления пересыщения в растворах, конечно, очень важны, но, к
сожалению, данные в этой области не слишком надежны. Дело не тол1КО в том, что в
растворах, как и в чистых жидкостях, трудно исключить образование зародышей на
случайных примесях, но и в том, что растворы, как и чистые жидкости, проявляют эффект
памяти, вследствие чего степень возможного пересыщения зависит от предыстории
раствора, особенно его термической обработки. Малорастворимые соли могут осаждаться
при перемешивании, и поэтому степень пересыщения раствора оценить трудно.
Заменив х на S/So, можно привести уравнение (VIII-16) к виду
In t = kx — k2tlT* (In S/S0)2. (VIII-20)
Штауфф [27] показал, что это уравнение хорошо согласуется с данными для
растворов хлората калия. Если принять, что индукционный период (или время начала
видимого осаждения) обратно пропорционален /, и затем заменить In/ на — \nt, то в
этой форме уравнение (VII1-20) описывает также осаждение смешанного сульфата
калия и алюминия [28]. Гиндт и Керн [29] принимают среднюю скорость зародышеобра-
зования N/t (где N — число образующихся кристаллов) пропорциональной / и по
наклону кривых \g(N/t) — \/(\nSfS0)2 оценивают межфазное натяжение между
зародышем и раствором. Для КС1 и других галогенидов эти авторы получили довольно
низкие значения межфазного натяжения от 2 до 3 эрг/см2. Поверхностное натяжение
можно оценить также по критическому пересыщению, т. е. по величине отношения S/S0,
экстраполированной на бесконечную скорость осаждения или нулевой индукционный
период. Энюстюн и Туркевич [30] нашли, что для SrS04 это отношение равно 7,5.
Пользуясь этой величиной и поверхностным натяжением, найденным из собственных
данных по растворимости, авторы оценили критический радиус зародышей, который
оказался равным ~18 А. По данным Ла-Мера и Динегара [31], критическое
пересыщение растворов BaS04 равно 22. Если считать, что зародыши BaS04 по размеру не
отличаются от зародышей SrS04, то межфазное натяжение BaS04 составляет
150 эрг/см2 (см. также работу [ЮЗ] в списке литературы к гл. VII).
Ниельсен и др. [32] отмечают, что время начала видимого осаждения из растворов
BaS04 и число образующихся в них кристаллов пропорционально Sa, где показатель
степени а колеблется в интервале от 10 до 18. Авторы предполагают, что /
определяется законом действия масс, и, следовательно, критические ядра, или зародыши,
состоят из а ионов.
4. Рост кристаллов
Различимые глазом кристаллы, образующиеся в процессе
кристаллизации, могут начать свой рост как на ядре из того же
кристаллического материала, так и на поверхности посторонней частицы,
действующей как затравка. Если проблему примесей на время оставить в
стороне, то следует признать, что теория зародышеобразования на качест-
Образование новой фазы
305
венном уровне объясняет ряд явлений, наблюдаемых при
кристаллизации из растворов.
Ядра, образовавшиеся в пересыщенном растворе, растут,
присоединяя к себе попавшие на их поверхность частицы, и в результате
концентрация растворенного вещества вблизи поверхности падает. Таким
образом, между процессами зародышеобразования и роста кристаллов
существует некоторая конкуренция. Чем выше скорость образования
зародышей, т. е. чем больше число зародышей образуется до того, как
истощится раствор, тем меньше конечный размер кристаллов. На этом
качественном наблюдении основано следующее эмпирическое
выражение, известное как закон Веймарна [33]:
l/d=kS/S0, (VIII-21)
где d — некоторый размер частицы. В большинстве исследованных
систем этот закон соблюдается лишь приблизительно.
В работе Ла-Мера и др. [34] по монодисперсным золям дан красивый пример
регулируемого соотношения скоростей образования и роста кристаллических
зародышей. Оказывается, путем кислотного разложения S20|" можно получать практически
монодисперсные золи серы. При медленном разложении концентрация растворенной
серы медленно поднимается до концентрации, соответствующей критическому
пересыщению зародышеобразования. Далее начинается процесс образования зародышей, но
вскоре после этого концентрация серы падает ниже критического значения. Теперь ися
вновь образующаяся при разложении тиосульфата сера идет на рост ядер серы.
Скорость роста кристаллов практически постоянна и достаточно велика, так что уровень
критической концентрации зародышеобразования больше не достигается. В результате
в системе образуется только одна партия ядер, которые затем равномерно растут,
образуя в конечном итоге монодисперсный золь.
Весьма интересной темой является механизм роста кристаллов. Если кристалл
совершенный, построение нового слоя начинается с образования своего рода зародышей,
так как первые несколько атомов должны занять положения, характеризующиеся
относительным избытком свободной энергии. Беккер и Деринг [5] рассматривают рост
кристаллов именно с этих позиций. Более новая теория этого процесса предложена Шол-
лем и Флетчером [35].
Центрами образования поверхностных зародышей могут служить дислокации.
Так, Фрэнк [36] предположил, что рост кристалла может происходить на выступе
винтовой дислокации (см. разд. V-4B), и в этом случае поверхность развивается по
спирали. Хотя явлениям кристаллизации посвящено довольно большое число работ, полной
ясности в вопросе, какой именно механизм роста кристаллов играет доминирующую
роль, не достигнуто. Бакли [37] отмечает, что картины спирального роста не так уж
часты и, более того, спиральный рост наблюдается на вполне развитых и,
следовательно, медленно растущих поверхностях. Интерферометрические данные по
концентрационным градиентам вокруг растущего кристалла [38, 39] показывают, что в зависимости
от кристалла максимальный градиент может наблюдаться как в центре грани, так и
вблизи ребер. Со временем картина интерференционных полос может значительно
меняться без какой-либо видимой связи с локальными скоростями роста. Ясно, что,
рассматривая рост кристаллов, необходимо учитывать возможность миграции частиц
от точки осаждения на поверхности к месту ее окончательной локализации. Тем не
менее механизм Фрэнка признается многими исследователями, и в отдельных случаях
действительно можно наблюдать медленный поворот спирали, образующейся на
поверхности кристалла в процессе его роста [40].
Интересным вопросом является морфологическая стабильность растущего
кристалла. Так, поверхность цилиндра из льда со временем вдоль и поперек покрывается
волнами, что, очевидно, объясняется действием сил поверхностного натяжения [41].
Стимуляция зародышеобразования с помощью посторонних тел, конечно, относится
к хорошо известным явлениям. Большинство химиков знает, что на практике для того,
чтобы вызвать кристаллизацию, иногда достаточно потереть палочкой о стенку стакана
Правда, как отмечает Уили [42], никакие вещества, кроме самого льда, не способны
вызвать образование зародышей льда вблизи 0°С. Одномикронные частицы иодида
серебра, имеющие такую же, как лед, кристаллическую структуру и очень близкие
параметры решетки, вызывают образование зародышей льда только при температуре
ниже —4°С [43]. По-видимому, можно найти более эффективные стимуляторы
зародышеобразования в парах воды [44]. По мнению Флетчера [45], энергетический
барьер роста кластеров льда на поверхности посторонней частицы минимален, если на
трехфазной границе частица—лед—вода краевой угол мал. Это означает, что
поверхность такой частицы должна быть гидрофобна. Механизм зародышеобразования в парах
воды представляет особый интерес в связи с проблемой получения искусственных
осадков.
20—1421
306
Глава VIII
В заключение отметим, что известен ряд систем, где развитие процесса зародыше-
образования нежелательно, как, например, при получении стекол. Стекла часто
образуются при охлаждении смесей растворителей. По-видимому, общими критериями стек-
лообразования в таких системах являются почти полная взаимная растворимость
в жидком состоянии (как, например, в смеси воды и глицерина) и невозможность
образования смешанных кристаллов.
5. Упражнения
1. Рассчитайте скорость образования зародышей льда при нескольких
температурах и найдите температуру, соответствующую максимальной скорости. AGd воды
считайте равным 5 ккал/моль. Исходя из полученного результата, объясните, почему воду
трудно получить в стеклообразном состоянии.
2. Оцените, каким было бы критическое пересыщение воды, если бы частотный
множитель в уравнении (VII-11) был действительно занижен в 1020 раз. Какую
величину поверхностного натяжения дает такая «исправленная» теория, если пользоваться
величиной критического пересыщения 4,2, найденной экспериментально.
3. Проверьте правильность кривой, приведенной на рис. VIII-1.
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Bradley R. S., «Nucleation in Phase Changes», Quart. Rev. (London), 5, 315 (1951).
Бакли Г., Рост кристаллов, М., ИЛ, 1954.
Ewald P. P., Juretschke #., Structure and Properties of Solid Surfaces, University of
Chicago Press, Chicago, 1953.
Химия твердого состояния, под ред. В. Гарнера, М., ИЛ, 1961.
Nichioka К., Pound G. M., Surface and Colloid Science, Matijevic E., ed., Wiley, New
York, 1976.
Nucleation, Zettlemoyer A. C, ed., Marcel Dekker, New York, 1969.
The Physics of Rainclouds, Cambridge University Press, Cambridge, England, 1962.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Dunning W. J., Nucleation, Zettlemoyer A. C, ed., Marcel Dekker, New York,
1969.
2. Christiansen J. A, Nielsen A. E., Acta Chem. Scand., 5, 673 (1951).
3. Bradley R. S., Quart. Rev. (London), 5, 315 (1951).
4. Gibbs J. W., Collected Works of Gibbs J. W., Longmans, Green, New York, 1931,
p. 322.
5. Becker R., Boring W., Ann. Phys., 24, 719 (1935).
6. Volmer M., Kinetik der Phasenbildung, Edwards Brothers, Ann Arbor, Michigan,
1945.
7. Френкель #. #., Кинетическая теория жидкостей, М., Изд. АН СССР, 1945.
8. Turnbull D., Fisher J. С, J. Chem. Phys., 17, 71 (1949).
8a. Reid R. C, American Scientist, 64, 146 (1976).
9. Cahn J. W., Hilliard J. E„ J. Chem. Phys., 31, 688 (1959).
10. Plesner I. W., J. Chem. Phys., 40, 1510 (1964).
11. Oriani R. A., Sundquist B. E.t J. Chem. Phys., 38, 2082 (1963).
12. Lothe /., Pound G. M., J. Chem. Phys., 36, 2080 (1962).
13. Deryaguin B. V., J. Colloid Interface Sci., 38, 517 (1972).
13a. Reiss #., Nucleation II, Zettlemoyer A. C, ed., Marcel Dekker, 1976.
14. Volmer M.t Flood H., Z. Phys. Chem., A170, 273 (1934).
15. Sander A., Damkohler G., Naturwiss., 31, 460 (1943).
16. Higuchi W. L„ O'Konski С. Т., J. Colloid Sci., 15, 1337 (1949).
17. LaMer V. K., Pound G. M.f J. Chem. Phys, 17, 1337 (1949).
18. Benson G. C, Shuttleworth R.f J. Chem. Phys., 19, 130 (1951).
19. Walton A. G., J. Chem. Phys., 36, 3162 (1963).
20 Barschdorff В., Dunning W. J., Wegener P. P., Wu B. J. C, Nature Phys. Sci., 240,
166 (1972).
21. de Nordwall H. J., Staveley L. Л. К., J. Chem. Soc, 1954, 224.
22. Thomas D. G.f Staveley L. A. K., J. Chem. Soc, 1952, 4569.
23. Mason B. /., Proc. Roy. Soc. (London), A215, 65 (1952).
24. Schuttleworth R., Proc. Phys. Soc. (London), 63A, 444 (1950).
25. Turnbull D., Cormia R. L.t J. Chem. Phys., 34, 820 (1961).
26. Данилов В. И., Журн. эксп. и теор. физ., 19, 235 (1949).
27. Stauff /., Z. Phys. Chem., A187, 107, 119 (1940).
28. Neumann K., Miess A., Ann. Phys., 41, 319 (1942).
29. Gindt R., Kern R., CR, 256, 4186 (1963).
30 Enustun B. V., Turkevich J., J. Amer. Chem. Soc, 82, 4502 (1960).
31 LaMer V. K., Dinegar R. H., J. Amer. Chem. Soc, 73, 380 (1951).
Образование новой фазы
307'
32. Nielsen A. E., Acta Chem. Scand., 15, 441 (1961).
33. von Weimarn P. P., Chem. Rev., 2, 217 (1925).
34. LaMer V. K., Dinegar R. H„ J. Amer. Chem. Soc, 72, 4847 (1950).
35. Sholl C. A., Fletcher N. H., Acta Metallurgica, 18, 1083 (1970).
36. Frank F. C, Discuss. Faraday Soc, 5, 48 (1949).
37. Buckley H. E., in Structure and Properties of Solid Surfaces, Gomer R, Smith С S.,
eds., University of Chicago Press, Chicago, 1952, p. 271.
38. Krueger G. C, Milter C. W., J. Chem. Phys., 21, 2018 (1953).
38. Goldsztaub S. P., Kern R., Acta Cryst., 6, 842 (1953).
40. Dunning W. J., private communication.
41. Coriell S. R., Hardy S. C, Sekerka R. F., J. Crystal Growth, 11, 53 (1971).
42. Wylie R. G., Proc Phys. Soc. (London), B66, 241 (1953).
43. Vonnegut В., J. Appl. Phys., 18, 593 (1947).
44. Garten V. A., Head R. В., Nature, 205, 160 (1965).
45. Fletcher N. H., private communication
20*
ГЛАВА IX
Поверхность раздела жидкость—твердое тело.
Адсорбция из растворов
В этой главе мы рассмотрим наиболее существенные и важные
адсорбционные явления, происходящие на поверхностях твердых тел в
присутствии растворителя. Адсорбции из растворов посвящено
огромное число работ, и естественно, что здесь приходится ограничиться
изложением только основных фактов и теорий.
Адсорбционные явления, наблюдаемые в растворах неэлектролитов,
в значительной мере определяются концентрацией адсорбата. При
низких его концентрациях адсорбция весьма напоминает адсорбцию газов,
тогда как при высоких концентрациях роль растворителя становится
более явной. Адсорбцию электролитов в основном рассматривают как
обмен компонентов двойного электрического слоя либо на поверхности
лепористого тела, либо в ионообменнике, например цеолите.
Очень важное применение адсорбция из растворов нашла в
жидкостной хроматографии, в которой раствор пропускается через
фиксированный слой адсорбирующего материала. Хроматография здесь не
рассматривается отчасти потому, что она затрагивает вопросы, строго
говоря, не относящиеся к химии поверхностей, и отчасти потому, что эта
область слишком широка для краткого изложения.
1. Адсорбция неэлектролитов из разбавленных растворов
Адсорбцию неэлектролитов на поверхности раздела твердое тело —
раствор можно рассматривать, основываясь на двух различных
физических моделях. В первой модели предполагается, что адсорбция, по
существу, ограничена монослоем, непосредственно прилегающим к
поверхности, а последующие слои фактически представляют собой
нормальный раствор. Эта картина напоминает хемосорбцию газов (гл. XV)
и согласуется с предположением о том, что силы взаимодействия
между твердым телом и растворенным веществом быстро ослабевают по
мере увеличения расстояния. Однако в отличие от теплоты хемоеорбции
газов теплота адсорбции из раствора обычно довольно мала и
сравнима скорее с теплотой растворения, чем с энергией химического
взаимодействия.
Вторая модель предполагает, что адсорбция связана с довольно
толстым (возможно, до 100 А) полимолекулярным межфазным слоем,
находящимся в медленно спадающем потенциальном поле поверхности
твердого вещества (см. разд. VII-5B). Примерно такая же картина
имеет место при физической адсорбции паров (см. гл. XIV),
образующих полимолекулярный слой при давлениях, близких к давлению
насыщенных паров (см., например, рис. VII-15). С этой точки зрения
адсорбция из раствора представляет собой перераспределение вещества
между объемной и поверхностной фазами.
Хотя справедливость обеих моделей подтверждена
экспериментально, для простого анализа предпочтительна монослойная модель, но, ра-
Поверхность раздела жидкость — твердое тело
309
зумеется, ею не следует увлекаться чрезмерно. Прежде всего
рассмотрим адсорбцию из разбавленного раствора, так как именно с такого
рода адсорбцией чаще всего приходится сталкиваться на практике.
Важно также, что относительно простые уравнения, описывающие
адсорбцию из разбавленных растворов, пригодны и для интерпретации
данных по адсорбции из концентрированных растворов.
А. Изотермы адсорбции
Количество молей растворенного вещества, адсорбированного одним
граммом адсорбента, экспериментально определяется как AC2Vv.s>/m,
где АС2 — изменение концентрации раствора после завершения
адсорбции, Vp-р — общий объем раствора и m — число граммов адсорбента.
Число молей и другие экстенсивные величины удобно относить к
одному грамму адсорбента. В этом случае ns2, число молей
адсорбированного вещества, приходящееся на грамм адсорбента, дается выражением
nl=VAC2=n^N2f (IX-1)
где п0 — общее число молей раствора на грамм адсорбента и AN2—
изменение мольной доли растворенного вещества в результате адсорбции.
Для разбавленных растворов оба выражения эквивалентны, однако в
случае более концентрированных растворов эта эквивалентность
нарушается. Основные определения и термины, принятые в данной области,
подробно обсуждаются Эверетом [1].
Как правило, величина я| зависит от равновесной концентрации
растворенного вещества С2 и температуры, т. е. n%=f(C2, T). При
постоянной температуре nl=fT(C2). Именно эту функцию, называемую
изотермой адсорбции, и находят в большинстве экспериментальных
работ, т. е. определяют адсорбцию в зависимости от концентрации при
постоянной температуре.
Предложено много различных функциональных зависимостей f;
часть из них базируется на результатах экспериментальных
исследований, часть — на теоретических моделях. Одной из важнейших
теоретических функций является изотерма адсорбции Лэнгмюра [2]. Лэнг-
мюровская модель адсорбции из растворов предполагает, что, как и
при адсорбции газов (см. разд. XIV-3), на поверхности имеется
определенное число центров (или мест) адсорбции, на каждый из которых
приходится площадь а0; все адсорбированные частицы
взаимодействуют только с центрами адсорбции и не взаимодействуют друг с другом;
таким образом, адсорбция ограничена лишь монослоем. Однако
применительно к адсорбции из растворов эту модель, по-видимому,
целесообразно представить несколько иначе. Адсорбция все еще ограничена
монослоем, но теперь этот слой рассматривается как идеальный
двумерный раствор вещества и растворителя, молекулы которых
занимают в монослое одинаковую площадь а0. Латеральные взаимодействия,
отсутствующие в модели фиксированных центров, исключаются из мо-
лели идеального двумерного раствора с помощью предположения об их
независимости от состава монослоя. В первом варианте а0
определяется свойствами решетки твердого тела, тогда как во втором варианте
это — свойство адсорбированных частиц. В обеих моделях
адсорбционные свойства системы целиком определяются взаимодействием адсор-
бат — твердое тело, при этом адсорбция представляется как
конкуренция между молекулами растворенного вещества и растворителя.
Следует отметить, что обе модели приводят к одним и тем же
математическим выражениям, однако в дальнейшем нам удобнее будет
пользоваться моделью двумерного раствора, выражая при этом поверх-
310
Глава IX
ностную концентрацию в мольных долях. Процесс адсорбции можно
представить как реакцию
А (растворенное вещестио в растворе, iV2) +
+ В (адсорбированный растворитель, N{) =
=А (адсорбированное растворенное вещество, Л^) +
+ В (растворитель в растворе, Л^).... (IX-2)
Константа равновесия этого процесса равна
K=NlajN\a2t (IX-3)
где а,\ и а2 — активности растворителя и растворенного вещества в рас-
'гворе; активности адсорбированных частиц выражаются соответственно
'их мольными долями Nf и Ns, что, несомненно, упрощает
рассматриваемую модель. В разбавленном растворе а,\ — постоянная величина, и,
следовательно, Ь = К/а\. Учитывая, что Nf +Nf=l, из уравнения (IX-2)
получаем
Щ=Ьа2/(\+Ьа2). (IX-4)
Поскольку n%=Ninsf где ns — число молей центров адсорбции в
расчете на грамм адсорбента, уравнение (IX-3) можно также записать как
п\ =nsba2l( 1 + ba2) (IX-5)
или
e=to2/(i-fte2),
где Q = n$/ns — доля занятой поверхности, a ns определяется
выражением
ns=2lNo°, (IX-6)
в котором Z — удельная поверхность адсорбента. Для достаточно
разбавленных растворов коэффициент активности не имеет особого
значения, и, таким образом, в уравнении (IX-4) а2 можно заменить на С2.
Константу равновесия К можно записать в виде
K=ebso/RerAHo/RT9 (ix-7)
где Д#° — суммарная энтальпия адсорбции (обычно ДЯ° заменяют на
-—Q, где Q — теплота адсорбции). Таким о'бразом, постоянная Ь равна
b=b'eQ/RTt (IX_8)
Энтропию и энтальпию адсорбции формально можно разделить на
вклады отдельных компонентов:
/t=/c2//clf as°=as°2—as;, д#о=ля°2—дя;. цх-9)
Кроме того, уравнение (IX-5), записанное как
0/(1— в)=/Са2/а1 = йа2^йС2, (IX-10)
формально аналогично уравнению Лэнгмюра для адсорбции газа, если
считать, что Ь последнем случае вторым компонентом является
«вакуум» или «дырочный» газ с ai=l и нулевыми энтропией и энергией
адсорбции [3]. Рассматриваемую модель не обязательно ограничивать
идеальными центрами адсорбции. Эверет [3] расширил эту модель,
включив в рассмотрение поверхностные коэффициенты активности в
виде поправок к Nf и A/f.
Теперь вернемся к уравнению (IX-5) и заменим в нем а2 на С2.
Очевидно, что при низких концентрациях я| пропорционально С2,
причем коэффициент пропорциональности равен nsb. При достаточно вы-
Поверхность раздела жидкость — твердое тело
311
соких концентрациях nl достигает предельного з-начения, равного ns.
Таким образам, ns является мерой емкости адсорбента, а Ь — мерой
интенсивности адсорбции. В рамках идеальной модели ns не зависит от
температуры, тогда как b является ее экспоненциальной функцией,
определяемой уравлениехМ (IX-8). Обе постоянные удобно оценивать,
представив уравнение (IX-5) в виде
С2/гЦ = \/п*Ь + С2/п*. (IX-11)
Таким образом, зависимость С2\п\ от С2 графически изображается
прямой, имеющей наклон l/ns и отсекающей от оси ординат отрезок l/nsb.
Если вместо модели центров адсорбции использовать модель
поверхностного раствора, аналогичного рассматриваемому в разд. П-7В, то
получается уравнение, математически эквивалентное уравнению (IX-4).
Условие постоянства объема поверхностного раствора выражается
равенством vs=nfV1~\-nlV2. Отсюда, учитывая активности двух
компонентов в поверхностной фазе af и а\ и их объемные доли Vf и Vi,
получаем
xi=vsba2/(l+ba^f (IX-12)
где vl—объем адсорбированного растворенного вещества, а
Vs—(постоянный) объем поверхностного раствора [4].
Следует упомянуть еще два теоретических подхода, а именно
термодинамическую теорию адсорбции Вагнера [5] и теорию Барета [6],
рассматривающего и раствор, и адсорбированную фазу как смесь
молекул, подобных молекулам газа и твердого тела.
Большинство поверхностей являются гетерогенными, и, таким
образом, b в уравнении (IX-8) зависит от 6. В этом случае уравнение
изотермы адсорбции принимает следующий вид:
[со
e(cZ9T)=\f{b)B(ct,b,T)db9 (ix-i3)
с
где f(b) — функция распределения b; Q(C2, b, T) — изотерма
адсорбции на однородной поверхности [например, уравнение (IX-5)] и
в(С2, Т) —экспериментально наблюдаемая изотерма адсорбции. В
некотором смысле данный подход можно рассматривать как попытку
избежать использования коэффициентов поверхностной активности.
Решение этого интегрального уравнения приведено в разд. XIII-14.
Здесь же мы остановимся лишь на одном частном примере. Если
Q(C2,b,T) определяется уравнением (IX-5) и зависимость b от 0
полностью обусловлена изменением теплоты адсорбции Q, а
распределение f(Q) равно
f(Q)=ae-Q/nRT9 (IX-14)
то решение уравнения (IX-13) имеет вид [7, 8]
@==ns2/ns=aci/ny (IX-15)
где a=aRTnb', a b' выражается уравнением (IX-8). Уравнение (IX-15)
известно как изотерма адсорбции Фрейндлиха [9].
В отличие от изотермы Лэнгмюра изотерма Фрейндлиха при
низких концентрациях не только не дает линейной зависимости, оставаясь
вогнутой в направлении к оси концентраций, но и не дает предельного
значения адсорбции при насыщении. Построив зависимость lgn от
\gC2, можно найти постоянные ans и я, определяющие форму изотермы
Фрейндлиха. Отсекаемый от оси ординат отрезок ans характеризует
емкость адсорбента, а наклон \\п характеризует интенсивность адсорбции.
Как уже отмечалось, форма изотермы Фрейндлиха такова, что п
должно быть больше единицы.
312
Глава IX
Нельзя с уверенностью сказать, что данный выше вывод уравнения
Фрейндлиха одноз-начен. Поэтому, если экспериментальные данные
удовлетворяют этому уравнению, то только вероятно, но совсем не
обязательно, что поверхность гетерогенна. Вообще говоря, уравнение
изотермы Фрейндлиха является эмпирическим и применяется лишь для
обработки экспериментальных данных.
Б. Качественные результаты адсорбционных исследований.
Правило Траубе
Большинство исследованных неэлектролитов относится к
органическим соединениям; сюда входят не только жирные кислоты,
ароматические кислоты, сложные эфиры и другие соединения с одной
функциональной группой, но и множество более сложных веществ, например
порфирины, желчные пигменты, каротиноиды, липиды, красители. Для
сложных веществ нередко изучены только их хроматографические
свойства, по которым можно качественно оценить относительную адсорби-
руемость веществ, но нельзя найти соответствующие изотермы
адсорбции.
В качестве адсорбентов используют, особенно в старых работах,
окись алюминия, силикагель, различные формы углерода (кровяной
уголь, сахарный уголь, другие активные угли, сажу) и различные
органические соединения, например сахар и крахмал. Адсорбционные
свойства гидроокисей и углеродных материалов сильно зависят не только
от состава и дисперсности, но и от содержания влаги и глубины
термообработки или активации образцов. Из растворителей наиболее
широко применяется вода; во всяком случае большая часть работ
выполнена в водных системах. Однако опубликована масса данных и для
разнообразных органических растворителей.
Адсорбционное поведение исследуемой системы можно
охарактеризовать, правда только качественно, используя постоянные уравнения
(IX-9). Как правило, полярный (неполярный) адсорбент
преимущественно адсорбирует более полярный (неполярный) компонент
неполярного (полярного) раствора. Под полярностью здесь, вообще говоря,
понимается способность вещества к образованию водородных связей или
диполь-дипольному взаимодействию. Полукачественным выражением
вышесказанного служит известное правило Траубе [10], которое
Фрейндлих [9] формулирует следующим образом: «при движении вверх по
гомологическим рядам адсорбция органических веществ из водных
растворов сильно и неуклонно возрастает».
Правило Траубе наглядно иллюстрируют данные, приведенные на
рис. 1Х-1,а. Первоначальный наклон кривых адсорбции из водного
раствора на угле и, следовательно, величина Ь в уравнении (IX-4)
возрастают в ряду: муравьиная кислота, уксусная кислота, пропионовая
кислота и масляная кислота. Холмс и Мак-Келви [11], отмечая
относительность соотношения полярностей в адсорбционных системах,
дополняют сформулированное Фрейндлихом правило Траубе, утверждая, что
гомологическая последовательность обращается, если адсорбент
полярный, а растворитель неполярный. Как следует из рис. 1Х-1,б, при
адсорбции жирных кислот на силикагеле из раствора в толуоле
последовательность изотерм адсорбции действительно является обратной
относительно последовательности, приведенной на рис. 1Х-1,а. Более того,
по данным Бартелла и Фу [12], обратная последовательность изотерм
адсорбции на силикагеле сохраняется даже при использовании водных
растворов.
Равномерное увеличение адсорбируемости в гомологическом ряду
можно объяснить одинаковым вкладом СН2-групп в работу адсорбции
(см. гл. II). Естественно, что при этих допущениях введение каждой
Поверхность раздела жидкость — твердое тело
313
новой СН2-группы приводит к увеличению работы адсорбции на одну
и ту же величину. При адсорбции из разбавленных растворов
поверхностное давление л и изотерму адсорбции можно связать с помощью
уравнения (VII-11)
я = (#772) f л#1пС2. (IX-16)
о
Если адсорбция описывается изотермой Лэнгмюра, то, решая
совместно уравнения (IX-5), (IX-6) и (IX-16), получаем
n=(RT/N&>)ln(\+bCj. (IX-17)
Таким образом, поверхностное давление я непосредственно связано с
величиной ЬС2. Уравнение (IX-17) известно как уравнение Шишковско-
го [13]. В рамках этого подхода последовательность, показанная на
рис. IX-1, а, означает, что при движении по гомологическому ряду
поверхностное давление остается неизменным, только если в достаточной
степени снижается концентрация раствора. Последнее утверждение, по
существу, эквивалентно обычной формулировке правила Траубе для
поверхностного натяжения растворов (разд. Н-7Г).
Известно, что между степенью адсорбции вещества и его
растворимостью в используемом растворителе существует следующее
соотношение: чем менее растворимо вещество, тем более оно склонно к
адсорбции. Так, Хансен и Крэйг [14] нашли, что изотермы членов одного и того
же гомологического ряда жирных кислот и спиртов можно совместить
друг с другом, если число граммов адсорбированного вещества,
приходящееся на грамм адсорбента, представить в виде зависимости от
приведенной концентрации С2/С°21 где С°2 — растворимость адсорбата в
растворителе. Хансен и Крэйг использовали в качестве растворителя
воду, а в качестве адсорбентов — графой (углеродный материал с
довольно однородной поверхностью, полученный путем частичной графитиза-
/о
г г / ^
3
"t
6
Рис. IX-1 Иллюстрация правила Траубе [12] Адсорбция жирных кислот на угле \\\
родного раствора (а) и адсорбция жирных кислот на силикагеле и.* голуолл (б)
Адсорбируемые кислоты / — муравьиная; 2 — уксусная; 3 — пропионовая; 4— масляная; 5 — кап-
риловая.
314
Глава IX
ции сажи) и сферой. Подобное совпадение изотерм наблюдается и при
адсорбции паров (см. разд. XIV-9). Некоторые данные Хансена и Крэй-
га приведены на рис. IX-2. Отклонение нижних членов гомологического
ряда от основной кривой при высоких C2jC02 объясняется их
относительно высокой растворимостью, при этом возможен вторичный эффект,
обсуждаемый в разд. IX-4.
Коррелирующая роль С\ подтверждает представление об адсорбции
как о распределении адсорбированного вещества между объемной и
поверхностной фазами, при этом К\ и /С2 в уравнении (IX-9) можно
рассматривать как частные статистические суммы соответствующих
компонентов. При переходе к лучшему растворителю AS2 и ДЯ2 меняются
так, что /С2 уменьшается и в результате произведение К2С°2 остается
почти постоянным. Увеличение температуры обычно приводит к
уменьшению адсорбции, т. е. к уменьшению b или К в уравнении (IX-9).
Этот эффект можно объяснить либо тем, что обычно адсорбция —
экзотермический процесс, либо тем, что С\ увеличивается. Например, по
данным Бартелла [15], с ростом температуры адсорбция бутилового
спирта на активном угле из разбавленных растворов увеличивается,
однако в более концентрированных растворах наблюдается обратная
зависимость адсорбции от температуры. Последнее объясняется
уменьшением растворимости бутилового спирта в воде с ростом температуры.
Адсорбцию из растворов можно интерпретировать также с помощью
теории адсорбции, предложенной Поляни (подробно она обсуждается
в гл. XIV, разд. XIV-7). В рамках этого подхода адсорбция
рассматривается как своего рода осаждение из раствора под действием
адсорбционного потенциала. При этом
RT\n(CVC)=eSL, (IX-18)
где С0 —растворимость адсорбата и eSl — адсорбционный потенциал.
Последний представляет собой функцию величины адсорбции и
уменьшается с увеличением толщины адсорбированного слоя. По существу,
этот же подход использован в модели полимолекулярной адсорбции
(подробно данный вопрос рассматривается в работе [19]).
0,10 0,20 0,30 Ц40 0,50 0,60 0,70 0,80 0,90 1,00
Активность или приведенная кониентрация
Рис. IX-2. Адсорбция жирных кислот на сфероне 6 [14].
Адсорбируемые кислоты: / — уксусная; 2 — пропионовая; 3 — масляная; 4 -
капроновая; 6 — энантовая.
валериановая; 5 —
Поверхность раздела жидкость — твердое тело
315
Все вышесказанное подтверждает, что адсорбция из растворов —
это сложный процесс, зависящий как от взаимодействия молекул
растворенного вещества и растворителя между собой в объемной и
поверхностной фазах, так и от их взаимодействия с адсорбентом.
Специфическую роль каждого из этих факторов трудно охарактеризовать
глубже, чем это было, сделано при обсуждении правила Траубе. Вообще
говоря, если между адсорбентом и адсорбатом образуются водородные
связи, адсорбционная постоянная К достигает больших значений.
Киплинг [17] приводит примеры относительно высокого сродства силижа-
геля к нитро- и нитрозопроизводным дифениламина и N-этиламина
[18] и значительно более сильной адсорбции фенола на активном угле
по сравнению с его ди-орго-производными грег-бутилового спирта [19].
Следует отметить, что поверхность многих активных углей частично
окислена. Так, сферой 6 содержит на поверхности атомы кислорода
[20], на которых спирт адсорбируется предпочтительнее, чем бензол.
Однако после обработки при 2700 °С, приводящей к образованию гра-
фона, адсорбируется преимущественно бензол [21]. Ароматические
соединения проявляют тенденцию к преимущественной адсорбции на
алифатических группах, например на поверхности углерода, что,
по-видимому, обусловлено л;-электронным взаимодействием, или, другими
словами, высокой поляризуемостью ароматических групп. В случае
массивных ароматических молекул эта тенденция ослабляется, возможно,
вследствие увеличения расстояния между ароматической группой и
поверхностью адсорбента [19]. Такие высокомолекулярные вещества,
как сахар, красители и полимеры, больше склонны к адсорбции,
чем их более легкие аналоги. Порядок элюирования из хроматографи-
ческих колонок обычно является обратным по отношению к величинам
К, характеризующим адсорбционную активность вещества. Таким
образом, даже основываясь на качественных хроматографических
данных, имеющихся в литературе, можно сравнивать адсорбционные
свойства различных веществ. Данной теме посвящено множество обзоров,
например обзор Негера [22].
При адсорбции 'из растворов важную роль могут играть и чисто
геометрические факторы. Так, из смеси гексан — бензол цеолит линде
5 А адсорбирует преимущественно гексан, который в отличие от
бензола может проникать в поры адсорбента. Широкопористые цеолиты
10Х и 13Х адсорбируют значительно сильнее бензол [23]. Если не
принимать во внимание такие специфические эффекты, можно
предположить, что по своему механизму адсорбция в пористом теле ближе к
капиллярной конденсации (см. разд. XIV-16B), чем к адсорбции на
поверхности. Эту точку зрения разделяют, в частности, Хансен и Хансен
[24]. Адсорбцию в пористом теле можно представить себе следующим
образом. Относительно толстые пласты адсорбированной фазы
удерживаются на поверхности раздела трех фаз раствор —
адсорбированная фаза — твердое тело благодаря малому краевому углу и действию
межфазного натяжения на поверхности раздела адсорбированная
фаза— раствор. По-видимому, такое описание вполне возможно и для
систем, в которых концентрация адсорбата близка к пределу
растворимости (см. разд. IX-1В), но оно вряд ли соответствует общему
механизму адсорбции из растворов [4, 25].
Наконец, взаимодействие между адсорбентом и адсорбатом может
быть настолько специфическим, что адсорбцию с полным основанием
можно называть хемосорбцией. В этом случае изотерма адсорбции
имеет вид простой лэнлмюровокой изотермы с очень большими
значениями К, причем адсорбционное равновесие в системе может
устанавливаться медленно. Именно так протекает адсорбция жирных кислот на
металлах, что, вероятно, обусловлено образованием солей с катионами
окисного слоя, покрывающего металл. Хакерман и др. [26] показали,
31G
Глава IX
12.
to
fj
s* ь
i
[ I
I
i
' crtrH
Ж.А
^
iJ^J
i
|
i
^>zg,
* f
2#
1
J/
*?# /
\l
""WH
1 i
i !
_.. [ ...1
г 1
1 /
0,2 0,4 0,6 0,3 1,0
c/c0
Рис. IX-3. Капиллярная конденсация на силикагеле воды в гексиловом спирте [32J.
что жирные кислоты, нитрилы и т. д. адсорбируются на железном и
стальном порошке частично необратимо и дают изотерму лэнгмюров-
ского типа. В то же время Смит и Ален [27] отмечают, что адсорбция
я-нонадекановой кислоты на меди, никеле и алюминии вполне
отчетливо зависит от того, в каких условиях проводилась предварительная
обработка исследуемой поверхности: на воздухе или в растворителе, не
содержащем кислорода. Это обстоятельство может оказывать
существенное влияние на свойства антикоррозионных покрытий [28, 29].
В. Полимолекулярная адсорбция
Изотерма Лэнгмюра [уравнение (IX-5)] применима к самым разным системам,
включающим разбавленные растворы. Нередко, однако, для таких систем получают и
S-образные изотермы. Хансен и др. [30] нашли, что изотермы адсорбции ряда высших
кислот и спиртов (с числом атомов углерода не менее четырех) из водных растворов
ка различных углях не проявляют стремления к насыщению и по общему виду
напоминают изотермы, характерные для полимолекулярной адсорбции (см. гл. XIV,
разд. XIV-5). Особенно значительный рост адсорбции соответствует конечному участку
изотермы, где концентрация приближается к концентрации насыщенного раствора
Адсорбция из растворов весьма похожа на низкотемпературную адсорбцию паров:
область изотермы, напоминающая плато, переходит в восходящую ветзь, поскольку
адсорбция по мере приближения к давлению насыщенных паров Р° быстро возрастает.
При исследовании адсорбции паров в качестве переменной рационально принять
относительное давление Р/Р°\ аналогично при адсорбции из растворов, как отмечается
в предыдущем разделе, концентрацию удобнее выражать в относительных единицах
С/С0. Как следует из данных Хансена и др. [14], приведенных на рис. IX-2, при
адсорбции из концентрированных растворов, несомненно, имеет место своего рода
полимолекулярная адсорбция; в противном случае пришлось бы принять, что в плотном монослое
на молекулу приходится неоправданно малая площадь поверхности.
Для описания полимолекулярной адсорбции из растворов в принципе можно
использовать различные теоретические изотермы полимолекулярной адсорбции паров,
обсуждаемые в гл. XIV. В этом направлении, однако, сделано очень мало Как
правило для обработки экспериментальных данных используют уравнение БЭТ (Брунауэр,
Эммет Теллер) (разд. XIV-5). Данные, приведенные на рис. IX-3, неплохо
описываются модифицированным уравнением БЭТ, если адсорбция ограничена приблизительно
тремя слоями. Модель Поляни, о которой говорилось в предыдущем разделе, очень
хорошо описывает полимолекулярную адсорбцию [19].
В отличие от адсорбции газов при адсорбции из растворов в принципе на
поверхности адсорбента могут адсорбироваться два компонента. И действительно, нет
никаких оснований считать, что полимолекулярная адсорбция растворенного вещества
сопровождается полным вытеснением растворителя. Иными словами, полимолекуляр-
HVK) адсорбцию из растворов, вероятно, удобнее всего рассматривать как разделение
ф*аз обусловленное взаимодействием раствора с твердой поверхностью, ^или как
капиллярный эффект. Разделение фаз в резульгаче взаимодействия с твердой
поверхностью по-видимому, и наблюдали Киселев и сотр. [31], исследуя адсорбцию метано;
ла из гептана на силикагеле. Они получили 5-образную изотерму с крутой восходящей
ветвью при С2/С§—^1. Бартелл и Донахью [32] приводят изотермы адсорбции воды
Поверхность раздела жидкость — твердое тело
317
на силикагеле из растворов с гексиловым спиртом, которые круто поднимаются вверх
в области значений С^С^, приблизительно равных 0,8 (аналогичные изотермы
показаны на рис. IX-3). При адсорбции паров такой ход изотерм характерен для капиллярном
конденсации, и вполне возможно, что и в данном случае разделение раствора связано
с действием капилляров. Поскольку силикагель адсорбирует преимущественно воду, то
с увеличением концентрации воды обогащенный водой слой утолщается и, если
капиллярное давление над образующейся искривленной поверхностью приводит к
появлению положительной движущей силы, в порах образуются мениски. Таким образом,
эффект капиллярного давления сводится к уменьшению локальных значений C°s.
Более простым типом полимолекулярной адсорбции, по-видимому, является
физическая адсорбция вещества поверх его собственного хемосорбированного слоя. Наблю
даемая при этом изотерма адсорбции представляет собой сумму двух изотерм Лэнгмю-
ра. Однако, если хемосорбция завершается при низких концентрациях, результирующая
изотерма может иметь обычный вид, только ее начальная точка не будет
соответствовать нулевой точке на оси абсцисс. Изотермы этого типа наблюдаются при адсорбции
капроновой и стеариновой кислот на стали [33]. В принципе к изотермам подобного
рода может приводить и наличие двух различных поверхностей, на одной из которых
адсорбция значительно сильнее, чем на другой.
2. Адсорбция полимеров
Теория адсорбции полимеров так тесно связана с собственно химией полимеров и
настолько специфична, что мы ограничимся лишь самыми общими представлениями
Прежде всего следует отметить, что, поскольку нелинейные полимеры малорастворимы,
исследования адсорбции из растворов проводятся в основном на линейных
макромолекулах, например синтетических каучуках, различных видах целлюлозы, метакрилате,
поливиниле, иолистиролах и т. д. [17, 34, 35]. Чаще всего в качестве растворителей
используют сильнополярные органические растворители, а в качестве адсорбента —
уголь (что, по-видимому, обусловлено спецификой резиновой промышленности). Далее,
полимеры, получаемые обычными способами, представляют собой полидисперсную
смесь, и их адсорбцию следует рассматривать как адсорбцию многокомпонентной
системы, в которой важную роль могут играть эффекты фракционирования. Авторы
более поздних работ пытаются изучать адсорбцию полимеров одного молекулярного
веса или хотя бы фракций с узким распределением молекул по весу. Кроме того, как
и на поверхности раздела вода—воздух (разд. Ш-12), на поверхности раздела
твердое тело — раствор возможно большое число конфигураций макромолекул. Вероятно,
поэтому адсорбционное равновесие может устанавливаться крайне медленно: уровень
адсорбции, как будто установившийся после одно- или двухчасовой выдержки, может
медленно смещаться вверх в течение многих дней или месяцев (см. [36]). Для
медленной адсорбции полимеров Геллер [37] дает уравнение
\l(xlm)=k + k'tt (IX-19)
где х/гп — количество адсорбированного полимера (в граммах) в расчете на один
грамм адсорбента и t — время. И наконец, для описания состояния на поверхности
раздела требуется несколько параметров. К таким параметрам, в частности, относятся:
число точек присоединения; распространение молекулы по поверхности, выражаемое
средним радиусом (г2)1/з занимаемой ею площади, и толщина Аг (рис. IX-4). К
сожалению, из адсорбционных данных определить столько параметров нереально, поэтому
подтвердить или опровергнуть различные предлагаемые модели довольно трудно
Очень простую модель дает рассмотрение адсорбции на основе закона действия
масс. В этом случае в уравнении (IX-2) следует учесть, что одна молекула полимера
вытесняет v молекул растворителя. В результате N\ в уравнении (IX-3) заменяется
на (iVi)v, и уравнение (IX-10) принимает следующий вил:
e/v(i-e)v = 6c2. (ix-20)
Можно также ввести различные допущения относительно статистики адсорбции,
например что расстояния между концами молекулы распределяются по закону Гаусса
Это допущение приводит к уравнению [39]
e/(i_e)e2^e={KC)i/v. (IX-21)
Детальный статистический анализ конфигураций макромолекул на поверхностях разде
ла дан в работах Зильберга [40] ( см. рис. III-42) и Димарцио и др. [41]. Эверет и др
[42] провели статистико-механический расчет адсорбции мономеров и г-меров Со
гласно расчетам Мак-Кракина [43], если энергия адсорбции, приходящаяся на сегмент,
превышает ~kT, доля адсорбированных сегментов довольно велика, хотя отдельные
петли должны выходить в раствор.
Учитывая сложность различных теорий, нельзя не отметить тот странный факт, что
в пределах погрешности эксперимента большинство данных по адсорбции полимеров
одновременно описываются как простым уравнением Лэнгмюра [уравнение (IX-10) ],
так и другими уравнениями [34, 37, 43]. Адсорбция полимеров — явление настолько
Рис. IX-4. Гипотетическая конформация адсорбированной цепной молекулы [35]
Поверхность раздела жидкость — твердое тело
319
Рис. IX-5. Адсорбция поливинилацетата
на железном порошке в четыреххлори-
стом углероде [34].
О 0,04 0,06 0J2 0J6 0,20
Равновесная концентрация, г/100 мл
сложное, что разобраться, например, в том, почему в отдельных случаях наблюдаются
отклонения от закона действия масс [уравнение (IX-20)], не просто.
Еще одна особенность адсорбции полимеров — возможность ее увеличения с
ростом температуры, как показано на рис. IX-5 (здесь, однако, имеются и исключения
[44]). Это означает, что при адсорбции преобладают не энергетические, а энтропийные
факторы. Поскольку энтропия полимера уменьшается, увеличение адсорбции с
температурой должно быть связано с увеличением энтропии растворителя. Последнее трудно
объяснить вытеснением адсорбированного растворителя в раствор, так как при этом
нарушается уравнение (IX-20). Скорее всего рассматриваемый эффект связан со
свойствами поверхностной фазы. Как показывает рис. IX-6, адсорбированные пленки могут
быть довольно толстыми. Толщину пленки (Аг на рис. IX-4 и IX-5) можно оценить
гидродинамически по увеличению кажущегося радиуса частиц адсорбента при
измерении зависимости вязкости раствора или по изменению эффективного диаметра пор
Мол. масса
• 950000
° НО 000
'О 0,05 0,10 0,15 0,20
Равновесная концентрация, г/ЮОмл
0 0,05 0J0 0J5
Равновесная концентрация, г/ЮОмл
020
Рис. IX-6. Адсорбция на пирексе полистирола в бензоле при 30 °С (а) и зависимость
толщины адсорбированной пленки Аг от равновесной концентрации раствора (б) [45а].
320
Глава IX
вследствие адсорбции полимера при течении раствора через пористое тело. Величину Дг
можно определять также эллипсометрическим методом [45].
При десорбции полимеров обычно наблюдается гистерезис (см., например, [36] и
[45а]). Это еще раз напоминает о том, что данные по адсорбции редко относятся
к истинному конечному равновесию. Вид гистерезиса (открытая петля) в этом случае
иной, чем в системах, способных к капиллярной конденсации (закрытая петля), что
характерно для наличия на поверхности остаточного трудно десорбируемого полимера
Вообще говоря, десорбция полимера представляет довольно интересную проблему.
Пели после достижения адсорбционного равновесия раствор разбавить или заменить
на чистый (но тот же самый) растворитель, то полимер медленно десорбируется с
поверхности адсорбента. И все же нельзя сказать, что адсорбированный полимер
необратимо связан с поверхностью! При добавлении в равновесную смесь меченого полимера
наблюдается довольно быстрый обмен с адсорбированным полимером. Это означает,
что, хотя адсорбированный полимер не вытесняется молекулами растворителя, он может
вытесняться другой молекулой полимера. Отметим также, что замена исходного
«плохого» растворителя «хорошим» растворителем приводит к ускорению десорбции (в
данной ситуации под «хорошим» растворителем подразумевается растворитель, в котором
взаимодействие растворитель — полимер является сильным и полимерная молекула
имеет в растворе большой радиус вращения; в противном случае растворитель —
«плохой») [46].
3. Определение удельной поверхности
При оценке удельной поверхности адсорбентов по результатам измерения
адсорбции из растворов исходят примерно из таких же соображений, что и при определении
удельной поверхности по адсорбции газов. Однако в данном случае положение
осложняется тем, что в растворах могут присутствовать крупные молекулы с
неопределенной ориентацией на поверхности, способность которых проникать в поры адсорбента
различна. Для правильной оценки удельной поверхности исследуемого материала
прежде всего необходимо, чтобы соблюдалась определенная модель адсорбции. На практике
это означает, что измерения ограничиваются такими системами, в которых реализуется
изотерма Лэнгмюра, описываемая уравнением (IX-11). При обработке
экспериментальных данных, например по уравнению (IX-11), из соответствующего графика находят
постоянную ns и затем по уравнению (IX-6) рассчитывают удельную поверхность 2
исследуемого образца. Единственная трудность — найти правильное значение а0.
Для определения удельной поверхности адсорбентов по адсорбции газов обычно
используют метод БЭТ. При этом вполне разумно принимают, что а0 равна вандер-
ваальсовой площади молекулы адсорбата. Кроме того, так как молекулы
адсорбируемых газов обычно малы или даже являются одноатомными, ориентация их на
поверхности не играет особой роли. При адсорбции из растворов может иметь место как
хемосорбция (и в этом случае а0 определяется площадью, занимаемой центрами
адсорбции на поверхности адсорбента), так и физическая адсорбция (при этом а0
в основном зависит от площади молекулы адсорбата, определенным образом
ориентированной на поверхности).
Обычно для оценки удельной поверхности используют адсорбцию жирных кислот,
поскольку они очень часто ориентируются перпендикулярно поверхности, занимая
в плотном монослое площадь 20,5 А2 в расчете на молекулу. Вертикальная
ориентация жирных кислот наблюдается, например, на саже [47], не слишком
электроположительных металлах [48, 30] и двуокиси титана [49]. Во всех этих случаях происходит,
по-видимому, хемосорбция, которая обусловлена либо образованием водородных
связей, либо даже образованием солей с окислами поверхности. Чтобы исключить
многослойную адсорбцию поверх первого слоя, используют полярные растворители, но и при
этом кажущаяся площадь может зависеть от природы растворителя. Если принять о°
равной 20,5 А2, то полученные величины удельной поверхности могут оказаться как
меньше, так и больше соответствующих значений, оцениваемых по адсорбции газов.
При адсорбции стеариновой кислоты на двуокиси титана [50] (см. упражнение IX-4)
сказывается либо уменьшение параметров решетки, определяющих а0, либо слишком
плотная упаковка молекул в пленке. В случае адсорбции на металлах может
происходить полимолекулярная адсорбция или химическое взаимодействие кислоты с окисной
пленкой на поверхности металла. Кроме того, следует иметь в виду, что ориентация
молекул на поверхности может значительно отличаться от вертикальной. Так, молекулы
стеариновой кислоты, адсорбирующиеся на графитированной саже, ложатся на
поверхность плоско (рис. IX-7). При этом адсорбция все еще описывается уравнением
Лэнгмюра [51]. Таким образом, оценивать удельную поверхность по адсорбции
жирных кислот следует весьма осторожно.
В качестве адсорбатов для оценки удельных поверхностей широко используются
также красители. Популярность этого метода обусловлена прежде всего простотой
колориметрического определения концентрации красителя в растворе. Обычно
адсорбция красителей описывается уравнением Лэнгмюра, однако она может быть и
полимолекулярной. Кроме того, адсорбция красителей может зависеть от состава раствора
и состояния поверхности. Так, по данным Колтоффа и Мак-Невина [52], изучавших
адсорбцию фиолетового красителя для шерсти, удельная поверхность сульфата бария
Поверхность раздела жидкость — твердое тело
321
Рис. IX-7. Расположение молекулы стеариновой кислоты, адсорбированной на
поверхности графитированного углерода [51].
составляет 1 м2/мг. В то же время Джоплинг [53] показал, что в зависимости от
концентрации ионов бария эта величина может возрасти не менее чем втрое (что, вероятно,
обусловлено влиянием поверхностного потенциала на адсорбцию ионного красителя).
Грэхэм [54] нашел, что кажущаяся площадь, занимаемая молекулой метиленового
голубого, на графоне составляет 197 А2, т. е. больше истинной площади поперечного
сечения молекулы, равной 175 А2, однако на более окисленной поверхности сферона
кажущаяся площадь молекулы составляет всего около 105 А2. Паддэй [56]
предполагает, что эти расхождения связаны с ассоциацией красителя на поверхности и в
растворе. Как и жирные кислоты, красители следует использовать для оценки удельной
поверхности образцов весьма осторожно.
Джайлс и др. [57] предложили в качестве адсорбата /г-нитрофенол и попытались
для этой цели применить также иод и фенол (см. [17]).
Существуют еще два других метода определения удельной поверхности по
адсорбции из растворов. Эверет [58] предложил метод, в котором используются бинарные
жидкие системы (см. ел. разд.). Этот метод обсуждается в работе [59]. Удельную
поверхность можно оценивать также по вытеснению одноименно заряженных ионов
с заряженной поверхности раздела фаз [60]. Этот метод, рассматриваемый
в разд. IX-5, интересен тем, что он не требует знания площади, приходящейся на
центр адсорбции, или площади, занимаемой молекулой адсорбата на поверхности
адсорбента.
Вообще, следует отметить, что методы определения удельной поверхности по
адсорбции из растворов хотя и удобны экспериментально, но не свободны от
систематических погрешностей (см. также обсуждение методов определения удельной
поверхности в разд. ХШ-2). Тем не менее при надлежащей стандартизации методики адсорбции
из раствора и использовании независимых способов контроля эти методы можно
весьма эффективно применять для определения относительных удельных поверхностей
сходных материалов.
4. Адсорбция в бинарных жидких системах
А. Адсорбция на поверхности раздела твердое тело — раствор
До сих пор речь шла только о таких системах, в которых
растворенное вещество было разбавлено настолько, что его адсорбция не
сопровождалась значительным изменением активности растворителя. При
адсорбции из бинарных жидких смесей с полным диапазоном
возможных концентраций, от чистой жидкости А до чистой жидкости В, необ-
21—1421
322
Глава IX
ходим более тщательный анализ. В этом случае определения
«растворенное вещество» и «растворитель» больше не имеют смысла. Тем не
менее уравнения, описывающие адсорбционное поведение системы,
удобно отнести к одному из компонентов, произвольно обозначенному
нами как компонент 2.
Адсорбция в бинарных жидких системах все еще определяется
уравнением (IX-1), но выраженным как
п% (кажущееся) =/i0A#£, (IX-22)
поскольку в концентрированных растворах использовать единицы
концентрации неудобно из-за зависимости плотности от состава. Индекс
/ показывает, что данная величина относится к раствору. Кроме того,
уравнение (IX-22) теперь определяет не истинное, а кажущееся
количество (в молях) адсорбированного компонента. Как будет показано
ниже, кажущаяся адсорбция определенным образом связана с
величиной относительного поверхностного избытка.
Предположим, что гиббсовская разделяющая поверхность (разд.
П-5) располагается на поверхности твердого тела (при этом,
разумеется, предполагается, что само твердое тело нерастворимо). В этом
случае поверхностный избыток Г|, по определению, равен (см.
упражнение IX-8)
Т1 = (п*/2)№-Щ)9 (IX-23)
где ns — общее число молей обоих компонентов в адсорбированном
слое, a N£ и Nl2 — относительные мольные доли компонента в
адсорбированном слое и в растворе, находящихся в равновесии друг с другом.
Как и прежде, для удобства числа молей отнесены к общему числу
молей системы, приходящихся на грамм адсорбента. Уравнение
(IX-23) можно записать следующим образом:
Ti=(nV%)Wn5—nL/nl)9 (IX-24)
где п§ и п[ — число молей 2 в адсорбированном слое и в растворе
соответственно. Учитывая, что /xf+n^ =/iJ (n\ — общее число молей
компонента 2) и ns-\-nl=n° (n° — суммарное число молей компонентов),
уравнение (IX-24) можно привести к виду
rj=(VS) {N\-Ni)=n^Niiy^ (IX-25)
Если принять, что N[-{-N1=1 и ns=nf + п$, то из уравнения (IX-23)
можно получить еще одну форму уравнения (IX-25):
Г«=л0ДЛГ£/2 = (nlN{-n\Ni)/ 2# (IX-26)
Важно отметить, что экспериментально определяемая, или кажущаяся,
адсорбция /г0ДЛ^/2 соответствует Г|, а не количеству компонента 2 в
адсорбированном слое ni. Только в разбавленном растворе, где Ni—►
—Я) и Nf—И, измеряемая адсорбция близка к п\. Таким образом, в
бинарных жидких системах изотерма адсорбции, т. е. зависимость П
от /V2,— это изотерма состава, или, как ее иногда называют, изотерма
изменения состава.
Уравнение (IX-26) показывает, что Г£ можно рассматривать как
разность индивидуальных изотерм компонентов 1 и 2 На рис. IX-8
[61] приведены изотермы состава, полученные при различных
комбинациях индивидуальных изотерм. Обратите внимание на рис. IX-8, а,
который показывает, что даже в отсутствие адсорбции компонента 1
кажущаяся адсорбция компонента 2 проходит через максимум (такой ход
изотерм связан с изменением N{, см. уравнение (IX-26)). Во всех дру-
Поверхность раздела жидкость — твердое тело
323
Концентрация ■
Рис IX-8. Изотермы адсорбции [61]
индивидуальные изотермы адсорбции;
-изотермы изменения состава.
гих случаях в концентрированных растворах кажущаяся адсорбция
компонента 2 отрицательна.
Эверет и др. [62] разработали усовершенствованную методику
экспериментального определения величин Г*. Некоторые данные этих
авторов приведены на рис. IX-9. Особый интерес здесь представляет
область отрицательных значений nf при низких температурах.
В некоторых работах вместо д? и п\ в уравнении (IX-26)
используются различные изотермы адсорбции. Так, Вильяме [63] и Бартелл и
др. [64] в качестве п\ и гФ берут изотерму Фрейндлиха. Поскольку
индивидуальные изотермы компонентов 1 и 2 содержат по две
эмпирические постоянные [см. уравнение (IX-15) ], в комбинированное
уравнение входят четыре подгоночных параметра, с помощью которых можно
описать почти любые экспериментальные данные. Разумеется, такая
обработка экспериментальных данных в какой-то мере теряет смысл.
Более изящный и интересный метод определения адсорбции
компонентов бинарных смесей предлагают Киплинг и Тестер [65]. Авторы
получили индивидуальные изотермы адсорбции паров бензола и
этанола на активном угле, находящемся в равновесии с данным раствором,
и по увеличению веса адсорбента и изменению состава раствора
рассчитали содержание каждого компонента в адсорбированной пленке.
Затем по индивидуальным изотермам адсорбции с помощью уравнения
ПХ-26) Киплинг и Тестер рассчитали изотермы кажущейся адсорбции,
которые, по существу, совпали с изотермами, измеренными
непосредственно. Данные Киплинга и Тестера приведены на рис, IX-10. Авторы
нашли также, что индивидуальные изотермы адсорбции чистых бензо-
та и этанола на угле описываются уравнениями Лэнгмюра Гуравнение
(IX-4)] "V
0, =ЪХР,1(\ +blPl), 62=VV(1 +b,P2),
(IX-27)
21*
24
Глава IX
QAY-
OJh
I
0,2
OJ
0F-
-oj
—г
h
Г Кг
L
1
mfijf
_j
i #L*"—i—
о о *V \3s
25S/5/fV^
гез./у/с-Л
j l i 1
т 1 г
^3tf,15K
Л28,15К
\,313,15K
,1. 1.. . 1
A
-\
-\
ь-Я
0,2
0A
Ni
0,6
0,8
Рис IX-9. Изотермы изменения состава или изотермы поверхностных избытков для
адсорбции бензола (7) и «-гептана (2) на графоне [62].
и оценили входящие в эти уравнения постоянные Ь\ и Ь2. С учетом этих
постоянных они рассчитали приведенные на рис. IX-10, а изотермы
адсорбции смеси паров, предполагая, что вся поверхность адсорбента
покрыта адсорбированной пленкой. Уравнение Лэнгмиора для
конкурентной адсорбции двух компонентов газовой фазы имеет следующий вид
(см. гл. XIV, разд. XIV-3):
e2=&2P2/(l+^i + V>2). (IX-28)
При указанном выше дополнительном
(IX-28) можно записать в другой форме:
предположении уравнение
во =
ь*р*
b2P»N[
b,P!+b2P2 ^PJtfJ+V^'
(IX-29)
где b\ и Ь2 идентичны соответствующим постоянным в уравнении
(IX-27). Как видно из рис. IX-10, а, полученные таким способом
(пунктирная линия) и экспериментальные (сплошная линия) изотермы
хорошо согласуются.
Рассмотренную в разд. IX-1 модель Лзнгмюра можно
непосредственно применить к уравнению (IX-23) [3]. Заменим в уравнении (IX-3) ах
и а2 на Nx и N2 (индекс / здесь опускается) и решим это уравнение
относительно N (заменяя при этом N\ на 1—N2).
№—N - (IX.30)
Подстановка последнего уравнения в уравнение (IX-23) дает
выражение
(K-\)N1N2
(IX-ЗП
Поверхность раздела жидкость — твердое тело
325»
■7 0,2 0,4 0,6 0,8
Концентрация этанола
в жидкой фазе, мол. доли
\
0.5
0
-0,5
-1.0
4П
° П.
^оЧ
| l
6 I
i i 1
0t2 0,4 0,6 0,8
Концентрация этанола
в равновесной смеси, мол. дола
Рис. IX-10. Изотермы адсорбции из бинарных жидких смесей и индивидуальные
изотермы адсорбции паров [65].
Система: этанол — бензол — активный уголь, а) — индивидуальные изотермы адсорбции паров
смеси, б) — расчетная изотерма и экспериментальные данные для жидкой смеси.
или, если использовать кажущуюся адсорбцию n°AN2,
NlN2/n°AN2 = l/ns{K—l) + (l/ns)N2.
(IX-32)
Последнее выражение весьма напоминает уравнение Лэнгмюра,
преобразованное в уравнение (IX-11). Отметим, что, если /С=1, Г|=0, т. е.
на поверхности раздела фракционирования не происходит. Эверет [3]
подтвердил применимость уравнения (IX-32) на нескольких системах
типа бензол — циклогексан — сферой 6.
Активность компонентов в адсорбированной фазе не обязательно
выражать через их мольные доли. Так, например, если молекулы двух
адсорбирующихся веществ различны по размеру, то уравнение (IX-2)
целесообразно представить как
Компонент 1 в растворе , Компонент 2 в адсорбированной фазе _
_ Компонент 1 в адсорбированной фазе . Компонент 2 в растворе
О"!
, (IX-33)
где о— площадь, занимаемая молекулой (или объем молекулы, если
толщина адсорбированной фазы предполагается постоянной). Тогда
уравнение (IX-3) можно представить в форме
K = (a[/a£)(ai/aQ<>i'a*.
(IX-34)
Используя уравнение типа (И-57), можно установить зависимость
между отношением коэффициентов активности и разностями поверхностных
натяжений, а затем исключить последние из полученного выражения с
326
Глава IX
помощью уравнения Гиббса—Дюгема (П-86) и адсорбционного
уравнения Гиббса (П-83). В итоге получаем [3, 60, 66]
In /С =—ст± Г (TyN2) d In at. (IX-35)
fli=0
Аналогичный вывод дан в работе [67].
При больших N2 изотермы типа представленной на рис. IX-8, а ста-
новятся почти линейными, т. е.
п^Щ=а—ЬЩ. (IX-36)
Уравнение (IX-26) можно записать как
n0AN{=ns2 — nsNl2 (IX-37
(поскольку ns=nf-{-ni и N(-\-Nl=l). Сравнение уравнений (IX-36) и
(IX-37) показывает, что наклон Ь линейной зависимости кажущейся
адсорбции от N2 равен емкости монослоя ns. Следовательно, зная площадь
молекулы, нетрудно оценить удельную поверхность образца. При этом
предполагается, что линейная область изотермы соответствует
преимущественной адсорбции компонента 2 и, таким образом, п\ почти не
меняется [58, 59].
Б. Соотношения между изотермами адсорбции
на различных поверхностях раздела
Селективная адсорбция из раствора может происходить не только на поверхности
находящегося в равновесии с раствором твердого адсорбента, но и на поверхностях
раздела раствор—пар (см. гиббсовскую адсорбцию в гл. II) и твердое тело—пар (как
в рассмотренном выше примере). Цель данного раздела — вкратце обсудить ряд
интересных соотношений, связывающих эти три класса адсорбционных явлений.
1. Поверхности раздела раствор — твердое тело и раствор — пар. В предыдущем
разделе величина поверхностного избытка Г| была определена относительно
разделяющей поверхности, расположенной на поверхности твердого тела. Разделяющую
поверхность можно было бы расположить в фазе раствора таким образом, чтобы
поверхностный избыток компонента 1 был равен нулю. При таком расположении разделяющей
поверхности поверхностный избыток компонента 2 определяется как Г| и его можно
найти с помощью методики, изложенной в разд. П-5.
Поверхностный избыток Г J определяется как избыток числа молей компонента 2
в поверхностном слое по сравнению с числом молей этого компонента в объеме
раствора, содержащем такое же число молей компонента 1, что и поверхностный слой.
Таким образом,
^ П = п\ - п\ (NtINx) = п" (Щ - N\N2INX), (IX-38)
или
V ri e {ns/Ni) {щ „ N%) 9 (1Х.з9)
^
Г1 = П/ЛГх = я0Д#2/2! Nx. (IX-40)
Решая совместно уравнения (IX-40) и (IX-31), получаем
Г^ = (^/^) {[(/С— 1) Л^2]/[1 -Ь(/С— 1) 7V2]}. (IX-41)
Обратите внимание, что Г 2 не стремится к нулю при N1—*1. Применительно к
поверхности раздела раствор—пар эта особенность параметра Г| обсуждалась в разд II-5
Отсюда, кстати, следовало, что
ЛГ1Г1 = Г^ = П. (IX-42)
Уравнение (IX-38), полностью аналогичное уравнению (П-123), вместе с
уравнением Гиббса (Н-85) дает выражение
kslV2 = Уз - ySLl2 = ( «7V/2) In [1 + (К - 1) Л'2], (IX-43,
Поверхность раздела жидкость — твердое тело
327
0,2 ОА 0,6 0,8
Концентрация пиперидина (а) или
циклогексана (6) в жидкой (разе, мол, дола
W
Рис. IX-11. Изотермы поверхностных избытков для системы циклогексан—пиперидин
на поверхности раздела жидкость—графой (а) и жидкость—пар (б) [17].
которое в свою очередь соответствует уравнению Шишковского (Н-67). В нем
постоянная а заменена на К—1 и концентрация выражена не в молях на литр, а в мольных
долях.
Полученные уравнения позволяют сравнить величины К для поверхностей раздела
трердое тело—раствор и раствор—пар. Например, при адсорбции бензола и
циклогексана на сфероне 6 [описываемой как указано в предыдущем разделе, уравнением
(IX-32)] /CcoL]2=6,8 И (т- е- преимущественно адсорбируется циклогексан). Из
данных, соответствующих поверхности раздела раствор—пар [68], получают /Cl1.,v = H
(индексами обозначена поверхность раздела, к которой относится К). Очевидно, что
в обоих случаях преимущественно адсорбируется циклогексан, хотя на поверхности
раздела углерод—раствор преимущественная адсорбция циклогексана выражена
в меньшей степени.
С помощью уравнений (И-57) и (П-58) относительную адсорбционную активность
поверхности раздела можно выразить несколько иначе. Решая совместно эти уравнения
и принимая, что площади, занимаемые молекулами обоих компонентов на поверхности
раздела твердое тело—раствор, одинаковы и равны а0, получаем
*5L12 = NlNjNlNt = exp [(ySLl - ySLJ &>/kT],
(IX-44)
гДе Ysl, и 7sl2—межфазное натяжение в присутствии только одного жидкого
компонента. Аналогичное уравнение для поверхности раздела раствор—пар имеет
следующий вид:
(IX-45)
Kl12v = exp [(yL±v - yl2v) o°/kT]
Если жидкости не смачивают твердое тело, то, решая совместно уравнения Юнга
[уравнение (VI1-18)] для каждой из двух жидкостей, получаем выражение
(YSLi — ySL2) = (л°3у2 — 7l°SVi) + (yLiy COS 6i — yLlV COS 62) ,
(IX-46)
из которого можно найти Ksl12. Уравнение (IX-46) можно представить также как
(YsLx - ysQ = (Vl2 - Уьг) + Vsl, - IslJ , (IX-47)
где / определяется уравнением (VII-39). Следует отметить, что уравнение (IX-47)
применимо как к несмачивающим, так и к смачивающим жидкостям. Пренебрегая
в первом приближении членом Isl2—?slv получаем
Ksl12 = 1/Kl12v.
(IX-48)
В рамках лэнгмюровской модели это означает, что изотерма Г2 на поверхности
раздела твердое тело—раствор описывается уравнением того же вида, что и изотерма
Г2 на поверхности раздела раствор—пар [уравнение (IX-42)]. Отсюда следует также,
что изотерма Г2 ~N2, характеризующая адсорбцию на поверхности раздела твердое
тело—раствор, должна налагаться на изотерму адсорбции Г^— Л^ для поверхности
раздела раствор—пар. На рис. IX-11 приредены две изотермы, полученные для разных
систем, но тем не менее имеющие одинаковую форму (см. [17]).
328
Глава IX
2. Поверхности раздела твердое тело—раствор и твердое тело—пар. Уравнение
(IX-31) можно привести к виду
0 = (/С— 1)N^/ll + (К - 1)N2] = (К- 1) ад/М + Мш) (IX-49)
или
9 = KN2I(NX + KN2) - N2. (IX-50)
В данном случае адсорбция на поверхности раздела твердое тело—раствор
определяется как избыток относительно величины адсорбции, которая имела бы место, если
бы концентрация раствора не менялась вплоть до самой поверхности раздела (т. е. 9
должна быть равной нулю при Х=1).
Решая совместно уравнения (IX-50) и (IX-29), получаем
K = b2Pyb1P°1, (IX-51)
где Pi и Р2 — упругости паров чистых жидкостей. С помощью подобного подхода
Киплинг и Тестер рассчитали приведенную на рис. IX-10 изотерму адсорбции на
поверхности раздела твердое тело—раствор, исходя из изотерм адсорбции чистых
жидкостей.
Зная индивидуальные изотермы адсорбции паров на поверхности раздела твердое
тело—пар, можно с помощью уравнения (IX-48) рассчитать адсорбцию на поверхности
раздела раствор—пар. Таким образом, в рамках лэнгмюровской модели для идеального
раствора по адсорбционным свойствам поверхности раздела одного типа можно
оценить адсорбционные свойства поверхностей раздела двух других типов. Конечно, такие
расчеты не очень точны, поскольку они основаны на довольно грубых посылках.
В. Теплоты адсорбции на поверхности раздела
твердое тело — раствор
Данных по теплотам смачивания твердых тел растворами получено довольно
мало, тем не менее они показывают, что теплоты смачивания реальных систем могут
почти не отличаться от идеальных. Юнг и др. [69] исследовали систему
графой—водный раствор бутанола, в которой монослойная адсорбция бутанола завершается при
довольно низких концентрациях. С помощью прямых адсорбционных измерений авторы
определили зависимость 9&— доли поверхности, покрытой бутанолом, — от
концентрации бутанола. Затем по теплотам смачивания графона бутанолом (111 эрг/см2) и водой
(32 эрг/см2) была найдена соответствующая теплота смачивания графона раствором.
При этом предполагалось, что компоненты адсорбированной пленки взаимодействуют
с поверхностью адсорбента независимо друг от друга, т. е.
Яеы = ЩЯ1+Щйш. (IX-52)
где #см — теплота смачивания раствором, a qi и qz— теплоты смачивания соотве1Ст-
вующими чистыми жидкостями. К этой средневзвешенной величине qCu был добавлен
тепловой эффект, обусловленный изменением концентрации водного раствора в
результате перехода бутанола в поверхностный раствор (эффект концентрирования
рассчитывался по данным о теплотах растворения бутанола в воде). Оказалось, что
полученные таким способом расчетные теплоты смачивания очень хорошо согласуются с"
экспериментально найденными.
Покажем на конкретном примере, как проводится обработка данных по теплотам
смачивания. Согласно результатам адсорбционных измерений, при концентрации
бутанола 0,3 г/100 мл степень заполнения поверхности 9 равна 0,5. Теплота растворения
бутанола составляет 25 кал/г растворенного бутанола. Площадь, занимаемая молекулой
бутанола в плотном монослое, принимается равной 40 А2, что соответствует адсорбции
3-Ю-8 г/см2, т. е. 1,5-Ю-8 г/см2 при 9 = 0,5. Чтобы удалить такое количество бутанола
из раствора, требуется затратить энергию примерно в 15 эрг. Теоретически теплота
взаимодействия графона с раствором бутанола составляет (113+32)/2, или 72 эрг.
Следовательно, собственно теплота смачивания должна быть равна около 57 эрг/см2,
что почти совпадает с экспериментальной теплотой смачивания. Аналогичный подход
оправдал себя и при изучении системы бензол—циклогексан—активный уголь [70].
Успех расчетов, основанных на предположении аддитивности, показывает, что
взаимодействие адсорбат—адсорбат в смешанной поверхностной фазе слабо сказывается на
теплотах смачивания.
Изотермы, приведенные на рис. IX-9, позволяют с помощью уравнения (IX-35)
рассчитать зависимость К от температуры. Это совершенно иной и более основательный
подход к оценкам теплот адсорбции, чем рассмотренный выше. По линейной
зависимости 1п/( от 1/Т можно определить энтальпию, которая при условии аддитивности должна
быть равна разности теплот смачивания графона в бензоле и я-гептане. Найденная
таким образом теплота адсорбции равна 2,6-10~3 кал/м2 [62], т. е. практически не
отличается от теплоты смачивания 2,4-10~3 кал/м2, найденной прямым методом.
Поверхность раздела жидкость — твердое тело
329
5. Адсорбция электролитов
Различают несколько типов взаимодействия электролита с
адсорбентом. Электролит может адсорбироваться как единое целое; этот
процесс напоминает молекулярную адсорбцию из растворов. Чаще,
однако, ионы одного знака удерживаются поверхностью сильнее, чем
ионы другого знака, образующие диффузный слой. Поверхность может
быть полярной и характеризоваться потенциалом i|l При этом в рамках
модели Штерна (разд. IV-3) адсорбцию можно рассматривать как
обмен с ионами диффузной части двойного слоя.
В ионоо'бменниках первичные ионы, химически связанные с
остовом полимера, обмениваются с ионами диффузного слоя. Ниже
приведено несколько примеров, иллюстрирующих адсорбцию электролитов.
А. Адсорбция электролитов и двойной электрический слой
Адсорбция электролитов на заряженной поверхности
обусловливается как электростатическими, так и специфическими химическими
силами. Вообще говоря, этот вопрос до некоторой степени затрагивался
в связи с другими темами. Здесь же мы дадим краткую сводку данных
по адсорбции на заряженных поверхностях и приведем некоторый
дополнительный материал. Уравнение Штерна [уравнение (IV-18)]
можно привести к виду, подобному уравнению Лэнгмюра [уравнение
(IX-10)]:
6/(1 — 0)==С2 ехр [(2Вф + ф)/#Г]. (IX-53)
В результате свободная энергия адсорбции, или, что менее точно,
энергия адсорбции Q, выражается как сумма электростатической и
химической составляющих.
Адсорбция в слое Штер«а рассматривалась в связи с влиянием
ионов на £-потенциалы (разд. IV-8), электрокапиллярными явлениями
(разд. IV-9), электродными потенциалами (разд. IV-10) и в связи с
влиянием электролитов на заряженные монослои (разд. III-14). Более
специфично штерновский слой проявляется при адсорбции
электролитов на ионных кристаллах. В этом направлении проделана большая
работа, что отчасти обусловлено важностью адсорбции электролитов в
плотном слое при получении аналитически чистых осадков и отчасти—
ролью адсорбции электролитов в коагуляции и других коллоидных
процессах.
Так, Вейзер [71], исследуя адсорбцию различных ионов на
сульфате бария, пришел к выводу, что степень адсорбции больше связана
с растворимостью бариевой соли адсорбируемого иона, чем с его
зарядом. Панет, Хан и Фаянс [72] также нашли, что на кристаллической
поверхности ион адсорбируется сильнее, если он образует с
противоположно заряженным ионом кристалла труднорастворимое или слабо
диссоциирующее соединение. В рамках уравнения (IX-53) это,
по-видимому, означает, что в данном случае адсорбция больше
контролируется ф, чем ip.
Адсорбция на ионных кристаллах нередко осложняется старением
поверхности. Удельная поверхность осадков обычно с течением
времени падает. Это уменьшение сопровождается снижением удельной
поверхностной энергии, обусловленным уменьшением числа ребер, углов
и других участков, обладающих повышенной энергией. Этот эффект
подробно изучен, в частности, Колтгоффом и др. [73].
Наличие двойного электрического слоя может приводить та»кже к
адсорбции нейтральных веществ, даже если они химически не
взаимодействуют с поверхностью твердого тела. Как отмечалось выше в
связи с обсуждением рис. IV-3, осмотическое давление растворителя меж-
330
Глава IX
Концентрация, моль/л
Рис IX-12. Изотермы адсорбции на частицах латекса-G в Ю-3 М растворе КВг (рН 8)
[76].
Адсорбируемые, ионы- / — гексадецилтриметиламмоний; 2 — додециламмоний; 3 — децилтриметил-
аммоний; 4 — октилтриметиламмоний. Стрелками отмечены точки ККМ; штриховой вертикальной
линией обозначено изменение знака заряда поверхности при адсорбции иона гексадецилтриметил-
аммония.
ду двумя заряженными пластинами ниже, чем в свободном растворе.
Между раствором, находящимся между этими пластинами, и
свободным раствором устанавливается равновесие, которое можно сдвигать,
меняя ионную силу раствора. Типичный пример проявления этого
влияния— сильная зависимость межплоскостного расстояния в
монтмориллоните (алюмосиликат слоистой структуры, см. рис. IX-16) от ионной
силы внешнего раствора. В этом случае межплоскостное расстояние в
разбавленном растворе, равное 19 А, уменьшается в 1—2 М растворе
1 : 1 электролита до 15А [74]. Феноменологически уменьшение
межплоскостного расстояния связано с подавлением адсорбции воды
электролитом.
В отсутствие сильного химического взаимодействия с поверхностью
твердого тела адсорбция ионов в значительной мере определяется их
зарядом. На этом основан давний вывод [75] о том, что адсорбция
ионов возрастает с увеличением их заряда. В свою очередь степень
адсорбции определяет способность ионов вызывать коагуляцию золей,
т. е. можно утверждать, что коагулирующая способность иона тем
больше, чем выше его заряд. Это правило Шульце—Гарди обсуждалось в
разд. VI-4B.
Очень часто при адсорбции электролитов важную роль играют как
химическое, так и электрохимическое взаимодействие. Так, Коннор и
Оттевил [76] пришли к выводу, что адсорбция четвертичных
аммониевых ионов с длинными цепями на частицах латекса первоначально
носит в основном электростатический характер. Благодаря
поверхностным гидроксильным группам поверхность самого латекса заряжена
отрицательно. В точке перегиба изотерм, показанных на рис. IX-12,
поверхностный заряд латекса нейтрализуется (в этой точке направление
электрофоретического движения частиц латекса меняется на обратное)^,
и дальнейшая адсорбция определяется притяжением алкильных цепей
к поверхности. При очень высоких концентрациях может наблюдаться
своеобразная ассоциация адсорбированных молекул. Фюрстенау и др
Поверхность раздела жидкость — твердое тело
331
^
£
ч
tt
^
г
1
§
-юо
-80
-60
-40
-20
0
20
/п
60\-
100
р 1 1—
l$"' """^L^ *^<
о \ Nfc
L •^\ь \
ГАС® V
Ь °Ск
I оС<2
Г дСю
[- вЫН^ООССНз
II I I
—I
,„] -,_
п г"
^^^
V A^Ne
°Ч ^Чл
DV^n
_J |_
I
I
I
H
•A
10
-? Ю'6 10'5 10"4 W3 10~z
Концентрация электролита, моль/л
Ю
-1
Рис. IX-13. Влияние длины углеводородной цепи на С-потенциал кварца в растворах
ацетата аммония и алкиламмония [78].
[77] предполагают, что в подобных системах (к ним относится, в
частности, система додецилбензолсульфонат натрия — окись алюминия)
агрегация молекул на поверхности приводит к образованию
полумицелл. Последние, как и обычные мицеллы, образуются лишь в
растворах, концентрация которых превышает критическую концентрацию
мицеллообразования (ККМ) (см. разд. XI-5). Хотя это действительно
довод в пользу поверхностной ассоциации адсорбированных молекул,
все же вопрос, насколько образующаяся при этом структура близка к
мицеллярной, остается открытым.
Влияние адсорбции на заряд частиц адсорбента можно определить
с помощью электрофоретических измерений и затем выразить как
изменение ^-потенциала. Так, адсорбция катионов на кварце в конечном
итоге приводит к уменьшению ^-потенциала до нуля (рис. IX-13).
Наблюдаемую линейную зависимость £ от lg C2 вблизи £=0 можно
объяснить тем, что в этой области концентрация в основном определяется ф
[уравнение (IX-51)]. Наклон кривой {d\gC2/dn\=oy где п — число
атомов углерода в углеводородной цепи, соответствует энергии адсорбции
600 кал/СН2-группа, что практически совпадает с энергией адсорбции,
найденной для поверхности раздела вода — воздух (см. разд. 11-7Г).
Фюрстенау рассматривает этот результат как свидетельство
поверхностной ассоциации или образования «полумицелл».
Поверхностный заряд можно контролировать или фиксировать с
помощью потенциал-определяющего иона. В табл. IX-1, заимствован-
Таблица IX-I
Потенциал-определяющие ионы и точки нулевого заряда различных минералов [79]
Минерал
Фторапатит Ca5(P04)3(F, ОН)
Гидроксиапатит Са5(Р04)з(ОН)
Глинозем А1203
Кальцит СаСОз
Флюорит CaF2
Барит (синт.) BaS04
Иодид серебра
Хлорид серебра
Сульфид серебра
Потенциал-определяющий ион
н+
н+
н+
н+
Са+2
Ва+2
Ag+
Ag+
Ag+
Точка нулевого
заряда
рН 6
рН 7
рН 9
рН 9,5
рСа 3
рВа 6,7
pAg 5,6
pAg 4
pAg 10,2
332 Глава IX
ной из работы [79], приведены потенциал-определяющие ионы ряда
минералов и концентрации этих иойов, отвечающие точкам нулевого
заряда. Отметим, что для многих минералов (окислы, силикаты,
фосфаты, карбонаты и т. д.) потенциал-определяющим является ион
водорода. Для таких минералов адсорбция поверхностно-активных ионов
сильно зависит от рН (см., например, рис. IX-14).
Потенциал-определяющие ионы играют важную роль во флотации (см. разд. XI-4B).
В электрохимии очень важное значение имеет адсорбция
электролитов на металлах. Из .новых работ в этой области отметим исследование
методом эллипсометрии [80] адсорбции различных анионов на Ag-, Au-,
Ru- и Ni-электродах.
Б. Оценка удельной поверхности по отрицательной адсорбции
Теория двойного электрического слоя положена в основу
интересного метода оценки удельной поверхности твердых тел по степени
вытеснения с поверхности раздела твердое тело — раствор номов,
имеющих тот же знак заряда, -что и поверхность твердого тела. Согласно
уравнению (IV-2), вблизи отрицательно заряженной поверхности
концентрация анионов меньше концентрации катионов (рис. IX-15).
Вследствие такого вытеснения отрицательных ионов концентрация раствора,
приведенного в равновесие с твердым телом, возрастает с п0 до n'Q.
В этом случае уравнение материального баланса имеет вид
АГ=УД/?0, (IX-54)
где А —площадь поверхности твердого тела, находящегося в растворе
объемом V, Г-— отрицательная адсорбция анионов и Ап0=(п'—п0) —
Ю431 1 1 I 1 I I I
J 4 5 6 7 8 9 10
РН
Рис. IX-14. Влияние рН на адсорбцию додецилсульфоната натрия на окиси алюминия
в 2-10—3 М растворе NaCl [79]
Поверхность раздела жидкость — твердое тело
333
Рис. IX-15 Распределение ионов вблизи незаряженной (п0) и отрицательно заряженной
(п'0) поверхности при очень большом -ф0 [60].
увеличение концентрации раствора. Отрицательная адсорбция равна
заштрихованной области «а рис. IX-15, т. е.
-rC)dx.
(IX-55)
Последнее уравнение можно привести к окончательному виду, заменив
гг на выражение (IV-2) и dx на dty [с помощью уравнения (IV-11)].
Сделав ряд упрощающих предположений, ван ден Хул и Ликлема [60]
получили для водных растворов 1 : 1 электролита при 20°С следующее
уравнение:
А-==0,52.109У/г0/У/г;>
(IX-56)
где V выражено в см3, а концентрации — в моль/см3. Этот метод был
успешно применен авторами для определения удельной поверхности
суспензий Agl. Поскольку метод дает удовлетворительные результаты
лишь при постоянном (и достаточно высоком) -фо, такие измерения
проводятся при соответствующей концентрации ионов 1~.
Идея метода отрицательной адсорбции была высказана Шофильдом
[81, 82], который вывел уравнения, аналогичные приведенным, но при
условии постоянства поверхностного заряда твердого тела. При этом
допущении метод отрицательной адсорбции особенно пригоден для
цеолитов и глин, на поверхности которых имеется определенное число
дискретных центров, несущих постоянный заряд. Примером может
служить относительно недавняя работа Эдвардса и Квирка [83], в
которой для определения удельной поверхности монтмориллонита
использовалось вытеснение ионов хлора.
В. Адсорбция противоионов. Ионный обмен
С теоретической и практической точек зрения большой интерес
представляет обширная группа адсорбентов, у которых имеются
заряженные центры —ионы или ионные группы, входящие в решетку
адсорбента. Монтмориллонитовые глины, например, имеют сложную структуру.
Слои тетраэдров Si04 чередуются со слоями октаэдров, образованных
334
Глава IX
О Кис/город •Кремний о Алюминий Q Калии
© (ОН) «> Si-AI Ф Al-Mg
Рис. IX-16. Слоистая структура глин, пирофиллита и слюды [84].
ионами О- и ОН~, которые координированы А13+ (рис. IX-16) [84].
В не слишком кислом растворе возможен обмен катионов на протоны.
Кроме того, монтмориллонитовые глины способны к набуханию, что
связано с влиянием ионной силы раствора на отталкивание двойных
слоев (см. разд. IV-4B, гл. 4 и [85]).
Кристаллическая решетка каркаса алюмосиликатов построена из
силикатных тетраэдров, в части которых кремний замещен на
алюминий. Для того чтобы такая система оставалась электронейтральной, в
нее должны входить катионы или протоны, образующие гидроксильные
группы. Известно множество такого рода структур. Некоторые из
каркасных алюмосиликатов имеют пористую трехмерную решетку и,
подобно слоистым алюмосиликатам, способны как к набуханию, так и к
ионному обмену. К такого рода алюмосиликатам относятся, в
частности, цеолиты, которые интенсивно исследуются и как ионообменники,
и как адсорбенты газов (см., например, [86] и [87]).
Органические ионообменники были впервые получены в 1935 г.; в
настоящее время известно очень много их типов. Первые органические
ионообменники представляли собой фенол-формальдегидные смолы на
основе природных фенолов, однако сейчас более распространены
различные полистирольные смолы. В них вводят группы RS03, кислотность
которых настолько высока, что ионный обмен может происходить в
довольно кислом растворе. Свойства таких ионообменников можно
менять, увеличивая или уменьшая число сульфогрупп и степень сшивки.
В ионообменник можно вводить и другие группы, например RCOO-,
селективно обменивающиеся с определенными катионами. Широко
используются анионообменные смолы, содержащие группы RNH2. При
обработке таких смол кислотой аминогруппы переходят в группы
RNH.JX-, где Х- может обмениваться на другие анионы.
Свойства ионообменников больше определяются кинетикой и
условиями равновесия ионного обмена, чем чисто поверхностными факто-
Поверхность раздела жидкость — твердое тело
335
рами. Формальное выражение, описывающее ионный обмен, имеет
следующий вид:
AR+B = BR+A, (IX-57)
где R — матрица, А и В — обменивающиеся ионы; предполагается, что
система подчиняется закону действия масс. Поскольку AR и BR
распределены внутри обменивающейся фазы, их можно рассматривать как
компоненты некоторого неидеального раствора. Для этого их-
концентрацию, выражаемую в мольных долях, необходимо умножить на
соответствующий коэффициент активности. Другими словами,
ионообменную фазу можно представлять фактически как концентрированный
раствор электролита и использовать в расчетах его объемные
концентрации, но опять же с поправкой на коэффициент активности.
Неидеальность такого раствора можно оценить, рассматривая ионообменную
фазу как среду, проницаемую для катионов, но непроницаемую для R
и ионов решетки. При таком подходе ионный обмен подобен доннанов-
скому равновесию (см. разд. IV-11B), что позволяет, в частности,
довольно просто объяснить причины набухания.
Скорость ионного обмена обычно определяется диффузионными
процессами, причем скорость-определяющей стадией может быть как
диффузия через пограничный слой жидкости на внешней поверхности ионо-
обменника, так и диффузия в самом ионообменнике [88].
Теоретическое рассмотрение внутридиффузионных процессов осложняется
необходимостью учета требования электронейтральности [89, 90].
Рассмотренные в этой главе вопросы тесно связаны с очень
широкой областью ионообменной адсорбции и ионообменной
хроматографии, подробное обсуждение которых не входит в наши задачи.
Исчерпывающие сведения по всем этим вопросам читатель может найти в
соответствующих руководствах и в работах [74—77].
6. Упражнения
1. Покажите, что при суммировании по всем компонентам раствора 2п^ в
уравнении (IX-1) равна нулю.
2. Авторы работы [95] показали, что адсорбция аэрозоля ОТ на адсорбенте
вулкан R подчиняется уравнению Лэнгмюра и описывается линейной зависимостью С/х
от С, где С измеряется в моль/л, ах — в мкмоль/г. Отношение С/х равно 100, если
С = 0,5. Прямая проходит практически через начало координат. Рассчитайте
предельную адсорбцию в микромолях на грамм.
3. Исследуется адсорбция полистирола (мол. вес 300 000) из толуола на угле
Удельная поверхность угля составляет 120 м2/г, предельная адсорбция равна 33 мг
полистирола на 1 г угля. При концентрации полимера в растворе 0,1 мг/мл адсорбция
составляет 28 мг/г. а) Предположите, что адсорбция описывается уравнением
Лэнгмюра, и рассчитайте постоянную Ъ этого уравнения, б) Сделайте то же самое, использ\ я
уравнение (IX-20) и принимая v = 50. в) Постройте для а) и 6) полные изотермы и
оцените, какова должна быть точность эксперимента, для того чтобы четко различить
эти две изотермы, г) Рассчитайте число молекул полимера, адсорбированных на одной
частице угля при предельном заполнении поверхности.
4. Ниже приведены результаты измерений адсорбции стеариновой кислоты на сфе-
роне б из различных растворителей:
Количество адсорбированной кислоты, ммоль/г
Растворитель tf8=0.001 Л'8=0.004
Циклогексан 0,030 0,050
Этиловый спирт 0,015 0,025
Бензол 0,008 0,010
Рассчитайте для каждой системы кажущуюся удельную поверхность сферона,
предполагая, что адсорбция описывается уравнением Лэнгмюра. Какие при этом придется
сделать допущения? Насколько точны полученные результаты? Ответ обоснуйте.
5. В 100 мл водного раствора метиленового голубого содержится 0,15 мг
красителя. Оптическая плотность раствора (или молярное поглощение) при некоторой длине
волны составляет 0,65. После добавления 25 мг активного угля оптическая плотность
раствора снизилась до 0,20 Оцените удельную поверхность угля.
336
Глава IX
6 При измерении адсорбции стеариновой кислоты из раствора в «-гексане на
стальном порошке получены следующие результаты:
Концентрация, Адсорбция, Концентрация, Адсорбция,
ммоль/л мг/г ммоль/л мг/г
0,01 0,786 0,15 1,47
0,02 0,864 0,20 1,60
0,04 1,00 0,25 1,70
0,07 1,17 0,30 1,78
0,10 1,30 0,50 1,99
Объясните адсорбционное поведение системы и рассчитайте удельную поверхность
стали.
7. Для оценки удельной поверхности порошкообразного твердого вещества можно
использовать адсорбцию красителя из раствора. Предположим, что при введении 1 г
костяного угля в 100 см3 Ю-4 М раствора метиленового голубого равновесная
концентрация красителя падает до 0,6-Ю-4 М, а при введении 2 г костяного угля равновесная
концентрация красителя равна 0,4-10~4 М.
С помощью уравнения Лэнгмюра рассчитайте удельную поверхность костяного
угля (в м2/г). Площадь, занимаемую молекулой метиленового голубого в плотном
монослое, примите равной 65 А2.
8. Выведите уравнение (IX-23).
9. Пары А и В адсорбируются на некотором твердом теле в соответствии с
уравнением Лэнгмюра [уравнение (IX-27)]. При 25 °С давление, при котором покрывается
половина поверхности, для чистого А составляет 5 мм рт. ст., а для чистого В —
2 мм рт. ст.; давления насыщенных паров А и В соответственно равны 75 и
50 мм рт. ст. Рассчитайте и постройте а) изотермы адсорбции паров чистых А и В,
б) изотермы адсорбции отдельных компонентов на поверхности твердого тела,
находящегося в равновесии с парами растворов различного состава — от чистого А до
чистого В, и в) изотермы изменения состава для кажущейся адсорбции из различных
растворов — от чистого А до чистого В. Раствор, поверхностный слой и пары считайте
идеальными.
10. Как видно из рис. П-8, а (гл. II) поверхностное натяжение смесей изооктан—
бензол очень хорошо описывается уравнением (Н-60), если а принять равным
112 А2/молекула. Рассчитайте зависимость Г2 от N2 для поверхности раздела
раствор—воздух, где в качестве компонента 2 взят бензол. С помощью уравнения (IX-45)
рассчитайте аналогичную зависимость для поверхности раздела раствор—твердое тело.
11. Для адсорбции на сфероне 6 из смесей бензол-циклогексан прямая,
выражающая зависимость NiNilnfkNi от Nz (в качестве компонента 2 здесь взят циклогексан),
имеет наклон 2,3 и отсекает от оси ординат отрезок, равный 0,4. а) Рассчитайте
величину /(. б) Приняв площадь, приходящуюся на молекулу, равной 40 А2, рассчитайте
удельную поверхность сферона 6. в) Постройте график изотермы изменения состава.
12. На рис. IX-17 приведены полученные Киплингом [17] индивидуальные
изотермы адсорбции бензола и бутилового спирта из смешанных паров на графоне и
сфероне 6 Рассчитайте и постройте для каждого адсорбента изотермы изменения состава
при адсорбции из жидкой смеси бензол—бутиловый спирт при 30 °С.
13. Используя данные, приведенные на рис. IX-17, рассчитайте и постройте
изотермы адсорбции бензола и бутилового спирта на графоне и сфероне 6 из паров,
содержащих только один компонент.
14. Из уравнения (IX-31)
ч с (*-1)ЛЦУ1
nl (кажущ.) = ns X+(K__X)N^
следует, что при определенных условиях должна наблюдаться отрицательная
кажущаяся адсорбция. Что это за условия? Каким изотермам изменения состава,
приведенным на рис. IX-8, ближе всего соответствует изотерма, найденная для этих условий?
15. Рассчитайте теплоту смачивания графона водным раствором бутанола
концентрацией 0,1 г/100 мл (см. разд. IX-4B).
16. Приведенные в разд. IX-4B экспериментальные теплоты адсорбции в
действительности соответствуют теплотам смачивания. Допустим, что теплота адсорбции газа
измеряется с помощью следующего процесса:
Твердое тело находится в контакте Твердое тело находится в контакте
с раствором, но адсорбции не про- *- с раствором и покрыто равновес-
исходит, таким образом, Г£ = 0 ным адсорбированным слоем
Используя численный пример, данный в разд. IX-4B, рассчитайте теплоту адсорбции
(в эрг/см2) на графоне из водного раствора бутанола концентрацией 0,3 г/100 мл.
17. Почему адсорбированный полимер при разбавлении равновесного раствора
десорбируется очень медленно и почему в той же самой равновесной системе
происходит быстрый обмен с меченым полимером?
Поверхность раздела жидкость — твердое тело
337
0,5
ОА
0,3
!* ОЛ
| 0,1
5 О
о;"
й ОА
ИЗ
0,2
О ОЯ ОА 0,6 0,8 fft
Концентрация спирта
в жидкой фазе, мол. доли
Рис. IX-17. Индивидуальные изотермы адсорбции «-бутилового спирта и бензола на
(а) графоне и (б) сфероне 6 из смесей [17].
18. Как следует из рис. IX-15, вытеснение коионов (т. е. ионов, несущих заряд
того же знака, что и поверхность) происходит вследствие увеличения концентрации
раствора от «о до п'0. Поскольку раствор должен оставаться электронейтральным, это
означает, что концентрация противоионов также должна увеличиваться с п0 до п'0.
И все же рис. IX-15 показывает, что катионы адсорбируются. Уменьшается ли
концентрация катионов при введении адсорбента в раствор? Дайте подробное объяснение
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Delay R., Prigogine /., Surface Tension and Adsoprtion, transl. by Everett D. H., Wiley,
New York, 1966.
Eitel W., Silicate Science, Vol. 1, Academic Press, New York, 1964.
Freundlich #., Colloid and Capillary Chemistry, Methuen, London, 1926.
Kipling J. /., Adsorption from Solutions of Non-Electrolytes, Academic Press, New York,
1965.
Lederer E., Lederer M., Chromatography, Elsevier, New York, 1955.
Marinsky J. A., Marcus Y., eds., Ion Exchange and Solvent Extraction, Dekker M., New
York, 1973.
Mittal /C. L., Adsorption at Interfaces, ACS Symposium Series No. 8, American Chemical
Society, Washington D. C, 1975.
Nachod F. C, Schubert J., Ion Exchange Technology, Academic Press, New York,
1956.
Osborn G. H., Synthetic Ion Exchangers, 2nd ed., Chapman and Hall, London 1961.
Samuelson 0., Ion Exchangers in Analytical Chemistry, Wiley, New York, 1955.
Schay G., Surface and Colloid Science, Matijevic E., ed., Wiley-Interscience, New York,
1969.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Everett D. #., Pure Appl. Chem., 31, 579 (1972).
2. Lagmuir L, J. Amer. Chem. Soc, 40, 1361 (1918).
3. Everett D. #., Trans. Far. Soc, 60, 1803 (1964); 61, 2478 (1965). Ash S. G.,
Everett D. Я., Findenegg G. #., Trans. Far. Soc, 64, 2645 (1968).
4. KUnkenberg A.t Rec Trav. Chim., 78, 83 (1959).
5. Wagner C, Nachrichten der Akademi der Wissenschaften in Gottingen, II. Mathema-
tisch-Physikalische Klasse, No. 3, 1 (1973).
6. Baret J. F., Kolloid-Z. Z. Polymere, 246, 636 (1971).
7. Zeldowiish J\, Acta Physicochim. (USSR), 1, 961 (1934).
8. Halsey G., Taylor H. S., J. Chem. Phys., 15, 624 (1947).
9. Freundlich #., Colloid and Capillary Chemistry, Methuen, London, 1926.
22—1421
338
Глава IX
10. Traube /., Ann., 265, 27 (1891), and preceding articles.
11. Holmes H. N., McKelvey J. В., J. Phys. Chem., 32, 1522 (1928).
12. Bartell F. E., Fu Y.t J. Phys. Chem., 33, 676 (1929).
13. von Szyszkowski В., Z. Phys. Chem., 64, 385 (1908); Meissner H. P., Michaels A. S.,
Ind. Eng. Chem., 41, 2782 (1949).
14. Hansen R. S., Craig R. P., J. Phys. Chem., 58, 211 (1954).
15. Bartell F. E., Thomas T. L., Fu Y., J. Phys. Colloid Chem., 55, 1456 (1951).
16. Manes M.} Hofer L. J. £., J. Phys. Chem., 73, 584 (1969).
17. Kipling J. J., Adsorption from Solutions of Non-Electrolytes, Academic Press, New
York, 1965.
18. Schroeder W. A., J. Amer. Chem. Soc, 73, 1122 (1951).
19. Wheeler O. H.f Levy E. M., Can. J. Chem. 37, 1235 (1959).
20. Smith W. R.t Schaeffer W. D., Proc. Rubber Technol. Conf., 2nd, London, 1948.
21. Gasser C. G., Kipling /. /., Proc. Conf. Carbon, 4th, Buffalo, 1959, p. 55.
22. Neher R., Chromatog. Rev., 1, 99 (1959).
23. Жданов С. П., Киселев А. В., Павлова Л. Ф., Кинетика и катализ, 3, 445 (1962).
24. Hansen R. D.f Hansen R. S., J. Colloid Sci., 9, 1 (1954).
25. Morrison J. L., Miller D. M.t Can. J. Chem., 33, 350 (1955).
26. Hackerman N„ Roebuck A. H., Ind. Eng. Chem., 46, 1481 (1954). See also Mat-
sen F. A., Makrides A. C., Hackerman N., J. Chem. Phys., 22, 1800 (1954).
27. Smith Я. A., Allen K. A., J. Phys. Chem., 58, 449 (1954).
28. Finley H. F., Hackerman N., J. Electrochem. Soc, 107, 259 (1960).
29. Kar G., Healy T. W., Fuerstenaa D. W., Corrosion Sci., 13, 375 (1973).
30. Hansen R. S„ Fu Y.t Bartell F. E., J. Phys. Colloid Chem., 53, 769 (1949).
31. Джигит О. М„ Киселев А. В., Красильников К. Г., ДАН СССР, 58, 413 (1947).
32. Bartell F. £., Donahue D. /., J. Phys. Chem., 56, 665 (1952).
33. Cook E. L., Hackerman N., J. Phys. Colloid Chem., 55, 549 (1951).
34. Utlman R., Koral J., Eirich F. R., Proc. Intern. Congr. Surface Activity, 2nd, London,
1957, Vol. Ill, p. 485.
35. Rowland F., Bulas R., Rothstein E.t Eirich F. R., Ind. Eng. Chem., September 1965,
p. 46.
36. Peterson C, Kwei T. /0, J. Phys. Chem., 65, 1330 (1961).
37. Heller W., Pure Appl. Chem., 12, 249 (1966).
38. Frisch H. L., Hellman M. Y„ Lundberg J. L., J. Polymer Sci., 38, 441 (1959).
39. Frisch H. L., Simha R., J. Chem. Phys., 27, 702 (1957), and earlier papers.
40. Silberberg A., J. Phys. Chem., 66, 1872, 1884 (1962); J. Colloid Interface Sci., 38, 217
(1972).
41. Hoeve С A. J., DiMarzio E. A., Peyser P., J. Chem. Phys., 42, 2558 (1965).
42. Ash S. G.f Everett D., Findenegg G. //., Trans. Far. Soc, 66, 708 (1970).
43. Fontana B. J., Thomas J. R.t J. Phys. Chem., 65, 480 (1961); McCrackin F.t J. Chem.
Phys., 47, 1980 (1967).
44. Gilliland E. R.} Gutoff E. В., J. Appl. Polymer Sci., 3, 26 (1960).
45. Stromberg R. R.f Tutas D. J.t Passaglia E., J. Phys. Chem., 69, 3955 (1965).
46. Rowland F. W., Eirich F. R., J. Polymer Sci., 4, 2421 (1966)
46. Eirich F. R., Interface Conversion for Polymer Coatings, Weiss P., Cheever G. D.,
eds., American Elsevier, 1969.
47. Smith H. A., Hurley R. В., J. Phys. Colloid Chem., 53, 1409 (1949).
48. Tingle E. D.t Trans. Faraday Soc, 46, 93 (1950).
49. Kipling J. J., Wright E. H. M., J. Chem. Soc, 1964, 3535.
50. Harkins W. D., The Physical Chemistry of Surface Films, Reinhold, New York, 1952,
p. 244.
51. Kipling J. /., Wright E. H. M., J. Chem. Soc, 1962, 855.
52. Kolthoff I. M., MacNevin W. M., J. Am. Chem. Soc, 59, 1639 (1937).
53. J opting D. W., J. Appl. Chem. (London), 2, 642 (1952).
54. Graham D., J. Phys. Chem., 59, 896 (1955).
55. Kipling J. J., Wilson R. B.f J. Appl. Chem., 10, 109 (1960).
56. Padday /. F.} Pure and Applied Chemistry, Surface Area Determination, Butterworths,
London, 1969.
57 Giles C. H., MacEwen T. H., Nakhwa S. N.t Smith D., J. Chem. Soc, 1960, 3973.
58. Everett D. H.t Trans. Far. Soc, 61, 2478 (1965).
59. Schay G., Nagy L. G., J. Colloid Interface Sci., 38, 302 (1972).
60. Van den Hul Я. /., Lyklema J., J. Colloid Interface Sci., 23, 500 (1967).
61. Kipling J. /., Quart. Rev. (London), 5, 60 (1951).
62 Ash S. G., Bown R., Everett D. H., J. Chem. Thermodyanics, 5, 239 (1973).
63. Gustaver В., Kolloid-Z., 31, 358 (1922).
64. Bartell F. E.t Scheffler G. N., J. Amer. Chem. Soc, 53, 2507 (1931), and preceding
papers.
65. Kipling J. J., Tester D. A., J. Chem. Soc, 1952, 4123.
66. Parfitt G. D., Thompson P. C, Trans. Far. Soc, 67, 3372 (1971).
67 Schay G., Surface and Colloid Sci., 2, 155 (1969); J. Colloid Interface Sci., 42, 478
(1973).
68. Kipling J. L, Proc. Intern. Congr. Surface Activity, 3rd, Mainz, 1960, Vol. 2, p. 77.
Поверхность раздела жидкость — твердое тело
339
69. Young G. J., JChessick J. /., Healey F. H.f J. Phys. Chem., 60, 394 (1956).
70. Billett D. F., Everett D. H., Wright E. E. H., Proc. Chem. Soc (London), 1964, July,
p. 216.
71. Weiser H. B.t Colloid Chemistry, Wiley, New York, 1950.
72. Fajans K., Radio Elements and Isotopes; Chemical Forces and Optical Properties of
Substance, McGraw-Hill, New York, 1931.
73. Kolthoff I. M., Bowers R. C, J. Amer. Chem. Soc, 76, 1503 (1954).
74. Posner A. M., Quirk J. P., J. Colloid Sci., 19, 798 (1964).
75. Bancroft W. D., J. Phys. Chem., 19, 363 (1915).
76. Connor P., Ottewill R. H„ J. Colloid Interface Sci., 37, 642 (1971).
77. Dick S. G., Fuerstenau D. W.f Healy T. W.f J. Colloid Interface Sci., 37, 595 (1971).
78. Somasundaran P., Healy T. W., Fuerstenau D. W., J. Phys. Chem, 68, 3562 (1964).
79. Fuerstenau D. W., Chem. Biosurfaces, 1, 143 (1971).
80. Paik W., Genshaw M. A., Bockris /. O'M., J. Phys. Chem., 74, 4266 (1970).
81. Schofield R. /C, Nature, 160, 408 (1947).
82. Schofield R. K., Talibuddin 0.t Discuss Faraday Soc, 3, 51 (1948).
83. Edwards D. G., Quirk /. P., J. Colloid Sci., 17, 872 (1962).
84. Apian F. F., Fuerstenau D. W., in Froth Flotation, Fuerstenau D. W., ed., American
Institute of Mining and Metallurgical Engineering, New York, 1962.
85. Bolt G. #., Miller R. D., Soil Sci. Amer. Proc, 19, 285 (1955); Blackmore A. V.,
Miller R. D.t op. cit., 25, 169 (1961). van Olphen H., J. Phys. Chem., 61, 12.76
(1957).
86. Barrer R. M., Gibbons R. M., Trans. Faraday Soc, 59, 2569 (1963), and preceding
references.
87. Gaines G. U Thomas H. C, J. Chem Phys, 23, 2322 (1955).
88. Boyd G. E.t Adamson A. W., Myers L. S.t Jr., J. Amer. Chem. Soc, 69, 2836
(1947).
89. Grossman J. /., Adamson A. W., J. Phys. Chem., 56, 97 (1952).
90. Schlogl R., Helflerich F., J. Chem. Phys., 26, 5 (1957).
91. Marinsky J. A., Marcus Y., eds, Ion Exchange and Solvent Extraction, Dekker M.,
New York, 1973.
92. Osborn G. H., Synthetic Ion Exchangers, 2nd ed., Chapman and Hall, London,
1961.
93. Nachod F. C, Schubert J,, Ion Exchange Technology, Academic Press, New York,
1956.
94. Kunin R., Myers R. J., Ion Exchange Resins, Wiley, New York, 1950.
95. Abram J. C., Parfitt G. D.t Proc 5th Conf. Carbon, Pergamon Press, New York, 1962,
p. 97.
22*
ГЛАВА X
Трение и смазка. Адгезия
1. Введение
Эта и две следующие главы дают представление лишь о некоторых
областях применения химии поверхностей. О трении и смазке
говорится более или менее подробно в любом руководстве по химии
поверхности, так как они имеют непосредственно отношение к поверхностям,
и, кроме того, эффективность смазки определяется свойствами
поверхностных пленок. В этой главе рассматривается (правда, довольно
кратко) и адгезия, поскольку она в очень большой степени зависит от
свойств пленок на твердых поверхностях. Вообще говоря, трение и
адгезия до некоторой степени связаны между собой.
2. Трение между несмазанными поверхностями
А. Закон Амонтона
Коэффициент трения [i между двумя твердыми телами определяется
как F/W, где F — сила трения и W — нагрузка, или сила, направленная
по нормали к трущимся поверхностям (рис. Х-1). С коэффициентом
трения jli связан очень простой закон, который удивительно хорошо
соблюдается на практике. Этот закон, известный как закон Амонтона,
гласит, что \х не зависит от кажущейся площади контакта. Это
означает, что при одной и той же нагрузке W силы трения для маленького и
большого кубиков, скользящих по одной и той же поверхности,
одинаковы. В результате \х не зависит от нагрузки. Таким образом, если
W{ = W2, то F{=F2.
С трением между различными объектами мы сталкиваемся
постоянно. Тем более любопытно, что, хотя закон Амонтона хорошо
выполняется, на первый взгляд он противоречит здравому смыслу. И
действительно, когда в 1699 г. французский военный инженер Амонтон
представил результаты своих наблюдений в Королевскую академию наук,
их встретили довольно скептически. Амонтон предвидел такую
возможность и в своей статье (Mem. Acad. Roy. Sci, 1699, 206) по-пытался дать
качественное объяснение полученных результатов. Однако, как это
часто бывает, закон, отражающий экспериментальные факты, лучше
перенес испытание временем, чем данное ему объяснение. По мнению
Амонтона, трение отчасти связано с работой, совершаемой при
вертикальном движении тела на шероховатостях поверхности. Подлинные
причины возникновения трения (или по крайней мере принятые в
настоящее время), как показано ниже, совершенно иные. Кроме того,
Амонтон упорно доказывал, что коэффициент трения всегда равен 7з-
Действительно, обычная его величина близка к 7з, но, как показано в
разд. Х-4, коэффициент трения между по-настоящему чистыми
поверхностями может быть значительно больше, а коэффициент трения
между поверхностями некоторых пластиков намного меньше 7з.
Трение и смазка. Адгезия
341
Рис. Х-1. Соотношение между
нагрузкой (W) и силой трения F
(закон Амонтона).
wf
1
м
Хотя основной закон трения известен с 1699 г., только недавно он
получил, вероятно, правильное и теперь общепринятое объяснение, в
основу которого положены результаты детального изучения
микроскопической природы поверхностей и контактов между ними.
Б. Природа контакта между двумя твердыми поверхностями
Имеется множество доказательств того, что даже очень гладкие на
вид поверхности на молекулярном уровне являются неровными.
Природу таких неровностей можно исследовать
электронно-микроскопическим методом либо при малых углах отражения, либо с помощью
углеродных реплик. Этими способами достигается разрешение до 10 А [1],
что позволяет непосредственно увидеть не только дефекты, ступеньки
и т. п. на поверхности (см. разд. V-4), но и борозды, оставляемые при
скольжении одной поверхности по другой. Ценную информацию о
структуре поверхностей можно получить также, изучая их методом
дифракции медленных электронов и автоэмиссионными методами (см.
разд. V-6). Оптические интерференционные методы позволяют
выявлять изменения уровня поверхности всего на 10 А. В более грубом
масштабе шероховатость поверхности можно контролировать по
колебаниям иглы с алмазным кончиком, медленно движущейся по
поверхности.
Результаты таких исследований ясно показывают, что на
поверхностях кристаллических материалов имеются неровности высотой в сотни
и тысячи ангстрем. Неровности такого масштаба имеются и на
притертых или шлифованных поверхностях. Даже полированные поверхности
металлов не являются действительно гладкими. Как отмечено в
разд. V-1B, полировка, по-видимому, вызывает локальное плавление,
вследствие чего грубые неоднородности сглаживаются и поверхность
становится волнистой. Поверхностям металлов свойственно также
покрываться окисной пленкой (рис. Х-2) [1].
Г|ЛлМ*Ч
N\ 5"
— j
\\\4
Рис. Х-2. Схематическое изображение топографии и структуры области поверхностного
слоя полированного металла [1].
/ — окисный слой, 0,01—0,1 мкм; 2 — зона глубокой деформации, 1—2 мкм; 3 — слой Бэйльби,
0,1 мкм; 4 — область крупномасштабной деформации; 5—10 мкм; 5 — область слабой
деформации, 20—50 мкм.
342
Глава X
Рис. Х-3.
Поскольку даже самые гладкие поверхности являются неровными,
две поверхности, приведенные в контакт друг с другом, соприкасаются
только на отдельных участках. Фактически в первый момент
поверхности соприкасаются только в трех точках, но даже при самой
ничтожной нагрузке в этих точках развивается давление, достаточное для
деформации, приводящей к появлению множества новых точек контакта.
Таким образом, истинная площадь контакта значительно меньше
кажущейся площади (рис. Х-3).
Площадь контакта можно оценить, например, определяя
электрическую проводимость при соприкосновении твердых тел. Можно показать,
что, если увеличение сопротивления связано с сокращением площади,
через которую проходит электрический ток, то измеряемая
проводимость должна быть пропорциональна Л1/2, где А — истинная площадь
контакта [2]. Для стальных пластинок при нагрузке 10 кГ найденная
в лабораторных условиях истинная площадь контакта А составляет
около 0,01 % кажущейся площади.
Еще одним свидетельством того, что трение определяется истинной
площадью поверхности, которая намного меньше кажущейся площади,
служит очень высокая температура, развиваемая при скольжении
одного тела по другому. Эту температуру можно оценить, водя ползун из
одного металла по поверхности другого металла и отмечая при этом
максимально возможное увеличение температуры. На рис. Х-4
приведены некоторые данные по увеличению локальной температуры при
трении стали с различными поверхностями [2]. Как оказалось,
локальное увеличение температуры может достигать нескольких сотен
градусов. Обычно рост зависимости АГ от скорости скольжения
прекращается, когда максимальная локальная температура достигает температуры
плавления более плавкого металла. Если один из трущихся
материалов, например стекло, прозрачен, то локальную температуру горячих
участков можно оценить по инфракрасному спектру излучаемого при
трении света. Таким способом удалось установить, что при трении
стекла по стали температура поднимается до 1200 °С.
Подведем некоторые итоги. Совершенно ясно, что контакт между
двумя поверхностями ограничивается небольшой частью видимой по-
верхности и вследствие этого при трении развиваются довольно высо-
400
$.300
S200
<5
«о
I
100
Спла
в_Ш
A>
J\
W
&
л/
w
V
Сеин
Щ
Галлии
Z. i i
/00 200 300 400 500 600 700
Скорость, см/с
Рис. Х-4. Зависимость локальной re\t-
пературы от скорости скольжения
Трение и смазка. Адгезия
343
кая локальная температура и, как показано ниже, давление. Наконец,
известно [4, 5], что при скольжении одной поверхности по другой обе
поверхности не остаются неизменными. Микроскопический анализ
следов, оставляемых ползуном, показывает, что они состоят из небольших
выемок и углублений, образуемых в результате физического отрыва
частиц мягкого металла более твердым металлом. Аналогично на
радиоавтографе, полученном прижатием фотоэмульсии к более твердому
металлу, имеются засвеченные точки, соответствующие захваченным
частицам мягкого металла с радиоактивной меткой. Все это
подтверждает, что в местах контакта происходит довольно сильное схватывание
или фактически сварка соприкасающихся поверхностей.
В. Роль сдвига и пропахивания. Объяснение закона Амонтона
При соприкосновении двух поверхностей в немногих точках
первоначального контакта развивается огромное давление, вызывающее
немедленную и непрерывную деформацию участков поверхности вокруг
этих точек. Это пластическое течение продолжается до тех пор, пока
общая площадь контакта не станет такой, что локальное давление
упадет до предела текучести мягкого материала Pw. В результате, как
показано на рис. Х-5, область контакта состоит из зоны пластического
течения, за которой следует зона упругой деформации.
• Таким образом, фактическая площадь контакта определяется
пределом текучести материала
A=W/Pm. (X-1)
Для большинства металлов Рш лежит в пределах 10—100 кГ/мм2, и,
следовательно, при нагрузке 10 кГ истинная площадь контакта
действительно должна быть приблизительно равна найденной в опытах с
измерением электропроводности величине Ю-3 см2. Конечно, в такой
оценке абсолютных значений А имеется значительная неопределенность,
поскольку в точках контакта может произойти деформационное
упрочнение (или наклеп) металла, вследствие чего действительная величина
Рт превысит Рт нормального металла. Хотя относительно величины
Рт и имеются некоторые сомнения, уравнение (Х-1) тем не менее
сохраняет свое значение. Пропорциональность площади контакта
нагрузке нарушается лишь при очень малых нагрузках, при которых не
достигается предел упругости. Как показывает анализ, в этом случае при
скольжении полусферического ползуна по плоской поверхности
A=kWV*. (X-2)
Исследуя трение, обычно измеряют силу, приводящую в движение
ползун, прижатый к неподвижной пластине. В общем случае эта сила
слагается из двух составляющих. Во-первых, имеется сила,
необходимая для осуществления сдвиговой деформации соединений в точках
фактического контакта. Эта сила определяется выражением
F=Asm9 (X-3)
где sm— сдвиговая прочность единицы площади. Вторая
составляющая представляет собой силу, требуемую для перемещения более
мягкого материала по фронту более твердого. Если металлы имеют
различную твердость, то на мягком металле остается след в виде «пропа-
Рис. Х-5. Пластическая деформация в области
контакта.
344
Глава X
Рис. Х-6. Сдвиг (а) и «пропахивание» (б) при трении.
ханной» полосы. На пропахивание, естественно, затрачивается
определенная работа. В общем случае можно ожидать, что F'
пропорциональна поперечному сечению ползуна (см. рис. Х-6), т. е.
F=kA\ (X-4)
где А'— поперечное сечение пропаханного следа.
Вклад пропахивания в общую работу трения можно оценить с
помощью очень тонкого ползуна (рис. Х-6,б), для которого работа
сдвига минимальна. Обычно эффект пропахивания важен, только если
твердый материал перемещается по мягкому; для двух твердых материалов
трение в основном определяется сдвиговой составляющей. В последнем
случае, исключая А из уравнений (Х-1) и (Х-3), получаем
F=W(sjPm) (X-5)
или
fi=;Sm/Pm=COnst. (Х-6)
Это и есть закон Амонтона, сформулированный в начале главы.
Отметим, что в уравнении (Х-6) как предельная, так и сдвиговая
прочность относятся главным образом к более мягкому металлу и,
таким образом, ii определяется отношением свойств одного и того же
материала. Поскольку sm и Рт меняются параллельно, их отношение
почти не зависит от природы самого металла. Это согласуется с тем
фактом, что коэффициент трения, как правило, лежит в пределах
~0,5—1,0. Кроме того, температура не должна сильно влиять на jx,что
и наблюдается на опыте.
Проведенный анализ показывает, что закон Амонтона
действительно соблюдается, если ни одна из трущихся поверхностей не является
слишком мягкой. Так, по данным Боудена и Тэйбора [2], если
нагрузка составляет от 0,037 до 4000 Г, коэффициент трения \л алюминия по
алюминию имеет почти постоянное значение. Для пластиков дело
обстоит не так просто, поскольку, как отмечается в разд. Х-5В, истинная
площадь контакта А в значительной мере определяется упругой
деформацией.
Коэффициент трения зависит также от относительной скорости
движения двух трущихся поверхностей. Эта зависимость объясняется,
например, влиянием скорости движения на локальную температуру,
степень упрочнения металла и соотношение работ сдвига и пропахивания.
Все эти факторы способствуют уменьшению коэффициента трения с
увеличением скорости скольжения [6, 7]. Такая зависимость
противоречит правилу, иногда называемому законом Кулона, согласно которому
\1 не должен зависеть от скорости движения. Правда, при очень низких
скоростях, около 0,01 см/с, используемых в большинстве опытов по
трению, влияние скорости незначительно, и обычно (но не всегда, см. ел.
раздел) им можно пренебречь.
Г. Статическое и «скачкообразное» трение
Вообще говоря, необходимо различать статический и кинетический коэффициенты
трения, \is и [ik. Первый определяется минимальной силой, приводящей систему в
движение, а второй — силой, требуемой для поддержания заданной скорости скольжения.
Трение и смазка. Адгезия
345
Нетрудно показать, что в общем случае ц5>ц*. Предположим, что \is меньше \xk.
Тогда FS=W\)LS и Fh=W\ih, т. е. F8<Fh, если нагрузка равна W. Теперь, если к ползуну
приложить силу F, которая больше Fs, но меньше Fk, сложится парадоксальная
ситуация. Поскольку F больше Fs, ползун должен двигаться, но, так как F меньше Fkt он
не должен двигаться. Устранить это противоречие можно, только предположив, что
статический коэффициент трения равен или больше кинетического коэффициента
трения (или скольжения). С возрастанием длительности контакта статический
коэффициент трения проявляет тенденцию к увеличению, и поэтому сомнительно, чтобы при
нулевом времени \is и \ik были равны друг другу. Фактически \x,k является функцией
скорости скольжения и с увеличением скорости, по-видимому, проходит через
максимум. Для титана этот максимум находится ниже 10~8 см/с, для индия — около
10-4 см/с, а для очень мягкого пластика тефлона — около 1 см/с [8]. Таким образом,
при обычных скоростях порядка 0,01 см/с большинство материалов характеризуется
отрицательным коэффициентом зависимости \хь от скорости скольжения. Следует
отметить, что большая часть перемычек, образующихся в результате схватывания выступов
поверхностей, по-видимому, достигает примерно 0,001 см, и поэтому получить имеющие
реальный физический смысл значения ц* можно только при условии, что ползун
прошел расстояние такого же порядка. Это ограничение необходимо учитывать, изучая
трение при очень малых скоростях скольжения.
В опытах по изучению трения, особенно при малых скоростях скольжения, может
наблюдаться так назывыемый «stick-slip»-3(|)({)eKT, или «скачкообразное» трение:
ползун движется скачками, которые могут совершаться с довольно высокой частотой.
Данный эффект отчасти связан с проявлением или отсутствием жесткости в механизме
удерживания ползуна. При мгновенном «заедании» ползун продолжает двигаться,
совершая работу против упругой силы сопротивления. Как только эта сила превысит
значение, соответствующее \is, ползун быстро скользит вперед, проскакивает некоторое
расстояние (если в системе имеется достаточный люфт) и «заедается» опять. Чем
больше разность между статическим и кинетическим коэффициентами трения, тем
отчетливее проявляется «скачкообразное» трение. Если ползун перемещается по смазанной
поверхности, подобный эффект наблюдается, только когда температура превысит
некоторую четко выраженную величину. При положительном коэффициенте зависимости jlu
от скорости скольжения способность ползуна к скачкообразному проскальзыванию
уменьшается, что в итоге приводит к ослаблению эффекта. Попутно отметим, что
именно этим эффектом объясняется хорошо знакомый каждому студенту скрип мела по
доске.
3. Два частных случая трения
А. Оценка скорости движения транспортного средства
по длине буксования
Примером интересного и очень важного практического применения
закона Амонтона может служить оценка минимальной скорости
движения транспортного средства по длине его следа при буксовании.
В отсутствие буксования система транспортное средство — дорога
характеризуется коэффициентом статического трения; в каждый момент
времени часть шины, находящаяся в контакте с мостовой, имеет
нулевую скорость. Если буксование происходит на обычной мостовой, то,
поскольку в рассматриваемой паре шина — дорога первая является
более мягким материалом, коэффициент трения, определяемый
уравнением (Х-6), в основном зависит от свойств используемой резины и почти
одинаков для любых дорог. Как правило, \х, примерно равно 0,7—0,8.
Если принять, что при буксовании \х остается постоянным, то,
используя закон Амонтона, можно получить очень простое соотношение,
связывающее первоначальную скорость транспортного средства и
длину следа буксования. Первоначальная кинетическая энергия
транспортного средства равна mv2/2. При торможении эта энергия полностью
компенсируется работой торможения, которую сила F совершает на
расстоянии буксования d. Согласно закону Амонтона,
F=iiW=mg\i. (X-7)
Следовательно,
mv2/2 = Fd =mg\id (X-8)
или
t;=(2d|ig)V2. (X-9)
346
Глава X
Рис. Х-7. Коэффициенты трения при температурах, близких к точке плавления [121.
В опытах использовался ползун, покрытый твердым криптоном, окисью углерода и водой. На
дополнительной шкале показаны стандартные температуры кипения по отношению к гомолсмиче-
ской криптоновой шкале.
Таким образом, если закон Амонтона выполняется, первоначальная
скорость определяется только коэффициентом трения и длиной
буксования. В уравнение (Х-9) не входят ни масса транспортного средства, ни
размер или ширина поверхности качения шины, ни жесткость
используемых тормозов (важно только, чтобы тормоза удерживали колеса
от вращения, т. е. обеспечивали буксование).
Как и следовало ожидать, приведенная выше картина является
достаточно упрощенной. При увеличении скорости коэффициент трения
проявляет тенденцию к возрастанию, а на влажной мостовой он
уменьшается [9]. На влажной дороге \i снижается до 0,2, и, по существу,
протекторный рисунок на поверхности качения и боковых поверхностях
шины в основном предназначен для предотвращения образования слоя
воды между поверхностью шины и дорогой. Сцепление шин с влажной
дорогой, разумеется, зависит и от текстуры дорожного покрытия. Тем
не менее при разумном использовании данный метод позволяет
получить независимую оценку скорости транспортного средства перед
началом торможения и широко применяется при расследовании дорожно-
транспортных происшествий.
Б. Трение на льду и на снегу
Коэффициент трения между двумя несмазанными твердыми телами обычно
находится в интервале от 0,5 до 1,0. Поэтому чрезвычайно интересно выяснить, почему при
скольжении различных тел по льду или снегу он составляет всего 0,03. В первом
объяснении, выдвинутом Рейнольдсом в 1901 г., предполагалось, что под действием
локального давления лед плавится, и в результате образуется тонкая пленка воды.
Быстрое увеличение коэффициента с падением температуры, особенно ниже —10 °С, при
малых скоростях скольжения качественно подтверждает это объяснение. Более того,
имеются данные [1, 10], почти не оставляющие сомнений в том, что при скольжении
действительно образуется тонкая пленка воды.
Несмотря на свою привлекательность, теория плавления льда под давлением не
дает более или менее точных количественных опенок. Так, чтобы точка замерзания
понизилась всего до —10°С, требуется локальное давление около 1000 кГ/см2. Есл;*
речь идет о лыжнике среднего веса, это означает, что истинная площадь контакта
должна составлять всего несколько сотых квадратного сантиметра, что маловероятно
Фактически при — 10°С при малых скоростях движения \х равен ~0,4. Однако ир;
скорости скольжения около 5 м/с коэффициент трения быстро падает—приблизительно
до 0,04 [1].
Другое объяснение низкого коэффициента трения по льду и снегу состоит в том
что при низких температурах пленка воды, обусловливающая низкое трение, обпз
зуется в результате локального разогрева. Приблизительный расчет показывает, чт -
энергии, диссипируемой при трении, достаточно для плавления ощутимого слоя льла
или снега и без допущения чрезвычайно малой истинной площади контакта. Kpovr
того, как показывают опыты с лыжами, изготовленными из различных материалов
непокрытых различными смазками, коэффициент трения тем ниже, чем меньше тепле-
проводность поверхности лыж [11]. Можно ожидать, чго истинная площадь контакт?.
Трение и смазка. Адгезия
347
все же составляет только некоторую часть видимой поверхности, и поэтому теория
фрикционного плавления требует, чтобы тепло, выделяемое при трении, уходило через
корпус лыжи не слишком быстро.
На неправильность теории плавления льда под давлением указывает и то, что
коэффициент трения льда меняется с изменением температуры так же, как
коэффициент трения других тел, например твердого криптона и сухого льда [12], бензофенона
и нитробензола [1]. Данные для первых двух материалов приведены на рис. Х-7
в виде зависимостей \х от относительной температуры. Для этих веществ плотность
твердой фазы выше плотности жидкой фазы и, таким образом, падение \х по мере
приближения к точке плавления не может быть обусловлено плавлением под давлением.
Хотя для снега и льда вблизи 0°С плавление под давлением может играть важную
роль, вероятно, даже здесь основное значение имеет плавление в результате локального
разогрева. Лед представляет собой вещество необычайно сложной структуры.
Предполагается [13, 14], что вблизи точки плавления на поверхности льда образуется жид-
коподобный слой. Если это верно, то наблюдаемые при малых скоростях скольжения
вблизи О °С низкие значения [i могут быть обусловлены не столько плавлением
вследствие разогрева, сколько специфической природой поверхности воды.
Между прочим, нормальный коэффициент трения твердого криптона (при
температурах ниже точки его плавления) соответствует уравнению (Х-6). Твердый криптон —
довольно мягкий материал, и его сдвиговая прочность sm мала. Само по себе это спо
собствует уменьшению \i. Однако данный эффект компенсируется необычно большой
истинной площадью контакта вследствие столь же низкой величины Рт. Таким
образом, отношение sm/Pm остается почти постоянным, несмотря на значительные колебания
входящих в него величин при переходе от одного материала к другому.
4. Трение между металлами. Влияние окисных пленок
Исследуя трение между металлическими поверхностями, необходимо
различать трение между действительно чистыми металлами и
металлами, покрытыми адсорбированными газами или окисными пленками.
Если с помощью электронной бомбардировки поверхность,
предварительно прогретая в вакууме, полностью освобождена от всех
загрязнений, то коэффициент трения, например, вольфрама, меди, никеля и
золота может быть довольно велик. Боуден и Хьюз [15] показали, что
коэффициент трения очищенных металлов колеблется от 3 до 6.
Приведенные в контакт и слегка потертые друг о друга чистые
(обработанные указанным способом) поверхности никеля так прочно
схватываются, т. е. фактически свариваются, что для их разъединения требуется
приложить значительное усилие [16]. При комнатной температуре
поверхности железа характеризуются \i, равным 3,5; однако
схватываются они лишь при 300 °С. Маклин и Янки [17] показали, что полученные
путем механической обработки в инертной атмосфере свежие
поверхности металлов обычно так же схватываются между собой. В опытах с
парами разнородных, и в частности взаимно нерастворимых, металлов
схватывание наблюдается далеко не всегда. Так, взаимно
нерастворимые кадмий и железо, если их потереть друг о друга, действительно
схватываются между собой, однако пара серебро—железо не
схватывается. Образующиеся при схватывании двух поверхностей перешейки,
по-видимому, обладают большой прочностью, во всяком случае,
прочность схватывания двух подобных металлов, по существу, не отличается
от прочности схватывания поверхностей одного и того же металла.
Представляет интерес также тот факт, что трение очень чистых
поверхностей в начале скольжения может быть относительно низким, но
вскоре быстро возрастает настолько, что становится возможным
схватывание. Объясняется это, возможно, недостаточной пластичностью
свежей поверхности, быстро восстанавливающейся сразу после локального
разогрева в результате скольжения (см. также разд. Х-6).
В присутствии воздуха поверхности металлов ведут себя при трении
совершенно иначе. Так, Тингл [18] показал, что с увеличением
толщины окисного слоя при выдерживании чистых поверхностей меди на
воздухе коэффициент трения уменьшается с 6,8 до 0,80. Как отмечает
Уайтхэд [19] (см. также [1]), на воздухе поверхности металлов ведут
348
Глава X
себя по-разному. При очень легких нагрузках окисный слой
эффективно предотвращает контакт между металлами (и тем самым снижает
электрическую проводимость); при этом коэффициент трения обычно
равен 0,6—1,0. При высоких нагрузках пленка на поверхности
некоторых металлов, например меди, разрушается, и по мере возникновения
контактов типа металл—металл jli (и электропроводность) возрастает.
Окисная пленка на алюминии разрывается даже при очень малых
нагрузках; возможно, это обусловлено тем, что сам металл мягче окисла,
а это способствует растрескиванию последнего. На серебре образуется
очень тонкая окисная пленка, и поэтому его коэффициент трения почти
не зависит от нагрузки. Во всех случаях, даже при образовании
контактов типа металл—металл, коэффициент трения ниже, чем для
совершенно чистых поверхностей, либо вследствие адсорбции газов, либо
из-за наличия участков или фрагментов окисного материала.
Для таких неоднородных поверхностей Боуден и Тэйбор [20]
предлагают следующее соотношение:
F=A(asrn + (l-a)s0)y (Х-10)
где а — доля поверхности контакта типа металл—металл, sm и s0 —
сдвиговая прочность металла и окисла соответственно. В известном
смысле влияние окисных покрытий на трение можно рассматривать
как частный случай влияния пленок вообще. Подробно этот вопрос
обсуждается в разд. Х-7, где речь идет о граничной смазке.
5. Трение между неметаллами
Л. Относительно изотропные кристаллы
К относительно изотропным твердым телам относятся самые разнообразные
вещества и материалы, например твердый криптон, хлорид натрия и алмаз, поэтому
не удивительно, что при трении все они могут вести себя по-разному. Более мягкие
твердые тела обычно подчиняются закону Амонтона и характеризуются
«нормальными» значениями \i от 0,5 до 1,0, если только их температура не слишком близка к
точке плавления. Ионные кристаллы, например хлорид натрия, также подчиняются
закону Амонтона, хотя они обычно довольно хрупки, и вследствие этого их поверхности
могут необратимо изменяться, в частности растрескиваться. Следовательно, площадь
контакта таких кристаллов в основном определяется, по-видимому, пластичным
течением, а не упругой деформацией.
Совершенно иначе ведет себя алмаз. Коэффициент трения алмаза мал, около 0,1,
и его зависимость от нагрузки можно описать, предполагая, что истинная площадь
контакта меняется в соответствии с уравнением (Х-2) [1]. Таким образом,
фрикционные свойства алмаза в основном определяются упругой деформацией. Пластическое
течение здесь особой роли не играет. Отметим, что, когда нагрузка превышает
некоторую критическую величину, на поверхности алмаза также появляются трещины.
Фрикционные свойства сапфира аналогичны свойствам алмаза [21]. По-видимому, низкий
коэффициент трения алмаза в какой-то мере связан с наличием на его поверхности
адсорбированной воды, действующей как своего рода смазка. Во всяком случае, при
очистке поверхности алмаза в вакууме jui возрастает примерно до 0,6. Кроме того,
поверхность алмаза способна к частичному окислению. Так, природные алмазы могут
быть гидрофильными или гидрофобными в зависимости от того, в какой среде
происходило их образование — на воздухе или в воде. Связь между смачиваемостью и
фрикционными свойствами поверхности, по-видимому, не исследовалась.
Б. Слоистые кристаллы
Некоторые вещества, например графит, тальк и дисульфид молибдена, имеют
слоистую кристаллическую структуру. Сдвиговая прочность вдоль кристаллических
слоев таких веществ и, следовательно, коэффициент трения должны быть малы. И
действительно, коэффициент трения \х для графита составляет около 0,1 [21, 22]. Здесь,
однако, определенную роль играют адсорбированные газы, поскольку при обезгажива-
нии \i возрастает приблизительно до 0,6 [21, 23]. Кроме того, как показывает
микроскопический анализ, следы графитового ползуна состоят из чешуек графита, скатанных
в очень маленькие комочки диаметром около 0,05 мкм [24]. Этого может быть вполне
Трение и смазка. Адгезия
349
Рис. Х-8. Зависимость коэффициента
трения стального ползуна по тефлону
от нагрузки (первая подача). Скорость
ползуна 0,01 см/с, температура 25 °С
[26].
0,6,
0,5
0А
0,3
0,2
0,1
' 1 '
V*4#
■^о,—°
. I .
1 г
i ' i
^•^
о ^
! . 1
4 6
F, Кг
i I i I
н
J
^ Us J
-^ 1
Mk 1
, 1 , 1 1
8 Ю
достаточно^ чтобы уменьшить коэффициент трения до экспериментально наблюдаемых
величин. При этом роль адсорбированных газов сводится к усилению способности
чешуек графита к объединению.
Дисульфид молибдена, структура которого подобна структуре графита также
характеризуется низким коэффициентом трения. Правда, при обработке в вакууме и
дисульфида молибдена не возрастает. Поскольку отдельные слои в кристалле
дисульфида молибдена связаны слабее, чем в графите, механизм трения дисульфида может
быть иным. Коэффициент трения молекулярно гладких поверхностей слюды в большой
степени зависит от нагрузки; при малых нагрузках и в присутствии воздуха и падает
почти до нормального уровня.
В. Синтетические полимеры
В последние годы проведен ряд работ по изучению фрикционных свойств
органических полимеров. В большинстве случаев коэффициенты трения полимеров лежат
в нормальном диапазоне и соответствуют уравнению (Х-6). Однако при более
внимательном анализе экспериментальных данных по трению обнаруживаются серьезные
осложнения. Прежде всего, как показано на рис. Х-8 на примере сополимера гекса-
фторэтилена и гексафторпропилена [26], jx сильно зависит от нагрузки, и очевидно,
что площадь контакта определяется больше упругой, чем пластичной деформацией'.
Различие между статическим и кинетическим коэффициентами трения объясняется
переносом ориентированной пленки полимера на движущийся стальной ползун и
низкой адгезией между этой пленкой и поверхностью полимера. Политетрафторэтилен
(тефлон) характеризуется относительно низким коэффициентом трения (~0,1). Эту
и другие особенности фрикционных свойств тефлона объясняют довольно гладким
молекулярным профилем его поверхности [27].
С увеличением температуры коэффициент трения многих полимеров проходит
через максимум, что, по-видимому, связано с несколько различной температурной
зависимостью их пределов упругости и сдвига [7]. Поскольку полимеры — обычно
довольно мягкие материалы, можно предполагать, что их фрикционные свойства в
значительной мере обусловливаются образованием пропаханных борозд или других
макроскопических дефектов. Боуэрс и Зисман [26] отрицают важность подобного эффекта,
а Боуден и Тэйбор [1] считают, что при трении пластиков важную роль играют потери
энергии, обусловленные гистерезисом упругости. Вклад эффекта упругости можно
оценить по силе трения при качении по плоской поверхности шара, находящегося под
заданной нагрузкой.
6. Некоторые дополнительные сведения по теории трения
между несмазанными поверхностями
Одним из интересных вопросов теории трения является зависимость
площади контакта от условий скольжения. Это изменение можно
измерять либо по проводимости, в случае металлов пропорциональной А1^
(проводимость области контакта металлических поверхностей в
основном определяется числом образующихся между ними соединений, или
перешейков), либо по нормальной адгезии, т. е. силе, необходимой для
350
Глава X
разделения поверхностей. Так, стальной шарик, прижатый на короткое
время к поверхности индия нагрузкой 15 Г, в последующем отрывается
от поверхности только усилием не ниже 15 Г [28]. Если эту систему
привести в относительное движение (кстати, характеризующееся
довольно высоким коэффициентом трения, равным 5) и затем остановить,
то сила, требуемая для отрыва шарика от плоской поверхности,
возрастает до 100 Г. Отношение 100 Г к 15 Г можно принять равным
отношению площадей соединений подвижной и неподвижной поверхностей.
Даже в отсутствие ощутимого движения (см., однако, далее)
приложение силы к одному из членов фрикционной пары приводит к
микросмещению одной поверхности относительно другой и нередко к
увеличению площади контакта. В таких опытах отношение F/W определяется
как ф, поскольку в данной ситуации коэффициент трения не
соответствует ни jiife, ни \xs. В работе Бэрвелла и Рабиновича [29] ф
полуэмпирически связано с изменением площади контакта. Авторы предполагают,
что в состоянии покоя площадь контакта А0 двух прижатых друг к
другу твердых тел определяется пластической деформацией и описывается
уравнением (Х-1). Если, однако, кроме нормального напряжения,
имеется и сдвиговое напряжение, то предел текучести задается
выражением
V + as*=P*m, (Х-11)
где а — постоянная и Р — давление, развиваемое в условиях
скольжения. Поскольку W остается тем же самым, Рш/Р должно быть равно
отношению А/А0, где А — площадь контакта при скольжении. Учитывая
также, что As = yW и AP = W, уравнение (Х-11) можно привести к виду
1+аф2 = (Л/Л0)8. (Х-12)
Постоянную а можно оценить по минимальной силе F0, приводящей
ползун в движение после наложения нагрузки, дающей контакт
площадью А0. В указанных условиях Р = 0, A0s = F0i A0Pm=W и, как
следует из уравнения (Х-11),
a=(W/F0)\ (X-13)
Для пар сталь — индий и платина — платина [1] а равна 3 и 12
соответственно. В обоих случаях зависимость ф2 от (А/А0)2У где А и А0
оцениваются либо по адгезии, либо по электропроводности, довольно
хорошо описывается уравнением (Х-12). Следует отметить, что этот анализ
не затрагивает основных предположений, заложенных в уравнении
(Х-6). Тем не менее он позволяет получить дополнительные сведения
о природе соединений и в известной мере свидетельствует в пользу
представления о том, что адгезия в местах соединений очень сильна и
что сдвиг развивается в объеме более мягкого материала, а не на
фактической поверхности раздела.
Согласно уравнению (Х-12), площадь контакта и ф (или \х) должны
вместе неограниченно возрастать. Именно так обстоит дело в случае
очень чистых металлических поверхностей, которые прочно
схватываются между собой, особенно если вначале приложить небольшое
сдвигающее усилие. Однако в нормальных условиях развитию площади
контакта препятствуют примеси, поверхностные дефекты и т. п. Силу,
компенсирующую сопротивление в результате роста А (см. упражнение Х-8),
можно оценить по уравнению (Х-3), исключив из последнего А с
помощью выражения (Х-12).
Даже при очень небольшой сдвигающей силе возможно,
по-видимому, очень медленное относительное движение трущихся поверхностей
относительно друг друга. В этом случае наблюдаемый коэффициент
трения должен отвечать ф, и, таким образом, ф представляет собой
реальный коэффициент трения при малых скоростях. Действительно,
Трение и смазка. Адгезия
351
Рис. Х-9. Зависимость коэффи- £0
циента трения чистой стали по '
индию от конечной скорости /^тах
скольжения (нагрузка 300 Г)
^ 1ft
0,5
~ да-/*? 10-о ю-б ю-4 -iQ-z i
К см/с
даже при очень слабой сдвигающей силе в системе сталь — индий
устанавливается стационарное движение; соответствующая зависимость \х
(или <р) от скорости скольжения приведена на рис. Х-9. Как ни
странно, найти статический коэффициент трения для данной пары
весьма сложно! Эмпирически статический коэффициент трения
определяется силой, вызывающей едва видимое скольжение, т. е. скольжение со
скоростью около 0,01 см/с. В рассматриваемом примере \is
соответствует максимальному значению [х. Конечно, в общем случае такое
соответствие не обязательно, но тем не менее ясно, что \is определяется менее
строго, чем \ik.
В связи с кривой, представленной на рис. Х-9, возникает еще один
вопрос. Дело в том, что эта кривая показывает изменение F при
постоянном W. Вполне вероятно, что при изменении W она
неравномерно смещается. Если это так, то обычные кривые зависимости \xs от
нагрузки представляют собой явно произвольное сечение сложной
многомерной картины, описывающей поведение исследуемой системы при
трении.
Из рис. Х-9 следует также, что при очень малых скоростях \х может
приближаться к нулю. Вообще говоря, это может означать, что по своей
природе \х близко к коэффициенту вязкости. Тогда кривую на рис. Х-9
можно интерпретировать следующим образом. С уменьшением скорости
движения кривая должна выйти на уровень fimax, соответствующий \is>
однако при очень низких скоростях скольжения проявляется ползучесть,
или молекулярное течение, которое приводит к снижению \х (в обычных
опытах по трению ползучесть не наблюдается).
В заключение приведем уравнение, предложенное Дерягиным и
др. [31]:
F = iiW + iiAp09 (Х-14)
где Лр0 фактически представляет собой добавку к внешней силе W,
обусловленную внутренним или адгезионным давлением р0. Это
уравнение приблизительно описывает поведение многих систем,
обнаруживающих отклонения от закона Амонтона, и в частности системы
парафин — стекло.
Отметим также, что коэффициент трения поверхностей,
находящихся в контакте с раствором электролита, зависит от приложенного
потенциала [30].
352
Глава X
7. Трение между смазанными поверхностями
А. Граничная смазка
Если масляная пленка, нанесенная на трущиеся поверхности,
достаточно толста, так что разделяемые ею поверхности, по существу, не
касаются друг друга, то коэффициент трения зависит в основном от
гидродинамических свойств масла, особенно его вязкости. В этих условиях
специфическая природа поверхностей твердых тел не проявляется и
закон Амонтона не действует.
По мере увеличения нагрузки и уменьшения относительной скорости
движения пленка между двумя поверхностями становится тоньше и
контакт между поверхностями возрастает. В результате коэффициент
трения возрастает от очень низких значений, соответствующих
гидродинамическому трению, до некоторой величины, обычно меньше
коэффициента трения несмазанных поверхностей. Последний тип смазки, т. е.
смазки, в которой важную роль играет природа поверхностного слоя,
называют граничной смазкой. Кривые зависимости коэффициента
трения от скорости, подобные приведенной на рис. Х-10, называются
кривыми Стрибека [32].
Ряд классических работ по исследованию граничной смазки
принадлежит Вильяму Гарди [33, 34]. Он, в частности, показал, что граничное
трение обусловливается адсорбционными пленками смазки, и высказал
предположение о том, что углеводородные поверхности таких пленок
ослабляют силу взаимодействия трущихся частей.
Гарди исследовал углеводородные смазки, в том числе длинноцепо-
чечные парафины, спирты и кислоты. В его работах смазка обычно
использовалась с некоторым избытком и наносилась на поверхность либо
в виде чистой жидкости, либо в виде раствора в петролейном эфире.
Иногда после нанесения смазки поверхность металла полировалась. По
данным Гарди, в условиях граничной смазки \i находится в интервале
от 0,05 до 0,15, т. е. значительно ниже, чем для несмазанных
поверхностей. В пределах одного гомологического ряда \х линейно убывает
по мере увеличения молекулярного веса смазки, хотя для жирных
кислот при молекулярном весе 200 jx выходит на постоянный уровень и
становится примерно равным 0,05. Зависимость ji от молекулярного
веса смазки и ее химической природы показана на рис. Х-11.
Позднее данные Гарди были подтверждены работами Левина и Зис-
мана [35], которые продолжили исследования в этой области. Они
исследовали пленки на стеклянных и металлических поверхностях,
наносимые из раствора или расплава смазки. Для спиртов кривая
зависимости |ы от молекулярного веса выходит на постоянный уровень
(также соответствующий (х = 0,05) при молекулярном весе около 280, т. е.
ю-1
10
-4
Граничная
смазка
10
-г
ю-'
Переходная ойшсть
Гидродинамическая
\уг смазка
В
71-У
Р
Рис. Х-10. Области гидродинамической
и граничной смазки [32].
Трение и смазка. Адгезия
353
при более высоком молекулярном весе, чем для кислот. В целом же
смазочные свойства спиртов и кислот аналогичны. По данным Рассела
и др. [36], при наличии углеводородных пленок кривые трения по меди
выходят на постоянный уровень при молекулярном весе 400 и pi = 0,10.
Точки выхода |li на постоянный уровень рассматриваются Левиным и
Зисманом как точки, соответствующие образованию плотного монослоя.
Этот вывод подтверждается тем, что краевые углы в системе воздух—
йодистый метилен—углеводородная пленка перестают расти
приблизительно при том же молекулярном весе углеводорода.
Теперь уже нет сомнений в том, что уменьшение коэффициента
трения смазками, подобное рассмотренному выше, обусловлено
образованием тонкой, возможно мономолекулярной, пленки адсорбированного
вещества. Так, Фрюинг [37], используя полусферический стальной
ползун, показал, что коэффициенты трения различных спиртов, сложных
эфиров и кислот практически не зависят от того, имеется ли избыток
смазки или она нанесена в виде одного или нескольких монослоев по
методу Лэнгмюра — Блоджетт (см. гл. III, разд. 111-16). Монослойные
пленки низкомолекулярных спиртов, альдегидов, парафинов и воды,
адсорбированные на поверхности стали из паровой фазы, снижают \i, так
же как пленки, нанесенные другими способами [38]. Аналогичные
изменения \х дают и монослои галогенированных соединений,
адсорбированных на металлических или стеклянных пластинках либо из раствора
в воде или органическом растворителе, либо из паровой фазы [36].
Ясно также, что в условиях граничной смазки коэффициент трения
в значительной мере зависит от состояния монослоя. По данным Фрю-
инга, при нагревании до некоторой критической температуры р, резко
возрастает с ~0,1 до ~0,4. Иногда при критической температуре \i
меняется не очень резко, однако и в этом случае плавное скольжение
переходит в скачкообразное. Для углеводородов (рис. Х-12), спиртов
и кетонов критическая температура трения близка к их обычной
температуре плавления [36]. При движении по гомологическому ряду ц
выходит на постоянный уровень, как только достигается член ряда,
температура плавления которого соответствует температуре измерений
[35]. Весьма вероятно, что температура резкого изменения jx отвечает
переходу от растянутой к конденсированной пленке; подобная
корреляция между температурой фазового перехода и температурой плавления
наблюдается и для пленок на поверхности воды.
0 100 200 300 400
Молекулярный вес
Рис. Х-11. Зависимость коэффициента трения от молекулярного веса граничной смазки
при испытании со сферическим ( ) и плоским ( ) ползунами [33].
23-1421
354
Глава X
Ofli
® о •©
Температура
плавления
-200 400 О
Температура,°С
100
Рис. Х-12. Влияние температуры на статическое трение медной пары, смазанной
углеводородами в сухом гелии [36].
/ — мезитилен; 2 — додекан; 3 — гексадекан, 4 — октакозан; 5 — гексатриаконтан; 6 — дотриакон-
тан; 7 — несмазанная медь; кинетическое трение; «скачкообразное» трение.
Таким образом, для хорошей граничной смазки требуется, чтобы
адсорбированная пленка находилась в конденсированном состоянии.
На это указывают также результаты исследования свойств монослоев
жирных кислот Для пленок большинства жирных кислот на стекле
[35], платине [38] и различных полимерах [7] характерно резкое
изменение \i при температуре, близкой к точке плавления этих кислот, что
в общем соответствует свойствам пленок других веществ. Однако для
лауриновой кислоты на меди [2] и стеариновой кислоты на цинке [39]
такое изменение |li наблюдается при ПО и 130°С, что выше их
температур плавления на 43 и 69 °С соответственно. Указанные критические
температуры близки к температурам размягчения солей данных
жирных кислот и соответствующих металлов. На возможность образования
таких солей в результате хемосорбции жирных кислот на окисных
пленках указывают, в частности, результаты адсорбционных
исследований (см. разд. 1Х-1Б).
Б. Механизм граничной смазки
Согласно представлениям Гарди, низкие коэффициенты трения в
условиях граничной смазки обусловлены ослаблением адсорбированными
пленками силовых полей между трущимися поверхностями; в общем
эта точка зрения, безусловно, правильна, хотя и требует некоторого
уточнения. На этом вопросе остановимся несколько подробнее.
Трение и смазка. Адгезия
355
Рис. Х-13. Модель граничной смазки по
Гарди [34].
Как уже отмечалось, при граничной смазке величина \х сильно
зависит от состояния адсорбированной пленки и, чтобы коэффициент
трения был низким, пленка должна находиться в конденсированном
состоянии. По Гарди область контакта выглядит так, как схематически
показано на рис. Х-13. Однако эта картина не может быть верна по
крайней мере по двум причинам.
Во-первых, известно, что при очень слабых нагрузках коэффициент
трения в условиях граничной смазки возрастает (рис. Х-14) почти до
нормальных значений [1, 9], что нельзя объяснить, используя модель
Гарди. Попутно отметим, и это понятно, что граничная смазка резко
ухудшается при очень высоких нагрузках [40] и при повторных
перемещениях по тому же самому следу [41].
Во-вторых, даже в условиях нормальной граничной смазки при
малых |х контакты типа металл — металл все еще имеют место. Это ясно
показывают результаты исследований с применением радиоавтографии
[39]. В работах такого рода перенос металла с радиоактивного
ползуна на неподвижную поверхность регистрируется по участкам
засвечивания фотоэмульсии, помещенной перед исследуемой поверхностью.
Оказалось, что, хотя граничная смазка сильно уменьшает общее
количество перенесенного металла, это уменьшение в основном относится к
размеру, а не к числу перенесенных частиц. Иными словами,
радиоавтографы смазанных и несмазанных поверхностей больше отличаются
друг от друга интенсивностью пятен, чем их числом. Боуден и Тэйбор
[1] отмечают, что при граничной смазке жирными кислотами число
пятен уменьшается в 3—4 раза, тогда как общее количество
перенесенного металла уменьшается почти на 5 порядков. Именно поэтому, по-
видимому, различные граничные смазки дают примерно один и тот же
коэффициент трения, несмотря на весьма значительные различия в
допускаемой ими степени износа трущихся поверхностей. Несомненно, это
практически важный вопрос.
10
10
1 10
Нагрузка, Г
10*
103
10'
Рис. Х-14. Зависимость коэффициента трения от нагрузки при трении меди по меди,
смазанной лауриловой ( ) или октакозановой ( ) кислотой [19].
23*
356
Глава X
Приведенные данные были положены в основу второй модели
(рис. Х-15) [2]. В соответствии с результатами радиоавтографических
исследований предполагается, что нагрузка распределяется по
площади А, на части которой аА имеется контакт металл—металл со
сдвиговой прочностью sm, а на остальной части — контакт пленка—пленка со
сдвиговой прочностью Sf. Таким образом, по аналогии с уравнением
(Х-10) общую силу трения F можно выразить как
F = A[astn + (l—a)sf\ (X-15)
или
F=Alsm + A2sf. (Х-16)
Чтобы объяснить значительное уменьшение захвата при граничной
смазке, приходится предположить, что а — величина порядка Ю-4.
Следовательно, в условиях граничной смазки трение в основном
обусловлено взаимодействием типа пленка—пленка.
Хотя данная модель и имеет определенные преимущества по
сравнению с моделью Гарди, ее все же нельзя считать удовлетворительной.
Так, в частности, она не объясняет, почему А2 должна значительно
превышать А\ или почему при малых нагрузках 5/ возрастает. Эта модель
не объясняет и зависимости электропроводности от нагрузки. При
малых нагрузках проводимость очень мала. Это, вообще говоря,
укладывается в рамки рассматриваемой модели, т. е. соответствует низким
значениям А\ и, вероятно, высокому электрическому сопротивлению
пленки. Однако при таких нагрузках, при которых jlx падает до
нормальных значений, электропроводность смазанных поверхностей
становится почти такой же, как у несмазанных поверхностей. Поскольку при
низких нагрузках контакт металл—металл мал, остается
предположить, что пленка в этих условиях становится проводящей. Кроме того,
чтобы объяснить, почему при нормальных нагрузках в условиях
граничной смазки закон Амонтона выполняется, необходимо предположить,
что А2 пропорциональна нагрузке. Непонятно, однако, каким образом
это предположение могло бы реализоваться в рамках
рассматриваемой модели.
Несколько лет назад была предложена третья модель [42], которая
в значительной мере устраняет эти противоречия. Согласно этой
модели, только при очень малых нагрузках поверхности прижимаются друг
к другу так, как показано на рис. Х-15, т. е. при малых нагрузках
имеются небольшие участки контакта металл—металл, окруженные зонами
почти нормальных монослоев. При этом нагрузка удерживается как
участками контакта металл—металл, так и участками контакта двух
пленок. Поскольку А2 соответствует площади зон контакта граничных
пленок, ясно, что с уменьшением Ах отношение А2/А{ растет. Поэтому при
малых нагрузках закон Амонтона не должен выполняться. В этих
условиях \i должен приближаться к нормальным значениям, характерным
для несмазанных поверхностей в той степени, в какой он зависит от А\.
Кроме того, вследствие стерической затрудненности углеводородных
цепей сама по себе Sf может быть довольно велика.
Рис. Х-15. Вид области контакта в
условиях граничной смазки по Боудену и
Тэйбору [2].
Трение и смазка. Адгезия
т
Рис. Х-16. Модель сжатой пленки при граничной смазке.
Теперь обратимся к нормальным нагрузкам. Вряд ли можно
сомневаться в том, что в этом случае большая часть нагрузки удерживается
граничной пленкой и, следовательно, сама пленка находится под
некоторым механическим давлением. Ясно, что даже при деформации
шероховатой металлической поверхности, недостаточной для образования
дополнительной площади контакта металл—металл за счет смещения
пленки, последняя все же находится под давлением и несколько
сжимается. Увеличение свободной энергии пленки под действием давления
равно] VdPy где V—молярный объем пленки и Р — механическое
давление. С увеличением давления стремление жидкости к истечению и
упругость ее паров возрастают. Так, для несжимаемой жидкости
ЯГ1пР/Р°=7Р, (Х-17)
где Р и Р° — упругость паров жидкости под давлением и в обычных
условиях соответственно.
Следует иметь в виду, что в условиях граничной смазки площадь
фактического контакта, несомненно, является только частью видимой
общей площади контакта. Таким образом, под давлением находятся
только отдельные небольшие пятна пленки. Вследствие этого утечка
материала из сжатой пленки проявляется как перенос молекул пленки
из области сжатия в смежную нормальную пленку (рис. Х-16). В этих
условиях механическое равновесие молекул пленки описывается
уравнением
Р я' я
Г VdP + Г o'dri = Г odn, (Х-18)
0 0 0
где я и я'— поверхностное давление нормальной и сжатой пленки, а
о и о' — соответствующие площади молекул в пленке. В этом
уравнении второй и третий интегралы в соответствии с уравнением Гиббса
[см. уравнение (VII-11)] отвечают упругости паров пленки в двух
различных состояниях. Таким образом, равенство (Х-18) эквивалентно
утверждению, что понижение упругости паров пленки при я'
относительно упругости паров при я компенсируется механическим давлением.
Как уже отмечалось, пленки хорошей граничной смазки,
по-видимому, находятся в конденсированном или твердом состоянии. Сжатая
пленка (рис. Х-16) может состоять из молекул, лежащих более или
менее плоско (такая пленка напоминает монослой в состоянии L\). Как
следует из уравнения (Х-18), механическое равновесие такой пленки
определяется условием
я
РУ ^ ( аая; я ^ jxs; я' ^ nLl. (Х-19)
л'
При этом принимается, что оба состояния пленки относятся к одной
и той же я—сг-кривой и что V = const. Анализируя я—а-кривую моно-
358
Глава X
слоя жирной кислоты на воде, в первом приближении можно принять,
что
Рат=(я — я') а или Рт=Ая, (Х-20)
где т — толщина конденсированной пленки и а — площадь, занимаемая
молекулой в монослое. Следовательно, V=ox*. При я', пренебрежимо
малом по сравнению с я, уравнение (Х-20) можно упростить:
Рт=я (Х-21)
или, так как P = W/A,
A=(t/tc)W (X-22)
и
a=xsf/n. (X-23)
Если я и т принять равными бОдн/см и 10 А соответственно, то я/т
составляет около б кГ/мм2. Для сравнения отметим, что пределы
упругости свинца, меди и мягкой стали соответственно составляют около 2;
31 и 65 кГ/мм2.
Теперь механизм граничной смазки можно представить
следующим образом. На слишком выступающих шероховатостях поверхности,
где локальное давление превышает предел прочности металла,
материал пленки полностью вытесняется, и в результате на некоторой части
поверхности возникает контакт металл—металл. В дальнейшем даже
небольшой, вероятно, упругой деформации металла достаточно для
того, чтобы значительная часть пленки находилась под переменным
механическим давлением и, таким образом, большая часть нагрузки
приходилась на сжатую пленку. В первом приближении [уравнения (Х-20) и
(Х-21)] площадь сжатой пленки пропорциональна нагрузке, и поэтому
закон Амонтона должен выполняться. Поскольку в сжатой пленке
молекулы лежат плоско, сдвиговая прочность сжатой пленки s}
значительно ниже sm или S/. Этим и объясняются низкие значения jli в
условиях граничной смазки при нормальных нагрузках.
Для оценки s'f Боуден и Тэйбор [1] использовали скрещенные
цилиндры из слюды, покрытой граничной смазкой. Предполагая, что в
данном случае кажущаяся и истинная площади контакта одинаковы,
авторы нашли, что sf равно 250 Г/мм2. Хотя эта величина может быть
и не совсем точна, при ее подстановке в уравнение (Х-22) вместе с
приведенными выше значениями я и т получаем ц, равное 0,04, что очень
близко к обычным значениям \х для граничной смазки. Авторы
поддерживают высказанную Вильсоном [43] в 1955 г. мысль о том, что на
несущих участках поверхности молекулы сжатой пленки принимают
горизонтальное положение. Можно заметить, что при таком подходе
предел прочности твердого тела не учитывается; требуется только, чтобы
он был достаточно низким. Если это условие выполняется, то
деформация областей контакта приводит в основном к сжатию пленки и
переходу ее в Li-состояние (в приведенном численном примере этот пере-
* Уравнение (Х-20) можно вывести и другим способом. Пусть при небольшом
смещении от равновесного состояния толщина сжатой пленки уменьшается на йт
Вследствие этого из сжатой пленки в нормальную переносится.
dn = d%'lV = fa'/от
молекул на единицу площади. При этом совершается механическая работа Pdx/,
которая компенсируется работой переноса dn молекул против разности поверхностных
давлений в нормальной и сжатой пленках. Таким образом,
Ра[т' = (я — я') odn = Andx'/r.
Из этого выражения после соответствующего преобразования и получаем уравнение
(Х-20).
Трение и смазка. Адгезия
359
ход совершается при давлении 6 кГ/мм2). В условиях граничной смазки
коэффициент трения не должен зависеть от природы твердого тела, что
и наблюдается на практике.
Не следует забывать, что любой механизм граничной смазки должен быть
динамическим, поскольку обычно определяется кинетический, а не статический
коэффициент трения. Если рассматриваются несмазанные поверхности, предполагается, что
при движении шероховатостей точки контакта непрерывно образуются и срезаются.
Таким образом, процесс образования и срезания областей контакта является
стационарным. Аналогичная картина с непрерывным образованием и исчезновением областей,
подобных изображенной на рис. Х-16, по-видимому, имеет место и в условиях
граничной смазки. Для деформации контактирующих участков твердых поверхностей и
миграции молекул из сжатой пленки в нормальную требуется определенное время.
Поэтому уравнения (Х-18) и (Х-22), относящиеся к равновесным условиям, вряд ли
полностью применимы при высоких скоростях скольжения. Конечную скорость
установления равновесия можно продемонстрировать с помощью следующего численного
примера.
Как известно, даже конденсированные пленки обладают некоторой диффузионной
поверхностной подвижностью. Ридил и Тэдейон [44] показали, что процесс переноса
пленок стеариновой кислоты с одной поверхности на другую, по-видимому, обусловлен
поверхностной диффузией в отдельных точках контакта твердых тел. Такой перенос,
конечно, наблюдается и в опытах по трению, когда несмазанный ползун быстро
покрывается слоем граничной смазки, нанесенной на поверхность, по которой он скользит
[35]. Количественных данных по истинным коэффициентам поверхностной диффузии
получено очень мало. Согласно Россу и Гуду [45], коэффициент диффузии бутана
в монослое на сфероне 6 составляет около 5-10-3 см2/с. Допустим, что средний
диаметр области контакта равен около 10~3 см. Молекула проходит это расстояние
примерно за 10~4 с. Такой скорости прохождения точек контакта относительно друг друга
соответствует скорость скольжения 10 см/с. Таким образом, при обычных скоростях
порядка 0,01 см/с сжатая пленка успевает образоваться.
До сих пор предполагалось, что поверхностное давление достаточно велико и
соответствует давлению конденсированной пленки. Однако, если начать с малых я, то Ая
мало и площадь сжатой пленки типа L±, по которой распределена нагрузка W,
становится чрезмерно велика. Иными словами, в этом случае сжатая пленка настолько
разрежена, что она мало препятствует возникновению контакта металл—металл. Именно
так, по-видимому, обстоит дело и при повышении температуры (или уменьшении
молекулярного веса смазки). В этих условиях пленка переходит в растянутое состояние,
в котором сжатая пленка становится очень разреженной, и в результате площадь
контакта металл—металл и соответственно \i значительно возрастают.
Как граничная смазка значительный интерес представляет себациновая кислота
НООС—C8Hi6—СООН. Вероятно, при всех поверхностных давлениях молекулы
себациновой кислоты в пленке ориентируются плоско. Сама пленка находится в высоко-
конденсированном состоянии, и, таким образом, я велико. Модель сжатия пленки все
еще применима, хотя возможность поверхностной диффузии настолько мала, что
равновесные соотношения вряд ли должны выполняться. Однако, поскольку молекулы пленки
лежат плоско, можно ожидать, что пленки себациновой кислоты характеризуются тем
же значением s£, что и сжатые пленки соединений с неразветвленными
углеводородными цепями. И действительно, коэффициент трения поверхностей, покрытых себациновой
кислотой, приближается к обычным значениям коэффициента, характерным для
граничных смазок. Важно, однако, отметить, что при малых нагрузках \х себациновой
кислоты в отличие от других граничных смазок не возрастает [2]. Следовательно,
даже малые нагрузки удерживаются пленкой, а не контактами металл—металл.
Вообще говоря, последнее может быть верно и для смазок с неразветвленными цепями.
В этом случае высокий коэффициент трения объясняется большой сдвиговой
прочностью пленки Sf, обусловленной, как предполагается выше, стерической
затрудненностью углеводородных цепей.
При очень высоких давлениях граничная смазка может разрушаться.
Предполагается [40], что влияние давления аналогично влиянию высоких температур. Это
предположение не так уж необоснованно. С увеличением нагрузки количество диссипируе-
мого тепла возрастает, и как можно было ожидать, параллельно повышается и
локальная температура. Согласно модели сжатой пленки, увеличение ц при больших
нагрузках связано с растяжением пленки.
В заключение отметим, что модель сжатой пленки позволяет качественно
объяснить, почему электрическое сопротивление контакта поверхностей не увеличивается при
нанесении граничной смазки. По-видимому, здесь дело в том, что из-за близости
полярных головок, находящихся на противоположных поверхностях, электрическая
устойчивость (или, возможно, напряжение диэлектрического пробоя) сжатой пленки
значительно ниже объемной устойчивости смазки. По мнению Уилсона [43], повышенная
проводимость граничных пленок может быть обусловлена туннельным эффектом
го
Глава X
8. Адгезия
До сих пор понятие «адгезия» мы использовали только в узком
смысле и только в связи с определением работы адгезии (гл. II, разд.
П-3). Однако это понятие имеет более широкий смысл. В частности,
под адгезией понимают прочность связи двух соприкасающихся фаз, и
в этом случае ее определяют как нагрузку, необходимую для
разрушения этой связи. Последнее определение применяется на практике для
характеристики клеевых соединений.
А. Идеальная адгезия
Под идеальной адгезией понимают просто адгезию,
соответствующую той или иной модели. Например, работу и энергию адгезии,
выражаемые уравнениями (П-51) и (VII-8), определяют как обратимую
работу и энергию в расчете на квадратный сантиметр, необходимые для
разделения двух фаз, которые первоначально имели общую
поверхность раздела. Краевые эффекты во внимание не принимаются. Хотя
в реальных условиях энергия адгезии является более эффективной
характеристикой, чем обратимая работа, мы ограничимся здесь только
последней.
Уравнение (П-51) можно записать в более полном виде:
^a(B)B(A)=Va(B)+Yb(A) — Yab=^ab яа(В) лВ(а)> (Х-24)
где в скобки заключена та фаза, которая насыщает фазу, приведенную
перед скобками. В численном примере, рассмотренном в гл. III, разд.
Ш-2А, для системы вода (А)—бензол (В) даны следующие значения
работ адгезии: WA(b)b(a) = 56 эрг/см2 и №ав = 76 эрг/см2. Это вполне
характерные для работы адгезии цифры. Поскольку при разделении фаз
работа адгезии совершается на расстоянии порядка всего нескольких
молекулярных диаметров, приведенные значения соответствуют
довольно большим разделяющим силам. Если, например, эффективное
расстояние принять равным 10 А, то работе адгезии 56 эрг/см2
соответствует средняя сила 5,6-108 дн/см2, или 560 кГ/см2, что значительно
выше сопротивления разрыва большинства клеевых соединений.
Уравнение (Х-24) можно объединить с различными
полуэмпирическими уравнениями. Так, применяя правило Антонова [уравнение
(111-12)], получаем
^А(В)В(А> —2yB(A), (X-25)
что хорошо согласуется с данными для системы бензол—вода.
Уравнение Джирифалко и Гуда [уравнение (III-7)] дает
^ab=2(YaYb)1/2 (X-26)
(последнее уравнение согласуется с указанными данными хуже). Если
А — твердое тело, а В — жидкость, имеющая на А определенный
краевой угол, то
^А(В)В(А)=7В(А) (1 +COS0B). (Х-27)
Вместе с соотношением Зисмана [уравнение (VII-36)] это уравнение
дает следующее выражение:
^А(В)В(А)=Тв(А) (2 + Ръ)~Р1&а). (Х-28)
Из уравнения (Х-28), в частности, следует, что с изменением ув(А>
работа адгезии данной твердой поверхности проходит через максимум [46].
Трение и смазка. Адгезия
361
Дифференцируя уравнение (Х-28) и приравнивая производную нулю,
получаем
^max=(l/P)(l+PYc/2)2. (X-29)
Для исследованных Зисманом и др. [46] низкоэнергетических
поверхностей р составляет около 0,04 и Wmax приблизительно равна их
критическому поверхностному натяжению ус. Таким образом, чтобы
обеспечить на этих поверхностях оптимальную адгезию, жидкость должна
иметь довольно большой краевой угол.
Идеальной моделью адгезии может служить также показанная на
рис. 1-27 (гл. I) система, состоящая из двух пластин, разделенных
пленкой жидкости. Если жидкость смачивает обе пластинки и мениск
является цилиндрическим, то давление Лапласа Р равно 2уЦх, а сила,
прижимающая пластины друг к другу, определяется выражением
F=2yLV/x\ (Х-30)
Таким образом, сила, необходимая для разделения пластинок, между
которыми находится очень тонкая пленка жидкости, может быть
чрезвычайно велика. Как указано в упражнении 1-6 (гл. I), в последнее
уравнение следует дополнительно включить член, учитывающий
изменение различных поверхностей раздела фаз в зависимости от
расстояния между пластинами.
Б. Адгезия в реальных системах
Проведенное выше обсуждение показывает, что в идеальных
системах адгезия между двумя поверхностями раздела довольно велика. На
практике работа адгезии между двумя разнородными материалами
должна превышать работу когезии менее прочного материала.
Подобное положение имеет место и в опытах по трению, когда сдвиг,
по-видимому, происходит по менее прочному материалу, а не по самому
месту контакта. По мнению Бикермана [47], даже если вероятен разрыв
по поверхности раздела, основную роль в этом процессе играет
ослабленный граничный слой, представляющий собой тонкий (но
полимолекулярный) слой измененного материала, механически менее прочный,
чем любая из контактирующих объемных фаз. Ослабленный граничный
слой может состоять из окислов, загрязнений и т. д., и, кроме того, он
может образовываться и на поверхности структурно измененного, но
вполне чистого материала. С этой точки зрения большой интерес
представляет сообщение Шорнхорна и Райэна [48] о том, что тщательная
очистка пластика значительно ухудшает его сцепление с
металлическими подложками. Гуд [49] считает, что ослабленный слой образуется
мономолекулярной поверхностью раздела, а если это так, то разрыв
клеевых соединений должен действительно проходить по поверхности
раздела, а не смежным с ним областям.
Как указывалось в разд. Х-8А, адгезия тесно связана со свободной
поверхностной энергией системы, так же как, например, работа
адгезии связана со смачиванием или краевым углом. Следует подчеркнуть,
что при конечном краевом угле жидкости на твердой подложке
структура поверхности должна нарушаться, как и в присутствии
адсорбированного слоя [50]. Это одинаково относится как к поверхностям
раздела между жидкостью и твердым телом, так и к поверхностям
раздела между твердыми телами. В отношении структурных изменений
поверхностей адгезионные системы формально можно отнести к одному
из двух классов [51]. В системах класса А структурные нарушения
твердых поверхностей и, следовательно, энтропия адгезии малы.
Свойства систем класса В в значительной мере определяются изменениями
структуры поверхностного слоя одной или обеих фаз. При этом небла-
362
Глава X
F4
Гладкая поверхность
Пузырьки газа<{ Клей
Шероховатая поверхность I
Рис, Х-17. Влияние
шероховатости поверхности на копла-
нарность пузырьков газа [46].
гоприятные изменения энтропии компенсируются неожиданно высокой
энергией адгезии. Различие между энтропией и энергией адгезии
может иметь важное практическое значение. Вполне вероятно, что
прочность клеевого соединения больше определяется энергией, а не
свободной энергией адгезии. Этим можно объяснить необратимый
характер разрыва соединения при критической нагрузке. Важное
практическое значение имеет также тот факт, что адгезионная прочность в
системах класса А должна быть ниже, чем в системах класса В.
Некоторые вопросы, связанные с адгезионными свойствами поверхностей
раздела жидкость — твердое тело, рассматриваются в гл. VII, разд. VII-5.
В реальных системах определяющую роль нередко играют
совершенно другие факторы. Для хорошей адгезии необходима довольно
большая площадь фактического контакта между фазами. Однако, как
показано на рис. VII-8 (гл. VII), жидкость, надвигающаяся на
шероховатую поверхность, может захватывать воздух, и, таким образом, в
этом случае хороший контакт между фазами ограничивается только
частью поверхности. Предотвращению образования такой составной
поверхности способствует небольшой краевой угол. В результате одним
из критериев хорошей адгезии является растекание клея по
поверхности [52]. хотя, как показано выше, это может не соответствовать
идеальной работе адгезии.
Следует, однако, отметить, что фактическая прочность «хороших»
клеевых соединений, как правило, составляет только около одной
десятой идеального значения [53], что трудно объяснить неполным
смачиванием соединяемых поверхностей клеем. На клеебые соединения
могут действовать как нормальные, так и срезающие силы. Если
срезающая сила приложена к одной из склеенных поверхностей, может
наблюдаться «отслаивание», т. е. образование трещины, которая затем
расходится во все стороны. Подобный эффект может иметь место и в
отсутствие срезающей силы просто вследствие наличия в
поверхностном слое дефектов и захваченных пузырьков воздуха. Зисман [46]
полагает, что на шероховатых поверхностях клеи дают более прочные
соединения потому, что дефекты поверхностного слоя, удерживающие
захваченные пузырьки воздуха, не лежат в одной плоскости и
затрудняют распространение трещин. Влияние шероховатости на копланар-
ность пузырьков газа показано на рис. Х-17. Примером может служить
адгезия льда к различным твердым телам (в обычных условиях адгезия
льда минимальна). К металлам лед прилипает прочно, причем отрыв
происходит по самому льду. На тефлоне лед удерживается
значительно хуже, что, по-видимому, обуслозлено плохой смачиваемостью
тефлона водой, вследствие чего на поверхности раздела лед — полимер
образуются пузырьки воздуха. Концентрация напряжений на этих
пузырьках и приводит к распространению трещин по поверхности раздела
фаз. Если, однако, провести предварительно обезгаживание воды,
подвергнув ее нескольким циклам замораживания и оттаивания, то вода
проникает в шероховатости лучше и адгезия становится довольно
прочной [54]. Адгезия льда к металлам и полимерам рассматривается
также в работах [55—57]. При сдвиге на поверхности раздела лед —
подложка может проявляться также ползучесть льда [58].
Трение и смазка. Адгезия
363
Очень важным и интересным, но довольно неопределенным
вопросом является адгезия в биологических системах других подобных
операциях.^ При пересадке некоторых тканей, лечении зубов и требуется
прочный контакт между искусственными материалами и тканями
организма. Желательно, однако, чтобы компоненты крови слабо прилипали
к искусственным кровеносным сосудам, клапанам сердца и другим
протезам. Адгезия в биологических системах подробно рассматривается в
обзоре Бэйера [59].
9. Упражнения
1^При испытаниях на сухой бетонной дороге автомобиль разгоняется до
определенной скорости и затем тормозится силой F, действующей на тормозную педаль.
В ходе испытаний измеряется замедление а. При силе ^о автомобиль начинает
буксовать. Набросайте в общих чертах зависимость а от F вплоть до значений F>F0.
2. Самолет, оборудованный лыжами, совершает вынужденную посадку на
заснеженную дорогу и,в не успев остановиться, сталкивается со стоящим автомобилем.
Инспектор, ведущий расследование аварии, оценивает скорость приземления самолета
по формуле, обычно используемой для определения скорости движения автомобиля
перед торможением по следам буксования на мостовой.
Обсудите различия между следами буксования автомобиля на мостовой и следами,
оставляемыми самолетом при посадке. Является ли полученный инспектором ответ
а) завышенным, б) заниженным, в) приблизительно правильным г) или же он
содержит большую и в общем случае непредсказуемую ошибку?
3. Выведите уравнение, аналогичное уравнению (Х-9), для дороги, наклоненной
относительно горизонтали под углом 9.
4. При исследовании трения стали в качестве граничных смазок используются
а) СН3(СН2)8СООН и б) НООС(СН2)8СООН. Измерения проводятся в обычных
условиях, при 25 °С. Предположим, что для смазки а) проведена оценка коэффициента
трения. Будет ли коэффициент трения для смазки б) выше, ниже или таким же, как
для а)? Обсудите подробно, чем отличаются эти две системы.
5. Коэффициент трения меди по меди равен около 0,8. Предполагая, что
шероховатости или места контакта поверхностей представляют собой конусы с диаметром
основания и высотой около Ю-3 см и принимая, что предел текучести меди равен
30 кГ/мм2, рассчитайте локальную температуру при скорости скольжения 10 см/с и
нагрузке 15 кГ. Считайте, что вся выделяющаяся теплота трения расходуется только
на нагрев шероховатостей.
6. Электрическое сопротивление соединения двух круглых пластин определяется
выражением /?=1/2 ak, где а — радиус соединения и k — удельная проводимость
металла. При нагрузке 30 кГ сопротивление равно 5-10"5 Ом. Предел текучести и
удельное сопротивление стали соответственно равны 60 кГ/мм2 и 4-10-5 Ом/см. Рассчитайте
число контактов, предполагая, что их проводимости — аддитивные величины.
7. Для многих металлов отношение предела текучести к предельному напряжению
сдвига составляет около 5. С помощью уравнений (Х-3) и (Х-12) рассчитайте
величину ф в начале скольжения (т. е. \xs) стали по индию.
8. Используя приведенную на рис. Х-8 зависимость \xs от величины нагрузки,
определите, как меняется площадь контакта с изменением нагрузки, и постройте
кривую зависимости А от W.
9 Рассчитайте угол, при котором начинается скольжение массивного твердого
тела на наклонной плоскости, если коэффициент трения равен 0,40.
10 Ниже в таблице приведены некоторые данные, полученные при изучении
трения двух медных поверхностей. При одинаковой скорости скольжения эти данные
могут относиться как к несмазанным поверхностям, так и к поверхностям, смазанным
цетиловым спиртом, лауриновой кислотой или парафиновым маслом.
120 °С
Ста, Г Нагрузка. Г Сила, Г
23 °С
агру.жа, Г Сила, Г
0,010 0,01
1,0 0,30
10,0 1,0
100,0 10,0
1000,0 100,0
100 °С
Нагрузка, Г
10,0
1000,0
10,0 3.0
100.0 30,0
100,0
Использовалась ли, судя по приведенным данным, какая-либо смазка (или смесь
смазок)? Если да, то какая именно? Ответ обоснуйте.
11. Рассчитайте поверхностное натяжение жидкости, для которой работа адгезии
к поверхности ус = 20 эрг/см2 максимальна. Каким должен быть краевой угол?
12. Утверждается, что работа адгезии между двумя разнородными материалами
больше работы когезии менее прочного материала. При каких условиях это
утверждение правильно и при каких условиях оно ошибочно?
364
Глава X
13. Согласно приписываемому де Бройну [60] правилу, полярные подложки и
полярные клеи не дают прочных соединений. Согласуется ли это правило с
представлениями об идеальной адгезии?
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Adhesion, Eley D. D , ed , The Clarendon Press, Oxford, 1961.
Adhesion and Adhesives, Houwink R., Salomon G., eds., Elsevier, New York, 1965.
Bikerman J /., The Science of Adhesive Joints, Academic Press, New York, 1961.
Боуден Ф. П., Тэйбор Д., Трение и смазка твердых тел, часть I, M., Машгиз, 1960, ч. 2,
М., Машгиз, 1968.
Contact Angle, Wettability and Adhesion, Advances in Chemistry Series No. 43,
American Chemical Society, Washington, D. C, 1964.
Friction and Wear, Davies R., ed., Elsevier, New York, 1959.
Mechanisms of Solid Friction, Bryant P. J., Lavik M., Salomon G., eds., New York,
1964
Tabor F. P., Surface and Colloid Science, Matijevic E., ed., Wiley-Interscience, New York,
1972.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Боуден Ф. П., Тэйбор Д., Трение и смазка твердых тел, ч. 2, М., Машгиз, 1968.
2. Боуден Ф. П., Тэйбор Д., Трение и смазка твердых тел, часть 1, М., Машгиз, 1960,
ч. 2, М., Машгиз, 1968.
3. Bowden F. P., Thomas P. Я., Proc. Roy. Soc. (London), A223, 29 (1954).
4. «A Discussion on Friction», Proc. Roy. Soc. (London), A212, 439 (1952).
5. Sakmann B. W., Burwell /. Т., Irvine /. W., J. Appl. Phys., 15, 459 (1944).
6. Burwell J. Т., Strang C. D.f J. Appl. Phys., 20, 79 (1949).
7. Fort Т., Jr., J. Phys. Chem., 66, 1136 (1962).
8. Rabinowicz E., Friction and Wear, Davies R., ed., Elsevier, New York, 1969;
Burwell J. Т., Rabinowicz E., J. Appl. Phys., 24, 136 (1953).
9. O'Hara C. E., Osterburg /. W.f An Introduction to Criminalistics, Macmillan, New
York, 1959, p. 310.
10. Bowden F. P., Hughes T. P., Proc. Roy. Soc. (London), A172, 289 (1939).
11. Bowden F. P., Proc. Roy. Soc. (London), A217, 462 (1953).
12. Bowden F. P., Rowe G. W., Proc. Roy. Soc. (London), A228, 1 (1955).
13. Fletcher N. H., Phil. Mag., 7, No. 8, 255 (1962).
14. Adamson A. W., Dormant L. M„ Orem M., J. Colloid Interface Sci., 25, 206 (1967).
15. Bowden E. P., Hughes T. P., Proc. Roy. Soc. (London), A172, 263 (1939).
16. Bowden F. P., Young J. £., Nature, 164, 1089 (1949).
17. Machlin E. S., Yankee W. R., J. Appl. Phys., 25, 576 (1954).
18. Tingle E. D., Trans. Faraday Soc, 46, 93 (1950).
19. Whitehead /. R., Proc. Roy. Soc. (London), A201, 109 (1950).
20. Bowden F. P., Tabor D., Ann. Rept., 42, 20 (1945).
21. Bowden F. P., Young J. E., Proc. Roy. Soc. (London), A208, 444 (1951).
22. Feng 1. M., Lubrication Eng., 8, 285 (195?).
23. Bowden F. P., Young J. E., Rowe G., Proc. Roy. Soc. (London), A212, 485 (1952).
24. Spreadborough /., Wear, 5, 18 (1962).
25. Rowe G. W., Wear, 3, 274 (1960).
26. Bowers R. С Zisman W. A., Mod. Plastics, 41 (December 1963).
27. Pooley С. М., Tabor D.f Proc. Roy. Soc. London, A329, 251 (1972).
28. McFarlane /. 5., Tabor D.t Proc. Roy. Soc. (London), A202, 244 (1950).
29. Burwell /. Т., Rabinowicz E.f J. Appl. Phys., 24, 136 (1953).
30. Bockris J. O'M., Argade S. D., J. Chem. Phys., 50, 1622 (1969).
31 Deryaguin B. V., Karassev V. V., Zakhavaeva N .N„ Lazarev V. P., Wear, 1, 277
(1957—1958).
32 Bondi A., Physical Chemistry of Lubricating Oils, Reinhold, New York, 1951.
33. Hardy W. В., Bircumshaw L, Proc. Roy. Soc. (London), A108, 1 (1925).
34 Hardy B. W., Collected Works, Cambridge University Press, Cambridge, England,
1936.
35. Levine O., Zisman W. A., J. Phys. Chem., 61, 1068, 1188 (1957).
36 Russell J. A., Campbell W. E., Burton P. A, Ku P. M., ASLE Trans., 8, 48 (1958).
37. Frewing J. /., Proc. Roy. Soc. (London), A181, 23 (1942).
38. Fraioll A. V., Healey F. H., Zettlemoyer A .C., Chessick J. J., Abstracts of Papers,
13th Meeting of the American Chemical Society, Atlantic City, New Jersey,
September 1956.
39. Tabor D., Proc. Roy. Soc. (London), A212, 498 (1952).
40. Williams C. G., Proc. Roy. Soc. (London), A212, 512 (1952).
41 Cottington P. L.t Shafrin E. G., Zisman W. A., J. Phys. Chem., 62, 513 (1958).
42. Adamson A. W., The Physical Chemistry of Surfaces, Interscience, New York, 1960;
also, unpublished work, 1959.
Трение и смазка. Адгезия
365
43. Wilson R. W., Proc. Phys. Soc, 68B, 625 (1955).
44. Rideal E., Tadayon /., Proc. Roy. Soc. (London), A225, 346, 357 (1954).
45. Ross /. W., Good R. J., J. Phys. Chem., 60, 1167 (1956).
46. Zisman W. A., Advances in Chemistry, No. 43, American Chemical Society,
Washington, D. C, 1964, p. 1.
47. Bikerman J. J., The Science of Adhesive Joints, 2nd ed., Academic Press, New York,
1968.
48. Schonhorn #., Ryan F. W., J. Polymer Sci., 7, 105 (1969).
49. Good R. J., J. Adhesion, 4, 133 (1972).
50. Adamson A. W., J. Colloid Interface Sci., 44, 273 (1973).
51. Adamson A. W.t Shirley F. P., Kunichika К. Т., J. Colloid Interface Sci., 34, 461
(1970).
52. Huntsberger /. R.f Advances in Chemistry, No. 43, American Chemical Society,
Washington, D. C, 1964, p. 180; Sharpe L. H., Schonhorn H., ibid., p. 189.
53. Adhesion, Eley D. D., ed., The Clarendon Press, Oxford, 1961.
54. Zisman W. A., Ind. Eng. Chem., 55, No. 10, 18 (1963).
55. Jellinek H. H. G., J. Colloid Interface Sci., 25, 192 (1967).
56. Bascom W. D., Cottington R. L„ Singleterry C. R.t J. Adhesion, 1, 246 (1969).
57. Landy M., Freiberger A., J. Colloid Interface Sci., 25, 231 (1967).
58. Barnes P., Tabor D., Walker /. С F.f Proc. Roy. Soc. London, A324, 127 (1971).
59. Baier R. E., Adhesion in Biological Systems, Academic Press, New York, 1970;
Baier R. E., Weiss L.} Adv. in Chem., 145, 300 (1975).
60. deBruyne N. A., The Aircraft Engineer, XVIII, No. 12, 52 (1939).
ГЛАВА XI
Смачивание, флотация и моющее действие
1. Введение
В этой главе мы продолжим обсуждение различных прикладных
областей химии поверхностей, начатое в гл. X. В каждом из
рассматриваемых здесь явлений важную роль играют краевой угол — обычно
между жидкостью и твердым телом, а также адсорбция поверхностно-
активных веществ, приводящая к изменению свободной энергии
соответствующих поверхностей раздела.
Вопросам смачивания, флотации и моющего действия посвящено
очень большое число работ. В этих областях накоплен большой
фактический материал и развиты определенные теоретические представления.
Эта глава ни в коей мере не претендует на полноту охвата
рассматриваемых вопросов, а лишь иллюстрирует роль химии поверхностей при
решении некоторых прикладных задач.
2. Смачивание
А. Связь смачивания с краевым углом
На практике понятиям смачивание и несмачивание нередко
придают различный смысл, в зависимости от желаемого эффекта. Обычно,
однако, термин «смачивание» означает, что краевой угол между
жидкостью и твердым телом равен нулю или настолько близок к нему, что
жидкость свободно растекается по поверхности твердого тела.
Соответственно, когда говорят о «несмачивании», считают, что краевой угол
превышает 90° и, таким образом, жидкость стремится уйти с
поверхности или собраться в сферическую каплю.
Основным соотношением, связывающим смачивающие свойства
жидкости с краевым углом (рис. XI-1), является уравнение Юнга (см.
разд. VII-4A)
cos 0=(ysv—ySL) !yL v. (XI-1)
Смачивание происходит при условии, что краевой угол достаточно мал
и коэффициент растекания
SLis=4sv—4LV—ysL (Х1"2)
имеет положительное значение.
Следовательно, чтобы обеспечить растекание, в первом
приближении необходимо по возможности уменьшить ysL и yLv. На практике это
лучше всего делать, вводя в жидкую фазу какое-либо поверхностно-ак-
Смачивание, флотация и моющее действие
367
тивное вещество, адсорбирующееся на поверхностях раздела
жидкость— твердое тело и жидкость — воздух и тем самым понижающее
их поверхностные натяжения. Если поверхностно-активное вещество
Жидкость^.
рис. хм. у//////////////////////;://',
Твердое тело
нелетуче, то можно предполагать, что оно не влияет на ysv (см.,
однако, разд. \Ш-4Д).
Очень часто желателен хороший контакт между жидкостью —
обычно водой или водным раствором — и поверхностью, покрытой маслом,
жиром или воском. Приведем несколько примеров. При распылении
растворов инсектицидов требуется, чтобы распыляемая жидкость
смачивала вощеную поверхность листьев или хитиновый покров насекомых:
средства для мытья домашних животных должны смачивать их
жирную шерсть; чернила должны смачивать бумагу; при отмывке
текстильных волокон сначала удаляют нежелательные природные масла и
затем волокна пропитывают соответствующими составами; для
слеживания пыли и порошков (например, в угольных шахтах) жидкость должна
хорошо смачивать их частицы.
Как уже отмечалось, обычно для улучшения смачивания
используют добавки поверхностно-активных веществ. На первый взгляд,
казалось бы, улучшить смачивание можно, понизив уьу, и, следовательно,
достаточно располагать относительно небольшим набором
поверхностно-активных веществ. На самом деле, однако, желательно также,
чтобы поверхностно-активное вещество понижало также ysl. Это
значительно осложняет выбор добавок, поскольку влияние
поверхностно-активных веществ на ysb различных материалов является весьма
специфическим.
Молекулы смачивателей и других поверхностно-активных веществ
включают как полярные, так и неполярные группы. Неполярная часть
молекулы — это обычно алифатический или ароматический
углеводород или фторуглерод. Полярная часть молекулы образуется
различными функциональными группами (неионными или ионными),
содержащими кислород (карбоксильные кислоты, простые и сложные эфиры или
спирты), серу (сульфоновые кислоты и их эфиры, сульфаты и их
эфиры), фосфор, азот, галогены. Перечень ряда поверхностно-активных
веществ приводится в работах [1—3].
На смачивание может оказывать некоторое влияние и гистерезис
краевого угла (см. разд. УП-4Г). Обычно более важным считается угол
натекания, однако в некоторых случаях, например при использовании
средств для уничтожения паразитов в шерсти овец, значение имеет и
угол оттекания, определяющий задержку моющего средства в шерсти
после смачивания.
Как отмечалось в разд. УН-4Г, уменьшению гистерезиса до
минимума способствует подвижность поверхностно-активного вещества в
пленке (см. также работу [4]). Это означает, что хороший смачиватель
должен давать жидкую, а не твердую пленку.
Б. Смачивание как капиллярное явление
В некоторых случаях смачивание определяется не только краевым
углом. Так, при пропитке порошкообразных материалов и смачивании
волокон требуется, чтобы жидкость не только смачивала обрабатывае-
366
Глава XI
мые материалы, но и достаточно быстро проникала между частицами
или волокнами. Пропитка пористых тел связана с явлением
капиллярного подъема, при котором движущей силой служит разность давлений
на искривленной поверхности мениска. Согласно уравнению (VII-28),
капиллярное давление в поре с радиусом (или эквивалентным
радиусом) г равно
AP=2ylvcos0//*. (XI-3)
Уравнение (XI-3) целесообразно представить в двух различных
формах. Если 0 не равен нулю,
^P = 2(ysy-ySI)/r. (ХМ)
Поскольку обычно изменить ysv практически невозможно, чтобы ДР
была большой, следует по возможности уменьшить увь. Однако при
6 = 0 уравнение (XI-3) принимает следующий вид:
AP=2yLV/r, (XI-5)
и теперь ДР тем больше, чем больше уьу. Таким образом, задача
сводится к тому, чтобы найти такое поверхностно-активное вещество,
которое уменьшало бы ysl, но не снижало бы уьу- Поскольку любое
поверхностно-активное вещество влияет на оба межфазных натяжения,
выбор реагента, дающего такой сложный эффект, проводится с учетом
свойств каждой конкретной системы. Естественно, эта задача более
трудна, чем выбор обычных смачивателей.
Кроме большого ДР, при пропитке желательно также, чтобы
скорость движения жидкости в капилляре была достаточно велика. В
горизонтальных капиллярах и, вообще, если силами тяжести можно
пренебречь, скорость движения жидкости определяется уравнением Уош-
борна
v=ryLlL2COSQSL1L2 (ХШ
4(Vi+W2)
Это уравнение записано для такой системы, в которой жидкость L2
вытесняется жидкостью L\\ l\ и k — длины столбиков соответствующих
жидкостей в капилляре; t)i и г\2 — вязкости жидкостей. Если жидкость
вытесняет воздух, величина Yb(cos0)/Tj имеет размерность скорости и,
следовательно, может служить мерой скорости пропитки порошка или
пористого тела жидкостью.
Ньюмен и др. [6] получили уравнение (XI-6) в более общей форме. По мнению
Гуда [7], в движущую силу при пропитке следует ввести поправку на поверхностное
давление. Авторы работы [8], основываясь на данных по скорости пропитки маслом
смоченных водой капилляров радиусом от 5 до 35 мкм, предполагают, что при
вытеснении маслом вода образует кольцевые пленки толщиной до 100 А. Следует отметить,
что в упомянутых работах не учитывается возможная зависимость краевого угла от
скорости и направления движения [9].
В. Извлечение третичных масел
Проблема смачивания имеет очень важное значение и при промышленном
извлечении третичных масел. Как правило, процесс, при котором масло сначала
перерабатывается в третичное масло и затем выводится из системы, не экономичен.
Образующееся третичное масло можно извлекать либо прокачкой воды через реакционную смесь
(оводнение), либо прокачкой (при других температурах) смеси масла и воды. В
конечном итоге это становится также неэкономичным, так как в реакторе все же
остается от 30 до 50% исходного масла. Для извлечения третичных масел разработан
процесс экстракции путем прокачки смеси, содержащей третичное масло, через пористую
перегородку. В этом процессе важную роль играют поверхностно-активные вещества
[10], хотя механизм их действия еще не совсем понятен. Для улучшения разделения
желательно уменьшить капиллярное давление мениска масло—вода, уменьшив
межфазное натяжение между маслом и водой. Вероятно, целесообразно также уменьшить
Смачивание, флотация и моющее действие
369
Жидкость
а
Жидкость
6
краевой угол на трехфазной границе, чтобы вода легче вытесняла масло с поверхности
твердого тела. Подробно процесс извлечения третичных масел рассмотрен в работе
Мелроуза [11].
3. Гидрофобность и водонепроницаемость
Если краевой угол воды на поверхности твердого тела больше 90°,
то такую поверхность называют гидрофобной. Очевидно, что
гидрофобность тесно связана со смачиванием. Чтобы показать, насколько
важна гидрофобность поверхности, приведем следующий пример. Теплофи-
зические свойства (в частности, теплопроводность) обычного
конденсатора пара улучшаются, если жидкость не смачивает поверхность, а
стекает с нее в виде капель.
Выше мы говорили, какие условия способствуют смачиванию ткани
водой. Изменив эти условия на обратные, можно сделать ткань
гидрофобной. Иными словами, водонепроницаемость можно обеспечить, если
ДР — большая отрицательная величина. Как следует из рис. XI-2, при
отрицательном ДР (т. е. при 6>90°) жидкость не проходит между
волокнами ткани, тогда как при положительном ДР она свободно
проходит через них. Следует отметить, что ткань, имеющая гидрофобную
поверхность (рис. XI-2,а), отнюдь не является водонепроницаемой. У этой
ткани есть поры, и при достаточном гидростатическом давлении вода
может проходить через них.
Поскольку краевой угол воды на поверхности волокон превышает
90°, капиллярное равновесие данной системы описывается уравнением
(XI-4) В это уравнение непосредственно входит не поверхностное
натяжение жидкости, а величина ysv— ysL, которая в данном случае
должна иметь отрицательное значение. Этого можно достичь, покрыв
поверхность волокон веществом, значительно уменьшающим ysv- В
рамках представлений о критическом поверхностном натяжении (разд.
УП-4Д) это означает, что ус твердой поверхности следует уменьшить
приблизительно до 40 дн/см, а если возможно, и ниже. В
промышленном масштабе для пропитки применяют зелан и различные
силиконовые полимеры [12]. Зелан
С17Н86С(ЖНСНам/~~\V СГ
представляет собой водорастворимое вещество. Волокно, пропитанное
раствором зелана, прогревают при 120—150 °С, далее промывают и
высушивают. Предполагают, что при термообработке четвертичная
аммониевая соль превращается в амид (С^Нзб'СОМН^СНг, который
образует воскообразное покрытие, прочно прилипающее к поверхности волокон.
Молекулы силиконовых полимеров состоят из цепей —О—Si—О—Si—
с боковыми алкильными группами и поэтому образуют покрытия
такого же типа, как и углеводороды, и так же прочно удерживаются
волокнами.
Одним из факторов, способствующих улучшению
водонепроницаемости ткани, является повышение краевых углов на сетчатой структуре
Рис. XI-2. Влияние краевого угла на
водопроницаемость тканей:
24—1421
370
Глава XI
тканей [уравнение (VII-34)]. Для увеличения краевого угла
используют также гидрофобные покрытия с микрошероховатой поверхностью
(VII-31).
Гидрофобизаторы различных типов используют также для предотвращения
старения дорожных покрытий, состоящих из щебенки, смешанной с битумом. Дело в том,
что вода, проникающая на поверхность раздела камень—битум, отделяет щебенку от
связующего материала. Хотя различные поверхностно-активные добавки затрудняют
этот процесс, в целом удовлетворительного решения данной проблемы не найдено, и
предстоит еще большая работа.
Для предотвращения загрязнения окружающей среды важное значение имеет
разработка способа удаления разлитых масел и нефтепродуктов. С помощью
соответствующих поверхностно-активных добавок можно предотвратить растекание масел.
Образующиеся при этом сгустки собирать гораздо легче [14].
4. Флотация
Очень важной и в то же время довольно сложной областью
применения химии поверхностей является флотационное разделение
минералов. Этот метод представляет исключительную ценность для
горнодобывающей промышленности, так как позволяет экономично
обрабатывать огромные количества измельченных руд и отделять ценные
минералы от пустой породы. Первоначально флотация применялась только
для переработки некоторых сульфидных и окисленных руд, однако в
настоящее время она применяется и во многих других случаях. В
далеко не полный перечень руд, обогащаемых методом флотации в
промышленном масштабе, можно включить никеле- и золотоносные руды,
кальцит, флюорит, барит (сульфат бария), шеелит (вольфрамат
кальция), карбонат и окись марганца, окислы железа, гранатовые породы,
титанжелезные окислы, окислы кремния и силикаты, уголь, графит,
серу и некоторые растворимые соли, например сильвинит (хлорид калия).
Подсчитано, что ежегодно флотационным методом перерабатывается
109 т руды [15, 16]! Приблизительно до 1920 г. флотационные
процессы были довольно примитивными и основывались прежде всего на
эмпирическом наблюдении, что пульпа медной или свинцово-цинковой
руды (смеси измельченной руды с водой) может обогащаться (т. е. в
ней может повышаться содержание собственно минерала) при
обработке большими количествами жиров или масел. Частицы ценного
минерала собираются в слое масла и, таким образом, отделяются от пустой
породы и воды. Позже масляная флотация была почти полностью
вытеснена так называемой пенной флотацией. При использовании
пенной флотации к пульпе прибавляют небольшое количество масла и
вспенивают, перемешивая ее или пробулькивая через нее пузырьки
воздуха. Частицы минералов концентрируются в образовавшейся
пене, которую периодически снимают с пульпы.
Довольно скоро выяснилось, что даже небольшие изменения в
составе масел могут оказывать значительное влияние на их способность
к флотации. До сих пор многие флотационные процессы строго
засекречены. В этой области сложилась необычная ситуация: отработка и
усовершенствование процессов ведется эмпирическим путем, а теория
лишь пытается объяснить достигнутые результаты. В целом, однако,
механизмы флотационных процессов достаточно понятны, и в
настоящее время в промышленном масштабе выпускается и используется
большое число самых разнообразных добавок, улучшающих
эффективность этих процессов. К таким добавкам относятся коллекторы,
адсорбирующиеся на минеральных частицах и при этом меняющие краевой
угол в желательном направлении; активаторы, усиливающие
селективное действие коллектора; депрессанты, селективно подавляющее
действие коллектора, и пенообразователи, способствующие образованию
пены. Как видно из дальнейшего обсуждения, пенообразователи могут
играть непосредственную роль и в самом процессе флотации.
Смачивание, флотация и моющее действие 37Р-
Фаэа В
°6°
Рис. XI-3. Флотация минерала воздушными
пузырьками.
Фаза А
А. Роль краевого угла при флотации
В процессе флотации частицы руды захватываются пузырьками
воздуха и, всплывая с ними (рис. XI-3), прочно удерживаются в пене.
После того как это было доподлинно установлено (примерно в 1915 г.),
было предложено несколько теорий флотации. В одной из них захват
частиц пирита пузырьками воздуха объяснялся тем, что пузырьки
воздуха и частицы кварца заряжены отрицательно, тогда как частицы
пирита заряжены положительно. Таким образом, селективная адгезия
между частицами пирита и пузырьками воздуха связывалась с
электростатическим взаимодействием. Уже к 1919 г. становится ясно, что
основную роль в процессе флотации играют не электростатические силы,
а краевой угол. Однако в настоящее время признается, что
электрический заряд частиц в значительной мере определяет их адсорбционные
свойства и, следовательно, краевой угол и адгезию к пузырькам.
Рассмотрим, каким образом частица может занять устойчивое
положение на границе раздела двух жидких фаз (рис. XI-4). При этом
действие сил тяжести вначале учитывать не будем и, кроме того, допустим,
что твердая частица является сферической и что и она, и обе жидкие
фазы А и В имеют одинаковую плотность. Частица может находиться
только в фазе А или только в фазе В либо располагаться на
поверхности раздела этих фаз. В последнем случае полная свободная энергия
системы определяется ysA и ysb, а также некоторым уменьшением
поверхности раздела жидкость — жидкость.
В условиях равновесия полная свободная поверхностная энергия
системы частица — поверхность раздела фаз минимальна, т. е. при
небольшом смещении частицы изменение свободной энергии этой
системы равно нулю. Чтобы найти условие равновесия, обратимся к схеме,
изображенной на рис. XI-5. Предположим, что h — глубина проникания
частицы в фазу Л. При этом площадь поверхности раздела частица —
жидкость А равна 2nrhy а площадь поверхности раздела частица —
Фаза В
Фаза А
Рис. XI-5.
24*
372
Глава XI
жидкость В равна 4я/*2—2nrh. Занятая частицей площадь поверхности
раздела жидкость — жидкость составляет л;/2, где
/ = [r2—(r-h)2}1/* или Ai=n(2rh—h2).
В условиях равновесия
dG=0=ySA (2nrdh) + ySB {—2nrdh) —yABn (2r— 2ft) dh. (XI-7)
После соответствующих преобразований получаем
Уза -ysB=(l-h/r)yBB=cosQ-yAB. (XI-8)
Уравнение (XI-8), по существу, представляет собой уравнение Юнга
для равновесного краевого угла. Анализ этого уравнения приводит к
заключению, что на поверхности раздела между двумя жидкостями
частица стремится занять такое положение, при котором 6 становится
равным равновесному краевому углу. Иначе говоря, если 0 больше О,
частица занимает на поверхности устойчивое положение.
Прочность связи частицы с поверхностью раздела фаз показывает следующий
пример Предположим, что 6 = 90° и ysA=yse. Тогда ASa=Asb, т. е. частица
располагается так. что поверхность раздела Л—В как бы делит ее пополам, и, следовательно,
Адв = гсг2. Чтобы удалить частицу из равновесного положения на поверхности раздела
фаз, требуется энергия, равная пг2уАв. Для частицы радиусом 1 мм при \ав —
40 эрг/см2 эта энергия составляет около 1 эрг. При удалении частицы с поверхности
раздела жидкостей эта работа совершается на расстоянии, примерно равном радиусу
частицы. Поэтому сила, удерживающая частицу на поверхности раздела,
приблизительно равна 10 дн.
На рис. XI-6 показан обычный случай, когда частица удерживается на
поверхности раздела жидкость—воздух благодаря действию поверхностных сил. Как показывает
рассмотренный выше пример, возвращающая сила, удерживающая частицу на
поверхности раздела, приблизительно пропорциональна радиусу частицы. Для того чтобы
частица оставалась на плаву, возвращающая сила должна быть равна или должна
превышать силу тяжести. Поскольку последняя изменяется пропорционально кубу
радиуса, ясно, что существует максимальный размер, при котором частица еще может
удерживаться поверхностью раздела. Так, в рассмотренном примере плотности
частицы 3 г/см3 соответствует максимальный радиус около 0,1 см.
На практике при определенных мерах предосторожности можно заставить плавать
и частицу несколько большего размера, чем соответствующий ее плотности
теоретический максимальный размер. Как показано на рис. XI-7, частица, имеющая
неправильную форму, стремится занять на поверхности раздела такое положение, чтобы
трехфазная граница приходилась на ее выступающие части или ребра. В этом случае,
чтобы линия контакта подвинулась дальше, частицу необходимо дополнительно
нагрузить. Для хорошей флотации желательно обеспечить значительный запас устойчивости
частицы на поверхности раздела, с тем чтобы при механическом перемешивании
пульпы частица не отрывалась от пузырька. Практический верхний предел размера частиц
при этом механизме флотации составляет 0,3 мм. Имеется также и нижний предел.
Лежа [16] отмечает, что частицы меньше приблизительно 5 мкм образуют слишком
устойчивый шлам и поэтому не могут подвергаться флотационной обработке.
Указанный верхний предел размеров частицы может быть
значительно превышен, если к ней прикрепляется не один, а несколько
пузырьков* Правда, прежде чем прилипнуть к частице, пузырек должен
преодолеть некоторый энергетический барьер. Механизм этого процесса
Рис. XI-6
* Это можно проиллюстрировать с помощью довольно простого, но красивого
опыта. В стеклянный шар помещается некоторое количество 1%-ного раствора
бикарбоната натрия и добавляется немного нафталиновых или камфорных шариков После
этого шар заполняется на одну треть (по объему) уксусом. Пузырьки, образуемые
медленно выделяющейся двуокисью углерода, прилипают к нафталиновым шарикам и
поднимают их на поверхность. Выйдя на поверхность, пузырьки лопаются, и шарики.
утратив плавучесть, опускаются. Этот процесс может повторяться многократно.
"W"-
Смачивание, флотация и моющее действие
373
Рис. XI-7.
подробно рассмотрен в работе Лежа и Полинга [17] (см. также [18,
19]. Прилипание пузырька к поверхности можно разделить на две
стадии: на первой стадии (рис. XI-8, б) меняется форма пузырька, а на
второй (рис. XI-8, в) — происходит собственно прилипание к
поверхности. Стадия 1, т. е. стадия деформации пузырька, не так уже
нереальна. Пузырек, ударяясь о поверхность, действительно меняет свою
форму и только после того, как пленка жидкости между ним и
поверхностью достаточно утоныпится, прилипает к поверхности (см. [18, 20]).
На стадии 1 изменение свободной поверхностной энергии составляет
AG^AA^v^, (XI-9)
где AALV = ALV>-\-ASv— xLV. На второй стадии
№2=(ysv-ySL-yLV) Asv=-WaAsv. (XI-10)
Отсюда для всего процесса
AG = -~WaAsv + vLVA ALV=-WnpaKT, (XI-11)
где Wa — работа адгезии (вообще говоря, не совпадающая с WSl).
Таким образом, —AG соответствует фактической работе адгезии пузырька
к плоской поверхности, a AG приблизительно равна энергетическому
барьеру адгезии.
В качестве примера рассмотрим поведение пузырька диаметром 0,1 см в системе,
для которой Wa — ЗО эрг/см2, Yz.v = 30 эрг/см2 и 6 = 90°. Предположим, что выходя на
поверхность, пузырек принимает форму полусферы. В этом случае №практ=0,19 эрг,
a a6i = 0,18 эрг. Потенциальная энергия, которую пузырек может приобрести при
всплытии, составляет только 0,066 эрг, т. е. значительно меньше барьера AG\, и, таким
образом, прилипание пузырька к поверхности затруднено. Однако если пузырек прилип
к поверхности, обращенной вверх, как показано на рис. XI-8, г, барьер,
препятствующий его отрыву, равен AG2, или 0,38 эрг. Следовательно, и в этом случае барьер
значительно выше изменения потенциальной энергии пузырька при сдвиге его центра
тяжести в обратной последовательности. Основываясь на сказанном, можно сделать
качественный вывод, что пузырьку трудно прилипнуть к твердой поверхности, но,
прилипнув, так же трудно от нее оторваться.
Согласно уравнению (XI-8), если краевой угол равен нулю (рис.
Х1-8,г), пузырек не удерживается на плоской поверхности. Однако, если
он входит в полусферическое углубление (рис. XI-8, е) такого же
радиуса, то его форма не искажается и общее изменение свободной
энергии составляет
AGia=-WaAsv. (XI-12)
Рис. XI-8. Искажение формы и адгезия пу- -
зырька. **
374
Глава XI
Для рассмотренного выше численного примера AG\a равна 0,47 эрг,
т. е. работа адгезии в системе пузырек — полусферическое углубление
даже выше, чем при 0 = 90° и плоской поверхности.
Приведенные примеры указывают на два основных механизма
захвата минеральных частиц пузырьками. По мнению Таггарта [21], на
поверхности частицы сначала образуется зародыш пузырька, который
постепенно растет, например в результате пересыщения раствора
воздухом в областях пониженного давления в завихрениях, вызываемых
лопастями механической мешалки. Такие пузырьки, растущие в полостях
и углублениях частицы, особенно устойчивы к отрыву. Годэн [22]
предполагает, что растущие пузырьки приклеиваются к частицам при
столкновениях. Классен [12] считает возможными оба механизма и
отмечает, что столкновение пузырька с частицей эффективнее, если на ее
поверхности уже имеется растущий микропузырек. Вообще говоря,
механизм столкновений, по-видимому, имеет более важное значение, чем
механизм роста пузырьков [23].
Б. Флотация рудных минералов
Как показано в предыдущей части этого раздела, для хорошей
флотации минералов важно, чтобы краевой угол на трехфазной границе
частица — раствор — воздух был достаточно велик. Некоторые
минералы, например графит, по своей природе гидрофобны. Однако даже при
их флотации в систему выгодно вводить коллекторы — вещества,
которые, адсорбируясь, образуют на твердой поверхности гидрофобную
пленку. Роль таких коллекторов особенно важна, если проводится
обогащение гидрофильных минералов, например кремнезема.
При флотации свинцовых и медных руд в качестве коллекторов
широко применяются ксантогенаты
yO-R
S=(r
4s-k+
Предполагалось, что эти соединения связываются с поверхностью в
результате следующей реакции:
РЬ(ОН)2 + 2ROCS^ > Pb -S-C^
L XOR
20Н- (XI-13)
Однако уже довольно давно экспериментально установлено, что на
действие ксантогенатов определенное влияние оказывает растворенный
кислород. В настоящее время эти наблюдения подтвердились. Так, в
обезгаженных растворах этилксантогенат на меди не адсорбируется
[24, 25]. По-видимому, в данном случае важное значение имеет не
только окисление поверхности, но и то обстоятельство, что само
поверхностно-активное вещество может находиться в растворе в окисленном
виде, т. е. в виде диксантогена
(R-0-C-S-)2
Решающая роль кислорода в механизме химического взаимодействия
между минералом и коллектором подчеркивается и в работе Годэна
[26]. Примером сложности флотационных процессов может служить
также поведение лауриновой кислоты при флотации медной руды:
адсорбированная кислота присутствует на поверхности минеральных
частиц либо как лаурат меди, либо в виде лаурат-ионов [27].
Для улучшения флотации нередко прибегают к довольно хитроумным приемам
Так, сами по себе цинковые руды флотируются ксантогенатами плохо, однако после
предварительной обработки руды разбавленным раствором сульфата меди флотация
Смачивание, флотация и моющее действие
375
воздух
\
с^водньш раствор л ^ ^-^ NP
! УШВвШ >
.VS
V
ггп
М—М--М--М--М--М--М у/£
iiiiiiiiiiiiiilTniiiiillv^
~QOnf)/ra unnmuiin I \\v У.
Твердая частица
^ЪУ/\' У Коллекпщ У Пенообразо- I ПК
ватель
Водный
раствор
Контактный
угол
м—м—м—м—м—м—м~м
lllllllllllllllllllllllin
Твердая частица
Коллектор
Рис. XI-9. Взаимное проникание пленок эмульгатора и коллектора [29].
значительно улучшается. Дело в том, что в процессе предварительной обработки
проводится электроосаждение тонкого слоя меди на минеральных частицах. Еще один
пример: обработка руды, содержащей железо, цинк и свинец, разбавленным раствором
цианида подавляет адсорбцию коллектора на первых двух минералах и не влияет на
адсорбционные свойства последнего. В этом случае цианид можно назвать
депрессантом.
Кроме большого краевого угла, при флотации желательно также,
чтобы пузырьки, нагруженные минеральными частицами, не лопались
при достижении поверхности, т. е. чтобы пузырьки образовывали
устойчивую (но не слишком устойчивую) пену. С этой целью в систему
обычно добавляют различные пенообразователи, например длинноце-
почечные спирты, сосновое масло и т. п. Однако, как правило, действия
пенообразователя и коллектора не являются независимыми друг от
друга.
На первый взгляд может показаться, что наилучшие условия
флотации обеспечиваются в том случае, когда коллектор образует плотный
монослой, при котором краевой угол должен быть (и это действительно
так) наибольшим. И все же, как показали Годэн и Сун [28], флотация
оптимальна в таких системах, в которых адсорбция коллектора
соответствует всего 5—15% плотного монослоя. При большей адсорбции
коллектора адгезия пузырьков воздуха к частицам ухудшается. Данные
Шульмана и Лежа [29] по системе ксантогенат—лауриловый спирт —
медь свидетельствуют о том, что лауриловый спирт проникает в пленку
адсорбированного этилксантогената или приводит к образованию
смешанной пленки (см. разд. III-8). Когда пузырек и частица
разъединены (рис. XI-9), пенообразователь концентрируется на поверхности
пузырька, а коллектор — на поверхности частицы. При слипании
пузырька и частицы пенообразователь проникает в пленку коллектора, что
приводит к заметной стабилизации трехфазной границы твердое тело —
376
Глава XI
жидкость — воздух. Если концентрация коллектора достаточна для
образования плотного монослоя, проникание пенообразователя в
адсорбированную пленку коллектора затруднено и эффект «запирания»
ослабляется. В конечном итоге мы приходим к следующему выводу.
Основное условие хорошей флотации — большой краевой угол — сводится
к обеспечению отрицательной разности ysv— ysL> Адсорбция
коллектора на поверхности раздела частица — жидкость косвенно способствует
этому, поскольку при этом межфазное натяжение между
адсорбированной пленкой и жидкостью может быть выше, чем соответствующая
величина для поверхности раздела пленка — воздух. Проникание
пенообразователя в пленку на границе с воздухом дает промежуточный
эффект, снижая ysv, но мало влияя при этом на ysb-
Следовательно, пенообразователь прежде всего должен
стабилизовать контакт между частицей и пузырьком, а сама по себе способность
его к образованию устойчивой пены имеет второстепенное значение
(см. [30] и гл. XII). Кроме того, как показано в следующем разделе,
минерализованные пузырьки сами дают устойчивые пенные системы.
В. Флотация нерудных минералов
Выше мы рассмотрели флотацию свинцовых и медных руд ксанто-
генатами, где адсорбция коллектора определяется в основном
химическим взаимодействием. Флотационные процессы широко применяются
также и для переработки минералов других типов, и в частности солей,
например хлорида калия, и нерастворимых окислов, например кварца
или окиси железа. В этих случаях важную роль в адсорбции
коллектора играют и другие факторы.
Рис. XI-10. Зависимость способности гётита к флотации от поверхностного заряда [32]
Вверху показана зависимость ^-потенциала от рН при различных концентрациях хлорида натрия;
внизу — влияние рН на эффективность флотации в 10~3 М растворах хлорида додециламмония,
додецилсульфата натрия или додецилсульфоната натрия.
Смачивание, флотация и моющее действие
377
Равновесная концентрация додецилсульфоната
натрия, моль/л
Рис. XI-11. Система окись алюминия—водный раствор додецилсульфоната натрия
при рН 7,2, ионной силе 2-10~3 н. и 24 °С [34а].
/ — краевой угол; 2 — адсорбционная плотность, 3 — электрофоретическая подвижность
Примером может служить флотационное отделение сильвина (КС1)
от галита (NaCl) в насыщенных растворах с помощью длинноцепочеч-
ных аминов, например соли додециламмония. Странно, конечно, что две
очень схожие между собой соли разделяются таким простым
реагентом. Это можно объяснить тем, что размеры иона R—NHg позволяют
ему входить в вакансию К+, но не позволяют вытеснять ион Na+.
Таким образом, прочную адсорбцию аминов на сильвине можно
рассматривать как своего рода изоморфное поверхностное замещение [19, 31].
Для отделения барита BaS04 от окислов в качестве коллектора
используют олеиновую кислоту. Это же относится и к кальциту CaF2. Очень
вероятно, что сильная адсорбция коллектора на барите и кальците
обусловлена нерастворимостью солей щелочноземельных металлов и
жирных кислот (см. гл. III, разд. III-6E).
Флотация нерастворимых минеральных окислов лучше всего
объясняется на основе теории двойного электрического слоя. В этом случае
потенциал поверхности минерала г|> имеет такое же важное значение,
как и специфическое химическое взаимодействие.
Потенциал-определяющим ионом для окислов служит ион водорода (см. гл. IV, разд. IV-6),
причем рН точки нулевого заряда сильно зависит от природы
поверхности самого окисла. Так, для кварца в точке нулевого заряда рН
примерно равен 3, а для гётита FeO(OH) рН равен 6,7 [32]. Гётит
эффективно флотируется анионными поверхностно-активными соединениями
при рН>6,7, когда поверхность минерала заряжена положительно. Ка-
тионные поверхностно-активные вещества работают при более высоких
значениях рН, когда поверхность заряжена отрицательно.
378
Глава XI
Молекулы коллектора, адсорбированного на окисле, по-видимому,
располагаются в штерновском слое (рис. IX-13), т. е. адсорбция
приводит к уменьшению ^-потенциала. При высоких степенях заполнения
поверхности коллектора ^-потенциал может даже обращаться. Это
показывает, что в таких системах химические силы но меньшей мере
сопоставимы с электростатическими. По мнению Годэна и Фюрстенау
[33], резкое падение g-потенциала при некоторой концентрации
коллектора обусловлено своего рода фазовым переходом в адсорбированной
пленке поверхностно-активного вещества. Авторы предполагают, что в
этой точке начинается образование поверхностных мицелл. Такое
предположение, по существу, аналогично предположению Лэнгмюра об
образовании пленок промежуточного типа на жидких подложках (см.
гл. III, разд. III-6B).
Сильная зависимость адсорбции поверхностно-активного вещества
от концентрации наблюдается и в системе глинозем — водный раствор
додецилсульфоната натрия [34]. Как показано на рис. IX-11, адсорбция
резко возрастает при концентрации, близкой к 10~4 М, когда,
по-видимому, образуются поверхностные мицеллы или полумицеллы.
Интересно, что в точке обращения ^-потенциала никаких резких изменений ни
в изотермах адсорбции, ни в краевом угле не наблюдается.
Адсорбцию коллекторов можно усиливать или ослаблять, вводя в
систему многозарядные ионы, способствующие адсорбции или
подавляющие ее. Умело добавляя различные электролиты и регулируя рН,
можно добиться значительной селективности флотации.
Наконец, вкратце рассмотрим так называемую ионную флотацию, предложенную
Себба [35] (см. также гл. III, разд. III-6E). В этом методе используется способность
поверхностно-активных соединений образовывать нерастворимые соли или коагуляты
с некоторыми ионами, находящимися в растворе (например, жирные кислоты образуют
такие соли с двухзарядными ионами меди). При пропускании через систему пузырьков
воздуха коагулят собирается на поверхности в виде пены. Таким способом из раствора
селективно выделяются вполне определенные ионы. Можно полагать, что этот
интересный метод пригоден для флотационного извлечения следов ценных элементов,
содержащихся в океанской воде.
5. Моющее действие
Моющее действие определяется как способность моющих веществ
и их растворов удалять прилипшие к различным поверхностям (тка-
ней> металлов и т. д.) посторонние частицы или загрязнения и
переводить их во взвешенное состояние. Простая механическая очистка
поверхностей (например, с помощью абразивов) и химическое
растворение загрязнений к мойке не относятся. Старейшим и наиболее
известным моющим средством является обычное мыло, эффективность
которого при стирке тканей — отличный пример моющего действия.
А. Общий механизм моющего действия
Загрязнения, прочно удерживаемые тканями, обычно представляют
собой маслянистые продукты (животные жиры, жирные кислоты,
нефтепродукты и другие самые разнообразные вещества [36, 37]) с
включениями частиц пыли, копоти и т. д.
Из-за сложности и невоспроизводимости состава загрязнений при исследовании
механизма моющего действия необходимо пользоваться одними и теми же
загрязняющими смесями и стандартными методиками нанесения загрязнений и процедурами
мойки. Стандартная загрязняющая смесь содержит ламповую сажу и некоторое
количество вазелина. В качестве стандартной аппаратуры для мойки используют
специальную стиральную машину («Лондерометр»), в которой стандартные образцы тканей
перемешиваются с моющими растворами в воспроизводимых условиях (степени
перемешивания, температуре и т. д.). Контролируя условия мойки, можно получить рабочие
характеристики самых разнообразных моющих средств. Обычно степень
загрязненности ткани оценивают по коэффициенту отражения поверхности ткани. При этом ис-
Смачивание, флотация и моющее действие 379
Водная (раза^
Маслянистое загрязнение
у Твердое тело
Ъо
Рис. XI-12. Соотношение между поверхностными натяжениями при удалении
загрязнения.
пользуют эмпирическое соотношение между количеством частиц сажи и белизной
ткани. В некоторых случаях в загрязняющую смесь вводят меченые атомы, и тогда
степень загрязненности ткани определяют по ее радиоактивности.
На рис. XI-12 приведена типичная схема удаления с поверхности
жировой частицы, удерживаемой силами поверхностного натяжения.
Из этого рисунка следует довольно простой вывод. Изменение
свободной поверхностной энергии при отрыве частицы грязи от поверхности
равно
AG=Ywo + Ysw—Yso- (XI"14)
Самопроизвольный отрыв частицы возможен при условии, что AG^O
или
4so>4wo + 4sw- (XI-15)
Если загрязняющая смесь представляет собой жидкость, то для ее
удаления необходимо, чтобы краевой угол водной фазы 0 был как можно
меньше (рис. XI-13). При 6 = 0, т. е. при нулевом или положительном
коэффициенте растекания водной фазы, мы опять приходим к
уравнению (XI-15).
Как показывает анализ этого уравнения, чтобы адгезия грязи к
твердой поверхности была нулевой или отрицательной, необходимо
максимально уменьшить ywo и ysw, минимально меняя при этом yso.
По этой причине можно ожидать, что эффективным моющим
действием должны обладать поверхностно-активные вещества,
адсорбирующиеся как на поверхности раздела масло — вода, так и на поверхности
раздела твердое тело — вода. Такие поверхностно-активные вещества
называют детергентами. В то же время значительное уменьшение
поверхностного натяжения поверхностей раздела вода — воздух,
проявляющееся, например, в образовании пены, само по себе еще не
является прямым указанием на то, что поверхностно-активное вещество
может быть хорошим моющим средством (детергентом). Ниже
рассматриваются факторы, определяющие моющее действие различных
веществ.
Б. Свойства растворов коллоидных электролитов
Растворы детергентов обладают рядом довольно специфических и
интересных свойств, характерных для так называемых коллоидных
электролитов и косвенно или непосредственно связанных с их моющей
Вода ^ч. масло
в (
Рис. XI-13. Соотношения между поверхностными */}//////////////////Ъ/////////////////
натяжениями при удалении загрязняющей жид- //////////////'////'///'//''/'/'/''/'/''
кости. Твердое тело
380
Глава XI
Область ккм
Концентрация додецилсульфата натрия*, %
Рис. IX-14. Свойства растворов коллоидного электролита (додецилсульфата натрия)
[38].
1 — моющая способность, 2 — плотность заряда, 3 — проводимость (высокочастотная); 4 —
поверхностное натяжение, 5 — осмотическое давление; 6 — эквивалентная электропроводность; 7 —
межфазное натяжение.
способностью. Поэтому, прежде чем перейти к более детальному
обсуждению механизма моющего действия, имеет смысл сначала
рассмотреть эти свойства.
На рис. XI-14 приведены зависимости, описывающие физические
свойства раствора додецилсульфата натрия — типичного коллоидного
электролита [38, 39]. Как видно из этого рисунка, наиболее
значительные изменения физических свойств соответствуют области так
называемой критической концентрации мицеллообразования (ККМ).
Приблизительное постоянство осмотического давления при концентрации
детергента выше ККМ показывает, что в этих условиях протекает
процесс, весьма сходный с выделением новой фазы. И хотя на самом деле
никакого значительного разделения фаз здесь не наблюдается, резкое
увеличение рассеяния света свидетельствует о переходе системы в
коллоидное состояние. Предложено хорошо аргументированное
объяснение, согласно которому в области ККМ начинается агрегация длинно-
цепочечных электролитов в довольно большие заряженные частицы.
Такие частицы обычно называют мицеллами. Детальное рассмотрение
физической химии мицеллообразования несколько выходит за рамки
этой книги. Однако это явление столь характерно для растворов
детергентов, что о нем необходимо сказать хотя бы несколько слов.
Существование агрегатов в растворах детергентов было доказано
примерно в 1913 г. [40]. С тех пор о растворах коллоидных
электролитов написаны тома. В настоящее время установлено, что мицеллы
довольно однородны по размеру и состоят из 50—100 мономерных
молекул. Очень важные сведения о природе мицелл дает исследование
рассеяния света [41—43]. Этим способом найдено, в частности, что в
растворе кажущийся молекулярный вес таких поверхностно-активных
Смачивание, флотация и моющее действие
381
Сферическая
мицелла
•+
•+
•+
Рис. XI-15. Схематическое изображение сферической и пластинчатой мицелл.
веществ, как лаурилсульфат и додецилсульфат натрия, составляет от
12 000 до 40 000 г/моль, причем с увеличением ионной силы раствора
он растет.
Ценные сведения о свойствах коллоидных электролитов дают также
диффузионные исследования. В работах этого рода используется
способность растворов коллоидных электролитов к солюбилизации. Это
очень интересное свойство растворов детергентов заключается в том,
что при концентрациях выше ККМ в растворы переносятся
нерастворимые в обычных условиях органические молекулы, например бензол
и различные красители. Так, краситель оранжевый ОТ окрашивает
чистую воду очень слабо, однако в присутствии додецилсульфата натрия
он дает раствор темно-красного цвета. По-видимому, солюбилизованное
вещество внедряется в саму мицеллу, поскольку для получения такого
эффекта необходимо наличие мицелл. Справедливость такого
предположения подтверждай т и другие данные. Измеряя скорость диффузии
солюбилизованного красителя в гомогенном растворе детергента,
можно приблизительно оценить коэффициент самодиффузии мицелл. В
рассмотренном примере коэффициент самодиффузии составляет около
6-10-8 см2/с и уменьшается с ростом ионной силы [44, 45].
Если детергент является электролитом, то мицеллы обычно несут
определенный заряд. Это связано с тем, что агрегируются только длин-
ноцепочечные ионы, тогда как противоионы агрегатов не образуют.
Присутствие большого заряда на мицеллах проявляется, например, в их
злектрофоретической подвижности [46]. Правда, эффективный заряд
мицеллы ниже, чем заряд, соответствующий степени агрегации (т. е.
числу мономерных молекул), поскольку некоторая часть противоионов
связывается с мицеллой, по-видимому, образуя часть штерновского слоя
(см. разд. IV-3) [47]. Одновременные измерения самодиффузии и
злектрофоретической подвижности показывают, что типичная мицелла
состоит приблизительно из 100 мономерных молекул, тогда как ее
эффективный заряд соответствует 50—70 элементарным зарядам [48, 39].
Многие годы структура мицелл была предметом дискуссий и
ожесточенных споров между сторонниками Гартли [50], предложившего
сферическую модель мицеллы, и сторонниками Мак-Бэна [51],
считавшего, что существуют также и пластинчатые структуры. Обе модели
изображены на рис. XI-15. В значительной мере разногласия
исследователей были обусловлены различной интерпретацией данных по
дифракции рентгеновских лучей. Подробно эти вопросы рассмотрены в
работах указанных авторов [50, 51], а также в работе Гаркинса [52].
Полученные в настоящее время данные согласуются с предположением
о сферической форме мицелл [53, 54], и эта модель принимается
сейчас как основная. Теоретический анализ сил, определяющих образова-
Лластинчатая
мицелла
Вода-+
Ш1Ш
f-ffftff
Л11Ш
TTfflfT
ишл
382
Глава XI
Концентрация детергента
Рис. XI-16. Концентрации отдельных частиц в растворах коллоидного электролита [38]
ние мицелл, дается в работах Дебая [41, 45], Рейха [56] и Филлипса
[57]. Тэнфорд [58] предполагает, что мицеллы имеют эллиптическую
форму.
На рис. XI-16 показано фактическое изменение концентрации различных частиц
в зависимости от стехиометрической концентрации анионного детергента. Если
концентрация детергента выше ККМ, концентрация свободных R~-hohob уменьшается. С
увеличением общей концентрации детергента концентрация R~-hohob убывает, тогда как
концентрация противоионов, например Na+, возрастает. При этом активность
электролита, равная произведению активностей Na+ и R-, слегка повышается, а начиная
с ККМ, концентрация мицелл возрастает почти линейно. Исходя из очень точных
данных по проводимости [59], предполагают, что при концентрации ниже ККМ
образуется некоторое количество димеров. Однако более поздние электрохимические
измерения [60] показали, что на самом деле степень предассоциации значительно ниже.
Систему детергент—вода можно рассматривать и иначе [38]. На рис. XI-17
приведена качественная диаграмма состояния коллоидного электролита. Температура Tk,
соответствующая точке В, обозначает температуру Крафта; если T>Tk, растворимость
коллоидного электролита увеличивается очень быстро. Обратите внимание, что при
T<Tk увеличение концентрации коллоидного электролита приводит к осаждению
твердого мыла, а не к образованию мицелл. Это означает, что в таких условиях моющая
способность мыла не проявляется.
В ряде работ обращалось внимание и на другие свойства растворов коллоидных
электролитов. Так, авторы работ [61] исследовали зависимость ККМ от состава смеси
детергентов. Методом ЭСР (с использованием свободных радикалов нитроокиси в
качестве солюбилизованной спиновой метки) показана относительная внутренняя
жесткость мицеллы [62]. С помощью быстрых релаксационных методов (быстрое
смешивание в потоке, температурный скачок) найдено, что константа скорости диссоциации
мицелл — величина порядка 100 с-1 [63]. Спектры ЯМР дают значительно большую
<3
Ионы
Коллоидные частицы
а иены
/вердые кристаллы
и ионы
Концентрация
Рис. XI-17. Диаграмма состояния раствора коллоидного электролита [38].
Смачивание, флотация и моющее действие
383
скорость диссоциации мицелл [64]. Однако возможно, что данные ЯМР и результаты
кинетических измерений относятся к различным процессам.
В водных растворах коллоидные электролиты обычно описываются общей
формулой M+R-, где R~ — поверхностно-активный ион. Такие соли образуют мицеллы и
в неводных (и неполярных) растворителях. В присутствии некоторого количества воды
полярные группы молекул детергента обращены внутрь мицеллы. В почти безводной
среде структура мицелл чрезвычайно сложна (см. [65], а также гл. XII, разд. ХП-5,
посвященный мицеллярным эмульсиям).
Кроме ионных детергентов, известно множество неионных детергентов. Часто это
низкомолекулярные полимеры, обладающие полярной и неполярной частями. Такие
детергенты также образуют мицеллы и способны к солюбилизации (см. [66] и [67]).
В. Факторы, определяющие моющее действие
Поскольку хорошие детергенты обязательно образуют коллоиды,
можно предположить, что мицеллы должны оказывать
непосредственное влияние на моющее действие. Мак-Бэн [68], например, одним из
основных факторов моющего действия считал солюбилизацию. По его
мнению, жирные загрязнения включаются в мицеллы детергентов, так
же как солюбилизованные красители и другие органические
молекулы. Однако, как видно из рис. XI-14, с увеличением концентрации
детергента его моющая способность растет до момента достижения
области ККМ, а затем остается практически постоянной. Поскольку по
достижении области КММ концентрация мицелл непрерывно растет,
это означает, что прямая корреляция между концентрацией
детергента и его моющим действием отсутствует. Отсюда однозначно следует,
что моющая способность определяется наличием длинноцепочечных
мономерных ионов или молекул и очень вероятно, что те же свойства,
которые обусловливают хорошее моющее действие, способствуют и
образованию мицелл. Таким образом, процесс мицеллообразования
является скорее осложняющим, чем благоприятствующим, фактором.
При рассмотрении возможных механизмов моющего действия
прежде всего следует отметить несомненную важность схем,
представленных на рис. XI-12 и XI-13. В работе Адама и Стивенсона [69]
приведены очень удачные фотографии, показывающие, как при добавлении
в водный раствор цетилсульфата натрия пленки ланолина, прилипшие
к шерстяным нитям, «скатываются» в шарики, которые затем легко
отрываются от поверхности нити. Этот эффект можно объяснить
неуклонным уменьшением краевого угла на трехфазной границе масло—
вода—твердое тело (рис. XI-13) с увеличением концентрации мыла.
Как отмечается выше, такое изменение краевого угла должно быть
обусловлено уменьшением либо ywo или ysw, либо обоих вместе.
Согласно уравнению Гиббса (см. гл. II, разд. П-5), это означает, что
детергент должен адсорбироваться на соответствующих поверхностях
раздела. Мыла действительно адсорбируются на тканях [71—73], что
приводит к уменьшению ysw (см. разд. Х1-5Г). Совершенно очевидно,
что молекулы поверхностно-активных веществ адсорбируются и на
поверхности масло — вода (разд. Ш-13), в результате чего уменьшается
ywo- Таким образом, если ткань загрязнена жидкостью, то изменение
межфазного натяжения под действием детергента, по-видимому,
приводит к значительному уменьшению адгезии между грязью и тканью.
Следует отметить, что при обработке детергентами жиры могут
удаляться не только вследствие образования капелек, легко отрывающихся
от поверхности, но и в результате самопроизвольного
эмульгирования. В последнем случае жир переходит в раствор и перестает
существовать в виде отдельной фазы. В этой связи нельзя не упомянуть
работу Цетлмойера и др. [74], который исследовал вытеснение пленки воды
(поверхность раздела воздух — вода и вода — твердое тело) пленкой
масла (поверхности раздела воздух — масло и масло — твердое тело).
Как уже отмечалось, многие обычные загрязнения включают боль-
384
Глава XI
шие или меньшие количества жиров. Поэтому эффективность
детергентов определяется не только способностью отрывать жиры от
поверхности, но и способностью удерживать жиры после этого в растворе в
суспендированном состоянии и, таким образом, предотвращать их
повторное осаждение. Не будь этого, при мойке грязь не удалялась бы,
а перераспределялась. Следовательно, детергенты должны обладать
суспендирующей способностью. Так, суспензия сажи, быстро
осаждающаяся в обычных условиях, в присутствии детергента становится
абсолютно устойчивой. Подобным образом ведут себя и суспензии других
твердых веществ, например двуокиси марганца [75, 76]. Очевидно, что
детергент адсорбируется на поверхности раздела частица — раствор.
По-видимому, суспендирующее действие детергента в основном
обусловлено дефлокуляцией агрегированных частиц и отчасти изменением
их поверхностного заряда. Если не учитывать отталкивания
одноименно заряженных поверхностей, наличие адсорбированных длинноцепо-
чечных молекул предотвращает коалесценцию частиц, подобно тому
как граничная смазка устраняет непосредственный контакт трущихся
поверхностей (см. разд. Х-7Б). В моющие средства часто добавляют
карбоксиметилцеллюлозу, способствующую суспендированию жиров
[77]. Действие этого агента, по-видимому, также связано с адсорбцией
на поверхности частиц, однако более прочной, чем в случае
детергентов, поскольку полимерное вещество образует толстые трудно
отрываемые от поверхности адсорбированные пленки (см. разд. IX-2). Для
эффективного удаления с тканей твердых частиц хороший детергент
должен обладать также защитным действием, выражающимся в
предотвращении прилипания частиц к отмываемой поверхности.
Помимо различных поверхностно-активных веществ, в моющие
препараты нередко вводят вещества, сами по себе не обладающие
моющими свойствами, но усиливающие эффективность детергентов [78].
Типичным примером такого рода соединения является пирофосфат
\та4Р207. Влияние пирофосфата, по-видимому, отчасти объясняется
Смачивание, флотация и моющее действие
385
Равновесная концентрация, тль/л-103
Рис. XI-19 Изотерма адсорбции додецилбензолсульфоната натрия на хлопке [82].
связыванием катионов, обусловливающих жесткость воды [77]. Пиро-
фосфат натрия может, кроме того, оказывать влияние на
поверхностный заряд частиц [79]. Недостатком пирофосфата является его
сильное разложение в природной воде. Поэтому в последнее время
ведется поиск других веществ. Определенные успехи в этом направлении уже
достигнуты [80].
Очевидно, что эффективность моющего действия определяется
балансом сил, действующих в противоположном направлении [37]. С
одной стороны, загрязнение удерживается на поверхности либо под
действием сил поверхностного натяжения, либо в результате
механического захвата, а с другой стороны, в результате суспендирующего и
защитного действия детергента оно стремится перейти во взвешенное
состояние. По мнению Рейха [81], при обработке тканей растворами
детергентов перемешивание качественно играет такую же роль, как
температура в химической реакции.
Г. Адсорбция детергентов на тканях
Адсорбция молекул детергентов на тканях и поверхностях раздела твердое тело —
раствор обычно чрезвычайно сложна. Поэтому здесь этот вопрос можно рассмотреть
лишь очень кратко. На рис. XI-19 приведены характерные изотермы адсорбции
додецилбензолсульфоната натрия на хлопчатобумажной ткани [82]. Точка перегиба
соответствует резкому увеличению наклона кривой, после чего следует быстрый рост
адсорбции до некоторого максимального значения. Аналогичные данные получены Сали-
бом и Китченером [83] (см. также [70—72]) и позднее Мукерджи и Анавилом [84].
Если эти данные относятся к истинному равновесию и между раствором и
адсорбированной фазой не происходит перераспределения компонентов (разд. П-6Б), то
наличие максимума на изотермах адсорбции, по-видимому, трудно согласовать со вторым
законом термодинамики.
Удовлетворительного объяснения этому эффекту пока что не найдено. Скорее
всего дело здесь не в специфических свойствах адсорбента, а в природе веществ,
присутствующих в растворе. Так, изотермы адсорбции додецилбензолсульфоната
натрия на никеле совершенно аналогичны приведенным изотермам адсорбции этой
соли на хлопчатобумажной ткани. Мукерджи и Анавил [84] высказали заманчивое
предположение, что адсорбционный максимум обусловлен вытеснением мицелл
поверхностно-активного вещества с одноименно заряженных участков поверхности. Вообще
говоря, изотермы адсорбции поверхностно-активных веществ напоминают изотермы
адсорбции в бинарных системах (см., например, рис. IX-8). В целом проблема
адсорбции поверхностно-активных веществ заслуживает серьезного внимания.
25—1421
386
Глава XI
Д. Практическое применение детергентов
В принципе все детергенты делятся на три группы: анионные, катионные и
неионные. Первая группа обозначается общей формулой MR, где R —
поверхностно-активный анион. К этой группе соединений относятся обычные мыла (соли жирных кислот)
и огромное число синтетических детергентов, таких, как сульфаты и сульфонаты
(например, додецилбензолсульфонат натрия и лаурилсульфат натрия). К катионным
детергентам, общая формула которых RX, где R — поверхностно-активный катион,
относится множество длинноцепочечных солей четвертичного аммония, таких, как сапамины
(например, [(СН3)3—CCH = CH2NHCOCi6H33]ISOf-). Поверхностно-активные вещества
этого типа находят широкое применение при решении различных вопросов, связанных
со смачиванием: гидрофобизация поверхностей, образование и разрушение эмульсий,
диспергирование чернил и т. д.
Хотя неионные детергенты, как следует уже из их названия, и не являются
электролитами, в их молекулах, как и в молекулах других детергентов, имеются и полярные
и неполярные группы. К неионным детергентам относятся, например, такие соединения,
как
RCO (OCH2CH2) *СН2СН2ОН, RC6H5 (OCH2CH2) *СН2СН2ОН
и RCON[(OCH2CH2)^OH]2.
Они успешно конкурируют с малыми и синтетическими анионными детергентами и
широко применяются в быту, например для мойки окон и стекол автомашин (не
полностью смываемый детергент при высушивании образует тонкую пленку,
способствующую стеканию капель), в качестве инсектицидов и как детергенты, предназначенные
для автоматических стиральных машин.
В последние годы в результате широкого применения детергентов появилась
опасность накопления огромных количеств пены в прудах орошения и реках, в которые
детергенты сбрасываются после использования. В связи с этим возникла проблема
контроля пенообразующего действия детергентов (к производству рекомендуются
моющие средства с не слишком высокой пенообразующей способностью и содержащие
диспергаторы пены) и способности детергентов к биологическому разложению. Вообще
говоря, мыла и неразветвленные сульфаты разлагаются довольно легко, и реки могут
самоочищаться от них. Такие детергенты представляют минимальную опасность для
фауны. В то же время следует избегать применения детергентов, содержащих
ароматические группы и разветвленные цепи.
6. Упражнения
1. Иногда говорят об «отрицательном поверхностном натяжении». При этом
имеют в виду следующее: при добавлении поверхностно-активного вещества
межфазное натяжение я, например на границе вода—воздух или вода—масло, может
превышать первоначальное поверхностное натяжение. Обсудите а) свойства системы с
отрицательным поверхностным натяжением и решите, б) каким способом можно
экспериментально оценить величину отрицательного поверхностного натяжения.
2. Ниже приведена таблица, в которой показано, как меняется межфазное
натяжение в некоторых реальных системах. Каждая строчка соответствует отдельной
системе. В перечисленных системах могут осуществляться не все из указанных типов
взаимодействий, причем не все эти взаимодействия можно контролировать
непосредственно.
Для каждой системы показано, как нужно изменить соответствующее межфазное
натяжение, чтобы можно было решить конкретную практическую задачу, например
улучшить смачиваемость, моющую способность и т. д. Знаки плюс и минус показывают,
что введение поверхностно-активного вещества должно приводить к увеличению или
соответственно уменьшению поверхностного натяжения.
Каким реальным системам могут соответствовать системы, включенные в таблицу,
и почему поверхностные натяжения желательно менять в указанных направлениях?
Системы у§д
а
б —
в
г
Примечание: 5 —твердое тело, Л — воздух, W — вода или водный раствор, О — масло
или органическая водонерастворимая фаза.
3. Из шерстяных нитей диаметром 20 мкм и плотностью 1,3 г/см3 изготовлена
ткань плотностью 0,8 г/см3. Угол натекания воды для отдельной нити составляет 120°.
Рассчитайте при разумных допущениях а) краевой угол воды на ткани и б)
максимальную толщину слоя воды, удерживаемого тканью.
ysw
+
vso
+
yow
yWA
Смачивание, флотация и моющее действие
3S7
4. Темпельтон [8] измерял скорость вытеснения воды маслом (w-цетан) в
капилляре диаметром 30 мкм, предварительно смоченном водой. Длина капилляра составляла
10 см, а движущая сила соответствовала напору столба воды высотой 45 см. Когда
мениск находился на расстоянии 2 см от «масляного» конца капилляра, скорость
движения мениска равнялась 3,6-Ю-2 см/с. После смещения мениска на 6 см его скорость
понизилась до ЫО-2 см/с. Вода смачивает капилляр, межфазное натяжение на
поверхности раздела вода—масло равно 30 дн/см.
Рассчитайте кажущиеся вязкости масла и воды. Предполагая, что вязкости
жидкостей в капилляре равны 0,9 их объемной вязкости, оцените толщину неподвижной
кольцевой пленки жидкости в капилляре.
5. Рассчитайте AGi, AG2 и №Практ (см. разд. XI-4A) для пузырька, находящегося
в такой системе, для которой WSl=2S эрг/см2 и уь = 35 эрг/см2. Рассчитайте также
AGia, свободную энергию адгезии пузырька радиусом 0,2 см в полусферическом
углублении поверхности.
6. По данным Фюрстенау и др., при Ю-3 М концентрации длинноцепочечных
аммониевых ионов RNH3 на поверхности кварца адсорбируется шесть десятых
монослоя; при этом С-потенциал равен нулю. При Ю-5 М концентрации RNHJT ^-потенциал
составляет —60 мВ. Принимая простую штерновскую модель, рассчитайте заполнение
поверхности в последнем случае.
/ Поскольку краевой угол пропорционален ysv — \sl, введение в систему
поверхностно-активного вещества, адсорбирующегося на поверхности раздела твердое
тело—раствор, должно приводить к уменьшению ysL и, следовательно, к увеличению
разности ysv—ysL и снижению 0. И все же добавки поверхностно-активных веществ
при флотации вызывают увеличение 6. Следовательно, исходное утверждение неверно.
В чем заключается ошибка?
8. Что важнее для адгезии пузырьков при флотации: угол натекания или угол
оттекания? Дайте подробное объяснение.
9. В разд. Х1-5Г утверждается, что положение максимума на изотерме адсорбции,
приведенной на рис. XI-19, противоречит второму закону термодинамики. Докажите
справедливость этого утверждения. Сконструируйте «вечный двигатель», основанный
на этом эффекте.
10. Образование мицелл можно рассматривать как химическую реакцию, например
40Na+ -1- «OR" = (Na40R80)4°-,
подчиняющуюся закону действия масс. Для додецилбензолсульфоната ККМ составляет
около Ю-3 М при 25 °С. Рассчитайте К для приведенной реакции, предположив, что
единственным процессом является мицеллообразование. Постройте зависимости,
аналогичные приведенным на рис. XI-16. Включите в графики соответствующую кривую для
произведения [Na+][R-]. Примечание. Прежде чем начать расчеты, хорошенько
обдумайте задачу.
11. Утверждается, что способность загрязняющих ткань частиц повторно
адсорбироваться на ткани в определенной степени зависит от заряда поверхностей раздела
твердое тело—жидкость для частиц и ткани. Какими экспериментами можно проверить
это утверждение?
12. Известно, что некоторое вещество, понижающее поверхностное натяжение
воды, адсорбируется на поверхности раздела масло—вода, но не адсорбируется в
заметной степени на поверхности раздела вода—ткань. Можно ли этот детергент
использовать для /) гидрофобизации ткани или 2) стирки ткани?
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Fowkes F. M., Solvent Properties of Surfactant Molecules, Shinoda K-, ed., Marcel Dek-
ker, New York, 1967.
Fuerstenau D. W., Pure and Applied Chemistry, 24, 135 (1970).
Годэн A. M., Флотация, М., Металлургиздат, 1959.
Harris J. C, Detergency Evaluation and Testing, Interscience, New York, 1954.
Moilliet /. L., Collie В., Black W.f Surface Activity, E. and Spon F. N., London. 1961.
Niven W. W., Jr., Industrial Detergency, Reinhold, New York, 1955.
Rosen M. J., Goldsmith H. A, Systematic Analysis of Surface-Active Agents, Wiley-In-
terscience, New York, 1972.
Шварц Л. М., Перри Дж., Берч Дж., Поверхностно-активные вещества и моющие
средства, М., ИЛ, 1960.
Jungermann Е., Cationic Surfactants, Marcel Dekker, Inc., New York, 1970.
Surface Activity and Detergency, Durham K., ed., Macmillan, New York, 1961.
Sutherland K. L., Wark L. W., Principles of Flotation, Australasian Institute of Mining
and Metallurgy, Melbourne, 1955.
Waterproofing and Water Repellency, Moiliet J. L., ed., Elsevier, New York, 1963.
25*
388
Глава XI
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Young С. В. F., Coons К. W., Surface Active Agents, Chemical Publishing Company,
New York, 1945
2. Schwartz A. M., Perry J. W., Surface Active Agents, Interscience, New York,
1949
3 Walker P. L., Peterson E. E., Wright С. С, Ind. Eng. Chem., 44, 2389 (1952)
4. Dervichian D. G., Lachampt F., Bull. Soc. Chim. (France), 1951, 289.
5. Washburn E. W., Phys. Rev, Ser. 2, 17, 273 (1921).
6. Szekely J, Newmann A. W.f Chuang Y. K., J. Colloid Interface Sci, 35, 273 (1971).
7. Good R. J, J. Colloid Interface Sci., 42, 473 (1973).
8. Templeton C. C., Rushing S. S., Jr., J Petrol. Technol., September 1956.
9. Elliott G. E. P., Riddiford A. C., Nature, 195, 795 (1962); Haynes M.t Blake Т.,
private communication.
10. Gogarty W. В., Surkalo H., J. Petrol. Technol., 24, 1161 (1972) and references
therein.
11. Melrose /. C, Can. J. Chem. Eng., 48, 638 (1970).
12. Moilliet J. L, ed., Water Proofing and Water Repellency, Elsevier, New York,
1963.
13. Dron R. P., Advances in Chemistry Series No. 43, American Chemical Society,
Washington, D. C, 1964, p. 310.
14 Sebba F., Chem. Ind., p. 1157 (1971).
15. Flemming M. G., Kitchener /. A., Endeavor, 24, 101 (1965)
16. Leja J., Chemistry in Canada, April 1966, p. 2; J. Chem. Ed., 49, 157 (1972).
17. Leja /., Poling G. W., Preprint, International Mineral Processing Congress, London,
April 1960.
18. Классен В. И, Мокроусов В. А., Введение в теорию флотации, М., Металлургиздат,
1959.
J9. Годэн А. М., Флотация, М., Металлургиздат, 1959.
20. Frankel S. P., My sets К. J., J. Phys. Chem , 66, 190 (1962).
21 Taggart A. F., Handbook of Ore Dressing, Wiley, New York, 1945.
22. Gaudin A. M.f Flotation, McGraw-Hill, New York, 1932.
23. Sutherland K. L., J. Phys. Colloid Chem., 52, 394 (1948).
24. Poling G. W.f Leja /., J. Phys. Chem., 67, 2121 (1963).
25. Guarnaschelli C, Leja J., Separation Sci., 1 (4), 413 (1966).
26 Gaudin A. M., J. Colloid Interface Sci., 47, 309 (1974).
27. Scowen R. V., Leja /., Can. J. Chem., 45, 2829 (1967).
28. Gaudin A. M., Sun S. C, AIME, Tech. Pub. 2005, May 1946.
29. Schulman J. #., Leja /., Kolloid-Z., 136, 107 (1954).
30 Sutherland K. L., Wark I. W., Principles of Flotation, Australasian Institute of
Mining and Metallurgy, Melbourne, 1955.
31. Fuerstenau D. W., Fuerstenau M. C., Mining Eng., March 1956.
32. Apian F. F., Fuerstenau D. W., Froth Flotation, 50th Anniversary Volume,
Fuerstenau D. W., ed., American Institute of Mining and Metallurgical Engineering, New
York, 1962.
33. Gaudin A. M., Fuerstenau D. W., Mininig Eng., October 1955.
34. (a) Fuerstenau D. W., Healy T. W., Adsorptive Bubble Separation Techniques,
Academic Press, 1971, p. 92. (.6) Fuerstenau D. W., Pure Appl. Chem., 24, 135 (1970).
35. Rose M. W., Sebba F., J. Applied Chem., 19, 185 (1969).
36. Snell F. D., Snell С. Т., Reich L, J. Amer. Oil Chem. Soc, 27, 1 (1950).
37. Schwartz A. M., Surface and Colloid Science, Matijevic E., ed., Wiley-Interscience,
1972, p. 195.
38. Preston W. C., J. Phys. Colloid Chem., 52, 84 (1948).
39. Williams R. J., Phillips /. N., Mysels K. J., Trans. Faraday Soc, 51, 728 (1955).
40 McBain J. W., Trans. Faraday Soc, 9, 99 (1913).
41. Debye P., J. Phys. Colloid Chem., 53, 1 (1949).
42. Mysels K. /., Princen L. H., J. Phys. Chem., 63, 1696 (1959).
43. Huisman H. F., Koninkl. Nederl. Akademie Van Wetenschappen-Amsterdam,
Proceedings Series B, 67, 367 (1964).
44. Stigter D., Williams R. J., Mysels K. L, J. Phys. Chem., 59, 330 (1955).
45. Clifford J., Pethica B. A., J. Phys. Chem., 70, 3345 (1966).
46 Stigter D., Rec Trav. Chim., 73, 593 (1954).
47. Stigter D., J. Phys. Chem., 68, 3603 (1964).
48 Brady A. P., Salley D. /., J. Amer. Chem. Soc, 70, 914 (1948).
49. Mysels /C. /., Dulin C. /., J. Colloid Sci., 10, 461 (1955).
50. Hartley G. S., Aqueous Solutions of Paraffin-Chain Salts, Hermann et Cie, Paris,
1936.
51. Colloid Chemistry, Theoretical and Applied, Reinhold, New York, 1944; см. также
работу [38].
52 Harkins W. D., The Physical Chemistry of Surface Films, Reinhold, New York,
1952.
53 Hartley G. S., Ann. Rept. Progr. Chem. (Chem. Soc. London), 45 (1948), 33.
Смачивание, флотация и моющее действие
389
54. Pethica В. А., Ргос. 3rd Intern. Congr. Surface Activity, Vol. I, 1960, p. 212.
55. Debye P., Ann. N. Y. Acad. Sci., 51, 573 (1949).
56. Reich L, J. Phys. Chem., 60, 257 (1956).
57. Phillips J. N., Trans. Faraday Soc, 51, 561 (1955).
58. Tanford C, J. Phys. Chem., 78, 2469 (1974).
59. Mukerjee P., Mysels K. J., Dulin C. /., J. Phys. Chem, 62, 1930 (1958).
60. van Voorst Vader F., Trans. Faraday Soc, 57, 110 (1961)
61. Lange H.y Beck К. H., Kolloid-Z. Z.-Polymere, 251, 424 (1973).
62. Povich M. J., Mann J. A., Kawamoto A., J. Colloid Interface Sci., 41, 145 (1972).
63. Colen A. H., J. Phys. Chem., 78, 1676 (1974).
64. Muller N., J. Phys. Chem., 76, 3017 (1972).
65. Muller N., J. Phys. Chem., 79, 287 (1975).
66. Schwuger M. J., Kolloid-Z. Z.-Polymere, 240, 872 (1970).
67. Fowkes F. M., Solvent Properties of Surfactant Solutions, Shinoda К, ed , Marcel
Dekker, New York, 1967.
68. Advances in Colloid Science, Vol. I, Interscience, New York, 1942.
69. Adam N. /(., Stevenson D. G., Endeavour, 12, 25 (1953).
70. McDonnell F. R. M., Proc. 3rd Intern. Congr. Surface Activity, Vol. Ill, 1960,
p. 251.
71. Griffith J. G., Proc. 3rd Intern. Congr. Surface Activity, Vol. IV, 1960, p. 28.
72. Schwartz W. J., Martin A. R.t Rutkowski B. J., Davis R. C, Proc. 3rd Intern. Congr.
Surface Activity, Vol. IV, 1960, p. 37.
73. Meader A. L., Jr., Fries B. A., Ind. Eng. Chem., 44, 1636 (1952)
74. Wilkinson M. C, Aronson M. P., Zettlemoyer A. C., J. Colloid Interface Sci, 37, 498
(1971).
75. McBain J. W.f Harborne R. S., King A. M., J. Soc. Chem. Ind., 42, 373T (1923).
76. Greiner L.} Void R. D., J. Phys. Colloid Chem., 53, 67 (1949).
77. Moilliet J. L., Collie В., Black W.f Surface Activity, E. and F. N. Spon, London,
1961.
78. Durham K., ed., Surface Activity and Detergency, Macmillan, New York, 1961.
79. Durham K-, Proc. 2nd Intern. Congr. Surface Activity, Vol. IV, 1957, p. 60.
80. Krings P., Schwuger M. J., Krauch С. И., Naturwissenschaften, 61, 75 (1974);
Perth P., Jakobi G., Schmadel E., Schwuger M. J., Krauch C. H., Angewandte Chemie,
87, 115 (1975).
81. Reich I., Void R. D.f J. Phys. Chem., 63, 1497 (1959).
82. Fava A., Eyring H.f J. Phys. Chem., 60, 890 (1956).
83. Saleeb F. Z., Kitchener J. A., J. Chem. Soc, 1965, 911.
84. Mukerjee P., Anavil A., Adsorption at Interfaces, Mittal K. L., ed , ACS Symposium
Series, Vol. 8, Washington, D. C, 1975, p. 107.
ГЛАВА XII
Эмульсии и пены
1. Введение
Эта глава, как и посвященная проблемам гетерогенного катализа
гл. XV, представляет собой лишь краткое введение в некоторые
специальные области применения физической химии поверхностей.
Проблемы, затрагиваемые здесь, имеют важное технологическое значение, что
отражается в огромном потоке научно-технической литературы. Как и
ранее, в этой главе обсуждаются только самые основные вопросы,
непосредственно связанные с химией поверхностей.
Эмульсии и пены рассматриваются в одной главе, поскольку в обоих
случаях система содержит две частично смешивающиеся подвижные
фазы и, как правило, поверхностно-активное вещество. И эмульсии,
и пены представляют собой дисперсию одной фазы в другой. Если обе
фазы жидкие, система называется эмульсией, если же одна из фаз
газообразная, то мы имеем дело с пеной (или аэрозолем). В обоих
случаях дисперсная фаза состоит из относительно крупных частиц, т. е.
размер капелек и пузырьков газа, как правило, превышает несколько
десятых микрона. Обычно рассматриваемые системы нестабильны и
могут делиться на две фазы, т. е. расслаиваться, если речь идет об
эмульсии, или разрушаться, если рассматривается пена. Стабильность
пен и эмульсий в значительной мере определяется их зарядом и
наличием на поверхности раздела фаз пленок поверхностно-активных
веществ. Эмульсии и пены несколько отличаются от коллоидов, хотя
резкую границу между ними провести трудно. Так, обычные кремы
представляют собой эмульсию масла в воде, а масляный гидрозоль — очень
тонкая суспензия капелек масла в воде, получаемая путем
конденсации паров масла, — фактически является коллоидом. В гидрозоле на
долю масла приходится лишь небольшая часть объема системы, и
частицы масла настолько малы, что обычной тепловой конвекции
достаточно для предотвращения их осаждения. В кремах, пастах и пенах на
долю дисперсной фазы приходится уже значительная часть общего
объема системы. Расслаивание и разрушение таких систем
предотвращается наличием пленок, адсорбированных на поверхностях раздела
фаз, или действием сил электрического отталкивания. Кроме того,
возможно также самопроизвольное эмульгирование и образование
эмульсий, в которых размер капелек сравним с размером мицелл
детергентов.
2. Общие свойства эмульсий
Эмульсией называется дисперсная система, в которой частицы
одной жидкой фазы распределены в другой жидкой фазе. Как правило,
одна из фаз эмульсии — вода, другая фаза — водонерастворимая
жидкость, называемая в общем случае «маслом». В соответствии с этим
существует два основных типа эмульсий — дисперсии масла в воде
(М/В) и дисперсии воды в масле (В/М).
Эмульсии и пены
391
Оба типа эмульсий изображены на рис. ХИ-1. Одна из фаз
эмульсии («внешняя») является непрерывной, а другая («внутренняя»)
образована отдельными частицами. К какому типу относится эмульсия,
обычно установить не так уж трудно — любой эксперт может
определить это на ощупь. Более объективный метод — добавление к эмульсии
некоторого количества одной из жидких фаз. При этом эмульсия
легко разбавляется, если добавляемая жидкость представляет собой
внешнюю фазу. Для определения типа эмульсии в систему можно
вводить и какой-либо краситель, растворимый только в одной из фаз.
Если краситель растворим во внешней фазе, то эмульсия быстро
окрашивается им. Наконец, эмульсии типа М/В характеризуются значительно
большей электропроводностью, чем эмульсии типа В/М.
Помимо химического состава, одна из основных характеристик
эмульсии — отношение объема внутренней фазы к объему внешней
фазы (ф). Как отмечается в разд. ХП-4В, упаковка шаров плотнейшая
при ср, равном 0.74. В более разбавленных эмульсиях внутренняя фаза
действительно существует в виде сферических частиц. Влияние ф на
вязкость системы, состоящей из жестких сферических частиц,
определяется предельным законом Эйнштейна [1]:
т|=Ло(1 + 2,5ф). (ХИ-1)
При ф выше 0,02 наблюдаются отклонения от этого закона.
Полуэмпирически вязкость эмульсий в широком диапазоне ф можно описать,
заменив выражения в скобках соответствующим степенным рядом. Бехер
[2] и Шерман [3] выражают вязкость с помощью общего уравнения
Ппр=Л/Ло -1 =аф + 6ф2 + сф3..., (ХИ-2)
где т]Пр — приведенная вязкость. Шерман [3] табулировал
эмпирические значения постоянных а, Ь и с для ряда систем. Расчетные
значения Ъ обычно находятся в диапазоне от 3 до 6 (см. упражнение ХП-3).
Капельки эмульсий обычно не обладают заметной жесткостью; это
учитывается в теоретическом уравнении Тэйлора [4]
Л=т|в{1+2,5ф[(р+4-)/(Р+1)]}. (ХШ-3)
где р — отношение вязкостей внутренней и внешней фаз. Более
концентрированные эмульсии относятся к неньютоновским жидкостям, и
поэтому их вязкость зависит от скорости сдвига. Кроме того, ц
зависит не только от ф, но и от среднего размера и распределения
размеров капелек эмульсии [5]. Обычными микроскопическими методами
распределение размеров капелек определить с достаточной точностью
трудно. Чаще всего эмульсию характеризуют средним размером или
числом (концентрацией) капелек п.
Важными физическими свойствами эмульсий являются также их
электропроводность и диэлектрическая проницаемость (эмульсии
В/М), а также электрофоретическая подвижность диспергированной
фазы. Динамическое и кинетическое поведение эмульсий определяется
Рис. XII-1 Два типа эмульсий: эмульсия масла
в воде, М/В (а) и эмульсия воды в масле,
В/М (б). а
392
Глава XII
влиянием скорости сдвига на их вязкость (тиксотропия и реопексия,
или обратная тиксотропия), скоростью уменьшения п во времени (коа-
лесценция или агрегация) и скоростью расслоения (например, молока)
на две эмульсии — более концентрированную и более разбавленную.
Локальные физические свойства эмульсий исследуют, изучая их
диэлектрическую релаксацию, спектры ядерного магнитного резонанса
[6] и инфракрасные спектры. Эти методы дают сведения о составе
межфазной области в зависимости от состава обеих фаз. Размеры и
распределение по размерам очень маленьких капелек или мицелл
определяют по рассеянию света и дифракции рентгеновских лучей под
малыми углами [8]. Довольно точным методом исследования формы
капелек эмульсий и распределения их по размерам является
сканирующая электронная микроскопия [8а].
Этот краткий перечень экспериментальных методов, применяемых
для изучения эмульсий, показывает, насколько сложны эти системы, и
в то же время демонстрирует, каким богатым выбором методов
располагает исследователь. Далее мы рассмотрим лишь некоторые
наиболее существенные свойства эмульсий.
3. Факторы, определяющие устойчивость эмульсий
Энергичное перемешивание двух чистых несмешивающихся
жидкостей, например бензола и воды, приводит к образованию дисперсии.
Однако в такой системе ни одну из фаз однозначно нельзя определить
как, внешнюю или внутреннюю. После прекращения перемешивания
фазы разделяются настолько быстро, что такую систему вряд ли
можно назвать эмульсией. По-видимому, относительно устойчивой
суспензией одной чистой жидкости в другой является только гидрозоль
масла. Как уже отмечалось, такие системы следует относить к коллоидам,
а не к эмульсиям.
Чтобы получить устойчивую или достаточно устойчивую эмульсию,
если только речь идет не о гидрозоле масла, в систему всегда
необходимо вводить поверхностно-активное вещество. Так, если в систему
бензол — вода ввести немного мыла, то в результате получается
истинная эмульсия, которая расслаивается крайне медленно. Теоретически
устойчивость эмульсий определяется, во-первых, природой межфазных
пленок, что, вообще говоря, вполне очевидно, во-вторых, механизмом
действия этих пленок, предотвращающим коалесценцию капелек.
А. Макроскопические теории стабилизации эмульсий
Вполне понятно, что, поскольку для эмульсий характерна большая
удельная поверхность раздела фаз, любое уменьшение межфазного
поверхностного натяжения должно снижать стремление системы к коалес-
ценции и увеличивать ее стабильность. Этим, собственно, и объясняется
в свете законов термодинамики роль эмульгирующих агентов. В
качестве примера рассмотрим систему парафиновое масло — вода [9]. Для
чистых жидкостей межфазное натяжение в этой системе составляет
41 дн/см. При добавлении к водной фазе олеиновой кислоты до
концентрации 0,001 М натяжение уменьшается до 31 дн/см. В этих
условиях уже можно получить достаточно устойчивую эмульсию.
Нейтрализация эмульсии 0,001 М гидроокисью натрия вызывает снижение
поверхностного натяжения до 7,2 дн/см. Если же в эмульсию ввести
хлорид натрия (до концентрации 0,001 М), то межфазное натяжение
становится ниже 0,01 дн/см. При замене парафинового масла на
оливковое конечное значение межфазного поверхностного натяжения
составляет 0,002 дн/см. В последней системе наблюдается самопроизволь-
Эмульсии и пены
393
ное эмульгирование, т. е. если к водной фазе добавить масло,
эмульгирование происходит и без перемешивания.
Более простой пример — две частично смешивающиеся жидкости
при критической температуре смешиваемости, при которой межфазное
поверхностное натяжение между двумя жидкостями стремится к нулю
[10]. Если раствор охладить до температуры чуть ниже критической,
то наблюдается опалесценция. Такой раствор можно рассматривать
как эмульсию, образование которой обусловлено очень низким
поверхностным натяжением.
Если исходить из того, что поверхностная энергия двухфазной
системы должна быть минимальной, то приходится принять, что в
стабильной однородной эмульсии объемная доля внутренней фазы не должна
превышать 0,74 (см. упражнение ХП-2). На самом же деле
существуют довольно стабильные эмульсии с объемной долей внутренней фазы
вплоть до 99%. Дело в том, что в реальных эмульсиях внутренняя
фаза состоит из сферических частиц с довольно широким диапазоном
размеров [11]. Таким образом, реальные системы находятся в мета-
стабильном равновесии, устойчивость которого определяется не
минимумом полной свободной энергии, а иными факторами.
При рассмотрении эмульсионных систем обычно приходится
прибегать к различным моделям. Так, например, тип эмульсии, образуемой
при смешивании соответствующих компонентов, можно довольно
надежно определить, проанализировав межфазные натяжения в
исследуемой системе. Банкрофт [12] и Клаус [13] предполагают, что пленка
поверхностно-активного вещества, стабилизирующего эмульсию, по
своей природе является дуплексной и, таким образом, натяжение
внутренней и внешней поверхностей пленки различно. Следовательно, тип
образуемой эмульсии (В/М или М/В) должен быть таким, чтобы
внутренняя поверхность характеризовалась высоким межфазным
натяжением. Так, натриевые соли жирных кислот и аналогичные соли других
щелочных металлов должны способствовать стабилизации эмульсий
типа М/В. Это объясняется тем, что такие соли больше растворимы в
воде, чем в масле, и поэтому межфазное натяжение на границе
пленка— вода должно быть ниже, чем на границе пленка — масло. И
наоборот, при введении в систему таких поверхностно-активных веществ,
которые более растворимы в масле, а не в воде, должны
стабилизоваться эмульсии типа В/М, что действительно наблюдается на
практике.
Модель дуплексной пленки в какой-то мере включает в себя более
механистическую модель «ориентированных клиньев» [14], одно время
получившую широкое распространение. Стабильные пленки должны
быть ориентированы таким образом, чтобы полярные группы
находились в водной фазе. Согласно модели «ориентированных клиньев»,
молекулы поверхностно-активных веществ имеют клиновидную, или
коническую, форму и стабилизуют тот тип эмульсий, в котором такие
конусы ориентированы основанием наружу, т. е. во внешнюю фазу. Так,
в натриевых мылах карбоксильная группа аниона образует основание
конуса и поэтому должна быть обращена наружу. Естественно, что в
этом случае должна стабилизоваться эмульсия типа М/В. В то же
время полярные части молекул цинковых солей жирных кислот,
связывающие две карбоксильные группы, уже двух углеводородных цепей,
образующих второй конец молекулы. Такие соли должны
стабилизовать эмульсии типа В/М.
В то время как теория ориентированных клиньев слишком
примитивна для широкого использования, модель дуплексной пленки, если от
нее не требовать слишком многого, может быть весьма полезна при
рассмотрении самых разнообразных систем. Для простых
поверхностно-активных веществ, когда межфазная пленка является мономолеку-
394
Глава XII
Рис. ХГГ-2. Стерические эффекты при проникании цетилового и олеинового спиртов
в монослои цетилсульфата натрия
лярной, а не дуплексной, эта качественная модель дает примерно
такие же результаты, как и лэнгмюровский принцип независимого
поверхностного действия (см. гл. II, разд. И-3). Модель дуплексной
пленки дает рациональное объяснение роли двойных электрических
слоев на обеих сторонах поверхности раздела и согласуется с
эмпирическими правилами аддитивности, например с системой ГЛБ
(разд. ХП-6).
Б. Специфические и химические структурные факторы
Роль энергетических и кинетических факторов, определяющих
образование пленок, по-видимому, наиболее важна в тех случаях, когда в
системе имеется более двух растворенных поверхностно-активных
веществ, поскольку в таких системах наблюдается эффект пенетрации
монослоев или образования поверхностных комплексов (см. гл. III,
разд. III-8). Шульман и др. [16, 17] отмечают, в частности, что
эмульсии особенно устойчивы, если адсорбированная пленка поверхностно-
активного вещества образует прочные поверхностные комплексы с
частицами масляной фазы. Так, Шульман и Штенхаген [16] обнаружили
возможность получения великолепных эмульсий типа М/В при
диспергировании раствора холестерина в нуйоле и водного раствора цетил-
фосфата натрия. Позднее Шульман и Кокбэйн [17] показали, что
чистый холестерин в воде не дает никаких эмульсий, а в присутствии
цетилфосфата натрия образует неустойчивую эмульсию.
Стабилизующее влияние смешанных пленок может объясняться как очень низкой
скоростью десорбции (см. гл. XI, разд. Х1-4Б), так и поверхностной
вязкостью таких пленок.
При образовании проникающих комплексов важную роль играют
стерические факторы. Это проявляется, например, при замене
стабилизующей смеси цетилсульфат натрия — цетиловый спирт на смесь це-
тилсульфат натрия — олеиновый спирт. В первом случае образуется
превосходная эмульсия (фактически крем), а во втором — очень плохая
эмульсия. Как видно из рис. XI1-2, ухудшение эмульгирующей
способности стабилизующей смеси в присутствии олеинового спирта может
быть обусловлено трудностью включения изогнутой цепи олеинового
спирта в пленку. Авторы [17] отмечают, что в общем случае
межфазная пленка должна находиться в состоянии двумерной
конденсированной жидкости (но не в твердом состоянии), чтобы жесткость
поверхности не была слишком велика.
Адсорбированные пленки играют чрезвычайно важную роль в
механизме предотвращения коалесценции капелек внутренней фазы. Коалес-
ценция происходит в две последовательные стадии. Сначала капельки
Эмульсии и пены
395
должны прижаться друг к другу, чтобы преодолеть сопротивление
адсорбированных пленок, подобное сопротивлению граничных смазок при
контакте твердых поверхностей (гл. X, разд. Х-7Б). Затем, если
капельки сольются, из поверхностного слоя должно освободиться некоторое
количество поверхностно-активного вещества. Как указывает Алек-
сандер [18], при коалесценции частиц эмульсии наиболее замедленной
может быть стадия десорбции. Вторая стадия может быть
замедленной и вследствие того, что освобождающееся поверхностно-активное
вещество образует твердую фазу в виде нитей или кристаллов.
Выделение твердой фазы наблюдается, например, в пленках солей жирных
кислот и поливалентных металлов, а также в эмульсиях,
стабилизованных белками.
В отношении эмульсий последнего типа следует отметить, что, хотя белки, глю-
козиды, стерины и т. д. обычно хорошо растворимы в воде, тем не менее они часто
способны эффективно стабилизовать эмульсии (и пены). По данным Беркмана и Иглоффа
[19], стабилизующее действие природных соединений на эмульсию бензол — вода
уменьшается в ряду агар, сапонин, альбумин, пектин, желатин, лецитин и казеин.
Как отмечалось в гл. III, разд. III-12, при растекании белков на поверхностях
раздела вода — воздух и вода — масло образуются прочные, но довольно аморфные и
вязкие пленки, структура которых не вполне соответствует структуре природных
белков. Вследствие растекания по поверхности раздела различных боковых цепей
белковые молекулы в пленке частично денатурированы. После выхода на поверхность
молекулы белков и других сложных природных соединений не могут вернуться в раствор
Если каплю такого раствора механически раздробить и затем снова скатать в шарик,
материал пленки не возвращается в раствор, а собирается на поверхности либо
утолщая ее, либо образуя складки типа пленки на молоке. Это же явление наблюдается и
при коалесценции капель. Процессами такого рода объясняется образование довольно
толстых пленок или мембран в эмульсиях, стабилизованных биологическими
веществами (см., например, [11]). Кокбэйн и Мак-Робетс [20] отмечают также, что по
преимущественной смачиваемости пленок одной или другой фазой можно определить тип
эмульсии.
В. Роль дальнодействующих сил в стабилизации эмульсий
Разрушение эмульсий, по всей видимости, протекает в две стадии:
на стадии флоккуляции образуются скопления капелек эмульсии, а на
стадии коалесценции их число уменьшается [21, 22]. Как уже
отмечалось, скорость коалесценции определяется главным образом силами
отталкивания между пленками на поверхности капелек и степенью
необратимости десорбции пленок. В результате центрифугирования
эмульсий при достаточно высоком ускорении образуется плотная
полиэдрическая структура, аналогичная структуре пен [22, 23] (см. разд. ХП-8).
В этом случае механизм коалесценции примерно такой же, как и при
разрушении пен.
В то же время на флоккуляцию должны оказывать влияние даль-
нодействующие силы, проявляющиеся при сближении капелек.
Прежде всего следует отметить, что капельки масла в эмульсиях типа
масло— вода обычно заряжены отрицательно; для примера на рис. ХП-3
приведена зависимость подвижности частиц в системе нуйол — вода от
концентрации поверхностно-активного вещества [24]. Ход изменения
потенциала вблизи поверхности раздела масло — вода показан на
рис. ХП-4, взятом из работы [25]. На этом рисунке AV представляет
собой разность поверхностных потенциалов между двумя фазами, % —
скачок поверхностного потенциала (см. гл. IV, разд IV-11). Если в
системе имеется электролит, то растворимость катионов и анионов в
обеих фазах, вообще говоря, различна. Обычно в масле анионы
растворимы несколько больше, чем катионы, и поэтому (рис. ХП-4, б)
капельки должны нести отрицательный заряд.
По мнению Чисмэна- и Кинга [26], отталкивание между
капельками масла должно тем эффективнее предотвращать флоккуляцию, чем
больше толщина диффузного слоя и чем выше поверхностный
потенциал if>0. Однако эти две величины по-разному зависят от концентрации
396
Глава XII
10
3
t
t
J
2\-
Аэрозоль ОТ
2.5°C
Подвижность,
_L
30
1
20 I
I
10 §
I
0.3
0 0,1 0Я
Концентрациях
Рис. XII-3. Подвижность капелек нуйола в растворах аэрозоля ОТ и межфазное
натяжение на поверхности раздела водный раствор аэрозоля ОТ—нуйол [24].
электролита. С увеличением концентрации электролита полный
поверхностный потенциал электролита возрастает, так как при этом
возрастает абсолютный избыток анионов относительно катионов в
масляной фазе, а толщина двойного слоя уменьшается. В результате, как
показали Чисмэн и Кинг, кривая зависимости устойчивости водных
эмульсий амилового спирта от концентрации электролита проходит
через максимум приблизительно при 2 мэкв./л.
В присутствии ионного поверхностно-активного вещества потенциал
должен меняться (рис. ХИ-4, в) примерно так же, как в присутствии
поверхностно-неактивного электролита. Однако адсорбция
поверхностно-активного вещества дополнительно приводит к уменьшению
межфазного натяжения и, таким образом, повышает устойчивость эмульсии.
При рассмотрении заряженных монослоев (гл. III, разд. 111-4) было
показано, что взаимное отталкивание заряженных групп приводит к
некоторому растяжению пленки и, следовательно, к снижению я.
Введение электролита снижает взаимное отталкивание поверхностных
зарядов вследствие увеличения концентрации противоионов. В результате
пленка становится более плотной, и ее поверхностное давление возра-
Масло
j
вода Масло1
\Х j
вода
Масло
Вода
1
Li
%
!
а
в
Рис ХИ-4 Изменение потенциала на поверхности раздела масло—вода в отсутствие
электролита (а), в присутствии электролита (б), в присутствии поверхностно-активных
ионов и большого количества соли (в) [25].
Эмульсии и пены
397
60
х40
кТ
20
О
-20
Рис. ХП-5. Расчетная энергия взаимодействия сближающихся капелек парафинового
масла, стабилизованных бычьим альбумином [27].
стает. Таким образом, можно качественно объяснить влияние
электролита на межфазное натяжение и устойчивость эмульсий.
Возвращаясь к общей картине, следует отметить, что коалесценция
зависит не только от барьера, обусловленного отталкиванием двойных
электрических слоев. Согласно теории ДЛФО (см. гл. VI, разд VI-4B),
на кривой потенциальной энергии сближающихся капелек имеется
пологий минимум. Пример [27] такой теоретической кривой показан на
рис. ХН-5 (см. также [27а]). Наличие энергетического минимума
может приводить к тому, что при флоккуляции частицы будут
останавливаться на некотором расстоянии друг от друга, не проявляя
стремления к дальнейшему сближению.
Аналогичные исследования проведены также на эмульсиях типа
вода — масло. Теперь капельки представляют собой водную фазу и
заряжены положительно [28, 29]. В таких системах ^-потенциал и
стабильность очень слабо коррелируют между собой. В третьей работе
Олберса и Овербека [30] по градиенту сдвига, достаточного для
отрыва флоккулированных капелек, произведена оценка силы дальнодейст-
вующего вандерваальсового притяжения между отдельными
капельками эмульсии.
Г. Стабилизация эмульсий твердыми частицами
В качестве стабилизаторов эмульсий большой интерес представляют порошки.
Например, эмульсия бензол — вода стабилизуется карбонатом кальция, частицы которого
собираются на поверхности капелек бензола, тем самым защищая их от слияния.
Скарлетт и др. [31] сообщают о стабилизации эмульсии толуол — вода пиритом и о
стабилизации эмульсии вода — бензол углем и иодидом ртути. Кристаллы тристеарат-
глицерина стабилизуют эмульсии вода — парафиновое масло [32].
Как указывается в гл. XI, разд. XI-4A, при конечном краевом угле между твердой
частицей и двумя жидкими фазами на поверхности раздела жидкость — жидкость
частица занимает устойчивое положение. Чтобы удалить ее с поверхности раздела,
требуется затратить работу, и поэтому коалесценция затруднена. Кроме того, исходя из
величины краевого угла, можно предсказать тип образуемой эмульсии. Как показано
на рис. ХП-6, большая часть объема частицы находится во внешней жидкости,
которая почти полностью смачивает их. Это вполне согласуется с моделью
ориентированных клиньев; согласно этой модели жидкость, в которой находится более широкая
часть частицы, должна составлять внешнюю фазу. По влиянию
поверхностно-активных веществ на краевой угол можно предсказать также их действие на эмульсии.
Проводя стабилизацию эмульсий сульфатом бария, Шульман и Лежа [33] показали,
что влияние поверхностно-активных веществ действительно определяется величиной
краевого угла.
Стабилизация эмульсий твердыми частицами на поверхности раздела жидкость—
жидкость может наблюдаться и в тех случаях, когда в систему твердые частицы
специально не вводятся. Если пленка на поверхности капель является достаточно жесткой
или если равновесие между пленкой и объемными фазами устанавливается очень мед-
200
50 /OflTv^jSO.
о
Н,А
-250
398
Глава XII
6L
%t
Рис. XII-6. Стабилизация эмульсии небольшими частицами.
ленно, то, как уже отмечалось, пленку можно рассматривать как твердую или геле-
образную фазу, образующуюся в результате коалесценции капелек или механического
нарушения их формы.
4. Старение и обращение эмульсий
Как показано на рис. ХП-7, процессы старения можно разделить по
крайней мере на три типа. Капельки внутренней фазы могут
флоккулировать, т. е. объединяться в группы, не теряя собственной
индивидуальности. Образующиеся при коагуляции флоккулы могут затем
подвергаться гравитационному сепарированию. Этот процесс
называется расслоением эмульсии. При коалесценции эмульсия в конце концов
разрушается, что приводит к образованию двух слоев жидкости.
Кроме того, возможно также обращение эмульсий.
А. Кинетика флоккуляции и коагуляции
Существует два подхода к кинетике флоккуляции и коагуляции
капелек. Первый берет свое начало от соотношения Смолуховского [34],
определяющего скорость столкновений сферических частиц в
результате диффузии:
R=\QnDrn\
(ХИ-4)
где п — число частиц в кубическом сантиметре, г — радиус частиц и
D—коэффициент диффузии. Если частицы сферические, коэффициент
диффузии D определяется формулой Стокса — Эйнштейна
D=kT/6my.
Расслоение
Рис. XI1-7. Процессы старения
эмульсий.
Эмульсии и пены
399
Рис. ХИ-8. Влияние электролита на ско
рость коагуляции эмульсии, стабилизован
ной аэрозолем МА [25].
о го 40 во во юо
Концентрация ста, ммоль/л
Скорость эффективных столкновений dn/dt определяется
энергетическим барьером коагуляции £* по уравнению
dn/dt = —kn\ (XII-5)
где
k = (8kT/34))e-E*/kT
Величина dn/dt фактически равна скорости исчезновения первичных
частиц и, следовательно, скорости уменьшения их общего числа.
Интегрируя уравнение (ХН-5), получаем
l/n = l/n0+kt. (XII-6)
Уравнение (ХП-6) является весьма приблизительным. Более точный
вывод уравнения скорости коагуляции дан Кройтом [35] и Бехером
[2]. При точном анализе необходимо учитывать образование
агрегатов, содержащих больше двух частиц. В результате уравнение (ХП-8)
соблюдается лишь приблизительно, однако величина d(\/n)dt все же
используется в качестве меры скорости флоккуляции или коагуляции.
На рис. ХП-8 приведены для примера данные ван ден Темпеля по
влиянию концентрации на скорость флоккуляции эмульсии М/В.
Обратите внимание, что величина d(l/n)/dt (в приближенной теории
равная k) быстро возрастает с увеличением ионной силы раствора. Это,
по-видимому, обусловлено уменьшением толщины двойного слоя и,
возможно, также адсорбцией положительно заряженных ионов в слое
Штерна. Предэкспоненциальный множитель k0= (8kT/3y]) в уравнении
(ХИ-5) должен составлять около КН1 см3/с, однако при низких
концентрациях электролита величина k0 для кривых, приведенных на рис.
ХП-8, на один-два порядка меньше его теоретического значения.
Качественно это уменьшение можно объяснить отталкиванием двойных
слоев. Дэвис [36] использовал предельную форму уравнения (IV-31),
полагая (эмпирически), что
£* =4 ^
где £* выражено в калориях, а фо — в милливольтах.
Рассмотренная теория относится прежде всего к скорости флоккуляции. При
необратимом старении эмульсий важную роль играет коалесценция капелек, которой
предшествует разрушение разделяющих их пленок жидкости. Спилман [37] и Хониг
и др. [38] развили теорию коалесценции, в которой наряду с теорией ДЛФО
учитываются также гидродинамические факторы*. Полученные авторами уравнения прошли
успешную экспериментальную проверку в работе Бернштейна и др. [39].
* См. также работу Б. В. Дерягина и В. М. Муллера [см. ДАН СССР, 176, 869
(1967)]. — Прим. ред.
<6h
/2
/MgCl2
400
Глава XII
В ряде работ исследовалась равновесная форма двух прижатых друг к другу
капелек [40] и скорость утоньшения пленок [41, 42]. Однако авторы этих работ
использовали лишь гидродинамические зависимости и не учитывали существование барьера
пленка — пленка, препятствующего окончательному разрыву межфазных пленок.
А именно здесь важную роль в стабилизации эмульсий играют химические факторы.
Б. Обращение и разрушение эмульсий
Большой интерес представляет эффект превращения эмульсии типа
А/В в эмульсию типа В/А. Вообще говоря, такое обращение можно
вызвать, создав условия, при которых эмульсия противоположного
типа нормально устойчива. Во-первых, если внутренняя фаза состоит из
однородных жестких сферических частиц, то эмульсия должна
обращаться при ф больше 0,74. Как указывалось в разд. ХП-3, этой
величине ф соответствует плотная упаковка частиц. На самом деле
капельки эмульсии, конечно, способны к деформации и не являются
монодисперсными, поэтому приведенный критерий обратимости имеет лишь
ограниченное применение. В работе [15] обращение
стабилизированных стеаратом натрия эмульсий бензол — вода из М/В в В/М
наблюдалось при увеличении ф почти до идеального значения 0,74. По данным
работы [43], кремы холодного приготовления обращаются при ф = 0,45.
По данным Робертсона [44], критическая величина ф достигает 0,9, а
Пиккеринг [45], используя в качестве эмульгирующего агента мыло,
получил эмульсии типа М/В, содержащие до 99 об. % масла. Таким
образом, хотя введение в эмульсию дополнительного количества
внутренней фазы и может приводить к ее обращению, нельзя с
уверенностью сказать, что это произойдет именно при теоретическом значении
Ф, равном 0,74. Как показал Себба [45а], в предельном случае
возможно образование «двухжидкостных пен» — эмульсий, в которых
капельки внутренней жидкости образуют ячеистую структуру с тонкими
прослойками внешней жидкости. Внешне такие эмульсии выглядят как
пены.
Во-вторых, напомним, что мыла с однозарядными ионами
способствуют стабилизации в основном эмульсии типа В/М. Поэтому не
удивительно, что введение кальциевой соли в эмульсию М/В,
стабилизованную натриевым мылом, может приводить к обращению. Этот эффект,
наблюдавшийся, в частности, Клаусом [13], подробнее обсуждается в
разд. ХП-6. Не всегда для обращения эмульсии необходимо
использовать поливалентные электролиты. По данным Кремнева и Куибиной
[46], по мере увеличения концентрации водного раствора хлорида
натрия или другого 1 : 1 электролита с 0,25 до 0,3 М эмульсии бензола,
стабилизованные концентрированным (0,3 М) олеатом натрия,
разрушаются и затем обращаются. Наконец, обращение эмульсии
можно вызвать также изменением температуры. Так, Уэлмэн и Тартар [15]
вызывали обращение эмульсий М/В, стабилизованных стеаратом
натрия, простым охлаждением.
Итак, если внутренняя фаза не слишком разбавлена, то в общем
случае тип эмульсии определяется некоторым динамическим
равновесием различных факторов и чутко реагирует на изменение условий. На
рис. ХН-9 приведена схема процесса обращения эмульсий, обобщающая
результаты чрезвычайно интересных наблюдений Клауса [13]. Автор
заметил, что при введении кальциевой соли в эмульсию М/В,
стабилизованную натриевым мылом, масляные глобулы сначала деформируются,
а затем по мере приближения концентрации к критической
удлиняются и приходят в интенсивное «броуновское» движение. При этом
линейные участки водной фазы в масляной фазе образуют шейки и
отрываются, образуя эмульсию В/М. Интенсивное движение и заметное
течение двух фаз в критической точке обращения, по-видимому,
обусловлены локальными флуктуациями концентрации при смешении до-
Эмульсии и пены
401
Рис. ХП-9. Процесс обращения
эмульсии [13].
А — водная фаза; В — масляная или
другая неводная фаза; С —
адсорбированная пленка поверхностно-активного
вещества или другого
диспергирующего агента.
бавляемой кальциевой соли с системой, т. е. эффектом Марангони (см.
гл. III, разд. Ш-2Б).
Для разрушения, или деэмульгирования, эмульсии можно
использовать либо рассмотренные выше методы обращения (разумеется,
несколько изменив их), либо методы ускорения коалесценции капелек.
Эмульсии разрушаются и вследствие фазового перехода в одной из
жидких фаз, например при нагревании почти до температуры кипения
внутренней фазы или при замораживании и последующем оттаивании.
Удаление эмульгатора с помощью абсорбционной хроматографии
также приводит к разрушению эмульсии [47].
В работе [48] описано влияние температуры на стабильность
эмульсий нуйол — вода. Наконец, эмульсии масла в воде можно разрушать,
пропуская их через слой металлических гранул [49].
5. Спонтанное эмульгирование. Мицеллярные эмульсии
и микроэмульсии
Как уже отмечалось в разд. ХП-3, некоторые системы способны к спонтанному
эмульгированию, т. е. даже при осторожном введении одной жидкости (плюс
поверхностно-активное вещество) в другую струйка вводимой жидкости спонтанно дробится
или разветвляется на потоки мельчайших капелек эмульсии. Этот эффект не
вызывает сомнения [2]. В принципе он может быть обусловлен локальными градиентами
концентрации, приводящими к эффекту Марангони. Поэтому возникает вопрос,
действительно ли при спонтанном эмульгировании сразу образуется устойчивая эмульсия или
же в дальнейшем в объемных фазах, насыщенных относительно друг друга и
поверхностно-активного вещества, происходит коалесценция первичных частиц.
Одним из наиболее строгих критериев истинной стабильности эмульсии является
обратимое изменение размеров капелек при изменении состава объемных фаз или
условий образования эмульсии. Некоторые системы действительно удовлетворяют этому
критерию. Баукот и Шульман [50] показали, что введение длинноцепочечных спиртов
(например, гексанола) в грубую эмульсию типа М/В (например, стабилизованную
натриевым мылом эмульсию бензол — вода) приводит к постепенному уменьшению
размера капелек. В конечном итоге эмульсия становится прозрачной и однородной на вид.
Под действием спирта капельки масла становятся очень маленькими, от 100 до 500 А
в диаметре. Такие капельки больше похожи на разбухшие мицеллы, чем на
нормальные капельки масла, и не видны под микроскопом, поскольку их размеры меньше
длины волны видимого света. Однако методы рассеяния света и рентгеновского
излучения показывают, что осветленные эмульсии явно двухфазны [51]. Подобное
уменьшение размера капелек эмульсии описывается также в работе Уинзора [52], который
показал, что мицеллярные эмульсии могут находиться в равновесии либо с масляной,
либо с водной объемной фазой.
Шульман и др. [51] назвали такие системы микроэмульсиями, однако их,
по-видимому, целесообразнее называть мицеллярными эмульсиями, что лучше отражает
некоторые специфические особенности этих систем. Как и в обычных эмульсиях, в ми-
целлярных эмульсиях Ф может достигать 0,5, т. е. они не слишком разбавлены
относительно внутренней фазы. Внутренняя фаза представляет собой водный раствор,
правда, высокоструктурированный под действием поверхностно-активного вещества и
спирта. Кроме того, поскольку размеры капелек малы, можно предполагать, что даже
в центре капелек их свойства отличаются от свойств нормальной объемной фазы. При
неограниченном разбавлении водой эмульсия в конце концов обращается в эмульсию
типа М/В, вероятно имеющую нормальную структуру. Однако, если добавить электро-
26-1421
402
Глава XII
лит, то мицеллярная эмульсия может сохраняться в виде отдельной фазы, находящейся
в равновесии с водным раствором электролита. Это показывает, что активность воды
в частицах эмульсии мала или что внутри капель повышенное осмотическое давление.
Спонтанный вход воды в частицы можно затруднить, значительно уменьшив
внешнее осмотическое давление путем добавления в воду некоторого количества
электролита. Таким образом, мицеллярные частицы находятся в равновесии с окружающей
средой и обратимо реагируют на изменения в ней [52а].
В последние годы мицеллярные эмульсии привлекают все больше внимания; так,
например, их применяют при выделении третичных углеводородов [53]. Предложена
модель [54], объясняющая способность мицеллярной эмульсии находиться в
равновесии с водным раствором электролита. Впоследствии [55] с помощью этой модели
были проанализированы данные по распределению электролита, воды и поверхностно-
активного вещества между двумя фазами. Опубликованы работы, в которых
исследуются вязкость ;[56], ЯМР-спектры [57] и химические свойства [57а]
микроэмульсий. Эблинг и Парте [58] описали «микроэмульсию» винилстеарата Более полные
сведения по данной теме можно найти в обзоре Розано [59].
6. Гидрофильно-липофильный баланс
Эмульсии широко используются в разного рода технологических
процессах, и здесь практика все еще опережает теорию. Поскольку
очень важно знать заранее, какой тип эмульсии (М/В или В/М) и
насколько стабильную эмульсию мы получим при совместном
диспергировании масла и воды в присутствии тех или иных эмульгаторов, на
практике часто руководствуются следующим эмпирическим правилом:
жидкость, лучше растворяющая эмульгатор, образует внешнюю фазу
[60] (см. табл. ХП-1). На этом правиле основано несколько способов
Таблица ХП-1
Шкала ГЛБ
Растворимость поверхностно-активного
вещества в воде
Не диспергируется
Диспергируется плохо
Мутная неустойчивая дисперсия
Мутная устойчивая дисперсия
Полупрозрачный или прозрачный
раствор
Прозрачный раствор
ГЛБ
щ
{Ю/
{12]
} Детергент )
(14)
|lg| Солюбилизатор J
Применение
Эмульгатор типа В/М
Смачивающий агент
Эмульгатор типа М/В
количественной оценки эффективности эмульгаторов; некоторые из них
вкратце рассматриваются ниже.
Широкое применение нашла предложенная Гриффином [61]
система численных коэффициентов, называемых числами гидрофильно-ли-
пофильного баланса (ГЛБ). В основу своей системы Гриффин положил
приведенную в табл. ХП-1 линейную шкалу чисел, характеризующих
действие поверхностно-активного вещества (обратите внимание на
корреляцию между числами ГЛБ и растворимостью
поверхностно-активного вещества). Далее в соответствии с этой шкалой каждому веществу
приписывается определенное число (подробный перечень чисел ГЛБ дан
в работе [2]), причем предполагается, что для смеси поверхностно-
активных веществ число ГЛБ равно средневзвешенному значению.
Ход рассуждений Гриффина при построении системы чисел ГЛБ
можно проиллюстрировать следующим примером. Предположим, что
нам необходимо получить эмульсию М/В. Для эмульгирования масля-
Эмульсии и пены
4034
ной и водной фаз мы используем различные смеси, например смесь
спана 65 (сорбитолтристеарат, ГЛБ = 2,1) и твина 60 (полиоксиэтилен-
сорбитанмоностеарат, ГЛБ=14,9). После ряда опытов мы нашли, что
смесь 80% твина 60 и 20% спана 65 (ГЛБ=12,3) дает эмульсию с
оптимальными свойствами. Теперь предположим, что в данной системе
М/В оптимальным эмульгатором является любая смесь с ГЛБ=12,3.
Например, при использовании смесей спана 85 (сорбитантриолеат,
ГЛБ = 1,8) и твина 20 (полиоксиэтиленсорбитанмонолаурат, ГЛБ = 16,7)
оптимальными свойствами должна характеризоваться смесь,
содержащая 70% твина 20 и 30% спана 85. Вообще говоря, абсолютные
характеристики эмульсий для этих смесей могут различаться, однако в
обоих случаях образующиеся эмульсии имеют оптимальные
характеристики. На следующем этапе мы должны приготовить ряд таких
оптимальных смесей и найти ту из них, которая дает эмульсию с лучшими
абсолютными характеристиками.
Дэвис [36] распространил принцип аддитивности ГЛБ на
функциональные группы поверхностно-активных веществ. Список групповых
чисел ГЛБ дан в табл. ХП-2. Эмпирическое число ГЛБ данного по-
Таблица ХП-2
Групповые числа ГЛБ
Гидрофильные группы
—S04Na
-COOK
—COONa
Сульфонат
—N (третичный амин)
Сложный эфир (сорбитановое
кольцо)
Сложный эфир (свободный)
—СООН
—ОН (свободная)
—О—
—ОН (сорбитановое кольцо)
ГЛБ
38,7
21,1
19,1
~п,о !
9,4
6,8
2,4
2,1
1,9
1 3
0,5
Липофильные группы
-СН2- ]
-СНз
—СН= J
-(СН2-СН2-СН2-0-)
ГЛБ
—0,475
—0,15
верхностно-активного вещества рассчитывается следующим образом: к
алгебраической сумме групповых чисел добавляют 7. Так, для цетило-
вого спирта Ci6H33'OH расчетное число ГЛБ составляет 7+1,9+-
+ 16 (—0,475) = 1,3. Числа ГЛБ связаны также с температурой фазового)
перехода [62].
Система чисел ГЛБ позволяет систематизировать весьма
запутанные данные по эмульгирующим свойствам различных поверхностно-
активных веществ и их смесей и способствует эффективной
организации поиска оптимальных эмульгирующих составов. От нее, однако,
нельзя требовать слишком многого, поскольку при углубленном
анализе возникают различные осложнения. Сложный характер действия
поверхностно-активных смесей хорошо виден, например, из рис. Х1Ы0„
на котором показана возможная молекулярная структура межфазных
пленок на капельках эмульсии, стабилизованных смесью твина 40 и
спана. 80. Не удивительно, что в действительности числа ГЛБ не
совсем аддитивны и что их эффективные значения зависят от природы
масляной фазы и других факторов. Как уже отмечалось, тип
образуемой эмульсии М/В или В/М зависит также от величины <р и множества
других физических характеристик, поэтому эмульсию нельзя характе»
ризовать только числом ГЛБ эмульгатора.
26*
404
Глава XII
Рис. ХП-10. Ориентация молекул твина 40 и слана 80 в смешанных пленках,
адсорбированных на поверхностях раздела масло—вода [63].
7. Применение эмульсий
В промышленности спонтанное эмульгирование являеется скорее
исключением, чем правилом, и для получения эмульсий используется
множество самых разнообразных измельчителей, смесителей и
гомогенизаторов. Принцип работы всех этих устройств показан на рис. ХП-11.
Под действием потока жидкости или механических сил крупные капли
диспергируемой фазы вытягиваются и принимают веретенообразную
форму. Как подчеркивается в гл. I, разд. 1-3, цилиндрический столбик
жидкости, длина которого превышает длину окружности, неустойчив
и разрушается на неравные части. Соответственно длинные столбики
или струйки жидкости распадаются на ряд мелких капелек. Поэтому
при эмульгировании крупные вытянутые капли под действием сил
поверхностного натяжения (а также вихревых токов жидкости) дробятся
на множество значительно меньших капелек, которые в свою очередь
могут подвергнуться дальнейшему диспергированию. Очевидно, что этот
процесс особенно сложен при отношении объемов двух фаз, близком
к единице. В этом случае диспергируются обе жидкие фазы и
свежеприготовленная эмульсия, по-видимому, представляет собой смесь
эмульсий двух типов. Капельки жидкости, в конечном итоге образующей
внешнюю фазу, коалесцируют в большей степени, чем капельки
внутренней фазы. Эта картина положена в основу кинетической теории
Дэвиса, рассмотренной в предыдущем разделе.
Эмульсии и пены
405
Рис. ХП-11. Искажение формы капли при эмульгировании.
На практике эмульсии применяются чрезвычайно широко. Приведем
лишь краткий перечень некоторых из них: битумные эмульсии для
дорожных и кровельных покрытий, бензиновые эмульсии (например,
для огнеметов), окрасочные эмульсии (в том числе латексные краски),
сельскохозяйственные распыляемые смеси, различные
пятновыводители и моющие средства, большинство косметических кремов и лосьонов,
различные пищевые эмульсии (например, маргарин, мороженое и
майонез). В виде эмульсий выпускаются и многие лекарственные составы.
Например, мазь от ожогов представляет собой эмульсию типа М/В, а
бальзам для смягчения сухой кожи — эмульсию типа В/М. Нередко
приходится проводить и деэмульгирование. Примерами могут служить
разрушение молочной эмульсии типа М/В для получения масла и
разрушение эмульсии соленой воды, затрудняющей переработку сырой
нефти.
8. Пены. Структура пен
Пену можно рассматривать как эмульсию, в которой внутренняя
фаза является газообразной. Чтобы получить устойчивую пену, как и
при получении обычных эмульсий, необходимо ввести в систему
некоторое количество поверхностно-активного вещества. Сходство пен и
эмульсий особенно заметно, когда пена состоит из почти сферических
пузырьков, разделенных довольно толстыми пленками жидкости.
Такие пены Манегольд [64] называет шаровыми.
Существуют также пены, состоящие в основном из газовой фазы,
разделенной на ячейки тонкими пленками или перегородками. Эти
ячейки имеют форму многогранника, и всю пену можно
рассматривать как систему, объем которой плотно заполнен более или менее
правильными многогранниками. Такие пены называются
полиэдрическими. Их можно получать либо путем интенсивного обезвоживания
шаровых пен, либо непосредственно из маловязкой жидкости. Интересно,
что при центрифугировании эмульсий внутренняя жидкость иногда
образует также полиэдрические ячейки, разделенные тонкими пленками
внешней фазы жидкости. Кроме этих двух типов пен, существуют еще
и пены промежуточного типа, например полученные Себба [64а]
микрогазовые эмульсии, внутренняя фаза которых образована скоплением
газовых пузырьков.
Здесь мы рассмотрим лишь полиэдрические пены, так как с ними
чаще приходится иметь дело. Остановимся сначала на геометрии
полиэдрических пен. Если три пузырька соединить, как показано на
рис. ХП-12, то три разделяющие пленки, или перегородки, встречаясь^
образуют трехгранный столбик жидкости (перпендикулярный
плоскости рисунка), называемый треугольником или границей Плато.
Равновесие между тремя жидкими пленками исследовалось довольно
подробно Плато* [65] и Гиббсом [66]. Граница Плато образует канал,
играющий важную роль в механизме утоньшения пленок. На
рис. ХП-12, б граница Плато приведена в увеличенном масштабе.
*Работы Плато написаны легко и читаются с большим интересом.
406
Глава XII
66^
Рис. ХП-12. Граница Плато. CL г
Прежде всего обращает внимание большая кривизна поверхности в
области контакта трех пузырьков А. Это указывает на значительный
перепад давлений между газообразной и жидкой фазами. В
результате жидкость выдавливается из пленки на границу Плато, что играет
важную роль в осушении пены.
Три пузырька, стенки которых встречаются под углом 120°,
образуют механически устойчивую систему. К системе трех пузырьков
можно добавить четвертый пузырек (рис. ХП-13), однако такая система
неустойчива. При малейшем нарушении равновесия или возмущении
пленки приходят в движение и в конце концов принимают вид,
приведенный на рис. ХП-13, б. Таким образом, двумерная пена образует
более или менее однородную гексагональную решетку.
Геометрия трехмерных пен гораздо сложнее. Поскольку стенки
всех пузырьков должны быть одинаковыми, при пересечении трех
стенок с образованием границ Плато или ребер, углы пересечения по-
прежнему должны быть равны 120°. Встречаясь в одной точке, четыре
таких ребра должны образовывать четырехгранный угол, равный
109°28'. В обширном статистическом исследовании геометрии реальных
пен, выполненном Матцке [67], показано, что в пенах действительно
чаще всего наблюдаются именно такие углы.
Вполне разумно предположить, что ячейки состоят из правильных
многогранников одного типа. Этим требованиям лучше всего
соответствует пентагональный додекаэдр (фигура, образованная 12
пятиугольными гранями). По данным Матцке, более половины граней ячеек
реальных пен действительно являются пятиугольниками и примерно 10%
многогранников представляют собой пентагональные додекаэдры.
К аналогичным выводам еще раньше пришел Деш [68].
Следует отметить, что в пентагональном додекаэдре углы несколько отличны от
приведенных выше (116°33' между двумя гранями и 108° между пересекающимися
ребрами) и поэтому такими телами полностью заполнить пространство невозможно
Проблему заполнения пространства различными телами рассматривали еще Гиббс
[66] и Кельвин [69]. Последний показал, что полностью пространство можно
заполнить усеченными октаэдрами (многогранник, образованный шестью квадратами и
восемью шестиугольниками). При соответствующем искривлении граней усеченный
октаэдр обеспечивает требуемые углы. Это, однако, противоречит экспериментальным
данным: в пенах Матцке четырехугольными были лишь 10% граней ячеек. Возникает
вопрос: действительно ли результирующие силы, действующие на каждую грань,
границу Плато или вершину равны нулю или же они уравновешиваются изменением
локального давления жидкости внутри стенок, разделяющих ячейки? Такие изменения
а 6 Рис хп-13
Эмульсии и пены
407
давления могут играть значительную роль в механизме осушения пен (см. ниже), в
результате чего пленки внутри пен утоньшаются и становятся неустойчивыми быстрее,
чем изолированные плоские пленки.
9. Утоньшение пен
А. Утоньшение изолированных пленок
Сначала рассмотрим простой пример: плоская мыльная пленка
натянута на прямоугольную рамку (рис. ХП-14). Чтобы получить такую
пленку, рамку погружают в мыльный раствор и осторожно поднимают
(чтобы исключить возможность испарения, всю систему предварительно
помещают в замкнутый объем). Вначале образуется относительно
толстая пленка, однако она сразу же, после того как рамку вынут из
раствора, начинает утоныыаться и довольно быстро становится «цветной»,
т. е. на ней появляются радужные полосы. Окрашивание пленки
обусловлено интерференцией света при отражении от передней и задней
поверхностей пленки (см. гл. III, разд. Ш-ЗГ). В результате стекания
избытка жидкости толщина пленки уменьшается снизу вверх.
Соответственно расстояние между интерференционными полосами, которое
вверху больше, чем внизу, быстро сужается, по мере того как
толщина пленки становится больше длины волн видимого света. Процесс
утоньшения пленок наблюдать очень интересно: окрашенные полосы
медленно движутся вниз, при этом расстояние между ними
увеличивается. Со временем верхняя часть пленки становится серой, а затем
черной. Граница между черной и серой пленкой также движется вниз,
до тех под пока вся пленка, за исключением ее самой нижней части,
не становится черной. Теория интерференции света на пленках
довольно сложна. Ознакомиться с ней можно по работам Рэлея [70], Рэйн-
хольда и Рукера [71] и Бикермана [72].
При исследовании пленок возникает ряд интересных вопросов. Согласно данным
Перрена [73] и более недавним наблюдениям Майсельса и др. [74], а также Овербека
[75], одновременно могут сосуществовать черные пленки различных типов,
отличающихся друг от друга по толщине. При переходе одного типа черной пленки в другой
ее толщина ступенчато меняется. Толщина наиболее тонкой черной пленки (в случае
мыльных пленок) примерно равна 45 А, т. е. ненамного больше удвоенной толщины
Рис. ХП-14. Утоньшение мыльной пленки,
натянутой на рамку. (С разрешения
проф. К. Дж Майзелса).
408
Глава XII
монослоя мыла. Такие пленки выглядят черными, поскольку их толщина настолько
мала, что на всех длинах волн видимой области в результате интерференции света,
отраженного от задней и передней поверхностей пленки, свет гасится. Толщина
горизонтальных нестекающих пленок, по-видимому, определяется степенью отсоса воды на
границу пленки и в основном отражает баланс сил электростатического отталкивания
двух двойных электрических слоев и дальнодействующих сил вандерваальсового
притяжения (см. гл. VI, разд. VI-4B). Фактически изучение таких пленок является одним
из способов исследования указанных сил [75, 76]. Ценные сведения по данному
вопросу можно получить, определяя краевой угол между плоской мыльной пленкой и
границей Плато '[76а].
До сих пор молчаливо предполагалось, что при утоныиении вид
жидких пленок меняется довольно медленно. В действительности
цветная картина пленки меняется очень быстро, особенно на границе
между пленкой и несущей рамкой. Характер движения или, скорее, течения
цветных пятен по пленке является очень сложным. В первом
приближении он определяется вихрями утоньшенной (и, следовательно,
окрашенной по-другому) пленки, отделяющимися от краев и движущимися
внутрь рамки и вверх. Рассмотрение этих павлиньих хвостов
показывает, что образующиеся таким образом пятна растут до тех пор, пока
не покроют всю пленку и не исчезнут из виду. Кроме того, в серой
пленке по всей ее ширине образуются пятна черной пленки, которые
поднимаются к границе между черной и серой пленками, извергая на
границе небольшие струйки серой пленки. Перечень цветов пленок
различной толщины дан в работе [77].
Это краткое описание процесса утоньшения пленок ясно показывает,
что механизм утоньшения пленки заключается в образовании пятен
тонкой пленки на границе и удалении избытка жидкости в граничный
канал. Таким образом, утоньшение пленки — это прежде всего краевой
процесс, и скорость его определяется тем, что происходит на границах
пленки. В результате суммарная скорость утоньшения обратно
пропорциональна ширине пленки [78]. Как уже отмечалось, вследствие
большой кривизны на границах канала давление жидкости в канале
должно быть ниже, чем в пленке. По-видимому, наличие этой разности
давлений и приводит к образованию тонкой пленки [75].
На первый взгляд может показаться, что пленка утоныпается в результате
постепенного стекания жидкости внутри пленки. Однако при более глубоком рассмотрении
оказывается, что этот механизм может играть важную роль лишь в толстых пленках.
Стекание жидкости внутри пленки соответствует течению вязкой жидкости между
параллельными пластинами. Для этого случая Гиббс Г66] вывел уравнение
*ср = Р^2/8ть (ХП-7)
посредством которого средняя скорость течения жидкости vcp представляется в виде
функции толщины пленки б, вязкости г\ и плотности р жидкости. Например, скорость
стекания водной пленки толщиной 1 мкм составляет около 10~4 см/с. Кроме того,
можно ожидать, что внутри пленки вязкость жидкости выше, чем в объеме. Правда,
анализ некоторых экспериментальных данных показывает, что вязкость жидких
пленок меняется, если толщина последней не превышает 10 А [76]. Этот вывод
подтверждается спектрами ЭПР [79], хотя и не согласуется с данными, рассмотренными в
разд. VI-2A.
Б. Осушение пен
Пены с очень толстыми пленками, или шаровые пены, по-видимому,
обезвоживаются гидродинамически. Однако в ячейках полиэдрических
пен с очень тонкими пленками «перегородки» подобны рассмотренным
выше мыльным пленкам и, вероятно, обезвоживаются по тому же
механизму. В результате осушения пленочные перегородки становятся
все тоньше и то там, то здесь разрываются. В некоторых случаях
сначала разрушаются самые верхние ячейки, и, таким образом, объем
пены со временем непрерывно уменьшается. В других случаях в
основном разрушаются внутренние перегородки. При этом газовые ячейки
Эмульсии и пены
Рис. ХП-15. Самопроизвольный разрыв вертикальной плоской пленки, натянутой
на стеклянную рамку шириной 2 см [78]
становятся больше, а плотность пены уменьшается. Кроме разрушения
ячеек, изменению распределения размеров и формы ячеек во времени
способствует диффузия газа через перегородки, разделяющие ячейки.
Во втором издании этой книги отмечалось, что механизм
разрушения мыльной пленки не известен. С тех пор появилось много новых
данных, полученных с помощью довольно тонких экспериментов.
Например, авторы работы [80] показали, что мыльная пленка, натянутая
на рамку (рис. ХП-14), начинает разрываться по краю (рис. XII-15).
10. Устойчивость пен
Одной из основных характеристик устойчивой пленки является ее
сопротивление механическому воздействию. В качестве такой
характеристики Гиббс [66] рассматривает упругость пленки:
E = 2dY/dlnA, (XII-8)
где А — площадь пленки (см. гл. III, разд. III-3B). Для двухкомпонент-
ной системы уравнение (XI1-8) можно представить в следующем виде:
Е=4(Г12)2(ф2/^ш2), (ХИ-9)
где Г*2 —поверхностный избыток компонента 2, \л2 — химический
потенциал этого компонента и т2 — его количество на единицу площади
пленки. Качественно Е характеризует способность пленки менять свое
поверхностное натяжение в момент наложения растягивающего или
410
Глава XII
1
I
гэи
гоо
150
100
50\
0\
тные
L_ ^
5: 1
овер
\
«о <г> 1
Вязкост
пуа
-20-10-* 1
/ t
-toy-* $
/• J
¥ 1
#
f
5А-
1 ■
|в*-»*
^^^
^^^
X
f
10"иМ
1 I
-Н
А
А
0t005 Oftl
Концентрация спирта, %
Рис ХП-16. Время жизни и поверхностная вязкость пен в 0,1%-ных растворах лаурата
натрия (рН 10) с различным содержанием я-додецилового спирта. При изменении
концентраций я-додецилового спирта от 0,01 до 0,025% время жизни пены возрастает
с 6,5 до 30 мин [84].
сжимающего усилия. При растяжении поверхности концентрация
поверхностно-активного вещества в пленке падает и соответственно
возрастает поверхностное натяжение, препятствующее разрыву пленки.
Для чистых жидкостей Е, по определению, равно нулю, и поэтому они
не дают устойчивых пен. В то же время, как показывает уравнение
(ХН-9), величина Е может быть большой, только если и Г*, и d^ldmz
достаточно велики. Фактически это означает, что концентрация
поверхностно-активного вещества должна быть велика, но не слишком. Этот
вывод подтверждают данные Барча [81], показавшего, что
концентрации жирной кислоты и спирта, соответствующие максимуму
устойчивости пен, заметно ниже той концентрации, которой отвечает минимум-
поверхностного натяжения. Измеренные значения Е находятся в
диапазоне от 10 до 40 дн/см [82].
Кроме равновесных, или обратимых, процессов на упругое
сопротивление пленки могут оказывать влияние и некоторые переходные
процессы. По данным Рэлея [70], свежая поверхность пленки
обладает повышенным (относительно равновесных условий) поверхностным
натяжением (см. гл. I, рис. 1-19).
Росс и Хаак [83] указывают, что, если поверхностно-активное
вещество может быстро диффундировать из объема пленки на
поверхность, образующиеся на короткое время пятна тонкой пленки могут
локально менять исходное поверхностное натяжение пленки еще до
утоньшения всей пленки. Таким образом, изменения поверхностного
натяжения «снимаются» без уменьшения первоначальной толщины
пленки, и на некоторое время эта область пленки остается
механически слабой. Отсюда следует, что хорошие стабилизаторы пен должны
Эмульсии и пены
411
адсорбироваться на поверхности достаточно медленно (в миллисекунд-
ном масштабе). Детальное исследование реакции пленок на внешние
возмущения проведено в работе [85].
Для получения устойчивой пены, по-видимому, важно, чтобы пленка
не только была упругой (с высоким пределом упругости), но и
отличалась высокой поверхностной вязкостью. Браун и др. [86] обнаружили
определенную корреляцию между устойчивостью и вязкостью пленок,
содержащих я-додециловый спирт и различные другие поверхностно-
активные вещества. Аналогичные данные Дэвиса [84] приведены на
рис. ХП-16. Рассматриваемый эффект, по-видимому, объясняется
уменьшением скорости стекания пленки на ее границу по мере увеличения
вязкости. Опыты со свободными мыльными пленками ясно показывают,
что скорость стекания пленки через границу Плато резко уменьшается,
если адсорбированная пленка поверхностно-активного вещества по
типу приближается к твердой пленке.
В заключение следует указать на отсутствие строгого анализа
возможной взаимосвязи факторов, определяющих устойчивость пен.
Качественно время жизни пены зависит от скорости утоньшения,
устойчивости тонких пленок по отношению к испарению и механическим
сотрясениям, включая сотрясения, передаваемые через массу пены при
разрыве перегородок между ячейками и резком сдвиге стенок соседних
ячеек. Устойчивость пен рассматривается в работах Бурцика [87] и
Кампа и Дурхама [88].
На основе изложенных представлений можно качественно
проанализировать действие антивспенивателей, препятствующих образованию
пены. Прежде всего антивспениватель должен вытеснять образующее
пену поверхностно-активное вещество с поверхности раздела. При этом
он должен ухудшать характеристики, определяющие устойчивость
пены. Подробно действие антивспенивателей обсуждается Россом и
др. [89].
11. Пенообразователи и пены, имеющие практическое значение
Из изложенного выше следует, что поверхностно-активные
вещества, особенно коллоидные электролиты (см. гл. XI, разд. Х1-5Б) и
биологические вещества, например белки, как правило, должны быть
хорошими пенообразователями. Все эти вещества образуют пленки,
равновесие которых с подложкой устанавливается не слишком быстро.
Как и в эмульсиях, в качестве стабилизаторов пен могут служить
твердые частицы.
Пены широко используют в борьбе с огнем (при этом в качестве
поверхностно-активных веществ применяют сапонин или гидролизован-
ные белки, образующие довольно жесткие пены), в пенной флотации
(см. гл. XI, разд. XI-4) и в быту (взбитые сливки, яичные белки,
различные пенные средства для стирки и очистки).
Конечно, в некоторых случаях важно уметь предотвращать
образование пены. В качестве антивспенивателей в котлах используют
полиамиды (например, триамид стеариновой кислоты с диэтилентриами-
ном). Широко распространены также такие антивспениватели общего
назначения, как алкилполисилоксаны и трибутилфосфат. Теории пен
и их практическому применению посвящена монография Бикерма-
на [90].
12. Упражнения
1. Обсудите вкратце две основные причины, по которым две чистые несмешиваю-
щиеся жидкости не образуют устойчивой эмульсии.
2. Покажите, что, если эмульсия состоит из однородных жестких сферических
капелек, максимальное значение Ф равно 0,74.
412
Глава XII
3. Найдите теоретическое значение а в уравнении (ХН-2).
4. Согласно теории ориентированных клиньев, олеат натрия стабилизует
эмульсию типа М/В благодаря тому, что молекулы олеата имеют клиновидную форму.
Допустим, что в присутствии олеата натрия диаметр капелек эмульсии равен 1 мкм.
Какова в соответствии с теорией ориентированных клиньев площадь пленки,
приходящаяся на одну углеводородную цепь, если полярная группа занимает площадь 45 А2?
5. Кроме упомянутой в упражнении 4 теории ориентированных клиньев, для
объяснения стабилизации эмульсий поверхностно-активными веществами используют
теорию дуплексной пленки. Предположим, что имеется система масло — вода —
поверхностно-активное вещество, образующая эмульсию типа М/В или В/М с капельками
диаметром 1 мкм. Рассчитайте разность межфазных натяжений между поверхностями
раздела пленка — вода и пленка — масло, если свободная энергия гипотетического
процесса обращения эмульсии при Ф = 0,5 составляет 200 кал/см3 эмульсии.
6. Масляная капля диаметром 10 мкм окружена 10 000 небольших сферических
частиц, которые едва касаются ее поверхности (рис. ХН-б). Внешней фазой является
вода. Межфазное натяжение на границе раздела масло — вода составляет 4,0 дн/см,
а разность межфазных натяжений твердое тело — масло и твердое тело — вода равна
3,5 дн/см, т. е. yso—Y^w=3,5. Рассчитайте а) диаметр однородных сферических
частиц, б) краевой угол масло — вода — твердое тело (в водной фазе) и в) работу
отрыва частиц от масляной капли, вследствие которого масляная капля и частицы
окружаются водой (и далее могут осесть на дно сосуда). (При решении этого довольно
запутанного упражнения рекомендуется вспомнить рис. XI-5, гл. XI.)
7. С помощью теории Смолуховского и Дэвиса рассчитайте скорость d(l/n)/dt коа-
лесценции капелек в эмульсии нуйола, стабилизованной 0,2% аэрозоля ОТ. Для
расчета используйте данные, приведенные на рис. ХН-4. (При решении этого упражнения
полезно вспомнить упражнение 9 гл. IV.)
8. Смесь состава 70% твина 60 и 30% спана 65 придает оптимальные свойства
некоторой эмульсионной системе. Каков оптимальный состав смеси лаурилсульфата
натрия и цетилового спирта для данной эмульсионной системы?
9 Смесь поверхностно-активных веществ с числом ГЛБ, равным 8, дает хорошую
косметическую эмульсию типа В/М, в которой масляной фазой является аланин.
Предложите две возможные эмульгирующие смеси, содержащие 10% цетилового
спирта.
10. Рассмотрите систему из двух мыльных пузырьков, имеющих общую
перегородку. Радиусы кривизны пузырьков соответственно R\ и R2, а радиус кривизны
перегородки равен R. В каких условиях R = 0 и Ri=R2?
11. Выведите уравнение (ХН-9) из уравнения (ХП-8). Сформулируйте
используемые допущения. Увеличится или уменьшится упругость поверхности при объемной
концентрации поверхностно-активного вещества, близкой к ККМ?
12. Оцените гидростатическое давление границы Плато, образуемой на стыке трех
тонких черных пленок. Обоснуйте используемые в ваших расчетах допущения.
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Becker P., Emulsions, 2nd ed., Reinhold, New York, 1965.
Berkman S., Egloff G., Emulsions and Foams, Reinhold, New York, 1961.
Bikerman J. J., Foams, Springer-Verlag, New York, 1973.
Davies J. Т., Rideal E. K-, Interfacial Phenomena, Academic Press, New York, 1961.
Manegold E., Schaum, Strassenbau, Chemie und Technik, Heidelberg, 1953.
Moilliet J. E., Collie В., Black W., Surface Activity, E. and F. N. Spon, London, 1961.
Osipow E. E, Surface Chemistry, Reinhold, New York, 1962.
Overbeek J. Th. G., Proc. IVth Int. Cong. Surface Active Substances, Vol. 2, Gordon and
Breach, New York, 1967, p. 19.
Sherman P., Emulsion Science, Academic Press, New York, 1968.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Einstein A, Ann Phys, 19, 289 (1906); 34, 591 (1911).
2. Becker P., Emulsions, Reinhold, New York, 1965.
3. Sherman P., Emulsion Science, Academic Press, New York, 1968, p. 131.
4. Taylor G. L, Proc. Roy. Soc. (London), A138, 41 (1932).
5. Sherman P., J. Phys. Chem., 67, 2531 (1963).
6. Cratin P. D., Robertson B. K, J. Phys Chem., 69, 1087 (1965).
7. Stevenson A. F., Heller W„ W attack Af. L., J. Chem. Phys., 34, 1789, 1796
(1961).
8 Kratky O., Kolloid-Z., 182, 7 (1962).
8a. Eissant K. /., Mayhan K. G., J. Colloid Interface Sci., 42, 201 (1973).
9. Harkins W. D„ The Physical Chemistry of Surface Active Films, Reinhold, New York,
1952, p. 90.
10. Rice О. K., J. Phys. Chem., 64, 976 (1960).
11 Packer K. J., Rees C, J. Colloid Interface Sci., 40, 206 (1972).
Эмульсии и пены
413
12. Bancroft W. D.t J. Phys. Chem., 17, 501 (1913).
13. Clowes G. H. A., J. Phys. Chem, 20, 407 (1916).
14. Harkins W. D., Beeman N., J. Amer. Chem. Soc, 51, 1674 (1929).
15. Wellman V. E.f Tartar Я. V., J. Phys. Chem., 34, 379 (1930).
16. Schulman J. Я, Stenhagen E., Proc. Roy. Soc. (London), B126, 356 (1928).
17. Schulman /. #., Cockbain E. G., Trans. Faraday Soc, 36, 651 (1940).
18. Alexander A. E., «Surface Chemistry and Colloids», Mark H, Verwey E. J. W., eds.
Advances in Colloid Sciences, Vol. Ill, Interscience, New York, 1950.
19. Berkman S.f Egloff G., Emulsions and Foams, Reinhold, New York, 1941, pp. 93f,
175
20. Cockbain E. G., McRoberts T. S., J. Colloid Sci, 8, 440 (1953).
21. Void R. D, Groot R. C, J. Soc. Cosmetic Chem, 14, 233 (1963).
22. Rehfeld S. /, J. Phys. Chem, 66, 1966 (1962).
23. Void R. D.y Groot R. C, J. Colloid Sci, 19, 384 (1964).
24. Powell B. D., Alexander A. E., Can. J. Chem, 30, 1044 (1952).
25. van den Tempel M., Rec. Trav. Chim, 72, 419 (1953).
26. Cheesman D. F., King A., Trans. Faraday Soc, 36, 241 (1940).
27. Kitchener J. A., Musselwhite P. R., Emulsion Science, Sherman P, ed. Academic
Press, New York, 1968, p. 104.
27a. Huisman F., Mysels K. L, J. Phys. Chem, 73, 489 (1969).
28. Albers W., Overbeek J. Th. G.} J. Colloid Sci, 14, 501, 510 (1959); ibid, 15, 489
(1960).
29. Rigole W., Van der Wee P. J. Colloid Sci, 20, 145 (1965).
30. Gillespie Т., Wiley R. M., J. Phys. Chem, 66, 1077 (1962).
31. Scarlett A. /, Morgan W. L., Hildebrand /. Я, J. Phys. Chem, 31, 1566 (1927).
32. Lucassen-Reynders E. Я, van den Tempel M., J. Phys. Chem, 67, 731 (1963).
33. Schulman J. H., Leja J., Trans. Faraday Soc, 50, 598 (1954).
34. von Smoluchowski M., Phys. Z, 17, 557, 585 (1916); Z. Phys. Chem, 92, 129
(1917).
35. Кройт Г. Р., Наука о коллоидах, I, М, ИЛ, 1955.
36. Davies J. Г, Proc. 2nd Int. Congr. Surface Activity, London, Vol. I, p. 426.
37. Spielman L. Л, J. Colloid Interface Sci, 33, 562 (1970).
38. Honig E. P., Wiersma P. Я, Roeberson G. /, J. Colloid Interface Sci, 36, 97
(1971).
39. Bernstein D. F.t Higuchi W. I., Ho N. F. H., J. Colloid Interface Sci, 39, 439
(1972).
40. Princen H. M, J. Colloid Sci, 18, 178 (1963).
41. Gillespie Т., Rideal E. K., Trans. Faraday Soc, 52, 173 (1956).
42. Frankel S. P, Mysels K. /., J. Phys. Chem, 66, 190 (1962).
43. Salisbury R., Leaullen E. E., Chavkin L. Г, J. Amer. Pharm. Assoc. (Sci. Ed.), 43,
117 (1954).
44. Robertson Т. В., Kolloid-Z, 7, 7 (1910).
45. Pickering S. U., J. Chem. Soc, 1907, 2002; Smith E. L, J. Phys. Chem, 36, 1401
(1932).
45a. Sebba F., J. Colloid Interface Sci, 40, 468 (1972).
46. Кремнев Л. Я., Куйбина Н. И., Коллоидн. журн, 17, 34 (1955).
47. Green Т., Harker R. P, Howitt F. О, Nature, 174, 659 (1954).
48. Void R. D., Mittal К. L, J. Colloid Interface Sci, 42, 436 (1973).
49. Fowkes F. M., Anderson F. W., Berger J. E., Environ. Sci. Technol, 4, 510
(1970).
50. Bowcott L E., Schulman J. Я, Z. Elektrochem, 59, 283 (1955).
51. Schulman J. Я, Stoeckenius W.} Prince L. M, J. Phys. Chem, 63, 1677 (1959).
52. Winsor P. Л, Trans. Faraday Soc, 44, 476 (1948).
52a. Prince L. M, J. Colloid Interface Sci, 52, 182 (1975).
53. Gogarty W. B, Surkalo Я, J. Petrol. Tech, 24, 1161 (1972) and references
therein
54. Adamson A. W., J. Colloid Interface Sci, 29, 261 (1969).
55. Tosch W. C, Jones S. C, Adamson A. W., J. Colloid Interface Sci, 31, 297
(1969).
56. Falco J. W., Walker R. D., Jr., Shah D. O, A. I. Ch. E. J, 20, 510 (1974).
57. Shah D. O, Ann. N. Y. Acad. Sci, 204, 125 (1973).
57a. Letts K., MacKay R. Л, Inorg. Chem, 14, 2993 (1975).
58. Elbing E., Parts A. G., J. Colloid Interface Sci, 37, 635 (1971).
59. Rosano H. L, Peiser R. C, Rev. Francais des Corps Gras, April 1969, p. 249.
60. Bancroft W. D, J. Phys. Chem, 17, 501 (1913); ibid, 19, 275 (1915).
61. Griffin W. C, J. Soc. Cosmetic Chem, 1, 311 (1949); ibid, 5, 249 (1954).
62. Parkinson C, Sherman P, J. Colloid Interface Sci, 41, 328 (1972).
63. Boyd J., Parkinson C, Sherman P, J. Colloid Interface Sci, 41, 359 (1972).
64. Manegold £, Schaum, Strassenbau, Heidelberg, 1953, p. 83.
64a. Sebba F„ J. Colloid Interface Sci, 35, 643 (1971); ACS Symposium Series No. 9,
1975.
414
Глава XII
65. Plateau J., Mem. Acad. Roy. Soc. Belgique, 33, (1861), sixth series and preceding
papers.
66. Gibbs J. W., Collected Works, Vol. I, Longmans, Green, New York, 1931, pp. 287,
301, 307.
67. Batzke E. В., Amer. J. Botany, 33, 58 (1946).
68. Desch C, H., Rec. Trav. Chim., 42, 822 (1923).
69. Wells A. F., The Third Dimension in Chemistry, The Clarendon Press, Oxford, 1956,
p. 57; Thompson D. W., Growth and Crystal Form, Cambridge University Press,
Cambridge, England, 1943, p. 551.
70. Rayleigh J. W. S., Scientific Papers, Vol. 2, Cambridge University Press,
Cambridge, England, p. 498.
71. Reinhold A. W., Rucker Л. W., Trans. Roy. Soc. (London), 172, 447 (1881).
72. Bikerman /. /., Foams, Reinhold, New York, 1953, p. 137.
73. Perrin J., Ann. Phys., 10, No. 9, 160 (1918).
74. Jones M. N., Mysels K. /., Scholten P. C, Trans. Faraday. Soc, 62, 1336 (1966).
75. Overbeek J. Th. G.} J. Phys Chem., 64, 1178 (1960).
76. Mysels K. /., J. Phys. Chem., 68, 3441 (1964).
76a. Mysels K. /., Electroanal. Chem. Interfacial Electrochem., 37, 23 (1972).
77. Princen H. M., Mason S. G., J. Colloid Sci., 20, 453 (1965).
78. Mysels K. J., Shinoda K., Frankel S., Soap Films, Studies of Their Thinning and
a Bibliography, Pergamon Press, New York, 1959.
79. Povich M. /., Mann /. A., J. Phys. Chem., 77, 3020 (1973).
80. Mysels K. /., J. Colloid Interface Sci., 35, 159 (1971).
81. Bartsch D„ Kolloid Chem. Bei., 20, 1 (1925).
82. Prins A., van den Tempel M., J. Phys. Chem., 73, 2828 (1969).
83. Ross S., Haak R. M., J. Phys. Chem., 62, 1260 (1958).
84. Davies /. Т., Proc. 2nd Int. Congr. Surface Activity, Vol. 1, p. 220.
85. Prins A., van den Tempel M., Special Discuss. Faraday Soc, No. 1, 1970, p. 20
86. Brown A. G., Thuman W. C, McBain J. W., J. Colloid Sci., 8, 491 (1953).
87. Burcik E. J., J. Colloid Sci., 8, 520 (1953).
88. Camp M., Durham K., J. Phys. Chem., 59, 993 (1955).
89. Ross S., Hughes A. F., Kennedy M. L., Mardoian A. R., J. Phys. Chem., 57, 684
(1953).
90. Bikerman /. /., Foams, Springer-Verlag, New York, 1973.
ГЛАВА XIII
Поверхность раздела твердое тело —газ
1. Введение
Три заключительные главы книги посвящены одной из важнейших
областей физической химии поверхностей, а именно адсорбции на
твердых телах из газовой фазы. С феноменологической точки зрения
ясно, что при контакте твердой и газовой фаз молекулы определенным
образом распределяются между обеими фазами. Компонент газовой
фазы, заметно адсорбирующийся на поверхности твердого тела,
обычно называют адсорбатом. Количественно адсорбцию можно выражать,
например, в виде зависимости приведенного к нормальным условиям
объема газа, адсорбированного граммом адсорбента, v от давления
Р. В общем случае распределение адсорбата между твердой
поверхностью и газовой фазой зависит от температуры, и поэтому полное
эмпирическое описание адсорбции имеет вид функции v = f(P, T).
В принципе функции f(P, T) достаточно для полного
термодинамического описания адсорбции. Однако для сопоставления этой функции
с различными моделями адсорбции желательно относить v не к массе
адсорбента, а к его площади, выраженной в квадратных сантиметрах.
Иными словами, желательно знать 6 — долю поверхности, покрытой
молекулами адсорбата. Поэтому и при теоретических исследованиях, и
при практическом использовании адсорбции на твердых телах из
газовой фазы исключительно важной характеристикой является удельная
поверхность адсорбента 2.
В настоящее время макроскопического описания адсорбции
становится уже недостаточно. Необходимо иметь подробные сведения о
структуре и химическом составе поверхности твердого тела и
комплексах адсорбат — адсорбент. Под действием вандерваальсовых сил все
газы при температуре ниже критической адсорбируются на твердой
поверхности. Это явление называется физической адсорбцией.
Основное внимание при исследовании такой адсорбции
уделяется природе и силе взаимодействия между адсорбентом и
адсорбатом, а также взаимодействию между молекулами адсорбата. Большой
интерес представляют также степень неоднородности поверхности
адсорбента и способность адсорбированных молекул к поступательному,
вращательному и колебательному движению.
В последние годы становится все яснее, что в процессе адсорбции
структура поверхности может заметно меняться. Качественно такие
изменения возможны в том случае, когда энергия адсорбции сравнима
с поверхностной энергией адсорбента (в расчете на одну молекулу).
Как показано в табл. ХНЫ, физическая адсорбция, по-видимому,
приводит к изменению структуры поверхности молекулярных адсорбентов
(например, льда, парафина или полимеров), но не влияет на
поверхность тугоплавких твердых тел (например, обычных металлов, их
окислов, углеродистых материалов), отличающихся высокой поверхностной
энергией. Последние могут меняться лишь при хемосорбции.
416
Глава XIII
Таблица XII1-1
Типы адсорбционных систем
Тип взаимодействия адсорбат—
адсорбент
Вандерваальсово
(физическая адсорбция)
Химическое (хемосорбция)
Типы адсорбентов
молекулярные адсорбенты
Изменение структуры
поверхности при адсорбции
(Модификация поверхности
адсорбента вследствие
протекания химической
реакции)
тугоплавкие адсорбенты
Неизменность структуры
поверхности при адсорб*
ции
Перестройка поверхности
при адсорбции
Цель этой главы — обобщить основные подходы к исследованию
физического и химического состояния адсорбционных систем
различных типов.
2. Удельная поверхность твердых тел
Прежде чем приступить к глубокому физико-химическому анализу
любого процесса адсорбции, в первую очередь необходимо определить
удельную поверхность адсорбента. Это можно сделать как в ходе
самих адсорбционных измерений (адсорбционные методы определения
удельной поверхности рассматриваются в следующей главе), так и с
помощью ряда других методов, обсуждаемых ниже. Рамки этой книги
не позволяют охватить все методы определения удельной поверхности.
В частности, такие методы оценки размеров частиц и пор, как,
например, оптическая и электронная микроскопия, дифракция рентгеновских
лучей и методы, основанные на измерении проницаемости, здесь не
рассматриваются. Подробные сведения по всем этим вопросам
читатель может найти в работах [1, 2].
.4. Физический смысл понятия «удельная поверхность адсорбента»
Как будет видно из дальнейшего рассмотрения, любой метод
определения удельной поверхности включает измерение некоторой
физической характеристики, которая заведомо качественно зависит от общей
площади поверхности адсорбента и которая теоретически может быть
связана с истинной удельной поверхностью. Важно понимать, что
различные методы дают отличающиеся результаты и что таких различий
и следует ожидать. Проблема заключается в том, что при
внимательном анализе понятие «удельная поверхность» становится довольно
туманным.
Оценить, насколько трудно определить точный смысл понятия
«удельная поверхность» твердого тела, можно, рассмотрев аналогичный
вопрос о «длине» некоторого участка береговой линии. На первый
взгляд длину береговой линии между двумя точками можно определить
просто как расстояние вдоль берега. В географических книгах нередко
встречаются утверждения такого рода: «вследствие изрезанности
береговая линия штата Мэн фактически составляет 2000 миль».
Представляется вполне разумным, что длина береговой линии этого штата
больше прямой линии, соединяющей крайние прибрежные точки на его
границах, и что в нее следует включить длины берегов
многочисленных заливов, гаваней, мысов и т. д. Однако при более близком
знакомстве со структурой побережья дело стопорится. Нарис.XIII-1 показано
изменение вида гипотетической линии при последовательном увеличе-
Поверхность раздела твердое тело — газ
417
' ^> ]
^У }
к у
Рис. ХНЫ. Последовательное увеличение /
масштаба гипотетической береговой линии. 'П. G ^
нии. Совершенно очевидно, что по мере увеличения масштаба изрезан-
ность береговой линии возрастает, и поэтому при каждом последующем
увеличении масштаба длину береговой линии необходимо умножать
на некоторый больший или меньший постоянный множитель.
Кажется, что последовательно увеличивая масштаб, этот процесс
можно продолжать до бесконечности. Логическую точку можно
поставить, только остановившись на некоторой «абсолютной» длине
береговой линии. Если же этого не сделать, придется принимать во
внимание отдельные камни на берегу, отдельные песчинки и, наконец,
поверхность отдельных атомов и молекул. Эту логическую трудность
географы обходят, принимая во внимание лишь такие изгибы береговой
линии, характерная длина которых больше некоторого произвольно
выбранного размера.
Аналогичным образом нередко поступают и при оценке удельной
поверхности. При этом минимальный размер принимаемых во
внимание неоднородностей поверхности определяют, исходя из
разрешающей способности микроскопа или размера молекул адсорбата.
Существует и другой подход к оценке удельной поверхности. Можно
подсчитывать, например, число атомов или молекул, выходящих на
поверхность. Результаты такого подсчета, безусловно, полезны, однако
и они не дают однозначного абсолютного значения удельной
поверхности. По-видимому, ближе всего этому способу определения удельной
поверхности соответствует определение геометрической площади
плоской жидкой поверхности.
Наконец, свойства поверхностных атомов и молекул твердых тел
зависят от их расположения, что может значительно затруднять
определение удельной поверхности. Как показано в гл. V, разд. V-4,
поверхностная неоднородность твердых тел имеет самые разнообразные
причины. Естественно, что неоднородность поверхности по-разному
влияет на результаты измерений, зависящие от состояния
поверхностных атомов или молекул. И поскольку энергия и энтропия молекулы
в поверхностном слое не обязательно пропорциональны друг другу,
наличие неустойчивых состояний на поверхности может по-разному
отражаться на свободной и полной поверхностной энергии. На ряде
гипотетических образцов твердого тела с одной и той же площадью, но
различной поверхностной энергией или разными
кристаллографическими плоскостями количества адсорбированного вещества могут заметно
различаться, если адсорбция зависит от поверхностной энергии или
межатомного расстояния. В таких условиях даже относительная
адсорбция на различных образцах не является однозначной мерой их
относительной площади.
Все эти рассуждения приведены здесь для того, чтобы подчеркнуть
относительность понятия «удельной поверхности». Хотя это свойство
твердых тел широко применяется в этой и последующих главах,
следует помнить, что его действительный смысл определяется методом
измерения и теорией этого метода. К счастью, исследователя интересу-
->г
27—1421
418
Глава XIII
ет, как правило, относительная удельная поверхность, а не ее
«абсолютное» значение. Для определения отношения площадей различных
материалов, вообще говоря, пригодны самые разнообразные методы.
Полученные таким образом данные вполне можно использовать для
предсказания или корреляции свойств, тесно связанных с той
характеристикой, которая измеряется при определении удельной поверхности.
Так, величины удельной поверхности, оцененные адсорбционными
методами, позволяют точнее предсказать адсорбцию сходных адсорба-
тов, чем, скажем, относительные теплоты смачивания или их
относительные поверхности, определенные микроскопически.
Б. Методы, требующие знания свободной, или полной,
поверхностной энергии
В предыдущих главах описан ряд методов оценки свободной, или
полной, поверхностной энергии твердых тел. Обычно при
использовании этих методов необходимо знать удельную поверхность
исследуемого образца, определенную каким-нибудь независимым способом.
И наоборот, если удалось оценить удельные термодинамические
величины, эти методы можно применять для нахождения удельной
поверхности. Это относится, в частности, к методам измерения теплоты
растворения (см. гл. V, разд. V-5B), теплоты смачивания (гл. VII,
разд. VII-3A) или увеличения растворимости (гл. VII, разд. VII-2)
порошков.
При определении абсолютных значений удельных поверхностей
используются два подхода. Бартелл и Фу [3] находят удельную
поверхность порошкообразных образцов а, объединяя теплоту смачивания
исследуемого порошка какой-либо жидкостью
4=2(esv-Esl) (ХНЫ,
с данными по температурной зависимости краевого угла той же
жидкости [уравнение (VII-37)]:
q=21 (Еь cos 9—TyL cos в/dT), (ХШ-2)
где q отнесено к одному грамму порошка, так что 2 представляет
собой площадь, приходящуюся на 1 г. При обработке
экспериментальных данных с помощью уравнения (ХШ-2) авторы принимают, что
членом dcosQ/dT можно пренебречь. Анализ данных табл. VII-2
(гл. VII) показывает неправомерность этого допущения. Поэтому
использовать уравнение (ХШ-2) на практике не так уже просто (см. [4]).
Рассмотренный выше общий метод, т. е. сравнение
экспериментально найденных теплот смачивания с известной теплотой смачивания,
отнесенной к одному квадратному сантиметру, обсуждается и
принимается многими авторами [5—7]. Величину ESv—ESl можно оценить,
например, по адсорбционным данным или по так называемой изосте-
рической теплоте адсорбции (см. гл. XIV, разд. XIV-12Б). Во многих
случаях, когда достаточно знать лишь приблизительную относительную
удельную поверхность (как например, при определении характеристик
углей и других природных продуктов), метод определения теплоты
смачивания вполне пригоден [8]. Петика и др. [9] подчеркивают, однако,
что для микропористых адсорбентов удельные поверхности,
определенные из теплот смачивания и изотерм адсорбции, могут быть
совершенно различными.
Второй метод определения абсолютных величин удельных
поверхностей включает следующие операции. Сначала твердое тело
приводится в равновесие с насыщенным паром. Молярная свободная энергия
Поверхность раздела твердое тело — газ
419
I
Рис. ХН-2. Ограничение скорости растворения вследствие
диффузии вещества через пограничную пленку. U^»-l
адсорбированного вещества должна быть такой же, как у чистой
жидкости. Разумно предположить, что поверхностная энергия EL
поверхностей раздела адсорбированная пленка — пар и жидкость — пар
одинакова (вообще говоря, если исходить из законов термодинамики, это
допущение не совсем правильно). Обратите внимание, что по своей
природе адсорбированная пленка является дуплексной, т. е.
поверхности раздела пленка — пар и пленка — твердое тело различны. Если
теперь исследуемый образец погрузить в чистый жидкий адсорбат,
поверхность раздела пленка — пар исчезнет. При этом выделится
теплота, соответствующая AEL, откуда можно найти А.
Гаркинс и Юра [5] успешно применили этот метод к системе ТЮг—
НгО. Отметим, однако, что на практике применение этого метода
сопряжено с рядом трудностей: если адсорбированная пленка толстая,
необходимо принимать во внимание возможность капиллярной
конденсации между частицами, а если пленка тонкая, ее поверхностная
энергия значительно отличается от поверхностной энергии
адсорбирующейся жидкости.
В заключение отметим, что мы приводим критические замечания
относительно тех или иных методов определения удельной поверхности
лишь для того, чтобы подчеркнуть, что к обычным утверждениям типа
«используемый метод дает абсолютную удельную поверхность» надо
относиться весьма осторожно.
В. Скорость растворения
Среди различных методов определения удельной поверхности особое место
занимает метод определения поверхности растворимых материалов по скорости их
растворения. Можно ожидать, что при данной температуре начальная скорость растворения
пропорциональна удельной поверхности. Это предположение экспериментально
проверено на образцах каменной соли [10]. При растворении важное значение имеют
скорости как прямого (Rf), так и обратного (Rb) процессов (т. е. процессов растворения
и осаждения):
Rf = —d (NaCl)/df = ki\t (XIII-3)
Rb = d (NaCl)Att = *2AaNaCi, (XIII-4)
где flNaci — активность растворенной соли. Используя одиночный кубик соли, можно
связать А с массой остающейся соли W, поскольку образец сохраняет приблизительно
кубическую форму даже при значительном растворении. Если образец омывается
стационарным потоком воды, процесс растворения довольно точно описывается
выражением для Rf. При растворении в постоянном объеме воды скорость процесса
определяется алгебраической суммой Rf и Rb. Пользуясь этими данными, можно оценить
удельную поверхность порошкообразных образцов.
Константы скоростей реакций k\ и k2, вообще говоря, зависят от степени
перемешивания, хотя их равновесное отношение, конечно, остается постоянным Скорость
определяющей стадией процесса растворения, по-видимому, является диффузия через
пограни тп>ю пленку жидкости. Как показано на рис. XIII-2, жидкие слои,
находящиеся вблизи образца, характеризуются очень низкой скоростью диффузии по нормали к
его поверхности. Концентрация в слое, примыкающем к образцу, равна
концентрации насыщенного раствора С0. На некотором расстоянии от поверхности т
концентрация практически не отличается от концентрации в объеме раствора С. В об-
27*
4 С,
I
420
Глава XIII
щем случае скорость растворения определяется скоростью диффузии растворенного
вещества в направлении градиента концентрации С0—С:
#полн = —АШС/dx = DA (C0 - С)/т. (ХШ-5)
Из сравнения этого уравнения с уравнением (ХШ-3) и (XIII-4) следует, что ki =
= DC0/t и k2=DJT:. Толщина т и, следовательно, k\ и k2 зависят от скорости
перемешивания. Эмпирически найдено, что при растворении в потоке жидкости т связано с
линейной скоростью потока v соотношением [11]
x = (a/v)\ (XIII-6)
где а и п — постоянные. Данные по скоростям растворения NaCl и КС1 представлены
в работе Здановского [12]. Более полная теория процесса диффузии развита
Купером [13].
Измерение скорости растворения позволяет найти величину, которую можно
отождествить с общей площадью растворимых порошков. На самом же деле это площадь
поверхности однородной пленки, толщина которой равна нескольким микронам, но, по
существу, довольно неопределенна. Поэтому при такой оценке поверхности
микрошероховатости не учитываются.
Замедленность стадии растворения может наблюдаться в тех случаях, когда
поверхность растворяется в результате химической реакции. По-видимому, именно
такая ситуация имела место при определении скорости растворения кремнезема
плавиковой кислотой [14]. Сначала определялась скорость растворения стержней из
кремнезема с измеренной площадью сечения, а затем этим же методом определялась
скорость растворения порошкообразных образцов. Скорость перемешивания практически
не влияла на скорость растворения кремнезема Более того, удельная поверхность
образцов, найденная этим способом (около 0,5 м2/г), хорошо согласуется с величиной,
оцененной по изотермам адсорбции. Таким образом, если скоростьопределяющей
стадией является реакция коррозии поверхности, скорость растворения характеризует всю
поверхность, включая неоднородности поверхности молекулярного масштаба. Ясно
также, что при использовании метода растворения для каждой исследуемой системы
прежде всего необходимо определить, какая стадия определяет скорость процесса в целом.
Г. Электрохимический метод определения удельной поверхности
' При погружении инертного металлического электрода, например
серебра или платины, в раствор электролита, например разбавленную
серную кислоту, на электроде устанавливается более или менее
воспроизводимый начальный потенциал, который можно измерить с
помощью чувствительного катодного вольтметра. Если теперь через
систему пропускать небольшой ток плотностью несколько микроампер
на квадратный сантиметр, потенциал электрода повысится до
некоторого нового постоянного значения.
Боуден и Ридил [15] нашли, что кривая заряжения, т. е.
зависимость потенциала электрода от времени пропускания постоянного
тока, почти линейна и описывается зависимостью
—£=fy + canstf (XIII-7)
где q — заряд, прошедший через электрод, равный произведению тока
на время, или количество активного вещества на поверхности
электрода. Линейность кривой заряжения, по существу, означает постоянство
емкости двойного слоя. Таким образом, при переходе от одной
системы к другой k должна меняться пропорционально площади электрода
{16], а отношение величин k для двух электродов дает отношение их
удельных поверхностей. Приняв геометрическую и истинную
поверхности жидкой ртути одинаковыми и, таким образом, установив k,
Боуден и Ридил показали, что для твердых металлов истинная поверхность,
как правило, значительно выше кажущейся, или геометрической,
поверхности. Для платинированной платины отношение двух площадей
равно 1830. Более подробно этот метод описан в работах [17—19].
Авторы работы [20] определили поверхность платинированной
платины двумя методами — электрохимическим и БЭТ (см. гл. XIV,
разд. XIV-5) — и нашли, что оба метода очень хорошо согласуются
между собой.
Поверхность раздела твердое тело — газ
42 Г
Д. Ртутная порометрия
В описываемом ниже косвенном методе определения удельной
поверхности используется распределение пор по размерам в пористых,
материалах или прессованных порошках. Этот широко применяемый
метод основан на одном из фундаментальных уравнений химии
поверхностей, а именно уравнении Лапласа [гл. I, уравнение (1-7)].
Напомним, что еще в 30-х годах Бартелл и др. [21] использовали уравнение
Лапласа для определения среднего радиуса пор по входному давлению
смачивающей жидкости в пористую перегородку (гл. VII, разд. VII-4B).
Наиболее удобный метод нахождения истинного распределения пор
по размерам предусматривает вдавливание в пористое тело несмачива-
ющей жидкости, в частности ртути [22], краевой угол которой на
многих поверхностях приблизительно одинаков (например, на стекле
краевой угол ртути 140°). При этом, если все поры исследуемого образца
равнодоступны, заполняются только те поры, для которых
r>2v|cosG|/P. (XIII-8)
Таким образом, при увеличении давления ртути заполняются все
меньшие и меньшие поры, пока наконец ртуть не заполнит весь
объем пор.
Риттер и Дрэйк [22, 23] разработали специальный прибор —
ртутный поромер, позволяющий установить распределение пор по
размерам; твердый пористый образец помещают в дилатометр (ампула с
длинным узким горлом) и вакуумируют. После этого дилатометр
заполняют ртутью и помещают в заполненную азотом* толстостенную
бомбу, рассчитанную на давление выше 3500 атм. Поскольку ртуть
вдавливается в поры исследуемого образца, по мере повышения
давления уровень ртути в трубке дилатометра снижается, а
сопротивление проволоки, натянутой вдоль оси трубки, увеличивается. Если
сопротивление проволоки было предварительно откалибровано,
нетрудно рассчитать объем вдавленной ртути. Ртутный поромер подробно
описан, например, Уинслоу и Шапиро [24].
Обработка экспериментальных данных, т. е. данных о зависимости
объема вдавленной ртути от давления, проводится следующим образам.
Пусть dV представляет собой объем пор радиусом от г—dr до г.
Тогда dV связано с г некоторой функцией распределения пор по радиусам
D(r):
dV=D(r)dr. (XIII-9)
При постоянных 0 и у (известно, что краевой угол зависит от
давления слабо) из уравнения Лапласа получаем
Pdr+rdP=0, (XIII-I0)
что вместе с уравнением (XIII-9) дает
dV =D (r) {rIV) dP =D (г) (2у cos G/P2) dP (XIII-11)
или
D(r) = (Pjr)dV/dP. (XIII-12)
Таким образом, D(г) определяется наклоном кривой зависимости V
от Р. Некоторые наиболее наглядные данные порометрического
анализа приведены на рис. XIII-3. Распределение объема пор по радиусам
можно рассчитать также по десорбционной ветви изотерм адсорбции
в области капиллярной конденсации (см. гл. XIV, разд. XIV-16).
Джойнер и др. [25] показали, что, если исследуется древесный уголь,
оба метода дают очень близкие результаты (рис. XIII-4).
*В настоящее время более широкое распространение получили гидростатические
ртутные поромеры, полностью заполненные жидкостью — Прим. перев.-
422
Глава ХШ
1,50
1.00
0,50
0,00
Ч-^L
/о
J
oV
о \
Я °
\
1
\/
о \
^ п
о >^|
О]
——• 1
гооо шо бодо
Радиус nopt A
8000 10000
Рис. XI1-3. Дифференциальные кривые распределения пор по радиусам, найденные
методом ртутной порометрии [23].
/ — кизельгур, 2 — ультратонкий стеклянный фильтр.
В основу приведенной выше теории ртутной порометрии, по
существу, положена следующая модель: пористое тело представляет собой
пучок капилляров различных размеров. Тот факт, что в
действительности в пористом теле каналы взаимосвязаны, по-видимому, не вносит
существенной ошибки, если все поры равнодоступны [26]. Последнее
означает, что в пору данного размера ртуть всегда должна входить
через такую же или более широкую пору. Однако возможна и
альтернативная ситуация, когда в широкую пору можно пройти только через
узкую пору или сужение (рис. ХШ-5). Такие «бутылкообразные»
поры ртуть не может заполнить до тех пор, пока давление не
поднимется до величины, соответствующей радиусу сужения. По достижении
этого давления пора заполняется вся сразу, что приводит к
значительному завышению кажущегося объема пор, радиус которых
соответствует радиусу сужений. Наличие «бутылкообразных» пор является
одной из причин гистерезиса, нередко наблюдаемого при сбрасывании
со'
i
OflOZ
0,001
пппп
f\
р\
1 \
L 4
yv
/°V
/ 4
1 /
1 l-f
/ /Л
/ /
/ /
/ /
/ 1
\ /
J /
1/
i
J
—о— 2
<&
^4
N t\
\ \\
\ *A
V Л
\ \
ч Л
V44n
^r^
^"■■P-^HJ
iOO 200
Padf'C nop, A
300
Рис. XIII-4. Кривые распределения пор по радиусам, рассчитанные по кривым
вдавливания ртути при краевых углах 140 и 130°, и кривая распределения, найденная по
изотермам адсорбции азота на угле [25].
/ — изотерма адсорбции азота, удельная поверхность 65,8 м2/г; 2 — данные порометрии (9 = 130°)
64,5 м2/г; 3 —данные порометрии (0 = 140 °С), 42 2 м2/г. Удельная поверхность определена по
хметоду БЭТ.
Поверхность раздела твердое тело— газ
423
Рис. XIII-5. «Бутылкообразная» пора.
давления. При понижении давления ртуть выходит из входного
капилляра, однако в широкой части она остается запертой, как в ловушке.
Поэтому прямой и обратный ходы зависимости V от Р обычно не
совпадают [27]. Значительный гистерезис кривой вдавливания ртути
наблюдается, например, на активных углах (рис. ХШ-6). Общее число
«бутылкообразных» пор можно оценить по конечной точке кривой
обратного хода; оно может составлять незначительную долю общего
объема пор (алюмосиликатный гель) и достигать 80% этого объема
(активный уголь).
Е. Другие методы оценки удельной поверхности
В настоящее время разработан ряд самых различных методов оценки удельной
поверхности, включая прямой микроскопический или электронно-микроскопический
анализ. Степень кристалличности порошков и, следовательно, размер частиц можно
оценить по диффузности рентгенограмм *[27а]. Для исследования структуры пористых тел
довольно широко применяют методы, основанные на измерении проницаемости. Хотя
эти методы не имеют прямого отношения к теме этой книги, их все же стоит
рассмотреть хотя бы вкратце. Представим пористую среду в виде пучка капилляров. Тогда,
согласно закону Дарси (1956 г.), объемная скорость вязкого течения через эту среду
должна быть пропорциональна градиенту давления:
Q = (гЧ/8ц) (АР//) = К (ЛАР/г]/), (XIII-13)
где Q — объемная скорость течения, г — радиус капилляров, А — общая площадь
поперечного сечения образца, / — длина капилляров, ДР — перепад давления на образце,
т] — вязкость жидкости. Коэффициент К называется коэффициентом проницаемости
среды.
При использовании уравнения (XIII-13) г принимают пропорциональным объему
свободного пространства (т. е А 1г, где е — пористость образца), деленному на
площадь поверхности пор. Таким образом,
г«*в/[Л0(1-в)Ь
(ХШ-14)
s?
I
I
0,75
0,6
0А
0,2
0
1,75 КО
85,360 1066
•О
I
г**-*
г
в^р#**-^
о /
• 2
280 420 560
Давление, ашм
5U 35S 0 266
fluiM'>mp nop, A
700
Рис. ХШ-6. Гистерезис кривых вдавливания ртути при циклическом увеличении и
сбрасывании давления [27].
/ — активный уголь; 2 — алюмогель; подъем давления, — сброс давления.
424
Глава XIII
где Ao=Al(l—е) — удельная поверхность частиц, образующих пористое тело.
Предположим далее, что эффективная, или открытая, площадь пор равна еА, тогда из
уравнений (XIII-13) и (XIII-14) получаем следующее выражение для /С:
К = 4" (^о)2[в2/(1 - е)2]. (ХШ-15)
Более детальный анализ уравнений проницаемости приведен в работах Козени
[28], Кармана [29] и Коллинза [2]. Очевидно, что на результаты оценки А0 по К
влияет топология пористой системы. Таким образом, точность данного метода зависит от
адекватности применяемой^ модели. Баррер [30] и Краус [31] вывели подобные
уравнения также для течения газа.
Хотя результаты, полученные различными методами, могут серьезно различаться,
было бы несправедливо дать им общую отрицательную оценку. Как видно из
приведенных в табл. XIII-2 данных Эммета [32] для окиси цинка, совпадение между
результатами определений, проведенных разными методами, может быть вполне
удовлетворительным.
Таблица XIII-2
Результаты определения размеров частиц окиси цинка различными методами [32]
Удельная поверхность по адсорбции азота при
—195°С, м2/г
Средний размер частиц, мкм
Подсчет частиц под микроскопом
По адсорбции метилстеарата
Подсчет частиц под ультрамикроскопом
По проницаемости
По адсорбции азота
Образец
F-1601
9,48
0,21
0,19
0,135
0,12
0,115
К-1602
8,80
0,25
0,24
0,16
0,15
0,124
G-1603
3,88
0,49
0,55
0,26
0,25
0,28
3. Структура и химическая природа твердой поверхности
В предыдущем разделе мы вкратце рассмотрели основные
макроскопические характеристики твердого адсорбента. Мы обсудили, что
такое удельная поверхность и распределение пор по размерам в
пористом адсорбенте. Для полного описания адсорбента, кроме того,
важно как можно больше знать о микроскопической структуре
поверхности. В этом отношении очень информативными являются
современные спектроскопические и дифракционные методы, о которых
говорилось в гл. V, разд. V-5. Определенную ценность представляет также
статистическое распределение энергии центров адсорбции (см. гл. V,
разд. V-4T и гл. XIV, разд. XIV-14). В некоторых случаях важную
роль играют рассмотренные в разд. V-4 крупномасштабные
поверхностные структуры, обусловленные поверхностными дефектами и
дислокациями.
Состав и химическое состояние поверхности имеют очень важное
значение, особенно в гетерогенном катализе, когда, как правило,
используются смешанные поверхности. Поскольку в катализе широко
применяются переходные металлы, целесообразно определить их
валентное состояние в изучаемой системе. Наиболее вероятное
валентное состояние переходных металлов определяют по магнитной
восприимчивости [33], электронному парамагнитному резонансу [34] и
спектрам поглощения рентгеновских лучей, тонкая структура которых
зависит от химической природы среды, окружающей ионы металла [35].
Ионы переходных металлов характеризуются наличием низких
энергетических электронных состояний, обусловленных расщеплением
уровней d-электронов, характер которого зависит от заряда иона и
симметрии возмущающего поля ближайшего окружения. Вследствие
Поверхность раздела твердое тело— газ
425
этого полезную информацию об энергетическом состоянии переходных
металлов дают также спектры поглощения видимого света [36—38].
На поверхностях многих твердых тел имеются посторонние атомы и
группы, настолько тесно связанные с этими поверхностями, что их уже
нельзя рассматривать как адсорбированные. Так, адсорбционные
свойства сажи в значительной мере определяются частичным окислением
поверхности (гл. VII, разд. VII-3A). В зависимости от условий
обработки окисленная поверхность может быть кислой или основной [39].
Существенное влияние на адсорбционные свойства саж оказывает
расположение углеродных колец [40]. Серьезные дискуссии вызывает
химическая природа кислотных центров алюмосиликатных
катализаторов. Основная проблема здесь заключается в определении типа
кислотности этих центров, т. е. являются ли они кислотами Бренстеда
(доноры протонов) или Льюиса (акцепторы электронов). Имеющиеся
данные не позволяют сделать однозначный выбор, хотя ИК-спектры и
указывают на наличие на поверхности гидроксильных групп [41].
4. Природа комплексов типа твердый адсорбент —- адсорбат
Прежде чем в следующих двух главах приступить к подробному
обсуждению физической и химической адсорбции, имеет смысл в
общих чертах рассмотреть, каким образом можно оценить химический
состав и структуру комплексов твердое тело — адсорбат. Обычно при
рассмотрении адсорбции считают, что поверхность адсорбента инертна.
Это не совсем правильно, так как при адсорбционном взаимодействии
ни адсорбат, ни адсорбент не остаются неизменными, и в этом смысле
можно говорить об образовании комплексов между адсорбентом и ад-
сорбатом. Фактически адсорбция определяется тремя факторами:
1) влиянием адсорбента на молекулярную структуру адсорбата,
2) влиянием адсорбата на структуру адсорбента и 3) образованием
непосредственной связи или локальным взаимодействием между
центрами адсорбции и адсорбатом.
А. Влияние адсорбции на свойства адсорбата
В соответствии с законами термодинамики и статистической
механики внутренняя энергия и энтропия молекул в адсорбированном и
газообразном состоянии должны различаться, даже если не принимать
во внимание энергию образования адсорбционных связей или
изменение энтропии вследствие фиксации молекул адсорбата в
адсорбированном слое. Ясно, например, что адсорбированная молекула частично
или полностью теряет вращательные степени свободы.
Поэтому представляется целесообразным хотя бы в общих чертах
рассмотреть основы статистико-механической оценки энергии и
энтропии вращения, тем более что это пригодится в дальнейшем.
Согласно принципу Больцмана, средняя по достаточно длительному
промежутку времени энергия молекулы определяется выражением
2>а ?:gfiii S}
t./kT
8=l>r=w^' (ХШ-'6)
У
где суммирование проводится по всем возможным энергетическим
состояниям 8j, a gj — статистический вес /-го состояния. В статистической
термодинамике доказывается, что средняя по достаточно длительному
промежутку времени энергия молекулы равна мгновенной средней
энергии для системы таких молекул. Средняя молярная энергия си-
426
Глава XIII
стемы Е принимается равной We. Уравнение (XIII-16) можно записать
как
E=RT2dlnQ/dT, (XIII-17)
где Q — статистическая сумма, равная знаменателю в уравнении
(XIII-16). Тогда теплоемкость системы определяется выражением
Cv=(dE/dT)v=(R/T2) (д2 In Q/3 (1/Г)2). (ХШ-18)
Отсюда можно найти энтропию
т
S = f Cvd lnT=E/T + R In Q, (XIII-19)
о
если считать, что при OK она равна нулю. Поскольку свободная
энергия Гсльмгольца А равна Е—TS, энергия А связана с суммой по
состояниям стедующим выражением:
А = — #71nQ. (XIII-20)
Вращательная энергия жесткой молекулы определяется
выражением
J(J+l)h2/8n4kT,
iii J — квантовое число и / — момент инерции. Если расстояние
между -нергетическими уровнями мало по сравнению с kT, то при расчете
суммы по состояниям для вращательных степеней свободы Qrot
вместо суммирования можно использовать интегрирование. В результате
получаем
Qltl = (l/na) (8кЧкТ/Н,2)*/2, (ХШ-21)
Уравнение (ХШ-21) описывает молекулу, имеющую п независимых
вращательных степеней свободы и момент инерции /, который для
асимметричной молекулы равен главному моменту инерции.
Величина а называется числом симметрии и характеризует число
неразличимых состояний, в которые молекула может попадать при вращении.
Вращательная энергия и эчтропия равны
Evoi=nRT/2,
Srot =R [In [(1,rox) (8n4kT/h2)n/2\ + n/2\. (XIII-22)
Момент инерции молекулы в среднем составляет около 10~39 г-см2.
Принимая эту величину за единицу, молекулам бензола, азота и
аммиака можно приписать значения /, равные соответственно 18, 1,4 и
0,28 г-см2. Для газообразного бензола при 25°С а=6, п=3 и Srot~
^21 кал/моль-град. Адсорбированная молекула теряет эту энтропию
полностью, если она не вращается, или частично, если она сохраняет
способность вращаться только вокруг единственной оси. (Последний
случай имеет место, когда молекула бензола лежит плоско на
поверхности адсорбента). Вращательная энергия паров бензола
составляет 0,88 ккал/моль. При адсорбции эть чергия также полностью или
частично освобождается либо переходит к -солебательную энергию.
При средних температурах колебатель.1 »с состояния молекул
достаточно разделены между собой и поэтом} не восенг существенного
вклада в энтропию и энергию малых молекул. Однако при высоких
температурах изменения внутренней энергии и энтропии молекул могут
обусловливаться изменениями колебательных степеней свободы при
адсорбции. В то же время ясно, что даже при физической адсорбции
молекулы адсорбата на поверхности должны быть поляризованы (см.
гл. VI, разд. VI-3B). К еще более заметным изменениям энергетическо-
Поверхность раздела твердое тело — газ
Л '7
го состояния молекул адсорбата должца проводить хемосорбция. Таким
образом, адсорбция влияет не только на вненпюю, но и на внутреннюю
энергию адсорбированных молекул.
Ценные сведения об энергетическом состоянии адсорбированных
молекул дает ИК-спектроскопия [43, 44]. Примером может служить
работа Блайхолдера и Ричардсона [45] по адсорбции аммиака на
активированной окиси железа. Авторы нашли, что при адсорбции
полосы при 3,0 и 6,1 мкм слегка сдвигаются (3,1 и 6,3 мкм). При этом
заметно меняется отношение интенсивностей этих полос. Если бы на
поверхности происходило образование ионов аммония, то можно было
бы ожидать появления полос при 3,4 и 6,9 мкм. Таким образом,
основываясь на экспериментальных данных, можно предполагать, что
аммиак адсорбируется не в виде ионов, хотя адсорбция, вероятно,
сопровождается образованием водородных связей. Форма полос ИК-
спектра показывает также, что молекулы адсорбированного аммиака
утрачивают вращательные степени -свободы. При совместной
адсорбции воды и аммиака в спектре появляются характерные
полосы ионов аммония. На рис. XIII-7 приведены ИК-спектры
поверхностей различных образцов кремнезема. Полосу при 3700 см-1 в спектре
высушенного кремнезема приписывают одиночным поверхностным гид-
роксильным группам. При гидратировании поверхности интенсивность
широкой полосы при 3400 см-1 растет, и, следовательно, ее можно
отнести к адсорбированным молекулам воды.
Интересно, что те линии ИК-поглощения, которые по соображениям
симметрии запрещены для свободных газовых молекул, могут появиться
fe ИК-спектре, если эти молекулы адсорбированы. Так, Шеппард и Иетс
[47] нашли, что при адсорбции метана и водорода на стекле в их
спектрах появляются полосы, запрещенные в нормальном газообразном
состоянии. Это означает, что при адсорбции происходит некоторое
понижение симметрии молекул. Форма отдельных полос спектра метана
указывает на уменьшение вращательных степеней свободы. При адсорбции
азота на никеле в ИК-спектре поглощения появляется полоса,
отвечающая запрещенному в нормальных условиях валентному колебанию связи
N—N (рис. XIII-8). Появление этой полосы и полос молекул,
содержащих изотопы азота, свидетельствует об отсутствии диссоциации молекул
азота на атомы.
Приведем еще несколько примеров успешного применения ИК-
спектроскопии. По скорости исчезновения полосы поглощения окиси
Рис. XIII-7 Спектры Si02, взвешенного
в ССЦ [46]:
а — Si02, высушенный при 750 °С; б — гидратирован-
ный Si02. (С разрешения Am. Chem. Soc.)
CVj
53
*:
У
*c
Cj
5»,
с?
Си
■§•
--ч
_
_
1
\
II
1
1
г
"' ^~
la
r
i
—' 1
i
4000 3500 3000
Волновое число, см~1
428 Глава XIII
Рис. ХШ-8. Спектр смеси 14N2, 15N2
и l4N2—15N, хемосорбированной на
никеле [44]. (С разрешения Am
Chem. Soc.)
углерода и скорости появления полосы двуокиси углерода Йетс [48]
смог проследить за окислением окиси углерода, хемосорбированной на
золоте. Квирк и др. [49] приводят ИК-спектры соединений типа
комплексов пиридина с глинами. В работе Цетлемойера и др. [50]
исследованы различные формы воды, адсорбированной на частично гидро-
фобизованных кремнеземах.
Изучение адсорбатов можно также проводить методом
комбинационного рассеяния, который в некоторых случаях менее чувствителен к
типу адсорбента, чем обычная ИК-спектроскопия i[51]. He так давно
стало возможным получать микроволновые спектры адсорбированных
молекул. Достоинством последнего метода является то, что даже очень
слабое торможение вращения приводит к заметному уширению линий
спектра.
На различия между энергетическими состояниями и, следовательно, внутренней
энергии молекул на поверхности адсорбента и в газовой фазе указывает также
изменение электронного спектра поглощения во времени. Так, по данным Лефтина и
Холла [52], при адсорбции а-метилстирола на алюмосиликатном катализаторе появляется
новая полоса поглощения при 400 нм. Появление этой полосы авторы связывают с
образованием карбоксильных ионов. При менее специфических взаимодействиях адсор-
бата с адсорбентом влияние адсорбции на электронные спектры значительно слабее.
Исследуя адсорбцию бензола и других ароматических соединений на аэросиле (одна
из марок кремнеземов), Киселев и др. ([53] наблюдали сдвиги полосы от 200 до
300 см-1 (около 700 кал/моль) в более длинноволновую область УФ-спектра.
Леермакерс и др. [53а] провели обширное исследование спектров и фотохимии
адсорбированных органических соединений. Следует отметить, что пики поглощения
дают только разность энергий основного и возбужденного состояний. Таким образом,
даже относительно малые смещения этих пиков могут отражать большие, но
параллельные изменения абсолютной энергии двух указанных состояний. Иными словами, сдвиги
пиков поглощения при адсорбции могут указывать на значительные изменения энергии
основных состояний. Как и потеря вращательной энергии, эти изменения вносят
определенный вклад в теплоту адсорбции. Спектры электронного парамагнитного
резонанса динитрозо-грег-бутила, адсорбированного на алюмосиликате, показывают изменение
адсорбата при его взаимодействии с поверхностью [54].
Рассмотренные внутримолекулярные изменения адсорбата при
адсорбции играют доминирующую роль при низкой степени заполнения
поверхности, когда расстояния между адсорбированными молекулами
относительно велики. При высоких степенях заполнения и, конечно,
при полимолекулярной адсорбции важную роль играет также
межмолекулярное взаимодействие в адсорбированной пленке. При
полуэмпирическом описании взаимодействие адсорбат — адсорбат выражают
в виде зависимости потенциальной энергии молекул адсорбата от
расстояния между ними. Эти методы рассматриваются в следующей
главе (разд. XIV-10). Здесь же мы ограничимся лишь
экспериментальными методами исследования состояния адсорбированного слоя.
К таким методам относится, в частности, ядерный магнитный
резонанс (ЯМР). Теория и методы измерения спектров адсорбированных
веществ подробно описаны в работе О'Рейли [55]. Результатам
адсорбционных исследований с применением ЯМР посвящен обзор Ри-
зинга [56]. Спектры ЯМР можно получать лишь на атомах, имеющих
V
г
. 1 1
1 1 1 I
Т
1 1 .1 1
ММ И
'Ч
i i i i i
2100 2060 2020
Волновое число, см'1
Поверхность раздела твердое тело — газ
429
Ю'6
ю~7
Ь? Ю-8
ю-9
Ю'10
W'J Ю'2 КГ* 10°
x/m, eHzO/zSiOz
Рис. XIII-9. Времена корреляции протонов при адсорбции воды на силикагеле [61].
ненулевой магнитный момент ядер. Поэтому применение этого метода
в адсорбционных исследованиях ограничивается главным образом ад-
сорбатами, содержащими атомы водорода, фтора, натрия, алюминия
и кремния. Кроме того, ширина линий спектра ЯМР определенным
образом связана с химическими сдвигами при адсорбции. В
отношении времен релаксации и ширины линий наиболее интересными, по-
видимому, являются работы по ЯМР протонов, преимущественно воды.
Брей и Лоусон [57] исследовали изменение ширины линий ЯМР и
времени релаксации протонов в зависимости от степени заполнения и
температуры при адсорбции воды, метанола и т. п. на окиси тория. Если
н-декан адсорбируется на сфероне или алмазе, ширина линии первого
адсорбированного слоя очень велика, но при адсорбции третьего и
последующих слоев эта полоса расщепляется [58] на ряд узких линий.
Поскольку узкая линия ЯМР указывает на достаточно высокую
подвижность, приводящую к усреднению локальных магнитных полей,
авторы считают, что расщепление линии свидетельствует о высокой
подвижности молекул, находящихся выше второго слоя. Время
релаксации в продольном (Т{) и поперечном (Т2) направлениях можно
связать с временной корреляцией t [59], которая приблизительно равна
времени, требуемому для поворота молекулы на один радиан или ее
перемещению на расстояние, сравнимое с собственными размерами.
Ризинг и др. [60] показали, что для воды, адсорбированной на
древесном угле, t аппроксимируется выражением To^Q/JiT, где т0 составляет
3-Ю-23 с и Q равно 12 ккал/моль. Полученные этими авторами спектры
ЯМР указывают на присутствие более чем одной формы
адсорбированной воды. По данным Циммермана и Лазатера [61], при
заполнении поверхности выше 0,5 вода, адсорбированная на силикагеле, при-
I I I I , М| I 1 l 1 1 1!!| 1 1 I I I 1Щ
' i i I i ill
X/m =0,044
9=0,5 0=\1
j i i' i 11 in
_u in
430
Глава XIII
Рис. XIII-10. Зависимость диэлектрической проницаемости паров воды,
адсорбированных на a-Fe203, от относительного давления при постоянной температуре 15 С°
(зачерненные точки соответствуют десорбции). Монослойнаи адсорбция завершается при
/>/ро — о,1. при Р/Р° —0,8 поверхность покрыта несколькими слоями адсорбированной
воды [63].
сутствует в двух формах. Зависимость временной корреляции протонов
от заполнения поверхности силикагеля водой, представленная на
рис. ХШ-9, показывает, что подвижность молекул на поверхности
резко возрастает вплоть до предполагаемой точки монослойного
заполнения. Возможность установления фазового состояния может быть
основана на том, что для воды при 25 °С t составляет К)-11 с, тогда как
для льда (или «твердой» воды) оно равно приблизительно 10~5 с.
Следовательно, если исходить из данных рис. ХШ-9, то можно
предположить, что при 8<0,5 адсорбированная вода находится в состоянии,
подобном твердому, а при 6>1 —в состоянии, -подобном жидкому. Спектр
ЯМР этилена, адсорбированного на цеолите, указывает на изменение
химического состояния адсорбата. Авторы работы [62] сравнили
сдвиги линии в спектрах ЯМР со сдвигами полос в ИК-опектрах
поглощения и объяснили появление первых деформацией структуры
адсорбированных молекул.
Теперь обратимся к совершенно иному методу — определению
диэлектрической проницаемости адсорбированных пленок, который тем
не менее дает результаты, близкие к результатам метода ЯМР. На
рис. XIII-10 показана зависимость диэлектрической проницаемости
адсорбированной воды от степени заполнения поверхности a-Fe203 и
частоты. По частотной зависимости диэлектрической проницаемости,
особенно комбинируя эту зависимость с диэлектрическими потерями,
можно оценить характерное время релаксации т. По существу, т — это
время перемещения или переориентации молекул, вызванных
изменением электрического поля. В рассматриваемом случае т меняется
приблизительно от 1 с (при монослойном заполнении) до 10~4 с (при
полимолекулярной адсорбции) [63]. Поскольку это характерное время
оказалось значительно больше, чем для нормальной воды (10~10 с),
авторы сделали вывод, что адсорбированная вода, подобно льду,
структурирована вследствие интенсивного образования водородных связей.
К подобным выводам пришел и Эберт [64], исследовавший
диэлектрическую проницаемость воды, адсорбированной на окиси алю-
Поверхность раздела твердое тело — газ
431
миния. Аммиак, адсорбированный на викоре, также имеет структуру,
подобную структуре льда [65].
При рассмотрении моделей адсорбции и анализе энтропии
адсорбции нередко говорят о «подвижной» и «локализованной» адсорбции
(см. гл. XIV, разд. XIV-ЗБ). По аналогии с текучестью объемной фазы
более прямым критерием подвижности адсорбата является
коэффициент поверхностной диффузии. Оценка коэффициентов диффузии по
времени диэлектрической релаксации дает для адсорбированной воды
значительно более низкие значения (Ю-9 см2/с), чем для нормальной
воды (Ю-5 см2/с).
Б. Влияние адсорбата на адсорбент
До сих пор нас в основном интересовало химическое и физическое
состояние адсорбата. Почему бы, однако, не считать, что при
адсорбции меняется не только адсорбат, но и адсорбент? Фактически
адсорбционные свойства системы, особенно термодинамические свойства,
правильнее связывать не с адсорбатом, а со всей системой
адсорбат—адсорбент. В меньшей степени это относится к диэлектрическим
изменениям. Хотя изменениями свойств адсорбента в процессе адсорбции
нередко пренебрегают, некоторые данные указывают на то, что при
взаимодействии с адсорбатом адсорбент далеко не инертен.
Прежде всего вполне вероятно, что при адсорбции неоднородности
и дефекты поверхности обратимо перераспределяются. Как отмечается
в гл. V, разд. V-4B, присутствие адсорбированных молекул должно
приводить к изменению энергии центров адсорбции (рис. V-8). При
температуре выше некоторого критического для поверхностной
подвижности значения распределение центров адсорбции зависит от степени
заполнения поверхности адсорбатом. Кроме того, несколько первых
слоев кристаллической поверхности твердого тела имеют искаженную
структуру (гл. V, разд. V-7). В присутствии адсорбата степень
нарушения структуры поверхностного слоя, конечно, должна меняться,
причем этот процесс не обязательно сопровождается массовым
переносом атомов твердого тела. Имеется ряд данных, которые можно
непосредственно связывать с изменением структуры поверхностного слоя.
Так, Лэндер и Моррисон, исследуя дифракцию медленных электронов
на поверхности германия, пришли к выводу, что при адсорбции иода
имеет место значительная перестройка поверхности. Применив метод
автоэлектронной микроскопии, Эрлих и др. [66] обнаружили, что
структуры поверхности вольфрама при адсорбции и десорбции азота
меняются. Изменения адсорбента при хемосорбции подробно
рассмотрены в обзоре [67]. Получены также некоторые данные,
свидетельствующие о структурной перестройке поверхностей молекулярных
кристаллов при физической адсорбции. При адсорбции я-гексана на льду
такие изменения наблюдаются при температурах выше —35 °С [69].
Как уже отмечалось при обсуждении данных табл. ХШ-1,
наиболее значительные изменения структуры поверхности можно ожидать в
том случае, когда энергия адсорбции сравнима с энергией связей или
молярной поверхностной энергией твердого тела. Это означает, что
при хемосорбции структурной перестройке могут подвергаться даже
поверхности таких твердых тел, как металлы и ионные кристаллы.
В конце концов теплоты хемосорбции (от 10 до 50 ккал/моль) вполне
сопоставимы со значениями Е8', приведенными в гл. II, табл. И-1 [70].
Теплота физической адсорбции близка к теплоте конденсации
адсорбата и не превышает 10 ккал/моль. Поэтому, если не учитывать
относительно небольшие структурные изменения, поверхности твердых тел,
характеризующихся высокой поверхностной энергией (например, угля,
различных металлов и ионных кристаллов) при физической адсорбции
432
Глава XIII
должны быть относительно инертными. Этот вывод, однако, не
распространяется на адсорбцию паров на низкоэнергетических поверхностях
(пластик и молекулярные кристаллы), как в рассмотренном примере
адсорбции я-гексана на льду.
By и Коупланд [71] рассчитали из адсорбционных данных
изменение поверхностных термодинамических свойств адсорбента.
Оказалось, например, что при адсорбции воды изменение энтальпии
сульфата бария сравнимо с теплотой адсорбции самой воды. Таким
образом, если исключить физическую адсорбцию на высокоэнергетических
твердых поверхностях, адсорбат существенно влияет на свойства
адсорбента. Естественно, что этому важному вопросу следует уделять
гораздо больше внимания, чем это делалось до сих пор.
В. Связи между молекулами адсорбата и поверхностью адсорбента
Можно предполагать, что основной вклад в энергию
взаимодействия между адсорбентом и адсорбатом вносят места непосредственного
контакта поверхностных атомов с адсорбированными частицами. Это
относится прежде всего к хемосорбции, в процессе которой, как
правило, образуются действительно химические связи, и в значительной
мере к физической адсорбции. Возможным исключением является
полимолекулярная адсорбция, которую можно рассматривать как
результат проявления слабых дальнодействующих силовых полей. Еще одно
возможное исключение — адсорбция ароматических молекул,
сопровождаемая делокализацией электронов.
Обычно в адсорбционных исследованиях весь тепловой эффект
принято относить к адсорбционным связям, хотя, как показано в
предыдущей части этого раздела, в энергию взаимодействия значительный
вклад могут вносить и другие факторы, менее локальные по своей
природе.
В ряде работ [72—74] образование связей между молекулами
адсорбата и поверхностью адсорбента рассматривается в свете
представлений квантовой механики. Однако развитие квантово-механической
теории адсорбционных связей затруднено из-за отсутствия прямых
экспериментальных данных. Так, до сих пор не известны ни длины
адсорбционных связей, ни такие полосы поглощения в ИК-спектрах,
которые можно было бы приписать этим связям. Отсутствие таких
полос, по-видимому, объясняется тем, что адсорбционные связи слишком
слабы или распределены по многим центрам и поэтому не могут
заметно поглощать в доступной области длин волн. Удачным
исключением, по-видимому, является наблюдаемая при адсорбции водорода на
платине слабая полоса при ~4,7 мкм, приписываемая связи Н—Pt
[75].
При физической адсорбции взаимодействие адсорбата с
адсорбентом значительно слабее, и наблюдать полосы поглощения
адсорбционных связей в этом случае еще труднее. Так, исходя из энтропии
адсорбции, Эверет [76] считает, что в системах типа аммиак — уголь полосы
поглощения адсорбционных связей должны находиться в области
300 мкм (это соответствует примерно 1 ккал/моль). Прочность
адсорбционной связи при физической адсорбции можно оценить, задаваясь
той или иной потенциальной функцией i[77, 78]. Однако для этой цели
удобнее применять различные модели, обсуждаемые в следующей
главе (разд. XIV-10).
5. Упражнения
1. При 25 °С краевой угол воды на монокристалле нафталина составляет 89°, а
величина dQ/dT равна —0,13 град/К. Используя, если необходимо, данные табл. П-1
гл. II, рассчитайте теплоту смачивания порошка нафталина с удельной поверхностью
10 м2/г (см. [79]).
Поверхность раздела твердое тело — газ
433
2. По данным Бартелла и Фу [3], адгезионное натяжение, т. е. ysv—ysL,
поверхности раздела вода — кремнезем составляет 82,8 эрг/см2, а его изменение в
зависимости от температуры составляет —0,173 эрг/см2-К. Теплота смачивания исследуемого
образца кремнезема водой равна 15,9 кал/г. Рассчитайте удельную поверхность
образца в см2/г.
3. Гаркинс и Юра [5] нашли, что теплота смачивания водой образца ТЮ2,
покрытого толстой пленкой адсорбированной воды, составляет 0,409 кал/г. Рассчитайте
удельную поверхность образца ТЮг в см2/г.
4. Используя кривую, проведенную через точки, обозначенные квадратиками на
рис. XIII-4, качественно восстановите график исходной зависимости объема ртути,
вдавленной в поры 1 г образца, от приложенного давления.
5. Изучение тонкодисперсного серебряного порошка под микроскопом показало,
что он состоит из сферических частиц диаметром 1 мкм. Плотность порошка равна
3 г/см3. В субмикроскопическом масштабе поверхность частиц довольно шероховата;
предположим, что контур поперечного сечения частицы имеет вид береговой линии,
изображенной на рис. XII1-1, где левой стрелке соответствует расстояние 0,1 мкм,
а каждое последующее изображение десятикратно увеличено.
Какова ожидаемая удельная поверхность порошка, если а) измеряется скорость
растворения; б) в опытах Гаркинса и Юры адсорбция воды при Р° составляет
8,5 см3(НТД)/г (после адсорбции авторы измеряли теплоту смачивания); в) по
методу Боудена и Ридила измеряются кривые заряжения порошка, спрессованного в
пористый электрод, и г) измеряется скорость течения потока жидкости через
перегородку из спрессованного порошка? Для всех этих случаев дайте численные оценки и
подробно объясните сделанные допущения.
6. Рассчитайте вклад вращательного движения в энтропию бензола,
адсорбированного на угле при 25 °С, предполагая, что на поверхности угля молекула бензола
имеет одну вращательную степень свободы.
7. Рассчитайте вклад вращательного движения в энтропию адсорбции аммиака
на кремнеземе при — 35 °С, предполагая, а) что адсорбированный аммиак сохраняет
одну вращательную степень свободы и б) что он не сохраняет ни одной
вращательной степени свободы. В первом случае атом азота непосредственно связан с
поверхностью.
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Advances in Chemical Physics, Vol. 9, I. Prigogine, ed., Interscience, New York,
1965.
Butler J. A. V., Flectrical Phenomena at Interfaces, Methuen, London, 1951.
Коллинз Р. Е., Течение жидкостей через пористые материалы, М., Мир, 1964.
Межфазовая граница газ — твердое тело, под ред. Э. Флода, М., Мир, 1970.
Gregg S. L, The Surface Chemistry of Solids, Reinhold, New York, 1951.
Hair M. L., Infrared Spectroscopy in Surface Chemistry, Marcel Dekker, New York,
1967.
Hill T. L., Introduction to Statistical Thermodynamics, Addison-Wesley, Reading, Mass.,
1962.
Irani R. R., Callis C. F.t Particle Size, Wiley, New York, 1963.
Ross S., Olivier J. P., On Physical Adsorption, Interscience, New York, 1964.
Saltsburg H., Smith /. N., Jr., Rogers M., eds., Fundamentals of Gas-Surface Interactions,
Academic Press, New York, 1967.
Somorjai G. A., Principles of Surface Chemistry, Prentice-Hall, New York, 1972.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Irani R. R.f Callis C. F., Particle Size, Wiley, New York, 1963.
2. Коллинз P. E„ Течение жидкостей через пористые материалы, М., «Мир»,
1964.
3. Bartell F. E., Fu Y., «The Specific Surface Area of Activated Carbon and Silica», in
Colloid Symposium Annual, Vol. 7, Weiser H. В., ed., Wiley, New York, 1930.
4. Whalen /. W., Wade W. H., J. Colloid Interface Sci., 24, 372 (1967).
5. Jura G., «The Determination of the Area of the Surfaces of Solids» in Physical
Methods in Chemical Analysis, Vol. 2, Berl W. G., ed., Academic Press, New York,
1951.
6. Harkins W. D., Boyd G. E., J. Amer. Chem. Soc, 64, 1195 (1942).
7. Ergun S., Anal. Chem., 24, 388 (1952).
8. Bond R. L., Maggs F. A. P., Fuel, 28, No. 8, 169 (1949).
9. Tyler A. /., Taylor J. A. G., Pethica B. A., Hockey J. A., Trans. Faraday Soc, 67,
483 (1971).
10. Gleeson G. W., J. Chem. Educ, 15, 187 (1938).
11. Boyd G. E., Adamson A. W., Myers L. S., Jr., J. Amer. Chem. Soc, 79, 2836
(1947).
28—1421
434
Глава XIII
12. Здановский А. В., ЖФХ, 25, 170 (1951); Chem. Abstr., 48, 4291с (1964).
13. Cooper A. R., Jr., Trans. Faraday Soc, 58, 2468 (1962).
14. Palmer W. G., Clark R. E. D„ Proc Roy. Soc. (London), A149, 360 (1935); Dar-
mois E., Chim. Ind. (Paris), 59, 466 (1948); Bergman I., Cartwright J.f Bentley R. A.,
Nature, 196, 248 (1962).
15. Bowden F. P., Rideat E. K., Proc. Roy. Soc. (London), A120, 59 (1928).
16. Kortum G., Bockris J. O'M., Textbook of Electrochemistry, Vol. 2, Elsevier, New York,
1951, p. 360.
17. Franck E. U., Biedermann H., Kolloid-Z., 129, 137 (1952).
18. Wiebe A. K., Winkler С. Л., Can. J. Chem., 31, 665 (1953).
19. Wagner C, J. Electrochem. Soc, 97, 72 (1950).
20. Joncish M. J., Hackerman N., J. Electrochem. Soc, 111, 1286 (1964).
21. Bartell F. E., Bartell L. S, J. Amer. Chem. Soc, 56, 2202 (1934).
22. Ritter H. L., Drake L. C, Ind. Eng. Chem., Anal. Ed , 17, 782 (1945).
23 Drake L. C, Ind. Eng. Chem., 41, 780 (1949).
24. Winslow N. M., Shapiro J. J., ASTM Bull., No. 236, p. 39 (1959).
25. Joyner L. G., Barrett E. P., Skold R., J. Amer. Chem. Soc, 73, 3155 (1951).
26. Everett D. #., in The Solid-Gas Interface, Flood E. A., ed., Dekker, New York,
1967.
27. Drake L. C, Ritter H. L., Ind. Eng. Chem., Anal. Ed., 17, 787 (1945).
27a. Yates D. J. C, Can. J. Chem., 46, 1695 (1968).
28. Kozeny J., Sitzbek. Akad. Wiss. Wien, Wasserwirtschaft Math. Nat., Kl. Ha, 136, 271
(1927); Wasserwirtsch., 22, 67, 86 (1927).
29. Carman P. C, Trans. Inst. Chem. Engrg. (London), 15, 150 (1937).
30. Barrer R. M., Discuss. Faraday Soc, 3, 61 (1948); Barrer R. AT, Grove D. M„ Trans.
Faraday Soc, 47, 826 (1951).
31. Kraus G., Ross J. W.t Girifalco L. A., J. Phys. Chem., 57, 330 (1953); see also
Kraus G., Ross J. W., J. Phys. Chem., 57, 334 (1953).
32. ; Emmett P. H., Catalysis, Vol. I, Reinhold, New York, 1954, p. 60.
33. Selwood P. W., Magnetochemistry, Interscience, New York, 1956.
34. O'Reilly D. E.} Maclver D. S., J. Phys. Chem., 66, 276 (1962).
35. Lewis P. #., J. Phys. Chem, 66, 105 (1962).
36. Stone F. S., Chem. Ind., 41, 1810 (1963).
37. Orgel L. E., An Introduction to Transition Metal Chemistry, Butler and Tanner,
London, 1960.
38. Dowden D. A., Endeavour, 24, 69 (1965).
39. Boehm H. P., Advan. Catalysis, 16, 179 (1966).
40. Hefining G. R., Z. Elektrochem., 66, 629 (1962).
41. Basila M. R., J. Phys. Chem., 66, 2223 (1962).
42. Kemball C, Proc. Roy. Soc. (London), A187, 73 (1946).
43. Little L. #., Infrared Spectra of Adsorbed Molecules, Academic Press, New York,
1966.
43a. Hair M. L.f Infrared Spectroscopy in Surface Chemistry, Marcel Dekker, New York,
1967.
44. Eischens R. P., Accts. Chem. Res., 5, 74 (1972).
45. Blyholder G., Richardson E. A., J. Phys. Chem., 66, 2597 (1962); Parfitt G. D.,
Ramsbotham J., Rochester С. H., Trans. Faraday Soc, 67, 841 (1971).
46. Bascom W. D., J. Phys. Chem., 76, 3188 (1972).
47. Sheppard N., Yates D. J. C, Proc Roy. Soc. (London), A238, 69 (1956).
48. Yates D. J. C, J. Colloid Interface Sci., 29, 194 (1969).
49. Olejnik S., Posner A. M., Quirk J. P., Spectrochimica Acta, 27A, 2005 (1971).
50. KUer K, Shen J. H., Zettlemoyer A. C.f J. Phys. Chem., 77, 1458 (1973).
51. Hendra P. J., Turner L D. M., Loader E. L, Stacey M., J. Phys. Chem., 78, 300
(1974).
52. Leftin H. P., Hall W. K., J. Phys. Chem., 66, 1457 (1962).
53. Абрамов В. И., Киселев А. В., Лыгин В. И., ЖФХ, 37, 1156 (1963).
53а. Weis L. D.f Evans Т. R., Leermakers P. A., J. Amer. Chem. Soc, 90, 6109 (1968) and
references therein.
54. Lozos G. P., Hoffman В. М., J. Phys. Chem., 78, 200 (1974).
55. O'Reilly D. E.f Advan. Catalysis, 12, 31 (1960).
56. Resing H. A., Advan. Molecular Relaxation Processes, 1, 109 (1967—1968); ibid., 3,
199 (1972).
57. Brey W. S., Jr., Lawson К D„ J. Phys. Chem., 68, 1474 (1964).
58. Graham D., Phillips W. D., Proc 2nd Int. Congr. Surface Activity, London, Vol. II,
p. 22.
59. Bloembergen N., Pur cell E. M., Pound R. V., Phys. Rev., 73, 679 (1948).
60. Resing H. A., Thompson J. K, Krebs J. J., J. Phys. Chem., 68, 1621 (1964).
61. Zimmerman J. R.t Lasater J. A., J. Phys. Chem., 62, 1157 (1958).
62* Muha G. M., Yates D. J. C.t J. Chem. Phys., 49, 5073 (1968).
63. McCafjerty E., Zettlemoyer A. C.} Discuss. Faraday Soc, 239 (1971).
64. Ebert G, Kolloid-Z, 174, 5 (1961).
65. Lubezky /, Feldman U., Folman M, Trans. Faraday Soc, 61, 1 (1965).
Поверхность раздела твердое тело — газ
435"
66. Ehrlich G.f Hudda F. G., J. Chem. Phys., 35, 1421 (1961).
67. Somorjai G. A., Principles of Surface Chemistry, Prentice-Hall, New York, 1972,,
p. 239ff.
68. Adamson A. W., Orem M. W., Progress in Surface and Membrane Science, Caden-
head D. A., Danielli J. F., Rosenberg M. D., eds., Academic Press, New York, 1974„
Vol. 8.
69. Adamson A. W., Dormant L. M„ Orem M. W., J. Colloid Interface Sci., 25, 206
(1966); Orem M. W., Adamson A. W., ibid., 31, 278 (1969).
70. Ehrlich G., Brit. J. Appl. Phys., 15, 349 (1964).
71. WuY. C, Copeland L. E., Advan. Chemistry Ser. No. 33, 348 (1961).
72. Grimley T. £., Advan. Catalysis, 12, 1 (1960).
73. Dunning W. J., The Solid-Gas Interface, Flood E. A., ed., Marcel Dekker, New York,
1966.
74. Koutecky J., Advan. Chem. Phys., 9, 85 (1965).
75. Pliskin W. A., Eischens R. P., Abstracts of the April 1959 Meeting, American
Chemical Society, Boston.
76. Everett D. #., Proc. Chem. Soc. (London), 1957, p. 38.
77. Steele W. A., Halsey G. D„ Jr., J. Phys. Chem., 59, 57 (1955).
78. Barker J. A., Everett D. #., Trans. Faraday Soc, 58, 1608 (1962).
79. Jones /. В., Adamson A. W., J. Phys. Chem., 72, 646 (1968).
ГЛАВА XIV
Адсорбция газов и паров на твердых телах
1. Введение
Тема этой главы чрезвычайно обширна, поэтому здесь, как и в
предыдущих главах, затрагиваются лишь основные модели и теории,
имеющие самостоятельный интерес или же позволяющие познакомить
читателя с наиболее важными экспериментальными данными.
Как отмечается во введении предыдущей главы, для
феноменологического описания адсорбции используют эмпирическую функцию v =
= f(P, T), где v — количество адсорбированного вещества, чаще всего
в см3 (приведенного к нормальным температуре и давлению)/г
(адсорбента). Обычно экспериментально определяют изотерму адсорбции
v = fT(P), а при более детальных исследованиях подобные изотермы
измеряются при нескольких температурах. На рис. XIV-1
представлены некоторые данные из детальной работы Дрэйна и Моррисона [1].
Эти данные типичны для физической адсорбции: при низких давлениях
адсорбция достигает некоторого предельного значения (рис. XIV-l,a),
но в дальнейшем, по мере приближения давления к давлению
насыщенного пара Р° (для азота при 75 К Я0—1 атм), адсорбция опять
возрастает (рис. XIV-1, б).
Экспериментальные данные можно представить также в виде
зависимостей v от Т при постоянном давлении или в виде зависимости Р
от Т при постоянном v. В первом случае получаем изобары адсорбции,
а во втором — изостеры (см. упражнение 1 к этой главе).
Как уже отмечалось в гл. XIII, адсорбцию принято делить на
физическую адсорбцию и хемосорбцию. При физической адсорбции
равновесие устанавливается очень быстро (если только скорость адсорбции
не ограничивается скоростью массопереноса в газовой фазе или
внутри пористого адсорбента) и обратимо. Считают, что физическая
адсорбция вызывается теми же относительно неспецифическими силами
межмолекулярного взаимодействия, что и конденсация паров. Поэтому
теплота физической адсорбции должна быть близка к теплоте
конденсации. Обычно физическая адсорбция начинает играть важную
роль, лишь когда температура газа понижается ниже критической,
т. е. когда газ находится в виде пара.
Хемосорбция может быть как быстрой, так и медленной и может
протекать при температуре и выше, и ниже критической температуры
адсорбата. От физической адсорбции ее отличает большая
чувствительность к химической природе адсорбента и адсорбата, кроме того,
теплота адсорбции достаточно высока, чтобы ее можно было приписать
образованию химических связей. Хемосорбированное вещество может
с трудом удаляться с поверхности адсорбента, причем десорбция
может сопровождаться химическими процессами. Например, при
термической десорбции кислорода с угля (кислород хемосорбируется на угле
очень прочно) вместо кислорода выделяется смесь окиси и двуокиси
углерода [2]. Поскольку образование химических связей обусловлено
Адсорбция газов и паров на твердых телах
Рис. XIV-1. Изотермы адсорбции N2 на рутиле при низких (а) и высоких (б)
давлениях.
короткодействующими силами, предполагается, что хемосорбция про-
текает лишь в монослое. В то же время, как видно из рис. XIV-1, на
физическую адсорбцию это ограничение не распространяется.
Фактически физическая адсорбция может протекать как поверх хемосорбиро-
ванного монослоя (см. гл. IX, разд. IX-1B), так и параллельно с хе-
мосорбцией. Например, ИК-спектры двуокиси углерода,
адсорбированной на х-окиси алюминия, показывают присутствие на поверхности
адсорбента как физически адсорбированных, так и хемосорбированных
молекул [3].
Хемосорбция нередко протекает довольно медленно со скоростью,,
определяемой наличием некоторого активационного барьера.
Фактически процесс хемосорбции может состоять из двух стадий: сначала
происходит физическая адсорбция газа, а затем он вступает в медленную
химическую реакцию с поверхностью твердого тела. При низких
температурах скорость хемосорбции может быть так мала, что
практически наблюдается лишь физическая адсорбция. При высоких же
температурах физическая адсорбция почти незаметна (вследствие низкой
энергии адсорбции) и имеет место лишь хемосорбция. В качестве
примера рассмотрим адсорбцию водорода на никеле. Изобара этого
процесса схематически изображена на рис. XIV-2. Кривые 1 и 2
показывают соответственно нормальное уменьшение физической адсорбции и
хемосорбции с ростом температуры. В переходной области, кривая 3,
хемосорбция протекает с заметной, хотя все еще небольшой
скоростью. Поэтому в этой области расположение точек определяется
временем, отведенным на установление равновесия. По существу, кривая 3
438
Глава XIV
является неравновесной и при охлаждении в точности не
воспроизводится. В действительности при охлаждении получают некоторую
кривую, находящуюся между кривыми 1 и 4, положение которой
определяется скоростью охлаждения.
Как показано в предыдущем разделе, резкой границы между двумя
типами адсорбции не существует, хотя в предельных случаях они
различаются легко. Правда, большинство экспериментаторов стремятся
отнести свои исследования либо к физической адсорбции, либо к хе-
мосорбции, но это не больше чем условность, отражающая
практические интересы или субъективные взгляды авторов. Во всяком случае,
хотя эта глава посвящена исключительно физической адсорбции,
большая часть изложенного здесь материала в равной степени применима
и к хемосорбции. Пока же мы ограничимся рассмотрением обратимых
адсорбционных процессов, в которых достигается истинное равновесие,
а при десорбции химическая природа адсорбата остается неизменной.
2. Время адсорбции
Очень наглядное представление об адсорбции как о динамическом
процессе дает время адсорбции, которое, согласно де Буру [4],
определяется как время, в течение которого адсорбированная молекула
находится на поверхности адсорбента. Рассмотрим молекулу газа,
приближающуюся к поверхности твердого тела. В отсутствие сил
притяжения между молекулой и твердым телом время, в течение которого
молекула находится вблизи поверхности, должно быть порядка
периода молекулярных колебаний (~10~13 с), а коэффициент аккомодации
должен быть равен нулю. Следовательно, после соударения с
поверхностью молекула сохраняет первоначальную энергию. Последнее
означает, что «горячая» молекула, ударяющаяся о «холодную» поверхность,
должна отражаться зеркально, сохраняя при отскоке свою
первоначальную энергию.
Если между молекулой и поверхностью действуют силы
притяжения, то, согласно уравнению Френкеля (см. i[2]), среднее время жизни
молекулы на поверхности равно
т=т0^/*7\ (XIV-1)
где to — время молекулярного колебания, составляющее от 10~13 до
Ю-12 с, a Q — энергия взаимодействия молекулы с поверхностью, т. е.
теплота адсорбции. Разумно считать, что адсорбция имеет место, лишь
•если т достигает хотя бы нескольких периодов молекулярных
колебаний. При этом между молекулой и поверхностью успевает установиться
тепловое равновесие, и при десорбции молекула покидает поверхность
в направлении, не зависящем от направления ее падения на
поверхность. В этом случае говорят, что коэффициент аккомодации равен
единице.
Рис. XIV-2. Изобара адсорбции в области
перехода от физической адсорбции к хемосорбции.
Адсорбция газов и паров на твердых телах
439
Кроме Q и т, важное значение имеет концентрация молекул на
поверхности Г, определяемая равенством
T=Zt, (XIV-2)
где Z — число молей газа, сталкивающихся с одним квадратным
сантиметром поверхности за одну секунду, а Г измеряется в моль/см2.
Предположим, что коэффициент конденсации равен единице, т. е. что
все молекулы, сталкивающиеся с поверхностью, прилипают к ней. Как
следует из уравнения (XIV-2), при очень низких значениях Q
концентрация газа на поверхности практически не отличается от его
объемной концентрации, следовательно, поверхностный избыток Г| в
уравнении (IX-23), по существу, равен нулю. Собственно, это и показано
в первых двух строках табл. XIV-1, в которой дана классификация ти-
Таблица XIV-1
Классификация типов адсорбции
Q, ккал/моль
0,1
1,5
3,5
9,0
20,0
40,0
Т, с (25 °С)
10-1з
10-12
4.10-п
4. Ю-7
100
1017
Г, моль/см2
0
0
Ю-12
ю-8
Примечание
Отсутствие адсорбции; падающие на
поверхность молекулы отражаются зеркально;
коэффициент аккомодации равен нулю
Область физической адсорбции; коэффициент
аккомодации равен единице
Область хемосорбции
пов адсорбции на основе рассмотренной динамической модели, Как
видно из табл. XIV-1, при средних значениях Q порядка нескольких
ккал/моль Г возрастает до величины, сравнимой с емкостью
монослоя. Эта область соответствует физической адсорбции.
Наконец, если теплота адсорбции Q близка к энергии химических
связей (нижние строки табл. XIV-1), т становится очень велико и,
следовательно, попавшие на поверхность молекулы десорбируются
медленно. В этом случае расчет Г по уравнению (XIV-2) дает чрезмерно
большие, а то и явно абсурдные значения. Дело в том, что в
уравнении (XIV-2) число молекул, упавших на поверхность и прилипших к
ней, приравниваются к частоте столкновений молекул с поверхностью.
Однако по мере заполнения монослоя все большая часть падающих
молекул попадает на занятые участки поверхности и отскакивает, не
успев полностью обменяться с ней энергией. Один из способов учета
этого эффекта связан с применением уравнения Лэнгмюра, которому и
посвящен следующий раздел.
3. Изотерма адсорбции Лэнгмюра
В следующих нескольких разделах рассматриваются различные
модели адсорбции и основанные на них теории. Как уже отмечалось,
адсорбционные данные представляют не только в виде изотерм
адсорбции, однако последние очень удобны для теоретической обработки
данных. Поэтому прежде всего необходимо, чтобы расчетная изотерма
адсорбции совпадала с экспериментальной. Кроме того, теория
должна правильно предсказать изменение теплоты и энтропии адсорбции с
изменением количества адсорбированного вещества. Простого
сопоставления теоретических и экспериментальных изотерм адсорбции в
настоящее время уже недостаточно.
440
Глава XIV
А. Кинетический вывод уравнения Лэнгмюра
Вывод уравнения Лэнгмюра, приведенный в этом разделе, по
существу, не отличается от вывода, данного в работе Лэнгмюра [5]т
опубликованной в 1918 г. Этот вывод основан на разделении скоростей
испарения и конденсации. Предполагается, что на поверхности имеется
определенное число мест (или центров) адсорбции S, часть которых
S\ занята адсорбированными молекулами, а часть S0 = S—S\ свободна.
Скорость испарения принимается пропорциональной S\ и записывается
в виде k\S\. Скорость конденсации пропорциональна свободной
поверхности So и давлению газа, т. е. равна k2PS0. В условиях равновесия
kiSi =k2PS0=ktP (S — St). (XIV-3)
Поскольку SJS равно 6 — доле поверхности, покрытой
адсорбированными молекулами, уравнение (XIV-3) можно записать как
Q=bP/(l+bP)9 (XIV-4)
где
b=k2/ki. (XIV-5)
Заменяя 0 на v/vm,rjie vm — объем адсорбированного газа (см3(НТД)/г)
при монослойном заполнении, получаем
v=vmbP/(l+bP). (XIV-6)
Анализ уравнения (XIV-6) показывает, что при низком давлении
количество адсорбированного газа пропорционально давлению:
v=vmbP9 (XIV-7)
тогда как при высоких давлениях оно стремится к предельному
значению, равному vm. На рис. XIV-3 показана типичная изотерма
Лэнгмюра. Для удобства обработки экспериментальных данных уравнение
(XIV-6) можно привести к линейному виду
P/v = l/bvm + P/vm. (XIV-8)
Зависимость P/v от Р имеет вид прямой, по углу наклона которой и
по отрезку, отсекаемому на оси ординат, можно оценить постоянные
vm и Ь. В свою очередь vm связано с удельной поверхностью твердого
тела 21 соотношением
f« = E W, (XIV-9)
где а0 — площадь, приходящаяся на одну адсорбированную молекулу
в монослое, или величина посадочной площади, a v0 — объем одного
моля газа при нормальных условиях (22 400 см3/моль). Таким
образом, при известном а0 по величине vm можно рассчитать 2.
При конкурентной адсорбции нескольких адсорбатов аналогичный
вывод приводит к уравнению
^=^W(i + 2VV). (Xiv-iO)
р Рис. XIV-3. Изотермы Лэнгмюра.
Адсорбция газов и паров на твердых телах
441
Постоянные скорости kx и k2 связаны с динамическими
характеристиками системы, рассмотренными в предыдущем разделе. Постоянная
k\ просто равна обратному времени адсорбции, т. е.
£1=(1/т0)е-<?/*г. (XIV-11)
Для того чтобы оценить k2, представим центр адсорбции в виде
квадрата площадью а0. Тогда скорость адсорбции можно приравнять к
частоте падения молекул на участок поверхности площадью о0. Согласно
кинетической теории газов,
k2=N0oV(2nMRT)V2. (XIV-12)
Следовательно, постоянная Лэнгмюра b равна
b=N0G\e^T/(2nMRT)l\ (XIV-13)
Эту постоянную удобно записать в виде соотношения
Ъ =^г, b0 =N0aX/(2nMRT)1<\ (XIV-14)
где bo — частотный множитель. Например, для азота при температуре
кипения 77 К &о = 9,2- Ю-4, Р=1 атм, а0 принимается равной 16,2 А2
(фактически это — расчетное значение площади молекулы азота), а
то=1(Н2 с.
Б. Статистико-термодинамический вывод
Приведенный вывод уравнения Лэнгмюра на основе определенной
механической модели интуитивно представляется чрезмерно простым.
И действительно, общим недостатком кинетических выводов
равновесных соотношений является то, что обычно в них содержится больше
допущений, чем необходимо. Уравнение Лэнгмюра (как и другие
уравнения изотерм адсорбции) можно получить с помощью статистической
термодинамики, предполагая, что молекулы адсорбата могут
находиться в двух различных состояниях.
Ниже дан несколько видоизмененный вывод Фаулера и Гуггенгейма
[6]. Предполагается, что при адсорбции из газовой фазы сумма по
состояниям и потенциальная энергия молекул меняются (разд. XIII-4A)
и что адсорбированные молекулы утрачивают способность к
нормальному поступательному движению и локализуются на центрах
адсорбции, не взаимодействуя с соседними адсорбированными молекулами.
Энергия взаимодействия адсорбированных молекул характеризуется
теплотой адсорбции Q.
Поскольку в газовой фазе поступательная и внутренняя (т. е.
вращательная и колебательная) энергии молекул независимы друг от
друга, сумму по состояниям для газа можно представить как
Q*=<tfoCTQ£,yrp. (XIV-15)
Для адсорбированных частиц
Qs = Q^HTpQ^yTp^^7. (XIV-16)
где Оцентр—сумма по состояниям центров адсорбции, смысл которой
объясняется ниже, а введение члена eQ/RT означает, что Qs приведена
к газообразному состоянию. Кроме того, Qs зависит только от
температуры и не зависит от степени заполнения центров адсорбции. Чтобы
получить полную сумму по состояниям, необходимо умножить Qs на
число различных способов размещения N молекул на центрах S. Это
число нетрудно найти, если учесть, что первую молекулу можно
разместить на поверхности S способами, вторую — 5—1 способами и т. д.
442
Глава XIV
Таким образом, число способов размещения N молекул на
поверхности равно
S(S—l)...(S — N—l) или S\/(S — N)\
Поскольку все адсорбированные молекулы идентичны, из этого
числа N1 способов неразличимы между собой, и в конечном итоге полная
сумма по состояниям для N молекул принимает вид
Согласно уравнению (XIII-20), для адсорбированного слоя
свободная энергия Гельмгольца равна — feHnQsnoJ1H. Поэтому, используя
приближенную формулу Стирлинга для факториала х\ = (х/е)х, получаем
As=kT\— S\nS + N\nN + (S — N)In(S — Л/) — N InQ*J. (XIV-18)
По определению, химический потенциал \xs равен (dAsldN)T, и таким
образом,
^=—kTlnlN/(S—N)]—kTlnQs. (XIV-19)
Химический потенциал молекулы в газовой фазе равен
|л«г=—ЛПпО*. (XIV-20)
Приравнивая \is и \ig и учитывая, что Q = N/S, получаем
e/(i—e)=Q*/Q*. (xiv-2i)
Теперь нетрудно проанализировать суммы по состояниям более
подробно. Энергетические состояния поступательного движения
молекул можно найти с помощью квантовомеханической модели движения
частицы в ограниченном пространстве. В одномерном пространстве
длиной а
en=n2h2/8a2m, (XIV-22)
следовательно, сумма по состояниям одномерного поступательного
движения равна
оо
QnocT =У ехр(—г„/ЬТ) s& Гexp(—n?hV8a2mkT) dn =
1-мерн* J
п О
=(2nmkT/h2)y2a. (XIV-23)
Сумма по квантовым числам п здесь заменена интегралом, поскольку
обычно энергетические состояния расположены очень близко друг к
другу (такая замена возможна, даже если а соизмерима с размерами
молекул). В двумерном пространстве
Qhoct. , =(2nmkT/h*) a\ (XIV-24)
2-мерн
а в трехмерном пространстве
QnocT=(2лткТ/к*у/2кТ/Р, (XIV-25)
где а3 заменена объемом, приходящимся на одну молекулу газа и в
свою очередь равным kT/P. Подстановка уравнений (XIV-25) и
(XIV-16) в уравнение (XIV-21) дает
9/(1 -в)^\(hV2nmkTfhikT] (QUTpQLiyTp/Qbyip) (eQ/RT) P (XIV-26)
или
в/(1—6)=W>. (XIV-27)
Адсорбция газов и паров на твердых телах
443
Это уравнение, по существу, совпадает с уравнением (XIV-4), т. е.
уравнением Лэнгмюра, где Ь0 равно
Ь'0 = l(h*/2nmkTf/2/kT] (QsUeHTpQSBHyTp/QfHyTp). (XIV-28)
Формально оба выражения для Ь0 идентичны. Это можно показать,
предположив, что при адсорбции три степени свободы поступательного
движения молекулы переходят в две степени свободы поступательного
движения в двумерном пространстве площадью а2 = о° плюс одна
степень свободы колебательного движения по нормали к поверхности.
Если молекула совершает поступательное движение на поверхности,
сумма по состояниям определяется уравнением (XIV-24). Энергия
гармонического осциллятора с одной степенью свободы равна
e„ = (/t+4-)*v° (XIV-29)
и
_ phvO/2kT
Qk = H ехр(-гп/кТ) = /v0 . (XIV-30)
n e l
Если адсорбционная связь настолько слаба, что /iv°/A7<Cl, уравнение
(XIV-30) упрощается и переходит в QK~kT/hv°. Теперь, введя
обозначение
<Кентр=(&ост.,Х(&., (XIV-31)
go аде. связь
получаем
q^UTp=(2nmkT/h2) (<т°) (kT/hv°), (XIV-32)
и, так как v° соответствует I/to,
b'0 = [NoX/(2nMRTy/2] (QiBHyTp/QfHyTp)=60 (<}внутр/(Йнутр). (XIV-33)
Таким образом, кинетический и статистико-механический выводы
дают одинаковые результаты, если принять ряд специфических
допущений, в частности что суммы по состояниям для внутренней энергии
молекул адсорбата в газовой и адсорбционной фазах совпадают
(см. [8]). Как отмечено в гл. XIII, разд. XIII-4A, последнее допущение
в общем случае неверно, поскольку при адсорбции должна происходить
хотя бы частичная потеря вращательных степеней свободы.
В. Энтропия адсорбции
1. Конфигурационная энтропия. Факториальное выражение в
уравнении (XIV-17) отражает число способов размещения молекул в
данном состоянии, и его можно определить как конфигурационную сумму
по состояниям:
QiU= (S JlN)m . (XIV-34)
Поскольку Оконф от температуры не зависит, из уравнения (XIV-19)
находим, что 5^нф=/г1пОконФ. Применяя приближение Стерлинга и деля
результат на N, получаем интегральную конфигурационную энтропию
Зконф, отнесенную к одной молекуле:
S*K0H4) = _£| ±=^L ln(l— 9) +In б]. (XIV-35)
Дифференциальную энтропию находят с помощью операции
S =д (NS)/dN=S+N (dS/dN),
444
Глава XIV
приводящей в конечном итоге к выражению
^онф = -£1п14-§-- (XIV-36)
(Этот же результат ^ожно непосредственно получить из уравнения
(XIV-19), поскольку 5 = —d\i/dT зависит только от конфигурационного
члена этого уравнения.)
Таким образом, термодинамически модель Лэнгмюра справедлива,
если теплота адсорбции Q постоянна и энтропия адсорбции меняется с
изменением 6 в соответствии с уравнением (XIV-36).
Значение конфигурационной энтропии в модели Лэнгмюра
проявится особенно четко, если приведенный вывод повторить, предполагая,,
что адсорбированные молекулы подвижны. При кинетическом выводе
подвижность молекул учитывается заменой скорости конденсации
k2PS0 на ft2PSf в результате чего 8 становится равным ЬР. В статиста-
ко-термодинамическом выводе предположение о подвижности молекул
приводит, во-первых, к тому, что факториальный множитель в
уравнении (XIV-17) становится равным SN/N\ (в этом случае каждую из N
молекул можно разместить S способами) и уравнение (XIV-21)
переходит в
6=Q*/Q*, (XIV-37)
и, во-вторых, к тому, что при нахождении Оцентр а2 в уравнении
(XIV-24) заменяется на общую площадь поверхности A=Sa°, а не на
площадь, занимаемую одним центром а0. В обоих случаях изотерма
адсорбции имеет вид
в=ЬР,
b =b'0eW*T=b0e^T. (XIV-38)
Теперь молекулярная интегральная и дифференциальная энтропии
определяются выражениями
Slo*b.. = -klnB + k, (XIV-39)
подв.
5конФ.,=— A In в. (XIV-40)
подв.
Подвижной адсорбции соответствует, в частности, адсорбция паров
на собственной жидкой поверхности. При этом 6 равно единице, Р
равно упругости насыщенных паров Р°, а теплота адсорбции совпадает с
теплотой конденсации Qv. В этом случае постоянную Лэнгмюра удобно
определить как Ь°. Из уравнения (XIV-38) следует, что
1 =b°P° =fe0P° exp (QJRT). (XIV-41)
Если теперь ввести обозначения c = bfb° и х = Р/Р°у уравнение
Лэнгмюра принимает следующий вид:
В = сх/(1+сх). (XIV-42)
2. Величины энтропии адсорбции. Модель Лэнгмюра редко
применяют для оценки общего изменения энтропии адсорбции, однако ста-
тистико-термодинамическая модель позволяет довольно легко
установить различные возможные значения энтропии адсорбции и ее
изменения. Оценим, например, изменение дифференциальной энтропии
1 моля газа, адсорбирующегося при давлении 1 атм. Заполнение
поверхности примем равным 0. Оценка сводится к расчету отдельных
компонентов, вносящих вклад в энтропию адсорбата.
Адсорбция газов и паров на твердых телах
445
Прежде всего запишем полную сумму по состояниям для 1 моль
свободно движущихся частиц:
QLm=(l/M) [(2nmk/h*)*'*Vf. (XIV-43)
Подставляя это выражение в уравнение (XIII-19), используя
приближение Стирлинга и заменяя V/N на kT/P (P=l атм), получаем
конечное уравнение, известное как уравнение Саккура — Тетроде:
S°JCT =R In (75/2M3/2) — 2,30. (XIV-44)
Например, при 77 К для азота Sndr составляет 29,2 энтропийной
единицы (кал/град -моль).
Если адсорбция локализованная, необходимо учесть вклад
адсорбционной связи. Подставляя QK из уравнения (XIV-30) в уравнение
(XIV-19), получаем для одной степени свободы колебательного
движения выражение
^^{^Г^-!" (1-е-*"")} (XIV-45)
которое приблизительно равно R[l—ln(hv°/kT)]. Так, при Г=77 К и
v°=1012 с-1 (см. работу i[9]) 5KS составляет 2,9 энтр. ед. в расчете на
степень свободы.
Далее, если посадочная площадка рассматривается как участок
двумерного пространства площадью а0, в котором адсорбированные
молекулы движутся свободно (такое представление неявно
используется в кинетическом выводе изотермы Лэнгмюра), то для N.
адсорбированных молекул соответствующая полная сумма по состояниям
равна [(2nmkT/h2)o°]N, а энтропия определяется выражением
S*OCT., =R In (MTcfi) + 63,8. (XIV-46)
ао, 2-мерн
Для азота (а0 = 16,2 А2) при 77 К эта энтропия равна 11,4 энтр. ед.
Если адсорбированный газ подвижен, полная сумма по
состояниям равна
(S"/N\)l(2nmkT/h2)/A]".
Учитывая, что А/М = а°/8, получаем [7]
Sii0CT., = — R In 6 + R In (MT&>) + 65,8 (XIV-47)
2-мерн
ИЛИ
S*0CT„ =— R In 9 + R In (MTo°) + 63,8. (XIV-48)
2-мерн
Обратите внимание, что неконфигурационная часть уравнения (XIV-48)
совпадает с энтропией, определяемой уравнением (XIV-46).
Теперь мы можем приступать к различным оценкам энтропии
адсорбции А5адС ♦ Обычно рассматривают две предельные ситуации [11].
Если энтропия локализованной адсорбции определяется лишь
конфигурационным членом, то
AS°,OK. = -R In [9/( 1 -9)] - S°JCT (XIV-49)
аде.
= 0 —29,2
= —29,2
446
Глава XIV
(численные значения относятся к азоту при 77 К и 9 = 0,5). Если же
адсорбированная пленка подвижна, энтропия адсорбции определяется
следующим образом:
AS0ncWB. =—R In Э + S*0CT., - S°n£CT. (XIV-50)
аде сто, 2-мерн
= 1,4 +11,4 —29,2
=—16,4
На первый взгляд различие между двумя предельными ситуациями
достаточно, чтобы по величинам энтропии адсорбции судить о
состоянии адсорбированной пленки. Оценим, однако, энтропию адсорбции
для кинетической модели Лэнгмюра, которая предполагает, что
центры адсорбции представляют собой двумерные ячейки и что при
адсорбции образуется слабая связь с частотой v° = 1/t0. При указанных
условиях
Л5лок. = -Я1п[9/(1 -9)] + S*0CT., +Sl-S°JCT (XIV-51)
аде а0, 2-мерн аде. ев
= 0 +11,4 +2,9 —29,2
= — 14,9
Таким образом, энтропия «локализованной» адсорбции может
меняться в широких пределах в зависимости от того, что собой представляет
центр адсорбции: место образования сильной адсорбционной связи с
незначительной энтропией или же двумерную ячейку со слабым
адсорбционным полем [8]. При оценке Д5аДС необходимо учитывать
также возможный вклад поверхностных колебаний в энтропию подвижной
адсорбции и во всех случаях вносить в величину энтропии поправку,
связанную с утратой возможности вращательного движения при
адсорбции. Кроме того, на величину 5аДС может влиять также изменение
структуры адсорбента в результате адсорбции (см. гл. XIII,
разд* ХШ-4Б). Все эти неопределенности не позволяют однозначно
охарактеризовать состояние адсорбированного слоя просто путем
сравнения численных значений энтропии адсорбции, найденных из опытных
данных, с теоретическими значениями. Необходимы дополнительные
сведения о поверхностной подвижности и колебательных поверхностных
состояниях, полученные независимыми способами. Примером может
служить работа Росса [12], в которой исследовалась адсорбция я-бу-
тана на угле сферой 6. Оценка А5аДС, по экспериментальным данным,
дает значение, близкое к величине энтропии подвижной адсорбции,
рассчитанной по уравнению (XIV-50). В то же время энергия активации
диффузии, найденная из температурной зависимости коэффициента
диффузии, оказалась равной 6 ккал. Последнее указывает на то, что
на самом деле адсорбированный бутан не может быть подвижным.
Г. Латеральное взаимодействие
Модель Лэнгмюра предполагает, что адсорбированные молекулы взаимодействуют
с центрами адсорбции с энергией Q и не взаимодействуют в то же время друг с
другом. Возможность такого латерального взаимодействия предусмотрена в модели Фау-
лера и Гуггенгейма [6]. Вероятность адсорбции молекулы на данном центре равна
N/S. Если каждый центр адсорбции имеет z соседних центров, то вероятность
нахождения адсорбированной молекулы на одном из соседних центров составляет zN/S.
Таким образом, доля адсорбированных молекул, взаимодействующих между собой,
равна 20/2 (множитель 1/2 учитывает то, что каждая молекула считалась дважды).
Если энергия латерального взаимодействия двух молекул равна сек то энергия
адсорбции дополнительно увеличивается на zo>0/2, а дифференциальная энергия адсорбции —
на 20)9.
Адсорбция газов и паров на твердых телах
447
С,01 0J / 10
ЬР
Рис. XIV-4. Изотермы адсорбции, соответствующие уравнению Лэнгмюра (XIV-52),
учитывающему взаимное притяжение адсорбированных молекул.
Соответствующие поправки необходимо внести и в уравнение Лэнгмюра:
9/(1 -9) =Ь'Р,
V = 60 ехр [ (Q + гсо9) /RT] = Ь exp (zcoQ/RT). (XIV-52)
Влияние латерального взаимодействия наглядно проявляется при построении
зависимости 9 от ЬР при различных значениях fi=zoy/RT (рис. XIV-4). При Р<4 изотермы
адсорбции напоминают изотерму Лэнгмюра, но характеризуются более крутым ростом
9. Если же Р>4, кривая становится S-образной. Как и в примере, рассмотренном в
гл. VI, рис. VI-2, это указывает на существование равновесия между двумя фазами,
соотношение между которыми определяется величинами 9, соответствующими крайним
точкам штриховой линии.
Величина zw зависит от расстояния между центрами адсорбции, которое
определяет возможность нормального вандерваальсового взаимодействия между
соседними адсорбированными молекулами. Если, например, zco принять равным примерно
одной четвертой энергии испарения [13], то для подчиняющейся правилу Трутона
жидкости, температура которой близка к ее нормальной температуре кипения, Р
должно быть равно 2,5. Критическое давление Рс> т. е. давление, соответствующее 9=0,5
и р = 4, зависит как от Q, так и от Т. Эту зависимость выражают, исходя из
уравнений (XIV-41) и (XIV-42), следующим образом [14]:
Рс/ро==1,Р2Сш (XIV-53)
Достоинством уравнения (XIV-53) является то, что с можно оценить
экспериментально с помощью уравнения БЭТ (см. разд. XIV-5). Латеральное взаимодействие
учитывается и в других более или менее строгих теоретических моделях. Так, Киселев и
сотр. [15] для обобщения собственных данных по физической адсорбции в самых
разнообразных системах использует уравнение
Кгх = 6/(1 — 9) — КгКпОх, (XIV-54)
где Кп характеризует степень взаимодействия между молекулами адсорбата, a /Ci+
-\-К1Кп = с. Таким образом, при Кп~0 уравнение (XIV-54) приводится к уравнению
(XIV-42). Более подробно латеральное взаимодействие в адсорбированных слоях
рассматривается Янгом и Кроуэллом i[16] и Хонигом [17].
Д. Практическое применение уравнения Лэнгмюра
Уравнение Лэнгмюра довольно хорошо описывает адсорбционные
данные для большого числа разнообразных экспериментальных систем.
Многие из таких систем рассмотрены в книгах Брунауэра [18], Шваба,
Тэйлора и Спенса [19] и Янга и Кроуэлла [16]. Обычно
экспериментальные данные представляют в виде линейной зависимости,
выражаемой уравнением (XIV-8); при этом постоянные b и vm рассчитывают по
наклону прямой и отрезку, отсекаемому на оси ординат. Если извест-
448
Глава XIV
на а0, то с помощью уравнения (XIV-9) можно найти удельную
поверхность исследуемого образца. Правда, в такой оценке удельной
поверхности имеется некоторая неопределенность. На практике принято
считать, что о0 равна площади поперечного сечения молекулы адсорба-
та, оцененной по его плотности в жидком или твердом состоянии.
Впервые этот прием был использован Брунауэром и др. [20],
исследовавшими адсорбцию различных газов на активных углях. Также обычно
поступают и при изучении адсорбции из растворов (см. гл. IX,
разд. IX-3). Однако в модели Лэнгмюра существенную роль играет
представление о центрах адсорбции, положение которых определяется
структурой поверхности адсорбента. Обычно о структуре поверхности
известно очень мало, и за неимением лучшего приходится прибегать к
величинам а0, рассчитанным по плотности конденсированного адсорба-
та. Проблема определения сг° обсуждается также в разд. XIV-5B.
Следует отметить, что возможность описания экспериментальных
данных уравнением Лэнгмюра сама по себе еще не доказывает
справедливости этого уравнения. Строгая проверка уравнения Лэнгмюра
предполагает доказательство независимости vm и Q от температуры.
При этом оказывается, что многие системы, изотермы которых следуют
уравнению (XIV-8), такой более строгой проверки не выдерживают.
В некоторых случаях это объясняется образованием
полимолекулярных слоев (см. следующий раздел), но вообще модель Лэнгмюра
слишком проста, чтобы от нее можно было ожидать действительного
соответствия экспериментальным системам. Однако в более сложных
моделях вводится большее число полуэмпирических параметров, так что,
кроме вероятности лучшего соответствия экспериментальным данным,
от этих моделей не так уж много пользы. В то же время простая
модель Лэнгмюра не только имеет достаточно общий характер, но и
служит отправной точкой при построении многих более точных моделей
[см., например, уравнение (XIV-52)].
4. Экспериментальные методы
Прежде чем приступить к различным специальным вопросам теории адсорбции
газов, целесообразно хотя бы вкратце рассмотреть некоторые экспериментальные
методы исследования адсорбции газов. Подробно они обсуждаются Россом и Оливье
[21].
По-видимому, наиболее распространенным методом измерения изотерм адсорбции
является объемный метод, в котором количество адсорбирующегося газа определяется
до и после приведения его в контакт с адсорбентом.
Схема простой вакуумной установки для измерения адсорбции объемным
методом приведена на рис. XIV-5. Адсорбент, обычно порошкообразный, помещают в
ампулу ), которая термостатируется при заданной температуре Т\. Установка включает
также манометр 2 и газовую бюретку 3. Непосредственно перед проведением
измерений определяют «мертвое пространство» установки, т. е. объем газа в ампуле / до
трехходового крана 5. Для этого установку откачивают, кран 5 закрывают, т. е.
ампулу с образцом отсоединяют от вакуумной линии, и в последнюю напускают некоторое
количество неадсорбирующегося газа, например гелия. Объем и давление газа
контролируют с помощью манометра и бюретки. После этого ампулу / соединяют с 3 и
определяют изменение давления и объема газа. Поскольку в процессе измерений часть
мертвого пространства находится при температуре Гь а часть — при комнатной
температуре 7"2, для точного разделения мертвого пространства на две части необходимо
провести два независимых измерения при различных объемах и давлениях гелия в
установке. После этого гелий откачивают и при закрытом кране 5 в установку
напускают немного адсорбирующегося газа, количество которого также определяют по
положению менисков ртути в манометре и бюретке. Наконец, краном 5 ампулу /
соединяют с бюреткой 3 и после установления равновесия измеряют давление и объем
оставшегося газа. Пользуясь калибровочными данными и результатами измерений,
можно рассчитать количество адсорбированного газа. Установка содержит также
газовый термометр 4У погруженный в тот же термостат, что и ампула с образцом.
В литературе описано множество установок, предназначенных для объемных ад
сорбционных измерений. Мы укажем лишь статью Хобсона [22], в которой
рассматриваются специфика работы при низких давлениях, и статью Дэвиса и др. [23], в
которой описана лабораторная установка для студентов-старшекурсников.
К манометру
Маклеода,
• К насосу
Рис. XIV-5. Схема вакуумной установки для измерения адсорбции газов.
/ — ампула с образцом; 2, 3— газовая бюретка и манометр; 4— газовый термометр;
ходовой кран.
5 — трех-
Рис. XIV-6. Калориметр для
измерения теплот смачивания [29].
1 — система ввода растворителя и
осушенного азота; 2—уплотненный ввод
мешалки; 3 — найлоновая крышка; 4 — ввод тер-
мистора; 5 — держатель нагревателя и
ось мешалки; 6 — держатель образца; 7 —
мешалка; 8 — отвод для откачки рубашки
калориметра
29—1421
450
Глава XIV
р рд р ро
Рис. XIV-7. Пять типов изотерм адсорбции по Брунауэру [18].
Широкое применение нашел также предложенный Мак-Бэном i[24] весовой метод
измерения величины адсорбции. Сам Мак-Бэн для взвешивания использовал тонкую
кварцевую спираль, однако современные установки обычно делают на основе
микровесов или чувствительных датчиков (см., например, [25]).
Если общая поверхность исследуемого образца невелика (например, всего
несколько сотен квадратных сантиметров), количество адсорбированного газа так мало, что
его обычными методами трудно измерить. Произведение объема газа на его
давление при контакте с адсорбентом меняется настолько мало, что точность измерения
резко снижается.
Один из способов решения этой проблемы — проведение измерений при такой
температуре Т\, при которой упругость паров жидкого адсорбата является очень низкой
(например, криптон при —195 °С [26, 27]). В этом случае монослой обычно образуется
при давлении, составляющем всего несколько десятых упругости насыщенных паров,
независимо от абсолютной величины последней, и, если Р° очень мало, даже
небольшая адсорбция приводит к относительно большим изменениям произведения объема
на давление для газа, находящегося в вакуумной линии.
В настоящее время ультравакуумные установки широко применяются не только
в спектроскопических и дифракционных исследованиях поверхности, но и при изучении
адсорбции на очень чистых поверхностях. Методика работы на таких установках
довольно специфична, и в этой книге нет необходимости подробно останавливаться на
ней. Необходимые сведения по методам получения и измерения высокого вакуума
можно найти, например, в обзоре [22].
Важной экспериментально измеряемой величиной является теплота адсорбции.
Непосредственно теплоту, выделяющуюся при приведении паров адсорбата в контакт
с образцом, можно изморить с помощью калориметра, описанного Биби и др. [28].
Другой метод определения теплоты адсорбции предусматривает измерение теплоты
смачивания в жидком адсорбате адсорбента, содержащего различные количества
предварительно адсорбированного пара. Разность между теплотами смачивания при
различных степенях заполнения поверхности непосредственно связана с
интегральной теплотой адсорбции (см. гл. VII, разд. VII-ЗБ). Пример современного калориметра
дан на рис. XIV-6 [29] (см. также [30]). В качестве чувствительного датчика
температуры можно использовать кварцевый пьезоэлемент [31]. Наконец, адсорбцию из
газовой фазы, как и адсорбцию из растворов, можно измерять хроматографическим
методом [16].
5. Изотерма БЭТ и ее модификации
Далеко не всегда изотермы адсорбции имеют форму изотермы
Лэнгмюра. Согласно Брунауэру [18], большинство изотерм адсорбции
газов и паров можно условно отнести к одному из пяти типов,
показанных на рис. XIV-7. Изотермы I типа, имеющие форму изотермы
Лэнгмюра, характеризуются монотонным приближением адсорбции к
некоторому предельному значению, по всей видимости
соответствующему заполненному монослою. Изотермы II типа очень часто
наблюдаются при физической адсорбции и, несомненно, свидетельствуют об
образовании полимолекулярного адсорбированного слоя. Многие годы
точка перегиба В считалась точкой завершения заполнения монослоя.
Удельные поверхности, оцененные по этой точке, довольно хорошо
согласуются с величинами, найденными из изотерм I типа. Изотермы
III типа относительно редки и, по-видимому, характерны для адсорб-
Адсорбция газов и паров на твердых телах
451
X
Xq
%
X
Рис. XIV-8. Два дополнительных типа изотерм
адсорбции для несмачивающих адсорбатов [34]. "
ции, теплота которой равна или меньше теплоты конденсации адсор-
бата. Примером изотермы III типа может служить изотерма
адсорбции азота на поверхности льда [32]. Изотермы IV и V типа относятся
к капиллярной конденсации. Для них характерно достижение
некоторого предельного значения непосредственно перед Р/Р°=1 и
наличие гистерезиса.
Данное традиционное описание типов изотерм целесообразно
дополнить некоторыми замечаниями. При приближении к Р° вслед за
почти горизонтальным участком изотермы I типа нередко
наблюдается заметный подъем. Вообще говоря, эта изотерма обычно
наблюдается при хемосорбции адсорбата при давлениях значительно ниже Р°.
Изотермы II и III типа приближаются к линии Р° асимптотически.
Такие изотермы экспериментально наблюдаются при адсорбции на
порошках, и тенденция к неограниченному утолщению
адсорбированной пленки отражает процесс капиллярной конденсации в
пространстве между частицами [33] (см. гл. VII, разд. VUAJX). При полном
смачивании адсорбента жидким адсорбатом такие изотермы можно
ожидать и в случае адсорбции на плоской поверхности. Изотермы IV и V
типов, как правило, характерны для пористых тел. Целесообразно
ввести еще по меньшей мере два дополнительных типа изотерм адсорбции,
изображенных на рис. XIV-8. Оба типа возможны при адсорбции на
плоской поверхности при условии, что жидкий объемный адсорбат
образует на поверхности конечный краевой угол [35].
Л. Вывод уравнения БЭТ
Вследствие того что при физической адсорбции на
высокоэнергетических порошкообразных материалах преобладают изотермы II типа,
последние имеют важное практическое значение. Брунауэр, Эммет к
Теллер [20] показали, каким образом можно распространить модель
Лэнгмюра на полимолекулярную адсорбцию. Полученное авторами
уравнение изотермы адсорбции известно как уравнение БЭТ. Ниже дан
традиционный вывод этого уравнения, основанный на детальном
анализе динамического равновесия между скоростями адсорбции и
десорбции молекул. Основное допущение Брунауэра, Эммета и Теллера
VII
29*
452
Глава XIV
о 8
I S3 I Sz I S, I Si 52 Рис XIV-9. Модель БЭТ.
состоит в том, что уравнение Лэнгмюра применимо не только к
первому, но и к другим слоям. Кроме того, авторы постулируют, что теплота
адсорбции в первом слое Q может иметь особое значение, которое
отражает специфику взаимодействия молекул адсорбата с адсорбентом,
тогда как во всех последующих слоях теплота адсорбции равна
теплоте конденсации жидкого адсорбата Qv. Предполагается также, что
конденсация и испарение имеют место лишь на уже покрытых и с уже
покрытых молекулами участков поверхности. Как показано на
рис. XIV-9, в данной модели поверхность адсорбента можно разделить
на свободную поверхность S0; поверхность Su покрытую одним слоем;
поверхность S2, покрытую двумя слоями адсорбата, и т. д. В условиях
равновесия число молекул, конденсирующихся на данном слое, равно
числу молекул, испаряющихся с последующего слоя. Так, для 50
a^S^b.S^Q^, (XIV;55)
а для всех последующих слоев
a.PS^^b.S^y^. (XIV-56)
Отсюда следует, что
и
5. =xi'1Si =ух1~150=сх18ОУ
где
У=(а±/Ь±)Р&'*т9
х=(а1/Ьй)РеЧ«т*
c=y/x=(aibi/bial) e(Q^Qv)/RT « e^-Q^/RT . (XIV-58)
Далее,
^«ffj^j/ffjS.UcsJj^Wso + So JH- <XIV-59)
Суммируя выражения, приведенные в скобках, получаем уравнение
v/vn = [cx/(l—x)*\/[l+cx/(l-x)], (XIV-60)
которое после соответствующих преобразований принимает следующий
вид:
V СХ
(XIV-57)
(1-х)[1 +(с_1)*]
(XIV-61)
Существенным дальнейшим шагом является принятие допущения,
согласно которому отношение частотных членов ajbi равно аналогичному
^отношению для равновесия жидкий адсорбат—пар. Решая далее
совместно уравнения (XIV-57) и (XIV-41) (где Ь\ =аг-/6») при указанном
допущении, получаем равенство х = Р/Р°. Кроме того, обычно ajbi
принимают равным ctilbu что позволяет значительно упростить уравнение
(XIV-58), используемое для интерпретации постоянной с.
*Предполагается, что при /^2 все az=const и bi = const— Прим. ред.
Адсорбция газов и паров на твердых телах
453"
Как и уравнение Лэнгмюра, уравнение БЭТ можно получить также
с помощью статистической механики. Правда, такой вывод значительно
сложнее рассмотренного кинетического вывода.
Б. Свойства уравнения БЭТ
Предложенное в 1938 г. Брунауэром, Эмметом и Теллером
уравнение заполнило существенный пробел в теории адсорбции и постепенно
завоевало признание как одно из самых надежных уравнений,
используемых для определения удельной поверхности по адсорбционным
данным. Уравнение БЭТ можно представить в виде
x/v(l—x) = l/cvm + (c—l)x/cvm. (XIV-62)
Таким образом, зависимость x/v(l—х) от х представляет собой
прямую, по наклону которой и пересечению с осью ординат можно найти
vm и с. Далее с помощью уравнения (XIV-9) величину vm можно
пересчитать на удельную поверхность исследуемого материала. Для
этого необходимо лишь знать а0. Если адсорбция многослойная,
разумно в качестве а0 использовать не площадь центра адсорбции, а площадь
поперечного сечения молекулы адсорбата, рассчитанную в
зависимости от температуры из плотности жидкого или твердого адсорбата.
Наиболее удовлетворительные результаты обычно получаются при
следующих значениях а°(А2) : N2 16,2; 02 14,1; Аг 13,8; 'Кг 19,5; я-С4Нш
18,1. Эти величины, а также значения а0 для других адсорбатов
критически обсуждаются в работе [38]. Отметим, что приведенные
значения близки к рассчитанным из плотностей жидкостей при температурах
их кипения и поэтому вполне пригодны для полимолекулярной
адсорбции. Правда, иногда эффективная площадь поперечного сечения
молекулы адсорбата может все же значительно отличаться от значения а0,
найденного из плотности жидкого адсорбата. Так, Пирс и Эвинг [39]
показали, что адсорбция азота на поверхности графита определяется
кристаллической структурой адсорбента, и поэтому эффективная
площадь молекулы азота составляет 20 А2, а не 16,2 А2.
Поскольку уравнение БЭТ приводится к линейному виду, его
довольно удобно применять для обработки экспериментальных данных.
Такая обработка, как правило, дает вполне разумные результаты (см.
также разд. XIV-8), и поэтому метод БЭТ фактически стал
стандартным методом определения удельной поверхности адсорбентов. Обычно
адсорбатом при этом служит азот при 77 К. Однако в общем случае
метод БЭТ пригоден для любых систем, дающих изотермы II типа.
Правда, область применимости уравнения БЭТ не очень широка —
обычно линейная зависимость, выражаемая уравнением (XIV-62),
наблюдается в интервале Р/Р° от 0,05 до 0,3 (рис. XIV-17). Уравнение
БЭТ, наилучшим образом описывающее экспериментальные данныег
при низких давлениях, как правило, дает заниженные, а при высоких
давлениях — завышенные величины адсорбции.
Уравнение БЭТ охватывает три из пяти типов изотерм,
приведенных на рис. XIV-7. Так, при больших с, т. е. при Qi>Q^ оно
приводится к уравнению Лэнгмюра [уравнение (XIV-42)], а при малых с
получается изотерма III типа (рис. XIV-10). Однако, если рассматривается
адсорбция относительно инертных газов, например азота, аргона и
т. д., на полярных поверхностях, с равно примерно 100, что
соответствует изотермам II типа. Для таких систем уравнение (XIV-61) можно
аппроксимировать выражением
v/vm = l/(l-x)9
(XIV-63)
454
Глава XIV
Рис. XIV-10. Изотермы БЭТ.
которое достаточно хорошо описывает экспериментальные данные в той
области, где обычно хорошо работает уравнение БЭТ. Уравнение
(XIV-63) положено в основу «одноточечного» метода определения
удельной поверхности [40].
В. Модификации уравнения БЭТ
Успех уравнения БЭТ стимулировал поиск других уравнений,
описывающих изотермы II типа в более широкой области. Так, если
предполагать, что полимолекулярная адсорбция ограничивается п слоями,
например из-за близости противоположных стенок в капиллярах, то
получается следующая модификация уравнения БЭТ:
v=[vmcxl(\— x)\[\— (n + \)xn + nxn+1]/[\+(c— l)x— cxn+1]. (XIV-64)
Как следует из рис, XIV-11, для малых п величина адсорбции при
высоких Р/Р° заметно уменьшается. Таким образом, при
соответствующем выборе п уравнение (XIV-64) может описать экспериментальные
данные в более широком диапазоне, чем уравнение (XIV-61). В
работе Киселева и сотр. [15] предложено уравнение, аналогичное
уравнению (XIV-54), которое приводит к уравнению БЭТ, если параметр
латерального взаимодействия Кп равен нулю. Имеются и другие
модификации уравнения БЭТ, которые лучше, чем немодифицированное
уравнение, описывают экспериментальные данные, но они также
содержат не меньше одного дополнительного подгоночного параметра.
Более полные сведения о всех этих уравнениях можно найти в книгах
Янга и Кроуэлла '[16] и Грега и Синга [41]. Здесь же отметим толь-
*6
Л=оо,
Р/Р°
Рис. XIV-11. Изотермы БЭТ при
ограниченном числе п
адсорбирующихся слоев.
Адсорбция газов и паров на твердых телах
455
ко, что если адсорбированная фаза по своим свойствам отличается от
жидкого адсорбата, т. е. если а^ЪхФЫ, то эффективная упругость
насыщенных паров должна составлять Р0/, а -не Р° ч (см. гл. XII,
разд. ХН-5В) и, следовательно, х необходимо умножить на некоторый
множитель k [42].
6. Изотермы, основанные на уравнении состояния
адсорбированного слоя
Как показано в гл. VII, разд. VII-ЗБ, формально адсорбцию можно
оценить по поверхностному давлению адсорбированного слоя или
уменьшению свободной поверхностной энергии твердого тела,
непосредственно связанных с интегралом J vdlnP. И наоборот,
рассматривая адсорбированный слой как двумерную пленку типа монослойных
пленок на жидких поверхностях и вводя соответствующие уравнения
состояния, можно получить уравнения, удовлетворительно
описывающие экспериментальные изотермы адсорбции.
А. Нахождение зависимостей типа поверхностное давление —
площадь из изотерм адсорбции
В соответствии с уравнением (VII-12), см. гл. VII, полученным
непосредственно из уравнения Глббса,
Р' - ~ (XIV-65)
nnp»Pl=(RT/v0X)r9vdlnP
Для графического интегрирования адсорбционных данных это
уравнение обычно приводят к более удобному виду:
Pi/vi
^upuPi = [RTiv0^ ^vd\n(P/v) + Vi]. (XIV-66)
P/v при v-»0
При низких давлениях адсорбция линейно зависит от давления
(область закона Генри) и отношение P/v является постоянным; при более
высоких давлениях наблюдается отклонение от линейности. Если при
vi изотерма все еще линейна, то уравнение (XIV-66) приводится к виду
n=RTVi/v0 Е = TRT или ko=RT. (XIV-67)
Грег [42а] (см. также [41]) рассмотрел различные типы
зависимостей поверхностное давление — площадь, полученные из изотерм
адсорбции. Качественно эти зависимости подобны аналогичным
зависимостям для пленок на поверхностях твердых тел и жидкостей,
следовательно, соответствующие уравнения состояния применимы и для
двумерных фаз.
Б. Вывод изотерм адсорбции из уравнений состояния
двумерных фаз
Существует ряд уравнений состояния, в равной мере применимых
как к твердым телам, жидкостям и газам, так и к их двумерным
аналогам. Ниже некоторые из этих уравнений используются для
получения соответствующих изотерм адсорбции газов.
1. Идеальный двумерный газ. В этом случае состояние
адсорбированного слоя описывается уравнением (XIV-67). В результате получаем
kP=Q. (XIV-68)
456
Глава XIV
Рис. XIV-12. Сравнение изотермы Лэнгмюра и
изотермы, соответствующей модифицированному урав-
р нению состояния двумерной адсорбированной фазы.
Таким образом, предположение, что адсорбированный слой
представляет собой идеальный двумерный газ, приводит к линейной изотерме,
или изотерме Генри.
Вполне очевидно, что уравнение (XIV-67) должно описывать
состояние адсорбированного слоя лишь при очень низких степенях
заполнения поверхности, т. е. в случае очень разреженного двумерного
газа. При более высоких степенях заполнения в это уравнение,
естественно, необходимо ввести поправку на собственную площадь
молекул адсорбата:
я (а—а0) =#7. (XIV-69)
Теперь
lnP*=(l/RT) f a&i=f d8/[6(l— б)2] (XIV-70)
и (учитывая, что Q = a°/a)
АР=[6/(1 —6)] е6''*1-0). (XIV-71)
Уравнение (XIV-71) дает изотерму, настолько похожую на изотерму
Лэнгмюра (рис. XIV-12) (см. также книгу де Бура [4]), что
различить их, основываясь на результатах эксперимента, не просто.
Аналогичное уравнение, полученное Фольмером [43],
\nkP=\nn + bn/RT (XIV-72)
довольно хорошо описывает данные Кэмбола и Ридила [44] по
адсорбции паров различных органических соединений на ртути.
2. Уравнения состояния типа уравнения Ван-дер-Ваальса.
Следующий логический шаг вперед —введение в уравнение состояния
поправок, учитывающих как собственную площадь молекул, так и силу их
взаимного притяжения. В результате должен получиться аналог
уравнения Ван-дер-Ваальса. Особое внимание уравнениям этого типа
уделяется в работах де Бура [4], а также Росса и Оливье [21]. В свое
время автор этой книги также достаточно подробно исследовал те
типы изотерм адсорбции, которые можно получать, исходя из
подобных уравнений состояния [45].
Напомним, что постоянные а и b в уравнении Ван-дер-Ваальса
зависят от объема и температуры. Это учитывается, например, в
модифицированном варианте этого уравнения, предложенном Бенсоном и
Голдингом [46]:
[Р + (а/У5/зГ2/з)] [V—6V-V2] =Я7\ (XIV-73)
Существует множество вариантов уравнения состояния неидеального
двумерного газа. Некоторые из этих уравнений и соответствующие им
изотермы адсорбции приведены в табл. XIV-2. Во всех случаях урав-
нения изотерм адсорбции довольно сложны, однако общий вид
семейства кривых для любого из этих уравнений подобен тому, который
изображен на рис. XIV-13. Штриховой линией показан фактический
Адсорбция газов и паров на твердых телах
45Г
0,01 0,1 1 10
HP
Рис. XIV-13 Изотермы адсорбции, соответствующие уравнению состояния двумерной
адсорбированной фазы типа уравнения Ван-дер-Ваальса.
ход изотермы в области конденсации двумерного газа в жидкость.
Обратите внимание на сходство этих кривых с приведенными на
рис. XIV-4 изотермами Лэнгмюра, построенными с учетом
латерального взаимодействия.
Приведенные уравнения довольно хорошо описывают отдельные
экспериментальные изотермы адсорбции в субмонослойной области.
Так, Росс и Уинклер [47] нашли, что в области 0,1<Э<0,5 адсорбция
азота на саже при 77,8 К описывается третьим уравнением табл. XIV-2.
Практическое применение уравнений, приведенных в табл. XIV-2, как
и практическое использование различных модификаций уравнения
Таблица XIV-2
Уравнения состояния двумерной адсорбированной фазы
и соответствующие изотермы адсорбции
Уравнение состояния
Уравнение состояния типа уравнения
состояния идеального газа
no = RT
л (о — а0) = RT
Уравнение состояния типа уравнения
Ван-дер-Ваальса
(л + а/о2) (о - о°) = RT
(л + а/а3) (а — а0) = RT
(л + а/о3) (о — о"2/о) = RT
Уравнение состояния с вириальными
коэффициентами
ла = RT -j- ал — рл2
Изотерма адсорбции
in kP = in e
in*p = e/(i —e) +in [e/(i -G)]
In kP = 0/(1 — 0) + In [6/(1 — 6)] — c6
In kP = 6/(1 — 6) + In [0/(1 — 6)] — c02
In kP = 1/(1 — 0) -f — In [0/(1 - 0)] - cB
{c = 2a/o°RT)
In kP = ф2/2(о + (1/2©) (ф + 1) +
+ [(cp-l)2 + 2co]1/2_
-1п{(Ф-1)+[(ф--1)2+2©]1/2}
(Ф = 1/0, © = 2ЩТ/а2)
458 Глава XIV
БЭТ, осложняется достаточно широкими возможностями выбора
алгебраического вида изотермы и достаточно большим числом
подгоночных параметров (vm, с и k), так что обычно трудно определить,
насколько серьезное значение следует придавать тому, что данная
изотерма описывает конкретные данные. Проблема возможных фазовых
изменений обсуждается в разд. XIV-11, а влияние неоднородности
поверхности— в разд. XIV-14.
3. Конденсированные адсорбированные слои. Гаркинс и Юра
[48] предположили, что в случае изотермы II типа адсорбат
находится на поверхности в конденсированном состоянии. Используя
уравнение (Ш-50) в виде
я=Ь—ао (XIV-74)
и применяя преобразование Гиббса, авторы получили выражение
In Р/Р° =B—A/v\ (XIV-75)
где
A=aL2v20/2RT и Ъ=кАЧъ (XIV-76)
Согласно уравнению (XIV-75), экспериментальные данные,
обработанные в виде зависимости 1п(Р/Р°) от l/v2, должны располагаться на
прямой. Это действительно наблюдается для многих изотерм II типа, в
частности для изотермы адсорбции азота на двуокиси титана.
Эмпирически найдено, что для данного адсорбата константа k в уравнении
(XIV-76) не зависит от природы твердого тела. Так, для азота при
77 К константа k равна 4,06 (если 2 выражена в м2/г).
7. Потенциальная теория
А. Теория Поляки
Еще один подход к полимолекулярной адсорбции основан на
представлении о потенциальном поле поверхности твердого тела, в
которое «падают» молекулы адсорбата. В рамках этого подхода
адсорбированный слой напоминает атмосферу: вблизи поверхности твердого
тела он сжат, а в наружных слоях — разрежен. Потенциальная теория
адсорбции была предложена Поляни в 1914 г., хотя сама идея
потенциального поля была высказана гораздо раньше (см. кн. Брунауэра
[18]). Наглядное представление о потенциальном поле дают
эквипотенциальные поверхности (т. е. поверхности равного адсорбционного
потенциала), проведенные вдоль поверхности адсорбента. На
рис. XIV-14, на котором представлено поперечное сечение адсорбента
и адсорбционного пространства, эти поверхности изображены
штриховыми линиями. Расстояние между каждой парой эквипотенциальных
Газовая
Фаза, м
Область
адсорбции
Адсорбент
Рис. XIV-14. Профили изопотенциальных
поверхностей вблизи поверхности
адсорбента [18].
Адсорбция газов и паров на твердых телах
459
fi
Рис. XIV-15 Зависимость
плотности адсорбированной фазы от п
адсорбционного потенциала
(потенциальная теория Поляни) [18]. Ц(кривая2.) Углах'!Р$(криеая1)
поверхностей соответствует некоторому объему, и, таким образом,
между потенциалом е и объемом ф существует определенная зависимость.
Очевидно, что если между газом и поверхностью адсорбента
установилось равновесие, то при переносе небольшого количества
адсорбата из газовой фазы в адсорбированный слой полная свободная энергия
системы не должна меняться. Таким образом, работа гх, совершаемая
адсорбционными силами при переносе адсорбата из газовой фазы на
расстояние х от поверхности, должна компенсироваться увеличением
свободной энергии адсорбата, обусловленной его сжатием, т. е.
8x=fvaP. (XIV-77)
Количество адсорбированного газа определяется выражением
оо
»=2 f(P=,-Pe)<**. (XIV-78)
а связь между плотностью р и давлением задается с помощью
соответствующего уравнения состояния адсорбата. Все эти уравнения
позволяют преобразовать любую изотерму адсорбции либо в
зависимость е от ф, называемую характеристической кривой, либо в
зависимость р от ф. Пример последней зависимости показан на рис. XIV-15.
При высокой температуре (кривая 3) адсорбат остается газообразным,
хотя и несколько сжимается потенциальным полем; при более низкой
температуре (кривые 1 и 2) давление адсорбата вблизи поверхности
достигает Р°, что приводит к его конденсации.
Теория Поляни, по существу, является термодинамической теорией.
В ней не делается попыток найти функцию е(ф) или каким-либо
образом определить 2. Важно, однако, что, согласно этой теории, функция
г(ф) не должна зависеть от температуры и, следовательно, для
данной системы адсорбент—адсорбат все изотермы должны приводиться
к одной и той же характеристической кривой. Часто
характеристические кривые, найденные из различных изотерм, действительно
совпадают. Так, авторы работы [49], измеряя адсорбцию двуокиси серы на
силикагеле при восьми различных температурах (от 193 до 373 К),
получили одну и ту же характеристическую кривую для всех изотерм
адсорбции (рис. XIV-16). Потенциальную теорию можно применять и в
субмонослойной области. В этом случае е больше зависит от Э, чем
от ф, и на самом деле характеризует неоднородность поверхности.
И действительно, расчет распределения энергии центров адсорбции на
460
Глава XIV
со
3000
с 2000 \-
1000
о
ш
•
о
+
X
А
Д
373 К
353
330
303
173
238,6
219
193
SPtAfM°
Рис. XIV-16. Характеристическая кривая для адсорбции двуокиси серы на силикате-
ле [49].
гетерогенной поверхности в общем эквивалентен нахождению
характеристической кривой для этой поверхности (см. разд. XIV-14).
Для полимолекулярной адсорбции разумно предположить, что на
поверхности адсорбента газ конденсируется в жидкость (см., кривые 1
и 2 на рис. XIV-15). Далее предположим, что весь адсорбированный
газ находится в практически несжимаемой жидкой пленке. В этом
случае толщина пленки х связана с v соотношением
v = ^xv0/Vh
(XIV-79)
где Vi — молярный объем жидкости, а потенциал е*, достаточный, чтобы
вызвать конденсацию адсорбата, на расстоянии х от поверхности равен
Ex = KTln(P°/Pg), (XIV-80)
где Pg — давление пара, находящегося в равновесии с
адсорбированным слоем. Теперь характеристическая кривая имеет вид зависимости
RT \n(P°/Pg) от х (или от v, если величина 2 неизвестна). Дубинин и
сотр. [50] широко используют следующее эмпирическое соотношение
между х и ех;
х=х0ехр(—te2), (X1V-81)
где для пористых тел х0 — объем пор, а х — объем адсорбированного*
сжиженного газа при данном значении P°/Pg. Уравнение (XIV-81)
известно как уравнение Дубинина — Радушкевича (см. также [51]).
Б. Соответствие между потенциальной теорией
и теорией двумерной адсорбционной пленки
Между потенциальной теорией и теорией, основанной на представлении о
поверхностном давлении адсорбированной фазы, имеется интересное соответствие. Согласна
уравнению (XIV-78), изменение трехмерного давления Р с расстоянием от
поверхности определяется е(х) и трехмерным уравнением состояния адсорбата. В то же время
уравнение (Н-43) (гл. II) можно привести к виду
I-
Pg)dx.
(XIV-82)
Таким образом, при известной зависимости Р(х) для каждого Рб можно найти
соответствующее значение я.
А дсорбция газов и паров на твердых телах
461
В простейшем случае г(х) имеет вид прямоугольной потенциальной ямы: при '
0<.х^х0 е = е0, а при х>х0 е = 0. Внутри области х^х0 давление равно Р°, а вне
этой области P = Pg и, таким образом,
я = (Р« - Pg) х0 ^ Р%, (XIV-83)
где Р° определяется уравнением (XIV-78) и уравнением состояния адсорбата. Кроме
того, о равно V/xq. Далее, если трехмерное уравнение состояния дается функцией
V = f(P), двумерное уравнение состояния имеет аналогичный вид, т. е. x0G=f(n/xo).
Если, например, f(P) представляет собой уравнение Ван-дер-Ваальса
(/> + а/1/2) (1/ - b)=RT9 (XIV-84)
то поверхностное давление, определяемое уравнением Гиббса, связано с а
соотношением
(я + а/х20о2, (о — Ь/х0) = RT. (XIV-85)
Следовательно, можно было бы ожидать, что критическая температура пленки
адсорбата равна его критической температуре в жидком состоянии. Однако, если в
действительности адсорбированные молекулы образуют подвижную двумерную фазу, а не
тонкую, но все еще трехмерную пленку, то, как показал де Бур [4], критическая
температура двумерного неидеального газа должна быть вдвое меньше нормальной
критической температуры. Конечно, рассмотренная здесь теория, в основу которой
положена прямоугольная функция е(х), слишком примитивна. В ней не учитываются, в
частности, ориентация и поляризация молекул адсорбата на поверхности, в результате
чего уравнение состояния адсорбционного слоя может отличаться от уравнения
состояния жидкого адсорбата.
В. Изотермы, основанные на различных функциях потенциал —
расстояние от поверхности
Как было показано выше, в рамках потенциальной теории
адсорбцию в монослое можно описать, пользуясь приближением
прямоугольной потенциальной функции. Разумеется, это не единственно
возможный вид потенциальной функции. В частности, рассматривая
полимолекулярную адсорбцию, разумно допустить, что взаимодействие между
адсорбентом и адсорбатом обусловлено в основном дисперсионными
силами и, следовательно, потенциал плоской поверхности меняется
обратно пропорционально кубу расстояния от поверхности (см. гл. VI,
разд. VI-3A). Чтобы исключить бесконечный потенциал самой
поверхности, запишем потенциальную функцию как
г(х)=г0/(а+х)\ (XIV-86)
где а — расстояние порядка молекулярного радиуса*. Решая
совместно уравнения (XIV-81) и (XIV-86), получаем
RT In (P°/P)=e0/(a + x)3, (XIV-87)
где Р — давление газа (в индексе g теперь нет необходимости). Решая
это уравнение относительно х и подставляя найденное выражение в
уравнение (XIV-80), получаем
v = — а + рю-Vs, (XIV-88)
где
a=av0 V /V„ Р=Ч>( W (ео/ЯЛ1/з, <* = ЩР»1Р).
Это означает, что при Р—*Р° толщина пленки жидкости,
конденсирующейся в потенциальном поле, обратно пропорциональном кубу
расстояния, возрастает бесконечно.
*При выводе уравнения (XIV-86) принимают, что твердое тело является
бесструктурным. Вообще говоря, это допущение не очень приемлемо для молекул первого слоя
полимолекулярной пленки на поверхности кристалла. Кроме того, постоянную е0
было бы лучше записать как (e0,sl—s0,ll) [52], где 80,sl = (я/6)nsAsb, eoll =
= (п/6)пьАьь [см. гл. VI, уравнение (VI-24)].
462
Глава XIV
Уравнение (XIV-88) довольно хорошо описывает изотермы II типа,
обычно даже лучше, чем уравнение БЭТ. Более того, конкретный вид
потенциальной функции оказывается не очень существенным: при
использовании функции, убывающей обратно пропорционально квадрату
расстояния, получается уравнение [сходное с уравнением (XIV-76)],
которое описывает экспериментальные данные почти так же хорошо,
как уравнение (XIV-88). И здесь модели, значительно отличающиеся
друг от друга, приводят к довольно похожим уравнениям.
В общей теории, предложенной Френкелем [53] и затем
уточненной Холси [54], Хиллом [55] и Мак-Милланом и Теллером [56],
используется уравнение типа уравнения (XIV-88) с а = 0:
(v/vmy = A/In (P°/P), A =e0/x»mRT, (XIV-89)
где хт — толщина пленки при монослойном заполнении. В этом
уравнении, часто называемом уравнением Френкеля — Холси — Хилла,
показатель степени п подбирается эмпирически. Холси [54] определил
значения п для различных систем и показал, что обычно эти значения
находятся в интервале от 2 до 3. Пирс [57] нашел, что при адсорбции
азота п равно 2,75 и практически не зависит от природы твердого тела.
Как и в случае уравнения БЭТ, попытки уточнения уравнений (XIV-88) и
(XIV-89) обычно приводят к их усложнению и появлению дополнительных
эмпирических параметров. Гринлиф и Холси [58] предложили уравнение
Р = Ьп ехр [(с/Ь) п] + Р° exp [—a (v/vm)-3], (XIV-90)
где a, b и с — постоянные, первые две положительные, третья — отрицательная; л—
количество адсорбированного газа, a v и vm имеют свои обычные значения. В
отличие от уравнения БЭТ при низких давлениях уравнение (XIV-90) соответствует закону
Генри (см. разд. XIV-10), а при высоких давлениях (см. разд. XIV-1 ЗА) правильно
предсказывает изменение энтропии адсорбции. Интересно, что это уравнение может
давать изотермы типа изображенной на рис. VII-15 (гл. VII). Адамсон [59]
предложил уравнение
kT In (Po/P) = g/x3 + e0e-a* — ре"4**. (XIV-91)
Первый член справа соответствует потенциальной функции, убывающей обратно
пропорционально кубу расстояния, второй член отвечает эмпирической функции для
пленок средней толщины (этот член согласуется с поляризационной моделью, разд. XIV-
7Г), а последний член отражает структурные изменения в адсорбированной пленке
по сравнению с обычным жидким адсорбатом. Это уравнение пригодно для связи
изотерм адсорбции с краевыми углами (см. гл. VII, разд VII-5B) Ранее подобное
уравнение использовали Рой и Холси [60]. Холси [61] допускает, что распределение
величин 8о, определяемых уравнением (XIV-89), фактически отражает неоднородность
поверхности. Уравнение, предложенное Бонетайном и др. [62], представляет собой
один из вариантов уже упоминавшегося уравнения Дубинина [уравнение (XIV-82)].
Г. Поляризационная модель
В 1929 г. де Бур и Цвиккер [63] высказали предположение, что при
адсорбции неполярного адсорбата на поверхности полярного
адсорбента в первом адсорбированном слое поверхность индуцирует диполи,
которые в свою очередь индуцируют диполи в следующем слое, и т. д.
На этом основан еще один интересный способ нахождения
функции г(х). Как показано в гл. VI, разд. VI-3B, модель де Бура —Цвик-
кера приводит к выражению
е(л;)=е0бГ^, (XIV-92)
что совместно с уравнениями (XIV-80) и (XIV-81) дает
RT In (P«/P)=e0e-™ (XIV-93)
или
In In (P°/P) = In (e0/RT) - (aVtfv0 ^) v, (XIV-94)
Адсорбция газов и паров на твердых телах
463
Таким образом, согласно этой теории, зависимость lg\g (Р°/Р) от v
должна быть линейной, что действительно часто наблюдается на
практике.
Теория де Бура — Цвиккера подверглась суровой критике Бруна-
уэра [18], основное возражение которого заключалось в том, что
эффект поляризации недостаточно велик. Это привело к почти полному
забвению поляризационной теории. Однако некоторые новые данные
показывают, что в этой теории все же имеется рациональное зерно.
Бьюиг и Зисман [64], в частности, показали, что адсорбция н-гексана
на различных металлах приводит к значительному изменению
поверхностного потенциала А У, соответствующему довольно большому
индуцированному дипольному моменту порядка 0,3 дебая (D). Согласно
расчетным данным, для индуцирования такого диполя на молекулах
я-гексана на поверхности должно быть поле напряженностью около
107 В/см. Значительное изменение AV обнаружено и при адсорбции
инертных газов на металлах |[65]. Так, по данным Притчарда [66], при
адсорбции ксенона на меди, никеле, золоте и платине при —183 °С
значение AV меняется от 0,2 до 0,8 В, причем в момент завершения
образования монослоя наклон зависимости AV от v резко уменьшается. По
мнению Бенсона и Кинга [67], адсорбция инертных газов на окиси
алюминия в значительной мере определяется локальными
электрическими полями. Поверхность графита, по-видимому, также
характеризуется сильным полем, обусловленным разделением я-электронов и
положительно заряженных атомов углерода. В последнее время
получены спектроскопические данные (гл. XIII, разд. XIII-4),
свидетельствующие о значительной поляризации адсорбированных частиц. Как
показано в разд. XIV-10, даже на поверхностях молекулярных
кристаллов дисперсионным силам можно приписать только часть энергии
адсорбции. Более того, на поверхностях, покрытых прослойками
предварительно адсорбированных инертных веществ, потенциальное поле
убывает почти экспоненциально. Таким образом, можно считать
доказанным, что в общем случае адсорбция в первом слое больше
определяется электростатическим поляризационным взаимодействием
(уравнение (VI-38), гл. VI), чем дисперсионными силами.
В этой главе под полимолекулярной адсорбцией подразумевается
адсорбция в диапазоне значений Р/Р°, при которых справедлива
модель БЭТ, или при соотношении v/vm^3 (образование более толстых
адсорбированных слоев рассмотрено в гл. VII, разд. VII-5B). Одной из
важнейших теоретических задач является оценка индуцированного ди-
польного взаимодействия во втором и третьем слоях. Такой расчет
осложняется тем, что в этом случае молекулу нельзя рассматривать
как точечную сферу. Чтобы обойти эту трудность, постоянную а в
уравнении (XIV-95) выражают эмпирической формулой (см. разд. VI-3B,
гл. VI):
а=— (l/d0) In (а/d3)2, (XIV-95)
где d может быть меньше диаметра молекулы d0. С учетом уравнения
(XIV-95) уравнение (XIV-94) принимает следующий вид:
In In (P°/P) =ln (&0/RT) — [\n (a3/a)2J (v/vm). (XIV-96)
Обработка типичных изотерм II типа, например изотерм адсорбции
окиси углерода или азота на кремнеземе С [16] или изотерм
адсорбции азота на хлориде калия [65], с помощью уравнения (XIV-96)
приводит к a/d3, примерно равному 0,4 и, следовательно, d, приблизительно
равному атомному радиусу [68].
В поляризационной теории г(х) значительно выше соответствующей
энергии дисперсионного взаимодействия. Поляризация
адсорбированных частиц должна сопровождаться их сильной ориентацией в полимо-
464
Глава XIV
лекулярных слоях, в результате чего структура последних может
значительно отличаться от структуры нормальной жидкости. В гл. VII,
разд. VII-5, показано, что изменение структуры адсорбированного слоя
под действием твердой поверхности может оказывать существенное
влияние на краевые углы. Проблема строгой трактовки состояния
адсорбированного слоя, конечно, исключительно трудна. Еще в 1952 г.
Хилл [55] отметил, что развитие теории адсорбции тормозится
отсутствием удовлетворительной теории жидкого состояния даже для
одноатомных жидкостей, и в частности отсутствием точного описания
свойств жидкостей при совместном электрическом и дисперсионном
взаимодействии. С тех пор в этой области достигнуты некоторые
успехи, но в целом проблема жидкого состояния остается труднейшей
теоретической проблемой (см. [69]).
8. Сравнение удельных поверхностей, найденных с помощью
различных моделей полимолекулярной адсорбции
Как неоднократно отмечалось, возможность удовлетворительного
описания экспериментальных данных с помощью какого-либо
уравнения изотермы адсорбции сама по себе еще не служит доказательством
справедливости этого уравнения. Для примера сравним данные по
адсорбции азота на порошкообразном хлориде калия при 78 К [63],
обработанные с применением четырех различных уравнений (рис. XIV-17).
Как видно из рис. XIV-17, все используемые теоретические уравнения
удовлетворительно описывают экспериментальные данные. Для
простых газов, таких, как азот, кислород, аргон и т. п., обычно уравнение
БЭТ выполняется в диапазоне Р/Р° от 0,05 до 0,3, а уравнения (XIV-88)
(потенциальная теория) и (XIV-98) (поляризационная теория) —в
диапазоне Р/Р° от 0,1 до 0,8. Таким образом, едва ли можно считать
какую-либо модель предпочтительной. Тем не менее на практике почти
исключительно используется уравнение БЭТ. Отчасти это обусловле-
БЭТ
Х*Р/Р
2h
/Ь
Потенциальная
теория
Поляризационная
теория
р/р0
0,93 04
4 L
0J
1
w
lb
Рис. XIV-17. Обработка данных по адсорбции азота на хлориде калия при 79 К с
использованием различных уравнений изотерм адсорбции [70].
Адсорбция газов и паров на твердых телах
465
но традицией и известностью уравнения БЭТ, отчасти тем, что vm
входит в него в явном виде.
Более строгим критерием справедливости уравнения изотермы
адсорбции является независимость отношений удельных поверхностей
различных образцов от природы адсорбата. В табл. XIV-3 приведены
Таблица XIV-3
Отношение величин удельных поверхностей ряда адсорбентов,
определенных пятью методами по изотермам адсорбции различных газов
Газ
(температура, К)
02 (90)
Аг (90)
N2 (78)
02 (78)
N2 (78)
СО (78)
N2 (78)
С2НбС1 (195)
Отношение величин удельных поверхностей 2а
БЭТ
ПО
потенциальная
теория^
поляризационная
теория8
характеристическая изотерма
2 (яичный альбумин) г/2 (КС1)
4,0
4,0
5,3
4,4
±15%
5,2
7,0
5,6
5,9
±12%
5,5
5,7
5,7
5,6
±2%
5,3
5,6
4,4
5,1
±6%
5,2
6,7
5,4
5,8
±10%
2 (ТЮ2)/2 (КС1)
5,2
6,4
5,8
±10%
8,8
6,8
7,8
±13%
8,1
7,9
8,0
±1%
6,7
6,7
6,7
i ±0%
8,1
7,1
7,6
±7%
2 (кремнезем С)/2 (графитированная сажа стерлинг S450)
3,0
2,9
2,7
2,9
±4%
3,1
3,2
2,4
2,9
±11%
2,9
2,6
3,2
2,9
±7%
2,7
2,8
2,5
2,7
±4%
3,0
3,0
2,4
2,8
±9%
Данные взяты из следующих источников: яичный альбумин [71]; КС1 [70]; TiO» [71];
кремнезем С и стерлинг S450 [73].
6 Уравнение (XIV-88).
в Уравнение (XIV-96).
гЛиофилизованный сухой белок.
отношения удельных поверхностей различных адсорбентов,
рассчитанных из изотерм адсорбции не менее чем двух адсорбатов. Данные
табл. XIV-3 показывают, что при переходе от одного адсорбата к
другому отношения удельных поверхностей, найденных с помощью
уравнения БЭТ, могут меняться на 10—15%. Уравнение Гаркинса — Юра
имеет несколько лучшие показатели. Еще меньшие изменения
отношения площадей дают различные модификации потенциальной теории
(т. е. применение закона обратных кубов или поляризационного
потенциала или использование характеристической изотермы). Обратите
внимание, что, если применяется уравнение БЭТ, отношения удельных
поверхностей, как правило, заметно ниже, чем в остальных четырех
случаях. По всей видимости, это отражает тот факт, что уравнение БЭТ
более приемлемо в области относительно низких значений Р/Р°, чем
уравнения, полученные с помощью других теорий. Более подробно все
эти теории обсуждаются в разд. XIV-13.
30—1421
466
Глава XIV
9. Характеристическая изотерма
Таким образом, различные уравнения почти с одинаковым успехом
описывают адсорбционные данные в широком интервале
относительных давлений, хотя и дают несколько различные значения 2. Поэтому
можно предполагать, что в области полимолекулярной адсорбции
форма изотермы адсорбции определяется природой адсорбата и
практически не зависит от природы твердого тела. Следовательно, для
данного адсорбата все кривые зависимости lg v от некоторой произвольной
функции Р/Р° должны быть параллельными и при вертикальном
переносе совместимыми друг с другом. Как отмечалось еще в первом
издании этой книги (см. [74]), данное предположение на практике
выполняется на редкость хорошо. Например, рис. XIV-18 показывает
совмещение ряда изотерм адсорбции азота. В пределах погрешностей
эксперимента в интервале Р/Р° от 0,3 до 0,95 при соответствующем выборе
оптимальных значений vm аналогичные изотермы получаются и для
других адсорбатов. Как правило, экспериментальные данные ложатся
на одну и ту же кривую. При Р/Р° ниже 0,3 кривые, полученные на
различных адсорбентах, постепенно расходятся. Предположительно это
связано с тем, что при низких относительных давлениях начинает
сказываться влияние природы твердого тела. Ранее подобные выводы
были сделаны Пирсом ,[57], Халасом и Шаем [75] и Дубининым [50].
Кривая, приведенная на рис. XIV-18, по существу, совпадает с
характеристической кривой теории Поляни, однако в данном случае еег
по-видимому, лучше называть характеристической изотермой. Если же
экспериментальные результаты для данного адсорбата представить в
виде зависимости \gv/um от RT In (Р/Р°), а не от In (P/P°), то в
соответствии с теорией Поляни должна получиться кривая, форма которой
почти не зависит от температуры. Такую кривую можно было бы
называть характеристической адсорбционной кривой.
Таким образом не удивительно, что приведенные в табл. XIV-3
отношения удельных поверхностей так хорошо соответствуют друг
другу. По существу, любая изотерма, используемая для обработки
адсорбционных данных (для непористых адсорбентов), должна включать
параметр, пропорциональный удельной поверхности. Этим и
объясняется успех метода точки «5» (разд. XIV-5) и других одноточечных
методов: в области характеристической изотермы при любом Р/Р°
измеряемая величина адсорбции v связана с удельной поверхностью
твердого тела некоторым коэффициентом пропорциональности, не
зависящим от природы твердого тела.
iA <г
Ф
ote Ofi 0A
w=lnP/P°
Рис. XIV-18. Характеристические изотермы адсорбции азота на различных пористых
веществах при 78 К.
У — КС1-1 [70]; 2 — яичный альбумин 61 \[7\]; 3 — бычий альбумин 68 [71]; 4 — двуокись титан»
[166]; 5 —графой [76]; 6 — яичный альбумин 59 [71]; 7 — полиэтилен [167].
Адсорбция газов и паров на твердых телах
467
Де Бур и сотр. [77, 78] использовал характеристические изотермы
для построения так называемых ^-кривых. Если принять, что для
некоторой стандартной системы уравнение БЭТ дает правильные значения
vm и что плотность адсорбированного слоя равна плотности жидкости,
величины v/vm можно преобразовать в толщину адсорбированного
слоя t и построить характеристическую изотерму для данного адсорба-
та в виде зависимости t от Р/Р°. Теперь обработка экспериментальных
данных для любой новой системы сводится к сопоставлению
измеряемых значений v со значениями t, определяемыми по стандартной
^-кривой при тех же величинах Р/Р°. В табл. XIV-4 приведены величины /
для адсорбции N2 при 78 К, найденные де Буром и сотрудниками.
Таблица XIV-4
^-Кривая для адсорбции азота при 78 К [77]
Р/ро
0,08
0,10
0,12
0,14
0,16
0,18
0,20
0,22
0,24
0,26
0,28
0,30
о
t, A
3.51
3,68
3,83
3,97
4,10
4,23
4,36
4,49
4,62
4,75
4,88
5,01
Р/ро
0,32
0,34
0,36
0,38
0,40
0,42
0,44
0,46
0,48
i 0,50
1 0,52
0,54
0
t, A
5,14
5,27
5,41
5,56
5,71
5,86
6,02
6,18
6,34
6,50
6,66
6,82
Р/ро
0,56
0,58
0,60
0,62
0,64
0,66
0,68
0,70
0,72
0,74
0,76
0,78
°
*, А
6,99
7,17
7,36
7,56
7,77
8,02
8,26
8,57
8,91
9,27
9,65
10,07
Р/ро
0,80
0,82
0,84
0,86
0,88
0,90
0,92
0,94
0,96
0,98
о
t, A
10,57
11,17
11,8£
12,75
13,82
14,94
16,0я
17,5»
19,8»
22,9»
Значения, полученные экстраполяцией и, несомненно, завышенные из-за капиллярной
конденсации газа между частицами адсорбента.
Если экспериментальная изотерма адсорбции ложится на ту же
характеристическую изотерму, что и стандартная /-кривая, то зависимость t
от v должна быть линейной. Наклон этой зависимости для
низкотемпературной адсорбции азота определяется как
E = 15,47i;/*f (XIV-97)
где 2 измеряется в м2/г, a v — в см3 (НТД)/г и t — в А. Синг [78]
(см. также работу [41]) проверил это уравнение на большом числе
литературных данных. Чтобы не прибегать к уравнению БЭТ, Синг
вместо / использует соотношение v/vx, где vx — адсорбция при Р/Р° =
= 0,4.
Существование для каждого адсорбата некоторой
характеристической изотермы существенно облегчает определение величин
относительной удельной поверхности твердых тел. Исследователь,
интересующийся только этим параметром, может выбрать любое удобное уравнение
изотермы адсорбции, не обращая особого внимания на правильность
предпосылок, лежащих в основе этого уравнения. Конечно, неплохо бы
знать, каким именно моделям соответствуют те или иные особенности
экспериментальных изотерм, но в настоящее время возможности
определения корректности адсорбционной модели весьма ограничены.
Более подробно этот вопрос обсуждается в разд. XIV-13.
30*
468
Глава XIV
Рис. XIV-19 Изменение потенциальной энергии при вандерваальсовом взаимодействии
атомов >глерода [79].
Кривые 1а и 16 рассчитаны по уравнению (XIV-98), постоянные оценены по данным об энергии ко-
гезии и сжимаемости графита соответственно, кривая 2 рассчитана по уравнению (XIV-99).
(Печатается с разрешения У Phys. Chem [79]; © Am. Chem. Soc.)
10. Применение потенциальной теории для описания адсорбции
при заполнениях ниже монослойного
В этом случае основная проблема заключается в том, чтобы найти точные
выражения для короткодействующего взаимодействия адсорбент—адсорбат, которые
можно было бы использовать при расчете теплоты и свободной энергии адсорбции.
'Потенциальная функция может описываться уравнением типа (V-10) (см. гл. V), т. е.
8(г)=—ЛДб + Я/г12,
или уравнением, содержащим экспоненциальный член,
е (г) = — Л/г** -f Be~Cr.
(XIV-98)
(XIV-99)
Постоянные в этих уравнениях можно оценить по данным об энергии когезии и
сжимаемости жидкостей или твердых тел, а также по отклонению газовой фазы от
идеальной На рис. XIV-19 показано несколько типичных кривых зависимости
потенциальной энергии адсорбционной системы от расстояния между молекулой адсорбента
и поверхностью твердого тела [79]. Потенциальную функцию можно связать с
адсорбцией па следующим образом:
X
Cg)dry
(XIV-100)
где
■ Соё
г-г/kT
Концентрация адсорбата в газовой фазе С8 равна P/RT. Следовательно,
оо
k'A = па/Р = A (\/kT) \ Г ( e~e/kT - l) dr\,
(XIV-101)
где k' — постоянная Генри, т. е. начальный наклон изотермы адсорбции. В данном
расчете предполагается, что адсорбция протекает при достаточно низких значениях 9,
когда степень заполнения пропорциональна давлению, и что поверхность, безусловно,
однородна. Расстояние а соответствует точке е=0, т. е. точке, в которой вандерва-
альсово притяжение уравновешивается короткодействующим отталкиванием.
Численное значение интеграла в уравнении (XIV-101) можно найти, определив
постоянные в уравнении (XIV-98) или (XIV-99) по каким-либо независимым данным
(по сжимаемости, неидеальности газа и т. д.). После этого, сопоставив расчетную по-
Адсорбция газов и паров на твердых телах
469
стоянную Генри с экспериментальным значением nJP, можно найти удельную
поверхность адсорбента. Вообще говоря, результаты такого расчета зависят от выбранного
значения а. Этот параметр можно найти эмпирически, путем подбора такого его
значения, при котором получается правильная температурная зависимость постоянной
Генри. Таким способом можно оценить А, не прибегая к каким-либо специфическим
допущениям относительно площади поперечного сечения молекулы адсорбата.
Приведенная теория, по существу, совпадает с теорией, развитой Стилом и Холси
[80] (см. также обзор Стила [69]). В этом направлении большая работа проделана
также Эверетом и др. [81]. Трудной проблемой в рассматриваемой теории является
то, что интеграл в уравнении (XIV-101) в очень большой степени зависит от выбора
функции е(г) и поэтому его нельзя использовать для строгой и независимой оценки
энергии взаимодействия адсорбент — адсорбат из объемных свойств адсорбента и
жидкого или газообразного адсорбата. Проблема учета периодичности расположения
атомов на поверхности адсорбента подробно обсуждается в работах Стила [82] и Рикка
и др. '[82а].
До сих пор мы рассматривали адсорбцию лишь при очень низких степенях
заполнения, когда отношение па/Р равно постоянной Генри. При несколько более высоких
Р/Р° величина па/Р начинает отклоняться от постоянной Генри, что объясняется
латеральным взаимодействием адсорбированных молекул. Это взаимодействие также
можно рассчитать, используя ту или иную потенциальную функцию, если известна
поверхностная концентрация яа/А. В то же время по величине отклонения от закона Генри
4h
§зЬ
С*Нб
1Г~
[-
тю2 —
аморфный
—/углерод
алмаз
Р-33 —
'/яр щелочные
<Ш галогениды
L СН3ОН~_
1 ни- CrUQH
13_=-СОг СОг
Нгс5 С^ мНз_
-ДНг(1Мг)
1-
Экспериментальные
данные г
^л
— QH6
— Н20
— Рзз
—h
— со2
—углерод
алмаз
Скм
— нго
— NH3
Ci-JsOH
—coJ
сбнб
— h
п-Скм
Рис. XIV-20. Экспериментальные и теоретические величины энергии взаимодействия
в различных системах [86].
Значения постоянной С, соответствующей коэффициенту С\ в уравнении (VI-23), оценивались по
уравнению (VI-17) (уравнение Лондона) или уравнению (VI-19) (уравнение Кирквуда — Мюллера).
Масштаб последней колонки (плотность, умноженная на значение С ^м (выбран таким, чтобы
получить правильное значение лС^^для метанола; значения пС^^ для ТЮ2, алмаза, сажи Р-33-
и аморфного угля выходят за пределы шкалы.
470
Глава XIV
можно рассчитать А. Здесь опять встает вопрос о выборе размера молекул в
двумерном газе. Эту величину можно определить по отклонению состояния газообразного
адсорбированного слоя от идеального; можно также провести предварительный анализ
самой постоянной Генри k'. Задача осложняется также тем, что, хотя
адсорбированные молекулы по поверхности практически не движутся, они тем не менее совершают
колебательные движения по нормали к поверхности и, таким образом, /га/А на самом
деле не дает истинного среднего расстояния от поверхности. С учетом всех этих
факторов расчет энергии адсорбции или величин k' становится очень сложным. Для
нахождения оптимальных значений параметров, соответствующих экспериментальным k',
•отклонениям от К и их температурным зависимостям, обычно требуется несколько
диклов последовательных приближений. Принимая различные условия движения
молекул в адсорбированном слое, Баркер и Эверет [81] получили для упомянутой выше
графитированной сажи значения удельных поверхностей от 86 до 128 м2/г. Джонсон
и Клейн [83] рассматривают влияние выбора вида потенциальной функции,
описывающей взаимодействие между молекулами адсорбата, используя данные по адсорбции
аргона на графитированной саже Р-33. Авторы показали, что на результаты
обработки экспериментальных данных с учетом латерального взаимодействия мало влияет вид
отталкивательного члена потенциальной функции. Эверет [84] отмечает, что результаты
таких расчетов вообще должны в меньшей степени зависеть от неоднородности
поверхности и абсолютных значений теоретических параметров, чем рассмотренный выше
метод, основанный на прямой оценке постоянной Генри.
Большая часть расчетных данных, приведенных на рис. XIV-20, относится к
графиту (или пиролитическому углероду). При вычислении энергии адсорбции
предполагалось, что взаимодействие адсорбент — адсорбат обусловлено только дисперсионными
силами. Это предположение критикуется многими авторами. Особенно большие
сомнения оно вызывает в случае адсорбции азота на различных адсорбентах [см.,
например, уравнение (XIV-87)]. Известно, что молекулярные кристаллы как адсорбенты
имеют довольно однородные поверхности [85]. На таких кристаллах (в частности,
кристаллах льда, аммиака, двуокиси углерода, метанола, иода и бензола) выполнен ряд
работ по адсорбции азота [86]. В этих системах адсорбционное взаимодействие
должно быть исключительно вандерваальсовым, поскольку адсорбция не сопровождается
разрывом каких-либо связей на поверхности молекулярного кристалла. На рис. XIV-20
приведены экспериментальные теплоты адсорбции на поверхностях молекулярных
кристаллов и некоторых других поверхностях, а также величины теплот адсорбции,
рассчитанные с использованием потенциальных функций [уравнения (VI-17) и (VI-19)].
Для разных адсорбентов теоретические и экспериментальные значения Q не
совпадают не только по абсолютным значениям, но и (что еще более важно) по порядку
расположения. Поэтому можно сделать вывод, что поляризационное взаимодействие
играет не менее важную роль, чем дисперсионное. Этот вопрос обсуждается также
в разд. XIV-13.
11. Ступенчатая адсорбция и фазовые переходы
До сих пор мы рассматривали изотермы, плавно меняющиеся от
точки к точке. Долгое время исследователи обращали внимание лишь
на изотермы этого типа. В настоящее время стало ясно, что такая
форма кривых очень часто является следствием неоднородности
поверхности и что различные адсорбаты (и, возможно, комплексы между адсор-
батом и адсорбентом) могут претерпевать фазовые переходы, которые,
однако, четко проявляются лишь на очень однородных поверхностях.
В 1965 г. Холси, выступая по поводу присуждения ему премии Кен-
далла, собрал на одной диаграмме всевозможные типы фазовых
переходов. Эта диаграмма приведена на рис. XIV-21.
Первый переход в субмонослойной области соответствует
конденсации двумерной разреженной пленки. Обратите внимание, что этот
ттереход предсказывается теоретически как для локализованных пленок
(С латеральным взаимодействием [уравнение (XIV-52)], так и для не-
вдеальных подвижных пленок, подчиняющихся двумерному уравнению
Бан-дер-Ваальса и другим подобным уравнениям, приведенным в
табл. XIV-2. Впервые двумерная конденсация в адсорбированном слое
•наблюдалась при адсорбции криптона на бромиде натрия [87]; в
настоящее время таких примеров известно довольно много. На рис. XIV-22
приведена серия изотерм адсорбции криптона на грани (001)
графита [88]. Штриховой линией обозначена вероятная фазовая диаграмма
адсорбированного слоя; область при температуре немного ниже 85 К
.соответствует равновесию типа газ — твердое тело, а при несколько бо-
Рис XIV-21. Обобщенная изотерма
адсорбции по Холси.
§
is 2
1
«50
t
e /
Точка предельного
заполнения
Изменение
структуры
Изменение
структуры
Двумерная
'конденсация
Изотерма Генри.
$
0,5
1,0
OS
0,3
I
Ос*
<§
0.1
I i М М М М Г' ГЧ ' l ' I • I ' I ' i
Ml Hi4l
x ¥
\— x
71! I t ' If
I у
x I
111
WW 7
v
■ i.i
■ i ■ i . i . i
0 5/0
Давление, Ю'3мм рт.ст.
Рис. XIV-22. Изотерма адсорбции криптона на грани (001) графита в монослойной
области [88].
Температура адсорбции, К'
а -79,24; 6-80,54; 8-81,77; г - 82,83; д-83,84; е — 84,69; ж-85,33; 3-8574- и-8612-
к -86,58; л -87,08; м -87.61; «-87,81; 0-88,46
472
Глава XIV
i ' ' 1
\—Vm
у
г
eft fT
J 1
/(94,J°C J
jj^?c\
I l !
4005 0,0/0 Q0/5
p/pO
0f2 0,4 0,ff 0,8
p/p0
Рис. XIV-23. Изотермы адсорбции хлорэтана на графите стерлинг МТ [92].
лее высокой температуре находится область равновесия между
газообразной и жидкой двумерными фазами. В тройной точке (~85 К)
на поверхности существует равновесие типа газ — жидкость — твердое
тело. Аналогичные изотермы нередко наблюдаются при адсорбции
паров на графите [89] и других адсорбентах [90]. Например, используя
метод дифракции гелиевого пучка [91], удалось показать, что при
адсорбции этанола на грани (001) фторида лития переход
неупорядоченной пленки в упорядоченную происходит при температуре около 150 К-
В области полимолекулярной адсорбции, как и в субмонослойной
области, также возможны фазовые переходы. На рис. XIV-23
приведены полученные Дэвисом и Пирсом [92] изотермы адсорбции хлор-
этана на графите стерлинг МТ с характерными ступеньками фазового
перехода в первом и втором слоях.
Одно из условий появления на изотермах адсорбции вертикальных
ступенек, соответствующих различным фазовым переходам, —
достаточная однородность поверхности. В противном случае на различных
участках поверхности переход происходит при различных давлениях,
в результате чего ступенька нивелируется. Таким образом, наличие на
изотермах адсорбции вертикальных ступенек свидетельствует об
однородности поверхности. Отчасти поэтому поверхности графитированных
углеродов и некоторых других адсорбентов считаются довольно
однородными. Конечно, такой критерий однородности поверхности не одна-
значен, хотя обратное утверждение, что монотонность изотермы
адсорбции обязательно связана с неоднородностью поверхности, является еще
менее строгим.
12. Термодинамика адсорбции
Л. Теоретическое рассмотрение
В этом разделе мы рассмотрим некоторые термодинамические
соотношения, описывающие адсорбцию газов. Представляют 'интерес два
предельных адсорбционных процесса. В первом случае адсорбция
вещества Х2 на адсорбенте Х\ описывается уравнением
n\Xi (адсорбент при Т) + п§Х2 (газообразный адсорбат при Р, Т) =
=п\Х2(таз, адсорбированный на п\Х^. (XIV-102)
Адсорбция газов и паров на твердых телах
473
Такой процесс можно -назвать интегральной адсорбцией. Если он
проводится при постоянном объеме, то 'выделяемая теплота Qi равна
изменению энергии АЕ2 или, в расчете .на моль адсорбата, qi = AE2 (здесь и
далее штрихами отмечены молярные величины). Во втором случае
адсорбционный процесс проводится ло схеме
я§Х2(газ, Р, Т)=Аг|Х2(газ, адсорбированный при
постоянном отношении n2s/n[s). (XIV-103)
Теплота, выделяющаяся в процессе адсорбции такого типа, называется
дифференциальной теплотой Qd адсорбции при постоянном объеме.
В расчете на 1 моль дифференциальная теплота адсорбции равна
qd = AE2y где АЁ2—изменение парциальной молярной энергии. В
результате
ЯЛ=№дг4)Т9у. (XIV-104)
1. Теплота и энтропия адсорбции. Феноменологически процессы
адсорбции, абсорбции и растворения .можно рассматривать как
взаимодействие двух фаз с образованием комплексов типа адсорбент—адсор'-
бат. Формально такой процесс описывается уравнениями
dGs=Gl'dnl -f Gj'drtJ (XIV-105)
и
G*=n*Gs' +"iGs\ (XIV-106)
Однако, как правило, при рассмотрении термодинамики адсорбции
предполагают, что адсорбент является инертным, и все внимание
фокусируют исключительно на адсорбате. В дальнейшем мы будем
придерживаться обозначений, используемых в работах Хил л а [55, 93] и Эве-
рета [94]. Прежде всего запишем следующие соотношения:
dEs=TdSs— ndA + li2dns2y Es =TSS—яА+ \i2ns2, (XIV-107)
dHs=TdSs—ndA i-^, Hs=TSs—nA + \i2ns29 (XIV-108)
dAs=— SsdT—ndA + ii2dns2i As=—яА + \12п\, (XIV-109)
dGs = —SsdT — nd A + ix2dns2J Gs = —я А + \л2п%. (XIV-110)
Уравнения второго столбца выводят, интегрируя соответствующее
уравнение первого столбца при постоянных интенсивных переменных (см.
гл. II, вывод уравнения (П-79)). Обычно в термодинамике адсорбции
дополнительно вводят некоторые специальные обозначения, и в
частности
dW=TdSs + Adn 4- \i2dn%, H*=TSS + ц2я*, (XIV- 111)
dGs = — SsdT + Adn + \i2dns2, Gs=[i2ns2. (XIV-112)
Величины H9 и Gs обозначают то же, что и Н и G для объемных
систем.
Ита.к, используя приведенные выше обозначения, запишем
термодинамическое соотношение для процесса, описываемого уравнением
(XIV-103), где Р — равновесное давление адсорбата:
AG2=GS2 —GJ.*' =RT In P. (XIV-113)
В этом уравнении величина Gf определяется как
(dGs2/dnl)T yA=ii2.
474
Глава XIV
Для G\ можно записать следующее обычное термодинамическое
уравнение:
[д (G»-*4T)/dT\p^ = -H°*'/T*9 (XIV-114)
где верхний индекс 0 говорит об отнесении к стандартному состоянию
(газ при 1 атм). В то же время
[д(а1'/Т)/дт]А^-щ/т*. (xiv-i 15)
Решая совместно уравнения (XIV-13) — (XIV-15) с учетом того, что
л£/А = Г, получаем
(д In Р/дТ)г=— (tff — H$')/RT2=— AW'2/RT2=qsi/RT\ (XIV-116)
Верхние индексы, относящиеся к газовой фазе, здесь опущены,
поскольку последняя предполагается идеальной. Величина qst называется изо-
стерической теплотой адсорбции.
Поскольку G§' =(dGf7d/iS)jt=|i2 и G|=G|',
из уравнения (XIV-113) также следует, что
AG; =Gj' - GK =RT In P (XIV-117)
и
(d{Gl'jT)/dT)n=—Hf/T*. (XIV-118)
И в итоге
(д In P/dT)n=-(Hl'-H$')/RT*=-AH'jRT*=qn/RT*. (XIV-119)
Величину AH^ Хилл назвал равновесной теплотой адсорбции. Решая
последнее уравнение совместно с уравнениями (XIV-108) и (XIV-111),
получаем
Н1'=#|' + я/Г. (XIV-120)
Можно также показать, что
ДН;=АЯ; + (Г/Г) (дл/дТ)Р>т. (XIV-12!)
Таким образом, различают четыре теплоты адсорбции:
1) интегральную калориметрическую
Qi=(Qi/nl)V9 (XIV-122)
2) дифференциальную калориметрическую
qd=(dQt/dnl)T9Vt (XIV-104)
3) из остер ическую, или дифференциальную (термодинамическую)
qst = — AF; =qd + RT, (XIV-123)
4) интегральную (термодинамическую)
<7я=— AH'2=qt + RT—л/Г. (XIV-124)
Из соотношений (XIV-107) —(XIV-112) вытекают следующие
уравнения:
7H'=TSl' + (%9 (XIV-125)
Hj'^TSl' + Gs', (XIV-126)
А5;=(5Г -SK) =(АЯ;-АО;)/Г, (XIV-127)
AS' =(Si - SK) =(AH; - AG;)/7\ (XIV-128)
Адсорбция газов и паров на твердых телах
475
где
ag;=ag;=rt in я. (xiv-129)
С помощью этих уравнений по изотермам адсорбции, полученным
при различных температурах, можно рассчитать дифференциальную и
интегральную энтропию адсорбции <в зависимости от степени
заполнения поверхности. Вообще говоря, дифференциальная энтропия
адсорбции лучше отражает процессы, протекающие при адсорбции, однако
статистико-термодинамичеекие методы дают прежде всего величину
интегральной энтропии адсорбции.
Адсорбированная фаза по своим свойствам нередко сходна с
жидким адсорбатом. Об этом свидетельствует приближение теплоты
адсорбции к теплоте конденсации в полимолекулярной области. По этой
причине в .качестве стандартного состояния свободного адсорбата
обычно принимают чистую жидкость. В этом случае можно записать:
ДОзд=Авад =RT In x (XIV-130)
и
(XIV-131)
(XIV-132)
Кроме того,
Д#2(/)=#2 —^2 >
as'2U)=ss;-s°2r,
AH2(/)=HS2 — Я2'
AS2(/)=S2 —^2'
q8Ui)=KT*(dlnx/dT)r=qst-AHl (XIV-133)
qm =RT*(dln xlffT)n=q«-bH'v. (XIV-134)
Таким образом, при выборе жидкого состояния в качестве
стандартного теплота и энтропия адсорбции отличаются от аналогичных величин,
отнесенных к стандартному газообразному состоянию, соответственно
на теплоту и энтропию испарения жидкого адсорбата.
Наконец, «в качестве стандартного вполне .можно принять некоторое
состояние адсорбированной фазы. Де Бур [11] предлагает считать
стандартным такое состояние адсорбированный фазы, в котором
среднее межмолекулярное расстояние равно межмолекулярному
расстоянию в газовой фазе. При 0°С поверхностное давление стандартного
идеального двумерного газа составляет 0,338 дн/см. Площадь (в см2),
приходящаяся на одну молекулу адсорбата, в стандартном состоянии
равна 4,08-10~16 Т. При таком «выборе стандартного состояния
соотношения между величинами трансляционной энтропии двух- и
трехмерного газа существенно упрощаются.
2. Термодинамические величины, характеризующие изменение
состояния адсорбента. При протекании адсорбционного процесса
адсорбент не обязательно остается инертным. Проблема расчета изменения
термодинамических величин, относящихся к адсорбенту, подробно
рассматривается Копландом и Янгом [96]. Основная трудность здесь
состоит в том, чтобы определить термодинамические величины, например
^is' [уравнение (XIV-105)], для системы, состоящей из частиц
адсорбента, количество которых нельзя изменить даже на бесконечно -малую
величину dn\, не -вызвав соответствующего изменения удельной
поверхности системы. Эту трудность устраняют, заменяя п\ «а величину Дя?,
соответствующую добавлению одной частицы адсорбента, и принимая в
то же время, что термодинамические «величины являются
непрерывными функциями, определяемыми в точках между последовательными
значениями приращений IS.nl. При этих допущениях к адсорбционной
системе можно применить обычные термодинамические соотношения
для двухкомпонентных систем.
476
Глава XIV
Таким образом, в дифференциальном процессе, описываемом
уравнением (XIV-103), dn\ равно нулю. Тогда из уравнения (XIV-105)
следует, что
bG=^G'2dnl=RT f (In P)dnl (XIV-135)
о о
Кроме того, согласно уравнению Гиббса,
dn={n\ll>'n\)RTd\nPy
где Е/ — площадь, приходящаяся на моль адсорбента. Поскольку п\
не меняется, решая два последних уравнения совместно с уравнением
(XIV-113), получаем
2'я=(/?77л») Г n\d In Я=(1//if) (n\AG2 — Г AG2dns2)f (XIV-136)
о о
и так ка,к в соответствии с уравнениями (XIV-105) и (XIV-106)
0=nidGl' + nid(%.
TO п\
Е'я = (1//!£) f n\dAG2 = — AG[. (XIV-137)
о
Тогда дифференциальные теплоты адсорбции равны
Ая;=[а(де;/т)/з(1/Г)] ^^ (xiv-138)
и
дя;=[а(Ас;/Г)/а(1/Г)] ^^ 2, =яг* (din р/дТ)г. (xiv-139)
Последнее уравнение, по существу, совпадает с уравнением (XIV-116).
Величину АН[, по-видимому, удобнее всего определить как
АН[ = АН1п\ {пЦп\) А~Н2. (XIV-140)
Можно показать, что
АН = — яА + nlRT* (д In Р/дТ)п (XIV-141)
(разделив это выражение на я£, получаем AHg =ДЯ+я/Г). Таким же
способом из уравнений, аналогичных уравнению (XIV-125), .можно
найти соответствующие изменения энтропии.
На рис. XIV-24 даны термодинамические зависимости для системы
вода — сульфат бария, рассчитанные By и Копландом [97] с помощью
приведенных соотношений. Здесь же показаны результаты
калориметрического определения теплот адсорбции воды на сульфате бария.
Обращает на себя внимание не только хорошее соответствие
калориметрических и термодинамических величин АН2, но и то
обстоятельство, что АН[ не равна нулю. Если считать, что в адсорбционном__взаимо-
действии участвует только поверхностный .слой, то величины АН[,
отнесенные к одному молю поверхностного слоя адсорбента, становятся
вполне соизмеримыми с АН'2. То же самое можно оказать и о AG[ и
AG'2. Таким образом, если используемый адсорбент характеризуется
заметной летучестью, то можно ожидать, что адсорбция приведет к
изменению упругости его парой. Было бы очень интересно провести такие
Адсорбция газов и паров на твердых телах
477
О 10 vm 20 JO U0
пг,ммоль НгО/моль BaS04
Рис. XIV-24. Изменение дифференциальной энтальпии при адсорбции воды на
сульфате бария [97].
АЯг— парциальная молярная энтальпия воды (—калориметрические данные, О значения,
рассчитанные по температурному коэффициенту X); Д#1 — парциальная молярная энтальпия сульфата
бария.
опыты, например исследуя влияние адсорбции углеводородов [85] на
упругость паров воды над твердым льдом в 'интервале температур от
нуля до —50 °С. По (результатам таких определений можно было бы
оценить толщину слоя льда, находящегося в -равновесии с газовой
фазой. Структурные «изменения термостойких твердых тел можно
определить другими способами, например исследуя деформацию рельефа
поверхности при адсорбции. Интересная попытка расчета
соответствующего вклада в адсорбционные термодинамические величины была
сделана Куком и др. [99].
Б. Экспериментальные данные по теплоте и энтропии адсорбции
Прежде чем перейти ,к результатам измерений теплоты и энтропии
адсорбции, целесообразно вкратце рассмотреть различные методы
определения этих величин.
Интегральную теплоту адсорбции Q* .можно измерить
калориметрически, непосредственно определяя тепловой эффект при контакте
заданного количества адсорбата с чистой поверхностью адсорбента. Иногда
удобнее измерять теплоту смачивания твердого тела жидким адсорба-
том. При смачивании чистого твердого тела мы получаем интегральную
теплоту адсорбции при Р = Р°, т.е. Qi(P°) или qi(P°), тогда как при
смачивании адсорбента, предварительно выдержанного до
установления равновесия в парах адсорбента давлением Р, тепловой эффект
соответствует разности [Qi(P°)—Qi(P)]- Таким образом, измеряя теплоту
смачивания при Р и Я0, -можно найти q%{P) [100, 101].
Дифференциальную теплоту адсорбции qa находят по наклону зависимости Qi от
nl или измеряют тепловой эффект при введении в систему небольших
добавок адсорбата [102].
Изостерическую теплоту адсорбции qst можно найти с .помощью
уравнения (XIV-116) из изотерм адсорбции, измеренных .при
нескольких температурах (см. [76]). Интегрируя изотермы адсорбции,
измеренные вплоть до низких давлений, можно найти величины я и далее
с помощью уравнения (XIV-124) рассчитать также и интегральные
величины qi.
Парциальную молярную энтропию адсорбции AS'2 определяют из
qd или qst по уравнению (XIV-127). Таким образом, чтобы найти AS'2,
необходимы либо калориметрические теплоты адсорбции и одна изо-
478
Глава XIV
St
II
к °
[б
•ч^
эт
\^_ <
а 1
* 1
о о,г
0,6 ф
Средняя толщина слоя, А
5 Ю
/А f,8
5 10
НгО,мг/г
It
II
р
§^
3,0
2JS
2,0
1>
Ф\
0,5\
г- i i "— i м"
А 1
АО
о /
"а2
1 i i
1 ■
в I
-j
ч
-|
» 1
0%5
V/Vm
2,0
EL(NZ)
2.5
Рис. XIV-25.
а — дифференциальная теплота адсорбции азота на саже сферой 6 при 78,5 К i[102]; б — толщин»
пленки воды и теплота смачивания (в расчете на ом2) поверхности двуокиси тятана JJ04J;
в — дифференциальная теплота адсорбции азота на графите (/ и 2 — значения, полученные
калориметрически [76]; г — изостерические теплоты адсорбции н-гексана на льду, v m =0,073 см»
(НТД) [105]; <Э — изостерические теплоты адсорбции аргона на графитированной саже,
предварительно покрытой заданным числом слоев этилена [106].
терма адсорбции, либо изотермы адсорбции, измеренные при
'нескольких температурах. Для определения интегральной энтропии адсорбции
с помощью уравнений (XIV-119) и (XIV-128) требуются полные
изотермы, полученные .при 'нескольких температурах. Используя
уравнение (XIV-124), можно рассчитать AS2 по калориметрическим данным и
одной полной изотерме адсорбции. По мнению Юры и Хилла [100],
последний -метод «наиболее точный.
Теперь обратимся ,к результатам экспериментального определения
теплоты и энтропии адсорбции и прежде всего посмотрим, согласуются
ли между собой калориметрические и термодинамические теплоты
адсорбции. В книге Брунауэра [18] приводятся примеры адсорбции
различных паров (двуокиси углерода, метанола, азота и воды) на
активных углях, в которых qa и qst в пределах погрешности эксперимента
практически совпадают. ГрейсО'Н и Астон [103] нашли, что при
адсорбции неона на графитированной саже довольно сложная зависимость qa
от величины адсорбции очень близка к аналогичной зависимости qst.
Подобный пример для адсорбции воды на сульфате бария приведен на
рис. XIV-24. Обращает внимание также совпадение изостерических и
калориметрических величин на рис. XIV-25, в. Вообще говоря, вопрос о
соответствии калориметрических и термодинамических теплот
адсорбции не так уж тривиален. Такого соответствия может и не быть, если
Адсорбция газов и паров на твердых телах
47$
otoof от о9ооз от ощ от
то
О 1
г з 4 5 б
Объем, см3/г
Рис. XIV-25. (Продолжение.)
система обнаруживает гистерезис (см. разд. XIV-16), а если
поверхность неоднородна, такое соответствие трудно обосновать
термодинамически.
Обычно с увеличением количества адсорбированного вещества
дифференциальные теплоты адсорбции постепенно уменьшаются и при
физической адсорбции по мере приближения Р к Р° стремятся к теплоте
конденсации адсорбата. Некоторые примеры такого (рода приведены на
рис. XIV-25. В предполагаемой точке завершения образования
монослоя qst может 1резко уменьшаться (рис. XIV-25, в). Более плавное
уменьшение qst в этой области (рис. XIV-25, а, б), по-видимому,
указывает на неоднородность поверхности. Резкое изменение характера
зависимости изостеричеокой теплоты адсорбции я-текоана на поверхности
льда вблизи —35°С объясняется тем, что при (более -высоких
температурах образуются поверхностные клатраты. Как показано на
480
Глава XIV
рис. XIV-25, д, чтобы экранировать молекулы аргона от поля
поверхности графитирО'ванной сажи, достаточно всего лишь двух -монослоев
этилена; при дальнейшем росте предварительной адсорбции этилена изосте-
рическая теплота адсорбции аргона практически не меняется.
Характерные примеры зависимости энтропии адсорбции от степени
заполнения приведены на рис. XIV-26, б. Обычно TAS'2 сравнима с
Д#з, и, таким образом, энтропия вносит существенной ©клад в
изменение свободной энергии адсорбции. Обратите внимание, что энтропийные
кривые на рис. XIV-26, б являются почти зеркальным отображением
энтальпийных кривых на рис. XIV-26, а. В результате максимумы и
минимумы отдельных кривых компенсируют друг друга и кривая свобод-
U0 1,5
У/Ут
3ft
с?
^
^
1
«о
-18
■20
-22
-24
-26
-28
-30
-32
-34
0 0,2 0,4
/,2 v/vm —
Рис. XIV-26.
а —энтропия, энтальпия и свободная энергия адсорбции азота на графоне при 78,3 К (в
качестве стандартного состояния (принято жидкое) [76]; б — изостерическая теплота и парциальная
молярная энтропия адсорбции аргона, азота и окиси углерода на льду [107]; в — дифференциальная
энтропия адсорбции к-гексана на саже сферой 6, обработанной при 1700 (/), 2800 (2) и 3000 °С (3)
и на графите стерлинг MT-1, обработанном при 3100 °С (4) [151.
Адсорбция газов и паров на твердых телах
481
Рис. XIV-26. (Продолжение.)
ной энергии, а следовательно, -и изотерма адсорбции ;меняются
довольно плавно.
Как и энтальпия адсорбции, по -мере приближения Р к Р° энтропия
адсорбции стремится к энтропии -конденсации. Это еще один довод в
пользу того, что адсорбированный слой по своей природе близок ж
жидкому адсорбату.
Интересно, <что величины AS'2 часто -проходят через минимум вблизи
v = vm. Интересный пример такой зависимости наблюдался Иоирикяном
и Киселевым [15], изучавшими адсорбцию я-гексана на различных са-
жах. Ка-к показано «а рис. XIV-26, в, глубина минимума зависит от
степени графитизации и, 'Следовательно', от степени однородности
поверхности. Хилл и др. [108] обнаружили очень четкий минимум AS/2
при адсорбции азота на графоне, имеющем, по-видимому, весьма
однородную поверхность.
Принято считать, что минимум энтропии соответствует точке полного
заполнения_поверхности моносло-ем. Согласно уравнению (XIV-36), в
этой точке 5конф должна стремиться >к минус бесконечности, но в
реальных система^ шмимолекулярная адсорбция частично -компенсирует
уменьшение Зконф. Влияние неоднородности поверхности на энтропию
адсорбции рассматривается также в разд. XIV-14.
13. Сравнение различных моделей адсорбции
Как указывалось в разд. XIV-8, совпадение теоретической изотермы
адсорбции с экспериментальными данными при одной температуре еще
не доказывает правильности предпосылок, на основе которых выведено
уравнение изотермы. Совершенно различные в своей основе модели
могут приводить к уравнениям, которые не только не различимы
экспериментально, но даже математически идентичны. В ряде случаев в
области полимолекулярной адсорбции форма изотермы почти не
зависит от природы твердого тела, и любые уравнения, описывающие ее,
дают для различных адсорбентов одинаковые относительные удельные
поверхности. Таким образом, соответствие величин удельной
поверхности также не может служить достаточным критерием приемлемости
модели адсорбции.
31—1421
482
Глава XIV
Данные по теплоте и энтропии адсорбции позволяют провести более
строгую .проверку адсорбционной модели, хотя и при этом возможны
лишь качественные выводы.
А. Модель Лэнгмюра — БЭТ
В этой .модели принимается, что адсорбция локализована во всех
слоях, причем АН'2 в первом слое является некоторой постоянной
величиной, а в последующих слоях равна теплоте конденсации. Модель
Лэнгмюра вполне приемлема при низких P/P^jho, как показано в
разд. XIV-3B, ее трудно отличить по величине AS't от модели
подвижной адсорбции, тем более что обе модели дают математически
эквивалентные уравнения изотермы адсорбции (разд. XIV-бБ). Чтобы
надежно определить характер адсорбции, необходимы данные, полученные
каким-либо независимым способом, например необходимо знать
коэффициенты поверхностной диффузии или энергии комплексов
адсорбент— адсорбат (см. также разд. XIII-4). При этом необходимо
учитывать также влияние неоднородности поверхности, рассматриваемое в
разд. XIV-14.
Что же касается области полимолекулярной адсорбции, то здесь
положение еще сложнее. Основные допущения, заложенные в модель
БЭТ, являются нереальными. Как следует из рис. XIV-25, а, эта модель
неверно предсказывает как изменение qa от Э (правда, отчасти из-за
неоднородности поверхности), так и аналогичную зависимость AS'2.
Вообще говоря, имеется -много данных, указывающих на то, что приР,
близком к Р°у свойства адсорбированного слоя приближаются к
свойствам жидкого адсорбата. И хотя модель БЭТ в целом правильно
отражает изменение энергии адсорбции при больших Р/Р°, основное ее
предположение о неподвижности молекул в полимолекулярных слоях
не согласуется с жидкими свойствами этих слоев и к тому же
получаемая величина конфигурационной энтропии ошибочна. По мнению
Каеееля [109], на неудовлетворительность модели БЭТ указывает и то,
что для этой модели интелрал / в уравнении (VII-39) (.гл. VII) равен
бесконечности. Исследуя десорбцию смесей кислород—азот на
двуокиси титана, Арнольд [109а] пришел к выводу, что .молярная энтропия
второго и третьего слоев равна энтропии .нормальной жидкости и что
закон Рауля гораздо лучше соответствует экспериментальным данным,
чем уравнение БЭТ. Все это также указывает на жидкоподобные
свойства полимолекулярных слоев. Можно привести еще ряд примеров,
когда модель БЭТ оказывалась явно неудовлетворительной. Так,
изотермы адсорбции азота и аргона на тефлоне 6 О'Чень сильно
отклоняются от линейной зависимости БЭТ [110]; изотермы адсорбции азота
на Ti02 (рутиле), дегидратированном в различной степени, дают
слишком большие величины удельных поверхностей [111], и, наконец, при
наличии микропор удельные поверхности, найденные по методу БЭТ,
также явно ошибочны (см. [112]).
Брунауэр [113, 114] оправдывает недостатки модели БЭТ
необходимостью введения упрощений, позволяющих получить двухпараметриче-
ское уравнение, удобное для практического использования.
Предположение о постоянстве теплоты адсорбции в первом слое основано на
взаимной компенсации влияния неоднородности поверхности и
латерального взаимодействия, а допущение постоянства теплоты адсорбции
(вместо ее уменьшения) в последующих слоях компенсируется
завышенной оценкой энтропии адсорбции. Этим и объясняется, почему
модель БЭТ, как правило, работает хорошо. Однако эти же допущения
снижают ценность модели при более или менее детальном анализе
физической природы полимолекулярных слоев. Таким образом, уравнение
Адсорбция газов и паров на твердых телах
483
БЭТ, -несомненно, очень полезно при определении удельных
поверхностей и дает -некоторую информацию о природе адсорбированного -слоя,
правда .на уровне допущений, положенных в основу этой модели.
В частности, по величине константы с можно оценить среднюю теплоту
адсорбции в первом слое.
Б. Изотермы адсорбции, основанные на уравнении состояния
двумерной фазы
В настоящее время почти нет сомнений .в том, что точка перегиба
на изотермах II типа приблизительно соответствует началу
полимолекул ярн ой адсорбции. В области, лежащей выше этой точки, концепция
двумерной фазы представляется практически бесплодной, поскольку
она не позволяет ввести еще одну переменную — толщину
адсорбированного слоя. Тем не менее полученные на основе такой модели
уравнения пригодны для эмпирической обработки экспериментальных
данных.
Относительно применения модели двумерной фазы в субмонослой-
ной области можно сделать те же замечания, что и относительно
модели локализованной адсорбции. Предположение о том, что
адсорбированный монослой представляет собой неидеальный двумерный газ,
описываемый соответствующим уравнением состояния, вполне приемлемо.
Однако экспериментально отличить такую -модель от модели
локализованной адсорбции чрезвычайно трудно, а если возможна хотя бы
незначительная неоднородность поверхности, почти невозможно (см.
разд. XIV-14). Даже фазовые переходы можно объяснить, исходя из
совершенно иных представлений. Росс и Оливье [21], разрабатывая
основанную на уравнении состояния типа уравнения Ван-дер'-Ваальса
модель, согласовали ее с моделью Лэнгмюра. По мнению автора этой
книги, обе эти модели постепенно должны слиться в единую модель
субмонослойной адсорбции, построенную с учетом энергетических
состояний комплексов адсорбент — адсорбат, взаимодействия адсорбат—
адсорбат и энергетической неоднородности- поверхности. Информацию
такого рода следует получать из независимых измерений (см.,
например, гл. XIII), а не путем подгонки теоретических изотерм к
экспериментальным данным.
В. Потенциальная модель
Возвращаясь к вопросу о полимолекулярной адсорбции, следует
сказать, что в данном случае потенциальная модель в основе своей
вполне приемлема. Она объясняет такие эмпирические факты, как
совпадение величин RT In (P/P°) для систем, находящихся, по существу,
в эквивалентных состояниях, и сближение свойств полимолекулярного
слоя со свойствами жидкости при Р—кР°. Однако конкретная
теоретическая трактовка этой модели пока слишком примитивна.
Используемые в потенциальной теории различные функции е(г) имеют о«чень
приближенный характер. Даже общий вид уравнения (XIV-81) нельзя
считать вполне корректным, поскольку в нем не учитывается различие в
структурах адсорбированной фазы и жидкого адсорбата. Поверхность
адсорбента обязательно влияет на структуру адсорбированного слоя.
Подобное влияние должно иметь место при нанесении на поверхность
пленки нерастекающейся жидкости (см. гл. VII, разд. VII-5).
Последний член уравнения (XIV-91) можно рассматривать в лучшем случае
лишь как полуэмпирическую, хотя и вполне разумную попытку учесть
структурные изменения в адсорбированной фазе.
Ценным источником информации об адсорбционном потенциале
особенно полярных адсорбентов является характеристическая изотерма
31*
484
Глава XIV
Рис. XIV-27. Изотермы адсорбции азота при —195 °С на чистой саже (1) и саже
(2—6), предварительно покрытой пленкой бензола, содержащей 0,6, 1,1, 1,5, 4,5 и 6,2
статических монослоя соответственно [115].
(или ^-кривая). Очень важно, что для этих адсорбентов толщина
пленки t (ил-и v/vm) как функция Р/Р° практически не зависит от природы
адсорбента. Таким образом, можно залисать
v/vm=f(P!P»), (XIV-142)
где функция / (и любые (Входящие в «ее постоянные) не зависит от
природы твердого тела (но могут меняться пр'и переходе от одного ад-
сорбата -к другому).
К сожалению, ни один из вариантов потенциальной теории не
указывает «на существование характеристической изотермы. Уравнение
(XIV-88) ясно не удовлетворяет этому критерию; уравнение (XIV-99)
также следует исключить, поскольку оно дает f, включающую
постоянную Л, которая зависит от энергии дисперсионного взаимодействия е0,
'Определяемого в свою очередь природой адсорбента. Не лучше в этом
отношении и уравнение (XIV-94), согласно которому е0 зависит от
полярности поверхности адсорбента [см. также уравнение (V-38) ]. Ясно
только, что при адсорбции более одного или ;в крайнем случае двух
слоев молекулы адсорбата практически не взаимодействуют с
поверхностью адсорбента.
Такая изоляция молекул верхних слоев от поверхности адсорбента, по-видимому,
действительно имеет место. Об этом, в частности, свидетельствуют данные Дубинина
и сотр. [115], приведенные на рис. XIV-27. Изотермы адсорбции азота измерялись при
—185 °С. Адсорбентом служила сажа, предварительно покрытая различными
количествами адсорбированного бензола. После нанесения всего лишь около 1,5
статистического монослоя бензола никаких изменений на изотермах адсорбции азота
обнаружить не удалось. Все изотермы имеют одинаковую форму и, более того, ложатся на
одну и ту же характеристическую изотерму. Предварительная обработка образцов
приводит лишь к уменьшению расчетных значений vm при изменении толщины слоя
адсорбированного бензола от 0 до 1,5. Аналогичные данные получены Холси и др.
[116], который исследовал адсорбцию аргона и азота на рутиле, постепенно
увеличивая содержание предварительно адсорбированной воды. В этом случае предельная
изотерма адсорбции достигалась лишь при нанесении около четырех статистических
монослоев воды, причем приближение к предельной изотерме носит почти экспоненци-
.альный характер. Интересно, что предельная изотерма адсорбции азота очень похожа
Адсорбция газов и паров на твердых телах
48S
на изотерму адсорбции азота на специально приготовленном порошкообразном льду,
имеющем, по-видимому, аморфную структуру [32, 98]. В то же время при адсорбции
азота на угле при постепенно увеличивающемся слое предварительно
адсорбированного метанола предельная изотерма адсорбции не достигается [115].
Ясно, что для решения проблемы построения потенциальной функции необходимо
иметь более подробные сведения о структуре полимолекулярного слоя. Авторы ряда
работ [10, 55, 117] пытались разработать статистико-механическую теорию адсорбции
молекул в потенциальном поле. Ввиду исключительной сложности задачи эти
попытки оказались не слишком успешными.
14. Адсорбция на неоднородных поверхностях
Обсуждение моделей адсорбции, проведенное в предыдущем
разделе, показало, что почти для всех исследуемых систем возможная
неоднородность поверхности практически исключает как экспериментальную
проверку моделей адсорбции, так и более или менее строгую
теоретическую интерпретацию экспериментальных данных. Совершенно ясно, что
поверхности твердых тел обычно неоднородны (ом., например, гл. V,
разд. V-4). На неоднородность .поверхности непосредственно указывают
данные по теплоте и энтропии адсорбции, приведенные на рис. XIV-25
и XIV-26.
Л. Энергетическое распределение центров адсорбции
Очевидно, что неоднородность поверхности прежде всего влияет на
адсорбцию в первом слое. Поэтому здесь ;мы ограничимся лишь
рассмотрением адсорбции в пределах монослоя. В этом случае независимо
от того, какая из моделей выбрана, изучение адсорбции на
неоднородной поверхности в самом общем виде представляет собой задачу
определения доли покрытой поверхности 0 в виде некоторой функции Q, Р
и Т (Q — энергия адсорбции, Т и Р имеют обычные значения). Если
поверхность неоднородна, то вероятность того, что данный центр
характеризуется энергией адсорбции от Q до Q + dQ, можно определить с
помощью функции распределения как f(Q)dQ. Экспериментально
наблюдаемая величина адсорбции равна сумме величин адсорбции на
различных участках поверхности, и ее можно представить в виде некоторой
функции в от Р и Т:
оо
S(P,T)=^Q(Q,P,T)f(Q)dQ. (XIV-143)
6
Полезно ввести также интегральную функцию распределения F,
которая определяется как доля поверхности с энергией адсорбции больше Q.
f(Q)=dF/dQ9 (XIV-144)
и, следовательно,
со
в (Р, 7) = Гв (Q, P, T) dF. (XIV-145)
о
Обычно зависимость qa от в не совпадает с функцией F(Q), поскольку
в той или иной мере адсорбция одновременно протекает на всех
участках поверхности, и, таким образом, теплота, выделяющаяся при
адсорбции dn\ молей, представляет собой средневзвешенную величину.
Исключением является лишь адсорбция при ОК. В этом случае
адсорбция постепенно распространяется на участки с более высокой
величиной Q, и поэтому <7<*(6) эквивалентна F(&). Этим обстоятельством
воспользовались Дрэйн и Моррисон [1], которые определили qd{&) для
аргона, азота и кислорода на двуокиси титана цри ряде температур и
486
Глава XIV
затем экстраполировали температурные зависимости <7<*(в) на ОК.
Такой метод нахождения ^(в) очень труден, и к тому же лри
экстраполяции вводятся некоторые допущения. «Поэтому было 'бы очень
желательно найти способ интегрирования уравнения (XIV-143) или
(XIV-145), с тем чтобы энергетическое распределение центров
адсорбции можно было находить из данных, полученных при обычных
температурах.
Один из способов решения этой проблемы заключается ,в подборе
таких функций 0(Q, Р, Т) и /(Q), при которых возможно
'интегрирование уравнения (XIV-143). Так, если f(Q)=ae~^nRT и 6(Q, Я, Т)
представляет собой уравнение Лэнгмюра, то при 'интегрировании
получается уравнение Фрейндлиха (см. гл. IX, разд. 1ХЧ А). Росс и Оливье
[21] интегрируют уравнение (XIV-143), принимая, что f(Q) имеет вид
гауссовой функции, a 0(Q, Р, Т) определяется двумерным уравнением
Ван-дер-Ваальса. Авторы протабудировали решения для различных
значений параметров этих функций.
Существует и непрямой путь «нахождения изотермы адсорбции по
заданным функциям f(Q) и 8(Q, Я, Т). Темкин [118] принял, что
энергия всех центров меняется в соответствии с уравнением Q = Qo (1—ав),
и, подставив последнее уравнение в выражение для .параметра Ь
уравнения Лэнгмюра, получил следующее уравнение:
In P =—In (b0eQo/RT) +1п [0/(1 +0)1 + Q0aB/RT. (XIV-146)
Еще один подход -к проблеме неоднородности поверхности—выбор
такой функции 6(Q, Р, Г), подстановка которой .в интелральное ура<в-
нение (XIV-143) позволяет найти f(Q) по экспериментальной изотерме
адсорбции. Хобсан [119], например, в качестве локальной изотермы
адсорбции использует изотерму, основанную, по существу, на
модифицированном двумерном уравнении Ван-дер-Ваальса, которое при низких
давлениях является линейным, а при 8=1 дает вертикальную
ступеньку. Сипе [120] показал, что, если применить лэнг.мюроескую модель
адсорбции, уравнение (XIV-143) можно подвергнуть стандартным
преобразованиям и получить функцию f(Q) в явном виде. Запишем
уравнение (XIV-143) следующим образом:
оо
e(P,T) = ^f(Q)bP/(\+bP)}dQ =
0
= [er<'*Tf (Q)/((fi'«T + 1 /b0P)dQ (XIV-147)
о
или
' О
(\/RT)e(l/b0y)=f x\f(RT\nx)/(x + y)ldx, (XIV-148)
i
где у= 1 b0P и x=eQ/RT. Теперь уравнение приводится к виду
со
X (У) = \ *Ф Ш* + У) dxy (XIV-149)
решением которого является функция
ф (*) = [/ (xe-^ — 'jiixe^frni. (XIV-150)
Адсорбция газов и паров на твердых телах
487
Дальнейшее решение определяется аналитическим видом зависимости
в от Р. Так, если 0(Р, Т) =ЛРС, то
Х(У)=(А/ЯТЬ&!Г. (XIV-151)
Подставляя последнее выражение -в уравнение (XIV-150), получаем
Ф (x)=(A/RTbc0) [(xe-^)-c—(xe^)-c]/2m=(A/RTbc0) (sin ж) (х~с/п) (XIV-152)
или
/ (Q) =(A/RTb$) (sin nc) (1/я) exp (-cQ/RT), (XIV-153)
что является более точным решением для f(Q), чем уравнение (IX-14).
Если в принять равным АРс1(\-\-АРс), т.е. принять, что в стремится
к 'некоторому предельному значению, то окончательное выражение для
f(Q) имеет вид гауссовой функции. Используя функцию 0=[Р/(Л +
+ Р)]С, описывающую данные по адсорбции азота на двуокиси титана
в интервале 0 от 0,5 до 0,9, Хониг и Рейерсон i[121] .получили /(Q),
монотонно уменьшающуюся € ростом Q. Те же данные описываются и
уравнением
e=A\n[(kP+c)/(P+c)u
однако в этом .случае уравнение (XIV-50) дает f(Q), имеющую
.постоянное значение в определенном диапазоне Q и равную нулю вне этого
диапазона.
Вполне очевидно, что в общем случае решение 'интегрального
уравнения (XIV*-143) в значительной мере зависит от входящих в него
аналитических «выражений, особенно @(Р, Т). Поскольку выбор этих
-выражений диктуется возможностью соответствующих математических
преобразований, они далеко не всегда удовлетворительно согласуются с
экспериментальными данными. Поэтому достоверность находимой
таким способом функции f (Q) установить очень трудно.
Уравнение (XIV-143) можно решать также методом
последовательных приближений i[122], пользуясь следующей процедурой. Сначала
выбирается функция 6 (b, P). В качестве таковой можно взять любую
функцию, в которой Ъ пропорционально eQ/RT, например уравнение
Лэнгмюра или какое-либо из уравнений, .приведенных в табл. XIV-2.
Выбранная функция табулируется или наносится на график, подобный
приведенному на рис. XIV-28, б, где для простоты Q{bP) определяется
уравнением Лэнгмюра. В качестве первого приближения Q(bP)
заменяют на ступенчатую функцию. На рис. XIV-28 ступенька возникла бы
при ЬР=\, та,к что 6 = 0 при ЬР<С\ « 6=1 при ЪР>\. Вообще говоря,
ступенчатая функция описывает адсорбцию при 0 К, когда центры
адсорбции заполняются в строгом порядке: центр с данным b (и,
следовательно, Q) заполняется при P=l/b и, наоборот, при давлениях,
ниже соответствующего данному значению 1/Я, заполняются лишь
центры с b<Zl/P. Следовательно, в первом приближении .кривая
зависимости в от 1/Р эквивалентна кривой зависимости F от b
(рис. XIV-28, а).
В качестве второго приближения принимают, что при данном Р
для каждого b значения 6 определяются графиком, приведенным на
рис. XIV-28, б, а значения F — графиком первого приближения
(рис. XIV-28, а). Далее, используя ряд значений ft, строят
вспомогательную зависимость 6 от F, приведенную на рис. XIV-28, в. Теперь
суммарное заполнение поверхности 0 должно определяться
интегралом \ QdF, и, таким образом, лри данном Р площадь под
вспомогательной кривой (рис. XIV-28, в) равна 0расч. По-лученные этим способом
значения в, вообще говоря, могут несколько отличаться от
экспериментальных значений 0. В этом случае во втором приближении
следует уточнить F, приняв, что F2 = F{ 0Эксп/0Расч. Эту величину F2 под-
488
Глава XIV
—г
Г%
i_
^^
—i 1—|
н
V
i r4J
/,0h^
05b
10 Юг Ю4-
HP
10b
Рис. XIV-28. Методика расчета энергетического распределения центров адсорбции
[122].
а — изотерма адсорбции, представленная в виде зависимости в от MP, последовательные
приближения зависимости F от Ь; б — зависимость 0(Q) (в данном в случае соответствующая
уравнению Лэнгмюра); в — зависимости 9 от F при двух различных давлениях.
ставляют в зависимость F от Ь при & = 1/Р. Затем процедуру повторяют
для других значений Р и по полученным Р2. строят уточненную кривую
-интегрального распределения F от Ь.
Иногда, как показано на рис. XIV-28, а, требуется дополнительно
провести третий цикл последовательных приближений. При этом
выполняют те же процедуры, что и во втором цикле. Для выбранного Р
берут серию значений Ь и строят вспомогательную кривую. Площадь
под этой .кривой дает значение враСч, по которому находят третье
приближение Р3 для Ь, соответствующего выбранному значению Р.
Повторяя эту процедуру для других значений Р, получают зависимость
7*3 от Ь.
Вообще говоря, точного решения уравнения (XIV-143) не
существует, поскольку экспериментальные данные всегда содержат некоторую
ошибку и предполагаемая функция 6 не может 'быть верной для всей
системы. Поэтому последовательные приближения зависимости F от
Ь в точности не сходятся, особенно если поверхности -почти однородны.
При проведении циклов последовательных .приближений довольно
быстро наступает момент, когда получающиеся зависимости F от Ъ
начинают мало отличаться друг от друга, причем в этих различиях не
обнаруживается «никакой закономерности. Конечно, если используется метод
последовательных приближений, расчеты целесообразно вести на ЭВМ.
Полученную зависимость F от Ъ нетрудно преобразовать в
зависимость Рот Q(b) (если применяется уравнение Лэнгмюра Q{b) =
= b0eQ/RT), по которой можно построить кривую зависимости f(Q) от Q.
На рис. XIV-29 приведены подобные функции распределения,
полученные путем обработки методом последовательных приближений данных
Дрэйна и Моррисона [1] (локальной изотермой служит изотерма БЭТ
[123]) и Хонига и Рейерсона {121]. Обработка данных проводилась с
помощью уравнения Лэнгмюра и его аналогов. Рис. XIV-29, а
показывает, что результаты, получаемые методом последовательных
приближений, неплохо согласуются с истинным энергетическим распреде-
Адсорбция газов и паров на твердых телах 489
Е(е6эт) Е Е(с) а J
Е, икал/моль
J
2
2,3 2,5 3,0
Q
Рис. XIV-29.
а — энергетическое распределение центров адсорбции рутила, найденное из изотерм адсорбции
аргона, полученных Дрэйном и Моррисоном [1]. Сплошная линия — распределение, рассчитанное
по изотермам адсорбции при 85 К; штриховая линия — распределение, найденное Дрэйном и Мо-
риссоном экстраполяцией к О К; штрих-пунктирная линия показывает предполагаемый авторами
ход распределения в области низкой энергии адсорбции, б — энергетические распределения
центров адсорбции, найденные из изотерм адсорбции азота, кислорода и аргона на рутиле [121]
лением центров адсорбции. Ка,к видно -из рис. XIV-29, б, это
распределение зависит как от адсорбата, так и от адсорбента.
Если поверхности очень неоднородны, энергетическое распределение
центров адсорбции почти не зависит от адсорбционной модели.
Значительная ошибка в выборе выражения для энтропии адсорбции
(например, bo) проявляется в том, что получаемое распределение становится
зависимым от температуры, а этого не должно быть. При
'Использовании модели латерального взаимодействия распределение сдвигается по
оси Q на (величину, соответствующую средней энергии 'взаимодействия
молекул адсорбата между собой.
Таким образом, для неоднородных поверхностей вид распределения
находится до-вольно точно, что особенно ценно при анализе изменения
состояния поверхности адсорбента после той или иной обработки.
Примером могут служить кривые, приведенные на рис. XIV-30 [124].
Аналогичные данные получены и при исследовании двуокиси титана,
подвергнутой облучению в ядерном реакторе [125], и различных видов саж
и алюмооиликатных катализаторов /[126]. Хауз и Джэйкок [127]
обработали данные по адсорбции криптона на анатазе (Ti02) двумя мето-
490
Глава XIV
Q, ккал/моль
Рис. XIV-30. Энергетическое распределение центров адсорбции азота на кремнеземе SB,
обезгаженном при 110 (1) и 300 °С (2). (Печатается с разрешения J. Phys. Chem.
[124]. © Am. Chem. Soc.)
дами — Росса и Оли-вье [21] и Адамсона. [122]. Оба метода позволяют
удовлетворительно описать экспериментальные данные, но дают
различные энергетические распределения в зависимости от выбора
локальной изотермы адсорбции (уравнение Лэнгмюра или изотерма,
основанная на двумерном уравнении Ван-дер-Ваальса).
В случае относительно однородных поверхностей складывается
парадоксальная ситуация. Как и прежде, для нахождения f(Q) можно
использовать различные модели адсорбции, однако получаемые при
этом f(Q) имеют вид довольно узких функций, подобных гауссианам,
положение которых в значительной мере определяется выбором
адсорбционной .модели. Например, все три распределения, приведенные на
рис. XIV-31 [129], вполне удовлетворительно описывают данные по
адсорбции азота на кремнеземе BN [128], хотя относятся ,к
совершенно различным функциям 0(Q, Р, Т). Таким образом, для почти
однородных поверхностей ни модель адсорбции, ни энергетическое
распределение центров адсорбции однозначно определить нельзя.
На этом трудности не кончаются. Применение описанного анализа
энергетического распределения центров адсорбции для моделей с латеральным взаимодействием
предполагает неоднородность взаимодействия между молекулами адсорбата на
отдельных участках. Вообще говоря, это предположение не является достаточно
обоснованным. Фактически полное статистическое описание неоднородности должно
учитывать энергетическое распределение центров, смежных с центром, характеризуемым
данной энергией. При такой ситуации для нахождения слишком большого числа
переменных одних адсорбционных данных становится, по-видимому, недостаточно.
В этом отношении может оказаться полезным сопоставление изотерм адсорбции
газов, например азота и бутана [128], молекулы которых заметно различаются по
размеру. Формальная статистико-механическая теория адсорбции на неоднородных
поверхностях разработана Стилом [1130].
Адсорбция газов и паров на твердых телах
491
12
//
10
9
8
-^ 7
^ 6
5
3
2
i
~ifi 1,9 2,0 2,1 2,2 2,3 2£ 2,5 2,6
Q, ккал/мопь
Рис. XIV-31. Распределение энергии взаимодействия при адсорбции азота на
кремнеземе BN.
а — модель Лэнгмюра, б — модель Лэнгмюра с учетом латерального взаимодействия, в — модель
адсорбированной фазы, описываемой уравнением состояния типа уравнения Ван-дер-Вааль-
са (128]
Б. Термодинамика адсорбции на неоднородных поверхностях
Обычно считают, что изоетерические теплоты адсорбции,
найденные для гетерогенной поверхности, непосредственно связаны с
калориметрическими теплота ми уравнением (XIV-123), хотя
термодинамически это верно, лишь если химический потенциал адсорбата не
претерпевает скачкообразных изменений с ростом в [131]. Эквивалентность
нзостерических и калориметрических те плот аналитически до-казана
лишь для случая, когда в(ф, Р, Т) представляет собой уравнение
Лэнгмюра [132].
Ка,к показал Эварет {9], 'неоднородность поверхности очень сильно
влияет «а энтропию адсорбции. Это видно из рис. XIVi-32, на котором
приведено изменение AS'2 с G для различных моделей адсорбции на
однородных и неоднородных поверхностях (неоднородность поверхности
учитывалась путем использования энергетического' распределения
центров при адсорбции азота на двуокиси титана [122]. В данной ситуации
нас интересует не столько зависимость от 0 абсолютных значений
энтропии адсорбции, сколько изменение ее конфигурационной
составляющей. Оказывается, что £'КОнф так меняется на неоднородной
поверхности, что различия между отдельными моделями почти полностью
нивелируются. Объясняется это тем, что на неоднородной поверхности
каждая новая порция адсорбата заполняет лишь небольшую часть
доступной поверхности. Если только в не стремится к нулю или единице,
5Конф очень неоднородной поверхности равна нулю независимо от
модели адсорбции.
492 Глава XIV
Рис. XIV-32. Теоретические и расчетные зависимости энтропии адсорбции азота на
двуокиси титана.
Сплошные линии — теоретические зависимости, соответствующие модели Лэнгмюра (а), модели
идеального газа (б) и модели неидеальной двумерной адсорбированной фазы {в). Во всех
случаях поверхность предполагается однородной, в точке 6=0,5 кривые совмещены, / — расчетная
зависимость, соответствующая модели Лэнгмюра ,[128] с заданным i[125] энергетическим
распределением центров адсорбции f (Q), 2 — аналогичная зависимость, соответствующая модели
неидеальной двумерной адсорбированной фазы
В данной ситуации имеются и «свои положительные моменты.
Поскольку для 'неоднородной поверхности ни энергетическое
распределение центров адсорбции, ни конфигурационная энтропия-не слишком
зависят от «выбора модели- адсорбции, первая дает надежную информацию
об энергетическом состоянии поверхности адсорбента, а энтропия
адсорбции теперь относится ,к изменению энтропии образования
комплексов адсорбент — адсорбат. При этом необходимость в поправке на
«изменение конфигурационной энтропии отпадает.
15. Скорость адсорбции
Еще одним независимым методом определения удельной поверхности может
служить определение точки резкого изменения скорости адсорбции. Так, Юра и Пауэлл
[133] показали, что величины удельных поверхностей, найденные кинетическим и
адсорбционным (БЭТ) методами при адсорбции аммиака на крекинговом катализаторе
и азота на двуокиси гитана, довольно хорошо согласуются между собой. Кальвэ
[134] также обнаружил резкое изменение выделения тепла в точке завершения
заполнения монослоя при адсорбции воды на двуокиси титана.
Такие эффекты нельзя объяснить, исходя из представлений химической кинетики.
Исследуя скорость адсорбции воды на лиофилизованных белках, Бенсон и др. [71]
пришли к выводу, что на наблюдаемые скорости адсорбции сильное влияние
оказывает разогрев образцов теплом, выделяющимся при адсорбции. Создается впечатление,
что фактическая скорость адсорбции очень велика и что медленное изменение
давления пара над адсорбентом обусловлено просто медленным охлаждением образца
после первоначального нагрева при приведении адсорбата в контакт с адсорбентом.
По данным Дейтца и Карпентера [135], даже при очень низких заполнениях 6,
достигающих всего нескольких процентов, аргон и азот адсорбируются на алмазе очень
медленно. Авторы показали, что в данном случае лимитирующим фактором является
не низкая теплопроводность алмаза, а медленный переход поверхности алмаза в
более активное состояние после охлаждения образца перед опытом; сам по себе
процесс адсорбции протекает очень быстро. Изменение состояния поверхности является
Адсорбция газов и паров на твердых телах
493
Рис. XIV-33. Пространственное расположение тетраэдрических групп (Al, Si)04,
образующих кубооктаэдрические полости в некоторых полевых шпатах и цеолитах [138]
обратимым и, по-видимому, связано с эффектом Даннинга (гл. XIII, ХИ1-4Б).
Аналогичное явление наблюдали также Гуд и сотр. [136]. Измеряя теплоту смачивания
А1203 и Si02 водой, авторы обнаружили длительное остаточное выделение тепла,
приписываемое ими медленной гидратации поверхности.
В заключение отметим, что данные, свидетельствующие о замедленности
установления равновесия при физической адсорбции, следует анализировать весьма
осторожно и тщательно. Чаще всего ограниченная скорость адсорбции обусловлена
тривиальными причинами. Не исключено, однако, что при внимательном анализе этого
явления будут найдены новые интересные и неожиданные зависимости.
16. Адсорбция на пористых телах. Гистерезис
Как правило, адсорбаты, температура .которых превышает
критическую, не дают изотерм полимолекулярной адсорбции. В таких условиях
пористый адсорбент, если -в нем нет пор молекулярных размеров, ведет
себя подобно другим адсорбентам такого же состава. При наличии в
адсорбенте пор молекулярных размеров различия между адсорбцией и
абсорбцией в значительной мере стираются. Если температура ниже
критической, возможно ка.к образование полислоев, так «и .капиллярная
конденсация. Остановимся на особенностях адсорбции пористыми
телами несколько подробнее.
А. Молекулярные сита
Если поры адсорбента настолько малы, что адсорбент действует
как молекулярное сито, то кажущаяся удельная поверхность
адсорбента, определяемая из адсорбционных данных, в значительной мере
зависит от размера молекул адсорбата. По предложению Мак-Бэна
[137] в таких случаях адсорбцию называют «персорбцией». В этой связи
большой интерес представляют цеолиты, построенные из
тетраэдрических групп (Al, Si)04. Последние связаны между собой таким образом,
что между ними образуются большие полости, в которые молекула
адсорбата может войти лишь через более узкие отверстия [138]
(рис. XIV-33). Так, шабазит CaAbiSi^O^ имеет полости диаметром 10 А
с шестью входными отверстиями, или окнами, диаметром около 4 А.
494
Глава XIV
Одно- и двухатомные газы, вода и я-алканы могут проходить через
такие отверстия, тогда как более крупные молекулы через «их не
проходят [139J. Кроме того, в шабазите, по-видимому, имеются полости
меньшего размера, благодаря чему можно проводить разделение
молекул водорода и азота [140]. Замена кальция на .другие ионы (как
отмечалось в гл. IX, разд. IX-3B, цеолиты обладают ионообменными
свойствами) сильно отражается на адсорбционных (свойствах цеолитов.
Промышленность выпускает синтетические цеолиты (молекулярные
сита линде) с входными отверстиями различного диаметра—от 4 до
10 А [138].
Изотермы адсорбции на цеолитах часто имеют вад изотермы Лэнг-
мюра (в условиях, когда .полимолекулярная адсорбция маловероятна),
причем vm и b сильно зависят от природы катиона. Примером .могут
служить приведенные в работе [141] изотермы адсорбции этилена на
различных шабазитах (предполагается, что в этих «цеолитах имеется
два типа центров адсорбции). По-видимому, в процессе адсорбции
происходит постепенное заполнение полостей цеолита. Авторы работы
[142] предлагают уравнение изотермы адсорбции на цеолитах,
аналогичное уравнению (XIV-82), где е2 заменен на еп.
Образование клатратных соединений можно рассматривать как частный случай
персорбции. В клатратах также имеются полости, но без входных окон. Таким
образом, «адсорбция» с образованием клатрата протекает как кристаллизация частиц
твердого тела с включением молекул «адсорбата». Примером может служить
кристаллизация хинола в присутствии растворителя или растворенного газа, молекулы которых
достаточно малы и могут входить в полости диаметром несколько ангстрем,
образуемые молекулами хинола. Иногда в такие полости входит не одна, а несколько
молекул. Таким образом, получаются стехиометрические кристаллы, однако при этом
решающую роль играют не химические, а топологические факторы. Такие разные по
своей природе вещества, как двуокись серы, метанол, муравьиная кислота, азот,
образуют с хинолом клатратные соединения [143].
Интересно, что клатратные соединения может образовывать и обычный лед.
Каждая элементарная ячейка кристалла льда включает попость с шестью входными
окнами диаметром 5,9 А и двумя окнами диаметром 5,2 А [144]. Лед дает клатратные
соединения с самыми разнообразными веществами, начиная с инертных газов и
кончая углеводородами. Причем для получения таких клатратов совсем не обязательно
проводить кристаллизацию in situ. По данным Баррера и Ружички [145],
порошкообразный лед самопроизвольно образует клатрат с ксеноном или криптоном при
температуре —78 °С. Самопроизвольное образование клатратных соединений наблюдалось
также при исследовании адсорбции этана (при —96 °С) [98] и окиси углерода [148]
на льду. Все эти случаи можно рассматривать как примеры глубокой (!) перестройки
адсорбента под влиянием адсорбата.
Б. Капиллярная конденсация
Если температура адсорбата ниже .критической, адсорбция, как
правило, является полимолекулярной, причем наличие пор может
проявляться не только в ограничении возможного числа слоев адсорбата на
поверхности [см. уравнение (XIV-64)], но и .в возникновении
.капиллярной конденсации. В настоящее время известно множество -различных
пористых адсорбентов, имеющих в отличие от цеолитов поры самых
разных размеров и формы. Для та,ких адсорбентов характерно наличие
адсорбционного гистерезиса, проявляющегося в том, что десорбционная
ветвь изотермы адсорбции смещена -относительно адсорбционной ветви
в область более низких значений Р/Р° (рис. XIV-34). Кроме того, для
■изотерм с гистерезисом характерно наличие почти горизонтального
участка при Р/Р°, близком к единице (см. рис. XIV-7). В этом разделе
речь пойдет лишь об изотермах с замкнутой гистерезисной петлей типа
изображенных на рис. XIV-34, бив.
Появление незамкнутой петли, показанной на рис. XIV-34, а,
объясняется по меньшей мере двумя причинами. Во-первых, появление
такой петли может быть обусловлено наличием в адсорбенте
бутылкообразных пор, захватывающих адсорбат ка.к в ловушку (см. гл. XIII,
Адсорбция газов и паров на твердых телах
495
Р/Р° ' ° р/рО
Рис. XIV-34. Гистерезисные петли при адсорбции.
/ О
р/рь
рис. XIII-6). Подобный эффект'наблюдается, например, при измерении
обратного хода -кривых 'вдавливания ртути три исследовании пористой
структуры методом ртутной порометрии. Применительно к адсорбции
паров более приемлемо второе предположение о 'необратимом
изменении пористой структуры адсорбента в ходе адсорбции, в результате чего
условия десорбции весьма отличаются от условий адсорбции [147].
Как показано 1на рис. XIV-35, на котором приведены изотермы
адсорбции азота на различных пористых телах, гистерезисные петли
могут иметь самую разнообразную форму (см. также [149]).
Впервые .мнение о том, что^ гистерезис связан с -капиллярной
конденсацией, было высказано Жигмонди [150]. Он предположил, что
гистерезис изотермы адсорбции обусловлен гистерезисом краевого угла
из-за наличия примесей. Так, можно было 'бы объяснить появление
изотерм типа приведенной на рис. XIV-34, а, однако для многих систем
характерны замкнутые петли. В большинстве ранних и во многих
современных работах адсорбент представляют в виде пучка .капилляров
различного сечения. Коэн [151] высказал предположение, что
адсорбционная ветвь (кривая abc на рис. XIV-34, б) отражает образование
толстых пленок, радиус кривизны которых равен радиусу капилляра г.
Таким образом, при данном ха в соответствии с уравнением Кельвина
[уравнение (11-20), гл. II] заполняются все поры, для которых
справедливо равенство
Xa==e-yv/rRTt (XIV-154)
В точке с все капилляры полностью заполнены, а при десорбции они
освобождаются через отступающие мениски кривизной 2/г. Таким
образом, на каждом этапе десорбции (ветвь dea) освобождаются
капилляры, для которых
(XIV-155)
xd=er**virRTm
Участок cd можно отнести к относительно большим коническим порам,
которые не дают гиетерезиеной ветви. Поскольку ход адсорбционной
ветви определяется как адсорбционным потенциалом (обычно
полимолекулярного слоя), так и радиусом кривизны капилляров, для
нахождения распределения пор по размерам, как правило, используют де-
сорбционную ветвь. При этом, как показали Баррет и др. [152] и Пирс
[148] (см. также [50]), эффективная кривизна мениска определяется
радиусом кривизны капилляра за вычетом толщины
полимолекулярного слоя, соответствующего данному Р/Р°. Толщину адсорбированного
слоя можно оценить по адсорбционным данным, полученным для
такого же, но непористого материала. С этой целью широко используются
/-кривые де Бура (см. табл. XIV-4). Расчет распределения пор по
размерам проводится следующим образом. Для каждого Ра (давление
пара при десорбции) по уравнению (XIV-155) рассчитывается
эффективный радиус капилляра, к которому добавляется соответствующая
4%
Глава XIV
0,2 0£ 0,6 0,8
Р/Р°
Рис. XIV-35. Изотермы адсорбции азота [148].
Адсорбент / — катализатор Оултона; 2 — костяной уголь номер 452, 3 — активный древесный
уголь, 4 — катализатор Г12 на основе окиси алюминия; 5 — пористое стекло; 6 — аэросил. Шкала
объемов дана в произвольном масштабе, верхняя шкала дает радиусы пор, соответствующие
различным относительным давлениям.
Ра толщина адсорбированного полимолекулярного слоя. В результате
получаются «истинные значения радиуса капилляра, отвечающие
данному давлению пара. После этого рассчитывают объем -и поверхность
пор, освобождающихся при ступенчатом 'изменении давления. При
расчете объемов, освобождающихся «а всех стадиях после первой,
вносится .поправка на утоныление полимолекул яркого слоя -на всей открытой
поверхности пор. Полученные значения суммарных объемов пор,
радиус которых больше соответствующих г, табулируются. Затем по
наклону соответствующей кривой находят искомое распределение -пор по
размерам (радиусам). Как видно из рис. ХШ-4 (гл. XIII), найденная
таким способом кривая очень хорошо согласуется с данными ртутной
порометрии.
Эверет [153] подчеркивает, что для реальных систем капиллярная
модель может быть совершенно неверной, и, хотя результаты,
полученные на ее основе, представляются самосогласованными, на самом деле
они дают о пористой структуре исследуемого материала лишь очень
приблизительное представление. Основная проблема заключается в
учете «бутылкообразных» пор (рис. ХШ-5, гл. XIII), широкие части
которых освобождаются при давлениях, соответствующих капиллярным
давлениям входных каналов. Влияние геометрии капилляров на
десорбцию подробно обсуждается также в работе Баррера и др. [154].
Брунауэр и др. [155, 156] развили «безмодельный» метод
построения распределения пор по размерам. Этот метод не требует каких-либо
специальных предположений относительно формы пор и основан на
общем термодинамическом соотношении, полученном Киселевым [157]:
yd\=b\uln, (XIV-156)
где dA—поверхность, исчезающая при заполнении поры в результате
капиллярной конденсации, A[i — изменение химического потенциала ад-
сорбата, равное RT In P/P°9 a dn — «число молей жидкости,
сконденсировавшейся в поре. Можно показать, что уравнение Кельвина является
частным случаем уравнения (XIV-156) (ом. упражнение XIV-36). Инте-
Адсорбция газов и паров на твердых телах
497
Ik Я
5 10 15 20 25 30 35 40 45 50 55 60
о
г.А
Рис. XIV-36. Распределение пор по размерам в отвержденной массе портланд-цемента
[155]:
1 — безмодельный метод, 2 — капиллярная конденсация в цилиндрических порах.
грируя уравнение (XIV-156), получаем
s
А = — (RT/y) Г (In P/P°)dn.
(XIV-157)
Гидравлический радиус гн поры определяется соотношением
rh=V/A, (XIV-158)
где V — объем группы пор, а А — их удельная поверхность. Методика
обработки данных с использованием без модельного метода аналогична
описанной выше. Для (Каждого последующего шага уменьшения
давления -вдоль дасорбционной ветви рассчитывают объем и поверхность
[по уравнению (XIV-157)] группы освобождающихся пар,
соответствующие изменению п. Далее по уравнению (XIV-158) рассчитывают
гидравлический радиус пар.
Правильность расчета можно проконтролировать по соответствию
общей поверхности пор, найденной в результате анализа распределения
пор, и величины, полученной методом БЭТ по части изотермы до
гистерезисной петли. На рис. XIV-36 -показано распределение пор по
размерам для отвержденной массы портланд-цемента, рассчитанное
безмодельным методам Брунаузра—Микаэля — Б-одора [155], и
старым методом, основанным на уравнении Кельвина для цилиндрических
пор. Оба распределения неплохо согласуются между собой, если учесть,
что гидравлический радиус 'цилиндра равен четверти его диаметра.
Более полное представление о пористой системе дает метод «сканирующих
кривых» (рис. XIV-34, в). Так, если адсорбцию вести лишь до точки а и затем начать
десорбцию, то изотерма десорбции пойдет по нижней кривой ab; при повторной
адсорбции из точки b ход процесса опишется верхней кривой bd и т. д. Любая полная
модель должна детально объяснять ход таких сканирующих кривых, и, наоборот, из
этих кривых можно получить ценные сведения о природе пор. Результаты
исследования пористых структур методом сканирования обобщены Рао [158] и Эмметтом
32—1421
498
Глава XIV
Рис. XIV-37. Рельефная карта гипотетической доменной поверхности с сечениями,
соответствующими отдельным доменам.
Эверет [160] делит пористую систему на ряд доменов, в первом приближении
действующих независимо друг от друга. Каждый домен состоит из элементов адсорбента,
заполняющихся при одном относительном давлении хаи) и освобождающихся при
другом относительном давлении *do> Объем элементов домена равен Vj. Таким
образом, каждый домен характеризуется тремя переменными, а график функции
v(xa, Xd) представляет собой сложную поверхность, чем-то напоминающую рельефную
карту. На рис. XIV-37 топография такой поверхности показана в виде ряда сечений,
расположенных на равных расстояниях друг от друга. При последовательном
увеличении относительного давления от ха до xa+dxa должны заполняться все домены,
находящиеся внутри этого интервала, однако в общем случае эти же домены могут
освобождаться при давлениях от Xd — О до Xd=xa. Сечение поверхности V(xa, Xd) при
ха дает распределение х<*, а площадь сечения, умноженная на nadxa, равна общему
объему этих доменов и на изотерме адсорбции соответствуег dVa Поскольку Xd
любого домена не может превышать его ха (домен не может освобождаться при
давлении выше давления его заполнения!), основание топологической карты должно
представлять собой прямоугольный равнобедренный треугольник.
Адсорбции отвечает последовательное движение вдоль ряда сечений,
соответствующих выбранным значениям ха. Однако при десорбции на шаге dxd освобождаются
лишь те домены, которые заполнялись в интервале от xa=Xd до ха = 1.
Распределение объема этих доменов дается сечением, параллельным оси ха> а десорбирующийся
объем dVd равен произведению площади этого сечения на dxd- Такая
детализированная карта описывает не только адсорбционную и десорбционную ветви изотермы
адсорбции, но и все возможные гистерезисные петли. Проблема построения такой карты
по адсорбционным данным сходна с проблемой нахождения энергетического
распределения центров адсорбции (разд. XIV-14А), однако в данном случае задача гораздо
сложнее, поскольку необходимо найти не одно-, а двумерное распределение. Тем не
менее метод Эверета обещает стать одним из самых эффективных методов
исследования структуры пористых тел.
В заключение остановимся на температурной зависимости адсорбции в пористых
телах. Простые опыты с системой поршень — цилиндр показывают, что при
гистерезисе системы в цикле должна теряться механическая работа (т. е. должно выделяться
тепло). В необратимых процессах этого типа изменение энтропии при небольших
смещениях системы из состояния равновесия не равно bqjT. Поэтому, как отмечает Ла-
мер [16], в этом случае уравнения типа уравнения (XIII-16), полученные на основе
второго закона термодинамики, теряют ясный физический смысл. В гистерезисных
системах, конечно, можно получить два ряда значений qst> относящихся к
адсорбционной и десорбционной ветвям. Обычно эти величины не равны друг другу и ни одна
из них не соответствует калориметрической теплоте адсорбции. Этот эффект можно
объяснить локальной необратимостью системы. Адсорбция при увеличении х на б* не
эквивалентна десорбции при последующем уменьшении относительного давления на
ту же величину бх. Поэтому к данным по изостерическим теплотам адсорбции и ин-
Адсопбция сазов и паров на твердых телах 499х
о,а
оа
со 0,3
«о
оя
0J
'О I 2. 3 4 5 06 7 8 9 10 11 11
t,A
Рис. XIV-38. Изотерма адсорбции азота на силикагеле при 77,3 К, построенная в виде
зависимости v от t [163].
терпретации их физического смысла следует относиться очень осторожно, хотя,
конечно, в отдельных ситуациях или для определенных моделей расхождение между qst и
калориметрической теплотой может быть не так уж велико [162].
В. Анализ микропор
Многие адсорбенты, например некоторые еиликагели, угли и цеоли-
ты, имеют поры .молекулярных размеров, т. е. поры диаметром от
нескольких ангстрем до 10—16 А. Адсорбцию в таких порах трудно
объяснить капиллярной конденсацией, к тому же в микропористых
системах гистерезис о-бычно не наблюдается. Адсорбцию -в микропоре можно
рассматривать как полимолекулярную адсорбцию, приводящую к
заполнению поры 'вследствие слияния слоев, адсорбированных -на
.противоположных стенках поры. Вначале изотерма (адсорбции на микропо'-
ристом теле похожа на изотерму БЭТ с высоким значением с
(рис. XIV-10), но по мере заполнения пор и резкого уменьшения
доступной для адсорбции поверхности, изотерма все больше напоминает
изотерму Лэнтмюра (рис. XIV-3). Иногда такие изотермы адсорбции
неплохо описываются уравнением БЭТ для ограниченного числа слоев it
[уравнение (XIV-64)].
Недавно Михаэль, Брунауэр и Бодор [163] предложили метод
нахождения распределения микропор по размерам, .который, по существу,
представляет собой модифицированный вариант /-метода определения
удельной поверхности (разд. XIV-9). /-Метод основан на том, что в
соответствии с уравнением (XIV-97) зависимость приведенного к
нормальным условиям объема (см3) газа, адсорбированного 1 г
адсорбента, от величины t при соответствующем Р/Р0> должна иметь вид прямой,
наклон .которой пропорционален удельной поверхности 2. Как
показано на рис. XIV-38, v,/-кривые, полученные для микропористых
адсорбентов, изгибаются. Это явление можно рассматривать не как
отклонение от характеристической изотермы, а .как проявление постепенного
уменьшения удельной поверхности при заполнении микропор. По
мнению Микаэля и сотрудников, наклон и, /-кривой в каждой ее точке дает
правильное значение доступной поверхности адсорбента для данных
Р/Р° и v. По изменению удельной поверхности между двумя соседними
точками кривой можно оценить объем микропор, заполняющихся при
т—I—I—I—i—I—i—I—I—i—г
600
Глава XIV
треднем для этих двух точек Р/Р°9 среднюю толщину t
адсорбированного слоя и размер заполняющихся пор. Хотя метод Микаэля — Бру-
науэра — Бодора дает вполне приемлемые результаты [156], тем не
менее он подвергся вполне обоснованной критике со стороны Дубинина
[164]. Автор этой книги также считает, что в области относительно
низких Р/Р°, при которых .происходит заполнение микропор, примене-
лие /-метода нецелесообразно,
17. Упражнения
1 Постройте ряд изостер и изобар, соответствующих изотермам, приведенным
на рис. XIV-1.
2. Выведите уравнение Лэнгмюра в общем виде [уравнение (XIV-10)].
3 Проведите квантовомеханический расчет трех нижних энергетических уровней
атома азота, находящегося в одномерном ящике длиной 4 А. Рассчитайте О^ерн ПРИ
78 К двумя способами: с помощью интегрального приближения и путем
непосредственного вычисления суммы VJexp (—en/kT).
п
4 Изотермы адсорбции газов А и В на некотором твердом теле описываются
уравнением Лэнгмюра. Предполагается, что адсорбция смеси этих газов, или конкурентная
адсорбция, также описывается этим уравнением. При температуре 77 К заполнение
поверхности 0 = 0,01 чистым газом А достигается при Р=100 мм рт. ст., а чистым
газом В — при 10 мм рт. ст. а) Рассчитайте разность теплот адсорбции газов Qa и
Qb Обоснуйте все принятые вами допущения и приближения, б) Рассчитайте Qa при
77 К и парциальных равновесных давлениях А и В, равных 200 мм рт. ст. в) Как
изменится полученное значение Qa, если адсорбция происходит при указанных
условиях, но на неоднородной поверхности. Локальные изотермы адсорбции по-прежнему
соответствуют уравнению Лэнгмюра.
5. Для определения удельной поверхности порошков можно использовать
адсорбцию красителя из раствора. Предположим, что 1 г костяного угля приводится в
равновесие с 100 см3 раствора метиленового голубого. Первоначальная концентрация
раствора—10~4 М, конечная — 0,6-10-4 М. Однако, если навеску угля удвоить (2 г),
конечная концентрация раствора становится равной 0,4* 10~4 М.
Рассчитайте удельную поверхность костяного угля (в м2/г), предполагая, что
адсорбция метиленового голубого описывается уравнением Лэнгмюра. Площадь,
приходящаяся на молекулу метиленового голубого в плотном монослое, примите равной
65 А2
6. Рассчитайте AS'2 при 0 = 0,1 для одноатомного адсорбата, образующего с
адсорбентом слабую адсорбционную связь и имеющего три колебательные степени свободы.
7. Определите условия, при которых постоянная bo в кинетическом выводе
уравнения Лэнгмюра совпадает с постоянной bo в статистико-термодинамическом выводе.
Обсудите физический смысл этих условий. Обсудите также, при каких условиях
постоянная bo в кинетическом выводе соответствует неявному допущению, заложенному
в уравнение (XIV-49). _
8. Известно, что при 323,1 К стандартная энтропия адсорбции А52 бензола на
некоторой поверхности составляет —25,2 энтр. ед В качестве стандартных состояний
приняты пар при 1 атм и пленка площадью 22,5-Г А2 в расчете на молекулу. В каком
состоянии — подвижном или локализованном — находится адсорбированная пленка?
9. Выведите уравнение (XIV-53).
10. Покажите, что критическое значение (3 в уравнении (XIV-52) (т. е. значение
р, выше которого на зависимости ЬР от 0 появляются максимум и минимум)
действительно равно 4. Каково критическое значение 0?
11. В работе Дрэйна и Моррисона [1] приводятся следующие данные по
адсорбции азота на рутиле при 75 К:
1,17
14,00
45,82
87,53
127,7
164,4
204,7
239,0
600,06
719,54
821,77
934.68
1045,75
1146,39
1254,14
1343.74
275,0
310,2
341,2
368,2
393,3
413,0
429,4
443,5
1441,14
1547,37
1654,15
1766,89
1890,11
2018,18
2144,98
2279,15
455,2
464,0
471,2
477,1
482,6
487,3
491,1
495,0
2418,34
2561,64
2694,67
2825,39
2962,94
3107,06
3241,28
3370,38
498,6
501,8
3499,13
3628,63
(Р дано в мм рт ст , а и — в см3/г адсорбента).
Постройте график, соответствующий линейному уравнению БЭТ, найдите vm и с
и рассчитайте удельную поверхность в м2/г.
Адсорбция газов и паров на твердых телах
501
Упругость насыщенных паров азота дается выражением [41]
jg ро = _зз9,8/Г + 7,71057 — 0,0056286 lg Т.
12. При обработке данных по адсорбции азота на графоне при 77 К с помощью
графика, соответствующего линейному уравнению БЭТ, найдено, что наклон
экспериментальной прямой и отсекаемый отрезок на оси ординат соответственно составляют
1,5 и 0,005 (обе величины даны в см3 (НТД)/г адсорбента). Рассчитайте vm>
предполагая, что площадь молекулы азота равна 16 А2. Рассчитайте также теплоту
адсорбции в первом слое (теплота конденсации азога составляет 1,3 ккал/моль).
Значительно ли изменится vm, если отсекаемый отрезок принять равным нулю (при том же
наклоне кривой)? Обсудите вкратце практическое значение полученного результата.
13. Рассмотрите вариант уравнения БЭТ с с=1. Рассчитайте при 0, равном 0,1
и 1,5, для такого случая теплоту адсорбции:
А (жидкий адсорбат при Т) = А (равновесный адсорбированный слой при Р и Т).
Для тех же значений 0 рассчитайте также энтропию адсорбции. И наконец, выведите
уравнение состояния двумерной адсорбированной пленки.
14 Хюттиг [165] предложил уравнение
х (1 + x)/v = 1 /cvm + x/vm, (XIV-159)
которое можно получить с помощью модели БЭТ, предполагая, однако, что каждый
слой ведет себя как независимая лэнгмюровская пленка, максимальное заполнение
которой определяется фактической площадью лежащего под ней слоя. Выведите это
уравнение
15. Рассмотрите следующую модель, приводящую к уравнению, очень похожему
на уравнение БЭТ. При адсорбции образуется полимолекулярная структура, причем
адсорбция первого слоя описывается уравнением Лэнгмюра, адсорбция последующих
слоев — законом Рауля; способность молекулы к десорбции не зависит от того,
находятся или не находятся над ней другие молекулы. Выведите уравнение изотермы
адсорбции, дополнив модель необходимыми допущениями.
16. Рассчитайте и постройте изотерму v/vm—f(P/P°), соответствующую уравнению
(XIV-64), предполагая, что с = 200 и я = 4.
17. Выведите уравнение (XIV-73) из уравнения (XIV-70).
18. По данным, приведенным в упражнении 11, постройте график,
соответствующий уравнению (XIV-76). Рассчитайте vm, принимая k равным 4,06.
19. Покажите, что, если адсорбция описывается уравнением Дубинина [уравнение
(XIV-82)], Лко.,ф=0.
20. По данным, приведенным в упражнении 11, постройте зависимости,
соответствующие уравнениям (XIV-88) и (XIV-89). Объясните, почему зависимости имеют
такой вид.
21. По данным, приведенным в упражнении И, постройте зависимость,
соответствующую уравнению (XIV-94). Объясните, почему зависимость имеет такой вид.
22. По тем же данным постройте зависимость v от t (при построении можно
использовать также данные табл. XIV-4) и рассчитайте удельную поверхность рутила.
23. Рассчитайте и постройте соответствующие уравнению (XIV-76) зависимости
для адсорбции азота при 77 К на образце дзуокиси титана с удельной поверхностью
90 м2/г. Предварительно примите, что В равно 1, 2 и 4. Согласуются ли полученные-
зависимости с уравнением БЭТ (в пределах обычной степени точности) и, если
согласуются, то чему равна величина vm в этом уравнении? Постройте качественные
зависимости поверхностного давления адсорбированной пленки от а для всех трех
случаев.
24. Получена изотерма адсорбции, описываемая уравнением (XIV-89) в виде
\nv = B— (1/л)1п1п(Р°/Я),
где я = 2,75 и Б = 3,2. Рассчитайте значения vm и с, соответствующие уравнению БЭТ.
25. По данным, приведенным в табл. XIV-4, постройте график зависимости vfVm.
от Р/Р°. а также графики зависимостей, соответствующих а) уравнению БЭТ, б)
уравнению (XIV-89) и в) уравнению (XIV-94).
26. По данным, приведенным на рис. XIV-1 и в упражнении 11, рассчитайте
значения qst во всем диапазоне величин v и постройте зависимость qst от v/vm.
27. Предположим, что имеется некоторая гетерогенная поверхность, 15% которой
занимают центры адсорбции с Q=2 ккал/моль, 50%—центры с Q = 3 ккал/моль и
остальную часть — центры с Q=4 ккал/моль. На всех участках адсорбция
описывается уравнением Лэнгмюра с Ь0, определяемым уравнением (XIV-14). Рассчитайте
В(Р, Т) для азота при 77 и 90 К. Для нескольких значений в найдите q&t и сравните
полученный результат с предполагаемым интегральным энергетическим
распределением центров адсорбции.
28. Протабулируйте изотерму А на рис. XIV-35 и рассчитайте соответствующее
распределение пор по радиусам. Масштаб рис. XIV-35 примите равным 50 см3
(приведенного к нормальным условиям газа) на деление (200 см3 по всей оси ординат).
502
Глава XIV
29. Покажите, что если S(P,T)—ЬР/(\-\-ЬР), то (р(х) определяется уравнением
(XIV-150).
30. Как выглядела бы доменная карта, приведенная на рис. XIV-37, в отсутствие
гистерезиса, т. е. при обратимой адсорбции?
31. Проекция доменной карты на ее основание дает обычный двумерный график,
описывающий адсорбционные и десорбционные свойства системы ha этом графике
область домена, заполненную в данных условиях, можно обозначить штриховкой
соответствующей части прямоугольного равнобедренного треугольника. Заштрихуйте
области доменов, заполненных а) при адсорбции до xa = 0J; б) при десорбции до Xd =
= 0,4, после адсорбции до xa = 0J и в) при повторной адсорбции от *d = 0,4 до ха==
= 0,6.
32. Оцените интеграл / в уравнении (VI1-39) для газа, адсорбция которого
описывается уравнением БЭТ.
33. Измеряется адсорбция азота на мелкодисперсном непористом порошке.
Найдено, что при 77 К 0 = 0,5 достигается при Р/Р°=0,02, а_при 90_К —при Р/Р°=0,2.
Рассчитайте изостерическую теплоту адсорбции, а также AS0 и AG0 при 77 К.
Опишите процесс, которому соответствуют найденные величины. В каком состоянии,
газообразном или жидком, находится адсорбированный азот? Температура кипения азота
при давлении 1 атм равна 77 К, а теплота испарения составляет 1,35 ккал/моль.
34. Обсудите физические условия, при которых на гетерогенной поверхности могут
наблюдаться ступенчатые изотермы адсорбции газа.
35. Выведите выражение для суммы по состояниям двумерного газа,
находящегося в стандартных условиях, рекомендуемых де Буром. Далее найдите «S^ct и свя"
жите эту стандартную энтропию с Sn'Q^T . Ответ представьте в виде уравнения
36. Выведите уравнение (XIV-156) и затем из этого уравнения получите
уравнение Кельвина [уравнение (П-20)].
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Де Бур Я., Динамический характер адсорбции, М, ИЛ, 1962. Межфазовая граница
газ — твердое тело, под ред. Флада Э., М., «Мир», 1970.
Fowler R. H., Guggenheim E. A., Statistical Thermodynamics, Cambridge University
Press, Cambridge, England, 1952 (см. перевод первого издания: Фаулер Р., Гугген-
гейм Э., Статистическая термодинамика, М., ИЛ, 1949).
Грег С, Синг К., Адсорбция, удельная поверхность, пористость, М., «Мир», 1970.
Ross S., Olivier J. P., On Physical Adsorption, Interscience, New York, 1964.
Sattzburg H., Smith J. N., Jr., Rogers M., eds., Fundamentals of Gas-Surface Interactions,
Academic Press, New York, 1967.
Young D. M., Crowell A. D.t Physical Adsorption of Gases, Butterworths, London, 1962.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Drain L. E., Morrison /. A., Trans. Faraday Soc, 49, 654 (1953).
2. Coltharp M. Т., Hackerman N„ J. Phys. Chem., 72, 1171 (1968).
3. Gregg S. J., Ramsay J. D. F.t J. Phys. Chem., 73, 1243 (1969).
4. Де Бур Я., Динамический характер адсорбции, М., ИЛ, 1962.
5. Langmuir L, J. Amer. Chem. Soc, 40, 1361 (1918).
6. Fowler R. H., Guggenheim E. A., Statistical Thermodynamics, Cambridge University
Press, Cambridge, England, 1952 (см. перевод первого издания: Фаулер Р., Гугген-
гейм Э., Статистическая термодинамика, М., ИЛ, 1949).
7. Young D. М., Crowell A. D., Physical Adsorption of Gases, Butterworths, London,
1962.
8. Lennard-Jones J. E„ Devonshire A. F., Proc. Roy. Soc, A156, 6, 29 (1936).
9. Everett D. H., Proc. Chem. Soc. (London), 1957, 38.
10. Kemball C, Proc. Roy. Soc, London, A187, 73 (1946).
П de Boer J. #., Kruyer S., Koninkl. Ned. Akad. Wetenschap. Proc, 55B, 451
(1952).
12. Ross J. W., Good R. J., J. Phys. Chem., 60, 1167 (1956).
13 Ross S., Olivier J. P., The Adsorption Isotherm, Rensselaer Polytechnic Institute,
Troy, New York, 1959, p. 39f.
14. Hill T. U J. Chem. Phys., 15, 767 (1947).
15. Isirikyan A. A., Kiselev A. V., J. Phys. Chem., 66, 205, 210 (1962).
16. Young D. M., Crowell A. D.} Physical Adsorption of Gases, Butterworths, London,
1962.
17. Хениг Дж., в кн. «Межфазовая граница газ —твердое тело», под ред. Флада Э,
М., «Мир», 1970.
Адсорбция газов и паров на твердых телах
503
18. Брунауер С., Адсорбция газов и паров, т. I, M., ИЛ, 1948.
19. Schwab G. М., Taylor Н. S., Spence R., Catalysis, Van Nostrand, New York,
1937.
20. Brunauer S., Emmett P. H., Teller E., J. Amer. Chem. Soc, 60, 309 (1938).
21. Ross S., Olivier J. P., On Physical Adsorption, Interscience, New York, 1964.
22. Hobson J. P., A. I. Ch. E. Symposium Series, 68, No. 125, 16 (1972).
23. Davis B. W., Saban G. #., Moran T. F., J. Chem. Ed. 50, 219 (1973).
24. McBain J. W, Bakr A. M., J. Amer. Chem. Soc, 48, 690 (1926).
25. Blake T. D, Wade W. H.f J. Phys. Chem., 75, 1887 (1971).
26. Beebe R. A., Beckwith J. В., Honig J. M., J. Amer. Chem. Soc, 67, 1554 (1945).
27. Rosenberg A. /., J. Amer. Chem. Soc, 78, 2929 (1956).
28. Amberg G. H., Spencer W. B.., Beebe R. A., Can. J. Chem. 33, 305 (1955).
29. Tyler A. J., Taylor J. A. G., Pethica B. A., Hockey /. A., Trans. Faraday Soc, 67,
483 (1971).
30 Катализ. Вопросы избирательности и стереоспецифичности катализаторов, М., ИЛ,
1963; Wade W. Н., Deviney M. L., Jr., Brown W. Hnoosh M. H., Wallace D. R.,
Rubber Chem. Technol., 45, 117 (1972).
31. Gardner J. E., Riney /. S., Wade W. H., Rev. Sci. Inst., 38, 652 (1967).
32. Adamson A. W., Dormant L., J. Amer. Chem. Soc, 88, 2055 (1966).
33. Wade W. H., Whalen J. W.t J. Phys. Chem., 72, 2898 (1968).
34. Adamson A. W., J. Colloid Interface Sci., 27, 180 (1968).
35. Tadros M. E., Ни, P., Adamson A. W., J. Colloid Interface Sci., 49, 184 (1974).
36. Cassie A. B. D., Trans. Faraday Soc, 41, 450 (1945).
37. Hill T, J. Chem. Phys., 14, 263 (1946), and succeeding papers.
38. McClellan A. L., Harnsberger H. F.t J. Colloid Interface Sci., 23, 577 (1967).
39. Pierce C., Ewing В., J. Phys. Chem., 68, 2562 (1964).
40. Kaiz M. J., Anal. Chem., 26, 734 (1954).
41. Грег С, Синг К., Адсорбция, удельная поверхность, пористость, М., «Мир»,
1970
42. Anderson R. В., J. Amer. Chem. Soc, 68, 686 (1946).
43. Gregg S. J., J. Chem. Soc, 1942, 696.
43. Volmer M., Z. Phys. Chem., 115, 253 (1925).
44. Kemball C., Rideal E. K., Proc Roy. Soc (London), A187, 53 (1946).
45. Adamson A. W., unpublished work (1954).
46. Benson S. W., Golding R. A., J. Chem. Phys., 19, 1413 (1951).
47. Ross S., Winkler W., J. Colloid Sci., 10, 319 (1955); J. Amer. Chem. Soc, 76, 2637
(1954).
48. Harkins W. D., Jura G., J. Amer. Chem. Soc, 66, 1366 (1944).
49. McGavack J., Jr., Patrick W. A., J. Amer. Chem. Soc, 42, 946 (1920).
50. Дубинин М. M.t ЖФХ, 39, 1305 (1965).
51. Sparnaay M. J., Surface Sci., 9, 100 (1968).
52. Adamson A. W., Ling L, Advances in Chemistry No. 43, American Chemical Society,
Washington, D. C, 1964.
53. Френкель Я. И., Кинетическая теория жидкостей, М., Изд. АН СССР, 1945.
54. Halsey G. D., Jr., J. Chem. Phys., 16, 931 (1948).
55. Hill T. L., Advan. Catalysis, 4, 211 (1952).
56. McMillan W. G., Teller E., J. Chem. Phys., 19, 25 (1951).
57. Pierce C., J. Phys. Chem., 63, 1076 (1959).
58. Greenlief C. M.t Halsey G. D., J. Phys. Chem., 74, 677 (1970).
59. Adamson A. W., J. Colloid Interface Sci., 44, 273 (1973); Adamson A. W., Ling I.,
in Advan. Chem., 43, 57 (1964).
60. Roy N. N., Halsey G. D.f Jr., J. Chem. Phys., 53, 798 (1970).
61. Halsey G. D., Jr., J. Amer. Chem. Soc, 73, 2693 (1951).
62. Ginous J., Bonnetain L., CR, 272, 879 (1971).
63. de Boer J. H., Zwikker C., Phys. Chem., B3, 407 (1929).
64. Bewig K. W., Zisman W. A., J. Phys. Chem., 68, 1804 (1964).
65. Eberhagen A., Fortschr. Phys., 8, 245 (1960).
66. Pritchard J, Nature, 194, 38 (1962).
67. Benson S. W., King J. W., Jr., Science, 150, 1710 (1965).
68. Adamson A. W., unpublished work.
69. Стил У. А., в кн. «Межфазовая граница газ — твердое тело», под ред. Флада Э.,
М., «Мир», 1970.
70. Keenan A. G., Holmes J. M.f J. Phys. Colloid Chem., 53, 1309 (1949).
71. Benson S. W., Ellis D. A., J. Amer. Chem. Soc, 72, 2095 (1950).
72. Arnold J. R., J. Amer. Chem. Soc, 71, 2104 (1949).
73. Pierce C., Ewing В., J. Phys. Chem., 68, 2562 (1964).
74. Adamson A. W., The Physical Chemistry of Surfaces, Interscience, New York, 1960,
and unpublished work, 1954.
75. Halasz I., Schay G., Acta Chim. Acad. Sci. Hung., 14, 315 (1956).
76. Joyner L. G., Emmett P. H., J. Amer. Chem. Soc, 70, 2353 (1948).
77. Lippens B. C., Linsen B. G., de Boer J. H., J. Catalysis, 3, 32 (1964); de Boer J. H.t
Lippens B. C., Linsen B. G., Broekhoff J. С P., van den Heuvel A., Osinga Th. J.,
504
Глава XIV
J. Colloid Interface Sci., 21, 405 (1956); Cranston R. W.t Inkley F. A., Advan.
Catalysis, 9, 143 (1957).
78. Bhambhani M. R., Cutting P. A., Sing K. S. W., Turk D. H., J. Colloid Interface
Sci., 38, 109 (1972).
79. Pisani C, Ricca F., Roetti C, J. Phys. Chem., 77, 657 (1973).
80. Steeele W. A., Halsey G. D„ Jr., J. Chem. Phys., 22, 979 (1954).
81. Barker J. A., Everett D. H.t Trans. Faraday Soc, 58, 1608 (1962).
82. Steel W. Л., Surface Sci., 36, 317 (1973).
83. Battezzati L., Pisani C, Ricca F., J. Chem. Soc, Far. Trans. II, 71, 1629 (1975).
83. Johnson J. D., Klein M. L., Trans. Faraday Soc, 60, 1964 (1964).
84. Everett D. H., in Surface Area Determination, Proc. Int. Symp., Bristol, 1969, But-
terworths, London.
85. Adamson A. W.t Orem M. W., Progr. Surface Membrane Sci., 8, 285 (1974).
86. Dormant L. M., Adamson A. W., J. Colloid Interface Sci., 28, 459 (1968).
87. Fisher В. В., McMillan W. G., J. Amer. Chem. Soc, 79, 2969 (1957).
88. Larher Y., J. Chem. Soc, Faraday Trans. I, 70, 320 (1974).
89. Steele W. A., Karl R., J. Colloid Interface Sci., 28, 397 (1968).
90. Nardon Y., Larher Y., Surface Sci., 42, 299 (1974).
91. Mason B. R., Williams B. R., J. Chem. Phys., 56, 1895 (1972).
92. Davis B. W., Pierce C, J. Phys. Chem., 70, 1051 (1966).
93. Hill T. L.t J. Chem. Phys., 17, 520 (1949).
94. Everett D. H., Trans. Faraday Soc, 46, 453 (1950).
95. Smith R. N.t J. Amer. Chem. Soc, 74, 3477 (1952).
96. Copeland L. E., Young T. F., Advances in Chem., 33, 348 (1961).
97. Wu Y. C, Copeland L. E., Advances in Chem., 33, 357 (1961).
98. Adamson A. W.f Dormant L.t Orem M.f J. Colloid Interface Sci., 25, 206 (1967).
99. Cook M. A., Pack D. H., Oblad A. G, J. Chem. Phys., 19, 367 (1951).
100. Jura G.. Hill T. L., J. Amer. Chem. Soc, 74, 1598 (1952).
101. Zettlemoyer A. C, Young G. J., Chessick /. /., Healey F. H., J. Phys. Chem, 57, 649
(1953).
102. Kington G. L., Beebe R. A., Polley M. H., Smith W. R., J. Amer. Chem. Soc, 72,
1775 (1950).
103. Greyson J., Aston J. G., J. Phys. Chem., 61, 610 (1957).
104. Harkins W. D., Jura G., J. Amer. Chem. Soc, 66, 919 (1944).
105. Orem M. W., Adamson Л. W., J. Colloid Interface Sci., 31, 278 (1969).
106. Prenzlow C, J. Colloid Interface Sci., 37, 849 (1971).
107. Nair N. #., Adamson A. W., J. Phys. Chem., 74, 2229 (1970).
108. Hill T. L.t Emmett P. H., Joyner L. G., J. Amer. Chem. Soc, 73, 5102 (1951).
109. Cassel H. M., J. Chem. Phys., 12, 115 (1944); J. Phys. Chem., 48, 195 (1944).
110. Arnold /. R., J. Amer. Chem. Soc, 71, 104 (1949).
110. Whalen J. W., Wade W. H.f Porter J. J., J. Colloid Interface Sci., 24, 379 (1967).
111. Day R. E., Parfitt G. D., Trans. Faraday Soc, 63, 708 (1967).
112. Gregg S. J., Lang}ord J. F., Trans. Faraday Soc, 65, 1394 (1969).
113. Брунауер С., Копеланд Л. Е., Кантро Д. Л., в кн. «Межфазовая граница газ —
твердое тело», под ред. Флада Э., М., Мир, 1970.
114. Brunauer S., in Surface Area Determination, Proc. Int. Symp., Bristol, 1969, But-
terworths, London.
115. Capaxoe А. И., Дубинин М. М., Березкина Ю. Ф., Изв АН СССР, сер хим , № 7,
1165 (1963).
116 Karasz F. E., Champion W. M., Halsey G. D., Jr., J. Phys. Chem., 60, 376 (1956).
117. Steele W. A., The Solid-Gas Interface, Flood E A., ed., Dekker, New York, 1966.
118. Трепнел Б., Хемосорбция, М., ИЛ, 1958.
119. Hobson J. P., Can. J. Phys., 43, 1934 (1965).
120. Sips R., J. Chem. Phys., 16, 490 (1948).
121. Honig J. M.t Reyerson L. H., J. Phys. Chem., 56, 140 (1952); Honig J. M., Ro-
senbloom P. C, J. Chem. Phys., 23, 2179 (1955)
122. Adamson A. W.t Ling I., in Advances in Chem., 33, 51 (1961).
123. Dormant L. M., Adamson A. J., J. Colloid Interface Sci, 38, 285 (1972).
124. Whalen J. W., Phys. Chem., 71, 1557 (1967).
125. Adamson A. W.f Ling I., Datta S. K., in Advances in Chem., 33, 62 (1961).
126. Hsieh P. Y., J. Phys. Chem., 68, il068 (1964); J. Catalysis, 2, 211 (1963).
127. House W. A., Jaycock M. J., J. Colloid Interface Sci., 47, 50 (1974).
128. Adamson A. W., Ling I., Dormant L., Orem M., J. Colloid Interface Sci., 21, 445
(1966).
129. Ross 5., Pultz W. W., J. Colloid Sci., 13, 397 (1958).
130. Steel W. A., J. Phys. Chem., 67, 2016 (1963); Honig J. M, Advances in Chem., 33,
239 (1961).
131. Everett D. H., private communication.
132 Helper L. G., J. Chem. Phys., 16, 2110 (1955).
133. Jura G.} Powell R. E., J. Chem. Phys., 19, 251 (1951).
134. Calvet J., CR, 232, 964 (1951).
135. Deitz V. R.f Carpenter F. G.t in Advances in Chem., 33, 146 (1961).
Адсорбция газов и паров на твердых телах
505
136. Guderjahn С. Л., Paynter D. A., Berghausen P. Е., Good R. J., J. Phys. Chem., 63,
2066 (1959).
137. McBain J. W., Colloid Symp. Monograph, 4, 1 (1926).
138. Barrer R. M., Proc. 10th Colston Symp., Butterworths, London, 1958, p. 6.
139. Barrer R. M., Discuss. Faraday Soc, 7, 135 (1949); Quart. Rev., 3, 293 (1949).
140. Rabinowitsch E., Wood W. C, Trans. Faraday Soc, 32, 947 (1936).
141. Yates D. J. С, J. Phys. Chem., 70, 3693 (1968).
142. Dubinin M. M., Astakhov V. A., Advances in Chem., 102, (1971).
143. Powell H. M., J. Chem. Soc, 1954, 2658.
144. Barrer R. M., Stuart W. L, Proc. Roy. Soc. (London), A243, 172 (1957).
145. Barrer R. M., Ruzicka D. J., Trans. Faraday Soc, 58, 2262 (1962).
146. Adamson A. W., Jones B. R., J. Colloid Interface Sci., 37, 831 (1971).
147. Bailey A., Cadenhead D. A., Davies D. H., Everett D. H., Miles A. J., Trans.
Faraday Soc, 67, 231 (1971).
148. Pierce C, J Phys. Chem., 57, 149 (1953)
149. Razouk R. L, Nashed Sh., Antonious F. N., Can. J. Chem , 44, 877 (1966).
150. Zsigmondy R., Z. Anorg. Chem., 71, 356 (,1911).
151. Cohan L. H., J Amer. Chem. Soc, 60, 433 (1938); see also ibid., 66, 98 (1944).
152. Barrett E. P., Joyner L. G., Halenda P. P., J. Amer. Chem. Soc, 73, 373 (1951).
153. Everett D. H., Proc. 10th Colston Symp, Butterworths, London, ,1958, p. 95.
154. Barrer R. M., McKenzie N„ Reay J. S. 5., J. Colloid Sci., 11, 479 (1956).
155. Brunauer S., Mikhail R. Sh., Bodor E. E., J. Colloid Interface Sci., 24, 451 (1967).
156. Hagymassy J., Jr., Odler I., Yudenfreund M., Skalny J., Brunauer S., J. Colloid
Interface Sci., 38, 20 (1972).
157. Киселев А. В., Усп. хим, 14, 367 (1945).
158. Rao К. S., J. Phys. Chem , 45, 517 (1941).
159. Emmett P. H., Chem. Rev., 43, 69 (1948).
160. Эверет Д. Н., в кн. «Межфазовая граница газ — твердое тело», под ред. Флада Э,
М., Мир, 1970; Everett D. Н, Trans. Faraday Soc, 51, ,1551 (1955).
161. LaMer V. К., J. Colloid Interface Sci., 23, 297 (1967) (posthumous paper).
162. Kington G. L., Smith P. S, Trans. Faraday Soc, 60, 705 (1964).
163. Mikhail R. Sh., Brunauer S., Bodor E. E., J. Colloid Interface Sci, 26, 45 (1968).
164. Dubinin M. M., J. Colloid Interface/Sci., 46, 351 (1974).
165. Huttig G. F., Monatsh. Chem., 78, 177 (1948).
166 Harkins W. D., Jura G., J. Amer. Chem. Soc, 66, 919 (1944)
167 Zettlemoyer А. С, Chand A, Gamble E., J. Amer. Chem Soc, 72, 2752 (1950)
ГЛАВА XV
Хемосорбция и катализ
1. Введение
В этой заключительной главе мы рассмотрим адсорбционные
процессы, в которых между адсорбатом -и адсорбентом образуются связи,
по прочности приближающиеся к обычным химическим связям, и в
которых химические -свойства адсорбированного соединения могут
заметно отличаться от -свойств исходного адоорбата. Обычно такую
адсорбцию назыв-ают хемосорбцией, хотя, как отмечается во введении в
гл. XIV, резкую границу .между физической адсорбцией и хемосорбцией
провести трудно и .многие принципы физической адсорбции приложимы
и к хемооорбции. Экспериментально тип адсорбции можно определить
по поведению системы при низких степенях заполнения поверхности:
хемосорбция всегда ограничена монослоем, поскольку теплота
адсорбции в первом слое обычно значительно выше, чем в последующих слоях.
В отличие от многослойной адсорбции хемосорбция может происходить
и при температурах значительно выше критической температуры
адсорбата.
Долгое время хемосорбция и катализ были так тесно связаны между
собой, что их фактически не различали. Хемосорбцию рассматривали
как один из видов адсорбции, а гетерогенный, или .контактный, катализ
как ее следствие. Ввиду промышленного значения катализа в то время
основной упор делался на исследование специальных каталитических
систем. В последние годы в связи с интенсивным развитием
высоковакуумной техники и на ее основе аппаратуры для спектроскопических и
дифракционных исследований (см. гл. V, разд. V-6) хемосорбция
выделилась в самостоятельную область химии поверхностей. Интересы
исследователей, работающих в этой области, непосредственно с
катализом не связаны (хотя, конечно', имеют к нему некоторое отношение).
Выяснение молекулярных механизмов хемооорбции создает прочную
основу для глубокого понимания не только каталитических процессов,
протекающих на поверхностях металлов, но и каталитических свойств
металлоорганических соединений. Так, кластерные соединения металлов
по своим свойствам почти не отличимы от диспергированных частиц
этих металлов на носителях.
Эта глава начинается с рассмотрения хемооорбции сначала в свете
представлений молекулярной, а затем феноменологической теории.
Далее обсуждается гетерогенный катализ, причем сначала на
феноменологическом, а уже после этого на молекулярном уровне с учетом
современных представлений о структуре поверхностей катализаторов.
Естественно, что всю литературу по хемооорбции и катализу
охватить в одной главе невозможно. Приходится ограничиться лишь
основными положениями и их иллюстрацией. Более детальные сведения по
данной теме читатель может найти в нескольких монографиях (см.
общий список литературы), в том числе в популярной работе [1] и в
обзоре по теории хемооорбции [1а].
Хемосорбция и катализ
507
2,0
US
pb^k
<>>
5 1.0
<v>
&
3
0,5\-
1 1 1 1 1 1 г
45" С(4х2)*5°
г^-
0,35ЭВ
%Ч
ъы
\
w I
-L
JL
JL
J-
0,1 0,2 0,3 0А 0,5 0,6
Степень заполнения, монослои
_L
0.7 0,8
Рис. XV-1. Адсорбция окиси углерода на плоскостях (100) палладия [3].
Тип структуры, / — неупорядоченная, типа структуры двумерного газа, 2 — с ближним порядком,
типа структуры двумерной жидкости; 3 — упорядоченная, типа двумерного кристалла.
2. Хемосорбция. Молекулярные механизмы хемосорбции
А. Исследование структуры металлических поверхностей
по данным ДМЭ
Ценные сведения о структуре поверхности металла и самого хемо-
сорбированного слоя дает метод дифракции медленных электронов
(ДМЭ, см. гл. V, разд. V-бБ). Данные ДМЭ для -ряда таких систем
обобщены в работе Соморджея [2а]. Например, атомы кислорода, хе-
мосорбированного ,на плоскостях 'никеля (НО), образуют решетку или
сетку типа (2X1), тогда как 'молекулы хемосорбированной -на этих
же плоскостях окиси углерода образуют решетку (1X1). Если хе-
хмосорбируется водород, дифрактограмма соответствует решетке
(1X2). Правда, теперь это относится к поверхностным атомам
никеля, поскольку вследствие низкой плотности электронов метод
ДМЭ не детектирует атомов водорода.
Молекулярная структура хемоеорбированного слоя может меняться
в зависимости от степени заполнения. Как показано на рис. XV-1, если
степень заполнения соответствует примерно половине монослоя,
молекулы окиси углерода связаны на поверхности с отдельными
неупорядоченными центрами. При более высоких заполнениях адсорбированный
слой из неупорядоченного становится структурированным и
характеризуется определенной симметрией, отличающейся от симметрии
кристаллической решетки. Соморджей ;[2] приводит и другие примеры, когда
неупорядоченная или, по существу, случайная при низких заполнениях
адсорбция при более высоких заполнениях дает упорядоченные
структуры (обычно соответствующие структуре подложки). Это, в частности,
508
Глава XV
справедливо для систем Х«е—Си (100), Хе—1г (100) и бензол—Pt (111).
Соморждей -считает, что структура хемосорбированного' слоя, как
правило, характеризуется 1) (Наименьшей элементарной ячейкой,
которую допускают размеры молекулы адсорбата, и 2) поворотной
симметрией подложки субстрата [2].
Б. Спектроскопия хемосорбированных частиц
Описанные в гл. V, разд. V-6, спектроскопические методы
исследования состава и состояния поверхностей твердых тел обычно
применимы и для исследования хемооорбиро-ванных частиц. Широкое
применение, в частности, нашла инфракрасная спектроскопия (см. также
гл. XIII, р-азд. XIII-4). Приведем несколько примеров. Эйшенс и
Джэкноу [4] обнаружили, что 15N2, адсорбированный никелем,
нанесенным на силикагель, дает полосу при 2128 см-1. Если же
адсорбируется смесь изотопов 14N—15N, полоса сдвигается .к 2160 см-1. Такой
изотопный сдвиг соответствует двухатомным молекулам азота, что
указывает на отсутствие значительной диссоциации молекул азота на
поверхности. Предполагается, что при взаимодействии азота с
поверхностью ни,келя образуются комплексы Ni—Ns==N+. Расчетная
прочность связей Ni—N и N—N соответственно равна 3-Ю5 и 19,1 X
Х105 дн/см. Положение полосы адсорбированного -азота можно
контролировать, добавляя второй активный газ. Еще один пример —
адсорбция смеси окисей углерода и азота на поверхностях различных
металлов, приводящая к появлению полосы при 2260 см-1. Эта полоса
приписывается изоцианату типа М—NCO, образующемуся при хемосорб-
ции [5].
Первое время исследовали лишь ИК-спектры пропускания
порошков с высокой удельной поверхностью. Достаточно чувствительным
является также метод измерения ИК-спектров отражения зеркальных
металлических поверхностей, и в частности монокристаллов, при
больших углах падения [6]. Изучая поверхности реальных катализаторов,
имеющих сложную структуру, целесообразно использовать также ДМЭ
и другие физические методы.
00
Со
!
700имп
а-СО
1
^^^^^ «•*
У У?-С(
\ \ |
Чистый \М(<рон)
7/4 719 724
Кинетическая энергия, эВ
Ркс. XV-2. Спектры ЭСХА окиси углерода, хемосорбированной на вольфраме [1, 8]
Верхняя сплошная линия относится к а- и Р-формам хемосорбированной окиси углерода, средняя
штриховая линия — спектр ЭСХА после селективной десорбции а-СО; нижняя пунктирная ли-
ния — спектр чистой вольфрамовой поверхности.
Хемосорбция и катализ
509
Ценные сведения о молекулярных механизмах хемосорбции дают «и
такие физические методы исследования, как электронная
спектроскопия для химического анализа (ЭСХА), ультрафиолетовая
фотоэлектронная спектроскопия (УФС) и десорбция под действием электронов
(ДДЭ) [1]. Приведенный на рис. XV-2 спектр ЭСХА для окиси углеро*-
да, хемосорбированной на вольфраме, ясно показывает, налример,
существование двух типов хемосорбированных молекул, обозначаемых
как а-СО и (3-СО. Наконец, для определения микропримесей
используют электронный парамагнитный резонанс {7].
Я. Работа выхода
Работа выхода электронов через поверхность раздела фаз (см.
гл. V, V-6B) сильно зависит от присутствия адсорбированных частиц.
И наоборот, по изменениям работы выхода можно судить о типе евяз>и
хемосорбированных частиц с поверхностью. Как указывает Соморджей
[2], при хемосорбции значения АФ находятся в интервале от —1,5 В
(окись углерода — железо) до 1,6 В (.кислород — никель). По работе
выхода можно контролировать также изменение состояния
поверхности. Так, хемосорбируемый чистым .алюминием «кислород в зависимости
от условий либо образует поверхностный окисел, либо проникает в
объем поверхностного слоя. При этом работа выхода может как
увеличиваться, так и уменьшаться [9].
Центры хемосорбции различных типов характеризуются
определенными значениями ДФ. Как уже отмечалось, хемосорбированная на
вольфраме окись углерода, по-видимому, находится в двух формах. По
данным Петика и др [10], для а-СО и |3-СО на вольфраме АФ
равна 0,6 и —0,1 В соответственно. Предполагается, что эти две формы
обусловлены различными типами хемосорбционных связей и, вероятно,
относятся к различным типам центров адсорбции. Это предположение
частично основано на данных флэш-десорбции, рассматриваемой ниже.
Г. Флэш-десорбция
Очень мощным методом исследования скоростей адсорбции и
десорбции является флэш-десорбция. В экспериментальном отношении этот
метод довольно сложен [11, 12]. Сначала чистую нить или поверхность
(обычно металла) выдерживают в стационарном потоке газа низкого
давления. Обычно давление газа не превышает 10~7 мм рт. ст., так что
при неактивированной адсорбции для полного заполнения .монослоя
требуется несколько минут. Зная время нахождения исследуемой
поверхности в потоке газа и принимая коэффициент конденсации равным
единице, можно рассчитать предельную величину адсорбции. Далее
поверхность быстро нагревают электрическим током (если исследуемый
образец—-тонкая проволока) или мощным пучком света (если это
плоская поверхность монокристалла). В результате адсорбированный
газ десорбируется, и давление в системе возрастает. По изменению
давления нетрудно рассчитать фактическую величину адсорбции и,
следовательно, .коэффициент конденсации.
При быстром нагреве до высокой температуры весь
адсорбированный газ десорбируется практически одновременно'. Если, однако,
образец нагревать постепенно, то наблюдается последовательная десорбция
отдельных порций газа. На рис. XV-3 показан ряд спектров десорбции
(для различных степеней заполнения поверхности) окиси углерода,
адсорбированной на плоскостях (100) вольфрама [1'3]. Легче всего
десорбируется а-'форма с кажущейся энергией активации около
15 ккал/моль. Адсорбат, выделяющийся при высоких температурах,
по-видимому, находится в нескольких состояниях: рь р2 и (33. Энергия
510
Глава XV
900 то
т,к
Рис. XV-3. Спектры флэш-десорбции окиси углерода, хемосорбированной на чистой
поверхности (100) вольфрама при различных степенях первоначального заполнения
поверхности [13].
активации последней формы достигает 90 ккал/моль. Считают, что
а-форм а представляет собой карбонильный -комплекс металла, т. е.
W—СО. Связь С—О значительно слабее сильных связей в р-формах, и
поэтому последние, по-видимому, являются продуктами частичной
диссоциации СО на С и О ,[1]. По данным Эйриха [14], адсорбированный
на вольфраме азот также .находится в нескольких сармах. Слабо
удерживаемые на поверхности а- «и 7"Ф°'РМЫ включают молекулярный азот,
а прочная (81 ккал/моль) р-форма, вероятно, содержит
диссоциированные атомы. На разных гранях (Кристаллов одного и того же металла
состояния хемосорбироБанного таза могут быть совершенно
различными. На рис. XV-4 приведены десорбционные спектры водорода, хемо-
сорбированного на гранях (100) -и (111) вольфрама [15].
Предполагается, что Y-ф'Сфма относится к молекулярному водороду, а jj-формы —
к атомарному водороду, адсорбированному на центрах различных
типов.
К настоящему времени накоплен большой фактический материал по
хемосорбции в самых разных системах. Приведенные примеры ясно
показывают сложность таких систем, особенно тех из них, которые
обладают каталитической активностью.
Как видно из рис. XV-3 и XV-4, каждая форма хемосорбированного
вещества дает на спектре десорбции, т.е. на кривой зависимости
скорости десорбции от температуры, отдельный пик. При постоянной скоро-
А
Десорбция Но
с WOOD) г
410 200 300 400 500 600
У
Десорбция Нг
с W(111)
-125 200 300 400 500 600
TpmeDawpa. К
Рис XV-4. Спектры десорбции
молекулярного водорода из монослоев на
поверхностях (100) и (111)
вольфрама [15].
Хемосорбция и катализ
511
ста наг.рева (Т—To = bt) скорость десорбции описывается
выражением [16]
—Ъ (dn/dT) = —(dn/df) =Anme~ (E*d/RT), (XV-1)
где п — число адсорбированных атомов, А — частотный множитель,
Ed—энергия активации десорбции и m — порядок реакции десорбции.
Поскольку скорость десорбции экспоненциально зависит от —Ed/RT,
при низких температурах она мала. Ко времени достижения очень
высоких температур п становится малым и десорбция вновь резко
замедляется.
3. Изотермы хемосорбции
При построении моделей хемосорбции «важно хорошо представлять
себе природу исследуемой системы. Как уже отмечалось, хемосорбцион-
ные равновесия обычно устанавливаются даже в таких условиях, когда
ни физическая, ни полимолекулярная адсорбция не имеют особого
значения, хотя и могут (особенно первая) оказывать определенное
влияние на кинетику хемосорбции.
Поскольку цри хемосорбции, как правило, образуются относительно
прочные адсорбционные связи, основной моделью хемосорбции
является модель Лэнгмюра*; из нее в дальнейшем мы и будем исходить.
Поэтому, прежде чем приступить .к изложению вопроса, целесообразно
вспомнить материал, рассмотренный в гл. XIV, разд. XIV-3 и XIV-13.
Простое уравнение Лэнгмюра
e=6P/(i+w>), (xv-2)
вполне удовлетворительно описывающее -адсорбцию водорода на меди
[17], выполняется не так уж часто. Как правило, модель Лэнгмюра
требует специального уточнения. Ниже рассматриваются способы учета
неоднородности поверхности и взаимодействия между хемосорбирован-
ными частицами (латзральное взаимодействие), а также виды изотерм
хемосорбции, получаемые при наличии двух смежных центров
адсорбции или диссоциации адсорбирующихся частиц.
А. Изменение теплоты адсорбции
В том, что теплота хемосорбции нередко меняется со степенью
заполнения поверхности, нет ничего удивительного. Это, собственно,
следует уже из материала, приведенного' в предыдущем разделе. Примеры
такой зависимости даны на рис. XV-5. Обычно ее объясняют либо
неоднородностью поверхности, либо энергетическим распределением
центров адсорбции (гл. XIV, разд. XIV-14). (В реальных системах
возможен комбинированный механизм изменения теплоты хемосорбции.)
Если дифференциальная функция распределения Q имеет
экспоненциальный вид, то модель Лэнгмюра приводит к изотерме Фрейндлиха:
в(Р,Т)=АРс, (XV-3)
где с — коэффициент (обычно меньше единицы), часто записываемый
как 1/л. (Здесь и далее в — среднее заполнение поверхности, а 6 —
заполнение участков с одинаковым значением Q.) В линейной форме
уравнение (XV-3) имеет следующий вид:
\gv = lg(vmA)—n\gP. (XV-4)
*Эту модель не следует путать с моделью двумерного неидеального газа (см. гл.
XIV, разд. XIV-3).
512
Глава XV
1 1 1 -L- -J Рис. XV-5. Теплота адсорбции водо-
0,2. 0,4- Ofi 0,8 W рода на поверхностях различных
Доля занятой поверхности металлов [18].
В широком диапазоне в уравнение (XV-4) отписывает лишь считанные
экспериментальные изотермы, и в частности -изотермы адсорбции азота
и водорода, на порошкообразном вольфраме [19]. В области
умеренных степеней заполнения (средняя часть рис. XV-5) теплота «адсорбции
водорода на различных металлах действительно представляет собой
линейную функцию lg в, что соответствует экспоненциальному
виду f(Q).
Существенный недостаток уравнения Фрейндлиха заключается в
том, что при бесконечно большом давлении оно предполагает
неограниченный рост 9, т. е., иными словами, дает бесконечные значения Q при
нулевом заполнении и нулевые значения Q при очень большом
заполнении. Поэтому это уравнение применимо только к средней области
изотермы адсорбции. Частично эти трудности можно обойти, предполагая
(см. гл. XIV, разд. XIV-13A), что
в=АРс/(1+АРс). (XV-5)
Теперь f(Q) представляет собой почти гауссову кривую, и ее, кроме
того, -можно нормализовать. Однако и в этом случае Q
катастрофически растет при 6 = 0.
Предполагая линейную зависимость «между Q и 0, т. е.
Q=Qo(l-a0) или eQ=(l/a)(l-Q/Q0)9 (XV-6)
можно прийти iK уравнению, .которое в области средних значений 0
мО'Жно представить в виде
0=(i?77Qoa) In P + const. (XV-7)
Уравнение (XV-7) известно 1ка,к изотерма Темкина [20] [см. также
уравнение (XIV-146)]. Это уравнение также пригодно лишь для
описания средней части изотерм адсорбции. Примером может служить
адсорбция водорода на вольфрамовой нити [21]. Часто, однако, провести
резкую границу ,между рассмотренными изотермами довольно трудно.
Так, в области средних заполнений адсорбция азота на железе
описывается ,как уравнением Лэнгмюра [уравнение (XV-2)], так и
уравнениями Фрейндлиха или Темкина [11].
Изотермы хемосорбции, по-видимому, предпочтительнее
преобразовывать в соответствующие -кривые энергетического распределения
центров адсорбции (см. гл. XIV, разд. XIV-64), чем подбирать к ним
аналитические выражения, основанные на той или иной функции f{Q)-
Второй метод позволяет эмпирическим путем найти уравнение,
описывающее экспериментальные данные. Однако он .может привести «к оши-
Хемосорбция и катализ
513
борным выводам. Ценные сведения о .природе хемосорбции дает
раздельное определение скоростей адсорбции и десорбции (см.
разд. XV-4).
Неоднородность поверхности может обусловливать различные
типы хемосорбции, как, например, при адсорбции окиси углерода и
водорода <на вольфраме (рис. XV-3 и XV-4). Наличие на поверхности
различных (Кристаллографических плоскостей, как, например, в
порошках, также приводит -к неоднородному характеру адсорбции.
Неоднородность может быть связана также с дефектами и примесями, число
которых сильно зависит от характера предварительной обработки
материала. Многие катализаторы представляют собой сплавы или
специальные комбинации активных поверхностей. Следует отметить, что
состав поверхностного слоя сплава не обязательно соответствует
объемному составу: в поверхностном слое один из .компонентов, .как в
жидких растворах, находится в избытке. Так, поверхность медно-никеле-
вых сплавов, по-видимому, сильно обогащена .медью [22].
Вторая общая причина зависимости теплоты адсорбции от степени
заполнения — взаимодействие типа адсорбат— адсорбат. При
физической адсорбции этот эффект обычно проявляется как латеральное
притяжение, вызванное вандерваальсовым взаимодействием между
молекулами адсорбата, и приводит, ,как нетрудно показать, к изотерме,
описываемой уравнением (XIV-52).
Силы вандерваальеового притяжения относительно слабы .по
сравнению с силами, обусловливающими хемосорбцию. Поэтому при
хемосорбции, как правило, более важное значение имеет взаимное
отталкивание адсорбированных частиц. Эффекты отталкивания могут быть
двух типов. Если расстояния между центрами адсорбции малы по
сравнению с размерами молекул адсорбата, то между электронными
облаками адсорбированных частиц возникает короткодействующее
отталкивание, обычно описываемое экспоненциальным выражением
типа уравнения (V-19), гл. V. В рамках теории латерального
взаимодействия, данной в разделе XIV-ЗГ, в случае отталкивания вклад
энергии взаимодействия молекулы с z ближайшими соседями, гсоб, в
теплоту адсорбции является отрицательным. Как указывают Фаулер
и Гуггенгейм [23], строгая теория латерального взаимодействия
должна учитывать, что при латеральном притяжении соседние центры
адсорбции оказываются занятыми чаще, а при латеральном
отталкивании реже, чем можно было бы ожидать, исходя из статистики
(соответственно со имеет положительное или отрицательное значение).
Второй тип взаимного отталкивания адсорбированных частиц
может быть дальнодействующим. При сильной поляризации молекул
адсорбата, образующих адсорбционные связи, или при сильной
ориентации существующих диполей адсорбированный слои состоит из
одинаково ориентированных диполей, между которыми существует
взаимное электростатическое отталкивание. Присутствие таких
диполей можно обнаружить по изменению поверхностного потенциала Л У
при адсорбции (гл. V, разд. V-6B). В суммарную энергию
взаимодействия адсорбированных частиц вносят вклад как короткодействующее
кулоновское отталкивание соседних диполей друг от друга, так и
дальнодействующее отталкивание, обусловленное существованием ди-
польного поля. Последнее убывает пропорционально кубу расстояния,
и его можно оценивать по величине поверхностного дипольного.
момента. Так, изменение \х от 23 до 3,8 D при Q, снижающемся от 32
до 17 ккал/моль в процессе адсорбции натрия -на вольфраме в
диапазоне 0 от 0 до 1, полностью приписывается дальнодействующему
электростатическому отталкиванию диполей. При этом значительное
уменьшение \х с увеличением 0 можно рассматривать как результат
взаимной деполяризации адсорбированных диполей ?[24]. -Vf ^ г'
33—1421
514
Глава XV
Короткодействующее отталкивание количественно оценить очень
трудно. Сравнение теоретических и экспериментальных кривых
зависимостей Q от 6 (см., например, работу [9]) осложняется тем, что без
учета поверхностной неоднородности определение значений со —
занятие довольно бессмысленное. Достаточно, например, указать на
формальное сходство зависимостей Q от Э, .которые дают уравнение
(XV-6), выведенное в предположении поверхностной неоднородности,
и уравнение (XIV-52), полученное для латерального взаимодействия.
Б. Роль числа центров адсорбции и координационного
числа адсорбата
Поскольку в хемооорбционных системах предполагается
взаимодействие между адсорбентом и адсорбатом, -связанное со
специфическими центрами адсорбции, процесс хемосорбции может осложняться
тем, что хемосорбированная молекула занимает или блокирует второй
соседний центр адсорбции. Это означает, что на .каждую
адсорбированную молекулу фактически приходится два смежных центра.
В рамках модели Лэнгмюра в этом случае скорость адсорбции
описывается кинетическим уравнением [91
Скорость адсорбции =k2P [z/(z — 6)1 (1 — 9)2, (XV-8)
тогда как скорость десорбции по-прежнему равна
Скорость десорбции =kiQ1 (XV-9)
где z — число центров адсорбции, находящихся непосредственно
вблизи данного центра. Приравнивая обе скорости, получаем
квадратичную форму уравнения Лэнгмюра:
bP=[(z — Q)/z] [6/(1—0)2J. (XV-10)
Если вследствие диссоциации адсорбированная молекула занимает
два центра, то выражение для скорости десорбции принимает
следующий вид:
Скорость десорбции;^ [{z— \f/z{z—Щ б2 (XV-11)
и, таким образом, изотерма адсорбции дается уравнением
(&'Р)1/2=е/(1—6), (XV-12)
где
*'=(*2#i) [*/(*-1)1".
Последней изотермой описывается, например, адсорбция .водорода
на вольфраме: при низких давлениях наклон кривых зависимости lg v
от \g P равен 72, что соответствует уравнению (XV-12). В этой
области теплота адсорбции почти постоянна, и, следовательно, такой ход
экспериментальных зависимостей не связан с неоднородностью
поверхности [25]. Следует отметить, что правильность множителей,
.включающих 2, до сих пор экспериментально не доказана и что
приведенные выше уравнения изотерм адсорбции основаны исключительно на
модельных представлениях.
Кроме того, при выводе этих изотерм адсорбция предполагалась
локализованной. Однако, как уже отмечалось (см. обсуждение
рис. XIV-31), экспериментально различить нелокализованную и
локализованную адсорбцию чрезвычайно трудно (см. также разд. XV-5).
Хемосорбция и катализ
515
I
Расстояние
от
поверхности-**
м+х+х
Расстояние
от
поверхности-
м+Х9
Рис. XV-6. Кривые потенциальной энергии для неактивированной (а) и
активированной (б) хемосорбции [11].
В. Термодинамика адсорбции
Термодинамическая теория, развитая для физической адсорбции
(гл. XIV, разд. XIV-12), конечно, применима -и ,к хемосорбции. Как >и
в физической адсорбции, в хемосорбции термодинамические
уравнения в основном служат для расчета теплот адсорбции, т. е. для
нахождения qst из данных, полученных при различных температурах.
Найденные таким способом значения qst должны совпадать с
калориметрическими дифференциальными теплотами адсорбции, отличаясь от
последних не больше чем на RT, вероятно, даже для неоднородных
поверхностей. Правда, при исследовании хемосорбции всегда существует
опасность несоответствия экспериментальных данных адсорбционному
равновесию. Рассматриваемый в разд. XV-5 критерий Бика для
поверхностной подвижности применим для предельной ситуации, когда только
часть поверхности находится в равновесии с газовой фазой. Напомним,
что в таких случаях величины qst не имеют ясного физического смысла.
Энтропия хемосорбции находится в общем так же, как энтропия
физической адсорбции (гл. XIV).
4. Кинетика хемосорбции
А. Энергия активации
Как отмечаетсд в гл. XIV, разд. XIV-1, несмотря на отсутствие
термодинамических ограничений, при низких температурах
хемосорбция может протекать настолько медленно, что единственным
процессом в адсорбционной системе можно считать физическую адсорбцию.
Замедленность хемосорбции .-при низких температурах указывает на
ее активационный характер, т. е. на то, что при хемосорбции
преодолевается энергетический барьер. На этом вопросе мы остановимся
подробнее.
Классическое 'Объяснение причин проявления энергетического ак-
тивационного барьера при диссоциации в процессе хемосорбции
принадлежит Леннарду-Джонсу [23]. На рис. XV-6 приведена
энергетическая диаграмма, характеризующая изменение энергии системы
молекула адоорбата — поверхность в ходе адсорбции. Кривая М+Х2
описывает изменение потенциальной энергии при приближении
молекулы Х2 к поверхности. На этой кривой имеется пологий минимум,
соответствующий энергии физической адсорбции и расположенный на
33*
516
Глава XV
расстоянии, равном сумме вандерваалысовых радиусов поверхностного
атома -и адсорбированной молекулы. Кривая М+Х+Х характеризует
потенциальную энергию двух атомов X. Вдали от поверхности эта
кривая отделена от первой кривой расстоянием, равным энергии
диссоциации Х2. Если атОхМ перенести на поверхность, он может вступить
с ней в химическую связь. Тогда на кривой М+Х+Х появятся
глубокий минимум (на рисунке этот минимум несколько глубже, чем он
есть на самом деле), расположенный !на более близком расстоянии от
поверхности, чем минимум физической адсорбции. Кривые М+Х2 и
М+Х + Х пересекаются, и поэтому имеется возможность перехода с
одной .кривой на другую. Вследствие .квантово-механического эффекта
в области -пересечения реальные потенциальные кривые смешиваются
и становятся скругленными. Характер хемосорбций в общего случае
определяется видом потенциальных зависимостей в области
пересечения. Так, если кривая выглядит так, как на рис. XV-6, а, хемоеорбция
должна протекать легко: физически адсорбированная молекула
непосредственно переходит в хемосорбированное состояние, не теряя
энергии физической адсорбции или, в худшем варианте, преодолевая лишь
небольшой активационный барьер. Во втором случае (рис. XV-6, б),
чтобы перейти из состояния физической адсорбции в
хемосорбированное состояние, молекула должна обладать энергией, составляющей
значительную долю энергии диссоциации. Ясно, что теперь
хемосорбция должна иметь явно активационный характер.
Рассмотренные .кривые потенциальной энергии даны в несколько
упрощенном виде. На рис. XV-6, в частности, не отражено влияние
межатомного расстояния X—X на энергию адсорбированной
молекулы. Это означает, 'что активационный барьер хемосорбций включает
также энергию растяжения связи X—X до расстояния,
соответствующего расстоянию между центрами адсорбции. Так, адсорбция
водорода на различных углеродных поверхностях может протекать по
следующему механизму. При приближении молекулы водорода «к паре
соседних атомов углерода связь Н—Н растягивается, одновременно
образуются связи С—Н и в конечном итоге атомы водорода
переходят в хемосорбированное состояние:
Н Н
—О
Н Н
А— А
Согласно результатам расчета Шермана и Эйринга [27], энергия
активации этого процесса минимальна (7 ккал/моль), если длина связи
С—С равна 3,5 А (рис. XV-7).
Качественно появление этого минимума авторы объясняют тем,
что при слишком больших длинах связи С—С связь Н—Н должна
значительно растянуться, а при слишком малых расстояниях С—С —
сжаться. Таким образом, в обоих случаях для перехода в
энергетически выгодное состояние с образованием связей С—Н система долж-
50
*4J
-U
«* 2,5 3,5^ о 4,5
Длина связи С—С, А
Рис. XV-7. Расчетная кривая
зависимости энергии активации адсорбции
водорода на углероде от длины связи
С—С. ' " '
Хемосорбция и катализ
SIT
на преодолевать дополнительный актив анионный барьер,
обусловленный взаимным притяжением или отталкиванием атомов водорода при
деформации связи Н—Н. Длина -связи С—С для графита и алмаза
составляет соответственно 1,42 и 1,54 А. При таких (расстояниях
энергия a-ктивации примерно (равна 45 ккал/моль, т. е. значительно выше
экспериментальных значений 22 и 14 ккал/моль [28]. Если, однако,
не учитывать расстояния между ближайшими соседями (.процедура,
вообще говоря, сомнительная), то -на поверхностях этих материалов
•всегда можно 'найти пары атомов углерода, удаленные друг от друга
примерно на 2,8 А, и, таким образом, .привести расчетные величины в
согласие с экспериментальными значениями [11]. Естественно, что
возможность альтернативного выбора пар центров адсорбции весьма
'затрудняет «использование уравнений с единственно допускаемыми
значениями z, например уравнения (XV-10).
Авторы работы [29], используя метод молекулярных орб-италей и
проведя оценку различных интегралов перекрывания, разработали
более строгую теорию, которая применительно к хемосорбции
водорода на гранях (111) Pt дает результаты, хорошо согласующиеся с
данными флэш-десорбции и ДМЭ. Следует отметить, что все более
широкое применение ДМЭ для исследования хемосорбированных слоев
позволяет существенно углубить теоретический анализ состояния
хемосорбированных частиц на различных -поверхностях (например, часто
наблюдаемых при хемосорбции структур С(2Х'2) [30] (см.также [3]).
Тем не менее, как отмечают Вайнберг и Мерил [28], общей
реалистической кв-антовомеханической теории хемосорбции пока не существует.
Б. Скорость адсорбции
Вопрос о скоростях хемосорбции мы уже затрагивали в разд. XV-2T,
посвященном флэш-десорбции. Этот метод даст ценную информацию
как об адсорбции, так и о десорбции молекул, по крайней мере если
исследуются поверхности монокристаллов. Теория кинетики
хемосорбции, по существу, не отличается от теории кинетики физической
адсорбции, рассмотренной в гл. XIV, разд. XIV-3A. Напомним, «что
скорость адсорбции просто равна скорости, с которой молекулы газовой
фазы бомбардируют центр адсорбции площадью >о°, умноженной на
долю незанятых центров 1—9. Сходство этих теорий становится еще
большим, если в них включить дополнительный множитель —
коэффициент конденсации с, характеризующий долю молекул, прилипающих
к поверхности, от общего числа молекул, падающих на ллощадь а0.
Если рассматривается активированная адсорбция, доля прилипших
молекул, переходящих в хемосорбированное состояние, определяется
экспоненциальным множителем ех'Г>{—Г /RT). В результате
уравнение (XIV-12) для константы скорости адсорбции принимает такой
вид:
k2 = [Nco° exp (—E*a/RT)]/(2nMRTy<* =A exp (—El/RT). (XV-13)
Соответственно скорость адсорбции равна
%a=dQ/dt =kj (8) P, (XV-14)
где /(0) —доля доступной поверхности. В простои лэнгмюровской
модели /(6) равна (1—8). Однако эта функция может принимать и
другие формы, например если адсорбирующая молекула занимает два
смежных свободных центра. Величина
s=cf(Q)exp(—El/RT),
называемая коэффициентом прилипания, характеризует
эффективность соударений молекул газа с поверхностью.
518
Глава XV
Скорость адсорбции можно описать также в рамках теории
абсолютных скоростей через константу равновесия реакции образования
активированного или переходного комплекса. На рис. XV-6,6 этому
переходному комплексу соответствует максимум потенциальной
энергии. При формальном подходе коэффициент конденсации с заменяется
на выражение, содержащее сумму по состояниям переходных
комплексов [11, 31].
При достаточно большой энергии активации El скорость
адсорбции можно измерять обычными адсорбционными методами. Так, Шол-
тен и др. [32] исследовали скорость адсорбции азота на железном
катализаторе удельной поверхностью 6 м2/г с помощью вакуумных
весов. В этих опытах вес катализатора равнялся 87 г, а вес
адсорбированного азота при 9 = 1 составлял 39 мг. С увеличением 6 скорость
адсорбции быстро падала. Авторы сначала представили полученные
данные в виде зависимости (l/P) (dQ/dt) от 0, а затем по
температурной зависимости скорости адсорбции при данном «0 построили график
Еа—0, приведенный на рис. XV-8. Обратите внимание, что на кривой
зависимости энергии активации от -0 излом наблюдается примерно в
той же области, что и на кривой зависимости Q от 0.
Зависимость Еа от 0 не такое уж необычное явление. Используя
эмпирическое соотношение
£;=£;+ае,
из уравнения (XV-14) получаем известное уравнение Еловича [33]:
dQ/dt=Af (0) Р ехр [ — (£*+ aQ)/RT]. (XV-15)
Таким образом, при данной температуре скорость адсорбции меняется
пропорционально }(Q)e~a0.
В рассмотренном выше примере скорость хемосорбции в интервале
значений 0 от 0,07 до 0,22 можно описать уравнением
dQ/dt=21,9PN/132>49/* er №o+775ooqvrt (XV-16)
где давление выражено в см рт. ст., а время—,в -минутах. Уравнение
(XV-16) нетрудно привести к уравнению (XV-15). Вид функции /(0)
в данном случае особого значения не имеет. Поскольку молекула
1 1 1 1 1 1 1 1
1 1 I I I I I 1_
0,1 0,1 0,3 0А 0,5 0,6 0,7 0,8
Рис XV-8 Влияние степени заполнения на энергию активации адсорбции и десорбции,
а также на теплоту хемосорбции азота на однократно промотированном
восстановленном железе Расчет Q (9) проводился по уравнению Q = Ed—Еа [32].
50
I
% зо
* I
20\
Щ
Хемосорбция и катализ
519
азота, по всей вероятности, адсорбируется на двух центрах, в
качестве /(8) можно использовать функцию (1—8)2, которая в
рассматриваемом узком диапазоне значений 0 в свою очередь аппроксимируется
экепонентой е~2'22е пренебрежимо малой по сравнению с другими
экспоненциальными членами. Зато частотный -множитель А
[уравнение (XV-13)] в том же диапазоне значений 0 увеличивается на пять
порядков, что указывает на непрерывное изменение коэффициента
конденсации, или, иными словами, изменение суммы по состояниям
переходных комплексов. Такие изменения также не являются
необычными. Например, при адсорбции кислорода на кремнии коэффициент
прилипания значительно уменьшается с ростом 0 [34].
Приведенный выше пример довольно типичен для хемосорбции: с уменьшением Q
или увеличением 0 как энергия активации, так и частотный множитель, как правило,
растут. Аналогичное явление обнаруживается и при сравнении скоростей
каталитических реакций на ряде подобных катализаторов с различными средними значениями Q.
Шваб и др [35] выражают А в виде линейной функции e£*//z, где h — эмпирическая
постоянная, а £* — энергия активации каталитической реакции. Констэбль [36, 37]
показал, что эта зависимость соблюдается, если поверхность гетерогенная и доля
центров, характеризующихся данным значением £*, пропорциональна е ~" ^'\ Хотя работы,
о которых шла речь выше, достаточно старые, но физическая картина, согласно
которой увеличение £* с ростом G сопровождается увеличением доли поверхности,
характеризующейся данной энергией активации, все еще сохраняет свое значение.
Можно предполагать, что в каталитической реакции принимает участие лишь небольшая
часть поверхности и, таким образом, в может значительно меняться с изменением Ем.
Однако для адсорбции азота такое объяснение не подходит, поскольку в этом случае
изменение 0 известно и к тому же мало. Изменение скорости адсорбции азота на
железе скорее всего обусловлено зависимостью коэффициента конденсации от £*.
Учитывая терминологические различия, данные по скоростям каталитических реакций и
адсорбции можно интерпретировать в рамках одних и тех же представлений.
Изменение скорости адсорбции в зависимости от степени заполнения поверхности
объясняется тем, что, с одной стороны, из-за очень сильной локализации адсорбата
центры адсорбции характеризуются отрицательной относительной энтропией
адсорбции, а, с другой стороны, высокая энергия адсорбции способствует деформации
связей, приводящей к хемосорбции. В результате минимум кривой потенциальной энергии
М+Х+Х (рис. XV-6, б) становится глубже, кривая М+Хг пересекается на более
низком уровне и, следовательно, энергия активации адсорбции снижается.
Теперь вернемся к системе азот — железо (рис. XV-8). Очевидно,
что .при 0>О,22 состояние хемоеорбированных частиц должно
меняться. При этом по маре увеличения 0 энергия активации и теплота
адсорбции остаются более или менее постоянными, а частотный
множитель уменьшается. По мнению Шолтена и др. [32], в данной области
адсорбция азота становится нелокализованной. Возможно, однако,
что при этом азот адсорбируется, не диссоциируя, или что адсорбция
протекает на 'кристаллических плоскостях, допускающих большее
число колебательных и вращательных степеней свободы.
В. Скорости десорбции
Энергия активации десорбции Е\ как минимум .равна теплоте
адсорбции Q, поэтому десорбция всегда является активированной.
В общем случае
Ei=E*a+Q. (XV-17)
Это означает, что энергия активации десорбции может быть
значительно больше энергии активации адсорбции. Кроме того, Е J
значительно сильнее, чем £а, зависит от степени заполнения поверхности 0,
поскольку на Ed непосредственно влияет зависимость Q от -0. В
рамках лэнгмюровской модели скорость десорбции определяется
следующим выражением:
Rd=-dQ/dt=(l +т0) exp (-Q/RT) exp (—El/RT) f/0, (XV-18)
где /'(0)—функция, определяемая характером хемосорбции. Если
адсорбция не сопровождается диссоциацией и все центры на поверх-
520
Глава XV
ности равнодоступны (ом. гл. XIV, разд. XIV-3), /'(-9) просто равна 6;
цри диссоциации хемосорбирующейея молекулы на два атома
П9)=92.
В качестве примера рассмотрим десорбцию азота -с поверхности
восстановленного железного катализатора. Экспериментальные
значения Ed для этого процесса также представлены на рис. XV-'8.
Эмпирически скорость десорбции азота с поверхности железа описывается
выражением
—flf8/d/=4,8. 101 W-10>646 £[-55000+292006]/^ ' (XV-19)
где время опять дано .в минутах, а эмпирический член е~10'640 лри
02 введен для компенсации и отражает статистическую вероятность
нахождения рядом двух заполненных центров адсорбции. Таким
образом, данные по скорости десорбции вполне согласуются с
представлением о том, что адсорбированная фаза состоит из атомов азота,
которые при десорбции ассоциируют в молекулу. Интересно, 'что на
.кривой зависимости Ed от 8 отсутствует перегиб, (характерный для
зависимости Е\ («и в меньшей степени Q) от 0 в области 9 = 0,22. В
рамках теории абсолютных скоростей это объясняется тем, что при
десорбции активированное состояние по своей природе практически не
отличается от адсорбированного состояния. В результате, хотя
изменение 9 оказывает значительное влияние на кинетику адсорбции, ла
десорбции оло почти :не сказывается. Очень часто, например лри
адсорбции двуокиси углерода ла окислах цинка, хрома, марганца и
других металлов, величины E*d и Q очень близки между собой [38].
По-видимому, здесь имеют место поверхностные химические реакции,
приводящие к образованию соответствующих карбонатов.
5. Поверхностная подвижность
Вопрос о поверхностной подвижности неоднократно затрагивался
в различных разделах этой книги. Фактически в зависимости от кол-
текста 'использовались два различных представления. При
рассмотрении физической адсорбции молекулы адсорбата считают подвижными.
При этом предполагают, что оли свободно перемещаются по
поверхности и, по существу, образуют двумерный .неидеальный газ. В этом
смысле адсорбат подвижен, только если энергетический барьер для
процесса переноса молекул адсорбата по -поверхности мал по
сравнению с kT. Такая подвижность адсорбированного слоя при хемосорб-
ции маловероятна, хотя и не исключается полностью. Так, исходя из
аномально низкой энергии активации адсорбции водорода на никеЛе,
можно предполагать, что в некоторых случаях значительная делока-
лизация электронов на поверхностях металлов -может приводить к
высокой подвижности адсорбированных частиц.
Вообще говоря, энергетический барьер латерального движения при
хемосорбции разумно связать с наличием на поверхности
специфических центров. Поэтому адсорбция должна подчиняться законам
статистической термодинамики локализованного состояния. В то же
время кинетика адсорбционных и .каталитических процессов в
значительной мере зависит от частоты и -природы перескоков
хем©сорбированных частиц от одних центров к другим. В этом смысле пленка
может быть довольно подвижной, хотя ее конфигурационная энтропия
все еще не отличается от энтропии локализованного состояния.
Ценные сведения о поверхностной подвижности хемосорбирован-
ных частиц (правда, для довольно ограниченного числа систем) дает
•автоэмиссионная 'микросколия. Этим .методом -можно наблюдать,
например, как молекулы, адсорбированные на одной стороне острия,
Хемосорбция и катализ
521
распространяются по всей поверхности острия. При этом
интенсивность и число «отдельных лятен изменяются. Скорость и характер
этого процесса сильно зависит от температуры (см. рис. V-20), Так,
при температуре около 400 К атомы азота начинают довольно
свободно мигрировать ,на плоскостях (111) вольфрама [34]. Хэйворд и Треп-
нел [11] указывают, что миграция хемосарбировашшх частиц на
поверхности -становится значительной при температуре, равной
приблизительно (половине температуры, при которой начинается заметное
испарение. Хотя к этому «выводу авторы пришли, анализируя данные
по хемосорбции на -вольфраме, он тем не .менее -имеет довольно общее
значение. Отметим также возможность -исследования миграции
отдельных атомов с помощью автоио-нной микроскопии. При
достаточном 'числе измерений можюо по смещению атома в единицу времени
статистически оценить коэффициент поверхностной диффузии.
Макроскопические измерения поверхностной подвижности
довольно трудны и проводятся не так уж часто-. В работе [39] скорость
расширения пятна калия, адсорбированного на вольфраме, определялась
по усилению фотоэлектрического эффекта (в УФ-области) в
присутствии калия. Найденный таким способом коэффициент диффузии при
480 К составляет 6-Ю-6 см2/с, а энергия активации поверхностной
диффузии равна 15 «кал/моль.
В относительно недавно опубликованной работе [40]
радиоавтографическим методом измерена скорость самодиффузии атомов
никеля на плоскости никеля (111) из пятна радиоактивного никеля.
Полученные результаты описываются уравнением
Ds = 300e-£W (XV-20)
где Ds измзряется в см2/с, а £* = 38±4 ккал/моль.
Косвенно подвижность хемосорбированных частиц можно оценить,
сравнивая энтропию адсорбции с ее расчетными значениями.
Подробно методы расчета энтропии хемосорбции описаны в работе Хей-
ворда и Трепнела [11]. Однако в принципе они практически не
отличаются от методов, рассмотренных в гл. XIV, разд. XIV-3B и XIV-13,
и сталкиваются в общем с такими же трудностями. По мнению
автора, абсолютные величины адсорбции или их зависимость от 0 вряд ли
может служить надежной характеристикой поверхностной
подвижности.
Бик [41] предложил эмпирический критерий поверхностной подвижности в пористых
адсорбентах. Как правило, поверхности таких адсорбентов можно считать
гетерогенными, и поэтому для них теплота адсорбции должна зависеть от 0. Допустим, однако,
что поверхностная подвижность адсорбата очень мала, и поэтому равновесие между
различными частями поверхности отсутствует. Тогда первая порция адсорбата займет
наиболее доступные центры с теплотой адсорбции, характерной в среднем для всей
поверхности. Следующая порция адсорбируется на ближайших доступных центрах и
дает такую же среднюю теплоту адсорбции. В результате кажущаяся теплота
адсорбции остается постоянной. Аналогичный критерий поверхностной подвижности
используют также Гримли и Уокер [42], показавшие, что латеральное взаимодействие на
однородной поверхности максимально, если адсорбция подвижна и Q меняется
пропорционально б2. В случае неподвижной адсорбции такая зависимость Q от б2
отсутствует.
В заключение отметим, что поверхностную подвижность опредеделяют тремя
различными способами. Согласно статистической термодинамике, в выражение для
энтропии адсорбированной пленки должен входить член, отражающий возможность
поступательного движения молекул в двумерном пространстве (лично автору такая
возможность представляется маловероятной). В рамках равновесной термодинамики
адсорбция относится к подвижной, если вследствие поверхностной диффузии (или любого
другого механизма) адсорбированные атомы занимают энергетически наиболее
выгодные центры поверхности за времена, малые по сравнению с длительностью опыта. По
существу, это определение совпадает с рассмотренными выше критериями Бика и
Гримли и Уокера. И наконец, поверхностную подвижность можно оценить по
способности адсорбированной пленки к миграции по поверхности или течению в
макроскопическом масштабе.
522
Глава XV
Первый способ определения поверхностной подвижности вряд ли представляет
практическую ценность. На энтропию адсорбции влияет слишком много факторов, и
поэтому ее экспериментальные значения для исследуемой системы не могут служить
надежной характеристикой поверхностной подвижности.
Второе определение особенно полезно в хемосорбции, которая отличается от
физической адсорбции тем, что в процессе хемосорбции образуются настолько прочные
связи, что вследствие поверхностной неподвижности адсорбированные частицы
характеризуются случайным, а не равновесным распределением по поверхности.
Третий способ, реологический по своей сути, имеет вполне определенную
экспериментальную направленность. Он позволяет использовать для описания
адсорбированных пленок те же критерии, что и для объемной фазы, и, конечно, служит
надежной основой при определении состояния пленок на жидких подложках. Как
отмечается в гл. III, твердые пленки имеют упорядоченную структуру и обладают
определенной упругостью и прочностью; жидкие пленки характеризуются сплошностью и
способностью к вязкому течению; особенностью газообразных пленок является их
способность к быстрому установлению равновесия со всеми частями поверхности. Если
подложка пленки твердая, провести такие тонкие различия довольно трудно, однако
общий подход здесь остается тем же. По мнению автора, этот способ определения
подвижности наиболее практичный и последовательный.
6. Хемосорбционная связь
Полной теории хемосорбционной связи до сих пор не существует.
В конце концов, и теория химической связи все еще строится -на
полуэмпирической основе. Исключение составляет только теория
химической связи нескольких -простейших двухатомных молекул. В
случае хемосорбции положение осложняется необходимостью учета
изменений в межфазной области в присутствии посторонних частиц.
Сходная проблема возникает при оценке поверхностной энергии чистых
твердых тел. В силу необходимости теоретический анализ хемосорб-
ционной связи сводится к приблизительному описанию хемосорбиро-
ванного состояния (молекулярная форма, валентность и т.д.) и
основывается на относительно упрощенных моделях. Полный обзор работ
по данной теме дан Гомером [1а].
А. Теория локализованной связи
В одном из довольно успешных подходов хемосорбцию нередко
рассматривают просто как реакцию, протекающую с образованием
связи между молекулой адсорбата и адсорбентом, энергетически
подобную реакции образования двуатомной молекулы. Например,
адсорбцию атомов щелочного металла на металлической .поверхности
можно разделить на следующие стадии:
М(г.)=М+(г.) + е~(г.), Qi=—/ (потенциал ионизации);
е~(г)=е~ (в металле), Q2=W (работа выхода); (XV-21)
М+(г.)=М+(адс.) Q3=e2/4r().
Величина Q3 соответствует потенциальной энергии иона, находящегося
на расстоянии г0 от поверхности, и обусловлена силой
электростатического изображения (ион, приближающийся к поверхности
проводника, притягивается .к нему так, как будто в последнем
индуцируется равный и противоположный по знаку заряд, расположенный под
поверхностью на расстоянии г0). Как видно из табл. XV-1 [11],
теоретические значения энергии взаимодействия удовлетворительно
согласуются с экспериментальными величинами Q. В этом приближении
структурой металла пренебрегают, а радиус хемосорбированного иона
щелочного металла г0 принимают равным радиусу иона в кристалле
соответствующего галогенида щелочного металла.
Хемосорбция и катализ
523
Система
Na на W
К на W
Cs на W
Теплоты хемосорбции на щелочных i
/, ккал
118,0
99,6
89,4
W, ккал
ооо
<2з, ккал
44,5
35,9
31,1
металлах [11]
Q (расч.), ккал
30,5
40,3
45,7
Таблица XV-1
Q (эксп.), ккал
32
64
Энергию образующихся три хемосорбции ковалентных связей
можно оценить по электроотрицательности компонентов системы.
Например, для диссоциативной хемосорбции водорода на вольфраме
2W + H2 = 2(W-H)
(XV-22)
(XV-23)
При этом предполагается, что в процессе хемосорбции связи W—W
не рвутся. Энергия связи Н—Н известна, а величину £V-h можно
оценить из соотношения
1
E\v-h — "о" (£w-w—^н-н) + 23 (Xw — Хн)2,
(XV-24)
где A\v и ХИ — соответствующие электроотрицательности. В результате
энергия адсорбции равна
Q =£w_w + 46 (XW-XH)\ (XV-25)
Энергия связи W—W составляет около одной шестой энергии возгонки
вольфрама (см. гл. II, разд. П-1Б), а. для оценки электроотрицательно-
стей существуют различные схемы, из которых наиболее
разработанной, по-видимому, является схема Малликена [44]. Поскольку связь
W—Н в значительной мере .носит ионный характер, величину Xw—^н
можно приблизительно оценить по поверхностному дипольному
моменту. Последний непосредственно связан с экспериментально
определяемой разностью поверхностных потенциалов {45, 46].
В то же время, согласно квантово-механической оценке [47],
величина £w-h связана с энергиями образования чисто ионной [уравнение
(XV-21), но с Qs=e2/rQ] и чисто ковалентной [уравнение (XV-24), но с
yYw—Хн = 0] связей следующим линейным соотношением:
Ew-H = [/£f-(l -f)£j/(2/-l), (XV-26)
где индексы i и с относятся к ионной и ковалентной связям
соответственно; f — степень ионизации связи, определяемая выражением
/ = ji/er0, в котором \х — дипольный момент поверхностного комплекса
W—Н. Этим методом Хэйворд и Трепнел [11] оценили энергии связей
для большого числа хемосор'бцион'н-ых систем. Некоторые полученные
ими значения приведены в табл. XV-2. Дополнительные сведения для
ряда других систем читатель может найти в монографии Соморд-
жея [2].
Таким образом, электроотрицательность, по существу, определяется
просто как сумма энергий ионных и ковалентных связей [49].
Фактически этот метод не отличается от аналогичного (и к тому же
проверенного) метода определения энергии химических связей. Поэтому
предполагается, что в теоретических расчетах значения энергии
поверхностных связей вполне можно заменять энергиями связей в
соответствующих соединениях. Так, теплота образования W03 (г) из газо-
524
Глава XV
Таблица XV-2
Расчетные и экспериментальные величины теплоты хемосорбции
Система
адсорбат
н2
н2
н2
о2
о2
N2
СО
С2Н4
NH3
адсорбент
W
Fe
Ni
W
Pt
w
Ni
W
С
Q, ккал/моль
расч.
37
20
18
74
54
106
35
73
32
эксп.
45
32
30
194
70
95
42
102
17
образных элементов составляет 193 ккал (в расчете на 1 моль
кислорода), что почти совпадает с теплотой хемосорбции кислорода на
вольфраме, равной 194 .ккал. Аналогично теплота образования
Ni(CO)4 (г) из Ni (г) и Со (г) равна 35 ккал/моль СО, а теплота
хемосорбции СО на Ni составляет 42 ккал/моль СО [11].
Эти же представления применимы и к адсорбции на поверхности
углерода. Например, хемосорбцию водорода на углероде можно
представить в виде реакции
2С + Н2 = 2СН. (XV-27)
Если считать, что при хемосорбции образуется нормальная
углеводородная связь (энергия которой, например, составляет одну четвертую часть
полной энергии образования метана), то Q .можно вычислить с помощью
равенства
Q=2£C-h-£h-h. (XV-28)
Аналогичный, хотя и несколько более сложный метод применяется и
для оценки энергии хемосорбционных связей сложных молекул.
Конечно, во всех случаях расчетные значения Q зависят от допущений
относительно природы образуемой связи. Например, при расчете теплоты
адсорбции водорода на частично окисленной поверхности -металла
.необходимо учитывать тот факт, что водород адсорбируется прежде
всего на поверхностных окислах, а не на чистой поверхности металла.
Приведенные в табл. XV-2 значения Q показывают, что теория
локализованных связей дает в общем удовлетворительные результаты.
С этой точки зрения поверхностные химические связи по своей природе
не слишком отличаются от обычных химических связей в простых
соединениях. Однако иногда различия между теорией и экспериментом
настолько значительны, что приходится допустить существование
каких-то неучтенных специфических факторов. Некоторые из этих
специфических факторов рассматриваются ниже.
Б. Металлы
В общем случае начальные теплоты адсорбции на различных
металлах располагаются в определенном порядке независимо от природы
адсорбата (по .крайней мере это справедливо для таких обычных ад-
сорбатов, как водород, азот, аммиак, окись углерода, этилен и
ацетилен), убывая в следующей последовательности: Ta>W>Cr>Fe>Ni>
>Rh>Cu>Au (рис. XV-9) [11]. Поэтому можно предположить, что,
во-первых, при хемосорбции наибольшей активностью отличаются пере-
Хемосорбция и катализ
525
ходные /металлы ,и, во-вторых, в пределах одного ряда активность
переходного металла уменьшается с увеличением его порядкового номера.
Такой характер изменения теплоты хемосорбции свидетельствует об
участии d-орбиталей металлов в образовании адсорбционной связи.
Первые попытки установить корреляцию между хемосорбцией и
свойствами d-электро'нов в металле принесли лишь частичный успех [11, 50].
Правда, Бик [41] действительно обнаружил взаимосвязь между
каталитической активностью металла при гидрировании этилена и
вкладом d-электронов, участвующих в образовании хемоеорбционной связи
(т. е. не участвующих в образовании металлической связи) (рис. XV-10).
Роль d-электронов в хемосорбции на переходных металлах
подтверждают также измерения магнитной восприимчивости. Селвуд и др. [51]
нашли, что с увеличением количества хемосорбированного водорода
магнитное насыщение никелевого порошка линейно уменьшается. По
оценке авторов, в образовании связей Ni—Н используется 0,7
«вспаренного rf-электрона в расчете на каждый адсорбированный атом
водорода. Интересно, что водород, физически адсорбированный при
—196 °С, не влияет на магнитную восприимчивость. Однако при
•нагревании выше —196 °С водород начинает хемоеорбироваться и
восприимчивость системы уменьшается [51, 52]. Аналогичное влияние на
удельную магнитную восприимчивость оказывают и другие адсорбаты,
например бензол, циклогекеан, этилен и этан.
Некоторые адсорбаты, например окись углерода и этилен, образуют
с переходными металлами очень устойчивые координационные
соединения [53]. В таких случаях хемосорбционные свойства системы,
по-видимому, в большей степени определяются химической природой
поверхностных комплексов, а не характером металлической связи. В образо-
Рис. .XV-9. Теплоты хемосорбции на различных переходных металлах первого (/),
второго (2) и третьего (3) периодов периодической системы Менделеева. ; >
526
Глава XV
вавдш координационных связей участвуют нижние незаполненные
d-орбитали, доступность которых коррелирует с общим характером
изменения теплот хемосорбци'и на различных металлах. В пользу
данного подхода свидетельствует успешная оценка теплоты хемосорбции
окиси углерода на никеле по теплоте образования Ni(CO)4- Расчет
энергии поверхностных координационных связей осложняется тем, что
в несимметричном окружении d-орбитали не являются эквивалентными
и делятся на две группы и более. Так, в октаэдрических комплексах
d-орбитали делятся на две группы: в первую группу входят dZ2 и
dX2—^2-ор'битали, участвующие в образовании координационной связи, а
во вторую — dxy, dxz- и d^-орбитали, образующие металлическую связь.
Это расщепление, безусловно, сказывается на энергии координационной
связи, и, таким образом, -влияние поля липанда, например вызываемое
этим полем отщепление вырожденных уровней, может иметь важное
значение в хемосорбции [54, 55] и в фотодесорбции [55]. Развитие
химии координационных комплексов металлов — координационных
соединений, в центре которых находятся три и более связанных между
собой ато-ма металла, стимулировало поиск аналогичных поверхностных
комплексов при хемосорбции соответствующих лигандов. Здесь следует
отметить, в частности, успешный квантовомеханический расчет
методом ППДП (полное пренебрежение дифференциальным
перекрыванием) энергии взаимодействия окиси углерода с кластерами атомов
никеля на плоскостях (100) и (111) [56]. Известен и совершенно иной
подход к ^адсорбции на металлах, в котором, предполагается, что хемо-
сорбция молекул адсорбата обусловлена непрямым взаимодействием
при участии электронов проводимости.
В. Полупроводники
Адсорбционные свойства окислов и других полупроводников в
значительной мере определяются их электрическими свойствами. В этом
разделе мы остановимся лишь на некоторых особенностях адсорбции на
этих материалах. Для углубленного изучения данного вопроса
рекомендуется книга Хэйворда и Трепнела [11].
Для многих кристаллов характерно значительное перекрывание ор-
биталей соседних атомов, приводящее к образованию зонной структуры.
Если такие зоны заполнены лишь частично, кристалл обладает
электропроводящими свойствами. Если же все энергетические
I
и
IB
s
5г
48
44
40
36
W
О
- Тс
Ср
1
RhL
v^
^ Поликристаллический
1 1 i . 1
4,0 3,0 2,0 1,0
lg k (гидрирование С2НА )
0,0
Рис. XV-10. Корреляция между каталитической активностью металлов при
дегидрировании этилена и процентом rf-электронов, участвующих в образовании металлической
связи [52].
Хемосорбция и катализ
527
зоны кристалла заполнены электронами полностью или не
заполнены совсем, проводимость его очень мала. К
кристаллам последнего типа относятся, в 'частности, стехиометриче-
ские окислы металлов. Допустим, однако, что в окисле имеется
избыток металла. Тогда в свободную зону, образованную 3s- и Зр-орби-
талям.и (ионов кислорода, «забрасывается» некоторое количество элек
тронов, и окисел становится электропроводящим. Примером такого
окисла может служить ZnO, обычно содержащая некоторый избыток
цинка.
Процесс адсорбции .кислорода на окиси цинка .включает следующую
реакцию:
02 + 4в- = 202- (аде.), (XV-29)
приводящую -к уменьшению избытка цинка. При этом число электронов
в зоне проводимости -и, следовательно1, электропроводность окисла
также должны уменьшаться, что в действительности наблюдается на
опыте. Такая адсорбция называется деплетив:ной или истощающей.
В то же время некоторые окислы, (например NiO, обогащены
кислородом. В NiO электронейтральность обеспечивается тем, что часть
никеля .находится в трехвалентном состоянии. Ионы Ni3_b оттягивают на
себя электроны из верхней заполненной (валентной) зоны, и, таким
образом, опять создаются условия для проведения электрического тока.
В этом случае адсорбция кислорода также описывается уравнением
(XV-29). Однако теперь электроны вытягиваются из частично
истощенной валентной зоны, что .приводит к появлению дополнительных ионов
Ni3+. Этот процесс продолжается вплоть до образования монослоя.
Поскольку при адсорбции кислорода на окиси никеля вблизи валентной
зоны появляются дополнительные вакансии, электропроводность
окисла должна возрастать. Этот вывод также подтверждается
экспериментально [58].
Следовательно, адсорбаты, образующие на поверхности адсорбента
анионы, должны, как правило адсорбироваться .на полупроводниках
р-типа (например, NiO) более активно, чем на полупроводниках
д-типа (например, ZnO). При этом совсем не обязательно, чтобы тип
полупроводника определялся избытком или недостатком его
собственных ионов. Такую же роль могут играть примеси, нередко вводимые
преднамеренно. Так, при введении в решетку NiO ионов Li+
электронейтральность сохраняется в результате образования дополнительных
ионов Ni3+. Последние конкурируют с адсорбирующимися ионами
кислорода, стремясь захватить электроны из валентной зоны, и, таким
образом, активность окисла по отношению к адсорбции кислорода
должна уменьшаться.
Количественно деплетивная адсорбция ионотенных веществ на
полупроводниках описывается теорией «граничного слоя» [11, 59].
Согласно этой теории, в результате адсорбции образуется заряженный
слой глубиной /, в пределах которого все дефекты, образованные
заряженными частицами, могут нейтрализоваться адсорбирующимися
частицами. В результате при плотности дефектов, равной п0 (число
избыточных атомов цинка на 1 см3 ZnO), концентрация адсорбата на
поверхности равна п01 или
e=/i0/o°, (XV-30)
где а0 — площадь одного центра адсорбции, примерно равная Ю-15 см2.
Плотность заряда в граничном слое принимается постоянной и равной
ещ. При этих условиях интегрирование уравнения Пуассона (IV-5X
приводит к выражению
Vs =2np/2/D=2nen0l2/D. (XV-31)
528
Глава XV
Решая совместно уравнения (XV-30) и (XV-31) и исключая Z, получаем
9 =о° (DV/i0/2ney\ (XV-32)
где Vs — изменение поверхностного потенциала в результате
адсорбции. При Z)=10 и а° = 10~15 ом2 уравнение (XV-32) .принимает
следующий вид:
e=3.io-2(n0vs)i/2. (xv-зз)
Если число дефектов По равно, например, 1018 см-3, a V6=l В (это
соответствует обычному изменению поверхностного потенциала при
адсорбции), 8 составляет около 0,003. Таким образом, теория
предсказывает очень большое изменение поверхностного потенциала даже при
незначительной адсорбции -кислорода. Теория граничного слоя
объясняет также фотоадсорбцию: при освещении поверхности плотность
электронов в граничном слое может меняться, что приводит к
увеличению или уменьшению адсорбции в зависимости от типа
полупроводника.
Исследование адсорбции на поверхностях полупроводников имеет
важное практическое значение, поскольку при адсорбции могут
меняться (обычно обратимо) характеристики полупроводниковых приборов
[60]. Так, вода, кислород и двуокись углерода, адсорбируясь на
поверхности германия или кремния, образуют полупроводниковый
офисный слой. При этом поверхность полупроводника я-типа приобретает
свойства полупроводника р-типа. Кроме того, изменение поверхностного
потенциала полупроводников при хемосорбции .можно использовать для
детектирования малых количеств адсорбируемого материала.
Довольно сложные и пока непонятные явления наблюдаются при
покрытии полупроводника тонкой пленкой металлического
катализатора. Например, при нанесении серебряного катализатора на
полупроводник /г-типа энергия активации дегидрирования муравьиной кислоты
уменьшается с уменьшением проводимости подложки [60а].
Г. Кислотно-основные системы
В ряде адсорбционных систем взаимодействие адсорбата с
центрами адсорбции осуществляется в результате либо переноса протонов,
либо кислотно-основной реакции льюисового типа. Так, обнаруженная
Бенсоном и Зигофом [61] сильная и довольно специфическая
адсорбция НС1 и NH3 на лиофилизованных белках количественно
соответствует числу основных и кислотных центров, определяемых титрованием.
Образование некоторых координационных связей также можно
рассматривать -ка.к реакцию между льюисовой кислотой- (ион металла) и
льюисовым основанием (лиганд), а, например, очень сильную
кислотность поверхности 'частично дегидратированного сульфата никеля
можно объяснить наличием незаполненных d-орбиталей никеля на
поверхности [62]. Кислотность поверхностей определяют либо титрованием
основаниями, растворенными в неводных растворителях, либо по
адсорбции основных газов. Поверхности, имеющие .кислотные свойства,
могут быть каталитически активными (например, в реакции
деполимеризации паральдепида).
„ Важную группу адсорбентов с кислотными центрами образуют
алюмосиликаты, широко применяемые в качестве катализаторов при
'крекинге. 'Поверхностные группы с центральным атомом алюминия «могут
быть либр донорами протонов (т.е. кислотой по Бренстеду), либо
«•акцепторами электронов (т.е. кислотой до Льюису). Тип центра в
принципе можно определить методом ИК-спектроскопии. В зависимости от
типа центра при адсорбции основания, например аммиака или пириди-
Хемосорбция и катализ
529
I ..
Si Ю:
I
• •
Ю:
• •
■Si—
• о* ч;— (кислота,
ШУ.' т Льюиса)
н :о: Н+
I
Рис. XV-11.
-Si Ю: *-Al-^ :o: Si-
I " J "I
• •
Ю:
• •
-Si—
I
(кислота
Бренстеда)
на, образуются либо ионы аммония и пиридиния, либо соответствующее
координационное соединение. На рис. XV-12 приведена часть ИК-спект-
ра пиридина, адсорбированного на алюмосиликатаом катализаторе
[63]. Полоса при 1450 см-1 приписывается пиридину,
адсорбированному на льюисовых центрах, а полоса при 1490 ом-1—пиридину,
адсорбированному на бренстедовских центрах. Как видно из рисунка, при
выдерживании катализатора в парах воды доля бренстедовских
центров растет. Этот процесс обратим: после удаления воды спектр г
становится аналогичным спектру а.
Рис. XV-12. ИК-спектры пиридина и воды на алюмо-
силикатном катализаторе [63].
а — образец выдерживали 1 ч в парах пиридина при давлении
17 мм и температуре 150 °С и затем вакуумировали при этой же
температуре в течение 6 ч; б — образец выдерживали 1 ч в
парах воды при 15 мм и 150 °С и после этого вакуумировали при
150 °С также в течение 1 ч; в — образец выдерживали 1 ч при
16 мм и 25 °С и вакуумировали при 25 °С в течении 1 ч; г —
образец вакуумировали 16 ч при 150 °С.
юоо 1600 то
Частота, см4
34—1421
530
Глава XV
7. Механизмы гетерогенного катализа
Каталитическая pea-кция -на поверхности твердого тела включает
следующие стадии: /) диффузия реагирующих веществ к поверхности
(обычно эту стадию считают быстрой); 2) адсорбция реагирующих
веществ (если адсорбция активированная, эта стадия может быть
медленной); 3) диффузия реагирующих веществ .к активным центрам (если
адсорбированные частицы достаточно подвижны); 4) реакция между
адсорбированными частицами (нередко именно эта стадия определяет
скорость процесса в целом); 5) десорбция .продуктов реакции (нередко
замедленная) и 6) диффузия продуктов реакции от поверхности.
Когда «имеют дело с пористыми катализаторами, скорость
каталитической реакции может определяться стадиями 1 1и 6 [64]. Однако, если
все поверхности равнодоступны и открыты, эти стадии, как правило,
особого значения не имеют. Кинетика адсорбции и десорбции
рассматривалась в разд. XV-4, поэтому в этом разделе основное внимание мы
уделим стадии 4, т. е. реакции между адсорбированными частицами.
Л. Каталитические реакции, скорость которых определяется
скоростью адсорбции или десорбции
Как уже говорилось в гл. XIV, разд. XIV-15, адсорбция одного или
нескольких реагирующих веществ, стадия 2, нередко протекает весьма
быстро. В то же время энергия активации десорбции по меньшей мере
равна теплоте адсорбции Q, т. е. стадия 4 должна быть
активированным -и, весьма вероятно, замедленным процессом. Это приводит,
казалось бы, к парадоксальной ситуации. Например, при комнатной
температуре каталитический обмен между водородом и дейтерием на
поверхностях металлов протекает весьма быстро. И это в таких условиях,
когда скорость десорбции образующегося HD, по-видимому, мала.
Поэтому Ридил [65] считает, что в действительности обмен водорода и
дейтерия на поверхностях металлов идет по другому механизму.
Ранее Бонхоффер и Фаркаш [66] предположили, что водород и
дейтерий хемосорбируются на поверхности металлов в виде атомов,
которые затем рекомбинируют в десорбирующийся HD (рис. XV-13, а).
Однако, по мнению Ридила, в данном случае обмен осуществляется
путем взаимодействия хемосорбированных атомов со сталкивающимися
с ними или физически адсорбированными молекулами (рис. XV-13, б).
Аналогичный механизм имеет место и при конверсии орто- и параводо-
рода на поверхностях металлов. Еще одним примером реализации
этого механизма может служить синтез Фишера—Тропша
пСО + (2л + 1) Н> = иН20 + СлН2П+2, (XV-34)
в котором водород реагирует с хемоеорбированными СО, С, СНг и т. д.
(рис. XV-13,*).
Выбрать какой-либо один механизм довольно трудно (см. [67]).
Нередко на поверхности имеются центры адсорбции 'нескольких типов.
Приведенные в разд. XV-2 примеры свидетельствуют о том, что наряду
с несколькими формами прочно связанных и, возможно,
диссоциированных частиц на поверхности присутствуют физически
адсорбированные в молекулярном виде частицы. Более определенный ответ на
рассматриваемый вопрос могут дать проводящиеся в настоящее время
исследования каталитических реакций на вполне определенных
поверхностях монокристаллов. Как показывают исследования металлокластер-
ных катализаторов, правильнее всего представлять хемосорбционные
связи, какМ—Н, М = С, М=СО и т. д. [68].
Хемосорбция и катализ
53Г
Н2 НО 02 о - Р
ill \ '
HHDD Н D, _ Н D
ТтТПТЛ/ 777Г/~ Т/Гп/
а <5"
со н2 с он2
II
и
//// //7//
с н2 сн2
_м_м- ;^т-/м/ итЛ
///// /////
в
Рис. XV-13. Механизмы каталитического обмена водорода на дейтерий (а, б) и
механизм синтеза Фишера—Тропша, предложенный Ридилом (в).
Б. Каталитические реакции, скорость которых определяется
г скоростью реакции в адсорбированной пленке
Как «и реакции, протекающие в объемных фазах, реакции в
адсорбированных пленках являются либо одно-, либо бимолекулярными или
же представляют собой 'некоторую последовательность таких реакций.
Реакции, в которых участвуют три молекулы, во 'внимание можно не
принимать. Скорость поверхностной реакции обычно выражают с
помощью закона действия масс. Так, скорость бимолекулярной реакции
принимают .пропорциональной про-изведению двух .поверхностных
концентраций. Как показано ниже, зависимость кажущейся скорости
реакции от давления газовой фазы определяется видом -изотермы
адсорбции. Скорость поверхностных реакций можно «интерпретировать также
в рамках теории абсолютных скоростей [69].
Рассмотрим вкратце вопрос о том, почему гетерогенный катализ
протекает быстрее, чем гомогенный. Если реакция бимолекулярная,
одной из возможных причин эффективности гетерогенного катализа
может быть повышенная (по сравнению с концентрацией в газовой
фазе) концентрация реагирующих веществ в адсорбированной пленке.
Таким образом, совсем не обязательно, (чтобы реакция на поверхности
по характеру сколько-нибудь отличалась от гомогенной реакции.
Однако очень часто на катализаторах реакция протекает по иному
пути, чем гомогенная реакция, и лри этом важную роль может играть
природа поверхности катализатора. Особенно это ясно в'идно на
примере мсномолекулярных реакций, для которых поверхностная
концентрация особого значения не имеет.
Важным специфическим фактором, определяющим каталитическую
активность, является .межатомное расстояние на поверхности
катализатора. Этот вопрос уже затрагивался в гл. XIV, разд. XV-4A, пр-и
обсуждении влияния расстояния С—С в алмазе, графите и т. п. на
энергию активации адсорбции водорода. Бик и др. [70] показали, что
конденсированные на стеклянную пластинку 'никелевые .пленки, поверх-
34*
532
Глава XV
Характерный. I
I размер ступени
Рис. XV-14. Монокристалл платины, расщепленный так, чтобы грань (111)
образовывала короткие ступеньки [73].
ность которых образована в основном плоскостями (ПО), значительно
более активны, чем неориентированные .пленки. Точно так же скорость
каталитической реакции между водородом -и кислородом на
поверхности меди оказалась на плоскости (111) вдвое большей, чем на
плоскости (ПО). Роль геометрических факторов в катализе подробно
обсуждается в работе Гриффита [71].
Еще более важное значение имеет сформулированный Баландиным
[72] геометрический принцип структурного соответствия, согласно
которому структура поверхности катализатора должна определенным
образом соответствовать конфигурации и межатомным расстояниям
реагирующих молекул. Например, при гидрировании молекула (бензола
должна лежать на поверхности 'всей своей плоскостью. Это возможно
лишь при условии, что .поверхность катализатора имеет гексагональную
симметрию, т.е. если она образована плоскостями (111) гранецентри-
рованной кубической или плотноулакованной гексагональной решетки.
Имеется ряд примеров, показывающих, что металлы с объемноцентри-
рованной решеткой при гидрировании менее активны, чем металлы с
гранецентрированной решеткой, и что плоскости (111) отличаются
большей каталитической активностью, чем плоскости (ПО) или (100).
Эти данные согласуются с данными, полученными методом
авто-электронной и авто ионной микроскопии, ДМЭ и другими физическими
методами исследования. Более того, поверхность монокристалла платины,
образованная ступеньками плоскостей (111) (рис. XV-14), в реакции
дегидроциклизации я-гептана каталитически более активна, чем
гладкая поверхность (111) [73]. Таким образом, для каталитической
реакции важное значение имеет не только «первичная» структура
поверхности катализатора, т. е. тип симметрии и пространственное
расположение атомов поверхности, но и ее «вторичная» структура—ступеньки,
ребра и друпие микротопологические особенности.
В ряде случаев роль катализатора сводится просто к
концентрированию реагентов. Это относится, например, к каталитическому
дегидрированию этанола в этилен на окиси алюминия. Предполагается, что эта
реакция идет по кислотно-основному механизму
С2Н5ОН+Н+ (центр) ?=* С2Н6ОН2 (аде.)
||-Н20(адс.) (XV-35)
—Hf (центр) +
Н2С=СН2 ( " СН3СН2 (аде.)
т. е., по существу, так же, как гомогенная реакция в растворе.
Хемосорбция и катализ
533
Таким образом, геометрия поверхности катализатора, по-видимому,
влияет на энергию активации и теплоты адсорбции «и десорбции, что в
конечном итоге и определяет .концентрацию и подвижность
адсорбированных частиц ,на поверхности. Если эти частицы являются
радикалами и реакция протекает путем их рекомбинации, увеличение
поверхностной .концентрации реагирующих -веществ .приводит к ускорению
каталитической реакции. Кроме того, катализатор -может действовать как
кислота ('или основание), ускоряя реакцию образующимися ионами
карбония или оксония. Фактически это указывает на возможность
разработки катализаторов, действующих путем концентрирования и
ориентирования реагирующих веществ, адсорбированных .в полимолеку-
лярных слоях.
8. Влияние характера адсорбции на кинетику гетерогенного
катализа
Кинетику гетерогенного катализа изучать значительно труднее,
чем кинетику гомогенного катализа, поскольку концентрации
реагирующих веществ и продуктов реакции в газовой фазе экспериментально
определять проще, чем в поверхностной фазе, где непосредственно
.протекает гетерогенная реакция. По аналогии с гомогенными системами
истинная (Кинетика гетерогенной реакции определяется видом
зависимости скорости реакции от поверхностных концентраций. На .практике,
однако, наблюдается лишь .кажущаяся кинетика, выражаемая
зависимостью скорости реакции от давления различных газов. Соотношение
между истинной и кажущейся кинетикой определяется адсорбционным
равновесием, т. е. связью между концентрациями в поверхностной и
газовой фазах. В этом разделе рассматривается влияние
адсорбционного равновесия на кинетику гетерогенного катализа.
В настоящее время строгий учет неоднородности поверхности или
сложного латерального взаимодействия на поверхности невозможен.
Поэтому при разработке теории -приходится прибегать к значительным
упрощениям. В предельном варианте — модель Лэнгмюра — Хиншель-
вуда — предполагается, что молекулы в адсорбированном слое
довольно подвижны и, прежде чем десорбироваться, подвергаются
многочисленным столкновениям. При этих допущениях скорость реакции
определяется законом действия масс, а адсорбционное равновесие
описывается простым уравнением Лэнгмюра.
Напомним, что применительно к конкурентной адсорбции уравнение
Лэнгмюра, уравнение (XIV-10), записывается как
st=s [w(i+2*A)]f (xv-36)
где
b.=bojeQJ/RT. (XV-37)
Скорость бимолекулярной реакции веществ А и В предполагается
пропорциональной SA-SB. Теперь рассмотрим несколько конкретных
примеров применения модели Лэнгмюра — Хиншельвуда.
А. Мономолекулярные поверхностные реакции
Предположим, что на поверхности протекает реакция
А > C+D,
скорость которой описывается законом
dnA/dt = —kSA
или
dnA/dt=-kS [bAPA/(l +bAPA+bcPc+bDPD)l
(XV-38)
(XV-39)
35-1421
534
Глава XV
Если продукты реакции С и D адсорбируются слабо, уравнение
(XV-39) .приводится к ©иду
dnAldt=kS [bAPA/(l +bAPA)) =k'PA/(l+bAPA). (XV-40)
Таким образом, кажущаяся скорость мономолекулярной реакции
описывается уравнением, подобным уравнению Лэнгмюра: при низких Ра
скорость реакции пропорциональна Ра, а при высоких Ра она достигает
предельного значения, равного kS. Уравнение (XV-40) описывает, в
частности, разложение йодистого водорода на золоте и платине [76,
77] и закиси азота на полуторной окиси индия [78]. Если один
(например, С) или оба продукта реакции сильно адсорбируются,
уравнение (XV-39) принимает следующий вид (второй предельный вариант):
dnJdt = -hS [bAPA/(l+bcPc)\=-k'PA/(l +bcPc). (XV-41)
Если продукт С адсорбируется сильнее, чем А или D, правая часть
уравнения (XV-41) приблизительно равна —£'РА/ЬсРо Торможение
реакции образующимся продуктом реакции, в частности кислородом,
наблюдается, например, при разложении закиси азота на Pt при
600—1200 °С.
Так же как истинная и кажущаяся кинетика связаны между собой
через изотерму адсорбции, так и истинная и кажущаяся энергия
активации связаны друг с другом через теплоту адсорбции. В приведенных
выше уравнениях кажущаяся константа скорости kf «включает две
зависимые от температуры величины: истинную константу скорости k и
параметр feA.
Таким образом,
К =kbASA =kb0ASAeQ*/RT. (XV-42)
Далее, пренебрегая слабой температурной зависимостью SA и
Ьоа, получаем
d In kf/dT=EKajRT^(EllcT-QA)/RT' (XV-43)
или
^каж ==-^ист Уа*
Следовательно, кажущаяся энергия активации меньше истинной
энергии активации на теплоту адсорбции. При нахождении к? из
экспериментальных данных необходимо учитывать, что б большинстве
приведенных выражений температура влияет не только на -числитель k'PAy
но и на знаменатель. Однако при низких давлениях уравнение (XV-43)
можно непосредственно применять вместе с уравнением (XV-40). Если
адсорбция одного из продуктов реакции доминирует, уравнение
(XV-39) приводится к виду
dnA/dt=—k'PA/Pc. (XV-44)
и в результате
£каж = £ист-<ЭА + <2с (XV-45)
На первый взгляд может показаться, что роль поверхности в
каталитической реакции сводится просто к изменению энергии активации
реакции на величину теплоты адсорбции. Это, однако, не так.
Истинная энергия активации поверхностной реакции сама по себе может
совершенно отличаться от энергии активации гомогенной реакции.
Например, истинная энергия каталитического разложения аммиака на
вольфраме составляет всего 39 ккал/моль, тогда как энергия активации
реакции в газовой фазе равна 90 ккал/моль.
Хемосорбция и катализ
535
Б. Бимолекулярные поверхностные реакции
Теперь рассмотрим бимолекулярную поверхностную реакцию,
протекающую по уравнению
А + В > C+D.
В соответствии с законом действия масс скорость этой реакции равна
dnA/dt = —kSASB. (XV-46)
Подставляя в последнее уравнение вместо 5А и 5В соответствующие
выражения для -конкурентной адсорбции [уравнение (XV-36)],
получаем для кажущейся скорости бимолекулярной каталитической
реакции следующее общее выражение:
dnjdt = -kS [ WVV( 1 + bAPA + bBPB + 2 &c,dPc,d)2] m (XV-47)
Из многих возможных частных случаев остановимся лишь на двух.
Если и реактанты, и продукты реакции адсорбируются слабо,
уравнение (XV-47) принимает такой вид:
dnA/dt=-k,PAPE. (XV-48)
Примерами реакций такого типа могут служить окисление закиси азота
кислородом на стекле (при 85 К) [80] и гидрирование этилена на
активном угле (при низком давлении и —80 °С) [81]. Если А
адсорбируется слабо, а В, наоборот, сильно, получаем
dnA/dt=—k'PAlPB. (XV-49)
Таким образом, реакция может тормозиться одним из реагирующих
веществ.
На составных поверхностях, -состоящих из участков двух видов, на
одних из которых адсорбируется А, а на других — В, скорость реакции
также пропорциональна SA-5B. Более подробно модель Лэнгмюра!—
Хиншельвуда обсуждается в работах [69, 82] и '[83].
В. Кинетика каталитических реакций при сложных изотермах
адсорбции
Как показывают уравнения (XIV-16) и (XIV-19), см. гл. XIV, зависимость
энтропии или энергии адсорбции от степени заполнения 0 приводит к усложнению вида
изотерм адсорбции. Может показаться, что применение закона действия масс к этим
изотермам должно приводить к уравнениям, которые трудно использовать и еще
труднее проверить. Однако, как уже отмечалось в разд. XV-4B, гл. XIV, изменение Q при
изменении 6 нередко компенсируется изменением частотного предэкспоненциального
множителя в выражении для константы скорости каталитической реакции. Таким
образом, влияние неоднородности поверхности на характер зависимости k от 0 часто
не так уж существенно, как можно было бы ожидать.
Установить механизм каталитической реакции путем подбора выражений,
основанных на законе действия масс и описывающих экспериментально наблюдаемую
кинетику в широком интервале заполнений поверхности, чрезвычайно трудно. Это
ограничивает применимость уравнений типа уравнения Лэнгмюра—Хиншельвуда. На
практике лучше всего работать в таких условиях, в которых эти уравнения можно привести
к одной из предельных форм. При исследовании сложных каталитических систем
основные усилия должны быть направлены не на подбор теоретического выражения, до-
статочно точно описыв-ающего экспериментальные данные по скоростям реакции, а на
идентификацию промежуточных соединений с помощью изотопного обмена,
инфракрасной спектроскопии, данных по кислотности поверхности и т. д.
9. Механизмы некоторых каталитических реакций
В этом разделе мы рассмотрим вкратце .некоторые каталитические
реакции, а именно синтез аммиака, синтез Фишера—Тропша,
дегидрирование этилена и каталитический крекинг углеводородов. Хотя вы-
35*
536
Глава XV
браны эти реакции в общем-то произвольно-, все они практически
важны и, кроме того, неплохо изучены, что позволяет в полной мере
оценить /сложности, возникающие при исследовании различных
каталитических систем.
А. Синтез аммиака
Типы эффективных промышленных катализаторов синтеза аммиака
подробно обсуждаются Б рун а у эр ом и Эмметом [84] и Франкенбургом
[85]. Чаще всего используют железо-железоокисный катализатор, про-
мотированный добавками окисей алюминия и калия. Окись калия
действует только в присутствии окиси алюминия. Этот катализатор
отравляется двуокисью и окисью углерода (первая, вероятно, адсорбируется
на окиси калия, а вторая—-на активных ^центрах самого железа), а
также водородом и кислородом. В последние годы были проведены
обширные исследования синтеза и разложения аммиака на
поверхностях монокристаллов вольфрама с помощью таких современных
методов, как ДМЭ, определение работы выхода электронов,
флэш-десорбция и т. п. В результате получены ценные сведения как о механизме
адсорбции чистых N2, H2 и NH3, так и о самом процессе разложения
аммиака на поверхности вольфрама. Примером работы такого рода
может служить статья Мак-Алистера и Хансена [86].
Изучение механизма синтеза аммиака осложняется разнообразием
катализаторов этой реакции и огромным количеством имеющихся
данных. Кроме того, необходимо найти объяснение таким эффектам, как
промотирование. В общем случае реакция образования аммиака, по-
видимому, включает следующие стадии:
1. N2(r.) = N2(aAc.).
2. Ыа(адс.)=2Ы(адс),
3. Н2 (г.) = Н2 (аде.),
4. Н2(адс.)=2Н(адс),
5. N + Н = NH (образование имида).
6. NH +H = NH2 (образование амида),
7. Ш2+Н = Ш3(адс),
8. Ш3(адс.) = Ш3(г.).
По общему мнению, основное требование к катализатору синтеза
аммиака сводится к тому, чтобы его поверхность могла эффективно
активировать связь N—N, не удерживая, однако, азот излишне прочно (как,
например, при образовании нитрида), чтобы он мог реагировать в
дальнейшем. Активация водорода имеет лишь второстепенное значение,
и поэтому большинство катализаторов гидрирования обычно не
проявляют активности по отношению к синтезу аммиака. Реакция (2) может
быть довольно сложной. На это, в частности, указывает ускорение в
присутствии некоторого избытка водорода изотопного обмена 14N—15N,
который в условиях быстрого синтеза аммиака протекает медленно.
Реакции (3) и (4) также сильно упрощены. Кроме
низкотемпературной физической адсорбции, на однократно и двукратно промотирован-
ных катализаторах, по-видимому, возможны два типа хемосорбции
водорода, характеризующихся различной эффективностью дейтериево-
го обмена и конверсии водорода.
Кинетика синтеза и разложения аммиака зависит от типа
используемого катализатора. Если применяются промотированные железные
катализаторы, интерпретация экспериментальных данных затруднена
из-за сложной зависимости скорости каталитической реакции от
давления азота, водорода и аммиака. Один из наиболее удачных механиз-
Хемосорбция и катализ
537
мов синтеза аммиака был предложен Темкиным и Пыжевым [88] и
затем развит в работе Лава и Эммета [85, 89]. Согласно
основополагающему допущению, сделанному этими авторами, скорость реакции в
целом определяется скоростью адсорбции азота, и, таким образом,
скорость образования аммиака пропорциональна давлению азота и
доле поверхности, свободной от аммиака и водорода и находящейся в
свою очередь в равновесии с промежуточными продуктами реакции
М—Н, М—NH и М—NH2, где М — поверхность катализатора.
Исследуя кинетику разложения аммиака на монокристалле
вольфрама, Мак-Аллиетер и Хансен [86] получили следующую
зависимость:
—d (NHS)/dt =a + bP%h3, (XV-50)
где постоянные а и Ь зависят от типа грани— (111), (ЮО) или (ПО).
Авторы предложили механизм, согласно .которому большая часть
поверхности покрыта комплексами W—N, а 'член а в уравнении (XV-50)
определяется медленной реакцией
2 (W-H) > W2N + 4" N2
Второй член уравнения (XV-50) противоречит механизму Темкина —
Пыжева и, по существу, соответствует равновесию между
поверхностными соединениями W2N3H2 и WNH и газообразным аммиаком.
Б. Синтез Фишера — Тропша
Уже упоминавшийся при обсуждении механизма Ридила \[уравнение
(XV-34)] синтез Фишера — Тропша заключается в получении
углеводородов (и воды) из окиси углерода и водорода главным образом на
кобальтовом -катализаторе. Этот синтез является одним из основных
методов производства бензина, дизельного топлива и вообще
углеводородов. Каталитическая реакция между окисью углерода и .водорода
была открыта (вернее, открыта заново) в 1913 г., а детально изучена
Фишером и Тропшем примерно в 1925 г. [90]. Особенно важное
значение эта реакция имела для экономики Германии, не имеющей
собственной нефти, но располагающей значительными запасами бурого
угля. Газификация угля дает именно такую смесь водорода и окиси
углерода (2 : 1), какая необходима для синтеза Фишера — Тропша.
В качестве катализаторов обычно применяют смешанный
катализатор Со—Th02—'MgO, нанесенный на кизельгур. Нередко торий заменяют
на марганец или другие металлы, а кобальт — на никель, медь или
цинк. Таким образом, получается довольно большое число
разнообразных катализаторов. Обычно кобальтовые катализаторы работают при
давлении 1 —10 атм и температуре около 200 °С. Получаемый в этих
условиях жидкий продукт примерно на 50% состоит из углеводород о-в
от С4 до Сю.
Сами Фишер и Тропш предложили механизм, подобный
показанному на рис. XV-13, в, но они считали все промежуточные соединения хе-
мосорбированными. Существенной особенностью механизма,
предложенного Фишером и Тропшем, является образование промежуточных
продуктов — карбидов металлов. Хотя в патенте упор делается именно
на карбиды, сомнения в реальности образования карбидов
высказывались неоднократно. Так, Уэллер и др. [91] показали, что
предварительная карбидизация кобальтового катализатора ингибирует синтез.
Анализ рентгеновских спектров, используемых в синтезе катализаторов,
подвергнутых предварительно такой обработке, не подтвердил
предположения об образовании карбида. Круммер и др. [92] нашли, что
538
Глава XV
О Н О-Н
с+н2—>• с
II II
м м
н о-н н о-н н о-н
V + V -~W
н II II II
м м мм
н о-н сн3 о-н
\ / \/
С—С +Н2 >- С
II II II
мм м
->■ R—СН2—CHO >■ Кислоты, эфиры, спирты
СН2 О-Н
\ /
С +Н2 > R—СН2—СН2—ОН >■ Углеводороды
II
М
Рис. XV-15 Механизм синтеза Фишера—Тропша.
меченный 14С углерод, предварительно осажденный на катализатор из
окиси углерода, в синтезируемых углеводородах не появляется.
В настоящее <время более широкое признание получил -механизм,
предложенный Элвинсом и Нэшем [93] и уточненный Сторчем и др.
[94]. Этот механизм исключает стадию образования карбида, но
предполагает образование промежуточных кислородсодержащих или епир-
топодобных соединений (рис. XV-15). Круммер и др. [95] получили
данные, непосредственно подтверждающие правильность этого
механизма. Они, в частности, показали, что введение в реакцию Фишера —
Тропша меченных 14С спиртов приводит к появлению .меченных им же
углеводородов.
Приведенная на рис. XV-15 схема, по-видимому, имеет общее
значение и при каталитическом получении спиртов [96], особенно
метанола. В этом случае в качестве эффективного катализатора
используется окись цинка, промотированная добавками других окислов, более
тугоплавких и трудновосстанавливаемых, например окислов хрома,
железа и магния. Кинетика каталитического образования спиртов,
исследованная Наттом и др. [96], имеет столь же сложный характер, как
и рассмотренная выше кинетика синтеза аммиака.
К синтезу Фишера — Тропша примыкает реакция оксосинтеза, или
реакция гидроформилирования двойных связей:
R—СН==СН2+СО+Н2 >- R—СН2-СН2—СНО или R—СН(СНО)—СН3
Для этих реакций используются катализаторы, подобные
катализаторам синтеза Фишера — Тропша.
В. Гидрирование этилена
Каталитическое гидрирование этилена протекает на различных
металлах, например никеле (включая активный или скелетный никель,
полученный выщелачиванием кремния или алюминия из NiSi2, NiAl,
NiAl2), восстановленной меди, платине, родии, железе и хроме. Опуб-
Хемосорбция и катализ
539
ликова-н обзор литературных данных по гидрированию этилена [97]
(см. также [83]). Здесь же этот процесс рассматривается лишь в
общих чертах.
На некоторых катализаторах в определенной области относительных
давлений водорода «и этилена кинетика гидрирования соответствует
уравнению (XV-49), где в качестве сильно адсорбирующего вещества
В выступает этилен, т. с.
dPHJdt=-kPH2. (XV-51)
До 1955 г. большинство работ по хемосорбции и гидрированию
этилена проводилось адсорбционными и газоаналитическими методами, в
настоящее же время шире используются разнообразные физические
методы, включая измерения магнитной восприимчивости, ИК-спектроско-
пию и др.
Уже первые исследования, например работа Дженкинса и Ридила
[98], показали, что при хемосорбции этилена на никеле разрываются
связи углерод — водород. Кроме того, авторы ряда работ, например
[99], установили, что связь углерод — углерод также может
разрываться. Это приводит, в частности, к образованию метана при десорбции
этилена, хемосорбированного на никеле. По данным
ПК-спектроскопии, этилен хемосорбируется на поверхности никеля с образованием
соединения
Н Н
\ /
с=с
I I
м м
а при напуске водорода образуются хемосорбированные радикалы
типа СН3СН2.[100].
При определенных условиях на никеле и других катализаторах
возможен гидро'генолиз этана, т.е. превращение последнего в метан [101].
Скорость этого процесса описывается выражением
Скорость =£PS2h6Ph, (XV-52)
где ^с2н6 и Рн — парциальные давления этана «и водорода [101], а
показатели степени пят соответственно равны 1 и —1,3. Интересно,
что сплавление никеля с медью (см. разд. XV-3 и [22]) приводит крез-
кому уменьшению скорости гидрогенолиза, хотя на скорости реакции
дегидрирования, например превращений 'циклогексана в бензол, это
почти не сказывается. Вообще поверхностные процессы, протекающие
при каталитическом гидрировании — дегидрировании, отличаются
чрезвычайной сложностью.
Г. Каталитический крекинг углеводородов
Кислые окисные поверхности катализируют ряд реакций
углеводородов, в том числе крекинг — расщепление высокомолекулярных
углеводородов на низкомолекулярные (например, производство бензина из
нефти), риформинг — изомеризация и перераспределение
молекулярного веса углеводородов путем гидрирования-дегидрирования и алки-
лирование — процесс, обратный крекингу. В одном из первых крекинг-
процессов, запатентованном Гудри [102] в ЮЗЗ г., в качестве
катализатора использовалась активированная бентонитовая глина. В
настоящее время для этой цели применяют синтетические алюмосиликаты,
полученные осаждением окиси алюминия в присутствии силикагеля с
последующей фильтрацией, промывкой, сушкой и прокаливанием.
Активность этих катализаторов явно связана с наличием на их поверхно-
540
Глава XV
ста кислотных центров [103], хотя, как уже отмечалось (см.
рис. XV-12), не совсем ясно, являются ли эти центры кислотами Брэн-
стеда 'или Льюиса.
Общая особенность крекинговых процессов — образование на
промежуточной стадии .реакции ионов ка!рбония по реакции
RH + Н+ (кислотный центр) >- R+ (аде.) + Н2 (XV-53)
где кислотный центр может быть, -например, кислотой Брэнстеда
(рис. XV-12). Образующийся ион карбония далее подвергается
различным реакциям, «например перегруппировке >или расщеплению
СН3—СН2—СН2 > СН2—СН=СН2 ^ СН3—СН—СН3
н+
RCH—СН2—СН3 > R—СН=СН2 + СН3 (XV-54)
+ +
R-CH=CH2+CH3 > R—СН(СНд)—СН2
а завершает образование цепи реакция, обратная реакции (XV-53).
Вследствие практической важности крекинг и связанные с ним
процессы интенсивно исследуются. В каталитическом крекинге возможен
довольно точный контроль образующихся продуктов по степени
'ненасыщенности, изО'меризации и содержанию ароматических соединений,
что в более раннем некаталитическом термическом крекинге было
недостижимо. Однако до сих пор в механизмах каталитических
крекинговых процессов остается много неясного, и в этой области
необходимы фундаментальные (исследования.
10. Упражнения
1. Предложите не менее четырех экспериментальных способов определения или
критериев, позволяющих надежно установить, относится ли адсорбция в данной
системе к физической адсорбции или хемосорбции.
2. Известно, что ускорение бимолекулярных реакций катализатором может быть
обусловлено концентрированием реагирующих веществ на поверхности катализатора.
Предположим, что вещества А и В реагируют в газовой фазе в стехиометрическом
отношении 1 : 1 и скорость этой реакции описывается соответствующим кинетическим
уравнением для бимолекулярной реакции с константой скорости k, равной Ю-5 л»
•моль/с (при 0°С). Предположим теперь, что эквимолярная смесь газов конденсируется
на поверхности катализатора, образуя жидкую пленку, и далее реагирует с той же
константой скорости, что и в газовой фазе. Рассчитайте соотношение времен
полуреакций в газовой фазе и на поверхности катализатора при 0°С. Плотность жидкой
пленки в 1000 раз больше плотности газовой фазы.
3. Дополните табл. XV-1 расчетными значениями теплот адсорбции лития и
рубидия на вольфраме
4. При проведении флэш-десорбции измеряется скорость изменения давления газа.
С этой целью система нагревается со скоростью dT!dl = b, одновременно ведется
откачка объема системы с постоянной скоростью и в момент времени t измеряется
давление. В результате измеряемое давление в любой момент времени пропорционально
—dn/dt, где п—число молей адсорбированного газа. Проинтегрируйте уравнение (XV-1),
представив, что десорбция является реакцией второго порядка, и найдите
максимальное значение d(dn/dt)/dT. Полученный результат используйте для оценки величин £^
соответствующих пикам рь р2 и 03 на рис. XV-3, считая, что Л =0,01 см2/молекула• с,
Ь=2 К/с и п при температуре максимальной скорости десорбции равно 1014
молекул/см2.
5. Примите условия упражнения 4, но рассматривайте десорбцию как реакцию
первого порядка. Оцените частотный множитель Л, исходя из трактовки уравнения Лэнг-
мюра, данной в гл. XIV, и предполагая, что bun имеют такие же значения, что и
в упражнении 4. Найдите также E*d для а-состояния на рис. XV-3.
6. Рассчитайте коэффициент самодиффузии атомов никеля на поверхности никеля
(111) при 6000 К. На какое расстояние в среднем перемещается атом при этой
температуре за 1 час?
Хемосорбция и катализ
541
7. Основываясь на данных Франкенбурга [25], рассчитайте изостерическую
теплоту адсорбции водорода на вольфрамовом порошке при нескольких 0 (выбор значений
vm обоснуйте) и постройте зависимость q8t от 0.
8. Рассчитайте энтропию адсорбции азота на железном катализаторе AS2 для
нескольких значений 0, используя приведенные в разд. XV-4B данные Шолтена и
сотрудников.
9. Величина Gq в уравнении (XV-6) фактически соответствует F(Q) в уравнении
(XIV-145). С помощью этих соотношений выведите функцию В(Р, Т) и приведите ее
к виду уравнения (XV-7). Полученный результат сравните с уравнением (XIV-146)
и объясните выявленные расхождения.
10. Двумя независимыми способами оцените теплоту диссоциативной хемосорб-
ции 12 на меди.
11. Скорость хемосорбции описывается законом
dB/dt = Ае~ш.
Является ли зависимость 0 от lg/ линейной (т. е. соответствует ли она уравнению
Еловича)?
12. Рассчитайте глубину граничного слоя для адсорбции на полупроводнике при
п0=1018 дефектов/см3, D=10, Ve=\ В, а°=10-15 см2.
13. Ограничивается ли ионная хемосорбция водорода на a) ZnO и б) NiO лишь
очень малыми значениями 0? Дайте подробное объяснение.
14. При исследовании каталитического разложения N0 на N2 и 02 на Pt
получена следующая экспериментальная зависимость:
dPNO/dt = -kPNO/Po2.
Выведите подобную зависимость, исходя из разумных допущений о механизме этой
реакции и считая, что адсорбция газов протекает в соответствии с уравнением Лэнг-
мюра. Кажущаяся энергия активации, найденная по температурной зависимости k,
составляет 15 ккал/моль. Теплоты адсорбции N0 и 02 соответственно равны 20 и
25 ккал/моль. Найдите истинную энергию активации рассматриваемой реакции.
15. В одной из ранних работ по каталитическому окислению S02 в БОз на
платинированном асбестовом катализаторе получены следующие результаты: 1) скорость
окисления SO2 пропорциональна давлению S02 и обратно пропорциональна давлению
S03; 2) кажущаяся энергия активации составляет 30 ккал/моль; теплоты адсорбции
S02, S03 и 02 равны 20, 25 и 30 ккал/моль соответственно.
С помощью модели Лэнгмюра — Хиншельвуда покажите, что экспериментальные
данные можно объяснить, предполагая, что поверхность состоит из поверхностей
двух типов, Si и S2, и что скорость процесса определяется реакцией
S02 (аде. на S2) + 02 (аде. на 52) > Промежуточное соединение
Какой вид в рамках данной модели должна иметь зависимость скорости от давления
а) при низком давлении кислорода и б) в начале реакции, когда количество БОз
пренебрежимо мало? Рассчитайте для данной модели истинную энергию активации.
16. Согласно Швабу, кинетика разложения аммиака на платине описывается
уравнениями
а) при низком давлении N2: dP^u3/dt = —^Nh3/^n2»
б) при низком давлении Н2: dP^wJdt =—к'Рыня/Рн2,
где Р — соответствующее парциальное давление. Выведите эти уравнения, исходя из
модели Лэнгмюра—Хиншельвуда.
СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ
Лшмор П., Катализ и ингибирование химических реакций, М, «Мир», 1966.
Catalysis, Emmett P. H., ed., Reinhold, New York, 1956
Fundamentals of Gas-Surface Interactions, Saltzburg H., Smith J. N., Jr., Rogers M., eds.,
Academic Press, New York, 1967.
Hayward D. 0., Trapnell B. M. W., Chemisorption, Butterworths, London, 1964.
Molecular Processes on Solid Surfaces, Draublis E., Gretz R. D., Jaffee R. I., eds., McGraw-
Hill, New York, ,1968.
Solid State Surface Science, Green M, ed., Marcel Dekker, New York, 1969.
Somorjai G. A,, Principles of Surface Chemistry, Prentice-Hall, Englewood Cliffs, New
Jersey, 1972.
Storch H. H., Golumbic N., Anderson R. В., The Fischer-Tropsch and Related Systems,
Wiley, New York, 1951.
The Structure and Chemistry of Solid Surfaces, Somorjai G. A., ed., Wiley, New York,
1969.
542
Глава XV
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Yates J. Т., Jr., Chem. Eng. News, p. 19 (August 26, 1974).
2a. Gomer R., Accts. Chem. Res., 8, 420 (1975).
2. (a) Somorjai G. A., Principles of Surface Chemistry, Prentice-Hall, Englewood
Cliffs, New Jersey, 1972. (6) Somorjai G. A., Kesmodel L. L., MTP International
Review of Science, Butterworths, London, il975.
3. Tracy J. C, Patmberg P. W.t J. Chem. Phys ,51, 4852 (1969).
4. Eischens R. P., Jacknow J., Proc. 3rd Int. Congr. Catalysis, Amsterdam 1964,
North-Holland Publishing Co., Amsterdam, 1965.
5. Unland M. L., Science, 179, 567 (1973).
6. (a) Chesters M. A., Pritchard J., Sims M. L., Chem. Commun., 1454 (1970).
(6) Pritchard J., Sims M. L., Trans. Faraday Soc, 66, 427 (1970).
7. Miller D. J., Haneman D., Surface Sci, 19, 45 (1970).
8. Yates J. Т., Jr., Madey T. E., Erickson N. E., Surface Sci, 43, 257 (1974).
9. Wells R. L., Fort Т., Jr., Surface Sci., 33, 172 (1972).
10. Mill M. P., Pethica B. A., Trans. Faraday Soc, 65, 876 (1969).
11. Hayward D. O., Trapnell B. M. W., Chemisorption, Butterworths, London, 1964.
12. Eirich G., J. Phys. Chem, 60, 1388 (1956); J. Appl. Phys., 32, 4 (1961).
13. Vismanath Y., Schmidt L. D., J. Chem. Phys., 59, 4184 (1973).
14. Eirich G.} Proc. 3rd Int. Congr. Catalysis, North-Holland, Amsterdam, 1965,
p. 113.
15. Madey Т. Е., Surface Sci., 29, 571 (1972).
16. Tamm P. W., Schmidt L. D., J. Chem. Phys., 54, 4775 (1971).
17. Ward A. F. H., Proc. Roy. Soc. (London), A133, 506 (1931).
18. Beeck O., Discuss. Faraday Soc, 8, 118 (1950).
19. Frankenburg W. G., J. Amer. Chem. Soc, 66, 1827 (1944).
20. Трепнел В., Хемосорбция, М., ИЛ, 1958.
21. Hickmott Т. W., J. Chem. Phys., 32, 810 (1960).
22. Cadenhead D. A., Wagner N. J., J. Catalysis, 27, 475 (1972).
23. Fowler R., Guggenheim E. A., Statistical Thermodynamics, Cambridge University
Press, Cambridge, England, 1952, p. 437.
24. Bosworth R. C. L., Proc Roy. Soc, A162, 32 (1937).
25. Frankenburg W. G., J. Amer. Chem. Soc, 66, 1827 (1944).
26. Lennard-Jones /. E., Trans. Faraday Soc, 28, 333 (1932).
27. Sherman A., Eyring H., J. Amer. Chem. Soc, 54, 2661 (1932).
28 Barrer R. M., J. Chem. Soc, 1936, 1256, and succeeding papers.
29 Weinberg W. H., Merrill R. P., Surface Sci, 33, 493 (1972).
30 Einstein T. L, Schrieffer J. R., Phys. Rev, B, 7, 3629 (1973); J. Vac. Sci. Technol,
9, 956 (1972).
31 Глесстон С., Лейдлер К, Эйринг Г., Теория абсолютных скоростей реакций, М,
ИЛ, 1948. л ^
32 Scholten J. J. F., Zwietering P., Konvalinka J. A., de Boer J. tf. Trans. Faraday Soc,
55, 2166 (1959).
33. Елович С. Ю., Жаброва Г. М., ЖФХ, 13, 1761 (1939).
34 Eisinger /., Law J. Т., J. Chem. Phys, 30, 410 (1959).
35 Schwab G., Schwab-Agallidis E., J. Amer. Chem. Soc, 71, 1806 (1949).
36 Schwab G.t Taylor H. S., Spence R., Catalysis, Van Nostrand, New York, 1937,
pp. 197, 183.
37 Constable F. H., Proc Roy. Soc (London), A108, 355 (1925).
38. Garner W. E., J. Chem. Soc, 1947, 1239.
39 Bosworth R. С L., Proc Roy. Soc (London), A154, 112 (1936).
40. Wolfe J. R.f Weart H. W., The Structure and Chemistry of Solid Surfaces,
Somorjai G. A, ed, Wiley, New York, 1969.
41 Beeck O., Advan. Catalysis, 2, 151 (1950).
42 Grimley Т. В., Walker S. M., Surface Sci, 14, 395 (1969).
43 Day M. C, Jr., Selbin J., Theoretical Inorganic Chemistry, Reinhold, New York,
1962, p. 112.
44 Mulliken R. S., J. Chem. Phys, 2, 782 (1934); 3, 573 (1935).
45 Eley D. D., Discuss. Faraday Soc, 8, 34 (1950).
46 Culver R. V., Tompkins F. C, Advan. Catalysis, 11, 67 (1959).
47 Higuchi I., Ree Г, Eyring #, J. Amer. Chem. Soc, 79, 1330 (1957).
48. Трепнел В., Хемосорбция, М, ИЛ, 1958.
49 Pauling L., The Nature of the Chemical Bond, Cornell University Press, Ithaca,
1960. (См. перевод первого издания: Паулинг Л., Природа химической связи,
Госхимиздат, 1947.) ,<л-лч
50 Hickmont W. A., Ehrlich G., J. Phys. Chem. Solids, 5, 47 (1958).
51' Dietz R. E., Selwood P. W., J. Chem. Phys, 35, 270 (1961).
52 Selwood P. W., J. Amer. Chem. Soc, 78, 3893 (1956).
53 Коттон Ф, Уилкинсон Дж., Современная неорганическая химия, М, Мир, 1УЬУ.
54 Дунинг У., в кн. «Межфазовая граница газ —твердое тело», под ред. Э. Фла-
да М, Мир, 1970.
X ему сорбция и катализ
543
55. Stone F. S.t Anales Rea' Soc. Espan. Fis. Quim., 61B, 109 (1965).
56. Blyholder G., J. Phys. Chem., 79, 756 (1975).
57. Grimley Т. В., J. Aim-. Chem. Soc, 90, 3016 (1968).
58. Garner W. E., Stone F. S., Tiley P. F.t Proc. Roy. Soc. (London), A211, 472
(1Уо^).
59. Stone F. S., Advan. Catalysis, 13, 1 (1962).
60. The Electrochemistry of Semiconductors, Holmes P. J., ed., Academic Press, New
York, 1962.
60a. Schwab G.t J. Colloid Interface Sci., 34, 237 (1970).
61. Benson S. W., Seehof J. M., J. Amer. Chem. Soc, 73, 5053 (1951).
62. Takeshita Т., Ohnishi R., Matsui Т., Tanabe K., J. Phys. Chem., 69, 4077 (1965).
63. Baslla M. R„ Kantner T. R.t Rhee К. H.} J. Phys. Chem., 68, 3197 (1964).
64. Weisz P. В., Prater C. D., Advan. Catalysis, 6, 143 (1943).
65. Rideal E. K., Proc. Cambridge Phil. Soc, 35, 130 (1938).
66. Bonhoeffer K. F., Farkas A., Z. Phys. Chem., В12, 231 (1931).
67. Eley D. D., Norton P. R., Discuss. Faraday Soc, No. 41, 135 (1966).
68. (a) Smith G. C., Chojnacki T. P., Dasgupta S. R., Iwatate K., Waiters K. L., Inorg.
Chem., 14, 1419 (.1973); (6) Robinson A. L.t Science, 185, 772 (1974).
69. Emmett P. H., Catalysis, Reinhold, New York, 1954.
70 Beeck O., Wheeler A., Smith A. E., Phys. Rev., 55, 601 (1939)
7: Griffith R. H., Advan. Catalysis, 1, 91 (1948).
72 BalandinA. A., Z. Phys. Chem., B3, 167 (1929).
73 Somorjai G. A., Catal. Rev., 7, 87 (1972).
74. Whitmore F. C., J. Amer. Chem Soc, 54, 3274 (1932).
75. Pines H., Manassen /., Advan. Catalysis, 16, 49 (1966).
76. Hinshelwood С. N.t Prichard C. R., J. Chem Soc, 1925, 1552.
77 Hinshelwood C. N., Burk R. E.f J. Chem. Soc, 1925, 2896.
78. Schwab G„ Staeger R., von Baumback И H., Z. Phys. Chem., B21, 65 (1933).
79. Hinshelwood C. N., Prichard C. R., J. Chem. Soc, 1925, 327.
80. Temkin AT, Pyshev V., Acta Physicochem. (USSR), 2, 473 (1935).
81 Schuster C, Z. Phys. Chem , В14, 249 (1931).
82. Schwab G.t Taylor tf. S., Spence R.f Catalysis, Van Nostrand, New York, 1937.
83. Ашмор П., Катализ и ингибирование химических реакций, М., «Мир», 1966.
84. Emmett P. H., J. Chem. Educ, 7, 2571 (1930); Brunauer S.t Emmett P. H.t J. Amer.
Chem. Soc, 62, 1732 (1940).
85. Frankenburg W. G.f Catalysis, Vol. Ill, Emmett P. H., ed., Reinhold, New York,
1955, p. 171.
86. McAllister J., Hansen R S., J. Chem. Phys., 59, 414 (1973).
87. J oris G. G., Taylor H. S.t J. Chem. Phys., 7, 893 (1939).
88 Temkin M., Pyzhev V., Acta Physicochim. (USSR), 12, 327 (1940).
89. Love K. S., Emmett P. H.t J Amer. Chem. Soc , 63, 3297 (194,1).
90. Anderson R. В., Catalysis, Vol. IV, Reinhold, New York, 1956, pp 1, 29; Storch H. H.,
Advan. Catalysis, 1, 115 (1948).
91. Welter S., Hofer L. J. E., Anderson R. В., J. Amer. Chem Soc, 70, 799 (1948).
92 Kummer J. Т., DeWitt T. W., Emmett P. H., J. Amer. Chem. Soc, 70, 3632
(1948).
93 Elvins О. С, Nash A. W, Nature, 118, 154 (1926).
94 Storch H. H., Golumbic N.t Anderson R. В, The Fischer-Tropsch and Related
Synthesis, John Wiley, New York, 1951. Anderson R. В., Catalysis, Vol. IV,
Emmett P. H, ed., Reinhold Publishing, New York, 1956.
95 Kummer J. Т., Podgurski H. H., Spencer W В., Emmett P. H., J. Amer. Chem. Soc,
73, 564 (1951).
96 Natta G.t Catalysis, Vol. Ill, Emmett P. H., ed., Reinhold, New York, 1955.
97. Eley D. D., Catalysis, Vol. Ill, Emmett P. H., ed , Reinhold, New York, 1955,
p. 49.
98. Jenkins G. L, Rideal E. K., J. Chem. Soc, 1955, 2490.
99. McKee D. W.t J. Amer. Chem. Soc, 84, 1109 (1962).
100. Eischens R. P., Pliskin W. A., Advan. Catalysis, 10, 2 (1958).
101. Sinfelt J. H., Carter J. I., Yates D. J. C., J. Catalysis, 24, 283 (1972).
102. Shankland R. V., Advan. Catalysis, 6, 271 01954).
103. Roland L. В., Tamele M. W„ Wilson J. N., Catalysis, Vol. VII, Emmett P. H., ed.,
Reinhold, New York, 1960, p. 1.
СПИСОК ДОПОЛНИТЕЛЬНОЙ ЛИТЕРАТУРЫ
К главе I
Кутейц Н. Т., Шиц Л. А., Нейман Б. А., Горюнов Ю. В. Прибор для измерения
поверхностного натяжения жидкостей методом наибольшего давления в газовом
пузырьке. — Коллоидн. журн., 1976, т. 38, с. 362.
Шиц Л А. Прибор для определения поверхностного натяжения жидкостей методом
счета капель. —ЖФХ, 1965, т. 39, с. 1792.
544
Глава XV
Пригородов В. Н. Прибор для определения поверхностного натяжения микроколичеств
жидкости. — Коллоидн. журн., 1971, т. 33, с. 168.
К главе II
Русанов А. И. Фазовые равновесия и поверхностные явления. — Л.: Химия, 1967.
Пригожий И., Дефей Р. Химическая термодинамика. Пер. с англ. — Новосибирск,
1966.
Гиббс Д. В. Термодинамические работы. — М.-Л.: Гостехиздат, 1950.
Фрумкин А. Н. Тонкие слои на поверхности воды. — Усп. физ. наук, 1924, т. 4,
с. 172.
К главе III
Мономолекулярные слои. Сб. статей. — М.: ИЛ, 1956.
Сривастава В. К. Лэнгмюровские молекулярные пленки и их применение. — В кн.:
Физика тонких пленок. — М., 1977, т. 7, с. 340.
Измайлова В. Н., Ребиндер П. А. Структурообразование в белковых системах. — М.:
Наука, 1976.
Трапезников А. А. Поверхностная вязкость и методы ее измерения. — В кн.:
Совещание по вязкости жидкостей и коллоидных растворов. — М.: Изд. АН СССР, 1941,
т. I, с. 67.
Трапезников А. А. Температурн-ая зависимость поверхностной вязкости монослоев
высших спиртов. В кн.: Совещание по вязкости жидкостей и коллоидных
растворов.—М.: Изд. АН СССР, 1944, т. II, с. 54.
Трапезников А. А. Реология и структурообразование в трехмерных и двумерных
системах. — ЖФХ, 1970, т. 44, с. 916.
Трапезников А. А. Монослои нерастворимых веществ и адсорбция. В кн.: Расширенные
тезисы докладов на 2-й Всесоюзной конференции по теоретическим вопросам
адсорбции.—М.: Наука, 1969, с. 28.
Воинов О. В., Трапезников А. А. К теории дискового вискозиметра при малых
значениях поверхностной вязкости. — Коллоидн. журн., 1974, т. 36, с. 757.
К главе IV
Дамаскин Б. Б., Петрий О. А. Введение в электрохимическую кинетику. — М.: Высшая
школа, 1975.
Дамаскин Б. Б., Петрий О. А., Батраков В. В. Адсорбция органических соединений на
электродах. — М.: Наука, 1968.
Современные аспекты электрохимии. Пер. с англ./Под ред. Дж. Бокриса, Б. Ко-
нуэя. —М.: Мир, 1967.
Дерягин Б. В. Теория взаимодействия чястиц в присутствии двойных электрических
слоев и агрегативной устойчивости лиофобных коллоидов и дисперсных систем. —
Изв. АН СССР, сер. хим., 1937, № 5, с. 1153; Acta Physicochim (USSR), 1939,
v. 10, p. 333.
Дерягин Б. В. Об отталкивательных силах между заряженными коллоидными
частицами и теории медленной коагуляции и устойчивости лиофобных золей. —
Коллоидн. журн., 1940, т. 6, с. 291; Trans. Faraday Soc, 1940, v. 36, p. 203, 730.
Дерягин Б. В., Ландау Л. Д. Теория устойчивости сильно заряженных лиофобных
золей и слипания сильно заряженных частиц в растворах электролитов. — Журн.
экспер. и теорет. физики, 1945, т. 15, с. 633; Acta Physicochim (USSR), 1941, v. 14,
p. 633.
Дерягин Б. В. Применение уравнения Гиббса — Дюгема к выводу электростатической
слагающей расклинивающего давления. — Коллоидн. журн., 1977, т. 39, с. 1139.
Духин С. С. Электропроводность и электрокинетические свойства дисперсных систем
Киев: Наукова думка, 1975.
Духин С. С, Дерягин Б. В. Электрофорез. М.: Наука, 1976.
Dukhin S. S., Derjaguin В. V. Electrokinetic Phenomena «Surface and Colloid Science»,
Ed. E. Matijevic, № 7, N. Y., 1974.
Дерягин Б. В. Теория гетерокоагуляции, взаимодействия и слипания разнородных
частиц в растворах электролитов. — Коллоидн. журн., 1954, т. 16, с. 425; Discuss.
Faraday Soc, 1954, № 18, 85.
Дерягин Б. В. Применение силовых полей к выводу некоторых термодинамических
соотношений, в частности обобщенного уравнения сорбции и нового
электрокапиллярного уравнения. — Коллоидн. журн., 1935, т. I, с. 217; Acta Physicochim
(USSR), 1935, v. 2, p. 377.
Электроповерхностные явления в дисперсных системах. Под ред.: О. Н. Григорова,
Д. А. Фридрихсберга. — М.: Наука, 1972.
К главе V
Поверхностные свойства твердых тел. Пер. с англ./Под ред. М. Грина. — М.: Мир,
1972.
Новое в исследовании поверхности твердого тела. Пер. с англ. — М.: Мир, 1977.
Хемосорбция и катализ
545
Волькенштейн Ф. Ф. Физико-химия поверхности полупроводников, М.: Наука, 1973.
Ребиндер П. А., Щукин Е. Д. Поверхностные явления в твердых телах в процессах
их деформации и разрушения. — Усп. физ. наук, 1972, т. 108, с. 3.
Гегузин Я. Е. Физика спекания. — М.: Наука, 1967.
К главе VI
Исследования в области поверхностных сил.: Под ред. Б. В. Дерягина. — М.: Изд. АН
СССР, 1961, 1964, 1967.
Поверхностные силы в тонких пленках.: Под ред. Б. В. Дерягина. — М.: Наука, 1972,
1974.
Дерягин Б. В. К вопросу об определении понятия и величины расклинивающего
давления и его роли в статике и кинетике тонких слоев жидкостей. — Коллоидн. журн.,
1955, т. 17, с. 207.
Дерягин Б. В., Чураев Н. В. К вопросу об определении понятия расклинивающего
давления и его роли в равновесии и течении тонких пленок. — Коллоидн. журн., 1976,
т. 38, с. 433.
Derjaguin В. V. Untersuchungen des Spaltdrukes dunner Filme, deren Entwicklung, Er-
gebnisse und zu losende aktuelle Probleme. — Colloid and Polymer Sci., 1975,
p. 253, 492.
Дерягин Б. В., Зорин 3. М. Исследования поверхностной конденсации и адсорбции
паров вблизи насыщения оптическим микрополяризационным методом I и П. — ЖФХ,
1955, т. 29, с. 1010, 1755.
Зорин 3. М., Соболев В .Д, Чураев Н. В. Измерение капиллярного давления и
вязкости жидкостей в кварцевых микрокапиллярах. — ДАН СССР, 1970, т. 193, с. 630.
Дерягин Б. В., Карасев В. В. Изучение граничной вязкости органических жидкостей
методом сдувания —Коллоидн. жури., 1953, т. 15, с. 365.
Дерягин Б. В., Карасев В. В. Измерения граничной вязкости по кинетике утоньшения
смачивающих пленок жидкостей в процессе сдувания. — ЖФХ, 1959, т. 33, с. 100.
Дерягин Б. В., Абрикосова И. И. О законе межмолекулярного взаимодействия на
больших расстояниях. — ДАН СССР, 1953, т. 92, с. 759.
Дерягин Б. В., Абрикосова И. И. Прямые измерения молекулярного притяжения
твердых дел I и П.—Журн. экспер. и теорет. физики, 1966, т. 30, с. 933; 1956, т. 31,
с. 3.
Дерягин Б. В., Абрикосова И. И., Лифшиц Е. М. Молекулярное притяжение
конденсированных тел. — Усп. физ. наук, 1958, т. 64, с. 493.
Derjaguin В. V. Investigations of the forces of interaction of surfaces in different media
and their application to the problem of colloid stability. — Discass Faraday Soc, 1954,
№ 18, p. 181, 198, 211, 215.
Sheludko A. Thin Liquid Films. —Adv. Coll. Interf. Sci., 1967, v. 1, p. 301.
Ершова Г. Ф., Зорин 3. М., Чураев Н. В. Температурная зависимость толщины
полимолекулярных адсорбционных пленок воды на поверхности кварца. — Коллоидн.
журн., 1975, т. 37, с. 208.
Дерягин Б. В., Чураев Н. В. Изотерма расклинивающего давления пленок воды на
поверхности кварца. —ДАН СССР, 1972, т. 207, с. 572.
Derjaguin В. V., Churaev N. V. Structural Component of the disjoining pressure of thin
layers of liquids. — Croatica Chemica Acta, 1977, v. 50, p. 187.
Derjaguin B. V. Special properties and anisotropy of the boundary layers of liquids. —
Chemica Scripta, 1976, v. 9, p. 97.
Derjaguin B. V., oZrin Z. N., Churaev N. V., Shishin V. A. Examination of thin layers of
liquids on various solid substrates; Wetting, Spreading and Adhesion, London, Acad.
Press, 1977, p. 201.
Дерягин Б. В., Вершинин П. В., Кириленко Н. В. О незамерзающей воде в почве. —
Изв. АН СССР, серия географ, и геофизич., 1949, т. 13, с. 108.
Дерягин Б. В., Будневич С. С. О скольжении твердых тел по льду. — Журн. технич.
физ., 1952, т. 22, с. 1967.
Derjaguin В. V., Churaev N. V. The theory of frost action.— J. Coll. Int. Sci. (in
print).
К главе VII
Сумм Б. Д., Горюнов Ю. В. Физико-химические основы смачивания и растекания. М.:
Химия, 1976.
Фрумкин А. Н. О явлениях смачивания и прилипания пузырьков. — ЖФХ, 1938, т. 12,
с. 337, 511.
Дерягин Б. В. Теория капиллярной конденсации и других капиллярных явлений с
учетом расклинивающего действия полимолекулярных жидких пленок. — ЖФХ, 1940,
т. 14, с. 137; Acta Physicochim (USSR), 1940, v. 12, p. 181; Proc. 2nd Int. Congr.
Surface Activity (London), 1957, v. 2, p. 153.
546
Глава XV
Дерягин Б. В., Щех баков Л. М. О влиянии поверхностных сил на фазовые равновесия
полимолекулярных слоев и краевой угол смачивания. — Коллоидн. журн., 1961,
т. 23, с. 40.
Дерягин Б. В., Кусаков М. М., Лебедева Л. С. О радиусе действия молекулярно-по-
верхностных сил в полимолекулярных сольватных (адсорбционных) слоях. — ДАН
СССР, 1939, т. 23, с. 670.
Мартынов Г. А., Старов В. М., Чураев Н. В. Гистерезис краевого угла на однородных
поверхностях. — Коллоидн. журн., 1977, т. 39, с. 472.
К главе VIII
Френкель Я И. Кинетическая теория жидкостей. М.: Изд. АН СССР, 1945 (см. также
издания 1959 и 1975 гг.).
Каишев Р. Рост кристаллов. О некоторых вопросах молекулярно-кинетической теории
образования и роста кристаллов. Сб. статей. — М.: Изд. АН СССР, 1961, с. 26.
Дерягин Б. В., Прохоров А. В., Туницкий Н. Н. Статистическая термодинамика
образования новой фазы. Теория вскипания летучих жидкостей. — Журн. эксп. и теор.
физ., 1977, т. 73, с. 1891.
Дерягин Б. В., Федосеев Д. В. Рост алмаза и графита из газовой фазы. — М.: Наука,
1977.
Федосеев Д. В., Чужко Р. К., Гривцов А. Г. Гетерогенная кристаллизация из газовой
фазы. — М.: Наука, 1978.
К главе IX
Чмутов К. В. Хроматография. — М.: Химия, 1978.
Когановский А. М., Левченко Т. М., Кириченко В. А. и др. Адсорбция растворенных
веществ. — Киев: Наукова думка, 1977.
К главе X
Дерягин Б. В. Что такое трение? —2-е изд. —М.: Изд. АН СССР, 1963.
Дерягин Б. В. Молекулярная теория трения и скольжения. — ЖФХ, 1934, т. 5,
с. 1165.
Ахматов А. С. Молекулярн-ая физика граничного трения. — М.: Физматгиз, 1963.
Крагельский И. В. Трение и износ. — М.: Машиностроение, 1968.
Ребиндер П. А., Петрова Н. Н. Физико-химические основы явлений износа трущихся
поверхностей и смазки при высоких давлениях. — В кн.: Всесоюзная конференция
по трению и износу в машинах I. — М.-Л.: Изд. АН СССР, 1939, с. 484.
Дерягин Б. В., Кротова Н. А., Смилга В. П. Адгезия твердых тел. — М.: Наука, 1973
(См. также исправленное издание 1976 г.).
Берлин А. А., Басин В. Е. Основы адгезии полимеров. — М.: Химия, 1974.
Дерягин Б В., Снитковский М. М., Юрьев В. Н., Колельман В. А. Вольтамперная
характеристика тонких слоев и ее применение к оценке смазочной способности. —
В кн.: Поверхностные силы в тонких пленках. — М.: Наука, 1979.
Derjaguin В. V. The mechanism of boundary lubricating film. Short- and long-range
action in the theory of boundary lubrication.—Wear, 1958, v. 1, № 4.
К главе XI
Классен В. И., Мокроусов В. А. Введение в теорию флотации. — 2-е изд. — М.:
1959.
Ребиндер П. А. Физико-химия флотационных процессов. — М.: Металлургиздат,
1933.
Дерягин Б. В., Леви С. М. Физико-химия н-анесения тонких слоев на движущуюся
подложку. — М.: Изд. АН СССР, 1959.
Derjaguin В V., Dukhin S. S. Theory of flotation of small and medium-size particles.—
Fransactions Bull. Inst. Min. Met, 1961, v. 70, p. 221.
Дерягин Б. В., Духин С. С, Рулев Н. Н. Метод капиллярной гидродинамики тонких
пленок в теории флотации. — Коллоидн. журн., 1977, т. 39, с. 1051.
Дерягин Б. В. О толщине слоя жидкости, остающегося на стенках сосудов после их
опорожнения, и теории нанесения фотоэмульсии при поливе кинопленки. — ДАН
СССР, 1943, т. 39, с. 11.
К главе XII
Тихомиров В. К. Пены. Теория и практика их получения и разрушения. — М : Химия,
1975.
Хемосорбция и катализ
547
Клейтон В. Эмульсии. Пер. с англ. — М: ИЛ, 1950.
Кругляков П. М., Ровин Ю. Г. Физико-химия черных углеводородных пленок. — М.:
Наука, 1978.
Эмульсии. Пер. с англ. — Л.: Химия, 1972.
Кругляков П. М. Типы стабилизации эмульсий и особенности обращения фаз. — Кол-
лоидн. журн., 1977, т. 39, с. 161.
Шелудко А. Д. Новое в исследовании тонких слоев. В кн.: Успехи коллоидной химии.
М.: Наука, 1973, с. 51.
Ребиндер П. А., Венстрем Е. К. К физике пен и эмульсий. — ЖФХ, 1931, т. 2, с. 754.
Ребиндер П. А. К теории эмульсий. — Коллоидн. журн., 1946, т. 8, с. 157.
К главе XIII
Киселев А. В., Лыгин В. И. Инфракрасные спектры поверхностных соединений и
адсорбированных веществ. — М.: Наука, 1972.
Дерягин Б. В. Измерение удельной поверхности пористых и дисперсных тел по
сопротивлению течению разреженных газов. — ДАН СССР, 1946, т. 53, с. 627.
Дерягин Б. В., Внуков С. П., Федосеев Д. В. Определение удельной поверхности
порошков методом квазистационарной фильтрации разреженного газа. В кн.:
Адсорбция и пористость. — М.: Наука, 1976, с. 117; Power Technology, 1976, v. 14,
p. 169.
К главе XIV
Основные проблемы теории физической адсорбции./Под ред. М. М. Дубинина, В. В. Сер-
пинского.— М.: Наука, 1970.
Дубинин М. М. Адсорбция и пористость. Учебное пособие. — М.: 1972.
Дубинин М. М. Новые исследования равновесий и кинетики адсорбции газов и паров
микропористыми телами. — Усп. хим., 1977, № 11, с. 1929.
Авгуль Н. Н., Киселев А. В., Пошкус Д. П. Адсорбция газов и паров на однородных
поверхностях. — М.: Химия, 1975.
Рогинский С. 3., Адсорбция и катализ на неоднородных поверхностях. — М.-Л.: Изд.
АН СССР, 1948.
Адсорбция и пористость./Под ред. М. М. Дубинина, В. В. Серпинского. — М.: Наука,
1976.
Исирикян А. А., Киселев А. В. Изотермы адсорбции паров азота, бензола и w-гексана
и теплоты -адсорбции бензола и я-гексана на графитированных сажах I, II, III. —
ЖФХ, 1962, т. 36, с. 1165; 1962, т. 36, с. 1723; 1963, т. 37, с. 1776.
Дерягин Б. В., Чураев Н. Н. Полимолекулярная адсорбция и капиллярная
конденсация в узких щелевых порах. — Коллоидн. журн., 1976, т. 38, т. 1082; J. Coll. In-
tert. Sci., 1976, 54, p. 157.
К главе XV
Трепнел Б. Хемосорбция. Пер. с англ. — М.: ИЛ, 1958.
Хемосорбция и ее роль в катализе./Под ред. С. 3. Рогинского. — М.: 1970.
Электронные явления в адсорбции и катализе на полупроводниках./Под ред. Ф. Ф. Воль-
кенштейяа.— М.: 1969.
Temkin M. Die Gasadsorption und der Nernstsche Warmesatz, Acta Physicochimica
(USSR), 1934, v. 1, p. 36.
ДОПОЛНЕНИЕ
Поверхностные силы и расклинивающее
давление
Б. В. Дерягин
Трактовка поверхностных явлений Гиббсом в его классическом
труде «Теория капиллярности» основ-ана ,на введении межфазных сгуще-
н'ий экстенсивных величин: масс компонентов, свободной энергии,
энтальпии. Так, выражение свободной энергии Гиббса G (изобарно-изо-
термического потенциала) дополняется членами вида
А,*б&, (1)
где G% — межфазная свободная энергия (приходящаяся на единицу
площади раздела i-и и k-й фаз), Aih— площадь соответствующей
поверхности раздела. Для однокомпонентной системы
6=7, (2)
где у— поверхностное натяжение на границе жидкость — насыщенный
пар.
Всякая физическая поверхность раздела представляет собой зону
конечной толщины, в которой действуют поверхностные
(молекулярные и электрические) силы и происходит перестройка молекулярной
структуры. В результате концентрация (компонентов и объемная
плотность свободной энергии и энтропии в точках переходной зоны
отличаются от их значений вне этой зоны, за пределами действия
поверхностных сил. Поэтому трактовка Гиббса становится -неприменимой, если в
системе имеется такая -прослойка, в которой вследствие малой толщины
происходит перекрывание переходных зон между этой прослойкой и
двумя фазами, ею разделяемыми.
В результате такого перекрывания нарушается аддитивность
вкладов типа (1), вносимых двумя переходными зонами. Для учета этого
необходимо дополнить выражение для свободной энергии Гиббса
членом вида
AG (Л), (3)
где А — площадь прослойки, h — ее толщина. Присутствие члена (3)
означает, что изменение толщины прослойки в равновесном процессе
требует затраты работы. При малом изменении толщины должно
выполняться равенство
aG(h) = —U(h)dh. (4)
Из уравнения (4) следует, что U(h) —это давление, которое надо
приложить к тонкому слою, чтобы сохранить его равновесную толщину
или изменять ее в термодинамически равновесном процессе. Поскольку
рассматривается изобарно-изотермический процесс, U{h) представляет
собой давление, избыточное по сравнению с давлением в той фазе,
Поверхностные силы и расклинивающее давление
549
2
~—~Т\~\р^-^\
- KbbrH-xt'-
~^_ ——— -r^f* ~
- Y'*\\\\\*u\ - ' i * р„\
U 'р — -
_ЛГ~_~ J
частью которой является рассматриваемая прослойка (см. рисунок 1).
Отсюда следует основное определение расклинивающего давления:
П(А)=Р-Я0, (5)
где Р — давление на поверхности прослойки (предполагаемые плоско-
параллельными), а Р0— гидростатическое давление в фазе,
утоньшенную часть которой представляет прослойка. Вместо Р — можно
подставить Pzz — нормальную к поверхностям «пленки слагающую тензора
давления в прослойке. Поскольку переходные межфазные зоны
перекрываются, во всех частях прослойки давление анизотропно, но при
этом Pzz во всех сечениях прослойки постоянно.
Существование расклинивающего давления было впервые
установлено при проведении экспериментов с жидкими прослойками 'между
слюдяными листочками [1], со смачивающими пленками,
образующимися между твердыми -пластинками и прижимаемыми к -ним
пузырьками газа [2], <и при изучении равновесного состояния свободных пленок
между двумя пузырьками [3], а само понятие «расклинивающее
давление» впервые сформулировано Дерягиным. В дальнейшем были
рассмотрены различные слагающие р-аеклинивающего давления, зависящие
от перекрывания зон действия поверхностных сил и эффектов
различной природы. В первую очередь была рассмотрена ионно-электростати-
ческая слагающая, возникающая при перекрывании диффузных ионных
атмосфер, образованных на обеих поверхностях прослойки.
Рассмотрим две параллельные пластинки, погруженные в раствор
электролита. Проще всего вывести электростатическую слагающую
расклинивающего давления, предполагая, что при утоныиении
прослойки раствора электролита электрический потенциал на ее границах не
меняется. Даже не проводя интегрирования уравнения Пуассона —
Больцмана (IV-6) при этих граничных условиях, можно увидеть, что с
уменьшением толщины прослойки h снижается плотность
поверхностного заряда на ее границах а и, как следствие i[cm. уравнение (IV-15)],
/ d\\> \
градиент потенциала \~~dx~J вблизи стенок. Соответственно
уменьшается и приложенная к стенкам электрическая сила, выражаемая натя-
D ( dty\*
жениями Максвелла "eJTl "5F J . При h—*0 эта сила также стремится
к нулю. Между тем на наружных поверхностях пластинок ничего
(в том числе градиент потенциала и заряд) не .меняется. Поэтому
равнодействующая М'аксвелловских сил натяжений, действующих на
каждую пластинку, сводится к их взаимному отталкиванию, равному
разности
П = D (d^Y D (d^Y
Чтобы определить зависимость Пе от Л, необходимо провести
интегрирование уравнения Пуассона — Больцмана. Решение упрощается в
550
Дополнение
двух предельных ситуациях — при малом и большом потенциале (в
последнем случае для симметричного электролита).
Для первого случая Дерягин [4] получил зависимость
« vч 8л d ch2 (h/2d) '
Во втором случае, когда /i<Cd, спра(ведлива приближенная
формула [5]
И' — 8 \zxe ) h* '
где z\e — заряд противоиона.
Далее была рассмотрена молекулярная слагающая, возникающая,
согласно теории Лифшица, при перекрывании вблизи поверхностей
раздела таких зон, в .которых (в отличие от областей, расположенных
внутри фаз, далеко от поверхностных слоев) тензор электромагнитного
флуктуационного поля анизотропен и неоднороден.
На близких расстояниях h (не превышающих 200—300 А) сила
притяжения F двух одинаковых тел 1, разделенных прослойкой 2, по Лиф-
шицу, Дзялошин-скому и ГЬитаевскому, равна [6]:
со
F=—n = к Ме1~е*)* dl = -±—
lLfn 8я2/г3 J [ 8l — е2 ) as 6яЯ3 •
о
где h — постоянная Планка, е(/£) —частотные зависимости
диэлектрической проницаемости на мнимой оси частот.
Для больших расстояний (500 А и больше), когда полностью
сказывается так называемое электромагнитное запаздывание, зависящее
от существенного изменения фаз электро!магнитных волн
флуктуационного происхождения при их распространении через прослойку 2, силы
притяжения выражаются более просто. Сила притяжения одинаковых
тел 1 в этом предельном случае равна [6]:
где
Зпс
16л2Д4/е20 ,
1
Sio-P^2
*10
+7 +
I 510 — ар у
dp _ В
р2 ~ h*
Sio = V Р2— 1 + (8io/£2o) и a=810/e20;
ею и его — статическая диэлектрическая проницаемость; с — скорость
света.
Существенно, что, используя натяжения электромагнитного поля
Максвелла и вводя соответствующие тензоры, можно заменить силы
электростатического 'взаимодействия ионов по закону Кулона и
молекулярного взаимодействия на силы близкодействия. Исключив дально-
действующие силы, -можно вполне обоснованно записать, что
P22=const, (6)
а это означает, что PZz не зависит от местоположения внутри
прослойки, если в PZz включены соответствующие тензоры максвелловских
натяжений [7].
В теории устойчивости лиофобных коллоидов ограничиваются этими
двумя слагающими расклинивающего давления, суммируя их и
используя с помощью преобразования [8]
оо
N(H)=nr (u(h)dh (7)
Поверхностные силы и расклинивающее давление
551
для расчета взаимодействия N (Н) сферических частиц -радиуса г,
разделенных зазором Н.
Выражения для сил взаимодействия электрической и молекулярной
природы составили основу теории устойчивости лиофобных коллоидов,
развитой «в трудах Дерягина (1937—1941 и 1954 гг.), Дерягина -и
Ландау (1941 г.), Фервея и Овербека (1944—1948 гг.) [9], Муллера
(1965—1977 гг.) [10, 11] и др. и известной, как теория ДЛФО.
Наиболее простые выводы теории относятся к системам с -низким
и высоким потенциалом поверхности. В первом случае условие
устойчивости определяется неравенством dD^\>A, где d — толщина лонных
атмосфер, тф0 — потенциал поверхности частиц.
Условие устойчивости сильноз-аряженных частиц приведено в гл. VI
данной книги [уравнение (VI-47)].
Как -показали Дерягин -и Чураев [12], при перекрывании диффузных
адсорбционных слоев, расположенных у поверхностей прослойки
раствора недиссоциирующего вещества в растворителе, на
молекулярное притяжение, наблюдаемое в отсутствие растворенного компонента,
накладывается третья, «адсорбционная», слагающая расклинивающего
давле-ния. В данной ситуации (в отличие от случая перекрывания
ионных диффузных атмосфер) эта слагающая в зависимости от природы
растворителя и растворенного вещества может иметь как
положительный, так и отрицательный знак. Положительная адсорбционная
слагающая может превысить молекулярное притяжение, при этом
результирующее расклинивающее давление окажется положительным и
сведется к отталкиванию. Шелудко и Эксерова [13] установили это
экспериментально (изучая свободные пленки водного раствора масляной
кислоты).
Лиофильные поверхности способны вследствие образования
водородных связей, дшюль-дипольных и других взаимодействий менять
структуру прилегающих слоев полярных жидкостей по сравнению со
структурой в объеме. Таким образом возникают «граничные слои» с
особой структурой. При перекрывании двух та.ких граничных слоев в
тонкой прослойке возникает четвертая, структурная, слагающая
расклинивающего давления. О ее существовании говорят результаты опытов
по измерению расклинивающего давления адсорбционно-смачивающих
пленок воды на гидрофильных поверхностях слюды, кварца, стекла
[14, 15]. Расклинивающее давление вычислялось по уравнению
ЩН) = -^-Ы-£- (8)
где v — молярный объем воды в пленке, R — газовая постоянная,
Т — температура по шкале Кельвина, ps — давление пара,
находящегося в равновесии с плоской поверхностью воды, р — давление пара,
находящегося в равновесии с пленкой данной толщины h. Уравнение (8)
легко вывести термодинамически, вычисляя работу переноса малой
части слоя на объемную фазу. Это можно сделать двояко: исходя либо из
уравнения (4), либо из зависимости химического потенциала пара от
давления.
Имеются и другие независимые строгие доказательства
существования структурных особенностей полимолекулярных граничных слоев.
В частности, к ним относится установленное Соболевым, Зориным и
Чураевым [16] повышенное (по сравнению с объемным) значение
вязкости граничных слоев воды вблизи поверхности кварца [16].
Наконец, структурные особенности воды в граничных слоях следуют
из существования термоосмоса воды в пористых телах, исследованного
впервые Дерягиным и Сидоренковым [17]. Применение термодинамики
необратимых процессов показало, что течение под действием градиента
температур возникает в* результате «теплового скольжения» жидкости
552
Дополнение
по стенка-м пор, скорость которого U пропорциональна градиенту
температур, параллельному стенке. Коэффициент пропорциональности
зависит от особенностей удельной э-нталыши в граштчном слое, как
следует из формулы Дерягина
О
где Н — удельная энтальпия на расстоянии х от стенки, Я0 — ее
«'нормальное» значение в объеме жидкости, h0 — расстояние, за пределами
которого Н—#о = 0.
Сложность этого эффекта проявляется в том, что в тонких порах
или прослойках (толщина h которых существенно меньше чем 2fto)
направление термоосмоса меняется на противоположное [18].
Объяснить это можно, только допустив, что величина Н—Я0 при
изменении х меняет знак на обратный. Такая «двухслойность» граничных
слоев согласуется и с некоторыми другими наблюдениями [19].
Следует отметить, что без структурной слагающей
расклинивающего давления нельзя объяснить устойчивость лиофильных дисперсных
систем, например суспензий гидрофильных глин в воде, аэросила и
золей, поверхность которых лиофилизована под влиянием адсорбции
поверхностно-активных (дифильных) молекул.
В настоящей монографии рассматривается так называемое
гидрофобное взаимодействие (притяжение) гидрофобных тел в воде.
Несомненно, что такой же эффект .может быть результатом действия
структурной слагающей расклинивающего давления, но имеющей в отличие
от рассмотренных выше случаев отрицательный знак и потому
приводящей к притяжению.
К сожалению, радиус действия этих сил не установлен и не
проводилось отделение структурной составляющей от действия
дисперсионных сил.
СПИСОК ЛИТЕРАТУРЫ
1. Дерягин Б. В., Обухов Е. В. — Коллоидн. журн., 1935, т. 1, с. 385.
2. Дерягин Б. В., Кусаков М. М. — Изв. АН СССР, сер. хим., 1936, № 5, 741; № 5,
1119, 1937.
3 Дерягин Б В , Титиевская А. С —ДАН СССР, 1935, т 89, с. 1041.
4. Дерягин Б. В. — Изв. АН СССР, сер. хим., 1937, № 5, с. 1153.
5. Дерягин Б. В., Ландау Л. Д. — ЖЭТФ, 1945, т. 15, с. 663.
6. Дзялошинский И. Е., Лифшиц Е. М., Питаевский Л. П. — Успехи физич. наук, 1961,
т. 73, с. 381.
7. Дерягин Б. В., Чураев Н. В. — Коллоидн. журн., 1976, т. 38, с. 438.
8 Дерягин Б. В —Журн. физич. химии, 1935, т. 6, с 1306.
9. Verwey E. J. W., Overbeek J. Th. G. — Theory of the Stability of Lyophobic Colloids,
Amsterdam, 1948.
10. Муллер В. М. Исследования в области поверхностных сил: Сб. статей, 1967. Под
ред. Б. В. Дерягина. — М.: Наука, с. 270; 1974. Под ред. Б. В. Дерягина. — М.:
Наука, с. 245.
11. Муллер В М. — Коллоидн. журн., 1976, т. 38, с. 704.
12 Дерягин Б В., Чураев Н. В. —ДАН СССР, 1975, т. 222, с. 554. Коллоидн. журн.,
1975, т. 37, с. 1075. J. Coll. Interface Sci., 1917, v. 62, p. 369.
13. Шелудко А., Ексерова Д. — Годишн. Софийск. унив. (1959—1960), т. 3, София,
1961, с. 205.
14. Дерягин Б. В., Зорин 3. М. — Журн. физич. химии, т. 29, с. 1755, 1955.
15. Дерягин Б. В., Чураев Н. В. — ДАН СССР, 1972, т. 207, с. 572.
16. Зорин 3. М., Соболев В. Д., Чураев Н. В. —ДАН СССР, 1970, т. 193, с. 630.
17. Дерягин Б. В., Сидоренков Г. П. —ДАН СССР, 1941, т. 32, с. 622.
18. Возный П. А., Чураев Н. В. — Коллоидн. журн., 1977, т. 39, с. 438.
19 Дерягин Б В , Шутор Ю , Нерпин С. В , Арутюнян М. А. — ДАН СССР, ,1965, т 161,
с. 147.
Предметный указатель
Автофобные пленки 154
Автофобные системы 286
Адгезионное натяжение 274
Адгезия 360—362
в реальных системах 361
и капиллярное давление 361
и краевой угол 361
и ослабленные граничные слои 361
и трение 349
и шероховатость поверхности 362
при мойке 379
пузырьков при флотации 373
работа 57, 360
Адсорбат
влияние адсорбции 425
на адсорбент 431
диффузия 431
подвижность 431
фотохимия 428
Адсорбент
влияние адсорбата 415
термодинамические характеристики
475
Адсорбированные пленки
влияние на адсорбцию 484
при граничной смазке 354
Адсорбция
в бинарных жидких системах 321
в линейной области 468
влияние на структуру адсорбента 415
время 438
гистерезис 493—499
детергентов 385
доменная модель 385
и капиллярная конденсация 494
и краевой угол 287, 288
изменение свободной поверхностной
энергии 271
изобара 436
из растворов 308
влияние состава раствора 315
и растворимость 314
капиллярная конденсация 316
красителей 320
на неоднородных поверхностях 311
определение удельной поверхности
320
полимеров 317
полимолекулярная 314, 316
теплота 328
электролитов 329
из остер а 436
изотерма; см. Изотермы адсорбции
изменения состава 309, 324, 325
и краевой угол 288
обобщенная 471
кинетика хемосорбции 515
классификация типов 416, 439, 515
латеральное взаимодействие 446, 511,
513
методы исследования 448
на неоднородных поверхностях 485—
492, 511", 513, 519
на поверхности жидкостей 77
на пористых телах 493
определение 415
отрицательная 332
перестройка поверхности 520
поверхностная подвижность 520
поверхностное давление 455
противоионов 333
расширение твердых тел 222
скорость 492, 515
сравнение моделей 481
стандартное состояние 475
ступенчатая 470
субмонослойная 468
теплота 474, 477
термодинамика 472—481, 491
фазовые переходы 470
физическая 271, 436, 515
характеристическая кривая 484
хемосорбция 492, 515
электролитов 329
энергетическое распределение центров
485
энтропия 443, 446, 475, 477
как критерий монослойного
заполнения 481
на неоднородных поверхностях 492
Азот
адсорбция на
железном катализаторе 518
катализаторе синтеза аммиака 536
кремнеземе 490
никеле 428
нитриде бора 491
различных твердых телах 466, 496
рутиле 437, 466, 489
саже 478, 480, 484
молекулярная площадь 453
^-кривая 467
Активаторы флотации 370
Алканы
краевые углы 283
поверхностное натяжение 394
Алкиламмония ионы, адсорбция 330, 331
Алмаз, структура 207
36—1421
554
Предметный указатель
Алюминия окись 332, 377
Алюмосиликаты 334, 529
Альбумин
бычий, адсорбция азота 466
монослои 140
яичный, адсорбция азота 466
Амальгамы, злектрокапиллярные
свойства 187
Аминомасляная кислота 165
Аммиак
разложение 537
синтез 536
Амонтона закон 340
Аномальная вода 49, 263
Антивспениватели 411
Антонова правило 93, 360
Аргона
адсорбция 478, 480, 489
молекулярная площадь 453
поверхностная энергия 210
Аэрозоль ОТ, эмульсии 396
Баландина принцип структурного
соответствия 532
Бария стеарат, надстроенные пленки 153
Бария сульфат, адсорбция воды 477
Бейльби слой 2,02
Белки; см. также Монослои, Пленки
молекулярная масса 75
стабилизация эмульсий 395
Бензол
адсорбция
из растворов 324—325, 328
на графоне и сфероне 337
коэффициент растекания на воде 90
поверхностное натяжение смесей 60
Биологические вещества
дальнодействующие силы 252
как эмульгаторы 395
монослои 137
на поверхности раздела
масло—вода 141
Блоджетт пленки; см. Пленки
надстроенные
Бора нитрид, адсорбция азота 431
Бутан, молекулярная площадь 562
Вассермана антитела, монослои 141
Веймарна закон 305
Весы пленочные Лэнгмюра 87, 97
Взаимодействие
вандерваальсово, макрообъектов 257
гидрофобное 259, 552
дипольное 210, 247, 258
дисперсионное 248
ион-дипольное 247
молекулярное 246
энергия в различных системах 469
Вибрирующего электрода метод 99
Вильгельма пластинки метод 99
измерение краевых углов 275
поверхностного давления 96
поверхностного натяжения 27
Вино, эффект Марангони 96
Вискозиметры поверхностные 103—104
Вода
адсорбированные пленки, ЯМР 429
адсорбция на
алюмосиликатах 529
двуокиси титана 478
окиси железа 430
ртути 82
силикагеле 316, 429
углероде 291
переохлаждение 303
пересыщение паров 30
упругость паров над искривленной
поверхностью 48
Водно-этанольные смеси
поверхностное натяжение 60, 61
поверхностные избытки 66
Водонепроницаемость 369
Водород
адсорбционная связь с платиной 432
адсорбция на
вольфраме 510, 512
металлах 512, 525
углероде 616
теплоты адсорбции на металлах 512,
525
Волны; см. Капиллярные волны
Вольга-потенциал 99, 189
Вольфрам
адсорбция
азота 232
водорода 510, 512
ксенона 233
окиси углерода 508, 510
щелочных металлов 523
структура поверхности 233
Время адсорбции 438
Вульфа метод 205, 221
Вязкость; см. также Монослои
и устойчивость пен 409
монослоев 101
продольная 101
сдвиговая 101
эмульсий 390
Газообразные пленки; см. Монослои
Гальвани-потетигл 149, 189
Гамакера постоянная 256, 289
Гексан, адсорбция 77
на сфероне 480
Гексатриаконтановая кислота, монослои
109
Гексафторлропилен, трение 349
Гельмгольца плоскости 166, 186
Гельмгольца формула конденсатора 100
Генри закон 468
Гетит, флотация 376
Гиббсовские монослои; см. Монослои
Гидрирование этилена 538
Гидродинамическая смазка 352
Гидрофильно-липофильный баланс 402
Гидрофобное взаимодействие 259
Гидрофобность 369
Гидроформилирование 538
Гистерезис
адсорбции 493
вдавливания ртути 423
краевого угла 279
Глиадин 137
Гофмейстера ряды 178, 185
Графит; см. также Графой, Сферой,
Углерод
адсорбция
стеариновой кислоты 321
хлористого этила 472
трение 348
Предметный указатель
555
Графой; см. также Углерод
адсорбция
азота 601, 478, 480
углеводородов 324, 327
Гуда — Фоукса теория 92
Гудри процесс 539
Гуи — Чепмена теория 164
Давление
влияние на поверхностное натяжение
49
осмотическое 174
поверхностное; см Поверхностное
давление
расклинивающее 266, 548
Дарси закон 423
Двойной слой
взаимодействие двух двойных слоев
168, 258, 261
в заряженных пленках 145
Дебая — Хюккеля теория 163
дискретного заряда эффект 171
диффузный 165—168, 169
емкость 167
и адсорбция электролитов 329
и дзета-потенциал 172
и растворимость порошков 268
и флотация 377
и эмульсии 395
модель 186
плоскости Гельмгольца 166, 171, 196,
258, 261
плотный слой 166, 169
при перенапряжении 196
свободная энергия 167
структура 169
Штерна теория 167, 171
электрический момент 173
электрофоретическое торможение
ионов 173
Двумерные газы 82—90
идеальные 82
неидеальные 85
Дебая — Хюккеля теория 163
Декан, растворы 60
Депрессанты во флотации 370
Десорбция
и устойчивость эмульсий 392
скорость 520
стимулированная электронами 223
флэш-десорбция 509
Детергенты; см. также Коллоидные
электролиты, Мыла
адсорбция на тканях 385
критическая концентрация мицеллооб-
разования 380
применение 386
солюбилизация 381
Дефекты; см. Кристаллы
Деформация поверхности 209—213
пластическая, при трении 343
при адсорбции 431
Дзета-потенциал 172, 176
Диполь-дипольное взаимодействие 247
Дискретного заряда эффект 171
Дислокации; см. Кристаллы
Дисперсионный потенциал; см.
Потенциал
поверхностные 215
Дифференциальная теплота адсорбции
474, 478
Дифракция электронов 202, 225
быстрых 225
. в режиме сканирования 223
медленных 225, 227, 507
на пленках 108
эмиттированных полем 223
Диффузный двойной слой 165—168, 169
Диэлектрическая проницаемость
адсорбатов 430
тонких пленок 251
ДЛФО-теория 261
Додекаэдры, в пенах 406
Доменная модель адсорбции 498
Доннана равновесие 193
и реакции в монослоях 135
потенциал 145
Дуплексные пленки 393
Емкость двойного электрического слоя
167, 179, 184, 185
Железа окись, адсорбция воды 430
Жидкие кристаллы 251
Жидкие пленки; см. Монослои
Жидкости
переохлаждение 304
поверхностное натяжение 38
природа поверхности 50
Загрязнения, удаление детергентами 379
Закон
Амонтона 340
Веймарна 305
Дарси 423
Кулона 246, 344
параболический, скорости коррозии
240
Замерзания температура
влияние поверхностного натяжения
269
Запаздывания эффект 257
Зародышеобразование 48, 297—304
в однокомлонентных системах 302
в растворах 304
при кристаллизации 304
Защитное действие при мойке 384
Зелан 369
Зисмана кривые 283
Золи
лиофобные 177
скорость флоккуляции 263
Золото
золи 177
поверхностное натяжение 219
Изобары адсорбции 436
Изооктан, растворы 60
Изостеры адсорбции 436
Изотермы адсорбции 436
БЭТ 450—482
модификации 454
в поляризационной модели 462, 483
в потенциальной теории 458, 483
Гар«инса — Юры 458
Киселева 447
Лэнгмюра 309, 439-448, 482, 511
модификации 570
на основе уравнения состояния
556
Предметный указатель
идеального двумерного газа 456
конденсированной пленки 458
неидеального двумерного газа 456
поверхностные избытки 327
Поляни 458
сравнение моделей 464, 481
ступенчатые 471
Темкина 486, 512
типы 450, 451
Фаулера — Гуггенгейма 446
Фрейндлиха 311, 486, 511
Френкеля — Холси — Хилла 468
характеристическая 459, 466, 483
Интерферометрия пленок 107
Инфракрасная спектроскопия; см.
Спектроскопия
Ионная флотация 121, 378
Ионный обмен 333
Испарение
и эффект Марангони 95
сопротивление монослоев 127
Калориметр, измерение теплот
адсорбции 449—450
растворения 220
Кальция карбонат
разложение 239
стабилизация эмульсий 397
Камфора, движение на поверхности
воды 86
Канцерогены, монослои 141
Капиллярная конденсация 316, 495—498
Капиллярная постоянная 15
Капиллярное действие
влияние электрического поля 37
при адгезии 361
при смачивании 367
Капиллярное понижение 17
Капиллярное поднятие 14, 17
вес столбика жидкости 18
точное решение 17
экспериментальное применение 20
Капиллярность 9
Капиллярные волны 36, 150
Капиллярный метод в электроосмосе
174
Капиллярный электрометр 182
Капилляры 14
адсорбция из растворов 316
и смачивание 367
скорость входа жидкости 368
упругость паров 48
Капли
образование в парах 299
форма 28—33, 289, 405
Каталаза, монослои 141
Катализ 506
кинетика 530
и изотермы адсорбции 533
Лэнгмюра — Гиншельвуда механизм
533
механизмы 530
Ридила механизм 530—531
структурные факторы 531—532
Катализатор железный
адсорбция азота 518
Катализаторы
адсорбция азота 496, 518
кислотно-основные центры 528
роль ^-электронов 525
Кварц; см. также Кремнезем
дзета-потенциал 331
притяжение между пластинками 261
Кислород
адсорбция на окиси никеля 527
Кислоты жирные
адсорбция 313, 314, 321
монослои 112, 114, 144
смазочные свойства 353, 359
смешанные пленки 124
Кластеры в зародышеобразовании 297,
299
Клатраты 494
Коагуляция
золя золота 177
порог 177
Когезия, работа 57
Коионы 337
Коллекторы во флотации 370, 374
Коллоидные электролиты 379
Крафта температура 382
критическая концентрация мицелло-
образования 380
мицеллообразование 380
пенетрация 127
поверхностное натяжение 27, 32
свойства 379
фазовая диаграмма 382
Коллоиды
лиофобные, теория 550
устойчивость 177
флоккуляция 261
Конденсация; см. Зародышеобразование
Конденсоры 462
Контактный катализ; см. Катализ
Контактный потенциал; см.
Вольта-потенциал, Потенциал
Корреляционные функции 55
Коррозия 241
Краевой угол 273, 282
влияние поверхностно-активных
веществ 285
воды на тканях 369
гистерезис 279
движущегося мениска 369
и адгезия 361
и адсорбция 286
и гравитационное поле 287
измерение 275—277
и моющее действие детергентов 379
и поверхностное давление 288—291
-и смачивание 399
и теплота смачивания 284, 418
и флотация 371
критическое поверхностное
натяжение 283
модели 288—290
на неоднородных поверхностях 277
на низкоэнергетических поверхностях
283, 285
на поверхности пористых тел 278
на составных поверхностях 278
натекания 280, 281
на шероховатых поверхностях 278
оттекания 280, 281
табличные значения 282
температурная зависимость 282, 284
Юнга (Юнга — Дюпре) уравнение
273
Красители, адсорбция 320
Крафта температура 382
Крекинг углеводородов 539
Предметный указатель
557
Кремнезем
адсорбция паров 427, 490, 491
скорость растворения 420
Кривизна поверхности
влияние на поверхностное натяжение
49
радиус 11
Криптон
молекулярная площадь 448, 453
определение удельной поверхности
450
твердый, трение 346
Кристаллы
винтовые дислокации 216
габитус 214
дислокации 205, 215
инертных газов 207
ионные 210
ковалентные 207
металлов 213
молекулярные 412
напряжения 203—204
относительно изотропные, трение 348
работа расщепления 219
равновесная форма 205
равновесные поверхности 214
рост 304
слоистые, трение 347
теплоемкость 221
теплота растворения 220
трение 347
энергия ребер 211
Критическая концентрация мицеллообра-
зования 380
Критическое поверхностное натяжение
283
Кулона закон трения 344
Латекс 330
Лаурилсульфат, растворы 60
Лед
адгезия 362
адсорбция
азота 480
гексана 478
окиси углерода 480
как хелатообразователь 494
поверхностная энергия 269, 304
трение 346
Линзы 89, 95
Лиофобные коллоиды; см. Коллоиды
Липиды
как стабилизаторы эмульсий 395
пленки 143
Лэнгмюра принцип независимого
поверхностного действия 57
Лэнгмюра — Хиншельвуда механизм
катализа 533
Мак-Бэна весы 450
Макромолекулы; см. также Полимеры
дальнодействующее взаимодействие
312
Макроскопических объектов
взаимодействие 257
Марангони эффект 95, 401
Масла третичные, извлечение 368
Меди окись, восстановление 240
Меди сульфат, гидратация 239
Медь
адсорбция ксантогенатов 374
время жизни атомов на поверхности
201
поверхностное натяжение 219
смазка 354
трение 347
Мембранный потенциал; см. Доннанов-
ское равновесие
Металлы
адсорбция водорода 512
граничная смазка 350
каталитическое гидрирование этилена
526
коррозия 241
окисные пленки 241
поверхностная свободная энергия 218
поверхностная энергия 213
трение 347
хемосорбция 525
Меченых атомов метод 69, 108
Микрогазовые эмульсии 405
Микропоры, анализ 499
Микроскопия 224
автоионная 231, 234
автоэлектронная 231
оптическая 224
пленок 108
сканирующая электронная 225, 226
ультрамикроскоп 108
электронная 108, 224
эмульсий 392
Микротомный метод 69
Микроэмульсии 401
Минералы, флотация 374
Мицеллы 378—381
в монослоях 117
диффузия 381
солюбилизующая способность 380
Мицеллярные эмульсии 401
Молекулярные сита 493
Мономолекулярные пленки; см.
Монослои, Пленки
Монослои
адсорбция паров 127
белков
на поверхностях раздела масло —
вода 141
пенетрация 141
растекание 166
реакции 141
биологических веществ 136
влияние ионов металлов 120
влияние на скорость испарения 127
влияние подложки 120
вязкость 101, 118
газообразные ПО, ИЗ
гиббсовские 72, 80
гидролиз эфиров 133
дифракция 108
доннановский эффект 134
жидкие 110, 114
конденсированные 111, 116
растянутые ПО, 114
заряженные 145
коллапс 139
микроскопия 108
мицеллярная модель 117
молекулярная структура и типы 121
на жидких поверхностях 86
на поверхности раздела твердое
тело— газ; см. Адсорбция
558
Предметный указатель
на твердых поверхностях 153
оптические свойства 105
ориентация молекул 120, 125, 134,
135
осмотическая модель 113
пенетрация 141
перенос 153
поверхностные потенциалы 100
полимеров 136, 143
промежуточные ПО, 116
растворение, скорость 130
реакции 131, 141
реология 108, 118, 127
свободная энергия смешивания 126
сжатые, при граничной смазке 357
сжимаемость 101
смешанные 124
состояния 109
стандартное состояние 123
твердые 111, 117, 139
температура полурасширения 116
упругость 101
упругость двумерного пара 114
фотохимия 136
экспериментальные методы
исследования 95
Моющее действие 378
Мыла, см также Детергенты,
Коллоидные электролиты
фазовая диаграмма 382
Натрия додецилбензолсульфонат,
адсорбция на хлопке 385
Натрия додецилсульфат
адсорбция на окиси алюминия 377
растворы 71, 76, 380
при флотации 376
Натрия додецилсульфонат
адсорбция на окиси алюминия 377
флотация 376
Натрия лаурилсульфат, растворы 32
Натрия хлорид
деформация поверхности 211
поверхностная энергия 211
растворы 60
скорость растворения 419
флотация 376
Неионные детергенты 386
Неметаллы, трение 349
Неоднородность поверхности
и адсорбция 311, 511
Неэлектролиты, адсорбция из растворов
308
Никель
структура поверхности 229
теплоты хемосорбции 512
Нонадециламин, монослои 121
Обращепие'эмульсий 398
Окислы, поверхностная энергия 212
Окислительные реакции в монослоях 136
Окисные пленки, влияние на трение 347
Оксистеариновая кислота, лактонизация
на поверхности 133
Оксосинтез 538
Октадецилтриамин 147
Октакозановая кислота, смазка 355
Октан, адсорбция 77
Октановая кислота, поверхностное
натяжение растворов 156
Октаэдры, усеченные, в пенах 406
Оптические свойства пленок 106
Ориентационные силы 247
Ориентация поверхностная 251
Ориентированных клиньев теория 393
Осмотическое давление 77
Отрицательная адсорбция 332
Оултона катализатор, адсорбция азота
496
Палладий, адсорбция окиси углерода
507
Параболический закон коррозии 240
Парахор 46, 57
Парафин, поверхностное натяжение 219
Парафиновое масло
краевые углы 281
эмульсии 392
Пары
абсорбция мо«ослоями 127
пересыщение 297, 302
Пенообразователи 370, 375, 411
Пенетрация 141
во флотации 375
Пены 390, 405—411
микрогазовые 405
осушение 407, 408
перегородки 406
полиэдрические 405
применение 411
структура 405
упругость пленок 409
устойчивость 409
шаровые 405
Пентадекановая кислота, пленки 77, 115
Перенапряжение 194
Переноса коэффициент 196
Пересыщение растворов 271
Персорбция 493
Перья, краевые углы воды 278
Пиперидин 327
Платина, адсорбция водорода 432
ПЛАВМ-ванна 72
Плато граница 405
Пленки 89, см. также Монослои
автофобные 154
адсорбционные 154
белковые 136, 141
внутренняя ориентация 153
в эмульсиях 393
вязкость 251, 393
давление 72, 95, 272
дуплексные 90
заряженные 145
и краевые углы 288
липидные 143
мыльные 9—14, 407, 409
на границе жидкость — жидкость
144
надстроенные 152
на неводных поверхностях 144
на твердых поверхностях 153
окисные, на поверхностях металлов
241
перенос 153
полимерные 136, 143
серые 408
спонтанное разрушение 410
упругость 409
устойчивость 409
утоньшение 407
Предметный указатель
559
фосфолипидные 143
черные 408
Поверхности; см. также Поверхности
раздела фаз
автофобные 286
жидкостей 50
оптические свойства 50, 105
проводимость 226
твердых тел
влияние предыстории 202
подвижность 201
состав 223
структура 223, 230, 424
Поверхности раздела фаз 9; см. также
Поверхности
белковые пленки 143
масло — вода, потенциал 179
низкоэнергетические, спектры
смачиваемости 284
ориентация молекул 56
пленки между жидкими фазами 144
раствор — пар 326
раствор — твердое тело 326
ртуть — водный раствор 183
структура 50
твердое тело — газ 200
твердое тело — жидкость 268
твердое тело — пар 327
твердое тело — расплав 269
Поверхностная вязкость 101; см. также
Вязкость
Поверхностная проводимость 226
Поверхностная свободная энергия 9, 11,
44; см. также Поверхностное
натяжение
дисперсионная составляющая 92
единицы 10
жидкостей, расчет 54
и адсорбция 271
и поверхностное натяжение 52, 203
и равновесная форма кристаллов 221
и растворимость 268
и скорость деформации металлов 219
кристаллов, оценка по работе
расщепления 219
Поверхностная теплоемкость 45
Поверхностная фаза 66
Поверхностная энергия 45, 46, 51, 54
и теплота растворения 220
твердых тел, оценка 218
Поверхностная энтальпия 45
Поверхностная энтропия 44
Поверхностное напряжение кристаллов
204, 211
Поверхностное натяжение 9, 11; см.
также Поверхностная свободная энергия
влияние
вращения 50
давления 49
кривизны поверхности 49
магнитного поля 50
электрического поля 50
единицы 10
значения 38
и свободная поверхностная энергия
10, 51
измерения методы
взвешивания 22
висящей капли 28
вращающейся капли 28
динамические 34
капиллярных волн 36
колеблющейся струи 35
максимального давления в
пузырьках 21
отрыва кольца 24
пластинки Вильгельми 26, 96, 144
сидящей капли или пузырька 32,
144
тензиометричеокий 25
и эмульсии 392
критическое 283
механическая аналогия 50
расплавов солей 60
растворов 58, 79, 80
смесей 60
твердых тел
теоретическая оценка 207
экспериментальная оценка 218, 268
Поверхностные избытки
измерение 68
определения 61
Поверхностные пленки; см. Адсорбция,
Монослои, Пленки
Поверхностные фазы, термодинамика 66
Поверхностный разряд
в теории двойного слоя
и отталкивание сферических частиц
261
и флотация 376—377
и электрокапиллярность 179, 183
Поверхностный потенциал 99, 189
Поверхностный слой; см. также
Поверхности раздела фаз
изменение давления по толщине 54,
460
толщина 50
Поверхность
натяжения 53
разделяющая 52, 64
удельная; см. Удельная поверхность
Подвижность
в физической адсорбции 444
в хемосорбции 520
поверхностная, определение 521
Поккельс точка 87
Поливода; см. Аномальная вода
Полигексафторпропилен, трение 349
Полимеры; см. также Макромолекулы,
Монослои, Пленки
адсорбция 317
трение 349
Полимолекулярная адсорбция, см.
Адсорбция, Изотермы адсорбции
Полировка 202
Политетрафторэтилен
краевые углы 283
трение 349
Полониевого электрода метод 100
Полупроводники, катализ 526
Поляризационная модель адсорбции
402
Поляризация; см. также Адсорбция,
Потенциал
в электрокапиллярных явлениях 181
концентрационная 194
при хемосорбции 513
электродов 194
Пористые тела
адсорбционные свойства 493
проницаемость 423
структура 422, 495
Поромер ртутный 421
Порошки
560
Предметный указатель
краевые углы 277
растворимость 268
стабилизация эмульсий 397
Портланд-цемент, пористая структура
497
Поры
бутылкообразные 423
распределение по размерам 422, 495
Потенциал
абсолютная разность потенциалов
между фазами 187
вандерваальсовский 248
Вольта 99, 189
Гальвани 149, 189
Гуи 147
Дебая 248
диполь-индуцированный диполь 258
дисперсионный 248—250
запаздывающий 257
значения 469
дзета-потенциал 172
и устойчивость коллоидов 176
Доннана 145
изменение на поверхности раздела
149
Кеезома 247
Лондона 248
межфазный 149
ориентационный 247
поверхностный 99, 189
поверхностный скачок 190
поляризационный 258
при флотации 376
рациональный 183
реальный 190
седиментационный 176
течения 175
химический 190
электродный 192
необратимый 194
электрохимический 190, 192
Потенциалопределяющие ионы 377
Потенциальная функция; см. Потенциал
Потускнение 240
Правило
Антонова 93, 360
Траубе 79, 312
Шульце —Гарди 330
Предел прочности 222
Принцип
независимого поверхностного
действия 57
структурного соответствия 532
Проволока, сжатие поверхностными
силами 219
Промежуточные пленки; см. Монослои
Протонный магнитный резонанс; см.
Ядерный магнитный резонанс
Пузыри
адгезия 373
мыльные, механическое равновесие 10
форма 28, 373
Работа
адгезии 57, 360
выхода 191, 235, 509
когезии 57
Радиальная функция распределения 55
Радиус кривизны 11
Рамановская спектроскопия; см.
Спектроскопия комбинационного рассеяния
Расклинивающее давление 266, 548
Распределение энергии центров
адсорбции
на кремнеземе 490
на рутиле 489
Рассеяние ионов 225, 235, 237
реакционное 236
Растворения скорость 239
монослоев 130
определение удельной поверхности
419
Растворимость
и свободная поверхностная энергия
268
Растворы
адсорбция 308
пересыщенные 304
поверхностное натяжение 58
регулярные 59
Растекание
белков на жидкостях 166
жидкости по жидкости 89
замедленное 95
и адгезия 362
и смачивание 366
кинетика 944
коэффициент 89, 91, 274
критерии 89
Расширение
пленок 114
твердых тел при адсорбции 222
Реология монослоев 118, 127
Ридила механизм катализа 530
Ртутный поромер 421
Ртуть
адсорбция паров воды 82
пленки на поверхности 145
электрокапиллярные свойства 183
Руды, флотация 370
Рутил, адсорбция азота 466, 489
Сварка при трении 347
Свободная энергия; см. Поверхностная
свободная энергия
Связь
адсорбат — адсорбент 432
адсорбционная 432, 468—478, 522—
526
гидрофобная 259
хемосорбционная 522
Себациновая кислота, смазывающие
свойства 359
Сера, золи 305
Серебра галогениды 189
Серы двуокись, адсорбция на силикагеле
460
Силикагель 313, 315
адсорбция
азота, анализ микропор 499
воды из растворов 316
двуокиси серы 460
жирных кислот 313
краевые углы 281
Силоксаны 152
Силы
вандерваальсовы 247
дальнодействующие 246, 260, 395
короткодействующие 210, 246
Сканирующие изотермы адсорбции 497
Скорость
адсорбции 492, 517
Предметный указатель
561
испарения через монослои 127
растекания 94
сдвига при трении 343, 350
скольжения и трения 342, 359
Скрип мела 345
Слюда 334
Смазка; см. также Трение
гидродинамическая 352
граничная 352—359
Смачивание 366
и краевой угол 366
как катшллярное явление 367
спектры смачиваемости 284
Снег; трение 346
Соли; см. также Электролиты
пересыщенные растворы 304
порошкообразные, растворимость 269
трение 348
Солюбилизация 381
Спекание порошков 200
Спектроскопия
абсорбционная
в видимой области 225, 42в
инфракрасная 255, 427, 508
мягкого рентгеновского излучения
223
ультрафиолетовая 225
автоионная 231
автоэмиссионная 231
ионно-нейтрализационная 223
комбинационного рассеяния 428
масс вторичных ионов 223, 2'25, 235
оже-эле«тронная 223, 236
пленок 107
потенциала появления 223
рентгеновская, тонкой структуры
спектров поглощения 223
рентгеновская фотоэлектронная 223
стимулированной электронами
десорбции 223
тормозного излучения 223
ультрафиолетовая фотоэлектронная
223
фотоэлектронная 223, 225, 237
характеристических потерь энергии
223
хемосорбированных частиц 508
электронная, для химического
анализа 223, 225, 238, 509
эмиссионная, мягкого рентгеновского
излучения 223
Спирты
адсорбция 316, 337
влияние на испарение жидкостей 129
мицеллярные эмульсии 401
монослои 114, 119, 144
смазочные свойства 353
смешанные пленки 125
поверхностное натяжение растворов
74
Сталь, трение 342
Стеарилтриметиламмония ионы,
монослои 147
Стеариновая кислота
адсорбция на графите 401
монослои 98, 121
пленки на ртути 106
растворение монослоев 131
смешанные монослои 126
Стекло
граничная смазка 353
дзета-потенциал 177
образование 305
спеченное, пористая структура 422
Стерлинг; см. Углерод
Стрибека кривая 352
Струи
колебания 35
разрушение 15
Суспендирующая способность 384
Сферой; см. также Углерод
адсорбция жирных кислот 314, 337
адсорбция н-гексана 480
Табачной мозаики вирус 252
Тактоиды 252
Тальк, трение 348
Таммана температура 205
Тантал, адсорбция водорода 512
Твердые тела
влияние адсорбированных газов 272
площадь контакта при трении 342
поверхностная диффузия 201
поверхностная подвижность 201
поверхностное натяжение
и модуль жесткости 217
поверхностные дефекты 214
полировка 202
предел прочности 222
природа поверхности 341
расширение при адсорбции 222
реакции на поверхностях 239
сжатие под действием поверхностных
сил 207
скорость растворения 239
состав поверхностного слоя 225, 424
спекание 201
спектроскопия поверхности 225
старение поверхности 329
структура поверхности 229, 424
теплота смачивания 270
трение 348
удельная поверхность 523; см. также
Удельная поверхность
шлифовка 202
Теплоемкость; см. Поверхностная
теплоемкость
порошков 221
Теплота
адсорбции (хемосорбции) 473, 512,
522, 524
гистерезис 498
дифференциальная 474, 478
из растворов 328
из остерическая 474
интегральная 474, 477—481
на металлах 512
на неоднородных поверхностях 491
определение удельной поверхности
418
растворения 220
смачивания 270
Термодинамика
адсорбции 472
бинарных систем 61
жидких поверхностей 44
поверхностей, статистическая 54
Термоэлектронная работа выхода 191,
235, 509
Тефлон, см. Политетрафторэтилен
Тиоиндиго, монослои 136
Титана двуокись, адсорбция
азота 466, 489
562
Предметный указатель
воды 478
кислорода 272
Топотактические реакции 240
Топохимические реакции 239
Траубе правило 79, 312
Трение
влияние поверхностного потенциала
189
влияние температуры 353
и адгезия 350
и граничная смазка 352
и нагрузка 355
коэффициент 340, 344
кристаллов
относительно изотропных 348
слоистых 348
Кулона закон 344
локальная температура 342
льда 346
металлов с окисной пленкой 347
неметаллов 348, 351
несмазанных поверхностей 340, 349
пластическая деформация
поверхностей 343
площадь контакта 343, 350
полимеров 349
при буксовании 345
скачкообразное 344
снега 346
статическое 344
Третичные масла, извлечение 368
Трикрезилфосфат, смешанные монослои
126
Триолеин 135
Трипальмитин 136
Тромбоустойчивые пленки 143
Углеводороды
адсорбция
на воде 76, 77, 78
на твердых телах 324, 337, 480
крекинг 539
смазочные свойства 354
Углерод
адсорбция
азота 478, 485, 496
аргона 478
водорода 616
воды 291
из растворов 321
криптона 471
стеариновой кислоты 321
хлорэтана 472
графой, адсорбция
азота 478, 480
из растворов 327, 337
пористая структура 422
сажа 478, 480, 484
стерлинг 472, 480
сферой 314, 337, 478—481
Углерод четыреххлористый
адсорбция на кремнеземе 427
поверхностная энергия 45
Углерода двуокись
адсорбция на металлах 526
твердая, трение 346
Углерода окись
адсорбция на металлах 524
десорбция с вольфрама 510
Уголь, см. также Углерод
адсорбция жирных кислот 313, 321
активный, адсорбция паров 325
пористая структура 422
теплота смачивания 336, 518
Удельная поверхность; см. также
Пористые тела
абсолютная 419, 468
определение по
адсорбции из раствора 320
адсорбции красителя 320
адсорбции стеариновой кислоты 320
кривой вдавливания ртути 421 •
кривой заряжения 420
методу БЭТ 453
полимолекулярной адсорбции 464
проницаемости 423
скорости растворения 419 з
субмонослойной адсорбции 468
теплоте смачивания 418
уравнению Лэнгмюра 447
сравнение различных моделей 464
физический смысл 416
Ультрамикроскоп 108
Упругость
монослоев 102
пара, влияние кривизны поверхности
48
пленок 409
Уравнение
Амага 75
Антонова 93
Беккера — Дариига 299
Больцмана 163
Брагера — Жуховицкого 213
Брунауэра — Эммета — Теллера
(БЭТ) 450-456
Ван-дер-Ваальса 253
двумерное 76, 116,
Во-ннегута 34
Гельмгольца, конденсатора 100
Гиббса 63, 180
проверка 68
Гиббса — Дюгема 64
Грэхема 181
Гуггенгейма 46
Гуда — Фоукса 93
Гуи — Чепмена 164
Дарси 423
Дебая — Хюккеля 164
Джирифалко — Гуда 92, 288
Джирифалко — Гуда — Фоукса 289
Дониана 135, 145, 193
Дубинина — Радушкевича 460
Кельвина 48, 206, 269, 495
Кирквуда — Мюллера 249
Киселева 447
Козени 424
Ли'ппмана 179
Лифшица 257
Лондона 249
Лэнгмюра 77, 310, 440, 511
кинетический вывод 440
линейная форма 440
применение 447
статистический вывод 441
Вавье — Стокса 150
Нернста 193
Пуазейля 102, 175
Пуассона 163
Рамзея — Шилдса 46
Смолуховского 398
Стокса — Эйнштейна 398
Тафеля 195
Предметный указатель
563
Темкина 512
Тэйта 22
Уошборна 368
Фаулера — Нордхейма 234
Фоукса 289
Фрейндлиха 311, 486, 511
Френкеля — Холси — Хилла 468
Хаггинса — Майера 210
Этвеша 46
Юнга 273
термодинамика 281
Юнга— Дюпре 273
Юнга — Лапласа 11, 53
Уравнения состояния; см Изотермы
адсорбции
Фика закон 130
Фишера — Тропша синтез 530, 537
Флоккуляция
лиотропных коллоидов 262
порог 177
эмульсий 398
Флотация 370—378
адгезия пузырьков 373
влияние рН 376—377
ионная 378
краевые углы 371
нерудных минералов 376
рудных минералов 374
эффект пенетрации 376
Флуоресценция монослоев 136
Флэш-десорбция 509
Функция распределения 54, 425, 441
вращательного движения 426, 445
колебательного движения 443
поступательного движения 442, 445
свободная энергия Гельмгольца 54
426
Характеристическая кривая 483
Хемосорбция
влияние на работу выхода 509
изотермы 511
и каталитическая активность
металлов 524
кинетика 515
кислотно-основные центры 528
координационное число адсорбата 514
латеральные взаимодействия 513
методы исследования 507—509
на металлах 524
на неоднородных поверхностях 511
на полупроводниках 526
поверхностная подвижность 520
применение спектральных методов
508
связи 522
скорость адсорбции 517
скорость десорбции 519
сравнение с физической адсорбцией
515
теория граничного слоя 527
теплоты 511, 524
термодинамика 515
энергия активации 515
Хлопок 385
Хлорофилл, монослои 108, 136
Холестерин, смешанные монослои 141
Хроматография 315
36*
Цеолиты 315, 334, 493
Циклогексан
адсорбция 327
растворы 60
Цилиндрические столбики,
неустойчивость 14
Цинка окись, адсорбция 527
Шабазит, адсорбция газов 493
Шлифовка 202
Штерна теория 167, 171
Шульце — Гарди правило 178, 262
Щелочные металлы
адсорбция на вольфраме 522
Щелочных металлов галогениды
поверхностная энергия 210—212
Электродные потенциалы 192
Электродные явления, необратимые 194
Электрокапиллярность 178—187
методы исследования 182
термодинамика 179
Электрокинетический эффект 172
Электролиты
адсорбция 329
влияние на электрокапиллярную
кривую 183
Электронная микроскопия 225, 226
монослоев 108
Электронный парамагнитный резонанс
225, 428
Электроосмос 173
Электрополировка 202
Электроотрицательность 523
Электрофорез 172
Электрофоретическое торможение ионов
173
Электрохимический метод
определения удельной поверхности
420
Электрохимический потенциал 190, 192
Эллипсометрия 22:5
в коррозионных исследованиях 241
определение поверхностных избытков
71
пленок 105
Эмульгирование
механическое 404
спонтанное 401
Эмульсии 390—405
вязкость 391
гидрофильно-липофильный баланс
402
двойной электрический слой 396
Марангони эффект 401
микрогазовые 405
мицеллярные 401
обращение 390, 400
отношение объемов фаз 391, 393
подвижность капелек 396
практическое применение 404
разрушение 398, 400
расслоение 392, 398
реопексия 392
скорость коагуляции 398
стабилизация
роль дальнодействующих сил 395
структурными факторами 394, 404
564
Предметный указатель
твердыми частицами 397
теория 392
старение 398
тиксотропия 392
типа вода/масло 390, 394, 397
типа масло/вода 390, 394, 397
флоккуляция 400
Энантовая кислота, поверхностное
натяжение растворов 35
Энергия; см. Поверхностная энергия
Энергия ребер кристаллов 211
Энтальпия; см. Поверхностная
энтальпия
Энтропия; см. также Поверхностная
энтропия
адсорбции 443—444
дифференциальная 444
интегральная 444
конфигурационная 443
Эйнштейна закон вязкости 391
Этилен, гидрирование 538
Этиловый спирт, растворы 60, 66
Эфиры, гидролиз монослоев 133
Ядерный магнитный резонанс 225
адсорбатов 428
времена корреляции 429
пленок 108, 251
Содержание
ПРЕДИСЛОВИЕ К РУССКОМУ ПЕРЕВОДУ 5
ПРЕДИСЛОВИЕ 7
Глава I. КАПИЛЛЯРНОСТЬ 9
1. Поверхностное натяжение и поверхностная свободная энергия .... 9
2. Уравнение Юнга — Лапласа И
3. Некоторые опыты с мыльными пленками 13
4. Капиллярное поднятие 14
5. Метод максимального давления в пузырьках 21
6. Метод взвешивания капель 22
7. Метод отрыва кольца 24
8. Метод пластинки Вильгельми 26
9. Методы, основанные на определении формы неподвижных капель или
пузырьков 28
10. Динамические методы измерения поверхностного натяжения 34
11. Некоторые другие проявления капиллярности 36
12. Величины поверхностных н«атяжений, измеренные различными методами 37
13. Упражнения" 39
Список литературы ... 41
Глава II. ПРИРОДА И ТЕРМОДИНАМИКА ЖИДКИХ ПОВЕРХНОСТЕЙ
РАЗДЕЛА 44
1. Однокомпонентные системы 44
2. Структура поверхностей раздела 50
3. Ориентация на поверхностях раздела 56
4. Поверхностное натяжение растворов 58
5. Термодинамика бинарных систем. Уравнение Гиббоа 61
6. Экспериментальная проверка уравнения Гиббса. Прямые измерения
величин поверхностных избытков 68
7. Гиббсовские монослои 72
8. Упражнения ... 81
Список литературы 83
Глава III. ПЛЕНКИ НА ЖИДКИХ ПОВЕРХНОСТЯХ 86
1. Введение 86
2. Растекание одной жидкости по поверхности другой 89
3. Экспериментальные методы исследования мономолекулярных пленок . . 95
4. Состояния мономолекулярных пленок 109
5. Соответствие между я и трехмерным давлением 112
6. Дальнейшее рассмотрение состояний мономолекулярных пленок . . . 113
7. Термодинамика монослоев 122
8. Смешанные пленки 124
9. Скорости испарения через мономолекулярные пленки 127
10. Скорость растворения монослоев 130
11. Реакция в мономолекулярных пленках 131
12. Белковые и полимерные пленки 136
13. Пленки на поверхностях типа жидкость — жидкость и неводных
поверхностях 144
14. Заряженные пленки 145
15. Капиллярные волны 150
16. Пленки, осажденные на поверхности твердых тел 152
566 Содержание
17. Упражнения 154
Список литературы 156
Глава IV. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ПОВЕРХНОСТЕЙ 162
1. Введение 162
2. Двойной электрический слой 162
3. Теория Штерна 166
4. Свободная энергия диффузного двойного слоя 167
5. Отталкивание между двумя плоскими двойными слоями 168
6. Природа различных частей «двойного» слоя 169
7. Дальнейшее развитие теории двойного слоя 171
8. Дзета-потенциал 172
9. Электрокапиллярность 178
10. Заряженные поверхности раздела твердое тело — жидкость 188
И. Типы потенциалов и смысл понятия «разность потенциалов между
двумя фазами» 189
12. Упражнения 196
Список литературы .... . ... 198
Глава V. ПОВЕРХНОСТИ ТВЕРДЫХ ТЕЛ 200
1. Введение 200
2. Термодинамика кристаллов . 203
3. Теоретические оценки поверхностной энергии и свободной
поверхностной энергии 207
4 Факторы, влияющие на поверхностную энергию и поверхностное
натяжение реальных кристаллов 213
5 Экспериментальная оценка поверхностной энергии и свободной
поверхностной энергии 218
6 Методы определения структуры и состава поверхности 223
7. Реакции на поверхностях твердых тел 239
8. Упражнения 241
Список литературы 224
Глава VI. ДАЛЬНОДЕЙСТВУЮЩИЕ СИЛЫ 246
1 Силы, действующие между атомами и молекулами . .... 246
2. Качественные данные, указывающие на существование дальнодействую-
щих сил 250
3. Дальнодействующие силы . 255
4. Экспериментальное подтверждение существования д-альнодействующих сил 260
5. Упражнения 265
Список литературы 266
Глава VII. ПОВЕРХНОСТЬ РАЗДЕЛА ТВЕРДОЕ ТЕЛО— ЖИДКОСТЬ.
КРАЕВОЙ УГОЛ 268
1. Введение 268
2. Определение величины свободной поверхностной энергии по измене-
^ нию растворимости ... 268
( 3. Определение разностей поверхностной энергии и свободной поверхностной
^-- энергии из данных по теплоте смачивания и адсорбции 270
4. Явления, связанные с возникновением краевого угла 273
5. Некоторые теоретические аспекты явлений, связанных с образованием
краевого угла 286
6. Упражнения 291
Список литературы .... 294
Глава VIII. ОБРАЗОВАНИЕ НОВОЙ ФАЗЫ. ЗАРОДЫШЕОБРАЗОВАНИЕ И
РОСТ КРИСТАЛЛОВ 297
1. Введение 297
2. Классическая теория зародышеобразования 297
3. Результаты экспериментальных исследований процесса
зародышеобразования 302
4. Рост кристаллов 304
5. Упражнения 306
Список литературы 306
Глава IX. ПОВЕРХНОСТЬ РАЗДЕЛА ЖИДКОСТЬ — ТВЕРДОЕ ТЕЛО.
АДСОРБЦИЯ ИЗ РАСТВОРОВ 308
1. Адсорбция неэлектролитов из разбавленных растворов 308
2. Адсорбция полимеров .... 317
Содержание
567
3. Определение удельной поверхности 320
4. Адсорбция в бинарных жидких системах 321
5. Адсорбция электролитов 329
6 Упражнения 335
Список литературы 337
Глава X. ТРЕНИЕ И СМАЗКА. АДГЕЗИЯ 340
1. Введение 340
2. Трение между несмазанными поверхностями 340
3. Два ч-астных случая трения 345
4. Трение между металлами. Влияние окисных пленок .... . 347
5. Трение между неметаллами 348
6. Некоторые дополнительные сведения по теории трения между
несмазанными поверхностями 349
7. Трение между смазанными поверхностями 352
8. Адгезия • 360
9. Упражнения • 363
Список литературы • 363
Глава XI. СМАЧИВАНИЕ, ФЛОТАЦИЯ И МОЮЩЕЕ ДЕЙСТВИЕ .... 366
1. Введение • 366
2. Смачивание . 366
3. Гидрофобность и водонепроницаемость . 369
4. Флотация 370
5. Моющее действие . 378
6. Упражнения . 386
Список литературы 387
Глава XII. ЭМУЛЬСИИ И ПЕНЫ .390
1. Введение 390
2. Общие свойства эмульсий 390
3. Факторы, определяющие устойчивость эмульсий 392
4. Старение и обращение эмульсий 398
5. Спонтанное эмульгирование. Мицеллярные эмульсии и микроэмульсии . 401
6. Гидрофильно-липофильный баланс 402
7. Применение эмульсий 404
8. Пены. Структура пен 405
9. Утоньшение пен 407
10 Устойчивость пен 409
11. Пенообразователи и пены, имеющие практическое значение 411
12. Упражнения . 411
Список литературы 412
Глава XIII. ПОВЕРХНОСТЬ РАЗДЕЛА ТВЕРДОЕ ТЕЛО —ГАЗ .... 415
1. Введение 415
2 Удельная поверхность твердых тел 416~
3. Структура и химическая природа твердой поверхности 424
4. Природа комплексов типа твердый адсорбент — адсорбат 425
5. Упражнения 432
Список литературы 433
Глава XIV. АДСОРБЦИЯ ГАЗОВ И ПАРОВ НА ТВЕРДЫХ ТЕЛАХ .... 436
," 1. Введение . 436
2. Время адсорбции 438
3. Изотерма адсорбции Лэнгмюра 439
4. Экспериментальные методы . 448
5. Изотерма БЭТ и ее модификации ... 450
6. Изотермы, основанные на уравнении состояния адсорбированного слоя . . 455
7. Потенциальная теория 458
8. Сравнение удельных поверхностей, найденных с помощью различных
моделей полимолекулярной адсорбции -164
9. Характеристическая изотерма ±66
10. Применение потенциальной теории для описания -адсорбции при
заполнениях ниже монослойного . 4?S
11. Ступенчатая адсорбция и фазовые переходы -~0
12. Термодинамика адсорбции 4"!'
13. Сравнение различных моделей адсорбции 4S1
14. Адсорбция на неоднородных поверхностях ... 455
15. Скорость адсорбции 492
16. Адсорбция на пористых телах. Гистерезис 493
568
Содержание
17. Упражнения 500
Список литературы 502
Глава XV. ХЕМОСОРБЦИЯ И КАТАЛИЗ 506
1. Введение 506
2. Хемосорбция. Молекулярные механизмы хемосорбции 507 #
3. Изотермы хемосорбции 511
4. Кинетика хемосорбции 515
5. Поверхностная подвижность 520
6. Хемосорбционная связь 522
7. Механизмы гетерогенного катализа 530
8. Влияние характера адсорбции на кинетику гетерогенного катализ-а . . . 533
9. Механизмы некоторых каталитических реакций 535
10. Упражнения 540
Список литературы 541
Список дополнительной литературы 543
Дополнение. ПОВЕРХНОСТНЫЕ СИЛЫ И РАСКЛИНИВАЮЩЕЕ
ДАВЛЕНИЕ. Б. В. Дерягин 548
Список литературы 552
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 553
Адамсон А.
ФИЗИЧЕСКАЯ ХИМИЯ ПОВЕРХНОСТЕЙ
Научный редактор Р. И. Краснова
Мл. научный редактор И. С. Ермилова
Художник К. П. Сиротов
Художественный редактор Г. В. Шотина
Технический редактор Т. А. Максимова
Корректор В. И. Постнова
ИБ № 1297
Сдано в набор 22 02.79 г. Подписано к печати 23.07.79 г.
Формат 70X1081/i6. Бумага типографская № 1.
Гарнитура латинская. Печать высокая.
17,75 бум л., 49,70 усл. печ. л , уч.-изд. л. 50,26.
Тираж 6500 экз. Изд. № 3/9680. Зак. 1421. Цена 4 р. 30 к.
Издательство «Мир» Москва, 1-й Рижский пер., 2
Московская типография № 11 Союзполиграфпрома
при Государственном комитете СССР
по делам издательств, полиграфии и книжной торговли.
Москва, 113105, Нагатинская ул., д. 1.