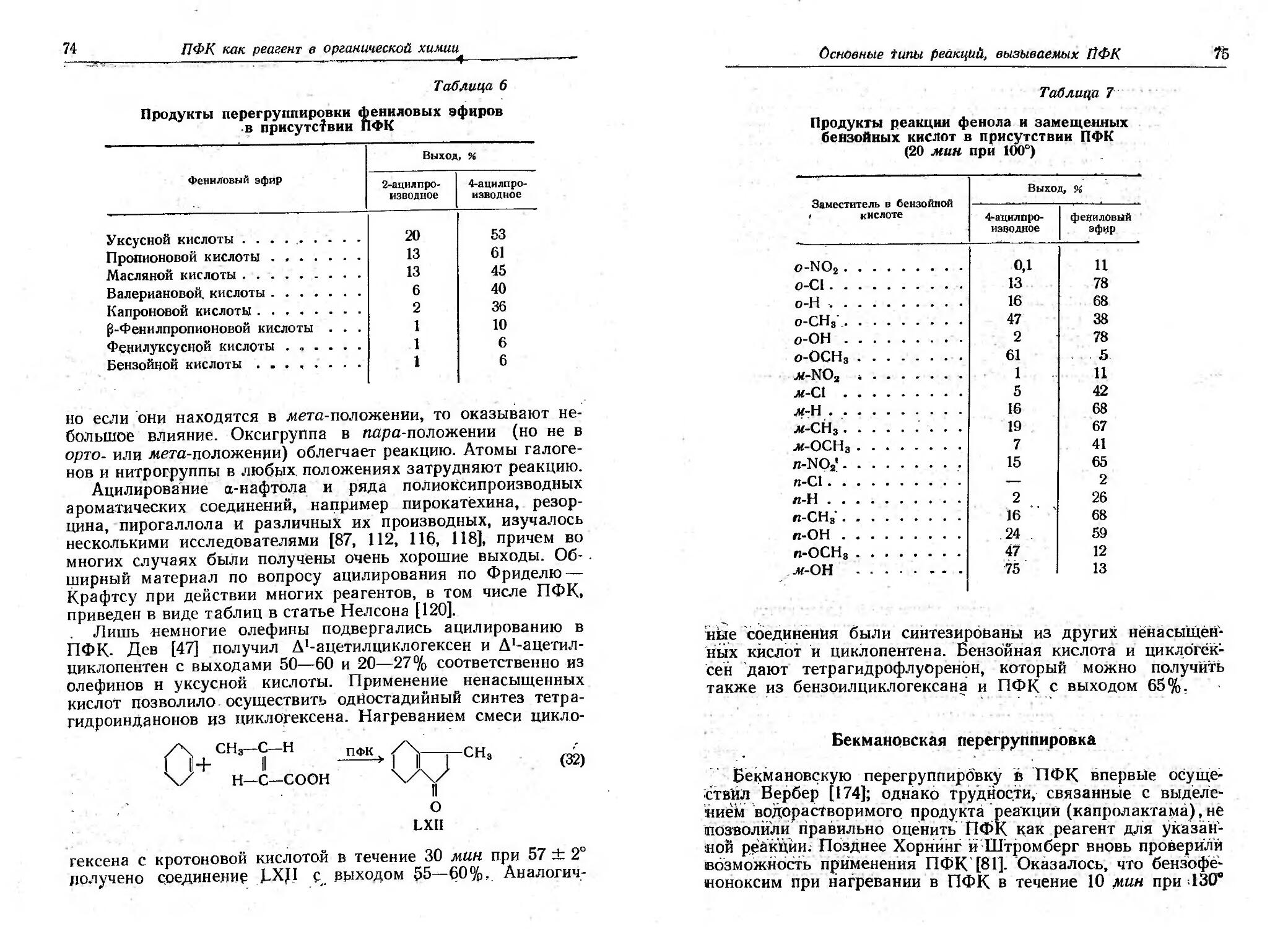
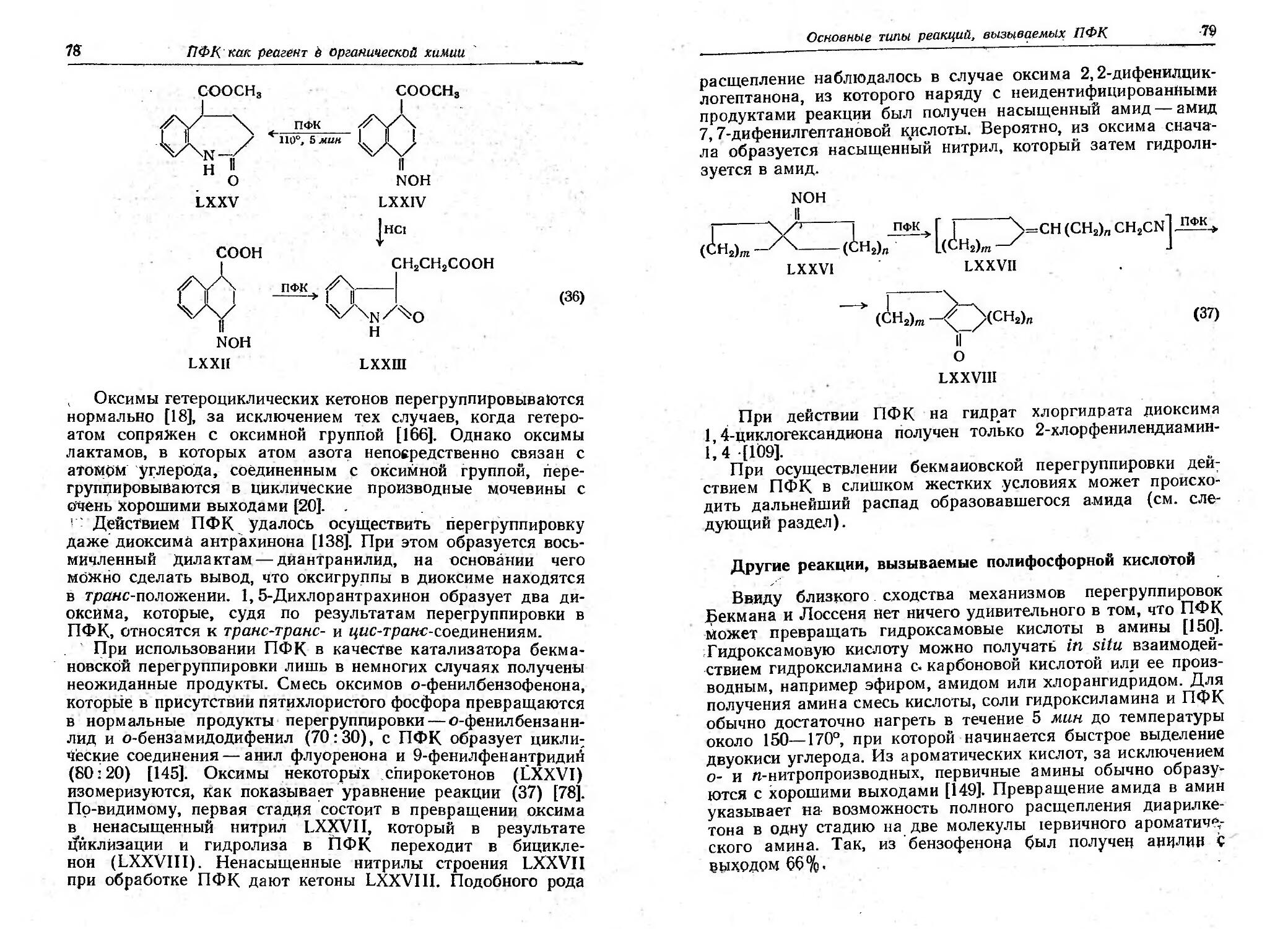
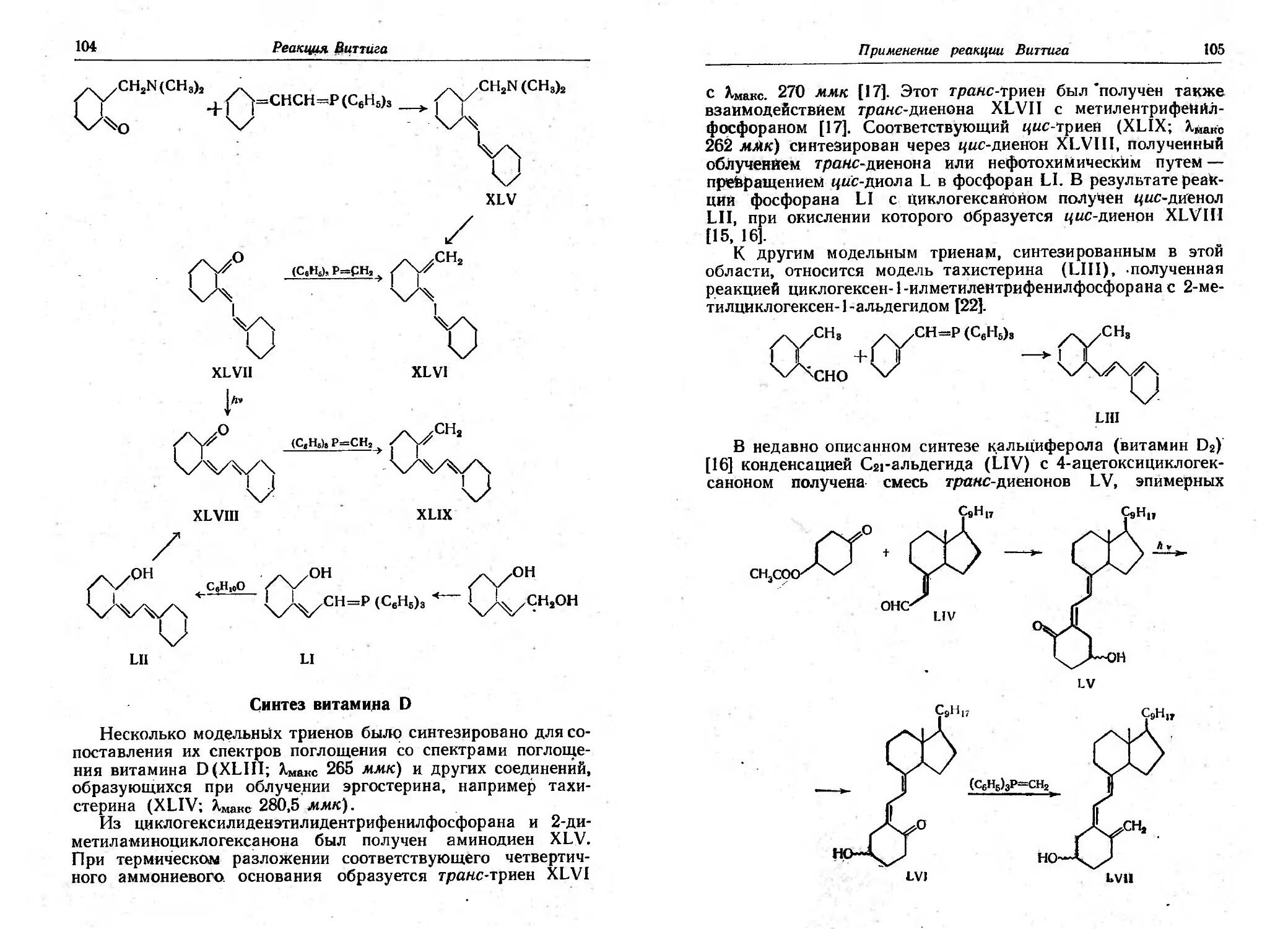
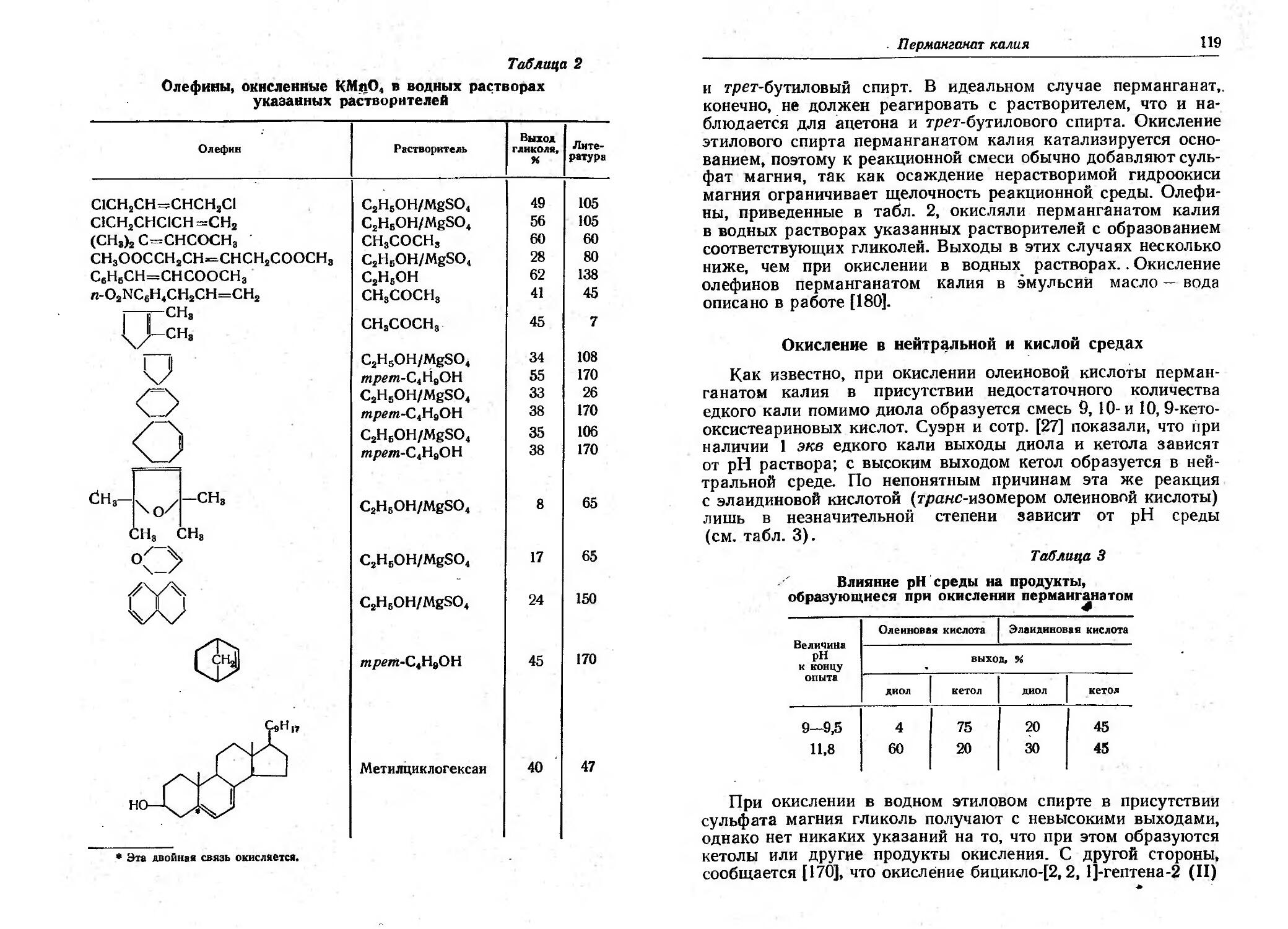
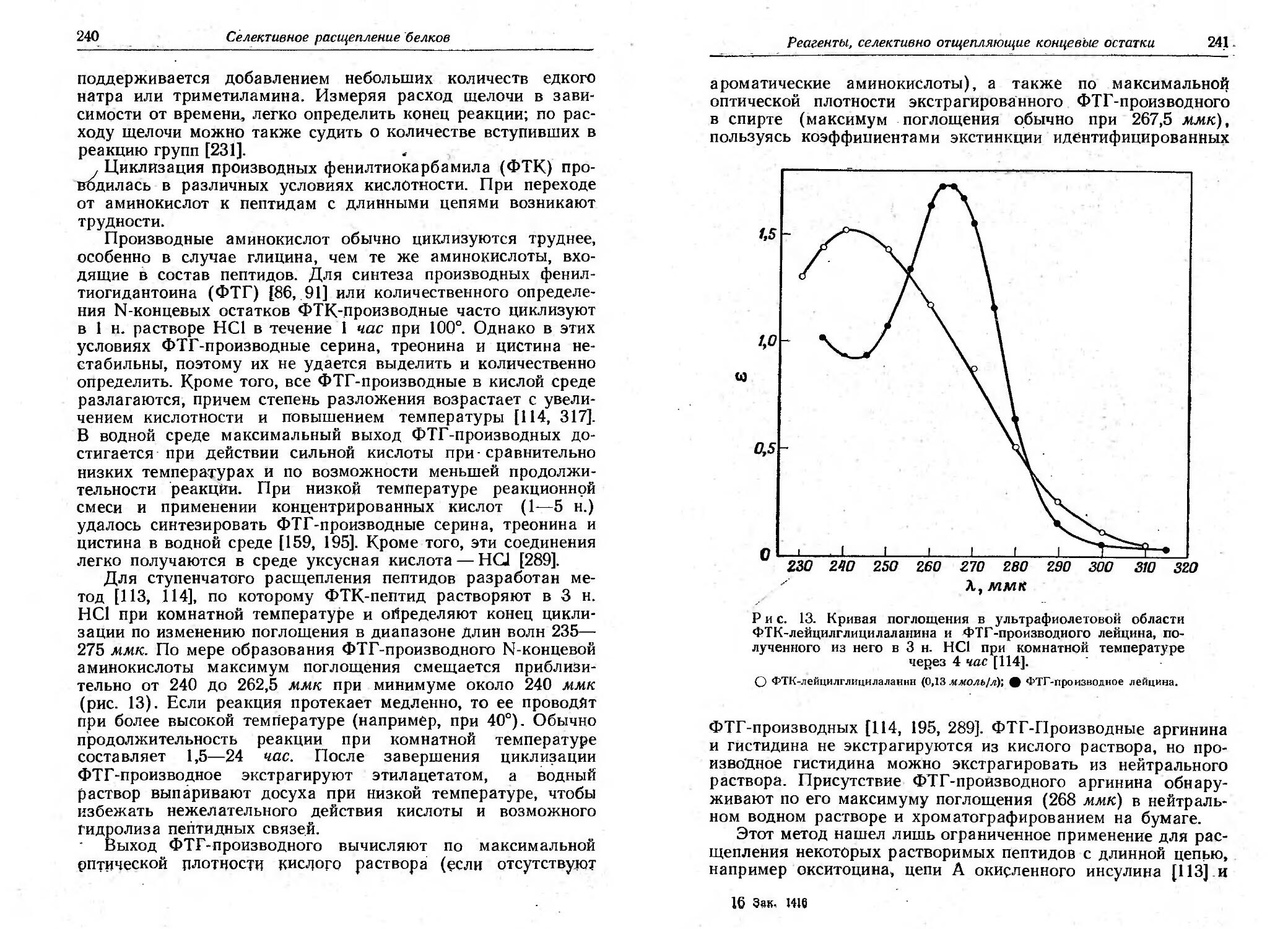
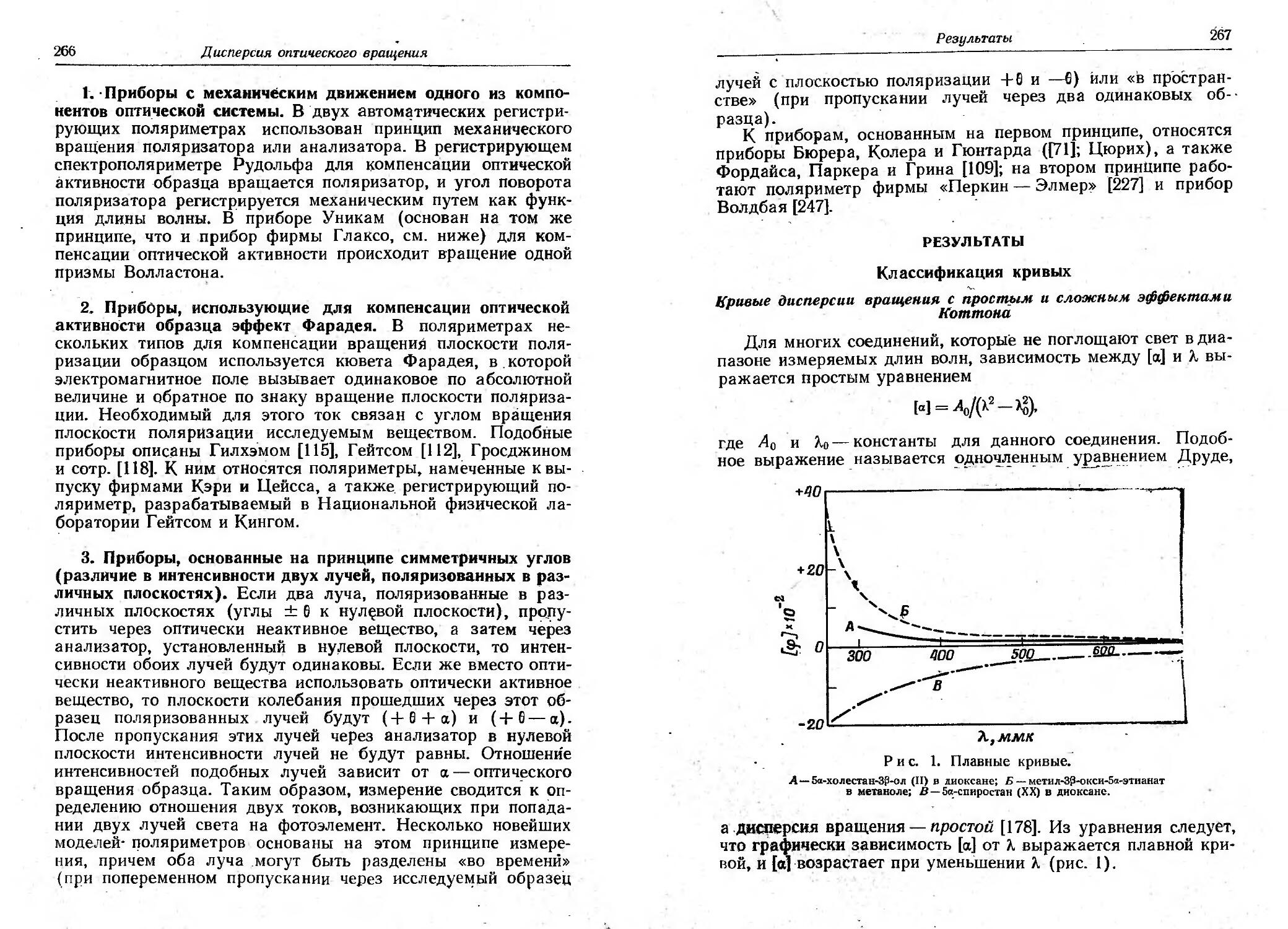
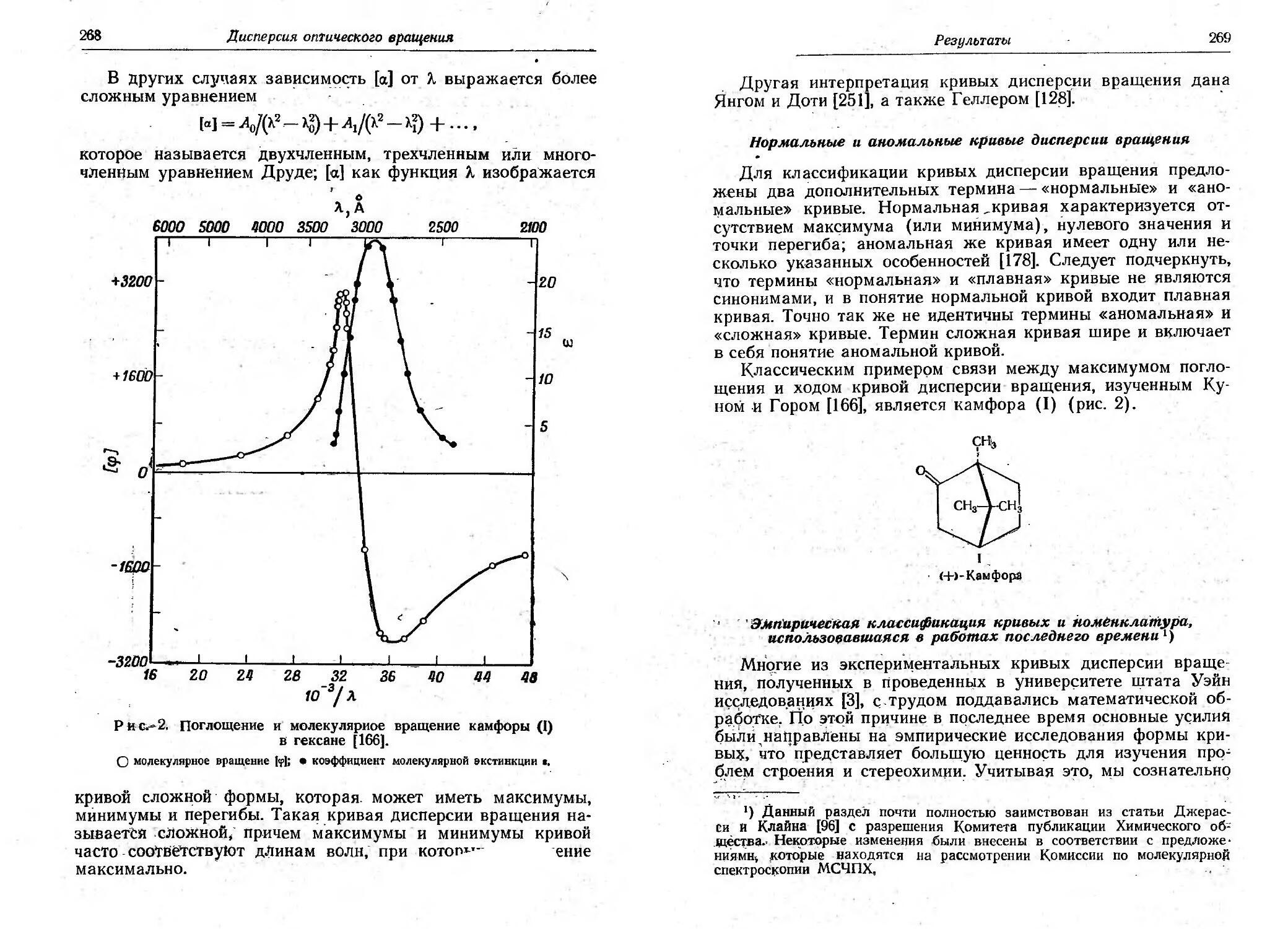
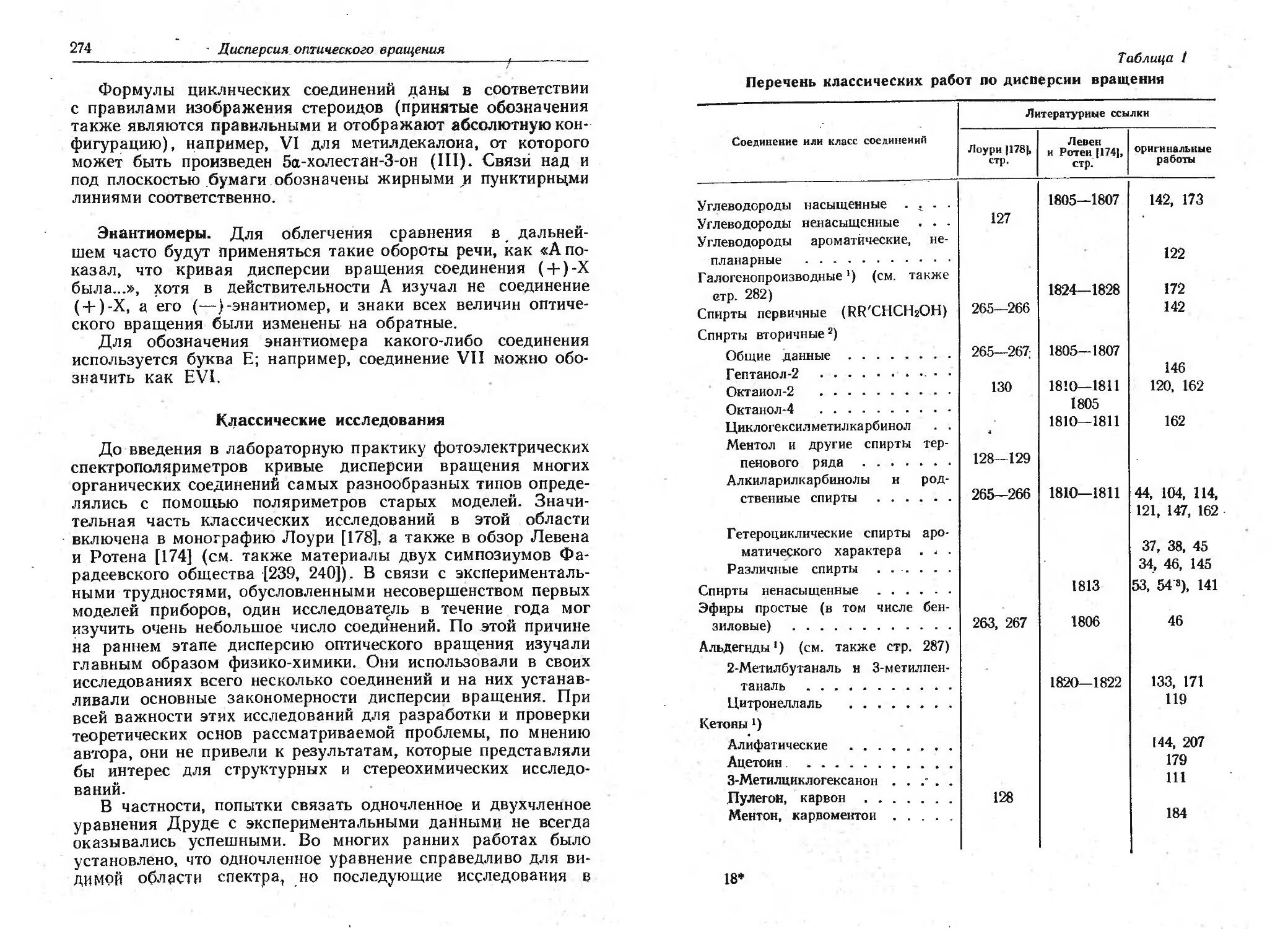
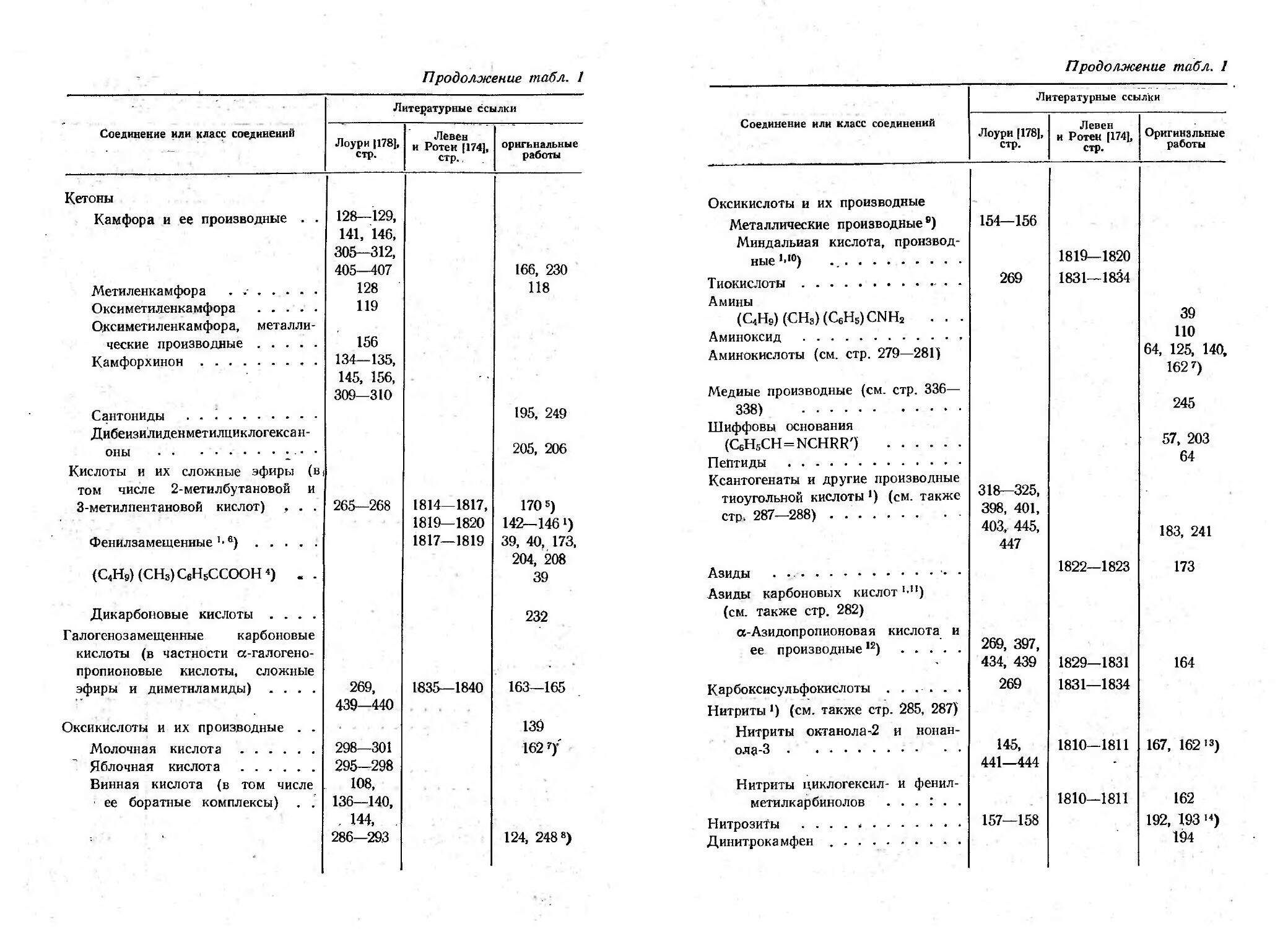
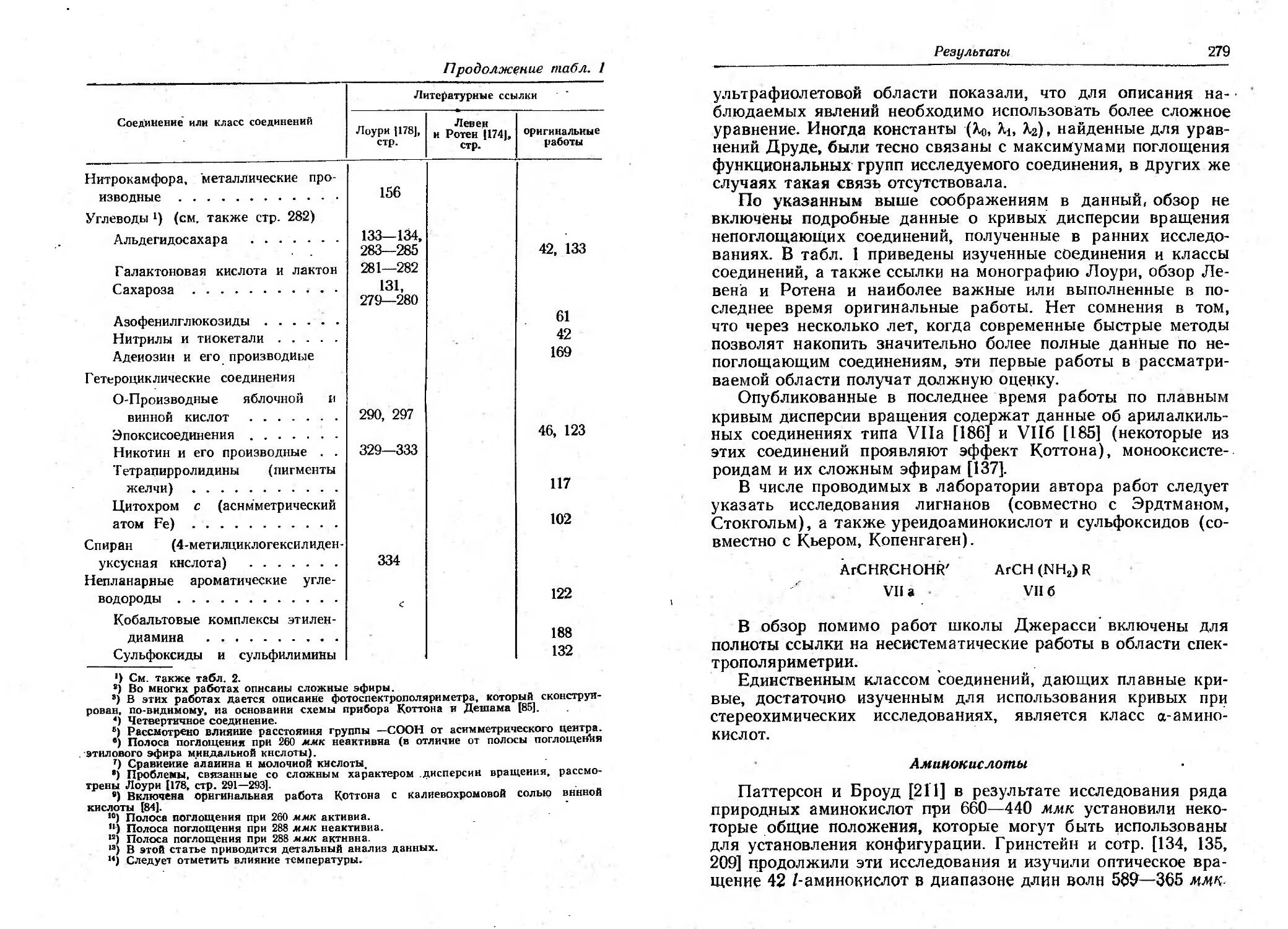
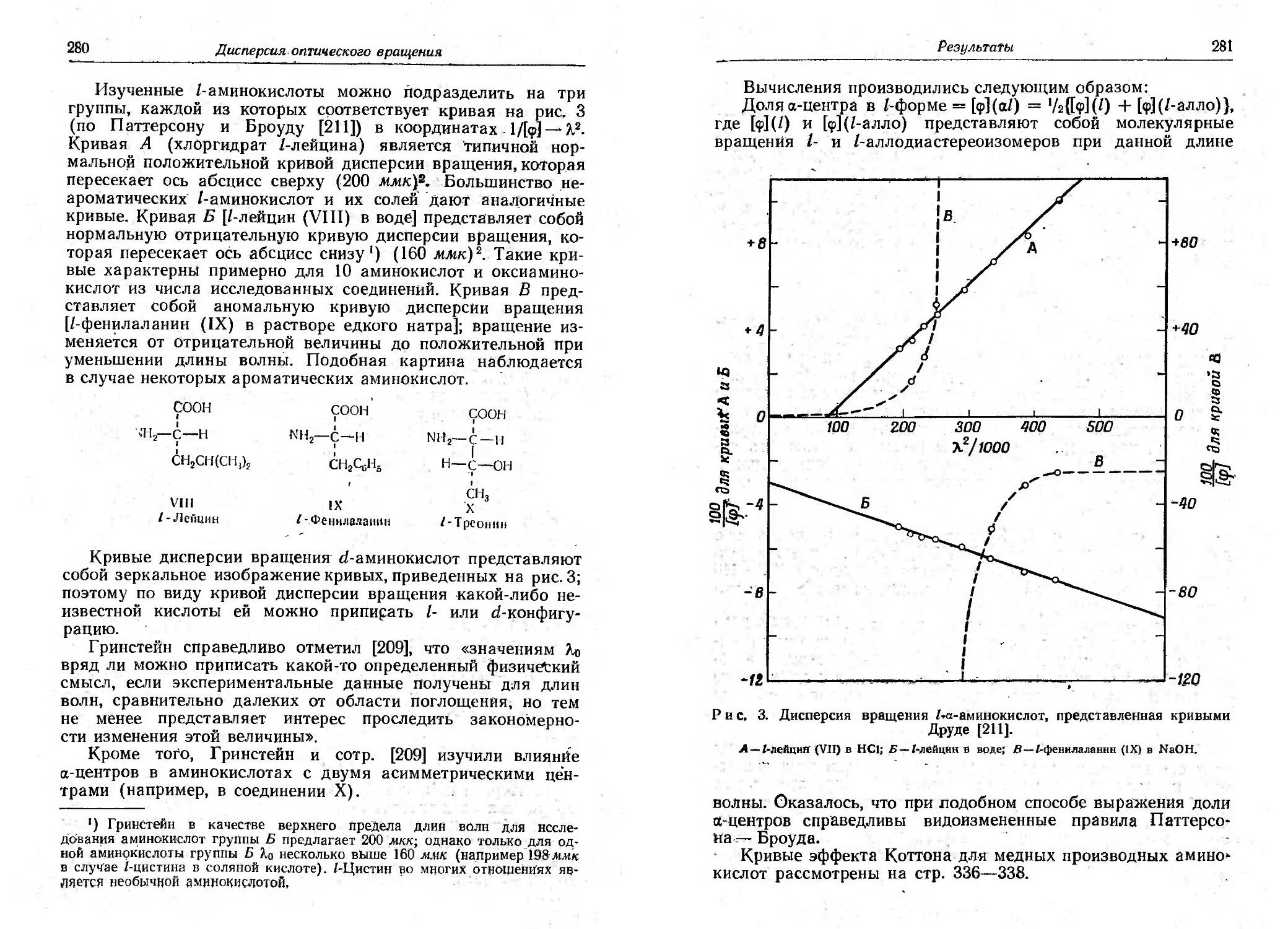
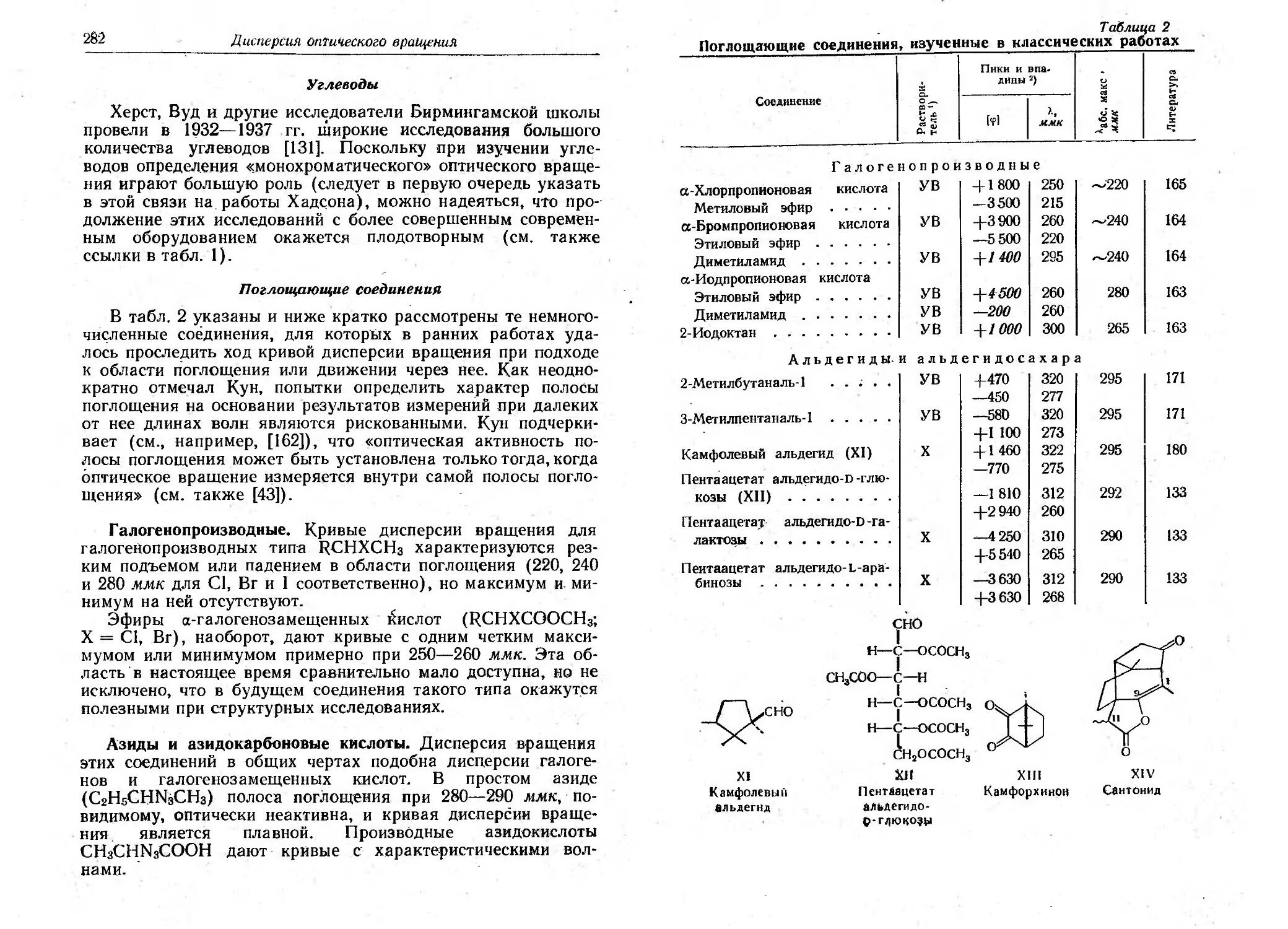
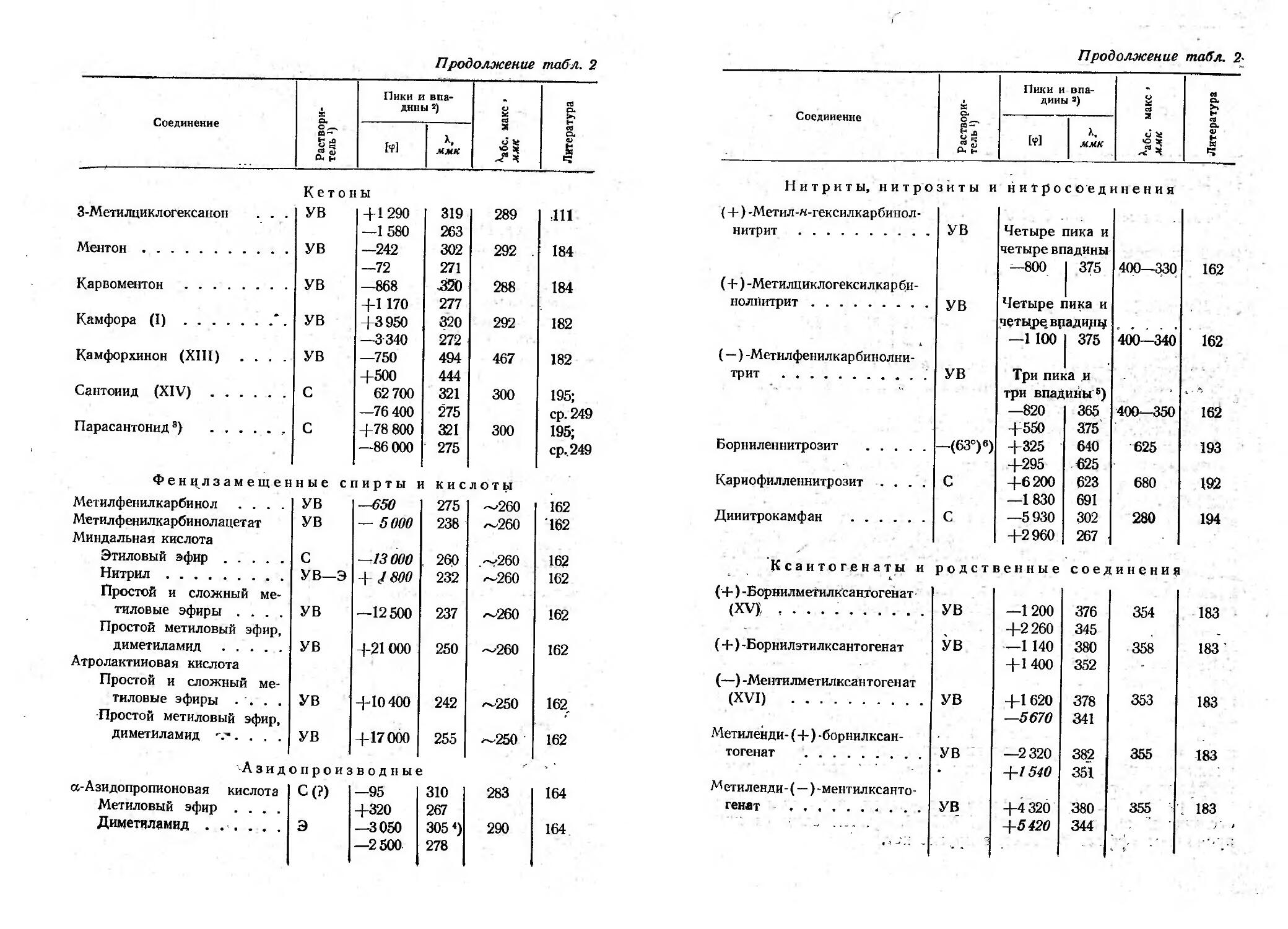
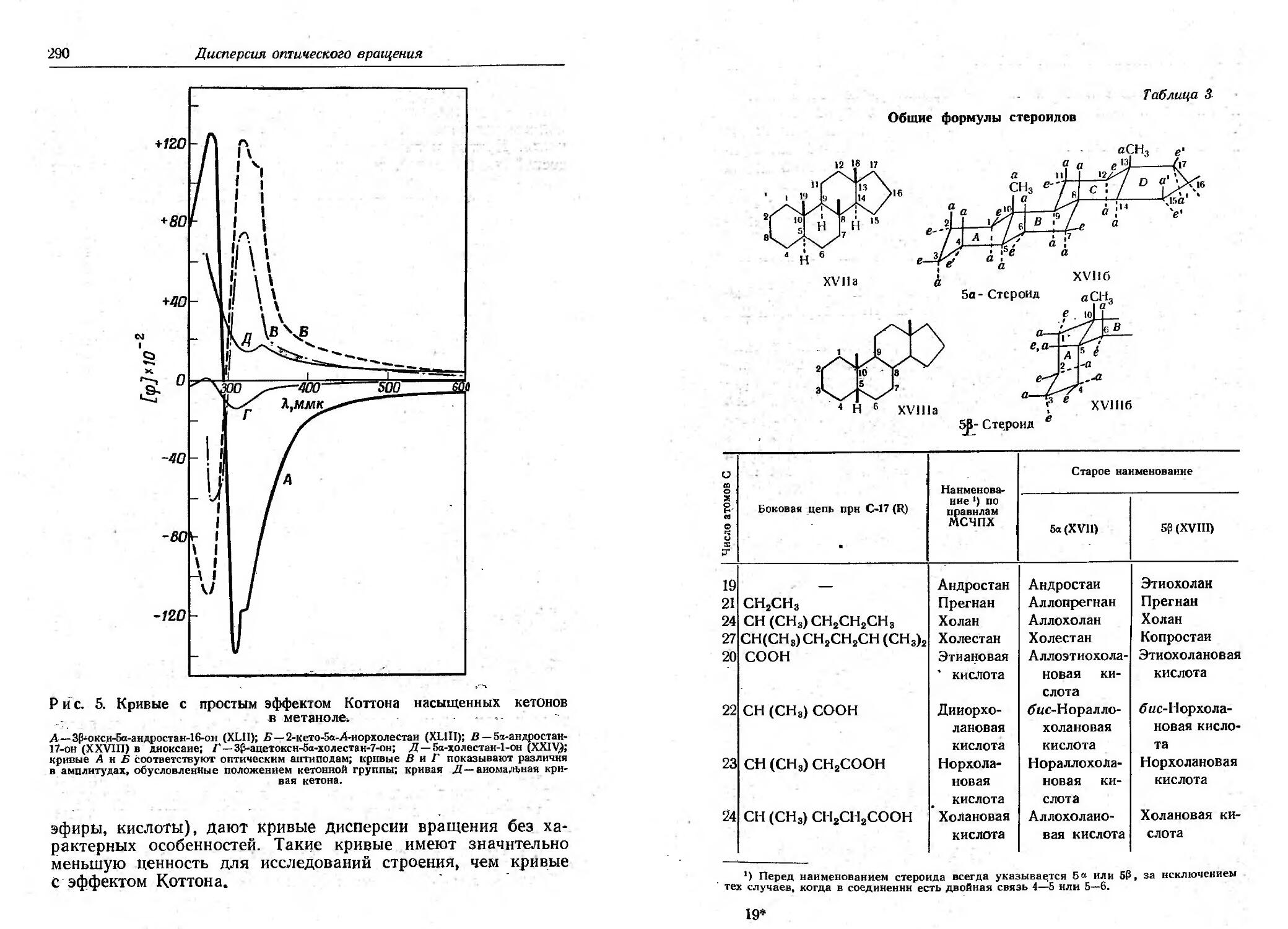
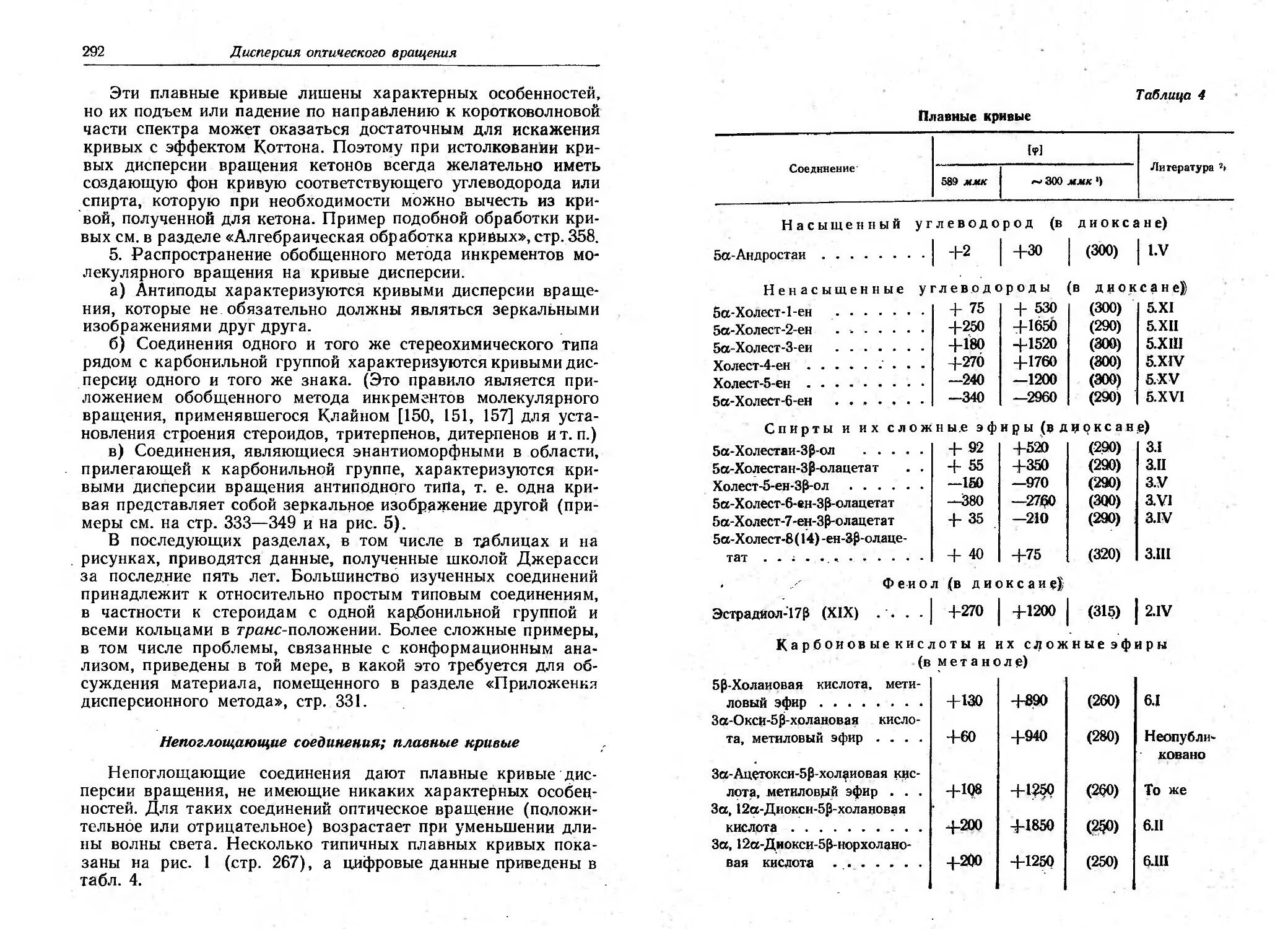
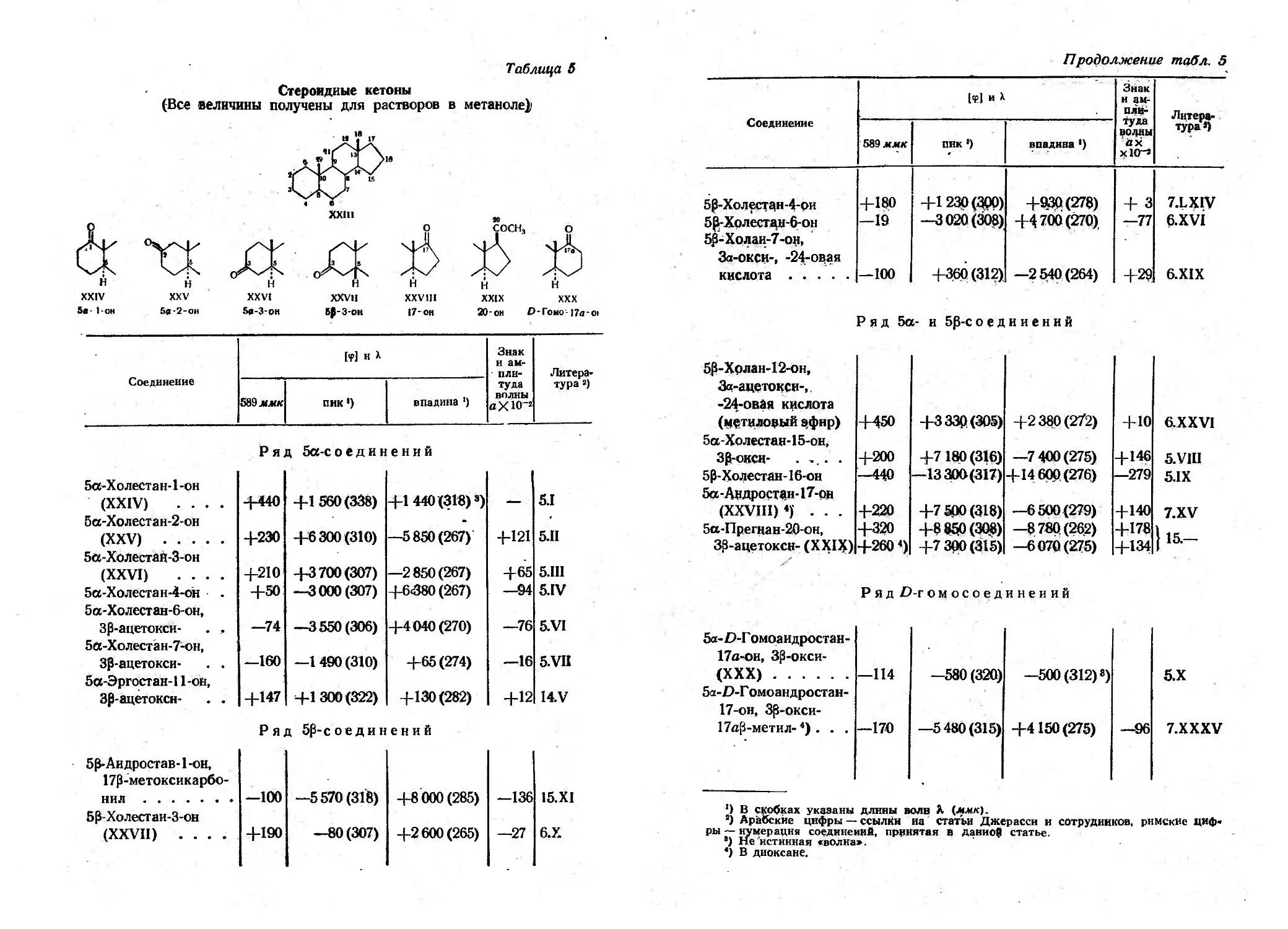
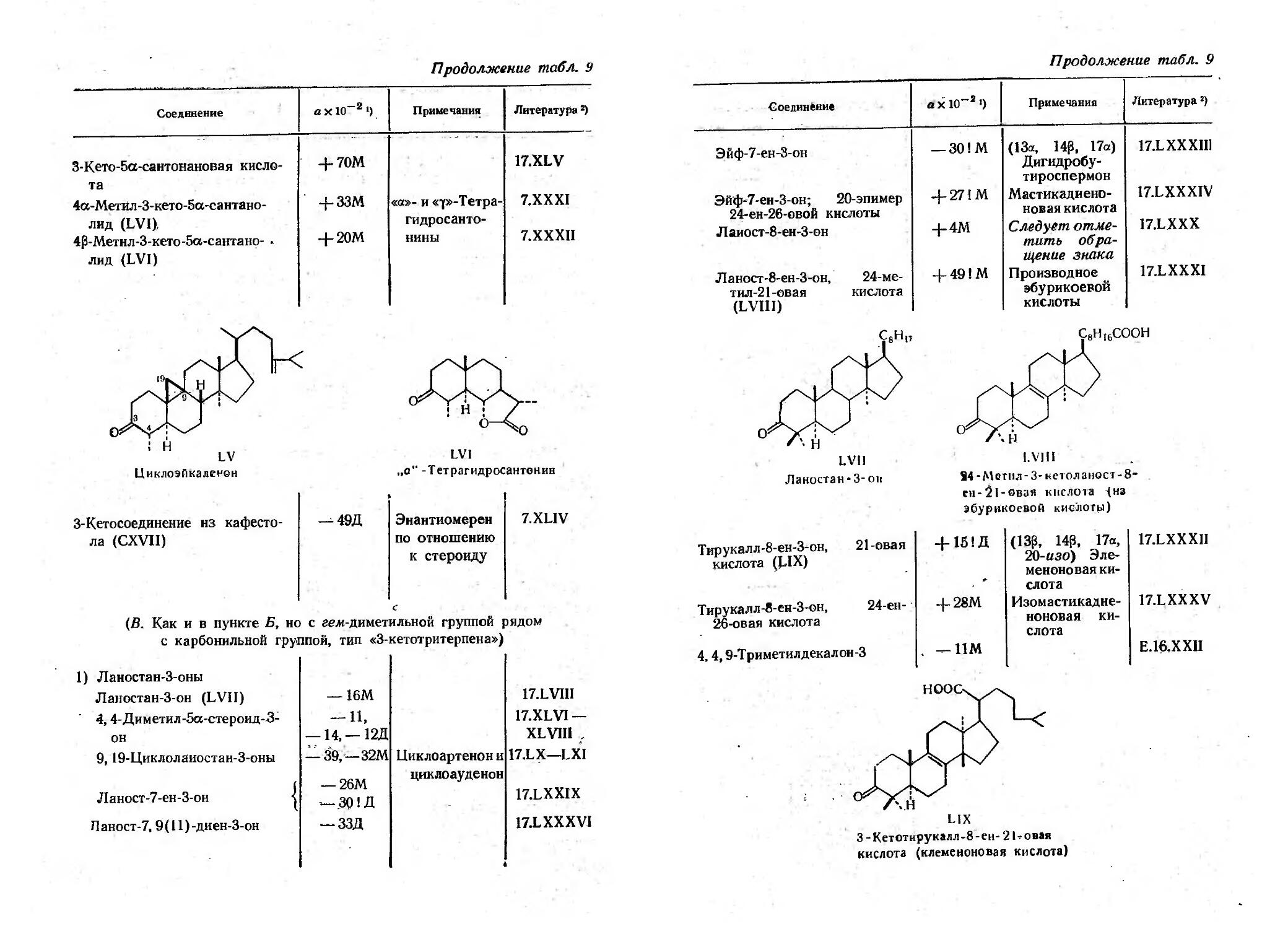
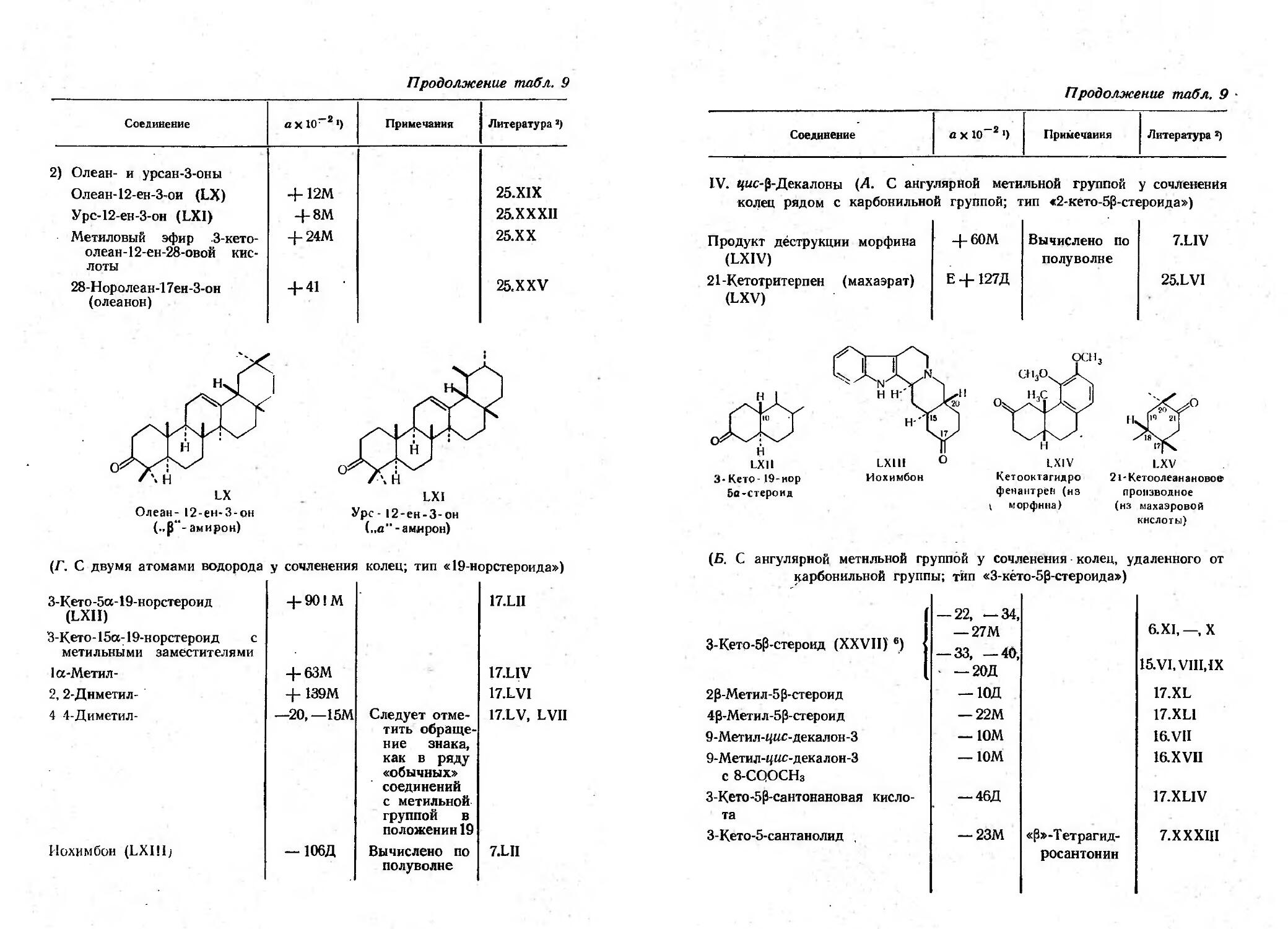
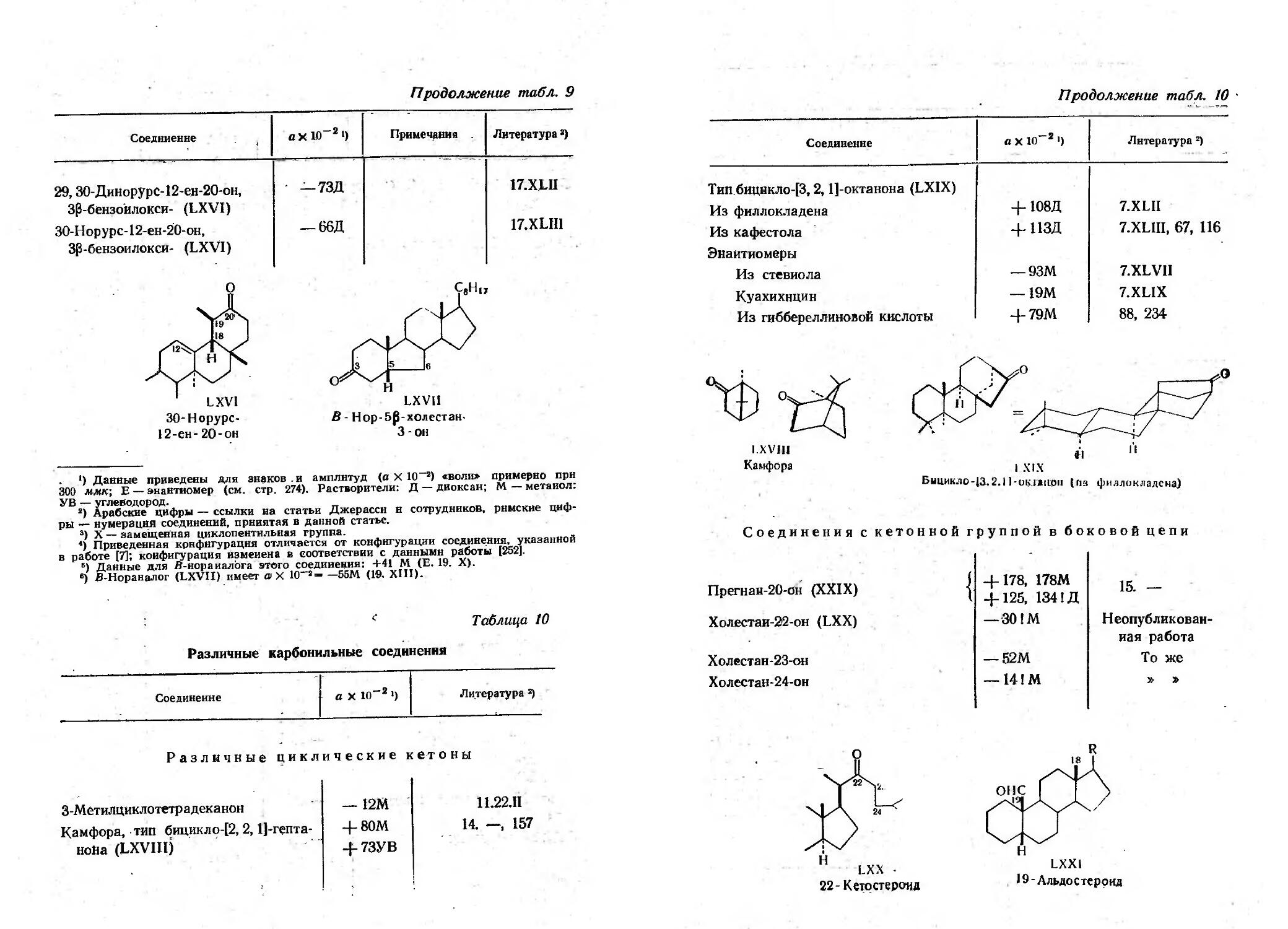
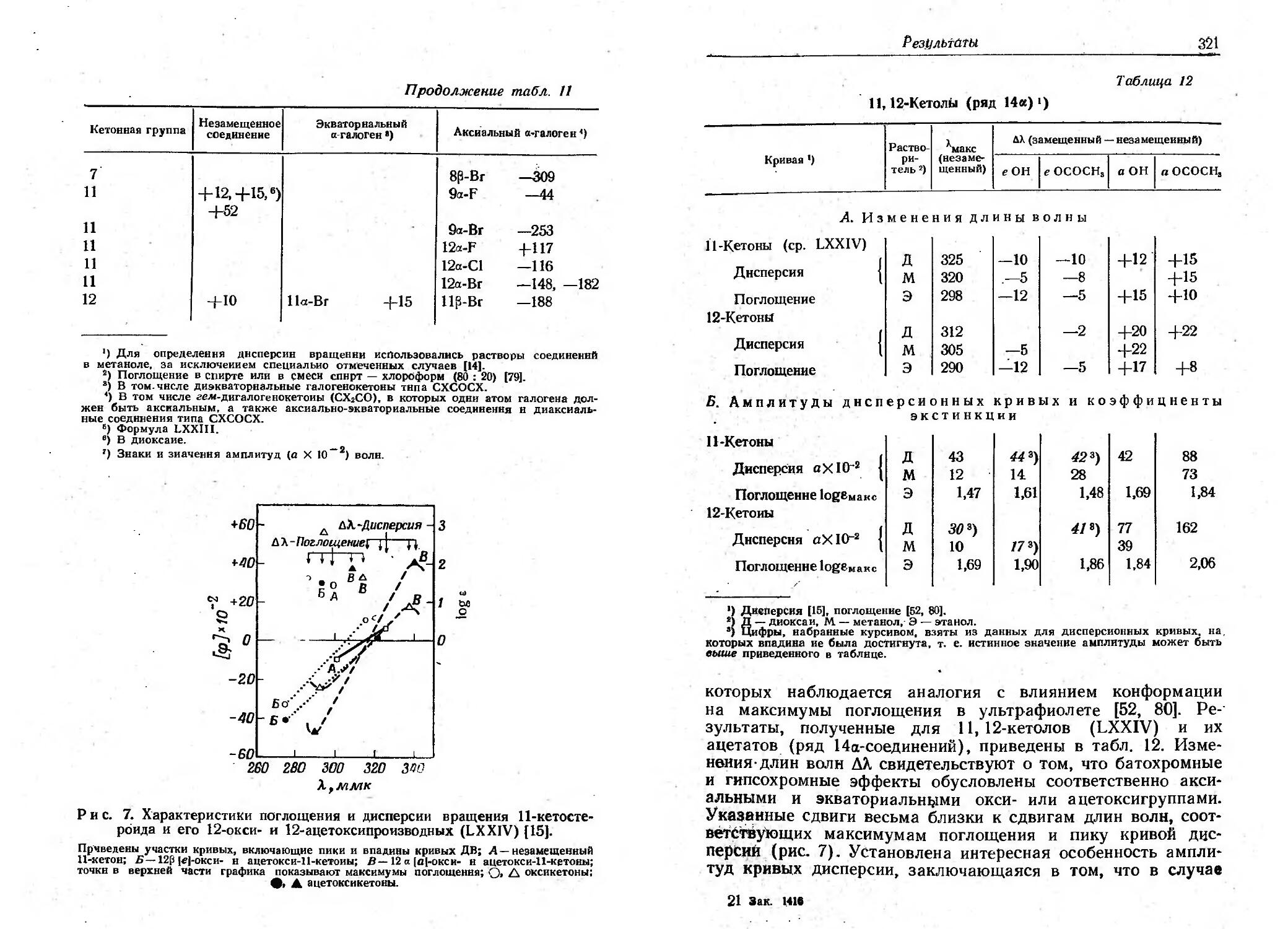
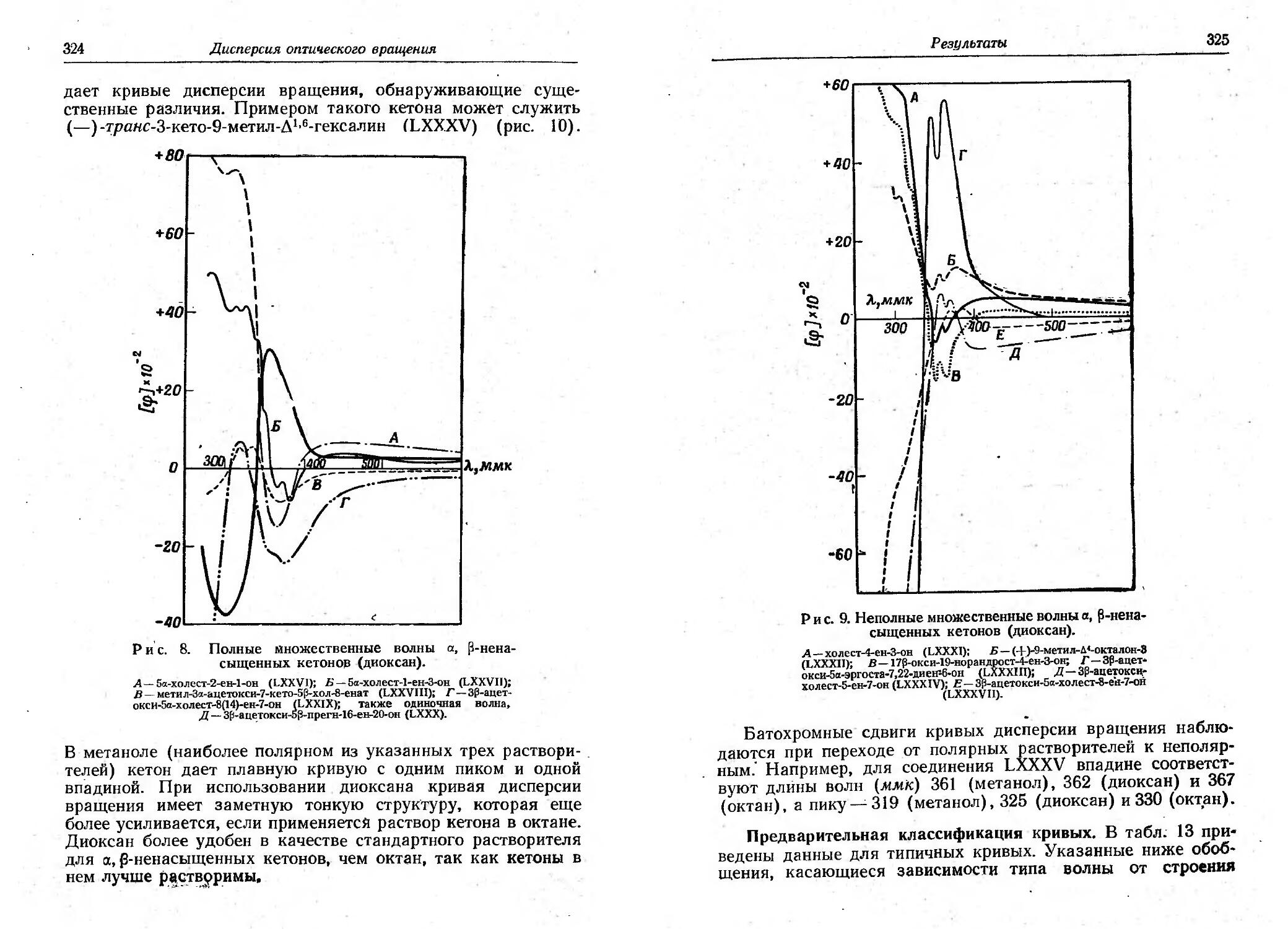
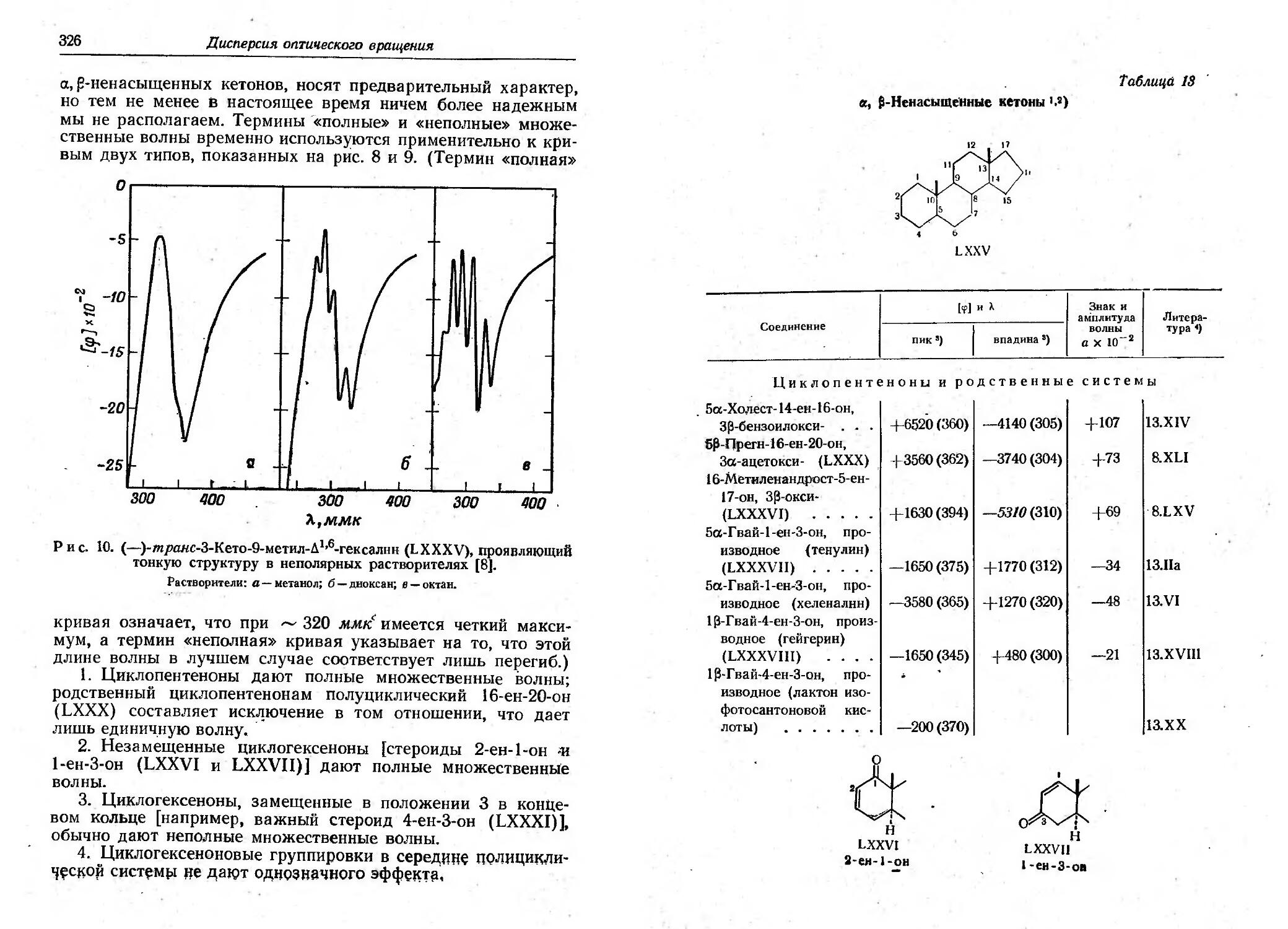
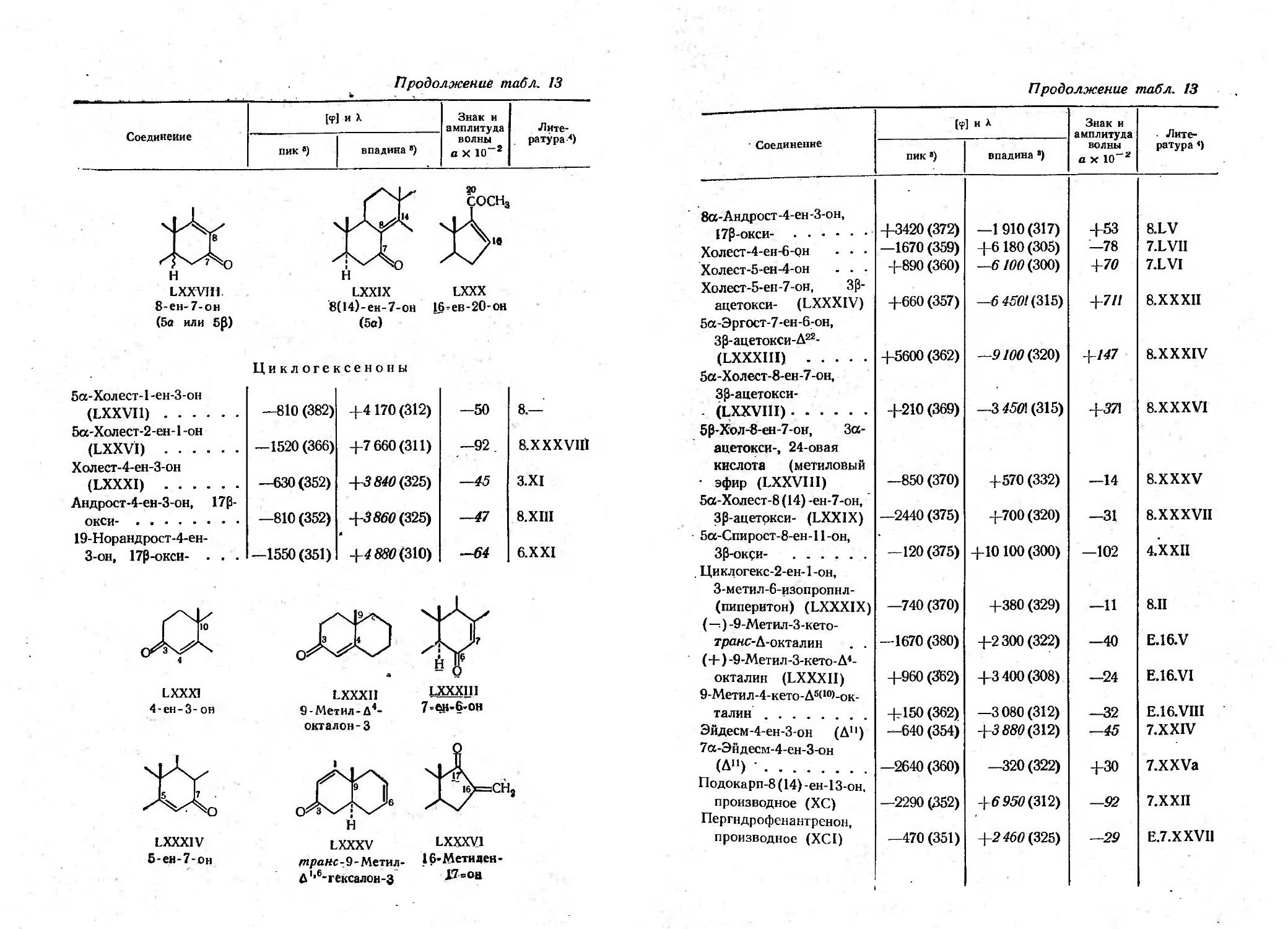
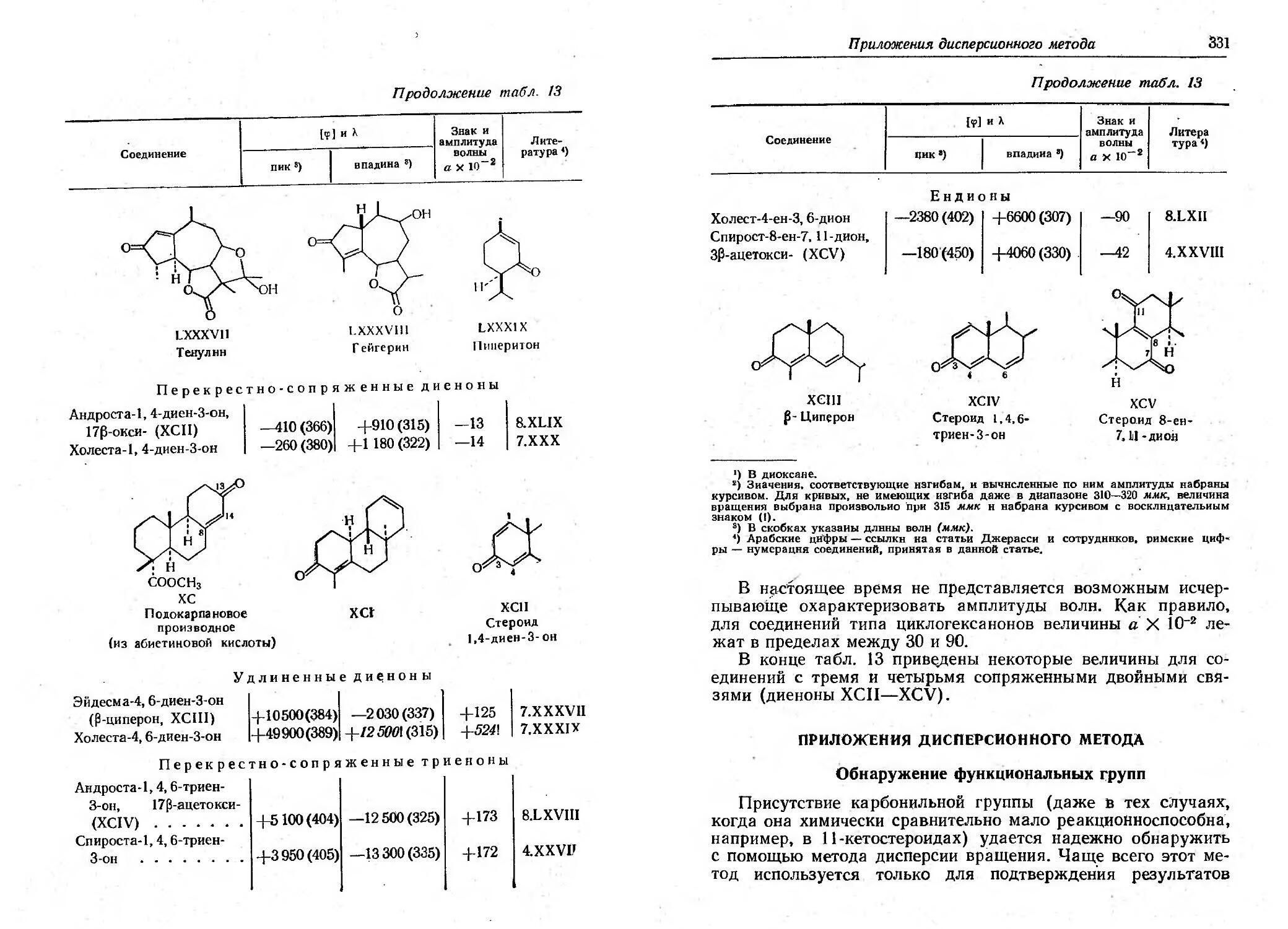
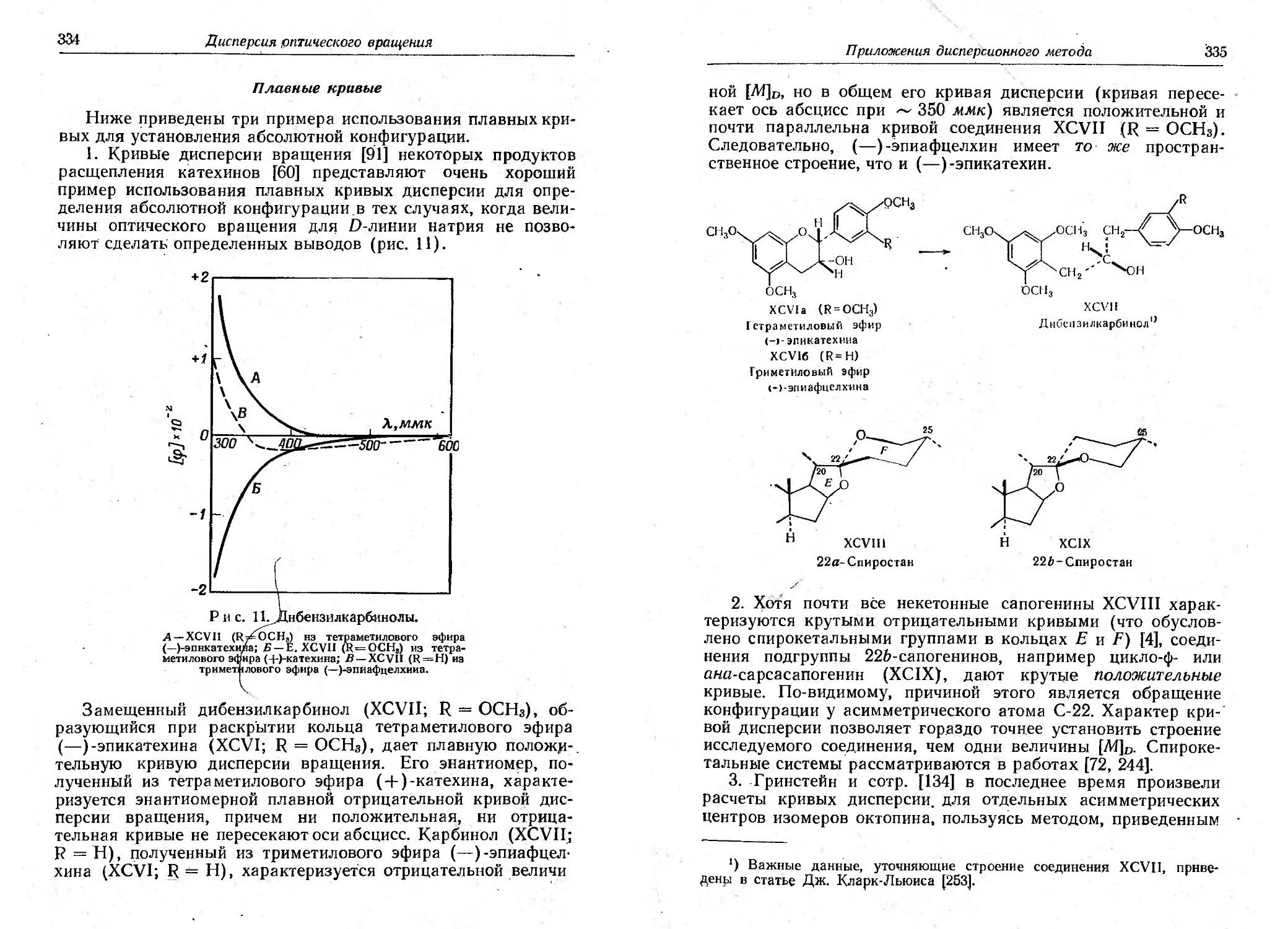
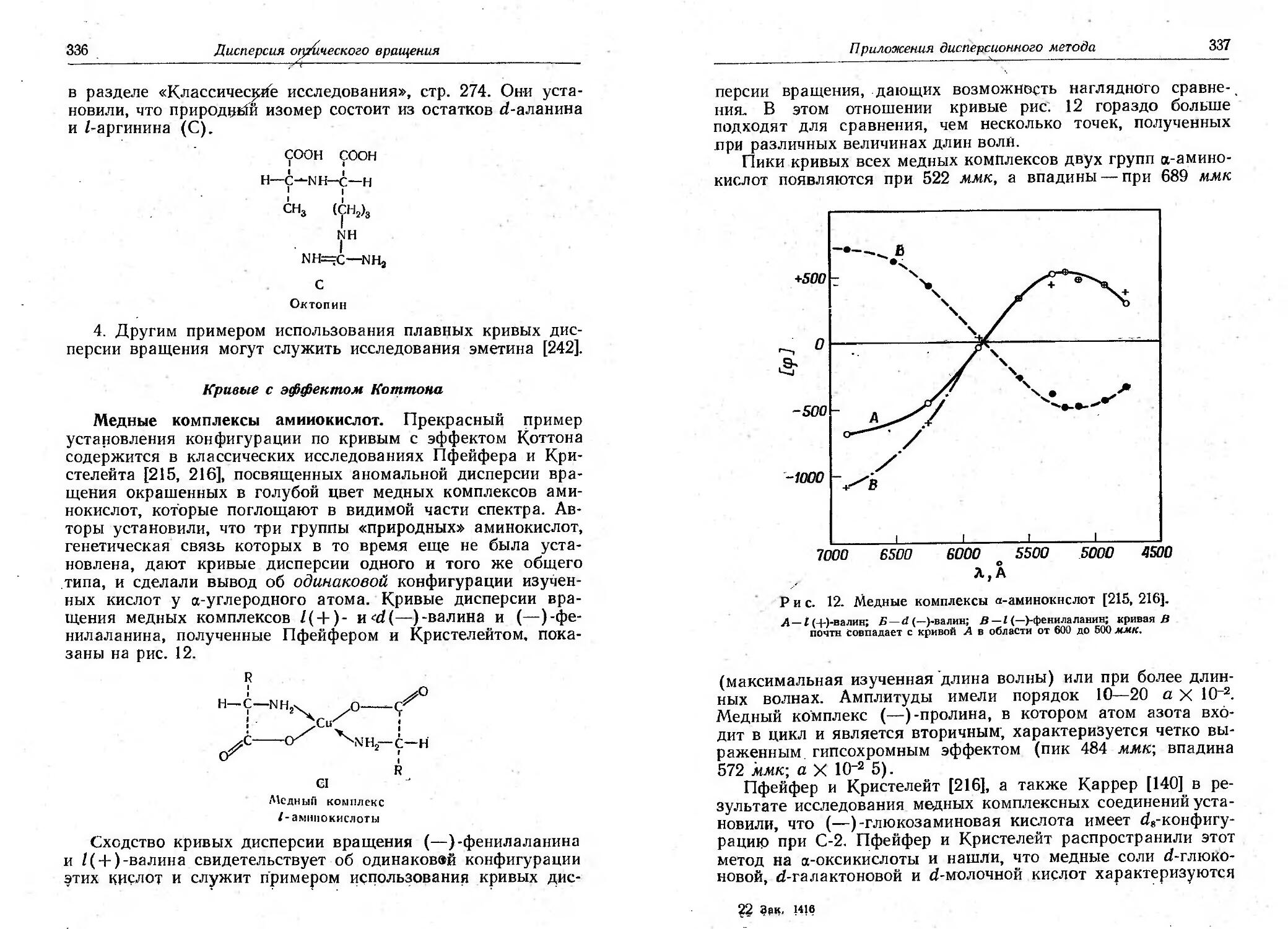
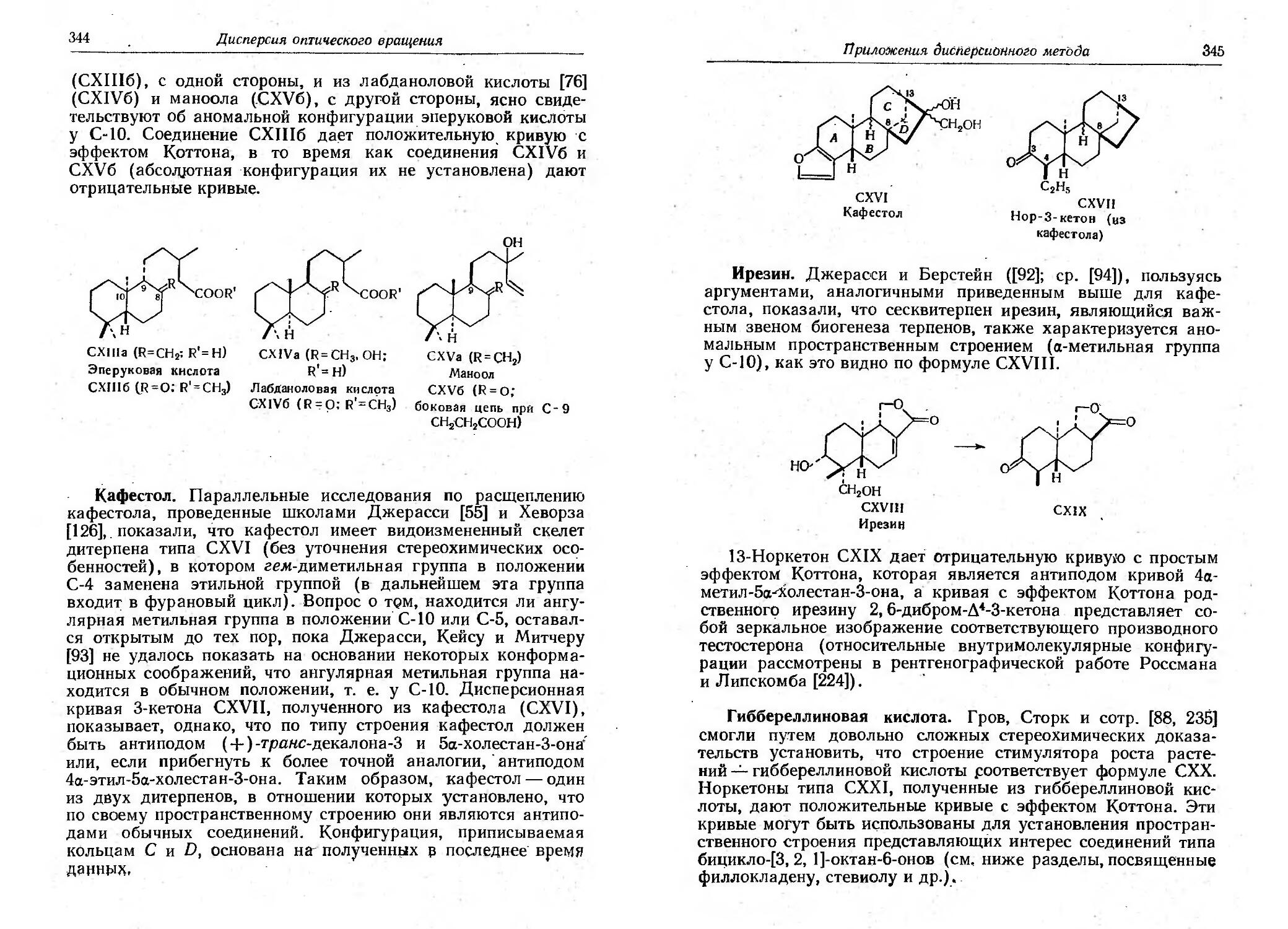
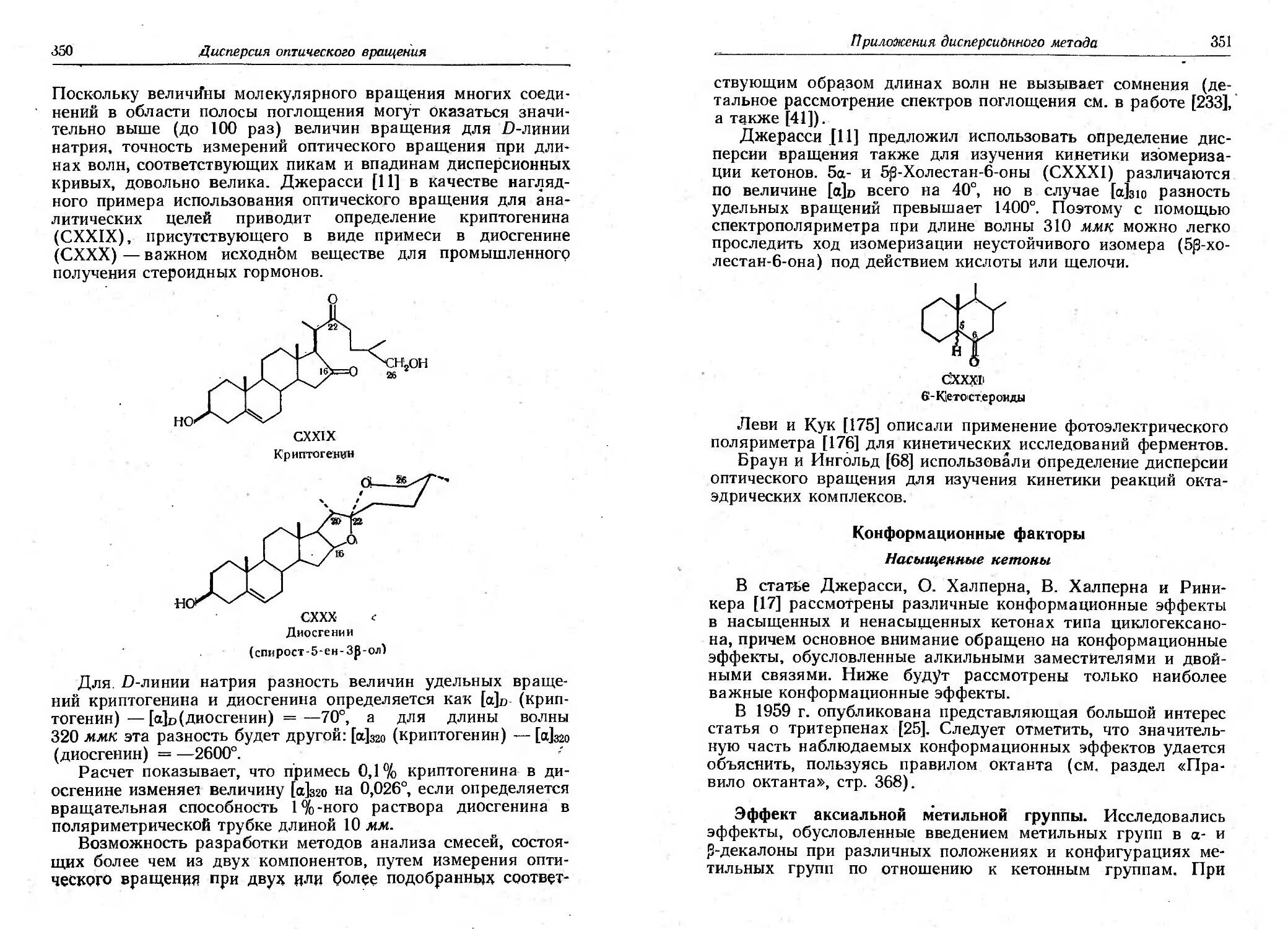
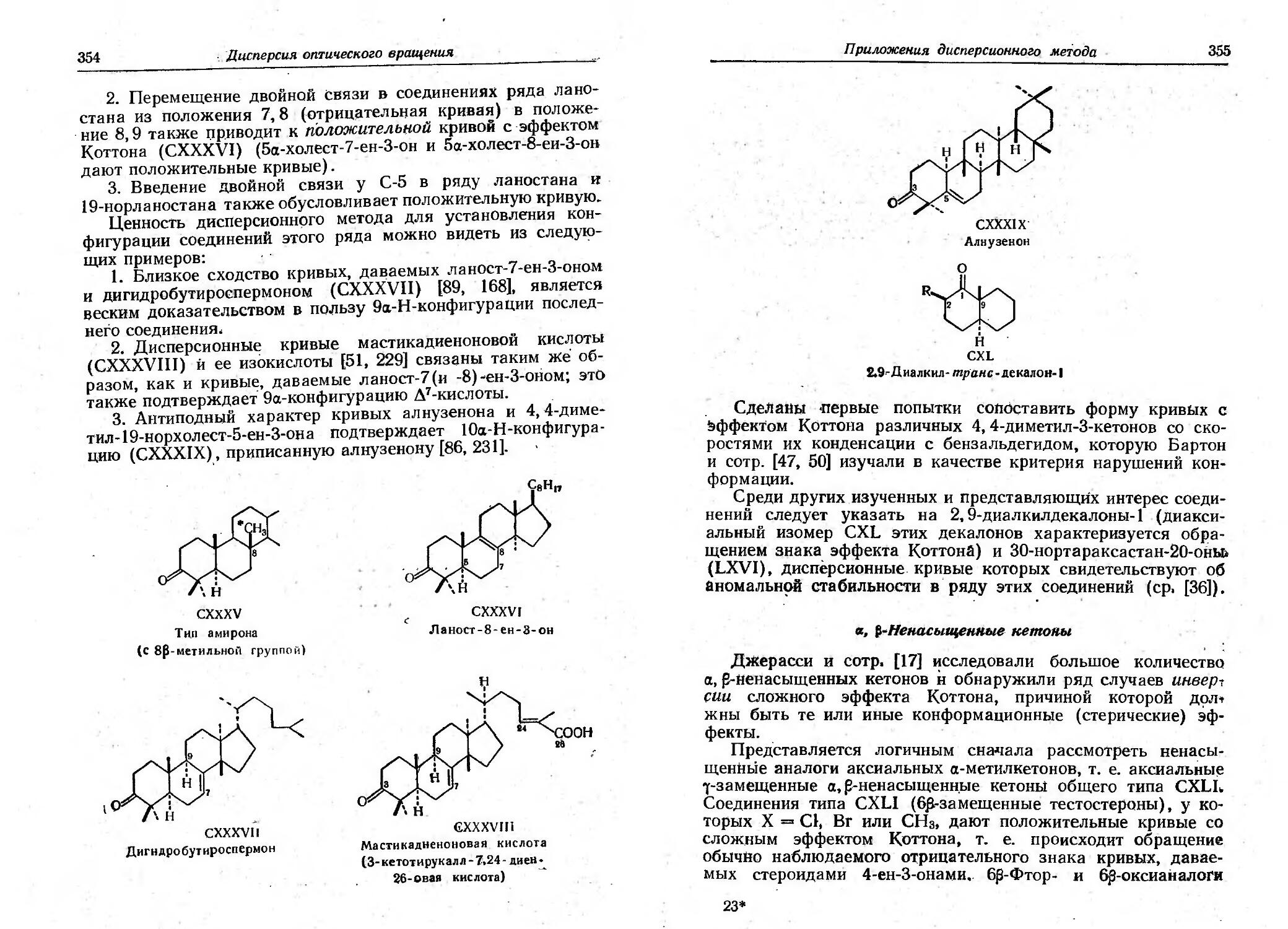
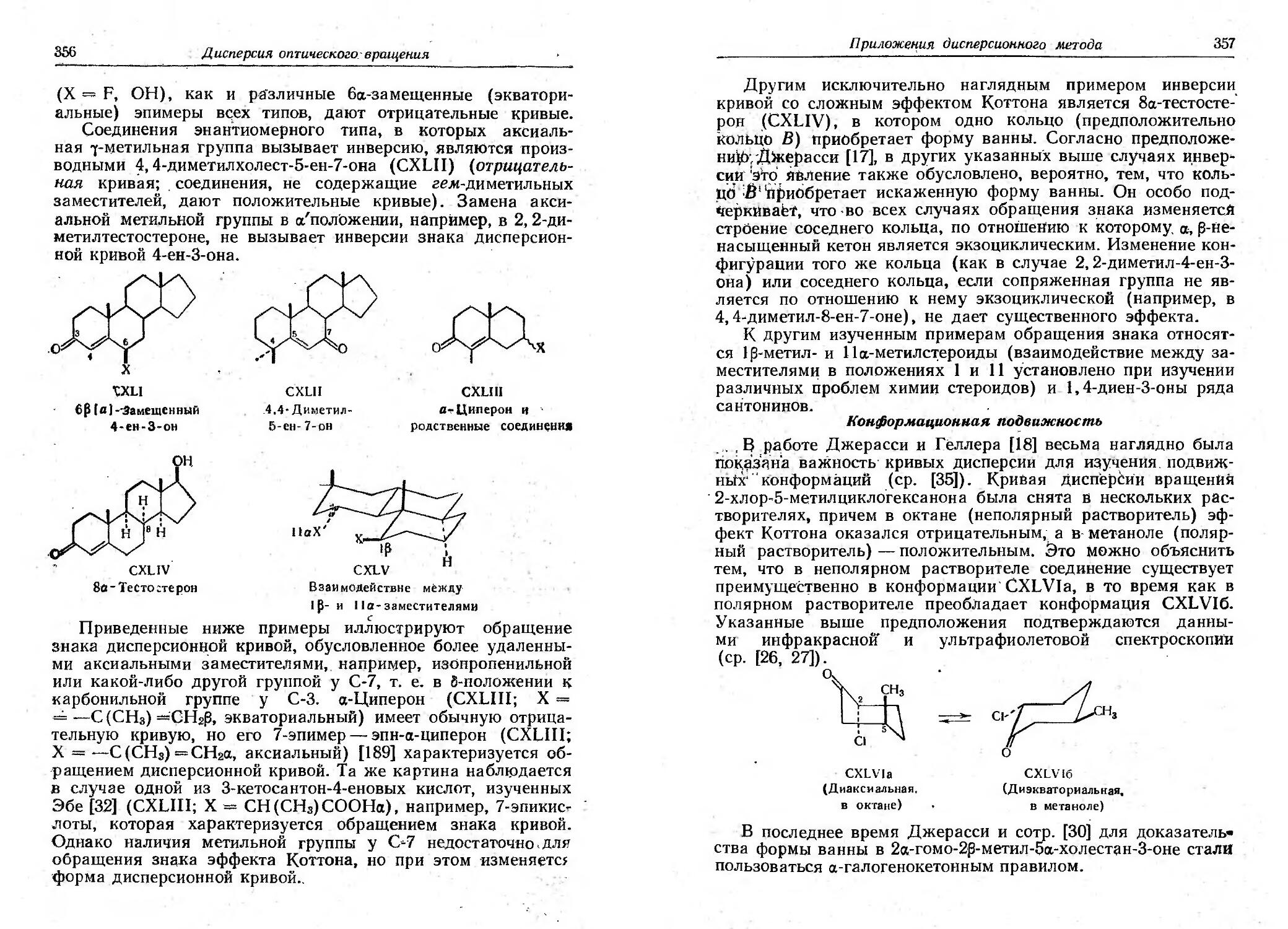
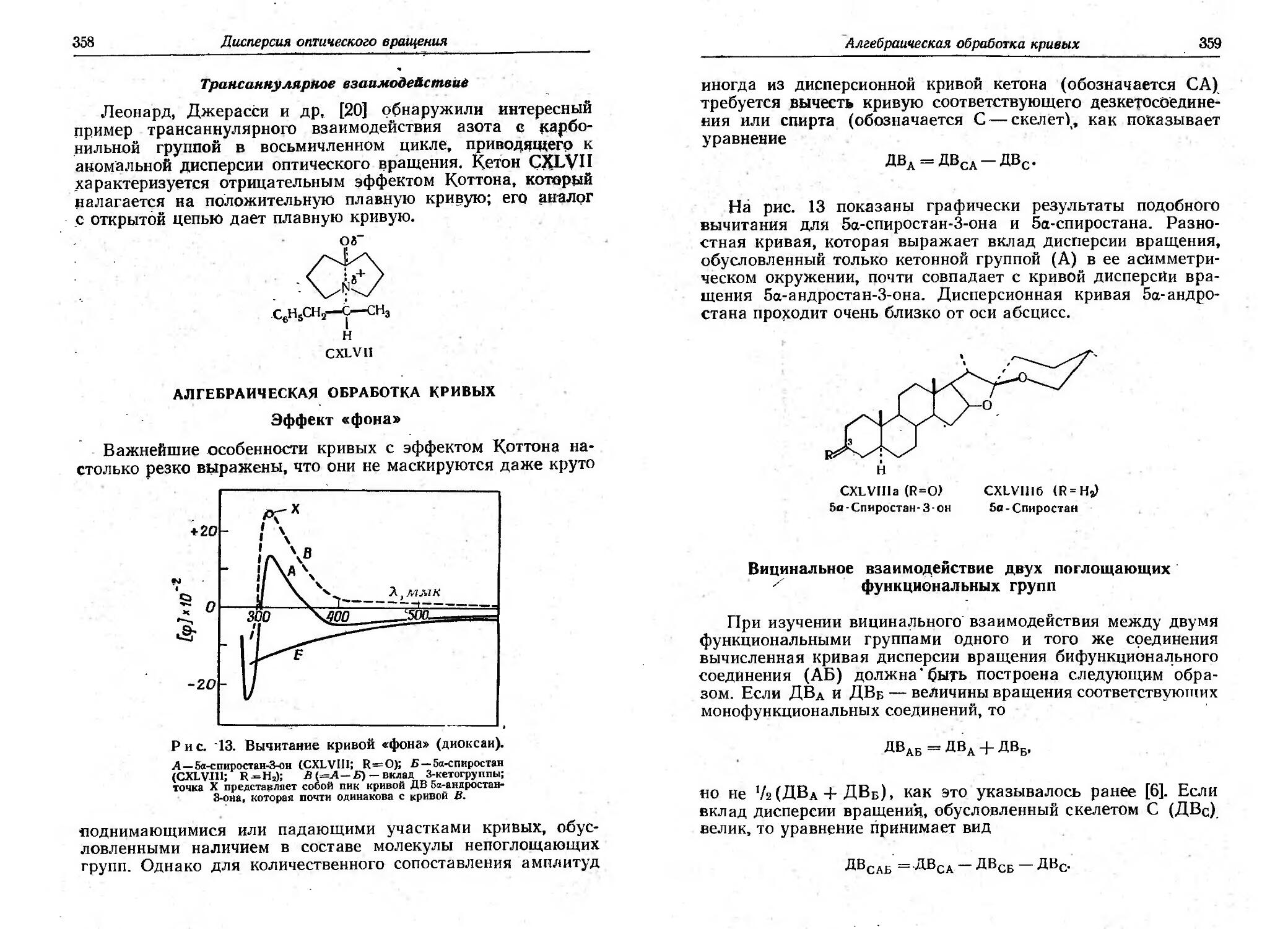
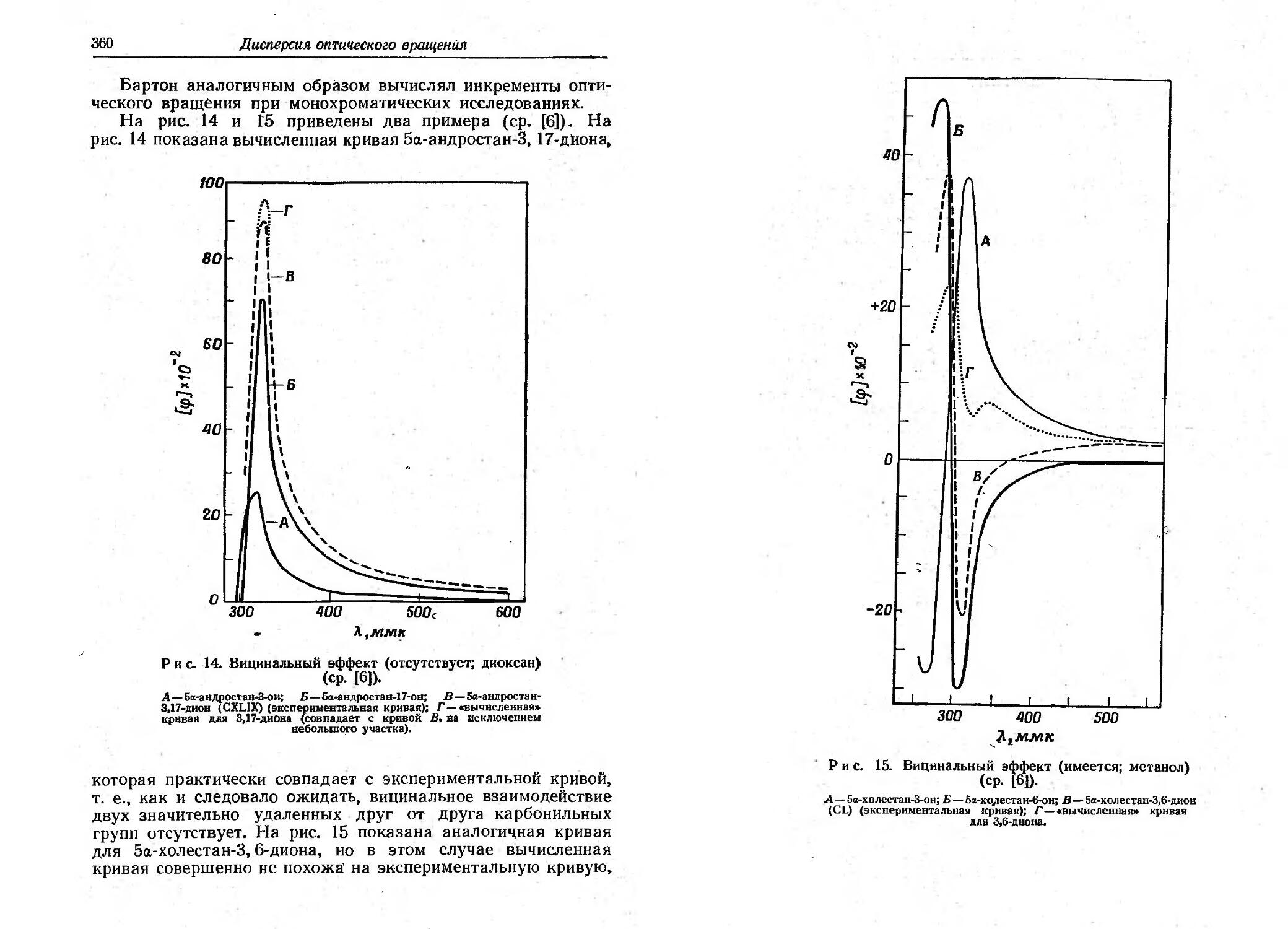
Текст
METHODS AND RESULTS
УСПЕХИ
орrАНИЧЕСКОЙ
ХИМИИ
ADV ANCES IN ORGANIC CHEMISTRY
VOLUME I
т о м 1
EdItors
. RALPH А. RAPHAEL, The University. OIasgow, Scotland
EDWARD С. TAYLOR. Princeton UniversIty, Princeton, New Jersey
HANS WYNBERO. Tulane University, New Orleans, LouisIana,
and Rijksuniversiteit, Leiden, ТЬе Netherlandf
ПЕРЕВОД С АнrлИйскоrо
канд. ХИМ. наук Я. Ф. КОМИССАРОВА
ПОД РЕДАКUИЕЙ
академика И. Л. КНУНЯНЦА
1 960
INTE
SCIENCE PUBLISHERS, INC., NEW YO
K
INTE
SCIENCE PUBLISHE
S LTD., LONDON
МОСКВА 1963
ИЗДАТЕЛЬСТВО ИНОСТРАННОЙ ЛИТЕРАТУРЫ
от РЕДАК.ции
КИИfа представляет собой первый том серии с'борииков
"по актуальным вопросам орrанической .химии. В книсе
помещены шесть обзорных статей, которые содержат новей-
шие данные по электролитическому сиитезу Кольбе, полифос-
фориой кислоте как реасенсу в орrанической химии, реакции
Виттиrа, методам rидроксилирования, селективному расщепле-
нию белков, а также по вопросу дисперсии оптическоrо вра-
щения и изучению строения орrанических молекул. В каждой
статье рассматриваются сущиость и механизм реакций, обла-
сти их применения и причины, orраннчивающие возм жность
их приме.иения. Особенио подробио patcMoTpeны условия
экспериментальиоrо осуществления отдельиых методов и воз-
можные побочные реакции.
Книса предназначена для широких KpyroB химиков орrа-
ников.
Редакция литературы по химии
Предлаrаемая вниманию читателя книrа представляет
собой первый том новой серии сборников «Успехи орrаниче-
ской химии», включающих ряд статей, посвященных описанию
типичных синтетических реакций и новых методов исследова-
ния орrанических .соединений. .
1( участию в составлении сборников привлечены ведущие
специалисты разных стран.
В первый том вошли статьи, охватывающие ШИр JКий Kpyr
вопросов. Так, в статьях «Реакция Виттиrа» и «Методы rид-
роксилирования» (окисление олефинов в вицинальные rли-
коли) рассматриваются важнЫе методы синтетической opra-
нической химии. Особый интерес представляет подробно
изученная лишь в последнее время реакция Виттиrа, позво-
ляющая синтезировать различные соединения с межуrлерод-
ной двойной связью (в частности, полиены и каротиноиды) из
соединений типа трифенилфосфинметиленЬв.
Специфическому препаративному методу посвящена
.статья «Элекrролитическая конденсация по Кольбе», вклю-
чающая описание аппаратуры и охватывающая исследования
последних лет, в том числе работы по установлению кон фи-
rурации природных ненасыщенных кислот.
Весьма актуальное значение приобрел а полифосфорная
кислота как peareHT для циклизации, аuилирования, бекма-
НОВСКой переrруппировки и т. д. Этот вопрос обстоятельно
рассмотрен в отдельной статье.
Важной проблеме, стоящей на rрани орrанической химии
и биохимии, посвящена статья «Селективное расщепление
белков», в которой рассмотрены методы расщепления белков
и полипептидов с целью установления их аминокислотноrо
состава и порядка расположения аминокислот.
Большое значение для установления конфиrурации при-
родных соединений приобрел метод дисперсии оптическоrо
вращения. Статью, посвященную этому методу, следует
6
От редакции
рассмат.ривать как дополнение к вышедшей недавно моно-
rрафии К. Джерасси «Дисперсия оптическоrо вращения»
(ИД 1962). .
1( особенноcrям этоrо и последующих сборников относятся
широта и актуальность рассматриваемоrо материала, ком-
пактность и ясность изложения, включение кратких типовых
экспериментальных методик и полнота литературных ссылок.
Сборники серии «Успехи орrанической химии» несомненно
окажутся полезными для химиков орrаников и специалистов,
работающих в смежных областях, и найдут свое место наряду
с такими известными изданиями, как «Реакции и методы син-
теза орrанических соединений» (rосхимиздат) и «Орrаниче-
ские реакции» (ИЛ).
ПРЕДИСЛОВИЕ
Орrаническая химия одна из наиболее систематизиро-
ванных наук, которая предоставляет широкие возможности для
издания научной литературы. I(аждый новый шаr в этом Ha
правлении нуждается если не в оправдании, то хотя бы в объ-
яснении.
В полном противоречии с мноrочисленными предсказа-
ниями о том, что орrаническая химия исчерпала свои воз-
1\IOЖНОСТИ, эта наука продолжает стремительно развиваться.
Нередко при такой быстроте развития создается разрыв во
времени между разработкой новых полезных методов и идей,
общей их оценкой и практическим применением химиками
орrаниками. В связи с этим возникает потребность в серии
сборников, содержащих отдельные статьи, посвященные кри
тическому разбору и оценке новых методов и представлений,
необходимых для дальнейшеrо развития, а также расшире-
нию областей применения ранее хорошо зарекомендовавших
себя методов.
Нетрудно провозrлашать такие истины:но совсем друrое
дело убедить деятелей науки в том, чтобы они взяли на себя
тяжелые обязанности авторов подобных обзоров. В идеальном
случае авторами обзорных статей должны быть ученые, 01-
крывшие новые методы или непосредственно работающие в
данной области. Такой критерий в известной степени противо-
речив, поскольку мноrие соrласны с изречением: «I(то умеет
работать, работает; кто этоrо не в с()стоянии делать, пишет
обзоры». Все же в резулыа'те разумноrо сочетания убежде-
ния .В необходимости составления обзоров и увлечения по-
ставленной задачей при издании предлаrаемой серии сбор
ников удалось достичь общей доrоворенности, и мы выра-
жаем искреннюю блаrодарность всем авторам за их участие
в воплощении замысла.
Если не считать некоторых формальных требований, мы
не пытались диктовать условия, касающиеся стиля и общеrо
8
Предисловие
оформления статей, и не хоТели вводить в сборники сухую,
обезличивающую' унификацию. В связи с этим одни статьи
изложены достаточно подробно, в друrих же дана лишь са-
мая общая картина. .Во всех статьях нашли отражение инди-
видуальность авторов, их ВзrЛЯДЫ и порой полемичес;кие вы-
сказывания. В большинстве случаев, но не всеrда, С'fатьи
носят методический характер; помимо общеrо разбора Me
тода, коrда это признается полезным, ВВОДится раздел с Ьпи
санием типичных опытов.
Серия сборников указанноrо хараlпера, естественно, не
может удовлетворить всех, и мы надеемся получить от чита-
телей критические замечания и пожелания о содержании
будущих сборников.
ЭЛЕКТРОЛИТИЧЕСКАЯ КОНДЕНСАЦИЯ
ПО КОЛЬБЕ 1)
Б. УИДОН
Р. Рафаэл
э. Тейлор
Х. Вuнбере
ВВЕДЕНИЕ
Из различных реакций орrанических соединений на элек
. тродах наибольшее значение для синтеза имеет реакция, от-
крытая I\ольбе [83] в 1849 r. Первоначально синтез Кольбе
состоял в образовании симметричноrо уrлеводорода и дву-
окиси уrлерода при электролизе соли карбоновой . кислоты:
2RCOO 2e R R+2C02'
в 1855 r. Вюрц [154] применил эту реакцию для электро-
лиза смесей д yx жирных кислот и получил при этом смесь
двух симметричных уrлеводородов и несимметричноrо про-
дукта перекрестной конденсации: .
RCOOH
.//
R R
у
R R'
R'COOH
"-
R' R'
Такое применение реакции Кольбе о:rкрыло возможность
электролитическоrо синтеза разнообразных несимметричных
соединений и в дальнейшем оказалось исключительно ценным.
Хотя при этом всеrда образуется смесь трех веществ, часто
онИ MorYT быть леrко разделены. Выход несимметричноrо
проду.кта реакции нередко превышает выходы этоrо же веще
ства при получении ero друrими, обычно более длительными
методами. При этом допустимо большое различие в величине
1) Более подробно электролитические синтезы по Кольбе рассмотрень}
в обзорной статье [. Э. Свадковско/1 и С. А. Войткевич «Электролитиче-
ская конденсация карбоновых кислот»,. Успехи химии, вып. 3, 364 4()3
(1960). При-м" перев.
LO
Эле"тролитическая конденсация по Кальбе
Введение
11
сочетающихся радикалов; обычно соотношения образую-
щихtя трех соединений соответствуют ожидаеМЫМ на OCHO
вании соотношения исходных веществ и их поведеlШЯ на
аноде. Следовательно, чтобы облеrчить превращение BToporo
компонента в требуемый несимметричный продукт реакции,
можно применять . большой избыток вполне. доступной кис
лоты [63].
Важную роль сыrрало также открытие -Брауна и Уокера
[24], сделанное в 1891 r. Они обнаружили, что кислые эфиры
двухосновных кислот жирноrо ряда в отличие от самих кис;-
лоl'. [143, 147] обычно вступают в реакцию I(ольбе с образова- ,
нием полных эфиров:
2J;ЮОС (СН 2 )n СООН ROOC (СН 2 )2n COOR.
Первоначально для реакции Кольбе использо ались вод-
ные .растворы исходных веществ; в последнее время стали
широко применять метанольные растворы. Явное преимуще-
ство метанола заключается в том, что он является превос-
ходным растворителем для большинства орrанических кислот.
Более . Toro, экспериментальные условия, обеспечивающие
оптимальные выходы (большая концентрация кислот, высо-
кая плотность тока на аноде, низкая температура, небольшая
величина рН электролита), леrче создать в метЗНОЛЬНОЙ, чем
в водной среде [59, 63, 119, 149]. Недостатком при исполlY'
зовании метанола в качестве растворителя являются значи-
льное возрастание сопротивления электролизера и, следова-
тельно, выделение большеrо' количества тепла в процессе
электролиза. Друrой недостаток сост'оит в превращении не-
значительных количеств исходных кислот RCOOH в их Me
тиловые эфиры [17, 26, 96]. С друrой стороны, побочные реак-
ции, приводящие к образованию спиртов ROH [41, 45, 47, 51,
53,58, 70, 86], сложных эфиров RCOOR [83, 113], а также сме-
сей предельных уrлеводородов RH и соответствующих этиле-
новых соединений [63, 85, 91, 126], в метаноле протекают в
значительно меньшей степени, чем в водной среде [59, 63, 119].
Удобный общий способ выполнения синтезов I(ольбе за-
ключается в следующем. Исходную кислоту (или кислоты)
растворяют в метаноле, содержащем достаточное для нейтра-
лизации небольшой части (около 2%) кислоты (или кислот)
количество метилата натрия и затем раствор подверrают
электролизу между двумя ПЛатиновыМИ электродами до сла-
бощелочной реакции. По мере электролиза карбоксилат-ионы
превращаются на. аноде в Rонечный продукт; выделяющийся
на катоде uатрий реаrирует с растворителем, и образующаяея
щелочь частично нейтрализует избыток кислоты (или кислот). .
Процесс продолжается таким образом до полноrо израсходо-
вания исходноrо вещества.
Недавно предложен друrой метод [33], по которому мети-
лат натрия применяется в количестве, достаточном для ней-
трализации большеi;i части или Bcero ИСХОДноrо вещества.
Полученный метанольный раствор подверrается электролизу
между Qлатиновым анодом и ртутным катодом. При приложе-
нии к электродам разности потенциалов электролит не стано-
вится щелочным, так как избыток натрия, вьщеляющеrося
на ртутном катоде, связывается ртутью с образованием амаль
raMbI. Вследствие высокой начальной концентрации карбокси-
лат-ионов .можно работать при большой плотности тока, что
ведет к сокращению продолжительности реакции. Плотность
тока падает с уменьшением концентрации карбоксйлат ионов
в результате электролиза, что позволяет леrко установить
конец реакции.
При осуществлении описанных метОДОIl электролиза с пре-
паративной целью не требуется сложной аппаратуры. В ла-
бораторном масштабе реакции можно проводить с вполне
удовлетворительными результатами в электролизере простой
конструкции стакане [33, 118] или большой пробирке [63],
не принимая особь х мер предосторожности для реrулирова-
ния электродных потенциалов. Разработан электролизер не-
прерывноrо действия полузаводскоrо типа [13]. .
В отличие от мноrочисленных экспериментов в водной и
метанольной средах, электролиз солей в избытке соответствую-
щей безводной жирной кислоты [60, 71] и расплавленных со-
лей [11, 100, 112] привлек к себе очень мало внимания.
Механизм реакции I(ольбе служил предметом широкоrо
обсуждения [149]. Наиболее вероятно, что на аноде происхо
.дят последовательно три процесса: а) разряд карбоксилат-
ионов RCOO с образованием карбоксилат-радикалов;
б) быстрое декарбоксилирование этих радикалов с образо-
ванием алкильных радикалов и двуокиси уrлерода; в) реком-.
бинация алкильных радикалов с образованием продукта
реакции:
e
RCOO RCOO. R. +СО 2
2R. R R
Естеств.енно, что отмеченные ранее побочные реакции, а также
различные реакции замещения [54, 56, 61, 94] и полимериза-
иии [62]. которые наблюдались при электролизе карбоновых
кислот, можно лучше Bcero объяснить промежуточным
образованием свободных радикалов, Новые кинетические
12
.. Области nрuмененц" реа"ции 18
Таблица 2
ЭJlеКТРОJlИЗ КИСJlЫХ э иров' ноос (CH2)nCOOR
по ОJlьбе
n РастворитеllЬ /выхо д , % 1 Литература
С 2 Н 5 1 Н 2 О I 60 I 24
С 2 Н 5 2 Н 2 О 50 104
СН з 2 СНзОН 76 18,3З
СН з 3 СНзОН 67 16
СН з 4 СНзОН 9().........95 13
С 2 Н 5 7 СНзОН 45 10
С 2 Н 5 8 Н 2 О 4 20, 138
СН З 8 СНз. ОН 66 63
С 2 Н 5 9 СНзОН ",57 Н8
СН з 10 СНзОН 43 124, 155
C2H 10 СНвОН 118
СНа Н СНвОН 60 Н6
СНа 12 СНзОН ",45 '155
СНа 14 СНзОН 68 118 (ер. 155)
С 2 Н 6 16 Н 2 О.........с 2 Н 5 ОН 60 38 (ер. 155)
Эле"тролитическая ICOн.Ьен.сация по Кольбе
исследования электролиза ацетатав и пропионатов также под-
тверждают указанные представления а механизме реакции
Кальбе.
ОБЛАСТИ ПРИМЕtlЕНИЯ РЕАКЦИИ
Не все кислоты и кислые эфиры двухосflОВНЫХ .кислот
вступают в реакцию, Кольбе. Структурные признаки, которые
в известной мере оrраничивают возможности реакции, в Ha
стоящее время достаточно хорошо установлены [23, 40, '137,
149].
При электролизе одноосновных кислот и кислых эфиров
двухосновных кислот 'жирноrо ряда с неразветвленными цe
пями, содержащих от двух до .восемнадцати и более атОМОВ
уrлерода, ожидаемые продукты образуются с выходами
Таблица 1
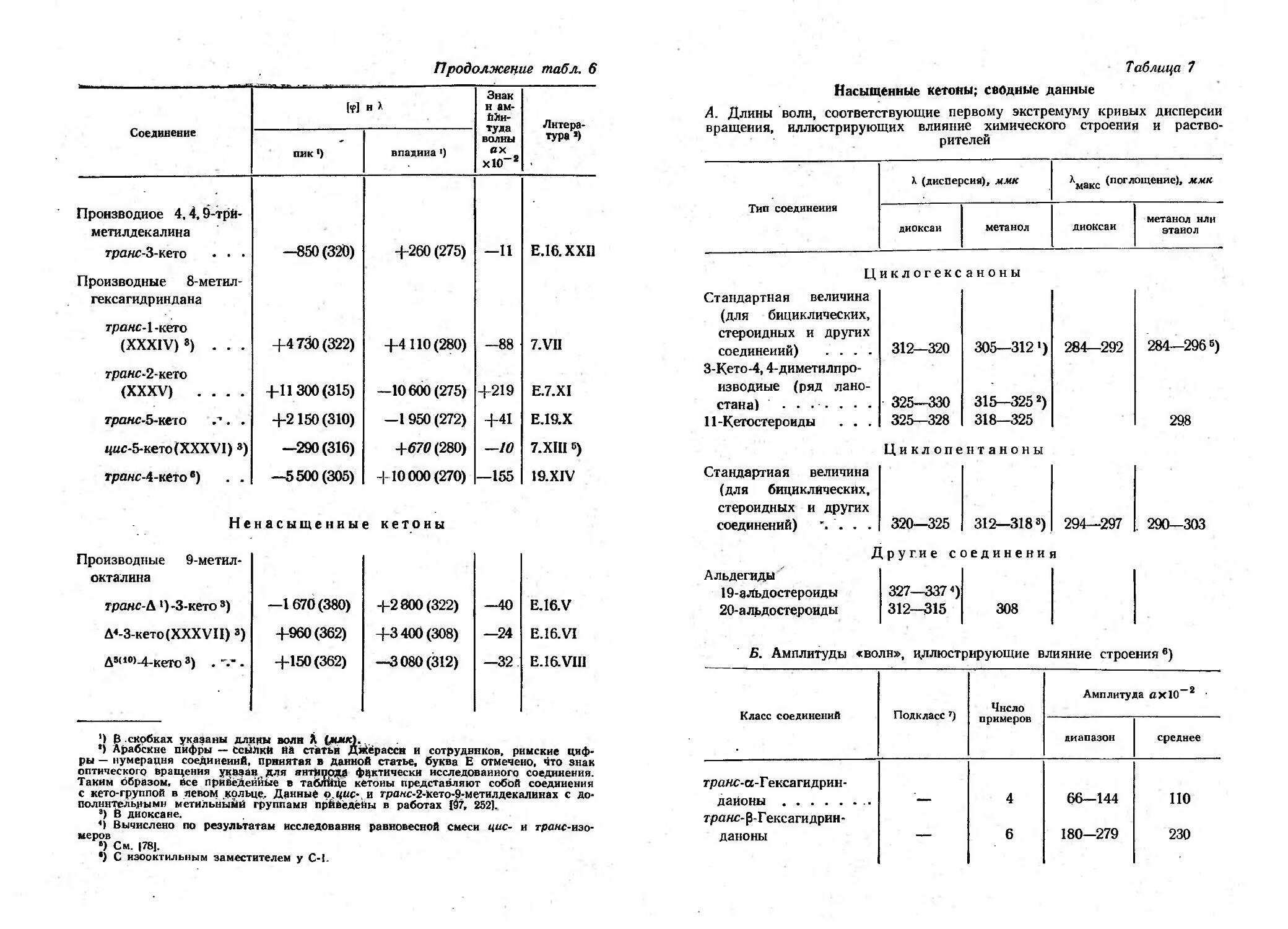
Электролиз жирных кислот снз (СН2)nСООН
по Кольбе
n
Растворитель
I Выход, % I Литература
о
о
1
2
4
10
12
14
14
16
16
18
Н 2 О
СНзОН
Н 2 О
Н 2 О
Н 2 О
H20 C2H50H
СНзОН
H20 C2H50H
H20 C2H50H
H20 C2H50H
H20 C2H50H
H20 C2H60H
00 1)
931)
40
60
89
90
60
89
60
88
60
73
48
48
40
32
109
110
. 88, 150
110
120
110
120
110
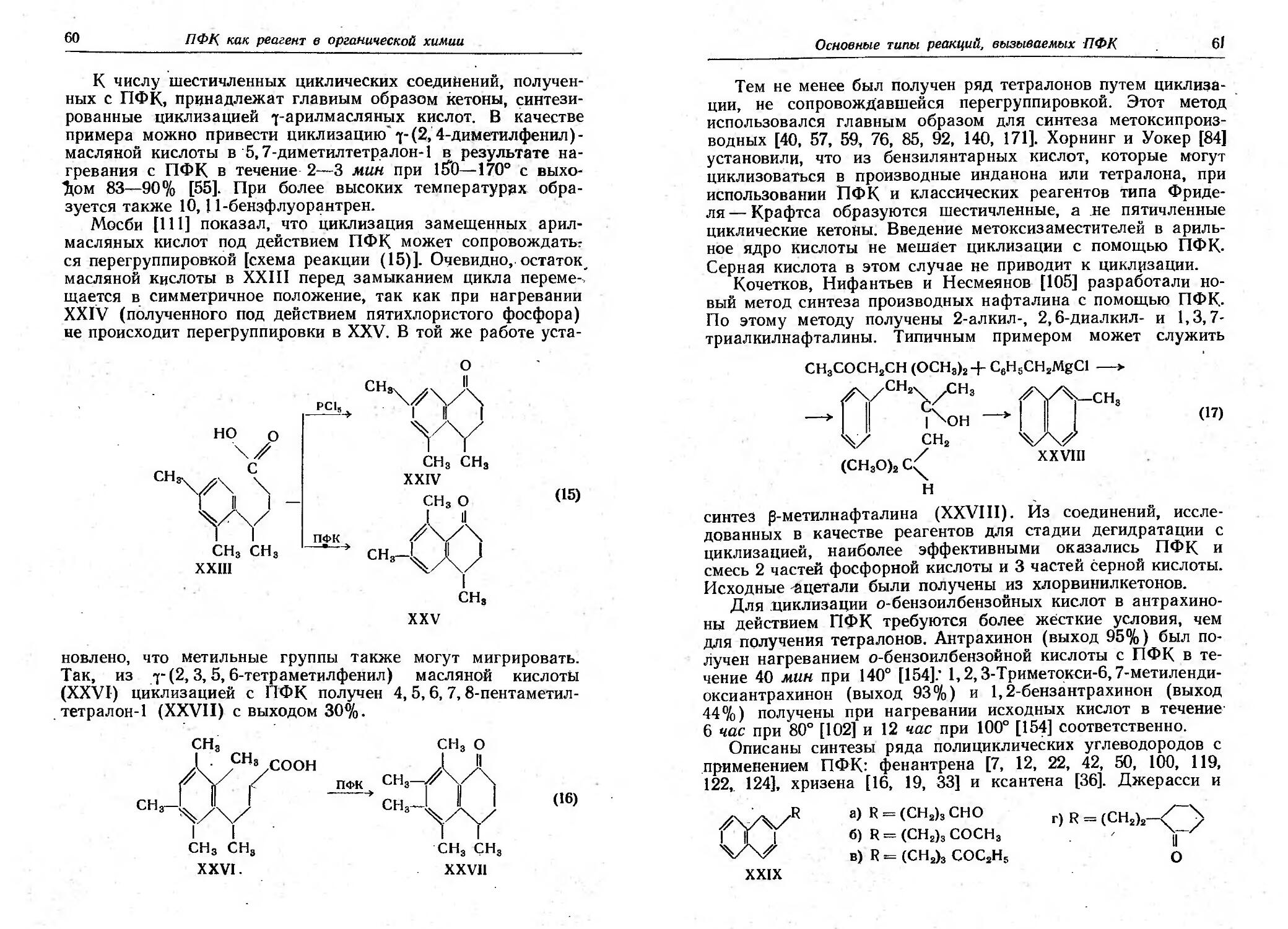
электролиза по I(ольбе были получены соединения 111 и IV
с выходами 32 и 20% соответственна.
СНзООС---(""" СООН СНзООС---(""" ООСНз
1 IП
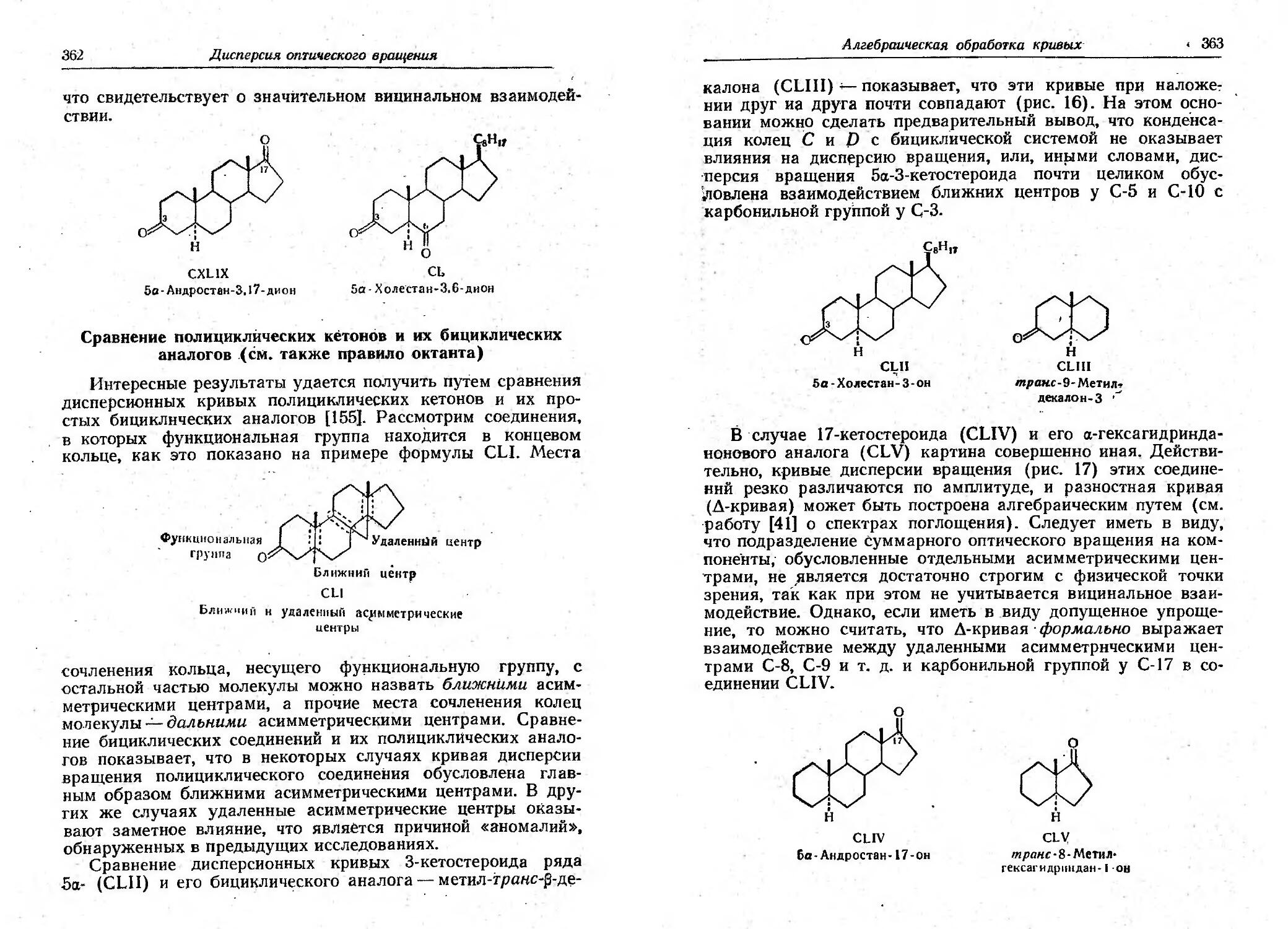
O COOH ОС)
11 IV
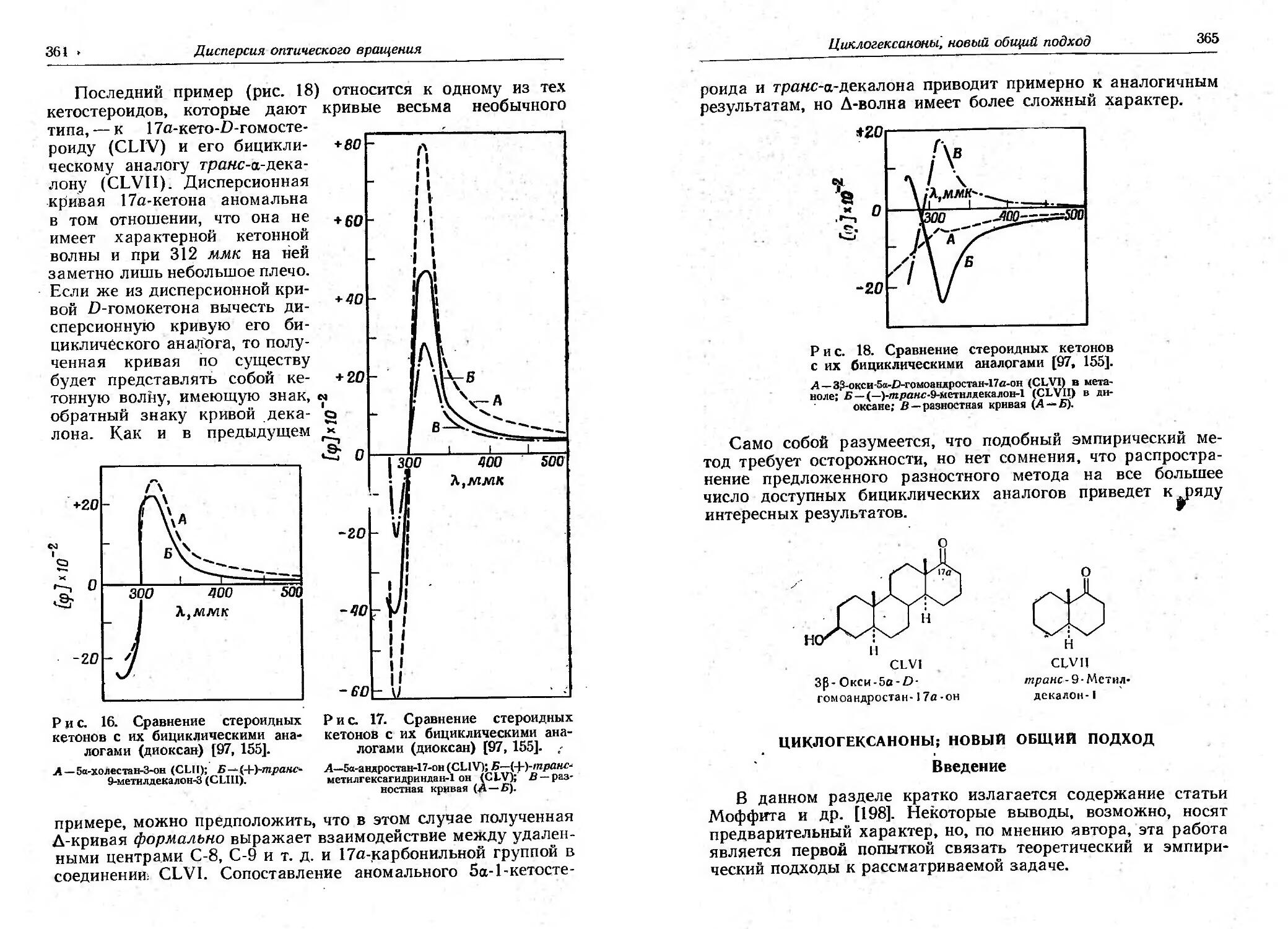
Алкильные заместители, расположенные дальше, чем в
!1 положении; от карбоксильной rруппы, если и оказывают
неблаrоприятное влияние на реакцию I(ольбе, то абычно
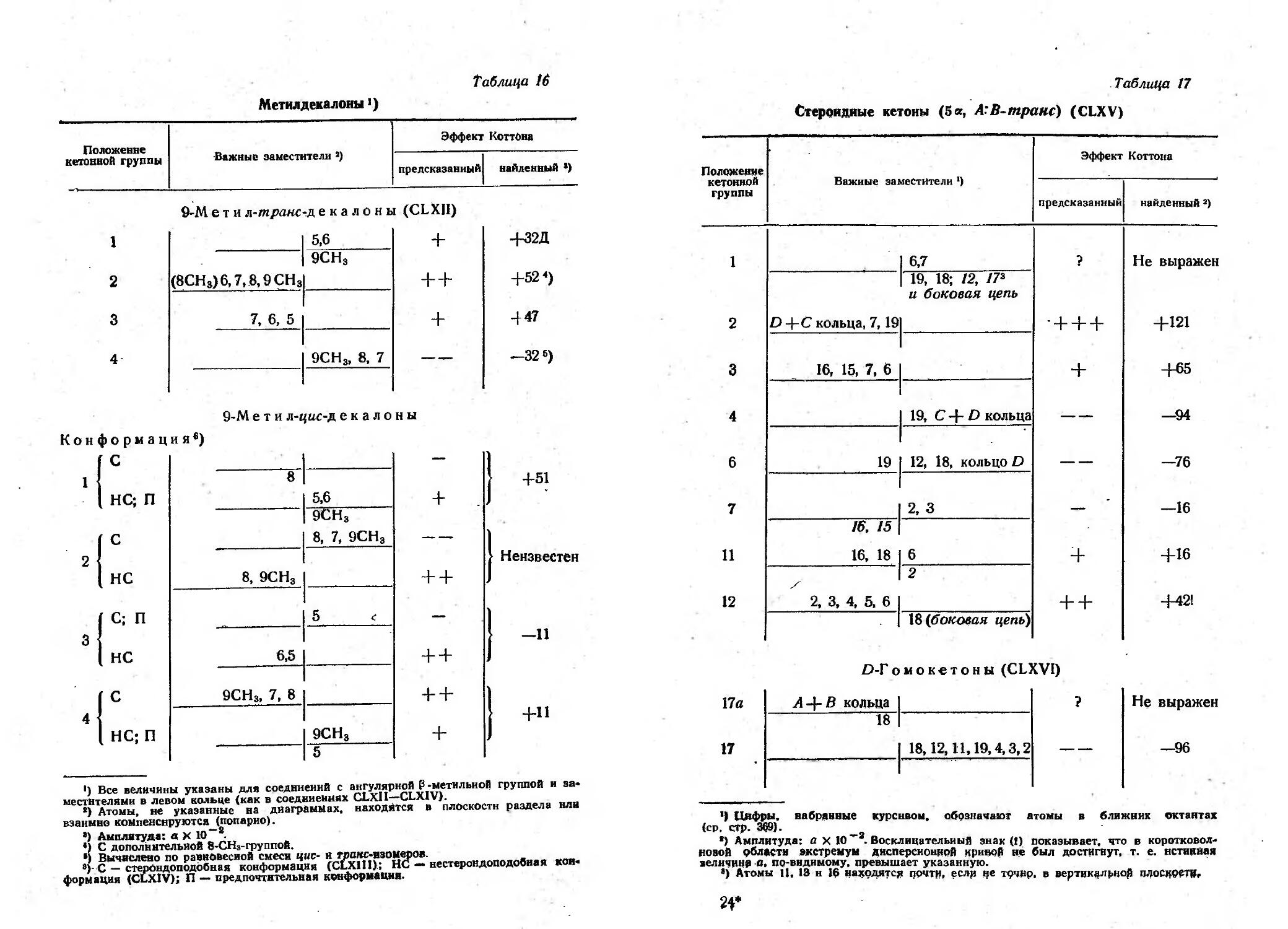
незначительное [39, 57, 109, 110]. 3а послед ие rоды аписано
MHoro примеров анодной конденсации -MOHa .и.. , диалкил-
замещенных кислот и КИiЛЫХ эфирав; а также 1- л]{илзаме-
щенных кислот и кислых эфиров (см., например [3, 4, 12, 28,
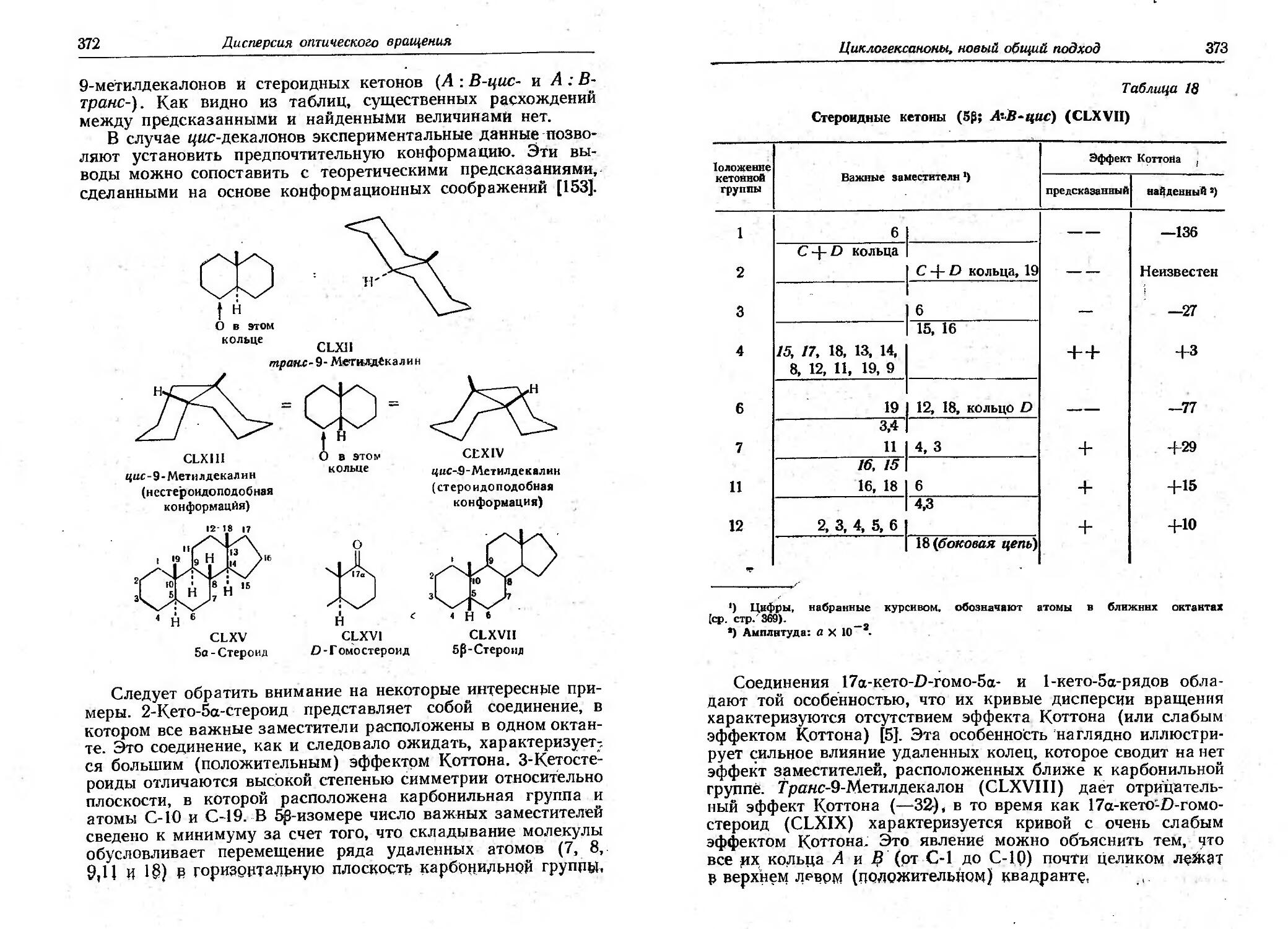
66, 87, 89 92. 95, 101.. .,,l03., 126 132]), протекающи:к,с ВЬ!С<>-:
кими выход ми. ..
Влия;ние друrих заместителей в а положении часто, в.ыр.а
женЬ более резко., чем влияние. алКильных rрупп. При л .кт.".
ролизе IЩqлы .: .!! ловых эфиров м. ло овой . КИС!Iо J t
') Выход ПО току.
5O 90% (см. табл. 1 и 2). Однако. при наличии алкильной
rруппы в а-положении к отщепляющейся карбоксильной rруп
пе выхады резко снижаются, причем они редко превышают
1,0% (ср. [149]). Исключение составляют монометилавый эфир
ци,клоrександикарбоновой кислаты (1) [43] и тетраrидропи-
ранкарбоновая-4 кислота (11) [14], из которых в результате
1.
ЭлектралиtическllЯ fU>ноенсачuя fI() Кальбе
Области nрименения реакции .
15
аРИJIОКСИУКСУСНЫХ [44, 54] и фенилуксусной [60, 94] кислот и
6 меньшей степени дифеиилуксусной кислоты {I 15 142], три
фторуксусной кислоты [139] и некоторых а-ациламинокцслот
[93] конденсация происходит, но в случае а-I'алоrен-. [35, 80,
107, 140], a-оКСи- [145], а-алкокси- [37, 145] и -цианзамещен-
ных кислот [52] этоrо не наблюдалось. Однако следует под_.
черкнуть, что экспериментальные условия во мноrих ранних
исследованиях электролиза а-замещенных киCJ1о.т в настоя-
щее время -нельзя считать наиболее блаrоприятнцми для
реакции I(ольбе. Поэ:rомУ может представить интерес повтор-
ное изучение электролиза а замещенных кислот, в особенности
а-алкокси- и а-цианзамещенных IQIСЛОТ.
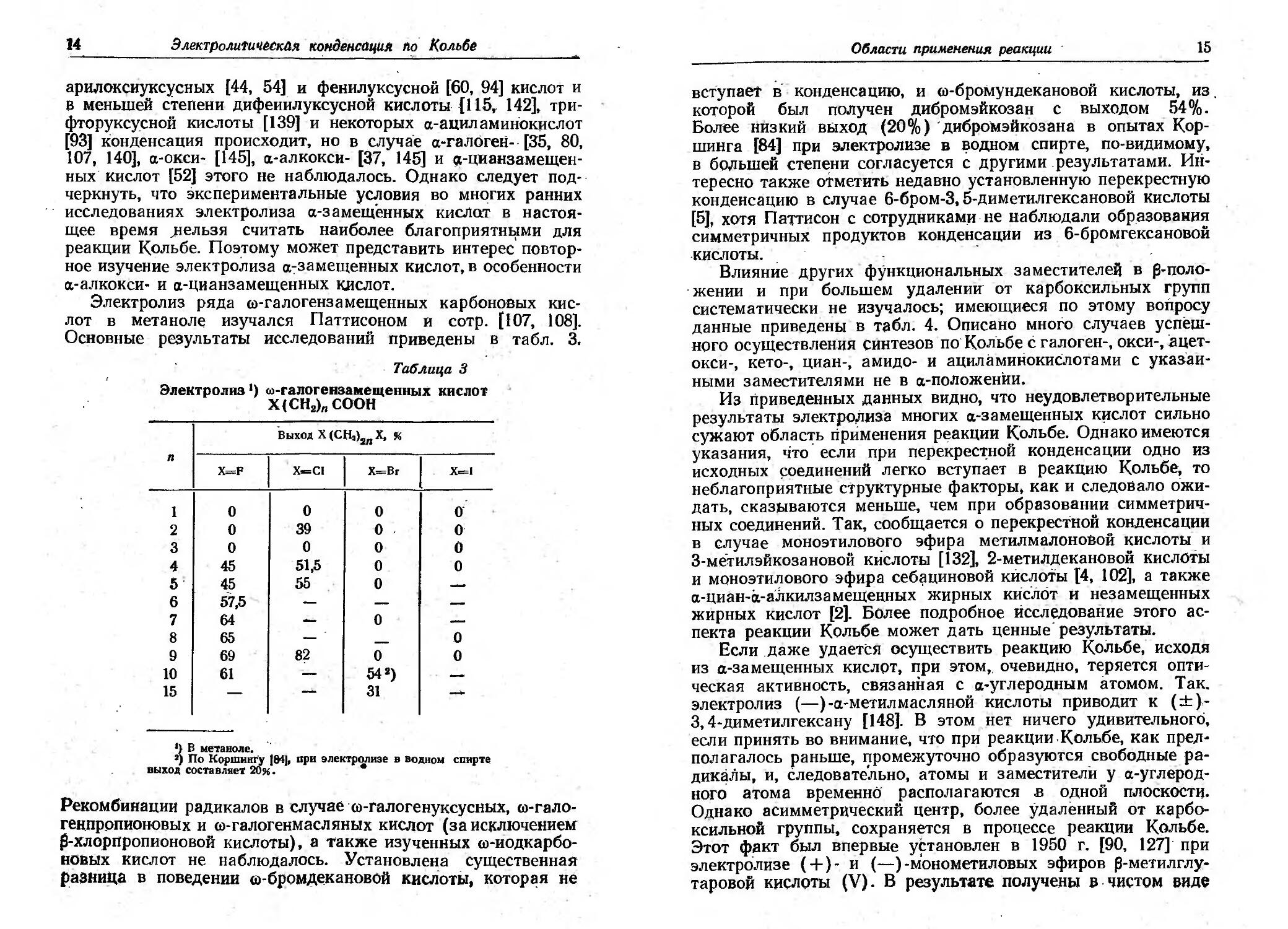
Электролиз рЯДа (i)-rалоrензамещенных карбоновых кис-
лот в метаноле изучался Паттисоном и сотр. [107, 108].
Основные результаты исследований Приведены в табл. 3,
Таблица 3
Электролиз 1) oo-rалоrензамещенныХ кислот
Х (сн 2 )n соон
X CI
Выход х (СН')2п Х, "
X B.
вступаet в' конденсацию, и (i)-бромундекановой кислоты, из
которой был получен дибромэйкозан с выходом 54 %.
Более низкий выход (20%)' дибромэйкозана в опытах I(ор-
шинrа [84] при электролизе в OДHOM спирте, по-видимому,
в БО,7lьшей степени соrласуется с друrимирезулыатами. Ин-
тересно также отметить недавно установленную перекрестную
конденсацию в случае 6-бром-3,5-диметилrексановой кислоты
[5], хотя Паттисон с сотрудниками. не наблюдали образовамв
симметричных продуктов конден ации из 6-бромrексановои
.кислоты.
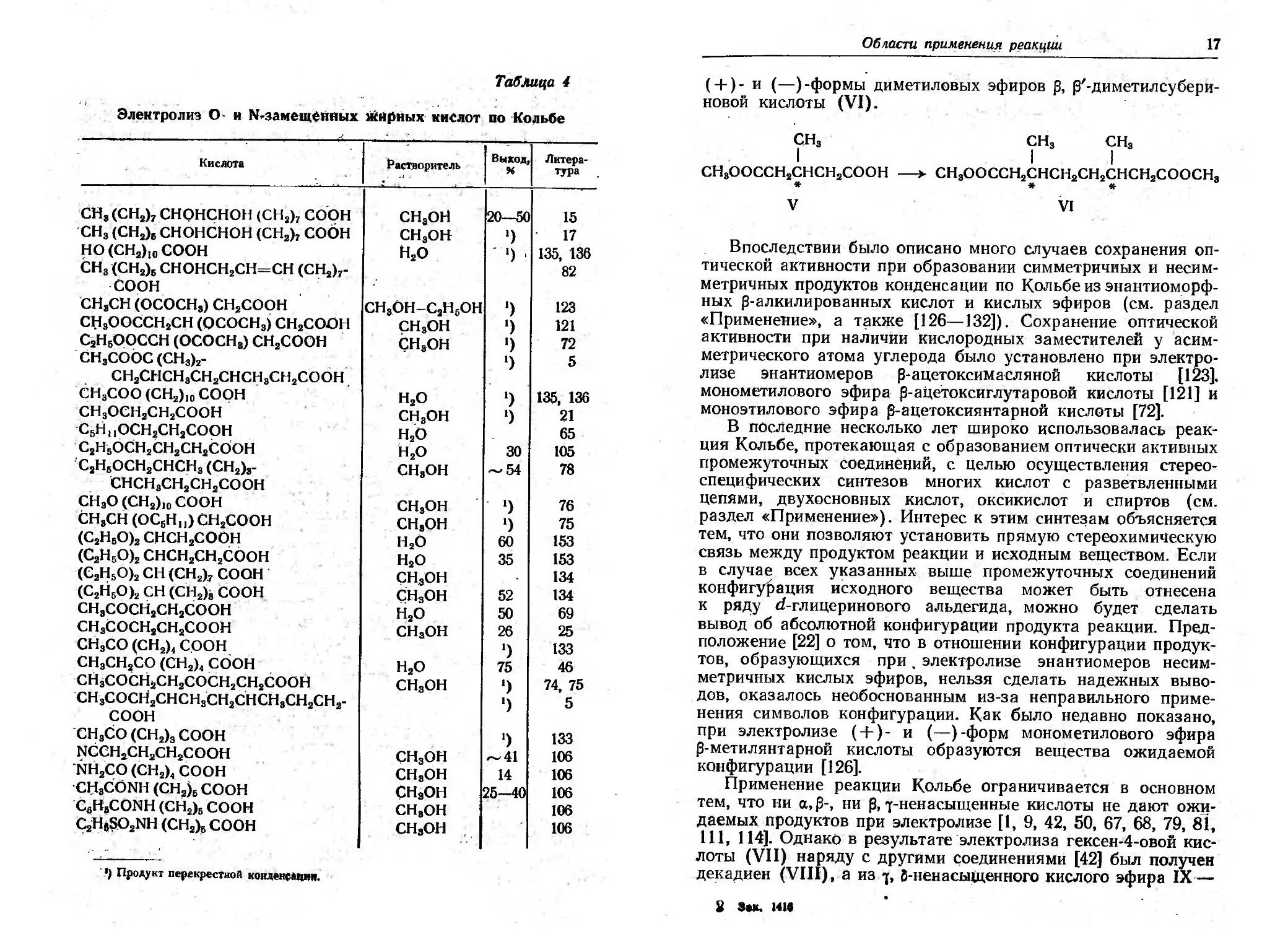
Влвяние друrих функциональных замествтелеii в -поло-
. жении и при большем удалении' от карбоксильных rрупп
систематически не изучалось; имеющиеся по этому вопросу
данные приведены в табл. 4. Описано MHoro случаев успещ-
Horo осуществления синтезов по Кольбе с rалоrен-, окси-, ацет-
окси-, кето-, циан-, амидо- и аЦиламинокислотами с указаи-
ными заместителями не в а-положении.
Из rtриведенных данных видно, что неудовлетворительные
результаты электро иза мноrих а-замещенных к слот сильно
сужают облас ь rtрименения реакции !,(ольбе. Однако имеются
указания, что если при перекрес'l:НОИ конденсации одно из
исходных соединений леrко вступает в реакцию I(ольбе, то
неблаrоприятные структурные факторы, как и следовало ожи-
дать сказываются меньше, чем при образованив симметрич-
ных оединений. Так, сообщается о перекрестной конденсации
в случае моноэтилов<?rо эфира метилмалоновой ислоты. и
3-метилэйкозановой кислоты [132], 2-метилдекановои кислоты
и МQноэтиловоrо эфира себ,щиновой кис-!юты {4, 102], а также
а-циан-ос-алквлзамещецных жирных кислот инезамещенных
жирных кислот [2]. Более подробное иссл дование этоrо ас-
пекта реакции I(ольбе может дать ценные результаты.
Если даже удается осуществить реакцвю I(ольбе, исходя
из а-замещенных кислот, при этом" очевидно, теряется опти
ческая активность, связанная с а-уrлеродным атомом. Так.
электролвз ( ) -а-метил масляной кислоты приводит к (:t }.-
3,4-диметилrексану [148]. В этом нет ничеrо удивительноrо,
если принять во внимание, что при реакции .I(ольбе, как прел-
полаrалось раньше, I)ромежуточно образуются свободные ра-
диюi.тiы, и, следовательно, атомы и заместители у а-уrлерод-
Horo атома временно располаrаются .в одной ПJIОСКоетц.
Однако асимметрический центр, более удаленный от карбо-
ксильной rруппы, сохраняется в процеССе реакции I(ольбе.
Этот факт был впервые установлен в 1950 r. [90, 127] при
электролизе (+) - и ( ) -монометиловых эфиров -метилrлу-
таровой квслоты (У). В результате получеJlЫ в. чистом виде
п
X P
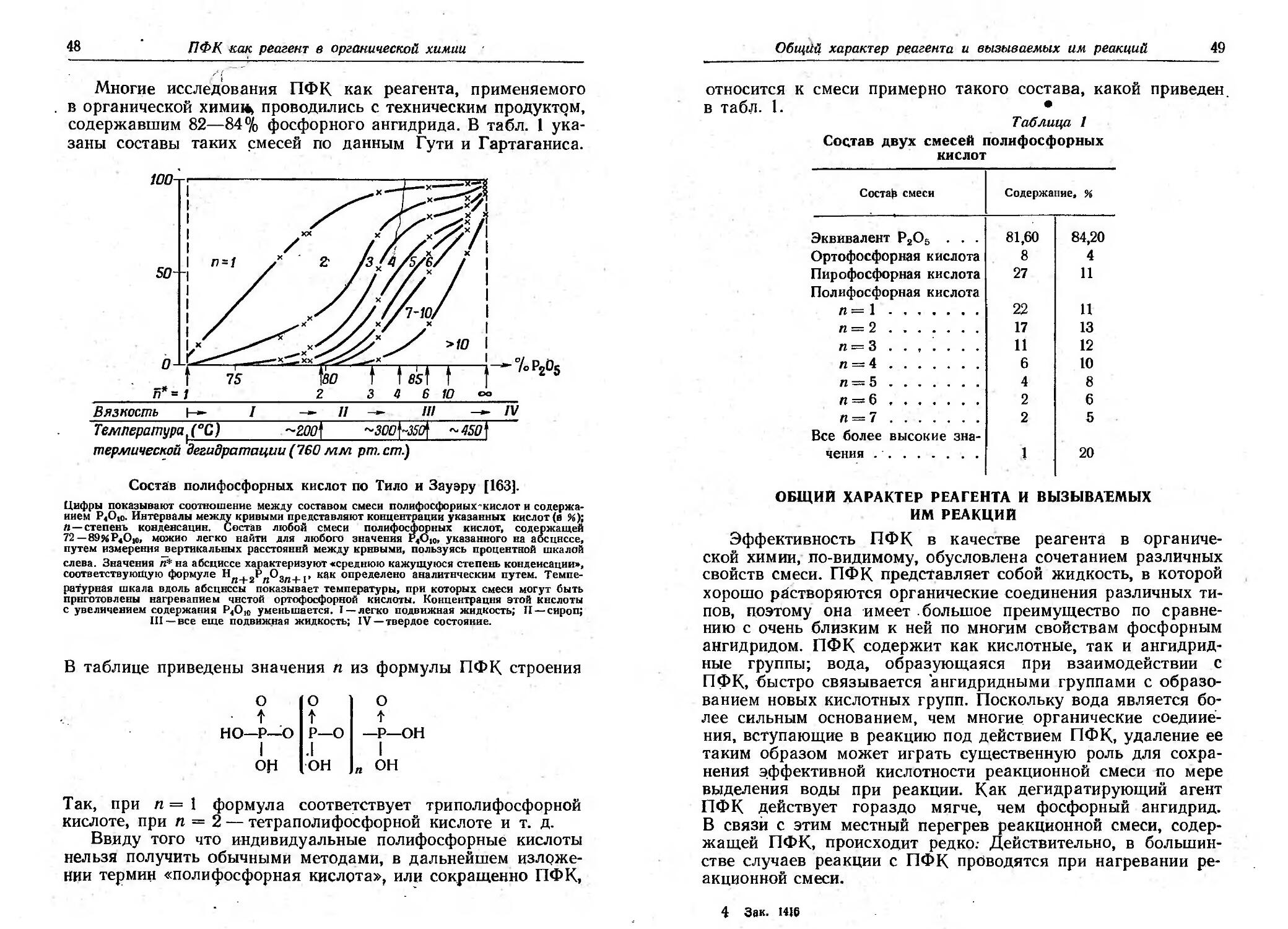
1 О
2 О
3 О
4 45
5' 45
6 57,5
7 64
8 65
9 69
10 61
15
X I
О
39
О
51,5
55
82
О
О
О
О
О
О'
о
о
О
О
О
542)
31
о
О
J) в метаИОJJе.
') По Коршииrу 1&1), при электролизе в ВОдНом спирте
выхо-ц составляет 20%. ·
Рекомбинации радикалов в случае '(i)-rалоrенуксусных, (i)-rало-
rендррпионовых и (i) rалоrенмасляных кислот (за исключением
-ХЛОРI1РОПИОНОВОЙ кислоты), а также взученных (i)-иодкарбо-
НОЬых Кислот не наблюдалось. Установлена существенная
разница в поведении ш-БРОМА каJlОВОй кисЛоты, котор я не
Области nрименения реакцrШ
17
ТаБАица 4
Электролиз о- и. N замещенных жирных' кислот во Кольбе
Кислота '/ аСТJ!оритель IBы: 1 Литера.
тура
СН з (СН 2 )7 СНОНСНОН (СИ 2 )7 со'он СНзОН 20----50 15
"СНз (CH 2 )/i СНОНСНОН (СН 2 )7 собн СНзОН 1) 17
t10 (cH 2 )lo СООН Н 2 О . 1) , 135, 136
СНа .(CH 2 )/i CHOHCH2CH CH (CH2)7 82
.СООН
'СНзСН (ОСОСН з ) СН 2 СООН СНз.ОН С2Н50Н 1) 123
Сl:l з ООССН 2 СН (ОСОСН з ) СН 2 СООН НзОН 1) 121
C 2 H 5 0QCCH (ОСОСН з ) СН 2 СООН GНзОН 1) 72
СНзСООС (СНэk 1) 5
СН2СНСНЗСН2СНСJ:iзСН2СООН,
СНзСОО (cH 2 )lo СООН Н 2 О 1) 135, 136
сн з осн 2 сн 2 соон СНзОН 1) 21
'С 5 Н IIOCH 2 cH 2 cOOH Н 2 О 65
. С2НБОСН2СН2СН2СООН 1-120 30 105
С 2 Н s ОСН 2 СНСН з (СН2)З СНзОН .......54 78
СНСН з СН 2 СН 2 СООН
СНзО (cH 2 )lo СООН СНзОН 1) 76
СНзСН (ОС 5 Н 1 д СН 2 СООН СНвОН 1) 75
(С 2 Н Б О)2 СНСН 2 СООН н 2 о 60 153
(С 2 Н 5 О)2 СНСН 2 СН 2 СООН Н 2 О 35 153
(С 2 '15 0 )2 СН (СН 2 ).7 СООН . СН,аОН 134
(С 2 Н 5 О)2 СН (СН 2 )В соон С,НэОН 52 134
СН з СОСН 2 СН 2 СООН Н 2 О 50 69
СН з СОСН 2 СН 2 СООli СНзОН 26 25
СНзСО (СН 2 )4 СоОН 1) 133
СН з СН 2 СО (СН 2 )4 СООН Н 2 О 75 46
СНзсоtН2СН2СОСН2СН2СООН СНвОН 1) 74,75
.СНзСОСН2СНСНзСН2с'НСНзСН2СН2- 1) 5
СООН
'СНзСО (СН 2 )з СООН 1) 133
t;olCCH 2 cH 2 cH 2 cOOH СНзОff ,...,,41 106
-NН 2 сО (СН 2 )4 СО ОН СНвОН 14 106
'CI::l 8 CONH (СН 2 }б СООН СНзОН 25......-40 106
'СаНзСОNН (СН 2 )б СООН СНвОН 106
CiHi 02NH (СН 2 )б СООН СНвОН 106
'.) Пр<>дукт перекреетноil KOIЦI!RCIiIPtIf.
(+)- и ( )-формы диметиловых эфиров , (3'-диметилсуберц-
НОвой кислоты (VI). .
СНЗ
I
СН з ООССН 2 СНСН 2 СООН
*
v
СНз СНз
I I
СНзООССН2СНСН2СН2СНСН2СООСНз
* *
VI
. Впоследствии было описано MHoro случаев сохранения оп-
тической активности при образовании симмеТРИЧFlЫХ и несим-
метричных продуктов конденсации по Кольбе из энантиоморф-
ных .алкилированных кислот и кислых эфиров (см. раздел
«ПрименеRие», а Ч1кже [126 132]). Сохранение оптической
активности при наличии Кислородных заместителей у асим-
метрическоrо атома уrлерода было установлено при электро
лизе энантиомеров (3-ацетоксимасляной кислоты [123].
монометиловоrо эфира (3-ацетоксиrлутаровой кислоты [l2t] и
моноэтиловоrо эфира -ацетоксиянтарной кислоты [72].
В ПОcJiедние несколько лет широко использовалась реак-
ция Кольбе, протекающая с образованием оптически активных
промежуточных соединений, с целью осуществления стерео-
специфических синтезов мноrих кислот с развеТ8ленными
цепями, двухосновных кислот, оксикислот И спиртов (см.
раздел «Применение»). Интерес к этим синте ам объясняется
тем, что они ПОзволяют установить прямую стереохимическую
связь между продуктом реакции и исходным веществом. Если
в случае всех указанных выше промежуточных соединений
конфиrурация исходноrо вещества может быть отнесена
к ряду d-rлицериновоrо альдеrида, можно будет сделать
вывод об абсолютной конфиrурации продукта реакции. Преk
положение [22] о том, что в отношении конфиrурации продук-
тов, образующихся при. электролизе энантиомеров несим-
метричных кислых эфиров, нельзя сделать надежных выво-
дов, оказалось необоснованным из-за неправильноrо приме-
нения символов конфиrурации. Как было недавно показано,
при электролизе (+) - и ( ) .форм монометиловоro эфира
.метилянтарной кислоты образуются вещества ожидаемой
конфиrурации О26].
Применение реакции I(ольбе оrраничивается в основном
тем, что ни (1, ., ни (3,1'-ненасыщенные кислоты не дают ожи-
даемых продуктов при электролизе [1, 9, 42, 50, 67, 68, 79,81,
111, 114]. Однако в резулыатеэлектролиза rексен-4-0ВОЙ кис
лоты (VII) наряду с друrими соединениями [42) был получен
декадиен (VIП), а из 1, .ненасыщенноrо КИCJIоrо эфира IX.
'8.. 1410
18
Эле"тролитичес"ая "онденсация 11() /(альбе
п puмeHI!Hиe
ожидаемый по:"ный эфир Х [92].
СНзСН==СН (СН 2 )2 СООН СНзСН==СН (СН 2 )4 СН==СНСН з
VII VШ
двухосновных кислот электролизом жирных кислот и кислых
эфиров двухосновных кислот нормальноrо строения До cpaB
нительно недавнеrо времени было сделано мало попыток
более широкоrо использования реакции Кольбе. Однако на-
чиная с 1950 r. метод электролиза по Кольбе был использо-
ван для синтеза свыше сорока природных соединений, rлав-
ным образом липидов. .
Так, Каррером и сотр. [77. 78] электролитический метод
получения симметричных соединений (Jыл использован для
синтеза перrидробикс\пiа (XIII) и перrидрокроцетина (XVII)
с целью подтверждения строения уrлеродноrо скелета, при
писанноrо двум каротиноидам биксину (XIV) и кроцетину
(XVIII). Из (1, cr.'-диметилпимелиновой КИСЛОты (XI) при вза-
имодействии с малоновым эфиром с последующим частич-
нымrидролизом продукта реакции получен J{ислый эфир ХН,
из KOToporo после электролиза и последующеrо rидролиза
был синтезирован перrидробиксин (XIII). ДЛЯ получения
перrидрикроцетина (ХVП) то же исходное вещество (Х'
СНЗ СНз
1 1
НООССНСН 2 СН 2 СН 2 СНСООН
1. Синтез с малоновым 9фнром 1 2. Частнчвый rидролиз эфира
нвухосн08ВОЙ кислоты
сна СНа
I 1
. C2HsOOCCH2CH2CHCH2CHsCH2CHCH2CH2COOH
1. Электролиз 1 2. rидролиз
СН в СНа СНз СНа
I . 1 1 I
ноос (СН 2 )2 си (СН 2 )з сн (СН 2 )4 сн (СН 2 )з сн (СН 2 )2 СООН
t
СН в СНз
I . I СООСН з
ноосААЛ/ /V
СНз СНз
СНз
I
С 2 Н Б ООССН==С (СН 2 )2 СООН
JX
СНа СНз
1 1-
С 2 Н Б ООССН==С (СН 2 ). С==СНСООС 2 Н б
Х
Такие I-lенасыщенные кислоты, как петроселиновая [141),
. пальмитоолеиновая [17), 01Jеиновая [15, 16,26,82, 111, 141],
рицинолевая [82], ундециленовая [15, 64, 111, 117) и эруковая
[141), которые содержат еще более удаленную от карМ"
ксильной rруппы ДВОЙНУIQ связь, успешно использовались
как исходные вещества для синтезов Кольбе. Более Toro, мо-
дельные исследования с олеиновой и элаидиновой кислотами
показали, что rеометрическая конфиrурация двойной связи
при электролизе сохраняется [15]. Следовательно, если конфи.
rурация исходных кислот "звестна, продуктам электролиза
можно прип"сать определенную конфиrурац"ю. . .
Подобно соответствующим этиленовым соединениям,
(1, -ненасыщенные кислоты с тройной связью не. вступают
в реакцию Кольбе [144], но кислоты и ки ые эфиры с трой-
ной связью, удаленной от карбоксильной rруппы, нормально
реаrируют в условиях синтеза I(ольбе [7, 8]. .
Ввиду Toro что (1, .ненас,ыщенные кислоты с двойной и
. тройной связями не удается подверrнуть электролизу по I(оль-
бе, нет ничеrо удивительноrо в том, что ароматические кис-
лоты с карбоксильной rруппой, непосредственно связанной с
бензольн'ым ядром, также не реаrируют в сколько нибудь за-
метной степени в обычных условнях реакции Кольбе [49, 54,
5 . Это оrраничение .не относится к кислотам типа
С 6 Н б (СН 2 )nСООН [36, 54, 82, 94; см., однако, 20].
ПРИМЕНЕНИЕ
ОсновополаrаЮЩие исследования I(ольбе, Вюрца, а также
Брауна и Уокера, выполненцые зздолrо до конца прошлоrо
.столетия, отчетливо указали на потенциальные возможности
приме.нения электролиза для. орrзническоrо синтеза. Тем не
ме.JlееПОМtlМО получения уrлеВОДОРОДОQ и ПQЛНЫ эф"ров
было превращено в кислый эфир XV, электрол"з KOToporo
привел к образованию полноrо эфира XVI, превращенноrо
зате обычным методом через соответствующие дибромид и
rликоль в перrидрокротеции (XVII). В обоих случаях синте-
тические продукты и продукты, полученные rидрированием
природных . каратин.оидов, по-видимому, представлЯJIИ. собой
а-
19
XI
XII
ХШ
XIV
20
Электролитическая ICонденlацuй по /(ольбе
одинаковую смесь возможных рацематов и давали одни и. те
же кристаллические амиды.
ф
н
XIXa
СНз СНЗ
1 ,.
XI С2Н500ССН2СНСН2СН2СН2СНСН20Н
1 Синтез с малоновым эфиром
СНЗ СНЗ
11
С2Н50СН2СНСН2СН2СН2СНСН2СН2СООН xv
1 Электролиз
СНз СНз СНз СНз
I I I I
С 2 Н 5 ОСН 2 СН (СН 2 ); сн (СН 2 )4 СН (СН 2 )з СНСН 2 ОС 2 Н 5 XVI
!
СНз СНз СНз СНз
1. I I I
НООССН (СН 2 )з сн (СН 2 )4 СН (СН 2 )з снеоон XVII
t
СНЗ . СНз
) А.. 1 А.. А. А. А. OOH
НООС / 'W . XVIII
СНз СНз
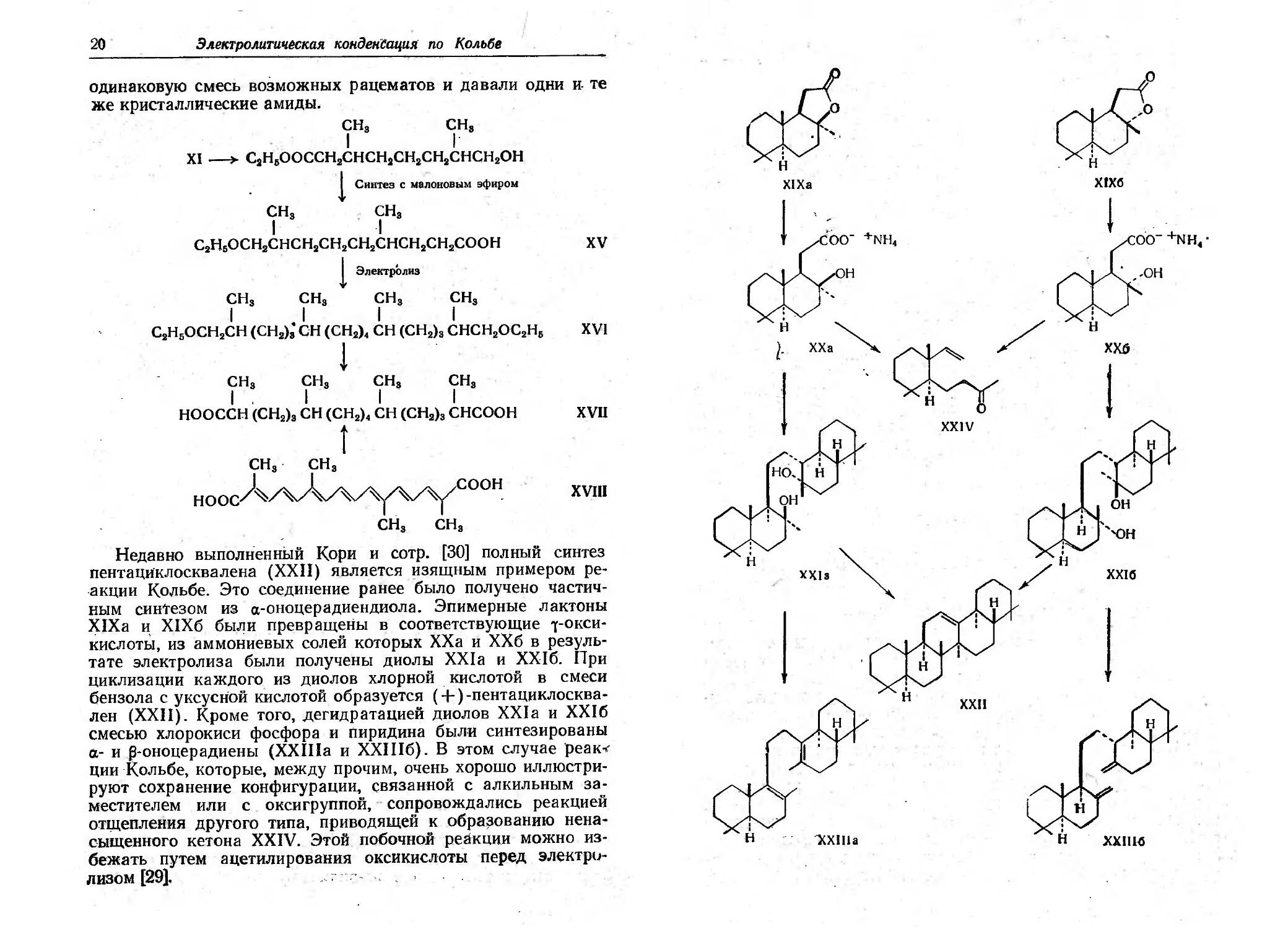
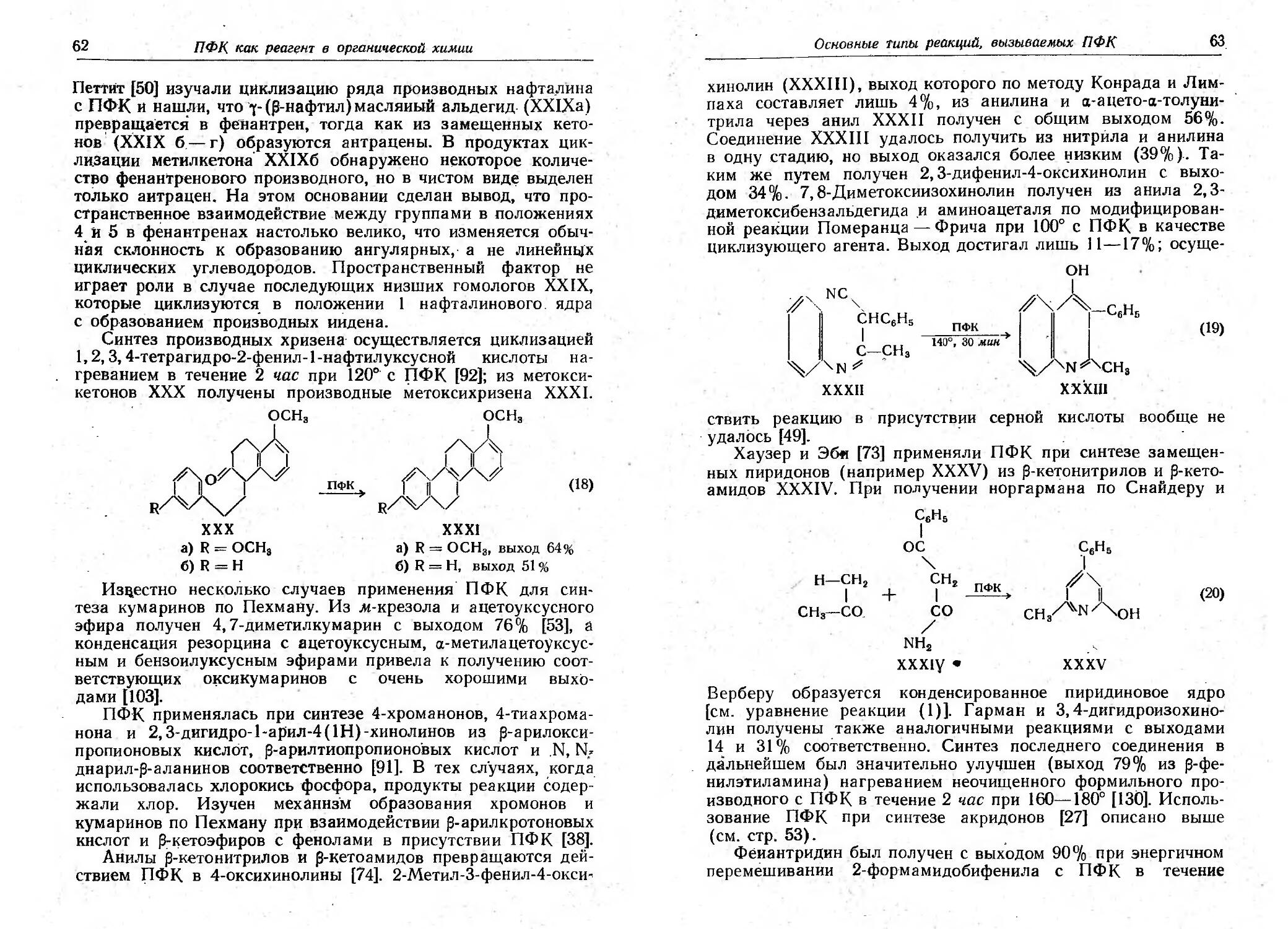
Недавно выполненный I(ори и сотр. [30] полный синтез
пентациклосквалена (ХХII) является изящным примером ре-
акции КОJlьбе. Это соединение ранее было получено частич-
ным синtезом из а-оноцерадиендиола. Эпимерные лактоны
XIXa и ХIХб были превращеIiы в соответствующие j-ОКСИ-
кислоты, из аммониевых солей которых ХХа и ХХб в резуль-
тате электролиза были получены диолы XXIa и ХХIб. При
циклизации каждоrо из диолов хлорной . кислотой в смеси
бензола с уксусной кислотой образуется (+) -пентаццклосква-
лен (ХХII). Кроме Toro, деrидратацией диолов XXla и ХXIб
смесью хлорокиси фосфора и пиридина были синтезированы
0.- и оноцерадиены (XXIIIa и ХХIIIб). В этом случае реак-<
ции .I(ольбе, которые, между прочим, очень хорошо иллюстри-
руют сохранение конфиrурации, вязанной с алкильным за-
местителем или с оксиrруппой, СQпровождались реакцией
отщепления друrоrо типа, приводящей к обра;юванию нена-
сыщенноrо кетона XXIV. Этой побочной реакиии можно из-
бежать путем ацетилирования оксикислоты перед электрц-
пИЗ0М [29].
! : . d()Q- +NH4
W..O H
' ХХа
j
н';:&,
он
XXI8
J
.'ХXI 11 а
ф
. н
ХIХб
!
Ф . OO +NH4'
"ОН
,
XM
н О I
XX1V & Н
'. I
I
...
ОН
-"''Он
ХХlб
XXII
j
ff
ХХI Шi
ЭАeJCТРОIШf'uчеClCQя конденсация па I(ОАь6е
п рименение
2з
22
Насыщенные жирные кислоты
Еще' в 1895 r. Миллер и Хофер 1146] разработали метрд
синтеза ЖИРНI:!IХ кщ:лот XXVIII, состоящий. в электролизе
смеси монокарбоновой кислоты XXV и кислоro зфира XXVI
с. последующим rИДРОЛИЗ0М первоначально образующеr:oся
продукта перекрестной конденсации XXVII.
R R R'OOC (CH t )2n COOR'
t t
RCOOH + НООС (СН 2 )n' COOR' .......-+ R (СН 2 )n COQR' .......-+
XXV XXVI ХХУII
R (СН 2 )n СООН
XXVIII
Первоначальные условия реакции в дальнейшем были в
значйтельной степени улучшены [63]. Этот удобный метод
позволяет удлинять цепь карБОНОВОЙ"IШСЛОТЫ на любое число
атомов уrлерода практически за одну операцию. Например,
стеариновая кислота (XXIX) была получена [63] из миристи-
новой кислоты И кислоrо эфира аДИПИИОВОЙ кислоты, из ук-
сусной КИСЛQ'tЫ и кислоrо эфира rексадекандика рбоновой ки-
слоты, а также из каприновой кислоты и кислоrо эфир'а себа .
циновой IШСЛОТЫ.
СН з (СН 2 )12 СООН + НООС (СН 2 )4 СООСНЗj
.\.-
CHjjCOOH + НООС (СН 2 )16 СООСН з СН з (СН:дI6 СООН
XXIX
t
СН З (СН 2 )а СООН + НООС (СН 2 )а СООСН з ..........J
Помимо простоты, электролитический метод имеет то пре-
имущество, что в этом случае обычно получаются жирные
кислоты высокой степени чи тоты. Смесь yr леводорода, кис
лоrо эфира и полноrо эфира, образующихся в результате сим-
метричной и перекресТной конденсации, часто можно разде
лить 'переrонкой. I(роме Toro, смесь можно rидролизовать и
кислотную часть.. разделить на двухосновную и нужную одно'"
основную кислоты переrонкой, кристаллизацией, экстракцией
растворителем или методом распределения. П ри COOTBeT
ствующем подборе исходных кислот получаются вещества,
которые- не заrрязнены кислотами с близкими физическI'JМИ
свойствами и поэтому Moryт быть леrко очищены. Однако
. при очистке продуктов реакции иноrда встречаются затруд-
нения при ра90те с малыми количествами исходных кислот.
коrда цепь удлиняется лишь на несколько атомов уrлерода.,
Трудяость очиспш 'объясняется rлавным ..образом заrрязне-
нием монciэфира, образующеrося в результате желательной
перекрестной конденсации, небольшими количествами мети-
ловоrо эфира исходной кислоты. Такие прОдукты образуются
при побочных реакциях исходной кислоты с метанолом, обыч-
но применяемым в качестве растворителя при. электролизе
(см. раздел «Введение»). Очистку. леrко осуществить, еСЛf!
ПрИМенятЬ кислые бензиловые эфиры вместо кислых метило-,
вых и этиловых эфиров. БензиJIOВЫЙ эфир, образующийся
в результате перекрестной конденсации,.МОЖНО отделить от
метил()воrо эфира исходной кислоты переrонкой и затем rид
ролизовать или превратить без предварительноrо выделения
в требуемую кислоту rидроrенолизом [34, 96].
Разветвленные жирные кислоты
Электролитический метод вполне приrоден для получе-
ния мноrих жирных кислот ИЗ0строения. I(ак известно, подоб
ные соединения встречаются, хотя обычно в очень малых ко-
личествах, во мноrпх природных липидах. Асано и Ота ([4];
ср. [102]) синтезировали рацемическую туберкулостеариновую
кислоту (XXXI) электролизом 2 метилдекановой кислоты
(ХХХ) и моноэтиловоrо эфира себациновой кислоты. Такая
успешная перекрестная конденсация с участием а-замещен
ной кислоты вызывает интерес (см. раздел «Области приме-
нения реакций») , однако этот метод, естественно, нельзя
СИЗ
I
СН з (СН 2 )7 снеоон + НООС (СН 2 )а СООС 2 Н 5 .......-+
ХХХ
СН З
........-+ СНа (СН 2 )7 tH (СН 2 )а СООН
XXXI
использовать для получения ( )-туберкулостеариновой кис..
JIOTbl rлавной составной части м'икобактерий туберкулеза,
и ее правовращающеrо изомера.. Они MorYT быть получены
друr: им путем, предложенным Линстедом и сотр. [89]. Пере-
крестной конденсацией октановой кислоты и монометиловоrо
эфира "метилrлутаровой кислоты (V) получают 3-метилун-
дека новую кислоту (ХХХII), при дальнейшей конденсации ко.
торой с монометиловым эфиром ззелаиновой кислоты OOQa-
зуется ( :t: ) -туберку лостеа риновая кислота (XXXI). Если в
описанную реакцию вводить вполне доступные энантиоморф-
ные формы КИСJIоrо эфира V. то при электролизе Ае происходит
24
Электролитическая конденсация 'I'!O l(ольбе
Применение
2...
. *
СНа (СН 2 )6 СО ОН + НООССН 2 СНСН 2 СООСН а ............
. I .
СНа
V
СНа (СН 2 )16 СООН + (XXXIV)
СНа СНа СНа
I I I
СНа (CH )17 СНСН 2 (;НСН 2 С==СН 2
ххху
1. ЭлеК'!'РОЛ\lЗ )
2. ПIlРОЛ!lЗ
раце изации и образуются чистые (+) - и ( -) -формы тубер-
ку,nостеаРИRОВОЙ кислоты [Ю], причем ( ) -форма идентична
ПРИрQДНОМУ продуК'rу.
1. N РРNСУКЦННИМИА, ..
2. Лревр!iщеИllе ., ацетат
'. , .
----+ СНа (СН 2 )7 СНСН 2 СООН
I
СНа
ХХХН
(ХХХII) + НООС (СН 2 )у СООСН а ----+
*
СНа (СН 2 )7 СН (СН 2 )а СООН
I
СН!,
ХХК(
СНа СНа. СНа
I J I
СНа (CH 2 )ii СНСН 2 СНСН==ССН 2 ОСОСН а
XXXVI
1. ЦАIН,
2. СrО.fпиридии ..
3. Ag.O
4. Этерификация
Электролитические Методы были использованы недавно
также для синтеза друrой составной части микобактерий TY
беркулеза разветвленной миколипеновой кислоты: которой
приписаlЮ с:троение (+) -эрuтро-2, 4, 6-триметилтетракозен-2-
авой-транс кислоты. В одном из методов синтеза метиловоrо
эфира XXXVII рацемической формы этой кислоты ацетокси-
кислота XXXIV, полученная из эрuтро- , '-диметилпимелино-
вой кислоты (XXXI 11), подверrалась электролизу совместно
со стеариновой кислотой. rIосле пиролиза продукта реакции
получен олефин XXXV. При реакции этоrо олефина С N-бром-
сукцинимидом был синтезирован бромид, превращенный за-
тем в ацетат XXXVI, из KOToporo был получен метиловый
эфир XXXVII. Замена в этом синтезе рацемата ХХХПI соот-
ветствующей энантиоморфной формой должна привести к об.
разованию самой миколипеновойкислоты.
СНа. СНа
I I Несколько
НООССН 2 СНСН 2 СНСН 2 СООН стадиЙ ..
ХХХIII
СНа СНз СНа
I I I
НООССН 2 СНСН 2 СНСН 2 ССН з
I
I
ОСОСН а
СНа СНа СНа
I I I
----+ СНа (СН 2 )17 СНСН 2 СНСН==ССООСН а
XXXVII
1( числу друrих липидов, полученных электролитическим
методом, относятся кислоты изостроения XXXVIII [73, 97] и
.прщщвращающие кислрты с разветвленной цепью XXXIX [97],
Щ)ТОрЫе. как .и nQлучеНlIые из них восстановлением спирты,
идентичны важныI составным частstм ланолина.
СНа СНа
I ' I
СНаСН (CH2) CQOH + ноос (СН 2 )n COOR............CHaCH (СН 2 )т+n СООН
. XXXVIII
т ==2, 1.,2, 4, 6, 10, 8; 10, 12, 14, 8 и
п == 4, .7,.8; 8, 8, 4, 8, 8, 8,8,. 16 с601ветственно
.-' * .
СН а СН 2 Сli (СНа)т СООН + ноос (СН 2 )n GOOR
I .
СНа
СНа
J
СНвСНаСН (СН 2 )т+n СООН
*
XXXIX
т 2. 2; 1, 2, 4, 6, 8, 10, 4; 14, 18 и
. .
п == 2, 4, 7, 8, 8, 8, 8, 8, 16, 8, 8 соответственно
XXXIV
Окснсоединеиия
К друrому типу ки-СЛОТ, найденных в J!анолине и таких
природных продуктах, как цереброзиды, относятся а,-ОКСИКИС-
лоты XLI. Стереохимия этnх. соединений была установлена
электролитическим синтезом [72] ряда антиподов из жирных
Электролитическая конденсация по Кольбе
26
Прuменение
27
ислот И ацетата ( ) моноэтиловоrо эфира яблочной кисло-
ты (XLa). ПОсJ<'ольку исходный' продукт, содержащий aцeT
оксиrруппу в а-положении. к отщепляемой при электролизе
карбоксильной rруппе, це вступает в реакцию ольбе (см.
стр. 12), в этой рабgте электролизу подверrали смесь двух
изомеров положения (XLa и ХLб).
. .
СНз (СН 2 )б СНСН 2 СООН
1
ОСОСН з
1. Электролиз с:.
НОО С (С н!). СООСн.
2. rюфолиз '+
. *
СН з (СН 2 )n СООН+НООССН2СНСООС2Нь+нООССНСН2СООСаНб
I 1.
ОСОСН а ОСОСН а
XLa ХLб
.
СН з (СН 2 )б СН (СН 2 )10 СООН
I
ОН
XLIV
XLI
Аналоrичным образом была установлена конфиrурация
( + ) -эйкозанола-2 (XL VI) спирта, содержащеrося в МИКО-
бактериях туберкулеза птичьеrо типа и tiтothy bacillus. При
rидролизе ацетильноrо производноrо, полученноrо в резуль-
тате электролиЗа смеси стеариновой и (+) -З-ацетоксимасля-
ной (XLV) кислот, образуется вещество, идентичное природ-
ному спирту (XL VI) [123].
* *
СН з (СН 2 )n+ 1 СНСООС 2 Н б ......... СНа (СН 2 )n+ i снеоон
I 1.
ОСОСН а ОН
п==О, 2, 4,6,12
в качестве при мера более общеrо метода получения опти-
чески активных оксикислот можно привести недавно выпол-
Ненное определение [122; ер. 121] абсолютной конфиrурации
рицинолевой кислоты. В результате перекрестной коиденса-
ции при электролизе смеси rексановой . кислоты и мономети-
ловоrо эфира ( )- -ацетоксиrлутаровой кислоты (ХLП)
была получена (+) -З-оксинонановая кислота (XLIII), пред-
СТ8вляющая собой антиПОД продукта ОJ(ИСJIJ:lТe}lьноrо расщеп-
ления метиловоrо эфира рицинолевой кисл ты. Ацетилирова-
ние соединения XLIII и последующий электролиз смеси про-
дукта реакции с монометиловым эфи.ром ю, w-нонандикарбо-
новой кислоты приводят К (+) 1 2-0ксистеа риновой кислоте
(XLIV), представляющей с<>бой антипод диrидрорицинолевой
кислоты. Поскольку конфиrурация исходноrо вещества (XLII)
известна, можно считать выясненной и конфиrурацию рици-
нолевой кислоты. ., . -
..
СНа (СН 2 )lб СО ОН + НООССН 2 СНСН з
I
ОСОСН.
1. Электролиз '+
2. rК.IIрОJlИЗ
XLV
*
СНа (СН 2 )17 СНСН а
I
ОН
XLVI
* .
НООССН 2 СНСН 2 СООСН з
I
ОСОСН а
XLII
1. Элект олиз с
СН,< .kCOOH
2. идрОли:f.
эрuтро- И трео-Формы (:!::) -диоксипроизводных ненасы-
щенных жирныхlЩCЛОТ претерпеваIC?Т реакцию Кольбе, со-
храняя конфиrурацию [15, 17]. Так, при электролиЗе смеси
эрuтро-9,10-диоксистеариновой кислоты (XLVII) и кислоrо
эфира адипиновой кислоты' образуется эрuтро диоксибеrено-
вая кислота (XLVIII) [15].
СНа (СН 2 )7 сн СН (СН 2 )7 СООН + ноос (СН 2 )4 СООСН а
I I .
. ОНОН
XLVII
1. Электролиз
2. rи.о.ролиз )
*
СНа (СНа)б СНСН 2 СООН .-.....+
. 1 .
ОН
XLIII
СН з (СН 2 )7 СН СН (CH 2 )1I СООН
I I .
ОН ОН
Х!. VЩ
Электролитичес"ая конденсация по 1(альбе
п рименение
29
28
Реакции 9лектролитйчес ой конденсации были недавно
широко использоsаны для' установления строения спирта тер-
пеновоrо ряда фитола, и ющеrо конфиrурацию -3, D-7, D-I 1,
I5-тетраметилrексадецен-траftс 2 ола 1 [26]. Синтез был про-
веден по следующей схеме:
........
Несколы(о стаАII'
Ненасыщенные кислоты
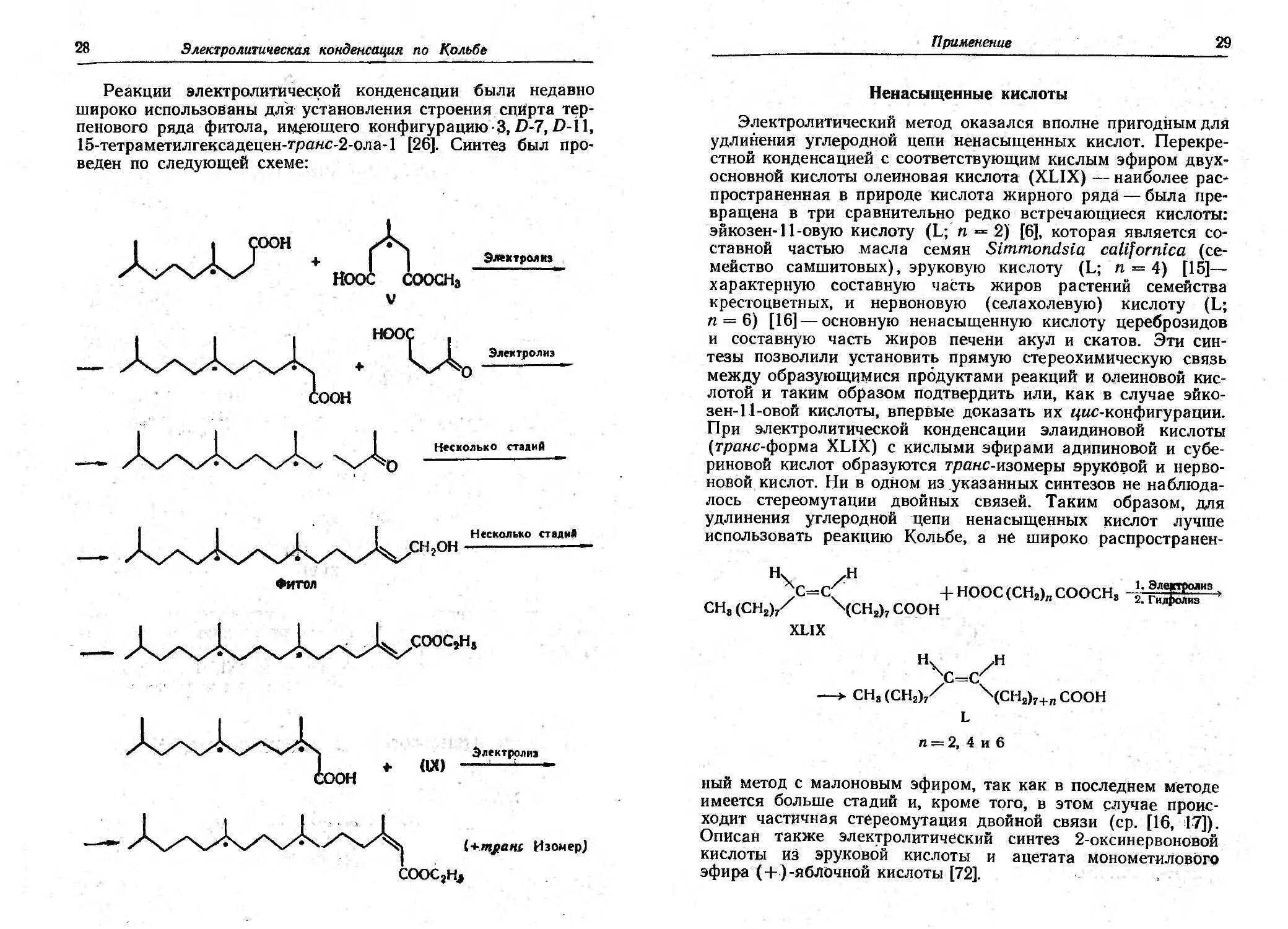
Электролитический метод оказался вполне приrодным для
удлинения уrлеродной цепи ненасыщенных кислот. Перекре-
стной конденсацией с соответствующим кислым эфиром ДBYX
ОСНОВНОй кислоты олеиновзя кислота (XLIX) наиболее pac
пространенная в природе кислота жирноrо ряда была npe-
вращена в три сравнительно редко встречающиеся кислоты:
эйкозен-ll овую кислоту (L;. n "'"' 2) [6], которая является со-
ставной частью масла семян Simmondsia саЩоrniса (се-
мейство самшитовых), эруковую кислоту (L; n >== 4) [15]
характерную составную часть жиров растений семейства
крестоцветных, и нервоновую (селахолевую) кислоту (L;
n == 6) [16] основную ненасыщенную кислоту цереброзидов
и составную часть жиров печени акул и скатов. Эти син-
тезы позволили установить прямую стереохимическую связь
между образующщшся продуктами реакций и олеиновой кис-
лотой и таким образом подтвердить или, как в случае эйко-
зен lI-овой кислоты, впервые доказать их цuс конфиrурации.
При электролитической конденсации элаидиновой кислоты
(траftс форма XLIX) с кислыми эфирами адипиновой и субе
риновой кислот образуются траftс изомеры эруКЩюй и нерво-
новой кислот. Ни в одном из указанных синтезов не наблюда-
лось стереомутации двойных связей. Таким образом, для
удлинения уrлероднойцепи ненасыщецных ки-слот лучше
использовать реакцию Кольбе, а не широко распространен
.. оон 11
Э_КТРOJlНS
+но оос.н. ·
v
+ НООт 1 .
ЭлеICТРОЛИЗ
............
o
Несколько ('ТаимА
.ИТОJl
н н
" / 1. Эл ив
/С==С, . + НООС (СН 2 )n СООСН з 2. rИА Рол из 4
СНа (СН 2 )7 '(СН 2 )7 СООН
XLIX
..
(tX)
лектр!>лиз
Н" /Н
с==с
СН з (СН 2 )7/ "(СН 2 )нn СООН
L
п==2,4и6
. C-..I"'" и'.....)
СООСаН..
ный метод с малоновым эфиром, так как в последnем методе
имеется больше стадий и, кроме Toro, в этом случае проис
ходит частичная стереомутация двойной связи (ср. [16, п]).
Описан также элек:rролитич ский синтез 2 оксинервоновой
кислоты из ЭРУКовой кислоты И ацетата монометиJiовоrо
эфира (+) -яблочной кислоты [72].
Электролитическая кoнiJенсация по Кальбе
Прuменение
31
Н" /Н
с==с
СН з (CH2) / "(СН 2 )7 соон
LI
Н" /Н
с-==с
/" .
СНз (СН 2 )5 (СН 2 )9 СООН
LV
ния цuе-изомеров ненасыщенных кислот (15]. Эти непрямые
электролитические синтезы через промежуточно образующие- .
ся диоксисоединения обычно не имеют преимуществ перед
прямым методом удлинения цепи ненасыщенной кислоты, за
исключением тех случаев, коrда в ходе синтеза желательно
осущ ствить стереомутацию и и коrда затруднена очистка
исходноrо вещества или конечноrо продукта. Очистку ч'аще
Bcero трудно осуществить при удлинении цепи с применением
кислых эфиров янтарной н, по-видимому, малоновой кислот
(ер. [17, 96]). В этих случаях продукт электролиза диокси-
производноrо леrче очистить от следов исходноrо вещества
[17, 96]. .
Друrим приМером прямоrо удлинения цепи ненасыщенных
кислот может служить превращение (+) -циклопентен-2 илук-
сусной кислоты (LVI) в хаульмуrровую (LVI]; n == 11) [99] и
алепрестовую (LVII; n == 4) [152] КИСлоты два представи
теЛя циклопентениловых кислот, содержащихся в масле семян
видов Н ydпoearpus. Поскольку стереохимически ИСХОДНое Be
щество принадлежит к ряду d-rлицериновоrо альдеrида, эти
синтезы показывают, что природные циклопентениловые кис
лоты обладают конфиrурацией, указанной на схеме:
Примером получения Стране-продукта из исходноrо. веще-
ства цuе-строения может служить. стереоспецифический син-
тез [17] вакценовой кислоты (LIV), которая Qаходится в сле
дах во мноrих животных жирах и предстаВJlяет собой первую
жирную кислоту тране-конфиrурации, выделенн..ую из при-
родных веществ. rидрокеилирование пальмитоолеиновой кис-
лоты (LI) .....,...одной из rлавных составных частей жиров мор-
ских животных надмуравьиной кислотой прщзодит к трео-
9,10-ди о ксипальмитиновой кислоте (LII). При электролизе
!
н ОН н он
I I I I
СНа (СН 2 )5 c c (СН 2 )7 СООН СН З (СН 2 )5 c c (СН 2 )о СООН
. I I I I
НО Н ОН Н
LП LШ
!
СНа (СН 2 )5" . /Н
с==с
Н/ "(СН 2 )о СООН
LIV
H2COOH + HOOC(CH 2 )п COO R
LVI
, JI.IIТРОnИЗ
1 . r8APOnU. ·
этой кислоты совместно с монометилоВым эфиром янтарной
кислоты образуется Tpeo-ll, 12 диокснстеариновая кислота
(LIII), которую бромируют И дебромируют. обычными MeTO
дами и получают ненасыщенную тране кислоту (LIV). Непо
средственное удлинение цепи пальмитоолеиновой кислоты
путем электролиза ее вместе с монометиловым эфиром янтар-
ной кислоты приводит К цuе-изомеру (L У) вакценовой кис-
лоты, который также встречается в природе. Она представ{
ляет собой основную ненасыщенную жирную кислоту. содер""
жащуюся в некоторых бактериях, и идентична rемолитиче-
СКОМУ фактору мозrа лошади. .
"Подобно тому, как из трео-диоксипроизводных жирных
К;ВСЛОТ можно получать транс ненасыщенные кислоты, что
Ц(JИ8зывает приведенный . выше при мер, соответствующие
эрuтро-дноксикислоты MoryT "быть ИСПQльзоааны для .получе
............. C:H;)a+1 СООН
LVII
Друrой способ получения ненасыщенных кислот состоит
в удлинени" цепи электролизом кислот с, тройной связью и
кислых эфиров двухосновных кислот. Из стеароловой кисло.
ты (LVIII) и кислоrо эфира адипиновой кислоты получена'
беrеноловая кислота (LIX) [8], тоrда как электролиз смеси
каприловой кислоты и кислоrо эфира кислоты с тройной
связью LXI [7; ер. 31] приводит непосредственно к образо
ванию таририновой кислоты (LXII) [7], которая содержится
в масле семян Pieramnia. При частичном восстановлении
стеароловой и таририновой кислот над катализатором JIинд
лара образуются соответствующие ненасыенныыe цuс-кисло-
ты эруковая (LX) и петросел новая (LXIII), представляю
щие собой характерные составные части жиров, содержащихся
32
Электролитическая конденсация па Кальбе
л pUMeHeliue
33
в семенах растений сеМейства крестоцветных и зонтичных
соответственно.
СНа (СН 2 )7 0== С (СН 2 )7 СЬОН.+ ноое (СН 2 )4 СООСН в : ::; ::из
L VIII
.......-+ СНа (СН 2 )? С==С (СН 2 )н СООН н./Рd РЬ -+
LIX
Циклические соединения
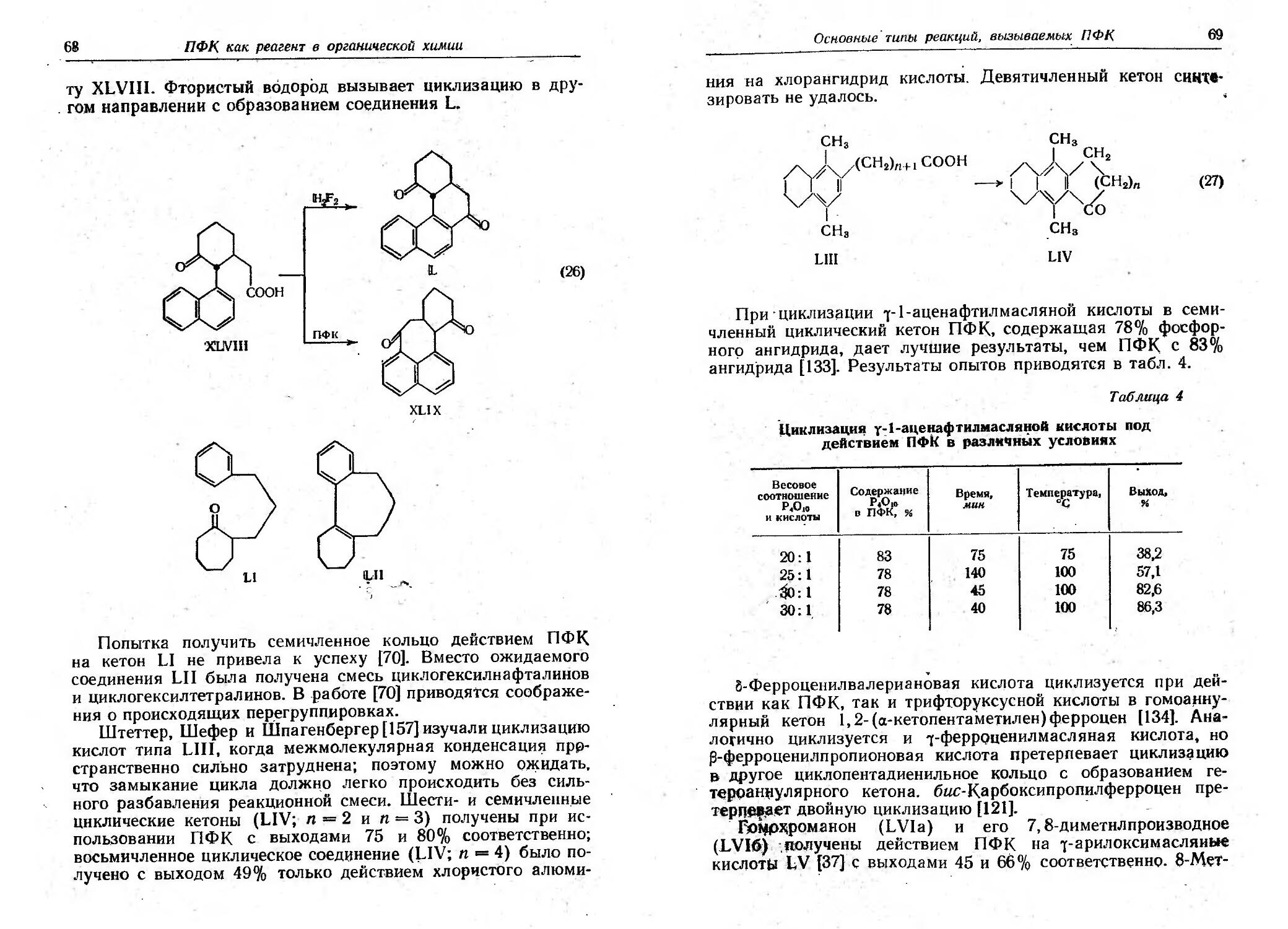
Одним из первых примеров использования реакции I(ольбе
для синтеза при родных веществ явилось получение (:t)-MYC
кона Хансдиккером [76]. Электролиз смеси lO метоксиундека
новой кислоты (LXX) и моноМетиловоrо эфира метилrлута-
ровой кислоты (У) привел к образованию метоксиэфира
LXXI, далее превращенному через бромид LXXII и кетоэфир
LXXIII в (:t) MYCKOH (LXXIV).
Н" /Н
С==С .
СНа (СН 2 )/' "\.(СН 2 )11 СООН
LX
СНз (СН 2 )в СООН + НООС (СН 2 )4 О== С (СН 2 )4 СООСН а : :;; ::из -+
(LXI)
СНа (CH 2 )lo С==С (СН 2 )4 СООН н.fРd РЬ -+
LXII
Н" /Н
С ==<с
СНа (CH 2 )lo/ . "(ОН2)4СООН
LXIН
Применение указанных реакций для синтеза олеиновой
кислоты [8] представляет rораздо более общий метод получе-
ния ненасыщенных }f(ИрНЫХ кислот, чем описанные выше Me
тоды. В резУJll;>та ;;'ЭJfектролиза J{ИСJIоrо эфир.а ЮJСЛОТЫ с
ТРОЙНОЙ связью .. (IJCV; n == 4) или ero Hl;fi!,lpero rомолоrа
(LXV, n == 3) с одноосновнойкислотой LXIV и дальнейшей
конденсации образовавшейся кислоты с тройной связью
СНа (CH2)7 n соои + HOOG. ( tl2)" C$fC(CH 2 )n СООСН а : ::; :из -+
LXIV LXV
СНа (СН 2 )7 С ==С (СН 2 )n СООН
LXVI
. . 1. Электролиз
(LХVI)+НООС(СН2)7 iI ООР З 2.Тидролиз )
I.,XVII
H.fPd Pb
'СНа (СН 2 )7 :5C (СН 2 )7 COQH . . )
LXVIII
Н Н :,
."с==с/.
СН а {СН 2 )7/' '''(CH )7 СООН
. 'LXlX. .
LXVI. е .КИСЛЫ14 эфиром LXVII получена стеарЬловая кислота
(L)\VIH). Частичным rидрированием ЭТОЙ кислоты над ката-
л заТQРОМ Линдлара получают ()леиновую кислоту (LXIX).
СНа
I .
СНаО (CHa)IO СООН + HQOCCH 2 CHCH 2 COOCH B
LXX V
СНа СНа
I I
CHaO (СН 2 ) I I СНСН 2 СООСН а Ве (СНа);! снеНаСООН
LXXI LXXII
СНа
СНа I
I /СН"
Br (CH a )ll СНСН 2 СОСН 2 СООСН а (CH 2 )l2 / СН 2
"СО
LXXIII LXXIV
Позднее Сrельберr Стенхаrен [130] описал первые синтезы
( + ) и ( ) MYCKOHa, из которых последний идентичен при-
РОДНОМУ продукту. При электролизе смесей неполноrо эфира
ДВУХОСНОВt!ОЙ кислоты LXXV и (+) - или ( ) формы моно-
метилово(о эфира метилrJ1утаровой кислоты (V) образуют
ся два антипода метилтапсиевой к слоты (LXXVI), которые
можно через дихлоранrидриды кислот и циклические дике-
тены превратить в ( ) и (+) MYCKOH (LXXVII).
СНзООС (CH a )lI СООН + Н60ССН2 НСН2СООСНз : ::;: ::иа -+
СНа
XXV V
. *
. НООС (CH a )l2 СНСН 2 СООН
tн з
*
/)Н",-
/ СНз "'-
(CH a )12 СН 2
co/
LXXVI
LXXVII
3 Зак. 1416
з4
Электролитическая конденсация по. к.ольбе
Описание экспериментов
35
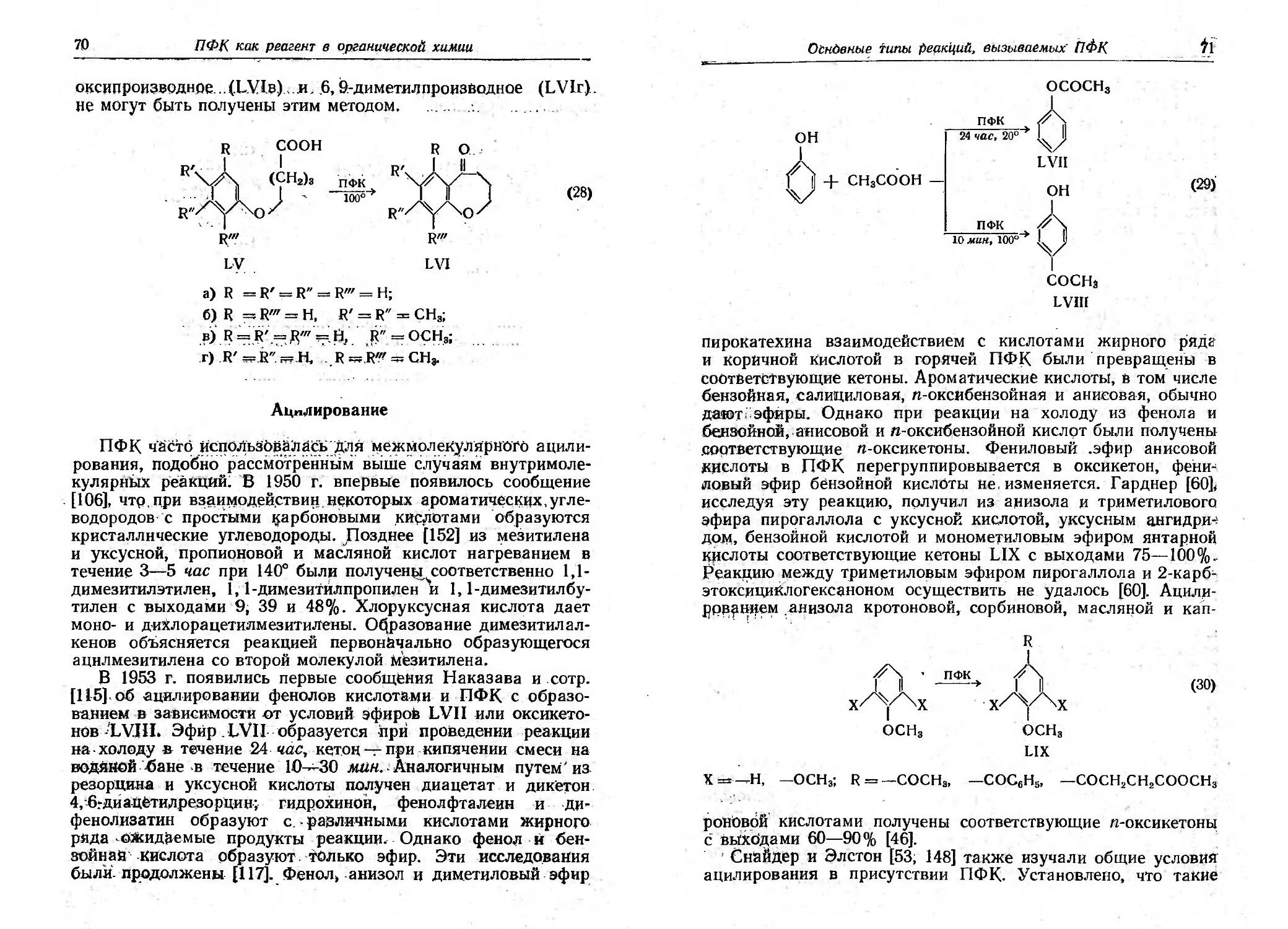
Установление К(jнфиrурации путеМ элеКТРОJlитиче<;ких
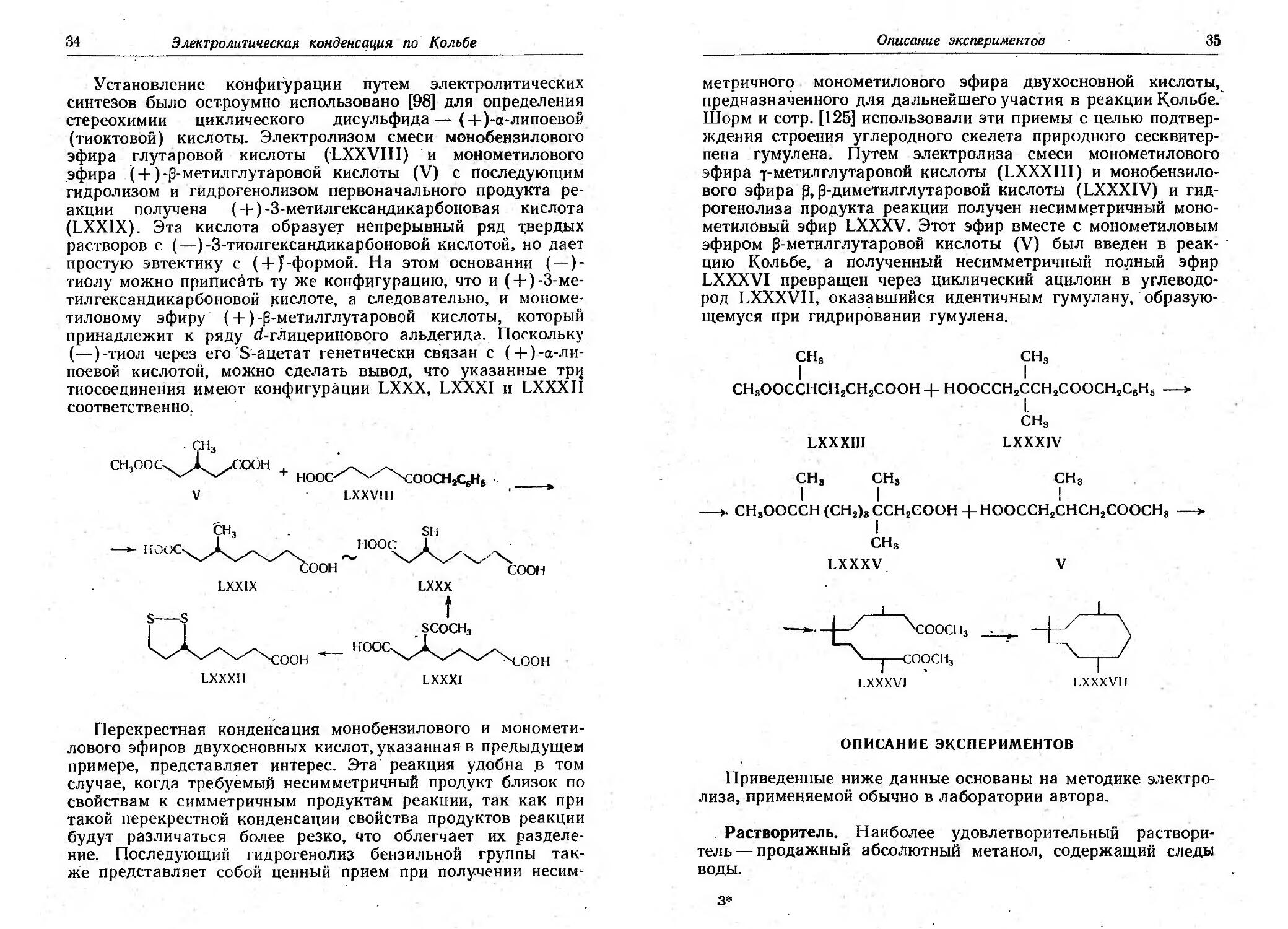
синтезов было ост.роумно использовано [98] для определения
стереохимии циклическоrо дисульфида (+ )-а-липоевоif
(тиоктовой) КИСЛОТЬJ. Электролизом смеси монооензнловоrо
эфира rлутаровой кислоты (LXXVIII) . и монометиловоrо
.эфира (+) - метилrлутаровой кислоты (У) с последующим
rидролизом и rидроrенолизом первоначальноrо продукта ре-
акции получена ( +) -З-метилrександикарбоновая кислота
(LXXlX). Эта кислота образуе:r непрерывный ряд 1;вердых
растворов с ( ) -3-тиолrександикарбоновой кислотой. но дает
простую эвтектику с (+ J -формой. На этом основании ( )-
тиолу можно приписать ту же конфиrурацию, что и (+) -З ме-
тилrександикарбоновой J<ислоте, а следовательно, и мономе-
тиловому эфиру. (+) -метилrлутаровой кислоты, который
принадлежит к ряду d-r.iIицериновоrо альдеrида. Поскольку
( ) -Т}lОЛ через ero .S' aueTaT rенетически связан с (+) -а-л и-
паевой кислотой, можно сделать вывод, что указанные TPI1
тиосоединения имеют конфиrурации LXXX, LXXXI 11 LXXXII
соответственно,
метричноr<? монометиловоrо эфира двухосновной кислоты,
предназначенноrо для дальнейшеrо участия в реакции I(ольбе.
Шорм и сотр. р25] использовали эти приемы с целью подтвер-
ждения строения уrлеродноrо скелета природноrо сесквитер-
пена rумулена. Путем электролиза смеси монометиловоrо
эФира1-метилrлутаровой кислоты (LXXXIII) и монобензило-
Boro эфира , -диметилrлутаровой кислоты (LXXXIV) и rид-
роrенолиза продукта реакции получен несиммrтричный моно-
метиловый эфир LXXXV. Этот эфир вместе с монометиловым
эфи:ром метилrлутаровой кислоты (У) был введен в реак- .
цию Кольбе, а полученный несимметричный ПО.[lный эфир
LXXXVI превращен через циклический ацилоин в уrлеводо-
род LXXXVII, оказ вшийся идентичным rумулану,. образую-
щемуся при rидрировании rумулена.
. СН з
CI-jl00С ОЬН.
+ HOOC ooCHtCeН. .
V LXXVIlI
СНз СНз
I 1
СН з ООССНСН 2 СН 2 СООН + НООССН2ССН2СООСН2С6Н5
1.
СНз
LXXXIII LXXXIV
.
СН з СН з СНз
1 1 I
СНзООССН (СН 2 )З ССН 2 СООН + НООССН 2 СНСН 2 СООСН з
I
СНз
LXXXV V
СН з _ SH
I{ООС 1 - НООС l . .
rv '-/"
СООН СООН
LXXX
t
_ SСОСН З
HOOC
....
. <'-ООН
I.XXXI
LXXIX
s s
COOH
LXXXII
......... СООCljз ......:........
УсООСli з
LXXXVJ LXXXV"
Перекрестная конденсация монобензиловоrо и мономети-
ловоrо эфиров двухосновных кислот, указанная в предыдущем
при мере, представляет интерес. Эта. реакция удобна .В том
случае, коrда требуемый несимметричный продукт близок по
свойствам к симметричным продуктам реакиии, так как при
такой перекрестной конденсации свойства продуктов реакции
буду.т различаться более резко, что облеrчает их разделе-
ние. ПоследующиЙ rидроrенолиз бензильной rруппы так-
же представляет собой ценный прием при полу.чении несим"
ОПИСАНИЕ ЭКСПЕРИМЕНТОВ
Приведенные ниже данные основаны на методике ЭJlекrро-
лиза, применяемой обычно в лаборатории автора.
. Растворитель. Наиболее удовлетворительный раствори-
тель продажный абсо.tIютный метанол, содержащий следЫ
воды.
3*
з6
Электролитическая конДенсация по Кольбе
Описание экспериментов
37
Электролизеры. Для лектролиза в лабораторном мас-
штабе. при использовании примерно 250 2 кислот наиболее
приrодны электролизеры, сделанные из больших пробирок
или стекляннЫХ cTaJ.{aHoB (рис. 1). Во время электролиза
электролизер охлаждают льдом, а иноrда льдом с солью или
смесью cyxoro льда и спирта. Большие электролизеры (на-
пример 350 Х 75 мм) дополнительно снабжены змеевиковым
ХОЛОДИЛЬНИ1ЮМ для облеrчения отвода выделяющеrося тепла.
Ввиду энерrичноrо выделения дву-
+ окиси 'уrлерода в процессе электро-
лиза механическоrо перемешиваиия
не требуется.
Электрическая цепь. В' электрическую цепь входят источ-
ник постоянноrо тока напряжением 110 в, электролизер, а-М-.
пер метр (0 5 а), одИII или два больших реостата (на 50 ом
каждый) и обычный переходный переключатель, как показано
на рис. 2.
Методика работы. Металлический натрий в количестве, до-
статочном для нейтрализации примерно 2% применяеМЫХ
кислот, растворяют в абсолютном метаноле. Затем добавляют
исходные кислоты и полученный раствор подверrают электро-
лизу до слабощелочной реакции. Расход тока (в фарадах),
Электроды. Следует применять
rладкий платиновый анод, который
может быть замене лишь иридие-
вым анодом, но это исключено по
економическим соображениям. К ма.
териалу для катода предъявляются
меньшие требования. Рекомендуется
применять платину, так как тоrда
оба электрода будут взаимозаме-
няемыми, и можно периодически
ИЗМенять направление тока. Таким
образом, обычно при меняются эЛеК-
тролизеры, снабженные двумя Па-
раллельными электродами, выре-
занными и з платиновой фолы"и тол-
щиной 0,05 мм. Каждый электрод
Рис. 1. Схема 9лектро- присоединяют к короткой платино-
лизера. вой проволоке, наrревая их паяль-
ной лампой до KpacHoro каления
и склепывая ударом молотка.
Свободный конец проволоки впаивают в стеклянную трубку,
обращая особое внимани на то, чтобы не оставалось капил-
лярных отверстий. Для создания электрическоrо контакта
в трубки с платиновыми проволоками заливают небольшое
количество ртути. Электроды должны находиться на расстоя-
нии 2 3 мм, что достиrается осторожным нажатием на
электроды через фильтровальную бумаrу. Между эл ктро-
дами, размер которых больше 40 Х 40 мм, рекомендуется
подвещивать небольшие стеклянные палочки, чтобы они
не повреждались в результате случайноrо контакта при
Iлектролизе.
111 11,
111 11,
.111 111
111 11I
11.' 111
I
1 ,
1
1
,
Реостат
t
Ртуть
Платuновои
проволока
Ллатuноваll
срол6t,О
Рис. 2. Схема 9лектрической цепи.
неоБХОДИ!JЫЙ для завершения реакции, обычно равен теорети-
ческому или в 1,5 раза выше в случае простых кислот и моно-
метиловых эфиров двухосновных j{ИСЛОТ; при электролизе
монобензиловых эфиров может потребоваться трехкратнbl,Й
расход тока.
В результате электролоза (в особенности ненасыщенных
кислот) на одном из электродов может образоваться нерас-
творимый осадок, что влечет за собой уменьшение силы ТОК:;!.
Образования подобных осадков можно избежать, если время
от времени с помощью переключателя изменять направление.
тока.. В некоторых случаях периодически приходится преры-
'вать электролиз и очищать электроды.
При электролизе желательно поддерживать температуру
электролита около 200 и не допускать повышения температуры
выше 500. .
Ниже ПрИБОДИТСЯ описание некоторых типичных примеров
реа кций Кольбе.
38
Электролитическая конденсация по Кольбе
Описание экспериментов
з9
н rексакозан [88, 150]
К раствору метилата натрия, приrотовленному 'из 0,1 е"
металлическоrо натрия u и 25 мл абсолютноrо метанола, добав-
ляют 5 е миристин,?вои кислоты. Полученный раствор поме-
щают в стеклянныи стакан (250 Х 30 мм) с двумя электро-
дами из платиновой фольrи (30 Х 20 мм, расстояние между
электродами 2 мм). Электролиз при силе тока около 1 а про-
водят до щелочной реакции. Содержимое электролизера ней- .
тра изуют несколькими каплями ледяной уксусной кислоты
и большую часть растворителя отrоняют в вакууме. Остаток
выливаюТ в воду и из смеси экстраrируют эфиром продукты
реакции. Эфирный раствор тщательно промывают 2 н. рас-
твором едкоrо натра, затем водой, 'сушат хлористым кальцием
и отrоняют эфир. После перекристаллизации остатка из пет-
ролейноrо эфира (т. кип. 40 600) получают 2,4 е rексакозана;
выход 60%, т. пл. 57 580.
кислоты. полученный раствор помещают в стеклянный стакан
с двумя электродами ИЗ платиновой фольrи (40 Х 25 мм, рас-'
стояние между электродами около 1,5 мм) и подверrают элек-
тролизу при силе тока 2 а до щелочной реакции. Содержимое
элеК',ролизера Пf)сле двух операций объединяют, нейтрали-
зуют несколькими каплями уксусной кислоты и упаривают
в вакууме. Остаток rидроЛИЗУЮТ водно метанольным раство-
ром едiюrо кали, продукты реакции разделяют на нейтраль
ную и кислотную части. Переrонка нейтральной части дает
12 е H TeTpaдeKaHa; выход 49%, т. кип. 1280 при 19 мм рт. ст.,
п 1,4275. Переrонкой кислотной части получ ют 11,9 е
(+ ) 3 метилундекановой кислоты; выход 48%, т. кип. 1170
при 0,5 мм рт. ст., п 1,4350, [а-Ш + 4,500. После перекристал-.
лизации 2,72 е остатка с т. пл. 81,5 82,5° сначала из смеси
бензола с петролейным эфиром (т. кип. 60 800) а затем из
ВОДЫ с небольшим количеством метанола получают 2,03 е
(+) , /-диметилсубериновой кислоты с т. пл. 83 83,50.
Дим тиловый эфир . / диметилсубериновой кислоты [90]
. К раствору метилата натрия, приrотовленному из 0,57 е
металлическоrо натрия, 90 мл абсолютноrо метанола и 10" мл
BO Ы, добавляют 35 е моuнометиловоrо эфира -метилrлутаро-
вои кислоты. Полученныи раствор помещают в большую про-
бирку (диаметр 50 мм) с катодом из платиновой фольrи и
анодом из платиновой спирали (длина проволоки 200 мм,
диаметр 0,02 мм, общая площадь поверхности 3,52 см 2 ) и под-
верrают электролизу при силе тока 2 а. Электролиз прекра
щают через 3,5 час, коrда электролит становится tлабощелоч
ным. К содер имому u электролизера приливают 1,22 е кон-
центрированнои сернои кислоты, затем ero фильтруют и упа-
ривают в вакууМе для удаления большей части растворителя.
К остатку приливают эфир, эфирный раствор промывают рас-
твором бикарбоната натрия, затем водой, сушат и упари-
вают. Остаток переrоняют и пол у чают 184 е диметиловоrо
Ф I '
Э ира , диметилсубериновой кислоты; выход 80%, т. кип.
101,5 102,50 при 0,6 мм {JТ. ст., n ,51,4376.
Нервоновая (цис тетракозен-15-0вая) кислота [16]
К раствору метилата натрия, приrОТ08ленному из 0,07 е
металлическоrо натрия и 40 мл абсолютноrо метанола, доба-
вляют смесь 10,0 е (0,036 моля) олеино ой кислоты и 19,0 2
монометиловоrо эфира субериновой ки слоты. Полученный
раствор помещают в стеклянный стакан с двумя электродами
из платиновой фольrи (20 Х 25 мм, расстояние между элек-
тродами 3 мм) и двумя U образными стеклянными трубками,
через которые пропускается холодная вода. На начальной
стадии электролиза при сИЛе тока 1,4 а начинает выделяться
бесцветный твердый осадок. К концу реакции сила тока
уменьшается. но она восстанавливается до первоначальной
величины при добавлении монометиловоrо эфира (Bcero 24,5 е,
И;/IИ 0,13 моля). После ЭJiектролиза содержимое электроли-
зера, дающее щелочную реакцию, подкисляют, упаривают и
разделяют на кислотную и нейтральную части. При переrонке
кислотной части из колбы Кона получено: а) 1,6 е ненасы-
щенноrо маслянистоrо ,вещества с т. кип. 70 120° при
10 5MM рт. ст., nl5' 1,4409; б) 10,5 2 диметиловоrо эфира до-
декандикарбоновой кислоты, не. подверrавшеrося дальнейшей
. очистке, с т. кип. 127 130° при 1O 5 мм рт. ст., т. пл. 39 41°
(чистое вещество плавится при 430); в) 5,9 2 маслянистоrо ве-
щества с т. кип. 186 202° при 10 5 мм рт. СТ., т. -Пл. 12 13,50,
после rидролиза KOToporo избытком 2 н. водно-метанольноrо
раствора едкоrо натра было получено 4;4 е достаточно чистой
(+ ) 3 Метилундекановая кислота [91]
. К раствору метилата натрия, приrотовленному из 0,09 2
металлическоrо натрия и 80 мл абсолютноrо метанола добав
ляют смесь 10 2 JO,0625 моля) монометиловоrо эфира (+)-
f3-мe:rилrлутаровои кислоты и 18 2 (0,125 моля) каприловой
40
Электролитическая конденсация по Кольбе
Литература
41
ЛИТЕРАТУРА
1. А а r I а n d G., J. prakt. СЬет., 6, 256 (1873); 7, 142 (1873).
2. А s а n о М., I< а m е d а У., W а d а Т:, J: Pharm. Soc. Japan, 63, 538
(1943); 64, N2 8А, 25 (1944); 65, N2 4А, 15 (1945); С. А., 44, 7229
(1950); 45, 4302 (1951).
3. А s а n о -М., к: а m е d а У., W а d а Т., J. РЬаrIП. Soc. Japan, 65,
N2 7/8А, 5 (1945); С. А., 45,5617 (1951). .
.'4. Asano М., Ohta J., J. Pharm. 50С. Japan, 65, N2 5/6А, 10 (1945);
. С. А., 45, 4302 (1951).
5. А s s е 1 i n е а u С.. А s s е 1 i n е а и J., S t.a 11 ь е r g S t е n h а g е n S.,
S t е n h а g е n Е., Acta СЬет. Scand., 10,478, 1035 (1956).
6. Baker В. W., Houghton R. Р.. Weedon В. С. L., неопублико-
ванные данные.
7. В а k е r В. W., I< ie r s t " а d R. W., L i n s t е а d R. Р., W е е-
d о n В. с. L., J. СЬет. Soc., 1954, 1804.
8. Baker В. W., Linstead R. Р., Weedon В. С. L., J. СЬет. Soc.,
1955, 2218.
9. В е h а 1 А., Апп. сЫт et phys., 16,367 (1887).
10. В е n n е t t G. М., G и d g е о n Н., J. СЬет. Soc., 1938, 1679.
Н. В е r I Е., Ber., 37, 325 (1904).
12. В i r с h S. F., G r i р Р V. Е., М с А 11 а n D. Т., N а t h а n w. 5.,
J. СЬет. 50С., 1952, 1363.
13. В. 1. о. S. Final Report N2 1472. Нет N2 22, р. 13; С. 1. о. 5.
ХХХШ 50, р. 728:
14. В 1 о о d с. Т., С а r t w r i g h t N. J., L i n s t е а d R. Р., J. СЬет.
Soc., 1952, 2268.
15. В о и n d s о. G., L i n s t е" а d R. Р., W е е d о n В. С. L., J. СЬет. Soc.,
1953, 2393.
16. В о и n d s о. G., L i n s t е а d R. Р., W е е d о n В. С. L., J. СЬет.
Soc., 1954, 448.
17. В о и n d s о. G., L in s t е а d R. Р., W е е d о n В. С. L., J. Сhеш.
Soc., 11154, 4219.
18. В о и v е а и 1 t L., ВиН. soc. shim. France, Мет., 29, 1042, 1046 (1903).
19. В о w m а n R. Е., М а s о n R. G., J. СЬет. 50С., 1951, 2748.
20. В r ее d е r v е I d Н., I( о о у m а л Е. С., Rec. trav. сЫт., 76, 10 (1957).
21. В r е t t 1 е R., Р 01 g а r N., J. СЬет Soc., 1956, 1620.
22. В r i d g е w а t е r R. J., Biochem. J., 64, 593 (1956).
23. В r о с k m а n С. -J., Electro Organic Chemistry, John Wiley апа 50ns,
New York, 1926.
24. В f О W n А. С., W а 1 k е r J., Апп., 261, 107 (1891); Trans. Roy. Soc,
Edinburgh, 36, 291 (1891).
25 В u с h t а Е., В и r g е r К, Апл., 580, 125 09@), )
26. В u r r е 11'J. w. к., W е е d о n В. С. L., неопубликованные данные.
27. С а v а n n а R., S t а 11 ь е r g - S t е n h а g е n 5., Atti acad. naz1. Lin.
cei, Мет., C1asse sci. fis., mat. е nat., 3, 31 (1950).
28. С а v а n n а R., S t а 11 ь е r g - S t е n h а g е n 5., Ricerca sci., 20,
1709 (1950); ср. С. А., 45, 6573 (1951).
29. Corey Е. J., Sauers R. R., J. Ат. СЬет. Soc., 79, 3925 (1957).
30. С о r е у Е. J., S а и е r s R. R., Swann S., J. Ат. Chem. Soc., 79, 5826
(1957). .
31. Cram о. J., AJlinger N. L., J. Ат. СЬет. Soc., 78, 25i8 (1956).
32. D е л i л а Е., Gazz. chim_ ital., 68, 443 (1938).
33. D i n h N g и у е n N., Acta Chem. Scand., 12, 585 (1958).
34. D о 1 е j s L., N о v о t n у L., Col1ection Czechos1ov. Chem. Communs.,
19,716 (1954). -
35. Е 1 Ь s К, I( r а t z к., J. prakt. СЬет., 55. 502 (1897):
36. Е v а n s Е. А., W h а 11 е у М., J. СЬет. 50С., 195'4, 3642.
37. F н i r w е а t h е r 'D. А., Proc. Roy. Soc. Edinburgh, 45, 23 (1925)..
38. F а i r w е-а t h е r о. А., Proc. Roy. Soc. Edinburgh, 45; 283 (1925).
39. F а r m е r Е. Н., К r а с о v s k i J.. J. СЬет. Soc., 1926, 2318.
40. F i с h t е r F., Organische EIektrochemie, Steinkopff, Dresden und
Leipzig, 1942.
41. F i с h t е r F., В fi r g i пА., He1v. Chim. Acta, 14, 90 (1931).
42. F i с h ti r F., Н о I Ь r о Т., He1v. Chim. Acta, 20, 333 (1937).
43. Fichter F., Ho1bro Т., He1v. Chim. Acta, 21,141 (1938),
44. F i с h t е f F., К е s t е n h о 1 i К., Не1у. СЫт. Acta, 25, 785 (1942).
45. F i с h t е r Р., L е и р i пО., Не1у. Chim. Acta, 21, 616 (1938).
46. F i с h t е r F., L и r i е S., Helv. Chim. Acta, 16, 885 (1933).
47. Fichter Р., Metz Е, He1v: Chim. Acta, 19,880 (1936).
48. Fichter F., Meyer R. Е., He1v" Chim. Acta, 16, 1408 (1933).
49. Fich ter F., Меу er R. Е., He1v. Chim. 'Acta, 17,535 (1934).
50. Fichtef F., Petrovitch А., Helv. Chim. Acta, 24,549 (1941}.
51. F i с h t е r F., R и е g g R.. Helv. Chim. Acta, 20, 1578 (1937).
52. F t с h t е r F., S с h n i d е r А., Helv. СЫт. Acta, 13, 103 (1930).
53. F i с h t е r F., S i е g r i s t W., Helv. СЫт. Acta, 15, 698 (1932).
54. Fichtef F., Stenz1 Н., He1v. Chim. Acta, 22, 971 (1939).
55. F i с h t е r F., S t е n z 1 Н., В е g 1 i n g е r Е., Неlу. Chim. Acta, 21,.
375 (1938). .
56. F i е s е r L. F., С 1 а р р R. С., D а u d t W. К, J. Ат. Chem. Soc., 64,
2052 ( 1942)).
нервоновой кислоты; выход 37%, т. пл. 37 390. После очист-
ки через литиевую соль получено 3 е кислоты с т. пл. 39,5
40,50. К:ислоту дважды перекристаллизовывают из спирта при
00 и получают нервоновую кислоту в виде ПJ;lаСТИНQК с т. пл.
40,5 41°.
Остаток (0,9 е) после ПереrOlIКИ содержит э,аrрязненный
тетратриа конта -цис-9-цис-25- диен.
Электролитическая конденсация по Кольбе
Литература
43
42
57. G i n g е с L. G., А n d е r s о л R. J., J. Biol.. СЬет., 157, 2Gз (1945).
58. G 1 а s s t о n е S., Н i с k Ii n g А., J. Chem. Soc.. 1934, 1878.
59. G 1 а s s t о л е S., Н i с k 1 i n g А., Tcans. Electrochem. Soc., 75, 333
(1939).
60. G о 1 d S с h т i d t 5., L е i с h е с W., Н а а 5 Н., Апп., 577. 153
(1952).
61. Goldschmidt S., Мiпsiлgес М., Ber., 87, 956 (1954).
62. G о 1 d s с h т i d t S., S t о с k 1 Е., Вет., 85, 630 (1952).
63. G с е а v е s W. S., L i n s t е а d R. Р., S h е р h а r d В. R., Т h o
т'а s S. L. S., W е е d о n В. С. L., J. СЬет. Soc., 1950, 3326.
64. G u s t Ь е е G., S t е n h а g е n ,Е., Svenck Кет. Тidskr., 54, 243
(1942).
65. Ha.monet J., ВиН. SOc. chim.,Fr8nce, Мет., 33, 513 (1905).
66. Н а n с о с k J. Е; Н., L i n s t е зd R. Р:, J. Chem. Soc., 1953, 3490.
67. Н е n с i с h Р., Н е с z о g А., Ber., 52, 2128' (1919).
68. Hencich Р., Schenk W., Ber., 52, 2120 (1919).
69. Н о f е с Н., Вес., 33, 655 (1900). .
70. Н о f е r Н., М о е s t М.; Апп., 323, 285 (1902).
71. Н о Р f g а r t n е с К, Молаtsh., 32, 523 (1911).
72. Н о с n О. Н. S., Р с е t о с i и s У. У., J. Chem. Soc., 1954, 1460.
73. Н о и g е n Р. .W., 11 s е О., S и tt о n О. А., de V i 11 i е с s J. Р.,
J. СЬет. Soc., 1953,98.
74. Нилsdiесkеr н., Вес., 75, 447 (1942).
75. Н и па d i ее k е r Н., Вес., 15, 460 (1942).
Щ Н и n s d i е с ker Н., Вес., 75, 1197 (1942).
77. К 8 r r е с Р., В е n z Р., М о r f R., R а и d n i t z Н., S t о 11 М.,
Т а k 8 h а s h i Т., Helv. СЫш. Acta, 15, 1399 (1932).
78. К а r С е r Р., В е n z F., S t о 11 М., Helv. СЫт. Acta, 16, 297 (1933).
79. К ас с е r Р., St о 11 М., Неlу. СЫт. Acta, 14, 1189 (1931).
80. к' а и f 1 е r Р., Н е r z о g С., Вес., 42, 3870 (1909).
81. К е k и 1 е А., Апл., 131,88 (1864).
82. К i ta и с а 5., ВиН, Inst. Phys. СЬет. Reseacch (Tokyo), 16, 765
(1937); С. А., 32, 4523 (1938); ср. repM. пат. 624331; с. А., 30, 2504
(1936).
83. К 01 Ь е Н., Апп., 69, 257 (1849)'.
84. К о с s с h i n g Н., Ber., '86, 943 (1953).
85. К си i s А., S с h а n z е с W., Z. physik. СЬет. (Leipzig), AI91, 301 (1942).
86. К i.1 n и z i Т., J. Ат. СЬет. Soc., 75, 1597 (1953).
87. L е о n а r d N. J., М а d е с Р. М., J. Ат. СЬет. Soc., 72, 5388. (1950,
88. L i n s t е а d R. Р., Е 1 v i d g е J. А., W h 8 11 е у М., А Course in Mo
decn Techniques of Organic Chemistry, Butterworths, London, 1955.
89. Liлstеаd R. Р., Lunt J. С., Weedon В. С. L., J. СЬет. Soc.,
1.950, 3331.
90. L i n s t е а d R. Р., L и n t J. С., W е е d о n В. С. L., J. СЬет. Soc.,
1950, 3333,
91. L i n s t е а d R. Р., L и n t J. с., W е е d о n В. С. L., J. Chem. Soc.,'
1951, 1130.
92. Linste.ad R. Р., Lunt J. с., Weedo.n В. С. L., She
р h а r d В. R., J. СЬет. Soc., 1952, 3621.
93. Linstead R. Р., Sh'ephacd В. R., Weedon В. С. L., J. Chem.
Soc., 1951, 2854.
94. L i n s t е а d R. Р., S h е р r d В. R., W е е d о л В. С. L., J. СЬет.
Soc., 1952, 3624. .
95. L i n s t е 8 d R. Р., S h ер h 8 С d В. К, W е е d о n В. С. L., L и n t J. С.,
J. СЬет. Soc., 1953, 1538.
96. L i n s t е а d R. Р., W е е d оп В. С. L., W 1 а d i s 1 а w 'В., J. Chem.
Soc., 1955. 1097.
97. М i 1 Ь и r n А. Н., Т r и t е с Е. У., J. Chem. Soc., 1954, 3344.
98. М i s 1 о w К, М е 1 и с h W. с., J. Ат. Chem. Soc., 78, 5920 (1956).
99. М i s 1 о w К, S t е i n Ь е с g 1. У., J. Ат. СЬет. Soc., 77, 3807 (1955).
100. М о о с h о и s е G. 'В., Trans. F8caday Soc., 28, 766 (1932).
101. Moroe Т., J. Ph8rm. Soc. Japan, 70, 416 (1950); 71, 121, ,"23 (1951);
С. А., 45, 2396, 8456 (1951),
102. Moroe Т., J. Pharm. Soc. Japan, 70,601 (1950). . .
103. М ос о е Т., S и g а w а r а М., З. Pharm. Soc. Jap8n, 72, 313 (1952);
С. А., 47, 6353 (1953).
104. М и r r а у А. R." Т а.у 1 о r Т. W. J., J. СЬет. Soc., 1937, 1450.
105. N о у е s А. А., Ат. Chem. J., 19, 775 (1897).
106. О f f е Н. А., Z. Naturfocsch., 2Ь, 182, 185 (1947).
107. Р а t t i s о n Р. L. М., S t с о t h е с s J. В., W о о 1 f о с d R. G., J. Ат.
Chem. Soc., 78, 2255 (1956).
108. Р 8 t t i s'On Р. L. М., W о о 1 f о с d R. G., J. Ат. Chem. Soc., 79, 2306,
2308 (1%7).
109. Ре t е r s е n J., Z. physik. СЬет., 33, 294 (1900).
110. Ре t е r s е n J., Z. Elektrochem., 12, 141 (1906).
111. Ре t е с s е n J., Z. Elektcochem., 18, 711 (1912).
112. Ре t е r s е n J., Z. Elektrochem., 20, 328 (1914).
113. Ре t е с s е n J., Z. physik. Chem., А191, 301 (1942).
114. Петров А. Д., Вяхирев Д. А., жох, 9, 513 (1939).
115. Riссочопi L., Gazz. сЫт. ital., 70, 748 (1940).
116. R'u z i с k а L., S t о 11 М., Helv. Chim. Acta, 16,493 (1933).
117. Ruzicka L., Sto\l М., Scheccer W , Schinz Н., Sei.
d 1 С. Р., Helv. СЫт. Acta, 15, 1462 (1932).
118. tizicka L., Stoll М., Schinz Н., Helv. Chim, Acta, 11, 1174
(1928).
119. S 8'1 а и z е J., ВиН. soc. сЫт. France, Мет., 37, 522 (1925).
120. Schmi'dt А. W., Schoellec У., Eberlein К, Вес., 74, 1313
(1941) ,
121. S е r с k Н 8 n s s е n к., Arkiv Kemi, 10, 135 (1956).
122. S е r с k Н ап s s е n к., Chem. and lnd., 1958, 1554.
44
Электролитическая конденсаЦиЯ по /(ольбе
ПОЛИФОСФОРНАЯ КИСЛОТА КАК PEArEHT
в оРrАНИЧЕСКОИ ХИМИИ
123. S е r с k Н а n s s е n к., S t ii 11 Ь е r g 8 t е n h а g е n 8., 8 t е п-
h а g е n Е., Arkiv Kemi, 5, 203 (1953).
124. 8 i n g е r R., S р r е с h е r Р., Helv. СЫт. Acta, 30, 1001 (1947).
125. Sorm F., 8treib'l М., Jarolim V., Novot'ny L., Doleis L.,
Н е r о u t V., Спет. listy, 48, 575 (1954); Chem. and Ind., 1954, 252.
126. 8 t ii 11 Ь е r g G., Arkiv Kemi, 12, 153 (1958).
127. 8 tii 1 1 Ь е r g 8 t е n h а g е n S., Arkiv Kemi, 2, 95 (1950).
.128. 8tiillberg S tenhagen S., Arkiv Kemi, 2, 431 (1950).
129. S t а 11 ь е r g - S t е n h а g е n S., Arkiv Kemi; 3, 249 (1951).
130. S t а 11 ь е r g 5 t е n h а g е-п 5., Arkiv Kemi, 3, 273 (1951).
132, 8 t ii 11 Ь е r g. 8 t е n 11 а g е n S., Arkiv Kemi, 6, 537 (1954).
133. 8toll М., Helv. СЫт. Acta, 34, 1817 (1951).
134. S t о 11 М., R о u v е А., Helv. СЫт. Acta, 20, 525 (1937).
135. С в а Д к о в с ка я [. Э., В о й т К е в и ч С. А., С м о л ь я н и в 0-
ва Е. К, Белов В. Н., жох, 27, 2146 (1957).
136. Свадковская [. Э., Смолъянинова Е. К., Белов В. Н.,
жох, 28, 2268 (1958). .
137. S w а n п. S., Trans. Electrochem. Soc., 69, 289, 339 (1936); 77, 460
(1940); 88, 104 (1945).
138. Синтезы орrанических препаратов, 00. 3, Издатинлит, 1952, стр. 508.
139. S w а r t z. F., Виll. эос. сЫт. Belges, 42, 102 (1933); Виll. acad. roy.
Belg., 17, 27 (1931).
140. Т h i е s s е n G. W., М i 11 е r R., J. Ат. СЬет. Soc., 77, 770 (1955J.
141. U е n о S., т а т u r а Т., J. Soc. Chem. Ind. Japan, 46, 1213 (1943);
С. А., 42,6735 (1948).
142. V а n d е r Н о е k А. J., N а u t а W. Т., Rec. trav. сЫт., 61, 845
(1942) .
143. V а n z е t t i В. .L., АШ. accad. nazl. Lincei, Мет., Classe sci. fis. mat.
е па!., 7, 331 (1898); 13, 112' (1904); 15,574 (1906); 16,79,'39 (1907).
144. V а n z е t t i В. L., Gazz. сЫт. ita1, 46, 49 (1916).
145. v о n М i 11 е r W., Н о f е r Н., Ber., 27, 461 (1894).
'146. v о n М i 11е r W., Н of е r Н., Ber., 28, 2427 (1895).
147. W аl k е r J., W о о d J. К, J. Chem. Soc., 89, 598 (1906).
.148. W а 11 i s Е. S.,. А d а т s F. Н., J. Ат. Chem. Soc., 55, 3838 (1933).
149. W е е d оп В. С. L., Quart. Revs. (London), 6, 380 (1952)..
150. W е е d о n В. С. L., неопубликованные даниые.
151. WilS0П С. L.; Lippincott W, Т., J. Ат. Chem. Soc., 78, 4 O
(1956) .
152. W 1 а d i s 1 а w В., J. СЬет. Soc., 1955, 4227.
153. W о hI А., S с h w еН z е r Н., Ber., 39, 890 (1906).
154. W u r t z А., Апп. chim. et phys., 44, 291 (1855); Jahresbericht., 575
(1855).
155. Zi е g 1 е r 1\., Н есЬ е Ih а тт е 1: W., Ann., 528, 114 (1937)
Ф. у л Иf, [. СНАИДЕР
ВВЕДЕНИЕ
в течение последних лет смесь поли фосфорных кислот,
обычно называемая просто «полифосфорной кислотой»
(ПФК), находит все возрастающее применение в синтетиче
ской орrанической химии. Сначала ПФК получила признание
как peareHT для циклизации, а в дальнейшем она была ис
пользована в различноrо рода реакциях, катализируемых кис-
лотами, в том числе для этерификarlии, rидролиза, кондечса-
ции, ацилирования, переrруппировок и т. д. Еще до Toro как
ПФК была признана полезным peareHToM в орrанической хи
мии, в литературе встреч лись разрозненные сведения о при-
менении «смесей» фосфорной кислоты и фосфорною анrидрида
для циклизации жирноароматических кислот в соответствую
щие кет.оны. В первых .таких работах [100, 141], известных
авторам, фосфорный энrидриД добавляли к смеси карбоновой
и фосфорной кислот. В дальнейшем смешивали оба Heopra-
нических реатента или анrидрид растворяли в фосфорной
кислоте, после чеrо .зводили в реакцию ка рбоновую кислоту
[10, 12, 25, 127]. пфк. МQЖН О получать наrреванием фосфор-
ной кислоты с ее анrидридом (см. раздел «Строение полифос-
форных кислот»), поэтому вполне вероятно, что в некоторых
из указанных опытов ПФК была активным реаrирующим ве-
ществом. В последнее время стали применять rотовую техни
чес!{ую ПфК или получали ее заранее наrреванием смеси
кислоты и анrидрида до достижения равновесия. Например,
rилмор и Хортон [67] наrревали такие смеси на па ровой бане
в течение 2 4 час. Через 2 .часв смеси еще оставалось TBep
дое вещество, но, очевидно, в количестве, не препятствовав-
шем циклизации жирноароматических кисЛОТ. Смеси фосфор
ной кислоты и. ее анrидрида, не доведенные до состояния
равновесия, не равноценны ПФк., Это видно из Toro, что по-
46
ПФ/( как реа2ент 8 Ореанической химии
CTpOeHUf! ПфК,
47
пытки осущесцшть синтез изатина по 3андмейеру из изо
нитрозоацет n-анизид1IДа при использовании смесей фосфор
ной кислоты и ее анrидрида [146] оказались бе спешными.
Впоследствии было установлено, что ПФI( в е;Жi приrодна
для циклизации по 3андмейеру [53], в частнос'I"И ДЛЯ замыка-
IЩЯ ц.ИКла в указанном производном анизидина [128].
Насколько а.вторам известно, впервые полифосфорная кис
лота была предложена в качестве катализатора орrанической
реакции Розеном. Б 1941 r. он получил патент, в котором
описана конденсация этиленовоrо соединения с разветвлен
ным предельным уrлеводородом над катализатором, содержа
щим «тетрафосфорную кислоту» [135]. Применение тетрафос
форной кислоты для дезалкилирования фенолов,было запа
тейтовано в 1945 r, Стиллсоном и Фишелом [158].
Несмотря на предположения о возможности использования
ПФ К в синтетической орrанической химии, этот peareHT при-
влек к ,себе внимание как ценное конденсирующее средство
лишь в 1950 r. в результате случайноrо наблюдения, сделан
Horo Бербером [153] при попытке циклизации N фОрМИkdl-
триптофана в 3, 4 диrидро карболин-3-карбоновую кислоту
деЙСТl!ием хлорокиси фосфора. Хлорокись фосфора была взя-
та из склянки, которая до этоrо несколько лет стояла в
лаборатории неплотно закрытой. В укззанныx условиях не
только произошла желательная циклизация, но в' результате
ароматизации и декарбоксилирова'ния образовался HoprapMaH
(1), Д./1я синтеза KOToporo, как предполаrалось, были необхо-
пользовании ПФК в различных реакциях. Баба [11] и Кусуда.
[106] рассмотрели данные об ацилироваНtlи фенолов в присут:
ствии ПФ К Попп и Макивен [129] опубликовали в 1958 r.
очень подробныЙ 'абзор с множеством таблиц, посвященный
применению ПФк. Б настоящей работе рассматриваются
только такие Области рименения, коrда ПФ К дает особые
преимущества; исч . ерп IВающей сводки литературы не приво
дится. Мноrие не указ нные здесь работы рассмотрены в ра-
боте Поппа и Макивен [129].
Ilп( r оон
/"'-N / /
н нс==о
. A
пФк+р.оСI.... I ." I
H.O C02 11 N
V"'-N/"'-f"
н
1
(1)
СТРОЕНИЕ ПОЛИФОСФОРНЫХ КИСЛОТ'
Литература по вопросу строения «высших uфосфорныx кис
лот» столь обширна, что трудно дать краткИи обзор всех ра-
бот. Особенно следует 'Отметить стат и Белла [21], rути и
rартаrаниса [89], а также Тило и 3ау:ра [163]. Мшкно считать
установленным, что при термическои деrидратации фосфор-
ной кислоты, при взаимодействии хлорокиси фосфора с фос-
форной кислотой и при взаимодействии фосфорноrо анrидри-
да с фосфорной кислотой образуютс одина ковые смеси поли-
фосфорных кислот. Равновесие междурззличными состав-
ными частями ПФК зависит только от степени rидратации
исходной фосфорной КИСЛОТЫ,а не от метода получения. Сме-
си удобно классифицировать по процентному содержанию
фосфорн'Оrо анrидрида и воды, из КОТОРЫ:1{ MorYT быть приrо-
товлены смеси, причем обычно указывается только о ПрОIlент-
ное содерж ние P 4 0 10 . Б смеси, содержащие до 85 Уо анrид
рида, помимо ортофосфорной 'и пирофосфорной кислот вхо-
дят лиш ' линейные полифосфорные кислоты. При более ВЫ-
саком содержании P 4 0l O в смесях содержатся также цикли-
ческие соединения и соединения .трехмерной структуры. По
данным Тило [162], при наrревании полностью rидролизован-
ной хлорокиси фосфора .образуется такая же ПФК, как и при
наrревании фосфорной кислоты. Хлорфосфорные кислоты,
представляющие собой промежуточно образующиеся роду,к
ты rидролиза,. MorYT быть превращены в. циклическии хлор-
анrидриД триметафосфорной кислоты или в хлорполифосфор
ные кислоты в зависимости от степени первоначальноrо rидро-
лиза. При дальнейшем наrревании хлорполифосфорные кис-
лоты дают трехмерные полимеры, которые в свою очередь
в результате равновесной реаКIIИИ с водой MorYT дать линей
ные кислоты. .
На rрафике представлены результаты тщательноrо иссле-
дования состава. поли фосфорных кислот, выолненноrоo ТИJIО
1f 3ауэрам методом хроматоrрафии на бумаrе.,
димы две дополнительные стадии. Попытки воспроизвести
реакцию со свежей хлорокисью фосфора и с друrими Кислот
ными реаrентами оказались безуспешными. Цель 'была до-
стиrнута лишь при использовании смеси технической ПФК с
ЮlOрокисью фосфора. Это привело к выводу, что в склянке"
в результате rидролиза и полимеризации образовалась ПФК;
nOC.l1e ЭТOI.О были начаты систематические исследования эф
,фективности ПФК [154 . Б течение нескольких лет были най-
.Дены мноrие о()ласти применения ПФI(, I:f вскоре появились
обзоры, посвященные этому peareHTY. Первый обзор литера
туры о циклизации при использовании ПФК был сделан в
J954r. Улиrом [168]. Кеннард [96] опубликовал данные об ис
48
ПФК peU2eHT 8 ореанuческой химии '
ОбщtЩ характер реаеента и вызываемых им реакций
49
!'f
Мноrие исследования ПФК как peareHTa, применяемоrо
в орrанической химиИt, ПрОБОДИЛИСЬ с техническим продуктqм,
содержавшим 82 84% фосфорноrо анrидрида. В табл. 1 YKa
заны составы таких месей по данным rути и rартаrаниса.
относится к смеси примерно TaKoro состава, какой приведен,
в таБJI. 1. ·
Таблица 1
CO TaB двух смесей ПОJIИфОСфОРНЫХ
КИСJIОТ
100
I /"" : I
I /' ,,
I )(Х". ,, J/I
i:// /'i
i. .: :B >,0 !
О i": "..... "" I о/ n О .
t ,о r2 5
п"= 1
Вязкость 1 JJ
Темлература , (ОС) 2oof "'зоо@
теРNlичес ой дееиОратации (760 мм рт. ст.)
Состар смеси
Содержание, %
/V
"'4501
ЭКВlIваJJент Р205 81,60 84,20
Ортофосфорная кислота 8 4
Пирофосфорная КИСJJота 27 11
ПОJJифосфорная КИСJJота
п==1 22 11
п==2 17 13
п==3 11 12
п==4 6 10
п==5 4 8
n==6 2 6
n==7 2 5
Все БОJJее высокие 3Ha
чения ... 20
COC'l'a:B ПОJJИфОСфОРНЫХ КИСJJОТ ПО ТИJJО И 3ауеру [163].
Цифры показывают соотношение между составом смеси полифосфориых'кислот и содержа-
иием р.о,о. Интервалы между кривыми представляют концентрации указаниых КИСJ)ОТ (в %);
n степенъ коидеисацин. Состав любой смеси полифосФорных кислот, содержащей
72 89%P.O,., можио леrко найти для любоro значения 15.0,., указанноrо на абсциссе,
путем измерення вертикальных расстояннй между крнвыми, пользуясь процентной шкалой
слева. 3начения п* на абсциссе характеризуют «среднюю кажущуюся степень кондеисации.,
соответствующую формуле Нn+2Р nозn+ l' как определено аналитнческим путем. Темпе-
ратурная шкала вдоль абсцнссы показывает температуры, при которых смеси MorYT быть
прнrОТQвлены наrревапием чнстой ортофосфорной кислоты. Концентрацня этой кнслоты
С увеличеиием содержания Р.О,. умеиьшается. I леrко подвижиая жидкость; lI сироп;
111 Все еще ПОДВИЖJIая ЖИДКосТЬ; IV твердое СОСТОЯиие.
о
t
HO P O
I
01'1
о
t
P o
.1
'ОН
о
t
P OH
1
n ОН
ОБЩИЯ ХАРАКТЕР PEArEHTA И ВЫ3ЫВА'ЕМЫХ
ИМ РЕАКЦИЯ
Эффективность ПФК в качестве peareHTa в орrаниче
ской химии, по-видимому, обусловлена сочетанием различных
свойств смеси. ПФ К представляет собой жидкость, в которой
хорошо растворяются орrанические соединения различных ти-
пов, поэтому она 'имеет. большое преимущество по сравне-
нию с очень близким к неи по мноrим свойствам фосфорным
анrидридом. ПФК содержит как кислотные, так и анrидрид-
ные rруппы; вода, образующаяся при взаимодействии с
ПФК, быстро связывается анrидридными rруппами с образо-
ванием новых кислотных rрупп. Поскольку вода является бо.-
лее сильным основанием, чем мноrие. орrанические соедиие-
ния, вступающие в реакцию под действием ПФI(, удаление ее
таким образом может иrрать существенную роль для сохра-
нения ффективной кислотности реакционной смеси по мере
выделения воды при реакции. Как деrидратирующий areHT
ПФ К действует rораздо мяrче, чем фосфорный анrидрид.
В связи с этим местный переrрев реакционной смеси, содер-
жащей ПФК, происходит редко: Действительно, в большин-
стве случаев реакции с ПФ К проводятся при наrревании ре-
акционной смеси.
в таблице приведены значения п из формулы ПФК строения
Так, при п == 1 формула соответствует триполифосфорной
кислоте, при п == 2 тетрапоЛИфОСфОрНОЙ кислоте и т. д.
Ввиду Toro что индивидуальные полифосфорные кислоты
нельзя получить обычными методами, в дальнейшем ИЗЛQже
НИИ терми «поли фосфорная кислота», ИJJ!:f сокращенно ПФ К,
4 дак. 1410
50
ПФ/( как реасент ворсанической XUMut: f
Общий характер реасеНТа и вызываемых им реакций
51
Имеются указания, .что добавление хлористоrо водорода
или вещества, котор"е реаrирует с образованием хлористоrо.
водорода, может в некоторых случаях изменять х фактер pe
а reHTa , вероятно, вследствие увеличения ero эффективной
КИСЛОТНОСТIi. Так, Хорнинr и Штромберr [82] (см. таI5.же раз-
дел «Бекм н . ()вская переrруппировка J вместо переrрупп . и
ровки окси ов В присутствии ПФ К 'екомендуют осущест
влять переrруппировку их хлорrидра в. Аналоrично этому
Снайдер и Конецкий [151] нашли, чтq бензофлавин (11) при
одновременных циклизации и ароматизации хлорrидрата co
ответствующеrо тетрамина получается с выходом (48 % ) ,
С 6 И 5
I
/СН", , 6НБ
си J)/ "'/ CH ПФК СН ' .#"' "'./ СНз
NH: NH2 NН2 ,\ NИ: 'НСl NH: ) N ) NH2 (2)
.П
вдвое превышающим Bьtxoд бензофлавина (24%) из свобод..
ното амина. При использовании свободноrо амина и добавле
нии поваренной соли в качеств источника хлористоrо
водорода беНЗЬфЛ8ВИН был получен с выходом 33%. Недоста-
ток таких реакций заключается в том, что при выделении
хлористоrо водорода образуется пена. Это.rо можно было бы
избежать, если применять сильную нелетучую кислоту, KOTO
рая обладала Быl такой же эффективностью, как и хлори-
СТI;>IЙ водород, но при этом не происходило бы пенообразо-
вания. п Толуолсульфокислота оказалась неэффективной при
синтезе бензофлавина, так как значительная часть ее под
. действием ПФК превращается в сульфон [151].
Почти во всех реакциях с ПФ К вместо нее можно приме
нять друrие кислотные катализаторы или деrидратирующие
.аrецты. Однако во мноrих случаях все же лучше применять
ПФК, так как при этом достиrается увеличени выходов,
реакции леrко осуществимы .и отсутствуют нежелательные
побочные реакции. Применение ПФК нередко позволяttт
осуществлять одновременно две ИЛИ три стадии, в связи с чем
отпадает необходимость в выделении промежуточно обра-
зующихся соединений. Так, мноrие циклические .кетоны
можно получить непосредственно из арилзамешенных кислот
или их эфиров, вместо Toro, чтобы сначала синтезировать
хлоранrидриды кислот и затем замыкать цикл действием
хлористоrо люминия (см. стр. 55 70). Далее можно про
вести бекмановскую переrруппировку кетонов (см. стр. 75 .
79), обрабатывая вещество источником rидроксиламина.н
ПФ К без выделения оксимов, а кислоты и их производные
можно подверrнуть переrруппировке Лоссеня без выделения
rидроксамовых кислот. В качестве замечательноrо примера
получения оксима взаимодействием с образующимся in sitи
rидроксиламином можно привести превращени€ флуоренона
в оксим обработкой при190 2000 нитрометаном в. растворе.
1 части P4010 в 2 частях сиропообразной фосфорной кисло-
ты [6]. Как было устацовлено, в тех же условиях нитроме
тан превращается в муравьиную кислоту и rидр.оксиламин.
Если при реакции с флуореноном повысить температуру до
250 .2550, то образующийся оксим переrруппировывается в
фенантридон; из бензофенона при более'низкой температуре
в результате переrруппировки получен бензаi:IИЛИД с BЫXO
дом 91 %..Следует отметить, что применявшаяся при этом кис-
лотная смесь содержала значительно меньше фосфорноrо aH
rидрида, чем техническая ПФК. Было бы интересно J3ыяснить,
может ли ПФК превращать первичное алифатическое НиТРО
соединение в результате изомеризации в rидроксамовую кис-
лоту и ее п€реrруппировки по Лоссеню.в следующий низший
член ряда первичных аминов.
ПФК часто применяют вместо таких rораздо более силь-
ных кислотных peareHToB, как хлористый алюминий и кон-
центрированная серная кислота. При обработке ПФК соеди-
нений, содержащих rруппы, чувствительные к действию более
жестких peareHToB, например сложноэфирную rруппировку,
не происходит побочных реакций. 'К друrим преимущества м
ПФК по 'сравgению с концентрированной серной кислотой
относится то,' что ПФК не 'Обладает заметным окислитель-
ным действием и лишь в иезначительной степени проявляет
. склонность к замещению атомов водорода в ароматическом'
ядре или не проявляет ее вообще. Преимущества ПФК перед
фтористым водородом,. в особенности для циклизации арил-
замещенных карБОНОБЫХ кислот, заключаются в том, что с
ПФ К МОЖf!О работать 'без особых мер предосторожности и, I
следовательно, в простой аппаратуре. Например, при по-
лучении а тетралона из 1' фенилмасляной кислоты и ПФК.
как описано в «Синтезах орrанических препаратов» [155],
требуются только стакан и мешалка. .
Следует отметить, что с ПФК удобно работать, но она не
совсем безвредна. ПФ К вызывает раздражение кожи, осо-
бенно при MHorOKpaT"OM контакте; при попадании ПФ К на
кожу рекомендуется сразу же промыть место контакта, а
для защиты rлаз от случайных брызr пользоваться предохр.а-
4*
52
Пфl( как реасент в ОРсGнической химии
Общий характер .реа2еНТа и ВЪtэываемых им реакций
53
нительными очками. Поскольку ПФК является вязкой жиk
костью, опасность попадания брызr меньше, чем при исполь
зова нии мноrих обычных peareHToB.
Переrруппировки с изменением уrлеродноrо скелета при
реакциях.с ПФl( наблюдаются rораздо реже, чем при ис-.
пользовании серной кислоты, хлористоrо алюминия или дpy
rих более кислотных areHToB. Тем не менее С.IIедует иметь.
в виду возможность переrруппировКli, так как .такие случаи
все же наблюдались. Например, при циклизации i (2, 4 .ци
метил фенил) масляной кислоты Мосби [111] получил кетон,
который может образоваться только в том случае, если оста-
ток масляной кислоты перед замыканием цикла миrрирует
из положения 1 в кольце в положение 6 (см. стр. 60). .
Иноrда при проведении реакции с ПфК возникают экспе
риментальные затруднения с выделением продукта реакции,
так как приходится rидролизовать избыток peareHTa и раз
бавлять смесь водой настолько, чтобы растворимостью про-
дукта реакции можно было пренебречь.. При работе с веще-
ствами OCHoBHoro характера перед выделением продукта
реакции может оказаться необходимым нейтралцзоаать раз-
бавленную фосфорную кислоту. Обычно ПФК употребляется
в таких количествах, что она служит и растворителем и pe
areHToM, поэтому при работе с большими объемами воцных
растворов MorYT возникнуть неудобства. Очевидно, ИНОfда
удобно брать меньшее количество ПфК, используя в этом
случае друrое вещество в качестве растворителя. К сожале:
нию, имеется мало данных о применен и растворителеи
в Реакциях с ПФI\.. Брокман и .Муксфельдт [26] в качестве'
растворителя при циклизации высокозамещенной uN арилант
раниловой шслоты (111) В акридон (IV), которыи представ
ляет собой. промежуточный продукт синтеза «деспептидоак
тиномицина», ИСПОЛЬЗОЩ1ЛИ ледяную уксусную кислоту. При
действии неразбавленной ПФ К на антраниловую кислоту даже
при комнатной температуре образуются смолистые продукты
реакции. При наrревании в течение 10 .мин на к пящеи во:
дяной бане с 15%-ным раствором ПФК в ледяном уксуснои
кислоте образуется акридон (IV) с выходом 82%. При такой
циклизации ацилируемое ядро сильно активироваItо четырьмя
электронодонорными заместителями несмотря на наличие эле-
ктроностяrивающей нитроrруППЫ. Кроме тoro, карбоксиль-
ная rруппа расположена в положении, чрезвычайно блаrо-
приятном для циклизации. По.видимому, ТОЛЬ'КО в подоб-
ных особых случаях карбоновые кислоты MoryT служить
растворитепями при внутримолекулярном ацилировании, по-
скольку при реакциях с Пфl( они также MorYT иrрать роль
зцилирующих areHToB (см. стр. 70 75).
СН 2 . СН 2 СН 2
rY " #V " А/ "
I I 1Н2 I 11 1 Н2 11 . 1 1Н2
СН 2 СН 2 . СН 2
V I V / /,,/
C OH +с С
11. НО/ "ОН НО/ 'ОН
О+Н
O VC 2
\ 1Н2
СН 2
I
СООН
ОСН з
СООН ) .
l/ ОСНз
СНз )," '",rСНз .
I 'N/ I
ОСН з Н N0 2
Ш
!
ПФК
сн.соон-+
СН 2
"f',/ "
. /11 СН2
6Н 2
V /
с==о
/
О.
I
OP OH
I
О
I
(OP---ОН)х
I
он
О ОСН з
11 I
( /"./ ОСНз
СНS N rСНз
I Н I .
ОСН з N0 2
!V
(3)
Т! ! H.o
СН 2 СН 2
N / " А/ ,
11 :: H+ -+ 111 ::
V / A/
+С с
O 11
О
i
(4)
54
ПФК ."atc peaZeHT 8 оpzaничес"ой химии
Основные типы реакций, вызываемых Пфl(
55
Поскольку ПФК представляет собой сложную смесь, ре-
акции с ее участием нельзя исследовать криоскопическими
. методами, оказавшимися очень полезными для изучения ме-
хаНИЗМа.реакции орtанических соединений в чистой серной
кислоте [65]. Из-за высокой вязкости ПФI( преДС'Fавляет со-
бой плохую среду для кристаллизации, и нет ничеrо УДИВИ-
'l'ельноrо в том, что путем кристаллизации не удалось ВЫДе-.
лить ни одноrо промежуточноrо соединения. В настоящее вре-
мя можно высказать только доrадки о мехаНизме действия
ПФI( на орrанические СCiединения. Наиболее вероятно, что
она действует как протонная кислота, кислота Льюиса и как
фосфорилирующее средство. Так, при циклизации j-фенил-
масляной кислоты на начальной стадии реакции происходит
протонизация или образование смешанноrо анrидрида, как
это показывает схема (4). В случае превращения j-лактонов
в циклопентеноны сделано предположение о прОмежуточном
эбразовании кетокарбониевоrо иона [481 .
Первой стадией lIереrруппировок по Бекману и по Лос-
сеню также может быть образование фосфорных эфиров,
связанных с rруппировкой C==N OH При реакциях ни-
rрилов с циклизацией (стр. 55 70) или при их превращ€нии
в амиды (стр. 79 81) первая стадия состоит, вероятно, в
присоединении {{ тройной связи.
ОСНОВНЫЕ ТИПЫ РЕАКЦИЯ, ВЫЗЫВАЕМЫХ ПОJIИФОСФОРНОR.
КИСJIОТОЯ
+
NH 2 O ОН
11 I I
ArC == N .............. ArC O P O (P O)n Р (ОН)2
{ t '*"
О О О
(5)
Циклизация с образованием пятичленных колец
Наrреванием -арилпропионовых кислот или их эфиров с
ПФК получен ряд инданонов [44, 45, 64.. 66, 69, 79, 92, 154].
В их число' входят метоксизамещенные инданоны, которые при
использовании классических peareHToB получаются с низкими
выходами или их вообще не удается получить [25, 79. 80, 94,
102, 169]. Аутоконденсацию под влиянием ПФК можно свести
к минимуму в мяrких услов"ях [106, 154]. Элснер и Пар-
кер [52] для циклизации некоторых -то.ТlИлпропионовых и
-толилмасляных кислот во избежание аутоконденсации и
изомеризации ПРОДУКТ9В реакции вместо ПФК использовали
безводный фтористый водород. Однако из их работы H ЯСI;IО,
руководствовались ли они при этом опытными данными или
аналоrией с иЗВестной изомеризацией в ряду тетралона (см.
следующий раздел). Вопрос об изомеризации при с нтеэе
инданои()в из -заМещенных кислот (выше пропионовои кис.
лоты) не был достаточНО подробно изуче . При циклизаций
-фенилмасляной кислоты и ее М- и п-метоксипроизводных
(выходы 87, 86 и 17% соответственно), -Фенил- -метилмас-
ляной кислоты (выход 74%) и ее п-метоксипроизводноrо
(выход 19%). [79], а также -фенилвалериановой кислоты (вы-
ход 91 %) [19] переrруппировки не наблюдалось. .
rрин и Хей [68] сопоставили эффективность ряда peareH
тов для Щiклизации тринадцати l-нафтилзамещенных жирных
кислот с/метоксиrруппами в ядре в положении 4, 5, 6 или 7.
Если мето{{сиrруппа находится в положении, активирующем
ядро к циклизации, то можно пользоваться концентрирован-
ной -серной кислотой. Если же метоксиrруппа находится в
друrи.х положениях, при д йствии серной кислоты происходит
сульфирование; при действии Пфl( на некоторые. соединения
этой rруппы образуются кетоны с хорошими выходами. p
акция а-нафтилуксусной кислоты с серной кислотой приво-
дит К образованию только водорастворимых продуктов, а при
действии на хлоранrидрид кислоты хлористоrо алюминия
получается циклический продукт с низким выходом. При про-
ведении реакции с ПФК выход аценафтенона достиrает 40%.
5- и 7-Метоксинафтилпроизводные дают кетоны с выходами
50 и 30% соответственно; из 4- и 6-метоксипроизводных не
удалось получить индивидуальных продуктов реакции.
-(6.Метокси-l-нафтил)пропионовая кислота (V) цикли-
зуется 8 'ПОЛ0же ии 2 нафталиновоrо ядра с. образованием
fIредполаrается, что такое промежуточно образующееся
соединение может атаковать соседний ароматический оста-
ток таким же образом, как fалоrенанrидрид или анrидрид
карбоновой кислоты, что прИВОдит К иминокетону, который
затем rидролизуется. При непосредственном rидролизе обра-
зуется амид кислоты. Следует отметить, что ПФI( можно при-:
менять для rидролиза нитрилов в амиды кислот (см. стр. 77).
ТOfда как близкий к ней фосфорный анrидрид обычный
peareHT для превращения амидов в нитрилы, а 100%-ная фос-
форная кислота обычный peareHT для rидролиза нитрилов
в кислоты. Несомненно, объяснение заключается в обра-
зовании промежуточноrо соединения указанноrо выще типа,
котор'ое стойко в полифосфорной кислоте, но быстро rидро-
лизуется при разбавлении раствора водой.
56
ПФК как реаеент в орzанической химии
Основные типы реакций, вызываемых ПФК
57
бензинданона (VI; выход 44%), 'который был получен ранее
[24] с несколько лучшим выходом при постепенном добавле
нии фосфорноrо анrидрида к смеси ка'рбоновой кислоты и
сиропообразио.й фосфорной кислотЫ. Если метоксиrруппа Ha '
ходится в положении 5 или 7, то циклизация происходит в
l1ери положении с образованием шестичленных кетонов
перинафтенонов.
CH cH2COOH
I
АЛ
СНзО
V
впервые установил эффективность ПФк. в таких синтезах, по-.'
лучив 2,5-диарилфураны Х из 1,4-дикетонов IX с почти ко-
личественными выходами. Друrие исследователи использо
вали ПФк. дЛЯ синтеза бензофуранов и дибензофуранов [41.
44, 165].
пФк. # )
100°, 30 .мин -+- N"-.A
СНзО о
VI
CH2 CH2
I I пФк.
RC 6 H 4 CO COC 6 H 4R 130 150°. i.5 час -+- RC6H4 0) C6H4R (8)
(6). .
IX
Х
VH
СН з
I
R )
"
О
VIII
(7)
Синтез индолов с ПФк. описан в целом ряде работ. Впер
вые ПФк. была использована для циклизации арилrидразо
нов по Фишеру [53, 98]. Получение производноrо rидразона и
ero циклизация виндол MorYT быть выполнены в одну опе-
рацию. Так, 2 фенилиндол, 3-метил-2-фенилиндол, 2 МетИлин
дол и 2 меТИЛ 3 ЭТИЛИНДОJ] были получены соответственно из
а цетофенона , пропиофенона, ацетона и диэтипкетона с хоро-
щими выходами. Хлориндолы также были синтезированы с
ПФк. [139]. Пармертер, Кук и Диксон [126} подверrли цикли-
зации 0-, .м- и п ни'Срофенилrидразоны ЭТИЛовоrо эфира пи-
ровиноrрадной кислоты действием ПФк. в течение 30 .мин
при температурах ниже 1250 и получили' этиловые эфиры
нитроиндолкарбоновой Кl.fслоты, из которых В результате rид-
ролиза и декарбоксилирования были получены нитроиндолы.
Первоначальные попытки получения 7 нитроиндола по этому
методу не привели к успеху потому, что о нитрофенилrидр-
азон не изменяется при действии обычных катализаторов [137].
При использовании ПФК. были получены o и п-нитрофенил-
rидразоны с выходами 57 и 66% соответственно. I(ак и ожи
далось, .м liИтропроизводное циклизуется в двух возможных
направлениях, в связи с чем были получены эфир 4 нитро
индолкарбоновой кислоты с выходом 19% и эфир 6 нитроин.
долкарбоновой кислоты с выходом 8,2%. Циклизацией о-ни
трофенилrидразона при более высокой температуре Зинrер и
UUайв получили эфир индолкарбоновой кислоты с выходом
только 13,4% [143].
ФенилrидраЗ0НЫ 2-, 3 и 4 ацетилпиридинов при Harpe
вании в течение нескольких минут с пФк. при 1800 с xopo
шими выходами превращаются в соответствующие пиридил-
ИНДО:ТIы [159]. Производные -карболина синтезированы цик
лизацией арилrидразонов 3-кетопиперидона-2 по Фишеру [2].
Имеется патент [13] на получение 2, 3 диметилиндола из
N бутениланилина и ПФI(.
Описана также циклизация с образованием бензфлуоре-
нонов [92], 4, 5 фенантриленкетона [136]" и хроминданона [127].
При попытке циклизации этиловоrо эфира 1- -нафтилмеТИk
2-кетоциклоrексанкарбоновой кислоты в производное 3,4-бенз
флуорена получены отрицательные результаты. При действии
серной кислоты на холоду кетон был получен с высоким вы-
. ходом [95], а 2.fJ нафтилметилтетралон-l превращался в ин-
деновое производное, которое было деrидрировано в 1, 2, 5, 6-
диб.ензфлуорен [23].
Безуспешными Оказались попытки циклизации -3-индо-
лилпропионовой. кислоты действием «фосфорноrо анrидри
да ортофосфорной кислоты». фтористоrо водорода и фто
ристоrо бора; при действии фосфорноrо аlirидрида в ксилоле
получен ожидаемый кетон с выходом 11 % [93].
ПЯтичлеННЫе циклические кеТОliы VIII были получены
Реем и Девом [132] деrидратацией j-лактонов VII действием
ПФК. При этом выходы нередко превышали 90%, т. е. pe
зультаты были HaMHoro лучше, чем при применении друrих
peareHToB. Аналоrичным образом из производных циклоrеп
'Тенил- и циклоrептилиденянтарнойкислоты получены нена-
сыщенные кетоны, содержащие конденсированные пятичлен-
ные и семичленные кольц [44, 48, 132].
СН з
I ПФК
R CH2 CH2 CH2 CO 100", 1.5 2.5 час -+-
O ...............
Пфl(.применялась для замыкания цикла с образоваliием
пятичленных rетероциклических соединений, Наулин [123]
ПФК как pea2eнt 8 орzанической химии
Основные типы ТJеа чuй, вызываемых .ПФ",
59
58
#"'- HC=:NOH
U 1 Ьо .
"'-N/
н
XI
A =:o
ПФК I 11 1 . ) +NНз
800, 3OA(иH N =:0
- Н
ХН
(9)
При синтезе тионафтенов ЦИК:{lизацией а-арилтиокетонов
наблюдались переrруппировки. В то время как бензоильное
производное XVH дает продукт переrруппировки XVIH
с выходом 32%, из соединения с ацетильной rруппой вместо
бензоильной получаются 3-алкилтионафтены без переrРУIJПИ-
ровки [17, 41]. l\aK показали Данн и к.окорудз [39], HarpeBa
ние соединения XVH с пфк. в течение 2 час при 1000 ведет'
( "'- 11 О=: с У н С 2 6Н5 A
180 1 КЗ час I J 1I (12)
V"'-S/ '\ "'-S/"C 6 H&
XVH ХVШ
!{ образованию изомерноrо 3-фенилтионафтена. В присут-
ствии фтористоrо водорода соединение XVI I и 3-фенилтио-
нафтен превращаются в XVIII. Дэвис и Мидлтон [41] уста-
новили также, что фенилфенациловый эфир в присутствии
пфк. переrруппировывается в 2-фенилбензофуран. Циклиза-
ция КетоН'а XIX в ниден ХХ не сопровождается переrруппи
. ровкой [41, 1 02]. . .
сн oJ'-... о:=осс 6 н 5 . С О (
СН З о I 11 H2 ПФК нз /T C 6 H S (13)
з ACH2/ СНзО V /
пх ХХ
Среди друrих циклизаций с участием пфк., приводящих
к образованию пятичленных rетероциклических соединений,
следует отметить синтез тиадиазолов [107], оксадиазолов [53,
129], окисей арсафлуорена [28], тиено-[3,2-Ь]-пиррола [110] и
птеридинов [167].
Действием Пфl( па изонитрозоацетанилид (XI) получен
изатин (ХН) с выходом 50 60% [53, 128]. Производные с
метильиыми и метоксильными rруппами в кольце дают иза-
тины с примесью N-фе"илоксамидов. Из производных с хл()-
ром В положениях 2 и 4 получены оксамиды с выходом 40
50 % и небольшое количество изатинов, а из нитро- и амино-
производных образуются лишь высокоплавкие продукты кон-
денсации.
Хейн Олхейм иЛивит [75] применяли пфк. для синтеза
2-замещ нных бензимидазолов, бензоксазолов и бензотиазо-
лов (XIV) из кислот, tложных эфиров, амидов и нитрилов
взаимодействием с о-амино-, о-окси- и o-меркаптоаНИJIидами
(XHI) [схема реакции (10)]. Выходы обычно хорошие,
а метод МОЖНQ было распространять на синтез 6ис-бенз-
имидазолов [173]. . .
O= NH # /N
I 2+ Ry ПФI.< J 11 C R
хн X/
ХШ XIV
Х == NH, О, s; . У=; соон, COOR, CONH 2 , CN; R.""" аЛКИJJ ИJJИ арИJJ
(10)
Ilроизводные семикарбазида под действием Пфl( превра-
щаются в замещенные триазолы [9]. Так, из 4-бензоил-I-фе-
нилсемикарбазида (XV) получен 3-0кси-l, 5-дифенил-l, 2, 4.
триазол (XVI) с выходом 76%. При замене бензоильной
rруrшы в замещенном семикарбазиде п-нитробензоильной по-
лучен соответствующий l-нитрофенилтриаэол, но в случае
2,4-динитробензоильноrо производноrо реакцию не удалось
осуществить.
С 6 Н Б
I
NH
"-.
C6H5 CO NH
\ .\
.NH CO
XV
ПФК
650, 45 МИН
с 6 н Б
I
/N"-.
C6H5 C N
.Il 11
N COJi
XVl
(11)
ЦИКo/Iизация с образованием шестичлеиных колец
Уиткоп и Патрик [175] нашли интересную реакцию рас-.
ширения цикла, сопровождаемую переrруппировкой типа пе-
реrруппировки BarHepa Меервейна и состоящую в превра-
щении спирооксиндола (XXI) в 9-метилтетраrидрокарбаЗОl1
(ХХII). .
п I <=1
V N/ OH
I н
СН з
XXI
# /'\.
НСl И И ПФК I 11 "1
V"-.NA/
I
СН з
ХХII
(14)
60
ПФ/( как реасент в ОР2анической химии
Основные типы реакций, вызы8аемых ПФ/(
61
Тем не менее был получен ряд тетралонов путем цикли а .
ции, Не сопровождавшейся переrруппировкой. Этот метод
использовался rлавным образом для синтеза метоксипроиз-
водных [40, 57, 59, 76, 85, 92, 140, 171]. Хорнинr и Уокер [84]
установили, что из бензилянтарных кислот, которые MorYT
циклизоваться в производные инданона или тетралона, при
использовании ПФК и классических peareHToB типа Фриде
ля Крафтса образуются шестичленные, а .не пяuтичленные
циклические кетоны. Введение метоксизаместителеи в ариль-
ное ядро кислоты не мешает ЦИКЛJ{зации с помощью ПФк.
Серная кислота в этом случае не приводит к цикл зации.
Кочетков, Нифантьев иНесмеянов [105] разработали но-
вый метод синтеза производных нафталина с помощью ПФК.
По этому методу получены 2 алкил , 2, 6 диалкил и 1,3,7-
триалкилнафталины. Типичным примером может служить
СН з СОСН 2 СН (ОСН З )2 + C 6 H 5 CH 2 MgCl
(J СН 2"./ СН З # CH
11 ?".оН I 11 t ) з (17)
/ СН 2 Л
(СН з О)2 с( XXVIIl
Н
синтез -метилнафталина (XXVIII). Из соединений, иссле
дованных в качестве peareHToB для стадии деrидратации с
циклизацией, наиболее эффективными ок залисьu ПФК и
смесь 2 частей фосфорной кислоты и 3 частеи сер нои кислоты.
Исходные . .цетали были получены из хлорвинилкетонов.
Для -циклизации o-бензоилбеНЗ0ЙНЫХ кислот в антрахино
ны действием ПФК требуются более жесткие условия, чем
для получения тетралонов. AHTpaX HO (выход 95%) был по
лучен наrреванием о-бензоилбензоинои кислоты с ПФК в Te
чение 40 .мин при 1400 [154]: 1,2, 3- Триметокси 6, 7-метиленди-
оксиантрахинон (выход 93%) и 1,2-бензантрахинон (выход
44 % ) получены при наrревании исходных кислот в течение'
б час при 800 [102] и 12 час при 1000 [15 ] соответственно.
Описаны синтезы ряда полициклических уrлеводородов с
применением ПФК: фенантрена [7, 12, 22, 42, 50, 100, 119,
122, 124], хризена [16, 19, 33] и ксантена [36]. Джерасси и
ОУ .' R а) R == (СН 2 )з СНО r) R == (CH2k-- >
I I б) R == (СН 2 )з СОСНз '11
л в) R == (СН 2 )з СОС 2 Н 5 о
XXIX
К числу 'шестичленных циклических соединений, получен-
ных с ПФI(, прпнадлежат rлавиым образом кетоны, синтези-
рованные циклизацией j-арилмасляных кислот. В качестве
примера можно привести циклизацию - j- (2,' 4-диметилфенил)
масляной кислоты в '5, 7 диметилтетр.алон-l в результате на-
rревания с ПФI( в течение. 2 3 .мин при lbO 1700 с выхо--
OM 83 90% [55]. При более высоких темпераТУРFlХ обра-
зуется также 1 О, l1-бенэфлуорантрен.
Мосби [111] показал, что циклизация замещенных арил-
масляных кислот под действием ПФК может сопровождать,
ся переrруппировк6й [схема реакции (15)]. Очевидно,. остаток,
масляной кислоты в XXIII перед замыканием цикла переме ,
щается в симметричное положение, так как при наrревании
XXIV (полученноrо под действием пятихлористоrо фосфора)
не происходит переrруппировки в XXV. в той же работе уста-
PCI.
-+
о
С 11
Нз",# /
. 1 11 I
/"'(
СНа СНа
XXIV
СНз О
I 11
#'",/
CH \)
I
СНз
(15)
НО О
.".#
С
CH #,,,, '"
1. 11 I
/ /
СНЗ СНз
ХХШ
ПФК
-+
XXV
новлено, что метильные rруппы также MorYT миrрировать.
Так, из'}'- (2,3,5, 6-тетраметилфенил) масляной кислоты
(XXVI) циклизацией с ПФК получен 4,5,6, 7, 8 пентаметил
. тетралон-l (XXVII) с выходом 30%.
СНа
I . СНз СООН
(У ,/
СНз / /
I I
СНз СН в
XXVI.
СНз О
I 11
ПФК СНз #"'-/'"
CHJ 11 I
з ")/)/
. СНз СНз
XXVIl
(16)
ПФК как реаеент в ореанической химии
Основные типы реакций, вызываемых ПФК
63
62
ПеТ1'ИТ [50] изучали Щlклиэацию ряда производных нафта,лина
с ПФК Jt наШflИ, что '1 (1' нафтил)масляиый альдеrид- (XXIXa)
пре раща'ется в ф нантрен, тоrда как из замещенных KeTO
НОВ (XXIX б r) о разуются антрацены. В продуктах цик
ЛиЗации метилкетона ХХIХб обнаружено некоторое количе
СТВО фензнтреновоrо производнorо, но в чистом виде выделен
только аитрацен. На этом основании сделан вывод, что про
странственное взаимодействие между rруппами в положениях
4. и 5 в фенантренах настолько велико, что изменяется обыч
ная склонность к образованию анrулярных,' а не линеЙНbJХ
циклических yr левод.ородов. Пространственный фактор не
иrрает роли в случае последующих низших rомолоrов XXIX,
которые циклизуются. в положении 1 нафталиновоrо ядра
с обр.азованием производных иидена.
Синтез ПРОИЗБОДНЫХ хризена- осуществляется циклизацией
1,2, 3, 4-тетраrидро 2 фенил-l нафтилуксусной кислоты Ha
rреванием в течеIще 2 час при 1200. с пФК [92]; из метокси
кетонов ХХХ получены производные метоксихризена ХХХ1.
ОСН з ОСН з
A I, A /V
1 11 I I 11 t
() O YV ПфК (,,"/)/"'-1" (18)
RA/'vI RA/"'-/
ххх ххю
а) R == ОСН а а) R == ОСН з , ВЫХОД 64%
б) R == Н б) R == Н, ВЫХОД 51 %
ИЗllестно несколько случаев применения' ПФК для син
теза кумаринов по ПехмаfIу. Из .м крезола и ацетоуксусноrо
эфира получен 4,7-диметилкумарин с выходом 76% [53], I:l
конденсация резорцина с ацетоуксусным, CI метилацетоуксус
ным и бензоилуксусным эфирами привела к получению COOT
ветствующих о сикумаринов с очень хорошими Bыxb
дзми [103].
ПФК применялась при синтезе 4-хроманонов, 4-тиахрома
нона и 2,3 диrидро 1 арил 4(IН) хинолинов из арилокси
пропионовых кислот, арилтиопропионовых кислот и N, N;
днаРИk аланинов соответственно [91]. В тех случаях, коrда
использовал ась хлорокись фосфора, продукты реакции coдep
жали хлор. Изучен мех8ННз'м образования хромонов и
кумаринов по Пехману прц взаимодействии -арилкротоновых
кнслот и кетоэфиров с фенолами в присутствии ПФК [38].
Анилы -кетонитрилов и кетоамидов превращаются деЙ
ствием ПФI\ в 4-0КСИХИНОЛИНЫ [74]. 2 Метил 3 фенил 4 окси"
хинолин (ХХХlIl), выход KOToporo по методу Конрада и Лим-
паха составляет лишь 4%, из анилина и (l ацеТО-(l ТОЛУНИ-
трила через анил ХХХll получен с общим выходом 56%.
Соединение XXXllI удалось получить из нитрила и анилина
в одну стадию, но выход оказался более I:IИЗКИМ (39%). Та-
ким же путем получен 2, 3 дифенил 4-0КСИХИНОЛИН с BЫXO
дОМ 34%. 7, 8 Диметоксиизохинолин получен из анила 2,3-
диметоксибензальдеrида .и аминоацеталя по модифицирован
ной реакции Померанца Фрича при 1000 с ПФ К в качестве
циклизующеrо areHTa. Выход достиrал лишь 11 17 %; осуще
ОН
I
..f"'- А С Н .
I I ' 6 5
1400 :oK .мин --+ .1 J
/"N """СНа
хххш
. л"- NC
" ."
I ' I ' j 9НС6Нб
С СНз
/'\.N '
(19)
ХХХII
ствить реакцию в ПРИСУТСТВ!fИ серной кислоты вообще не
. удалось [49].. .
Хаузер и Эбй [73] применяли ПФ К при синтезе замещен
ных пиридонов (например XXXV) из кетонитрилов и KeTO
амидов XXXIV. При получении нортармана по Снайдеру и
С 6 Н б
I
ОС
"'-
СН 2
I ПФК
СО
/
NH 2
ХХЮУ ·
H CH2
,
СНз СО
+
С 6 Н б
.,
#"'-
I 11
снз N/"'-он
(20)
XXXV
Берберу образуется конденсированное пиридиновое ядро
[см. уравнение реакиии (1)]. rapMaH и 3, 4-диrидроизохино
лин получены также анаJюrичными реакциями с выходами
14 и 31 % соответственно. Синтез последнеrо соединения в
щiльнейшем БЫJl значительно улучшен (выход 79% из фе-
нилэтиламина) наrреванием неочищенноrо формильноrо про
изводноrо с ПФК в течение 2 час при 160 1800 [130]. Исполь
зование ПФ К при синтезе акридонов [27] описано выше
(см. стр. 53).
Феиантридин был ПОJlучен с вых'одом 90% при энерrичном
перемешивании 2 формамидобифенила с ПФК в течение
64
ПФ/( как редеент в ореанической химии
Основные типы реакций. 8ызы8аемых ПФ/(
65
1 час при 1400 [160]. При использовании хлористоrо цинка
выход составляет только 42%. Смесь хлор окиси .фосфора с
. хпорным оловом в кипящем нитробензоле (4 час). дает BЫ
ход около 90% [125]. При синтезе фенантридина с Пфl( было
-Оlмечен влияние пеrемешивания. Без перемешивания един
ствеиныи выделенныи продукт реакции представлял собой
N, N'-бuс (о-бифенилил) формамидин [160]. АналоrИЧIlЫМ пу-
тем получены б-ромированные фещIНТРИДОНЫ. Циклизацию
2-формамидо-2-нитробифенила и 2,2'-диформаМИДОбифенила
в присутствии .ПФК не удалось осуществить. Последнее со-
единение было подверrнуто двойной циклизации в 4, 9-диаза-
. пирен наrреванием в течение 8 час с плавом хлористоrо алю-
Миния и хлористоrо натрия при 250 2800 [15]. .
К!{руrим полиядерным rетероциКЛическим системам, СИlI-
тезированным .с ПФК, относятся 3, 4 диrидро-4 фенилкарбо-
стирил и З, 4- диrидро 4- изока рбостирил -[156], 4- ( 1, 2, 3, 4-тетра-
rидро-l-изохинолил) rидрокарбостирил, который получают
переrруппировкой -фенилэтиламида rетероауксина с после-
дующей циклизацией [161], и 2,4-диметилиндено-(3',2' : 6, 7)-
хинолин из анила ацетилацетона и 2-аминофлуорена [29].
Проктор и ТQМПСОН [IЗl] описалн новый СJ;юсоб получения
производных тетраrидрОизохинолина. Прн наrреванни п T()'-.
луолсульфонильноrо пронзводноrQ N- фенилэтилаланина
(XXXVI) с ПФК выделяются вода и' окись уrлерода и обра-
зуется толуолсульфонильное производное тетраrидроизохино-
лина (XXXVII). Однако из толуолсульфониламида N фенил-
о
но, 11
"c СН 2
А '" #')А.
1Jl N R I /( R (21)
. CH2 A)
XXXVl ХХХУII
Из янтарной кислоты и rидразинrидрата, взятых в моляр-
ном отношении 2: 1, под действием ПФК получен перrидро
1,4, 6, 9 тетракетопиридазо [I, 2-а] пиридазин с выходом 80%
[56].
ИЗ амида т-циклоrексен-I-илмасляной кислоты (ХЦ и
ПФ К получен спиропиперидон (XLI) [77].
< > CH2CH2CH2CONH2 пфк < X N > (23)
Н o
XL XLI
Циклизация с образованием семичленных колец
ПФК оказалась особенно эффективной при замыкании се-
мичленноrо кольца. Например, бензосуберон получен и3 -фе-
нилвалерианOIIОЙ кислоты с выходом 84% наrреванием с
ПФК в течение 2 час при '1000 [67, 88] и из метиловorо эфира
с выходом 90% [66]. Аналоrичным путем получены 7-кето-
1,2,3,7,8,9, 10, 10а-октаrидроциклоrепта-[dе]-нафталин (XLII)
с выходом 95% из 1-1,2,3,4 тетраrидронафтилмасляной кис-
лоты [88] и 1, 2 нафтосуберон (XLIII) с выходом 80 95% из
соответствующей кислоты [164]. Описано также метоксипро-
изводное 1,2-нафтосуберона [68]. Из о-фенилэтилбензойной
кислоты получено с прекрасным выходом ожидаемое произ-
водное' дибензоциклоrептанона [30].
O )
#"'/ /
I ) 1 I
"'f'
XLIII
O / '"
'" /
(n/'"
)v
ХЩ'
т аминомасляной кцслотPI (XXXVIII) действием ПФ К БЫJl по-
лучен 1 феннл-2-лирролидон (XXXIX).
о
-f'" но"" 11
I 11 с >
AN
I
SО2 С 6 Н . СН з
ХХХУIII
о
4'" "
. пФк I 11 N / I
/
(22)
Циклизацией с ПФК получены мноrие замещенные
беНЗQсубероны; по этому методу особенно успешно осущест-
влен синтез метоксибензосуберонов. Данные о метилбензо
суберонах приведены в табл. 2, о метоксибензосуберонах
в табл. З.
Описаны и друrие случаи замыкания цикла при действии
ПФ К с образованием суберона ряда фенантрена [88], кето-
rидробензазулена [3] и производноrо бензоциклоrексанцикло-
rеПТl'iнона [4]. ПФК ИСпользовалась также при получении про-
межуточных продуктов синтеза колхицина [69].
. XXXIX
5 3ак. 1416
Основные типы реакчий, 8btзываем.ыlx ПФ/(
61
Таблица 2
Замыкаоие ЦИJ(па с образованием меТНJlзамещ-еиных
бензосуберонов под действием ПФИ
Быход,
"
. Дейсхвием. ПФI(:. Не удалое., осуществ"ть циклit:зацmo
'}'-3, 4, 5 триметоксифенилп.р.опилянтарн()I:'О . анrидри,ца IIрmiз.-'
водное бензосуберона было получено с 75% HЫM выходом
только с хлористым алюмннием в нитробензоле [86]. Как ука-
зывалось выше!.-'j-{4-метоксинафтил-l) масляная и a 2-(4 Me-
токсинаФтил 1) -этиJir лутаровая кислоты претерпевают цикли-
зацию с образ-6в' шием шестичленных кетонов [68]. Метоксиль-
ная rруппа в положении 5' В нафталиновом ядре, несущем
карбоксиаЛ'ЮIЛЬНУЮ боковую цепь в положении 1, может
облеrчить замыкание цикла в nерu поло ении. Действитель-
,но, в соответствии с этим. предположеiiием" из Пр'оизводноrо
масляной кислоты XLIV под действием пфк:, серной кислоты
или хлорноrо олова образуется только перинафтанон (XL V).
Однако из замещенной rлутаровой кислотыХLУх была полу-
чена смесь, из которой выделено толы , к- тофенантреновое
производное XLVII. Аналоrично этому а-l нафтилметилrлута-
ровая кнслота в результате замыкания цикла в положении 2
дает инда нон, а'н.е Ilерйнафтанон [8].
Продукт реакции
Литера
тура
Время,
ми"
TeМIIe a I
тура, с
1 Метилбензосуберон-5
2.Метилбензосуберон 5; .
2,3 Диметилбен30суберон-5
1, 4-Диметилбензосуберон 5
240
2,5
120
35
13O 140
161
95
95
89
88
56
67
5
55
5
5
Таблица 3
..
Замыкание цикпа с образованием метоксизамещенных
бензосуберонов ПОД действием ПФК
Продукт реакции
I\blxO....
%
Лl!тера
тура
Время, 1 TeM!lef,a- 1
ми" тура, С
1 Метоксибензосуб ерон-5
1,2-Диметокси6ензосуберон-5
2,3-Диметоксибензосуберон-5
2,3-Димеrоксибензосуберон-5
. 4-Димето сйбензосуберон-5
1,2,3- Триметоксибензосуберон-5
2,3,4-Триметоксибеизосуберон-5
2,З,4-Триметоксибензосуберон-5
2, 3, 4- Триметоксибензосуберон-5
2,З-Метилендиоксибензосуберон
2, 3-Диметоксибензосуберен-5 кар-
боновая-6 кислота .
Этиловый эфир 2,3, 4-триметокси-
бензосуберен-5-карбоновой 6 кис-
лоты .. ., .
Этиловый эфир 2,3, 4-триметокси-
бензосуберен-5-дикарбоновой 5,6
кислоты, . ..
2,3, 4- ТРИNетоксибензосуберон 5
уксуснаll-6 кислота (еноллактон)
2,3, 4- Триметоксибензосуберон-5-
. уксусная-6 кислота (еноллактон)
Этиловый эфир 2, 3-диметокси 9-
бензЬиламинобензосуберен-5-кар-
боновои-6 кислоты , , ...
30
30
30
60
55
50
30
40
20
30
95
95
95
75
60
70
95
ioo
100
95
30
30
11
100
11
10
()""",,5
63
67 63
74 63
84 102
55 5
91 102
99 63
91,2 62
79 62
Полимер 63
о
'V"""" 66 ' "
' :о'
ОСН з
(сн 2 )з соон
(O /
')/V
ОС нз
ПФК
(24)
XLIV
. ;XLV
10
66 101
СН 2 СН 2 СООн.
'1
ф'СН'<;НСООН
.осн з
XLVI
(25)
5
90 104
h'- [) H2CH2COOH
пФк r у,
yv
осн з
ХLVП
5
97 104
60 62
100
98 62
45 101
I
. Днк тоtI 'хцх, содержащий семичлеН,ное кольцо, получ.е
1\Лl:fба..щщ и Т.J:fНЗ{)УРI:'ом 199] де ствием Пфl( H . !<еТQIЩС;Л.Q;
5"
БS
Основные' типы реакций, вызываемых ПФ/(
69
ПФ/( как peazeHT в ОРZйftическоЙ химии
LI
IН 2
ПФ К
ту XL VIII. Фтористый водород вызывает циклизацию в др у-
. roM направлении с образованием соединения L.
ния на хлоранrидрид кислоты. Девятичленный кетон сиw .
зировать не удалось.
СН з СН з
),/(CH2)пH СООН /,),/ C 2
J I 11 I I 11 (СН 2 )n
,/'\/ v /"-. /
I I Со
СН з C
(27)
LШ
LIV
1L
(26)
При . циклиз ции T l-аценафтилмасляной кислоты в семи-
членный циклический кетон ПФ К, содержащая 78% фосфор-
Hor9 анrидрида, дает лучшие результаты, чем ПФК,. с 83%
анrидрида [133]. Результаты опытов приводятся в табл. 4.
Таблица 4
Циклизаци r-l аценафтилмаCJlЯНОЙ J(ИС:JIOТЫ ПОД
действием пфk в разлиtпtblх условиях
XLIX
I1
BeCOBO СодеРЖВIJllе
соотношение Время, Температура, ВЫ!lОд,
p,OJO p.0 1O мин ос "
И КИСЛОТЫ В ЛФК, "
20: 1 83 75 75 38,2
25: 1 78 140 100 57,1
:l 78 45 100 82,6
30: 1 78 40 100 86,3
.....
Попытка получить семичленное кольцо действием ПФI\
на кетон LI не привела к успеху [70]. Вместо ожидаемоrо
соединения LII была получена смесь циклоrексилнафталинов
и циклоrексилтетралинов. в работе [70] прИВОДЯ'tся соображе-
ния о происходящих пер.еrруппировках.
Штеттер, Шефер и Шпаrенберrер [157] изучали циклизацию
кислот типа LIII, коrда межмолекулярная конденсаци Прf)-
странственно сил'ьно затруднена; поэтому можно щкидать.
что замыкание цикла должно леrко происходить без силь-
Horo разбавления реакционной смеси. Шести- и семичлеllные
цнклические кетоны (LIV; n == 2 и n == 3) получены при ис-
пользовании ПФК с выходами 75 и 80% соответственно;
восьмичленное циклическое соещщение (LJV; n == 4) было по-
лучено с выходом 49% только действием ХЛОрliстоrо алюми
а-Ферроценилвалериановая кислота циклизуется при дей
ствии как ПФК, так и трифторуксусной кислоты В rOMoa HY
лярцый кетон 1, 2 (а-кетопентаметилен) ферроцен [134]. Дна-
ло{ично циклизуется и 1-феРРQценилмасляная кислота. но
-ферроценилпропионовая кислота претерпевает циклИ3;,tцию
в дpyroe циклопентадиенильное кольцо с образованием re
теwаН УJlярноrо кетона. бuс-Карбоксипропилферроцен пре-
Tepn. T двойную циклизацию [121]. . .
. r't) X;poMaHoH (LVla) и ero 7,8 диметнлпроизводное
(LVI6) ',цолучены действием ПФК на т-арилоксимасляиые
КИСЛОТbI LV [37] с выходами 45 и 66% соответственно. 8-Мет-
70
ПФК как реаzеят в Ор20ническоfl химии
Основные тunы реркций, 8ызываемЬ/Х' ПФК
ti
О СИПРОИ3139ДНQе... (.LVI )...H ,.6, 9.-димеТИJшроизводное (L Vlr)..
не MorYT быть получены этим методом. ........
R СООН
R'. I I
"..л (СН 2 )з
R;;6 A o) ,
R.'"
ПФК
lOOo
R 0.,
R' . I IL
УУ )
R" O
R'"
(28)
он
I
0+
СНзСООН
ОСОСН з
ПФК (
24 час, 200 )
LVП
ОН
I
ПФК #)
10 мин. lOOo )
I
СОСНз
LVIП
(29)
LY
LVI
а) R == R' == R" == R'" == Н;
б) R == R'" == Н, R' == R" ::с СНз;
. i : i' "" ' 2.' ,F ' ==: ОСti:з;
т) Я' .H". ;;=;,.Н, ..R .".Я'!! СНз-
пирокатехина взаимодействием с кислотами жирноrо ряда
и корйчной кислотой В юрячей ПФI( были. превращены1 в
соответсtвующие кетоны. АроматичеС1ше кислотьr, в том числе
бензойная, салициловая, n ОКСйбеНЗ0йная и анисовая, обычно
даюr;;эфиры. Однако при реакции на холоду из фенола и
беноойно.й, . анисовой и n оксибензойной кислот были получены
Щ)Qтnетствующие n оксикетоны. Фениловый .эфир анисовой
J{СЛОТЫ в ПФI( переrруппировывается в оксикетон, фени
i1l0ВЫИ эфир бензойной кислоты Не, изменяется. [арднер [60]j
исследуя эту реакцию, получил из анизола и триметиловоrо
фира пироrаллола с уксусной кислотой, уксусным анrидри'"
ДОМ, бензойной кислотой и монометиловым эфиром янтарной
&iIСЛОТЫ соответствующие кетоны LIX с выходами 75 100%..
Реакр:ию между ТримеТИЛОIЩМ эфиром пироrаллола и 2 карб
этоксициItлоrекс lНОНОМ осуществить не удалось [60]. Ацили
ЯР' м ,анизола КРОТОНОБОЙ, сорбиновой, масля ой и ю(п
А n,JIирование
ПФ 1( ч'зёто испойьзьщi:лась 'длямежмолеклярнOI'() ацили
. ....... ... .. ...... ........ .. ..."... ... у '.
ровання, подобно рассмотренным выше случаям внутримоле-
кулярных реакnий: 'В 1950 r. впервые появилось сообщение
. [106], ЧТQ. n;р" ВЗ lИМ:оДеЙ,СТВЩI,. HeJ{oTopblX арома тичеСIЩХ, yr ле
водородов"с простыми арбон()выми .кис;iотами 'образуются
кристаллнческие уrлеводороды. Лозднее [152] из мезитилена
и уксусной, пропионовой и масляной КИСJJОТ наrреванием в
течение 3 5 час при 1400 БЫЛfl получен соответственно 1,1-
димезитилэтилен, 1, 1- димезитилпропилен и 1, 1- димезитилбу
тилен с выходами 9; 39 и 48%. Хлоруксусная кислота дает
моно- и д,ихлорацети;лмезити.тteны. О(\раЗ0вание димезитилал
кенов объясняется реакцией первоначально образующеrося
ацнлмезитилена со второй молекулой м зитилена.
В 1953 r. появились первые сообще1'lИЯ Наказава и .сетр.
[1 (.5], об ацял-ировании фенолов кислота.ми и ПФК с образо
В'а.нием в зависи,мости .от условий эфиров LVlIили оксикето-
нов .:'L VПI. Эфир. L Уп. . образуется :При пров.едени-и реа.кции
на. ХОJI0ДУ В течеНие .24. час, кетон."'"7" при кипячении смеси на
ВОАЯIЮЙ :-бане 'в течение 10....,..;...30 мин., Аналоr.ичным путем' из.
резорци-нз и уксусной КиCJ10ТЫ получен диацетат и дикerон.
4,:6 диа-nети,лрезорцин;. rидрохинон, фенолфталеин и 'дJl-
фенолизатин образуют С.. раЗJlИ.чными кислотами жирноrо
p$IAa ,Qжидil-eмые продукты реакции.. Однако феноJ.I' и 6ен-
3'ОЙная' .I(ислота образуют. ,ТОnько эфир. Эти иссл.едо.ваиия
б-ылJi. продолжены (117].. Фенол. .анизол " дим.етиловый. эфир
R
I
(')
хААх
I
ОСН з
LIX
Х H, ОСНз; R == СОСНз, СОС6Н5, СОСН2СН2СООСНз
N.
хААх
I
ОСН з
ПФК
(30)
jЮ'НО80Ц' кислотами получены соответствующие п оксикетоны
с Вьt1сdдами 6O 90% [46].
, СнаЙдер и Эл стон [53; 148] также изучали общие условия'
ацилирования в присутствии ПФI<. Установлено, ч'fо такие
7').,
ПФ/( ,как peaze1/t в fJРlйническоu химии
Основные типы реакций, вызываемых ПФК
73
ОСОС6Нб ОСОСН а
ПФК J) А
с.н.соон--+ У + у
СОСНа СОС 6 Н 5
LX LXI
пФкj СН,СООН
реакционноспособные соединения, как фенол и тиофен, дают
при 750 ацильные производные с выходами около 70%. Для
реакции бензола требуются настолько высокие температуры,
что образующиеся ЖtlрноаРОМ!iтичеСКИЕ:: KeToH]>1 претерпевают
аутоконденсацию. Дев [46] сообщил, что при наrревании то-
луола с уксусной кислотой и ПФ К в течение 2 час 15 .мин
пр" 850 образуется n метилацетофенон с выходом 75%. При
.ацилировании бензойной кислотой [148] аутоконденсация
не80зможна; в э:rих случаях реакции проводились при 1600
(выход n-метилбензофенона 70%). Электроностяrивающие за
местйтели в ароматической кислоте понижают активность
соед"нения, о чем свидетельствует невозможность ацилирова-
ния фенола n-нитробензойной кислотой даже при 1600. Двой-
ная связь в коричной кислоте оказывает аналоrичное влия-
ние; в этом случае удается ацилировать анизол, но бензол не
ацилируется. ИЗ фенола и уксусной кислоты получен п-оксй '
аце10фенон с выходом 69%; в случае применения капроновой
кислоты выход кетона достиrает лишь 35%, причем OДHOBpe
менно образуется эфир с выходом 18%. Из беНЗ0ЙНОЙ кис-
ло1'ы и фенола в результате наrревания смеси в течение 20 час
при 750 получены n оксикетон с выходом 51 % и следы эфира.
п-Крезол и бензойная кислота образуют только эфир без
вся.юн примеси о-окснкетона. .Из .м крезола и капроновой
кислоты получена смесь O и n-оксикетонов с выходом 22 и
6,% CO<lTBeTCTBeHHO. Амидные и аминоrруппы, связанные с
ароматическим ядром, пасс'И43ируют ero. Исключение пред
ставляет дифениламин, образующий около 15% дибензоилди
фениламина, в котором бензоильные rруппы находятся, по-
видимому, в п, п' положениях.
Прн изучении переrруппировки Фриса rарднер [61] при-
шел к выводу, что при использовании ПФ К выходы не выше,
чем с хлористым алюминием, но в этом случае наблюдается
большая склонность к переrруппировке в пара-положение,
причем переrруппировка в орто-поло ение .не является про
межуточной стадией пара-переrруппировки. Фениловый эфир
бензойной кислоты дает n-оксибензофенон и ero бензоат. При
наrревании фенилацетата с бензоиной кислотой в течени
1 час при 900 получают в качестве OCHoBHoro продукта peaK
ции бензоат п оксшiцет*иона (LX) с выходом 21 % и aцe
тат n-оксибензофенона (LXI) с выходом 3 %. Из фениловоrо .
эфира беНЗ0ЙНОЙ кислоты и уксусной кислоты получен лишь
бензоат n оксиацетофенона (LX) с выходом 21 %. Эти pe
3.ультаты показывают, что ацетаты переrруппировываются ro
раздо леrче, чем бензоаты.
ОСОСН а
I
#"-.
I 11
V
тno c . H .
V
(31)
Наказава и ero сотрудники изучали в сравнимых усло-
виях (l 20 .мин при 1000) ацилирование фенолов и пере-
rруппировки сложных эфиров по Фрису. Как видно из
3'абл. 5 и 6 [114], в ряду жирных кислот максимальНые вы-
ходы при ацилировании и при переrруппировке наблюдаются
т аб лица 5
Продукты реакцин фенола и карбоновых кислот
в присутствии ПФК'
Карбоновая кислота
Выход.. %
2 ациjщро- l 4--ацнлпро- 1 феQНЛОВЫЙ
нзводное ИЗВОДIlOе эфир
20
5
5
2
Уксусная
Пропионовая
Масляная . .
Валериановая
Капроновая. '.
-Фениппропионовая .
Фенилуксусная
Бензоиная . . . . .
13
4
1
65
81
76
58
40
18
19
9
3
3
15
35
57
67
74
90
в случае пропионовой кислоты. Изучалось также ацилирова-
ние фенола мноrими замещенными бензонными кислОта-
ми [113]. Полученныерезулыаты. приведены в табл. 7. Сле-
ДY T отметить, что в условиях опыта из фенола и бензойнон
кислоты получен п-оксикетон с выходом Bcero 16%. Как по-
казывает таблица, метоксильные и метпльные rруппы в орТО-
И napa-ПОЛQжениях способствуют протеканию ре8:КЦИИ,
74
ПФК как реш:ент в орzанической химии
i
Таблица 6
переrруппировки феНИJlОВЫХ эфиров
.iJ присутствии ПФК
Продукты
DCflOBHbIe типы реакции, вызыlаемыыx пФК
15
Таблиqа 1"
Продукты реаIЩИИ фенола и замещенных
бензойиых КИСЛОТ в присутствии ПФК
(20 .мин при 100")
ФеllНЛОВЫЙ афир
Выход. %
2 аЦIIЛПро
нзводное
ацилпро
наводное
Заместитель в бенаойной
кислоте
ВЫХОД, %
аЦИЛDРО
иаВОдНое
феииловый
афl:JР
Уксусной кислоты. .
Пропионовой кислоты
Масляной кислоты. .
Валериановой. кислоты .
Капроновой кислоты. .
-Фенилпропионовой кислоты
Фе илуксусной кислоты
Бензойной кислоты . . . , .
20
13
13
6
2
1
1
1
53
61
45
40
36
10
6
6
0,1
13
16
47
2
61
1
5
Ie
19
7
15
o-N0 2 .
o Cl. .
о-Н. .
o-СНз' .'
о-ОН.
o-ОСНз
M N02
M-Cl
-H . .
.m-СН з .
.m-ОСН з .
n-N0 2 1 .
n Cl. .
n-Н . .
п-СН з '. .
п-ОН .
п-ОСН з .
.-м-ОН
2
16
.24
47
75
но если они находяТся в .мета положении, то оказывают не-
большое. влияние. Оксиrруппа в пара-положении (но не в
орто- или .мета-положеюш) облеrчает реакцию. Атомы rалоrе-
нов и нитроrруппы в люБJ:>IХ. положениях затрудняют реакцию.
Ацилироваiше a-нафТОЛ8 и ряда ПО.l1иоксипроизводных
ароматич.еских соединений. например пирокатехина. резор
цина, пироrаллола и различных их производных, изучалось
несколькими исследователями [87, 112, 116, 118], причем во
мноrих случаях были получены очень хорошие выходы. Об-.
ширный материал по вопросу ацилирования по Фриделю
Крафтсу при действии мноrих peareHToB, в том числе ПФК,
приведен в виде таблиц в статье Нелсона [120].
. Лишь .немноrие олефины подверrались ацилированию в
ПФК. Дев [47) получил Ы-ацетилциклоrексен и L\1.ацетил-
циклопентен с выходами 50 60 и 20 27% соответственно из
олефинов н уксусной кислоты. Применение ненасыщенных
кислоТ позволило. осуществить одностадийный синтез тетра-
rидроинданонОВ из циклоrексена. Наrреванием смеси цикло
/"-. сНз С Н пфк /"'- С
1 11+ 11 I II ) НЗ (32)
"'-/ H C COOH
11
о
LХП
11
78
68
38
78
.5
11
42
68
67
41
65
2
26
68
59
12
13
1I e 'с<?еди ения были синтезированы из друrих ненасыщен'"
ных кислот и циклопентенз. Бензойная кислота и циклоrек
сен 'дают тетраrидрофлуорен,?н, который можно получить
также из бензоилциклоrексан и ПФК с выходом 65%,
БекмаНQвская переrруппировка
:.' . е мановс;кую переrI?УППИРОi3КУ 13 'ЛФК: впервы}e осуще
:CT8Y , В. рбеl? [174]; однако труДliОС.ТИ, свяэанньiе с выдел'е
яи м ДОР С1воримоrQ ПРОДу'кта реffкций(капролактама),не
П1О 'Во л.!f.. праВIiЛЬНО оцени ъ. I] KKaK peareHT д,ля ука'зан:'
:I:IС?И р а]{ЦИ ; По днее Хорнинr и 'Штромберr вновь проsерилИ
IВОЗМОЖIЮСТЬ Пl?и енения ПФК [81]. ОЮlзалось, что бензофе:"
vюноксим при наrревании в ПФI( в течение 10 мин при <1300
reKceHa с кротоновой кислотоЙ В течение 30 .мин при 57:!: 20
получено соединеJПI ,LХlI .. !3J:>IХОДОМ 55 60%, Аналоrич
16
Пф/( как рещем 8 fJрШНиЧескоu хиМиИ
йсновные типы реакции, вЬtзbtвае-мых ПФ/(
,
77
количественно лреtерnевает бекмановскую переrруппировку.
Очень хорощие результаты были получены и с мноrими дру-
rими кеТОКСИМf;JМИ. Установлено, что в ПФК переrруппировы-
ваются даже альдоксимы (82]. Это позвОлило впервые
использовать бекмановскую переrруппировку для устаиовле-
ния конфиrурации альдоксимов. Друrие peareHTbl только де-
fидратируют альдоксимы, . поэтому раньше конфиrурацию
альдоксимов устанавливали по методу fанча [71]. По этому
методу ацетат альдоксима обрабатывают щелочью, причем
з фира сuн-оксима образуется нитрил, Тоrда как эфир анти-
оксима oCTaeTcSj. без изменений или превращается в исход-
tfый оксим. Переrруппировка оксимов бензальдеrида в ПФК
подтверДИЛа прuписанную им ранее конфиrурацию. Из жид-
1(01'0 сuн-оксима LXIII деЙСТВИем ПФК при 1300 получено 9%
формаl!.илида . (LXIV) и 25% бензамида (LXV) , тоrда как
iвердыи антu-оксим (LXVI) дает 40% бензамида (LXV)
причем форманилид не образуется вообще. Очевидно, чт
продуктов реакции [51]. Оксим флуоренона, который при
дейсТВИИ обычнЫх peareHToB переrруппировывается в очень'
жестких условиях, превращают в фенантридон с выходом
93% [83] наrреванием с ПФК при 1800. Прнменение нитро-
метана как источника rидроксиламина для получения ука-
занноrо оксима было описано выше (см. СТр'. 51). а-Оксим
беизила (LXVII), который при действии пятихлористоrо фос-
фора образует хлорпроизводное' N-бензоилбензимидохлорид
(LXIX), с ПФК дает бензойную кислоту и бензамид, что
можно рассматривать каК результат rидролиза нормальноrо
(33)
C6H5 C C C6H5
11 11
О NOH
LXVII
Cl
I
C e H 5 CON ==C C6H5
LXlX
PCI.
C 6 H s CONHCOC 6 H 5
LХVШ
.I'
1n.'
(35)
C5H5 C H
11
NOH
LХШ
ПФК
1300 -+ C 6 H 5 NHCHO + C/jH s CONH 2
[С 6 Н 5 СООН + C 6 H 5 CONH 2 1
LXX LXXI
C6H5 C H
."
HO N
LXVI
пФк .
1300 --+ LXV
(34)
.
продукта переrруппировки LXVIII. Однако эта интерпрета-
ция встретила возражения [53], поскольку позднее бьщо уста-
новлено, что в условиях, близких к условиям этих опытов,
ПФК вызывает rидl)ОЛИЗ нитрилов в амиды с очень хорошими
выходами [147]. Взаимодействие дезокси6ензоина с азотистой
кислотой в ПФК при комиатной темпеРЭ1'уре (5 час) с обра-
зованием бензойной кислоты и бензони'фила можно объяс-
нить тем, что оксим XLVH расщепляется ПФК на кислоту
и нитрил, а нитрнл rидролнзуется в бензамид в более жест-
ких условиях [53]. Из оксима фенилацетона получен нормаль-
ный продукт переrруППИрОВКИ N-бензилацетамид с Bt>IXO-
дом 29%. В случае применения друrих peareHToB это наблю-
далось редко. .
ПФК использовал ась для сужения цикла при бекманов-
ской переrруппировке оксиМа 4-карбокситетралоиа-l (LХХП);
при этом в присутствии ПФК образуется оксиндолилпропио-
новая-3 кислота (LХХПI) (108]. Однако метиловый эфир
LXXIV дает ожидаемый семичленный лактам LXXV. При
обработке лактама LXXV концентрированной соляной кисло-
той в результате обмена между сложноэфирной и амидной
rруnпами и rидролиза эфнра образуется кислота LXXIII.
ОчевиднО, Пфl( вызывает обмен между карбоксильной и
аМИДНОЙ rруппами при превращении оксима LXXII в амид
LxXII1. .
LXIV
LXV
Выход 40% .
часть сuн-оксима u пе ед переrруппировкой изомеризуется в
антц-С?ксим, а стоикии антu-оксим переrруппировывается без
иsоМеризацин. Наrfевание хлорrидрата антu 'оксима 13 тече-
н"е 5 мин при 130 пр'Иводит к получен'Ию амида LXV с вы-
ходом 80%,
ВО мноrих случаях, оrда бекмановскую переrруппировку
было трудно или даже невозможно осуществить с друrими
реаrеитами, с ПФК получались положительные результаты
[83]. Так, оксим. а-тетралона, который при действии друrих
реаrеитов превращается в а-нафтиламин, переrруппировы
Baeт:c в rомокарбостирил с выходом 91 % [83]. Оксим 3, 5 ди-
метилц"клоr е ксен-2-0на-I, коtорый считается смесью син- и
.aHT,!l-форм, д eT только ненасыщенный лактам, соответствую-
щим сuн-форме [83J. Аналоrичным образом из сuн-оксима
.ци кл оrексеJ{-2-0на-l щтучен ожидаемый ненасыщенный лак-
1'8М, вто время как антu-оксим не' дает индивидуальных
7g
Основные тunы реакций, ВЫЗЫВf!емьtх ПФК
.7
ПФ/(' 'f(.alt реаеент iJ ореаR.ическоll химии '
СООСН з
rY ",
,л /
N 11
Н О
LXXV
СООН
I
00
11
NOH
LХХП
СООСН з
I
ПФК А/"...
1l()O, 5JКиH )\)
11
NOH
LXXIV
!НС\
СН 2 СН 2 СООН
ПФI< A I
I 11
"N / O
Н
расщепление наблюдалось в случае оксима 2, 2 дифенилцик
лоrептанона, из KOToporo наряду с неиденти<l!.ицированными
продуктами реакции был получен насыщенныи амид аМИД
7,7-дифенилrептановой к.ислоты. Вероятно, з оксима сн.ача-
ла образуется насыщенный нитрил, которыи затем rидроЛН
зуется в амид.
NOH
11
I Х ' I ПФК [ 1 CH (СН 2 )n CH2CN ]
(СН 2 )т (СН 2 )n (СН 2 )m
LXXVl LХХVП
(dH 2 )m <=>(CH2)n
11
О
LХХVШ
(36)
(37)
LXXIII
Оксимы rетероциклических кетонов переrруппировываЮТСЯ
нормальНО [18], за исключением тех случаев, коrда reTepo-
атом сопряжен соксимнОй rруппой [166]. Однако оксимы
лактамов, в которых атом азота неПОiредственно связан с
а1'Оl\ФМУr:лерьда, соединенным соксимной rруппой, пере-
rрупIJировыIаютсяя в циклические ПрОНЗБодные мочевины с
Qчень 'Хорошими ВЫХОДами [20]. . .
,.: Д йствием ПФК. удалось осуществить riереrруппировку
даже диоксима антрахинона [138]. При этом образуется BOCЬ
мичленный Дилактам диантранилид, на основаНИИ чеrо
МОЖно сделать вывод, что оксиrруппы в Диоксиме находятся
в транс-положении. 1,5-Дихлорантрахинон образует два ди
оксима, которые, судя по результатам Переrруппировки в
ПФ К, относятся к TpaHC TpaHC- и цuс-транс соединениям.
При использовании ПФК в качесТве катализат.ора бекма-
НОБСКОЙ переrруппировки лишь в немноrих случаях получены
неожиданные продукты. Смесь оксимов o-фенилбензоФенона,
KOTopbie в присутствии ПЯТ!:Iхлористоrо фосфора превращаются
в норм альные продукты переrрупПИрОВКИ о-фенилбензанн
лид и о-бенэамидодифенил (70: 30), с ПФК образует цикли
ческие соединения анил флуоренона и 9-фенилфенантридиr%
(80: 20) [145]. Оксимы некоторых .спирокетонов (LXXVI)
изомеризуются, как покаЗЫБа т уравнение реакции (37) [78].
ПQ-ВИДИМОМУ, первая стаДIJЯ состоит в превращеНИ1J о.ксима
в... ненасыщенный нитрил LX{CV 11 , который в результате
циклизации и rидролиза в ПФК переходит в бицикле-
нон (LXXVIII). Ненасыщенные нитрилы строения LXXVII
при обработке ПФК дают кетоны LXXVIII. Подобноrо рода
. При действии ПФК на rидр.ат хлорrипрата диоксима
1,4-циклоrександиона получен только 2-хлорфенилендиамин-
1,4 .[109]. u
При осуществлении бекмаиовскои переrруппировки деи
ствием ПФК в слишком жестких .условиях может происхо-
дить дальнейший распад образовавшеrося э-мида (см. сле-
дующий раздел).
Друrие реакции, вызываемые полифосфорной кислотой
Ввиду близкorо. СХОДСТВ.а механизмов переrруппироВОК
.Бекмана и Лоссеня нет ничеrо удивительноrо в том, что ПФК
можеr превращать rидроксамовые кислот.ы в. амины. [15 .
.fидроксамовую кислоту можно получать tn Sltu взаимодеи-
.ствием rидроксиламина с. карбоновой кислотой ил.!:! ее произ-
водным, например эфиром, амидом или хлоранrидридом. Для
получения амина смесь кислоты, соли rидроксиламина и Пфl(
обычно достаточно HarpeTb в течение 5 мин до температуры
около 150 1700, при которой начинается быстрое выделение
двуокиси уrлерода. Из ароматических кислот, за исключением
0- и n-нитропроизводных, первичные амины обычно образу-
ются с хорошими выходами [149]. Превращение амида в амин
указывает на возможность полноrо расщепления диарилке
тона в одну стадию на. две молекулы lервичноrо ароматич <
cKoro амина. Так, из бензофенона QЫЛ получеQ ЩПfЛШ!
1}ыI\QдQмM 66%.
ПФК как.реаеент в ореанической химии
Основные типы реакций, вызываемых. ПФК
81
80
Салициловая кислота и rидроксиламин 8< ПФ К дают ТО,ль-
ко бензоксазолон [150], тоrда как 3, 5 ДИ0Ксибеизойная кис.-
лота при 180 2000 превращается в 3,5-диоксианилин, в ре-
зультате rидролиза. KOToporo образуется флороrлюцин. Эта
реакция представляет интерес, поскольку таким путем можно
получить флороr люцин из кислоты [170]. .
ПФI( рекомендуется применять вместо серной кислоты в '
качестве среды для превращения кетонов в амиды по Шмид
ту [34, 53]. Путем наrревания эквимолярных количеств бен-
зофенона и азнда натрия с ПФI\ при перемешивании в тече-
ние 2,5 час при 500 был получен чистый бензанилид с выхо-
дом 80%, причем из маточноrо раСТВора удалось выделить
ДОПОJJнительно почти 20% несколько заrрязненноrо продук-
та (53]. Мноrие друrие кетоны были превращены в амиды с
выходами до 98% реакцией с азидом натрия и ПФК (темпе-
ратура не указана), причем в некоторых случаях наблю-
далась ацомальная реакция Шмидта [34]. Бензойная кислота
при 500 реаrирует с ПФI( и азидом натрня с образованием
анилина с выходом 48% и значительной примесн дифенилмо
чевины; n-нитробензойная. кислота в реакцию не вступает.
Амины при наrревании с карбоновыми кислотами и ПФ К
превращаются в амиды [149]. Максимальные выходы наблю-
даются в случае аминов со слабыми основНЫми свойствами.
Так, из бензойной кислоты и анилина при наrревании 8 тече-
ние 20 М,ин от 25 до 160" с последующей обработкой смеси
льдом не был получен амид, тоrда как из бензойной кис-
лоты и 2,4 динитроанилина в этих условиях образуется за-
'мещенный анилид с выходом 98%. Уксусная кислота дает
2.4-динитроанилид с выходом 92%. 0- и n-Нитробензойные
кислоты не вступают в реакцию; из .l1,нштробензойной кис
лоты и n-нитроанилина был получен соответствующий аМИД с
выходом 8%. в реакциях с n-нитроанилином леrкость обра-
зования амида возрастает с увеличением силы применяемых
кислот. В случае бензойной кислоты и N-метил-о-нитроаRИ
лина вместо образования амида происходит ацилирование
ядра [1].
Простые нитрилы жирноrо и ароматическоrо рядов при
наrревании в течение 1 2 час при 1000 с ПФI< {Iревращают
в амиды с выходами до 96% [147]. Только пространсrвеино
затрудненные. ннтрилы, например, нитрил мезитоновой кис-
лоты СН з СОСН 2 С (СН З )2СN и 2,4, 6-триизопропилбенЗ01IИ-
трил, в указанных условиях не реаrируют. Из i.щанrидрпна
ацетона после выдерживания в течение 18 час при комнатной
температуре получен амид а-оксиизомасляной кислоты с'вы-
}СОДОМ 31 %. При наrревании смеси в течение 30 М,ин при 850
образуется 2,2,5, 5-тетраметилоксазолидон-4, по-видимому,
в результате конденсации окснамида с ацетоном, выделяю-'
щимся из цианrидрина. fидролиз 4-нитро-2, 5 диметоксибен-
зонитрила в амид удается' осуществить с. хорошим выходом
только в ПФ К [170J. -Кетонитрилы обычно rидролизуются в
-кетоамиды [72, 147] с очень хорошими выходами. По имею
щимся данным, при rllдролизе -кетонитрилов трехфтористым
бором и водной уксусной 'кислотой образуются несколько бо-
лее чистые -кетоамиды, чем при, использовании ПФК [72].
К наиболее интересным примерам этерификации с ПФК
относится взаимодействие а-аминокислот с бензиловым спир-
том, осуществляемое наrреванием в течение 4 час при 90
1050 [54]. Этим методом былн получены хлорrидраты бензи-
ловых эфиров dl-фенилаланина (выход 65%), l-цистеина
(выход 45%), l-фенилаланина, l-лейцина и l-тирозина. ПФК
использовалась при получении миоrих монофосфатов амино-
спиртов, оксиэфиров, оксиамид и оксинитрилов [31]. ОДНИМ
из первых примеров примеи ПФК является полученне
фосфатов из спиртов {32}; в том числе из rлюкОЗЫ [142].
Данные о применении ПФК для деrидратации 'спиртов
в олефины немноroчисленны. Таким путем декаrидронафтол-2
был превращен в /),,9,10- 0к талин [43], 1,2-бензоциклооктен'-I-
ол-3 в 1, 2-бензоциклооктадиен-l, 3 [90] и ОКСlщетон в не-
насыщенный кетон [172].
ПФК применялась вместо YKCYCHOro анrидрида при нитро-
вании малоновых эфиров [97] и вместо rалоrенидов фосфора
при бромировании кислот (144].
Наrреванием ацетофенона и ПФI( при 70 800 был полу-
чен дипн6Н СвНБС(СНз) == 'CHCOCBH s [14].
Пространственно затруднениые кетоны, например мези-
ТИЛКе10НЫ, при действии ПФК rндролизуются в кислоты и
уrлеводороды [12 ]. В случае 3-ДУРОJ!:л-4-фенилпиридина
.(LXXIX) отщепление дурильной rруппы сопровождается
циклизацией в 2-азафлуоренон (LXXX) [58].
/ "" / )
, / ,
. I
СО
СНЗ,,/ jСНз
. 11 I
снз снз
LXXIX
/ ""- / "
, / ; +
""-с/
11
о
СНЗ"А/ СНз
11 I . (38)
СНз/V"СН з
LXXX
Q a . 1410
82
ЛФК как реаееНт в ореанической химии
()nисание эkспе/JиМ€НТО8
8з
ОПИСАНИЕ ЭКСПЕРИМЕНТОВ
полифосфорнойкислоты, помещенной в пробирке, и наблю .
дают за пОявлением . окраски. Если тотчас же появляется
темная окраска, то циклизацию, вероятно, можно проводи'ть
на холоду. Если окрашивание происходит медленно, про-
цесс циклизации можно вести при комнатной температуре.
ЕtJIИ.Ж исi1Ьiтуемая смесь при комнатной температуре слабо
()крашиваеtся или oCTaeTC1i бесцветной, то реакцию, видимо,
следует проводить' при наrревании. В препаративном опыте ПО
степени: окраски МОЖно судить о необходимой продолжитель-
ности реакции. Оптим альной продолжительности реакции
соответствует окраска максимальной интенсивности.'Реакцион-
ная смесь приобретает обычно темно красную, а иноrда ярко-
желтую или даже темно фиолетовую окраску. В дальнейшем
может происходить «ззrрязнение» окраски вследствие Bыдe
ления буроrо или черноrо осадка; момент изменения окраски
следует считать rюнцом реакции.
. 1( сожалению, при проведенйи реакций с ПФК: не все'r'да
. имеются столь характерные прнзнаки, по которым можно
было 'бы судить о ходе реакций. Чтобы установить возмож
ностьприменения ПФК В какой-либо новой ре l\ЦИИ, по ви
димому, следует проводить нескол'tко .опыtов с'малым.и KO
JlИчествами peareHToB в последовательно все более жестких
условиях, а 3 ходом реакции наблюдать, исПОльзуя наибо
лее u приrодныи в каждом данном случае Метод (спектраль
ныи анализ, rазовую хроматоrрафию, Выделе»ие продуктов
реакиии и т. д.).
I(ак УЖе было указано, раствори:тели редко применяли.сь
С ПФК, та)' как растворителем может служить избыток ПФК-
Хотя СОQтцошения между ПФК: и орrаническими реаrентами
в разных опытах колебались в широких пределах, отноше-
ние 10: 1 может быть принято как исходное. Большинство
орrанических соединений раст.воримо в ПФК:, и для начал'а
реакции требуется лишь перемешивание СМеси. В случае вы-
сокоплавких орrанических соединений МО1Кет оказаться целе
сообразным их измельчение в тонкий порошок И эиерrИчное'
перемешивание во время и после введения ПОРОшка в ПФК.
Для выделения продукта реакции реакционную Смесь
обычн.о выливают в раВНое по весу с ПФI( количество воды
или в воду СО льдом, взятыми в количестве, несколько превы-
ЦIающем количество ПФК- Продукт реакиии отфильтровы-
вают и экстраrируют ИJ1И подверrают непрерывной эКстрак
ции в зависимости от ero свойств. При выделении веществ
OCHOBHoro характера MorYT оказаться необходимыми даль-
нейшее раз'бавление смеси и нейтрализация КИСЛОТЫ'nеред
отде.пением прод.укта' реакции. Однако если фосфорнокисл ЭSJ ,
6*
Выбор экспериментальных условий
. Поскольку Пфl( применялась для самых разнообразных
реакций, трудно выбрать типовые экспериментальные усло
вия. Одно из преимуществ Пфl( заключается в'том, что она
эффективна в сравнительно мяrких условиях, поэтому коле-
.бания температуры и продолжительности реакции не имеют
TaKoro важноrо значения, как при использовании мноrих дру-
rих реаЕентов. Мноrие реакции с Пфl( .осуществляют при
температуре перовой бани, а продо жительность реакции вы-
бирают в зависимости от реакционной способности орrани-
ческих peareHToB. В каждом частном случае может оказаться
предпочтительной более низкая или более высок я теМПе-
ратура.
I(у [102] сопоставил наиболее блаrОf!РИЯТНl?lе условия об
разования различных инденов, инданонов-l, тетралонов I,
бензосуберонов-5 и антрахинонов при процессах циклизации
под действием ПФI( и пришел к выводу, что условия реакции
определяются реакционной способностью как ароматиче-
CKoro ядра, так и карбонильной rруппы. Если карбонильная
rруппа иеобычно реакционноспособна, как, напри:мер, фор
мильная rруппа в а-формиловых эфирах или карбонильная
rруппа в малоновом эфире, то' циклизация с участием неак-
тивированной фенильной I'руппы осуществляется взаимодей
ствием с ПФ К в течение 5 30 мин при 10". При карбо-
f/.ИЛЬНОЙ rруппе TaKoro характера, как в метилкетонах или в
ацетоуксусном эфире, реакция заканчивается за 3{) .мин при
комнатной температуре. В CJ!учае фенилкетонов и карбоно-
вых кислот обычно необходимо наrревание при 60 700 в Te
чение 30 БО .мин. Для превращения бензоилбензойных кис
лот В антрахиноны смесь требуется HarpeBaTb в течение
нескольких. часов при 80 900. Дезактивирующее влияние
карбонильной rруппы На ароматическое ядро, по-видимому,
является важным фактором в отношении увеличения стабиль-
ности этих кислот. I(роме 70ro, I(у установил, что ЖИДКИе и
низкоплавкие твердые соединения обычно циклизуются в ббu
лее мяrких условиях, чем аналоrи с более высокой те.мпера
тур6и 'плавления.
Мноrие исследователи наблюдали появление интенсив-
Horo окрашивания при циклизации В ПФ К I(у [102] и Улиr
[168] предлож,ши использовать характер окрашивания для
выяснения требуемых условий реакции. Для этоrо следы ве-
Щ СТ1 а 5ВОДЯТ при КОfdнаТIiОЙ температуре в 10. 30 частеЙ
84
пФ/( как реа2еН1 8 6Р2й1lцчвск6fl хиМии .
. ()nцса1lце эк.сnерuмёlll'йЬ
t5
соль ОСНQвания плохо растворима, как, I:fanример, в случае
бензофлавина (см. стр. 50), выделить осноаание не пред-
ставляет труда. Чтобы избежать стадии нейтрализации, при
вы елении некоторых веществ можно примен'йть peareHTbI,
вызывающие оБJ3азование осадка. .
ПФ К можно получать различными путями, 'как это Пока
зано в разделе «Введение». Автор предпочитает пользоваться
технической ПФК, выпускаемой фирмой «Виктор кемикл
уоркс» (Чикаrо). Это вещество представляет собой прозрач
ную, бесцветную или почти бесцветную жидкость с ВЫСОКОЙ
вязкостью. Раньше партии ПФ К маркировались с указанием
содержания фосфорноrо анrидрида в пределах 82 84 %, в по
следнее же время указывается содержание ортофосфорной
кислоты (ll5%), что точно соответствует содержанию 84%
фосфорноrо анrидрида. Вязкость жидкости необычно зависит
от температуры. После охлаждения ПФК может стать на-
столько вязкой, что ее нельзя переливать, но, если сосуд по-
сле этоrо HarpeTb на паровой бане, жидкость становится дo
статочнО подвижной и сохраняет это свойство при комиатной
температуре в течение нескольких суток. Склянки с ПФК по-
сле MHoroKpaTHoro ОТt{рывания на В./Iажном воздухе покры-
ваются в верхней части белой коркой. Насколько авторам
известно, корка пе была исследована; по-видимому, она со-
держит смесь продуктов rидр иза пфк. НалИчие корки не
препятствует выливанию жидкости и не сопряжено. с нежела-'
тельными явлениями.
Наиболее удобным методом получения ПФК в лаборато-
рии является наrревание фосфорноrо анrидрида с 85% ной
фосфорной кислотой В колбе,защищенной от ВJlаrи воздуха.
rилмор и Хортон [67] добавляли кислоту, по видимому, от-
дельными порциями к а нrидриду, времй от времени охлаж-
дая смесь водой. З тем смесь наrревали. изредка перемеши-
вая ее, на. паровои бане в течение 2 4 час. Через 2 час
часть твердоrо вещества остается нерастворенной, но это не
мешает применению peareHTa для циклизации арилзамещен
ных кислот в кетоны. Однако в некоторых случаях, напри-
мер при превращении ниtрилов в аМИДЫ (стр. 8O 81), TBep
дое вещество, если оно является фосфорным анrидридом,
может мешать реакции. Примененпе 1,5 2 фосфорноrо анrид
рида на 1 мл 85% ной ортофосфорной КИСЛОты дает смесь
ПФК примерно с таким же содержанием анrИДрИД8, как в
продажной Пфl(.
Для циклизации 3- -нафтилцикл()пентанон-l уксусно:й-2
кислоты, опи<;,анной в 19З8 r., I(ебнер и Робинсон [100) paCTBO
ряли .6 е этои кислоты в 20 мл сиропообраЗJ;lОЙ фосфорной
кислоты при осторожном наrреВ8IЩИ и затем «постепенно, по'
быстро», при энерrичном перемep..Iивании вводили в смесь
50 е фосфорноrо анrидрида. Температура подымалась выше
1000; чере .l час смесь обрабатывал" льдом и выделяли про-
дукт ..реакции. Остается не ясным, пр изошла ли в этом слу-
чае циклизация в результате действия' Р 4 О\о на карбоновую
кислоту или образовавшаяся ПФК быль активным peareHToM.
ОЗМQЖНО, чТО этот способ является боле'е жестким, чем при
менение предварительно приrотовленной ПФК, и ею следует
использовать, если ПФК оказывается неэффеК'FU.ВНОЙ.
Примеры синтезов
Циклизация арилзамещенных КИCJIот. Получение а-тетра-
лона из l-фенилмасляной кислоты в ПФК с выходом 75 86%
при температуре около 900 описано в «Синтезах орrанических
црепаратов» [155]. Ку [102) показал, что при увеличении про-
должительности реакции примерно с 7 до 30 мин при 700 вы-
ход повышается до 93 %. Пяти И семичленные циклические
кетоны обычно получают в указанных выше условиях. Ниже
приводится единственный пример циклизации в Пфl( с обра-
зованием восьмичленноrо циклическоrо кетона с хорошим
выходом. При этом. необходимо было применять roраздо боль-
шее количество Пфl( по ОТНОЦIению к карбоновой кислоте
(50: 1) ,. чем в случае кетонов с меньшим числом атомов уrле-
рода в цикле.
1, 2, 5.... Дибензоциклооктадиен -1, 5-QH-3 [35]:
Л/ '- Л: V
I 11 V 1 ПФК -+- 1 11 11 I (39)
У"-СН СООН # A
2 . 11
О
5 2 0- ( -фенилэтил) фенилуксусной кислоты [35) раств6ряют
в 250 мл rорячей ПФК и образовавшийся желтый раствор
перемешивают на nаро ой бане в течение 2 час. Охлажден
ную смесь выливают в 600 -мл ледяной воды при этом выпа-
дает белый осадок. Осадок отфилыровыв'ают, промывают
10% -ным раствором соды и водой сушат и перекристаллизо
Qывают из водноrо метанола. Получают 4,3 2 кетона в виде
бесцветных иrл с т. пл. 92 950; выход 93%. Проба для ана-
лиза после. двух перекристаллизаций из метанола и возrонки
при 1300 и 0,5 мм рт. ст. плавится при 95,2 96,50. .'
86
fIфl( как petlzeft'l' 80р2tJ.НllческО(;, химии
Описание экспериментов
87
Ме]К ().)JеКУJlярное ацм;ли}>ование. 4-МетилбенэофеI:iоН [53):
Бекмановская переrруппировка. Бензанилид [81]:
. НЗ > * Ho6c v. 1; O -)o СНз СО (""=> (40)
NOH О
F""" . ПФК --+ / NHJ
/ d ?" ,, /
(42)
:См.есь 10 е (0,109 моля) толуола, .23 е (0,188 моля) б 1IЗОЙ'-
;ИРЙ КИ,слоты и 75.2 ПФl\ энерrично перемеШlfJ3ают.3 чд.с при
160 1650 в колбе, снабженной механической мешаJЩОЙ и об-
ратным холодильником с хлоркальдиевой трубкой. Затем
смесь охлаждают и обрабатывают избытком ХОЛОДной воды.
Выделившееся маСЛЯf:IJ:!<;}:q . ещ ч q. .отделяют и последова-
тельно промывают ВОДой, разбавленным раствором едкоrо
!f.зтрд.и .снова БОДОй ,После ..цеР (QflКИ .ЛР.и. .lJ4 116° и
0,4 м-м рх. СТ. получают 15 2 n метилбещюф:енонэ с т. пл. 59°.
Смесь 2 2 оксимЗ'.рензофенона и 60 е ПФI( наrревают в тече-
ние 10 мин при 130°, время от времени встряхивая, и затем
выливают в 300 -мл воды. водныIй раствор обрабатывают
смесью ира с этилацетатом (1: 1). орrанический слой про
мывают водой и насьшiенным раствором поваренной соли.
После высушивания над сулрфатом маrнИЯ раствор выпари-
вают досуха и получают с количественным выходом вполне
чистый бензаfjИЛИД в виде бесцветных кристаллов с т. пл.
1бl 1620.
Синтез ИНДОJlОВ по Фишеру, Этиловый эфир 5 НИТР(jИНДОЛ-
карбоновой 2 кислоты [126]:' .
Переrруппировка Лоссеня. -Нафтиламин [150]:
(Y COOH + NH 2 0H ПФ --+ NH2 + С0 2 + Н 2 О (43)
VV 160 vv
NO N0 2
. . { 1I СНа ЛФК . .
J, I 105 115''''+ . "('Ii JLCOOC 2 H 5 (41)
'v "NHNo=CCOOC 2 H 5 N/:: '..
Н
к .смеси 1,74 2 хлорrидрата fllдроксиламина и 4 2 нафтой-
ной кислоты добавляют 50 2 ПфI<. Смесь перемешивают ме-
ханической мешалкой, при этом температура медленно повы-
wается. При 150° начинает быстро выделяться rаз и смесь
становится бурой. При 160° выделение rаза прекращается.
После эт-6rо смесь выливают на 250 2 толченоrо льда. Полу-
чеННliIЙ раст,В'ОР фильтруют от небольшоrо количества буроrо
осадка.и фильтрат нейтрализуют раствором едкоrо кали. По-
лучают 2,72 -нафтиламина; выход 81 %. т. пл. 107 1090.
Смесь 35 2 тонкоизмельченноrо п-нитрофенилrидразона
этиловоrо эфира лировиноrрадной кислоты и 300 2 ПФК на-
rревают на масляной бане в колбе, снабженной мощной ме-
цщлкой. I(оrда температура достиrает 90°, наЧllнается экзо-
термическая реакция и смесь становится полутвердой. Темпе-
ратуру смеси поддерживают ниже 125°, iюльзуясь в случае
необходимости охлаждения баней со льдом. После переме-
шивания в течение 30 мин при 110 1250 смесь разбавляют
-!I ДЯНОЙ BOДO .. выI!авш й.о<; д к. ОТ}J,е.ця т! Тll{а.те,льно про.-
ывают водои и сушат. .Для удаления возможной примеси
исходноrо фенил.rидразона осаДQК обрабатывают 150 млки.
iI JlRero спирта. Твердый о.садок ра{;творяют в 1 л кищ:iщеrо
чир.{? IJ КОJlбе с обраТНI>IМ холодильником; осадок paCTBO
р . ;rcя ()чень медленно. P CTBOp .фильтруют в rо.ряqем состРя
!l.ЙИ; и фи:льтрат упаривают .ДО 500 -МЛ, охлаждают' и остав-
ля т.в . ХО.1!.ОДИЛЬНом шк фу до завершения кристаллизациц.
пОJtУ :iЮТ 18,.7.2 И.НДОЛЬН(>fО производноrо в виде желтых кри
сталлоЗ; выход 57%, т. пл. 220 2230. АналитическичистыIй
образец плавится при 225 2260. . < .
rидролиз НИТРИJlа в амиД. Амид о-метилбензойной кислоты
[147]:
СНз СНз
< C==N + Н 2 О ПФК --+ < CONH2 (44)
Смесь 5 2 о толунитрила и 6,5 е ПФI( наrревают при переме
шивании 1,5 час при 115°. Полученный бесцветный раствор
разбавляют ледяной водой до 125 ,МЛ. Выпавший осаДОК OT
деЩП9Т 11 ПРИСQ \lНЯЮТ Щ: У осадок! 9браЗОВа! 1lIIfЙ Я ПРIf
ПФ/( как реаеент в ореан.ической химии
Литература
89
88.
ЛИТЕРАТУРА
1. Abramovitch R. А, Неу' D. Н., L ol1g R. А. J., J. СЬет. Soc.,
1957, 1781.
2. А Ь r а т о v i t с Ь. R. А., S h а р i r о О., J. СЬет. Soe., 1956, 4589,
4593.
3. А т i е 1 У., G i n s Ь u r g D., Теtrаhеdrол, 1, 9 (1957).
4. А т i еl У., G i n s Ь u r g О., Tetrahedron, 1, 19 (1957).
5. А n d е r s о n С. L., Н о r t о n W. J., W а 1 k е r F. Е., W е i 1 е r М. R.,
J. Ат. СЬет. Soc., 77, 598 (1955).
6. А n е t F. А L., В а v i п Р. М. G., О е w а r М. J, S., Сап. J. СЬет.,
35. 180 (1957).
7. А n s с'll М. F., В r о w n S. S., СЬет. апд Iпd, 1956, 984.
8. А n s е 11 М. Р., Н е у О. Н., J. СЬет. Soc., 1950, f?874.
9. А r с u 5 С. L., Р r у d а 1 В. S., J. Chem. Soc., 1957, 1091.
10. А r n о 1 d R. Т., С r а i g Р. N., J. Ат. СЬет. Soc., 70, 2791 (1948).
11. В а Ь а S.. Аnп. Proc.Gifu СоН. pharm., 5, 71 (1955); Iпd. Епg.
СЬет.,49, 1560 (1957). . .
12. В а с h m а n п W. Е., Н о r t о л W. J., J. Ат. Chem. Soc., 69,' 58
(1947) .
13. В а d е r А. R., Н У r е J. Е., пат. США 2765320 (1956) j С. А., 51,
5840 (1957).
14. В а d е r А. R., пат. США 2769842 (1956).
15. В а d g е r 'G. М., S а s s е W. F. Н., J. Chem..Soc., 1957,4.
16. В а i 1 е у А S., W о r t h i п g С. R., J. СЬет. Soc., 1956, 4535.
11. Вапfiеld J. Е., Oavies W.. Gamble'N. W., Middleto'n S.,
J: СЬет. Soc., 1956, 4791.
18. В а r k е n Ь u s С., О i е Ы J. F., V о g е 1 G. R., J. Org. СЬет., 20,
871 (1955).
19. Barltrop J. А, АсЬеэоп R. М., Philpott Р. G., Мае-
Р h е е К. Е., Н u n t J. S., J. Chem. Soc., 1956, 2928.
20. В е h r i п g er'H, М е i е r Н., Апn., 607, 67 (1957).
2.1. В е 11 R. N., Ind. Eng. СЬет., 40, 1464 (1948).
22. В е n d а 5 Н., О j е r а s s i С., J. Ат. Chern. Soc., 78, 2474 (1956).
23. В е r g m а п n Е. D., S z m u S z k о v i с z J., ВиН. Soc. сЫт. France,
20, 566 (1953).
24. В i 1I е t е r J. R., М i е s с h е r К., Helv. СЫт. Acta. 29, 859 (1946}.
25. В ir с h А. J., J ii g e.r R., R о Ь i п s о n R., J. СЬет. Soc., 1945,' 582.
26. В r Q с k m а n n Н., М u х f е 1 d t Н., СЬет, B.er., 89, 1397 (1956),
27. Brockrnann Н., Muxfeldt Н., Наеsе G., Chem. Ber., 89, 2174.
(1956) .
28. С а m р Ь е I1 1. О. М., Р о II е r R. С., J. СЬет. Soe., 1956, 1200.
29. С а m рЬ е 11 N., Т е m р 1 е А. F., J. СЬет. Soc., 1957,207.
30. С а т р Ь е 11 Т. W., G i n 5 i g R., S е h m i d Н., Helv. СЫт. Aeta, 86,
. 1489 (1953).
31. Cherbuliez Е., Rabinowitz J., Helv. СЫт. Acta, 39, 1455,
1461 (1956).
32. Cherbuliez Е., Weniger Н., Helv. СЫт. Ac.ta, 29, 2006 (1946),
33. С о 111 n 5 J. F., S m i t h Н., J. СЬеrn. Soc., 1956, 4308.
34. С о п 1 е у R. Т., СЬет. and Ind., 1958. 438.
35. С о р е А. с., S m i t h R. D., J. Ат. СЬет. Soc., 77, 4596 (1955).
36. С r о w d е r J. А., G i 1 Ь е r t Е., N у с h k а Н. R., пат. США 2783246
(1957); С. А., 51, 11392 (1957).
37. D а n n О., А r n dt W. О., Аnn., 587, 38 (1954).
38. О а n пО., 111 i п g G., Апп., 605, 146, 158 (1957J.
39. О а п пО., 1( о k о r u d z М., СЬет. Ber., 91, 172 (1958).
40. D а v i е s J. Е., К i n g Р. В., R о Ь е r t s J. С., J. СЬет. Soc., 1951>,
2782.
41. D а v i е s W., М i d d 1 е t о n S., СЬет. and Iпd., 1957, 599.
42. D е n о N. С., С h а f е t z Н., J. Org. Chem.. 19,2015 (1954).
43. Oev S., J. Iпdiап СЬет. Soc., 31, 1 (1954).
44 О е v S., СЬет. al1d Iпd., 1954, 1071.
45. О е v S., J. Indian СЬет. Soc., 32, 403 (1955).
46. О е v S., J. Iпdiап СЬет. Soc., 33, 703 (1956).
41. Dev S., J. Indiап СЬе'т. Soc., 34, 169 (1951).
48. О е v 5., R а i с., J. lnd. СЬет. 50С., 34, 266 (1957).
49. Djerassi с., Markley Р. Х., ВЬЕ'liеЬ R., J. Org. .СЬет...21.
975 (1956).
50. О j er а s s i С., Ре tt i t G. R., J. Org. СЬет., 22, 393 (1957).
51. D о n а t F. J., N е 1з о пА L., J..Org. Chem., 22, 1107 (1957).
52. Е 1 s п е r В. В., Р а r k е r К. J., J. .СЬет. $ос., 1957, 592.
53. Е 1st о n С. Т., Ooctoral Оissertаtiоп, Uпivеrsitу' of 'l11inois, 1954.
54. Erlanger В. F., Наll R:M., J. Ат. СЬет. 50С., 76, 5781 (1954).
55. Bvans R. F., 5mith J. С., J. Inst. Petrol., 37,80 (1951); J. СЬет.
50С., 1954, 798.
56. F е u е r Н., W у m а n J. Е., СЬет. апd Iпd., 1956, 577.
57. Frei Н., Schmid Н., Апп., 603,169 (1957).
58. F u s о n R. с., М i II е r J. J., J. Ат. Chem. 50С., 79, 3477 (1957).
59. G а i n d V. 5., G а п d h i R. Р., М u k h е r j i S. М., Chem. and Ind.,
1955, !593.
60. Gardne.r Р. О., J.Am. СЬет. Soc., 76, 4550 (1954).
61. G а r d n е r Р. О., J. Ат. Chem. Soc., 77, 4674 (1955).
62. G а r d n е r Р. О., Н о r t оп \V. J., J. Ат. Chem. Soc., 75, 4976
(1953).
нейтралиЗаЦии водноrо раствора едким кали. Осадок промы
вают водой, разбавленным раствором соды и, наконец, снова
водой. Получают 5.5 2 высушенноrо амида; выход 95%, т. п.q.
137 1400; после перекристаллизации из спирта т. пл. 1400.
. ПФ/( как peazeHT 8 tJрzаническо{l химиИ
Литература
91,с
63. G а r d n е r Р. О., Н () r t о n W. J., Т h о m р s о n G., Т w е 1 v е s R. R.,
J. Ат. СЬет. Soc., 74, 5527 (1952).
64. G а r d n е r Р. Ь., W u If m а п С. Е., О s Ь о r n с. L., J. Ат. СЬет.
Soc., 80, 143 (1958).
65. G i 11 е s р i е R. J., L е i s t е n J. А., J. СЬет. Soc" 1954, 1, 7.
66. G i 1т о r е R. с., Jr., J. Ат. СЬет. Soc., 73, 5879 (19Щ).
67. Gilmore R. с., Jr., Horton W.J.,J. Ат. Chem.Soc., 73, 1411 (1951).
68. G r е е п А. L., Н е у D. Н., J. СЬет. Soc., 1954, 4306. '
'69. Gutsche С. D., Flеmiпg F. А., J. Ат. СЬет. Soc., 76, 1771
(1954) .
70. G u t s с h е С. О., S а h а N. N., J о h n s о n Н. Е., J. Ат. СЬет. Soc.,
79, 4441 (1957). . . .
71. Hantsch А., Ber., 24,21 (1891).
72. Н а u s е r С. R., Е Ь уС. J., J. Org. СЬет., 20, 1448 (1957.).
73. Н а u s е r С. R., Е Ь У С. J., J. Ат. СЬет. Soc., 79, 725, 728 (1957).
74. Н а s е r С. R., М u r r а у J. G., J. Ат. СЬет. Soc., 77, 2851 (1955)'.
75. НеlП D. W., Alheim' R. J., Leavitt J. J., J. Ат. СЬет. Soc.,
79, 427 (1957).
76. Н е у о. Н., N а g d у К А., J. СЬет. Soc., 1954, 1204.
77. .Н 1) I R. К, J. Org. СЬеm., 22, 830 (1957).
78. Н i 11 R. К, С о n I е у R. Т., СЬет- and Iпd., 1956, 1314.
79. Н о r i i Z., N i п о m i у а К, Т а m u r а У., J. Pharт. Soc. Japan, 76,
163 (1956); С. А., 50, 13850 (1956). .
80. Н о r п i п g Е. С., КО о J., W а 1 k е r G. N., J. Аm. СЬеm. Soc. 73
5826 (1951). ' ,
81. Н о r n i n g Е. С., S t r О'т Ь.е r g V. L., J. Ат. СЬеm. Soc., 74, 2680
(1952) .
.82. Ноrпiпg'Е. С., Stromberg V. L., J. Аm. СЬеm. Soc., 74, 5151
(1952) .
83. Ноrпiпg Е. С., S romberg V. L., Lloyd Н. А., J. Аm. СЬет.
Soc., 74, 5153 (1952).
84. Horning Е. с., \Valker G. N., J. Аm. СЬет. Soc. 74 5147
(1952). ' ,
85. Н о r n i n g Е. С., W а 1 k er G. N., J. Аm. СЬеm. Soc., 75, 4592
(1953).
86. Н orto п W. J., J oh п so п Н. W., Zo 111 пgеr J. L., J. Аm. СЬеm.
Sqc., 76, 4587 (1954). .
87. Н о r t оп W. J., S реп с е J. Т., J. Аm. СЬеm. Sot., 77, 2894 (1955 .
<88. Ноr.f п W. J., \Valker Р. Е., J. Ат- СЬет. Soc., 74, 758 (1952).
89. Н и t I А. L., G а r t ag а n i s Р. А., Сап. J. Chem., 34, 785 (1956)'.
90. Н u I S g е п R., СЬет. Ber., 90, 1958 (1957). .
91. Н u r d С. О., н а у а u 8., J. Ат. Chem. Soc., 76, 5065 (1954).
92. J а r r е tt А. D., L о u.d оп J. О., J. СЬет. Soc., 1955,4052.
93. J.en n i n g s К F., J. СЬет. Soc., 1957, 497.
94. J о с е 1 у п Р. С., J. СЬет. Soc., 1954, 1640.
95. 1<:еепе В. R. Т., Schofield К. J. СЬет. Spc., 11}57,3181.
96. Кеппата К..С., Org. СЬет. ВиН., 29,1 (19&7). .
97. K spersky.J. P , Kla,ge.r к., J. Ат. СЬет, 80с., 77, 5433 (1955)..
.98. Кlssта.ц Н. ,М., Far.l1swQrth О. W., Wi,tkop 8., .J.Am.
СЬет. Soc., 74, 3948 (1952).
99. КНЬ a]l.s:k у .1';, G i n s Ь u r g О., J. СЬет. Soc" 1957. 1293.
IOО..,ко е.Ь де r.A.,'R о Ь i n s оп R., J. СЬет. Soc., 1938, 1994,
101. КОО J., J. Ат. СЬет. Soc., 75, 723 (1953). ..
102. KpoJ., J. Ат. СЬет. 80с., 7:5,.1 89, 1891 (1953).
103. К о о J., СЬет. апd Il1d., 1955, 445.
104. 1<: 0.'0 J.,. Н.а r.t w еЛ J. L., J. Ат. СЬет. Soc., 75, 1625 (1953). .
105. К о ч е т К о в Н. К., Н и Ф а н т ь е в Е. Е., Н е с м е я н о в 'А. Н.,. ДАН
СССР, 104, 422 (1955)'. .
106/Ки s u.d а К, Апп.. Proc. Gifu СоН. Pharm.,. 5, tЮ (1955); Ind.Eng,
hem., 49, 1560 (1957).
10'(. L а w s о пА., S еас 1 е С. Б., J. СЬет. Soc., 1957, 1556.. ..'
,;Lloy,d. Н. А." Но.rп.iпg.lЕ.,с., J. Ат. .СЬет. 8ос., 16, 3651 (1954).
СИI. М а m 1 о k L., ВиН. soc. сЫт. Frапсе, 23, М 5, 1182 (1956),. .' '."
НО. Matteso.11 Р..;:Б" Sn.yder Н. .R., .. Org. Сh щ., 22, ..150Q
(1957)..<.. .; .' . .
111. Mosby W. L" J. Ат..СЬет. 8ос.,.,74, 2564 .(l952);.J. Qrg.. Cnem., '
_1(1 53)... .
112. N а k а z а w а К, J. Pharm. Soc. Japan, 74, 836 (1954).
НЗ. N а k а z а w а к., .В а Ь а' S.,. J. РЬаст. Soc. Japa", 75, "378 (1955).
Il4. Nakazawa. К, Kusuda K.,.J. Pharm. Soc. JаРIш, 75, 257 (1955)..
115. N а k а z а w а К., .М а t s u u r а S., J. РЬатт. Soc. J.apan,. 74, 69
(1954).
Н6. N а k а z а w а К, 1\1 а t s u JJ r а S., J. Рhаrщ .8ос. J рап, 74, 1254
(1954).
117. Nаk;и:а:wа 1\., M.atsuura S., Kusuda I{., J. pharm. Soc. Ja-
рап, 74, 495, 498 (1954)'.
118. N а k а z а w а К, Т s u Ь о u ch i S., J. Pharm. 80с. .Jl,lpan, 74, 1256
.(1954).
119. N а s i р u r i О., Chem. апd Iпd., 1957, 425.
120. N е 1 s оп.К. L., Iпd. Eng. СЬет., 49; 1560 (1957).
121. Несмея.нов А. Н., Волькенау Н. А., Вильчевск.ая В. Д...
ДАН СССР, 111,362 (1956).
122. N е w m а fI М. S., W i s е R. М., J. Ат. СЬет. Soc., 78, 450 (1956).
123. N O,w 1 i п G., J. Ат. СЬет. Soc., 72, 5754 (1950). . .
124. Ochiai' Е., Okamoto Т., Natsume М., Рhаrт-Вull. Japan 5.
108 (1957)'. . ,
125. Ockenden О. .W., 8chofield К., J. СЬет. 80с., 1953,717.
126. Parmerter S. М., Cook А. G., Dixon W. В., J. Ат. СЬет. Soc
. ,80,4621 .(1958).. .,
127, Р f е if f r Р., Е 1 е r Н.! Anп., 545, 263 .<194Q}.
::12
ПФК ка" реаееНТ8 ОPZQнической хи lUи
Литература
9;3
128. Р i о z z i F., F а v i n i G., Atti accad. nazl. Lincei, Мет., Classe sci.
fis., mat. е nat., 18, 647 (1955) С. А., 50, 10076 (1956).
М!LPopp Р. О., M.cEwen w. Е., Chem. Revs;, .58, 321 1958).
130. Pra-+t Е. F.,R i с е R. а., L u с k е п Ь а u g h W., J. Ат. СЬеm. 50С.,
79, 1212 (1957).
131. Proctor а. R., Thompson R. Н., J. Chem. Soc., 1957,2302.
132. R /1 i С., О е v S., Experientia, 11, 114 (1955); О е v 5., J, Indian
СЬет. 50С., 32,255 (1955).
133. R е i d D. Но, 5 t а f f о r d W. Н., W а r d J. Р., J. СЬеm. 5ос., 1955,
119З.
134. R i n е h 8 r t К. L., Jr., С u r Ь у R. J., Jro, J. Аm. Chem. 50С., 79, 3290
(1957) .
135. Ro sen R., пат. США 2257193 (1941); С. А., 36,94 (1942).
136. Rutherford К. G., Newman М. 5., J. Ат. Chen'1. 50Со, 79,213
( 1957).
137. R у d о n Н. N., S i d d а р р а 5., J. СЬеm. Soco, 1951, 2462.
138. R у d о n Н. N., 5 m i t h N. Н. Р., W i 11 i а m s О., J. СЬет. 50С.,
1957, 1900.
139. R у d о n Но N., Т w е d d 1 е J. с., J. Chem. 5ос., 1955. 3499.
140. 5 с h m i d Н., В u r g е r М., Helv. СЫт. Acta, 35, 928 (1952).
Ш. 5 с h о 11 Ro, М е уе r к., Ber., 65, 902 (1932): .
142. 5eegmil1er J. Е., Horecker В. L., J. Biol. СЬет., 192, 175
(1951). .
143. S i п g е r Н., S h i v е W., J. Org. СЬеm., 22, в4 (1957).
144. S m i s s m а п Е. Е., J. Аm. Chem. 50С., 76, 5805 (1954).
145. S m i t h Р. Ао 5., J. Ат. СЬеm. $ос., 76, 431 (1954).
146. 5 n у d е r Н. R., неопубликованные данные.
'147. 5пуdеr Н. R., Еlstоп с. Т., J. Ат. СЬеm. 5ос., 76,3039 (1954).
148. 5пуdеrН. R., ЕIs10П с. Т., J. Ат. СЬеm. 50С., 77, 364 (1955).
149. 5 n у d е r Н. R., Е 1 s t о n С. Т., J. Ат. Сl1ет. 50С., 76, 3039 (1954).
150. 5 п у d е r Н. R., Е 1st оп С. Т., к е 11 о m О. В., J. Ат. СЬет. 50С.,
75,2014 (1953).
151. 5 п у d е r Н. R., К о n е с k у М. 50' J. Аm. СЬеm. 50С., 50, 4388
. (1958). .
.152. 5nyder Н. R., Roeske R. W., J. Ат. Chem. 50С., 74, 5820 (1952).
153. S п yd е r Н. R., W е r Ь е r F. Х., J. Ат. СЬеrn. Бос., 72, 2962 (1950)'.
154. 5 п у d е r Н. R., W е r Ь'е r F. Х., J. Ат. СЬет: 50Со, 72, 2965 (1950).
155. 5 п У d е r Н. R., W е rb е r F. Х., Org. 5упthеsеs, СоН. Vol. 3, 798 (195 ).
156. 5 t е р h е n s о n Е. F. М., J. СЬеm. 50С.. 1956, 258Ч. .
157. 5 t е t t е r Н., 5 с h а f е r В., 5 рап g е n Ь е r g е r Н., СЬеm. 'Ber.,. 89,
1620 (1956).
158. 5 t i 11 80 n G. Н., F i 8 h е 1 . В., пат. США 2383279 (1945); С. А.,
40, 95 (1946).
159.5uga8a\va Б., Terashima М.. Капоаkа У., Pharm. Виll..
(Tokyo), 4, 1 (1956); С. Z., 1957, 7932,
160. Т а у 1 о r Е. С., Jr., К а 1 е n d а N. W., J. Ат. СЬет. 50С., 76, 1699
(1954).
161. Т h е s i ng J., F u п k F. Н., СЬеm. Ber., 89, 2498 (1956) о
162. Т h i i о Е., частное сообщеиие. .
163. Т h i 1 о Е., S а u е r R., J. prakt. СЬет., 4, 324 (1957).
164 Treib s W., Н er d m а n п G., Апп., 609,70 (1957).
165. Т r i р Р е tt 5., J. СЬет. Бос, 1957, 419.
166. Т r u с е W. Е., S i m m s J. А., J. Org. СЬет., 22, 617 (1957).
167. Tschesche R., Barkemeyer Н., СЬет. Ber., 88, 76 (1955}.
168. U h 1 i g F., Апgеw. СЬеm., 66, 435 (1954).
169. U h 1 i g F.'- Doctoral Dissеrtаtiоп, University of Leipzig, 1954.
170. U h 1 i g Р., неопубликоваиные да иные. .
171. W а 1 k е r а. N., J. Аm. СЬеm. Бос., 75, 3387 (1953).
172. W а 1 k е r G. N., J. Ат СЬеm. Бос., 79, 3508 (1957).
173. W а n g L., J о u lli е М. М., J. Ат СЬеm. 50С., 79, 5706 (1957).
174. Werber F. Х., Doctor81 Oissertation, University of IШпоis, 1949.
175. Witkop В., Patrick J В., J. Ат. СЬет. 5ос., 75, 2572 (1953У.
А4еханuзм реакции
95
РЕАКЦИЯ ВИТтИrА 1)
G. ТР:J1f}ПЕТ
Существенное отличие данноро метода от остальных мето-
ДОВ получения олефинов состоит в том, что положение обра
зующейся двойной сnязи не вызывает сомнений, даже. если
она занимает энерrетически невыродное положение. Все ука-
занные выше стадии реакций осуществляются в мяrких усло
виях и не осложняj()тся побочными реакциями. Процесс По
лучил название реакции Виттиrа.
. Еще в 1919 r. Штаудинrер и Мейер [З5] сообщили, что
аддукт (VII) трифенилфосфина и дифенилдиазометана при
наrревании отщепляет азот и образует дифенилметилентри
фенилфосфоран (VIII), который стоек по отношени.ю кuобыч-
ным карбонильным соединениям, но при взаимодеиствии
с фенилизоцианатом отщепляет трифенилфосфиноксид с об
разованием кетенимида IX. Позднее Люшер [29] наrреванием
фосфорана VIII с дифенилкетеном при 1400 в бензоле под
давлеЩlем получил тетрафенилаллен почти с количественным
выIодом.. Хотя эти н.аБЛj()дения формально можно считать
как qepn*,e, описанные в литературе [29, ЗО] реакции рассма-
тщч _ еМ-Оiti,:чша, общий метод получения олефинов был раз-
p <:>raiI ВИ'т иrом по справедливости носит еро имя.
, Наrр!!вание ) (СвНs)з Р == С (СвНв)2
(СвНs)з p NN==C (С в Н!;)2
VII VIII
I (С.Н.).С""С""О
Ф
C.H 5 NCO --)о CsHsN==C==C (С в Н б )2 (С в Н в )2 с==с==с (С в Н в )2
IX
ВВЕДЕНИЕ 2)
Виттиr и Шёлкопф [41] поюiзали, что алкилиден- иарил
идентрифенилфосфораны (11), образующпеся при дейстВИИ со-
ответствующеrо peareHTa основноро характера ,на ал кил- и
арищщкилтрифенилфосфонийrалоrенид {I); ,леуко реаrИf)уют
с альдеrидам'и и I'{етонаМи. с образованием. БППО,flярных.соеди-
(С 6 Н s )з PCHRR'X Основание (С 6 Н s )з P==CRR' R"R"'CO
1 11
.........-+ R"R"'C O .........-+ (СвНs)з РО + RR'C==CR"R'"
, +'
RR'С Р(СвНs)з
III IV V
нений 111, которые в мяrких условиях расщепляются на три-
фенилфосфиноксид (lV) и олефин (V). Так, из метилтрифе-
нилфосфонийбромида и h-бутилJiития в эфире получается
раствор метилентрифенилфосфорана, который реаrирует с цик-
лоrексаноном с образованием бетаиноподобноrо соединения
VI. При наrревании взвеси этоrо биполярноrо соединения в
эфире при 650 отщепляется трифенилфосфиноксид и обра-
зуется метиленциклоrексан с выходом 48%.
+ Il C.H.Ы Р С С.Н,оО
(СвНs)з Р (СН З ) Br . (СвНs)з == Н 2
МЕХАНИЗМ РЕАКЦИИ
О ..
.........-+ <=>< + .........-+ О ==СН 2 + (СвНs)з РО
СН 2 Р (СвНs)з
VI
Алкилидентрифенилфосфоран можно рассматривать КаК
резонансный rибрид структур Х и XI. Реакция с карбониль
ным соединением заключается в атаке. нуклеофильным aTO
мом уrлерода фосфорана карбонильной rруцпы и в последую-
+
(С 6 Н s )з P CRR'
XI
(СБНs)з P==CRR'
Х
щем отщеплении трифенилфосфиноксида, вероятно, через ста-
дию образования четырехчленноrо циклическоrо соединения
. ХН.
1) Обзор Последнеrо времеии СМ. 143].
2) В статье принята следующая номенклатура фосфорорrанических
соединений: R4P+X --- фосфоиийrалоrеиид [СНЗ(ЧН5)зР+Вr метилтрифе
ннл'фосфонийбромид]; RзРО фосфиноксид [(СБН s ) зРО трифенилфосфин
оксид]; РsР фосфоран [(СвНв)sР пентафенилфосфоран]; .( 6НI)ЗР ""
==СН2 метилентрифеиилфосфораи.
+ ,
(CsHs)eP R R.
CR r(
хн
...............
.- +., .
{СБНs)зР ... CR R.
I 1\. '1I
Q СRЛ.
(СвНS>зР==СR
. .
O::CR ,&.
96
Реакц я Витти20
Области прц.мен,ения реакции
97'
+ +
(СНз)з Р СНз (СНз)з Р
.........-+ I +СН 4
O H O
ХIII
+ .
(СНз)з Р СНз
+
(СНз)з Р СНз
.........-+ 1+1
O СН 2 СН з
Алкилидентрифенилфосфораны (R == R' == Н или алкил) чрез
вычайно реакционноспособны, быстро поrлощают кислород и,'
помимо присоедииения к альдеrидам и кетонам, реаrируют
с водой, rалоrенанrидридами кислот, спиртами и друrими
карбонильными соединениями, например сложными эфирами.
Арилметилентрифенилфосфораны (R == Н, R' == ар ил) менее
реакционн<?способны. Например, бензилидентрифенилфосфо
ран не реаrирует с кетоном Михлера 140], диарилметилен
трифенилфосфораны (R == R' == арил) стойки по отношению
к кислороду и обычным карбонильным соединениям, но обес ,
цвечиваются при действии воды, спиртов и кислот [35]. Это
объясняется ПОВЫlllенной делокализацией отрицательноrо за-
ряда на атоме уrлерода метиленовой rруппы:
Виттиr и Xaar [40] указали на аналоrию между отщепле-
иием трифенилфосфиноксида и термическим разложением
четвертичных фосфониевых оснований ХПI и алкоrолятов XIV.
О СН2СНз
XIV
Биполярные соединения типа ХП; вероятно, промежуточ-
но образуются при получении олефинов действием трифенил-
фосфина на эпоксисоединения [40]. При наrревании трифенил
фосфина и окиси стирола при 1650 образуются трифенил-
фосфиноксид с выходом 86% и стирол с выходом 50%.
Аналоrично этому взаимодействие трифенилфосфина с эфи-
ром фенилrлицидной кислоты при 1700 в присутствии rидро
хинона приводит к образованию смеси эфиров циc и TpaHC
коричных кислот.
(С 8 Н 5 )З P ёH <=> (СвН5)ЗР СН""" \=>
(С в Н 5 )з Р + СН 2 '\...
J о
СН/
I
С 6 Н 5
+
1650 (С 6 Н 5 )з P CH2
I
O CH
I
С 6 Н 5
+
(С в Н 5 )з Р СН 2
.........-+ 1+ JI
O . СН
I
С 6 Н 5
Таки фосфораны, как флуоренилидентрифенилфосфоран
(XV,) [18] и циклопентадиенилидентрифеиилфосфоран (XVI)
[33), представляют собой исключение в том отношении, что
их М;ОЖI-.\О получать 6 водном растворе и они химически очень
стОЙКИ. Эти соединения не представляют интереса для реак-
ЦИИ Виттиrа.
Алкилидентриалкилфосфораны, например (СНз)зР == СН 2 .
реаrируют с карбонильными соединениями с образованием
бипo.rIЯРНЫХ соединений типа ХН, однако при наrревании этих
соединений триалкилфосфиноксид не отщепляется. Виттиr [41]
объясняет это rиперконъюrацией алкильных rрупп с положи-
тельно заряженным атомом фосфора, понижающей сродство
этоrо атома к электрону.
OtO
11
Р(СвНJз
xv
(<;НJз (СвНs)з
XVl
ОБЛАСТИ ПРИМЕНЕНИЯ РЕАКЦИИ
Трифенилфосфораны
Реактивы Виттиrа общей формулы (С 6 Н 5 )з Р == CRR' по-
дучают действием приrодноrо для этой цели основания на co
ответствующий фосфонийrалоrещщ. Они представляют собой
кристаллические соединения же. l 1Тоrо или KpacHoro цвета.
Разнообразие реакций, в которые способны вступать peaK
тивы Виттиrа, определяет способы их получения и использо-
вани в синтезе. Продукты, бразующиеся при быстром по-
rлощении кислорода, подробно не изучены. Возможно, что
ц «e c аналоrичен Действию серы на дифенилметилентри-
лфосфоран, приводящему к образованию трифенилфос
ф.lщCуд»фцда и тиобензофенона [35].
s .
( II)aP==C (CjlH S )2 (СвНб)а PS + (С в Н 5 )2 CS
7 Зах. 1416
Реакция Витти24
Области nрим.енения реакции
99
.98
При реакции с rалоrеноводородными кислотами образуют
ся соответствующие фосфонийrалоrениды, тоrда как при дей-
ствии воды отщепляется бензол и образуется алкилдифенил
фОСфИНОI\СИД.
Виттиrа были использованы такие приемы, как превраШ:еви
в тетраrидропираниловый эфир и образование ацет8ЛЯ [20!
НСI +
(С&Н 5 )з Р==СН 2 (С&Нs)з РСНзСI
I н 2 о .
С&Н& + (С&Н б )2 СНзРО.
+
(С&Н 5 )З Р (СН 2 СН 2 ОН) Br
ХVIП
СН 2 ОН
CH2P (С&Нs)з
Br
ХХ
C.H.LI О
C.H,CHO С 6 Н 5 СНс=:СНСН 2 СН 2 Н
XIX
(V CH20H
H C.H.LI I
([?'О v'v'v')
,) . v
ХХl
Алкилrалоrениды присоединяются к алкилидентрифенил
фосфоранам с образованием фосфонийrалоrенидов. Предпо-
лаrается, что при действии бутиллития на четвертичный
. фосфонийбромид (XVH) образуется циклобутилтрифенилфос
фонийбромид [31]. Особеноо леrко присоединяются аллил-
rалоrениды. Однако в большинстве случ-аев продукт реакции
представляет собой сложную смесь фосфонийrалоrенидов,
образующихся, вероятНО, в результате реа'кции обмена между
первоначально образовавшимся фосфонийrалоrенидом и не-
прореаrировавшим фосфораном [37].
Алкилидентрифенилфосф.ораны леrко' присоедйняются к
сложным эфирам [41]. При обработке промежуточно образую-
щихся аддуктов rалоrеноводородными кислотаМи образуются
кетоалкилтрифенилфосфонийrалоrениды, например ХХII.
В связи с этим нельзя применять реактивы Виттиrа, coдep
>f\ащйесложиоэфирную rруппировку в той же молекуле. Ис
ключение состав.ляют только реактивы, получаемые fIЗ а бром-
эфиров, например XXIV; rде резонанс. стабилизирует фосфо-
ран и дезактивирует CJ10ЖНОЭфИРНУЮ rруппировку. Так, в pe
зулыате реакции фосфонийбромида XXIII с этилатом натрия
в спирте и последующеrо взаимодействия с бензаЛl>деrидом
+ с.н.ц . + I I
(С 6 Н 5 )З PCH 2 CH 2 CH 2 CH 2 Br Br (С&Нs)з РСНСН 2 СН 2 СН 2 Br
XVI1
RBr. +
(С 6 Н 5 )з Р==СН 2 (С 6 Н 5 )З PCH 2 R Br
+
( ) (С&Н 5 )з P==CHR + (С 6 Н 5 )з РСНз Br
О
+ I
(С&Н5)зР==СН2+С&Н5СООС2Н5 (С&Н5)зРСН2СОС2Н5
I
С&Н5
+ HBr +
(С 6 Н 5 )з Р (СН 2 СОС&Н 5 ) ОС 2 Н 5 (С 6 Н 5 )З Р (СН 2 СОС 2 Н 5 ) Br
ХХП
+
(С&Н 5 )З PCH 2 R Br + (С 6 Н 5 )З Р==СН 2 (
При взаимОдействии со спиртами между реактивом Вит-
тиrа и соответствующим фосфонийалкоrолятом устанавли-
вается равновесие, что, однако, не препятствует использciва-
+
(С6Н5)зР==СRR' + R"OH (.) (С&Н 5 )З Р (CHRR') OR"
+
(С&Н 5 )З PCH 2 COOC 2 H 5 Br
ХХIП
C.H.ONa (С 6 Н 5 )з РСНСООС 2 Н 5 ++
XXIV
нию В синтезах реактивов Виттиrа, содерж.ащих оксиrруппы.
Действием 2 молей бутиллития на 1-0ксипропилтрифенилфос-
фонийбромид (XVIH) с последующим добавлением бензаль-
деrида получен олефин XIX с выходом 65% [37]. Из оксиф"ос-
фоиийбромида (ХХ) в результате действия 1,9 моля бутилли-
тия И последующей реакции с циклоrексаноном получен диен
XXI. с выходом 80% [15]. Для защиты оксиrРУI"!П в реакции
+ /0
++ (С&Н 5 )З РСН==С"
ОС 2 Н 5
образуется коричная кислота с выходом 77% [41]. Винилоr
фОСфОНliйбромида XXV, полученный из l бромкротоновоrо
эфира, реаrирует таким же образом [4], а фосфонийбромид
7*
100
Реакция BиTTuza
Области nрименения реакции
101
XXVI, который является rомолоrом XXV, находит применение
в синтеЗе витамина А [38, 42].
+ . . с.н.Щ Jа.
(С 8 Н в )з PCH 2 CH==CHCOOC 2 H B 8r CaH.t:HO.
ХХУ
.........-+ С.Н в СН===СНСН==СНСООС 2 Н 6
CHO + (с.н.), PcH,C(CH,) cнcooц в;
XXVI
OHa
)
Альдеrиды и кетоны
Реакция Виттиrа npOTeKaet без ОС;ТlOжнений с насыщен
ными иненасыЩенными алифаtическимlt и алицикличеСКItМИ
альдеrидаМh и кеtонаМи, алкиларил и диарилкетонами, а таК-
же с ароматическими альдеrидами Введе"ие карбонильных
с(} дииений rетероцикличеtкоrо ряда в реакцию Виттиrа еще
Не изучено. Альдеrид и KeTOHMotYT содержать следуюЩи .зй-
местители: окси- [16, 37], аЦетокси [23], метокси- [20], тетра-
rидрdt1Ираиилокси [20], диметилI'IМИНО- [41], ацетальную [20] и
концевую ацетиленовую rруппы [11], rалоrеньt. и нитро-
rрупПЫ в ароматическом ядре [41]. Можно прйменять также
карбонильные соединения с дополниtельной сложноэфирной
rруппировкой при обратном порядке смешения peareH1'OB: дo
бавлени.и фосфора на к избытку карбонильноrо соединения
[6] (см. стр. 106 1 07) .
Аномальная реакция наблюдалась в немноrих случаях.
Так, алкилидентрифенилфосфоран ХХХI и 2 метиленцикло-
reKcaHOH обiНIЗУЮТ триен ХХХII [21]. При действии 2, 4, 5-три
ацетоксибензальдеrида на фосфонийбромид, полученный из
,.-бромкротоновоrо эфйра, в присутствии этила та натрия об-
раsуется только 2 окси-4, 5-диацетоксибензальдеrид [4]. Пер-
вую ИЗ ::JТИХ реакций можно считать единственным случаем
присоединения реактива Виттиrа к 11, p-ненасыщеtlНОМУ кетоиу
в положение 1,4. d-rалоrенокеТDtIы Moryt реаrировать
с отщеплением rалоrеноводорода; так, 2-бромциклоrексанон
и фdсфоран ХХХI даю1' триен ХХХIII [37].
/ ) ,f'CH 2 А,f'СНСН==Р(С6Нв)з
\. O + ) 1 \.) "-/
XXXI ХХХII
I COOR
A/V LlA1Ii. А
-+ 8Ит8МЙН
БlIфункциональные реактивы Виттиrа нашли широкое при-
менение. Так, взаимодействием фосфор а нов (XXVII; n == 1,2)
с о фталевым альдеrидом были получеиы бициклические уrле
водороды (XXVIII и XXIX) [38], а из rеранилацетона и фос-
форана (XXVII; n == 2) синтезирован сквален (ХХХ) [14,
31, 36].
n l (XJ
-+ I
rno
Л/ С ХХУIII
[I[ + (С.Нв)з Р== Н (СН 2 )n СН== Р (С8Нв)з
CHO fY1
n 2
-+
XXVII d
XXIX
"п у ,
,f'0 " "'-
(111 +ХХУII (n==2).........-+ ( 1 1
Л V' (11 "- ,,/
Л ,,)
ХХХ
(X ,f'0 /"-
I + XXXI .........-+ I
. Br / / / )
I I
"'-/
ХХХIII
Этиленовые и ацетиленовые соединения не изменяются
при действии реактивов ВИ1'тиrа. Мноrие сильно неиасыщен-
ные алкилидентрифенилфосфораны были введены в реакцию
8иттиrа (см. следующий 'раздел).
Стереохимия образующихся олефинов
Образование сМеси циc и транс изомеров в результате
рассматриваемой реакции впервые наблюдалось Виттиrом [4 t]
в случае взаимодействия аллилидентрифеНJlлфосфораиа с
102
Реакция Виттиеа
п ри.менение решщии Виттией .
103
(,,-/сн 2 он /,,-/сн 2 он
,,-) /сооснз + )
1
соосн з
XXXIX XL
Образование фосфорана из аллилтрифенилфосфонийбро-
мида может сопровождаться цuс-транс изомеризацией аллиль-
ной rруппы. Из цuс аллилтрифеНИЛФ9сфонийбромида (XLI) ,
бутиллития (1,9 моля) и циклоrексанона при 400 получен диен,
содержащий 25%транс изомера XLII. При получ нии фосфо-
рана при 250 с последующим наrреванием реакционной
смеси до 00 после введения кетона содержание транс изомера
снижается до 5% [15].
О /сн 2 он
ycн,r (C,H&Ja
( ,/сн 2 он /VCH20H
H C.H.LI I + I
сон,оО VV"\A "\
I I I
"v "\А
I I
V
ХLII
ПРИМЕНЕНИЕ РЕАКЦИИ виттиrл
Метилентрифенилфосфоран часто применяется для синтеза
соединений с экаоциклическими метиленовыми rруппами. Из
циклоrексанона был получен метиленциклоrексан с выходом
48% [41]. В стероидные соединения удалось ввести экзоцикли
ческие метиленовые rРУПI]Ы в положения 3 [1, 341 7 [19, 34],
.12 [34] и 17 [34] и метиленовые rруппы в положения 20 [34],
24 [2, 19] и 25 [19]. Однако наиболее широкое применение ре-
акция Виттиrа нашла в синтезах витамина О, а также при
родных полиенов и полиенов, представляющих интерес для
изучения спектров поrлощения.
C 9 H 17
I
/"1/""
VV.
11
(
A CH2
I I
но/"---/
.XLIII
бензальдеrидом. Пр этом была. получена смесь цис- и
транс-l фенилбутадиенов (1.: 1). С тех пор считается, что об-
разование смеси изомеров возможно во всех ,подобных слу
чаях. КОJJ чественное соотношение выделеаных циc и TpaHC
изомеров может изменяться в зависимости от направлеl1UЯ
реакции, применяемоro основания и температуры реа ЦИИ.
Например, из акролеина и фосфорана XXXIV получен только
транс-уrлеводород ХХХУ, в то время как при реакции аллил-
идёнтрифенилфосфорана с альдеrиДОМ XXXVI образуется
смесь цис- и транс-уrлеводородов ХХХУ [8]. При взаимодей-
ствии бензилтрифенилфосфонийбромида с бутиллитием и за-
тем сбензальдеrидом образуется смесь 30% цис- и 70%
транс-стильбенов [40]. При использовании в качестве peareH
снзсн==сн (С:=С)2 CH CHCH==P (с в н 5 )з + сн 2 ==снсно
XXXIV
снзсн==сн (С:=С)2 СН==СНСН==СНСН==СН 2 (тpaHC )
ХХХУ
снзсн==сн (С:=С)2 СН==СНСНО + (С в Н 5 )з Р==СНСН==СН 2
XXXVI
ХХХУ (цис- и транс-)
та OCHOBHoro характера этилата натрия в спирте была полу
чена смесь 53% цас- и 47% tpaHC-СТИJIьбенов. Влияние тем-
пературы реакции на соотношение изомеров можно цоказать
на при мере взаимодействия бензальдеrида с бифосфораном
ХХХУII. При .комнатной температуре образуется смесь трех
цuс-транс-изомеров, а при наrревании в эфире в течение
1 цдс тольКо транс транс-изомер [31].
С . С С.Н.СНО
( вН5)З р==сн Н 2 СН 2 СН==Р (С в Н 5 )з )-
XXXVII
с в н 5 сн CHCH2CH2CH ==СНС в Н 5
Во мноrих случаях при реакции Виттиrа, по-видимому,
вследствие стерических эффектов образуется только один из
возможных изомеров. Например, при взаи'модействии 2-0КСИ-
метилциклоrексанон.а (ХХХVПI) с карбометоксиметилтрифе
нилфосфонийбромидом и метилатом натрия в метаноле полу
чена смесь цис- (XXXIX) и транс-изомеров (ХЦ, содер>t<а-
щая лишь 0,5 % ци€;- изомера, обна руженноrо по ero способ-
ности клактонизации [15].
(,(СН 2 0Н
"-/ o
ХJCХVШ
Br
ХН
+
(С.Н.). Р (сн.соосн.) в.. )
CH.ONa, CH OH
C 9 H 17
I
1/""
V
он
XLIV
104
РеакЧIЩ Вцттиеа
п рименение реакции BиTтuea
105
(X CH2N (СНЗ)2 ( /",,/CH2N (СН З )2
I + I==CHCH==:P (С 6 Н 5 )з I I
o V .
. у1
v
XLV
(УО
\А
I
V
XLVII
!h.
(УО
VVV""
V
XL VIII
с ианс. 270 .м.м" (17). Этот транс триен был .получен также
взаnмодействием транс-диенона XL VII с метилентрифенил-
фосфораном [17]. Соответствующий ЦUС 1риеА (XLIX; ЛмаRС
262.мм,,) синтезирован через цuс-диенон XLVIII, полученный
облучением траftс-диенона или нефотохимическим путеМ
преВращением цuс-диола L в фосфоран LI. В резулыате peaK
ции фосфорана LI с U:иклоrеКС8НОНОМ получен цuс-диеноЛ
LII, при окислении которою образуется цuс-диенон XLVIII
[15, 16].
К друrим модельным триенаJd, синтезированным в этой
области, относится модель тахистерина (LIII). .полученная
р.еакцией циклоrексен 1 илметилеllтрифенилфосфорана с 2-Me
тилциклоrексен I-алъдеrидом [22].
('н/СНа + (УСН==Р (С 6 Н 5 )з (УСН а
CHO V
v
/
/VCH 2
(С.Н,), P== H. I I
v'\
'о
XLVI
л ,,-;СН 2
(с.н,,). р==сн. / У
7.
V
LIII
В недавно описанном синтезе К,алы.(иферола (витамин О 2 )'
[16] конденсацией С21-альдеrида (LIV) с 4-ацетоксициклоrек-
саноном получена. смесь транс-диенонов L V, эпимерных
XLIX
0 9>
cн,fi ·
онс Сон"
ll\f
/
OH , (У ОН А/ОН
с.н,.О I 1 I
I VVCH==P (С 6 Н 5 )з .............. VV H20H
V
LII
LI
Синтез витамина D
Несколько модеЛ.ьньiх триенов было синтезировано для со-
поставления их спектров поrлощения со спектрами поrлощ.е-
ния витамина D (XLII1; Лианс 265 .м.м,,) и друrих соединений,
образующихся при облуче,НИИ эрrостерина. например тахи-
стерина (XLIV; MaHC 280,5 м.м,,). .
Из Щlклоrексилиденэтилидентрифенилфосфорана и 2 ди-
метиламиноциклоrексанона был получен аминодиен XL V.
При термическ<w разложении соответствующеrо четвертич-
Horo аммониеВОf-О. основания образуется транс триен XL VI
L-VJ
Ьу
lV
{ С6 Н 5)з Р ==СН 2
НО
INtl
Реакция BUTTuza
Родственные реатщии
107
106
Полнены
Для изучения спектров поrлощения был синтезирован ряд
полиенов, в том числе соединения СН з (СН == СН) nСН з , rAe
n == 8, 9 и 10 [9]. Декаен был получен путем взаимодействия
диальдеrида LVIII с н-rексадиен 2, 4 илидентрифенилфосфо
раном (LIX) и дальнейшеrо частичноrо rидрирования обра-
зующеrрся диацетилена.
сносн==сн (С == С)2 СН==СНСНО + СНа (СН==СН)2 СН==Р (С 6 Н 5 )з
L VШ LIX
СНз (СН==СН)4 (С:==С)2 (СН==СН)4 СНз СНз (СН==СН)IO СНа
В области каротиноидов помимо витамина А (см. стр. 100)
реакцией Виттиrа были синтезированы ликопин [26],15, 15'.де-
rндроликопин [26], 15, 15'-цuс ликопин [26], 15, 15' деrидро-
-каротин [26], диэфиры норбиксина и кроцетина [27]. Типич-
ным является синтез ликопина (LX) из фосфорана LXI. Син-
тез состоит в обработке фосфорана, полученноrо из броми-
cтoro rеранила, раствором кроцетиндиальдеrида в хлористом
метилене.
(LXV) [11], поли ацетиленовый уrлеводород LXVI, выделен-
ный из Arteтesia vulgaris[7], анациклин (LXVII), обладаю-'
щий инсектицидным действием [6], и полностью транс-изомер
полиацеТИJIена (LXVIII), выделенный из Carlina vиlgaris [5].
h-С 4 Н е (СН ==СН)з (С == С)2 СН 2 СН 2 СН 2 ОН LXII
СеН5 ( С== С)а (СН ==СН)2 СНз СНзСН ==СН (С == С)2 (СН==СН)з Н
LXIII . LXIV
h-С 6 Н. з (СН==СН)2 (С==С)2 СН==СНСН 2 ОН LXV
h-СзН r ( С== С)2 СН 2 СН 2 (СН==СН)2 CONHCH (СН З )2 LXVl
СНз ( С== С)з (СН ==СН)2 (СН 2 )4 СН==СН 2 LXVIl
СН 2 ==СНСН==СН (С == С)з СН ==СНСН 2 ОСОСН з LХVШ
При синтезе анациклина фосфоран LXIX добавляют
к этиловому эфиру фумаральдеrидокислоты. PeareHTbI смеши-
вают в обратном порядке, чтобы не применять избыток фос-
форана, который может реаrировать также со сложноэфир-
ной rруппой в альдеrидоэфире.
h-СзН r (С=:=С)2 СН 2 СН 2 СН==Р (С 6 Н s )з + ОНССН==СНСООС 2 Н з
LXIX
h-СаН7 (С=:=С)2 СН 2 СН 2 (СН==СН)2 СООС 2 Н з
у С-3. Диеноны L V при облучении ультрафиолетовым светом
количественно изомеризуются в смесь 5, 6-цuс-эпимеров (LYI),
которые реаrируют с метилентрифеНИЛфQсфораиом С образова-
нием смеси кальциферола и эnu-кальциферола (LVII)..
Образовавшиеся изомеры разделяют в виде 3, 5-динитробен-
зоато . При действии метилентрифенилфосфорана на смесь
транс-диенонов LV в виде ацетатов образуется, по-видимому,
5 J 6-транс-эnu-кальциферол [16, 23].
')//СН==Р (С 6 Н s )з / AA/ AA/CHO
J 11 + ОНС I I
'V".
LXI
Синтезы друrих соединений
Недавно описан синтез альдеrида [28] из трифенилметокси-
метилфосфонийхлорида, полученноrо присоединением хлор-
метилметiiловоrо эфира к трифенилфосфину. Эта реакция
молtет служить примером применения реакции Виттиrа для
получения соединений, не ПРИllадлежащих к классу олефинов.
Следует ожидать, что реакция Виттиrа найдет и друrое при-
менение в орrаническом с нтезе.
'''./ I I У')
() /VV ЛVYV А/ Л
LX
По реакции Виттиrа из природных полиенов получены
цикутол (LXII) [12], фенилдиентриин (LXIII) и полиеll LXIV,
выделенный из некоторых видов Coreopsis [3], энантетол
РОДСТВЕННЫЕ РЕАКЦИИ
Недавно Хорнер [42] описал два синтеза олефИНОI\ 1), ана-
лоrичныx реакции Виттиrа. В первом синтезе кипячением
алкилдифеНИЛфОСфИНQксида LXX с кетоном и амидом натрия
в беllзоле были получены натриевая соль дифенилфосфино-
1 В самое последнее время большое внимание привлек синтез олефи-
нов с примеНЕ!Rием карбанионов типа (G 2 H s )2P(O)CHR, rде R элеКТРОIlО-
стяrивающая rруппа. Этому вопросу пФсвящен специальный обзор [18a].
Прим. перев.
108
Р,шcuия ВЦ'l"t/J ZD
Эн;сnерц.менrал"ная часrь
109
вой кислоты и Рл фu:н. Iiаqриt.\ер, метилдифенилфосфии-
окщfJt С бензофеJi.ОНОI4 и амидом НtlТРИЯ в бензоле при кипя-
чещlП с обр тным хдлодильником В течение 4 "С qбразуЮТ
1,1 -ДliфеlJилэтцлен с ВЫJ.[QДОМ 70% и соль дuфе!lиJJфОСфИНО-
вой кислоты с выходом 6%.
_ О
)2рСН2R'-+ RRCO f11 8 1\1H 2 " .(C 6 н.JJ''''''CHR ..........
. 11 ....1.
О Q C R
LXX
успешно осуществлять только с чистыми кристаллическими
фосфонийrалоrецидами,
МетилтрифеН JJфосфонийбpdмид [41]. 1( раствору 100
трифеЩlЛфосфина в 500 ,мл бензола в колбе, выдерживаю
щей по"ышенцое давление, при JOO приливают 50 2 броми-
CToro l'4еТИЛ8. Смесь оставляют на 2 суток при комнатной
TeMnep{trype; образовавшиiicя метилтрифенилфосфонийбро-
мид (101 2) с т. пл. 227 2290 отделяют и промывают бен-
золом.
..............
о
11
{С 6 Н 5 )2 Р '+. RCH==CIt R
&
Реакция 8иттиrа
В первоначальной методике проведения реакции Виттиrа
[41] к взвеси а.iIкилтрифенилфосфоний ромида в эфире при
комнатной температуре в атмосфере азота, свободноrо ОТ кис-
лорода, приливают сначала 1 моль фениллития в эфире, а за-
тем аЛЬДеrиД или кетон. Полученное бетаиноподобное соеди
нение VI разлаrают в виде взвес'и в трубке Шленка при 650
в е2 З час. Трифенилфосфиноксид и бромистый литий
()бра$ytqт' нер створимое в эфире комплексное соединение, ко-
торое 'оТфильтровывают. .
ЧrоБJ;,f избещать црнt;iенения трубки Шленка, эфир можно
заменить тетраrидрофураном (т. кип. 640) [17]. Этот раство-
РИТeJ11! преДСТЩiляет особыfi интерес,. если один из компо
нентов р.еакциtl содержит свободную оксиrруппу, что может
привести к образованию нерастворимых в эфире литиевых
комплексов {37]. Большим недостатком тетраrидрофурана яв-
ляется то, что в нем ра<;творяется комплекс трифени.lJфОСфИН-
оксида с/бромистым ЛИТtlем, поэтому продукт реакции прихо-
дится отделять от эквимолярноrо ко,личества трифенилфос-
финоксида. Во мноrих случаях это разделение сопряжено с
трудностями, так как трифенилфосфиноксид проявляет ск,лqн-
ность к медленному просачиванию через хроматоrрафичес!<ие
колонки, за исключением .наиболее эффективных.
Во мноrих случаях, в особенности коrда образуется или
расширяется систеМа сопряженных двойных связей, нет необ-
ходимости в наrревании промежутОЧНО образующихся биilO-
лярных соединений. Так, из фосфорана LXXI и пентен-2-ин 4-
аля. в эфире после стояния cero в течение 1 час при комнат-
ной температуре получен триенин LXXII с выходом 60%.
h-С 4 Н g СН==СНСН==Р (С в Н 5 )з + ОНССН CHC==CH
LXXI
H C4Hg (СН==СН)з С==-СН
LXXII
Во втором синтезе при кипяченl'IИ с обратным холодильни-
ком диэтиловоrо эфира бензилфос:Финовой кислоты с бензо-
феноном и амидом натрия в беНЗОJlе в течение 6 час получен
трифенилэтилен с выходом 88%.
С в Н 5 СН 2 РО (ОС 2 Н 5 )2 + (С в Н 5 )2 СО + NaNH 2
С в Н 5 СН.""С (С в Н 5 )2+ N OPO (ОС 2 Н 5 )2+ NHs
ЭКСПЕРИМЕНТАпЬ АЯ ЧАСТЬ
Получение апкилтрифенилфосфонийrапоrенидов
Алкилтрифенилфосфонийrа,лоr J{ИJJ.Ы получают присоеди
нением алкилrалоrенидов к трифенилФосФинУ. В случае ал-
лилrалоrенидов и низших членов ряда алкилrалоreнидов ре-
акция леrко про екает при комнатной температуре или при
+
RX + (СвНа)з Р R (С в Н 5 )& Р Х
осторожном наrревании в растворителе, например бензоле.
С увеличением алкильноrо раДИКi\ла требуются более жест
кие условия реакции. PeareHTbl можно HarpeBaTb без раство-
рителя или кипятить с обратным холодильником в таком
полярном растворитеJ!t . как нитрометан. По своей реакцион-
ной способности алкилrалоrеНИДl,j располаrаются в порядке
RI > RBr > RC1. . .
Образующиеся фосфоние Iе соли обычно предстаВЛllЮТ
собой тверъ.ые кристаллические вещества. Они проявляют
склонность поrлощать воду и перед употреблением должны .
быть тщательно высушены. КРИСl'аллизация фосфонийrалоrе
ни.дов из СЛQЖНЫХ смесей часто С13язана с трудностями. Хоро-
ши раС'fвор телем для р стаЛjlИзации является тетраrид-
рофуран [15}. ОП IТЫ показали, '11'0 реакцию Виттиrа можно
ll()
Реакция Виттиеа
Экспериментальная часть
111
При получении фосфоранов вместо фениллития часто
лри:меняют н бутиллитий [13], но, ПО ВИДИМQМУ, это не дает
суще твенных П,реимуществ по сравнению более стойким фе
ниллитием. I)римен лись также трифенилмети,лнатрнй ЛЗ],
измельчен ыи натрии в эфире [32], расплавленный 'калий [29],
этилмаrниибромид тетраrидрофуране [15] и амид натрия в
ксилоле l40]. При деиствии этилата натрия на алкилтрифенил-
фосфонииrалоrенид в спирте образуется равновесна'Я смесь
этилата алкилтрифенилфосфония и соответствуюшеrо фосфо-
рана [40], который можно непосредственно вводить в реакцию
Виттиrа. БеНЗИЛТРIlфенилфосфонийхлорид и этилат натрия
+
(СвНs)з Р (CH 2 R) ОС 2 Н б " >- (СвНs)з P==CHR + С 2 Н Б ОН
в СПирте и бензальдеrид при комнатной температуре дают
стильбен с выхрдом 76% и 20% неизмененноrо фосфонийrало-
rенида [39]. Алкоrоляты натрия чаще Bcero применяются
с фоефонийrалоrенидами, получаемыми из а-бромэфиров. Ok
нако, как показывают последцие исследования, эти стойкие
фос ораны можно обычно получ.ать в водной среде, применяя
едкии натр в качестве peareHTa OCHoBHoro характера [27].
3-Метиленхолестан [1], 2,77 е метилтрифенилфосфонийбро-
мида обрабатывают 0,651 2 фениллития в 46 ,мл эфира при
встряхивании в течение 3 час. Затем добавляю.т 3 2 холеста-
нона и смесь кипятят с обратным ХОЛОДИЛhНИКОМ в течение
1 суток. Полученный эфирный раствор промывают водоЙ, cy
шат и упаривают в ваКУУМе. Остаток кипятят с обратным
холодильнико с избытком алюмоrидрида лития в эфире.
После обычнои обработки продукт реакции растворяют в пет-
ролейном эфире, раствор пропускают через 50 2 окиси алю
миния и вымывают 150 мл петролейноrо эфира. после кри-
сталлизац и из СМеси этилацетата,С метанолом получают 1,62
3 метиленхолестана в виде иrл; т. пл. 65 660, Ia]D + 230 с
2,16 (в CCI.). . '
Дициклоrексилидензтан [17]. 1( взвеси <10 2 Циклоrексил-
иденэтилтрифенилфосфонийбромида в 100 ,мл абсолютноrо
эфира приливают в атмосфере азота, свободноrо от КИС,1l0-
рода, 21,5 мл 1,3 н. раствора н-бутиллития в эфире. Твердое
вещество быстро растворяется, и полученный крt'lсный рас-
твор оставляют на ночь при комнатной температуре. После
приливания 2,56 2 циклоrексанона в 15 мл эфира раствор
перемешивают в течение 2 час, затем отrоняют эфир и доба-
вляют тетраrидрофуран. Раств<?р кипятят с обратным холо-
дильником в течение 2 час, после чеrо тетраrидрофуран OTro-
няют В ва.кууме, Остаток экстраrируют эфиром, эфирную вы-
тяжку промывают водой, сушат и упаривают. Остаток пере-'
rоняют и получают 3 2 дициклоrексилиденэтана с т. кип. 85
870 при 0,1 мм рт. ст. После перекристаллизации из петролей-
Horo эфира (т. кип. 40 600) получают бесцветные криста.IJЛЫ
с т. ПЛ. 45 470.
Карбометоксиметилентрифенилфосфоран [27]. 1( раствору
42,9. 2 ка рбометоксиметилтрифенилфосфонийбромида в 1 л
воды приливают при перемешивании разбавленный раствор ед-
Koro натра до щелочной реакции по фенолфталеину. Затем фос-
форан отфильтровывают, сушат на пористой пласТинке и пере-
кристаллизовывают, приливая петролейный эфир (т. кип. 40
5(0) к rорячему раствору вещества в этил ацетате. Фосфоран
кристаллизуется в виде бесцветных листочков с т. пл. 162 1630.
Метилбиксин [27]. Раствор 1,08 2 4, 9-диметилдодекапен-
таен-2, 4, 6, 8, 10-диаля-l, 12 и 4,4 2 а-карб!:?метоксиэтилиден-
трифенилфосфорана в' 50 мл бензола кипятят с обратным хо-
лодильником в атмосфере азота в течение 6 час. При охлаж-
дении медленно кристаллизуется метилбиксин (1,2 2); из ма-
точноrо раствора после упарива ия экстраrируют метанолом
еще 0,8 2 метилбиксина. После перекристаллизации .'из бен-
зола получают чистый метилбиксин с т. пл. 2030, которая не
понижается в смешанной пробе с природным стойким метил-
биксином.
циc и mранс-Стильбены [40]. К раствору этилата натрия,
приrотовленному из 0,46 2 металлическоrо натрия и 50 мл
аБСОЛЮТ!J{)rо спирта, добавляют в атмосфере азота 9 2 бен-
зилтрифенилфосфонийхлорида. К образовавшемуся темно.
желтому раствору приливают 2,1 2 свеЖепереrнанноrо бенз-
альдеrида. Через 54 час раствор выливают в 50 ,мл разба,в-
ленной бромистоводородной кислоты и отфильтровывают
образовавшийся транс стильбен (1,3 2); выход 35%, т. пл.
120,5 12I,5<0.
Фильтрат упаривают в колбе с колонкой высотой 400 ,ММ.
экстраrируют эфиром, эфирную вытяжку промывают раство-
ром бисульфита натрия и упаривают. После обработки остат-
ка .петролейным эфиром отделяют 4,2 2 трифенилфосфин-
оксида; выход 75%, т. пл. 151,5 152,5°. Переrонка петролей-
Horo экстракта дает 1,4 2 цuс-стильбена; выход 40,5%, т. кин.
139 140,50 при 11 ,ММ рт. ст., nь о 1,6200. После дальнейшеro
упаривания водноrо слоя (раствора в бромистоводородной
кис,лqте) получают 1,7. 2 бензилтрифенилфосфонийбромида;
выход 20%, т. пл. 277 2790_ .
112
Реакция Виттиео
Литература
113
ЛИТЕРАТУРА
1. Barton О. Н. R., Campos-Neves А. da S., Cooksof1 R с.,
J. СЬет. Soc., 1956,3500.
2. В е r gm а n W., Dusz а J. Р., Апп., 603,36 (1957).
3. В о h 1 m а n n Р., Ber., ВВ, 1755 (1955).
4. В о Ыm а n n Р., Ber.,90, 1519 (1957)_
5. В о hl m а n n Р., 1 n h о f f е n Е., Ber., 89, 21 (1956).
б. В о hI m а n n Р., 1 n 11 о If е n Е., Ber., 89, 1276 (1956).
7. ВоЫпlапп Р., Inhoffen Е., Herbst Р., Ber., 90,1661 (1957).
8. В оЫ m а n n Р., М а n n h а r d t H.-J., Ber., 88, 1330 (1955).
9. В о hI m а n n Р., М а n пЬ а r d t H. J_, Ber., 89, 1307 (195б).
10. В о h1 m а n n Р., Р о li tt З., B c., 00, 130 (1957).
11. В о hI m а n n Р., V i еЬ е Н.-О., Вет. 88, 1245 (1955).
12. В о hl m а n n Р., V i е h е Н.-О., Ber., 88, 1347 (955).
13. С о ff m а n О. О., М а r v е 1 С. S., J. Ат. СЬеm. Soc., 51, 3496 (1929),
14. D i с k е r О. W., W h i t 1 n g М с., СЬem. and Ind., 1956, 351.
15. Н а r r i s о n 1. Т., L У t bg о е В., неопублнкованные даНные.
16. Har.rison 1. Т., Lythgoe В., Proc. СЬет. Soc., 1957, 261; J.
СЬет. Soc., 1958, 8 7, 843.
17. Harrison 1. Т., Luthgoe В., Tri}Jpett S., сьет. and ln .,
1955, 1;>07; J. СЬет. Soc., 1955, 4016.
18. Н о r n ет L., L i n g n а u Е., Апп., 591, 135 (1954).
IBa. Н u i 5 m а n Н. О., СЬет. Weekblad, 59, 133 (1963).
19. 1 d 1 er О. R., F а ge rh u n d и. Н. М., J. Ат. СЬет. Soc., 79, 1988
( 1957) .
20. 1 n h о Н.е n Н. Н., В r ii с k n е r к., Н е s s H.-J., Ber., 88, 1850 (1955).
21. 1 n h о f f е n Н. Н., В r ii с k n е r К., D о m а g k о. Р., Е r d-
m а n n Н.-М., Ber., 88, 1415 (1955).
22. 1 n h о f f е n Н. Н., 1 r m s.c h е r К, Ber., 89, 1833 (1956).
23. 1 n h о ff е h Н. Н., К а t h J., S t i с h е r 1i n g W.; В r ii с k n е r К.,
Angew. СЬет., 67, 276 (1955); Апп., 603, 25 (1957).
24. 1 n h о ff е n Н. Н., Qu i n k е r t о., S с h ii t z S., Ber., 90, 1283
(1957) .
25. 1 s 1 е r О., С h о р а r d - d i t - J е а n L. Н., М о n t а v о n М., Кб-
е g g К, Z е 11 е r Р., Неlу. СЫт. Acta, 40, 1256 (1957).
26. f s 1 е r О., G u t m а n n Н., L i n d 1 а r Н., М о n t а v о n М., R б-
е g g R., R у s е r о., Z е Не r Р., Не1у. Q1im. Acta, 39, 463 (1956)'.
27.1 5 1 е r.o:; Ои tma n n Н., М о n t а v о n М., а ii е g g R., R у-
. s.e 1, (1.. .Z е 11 е r Р., Helv. СЫт. A€ta, 40, 1242 (1957).
28. L<'e v I П S. о., J. Аm. СЬет. SoO:, 60, бl50 (1958).
29.. L ii 5 С h е r о., Dissertation Eidg. ТесЬп: Hochschule, Ziirich, 1922.
30. М е у е r J., Неlу. Chim. Acta, 40, 1052 (1957).
Зl. Mondon А., Апп., 603, 115. (1957).
32. Парфентьев Л. Н., Шамшурин А. А., ЖОХ, 11, 865 (1939).
33. R а m i r е z Р., L е v у S., J. Org СЬет., 21, 488 (1956).
34. S о n d h е i m е r Р., М ес h о u 1 а m R., J. Аm. СЬет. Soc., 79, 5029
(1957).
35. S t а u d i n g е r Н., М е у е r J., Неlу. Chim. Acta. 2, 635 (1919).
36. Т r i р р. е tt S., СЬеm. апй lnd., 1956, 80.
37. Т r i р t5 е t t 5., неопубликовзниые дацные.
38. W i t t i g о.,.. Angew. СЬеm., 68, 505 (1956); Experientia, 12, 41
(1954).
39. W it ti g о., G е i s s 1 е r о:, Апп., 580, 44 (1953).
40. W i tt i g о., Н а а g W., Ber., 88, 1654 (1955).
41. W i t t i g о., S с h б 11 k о р (Н, Ber., 87, 13113 (1954).
42. Н о r n е r L., Н о f f m а n n Н.. W i Р Р е 1 Н. .о., Ber., 91, 61 (1958).
43. S с h 011 k () Р f U., Angew. СЬеm., 71, 260 (1959).
ВЫВОДЫ
Реакция Виттиrа представляет собой очень хорошИЙ метод
синтеза олефиНов, если заместители 8 фосфvран.е и. IOOp60
нильпоltf, соединении не nреnятствуют реакции. ОдиаJro на ос-
новании приведениых выше дaHH X можно сделать ВЫВОД, "то
высокая реакционная способность большинства фосфоранов в
значительной степени оrраничивает возмо>кность использова-
ния реакции, в особенности в сЛучае заранее синтезированных
фосфоранов, полученных действием TaKoro эффективноrо
peareHT8 OCHoBHoro характера, как н-бутиллитий. Однако
вполне вероятно что получение фосфорана in situ с примене-
нием этилата натрия в качестве основания. найдет более ши-
рокое применение и позволит преодолеть это затруднение.
Таким путем мо>кно получать и использовать in situ реактивы
Виттиrа, содержащие MeH e реакционноспособные замести-
тели, чем карБОЩ'lЛьная rруПпа, но нормально реаrирующие
с н бутиллитием и фосфора нами, например фосфоранами, об-
разующимися из rалоreноэфиров. Реакцию Виттиrа мо>кно
использовать для получения циклических олефинов действием
этилата натрия на фосфонийrалоrенид , синтезированные из
rалоrенокетоно .
8 Зак. 14111
Пер.манzанат калия
115
МЕТОДЫ rИДРОКсИЛИРОВАНИЯ
Ф. д. r Анет ОН
осмия в качестве peareHTa или катализатора, или с серебря-
ной солью иодоуксусной кислоты по Вудворду. Все эти ме-
тоды представляют интерес, хотя первые два имеют некото-
рые недостатки; последний метод, впервые описанный в 1953 r.,
находит все более широкое примеJlение. Имеются сведення
о том, что в случае сложных этиленовых соединений эти ме-
тоды не вполне взаимозаменяемы (см. стр. 130 135).
Наиболее .важный метод транс-rидроксилирования, несо-
мненно, состоит в реакции этиленовоrо соединения с надкис-
лотами. С этой целью применяют также реакцию Прево и
окисление перекисью водорода в щелочной среде или в при-
сутствии некоторых окисных катализаторов.
К друrим методам rидроксилирования, которые не рассма-
триваются здесь, так как они имеют оrраниченное значение
или реакция не может быть осуществлена в одну стадию, от-
носятся: а) присоединение rалоrенов к олефинам с последую
щим rИДРОЛИЗQМ диrалоrенида; б). присоединение элементов
хлорноватистой кислоты с дальнейшим rидролйзом rалоrен-
rидрина; в) реакция с раствором тетраацетата свинца в rоря-
чей уксусной кислоте; r) реакция с ацетатом окисной ртути;
д) реакция с хромовой кислотой.
вВЕДЕНИЕ
Частичное окисление олефина в соответствующее диокси-
соединение (rликоль или а-диол) обычно наЗЬLвают rидро-
ксилированием. Эта реакция u нашла применение для"расщеп-
ления природных соединении, при синтезе орrанических co
единений и для' установления строения мноrих олефинов; ре-
акция иМеет и теоретическое значение.
)с==с< rидроксипирование» с (OH) C (ОН)(
Имеется MHoro peareHToB, которые MorYT подобным обра-
зом окислять олефины, однако здесь рассматриваются наибо-
лее важные из них. Наибольший интерес представляют те ре-
areHTbI, которые действуют стереоспецифично и приводят к
полному или преимущественно циc или транс-присоединению
двух оксиrрупп. В случае мноrостадийных реакций цис- или
транс присоединение, если не дедается особых oroBopoK, отно-
сится к реакции в целом, а не к отдельной стадии процесса.
Ниже показаны структурные отношения между олефином
цис- или транс-конфиrурации и образующимся rликолем, ко-
торый может быть обозначен как цис- или транс. эрuтро- или
трео-, мезо- или dl-формав зависимости от остальных имею-
щихся rрупп:
ПЕРМАнrАНАТ КАЛИЯ
цuс-ПрисоеДинение
I
цис-Олефии
I
rликоль
>- цис-, .мезо-
или аритро-
транс ПрисоедииеНllе
( I
транс-Олефин
цuс ПрисоединеНllе I
Окисление перманrанатом калия представляет собой один
из простейших и давно известных методов rидроксилирования
олефинов, который продолжают lПироко Прl:IМенять несмотря
на свойственные ему оrраничения. Этот peareHT может окис-
лить олефины в нескольких друrих направлениях, и, кроме
Toro, образующийся rликоль может подверrаться дальней-
шему окислению или изомеризации под влиянием кислотноrо
или щелочноrо катализатора. Поэтому во избежание резкоrо
понижения выходов rликол.я из-за побочных реакций необхо-
димо тщательно контролировать условия реакции. Наилучшие
результаты обычно' получают в щелочной среде при испол -
зовании воды или водных орrанических растворителей; в ней-
тральной или кислой среде вМесто диола полностью или час-
ТИЧНQ образуются друrие продукты окисления.
Известно, что окисление перманrанатом представляет со-
бой цuс-rидроксилирование, но механизм реакции не ясен во
всех деталях. Предложенная впериые Бёзекеном [12] схема
с промежуточным образованием циклическоrо комплекса, со-
дерЖ8.щеrо арrанец, представляет интерес, так как позднее
к.риrи [30] показал, что при цuс-rидроксилировании действием
rликоль
) т р анс- dl-
транс-Присоединение .
или трео-
1( основным методам цuс-rидроксилирования относятся
реакции олефинов с перманrанатом калия, с четырехокисью
а.
Метод", иЩкж pщuишя
Перм.анzанат калия
ш
116
чеТ!:!Iрехокиси осмия промежУТОIlНО обра уеrся аналоrичное
ЦИ1{Л "Iеское соеДинение (см. стр. 121). 3Т.а точка зреНJfЯ
б"'Л8 недавпо принята друrими исслеДОlтте.nям" [77, 114].
Предпо.лаrается, что сначала образуется цро )Куточное цик
JППJ€ское соединение 1, К9торое затем rИДРОJlИЗУется в циc
rликоль.
Таблица 1
rИДРОf(СИJЦ4РО8а,нн олеф.tю8 KMn0 4 в 80дио-щеЛОЧJlоА
среде
Опефин
Выход
r пИКОЛЯ:t "
Литература
I I
Н..:......С ОкиспСllие H C O" /0
11 I Мп
H C H C O/ O
I . I
I
fидропllЗ H C OH
. ) 1
H C OH
I
СН 2 ==СНСН (ОС 2 Н 5 )2
СНа (CH )7 СН"",СН (СН 2 )7 СООН
67
00
7()"""",75
81
177
78
163
36
НООС (СН 2 )7 сн==-сн (СН 2 )7 СООН
//,,, (
1 I I
/'\. N "\.CH CHCOOH
?
41
Виберr и 3еrебарт [170], применив меченыи 018 перманrа-
HaT показали, что оба атома кислорода в rликоле поступаЮ'f
от окислителя. Они высказали предположение о механизме
nесщции соеДЩ-Iения 1 в различных условиях: с обраэованием
кетола или продуктов расщепления (см. стр. 119).'.
Окисление в щелочной среде
ся при соблюдении следующих условий: а) окисление дол-
жно быть проведено при o 10°; б) концентрация олеиновой
К1:I ЛОТЫ-В виде натРIteв(>й .или калиевой соли не должна пр е-
в\iщать 9,1 %; в) КОllцеЦТРiЩИЯ раствора перманrаната калия
. дОлжна превышать 1 %; r) продолжительность реакции
о о;ло 5 м-ин; д) с caMoro начала должен быть небольшой из-
бwток щелочи во 'избеЖClние образования кетооксистеарино-
вой кислоты (см. следующий раздел). В настоящее время
эта методика не применяется для количественных целей, но
она широко при меняется Д,11я качественноrо обнаружения
олеиновой и друrих моноолефинЬвых кислот. Неудобство ме-
тода для получения диоксикислот' заключается в необходи-
мости работать с очень большими объемами (1 .л раствора
Ha.1 е ОJ.lеиновой кислоты). Трейнар [163] предложил моди-
фикацию указанноrоспособа, позволяющую получать диокси-
соединенйя с умеренными ВQlходами (70 75%) при рязбав-
лении лишь 40 -мл на 1 е олефина.
В результате окисления диенов с изолированными двой-
ными связями [56] образуlPТСЯ диrликоли, но в случае диенов
с сопряженными связями реакция протекает более сложно.
При получении тетра- и rексаоксисоединений следует изб,е-
raTb работы с большими объемами воды, так как эти соеди-
нения заметно растворяются в воде.
Йодные орrанические растаориt.е.ли. Описанная выше ме-
тодика приводит к менее удовлетворительным результатам в
случае мноrих не растворимых в воде олефинов, поэтому были
сделаны попытки окислеtШЯ этих олефинов в водных орrани-
ческих растворителях. В качестве растворителей обычно при-
меняют ацетон и ЭТИЛОВЫй спирт и реже метилциклоrексан
Водный раствор. Обычно к раствору олефина в разбавлен-
ном растворе соды или едкоro натра приливают небольшой
изб ток разбавленноrо раСТвора перманrацата при комнат-
Hoft и.ли более низко(f температуре. ПО окончании реакции
образовавшийся осадок двуокиси марrанца отфилыровьщают
или переводят в раствор действием сернистоrо анrидрида;
rликоль при этом часто выделяется из водноrо раствора или
ero извлекают подходящим' растворит лем. По-видимому,
лучше переводить нерастворимую двуокись марrанца в рас-
'творимую соль марrанца, в особещ:юсти в случае кислот, хо-
рошо адсорбируем.ых двуокисью марrаНЦа [98]. Этот метод
особенно приrоден для rидрокси.rшроваliИЯ ценасыщенных Kt\-
слот, так как они растворимы в водно-щелочной среде, и про-
дуJCТ окисления обычно tlыпадает при подкислении реакцион-
ной смеси. Типичные олефины, которые rидроксилировали
таким путем, и выходы образовClВШИХСЯ rликолей приведеilы
в табл. 1.
Лапуорэ и Моттрам [78] особенно тщательно изучили окис-
ление о.rrеиновоii кислоты в 9,lO-диоксистеариновую кислоту
и описали методику количественноrо определения олеиновой
кис оты по этой реакции. По данным этих авторов, почти ко-
личе.ственные выходы диоксистеа рино вой кислОты доетиrают-
Таблица 2
Олефииы, окисленные kM O. в ВОДНЫХ pa TBopax
указанных растворителей
Олефин Растворите.nь В"ХО.l. Лите--
r.IIИКОЛSl.
" ратура
СIСН 2 СН "",СНСН 2 СI C 2 H 5 OH/MgSO. 49 105
CICH 2 CHCICH ==СН 2 C 2 H 5 OH/MgSO. 56 105
(СН З )2 C-==СНСОСН з СНзСОСН! 60 60
СН з ООССН 2 СН"",СНСН 2 СООСН з С 2 Н 5 ОН/ MgSO. 28 80
С 6 Н 5 СН==СНСООСН з С 2 Н 5 ОН 62 138
п 02NC6H.CH2CH==CH2 СНзСОСН з 41 45
( : СНаСОСНз. 45 7
) C 2 H 5 OНfMgSO. 34 108
трет-С.НеОН 55 170
=> C 2 H 5 OH/MgSO. 33 26
тpeт C.HeOH 38 170
) C 2 H 5 OH/MgSO. 35 106
тpeт C.HeOH 38 170
CH 0/ CH. C 2 H 5 OНfMgSO. 8 65
СНз сна
O/ > C 2 H 5 OНlMgSO. 17 65
'\.
#
W C 2 H 5 OНlMgSO. 24 150
(fj трет-С.НеОН 45 110
. ПерlolaNzйнат калия
119
и трет-бутиловый спирт. В идеальном случае перманrанат,.
конечно, не должен реаrировать с растворителем, что и на-
блюдается для ацетона и трет бутиловоrо спирта. Окисление
этиловоrо спирта перманrанатом калия катализируется осно-
ванием, поэтому к реакционной смеси обычно добавляют суль
фат маrнич, так как осаждение нерастворимой rидроокиси
маrния оrраничивает щелочность реакционной среды. Олефи-
ны, приведенные в табл. 2, окисляли перманrанатом калия
в водных растворах указанных растворителей с образованием
соответствующих rликолей. Выходы в этих случаях несколько
ниже, чем при окислении в водных растворах.. Окисление
олефинов перманrанатом калия в ЭМУJlЬСИИ масло вода
описано в работе [180].
Окисление в нейтр ьной и кислой средах
Как известно, при окислении олеиновой кислоты перман
raHaToM калия в присутствии недостаточноrо количества
едкоrо кали помимо диола образуется смесь 9, 1 o и 10, 9-KeTO
оксистеариновых кислот. Суэрн и сотр. [27] показали, что при
наличии 1 экв едкоrо кали выходы диола и кетола зависят
от рН раствора; с высоким выходом кетол образуется в ней
тральной среде. По непонятным причина м эта же реакция
с элаидиновой кислотой (транс-изомером олеиновnй кислоты)
J1ИШЬ в незначительной степени зависит от рН среды
(см. табл. 3).
Таблица 3
/ Влияние рН среды на продукты,
обрааующиеся при окислении пермаиrанатом
.,
ОлеИНОВ811 кислота I ЭЛ8И,1l.иновая кислота
Величина
рн
к концу
опыта
BblXO)l., "
,1I.иол кетол )(Иол кето"
4 75 20 45
60 20 30 45
9 9,5
11,8
МетилЦиклоrексаи
40
47
н
При окислении в водном этиловом спирте в присутствии
сульфата маrния rликоль получают с невысокими выходами
u '
однако нет никаких указании на то, что при этом образуются
кетолы или друruе продукты окисления. С друroй стороны,
сообщается [170], что окисление бицикло [2, 2, 1]-rептена-2 (11)
... Эта двойнаll связь ОКИCJIllеТСII.
120
Методы 2uдрОl<.силирова.чия
Четырехокись осмия
121
перманrанатом калия в водном трет ()утиловом спирте зави-
с"т от рН среды, причем в нейтральной .среде происходит раз-
рыв ДIЮЙНОЙ связи.
IJЕТЫРЕХОКИСЬ ОСМИЯ
. 010 RMnO.,80.1l.H. mpem C.H90H .
СН СН
2 но (неАтралЬ.Н8Я среда)
ВЫХОД 11
54-66%
КМПО.,80.1l.н.трет-С.НgО Н :фон
(щелочная среда ) H
Выход 45%
Реакция с аJlифатическими и аЩЩИКJlическими ОJlефинами
Хотя четырехокись осмия применялась и раньше в каче-
стве катализатора при rидроксилировании, К:риrи [30] ВПер
вые показал; что это соединение представляет собой чрезвы-
чайно эффективный rидроксилирующий areHT. При действии
эквивалентноrо количества четырехокиси осмия в абсолютном
эфире или реже в -бензоле [31], циклоrексане [31] или диок
сане [8, 30] на олефины при комнатной темп ратуре из
раствора медленно (примерно в те'Iение 4 суток) почти коли-
чественно вь падают продукты присоединения. Этот СЛОЖно
эфирный комплекс (III) разлаrается с образованием осмие-
вой кислоты или друrоrо осмиевоrо производноrо и диола,
соответствующеrо исходному олефину.
Окисление некоторых стероидов перманrанатом калия в
уксуснокислой' среде в условиях, не способствующих разрыву
двойной связи, дает оксикетоны, причем иноrда помимо окси-
. кетонов образуются эпоксисоединения [40, 85].
MaHraHaT КaJIИЯ
Манrанаткалия К 2 МПО4 в щелочной среде при KOMHaT
ной температуре превращает олефины в соответствующие
цuс-диолы [114, 139]. Олефины, приведенные в табл. 4, были
Таблuца 4
Окисление ОJlефииов K 2 MnO.
в щелnчноlt среде
I I
H C 050. H C O,
'11 I 0802
H C H C O/
I I
2Н.О'
H.050.
I
H C OH
I
H C OH
I
111
RCH==CHCOOH
R==C 6 H 5
R==СН з
СН з (СН 2 )7 сн===сн (СН 2 )1 СООН
OOH
OOH
40
25
32
Такое направление реакции соответствует цuс-присоеди-
нению rидроксильных rрупп; этот метод цuс-rидроксилирова-
ния представляет значительный интерес. Присоединение че-
тырехокиси осмия ускоряется в присутствии третичнь осно-
ваний, в бсобенности пирид а [31]. При этом выделяются
почти с количественным выходом интенсивно окрашенные
комплексы JV, в которых атом осмия координационно связан
с двумя молекулами основания. При разложении подобных
комплексов образуются диолы. Для разложения осмиевых
Олефии
I ВЫХО.1l.
мико",я, "
50
C5H,
H C O: о
I ",'"
}?S ...
H C O: о
I .
NCs.H/r'
JV
подверrнуты rUДj:",ксилированию таким путем; из циклоrек-
сена и ундециленовой кислоты диолы не были получены, хотя
в ьбоих случаях окислитель оказался израсходованныМ. На-
сколько можно судить по имеющимся данным, применение
MaHraHaTa калия не имеет никаких преимуществ по сравне-
ННЮ'С более обычным окислением олефинов перманrаН8ТОМ
калия.
соединений 111 и IV применялись раЗJ.lичные peareHTbl, в том
числе: а) кислые растворы x.rlOpaTa натрия и калия [30, 132];
б) сульфит натрия в водном спирте [23, 30, 145. 171, 172];
Таблица 5
типичные цис-rJJНКОJlИ, полученные действием 050. на ОJlефины
ВЫХОд, "
Литера-
цис-tЛИКОJlЬ & I l Iцис-rJlикоJlы тура
диол
но Ал ОН 98 84 30
W
ь
IOH 99 66 30
lJ OH
()()=он. 89 78 30
. ОН
он
А 81 30
lv 96
он
HO ( "> 100 31
98
HO-----,,
ОН ОН
I 31
o o 95 64
СН 2 ОН
I
СНОН
AI )'[ ОН 60 145
('I/\/
O#VV
I
продолжение табл. S
ВЫХОД, %
Литера-
цис-rликоль I циc-r JlИКОЛЬ 1 JUlОЛ тура
_фир III
или IV
СН 2 ОН
I
СНОН
AI OH ? -146
AI/ /
HoN
С 8 Н)7
HO"/"I 60 171
но,,]
. ("I/I/
HoA/V
С 5 Н 7 О 2
I
/"/А 100 172
АIЛ
I I
HO/VV
I
ОН
ОН .
("I OH 80 117
(Yy
HO/ )V
CHOH
(СН')8 I 87 127
L...... CHOH
124
Методы 2uдРОICсuлuроваIШЯ
в) щелочные растворы маннита [31, 117, 127] и формальде
rида (136); r) сероводород [8]. Сульфит натрия и маннит наи-
более употребительt:lt1.
Несмотря на простоту реакции и высокие выходы.rлико-
лей, методу присущи Ht!KoTopbIe недостатки, обусловленные
свойствами четырехокиси осмия. .этот peareHT очень дороr,
ввиду BbIcoKoro эквивалента требуется MHoro окислителя, он
довольно летуч, ero пары очень ядовиты и сильно деиствуют
на rлаза. В связи с этим четырехокись осмия неприrодна для
работы в большом масштабе, и ее применение оrраничи
вается в основном исследованиями труднодоступных веществ.
Реакция протекает очень rладко, поэтому она оказалась
весьма ценной при изучении веществ, доступных лишь в Ma
лых количествах, например в с.nучае стероидныХ ropMoHoB [147].
Характерliстика продукто реакции, образующихся при
окислении холестенона четырехркисью осмия, приводится в
работе [181]. '
цис rликоли, приведенные в табл. 5, MorYT служить типич-
ными примерами веществ, полученных рассмотренным спосо-
бом из соответствующих олефинов. В таблице указываются
выходы эфиров осмиевой кислоты 11 1 и IV и полученных из
них цис-rликолей или дается общий В1'>IХОД при превращении
олефина в диол. Друrие примеры можно найти в работах
[8, 23, 132, 136].
ТаБЛllца (j
rJlИКОJlН, ПОJlученные действием 0504 на ароматнческие
yr Jlf' ОДОрОДЫ
ИСХ"Jl.llье Вl!щество
fликоль
Хризен
ЛиреR
Реакция с аромати ескими соединениями
l,2 Бензантраценl)
Кук и Шентол [28] и Баджер [4, 5], основываясь на обна-
руженной Криrи [31] способности четырехокиси осмия rидро-
ксилировать фенантрен в положении 9,10, изучили действие
этоrо peareHTa на друrие полициклиЧеские ароматические
уrлеводороды, содержащие скелеТ фенантрена, и на антрацен.
Реакция протекает медленнее, чем с этиленовыми соединения-
ми, причем атакуются .наиболее реакционноспособные связи
ароматическоrо характера. Эта реакция резко отличается от
атаки ионными реаrентами, направленной на наиболее pe K-
ционноспособные ценtры молекулы, и имеет теоретическое
значение для изучения характера двойной связи в пол'ицикли-
ческих соединениях [4, 5]. Результаты окисления а ромаТИ\lе-
ских уrлеводородов четырехокисью осмия представляют осо-
бый интерес, так как. образующиеся продукты напоминают
продукты окислительноrо метаболизма указанных уrлеводо-
родов [28]. rликоли, приведенныIe в табл. 6, получены из ука-
занных уrлеводородов [4, 5, 28, 76].
l,2,5,6-Дибензантрацен
О.Ь\еrипХ Jlантрен
АЛ
I [] 1.
(У'\/'''?''
V", OH .
I
ОН
A/
I I11
А/"'?"
11 I I ОН
VV
I
ОН
АЛ))
V 1 I I ОН
r
I
ОН
ОН
HO (YY
(Y'V')r OH
V ОН
СНа
()Н
126
Методы zидРОICcuлирования
Продолжение табл. 6
Исходное вещество
r.llИКОJlЬ
8,4 Бензпирен
rNI
I I
{/
WY OH
ОН
ОН
AA/ OH
I 11 I I
,л/')/ОН
ОН
Антрацен 2)
') 1,-МеТН.II-, 9-меТИJl-, 9, 100димеТИJl-, 5, 9, lо.триметил-- и 5, б, 9, 100тетрамеТИ.ll-l, 2-бенз-
антрацены реаrируют анаJlоrичиым образом.
2) Образование тетрола из антрацена объясняется следующим образом. В результате
nрисоедииения .цвух оксиrрупп в положенин 1,2 образуется соединение с истииной двой-
иой связью"'(в ПOJlожении З, 4), которое затем леrко pearHpyeT с окислителем.
Окис.ление четырехокисью осмия и солями х.лорноватоА
кислоты
Четырехокись осмия применялась также в качестве ката-
лизатора rидроксилирования. rофман [67] впервые сообщил,
что водные растворы хлората натрия и хлората калия при
добавлении небольшоrо количества четыр хокиси осмия ста-
новятся сильными окислителями, способными rидроксилиро
вать атомы уrлерода, связанные между собой двойной связью.
Браун [16] установил, что выходы диолов возрастают при ис-
пользовании хлората бария и хлората серебра, которые в
дальнейшем нашли широкое пjшменение. Реакция протекает
в водной среде при температурах в пределах 0 500; иноrда
для завершения реакции требуется несколько суток или даже
недель.. Наиболее удовлетворитеЛЬНЬJе результаты получены
в случае соединениЙ, обладающих ХОТЯ бы слабой раствори- .
мостью в воде. Несмотря на эти оrраничения, метод оказался
вполне удовлетворительным. Он особенно приrоден для окис-
ления алифатических этиленовых соединений с короткой
цепью, например для соединений, приведенных в табл. 7, в
которой указаны выходы rликолей и применявшиеся хлор.аты.
Четырехокись осмия
127
Таблица 7
Олефнны, окислеииые J<JlораТАМИ в присутствии 0804 В качестве
каталнзатора
Хлорат калИЯ Хлорат бария Хлорат серебра
Олефии выход I литера-
выход I литера- выход I литер",-
rли оля, тура r ликоля, тура ..rЛИ ОЛII, тура
%
RCH2CH CHCOOH
R H 17 54 48 16 83 [6
66 70 52
R OH 1) 64 16 45 53
75 16
R CI 78 17
75 53
R==.Br 70 [9
R СНз 80 18
C2H5 86 18
НООССН.,."СНСООН 97 97
(цис- и транс-формы) (972) 97
O==C CH===CH C==O 100 16 70 16
O
А
V (462) 26
/
1) В виде лактона.
2) Олефин окисляли хлораТQМ натрия.
Поми о этих опытов И ранних исследований rофмзна [67, 68),
данныи метод применялся д;Ля окисления 1, 2 Диоксициклоrек-
сена-З [116], а также для получения rексита и пентита из не-
насыщенных MHoroaToMHbIX спиртов [79].
Полученные продукты реакции образуются несомненно в
результате цuс-rидроксилирования. В связи с этим было вы-
скаЗано предположение, что реакция протекает через присо-
единение четырехокиси осмия к олефину и распад образовав-
шеrося эфира осмиевой кис:лоты с последующей реrенерацией
четырехокиси при действии хлората [12, 30]. Соrласно друrой
точке зрения, происходит образование хлорноватистой кисло-
ты, которая и явЛ$Iется источником rндроксильных радика-
лов fI67].
128
Методы zидро"силиРО8(l1ШЛ
fаЛО2eflЫ и серебряные соАи карБОНО8ЫХ 'кислот
129
" ..Ку:к и Шентол [29] изучили действие реактива Миласа на
полициклические ароматические соединения, растворенные в
ацетоне. Из фенантрена и 1, 2 бензантрацена наряду с хино-
нами и кислотами, образовавшимися в результате расщепле-
ния кольца, были получены цuс диолы; из друrих соединений
получены только ХИНQНЫ и к:ислоты. Эти результаты отли-
iIаются от результатов, полученных при использовании четы-
рехокиси осмия, эфира и пиридина (см. выше раздел «PeaK
ция с ароматическими соединениями»). Это представляет
пекоторый интерес в связи с предположением о том, что окис-
ление реактивом Миласа, как и окисление по меТQДУ Криrи,
протекает через стадию омыления промежуточцо образую-
щихся циклических эфиров осмиевой кислоты [29, 100].
Способ rидроксилирования некоторых а, -ненасыщенных
кетонов действием перекиси водорода и четырехокиси осмия
в друrих растворителях (в эфире, бензоле) был использован
для rидроксилирования ряда стероидов; из которых типич
ными являются следующие соединения:
С 8 Н 17
AI
[' \/
O#VV
Окисление смесью четырехокиси осмия, перекиси водорода
. И mрепН_УТИJJQ.воrо сп р...а (ре кl.'И" МИJlцса)
Милас и Сасме.н [94] приrотовили безводные' растворы
перекиси водорода в трет-бутиловом спирте (!"\аrден и. qHr
[1О0} сомневаются в необходимости этоrо) и нашли, .I!.T0 та:
кие растворы сохраняются длитеЛЬЩ:lе время при комнатнои
температуре и не взаимодействуют с олефинами. Одtlако в
присутствии подходящеrо катализатора, например четырех
окиси осмия, peareHT способен rидроксилировать различные
этиленовые соединения с образованием цuс-диолов. Реакция
протекает при температуре, близкой к 00, в течение несколь-
ких часов или суток. Таким путем были окислены соедине
ния перечисленные в табл. 8 [94 96, 140], И, кроме Toro, изу-
чен превращение циклопентадиена в диокси!.{Икл пе тен [93,
108]. Из некоторых стероидов с межуrлероднои двои нои связью
в результате взаимодействия с реактивом иласа получена
смесь диола с кетолом [69, 86].
Таблица 8
Соединения, окислениые реактивом Миласа
Исходное вещество
Уrлеводороды
CH2 CH2
СН з СН==СН 2
(СН З )2 C CH2
(СН 8 )2 С СНСНз
С2НБСН СНСН8
С 2 Н Б СН==СНС II Н в
С 2 И s С (СНЗ)==ОСН II
Циклопентадиен 1 )
етиленциклобутан
Циклоrексен
Диаллил 1)
Стирол
(+)-Лимонен 1)
Цетен
rАлоrEiiы и СЕРЕБРЯНЫЕ СОЛИ КАРБОНОВЫХ КИСЛОТ
Продукты взаимодействия rалоrенов и серебряных солей
карбоновых кислот реаrируют солефинами; эта реакция ле-
жит в основе цuс-rидроксилирования по Вудворду и транс-
rидроксилирования по Прево соответственно.
При реакции эквимолярных количеств. иода и серебряной
соли карбоновой кислоты образуется ацилrипоиодит V, при
молярном отношенltи 1 : 2 реакция протекает дальше, и обра-
зуется комплекс. Симонини. Строение этоrо комплексноrо со-
едине,ния точно не установлено, но, по-видимому, лучще Bcero
оно соответствует формуле VI ([71, 74]; ер., однакЬ, [9]):
COOAg RCOOAg
" 2 ( AgI) RCOOl 7 RCOOAg. RCOOl
V VI
Прево [128] показал, что при реакции комплексно о ое.ziи-
нения. полученноrо из серебряной соли бензойной кислоты,
,
'"
'"
....
'"
о .
"'..
,;.
:::
M
><"
:150
","
Исходиое вещество
88 97
68
38
38
2
36
4 1
61
&9
58
45
50
35
77 2
Кислоты и их зфиры
НООССН==СНС ЮН (цис) 33
НООССН==СНСООН (транс) 48
С 2 Н Б ООССН==СНСООС 2 Н Б (цис) 41
С 2 Н Б ООССН==СНСООС 2 Н Б (rnpaHc) 58
СНзСН==СНСООН 54
СН з СН==СНСООС 2 Н о 56
СвНБСН==оСНСООН 56
О.neИl«)Вая кислОта 60
Спирты и друrие соединення
CH2==CHCH OH 60
CBH5CH C.HCH2:0H :12
(CI:I8)2 С==СI:IСОСН з 23
СН з СООСН==СН 2 2) 60
СН 2 ==СНОСН==СН 2 2) 00
Выход 60% [24]
1) Эти соедИнени!! превращаются при ОКИСJlеltин в тетроды.
2) ПРИ,окислеиин этнх соединеиий образ)'еТC1I СН.ОНСНО.
9 3ак. 1416
С 8 Н 17
I
AI/".
. /".j /
0#\;"./
11
о
Выход количественный [24]
[30
Методы eudроксиЛUРдван.uя
rаЛО2ены и серебряные соли карбоновых кислот
131
с олефинами образуются дибензоаты соотве твующих rли-
колей. Он предположил, что реакция .протекает IY'две стадии
с промежуточным образованием ацилироваННQFО иодrидрина
VII. В настоящее время установлено, ЧТ.Qs:y:ммарная реакция
представляет собой транс-присоединение. Вудворд (179), опи'
раясь на ранние исследования Уинстейна и Баклса [174], пока.
зал, как превращение ацилированноrо иодrидрина VII в аци-
лированный rликоль VIII может протекать с обращением.
конфиrурации. В этом случае суммарная реакция предста-
вляет собой цuс-присоединение и может быть выражена сле-
дующей схемой:
.......... С.Н(ОСОR)СН(ОСОR)--
УIII
r...:tролиз
"
мещение с обращением конфиrурации, что в конечном итоrе.
приводит к цuс-присоединению.
rидроксилирование rалоrенами и серебряными солями
карбоновых кислот по Вудворду осуществляется в три стадии
[72]. При взаимодействии иода с уксуснокислым серебром об-
разуется продукт, который превращает олефин в результате
транс-присоединения в иодацетат. Для этоrо реаrенты встря-
хивают в безводной уксусной кислоте при комнатной темпера-
туре. Иноrда иод вводят в реакцию постепенно, однако необ-
ходимость в этом вызывает сомнения. Вторая стадия Заме-
щение rалоrена оксиrруппой, которая в дальнейшем может.
подверrнуться ацетилированию, проводится с уксуснокислым
серебром в уксусной кислоте, содержащей достаточное коли-
чество воды, при наrревании смеси в течение 3 час при 1000
или 1 час при температуре кипения. Наконец, смесь моно- и
диацетатов выделяют и rидролизуют.
COOAg: coo! Вудворд ().
CH""'CH )о.. CHICH(OCOR} ".
транс-Пр"соеДИllеllие Прево
. УН
CH(OH)CH(OH)
(Обычно R::C6H5 в реЗКЦlIИ Преnо и
R:; СНз в резкиии ВУАI10рда)
CH CH
транс-
"
Присоеди-
ненне
CHI СН(ОСО СНз)
+
СН(ОСОСНз)СНI
()
цис-rИДрОКСИЛИрОВ8ние по Вудворду
Уинстейн и Баклс [174] установили, что при превращении
а,-ацетоксиrалоrенидов в ацилированные rликоли действием
уксуснокислоrо серебра в уксусной кислоте в безводной среде
конфиrурация сохраняется, при наличии же по крайней мере
эквимолярноrо колич"есtва воды наблюдается полное обраще
ние конфиrурации. Например,
{ СН(ОН)СН(ОСОСНЗ) . }
+
........... CH(OCOCH,)CH(OH)
сн(осоjнз)сн(ососн,)--::
............. CH(OH)CH(OH)
тре-о-
ICНзСн{iОiСOlСНв),СН ВrСН з
CH,C:OOAg. безводн. ! ! снзсооЛg,
СНэCQOн еодя. СНзСООН
" ()
mpeo 8рumро-
СНзСН(Qсоснз)сн(ососнJСН" ICН.эСН(.ОООСНЭ>СН(ОН)СН а
Таким образом, реакция Вудворда, так же как и окисле-
ние перманrанатом калия или четырехокисью осмия, ведет
I< цuс-rидроксилированию, 'однако она свободна от недостат-
ков, характерных для друrих методов. rидроксилирование по
Вудворду пока нашло лишь оrраниченное применение, но
перспективность метода не вызывает сомнений. Интерес к ре-
акции еще больше возрос в связи с тем, что, по имеющимся
даННl'>lМ, в некоторых случаях она при водит преимущественно
к цuc-изомеру, противоположному тому, который получается
при использовании четырехокиси осмия. Так, в результате
rи роксилирования по Вудворду образуются -цuс-rликоли
XI, ХН, XIII, а при использовании ч тыреХОI<ИСИ осмия
a,-цuс-rЛИКОJIИ. Вудворд и Братчер [179] объясняют образова-
ние -стереоизом.ера тем, что при атак!; 1+ со. CTOpOHЫ rд
Э.
Эти результаты были объяснены авторами на. основании пред-
ста.влений о взаимодействии аДетильной rруппы с соседней
rруппой. Вудворд и сотр. [178, 179] показали, что эти данные
можно использовать для такой модификации реакции Прево,
при которой .за начальным tpahc-присоеДИ8ением следует за-
Таблица 9
АJlИЦИКJlические rЛИКОJlи,ПОJlученные по методу Вудворда.
I BblXOJIi l Лите-
./. ратура
rалоеен.ьiu серебряные соли карБОНО8ЫХ КUСЛОТ
133
. f.пИКОlll>
п родо.л.жеlluе ma6.л.. 9
'.JlИКОIIЬ
I выход, / 'nите-
0/. ра'l'ура
СН з
CrH 73 70 .
OH
/"
СН з СНа
СвН а (ОСН з k2,3
()LOH 56 51
"j OH
Q OH' 60 3
,;-:--0 н
ОН
ОН 67 6
О
I /
6"
o
С 1Л /
. I '? 35
Ho...../"I/ / .
I l'
HO VV
ХН
H0l'rY
HO V
ХШ .
...".
'? '62
0 H2
I I
# ) /0
#V /
СНзО /1IVN")
I ."
СИЗО СНа
XIV
о 143
меньше сказываются 'пространсtвенные l,нения. с после-:-
ДУЮ1дей реакцией с бсосн з обр;:}зуется ацетилированный
иодrидрин /(Х):
'1j1)
oJJ.
IХ
н
I::!;. JSЧ >,+
1I
.
ОСО НЗ ..
.........
х XI'
Выход 71,% [179]
Выход 74'% [15]
МеJОД Вудворда был успешно использован для пплучеНIJЯ
,па !I !fЧ rт, ()пей, pepe!l C/leIJH X О, TaQn. 9" . 1'4'
[34
А1етоды 2uдроксuлuрования
fаЛО2ены и серебряные соли карбоновых кuслоt
135
указаны их выходы. В случае анrидрометилтетраrидробербе-
рина-А (XIV) [143] реакцию не удалось осуществить, вероят-
но, из-за внутр'имолекулярноrо пространственноrо влияния
соседних rрупп. . . .
[анстон и Моррис [57] показали, что метод ВУ,!I.ворда чрез-
вычайао эффективен для rидроксилирования олефянов с длин-
ной цепью. Некоторые результаты этих опытов приведены в
табл. 10. Получение зритро-9,10-диоксистеариновой кислоты
непосредственно из оливковоrо масла по этому методу пред-
ставляет собой, по-видимому, самый лучший путь для полу-
чения указанноrо rликоля.
кислоте образуется преимущественно трео-изомер с выхо-
дом 25%.
Моррис [991 опис цис-rидроксилирование при действии
иода и аЗОТН9КИCJ!Ofо серебра на метиловые эфиры олеино-
вой (выход r/Iиколя 68%) и элаидиновой кислот в бе:щоднЬМ
или влажно.trll: ацетонитриле.
В раб01е [181] дается характеристика продуктов окисления
холестенона четырехокисью осмия. Братчер и Ивенс [182] опи-
сали новый синтез цuс-циклоrександиола-l. 2.
Олефин
Выход rликоля, %
неочн- I в ЧИСТОМ
щенноrо виде
99 89
97 91
89 85
100 81
94 79
87 832)
94 972)
95 30 + 79)
49 42
93 62
95 12+ 144)
95 56
Реакция П рево
Реакция Прево применяется не столь широко, как этоrо
можно было ожидать, тем не менее. она представляет собой
эффективный метод транс-rидроксилирования олефинов и во
мноrих случаях приводит к вполне удовлетворительным ре-
зультатам [173].
Таблица 10
Олефины с длинной цепью, окнсленные по методу Вудворда
Индивидуальные соединения
Метиловый эфир олеиновой кислоты . .
МеТИ-!lОВЫЙ эфир элаидиновой кислоты
Эландиновая кислота
Олеиновый спирт
Элаидиновый спирт .
Технические продукты
Оливковое масло
Оливковое масло 1) . . . . . . . . . . .
Касторовое масло ...........
Метиловый эфир ундецилеиовой кислоты
Метиловый эфир rексадеценовой кислоты
Метиловый эфир линолевой кислоты ..
Олеиновая кислота. ." . . . . . . . .
Таблица 11
Продукты rндроксилирования олефинов по методу "рево
rлнколь нли дибензоат
BblxOll.J Лнтера-
% тура
691) 175
752) 175
33 104
73 104
70 104
85 64
44 83
СН з (СН 2 )7 СН (ОН) СН (ОН) (CI' 2 ), CI)OH
') Окислению обычио подверrали 0.01 мОЛя олефина; н данном случае нспользо-
вали 0,1 моля.
") Прннималось, что содержаине олеиновоi! кислоты в оливковом масле cocJa.
вляет 75%. .
') Данные относятся соответствеино К иизкоплавкому и высокоплавкому изоме-
рам; принималось, что в касторовом масле содержится 90% рнцииолевоi! КИСЛОТЫ.
') Данные отиосятся соответстве!/!/о к !/ИЗКОПJ1ввкОi! и высокоплаВКОi! тетраоксн-
стеарииовым кислотам. .
CH (СН 2 )n С.Н (ОН) СН 2 ОН
п,==, 13. .
п == 15
п == 17
С 6 Н Б СН 2 С Н (ОСО СБН s ) СН 2 (ОСОСБН s )
С 6 Н s СОО < > ОСОС 6 Н б
ОСН з
I
/
I .
("(СН а )7 СН (ОН) СН (ОН) (СН 2 )б СН з
1
703)
81
Окnслением эруковой кислоты иодом И уксуснокислым се-
ребром в водной уксусной кислоте Раман [133] получил зри-
"ро-рщколь с B QA9M7Q%, ТQП a Q ЩJ()Аf!91i YKCr g:f
) эрuтро-rликрль из tdет.иловоrо эфира элаидиновоi! кислоты.
з) tpeo-rJlИКОЛЬ из м.етИJlовоrо ,!фира олениовоi! кислоты.
) rндрокснлирование сопровождается иодироваиием активнрованноrо бензольиоrо
ядра.
Методы 2uдро"силuроеОIlUЛ
Надкислоты ароматuчеСКО20 и алuфаТriческо о рядов
137
J.36
. При '.обработке моноолефинов (l моль) серебряной солью
бензойной кислоты (2 моля) и иодом (1 моль) в сухом бен.
золе. образуются дибензоаты соответствующих rликолей.
В зависимости от реакционной способности олефина реакция
проводится при комнатной температуре или при длитепьном
кипячении с обратным холодильником (до 50 час) [128]. Хотя
нет необходимости в выделении серебряноrо комплекса VI,
rершберr [64] все же предложил удобный МеТОД извлечения
этоrо комплекса из rильзы в приборе Сокслета в кипящий
бензольный раствор олефина. Указанные выше реаrеИТЫ наи-
более употребительны, но и"од можно заменить хлором или
бромом, вместо серебряной соли бензойной кислоты можно
использовать соли уксусной, пропионовой, н-масляной, .м-iiи-
тробенЗойной и 3,5.динитробензойной кислот, а: вместо бен-
зола четыреххлористый уrлерод, хлороформ или эфир. Од-
нако самые лучшие выходы достиrаются при использовании
серебряной соли бензойной кислоты, причем дибензоаты rли-
колей хорошо кристаллизуются и леrко омыляются.
Таким путем осуществлял ось rидроксилирование мноrих
соединений с межуrлеродной двойной связью. Типичные про-
дукты реакции, полученные из соответствующих олефинов с
хорошими выходами, указаны в табл. 11.
При действии избытка окислителя на диолефины образу-
ются тетрабензоаТ i при избытке диолефина образуется не.
насыщенный дибензоат, как это наблюдалось в опытах Мак.
Кесленда и Хорсвилла с циклоrексадиеном-l, 4 ([83]; ср. [3]).
А..... () / [ .
СБН5СОО 1 I ОСОСвН/1 Изб",ток 11 1 Избыток ' 1 1 ОСОСвНб
СБН5СОО rОСОС6Н5 +-pearema v' "Аиолефнна \./ ОСОСБН5
Выход 11% Выход 37%
Этим авторам не удалось ВЫДелuть какие-либо индивиду-
альные вещества после окисления изомера с сопряженными
двойными связями циклоrексадиена-l, 3. . .однако Прево и
Лутц [130] описали получение тетрабецзоата эритрита и со-
ответствующеrо .ненасыщенноrо 1,2-дибеизоата rликоля с
очень незначительной примесью дибензоата бутен-2-диола-J,4
IIЗ бутадиена. ."
С Избыток
СН 2 ==СНСН:=, Н 2 peaTeHTa
С 6 Н 5 СООСН 2 СН (ОСОС 6 Нб) СН (ОСОСвН s ) СН 2 ОСОС 6 Н 5
Выход 60%
Избы'i'ОК. . . .
СН 2 ==СНСН-==СН, Qлефljна -+ CH2=CHC!i (ОСОСвНs) сн,ОСОСвН в
. Выход 80%. . . '.
Как уже отмечалось, реакция Прево протекает в две ста-
дии и в модифицированном виде представляет собой удоб
ный метод получения промежуточных ацилированных rало-
rенrидринов VII. ДЛЯ этоrо требуется молярное отношение
серебряной соли к rалоrену, равное 1: 1; в качестве раство:"
рителей применяют четыреххлористый уrлерод и хлороформ.
так как при этом замедляется вторая стадия реакции Прево
[1, 11,39,59, 165, 166].
НАДКИСЛОТЫ АРОМАТИЧЕскоrо И-АЛИФАТИЧЕскоrо
РЯДОВ
После первоrо сообщения Прилежаева [131] об окислении
олефинов надбензойной кислотой с ero именем связывают
образование эпоксисоединений и rидроксилирование олефи-
нов при действии любых надкислот. Окислению надкислота-
ми очень эффективному методу во мноrих областях opra-
нической химии посвящены обзоры Суэрна, опубликован
ные в 1949 r. [153] и в 1953 r. [154].
По-видимому, со всеми надкислотами сначала образуется
эпоксисоединение XV, которое при определенных условиях
можно выделить. В кислой среде реакционноспособное эпо-
ксисоединение более или менее леrко переходит в моноаци-
лирова"ное производное XVI rликоля XVII. Цикл в эпокси-
соединении XV может раскрыться самопроизвольно в -реак-
ционной смеси или процесс можно осуществить с предвари-
тельно выделенным эпоксисоединением. Образование эпокси-
соединениSJ и rидроксилирование при действии надкислот
нйстолькО тесно связаны между собой, чtоне;льзя рассматри
ватьОДНУ из этих реакций отдельно от друrой.
CH==CH"""
"..с-
. ..
ПрнсоеАине--
. ине
"7CH CH
,/
О
KV
RCOOH
r) "
СН(ОСОЮСН(ОЮ:'"
XVI
.с н)он( qн) -
VtJ
Из надкислот наиболее широко применяются надбензой-
ная, надфталевая, наДУКСfсная и надмуравьиная кислоты.
При действии первых двух кислот леrко образуются эпокси.
соединения. Хотя в случае применения надкислот жирноrо
ряда реакция обычно идет дальше, разработаны вполне
удо лет ориrел цые способ получеция по сисоедииевиl.
138
Методы 2uдрОICСUЛUрО8анuя
llадкuслоты аромаt.uчеСКО20 u алафатuчеСКО20 рядов
1М
Скорости окнсления надкнслотами
химия реакции, очевидно, достаточно выяснена [152]. Окись.
образуется в результате цuс-присоединения, но, так как рас-
крытие цикла в эпоксисоединениях по обычным методам со-
провождается вальденовским обращением, суммарная реак-
ция получения rликоля из олефина соответствует транс-при-
соединению. Это было подтверждено мноrими примерами.
Бхаруча и [анстон ([10]; ср. [174]) описали метод превраще
ния эпоксисоединения в rликоль с двумя инверсиями, т. е.
в конечном счете с .сохранением конфиrурации.
На основании изучения реакции циклических олефинов с
надбензойной кислотой Хенбест и сотр. [61, 63] пришли к вы-
воду, что окислитель обычно приближается с наименее про-
странственно затрудненной стороны молекулы, за исключе
ни ем Toro случая, коrда молекула содержит аллильную окси
rруппу. Таким образом, из ацетата XVIII образуется rлавным
образом соединение XIX с транс-расположением ацетокси- и
эпоксиrрупп, Torдa как из циклоrексен-2 ола-l (ХХ) получен
эпоксиспирт ХХI с окси- и эпоксиrруппами в цuс положении
друr к ЩJуrу; циклоrексеН-3-0л-l дает смесь двух эпоксисоеди-
нений ХХII и XXIII. Измерения скоростей реакций по-
казали, что в отличие от ацильных (OCOR) и алкильных
(OR) производных алл ильный rидроксил способствует реак-
ции. Предполаrается, что водородная связь обусловливает
ассоциацию peareHToB, блаrоприятствующую взаимодействию
между электрофильным атомом кислорода в надкислоте !1
олефином. .
так как надкислоты .жирноrо ряда более доступны и обла-
дают некоторыми преимущества ми при использовании их; в
промышленном масштабе [37, 38, 49, 50]. Недавно введенная
в употребление для rидроксилирования надтрифторуксусная
кислота, видимо, станет еще одним эффективным peareHToM
для этой реакции. Имеются отдельные сообщения о приме-
нении надиодной [55] и надсерной [102] кислот.
Механизм и стереохимия реакций с надкислотами ".
Суэрн [151] сопоставил результаты окисления мноrих не-
насыщенных соединений надкислотами и показал, что реак-
ция облеrчается при наличии электронодонорных rрупп по
соседству с двойной связью и затруд!fяется в случае элек-
троностяrивающих заместителей в том же положении. Это
иллюстрируется данными табл. 12, в которой приведены ско-
.рости образования эпоксисоединений (k Х IОЗ) при использо-
вании надуксусной и надбензойной кислот соответственно.
Результаты свидетельствуют о реакции между нуклеофиль-
ным олефином и электрофильной надкисJ.IОТОЙ и позволяют
понять трудность окисления 1.0лефинов и а, ненасыщенных
кислот и сложных эфиров [44, 155, 156].
Таблица 12
Олефин
Олефии
kхl()З
(надуксусная
кислота)
kxlO'
(иа1i.бен-
зоi!ная
кислота)
&
cS:' 6
XIX ХХ
6C
XVIII
СН 2 ==СН 2
СН з СН"""СН 2
сн з сн==снсн з
(СН З )2 С==СН 2
(СН З )2 С==СНСНсз
(СН 3 )2 с==с (СН 3 )2
0,19
4,2
93
92
,...,1000
Очень вы-
сокая, не
поддается
измерению
С Б Н s СН==СНСН 2 ОН
СБНsСН==СНСIЮ
СБН,сн==снсоон
203
4,7
0,13
ХХ'
O'() Hl> . '""O:
XXII
ХХ 111
Однако даже эти наименее реакционноспособные соедине-
ния были превращены в соответствующие эпоксисоединения
и rликоли, причем цаилучшие результаты были получены с
надтрифторуксусной К\!слотой. Подробный механизм этой ре-
акции не вполне ясеи [ 153. 168]. С друrой стороны, стерео-
АроматиЧ'еские надкислоты
'Реакция надкислот ароматическоrо ряда с олефинами
была впервые изучена на примере надбензойной кислоты [131].
С тех пор надбеизойная кислота стала широко использоваться
140
Методы zuдРОlCсилировOJШЯ
Надкаслоты аромаruчеСК020 u алuфатuчеСfC020 рядов
141
для получения эпоксисоединений из олефинов. В больШИIi:
стве случаев реакция протекает настолько пerKo, что было
предложено использовать ее для обнаружения и количествен-
Horo определения межуrлеродной двойной связи .(115). Эпокси-
соединения образуются при комнатной или более низкой TeM
'пературе в течение нескольких часов. В качестве растворите-
ля применяется хлороформ, эфир, бензол, ацетон или диок
сан. Данные о различных соединенияХ, окисленных таким
путем, были проанализированы Суэрном [153, 154}. Надбен-
зойную кислоту обычно получают взаимодействием перекиси
бензоила сметилатом [154] или этилатом [161] натрия либо
взаимодействием хлористоrо бензоила с перекисью натрия
[17] или перекисью водорода [73]. Надбензойная кислота об-
разуется также при окислении бензальдеrида кислородом
воздуха. Эта реакция была положена в основу HOBoro метода
получения эпоксисоединений совместным окислением бенз-
альдеrида и олефина [158, 159].
Мононадфталевая кислота, которую получают. взаимодей-
ствием фталевоrо анrидрида с перекисы9 водорода в щелоч-
ной среде [13, 14], также использовал ась для превращения
мноrих олефинов в соответствующие эпоксисоединения [.15,
153, 154]. Этот окислитель имеет некоторые преимущества по
сравнению с надбензойной кислотой; в частносТИ, он более
стоек, что важно в случае очень медленных реакций, и, кроме
тоrо,образующаяся фталевая кислота менее растворима в
хлороформе, чем бензойная кислота, и поэтому леrче отде-
ляется. Мононадфталевая кислота применяется почти в тех
же условиях, что и надбензойная кислота.
Применялись также надкамфарная [88, 90] и надслизевая
[91, 92] кислоты,которые, однако, не имеют преимуществ пе
ред более обычными надбензойной и надфталевой кислотами.
Обрззующаяся надкислот.а быстро реаrирует с любым оле-
фином, введенным в реакционную смесь [32, 33]. Описан [112]'
метод получения чистой надуксусной кислоты, основанный на
qкисле ии ацетаЛI деl'ида.
RСООН+И 2 О а с ) RCO a H+H 2 {)
Надуксусная кислота. В случае уксусной кислоты равно-
весие устанавливается медленно; реакция олефинов с уксус-
ной кислотой и перекисью водорода длится несколько часов
или суток, причем за это время может произойти разложе-
ние перекиси водорода [34, 66]. Однако в присутствии TaKoro
катализа'юра, как серная кислота, равновесие достиrается
примерно через 10 час лри 250, что обеспечивает наиболее
удобный метод получения надуксусной кислоты. Константа
равновесия такова, что в случае эквимолярных количеств ук-
сусной кислоты и 50% ной перекиси водорода 40% перекиси
расходуется ца превращение уксусной кислоты 13 HaДYKCYC
ную. .При молярных отношениях 2: 1 и 10: 1 выход надкис
лоты. увеличивается до 57 и 90% соответственно. Следова
тельно, для экономичноrо использования перекиси водорода
требуется БОЛЫllОЙ избыток уксусной кислоты.
. Приrотовленные таким образом растворы надуксусной
кислоты представляют собой один из лучших peareHl'OB для
rидроксилирования олефинов, так как первоначально обра-
зующееся эпоксисоединение леrко rидролизуется в оксиаце
тат (XVI; R==СН з ), щелочной rидролиз KOToporo привciдит «
диолу. Предварительноrо образования надуксусной.кислоты
не требуется; дост точно поддерживать смесь олефина, уксус-
ной кислоты, перекиси водорода и катализатора при темпера-
туре 400. л:3 этих условиях перекись водорода расходуется
почти количественно и диол образуется с высоким выходом
[37, 155].
Кроме Toro, разработаны методы с применением предвари
тельно полученной надуксусной кислоты для превращения
ол.ефинов в эпоксисоединения. В этом случае необходимо
удалить кислотный катализатор добавлением уксуснокислоrо
натрия и вести процесс окисления при температурах не выше
20 250 обычно в течение 3 4 час [37,48, 156]. .ионообменные
смолы, представляющие собой полистиролсульфокислоты, на-
пример амберлит IR-120 и дауэкс 50-X 80, облеrчают образо"
вание.надкислоты и не действуют при этом на эпоксисоеди-
нение. В связи с этим при использовании таких катализа-
торов можно работать пjш высокой температуре (до 800) и
нет необходимости в предварительном получении надкислоты.
При этом содержание уксусной кислоты можно снизить до
0,5 моля на 1 моль олефина [38, 49, 50].
Алифатические надкисЛОТЫ
Хотя известно большое число надкислот алифатическоrо
ряда и некоторые из них использовались для получения Эf!О-
ксисоединениЙ из олефинов [109, 110. 137], здесь будут рас-
смотрены лишь надмуравьиная, надуксусная и надтрифтор-
уксусная кислоты.
Наиболее удобный метод получения алифатических Haд
кислот состоит во взаимодействии карбоновой кислоты с пер.е-
кисью водорода:
142
A1eToд 1 2идроксиЛUрО8анuя
Общие замечания
Надмуравьиная кислота. Сама муравьиная кислота на-
столько сильная кислота, что равновесие в смеси с перекисью
водорода устанавливается быстро, и не требуется кислотноr{)
катализатора. Смес.и 90 98% нои муравьиной КИСЛ9ТЫ и
25 30% ной перекиси водорода при 400 превращают олефи-
вы без побочных реакций обычно в течение 2 4 час в окси-
формилоксипроизводные .(XVI; R == Н). Поскольку нет необ-
ходимости выделять или предварительно получатЬ надкисль
ту, меньшая -стойкость надмуравьиной кислоты .по сравнению
с надуксусной кислотой не имеет значения. Затем формили-
рованный rликОЛЬ rидролизуют щелочью или даже водой
(при переrонке с паром) [21, 37, 135, 155, 156]. Надмуравьи-
ную кислоту также можно использовать для получения эпо-
ксисоединений; при этом следует брать меньшие количества
муравьиной кислоты (0,25 O,5 'мОля на ] моль олефина), но
увеличивать продолжительность реакции [103]. .
I'идроксилирование 30% ной перекисью водорода в му-
равьиной' кислоте при 400 считается наиболее эффективным
методом rидроксилирования надкислотами [154]. Вторым по
эффективности' является раствор 30% ной перекиси водорода
в уксусной кислоте, содержащей ката'литические количества
серной кислоты. Более концентрированная перекись водорода
(90%-ная) имеет преимущества только в случае олефинов,
трудно rидроксилируемых надкислотами [44].
НадкиСЛОТbl ароматичеСКО20 и алифатичеСКО20 рядов
143
1. Окисление полиенов надкислотами изучено rораздо 'ме-
нее подробно. Коrда двойные связи расположены далеко друr
от друrа, они не оказывают взаимноrо влияния, и при окис-
лении таких соединений образуются MOHO и диэпоксисоеди-
нения, а также диолы и тетролы [15, 176]. Окисление Диенов
с сопряженными связями изучено недостаточно. В случае
1,4-диенов, содержащихся, например, в некотОрых природ-
ных жирных кислотах, были получены неожиданные резуль-
таты. Образование из линолевой кислоты диэпщссисоедине-
ния и дальнейшее превращение этоrо соединения в ацилиро-
ваннЫй rликоль протекают нормально, но при последующем
rидролизе тетраоксикислоты были получены с низкими выхо-
дами. Вероятно, при этом образуются в основном rетероцик-
лические соединения, содержащие кислород, что объясняется
наличием оксиrрупп в положениях 1,4 и 1,5 ([84, 157]; см.
также [111]). Бхаруча и I'анстон [10] сообщают, что при окис-
лении 12,13 диоксиолеиновой кислоты образуется с низкими
выходами 9, 10, 12, 13-тетраоксистеариновая кислота; удов-
летворительные результаты были получены при использова-
нии в качестве исходноrо вещества 12, 13 диацетоксиолеино-
вой кислоты. Описано [160] также превращение .tIинолевой
кислоты в эпоксисоединение.
2. С ацетиленовыми соединениями надкислоты взаимодей-
ствуют медл ннее, чем с этиленовыми. Это важное наблюде
ние [134]- было использовано как при синтезе [15, 135], так и
при расщеплении соединении сложноrо строения [174]. В Ka
честве примера, показывающеrо использование этоrо наблю-
дения при синтезе, можно привести получение (::!::) -арабита
и рибита по Рафаэлю rидроксилированием транс-енина XXIV
по двойной связи с последующим превращением ацетилено-
вой rруппы в диол друrим путем после частичноrо rидрирова-
ния [135]. '
Надтрифторуксусная кислота. Этот окислитель, получае-
мый из анrидрида трифторуксусной кислоты и 90%-ной пере-
киси водорода, является очень эффективным peareHToM для
превращения олефинов в эпоксисоедииения и rидроксилиро-
вания. Он более реакционноспособен, чем надмуравьиная кис-
ЛОТа, и rидроксилирует с хорошими выходами (60 95%) не
только простые олефИНI?I, но и (1, /3-ненасыщенные КИСЛОты и
сложные эфиры, а также друrие олефины, несущие отрица-
тельные заместители. Кроме Toro, надтрифторуксусная кис-
лота имеет некоторые преимущества при синтезе водораство-
римых rликолей [42]. В обычных условиях образуется окси-
трифторацетат (XVI; R == СF з ), который метанолизом, приl\tе-
няя кислотный катализатор, превращают в rликоль. В при-
сутствии подходящеrо буфера, например уrлекислоrо натрия
или кислой динатр"евой соли фосфорной кислоты, образуются
эпоксисоед"нения с выходом 7 90% [43]. ПО имеющимся
даниыМ [101], надтрифторуксусная кислота окисляет арома-
тические уrлеводороды в хиноны.
сн 2 он
1
сн
11
не
1
с
111
сн
?\ XIV
сн 2 он
1
снон
Надмуравъиная dHOH
кислота 1
с
111
сн
сн 2 он
I
H C OH
I
------+ H C OH
I
HO C H
I
СН 2 ОН
(:!::)-Арабит
сн 2 он
I
H.. C OH
I
+ H C OH
I
H C OH
I
СН 2 ОН
Рибит
144
А1етоды zидроксилирования
п ерекись водорода
145
3. Хотя окисление МОlJоолефинов с образованием эпокси-
. соединений и rидроксилирование, как правило, протекают
вполне -удовлетворитеЛI?НО, в некоторых случаях были полу-
eHЫ необычные ре?ультаты. а) При действии надмуравьи-
ной кислоты на соединения, содержащие rруппировку
CH(OH)CH==CH , например, на продукты аутоокисления
метиловоrо эфира олеиновой кислотыI. образуется только 5.0%
ожидаемоrо триола наряду со значительными количествами
продуктов кислотноrо расщепления [142]. ОПl:iсано окисле ии е
а. оксиолефинов [63] и -оксиолефинов [61, 155]. б) При окис
лении циклооктена надмуравьиной кислотой наряду С ожи
даемым тра1iс I,2-диолом образуются цuс I,4-диол (с луч
шим выходом) И соединения друrоrо типа. Раскрытие цикла
в эпоксисоединении сопровождается переrруппировкой, объ-
ясняемой трансаннулярными эффектами [118]. Такие же ре-
зультаты наблюдались в случае C g - [119], С\О, [118] и СJJ ЦИК-
лоалкенов [12.0] и в меньшей степеии в случае C6 [121] и
С 7 -циклоалкенов [122, 123]. в) 2, 4, 4 Триметилпентен-l и 2,4; 4-
триметилпентен-2 реаrируют с надбензойной киСЛотой нор-
мально, но с надмуравьиной и надуксусной кислотами пqми-
мо ожидаемых диолов образуются ненасыщенные одноатом-,
ные спирты, карбонильные соединения и производные диок-
сана [25]..
соедин ния.[89]:
Н 2 О 2 7 2НО . Олефии R 2 C (ОЩ С (ОН) R 2
. . (3 A)
Оптимальные результаты получены с l.о%-ной перекисью во-
дорода; однако скорость реакции мала (5 7 суток), реакция
протекает с небольши;ми . ВЬJходами и, ВJIДИМО, нестереоспеци-
фична [29]. По этим причинам метод не находит практиче-
cKoro применения.
Присоединение перекиси водорода, катализируемое
ультрафиолетовым CB TOM
Перекись водорода при действии ультрафиолетовых лу
чей с длиной ВОЛНы около 3.0.0.0 А распадается на свободные
радикалы, котОрые MorYT rИДРОКСИЛИ,ровать ценаСЫЩенные
Перекись водорода в присутствии окислов металлов,
используемых в качестве катализаторов
При попытке заменить четырехокись осмия (см. стр. 128
129) друrими катализаторами было установлено, что нек{)то-
рые окислы достаточно эффективны и заслуживают более
подрьбноro исследования. Тем не менее ни один из этих окис-
лоВ не нашел TaKoro широкоrо rприменения, как хорошо изу-
ченная четырехокись осмия. Окиси молибдена, селена и воль
фрама пр:едставляют некоторый интерес, но окиси хрома,
титана, тантала и ванадия менее удовлетворительны [1.0.0].
Трейбс рекомендовал применять перекись- водорода и. над-
ванадиевую кислоту'для получения эпоксисоединений и rли
колей и считал ацетон наиболее подходяLЦИМ растворителем
([164]; ср. [87]). С друrой' стороны, Маrден и Янr [1.0.0] после
систематическоrо ш;следования различных катализаторов для
окисления аллиловоrо спирта в водной среде пришли к вы-
воду, чтО в присутствии надванадиевой кислоты олефины
окисляются медленнее, чем с четырехокисью осмия, что обра-
зуются большие количества побочных продуктов и что opra-
нические растворители в большинстве случаев окисляются.
Эти авторы считают, однако, что трехокись вольфрама MO
жет с успехом заменить четырехокись осмия. При КОМнатной
температуре реакция прОтекает медленно, но скорость ее за-
метно возрастает при повышенных температурах и в присут-
ствии следов серной кислоты. К преимущества м трехокиси
вольфрама относятся ее нетоксичность и доступность, И, кро-
ме 'I'oro, с ней rораздо удобнее работать, чем с четырех-
окисью осмия. При окислении ряда олефинов и некоторых не-
насыщенных кислот и спиртов по этому способу были полу
чены удовлетворительные результаты.
Некоторые .исследователи преДПQчитают исiюль:;ювать .се-
ленистый анrидрид в трет-бутиловом спирте, диоксаН ,аце-
тоне или. в водной .среде [1.0.0: I44,I{9]. Так, сел нистый
ПЕРЕКИСЬ ВОДОРОДА
ДЛЯ превращения олефина в rликоль необходимо присо
единение двух атомов ВОДОрОДа и двух атомов кислорода к
каждой молекуле Ьлефина. Поэтому нет ничеrо удивит ель-
Horo в том, что были сделаны попытки осуществить указан-
ное превращение с помощью 'перекиси водорода. Изуче11 0
окисление олефинов перекисью водорода в следу.ющих усло-
виях: а) при облучении ультрафиолетовым светом; б) в при-
сутствии орrанической кислоты, в особенности муравьиной
или УКСУСНОй (см. стр. 14.o 142); в) в присутствии некоторых
окислов металлов или солей надкислот, способных служить
катализаторами окислнтельноrо процесса, в орrаническом
растворителе или без растворителя и r) в присутствии ще-
лочи. .
lQ Зак. 14lе
146
МеТоды 2uдроксилирован.uя
Лерекuсь водорода
147
Кинетические исследования показали, что стадией, опреде-
ляющей скорость реакции, является атака со стороны нуклео
фильноrо rидроперекисноrо иона; это соответствует механизму
реакции, приведенному ниже [22]. Вейц и Шеффер получили
таким путем эпоксисоединения из ряда халконов (ArCH == .
==СНСОС 6 Н 5). окиси мезитила и соединений XXY XXYII,
причем из соединений XXVI и ХХУII были получены диэпо
анrидрид используется как катализатор в реакции, приводя-
щей к образованию rлутаровоrо диальдеrида [149].
1 ) SeO., трет.С.Н.ОН . I I ОН
" 3О% ная Н,О.. 00, 45 час -+ V H
Выход 40%
ОНС (СН 2 )з СНО
Выход 31%
CH. OOH, NаВЮ 8 -+
Н 2 О 2 + ОН Н0 2 + Н 2 О
Наиболее интересной особенностью окисления перекисью
во1:r.орода, катализируемоrо окислами металлов, является то,
что в присутствии четырехокиси осмия происходит цuс присо
единение, тоrда как друrие окислы вызывают транс-присо-
ед'Йнение. Это свидетельствует о различии в механизме peaK
ции. в завис,имости от природы катализатора. Маrден и Янr
считают, что при реакции с четырехокисью осмия про межу-
точно образуются циклические эфиры осмиевой кислоты (см.
стр. 121, 124). а реакция с надвольфрамовой кислотой проте-
кает по следующей схеме ([100]; ср. [80]):
ОН
WO s н.о. -+ HW0 4 ОН Олефин I f!.o -+
транс-Присоединение -+ R2C CR2
I
OWOsH
R
t:::.. I
R2C==CH C==O + 02t1
[R'ь ё J ]
R
' I (?:
R2C CH C O ..............'
6.сон
R
I
R2C CH----C<==O
'-/
о
ксисоединения. Этот метод использ()вался'так е для по . луче-
ния эпоксисоединений из холестенона (XXVIII) [113] и ряда
J,4-нафтохинонов общей формулы XXIX [46, 162]. Этот метод
CH CHCOCвHв
( l
11
,,
I
СН ==СН СОС в Н 5
XXVIl
r7V С 6 Н 5
Ц /==O
CвHв
()Ir C B H 5
y,,/ C6H5
11
О.'
XXV
ОН
I
R2C CR2 + HWO s , ОН
1
ОН
XXVI
Различие В стереохимии этих в остальном аналоrичных реак-
ций означает, что в большинстве случаев они не представ-
ляют собой различные пути получения одноrо и Toro же сте-
реоизомера.
"А
("I!r L<
A I A/
I I
o VV
XXVIII
Перекись водорода в щелочной среде
I(ак впервые поюi.заJIИ Вейц и Шеффер [169], при Qкисле
нии (1, -ненасыщенных кетонов в водном метиловом спирте,
этиловом спирте, ацетоне или пиридине примерно при комнат-
ной температуре щелочными раствор.ами перекиси вОДОрОДа
леrко образуются соответствующие эпоксисоединения. Hacы
щенные кетоны, олефи.ны и /1, -ненасыщенные кисЛоты в ЭТИХ
условиях fle j1Зf\1еftЩОТСЯ, тоrда aK дикетоны раСЩеПЛS1ЮТС
О
11
rY ) 'fl
V
11
О
XXIX
представляет интерес, так как надбензойная кислота
(стр. 139 140) и Четырехокись осмия в эфире (стр. 121, 124)
не реаrируют с (1, -ненасыщенными кетонами [148].
В работах [183, 184] описаны стереохимия эпоксилирова-
ни я , катализируемоrо основаниями, истероизбирательность
при эпоксилировании в щел9ЧНОЙ среДе соответственнО.
10"
Методы i!uдроtCсилирО8ан.uя
. Э/(сnерuм.енtальная часТЬ
149
148
Э СПЕРИМЕНТАJ]ЬНАЯ. ЧАСТБ .
fидрокснлирование действием перманrаната
. Овисмнuе олеиновоfJ.' вис.лоты в раз6авмнном водiJо-ще.lЮ'lНОМ
. растворе {78}.
. 5 2 олеиновой кислоты наrревают с раствоРом 5 2 едкоrо
натра в 500 мл воды до образования прозрачноrо раствора,
затем раствор разбавляют 4 л воды, охлажденной льдом,
перемешивают при 100 и быстро прилива.JOТ к нему 400 мл
1 % -Horo paCTBOp перманrаната. Через 5 мин. жидкость обес-
цвечивают сернистым rЭЗ0М и подкисляют 150 -МЛ концентри-
рованной соляной кислоты. Выпавший осадок диоксистеари-
новой кислоты отфильтровывают, промывают 50 мл петролей-
Horo эфира (Т. кип. 60 800) для ускорения последующеrо BЫ
сушиванияи переносят в вакуум-эксик. тор. В,ысушенный
осадок измельчают, обрабатывают 100 150 мл петролейноrо
эфира (т. кип. 60 800) для удалеf!ИЯ н.асыщеннЫх кислот, со-
державшихся в олеиновой кислоте в качестве примесей, и
нерастворимую диоксистеариновую кислоТу очищают кристал-
лизацией из спирта; выход почти колич ственный, т. пл. 1320;
Описаны. [177] ПОДJIOбные экспериментальные условия
окисления по этому методу этилацеталя акролеина в этилаце-
таль {::!:) - r лицериноiюrо альдеrида.
ДОК двуокись марrанца отфильтровывают через складчаты
фильтр, большую часть трет-бутиловоrо спирта отrоняют
при атмосферном давлении и раствор упаривают на водяной
бане в вакууме до объеltfа около 250 ,мл. Полученный раствор
обрабатывают эфиром в течение 48 час в аппарате дJ'IЯ непре-
рывной экстракции, эфириую вытяжку сушат безводным суль-
фатом натрия. После отrонки растворителя остается 5,772 бе-
лоrо кристаллическоrо экзо-цис-бицикло-[2, 2, 1] rептандиола-
2,3; выход 45%. После возrонки при 105 1100 и 18 м,м рТ.. СТ.
получают 5,38 е вещества; выход 40%, т. пл. 139,5 140,50.
По этой же методике осуществлено rидроксилирование
циклопентена, циклоrексена и циклоrептена.
ОlШсление циклоzеl(,Cена в водно-спиртовом растворе {26/
К. взвеси 26 е циклоrексена в 600 мл спирта приливают
постепенно при энерrичном перемешивании в течение
1,5 час раствор 40 е перманrЭl;lата калия и 30 ..сульфата
маrния в 800 мл воды; поддерживая температуру смеси в
пределах от 15 до 200. Полученный раствор фильтруют,
упаривают до небольшоrо объема, насыщают поваренной
солью и экстраrиру:ют хлороформом 12 е цис-диола; выход
33%, т. пл. 980.
fидроксилирование действием четырехокиси осмия
Окисление циклоzептена {31}
1,92 е циклоrептена, 5,10 2 четырехокиси осмия и 3,5 мл
пиридина в 100 ,мл абсолютноrо эфира смешивают при О?
Почти сразу же начинают выпадать кристаллы буроrо цвета,
которые через 30 мин отфильтровывают и промывают эфиром;
получают 10 е кристаллов, выход 98,5%.
9,5 е аддукта циклоrептена, четырехокиси осмия и пири-
дина смешивают с 10 2 маннита в 100,Мл 10%-Horo водноrо
раствора дкоrо кали. Вскоре образуется прозрачный рас-
твор, который после стояиия в течение 12 час экстраrируют
хлористым метиленом. После отrонки растворителя переrо-
ияют цис-диол; т. кип. 90 1000 при 0,1 ,мм рТ. СТ., выход по-
чти количественный, т. пл. 480.
Окисление биЦlЖло-{2,2,I}-zептена-2 в водНОМ трет-бутиловом
. спирте {170/ .
. '
Охлажденный до 00 раствор 23,4 е перманrаната калия и
5 е едкоrо натра в 800.Мk:водыприливаютбыстро при энер-
rичном перемешиваиии к ОХЩlждеНlЮй до 100 смеси .1 л
трет-бутиловоrо спирта, 200 мЛ воды, 500. е,. толченоrо -льда
и 9,42 е бицикло-{2,2, I]-l'ептена-2. Через 3---"-5 мин. окраска
nepMaHraHaTa почти исчезает; но для ПОJlНоrо восстановления
перманrаната пропускают сернистыЙ rаэ. Выпавшую в оса-
ОlШсление ванцероzенныJC уzлеводородов {28/
К раствору (или взвеси) 2,5 ммоля уrлеводорода в 15 мл
чистоrо cyxoro бензола добавляют 2,5 ммоля четырехокиси
осмия и 5 ,Ммолей чистоrо пиридина. Постепенно окраска ста-
новится более rлубокой, 'и выпадает темно-коричневый ми-
крокристаллический комплекс. С 3,4-бензпиреном и 1,2-бенз-
антраценом и ero rомолоrами при комнатнОЙ температуре р'е-
акция заканчивается через 24 48 час. В случае менее реак-
ционноспособных или менее растворимых уrлеводородов (на-
пример антрацена, 1,2,5, 6- дибензантрацена) для завершения
реаКции при комнатной температуре требуется несколько су-
ток или даже недель. Окwсление хризена заканчивается чере3
неделЮ при 350.
ОбраЗ0вавшийся комплекс отфильтровывают, растворяют
в хлористом метилене и полученный раствор встряхивают ме-
ханически с 1 % -ным раствором едкоro кали, содержащим
150
А1етоды 2uдроксuлированu
ВкспериментаЛЫlQЯ часть
151
10% маннита. Окраска раствора в ХЛОРИСТО$ метилене блед-
неет, водный раствор окрашивается в розоtiый цвет осмина-
том калия. В некоторых случаях (пирен, 3,4-бензпирен,
1,2,5,6-дибензантрацен) орrанический слой сохраняет сла-
бую окраску вследствие образования хинонов. Большинство
образующихся диолов плохо растворимо и выпадает из рас-
твора в виде осадка. Осадок отфильтровывают, а ОСТЦльное
количество диола получают после отrонки хлористоrо мети-
. лена. Диолы, полученные с хорошими выходами, перекристал-
лизовывают из бензола, хлороформа или метанола или очи.
щают хроматоrрафированием в бензольном растворе на окиси
алюминия с последующим вымыванием хлороформом. В боль-
шинстве случаев диолы кристаллизуются плохо, некоторые
из них выпадают в виде rелей. Диацетаты диолов, образую-.
щиеся при непродолжительном наrревании диолов с уксус-
ным анrидридом, содержащим небольшое количество пири-
дина, представляют собой хорошо кристаллизующиеся бес-
цветные соединения.
зации 116 е осадка из 250 МЛ этилацетата получают 105 2
диола; выход 68%, т. пл. 1000.
Если при окислении хлорат бария добавляют постепенно,
а избыток ero восстанавливают сернистым анrидридом; то
выход продукта реакции составляет 78%.
Ок-исление 4 хлорк-ротОНО80Й к-ислоты четырехок-исью ос.мия
и x.ICiipaтoM бария {17{
Раствор (частично взвесь) 120 е 4-хлоркротоновой кисло-
ты (т. пл. 81,50) в 1,5 л воды, содержащей 0,5 2 осмиевой
кислоты и 60 2 хлората бария, оставляют стоять при комнат-
ной температуре, но вначале часто встряхивают. При этом
следят, 1/тобы температура смеси не превышала 300. I(ислота
растворяется полностью примерно через 4 5 час, через
20 час вступает в реакцию весь хлорат, и раствор становится
темным. Затем к раствору добавляют еще 4 с хлората барй:я
и смесь оставляют стоять 18 час. Полученный прозрачный
раствОр дваЖДЫ экстраrируют бензолом порциями по 500 МЛ
И водный раствор упаривают в вакууме при температуре не
выше 500 до образования rycToro сиропа. Этот сироп раство-
ряют в 1.5 л эфира, отфильтровывают неорrанический осадок
и раствор тщательно сушат сульфатом натрия. После отrонки
растворителя остается rустой, бесцветный сироп, из KOTopora
вскоре начинает выпадать ПОЛУI<ристаллический осаДОК. Про-
дукт реакции кристаллизуется из смеси 100 мл этил ацетата
и 50 мл хлороформа при 150. I(ристаллы отфильтровывают
и промывают холодной смесью эфира и хлороформа (1:3
по объему)..Маточный раствор паривают в вакууме и оста-
ток снова кристаллизуют. После трех последовательных пере-
кристаллизаций получают 109 е кристаллов с т. пл. 97 980
и 7 е кри'сталлов из остатка после повторной обработки эфи-
ром и последующей кристаллизации. После перекристалли-
Ок-исл.ение аллиловоzо спирта реак-тиво.м Миласа {94/
Смесь 100 мл 30% -ной перекиси водорода и 400 мл трет-
бутиловоrо спирта при добавлении небольших порций безвод-
Horo сульфата натрия разделяется на два слоя.. Спиртовыq
слой, содержащий большую часть перекиси водорода (93,8 % ).
сушат безводным сульфатом натрия и затем безводным суль-
фатом кальция. Полученный раствор с концентрацией пере-
киси водорода 6,32% можно концентрировать без потери пе-
рекиси переrонкой в вакууме при комнатной температуре в
стеклянном приборе. После стояния раствора больше 6 меся-
цев при комнатной температуре наблюдается лишь незначи-
тельцое уменьшение концентрации перекиси.
Четырехокись осмия хорошо растворяется в трет-бутило-
вом спирте, причем раствор вполне стоек в отсутствие в смеси
изобутилена. В присутствии изобутилена большая часть че-
тырехокиси осмия леrко восстанавливается внерастворимую
черную коллоидал.ьную окись, которая является чрезвычайно
активным катализат ром разложения перекиси водорода.
К 6,1 е аллиловоrо спирта приливают 54,6 мл peareHTa,
содерж.ащеrо 6,3% перекиси, и 1 мл раствора четырехокиси
осмия в качестве катализатора. Реакционная смесь сильно
разоrреваетсЯ, и ее необходимо охлаждать. Через 3 час пере-
кись оказывается полностью израсходованной, после чеrо
реакционную смесь разrоняют для удаления растворителя,
катализатора и непрореаrировавшеrо аллиловоrо спирта
(1,7 е). Получают 4,2 е rлицерина с выходом 60%, который
можно идентифицировать' В виде ero трибензоата (т. пл. 690).
rидроксилирова ие по Вудворду
Ок-исление dl-анmu-mранс-4,4а, 4в, 5,8, 8а-zек.еаzидро-l,
8а-ди.меmил-2 (3Н)-фенантрона (/Х) ({179/; ср. {75J)
В трехrорлую колбу, снабженную обратным холодильни-
ком и термометром, ПРИ:1Iивают раствор 1 О е ненасыщенноrо
кетона IX в 200 МЛ 99,5%-ной ледяной уксусной кислоты
(ч..д. а). После добавления 16,43 е ацетата серебра в реак-
ционную смесь ПОстепенно при энерrичном перемешивании
в течеН}I 30 мин при комнатной температуре вводят 11,69 ?
152
МеТоды тдроксилuрования
Экспериментальная часТЬ
153
/
тонкоизмельченноrо иода. После Toro как весь иод всту-
ПИТ в реакцию (через 30 мин), приливают 19,7 .мл раствора
УКСУСНОЙ кислоты. Раствор уксусной кислоты приrотовляют
из 48 .мл ледяной уксусной кислоты и 2,0 м.л воды. .Реакцион
ную смесь наrревают при энерrичном перемешивании в тече-
ние 3 час при 9().....-...95 0 . После этоrо смесь охлаждают, добав-
ляют избыток поваренной соли и отфильтровывают нерас-
творившиеся. соли. Осадок тщательно промываю'r rорячим
бензолом и фильтрат упаривают в вакууме. Полученный оста-
ток растворяют в метаноле, раствор фильтруют, нейтрали
-зуют несколькими миллилитрами метанольноrо раствора ek
Koro кали и затем приливают к нему раствор 3,1 е едкоrо
кали в метаноле. Для rидролнза смесь Оставляют на ночь при
комнатнОЙ температуре в атмосфере азота. На следующий
день продукт реакции тщательно нейтрализуют разбавлен
ной соляной кислотой при охлаждении льдом. Метанол oтrO-
няют в вакууме,. создаваемОм сначала водоструйным, а затем
масляным насосом. Оставшийся заrрязненный кристалличе
ский rликОЛЬ (12,2 е) растворяют в большом объеме этил-
ацетата, р.з.створ упаривают до начала выпадения осадка и
постепенно охлаждают до 00; при этом из Hero выпадает
рыхлая масса красивых иrольчатых кристаллов. После OTдe
леиия 7,48 е цис rликоля (выход 65%, т. пл. 184 1850) из
маточных растворов получают дополнительно 0,71 е r!lИКОЛЯ
(выход 6%, т. пл. 181 183°). После нескольких перекристал
лизаций из этил ацетата чистЫй /3-цис-rликоль плавится при
184,6 185,20. Из матОЧНЫХ растворов поСле отделения двух
порций /3 цис-rликоля и внесения затравки С1-цис rликоля по-
лучено небольшое количество (0,28 е) этоrо изомера (выход
2,5%, т. пл. 156 1570).
ОIШСЛi!ние ОЛi!финов с iJлинной цепью {57}
Для окисления ненасыщенных сложных эфиров можно ис-
пользовать следующий метод. 0,01 моля олефина, 0,022 моля
ацетата серебра и 0,01 моля иода в 65 мл ледяной уксусной
кислоты встряхивают в течение 30 мин при комнатной темпе-
ратуре. Затем к смеси приливают 10 мл уксусной кислотЫ,
содержащей 0,2 .мл (0,011 моля) воды, и кипятят смесь с об-
ратным холодильником 1 час. После этоrо смесь охлаждают,
отфильтровывают выпавшие соли серебра и осадоК промы-
вают небольшим количеством уксусной кислоты. Фильтрат и
промывные жидкости объединяют и отrоняют растворитель
наrреванием при 1000 в вакууме. Остаток разбавляют водой,
Зlкстраrируют эфиром, вытяжку промывают концентрирован-
ным водным 'раствором аммиака И затем водой. Растворитель
отrоняют, продукт реакции rидрЬлизуют кипячением в течение
1 час с избытком 3 н. водно-спиртовоrо раствора едкоrо кали,
затем смесь разбавляют и подкисляют соляной кислотой.
Выпавший после подкисления заrрязненный продукт окисле-
ния сушат в вакуум-эксикаторе над' концентрированной сер-
иой кислотой И. едКИМ кали и перекристаллизовывают, обычно
из метанола. .
При окислении кислот с двойной уrлерод-уrлеродной связью
образуюLЦИЙСЯ как побочный продукт (частично) ацетилиро-
ванный rликоль нельзя отмыть водным pacTBopqM аммиака,
поэтому после удаления уксусной кислоты и приливания воды
и эфира добавляют разбавленную соляную кислоту.' Выпав-
шие соли серебра отделяют и промывают эфиром. Эфирные
растворы объединяют, промывают водой, отrоняют раствори-
тель и rидролизуют остаток.
В случае образования продуктов нейтральиоrо характера
нет необходимости подкислять КОнечный rидролизат; продук'(
реакции выпадает обычно при охлаждении разбавленноrо
раствора.
Реакция .прево
ОиисЛi!ние меmиловоzо эфира ОЛi!иновоfl виcAotnы ({175}:
см. maвже {173}) .
Смесь 45,8 е высушенноrо в сушильном шкафу бензоата
серебра (содержание Ag 46%), 25,4 е иода и 300 мл cyxoro
бензола кипятят с обратным холодильником в течение
30 мин н.а водяной бане, защищая от попадания влаrи.
3атемк/смеси добавляют 29,7 е 96%-Horo метиловоrо эфира
олеиновОЙ кислоты и кипятят с обратным холодильником в
течение 24 час. Выпавший осадок иодистоrо серебра .отфиль
тровывают, фильтрат последовательно промывают водой, раз-
бавленным раствором бикарбоната натрия и снова водой.
Бензольный раствор сушат сульфатом натрия. После отrонки
растворителя в вакууме остаеТся 43,5 е KpacHoBaToro маслS1-
нистоrо вещества; выход 81 %.
1( части полученноrо продукта (10 е) приливают 50 мл
10% HotO водноrо раствора едкоrо натра и наrревают рас-
твор на водяной бане, периодически ero перемешивая. rоря
чий раствор при механическОм перемешивании подкисляют
концентрированной соляной КИСЛОТОЙ. Вверх всплывает слой
диоксикислО'l'Ы в виде масла, из водноrо слоя кристаллизует
ся беизойная к"слота. После затвердевания верхний СЛОЙ
отделяют и растирают с разбавлениой кислотой и затем с
водой, ПРОМЫВlJые воды при соедИНЯЮТ к водному СЛОЮ;
'-
154
Л1етооы zидрокtилированuл
Экспериментальная часть
155
из них при наrревании выделяется еще небольшое количе
ство маслянистоrо вещества, которое присоединяют к OCHOB
НОМУ продукту реакции и сушат на пористой пластинке. Про-
дукт окисления растворяют в абсолютном спирте. При стоя
НИИ из раствора выпадают кристаллы. Получают пять. порций
кристаллов u общим весом 5,9 е, которые после двух перекри-
сталлизации из этил ацетата плавятся при 93 940. Упаривая
пе воначальный маточный раствор, получают смесь бенЗ0Й'
нои' и диоксистеариновой кислот. Эти кислоты можно разде
лить путем обработки техническим reKcaHoM, в котором рас-
творяется только бензойная кислота. После перекристалли-
зации нерастворимоrо продукта из спирта получают еще
0,5 е диоксистеариновой кислоты. Общий выход СОставляет
93% (5,5 u е) в расчете на бензоксилированный продукт, под-
верrнутыи омылению.
тем в колбу добавляют 375 е очищенноrо циклоrексена. Цик-
лоrексен' для очистки встряхивают с насыщенным раство-
ром бисульфита JtатриЯ, сушат сульфатом натрия и переrо.
няют. Т мперату'РУ смеси повышают до 450, пропуская пар в
водяную баню, в .которой находится реакционный сосуд. В те-
чение 1,5 час при перемешивании вводят на поверхность раз.
дела двух фаз 585 е (100 об. %) перекиси водорода, при этом
смесь охлаждают, чтобы температура ее поддерживалась в
пределах 55 600. Постепенно смесь становится однородной.
Большую часть муравьиной кислоты отrоняют в вакууме, со-
здаваемом водоструйным насосом. Оставшийся заrрязненный
моноэфир муравьиной кислоты rидролизуют, переrоняя ero
с паром до отrонки 750 МА водной муравьиной кислоты.
Оставшиеся растворители отrоняют в вакууме; остается свет-
ло желтый сироп, который вскоре затвердевает. После пере-
кристаллизации получают 426 е бесцветноrо диола; выход
82%, т. пл. 96 970 (по литературным данным т. пл. 103,5
1040). Полученный диол достаточнО чист для дальнейшеrо ис-
пользования.
Способ выделения более чистоrо продукта описан Ребу.
ком и Адкинсом [141].
rидроксилирование действием надкислот
В обзоре Сверна [154] приводится следующее предупреж-
дение: .
«Препаративное получение надкислот и реакции с их уча-
стием всеrда следует про водить с предохранительным щитом,
так как в.некоторых случаях реакция протекает очень бурно
и не ПОДДается реrулированию. Если действие надкислоты
на uолефин нuеизuвестноrо строения или на олефин, содержа
щии по краинеи мере три электронодонорные rруппы, рас-
положенные у атомов уrлерода с двойной связью .или в He
посредственной близости от них, изучается впервые, то сле-
дует работать с небольшими количествами peareHToB (не
больше 0,1 моля) и при хорошем охлаждении. Смеси с Hak
кислотами, используемыми в качестве окислителей, нельзя
переrонять, если анализом не установлено, что активный кис-
,тюрод отсутствует либо присутствует, но внезначительных
концентрациях. При низком содержании надкислоты уксус-
ную и муравьиную кислоты можно безопасно и полностью
отrонять из реакционной смеси в вакууме при комнатной или
более низкой температуре. Надкислоты и друrие перекисные
соединения можно леrкО разрушить добавлением сульфата
заки и железа, бисульфита натрия или друrих восстанови':
телеи».
Ок-иеление олеиновой к-иелоты nерек-иеью водорода и муравьиной
к-uелотой {155/ '
К раствору 14,1 2 99,5% ной олеиновой кислоты в 42,3 МА
муравьиной кислоты при перемешивании сразу приливают
6,9 е 25,3 % -ной перекиси водорода при 250. Примерно через
5 MU1i на инается энерrичная реа ция. Смесь поддерживают
при 400, охлаждая ее водой в начале реакции и l1аrревая на
водяной бане к концу реакции. Примерно через 20 MU1i смесь
становится однородной. Расход перекиси водорода прекра
щается примерно через 2 час, коrда в реакцию вступает почти
теоретическое количество перекиси. Продукт реакции Bыдe
ляют одним из трех способов.
в опытах с указанными количествами peareHToB после OT
rонки в вакууме муравьиной кислоты остаются оксиформил-
оксистеариновые кислоты. Можно также выливать реакцион-
ную смесь в холодную воду и экстраrировать продукт реак-
ции 'эфиром. После упаривания эфирноrо слоя, промытоrо
водой, оксиформилоксистеариновые кислоты остаются в виде
нелетучеrо осадка. В опытах с большими количествами ре-
areHToB (не меньше 100 2) реакционную смесь выливают в
три или больше объемов воды, водный слой сливают, а Мас-
лянистый слой MHoroKpaTHo промывают водой. По всем
трем. фос!?(}аf,i <? <;ИфОРNflfлt?ксистеарИf!Q13Щ 1{И<;J]QТt?! мОЖНQ
Ок-иеление ЦUl(.лоzек-еена перек-ucью водорода и муравьиной
к-uелотой ([20/. ер. {2,141J)
В -трехrорлую колбу емкостью 3 А, снабженную мешалкой,
термометром, обратным холодильником и капельной ворон-
кой, помещают 1500 2 муравьиной КИСЛОты (уд. вес 1,20), за.
Методы 2идроК,Силированuя
Литература
157
156
получить в виде низкоплавкоrо твердоrо вещества с КQЛиче
ственными выходами.
Полученные оксиформилоксистеариновые кислоты Harpe-
вают в течение 1 час с избытком 3 н. водноrо раствора ед-
Koro натра. Бледно желтый раствор выливают при' переме-
шивании в избыток rорячей 3 н. соляной кислоты. После зii-
твердевания выделившеrося маслянистоrо веЩества ВОДньtй
слой сливают. Белый твер.il.ЫЙ продукт раСJ;Iлавляют в rоря-
чей воде и смесь перемеШИВ8ЮТ для удаления остатков солей
и растворимых кислот. Полученную таким образом диокtи-
стеариновую кислоту (15,6 е, выход 99% т. пл. 90 920) сушат
на воздухе. Часть продукта (5 е) тонко измельчают, трижды
промывают декантаt.tией техническим reKcaHoM (т. кип. 63
700), фильтруют и получают 4,7 е диоксистеариновой кислоты;
выход 93 %, т. пл. 920. п'осле перекристаллизации друrой
части (5 е) диоксикислоты из 25 мл 95% Horo спирта полу-
чают 4,0 е более чистоrо продукта; выход 79 %, т. пл. 940.
Аналоrичные результаты получены при замене 90%-ной
муравьиной кислоты 98%-ной кислотой, но В этом. случае
реакционная смесь не становится однородной.
растворителя вследствие ПРО1'екаюtя экзотермичеСIШЙ реак-.
IJИИ. После прили ания всей надкислоты смесь. перемеiIшваk>Т
15 ,Мин при комнатной температуре. Летучие растворители
отrоняют в .вакууме, остаток переrоняют r:lOлучают. 50,5 е
окситрифторацетата ,(т. кип. 38 600 при 2 .м,м рТ. ст.); три
фторацетат тримеrиламмония остается в переrонной колбе.
Окситрифторацетат кипятят с обратным холодильником в те-
чение 2 чае с 300 ,мл 3 % -Horo раствора ХЛОРl:Iстоrо водорода
в метаноле, затем растворитель отrоняют в вакууме и полу-
чают 15,1 2 бесцветноrQ пентандиола-2,3; выход 74%, Т; кип.
58 590 при 0,5 ,м рт. СТ.
Оиисмние пентена-2 надтрuфтору1tCj1СНОЙ иислотой {42/
1( охлажденной льдом эмульсии 6 ,мл 9О%-нои перекиси
водорода в 50 ял хлористоrо метилена приливают при пе -
мешивании 37,2 мл трифторуксусиоrо анrидрида и образо-
вавшиЙся раствор перемещиsают при охлаждении еще 10 ,Мин.
Холодный раствор переносят в капельную воронку с отвод-
ной трубкой для выравнивания давления. Раствор наДКИСЛО-
ты приливают по каплям Б течение 30 мин к раствору 14 е
пентена-2 й 21,4 е трифторацетата триметиламмония в 50,Мл
JlОрИСТQrо t.( rflл на. При TO:td 1Н!(5щода ТСJ! бурио flneQHe
ЛИТЕРАТУРА
1. А Ь Ь о t t О. с., .А r с u s с. L, J. СЬеtn. Бос., 1952, 1515.
2. AdkIns Н., Roebuck А. 1\., J. Ат. Chem. Soc., 70, 4041 (19 8).
3 А I-i М., О w е n L. N., J. СЬет. Soc.. 1958, 1066.
4. В а d g е r G. М;, J. Cb т. Soc., 1949, 456, 2497; 1950, 1726, 1809.
5. В ad 'g е r.<i. М., Quart. Rev.' (London), 5;. 160 (1951); Тhe' c Structure
I - and Reactions of' the Aromatic. Comp01.i.nds, Camtridge tJniversity
Press, 1954, р. 157 161.
6. Barkleyt. В., FarrarM; W., Knowles W. S., Raffe'lson Н.
l'hompsonQ. E.,J. Ат. СЬет. 8ос., 76, 5014 (1954). '
7. Bart1ett Р. о., Bav1ey А., J. Ат. Chem. 80с., 60, 2416 (1938).
8. В а r t о n О. Н. R., Е 1 а d' о., J. СЬет. Soc., 1956, 2085.
9. Beattie 1. R., Bryce Smith,O., Nature, 179,577.(1957).
10: В h а r u с h а КБ., G u n s t о n е F.D., J. СЬem. Soc., 1956, 1611.
11. В i r с k n Ь а с h L.', G е и Ь .в u J., В е r n i n g е r Е., .Ber., 65, 1339
(1932) .-'
12. В,О е эе k е ri J., Rev. 'trav. сЫт., 41;199 (1922).
13. Вбhmе Н., Ber.,70, 379 (1937);. Вбhmе Н., Steinke G., Вет.,
70, 1709 (1937).
14. В оЬте'н., Org. Syntheses,.3, 619 (1955).
15. Во 1тапп F.'-,8inn Н., Ber., 88,1869'0955).
16. В r а u n G.; J. Ат. Chem. s.oс., 51, 228 (1929).
17. r а u n G., J. Ат. Chem. 8ос., 52, 3176 (1930).
18. В r а u n С., J. Ат. СЬет. 5ос., 52, 3188 (1930).
19. В r а u n G., J: Ат. Chem. $ос.; 541 1133 (1932).
20. B'rooks В. Т., Brook.s. 'V!.. В., J. Ат. Chem. Soc., 55,4309':(1933).
21. Brown J. В., Henbest Н. св., Jones Е.. R.. H.,J. СЬет. Sbe.
1950, 3634. .' .' '. , , ·
22. В u n t оп С. А:, М i n k о f f G. J.,J. СЬет. Soc., 1949, 665.
. Bu=ten а 11 d t А., 'Sc Ьт i d t - Т h ете J., Р а u 1 Н., 'Ber., 7.'i.i 1112
(1939)'. . . . - .',':' -
24. В U t е п, tl d t А., W Q 1 Н., Ber., 71, 1483 (1938).
Оиuсмние оминовой иuслоmы neре"исью водорода, j11tCУСНОЙ
иислотой и серно4 иuс.лотой /155/
Раствор 14,4 е 98,1%-ной олеииовой IЩСЛОТЫ в 43,2 ,мл
ледяной уксусной кислоты, содержащей 1,1 е концентриро-
ван.ной серной кислоты, наrревают до 400 и окисляют при
этой температуре 6,75 е 25,8%-ной перекиси водорода. Реак-
ция не сильно экзотермическая, продолжительность реакции
6 час. ИЗ П.....l1ученной с количественным выходом оксиацет-
оксистеариновой кислоты после омыления, подкисления и пе-
рекристаллизации получают 9,lO-диоксистеариновую кислоту
с несколько меньшим выходом, чем при окислении перекисью
водорода и муравьиной кислотой.
..
158
А1етоды zидроксuлирования
Литература
159
25. В уе r s А., Н 1 с k i n Ь о t t о m W. J., J. СЬет. 50С., 1948, 284, J328.
26. Clarke М. Р., Owen L. N., J. СЬет. 50С., 1949,315.
27. Соlеmап J. Е., Rlcciuti С., 5wern О., J. Аm. Chem. 50С., 78,
5342 (1956).
28. С о о k J. W.. 5 с h о е n t а 1 R., Nature, 161, 237 (1948); J. Chrm S()c.,
1948, 170.
29. С о о k J. W., S с h о е n t а 1 R., J. Chem. 5ос., 1950,.47.
30. С r i е g е е R., Апп., 522, 75 (1936).
31. Стl egee R.,' М а rch а n d В., W а пп owl u s Н., Аnn., 550, 99 (1942).
32. О' А n s J., F r е у W., Ber., 45, 1845 (1912).
33. О' Ans J., Kneip А., Ber., 48, 1136 (191t).
34. О а v i е s а. а., Н е 1 1 Ь r о n 1. М., О w е n s W. М., J. СЬет. 50С.,
1930, 2542.
35. О j е r а s s i С., Н i gh . В., G r а s s n 1 с k 1 е Т. Т., Е h r 1 i с h R.,
М о о r е J. А., 5 с о t t R. В., СЬет. and Ind., 1955, 474.
36. D и р оп t а., D и 1 о и R., С о h е n J., ВиН. soc. chim. France, 1956,819.
37. Ои Pont Booklet A 6282, Epoxidation and HydroxyJation with Orga.
nic Peracids, Wilmington, Oelaware.
38. Ои Pont ВиllеНп Р бl 454, Hydrogen Peroxide-Resi!1r Technique {or
Epoxidation 01 Unsaturated Fats, ОПs, and Oerivatives, Wilmington,
Oelaware.
39. Е d w а r d s W. а. Н., Н о d g е s R., J. СЬет. Soc., 1954, 761.
40. Ehrensteln М., Oecker М. Т., J. Org. Chem., 5,544 (1940).
41. Е 1 n h о r пА., 5 h е r m а пР., Апп., 287,'35 (1895).
42. Е тmоп s W. О., Ра g а по А. 5., F ree та n J. Р., J. Ат. Chem.
50С., 76,.3472 (1954).
43. Emmons W. О., Pagano А. 5., J. Ат. Chem. 50С., 77,89 (1955У.
44. Е n g 1 i s h J., Jr., G r е g о r у J. О., J. Ат. Chem. 50С., 69, 2120
(1947) .
45. Fairbourne А., Foster а. Е., J. Chem. Soc., 1926,3146.
46. F i е s е r L. F., С а m р Ь е 11 W. Р., F r у Е. М., G а t е s М. О., Jr.,
J. Ат. Chem. 50С., 61, 3216 (1939).
47. Fieser М., Quilico А., Nlckon А., Rosen W.E,. Tarl
. ton Е. J., Fieser L. F., J. Ат. Chem. Soc., 75, 4066 (19531.
48. F 1 n d 1 е у Т. W., 5 w е r пО., 5 с а n 1 а n J. Т., J. Ат. СЬem. 50С.,
67,412 (1945).
49. G а II R. J., G r е е n s рап F. Р., lnd. Eng. СЬет., 47, 147 (1955).
50. G а 11 R. J., G r е е n s рап F. О., J. Ат. ОП Chemists' Soc., 34, ИН
(1957).
51. Ginsburg О., J. Аm. СЬет. 5ос., 75, 5746 (1953'.
. 52: G 1 а t t { 1 е 1 d J. W. Е., С h 1 t t u m J. W., J. Аm. Chem. 50С., 55. 3663
(1933) .
53. G 1 а t tf i е 1 d J. W. Е., R i е t z Е., J. Ат. СЬеm. 50С., 62, 974 (1940).
54. G I а tt fi е 1 d J. W. Е., W9 о r \l {{ 5., J. l\щ. Ghещ. SQc., 49, 2309
.(1927).
55. Graber R. Р., 5noddy С. 5., Jr., Arnold Н. В., Wend
ler N. L., J. Org. Chem., 21,1517 (1956).
56. G r е е n Т. а., Н 1 1 d it с h Т. Р., Вiochem. J., 29, 1552 (1935).
57. G и n s t о n е F. О., М о r r i s L. J., J. Chem. 50С., 1957, 487.
58. Gunstone F. О., Russell W. с.; J. Chem. 5ос., 1955,3782.
59. Halperin В. 1., ОопаЬое Н. В., Klelnberg J., Vande)',
wer {С. А., J. Org. Chem., 17,623 (1952).
60. Harrles С., Pappos, Ber., 34, 2979 (1901).
61. Henbest Н. В., Nlcholls В., J. СЬет. Soc., 1957,4608.
62. Н е пЬ е s t Н. В., 5 m it h М., J. Chem. 50С., 1957, 926.
63. Н е n Ь е s t Н. В., W i 1 s о n R. А. L., J. Chem. Soc., 1957, 1958.
64. Н е r s h Ь е r g Е. В., Helv. СЫт. Acta, 17, з51 (1934'). .
65. Н е и Ь е r g е r О., О w е n L. N., J. Chem. 50С., 1952, 910.
66. Н i I d i t с h Т. Р., J. Chem. 50С., 1926, 1828.
67. Н о f m а n n К. А., Ber., 45, 3329 (1912).
68. Н о f m а n n К. А., Е h r h а r t О., 5 с h n е 1 d е r О., Ber., 46, 1657
(1913) .
69. Н о g g J. А., L 1 n с о I n Р. Н., J а с k s о n R. W., S с h n е i d е r W. Р.,
J. Аm. Chem. 50С., 77, 6401 (1955).
70. Jefferies Р. R., Mil11gan В., J. Chein. 50С., 1956,2363.
71. J о h n s о n R. а., 1 n g h а m R. К, СЬет. Revs., 56, 219 (1956).
72. К е n n е r а. W., Апп. Repts. оп Progr. Chem. . (Chem. Soc. London),
51, 178 (1954).
73. Kergomard А., Bigou J., ВиН. soc. chiffi. France, 1956,486.
74. К 1 е 1 n Ь е r g J., Chem. Revs., 40, 381 (1947).
75. Knowles W. 5., Thompson Q. Е., J. Ат, Chem. 50С., 79, 3212
(1957) .
76. L а В и d d е J. А., Н е i d е 1 Ь е r g е r с., J. Ат. СЬет. Soc., 80, 1225
(1958)./
77. L зd Ь и r у J. W., С и 11 i s С. F., Сhеш. Revs., 58, 408 (1958).
78. L а р w о r t h А., М о t t r а m Е. N., J. СЬет. 50С., 127. 1628 (1925).
79. L е s р i е а и R., Advances in Carbohydrate Chemistry, Vol. П, Acade-
mic Press, New York, 1946, р. 107.
80. Linstead R. Р., Owen L. N., Webb R. F., J. Chem. Soc., 1953,
1225.
81. L о е v В., О а w s о n С. R., J. Ат. Chem. Soc., 80, 643 (1958).
82. L у n с h В. М., Р а и s а с k е r К. Н., J. Chem. 50С., 1955, 1525.
83. М с С а s 1 а n d а. Е., Н о r s w i 11 Е. С., J. Ат. СЬет. 50С.. 76, 1654
(1954) .
84. М с К а у А. F., L е v 1 t 1 n N., J о n е s R. N., J. Аm. Chem. 50С., 76,
2383 (1954).
85. Marker R. Е., Rohrma'nn Е., J. Ат. Chem. Soc., 62, 516 (1940).
86. М i e.s сЬ е r к., 5 с h m i d 1 i n J., Helv. Chim. Acta, 33, 1840 (1950).
87. М i I а s N. А., J. Аm. Chem. Soc., 59, 2342 (1937).
88. М 1 1 а s N. А., С 1 i f f 1. 5., J. Ат. СЬет. Soc., 55, 352 (1933}.
160
Методь{ 2uдРOlссилирован.UJl
Литература
i61
89. Milas Ы. А., Kurz Р; F., AI1s1ow W..P., Jr., J.'Am. Chem,50C..
59, 543 (1937).
90. М i 1 а 5 N. А., с А 1 е v у А., J. Ат. СЬет. 50с., 55, 349 (1933).
91. М i I а 5 N. А., Мс А 1 е v у А., J. Ат. СЬет. 50С., 56, 1219 (1934).
92. М i I а 5 N. А., М 5 А I е v у А., J. Ат. СЬеm. Soc" 56, 1221 (1934)'__
93. М iI а 5 N. А., М а 1 о л е у L. 5., J. Ат. Chem. Soc., 62, 1841 (1940).
94. М i 1 а s N. А., S и s s m a.I1 5., J. Ат. СЬеm. 50С., 58, 1302 (1936).
95. М i 1 а s N. А., 5 и s s m а л 5., J. Ат. СЬеm. Soc., 59, 2345 (1937)'.
96. М i 1 а 5 N. А., S u s s m а л S., М а s о л Н. 5., J. Аtn. СЬет. Soc., 61,
. 1844 (1939).
97. Мilав N. А., Terry Е. М., J. Ат. СЬет. 50С., 4'{, 1412 (1925).
98. М о r g а л Е. D., Р о I g ar N., J. Chern. 8ос., 1957, 3780.
99. М о r r i s L. J.., СЬеm. and Iлd., 1958, 1291.
100. М и g d а л М., У о u л g D. Р.. .J СЬет. 50С., 1949, 2988.
101. М u s g r а v е W. К. R., Chem. and Ind., 1958, 881; J. Chem. 80с., 1959, 1804
102. N а и d е t М., С а r r е r а Е, Revue Frал аisе des Corps Gras., 1, 478
(1954); С. А., 49, 12283 (1955).
103. N i е d е r h а и s е r W. о., к О r О 1 у J. Е., лат. США 2485160
(1949); С. А., 44, 7346 (1950).
104. Niеmалл С., Wаgлеr С. о., J. Org. СЬет., 7,2'Л (1942).
105. О wen L. N., J. СЬет. 80с., 1949,241.
106. О vl е n L. N., S а h а r i а о. 5., J. СЬет. Soc., 1953,2582.
107. О wел L. N., 5 m i th Р. N., J. СЬет, 80с., 1952,4026.
108. Owe n L. N., S m i th Р. N., J. СЬеm. Soc., 1952, 4035.
109.Parker W. Е., Ricciuti С., Ogg С. L., Swern о., J. Ат.
Chem. Soc., 77, 4037 (1955).
1l0. G r е е л s рап, G а II R. J., М а с К е 1I а r о, о., J. Org. СЬет., 20,
215 (1955).
111. Раиl R., Tchelitcheff 5., С. R., 239,1504 (1954).
112. Р h i 11 i Р s В., F r о s t i с k F. с., Jr., 8 t а r с h е r Р. S., J. Ат. Сhещ.
50С., 79, 5982 (1957).
113. p'1 а t t n е r PI. А., Н е и s s е r Н., К и 1 k а r 11 i А. В., Helv. СЫщ
Acta, 31, 1822 (1948).
114. Р о d е J. 5. F,. W а t е r s W. А., J. СЬет. Soc., 1956, 717.
115. Polgar А., Jилgлiсkеl J. L., iл Оrgалic Алаlуsis, Vol. Ш,
Iцtеrsciелсе Publishers, New York Lоndоп, 1956,.р. 271.
llб. R....o t е r л а k Th.. F r i е д! i Н., Helv. СЫ.т. Acta, 36, 251 (1953).
117. Р r еl0 g V.,. R uz icka L., Wi е 1 а.лd Р., Неlу. СЫт. Acta, 2&, 250
(1945).
118. Р r е 1 о g..V., S с h е n k е r к., He1v. СЫт.. Acta, . 35; 2044 (1952).
119. Р r е 1 о g V., 5 с h е л k е r К, К jj л g W., Helv. СЫт. Acta, '36,471 (1953).
12\). Pret.og V., Boarlan4V., H:elv. СЫт. Acta, 38,1776 (1955)..
.1 1. Соре д. С., Jоhлsоп Н. Е.; 5tерhелsол J; S., J. Ат. СЬет.
Soc., 78, 5599 (1956).
122. С Q Р е А. С., L i s s т. А., w о о d о. W.; Сhещ. and Ind., 1956, 823.
123. С о р е А. с., L i s s Т. А.. W о о d о. W., J. Ат. Chem. 50С., 79, 6287
(1957) .
124. С о Р е А. с., F е л t о л 8. W., 5 ре л с е r С. F., J. Ат. СЬет. 50С.,
74, 5884 (1952). .
125. С о ре А. с., К е о и g h А. Н., Ре t е r s о л Р. Е., 8 i m m о л s Н. Е.,
Jr., Wood о. W., J. Ат. СЬет. 8ос., 79,3900 (1957).
126. С о ре А. с., F О и r л i е r А., Jr., 8 i m m о п s Н. Е., Jr., J.. Ат. СЬет.
50С., 79, 3905 (1957).
I'Л. Prelog V., 5сhелkеr к., Gjjлthаrd Н. Н., Helv. СЫт. Acta,
35, 1598 (1952).
128. Prevost с., С. R., 196,1129 (1933).
129. Р r е v о s t с., С. R., 197, 1661 (1933).
130. Р r е v О <; t с., L и t z R., С. R., 198, 2264 (1934).
131. Пр и л е ж а е в Н., Ber., 42, 4811 (1909).
132. Рriлs о. А., Rеiсhstеiл Т., Helv. Chim. Acta, 25, 300 (1942).
133. R а m а л Р. 8., Сиrrелt 8ci. (Iлdiа), 26,52 (1957).
134. R а р h а е 1 R. А., Асеtуlелiс Соmроилds in Оrgалic 5улthеsis, Butter-
worths, Lолdол, 1955, р. 33. .
135. R а р h а еl R. А., J. СЬеm. 50С., 1949, 544.
136. R е i с h Н., S и tt е r М., R е i с h s t е i n 1., Helv. СЫт. Acta, 23,
170 (1940).
137. R i с с i и t i с., 8 i 1 Ь е r t L. 5., Р о r t \v. 8., J. Ат. ОН Chemists'
Soc., 34, 134 (1957).
138. Riiber с. N., Ber., 48, 827 (1915).
139. R i g Ь у W., J. СЬет. 80с., 1956, 2452.
140. Roberts J. о., Sauer С. W., J. Ат. СЬет. Soc., 71, 3925 (1949).
141. Roebuck А., Аdkiлs Н., Org. Sулthеsеs, 3,217 (1955).
142. R о s s J., G е Ь h а r t А. 1., G е r е с h t J. F., J. Ат. СЬет. 80с., 71,
282 (1 ).
143. Russell Р. В., J. Ат. СЬет. 80с., 78, 3115 (1956).
144. Seguin Р., С. R., 216, 667 (1943).
145. Se'rini А., Lоgеmапл W., Ber., 71,1362 (1938).
146. S е r i л i А., L о g е m а л л W., н i I d е Ь r а n d W., Ber., 72, 391
(1939) .
147. 8 h орр е е С. W., 8 h орр е е . Е., iл Rodd Е. Н., Ed., Chemistry of
СаrЬол Compounds, Elsevier, Amsterdam, 1953, р. 87&...--982.
148. 5 Р r i л g F. 8., Алл. Repts. ол Progr. СЬет. (СЬет. 80с., Lолdол)',
40, 107 (1943).
149. 8toll А., Liлdелmалл А., Jucker Е., Hclv. СЫт. 'Acta, 36.
268 (1953).
150. Stra ив F., ohrbacher А., Ber., 54,69 (1921).
151. S w е r л о., J. Ат. СЬет. Soc., 69, 1692 (1947).
152. 8wern о., J. Ат. СЬет. 50С., 70,1235 (1948).
153. 5 w е r л о., Chem. Revs., 45, 1 (1949).
154. Орrзнические реакции, сб. 7, ИЛ, 1956, стр. 476.
11 3ак. 1416
162
А1етоды zидроксилuровйния
155. S w е r n О., В i 11 е n G. N., F i n d 1 е у Т. \V., S с а n 1 а n J. Т., J. Ат.
СЬет. Soc., 67, 1786 (1945).
156. SWern О., Billen G..N., Scanlan J. Т., J. Ат. СЬет. Soc., 68,
1504 (1946).
157. S W е r n О., D i ск е 1 G. В., J. Ат. СЬет. Soc., 76, 1957 '(1954).
158. S W е r n О., F i n d 1 е у Т. W., J. Ат. СЬет. Soc., 72, 4315 (1950).
159. S W е r n О., F i n d 1 е у Т. W., S с а n 1 а n J. Т., J. Ат. СЬет. Soc.,
66, 1925 (1944).
160. S W е r n О., Р а r k е r W. Е., J. Org. СЬет., 22, 583 (1957).
161. Синтезы орrанических препаратов, 1, 422. (1932).
162. Т i s hl е r М., F i е s е r L. Р., W е n d 1 е r N. L., J. Ат. СЬет. Soc.,
.62, 2866 (1940).
163. Т r а у n а r d J. с., ВиН. soc. chim. France, 1952, 323.
164. Т r е i Ь s W., Ber., 72, 7, 1194 (1939);
165. Ушаков М. И., Чистов В; О., Вес., 68, 824 (1935).
166. Ушаков М. И., Чйстов В. О., Шлосберr М. А., ЖОХ, 5,1391
(1935).
167. W а t е r s W. А., Апп. Repts. оп Progr. СЬет. (СЬет. Soc. London),
42, 152 (1945).
16В. W а t е r s W. А., in GiIman Н., Ed., Organic Chemistry, Ап Ad-
vansed Treatise, Vol. IV, John Wiley and Sons, New York, 1953, р. 1165.
169. W ei t z Е., S с h е f f е r А., Ber., 54, 2327 (1921).
170. W i Ь е r g К. В., S а е g е Ь а r t h К. А., J. Ат. СЬет. Soc., 79, 2822
(1957) .
171. W i е 1 а n d Н., В е n е n d W., Вес., 75, 1708 (i942).
172. Wieland H.,. ehringerH., Апп., 549, 209 (1941).
173. Орrанические реакции, сб. 9, ИЛ, 1959, стр. 445.
174.. W i n s t е i n S., В u с k 1 е s R. Е., J. Ат. СЬет. Soc., 64, 2780, 2787
(1942).
175. W i t t с о f f Н., М i 11 е r S. Е., J. Ат. СЬет. Soc., 69, 31ЗS( 1947).
176. W i t t с о ff Н, R о а с h J. R., м ill е r s. Е., J. Arn. СЬет. Sot.,
71, 2666 (1949).
177. w.нzепtапп Е. J., Evans W. L., Hass Н., Schroeder Е. Р.,
Org. Syntheses, 2, 307 (1943).
178. W о о dw а r d R. 8., пат. США 2687435; С. А., 49, 14809 (1955).
179. W о о d w а r d R. В., В ("и t.c Ье r Р. V., Jr., J. Ат. СЬет. Soc., 80,
209 (1958).
180. С 0'1 е m а n J. Е., S w е r n О., J. Ат. ОН Chemists' Soc., 35, .675
': (1958).
181. Ё а s t h а m J. Р., М i 1 е s G. В. , К r а tli С . А. , J . Ат. СЬ S
ет. . ос.,
81, 3114 (1959).
182. В r и t с h е r F. V., Jr., Е уа ns G., J. Org. СЬет., 23, 618 (1958).
183. Н о u s е Н. О., R о R: S., J. Ат. СЬет. Soc., 80, 2428 (1958).
184. Z i m m е r m а n Н. Е., S i n g е r L., Т h у а g а r а j а n В. S., J. Ат..
СЬет. Soc., 81, 108 (1959).
СЕЛЕКТИВНОЕ РАСЩЕПЛЕНИЕ БЕЛКОВ
Е. О. ТОМПСОН
ВВЕДЕНИЕ
3а" последние 15 лет наши представления в области хи-
мии белков существенно и3Менились. Так, если в 1944 r. по.
следо ательностьсцепления аМИНОКИСЛОТ в белках была из-
вестна лишь' дл'я нескольких полипептидов, выделенных из
прОАУИОВ .Ч8сТичнorо rи:iфолиза белков [304], то в настоя-
щее .вреМя представляется возможным изобразить последова-
тет.иость аминокислотных остатков во мноrих крупных по.
bипerrrцзх, В том числе в инсулине [264], который. по своей
lt}mPоJ.ttНtаходится На rраннце между полипептидами и белка-
ми. 'в результате неДавно проведенных исследований точно
устаlIOВJIеНО разлйчие между инсулинами, выделенными из
жИвотных различных видов [46, 143]. Более Toro, методы рас-
щ пления, ока'завщиеся столь удачными применительно к ин-
cjJJ:ИНУ, С исключительным успехом используются наряду с
друrими тодами.исследования для изучения ряда белков.
ОБЪeJcr:oъi еТ8:льнЬfХ исследований явилась рибонуклеаза
белок, ''СОJiержащий 124 в'минокислотных остатка; химическое
kе'эТоrо бе,nка почти полностью установлено [9, 218J.
ЗJt8чиТёлыiые' успехи достиrнуты в изучении строения ЛИ30-
цима (йол: Вес 14700) .[311, 'з13J и параина (мол. вес 20340)
[296J. Следует отметить,. что точные молекулярные веса бычь-
ero инсулина [270] и рибонуклеазы [218], равные соответствен-
но 5732 и 13683, были установлены только на основании дан-
ных об их строении. Эти успехи в исследованиях структуры
беЛl<qвых СQединений знаменуют собой важный этап разви-
тия биохимии.
,; В орrанической химии оБыiныыM методом определения
с роеI;lИЯ сложных соединений является расщепление. их на
более простые составные части, которые MorYT быть выделе-
ны в чистом виде и идентифицированы. По строению оскол ов
устанавливает.ся структура исходноrо соединения, цто под-
тверждается, если это возможно, синтезом.
11.
Селективное расщепление белков
Введение
165
164
Для определения строения белков разработан ряд MeTO
дов, которые еще 20 лет тому назад были неизвестны, хро-
матоrрафия, противоточное распределение и ИОНQфорез в He
подвижной среде. Блаrода ря указанным методам удалось
получить белки в чистом виде и выделить их составные ча
сти пептиДЫ, аминокислоты и их производные. Эти методы
характеризуются не только высокой эффективностью, но по:
зволяют работать с количествами вещества порядка нескоЛЬ
ких микроrрамм. Следующим этапом явилась разработка хи
мических методов идентификации аминокислот и пептидов,
полученных расщеплением полипептида [266, 277, 320].
Возможности синтеза, появившиеся в результате YCTaHOB
ления последовательности аминокислотных остатков, были
незамедлительно осуществлены на пра.КТИJ{е. После определе
ния строения окситоцина [85] и вазопрессина [243] методом
последователыюrо расщепления Дю Виньо с сотрудниками
изящно подтвердили их строение прямым синтезом [20, 82, 84].
Описаны друrие методы синтеза окситоцина [34, 35, 258, 330].
Синтезированы также друrие при родные полипептиды rpa.
мицидин S [280] и rипертенсин [256, 279].
Биохимикам удалось создать еще более интересные соеди-
нения. Так, блестящим доказательством широких теоретиче-
ских и практических возможностей, открытых достижениями
химии пеПтидоВ, явился синтез первоrо ropMoHa с заДаННОЙ
структурой оксипрессина [172], в молекуле KOTOpOro сочета-
ются CTPYKTypHЫ особенности окситоцина и вазопрессина и
который обладает биолоrическими свойствами обоих указан-
ных ropMoHoB.
Применительно к белкам с более высоким молекулярным
весом существующие методы не позволяют полностью YCTa
новить последовательность аминокислотных остатков, но де-
лаются попытки свести проблему к выяснению природы «aK
тивноrо центра» молекулы. Например, папаин, содержащий
178 аминокислотныХ остатков, удается подверrнуть фермен-
тативному расщеплению и удалить 2/3 аминокислотных остат-
ков при полном сохранении ферментной активности (в рас-
чете на 1 моль) [148]. Установлено, что ферментная актив-
ность связана с сульфrидрильной rруппой, входящей в COC1i'aB
активноrо центра. Трипсин и химотрипсин приобретают фер-
ментную активность при разрыве лишь одной пептидной связи
в исходных неактивных молекулах [224, 225, 257].
В результате определения концевых rрупп большоrо коли
чества белков установлено, что мноrие простые белковые co
единения содержат цепи, в состав которых входит свыше 100
аминокисЛОТ. В этом отношении цепи молекулы инсулина,
содержащие 21 и 30 аминокиСЛОТ, представляют исключение,
хотя, как показал Мидом [214], химотрипсин состоит из трех
цепей, две из которых содержат 13 и 50 аминокислотных,
остатков соответственно. В подобных коротких цепях HeKO .
торые аминокиСЛОТЫ встречаются лишь по одному разу, и
СJроение исследуемоrо соединения удается установить путем
адентификации пептиДОВ с короткой цепью, получаемых
равнительно неспецифическими методами расщепления, Ha
прнмер частичным кислотным rидролизом.
В более длинных цепях аминокислотные остатки крайне
редко встречаются по одному разу, обычно же в таких цепях
имеется не меньше пяти одинаковых аминокислотных OCTaT
ков. В этих случаях для изучения соединений с длинной
цепью требуются .более селективные методы rидролиза, и для
установления последовательности аминокислот необходимо
выделять полипептиды с более длинной цепью. Однако такие
полипептиды с трудом поддаются фракционированию; для
каждоrо выделенноrо полипептида должны быть определены
количественный состав и последовательность сцепления ами.
нокислот.
Эта проблема значительно упростил аСь бы, если бы нам
были известны методы специфическоrо разрыва оrраничен
Horo числа пептидНЫХ связей, например связей, в которых
участвует какая либо одна аминокислота или родственные ей
аминокислоты. Для химика, работающеrо в области химии
пептидов, селективное расщепление белковых.молекул являет-
ся заветной мечтой, которая в настоящее время еще далека
от осуществления.
Идеальный peareHT для селективноrо расщепления бел-
ков должен отвечать следующим требоваJШЯМ: 1) вызывать
расщепление в условиях, исключающих расщепление связей
между друrими аминокислотами, и по возможности не при-
водить к рацемизации; 2) расщепление должно протекать с
хорошим выходом каЖ'доrо из искомых аминокислотных
остатков; 3) полученные в результате расщепления осколки
должны быть приrодны к фракционированию и очистке.
. Природные ферменты наиболее близки к идеальным реа-
reHTaM специфическоrо расщепления белков. Трипсин являет-
ся. наиболее специфичным; в отношении друrих протеин аз
установлены отклонения от специфичности, которой следовало
бl:oJ Q;жидать на ОСновании изучения их взаимодействия с син-
Т ""1J КИМИ субстратами. Однако известно, что трипсин рас-
.U1epJJJleT пептидные связи, в которых участвует карбоксиль-
H8SJ rруппа лизина или арrинина, имеющих положительно
заряженную боковую цепь. До <;их пор не обнаружеuо
16()
. Селективное расщепление белков
Номен"латура и типы nолunеnтидных цепей
167
расщепления трипсином друrих типов связей, но в то же вре-
мя установлено несколько случаев, коrда трипсин не вызы-
вает rидролитическоrо расщепления связей, в которых уча-
ствуют указанные выше остатки с положительным зарядом.
Ферменты способнь! также катализировать образование
связей,' которые первоначально отсутствовали в изучаемой-
молекуле [131, 333]. В структурных исследованиях все боль
шее применение находят протеолитические ферменты, ДHaKO
при этом не было получеНО.никаких доказательств образова-
ния новых связей в сколь.ко-нибудь заметных 'количествах.
Тем не менее по крайней мере для двух ферментов с различ-
ной специфичностью трипсина и химотрипсин , которые
вряд ли способl!Ы вызвать {)бразование о.lfной и той. же
связи, потребовал ось доказать отсутствие образования новых
связей.
Химики-орrаники до настоящеrо времени не достиrли су-
rцecTBeHHЫx усПехов в ра работке методов селектийноrо рас-
щепления. белков, однако имеющиеся данные 'о последов-а-
тельности сцепления аминокислот и стандартизация методов
определения концевых rрупп при расщеплении пептидных свя-
зей создают основу для исследования новых методов. Доступ-
ность инсулина с точно установленным количественным со-
ставом [223] и друrих белкЬв в сравнительно чистом виде
должна послужить .стимулом для. дальнейшеrо изучения про-
блемы селективноrо расщепления. .' .
к сожалению, химики,lfзучающие oвыe реакции пепти
дов, обычно пользуются только .rфостыми модельными соеди
нениями, в том числе ди- и трипептидами, .которые имеются
в продаже. Это отчасти объясняется тем, что .nри переходе
к более сложным полипептидам или белкам затрудняется кон-
троль за ходом реакции. Друrая причина заключается в ма-
лой доступности этих более сложных соединений, которые
удается выделить в сравнительно небольших КОЛИ1Jеtтвах, в
связи с ч.ем их строение устанавливалось на очень неболь-
ших образцах. Таким образом, желатель»О добиться TaKoro
положения, чтобы исследователь Mor при обрести обраЗЦI:!! по-
липептидов известноrо строения и высокой степени чистоты,
как это в настоя!Цеевремя делается с образцами инсулинi
через I(омисси:ю по белкам Международноrо союза Теорети-
ческой и прикладН-ой химии.
В настоящем обзоре обобщены химические и ферментные
методы селективноrо раёrцепления полипептидных цепей.
Автор не ставил перед собой задачи дать ссылки. на все ра-
боты по данной теме, считая более необходимым привести
ссылкА на обзорные и ИТОl'овые статьи.
НОМЕНКЛАТУРА И ТИПЫ ПОЛИПЕПТИДИЫХ ЦЕПЕЙ
Полипептидные цепи COCT0S!J из аминокислот, соединеflных
между собой пептидными связями. т. е. связями между а-ами-
ноrруппами и а-карбоксильными rруппамй. Существуют от_"
крытые, циклические 11 разветвленные полипептидные цепи.
Как правило, открытые полипептидные цепи имеют на од,
ном. конце свободную а-аминоrруппу а на друrом свободную
а-карбоксильную rруппу, которые MorYT быть обнаружены
различными методами определения концевых rрупп [I14, 277,
320]. В разветвленной полипептидной цепи одна. из rрупп в
зависимости от характера разветвления может отсутствовать.
Большая часть белков представляет собой соединения с от-
крытой цепью [265, 277].
Общепринятая номенклатура пептидов основана на пред-
ложениях Сэнджера и Таппи [271]. Остатки, имеющие свобод-
. ную а-аминоrруппу, называются N-концевыми, а остатки со
свободной а-карбоксильной rруппой С-концевыми rруппа-
1(11. С", :целью упрощения изображения. последовательности
ра Dоложеиия ам.,нокислот пользуются сокращенными назва-
ВИЯ ;аМИИЩQlСЛОТНЫХ остатков, состоящими обычно из трех
Первых букв tr8.зваиия [41]. N-Концевые и С-концевые остатки
отЛичают от остатков виутри цепи, добавляя к сокращению
соответственно H и OH.
'Ёсли ПОРЯдок расположения аминокислот в пептиде изве-
стен, то при написании структурной формулы сокращения. раз-
деляютсяточками. Например, Н. rли. Ала. ОН обозначает
дипептид rЛИЦИЩl.лании. СОlфаiдени.е Н. rли. (А.ла. Лей.) ОН
соответствует пептиду. в 'котором N-концевая rруппа пред-
ставляе.т собой rлицин (rликокол), а порядок расположения
аланина и лейцина не известен [266]. Если нет оrоворки,
1'0 все оптически активные "аминокислоты относятся к l-ряду;
Следует иметь в виду, что в ряде случаев N- или С-кон-
Ц8вые аминокислотные оетатки не MorYT бытьобнаруженьr
потому, что существующие методы их определения недоста-
точно совершециы. Известны также случаи, коrда в полипеп-
тиде с открытой цепью N-концевой, С-концевой остатки или
оба ОС'Iаткамаскируются кевалентно Сl}язаННОЙ ацидЬНОЙ или
амидной rруппой. Так, окситоцин [85, 326], вазопрессин [243]
м a-меланофоросТ1fМУJ.l.ИРУЮЩИЙ ropMoH [139] имеют C KOHцe- .
вые 8мидные rpyrmbl." В вирусе та.бачной мозаики (38), Ct-мела
нофоростимулир м ropMOHe [139] и полимиксине В I [144]
коlЩ*в8и аминоrруппа маскируется заместитеЛем .
В ./JКИ не так часто имеют 1!икличеtкую' структуру, как
считалосьн колько лет тому назад. Более тонкие ме'!<>ды
168
Селективно расщепление белков
Номенклатура и типы nолиnеnтидных цепей
169
определения концевых rрупп позволили обнаружить HOBЫ
концевые rруППы. Так, химотрипсиноrен имеет N концеJЮ
полуцистиновый остаток [29, 214], а оваЛЬQ,УМИН С концевои
пролиновый остаток. [230]. Бычий тормон роста содержит
два N концевых остатка и только один С концевой остаток,
что Дает ВОЗМО1Кность предполо1КИТЬ наличие разветвленной
цепи, в то время. как тормоны роста обезьяны и человека
содержат. лишь один N концевой и один С концевой остатки
[197]. I(оллаrен [36, 126] и кератин [40, 317, 344] eДHHCTBeH
ные белковые соединения, в которых не удалось установить
наличия концевых rрупп в стехиометрических количествах.
В этой связи следует указать на существование циклических
полипептиДОВ, например rраМИll,идина S [64], тироцидина
А [232], тироцидина В [180] и фаллоидина [215, 342].
На протяжении мноrих лет обсуждался вопрос о том, как
соединены между собой полипептидные цепи [53, 305]. Наи
более часто встречающейся ковалентнЬй связью, соединяющеЙ
полипептидные цепи, является дисульфидный мостик ци
стина. В последнее время в мостиках между полипептидны-
ми цепями обнаружены также фосфатные rруппы [237]. Уста-
новлено lIаличие как диэфирных, так и пирофосфатных
связей, причем по аналоrии с дисульфидными мостиками
фосфатный мостик может связывать две различные полипеп
тидные цепи (межцепочечный мостик), ил соединять два
'Остатка в одной и той же цепи, давая цикл (внутрицепочеч
ный мостик).
Возможны и друrие типы связей, приводящие к образова
ниЮ полипептидов трехмерной С1'руктуры, но их существова
ние . не получило еще экспериментальноrо подтверждения.
Так, имеются основанные на реакции fофмана данные [170,
183]. о наличии связей между полипептидными цепями инсу
лина, rлиадина и химотрипсина за счетаминоrрупп и (i)-Kap
боксильных rрупп изоrлутаминовоrо или изоаспараrиновоr
остатка. В случае инсулина существование подобных связеи
co
I
OC1 CH NH
)- I
(СН 2 )n
I
CONH 2 NH 2
n == 1, остаток аспараrина
n == 2, остаток rлутамина
CO
I
CH NH
I
(СН 2 )n
I
CONH 2 NH 2
I I
CH NH OC1 CH NH':"'"
I I .
(СН 2 )n (СН 2 )n
I I
CO CO
n == 1, остаток изоаспараrииа
n == 2, остаток изоrлутамина
СНО
r иэ ( H2)n+2NHa
I
СООН
п == 2, -формилпропионовая
кислота
СООН
I
CH NH2
rидролиз I
(СН 2 )n
I
NH 2
n == 1, IZ, -диаминопро-
пионовая кислота
n == 2, IZ, i-диамино
масляная кислота .
n == 1,
-формилуксусная
кис))ота
Ф
СНО+СО 2
I
СО з
не было подтверждено [269]. Однако при реакции I'офмана
с полипептидом из В. subtilis были получеllЫ кристаллические
производные -формилпропионовой кислоты [48], что соrла-
суется с наличием связей полиrлутаМиновой кислоты в j-ПО-
ложеюiИ, и незначительные количества а, i диаминомасляной
кислоты. Поскольку синтетический поли l rлутамин леrко
дает последнее соедицение [ 7], был сделан вЫвод, что при-
родный поли-d пептид, вероятно, содержит лишь i rлутами-
новые связи; это подтверждается проведенной в последнее
время работой [59]. . .
Наличие в полипептидах' необычных типов связей свиде-
тельствует о существовании биолоrическоro механизма их об-
разования, а также о том, что они MorYT присутствовать в
белках. Трудности исследования белков делают маловероят-
ным обнаружение ОДИНОЧНQrо аминокислотноrо остатка, на-
пример е: аминоrруппы ЛИЗЩlа, участвующеrо в образовании
необычноrо типа связи. Однако' для низкомолекулярных по..
липептрдов, например . б,щитрацина А и полимиксина В,
имеются данные, свидетельствующие о наличии связей не-
ьбыч:ноrо типа. Так, в бацитрапине А е: аминоrруппа лизина
и карбоксильная труппа аспараrиновой кислоты участвуют
в образовании пептидной связи, приводящей к появлению
С 2 Н 5 СНЗ
" /
СН
l' /S CH2
"'TH2 CH C I
'\N CH CONH
110
Селективное расщеn,i!eние. беЛКd(}
Разъединение nолиnеnтидных цепей
111
в молекуле цикла [145, 205]. Имеются также даннЫе [206, 337]
о пониженной реакционной способности а аминоrрупПЫ иэо
леЙЦlщовоrо остатка и SН-rруппы в соседних остатках, что,
по-видимому, объясняетёя образованием ТИ8ЭОЛИН9воrо цик-
ла (1). В полимиксине В. цепь разветвляется за счеТ амино
rрупп а, 1 диам.иномасляной кислоты 1144}.
При использовании надмуравьиной кислоты в качестве
окислителя выход [157, 179, 185, 316] цистеиновой кислоты
из цистеина, цистина и белков с известным содержанием: ци
стина не количественный '(90:t. 2%) . 1276}, прцчем данные о
побочных продуктах реакции окисления отсутствуют. В ин;
сулине для разъединения полипептидных цепей необходимо
О"Кислить два дисульфидных мостика между цистеиновыми
остатками различны,Х цепей, т. е. максимальный выход COCTa
вит 0,9 Х 0,9, или '81 % разъединенных цепей с сульфоrруп
.пами. При учете окисления в"утрицеПОЧ Чlюrо дисульфидноrо
мостика .максимальный выход разъединенных и полностьЮ
окисленных цепей буд т еще ниже. В этой связи' необходимо
указать, что данные о почти количественном выходе разъеДI:I-
ненных цепей йнсулин [240] нельзя считать надеж ыми [316].
В промышленности для обработки шерсти [5] вместо над-
муравьиной кислоты .предпочитают применять HaДYKCYCHY
кислоту, так как она устойчива. к ДеЙСТВИЮ воды и не раСТ80:;
ряет шерсть. Надмуравьиная кислота р?злаrается водой и
растворяет значительное, но не постоянное количество шер
сти [33]: По специфичности надуксусная кислота не отличает-
ся от надмуравьиной но точная количест;венная характери
стика процесса окисления не установлена.
При ,Изучении ст.роения. белков предварительное окисле-
нне исследуемоrо соединения не только высвобо>кда т поли-
пептидные цепи, но и разрушает внутрицепочечные циклы,
деJJая тем сам,ЫМ полипептидную цепь . более . восприимчи'вой
к ферментативному rидролизу. Например, при действии трип
сина на нативную рибонуклеазу фраrментация исходноrо беЛКа .
составляе'r Bcero 10% фраrментации пр дваритеJJЬНО окислен-
ной риБQнуклеазы ТрИПСI{НОМ [150]. вызывающим раЗРЫI}
большинства связей, на .которые он действует, на 85 IQO%.
ПО друrому методу цистиновые ме?Кцепочечные МОСТИI{И
окисляются бромом ИЛИ бромной водой, что так>ке приводит
к образованию сульфоrрупп. В случае ц"!стина выход цистеи;
новой кислоты кол'ичественный. Однако при попытках окис-
лить цистин инсулина и папаи а бромом без предварительноrq
частичноrо rидролиза продукты окисления были получень!
с невысокими выходами [316]. Для. щ>вышения. сте ни з ;
вершенности оКисления белки предварительно можно подвер-
raTb денатурации ил'и восстановлению. Из окситоцина
одноrо из низших полипептидов, при окислении бромной
водой образуется цистеиilOвая кислота с хорошим выходом;
одновременно наблюдается специфическое расщепление тиро
Зилизолейциновой связи (см. ниже раздел «Бромная
вода). '
РАЗЪЕДИНЕНИЕ попИПЕПТИДНЫХ ЦЕПЕП.
, Разрыв 'мостиков между ПОJ.I ипептидными цепями, обра-
<iуЮЩИМН белок, по видимому, является наиболее сеJIектив
ным метоДом расщепления и необходимым предварительным
этапом ра деления полипептидных цеПей.
Окнсле,:,ие дисульф.идных связей
Связи S S леrко окисляются до rрупп SОзН под
действнем мноrих окислителей, но побочнЫе реакции в MeHJj
шей степени протекают при ИСПОЛЬЗQвании надкислот, напри
мер надмуравьиной и наДУI\СУСНОЙ кислот.
Надмура!Зьиная кислота, леrко образующаяся при. взаимо-
дейстщlИ муравьиной кнс.лоты Н перекиси водорода [322],
п;ыла ИСПОЛl?зована Сэнд'жером [263].для разъединения поли-
пе.птидных цепей инсулииа. 1Jce аМИНОКИСJIотные остатки rли-
цильной цепи окисленноrо инсулина были" выделены. в' сте-
'хиометрических количествах [149]'в результате обраб.отки
лейцинаМИНQпептидазой. что свидетельствует об l-конфиrу-
рации и отсутствии рацем зации при ОКИСЛеНИИ. Надмуравьи-
ная ки ота в последнее время использовалась при изучении
мноrих полипептидов и белков, причем ни в одном случае не
на людалось разрыва пептидной связи. Помимо цистина и
цист ина liзменения под действием надмуравьиной кислоты
п-ретерпева:ют только метионин; превращающийся в сульфон
[150] с выходом 90%, и триптофан, который поrлощает три
атома кислорода 1322]. Белки, содержащИе триптофан (Ha
прим р лизоди ), при окислении надмуравьиной кислотоЙ
темн ют; НО":НI! ,В. JIи.эоциме [319], ни впапаине Л79] пеПТl-iд
ные связи не разрываются. При окислении в определенныx
условиях мо>кет происходить потеря тцрозина [150], а в при-
СУТС1.'вйи хлорид-ионов тирозин частично превращается в
3 хлортирозин и реже .в 3,5-дихлортирозин [315]. При со-
блюдении особых мер предосторожности, не допускающих со-
здания высоких концентраций перекиси водорода и хлорид-
ионов, удается иэбежатр образования хлорпроизводныx тц-
розииа [222, 315]. .
'.
172
Селективное расщепление белков
Разъединение nолиnеnтuдНbl!' цепей
173
R $------S R' +R"SH +Z RSH + R' S7"S R"
R' S S R" +R"SH () R'SH+R" S S R"
вых мостиков за счет действия небольшоl'О количества SH
rрупп и возникновения новых межцепочечных цистиновых.
мостиков, так что образуется более развитая трехмерная
структура. Аналоrичная реакция обусловливает взаимное
превращение в пептидах, содержащих цистин, при rидролизе
инсулина [260] в щелочной и кислой средах. При Этом удалось
выделить большее количество подобных пептидоВ, чем этоrо
можно было ожидать, исходя из данной структуры белковой
молекуЛЫ. Очевидно, что реакция протекает по различным
механизмам, а переrруппировка блокируется инrибиторами и
связывающими SН-rруппы реаrентами в щелочной среде и
тиолами в кислой среДе.
Для восстановления цйсrина в белках можно использ вать
большое количество кислых и щелочных восстановителеfj, но
обычно предпочтение отдается тиолам, которЫе восстанавли
вают в мяrких условиях и не дают побочных реакций. Ши
роко применяются также сульфит и бисульфит, которые с
цистином дают эквимолярные количества цистеина и соли
цистеин S-сульфокислоты [61, 208]. Сесил и Макфи [52, 212],
изучая кинетику реакции сульфита с простыми дисульфида
ми, показали, что при рН > 9 протекает бимолекулярная
реакция:
R S-...-.s R+SО R S SOi +RS
RS + н+ +Z RSH
Восстановление дисульфидных связей
Восстановление дисульфндных св зей являетсй более спе-
цифической реакЦIН Й, чем окисление, в том отНо1.t1еШШ, что
реЗrенты йе затраrивают триптофана и метионина. В каче-
стве восстановителей обычно используются такйе простые
ТИОЛОl:!ые соединения, как тиоrликолевая кислота, меркапто
ЭТа нол и цистеин. Равновесные реакции можно сдвиrать в
требуемом направлении, при меняя избыток восстановителя.
В ОТЛичие от окисления надкйслотами реакционная спо
собность цистиновых связей [109, 201, 238] по отноШению к
различным восстановителям неодинакова, и полное BOCCTa
новление, как правило, достиrается лишь в определенных
условиях. Блаrодаря леrкости окисления SН rрупп, oco
бенно в щеJiОЧНОЙ среде, восстановленный белок обычно CTa
билизируют реакцией с иодуксусной кислотой, иодацетами-
дом или дру ими реаrентами, блокирующими тиоловые
rруппы.
RSH+ICH2CONH2+0H RSCH2CONH2+H20+I
ДЛЯ полноrо восстановления обычно необходимо исполь-
зов.ать тиол и peareHT, вызывающий разрыв водородных свя-
зей, а следовательно, и разделение пептидных цепей. Так, ин-
сулин полностью восстанавливается только тноrл колятом в
присутствии 8 М раствора мочевины [202], а электрофорез на
бумаrе в 8 М растворе мочевины поз.воляет разделить ДВе по-
липептидные цепи. В отсутствие мочевины цистин восстанав-
ливается не более чем на 2/3. Степень вОсстановления дисуль-
фидных связей рибонуклеазы [282] также определяется кон-
центрацией мочевины. Тиоrликолят при рН 7 в отсутствие
поверхностно-активноrо вещества [209] ИЛfi rуанидина [171]
восстанавливает только. одну цистиновую связь из 17 связей,
имеющuхся в альбуминах человека и быка (мол. вес 65000).
в 0,2 М растворе натриеtюй соли децилсульфата при рН:7
в течение 1 час при комнатной температуре восстанавлива-
ются все цистиновые связи.
Желатинизация белков в присутствии мочевины объяс-
няетсЯ [158] взаимным nревращением тиоловых и дисульфид
ных rрупп соседних белковых молекул. Путем разрыва водо-
родных связей и выпрямления цепей белковьiх молекул моче.
вина создает условия для разрыва внутрицепочных ЦИСТИН9
При рН < 9 порядок реакции более сложен. Установлено, чТО
реакционноспособным компонентом является SO . а не
HSOi, и. что на скорость реакции заметное влияние оказы
ваЮТ э,Деgтрохимические факторы. Так, наличие отрицательно
зарйжеttltых rруhп coo рядом с дисульфидными связями
связывается со снижением скорости реакции, а положительно
заряженных rpynn с повышением скорости реакции.
Реакция SO с инсул.ином может служить примером за
висимости реакции от условuй [51]. Так, при рН 2,8 5,5
реакция протекает медленно и происходит разрыв толь о
одной дисульфидной связи; при рН 6,2 7,2 реакция проте-
кает значительно быстрее и разрываются две дисульфидные
связи, а при рН> 7,2 блаrодаря ионизации тиоловых rрупп
реакция становится обратимой; при рН 9 проис;:<одит раз-
рыв только 0,4 эквивалента днсульфидных связеи. Реакция
восстановления может быть доведена до конца при рН 6,5
7,0 в 8 М растворе мочевины и 3 М pacТl ope хлористоrо rya-
нидиния, а при рН 7,O 9,O в присутствии rидроокиси фе-
нилртути (11).
Селективное расщепление беЛКО8
Разъединение nолиnеnтuдных цепей
175
174 .
В последнее время исследован друrой метод доведения
восстановления до конца [16, З03], заключающийся в обра-
ботке сульфитом в таких условиях, при которых тиол вновь
окисляется _ в дисул фид. ОбраЗОВflВШИЙСЯ дисульфид реаrи-
рует :далее с друrой молекулой сульфита и полностью превра-
щается в s sоз -rруппу [61]. В отличие от цистеина rруппа
S SОз устойчива на воздухе, что позволило рекомендовать
это производное [303] для стабилизации цистеиновых соедине-
ний при хроматоrрафировании на бумаrе. Обработка инсу-
лина SO и окислителем приводит к высоким выходам 'со-
единений этоrо типа [16, 303]. Кроме '{oro, S SОз -rруппа
.(IerKo превращается в друrие представляющие интерес rруп-
пировки, например S CN, которые MorYT разлаrаться
снова с образоваИ{fем тиола [303].
Соединения, содержащие SСN-rруппы, леrко получить
из дисульФидов взаимодействием с растворами цианидов:
R S S R + CN RS + RSCN
" /
CH CH2 S S CH2 CH + CN
/ \.
"- /
CH CH2 -S + NCS CH2 CH
/ "-
"- "-
CH CH2 SCN+OH C==CH2+SCN +H20
/ /
Расщепление фосфатиых мо<;тиков
Все фосфатные мостики неустойчивы в присутствии щело:"
чи, например 0,25 н. NaOH при 250 [237]. Селективное рас-
щепление различных соединений было достиrнуто использо-
ванием фосфатаз, которые в простых субстратах специфичны
по ОТНОШеНИЮ к различным фосфатным связям [237]. Фос-
фатные rруппы, образующие межцепочечные мостики, после
превращения в моноэфиры можно выделить в . виде неорrани-
ческоrо соединения действием фосфомоноэстераз раститель-
Horo или животноrо происхождения.
Используя различные ферменты, можно охарактеризо-
вать фосфатные связи в белковом соединении как качествен-
но, так и количественно. Так, в а-казеине на долю моноэфи-
ров IV падает 40% общеrо содержання фосфора, на долю
амидоэфиров V также. 40% и на долю пирофосфата VI
20%. В -казеине весь фосфор присутствует в виде .диэфиров
VII, .связывающих. пептидные цепи. При разрыве .межцепо-
чечных фосфатных мостиков происходит расщепление а-
fJ-казеинов на более мелкие осколки.
О
#
O P OH
"-
ОН
IV
О О
11 11
O P P O
11
OtI он
VI
о
#
NH P O
"-
ОН
V
О
11
o P o
. I
он
VH
11
" " " /
CH CH2 S + С==СН 2 + Н 2 О CH CH2 S :JН2 CH + OH
/ / / "-
II m
Однако тиоцианатная rруппа леrко отщепляется от белков
при -элиминировании (309], в результате KOToporo обра-
зуют я тиоЦианат-ион и остаток аминоакриловой кислоты
(П). Рекомбицация оСтатка аминоакриловой кислоты и
цистеицовоrо остатка дает лантионииовый остаток (III),
леrКQ образующийся при обработке шерс.ти и друrих белок-
с-одержащих материалов растворами цианидов или щело
чей [316]. .
Таким .образом, этот метод не приrоден для разделения
полiшептидных цепей белковоrо соединения, но может быть
испоJIьзован для селективноrо расщепления полипептиДНОЙ
цепи (см. раздел «Химические методы», стр. 213). ..
В. .пепсине,. ij котором на молекулу приходится только один
aТQM фосфора, имеется диэфирная связь типа VП, которая
должна образовывать внутрицепочечный мостик, так как из-
вестно, что пепсин состоит из ОДl;IOЙ полипептиДНОЙ цепи
[146, 329].
Друrи типы мостиков
Результаты опредеJJения аминокислотноrо состава боль-
LiIiшства белков указьiва;от на наличие TaKoro количеСТВа
цистина, KOToporo вполне достаточно для образования ди-
сульфидных мостиков между известным числом OTKPbITbix по"
липептидных цепей. Однако rемоrлобин лошадн, имеющий
ПJесть .N-f\онцеВJ>IХ аЛИ1ювьiх Щ:Т ТКQВ (160, 245), не содержит
176
Селективное расЩfтле1Ше белков
PeazeHTbl, расщепляющие связи в nолиnеnrидной цепи
177
ц стина [161], тоrда как в авидине, который имее'f три N KOH
цевых аланиновых остатка [115], содержится только ОДИН
остаток цистина [323]. Очевидно, указанные белки должны об
ладать разветвленной структурой или содержать друrие типы
межцепочечных мостиков.
В . настоящее время установлено, что мноrие нативные
белки устойчивы к действию различных peareHToB. что можно
объяснить только мощным взаимодействием различных rруПП
в одной и той же пептидной цепи или взаимодействием поли
пептиДНЫХ цепей разных молекул. Влияние водородной связи
на повышение стабильности может быть значительным [187],
и для разделения двух неполярных боковых цепей в водном
растворе требуется больше энерrии, чем это следует из pac
чета вандерваальсовых сил. Это можно отнести за счет энер
rии, необходимой для разделения молекул воды, удерживае
мых вместе водородными связями, которые разрываются во
время установления равновесия между неполярными rруппа
ми и водой [174, 175]. Взаимодействия между небольшими
молекулами и белками [182] и между белковыми молекулами
[335] рассмотрены в недавно опубликованном обзоре и MorYT
быть проиллюстрированы на примере поведения инсулина в
растворе.
Молекулярный ..вес молекулы инсулина равен 5732 [261,
270], но мономер инсулина удается получить в растворе
только в особых условиях, например в водном растворе хлор
rидрата rуанидина [184], в орrанических растворителях [134,
251].и при низких концентрациях инсулина в pa TBopax с ма;
лой ионной. силой, коrда белок имеет высокии суммарныи
заряд [116, 135]. По мере увелич ния ионной силы раствора
и уменьшення cYMMapHoro заряда постепенно происходит
ассоциация мономера, приводящая в конечном итоrе к обра
зованию нерастворимоrо изоэлектрическоrо осадка (рН 5,3
6,1) . Кроме Toro, при наrревании инсулина в кислом pac
творе образуется осадок, состоящий из ассоциации инсулино
вых фибрилл, которые появляются такж в 6 М растворе
мочевины [335]. ПQ ВИДИМОМУ, взаимодеиствие неполярных
остатков основной фактор, обусловливающий стабильность
фибрилл, из которых, однако, удается реrенерировать кр.И
сталлический инсулин путем обработки щелочью [334].
fемоrлобин лошади, не содержащий цистина, представ
ляет особый интерес, так как методом измерения поверхно-
CTHOro натяжения удалось показать [129], что ero молекуляр-
ный вес равен 12000. fидродинамические методы определе
ния дают молекулярный вес около 68000, который при работе
с растворами f>fочеВИНJ>I снижается примерно вдвое [345]. Если
ассоциация обусловлена вторичными валентными силами, то
следует ожидать, что лишь таКие сильно действующие peareH-
ты [307], как мочевина, фенолы, rуанидиниевые соединения,
поверхностно-активные вещества . и орrанические раствори-
тели типа диметилформамида, MorYT вызвать диссоциацию,
для чеrо'моrут потребоваться также очень низкие или высо-
кие значения рН среды. Данные по указанной проблеме
являются недостаточными.
Методы разделения
После разъединения полипептидных цепей белка удается
выделить отдельные цепи в чистом виде, что сложнее сде-
лать в случае длинных полипептидных цепей [З06], чем ко-
ротких цепей, для выделения которых в чистом виде можно
применять различные методы, например хроматоrрафию на
бумаrе [320] и на колонке [219, 277], противоточное распреде-
ление [З31] и ионофорез [10, 266]. В окисленном инсулине, в
котором обе цепи сильно различаются по кислотности из-за
неодинаковоrо аминокислотноrо состава, разделение цепей
удается осуществить фракционированием солей [263], ионофо
резом [143, 263],. распределительным хрома1'оrрафированием
[6] или rrротивоточным распределением [190, 240]. Окисленный
химотрипсин, содержащий три пептидные цепи, дает три
фракции с характерными свойствами, позволяющими разде-
лять их. КОf>fбинацией метода осаждения при рН 6 и ионооб-
MeHHoro хроматоrрафирования створимоrо .вещества.
PEAfEHTbI, РАСЩЕПЛЯЮЩИЕ связи в ПОЛИПЕПТИДНОЯ
" ЦЕП
PeareHTbl, подобные к нце рированным кислотам, кото-
рые неизбирательно атакуют все пеПТИДНJ>Iе связи, имеют
лишь оrраниченное значеQие для расщепления полипептидов
с длинной цепью, так как- состав rидролизата по мере удли-
нения цепи ЗЩlчительНо усложняется. Общие вопросы rидро-
лиза полипептиДОВ подробно рассмотрены 8 обзоре Сэнд>кера
[266]. Следует отметить, что до начала работы по разделению
полученной в результате rидролиза смеси nептидов и амино-
кислот необходимо, чтобы продолжителыстьь rидролиза ис-
следуемоrо белка или полипептида БЬJЛа оптим:аЛJ>НОЙ.
Ферменты
При использовании ферментов оптимальная продолжи-
тельность rидролиза определяется чистотой ферментноrо пре-
парата и относительной скоростью расщепления различных
12 Зак. 1410
178
Селе"тивное расщепление белков
Реаеенты, расщепляющие связи в nо.лиnеlJ;тuдной цепи
179
связей. Скорость расщепления тех или иных связей друrими
протеиназами, присутствующими в препарате в виде приме-
сей. из-за их малой концентрации, как правило, значительно
ниже, чем скорость .расщепления связей, по отношеиию к KO
торым основной компонент ферментноrо препарата обладает
специфичностью. Прекращая инкубирование В' тот момент,
коrда скорость увеличения количества аМИНоrрупп становИТСЯ-
постоянной, удается свести к минимуму неспепифическое рас-
щепление связей. Следует избеrать з rрязнения реакцион-
ной смеси бактериями, особенно при длит.ельном инкубиро-
вании; это достиrается добавлением консервирующих средств,
например мертиолата (1: 10000, частей). Обычные. методы
контроля за протеолизом подробно описаны [70]; допол-
нительно можно указать На применение pH-стата [164] и Me
тод ана,llиза концевых rрупп .[114], который позволяет следить
за расщеплением индивидуальных связей, в то время как
друrие методы дают лишь общее число расщепленных связей.
В настоящее время известны только две эндопептидазы,
которые специфичны в такой CTeIJeI!H, что, зная аминокислот-
ный состав субстрата, можно предсказать вероятное число
расщепляемых связей. Оба эти фермента трипсин и химо
три-псин имеются в продаже в довольно чистом виде, но,
uоскольку они выделяются из.экстрактов поджелудочной же.
лезы, в препарате одиоr:оферментавозможно присутствие He
больших..количеств друrоrо. Химотрипсин инrибируется индо-
лом или фенилпропионатом И; кроме roro, леrче инактиви.
руется кислотами [249] и мочевиной ([137]; см. также [227])..
поэтому до ц кубирования трипсин рекомендуется предвари
тельно обрабатывать одним"изуказанных веществ. Трипсин
специфически инrибируется РЯ1ЮМ / низкомолекулярных беk
OB; этом вопро у посвяще пец льный обзор [128]. Толы о
в случае выокои.. специфич осто/ примеси MorYT возникнуть
сомнения отиосительно причи ы неожиданноrо расщепления
, связей.
Ферментативный rидролиз нативных белков, как правило,
протекает менее полно,. чем rидролиз денатурированных бел-
ков и белков' с разделеннЫМf! цепям.и в аналоrичных условиях
[128]. Во мноrих случаях в результате TaKoro более специф-и-
ческоrо расщепления ri()лучаются более крупные обломки ис-
ходной молекулы. Ранее отмечало ь, что после окисления ри-
бонуклеаза в большей степени подвержена ферментативному
rидролизу.
. Ферменты устойчивы при низких температурах, и фер-
ментативный rидролиз часто проводят при 250. Однако, как
"В случае БО,JIьшицства ХИl\1ических реакцнй, Прl1 повышеции
температуры резко возрастает скорость реакции. По - ..
для ускореция rидролиза связей,. медленно расщепляемых'
ферментом, температуру инкубирования часто повышают до
37...:--400. Друrим спо.собом увелЩlения скорости протеолиза
является повышение отношения фермент/субстрат.
. В данном разделе спеЦИфИЧНОС1'Ь протеолитических фер.
ментов рассматривается применительно к селективному рас-
щеплению полипептиДОВ и белков с известным порядком рас-
положения аминокислот. Следует, однако, иметь в виду, что
порядок расположения аминокислотных остатков в цепи не
определяет полностью пространственные взаимодействия. При
свертывании uепи и появлении, например, структуры а спи-
рали боковые цепи последовательно расположенных амино-
кислотных остатков выступают из спирали через определен
ные промежутки и повернуты друr к друrу на уrол, равный
примерно 1000 по отношению к оси спирали. Свобода враще
ния боковых' цепей обусловливает значитеЛЬ IOе разнообра-
зие занимаемых ими полож ний: они MorYT быть . удалены
от друrой. боковой цепи или пептидной связи, расположенных
на расстоянии нескольких аминокислотиых остатков в rлав-
ной цепи, на такое. же расстояние, каК и от CBoero аминокис.
лотноrо остатка или .пептидной связи. Кроме Toro, возможно
взаимодействие между боковыми цепями и пептидными свя-
зями, расположенным рядом rеометрически, но принадлежа-
щими к значительно удаленным друr от друrа в цепи амино
кислотным остаткам или даже к друrой полипептидной цепи
молекул. Таким .образом, знанне пространственной конфиrу-
рации может оказаТi>СЯ столь же важным при решении рас-
сматрива моrо вопроса, как и .знание .последовательности рас-
положения аминокислот.
Важно также знать, ч'f.(}' исследуемое вещество содержит
остатки аспараrиновой или rлутаминовой кислоты, а не аспа
раrина ИЛй rлутамина.
" Tpuпt:ua
.. Свойства трипсина подробно рассмотрены в ряде работ
[128, 228, 294], что позволяет оrраничиться кратким изложе
нием основных данных.
АJ{ТИВНЫЙ фермент. (мол. вес 23 000 24 000) [128] обра-
зуется из неактивноrо трипсиноrена при действии на Hero
трипсина [228] или u энтерокиназы [346], приводящих к разрыву
СВЯЗII Лиз. Илеи и оtщеплению лептида состава Н.Вал.
(А п)..Лиз.ОН [69, 76] от N концевоrо участка полипептид-
нои цепи. Таким образом, N концевыми rруппами ТРИПСИНО-
reHa и трипсина являются соответственно ва ин и изолейцин
12*
180
Селективное расщепление белков
РеаеентЫ, расщепляющие связи в nолиnеn'1'и{jlЮй цепи
181
[75]. С l(онцевой остаток как трипсиноrена, так и трипсина,
ПО llИДИМОМУ, представляет собой лизин ([104, 226]; см. TaK
же [224]).
Активность трипсина проявляется при рН 7 9; по отно-
шению к некоторЫм синтетическим субстратам оптимальная
акти ность трипсина. наблюдается при рН 7,8 [128]. В этих
пределах значений рН фермент леrко претерпевает аутолиз;
максимальная стабильность фермента наблюдается при
рН 2,3 н 300 [228]. Трипсин более устойчив в присутствии суб-
страта. Найдено, что раствор трипсина при рН 7,9 и 260 Te
ряет 50% активности за 30 .мин в отсутствие Са 2 + и полностью
инактивируется за 6 час [125]. Инактивирование фермента в
значительной степени замедляется в присутствии Са 2 + '[31,
77, 125]. Так, в указанных выше условиях, но в присутствии
0,01 моля Са 2 + потеря .активносtи составляет Bcero 5% за 8 чаС.
Трипсин стабилизируется также ацнлированием [246]. По
скольку молекула трипсина содержит 13 лизиновых остатков
и только 2 арrининовых остатка [128], которые образуют по
тенциально способные rИДРОЛИЗ0ваться при аутолизе связи,
при ацилировании е:-амююrрупп лизиновых остатков связи,
Б которых участвуют эти остатки; становятся устойчивыми
к ПIДролизу. Таким образом, ацилирование уменьшает коли
чество чувствительных к rидролизу связей и тем самым по-
вышает rидролитическую устойчивость фермента.
Результаты опытов с синтетическими субстратами показы:
вают [27], что трипсин атакует пептидную вязь, в которои
участвует карбоксильная rруппа l арrинина (VII1) или l ли-
зина (IX). Типичными синтетическими субстратами являются
бензоиллизиламид и бензоиларrиниламид. При защите е: ами-
1юrруппы лизиновоrо остатка каким либозаместителе чув-
ствительность субстрата к действию трипсина исчезает.
В последнее время показано, что перевод е: аминоrруппы
лизина ct-лактоальбумина в rуанидильную rруппу, т. е. полу-
чение остатков rомоарrинина (Х), также обусловливает пол-
ную стабильность ранее леrко расщеплявшихся трипсином
пептидных связей [336]. С друrой стороны, перевод цистино
вых остатков в S ( аминоэтил)цистеиновые остаТЮi (2S I ) вос-
становлением тиоrликолЯТОМ с последующим взаимодеиствием
с 2 бромэтиламином дает боковую цепь, весьма напоминаю-
щую боковую цепь лизина. Поли.S- (f'-аминоэтил) цистеин яв-
ляется субстратом для трипсина [204] так же, как и полили
зин. Введение этих остатков в полипептидные цепи вместо
полуцистиновых остатков должно повысить rИДРОJIИзуемость
полипептида трипсином. Этот тип превращения может OKa
заться полезным для определения последовательноСти амино
кислот в белках [204, 321]. rистидин и орнитин не MorYT за-
менить остатки арrщшна, лизина или S (f3 аминоэтил) цистеина.
I
NH
""
CH CH2 CH2 CH2 CH2 NH C NH2
/ 11
со NH
I
х
I
NH
""
CH CH2 S CH2 CH2 NH2
/
СО
I
XI
I
NH
"-
CH CH2 CH2 CH2 NH C NH2
/ I1
со NH
I
VIII
Положительно заряженная свободная аминоrруппа в а-ПО
ложенин в некоторых случаях способна помешать rидролизу,
в друrих же случаях этоrо Не происходит (СМ. ниже и стр. 183,
186, 187, 19О). Результаты исследований на синтетических
субстратах показывают, что при наличии положительно заря-
женной а аминоrруппы или отрицательноrо заряда рядом с
чувствительной к rидролизу связью разрыв связ рипсином
замедляется.
rидролиз полилизина под действием трипсина [332] яв
ляется примером влияния а аминоrрупп и карбоксильных
rрупп. Дилизин сравнительно устойчив к действию трипсина.
Активность заметно возрастает при увеличении числа остат-
ков лизина С трех (трилизин) до пяти (пентализин). Высшие
полимеры леrко rидролизуются по расположенным близко
I
NH
,
CH CH2 CH2 CH2 C.Hr""Nf12
/
СО
I IX
182
Реа2енТЫ, расщепляющие связи в nолuпе1Jтuдной цепи
183
Селективное расщепленце белков
Леrко расщепляемые связи
Ар... rли Лиз. Ала
22 23 29 .30
Арс. Ар.. Ли:;!. Тир
. 17 18 12 13
NH 2 NH.
I 1
Арс. fли l ). Лнз.Тли. 2)
8 9 8 9
Арс. Сер Лиз. ф
10 II 7 8
NH 2
I
Арс. Асп
33 34
Арс. fлу
!!5 8б
Арс. Три
8 9
Лиз. Сер
31 32
Лиз. Асп
37 38
Лиз. Асп (NH 2 )
61 62, а также
66 67
Лиз. Тнр
9] 9'2
Лиз. Тре
98 99
Лиз. rHC
] 04 ]0,5
Лиз. Лиз
]5 16
Лиз Вал
2] 22
Частично
расщеПЛllе-
мые Связи
Устойчивые
связи остатков
JlИ ИН8 и
арrинина
которой дилизин вполне устойчив к действию трипсина. При
БОЛIF вЬ!соких концеНТР,ациЯХ фермента реакция происхрдит,
НО лизин И трилИЗ J:i образуются по механизму транспептиди-
рования (ср. [193]): .
2Н. (Лиз).. ОН Н. Лиз. ОН + н. Лиз. Лиз. Лиз. ОН
Установлено [217], что салмин, молекула которото. coдep
жит периодически повторяющиеся арrиниларrинильные rруп-
пы, при rидролизе трипсином также образует свободный 8p
rинин. ЭТО может происходить при разрыве арrинильных свя
зей на N концевых участках или арrиниларrИНИНЩIЫХ связей
на С-J5:0нцевых участках, которые появляются в результате rи
дролиза под действием трипсина. Аналоrично этому при rид
рол изе лизоцима под действием трипсина [310] образуются
свободные арrинин (0,4 .моль/молЬ) илизин (0,9 моль/моль),
хотя в rидролизате 01{исленноrо лизоцима арrинин не был
найден [311]. Свободный лизин может образоватьс из N KO -
цевото лизильноrо остатка; -ПО имеющимся данным, молекула
лизоцима содержит арrиниларrинильные [313] и лизиларrи-
нильные rруппы [311].
В 1абл. 1 и на рис. 1 9 пока за но, какие связи расщеп
ляются трипсином в полипептидах и белках, для которых изве
стен порядок расположения аминокнслот. Из табл. 1 видно, что,
как правиЛО, трипсин действует на различные белковые цепи
так, как эrorо МОЖНQ .ожидать на основании изучения i'идролиза
синтетических суостратов _ под действием трипсина. Ниже будут
рассмотрены только случаи, отклоняющиеся от общих правил.
ОКИСЛ9'ный инсулин. Трипсин не действует на фракцию
А [267] кисленноrо инсулина (рис. 1); ero действие на фрак
цию Б' [272] покаЗ8!Ю на рис. 2. Имеются данные о разрыве
связи между остатками в положениях 16 и 22. При этом
остатки арrинина илизина це затраrиваются [102], но не исклю
чена возможность заrрязнения трипсина какой либо друrой.
протеа80Й. В присутствии незначительной примеси химотрип-
сина может ПРОИЗ0ЙТИ разрыв тирозиллейцильной связи. H
. w l7
неокисленный инсулин трипсин дейст ует довольно медленно
[49]. При низких отношениях фермент/субстрат [140] С-конце-
вой аланин освобождается быстрее, чем rептапепти По-ви-
димому, при целостности дисульфидных МОСТИКОв арrини.тi-
r лицильная связь более устойчива к действию фермента.
rлюкаrои. rлюкаrQН (рис. 3) содержит два находящихся
рядом остатка арrинина Арт. Арт. Ала [43]. Арrиниларrи-
17 18 19
ЩiЛЬflаff С8ЯЗl:> под де'kr м ТРИПСЩfа в. т ч н е ча<:
к концам цепи связям с образованием дилизина и трилизина,
но концевые пептидные связи во всех случаях являются ОТ-
носительно прочным и, поэтому образуют я лишь небольшие
количества лизина: В последнее время Уэйпи и YOTCOIJ [333)
отказались от ранее высказанной ими точки зрения, соrласно
Таблица J
ДеАствие трипсина на различные белки
Пептид или б,мок
ОкиСленный инсу
лин, цепь Б
f люкаrон
Вазопресснн
Окисленная рибо
уклеаза
Кортикоrропин
a-Mcr
-МСf
J;"ипертенснн
') Быка.
') Свиньн.
1) См. текст.
Арс. Трн
8 9
Арс. Три Лиз. Мет
ll]2 6 7
Арс. Вал.
'.2 "3'
Ар... Ала
18 19
Ар...ЦиSОзН Н. Jjиз. fлу
39 40 1 2
Лиз. Про
41 42
Арс. Арс
l7 ]8
. Лиз. Арс
16 l7
Apr. ПроЗ)
18 19
Лнз. Про
11 12
Лиз. Про
II 12
Лнз: Асп. О Н
17 18
Связи, расщепляемые
Н. r ЛИ. Илей. Бал
1 2 3
NH 2
I
r лу. f лу. UHSOdH. ЦиSОзН.
.5 6 1
Химотрипсином
пепсином
.r
I
""
I
r
папанном
1
плесневой протеазой
t
J
t l Связи, расщепляемые
в первую очередь
t . ; , ' Прочие расщe-nляемые
связи
Рис. 1. Порядок расположення аминокнслот в цепи А окислеЩlOrо инсу
NH 2 NH 2
I I
Н. Фе. Вал. Асп. fлу. [НС. Лей. ЦнSОаН. fди. Сер. fис. Лей. Вал. fлу.
С 1 2 3 4 5 6 1 8 9 10 11 12 13
вязи, расщепляе-
мые
NH 2 NH 2 NH 2
I I I
Ала. Сер. Вал. ЦнSОзН. Сер. Лей. Тир. fлу. Лей. rлу. Асп. Тир. ЦI1S0зН. Асп. ОН
8 9 10 11 12 13 14 15 16 17 18 19 20 21
t t i
i 1
t i
l' t r t t t
i I ! I I
,
t J t t t t
I I I I
t t t t 1 t
I I 1 I i
!
лина быка н связи в нем, rидролизуемые протеолитическимн ферментами.
Ала. Лей. Тнр. Лей. Вал. ЦиSОзН. f лн. rлу. Арс. r лн. Фе. Фе. Тир. Тре. Про. Лиз, Ала. 01-{
н 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
t i
. трипсином I
r. t t t
химотрипснном i I I I
r t t t t t t r i t
пепсином ! I I I I
плеснерой про t t t t r t t r t r t t t t
теазой 1. I I 1 I I 1 I I I
I i
t t t t i t l' t t t t t r r t t t t
субтили:щном I I I I I I I I I I I I I I I
t t t t t
ренннном I I ] I I
t Связи, расЩеПляемые t Про'ще расщепляемые
I в первую очередь I связи
Рис. 2. Порядок раСположения аминокислот в цепи Б окисленноrо
инсулина. и. СВЯЗи tI нем,. rидролизуемые протеОлитическими ферментами.
186
Селехтивное расщепление белков
NH 2
I
н. fис. Сер. rлу. fлн. Тре. Фе. Тре. Сер. Асп. Тир. Серо Лиз.
1 2 3 4 б 6 7 8 9 JO 11 ,12
ЯЗИ, расщепляе-
мые
трипсином
t
I
химотрипснном
t
,
t
I
t
I
t
,
субтилизином
t
,
t Связи, расщепляемые
I в первую очередь
t Прочие расщепляемые
i связи
I
Рис. 3. Порядок расположения аминокиСЛОТ в rлюкаrоне и СВЯ311
расщеп;Ляется в большей степени (на 70%), чем арrинилала
нильная связь (на 20%) [44]. Если бы арrи иларrинильная
связь разрывал ась раньше арrинилаланильнои связи, то сле
довало бы ожидать подавления rидролиза арrинилаланиль-
ной связи вследствие образования свободной а-аминоrруппы.
Однако имеющиеся данные свидетельствуют о медленном раз
рыве этой связи; 80% свободноrо арrинин образуется через
:50.час при 250 и рН 7,8. .
Кроме Toro, разрываются и друrие связи, в том <;исле
связи ароматических аминоКислот. Разрыв этих связеи за
трудняет фракционирование rидролизата, и в настоящее Bpe
мя не установлено, обусловлен ли rидролиз ароматических
аминокислотных остатков специфической активностью трип-
сина или наличием примеси друrой протеазы, например химо-
трипсина. В этой связи представляет v интерес vсообщение [210]
о ХИМОТРIJПтической активности, своиственнои трипсину. Эти
данные подтверждаются. близостью химическоrо состава и по-
следовательносты6 расположения аминокислот в пеПТИ-!J.ах,
выделенных из прилеrающих к активным центрам трипсина
и химотрипсина участков и содержащих диизопропилфосфат-
ный остаток инrибитора дищопропилфторфосфата [22,5].
Возможность заrрязнения ферментноrо препарата хи отрип
сином не была исключена, но все связи, на которые деиствует
химотрипсин, не расщеплялись, а введение в реакционную
смесь фенилпропионата инrибитора химотрипсина не
предотвращало разрыва связей в положениях 6 7 и 25 26,
о которых идет речь. К сожалеН}I:Ю, из опубликованноrо сооб-
щения не ясно, проводил ось ли термостатир,ование,фер'мента
Peai!eHTbl, расщепляющие связи в nолиnеnтuдной цепи
187
NH 2 NH 2 NH 2
I I I
Тнр. Лей. Асп. Сер. Арс. Арс. Ала. f ЛУ. Асп. Фе. Вал. f ЛУ. Три. Лей. Мет. Асп. Тре. он
ш м ffi ffi и и ш п w
i
j J
r
t
I
t
I
t
,
t
I
"
I
t
I
t
I
t
.,
в нем, rидролизуемые протеолитнческими ферментами.
в присутствии инrибитора до введения субстрата. ЕсЛl! этоrо.
не было сделано, то нельзя считать, что химотрипсин удалось
полностью ина тивировать. " .
Вазопрессин. Вазопрессин содержит одну аминокислоту
OCHoBHoro характера, которая в вазопреССине быка (ХН)
представляет собой арrинин, а в ropMoHe свин и лизин..
Трипсин В обоих случаях выЗывает выделение rпицилаМИД8
[83].' Некоторый интерес представляет тот факт, что в вазо-
NH. NH.
, i i
Н. Uис. Тир. Фе. rлу. Асп. Uис. Про. Apr. f ли. NH.
" J jтрипсин
ХН
прессине, как и в инсулине, перед ОСНОвной rруппой в цепи
находится пролильный остаток, который H инrибирует фер-
мент, в то время как разрыв ЛИЗИЛПРОЛильной или арrинил-
ПРОЛИЛЬНОй связи подавляется (см. табл. 1). в кортикотро-
пине, р'ассмотренном ниже, лизилпролильная и арrинилпро
лильная связи оказались устойчивыми.
Окисленная рибонуклеаза. олекула рибонуклеазы coдep
жит десять остатков лизина и четыре остатка арrинина [153]."
При количественном разрыве всех связей, в KOTOpЫ уча-.
ствуют карбоксильные rруппы указанных аминокислот, под
действием трипсина следует ожидат образования пятнадцати.
Связн,
Н. Лиз. fлу. Тре. Ала. Ала. Ала. Лиз. Фе. fлу. Арс. Сер. Тре. Се'
расщепляемые 1 2 З 4 5 6 7 8 9 10 11 12 13
l' l'
I I
трипсином
l'
1
l'
I
химотрипсином
Связи.
т
NH 2 '
I
MeT. Лиз. Сер. Арс. Асп. Лей. Тре. Лиз. Асп. Арс. UиSОз Н . Лщ
расщепляемые 30 31 32 33 34 35 36 37 38 39 40 41
i l' l' l'
11 I
пепсином
трнпснном
химотрипсином
l'
I
пепсином
Связн,
NH 2 NH 2
I 1
(UиSОзН, fлу, Ала, Вал, Сер). Лиз. Асп. Вал. Ала. ЦиSОз Н . Лн::,
расщепляемые 56 57 58 59 60 61 62 63 64 65 66
l' t
I I
трипсином
хнмотрнпсином
f
пепснном
Связи, расщепляемые
Асп. ЦиSОзН. Арс. r лу. Сер. Тре. r ли. Сер. Лиз. Тир. Про.
'83 84 858687888990 9192 93
i .j
трипсином
хнмотрипснном
пепсином
Связи,
NH 2
I
(Асп, rлу, Про, fли, ЦиSОзН, Ала). Тир. (Вал, Вал, Про, fис).
расщепляемые 109 110 111 112 11З 114 115 116 117; 118 119
трипсином
химотрипсином
r
пепсином
Рис, 4, Частичны" порядок расположения аминокислот в окисленной рибо
NH 2 NH 2 NH 2 NH 2
I I I I .
Сер. Асп. rис. Мет. rлу. Ала. Ала. Сер. Сер. Сер. Асп. Тир. ЦиSОзН. Асп. fлу. MeT
11 15 16 17 18 19 20 21 22 2З 24 25 26 27 28 2,9
т
l'
I
NH 2 NH 2
I I
Про Вал. Асп. Тре. Фе. (f ЛУ, Вал. Лей, Сер, fис), (Асп, r ЛУ, Ала, Вал)
42 43 44 45 46 47 48 49 50 51 52 53 54 55
т
r r
l'
I
l'
1
NH 2 NH 2 NH 2 NH 2
I I I I
Асп. fли. Тре. t\сп. fлу. ЦиSОзН. Тир. fлу. Сер. Тир. Сер. Тре. Мет. Сер. Илей. Tpe
67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82
i
l'
1
i
NH 2 NH 2 NH 2
I I I
Асп. Ала. UиSОзН. ,Тнр. Лиз. Тре. Тре. Асп. Ала. [ЛУ. Лнз. fис. (Илей, Илей, Вал)
94 95 96 97 98 99 100 101 102 103. 104 105 106 107 108
l' l'
1 I
i
i
l'
,
i
t
I
Фе. Асп. Ала. Сер. Вал. ОН
120 121 122 123 124
l'
I
l'
I
нуклеазе и связи в ней, rидролизуемыс протеолнтическими ферментами.
1" Связи. расщепляемые
. в первtю очередь
t Прочие расщепля.емые
1 сВЯЗ!!
190
Селективное расщепление белков
Решенты, расщепляющие связи 8 nолипеnтидноu цепи 191
Тринадцать основных пептидов, выделенных при rидро-.
лизе рибонуклеазы, содержат все аминокислотные остаТIЩ,
входящие в состав этоrо фермента; исследование осколков
позволило точно определить количество остатков двух амино
кислот [152]. Порядок соединения пептидов между собой в ис
ходном белке был установлен по результатам исследования
пептидов, полученных из рибонуклеазы под действием хима.
трипсина [154].
Друrой метод специфическоrо rидролиза окисленной' рибо-
нуклеазы пр дложен Редфилдом и Анфинзено,М [249]. Он за-
ключается в защите Е-аминоrрупп лизина динитроф нильными
rруппами, что препятствует разрыву связей, в' которых уча.'
ствуют эти остатки лизина, под действием трипсина. Посколь-
ку на 1 моль рибонуклеазы приХодится только 4 моля арrи-
нина, в этих условиях можно было ожидать образования Bcero
пяти фраrментов. Это подтверждается результатами анализа.
Разрываются только те вязи, в которых участвуют остатки
арrинина (рис. 4). Связь Apr. ЦиSОзН . разрывалась зна-
. 39 40
чительно медленнее, чем остальные связи. Из пяти крупных
пептидных фраrментов тот фраrмент, которЫй не содержи'!
арrинина, очевидно, образуется из С концевоrо участка окис-
ленной рибонуклеазы, а пептид, полученный при отщеплении .
N-концевоrо участка исходной цепи, идентифицируется по
ero N-концевому остатку. Относительный порядок располо-
жения трех остальных фраrментов может быть установлен пу-
тем выделения и идентификации содержащих арrинин пепти
дов из кислотных И ферментных rидролизатов. Эти пептиды
леrко обнаружить по даваемым ими специфическим цветным
реакцияМ [320]. Определенная таким образом частичная струк-
тура рибонуклеазы совпадает со структурой, предложенной
Хёрзом и сотр. [154].
Пос.педовательность расположения аминокислот, прнве,.
денная на рис. 4, установлена на основании данных обеих
rрупп исследователей [9, 10, 151, 154, 155).
фраrментов исходной цепи. Oд aKO в полипептидной цепи
риБОНУ1<Леазы не происходит ни отщепления N-концевоrо
остатка лизииа [11], ни разрыва лизилпролильной связи
Лиз. Про (рис. 4). Методом ионообмен ой хроматоrрафии
41 42
было выделено то.пько тринадцать пептидов (рис. 5) с выхо-
дами 50 IOO% [1.52]. Эта работа Хёрза, Мура и Стvейна мо.
жет служить образцом для будущих исследовании друrих
1,5
[rЛ!l,rлu,сеР2.Тре] лuз(т1; 100./0)
16
[ЦUС,Асп(NН2),Ала,Ва:nJлuз( ; О/О J
15
<:>
'"
'-'
:;:,
:r
11,0
:t:
:;:,
%
'" 0,5
....
:t:
::.
:х:
ACn'APi\ j 1f; O/o)
NНз (из
Ipeaz708
Количество вытекаЮЩl!UО,5 1,0 1,5 2;0
жидкости, л OZH рН31 35 0 I Постепенное увеличение рН u [Na+]
: .., , лuз.rЛ!l.Тре.Ало.Ала.Ала.лиЗ( ;1000/о)
110
[Асп(NН 2 ),r лу(NН 2 J,Ало, Тр е 2]
I ЛuЗ (100 j 1000/0) [АСП(NН2),лей.тре]ЛU3( IОО ;9t foJ (NH J Фе)АРi\(1S'В5"10)
8 \ " Cep.Api\{ ;55%) Л!/ 2 , 1 ;5
9 1 12 13+11/
I r
2,s з,0 4,0
(О,zн.,рНЗ,f 2,он рН5,1),З50. .
Р и с.б: Пептиды rидролизата, получеиноrо в результате rидролиза 2OO.At1.
окнсленной рибонуклеазы; под действием трипснна в течение 20 час [152].
Хроматоrрафирование rИДРОЛИЗllта ПРО80ДИЛОСЬ иа колоике с сульфироваиным ПОЛИ J10'
лом (смола даузкс X2, 150 х 2 сАС). Промывиая жидкость собиралась порциями по . л.
Для анализа нннrНдРНИНЫМ способам отбирались аЛИК80тные части (0,5 .мл). Пифры
в скобках указывают выход после rидролиза в течеиие 3 и 20 час.
4,5
I
белков с длинными полипептидными цепями. Авторы тща-
тельно определили оптимальное время rидролиза и YCTa o-
вили, что оно оказывает заметное .влияние на выход трех пеп
тидов, два из которых являются продуктами распада TpeTbero
пептида (остатки 38 61), содержащеrо трудно rидролизую
щуюся свя.зl.! Apr. Ци SOl!li , ВI?!?'-ЧЦ друrоrо пептида (ос-
татк'м 67:""""85) резко уменьшает.ся со временем (с 50% через
3 чm:: до 15% через 20 час), но характер расщеплеНИ!l этоrо
пептида не удалось установить, так как в реакционнои смеси
не было обнаружено продуктов раСIЦепЛ.ения.
Кортикотропии, Последовательность расположения амино-
кислот в адренокортикотропном ropMoHe (кортикотропине)
свиньи была установлена двумя rруппами исследователей.
Они работали с исходными веществами, кОторые отличались
только .по, количеству амцдных rрупп, поскольку во время
выделения ropMoHa возможно дезамидировзние. Кортикотро-
пин свиньи леrко теряет аМИДные rруппы [79]; так. при рН 9
и 250 aa18 22 час происходит дезамидирование еДЯRСl'Ве.I:f,:'1
Horo rлутамцновоrо остатка (в. положении.'30 на рис. .6), а за
Реасенты, расщепляющие связи в nолиnеnтuдной цепи 193
Н. Сер. Тнр. Сер. Мет. rлу. rис. Фе. Apr. Три. rли. Л113
1 2 3 4 5 6 7 8 9 10 11
пепсином
1
t
i
I
t
I
t
,
i
2 3 суток дезамидирование происходит до конца, причем
ropMoH не теряет активности [283]. Подобное дезамидирова-
ние, по видимому, происходило при выделении Уайтом и сотр.
[338] кортикотропина А. Последовательность аМинокислот в
КОрТИКОТрОnИНе свиньи показана на рис. 6. Единственным
участком цепи, в отношении KOToporo имеются расхождения
по вопросу последовательности. расположения аминокисл()т
ных остатков, является участок 25 28. Эти раСХождения, воз
можно, вызваны техническими трудностями при расщеплении
по Эдману (см. стр. 237), которое широко использовалось для
изучения строения кортикотропина [284]. В одной из предло
женных структур КОРТИIютропина [341] последовательность
расположения остатков 10 14 и 19 20 не указана. По-види-
мому, rормональная активность кортикотропина обусловлена
той частЬЮ цепи, которая оrраничеlfа аминокислотными OCTaT
ками в положеItиях 1 24 [23, 340], поскольку частичный rид
рол из кортикотропина под действием пепсина ПРИВОДИТ к ОТ-
щеплению одиннадцати остатков от С-концевоrоучастка цепи,
а при rидролизе разбавленной кислотой этоrо rидролизата
отrцепляется erцe неLКОЛЬКО остатков без потери активности.
. Расщепление трипсином быстро инактивирует молекулу;
необычная rрупnировка из четырех остаТков OCHoBHoro хар-ю<-
тера лиз.лиз.Арr.Арr'nро приводит к появлению боль-
15 16 17 18 19
шоrо числа продуктов распада за счет разрыВа связей на
этом участке. Связи Лиз.про и Арr.Про оказались
11 12 18 19
устойчивыми К действию трипсина. Выходы пептидных оскол-
ков, Bыдe HHЫX методом противоточноrо распределения, сви-
детельствуют о том, что связи Арr.Три , Лиз.Лиз и
13 9 15 16
лиз.вал разрываются не менее чем на 90% [284]. Частич-
21 22
ный разрыв связей Лиз.Арr и Apr.Apr происходит не
16 17 17 18
более чем на 20%, при этом образуется еще четыре пептиД-
ных осколка с выходом 10 20%. При быстром расщеплении
связи Лиз.Лиз рядом СО связью Лиз.Арr появляется
15 16
свободная аминоrруппа, стабилизирующая эту связь по отно-
шению к трипсину. Аналоrично этому молекулы, расщепление
которых протекает сначала по связи Лиз.Арr , в дальней-
16 17
шем лишь с трудом претерпевают расщепление по связи
Apr.Aor .
17 18
Таким образом, За счет расщепления молекулы кортико-
тропина На указанном участке удалось выделить следуюrцие
Связи, расщепляе-
мые
химотрипснном
t
I
i
t t
I I
трипсином
пепсином
r
Про. Вал. rлн. Лнз. Лиз. Арс. Apr. Про. Вал. ЛИ3. Вал. T,!p
6 П U Ш W 17 lli " п п
Связи, расщепляе-
мые
t
1
t
I
химотрипеином
t
I
t
I?
трипсином
пепсином
NH 2
I
Про. Асп. rли. Ала. rлу. Аеп. rлу. Лей. Ала. rлу. Ала. Фе
24 25 26 27 28 29 30 31' 32 33 34 35
Связи, расщепляе-
мые
трипсином
химотрипеином
Про. Лей. rлу. Фе. он
36 37 38 39
Связи, расщепляе-
мые
трнпсином
:1имотрипеином
t
I
1' 1 Связи, расЦ\епляемые
в перв)'ю очередь
jпрочие расщепляемые
I связи
пепсиНоМ
Рис. 6. Порядок .раСПОJlожения аМИНОКИСЛОТ в кортикотропине свиньи
и СВЯЗИ в нем, rндролизуемые протеолитическимн ферментами.
13 3ак. 1416
194
Селективное расщепление белков
Решенты, расщепляющие связи 8 nолunеnтuдной цепи
195
пептиды с выходом 93 вес. % (ср. с рис. 6);
90% . н. Три. r/lИ. Лиз. Про. Вал. rли. Лиз. ОН
10% (макс.) Н. Три. r ЛИ. Лиз. Про. Вал. r ЛИ. Лнз. Лнз. ОН
70% н; Лиз. Api'. Арс. Про. Вал. Лиз. ОН
20'16 (макс.) Н. Ар'Т. Apr,. Про! Вал. Лиз. ОН
2096 (макс.) Н. Арс. Про. Вал. Лиз. ОН
1096 (макс.) Н. ЛИЗ. Арс. ОН
Вопреки ожиданиям, в rидролизате не было обнаружено сво-
бодных Лliзина и арrинина.
Кортикотропин овцы проявляет видовую oco eHHOCTЬ,
которая заключается в том, что вместо аминокислотныХ остат-
ков Лей.Ала он содержит Ала.Се'р [199] и, кроме Toro,
т т _
на участке 25 28 аминокислоты имеют иную последователь-
IЮСТЬ; Ала.rJJи.r,1Iу.Асп .. rидроляз под действием трип-
сина на участке Лиз.ЛИ8.Арr.Арr кортикотропина овцы
также происходит иначе:
Лиз. ЛI1З. Apr. Apr. Про. В;iЛ. Лиз, ВаЛ
15 16 17 18 19 2U 21 2!!
1 11 1
Н. Лиз. Арс. ОН .
. Н. Арс. Про. Вал. Лиз. ОН
Н. Лиз. Арс. Арс. ОН
Таким образом,"rlщролизат не содержал пецтидов с лизил-
'лиЗильной связью, а также пеnти.цов с N-концевым арrинил-
арrинильным OCT8TKOM t но пептиД с С концевой .арrnниларrи
Н1fЛЬНОЙ rруппой БыI.. найден. ПРИСУТСТВИЯ !Iептида н.про.
ВалЛиз.ОН не было установлено, хотя выделение пептида
H-Лиз.Арr.Арr.ОН свидетельствует о разрыве связи Apr.
ffl
Лlr ' Условия rидролиза кортикотропина овцы (pH9,3, 38 е ,
. 6 час) отличались от. условий, в которых rидролизовался KOp
тикотропин свиньи (рН 7,в.........9,О, 250, 4 час), но 91'0 обстоя-
тельство не может объяснить совершенно ииоrо хода rидро-
Jlиза. ropMOHa трипс ном. .Возможно, что причиной этqrо
являются реакnии трансnептидирования [193, 333], как и в
случае полилизина (см. СТР. 181 183).
ropMoHa. Основной компонент ropMOHa (a MCr) [192] и .BTO
роЙ компонент ( -МСП [25, 120, 192, 244] были выделены. в .
R. Сер. Тир. Сер. Мет. rлу. rис. Фе. Арс. Три. r ли. Лиз. Про. Вал. NHi
1 2 З 4' 5 6 7 . 8 9 10 11 12 1<1
Связн, расщепляе-
мые
t
трнпсином I
i t r
хнмотрнпсином I
1' 1 Связи, расщепляемые
в первую очередь
. l' Прочие рас-
i щепляемые
;' связи
р н с. 7. Порядок расположения амннокислот в a-МСr И
rидролизуемые ТРИПСliЦОМ И хнмотрипснном.
СВЯЗИ В нем,
чистом виде. Последовательность аминокис.лот в a MCr [139]
и .Mc:r [120, 142] была определена на очень небольших коли-
чествах вещества.
Н. Аеп. r ЛУ. r лн. Про. ТИР. Лиз. Мет. r лу. rHC. Фе. Apr""""'-
1 2 3 4 5 6 7 8 9 10 11
Связн, расщепляе-
мые
трипсином
i
r
хнмотрипсином
t
I
Три. rли. Сер. Про. Про. Лиз. Асп. ОН
12 13 14 1.5 16 17 IR
t
I
СВЯЗИ расщепляе-
мые
трипсином
хнмотрипсином
i
I
1" Связи, расщеllлslемыe
в первую очередь
l' Прочие расщепляемые
! . связи
i
. МеланофорЬстимулирующие ropMoHhI. I(ортикотропин по
.мимо кортикотропной активности об.ладает также мелан:офо-.
ростимулирующей активностью, равной примерно. '/100 актив-
ности чliстоrо меланофоростимулирующеrо ropMOHa(Mcr),
выдцеиноrОlJЗ' . rипофиза . с"иньи '[120, 192, 198]. fипофиз
;.свинь 'содержит два активиых . меланофоростимулирующих
Рис. 8. Порядок расположения амннокислот в -Mcr И связи в нем,
rидролизуемые трипсином и химотрипсином.
a Mcr (рис. 7) имеет тот же ПОрЯДОI{ Р'асположения пер
вых тринадцати аминокислот N концевоrо участка цепи, что
и кортикотропин, но ero а-аминоrруппа содержит неизвестный
13*
Селективное расщепление белков
Peai!eHTbl, расщепляющие свщJU в nОЛlJлеnтидной цепи
197
196
заместитель. I(роме Toro, (1-Mcr имеет С-концевую амидную
rруппу. -МСr (рис. 8) характер.изуется такой же последова-
тельностью аминокислот в положениях 7 13, как a-Mcr и
кортикотропин в положениях 4 1 О, но имеет друrую после-
довательность расположения аминокислот на N и С-конце-
вых участках цепи.
rидролиз a-МСr под действием трипсина дал только два
осколка [139], соответствующих разрыву связи Арr.Три .
8 9
I(ак и в случае кортикотропина, СВЯЗЬ Лиз.Про оказалась
11 12
устойчивой.
Из fJ-мсr под деЙСТJшем трипсина образовалось три ос-
колка [120, 142], при этом связь Лиз.Асп.ОН оказалась
устойчивой. Выход всех пептидных осколков превышал 80%.
Поскольку в инсулине С-концевая связь Лиз.Ала.ОН раз-
рывала СЬ трипсином, устойчивость связи Лиз.Асп.ОН в
-МСr, ПО-J3идимому, обусловлена комбинированным эффек-
том (1- и а-карбоксильных rрупп аспараrинов'Ой кислоты, так
как в обоих случаях перед указаннЫМИ С концевыми rруппа
ми находится пролильный остаток. Установлено [241], что ли-
зиновая связь устойчива в Н.тир.лиз.rлу.ОН, но не в
Н.Тир.Лиз.rлу.Тир.ОН. В рибонуклеазе (рис. 4) связи
Арr.rлу и Лиз.Асп леrко разрывались.
85 86 37 38
выделенноr:,о из сыворотки крови лошади [292]. Этот декапеп-
тид под деиствием присутствующеrо в плаЗi\1'е крови фермента
отщепляет rистидиниллейцин от C-коНцевоrо участка и пре-
вращается в октапептид rипертеJIСJЩ I I.
Трипсин, как этоrо следовало ожидать на основании дан-
HЬJX о ero специфичности действия, разрывает в молекуле
св зь Арr.Вал .
Друrие белки. При изучении последовательности располо-
жения аминокислот в друrих белках с помощью rидролиза
трипсином получены результаты, которые соrласую:rся с име-
ющимися данными о специфичности действия трипсина, Од-
нако в тех случаях, коrда точное расположение аминокислот
в исследуемом веществе неюшестно, влияНие последователь-
ности аминокислот на rидролиз данноrо белковоrо соединения
трипсином оuеНИ1Ъ не удается. .
u К бел ам, которые исслеДОQались методомrидролиза под
деиствием ТРJfпсина, ОТНОСЯТСЯ щщаин [298], ЛИЗОIЩМ [311],
ЦИТОХРОМ [325], протаМин. [217], химотрипсиноrен [225, 257],
ТРИШ;ИНОl'ен [76, 225], вирус табачной мозаики [111, 274] и ['е-
моrлобин [163]. В цитохроме с трипсин разрывает связь
Лиз.UиSОзН [325, 327].
Рис. 9. ПОРЯДОК расположения аминокнслот в rнпертенсине
и связи в нем, rидролизуемые трипс ном н химотрипсином.
;
Заключение. В заключение следует отметить, что для про-
явления специфичности трипсина необходимо, чтобы rидроли-
зуемая молекула содержала положительно заряженную бо-
ковую цепь соответствую их размеров, которая способствует
сближению карбоксильнои rруппы с чувствительной к rидро-
лизу связью. Однако при наличии положительно заряженной
rруппы rоСеДНЯЯ связь не всеrда становится чувствительной
к rидролизу. Действительно, как указывалось выше, остатки
ПРОЛИ}fа, блаrодаря KOTOpb1M имщюrруппа сближается с со-
седнеи связью, обусловливают устойчивость к rидролизу. Не-
сколько расположенных рядом остатков OCHQBHOr9 характера
изменяЮТ чувствительНость связи. СосеДНJfе СJlободные (1-ами-
ноrруппы или комбинированное влияние а;- и а-карбоксиль-
ныIx rрупп также MorYT предотвратить rидролитический раз-
рыв связи.
В настоящее время наиболее специфическим из известных
методов rидролиза для изучения последовательности распо-
ложения аминокислот в ПQлипептидах и белках, особенно в
случае 'Окисленной рибонуклеазы, является rидролиз под дей-
ствием трипсина. При этом следует иметь в виду, что в на-
ти ных белках мноrие связи MorYT оказаться недостуПНЫМИ
деиствию фермента, но они претерпевают разрыв после рэ'i-
fипертенсии. При действиИ реннина на белок сыворотки
крови образуется несколькО вещес'I:В, повышающих кровяное
давление [236, 279, 291]. Порядок расположения аминокислот
Н. Асп. Арс. Вал. Тир. Вал. rHC. Про. Фе. rис. Леи. он
1 2 3 4 5 6 7 8 9 10
Gвязи, расщепляемые
трипсином
t
I
химотрипснном
t
I
1
в основном компоненте, получаемом из сыворотки крови
быка, rипертенсине I, который является декапептидом [98],
показан н'а рис. 9.
Аналоrичная последовательность аминокислот, но с изо-
лейцинОМ вместо валина, была установлена для декаПiптида.
198
Селекти81u!е ра щепление белков
Реа2ентЫ, расщепляющие связи в полипеnтидной цепи
199
вертывания молекулы путем де атурацйи, окисле.нин и т. д.
rидролиз трипсином в сочетании с друrими ферментами, в
первую очередь химотрипсином, позволяет п учить важные
данные о последоватеЛЬНОСТИ расположеiIИЯ. аминокислот.
Основной проб.)1емой является фракционирование пещидов,
полученных в результате rидролиза трипсином. Трудности р.а-
боты с динитрофенильными (ДНФ) произв дными пеП ИДQВ
обусловлены их нерастворимостью и СИЛЬНОИ адсорбциеи бу-
маrой и в ионообменных колонках. Эти трудности можнр пре
одолеть, если вместо ДНФ производных использовать карбо-
б-ензоксипроизводные [12], от которых карбобензоксиrруппа
леrко отщепляется при действии безводноrо бромистоrо водо:
рода в муравьиной кислоте [26]. После отщепления защитнои
rруппы проблема сводится к выбору метода исследования
более крупных пептидных осколков. Так, в зависимости от
размеров получаемых осколков исходноrо вещества и TPYДHO
стей, связанных с фракционированием этих осколков, можно
использовать rидролиз трипсином окисленноrо белка или rИk
ролиз ацилированноrо окисленilOrо белка. Полипептид:r, ко-
торые надежно фракционируются на колонке со сМолои дау-
экс 50-Х2, имеют в своей цепи не больше 20 30 аминокислот-
ных остатков [219].
При работе с пептидами, содержащими цистин и метионин,
без предварительноrо окисления неQбходимо 'учитывать до.
полнительные факторы, например их нерастворимость и
. склонность к окислениЮ.
ХИМОТРИПСl\НЫ,
полученные при быстром
активировании .
/' "
/ "-Аутолиз
Трипсин "\а
/ Химотрипсины,
Химотрипсиноrен полученнце при мецленном
" акт:ивированин
. Химотрипсин"- .1'
"- /'rрипсин
":. / .
Неохимотрипсииоrены
Хu.мотрunсин
a-ХимОТРИПСИН представляет собой один из протеолитиче-
ских ферментов, которые MoryT быть получены из »еактивноrо
предшественника химотрипсиноrена. Химотрипсиноrен акти-
вируется небольшими количествами трипсина. Субтилизин [45]
также способен активировать химотрипсин. Ферментная
активнОСТЬ обусловлена специфическим де ствием тр псина,
которое заключается в разрыве' только однои пептиднои связи,
а именно связи Арr.Илей , хотя химотрипсиноrен содержит
двенадцать остатков лизина и четыре остатка арrИНИlIа [12'8].
.Изучение N и С-концевых остатков химотрипсиноrена и раз.
личных продуктов ero р спада позволило полностью выявить
химические превращения, которые претерпевает химотрипси-
HoreH при активировании. Данные, получ нные в ряде работ
[224, 225, 257], представлены на рис. 10. Процессы активиро
вания химотрипсиноrена можно представнть следующим об-
разом:
Неохимотрипсиноrены и химотрипсины, указанные ;на
рис. 10, не единственные представители этих родственных
rрупп белков. Имеются KocBueHHbIe доказательства [257] суще-
ствования друrих соединении подобноrо Типа. Данные, приве-
денные на рис. 10, являются результатом мноrолетнеЙ работы
в нескольких.лабораториях, в первую очередь в лабораториях
Денюеля и Нейрата, и служат Har лядной ИЛЛIQстрацией успе-
хов в технике эксперимента, достиrнутых за этот период.
С-Концевая аминокислота химотрипсиноrена оказалась
нереакционноспособной по отношению к карбоксипептидазе и
при rидра.зинолизе [225]. Однако при действии карбоксипеп
тидазы на денатурированный мочевиной химотрипсиноrен об-
разуются аминокислоты; С-концевой участок имеет состав
(Ала,Вал) .Лей [118]. По данным работ [214, 224], этот уча.
сток харarперизуется друrим составом, поэтому на рис. 10 он
изображен как Х.ОН.
Активность химотрилсина проявляется при рН 7 9,..:HO
она HeCKO ЬKO меняет.ся в зависимости от суБС1.:рата [128]. M K.
С!lмаJIьНЫИ rидролиз некоторых синтетических субстратов, IJa-
пример' бензоил-l.тирозиламида, 'наблюдается при рН 1,8. .::
При оптиМальной величи.не рН химотрипсин устойчивее
трипсина но в концентрированном раетворе при ,РН :7,8 Ьн
претерневает аутолиз без потери ..Б.ктивности, превращаЯСf> в
две новые ф рмы tз. И 1'-ХИМОТРИП ИН I. . .
Исследования химотрипсина на синтеТических субстраТ2Х
показа и, что специфичность фермента проявляется нескол';ко
шире, чем специфичность трипсина. I(ак правило, пептидныI'.
связи, rидролизуемые химотрипсином, образованы карбо-
ксильными rру пами амин кислот, имеющих БОКОВЫе цепи
арОМатическоrо характера, например тирозина, фенилаланина
или триптофана. К:роме Toro, атаке подверrаются соединения,
содержащие метионин и лейцин, но rидролиз протекает ro-
раздо медленнее [128, 228].
:iS
t:;;
:»
::<:
lJ..j
t:;;
о
:с
с С; I
=: t; QJ '"" 0-.1'::;;: :s:
t; «I -=; a. QJ QJ
r:(: t
'с;:) <J) g
<!> з::
.;;' з::
..........."'. о
Ь,,- 1
$
....
oz
I
.....
::с -:Е
z
rт),:S::Cl.cut:to:sC
::S:: QJ :s:: o.. u t:;.........U
t:;; t:;; 1-- 1-- < < <
lJ..j
:iS
з::
со
:s:
1--
::<:
<
11
:iS
t:;;
:»
:..:
lJ..j
t:;;
о
::Е
.:.:1
.:s: е; QJIL.o o..,:s:: :s:
t:; ttI Q., Q) CU t:;
t.... 00 :s: 1< u t:;; t....
I I
cl.
...
U
I
g
i
lJ..j
:iS
з::
00
:s:
....
:..:
<
lJ..j
::с
м
з::
O:: CO !"
vi "'
1 ....
с2'
.L
::r;C'I :ё
r
Ct:I о::;: с..; QJ С «1 С
:S: QJ :!t Cl. U U
с:; с:; ....:1--- «<
'"
:.:
u
с
'"
о-
..
о
:i!!
:s:
х
I
'"
...
....
о
:z:
:s:
u
с
:s:
о-
..
о
:2
:s:
Х
'"
о:
и
с:
'"
со.
..
о
>1
о:
><
:t: :I:
О О
:s: с:: -ij ..s. =
«I t; cl. -и a:;
[
I "'
м з::
<!>
6
I х
J,
:!.
J..
-;Е; -:Е
I I Z
м :11::: 0..1 QJ с; C'I:S =
:S: C1J :s: o.. u t; U
t:;; t:;; 1--;1-- <1< <
1 ;
r.-
о:
о:
u
с:
..
со.
..
о
'"
о:
><
...............
t;oo с:а.. -:!: :s:
'::L, CU QJ t;
ct: U t:;; t...
I
о-
...
u.
I
"' ::J
.i
:s: "
" '"
t.... 00
L",
-;:;
ф
::с
C>:; f
<i'
I .z
'"
1-
::с -:ЕI -:Е
О !
M,:S:: с.. си a::::lca с
:S: QJ :S: o.. U u
t:;;t:;;1--1-- <1«
i 1
.::
s: " ...
'::; ttI
L 00 :s:
'"
'"
u
С
..
о
:i!!
'"
><
I
""
:с
с?
:Е
о: .3
'" с:
и и
;
со. Q)
.. со.
о '":
:с
>< 1
'"
", ..
<::;'1
р..
...
u
I
j
'" ::ё
,
,trJ
с>:; S
.1
ti) ф
I Z
с>:;
1-
-:Е
z
.'" с
.. ....
< <
:i
:r:
з::
о
м :11::: cl.
= QJ З:
с:;: с:; 1--
.....
...
р..
-= 1
:;
t.... 00 :s: < u 1;::;: t....
I Ь.
...
"'
='[
."'
:i
..
с:
..
со.
..
о
:11
о:
><
'"
...
....
о
'"
:s:
u
с
'"
р..
..
о
:>!
:s:
Х
о
...
:t:
Ш"'
ёX
l' ф
v') .......... , v
:с
. z j
,..."
:t: с
q':;:
:...... gj - са
с:;: ... {:; .:;:
:с х
+
:t:
О
"
:s:
u
с
:s:
cl.
..
О
:2
:s:
><
I
<:1
:I:
со.
..:
з::
о
:s: 't:;:II I,"", o..' :s::
са =;''''''''''''о..'''''''''''QJ (j"J =;
t.... 00 :S:: < i t:;; t
gg U) U
:,
и
х
; }. !
з:: I ....
5 i
м .:= cl. C't:I с:
:S: q.J :s: =; и
с:; q .... <1: <
з::
,....
р..
...
u
f-ouшm
=t.H:Q
"'", :zs
o..::s ('1'}
f-oО
= 8 .
=5
с..; g;и=м CV
:I: 5.: 5
a. :'g 5
ъ ;
5 t;{ In
r:: =<::s
:s: oiQ):!"''''
E!
. ::1 Q.
:s::
1< U =
:2 :s:
(1) t::o.. Q)
S t:: Q)U
'" :s:: Q...o..
6c03tQ i2
8.. t:: ;
:S:: CUr::f-!aj:S::
j:Q [
Е-о o..r... О
;:J' :s:OE-о
"" >.:>!gJgJS2
::sQ)E-оut=
и fs1g
:!
:I: Q)=::s=
::с :S:=
= ..
о:: t:: ga
е I=Q);;
[:S:U
0::'" t a=
:;: о::;;: :>! '"
i
er =< gJ
I=t:
:S::
8:
i!uia
cl) ::I! CIS е:; .... t=
:s:: a:I >J o ==
=:g
aJ З!
g; ;r о..::Е! :Z:: m
:i; E-оtL>Q.lgt
g cu
t:: ::S
d
""""'" QJ
O CIS;:f
u и cu=:=
:s:: o
С. .Б ::;!:
о", 10
I:Q E-oe:;
:I5= :S;
#i9 a.
:s::g
::1= Q I
'"
"
<
:s:
...
....
о
'"
'"
u
С
'"
cl.
..
О
>!
:s:
х'
о
...
202
Селективное расщепление белков
Химотрипсин использовался для rидролиза полипептидов
и белков до выделения пептидов с целью изуtlения последова
тельности аминокислот. Полученные до на.стоящеrо времени
данные о том, какие типы связей подверrаются разрыву под
Таблица 2
Действие химотрипсина на различные белки
Связи оста"ков тирозииа, фенилаланииа и "рип,'офана Друrие
Пептид или I I расщепляемые
белок частично ус"оtl связи
леrко расщепляемые расщепляемые чивые
Окисл и-
ИЫй
иису лиll UИ SОзН. Сер
цеп» А Тир. fлу (NH,) Тир. Ци SO.H
14 15 19 20' II 12
цепь Б Фе. Тир Тир. Лей Лей, Тир Фе.Фе
25 26 16 17 15 16 24 25
Три. T b
26 7
rлюкаrои e. T e Тир. Сер ;
10 II
Фе. Вал Тир. Лей
22 23 13 14
Т и. Лей
5 26
Окис.чеи- Фе. rлу ТИf. Ци SO.H Тир. Про fлу. Ала
ная рибо 8 9 2 26 . 92 93 18 19
Фе. ? Тир. rлу INH.) Лей. тре
иуклеаза .46 47 73 74 35 36
Фе. Асп Тир. Сер Асп (NH,). Вал
120 121 76 77 62 63
Тир. Лиз Мет. Сер
97 98 79 80
'rир;v ? rOl (нн.). Лиз
115 116 1 104
fис. Илей или Вал
105 106
Кор,'ико- Фе. Apr Тир. Сер Пф. Про Лиз. Лиз
7 8 2 3 23 24 15 16
,'ропии Три. rли Фе. Про Лей. f'лу
35., 36 37 38
.. 9 10
Il-МС!' Ф:. AB r Тир. Gep Три, rли -
2 3 9 10
-Mcr .Фе. Apr. тЕ/!' fли TIJP. Лиз
.. 10 :l1 2 13 5 6
rиперteн- Фе. [НС Тир. Вал
сии 8 09 4 5
деЙСТ:ВйеМ этоrо фермента (твбл..2), подтверждают, что обыч-
но происходит разрыв связей, в которых участвуют остатки
фенилаланина и ТИрОЗИНа, но иноrда именно эти связи ока-
зывютсяя устойчивыми, а разрываются друrие типы связей.
Реаеенты, расщепляющие связи в nолunenтидной цепи
203
ПРlf активировании ХИМОТРJiпсиноrена трипсином, в ходе.
KOToporo наблюдается также аутолиз-или действие химотрип:
син.а на. ХИМОтрипсиноrен, помям(.) ожидаемоrо rидролиз
связи Тир.Тре происходит разрыв связей Лей.Сер и
Асп(NН2) .Ала , т. е. связей. образованных остатками, H
содержащими боковых цепей ароматическоrо характера. Та-
ким обра ом, связь Тир. Tpe представляет собой единст-
венную связь, в. которрй участвует аминокислота с аромати
ческим заместителем в боковой цепи, хотя белок содержит
чеТQIре остатка тирозина, шесть остатков фенилаланина Ji
шесть остатков триптофан . Это является еще одним доказа-
тельством устойчивости нативноrо белка к ферментативному
rидролизу.
. . ОКИ'сленный инсулин. rлицИЛьная цепь окисленноrо инсу-.
ЛЩlа содержит ДВ(} 9статка тирозина. Обе связи, в которых
участву1Qт ;1ТИ 9 T :rKJi, претерпевают I'идролиз [2б7}. Связь
Тир.rлу(NН2) rидролизуется.. rораздо быстрее и пол-
14 15
нее. чем связь Тир.ЦиSОзН . Так, через 5 мин разрывает-
ся только СВ Зь MelКДy оствтками в ПОЛОlКении 14 f5 и об-
разуются лишь два пептида., а через 16 час из rидролизата
моlКЯО. выделить еще четыре J{омпонента [143], которые обра-
зуются при разрыве связи 19 20, а также, вопреки ОlКида-
ниям, связи ЦиSОзН.Сер (см. рис. 1).
II 12
При частичном разрыВе связей в положениях 11 12 и
19 20 состав rидролизата становится. более СЛОlКНЫМ, что
затрудняет последующее фракционировани.е. Аналоrичные
т:рудности--'Возникают и При частичном изменении какоrо-либо
амино]<ислотноrо остатка цепи. Например, превращение части
остатков т розина во время окисления в хлортирозин приво-
дит К тому, что Наряду с тирозинсодержащими пептидами об-
разуется такое же число хлортирозинпроизводиых. Частичное
дезамидирование при получении ряда белков {54, 55, 133] при-
водит к образованию параллельных рядов амидосодержащих
и дезамидированных пептидов [269], Друrой трудностью:
встречающейся при работе с концевыми rJJутаМИНl!лпепти-
дами, явл ется их способность отщеплять аммиак от остатка
rлутамина с образованием соответствующеrо пироrлутамил
пептида, что наблюдается в случае окисленноrо инсулина [267.
269] и рибонуклеазы [154]. . .
Неожиданным явился раз.рыв связи ЦиSОзН.Сер под
действием .химотрипсина. В контрольных опытах с химотрип
сином, который предварительно инкубировался со специфи-
ческим ИIJrибитором диизопропилфторфосфатом, разрыв-а
....
Селективное расщепление белков
Решенты, расщепляющие связи 8. nолunеnтuдной цепи
JЮ5
204
Окисленная рибонуклеаза. Действие химотрипсина на ри-
бонуклеазу менее специфично, чем действие На эТОт субстрат
трипсина. Об этом свидетельствуЮт более низкие выходы по-
липептидов . при раз елении rидролизата методом ионообмен-
ной хроматоrрафии Р54]. В выделенных полипептидах уста-
новлено наличие 151 аминокислотноrо остатка, в то вреМЯ
как в полипептиДах, получеtшы1x в результате расщепления
трипсином, обнаружено Bcero 124 остатка. По-видимому, это
объясняется тем, что некоторые участки полипептидной цепи
пояt!лSlЮТСЯ более чем в одном из пептидных обломков. О бо-
лее сложном составе rидролизата можно судить по неболь-
шим количествам примесей (как правило, не выше 15%),
присутствующих в большинстве основных фракций. Эти пlш-
меси не мешали определению аминокислотноrо состапа фрак-
ций, но их присутствие еще раз подчеркивает трур.ности, ко-
торые встречаются при фракционировании смесеи пептиДОВ,
полученных менее специфическими методами rидролиза.
rидролизаты рибонуклеазы были получены инкубйрованием
в течение 24 час с ферментом при рН 7. При более кратковре-
менном инкубировании rидролизат содержал дополнитеЛЬНQ
несколько пепти;ll,ОВ, так как происходил только частичный
разрыв некоторых связей, и продукты rидр6лиза (пептиды)'
содержались в меньших, чем при полном rидролизе, КОЛИЧе-
ствах. Выход основных пептиДОВ составлял 40 80%. Связи,
разрываемые химотрипсином, показаны на рис. 4. Если бы
какие-либо друrие связи rидролизовались более чем на 10%,
то в rидролизате были бы обнаружены продукты rидролиза.
Н апример, наличие пептида примерноrо состава ЦиSОзН.
rлу.Асп.МеТ2 с выходом около 20% следует рассматривать
как доказательство частичноrо разрыва связи Мет.Лиз .
30 31
Только связь, содержащая тирозин или фенил8.ланин, на-
пример связь Тир.Про , оказалась rидролитически полно-
92 93. .
стью устойчивой. Расщепленные химотрипсином связи пока-
заны в табл. 2. Разрыв 15% связей Лиз.Фе , возможно,
'7 8
вызван присутствием следов трипсина в химотрипсине.
rлюкаrон. При rидролизе rлюкаrона химотрипсином не
наблюдается никаких отклонений, причем все связи разры-
ваются не менее чем на 80% (см. рис. 3).
Кортикотропин. Действие химотрипсина на кортикотропин
[284] представлено на рис. 6. Устойчивыми к rидролизу ока-
зались связи Тир.Про и Фе.про .
23 24 з5 36
Наличие положихельно заряженной rруппы на участке
Фе.Арr не мешает количественному разрыву этой связи.
7 8
Точно TaJ5, же отсутствие боКоВОЙ цепи. ароматическоrо харак-
тера ИЛи наличие соседнеrо отрицательноrо зарЯДа не пре-
пятствует колич:естnенному разрыву связи Лей.rлу . Од-
37 38
HaI<o разрыва связей Мет.rлу и Лей.Ала не проис-
4 5 31 32
ходит. Расщепление связи ЛИз.Лиз химотрипсином. кото-
15 16
рое оказалось совершенно неожиданным, возможно, вызваН9
присутствием примеси трипсина.
связи в rлицильной цепи не наблюдалось. Расщепление той
же связи сх.-химотрипсином происходило В меньшем по разме-
рам пептиде, содержащем остаТки 1 13 rлицильной цепи, но
простая модель аммониевая соль карбоксамида N-ацетил-
l цистеиновой кислоты не тидролизовалась [220].
Имеются данные [228], что наличие отрицательноrо' заряда
вблизи чувствительной к rидролизу связи мо>кет препятство-
вать разрыву связи химотрипсином. Однако этому противоре-
чит расщепление связей ЦиSОзН.Сер и Тир.ЦиSОзН ,
которые имеют сильные отрицательные зарЯДЫ блаrодаря со.
седней SОз -rруппе, или друrих связей, например Фе.АсП
(см. табл. 2).
В фенилаланильной цепи инсулина разрыиа свяЗИ рядом
с N-конuеВblМ фенилаланильным остатком не происходило,
что, ЩJ-ВИДИМОМУ, .обусло'влено влиянием соседней положи-
тельно заряженной. rруппы. Можно ожидать, что rИДРОJIИЗ
rруппировки Фе.Фе.Тир в этом полипептиде протекает
24 25 26
сложно. В основном разрывается связь 26 27, в которой
участвует остаток тnрозина [272]. Устойчивость С-концевой
rруппы Фе.Фе в образующемся пептиде позволяет предпо-
ложить, что расположенный рядом с ЭТОЙ связью отрицатель-
ный заряд сх. карбоксильной rруппы замедляет rидролиз свя-
зей, которые обычно леrко расщепляются.
М.елаНОфОРОСТИМУЛИРУЮЩlfе ropMOHbI (MCr). Ра'сщепле-
ние этих полипептидов произошло в тех местах, rде ЭтОrО сле-
довало ожидать (см. рис. 7 и 8). Связь, в которой участвует
остаток триптофана, не 'была полностью rидролизована в
условиях проведения опытов [120, 142, 192]. Так, связь
Три.rли в cx.-МСr не разрывал ась количественно в тече-
9 10
ние 30 .мин при :ЩО и рН 8.2, но через 16 час, по-видимому,
200
. Селективное расщепление белков
PeazeHTbt, расщепляющие связи в nолunеnтuдной цепи
207
происходил полный rидролиз. Уча.СТQК Три.rJЩ в MCr
12- . 13
Jаkже расщеплял<;я не полностьюJi20,. t4;2],ДCj е..'Iерез 18
.24 час при рН 8 и 3 O из rИДРРЛИЗЗJ,а Бь,ловыдJj но"нес.J{оль--
;&0 более крупных пеПТИД()В(Q!:татки12 18) [120]. .
Связь Тир.Лиз (см. рис. 8) при действии химотрип-
5 6
сина в. течение 20 мин при 30<> и рН 8 разрывалl'\СЬ лиШьчl'\@-
тично. При этом из участка цепи 1 10 выделены три пеп-
тида, два из которых являются продуктами дальнейшеrо рас-
-пада TpeTbero пептида [142]. Присутствие основной rруппы
.в боковой цепи остатка лизина в этом случае вряд ли суще-
ственно сказывалось .на скорости rидролиза, поскольку звено
Фе.Арr в 11- и -Mcr претерпевает быстрый и полный
rидролиз. Возможно, что при этомзатраrивает.ся оседний
.остаток ПрОЛИ8а.
Как и в случае соответствующеrо участка цепи кортико-
тропина, связь Мет.rлу устойчива к действию химотрип-
сина..
о распределении в молекуле амидов [269], установления при-
роды амидов (например, содержит ли исследуемая молекула'
oCTaTKI:I аспараrина или rлутамина, а не изоаспараrина или
изоrлутамина [188]), определения положения дисульфидных
мостиков [259] или участков цепи, содержащих аминокислОТ-
ные остатки, которые леrко удается обнаружить специфиче
скими цветными реакциями, например участки, содержащие
арrинин [249]. В резулыатедальнейшеrо rидролиза крупных
полипептидов под действием трипсина можно получать про-
стые пептиды, которые удается идентифицировать [272].
ДрJ1zие ферменты
Для расщепления 1J0липептидов и белков использова.пись
и друrие ферменты. Однако их действие оказаЛОСЬ недоста-
точн'о. сriецифичным поэтому они н'е рассматриваются подроб-
но. .Для оценки потенциальных возможностей ЭТ}lХ фермен-
тов следует указать на некоторые особенности их действия.
НеСМQТРЯ на относительную неспецифичность, эти ферменты
исключительно важны для расщепления природныхбелковых
соединений на ме'nкие осколки с целью получения дaHHЫ
Пепсин. При рН < 5 пепсиноrен аутокаталитически пре-
вращается в пепсин по следующей реакции:
Пепсиноrен Пепсин + ИнrиБИ10р + Различные пептиды.
Аминокислотный COCTa пеnсиноrена, пепсина и инrибитора
пепсина известен [328, 29]. На основации данных о строении
N. и С-концевых участков можно сделаtь вывод, ЧТО пепсин
образуется из С-концевоrо участка пепсиноrена, поскольку
пепсин и пепсиноrен имеют одинаковые С-концевые, но раз-
ные N концевые участки [147, 329]. .
Имеется доказательство Toro, что пепсин менее однороден,
чем трипсин и химотрипсин [128]. Этим отчасти объясняется
широкий спектр действия пепсина в отношений пептидных
связей. Результаты изучения действия пепсина на синтетиче-
ские субстраты показывают, что пепсин вызывает разрыIB
связей, в которых участвует аминоrруппа аминокислОТ с бо-
ковой цепью ароматическоrо характера.
Типичным синтетическим субстратом может . служить кар-
бобеН30ксиrлутамилтирозин. Наличие аминоrруппы рядом с
rидролизуемой пепсином сIlязью подавляет действие фермента.
Если одна из карбоксильных rруПП ЭТОrО субстрата защище-
на амидной rруппой, то активность фермента также снижает-
ся, а при зщ.ците обеих карбоксильных rрупп подавляется
полностью [27]. .
Максимальная активность пепсина по отношению к боль-
шинству синтетических субстратов наблюдается при рН 4.
В случае белковых субстратов и синтетических субстратов
с последовательно расnоложеНfIЫМИ ароматическими амино-
КИСЛО'l'ными остатками, например ацетил фенил аланил фенил-
аланина, максимальная активность пепсина проявляется при
рН """ 2. ОДН8КО при такой' высокой кислотности среды пепсин
вследствие аутоли'за неустойчив. Пепсин максимально устой;'
чив при рН 5 5,5 и быстро денатурируется при. р Н6.
Заключение. Действие химотрипсина по отношению к суб-
стратам с длинной пептиДНОЙ цепью достаточно специфично,
что позволяет использовать ero для селективноrо расщепле-
ния бе;лков. Если пролильный остаток расположен за амино-
КИCJlотой с ароматической боковой цепью, '1'0' пептидная связь
устойчива к rидролизу.
Сос д.ше а;-аминоrруппы илиа;-карбоксиJiьные rруппы за-
метно замедляют скорость rидролиза. Друrие боковые цепи
кислотноrо или OCHoBHoro характера оказывают меньшее влия-
ние. Действие химотрипсина не оrраничивается связями, в ко-
.торых участвует карбqксильная rруппа ароматической амино-
кислоты, так как происходит частичный rидролиз связей, в об-
разовании которых приiшмают участие самые разнообразные
аминокислоты (сМ. табл. 2).
Селективное расщепление белков
Реаеенты, расщепляющие связи в nолunеnтидной цепи
209
208
Действие пепсина на цепи А {267] и Б {272] окисленноrо
инсулина (рис. 1 и 2), на кортикотропин [23] (рис. 6) и окис-
ленную рибонуклеазу [17] (рис. 4) изучено довольно подробно.
Таблица 3
Действие пепсина на различиые белки
Устойчивые свяsи. .. обрцо-
ваннн которых участвует
амнноrруппа тнрО!шна или
феНИЛRJlRпииа
Расщепляемые связи
стратах. Попытка четко разrраничить леrко rидролизующиеся
и частично rидролизующиеся связи оказалась безуспешноif,
поскольку во мноrих случаях разрыв некоторых связей влияет
на rидролиз соседних связей, которые обычно леrко разры-
ваЮтся. Кроме Toro, следует отметить, что данные по расщеп-
лению рибонуклеазы неполны. так как до сих пор точный
порядок расположения некоторых аминокислотных остаТкОВ
не известен.
Однако, как показывает табл. 3, мноrие связи, в которых
не участвуют остатки ароматических аминОкислот, rидроли-
зуются. в то время как мноrие связи, которые долщны были
бы разрываться в данных условиях. оказались устойчивыми.
По видимому, это можно объяснить тем, что субстрат факти-
чески подверrается действию нескольких ферментов, или тем,
что до настоящеrо времени недостаточно выяснены особен
ности структуры, необходимой для осуществления атаки сО
стороны пепсина.
Принятый метод обозначения мест атаки фермента на
субстрат порядковыми номерами остатков не может передать
всю сложнОсть состава rидролизатов. Например, в случае
цепи А окисленною инсулина инкубирование с пепсином при-
водит к образованию семи пептидов за счет разрыва четырех
связей, указанных ниже:
Тир. rлу (NH 2 ). Леи. rлу. Асп (NH 2 ). Тир. ЦиSОsН' Асп (NH 2 ). ОН
l4 15 16 l7 18 19 20 21
i 1. i i
н. Тир. r лу (NH 2 ). ОН
Н. Тир. rЛ'у/(NН 2 ). Лей. ОН
Н. Тир. fлу (NH }. Лей. fлу. ОН
Н. Лей. fлу. Асп (NH 2 ). Тир. ЦиSОsН. Асп (NH 2 ). ОН
Н. f лу. Acn (NH 2 ). Тир. ЦиSОsн. Асп (NH 2 ). ОН
Н. Асп (NH 2 ). Тир. ЦиSОsН. Асп (NH 2 ). ОН
Н. Леи. fлу. ОН
Сложность состава этоrо' rидролизата до некоторой степени
можно объяснить инrибированием пепсина соседними с rид-
ролизуемой связью аминоrруппами. Так, молекула, разрыва-
ющаяся сначала по связи в положении 16 17, с трудом бу-
дет rидролизоваться по связи 17 18 и т. д.
Несмотря на ниЗ'кую специфичность пепсина, из rидроли-
зата цепи А инсулина был выделен большой N-концевои пеп-
тид, состояший из тринадцати аминокислотных остатков, что
в сочетании с данными по составу пептидов, образующихся
в результате частичноrо кислотноrо rидролиза, ПОЗВОЛИJJО
установить последовательность аминокислот в цепи А инсу-
лина [267].
Окисленныи
инсулин
цепь А fлу. rлу(NН 2 ) f лу (NH 2 ). Лей Асп(NН 2 ). Тир
4 5 15 16 18 19
Лей. Тир Лей.fлу
13 l4 16 17
Тир. r лу (NH 2 ) fлу. Асп (NH 2 )
14 15 l7 18
цепь Б Н. Фе. Вал Лей. Тир
1 2 15 16
fлу (NH 2 ). fис Тир. Лей
4 5 16 l7 I
i
Лей. Вал fли. Фе I
II 12" 23 24
rлу. Ала Фе. Фе
13 14 24 25
Ала. Лей Фе. ТИf
14 15 25 2
Кортикотро- fлу. rис т лу. Ала Н.Сер.Тир
пин
5 6 33 34 1 2
fлу. Асо Фе. Про fис. Фе
28 29 35 36 6 7
Асп. fлу (NH 2 ) fлу. Фе. ОН Вал, Тир
29 30 38 39 22 23
fлу (NH 2 ). Лей
30 31
Окисленная
рибону- Ала.Ала Фе.1
клеаза Лиз. Фе Лиз. Тир
5 6 '1 8 91 92
Фе. f лу Связи 51 52, Сер. ТИf Ци SOsH. Тир
8 9 55.......-56. 24 2 96 97
108 109 ,
Тре. Фе Ци SOsH. Тир Ала. Тиr
45 4б 72 73 114' II
Фе. Асп Сер. Тир 1. Фе
120 121 75 76 119 120
в табл. 3 показаны связи, разрываемые пепсином, а также
те СВSJзи, на которые пеПСИН должен был бы действовать, судя
по erO специфичности, установленной на синтетических суб
14 3ак. 1416
210
Селективное расщепление белков
Реаеенты, расщепляющие связи 8 nолиnеnтидной цепи
211
Папаин. Этот внутриклеточный фермент В настоящее времЯ
получают в исключительно чистом кристаллическом виде из
экстрактов продажною cyxoro латекса ДЫННоrо дерева
(Carica рарауа) [178]. Активность фермента зависит ОТ нали.
чия ьдной сульфrидрильной rруппЫ [296]. В присутствии.
восстановителя (например, цистеина или цианида) и комплек-
сообразуk>щеrо peareHTa (например, этилендиа минтетрааце-
тата) получаются воспроизводимые активности ферментноrо
rtрепарата.
Молекулярный вес папа ина равен примерно 20500; ero
молекула содержит. nриблизительно 180 OCTaTKO аминокис-
лот, но при инкубировании c-лейцинаМинопептидазой от N KOH-
цевоrо участка цепи папаина отщепляется до двух третей
остатков аминокислот без потери исходной ферментной актив-
ности [148]. .
Максимальная а тивность папаина проявляется при
рН 5 7,5; при более высоких значениях рН в.озможны хими-
ческие превращения и реакции переноса [117, 178].
Установлено [27], что частично очИЩенный папаин спосо-
бен атаковать синтетические субстр.аты амидноrо и пептиД-
Hoto типа. Аналоrl:!ЧНЫМИ свойсТвами обладает и кристалли-
ческий ферщшт [17S], который вызваетT расщепление, хотя
и с весьма раЗЛIiЧНЫМИСКОРОСТЯМИ, всех синтетических суб-
стратов для ТрИПСliна, пепсина, химотрипсина, карбоксипепти-
дазы и пептидаз. Из известиых в настоящее время субстратоо
папаиНЙ наиболее чувствительным оказался бензои;rr-l-арrи-
ниламиД. Атака фермента иа фракцию А окисленноrо инеу-
лина свидетельствует о широком спектре. rидролитическоrо
деис'i'ВИН, напомИlIающем действие пепсина, хотя степень раз
рыв а различных связей этими ферментами весьма различна.
,Связи, атакуемые папаином, показаны, на рис. 1. Пред-
ставляет интерес тот факт, что в незатронутой фракции А
расщепляется связь ЦиSОзН.Сер , а в пептидном осколке,
11 12 .
состоящем из остатков 1 13 ЭТОй цепи, вместо этой связи
раЗр IВается свя ь Сер.Вал . Это также показывает, что
9 10
разрыв чувствительной к rидролизу связи определяется не
только характером остатков, участвующих' в образовании
связи, но и друrими факторами.
Протеаза плесени и субтилизин. Протеаза плесени, выделен-
ная в кристаллическом'виде из фильтратов культуры А. ory-
zae, оказалась во MHoro раз активнее папа ина при rидролизе
казеина и rемоrлобина [66]. Найдено, что этот фермент при-
водит к более rлубокому rидролизу цепей окисленноrо инсу-
лина. чем. все рассмотреlIные выше ферменты [269]. Связи,
разрываемые протеазой плесени, показацы на рис. 1 и 2.
Субтилизин был получен в кристаллическом виде fунтле-
берrом и Оттезеном [130] из .среды, в которой выращиваJJСЯ
штамм В. subtilis. Первоначально этот протеолитический фер-
мент был обнаружен по ero способности вызывать оrраничен-
ный rидролиз нативноrо овальбумина, сопровождающийся
образованием друrоrо способноrо кристаллизоваться белка
плакальбумина [200] и rексапептида Ала.fли.ВаЛ.Асп.Ала.
Ала [231].
Специфичность разрыва этой связи весьма пр мечательна,
если учесть разнообразие пептидных связей, разрываемых
этим ферментом в друrих белковых соединениях. Вообще суб-
тилизин характеризуеТС51 таким же широким диапазоном спе-
цифичности, как и плесневая протеаза. Оба фермента при
кристаллизации выпадают в виде кристаллов одинаковой
формы,. но они имеют разные изоэлектрические точки [130],
поэтому их вряд ли можно считать идентичНЫМИ.
Окисленный окситоцин (ХIП) расщепляется субтилизином
по указанным ниже связям [326]:
H-ЦиSОзН. Тир.Илeii.r лу(NН 2 ).Асп (NH 2 )
1 i
циsозн.про.лей.r лу.NН 2
< i
ХIII
В цепи Б окисленноrо инсулина (см. рис. 2) из 29 связей
субтилизин rидролизует 18 связей [324], а в при родном инсу-
лине свиньи [213] в цепи Б rидролизуется только 13 связей,
что свидетельствует о влиянии структурных факторов на ход
14*
Кортикотропин СВЩIЬИ расщепляется под действием пеп-
сина аналоrичным образом, давая три крупных активных об-
ломка [23], состоящих из остатков 1 28, 1 30 и I Зl. Боль-
шое количество мелких пептидов получено из XBocToBoro уча-
стка цепи кортикотропина, леrко подверrающеrося rидролизу
3, 19 . ,
В противоположность далеко идущему rидролизу окислен-
ной рибонуклеазы. при действии пепсина в определенных
условиях на нативный белок rидролизуется только ОДНа пеп-.
тидная связь с отщеплением от С-концевоrо участка тетрапеп-
тида и образованием вещества, лишенноrо ферментной актив-
ности [8].
о
Q.
с::
Q.
!---
o.
:s:
f-:
.,
е
cu
е
:r ........
<:
L....
..:
с Q.
:r: u «
z <; >,
:t <:
t
:Е . tr)
z < .,;
.......... ..
IX)
.,
с:::
о.
'"
!---
...
с
>.
<:
L....
""
.,
с:::
>,
:f t:;
'z t..;
Q.
:s:
!---
.
""
си
с:::
р-
си
U
:s:
<I) :::J
""
..
<: '-'
:s:
Q.
..
..
со
!---
",.
:::J <I)
:s:
<I1 :::J
:Е:
Z L....
>.
<:
L....
.,;
..
C!J
..
<:
:s:
..........
'"
<:
L....
:t:
::J:
q
..
<:
<:
M
:s:
с:::
.",
..
с:::
..
<:
<:
<:
L..
..
..
C!J
.,,;
си
r::;
u
:s:
L....
о.
..
u
i
1-:
'"
<I)
""
си
с:::
u
:s:
L..
r:
Z L....
:r:'" ё
Z
<:
..
CIJ
:t:'
Реаеенты, расщепляющие связи в полunеnтидной lienu 213
aJ
21
::I!
aJ
>,
'"
:s:
о;
о
р-
1=1:
:s:
'-
протео.rlИза. Связи, разрываемые субтилизином в инсулине
свиньи, показаны На рис. 11, а соответствующие связи rлю
KarOHa на рис. 3. В обзоре Анфинзена и Редфилда [1 О] при-
водятся имеющиеся данные по действию субтилизина на QИ-
бонуклеазу.
Вряд ли имеет смысл делать какие-либо обобщениSI, ка-
сающиеся специфичности этоrо фермента. В случае инсулина
наблюдается избирательное действие на связи, образованные
карбоксильной rруппой лейцина, тоrДа как в отношении rлю-
KaroHa это не ясно [287]. Поэтому создается впечатление, что
в образовании rидролизуемых субтилизином связей. MorYT
принимать участие все аминокислотные остатки, за исКЛЮче-
нием, по-видимому, пролина.
Леrочная протеиназа 1 и реннин. Очищенная протеиназа,
ВЫДеленная из леrкоrо быка,. разрывает в цепи Б окислен-
HOro инсулина те же связи, что и пепсин [67]. Синтетические
субстраты для леrочной протеиназы до сих пор не найдены.
Изучено также действие кристаллическоrо реннина на
окисленный инсулин [103]. Найдено, что он rидролизует неко-
торые связи, атакуемые пепtином. В условиях, в которых
исключена возможность заrрязнения препарата реннина пеп-
.сином, было установлено, какие СВЯЗИ разрывает этот фер-
мент (см. рис. 2) .
Тромбин. Превращение фибриноrена в фибрин под дей-
ствием тромбина является примером оrрани'!енноrо протео-
лиза, затраrивающеrо TO.!IbKO две или три связи примерно из
3000 связей фибрина и приводящеrо к образованию двух по-
липептиДQВ, которые были охарактеризованы [18, 30]. Оба
полипептида содержат арrинин. Поскольку тромбин rидроли-
зует синтеТЮ:Iеские субстраты, например метилОвый эфир то-
луолсульфонйл-l-арrинина [285], был сделан вывод, что в
фибриноrене происходит расщепление арrинильных связей.
Однако лизин в одном из.пептидов может участвовать в обра-
зовании разрываемой связи, так как субстратами тромбина
являются как этиловый эфир лизина, так и лизилаланиновая
связь в цепи Б окисленноrо инсулИна [95]. Протеолитическоrо
действия тромбина на овальбумин и миозин кролика не было
обнаружено [18].
;:;;
aJ
:I:
J:Q
:s:
м
о>:
CQ
u
:s:
:s:
:I:
:s:
CQ
u
aJ
:I:
:s:
о; .
,
:I: :I:
:S: i;
;:j
... :s:
о ...
0;\0
u>,
:s: u
:.:
О
:I:
:S:
;:;;
'"
с>:
:I:
::с
aJ
:;Е
О
о;
О
t::
u
'"
р-
:.:
о
1=1:
о>:
р-
О
t:::
.....
.....
u
:s:
о..
Химические методы
Химический метод селективноrо расщепления пептидной
цепи должен быть основан на использовании боковой цепи
аминокислоты, обладающей характерной реакционной спо-
собностью. Поэтому простые боковые цепи алифатическоrо
Реаеенты, расщепляющие связи в nолиnеnтидftOй цепи 215
Таблица 4
Аминокислоты с реакциоииоспособиыми боковыми цепями
Амииокислота
Боковая цепь
характера таких аминокислот, как rликокол, аланин, ваЛflн и
лейцины, не приrодны для этой цели:
.В табл. 4 приведены различАые реакционнЬспособные бо
ковые цепи аминокислот. В пролине такими rруппами ЯВ-
ляются иминоrруппа и карбоксильная rруппа. Пролин (а так-
же оксипролин) представляет собой исключение в ряду ами-
нокислот в том отношении, что он не содержит в пептиДНОЙ
цепи rруппы NH , способной образовывать водородную
евязь. r ометрия замкнутоrо пирролидиновоrЬ 1<ольца позво
ляет предположить, что пространственная структура белко
вой цепи не является непрерывной [93, 203]. Ме:тод химиче
eKorO воздействия на пролиновые остатки, если ero удастся
разработать, будет иметь БОJlьшое значение для исследова
ния белков.
Выше были рассмотрены попытки использовать для селек"
тивноrо расщепления боковые цепи цистиJtа и цистеина, об
рвзующиеся при восстанОвлении цистина (см. стр. 172 И ел.,
179 198). Друrа возможность селективноrо расщепления
[303] превращение этйх остатков в rруппы CH2SCN, KOTO
рые под действием щелочи раЗJIаrаются с образованием остат-
ков деrидроаланина (d.-аМ'иноаКРИJIОВОЙ кислоты). Это при-
ВOJHIT К появлению в пептидной цепи реакционноспособных
y.:iа с1'ков
"
NH
I OH
CH CH2 SCN
1
-СО
/
"
NH
I
С==СН 2 + SCN + Н 2 О.
I
СО
/
Цистеин
Цистин
Метионин
Серин
Треонин
CH2SH
CH2 SCH2
СН2СН2SСНз
CH20H .
CHOH
I
СН з
CH2COOH
. CH2CONH2
CH2CH2COOH
CH2CH2CONH2
"'-
СО
" C CH2
I 1
N СН 2
/ "'-/
СН 2
CH2C CH
I j
N NH
/
СН
CH2CH2CH2CH2NH2
CH2CH2CH2NHCNH2
11
NH
CH2 OH
CH2 < >
CH2U1(
V
KoropbIe под действием разбавленных кислот и щелочей или,
возможно, деrидропептидазбудут леrко расщепляться:
RCONHCCOR' --------+ RCOOH + NН з + СНзСОСОR'
11
СН 2
Попытки использования оксиаминокислот более подробно
описаны в следующем разделе. Как указывалось выше, pac
rцепление аминокислот OCHoBHoro характера проводилось
толв Р' при действии ТРИnС1ша (см. стр. 179 198) . Известны
рабаты, ,посвященные селективному расщеплению пептидных
связей в ар6матическй аминокислотах путем облучения
белка светом соответствующей. длины волны. В .большинстве
случаев исследования имели эмпирический характер и пред-
принимались rлавныIM образом с целью' изменения свой.ств
белков, часто обладающих ферментативными или иммунолоrи"
Аспараrиновая кислота
Аспараrин
fлутаминовая кислота
fлутамин
Пролин
rИСТИДИJj
Лизин
Арrинин
Тирозин
Фенилаланин
Триптофан
216
Селективное расщеnлеtШе белков
Реа2енты, расщепляющие связи в nолunептидной цепи 217
ческими своиствами. Полученные реЗультаты изложены в
ряде обзоров [80, 101,211].
Исследования возможности специфических расщеплений
сравнительно немнОrочисленны. Хотя известно, что при облу-
чении белков происходит разрыв пептидных связей, в случае
лизоцима [286] низкомолекулярные пептиДЫ или свободные
аминокислоты не были обнаружены.
Действие бромной воды на белки (см. стр. 224) является
еще одним примером расщепления пептидных связей, затра-
rивающеrо остатки тирозина. .
Триптофан быстро разрушается кислотами, но не изве-
стно, происходит ли разрыв пептидной цепи по остаткам ТРИП-
тофана так же быстро, как разрушение боковой цепи в ТРИП-
тофане. При окислении триптофана надмуравьиной кислотой
потребляется три атома кислорода и наблюдается потемнение
реакционной смеси, но разрыва пептидной связи не происхо-
дит (см. стр. 170 171). Однако вполне возможно, что удастся
разработать метод более быстроrо расщепления пептидной
цепи по остаткам предварительно окисленноrо триптофана.
Предпринимались также попытки исПОльзовать для селек-
тивноrо расщепления белков реакционноспособную боковую
цепь остаткОВ аспараrиновой или rлутаминовой кислоты. По-
лученные результаты рассматриваются ниже (стр. 227 229).
В табл. 4 приведены различные реакционноспособные
боковые цепи аминокислот, функциональные rруппы которых
можно использовать для селективноrо расщепления соединен-
ной с ними пептидной цепи.
Мuzрацuя ацuльной zpyппbl от N " О
v В 1924 r. Берrман 'и Майкели [28] обнаружили, что под
деиствием безводных кислотных peareHTOB ацильная rруППа
N-ациламиноспирта миrрирует с образованием О-ацильноrо
аналоrа. Под действием щелочи реакция ИДет в обратном на-
правлении.,
В качестве простоrо примера рассмотрим переrруппировку
этаноламида бензойной кислоты (XIV) в солянокислую соль
аминоэтилбензоата (XVI)'.
r C6H5 0 CH2
н+ " / I н+
C 6 H s CONHCH 2 CH 2 0H С CI
. OH / "t OH
HO NH2 CH2
XIV XV
C6H5COOCH2CH2NH;'CI
XVI
Филипс и Бальци [239] установили, что при этой реаи;-
ции проме>куточно образуется неустойчивое оксиоксазолиди-
новое соединение XVI. При этом в результате побочной реак-
ции отrцепляется вода и образуется оксазолиновое производ-
ное XVH, которое иноrда удаетСя выделить. Водные растворы
кислот превращают соединение XVH в сложный эфир XVI.
/0 CH2
C6H5 C I
N CH2
XVII
Филипе и Бальци осуществили миrрацию ацильной rруппы
от N к О в следующих условиях. Этаноламид бензойной кис-
лоты обрабатывался 3,3 н. раствором хлористоrо водорода
в абсолютном спирте в течение 1 недели при комнатной тем-
пературе. Выход солянокислой соли аминоэтилбензоата со-
ставил 65%. В отличие от неполной и медленноЙ миrрации
ацила от N к О обратнаst реакция протекает MrHoBeHHo и
практически количественно. Так, через 2 мин после титрова-
ния соединения XVI дО рН 1'0 и обратноrо титроваНИя до рН 5
95% сложноrо эфира переrруппировывается в амид. Попытка
провести ацильную переrруППИрОВКУ в разбавленной соляной
кислоте (0,04 н.) оказалась неудачной.
В белках те же реакции MorYT происходить с rидроксиль-
ныIии rруппами остатков серина и треонина, при этом обыч-
ная пептидная связь (XVIII) превращаетсst в О-пептидиль-
ную св.язь (XIX).
R CHOH
I нт
CHR' CO NH CH CONH . CHR' CO O CH R
OH + I
NНз-----сН сОNН
XVIII XIX
Миrрация аuильной rруппы от N к О при rидролизе пеп-
тидЬв концентрированными кислотами подтверждается ре-
зультатами анализа [74, 124], соrласно которым содер>кзние
оксиаМИНОКИСЛО1"ноrо азрта (определял.ось периО'Датным ме-
тодом или переводом в динитрофенильное производное) уве-
личивалось быстрее, чем аминокислотноrо азота (определя-
лось по Ван-Слайку). При низких температурах переrpуппи-
ровка происходил а более полно. Исследования относительных
218
Селективное расщепление беЛ,,08
Реа2енты, расщепляющие связu в nолиnеn1'uдной цепи
219
скоростей rидролиза N бензоилаланина, N бензоилсерина и
О бензоилсерина при 300 в 10 н. СОЛЯной кислоте [78] пока"
зали, что за 4 суток rидролиз указанных соединеиий прошел
на 6, 27 и 58 % COOT eTCTBeHHO. Более высокая стойкость к
rидролизу N бензоилсерина по сравнению с О бензои.лсери
ном указывает на то, что в данных условиях быстрой Миrpа
ции аЦИЛЬRОЙ rруппы от N к О не происходит, так как в про-
тивном случае степень rидролиза N_ и О ацильных производ-
ных б lла бы одинаковой. Дальнейшие опыты [72] показали,
что селективность rидролиза эдестина, овальбумина и reMo
rлобина в спиртовом растворе хлористоrо водорода, 10 н. сер-
ной кислоте или после предварйтельной обработки хлористым
тионилом была не выше, чем при rидролизе 12 н. соляной
кислотой. Однако после предварительной обработ и безвод-
ной серной кислотой и rидролиза белка 6 н. соляной кислотой
при 180 в течение 6 час с целью расщепления О пептидиль
ных связей специфичность расщепления . повышается. Наи
более показательные результаты получены с эдестином, в
котором 72 % сериновых и 33% треониновых связей rидроли
зовались соответственно в 70 и 32 раза быстрее, чем друrие
пептидные. связи.
При действии концентрированной серной кислоты на белки.
содержащие спиртовые rруппы, образуются. соответствующие
моноэфиры серной кислоты. При повышении температуры
реакционной смеси от 35 до 200 происходит ,частйчноесул.ь-
фирование циклических rрупп [253]. Инсулин. при обработке
серной кислотой не теряет биолоrической активности [123].
При длительном воздействии увеличивалось содержание амин-
Horo азота и образовывалось большее КОЛИIJеСТВQ диализуе-
Moro HerцeCTBa при разбавлении реакцИQННОЙ смеси водой СО
л.ьдом. Этих результатов и следовало ожидать, если в указан-
ных условиях происходили миrрация ацильной rруппы от
к О и последуЮщий rИДРОI1lИЗ возникших в'пептидах Эфl1pных
СВ I3ей водным раствором кислоты.
При ВЗаимодействии между серной кислотой. и реакционно
способными участками белков образуется вода, поэтому, для
Toro чтобы среда оставалась безводн6й, необходимо прини-
мать особые меры предосторожности. ОД1I8КО при сравнении:
результатов. 'полученных с }юнцентрированной идыIящей'.
серной кислотой, заметноrо различия в степени переrруппи-
ровки.небыло обнаружено [72]. . . '.
в -результате обработки концентрированноЙ серной кис
лотой.в течение 3 суток при 210 в фиброине шелка максималь-
но 62% пептидныХ связей пр вращается в O-пеП'rидильные.
свЯЗИ [96, 97]. Хотя вследствие изменений в скручивании ПСII-:
тидных цепей обратная реакция белков може'т оказаться бо-,
лее медлеJtной, как ЭТО ранее отмечалось в отношениц амино .
этилбензоата, было установлено, что выдерживание белковоrо
соединения прй рН 9 в течение нескольких часОВ значительно
снижает содержание аминноrо азота.
. Для повышения специфичности расщепления сложноэфир-
ной связи по сравнению со специфичностью кислотнorо rидро-
Лиза Эллиот ацилировал свободные аминоrруцпы при рН 5.
8 .результате обработки ацилированноrо белка 0,01 н. ще
лочью при комнатной температуре в течение 1,5 час значи-
тельио увеличивается количество диализуемоrо азрта, что со-
rласуется с r'идролизом эфирной связи С образованием смеси
ацетил- или формилсеРИJJпеп1<ИДОВ. От этих пептидов ациль-
ные rруппы были отщеплены обработкой на холоду paCTBO
ром хлористоrо водорода в метаноле; окисление периодато
продукта реакuии позволило установить, что из общеrо числа
остатков серина в 'цепи 62% составляют концевые свободные
остатки. описанныIe выше реакции, которые Эллиот [96] ис-
пользовал для селективноrо расщепления ПеПТИДНЫХ епей по
остаткам серина и треонина, протекают по следующеи схеме:
СН 2 ОН н 50 COOCH2 CH.COOCOCH.
I .' . I
CONHCHCO +-OH NHtCHCO
.......с00СН 2
. I
СНзСОNНСНСО
OH
cbO CH20H
. I
СНзСОNНСНСО.....;..
СН 2 ОН
1
NHtCHCO
CH.OH HCI
. ? .
8 фиброине шелка количество остатков треонина. очень
неЕелико по сравнению с ,остатками серИНа, поэтому в про-
дуктах расщепления не было обнаружено свободных конце-
вых rрупп треощша. Однако впоследствии были исследованы
белки, содержащие большее количество OCTaT OB тееонина,.
причем часть остатков серина оказалась устоичивои; а .ос-
татки треонина rораздо менее реакционноспособны, чем ос-
татки серина [247, 343]. В лизоциме, например, приблизи-
тельно 80% остатков серина . претерпевают миrраuию ацил"
ной rруппы, в то время как подобная переrруппировk::l
затраrивает Bcero 30% остатков треонина '[97].
Обработка безводной серной кислотой rлютена {343] и
rлиадина [247] сопровождалась миrрацией ац ьной rРУПII I
у ост 'П ов серина (соответственно на 100 и 70 Уь); у OCTaT oa
PeazeHTbl, расщепЛЯЮЩlfе связи в полиnептuдной цепи
221
220
Селективное расщепление белков
треонина подобной миrрации не наблюдалось (при окисле
нии периодатом образовался ацетальдеrид). В rлютене и
rлиадине на каждые три остатка ерина ПрИХОJ1JfТСЯ: при
мерно один остаток треонина, так что различие в резкцион
ной способности этих аминокислотных остаткор ресьма суще-
ственно.
По предложенному Эллиотом [96] методу эти белки после
обработки серной кислотой были подверrнуты ацилиро анию,
омылению и частичному дезацилироваЮJЮ хлористым BOДO
родом В метаноле. Попытки фракционировать продукты ионо
форезом и хромаТОfрафированием не имели успеха (были по-
лучены только отдельные пики). ВОЗМОЖНО,эти неудачи ча-
стично объясняются введением.В молекулы СУЛЬфОfРУПП. Для
блокирования свободных аминоrрупп rлиадина был предло-
жен друrой метод [247], заключающийся в дезаминироваиии
действием азотистой кислотой. При этом N конце13ые остатки
серина превращаютс.я в остатки rлицериНовой кислоты, и в
rидролизатах обработанноrо подобным образом белка было
обнаружено меньшее количество серина. 1( сожалению, работ.
посвященных омыл нию дезаминированныIx белков и после
дующему фракционированию продуктов rидролиза, не опуб
ликовано, так что до сих пор не ясно, можно ли осуществить
выделение ожидаемых пептиДНЫХ фраrментов. Денуэль [71]
отметил трудность деметилирования и дезаминирования ами-
ноrрупп (ср. [167]) друrих белков, оказавшихся свободными
в результате воздействия на белки серной кислоты.
Рамачандран и Макконнел [247] изучали изменение co
держания аминноrо азота б;лков в зависимости от ремени
воздействия на белок сернои кислоты. При 35 и О содер-
жание аминноrо азота достиrало MaKcl;!MYMa и затем падало,
что, возможно, объясняется реакцией <аминоrрупп с образо-
ванием сульфаматов. Это уменьшение содержания аминноrо
азота не позволяет установить оптимальную продолжитель-
ность обработки белка серной кис ()той. Рейц и сотр. [253]
не обнаружили признаков взаИjМодеиствия аминоrрупп с сер-
ной кислотой, но ПРОДQлжительность реакции в их опытах
составляла Bcero около 30 MtlH, тОfда как друrие авторы про
водили реакции в течение 2 суток и более. . ;
Обычно все же содержание аминноrо азота служи.т наи-
более точным показателем степени ацильной переrруnпи-
ровки. Аминоrруппы в белке, в котором произошла подобная
переrруппировка, становятся сравнительно малодоступными
для различных peareHToB. Так, попытки [57, 96] ввести ди-
нитрофторбензол (ДНФБ) J3 реакцию со свободными амино-
rРУПIJами привели к получению ожидаемоrо ДНФ серина (и
ДНФ треонина из лизоцима [97]), но выходы оказались зна-
чительно ниже, чем этоrо можно было ожидать на основаНIj:И .
данных о содержании аминноrо азота. Реакция в щелочной
среде осложняется обратноЙ переrруппировкой, которая, как
укззывалось выше, протекает чрезвычайно быстро. При рН 5
реакция с ДНФБ протекает медленнее, цо миrрации ацильной
rруппы от О к N не наблюдается. При рН 8,5 и 200 в течение
2,5 час в фиброине шелка в реакцию с ДНФБ вступило толь
ко 4,5% азота серина, а .при рН 5 и той же температуре за
4 час прореаrировало 23%. Bcero в реакциto может вступить
62% азота серина, что установлено на основании. данных о
снижении содержания аминноrо. азота при стоянии белка в
щелочной среде (рН 9) в течение нескольких часов [96].
В друrой работе [167], посвященной исследованию лизо-
цима, в котором ацильная rруппа миrрирует от N к О, сооб
щается, что после взаимодействия белка с ДНФБ при рН 5
в течение 8 час не б:ыло обнаружено ни ДНФ серина, ни
ДНФ треонина. Однако при разрыве О пептидильной связи
можно получить ожидаемые результаты, используя периодат
ный метод определения концевых оксиаминокислотных остат-
'{ов [97] или динитрофенилирование [247]. .
Несколько неожиданным является то, что ацетилирование
или формилирование при рН 5 дает rоразДо лучшие резуль-
таты, чем динитрофенилйрование. Этот вывод основан на KOC
венных данных, так как ацетилсерин не может быть выделен,
так как он, подобно ДНФ-серину, леrко rидролизуется. Кроме
Toro, белок, содержащий ДНФ сериновый остаток, вслед-
ствие неу,етойчивости ДНФ rрупп [96] не удалось расщепить
разбавленной щелочью подобно тому, как расщепляется бе
лок, содержащий аuетилсериновую rруппу. Расхождение дан-
ных моrло быТь вызsзно увеличением степени разложения
ДНФ-серина при rидролизе, как это наблюдалось в случае
друrих белков [42, 119].
Помимо Toro, что переrруппировка происходит неколиче
ственно, недостатком миrрации аЦIj:ЛЬНОЙ rруппы от N к О
как предварительноrо этапа исследования строения пептидов
явля тся изменение неJЮТОрЫ.Х амщюкислот rлиадина под.
действием серной кислоты [247]. Изменения претерпевают
амидные rруппы, метищIИН, арrицин, тирозин, фенилаланин
и цистин.
Помимо KpaTKoro сообiцени.я о фракционировании продук-
тов расщепления лизоцима [97, стр. 139], обработанноrо сер-
ной кислотой, метОДОМ ионофореза известен только один слу-
чай, коrда полученную таким методом пептидную фракцию
222
Селективное расщепдение белков
Реаеенты, расщепляющие связи в nолиnептидной цепи
223
удалось охарактеризовать после выделения (фиброин шелка).
После О!5работки химотрипсином был получен остаток,. co
стоявшии В основном из остатков серина, rлицина и аланина
и небольшоrо количества остатков пipозина [81]; этот оста-
ток соответствовал 60% иСКодноrо фибр'оина. Затем остатоК
обрабатывали при 270 серной или, что лучше, фосфорной
КИСЛОтой (содержащей фосфорный анrидрид, чТобы кис
лота оставалась безводной) при 400, охлаждали, разбавляли
и вводили в реакцию с ДНФБ при значении рН, которое CTY
пенчато повышали примерно до 9. В ходе такой обработки
сложноэфирные 'связи rидролизовались и освобожденные
аминоrруппы переводиЛисьв ДНФ производные. Из раство-
римых в воде ДНФ пептидов была выделена и охарактеризо-
вана фракция ДНФ Сер.rли.Ала.rли.Ала.rли.ОН, которая по
весу соответствовала 36% остатка после rидролиэа под дей
ствием химотрипсина. Эта фракция представляет собой п рио-
дически повторяющееся звено в молекуле фиброина [207]..
О возможности миrрации ацильной rруппы в разбаВJlен-
ных водных растворах кислот высказывались различные вред-
положения. Тенфорд [308] изучал кривые титрования несколь
ких подробно охарактеризованных белков (инсулин, рибону-
клеаза, лизоцим, лактоrлобулин, овальбумин и альбумин
сыворотки крови человека). Он установил, что по крайней
мере для УI<азанных белков отсутствуют данные, свидетель-
ствующие об увеJlИчении количества аминоrрупп при рН 2
самом низком значении, достиrнутом в ходе титрования. При-
веденные выше данные показывают, что переrруппировка леr-
че происходит в концентрированных водных растворах кислот.
В случае применения безводных орrанических раствори-
телей, содержащих кислоту, возможна миrрация аuнльных
rрупп, Н<.1ходящихся у определенных бстатков оксиаминокис
лот. Так, при определении концевых rрупп по методу ЭДМaliа
(см. стр. 237 245), соrласно которому производное пептид-а
обрабатыва.ют нитрометаном и НСl [87], уксусной кислотой и
HCl [88] или диоксаном и HCI (186] для циклизации N tюнце-
Boro остатка, установлено [2, 314], что на последующих CTa
ДЮlх отщеплен ия обнаруживаются небольшие количества
N"'концевых остатков серина или треонина. В одном сЛучае
ЭТG привело к неправильному выводу о последовательности
змйн(}кисльтных остатков [2, 186]. Обычно исследуемое соеди.'
нение обрабатывают CeH 5 NCS или динитрофторбензолом при
рН 8,5 Если же беЛОк находится в среде с такой величи
ной рН до добавления peareHTa, то свободны аминоrруппы,
появляющиеся в результате миr.рации ацильной rруППЫ оТ
N к О,вновь образуют пептидные свя::щ. Предварительную
обработку щелочью следует считать нужной мерой предосто
рожности при ступенчатом расщеплении в тех случаях, I.{оrда .
миrрация щщлыiой rруппы может явиться осложняющим
фактором. .
Кроухолл и Эллиот [65] изучали возможность использова-
ния хлористоrо водорода в абсолютном метаноле или в нитро
метане в качестве areHTa, вызывающеrо миrрацию ацильной
rруппы от N к О. в простых пептидах. Ни в одном случае
переrруппировка не была количественной и сопровождал ась
побочными реакциями. Ни дымящая серная кислота в нитро
метане, ни ледяная уксусная кислота при 1000 не вызывали
появления аминноrо азота. Как показал Бейли [14], мета-
нольные растворы НСl или BF3 также не приrодны, но пере
rруопировку простых пептищ)в на 80% удалось осуществить,
действуя на них смесями J3F3 или SпС1 4 С муравьиной или
уксусной кислотой в течение 1 4 час при 60 800. Более вы-
сокие выходы (85 9б%) были получены через промежуточ
ные циклические соединения оксазолины (XVH), образую-
щиеся при дей твии хлор окиси фосфора в течение 3 час при
комнатной температуре; оксазо,лины размыкаются в присут-
ствии воды цли разбавленной кислоты.
При действии аналоrичноrо peareHTa (POCI 2 F) наинсу
лин 50% связей серина и треонина претерпевают ацильную
переrруппировку. В СЛу'чае этерифицированноrо. инсулина
переrРУППИРQвка происходит почти количественно, о чем
можно судить по содержанию аминноrо азота [13].
Установлено [56, 57, 216], что п-ри этерификации белков
0;1 н. раствором НСl в метаноле увеличивается содержание
:аМИI'IноrО./азота, но в щелочной среде вследствие обратной
ад лъноii переrруппиров.ки содержание аминноrо азота па-
дает. В инсулине [56] наименее устойчивым остатком оказался
остаток треонина.
Друrим примером миrрации ацильной rруппы от N к О
ПОД влиянием беЗВОДноrо кяслотноrо peareHTa является обра
тимое инактивирование лизоцима безводной муравьиной кис-
лотой при комнатной температуре [167]. В. этом случае ход
переrруппировки контролировался путем определения coдep
жания аминноrо азота и измерения аКТИВI:!ОСТИ фермента.
ПQлное инактивирование наступало ч рез 16 час. Помимо
:увеличеf::lИЯ содержаЮ-lЯ аминноri) азота изменение белка. вы-
.р зялось также в появлении повышенноrо cYMMapHoro поло-
жите ьноrо заряда,что сказалось на подвижности молекулы
белка при ионофорезе. В водной среде при рН 8,5 ПРОИСХQ.
ди. лл обратные изменения; при рН 7,5 обращение было He
сtIOЛНЫМ есл'.l. СУДfiТЬ по ионофорезуи порлощению щелoqи,
224
Селективное расщепление белков
хотя активность фермента восстановилась полностью. Коли
чество пептидных связей, у которых произошла ацильная
переrруппировка от N к О, не установлено, но по крайней мере
одиннадцать остатков из девятц остатков .серина и семи
остатков треОНИН8 были затронуты переrруппировкой [312].
Бромная вода
В ходе исследований строения окситоцина [84, 221, 255]
была сделана попытка окислить этот полипептиД бромной
водой. В отличие от окисления окситоцина надуксусной кис-
лотой, коrда образуется один продукт реакции, при окисле-
нии бромной водой были получены два ПептидНЫХ обломка.
При действии бромной водой на полипептид, предварительно
окисленный надмуравьиной кислотой, образуются те же самые
обломки. Расщепление окситоцина представлено на рис. 12.
При действии бромной ВОДЫ на окситоцин происходят
окисление обеих половин цистиновых остатков в сульфо
аланильные остатки, бромирование тирозина и расщепление
тирозилизолейцильной связи. Направление реакции с бром-
ой водой не зависит от присутствия в цепи ОКСИТОЦина остат.
ка изолейцина, так как в вазопрессине, который вместо
изолейцина имеет фенилаланин, окисление бромной водой прIi-
водит к теМ же результатам [242]. При расщеплении вазопрес-
сина происходит заметное разложение и удается выделить
только один крупный пептидный фраrмент.
Бромная вода содержит око.10 3,5% брома и имеет вели-
чину рН, равную примерно 2. В работах, посвященных изу-
чению необычНОrо расщепляющеrо действия бромной воды
[254], сообщается, что бромирование тирозина в предвари-
тельно окисленном надмуравьиной кислотой окситоцине в ле
дяной уксусной кислоте или в водном растворе может не со-
провождаться разрывом связи, если концентрация раствора
составляет 0,5 н. по HBr. Дальнейшая обработка этоrо бро-
мированноrо и окисленноro окситоцина 0,05% -ной уксусной
КислоТой при комнатной температуре в течение 24 час, 1 н.
раствором HBr или слабым водным раствором NН з при тем-
ПераТуре оТ 5 До 100 в течение 45 .мин не привела к:рас-
щеплению. молекулы. Однако в результате обработки продукта
бромной водой при температуре от 5 до 100 получаются
два nептIiДНЫХ обломка. Расщепление обусловлено чув
СТВИТeJ!ЬНОСТЬЮ ароматическоrо кольца тирозина к rалоrени-
рованию. Это подтверждаеТСя тем, чТо ДНФ-производное
окисленноrо Окситоцина, содержащее вместо фенольной rруп-
пы динитрофенильную rруппу, при обработке бромной водой
15 аак. 1416
.",
<u
с::;
О
с:>..
t::
:I:
О
(f)
'"
::1
:ё 5
z <
:ё
z 1-. ..
1=
'"
'"
::s:
:I:
+
:r:
о
а.
w
:I:
О.
(f)
'"
::f
х
-:r:
z
'"
'"
1-.
..
<1
О
..
..
'"
:с
"
О
С.
10'
:Е
z
'"
'"
1-.
,,,,
<u
с::;
<5
с:>..
t::
::;
:с
::;
..
'"
с.
>,
"
z <
>, :r
:I: "'
Z '--:
,,,,
<u
'"
:s:
'"
<Л ::1
t::
:с '"
а.
'"
(....
'"
;с
..
:r::
z
'"
о{
О
..
'"
'" ,;,
1-. '"
.", \о
'" м
с::; Z.
g, '"
t:: <u'"
:I: ь ;:;
о i
rл '" ::;
'" '" '"
::1
со
'"
'"
"
О
С.
""
.", <u
О с:>..
", О
:с '"
<u ...
'" <J
'" '"
,2\ со..
I!!
р.О
:с
'" ::;
'"
ё
:I: t)
z <
;Е
Z I-:
.",
OJ
.,
::s:
а.
:s;. '"
:=;
g:) -= g
:i .
с5' '"
(f)
'"
:::r
:I:
'"
О ..
:с tQ
;', ;з::
tJ.ClJ
::t: Е--:ё
>,0",
'" .
щ CI
2
О '"
С.
10
:Е
z
:=
'"
1-.
,,:
OJ
с:;
О
с:>..
t::
:I:
О
с/)
'"
==!
5
z <
:ё
Z I-.
""
<u
'"
::s:
"
'"
ClJ
'"
О
С.
'"
'"
о{
с.
О
...
-е
с:>..
'"
'":
:I:
О
(f)
'"
=!
::с
,,,,
OJ
с::;
О'
со..
t::
i '"
о
VJ '"
'"
::1 .
:Е 5-
z < о
Z I-. ""
.::
OJ '"
'" '"
:s:: .
О
t
?::.
е а.
:с ",
t::! (....
I :I:
О ё
VJ
'"
::1
I
е
:r::
:Е
z
'"
'"
1-.
.
,
g
о
':.::
о
:х:
:е
о
о..
\о
со
:х:
:s:
::f
о
:s:
u .;
:.: =
о '"
..
О
:а
:х: !11
"1 О
О '"
tQ ос>
'" '"
а.ь
@'о;
'"
!;
:; t;
2 I
CI) '"
fЗЕ7.
d5
CI)
о
:х:
:Q
:s:
....
:.:
<1)
с:
CI)
U
:j
CJ
:s:
о..
Селективное расщепление vелков
Реаеенты, расщепляющие связи в полипептuднйй цепи
221
226
не претерпевает ни расщепления, ни замещения в бензоль
ном кольце.
Подобное образование фраrмеНТdВ является одним из
немноrих известных примеров селективноrо расщепления хи-
мическими метода ми, однако для теоретическоrо обосно ания
этой реакции рока еще недостаточно фактических данных.
Возможно, что лабильность связи, в которой участвует карбо-
ксильная rруппа тирозина, - обусловлена близостью бромиро
BaHHoro остатка тирозина и остатка сульфоаланина.
Представляет интерес исследовать действие бромной воды
на окисленную рибонуклеазу, в которой присутствуют
обе рассмотреНАые в случае окситоцина rруппировки:
ЦиSОзН.тир.лиз и -----: Тир,ЦиSОз Н . Асп (NH2) '
96 97' 98 .25 26 27
В окисленном инсулине в цепи А . имеется rруппировка
Асп (NH 2 ) .Тир.ЦиSОзН.Асп a 'H2) .ОН, и как окислен
18 r9 20 .- 21 .
ный инсулин, так и выделенная из Hero. цепь А при обра
ботке бромной водой при температурах от 5 до 100 дают
пептиД l:(nSОзН . Асп (NH 2 ) , что указывает на разрыв связи
за остатком тирозина [319]. I(оличественная сторона этоrо
расщепления еще требует изучения.
инсулина [268] позволило установить, что связи, в которых
участвуют остатки Цистеиновой кислоты и аминоrруппы се- .
рина и треонина, также разрываются. Аспараrиновая кислота
выделяется не количественно, и, кроме Toro. получаются раз
личные пептиды с низкими выходами.
Шредер [278] также сообщает, что в указанных условиях
пептиды образуются с низкими выходами. Таким образом,
специфичность этоrо метода не столь велика, как этоrо можно
было бы ожидать на основании данных о выделении свобод-
ных аминокислот, и этот метод безуцlOВНО неприrоден для
селективноrо расщепления белков.
Селеитивное расщепление, эатраzивающее остати"
ш:nараzuяовоil и zлуmaминовоil ииСJЮm
Переrруппировка пептидов, содержащих остатки аспара-
rиновой и rлутаминовой кислот. При обработке пептидов, co
держащих остатки эфиров ациласпараrиновой или 'I'-эфиров
ацилrлутаминовой кислоты, разбавленной щелочью, происхо-
дит лереrруппировка этих эфиров через промежуточно обра-
зующийся имид в ацилированный пептид, в которьм связи
остатка аспараrиновой или rлутаминовой кислоты находятся
соответственно в - или 'I' положении [21]. Поскольку подобные
изомеры содержат а карбоксильную rруппу, аналоrичную
С-концевому остатку, было сделано предположение, что
ИСПО,1Iьзование одноrо из методов последовательноrо отщепле-
ния С-концевоrо остатка приведет к селективному раСIЦепле
нию по связям, В KOTOPf;,IX участвуют аминоrруппы переrруп-
пированных остатков аспараrиновой или rлутаминовой ки ло-
ты. Ход переrруппировКИ показан на приведенной ниже
схеме. Обозначенная пунктирной линией связь аналоrична
связи С-концевоrо остатка и поэтому должна расщепляться
реаrентами, вызывющимии селективное отщепление C KOHцe-
вых rруПП.
RCONHCHCOR' .
I
(СН 2 )n СООСН з
или т-Метиловый эфир,
нормальные пептидные связи
OH
RCONHCH CONR' OH
I I
(CH2)n CO
Имидная форма
Селективиое выделение из белков аспараrиновой КИСЛОТbl.
Пептидные связи по обеим сторонам остатка аспараrиновой
кислоты в молекуле белка особенно леrко rидролизуются раз-
бавленными кислотами [233], приче степень rидролиза за
J\ИСИТ от рН раствора, а не от концентрации используемой
КИСЛОТЫ [32, 189]. Так, из альбумина сыворотки крови быка
за 18 час при 1000 и рН 2,14 выделяется 4"4% остатков аспа
раrиновой кислоты в виде аминокислоты, в то время как при
рН 3,15 освобождается всеro 26% остатков кислоты [189]. При
. экстракции эластина 0,25 М щавелевой кислотой при 1000
-был получен растворимый белок; единственной выделенной
свободной аминокис отой оказалась аспараrиновая КИСЛ0та
[235]. Однако присутствие в -продукте реакции пептидов с KO
роткой цепью и результаты определения концевых rруnп [24,.
234] указывают на значительную степень rидролиза и друrих .
пептиднЫХ связей, Исследования, проведенные на модельных
соединениях [73], позволили сделать вывод о лабильности
связей остатков сери на и треонина. Применение описанноrо
выше метода rидролиза для исследования цепи А окисленноrо
RCONHCHCOOH
I
(СН 2 )n CONHR
или т-Пептидные связи
Из модельных соединений, например, этиловоrо эфира
N -бензоил-а-аспа ра rилrЛИЦИЛ-li-rексила мида, при. обработке
0,28 н. раствором соды в течение 4 час при 400 образуется
смесь, состоящая из 75% из6мерноrо пептида с -аспараrиль-
15
Селективное рщ:щеnление белков
Реа2енТЫ, селективно ОТЩепляющие концев'Ые остатки
229
228
IfblM ОСТ8ТКОМ И 25% нормальноrо пептида (омыленное ис
ходное вещество). Стадией, определяющей суммарную CKO
рость изомеризации, в случае соединений, содержащих OCTaT
ки аспараrиновой .кислоты, является rидролиз имида, который
удается выделить при небольшой продолжительностйреак.
ции. Соответствующее аспараrинильноесоединение изомери
зуется лишь в незначительной степени.
Соединения, содержащие остаток r лутаминовой кислоты,
реаrируют в более жестких условиях. Так, этиловый эфир
N-бензоил-а-rлутамилrлицил-н rексиламида. оказался сравни-
тельно устойчивым в растворе соды при 50.0; за 7 час 64%
исходноrо вещества осталось неизмененным. Однако под дей
'Ствием 0.,1 н. NaOH при комнатной температуре была полу-
чена смесь 57% 'I'-rлутамилпептида и 43% а-rлутамилпептида.
В ряду соединений, содержащих rлутаминовую кислоту, сум-
марная скорость изомеризации определяется стадией замы-
кания цикла с превращением сложноrо 'эфира в имид, что от-
. личает эти соединения от пептидов, содержащих аспараrи-
новую кислоту.
Вторая стадия изомеризации разрыв пептидной связи
для этих .модельных соединений не описана. Однако, поСКоль-
ку методы селективноrо отщепления С-l<онцевых rрупп не
дщс>т высоких выходов В случае простых соединений, можно
полаrать, что общий выход при, селективном расщеплении
neптидных связей модельных соединений будет низким, а по
лученная смесь пептидов довольно сложной по составу;
В некоторых условиях может образоваться шестичленный .
циклический имид производное дикетопипеfJидина, которое
под дейс:rвием щелочи дает в качестве OCHOBHoro продукта .
т-rлутамильный изомер исходноrо rлутамилпептида.
C. CONHCHCONHCH,CONHC,HI'
I
СН,СН.СООН
t
25%
SOCI.. 00 Н
94 С. .CON CHCONHCH2CONHC.H..
% I I
СО СН.
"'-./
СН.
0,1 н. NaOH
Селективное расще.пление 45%
Пронзводное
кетопнрролидииа
01-
NH CHCONHCH2CONHC.HI'+ с.н.соон
I I
СО СН.
"'-./
4- СН.
с.н.СоtчНС Н С ONCH.CONHC.H.. С.Н.СОННС HCON НСН.СОNНС.И..
I I I I
СН.СИ.СО 46% сн.сн.соон
Производное дикетопипернднна а-[лутамилпептна
01-
C.H.CONHCHCOOH
I
. CH.CH.CONHCH.CON нс.н"
T-r лутамилпеПТиа
30%
Конденсация r карбоксильной rруппы «.rлутамилпептидов
с пептидной цепью. Эта реакция изучалась АВУМЯ rруппами
исследователей [22, 62]. Взаимодействием эфиров . N a цилr лу-
таминовой кислоты с хлористым тиойилом при 0.0 были полу-
чены соответствующие l-ацилпирролидоны-2 с высокими
выходз.ми. Ход реакции для N-бензоил-а.-rлутамилrлицил-н-
rексиламида показан на приведенной ниже схеме [22]. При
обработке ра бавленным раствором щелочи происходит се-
лектиВlIое расщепление цепи по связи, в которой участвует
аминоrруппа остатка rлутаминовой кислоты, но выход значи-
тельно снижается за счет конкурирующих реакций, приводя-
щих к восстановлению первоначальной 'структуры, а также
вследствие образоваflИЯ 'I'-rлутамильноrо аналоrа. Наоборот,
в случае n-толуолсульфонилrлицилrлицил-а.-rлутамилфенилал-
анилциклоrексиламида выход пиклическоrо соединения про-
изводноrо кетопирролидина был очень высоким, но rидро
лиз щелочьЮ привел только к реrенерации ИСХОДноrо а соеди-
нения (выход 90.%) [62}.
Хотя в результате ре;;iКЦИЙ в указанных сравнительно мяr-
ких условиях удается добиться частичноrо расщепления пеп-
ТИДной. цефi, соверш но ясно, что течение реакции в зна-
чителЬНой степени определяется порядком расположения
аМ, IUЮКИtл.ot 'В ..исследуемом .соединении. Переrруппировка
8 1-rлутамильные изомеры и сравнительно низкие BЫXO Ы
позвОлЯют сделать вывод, что в настоящее время этот метод
неприrоден для селектив"Нqrо расщепления длинных пептид-
ных цепей.
РЕАПНТЫ, СЕЛЕКТИВНО ОТЩЕПЛЯЮЩИЕ КОНЦЕВЫЕ ОСТАТКИ
Ферменты
Известны ферментаТИВl1ые методы определещIЯ N и C-KOH
цевых остатков. Преимуществом этих методов является воз-
можность осуществления реакцци в мяrких условиях и ис-
пользования небольших количеств белков, так как отщеплен-
"ные аминокислоты можно определять в микроколичест ах
Реш енты, селективно отщепляющие "онцевые остатки -ю
Таблица "5
Реакции nослеДОВАтельноrо расщепления пептидов
путем конденсацни peareHTa с (;r амнноrруппоА
Реаrеит
Л-ите.
ратура
применение при изучении природных вещеетв. Пользуя ь
тодом Эдмана, удалось получить данные о последователl>И().
сти аминокислотных остатков на N концевых участках бел-
ков, а также пептидных обломков. В связи с этим в даль
нейшем будут paCCMo1JJeHbl только примеры использования
фенилизотиоцианатноrо метода. Реакции," протекающие при
последовательном расщеплении пептидов фенилизоцианатом
по Эдману [89]: .
C 6 H s N==C==S+ CHRCONHCHR'CO рН 8 9
I
NH 2
Продукт кондеисации
ltИКJlическое
ПРОИЗ80диое
ФеНИЛИЭОliианат
C 6 H 5 NCO
Фенилизотиоцианат
C 6 l-f.NСS
Сероуrлерод
C S 2
Метилметоксидитио-
карбамат(диметил-
KcaHToreHaT)
СНзОСSSСН з
Метил- N -ЗllеТflЛДИТИ(J-
карбамат
СНзСОNНСSSСНз
C6H5NHCONHCHRCO
С6Н5NНСS,ШСНRСО
SCSNHCHRCO
СНзОСSNНСНRСО с
CH.CONHCSNHCHRCO
CHR CO
I I
NH N C6H5
"'. С/
. 11
О
5 3амещенный
3-фенилrидантоин
CHR CO
1 I
NH N C6H5
"'С/
11
s
5-Замещенный
3-фенилтиоrидан-
тоин
CНI CO
I 1
NH S
"'с/
11
s
4-Замещенный
2-тиотиазолидон-5
CHR CO
I 1
NH S
"'С/
11
S
4-Замещенный
тиазолиддион-2,5
CHR CO
I I
NH NH
"'С/
11
s
5-Замещенный
2-тиоrидаитоии
1
87
CHR CONHCHR'CO
I
NH NH C6Hs
"'-/
С
11
S
Быстрое расщеп CHR CO + NНзСНR'СО
леиие I
н+ в во иой или N S
беЗВQДПОЙ среде /
С
I
NH C6H5
191
ФеНl:lлтиокарбамилпептид 2-Анилино-4-замещенный 5-тиазолинон
Водиый расТВОр кислотыl /наrревание
-1-
ВОllИЫЙ оаствор кислоты CHR CO
Меllленное расщепление - I " 1
NH N C6H5
"'/
С
11
S
5-Замещенный
3-фенилтиоrидантоин
176
.,/
CHR COOH
I
NH NH C6H5
"'/
С
11
S
Фенилтиока амилъное
ПpQ.RЗВl:щиое
аминокисЛОТЫ
99
Вместо фенили отиоцианата было предложено применять
зам.ещенные изотиоцианаты, например 3,5-динитро-4-диме-
'rиламинофенилизотиоцианат [252] и n-азофенилфенилизотио-
цианат [248], KOTopbIe имеют то преимущество, что образуют
о рашенные производные. В качестве peareHTa был предло-
жен также n-иодфенилизотиоцианат [50], так как' в этом слу-
чае можно использовать меченые атомы. Указанные peareHTbl
до сих пор не нашли широкоrо ПрИМенения. Кроме Toro, из
данных, приведенных различными авторами, не ясно, цикли
зуются ли производные этих peareHToB быстрее; чем производ-
ные незамещенноrо фенилизотиоцианата.
Реакция фенилизотиоцианата с амино- или а-иминоrруп-
Пой rладко протекает при рН 8 9 и 400 обычно в смеси пи
ридин t3OA? и,/Ш ДИОJ(с?fl вода. Требуемая еличина рli
230
Селективное расщепление 6еМО8
Реа2еНТЫ. се.лек'l'U8НО Оf'щеnляющие концеl1ые остатки
231
хроматоrрафировацием реакционной смеси на бумаrе II 14,
320]. В ряде. случаев удается определить последователь-
ность' расположения аминокислот, так как .отще ление N-
или С-концевоrо остатка «обнажает» новую ковцевую труппу,
которая также может быть отщеплена действием фермецта.
Скорость отщепления последующих концевых rрупл может
меняться в очень широких пределах: от скорости отщеплен ия
первой концевОЙ rруппы до значительно более низкой ско-
рости.
Поскольку Прll ферментативном отщеплении концевых
rрупп не происходит ни рацемизации, .ни денатурации, про-
дукты расщепления биолоrически активных субстратов
приrодны для выяснения вопроса Q влиянии отщепления этиХ
rруПП на биолоrическую активность [10].
1( недостаткам ферментативных методов относится то, что
обла ть их применения оrраничивается только аминокислот-
ными остатI<ами с l-конфиrурациеи и свободными а-амино-
или а-карбоксильными rруппами. Кроме TOro, пеПТJЩные
связи, образованные некоторыми аминокислОтными остатка-
ми, не разрываются под действием ферментов, а влияние
предшествующих остатков может оказаться достаточным для
Toro, чтобы воспрепятствовать rидролитическому отщеплению
остатков, KOTOpЪJe, судя по дацным о специфичности действия
фермента, моrли бы отщеплятьСя. Наиболее важным усло-
вием успешноrо применения рассматрвваемых циже фермен-
тов является отсутствие примесей эндопептидаз. Небольшие
количества этих примесей приводят к разрыву внутрецних
ПеПТИДНЫХ связей, в результате чеro появляются новые суб-
CTPf!1' для фермента. Субстрат также должен быть настолько
чЙ'стым, чтобы примеси це моrли поt!fеwать. .ИСТОJIковацию по-
JIученных результатов.
в пептидах и белках, содержащих свободную. а-карбоксиль-
ную rруппу строения
,
NH CH CO:NH CH COOH
I I I
R' R
lCар!оксиnеnпJuдаза
Этот фермент может быть выделен из экстрактов подже-
лудочной железы в чистом виде [128],. но до использования
для определения последовательности амицокислот ero реко-
меJIдуется инкубировать с диизопропилфторфосфатом, ЧТGlбы
инактивщ:>овать возможные примеси химотрипсина, трипсина
И субтилизина [122, 267, 300]. Основные свойства и специфич-
ность действия карбоксипептидазы подробно рассмотрены в
ряде работ [228; 293]. В друrих работах [114, 136, 226, 320]
приводятся данные об использовании фермента для опреде-
ления последоватe.n:ьцости аминокислот в белках. Карбокси-
nептидаза специфична в отношении С-концевых аминокислот
С-Концевые амиДНЫе остатки, подобные остаткам в окси-
тоцине и вазопрессине [85], устойчивы к действию фермента.
Скорость отщеплен ия С-концевых остатков определяется
в основном характером боковой цепи R, но боковая цепь R'
соседнеrо остатка также может оказывать влияние на ско-
рость реакции. Наиболее быстро отщепляются ароматические
аминокислоты (именно поэтому так важно, чтобы в фермент-
ном препарате отсутствовал химотрипсин) , затем следуют
концевые аминокислотные остатки с большими алифатиче-
скиМ'И -боковыми. цепими. :ПО мере умеиьшения размеров ба-
КО8ФЙ неполярнои цепи илидовышения полярности боковой
пеПJitкорость р-асщ nления уменьшается.
'. Та.к, rликокОЛ и аспараrиновая и rлутаминовая кислоты от-
щеПJlЩОТСЯ медленцо, а скорость отщепления арrинина и ли-
ЭйRз зависит от степеничИGТОТЫ фермента. В последнее время
в препаратах карбоксипептидазы низкой степени чистоты об.
наружена новая осноiзцая карбоксипеП1'идаза [104, 105], спе-
цифически расщепляющая С-концевые пептидные связи, в
образовании которых участвуют аминоrруппы лйзина и арrи- .
нина.
Пролин и оксипролин полностьro устойчивы к действию
фермента.. -'11.истеин .в продуктах расщепления не был обна-
ружен. Полуцистин, если он присутствует в продуктах рас-
щепления, Mor образоваться за счет разрыва пептидной связи;
при этом связь с полипептидной цепью дисульфидным мости-
ком сохраняется. Окисление остатков цистина в цистеиновую
кислоту не должно давать 'способную отщепляться под дей
ствием карбоксипептидазы rруппу, так как она содержит за-
ряженную боковую цепь, но восстановление и алкилирование'
до SСН2СОNН2-rрупп ПрИБОДЯТ к образованию нейтраль-
Horo OCTaT a. Такой остаток был недавно обнаружен [198] в..
rИДРО/IИзатах, полученных при действии карбоксипептидазы
на восстановленный и алкилироваНllЫЙ пролактин, что свиде-
тельствует о присутствии С-концевоrо ПОЛуЦистиновоrо
остатка.
Влияние предшествующеrо аминокислотноrо остатка на
скорость отщепления концевой rруППЫ лучше Bcero можно
показатъ на п.римере соединений, СQдержащих остаток про-
СелектиВное расщепление белков
PeazeHTbl, селективно отщепляющие KиHцe6ыe остатки
233
232
лина. Так, в инсулине, цепь Б KOTopOrO содержит C KOHцeBoH
участок состава про.лиз.Ала.ОН, быстро отщеп,ляется ала.
нин, тоrда как отщеплению лизина препятству.ет сочетание
полярной .боковой цепи остатка лизина и предшествующеrо
пролильноrо остатка [136, 267]. В вирусе табачной мозаики с
. С-концевым участкоМ Про.Ала.Тре.ОН [37, 229] отщеп,
ляется только треоНИН [138], в то вреМя как в кортикотро"
пине, С концевой участок KOToporo имеет состав Про.Лей
rлу.Фе.ОН, скорость отщепления уменьшается в порядке фе.
нилаланин, rлутаминов я кислота, лейцин [136, 284, 339], II
реакция прекращается, коrда остаток пролина становится
С-концевым.
Определение числа пептидныХ цепей в белке путем коли-
чественноrо измерения скорости отщепления аминокислоТ
может оказаться ненадежным, если 'два соседних аминокис
лотных остатка отщепляются почти с одинаковой скоростью.
Это наблюдается в случае pocTOBoro ropMoHa быка, в котором
два остатка фенилаланина быстро отщеплSIЮТСЯ каРбоксипеп-
тидазой, после чеrо происходит отщепление аланина, лейцина
и серина. В этом белке имеются два N-концевых остатка, но
расщепление rидразином ПОЗl,юлило обна ру жить только один
С-концевой остаток фенилаланина Полученные при расщеп-
лении белка карбоксипептидазой результаты объясняются
тем. что С-концевой участок имеет состав Фе.Фе.ОН [198].
Данные, полученные при отщеплен ии концевых rрупп, как
правило, леrче истолковать, если более или менее точно из-
вестно, что белок состоит из одной открытой полипептидной
цепи. Если аминокислотные остатки располаrаются в поряд-
ке уменьшения скорости rидролиза, начиная от С-концевоrо
6'статка, то часто можно сделать ПР1'tвильные предположения
о последовательности расположения амиНокислот. Представ-
лен'Ие о трудностях, с которыми приходится сталкиваться в
ходе подобных исследований, можно составить на примере
рибонуклеаЗbI, которая, как. известно [249], содержит одну
fЮ.[IИПеПтидНую цепь с C KOHцeвЬ M участком Асп. Ала. Сер.
Вал. ОН. На основании результатов первоначальных опы
тОВ [11] по расщеплению рибонуклеазы карбоксипептидазой
сделан вЬ1вод, что С-концевой' участок имеет строение
Мет.Тир.Ала (Лей или Илей, Фе) .Вал.ОН, однако, только
при использовании препарата карбоксипептидазы, тщательно
обработанной .ДИИЗОПРОПИJIфторфосфатом, получены данные,
свидетельствующие, что С-концевой участок в действительно-
сти имеет строение' (Ала,Сер).Вал.ОН[249].
: Следует отметить,. 'что 13 таких белках, как овальбумин
[-230], . ,пролактин> [198J, . дрожжевая т.рио.зофо,сф атдerидроrе-
""аза !132], хи ютрипсиноrен, трипсин .и трипсиноrен [225],
окситоцин и вазопрессин [85], а меланофоростимулирующий
тормон [139]' и; JКарбоксипептидаза [320], имеются С-концевые
остапш, но они устойчивы к действию фермента.
В случае а JIактальбумина и лактоrлобулина [226], инсу-
лина [267], вируса табачноЙ мозаики [138] и лизоцима [166,
318] действие фермента весьма четко выражается в том, что
отщепляются только С-концевые остатки, а последующие кон-
цевые остатКИ более устойчивы блаrодаря характеру боковой
цепи или сосеДlIеrо остатка.
I<.арбоксиnептидаза не инактивируется 6 М раствором мо-
чевины при рН 8. Хотя скорость отщепления фенилаланина
из карбобензоксиrлицилфенилаланина составляет Bcero 25
50% скорости отщепления в отсутствие мочевинЫ, в тех же
услойиях отщепление аминокислот от дрожжевой триозофос-
фатдеrидроrенззы происходит быстро [132]. В отсутствие мо-
чевины этот субстрат не rидролцзуется ферментом.
Ле4цина.мuноnеnтидаза
ЭтОТ фермент часто; но в очень незначительных количе-
'ствах,. встречается в тканях млекопитающих. После Toro как
было обнаружено, что Mg2+ значительно повышает стабиль-
ность фермента, стало возможным получение [149, 299] пре
паратов лейnина инопеlJтидазы вьtсокой степени чистоты.
Максимальная а тивность наблюдается в присутствии Мп 2 +
при рН 9,l 9,3, но при рН > 9 фермент быстро инактиви-
руется. Опыты продолжительностью в несколько часов про-
fЮДЯТСЯ ,npи рН .8,0 8,5 и '400. в .присутствии M g 2+ или Мп 2 +
в каЧ eiвеЧlктиватора. Лейцинаминопепти.даза действует на
'Пепт;идные связи N-копnевоrо остатка полипептидных цепей
подобно. тому, как карбоксипептидаза отщепляет С-концевые
щатки. Очищенный препарат фермента не имеет эндопепти-
дазной активности и, поскольку. на Hero не действует диизо-
пропилфторфосфат, предварительное инкубирование фермен-
та этим инrибитором подавляет возможные примеси протеи.
назы.
В ряде обзоров [293, 295, 297] подробно раосмотрено
действие фермента на синтетические субстраты. Фермент
rидролизует не только лейцинсодержащие соединения, как это
можно предположить по. ro наименованию. Скорость rидро-
лиза различных соединений в основном определяется xapaK
тером остатка, несущеrо свободную аминоrруппу. Как пра
вило, скорость rидролиза алифатических соединений с HOp
ма ьной цепью явдяется максимальной g случае соединений
Селективное расщепление белков
Реа2еНТЫ, tе.л КТU8НО отщепляющие концевые остатки
235
,
234
с liаибол е длинной .боковой цепью т. е. лейциламида, и па-,
дает с уменьШением размера боковой цепи. Ароматические
соединения расщепляются медленнее, чем алнфатичес е сое-
динения с длинной цепью. Соединения с ПОЛЯРНЫf,и{труппами
в боковой цепи остатка, несущеrо свободную амииоrруппу,
rидролизуются сравнительно медлеНIiО.
. Активность .л.ейцинаминопептидазы, выражаемая числом
молей субстрата, расщепляемых в минуту весовой единицей
фермента, значительно выше активности карбоксипептидазы,
которая в свою очередь активнее спапаина .одной иЗ наибо-
лее эффективных протеиназ [297]. Вследствие ВЫСОКОй актив-
ности лейцинаминопептидазы даже менее чу ствитеЛЬНl?Iе
связи в полипептидных цепях MorYT rидролизоваться с замет-
ной скоростью. Кроме Toro, специфичность действия лейцин-
аминопептидазы не оrраничивается остатками определенноrо
типа, как в случае карбоксипептидазы. Так, фермент освобо-
ждает полуцистиновые остатки 'из пептидных связей. Пролин
и аминокислоты с полярными боковыми rруппами также от-
щепляются, хотя CKOpOCTI;I rидролиза MorYT быть небольши-
ми. В некоторых случаях подобный широкий спектр актив
ности выrоден, но он увеличивает трудности при попытках
установить пос,цедовательность сцепления аминокислот на
основании даI:lНЫХ О скорости отщепления аминокислот прй
разрыве пептидНЫХ связей (149]. .
При исследовании субстратов с длинной цепью [149] было
установлено, что некоторые нативные белки устойчивы к дей-
ствию фермента, в то время как белок с развернутыми цепя-
ми, а также окисленный или денатурированный белок леrко
rидролизуется. Например, цинковый комплекс инсулина почти
не расщепляется ферментом, но удаление цинка облеrчает
ступенчатый rидролиз. В этом случ е rидролиз не затраrи-
вает дисульфидных мостиков. Разделенные цепи А и Б окис-
ленноrо инсулина леrко rидролизуются. Аминокислотный
анализ свидетельствует о .rидролизе всех связей в цепи. А, в
то время как более м дленный rидролиз цепи Б позволил
установить последова1.'ельность первых шести остатков в
Этой цепи.
Нативные -лактоrлобулин и ropMoH роста медленно
rидрOJ1ИЗУЮТСЯ лейцинаминопептидазой; нативные а.льбуми-
ны плазмы крови человека и быка, лизоцим и риБOl"УКJlеаза
оказались устойчивыми к rидролизу. Однако предварительное
окисление альбумина плазмы крови чело ека, ЛИЗ0цима и ри-
бонуклеазы надмуравьиной кислотой привело к тому, что
указанные субстраты rидролизрвались ферментом и амино-
J\JiC.J!OTpr оrщеПЛЯЩIСI;> в ТQЙ IlQ<:цедоватеЛЬQОСТИ, которая была
'установлена ранее для N концевых участков. Денатурация
.альбумина человека 8 А4 раствором СОЛЯНОКИСЛОй соли rya-
нидина в течение 24 час при рН 8,5 не повышаетrидролизуе-
мость дaHHoro субстрата по сравнению с натнвным белком.
Окситоцин лейцинаминопептидазой rидролизуется доволь-
но медленно, что, возможно, обусловлено наличием N-конце-
BOro полуцистиновоrо остатка, поскольку rипертеI:lСИН (98]
(см. рис. 9) примерно TaKoro же молекулярноrо веса быстро
расщепляется до аминОкислот. rлюкаrон (см. рис. 3) по-
липептиД с открытой цепью также полностью rидролизуется
до свободных а минокиС.IIот [149]. .
Полное расщепление субстратов этим ферментом свиде-.
тельствует о l-конфиrурации всех аминокислот, входящих в
состав субстрата, так как фермент не отщепляет аминокис-
лот d-конфиrурации. .
Примером наиболее полноrо расщепления белковой цепи
при действии лейцинаминопептидазы является rидролиз
меркурипапаина. При низких концентрациях фермента пер-
вые девятнадцать аминокислотных остатков отщепляЮТСЯ за
24 час в примерно стехиометрических количествах. Реакция,
по-видимому, прекращается тоrда, коrда остаток арrинина
становится N-концевым. При более высоких соотношениях
фермент/субстрат расщепление происходит в большей сте-
пени, пока 2/3 белка не расщепится До своБОДН IХ аминокис-
ЛОТ. Белковый остаток после активации полностью. с.охра-
няет активность (в расчете на 1 моль) по отношению к бензо-
и.nарrиниламиду. Это свидетельствует о том, что активный
центр молекулы находится на С-концевом участке цепи.
. Данные об аминокислотах, отщеliЛЯЮЩИХСЯ при r лубоком
rцропlfЭ6..М РИf1ащшна, до сих пор отсутствуют, однако
иss.j ; 'ЧТО.среди'neрвых девятнадцати остатков нет про-
Jta.d I1рисутствие свобоД}fоrо пролина в rидролизатах пред-
стаlWlяет интерес в связи с наблюдениями Ли и сотр. [121]
о .действии лейЦинаминопептидазы на субстраты известноro
строения., содержащие пролин. Они нашли, что при инкубиро-
вании с ферментом меланофоростимулирующих ropMoH6B.
быка и свиньи (см. рис. 8) из бl;>Iчьеrо ropMoHa, N-конце-
вой участок KOТOporo имеет строение Н.АСI1.rлу.rли.Про ,
вЫдел'Яется большее количество аспараrиновой .кислоты
(1,0 моль), чем из меланофоростимулирующеrо ropMoHa
свиньи (0,43 моля), имеЮllJ,еrо последовательность аминокис-
лотных остатков Н.Асп.Сер.rли.Про . От меланофорости-
мулирующеrо тормона быка rлипин отщепляется лишь в не-
больших количествах, а от ropMoHa свиньи совсем не
отщеПJ!Яется, что свидетельствует о влиянии различных
230
СеЛВК:tU8НlJе раСЩеhлеlluе белков
Pea2eHtbI, СВltекtиЛНD оtЩВhAЛIOЩие RЫЩВЬЫ octatKu
31
соседних аминокислот оа скорость отщепления одних и тех
же N-концевых остатков. Низкое содержание rлицина в обоих
rидролизатах объясняется влиянием соседних остатков про-
лина. . Это предположение, которое не соrласуется с фак-
том полноrо rидролитическоrо расщепления rипертенсина (см.
рис. 9), подтверждается только данными, об отщеплении ва-
лина от пептида с. N-коицевым участком Н.Вал.Тир.ПJYО
в результате rидролиза в течение 24 чаt;. Однако при отщеп-
лении валина и 'Тирозина по методу Эдмана N-концевым ста-
новится остаток пролина, который отщепляется лейцинами-
нопептидазой. N-I(онцевой пролин в протаминах также от-
щепляется [7]. Окисленный надмуравьиной кислотой пролак-
тин с N-концевым участком Н.Тре.Про:Вал не отщепляет
аминокислот ПJД действием фермента.
В связи с повышенной rидролизуемостью развернутых
белковых молекул представляет интерес то, что лейцинами-
нопептидаза сохраняет некоторую активность в 8 А1 раство-
ре мочевины и 6 М растворе ацетамида и что происходящее
Инактивирование имеет пол}юстЬю обратимый характер. од-
нако в растворах хлорrидрат.а rуанидин'а инактивирование
протекает быстро инеобратимо.
тельно не установлены. Метод более приrоден для 9тщепле-
ния концевых rрупп пептидоВ, выделенных из белковых rид--
ролизатов, чем для отщепления концевых rрупп исходноrо
белiювоrо соединения. В любом случае предварите;llьная
фраrментация белковой молекулы и идеНТИфИl ация".получен
ных осколков являются .источником данных, необходимых для
установления полной последовательности расположениSl ами-
нокислот в исследуемом белке.
Время от времени предлаrались различные методы опре-
деления концевых rруПП пеПТИДОВ, основанные на использо-
вании тонких химических реакции. Как правило, эти методы'
[106, 320] дают лишь низкие выходы или недостаточно
разработаны, чтобы их с успехом можно было использовать
дЛЯ'исследования природных полипептидов и белков, ха рак.
теризующиХСЯ мноrообразием реакционноспособных боЩ)ВblХ
цепей.
Химические методы
В настоящем разделе рассматриваются только те методы,
которые обеспечивают ступенчатое отщепление аминокислот-
ных остатков, так что пептидная цепь после отщепления кон-
цевоrо остатка остается незатронутой. Таким образом., из
рассмотрения исключается 2,4-динитрофторбензольный ме-
тод, предложенный Сэнджером [262]. Этот метод, использо-
вавшийся для получения большей части сведений о N-конце-
вых rруппах пептидов и белков, подробно рассмотрен в ряде
обзоров [114, 277, 320]. Не рассматривается также метод рас-
щепления rидразином Акабори и сотр. [3, 4, 230], позволяю-
щий определять С-концевые аминокислоты. Этот метод в по-
следнее время был усовершенствован [39], так что он стал
nриюден для идентификации всех обычно встречающихся
аминокислот. :
Совершенно ясно, что требованиями, предъявляемыми ({
любому методу ступенчатоrо отщепления концевыIx rрупП,
являются выIокийй выход продукта отщепления на каждой
стадии и отсутствие одновременноrо расщепления друrих
пептидных связей. Рассмотрение наиболее удачною метода
отщепления концевых rрупп метода Эдмана приводит 1<
выводу, что оптимаЛJ>ные условия расщепления еще оконча-
Метод определения N-концевьtХ 2рУnn
Фенилизотиоцианатный и аналоrичиые методы. Для се-
лективноЮ ОТЩепления N-концевоrо остатка пептидной цеПи
предложен ряд методов, основанных на образовании N-З8ме-
щенноrо соединения типа ХХ.
.".
CHR' CO NH CHR"CONH
I
NH R
V
I1
s
хх
Обработка этих производных кислотой приводит К разры-
ву первой пептидной связи и образованию циклических ;тио-
rидантоиновых или родственных соединений. Эти цикличе-
ские соединения можно экстраrировать орrаническими рас-
творителями и идентифицировать химическими методами или
ИЗ, них можно. вновь получить аминокислоту.
F> areHTbI, используемые для этой ре(lКЦИИ, указаны. в
ТQбл. 5. Все эти peareHTbI в мяrких условиях (рН' 8,5, низкая
''rёtilI'Jep,aTypa) образуют lIроизводные, отличающиеся друr от
ipyf a по скорости uиклизаuии и растворимости в кислотных
t>eatёJ!t tt, ызывающих циклизацию. Указанные peareHTbl
успеII1НО,.4JР' ме.н.SlЛИСЬ для исследования простых пептИДОВ, но
только' фвff:i.1iизотиоцианатный метод Эдмана нашел ШИ'рокnе
240
Селективное расщепление .белков
Реаеенты, селективно отщепляющие концевЫе остатки
24 .
поддерживается добавлением неоольшИх количеств едкоrо
натра или триметиламина. Измеряя расход шелочи в зави-
симости от времени. леrко опр.еделить конец реакции; по рас-
ходу щелочи можно также судить о количестве вступивших в
реакцию rрупп [231]. .
Циклизация производных фенилтиокарбамила (ФТК) про-
вбдилась в различных условиях кислотности. При переходе
от аминокислот к пептидам с длинными цепями возникают
трудности.
Производные аминокислот обычно uиклизуются труднее,
особенно в случае rлицина, чем те же аминокислоты, вхо-
дящие в состав пептидов. Для синтеза ПрОИЗБОДНЫХ фенил-
тиоrидантоина (Фтr) [86, 91] или количественноrо определе-
ния N концевых остатков ФТК-производные часто циклизуют
в 1 н. растворе НСl в течение 1 час при 1000. Однако в этих
условиях Фтr-производные серина, треQнина и цистина не-
<:табильны, поэтому их не удается выделить и количественно
определить. I(роме Toro, все Фтr-производные в кислой среде
разлаrаются, причем степеНь разложения возрастает с увели-
чением кислотности и повышением температуры [114, 317].
В ВОДной среде максимальный выход Фтr-производных до-
стиrается. при действии СИЛьной кислоты при - сравнительно
низких температурах и по возможности меньшей продолжи:
тельности 'реакЦirи. При низкой температуре реакционщ>и
смеси и применении концентрированных кислот (l 5 н.)
удалось синтезировать Фтr-производные серина, треонина и
цистина в водной среде [159, 195]. Кроме Toro, эти соединения
леrко получаются в среде уксусная кислота на [289].
Для ступенчатоrо расщепления пептидов разработан ме-
тод [113, 114], по которому ФТК-пептид растворяют в 3 н.
HCI при комнатной температуРе и определяют конец цикли-
зации по изменению поrлощения в диапазоне длин волн 235
275 ММК. ПО мере образования Фтr-производноro N концевой
аминокислоты максимум поrлощения смещается приблизи-
тельно от 240 до 262,5 ММК при минимуме около 240 ММК
(рис. 13). Если реакция протекает медленно, то ее проводйт
при более высокой температуре (например, при 400). Обычно
продолжительность реакции при комнатной температуре
составляет 1,5 24 час. После завершения цикли ации
Фтr-производное экстраrируют этил ацетатом, а водный
раствор выпаривают досуха при низкой температуре, чтобы
избежать нежелательноrо действия кислоты и возможноrо
tидролиза пептидных связей.
. Выход Фтr-производноrо вычисляют по максимальной
QП'ПJческой РЛОТlfОСПl КИС,IJоrо раствора ( сли отсутствущт
ароматические аминокислоты), а также по максимальноti
оптической плотности экстраrИРОВ<J:нноrо Фтr-производноrо
в спирте (максимумпоrлощения обычно при 267,5 .мМК),
пользуясь КОЭффИlIиентами ЭКСТИНlщии идентифицированных
CI3
',5
310 320
1,0
0,5
о
/
Рис. 13. Кривая поrлощения в ультрафиолетовой области
ФТК-лейцилrлицилаланина и Фтr -производиоrо лейцина, по-
лученноrо из Hero в 3 н. НС1 при комнатной температуре
чер'ез 4 час [114]. . .
о ФТК лейцилrлицилалации (0,13 ммольfл); . Фтr-произиодиое лейцица.
Фтr-производных [114, 195, 289]. Фтr-Производные арrинина
и rистидина не экстраrируются из кислоrо раствора, но про-
изво:цное rистидина можно экстраrировать из нейтральноro
раствора. Присутствие Фтr-производноrо арrинина обнару-
живают по ero максимуму поrлощения (268 ММК) в нейтраль-
ном водном растворе и хроматоrрафированием на бумаrе.
Этот метод нашел лишь оrраниченное применение для рас-
щепления некоторых растворимых пептидов с длинной цепью,
например окситоцина" цепи А окщ:ленноrо инсулина [113].и
16 5<111. ИНI
242
Селективное .расщепленце белков
Реа2ен1'Ы, ttJ.AeKtu8JlO О'1'щеплJlЮЩие KOJltjei1ble Остатки
243
rипертенсина [98]. Экспериментальные трудности встретились
в случае окситоцина после пяти последовательных отщепле
ний N концевоrо остатка на втором полуцистиновом остатке,
а при исследовании цепи. А инсулина после пяти стадий
отщепления на f' сульфоаланильном остатке, соответствующем
цистеиновой кислоте. В rипертенсине, который не содержит ци-
стина, отщепляются только первые четыре аминокислотных
остатка, после чеrо выходы снижаются. Наблюдениям за хо-
дом циклизации путем периодическоrо измерения поrлощения
мешало поrлощение ароматических аминокислот и их произ-
водных.
Фтr-Производные можно идентифицировать xpoMaTorpa-
фированием на бумаrе [92, 186, 288] и на распределительной
колонке [290]. Последний метод приrоден для количественных
определений, но можно выполнять т кже быстрые полуколи
чественные определения путем элюирования пятен хромато-
rpaMM на бумаrе. Пятна проявляются ИОД-азидным реакти-
вом, специфичным на двухвалентную серу, а при ко.
.i1ичествеfiных определениях обнаруживаются IЮ сильному
поrлощению в УФ-области Фтr-производных [92].
Аминокислоты из Фтr-производных обычно реrенерируют
действием rидроокиси бария [86] при 1400 в течение 48 час
(по друrим данным [284], в течение 2 час) или 6 н. НСl при
1500 в течение .16 час [194]. Друrие авторы [98, 275] предпочи
тают проводить реrенерацию действием иодистоrо водорода
при 1400. Фтr Производные желательно. идентифицировать
непосредственно, так как триптофан, арrинин, серин, треонин,
цистеин и цистин разрушаются или лишь частично реrенери-
руются из них кислотами и щелочами, причем при такой об-
работке образуются друrие вещества, дающие положитель-
ную реакцию с нинrидрином. Друrие< аминокислоты можно
реrенерировать количественно кислотами ([194], но см. так-
же [108]) или щелочами [284].
По предложенной Эдманом методике [87] пользоваться
водными растворами кислот не реJ{омендуется во избежание
случайноrо. разрыва пеп.тидных связей. При действии таких
безводных peareHToB, как растворы хлористоrо водорода в
нитрометане, диоксане и ледяной уксусной кислоте [88], ПРJ4
комнатной температуре ФТI(-пептиды расщепляются практи-
чески MrHoBeHHo. в случае высших ФТI(-пептидов и ФТI(-бел-
ков эти peareHTbl дают низкие выходы Фтr-производных [114,
284 320], что, возможно, обусловлено нерастворимостью ФТI(-
производных или слишком жесткими условиями реакции. .
Резкое различие между скоростями расщепления ФТI(-
П ПТJlДОВ в водных растворах кислот fI в беЗI30ДНЫ кщ;лот
навело Эдмана .на мысль о необходимости исследования ме:
ханизма реакции расщецления [89].
Скорость расщепления в безводных средах определялась
по содержанию аминноrо азота, а не по выходу Фтr-произ-
водноrо. Хроматоrрафирование на бумаrе показало, что со-
единение, быстро образующееся из ФТI(-лейцилrлицина,-
представляет собой не лейцин-Фтr, а 2-анилино-4-изобутил-
тиазолинон-5 с максимумом поrлощения при 252. ммк (см.
схему на стр. 239). Наrревание (например, при перекристал-
лизации) оказывается достаточным, чтобы. это соединение
превратилось в лейцин Фтr. С друrой стороны, в безводной
кИслой среде ФТI(-лейцилrлицин непосредственно превра-
щается в лейцин-Фтr, в то время как в водной среде это
превращение проходит через стадию образования ФТI(-лей-
цина и с rор'аздо меньшей скоростью. Таким образом, разли-
чие в скоростях расщепления в водных и безводных средах
невелико, но скорости циклизации в Фтr-производные в этих
двух системах заметно отличаются.
Для ступенчатоrо расщепления ФТI(-производных высших
пептидов и белков, по-видимому, лучше примеНЯТJ:> безводные
кислотные peareHTbl, так как при этом снижается вероятность
разрыва связен внутри пептидной цепи при MHoroKpaTHoM.
последовательном отщеплении концевых остатков. Ступенча-
тэе расщепление ФТI(-инсулина в водной среде в присутствии
хлорrидрата rуанидина, который удерживает белок в раство-
ре, действием 1 н. НСl при 360 [112] или 0,1 н. НСl при 750 [60]
на начальных стадиях происходит нормально. Однако при
испо,пЬ30вании разбавленных кислот помимо ожидаемых
Фтr-пронзводных на последующих стадиях отщепления обра-
зуютс,я все возрастающие количества друrих фенилтиоrидан-.
тоинов, что свидетельствует о расщеплении друrих пептидных
связей.
Наиболее удачной из всех описанных методик расщ пле
ния крупных молР.кvл ФТК-пептидов и белков является MeTO
дика Френкель-I(онрата [110, 114]. По этой методике с uелью
устранения трудностей, связанных с нерастворимостью YKa
занных соединений, все реакции проводятся на полоске бу-
маrи, что обеспечивает доступ летучих peareHToB к болыuой
поверхности белка. .
Циклизация осуществляется в парах смеси 6 н. HCI и ле-
дяной уксусной кислоты ори комнатной температуре в тече
ние 4 16 час. Все Фтr производные можно экстраrироваТh
из бумаrи, но Фтr-производное полуцистина, если оно обра-
зуется, остается соединенным с пеnтидной цепью. Выходы
фенилтиоrидантоинов на последовательных стадиях расщеп-
16*
44
tелеlctивнЬе расЩ iiлеkие ел/({)fJ
Pea2eH'tbl, селекtи8НО ОТЩепллющие RОнцевЬtе OtTaTltu
245
....... .......
ления обычно высоки и в среднем составляЮТ около 80%
(по данным измерения максимальной оптической плотности).
Однако имеются сообщения [121], что выходы являются более
низкими, если они определяются по вЫделенным соединенияМ.
Наиболее успешное применение этот метод нашел для
'определения последовате.л,ьности расположени я аминокислот
rептапеПТИДноrо участка Н.Сер.Тир.Сер.Мет.rлу.rис.Фе
в кортикотропине овцы [141], декапептидноrо участка Н.
Асп.rлу.rли.про.тир.лиз.Мет.rлу.rис.Фе в меланофорости
мулирующем ropMoHe [120, 142] и пентапептидноrо участка
Н.Тре.про.Вал.Тре.про в пролактине [63].
Друrой метод, основанный на использовании безводной
трифторуксусной кислоты [100], которая очень хорошо paCTBO
ряет белки [173], успешно применялся для циклизации (5 .мин
при 00) ФТI(-производных при последовательном расщепле-
нии в пепсине участка Н.Илей.rлу.Асп.rлу [90]. Этот
метод можно при менять также для обработки ФТI(-ПРОИЗВОk
ных друrих белков. Вследствие быстроrо образования проме
)Куточноrо реакционноспособноrо тиазолинона (см. схему на
стр. 239), по видимому, это соединение лучше экстраrировать
после KpaTKoBpeMeHHoro проведения реакции и завершить
циклизацию в 3н. НС1, которая не разрушает Фтr-ПрОИЗВОk
ных серина и треонина. Представляет интерес тот факт, что
очень низкие выходы, получеl!ные Шефердом и сотр. [284)
при тщательном изучении расщепления пептидов- из кортико-
тропина, обусловлены потерями (50 70%) на стадии цикли-
зации в среде ледяная уксусная кислота НСl при 75 800 в
течение 15 .мин. Поскольку тиазолинон образуется быстро и
имеет высокую реакционную способность, подобные условия
циклизации являются, по видимому, ршшком жесткими. На
основании экспериментальных результатов этих авторов мож-
но предположить, что критическая фаза разложения наблю-
дается во время расщепления и циклизации или одноrо из этих
процессов, так как в более мяrких условиях выход аминокис-
лот при реrенерации из ФТI( пептидов оказался ниже, чем
выход аминокислоты из. Фтr-производноrо' аланина в анало-
rичных условия . Этим можно объяснить, почему некоторые
исследователи [108, 151, 242] предпочитают пользоваться M€-
тоДОМ вычитания, соrласно которому N-концевая аминокис-
лота обнаруживается по ее исчезновению. Несмотря на низ-
кие выходы и случайное расщепление связей, Шеферду и
сотр. [284] удалось обнаружить N-концевой остаток, так ка}{
ero количество обычно в 5 10 раз превыша€т содержание
друrих аминокислот U реакционной смеси. Однако в случае
неустойчивой, неэкстраrируемой или стречающейСЯ в пеn.
тидной цепи несколько раз аминокислоты низкие выходы не
являюtся надежнЫМ критерием и MorYT привести к неnра:
вильным выводам.
Друrие методы. З"амещенные о нитрофенильные соединения
вводят в свободную аминоrруппу действием соответствующеrо
фторпроизводноrо. Последующее восстановление нитро
['руппы дозволяет леrко осуществить циклизацию аминосо-
единения в лактам в мяrких условиях. Р. Холли и А. XOJI-
ли [156] при. разработке этоrо метода исследования простых
пептидов применяли l-фтор-2-нитро-4 карбометоксибензол, но
друrие исследователи [162, 169] предпочитали работать с бо-
лее доступным l-фтор 2, 4 динитробензолом. Реакции при сту-
пенчатом расщеплении по методу Р. Холли и А. Холли [156]
протекают по следующей схеме:
F",- :) N0 2 CHR CONHCHR/CO
# /
< + NH 2
"соосн з
CHR CONHCHR/CO
/
NH N0 2
"'-/
#
"'- /
"'-
сооен з
рН 8 9
CHR CONHCHR/CO-
/
NH NH 2
"'-/
Н,. Pt #
pнв /
"'-
еООСН в
рН 4
5 чаr J 25D--i'
CHR CO
1 I
NH NH
"'- /
#
"- d
"'-
СООСН з
i!
+ NH2CHR'CO
он
I
CHR C
1 11
NH N
"'- /
#
"'- / .
"'-
СООСН з
В случае динитрофенилпептидов (ДНФ пептиды) во из-
бежание вторичных реакций необходимо работаТЬF отсут-
246
Селеl'тивное расщепление белков
Реа2ентЫ, селективно отщепляющие концевые остатки
247
Методы определения С-концевых остатков
NaOH [177] или кислотами [301]; дезацилирование можно KOH
тролировать спектрофотометрически [177, 181]. .
Тиоrидантоины удается идентифицировать хроматоrрафи
рованием на бумаrе [68. 94] или путем реrенерации из них
аминокислоты [19], как это описано выше для фенилтиоrидан
тои нов, полученных по методу Эдмана (см. стр. 237 245)_
Эта реакция не приrодна для отщепления C KOHцeBЫX
остатков пролина, так как они не образуют rиоrидантоин, oc
татков аспараrиновой и rлутаминовой кислот, которые обра-
зуют циклические анrидриды, а не тиоrидантоины (аспараrин
и rлутамин, наоборот, дают тиоrидантоины [300), а также
остатков серина, треонина, цистина, арrинина илизина [19,
301], которые неустойчивы при циклизации или реrенерации'
аминокислоты из тиоrидантоиновоrо производноrо. Таким об
разом, этот метод находит весьма оrраниченное применение
для прямоrо определения строения пептидов и белков. Для
определения С-концевоrо остатка по разности [107] реакция
может ОЮlзаться боле'е полезной, но ее все 'Же нельзя исполь
зовать для определения аспараr}fНОВОЙ и }'лутаминовой кислот
и пролина. Однако путем микробиолоrическоrо анализа [107],
специфичноrо длSl остатков [-аминокислот, эти аминокислоты
MorYT бытЬ определены по потере оптической активности на
50% вследствие рацемизации том случае, коrда они яв-
ляются С-концевыми.
Этерификация, восстановление и миrрация. ацильной rруп
пы C KOHцeBЫX остатков. r:I.peдложена [15, 65] представляю
щая интерес. cxt:Ma последовательноrо отщепления С-конце-
вых ост утков путем этерификации и восстановления карбо-
ксиЛЬJlOй rруппы rидридом металла. Миrрация ацильной
rруnпы от N к О в продукте восстановления XXIV дает C-KOH
uевой остаток с леrко rидролизующейся сложноэфирной, а не
пептидной связью (ХХУ). Дальнейшее восстановление приво
дит к ero отщеплен ию в Биде аминоспирта ХХУII, в резуль-
тате чеrо у пептида ПОЯВJjяется С-концевой оксиа идный
остаток XXVI,. способный кацильной переrруппировке [14].
Описанный процесс можно проводить повторно.
ствие кислорода. Продукты реакции стабилизируют динитро
фенилированием. ДНФ Аминодиоксихиноксалины можно
идентифицировать .хроматоrрафическим методом, а N конце
вую аминокислоту определять в виде ДНФ производноrо пу
тем Fидролиза части HOBoro ДНФ-пептида. Преимущество
этоrо метода заключается в возможности расщепления в
мяrких условиях, при которых неспецифичное расщепление
пептиднОй связи маловероятно. Однако при работе с на-
тивными белковыми веществами [162, 169] до сих пор yдa
лось получить только низкие выходы. Описано [281] дальней-
шее усовершенствование метода расщепления, заключающее
ся в селективном восстановлении о нитроrруппы. При этом
получаются окрашенные продукты, которые более устойчивы
и леrко MorYT быть идентифицированы хроматоrрафированием
на бумаrе. Подробно применение этоrо метода расщепления
к пептидам еще не описано.
Расщепление ИЗ0тиоцианатами. Превращение С-концевоrо
остатка в ацилизотиьцианат ХХI облеrчает самопроизволь-
ную циклизацию в ацилтиоrидантоин ХХII [273].
NHCHRCONHCHR'COOH + HCNS NHCHRCONH CHR'
I
s==c СО
N/
ХЮ
OH NHCHRCOO + NH CHR'
I I
s==c со
,,/
NH
ХХIII
5-3амещенный
2 тиоrидантоин
NHCHRCON CHR'
I I
s==c СО
,,/
NH
ХХП
Тиоциановую кислоту обычно получают, действуя YKCYC
ным энrидридом (который блокирует N концевую rруппу) на
тиоцианат аммония. I(онденсация происходит при кратковре-
менном осторожном наrревании [19, 301]. Смешанные анrид-
риды rиоциановой и друrих кислот [177, 302], например
(C 6 H 5 0)2PONCS [177], обеспечивают более мяrкие условия
проведения реакции.
5-Замещенный 2.тиоrидантоин (XXIII) леrко дезаци.1IИ-
руется разбавленными щелочами, например, 0,01 н. раствором
ВосстачовлеНl{е
RСОNНСНR'СОNНСНR"СООСН з
КИСJlота
RCONHCHR'CONHCHR"CH 2 0H или хnор.анrидри.u;4
XXIV
RCONHCHR'COOCH 2 CHR". NH . Восста\{ОВJlение
XXV
RCONHCHR'CH 2 0H + NH 2 CHR"CH 2 0H
XXVr . ххуи
Селективное расщепление белков
248
Литература
249
Подобный метод Mor бы оказаться особенно приrодным
для расщепления пептидов, не содержащих остатков серина
или треонина (помимо N концевых OCTaTKI)B), например пеп-
тидов, которые образуются при расщеплении белков методом,
связанным с миrрацией ацильной rруппы (см. стр. 216 224).
При проведении исследования этим методом на стадии
восстановления и переrруппировки встречаются трудности.
Так, при восстановлении крупных пептидов, не растворимых
в реакционной среде, для получения удовлетворительных pe
зулыатов требуе'tся повышенная температура. Кроме Toro,
восстановительное расщепление пептидных связей, особенно
связей, образованных карбоксильнымиrруппами rлицина и
алаnина, может протекать друrим путем:
щепления. Для этих исследований знание последоватеЛЬНОСТf!
аминокислот во все возрастающем количестве пептидов Яв-
ляется особенно важfIЫМ.
ЗАКЛЮЧИТЕЛЬНЫЕ ЗАМЕЧАНИЯ
ЛИТЕРАТУРА
1. Abderhalden Е., Brockmann Н., Biochem. Z., 225, 386 (1930).
2. А с h е r R., L а u r i 1 а u. R., Т h а u r е а u х J., F r () m а g е о t С.,
Biochirri. et Biophys. Acta, 14, 151 (1954).
3. А k а Ь о r i S., О h n о К, 1 k е п а k а Т., О k а d а У., Н а n а f u 5 а Н.,
Н а r u n а 1., Т 5 U g i t а А., S u g а е К, М а t 5 U 5 h i m а Т., ВиН.
СЬет. Soc. Japan, 29, 507 (1956).
4. А k а Ь о r i S., О Ь." о К, N а r it а К, ВиН. СЬеm. Soc. Japan, 25, 214
(1952) .
5. А lех а n d er Р., Н ud 50 n R. F., Fox М., Biochem. J., 46, 27 (1950).
6. А n d е r 5 о n W., Compt. rend. trav. lаЬ. Car15berg, Sk сЫт., 29, 385
(1955).
7. А n d о Т., N а g а i У., Fuj i о k а Н., J. Biochem. (Tokyo), 44, 779
(1957). .
8. Anfin5en С. В., J. Biol. СЬет., 221, 405 (1956).
9. А n f i n 5 е п С. В., Fеdеrаtiоп Proc., 16, 783 (1957).
10. А n f i n 5 е n С. В., R е d f i е 1 d R. R., Advance5 in Protein СЬem., 11,
1 (1956).
Н. А n f i n 5 е п С. В., R е d f i е 1 d R. R., С h о а t е W. L., Р а g е J..
С а r r о 1 W. R., J. Biol. СЬет., 207, 201 (1954).
12. А п f i n 5 е n С. В., S е 1 а М., Т r i t с h Н., Arch. Biochem. BiophY5.,
65, 156 (1956).
13. В а i 1 е у J. L., см. С h i Ь п а 11 А. с. iп stoop R., Ed., Le5 Рrоtеiпе5
Rapport5 et Di5cussions, Iпstitut Intern. de Chimie Solvay: Brussel5,
1953, р. 119.
14. Bailey J. L., Biochem. J., 60; 170 (1955).
15. В а i 1 еу J. L., Biochem. J" 60, 173 (1955).
16. В а i 1 еу J. L., Biochem. J., 67, 21Р (1957).
17. В а i 1 еу J. L., Мо о r е S., S t е iл W. Н., J. Biol. СЬет., 221, 143
(1956).
18. В а i 1 е у к., В е t t е 1 h е i m Р. R.. Biochem. et Biophys. Acta, 18, 495
(1955).
19. В а р t i 5 t V. Н., В u 11 Н. В., J. Ат. СЬет. Soc., 75, 1727 (1953).
20. В а r t 1 е t t М. F., J о h1 А., R о е s k е R., S t е d m а n R. J., S t е-
w а r t F. Н. с., W а r d о. N., d u V i g п е а u d V., J. Ат. СЬет. Soc..
78, 2906 (1956).
21. Battersby А. R., RоЬiпsоп J. С., J. СЬет.. Soc., 1955,259.
22. Battersby А. R., RоЬiпsоп J. С., J. СЬет. Soc., 1956,2076.
23. В е 11 Р. Н., Н о w ar d К. S.. S h е р h е r d R. G., F i n n В. М.,
М е i s е n h е 1 d е r J, Н., J. Am, СЬет. Soc., 78, 5059 (1956).
CO NH CH20H + NH2
Подобное течение реакции считается [58] причиной наблю
давшихся ранее отклонений при определении C KOHцeBЫX ами-
нокислот в этерифицированном инсулине.
Трудности, которые встречаются при ацильной переrруп-
пировке от N к О, рассматривались выше (стр. 216 224).
Однако в случае небольших пептидов, растворимых в орrани-
ческих растворителях, в разработанных Бейли [15] условиях
реакции, по-видимому, можно успешно осуществить эту пере-
rруппировку.
Разработаны методы выделения и определения амино-
спиртов в микроколичествах, основанные на матоrрафиче-
ском разделении и спектрофотометрическом исследовании
ДНФ-производных аминоспиртов [65, 127, 165, 168] или самих
аминоспирТОВ, которые удается количеСтвенно определить пу-
тем окисления периодатом до формальn,еrида [250].
Некоторые из описанных в данном обзоре методов селек-
тивноrо расщепления "rрают важную роль в определении по-
следовательности расположения аминокислот в пептидах и
белка,Х. В настоящее время только наиболее перспективные
из этих методов находят практическое применение в той мере,
в какой они приrодны для установления связи между строе-
нием и биолоrической активнОстью белковЫх соединений. Од-
нако для исследования более сложных белков MorYT потре-
боват.ься друrие методы. Можно надеяться, что проблемы,
которые возникнут в связи с изучением этих беЛI<ОВ, будут
СТJIмулировать изыкаииеe flQB IX методов селективноrо рас-
250
Селективное рllсщеnлеkие белков
Литература
251
24. В е n d а 1 J. R., Biochem. J., 61, 31 (1955).
25. В е п f е у В. J., Р u r v i s J. L., J. Ат. СЬет. Soc., 77, 5167 (1955)'.
.26. Ber ger А., В еп 1 зЬ а i О., J. Org. Chem.,'17, 1564 (1952).
''Z1. В е r g m а n n М., F r u t о п J. 5., i л Nord Р. Р., Ed., Advances in
Enzymology, Vol. 1, Int€rscience Publishers, New York, 1941, р. 63
28. В е r g m а n п М., М i е k е 1 е у А., Z. physiol. СЬет., 140, 128' (1924).
29. В е tt е I h е i m F. R., J. Biol. СЬет., 212, 235 (1955).
30. В е tt е 1 h е i m F. R., Biochem. et Вiophys. Acta, 19, 121 (1956).
31. В i е r М., N о r d Р. F., Arch. Вiocbeт. Вiophys., 33, 320 (1951).
32. В I а ck Ь u r n S., L е е G. R., Biochem. J., 58,227 (1004).
33. ВlасkЬurп S., Lowther А. G., Biochem. J., 49, 552 (1951).
34. В о d а п s k У М., S z е I k i М., Т 6 m 6 r k е л у Е., W е i s z Е., неопуб-
ликованные данные; ер. В о d а n.s k у М., Record of СЬет.. Progr.
(Kresge Hooker Sci. Lab.), 18, 187 (1957).
35. Boissonas R. А., Guttmапп St., Jaquenoud Р. А., Wal-
I е r J. Р., Helv, СЫт. Acta, 38, 1491 (1955).
36. В о w е s J. Н., М о s s J. А., Biochem..J., 55, 735 (1953).
37. Braunitzer G., Naturwiss., 12,371 (1955).
38. Braunitzer G., Bioehim. et Biophys. Acta, 19,574(1956).
39. Bradbury J. Н., Nature, 178,912 (1956).
40. В r а d ь u r у J. Н., Biochem. J., 68, 482 (1958).
41. Brand Е., E'dsall J. Т., Апп. Rev. Biochem., 16,223 (1947).
42. В r о m е r W. W., S i п n L. О., В е.Ь r е n s О. К, J. Ат. СЬет. Soc.,
79, 279В (1957).
43. Bromer W. W., Siпп L. G., Behrens О. К, J. Ат. СЬет. Soc.,
79, 2807 (1957).
44. .В r о m е r W. W., S t а u Ь А, S i n n L. G., В е h r е n s о. К, J. Ат.
СЬет. Soc., 79, 2ВОI (1957).
45. В r о n f е п Ь r е n n е r А., L i п d е t s t r о m L а n g К, О t t е s е n М.,
ВiocЫт. et Biophys. Acta, 20, 408 (1956).
46. В r ow п Н., 5 а п g er Р., К i t а i R., Вiocbeт. J., 60, 556 (1955).
47. В r u с k п е r V., К о v а с s J., К о v а с s К, J. СЬет. Soc:, 1953, 1512.
48. В r u с k п е r V., К о v а с s J., N а g у Н., J. СЬет. Soc., 1953, 148.
49. В u t 1 е r J. А. V., D о d d s Е. С., Р h i II i Р s D. М. Р., S t е-
р h е п J. М. L., Biochem. J., 44, 224 (1949).
50. В u у I е R., L е о n i s J., Arch. iпtеrп. physiol., 62, 286 (1954).
51. Cecil R., Lоепiпg u. Е., Biochem.J., 66, 18Р (1957).
52. Cecil R., McPЫ e J. R., Biochem. J., 60, 496 (1955).
53.Chibnall А. с., Proc. Roy. Soc., BI31, 136 (1942).
54. С h i Ь па II А. С., Н а s е I Ь а с h С., М а n g а п J. L., R е е s М. W.,
Biochein. J., 68, 122 (1958).
55. С h i Ь п а II А. С., М а п g а n J. L., R е е s М. W., Biochem. J., 68,
III (1958).
56. С h i Ь п а 11 А. С., М а п g а п J. L'., R е е s М W., Biochem. J., 68,
1l.4 (1958).
57. С h i Ь п а II А С., R е е s 11. W., in W оlstепhоlmе G. Е. W., Cameron
,1\\. Р., The Che ical Str cture of Proteins, Churchill, Lопdоп, 1953;
р.70.
58. С h i Ь па 11 А с., R е е s 1>1. W., Biochem. J., 68, 105 (1958).
59. Chibnall А. С., Rees /11. W., Richards Р. М., Bil)cl1em. J., 68,
129 (1958).
61f. С h r i s t е n s е n Н. N., Ompt. rend. trav. lab. Carlsberg, 5ес. сЫт..
28, 265 (1952).
61. С I а r k е Н. Т., J. Biol. СЬem., 97, 235 (1932).
62. С I а у t о n р. W., К е n n tr G. W., S h е р р а r d R. с., J. СЬет. 50С.,
1956, 371.
63. С о 1 е R. р., G е s с h w i I1d 1. 1., L i С. Н., J. Шо!. СЬет., 224, 399
(1957).
64. Consden R., Gordon!. Н., Martin А. J. Р., Synge R. L. М.,
Biochem. J., 41, 596 (1947).
65. С r а w h а II J. с., Е II i о It О. Е, Biochem. J., 61, 264 (1955).
66. С r е w t h е r W. G., L е n по х Р. G., Nature, 165, 680 (1950).
67. D а'" n е n Ь е r g А. М., S m i t h Е. L., J. Вiol. СЬет., 215, 55 (1955).
6В. J) а u tre v а их М., В iserte G., с. R., 240, 1153 (1955).
69. О а v i е Е. W., Н е u r а t h Н., J. Biol. СЬет., 213, 515 (1955).
70. D а v i s N.' с., 5 m i t h Е L., iп Glick О., Ed., Meth6ds of. Bioche
mical Analysis, Vol. 11, Interscience Publishers, New Yori( London,
1955, р. 215.
71. О е s п u е Jl еР., W о 1 s te n Ь.о I m е G. Е. W., С а m е r оп М. Р.,
Eds., ТЬе Chemical Structure of Рrоtеiпs, Churchill, London, Н/53, р. 140.
72. О е s n и е 11 е Р., В о n j ои r G., Biochim. et Biophys. Acta, 7, 451
(1951) .
73. D е s n u е I1 е Р., В оп j ои r G., Biochim. et Biophys. Acta, 9, 356
(952) .
.74. DesnueJle Р., С.азаl А... Biochim. et Biophys. Acta, 2, 64 (1948).
75. О е s n и е Jl еР., F а Ь r е С., ВиН. зос. сЫт. biol., 36, 181 (1954).
76. Desnuelle Р., Fabre с., Biochim. et Biophys. Acta, 18,49 (1955).
77. О е s n и е II еР., G а Ь еЧ о t е а u С., Arch. Biochem. Вiophys., 69, 475
(1957).
7В. Desnuelle Р., Rovery М., Bonj our G., Biochim. et Biophys.
Acta, 2, 134 (l948).
79. О i хоп Н. В. Р., S t а с k -о и n n е М. Р., Biochem. J., 61, 483 (1955)'.
80. D о t у Р., G е i d u s с h е k Е. Р., Iп Neurath Н., ВаНеу К, Eds..
'ТЬе Proteins, Vol. 1, Academic Press, New York, 1953, Part А, р. 393.
Вl. D r и с k е r В., Н а i n s w or t h R., S m i t h S. G., J. ТехШе Inst., 44,
1420 (1953). .
82. d u V I g n е а u d V., G is h Р. Т., К а t s о у а n n i s Р. G., J. Ат.
СЬет. Soc., 76, 4751 (1954).
83. си Vigneaud V., Lawler Н. С., Рорепое Е. А., J. Ат. СЬет.
Soc., 75, 4880 (1953).
Селектuвное расщепление белков
Литература
253
252
84. ди Vigneaud У., RessleT С., Swan J. М., Roberts С. W.,
к а t s о У а n n i s Р. о., J. Ат. СЬет. Soc., 76, 3115 (1954).
85. d u V i g n 6 а u d У., R е s s 1 е r С., Т r i р р'е t t S., J. Blol. СЬеm.,
205, 949 (1953J.
86. Е d m а пР., Acta СЬет. Scand., 4, 277 (1950).
87. Е d m а пР., Acta СЬеm. Sсапd., 4,283 (1950)\
88. Е d m а пР., Acta СЬеm. Scand., 7, 700 (1953).
89. Е d m а пР., Acta СЬеm. $сапd., 10, 761 (1956).
90. Е d m а пР., Proc. Roy. AU5tralian СЬеm. In5t., 24, 434 (1957).
91. Е d m а пР., L а u Ь е r К, Acta СЬет. Scand., 10, 466 (1956),
92. Е d m а пР., S j о q u i 5 t J., Acta СЬет. Sсапd., 10, 1507 (1956).
93. Е d 5 а 11 J. Т., J. Cellular and Сошр. РЬУ5101., 47, Supp1. 1,163 (1956).
94. Е d w а r d J. Т., N 1 е 1 s е п S., СЬет. апд Iпd., 1953, 197.
95. Е h r е п р r е 1 s S., L е а с h S. J., S с h е r а g а Н. А., J. Дm. Chem.
Soc., 79, 6086 (1 !j51 ) .
96. Е II 1 о t t о. Р.. Blochem. J., 50, 542 (1952).
97. Е 11 1 о t t О. Р., In Wolstenho1me о. Е. W., Cameron М. Р., Eds.,
ТЬе Chemlcal Structure of Рrotеlпs, СЬитсЬШ, Lопdоп, 1953, р. 129.
98. Е 11 1 Q t t D. Р., Р е а r t W. S., Blochi m. J., 65, 246 (1957).
99. Е 1 m о r е О. Т., Т о s е 1 а п d Р. А., J. СЬеm. Soc., 1954, 4533.
100. Е 1 m о r е D. Т., Т о s е 1 а п d Р. А., J. СЬеm Soc., 1956, 188.
101. Е r r е r а М., Progress Biophys., 3, 88 (1953).
102. Fеltе1S0П J., Partrldge S. М., Blochem. J., 64, 607 (1956).
103. F i s h J. с., Nature, 180, 345 (1957).
104. F 01 k J. Е, J. Аm. СЬеm. Soc., 78, 3541 (1956)'.
105. F 01 k J. Е., G 1 а d n е r J. д., L а k 1 К, Federation Proc., 16, 181
(1957)'.
106. F о х S. W.. Аdvапсеs IпРrоtеiп СЬеm., 2, 155 (1945).
107. Рох S. W., Hurs.t Т. L., Griffith J. Р., Underwood о., J. Аm.
СЬеm. Soc., 77, 3119 (1955).
'. 108. F о х S. W., S е r а t W., Н u r s t Т. L., Т i а р р О. U., L u t j е n 5 D.,
J. Дт. СЬет. Soc., 79, 2846 (1957).
109. F r а е n k е 1- -С о п r а t Н., J. Blol. СЬет., 142, 119 (1942).
1l0, F r а е n k е 1- С о п r а t Н., J. Дт.. СЬет. Soc., 76, 3606 (1954).
111. F r а е n k е 1- С о n r а t Н., Pederatlon Proc., 16, 810 (1957).
112. Fraenkel-Conrat Н., Frаепkеl-Сопrаt J., Acta СЬет.
Scand., 5, 1409 (1951).' .
Н3. F r а е n k е 1- С оп r а t Н., Н а r r i 5 J. 1., J. Аm. СЬеm. Soc., 76, 6058
(1954).
114. Frаепkеl-Сопrаt Н., Harrls J. 1., Levy А. L., In Glick О.,
Ed., Methods of Blochemical Апа1уsis, Уоl. 11, Iпtеrsсlепсе Publl5herl'l,
New York London, 1955, р. 359.
115. F r а е n k е 1 - С о п r а t Н., Р о r t е r R. К, BloctJjm. et BiophY5. Acta;
9, 557 (1952).
Нб. F r е de r i с q Е., ДтсЬ. Blochem. Blophys., 65, 218 (1956).
Н7. Р r u t о n J. S., J о h n s t о п R. В., F r 1 е d М., J. Blo1. СЬеm., 190,
39 (1951).
118. G а Ь е 1 о t е а u С., де V е r n е j о u 1 Р., R о v е r у М., D е s п u е 1..
1 еР., С. R., 24l!, lЗ47 (1957). .
119. G е с h w 1 п d 1. 1., L 1 с. Н., Arch. Blochem. Blophys., 63, 316 (1955\.
120. G е s с h w i n d 1. 1., L i С.Н., В а r п а f i L., J. Дm. СЬет. Soc., 79.
1620 (1957).
121. Gеsсhwiпd 1. 1., LI с. Н., Barnafi L:, J. Дт. СЬет. Soc., 79,
6394 (1957).
122. G 1 а d n е r J. Д., N е u r а t h Н., J. Blol. СЬеm., 205, 345 (1953).
123. G 1 е n d е n п 1 п g М. В., G r е е п Ь е r g О. М., F r а е п k е 1 - С о п-
r а t Н., J. Вiol. СЬem., 167, 125 (1947).
124. Gordon А. Н., Маrtlп А. J. Р., 'SyIige R. L. М., Blochem. J.,
35, 1369 (1941).
125 G о r 1 п 1 L., ВiocЫт. et Boiphys. Acta, 7, 318 (1951).
126. G r :J. s s m а п W., Н 6 r m а n n Н., Z. physlol. СЬет., 292, 24 (1953).
127. G r а 5 s m а n .W., Н о r m а п n Н., Е п.d r е s Н.; z. physlo1. СЬет.,
296. 208 (1954).
128. G r е е'п N. М., N с u r а t h Н., Iп .Neurath Н., Bai1ey К, Eds.
ТЬе Protelns, Vol. 2, Academic Press, New York, 1954, Part В,
р. 1057.
129. G u а s t а 1I а J., Compt. rепd. trav. lаЬ. CarlsЬerg, Sk сЫт., 208,
1078 (1939).
130. G u n t 1 е Ь е r g А. У., О t t е s е n М., Compt. rend. trav. 1аЬ.. Car1s-
berg, Ser. chim., 29, 36 (1954).
131. Н а 1 s е у У. О., In Neurath Н., ВаНеу К, Eds" ТЬе Protelns, Vol. 2,
Academic Press, New York, 1954, Part В, р. 1135.
132. Наlзеу У. D., Neurath Н., J. Bio1. Cheni.., 217, 247 (1955).
133. н а r f.en 1 s t Е. J., J. Дт. СЬеm. Soc" 75, 5528 (1953).
134. Н ат f е n i s t Е. J., С r а 1 g L. С., J. Ат. СЬеm. Soc., 74, 3087 (1952).
135. Н а r т а р В., Ртос. Iпtеrп. Woo1 ТехШе Research Сопf. AU5tralia.
. 1955, Уоl. В, 1956, р. В98.
136. Н а r r i 5 J. 1., Symposlum оп РерНде Chemlstry, Specla1 рuыiаtlопп
Ng 2, СЬеm. Soc., Lопdоп, 1955, р. 71.
137. Harris J. 1., Nature, 177,471 (1956).
138. Harri.s J. 1" Кпlght с. А., J. BloI. СЬет., 214, 215 (1955).
139. Н а r r 1 s J. 1., L е r Не r Д. В., Nature>; 179, 1346 (1957).
140. Н а r r I s J. 1., L 1 С. Н., J. Аm. СЬеm. Soc., 74, 2945 (1952).
141. Н а r r i s J. 1., L 1 С. Н., J. Аm. СЬет. Soc., 76, 3607 (1954).
142. Н а r r 1 s J. 1., R о о s Р., Nature, 178, '90 (1956).
143. Н а r r 1 s J. 1., S а п g е r. F., N а u g h t оп М. Д., Arch. Blochem.
ВiopbY5., 65, 427 (1956).
144. Н а u s m а n n W., J. Ат. СЬеm. Soc., 78, 3663 (l956У.
145. Н а u s m а n n W., W е i 51 g е r J. R., С r а 1 g I . С., J. Ат. Chem.
Soc., 77, 723 (1955}.
254
Селектuвное расщепление белков
Литературll
255
146. Н е i r w е g h 15., Е d m.а пР., Bio.chim. et Biophys. Acta, 24, 219
(1957).
147. Н е r r i о t R М., in McElroy \У. D., аlавв В., Eds., ТЬе Месhапisт of
Епzуте Асtiоп, Johii Hopkins Press, Baltimore, 1954, р. 24.
148. Hil1 R. L.,"Smith E.'L., Biochim. et Biophys. Acta, 19,376 (1956).
149. Н i 11 R. L., 5 m it h Е. L., J. Bio1. СЬет., 228, 577 (1957).
150. Н i r s С.. Н. w., J. Bio1. СЬеm., 219, 611 (1956).
151. Н i r s С. Н. W., Fеdеrаtioп Proc., 16, 196 (1957).
152. Hirs с. Н. W., Moore 5., Stein W. Н., J. Biol. СЬет:, 219, 623
(1956) .
153. Н i r s с. Н. W., 5 t е i n W. Н., М о а r е 5., J. Bio1. СЬem., 211, 941
(1954) .
154. Н i r s С. Н. w., 5 t е i n W. Н., М о о r е 5., J. Biol. СЬет., 221, 151
(1956).
155. Н i r s С. Н. W., 5 t е i n W. Н., М о о r е 5., Intern. Union Pure Appl.
СЬет., Symposium оп Protein 5tructure, Paris, 1957, Jоhп Wiley and
Sons, New York, 1958, р. 211.
156. Н о 11 е у R. W., Н о 11 е у А. О., J. Ат. СЬem. 50С., 74, 5445 (1952).
157. Н о т т е s F. А., D f i n k w а а r d J. 5., Н u i s m а n Т. Н. J., Bio.chim.
et Biophys. Acta, 20, 564 (1956).
158. Н u g g i n s С., Т а р 1 е у О. F., J е п s е п Е. У., Nature, 167, 592
(1951).
159. 1 n g r ат У. М., J. Chem. Soc., 1953, 3717.
160. 1 n gr а т У. М., Biochim. et Biophys. Acta, 16,599 (1955).
161. 1 n g r а m У. М., Вiocbeт. J., 59, 653 (1955).
162. 1 п gr а т У. М., Biochiill. et Biophys. Acta, 20, 577 (1956).
163. 1 n g i а т У. М., Nature, 180, 326 (1957).
164. J а с о Ь s е п С. F., L е оп i s J., L i n d е r s t r " т L а п g К., О t t е-
s е n М., iп Glick О., Ed., Methods of Biochemica1 Апа1уsis, VoL IV,
Interscience Publishers, New York Lо.пdоп, 1957, р. 171.
165. J а t z J{ е w i t z Н., Т а т N., Z. physiol. ctiem., 296, 188 (1954).
'166. Jolles Р., Thaureaux J., Fromageo.t С., Arch. Biochem.
Biophys., 69, 290 (1957). .
167. J О. s е f s s о n L., Е d т а пР., Вiochim. et Biophys. Acta, 25, 614
(1957) .
168. J u t i s z М., Р r i v а t d е G а r i 1 h е М., 5 u q u е t М., F r о Ш а-
geot С., Виll. 500. сЫт. biol., 36,117 (1954).
169. J u t i s z М., R it s ch а f d W., Biochim: et Biophys. Acta, 17, 548
(1955).
170. Kai1de11., Капdе1 М., КоуаС5 J., Bruckner У., Naturwis .,
41, 281 (1954)'.
171. Katchals'ki Е., Benjamin а. 5., Gross У., J. Ат. Chem. Soc.,
79, 4096 (1957).
172. К а t s о у а n n i s Р. а., J. Ат. Chem. So.c., 79, 109 (1957).
113. К а t z J, J.! Nature, 169,708 (1952).,
174. К а u z т а n п W., in McElro.y W. D., Glass В., Eds., ТЬе Mecha:
nism of Епzуmе Action, Jo.hn Hopkins Press, Baltimore, 1954, р. 7{).
175. К а u z т а h п W., J. Cellu1ar and Со.тр. Physiol., 47, Suppl. 1, 113
(1956).
176. l\ennef а. W., Кhо.rапа Н. а., J. Chem. 50С., 1952,2076.
177. I(enner а. W., Кhоrапа Н. а., Stedman R. J., J. Chem. Soc.,
1953, 673.
178. К i т те 1 J. R., S т i t h Е. L., J. Bio1. Ch m., 207, 515 (1954).
179. Kimmel'J. R., Тhоmрsоп Е. О. Р., Smith Е. L."J. Bio1. СЬет.,
217, 151 (1955).
180. К i n g Т. Р., С r а i g L. с., J. Ат. СЬет. Soc., 77, 6627 (1955).
181. К j а е R. А., Е r i k s е пР., Acta Chem. Sсапd., 6, 448 (1952).
182. К 1 о t z 1.. iп Neurath Н., Ваilеу к., Eds., ТЬе Рrоtеiпs, Уо1. 1,
Academic Press, New York, 1953, Part В, р. 727.
18з. К о v а с s J., К а n d е 1 1., К а п d е 1 М.. В r u с k n е r В., Experientia,
11, 96 (1955).
184. К и р ke D. W., L i n d е r s t r" т . L а n g к., Вiосhiш. et Bio.phys. Acta,
13, 153 (1'954).
185. Laki к., Kominz О. R., Sуто.пds п., Lоrапd L., See.
g е r s W. Н., Arch. Biochem. Biophys., 49, 276 (1954).
1-86. L а n d т а n п W. А., О r' а k е М. Р., D i 11 а h а J., J. Ат. Chem. Soc.,
75, 3638 (1953).
187. Laskowski М., Jr., Scheraga Н. А., J. Ат. Chem. Soc., 76, 6305
(1954).
188. Law1er Н. С., Tay10r S. Р., 5wап А. М., du Vi.gпеаud У.,
Proc. Soc. Ехрtl. Bio1. Med., 87, 550 (1954).
189. L е а с h S. J., Proc. Intern. Wool ТехШе Research Сопf. Australia,
1955, Уо1. С, 1956, р. С181. .
190. L е а сl1 S. J., S с h е r а g а Н. Д., Compt. rепd. trav. lаЬ. Car1sberg,
5er. сЫт., 30, 271 (1958).
191. L е а n i s J., L е v у А. L., Compt. rепd. trav. lаЬ. Carlsberg, Sk сЫт.,
29, 57 (1954).
192. L е r n е r А. В. L е е Т. Н., J. Biol. Chem., 221, 943 (1956).
193. Lеviп Т., Berger А., 'Katchalski Е., Вiochem. J., 63,308
(1956).
194. Levy А. L., Biochim. et Biophys. Acta, 15, 589 (1954).
195. L ev у А. L., С h u n g О., ВiocЫт. et Вiophys. Aeta, 17, 454 (1955).
196. L i С. Н., Advances iп Рrоtеiп Chem., 11, 101 (1956).
197. t i С. Н., Federation Proc., 16,775 (1957).
198. L i С. Н., Аdvапсеs iп Рrоtеiп Chem., 12, 269 (1957).
199. L i с. Н., G е s с h w i n d.l. 1., С а 1 е R. О., R а а с k е 1. О., Н а r.
r i $ J. 1., О i х а п J. S., Nature, 176, 687 (1955).
200. L i n d е r s t r " т L а n g К:, О t t е s е п М., Compt. rепd. trav. lаЬ.
Car1sberg, Ser. сЫт., 26, 403 (1948).
201. L i п d 1 е у Н., Biochem. J., 42, 481 (1948).
256
Селективное расщепление беЛRО8
Литературll
257
202. L i n d 1 е у Н., J. Ат. СЬет. Soc., 77, 4927 (1955).
203. L i n d 1 е у Н., Щосhеm. .et Вiophys. Acta. 18, 194 (1955).
204. L i n d 1 е у Н., Nature, 178, 647 (1956).
205. L о с k h а r t 1. М., А Ь r а h а т Е. Р., Вiochem. J., 58,.633 (1954).
206. Lockhart 1. М., Abrah ат ЕР., Nеwtоп G. G. Р., Biochem.
J., 61, 534 (1955). .
207. L и с а s Р., S h а w J. Т. В., S т i t h S. G., Biochem. J., 66, 468 (1957)'.
208. L и g g J. W. Н., Biochem. J., 26, 2144 (1932). .
209. М а r k u s G., I( а r и s h Р., J. Ат. СЬет. Soc., 79, 134 (1957).
210. М с F а d d е n М. L., L а s k о w s k i М., Jr., Abstracts, 130th М ееtiпg,
American Chemical Society, Аtlапtiс СНу. September 1956, р. 71C. _
211. М с L а r е n А. О., Advances in Епzуто1., 9, 75 (1949).
212. МсРЬее J. R., Вiocbeт. J., 64, 22 (1956).
213. М е е d от В., Compt. rепd. trav. lab. Car1sberg, Ser. сЫт., 29, 403
(1955) .
214. М е е d о т В., Acta СЬет. Scand., 10, 881 (1956).
215. М е 1 о u n В., S о r т Р., Соllесtiоп Czechos10v. СЬет. Corri.muns.,. 20,
265 (1955).
216: М е у е r О., ,J и t i s z М., L i С. Н., ВиIl.' soc. сЫт. Ыо1., 38, 615
(1956).
217. М оп i е r R., J и t i s z М., Biochim. et" Biophys. Acta, 15, 62 (1954).
218. М о о r е S., Н i r s С. Н. W., S t е i n W. Н., Federation Proc., 15, 840
(1956) .
219. М о о r-e S., S t е i n W. Н., Advances in Protein СЬет., Н, 191 (1956).
220. М о w е r Н. Р., N i е.т а п п с., Biochim. et Biophys. Acta, 25, 420
(1957) .
221. М и е 11 е r J. М., Р i е r с е J. G., du V i g n е а u d V., J. Вio1. СЬет.,
204, 857 (1953).
222. М и е 1I е r J. М., Р i е r с е J. G., О а v о 11 Н., du V i е g n е а u d V.,
J. Biol. СЬет., 191, 309 (1951).
223. Nature, 179,567 (1957). '
224. N е и r а t h Н., Advances iп Protein СЬет., 12, 320 (1957).
225. N е u r a.t h Н., О i хоп G. Н., Fеdеrаtiоп Proc., 16, 791 (1957).
226. N е u r а t h Н., G i а d п е r J. А., О а v i е Е. W., in McElroy W. о.,
Glass В., Eds., ТЬе Месhапisт of Епzуте Асtiоп, Jоhп Норkiпs Press,.
ВаШтоrе, 1954, р. 50.
227. N е и r а t h Н., R и р I'e у J. А., О r е у е r W. S., Arch. Вiосhеш.
Biophys., 65, 243 (1956)'.
228. N е u r а t h Н., S с й w е r t G. W., СЬеm. Revs., 46, 69 (1950).
229. N i и С., F r а е n k е l. С о п r а t Н., Biochim. et Biophys. Acta, 16,
597 (1955).
230. N i u С., F r а е n k е 1 - С о п r. а t Н, J. Дт. СЬет. Soc., 77, 5882
(1955).
231. О t t е s е п М., W о 11 е n Ь е r g е r А., Compt. rend. trav. 1аЬ. Car1s.
ber , Ser. сЫт., 28, 463 (1953).
232. Р а 1 а di.n i . Д., С r а i g L. с., J. Ат. СЬет.. Soc.; 76. 688 .0.954);
233. Р а r t r i d g е S. М., о а v i s Н. Р., Nature, 165, 62 (1950).
234. Partridge S. М., Oavis Н. Р., Biochem. J., 61, 21 (1955).
235. Р а r (r.i d g е 5. М., О а v i s Н. Р., А d а i r G. 5., Biochem. J., 61,
II (1955).
236. Peart W. S.; Biochem. J., 62, 520 (1956).
237. Ре r 1 т а п п G. Е., Advances iп Protein СЬет., 10, 1 (1955).
238, Р h i 11 i Р s Н., Symposium оп Fibrous Proteins, 50С. Dyers Colourists,
Bradford, 1946, р. 39.
239., Phillips А. Р., Baltzy R.. J. Дт. СЬет. Soc., 69, 200 (1947).
240. Р i е r с е J. G., J. Ат. СЬеrn. Soc., 77, 184 (1955).
241. Р 1 е n t 1 Д. А., Р а g е 1. Н., J. Вiol. СЬет., 163,49 (1946).
242. Р о реп о е Е. А., du V i g n е а и d V., J. Biol. СЬет., 205, 133 (1953).
243. Р о реп о е Е. А., du V i g n е а и d V., J. Вiol. СЬет., 206, 353 (1954).
244. Porath J., Roos Р., LапdgrеЪе F. W., Mitche11 G. М;,
Biochim. et Вiophys. Acta, 17,598 (1955). .
245. Р о r te r Н. R., S а n g е r Р., Вiocbem. J., 42, 287 (1948).
246. R а т J. $., Т е r т i п i е 11 о L., В i е r М., N о r d Р. Р., Arch. Bio-
сЬет. Biophys.. 52, 464 (1954).
247. R а т а с h а п d r а п L. К, М с С о п п е 11 W. В., Сап. J. СЬет.. 33,
1638 (1955).
248. R а т а с h а п d r а п L. К, М с С о n п е 11 W. В., J. Аm. СЬет. Soc.,
78, 1255(1956).
249. Redfie1d R. R., Аllfiпsеп С. В.. J. Bio1. СЬет., 221, 385 (1956).
250. R е е s М. W., Biochem. J., 68, 118 (1958).
251. Rees Е. О., Siпgеr S. J., Nature, 176, 1072.(1955).
252. Reith W. S., Wа1drоп N. М., Biochem. J., 56,116 (1954).
253. R е i t z Н. с., F е r r е 1 R. Е., F r а' е п k е 1 - С о n r а t Н.. О 1-
cott H(S., J. Am. СЬет. Soc., 68, 1024 (1946).
254. R е s 5 1 е r с., du V i g п е а и d V., J. Вio1. СЬет., 211, 809 (1954).
255. R e.s s 1 е r С., Т r i р,р е t t S., du V i g 11 е а ud V., J. Bio1. СЬет.,
204,861 (1953).
256. R i tt е 1 W.,. 1 s е 1 in В., К ар р е 1 е r Н., R i п i k е r В., S с h w у.
zer К, He1v. СЫт. Acta, 40;614 (1957).
257. R о v е r у М., Р о i 1 r о U х М., У о s h i d а А., О е s п и е II еР., Bio-
сЫт. et Biophys. Acta, 23, 608 (1957).
258. R и d i п g е r J., Н оп Z 1 J., Z а v r а 1 М., СоН. Czechos1ov. .СЬет..
Соттипs., 21, 202 (1956).
259. R У 1 е А. Р., А n f i n s е п С. В., ВiocЫm. et Biophys. Acta 24, 633
(1957). .
260. R у 1 е А. Р., 5 а п g е r Р., Bjochem. J., 60, 535 (1955).
261. R у t е А. Р., S а п ge r Р., S т i t h L. Е., К i t а i R., Bioch ,
60,541 (1955).
262. S а n g е r F., Biochem. J., 39, 507 (1945).
263. S а п g е r Р., Biochem. J., 44, 126 (1949).
17 Заи. Ш6
. СелективнОе раСЩепление белков
Литература
259
58
264. S а n g е r Р., Proc. lntern. Wool ТехШе R.esearc Сопf. Australia,
1955, Vol. С, 1956, р. С 396.
265. S а n g е r Р., iп Вrоwп R., DапiеШ J. Р., Fibrous Рrotеiпs апd Тheir.
Bio10gical Significance, Cambridge University Press, 1955, р. 10.
266 S а n g е r Р., Дdvапсеs iп Рrоtеiп СЬет., 7, 1 (1952).
267. S а п g е r Е, Т h о т р s о n Е. о. Р., Biochem. J., 53, 366 (1953).
268. S а n g е r F., Т h о т р 5 о п Е. о. Р.. неопубликованные даниые.
2(>9. Sапgеr Р., Тhотрsоп Е. О. Р., Kitai R., Biochem. J., 59, 509
(1955) .
270. Sanger. Р., Тhотрsоп Е. О. Р., Тирру Н., Symposium Hor-
топеs Proteiques et Oerivees des Рrоtеiпеs, 11 е Сопgr. iпtеm. ЫосЫт.,
Paris, 1952, р. 26.
271. S а n g е r F., Т и р р у Н., Вiocbem. J,. 49, 463 (1951).
272. Sапgеr Р., Тирру Н., Вiocbeт. J., 49, 481 (1951).
273. S с h 1 а с k Р., К u m р f W., Z. physiol. Chem., 154, 125 (1926).
274. S с h r а т т G., А п d е r е r F. А., Naturwiss., 3, 74 (1955).
275. S с h r а m т а., В r а и п i t z е r а., S с h п е i d е r J. W., Nature, 176,
456 (1955).
276. S с h r а т т G., М о о r е S., В i g w о о d Е. J., Biochem. J., 57, 33
(1954) .
277. S с h r о е d е r W. д., Fortschr. СЬет. org. Naturstoffe, 11, 240 (1954).
278. S с h r о е d е r W. Д., iп Wо1stепhо1те G. Е., Сатеrоп М. Р., The СЬе-
mical Structure of Рrоtеiпs, Churchil1, Lопdоп, 1955, р. 184.
279. S с h w а r z Н., В и т р и s F. М., Р а g е 1. Н., J. Аm. СЬеm. Soc., 79,
5697 (1957).
280. S с h w У z е r R., S i е Ь е r Р., He1v. СЫт. Acta, 40, 624 (1957).
281. S с о f f о n е Е., V i а п е 11 о Е., L о r е п z i п i А., Gazz. сЫт. ita1.,
87, 354 (1957). .
282. S е 1 а М., V( h i t е Р. Н., Д n f i п s е п С. В., Sсiепсе, 125, 691
(1957). ,
283. S h е р h е r d R. G., Н о w а r d К. S., в е 11 Р. Н., С а с с i о 1 а А. R.,
С h i 1 d R. а., О а v i е s М. с., Е п g 1 i s h J. Р.. F i n п В. М.,.
Меisепhеldеr J. Н., Moyer А. W., Vап der Scheer J., J,
Ат. СЬет. Soc., 78, 5051 (1956).
284. S h е р h е r d R. G., W i 11 s оп S. О., Н о w а r d К. S., В е 11 Р. Н"
'0 а v i е s .о. S., О а v i s. S: В., Е i g п е r Е. А., S h а k е s р е а r е N. Е.,
J. Ат. СЬет. Soc., 78, 5067 (1956).
285. S h е rr у S., Т r 011 W" J. Biol. СЬет., 208,95 (1954).
286. S h u g а r О., Biochim. et Biophys. Acta, 8, 302 (1952).
287. S i n п L. G., В е h r е п s О. к., В r о т е r W. W., J. Ат. СЬет. Soc.,
79, 2805 (1957).
288. S j о q и i s t J., Acta СЬет. Sсапd., 7, 447 (1953).
289. S j о q u i s t J., Arkiv Kemi, 11, 129 (1957).
290. S j о q и i s t J., Arkiv Kemi, 11, 151 (1957).
291. S k е g g s L. Т., К а h n J. R., S h и т w а у N. Р., J. Ехрtl. Med., 103,
295 (1956).
292. Skeggs L. Т., Lentz К. Е., Каhп J. R., Shumway N. Р.,
Woods К. R., J. Exptl. Med., 104, 193 (1956).
293. S m i f h Е. L., in Nord Р. Р., Ed., Advances iп Enzymology, Vol.
ХН, Iпtеrsсiепсе PubIishers, NewYork Lопdоп, 1951, р. 191.
294. S m i t h Е. L., in Snmner J. В., Myrblick к., Eds., The Епzуmеs,
Vo1. 1. A,cademic Press, New York, 1951, Part 2, р. 793.
295. S rn i t h Е. L., Proc. Iпtеrп. Wool ТехШе Research Conf. AustraIia,
1955, Vol. С, 1956, р. С407.
296. S т i t h Е. L., Fеdеrаtiоп Proc., 16, 801 (1957).
297. S т i t h Е. L., D а v i s N. с., А d а т s Е., S Р а с k т а п о. Н.,
iп МсЕ1соу W. D., Glass В., Eds., ТЬе Mechanism of Епzуте Асtiоп,
John Норkiпs Press, Ba1timore, 1954, р. 291.
298. S т i t h Е. L., К i т т е 1 J. К, Proc. lntern. Woo1 ТехШе Research
Сопf. Australia, 1955, Vol. С, 1956, р. C199.
299. S Р а c'k m а n D. Н., S.rn it h Е. L., В i" о w n о. М., J. Bio1. СЬет.,
212,255 (1955).
300. Steinberg О., J. Аm. СЬет. Soc., 75, 4875 (1953).
301. S w а n J. М., Australian J. Sci. Res., А5, 711 (1 952}.
302. S w а nJ. М., AustraHan J. Sci. Res., А5, 728 (1952).
303. S w а n J. М., Nature, 180,643 (1957).
304. S у n g е R. L. М., СЬет. Revs., 32, 135 (1943). .
305. S У п g е R. L. М., ВиН. soc. сЫт. Ыо1., 27, 286 (1954).
306. S у п g е R. [. М., in Stoop R., Ed., Les Proteines: Rapports et Dis
сиssiопs, lпstitut lпtеrп. de chimie Solvay, Brussels, 1953, р. 153.
307. S у n g е R. L. М., Proc. lntern. Wool ТехШе Research Сопf. AustraIia,
1955, Vo1. В, 1956, р. В9.
308. Т а nf'"or d С., J. Аrn. СЬет. Soc., 77, 1912 (1955).
309. Т а сЬ ell О. 5., Н ас n i s h О. Р., СЬет. Revs,49, 1 (1951).
310. 'rhaureaux J., Jolles Р., С. R., 243,1685 (1956).
311, ТЬ а ur еа их J., J о 11е s Р., С. R., 243, 1926 (1956).
312. Thompson А. R., Biochem. ,J., 60, 507 (1955).
313. Т h о т р s оп А. R., Biochem. J., 61,253 (1955).
314. Тhотрsоп Е. о. Р., J. Biol. СЬет., 208, 565 (1954).
315. Т h о т р s о п Е. О. Р., Biochim. et Biophys. Acta, 15, 440 (1 954}.
316. Т h о т р s о п Е. о. Р., Proc. lпtеrп. Woo1 ТехШе Research Сопf. Ans-
. traHa, 1955, Vo1. С, 1956, р. С102.
317..Тhотрsоп Е. о. Р., Аиstrаliап J. Bio1. Sci., 10,225 (1957).
318. Тhотрsоп Е. О. Р., Biochim. et Biophys. Acta, 25, 210 (1957).
319. Т h о т р s о п Е. О. Р., неопубликованные данные.
320. ТЬ о т р s о n Е. О. Р., Т'Ь о т р s оп д. R., Fortschr. СЬет. org. Na
turstoffe, 12, 270 (1955).
321. Т i е t z е Е, G 1 а d n е r J. А., F 01 k J. Е., ВiocЫт. et Biophys. Acta,
26, 659 (195З).
11.
260
Селективное расщепление белков
322. Тоеппiеs G., Homiller R. Р., J. Ат. СЬет. Soc., 64, 3054
(1942) .
323. Т r i s t r а т G. R., iп Neurath Н., ВаНеу К., Eds., ТЬе Proteins.
Уоl. 1, Academic Press, New York, 1953, Part А, р. 181.
324, Т и р р у Н., MOhatsh., 84, 996 (1953).
325. Т и р р у Н., В о d о G., Мопаtsh., 85, 1024 (1954).
326. Тирру Н., Michl Н., Monatsh., 84, 1011 (1953F.
327. т u Р Р у Н., Р а 1 е и s S., Acta Chem. Scand., 9, 353 (1955).
328.У а п V и п а k i s Н., Н е r r i о t R. М., Biochim. et Biophys. Acta, .22,
537 (1957).
329. V а п V и n а k i s Н., !"l е r r i о t R. М., Biochiт. et Biophys. Acta, .23,
600 (1957).
330. V е 11 и z L., А m i а r d G., В а r t о s J., G о f f i n е t В., Н е у т е s R.,
ВиН. soc. сЫт. France, 1956, 1464. .
331. V о п Т а v е 1 Р., S i g п е r R., Аdvапсеs iп Protein СЬет., 11, 237
(1956).
332. W а 1 е у S. G., W а t s о n J., Biochem. J., 55, 328 (1953).
333. Waley S. G., Wаtsоп J., Biochem. J., 57, 529 (1954).
334. W а и g h о. Р., J. Ат. СЬет. Soc., 70, 1850 (1948).
335. W а и g h о. Р., Аdvапсеs iп Рrоtеiп СЬет., 9, 325 {1954).
336. W e"i 1 L., Т е 1 k а М., Arch. Вiocbeт. Biophys., 71, 473 (1957).
337, W е i s i g е r J. R., Н а u s т а п n W., С r а i g L. С., J. Ат. СЬет.
Soc., 77, 3123 (1955J.
338. Wh i t е W. Р., J. Ат.'СЬет. Soc., 75,503 (1953).
339. W h i t е W. Р., J. Ат. СЬет. Soc., 75, 4877 (1953).
340. W h i t е W. Р., J. Ат. СЬет. Soc., 77, 4691 (1955)'.
341. W h i t е W. Р., L а n d т а n n W. А., J. Am. СЬет. Soc., 77, 1711
(1955).
342. W i е 1 а п d Т., S с h о n W., Апп.; 593, 157 (1955).
343. W i s е Ь 1 а t t L., W i 1 s о п L., М с С о п n е 11 W. В., Сап. J. СЬет.,
33, 1295 (1955). <
344. W о о d i n А. М., Biochem. J., 63, 576 (1956)'.
345. W у т а '! ., Advances iп Рrotеiп СЬет.. 4, 407 0948).
346. Yamash.ina 1., Acta Chem. Scand., 10; 739 (1956).
ДИСПЕРСИЯ ОПТИЧЕскоrо ВРАЩЕНИЯ
И ИССЛЕДОВАНИЕ СТРОЕНИЯ оРrАНИЧЕСКИХ
СОЕДИНЕНИИ
В. КЛАйН
ВIJЕДЕНИЕ
Целью настоящеrо обзора является изnожеЩfе ОСНОВНЫХ
сведений по вопросу использования для структурных и сте-
реохимяческих исследований вращательной диспеРСИI:I, т. е.
.изменения вращения плоскости поляризации в зависимости
;от длины волны света. Теоретическая сторона этой проблемы
получит лишь беrлое освещение (подробности см. в работах
[138, 174, 178, 187, 210, 161], а также [91, rл. 12], так как в Ha
,стоящее время в этой области более важен эмпирический
подход. Нет сомнения, что в свое времяэм'пирический и CTporo
теоретический подходы к решению этой проблемы будут объ
единены в единое целое, но на современном этапе лучшей по
мощью со стороны исслеДОвателей эмпирическоrо направле-
ния исследователям-теоретикам является накопление разно-
Qбра uъц{ данных, подлежащих последующей обработке и
.обобщеиию.
. .' .Основные принципы,. связывающие оптическо вращение
еществ с их строением, известны уже давно. Вкратце мо-
жно сказать, что для соединения, которое не поrлощает св.ета
в изучаемом диапазоне длин волн, оптическое вращение
обычно возрастает с уменьшением длины волны. I(ривые, ха-
рактеризующие вращательную способность соединений, по-
rлощающих свеТ в изучаемом диапазоне, являются rораздо
болеё сложными и часто имеют один или несколько максиму-
мов и минимумов вблизи полос поrлощения.
Широкое использование измерений дисперсии вращения
плоскости поляризации в структурных исследованиях нача-
лось совсем недавно. Толчком послужило появление доступ-
ной модели фотоэлектрическоrо. спектрополяриметра, долу-
скающеrо быстрое 9предеJiение большоrо количества кривых
дисперсии ВР8!l1,ещ п iJ& 9РОТЦ:Пn. промежуток времени_
Дисперсия оптичеСК020 вращения
приборы
26з
262
Исследователи. работавшие ранее в этой области, испыты,
вали серьезные труДн(jСТИ, связанные с фотоrрафическими из
мерениями. Достаточно вспомнить, что для определения од-
ной кривой дисперсии вращения требовалась примерно трех-
недельная работа. Можно надеяться, чТ(j создание модели
автоматическоrо реrистрирующеrо поляриметра будет способ-
ствовать ДОСТИЖе.нию еще больших успехов в этой области. .
Данный обзор в значительной части посвящен проведен
ноОМУ в самое последнее время комплексу работ [1 31] с целью
выяснения зависимости между дисперсией оптич скоrо враще
ния и строением соединений нескольких cTporo определенных
классов. Более ранние работы рассматриваются менее ПОk
робно по той простой причине, что большие эксперименталь-
ные трудности не позволили сделать широких обобщений.
Однако это ни в коей мере не умаляет заслуr ученых, KOTO
рые провели трудоемкие и тщательные исследования (под
.робt:lblе обзоры этих работ даны Лоури [178], Левеном и POTe
ном II74]).
Изучение наиболее интересных особенностей дисперсион
ных кривых возможно только в том случае, коrда удается
измерить велнчину вращения плоскости поляризации KaKoro
либо соединения в пределах всей полосы поrлощения [160,
162]. Это вполне осуществимо экспериментально, если полоса
поrлощения лежит в доступной части спектра, а коэффициент
экстинкции мал. До настоящеrо времени карбонильная rруп
па (Лманс При 280 300 ммк; .€MaHC 50) является наиболее
удобной поrлощающей rруппой, которая отвечает сформули-
рованным выше требованиям. Соединения, содержащие K
.тонную или аЛЬДеrидную rруппу п(j срседству с асимметриqе
екими центрами (но не в кислотах, сложных эфирах и лак-
тонах), дают Кривые дисперсии вращения с очень резко
выраженными «максимумами» и «минимумами» .(называе-
мыми также «пиками» и «впадинами»).
Новый фотоэлектрический спектрополяриметр Рудольфа
[225] ДО настоящеrо времени широко использовался в струк-
турных исследованиях только одной школой школой про-
фессора Стэнфордскоrо университета К. Джерасси [1 :rl].
По указанным выше соображениям исследования этой- школы
проводились В основном С циклическими кетонами. Автор
данноro обзора пользуется случаем выразить rлубокую при-
знательность проф. Джерасси за личное участие в обсуждении
обзора и ообщени мноrих неопубликованных данных. Дже-
расси опубликовал два обзора с!зщiх работ [11, 90], а в 1959 r.
!3ыпустил моноrрафи [91].
Совершенно ясно; что в случае поrлощающих соединений
положение и интенсивность максимумов и минимумов будет
иметь несравненно большее значение для структурных иссле
дований, чем данные «монохроматических» определений
(обычно для D линии натри. ), которыми пользовались рань-
ше. Эти данные обобщены в ряде обзоров [154, 156, 191]. Для
соединений, не поrлощающих свет, картина не столь ясна.
Возможно, JlТO форма кривых или отношение величин опти-
ческоrо вращения при двух длинах волн ([<рЫ[<РЫ 1) и даже
одно значение вращательной способности для какой-либо дли-
ны волны, кроме D линии натрия, MorYT оказаться более важ-
ными для, структурных исследований, чем классическая
величина [<р]п.. Однако до проведения более широких исследо-
ваний непоrлощающих соединений окончательный вывод по
этому вопросу сдецать нельзя.
Йз за недостатка места в данном обзоре не рассматри
ваются вопросы дисперсии вращения Бысокомолекуляр-
HblX соединений. в том числе белков (см. [107, 108, 136, 149,
196.199], особенно [251]; см. также [91, rл. 17]).
ПРИБОРЫ
Классические методы
Почти все приборы, которыми пользовались до 1950 r.
для определения вращательной дисперсии, были сложны по
конструкции, причем требовалась трудоемкая работа по фо
тоrраФИР9ванию и фотом трированию спектров. Кроме TOro,
приборов почТи не было в продаже, поэтому неудивительно,
что работы в этой области были выполнены только теми спе-
циалистами, которые сами изrотовили для себя приборы. Если
бы даже ранние модели спектрополяриметров оказались бо
лее доступными, их все равно нельзя было бы применнть
в структурных и аналитических работах, так как для снятия
только одной кривой дисперсии вращения потребовалось
бы слишком MHoro времени.
Различные модели таких приборов, использовавшихся в
классических исследованиях, подробно описаны в обзорах
Хеллера [127] и Лоури [178], а ссылки на основнЫе работы и
оборудование можно найти в статьях Куна иЛевена [159],
Лоури [181] и Харrривса tI20].
1) В настоящее вреМя Для обозначения молекулярноrо вращения преД-
ПОЧИ1'ают пользоваться величииой [(j1], а не (М].
Дисперсия ОnТuческоzо враЩенил
Приборы
265
264
Современные спектрополяриметры
Рудольф [225] ввел в практику в 1955 r. фотоэлектрический
спеКl'РОПО,JIяриметр, который представляет собой обычный
п()ляриметр выс()кОй точности (с кварцевой оптикой), в KOTO
ром вместо натриевой лампы использован монохроматор
источник света с различными длинами волн, а уrол враще-
нИя плоскости поляризации определяется не визуально, а с
ПОМОщью фотоэлемента и фотоумножителя. Подобный спек-
трополяриметр позволил Джерасси с сотрудниками за шесть
л'ет снять кривые диспеРСIШ вращения более чем 2000 со-
единенйй, что, вероц,тно, превышает кo.1Iичество дисперсион,
ных кривых, полученных До Hero за всю историю поляримет-
рии. В настоящее время в употреблении находятся более
50 фотоэлектрических спектрополяриметров. "
Р зрабатываются приборы с усовершенствованной ОПти-
ческой схемой и автоматическими реrиетрирующими устрой.
ствами (см. следующий раздел), но, какими бы преимущест-
вами ни обладали подобные при боры, честь создания первоrо
спектрополяриметра, приrодноrо для повседневноrо примене-
ния химиком-орrаником в .лабораторных исследованиях, при-
надлежит проф. Брандту (Колумбийский универсщет) и фир-
ме «Рудольф» [64]. .
Приведенное ниже ОПисание конструктивных. особенностей
фотuэлектрическоrо СПектрополяриметра Рудольфа и порядка
рцботы с ним заимствовано в основном из статьи Джерасси
[1]. Фотоэлектрический спектрополяриметр Рудольфа модель
200S-80, состоит из четыIехx OCI;IOBHblX частей: ВЫООкоточноrо
поляриметра Рудольфа с круrоiюй шкалой (модель 80), квар-
цевоr;о монохроматора Бекмана, источников тока и фотоумно-
жительноrо фотометра фото волы (м'i:щель 520-М) с фото-
у.множителем для ультрафиолетовой области (RCA IP28).
Джерасси использовал в качестве источников света цирко-
ниевуюлампу Сильвания K 100 с концентрированной дуrо
и стеклянным кожухом (для области 700 300 ММ") и ксено-
flOВУЮ дуroвую лампу fановия 10-С-l мощностью .150 вт, ко-
тораяработала от спецйаЛqноrо истqчника постоянноf'О тока
"(для области нище 300 ММ"> '
, С,нятце'" J{рИВЫХ дисперсии вращенця может быть зна
чительно ускорено, если ИСПО,JIьзовать осцилляционный поля.
ризатор Рудольфа N2 200А [226]. Опытный исследователь Б
настоящее время снимает подобную кривую за 1/2 1 час.
Использовалась поляриметрическая трубка с заливкои
через центра.лъНQе отверстие и..с окнами .из пл,авленоrо квар-
11,а, закрепленными на цеМенте (д./шна,трубки 10 мм, ем.
кость < 2 .мл). I(онцентрация растворов оБЫЧЩI составляет_
1 или 0,1 %, а в слунае сильно поrлощающих соединений еще
меньше. .
Показания для каждой точки снимаютс J.]:важды, причем
обычно методом симметричных уrлов холостые показания
прибора с наполненной чистым растворителем трубкой сни-
маются ежедневно. В качестве растворителей при работе с
алицИШlическими кетонами при меняют обычно меt.анол и ди-
оксаН и реже хлороформ, Этанол и октан.
Прn исследовании со динений, не поrлощающих свет с
длиной волны более 400 ММК, измерения удобно проводить при
следующих длинах волн: 700, 650, 620, 589 (D-линия натрия),
550, 520 400 (через интервалы в 20 ММК) И 400 250 ММК (че-
рез интервалы в 5 или 10 .ммК). В области пиков и впадин
отсчеты надлеЖИТ производить через nнтервалы не больше
2,5 ММК.
Два отсчета ОДноrо"и TOro же показания прибора должны,
как правило, совпадать с точностью дО ::!:0,002 Q , за исключе-
:Иием области .более коротких волн. В. этой области наблю-
lI: 1.I0'rcjJ большие отклонения, поэтому следует производить
более двух отсчетов.' ДаННblе, полученные при ОJ1ределении
оптической активности двух растворов, 'приr.oтовленных из
одното и тoro же образца, должны СОВШl.Дать .с.точност ю не
меньше 3% (только. в случаесилъно разбавлецныI:x растворов
допускаются расхождения до 10%).
В лаборатории автора недавно был установлен поляри-
метр Рудольфа с монохроматором Уинкам SP50.0 вместо мо-
нохромаТ'рра:Бекмана и с ксеНОltОВОЙ. ла пой Сименса мощ-
HOCTbIQ.37S-вt в качестве источника света.
, . C yeT' также друrой тип прибора спектроnоляри-
. .метр к:естона фирмы «Стандард поляримеТр». Этот прибор,
fЮ-виJ(И-мому, 'Может. работать только в области 400 700 мм"
и"1iоэтому'находит лишь Qrраниченное применение для струк-
,турных исследований. Он МОЖет использоваться в качестве
приставки к спектрофотомеtру Бекмана (модель DU).
Приборы, находящиеся,в стадии разработки
и усовершенствования
Ниже дается лишь краткое 'описание приборов, предназна-
ченных для измерения- вр'ащения плоскости поляризации,.так
как мноrие из этих приборов существуют пока в виде моде-
лей или опытных образцов. Все приборы подразделяются на
три rруппы.
2б6
Дисперсия оnтическоzо вращения
Результаты
267
. 1.. . Приборы с механическим движением одноrо из компо
нентов оптической системы. В двух автом тических реrистри
рующих поляриметрах использован принцип механическою
вращения поляризатора или анализатора. В реrистрирующем
спектрополяриметре Рудольфа для J5;омпенсации оптической
активности образца враuцзется поляризатор, и уrол поворота
поляризатора реrистрируется механическим путем как функ-
ция длины волны. В приборе Уникам (основан на том же
принципе, что и прибор фирмы fлаксо, см. ниже) для ком-
пенсации оптической активности происходит враlЦение одной
призмы Волластона.
лучеЙ с плоскостью поляризации +8 и e) или «В простран
стве» (при пропускании лучей через два одинаковых об .
разца). . .
к приборам, основанным на первом принципе, относятся
приборы Бюрера, Колера и fюнтарда ([71]; Цюрих), а также
Фордайса, Паркера и fрина [109]; на втором принuипе рабо-
тают поляриметр фирмы «Перкин ЭЛ мер» [227] и пр и бор
Волдбая [247].
РЕЗУЛЬТАТЫ
2. Приборы, использующие для компенсации оптической
активности образца эффект Фарадея. В поляриметрах не-
скольких типов для компенсации враuцения плоскости поля-
ризации образцом используется кювета Фарадея, в . которой
электромаrнитное поле вызьrnает одинаковое по абсолютной
величине и Qбратное по знаку вращение плоскости полйриза-
пии. Необходимый для этоrо ток связан с уrлом враlЦения
плоскости полярйзации исследуемым веществом. Подобные
приборы описаны rилхэмом [115], fейтсом [112], fросджином
и сотр. [118]. К ним относятся поляриметры, намеченные к вы-
пуску фирмами Кэри и Цейсса, а также реrистрирующий по
ляриметр, разрабатываемый в Национальной физической ла-
боратории fейтсом и I(инrом.
3. Приборы, основанные на принципе симметричных уrлов
(различие в интенсивности двух лучей, поляризованных в раз-
личных плоскостях). Если два луча, поляризованные в раз-
личных плоскостях (уrлы :!: е к нул вой плоскости), ПрQnУ-
стить через оптически неактивное BelЦecTBo, а затем через
анализатор, установленный в ну.левой плоскости, то интен-
сивности обоих лучей будут одинаковы. Если же вместо опти-
чески неаКТИ8ноrо BelЦecTBa использовать оптически активное
вещество, то плоскости колебания прошедших через этот об-
разец поляризованных лучей будут (+ е + а.) и (+ е а.).
После пропускания этих лучей через анализатор в нулевой
плоскости интенсивности лучей не будут равны. Отношение
интенсивностей подобных лучей зависит от а. оптич скоrо
вращения образца. Таким образом, измерение сводится к оп-
ределению отношения двух токов, возникающих при попада-
нии двух лучей света на фотоэлемент. Несколько новейших
моделей' поляриметров основаны на этом принципе измере-
ния, причем оба луча MorYT быть разделены «во временй»
(при попеременном пропускании через исследуе ый образеu
Классификация кривых
Кривые дисперсии врищения с ;;pocт ы.м и сложным эффе"mа.ми
Коттона
Для мноrиХ соединений, которые не поrлощают свет в диа-
пазоне измеряемых длин волн, зависимостJ:, между [а.] и 'л BЫ
ражается простым уравнением
(а) == А о j(л 2 ),
rде Ао и 'Ло константы для данноrо соединения. Подоб-
ное выражение называется lJ.Ho,!,,!eH':IblM. у н нием р.руде,
+1/0
са
'е
...
О
.
. \
\
+20 \
,
'"
'" r;:
'....
А ................______
400 500 . _Шl1L.
. .,
............
,.....,. в
/'
-20/'
300
Л,ММК
Рис. 1. Плавные кривые.
А 5а-холестан-З -ол (11) в диоксане; Б метил-З[:l-окси--5а-этиаиат
в метаноле; В 5 спиростан (ХХ) в диоксане.
а .дисцерсия вращения простой [178]. Из уравнения следует,
что rрафически зависимость [а.] от 'л выражается плавной кри-
вой, и [а) возрастает при уменьшении 'л (рис. 1).
268
Дисперсия ОnТичеСICО20 враЩения
Результаты
269
в друrих случаях зав сим() ть [а.] от 'А выражается более
сложным уравнением
[а] == AoJ(}? A ) + A 1 /(A 2 A ) + ... ,
. Друrая интерпретация КрИВЫХ дисперсии вращения дана
Янrом и Дот и [251], а также rеллером [128].
Нормальные и аномальные "ри8ые дисперсии 8ращения
Для классификации КРИВЫХ дисперсии вращения предло
жены два ДОПQЛнительных термина «нормальные» и «aHO
Jylальные» кривые. Нормальная кривая характеризуется OT
сутствием максимума (или минимума), нулевоrо значения и
точки переrиба; аномальная же кривая имеет одну или He
сколько указанных особенностей [178]. Следует подчеркнуть,
что термины «нормальная» и «плавная» кривые не являются
синонимами, и в понятие нормальной кривой входит плавная
кривая. Точно так же не идентичны термины «аномальная» и
«сложная» кривые. Термин сложная кривая шире и ВJ5:лючает
в себя понятие аномальной кривой.
I(лассическим примеР9М связи между максимумом поrло
щения и ходом кривой дисперсии вращения, изученным Ky
ном.и [ором [166], является камфора (1) (рис. 2).
которое называется двухчленным, трехчленным или MHoro
ч;пенuым уравнением Друде; [а.] как функция 'А изображается
+3200
+1600
.......
IЩJI)
!
3200
16
ш
о ".
<;1-\
,
LjЭ.
"
1
(+) Камфора
. 'Sмn'uрWlесiIOЯ "лuссифu"ация "ри8ЫХ и номен"лаmура.
исnо.il.ЬЗО(lавшаяся 8 риботах nоследнеzо времени 1 )
МНQ.rие из эксш;ри ентальных кривых дисперсии враще-
ния, полученных в проведенныx в университете I.llTaTa Уэйн
Щ JLедов.Зf.ЩЯХ [3], c трудом поддавались математической об
р .БО1'1{е, П-О той причине в последнее время основные усилия
БЬ1ЛИ,наqравлены на эмпирические исследования формы кри
BЫ . ито п.реДСТ2вляет большую ценность для изучения про"
б!lеr.i строения и стереОХИМJj:И, Учитывая это, мы сознательно,
ЗБ
110
114
118
Рис. 2, ПОl'лощение и молекуляриое вращение камфоры (1)
в I'ексане [166].
О 1II0llекулярное вращенне 1'1'1; . КО9ффнцнент молекулярной вкстннкцнн .,
кривой сложной. формы, которая. может иМеть максимумы,
минимумы и переrибы. Такая .кривая дисперсии вращения на-
зываете$! . сложной;' причем максимумы и минимумы кривой
часТО .. соотве'rСТВУЮТ д.fIинам ВОЛН, при KOToпP . .ение
максимально.
- '.}-
1) Данный раздел почти полностью заимствован из статьи Джерас
си п Клайна [96] с разрешения Комитета публикации Химическоrо об"
. eqBa., Некоторые изменеJJИЯ .были внесены в соответствии с преДJJоже'
ЩIЯ-МН; ,которые Находятся На рассмотрении Комиссии по молекулярноii
спектроскопии МСЧПХ,
lluсnерсия оnтичеСКО20 враUfения
\
\
Результаты
271
270
остановили свой выбор на ряде новых терминов, ПQЗВОЛЯЮЩИХ
описать характер кривых, не воспроизводя их rрафически.
Если в дальнеишем удастся осуществить математический
а.нализ кривых поrлощения, то, возможно, появится и друrая,
Оолее точная терминолоrия. .
На современном уровне наших знаний необходимо рас-
смотреть три типа кривых дисперсии вращения (сокращенно
кривые ДВ), каждый из которых существует в двух антипод-
ных (энантиомерных, или зеркальных) формах (рис. 1,4 и 9).
В каждой статье" (или серии статей), посвященной рас-
сматриваемой проблеме, надлежит указывать, через какой
интервал длин волн производились отсчеты [2] и какова Be
личина вероятНОй ошибки [8, сноска 34]. В нача3lе экспери
ментальноrо раздела следует также указывать растворитель,
концентрацию раствора и температуру, при которой произво
дились измерения.
волн, обычно через интервалы в 100 ммк. Следует также ука-
зывать растворитель и концентрацию, если это не было сде-"
лано в ВВОДноЙ части.
При м ер 1. 5а Холестан-3 -ол (11) [3], кривая ДВ в ди-
оксане (с 1.0), 23 250; положительная плавная кривая:
[а]700 + 17°, [а]589 + 24°, [а]290 + 130°1).
11
50 Холестан 3 -ол
111
5a X0.1ecтaH'3.0H
IV
Холест.4'ен.3 он
Плавные кривые (рис. 1). Кривые первоrо типа не имеют
ни u мак имумов, ни минимумов 1) И характерны для соедин
нии, которые в изучаемом диапазоне длин волн не имеют
оптически активных полос поrлощения. Название «плавная»
кривая предложено независимо от Toro, может ли такая кри-
вая быть описана о.дночленным уравнением Друде. В настоя-
щее вреМЯ основная ценность этих кривых заключается в ТОМ
что они соответствуют соединениям (бесцветным), оптическо
вращение которых в УФ области всеrда больше, чем враще-
ние для D линии натрия. Поэтому сравнение соединений с ма-
лым [a]D лучше проводить в области более коротких длин
волн, которые МОЖl!О выбрать по кривой дисперсии. Плавные
кривые дисперсии MorYT быть названь! положительными или
отрицательными в. зависимости от Toro, поднимаются они или
падают- с уменьшением длины волны. Эти кривые удается
точно описать, не прибеrая к 'rрафикам, пользуясь терминами
удельное [а] или молекулярное ['1>] оптическое вращение при
следующих длинах волн: 1) при максимальной длиНе волны
при которой произведено измерение, обычно 700 ммк; 2) пр
589 .ммк (D-линия натрия), как почти во всех прежних опре
делениях зависимости между оптическим вращением и CTPYK
турой И .3) при минимальной длине волны, при которой про-
IJзведено измерение. В случае необходимости MorYT быть YKa
заны величины оптическоrо ВР2щения при друrих длинах
Кривые с простым эффектом Коттона. Для структурных и
. стереохимич:еских исследований наибольший' интерес предста
вляют аномальные кривые дисперсии вращения, для которых
характерны два типа (см. рис. 4 и 9). На рис. 4 показаны
типичные кривые с простым эффектом Коттона [84]. Каждая
такая кривая имеет один rеометрический «максимум» И один
rеометрический «минимум». Участок кривой, включающий
максимум и минимум, более или менее точно совпадает с по-
лосой поrлощения. Кривую называют кривой с положитель-
ным или отрицательным эффектом Коттона в зависимостИ
'ОТ Toro, находится ли участок кривой в начале волны при
движении в сторону более коротких длин волн над иЛИ под
осью абсцисс. Чтобы термины максимум и минимум кривой
дисперсии вращения не спутать с максимумами и миниМу-
мами поrлощения в видимой и ультрафиолетовой областях
спектра, целесообразно пользоваться терминами пик и впа-
дина.
Прелоr и Хейльброннер предложили немецкие эквиваленты
(Gipfel, Tal) терминов пик и впадина, а Уриссон француз-
ские (sommet, creux). Расстояние по вертикали между пиком
и впадиной (а на рис. 4) называется амплитудой волны.
При описании кривой с простым эффектом I(оттона сле-
дует указывать величины оптическоrо вращения при макси-
мальной длине волны (например 700 ММ1\:) , 589 ММ1\: и при
1) Или ТОЛЬко широкий максимум или минимум, не связзнны" с по-
лосо" поrлощения. Некоторые кривые пересекают ось нулевоrо вращения.
т. е. меияют знак
. 1) В США длина волны обычно указыва'ется нижним индексом, в то
время каК в Анrлии длину волны принято указывать в скобках обычным
курсивом. 8 температуру верхним индексом, например, [a]
(700 ммк) + 17°, (589) + 24°, (290) + 130° (см. [255]).
272
Дисперсия оптическоео еращения
Результаты
273
/
минимальной ДЛИНе волны, при которой про изведены измере-
ния. Кроме тон>, необходимо приводить величины вращения,
соответствующие кащдому заметному изменению направления
кривой, т. е. пику, впадине и менее важным участкамкри
вой плечу и переrи'бу. Все величины' оптическоrо вращения
надлежит располаrать в порядке уменьшения длины волны.
При м ер 2. 5а.-Холестан-3 он (111) [5], кривая ДВ в M Ta
.ноле (с 0,1), 29 310; [а.]700 + 37°, [а.]589 + 55°, [а.JэО7 + 959°;
[a.]207 7400, [a.]245 3620 (кривая А на рис.А).
. Следует подчеркнуть, что приведенные данные не YKa
зывают, через какие интервалы длин волн производились OT
счеты О].
По мнению автора данноrо обзора, настало. время исп'ОЛЬ .
-зовать для кривых дисперсии J;!ращения величины. молекуляр-
Horo вращения ['1>], вырщкаемоrо уравнением
!Ф] == [а] Х мол. весПОО.
Кривые со сложным эффектом 'Коттона. Третий тип кри
вых дисперсии вращения. усложнен в области поr лощения тем,
что имеет не меньше двух пиков и соответствующее число
впадин: Такие кривые называются кривыми со слОЖным эф
.фектом Коттона (см. рис. 9). Классическим примером может
служить кривая оптическоrо вращения октилнитрита, изучен
ная Куном и сотр. [167]. В некоторых случаях при опис.ании
кривой необходимо отметить широкие пики и впадины, а TaK
'Же. плечи и 'переrибы, как это сделано в привОдимом ниже
примере.
При м е р 3. Холест-4-ен-3 он (IV) [8]; кривая ДВ в диок
сане (сl,О), 29 31 о; [аЪОО + 53°, [а.]589 + 73°; [а.]G,25 ИО + 145°
(широкий пик), [а.Jз66 93°, [а.]З59 51 о, [а.]З52 1640, [а.Jз40 3З7 +
+ 265° (плечо), [а.]З25 + 1000° (переrиб), [а.]З11 + 1480° (пер'е
'rиб), [а.]275 + 21'00°.
. . ЭJ<СТР МУМЫ. В связи С необходимостью ввести термин,
.объединяющий понятия пика и впаДИНЬJ, МоФФитом был пред
ложей-термин «экстремум». Иноrда возникает необходимость
.в обозначении пика или впадины, появляЮiцихся на Щ:ШННО-
ВОЛНОвой стороне области эффекта I(оттона, например пика
или впадины при 310 ммк в случае насыщенноrо кетона; для
подобн.ых случаев предложен термин «первый экстремум».
Это позволит количественно сравнивать родственные соеди
нения и использовать метод инкрементов дл'я кривых диспер-
сии вращеIЩЯ [97, 155]. ПО этой причине все цифровыIe дан-
ные и кр.ивые, приведенные в настояЩем обзоре (за немно-
rими исключениями), относятся к ['1>], а не k [а.]. В настоящее
время символ [ер], предложенный Моффитом, чаще ИСПОJJЬ
зуется для обозначения молекулярноrо вращения, чем [М].
Друzие .методы zрафическ-оzо изображения данных
В классических йсследованиях дйсперсии вращения БЬ!Jl
использован ряд методов rрафическоrо ИЗ(jбраженйя данных
для проверки возможности их выражения уравнением. В об
ласти пропусканиян:аиболее ценным для структурных нссле-
дований, по-видимому, является выражение обратной 8елu
I1:UHbl вращения' l/[ер] как фуtIКции KBaдpaT длины волны 'А2.
Соединения, которые во всей изученной области спектра ИЛИ
в ее части описываются одночленным уравнением Друде, дают
прямые линии на rрафике в координатах 1/[ер] 'А2 (примеры
и более подробное рассмотрение приведеfIЫ в работе [178]).
_ . янr Доти [251] в последнее время предпО>lfflЛИ выражать
л 2 [ер] как функцию [ер], что также дает прЯМУЮJlИНИЮ для 'co
единений".<ПОДЧИНЯЮЩИХСЯ одночленному уравнению Друде.
По этоfvlУ вопросу см. та.кЖе работу rеллер'а;11281:'
Использование "ривых .моле"улярной диcn pcии вращения
Почти все данные, приведеннЫе в статьях Джера.сси и
сотрудников, представляют собой величины удельною 8раще
НUЯ. Как отметил профессор Джерасси (частное сообщение),
это было сделано с целью подчеркнуть, что величины [а.] в об-
ласти поrлол(ения очень велики по сравнению снебольшими
величинами удельноrо вращения [a.]D, с которыми привыкли
имеТJ:> дело химики орrанИIЩ,
фор.мулы. и оБQзначения.
. При отсутствии особых oroBopoK все формулы изображают
установленную абсолютную конфиrурацию'. Формулы ацикли
ческих соединений даны в ВИДе проекций по Фишеру (в Ha
стоящее время известно, что эти проекции правильно пере-
дают абсолютную конфиrурацию), например, формула V для
d rли.цериновоrо аЛЬДеrида.
СНа
I
I
H C......-{)H
. I
СН 2 ОН
V
оФ
н
VI
от
н
VII = EVJ
18 3&к. \'fl!>
274
" Дисперсия оnтическоео вращения
Таблица J
Перечень классических работ по дисперсии вращения
Формулы циклнческих соединений J.l,aHbl в соответствИи
с правилами изображения стероидов (принятые обозначения
также являются прави.rIЬНЫМИ и отображают абсолютную кон-
фиrурацию), например, VI для метилдекалоиа, от KOToporo
может быть произведен 5а-холестан-3 он (111). Связи над И
ПОД плоскостью .бумаrи . обозначены жирными и пунктирны.ми
линиями соответственно.
Соединение или класс соединеиий
Литературные ссылки
Лоури J178J, I Левен I
и Ротен 11741, ориrинальные
стр. стр: работы
1805 1807 142, 173
127
122
182 1828 172
265 266 142
265 267; 1805 1807
146
130 18!O 1811 120, 162
1805
181O 1811 162
12 129
26 266 18Ю 1811 44, 104, 114,
121, 147, 162 .
37, 38, 45
34:, 46, 145
1813 53, 54'З), 141
263, 267 1806 46
18 1822 133, 171
119
144, 207
179
111
128
184
Уrлеводороды насыщенные
уrлеводородыI ненасыщенные
Уrлеводороды ароматические, He
планарные .......
rалоrенопроизводные 1) (см. также
етр. 282)
Спирты первичные (RR'СНСН20Н)
Спнрты вторичные 2)
Общие данные
[ептаиол-2
Октаиол 2
Октанол 4
l{иклоrексилметилкарбинол
Ментол и друrие спирты Tep
пеиовоrо ряда
Алкиларилкарбинолы н род-
ственные спирты
Энантиомеры. Для облеrчения сравнения в дальней-
шем часто будут применяться такие обороты речи, как «А По-
казал, что кривая дисперсии вращения соединения (+)-х
была...», ?,отя в действительности А изучал не соединение
( + ) x, а ero ( ] -энантиомер, и знаки всех величин оптиче-
cKoro вращения были изменены на обратные.
Для обозначения энантиомера какоrо-либо соединения
используется буква Е; например, соединение VII можно обо-
значить как EVI.
Классические исследования
До введения в лабораторную практику фотоэлектрических
спектрополяриметров кривые дисперсии вращения мноrих
орrанических соединений самых разнообразных типов опреде-
лялись с помощью поляриметров старых моделей. Значи-
тельная часть классических исследований в Этой области
. включена в моноrрафию Лоури [178], а также в обзор Левена
и Ротена [174] (СМ. также материалы двух симпозиумов Фа-
радеевскоrо общества -[239, 240J). В связи с эксперименталь-
ными трудностями, обусловленными несовершенством первых
моделей при боров, один исследователь в течение rода Mor
изучить очень небольшое число соеди"'нений. По этой причине
на раннем этапе ДИСПерсию оптическоrо вращения изучали
rлавным образом фиЗи'lю химики. Они использовали в своих
исследованиях Bcero несколько соединений и на них устанав-
ливали основные закономерности дисперсии вращения. При
всей ва»сности этих исследований для разработки и проверки
теоретических основ рассматриваемой проблемы, по мнению
автора, они не привели к результатам, которые представляли
бы интерес для структурных и стереохимических исслеДО-
ваний.
В частности, попытки связать одночленНое и двухчленное
уравнения Друде с экспериментальными даIiНЫМQ не всеrда
оказывались успешными. Во мноrих ранних работах было
установлено, что одночленное уравнение справедливо для ви-
димой оБЛ{lСТI1 слектра 1 .но последующие исследованця в
fетероц.иклнческие спирты аро-
матическоrо характера
Различные спирты
Спирты ненасыщенные
Эфиры простые (в том числе бен-
зиловые) ............
Альдеrнды 1) (см. также стр. 287)
2-Метилбутаналь н 3 метилпен,
таналь
Цитронеллаnь
КеН}RЫ 1)
Алифатические
Ацетонн .
З-Метилциклоrексанон
.пулеrои, карвон
Ментон, карвоментои
18.
Продолжение табл. J
Литературные ссылки
Продолжение табл. 1
Соединение или к.пасс соединений
Соединение или класс соединений
Кетоны
Камфора и ее производные .
Метиленкамфора
Оксиметиленк мфора
ОJ<симетиленкамфора,
ческие ПРОИ3ВОдНые
Камфорхинон
металли
Сантониды .
J{ибеизилиденметилuиклоrексан
оны . .'
Кислоты и их сложные эфиры (В I
том числе 2 метилбутановой и
3 метилпентановой кислот)
Фенилзамещенные 1,11)
(С 4 Н 9 ) (СН з )С 6 Н 5 ССООН 4)
J{икарбоновые кислоты
[алоrенозамещенные карбоновые
кислоты (в частности а rалоrено
пропионовые кислоты, сложные
эфиры и диметнламиды)
Оксикислоты И их производные
Молочная кислота
Яблочная кислота
Винная кислота (В том числе
, ее боратные комплексы)
Литер,атурные Сi:ЫЛКJf
. I ....
. Левен
Лоури 1178), и Ротеи . 1174), I орнrьнальные
стр. стр. .. работы
12 129,
141, 146,
305------J 12,
405 07
128
119
156
134 135,
145, 156,
3Q9.......-31O
26 268
269,
439 440
298 301
295 298
108,
13 140,
. 144,
286 29.3
1814 1817,
181 g........ 1820
1817 1819
183 1840
166, 230
118
Оксикислоты И их производные
Металлические производные 9)
Миндальиая кислота, ПрО Н3ВО k
ные 1,10)
Тиокислоты
Амины
(С 4 Н 9 ) (СН з ) (C 6 H 5 )CNH 2
Аминоксид
Аминокислоты (см. стр. 279 28l)
195, 249
Медиые производные (см. стр. 336
338)
Шиффовы основания
(С 6 Н 5 СН NCHRR')
Пеnтиды
KcaHToreнaTbl и друrие производные
тиоуrольной кислоты 1) (см. также
стр. 287 288)
205, 206
170 5)
142 146 1)
39, 40, 173,
204,208
39
Азиды .. .
Азиды карбоновых кислот 1.11)
(см. также СТР. 282)
а Азидопропионовая кислота и
ее производные 12)
232
163'---165
Карбоксисульфокислоты
Нитриты 1) (см. также стр. 285, 287)
Нитриты октанола 2 и HOHaH
oJl<l 3
139
162 1 {
124, 2488)
Нитриты циклоrексил и фенил
метилкарбинолов
Нитрозиtы
Динитрока мфен
I Левен I .
Лоури (178), и Ротен (174), Ориrинзльные
стр. стр. работы
154-------156
269
318 325,
398, 401,
403. 445,
447
269, 397,
434, 439
269
145,
441........444
157 158
1819 1820
1831 1834
1822 1823
1829 1831
1831 1834
181O 1811
181O 1811
39
110
64, 125, 140,
162 1)
245
57, 203
64
183, 241
173
164
167, 162 1З )
162
192, 193 14)
194
Результаты
279
п родОЛЖf/ние табл. J
Соединение или класс соединений
JlитераТУРИl>lе ссылки
у.'Iьтрафиолетовой области показали, что для описания на-.
блюдаемых явлений необходимо использовать более сложное
уравнение. Иноrда константы (1.0, 1.1, 1.2), найденные для ypaB
нений Друде. были тесно связаны с максимумами поrлощения
функциональных' rрупп исследуемоrо соединения, в друrих же
случаях таtt:ая связь отсутствовала.
По указанным выше соображениям в данный, обзор не
включены подробные данные о кривых дисперсии вращения
непоrлощающих соединений, полученные в ранних исследо-
ваниях. В табл. 1 приведены изученные соединения и классы
соединений, а также ссылки на моноrрафию Лоури, обзор Ле
вена и Ротена и наиболее важные или выполненные в по-
следнее время ориrинальные работы. Нет сомнения в том,
что через несколько лет, коrда современные быстрые методы
позволят накопить значительно более полНые данные по He
поrлощающим соединениям, эти первые работы в рассматри-
ваемой области получат должную оцеI:IКУ.
Опубликованные в последнее время работы по плавным
кривым дисперсии вращения содержат данные об арилалкиль
ных соединениях типа VIIa [186] и VIIб [185] (некоторые из
этих соединений проявляют эффект Коттона) , монооксисте-.
роидам и их сложным эфирам [137].
В числе проводимых в лаборатории автора работ следует
указать исследования лиrнанов (совместно с Эрдтманом,
Стокrольм), а также. уреидоаминокислот и сульфоксидов (со-
вместно с Кьером, Копенrаrен).
I евеи I
Лоури 1178], и Ротеиl174], ориrинальиые
стр. стр. работ!>!
') См. также табл. 2.
') ВО миоrих работах описаиы сложиые эфиры.
.) В этих работах дается описаиие фотоспектрополяриметра. который сконструп
рован, по-виднмому. иа основаиии схемы прибора Коттона 11 Дешама 185]. .
') Четвертичное соединение.
5) Рассмотреио влияиие расстояиия rруппы COOH от аСИ1llметрическоrо центра.
") Полоса поrлощении при 260 .м.м" неактиВИа (в отличие от полосы поrлощев1lя
. .!lтиловоrо эфира м.иидальной кнслоты).
1) Сравиение алаИИиа и МОЛОЧИОЙ кислоты.
В) Проблемы, связанные со сложным характером ..l).исперсии вращеиия. paCCMO
трены Лоури 1178, стр. 291 29З]. .
") Включена орнrННaJlьиая работа 1(оттоиа с калиевохромовоЙ солью вииной
кислоты (84).
,О) Полоса поrлощеиия при 260 .м.м" активиа.
11) Полоса поrлощения при 288 .м.м" неактивиа.
'2) Полоса поrлощения при 288 .м.м" активна.
1.) В этой статье приводится детальный анализ данных.
") Следует отметить влияние температуры.
Нитрокамфора, .металлические про-
из водные . . . . . . . . .
Уrлеводы 1) (см. также стр. 282)
Альдеrидосахара
rалактоновая кислота и лактон
Сахароза .....
Аsофенилrлюкоsиды
Нитрилы и тиокетали
Адеиозин и ero. производиые
rет роциклические соединеНИя
О-Производные яблочной 1I
винной кислот .....
поксисоединения . . . . .
Никотин и ero производные
ТетрапирролидиНЫ (пиrменты
желчи) . . . . . .
Цитохром С (аснмметрический
атом Ре) . . . . . . . . .
Спиран (4-метилциклоrексилиден-
уксусная кнслота)
Непланарные ароматические уrле-
водороды ........
Кобальтовые комплексы этилен-
Диамина ..........
Сульфоксиды И сульфилимины
156
lз.з..........I34.
283 285
281 282
131,
279-----280
42, 133
61
42
169
290, 297
46, 123
329 333
117
102
334
ArCHRCHOHR'
VПа
ArCH (NH 2 ) R
VПб
122
188
132
в обзор помимо работ школы Джерасси. включены для
полноты ссылки на несистематические работы в области спек-
трополяриметрии. .
Единственным классом соединений, дающих плавные кри-
вые, достаточно изученным для использования кривых при
стереохимических исследованиях, является класс а. амино
кислот.
Амино"ислоты
Паттерсон и Броуд [211] в результате исследования ряда
природных аминокислот при 660 440 ММ" устанопили неко-
торые общие положения, которые MorYT быть использованы
для установления конфиrурации. rринстейн и сотр. [134, 135,
209] продолжили эти исследования и ИЗУЧИJIИ оптическое Bpa
щение 42 l аминокислот р диапазоне длин волн 589' 365 мм'\,
280
Дисперсия оптического вращения
Изученные /-аминокислоты можно подразделить на три
группы, каждой из которых соответствует кривая на рис, 3
(по Паттерсону и Броуду [211]) в координатах ЛДф] —ЯЛ
Кривая А (хлоргидрат 2-лейцина) является типичной
нормальной положительной кривой дисперсии вращения, которая
пересекает ось абсцисс сверху B00 ммк)К Большинство
неароматических /-аминокислот и их солей дают аналогичные
кривые. Кривая Б [/-лейцин (VIII) в воде] представляет собой
нормальную отрицательную кривую дисперсии вращения,
которая пересекает ось абсцисс снизу1) A60 ммкJ. Такие
кривые характерны примерно для 10 аминокислот и оксиамино-
кислот из числа исследованных соединений. Кривая В
представляет собой аномальную кривую дисперсии вращения
[/-фенилаланин (IX) в растворе едкого натра]; вращение
изменяется от отрицательной величины до положительной при
уменьшении длины волны. Подобная картина наблюдается
в случае некоторых ароматических аминокислот.
СООН
'2— С— Н
I
CH2CH(CHjJ
VIII
/ - Лейцин
СООН
NH2—с—Н
СН2С0Н5
IX
I- Фенилаланин
СООН
l-fa— С-и
н—с—он
СН3
X
/-Треонин
Кривые дисперсии вращения cf-аминокислот представляют
собой зеркальное изображение кривых, приведенных на рис. 3;
поэтому по виду кривой дисперсии вращения какой-либо
неизвестной кислоты ей можно приписать /- или cf-конфигу-
рацию.
Гринстейн справедливо отметил [209], что «значениям Яо
вряд ли можно приписать какой-то определенный физический
смысл, если экспериментальные данные получены для длин
волн, сравнительно далеких от области поглощения, но тем
не менее представляет интерес проследить
закономерности изменения этой величины».
Кроме того, Гринстейн и сотр. [209] изучили влияние
а-центров в аминокислотах с двумя асимметрическими це"н-
трами (например, в соединении X).
') Гринстейн в качестве верхнего предела длин волн для
исследования аминокислот группы Б предлагает 200 мкк; однако только для
одной аминокислоты группы Б Ка несколько выше 160 ммк (например" 198 ммк
в случае /-цистина в соляной кислоте). /-Цистин во многих отношениях
является необычной аминокислотой.
Результаты
281
Вычисления производились следующим образом:
Доля <х-центра в /-форме = [<р](а/) = 72{[<р](/) + [<р](/-алло)},
где [ф](/) и [<р](/-алло) представляют собой молекулярные
вращения I- и /-аллодиастереоизомеров при данной длине
-
Рис. 3. Дисперсия вращения ^а-аминокислот, представленная кривыми
Друде [211].
А—{-лейцин (VII) в НС1; Б—J-лёйции в воде; В—/-фенилаланнн (IX) в NaOH.
волны. Оказалось, что при подобном способе выражения доли
а-центров справедливы видоизмененные правила Паттерсо-
«а — Броуда.
Кривые эффекта Коттона для медных производных амино»-
кислот рассмотрены на стр. 336—338.
282
JZисnерсия ОnТичеСКО20 враtцения
Уzлеводы
Херст, Вуд и друrие исследователи Бирминrамской школы
провели в 1
32
1937 п. широкие исследования большоrо
количества уrлеводов [131]. Поскольку при изучении уrле-
водов определения «монохроматическоrо» оптическоrо враще
ния иrрают большую роль (следует в первую очередь указать
в этой связи на работы Хадсона), можно надеяться, чtо про-.
должение этих исследований с более совершенным COBpeM
H-
ным оборудованием окажется плодотворным (см. также
ссылки в табл. 1).
Поzлощающие соединения
В табл. 2 указаны и ниже кратко рассмотрены Те HeMHoro
численные соединения, для KoTopыIx в ранних работах yдa
лось проследить ход кривой дисперсии вращения при подходе
к области поrлощения или движении через нее. I(ак неодно-
кратно отмечал I(ун, попытки определить характер полосы
поrлощения на основании результатов измерений при далеких
от нее длинах волн являются рискованными. Кун подчерки-
вает (см., например, [162]), что «оптическая активность по
лосы поrлощения может быть установлена только тоrда, коrда
ОП'fическое вращение измеряется внутри самой полосы поrло-
щения» (см. также [43]).
fалоrенопроизводные, Кривые дисперсии вращения для
rалоrенопроизводных тип
R.СНХСН з характеризуются рез-
ким подъемом или падением в области поrлощения (220, 240
и 280 _
MK дЛЯ CI, Br и 1 соответственно), но максимум и ми
нимум на ней отсутствуют.
Эфиры а
rалоrенозамещенных
ислот (R.СНХСООСН з ;
х == Сl, Br), наоборот, дают кривые с одним четким макси-
мумом или минимумом примерно при 250
260 _
_
K. Эта об-
ласть'в настоящее время сравнительно мало доступна, ИQ не
исключено, что в будущем соединения TaKoro типа окажутся
ПО.lJезными при структурных исследованиях.
Азиды и азидокарбоliовые кислоты, Дисперсия вращения
этих соединений в общих чертах подобна дисцерсии rалоrе-
нов и rалоrенозамещенных кислот. В простом азиде
(С 2 Н 5 СНN з СНз) полоса поr.iющения при 280
290 мМ",' по-
видимому, оптически неактивна, и кривая дисперёии враще-
ния. является плавной. Производные азидокислоты
СНзСН.NзСООН дают. кривые с характеристическими вол-
нами.
Таблица 2
ПоrJlощающие соединения, изученные в классических работах
ПИКИ И виа_ - '"
ДИИЫ 2) <.> Q.
,;, '" ,.,
...
Q. '" '"
Соединение O
I :I! Q.
"'
>., и>: cu
....0 ['1'] ...
<.>'" м.мк 00,", :с
"'., .<;'" '"' t:;
1'....
rалоrенопроизводные
а
Хлорпропионовая кислота УВ +1800 250 .......220 165
Метиловый эфир . .
3500 215
а
Бромпропионовая кислота УВ +3900 260 .......240 164
Этиловый эфир
5 500 220
Диметиламид УВ +1400 295 .......240 164
а-Иодпропионовая кислота
Этиловый эфир УВ +4500 260 280 163
Диметиламид . . УВ
200 260
2
Иодоктан . . . . УВ +1000 300 265 163
Альдеrиды. и альдеrидосахара
2
Метилбутаналь-l УВ +470 320 295 171
450 277
3
Метилпентаналь-l УВ
58{) 320 295 171
+1100 273
Камфолевый альдerид (XI) Х +1460 322 295 180
770 275
Пентаацетат альдеrидо
D -rлю-
козы (ХП) . . . . . .
1 810 312 292 133
ПентаацетаJ. +2940 260
альдеrИДО'D
rа-
лакто
ы . . . . . . . . . Х ........4250 310 290 Ш3
+5540 265
Пеитаацетат альдerидо
L
apa.. ..........з630 290 133
бинозы . . . . . х 312
+3630 268
СНО
I
н
с.......-оСОСНз
I
снзсо(}-,---с
н
I ;
.
CHO н
с.......-оСОСНз )1J
I
Н
С
ОСОСНз
l
сн 2 ососн з о
XI ХН XIII XIV
Камфопевыil Пенtli8цеrат Камфорхинон Сантонид
aпbAerHA tlЛi>Аtrидо-
о
rJlЮ
Оi!\>I
Продолжение табл. 2
Продолжение табл. 2.
ПИКИ и ПП8- - '"
,:, дииы ') u С.
'" »
Соедииеиие с. '" ...
O I :.1 '"
.. Л, с4
...", ['1'] у>е cu
и", ММК 'OiI! ...
"'., '"
.. . 0.... «'" "! t;
ПИКИ и ВП8 - '"
дииы ') u
,:, '" с.
'" >.
Соедииеиие с. ::! ...
g:=--- I '"
с.
...", л. у>е cu
и", ['1'] !,;
"'., ММК 'О"!
0.... ",'" "! t;
3- етилциклоrексанон
Ментон
Карвоментон
Камфора (I)
Камфорхинон (ХШ)
СаНТОИИД (XIV)
Парасантонид 3)
УВ
УН
Кетоны
УН
УВ
УН
УН
УВ
с
с
УН
УВ
+1290 319
1580 263
242 302
72 271
868 .j20
+1170 277
+3950 320
3340 272
750 494
+500 444
62 700 321
76 400 275
+78800 321
86 000 275
50
5000
12 500
+21 000
+10400
+17000
Азидопроизводные
а Азидопропионовая кислота С (?) 95
етиловый эфир . . +320
ДимеТIfJIамид . ... " э ..........з 050
2 500
310
201
305 4)
278
300
300
275
238
",260
.....,260
237
.....,260
250
",260
242
",250
255
",250 .
283
290
289
,111
Нитриты, нитр.озиты И ниtросо.единения
(+ ) -Метил н rексилкарбинол-
нитрит
292
184
ФеНltлзамещенные спирты и кислот
Метилфенилкарбинол УН
Метилфенилкарбинолацетат УВ
Миндальная кислота
ЭТИЛОВЫЙ эфир С .......13000 26() .,,:,260
Нитрил . УВ Э + 1800 232 .....,260
Простой и сложный ме-
тиловые ЭфИРЫ
Простой метиловый эфир,
диметиламид
Атролактииовая КИСлота
Простой и сложный ме-
ТИЛОВЫе эфиры
простой метиловый эфир,
димет.иламид .
288
(+ ) -Метилциклоrексилкар и.
нолнитрит '.
184
292
182
467
( ) Метилфенилкарбинолни-
трит . _ .
182
195;
ср.249
195;
ср..249
Борниленнитрозит
Кариофилленнитрозит
162
'162
Дииитрокамфан
162
162
(630)6)
С
УН
УН
УВ
С
Четыре пик а и
четыре впадины
8OO I 3'{5
Четыре пика и
:четы'р вра.дИJI
1 100 I 375
Три пика .и
три впадиНЫ 5)
-----820 365
+550 3.75
+325 640
+295 .0625
+6200 623
1830 691
5 930 302
+2960 267
400
4<JO.---.-З50
'625
680
280
Ксаитоrена ы и родственные соединени
(+ ) - БОрНилмеtИЛК'саНтоrенат'
(XV) , '"
162
162
( + ) -Борнилэтилксантоreнат
16
162
( )- ентилметилксантоrенат
(XVI) .
Метиленди- (+ ) -борнилксан
тосенат
164
Метиленди ( )-ментилксанто-
rеиат УВ
164
УВ
УВ
УВ
УВ
1200 376
+2260 345
. 1140 380
+1400 352
+1620 378
5670 341
2 320 38
+1540 351
+4320. 380
+5420 344
354
358
353
355
355
162
162
162
193
192
194
183
183.
183
183
183
286
Дисперсия оптичеСКО20 вращения
Результаты
287
Продолжение табл. 2
Карбонильные соединения. Паско , большая' частьэтай
rлавы посвящена провед€нным в /rюследнее время исследо-
ваниям карбоннльных соединений, нет необхадимости под-
робна останавливаться На немнаrих классиче<:ких измерениях
аптич€скаrо вращения этай rруппы соединений.
Левен и Ротен 1171] изучили ряд альд.еrидов с развет
вленной цепью. типа R'R"CH (СН2) nСНО и установили. что'не-
котарые из них дают типичные карбонильные «валны». Как ПQ-
казали Лоури и сотр. [133], альдеrидны фармы некаторых
полиац€татов мовосахаридав дают аналоrичные кривые дис
персии вращения.
Euцe на раннем этапе исследО'ваний дисперсии враLЦения
была довольна подробно изучена одна rpуппа кетавО'в кам-
фора и ее Пf>аизводные.
Джерзсси и rеллер [24] изучили ряд алифзтических
альдеrидов и кетонав [С 2 Н 5 (СН з )СН (СН 2 )nСНО и
С2Н5(СНЗ)СН(СН2)nСОСНз], В которых изменялась длина
цепи между карбанильнай rруппой и асимметрическим
атамом.
ПИКИ и впа- - '"
:i: дииы 2) U со.
'" »
со. '" ...
Соединенне O I ::I! '"
"' },. со.
...... и>е cu
['1'1 ...
и" мм" "'iI! '"
"'.,
1>.... ",-"'iI! о::;
(+) Бориилдйксаитоrенат . УВ 2 230 390 366 183
+4 950 355
( ) Ментилдиксантоrенат . УВ +1 880 390 363 183
2 030 344
(+ ) Бориилдифеиилдитиоуре-
таи . . . . УВ +1680 578 520 183
.........(j730 436
( ) -Ментцлдифеиилдитиоуре
тан. . . . . УВ 2 430 570 515 183
+6180 436 ...-,
') РаСТВQрители: С спирт; УВ уrлеводород (reKcaH. rептан ,мн циклоrексаи):
х хлороформ; Э эфнр.
2) Курсивом набраны значения. соответствующне наИменЬШИМ длннам воли. при
которых ПРРВОДИЛНСЬ IIзмерения.
З) Эпимерен сантоннду у С-Н.
') Отрнцательный эффект Коттоиа наложеи на плавную отрнцательную кривую.
5) Сложный эффект Китона наложен на плавную отрнцательную кривую.
5) Плавная кривая ПР" 14°.
Нитриты. Кун и сатр. [162] весьма падробно изучили азоти-
стокислЫе эфиры трех родственных карбинолов общей фор-
мулы RСНОNОСН з , rде R == h-С 6 Н 1з , циклоrексил и С 6 Н5.
Эти соединения, полоса поr лощения. котарых лежит около
365 ммк, являются лучшими при мерами К.'Iассических иссле-
дований кривых со слажным эффектом Копана. I(ун пад-
черкнул, чтО' для полноrо понимания полученных кривых
rребуется 9пределить. круrщюй дихроизм разность показа-
телей преломления для левоrо и правоrо циркулярнополяри-
зооанноrо света.
Феннлзамещениые карбннолы и кислоты. а-Фенилпропио-
новая кислота (с"Н 5 СНСН з СООН) и. алкилфенилкарбиналы
(C 6 H 5 CHOHR) дают плавные кривые даже в области. длин
волн около 250 м.мк. rде праисходит поrлощение.
Производные миндальной кислоты (С 6 Н 5 СНОНСООН) и
атролактиновои кислоты [С 6 Н 5 С (СН з ) ОНСООН], аднако,
дают rораздо балее крутые плавнЫе кривые (в диапазоне
длин волн, в :Котором можно правес\fи измерения), а во мно-
rих случаях обнаруживают четкий максимум.
Однако даже среди небольщоrо количества исследован-
ных соединении установлены странные анамалии: соединение
С 6 Н 5 СНОСН з СОN (СН З ) 2 дает положительную кривую дис-
персии вращения спиком приблизительно при 250 м.мк, в то
вреМЯ как кривая соответствующеrо сложноrо метиловоrо
эфира является отрицательной. Кун [162] считает, что в этом
случае перейдены rраницы приложимости «ВИЦЩlальноrо
правила». В ряду праизводных атролактиновой кислаты и
метиловый эфир и диметиламид дают положительные кривые
с эффектом I(оттона.
В работе Лайла [185] было охарактеризовано несколько
соединений общеrо типа ArCH (NH) 2R, причем одни из них
проявляют эффект Копана, а дрvrие нет.
I(сантоrеиаты н родственные соединении. Чуrаев [241] и
позднее Лоури [183] провели обширные исследования ксанто-
rензтов (R,ОСSSСН з ) и родственных им праизводных тио-
уrольной кислоты, содержащих такие асимметричные остатки
терпенов, как борнил (ХУ) и ментил (XVI).
XV
c+)-БоРннлметил-
а\: atlTOreH8T
CSSCH'
/--....
XVI
( )- МенТИJIl!еТип....
KC8HToreH.'
СН'SСSО-'ф .
288
llисnерсuя оnтuчеСКО20 враtценuЛ
. Чуrаев, исследовал только область. д.лИlJ волн более
460 ММК, в которой отсутствуют полосы ПQrЛQщения (исклю
чение составляют немноrочисленные дитиоуретаны типа
ROCSNC 6 H 5 CSC6H5). Лоури и Хадсону [183], однако, yдa
лось измерить оптическое вращение при более коротких дли
нах волне. (нижний предел измерений ОКОЛQ 340 .ММК). что по
зволило охватить в осиовном полосы поrлощения в области
около 360 ММК. Полученные кривые являются типичными крн-
выми С простым эффектом Коттона. Лоури и Хадсон провели
сравнение экспериментальных кривых с кривыми,. построен
ными на основании различных уравнений, полученных теоре-
тическим путем. ,. ,
.в последнее время Сьоберr, Фредrа и Джерасси [31] пока
зали значение кривых дисперсии вращения KcaHToreHaToB
и дитиокарбаматов (XVIa; Q == о или NH) для стереохимии
:l OKCn и сх минокnслот.
S COOR
, 11 :
R SC Q C H
I
k"
XVla
Исследования, ПОСВSlщенные изучению аЛКЦИКJiических
кетонов и родственных соединений
Общие положения
Как уже отмечалось, единственная обширная. проrра.МJVia
исследований с помощью фотоэлектрическоrо спектрополяри-
метра была осуществлена Джерасси се сотрудниками [1 31].
Начав с изучеНI1Я некоторых стероидных rOp/'vIOHOB и 'род-
ственных более простых стерQИДОВ, Джерасси вскоре cMor
выработать следующие рабочие правила. . u
1. Среди леrко доступных алицикличе ких соединении
различных типов кетонь! насыщенноrо ря.n:а. дают кривые, ко,:-
торые наиболее приrодны для изучения строения соединении
и их стереохимии. слаБыIй максимум ,поrлощения указаннь}х
кетонов при 290 ММК об словливает щ)лучение примерно при
той же длине волны характеристических кривых с простым
эффектом I(P1:TOHf\. (рис. и 5). '
2. а,@ ненасыщенныI,кетоныы также дают важные кривые,
которые, однако, имеют более сложны формы; множественные
эффекты KOT:fOHa :8 облас:rи длин волн 380 300iMMK связаны
. С наличием СЩIРОJ;O максимума поrЛОЩ I1ИЯ цри 320 350 ММК.
Результаты
289
3. Кетонная rруппа 1) является единственной, для которой
обычно удается определить кривую дисперсии враlЦения для
полосы поrлощения, в которой проявляется оптическая актив
ность. Друrие поrлощающие rруппы или не обладают опти-
ч. ской активностыо' или поrлощают настолько сильно, что
tl/O
'"
I
"
O
600
.20
20 C
,о T
300
1
,
,
I
I
I
1/00
Л,ММК
500
20
Рис. 4. Кривые с простым эффектом Кот тона насыщенных кетонов,
иллюстрирующие ра3J\ИЧИЯ в дисперсии вращения, обусловленные про.
странствениым строением и влиянием растворителей.
А 5а-хоnестан-3-6н (XXVI) в метаноnе; Б 5а хоnестаи З-ои в диоксаие; В метиn з..кето
5(3 хоnаиат (XXVII) в метаноле; r лаиостаи он (LVIIJ в метаноле; на вставке в верхнем
правОМ yrпy ПОКазаНЫ пик (Р), впадина (Т) н амплитуда (а).
вблизи максимума поrлощения не удается определить вели-
чины оптическоrо вращения и, следовательно, изучить эффект
Коттона.
4. 'Соединения, не содержащие функциональных rрупп, вы-
зывающих поrлощение света при длине волны выше при-
мерно 260 ММК (например, уrлеводороды, спирты, сложные
') Проф. к. Джерасси исследовал ряд алифатических нитросоедине-
ний. Слабая полос.а 'поrлощения при 280 ММ" ПQЗВО:Jяет получить важ-
ные, кривые дисперсии вращения (частиое сообщение) (см. также [31]).
19 3ак. 1416
Дисперсия оптичеСli.020 вращения
290
Таблица 3-
Обшиt' формулы стероидов
C\I
I
t:)
......
><.
.......,
XV"a
+lJD
f\
1 "
I I
1 1
1 1
1 ,
1(\ ,
11 \ \
Ij \ \
1. ,\
I \ \
В'В
, '''''
.......
.......................
16
ХVlIб
5а Стероид
о
500
.. & 9
2 10 > 8 .
З 5 7
. 4 Н б XVllla
а
I :
4D . 1
И'
1
1
80 I
\ 1
\ I
\ I
\/
е
СТI;РОИД
ХVlIIб
" '"
о Старое наименоваине
.. Нанменова-
с>
::!! иИе ') по
с> Бок{)вая депь прн С-17 (Щ
.... r;кавнлам
..
с> СЧПХ 5" (XVII) 5 (XVIII)
"
"
'" .
;:r
19 Андростан Андростаи Этиохолан
21 СН 2 СН з Преl'нан Аллопреrнан Преl'нан
24 СН (СН з ) СН 2 СН 2 СН з Холан Аллохолан Холан
27 СН(СН з )СН 2 СН 2 СН (СН З )2 Холестан Холестан Копростаи
20 СООН Этиановая Аллоэтиохола Этиохолановая
кислота новая ки- кислота
слота
22 СН (СНа) СООН Лииорхо- бис-Норалло б uс-Норхола-
лановая холановая новая кисло-
кислота кислота та
23 СН (СНа) СН 2 СООН Норхола- Нораллохола- Норхолановая
новая новая ки- кислота
, кислота слота
24 СН (СН з ) СН 2 СН 2 СООН Холановая Аллохолаио- Холановая ки-
кислота вая кислота слота
120
р и. с. 5. Кривые с простым вффектом Коттона насыщенных кетонов
.в метаноле.
A. З .ОКСIl-5а андростаи 16 ои (XLII); Б 2 кето 5а.А-иорхолестаи (ХLIП); В 5".андростан,
17-0Н (ХХVПI) в J\иоксаие; r 3 -ацетоксн-5,, холестан-7 ОН; Д 5".холестан 1 ОН (XXIV);
кривые А н Б соответствуют оптическим антиподам; крнвые В и r показывают различня
в амплитудах, обусловленные положением кетонной rруппы; кривая Д аиома,т,ная кри-
вая кетона.
эфиры, КИСЛ01Ы), дают кривые дисперсии вращения без ха-
рактерных особенностей. Такие КРИJ3ые имеют значнтельно
меньшую ценность для исследований строеНИЯ t чем кривые
с. эффектом I(оттона.
') Перед наименованием стероида BcerJIa указыва тся 5 а или 5(3. за нсключениеN
тех с.'учаев, коrда в соединеннн естЬ двойная связь 4 5 нли 5 6.
19*
292
Дисперсия оптичеСКО20 вращения
Эти плавные кривые лишены характерных особенностей,
но их подъем или падение по направлению к коротковолновой
части спектра может оказаться достаточным для искажения
кривых с эффектом Коттона. Поэтому при истолковании кри-
вых дисперсии вращения кетонов всеrда желательно иметь
создающую фон кривую соответствующеrо уrлеводорода или
спирта, которую при необходимости можно вычесть из кри-
'вой, полученной для кетона. Пример подобной обработки кри-
вых см. в разделе «Алrебраическая обработка кривых», стр. 358.
5. Распространение обобщенноrо метода инкрементов мо-
лекулярноrо вращения на кривые дисперсии.
а) Антиподы характеризуются кривыми дисперсии враще-
ния, которые не. обязательно должны являться зеркальными
изображениями друr друrа. .
б) Соединения ОДНоrо и Toro же стереохимическоrо типа
рядом с карбонильной rруппой характеризуются кривыми дис-
персщ:! одноrо и Toro же знака. (Это правило является при-
ложением обобщенноrо метода инкрем;:,нтов молекулярноrо
вращения, применявшеrося Клайном [150, 151, 157] для уста-
новления строения стероидов, тритерпенов, дитерпенов и т. п.)
в) Соединения, являющиеся энантиоморфными в области,
прилеrающей к карбонильной rруппе, характеризуются кри-
выми дисперсии вращения антищ)Дноrо тиПа, т. е. одна кри-
вая представляет собой зеркаЛЬtlое изобр щстие друrой (при-
меры см. на стр. 333 З49 и на рис. 5).
В последующих разделах, в том числе в Т;J.блицах и на
. рисунках, приводятся данные, полученные школой Джерасси
за последние пять лет. Большинство изученных соединений
принадлежит к относительно простым типовым соединениям,
в частности к стероидам с одной карбонильной rруппой и
всеми кольцами в транс-положении. Более сложные примеры,
в том числе проблемы, связаННЫе с конформационным ана-
лизом, приведены в той мере, в какой это требуется для об-
суждения материала, помещенноrо в разделе «Приложеню!
дисперсионноrо метода», стр. 331.
Плавные кривые
Таблица 4
Соедннение.
Лиrература 2,
['1'1
589 ЖAlК I
,.., 300 AlЖК ')
н а с ы Щ е н н ы й у r Л е в о д о р о Д (в д и О к с а н е)
5а Андростаи . . . . . . . . I +2 I +30 I (300) 1 1 . v
Ненасыщенные уrлев дороды
5а- Холест-l eH
5а-Холест-2 ен
5a Холест-3-еи
Холест-4-ен .
Холест-5-ен .,
5а- Холест-6-ен
+ 75
+250
+180
+276
240
340
+530
+1650
+1520
+1760
1200
2960
(в ДHOKC He»)
(300) 5.Х!
(290) 5.ХН
(300) 5.ХIП
(800) 5.XIV
(300) БЖV
(290) 5.ХУl
Спирты и их сложны.е ЭфИр'Ы.<8 Дl,fqксан )
5а- Холестаи-З -ол
5а- Холестан-З'-олацетат
Холест-5-ен-З -ол
5а-Холест-6-Rн-З -олацетат
5а-Холест-7 -е -ЗР-олацетат
5а-Холест-8( 14) -еи-З{1-одаце-
тат
+92
+55
150
80
+35
+40
+520
+350
970
27f!J
21O
+75
(2 ) 3.1
(290) 3.11
(290) а.У
(ЗQO) 3. УI
(290) 3.1У
(320) 3.111
Феи о л (в д и о к с а и ,1
ЭстраДkl}л:17 (ХIХ) .....1 +270 I +1200 I (311$) 1 2 . 1V
Карбоиовые кислоты и их С/Jожные эфиры
(в етанол )
5Р-Холаиовая кислота, мети-
ловый эфир . . . .
3a-Оксtl-5 холаНЩlаll кисло-
та, метиловый эфир
Непоzлощающue соединения; плавные кривые
:
Непоrлощающие соединения дают плавНые Кривые' дис-
персии вращения, не имеющие никаких характерных особен-
ностей. Для таких соединений оптическое вращение (положи-
тельное или отрицательное) возрастает при уменьшении дли-
ны волны света. Несколько типичных плавных кривых пока-
заны на рис. 1 (СТР. 267), а цифровые данные приведены в
табл. 4.
+IЗО
+60
+890
+940
(260)
6.1
(280)
Неопубли-
. Jшвано
За-Ац оксн-5р ХОЩlИовая \щс-
лота, меТИЛОВJ>lЙ эфир +1QЗ +1 (2QO) То же
За, 12a-Диокси-SР-холаНОВI;IЯ
кислота . . . +200 +1850 ( ) 6.11
За, 12a-д.иокси S -норхолано-
вая кислота . , . . . . +200 +1250 (250) б.Ш
294
Дисперсия оптичеСКО20 вращения
Результаты
295
Продолжение табл. 4
мерения дисперсии вращения, приближается к полосе поrло
щения.
Джерасси [3] после мноrочисленныхпопыток пришел к BЫ
воду, что подrонка одно- и ДВУХЧЛЕ\ННЫХ уравнений Друде
к экспериментальньrм KpцBыM слишком 'Tpyдoe MKa, а: для
устаНОВЛfiНИЯ эмпирических законо ерностей потребуются
широкие исследованиSj рядовизом:еров из числа непоr;лощаю
щих / соединений. TaKoro рода и .с;ледЬванИ!я {IОЗВQ.[[$IТ JjЫЯВИТЬ
характеристики, которые найболее удФбны для изучения строе-
ния соединений. ПОДQбными Х<iрак'i'еРИСТИl\ами MOrYT Ql\a-
заться отношение величин оптическоrо вращения при .двух
CTaHд pTHЫX Д./1инах волн (например [<Р]ЗОО/[<Р]589) или 'сама
веЛИЧИНа [<р]зоо (вместо обычно исполрзуемой велцчццьr [<Р1589)
или 'наклон и точка пересечения с осью абсцисс КРИВQЙ KO
ординатах 1![q1] ').,2.
Мноrочисленные примеры1 исследования стероидов, не co
держащих кетонных rрупп, приведены в !работе Джонс? и
Клайна [137]. ;" .
lIaf.b UjeHHЫiJ "етЬны,,: '
.-о' - , : .""' i' . . . ,- ,
Кривые с простым эффектом Коттона. Общие nОilЮжеiн6i,.
Все исслеДОВанные НЗсЫJдeнные-:-кетоItы' (за .неболl:Ши"м ис
ключением) дают кривые!дисперсии ,ращерия с одним пикоt,i
... , . ., '['РI
Соеднненне I Лнтература .,
" 589 ммк ,.., 300 ммк ')
31%, 12а,Диоксц,5 ,дiiнор:Хола
новая кислота +110 +650 (255) 6.1У
31%, 121% Диокси 5 этиановая
кислота +300 +4740 (250) 6.У
З ,Окс ,51% этиановая кислота, +170 +3780 (250) 6.УI
метил'овый эфир
н
Х['Х
ЭСТРддИО'Л' 17р
Спиростаны (в ди о кса н е)
5а,22а,25D Спиростан ---.320 1440 (290) 4.1
ба, 22а, 25D Сl!иростаи 3 ол 240 1030 (300) 4.11
22а, 25D Спирост 5 ен,3 ол 470 2300 (300) 4.Vl
5 , 20а, 22а, 25D Спиростан,
З ,ол ( смилаrении) (ХХ) 290 1200 (300) 4.Х
5 ,201%,22а,25L Спиростан 3 ,
ол (сарсас поrенин) 340 14БО (300) 4..Ха
5 , 20 . 22а, 25D Спиростан,З '
ол (цикло 1jJ смилаrенин ) 2БО 1270 (300) 4.
5 , 20 , 22Ь, 25I,.,Спиростан,3 ,
ол ( цикло 1jJ,сарсасапоrе
нии) . +150 +815 (300) 4.Хб
ХХ[
Боковая 'цепь
Кдрденолида
л а к т о н ы (в Д и о к с а н е)
3 , 14 Диокси 5 ,карденолид
(как ХХ1) .......
3 , 14 Диокси 5 буфадиено
лид (как ХХЩ . . . . .
+4
+1690
(275) 15.1
80
4500
(320) 15.1У
') в скобках' указаны ДЛИНJ,I воли (ММ") для данной величинJ,I оптическоrо вра-
щения. ОБJ,IЧИО эта велнчнна представляет собой наименьшую ДJlННУ ВОЛНJ,I. прн
которой пронзво ились измерення.
') Ар...бские II.IIфры ссршкн на статьи Джерассн и сотрудннков, рнМские циф-
ры нумерацня соединеннй. lIрl!иятая в данной статье.
В общеl,\f случае величины оптичеСКОrо вращения при
300 ммк В 5 10 раз выше величин вращения, полученных
для D,линии натрия (589 ммк). Для производных этиановой
кислоты этот множитель может достиrать даже 20. Нена-
сыщенные лактоны (типа карденолида и буфадиенолида)
дают rораздо более: крутые кривые ([М]зоо в 50 и больше р.аз
превышает [М]Б89). В случае соединений обоих указанных ти-
пов нижний' предел длин вciЛн, при, которых проводились из-
,
н ХХ
5ас СПИрОСТдН (20а.22а. 25D)
о
ХХII
, Боковiiя "uепь
буфа иенолида
Таблица 6
п роi)олженuе табл.. 5
XXIV
5.. (-он
ХХУ
5cI-2 он
ХХУI
5cI 3 он
ХХУII
5' 3-0H
..
i>oeн,
н
XXIX
:Ю он
JЬ
н
ххх
D-rОМО' 17a 01
Знак
Iч>J и А и I!N"
ПJ!1j-' Ли.тера- .
СоеАииеиие 589 .м K I I тум тура t)
80IIИ"
пик ') впаАина 1) 'ах
xl<r'
I
5 .Хол с'tЦН+ОИ +180 + 1 2з9 (.&QP) +9АЦ (278) +3 7.ЦЦУ
щtХQлеСТ1I,u 6-0Н 19 020 (щ,) + 700 (270), 77 ().XVI
5fl Хо а -7-ЩI,
За-оКс..., .21.-0Ц Я
кислота . . 100 + (31:?) 2 &40 (264) + 6.XIX
Стероидиые кетоны
(Все величины получены для растворов в метаноле)
le
r. о
crvддi>
н н н н н
XXVIII
17-0Н
Р я д 51%- И 5fJ-с о е д и и е н и й
l'f'l и А Знак
и ам.
. пли- Литера.
Соедииеиие 589.м..икl I туда тура 2)
пик 1) впадина 1) ВОЛНЫ
aXIO 2
Ряд 5сх-соединений
5fl-ХРJlан-12-он,
3a-ацеТОКСll-, .
-2+0вая К1iслота
( т",JIЩJЫЙ э.фнр) +450
51%- Холестав-15-0Н.
Зji-окtц-
5p-ХOJ,IеСТ8н-16-0Н
5cx-ЛвДРОC'l: н-17-0Н
(XXVIII) 'J . '. +220
5а.-Преrцан-20-0fi. +320
3 -aцeTOKCB- (X I ) +260 4)
+3 33Q (30а) +2 3&0 (212)
+10 6.XXVl
5а Холестан-I-0Н
(XXIV) +440 +1560(338) +1 440 ( 1'8) 5) 5.1
51%.Холестан-2-0Н
(XXV) +230 +6300(310) 5 850 (267)' +121 5.Н
5('t- XO.1IeCT8Q -3-0Н
(XXVI) +210 +3 700 (307) 2 850 (267) +65 5.lll
51%-Холестан-4-0Н . +50 .......з 000 (307) +6<380 (267) 94 5.1V
51%.Холестан-6-он,
Зр-ацетокси- 74 3550(З06) +4040(270) 76 5.Vl
5(Х-Холестан- 7 OH,
3 -ацетокси- 160 1490 (310) +65(274) 16 5.VH
51%-Эрrостан-l1-0n,
ЗР-ацетоксн- +147 +1 зоо (322) +130(282) +12 14. V
Ряд 5Р-соединений
5 Аидростав-I-он.
17р метоксикарбо.
нил . . . . . . 100 5 570 (318) +8000 (285) 136 15.Х!
5Р- Холестаи-З-он
(XXVIl) +190 (307) +2600(265) 27 6.У.
+200 +7180(3\6) 7100(275) +146 5.VШ
----«о 13300(311)+146Р9(276) 279 5.lX
+7 fi,lO (318) 6 500(279)
+е i5.O ( ) e 7Щ (2&2)
+7 3РО (315) ----6010 (ZZ5)
+140 7.XV
+17$ } 15
+134 .
р я д D r о м о с о е Д и н е и и й
5а-D-rомоаидростан-
17 а-о и, 3 -окси-
(ХХХ) . . . . . . 114 580 (320) 500 (312) 8) 5.Х
5a-D.rомоаНАростан-
17 -он, 3 -окси-
17а метил-4). . . 17'() ......-5480(315) +4150(275) 96 7.ХХХУ
') в с\<обках указаны длины ВОЛН А (AlМК)_
2) Арабские цифры ссылки иа. с:татi.и Джерассн и сотрудииков, рНМСкие циф-
ры нумерацня соединеЩfА, ПРиНЯТ8Я а данно, СТаТЬе.
8) Не"истинная «волиа». .
') в диоксане.
298
Дuсnерсия оптичеСКО20 вращенuя
Таблица 6
и одиой впадиной в области 320 270 м,м'к, причем так назы-
ваемая средняя ТОЧКа волны'довольно близка к максимуму
поrлощенця полосы карбонильной rруппы, лежащему около
2 : jкK, 'Ра личня"в *fЖВЫХ. -Н&.flуче,нных АЛЯ отдельных ке-
тонов, ПО:ВИДJfМ9МУ, .обусловлены несущественными .особен-
ностями .1iоимметрических rруппировок, окружающих карба-
:iпi.riьЙую rpy}jiiy:'. , ",-
"Некоторые типичные кривые показаны на рис. 4 и 5, а ве-
Jпi9ИНЫ, харак'tеРИЗУI9щие ПИ:lЩ и впаДI:IНЫ кривых, получен-
HbIX 'ДЩI стерои;дных кетонов и бициклических аналоrов, nр'!-
BeдeHы в табл. 5 и 6. Изучение кривых и садержзщихся в
таблицах данных наrлядно показывает потеНЦиалъные воз-
мажности использования' kривых дисперсии для CTPYKTYPHbIX
исследований (необычнае ПОl3едение l-кето-5lX-стероидов и
17a-кето-D rомостерОJiДОВ, кривые.дисп рсии вращения кото-
рых не имеют настоящих пиков и впадин, рассматривается
на стр. 362 365).
Для определения строения соединения важны с следующие
характеристиkИ кривых дисперсии вращения: а) ампли-
туда волны (разность значений ] для пик а и впадины) и
б) точная длина волны. соответствующая пику, впадине и
средней точке волны. Паследняя характеристика обычно рас-
сматривается как величина откланения 11 .01' стандартной
kрИБОЙ. Как правила, OCHOBHQe внимание уделяется той части
волны, которая соответствует б6льшим длинам' ВОЛН (при-
мерно. .300 320, мм,к), так как. определения у «корdтковЬлно-
BorQ конца»саиряжены с трудностями. При изложении маТе-
риала предполаrается, что энантиоме.ры дают кривые диспер-
сии Qращения, которые являются зеркальными изображе-.
ниями. . с
Данные, касающиеся более широкоrо ряда насыщенных
кетонов, приведены в табл. 7, 8и 10. К. этим соединениям
относятся rлавным .образом бициклические кетонь! и I'Iолицик-
лические саединения с кетонной rруппой в концевом кольце.
Полож;ение и форма крищ)й с эффектом Коттона зависят .от
следующих важных структурных и стере.охимичес их особен
ностей: '1) р2змера цикла (циклопентанен или циклоrекса-
нан); 2) СОЧМI:Iеn.ия IOШeц (цис- или транс-); 3) положеюfя
карбонильноij: rруппы па отношению к месту сочленения колец
(0;- или! -дека.тIOН или rексаrидринданон); 4) заместителей
у места 'сочленения колец (водор.од 'или метильная rруппа);
5) наличия или отсутствия заместителей в о;-положениfr. по
щ»аЦlению ". карбонильиой '. I:'Py,nh : '( алоrен,rидроксил ал-
кил); 6) канформаЦИИ"ЭТИR' tX, заместителей (аксиальная или
9кваториащ.ная); 7) аномальных конформаций . цикла. или
БнциКJiнчеtкие кетоны
(Все величинь получены для растворов в метаноле, если нет оrоворки]
6:J
I
Н
ХХХ!
mpahc-I-Кето
аФ
н
XXXII
транс- 3 - Кето
9 МеТJ1лдекалоны
с;р
о ХХХIII
цис- 4 - Кето
fu
н
XXXIV
транс - I . Кето
o==d)
Н.,
XXXV
транс- 2 КетО
8 Ме.тилтексзrидр и нда н О ны
Фа
ji, .
XXXVI
цис- 5- Кето
т
о. 4
XXXVII
9 Ме7ИЛ L\4 окrалон-З
.' . "
Знак
: l'lft и:,?-, lt aM
пли Лнтера-
туда
Соединенне '. l' BOJ)Hbl тура ')
пнк ') впаднна 1) ах
х 1O 2
Насыщенные кетоны
Проиэводньiе 9 метил-
дека.чина
tpa1tc-l-кето.
(XXXI)3)
+2340 (318)
' 840 '(277) +32 7.II1
TpaпC-3 KeTO
(ХХХЩ 3)
+2240 (318)
l 3404) (305)
+2240(312)
45 ,(308)
+615 (322)
2 460 (275) +47 E.7.lX
l 900 4) (265) З2 4) E.16.XI
2 820 (275) +51 16.ХVШ
+735 (268) 11 Е.I6. УII
500 (275) +11 Е.I6.Х
TpaHc-4 Keтo
цис-l-кето
циc-3 Keтo
цис+кето (ХХХI1l)
продолже1f.uе таБЛ.6
Таблица 7
. ..
Зиак
['f'1 и и aM
fI:IIи Литера
СоеJlииеиие I туда
волны тура ")
ПИК ') впадииа ') ах
xl0 2
Пронзводиое 4, 4, 9-Tpil
метилдекалина
TpaНC 3 KeTO . 50 (320) +260 (275) 11 E.l6. ХХIl
Производные 8 метил
reксаrидриндана
TpaHC 1 Keтo
(XXXIV) 8) . .. . +4730 (322) +4110 (280) 88 7.VII
транс-2-кето
(XXXV) . . . . +11300 (315) 10 600 (275) +219 E.7.XI
tpahc-5-ке'IO . . . +2 150 (310) l 950 (272) +41 Е.Ш.Х
Liuс 5-кето(ХХХVI) З) 290 (316) +670 (280) 10 7.ХIII 5)
TpaHC 4 Keto 8) . . ........s 500 (305) + 1 о ()()() (270) 155 19.XIV
А. Длины
вращеиия,
НасыщенНЫе f(e1'oflbl; С80днЫе данные
ВОЛН, соответствующие первому экстремуму кривых дисперсии
иллюстрирующих влияние химическоro строения и paCTBO
рителей
(дисперсия), ммк
I
1
диоксаи
Метанол или
9таиол
Л макс (поr лощеиие), ммк
Тип соедииеиия
диоксзи
метаиол
Циклоrексаноны
Стандартная величина
(для бициклических,
стероидных и друrих
соединеиий)
3 KeTo-4, 4 диметилпро
изводиые (рЯд лано
стана) . . . ..
ll-Кетостероиды
312 320
ЗО5 3121)
284---.292
28 29б 5)
'32
32 28
31 25 2)
318 325
298
Циклопентаноны
Ненасыщениые кетоиы
Производные 9 метил-
окталина
Tpaнc-/1I)-3 KeTO З) 1 670 (380) +2 воо (322) Е.lб.V
114 3 кето(ХХХVП) З) +960 (362) +3400 (ЗО8) 24 Е.lб.VI
115(tO)-4 l<ето З) . . +150 (362) 080 (312) 32. Е.lб. VШ
Стандартиая величина
(для БИЦИКЛRческпх,
стероидных и друrих
соединений) '" 320 25
312 318 3). 294---.297 . 303
Друr.ие соединения
Альдеrид.ы
19 а.rtьдостероиды
20 ащ.достероиды
327 74)
312......;315
ЗО8
Б. АмплиТуды «ВОЛН», и,ллюстрирующие влияние строения 6)
') В:СК9бках ка аиы ДЛ}lIlЫ вола J,,,. .
') Арабские пифры I:сыпк" 111 стаТЫI Джераl:са и сотрудников, рнмские циф-
ры нумерация соедииеиий, праиятая 8 даниой статье, буква Е отмечено, что знак
оптнческоrQ IIращения К8$аи. МИ BHТIII1 Фl\ктически исследоваииоrо соединения.
Таким образом, все приведеliиые в та6llИце кеТОИbJ представJЦ,ют собой соедииения
с кето-rруппой в .1IеВОIl! .к9льце.. ДIIнные 9..цис'. и транс-2-kето-9-метилдекалинах с до-
полнн лы1мнH метипьны1iiи rруппамн прйili!Дены в работах 197, 252).
') В диоксане. .
'> Выqнслено ПО результатам ИСCJ1едовання равновесной смеси циc и транс нзо-
керов
1) См. 1781.
1) С ИЗОQКТИЛЫIЫМ заместителем у C-I.
Амплитуда aXlO 2
Класс соединений Подкласс 7) Чнсло
примеров I
диапазон среднее
транс-а rексаrидрин-
даионы . . . .. 4 66---144 110
Tpaнc- . rексаrидрин-
даноны б 180 279 230
п родолженuе табл. 7,
Амплитула axlO 2
Класс соедииеиий Подкласс 7} Число
. примеров I
дшtnаЭОII средНее
tpahc-а; Де!<алоны . . Ближняя
СНз 3 14 32 21
TpaHc a; Декалоны . Дальняя
СНз 2 32,93
транс а; Декалоны . . НН 5 5O 60 56
циc a;- Декалоны . . Ближняя
СНз 3 5().......136 133
циc a;- Декалоны . . . Дальняя
СНз 2 3, 11
транс Декалоны . . . Ближияя
СНз 8 77 136 107
транс- Декалоны . . . Дальняя
СНа 18 29 70 48
транс- Декалоны Лан. 12 11 39 24
транс- Декалоны . . . НН 2 63,90
циc Декалоиы . . , . Дальияя
СНз 12 1O 6 25
а Х 10 2 '}
.ч1:l.!<ЛОI1 итаиQИЫ
Таблица 8
Соедииение
I Литература I}.
Примечаиия
Моноцикдические
d Метилциклопентанон + 86
(XLI)
HVO
XLI
3 Метилцикло
пеитанон
-кетоны
I
O=(tJ
н
XLIII
2 KeTo 5a-A.
14
:
н
XLII
16- КеtостеРОИА
норстеvоид
22.III
Бициклические и полициклические кетоны
1. mраnс а.rексаrидринданоны
11. цuс а-rексаrидрииданоны
Е 34М Амплитуда зиачи-
тельно меньше, чем
у траnс-изомера
СО рядом с Н в месте
сочленения колец
8 Метил транс-rекса-
rидриндаи 1 -он
1 7 Кетостероид
(XXXVIII)
14-а Метил 1 7 Keтo
стероид
15 Кетоё'тероид
1) I Кето-5f1-стероид при 320 ммк; см. текст, отиосящийся к 4-кето-5f1-стероиду
и ero бициклическому аиалоry. с
2) А В Соедииеиия при 300 305 ММ".
В) В том числе соединений с мостиком в кольце типа LXIX.
4) Одно зиачеиие при 322 ММК
.) 17 a-Альдо D-rомостероид имеет " (поrлощеиие) 275 277 ммк в метаноле;
дисперсия весьма иеобычная (см. текст).
.) В таблицу включеН;'1 данные, получеиные для растворов исследуемых соедине
ний в диоксаие и метаиоле, и ОПУJl{ены данные. полученные для соедннений, в слу
чае которых можно ожидать аномалий (например. аномалий, обусловленных аксиаль
ными метильными rруппамн, ср. стр. 352). _
') Заместнтели у сочленення колец между несущнм карбонильиую rруппу кольцо'"
И остальной частью молекулы обоэиачеиы сокращенно:
Ближняя СН В анrулярная метильная rруппа у сочленеиия кольца около карбо
нильиой rруппы (XXXVIII).
Дальняя сИз анrулярная метнльная rpуппа У сочлеиения кольца, удалеиноrо от
карбонИJJЬИОЙ rpуппы (XXXIX).
Лан. типа ланостаиа. т. е. аналоrично дальней СНа. но С еем диметиЛЬНЫМИ
rpуппами около карбонильной rрупnы (XL).
НН водород в об()нх местах сочленения колец.
1 7 Keтo 1 4 стероид
3 KeTo A нор 5 стероид
(XLIV)
88Д
Е 140Д
E 66M
E I44M
+ 133М
ф
о
XLIY
з -KeTo-A HOp
5 ст'ронд
Сочленение с коль-
цом В приводит К
увеличению ампли-
туды. (см. стр.
362 364)
Ряд :Лаиаиа; а меньше,
чем для приведен-
ноrО..выше соеди-
нения
СО рядом с Н в месте
сочяенения колец
,
н ОН
XLV
Тип з Кетоrl3 тjОЛI1Д
7.VII
7.XV
17.LXXIII
5. VIII
7.XVI
7.ХIVб
Результаты
305
Продолжение табл. 8
искажений (уточнение этих факторов см. в примечаниях 5
и 6 к табл. .).
СОСJUlненне
Примечани я
111. транс р rексаrидринданоны (А. С одной метильиой rруппой
и одним атомом водорода у сочленения колец)
8-Метил-транс-rек
саrидриндан-2 он
(XXXV)
2-KeTo A Hop 5a CTe- .
роид (ХLШ)
16-Кетостероид
(XLII)
а)( 1O 2 1)
I Литература')
от
н
XXXIX
"Дальняя сн;'
Типы 9- метилдекалOlIOВ
oW
XI.
Тип .nанОСТаНА
ц)
11
XXXVIII \
..J1.1I1ЖНИЯ CH-l 11
{
+219
+206!
E.7.XI
19.VII
+234
7.ХХ
Кроме Toro, рассматриваются некоторые моноциклические
кетоны, ациклические (или с кетОННОЙ rруппой в боковой
. цепи) кетоны, полициклические соединения С кетонной rруп-
пой в средних Ko ьцax и альдеrиды.
Джерасси иКраковер [21] исследовали влияние размера
кольца на кривые дисперсии вращения 3-метилциклоалка-
нонов.
Роль перечисленных выше факторов (1 4), которые опре-
деляют так называемые общие стереохимические особенности
соединения, иллюстрируется данными, приведенными в таБЛ.8
и 9. Для удобства сравнения знаки волн кривых для кетонов,
указанные в таблицах, даны для левых концевых колец (по-
добных кольцу А стероидноrо скелета; например, в соедине
ниях ХХХVIП ХL, ХLIП ХLIV). В тех случаях, коrда ис-
следуемое соединение представляет собой энантиомер, на-
пример 16-кетостероид (ХLП,- для KOToporo вращение фак-
тически p;itBHO 264). ЗНак обращается и перед числовым
значением ставится буква Е (Е + 264). что позволяет удобно
сравнивать это соединение с А нор-2-кетосоединением ХLIП
(+234) .
Восклицательный знак (!) при амплитуде означает (за
исключением табл. 13), чтG пик или впадина, соответствую-
щие более ко,роткой длине волны, не определялись и что
истинная амплитуда может быть больше приведенноrо в Ta
блиuе значения.
Длины волн, соответствующие первым екстремумам; KOH
ститутивные эффекты; Длины волн, соответствующие первым
экстремумам для различных классов насыщенных кетонов, не
имеют существенных различий; исключение составляют лишь
кетоны с а-rалоrен- или а'=оксизаместителями (см. стр. 317
322). Небольшие различия в величинах л (первая точка по-
ворота), обусловленные конститутивными эффектами, при-
ведены в обобщенном виде в табл. 7 (часть А). Как правило,
20 Зак. 1416
{ Е+264
Е+279
7.XVIII
5.IX
(В. С двумя метильными rруппами у сочленения колеи)
14сх Метил 16 KeTocTe
роид
Е + 180Д
7,9 (l1)-Диеиовая
rруппировка
может оказы-
вать влияиие
17;LXXV
(В. С двумя атомами водорода у сочленеиия колец)
13.II1, Va, Vб
3 Кетоrвайанолиды I + 183, Ю3!,
132!Д
(XL V) 3) + 136!, 55 !,
88!Д
+ 146М
2 Keтo A-Hop 5 CTe-
роид
13.IX, Х, XI
(
13.XIХ
IV. чис- rексаrидриидаНОIl
152М
I 7.XIVa
') Данные. принедены для зиаков и амплитуд (а Х 10....) «вопи,. примерно при
300 ммк; Буква Е обозначает энантиомер (см. стр. 274). В качестве растворнтелеli ис-
пользовались дноксаи (Д) и метаиол (М). Восклицательный зИак (!) указывает, что
д.1Я более коротких длнн воли "кстремум не был достиrиут. поэтому амплитуда Фак-
тически может быть больше приведенноli в таблнце
2) Арабские цифры ссылки на статьи Джерасси н сотрудииков, рнмскне циф-
ры нумерацня соединеннй, принятая в данной статье.
) Эти соединеиня. cTporo rоворя. не явля.ются tt-rексаrИДрннданонамн. так каК
циклопеитаноновое _ кольцо сочленено с циклоrептаиовы:м кольцом. которое можно
считать ирнмерно эквивалеllТНЫМ циклоrе"сановому кольцу.
Циклоrексаионы
Таблица 9
Соединение
/
Литература 2,
СQI:дииение
Примечаиия
ах 1O 2 1)
Примечаиия
Моноциклические кетоны
3 Метилциклоrексанои { + 26М
(XLVI) + 29УВ
цис-2, 4 Диметилцикло- 2М
reкcaНOH (из актидио
иа)
tpahc-3 Метил-6-ИЗQПрО + юд Ментон
пилrексанон (XLVII)
Q
XLVI
3 М.IfТИлцикло-
tel<CaHOH
1 Кето-7 -оксисантано
вая кислота (XLVIII)
l-Кето 5а стероид
(XXIV)
17 а- Кето D-rомостероид
(ХХХ)
17a-Метил-17а кето D-
rОJ\lОСТ рОИД
,
/'-.-
XLVII
Ментон
+62М
+1711
зо
(В. С ,метильноiiI rpуппой У сочленения колец, удалеиноrо,
. от. карбонильней rруппы)
9-М тил транс-декалон-4 32М Приближеиное
значение; вычи-
слено по дан-
ным для равио-
весной смеси
транс- Т етра-
rидроэремофи-
лон
11.22.1
111
103
8.1
17родол епие табл.9
а Х 10 2 1) .!
I Литература 2)
Е. 16. XI
+109М
7.LXI4)
ftyoH
НСНзСООН
8, 9 Диметил 2-изопро-
пил T paHC декалон-4
(XLIX)
4 Кето-5снтероид 93М
(В. С атомами водорода у обоих
llез-D-14-кетостероиды I 60 . ' 59, I
(Ц 56М
50, 55д
XLVIII
1- Кето-7 - Оl<сисантанова9
кислота
с
9,II-лтор-Сте-
роид
I Ярко выраженная
аномалия: «вол-
на» отсутствует
(см. табл. );
следует отметить
влияиие допол-
иитеЛЬНОЙ Me
тильиои rруппы
7.III
E.17.LXXI
Бициклические и полициклические кетоны
1. транс а Де.каJЮНЫ (А. Сметильной rрУ1ППОЙ у сочленения колец рядом
с карбонильной rруппой1
9 Метил-траnc-декалон 1 + 32д
2,5, 5, 9-Тетраметилдека + 141М
лон-1
9 Метил-2Х декалон 1 З)
E.l7'.LXXII
X!-fХ
тpaHC tетраrидро-
/ зремофилон
7.LXIX
11. цис а-Декал6НЫ (А.
5.1
5.Х
9 Метил цис- декалон 1
l-Кето 5 -стероид
5.IV
c# HI4
: о
н
н
сочленений колец)
I 9.V VII
9.II1 IV
Ф 7 4 О
17
,
Н
L
14 :Кетодез- D-
стерои,ll.
LI
17-Кето- D-rомо
стеромд
Сметильной rруппой У СОЧ,JIенения колец
с карбонильной rруппой}
I +51М I
136, 111М
рядом
15.ХII
15.XI
(В. С етильной rруппой у сочленения колец, уда,JIенноrо от карбонильной
rруппы»)
+l1М
Неопублико-
ваиные даиные
9 Метил -цис- декалон 4
(ХХХIII)
8, 9 Диметил 2 изопро-
пил-цис декалон 4
4- Кето-5 -стероид
20.
Е.16.Х
+37М
+3М
7.LXIa 4)
7.LXIV
Соелннение
а Х 1O 2 1)
Прнмечания j.
Продолжепuе табл. !?
I а х 1O 2 1) I Прнмечания I Литература ')
СоелltНеllие
продолжепuе табл. 9
I Лнтература ')
111. трапс fI Декалоны (А. С. анrулярной метИПЬНОЙ rруqfroй у сочлеиения
колец, расположеиноrо 'БЛИЖе к карбонильной rpуппе: соедииеиия типа
«2 кето 5а стероида» )
(В_ С анrуляриой метиЛЬИОй rруппой у
удалеииоrо от карбоиильной rруппы; тип
{ +б5,+45М
3 I<ето 5а стероиды (XXVI) + 37, + 46Д
2 Кето 5а стероид
(XXV)'
17 Кеrо D rомостероид
с СНз rpуппой в по
ложении 17a (LI)
{
+ 121М
+77Д
Е+9БД
17 -Кето-D-rомостероид Е + 21Д
с СНз-rpуппой в по-
ложении 17 аа
Аксиальная метиль
ная rруппа в поло-
жеиии 17а вызы-
вает уменьшеиие
амплитуды
Фриделин (LII) Е + llОД
I X 5, 5. 9 Триметилде
калоиы-2
Производное эперуико
вой кислоты
Производное лабдано
ловой кислоты
I1роизводное маноола
I1роизводное оноцерина
LII
Фриделин
5.11
14.XIX
7.X XV
Неиасыщеиные соединения
3 Кето-5а стероид 7 eH
3- Кето-5а-стероид 8 eH
+56М
+48М
7.XXXlV
з-Кето-5а стероид ( 14) eH
3 Кето.5а стероид 14-ен
+72М
+55М
сочлеиеиия колец,
«3-кето 5а-стероида» )
5.111, 6. VII
4.XVII,
17.ХХIII
Двойиые связи
ие оказывают
существен-
Horo влияния,
за исключе-
иием /:.8 (14)
17.LXXXIX
17.ХС
17.XCI
17.ХСll
7.KXXVl
3 Кето 5а стероИДЫ с дополнительными алкильиыми rруппами
2а-Метил-3 кето 5а стероид + 62М, 1?:.XXXV
+29Д 17.XXXVII
2 МетиЛ 3 кето-5а стероид +73М 17.XXXVI
4а-Метил-3-кето 5а стероид +54!М 17.ХХIХ
4 - МеТИk3- то 5а-стероид +7М 17.ХХХ
6а МеТИ.1l-3 кето-5а стероид +33М 17.XXI
6 Метил 3-кето 5а стеР9ИД +51М 17.ХХП
2, 2-Диметил 3-кето-5С%.стероид +80М 17.XXXVIlI
4а Этил 3 кето 5С% стероид +62Д 17.XXXI
19 - Метил 39 HopTapaKcacтaH +29Д 17.XXXlV
20 ои (LIV)
19а-Метил зо- иортараксастаи +lOД 17.ХХХIII
20 OH
Циклаэйкалеион (4а метил 3 +45М 17.LXII
KeTo 9, 19 циклоструктура)
(LV)
g Метил-трапс декалои-3 +47Д E.7.IX
(ХХХЩ 5)
5, g-Диметил-rраtlС-Декалон +32М
+IООIД [X CH2 H2CH (СН з )- 12.lб
СООСН З ]
Е + вод [Х== Щi 2 СН 2 СН (СН З )- 12.IIIб
СООСН З ]
Е+ 136!д (Х==СН 2 СН 2 СООН) 12.116
.
Е +,135 !д Указа11О значеиие для 12.IV
половины молекулы
16.
1.111
LIV
30- НортараксаСТilН"
20 . OHW
п родОЛЖ6ние табл. 9
Продолжепие табл. 9
СоеДlЩение
СоеJlин ние
Пl'имечания Литература 2)
aXlO 2l). Примечани,! I литература").
aXI0 21)
3- Кето 5а-саИТОllановая кисло-
та
4а-Метил 3-кето 5а-саитано-
лид (LVI),
4 -Метил-3-кето 5а-сантано- .
лид (L VI)
LV
uиклоэrlкаЛl'l'QН
З-Кетосоединение из кафесто
ла (CXVII)
Эйф 7 eH 3 OH
+70М 17.XLV
+ 33М «а»- и «1»- Тетра- 7.XXXI
rидросаито-
+ 20М нины 7.ХХХlI
Эйф.7-еи-3 он; 20 эпимер
24,ен 26-0ВОЙ кислоты
Лаиост 8-еи-3-0Н
......:.49Д
Ланост-8 еН 3-0Н,. 24 Me
тил 21 овая кислота
(LVШ)
iJ!.
Y b
lVI
"О" Тетраrидросантонин
1.VII
Ланоста"' 3 011
ЭиаИТИQМереи
по отиошеиию
к стероиду
7.XLIV
30!M
(13а, 14 , 17а) 17.LXXXIII
Диrидробу-
тироспермон
Мастикадиено- 17.LXXXIV
новая кислота
Следует от.ме- 17.LXXX
тать об ра-
щение знлка
Производиое 17.LXXXI
9бурикоеlЮЙ
кислоты
+27!М
+4М
+49!М
СВН!БСООН
14 - Ме!Ти" 3- кетоланоС1'- 8
1I-21-0B<J!I КIIслота iHi
эБУfJliиоевоЙ киедот!>!)
Тирукалл-8 ен-3 он, 21 овая +15!Д (13 , 14 , 17а, 17.LXXXII
кислота (J..IX) 2О-изо) Эле-
меиоиовая ки-
слота
Тирукалл-е еll 3-0H, 24 eH- . +28М Изомастикадие- 17.LXXXV
26-0вая кислота ионовая ки-
слота
4. 4, 9-Триметилдекалои 3 l1M E.lf).XXlI
с
(В. Как и в пункте Б, ио с ееМ Диметильной rруппой рядом
с карбони,llЬНОЙ rру.r:IПОЙ, тип «3-кетотритерпена»)
l) Лаиостаи-3 оны
Ланостан 3 он (LVII)
4, 4 Диметил-5а стероид-.3
он
9, 19-Циклолаиостан 3 оны
16М 17.L VIII
11, 17.XLVI
--:: 1,4, 12Д XL VIIl :
39,' 32M Uиклоартеион и 17.LX LXI
ЦИКJlоаудеиои
Ланост 7 ен 3 он
l1аност-7. 9(l1) диен 3 он
{
26M
.30!Д
33Д
17.LXXIX
17.LXXXVI
llX
3 -l(етотирукалл-8 eH- 21. овая
кислота (КЛеменоновав кислота)
Продолжение табл. 9
t Литература')
а х 1O 2 ')
п родолжепuе табл. 9 .
I Литература '>
СоеJlинение
СоеJI.Инение
Примечаиия
I ах 10:--21) I
Примечания
2) Олеан и ypcaH 3 OHЫ
Олеан 12 еН 3.0И (LX)
Урс 12 ен 3 ои (LXl)
Метиловый эфир .3 KeTO
олеан 12 ен 28 овой кис-
лоты
28 Норолеан 17ен 3 ои
(олеанон)
О
LX
O.lleaH 12 eH,3.QH
(.,Р". амиран)
+12М
+8М
+24М
+41
LXI
Урс- 12 еН-З QН
("а" ам.нрон)
25.Х1Х
25.ХХХН
25.ХХ
IV. цис- Декалоны (А. С анrулярной метильной rрynпой у сочленения
колец рядом с карбонильиой rруппой; тип «2 кеТQ 5 .стерОliда»)
+ БОМ Вычислеио по
полуволне
Продукт деструкции морфина
(LXIV)
21 к.етотритерпен (махаэрат)
(LXV)
Е + 127Д
25.XXV
o
н
LXII
З.Кето.19-нор
5а-стеронд
н
lXIV
Кетооктаrидро
феиаитреи (из
\ МОРФИIIЗ)
LXIII О
Иохимбон
7.LIV
25.L VI
I.XV
2 l' KeTOO.lleaHaHOвoe
ПРОIlЗВОJlное
(Н3 МЗХЗЭРОВОi!
кислоты)
(F. С двумя атомами водорода у сочленения колец; тип «19 иорстероида»)
(В. С анrуляриой метильной rруппой у сочленения. колец, удаленноrо от
. рбонильной rруппы; тип «3.кето.5 .стероида»)
3 Keтo 5a 19 норстероид
(LXII)
З Кето 15а:19.норстероид с
метильными заместителями
lа-Метил
2, 2,Диметил .
4 4-Диметил-
Иохимбон (LXl!lj
+90!М
+63М
+ 139М
20, 15M
106Д
Следует отме-
тить обраще-
ние зиака,
как в ряду
«обычных»
соеДииеиий
сметильной.
rруппой в
положеиии 19
Вычислеио по
полуволне
17.Lll
I 22, 34,
27M
33, 40,
. 20Д
lOД
22M
lOМ
lOМ
3 Кето 5 ,стероид (ХХVЩ 6)
17.LIV
17.LVI
17.L V, L Vll
2 Метил 5 .стероид
4 Метил 5 стероид
9 Метил цис декалон 3
9. МеТИJI цис декалои 3
с 8 СQОСНз
3 KeTO-5 .сантонановая КиСЛО
та
з к.ето 5-сантаиолид .
23М « »-Тетраrид-
росантоиии
46Д
7,Lll
б.XI, , х
15.VI. VlII,fX
17.XL
17.XLl
lб.VII
16.XVll
17.XLlV
7.ХХХШ
Соедниенне
, I ахlO 21) 1-
п родолжепuе табл. 9
I Литература 2)
Соединенне
а Х lO 2 1)
Лнтература ")
ПримеЧjlНИЯ
':""73Д
17.ХЦI
Типбицпкло [3. 2, 1] oKTaHoHa (LXIX)
Из филлокладена
Из кафестола
Энаитиоме:ры
Из стевиола
Куахихнцин
Из rибберел.лино ой кислоты
93M
19M
+79М
29, 3O Динорурс 12 еи 20 он,
3 бензоilлокси (LXVI)
30 Hopypc 12 eH 20 oH,
3 бензоилокси {LXVI)
LXVl
зо Н opypc
12 eH 20 OH
п родолжеlluе табл. 10 .
б6Д
17.ХLIП
+ 108Д
+ lIЗД
LtJ
W .)O
"1
. ,
. .
LXVII
В - Нор-5 -холестан,
З он
I.XVIII
Камфора
7.XLII
7.XLIII, 67, 116
7.XL VII
7.XLIX
88, 234
о
I XIX
БIЩИlШо-13.2.1)-uкаЩJll (119 ФИ,1Локладсна)
il (1
Соединения с кетонной rруппой в боковой цепи
Преrнап 20 он (XXIX)
{ + 178, 178М
+ 125, 134!Д
"30!M
. 1) Данные ПРИllедены для знеков.и амплнТуД (а Х 1O ') «вол",. прнмерно прн
300 ММК; Е энантиомер (см. стр. 274). Растворители: Д диоксаи; М метаиол:
УВ уrле80ДОРОД.
') Арабские цифры ссылки на статьи Джерассн н сотрудннков, рнмские ццф
ры нумерация соединенцll, прниятая В данной статье.
") Х замеiцеп.ная циклопентильная rруппа.
4) Приведениая кояфнryрацня отличается от конфиryрацни соединения, указанной
в работе [7]; коифиryрация измеиена 11 еоответствии с даннымн работы [252].
.) Данные для В нораиалЬ..а !lT"ro соедииеиия: +41 М (Е. 19. Х).
.) В Норанa.nо.. (LXVII) имеет QJ Х 1O ' 55M (19. XlH).
<:
Таблица 10
Холестаи 22 он (LXX)
Различиые карбоиил&иые соедииеиия
ХОЛf!стаи 23 он
Холестан 24 ои
52M
14!M
Соединеиие
Ли.тература ')
I а Х 1O 2 1) I
12M
+80М
+ 73УВ
11.22.11
14. , 157
:2'
2.
,
l
LXX\
J 9 АпьдостероИJI
Различные циклические кетоны
3 Метилциклотетрадеканон
Камфора, . тип бицикло [2, 2, 1]-rепта
Ho1ia (LXVIlI).' . .
н
LXX .
22 Ket:QcTep01lJl
15.
Неопубликоваи-
иая работа
То же
» »
R
316
Дцсnерсия оnтцчеСК020 вращепuя
Продолжепuе табл. /0
Результаты
317
ЭффеJ<Т. Уместно подчеркнуть влияние конфиrурации
атомов, находящихся в положении по отношению к карбо-
нильной Tpynn , на 3HaJ{ эффекта I(оттона. Это наrлядно
ИЛЛЮСТРlfруется примером 3 кетостероидов, 5а- и 5f.j ряды ко-
торых (XXVI, XXVII) дают эффект Коттона противополож-
ното знака. 7 l(етостероиды 5a и 5f.j-рядов также xapaKTe
ризуются эффектрм Коттрва противоположноrо знака, He
CMOTp на одинакQ УW конфиrурацию rрупПИрОВКИВ а ПОЛО-
жении (C 8) по отношению к карбонильной rруппе в обоих
рядах соединений. См. также правило октанта (стр. 368).
Соедннение
а)( 1O 2 I1
Литература '\
Альдеrиды
Стероид 18 альдеrид 3)
арримина)
Стероид 19 альдеrид З)
дИИ и т. д.)
5 (LXXI)
5а
(из хол + 64Д
15.ХХ
(строфанти
а. rалоzено"етоны
Кривые дисперсии а rалоrенозамещенных циклоrексано
нов свидетельствуют о наличии существенных конформацион
ных эффектов [10, .14]. Фторпроизводные, которые по своему
поведению отличаются ОТ хлор- и бромпроизводных, а также
а-rалоrенозамещенные циклопентаноны рассмотрены на
стр. 318.
Экваториальные а-Хлор и а бромuиклоrексаноны дают
кривые дисперсии вращения тото же знака, что и исходные
кетоны без rалоrенноrо заместитеJjЯ. В случае аксиальных
а ХЛОр- и а бромциклоrексанонов подобная закономерность не
обязательна, так как для указанных соединений стереохимия
rруппироВКИ С == О СХ в uелом становится определяющей
и от нее зависит знак 'кривой с эффектом I(оттона. Знак кри-
вой можнО устаlfОВИТЬ заранее при рассмотрении модели
соответствующеrо кетона.
:Х
"
х
21, 35, 51Д 15.VI, ХУН, ХУIII
+ 24Д 15.XIX
') Данные прнведены для знаков н амплитуд (а Х 10....) «волн» примерно при
300 )11)111(;. Растворители: Д диоксан; М метанол; УВ уrпеводород.
2) Арабские цифры ссылки на статьн Джерассн и сотрудников. римские циф-
ры Нумерация соединеинй. прннятая в данной стаТье. .
.) Эти величины, по вндимому. зависят от ВИЦjJиальноrо эффекта.
значения л изменяются параллельно с величинами Лмакс (по
rлощение), как этоrо и следовало ожидать (ср. [1, 17]).
Обращает на себя внимание различие в величинах для
4-кето-5f3 стероида (л 300 -м-мк в метаноле) и ето бицикличе-
ското аналоrа цuс-9 м. тил-4-де.калона (л 322 м-мк в мета-
ноле). Джерасси и Марщалл [16] отметили, что эти соедине
ния, по видимому, имеют различные конформации (ср. [153]).
Амплитуды; конст тутиIщыe эффекты. Числовые значения
амплитуд для соединен й различных стипов можно, qчевидно,
подразделить на несколько rрупп (см. табл. 7, часть Б). Сле-
дует подчеркнуть, что величины амплитуд для транс-f3-rидрин-
данонов значительно выше соответствующих значений для их
транс-а аналоrов. Для структурных исследований значитель-
ную ценность может представит,Ь различие между двумя ти-
пами tpaHC-f.j декалонов; если ето удастся подтвердить допол-
нительными данными. Соединения типа XXXIX, к которым 01-
носятся 3-кето 5а-стероиды, имеют водород у сочленения колец
С-5 рядом с карбонильной rруппой, а в соединения типа
XXXVIII, включающих 2-кето-5а-стероиды, у соотве1'СТВУЮ-
щеrо сочленения колец (C-IO) находится метильнай rРУJIпа.
Со инения последнеrо типа характеризуются rораздо боль
шей амплитудой. Насколько автору известно, подобное раз-
личие не удается обнаружить друrими физическими методами.
См. также прав ло октанта (стр. 368).
lXXII
a rалоrеИ'О1<етоны
Ф 'б 1
; о
н
Br
lXXIII
б'Бром 7 кето.5а
стеронд
Модель циклоrексаноновоrо кольца поворачивают так,
чтоБJ>i .карбонильный атом уrлерода находился в «rолове»
кресла, и рассматривают ето по .связи О == С, как показаiю
стрелкой в формуле LXXII. Если аксиальный а-атом хлора
или брома находится справа от наблюдателя (LXXII; Х == Сl
или Br), то простой эффект Коттона характ ризуется no
ложuтельнЫ-М знаком; JIРИ расположении атома хлора или
брома слева (LXXII; Х' == Сl или Br) эффект Коттона будет
отрulfаrельныlм..
318
Дисперсия оптическою 8раще пu я
Таблица 11
Примеры приложения этоrо правила, определяющеrо .ха-
рактер дисперсии вращения а-rалоrенокетонов, к задачам
установления абсолютной кон-
+80 А'Л-ДислеРСЦll фиrурации раСсмотрены на
3K8. +---1 Акс. стр. 347 348.
+60 А'Л-Поепощеffuе ( . Помимо существенных изме-
Экр.--FrAКё.l нений формы кривых- диспер-
+40 t / . 2 сии вращения, обусловленных
D А . аксиальными заместителями,
w
, '" 1 с аксиальные и экваториальные
/и а""атомы хлора и брома BЫ3Ы
вают сдвиr длин волн, соответ-
ствующих пикам и впадинам
кривых с эффектом Коттона
(рис. 6). Аксиальные атомы
хлора и брома вызывают бато-
хромные сдвиrи, которые удает-
ся связать со СДвиrами в ульт-
рафиолетовом спектре, обуслов-
ленными этими rРУППамн и
изученными I(уксоном и сотр.
[79, 80]. Соответетвующие эква-
ториальные SаместитеJiИ' обус-
ловливают небольшие сдвиrи
длин волн, имеющие обычно
rипсохромный характер.
Подробные данные о rало-
reHOKeToH8x. в том числе сопо-
ставление кривых дисперсии с
максиМумами поrлощения в
ультрафиолетовой области,
приведены в табл. 11.
на:йдено, что знаки эффек-
та Коттона аксиа.льных а-фтор-
кетонов противоположны знакам эффекта Коттона для их
хлор- и броманалоrов. 1( настоящему времени еДинствен-
ными изученными а-бромциклопентанонами являются 16a: и
16fj-бромандростан-17-0НЫ [14], в случае которых термины
аксиальный и ЭКВ;!!ТОРИ8ЛЬНЫЙ не имеют смысла (см. также-
6,2п). .
+20
'1'
" о
........
s)..
о..;:;, -20
'.
.....
А
-40
/
!
I
'
-60
80
260 280 300 320 ЗIJО
Л,ММf(
Рис. 6. Характеристики поrло-
щения и дисперсии вращения
7-кето-5а-стероида _ и ero 6-бром-
ПРОИ:i\lюдноrо (LХШ) [14].
ПривеJltlНЫ участки кривых, включающие
пики и впадниы кривых ДБ; А неза"е-
щенный 7-кетон; Б 6" [еl-бро,,-7-кетои;
B 6 lаl.бром-7-кетон; точки в верхне/!
части rрафнка показывают макснмумы
поrлощення; Экв. Jlкваторнальный;
Акс. аксиальныil.
а-rалоrенокетоиы
А. Измеиения длин волн
о
Л макс (неза- I!.л (замещенный неза"ещенный)
мещенныil)
Кетонная "кваториаЛJ.ныlI ,,-rалоrен 8) аксиальный ,,-rалоrен 4j
rруппа
Дl) А2) I I I I
за"естнтель Д') А 2) эа"еСТИТСllЬ Д') А2)
3 (5а) 307 286 2а-СI +3 7 2а, 2 -CI2 +18 +15
3 (5а) 2a-Ur +4 4 2а, 2 -Br2 +23 +12
3 (5а) 4a-Br 4
2а, 4a-Br2 1
2a-CI, 4a-Br 7
6 (5а) 306 280 5а, 7 -Br2 +24 +25
6 (5а) 5а, 7a-Br2 +56 +60
75) (5а) 310 283 6a-Br 10 5 6 Br +25 +26
1 (5а) 8 - Br +25
11 . 322 294 9а-Р +18
11 325 6) 9a-Br +25
11 12а-Р +15 +176
11 12а-СI +15 +176
11 12a-Br +20 +23
12 305 280 l1a-Br 1O 6 l1 -Br +32
)
)
Б. Амплитуды а х 1O 2
I неза"ещенно.е l
Кетонная rруппа соеJlниение
Экваториальный
а-rалоrеи 8)
Аксиальный a-rапоrен 4)
2 +77 6) За Br +272
3 (5а) +65, +46 2а-СI +54 2а, 2 -CI2 +147
3 (5а) 2a-Br +62, +52 2а, 2 -Br2 +186
3 (5а) 4а- Br +33
3 (5а) 2 ,4a-Br2+53, +34
3 (5а) 2a-CI, 4a-Br +41
6 (5аН) 76 5а, 7 -Br2 282
6 (5аН) Ба, 7 -Br2 .....:..178
6 (5аОН) 11O 1a-Br +95
6 (5аОСОСН з ) 88 7a-Br +171
1 15 6a Br 27 6 -Br +143
а.-Кетол.ы
Джерасси, Тамму, Шиндлеру и сотр.[15] в результате под
робноrо исследования кривых диспер.син а-кетолов удалось
выявить интересные конформационные эффекты, в отношении
Рез.iJлЬtatы
321
17родол еnие табл. //
Таблица 12
I незамещенное l
Кетонная rруппа соединение
11, 12-Кетолы (ряд 14«) 1)
ЭкваторнаJIЪНЫ!!
а rалоrен .)
Аксиальны!! а-rалоrен ')
Кривая 'J
PaCTBO
ри
тель 2)
>'макс
(незаме--
щенный)
6>' (замещенны!! незамещеиный)
е он I е ососн.1 а ОН I а ОСОСН.
7
11
11a-Br
8 -Br
9а-Р
9a-Br 253
12а-Р +117
12а-С1 116
12a-Br 148, 182
+15 l1 -Br 188
+12. +15,6)
+52
А. И з м е н е н и я Д л и н ы в о л н ы
11
11
11
11
12
+10
i1-KeToHbl (ср. LXXIV)
{ Д 325 1O 10 +12 +15
Дисперсия м 320 . 5 8 +15
Поrлощение Э 298 12 5 +15 +10
12-Кетонlif
Д 312 2 +20 +22
Дисперсия м 305 5 +22
Поrлощеиие Э 290 ""':"12 5 +17 +8
') Для определення днсперсин вращенни использовалнсь растворы соединеннй
в метаноле, за искЛЮчеИИем специальио отмеченных случаев [14].
2) Поrлощение в спирте или в смеси СПНрТ ХЛОр6Форм (80: 20) [79].
.) В том.чнсле диэкваТОРНIльные rалоrенокетоны тнпа СХСОСХ.
') в том ЧИCJIе "ем.диrалоrенокетоиы (СХ,СО), в которых одни атом rалоrеНа дол-
жен быть аксиальным, а также аксиаЛЬНО !lкваториальные соединення н диаксиаль-
ные соедннения типа СХСОСХ.
5) Формула LXXIII.
.) В диоксаие.
') Знаки и зиачення амплитуд (а Х IO 2) волн.
+60 А l!.Л-Дuслерсuя 3
l!."Л-поzлощение
+110 "l 1 . 2
") .0 ВА /
В /
CN +20 БА / I ь.с
.
Q оС/ " .2
... ... I
......... О О
20
Б. Амплитуды дисперсионных кривых и коэффицненты
экстинкции
II-Keтoны
Д 43 44 З) 423) 42 88
Дисперсця аХ 10'..2 М 12 14 28 73
Поrлощеиие 10gs MaKc Э 1,47 1,61 1,48 1,69 1,84
12-кетоиы
{ Д 30 З ) 418) 77 162
Дисперсия аХ 10'...2 М 10 П З ) 39
Поrлощение10gs макс Э 1,69 1,90 1,86 1,84 2,06
') Дl(enерсия [15], поrЛОЩенне [52, 50].
') Д диоксаи, М метанол, Э этаНОЛ.
') Цифры, набранные курсивом, взяты из данных для дисперсионных кривых, на
которых впадина ие была AOCТl!rHYTa, т. е. истинное значение амПЛИТУДЫ может быть
tlыше приведенноrо в таблнце.
ЗОО 320
Л,ММК
Р Н с. 7. Характеристики поrлощения и дисперсии вращеиия 11-кетосте-
роида и ero 12-0КСИ- и 12-ацетоксипроизводных (LXX[V) [15].
Пр."ведены участки кривых, включающие пики и впаДЩIЫ кривых ДЕ; A незамещенный
Н-кетон; Б 12 (е]-окси- н ацетокси l1-кетоиы; В 12 а (а(-окси- н ацетокси-l1-Кетоны;
точкн в верхне!! части rрафика показывают максимумы поrлощеllНЯ; О, l:J. ОКСlIкетоны;
., ... ацеТОКСикетоны.
60
280 280
3/JtJ
которых наблюдается аналоrия с влиянием конформаuии
на максимумы поrлощения в ультр.афиолете [52, 80]. Ре-.
зультаты, полученные для 11, 12 кетолов (LXXIV) и их
ацетатов (рЯД 14а соединений), приведены в табл. 12. Изме-
Н6НиЯ, длин ВОЛН /1'Л свидетельствуют о том, что батохромные
и rипсохромные эффекты обусловлены соответственно акси-
а.1lЬНЫМИ и экваториаЛЬНIlIМИ окси- или ацетоксиrруппами.
Указанные сдвиrи весьма близки к сдвиrам длин волн, соот-
ветствующих максимумам поrлощения и пику кривой дuс-
перtJlИ (рис. 7). Установлена интересная особенность ампли-
ТУД кривых дисперсии, заключающаяся в том, что в случае
21 3ак. 1.410
40
322
Дисперсия оn'tичеСК02() враЩеНИЯ
РеЗJjльтаТbt
323
аксиальных (1 ацетоксикетонов наблюдается значительное YBe
личение амплитуды (для этих кривых также установлено зна
чительное увеличение 10g 6манс, но до тех пор, пока не будут
получены дополнительные данные, этот факт, по видимому,
следует рассматривать как случайное совпадение).
О ф :R
11
.
Н
J?f
J .11
. (RO) Р. ,12
,а
(OR)
нам, изменяются в зависимости от л'манс (поrлощение), как
этоrо и следовало ожидать ('см., например, стр. 317, rде при
ведены примеры, относящиеся к (1 rалоrенокетонам), так что
леrко удается установить закономерности изменения ампли-
туды для различных классов кетонов (см. табл. 7).
Сложный эффект Коттона в случае (1, ненасыщенных Ke
тонов при длине волны около 350 ммк несомненно связан
с максимумами поrлощения малой интенсивности в той же
области, которые исследовал Куксон [81]. В начале области
пorлощения (примерно 350 370 ммк) всеrда имеется один
или несколько экстремумов (пики или впадины). (Величины,
рассмотренные в данном разделе, во всех случаях относятся
к самым большим пикам и впадинам в этой области.) Соот-
ветствующие экстремумы у коротковолновоrо конца области .
поrлощения (вблизи 300 320 м.м;к) в некоторых случаях чет
ко выражены, но часто на круто падающей (или подымаю
щейся) кривой в этой точке заметен лишь слабый переrиб
(например, в случае холест 4 ен 3 она). В некоторых исклю
чительных случаях, например для стероида 16-eH 20-oHa
(LXXX), получена кривая с простым эффектом Коттона.
В действительности между этими двумя' крайними слу
чаями существуют всевозможные 'варианты, и небольшие из
менения в конфиrурации или в ха рактере заместителей MorYT
привести к видоизменению кривой, например к увеличению
переrиба или, наоборот, к выравниванию максимума ЩJИ
,.... 320 ммк. Эти факты позволяют сделать предположение
о том, что экстреМУМ или переrиб приблизительно при 320 ммк
имеет Ba Hoe значеtше и что эта характеристика кривой
(вместе .С четкими элементами кривой при 360 ммк) опреде
ляет положение, амплитуду и ширину волны кривых (1, He
насыщенных кетонов.
LXXIV
12 Окси (или ацетокси) II кетостероид
Рассмотрены [15] также кетолы, ОТНОСЯЩиеся к следую
щим типам стероидов (первая цифра обозначает положение
кетонной rруппы, а вторая положение rиДРОКСИЛЬНОЙ
rруппы): 4,5; 6,5; 16,17; 17,16; 17,170 (D roMo); 170, 17
(D rOMO); 20,17 (боковая цепь); 20,21 (боковая цепь); 20,17
(и 21) (боковая цепь).
Различuя. обусловленные растворителя.ми
Сравнение величин молекулярноrо оптическоrо враiцения
[M]D двух или более соединений в различных растворителях
всеrда приводит к неудовлетворительным результатам, так
как часто величина эффекта растворителя неизвестна. Срав.
нивать кривые дисперсии вращения веществ в различных рас-
творителях еще более нежелательно, поскольку .растворители
MorYT быть .причиной сдвиrов: а) в величине оптическоrо вра-
щения при любой длине волны; б)<в длинах волн, соответ-
ствующих пикам и впадинам; в) в амплитудах одиночных
волн и r) в тонкой структуре множественных волн. Фактор
(б) иллюстрируется сравнительнЫМи данными, приведенными
в табл. 7 (часть А).
Влияние растворителей.. Вполне возможно, что из за слож
ности спектров поrJl0щения не удастся установить четкую
связь между величиной л'манс (поrлощение) и средней точкой
волны кривой дисперсии. Следует подчеркнуть, что спектры
поrлощения были сняты для растворов веществ в reKcaHe
(Кую: он), а кривые дисперсии вращения получены (Джерас-
си) , как правило, для растворов в диоксане. .
Куксон [81] отметил, что коротковолновой максимум по
rлощения примерно при 350 ммк сдвиrается в сторону более
длинных волн и лучше расщепляется при использовании в Ka
честве растворителя уrлеводорода, а не спирта. Джерасси
и сотр. [8] установили, что один и тот же (1, ненасыщенный
кетор. в различных растворителях (метанол, диоксан и октан)
.
01:, .Ненасыщенные кетоны
Кривые со сложным эффектом Коттона, получен.ные ри
исследовании (1, -ненасыщенных кетонов [8, 13], на' первый
взrляд значительно труднее поддаются систематической об-
работке, чем плавные кривые насыщенных кетонов. В случае
насыщенных KeTOHouB «волны» появляются при максимуме
поrлощения кетоннои rруппы, равном примерl10 290 ммк, или
вблизи Hero. Длины волн, соответствующие пикам и впади-
324
Дисперсия оnтическоео вращения
дает кривые дисперсии вращения, обнаруживающие суще-
ственные различия. Примером TaKoro кетона мож т служить
( ) -траftC-3-кето-9 меТИЛ-dl,6-rекса.IIИН (LXXXV) (рис. 1 О).
+80
+60
РеЗ.lJльтаты
325
+40
+60
,.....\
\
,
,
,
,
,
,
I
I
+20
."
I
Q
><. О.
.......
20
О
+40
.
2
";+20
. .......А...
. .
20
.
\ А
....
'\
, .
""
\
\
\
\
r
40
t
{.'-.......
1::": f
',ii,;' 'B
l'
,
I
I
I
.1
I
I
! I
,
! I
I '
; I
-60
р и' с. 8. Полные множественные волны а, -HeHa-
сыщенных кетонов (ДИQксан).
А 5о;-холест-2 ен-I-он (LXXVI); Б 5о;-холест-l-ен..з-он (LXXVII);
В метил..зо;-ацетокси-7-кето 5 -хол-8-енат (LХХVПI); r 3 -aцeT'
окси-5а-ХОJlест-8(14)-ен-7-0Н (LXXIX); также одиночная волна,
Д 3 -ацетоксн..s{3 преrн-16-ен-20-0Н (LXXX).
Рис. 9. Неполные множественные волны а, p HeHa-
сыщенных кетонов (диоксан).
А холест4-ен-З-он (LXXXI); Б (+ )-9-меТИJl-А'-октаJlОН-З
(LХХХЩ; В 17 -окси-19-норандрост+ен-З-он; r Зf!-ацет-
окси-5а-эрrоста-7,22.диен>6-0Н (LXXXIII); Д 3f!.aneToKcЦo
холест 5-ен-7-0Н (LXXXIV); Е 3 -ацетокси-5О;-ХОJlест-8-еiJ:-7-оJi
(LXXXVII).
40
.:
в метаноле (наиболее полярном из указанных трех раствори- .
телей) кетон дает плавную кривую с одним пиком И одной
впадиной. При использовании диоксана кривая дисперсии
вращения имеет заметную тонкую структуру, которая еще
более усиливается, если при меняется раствор кетона в октане.
LLиоксан более удобен в качестВе стандартноrо растворителя
для а, {3-ненасыщенных кетонов, чем октан, так как кетоны в
нем лучше Р. тв."с;>римы.
Батохромные сдвиrи кривых дисперсии вращения наблю-
даются при переходе от полярных растворителей к неполяр-
ным: Например, для соединения LXXXV впадине соответст-
вуют длины волн (ммк) 361 (метанол), 362 (диоксан) и 361
(октан), а пику 319 (метанол), 325 (диоксан) и 330 (ОКТ,ан).
Предварительная классификация кривых. В табл 13 при-
ведены данные для типичных кривых. Указанные ниже обоб-
щения, касающиеся зависимости типа волны от строения
326
Дисперсия оптиllеСКО20 вращения
а., ненасыщенных кетонов, носят предварительный характер,
но тем не менее 13 настоящее время ничем более надежным
мы не располаrаем. Термины «полные» и «неполные» множе
ственные волны временно используются применительно к кри
вым двух типов, показанных на рис. 8 и 9. (Термин «полная»
D
ю
1;:)
....
х
........
.!!!J 1 5
20
25
5
sr
6
Таблица 18 .
«, -Ненасыще-Нные кетОНЫ 1,2)
,.
6
LXXV
l'fl и л Зиак и
амплитуда Литера
Соедиflение I волны тура ')
пик ') впадина ') а х 1O 2
Цик.лопентенонu и родственные системы
5а; Холест-14 ен 16-0Н,
3 бензоилокси .'
5 I1pecH 16 eH-20 OH,
3а ацетокси (LXXX)
16 Метиленандрост 5 ен
17 он, 3 -окси-
(LXXXVI) .....
5a rвай 1 eH-3 OH, про
изводное (тенулин)
(LXXXVII) .....
5a; rвай 1 eH-'3 OH, про-
изводное (хеленалнн)
l[ rвай-4 ен-3 он, произ-
водное (rейrерин)
(LXXXVIII)
1 .rвай-4-ен 3 он, про-
изводное (лактон изо-
фотосантоновой кис
.'юты) 200 (370)
в
зОо
А,ммк
рис. 10. ( )-тРlШс-3 Кето 9 метил-Lll.6-rексалнн (LXXXV), проявляющиit
тонкую структуру в неполярных растворителях [8].
Растворители: а метанол; 6 дноксан; в октан.
кривая означает, что при ,.... 320 ммк< имеется четкий маI{СИ
мум, а термин «неполная» кривая указывает на то, что этой
длине волны в лучшем случае соответствует лишь переrиб.)
1. Циклопентеноны дают полные множественные волны'
родственный циклопентенонам полуциклический 16-eH-20-0
(LXXX) составляет ИСК.I!ючение в том отношении, что дает
лишь единичную волну.
2. Незамещенные циклоrексеноны [стероиды 2 eH-I-0H ..и.
l-еН-3-0Н (LXXVI и LXXVII)] дают полные множественные
волны.
3. Циклоrексеноны, замещенные в положении 3 в коНЦе-
вом кольце [например, важный стероид 4-ен З он (LXXXI)],
обычно дают неПОJIные множественные волны.
4. vЦиклоrексеноновые rруппировки в середине ЦQJПЩИКлИ-
Ч СRОfl СИСТ МI>I пе дают ОР;НQЭJiачноrо эФфе 'f{l.
+6520 (360) 4140 (305) +107 13.XIV
+3560 (362) 3740 (304) +73 8.XLI
+ 1630 (394) 53lO (310) +69 '8.LXV
1650 (375) +1770 (312) 34 13.Па
3580 (365) +1270 (320) 48 13.VI
1650 (345) +480 (300) 21 13.ХVШ
13.ХХ
6:
н
LXXVI
2-eн '-он
I
оД
н
LXXVII
l-ен З-оа
Продолжен.ие табл. 13
Продолжение табл. 13
. .
['1') и >- 3нак и
Соединеиие амплитуда лите
I волны ратура .<)
пик ) впадина ) а Х lo 2
..
[,/,] и А
Знак и
амплитуда . Лит
волны раТура ')
а х lO 2
. Соединение
пик ) I впадина )
& 20
fi :6: 8a AHДpOCT 4 eH 3 OH,
17 окси . .. +3420 (372) 1910(317) +53 8.LV
Холест 4 ен 6 QН . . 1670 (359) +6 180 (305) :"""'78 7.L VII
7 о Холест 5 ен 4 OH +890 (360) б 100 (300) +70 7.LVI
Н Н . .
LХХVШ. LXXIX LXXX Холест 5-ен 7 OH. 3 -
8 eH-7 OH .8(I4)-ен 1 OH 19"eB 20 oH ацетокеи (LXXXIV) +660 (357) 4501 (315) +711 8.ХХХII
(5а или 5 ) (5а) 5а Эрrост 7 eH 6 OH,
3 ацетокси Ll22
Циклоrекееноны (LХХХIЩ . . . . . +5600 (362) 9100 (320) +147 8.XXXIV
5a Холест 8 ен 7 OH,
5a-Холест l еН 3.0Н 3 аuетокеи
(LXXVI1) .. .. .. . 81O (382) +4170 (312) 50 8. . <I.:XXVIII). . . . . +210 (369) 3 450! (315) +371 8.XXXVl
5а- Холеет-2 ен 1 OH 5p XoJI 8-eн 7 Olr, 3а-
(LXXVI) 1520 (366) +7660 (311) 92 8.XXXVIIl ацетокси , 24 овая
Холест-4 еН 3.0Н кислота (метиловый
(LXXXI) (352) +з 840 (325) 45 3.XI эфир (LXXVIII) 850 (370) +570 (332) 14 8.XXXV
AHДpOCT-4-eH-3 OH, 17 5 a Холест 8 (14) eH 7 OH, .
океи- . . . . . 81O (352) +3 860 (325) 47 8.ХIII 3 ацетокси (LXXIX) 2440 (375) +700 (320) 31 8.XXXVII
19 HopaHдpoeT 4 eH 5а.Спирост 8 ен 11 OH,
3-0Н, 17Р окси . 1550 (351) +4880 (310) 4 6.ХXI 3 -ОКl;:и- . . .. . .. 120 (375) +10 100 (300) 102 4.ХХII
Циклоrеке 2 ен 1 OH,
3 мети.!] 6 изопропнл
0;:1) (пипернтон) (LXXXIX) 740 (370) +380 (329) 11 8.II
М 11 (.....,) 9 Метил 3 кето
з# транС Ll-окталин . . 1670 (380) +2300 (322) 40 E.16.V
4 tl (+) 9 Мети.!] 3 кето.Ll4
окталин (LXXXIl) +960 (302) +3400 (ЗО8) 24 E.16.VI
LXXXI LXXXII LXXX UI 9 -Метил-4 кето Ll5(IО) ок .
4.eH-3 он 9 Метил 4 1. - .OH талин +150 (362) 3 080 (312) 32 Е.16. VIII
.. .. . .. . .. ..
окталон- 3 Э ЙДесм 4 eH 3'OH (LlIl) 640 (354) +3880 (312) 45 7.XXIV
7 а.Эiiдесм.4 ен 3 н
хх m (LlI1) . . . . . . . . 2640 (360) 320 (322) +зо 7.XXVa
'6 П одокарп 8 (14) eH 13 oH,
. О О з : производное (ХС) 2290 (.352) +6950 (312) 92 7.ХХII
Н Перrндрофенантренон,
LXXXI V LXXXV LXXX\f1 ПРОНЗВодное (XCI) 470 (351) +2460 (325) 29 E.7.XXVIJ
5,еи 7.0Н rnpaHcc9- Метил- . i)-Метиаен-
lJ, 1,6'rексалои-з 17.=08
Приложения дисnерсиОННО20 метода
331
Продолжение табло /3
Продолженuе табл. 13
3на" и
амплитуда Лите-
волны ратура ')
а )( lo 2
[,/,] и А 3на" и
Соедииение амплитуда Литера
I ВОЛНЫ тура 4)
ЦИI<") впадииа ") а Х 1O 2
Соедииение
['1'] и А
пнl< ') впадина ')
LXXXVII
Тенулии
о
I.XXXVlll
r ейrерин
_ о
11/
Xo.!]eCT-4 eH-3, 6-дион
Спирост-8-ен 7, Н-дион,
3 -ацетокси- (XCV)
LXXXl Х
Пllllеритон
J?:\
Пере крест но-сопряженные диеноны
AHдpOCTa I, 4-диеН-3-0Н, I \ I
17 окси- (ХСЩ 41O (366) +910 (315) 13
Холеста I, 4 диеН-3-0Н 260 (380) +1180 (322) 14
I
I Н
СООСН з
ХС
Подокарпаllовое
производное
(из абиетиновой кислоты)
. .
I I
Н
ХС!"
1 8 . хих
7.ХХХ
ХСШ
- Циперои
Ендионы
2380 (402) +6600 (307) 90
8.LХП
180'(4!50) +4060 (330). ----42
4.XXVIII
щ
f б
XCIV
Стероид 1.4.6-
триеН-3-0Н
XCV
Стеро.ид 8-ен-
7.11- ДИОЦ
1) В ДИОl<сане.
') Зиачення, соответствующие изrибам, И вычисленные ПО ннм амплитуды набраны
курсивом. Для кривых, не имеющих иэrиба даже в диапазоие 31O 320 жмк;. величина
вращения выбрана произвольио 'при 315 ЖМК; н набрана курсивом с восклнцательиым
знаком (1).
') в Сl<обl<ах Уl<азаиы длнны воли (ММК;).
4) Арабские цн'фры ссыл<ннаa статьи Джерасси и сотрудннков. римские циф-
ры нумерацня соединений, принятая в данной статье.
I
D
о 4
в на.сfоящее время не представляется возможным исчер-
пывающе охарактеризовать амплитуды волн. Как правило,
для соединений типа циклоrексанонов величины а О Х 10 2 ле
жат в пределах между 30 и 90.
В конце табл. 13 приве.дены некоторые величины для со-
единений с тремя и четырьмя сопряженными двойными свя-
зями (диеноны XCII XCV).
ХСI1
Стероид
1,4 диеll-3- он
Эйдесма-4, 6 диеН-3-0Н
( ципеРОIl. XCIII)
Xo.!]eCTa 4, 6 диеН 3-0Н
Удлиненныеди ноны
\ +10500(384) \ 2030(337) ]
+49900(389) +125001 (315)
+125 \ 7.XXXVII
+524! 7.ХХЮХ
ПРИЛОЖЕНИЯ ДИСПЕРсионноrо МЕТОДА
Пере крест но-сопряженные триеНОIIЫ
Андроста-l, 4, 6 триен-
3 Oll, 17 ацетокси
(XCIV) . . . . .. +5100(404) 12500(325) +173 8.LXVIII
Спироста-l, 4, 6 триен-
3-011 ....... +3950(405) 13300(335) +172 4.ХХVП
Обнаружение функциональных rрупп
Присутствие ка рбонильной rруппы (даже 13 тех с:лучаях,
коrда она химичесКИ сравнительно мало реакционноспособна-,
например, в ll-кетостероидах) удается надежно обнаружить
с помощью метода дисперсии вращения. Чащ Bcero этот Me
тод используется только для подтверждения результатов
Дисперсия оп'J'иЧескlJео ерtJ.Щени!J
17рило ения дисnерСИОНН020 метода
333
ЗЭ2
исследования строения соединений методом инфракрасной
спектроскопии, но известе'н ряд случаев, коrда кривые Дllспер
сии вращения оказались единственным среДСТвОМ установления
структуры. Например, карбонильные rРУПIIЫ циклопентано-
нов и ацетоксиrруппы поrлощают почти при Qдинаковых час
тотах (1749 1742 и 1742 1735 c.м 1 соответственно). Мноrие
соединения, содержащие обе функции, дают лишь один пик
примерно при 17 40 CM I. К их числу относятся, например,
3 ацетокси 17-кетосте роиды Добринер, Кацнельнбоrен и
Джонс [100]). В аналоrичных соединениЯХ, соДержащих Hepe
акционноспособную карбонильную rруппу в циклопентаноно
вом кольце, кривая дисперсии вращения может оказаться
единственным простым средством обна ружения карбонильной
rруппы.
атома у с-ю в 19 нор А4 3 кетостероидах, так как их кривые.
дисперсии напоминают соответствующие кривые обычных
А4-3-кетостероидов [8] (см. рис. 9).
Кривьiе- дисперсии иrрают важную роль в общем случае
дифференциации 3-кетонов 5a. и 5 рядов, наПриМер некото-
рых продуктов восстановления 19 Hop A4-3 KeTOCTepO ДOB [17].
Поскольку принципы УСТ(,1.новления относительнои кон фи-
rурации не отличаются от применяемых при определении
абсолютной конфиrурации, дальнейшие примеры приведены
ниже (стр. 338 340; табл. 15 и 16) при рассмотрении вопроса
об абсолютной конфиrурации. .
Накопление большеrо количества данныХ, возможно, по-
зволит по амплитудам «волн» кривых дисперсии вращения
кетонов судить об C1 или -положении кетоннои rруппы в кон-
цевом кольце по отношению к сочленению колец (см. табл.7,
часть Б). )
В целом приведенные выше материалы дают основания
считать метод дисперсии вращения расширенным и значи-
тельно улучшенным вариантом метода инкрементов молеку
'Лярноrо вращения (Бартон), поскольку дисперсия оптиче
cKoro вращения определяется при сотнях раз.тIИЧНЫХ длин
волн, а не по одной волне.
Определение положения функциональных rрупп
(карбонильных rрупп)
При исследовании рядов соединений, для которых имеются
надеж"ые эталонНые кривые дисперсии вращения, единствен
ным источником Д(щных, которые не удается получить дру-
rими физическими методами, часто может оказаться кривая
дисперсии HOBOfo соединения. Так,. в ряду стероидных кетонов
циклоrексаноновоrо типа почти каждое ПО,lIOжение кетонной
rруппы характеризуется определенной «волной», что пок зы
вают рис. 4 и 5 и данные табл. 5. Джерасси и Базельская
rруппа исследоват.елей [15] привели при мер стерОИдноrо MOHO
кетова (HPS 50), полученноrо деструкцией сердечноro аrли-
кона танrиниrенина. I(ривая дисперсии вращения моноке-
тона подтверждаеТ rипотезу, что ке1'онная rруппа в этом CTe
роиде (а следовательно, и. место присоединения ЭПОКСИДноrо-
цикла в исходном аrликоне) находится при С-7. Друrими
примерами являются рубиджервин (12 кетостероид [212], «фак.
тор выделения натрия» (20-кетостероид [202]), метаrенин
(7 кето 5.стер )Ид) и буфоталинин (19-кетостероид) [228].
Проблемы абсолютной коифиrурации
Определение относительиой К,онфиrурации "
Характер кривых дисперсии вращения поли циклических
соединений (особенно кетонов) в значительной степени обу-
словлен их стереохимией, поэтому кривые дисперсии враще
ния часто мож,но использовать для определения относитель-
ной конфиrурации асимметрических центров.
Важным примером подобноrо использования кривых дис-
персии является устаНО13ление р-конфиrурации водородиоrо
Общие положения
В прoriIлом метод инкрементов молекулярноrо вращения
(обычно A[M]D) нашел широкое применение для установления
абсолютных конфиrураций [154, 156, 191]. В будущем сравне-
ние кривых дисперсии вращения явится rораздо более COBep
шенныМ методом. определения абсолютной конфиrурации.
Действительно, даже в случае плавных кривых дисперсион
ный метод имеет то преимущество, что при rрафическом вы-
ражении полученных давных инкременты умножаIQТСЯ на 100,
что позволяет более четко проследить общий ход кривых.
Метод еще более чувствителен при наличии эффекта КОТ-
тона; так как кривые дисперсии вра ения в этом случае
имеют характерную форму. Само собои разумеется, что ви
цинальные и конформацИ,онные эффекты потребуют при ис
пользовании кривых дисперсии вращения для установления
абсолютной конфиrурации rораздо более тщательноrо aHa
Лиза, чем при монохроматических исследованиях (см.
стр. 351 358) .
334
Дисперсия рnтичеСКО20 вращения
Плавные кривые
17рuло енuя дисnеРСUОНН020 метода
335
ной [M]v, но в общем ero кривая дисn.ерсии (кривая пересе
кает ось абсцисс при "" 350 ммк) является положительной и
почти параллельна кривой соединения XCVII (R == ОСН з ).
Следовательно, ( )-эпиафцелхин имеет ТО же простран
ственное строение, что и ( ) -эпикатехин.
2. Хотя почти все некетонные сапоrенины XCVIII xapaK
теризуются крутыми отрицательными кривыми (что обуслов
лено спирокетальными rруппами в кольцах Е и Р) [4], соеди
нения подrруппы 22Ь сапоrенинов, например цикло ф или
aHa ca рсасапоrенин (XCIX), дают KPYTI:1I( положительные
кривые. По видимому, причиной этоrо является обращение
конфиrурации у асимметрическоrо атома С-22. Характер кри '
вой дисперсии позволяет rОраЗдо точнее установить строение
исследуемоrо соединения, чем одни величины [M]v. Спироке
тальные системы рассматриваются в работах [72, 244].
3. Тринстейн и сотр. [134] в последнее время произвели
расчеты кривых дисперсии, для отдельных асимметрических
центров изомеров октопина, ПОJIЬЗУЯСЬ методом, приведенным
Ниже приведены три примера использования плавных кри
вых для установления абсолютной конфиrурации.
1. Кривые дисперсии вращения [91] некоторых продуктов
расщепления катехинов [60] представляют очень хорошйй
пример использования плавных кривых дисперсии для опре
деления абсолютной конфиrурации.в тех СJIучаях, коrда вели
чины оптическоrо вращения ДJIЯ D линии Натрия не позво-
.'lяют сделать определенных выводов (рис. 11).
+2
С( 9С Нз
Н I
СНЗ0 У:Х О, .
I
h' OH
Н
ОСН з
XCVI а (R = осн з )
fетраметиловый эфир
( ,. Эl1икатехина
ХСVlб (R= Н)
fриметиповый эфир
I )-эпиафцелхина
'"
I
s!
><
"&.
L.:::I
хсvш
22а- Сl1иростан
Л,ММК
60CJ
2
/
Рис. 11. нбензилкар6инолы.
A XCVII (R. ОСН.) нз тетраметиловоrо эфира
( ) эпнкатехи а; Б I':. XCVlI (l OCH.) из TeTpa
метиловОrо э ира (+) катехина; B XCVII (R H) из
тримет ловоrо эфира ( )-эпиафцелхииа.
Замещенный дибензилкарбинол (XCVII; R == ОСН з ), об
разующийся при раскрыIиии кольца тетраметиловоrо эфира
( ) -эпикатехина (XCVI; R == ОСН з ), дает плавную ПОЛОЖJl .
тельную кривую дисперсии вращения. Ero энантиомер, по-
лученный из тетраметиловоrо эфира (+ ) катехина, характе-
ризуется энантиомерной плавной отрицательной кривой дис
персии вращения, причем ни положительная, ни отрица-
тельная кривые не пересекают оси абсцисс. Карбинол (XCVII;
R == Н), полученный из триметиловorо эфира ( )-эпиафцел'
хина (XCVI; R == Н), характеризует'ся отрицательной величи
R
СН О ОСН' СН OCH
3 ( ,: 2 3
У"'СН 2 /'с,......оН
0013
XCVII
ДН"СIIЗИJlкарбинол 1)
25
ty ' 22/;;:::;l-'
20
о
:
н XCIX
22Ь Спиростан
"
') Важные данн.ые, уточняющие строение соединения XCVII, прнве
Ден!>! в статье Дж. к.!]аfж Льюиса (253).
336
Дисперсия o,r-чеСК020 вращения
п риложения дисnер.с...иОННО20 метода
337
в разделе «Классичес е исследования», стр. 274. Они уста-
новили, что ПРИРОДIjь1й изомер состоит из остатков d-аланина
и l.арrинина (С).
«ООН «ООН
H C NH H
I I
I I
СН з (СН 2 )з
I
NH
,
N H .C N
С
Октопии
персии вращения, дающих возможн{){:ть наrлядноrо сравне-.
ния. В этом отношении кривые рис. 12 rораздо больше
подходят для сравнения, чем несколько точек, полученных
при различных величинах длин волА.
Пики кривых всех медных комплексов двух rрупп а амино-
кислот появляются при 522 ммк, а впадины при 689 ммк
4. Друrим ПрИМероМ использования плавных кривых дис.
персии вращения MorYT служить исследования эметина [242].
......,
о
. .... в
.....,
,
'е
"
,
"
"
"
+500
Кривые с эффеиmо-м Коттона
Медные комплексы амииокислот. Прекрасный пример
устщювления конфиrурации по кривым с эффектом Коттона
содержится в классических исследованиях Пфейфера и Кри-
стелейта [215, 216], посвященных аномальной дисперсии вра-
щения окрашенных в rолубой цвет медных комплексов ами-
нокислот, которые поrлощают в видимой части спектра. Ав-
торы установили, что три rруппы «природных» аминокислот,
rенетическая связь которых в то время еще не была уста-
новлена, дают кривые дисперсии одноrо и Toro же общеrо
типа, и сделали вывод об одинаковой конфиrурации изучен-
ных кислот у а уrлеродноrо атома. I(ривые дисперсии вра-
щения медных комплеКСов 1 ( + ) и <d ( ) -валина и ( ) -фе-
нилаланина, полученные Пфейфером иКристелейтом. пока-
заны на рис. 12.
500
,
,
'.
" . JI
,... --....
' 1000
7000 6000 4500
о
Л,А
Рис. 12. Медные комплексы а-аминокислот [215. 216].
A l (+)-валин; Б d ( )-валин; B l ( )-фенилапанин; кривая В
почтн совпадает с кривой А в области от 600 до 500 ММК.
GI
(максимальная изученная 'длина волны) или при более длин-
ных волнах. Амплитуды имели порядок 1O 20 а Х 10 2.
Медный ко-Мплекс ( )-пролина, в котором атом азота вхо-
дит в цикл и является вторичным., характеризуется четко вы-
раженным. rипсохроМНЫМ эффектом (пик 484 ммк; впадина
572 .ммк; а Х 10 2 5).
Пфейфер и Кристелейт [216], а также Каррер [140] в ре-
зультате исследования ме.дных комплексных соединений уста-
новили, что ( )-rлюкозаминовая кислота имеет d 8 -конфиrу-
раЦИ19 при С-2. Пфейфер и Кристелейт распространили этот
метод на a-окСИКИСЛОТЫ и наШJ1И, что медные соли d-rлюко-
новой, d.rалактоновой и d.мо.тючной кислот характеризуются
2 q!l , !4!I!
R
: #0
H y NH2""" O <;r
- Cu :
c cY' 'NH2 ? H
I
R
Л\сдныii комплекс
1- аМllllOКИСЛQТЫ
Сходство кривых дисперсии вращения ( }-фенилаланина
и 1 ( + ) -валина свидетельствует об одинаков<tй конфиrураuии
тих IЧН':ЛОТ и служит п.римером использовани кривых дне-
"338
Дисперсия оnтр(еСКО20 вращения
Лриложенuя дисnерсиОIOtО20 метода
339
кривыми дисперсии ВI:J J;ИЦения , в общем сходными с кривой
дисперсии вращения d валина.
rруппой исследователей, работающих в Бетесда [135], не-
давно установлено, что для rлутаминовой и аспараrиновой
кислот и их амидов спраiзед.'1ИВЫ общие закономерности, вы-
явленные в работах Пфейфера и Кристелейта. Если рассчи-
тать, какая часть дисперсии оптическоrо вращения прихо-
дится на долю a цeHTpOB медных комплексов аминокислот с
двумя асимметрическими центрами (треонин, пролин и др.),
то окажется, что эти кислоты также подчиняются указанным
выше правилам.
.J,:r
н
С"
16 I\етостероид
0=(1
н
С 111
2-l(eTo A -НОР-'
(5а) СТероид
Коттона. (Это правило не всеrда распространяется на соеди-
нения, в которых карбонильная rруппа находится в а-Поло-
жении по отношению к месту цикла, затронутому замеще-
нием.) Следует также отметить, что изменения конформации
кольцевой системы MorYT полностью изменить знак кривой
с эффектом Коттона (см. раздел «Конформационные фак
торы», стр. 351).
Кетоны. Результаты подробноrо анализа стероидНЫХ
кетонов (стр. 288 322, табл. 5) навели Джерасси на мысль
. использовать кривые дисперсии вращения этих соединений
для установления их абсолютной конфиrурации. Для этоrо
был исследован ряд бициклических кетонов известной абсо-
лютной конфиrурации, аналоrичных обычным типам стероид-
ных соединений (см. табл. 5). Оказалось, что полученные
кривые с простым эффектом Коттона имеют тот же знак, что
и кривые дисперсии стероидныХ аналоrов (исключение состав-
ляет 9-метил траkС декалон-l, стероидный аналоr KOToporo ве-
дет себя аномально). На основании полученных данных был
сделан вывод, что «характерные особенности кривых диспер-
сии аЛИЦИКJIических монокетонов в целом обусловлены CTPYК
турой и стереохимией rрупп, расположенных в непосредствен-
ной близости от карбонильной rруппы». Следовательно, обоб
щенный метод инкрементов молекулярноrо вращения [150,151,
157] можно распространить. на кривые дисперсии вращения.
Джерасси [7] следующим образом сформулировал принципы
метода инкрементов применительно к дисперсии вращения:
а) Концевые IlИКЛЫ одноrо и Toro же типа характери
зуются инкрементами дисперczии вращения, которые до нек6-
торой степени не зависят от характера остальной части моле-
кулы.
б) I(аждый концевой цикл может существовать в двух
энантиомерных формах, которые имеют противоположные
по знаку инкременты дисперсии вращения. : .
Убедительной иллюстрацией BToporo принципа MorYT слу-
жить 16 KeTo-(CII) и А-нор-2 кетостероиды (CIII), кривые
дисперсии которых (рис. 5) являются почти точными зеркаль
ными изображениями.
Следует указать еще на одно общее правило, заключаю-
щееся в. том, что замена водорода на метильную rруппу в ме-
сте сочленения колец не меняет знака кривой с эффектоtJI
Таблица -/4
Терпен Стероидиый аиалоr
.тIитература ,)
а; Циперон, карриссон Холест 4 ен-3 он
(CIV) (сесквитерпены
ряда эйдесман )
-
CIV
а Циперон
7.XXIV, 7.ХХш.
4.XXVI
.
:н
СООВ
СУ
Веоабиетиновая КИСлота
Тетраrидросантонины,
11 (Н) Ана.1JОrи,
тетраrидроартемизин
Фриделин
{ 5а-(и 5 -)Холестан-
3-0НЫ
7.ХХXl, 7.ХХХIII
(ср. 69, 158, 77, 236)
Ненасыщенный кетон из
неоабиетиновой кис
.1JOTbI (СУ)
17а, -Метил-D-rомо-
андростан-17 -он
19-Нортестостерон
7.ХХII, 7.ХXI
7.XXXVI, 7.ХХХУ
22" -
') Арабские цифры ссылки на статьи Джерасси и сотрудииков. римские циф-
ры нумерация соединениll, принятаи в данноlI статье.
340
)1uсперсия ОnТuчеСКО2D врйU{енил
Таблица 15
Сопоставление строения стероидов 'с одной стороны и
. три-, ди- И сесквитерпенов с друrой, впервые В IПолненное
Клайном на основании монохроматических исследований ин-
крементов вращения, в дальнейшем получило cTporoe хими
ческое подтверждение [156, 191]. Соединения, для которых
было проведено подобное сопоставление, служат подтвержде
нием метода установления строения на основании кривых
дисперсии. В табл. 14 привеДенЫ заимствованные из работы
Джерасси [7] примеры . кривых дисперсиИ вращения, имеющих
ту форму, котор.ая была для них предсказана.
Друrие rrримеры, в которых конфиrурации БЫJIИ yCTaHOB
лены дисперсионным методом, приведенЫ в табл. 15.
Некоторые соединения, промежуточно образующиеся при
полном синтезе стерОИДО8. В ходе работ, посвященных ПОk
ному синтезу стероидоВ, проведенных в Оксфорде Корнфор-
том и Робинсоном [83], были выделены и разделены на опти-
ческие антиподы некоторые производные ЦUС-СUIi траliс-пер
rидрофенантрена. Двум рядам энантиомерных соединений,
обозначенных этими авторами как А ( + ) и А ( ), COOT
ветствую)' формулы CVlI и CVlII, но тоrда возникает в шрос,
какому ряду следует приписать какую формулу. Автором
данной статьи сделано нескОЛЬКО попыток установить конфи
rурацию этих двух рядов соединений методом инкрементов
молекулярноrо вращения, но ни в одном случае полученные
данные не оказались вполне надежными, чтобы их можнО
было опубликовать.
Эту проблему удалось решить [9] путем сравнения кривых
дисперсии вращения соединения ряда А ( ) (неприродные
соединения) с соответствующиМИ КР!lВЫМИ соединений ряда
В ( +) (природные соединения; циc aIiTи-TpaIiC ), которым co
ответствует формула CVI, по оптически активным полосам
поrJIощения, обусловленным кетОННЫМИ rруппами.
Терпеи
Литература ')
СтероидиыЙ аиалоr
Относительные конфиrурации
2 KeTO 19 Н9Рстероиды 2 Кетостероиды
5 Метил З,кето I9-норсте З Кетостероиды
роиды
1 О Окси З кето 19.HopCTe
роиды
Коrаrенин
1 8 Нор 1 7 кетостероиды
'Ф Сантоннн
7 OKCH 1 -кетосантановая
КИС.1Jота
Иохимбон
Триснорrопанон
З.Кето 5 , lОJ3 эстрон, про
изводные
I9 Нор И , 17а. стероид
{4 ен-З.он)
Алантолактон, производ
ные
Кадино.1J
4 Метил 6 кетоrептановая
кислота (из актидиона)
Альдеrиды с разветвлен
ной цепью (нз фито.1Jа)
Петазо.1J (сесквитерпен)
rиббереллиновая кислота
rексаrидринданоны и дe
калоны
I8.Hop-D-rомо 1 7 KeTOCTe-
роиды
Продукт расщеп.1Jения .1JY-
мистерола
В Нор З кетостероиды
$
х н
,.HR
' о
,
х :
н
CVH
А(+)
/'- I J1(R
w'O
х Н
CVIII
I\Н
') Арабские qифры ссылки иа статьи Джерасси и сотрудииков, римские циф'
ры нумерация соединений, принятая в данной стаТЬе.
2) Соrласуется с коНфИrурацией, установленной на основании величии [MJD[62,.152].
Середон
СУ!
8(+) (ПРИРОДllOе
(оединение)
Промежуточные соединения прн синтезе
дез D I4 кетоны
стероидов;
I 9 Мети.1J транс дека.1Jон 1
J
З Кето 19 нор 5а. стероид
З KeTo A нор 5J3 стероиды
З Кето 5J3 с:rероиды
Стероид 4-ен-З-он
Метилдека.1JОНЫ и стерои-
ды 4 ен З-оны
Дека.1JОНЫ
4.Метилrексан.2 он
А.1Jьдеrнды с развеТв.1Jен
ной цепью
Ll4(10) Окта.1JОН З
2- .и З-Кетостероиды и Me
. ТИ.1Jrексаrидринданоны
Метилированные аналоrи
«Обычные» стероиды
(4-ен З оны)
5J3:0кси З кетостероид
«Обычные» 17 кетостерои
дЫ
З К етостероиды
З-Кето 5 стероид
«Обычные»
З кетостерои
'ды
АЛ.1Jоиохимбон
7.LXVI1 (ср. 74)
7.LXIX
7.LII 2), 17.LllI
101
222
95
56, 243
130
24, 103
29
28
88, 235
19, 78, 219
106
33
213
223, 237
177
234
73
105
217
342
Дисперсия оnтичеСК-О20 вращения
Приложения дисnерсиОННО20 метода
343
Два соединения ряда А ( +) дали отрицательные кривые
с простым эффектом I(оттона, которые имеют (jчець 'близкое
сходство с кривыми дисперсии, полученными для соединений
ряда В ( + ), т. е. соединений природноrо типа. Сравнение этих
кривых П03lюляет с уверенностью утверждать, что соединениям
типа А (+) и А ( ) отвечают формулы СVП и СVПI cooт
ветственно. Приведенный пример служит хорошей иллюстра-
цией Toro, каким образом метод дисперсии вращения дает
четкий и определенный ответ на вопрос о стереохимии иссле
дуеМQrо соединения, в то время как прежний монохромати-
ческий метод инкрементов молекулярноrо вращения не по-
зволяет решить эту проблему.
ЧИНЫ [M]D при замещениях 3-0ксиrруппы были аномальными..
Кривые дисперсии родственных лофенолу кетонов указывают
на отсутствие аномалии в стереохимии мест сочленения ко-
лец, что заставляет предположить наличие каких-то иных
структурных превращений в непосредственной близости к
оксиrруппе в положении 3.
Поскольку Jiмеются препятствия к образованию rемике-
таля в положении C 3 {о чем можно судить по отсутствию из-
менений в кривой дисперсии лофанона в метаноле при введе-
нии: в раствор соляной кислоты (см. стр. 348)], MO>l5HO пред-
положить, что замещение происходит у С-2 или С-4; . путем
прямоrо сравнения удалось установить, что лофанон являет-
ся 4а-метил 5а-холестан 3 оном. Следовательно, лофенол
представляет собой 4а метил 5С1-холест 7 ен 3 -ол (СХII).
Указанное исследование структуры лофенола интересно с
точки зрения использования ряда новых методов, в том числе
масс-спектрометрии и парофазной хроматоrрафии, наряду с
описаННЫМИ выше оптическими методами.
Эремофилон. Этот ненасыщенный кетон ряда сесквитер-
пенов (в настоящее время известно, что он имеет строение
CIX) представляет особый интерес, так как он является од-
ним из немноrих терпенов низкоrо молек.улярноrо веса, ко-
торые не подчиняются изопреновому правилу.
Джерасси и сотр. [7] пытались установить абсолютную
конфиrурацию эремофилона путем сравнения ero кривой
дисперсии с соответствующими кривыми 4-eH 6 OHa (СХ) и
5-ен-4-0на (CXI) и пришли к выводу, что эремофилон являет-
ся энантиомером соединения CIX. Однако в дальнейшем
Фw
о о о
4 :
Н
C"II
'nофеllо,q
НО
CIX
ЭремофипОll
'сх
Стероид 4-ен-
6-0Н
с
СХI
Стеронд 5-ен-
4-011
СQвершенно очевидным является биоrенетическое значение
4-монометилстероида (ср. с циклэйкаленолом [87]) как про-
межуточноrо звена между 4,4, 14-тримеТИJ!стероидами типа
ланостерола и обычными c'rероидамй [113]. Мазур, Вейцман и
Зондхеймер [190] одновре{\'16ННО опубликовали данные о струк-
туре цитростадиенола 24 этилиденовоrо производноrо лофе-
нола.
химические исследования эремофилона, также проведенные
исследователями школы. Джерасси [96, 252], показали, что
в действительности он имеет строение CIX. По-видимому, не-
удача дисперсионноrо метода при определении простраlfствен-
Horo строения эремофилона обусловлена какими-то аномали-
ями конформации.
Терпены аномально['о пространственноrо строения; дитер
пеНJ>I (эперуковая и лабданоловая кислоты). Эперуковая
кислота, относящаяся к классу дитерпенов [148], является пер-
вым из известных высших терпенов, который при сохранении
общих структурных особенностей ди- и тритерпенов и стерои-
ДОВ характеризуется аномальной пространственной конфиrу-
рацией у С-I0 (по стероидной номенклатуре), как это видно
ИЗ формулы CXIIla. Кривые дисперсии [12] очень близких по
строеlfИЮ кетонов. полученных из эперуковой кислоты
Лофенол. Интересным примером, показывающим, как
данные метода инкрементов молекулярноrо враLЦения и кри-
вые дисперсии вращения дополняют друr друrа, является
стерол лофенол С 2в Н 4в О [98]. В результате реакций лофенола
установлено, что он имеет 7_CTPYKTYPY. но изменения вели.
344
Дисперсия оnтическоzо вращения
ПРUЛО!JiCения oиcпepcиDНH020 метода
345
(СХlIIб), с одной стороны, и из лабданоловой кислоты [76]
(СХIVб) и маноола (СХVб), с друroй стороны, ясно свиде-
тельствуют об аномальной конфиrурации. эперуковой кислоты
у С-I0. Соединение СХIIIб дает положительную, кривую .с
эффектом Коттона, в то время как соединения СХIVб и
СХVб (аБСОЛJOтнаяконфиrурация их не установлена) дают
отрицательные крИвые.
СХУ!
J<афеСТОJl
лоо..
СХIIIа (Н=СН 2 ; Н'= Н)
Эперуковая кислота
СХlIIб (Н=О; R'=СН з )
C R'
)+)'. '
CXIVa (R=СН з . ОН;
Н'= Н)
Лабд:аноловая кислота
СХIVб (Н=(): R'=СН з )
л
W
CXVa (Н=СН 2 )
Маноол
СХVб (Н = о;
боковая цепь при С 9
СН 2 СН 2 СООН)
СХУ"
Нор З кетон (uз
кафестола)
Ирезин. Джерас'си и Берстейн ([92]; ср. [94]), пользуясь
арrументами, аналоrичными приведенным ВЫШе для кафе-
стола, показали, что сесквитерпен ирезин, являющийся важ-
ным звеном биоrенеза терпенов, также характеризуется ано-
MaJlbHblM пространственным строением (а-метильная rруппа
у C-IO), как это видно по формуле CXVIII.
. Кафестол. Параллельные исследования по расщеплению
кафестола, проведенные школами Джерасси [55] и uХеворза
[126],. показали, что кафестол имеет видоизмененныи скелет
дитерПена типа СХУI (без уточнения стереохимических осо-
бенностей), в котором zе'м-диметильная rруппа в положении
С-4 заменена этильной rруппой (в дальнейшем ЭТа rруппа
входит в фурановый цикл). Вопрос о TQM, находится Ли aHry-
лярная метильная rруппа в положении С-I0 или С-Б, оставал-
ся открытым до тех пор, пока Джерасси, Кейсу и Митчеру
[93] не удалось показать на основании некоторых конформа
ционных соображений, что анrулярная метильная rруппа Ha
ходится в обычном положении, т. е. у С-I0. Дисперсионная
кривая 3-кетона СХУII, полученноrо из кафестола (CXVI),
показывает, однако, что по типу стрОения кафестол должен,
быть антиподом ( + ) -транс-декалона-3 и 5a-холестаН-3-0На'
или, если прибеrнутьк более точной аналоrии,. антиподом
4CI этил-5CI-холестаН-3-0на. Таким образом, кафестол один
из двух дитерпенов, в отношении которых установлено, что
по своему пространственному строению они являются антипо-
дами обычных соединений. Конфиrурация, приписываемая
кольцам С и D, основана H полученных 13 послеДнее. время
ДЩlflрIХ,
W iO . O
но-' . I
. н
СН 2 ОН
СХУIII
Ирезии
..О'
q
CXIX
13-Норкетон CXIX дает отрицательную кривую с простым
эффектом Коттона, которая является антиподом кривой 4а-
метил-5а"'"холестан-З-она, а кривая с эффектом Коттона род-
cTBeHHoro ирезину 2,6-дибром-[\4-З-кетона представляет со-
бой зеркальное изображение соответствующеrо производноrо
тестостерона (относительные внутримолекулярные конфиrу-
рации рассмотрены в рентrеноrрафической работе Россмана
и Липскомба [224]). '
rиббереллиновая кислота. rpOB, Сторк и сотр. [88, 235]
смоrли путем довольно сложных стереохимических ДОКаза-
тельств установить, что строение стимулятора роста расте-
ний"":'" rиббереллиновой кислоты OOTBeTCTByeT формуле СХХ.
Норкетоны типа CXXI, полученные из rиббереллиновой кис-
лоты, дают положительные кривые с эффектом Коттона. Эти
кривые MorYT быть использованы для установления про;тран-
cTBeHHoro строения представляющих интерес соединении типа
бицикло-[З,2, 1]-октан-6-0НОВ (см, ниже разделы, посвященные
филлокладену, стевиолу и др,)._.
з46
Дисперсий Оn'l'иче(ЖО20 sраЩеllиJl
J7рuло ения дисnерсиОННО20 метода
347
CXXlI
Филлонладен
СХХIII
Стевиол
сюау
Изостевиол
Сесквитерпены (rуайанолидная rруппа). Джерасси, Oceц .
кий и Херц [13] на аснавании кривых дисперсии' вращения
смаrли предварительна устанавить абсалютную канфиrура
цию рЯда представителей rуайаналиднай rруппы сесквитер
певав.
Тенулин (LХХХVП) [48, 66] и rеланалин (СХХУ) [70, 129]
представляют собай циклапентенаны. Их кривые дисперсии
являются антипадом кривай стераида 14-eH-16 aHa, паэтому
у С-Sих абсолютная канфиrурация такава, как эта паказ.ана
на формулах. Однака в этай связи неабхадимо сделать две
аrаворки: 1) предпалаrается, чта метильная rруппа у C 13
стероида и вадород у C 5 rуайанолидав эквивалентны (изве
стна, чта в случае циклаrексенанав это именна так; см. табл.
13 и рис. 9); 2) следует принять, что ДОвальна сильно заме
Щенное циклаrептановое кальца В эквивалентна циклоrекса
наваму кальцу. Оба эти дапущения представляются абасна
ванными, хотя желательно было бы получить прямые паД
тверждения канфиrурации. Аналаrичные данные ПОказывают,
чта уrлеродный атом C 1 rейrерина (LХХХVIП) [214] и лак
тона изофотосантановай кислоты (CXXVI) имеет конфиrу-
рацию.
ОН { "
о
СХХI
Норке'l'ОН из
rиббереЛЛИНОВОii
кислоты
&
Филлокладен. Недавна проведенное rpaHTaM и Хаджесам
[116] сапоставление страения дитерпена филлакладена и ма-
наала паказала, чта ФиллаКЛ8ден характеризуется нармаль-.
ным строением в месте сачленения колец А и В. Положитель-
ная кривая с эффектом Каттона, палученная для наркетона
LXIX напаминает кривые аналоrичных бицикло [3, 2, 1]-окта-
HaHa , палученных из rиббереллинавай кислаты (CXXI). Та-
ким 'Образам, два уrлерадных мастика между C 8 и С-13
(кольцо D) имеют ариентац ю, и палнае строение филло-
кладена выражается фармулаи СХХП. Следует указать на
рабату Бриrrса и сатр. [67], в кота рай приведены даполни
тельные данные астраении филлакладена, палученные при
изучении кетанав, абразовавшихся при расщеплении каль-
ца D.
Стевиол и алкалоиды Garrya. Дитерпен стевиол (СХХПI)
мажет быть превращен в кетан изастевиал (CXXIV), катарыи
дает 'Отрицательную кривую с эффектам Каттана [7]. Эта сви
детельствует о том, что полажение бициклооктанавоrо кальца
в малекуле саатветствует указаннаму в фармулах СХХIИ
и CXXIV, катарые энантиомерны CXXI. В 'Отношении
калец А и В, 'Одна ка, нельзя сделать каких либа 'Определен-
ных выводав. Аналоrичные aprYMeHTbl примениМы к а.l1калои-
дам Garrya. Кетан куахихицин [99, 246] также дает отрица
телы ую крииую с эффектам Каттона [7], т. е. ero кольца С
и D далжны иметь строение, соответствующее фармуле
CXXIV.
;)
о
СХХУI
.пактон изофото.
сан]оновой кислоты
cxxv
r еланалlIН
Кривые дисперсии вращения показывают также, что
ряд насыщенных кетонав (Дljrидрапроизвадные), родственных
рассмотренным выше ненасыщенным кетанам, имеют CTPYK
туру типа -rидриндана!Iа с транс-сочлененными кальцами.
(СПI). Все эти кетаны дают палажительные кривые с эф-
фектам Коттона.
Возможности применения а rалоrенокетонноro правила.
Как известна [10, 14], в аксиаЛьна замещенных а хлар- и
а брамкетанах стереахимия rалаrенокетаннай rруппиравки
'Определяет знак кривой с эффектом Каттона. .Испальзование
этаrа правила 'Открывает широкие перспективы для аПреде
ления абсалютной канфиrурации! а также для рещения раз-
IIИЧIЩХ структурных пробле ,
348
Дисперсия оптичеСК020 вращения
п риложения дисnерсиОННО20 метода
349
Абсолютная конфиrурация 1) аксиальных а-rалоrенокето
нов определяется в несколько стадий. Все стадии (за исклю
чением первой стадии, не всеrда обязательной)осуществля
ются с микроколичествами веществ, которые к тому 'же не
расходуются: 1) если замещение можно провести в положе-
, . .
ния а и а, а точное подожение атома rалоrена не известно
то ero положение необходимо установить химическим путем;
2) . аксиальная ориентация а-rалоrенциклоrексанона должна
получить подтверждение методами ультрафиолетовой и ин
фракрасной спектроскопии; 3) должны быть сняты кривые
дисперсии вращения.
После указанных определений описанным выше методом
(ср. LXXII) можно установить, какая из двух' абсолютных
. конфиrураций дает наблюдаемый эффект I(оттона (положи-
т льный или отрицательный). .
Следует отметить еще два случая использования дисперсии
вращения в ряду а rалоrенокетонов. Если абсолютная кон-
фиrурация исходноrо кетона известна, но не установлено по
ложение (/1 или ос') аксиальнОrо rалоrена, то об атОМ можно
будет судить по характеру кривой дисперсии вращения. На-
оборот, если известны абсолютная конфиrурация кетона и
положение rалоrенноrо заместителя, но спектроскопическое
. опреде,nение ориентации rалоrена затруднено из-за наличия
дополнительных карбонильных rрупп, то по кривой диспер-
сии вращения можно установить ориентацию (см. также [23,
26, 27]).
о:-положении и аксиальные заместители в .положении по от- .
ношению К карбонильной rруппе). В качестве примера можно
привести JJофенол (СХП) (см. также стр. 343).
ОбнаРУ1Кение оптической активности у соединений с весьма
малой величиной МОJIекулярноrо вращения
Интересной побочной линией спектрополяриметрических
исследований явил ось «обнаружение» ОПтической активности
тех соединений, которые дают весьма малые величины опти-
ческоrо вращения D линии Натрия, но при пер.еХоде к более
коротким длинам волн обнаруживают значительную оптиче-
скую активность. Примерами подобных соединений MorYT
служить продукт расщепления витамина В 12 [75] (СХХУII) и
два тетраrидроионандиола [250], выделенные из мочи живот-
ных (СХХVIП).
Бициклическое соединение СХХVП имеет величину
[M]D + 1°,.AIO [М]З65 составляет 1650. Диолы СХХVПI ВПер
вые были выделены Прелоrом и др. [218] из мочи жеребых
кобыл. ПО данным этих авторов, они не проявляют измери-
мой оптической активности при D-линии натриЯ, что, воз
можно, объясняется внутренней компенсацией. ОднаКО диаце-
таты и дибензоаты этих стероидов характеризуются замеТНI;>IМ
вращением в диапазоне 500 300 мм/с (дисперсионные кривые
Диацетатов и бензоатов были сняты проф. Джерасси).
Еще раньше Прукнер, Острейхер и Фишер [220] исследо-
вали производные хлорофилла, которые казались лишенными
оптической активности.
римене''Ние для анализа
Любое свойство какorо-либо вещества, кОторое прямо про-
порционально концентрации данноrо вещества Х в pac
Т80ре, может ()ыть испо.львовано для аналитических целей.
O NH
снз- --CH2CH2COOH
О О
N
Н
CXXVII
Продукт рзсщеппеНIjЯ
BIJTBMljlja B I2
Образование rемикеталя. По предложенному Джерасси,
л. Митчером и Б. Митчером методу [22] в раствор насыщен-
Horo кетона в метаноле вводят небольшое КОЛичество соляной
( .
кислоты и отмечают изменения характера дисперсионной
кривой, обусловленные образованием rемикеталя.
" н+ ,,/ОН
/ с==о + СНзОН С
/ "'-ОСН)
Исчезновение кетоннОЙ «волны» свидетельствует о поЛfIО
те образования reM-икеталя. При частичном образовании re-
микеталя уменьшается амплитуда «волны», причем скорость
и степень уменьшения амплитуды определяются несколькими
структурными факторами, в том числе размером кольца и кон-
формационными факторами (экваториальные заместители в
J) Этот н последующий разделы заимствованы из работы [254}.
CXXVIII
ТетрзrIJДРОIJОIjЗН-
ДIjО/lЫ
350
uсnерсия оnrичеСК020 враtЦенuя
п риложения дисnерсиОННD20 меТйда
351
Поскольку величины молекулярноrо вращения мноrих соеди
нений в области ПОлосы поrлощения MorYT оказаться значи-
тельно выше (до 100 раз) величин вращения для D-линии
натрия, точность измерений оптическоrо вращения при дли
нах волн, соответствующих пикаМ и впадинам дисперсионных
кривых, довольно Велика. Джерасси [11] в качестве наrJ]ЯД-
Horo примера использования оптичесkоrо вращения для ана-
литических целей приводит определение криптоrенина
(CXXIX), присутствующеrо в виде примеси в диосrенине
(СХХХ) важном исходном веществе для промышленноrQ
получения стеl'ОИДНЫХ тормонов.
О
ствующим обрв,зом длинах волн не вызыва.ет сомнения (дe .
тальное рассмотрение спектров поrлощения СМ. в работе [233],
а та.кже [41]).
Джерасси Л 1] предложил использовать оПределение дис-
персии вращения также для изучения Кинетики изомериза-
ции кетонов. 5а- и 5;В-Холестан 6 оны (CXXXI) различаются
по величине [a]D Bcero на 400, но в случае [а]Зl0 разность
удельных вращений превышает 14000. Поэтому с помощью
спектрополяриметра при ДЛине волны 310 ммк МОЖно леrко
проследить ход изомеризации неустойчивоrо изомера (5 xo-
лестан-6-0на) под действием кислоты или щелочи.
ф
C:XXXI 1
6' -l(iетоlсТ.еро1lДЫ
"'.
Леви и Кук [175] описали применение фотоэлектрическоrо
поляриметра [176] для кинетических исследований ферментов.
Браун и Инrольд [68] использовали определение дисперсии
оптическоrо вращения для изучения кинетики реакций окта-
эдрических комплексов.
CXXIX
К'риптоrе'll1:f Н
СХЮG с
Диосrении
(спирост 5 ен З оп)
Конформационные факторы
Насыщенные кетоны
В стат-6е Джерасси, О. Халперна, В. Халперна и Рини-
кера [17] рассмотрены различные конформационные эффекты
в насыщенных иненасыщенных кетонах ТИПа циклоrексано-
на, причем основное внимание обращено на конформационные
эффекты, обусловленные алкильными заместИтелями и двой-
ными связями. Ниже будут рассмотрены только наиболее
важные конформационные эффекты.
В 1959 т. опубликована представляющая большой интерес
статья о тритерпенах [25]. Следует отметить, что значитель-
ную часть наблюдаемых конформационных эффектов удается
объяснить, пользуясь правилом Октанта (см. раздел «Пра-
вило октанта», стр. 368).
Эффект аксиальной метильной rруппы. Исследовались
эффекты, обусловленные введением метильных rрупп в а- и
-декалоны при различных положениях и конфиrурациях ме-
тильных rрупп по отношению к кетонным rруппам. При
Для. D-линии натрия разность величин удельных враще-
нии криптоrенина и диосrенина определяется как [a]D. (крип
тоrенин) [а]D(диоcrенин) == 700, а для длины волны
320 ммк эта разность будет друrой: [а]З20 (криптоrенин) [аJз о
(диосrенин) == 26000. . '
Расчет показывает что примесь 0,1 % криптоrенина в ди-
, о
осrенине изменяе1 величину [а)з20 на 0,026, если определяется
вращательная способность 1 % -ноrО раствора диосrенина в
поляриметрической трубке длиной 10 мм. u
Возможность разработки методов анализа смесеи, состоя-
щих более чем из двух компонентов, путем измерения опти-
чеСl<оrо вращеНИfl при ДBY или более подобранньр соответ-
352
Дисперсия Ьn'1'ическоiЮ вращений
п рuложения дисперсиОНН020 .метода
353
введении аксиальной метильной rруппы в декалон в а ПО-
пожение между кетонной rруппой и местом сочленения колец
(а в СХХХII) наблюдается один из наиболее резко выражен-
НЫХ эффектов, Заключающийся в уменьшении ампли'fУДЫ ке-
тонной волны. В противоположность этому введение соответ-
ствующей экваториальной метильной rруппы (е в СХХХII)
оказывает ЛИIlIЬ слабое влияние (или не дает никакоrо эф-
фекта) на кетонную олну.
2E( -
;
н
CXXXII
mpaHC Декалон
(замещение в
а -положеНИJ1)
.. НС i-I
I . - снз
I 3
: о
н
CXXXIV
транс - - Декалон
(тип ланостанона С
4.4- ди метильноrt rруппоrt)
'
I
e \ I : о
н
СХХХIII
транс- Дек ало"
(за 1ещеНllе в
'- положении)
Соединение
5a-ХолестаН-3-0Н
4а Метилзамещенный' (е В СХХХП)
4 -Метилзамещенный (а В СХХХП)
2а Метилзамещенный (е' В СХХХШ)
2 -Метилзамещенный (а' В СХХХШ)
2а, 2 -Диметилзамещенный (2е.м-ди
метильное соединение, а' + е'
в СХХХIП) . . . . . . . . .
При введении метильной rруппы (экваториальной или
аксиальной) в друrое положение рядом с кетоrруппой (а'
или е' в '-положение CXXXIII) наблюдается незначительныи
эффект или Он вообще отсутствует. Введение' 2е.м диметиль-
ных rруnп в '-положение вызывает некоторое увеличение
амплитуды ке'fОННОй вОЛНЫ. Примеры влияния заместителей
приведены ниже (ср. [17]):
«Обычные» 5а стерОИД-3-0НЫ и их бициклические аналоrи
(СХХХП; R==СН з ), а также их 19-нораналоrи (СХХХII;
R==H) во всех случаях дают положитеЛЬнЫе кривЫе с про
стым эффектом. I(оттона, _ причем на амплитуду оказывают
влияние заместители при С-2 и C 4, как это указано в пре-
дьщущем разделе.
4,4-Диметил-5а-3-0НЫ типа CXXXIV (независимо от Toro,
содержат они обычную анrулярную метильную rруппу при
С-I0 или нет) дают отрицательные кривые с эффектом Кот-
тона, если только картина не осложнена присутствием двой-
ных связей илц заместителей в кольце В.
Ниже приведены величины а Х 1 O 2 дЛЯ соединений этоrо
типа (ср. [17]):
aXl0 2
Ря;;:
4,4-Н,
(СХХХП)
+65, +45
+90!
+47
Ряд
41.4-(СН.).
((;XXXIV)
121), 162)
20. 15
1l
+45
+541
+7
+62
+73
5a-СтерОИД-3-0Н . . , .
19- Hop-5(х-стеРОИД-3-0Н
9- М е:rй'л-тращ-декалон
Причина подобноrо обращения знака не ясна, но, по-види-
мому, отчасти оно обусловлено «2-алкилкетонным» эффектом
[153] между положениями <;::-4 и С-З. а отчасти «пери»-эф-
фектом в положении между С-4 и С-6 (ср. CXXXIV).
Всю сложность факторов, определяющих знак эффекта
Коттона, вызываемоrо 3-кетоrруппой в ряду 4, 4--диметильных
соеДИНеНИЙ, можно проиллюстрировать также На слеДующих
примерах (см. табл. 9).
1. Введение . 8 -метильной rруппы (отмечена звездочкой
в формуле СХХХУ), как и в случае обычных пентацикличе-
ских тритерпенов (например, <<(1)>- и « »-амиронов), при водит
к получению положuтеЛbfЮЙ кривой.
+80
Друrими примерами являются тетра идросантонины и
тетраrидросантоновые кислоты 1) [31], а также 17С1-метил 17-
кето-D-rомостероиды [221].
:
Эффект 4,4-диметильных rрупп. Введение 4,4-димётиль-
ных rрупп оказывает rораздо большее влияние на дисперсион-
ные кривые -декалонов, как это видно на примере 4,4-ди-
метил-транс-декалонов-3 типа ланостан З-она (CXXXIV).
1) В случае тетраrидросантоновых кислот дисперсионные КРИВЫЕ
использовалнсь для определения абсолютной конфнrурации (см, СТР, 333)
1) Без 14а-метильнои rруппы.
2) С 14а-метильной rpуппой (ряд ланостана).
23 3ак. 1416
Приложен.ия дисnерсионн.О20 метода
355
354
'. Дцсnерсия оnтическоzо вращения
2. Перемещение двойной связи в соединениях ряда ланО
стана из положения 7, 8 (отриц телыJя КРИВ8s.!) в положе
. ние 8,9 также IJРИВОДИТ К nоложитеЛЫ;lOи кривон с эффектом
Коттона (CXXXVI) (5a-холест 7 еН-3-0Н и 5a-холест-8-еИ-3-0Н
дают положительные кривые).
3. Введение двойной связи У С-5 в ряду ланостана и
19-норланостана также обусловливает положительную кривую.
Ценность дисnерсионн()rо метода для установления KOH
фиryрации соединений этоrо ряда можно видеть из следую
щих примеров: ' .
1. Близкое сходство кривых, даваемых ланост 7 еН 3-0НОМ
и диrидробутироспермоном (CXXXVII) (89, 168], является
весКИМ доказательством в пользу 9а-Н-конфиrурации послед
Hero соединения.
2. Дисперсионные кривые мастикадиеноновой кис.т.юты
(CXXXVIII) й ее изокислоты [51, 229] связаны таким же об-
разом, как и кривые, даваемые ланост (и -8) -eH 3-0HOM; это
также подтверждает 9а конфиryрацию fj. -кислоты. .
3. Антиподный характер кривых алнузенона и 4, 4-диме
тил-19-норхолест-5-еН-3-0ва подтверждает 10а-Н -конфиrура-
цИЮ (CXXXIX).. приписанную алнузенону [86,231].
CXXXV
Т"Л ам"рона
(с SP-меТ"ЛЬНОi1 rруппоЙ)
CXXXVII
Д"rндробутироспермон
CXXXIX'
Алнузеион
R ф
2 9
,
Н
CXL
2.9,ДиалкlIЛ- тр.анс-декалон-I
Сде.11аны -первые попытки СОПОставить форму кривl,IХ С
эффектом Коттона различных 4, 4-диметил-3 кетонов со ско-
ростями их конденсации с бензальдеrидом, которую Бартон
и сотр. [47, 50] изучали в качестве критерия нарушений KOH
формации.
Среди друrих изученных и представляющих интерес соеди-
нений следует указать на 2, 9 диалкилдекалоны-l (диакси-
альный изомер CXL этих декалонов характеризуется обра-
щением знака эффекта KOTTOHlI) и 30-нортараксастан-20-0НЬЬ
(LXVI), дисперсионные кривые которых свидетельствуют об
аномальн стабильности в ряду этих соединений (ср. [36]),
с
CXXXV(
Ланост-S еН 3-0Н
". P-НенасыщеНН618 lU!тoнbl
Джерасси и сотр. [17] исследовали большое количес;в
а, .-ненасыщенных кетонов н обнаружили ряд случаев иHBep
сии сложноrо эффекта Коттона, причиной которой дол,
жны быть те или иные конформационные (стерические) эф
фекты.
Пр.едставляется лоrичным сна-чала рассмотреть ненасЬ!-
щенuые аналоrи аксиальных а-метилкетонов, т. е. аксиальные
j-замещенные а, -ненасыщенн.ые кетонЫ общеrо типа CXLi.
Соединения типа CXLI (6 замещенные тестостероны), у ко-
торых Х == Cl. Br или СНа, дают положительные кривые со
сложным эффектом I(оттона, т. е. происходит обращение
обычНО наблюдаемоro О1'рицательноrо знака кривых, давае-
мых стероидами 4-еН-3-0нами. 6 -Фтор- и 6 -оксиаilалоrи
23*
:
€XXXV((i
Мастинадненоновая кислота
(3 кетот"рукалл -1.24 диен.
26 овая к"слота)
356
Дисперсия оnтичеСКОi!О: вращения
п риложения ducпepcиOHH020 метода
357
Друrим исключительно наrлядным примером инверсии,
кривоЙ со сложным эффектом Коттона Является 8a-TeCTOCTe
рОН .<CXLIV), в котором одно кольцо (предположительно
IШЛЬЦ() В) приобретает форму ванны. Соrласно предположе-
ни\Ь', Д>керасси [17], в друrих указанных выше случаях И,нвер-
сиИ' :g'ro' Яhлеnие также обусловлено, вероятно, тем, что коль-
цо :}31Iiij>иОбретает искаженную форму ванНЫ. Он особо под
Цеjж"ва 1', что .ВО всех случаях обращения знака изменяется
строение соседнеrо кольца, по отношению к которому, (1, -He-
насыщенный кетон является экзоциклическим. Изменение кон-
фиrураuии Toro же кольца (как в случае 2, 2 диметил-4-ен 3-
она) или сосеДНеrо кольuа, если сопряженная rРУППа не яв
ляется по отношению к нему экзоциклической (например, в
4, 4.диметил 8-ен 7 оне), не дает существенноrо эффекта.
К друrим изученным примерам обращения знака относят-
ся ] .метил- и l1сх.-метилсrероиды (взаимодействие между за-
местителями в положениях 1 и 11 установлено при изучении
раз-личных проблем химии стероидов) и 1, 4-диен 3 оны ряда
сантонинов.
Кон.фор.мациО"llая пО 8иж"о€ть
.' .8 работе Джерасси и rеллера [18] весьма наrлядно была
rioi\i.3' Ha важность' кривых дисперсии для И УЧ,ения ПОдвиЖ
ньci;" конформiщий . (ср. (35]). Кривая дисперсии вращенИЯ
. 2 хлор"5 метилциклоrексанона была снята в нескольких рас-
творителях, причем в октане (неполярный растворитель) эф
фект Коттона оказался отрицательным,. а в. метаноле (поляр-
ный растворитель) положитеЛЬНЫМ. Это Можно объяснить
тем, что в неполярном растворителе соединение существует
преимущественно в конформации' CXLVIa, в то время как в
полярном растворителе преобладает конформация CXL Vlб.
Указанные выше предположения подтверждаются данны-
ми инфракрасной и ультрафиолетовой спектроскопии
(ср. [26, 27]).
'\, H,
LFЦ
cl
(Х == F, ОН), как и ре--зличные 6сх.-замещенные (экватори-
альные) эпимеры всех типов, дают отрицательные кривые.
Соединения энантиомерноrо типа, в которых аксиаль-
ная i метильная rруппа вызывает инверсию, являютсяпроиз
водными ,4-диметилхолест 5-ен-7 она (CXLII) (отрицатель-
ная кривая;. соединения, не содержащие 2е.м диметильных
заместителей, дают положительные кривые). Замена акси
альной метильНой rруппы в сх.'полЬжении, например, в 2, 2 ди-
метилтестостероне, не вызывает инверсии знака дисперсион-
ной кривой 4-еН-3-0на.
х: Ф
CXLV
Вэаи мОДеЙСТJ!Не между
Ip и Ilа заместитеJlЯМИ
с
Приведенные ниже примеры иллюстрируют обращение
знака дисперсионной кривой, обусловленное более удаленны
ми аксиальными заместителями, например, изоnропенилЬНОЙ
ИЛи какой-либо друrой rруппой у С-7, т. е. в д-положении к
карбонильной rруППе у С-3. а Циперон (СХLIП; Х ==
C (СН з ) =CH2 , экваториальный) имеет обычную отрица-
тельную кривую, но ero 7-эпимер эпн-а-циперон (CXLIII;
х == C (СН З ) ==СН 2 а, аксиальный) [189] характеризуется об-
'ращением дисперсионной кривой. Та же картина наБЛlPдается
в случае одной из 3-кетосантон-4-еновых кислот, изученных
Эбе [32] (CXLIII; Х == СН (СНз)СООНа), например, 7-эпикис..
лоты, которая характеризуется обращением знаКа кривой.
Однако наличия метильной rруППЫ у С-7 недостаroчно,для
обращения зшща эффекта Коттона, но при этом изменяетсs
форма дисперсионной кривой..
Х
'l;XLI
БР(а}- амешенный
4 ен-З-он
ОН-
CXL {У
80-TeCTO TepOH
x
CXLII
.4.4' Диметил
5 eH' 7 OH
CXLIIl
а.. Цилерон н.
родственные соеДинеll1Ul
I
Н
....
с"р'
о
CXLVla
(Диакси альная.
в октане)
СХLVlб
(Диэкваториапьная.
в метаноле)
в последнее время Джерасси и сотр. [30] для доказатель-
ства формы ванны в 2a-rомо-2 -метил-5сх.-холестаН 3-0не сталИ
пользоваться а rалоrенокетонным правилом.
Дисперсия оnтич.ескоео вращен.ия
358
Алеебраич.еСlCая обра60ТlCа кривых
359
ТрансаННjI./I.Яряое взааJllоде4ствив
Леонард, Джерасси и др, [20] обнаружили интересный
пример трансаннулярноrо взаимодействия азота с . рбо
.нильной rруппой в восьмичленнОМ . цикле, ПРИВОДSJщеrр к
аНОМ"аЛЬНОЙ дисперсии оптическоrо вращения. "етон GXLVII
.характеризуется отрицательным эффектом Коттона, КОТQрый
Jlвлаrается на положительную плавную кри ую; ero аН'Злоr
.С открытой цепью дает плавную кривую.
oa
W
С6НSСН2 НЗ
Н
CXL VH
иноrда из дисперсионной кривой кетона (обозначается СА).
требуется вычестlt кривую соответствующеrо дезкеtосоедине
fШЯ или спирта (обозначается c скелет)" как ПОRазывает
уравнеQие
ДВА == ДВ СА ДВ С '
На рис. 13 показаны rрафически результаты подобноrо
вычитания для 5а-спиростан-З-она и 5а-спиростана. Разно-
стная кривая, которая выражает вклад дисперсии вращения,
обусловленный только кетонной rруппой (А) в ее асимметри-
ческом окружении, почти совпадает с кривой дисперсии вра-
щения 5а-андростан-З-она. Дисперсионная кривая 5a-анЩ:Ю-
стана про.ходит ОченЬ близко от оси абсцисс.
АлrЕБРАИЧЕСКАЯ ОБРАБОТКА КРИВЫХ
Эффект «фона»
Важнейшие особенности КрИВЫХ с эффектом Коттона на-
столько резко в ражены, что они не маскируются даже круто
,
,
+20
p, X
, \
, \
, \ В
, '-
: А\
, '-
...
,
.
н
CXL VlIIa (н=о)
5а Спиростан-3'ОН
СХLVIlIб (н = H
5а - СПИРОСТ8Н
'"
I
О
8ицинальное взаимодействие двух по..- лощающих .
/ функциональных rрупп
20
При изучении вицинальноr6 взаимодействия между двумя
функциональными rруппами одноrо и Toro же соединения
вычисленная кривая дисперсии вращения бифункциональноrо
соединения (АБ) должна' Qblrb построена следующим .обра-
зом. Если ДВА И ДВБ величины вращения соотвеТСТВУЮIIIИХ
монофункциональных соединений, то .
Рис. -13. Вычитание кривой «фона» (ДИОКС8И).
А 51X-спиростан-3-0н (CXLVIII; R==O); Б 51X-спиростан
(CXLV.I11; R H2); .в (==A Б) вклад 3-кетоrруппы;
точка Х предстщ.ляет собой пик кривоli ДБ 5а-андростан-
З-она. которая почти одинакова с кривой В.
ДВ АБ == ДВА + ДВ Б ,
fюднимающимися или падающими участками КРИВЫХ, обус
ловленными наличием в составе молекулы непоrлощающих
rрупп. Однако для количественноrо сопоставления амплитуд
flO не Ч2 (ДВА + ДВ Б ), как это указывалось ранее [6]. Если
вклад дисперсии вращениц, обусловленный скелетом С (ДВС).
велик, то уравнение принимает вид
ДВ САБ .дBCA ДВ СБ ДВ С '
360
Дисперсия оnтичес"оzо вращепuя
Бартон аналоrичным образом вычислял инкременты опти-
ческоrо вращения при монохроматических исследованиях.
На рис. 14 и 15 приведены два при мера (ср. [6]). На
рис. 14 показана вычисленная кривая 5а-андростан-3, 17-диона,
60
""
I
Q
.....
..
.....,
40
Б
1/0
ЮО
,
,
I
I
I
: I А
ВО
:'\ r
:rj
1 f
: I
11
II B
I l
I I
I 1
, 1
, l
, 1
, I
, I Б
, I
, I
, ,
, ,
1 \
I \
, \
\
,
\
\
,
,
"
"
.........
..........
......................
В/'
,.
,
,
,
,
, ,
l'
1 ,
l'
\1
v
+20
.
(
.....................
.........................
C\I
I
><
.......
О
20
о
ЗОD 400 500(
Л, NlNl'f
600
Рис. 14. Вицинальный эффект (отсутствует; диоксан)
(ер. [6]).
А 5..-аидростаи-:kJи; Б Ба-аНJ!ростан-17 он: В 5...андростан-
З.17-дион (CXLIX) (экспериментальная кривая); r «вычисленная..
кривая ДЛЯ З,17-диова (совпадает с кривой В. иа исключением
небольшоro участка).
500
Рис. 15. Вицинальный эффект (имеется; метанол)
(ср. [6]).
которая практически совпадает с экспериментальной кривой,
т. е., как и следовало ожидать, вицинальное взаимодействие
двух значительно удаленных друr от друrа карбонильных
rрупп отсутствует. На рис. 15 показана аналоrичная кривая
для 5a-холестан.З,6-диона, но в этом случае вычисленная
кривая совершенно не похожа: на экспериментальную кривую,
А 5а.холестан З он; Б 5а.ХО,/lестаи--б--ои: B 5а.холестан.З,б.диои
(CL) (эксперимента.,ьная кривая): r «вычисленная.. крнвая
дла 3.б.ДlЮН8.
362
Дисперсия оптическоzо вращеlШЯ
Алzе6раическая 06ра60тка кривых.
, 363
калона (CLIII) показывает, что эти кривые при наложе7
нии друr из друrа почти совпадают (рис. 16). На этом OCHO
вании можно сделать предварительный вывод, что конденса-
ЦИЯ колец С и D с бициклической системой не оказывает
влияния на дисщ рсию вращения, или, ИН Мй словами, дис-
'персия вращения 5а-З кетостероида почти целиком обус-
;rовлена взаимодействием ближних центров у С-Б и C 1 О с
карбонильной rруппой у С-3.
что свидетельствует о значительном вицинальном взаимодей-
ствии.
CXLIX
ба- ДIIДРОСТ8н-3.17 - Дl10Н
о
.
н о
СЬ
5а - Холе.стан 3.6-дион
Сравнение полициклических кетонов и их бициклических
аналоrов .( СМ. также правило октанта)
Интересные результаты удается получить путем сравнения
дисперсионных крйвых полициклических кетонов и их про
стых бициклнческих аналоrов [155]. Рассмотрим соединения,
в которых функциональная rруППа нахоДИТСЯ в концевом
кольце, как это показано на примере формулы CLI. Места
CLII
Ба - Холестан: 3-0Н
от
t
Н
CLIII
тран.с-9- Метип
декапон-З ,
в случае 17-кетостероида (CLIV) и ero а-rексаrидрйнда-
H()HOВOro аналоrа (CLV) картина совершенно иная. Действи
тельно, кривые дисперсии вращения (рис. 17) этих соеДИlIе
пнй резко различаются по амплитуде, и разностная КРf!вая
(А-кривая) может быть построена алrебраическим путем (см.
.работу [41] о спектрах поrлощения). Следует иметь в виду,
что подразделение CYMMapHoro оптическоrо вращения на KOM
поненты; обусловленные отдельными асимметрическими цен-
,рами, не _,является достаточно строrим с физической точки
зрения, так как при этом не учитывается вицинальное взаи-
модействие. Однако, если иметь в виду допущенное упроще-
ние, то можно считать, что А-кривая' фор.малы-ю выражает
взаимодействие между удаленными асимметрнческими цeH
трами С-8, С-9 и т. д. И ка.рбонильной rруппой у С-17 в со-
единении CLIV.
ФУНlЩlf01f3ЛЬlf3Я
rрун п з
центр
()л IIЖННЙ иентр
CLl
5ЛII""'I'11 н удалеНIIЫЙ ас ыметричеСl<ие
иентры
<:очленения кольца, несущеrо функциональную rруппу, С
остальной частью молекулы можно назвать ближними асим-
метрическими центрами, а прочйе места сочленения колец
молекулы':"'" дальними асимметрическими центрами. Сравне-
ние бициклических соединений и их полициклйческих ан ало-
тов показывает, что в некоторых случаях кривая диспер<:ии
вращения полициклическоrо соединения обусловлена rлав-
ным образом ближними асимметрическими центрами. В др у-
rих же случаях удаленные асимметрические центры оказы-
вают заметное влияние, что явля тся причиной «аномалий»,
обнаруженных в предыдущих исследованиях.
Сравнение дисперсионных кривprх 3-кетостероида ряда
.5а- (CLII) и ето бициклическоrо аналоrа меТИki'Ранс- де-
о
CLIV
ба-Андростан.17-0Н
с6
н
CL
транс' 8. Метил.
rексаrндр"llдан-I.ОН
361 .
Дисперсия оnтическ,оzо вращения
Цuклоzексано1tЫ новый общий подход
365
+20
' \
\
\А
\
Б "
........
..................
C'I
I
'"
500
....., о
)00
2D
роида и транс а.-декалона приводит примерно к аналоrичным
результатам, но L\-волна имеет более сложный характер.
:t2D
+80
{'
"
"
"
I ,.
I . \
: '
., '
, \
,
,
а
. о
.s.
Последний пример (рис. 18) относится к одному из тех
кетостероидов, которые дают кривые весьма необычноrо
типа, к 17a KeTo D roMocTe.
роиду (CLIV) и ero бицикли-
ческому аналоrу TpaHc-a.-дeKa
лону (CLVlI). Дисперсионная
кривая 17 a кетона аном льна
в том отношении, что она не + 60
имеет характерной кетонной
волны и при 312 ммк на ней
заметно лишь небольшое плечо.
Если же из дисперсионной кри-
вой D-rомокетона вычесть ди- +IJD
сперсионную КРИВУЮ ero би
циклическоrо aHa.uora, то полу
ченная кривая по cYIЦecTBY
будет представлять собой ке- + 20
ТОННУЮ волну, имеюIЦУЮ знак, C'I
обратный знаку кривой ,дeKa 'э
лона. Как и в предыдущем
D
. !\ \
l' B
. '" А
\.......... ........
B . ......................
. ....
20
Рис. 18. Сравнение стероидныхкетоно в
с их БИЦИКЛJlческими анаЩJrами [97, 155].
А 3 Оl(си.5а-D rОМOlЩl\ростан.17а он (CLVI) в мета-
ноле: Б ( ) mраltс.9-1i<етНЛJ\екалон--l (СLVЦ) в ди
. оксане; В разносrная кривая (А Б).
Само собой разумеется, что подобный эмпирический ме-
тод требует осторожности, но нет сомнения, что распростра-
нение предложенноrо разностноrо метода на все большее
число доступных бициклических аналоrов приведет к. ряду
интересных результатов. ...
2D
500
IJO
11
с6
н
CLVII
транс. 9. МеТИfl'
декаЛОII-1
BO
CLV\
3 - Окси-5а-D.
rомоандростан-I7а -ОН
Р Jf с. 16. Сравнение стероидных
кетонов с их бициклическими ана-
леrами (диоксан) [97, 155].
А 5сх-холестаН--З-ои (CLII):' Б (+)-траltс-
9-метилдекалои-3 (CLllI).
Рис. 17. Сравнение стероидных
кетонов с их бициклическими aHa
лаrами (диоксан) [97,155]. :
А 5сх-аИJ\ростаи 17 ои (CLIV); Б (+) траItС-
метилrексаrидриидан--l ОН (С LV);' В раз-
постная кривая (А Б)_
циклоrЕКСАНОНЫ; НОВЫй ОБЩИй ПОДХОД
Введение
В данном разделе кратко излаrается содержание статьи
Моффита и др. [198]. Некоторые выводы, возможно, носят
предварительный характер, но, по мнению автора, эта работа
является первой попыткой связать теоретический и эмпири-
ческий подходы к рассматриваемой задаче.
при мере, можно предположить, что в этом случае полученная
А кривая формально выражает взаимодействие между удален
ными центрами C 8, C 9 и т. Д. И 17а арбонильной rруппой в
соединении; CLV1. Сопоставление аномальноrо 5a. I KeTOCTe
36б
Дисперсия оnтuчеС/Ф20 вращения
ЦUICдоееICсаноны, новый общий подход
367
" До послеДl'.lеrо времени соиершенноотсутствовала воз-
MO HOCTЬ надлежащей проверки теоретичеСJ(И1i предположе..
нии, так как применялась настолько несовершенная аппара-
тура, что экспеРlfментаJiьно можно было изучать весьма orpa-
ниченное число соединений. В настоящее время блаrодаря
внедрению в лабораторную практик:у спектрополяриметра
Рудольфа и широкому использованию этоrо прибора школой
Джерасси [1 30) число снятых кривых" ДИСl]ерсии вращения
кетонов превышает 2000: .
В недавно опуБJщкованной теоретической работе Моффи-
та и Московитца ([197]; ер. [91, rл. 12 и 13]) оптическая ак-
тивность поrлощающих соединений объясняется взаимодей-
ствием между поrлощающими функциональньщи rруппами и
связанными с ними атомами и rруппами. rеометрия более или
менее .жесткой циклоrексановой системы подробно изучена,
вследствие чеrо применение теоретически}( положений к цик-
лоrексанонам не представляет особоrо труда.
Считается, что лучшей мерой асимметрии rрупп, окружаю-
щих хромофор, является функция эллиптичности, называемая
приведенным вращением (RK). Знак приведенноrо оптическо-
ro вращения тот же, что и. эффекта Коттона. Путем сравне-
ния показано, что в случае соединений, для которых были
сделаны подробные расчеты [200]. величина R K весьма при..
ближенно пропорциональна амплитуде кривых с эффектом
I(оттона. В данном обзоре амплитуда ра.ссматривается как
суrубо приближенный показатель асимметрии rрупп, окру-
жающих карбонильную rрупцу, причем полностью учиты-
вается теоретическая ненадежность подобноrо подхода.
Ниже рассматриваются только частичное вращение на-
сыщенных кетонов, соответствующее полос поrлощения в
области 300 .м.мlc, а также влияние алкильных заместителей,
которые во мноrих случаях относятся к циклам; отличаю-
щимся от циклоrексаноновоrо "кольца. Все данные если нет
особой оrоворки, заимствованы из работ Джера си и ero
школы и получены при исследовании мет анальных растворов
(Д относится к величинам, полученным для раствора в ди-
оксане). Знак и величина эффекта Коттона указаны цифра-
ми в скобках, например (+ 25). Все величины указаны ДЛ5j-
а Х 10 2, т. е. представляют собой молекулярное, а не удель-
ное вращение. .
rеометрия циклоrексанонов
Циклоrексаноны Moryт быть представлены перспективной
формулой CL VIlI t которая делится на восемь октантов тремя
плоскостями:
" а) вертикальной плоскостью, проходящей через О. С\ и
С 4 ;
б) rоризонтальной плоскостьЮ, проходящей через C 1 , C 2R И.
C 2L (экваториальные заместцтели у С 2 Н и C 2 L находятся почти
целиком в этой плоскости);
в) вертик-альной плоскостью, проходящей через середину
карбонильной связи и перпендикулярной плоскости а.
Проекция кольца" и ero заместителей на вертикальную
плоскость правее С.., показанная на CLIX, может быть назва-
на октант ной проекцией, Атомы в кольце обозначены еле..
дующим образом: 1 карбонильный уrлерод; R2' L 2 атомы
уrлерода в а положении к карбонильной rруппе (правый и
левый соответственно); Rз, L з aTOMЫ уrлерода; 4 1- атом
уrлерода.
CL VIII
Uиклоrексанон
1 ;. а
+ I 1: I
ЗL 4 ЗR "" .
I j! I
.. _e L==.. ёP - 2 . R !I ....
I I
I . I +
I I I
а а
,
CLIX
Октаитная проекuия
Связь, соединяющая заместитель с атомом уrлерода коль-
ца, обозначается номером 'Этоrо атома, после KOToporo стоит
буква (аксиальный) или е (э.кваториальный). Так, напри-
мер, R2a обозначает аксиальную связь У BToporo атома уrле-
рода справа.
368
Дuсnерср,я оптическ;оzо вращения
Цuклоzехсаноны, новый общий подход
369
Правило октанта
В ПрОСТ IХ ПрОJiЗводных циклоrексанона все заместителн в
кольце находятся В четырех октантах формулы CLVIII, уда-
ленных от наблюдателя, т. е. за вертикальной ПЛОСкостью С.
Для этих Простейших случаев правило октаНта может
быть СфОРМУJIИРQвано следующим образом:
1. Вклад атомов, лежащих в дальнем НИжне.М Правом и
дальнем верхнем левом октантах, в парциально\'>f вращении
является положительной. .
2. Вклад атомов, лежащих в дальнем НИЖнем левом и
д«льнем верхнем правом октантах, в парциальном враlЦении
является отрицательной.
3. Атомы, лежащие в любой из плоскостей, разделяющих
октанты, не влияют на парциальное вращение.
К rруппе 1 относятся атомы R2ll, L3a, L3e; в rруппу 2
входят атомы L2a, R3a, R3e, а в rруппу 3 атомы R2e, L2e 1),
4а,4е.
В некоторых более сложных случаях часть молекулы мо-
жет находиться в одном или нескольких из ближних октан-
тов, т. е. слева от плоскости С в формуле CL VIII. Атомы, на-
. ходящиеся в каждом из Э'fих ближних октантов, вносят в
.суммарное оптическое вращение свой вклад, который по знаку
противоположен вкладу этих же атомов, если бы они нахо-
.дили(ь в дальних октантах. Так, атомы в ближнем нижнем
правом и ближнем верхнем левом октантах вызывают отри-
цательное оптическое враlЦение, а в ближнем нижнем левом
и ближнем верхнем правом положительное.
Правило аксиальных а rалоrенокетонов, paccMoTpeHHOt:
выше [10, 14], по-видимому, является частным случаем об
щих принципов, сформулированных в ("настоящем разделе.
Следует подчеркнуть, что предложенный метод ОСНован на
УПРОlЦенных представлениях о:rеометрии циклоrексаноновоrо
кольца [82] и не учитывает некоторые тонкие ОСQбенности
строения, которые в настоящее время еще не ясны. Более
детальное изучение, возможно, позволит установить для
каждоrо из заместителей полуколичественную характеристику
ero асимметричности,
rpaMMe CLX. Эта диаrрамма по существу представляет собой
упрощенный вариант ОR;тацтной проекции CLlX.
Верхнцй левый I Верхний правый
Нижний левый ] НижнllЙ правый
CLX
Октантная диarрамма
1. Каждый важный для оптическоrо вращения атом обо-
значается в соответствующем уrлу диаrраммы своим номером
(если это атом уrлерода) или номером и символом (прочие
атомы, за исключением водорода, который не указывается).
2. Атомы, находящиеся в четырех дальних октанта}/'
(большинство в большей части молекул), обозначаются араб-
скими цифрами, атомы, расположенные в четырех ближних
октантах, курсивом.
3. Атомы, JIежащие в любой из плоскостей раздела ОК-
тантной диаrраммы или взаимно компеНСНРУЮlЦиеся (попар-
но) блаrодаря симметрии относительно ПЛОСJ;<ОСТИ раздела, не
указаны на диаrрамме.
Примером изображения соединения на октантной диа-
rpaMMe может лужить CLXI.
R
!
! R
' :
,<. I
"" li IIз...-..li ==
7.........в g.....1I.. I
I I
rlO"""'"
- . .+ - .
i
CLXI
Октантнан диаrрамма для
3-кето- Ба- стеРО\lда
Условное обозначение важных атомов
Те атомы, которые находятся в восьми октантах и суще-
ственно влияют на величину оптическоrо вращения, можно
приБJlИженно, но удобно представить' на крестообразной диа-
') в качестве первоrо приближения.
Декалоны .Н сте оидные кетовы
В табл. 16 18 знаки эффекта Коттона, предсказанные по
пр?вилу октанта, сопоставляются со знаками и величинами
9ксперйментал но найдеЩЮfоэффекта KOTTOl.ia для ряда
24 Звк. 1410
Метнлдекалон" 1)
tаблица /6
. Таблица 17
Стероип.иые кетон", (5«, A:B тpaHC) (CLXV)
ПОJlоженне
Ke'lOHHOII rруппы
Важные заместители 2)
Эффект Копона
Эффект Коттоиа
ПОJlQЖе!l"е
Ке'!'О!llЩЙ Важиые заместители ') предсказаииыйl
rpуппы
иайденныll 2)
1 16,7 ? Не выражен
19, 18; 12, /73
u боковая цепь
2 D +С кольца, 7, 191 -+++ +121
з 16, 15, 1, 6 I + +65
4 I 19, С + D кольца 94
6 19 /12, 18, кольцо D 76
7 /2, 3 16
16, 15
11 16, 181 + +16
/
12 2, 3, 4, 5,.6 I ++ --Н2!
18(бокоаая цепь)
предсказаниыйl найдеиныll 1)
9 Me т и л-транс"д е к а л о н ы (CLXI1)
1 15,6 + 2Д
9СН з
2 (8СН з )6, 7,8,9СНзI ++ +524)
3 7, 6, 5 I + -+47
4. I 9СН з , 8, 7 32 5)
9-М е т и л-цис-д е к а л о н ы
к о н фор м а Ц и я 11)
1 I :с: п
8
I
\5.6
9 С Н з
I 8, 7, 9СН з
I
5 .:
I
I :СН з
21 :с
8, 9СН з
3 1 С; П
не
6,5
-1 :с; п
9СН з , 7, 81
+
]
+51
++
} Непзвесте"
++
}
1l
D-r о м о ке т о н ы (CLXV1)
А+ В кольца I
18
++
J
?
Не выражен
17а
+11
+
17
18,12,11,19,4,3,2
96
') Все ВeJlНЧНИЫ указаиы ДllJI соедниений с аиryЛJlриоll {j -метильиоll rруппой и за-
местнтеJlJlМИ в левом KOJIЬцe (как в соединениях CLXII eLXIV).
2) Атомы, не указаиные на диаrpаММах, иаходятся а плоскости раздела мв
взаимно КОМпеНСНРУЮТСJl (попарио).
8) Ампл_туда: 4 )( 1O 2.
1) С допопiIвтельиоfl 8'СН8 rpyппоfl.
1) ВЬ(чllСЛево по раВ80весиоfl смеси цuс- и t'paHC-НЗОNеров.
8)-.с стерондоподобиаJl коиформаЦИJl (CLXIII).; не -- иестерондопод06иая КОН-
формаЦИJl (CLXIV); n предпочтитепЬН8J1 конФОРIll8ЦНR.
'. ц-фры. ваБРIIинЬ(е курсивом, обозиачают атомы в БJlИЖИНК ОlCтактаж
(ср. c:tp. ЗIi9).
., АМПJlитуда: а Х 10 2. ВОСК.1lицаТeJlьныll зиак (1) показывает, что в коротковоп-
HOBolI qблаСТИВJ(стреNУIII дисперСИОЩ(оll IФИIIQII и.е был ДOCT!lrнyт. Т. е. нстиltВ811
lIeJ1И'llllltl .а, по-вндимому, превышает указаиную. .
8) Атомы 11, 18 и 1 "8 Q.ц.вrС1l I)РЧТI!. !!слl! "е Т9Чllр. в верТIIКIjЛ"lIоlI 1J",OC O,т.
:2-'.
372
Дисперсия оnтическоео вращения
9-метилдекалонов и стероидных кетонов (А: В-цuс- и А: В-
транс-). Как видно из таблиц, существенных расхождений
между предсказанными и найденныМи величинами нет.
В случае цuс-декалонов экспериментальные данныепозво
ляют установить предпочтительную конформацию. Эти вы-
воды можно сопоставить с теоретическими предсказаниями,"
сделанными на основе конформационных соображений [153J.
со
t н
о в этом
кольце
CLXIII
цис 9-МеТНJ\декалнн
(нестерондоподобнаи
конформации)
,
4 : 6
н
CLXV
5а Стероид
10J\оженне
кетоивой
rруппы
цис- етилдекалин
(стеро идоподобнаи
конформация)
It
JЬ
I
Н
CLXVI
D - r ОМО стеронд
, ,.(1)
зLD.
4 н 6 .
CLXVlI
5 -CTepOHJI
ЦиклоееКСйНОNЫ, HOBb.la общий nодход
373
Таблица 18
Стероидные кетоны (5 ; А:,В-цuс) (СLХVП)
Важные заместитеJ\И 1)
1
C+D кольц: I
I С + D кольца, 19
I 5, 16
15, 17, 18. 13, 14'1
8, 12, 11, 19, 9
19112, 18, кольцо D
3,4
11 14, 3
16, 15
16, 1816
4,3
2, 3, 4, 5, 61
18 (боковая цепь)
CLXII
тp= w:.""
о в зто!.' CtXIV
кольце
2
3
4
6
7
11
12
...
курсивом.
обозиачают
') ЦIlФРЫ, набранные
[ер. стр.' 369).
1) Амплитуда: а Х 1O 2.
Эффект Копона
предсказаВНЫАI наi!дениый ")
136
Неизвестен
Zl
++ +3
77
+ +29
+ +15
+ +10
атомы в блвжннх октантах
Следует обратить внимание на некоторые ИН1:ереСНрlе при-
меры. 2 Кето-5а.-стероид представляет собой соединение, в
котором все важные заместители расположены в одном октан-
те. Это соединение, как и следовало ожидать, характеризует;;
ся больШИМ (положительным) эффеКТ9М Коттона. 3-KeTOCTe
роиды отличаются высокой степенью симметрии относительно
плоскости, в которой расположена карбонильная rруппа и
атомы C 10 и C-19.B 5 -изомере число важных заместителей
сведено к минимуму за счет Toro, что складывание молекулы
обусловливает перемещение ряда удаленных атомов (7, 8,.
9,11 и 18) J} rориаQl:Iта.прную плоскостр карбоtl И ,1I{:>JiQi{ rРУПfl ,
Соединения 17a-кето-D-rомо-5а- и l-кето-5а-рядов обла-
дают той особе'нностью, что их кривые диспеРСflИ вращения
характеризуются отсутствием эффекта Коттона (или слабым
эффектом I(оттона) [51. Эта особенность 'наrлядно иллюстри-
рует <;ильное влияние удаленных колец, которое сводит на нет
эффект з местителей, расположенных ближе к карбонильной
rрурпе. Транс-9-Метилдекалон (CLXVIII) дает отриц-втель-
ныи эффект Коттона ( 32). в то время как 17a.-кето' D-rомо-
стер о ид (CLXIX) характеризуется кривой с очень слабым
эффектом KOTTOHa Это явление можно объяснить тем что
все 11 , ко,льца А и . (рт С-l до С-l О) почТи целиком Л $ат
BepxH l>1 P 9M (IlQ,1IQжителЬПQМ) квадранте,' .
374
ilисnерсия оnтuчеСЮО20 врйUЦе uя
Литература
875
3-----4 5 6 1 I
i А 18 1 i
::;; 2-----1--.....41>----9------8 1 15 lб
Н С 1. t I I
з 1I 12----lз ... ....I1 .
"8 .
нз<': .,
CLXVIII
9. Метил. траНС - деК8J10Н I
= А +8 ItОJlыt8
18
6. О j е r а s 5 i с., С I о s s'o n W., J. Аm. Chem. Soc., 78, 3761 (1956).
7. О j е r а s s i С., R i n i k е r R., R i n i k е r В., J. Аm. СЬет. 50С., 78,
6362 (1956).
8. D j er аа s i С., R i n i k е r R., R i n i k е r В., J. Ат. Chem. 8ос., 78,
6377 (1956).
9. D j er а 5 5 i С., К 1 уп е W., СЬет. and Ind., 1956, 988.
10. О j е r а 5 s i С., К 1 У n е W., J. Аm. СЬет. Soc., 79, 1506 (1957).
11. О j е r а 5 s i С., Bull. soc. сЫт. France, 1957, 741.
12. О j е r а s s i С., М а r s h а] I О., Tetrahedron, 1,238 (1957).
13. Ojerassi с., Osiecki J., Herz W., J. Org. Chem., 22, 1361
(1957).
14. Ojerassi С., Osiecki J., Riniker R.., Riniker В., J. Ат.
Chem. Soc., ВО, 1216 (1958).
15. D j е r а s s i С., Н а IO р е r n О., Н а 1 р е r n V., 8 с h i n d I е r О.,
Т а m m С., Helv. СЫт. Acta, 41, 250 (1958).
16. О j е r а 55 i С., М а r s сЬ а 11 О., J. Ат. Chem. 8ос., ВО, 3986 (1958)'.
17. Djerassi С., Halpern О., Halpern V., Riniker R., J. Ат.
Chem. Soc., ВО,4ОО1 (1958).
18. Djerassi С., GeIler L. Е., Tetrahedron, 3,.319 (1958)'.
19. D j е r а s s i С., М а r s h а 11 О., N а k а n о Т., J. Ат. Chem. Soc.,
ВО,485З (1958).
20. L е о n а r d N. J., А d а m с i k J. А., О j е r а s s i С., Н а 1 р е r пО., J.
Ат. Chem. Soc.,ВО, 4858 (1958).
21. Djerassi С., 1\rakower G. W., J. Ат. Chem. 80<:., 81, 237
(1959). .
22. Ojerassi С., Mitscher L. А., Mitscher В. J., J. Ат. СЬет.
Soc., 81,947 (1959).
23. О j е r а s 5 i С., 'F о r па g u е r а 1., М а n с er а О., J. Ат. Chem. Soc.,
81, (1959).
24. О je-r а s 5 i С., .G е 11 е r L. Е., J. Ат. Chem. 8ос., 81, 2789 (1959)'.
25. Ojerassi С., Osiecki 'J., Closson W., J. Ат. СЬет. Soc., 81,
4587 (1959).
26. Ojerassi С., Geller L. Е., Eisenbraun Е.' J., J. Org. Chem.,
в печати, 1959. .
27. А lli n g е r N. L., А 1 1 i n g е r J., G е 11 е r L. Е., О j е r а s 5 i С., J.
Org. Chem., в печатн, 1959.
28. А е Ь i А., О j е r а s 5 i С., Helv. Chim. Acta, 42, 1185 (1959).
29. С r а Ь Ь 6 Р., О j е r а s s i С., Е i s е n Ь r а u n Е. J., L i u S., Proc.
СЬет. Soc., 1959,264.
30. О J е r а s s i С., F i n с h N., М а u 1 i R., J. Ат. Chem. Soc., 81, 4997
(1959).
31. SjБЬеrg В., Fredga А., Ojerassi С., J. Аm. Chem. Soc.,81
. 5002 (1959).
32. АЬ е У., Н а r u k 8 W а Т., 1 s h i k а w а Н., М i k i Т., S u m 1М.,
Toga Т., J. Ат. СЬеm. Soc., 78,1416 (1956).
ф
н
::.
I
I
I З -Ek--) r
I '! I = C "
. '1 8 i 9 2 7. ' J
f{з С i
CLXIX
110' Keto-D. rОNостероид
Правило октанта было проверено на большом количестве
кетонов, изученных Дщерасси с СQТРУДНИJ(ами. За неболь-
шими исключениями все предсказания, относящиеся 1< соеди
нениям, молекулы которых представляют собой простые
сочетания циклоrексановых колец, соrласуются с эксперимен-
тальными данными КаК по знаку, так в щ:tfовном и по ве.пи-
чине эффекта Коттона.
В отношении кета нов с внутрикольщ выIии мостиками и
циклопентанонов картина не столь ясна в настоящее время, и,
возможно, для решения поставленной задачи потребуются
полуколичественные методы.
л и ТЕР А ТУР А1)
1. О j е r а s s i С., F о It z Е. W., L i Р Р m а n А. Е., J. Аm. Chem. Soc.,
77, 4354 (1955).
2. F о lt z Е. W., L i Р Р m а n А,. Е., О j е r а s s i С, J. Ат. Chem. Soc.,
77, 4359 (19551. .
3. L i Р Р m а n А. Е., F о I t z Е. W., О j е r а s s i с.,. J. Ат. Chem. Soc.,
77, 4364(1955). :
4. О j е r а s s i С., Е h r 1 i с h R., J. Ащ. Chem. Soc., 78, 440 (1956).
р. Ojerassi С., Closspn W., LipPlJlan А. Е., J. Аm. Chem. Soc.,
78, зi6З (l9Q ). .
1) СсыJtКи на ОСНовНЫе статьи ДЖ!!РЩ'СIJ с сотрудниками, ПОСВЯЩj!Н-
ные изучению дисперсии оптичеС1{оrо вращения, приведеиы в иач'Эле в по
рядке их опуБJj К "!iН S! tlJзпример, ССрЩ 1 9 9r" rp'B}'IO'J' ча-
рям I ХЧ, . .
376
Дисперсия оnти'lескоео вращенuЛ
Литература
377
33. А е Ы Н., G r о Ь С. А., 8 о Ь.ц щ а с h е r Е., Helv. СЫт. Acta, 41, 714
(1958).
34. А i r s R. S., В а 1 f е М. Р., 1 r w i п. М., I< е n у оп J., J. Chem. Soc.,
1942, 531. .
35. А II i" g е r J., А II i" g е r N. L., Tetrahedto", 2, 64 (Ш58).
36. Ames Т. R., B to"J; L., Bowers А., Halsall Т. G.,
J о" е 5 Е. . Н., J. Chem. Soc., 1954, 1905.
37. А n d е r s о n 1. G., В а 1 f е М. 15., К е n у о n J., J. СЬет. Soc., '1950,
1866.
38. А n d е r s о" 1. G., В а lf е М. Р., К е n у о" J., J. Chem. Soc., 1950,
1868.
.39. А r с u s с. L., I< е n у о n J., L е v i n Б., J. Chem. Soc., 1951, 40.
40. А r с u s с. L., К е n у о n J., J. Chem. 80с., 1939, 916.
41. А. u 1 i n Е r d t m а n G., СЬет: and Ind., 1955, 581.
42. Baldwin W. с. G., Wolfrum М. L., Lowry Т. 'М.,. J. Chem.
800., 1935, 696.
43. В а 1 f еМ. Р., J. Chem. 80с., 1950, 1871.
44. В а 1 f е М. Р., В е а v е n G. Н., К е n у о n J., J. Chem. Soc., 1950,
1857.
45. ВаНе М...Р., Irw'i" М., Ке"уоп J., J. Chem. 8ос., 1941,312.
46. Balfe М. Р., Hargreaves М. К, Кепуоп J., J. Chem. 80с.,
1950, 1861.
47. Barton D."H. К, Experiei1tia, Sиppl. 2,121 (1955).
48. В а r t оп D. Н. R., О е М а у о Р., J. ;Chem. Soc., 1956, 142.
49. Barton о. Н. К, Ое Мауо Р., Shafig М., J. Chem. Бос., 1957,
929.,
50. В а r t о" О. Н. R., Н е а d А. J., М а у Р. J., J. Chem. 8ос" 1957, 935.
51. В а r t о" о. Н. R., S е о ап е. Е., J. СЬет. Soc., 1956, 4150.
52. В а ит g а r t n е r G., Т а' m m С., Helv. СЫт. Acta, 38, 441 (1955)'.
53. Баженов Н..М., Видревнч Т. В., ЖФХ, 28, 1310 (1954).
54. Баженов Н. М., Волькенштейн М.("В., ЖФХ, 28, 1299 (195.4).
55. В е n d а s Н., О j е r а s s i С., Chem. and Ind., 1955, 1481.
56. Be"eso.va V., Sy.kQra V., Herout.V., Sorm Р., СЬет. Щldl"d.,
1958, 363.
57. .В е tt i М., Trans. Farad y SQc., 26, 337 (1930), ,
58. В i е 11 m а n n J. Р., С r а Ь Ь е Р., О u,r i 5 S о" G., Tetrahedro", 3,
303 (1958).
59. Bijvoet J. М., Peerdeman А. Р., v.an Воттеll A:J., Nature,.
168, 271 . (1951); I<oninkl. Ned. Akad. Wetenschap. Рl'ОС., 54В, 11)
(1951).
60. Bircb А. J., Clark Lewis J. W., Robertson А. V., J. Chem.
8ос., 1957, 3586.
61. В о" n е r W. А., J. Ат. Chem. Soc., 71, 3348 (1949).
62. В о 5 е А. К, С h а t t.e r j е е В. О...1 у е r R. 8., India" J. Phatm., 18,
185 (1956).
63. Bottomley W., Соlе А. R. Н., White D. Е., J. Chem. 'Бос:,'
1955, 2624.
64. В r а n d В., W а s h Ь u r n Е., Е r I а" g е r В. Р., Е II е" Ь о g er' Е.,
О а n i е 1. J.;' L i Р Р in а n n Р., S с h е u М., J. Ат. СЬет.. Soc., 76,
5037 (1954).
65. Brandt С. W., New Zeala"d J. Sci. Techol., 348,46 (1952).
66. В r а и" В. Н., Н е r z W., R а ь i n d r а" к; J. Ат. Chem. Soo., 7.д,
4423 (1956).
67. В r i g g s L. Н., С а i n В. Е, О а v i s В. R., W i 1 m s h u r 5 t J. К..
Tetrahedron Letters, 1959, N9 8, 13.
68. В r о w n D. О., 1 п g о 1 d С. К, J. Chem. Soc., 1953, 2680.
69. В r и d е r е r Н., А r i g о "i D., J е g е r О., Helv. СЫт. Acta, 39,
858 (1956). .
70. В ii с h i G., R о s е n t h а 1 О., J. Ат. Chem. Soc., 78, 3860 (1956).
71. Biirer Т., I(ohler М., Gii"thard Н. Н., Helv. СЫт. Acta, 41,
2216 (1958).
72. С а 11 о w R. к., М а 5 s у . В e.r е s f о r d Я. N.,. J. Chem. Soc., 1957.
4482.
73. С а 5 t е 11 s J., Jo" е s Е.. Я. Н., М е а k i n s G. О., W i Il i
а m sя. W. J., J. Chem. Soc., 1959, 1159.
74. С h о Р i- а N. М., С о с k е r W., Е d w а r d J. Т., М с М u r r а у Т. В. Н.,
8 t и а r t Е. R., J. Chem. 80с., 1956, 1828.
75. Clark V. М., J.oh"son А. W., Sutherla"d 1. О., Todd А. R.,
J. Chem. 80с., 1958, 2383.
76. С о с k е r J. О., Н а 1 s а 11 Т. G., J. Chem. 80с., 1956, 4262; 1957, 4401.
,71. С о с ke f W., О О d d s N. J. Н., М с М u r r а у Т. В. Н., Tetrahedro",
3, 160 (1958).
78. Conto} Н., Соhеп Е., J. Org. Chem., 23, 616 (1958).
79. С о о S о n R. С., J. Chem. Бос., 1954,282.
80. Coo'kson R. С., Oandegaonker S. Н., J. Chem. 800.,1955,352.
81. Cookson R. С., Oa"degaonker S. Н., J. Chem. 80с., 1955, 1651.
82. С о r е у Е. J., 8 n е е n R. А., J. Ат. Chem. Soc., 77, 2505 (1955).
83. С о r " f о i- t h J. W., R о Ь i nt> о n R., J. Chem. 80с., 1949, 1855.
84. С.оНо" А., А"". сЫт. et phys., 8, 347 (1896).
85. С о t t о" А., О е 5 с а m р s R., с. R. Acad. Sci., 182, 22 (1926).
86. С о u r t " е у J. L., G а s с о i g n е R. М., S z u m е r А. Z., Chem. and
liid., 1956, 1479.
87. С о х J. S. G., К i "g Р. Е., К i n g Т. J., Proc. Chem. 80с., 1957, 290.
88. Cross В. Е., Grove J. Р., McCloskey Р., Mulhol.
1 а n d Т. Р. С., К 1 У n е W., Chem. and Ind., 1959, 1345.
89. D а w s о " М. С., Н а I s а 11 Т. О., J о " е s Е. R. Н., М е а.
k i n s G. О., Р h i I1 i Р 5 Р. с., J'. Chem. 80с., 1956, 3172.
90. О j е r а s s i С., 15th Natio"al Orga"ic Chemistry Symposium of the
America" Chemical Society, 1957, Abstracts of Papers, р. 12.
91. Д ж е р а С с и К., Дисперси" QnтичеСI<;оrо вращения, ИЛ, 1962.
Дисперсия оnтичеСl>ОZО вращения
. ЛитераТУРА
З79
378
92. О i е r а s s i С., В и r s t е i n S., J. Ат. СЬет. Soe., 80, 2593 (1958)'.
93. Ojerassi с., Cais M.,.Mitscher L. А., J. Ат. СЬет. 50е., ВО,
. 247 (1958). .
94. Ojerassi С., Оопоуап Р. W., Burstein S., МаиН R., А. Ат.
Chem. Soc., 80, 1972 (1958).
95. Ojerassi С., Ehrenstein М., Апп., 612, 93 (1958).
96. О j е r а s s i С., К 1 у n е W., Proc. СЬет. 50е., 1957, 55.
97. О j е r а s s i С., М а и 1 i R., Z а 1 k о w L. Н., J. Ат. Chem. Soe., 81,
3424 (1959).
98. О j е r а s s i С., М i 11 s J. 8., V i 11 о tt i R., J. Ат. Сhепi. 80е., ВО,
1005 (1958).
99. О j е r а s s i с., S m It h С. R., L i Р Р m а n А. Е., F i g d о r 5. К,
Н е r r а n J., J. Ат. Chem. 80с., 77, 4801, 6633 (1955).
100. О о Ь r i n е r К, К а t z е i1 е 11 е n Ь о g е n Е. R., J о n е s R. N., The
Infrared Absorption Spectra о! 8teroids Ап At1as, Interscienee риыi-
shers, Inc., New York, 1953.
101. О и n s t а n W. J., F а z а k е r 1 е у Н., Н а 1 s а 11 Т. а., J о.
n е s Е. R. Н., Croat. Chim. Acta, 29, 173 (1957).
102. Е i с h h о r n G. L., С а i r n s J. F., Nature, 181, 994 (1958).
103. Е i s е n Ь r а u n Е. J., О s i е с k i J., D j е r а s s i С., J. Ат. Chem.
50С., 80, 1261 ( 1958) .
104. Е 11 i s о n L., К е n у о n J., J. СЬет. 8ое., 1954, 779.
105. F ie s е r L. F., F i е s е r М., Steroids, Reinho1d Pl.IbHshing Corp., New
York, 1959, р. 209 216.
106. F i s h m а n J., Chem. and Ind., 1958, 1556.
107. Fit t s о. О., К i r k w о о d J. G., J. Ат. Chem. 50С., 78, 2650 (1956).
108. F i t t 5 О. О., к i r k w о о d J. G., Proe. Natl. Acad. 8ei. U. 8., 42,
33 (1956).
109. Fordyce. W. В., Green J., parker А. С., Biochem. J., 68, 33
(1958).
но. French Н. 5., Gens С. М., J. Ат. Chem. 50С., 59, 2600 (1937).
111. French Н. 8., Naps М., J. Ат. Chem. 80е., 58; 23()3 (1936).
112. G а t е s J. W., Chem. and Ind., 1958, 190.
113. G а и t s с h i F., В 1 о с h К, J. Ат. Chem. Soc., 79, 684 (1957У.
114. G е r r а r d W., К е n у о n J., J. Chem. 80е., 1928, 2564.
115. G i 11 h а m Е. J., J. 8ci. Instr., 34, 435 (1957).
116. G r а n t Р. К, Н о d g е s R., Tetrahedron Letters, 1959, Ng 10, 21.
\17. Gray С. Н., Nicho1son О. С., Кlупе W., Jones Р. М., Nature,
184, 41 (1959).
118. G r о s j е а n М., L а с а m А., L е g r а n d М., ВиН. 50С. chim. France,
в печати, 1959.
119. Н а g е n Ьа с h А., z. physik. СЬет.. 89, 570 (1915).
120. Н а r g r е а v е s М. К, J. Chem. 80с., 1953,2953.
121. Н а r g r е а v е s М. К, J. Chem. 80с.; 1954, 1233.
' . Har reave5 М. 1\., J. Chem. oC'119541178Jr
123. Н а r g r е а v е s М. К., J. Chem. 50е., 1957, 1071.
124. Hargreaves М. К., Richardson Р. J., J. Chem. 80с., 1957.
2260.
125. Hargreaves М. К., Richardson Р. J., J. Chem. 80е., 1957,
3823.
126. Н а w () r t h R. О., J о h 1I S t о n е R. А. W., Chem. and Ind., 1956, 168;
J. СЬет. 80е., 1957, 1492.
127. Н е 11 е r W., in Weissberger А., Ed., Physical Methods о! Orga-
nic Chemistry,Vo1. I о! Technique о! Organic Chemistry, 2nd ed., In.
terscience Publishers, lпе., New York, 1949, Pt. 11, Chap. ХХIII.
128. Н е 11 е r W., J. Phys. СЬет., 62. 1569 (1958).
129" Н е r о и t V., R о m а i'i и k М., S о r m F., СоНесНоп Czechoslov. Chem.
Communs., 21, 1359 (1956).
130. Н е r о u t V., 8 У k о r а V., Tetrahedron, 4, 246 (1958).
131. Н i r s t Е. L., W о о d С. Е. et аl., J. Chem. Soc., 1932, 2108; 1 9за,
1564; 1934, 1151, 1825; 1935, 295, 1658; 1936, 1403; 1937, 848.
132. Н о 11 о w а у А., К е n у о n А.. Р hi l1i р s Н., J. Chem. Soc., I92В,
'Зооо.
133. Н и d s о n Н., W 01 f r о m М. L., L о w r у Т. М., J. СЬет. 50е., 1933,
\179.
134. I z u m i у а N., W а d е R., W i n i t z М., О t е у М. С., В i r п
Ь а u Ip 8. М., К о е g е 1 R: J., G r е ел 5 t е i n J. Р., J. Ат. Chem.
Soe., 79, 652 (1957).
135. Izum iya N., Winitz М., Birnba.um 8. М., Greenstein J. Р.,
J. Ат. Chem 50е., 78, 1602 (1956).
136. J а m е s Т. W., L е v е d а h 1 В. Н., Bioehim. et Biophys. Acta, 17, 453
(1955). .
137. J о n е s Р. М., К 1 У n е W., J. Chem. Вос., в печати, 1960.
138. К а и z та n n J., W а 1 t е r J. Е., Е у r i n g Н., СЬет. Revs., 26, 339
(1940).
139. К а r r е r Р., К а а s е W., He1v. СЫт. Acta, 2, 436 (1919).
140. К а r r е r Р., М е у е r J., Helv. СЫт. Acta, 20, 407 (1937).
141. Кепуоп J. et. а1., J. Chem. Soe., 1938, 312, 2104, 1452; 1939, 1697;
1942, 18; 1945, 273; 1954, 136&, 1955, 2051.
142. К е n у оп J. et а1., J. Chem. Soc., 1939, 633.
143. К е n у оп J. et а1., J. Chem. 80с., 1939,916.
144. К е n у о n J. et а1., J. Cht;m. Soc., 1941, 263.
145. К е n у о n J. et al., J. Chem. Soe., 1949, 2153.
146. К е n у о n J. et al., J. Chem. 80с., 1949,2721.
147. К е n у о n J. et а1., J. Chem. Soe., 1 93Q, 1156; 1940, 676; 1951, 382
148. К i n g F. Е.. J о n е s G., J. Chem. 80е., 1955, 658.
149. К i r k w о о d J. G., J. Chem. .Phys., 5, 479 (1937).
150. 1<: 1 У n е W., J. Chem.Soc., 1952, 2916.
151. К 1 У n е W., J. Сhещ. 50С., 1953, 3072.
152. К 1 У n е W., Chem. and Ind., 1953, 1032.
380
1(исnерсия О ТUЧескоkо враtЦения
Литература
'381
153. 1( 1 уп е W., Experientia, 12, 119 (1956}.
154. 1( lу n е W., in Braude Е. А., Nachod Р. с., Eds., Determination
of Organic Structures Ьу Physical Methods, Academic Press, lпс., New
York, 1955 .
155. 1( 1 У n е W., D j е r а s s i С., Angew. СЬеm., 69, 683 (1957).
156. 1( 1 у n е W., О u r i s s о n G.; в печати.
157. К 1 У IJ е W., S t о k е s W. М.. J. СЬеm. Soc., 1954, 1979.
158. 1( о v а с s о., н.е r о u t V., Н o.r а k М., S о r m Р., CoHection Czechos.
lov. Cbe . Communs., 21, 225 (1956).
159. 1( иЬ n W., Ber., 62, 1727 (1929).
160. 1( u h n W., Trans. Faraday Soc., 26, 293 (1930).
161. I(uhn W.; Z. Elektrochem., 56,506 (1952).
162. 1( u h n W., В i 11 е r Н., Z. physik. СЬеm., В29, I (1935).
163. I(uhn W., BilIer Н., Z. physik.Chem., В29, 256 (1935).
164. l(uhi1 W., Braun Е., Z. physik. СЬеm., 88,281 (1930).
165. КиЬп W., Freudenberg К, Wolf' I:, Ber., 63, 2367 (1930).
16б. I(uhn W., Gore Н. К., Z. physik. СЬеm., 812,389 (1931).
.167. Kuhn W., Lehmann Н. L., Z. physik. СЬеm. BI8, 32 (1932).
168. Lawrie W.; Hamilton W., S.prin-g' F. S.,Watson Н. S., J.
СЬет. Soc., 1956, 3272.
169. L е v е d а h 1 В. Н., J а m е s Т. W., ВiocЫm. et Biophys. Acta, 21, 298
(1956); 23, 442 (1957).
170. L е v е пеР. А., М а r k е r R. Е., J. СЬеm. РЬуз., 1, 662 (1933).
J71. Levene Р. А., RothenA., J. СЬеm. Phys., 4,48 (1936).
172. Levene Р. А., Rothen А., J. Chem. Phys., 4, 442 (1936).
173. L е v е пеР. А., R о t h е пА.; J. Org. СЬеm., 1,76 (1936);
174. L е v е пеР. А., R о t h е пА., in Gilman Н., Organic Chemistry,
John Wiley and Sons, lпс., New York, 1938, Vol. Н, СЬар. 21.
175. L е v у а: В.. С о о k Е. S., Biochem. J., 57, 50. (1954). .
176. Levy G. В., Schwed Р., Fergus О., Rev. Sci. Instr., 21, 693
(1950). <.
177. Loke К Н., Marrian G. Р., Johnson W. S., Meyer W. L.,
С ат е r оп О. О., Biocbim. et Biophys. Acta, 28, 214 (1958).
178. L о w r у Т. М., Optical Rotatory PoWer, Longmans, GreeIi and Со.,
New York, 1935.
179. L о w r у Т. М., В а 1 d w i n W. С. G., J. СЬет. Soc., 1935, 704.
180. L о w r у Т. М., В а 1 d w i n W. С. G., J СЬет. Soc., 1937, 233.
181. L о w r у Т. М., С о о d е А d а m s W. . с., PhiI. Trans.. А226, 39}
(192п.
182. Lowry Т. М., Gore Н. к., Proc. Roy_ Soc., A135, 13 (1932).
183. L о w r у Т. М., Н u d s о n Н., Phil. Trans., А232, 117 (1933).
184. L о w r у Т. М., L j s h т u n d R. Е., J. Cllem. Soc., 1935, 709.
185. L у 1 е G., Abstr., 136th Meeting, Arп. СЬет. Soc., Septem er 1959,
71Р.
186. М а t е о s J. L., С r а т О. J., J. Ат. СЬет. Soc., 81, 2756 (1959).
H 7.' М а t hi.e u J.. Р" Les ,Theories Moleculares du Pouvoir Rotatoire Na-.
turel, Gautie-VШаrs, Paris, 1946.
188, Ма: Иеи J. Р., J. СЬет. Phys., 33,78 (1936); Bul'" SOC. chim. France,
3, 463 (1936).
189: М с Q ui 11 i n F. J., J. СЬет. Soc., 1955, 528; 1956, 2670.
190. Mazur У., Weizmann А., Sondheimer F., J. Ат. Chem. Soc.,
80, 1007 (1958). .
191. М i 11 s J. А., 1( 1 У n е W., in l(Iупе W., Ed., Pr()gress in StercQ-
chemistry, Vo.. 1, Butterworths Scientifjc PubIications, London, 1954.
192. М i t с h е 11 S., J. СЬет. Soc., 1928, 3258.
193. М i t.c h е 11 S., С о r m а с k S. В., J. Chem. Soc., 1932, 415.
194. Mitchell S., Gordon R. R., J. СЬет. Soc., 1936,853.
195. М i t с h е 11 S., S с h w а r z w а 1 d К, J. СЬет. Soc., 1939, 889.
196. MoffittW., J. Cliem. РЬуз., 25, 467 (1956).
197. М о f f i t t W., М о s с о w i t z А., J. СЬет. Phys., 30, 648 (19&9).
i98. Moffitt W., Moscowitz А., Woodward R. В., Djerassi с.,
1( 1 У n е W., rотовЯТСЯ к печати.
199. М'о 1 f i t t W., У а n g J.. Т., Proc. Natl. Acad. Sci. U. S., 42, 596
(1956).
200. М о s с о w i t z А., РЬ. О. Thesis, Harvard University.
201. М о s е t t i g Е., N е s W. R., J. Org. СЬеm., 20, 884 (1955).
202. N е h е r R., D е s а u I1 е s Е., V i s с h е r Е., W i е 1 а n d Р., W е tt-
stei пА., Helv. СЫт. Acta, 41,1667 (1958).
203. N е r d е 1 G., В е с k е r 1\., К r е s z е G., СЬет. Вес, 89, 2826 (1956).
204. Nerdel G., Fischer L., СЬет. Ber., 81, 217 (1954).
205. N е r d е 1 G., G n а u с k В.., 1( r е s z е G., Апп., 580, 35 (1953).
206. N е r d е 1 G., G n а u с k В., 1( r е s z е G., СЬет. Ber., 88, 1006 (1955).
207. N е r d е 1 G., Н е n k е 1 Е., Chem. Ber., 86, 1002 (1953).
208. N е r 4 е'l G., J о h n U., СЬеm. Ber., 89, 1945 (1956).
209. О t е у М. С., G r е е n s t е i n J. Р., W i n it z М., В i r n Ь а и m S. М.,
J. Ат. СЬет. Soc., 77, 3112 (1955).
210. Р а r t i 11 g t о n J. К, Advanced Treatise оп Physical Chemistry, Vol. 4,
Longmans, Green and Со., London, 1953, р. 290 391.
211. Patterson J. W., Brod'e W. R., Arch. Biochem., 2, 247 {1943J.
212. Ре 11 е t i е r S. W., L о с k е О. М., J. Ат. СЬет. Soc., 79, 4531
(1957).
213. Ре d е r s о n R. L., С а m р Ь е 11 J. А., В а Ь с о с к J. С., Ер р-
s t е i n S: Н., М и r r а у Н. с., W е i n t r а u Ь А., М е е k s 'R. С.,
М е i s t er Р. О., R е i n е с k е L. М., Ре t е r s о п о. Н., J. Ат. СЬет.
Soc., 78, 15t2 (1956).
214. Ре r 01 d G. W., J. Chem. oc.. 1957, 47.
215. Р f е jf f е r 'Р., С hri s t е 1 е i t W., Z. physiol. СЬет., 245, 197 (1937).
216. Pf е jf f е r Р., Ch r i s t е 1 е i t W., Z. physiol. СЬет., 247, 262 (1937»).
217. Pois50n J., Neuss N., Goиtarel R., Janot М. М., ВиIl. зос.
сЫт. France, 1958! 1195.
382
Дисперсия оnтичеСК020 вращенuл
Литература
383
,
'\
218, Prelog V., Ffihrer J., Hagenbach R., Schneider R., Неlу.
СЫт. Acta, 31, 1799 (1948). .
219. Prelog V. et 81., Неlу. СЫт. Acta, 41, 2362, 2379, 2396 (1958); 42,
1239 (1959),
220. Pruckner Р., Oestreicher А., Fische1' Н., Ann., 64&, 41
(1940) .
221. a m i r е z Р., 8 t а f i е j 8., J. Ат. Chem. 8ос., 78, 644 (1956):
222. Rapala R. Т., Farkas Е., J. Ат. Chem. 80с., 80, iOO8 (1958).
223. R о m о А., Ре r е z J., R о m о J" Воl. inst. quim. Мех., univ. nal.
au!on. Ме, 9, 59 (1957).
224. R о s s m а n М. О., L i Р s с о m Ь W. N., J. Ат. СЬет. 80с., 80, 2592
(1958).
225. R \J d 01 Р h Н. С., J. Opt. 80с. Ат., 45,50 (1955).
226. R u d о 1 р h Н. С., Proc. In'5tr. 80с. Ат., Paper 56-3 1, 8eptem-
ber 1956. .
227. 8avitsky А., 81avin W., 8alinger R. Е., Pittsburgh Conference
оп Analytical and Applied 8pectroscopy, March 3, 1959.
228. 8 с h r б t е r Н., Т а m m С., R е i с h s t е i n Т., Неlу. СЫт.. Acta, 41.
720 (1958).
229. 8 е о а n е Е., J. СЬет. Soc., 1956, 4158.
230. S i n g h В. К et аl., J. Indian Chem. Soc., 34, 187 (1957).
231. Spring F. 8., Beaton J. М., Stevenson R., Stewart J. L.,
СЬет. and Ind., 1956; 1054.
232. Stallberg Stenhagen S., Arkiv Kemi, 3, 517 (1952).
233. S t е а r n s Е. 1., in Ме1l0П М. О., Ed., Analytical Absorption Spe-
ctroscOJ)y, John Wiley and Sons, Inc., New York, 1950, р. 3 398.
234. sto rk О., К h а s t gi r Н. N., S о 10 А. J., J. Ат. Chem. 8ос., 80,
6458 (1958).
235. S t о r k О., N е w m а n Н., J. Ат. Chem. Soc., 81, 3168 (1959).
236. S u m i М., J. Аm. СЬеm. Soc.,. 80, 4869 (195.J1).
237. Takeda К, Kubota Т., Sh.imaoka А., Tetrahedron, 7,62,
(1959).
238. Т а k е d а К., О k а n i s h i Т., Н а m в m о t о К., S hi m а о k а А.,
М а е z о n о N., J. Pharm. Soc. Japan, 77, 175 (1957).
239. Trans. Faraday Soc., 10,44 (1914).
240. Trans Faraday Soc., 26, 265 (1930).
241. Чуrаев Л., Оrородников А., ЖФХ, 85,481 (1913).
242. V а n Т.в m е 1 еп Е. Е., Н es t er J. В.,' J. Ат. Chem. Soc., 81, 507
(1959) .
243. Tsuda К, Tanabe К, Iwai 1., f'unakoshi К, J. Ат. СЬеm.
80с., 79, 5721 (1957).
244. W а 11 М. Е., 8 е r о t а S., J. Аm. Chem. 50С., 79, 6481 (1957).
245. W а s е r Е., Helv. СЫт. Acta, 6, 206 (1923).
246. W i е s n е r К., Е d w а r d s J. А., Experientia, 11, 255 (1955).
247. W о 1 d Ь у е F., Acta Chem, 5cand., 8 печати! 1959.
248. W о о d С. Е., N 1 с h 0\-' s S. О., J. Chem. Soc., 1928, 1671, 1696, 1112.
249. W о о d w 8 rd R. В., К оу а сЬ Е. '0., J. Аrn. Chem. Soc., 72, 1009
(195OJ. "
250. W r i ,Ы А. А., К 1 у n е W, J. Endocrinol., 18, 32 (1959'.
251. Yeng J. Т., Doty Р., J. Аm. СЬеm. Soc., 79, 761 (1957).
252. Z81kow L. Н., Markley F. Х., Djerassi С., J. Аm. Chem. 50с.,
81,2914 (1959).
253. С 1 а r k . L е w i s J. W., Рсос.. СЬет. Soc., 1959, 388.
254. J. Ат. СЬеm. 80с.; 79, 1506 (10).
255. Helv. СЫт. Acta, 41,.250 (1958).
..редметный указатель
385
Ацильные rруппы, мпrраЬ.i.lЯ 216 и
сл., 247 и. сл.
с реакционноспособнымн боко
выми цепями 214
а. Аминокислоты, кривые дисперсии
вращения 279,288
зтерификация с ПФК 81
Аминооксиды, кривые дисперсии
вращения 277
Амнноспиртьi, выделенне и опре
деление 248
S ( Аминоэтил)цистенновые OCTaT
ки 181
Амины, кривые. дисперсии враще
ния 277,279, 286
Амплнтуда, в днсперсии вращения
271, 302, 316
Анациклин, синтез по реакции Вит
тиrа 107
Антнподы, кривые дисперсии вра-
щения 292
Антрахнноиы, полученне с ПФК
61,82
Антрацены, получение с ПФ К 62
т-Арилзамещениые кислоты, uиклн-
зацня с ПФК 85
т-Арнлмасляные кислоты, цнклиза
ция с ПФК 60
Арилметилентрифенилфосфораны 97
Арилпропионовые кислоты, цикли-
зацня с ПФК 55
Аспараrиновая кислота, из эласти-
на 226
Аценафтенон, получение с ПФК
55
т Ацетоксикетоны, кривые диспер-
снн вращения 322 :
-Ацетоксимасляная кнслота, элек-
тролиз 17
t-l Ацетонафтилмасляиая кнслота,
цнклизация с ПФК'69
Ацилнрованне внутримолекулярное,
с ПФК 52 и сл.
межмолекулярное, получение
4-меТИJJ1бензофенона 86
ПФК 70 и ел., 66
l)арИЯ.ХJJdрат'126
Бацнтрацнн А, ilеПТИдНые связн 169
БеrеН(>повая кислота, синтез 31
Бекмана переrруппировка 54, 75 77
альд.оксимов 75
ан-ipахинондиоксима 78
без выделеНИЯ оксима 51
получение бензанилида 86
Белки, rидразинолиз236
;Ц:ействне пепсина 208
днсперсия вращения 263
молекулярные веса 164
мotтиковые связи 175
натнвные, rидролиз 178
разъединение полипептидных
цепей 17(}""",177
расщепленне изотнацнанатами
246
надмуравьиной кнслотой 170,
171
надуксусной кислотой 171
селективное 163 248
Бензанилид, получение с ПФК 51,
, 87
Бензиловыеэфиры жирных кислот
кн-с..пые, электролнз 34
синтез 23
Бензимид;!.золы, получение с. ПФК
.-58
бис Бензимидазолы, полученне с
ПФК 58
ВеН80ксазо.ч6ны 80
Бензоксазолы, получение с ПФ К 58
Вензосубероны, I'!Oлучение с ПФ К
66, 82
Бf'н<jотиазолы, получение с ПФК
58
Б-ензофенон .51
Бензофлавин, получение с ПФК 50
10, Il Бензофлуорантрен, получение
е ПФК 60
Бензофлуореноны, получение с ПФК
56
Бещюфураны, получение с ПФК57
Бяцикло [3, 2, 1] OHы 6, кривые дис-
перснн вращещНj 341,)
Бромна'я вода при Р.llсщеплении
белков, 171, 224 и сл. .
N БутенилаНИЛНli, превращение в
2, днметнлиндол 57
Вуфздиенолnд, кривая дисперсии
вращения 294
ПРЕДМЕТНЫй УКАЗАТЕЛЬ
Азидосоединення, кривые дисперсин
вращения 277, 282, 284.
Акрндоны, получение с ПФ К 53,63
Актнвные центры папанна, трипси
на химотрипсина 164 .
Але рестовая кислота, синтез 31
Алифатические дикарбоновые кис
ЛQТЫ, кислые эфнры, электролиз
10, 13
Алифатические кислоты, электро
лиз 12 и сл.
Алкалоиды, кривые днсперсии Bpa
щения 346
Алкилrалоrениды, взаимодействие с
реактивамн Виттиrа .98
а. Алкилзамещенные КНСЛОТI?I, элек
тролнз 12, 15, 23
АЛКНJFидентриалкилфосфораны, pe
акцня с карбонильными соедине
ниямн 96
Алкилидентриа рилфосфораны 97
АлкилтрифеНИЛфОСфОННЛfалоrени
ДЫ, получение 108
Аллиловый спирт, rидроксилирова
ние 151
Альдеrидосахара, крнвые днсперсии
вращения 283
Альдеrиды, кривые днсперсни Bpa
щення 275, 283
получение по реакции Внтти
ra 167
с разветвленной цепью, крнвые
ди персии вращення 287
Амиды, получение ацнлированнем
амидов с ПФК 89
Аминоrруппы, влияние на лизин 181
. влиянне на трипсин 193
Аминокислоты, ароматнческие, Meд
ные комплексы 336
кривые днсперсни вращения
277, 280
попытки использования прн рас.
щеплеlЩН (jел QВ 216
'5 .I(. 1410
BarHepa Меервейна переrруппи-
ровка 59
Вазопрессин 164, 177, 182
Вакценовая кислота, синтез 30
Вирус .табачной мозаики 167, 177,
231
Витамин А, синтез 100
Витамин D 94
Виттиrа реактивы 96
бнфункциональные 100
получение 108
реакция с алкилrалоrенидами
98
водой 97
rалоrеноводородными
кислотами 98
карбонильными coeДHHe
ниями 108
кислородом 97
серой 97
сложными эфирами 99
спиртами 97
Внттиrа реакция 94 и ел.
аиомальная 101
механизм 95
. стереохимия 102
Вода, взаимодействне с реактнвами
Виттиrа 87 .
Вольфрама окись 145
Восстановлеиие дисульфндных свя-
зей 172
полное инсулина 172
Вудворда метод, l'И.1фОКСlJлирование
129
rексаrидродиметилфенан
трена 151
длинноцепочечных олефи
нов 152 .
цис rидроксилирование 130
окисление оленновой кислоты 152
Оимонини комплекс 129
а. fалоrенокетоны (см. также Кето-
ны), крнвые дисперсни вращения
317
fалоrенокислоты (см. также Кисло
ты), взаимодействие с реактивами
Виттиrа 98
а. fалоrенокислоты, электролнз 14
fалоrенопроизводные, крнвые днс-
персии вращения 275; 282
а.-fалокетонное правило 347
fейrерин, стереохимия 347
н-fексакозан, синтез 37
rеланамин, кривая днеперсии BPjI-
ЦJ;е иSJ 347
386
Предметный указатель
Предметный указатель
387
fемикетали, образование и диспер-
сня вращения 348
fемоrлобин 176, 197
rидролиэ 197, 218
лошади 176
rетероциклнческие соединения, кри-
вые дисперсии вращения 278
rиббереллиновая кислота, кривая
дисперсии вращения 345, 346
fидразинолиз белков 236 .
.fндроксиламин, из нитросоединений
и ПФК 51
fидроксилирование 114 и сл.
fидроксилироваиие надкислотамн
154
ароматических yrлеводородов
149
олеииовой кислоты 155
пентена-2 156
циклоrексена 154
циклоrептена 149
fипертенсии 164, 196
fлиадии, обработка серной I\ИСЛО-
той 220
цис-fликоли, получеиие окислением
четырехокисью осмн я 132
fлутаровый диальдеrид 146
fлюкаrон 182, 202,205
( )-fлюкозамнновая кислота, мед-
ный комплекс 337
fлютен, обработка серной кислотой
220
fомохроманоиы 69
fрамицидии S 164, 168
fуанидина ПрОИЗВОДНЫе, возможио-
стн использования для диссоциа-
ции нативных белков 177
fумулан, синтез 35
fумулеи, строеиие 35
J{еrидратирование спиртов прн дей-
ствни ПФК 82
ДезаМИДИl)()вание 193
Декалоиы и правило октанта 369
«Деспептидоа ктнномицин» 53
4,9-Диазапирен, получение с ПФК
64
ДнаНТJ5аннлид 78
Диарилметилентрифенилфосфораны
95 .
2,5-Днарилфураны, синтез из 1,4-ди-
кетонов с ПФ К 56
Дибензилкарбинолы, аБСолютиая
конфиrурация 334
Дибензофураны, получение с ПФI\
51
1,2,5,6-)1)ЮеНЗ9циклооктадиен-
1, 5 он/..з, получение с: ЛФК 85
Диmдр6бутироспермои, влияние 4, 4-
ДИl\lетнльных заместителей 354
3,4-t{иrндроизохинолии, получение
с ПФ К 63
Диеноны, кривые дисперсии врат..-
ния 330
Диизопропилфторфосфат 203
Дикарбоновые кислоты алифатиче-
ские, электролиз 10, 13
Дилизии 182, 183
Димезитилалкены 70
Динитрофенилироваиие 220 и сл.
Дипнон, получение из ацетофенона
с ПФК 81
Дисперсионный метод, применение
331
Дисперсия оптическоrо вращения
261 264
пр.иборы 264
Дисульфндная связь в пептидах,
окисление 170
восстаиовление 172
Дитиокарбаматы, кривые дисперсин
вращения 298
ДифеииЛметилентрифенилфосфо-
ран, реакцня с дифенилкетеном
95
карбонильными соедине-
ниями 95
фенили оцианатом 95
1,l-Дифенилэтилен, получение из
бензофеНОRа 108
3,5-Дихлортирозии 170
Дициклоrексилиденэтаи, получение
по реакцин Внттиrа 110
Диэфнры кнслот, получение синте.
зом Кольбе 19
Длина волны «первоrо экстреМУМID
298
Др уде уравнение 267, 273, 274, 295
ИидольиЫй синтез с ПФR. 57, 86
ИнсулШ! 164, 16j>, 176 . .
обработJЦI сериой кислотои 218
окисленныЙ 177, 182, 203
действие трипсина 182
точно установленноrо состава
166
Ионофорез, для выделения пепти-
ДОВ 177 .
Ирезин, стереохимия 345
Жирные кислоты насыщенные, син-
тез 21
а-Казенн 175
-Казенн 175
КалИя манrаиат 120
пермаиrанат, в водном растворе
116
в водиых орrанических рас-
творнтелях 119
rндроксилирование 148
олефинов 117, 118
в нейтральных н кислых
растворителях 119 v
как rидроксилирующии аrеит
114 120 .
окнслеиие бицикло-[2,2, 1]-
rептена-2 120, 149
олеиновой кислоты 117,
118, 148
циклоrексеиа 149
хлорат 126 .
Кальциферол, частнчный сннтез по
реакцин Виттиrа 105
Камфора, кривые дисперсии враще-
ния 269, 287
Карбоксилыlые rруппы в белках,
влияиие на rидроЛиз трипсином
197
Карбоксипептидаза 230 233
Карбометоксиметилентрифе нил 4юс-
фораи, получение 111 v
Карбонильные rруппы, взаимО)l.еи-
ствие' с реактивами Виттиrа 107,
108
определение положеиия мето-
дом дисперсии вращения 332
Карбонильные соединения (см. так-
же Альдеrнды, Кетоны), кривые
днсперсин вращения 287
Карбоновые кислоты стероидные
(см. также Стероиды), кривые
дисперсии. вращення 293 .
Карбостирнлы, получеиие с ПФК
64
I<:арденолид, кривые дИсперсии вра-
щения 294
Изатии и производные, получение (.
ПФ К 58, 59
Изофотосаитоновой кислоты лактон,
стереохимия 347
Инда ноны, получение. с ПФК 55
Инден 82
производные, полу . чение с ПФI\
6 . .
25.
Каротииоиды, синтез по )Jе кции
Виттиrа 106
Катехииы, абсолютная коифиrура-
ция 334
Кафестол, стереохимия 344
Кератин 168
Кетолы, кривые дисперсии враще-
ния 321
Кетоны, алициклические, кривые
дисперсии вращения 288
а-rалоrенозамещенные 317,
318
моноциклические 306
насыщениые 275, 283, 287,
338,351
таблицы 296 297, 299 304,
3Об-......316
бицнклические, аиалоrн стерои-
дов 338
кривые дисперсии вращения
2981 306
коиформаuиоиные факторы 351
а, -ненасыщениые 322
полиц клически сравнение с
бициклическимн аиалоrами 362
кривые дисперсни вращеиия
298, 306
пространственио aTpy диеиные,
rидролиз с ПФК 81
реакция Шмидта с ПФ К 80
циклические, полученне с ПФК
45, 50 57, 59,.69
Кинетические исследования методом
дисперсни вращения 351
Кислород, взаимодействие с реакти'
'вами Виттиrа 97
Кислоты (см. также Аминокислоты,
f алоrенозамещенные кислоты)
кривые дисперсии вращения
амино 277, 288
окси '07, 288
тио 277
фенилзамещениых 284, 286
синтез
анте изо 25
изо 25
жнрных 22
а окси 25
правовращающих 25
циклизацня
'Y-зрилмасляНЫХ 60
арилпропноиовых 55 и сл.
электролиз
алифатических 12
алифатических двухосновных
10, 12
388
Предметный указатель
/
nреометный указатель
389
р; алкИЛ 12, 15, 23
а алкокси 14
ароматических 18
(iJ rалоrен 14
а, ненасыщеиных 17, 18
,т ненасыщеииых 17, 18
а окси 14
а циан 14
Кобальт, этил енди аминовы е комп
лексы, крнвые дисперсии враще
ния 278
Коллаrен 168
Кольбе синтезы 9 39
методика работы 37
механизм 11
области применения 12
перекрестная конденсация 23
приборы I1
применение 18
растворитель 1.0, 35
симметричные продукты 9
сохранение rеометрической кон-
фиrурации 18, 29
оптической активности 17:
23, 24
электрическая цепь 36
электроды 36
ячейки 11,.31
Конфиrурация, абсолютная 17
определение методом дисперсия
вращения 333, 341
относительная, определение
332
Конформация и дисперсня враще-
ния 298, 3.03, 351,357
Концевые rруппы замаскированные
167 .
Кортикотропин 182, 191, 2.05, 2.08,
232, 244
Коттоиа эффект 366, 369 374
кривые 267, 295, 298, 336
со сложным эффектом 272
. октилнитрнт 272
Коэффициент экСУинкции и диспер-
сия вращения 262
Кривые дисперсии вращения, алrеб
ранческая обработка 358
влияние растворителей 323
классификация 267 269
эффект 317
Ксантен, получение с ПФК 61
Ксантосенаты, кривые дисперсни
вращения 277, 285, 287
Кумарины, синтез по Пехману с
ПФК 62 '
а-Лактальбумцн ISI
Лактоны стероидные, кривые дис
персин вр.ащения 294
т-Лактоны, деrидратирование с
ПФК 56
превращение в циклопентаноны
54
Лантионин 174
ЛейцинаминопеПТИliаза 17.0, 233
влияние пролина на активность
234
длинноцепочечные субстраты
235
специфичность 233
Леrочная проте.иназа I 213
Лиrнаны, крнвые дисперсии враще-
ния 279
Лизин, влияние маскировки а ами
ноrрупп 183. .
Лизоцим 17.0, 197
Линдлара катализатор 31, 32
(+ ) а-Липоевая (пюктовая) кисло-
та, конфиrураЦjiЯ 34
Лоссеня переrруппировка 54
без выдел ния rндроксамовой
кислоты 51
получение -нафтиламина 87
Лофенол, дисперсия вращения 342
9 Метиmетраrидр(жарбаза.!l, полу
чеиие с ПФК 59
Метилтрифеиипфосфонийбромнд,
получеине 109
Метионин 17.0.
М колипеиовая КНСЛОТ8, синтез
24
Миласа реактив, окисление арома-
тических соединеиий 129
Минимум на кривых. дисперсии вра-
щеиия 271
Миристиновая кислота, электролиз
22,37
Множественные волны 324
Молекулярное вращение 273
Молибдена окись (см. также Оки-
си) 145
М6нонадФтале ая кислота 14.0
Монооксистероиды, крнвые диспер-
сии вращения 279
Мочевины растворы, опредрление
молекулярноrо веса 177
(::!:)-Мускон, синтез 33
Максимум на кривыx дисперсии
вращеиия 248
Мастикадиеноновая кислота, эф
фект 4, 4 диметильной rруппы в
ней 354
Медные производные, кривые дис
переии вращения 277, 281
Мезитил н, ацилирование в присут-
ствии ПФК 7.0
Меркаптандисульфид, обменная ре-
акция 172
Мерkаптоrруппу блокнрующий areHT
172
Меркурипаflаин 235
4-Метилбензофенон, получение с
ПФК 86
Метилбиксин, полученне 1II
Метилrексаrидриндаионы, кривые
дисперсии вращения 3.0.0
Метнлдекалоны, крнвые' дисперсии
вращеиия 299 30D
3 Метиленхолестан, получение 11.0
МетилоктаJiоны, кривые дисперсии
вращения 30.0 .
Меrилолеат, rидроксилирование по
реакции Прево 153
Надбензойная кислота 137, 139
Надкамфорная кислота 14.0 .
НадкислоТЫ, примениемые при rИk
роксилировании и эпоксидирова
нии 137, 139, 14.0, 154, 155
Надмуравьиная кислота 137, 17.0,
171
Надслизевая кислота 14.0
Надуксусная кислота 137, 14.0, 171
Надфталевая кислота 137
Нjlфта.u ина щ>оизводные, получение
сПФК61/. .
-НафтНJiамин, получение с ПФ К
87 .
1, 2 Нафтосуберон, полученне с
ПФК 65 .
Неохимотрипснноrеиы 199
Нервоновая (селахоленая) кисло'rа,
синтез 29,39
Нитрилы, пренращеиие в аМИДЫ 8.0,
87
циклизацня с ПФК 54
Нитриты, кривые дисперсии враще
ния 277
Нитрозиты, кривые дисперсии Bpa
щення 277
5 Нитроиндолкарбоновой 2 кислоты
'Э'l'1Мовый эфир, -получение с ПФ К
86
Нитросоединения, кривые дисuерсин
. вращеиия?:l7
Номенклатура, сокращения для ами
нокислЬтных остатков 167
N- и С-коицевых остатков
167
кривых дисперсИИ вращения
269
пептидНЫХ цепей 167
HoprapMaH, получение с ПФК 46,
63
19 Нор h.4 3 кетостероиды, конфиrу
рация 333
Овальбумин 168
rидролиз 218
Окисление дисульфидных связей 17.0
.и сл.
Окиси (см. такжё Осмин четырех .
окись) как катализаторы при-
соединения перекиси водорода
по двойным связям 145 .
арсафлуорена, получение с
ПФК 59
вольфрама 145
молибдена 145
надванадиевая кислота 145
селена 145
Оксадиазолы, получение с ПФК 59
а Оксикет6ны' (см. также Кетоны),
кривые дисперсии вращения 318
322
а-Оксикислоты, кривые дисперСIIИ
вращения 298
медиые комплексы 337
синтез 25 и сл.
электролиз 13
Оксимов хлорrидраты, переrруппн
ровка с ПФК 5.0
Окситоцин 164,.167
4-0кснхинолины, получение с ПФ К
62,63
Октанта правило 368 и сл.
Октантная проекция 366, 367
Олеиновая кислота, rидроксилиро
вание 148, 155
синтез 33
электролнз 18
Олефииы, rидроксилирование 114
и сл.
надкислотами 137 и сл.
перекисью водорода 144 и сл.
по реакции Вудворда 13.0
по реакции Прево 235 и сл.
получение по реакции Виттнrа
1.04 н сл.
390
п peдMeTHЬtй УlCазаtель
п ред.метный указатель
391
получение с ПФК 82
четырехокисью осмия 121 и сл.
а- и -Оноцерадиены, синтез 20
Осмия четырехокись
и хлораты, окислеИllе 126, 127,
150
реакция .с ароматическими со-
единениями 12 126, 149 151
реакция с алифатнческими н
алициклическUми олефииамн
I21 124, 149 151
Папаин 164, 168
активный центр 164
Пентациклическиетритерпеиы, 8ЛНЯ-
ние 4, 4- диметильных rрупп н;!
дисперсию вращения 352
Пентациклосквален, синтез '20
Пепсин 175, 207
сомосенность 207
действие на различные белки
207
Пепсиноrен, амннокислотныйсостав
207
Пептиды
. дисульфидиые связи 168
кривые дисперсин вращеиня 277
мелаИОФОРОСТИМУЛИРУЮIЦие
ropMoHbl' (MCf) 205
содержащие . остатки аспараrи
ноной кислоты, переrруппнровка
227
rлутаминовой кислоты
203
синтез
вазопрессина 164
rипертенсина 164
rрамицидина S 164
оксипрессина 164
окситоцина 164
фракционирование на ионооб-
. менной колонке 198
.. Пептидные цепи, инсулина 164
методы разделеиия 177
открытые 167
разветвленные 167
химотрипсина 165
циклические 167
Перrидробикснн, синтез 19
Перrnдрокроцетин, синтез 19
Перrnдрофенаитреиа пронзводные и
дисперсия вращения 340
Переrруппировка
кислот 59 ..
пептидов 227
при циклизации арилмасляных
хлорrндратов ОkСИМОВ с ПФК
50. '
Перекнсь водорода 144
Перииафтеноны, получеиие с ПФК
56 .
Петроселеновая кислота, сиитез 31
Пехмана синтезы, с ПФ К 62
Пик на kрИВЫХ дисперсин враще-
иия 272
пиридоны. получение с ПФК 63
Плакальбумии 211
Поверхностио-активиые вещества
как асенты, вызываЮIЦие диссоци-
ацию коиrломератов нативных
белков 177
Поли-l rnyтамин синтетичесКий 169
Полиены, синтез по реакции Вят-
:rиrа 106
ПОJIИЛИЗНН 181 183
Полнмеры, дисперсия вращеНIfЯ 264
Полимиксии В 110
Вl 167
Полифосфорная кислота (ПФК)
45-----88
как реасент, экспернментальные
условия 81 88
образов.ани.е 47
применение для ацилироваиия
70 75
деrндратацни 81
переrруппнровок 75 79
циклизации 54 б9
этерификации 80 81
стро ние 47 49
Поляризатор осцнлпяционный 264
Поляриметр реrистрирующий 266
Помераиt\а Фрича реакция с ПФК
63
Правило, определяющее характер
дисперсии вращения а-rалоrеиоке-
тонов 317
Прево реакция 130, 135, 153
Приборы для определения диспер-
сии вращения 262 и сл.
для электролитическоrо синтеза
35, 36 :
Применение дисперсии враIЦения
для аиализа 349
Принцип снмметричных уrлов 266
Пролактии 244 .
Пролин, ВЛняиие на активиость лей-
цинаминопептидаЗI:J 235
влияиие на актНвность .химо-
трипсина 207
остатки, ВЛИЯНИе на трипсии
197
Протамии 197
Протеаза ппесени 211
Противоточиое распределение, для
разделения пеПТИДНЫ!l( цепей 177
Птеридины, получение с ПФК 59
Ра деление компонентов белковых
цепей 170 177 .
Растворители, влияиие на кривые
дисперсии вращения 321, 323
орrанические как асенты разде-
леиия пептиднЫХ цепей 177
Расщеплеиие б лков, по rофману
168
по Эдману 193, 223
селективное бромной ВОДОЙ 224
белков 163 и сл. ..
ступенчатое, химические методы
236
Реактивы, Виттиrа 86
. для селfктивноrо раClЦеплеиия
165, 229, 237,246 .
пp1ICOединение обратимое 106
107
Реннин 197, 213
Риб6иукпеаза окисленная 182, 187,
204, 208
действие хlfМотрипсина 204
Рицииолевая кислота; конфиrурацня
26
электролиз f 8
Сапоrенины, определеине абсолют-
иой конфиrурации методом дис-
персин враIЦеиия 334
Связи дисульфидные, межцепочеч-
ные, внутрицепочечные 168 и сп.
Сера, взанмодеikтвие с реактивами
Виттиrа 97
Сесквитерпены, абсолютная конфн-
. rурация на основе крнвых дис-
персии враП{ения 341
Сквален, сиитез 100
Спектропоnяриметры 264
Специфичност в образоваиин свя-
зи 166
трипсина 165
а-Спираль 179
Спираи, кривая дисперсии враще
ння 278
Спирокетальиая rруПпа и дисперсий
вращения 3М
Сl]иростаиы, кривые диспеРСИI&' вра-
щения 294
Спирты
аллиловый, rидроксилирование
151
-амИIIО, выделение и определе-
ние 248
взаимодействне с реактивами
Виттиrа 98
деrидратация в олефины с ПФК
81
кривые дисперсии врашеиии
275,277
стероидиые (см. также Стерон-
ды), кривые дисперсин враще
ния 293
фенилзамещеН1Iые, кривые дис-
персии враIЦения 284, 286
Стеариновая кислота, синтез 22
Стеароловая кислота, электролнз 31
Стевиол, kривая дисперсин враще-
ния 346
Стереоспецнфические синтезы 17
Стероиды, кривые дисперсии враще:
ния, таблицы 313 316, 319, 321,
327 331,339 341
rранс-Стильбен, nОЛученне 111
цuс-Стильбен. получение 111
С убтилизин 198, 211
Сульфоксиды, кривые диспеРСИJl
враIЦения 278
.
Таририиовая кнслота, синтез 31
Тенулии, кривые дисперсии враще-
ния 346
Терпены, аномальная стереО!l(ИМНЯ
343
кривые дисперсии вращении
306 314, 329 331, 339 341
Тетраrидриндаиоиы 74
Тетраrидроизохииолина производ-
ные, получение с ПФК 64
Тетраrидросаитонины, влияние
аксиальиой метильной rруппы
352
Тетраrидрофлуоренон 75
а-Тетралои, получение с ПФК 51,
82, 85, 86
Тетралоны, получение с ПФК 60
Тетрафосфорная кислота 46
Тнадиазолы. получение с ПФ К 59
Тиазолиновый цикл 169
Тиено I3, 2 Ь] пиррол, получение с
ПФК 59
Тщ>rндаНТОИJJЫ 247
392
Предметный указатель
преаметный указаt АЬ
З9З
Тноrликолевая кислота 172
Тионафтены, получение с ПФК 59
Тиоцианатная rруппа, от[Цеплеиие
174
Тирозин 170
Тироцидин А 168
Тироцидин В 168
о Толуамид, получение с IJФК 87
Трансаннулярное взанмодействие и
аномальная дисперсия вращеиия
358
Триазолы, получение с ПФК 58
Триеноны, кривые дисперсии враще
ния 330
Трипсин 165, 179
активный центр 165
ацилирование ,1 O
действие иа белки 182
ииrибирование 178
расщепление пептидиых связей
178
специфичиость 165
Трипсиноrен 198
Триптофан 170,216
Тритерпеновые кетоны, крнвые дис
персии вращения 309
Трифеиилфосфин 109
взаимодействие с эпоксидами
96
Трнфенилэтилеи, получение из бен.
зофенона 108
Тромбин 213
Туберкулостеарииовая кнслота, сии
тез 23
Уrлеводороды, ароматические
rидроксилироваиие 149
кривые дисперсии вращения
275, 278
наСl$lщениые, кривые дисперсии
вра[Цения 275
иенасыщенные, крнвые диспер
син вращения 276
получение электролизом ['о
Кольбе 19
Уrлеводы, кривые дисперсии враще
ния 278, 282
Уреидоамииокислоты, кривые дис-
персни вращения 279
Фаллоидин 168
Фарадея эффект 266
Фенантреи, получеиие с ПФК 61
Феиантридин, получение с ПФ К 63
фепаптридоны 51
получение бекмаиовской пере-
rруппировкой 77
получение с ПФК 64
4,5 Фенантриленкетон, получение с
ПФК 56
2 Феннлбензофуран, получеиие с
ПФК 59
Фенилизотиоцианат 236
'У Фенилмасляная кислота 51
I Фенил 2 пирролидон, полученне с
ПФК 64
Фенолы, аЦИ.IJИРQвание, с ПФ К 73, 75
как areHTbl диссоциации белков
177
Ферменты 169 и сл.
c'I Ферроцеиилвалериановая кислота,
циклизация с ПФК 69
'У Ферроцеиилмасляная кислота,
циклизация с ПФ К 69
-ФерроценилпРопионовая кислота,
циклизация с ПФК 69
Фибрин 213
Фибриноrен 213
Фиброии шелка, обработка серной
кислотой 219
Филлокладен, кривая днсперсии
вращения 346
Фитол, коифиryрация 340
Фишера нндольный синтез, с ПФК
57,86
Флуоренилидентрифенилфосфоран
97' .
Флуоренон 51
Фосфатные мостики, расщепление
175
Фосфаты, получение с ПФК 81
Фосфора хлорокнсь 46
Фосфорная 'кислота, деrидратация
46
реакция с хлор окисью фосфора
47
Фосфорный аиrидрид 45
Фраrментация под действием фер-
ментов 171
Фриса переrруппировка 72, 7з
.а-Фторкетоны (см. также Кетоны),
кривые дисперсии врашеиия 318:
Функцнональные rруппы, обнару-
жеиные .методом дисперсии вра-
щения 332
определенне положення мето-
дом дисперсин враrцения 332
активный.центр 165
влияние пролина иа активность
206
действне на окисленную рибо
НУf(леазу 204
инrибирование 178
окисленный 177
специфичность 199
Химотрипсииоrен 168, 196
С-концевая аминокнслота в нем
199
Хлораты, rидроксилирование с че-
тырехокисью осмия 126
серебра, иатрия 126
4-Хлоркротоновая кислота, rидро
ксилирование с четырехокисью
осмия 150
ХлормеЗИТlfлены 70
2 Хлор 5 метилциклоreксанон, кри-
вая дисперсии вращеиня 357
3-Хлортирозин 170
Хризена производиые, получение с
ПФК 61, 62
5a,-ХолестаН-3-0Н, кривая дисперсии
вращения 272
5d;-Холестаи 3 ол, кривая диспер-
сии вращения 271 .
ХолестеиоIi, эпоксидирование 147
Холест.4-еН 3.0Н, кривая дисперсии
, нращения 272.
Хроманоны 62
Хромаtоrpафия, для разделени.я ко-
ротких полипептидных цепеи 177
. иа БУМ8rе 177
на колонке 177
хроминданыf. поЛуЧение е ПФК 56
Хромоиы 6.2
Хромофор, асимметрия 366
а-Цианокислоты, электролиз 14
Циклизация с ПФ К, арилзамеше\f
ных кислот 85
в пятичлеиные циклы 55
в iuестичленные циклы 59
в семичленные цикЛы 65
iранс-Циклоreксандиол, получение
154
чиС-ЦИК:JIоrександиол, П,олучение 148
. . ,
Хаульмуrровая кислота, синт.ез 2Q
Химотрипсив 164, 198
Циклоrексанон, rеометрия 366.
кривые дисперсии вращения
ЗО6, 365 366
октаитная проекция 367
Циклоrексеи, rидроксилироваиие
148, 154
Циклоrептен, rидроксилироваиие 149
Циклопентадиенилидентрифенил
фосфоран 97
Циклопентаионы, кривые дисперсии
вращеиия ЗО3
Цнкутол, синтез по реакции Витти-
са 106
Цистеиновая кислота, выход при
окисленни цистеина н цистина 171
Цитохром 197
Цитростадиенол, строение 343 "
Wиффовы основания, кривые дис-
персии вращения 277
Шмидта реакци кетонов 80
Эдестин, rидролиз 218
( + ) Эйкозанол-2, сиитез 27
Эйкозен II-0вая кисЛота 29
Эю;:тремумы, длины волн 305
Энантетол, синтез по реакции Вит-
тиrа 106, 107
Энантиомеры, кривые дисперсии
, вращения 292
Энтерокиназа 179
Эпоксидироваиие, 137, 141, 142
механиЗМ н стереохимия 138
Эремофилон, установление абсолют-
ной конфиrурацни методом дис-
персни враrцения 342
Эруковая кислота, электролнз 18, 29 .
синтез 29
Эстраднол 17 , кривая дисперсии
вращения 293
Этерификация, с ПФК 82
Эфиры простые, кривые' дисперсии
вращения 275
Эфиры сложные, 'взаимодействие с
реактивами Виттиrа 99
кривые дисперсни вращения 276
СОДЕРЖАНИ
Электролитическая КОНДенсация по Кольбе
Введение .........
Области прим.енения реакции . .
Применение . . . . . . . . . .
Насыщенные.жириые кнслоты
Разветвленные жирные кислоты
Оксисоединения
Неиасыщениые кислоты .
Циклические соединения
Описание зкспериментов . .
н rексакозан. . . . . . .
Днметиловый эфир ,[1' димеmлсубериновой кислоты
( +) 3-Метилундекаиовая кислота . . . . . .
Нервоновая (чис-тетракозеиоl5 овая) кислота
Литература' . . . . . . . . . . . .0 . . . .
Полифоефорная кислота как реаrеит в орrаиичеСI'Qii химии
<
Введение .....................
Строеиие по.iJифосфорных кислот . . . . . ". . . . .
Общий характер реаrеита и вызываемых им реакций
Основные типы реакций, вызываемых полифосфорной кнслотой
. Циклизация с образованнем пятичленныХ колец .
Циклизация с образованием шестичлеиных колец
Циклизация с образов цнем семичленных колец
Ацилированне .............,.. .
Векмаиовская переrруппировка . . . . . . .
Дрyrие реакции, вызынаемые полифосфорной кислотой
Описание экспериментов . . . . . . .
Выбор экспериментальиых условий
Примеры синтезов
Литератур'а . . .
'.
'.
Содержание
395
, .
9
9
12
18
22
23
25
29
33
35
38
38
38
39
40
Реакция 8иттиrа. . . 94
В ведеиие ..... 94
Механизм реакции 95
Области прнменения реакции 96
Трифеиилфосфораны . . 96
АльдеrИj1Ы и кетоны . . . . '. 101
Стереохимия; образующихся олефинов . 101
Применение реакцин Внттиrа . 103
Сннтез витамииа D . . . . . 104
Полиены . . ... . . . . . . 106
Синтезы друrих соединеиии . 107
Родственные реакции . 107
Экспериментальная часть . 108
Получение алкилтрифенилфосфоиийrалоrенидов . 108
Реакция Виттиrа 109
Выводы ... 112
Л и т е р а т у р а . . 112
Методы rидроксипирования 114
Введение ......... . 114
Перманrанат калня . 115
О!iliслеи.ие в щелочной среде . 116
Окисление в иейтральной и кнслой средах . 119
Маиrаиат калия . 120
Четырехокись осмия . 121
Реакция с алифатическими и аЛИЦиклическими олефннами . 121
Реакция с ароматическнмн соедииеииями _ . . . . . . .. . 124
ОКИСЛеlИlе четырехокисью осМия и солями хлорноватой кислоты 126
Окисление смесью четырехокиси осмня, перекиси водорода н
трет бутиловоrQ спирта (реактив Миласа) . . . 128
fалоrены н серебряиые солн карбоновых кислот . 129
чцс-fндроксилирование по Вудворду . . . . _ . 130
РеакШfЯ Прево . . . . . .'. . . . . . . _ . 135
Надкислоты ароматическоrо н алифатическоrо рядов . 137
Механизм и стереохимия реакций с надкислотами ; 138
Ароматическне надкислоты . 139
Алифатические надкислоты . 140
ОбщиезамеЧ8НИЯ . . . . . . 143
Перекись водорода ..... . 144
Присоединение перекнси ведорода, катализируемое ультрафио
летовым светом .............. _ .. . . . . . . . 144
Перекись водорода.в присутствин окислов металлов, нспользуе-
мых в качестве катализаторов . . . 145
JlеvеКИСJ> водорода ЩeJ!()tЩой среде . ...... "" 149
45
45
47
49
55
55
59
65
70
75
79
82
82
85
88
396
Содержание
Экспернментальная часть . . . . . . . . . .
rидроксилирование действ нем перманrаната
rндроксилированне действием четырехокиси осмия
rндроксилирование по Вудворду . . . .
Реакция Прево ............
rидроксилнрование действием надкислот
Литература. . . . . . . .
Селективное расщепление белков .
Введение .............
Номенклатура и типы полипептиДНЫХ цепей
Разъединение полипептидных цепей
Окисление дисульфидных связей . .
Восстановление дисульфндиыx связей
Расщепление фосфатных мостиков .
Друrие тнпы мостиков . . . . . ..
Методы разделения ........
Реаrеиты, расщепляющие связи в полипептидной цепи
Ферменты ..................
Хнмические методы ............
PeareHTbI, селективно отщепляющие концевые остатки
Ферменты .......
Химические методы
Заключительиые замечания
Литература. . . . . .
Содержание
397
..
. 148
. -148
149
. 151
. 153
.154
. 157
.163
., 163
167
. 170
170
. 172
. 175
.175
. 177
. 177
. 177
.213
.229
.229
.236
.248
.249
Определеиие относительной конфиrурации . . . . . . . . 332
Проблемы абсолютной конфиrурацин . . . . . . . . . 333
Обнаружеиие оптической активности у соединений с весьма
малой величиной молекулярноrо вращения . 349
Прнменение для аналнза . . . . 349
Конформацнонные факторы . . . 351
Алrебраическая обработка кривых . 358
Эффект «фона» . . . . . . ... . ........ 358
Вицинальное взаимодействие двух поrлощающих функциональ-
ных rрупп . . . . . . . . . . . . . . _ . . . . . . . . . . . 359
Сравнение полициклических кетонов и нх бнцнклических анал .
[ов (см. также правило октанта) . . . 362
Циклоrексаноны; новый общий подход . 365
Введение. ........ . 365
rеометрия циклоrексанонов . . . 366
Правило октанта ...... . 368
Декалоны и стероидные кетоны . 369
Л и т е р а т у р а . . . . . 374
Предметный указатель
., 384
Дисперсия оптическоl'О вращения и исследоваиие СТр6е8ИЯ opra
нических соедииений . 261
Введение ..... . 261
Прнборы ..... < . 263
Классические методы . . . . 263
Современные спектрополяриметры . . . . 264
Приборы, находящиеся в стадии разработки н. усовеРШeIlСТВО-
вания ....... . 265
Результаты ....... . 267
Классификация кривых .267
Классические исследования . 274
Исследоваиия, посвященные изучению аЛlЩиклических кетонов
н родственных соединений . . . . 288
а, Ненасыщениые кетоны ...... . 322
Приложения дисперсионноrо метода . . . 331
Обнаружение функциональных rpупп ., . . . . . . . . . 331
Определение положения функцнональиых rрупп (карбонильных
rру'UП) .,.,.,..' _ . .. , . . , . . . , , . . , , . " . 8&2
ИЗДАТЕЛЬСТВО ИНОСТРАННОй JlHTEPATYPbl
Имеются в продаже 1Сllи2и
УСПЕХИ
орrЛНИЧЕСКОП ХИМИИ
.. .. ..
АJlюмиииАорrанические соединения. Перевод С немецкосо, 1962, 320 стр.,
цеиа.l р. 56 К.
Барлоу Р. Введение в химическую фармаКОJlоrию. Перевод с анrлий-
CKoro, 1959, 464 стр., . eHa 1 р. 76 к.
rейлорд Н. ВосстаИОВJlение комплексными rндридами метаJlJlОВ. Пере-
вод С аиrлР.йскоrо, 1959, 912 стр., цеиа 5 р. 48 к.
ТетеРОЦИКJlические соедииения. Т о м 11. Перевод с анrлийскоrо, 1954,
436 етр., цена 3 руб.
ferepoЦlllUlllчаские соедннения. Т о м IV. Перевод С анrлийскоrо, 1955,
5з8 стр., цена 3 р. .48 к.
fетеРОЦИКJlические соединения. Т о м V. Перевод с аиrлийскоrо, 1961,
602 стр.. цена 3 р. 74 К.
fетероциuические соедииения. Т о м VI. Перевод с аиrJlийскоrо, 1960,
610 стр., цена 3 р. 65 к.
rольдштейн Р. Химическая переработка нефти. Перевод со BToporo
расширениоrо и переработанноrо анrлийскоrо издания, 1961, 423 стр., цена
2 р. 47 к.
Карн.ожицкий В. Орrанические перекиси. Перевод с французскоro, 1961,
154 стр., цена 64 коп.
Ловлейс А., Роч Д., Постельнек В. АJlифатические фторосодержащие
соединения. Перевод С анrлийскоrо, 1961, 345 стр., цена 2 р. 01 К.
Мэррей А.. Уильямс Л. Сиитезы орrаннческих соединениА с изотопами
уr.nерода. Ч. 11 Перевод с анrлийскоrо, 1962, 626 стр., цеиа 2 р. 80 к. .
Мэррей А.. Уильямс Л. Сиитезы орrанических соедииений с изотопами
уr.nерода. Ч. 11. Перевод с анrлийскоrо, 1962, 626 стр., цена 2 р. 80 К..
Мэррей А.. Уильямс Л. Сиитезы орrанических соединений с изотопами
водорода. Т о м 11. Перевод С анrлийскоrо, 1961, 619 стр., цена 2 р. 57 к.
Мэррей А.. Уильямс Л. Синтезы орrаиических соединениА с изото....и
ra.nондов, азота, КИCJIорода, фосфора, серы. Перевод С анrлийскоrо, 1962,
483 стр., пена 2 р. 11 к.
Синтезы орrаничеСkИХ препаратов, С б о р н н к 1. Перевод с анr.nиА-
скосо, 1948, 604 p., цена 3 р. 11 к.
Редактор В. 1f. U1еAUЖнина
Художннк Н. А. Лиrщн
Художеств. редактор /!. И. ПодмаРЬfl:ова
Техннч. редактор Е. С. Потапен.кова
Сдано в производство 20JV -1963 r.
Подписано к печати 3jXП-I963 r.
bYMara 6ОХ90 1 /... 12,5 бум. л.
25,0 печ. л.
Уч..нзд. л. 22,2 И&д. n 3/0515
иена 1 р. 75 к. Зак. 1416
.. .. ..
И3ДАТЕЛЬСТВО
ИНОСТРАННОЙ ЛИТЕРАТУРЫ
Москва, 1-11 Рижский пер., 2
Тнпоrрафия Н. 2 им. EBr. СоколовоlI
УЦБ н ПП Ленсовнархоза
Ленинrpад. Измайповский пр., 29.