Автор: Чучалин А.Г.
Теги: заболевания дыхательной системы внутренние болезни медицина практическое руководство исследования легочной функции диагностика легочных заболеваний
ISBN: 978-5-902123-32-3
Год: 2009
Текст
ФУНКЦИОНАЛЬНАЯ ДИАГНОСТИКА
В ПУЛЬМОНОЛОГИИ
Практическое руководство
г
_ЯГ t mcyspfre re
Функциональная диагностика
в пульмонологии
Практическое руководство
Под редакцией А.Г. Чучалина
Издательский холдинг «АТМОСФЕРА»
Москва
2009
ББК 54.12
Ф94
УДК 616.23+616.24
Научный редактор к.м.н. А.В. Черняк
Ф94 Функциональная диагностика в пульмонологии: Практическое руководство / Под ред. Чучалина А.Г. — М.: Издательский
холдинг «Атмосфера», 2009. — 192 с., ил.
ISBN 978-5-902123-32-3
Первое в отечественной литератур^ практическое руководство, посвященное
современным методам исследования легочной функции, их применению в повседневной клинической работе} Излагаются физиологические основы каждого
метода и особенности интерпретации результатов. Обобщен международный
опыт использования и интерпретации различных методов функциональной диагностики легочных заболеваний, в том числе сравнительно мало применяемых в
нашей стране, но крайне необходимых при диагностике функциональных тестов:
измерение легочных объемов, оценка диффузионной способности легких и силы
дыхательной мускулатуры, внелабораторные методы определения толерантности больных с бронхолегочной патологией к физической нагрузке и т.п. Особую
ценность придают руководству собственные клинические наблюдения авторов.
Для пульмонологов, терапевтов, врачей общей практики, семейных врачей, а
также для специалистов по функциональной диагностике.
63 Ч1/ 3//к
Гдонвцька^' / • j
нзуковэ .'vt i' j
!_■■■ ' \П_\ C j
ISBN 978-5-902123-32-3 © Авторский коллектив, 2009 г.
© ООО «Издательский холдинг
«Атмосфера», 2009 г.
Список авторов
Чучалин Александр Григорьевич — д.м.н., профессор, академик РАМН, директор ФГУ
НИИ пульмонологии ФМБА РФ, Москва.
Черняк Александр Владимирович — к.м.н., заведующий лабораторией функциональных и ультразвуковых методов исследования ФГУ НИИ пульмонологии ФМБА РФ,
Москва.
Чикина Светлана Юрьевна — к.м.н., старший научный сотрудник лаборатории функциональных и ультразвуковых методов исследования ФГУ НИИ пульмонологии
ФМБА РФ, Москва.
Авдеев Сергей Николаевич — д.м.н., профессор, заместитель директора по научной работе ФГУ НИИ пульмонологии ФМБА РФ, Москва.
Науменко Жанна Константиновна — к.м.н., старший научный сотрудник лаборатории функциональных и ультразвуковых методов исследования ФГУ НИИ пульмонологии ФМБА РФ, Москва.
Неклюдова Галина Васильевна — к.м.н., старший научный сотрудник лаборатории
функциональных и ультразвуковых методов исследования ФГУ НИИ пульмонологии ФМБА РФ, Москва.
Айсанов Заурбек Рамазанович — д.м.н., профессор, заведующий клинико-физиологическим отделом ФГУ НИИ пульмонологии ФМБА РФ, Москва.
Калманова Елена Николаевна — к.м.н., заведующая отделением функциональной диагностики ГКБ № 57, Москва.
* * *
Авторский коллектив выражает благодарность сотрудникам ФГУ НИИ пульмонологии ФМБА РФ за помощь при написании монографии:
Черняеву Андрею Львовичу (д.м.н., профессор, зав. отделом патологии), Самсоновой Марии Викторовне (д.м.н., зав. лабораторией патологической анатомии и иммунологии), Марченкову Ярославу Владимировичу (к.м.н., зав. лабораторией имидж-
диагностики), Амелиной Елене Львовне (к.м.н., зав. лабораторией муковисцидоза),
Анаеву Эльдару Хусеевичу (д.м.н., зав. лабораторией неинвазивной диагностики болезней органовдыхания), Лукашенко Екатерине Петровне (н.с. лаборатории функциональных и ультразвуковых методов исследования), Пашковой Татьяне Леонидовне (к.м.н., вед. н.с. лаборатории функциональных и ультразвуковых методов исследования).
Оглавление
Предисловие 7
А. Г. Чучалын
Список сокращений 8
Глава 1. Спирометрия 10
А. В. Черняк, С.Ю. Чыкина, З.Р. Айсанов
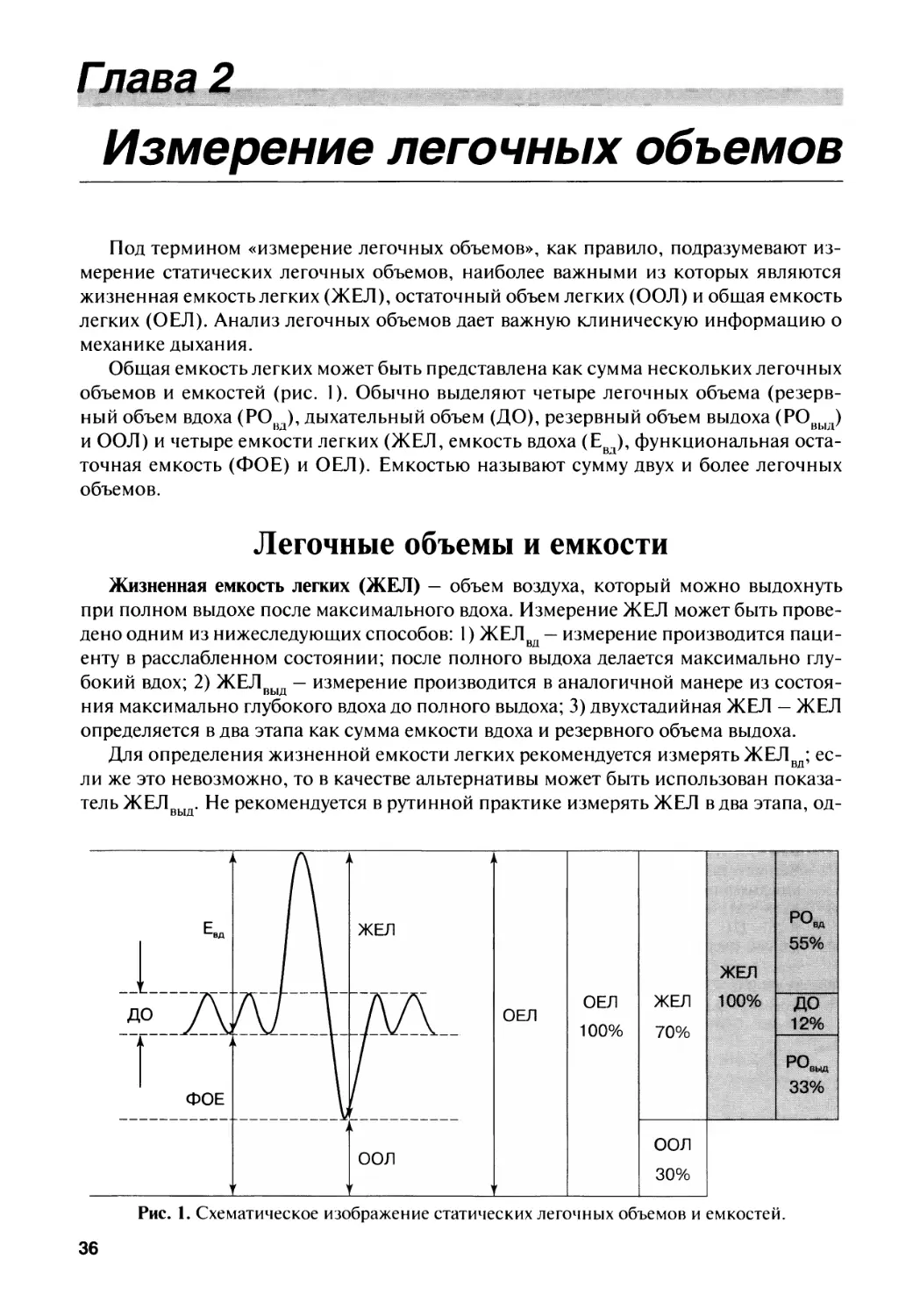
Глава 2. Измерение легочных объемов 36
А.В. Черняк
Глава 3. Бронходилатационные и бронхоконстрикторные тесты 63
А.В. Черняк, Ж. К. Науменко, З.Р. Айсанов
Глава 4. Диффузионная способность легких 84
А. В. Черняк, Г. В. Неклюдова
Глава 5. Оценка силы дыхательных мышц 105
С.Н. Авдеев, А. В. Черняк
Глава 6. Анализ газов артериальной крови 122
С.Н. Авдеев, Г.В. Неклюдова
Глава 7. Лабораторные нагрузочные тесты 140
Е.Н. Калманова, З.Р. Айсанов
Глава 8. Внелабораторные нагрузочные тесты 158
С.Ю. Чыкина
Цветные иллюстрации 180
Предисловие
Уважаемые коллеги!
Пожалуй, ни в одной области медицины функциональные методы исследования
не играют такой важной роли, как в пульмонологии. Клиническая физиология дыхания, являясь одним из самых сложных разделов медицинских знаний, располагает, наверное, самым большим разнообразием диагностических методов по сравнению с функциональными исследованиями других органов и систем. Для функциональной диагностики пульмонологических заболеваний как нигде важна активная
роль пациентов и степень взаимопонимания и сотрудничества пациента с врачом.
В то же время в нашей стране исследование респираторной функции крайне мало используется в повседневной клинической практике. Нельзя не упомянуть и о
недостаточных знаниях и неудовлетворительном соблюдении практическими врачами международных стандартов исследования легочной функции. Это касается не
только сложных функциональных методик, но и обычной спирометрии, которая
должна проводиться повсеместно и быть рутинным методом в практике врача первичного звена и обязательной частью врачебного осмотра любого пациента.
Всё это свидетельствует о насущной потребности в систематизации медицинских
знаний по респираторной функциональной диагностике именно методологического характера, касающихся выбора наиболее информативных методов при том или
ином бронхолегочном заболевании, подготовки оборудования и пациента, техники
проведения самого исследования и выполнения маневров, а также корректной интерпретации полученных результатов.
Главной целью написания данного практического руководства был не механистический обзор методик, имеющихся в распоряжении современного врача, но прежде всего трактовка результатов функционального исследования в контексте клинической ситуации в целом, когда одни и те же функциональные изменения могут расцениваться совершенно по-разному в зависимости от клинико-анамнестических,
рентгено-томографических и лабораторных данных. Таким образом, в основе современного функционального пульмонологического диагноза лежит один из краеугольных принципов сегодняшней медицины — тесное сотрудничество врачей разных специальностей: клиницистов, функционалистов, рентгенологов, морфологов.
Искренне надеюсь, что настоящее издание, представляющее собой качественно
новое методическое пособие по использованию функциональных методов в пульмонологии, окажется полезным для широкого круга специалистов, вовлеченных в диагностику и лечение пульмонологических заболеваний, и позволит существенно повысить методический уровень выполнения и интерпретации легочных функциональных тестов и качество диагностики респираторных заболеваний.
Председатель Российского респираторного общества,
директор ФГУ НИИ пульмонологии ФМБА России,
академик РАМН, профессор А. Г. Чучалин
7
Список сокращений
АТАК - анализ газов артериальной крови
АП - абсолютный прирост
БА — бронхиальная астма
ВГН — верхняя граница нормы
ВГО - внутригрудной объем (газа)
ВЭМ — велоэргометрия
ДИ — доверительный интервал
до — дыхательный объем
Евд- емкость вдоха (инспираторная
емкость легких)
ЖЕЛ — жизненная емкость легких
ИВЛ - искусственная вентиляция легких
Ксо - потребление СО в единицу времени в легких на единицу объема
Кео2 — коэффициент тканевой экстракции кислорода
КБД — коэффициент бронходилатации
КБК — коэффициент бронхоконстрик-
ции
КТ - компьютерная томография
мвл — максимальная вентиляция легких
мос — максимальная объемная скорость выдоха
нгн — нижняя граница нормы
ОЕЛ — общая емкость легких
ОПТ — отделение интенсивной терапии
оол — остаточный объем легких
ОРДС — острый респираторный дистресс-синдром
ОФВ, — объем форсированного выдоха
за 1-ю секунду
ОФВ6 - объем форсированного выдоха
за 6 с
ПК20 (ПД20) — провокационная концентрация (доза) препарата, вызывающая падение OOBj на 20%
ПОСвд - пиковая объемная скорость
вдоха
ПОСвыд - пиковая объемная скорость
выдоха (ПСВ)
Рдп — давление внутри внегрудных верхних дыхательных путей
РОвд - резервный объем вдоха
РОвыд - резервный объем выдоха
СОС25_75 - форсированный средний
экспираторный поток
(средняя объемная скорость) на среднем участке
кривой ФЖЕЛ между 25 и
75% ФЖЕЛ
ФВД - функция внешнего дыхания
ФЖЕЛ - форсированная жизненная
емкость легких
ФОЕ - функциональная остаточная
емкость легких
ХОБЛ — хроническая обструктивная
болезнь легких
ХРОЛ — хирургическая редукция объема легких
ЧСС - частота сердечных сокращений
6-МР — 6-минутное расстояние
6-МТ — 6-минутный тест (тест с ходьбой в произвольном темпе в течение 6 мин)
ATS — Американское торакальное общество
Ссар02 - содержание кислорода в крови
легочных капилляров
СОНЬ - карбоксигемоглобин
Dl - диффузионная способность легких
DLco — диффузионная способность легких по оксиду углерода
DM — проводимость альвеолярно-капиллярной мембраны
Do2 — объем кислорода, доставляемого
тканям в единицу времени
EFL — ограничение воздушного потока
при спокойном дыхании
ERS - Европейское респираторное общество
Fi02 — фракция кислорода во вдыхаемой смеси
MetHb — метгемоглобин
02НЬ - оксигемоглобин
Ральв — альвеолярное давление
Ратм ~ атмосферное давление
Рк — давление в камере
Рпл — плевральное давление
Ррот — атмосферное давление, измеренное в ротовой полости
Pdi - трансдиафрагмальное давление
РЕтах — максимальное экспираторное
давление в ротовой полости
Pes — внутриэзофагеальное давление
PetC02 — парциальное давление углекислого газа в конечной порции выдыхаемого воздуха
Pga — внутрижелудочное давление
Рн2о — парциальное давление паров
воды
Pimax — максимальное инспираторное
давление в ротовой полости
Р[А-а]Ог — альвеолярно-артериальный
градиент по кислороду
РаС02 — парциальное давление углекислого газа
Ра02 — парциальное давление кислорода
pH — концентрация ионов водорода
Q — сердечный выброс (минутный объем крови)
Qs - шунтовой кровоток
Qt — общий легочный кровоток
RQ — дыхательный (респираторный)
коэффициент
RSD — остаточная среднеквадратическая ошибка
Sa02 — степень насыщения гемоглобина артериальной крови кислородом (сатурация артериальной
крови)
Scv02 — насыщение центральной венозной крови кислородом
SR — стандартизованное значение остатков
Sv02 — насыщение смешанной венозной крови кислородом
VA — альвеолярная вентиляция
Vc — объем крови альвеолярных капилляров
VCo2 — продукция углекислого газа
VD — физиологическое «мертвое» пространство
v02 — потребление кислорода тканями
VT — дыхательный объем
АРаСО — градиент парциального давления СО между альвеолярным
воздухом и капиллярной кровью («движущее давление»)
глаща t
Спирометрия
Метод спирометрии был предложен в 1846 г. J. Hutchinson [1]. Спирометрия — самый простой и распространенный метод функциональной диагностики, который
можно рассматривать как первый, начальный этап в выявлении вентиляционных
нарушений. Он предназначен для измерения легочных объемов при различных дыхательных маневрах, как спокойных, так и форсированных.
Спирометрические данные позволяют установить, существуют ли нарушения
вентиляционной функции, и если существуют, то определить их тип (обструктивный, рестриктивный или смешанный). На основании данных одной только спирометрии невозможно поставить диагноз, так как выявляемые функциональные нарушения неспецифичны. Однако спирометрические показатели, как правило, обладают хорошей воспроизводимостью, что позволяет мониторировать течение заболевания. Кроме того, по спирометрии можно определить тяжесть заболевания:
например, по объему форсированного выдоха за 1-ю секунду (ОФВ,) и форсированной жизненной емкости легких (ФЖЕЛ) определяют степень тяжести хронической
обструктивной болезни легких (ХОБЛ) [2] и прогнозируют исход хирургических
вмешательств [3—11]; по ОФВ, и пиковой объемной скорости выдоха (ПОСвыд, синонимы: ПСВ, в англоязычной литературе PEF) — тяжесть бронхиальной астмы
(БА) [12]. Таким образом, метод спирометрии позволяет:
1) выявить обструктивные и рестриктивные нарушения вентиляции либо экстра-
торакальную обструкцию верхних дыхательных путей;
2) установить причину респираторных симптомов (хронического кашля, одышки, хрипов, стридора);
3) выявить причины изменений газообмена (гипоксемии, гиперкапнии) и других
лабораторных показателей (например, полицитемии и др.);
4) оценить риск оперативного лечения;
5) оценить физический статус пациента;
6) мониторировать динамику бронхиальной обструкции, особенно при БА и
ХОБЛ;
7) мониторировать динамику рестриктивных нарушений у больных с интерстициальными заболеваниями легких и патологией нервно-мышечного аппарата;
8) оценить эффективность лечения бронхолегочной патологии;
9) объективно оценить субъективные жалобы при профессиональной патологии
либо заболеваниях, связанных с воздействиями окружающей среды.
Метод является простым и безопасным, поэтому не существует абсолютных противопоказаний к его использованию. Однако маневр форсированного выдоха следует выполнять с осторожностью:
1) при пневмотораксе;
2) в первые 2 нед после острого инфаркта миокарда, после офтальмологических
операций и операций на брюшной полости;
3) при выраженном продолжающемся кровохарканьи;
4) при тяжелой БА;
10
Спирометрия
Рис. 1. Измерение спирометрических показателей, а — спирограмма форсированного выдоха. б — нормальная петля поток—объем, полученная при максимальных вдохе и выдохе; по
этим данным ПОСвыд = 10,3 л/с; МОС25 = 8,8 л/с, МОС50 = 6,3 л/с, МОС75 = 3,1 л/с;
МОС50вя = 7,5 л/с (МОС50вд — максимальная объемная скорость вдоха, когда пациент вдохнул 50% ФЖЕЛ; обычно МОС50вд в 1,5 раза больше МОС50). (По Чикина С.Ю., Черняк А.В.
Спирометрия в повседневной врачебной практике // Атмосфера. Пульмонология и аллергология. 2007. № 1. С. 6-11.)
5) при подозрении на активный туберкулез либо другие заболевания, передающиеся воздушно-капельным путем.
Основные параметры, получаемые при спирометрии, - это объем выдыхаемого
(или вдыхаемого) воздуха, поток (объемная скорость) и время, взаимосвязь которых
отражают кривые поток—объем и объем—время. Наиболее важными характеристиками этих кривых являются: ФЖЕЛ, ОФВ,, максимальные объемные скорости выдоха
на уровнях 25, 50 и 75% ФЖЕЛ, т.е. когда обследуемый выдохнул 25, 50 и 75% ФЖЕЛ
(МОС25, МОС50, МОС75), форсированный средний экспираторный поток на среднем
участке кривой ФЖЕЛ между 25% и 75% (СОС25 75, синоним МОС25_75), ПОСвыд
(ПСВ).
ФЖЕЛ можно измерить двумя способами. В первом случае непосредственно измеряются объем выдыхаемого воздуха и время. Строится график зависимости объема от времени — кривая объем—время
(спирограмма — рис. 1а). Во втором случае измеряются поток и время, а объем
рассчитывают, умножая поток на время.
Строится график зависимости потока
(объемной скорости) от объема выдыхаемого (вдыхаемого) воздуха - кривая поток-объем (рис. 16). Таким образом, обе
кривые отражают одинаковые параметры: интеграл от скорости воздушного
потока дает объем, который, в свою очередь, можно представить как функцию
времени. И наоборот, объем выдыхаемого (вдыхаемого) воздуха можно диффе¬
Рис. 2. Типичные ошибки при выполнении
маневра ФЖЕЛ. 1 - плохое начало маневра,
2 — медленный выдох, 3 — кашель, 4 — преждевременное прекращение выдоха. Пунктирной линией показано правильное выполнение маневра.
11
Гпава 1
ренцировать относительно времени, чтобы определить скорость потока. Современные спирометры по своей сути являются пневмотахометрами и позволяют оценивать основные параметры (объем, поток и время) и их взаимосвязь с помощью кривых поток—объем и объем—время.
Для корректной интерпретации результатов спирометрии необходимо быть уверенным в том, что исследование проведено правильно. Разработаны критерии, которые позволяют оценить корректность выполненного исследования [13—15]. Неправильное выполнение маневра форсированного выдоха является основной причиной вариабельности результатов теста. На рис. 2 представлены типичные ошибки
при выполнении спирометрического исследования.
Кривая поток—объем
Согласно данным литературы [15-17] и нашему собственному опыту, представление результатов спирометрии в виде кривой поток—объем является наиболее простым для интерпретации и наиболее информативным, поскольку максимальный поток зависит от механических свойств легочной ткани.
При форсированном выдохе у любого
человека существует ограничение максимальной объемной скорости воздуха.
Ограничение экспираторного потока достигается при умеренном усилии, и дальнейшее повышение усилия увеличивает
поток выдыхаемого воздуха только в начальной четверти маневра ФЖЕЛ. При
низких и средних объемах легких увеличение усилия не дает прироста потока.
Таким образом, после достижения пикового потока (ПОСвыд) каждая точка оставшейся части кривой определяет тот
максимальный поток, который может
быть достигнут при данном объеме легких (см. рис. 16). После выдоха 10—15%
ФЖЕЛ максимальная скорость выдоха
имеет ограничение, т.е. не может превысить определенного уровня. В отличие
от выдоха во время вдоха большее ин-
спираторное усилие вызывает больший
поток при всех уровнях жизненной емкости легких. Каждый человек имеет
уникальную кривую поток-объем, и,
поскольку такая кривая определяет максимальную объемную скорость выдоха,
кривая поток—объем у одного и того же
человека высоковоспроизводима.
Легочная ткань обладает эластичностью, которая является основной силой,
Рис. 3. Упрощенная модель механики дыхания. Легкие находятся в грудной клетке, объем которой изменяется вследствие движения
дыхательных мышц, играющих роль «поршня». При сокращении диафрагмы грудная
клетка увеличивает свой объем, воздух поступает в легкие. Во время выдоха объем
грудной клетки уменьшается и воздух через
трахею выходит из легких. Эластичность легочной ткани определяет скорость выдоха и
поддерживает бронхи раскрытыми. При
форсированном выдохе динамическая компрессия дыхательных путей вызывает их
сужение. (По Чикина С.Ю., Черняк А.В.
Спирометрия в повседневной врачебной
практике // Атмосфера. Пульмонология и
аллергология. 2007. № 1. С. 6-11.)
12
Спирометрия
заставляющей воздух при выдохе выходить из легких. Эластичность также играет
большую роль в поддержании просвета бронхов (рис. 3). При форсированном выдохе по мере уменьшения внутрилегочного объема нарастает динамическая компрессия дыхательных путей, что вызывает их критическое сужение и ограничивает скорость воздушного потока. Таким образом, максимальная скорость экспираторного
потока определяется: объемом легких; эластичностью легочной ткани, которая
обеспечивает прохождение воздуха по дыхательным путям и поддерживает просвет
бронхов открытыми; диаметром бронхов и сопротивлением дыхательных путей воздушному потоку.
Вдох, предшествующий маневру ФЖЕЛ, оказывает существенное влияние на экспираторные скоростные показатели. Для получения наилучших результатов исследования необходимо после спокойного выдоха сделать максимально глубокий вдох и
сразу же после этого без паузы выдохнуть весь воздух с максимальным усилием. Это
позволяет получить максимальные экспираторные потоки (пауза на высоте вдоха может вызвать «стрессовое расслабление» со снижением эластической тяги и увеличением растяжимости дыхательных путей, что ведет к уменьшению скорости выдоха).
Кривая поток—объем имеет следующие характеристики:
• экспираторная и инспираторная части петли имеют различную форму (см. рис. 16);
• при экспираторном маневре сразу после быстрого подъема начинается линейное
снижение потока вплоть до окончания выдоха. Поэтому экспираторная кривая
поток—объем обычно имеет форму почти прямоугольного треугольника, основанием которого является ФЖЕЛ, а вершина соответствует ПОСвыд. Начальная
часть экспираторной кривой (25—33% ФЖЕЛ) в большей степени зависит от прилагаемого пациентом мышечного усилия, а не от механических свойств легких.
В норме после достижения пика выдоха объемная скорость плавно снижается и
при достижении уровня остаточного объема легких (ООЛ) становится нулевой.
Эта часть кривой не зависит от усилий пациента и обладает высокой воспроизводимостью. При заболеваниях органов дыхания изменения механических свойств
легких приводят к изменению формы кривой. У людей старше 30 лет и при заболеваниях органовдыхания по мере завершения выдоха происходит закрытие мелких дыхательных путей, и ООЛ определяется как объем закрытия, поэтому поток
прогрессивно снижается до достижения ООЛ (рис. 4а). При высокой эластичности грудной стенки, которая свойственна молодым людям, а также у пациентов с
ограничением экскурсии грудной клетки ООЛ определяется ригидностью грудной
Рис. 4. Различные варианты кривой поток—объем, а — при возрасте >30 лет/заболеваниях органов дыхания, б - у молодых людей, в - у пациентов с ограничением экскурсии грудной клетки.
13
Гпава 1
стенки, которая ограничивает максимальный экспираторный поток. В этом случае в конце выдоха можно наблюдать резкое снижение потока (рис. 46, 4в);
• во время вдоха инспираторный поток зависит от приложенного усилия. Инспира-
торная кривая поток—объем симметрична: максимальный инспираторный поток
достигается приблизительно в средней точке кривой. Измерение максимальных
инспираторных потоков не получило широкого распространения, однако качественный анализ инспираторной и экспираторной кривых поток—объем позволяет
выявить изолированную обструкцию верхних дыхательных путей. Спирограммы,
соответствующие этим поражениям, далеко не так информативны для диагностики, как кривая поток-объем.
Основные спирометрические параметры
Спирометрическое исследование можно проводить при спокойном и при форсированном дыхании. С помощью маневра форсированного выдоха измеряют ФЖЕЛ
и показатели объемной скорости воздушного потока (ОФВр отношение
ОФВ^ФЖЕЛ, форсированный средний экспираторный поток на среднем участке
кривой ФЖЕЛ — СОС25 75, максимальные объемные скорости на уровнях 25, 50 и
75% ФЖЕЛ - МОС25, МОС50 и МОС75, ПОСвыд).
Форсированная жизненная емкость легких (ФЖЕЛ)
ФЖЕЛ - максимальный объем воздуха, который человек может выдохнуть после
максимально глубокого вдоха. ФЖЕЛ снижается при многих видах патологии, а повышается только в одном случае - при акромегалии. При этом заболевании все остальные легочные параметры остаются нормальными.
Причины снижения ФЖЕЛ:
1) патология легочной ткани (резекция легких, ателектаз); состояния, при которых уменьшается растяжимость легочной ткани (фиброз, застойная сердечная недостаточность). При обструктивных легочных заболеваниях ФЖЕЛ также снижается
за счет замедления опорожнения легких;
2) патология плевры и плевральных полостей (утолщение плевры, плевральный
выпот, опухоли плевры с распространением на легочную ткань);
3) уменьшение размеров грудной клетки. Легкие не могут расправляться и спадаться в полной мере, если движения грудной стенки (в том числе брюшного компонента) ограничены;
4) нарушение нормальной работы дыхательных мышц, в первую очередь диафрагмы, межреберных мышц и мышц брюшной стенки, которые обеспечивают расправление и опустошение легких.
Таким образом, нетрудно установить причину снижения ФЖЕЛ в каждом конкретном случае.
Следует помнить, что ФЖЕЛ - это максимальная форсированная экспираторная
жизненная емкость легких. У больных с обструктивными заболеваниями легких
ФЖЕЛ может быть существенно меньше, чем жизненная емкость легких (ЖЕЛ), измеренная при спокойном дыхании.
При тяжелых обструктивных заболеваниях легких время выдоха может превышать
15-20 с, а экспираторный поток в конце маневра может быть настолько мал, что спирометр с трудом воспринимает его. Выполнение длительного форсированного выдо¬
14
Спирометрия
ха может быть затруднительным и вызывать неприятные ощущения у пациента.
Во избежание этих явлений вместо ФЖЕЛ в последнее время используют показатель
ОФВ6 — объем воздуха, выдыхаемого за первые 6 с. У здоровых лиц ОФВ6 ненамного
меньше ФЖЕЛ. Кроме того, ОФВ6 лучше воспроизводим, чем ФЖЕЛ. Отношение
ОФВ,/ОФВ6 отражает степень ограничения воздушного экспираторного потока и
позволяет прогнозировать снижение ОФВ, у курильщиков [18, 19]. В отличие от маневра ФЖЕЛ более короткий маневр ОФВ6, не требующий достижения плато на кривой объем-время, снижает риск развития синкопальных состояний у тяжелых больных во время исследования и уменьшает утомляемость как пациента, так и медицинского персонала. Вместе с тем должные величины ОФВ6 не вполне разработаны, поэтому пока рекомендуется по-прежнему оперировать традиционной ФЖЕЛ.
Объем форсированного выдоха за 1-ю секунду (ОФВД
Из всех показателей наиболее важным является максимальный объем воздуха,
который человек может выдохнуть за 1-ю секунду маневра ФЖЕЛ, - ОФВ,. Он относительно независим от усилия, приложенного во время маневра выдоха, и отражает свойства легких и дыхательных путей. ОФВ, - наиболее воспроизводимый, часто
используемый и самый информативный показатель спирометрии.
При снижении скорости воздушного потока, например при эмфиземе, ХОБЛ,
БА, муковисцидозе, ОФВ, снижается соответственно тяжести обструкции. ФЖЕЛ
при этом также уменьшается, но, как правило, в меньшей степени. При рестриктивных нарушениях (ограничении расправления легких), например при легочном фиброзе, ОФВ, также снижается. Возникает вопрос: как различить, что явилось причиной снижения ОФВ, — рестрикция или обструкция? Для ответа на этот вопрос необходимо вычислить отношение ОФВ,/ФЖЕЛ.
Отношение ОФВ7/ФЖЕЛ
Важным спирометрическим показателем является отношение ОФВ,/ФЖЕЛ, которое обычно выражается в процентах и является модификацией индекса Тиффно
(ОФВ,/ЖЕЛвд, где ЖЕЛВД — максимальный объем воздуха, который можно вдохнуть
после полного спокойного выдоха). Объем воздуха, выдыхаемый за 1-ю секунду,
представляет собой достаточно постоянную долю ФЖЕЛ независимо от размера
легких. У здорового человека это отношение' составляет 75—85%, но с возрастом скорость выдоха снижается в большей степени, чем объем легких, и отношение несколько уменьшается. У детей, наоборот, скорости воздушных потоков высокие, поэтому отношение ОФВ,/ФЖЕЛ у них, как правило, выше — около 90%. При обструктивных нарушениях отношение ОФВ,/ФЖЕЛ снижается, поскольку ОФВ, снижается соответственно тяжести обструкции. ФЖЕЛ при этом также уменьшается,
но, как правило, в меньшей степени. При легочной рестрикции без обструктивных
изменений ОФВ, и ФЖЕЛ снижаются пропорционально, следовательно, их отношение будет в пределах нормальных величин или даже немного выше. Таким образом, при необходимости дифференцировать обструктивные и рестриктивные нарушения оценивают отношение ОФВ,/ФЖЕЛ.
Другие показатели максимального экспираторного потока
СОС25_75 — форсированный средний экспираторный поток (средняя объемная
скорость) в средней части форсированного экспираторного маневра между 25 и 75%
15
Гпава 1
ФЖЕЛ. СОС25 75 можно измерить непосредственно по спирограмме либо рассчитать по кривой поток—объем. Некоторые исследователи считают, что СОС25 75 более
чувствителен, чем ОФВ,, при диагностике ранних стадий бронхиальной обструкции
[20], однако он имеет более широкий диапазон нормальных значений [21].
Максимальные объемные скорости экспираторного потока (МОС25, МОС50 и
МОС75) на разных уровнях ФЖЕЛ (25, 50 и 75% соответственно) (см. рис. 16) не обладают высокой воспроизводимостью, подвержены инструментальной ошибке и зависят от приложенного экспираторного усилия [22], поэтому не играют существенной роли при определении типа и тяжести нарушений легочной вентиляции [15].
Пиковая объемная скорость выдоха (ПОСвыд), которая также называется максимальной экспираторной скоростью, - показатель, который измеряется в течение короткого отрезка времени сразу после начала выдоха и выражается либо в
л/мин, либо в л/с. ПОСвыд в большей степени, чем другие показатели, зависит от
усилия пациента: для получения воспроизводимых данных пациент должен в начале выдоха приложить максимум усилия [16]. Существуют недорогие портативные
приборы (пикфлоуметры) для измерения ПОСВЬ1а в домашних условиях и самоконтроля пациентами своего состояния, что получило широкое распространение у
больных БА [23].
Все эти показатели, как и ОФВ,, могут снижаться и у больных с рестриктивными
нарушениями.
Максимальные инспираторные потоки
Современные спирометры измеряют не только экспираторные, но и инспираторные потоки, в первую очередь максимальный инспираторный поток (или пиковая объемная скорость вдоха — ПОСвд). При этом испытуемый выполняет маневр
ФЖЕЛ и затем делает максимально быстрый и полный вдох, который отражается
спирометром в виде инспираторной кривой. Сочетание кривых вдоха и выдоха дает
полную петлю поток—объем.
При повышенном сопротивлении дыхательных путей снижаются как экспираторные, так и инспираторные максимальные потоки. Однако в отличие от выдоха,
при котором максимальные потоки ограничены, не существует механизмов, ограничивающих максимальные инспираторные потоки. Поэтому ПОСвд в большой степени зависит от приложенного усилия, а ее измерение не получило широкого распространения, за исключением выявления патологии верхних дыхательных путей.
Принципы интерпретации результатов
Источники вариабельности
В существующих рекомендациях Европейского респираторного общества (ERS)
и Американского торакального общества (ATS) по интерпретации измерения легочной функции, включая спирометрическое исследование, особое внимание уделяется необходимости тщательного лабораторного контроля за техническими и биологическими источниками вариабельности результатов [15, 24].
Биологическая вариабельность может быть обусловлена суточными колебаниями
показателей, курением или воздействием других химических/физических агентов.
Кроме того, состояние респираторной системы может измениться под воздействием
самой процедуры измерения; например, глубокий вдох может вызвать бронходила¬
16
Спирометрия
тацию и изменение эластических свойств легкого. Вариабельность функциональных
показателей у одного и того же пациента может быть обусловлена изменением активности патологического процесса (инфекция, контакт с профессиональными
вредностями и аллергеном), влиянием поллютантов на лиц с гиперреактивностью
дыхательных путей. Легочная функция может изменяться под воздействием препаратов, меняющих просвет бронхов. Ошибки при исследовании могут быть техническими, например вследствие различий в методике проведения исследования, в расчетах и трактовке данных.
Биологическая вариабельность сводится к минимуму, если уделяется пристальное
внимание времени и условиям проведения теста. Техническую вариабельность можно
минимизировать регулярной калибровкой, частой проверкой работы оборудования,
поддержанием его рабочего состояния, тщательной инструкцией пациента, допуском
к работе только высококвалифицированного персонала, способного проводить исследование профессионально и в соответствии со стандартными протоколами.
Должные значения
Существуют различные таблицы и формулы для расчета должных величин показателей спирометрии [15, 25]. В большинстве случаев исследования по разработке
должных величин ограничиваются расчетом средних значений, которые получают
при обследовании здоровых некурящих людей. В популяционных исследованиях
было выявлено, что распределения ОФВ, и ФЖЕЛ в среднем возрастном диапазоне
нормальные (гауссовы).
При нормальном (гауссовом) распределении параметра, оцениваемого по измерениям в достаточно большой выборке популяции, примерно 90% измерений имеют значения в интервале М ± 1,645 х SD, где М — среднее по выборке измеренное
значение, которое принимается в качестве должного значения, SD - стандартное отклонение (синонимы: среднеквадратичное отклонение, среднеквадратичная ошибка измерений). Указанный интервал также иногда называют 90% доверительным
интервалом. Поэтому для ОФВ1 и ФЖЕЛ нижняя граница нормы (НГН) и верхняя
граница нормы (ВГН) определяются следующим образом (рис. 5):
НГН = должное значение — 1,645 х SD,
ВГН = должное значение + 1,645 х SD.
Такой подход позволяет определить диапазон, в который будет попадать 90%
всей популяции: у 5% популяции показатель будет ниже нормы (т.е. <НГН), еще у
5% - выше нормы (т.е. >ВГН). Для других скоростных показателей и отношения
ОФВ,/ФЖЕЛ распределение не является симметричным (т.е. не является гауссовым) [26], поэтому нижняя граница физиологической нормы таких спирометрических показателей - это 5-й процентиль гистограммы должных значений. В нашем
случае практический интерес представляет НГН, а значит, применяя этот параметр для диагностики нарушений, мы получим в общей популяции 5% ложноположительных результатов. Практика использования в качестве НГН величин, получаемых путем умножения должных значений на коэффициент 0,8 (т.е. НГН при
этом составляет 80% от должного значения), может приводить к существенным
ошибкам. Например, у мужчины при росте 180 см в возрасте 30 лет НГН составляет для ОФВ, 81% от должного значения, а в возрасте 70 лет — 73% от должного значения (Miller М. How to interpret spirometry. Интерактивный курс по спирометрии
Гпава 1
Европейского респираторного общества, 2007 г.). Практика использования
80% от должных значений в качестве
фиксированного значения для нижней
границы нормальных значений ФЖЕЛ
и OOBj приемлема у детей, но может
приводить к существенным ошибкам
при интерпретации функции легких у
взрослых [27].
Использование 70% в качестве нижней границы нормы для отношения
ОФВ,/ФЖЕЛ приводит к значительному
числу ложноположительных результатов
(гиподиагностике ХОБЛ) у мужчин в
возрасте старше 40 лет и у женщин старше 50 лет [28] и к гипердиагностике
ХОБЛ у пожилых лиц, никогда не куривших и не имеющих характерных клинических симптомов [29]. Как известно, с
возрастом отношение ОФВ^ФЖЕЛ
снижается, поэтому некоторые авторы
для диагностики ХОБЛ у людей старше
70 лет рекомендуют использовать для
ОФВ,/ФЖЕЛ 65% порог нормы [30].
Для скоростных показателей нижняя граница нормальных значений =60% от
должных значений.
При выборе должных значений необходимо сравнить данные, получаемые с помощью выбранных уравнений должных значений, с собственными измерениями,
проведенными на репрезентативной выборке здоровых лиц [24]. Следует выбрать те
уравнения должных значений, при которых у взрослых разница между измеренными и рассчитанными значениями является минимальной [31]. У детей ориентируются на минимальную разницу логарифмов измеренных и рассчитанных значений
[31]. Чтобы быть уверенным, что выбранные должные значения приемлемы, необходимо обследовать достаточно большое число добровольцев (около ста) [24]. К сожалению, это трудновыполнимо для большинства лабораторий.
При использовании должных величин следует избегать экстраполяции за указанный диапазон роста и возраста [31]. Если все же возраст или рост пациента выходит
за границы популяции, для которой были разработаны должные значения, то в интерпретации необходимо указать, что была проведена экстраполяция. Должные величины зависят от антропометрических параметров (в основном от роста), пола,
возраста, расы. Чем выше человек, тем больше его легкие и протяженность дыхательных путей и, следовательно, максимальная экспираторная скорость. При вычислении нормальных значений для людей с кифосколиозом вместо роста в формулу следует поставить размах рук. У женщин объем легких меньше, чем у мужчин такого же роста. С возрастом эластичность легочной ткани снижается, в результате
происходит снижение объема и скорости выдоха. Вместе с тем следует принимать во
внимание и индивидуальные вариации нормы. Например, легочные заболевания
Измеренная величина
Рис. 5. Определение НГН и ВГН при нормальном распределении измеряемых (оцениваемых) спирометрических параметров. Площадь под колоколообразной кривой в диапазоне от НГН до ВГН равна 0,9 (т.е. частота
попадания результата измерения спирометрического параметра в указанный интервал
составляет 90%). (По Miller М. How to interpret
spirometry. Интерактивный курс по спирометрии Европейского респираторного общества.
2007 г. http://www.ers-education.org/pages)
18
Спирометрия
могут возникать у людей с исходными показателями легочных объемов и потоков
выше среднего уровня, и, несмотря на снижение на фоне заболевания показателей
относительно исходных значений, они по-прежнему могут оставаться в пределах популяционной нормы.
Повторные исследования
Спирометрические показатели (ОФВ, и ФЖЕЛ) надежно отражают динамику
состояния респираторной системы. Однако даже при этих простых исследованиях
могут возникнуть трудности при интерпретации повторных результатов, так как полученные изменения могут быть обусловлены технической и биологической вариабельностью. Чем больше интервал между повторными исследованиями, тем выше
вариабельность результатов.
Изменения результатов при повторных исследованиях можно считать объективными, если они носят однонаправленный характер. Динамика показателей достоверно зависит от времени суток, в которое проведено исследование, и состояния пациента. У здоровых лиц изменения ФЖЕЛ и ОФВ, являются клинически значимыми, если при повторных исследованиях в течение дня различия превышают 5%, в течение нескольких недель — 11-12%, за год — 15% [32]. Динамику скоростных
показателей кривой поток-объем оценить труднее.
Широкий диапазон нормальных значений затрудняет интерпретацию спирометрических показателей [33]. При спирометрическом исследовании значения у нижней
границы нормального диапазона могут свидетельствовать о том, что нарушений вентиляции не существует. Однако эти же результаты можно интерпретировать как наличие функциональных нарушений, если во время предыдущего исследования (например, до заболевания) показатели были значительно выше должных. Поэтому функциональные результаты следует анализировать в сочетании с клинической картиной.
Спирометрические исследования обладают высокой воспроизводимостью: их вариабельность у пациентов с хорошей кооперацией составляет 2—3% [34]. Таким образом, повторные результаты спирометрии позволяют мониторировать течение заболевания с высокой точностью. Благодаря высокой воспроизводимости спирометрия информативна в выявлении ранних (доклинических) обструктивных и рестриктивных нарушений легочной вентиляции [35].
Интерпретация результатов
Интерпретация результатов функционального исследования должна быть четкой, краткой и информативной. Простая констатация фактов, что какие-то показатели в норме, а какие-то снижены, не годится. В идеале, к интерпретации результатов функционального исследования должны применяться принципы клинического
принятия решения, где вероятность болезни после проведения исследования оценивается с учетом вероятности болезни до проведения исследования, качества исследования, вероятности ложноположительной и ложноотрицательной интерпретации
и, наконец, непосредственно результатов исследования и должных значений. Это
часто невозможно, потому что интерпретация многих, если не большинства, исследований проводится при отсутствии какой-либо клинической информации. Чтобы
улучшить ситуацию, по возможности следует спрашивать врачей, направляющих
пациента на исследование, на какой клинический вопрос необходимо ответить, а
19
Гпава 1
также до исследования поинтересоваться у пациента, почему его направили в
лабораторию. В этом отношении также
желательно записать респираторные
симптомы (например, кашель, мокрота,
хрипы и одышка), недавнее использование бронхорасширяющих препаратов,
анамнез курения.
Интерпретация будет более точной
при учете клинического диагноза, данных рентгенограммы грудной клетки,
концентрации гемоглобина и любых подозрений на нейромышечные заболевания или обструкцию верхних дыхательных путей.
Интерпретация результатов спирометрии строится на анализе основных
спирометрических параметров (ОФВ,,
ЖЕЛ используют ФЖЕЛ; предпочтительнее пользоваться максимальным значением жизненной емкости легких, полученным либо при форсированном маневре (ФЖЕЛ), либо при спокойном дыхании
(ЖЕЛВД или ЖЕЛвыл). На рис. 6 показана упрощенная схема диагностики вентиляционных нарушений. Такой подход позволяет выявить отклонения от нормы и избежать проблемы, возникающей при одновременном анализе большого числа показателей, когда наблюдается увеличение процента «ненормальных» результатов даже
при обследовании здоровых людей [24]. При интерпретации данных спирометрии у
здоровых добровольцев (п = 251) количество отклонений от нормы при анализе одного параметра не превышало 5%, при анализе трех параметров (ОФВ,, ФЖЕЛ и
ОФВ,/ФЖЕЛ) — 10%, а при анализе четырнадцати - 24% [36]. Однако следует помнить, что дополнительные параметры, например пиковый экспираторный поток и
максимальный инспираторный поток, могут помочь в диагностике изолированной
обструкции верхних дыхательных путей. Применение фиксированных значений
(для ФЖЕЛ и ОФВ,/ФЖЕЛ в качестве нижней границы физиологической нормы,
как правило, применяют 80% от должных значений) может приводить к ошибкам
при интерпретации функции легких.
Обструктивные вентиляционные нарушения
Наиболее частое показание к проведению спирометрического исследования -
выявление обструкции дыхательных путей и оценка ее выраженности. Обструктивный тип вентиляционных нарушений характеризуется снижением отношения
ОФВ,/ФЖЕЛ при нормальной ФЖЕЛ. Патофизиологической основой снижения
максимального экспираторного потока при бронхиальной обструкции является повышение сопротивления дыхательных путей, однако при недостаточном усилии,
приложенном пациентом во время выполнения маневра ФЖЕЛ, максимальный
экспираторный поток также будет снижен. Дифференцировать эти ситуации можно
при количественной оценке усилия пациента, измерив плевральное давление (с помощью внутрипищеводного баллона) или компрессионный объем в боди-камере.
ОФВ1
ФЖЕЛ
рестрикция
норма
смешанный
тип
обструкция
0 НГН ФЖЕЛ, % долж.
Рис. 6. Упрощенная схема интерпретации результатов спирометрии.
ЖЕЛ, ОФВ,/ЖЕЛ) [24]. Нередко вместо
20
Спирометрия
Рис. 7. Кривые поток-объем у больных с обструктивными заболеваниями органов дыхания,
а, б - БА, в - эмфизема легких. Пунктирными линиями обозначены должные экспираторные
кривые. (По Респираторная медицина: Руководство / Под ред. А.Г. Чучалина. М.: Гэотар-Медиа, 2007. Т. 1. С. 357.)
Ранними признаками обструктивных нарушений вентиляции у пациентов без
клинических проявлений, возможно, могут служить изменение формы экспираторной кривой поток—объем и снижение скоростных показателей, измеренных при
низких легочных объемах во время теста ФЖЕЛ (СОС25 75, МОС50, МОС75) (рис. 7а)
[37], однако в настоящее время не существует убедительных доказательств существования таких корреляционных связей [20, 26]. Более того, значительная вариабельность показателей затрудняет интерпретацию индивидуальных отклонений от должных значений [38].
При обструктивных нарушениях происходит снижение экспираторных потоков,
и нисходящая часть экспираторной кривой пациента располагается под должной
экспираторной кривой (рис. 7). Кроме того, обычное линейное снижение скорости
потока на кривой поток—объем нарушается, ее нисходящее колено приобретает вогнутую форму. Нарушение линейности нижней половины кривой поток—объем является характерной чертой обструктивных нарушений вентиляции и предполагает
наличие бронхиальной обструкции, даже когда ФЖЕЛ, ОФВ, и ОФВ,/ФЖЕЛ не
выходят за пределы нормальных значений. Выраженность изменений формы кривой зависит как от тяжести обструктивных нарушений, так и от нозологической
формы. Причиной этого чаще всего является сужение просвета дыхательных путей
при БА, ХОБЛ, эмфиземе, муковисцидозе, сдавление крупных бронхов и трахеи
опухолью извне, стенозирование эндофитно растущей опухолью, рубцовой тканью,
инородным телом. При подозрении на БА следует провести бронходилатационный
тест, а при необходимости — бронхоконстрикторный тест. Для оценки выраженности эмфиземы следует исследовать общую емкость легких и диффузионную способность легких.
Особое вйимание следует уделить синхронному снижению ОФВ, и ФЖЕЛ, при
котором отношение ОФВ,/ФЖЕЛ остается нормальным или почти нормальным. Такие изменения спирограммы чаще всего наблюдаются, если пациент делает вдох или
выдох не полностью или если поток настолько медленный, что для выдыхания всего
21
Гпава 1
о
с;
*
О
н
о
CZ
о
Рис. 8. Сравнение кривых поток-объем при форсированном дыхании (пунктирные линии) и
при спокойном дыхании (сплошные линии), а - поток в покое нигде не превышает форсированный поток (1-й тип), б - максимум потока в покое примерно равен форсированному потоку (при том же значении объема или в узком интервале вблизи максимума) (2-й тип), в -
поток в покое превышает форсированный поток на достаточно протяженном интервале изменения объема (3-й тип). У пациентов с 1-м типом дыхательного паттерна нет ограничения
экспираторного потока, а у пациентов со 2-м и 3-м типом имеется ограничение экспираторного потока. (По Респираторная медицина: Руководство / Под ред. А.Г. Чучалина. М.: Гэотар-
Медиа, 2007. Т. 1. С. 358.)
воздуха из легких требуется слишком большая продолжительность выдоха. В таком
случае дистальный отдел кривой поток—объем будет вогнутым (МОС75 снижена). Измерение ЖЕЛ (инспираторной или экспираторной) поможет более точно оценить
отношение OOBj к максимальному объему легких. Другая возможная причина одновременного снижения OOBj и ФЖЕЛ — коллапс мелких дыхательных путей в начале
выдоха. Если такие изменения наблюдаются при выполнении маневра с максимальным усилием, достоверный прирост ОФВ, после ингаляции бронхолитика подтвердит наличие экспираторного коллапса. Достоверное увеличение ОФВ,, ФЖЕЛ или
обоих параметров после ингаляции бронхолитика свидетельствует об обратимости
обструктивных нарушений (см. главу 3, раздел «Бронходилатационные тесты»).
Важную клиническую информацию можно получить при сравнении кривых поток-объем при спокойном и форсированном дыхании (рис. 8). В 1961 г. Hyatt предложил этот метод для оценки ограничения экспираторного потока при спокойном
дыхании (EFL) [39]. При наличии ограничения потока максимальная объемная скорость при спокойном выдохе больше или равна соответствующей (т.е. при значении
объема в точке максимума EFL) объемной скорости, полученной при выполнении
маневра ФЖЕЛ (рис. 86, 8в), что приводит к снижению вентиляционного резерва и
гиперинфляции.
В некоторых случаях возможна парадоксальная ситуация, когда поток при спокойном выдохе на достаточно протяженном интервале изменения объема больше,
чем при форсированном выдохе (см. рис. 8в). Возможной причиной такого феномена является потеря легкими эластической отдачи и уменьшение сил, поддерживающих просвет дыхательных путей. Это может наблюдаться при резко выраженных обструктивных нарушениях, эмфиземе.
При сравнении кривой спокойного выдоха и кривой ФЖЕЛ можно определить
резервный объем выдоха. При ожирении, беременности и асците резервный объем
выдоха снижается, и кривая спокойного дыхания сдвигается вправо.
22
Спирометрия
Обструкция верхних
дыхательных путей.
Форма максимальной
кривой поток—объем
существенно отличается от должной при обструкции верхних дыхательных путей [16, 17].
Своеобразная форма
кривой поток—объем
при поражениях верхних дыхательных путей
обусловлена различным
воздействием динамических факторов на
экстра- и интратора-
кальные дыхательные
пути. На экстратора-
кал ьн ы е д ы хате л ьн ы е
пути влияет атмосферное давление, на интра-
торакальные — внутри-
плевральное. Разница
между внешним давлением (атмосферным или плевральным) и давлением внутри дыхательных путей называется трансмуральным давлением. Положительное трансмуральное давление создает компрессию и уменьшает просвет дыхательных путей. Наоборот, отрицательное
трансмуральное давление поддерживает дыхательные пути открытыми, увеличивая
их просвет. Если обструкция возникает только во время вдоха либо выдоха, она считается переменной (рис. 9). Если воздушные потоки снижены во время обеих фаз дыхания, обструкция называется фиксированной.
Переменная экстраторакальная обструкция (например, при параличе голосовых
связок, увеличении щитовидной железы) вызывает избирательное ограничение воздушного потока при вдохе. Во время выдоха давление внутри дыхательных путей
увеличивается и превышает атмосферное, воздействующее на зону поражения снаружи, поэтому экспираторный поток меняется мало. Во время вдоха наблюдается
обратная картина: атмосферное давление значительно превышает давление в дыхательных путях, что приводит к снижению инспираторных потоков. Изменения ин-
спираторных потоков хорошо видны на кривой поток—объем (рис. 10а).
При переменной интраторакалъной обструкции (например, при опухоли нижнего
отдела трахеи (ниже яремной ямки грудины), трахеомаляции, гранулематозе Вегенера или рецидивирующем полихондрите) высокое внутриплевральное давление во
время форсированного выдоха превышает давление в дыхательных путях, что приводит к выраженному сужению их просвета с критическим снижением экспираторных потоков. Инспираторные потоки могут мало меняться, если плевральное давление более отрицательное, чем давление в дыхательных путях. Характерная кривая
поток—объем представлена на рис. 106.
Рис. 9. Переменная обструкция верхних дыхательных путей, а —
переменная экстраторакальная обструкция - снижение инспи-
раторного потока: во время вдоха давление внутри экстратора-
кальных верхних дыхательных путей (Р ) ниже атмосферного
(Ратм) — поток снижается; давление внутри интраторакальных
верхних дыхательных путей (Р it) выше плеврального (РП1) —
поток нормальный, б — переменная интраторакальная обструкция — снижение экспираторного потока: во время выдоха Рдпе1
выше Ратм - поток нормальный; РД11 jt ниже Р[п - поток снижается. (По Miller М. How to interpret spirometry. Интерактивный
курс по спирометрии Европейского респираторного общества.
2007 г. http://www.ers-education.org/pages)
23
Гпава 1
Рис. 10. Кривые поток-объем у больных с обструкцией верхних дыхательных путей, а — переменная экстраторакальная обструкция: МОС5()вд/МОС50выд <1, ПОСвыд — обычная или снижена, МОС50вд — снижена, б — переменная интраторакальная обструкция: МОС50вд/МОС50выд
>1, ПОСвыд - снижена, МОС50в1 - обычная или снижена, в — фиксированная обструкция:
МОС50вд/МОС50выД =1, ПОСВЫ1 - снижена, МОС50вд - снижена. (По Pellegrino et al. [24].)
При фиксированной обструкции (например, при опухолях на любом уровне верхних дыхательных путей или параличе голосовых связок с фиксированным стенозом, рубцовых стриктурах) инспираторные и экспираторные потоки нарушаются
почти в одинаковой степени. Локализация поражения не имеет значения, поскольку размеры трахеи при этом не зависят от давления внутри и снаружи дыхательных
путей (рис. 10в).
Для характеристики вышеуказанных поражений верхних дыхательных путей используются различные показатели, например отношение инспираторных и экспираторных потоков на уровне 50% жизненной емкости (МОС50вд/МОС50выд, в норме
это отношение приблизительно равно 1,5). Это отношение наиболее значительно
меняется при переменной экстраторакальной обструкции и неспецифично для другой патологии (см. рис. 10). При подозрении на изолированную обструкцию верхних
дыхательных путей следует подтвердить диагноз эндоскопически или рентгенологически.
Болезни мелких дыхательных путей. Сегодня не существует достаточно специфичных и чувствительных функциональных тестов для диагностики изолированной обструкции дистальных отделов дыхательных путей. Лучше всего функцию периферических дыхательных путей отражают скоростные показатели, измеренные при низких легочных объемах во время теста ФЖЕЛ (СОС25 75, МОС5(), МОС75), но они
имеют очень широкий разброс нормальных значений и вследствие этого низкую
воспроизводимость.
Классификация тяжести обструктивных вентиляционных нарушений. В большинстве случаев функция легких во многом определяет способность больного к повседневной физической активности, качество жизни и прогноз заболевания, в том числе
риск летального исхода не только от заболеваний органовдыхания, но и от сердечнососудистой патологии [40, 41]. Было показано, что у лиц некоторых профессий OOBj
и ОФВ,/ФЖЕЛ являются независимыми факторами риска летального исхода, в том
числе от заболеваний органов дыхания [42, 43]. Кроме того, метаанализ шести обзоров, посвященных смертности в различных профессиональных группах в Великобри-
24
Спирометрия
танин, продемонстрировал, что существует связь между риском смерти от ХОБЛ
и ОФВ, [44]. Пациенты, ОФВ, которых
при начальном обследовании был ниже
среднего значения более чем на 2 SD, по
сравнению с пациентами, ОФВ, которых
был не ниже 1 SD от среднего, имели в
12 раз более высокий риск смерти от
ХОБЛ, в 10 раз — от неопухолевых легочных заболеваний и вдвое — от сосудистых
заболеваний в течение 20-летнего периода наблюдения [44]. Доказано, что в большинстве случаев ОФВ, коррелирует с тяжестью симптомов и прогнозом заболевания, тем
не менее корреляции не позволяют точно предсказывать тяжесть и течение болезни у
конкретного пациента [24].
Для оценки тяжести обструктивных нарушений в большинстве случаев используют степень отклонения ОФВ, от должного значения (табл. 1). Эту классификацию
не применяют у пациентов с обструкцией верхних дыхательных путей, когда даже
слабо выраженная обструкция может быть опасна для жизни.
В некоторых случаях ОФВ, не позволяет должным образом идентифицировать
тяжесть вентиляционных нарушений, особенно при далеко зашедшей болезни. Так,
ОФВ, плохо коррелирует с ограничением воздушного потока при спокойном дыхании (EFL) [45, 46], тогда как клиническая значимость EFL достаточно велика, потому что ограничение воздушного потока приводит к усилению одышки, заставляет
дыхательные мышцы работать в невыгодных с точки зрения респираторной механики условиях и оказывает негативное влияние на сердечно-сосудистую систему
[45—47]. Хотя в настоящее время нет достаточных доказательств, чтобы использовать EFL для оценки тяжести вентиляционных нарушений в повседневной практике, такие измерения могут быть информативными у пациентов с несоответствием
результатов спирометрии тяжести одышки.
Для определения тяжести обструктивных нарушений не рекомендуется использовать отношение ОФВ,/ФЖЕЛ, поскольку при прогрессировании заболевания
ОФВ, и ФЖЕЛ могут снижаться синхронно, а их отношение останется при этом
нормальным. Тем не менее отношение ОФВ,/ФЖЕЛ помогает оценить тяжесть вентиляционных нарушений у людей с исходно большим объемом легких. В этих случаях ОФВ,/ФЖЕЛ может быть очень низким (50% и менее), а ОФВ, будет соответствовать обструкции легкой степени.
Рестриктивные вентиляционные нарушения
Рестриктивные нарушения вентиляции обусловлены процессами, снижающими
растяжимость легких и, следовательно, ограничивающими наполнение легких воздухом. В начале развития патологических нарушений, когда объем легких еще не снижен, скоростные показатели и отношение ОФВ,/ФЖЕЛ могут увеличиваться вследствие того, что паренхима легких оказывает большее растягивающее действие на
дыхательные пути: просвет бронхов увеличивается относительно объема легких. При
прогрессировании заболевания происходит уменьшение воздушности легочной ткани. Это проявляется снижением ЖЕЛ, кривая поток—объем становится высокой и узкой (рис. 11а). Пиковая объемная скорость обычно остается нормальной, после пика
Таблица 1. Классификация тяжести бронхиаль¬
ной обструкции [24]
Степень тяжести
ОФВр % от должного
Легкая
>70
Умеренная
60-69
Средняя
50-59
Тяжелая
35-49
Крайне тяжелая
<35
25
Гпава 1
наблюдается быстрое
линейное снижение
потока. Форма кривой
может и не меняться, а
представлять собой
пропорционально
уменьшенную копию
должной кривой, как,
например, при пуль-
монэктомии (рис. 116).
Рестриктивные нарушения могут встречаться при интерстициальных заболеваниях легких, обширной
воспалительной инфильтрации легочной
ткани, гипоплазии и
ателектазах легкого,
после резекции легочной ткани. При подозрении на интерстициальные заболевания легких следует измерить диффузионную
способность легких и общую емкость легких. К рестрикции также может приводить
и внелегочная патология, например поражение грудного отдела позвоночника, ребер, дыхательной мускулатуры; высокое стояние диафрагмы, что делает невозможным выполнение глубокого полноценного вдоха; нарушение регуляции дыхания
при угнетении дыхательного центра наркотическими препаратами или его повреждении опухолью, кровоизлиянием. При подозрении на мышечную слабость как
причину рестрикции следует измерить силу дыхательных мышц. Кроме того, у больных с выраженной мышечной слабостью значения ФЖЕЛ, измеренные в вертикальном положении и в положении лежа, будут существенно различаться из-за воздействия гравитации на органы брюшной полости. В норме ФЖЕЛ в положении лежа
на 5—10% меньше, чем в положении сидя [48]. При выраженной диафрагмальной
дисфункции эта разница превышает 30% [49].
Для диагностики рестриктивных нарушений недостаточно спирометрического исследования, а следует выполнить бодиплетизмографию и измерить легочные объемы.
Смешанные вентиляционные нарушения
Смешанные нарушения легочной вентиляции развиваются при сужении просвета дыхательных путей на фоне уменьшения легочных объемов. При этом спирометрия будет регистрировать одновременное снижение ФЖЕЛ, ОФВ, и ОФВ,/ФЖЕЛ.
Для уточнения характера функциональных нарушений необходимо выполнять
бодиплетизмографию с измерением легочных объемов.
В табл. 2 приведены типичные варианты вентиляционных нарушений. В таблицу
не включена обструкция верхних дыхательных путей, так как данные показатели
при этом малоинформативны, а диагностически значимым тестом является полный
контур петли поток—объем.
Поток, л/с Поток, л/с
Рис. 11. Кривые поток—объем у больных с рестриктивными вентиляционными нарушениями, а — фиброз легких, б - пульмон-
эктомия. Пунктиром показаны должные экспираторные кривые.
(По Респираторная медицина: Руководство / Под ред. А.Г. Чуча-
лина. М.: Гэотар-Медиа, 2007. Т. 1. С. 357.)
26
Спирометрия
Таблица 2. Типичные варианты вентиляционных нарушений
Показатель
Обструкция
Рестрикция
ФЖЕЛ, л
Норма или снижена
Снижена
ОФВ,, л
Снижен
Снижен
ОФВ,/ФЖЕЛ, %
Норма или снижено
Норма или повышено
СОС25_75, л/с
Норма или снижен
Норма или повышен
П0СНЫД’ Л/С
Снижена
Норма или снижена
Качественный анализ кривой поток—объем. Кроме механического запоминания вариантов вентиляционных нарушений, описанных в табл. 2, существует другой достаточно ценный с практической точки зрения подход, который заключается в визуальном сопоставлении кривой поток—объем пациента и нормальной (должной) кривой.
У здорового человека при правильно выполненном маневре сразу после достижения пиковой скорости выдоха начинается плавное снижение скорости потока, поэтому кривая поток—объем обычно имеет форму почти прямоугольного треугольника, основанием которого является ФЖЕЛ, а вершина соответствует ПОСВЬ1Д. Как
восходящая, так и нисходящая части кривой форсированного выдоха приближаются к прямой линии. Вариантом нормы считаются и кривые, у которых на нисходящей части появляется своеобразное «колено» (рис. 12а). Такие кривые свойственны
молодым людям. С возрастом эластичность легочной ткани уменьшается и скорость
выдоха снижается в большей степени, чем объем легких, поэтому у пожилых людей
может нарушаться линейность нисходящей части кривой поток—объем в дистальном отделе (рис. 126).
На начальных этапах обструктивных заболеваний кривая поток—объем ничем не
отличается от должной, и только позже, когда появляется механическое ограничение вентиляции, экспираторные потоки снижаются, и кривая больного располагается под должной кривой (см. рис. 76). Такое сопоставление кривых весьма информативно: то, что кривая больного располагается под должной кривой, означает, что
потеряна значительная доля площади под
кривой и имеет место
ограничение легочной
вентиляции. Вогнутая
форма кривой и пологая нисходящая часть
свидетельствуют об
обструктивных процессах. При выраженной обструкции и эмфиземе легких кривая
приобретает характерный излом: следующее
за пиком резкое снижение скорости экспираторного потока
сменяется пологим
Рис. 12. Варианты нормальной кривой поток—объем с нарушением линейности нисходящей части, а — выпуклый участок в
среднем отделе может появляться у молодых людей, б — вогнутый
участок в дистальном отделе может появляться у пожилых людей.
27
Гпава 1
участком кривой, отражающим экспираторный коллапс дистальных отделов дыхательных путей с образованием «воздушных ловушек» (см. рис. 7в).
При обследовании больного с легочным фиброзом (см. рис. 11 а) одного взгляда на
график достаточно, чтобы определить существенное уменьшение площади под кривой, отражающее ограничение вентиляции. Крутой спуск нисходящей части кривой
поток—объем и уменьшение ФЖЕЛ характерны для рестриктивных нарушений.
Максимальная вентиляция легких. При измерении максимальной вентиляции
легких (МВЛ) определяют максимальный объем воздуха, который может быть пропущен через легкие за I мин. Во время исследования пациенту необходимо дышать
максимально часто и глубоко. Длительность исследования обычно составляет 15 с за
исключением процедуры определения максимальной поддерживаемой вентиляции
легких, когда время исследования увеличивается до 4 мин. В последнем случае вдыхаемый газ должен содержать углекислоту для предотвращения гипокапнии. Частота дыхания при измерении МВЛ не стандартизована. Максимальные результаты
обычно регистрируют при частоте дыхания 70—120 в I мин, однако частота дыхания
не оказывает существенного влияния на полученные результаты [50]. Тем не менее
следует указать в протоколе, при какой частоте дыхания было проведено измерение,
например МВЛ90.
Результаты измерения МВЛ в значительной степени зависят от прилагаемого
усилия и желания пациента. Несмотря на это измерение МВЛ оказывается полезным в ряде ситуаций. Так, при нейромышечных и неврологических заболеваниях, а
также при выраженных вентиляционных нарушениях МВЛ снижается. При обструктивных нарушениях снижение МВЛ более выражено, чем при рестриктивных,
поскольку при уменьшении объема легких частое поверхностное дыхание компенсирует нарушения вентиляции.
МВЛ хорошо коррелирует с тяжестью одышки и физической работоспособностью. Кроме того, поддерживаемая МВЛ позволяет оценить выносливость дыхательных мышц и выявить ранние признаки их утомления [51]. Такое исследование следует проводить с особой осторожностью у пациентов с миастенией, у которых высок
риск развития дыхательной недостаточности.
В настоящее время МВЛ всё больше вытесняется показателем ОФВ,; эмпирически было установлено, что МВЛ примерно в 35 раз больше ОФВр
Клинические случаи
Клинический случай 1
Мужчина 53 лет. Жалуется на затруднение дыхания на вдохе, осиплость голоса. Курил в течение последних 30 лет по пачке в день, последний месяц не курит. Стридор.
При аускультации над легкими хрипов нет, дыхание проводится во все отделы. В проекции трахеи (область яремной ямки) выслушиваются свистящие
хрипы на вдохе. Результаты спирометрии представлены в табл. 3.
Исходная спирометрия выявляет обструктивные нарушения вентиляционной способности легких, на что указыва-
Рис. 13. Исходная кривая поток—объем.
28
Спирометрия
Ъблица 3. Результаты спирометрии (клинический случай 1)
Показатель
До ингаляции
сальбутамола
После
ингаляции
сальбутамола
Показатель
До ингаляции
сальбутамола
После
ингаляции
сальбутамола
ФЖЕЛ, л
6,38 (139)
6,41 (140)
МОС75, л/с
0,96 (49)
1,27 (65)
«Яс от ДОЛЖНОЙ)
(% от должной)
ОФВ,, л
3,27 (89)
3,23 (88)
П0Свьи> Л/С
3,55 (40)
3,19(36)
(Яс от должного)
(% от должной)
ОФВ,/ФЖЕЛ, %
51
50
Время выдоха, с
6,26
6,02
СОС25_75, л/с
2,24 (58)
2,62 (67)
МОС„л50’ Л/С
2,20
1,96
от должного)
П0СВД' Л/С
2,40
2,10
МОС25, л/с
3,30 (43)
3,19(41)
(% от должной)
[% от должной)
МОС5(), л/с
2,97 (62)
2,97 (62)
(% от должной)
ет снижение ОФВ,/ФЖЕЛ до 51%. ФЖЕЛ не снижена и составляет 139%. Выраженность обструктивных нарушений легкая, поскольку ОФВ, составляет 89% от
должного. Обращает на себя внимание генерализованное снижение скорости выдоха
и снижение объемных скоростей вдоха. В норме отношение МОС50вд/МОС50выд приблизительно равно 1,5; в данном случае - менее 1. Анализ кривой поток-объем указывает на наличие у больного фиксированной обструкции верхних дыхательных путей (рис. 13).
Повторная спирометрия после ингаляции 400 мкг сальбутамола не привела к существенному изменению показателей (см. табл. 3).
Рекомендовано было провести эндоскопическое и/или рентгенологическое обследование.
При рентгеновском обследовании обнаружена опухоль в верхних дыхательных
путях (рис. 14).
Клинический случай 2
Мужчина в возрасте 41 года жалуется на одышку при небольшой физической нагрузке и в положении лежа, из-за чего не может спать; чувство дискомфорта и боли
в правой половине грудной клетки. Все жалобы появились полгода назад после пе-
Рис. 14. Компьютерная томография. Опухоль гортани (указана стрелками).
29
Гпава 1
Таблица 4. Результаты спирометрии (клинический случай 2)
Показатель
В положении
Показатель
В положении
сидя
лежа
сидя
лежа
ФЖЕЛ, л (% должн.)
2,51 (55)
1,64(36)
МОС75, л/с (% должн.)
0,83 (40)
0,15(7)
ОФВ,, л (% должн.)
2,13(57)
1,16(31)
ПОСВыД, л/с (% должн.)
8,38 (93)
5,33 (59)
ОФВ,/ФЖЕЛ, %
85
71
АЕХ, л л/с (% должн.)
9,28 (41,2)
3,03(13,5)
СОС25_75, л/с (% должн.)
2,68 (62)
0,59(14)
Время выдоха, с
8,62
8,21
МОС25, л/с (% должн.)
7,97 (102)
4,74 (61)
МОСвд50’Л/С
4,53
3,39
МОС50, л/с (% должн.)
4,62 (94)
1,25 (25)
ПОСвд, л/с (% должн.)
4,58
3,71
Обозначения: АЕХ - площадь под экспираторной кривой поток-объем, % должн. - % от должного
(должной).
ренесенной вирусной инфекции. До этого пациент чувствовал себя хорошо, активно занимался спортом, никогда не курил.
При аускультации определяется ослабление дыхания в нижних отделах правой
половины грудной клетки. Результаты спирометрии представлены в табл. 4.
Исходная спирометрия выявляет патофизиологические нарушения вентиляционной способности легких, характерные для рестриктивных нарушений, на что указывает снижение ФЖЕЛ до 55% от должной. ОФВ,/ФЖЕЛ не снижено и составляет 85%. Отмечается снижение скорости выдоха в дистальном отделе кривой поток-объем (МОС75 равна 40% от должной), что может быть следствием уменьшения
объема легких.
Рестриктивные нарушения могут встречаться как при патологии легочной ткани
(интерстициальные заболевания легких, гипоплазия, ателектаз легкого, резекция
легочной ткани), так и при внелегочной
патологии (поражения грудного отдела
позвоночника, ребер, дыхательной мускулатуры; высокое стояние диафрагмы,
что делает невозможным выполнение
глубокого полноценного вдоха; нарушения регуляции дыхания при угнетении
дыхательного центра наркотическими
препаратами или его повреждении опухолью, кровоизлиянием). Для исключения патологии дыхательных мышц повторили исследование в положении лежа. Повторная спирометрия выявила падение ФЖЕЛ на 35% по сравнению с
исходным значением (с 2,51 до 1,64 л
(рис. 15), в норме разница не превышает
5-10%). Такое падение указывает на выраженную дисфункцию диафрагмы.
Было рекомендовано провести бо-
диплетизмографию и измерить диффу-
30
Поток, л/с
Рис. 15. Кривые поток—объем в зависимости
от положения тела пациента: кривая 1 - вертикальное положение, кривая 2 — горизонтальное. Пунктиром показана должная экспираторная кривая.
Спирометрия
Рис. 16. Рентгенограмма (а) и компьютерная томограмма (б) грудной клетки. Паралич правого купола диафрагмы проявляется его высоким стоянием.
знойную способность легких, а также сделать рентгенографию и компьютерную томографию легких.
Рентгенологическая картина релаксации правого купола диафрагмы — рентгенограмма грудной клетки и компьютерная томограмма — представлена на рис. 16. Видно, что правый купол диафрагмы расположен высоко — на уровне 3-го межреберья
при спокойном дыхании, тогда как в норме он должен проецироваться на уровне
4—5-го межреберья.
Таким образом, спирометрия у больного с одышкой выявила рестриктивные нарушения, при рентгеновском обследовании установлено, что рестрикция связана с
поражением диафрагмы. Выраженное снижение ФЖЕЛ в горизонтальном положении тела подтвердило диагноз паралича диафрагмы.
Клинический случай 3
Женщина 66 лет. Жалуется на одышку при физической нагрузке, периодическое
кровохарканье. Не имеет профессиональных вредностей, не курит.
При аускультации дыхание везикулярное, хрипы не выслушиваются. Результаты
спирометрии представлены в табл. 5.
При исходной спирометрии выявлены обструктивные нарушения вентиляционной способности легких, на что указывает снижение ОФВ,/ФЖЕЛ до 38%. ФЖЕЛ
не снижена и составляет 92% от должной. Обструктивные нарушения следует считать тяжелыми, поскольку ОФВ, составляет 41% от должного. Отмечается генерали-
Таблица 5. Результаты спирометрии (клинический случай 3)
Показатель
Исходно
Показатель
Исходно
ФЖЕЛ, л (% от должной)
2,81 (92)
MOC7V л/с (% от должной)
0,11 (9)
ОФВ,, л (% от должного)
1,06 (41)
ПОСвыд, л/с (% от должной)
4,02 (63)
ОФВ,/ФЖЕЛ, %
38
АЕХ, л л/с (% от должной)
1,91 (16,9)
СОС25_75, л/с (% от должного)
0,29(10)
Время выдоха, с
18,46
МОС25, л/с (% от должной)
0,80(15)
МОСвд50’ Л/С
3,43
МОС50, л/с (% от должной)
0,36(10)
ПОСвд, л/с (% от должной)
4,01
31
Гпава 1
Рис. 17. Исходная кривая поток—объем. Вогнутая форма экспираторной кривой и пологое нисходящее колено означают выраженные обструктивные процессы. Пунктиром
показана должная экспираторная кривая.
Рис. 19. Компьютерная томография высокого разрешения. Отчетливо видны округлые
похожие по форме тонкостенные образования, распространенные по всем легочным
полям, включая реберно-диафрагмальные
области.
зованное снижение скорости выдоха. Кривая поток—объем указывает на то, что потеряна значительная доля нормальной площади под кривой и у пациентки имеется
существенное ограничение легочной вентиляции (рис. 17).
В данном случае диагностируется лимфангиолейомиоматоз — редкая разновидность интерстициальных заболеваний легких, характеризующаяся прогрессирующей
пролиферацией гладкомышечных клеток в стенках бронхов, бронхиол и легочных
кровеносных и лимфатических сосудов. Диагноз подтвержден при гистологическом
исследовании открытой биопсии легкого (рис. 18, см. цветную вкладку на с. 180). Характерная компьютерно-томографическая картина представлена на рис. 19.
Клинический случай 4
Мужчина 56 лет. Рост 180 см, масса тела 57 кг, индекс массы тела 17,6 кг/м2. Жалуется на одышку при умеренных физических нагрузках. Курильщик со стажем
35 пачек-лет.
При аускультации на фоне некоторого ослабления дыхания в нижних отделах
обоих легких выслушиваются сухие разнотональные хрипы на выдохе в умеренном
количестве по всем полям. Результаты спирометрии представлены в табл. 6.
При исходной спирометрии выявлены нарушения вентиляционной способности легких по смешанному типу, на что указывает снижение ОФВ,/ФЖЕЛ до 22%.
ФЖЕЛ также снижена до 40% от должной. Однако отношение ОФВ,/ФЖЕЛ снижено в большей степени, чем ФЖЕЛ. Обструктивные нарушения следует считать
крайне тяжелыми, поскольку ОФВ, составляет 11% от должного. Отмечается генерализованное снижение скорости выдоха. Кривая поток-объем указывает на то,
что потеряна значительная доля нормальной площади под кривой и у пациента
имеется существенное ограничение легочной вентиляции (рис. 20, см. цветную
вкладку на с. 180). Резкое снижение скорости экспираторного потока сразу после
32
Спирометрия
1а6лица 6. Результаты спирометрии (клинический случай 4)
Показатель
До ингаляции
сальбутамола
После
ингаляции
сальбутамола
Показатель
До ингаляции
сальбутамола
После
ингаляции
сальбутамола
ФЖЕЛ, л
1,86 (40)
1,85 (40)
MOC7V л/с
0,11 (5)
0,10(5)
ОТ ДОЛЖНОЙ)
(% от должной)
ОФВ,, л
0,42(11)
0,46(12)
П0Свыд' Л/С
1,75 (20)
1,51 (17)
I °с от должного)
(% от должной)
ОФВ,/ФЖЕЛ, %
22
25
АЕХ, л л/с
0,47 (2,1)
0,45 (2,0)
СОС25_75, л/с
0,14(4)
0,14(4)
(% от должной)
{°С от должного)
Время выдоха, с
14,24
14,64
МОС25, л/с
0,20 (3)
0,21 (3)
МОСвд50- Л/С
4,16
4,63
(°с ОТ ДОЛЖНОЙ)
ПОСпл, л/с
4,64
5,35
МОС50, л/с
0,14(3)
0,16(3)
(% ОТ должной)
(°с от должной)
Обозначения: АЕХ - площадь под экспираторной кривой поток-объем.
пика сменяется пологим участком кривой, отражающим ранний экспираторный
коллапс дыхательных путей. Существенная разница между ЖЕЛ вдоха и ЖЕЛ выдоха указывает на наличие «воздушной ловушки».
Повторная спирометрия после ингаляции 400 мкг сальбутамола не привела к существенному изменению показателей (см. табл. 6).
Для уточнения характера функциональных нарушений следует выполнить бо-
диплетизмографию с измерением легочных объемов.
В данном случае у пациента эмфизема. Характерная компьютерно-томографическая картина представлена на рис. 21 (см. цветную вкладку на с. 180).
Заключение
Спирометрия представляет собой достаточно простой и широко применимый
метод функциональной диагностики, который может и должен использоваться повсеместно в диагностике хронической бронхолегочной патологии, для мониториро-
вания состояния таких больных и оценки эффективности лечения. В последние годы разработано множество видов портативных спирометров, что делает этот метод
еще более доступным, поскольку позволяет проводить исследование в любом медицинском учреждении. Спирометрия необходима для выявления ранних стадий
ХОБЛ у курильщиков, когда пациент еще не считает себя больным, поскольку отсутствует одышка - основной симптом, нарушающий повседневную активность и
заставляющий курящего человека обратиться к врачу. В связи с этим знание основных показателей спирограммы и умение интерпретировать результаты этого исследования необходимы каждому врачу.
Список литературы
1. Hutchinson J. On the capacity of the lungs and on the respiratory functions, with a view of establishing a pre¬
cise and easy method of detecting diseases by the spirometer // Trans. Med. Soc. (Lond.). 1846. V. 29.
P. 137-252.
33
Гпава 1
2. Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for Diagnosis, Management, and
Prevention of COPD. Bethesda, 2006.
3. Beckles M.A., Spiro S.G., Colice G.L., Rudd R.M. Lung Cancer Guidelines. The physiologic evaluation of
patients with lung cancer being considered for resectional surgery // Chest. 2003. V. 123. № l (suppl.).
P. 105s-114s.
4. Eagle K.A., Berger P.B., Calkins H. et al. [American College of Cardiology/American Heart Association
Task Force on Practice Guidelines.] ACC/AHA guideline update for perioperative cardiovascular evaluation
for noncardiac surgery - executive summary a report of the American College of Cardiology/American
Heart Association Task Force on Practice Guidelines// Circulation. 2002. V. 105. № Ю. P. 1257— 1267.
5. BTS guidelines. Guidelines on the selection of patients with lung cancer for surgery // Thorax. 2001. V. 56.
№ 2. P. 89-108.
6. Cykert S., Kissling G., Hansen C.J. Patient preferences regarding possible outcomes of lung resection. What
outcomes should preoperative evaluations target? // Chest. 2000. V. 117. P. 1551 — 1559.
7. Datta D., Lahiri B. Preoperative evaluation of patients undergoing lung resection surgery // Chest. 2003.
V. 123. P. 2096-2103.
8. Marx J.J., Punjabi N., Schwartz A. et al. Preoperative pulmonary evaluation // N. Engl. J. Med. 1999.
V. 341. P.613-614.
9. Reilly J.J. Evidence-based preoperative evaluation of candidates for thoracotomy // Chest. 1999. V. 116
(suppl.). P 474S-476S.
10. Reilly J.J. Preparing for pulmonary resection: preoperative evaluation of patients // Chest. 1997. V. 112
(suppl.). P. 206S-208S.
11. Schuurmans M.M., Diacon A.H., BolligerC.T. Lung cancer. Functional evaluation before lung resection//
Clin. Chest Med. 2002. V. 23. № 1. P. 159-172.
12. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention. Bethesda, 2006.
13. Miller M.R., Hankinson J., Brusasco V. et al. Standardisation of spirometry. Series «ATS/ERS task force:
standardisation of lung function testing». Edited by V. Brusasco, R. Crapo and G. Viegi. Number 2 in this
Series// Eur. Respir. J. 2005. V. 26. P. 319-338.
14. American Thoracic Society. Standardization of spirometry: 1994 update //Amer. J. Respir. Crit. Care Med.
1995. V. 152. P. 1107-1136.
15. Quanjer P.H., Tammeling G.J., Cotes J.E. et al. Lung volumes and forced ventilatory flows. Report Working
Party Standardization of Lung Function Tests, European Community for Steel and Coal. Official Statement
of the European Respiratory Society // Eur. Respir. J. 1993. V. 6. Suppl. 16. P. 5—40.
16. Гриппи MA. Патофизиология легких. M.; СПб., 1999.
17. Hyatt R.E., Scanlon P.D., Nakamura M. Interpretation of Pulmonary Function Test: A Practical Guide.
Philadelphia etc.: Lippincott Williams and Wilkins, 2003.
18. Swanney M.P., Jensen R.L., Crichton D.A. et al. FEV6 is an acceptable surrogate for FVC in the spiromet-
ric diagnosis of airway obstruction and restriction // Amer. J. Respir. Crit. Care Med. 2000. V. 162.
P. 917-920.
19. Enright P.L., Connett J.E., Bailey W.C. FEV,/FEV6 predicts lung function decline in adult smokers //
Respir. Med. 2002. V. 96. P. 444-449.
20. Cosio M., Ghezzo H., Hogg J.C. et al. The relations between structural changes in small airways and pulmonary-function tests // N. Engl. J. Med. 1978. V. 298. P. 1277-1281.
21. Cochrane G.M., Prieto F., Clark T.J. Intrasubject variability of maximal expiratory flow-volume curve //
Thorax. 1977. V. 32. P. 171-176.
22. McDonald J.B., Cole T.J. The flow-volume loop: reproducibility of air and helium-based tests in normal
subjects//Thorax. 1980. V. 35. P. 64-69.
23. Wright B.M., McKerrow C.B. Maximum forced expiratory flow rate as a measure of ventilatory capacity:
With a description of a new portable instrument for measuring it // Br. Med. J. 1959. № 5159. P. 1041 — 1046.
24. Pellegrino R., Viegi G., Brusasco V. et al. Interpretative strategies for lung function tests // Eur. Respir. J.
2005. V. 26. P.511-522.
25. Quanjer PH. Standardized lung function testing// Bull. Eur. Physiopathol. 1983. V. 19. Suppl. 5. P. 22-27.
26. Knudson R.J., Lebowitz M.D., Holberg C.J. et al. Changes in the normal maximal expiratory flow—volume
curve with growth and aging // Amer.' Rev. Respir. Dis. 1983. V. 127. P. 725-734.
27. American Thoracic Society. Lung function testing: selection of reference values and interpretative strategies //
Amer. Rev. Respir. Dis. 1991. V. 144. P. 1202-1218.
28. Hankinson J.L., Odencratz J.R., Fedan K.B. Spirometric reference values from a sample of the general US
population//Amer. J. Respir. Crit. Care Med. 1999. V. 159. P. 179-187.
34
Спирометрия
29. Hardie J.A., Buist A.S., Vollmer W.M. et al. Risk of over-diagnosis of COPD in asymptomatic elderly never-
smokers// Eur. Respir. J. 2002. V. 20. P. 1117-1122.
30. Medbo A., Melbye H. Lung function testing in the elderly. Can we still use FEV,/FVC <70% as a criterion
of COPD?// Respir. Med. 2007. V. 101. № 6. P. 1097-1105.
31. Stocks J. Quanjer PH. Reference values for residual volume, functional residual capacity and total lung
capacity // Eur. Respir. J. 1995. V. 8. P. 492-506.
32. Gold W.M. Pulmonary function testing//Textbook of Respiratory Medicine / Eds. J.F. Murray, J.A. Nadel.
3rd ed. Philadelphia: Saunders. 2000. P. 805.
33. McCarthy D.S., Craig D.B., Cherniak R.M. Intraindividual variability in maximal expiratory flow-volume
and closing volume in asymptomatic subjects // Amer. Rev. Respir. Dis. 1975. V. 112. P. 407-411.
34. Wise R.A., Connett J., Kurnow K. et al. Selection of spirometric measurements in a clinical trial, the Lung
Health Study//Airier. J. Respir. Crit. Care Med. 1995. V. 151. P. 675-681.
35. Wang M.L., McCabe L., Petsonk E.L. et al. Weight gain and longitudinal changes in lung function in steel
workers //Chest. 1997. V. 111. P. 1526-1532.
36. Glindmeyer H.W., LefanteJ.J., McColloster C. et al. Blue-collar normative spirometric values for Caucasian
and African-American men and women aged 18 to 65 // Amer. J. Respir. Crit. Care Med. 1995. V. 151.
P. 412-422.
37. Berend N., Thurlbeck W.M. Correlations of maximum expiratory flow with small airway dimensions and
pathology //J. Appl. Physiol. 1982. V. 52. P. 346-351.
38. Despas P.J., Leroux M., Macklem PT. Site of airway obstruction in asthma as determined by measuring maximal expiratory flow breathing air and a helium-oxygen mixture //J. Clin. Invest. 1972. V. 51. P. 3235-3243.
39. Hyatt R.E. The interrelationship of pressure, flow and volume during various respiratory maneuvers in normal and emphysematous patients //Amer. Rev. Respir. Dis. 1961. V. 83. P. 676-683.
40. Kannel W.B., Lew E.A. Vital capacity as a predictor of cardiovascular disease: the Framingham study //
Amer. Hearth J. 1983. V. 105. P. 311-315.
41. Kannel W.B., Lew E.A., Hubert H.B., Castelli W.P. The value of measuring vital capacity for prognostic purposes//Trans. Assoc. Life Insur. Med. Dir. Amer. 1981. V. 64. P. 66-83.
42. Tockman M.S., Comstock G.W. Respiratory risk factors and mortality: longitudinal studies in Washington
county, Maryland // Amer. Rev. Respir. Dis. 1989. V. 140. P. S56-S63.
43. Foxman B., Higgins I.T.T., Oh M.S. The effects of occupation and smoking on respiratory disease mortality //Amer. Rev. Respir. Dis. 1986. V. 134. P. 649-652.
44. Ortmeyer C.E., Costello J., Morgan W.K.C. et al. The mortality of Appalachian coal miners 1963 to 1971 //
Arch. Environ. Health. 1974. V. 29. P. 67-72.
45. Чикина С.Ю., Черняк A.B., Пашкова Т.Л. Ограничение экспираторного потока у ликвидаторов
Чернобыльской аварии (Сборник резюме 13-го Национального конгресса по болезням органовдыхания. Санкт-Петербург, 10-14 ноября 2003 г.) // Пульмонология. 2003. Прилож. С. 365 (LIV.53).
46. Нуралиева Г.С., Авдеев С.Н., Черняк А.В., Чучалин А.Г. Динамика ограничения воздушного потока
при тяжелом обострении у больных хронической обструктивной болезнью легких (Сборник тезисов 15-го Национального конгресса по болезням органовдыхания. Москва, 29 ноября—2 декабря
2005 г.) // Пульмонология. 2005. Прилож. С. 241 (898).
47. Черняк А.В., Авдеев С.Н., Амелина Е.Л., Айсанов З.Р. Ограничение воздушного потока при спокойном дыхании у взрослых больных муковисцидозом // Пульмонология. 2003. № 2. С. 100—108.
48. Allen S.M., Hunt В., Green М. Fall in vital capacity with weakness // Br. J. Dis. Chest. 1985. V. 79.
P. 267-271.
49. Laroche C.M., Carroll N., Moxham J., Green M. Clinical significance of severe isolated diaphragm weakness//Amer. Rev. Respir. Dis. 1988. V. 138. P. 862-866.
50. Ferris B.G. Epidemiology: Standardization project //Amer. Rev. Respir. Dis. 1978. V. 118. P. 1 — 120.
51. Rochester D.F., Arora N.S., Braun N.M.T. et al. The respiratory muscles in chronic obstructive pulmonary
disease (COPD) // Bull. Eur. Physiopathol. Respir. 1979. V. 15. P. 951-975.
35
ГЛдВд2
Измерение легочных объемов
Под термином «измерение легочных объемов», как правило, подразумевают измерение статических легочных объемов, наиболее важными из которых являются
жизненная емкость легких (ЖЕЛ), остаточный объем легких (ООЛ) и общая емкость
легких (ОЕЛ). Анализ легочных объемов дает важную клиническую информацию о
механике дыхания.
Общая емкость легких может быть представлена как сумма нескольких легочных
объемов и емкостей (рис. 1). Обычно выделяют четыре легочных объема (резервный объем вдоха (PC) ), дыхательный объем (ДО), резервный объем выдоха (PC).,)
ВД7 ВЫЛ
и ООЛ) и четыре емкости легких (ЖЕЛ, емкость вдоха (Евд), функциональная остаточная емкость (ФОЕ) и ОЕЛ). Емкостью называют сумму двух и более легочных
объемов.
Легочные объемы и емкости
Жизненная емкость легких (ЖЕЛ) — объем воздуха, который можно выдохнуть
при полном выдохе после максимального вдоха. Измерение ЖЕЛ может быть проведено одним из нижеследующих способов: 1) ЖЕЛВД — измерение производится пациенту в расслабленном состоянии; после полного выдоха делается максимально глубокий вдох; 2) ЖЕЛвыд — измерение производится в аналогичной манере из состояния максимально глубокого вдоха до полного выдоха; 3) двухстадийная ЖЕЛ — ЖЕЛ
определяется в два этапа как сумма емкости вдоха и резервного объема выдоха.
Для определения жизненной емкости легких рекомендуется измерять ЖЕЛвд; если же это невозможно, то в качестве альтернативы может быть использован показатель ЖЕЛ выд. Не рекомендуется в рутинной практике измерять ЖЕЛ в два этапа, од-
Рис. I. Схематическое изображение статических легочных объемов и емкостей.
36
Измерение легочных объемов
нако такое измерение возможно при обследовании больных с тяжелой одышкой,
когда пациент не может выполнить весь маневр целиком.
У здоровых лиц разница между ЖЕЛ и ФЖЕЛ минимальна. У больных с экспираторным ограничением воздушного потока маневр ФЖЕЛ может приводить к
перекрытию дыхательных путей, и ФЖЕЛ может быть значительно ниже, чем
ЖЕЛ [ 1 ]. ЖЕЛ в норме составляет приблизительно 70% ОЕЛ и включает в себя ДО,
РО и РО
вд выл
Дыхательный объем — объем воздуха, который вдыхается и выдыхается во время
дыхательного цикла при спокойном дыхании. Его следует рассчитывать как среднее
значение после регистрации по меньшей мере шести дыхательных циклов. Окончание фазы вдоха называют конечно-инспираторным уровнем, окончание фазы выдоха называют конечно-экспираторным уровнем.
Резервный объем вдоха — максимальный объем воздуха, который можно вдохнуть
после обычного среднего спокойного вдоха (конечно-инспираторного уровня).
Резервный объем выдоха — максимальный объем воздуха, который можно выдохнуть после спокойного выдоха (конечно-экспираторного уровня).
Емкость вдоха — сумма ДО и РОвд, в норме обычно составляет 60—70% ЖЕЛ.
Остаточный объем легких — объем воздуха, который остается в легких по окончании полного выдоха. Из всех вышеперечисленных объемов только ООЛ не может
быть измерен непосредственно. Он рассчитывается путем вычитания РОвыд из ФОЕ:
ООЛ = ФОЕ - РОвыд или ООЛ = ОЕЛ - ЖЕЛ. Последний способ более предпочтителен.
Измерение ООЛ имеет большую клиническую значимость. Снижение ООЛ может быть единственным физиологическим отклонением у пациентов с заболеваниями грудной клетки (скелетная деформация, фиброторакс) или патологией внутренних органов (застойная сердечная недостаточность, саркоидоз и т.д.). Повышение
ООЛ часто встречается у пациентов с обструктивными заболеваниями легких, у которых из-за отека бронхиальной стенки, сокращения гладкой мускулатуры, воспалительной клеточной инфильтрации увеличивается время выдоха, что препятствует
опустошению альвеол, возникают так называемые «воздушные ловушки». Увеличивается и ОЕЛ (объем воздуха в легких по окончании полного вдоха). Однако на начальных этапах заболевания ОЕЛ может быть в пределах нормальных значений.
Общая емкость легких рассчитывается двумя способами: ОЕЛ = ООЛ + ЖЕЛ или
ОЕЛ = ФОЕ + Евг1. Последний способ более предпочтителен. При рестриктивных
нарушениях ОЕЛ снижена.
Функциональная остаточная емкость - объем воздуха в легких и дыхательных путях после спокойного выдоха. ФОЕ еще называют конечным экспираторным объемом. ФОЕ — это объем, при котором эластическая отдача легких уравновешена эластической отдачей грудной клетки, направление же их противоположно друг другу.
На уровне ФОЕ дыхательная система находится в покое. ФОЕ = РОвыд + ООЛ и в
норме обычно составляет 40—50% ОЕЛ. При снижении эластической отдачи легких
(например, при эмфиземе) ФОЕ увеличивается, и, наоборот, при увеличении эластической отдачи (например, при легочном фиброзе) ФОЕ снижается.
Измерение ФОЕ является определяющим этапом при оценке легочных объемов.
К сожалению, этот показатель и показатели, рассчитанные с помощью ФОЕ (ООЛ и
ОЕЛ), нельзя измерить с помощью спирометрии. Для измерения ФОЕ существуют
специальные методы (см. ниже).
37
Гпава 2
Показания и противопоказания
для измерения легочных объемов
Первоначальным (и основным) показанием для измерения статических легочных объемов являлось выявление причины снижения ЖЕЛ (см. главу 1). В дальнейшем показания для исследования были расширены следующим образом:
1) подтверждение функционального диагноза, выставленного при спирометрическом исследовании;
2) диагностика рестриктивных или сочетанных обструктивно-рестриктивных нарушений вентиляционной способности легких и определение степени тяжести заболевания;
3) определение степени гиперинфляции у больных с обструктивными заболеваниями органовдыхания (например, буллезной эмфиземой и т.д.);
4) мониторирование течения заболевания и эффективности терапии;
5) определение прогноза на основании тяжести респираторных нарушений или
скорости ухудшения показателей за определенный период времени;
6) проведение предоперационных исследований для оценки риска развития
респираторных осложнений (например, при хирургической редукции объема
легких у больных с эмфиземой) и предоперационной коррекции состояния пациента.
Измерение легочных объемов, как и спирометрия, является безопасным, однако требует более высокой квалификации специалистов, выполняющих тестирование, и большего технического оснащения. Ограничениями для измерения являются:
1) отсутствие кооперации пациент—доктор;
2) клаустрофобия;
3) наличие приборов или устройств, которые не могут быть помещены в кабину для исследования (например, при непрерывном внутривенном введении лекарств);
4) постоянная кислородотерапия (во время исследования необходимо отключать
генератор кислорода и пациент не должен дышать через канюли или маску).
Если отсутствие кооперации делает невозможным практически все функциональные исследования, то остальные противопоказания относятся только к боди-
плетизмографии.
Методы измерения легочных объемов
Самыми распространенными являются методы разведения газов (газовой дилю-
ции) и бодиплетизмография. У здоровых лиц эти методики позволяют получать
сходные результаты [2-5].
Методы разведения газов
Методы разведения газов основаны на разведении (обычно гелия) и вымывании
(обычно азота) инертных индикаторных газов с использованием закрытой или открытой системы, с повторными дыхательными циклами или с одиночным вдохом.
Методы разведения газов широко применяются из-за простоты методики и относительной дешевизны оборудования.
38
Измерение легочных объемов
Метод разведения гелия. Наиболее широко используемый метод определения
ФОЕ, рекомендуемый для повседневной клинической практики, основан на достижении равновесной концентрации газа в легких и известном объеме (Vj) гелиевой
смеси с известной исходной концентрацией гелия (Не,) [6, 7]:
Количество гелия = Не, х V,. (1)
Пациент соединяется с закрытой системой в конце спокойного выдоха и дышит
этой газовой смесью до установления равновесной концентрации гелия (Не2) в спирометре и в легких:
Количество гелия = Не2 х (V, -I- ФОЕ). (2)
Поскольку количество гелия в закрытой системе не изменяется, приравняв правые части уравнений (1) и (2), получим:
ФОЕ = (Не, — Не2) х V,/He2.
Газовый анализатор основан на принципе теплопроводности и обладает линейностью. В большинстве анализаторов для обеспечения адекватного времени ответа
воздушный поток через датчик гелия должен быть постоянным и составлять не менее 200 мл/мин. Концентрация гелия регистрируется каждые 15 с, равновесие достигается при изменении концентрации менее чем на 0,02% за 30 с; при этом на экране монитора появляется надпись «Критерий стабильности достигнут». Дыхательный контур должен включать в себя поглотители, высушивающие газ и элиминирующие С02. Для поддержания стабильного объема в системе легкие-спирометр
вместо удаленного С02 в дыхательный
контур добавляется кислород (вручную
или автоматически). Это позволяет пациенту дышать в контуре продолжительное время до достижения гелиевого
равновесия (приблизительно 5 мин)
(рис. 2). У пациентов с тяжелыми нарушениями бронхиальной проходимости
или эмфиземой истинное значение ФОЕ
при измерении этим методом занижается, поскольку у таких больных в легких
есть гиповентилируемые и невентилиру-
емые пространства. Ошибки измерения
могут возникнуть и из-за утечки в дыхательном контуре и нелинейности анализатора гелия.
На практике пациенты не всегда
подключаются к контуру спирометра
точно по достижению среднего конечно-экспираторного уровня, следовательно, объем легких не будет равен
ФОЕ (рис. За, 36). Кроме того, объем системы легкие—спирометр может изменяться во время теста, если пациент не
(а)
Время, мин
(б)
Рис. 2. Определение ФОЕ методом разведения гелия (изображение на экране монитора). а - изменение концентрации гелия во
время исследования (время достижения равновесия (4 мин 2 с) показано вертикальной
пунктирной линией, равновесная концентрация гелия 5,46%, поток кислорода в конце
исследования 287 мл/мин), б - спокойное
дыхание до достижения равновесной концентрации; горизонтальная пунктирная линия соответствует ФОЕ.
39
Гпава 2
ФОЕ
^ находится в состоянии
покоя в начале исследования, и конечный
экспираторный объем
постепенно снижается
(рис. Зв). Для исправления этих ошибок
следует произвести
коррекцию ФОЕ.
Метод вымывания
азота основан на законе сохранения массы.
Для вымывания азота
используют открытый
контур. Легкие содержат неизвестный объем газа, в котором
концентрация азота
приблизительно 80%.
Пациент присоединяется к системе в конце
спокойного выдоха и
дышит 100% кислородом. Выдыхаемый газ
собирается до тех пор,
пока весь азот не будет
вымыт из легких, т.е.
пока концентрация
азота в течение последних трех дыхательных циклов не станет
менее 1,5% (рис. 4);
при этом на экране
монитора появляется
надпись «Критерий стабильности N2 достигнут». Измеряют совокупный объем выдыхаемого воздуха и концентрацию азота, по которым можно вычислить неизвестный исходный объем:
Рис. 3. Коррекция ФОЕ по кривым объем—время при разведении
гелия, а — пациент подключился к контуру спирометра на вдохе —
для коррекции ФОЕ необходимо вычесть AV. б - пациент подключился к контуру спирометра после глубокого выдоха — необходимо
прибавить AV. в - пациент не находится в состоянии покоя в начале исследования - необходимо вычесть AV. (Flo Wangeret al. [8|.)
N21 хФОЕ = N22x V2,
где N2I - концентрация азота в объеме легких на уровне ФОЕ в начале исследования, V2 — общий объем выдыхаемого газа в течение всего исследования, N22 — концентрация азота в объеме V2.
В клинической практике концентрация азота не опускается во время исследования ниже 1% [9], и процедура занимает приблизительно 7 мин. Анализируя угол наклона кривой изменения концентрации азота, можно оценить неравномерность
вентиляции легких [10]. У больных с обструктивными нарушениями истинное значение ФОЕ, как и при использовании метода разведения гелия, может быть заниже¬
40
Измерение легочных объемов
но. Чтобы более точно оценить ФОЕ у
таких пациентов, необходимо увеличить
время исследования до 15—20 мин, однако длительное исследование утомительно для пациентов, кроме того, у некоторых из них 100% кислород может угнетать дыхательный центр. Метод технически сложен (необходима тщательная
синхронизация сигналов потока и концентрации азота), чувствителен к утечке
в дыхательном контуре (особенно в ротовой полости) [11]. Чтобы избежать завышения ФОЕ вследствие элиминации
азота из крови и тканей (приблизительно 30 мл/мин), необходимо произвести соответствующую коррекцию.
Другие методы разведения. Объем легких (оценкой которого служит ФОЕ) можно
измерить также с помощью однократного вдоха газовой смеси: во время вымывания
азота при вдохе чистого кислорода [12] или при измерении диффузионной способности легких по оксиду углерода (DL ) с задержкой дыхания. Во втором случае газовая смесь содержит гелий, который служит индикаторным газом и позволяет измерить альвеолярный объем [13, 14]. У здоровых людей с минимальной неоднородностью вентиляции эти методы занижают истинный объем легких в незначительной
степени. У пациентов с ограничением воздушного потока занижение истинного легочного объема может быть существенным вследствие выраженной неравномерности распределения вдыхаемого газа. Методы разведения газов с одиночным вдохом в
большей степени недооценивают ФОЕ, чем методы с повторными дыхательными
циклами, поэтому они не рекомендуются для рутинного использования в клинической практике.
Общая бодиплетизмография
Бодиплетизмографический метод позволяет определить внутригрудной объем
(ВГО) газа — эквивалент ФОЕ [15—18]. Главной особенностью этого метода является то, что пациент помещается внутрь измерительной камеры бодиплетизмо-
графа (боди-камера). На сегодняшний день существуют плетизмографы трех типов: 1) измеряющие давление; 2) измеряющие объем; 3) измеряющие объем и давление.
Плетизмограф, измеряющий давление, является закрытой камерой постоянного
объема, в которой сидит и дышит пациент. Изменения объема вследствие сжатия и
расширения внутри грудного газа рассчитываются по изменению давления в боди-
камере. ВГО и сопротивление дыхательных путей измеряются при частом дыхании,
поэтому небольшая утечка, которая существенно не влияет на результат, допустима
и необходима, чтобы избежать подъема давления вследствие нагревания воздуха в
камере. Этот тип плетизмографов предназначен для измерения лишь небольших изменений объема, поскольку обладает высокой чувствительностью и превосходным
частотным ответом.
Плетизмограф, измеряющий объем, является камерой переменного объема с постоянным давлением. При изменении ВГО газ перемещается через отверстие в стен¬
Объем, л
Рис. 4. Определение ФОЕ методом вымывания азота (ФОЕ составляет 2,76 л). (По
Wanger et al. [8].)
41
Гпава 2
ке камеры, а затем измеряется объем этого газа. Этот тип плетизмографов позволяет оценивать как небольшие, так и значительные изменения объема. Однако для достижения хорошего частотного ответа система должна обладать низким импедансом, что является технически сложной задачей, поэтому прибор не рекомендуется
для рутинного использования.
Плетизмограф, измеряющий объем и давление, сочетает в себе особенности двух
предыдущих. Поскольку пациент дышит комнатным воздухом, изменения внутри-
грудного объема приводят к сжатию или расширению воздуха в камере, кроме того,
его перемещают через отверстие в стенке камеры. Компрессия или декомпрессия
воздуха оценивается по изменению давления, объем перемещенного воздуха измеряют с помощью спирометра/пневмотахометра.
Наиболее универсальным способом является использование камеры постоянного объема. Как правило, измерение ВГО проводят в конце спокойного выдоха (на
уровне ФОБ).
Внутригрудной объем газа. Измерение ВГО основано на законе Бойля—Мариотта:
при неизменных температуре и массе газа произведение численных значений давления и объема газа постоянно:
Р х V = const,
т.е.
P,xV, = P2xV2.
В конце выдоха альвеолярное давление (Р^^) равно атмосферному давлению,
измеренному в ротовой полости (Ррот), потому что в этот момент отсутствует поток
воздуха; ВГ’0 газа неизвестен. Когда дыхательные пути перекрываются на уровне ротовой полости, пациент делает попытки вдохов и выдохов, и газ, содержащийся в
легких, попеременно сжимается и разрежается. При попытке вдоха объем грудной
клетки увеличивается (ДУ), а давление внутригрудного газа снижается (АР): новый
ВГО равен V2 = V, + ДУ, новое давление Р2 = Р, + ДР:
Р, х У, = Р2 х У2 = (Р, + ДР) х (Vj + ДУ) = Р, х У, + Р, х ДУ + У, х ДР + ДР х ДУ.
При небольших перепадах давления величиной ДР х ДУ можно пренебречь, поскольку она очень мала. Следовательно:
Р, х ДУ = —Vj х ДР;
У, = -Р, х ДУ/ДР.
При измерении ВГО регистрируются изменения давления в ротовой полости.
Поскольку колебания давления происходят с небольшой частотой, то изменения
альвеолярного и ротового давления одинаковы: ДРрот = ДРа1ЬВ. За альвеолярное
давление принимается атмосферное давление (Р ) минус парциальное давление
паров воды (РН2о) при температуре 37°С, поскольку предполагается, что если газ
насыщен влагой, то объем водяных паров остается постоянным независимо от перепадов давления. Соответственно, если полученные формулы применить к легкому, то:
VL = -Ральв X AVL/AP,,bB = -(Ратм - РН2о) X AVl/AP
рот’
где Уь — внутригрудной объем.
42
Измерение легочных объемов
При использовании камеры постоянного объема изменение объема легких (AVL)
равно по абсолютной величине, но противоположно по знаку изменению объема га-
в в камере (AVK), которое можно вычислить по изменению давления в камере (АРк),
умноженному на коэффициент (К), полученный при калибровке. Окончательные
формулы имеют вид:
VL = (Ра™ - Рн2о) X AVK/APpor = (Ратм - Рн2о) X К X ЛРк/ДРрот.
При перекрытии дыхательных путей строится график зависимости АРрот от AVK
фис. 5), что позволяет вычислить среднее за период измерения значение отношения
AVK/APpoT = -АУь/АР^1ЬВ и измерить ВГО. На форму петель оказывает влияние дряблость щек, губ, дна полости рта. В связи с этим пациенты всегда должны плотно
придерживать руками щеки и подбородок (рис. 6). Вялость губ может быть вызвана
удалением зубных протезов, поэтому не рекомендуется снимать их перед исследованием. Измеренный объем чуть выше ФОБ, поскольку перекрытие дыхательных путей происходит не точно в конце выдоха. Для коррекции вводят поправочный коэф¬
фициент.
Бодиплетизмография позволяет
быстро провести несколько измерений
ФОБ (ВГО). Это выгодно отличает
бодиплетизмографию от методов вымывания азота или разведения гелия, поскольку последние позволяют проводить повторные измерения только после определенного периода, необходимого для возвращения альвеолярного
газа в исходное состояние. У больных
ХОБЛ интервал между исследованиями
должен составлять 10—20 мин. Кроме
того, ФОБ, измеренная бодиплетизмо-
графическим методом, включает в себя
как вентилируемые, так и невентилиру-
емые отделы легких. В связи с этим у
пациентов с легочными кистами и «воздушными ловушками» данный метод
«завышает» показатели по сравнению с
методами разведения газов. Разница
между показателями, полученными с
помощью этих двух методов, дает важную информацию о наличии невенти-
лируемого воздушного пространства в
грудной клетке и позволяет вычислить
объем «воздушной ловушки». Бодиплетизмография является более дорогим
методом, технически более сложным и
требует, чтобы пациент четко выполнял
указания врача и прилагал больше усилий, чем при исследовании методом
Рис. 5. Графическое представление респираторных усилий при перекрытии дыхательных
путей (изображение на экране монитора):
изменение давления в полости рта (ось у) соответствует изменению объема в боди-камере (ось х). Экспираторные усилия приводят к
увеличению давления в полости рта и разрежению в боди-камере, инспираторные
усилия - наоборот. Тангенс угла наклона
AVK/AP пропорционален ВГО (для данного измерения ВГО равен 3,07 л). Кривые петель дыхательных маневров (сплошные линии) указывают на хорошее выполнение
маневров, практически отсутствуют отклонения петель от осевой средней линии (пунктирная линия).
43
Гпава 2
разведения газов. Тем не менее боди-
плетизмография является предпочтительным методом, поскольку позволяет
более точно оценить ФОЕ [19].
Однако и при проведении боди-
плетизмографии возможны ошибки
измерения, поскольку существуют
факторы, оказывающие значительное
влияние на точность результатов. Метод
основан на полностью изотермической
компрессии, т.е. требует постоянства
температуры. Таким образом, чтобы избежать подъемов давления вследствие
нагревания воздуха в камере [20], плетизмограф должен сообщаться с атмосферой (утечка, насос или электронная
коррекция). Труднее устранить нагревание и увлажнение инспираторного воздуха и охлаждение экспираторного воздуха из-за конденсации водяных паров. Поверхностное частое дыхание (с частотой 2 Гц, или 120 дыханий в 1 мин) минимизирует влияние этих эффектов. Чтобы проводить измерения при спокойном дыхании,
необходимы дополнительные технические приспособления (например, специальный воздушный мешок для нагревания и увлажнения воздуха или электронная коррекция результатов).
Еще одной проблемой может быть спонтанно возникающие перепады атмосферного давления и артефакты, например вследствие хлопанья дверьми комнаты, которые существенно влияют на изменения давления внутри боди-камеры. В современных плетизмографах эта проблема также решается с помощью механических приспособлений и программного обеспечения [15, 21].
Бодиплетизмографическое исследование у больных с выраженными обструктивными нарушениями может завышать истинное значение ФОЕ [22]. Это обусловлено тем, что у таких пациентов колебания ротового давления при перекрытии дыхательных путей отстают от колебаний альвеолярного давления. Ошибка может
быть сведена к минимуму при проведении исследования с частотой дыхания менее
60 в 1 мин [23, 24]. У детей некоторое завышение ФОЕ может быть обусловлено нестандартными перепадами альвеолярного давления из-за очень податливой грудной клетки [25].
Рентгенографическое измерение объема легких
Объем легких можно измерить с помощью рентгенографии грудной клетки в передне-задней и латеральной проекциях [26—31]. Метод позволяет оценить ОЕЛ, при
этом результаты измерения незначительно отличаются от бодиплетизмографичес-
ких показателей даже у больных с бронхиальной обструкцией [27, 32]. Процедура
обработки данных должна включать в себя коррекцию, поскольку рентгенографически оценивается объем воздуха и тканей легких, а при бодиплетизмографии измеряют объем компрессионного воздуха (или объем сообщающегося воздуха при использовании методов разведения) [26, 27, 33).
Рис. 6. При измерении внутри грудного объема легких пациент должен плотно придерживать руками щеки и подбородок.
44
Измерение легочных объемов
Клиническое применение
измерения объемов легких
Как и при спирометрии, интерпретация результатов измерения объемов легких
основывается на их сравнении с должными значениями. В клинической практике
большинство врачей функциональной диагностики при анализе легочных объемов
используют должные значения, рекомендованные Рабочей группой Европейского
объединения угля и стали в 1993 г. (табл. 1). Как правило, на практике результаты
выражают в процентах от должного значения (полученное значение/должное значение х 100%), нижней границей нормы (НГН) считают 80% от должных величин.
Этот подход приемлем у детей [34], но не подходит для взрослых людей, поскольку
разброс значений от должного у взрослых постоянный и не зависит от роста и возраста пациента [35]. Исследования последних лет показали, что у взрослых людей в
качестве НГН следует брать значение 5-го процентиля гистограммы должных значений. Это позволит достаточно точно разграничить «норму» от «патологии». При
нормальном распределении 90% значений общей популяции (90% доверительный
интервал — ДИ) попадут в диапазон между 5-м и 95-м процентилями (их вычисляют как расчетное должное значение ± 1,64 х RSD); границами 95% значений общей
популяции (95% ДИ) будут 2,5-й и 97,5-й процентили соответственно (их вычисляют как расчетное должное значение ± 1,96 х RSD), где RSD (остаточная среднеквадратическая ошибка) — статистический параметр, который рассчитывают при разработке должных значений и рекомендуют указывать наряду с должной величиной
(см. табл. 1). На практике, как правило, за «норму» принимают диапазон значений
90% популяции.
В клинической практике трудности возникают не только с определением диапазона нормальных значений, но и с оценкой степени патофизиологических нарушений. Для этой цели рекомендуют использовать стандартизованное значение остат-
Таблица 1. Должные значения объемов легких для взрослых пациентов [36]
Показатели
Уравнение
95% ДИ*
90% ДИ*
RSD
Мужчины
ОЕЛ, л
7,99Р - 7,08
±1,37
±1,15
0,70
ООЛ, л
1,31Р + 0,022В- 1,23
±0,80
±0,67
0,41
ФОЕ, л
2,34Р + 0,01 В - 1,09
±1,18
±0,99
0,60
ФОЕ/ОЕЛ, %
43,8 +0,21В
±13,2
±11,1
6,74
ООЛ/О ЕЛ, %
14,0 +0,39В
±10,7
±9,0
5,46
Женщины
ОЕЛ, л
6,60Р - 5,79
±1,18
±0,99
0,60
ООЛ, л
1,81Р + 0,016В -2,00
±0,69
±0,58
0,35
ФОЕ, л
2,24Р + 0,001 В - 1,00
±0,98
±0,82
0,50
ФОЕ/ОЕЛ, %
45,1 + 0,16В
±11,6
±9,8
5,93
ООЛ/О ЕЛ, %
19,0 +0,34В
±11,4
±9,6
5,83
Обозначения: В - возраст (годы); Р - рост (м).
* Нижний и верхний процентили (2,5-й и 97,5-й процентили 95% доверительного интервала (ДИ) или
5-й и 95-й процентили 90% ДИ высчитывают как должное ± указанное число).
45
Гпава 2
Таблица 2. Стандартизованное значение остатков (SR) и соответствующий доверительный
интервал (ДИ%) при нормальном распределении данных [36]
ков (standardized residual (SR) — разность
полученного значения и рассчитанного
должного, деленная на RSD) — индекс,
указывающий, насколько измеренная
величина отличается от должной, а также
оценивающий вероятность получения
таких результатов в норме [ 1,37, 38]. Чем
ближе SR к нулю, тем лучше: SR = О
означает, что измеренная величина равна
должной; SR = 1,64 — верхняя граница
90% диапазона значений; SR = — 1,96 —
нижняя граница 95% диапазона значений (табл. 2). Например, при обследовании
двоих мужчин одного возраста (30 лет) и роста (180 см) ОЕЛ составила 5,45 и 7,45 л
соответственно; должное значение, рассчитанное по формуле, составило 7,30 л, а
RSD 0,70 (см. табл. 1). Стандартизованное значение остатков для первого пациента
равно (5,45 — 7,30)/0,70 = —2,64, а значит, ОЕЛ значительно меньше нормальных значений; для второго пациента SR равно (7,45—7,30)/0,70 = 0,21, а значит, ОЕЛ в пределах нормы.
SR
ДИ%
SR
ди%
SR
ди%
2,576
99
1,960
95
0,842
60
2,326
98
1,644
90
0,674
50
2,170
97
1,282
80
0,524
40
2,054
96
1,036
70
0,385
30
Нарушения легочной вентиляции по рестриктивному типу
Изначально основным показанием для измерения статических легочных объемов
была диагностика рестриктивных нарушений. Далеко не полный перечень заболеваний, для которых характерно нарушение легочной вентиляции по рестриктивному
типу, представлен в табл. 3.
В клинической практике алгоритм, основанный на анализе основных спирометрических параметров (ОФВ,, ЖЕЛ, ОФВ,/ЖЕЛ) и ОЕЛ [35], достаточно прост и информативен. Проблемы возникают, когда эти показатели (некоторые или все сразу)
находятся на границе нормальных значений. В этих случаях буквальная интерпрета-
Таблица 3. Заболевания и состояния, для которых характерны рестриктивные нарушения легочной
вентиляции
Легочная патология
Внелегочная патология
Беременность
Интерстициальные заболевания легких (легочный фиброз,
облитерирующий бронхиолит с организующейся пневмонией,
саркоидоз, гистиоцитоз X, альвеолярный протеиноз)
Пневмония
Резекция легкого
Ателектаз
Асбестоз
Злокачественные новообразования
Заболевания плевральной полости (пневмоторакс, фиброторакс,
гидроторакс)
Кардиомегалия
Нейромышечные заболевания (паралич диафрагмы, боковой
амиотрофический склероз, полимиозиты, миастения)
Патология грудной клетки (кифосколиоз, анкилозирующий
спондилоартрит, торакопластика)
46
Измерение легочных объемов
Таблица 4. Причины снижения обшей емкости легких
Легочная патология Пульмонэктомия
Коллапс легких
Консолидация
Отек
Фиброз и др.
Внелегочная патология Заболевания плевры (выпот, утолщение, пневмоторакс)
Деформации грудной клетки (сколиоз, торакопластика)
Слабость дыхательных мышц
Выраженное ожирение
Асцит
Хирургическое вмешательство в грудной/брюшной полости
ция функциональных изменений слишком упрощена и может привести к ложным
результатам. Для правильной оценки функционального статуса следует провести дополнительные исследования в соответствии с клинической ситуацией (например,
проба с бронходилататором, измерение диффузионной способности легких, оценка
силы дыхательных мышц, нагрузочный тест).
Наличие рестриктивных вентиляционных нарушений можно заподозрить на
первом этапе функционального исследования при спирометрии (см. выше): снижение ЖЕЛ, увеличение ОФВ,/ЖЕЛ >80—90%, характерная форма кривой поток—объем. Однако, как отмечалось ранее, снижение только ЖЕЛ не означает наличия рестриктивных нарушений, поскольку снижение ЖЕЛ при нормальном или слегка повышенном ОФВ,/ЖЕЛ часто наблюдают при недостаточном усилии во время выполнения маневров и/или при периферической обструкции. О наличии рестрикции
можно говорить только при снижении ОЕЛ ниже 5-го процентиля от должных значений [35] и нормальном отношении ОФВ,/ЖЕЛ. Причины, приводящие к снижению ОЕЛ, представлены в табл. 4.
ОЕЛ и ее составляющие равномерно снижаются при редукции количества альвеол,
что встречается при деструкции (например, опухоль, воспалительный процесс) и компрессии (плеврит, пневмоторакс, опухоль) легочной ткани, окклюзии дыхательных
путей (например, инородным телом), облитерации альвеолярного пространства (отек
легких) и после резекции легкого (рис. 7). Такие изменения не являются специфическими для какой-то определенной болезни, но возникают всякий раз при поражении
как минимум одного-двух сегментов легких [39]. При небольшом объеме поражения
потеря функционирующих альвеол компенсируется гиперфункцией интактных.
Субъективные симптомы заболевания появляются, когда функциональные резервы
достигают предела (например, при физической нагрузке). В покое субъективные ощущения возникают, когда не функционирует по крайней мере половина легочной ткани. Нарушения проявляются раньше, если интактная легочная ткань тоже не функционирует нормально (например, при сочетании вышеуказанной патологии с ХОБЛ).
При заболеваниях, приводящих к значительному ограничению вентиляции альвеол (ригидность легочной паренхимы при фиброзе легких; ограничение движения
грудной клетки при кифосколиозе, спайках диафрагмы или мышечной дистрофии;
утолщение плевры), объем оставшейся нормально функционирующей ткани легких
слишком мал, чтобы компенсировать потерю функции [39]. При этом тип функцио-
47
Гпава 2
150 г
Рис. 7. Типичные изменения статических легочных объемов при различных заболеваниях.
(По Pride N.B. Lung function measurement in respiratory diseases: mechanisms // ERS Congress.
Munich, 2006.)
нальных нарушений зависит от патологии. Например, нарушения легочной функции при слабости дыхательных мышц отличаются от нарушений при фиброзе легких
(в первом случае ООЛ будет значительно выше нормы, тогда как во втором случае
ООЛ будет нормальным или чуть увеличенным) (см. рис. 7).
Пневмоторакс и несообщающаяся булла являются особым случаем, который характеризуется нормальными ОФВ,/ЖЕЛ и ОЕЛ, измеренной с помощью бодипле-
тизмографии, но низкими ОФВ, и ЖЕЛ. В этом случае ОЕЛ, измеренная с помощью
методов разведения газов, будет снижена.
Если значение ОЕЛ находится на нижней границе нормы у пациента с болезнью,
приводящей к легочной рестрикции, рекомендуется осторожно делать выводы о типе вентиляционных нарушений. Типичным примером является легочная резекция.
Достаточно трудно выявить ожидаемые рестриктивные нарушения только по величине ОЕЛ в процентах от должной, если в результате роста легких или из-за большой
дооперационной ОЕЛ ее значение после резекции остается выше 5-го процентиля
должного. Внимательного подхода требуют и случаи сочетания нескольких заболеваний с противоположным влиянием на ОЕЛ. Так, при наличии обструкции и эмфиземы очень трудно заподозрить по ОЕЛ наличие рестриктивных нарушений у
больных с лобэктомией [40] или криптогенным фиброзирующим альвеолитом [41].
Опубликовано немного работ, в которых предложены четкие критерии классификации тяжести рестриктивных нарушений. В нашей лаборатории мы используем
следующие критерии снижения ОЕЛ:
• легкое - более 60% от должной;
• умеренное — 40—60% от должной;
• выраженное — менее 40% от должной.
48
Измерение легочных объемов
Анализ других (помимо ОЕЛ) статических объемов легких также может быть полезным при интерпретации результатов. Например, иногда снижение ООЛ является
единственным изменением [42] у пациентов с заболеваниями грудной клетки (скелетной деформацией, фибротораксом) или патологией внутренних органов (застой-
аой сердечной недостаточностью, саркоидозом). ФОЕ и РОвыд резко снижаются у
лиц с патологическим ожирением даже в тех случаях, когда ЖЕЛ и ОФВ, остаются в
пределах нормы [43]. РОвыд также снижается при асците и беременности. Эти примеры показывают сложную взаимосвязь между измеренными объемами и подчеркивают необходимость тщательного анализа.
Нарушения легочной вентиляции по обструктивному типу
Для идентификации обструктивных нарушений измерение статических объемов
легких не является обязательным, поскольку спирометрия позволяет достаточно точно выявить наличие бронхиальной обструкции и определить ее тяжесть. Измерение
статических легочных объемов позволяет дифференцировать обструктивные и смешанные обструктивно-рестриктивные нарушения. Для чисто обструктивных вентиляционных нарушений характерно снижение ОФВ,/ЖЕЛ при нормальной ОЕЛ.
Измерение объемов легких может помочь диагностировать заболевание и его
функциональные последствия. Например, если легочные объемы превышают верхнюю границу нормы (ВГН), можно предположить наличие эмфиземы, БА или других обструктивных болезней и оценить степень гиперинфляции легких. Причины,
вызывающие увеличение ОЕЛ, представлены в табл. 5.
Увеличение ООЛ выше ВГН при наличии обструкции, как считают, является
маркером закрытия дыхательных путей («воздушной ловушки»). Незначительное
повышение ООЛ является наиболее частым физиологическим отклонением у молодых лиц после эпизодов идиопатического спонтанного пневмоторакса [44], у которых при компьютерной томографии обнаруживались признаки центрилобулярной
эмфиземы в верхних отделах легких [45]. Повышение ООЛ также может наблюдаться при слабости экспираторных дыхательных мышц. Длительные наблюдения за курильщиками среднего возраста без явных признаков легочной патологии показали,
что у них в большей степени увеличиваются ООЛ и ОЕЛ, чем снижаются ЖЕЛ и
ОФВ, [46]. По величине ООЛ также прогнозируют улучшение вентиляционной способности легких после хирургической редукции объема легких (ХРОЛ) у больных с
тяжелой эмфиземой [47, 48].
Полезная информация может быть получена при исследовании ОЕЛ различными
методами у одного и того же пациента (см. выше «Внутригрудной объем газа»). При
обследовании здоровых людей результаты, полученные разными методами, сопоставимы, и объем «воздушной ловушки» составляет в среднем 170 мл [49]. У больных
с обструктивными заболеваниями органов дыхания объем «воздушной ловушки» значительно увеличивается и тесно
связан с тяжестью бронхиальной обструкции [50]. Разница между измерениями представляет клинический интерес у
больных с эмфиземой перед выполнением ХРОЛ [51,52].
Таблица 5. Причины увеличения ОЕЛ
Обструкция
Эмфизема
дыхательных путей
ХОБЛ
БА
Муковисцидоз
Бронхоэктазия и т.п.
Другие
Акромегалия
49
Гпава 2
В исследованиях последних лет подчеркивается важность оценки легочных объемов для определения тяжести заболевания. Например, при тяжелой обструкции дыхательных путей ограничение экспираторного потока приводит к замедлению опустошения альвеол на выдохе. При физической нагрузке нарушения механики дыхания
еще больше усугубляются: задержка воздуха в альвеолах возрастает, приводя к увеличению объема легких (динамической гиперинфляции). На поздних стадиях заболевания в результате необратимых изменений структуры легких, таких как формирование
булл, снижение эластичности легких и/или динамическая компрессия дыхательных
путей, развивается статическая гиперинфляция легких (увеличение ФОБ, ООЛ и
ООЛ/ОЕЛ). Больной вынужден дышать при более высоком объеме легких; возрастает работа дыхания для преодоления эластических сил, увеличивается потребность ин-
спираторных мышц в кислороде, возникает одышка и снижается физическая работоспособность. Степень гиперинфляции легких соответствует тяжести обструкции дыхательных путей [35]. Показано, что у больных ХОБЛ гиперинфляция легких в покое,
оцененная как отношение инспираторной емкости легких (Евд) к О ЕЛ, является самостоятельным фактором риска летального исхода, в том числе от легочных причин [53].
Нарушения легочной вентиляции по смешанному типу
Для смешанных вентиляционных нарушений характерно сосуществование обструкции и рестрикции. При функциональном обследовании таких больных выявляют снижение и ОФВ,/ЖЕЛ, и ОЕЛ. Поскольку ЖЕЛ может одинаково снижаться
как при обструкции, так и при рестрикции, не следует делать заключение о наличии
рестриктивных нарушений на основании простого измерения ОФВ, и ЖЕЛ. Если
ОФВ,/ЖЕЛ и максимальная ЖЕЛ ниже НГН, а метод общей бодиплетизмографии
недоступен, можно сделать заключение, что снижение ЖЕЛ, вероятно, обусловлено
гиперинфляцией, но нельзя исключить и рестриктивные нарушения. Наоборот, при
снижении ОФВ,/ЖЕЛ и нормальных значениях ЖЕЛ следует исключать легочную
рестрикцию.
Клинические случаи
Клинический случай 1
Мужчина 66 лет (рост 185 см, масса тела 78 кг, индекс массы тела (ИМТ)
22,8 кг/м2). Курил в течение 50 лет по 30 сигарет в день (стаж курения 75 пачек-лет).
Направлен на обследование торакальными хирургами по программе хирургической
редукции объема легких при эмфиземе.
Пациент считает себя больным в течение последних 10 лет, когда появились
одышка при физических нагрузках, кашель с умеренным количеством слизистогнойной мокроты.
Основные жалобы при поступлении: одышка при минимальной физической нагрузке, кашель с небольшим количеством слизистой мокроты, снижение физической работоспособности. Астеническое телосложение. Акроцианоз. В легких резко
ослабленное везикулярное дыхание, рассеянные сухие хрипы в нижнебазальных
сегментах с обеих сторон. Рентгенологически легочные поля диффузно эмфизема-
тозны во всех отделах, корни легких расширены за счет увеличения калибра сосудов,
диафрагма подвижна, сердце увеличено за счет правых отделов (рис. 8а). При компьютерной томографии легких видно, что в верхушках паренхима практически пол-
50
Измерение легочных объемов
Рис. 8. Визуализация легких, а - рентгенограмма: легочные поля диффузно эмфизематозны
во всех отделах, б — КТ: множественные воздушные полости в обоих легких.
ностью замещена воздушными полостями, между которыми имеются тонкие соединительнотканные перемычки (рис. 86). В нижних долях обоих легких также имеются воздушные полости, больше выраженные справа. При проведении статической
перфузионной сцинтиграфии легких выявлено резкое снижение перфузии в нижней
доле левого легкого (рис. 9, см. цветную вкладку на с. 181).
Результаты спирометрии и общей бодиплетизмографии представлены в табл. 6 и
на рис. 10.
При исходной спирометрии выявлены нарушения вентиляционной способности
легких по смешанному типу, на что указывает снижение ОФВ,/ФЖЕЛ до 22% и
Таблица 6. Результаты спирометрии (клинический случай 1)
Показатель
До ингаляции
сальбутамола
После ингаляции
сальбутамола
Коэффициент
бронходилатации,%
ФЖЕЛ, % от должной
78
96
23
ОФВ,, % от должного
22
30
36
ОФВ,, л
0,61
0,83
ОФВ,/ФЖЕЛ, %
22
25
СОС75_75, % от должного
5
9
MOC-,s, % от должной
5
8
МОС50, % от должной
4
8
MOC7S, % от должной
11
11
ПОСВН1, % от должной
30
37
Время выдоха, с
16,48
16,18
ЖЕЛ, % от должной
86
103
21
О ЕЛ, % от должной
180
174
-4
ООЛ, % от должного
335
292
-13
ООЛ/ОЕЛ, %
72
65
ФОЕ, % от должной
287
255
-11
ЕВ1, % от должной
53
79
50
51
Гпава 2
Выдох
Рис. 10. Функциональные исследования, а - кривые поток—объем при форсированном дыхании (1) и спокойном дыхании (2); пунктиром показана должная кривая форсированного выдоха. Резкое снижение скорости экспираторного потока сразу после пика отражает ранний экспираторный коллапс дыхательных путей и свидетельствует о выраженных обструктивных нарушениях. Кривая смешена влево, что указывает на выраженную гиперинфляцию легких, которая
существенно уменьшается после ингаляции сальбутамола, б - статические легочные объемы
(общая бодиплетизмография): увеличение ОЕЛ обусловлено резко выраженным увеличением
ООЛ; ЖЕЛ снижена. После ингаляции сальбутамола отмечается положительная динамика.
52
Измерение легочных объемов
ФЖЕЛ до 78% от должной. Отношение ОФВ,/ФЖЕЛ снижено в значительно большей степени, чем ФЖЕЛ. Обструктивные нарушения можно оценить как крайне тяжелые, поскольку ОФЕ^ составляет 22% от должного. Отмечается генерализованное
снижение скорости выдоха. Кривая поток—объем указывает на то, что потеряна значительная доля нормальной площади под кривой и у пациента имеется существенное ограничение легочной вентиляции (см. рис. 10а). Резкое снижение скорости
экспираторного потока сразу после пика сменяется пологим участком кривой, отражающим ранний экспираторный коллапс дыхательных путей. При сравнении кривых поток-объем при спокойном и форсированном дыхании обращает внимание
ограничение потока при спокойном дыхании (поток при спокойном выдохе больше,
чем при форсированном (см. рис. 10а)). Это приводит к гиперинфляции и снижению вентиляционного резерва.
Измерение статических объемов легких выявляет только обструктивные нарушения механики дыхания (см. рис. 106), исключая наличие рестрикции. ОЕЛ превышает верхнюю границу нормы и составляет 180% от должной. Увеличение ФОЕ до
287% от должной при наличии обструкции свидетельствует о гиперинфляции легких
в покое, увеличение ООЛ до 335% от должного и его доли в общей емкости легких
(72%) — о наличии «воздушных ловушек». ЖЕЛ снижена до 86% от должной, но остается в пределах возрастной нормы.
Пациент готовился к хирургической редукции объема легких, поэтому у него дополнительно определили объем «воздушной ловушки», который составил 2,2 л (разность ФОЕ, измеренной методом общей бодиплетизмографии (9,73 л, или 287% от
должной), и ФОЕ, измеренной методом разведения гелия (7,53 л, или 222% от
должной)), тогда как у здоровых людей эта разница около 0,17 л.
После ингаляции ^00 мкг сальбутамола получена достоверная положительная динамика как динамических, так и статических легочных объемов (см. табл. 6). Результаты исследования легочной функции были приемлемыми для хирургического лечения эмфиземы, которое впоследствии было успешно проведено.
Клинический случай 2
Женщина в возрасте 28 лет (рост 163 см, масса тела 39 кг, ИМТ 14,7 кг/м2) обратилась к пульмонологу с жалобами на одышку в покое, усиливающуюся при физической нагрузке, кашель с трудноотделяемой гнойной мокротой, общую слабость.
Никогда не курила.
С детства и на протяжении всей жизни ее беспокоят обострения бронхолегочной
инфекции, периодически отмечает нарушения стула. Ставились диагнозы: хронический обструктивный бронхит, БА, бронхоэктатическая болезнь.
При осмотре отмечается астеническое телосложение; акроцианоз. Обычная форма грудной клетки. При перкуссии грудной клетки определяется коробочный звук.
При аускультации — ослабленное дыхание, проводится во все отделы, множественные разнокалиберные хрипы. Частота дыхания 28 в 1 мин в покое, участие вспомогательной дыхательной мускулатуры.
Рентгенологически в обоих легких, преимущественно в верхних долях, определяются выраженные фиброзно-бронхоэктатические изменения (рис. 11а). При компьютерной томографии установлено, что верхняя доля левого легкого уменьшена в
размерах за счет плевропневмофиброза. Во всех легочных полях обоих легких определяются расширения бронхов 111—IV порядка с формированием множественных
53
Гпава 2
Рис. 11. Визуализация легких, а — рентгенограмма (прямая проекция): определяются выраженный фиброз и бронхоэкта-
зы, преимущественно в верхних долях
обоих легких, б — КТ: выраженные брон-
хоэктатические изменения с формированием пневмоцирроза в S3 верхней доли
левого легкого.
мешотчатых и цилиндрических бронхо-бронхиолоэктазов разных размеров, заполненных слизью, некоторые из них с горизонтальным уровнем жидкости и выраженной перифокальной инфильтрацией, с утолщенными стенками (рис. 116).
Результаты спирометрии и общей бодиплетизмографии представлены в табл. 7 и
на рис. 12.
Таблица 7. Результаты спирометрии (клинический случай 2)
Показатель
До ингаляции
сальбутамола
После ингаляции
сальбутамола
Коэффициент
бронходилатации,%
ФЖЕЛ, % от должной
65
70
7
ОФВ,, % от должного
40
43
7
ОФВ,, л
1,24
1,33
ОФВ,/ФЖЕЛ, %
53
53
СОС25_75, % от должного
11
13
МОС25, % от должной
24
25
МОС50, % от должной
12
15
МОС75, % от должной
8
10
ПОСт,п, % от должной
62
57
Время выдоха, с
10,87
8,93
ЖЕЛ, % от должной
66
75
14
ОЕЛ, % от должной
119
121
2
ООЛ, % от должного
253
238
-6
ООЛ/ОЕЛ, %
60
55
ФОЕ, % от должной
168
162
-4
Евд, % от должной
59
70
20
54
Измерение легочных объемов
Выдох
Рис. 12. Функциональные исследования, а - кривые поток-объем при форсированном дыхании (1) и спокойном дыхании (2); пунктиром показана должная кривая форсированного выдоха. Вогнутый характер нисходящего колена кривой указывает на наличие обструктивных
нарушений. Расположение кривой форсированного выдоха пациентки под должной свидетельствует об ограничениях легочной вентиляции. Кривая также смещена влево, что указывает на выраженную гиперинфляцию легких, которая практически не изменяется после ингаляции сальбутамола, б — статические легочные объемы (общая бодиплетизмография): увеличение ОЕЛ обусловлено резко выраженным увеличением ООЛ; ЖЕЛ снижена. После ингаляции сальбутамола отмечается увеличение ЖЕЛ за счет снижения ФОЕ.
55
Гпава 2
При исходной спирометрии выявлены нарушения вентиляционной способности легких по смешанному типу, на что указывает снижение ОФВ,/ФЖЕЛ до 40%.
ФЖЕЛ снижена до 65% от должной. Отношение ОФВ,/ФЖЕЛ снижено в большей
степени, чем ФЖЕЛ. Имеют место тяжелые обструктивные нарушения (ОФВ, 40%
от должного) и генерализованное снижение скорости выдоха. Кривая поток—объем указывает на обструктивные нарушения легочной вентиляции и снижение площади под кривой (см. рис. 12а). Нисходящее колено экспираторной петли не линейно, а равномерно вогнуто. Существует ограничение потока при спокойном дыхании (поток при спокойном выдохе практически равен потоку при форсированном маневре (см. рис. 12а), что свидетельствует о снижении вентиляционного
резерва).
ОЕЛ не снижена, что исключает смешанный тип нарушений. Снижение ЖЕЛ
обусловлено выраженными обструктивными нарушениями, гиперинфляцией легких (ФОЕ увеличена до 168% от должной) и наличием «воздушных ловушек» (повышение ООЛ до 253% от должного и его доли в ОЕЛ до 60%).
После ингаляции сальбутамола увеличение динамических легочных объемов
(ОФВ1 и ФЖЕЛ) не выявлено. Однако увеличение статических легочных объемов
(ЖЕЛвд и Евд) указывает на целесообразность применения бронходилататоров.
Анамнез заболевания, нутритивный статус, характерные КТ-признаки и выраженные обструктивные нарушения требуют исключения муковисцидоза. Муковис-
цидоз — наследственное заболевание, обусловленное системной дисфункцией экзокринных желез. Клинически оно проявляется прогрессирующей инфекцией и
обструкцией дыхательных путей, экзокринной недостаточностью поджелудочной
железы, нарушением процессов пищеварения и всасывания в кишечнике, холеста-
тическими осложнениями, а также снижением репродуктивной функции у мужчин в
связи с недоразвитием или отсутствием семявыводящих протоков. Данной пациентке было рекомендовано исследование хлоридов пота (лотовый тест) и генетическое
обследование, которые выявили значительное повышение концентрации хлоридов
пота (95 ммоль/л при норме до 60 ммоль/л) и мутацию deltaF508/3849~l-1 OkbC—Т, что
подтвердило диагноз муковисцидоза.
Клинический случай 3
Женщина 67 лет (рост 159 см, масса тела 75 кг, ИМТ 29,7 кг/м2). Жалуется на прогрессирующую одышку при физической нагрузке, сопровождаемую сухим кашлем,
Таблица 8. Результаты спирометрии (клинический случай 3)
Показатель
Исходно
Показатель
Исходно
ФЖЕЛ, % от должной
77
ПОСВыд, % от должной
126
ОФВ,, % от должного
84
Время выдоха, с
6,98
ОФВ,, л
1,69
ЖЕЛ, % от должной
78
ОФВ,/ФЖЕЛ, %
91
ОЕЛ, % от должной
78
СОС25_75, % от должного
130
ООЛ, % от должного
94
МОС25, % от должной
140
ООЛ/О ЕЛ, %
49
МОС50, % от должной
143
ФОЕ, % от должной
81
МОС75, % от должной
103
РОвыд, % от ДОЛЖНОГО
47
56
Измерение легочных объемов
Выдох
ОЕЛ
ФОЁ
боп:
Должные Измеренные
Рис. 13. Функциональные исследования, а - кривые поток—объем при форсированном дыхании (1) и спокойном дыхании (2); пунктиром показана должная кривая форсированного выдоха. Кривая форсированного выдоха высокая и узкая, смещена вправо: отмечается снижение
ФЖЕЛ, пиковая объемная скорость выдоха и объемные скорости воздушного потока увеличены по сравнению с должными значениями, б — статические легочные объемы (общая бо-
диплетизмография): снижение ОЕЛ обусловлено снижением ЖЕЛ при нормальном ООЛ.
57
Гпава 2
в течение последнего года. Никогда не
курила. Профессиональные вредности,
контакт с ингаляционными аллергенами
(птицы, сено, кондиционеры и т.д.) отрицает.
В легких выслушивается равномерно
ослабленное дыхание, мягкая конечно-
инспираторная крепитация по типу
«хруста целлофана» в базальных отделах.
Перкуторный звук с коробочным оттенком. Sa02 в покое 90%. Результаты спирометрии представлены в табл. 8.
При исходной спирометрии выявлены нарушения вентиляционной способности легких по рестриктивному типу, на
что указывает увеличение ОФВ,/ФЖЕЛ до 91% при снижении ФЖЕЛ до 77% от
должной. Бронхиальная проходимость не нарушена. На кривой поток-объем видно
небольшое снижение ФЖЕЛ, увеличение пиковой объемной скорости выдоха, после пика наблюдается быстрое линейное снижение потока (скоростные показатели
превышают должные значения). Форма кривой изменяется: она становится высокой
и узкой (рис. 13а), что также характерно для рестриктивных нарушений. Для подтверждения рестрикции измерены статические легочные объемы методом бодипле-
тизмографии: ОЕЛ снижена за счет уменьшения ЖЕЛ, ООЛ остается в пределах
нормальных значений; т.е. произошло перераспределение структуры ОЕЛ (рис. 136).
Такие функциональные изменения характерны для фиброза легких.
При компьютерной томографии определяется выраженный симптом «матового
стекла», в заднебазальных отделах легких выявлены признаки пневмосклероза,
пневмофиброза, а также тракционных бронхоэктазов (признаки интерстициальных
изменений легких) (рис. 14).
Клинический случай 4
Мужчина 51 года. Рост 175 см, масса тела 65 кг, ИМТ21,2 кг/м2. Курил в течение
года по 10 сигарет в день, последние 22 года не курит.
Таблица 9. Результаты спирометрии (клинический случай 4)
Показатель
Исходно
Показатель
Исходно
ФЖЕЛ, % от должной
51
Время выдоха, с
5,38
ОФВ,, % от должного
51
ЖЕЛ, % от должной
53
ОФВ,, л
1,80
ОЕЛ, % от должной
62
ОФВ,/ФЖЕЛ, %
81
ООЛ, % от должного
86
СОС25 75, % от должного
36
ООЛ/О ЕЛ, %
43
МОС25, % от должной
41
ФОЕ, % от должной
74
МОС50, % от должной
34
РОВЫ1, % от должного
54
МОС75, % от должной
27
Е , % от должной
52
ПОС,,,, % от должной
выд
45
Рис. 14. КТ: симптом «матового стекла», признаки пневмосклероза, пневмофиброза,
тракционных бронхоэктазов.
58
Измерение легочных объемов
Выдох (а)
Рис. 15. Функциональные исследования, а — кривые поток—объем при форсированном дыхании (1) и спокойном дыхании (2); пунктиром показана должная кривая форсированного выдоха. Кривая форсированного выдоха выглядит как уменьшенная копия должной и смещена
вправо: отмечается выраженное снижение ФЖЕЛ и пиковой объемной скорости выдоха, объемные скорости воздушного потока повышены по сравнению с должными значениями при
том же объеме легких, б — статические легочные объемы (общая бодиплетизмография): снижение ОЕЛ обусловлено примерно равномерным снижением ее составляющих (ЖЕЛ и ООЛ).
59
Гпава 2
При поступлении жалобы на постоянное чувство нехватки воздуха, усиливающееся при минимальной физической нагрузке, кашель с трудно отделяемой слизистогнойной мокротой.
Пять лет назад перенес левостороннюю пул ьмонэктомию по поводу опухоли легкого, после чего появились постепенно нарастающая одышка при физической нагрузке и периодический кашель с трудно отделяемой слизисто-гнойной мокротой.
При аускультации над левым легким дыхание не выслушивается, над правым легким дыхание жесткое, единичные рассеянные сухие хрипы. При перкуссии — коробочный звук. Частота дыхания в покое 24 в 1 мин. Sa02 в покое 97%.
На рентгенограмме органов грудной клетки левое легочное поле уменьшено в
размерах, затемнено, срединная тень смещена влево - состояние после пульмонэк-
томии. В правом легком явления эмфиземы, диффузного пневмосклероза, больше
выраженного в нижних отделах. Купол диафрагмы уплощен.
При спирометрии заподозрены рестриктивные нарушения легочной вентиляции (ОФВ,/ФЖЕЛ 81%, ФЖЕЛ снижена до 51% от должной), генерализованное
снижение скорости выдоха (низкий объем легких снижает эластическую отдачу, поэтому скоростные показатели могут быть снижены и при отсутствии обструкции
дыхательных путей) (табл. 9). По кривой поток—объем видно, что ФЖЕЛ снижена
почти в 2 раза, пиковая объемная скорость выдоха уменьшена, объемные скорости
экспираторного потока увеличены по сравнению с должными значениями при том
же объеме легких (рис. 15а). Форма кривой выглядит как пропорционально уменьшенная копия должной. Снижение площади под кривой свидетельствует об ограничении легочной вентиляции. Для подтверждения рестриктивных нарушений были измерены статические легочные объемы: ОЕЛ и ее составляющие снижены равномерно (рис. 156), что характерно для редукции количества альвеол за счет пуль-
монэктомии.
Заключение
Нарушения легочной вентиляции крайне редко являются патогномоничными
для определенного заболевания, поэтому почти всегда требуют дифференциальной
диагностики. Вследствие этого мы предостерегаем врачей функциональной диагностики от категоричных суждений о клиническом диагнозе. Функциональные исследования, независимо от их объема, как правило, позволяют лишь предположить
определенное заболевание. В большинстве случаев помощь в установлении правильного диагноза приносит совместное обсуждение полученных результатов вра-
чом-функционалистом, клиницистом и специалистом по лучевой диагностике.
Список литературы
1. Quanjer Р.Н., Tammeling G.J., Cotes J.E. et al. Lung volumes and forced ventilatory flows. Report Working
Party Standardization of Lung Function Tests, European Community for Steel and Coal. Official Statement
of the European Respiratory Society // Eur. Respir. J. 1993. V. 6. Suppl. 16. P. 5-40.
2. Pierce R.J., Brown D.J., Holmes M. et al. Estimation of lung volumes from chest radiographs using shape
information //Thorax. 1979. V. 34. P. 726-734.
3. Ross J.C., Copher D.E., Teays J.D., Lord T.Y. Functional residual capacity in patients with pulmonary
emphysema//Ann. Intern. Med. 1962. V. 57. P. 18-28.
4. Tierney D.F., Nadel J.A. Concurrent measurements of functional residual capacity by three methods //
J. Appl. Physiol. 1962. V. 17. R 871-873.
60
Измерение легочных объемов
5. Pare P.D., Wiggs B.J., Coppin С.A. Errors in the measurement of total lung capacity in chronic obstructive
lung disease//Thorax. 1983. V. 38. P. 468-471.
6. Contours of Breathing. V. 1 / Eds. Tammeling G.J., Quanjer PH. Leiden: Boehringer Ingelheim, 1979.
Hathiral S., Renzetti A.D. Jr., Mitchell M. Measurement of the total lung capacity by helium dilution in a
constant volume system // Amer. Rev. Respir. Dis. 1970. V. 102. P. 760-770.
8. Wanger J., Clausen J.L., Coates A. et al. Standardisation of the measurement of lung volumes // Eur.
Respir. J. 2005. V. 26. P.511-522.
9. Darling R.C., Cournand A., Richards D.W.J. Studies on intrapulmonary mixture of gases. III. Open circuit
methods for measuring residual air//J. Clin. Invest. 1940. V. 19. P. 609-618.
10. Fleming G.M., Chester E.H., Saniie J. et al. Ventilation inhomogeneity using multibreath nitrogen washout:
Comparison of moment ratios and other indexes // Amer. Rev. Respir. Dis. 1980. V. 121. P. 789-794.
11. Brunner J.X., Wolff G., Gumming G., Langenstein H. Accurate measurement of N2 volumes during N2
washout requires dynamic adjustment of delay time//J. Appl. Physiol. 1985. V. 59. P. 1008-1012.
12. Martin R., Macklem P.T. Suggested Standardized Procedures for Closed Volume Determinations (Nitrogen
Method). Bethesda: Division of Lung Disease, National Heart and Lung Institute, NIH, 1973.
13. Mitchell M.M., Renzetti A.D. Jr. Evaluation of a single-breath method of measuring total lung capacity //
Amer. Rev. Respir. Dis. 1968. V. 97. P. 571-580.
14. Cotes J.E. Transfer factor (diffusing capacity) // Bull. Eur. Physiopathol. Respir. 1983. V. 19. Suppl. 5.
P. 39-44.
15. Quanjer P.H., de Pater L., Tammeling G.J. Plethysmographic Evaluation of Airway Obstruction. Leusden:
Netherlands Asthma Foundation, 1971.
16. DuBois A.B., Botelho S.R., Bedell G.N. et al. A rapid plethysmographic method for measuring thoracic gas
volume; a comparison with a nitrogen wash-out method for measuring functional residual capacity //J. Clin.
Invest. 1956. V. 35. P. 322-326.
17. Mead J. Volume displacement body plethysmograph for measurements on human subjects // J. Appl.
Physiol. 1960. V. 15. P.736-740.
18. Nolle D., Reif E., Ulmer W.T. Die Ganzkorperplethysmographie. Methodische Probleme und Praxis der
Bestimmung des intrathorakalen Gasvolumens und der Resistance-Messung bie Spontanatmung //
Respiration. 1968. V. 25. P. 14—34.
19. Rodenstein D.O., Francis C., Stanescu D.C. Airway closure in humans does not result in overestimation of
plethysmographic lung volume // J. Appl. Physiol. 1983. V. 55. P. 1784-1789.
20. Van de Woestijne K.P, Bouhuys A. Spirometer response and pressure correction in body plethysmography //
Prog. Respir. Res. 1969. V. 4. P. 64-74.
21. Bryant G.H., Hansen J.E. An improvement in whole body plethysmography//Amer. Rev. Respir. Dis. 1975.
V. 112. P.464-465.
22. Stanescu D.C., Rodenstein P, Cauberghs M. et al. Failure of body plethysmography in bronchial asthma //
J. Appl. Physiol. 1982. V 52. P. 939-948.
23. Rodenstein D.O., Stanescu D.C. Reassessment of lung volume measurement by helium dilution and body
plethysmography in chronic airflow obstruction //J. Appl. Physiol. 1982. V. 126. P. 1040-1044.
24. Shore S., Milic-Emili L, Martin J.G. Reassessment of body plethysmographic technique for the measurement of thoracic gas volume in asthmatics//J. Appl. Physiol. 1982. V. 126. P. 515—520.
25. Habib M.P., Engel L.A. Influence of panting technique on the plethysmographic measurement of thoracic
gas volume // Amer. Rev. Respir. Dis. 1978. V. 117. P. 265-271.
26. Bush A., Denison D.M. Use of different magnification factors to calculate radiological lung volumes //
Thorax. 1986. V. 41. P. 158-159.
27. Pierce R.J., Brown D.J., Denison D.M. Radiographic, scintigraphic and gas dilution estimates of individual
lung and blood volumes in man // Thorax. 1980. V. 35. P. 777-780.
28. Barnhard H.J., Pierce J. A., Joyce J.W., Bates J.H. Roentgenographic determination of total lung capacity//
Amer. J. Med. 1960. V. 28. P. 51-60.
29. Loyd H.M., String T.I., DuBois A. B. Radiographie and plethysmographic determination of total lung capacity // Radiology. 1966. V. 86. P. 7-14.
30. Reger R.B., Young A., Morgan W.K.C. An accurate and rapid radiographie method for determining total
lung capacity//Thorax. 1972. V. 27. P. 163-168.
31. Pratt P.C., Klugh G.H. A method for the determination of total lung capacity from postero-anterior and lateral chest roentgenograms//Amer. Rev. Respir. Dis. 1967. V. 96. P. 548-552.
32. Rodenstein D.O., Sopwith T.A., Stanescu D.C., Denison D.M. Re-evaluation of the radiographic method
for measurement of total lung capacity // Bull. Eur. Physiopathol. Respir. 1985. V. 21. P. 521-525.
33. Harris T.R., Pratt PC., Kilburn K.H. Total lung capacity measured by roentgenograms // Amer. J. Med.
1971. V. 50. P.756-763.
61
Гпава 2
34. Quanjer Ph.H. Predicted values: how should we use them? // Thorax. 1988. V. 43. P. 663-664.
35. Pellegrino R., Viegi G., Brusasco V. et al. Interpretative strategies for lung function tests // Eur. Respir. J.
2005. V. 26. P.511-522.
36. Stocks J., Quanjer P.H. Reference values for residual volume, functional residual capacity and total lung
capacity. ATS workshop on lung volume measurements. Official statement of the European Respiratory
Society. Workshop report // Eur. Respir. J. 1995. V. 8. P. 492-506.
37. American Thoracic Society Statement. Evaluation of impairment/disability secondary to respiratory disease // Amer. Rev. Respir. Dis. 1982. V. 126. P. 945-951.
38. Miller M.R., Pincock A.C. Predicted values: how should we use them? //Thorax. 1988. V. 43. P. 265-267.
39. Quanjer P.H., Tammeling G.J. // De fysiologische basis van klinisch laboratorium-onderzoek / Ed. by
R.J.M. Croughs, H.C. Hemker. Utrecht: Oosthoek, Scheltema en Holkema, 1976.
40. Lanier R.C., Olsen G.N. Can concomitant restriction be detected in adult men with airflow obstruction? //
Chest. 1991. V. 99. P.826-830.
41. Wiggins J., Strickland B., Turner-Warwick M. Combined cryptogenic fibrosing alveolitis and emphysema:
the value of high resolution computed tomography in assessment // Respir. Med. 1990. V. 84. P. 365-369.
42. Owens M.W., Kinasewitz G.T., Anderson W.M. Clinical significance of an isolated reduction in residual volume//Amer. Rev. Respir. Dis. 1987. V. 136. P. 1377-1380.
43. Thomas PS., Owen E.R.T.C., Hulands C., Milledge J.S. Respiratory function in the morbidly obese before
and after weight loss // Thorax. 1989. V. 44. P. 382-386.
44. De Troyer A., Yernault J.C., Rodenstein D. et al. Pulmonary function in patients with primary spontaneous
pneumothorax// Bull. Eur. Physiopathol. Respir. 1978. V. 14. P. 31-39.
45. Lesur O., Delorme N., Fromaget J.M. et al. Computed tomography in the etiologic assessment of idiopathic spontaneous pneumothorax // Chest. 1990. V. 98. P. 341-347.
46. Colebatch H.J.H, Ng C.K.Y. Rate of increase in pulmonary distensibility in a longitudinal study of smokers//Thorax. 1988. V. 43. P. 175-182.
47. Fessler H.E., Scharf S.M., Permutt S. Improvement in spirometry following lung volume reduction surgery.
Application of a physiological model // Amer. J. Respir. Crit. Care Med. 2002. V. 165. P. 34-40.
48. Черняк А.В. Роль функциональной оценки при отборе пациентов с эмфиземой для хирургической
редукции объема легких//Симпозиум «Торакальная операция и подготовка больного». 15-й Национальный конгресс по болезням органовдыхания. Москва, 2 декабря 2005 г. М., 2005.
49. Кольцуй С.С. Система интерпретации функционального состояния внешнего дыхания в пульмонологии: Автореф. дис. ... докт. мед. наук. М., 1999.
50. Науменко Ж.К., Неклюдова Г.В., Черняк А.В. и др. Состояние кардио-респираторной системы у
взрослых больных муковисцидозом // Тер. архив. 2002. Т. 74. № 3. С. 52-55.
51. Wade J.F., Mortenson R., Irwin C.G. Physiologic evaluation of bullous emphysema // Chest. 1991. V. 100.
P. 1151-1154.
52. Nickoladze G.D. Functional results of surgery for bullous emphysema//Chest. 1992. V. 101. P. 119-122.
53. Casanova C., Cote C., de Torres J.P et al. Inspiratory-to-total lung capacity ratio predicts mortality in patients
with chronic obstructive pulmonary disease //Amer. J. Respir. Crit. Care Med. 2005. V. 171. P. 591—597.
62
Цветные иллюстрации к главе 1
Рис. 18. Гладкомышечный узелок в стенке
бронхиолы. Окраска гематоксилином и эозином. хЮО.
Рис. 20. Кривые поток—объем при форсированном маневре и при спокойном дыхании
пациента (синяя — до ингаляции сальбутамола, красная — после ингаляции 400 мкг сальбутамола). Кривые при форсированном маневре приобретают характерный излом: резкое снижение скорости экспираторного потока сразу после пика сменяется пологим
участком кривой, отражающим коллапс дистальных отделов дыхательных путей на выдохе с образованием «воздушной ловушки».
Рис. 21. КТ. а — топограмма: уплощенные купола диафрагмы, объем легких увеличен (особенно слева), б — аксиальный срез на уровне нижних долей легких, в — цветовая градуировка легких в соответствии с КТ-плотностью (красные участки - эмфизема, серые - сохраненная легочная ткань).
3
Бронходилатационные
и бронхоконстрикторные
тесты
При первичном исследовании функции дыхания почти всегда желательно выполнить бронходилатационный тест (или бронходилатационную пробу), т.е. повторить спирометрию после ингаляции бронходилататора. Пациент должен прилагать
максимальные усилия во время выполнения маневров как до, так и после приема
бронходилататоров. Перед исследованием пациенту необходимо объяснить причины и правила проведения теста, что позволит улучшить сотрудничество между врачом и пациентом.
Бронходилатационные тесты
Показания для проведения бронходилатационного теста
1. Установление обратимости бронхиальной обструкции, о которой говорят в
случае положительной реакции на бронходилататор. У лиц молодого возраста выраженная обратимость обструкции требует исключения БА.
2. Определение потенциального эффекта бронхолитической терапии. Если у пациента выявляется положительная реакция на бронходилататор, возможно, ему необходимо регулярное лечение этими средствами. Отсутствие значимого улучшения
показателей спирометрии в результате бронходилатационного теста ни в коей мере
не означает, что больной не должен лечиться бронхолитиками.
3. Мониторирование динамики легочной функции у больных с хроническими респираторными заболеваниями при длительном (многолетнем) наблюдении. Например, у пациентов с ХОБЛ с течением времени ухудшаются показатели легочной
функции, и чем быстрее это происходит (особенно на начальных стадиях заболевания), тем активнее должна быть терапия.
4. Выявление скрытого бронхоспазма у лиц с нормальными показателями спирометрии — это, возможно, самое важное показание для бронходилатационного теста.
Проведение бронходилатационного теста
Реакция на бронходилататоры является интегральной физиологической реакцией, в которую вовлечены эпителий дыхательных путей, нервы, медиаторы и гладкие
мышцы. Выраженность индивидуальной реакции на прием бронходилататора может варьировать, поэтому предположение о том, что бронходилатационный ответ
при однократном приеме препарата позволяет адекватно оценить как реактивность
дыхательных путей, так и эффективность лечения бронходилататорами, является
слишком упрощенным [1]. Последние рекомендации ERS и ATS предлагают оценивать бронходилатационный ответ не только после однократной ингаляции препара¬
63
Гпава 3
та в лабораторных условиях, но и при длительном лечении этим препаратом в течение 2—8 нед [2].
Перед проведением бронходилатационного теста следует отказаться от приема
бронхорасширяющих препаратов. Короткодействующие ингаляционные (32-агонис-
ты (сальбутамол, фенотерол) и антихолинергические препараты (ипратропия бромид) следует отменить за 4—6 ч, пролонгированные р2-агонисты (салметерол, фор-
мотерол) и метилксантины — за 12 ч, пролонгированный холинолитик (тиотропия
бромид) - за 24 ч до бронходилатационного теста. Курение не допускается в течение
1 ч до исследования и на протяжении всего исследования. Если препараты отменить
нельзя, то в протоколе исследования указывают название препарата, дозу и время
последней ингаляции. Не существует противопоказаний к проведению теста, за исключением отсутствия кооперации между врачом и пациентом и непереносимости
бронхорасширяющих препаратов. Если пациент не переносит (32-агонисты, то в качестве бронходилататора можно использовать М-холинолитик.
Бронходилатационный ответ зависит от многих факторов, определяющих достоверность результатов: выбора бронходилататора и его дозы (чем выше доза, тем
больше ответ), времени, прошедшего после ингаляции (как правило, реакция измеряется на пике действия препарата), способа доставки препарата вдыхательные пути (дозированный аэрозоль или небулайзер), соблюдения критериев воспроизводимости как исходной, так и повторной спирометрии и способа расчета бронходилатационного ответа. На сегодняшний день не существует единого стандарта выбора
бронходилататора, дозы или способа его применения при проведении бронходилатационного теста. Однако можно минимизировать внутри- и межлабораторные
различия при использовании дозированных аэрозольных ингаляторов, если придерживаться нижеизложенных правил [2]. Рекомендуется использовать короткодействующие р2-агонисты, например сальбутамол в максимальной разовой дозе
(четыре ингаляции по 100 мкг) или фенотерол (Беротек) (2 ингаляции по 100 мкг);
для достижения максимально возможной бронходилатации рекомендуется использовать спейсер — устройство, позволяющее улучшить доставку лекарственного препарата в дыхательные пути и повысить эффективность ингаляции бронходилататора (рис. 1). Повторную спирометрию проводят через 15 мин. Без использования
спейсера вдыхаемая фракция сальбутамола меньше и ее величина в значительной
Рис. 1. Спейсеры при проведении бронходилатационной пробы, а — различные виды спейсе-
ров. б — ингаляция бронходилататора с помощью спейсера.
64
Бронходилатационные и бронхоконстрикторные тесты
степени зависит от синхронизации вдоха с активацией (нажатием на клавишу) ингалятора.
Если целью проведения бронходилатационного теста является оценка клинической эффективности определенного препарата, то тест проводится с тем же лекарством, в той же дозе и при том же способе доставки, что и в клинической практике у
данного больного. Время оценки бронходилатационного эффекта должно соответствовать началу действия данного лекарственного препарата.
Интерпретация результатов
Интерпретация результатов бронходилатационного ответа состоит из нескольких
этапов. На первом этапе необходимо определить, превышают ли полученные данные вариабельность измерения, которая должна составлять <8%, или <150 мл [1, 3].
На сегодняшний день не существует единого мнения о том, как оценивать обратимость бронхиальной обструкции [2, 4]. Разные исследователи используют для вычисления бронходилатационного ответа различные методы и спирометрические показатели. Самым распространенным способом выражения бронходилатационного
ответа является абсолютное и относительное (в процентах от исходных значений либо от должных величин) изменение спирометрических показателей. Кроме того, как
упоминалось ранее, не существует единого стандарта выбора препарата, дозы и способа введения. Тем не менее, согласно последним рекомендациям ERS и ATS, абсолютное и относительное изменение ОФВ, и/или ФЖЕЛ (коэффициент бронходилатации (КБД)) позволяет достаточно точно определить, является ли обструкция дыхательных путей обратимой [2]. Абсолютный прирост (АП) и КБД определяются
следующим образом:
АП = Показательпосле — Показательисх,
Показательппгпр - Показатель
КБД = — — х 100%,
Показательисх
где АП - абсолютный прирост спирометрического показателя в мл, Показательпосле -
значение спирометрического показателя (в мл) после ингаляции бронходилататора,
Показательисх — значение спирометрического показателя (в мл) до ингаляции бронходилататора.
Бронходилатационный тест считается положительным, если после ингаляции
бронходилататора КБД составляет >12%, а АП >200 мл [2, 5].
Если изменение ОФВ, незначимо, то о положительной реакции на бронходила-
татор может свидетельствовать уменьшение гиперинфляции легких (снижение общей емкости легких и остаточного объема легких и как результат увеличение инспи-
раторной емкости легких) [6, 7]. При обследовании 33 больных с ХОБЛ тяжелого течения (среднее значение ОФВ, 27 ± 2% от должного) было показано, что после однократной ингаляции сальбутамола значимый прирост ОФВ, получен лишь у 6%
пациентов, тогда как снижение гиперинфляции легких — более чем у 40% пациентов. Также было выявлено достоверное повышение физической работоспособности
и уменьшение одышки. Улучшение клинических симптомов коррелировало со снижением легочной гиперинфляции [7]. Наличие такой взаимосвязи было выявлено и
в других исследованиях после ингаляции как р2-агонистов, так и антихолинергиче-
ских препаратов [8, 9]. В отличие от больных БА при ХОБЛ ответ на антихолинерги¬
65
Гпава 3
ческие препараты не менее, а иногда и более выражен, чем при назначении (^-агонистов. Но даже отсутствие бронходилатационной реакции при проведении исследования в лаборатории не исключает клинической эффективности бронхолитической терапии у больных ХОБЛ.
Изолированное увеличение ФЖЕЛ (>12% и >200 мл) после ингаляции сальбутамола, которое не связано с увеличением длительности выдоха, также является признаком бронходилатации [10]. В какой-то мере это может быть обусловлено тем, что
глубокий вдох может приводить к сужению просвета дыхательных путей и/или снижению ригидности стенки дыхательных путей, особенно после применения бронхо-
дилататора [6, 11].
Для оценки бронходилатационной реакции не следует использовать потоки, измеренные на разных уровнях ФЖЕЛ (МОС25, МОС50, МОС75, СОС25 75), так как у
этих показателей очень высокая вариабельность [5].
Если на первом этапе интерпретации обнаружено, что прирост показателей превышает порог вариабельности, следует перейти ко второму этапу. Необходимо определить клиническое значение полученных результатов. Известно, что выраженность
бронходилатации у больных БА выше, чем у больных ХОБЛ [2, 6, 12]. Однако результаты только лишь бронходилатационной пробы не позволяют отчетливо дифференцировать эти заболевания. В настоящее время считают, что при ХОБЛ имеет место
«частично обратимое» ограничение воздушного потока, которое в большей степени
обратимо при проведении антихолинергической терапии. Более того, при хронизации
БА и/или недостаточном контроле заболевания, приводящих к ремоделированию дыхательных путей, обструкция дыхательных путей становится менее обратимой.
В 2008 г. было завершено многоцентровое международное исследование UPLIFT,
в котором оценивали долговременное влияние антихолинергического препарата
тиотропия на легочную функцию у больных ХОБЛ. В ходе исследования у этих пациентов оценивали бронходилатационный ответ на короткодействующие антихоли-
нергические препараты (ипратропия бромид) и р2-агонисты (сальбутамол) в максимальных разовых дозах для достижения максимально возможной бронходилатации.
В результате бронходилатационный ответ варьировал в зависимости от критериев
его оценки (прирост ОФВ, на >12% и на >200 мл; прирост ОФВ, на >15% либо абсолютный прирост ОФВ, в процентах от должного на >10%) и выявлялся у 53,9; 65,6 и
38,6% больных соответственно, причем около половины больных с положительной
реакцией на бронходилататоры имели тяжелую ХОБЛ (III стадия по GOLD) [13, 14].
Число больных ХОБЛ с положительной реакцией объемных показателей (ФЖЕЛ,
ЖЕЛ) без значительной динамики потоковых параметров составило 5—49% в зависимости от критерия обратимости обструкции и стадии ХОБЛ.
Данное исследование подтвердило, что выражение «необратимая бронхиальная
обструкция», традиционно применяемое к ХОБЛ, нельзя понимать буквально, и обструкция обратима в той или иной степени почти у половины больных ХОБЛ. В то
же время полученные результаты носят исключительно исследовательский характер,
поскольку в клинической практике нецелесообразно стремиться к максимальной
бронходилатации при исследовании легочной функции, так как это сопряжено
прежде всего с повышением риска развития нежелательных эффектов от использования высоких доз препаратов. Помимо этого максимальная бронходилатация требует значительных затрат времени (около 2 ч в исследовании UPLIFT) и существенно увеличивает стоимость исследования [15].
66
Бронходилатационные и бронхоконстрикторные тесты
Рис. 2. Бронходилатационный тест у больных ХОБЛ. а - вариации обратимости бронхиальной обструкции, б — зависимость коэффициента бронходилатации (КБД) от исходной легочной функции, характеризуемой ОФВ,. (По Calverley et al. [16].)
Следует отметить, что «обратимость» может варьировать у одного и того же пациента в разные дни и быть как положительной, так и отрицательной; в работе [16]
процент пациентов, у которых обструкция была необратима, колебался от 58 до 62%
(рис. 2а). При этом выраженность бронходилатационной реакции существенно зависит от исходной легочной функции (рис. 26) [16].
Кроме того, у больных ХОБЛ при назначении бронходилататоров может отмечаться улучшение клинических симптомов заболевания без существенных изменений функции внешнего дыхания (ФВД) [7].
При положительной реакции на (32-агонист следует усилить бронходилатационную терапию. Улучшение бронхиальной проходимости в этом случае повысит доверие пациента к врачу и улучшит взаимопонимание, а строгое соблюдение предписаний врача в конечном счете поможет улучшить клиническое состояние пациента.
Бронхоконстрикторные тесты
Бронхиальная астма и ХОБЛ — наиболее частые диагнозы у пациентов с интрато-
ракальной обструкцией дыхательных путей [17]. Нередко у этих пациентов наблюдается значительная вариабельность степени обструкции, что указывает на повышенную чувствительность к окружающим раздражителям, приводящую к острому
бронхоспазму. Прогнозирование вероятной выраженности бронхоспазма, несомненно, представляет клинический интерес.
Вариабельность проходимости дыхательных путей можно оценить при помощи
бронхоконстрикторных (или провокационных; англ, challenge) тестов [18, 19]. Это
позволяет измерить степень так называемой восприимчивости дыхательных путей
(англ, airway responsiveness). Бронхиальная гипервосприимчивость определяется как
повышенная реакция на провоцирующий агент. Термин «гипервосприимчивость»
обобщает понятия гиперчувствительности (смещение кривой доза—эффект влево,
рис. За) и гиперреактивности (увеличение угла наклона кривой доза—эффект, построенной в ходе бронхоконстрикторного теста) (рис. 36).
67
Гпава 3
Метахолин, мг/мл
Метахолин, мг/мл
Рис. 3. Кривые доза—эффект, построенные в ходе провокационного теста. К - концентрация метахолина в мг/мл, по горизонтальной оси отложен логарифм К по основанию 2 и ниже показаны соответствующие значения К, по вертикальной оси - изменение ОФВ, в процентах от начального значения. 1 - кривые, характерные для здоровых людей, 2 - кривые при умеренной
бронхиальной гипервосприимчивости, 3 - кривые, характерные
для больных с выраженной гипервосприимчивостью дыхательных путей, а - смещение кривой доза—эффект влево, б — увеличение угла наклона кривой доза—эффект. (По Стандартизация
тестов исследования легочной функции // Пульмонология. 1993.
Прилож. С. 60.)
В настоящее время
бронхоконстриктор-
ные тесты широко
применяются в клинической практике. Разработаны международные рекомендации по
проведению этих тестов. Наиболее часто
используют провокации с фармакологическими веществами и
физическими раздражителями (гипо- или
гипертонические аэрозоли, холод, физическая нагрузка). Лучше
всего стандартизированы и наиболее безопасны фармакологические провокации с
метахолином и нагрузочные пробы. Поскольку бронхоконст-
рикторная реакция зависит от провоцирующего стимула, то
лучше отказаться от
термина «неспецифическая бронхиальная гипервосприимчивость»,
указывая стимул, вызвавший бронхоспазм.
Бронхиальная гипервосприимчивость —
комплексное физиологическое нарушение,
определяемое гетерогенностью механизмов
при БА [20] и ХОБЛ
[21]. Выявлена связь воспаления в дыхательных путях с тяжестью этих заболеваний.
Основной причиной гипервосприимчивости при БА чаще всего являются воспалительные изменения в гладкой мускулатуре, в то время как при ХОБЛ подчеркивается
важность геометрических или структурных изменений в формировании гипервосприимчивости. В любом случае наблюдаемый бронхоконстрикторный ответ будет более
значимым, если исходно имеется бронхиальная обструкция. Таким образом, бронхиальная гипервосприимчивость в ответ на провокационные стимулы, хотя и является
68
Бронходилатационные и бронхоконстрикторные тесты
основной характеристикой БА, включенной в ее определение в различных руководствах, тем не менее не считается синонимом БА, поскольку встречается и при других обструктивных заболеваниях, например ХОБЛ, муковисцидозе. Кроме того, у некоторых людей существует гипервосприимчивость дыхательных путей при отсутствии каких-либо респираторных симптомов (генетическая предрасположенность) [22].
У пациентов с нормальными показателями ОФВ, и ОФВ,/ЖЕЛ, но с эпизодами
диспноэ, непродуктивного кашля и хрипов в анамнезе бронхоконстрикторные тесты могут помочь в диагностике БА.
Показания для проведения бронхоконстрикторных тестов
Провокационные тесты позволяют выявить преходящую обструкцию дыхательных путей у тех пациентов, у которых ее нельзя подтвердить другим путем, что дает
возможность установить диагноз БА или исключить ее. Основными показаниями к
проведению бронхоконстрикторных тестов в повседневной клинической практике
являются:
• первичная диагностика БА, если спирография не позволяет установить диагноз;
• хронический малопродуктивный кашель;
• частые простудные заболевания, бронхиты;
• эпизоды затруднения дыхания при физической нагрузке или при контакте с холодным воздухом;
• экспертная оценка (по направлению из военкоматов, медико-социальных экспертных комиссий).
Эти тесты могут помочь при оценке тяжести течения и эффективности лечения
БА. Положительные результаты теста не являются дифференциально-диагностическим критерием БА и ХОБЛ [23]. Следовательно, при наличии обструкции дыхательных путей проведение провокационного теста не показано.
Таким образом, провокационные тесты показаны тем пациентам, у которых есть
типичные симптомы БА без другого подтверждения преходящей обструкции дыхательных путей (нормальные показатели спирометрии и отсутствие положительной
реакции в бронходилатационном тесте) [24, 25].
Противопоказания к проведению бронхоконстрикторных тестов
При соблюдении современных стандартов исследования бронхопровокационные тесты безопасны. Тем не менее существуют абсолютные противопоказания:
• ОФВ, <60% от должного, или < 1,0 л;
• аневризма аорты;
• инфаркт миокарда или инсульт в предшествующие 3 мес;
• неконтролируемая артериальная гипертензия (АД систолическое >200 мм рт. ст.
или АД диастолическое >100 мм рт. ст.).
Относительными противопоказаниями являются:
• ОФВ, <70% от должного, или <1,5 л;
• эпилепсия;
• беременность или кормление грудью.
В этих ситуациях необходимость проведения бронхопровокационного теста следует обсудить индивидуально с лечащим врачом.
Во время выполнения бронхоконстрикторных тестов необходимо соблюдать меры предосторожности: иметь в кабинете р?-агонисты и антихолинергические препа-
69
Гпава 3
Таблица 1. Лекарственные средства, снижающие бронхиальную гипервосприимчивость
Препарат
Период
отмены перед
исследованием
Короткодействующие ингаляционные бронхолитики
(сальбутамол, фенотерол и др.)
8ч
Ингаляционные бронходилататоры средней продолжительности действия
(ипратропий)
24 ч
Длительнодействующие (салметерол, формотерол, тиотропий)
48 ч
Короткодействующие пероральные теофиллины
12ч
Теофиллины средней продолжительности действия
24 ч
Пролонгированные теофиллины
48 ч
Таблетированные р9-агонисты обычной продолжительности действия
12ч
Пролонгированные р2-агонисты
24 ч
Кромогликат и содержащие его комбинированные препараты
8ч
Недокромил
48 ч
Ингибиторы лейкотриеновых рецепторов
24 ч
Антигистаминные препараты
3 сут
раты для устранения бронхоспазма, подводку кислорода, немедленно прекращать
ингаляцию бронхоконстрикторного вещества при появлении беспокоящих пациента симптомов (кашель, одышка и т.д.), наблюдать за пациентом в течение всего исследования, тщательно вентилировать кабинет либо пользоваться специальным
очистителем воздуха после завершения исследования.
В процессе тестирования возможно развитие нежелательных явлений: приступа
удушья, кашля, чувства нехватки воздуха, дистантных свистящих хрипов, головной
боли, головокружения. Симптомы, обусловленные бронхоспазмом, обычно легко
купируются ингаляционными р2-агонистами. Перед началом исследования пациент
должен быть проинформирован о возможных нежелательных эффектах.
Подготовка к исследованию
Дополнительно к противопоказаниям, упомянутым выше, при подготовке к исследованию следует обращать внимание на факторы, которые могут оказать влияние
Таблица 2. Факторы, повышающие бронхиаль-
ную гипервосприимчивость
Фактор
Длительность
действия
Воздействие аллергенов
окружающей среды
1-3 нед
Профессиональные
сенсибилизирующие вещества
1 мес
Респираторная инфекция
3-6 нед
Поллютанты воздуха
12ч
на конечный результат. Необходимо учитывать всю лекарственную терапию,
включая дозы и время приема препаратов. Многие лекарственные средства
способны снижать гипервосприимчивость бронхов, поэтому перед тестированием их следует отменять на период, соответствующий длительности их действия (табл. 1).
Кроме того, существуют факторы,
повышающие гипервосприимчивость
дыхательных путей (табл. 2).
70
Бронходилатационные и бронхоконстрикторные тесты
Влияние курения на бронхиальную гипервосприимчивость не доказано [26].
Возможно, существует краткосрочный острый эффект [27], поэтому пациента, как
правило, просят воздержаться от курения в течение нескольких часов до тестирования.
Бронхоконстрикторный тест с метахолином
В клинической практике более предпочтительны фармакологические провокационные тесты (чаще всего используют метахолин). Существуют различные методики доставки провоцирующего вещества в дыхательные пути: метод непрерывного
нормального дыхания в течение определенного периода времени и дозовый метод.
Первая методика проста, но не позволяет точно вычислить дозу ингалируемого вещества. Вторая требует использовать помимо небулайзера дозиметр, что позволяет
точно определить ингалируемую дозу. При проведении бронхоконстрикторного теста необходимо придерживаться следующего алгоритма: сначала проводится исходная спирометрия и оценивается ОФВ,. Если ОФВ, >70% от должного, то можно выполнять бронхоконстрикторный тест. В начале процедуры проводят ингаляцию физиологического раствора. Если падение ОФВ, превышает 10% от исходного, то
бронхоконстрикторный тест необходимо начинать с минимальной концентрации
метахолина. После ингаляции раствора с первой (минимальной — 0,03 мг/мл) концентрацией метахолина снова проводят спирометрию. Если ОФВ, снизился на 20%
и более от исходного значения, тест прекращают. Если ОФВ, снизился менее чем на
20% от исходного, то концентрацию метахолина увеличивают вдвое по сравнению с
предыдущей и вновь оценивают снижение ОФВ,. Если после ингаляции последней
(максимальной — 8 мг/мл) концентрации метахолина падение ОФВ, не достигло
20% от первоначального уровня, результат теста считают отрицательным. В противном случае тест прекращают при снижении ОФВ, на 20% и более от исходного. Концентрация (или доза) провоцирующего препарата, вызывающая снижение ОФВ, на
20% от исходного уровня, обозначается как ПК20 (или ПД20). Однако если у пациента имеются клинические симптомы БА и снижение ОФВ, составило 15—19% от исходного, то результат провокационного теста следует расценивать как сомнительный. В этом случае тест рекомендуется повторить через некоторое время.
Если два провокационных теста выполняются с интервалом в несколько часов,
бронхоконстрикторная реакция при повторном исследовании может быть меньше,
чем при первом, особенно если используют высокие дозы провоцирующего вещества [28, 29]. Если повторный тест проводили менее чем через 24 ч, то у лиц без БА может наблюдаться частичная толерантность к метахолину [29]; у пациентов с БА такая
толерантность не развивается [29, 30]. В приведенных работах толерантность к метахолину, возможно, была обусловлена более высокой кумулятивной дозой метахолина у людей без БА [29]. Тем не менее повторные тесты с метахолином рекомендуют
проводить с интервалом не менее 24 ч.
Падение ОФВ, характеризуется коэффициентом бронхоконстрикции (КБК) —
это относительное изменение ОФВ, в процентах от исходного значения (в некоторых клиниках предпочитают вычислять в процентах от значения после ингаляции
физиологического раствора) [19]:
КБК =
ОФВ, -ОФВ,
1 после 1исх
ОФВ
1исх
х 100%,
71
Гпава 3
0,03 0,06 0,13 0,25 0,5 1 2
Метахолин, мг/мл
Рис. 4. Расчет провокационной концентрации, вызывающей падение ОФВ, на 20%
(ПК20), методом линейной интерполяции
по кривой доза-эффект. В данном случае
предпоследняя концентрация (точка А) равна 0,5 мг/мл метахолина (падение ОФВ, составляет 13%), последняя концентрация
(точка В2) - 1,0 мг/мл метахолина (падение
ОФВ, составляет 25%), точка интерполяции
В, соответствует ПК20, равной 0,75 мг/мл метахолина. (По Стандартизация тестов исследования легочной функции // Пульмонология. 1993. Прилож. С. 60.)
терполяции В, получим для провокацио
ОФВ, на 20% (ПК20):
где ОФВ. — значение ОФВ, в мл по-
1 после 1
еле ингаляции метахолина, ОФВ,исх —
значение ОФВ, в мл до ингаляции физиологического раствора.
ПК20 (или ПД20) рассчитывают по
кривой доза-эффект методом линейной
интерполяции между двумя последними
точками кривой (рис. 4). По горизонтальной оси откладывается логарифм
концентрации (или дозы) по основанию
2 (log2K), по вертикальной оси - падение
ОФВ, в процентах от начального значения. Интерполяция производится между
предпоследней точкой А, которой соответствует падение ОФВ, <20%, и последней точкой В2, в которой падение ОФВ,
>20%. Точке В, (результату интерполяции) соответствует ПК20, т.е. падение
ОФВ, на 20%. Если обозначить концентрацию в точке А через К, и соответствующий процент падения ОФВ, через R,,
концентрацию в точке В2 через К2 и соответствующий процент падения ОФВ,
через R2, то согласно известным формулам линейной интерполяции в точке ин-
юй концентрации, вызывающей падение
log2nK20 = log2K, + (log2K2 - log2K,) x (20 - R,)/(R2 - R,),
0,03 0,06 0,13 0,25 0,5 1 2 0,03 0,06 0,13 0,25 0,5 1 2
Метахолин, мг/мл Метахолин, мг/мл
Рис. 5. Правильный и неправильный методы расчета ПК20. а - линейная интерполяция между точками А и В2 (правильное значение ПК20, соответствующее точке В,), б — метод линейной экстраполяции точек С2 и А (неправильное значение ПК*0, соответствующее точке С,).
Тест прекращают при падении ОФВ, >20% или после ингаляции максимальной концентрации метахолина. (По Стандартизация тестов исследования легочной функции // Пульмонология. 1993. Прилож. С. 60.)
72
Бронходилатационные и бронхоконстрикторные тесты
откуда
ПК20 = 2I,og2Ki + (,ое2к2 — 1оё2к1>х ^20 - Ri>/(R2 ~ Ri>I.
Современные приборы имеют программное обеспечение, которое автоматически рассчитывает ПК20, поэтому нет необходимости запоминать эти формулы. Не рекомендуется вычислять ПК20 методом экстраполяции (рис. 5).
После завершения бронхоконстрикторного теста больному проводят ингаляцию
Р2-агониста и через 15 мин повторно определяют ОФВр Пациент может покинуть
лабораторию, если ОФВ, восстановился не менее чем на 90% от исходного уровня.
Интерпретация результатов
Интерпретация результатов бронхоконстрикторного теста с метахолином представляет достаточно трудную задачу для врача. Верная трактовка результатов теста
основывается на изложенном ниже алгоритме и интуиции, которая появляется с
опытом работы. При анализе результатов у каждого пациента необходимо учитывать
многие факторы:
• вероятность БА до проведения провокационного теста с учетом симптомов БА;
• наличие и степень обструкции дыхательных путей до проведения теста;
• качество спирометрических маневров;
• результаты анкетного тестирования до проведения провокационного теста (если
проводили);
• симптомы пациента во время исследования;
• степень восстановления легочной функции после ингаляции бронхолитика в конце исследования;
• чувствительность и специфичность теста с метахолином;
• воспроизводимость теста.
Прежде чем приступить к интерпретации полученных данных, следует убедиться,
что тест с метахолином выполнен технически удовлетворительно и не было факторов, которые могли бы искусственно изменить восприимчивость дыхательных путей
(см. табл. 1 и 2). Сегодня не существует единого правила анализа результатов бронхопровокационного теста. Одно из достаточно употребительных правил основано на
том, что восприимчивость дыхательных путей — величина переменная и существует
частичный перекрест ПК20 у здоровых людей и у больных с бесспорной БА, т.е. имеется зона сомнительных результатов («пограничная»).
Как отмечалось ранее, наиболее частой причиной назначения провокационного
теста в клинической практике является оценка вероятности БА у больного, у которого диагноз предполагается на основании симптомов, но не является очевидным.
При этом необходимо сравнить вероятность БА до провокационного теста (исходная
вероятность) и после него (конечная вероятность). Вероятность БА после проведения провокационного теста учитывает и исходную вероятность, и результаты теста.
Таким образом, вклад провокационного теста — это выявление разницы между исходной и конечной вероятностями [31].
С эпидемиологической точки зрения исходная вероятность БА у конкретного
пациента равна распространенности БА в рандомизированной популяционной выборке (например, скрининговое обследование призывников для военной службы)
без учета истории болезни данного пациента. Распространенность БА в общей популяции относительно низкая — обычно около 5% [32—34], в таком случае и исход¬
73
Гпава 3
ная вероятность также
составит приблизительно 5%. Поэтому поло-
жител ьн ы й резул ьтат
провокационного теста
при ПК20 1 мг/мл существенно увеличивает
предполагаемую вероятность БА, поскольку
при такой исходной
вероятности наклон
кривой очень крутой
(рис. 6). Этот пример
показывает роль исходной вероятности при
определении конечной
вероятности БА.
При наличии у пациента симптомов, характерных для БА, исходная вероятность существенно выше, чем в популяции в целом, и
точно рассчитать ее намного сложней. Как
правило, исходная вероятность БА в клинической практике находится в диапазоне 30—70%. Результаты провокационного теста в такой ситуации могут дать полезную информацию. Например, если
исходная вероятность составляет 40% и ПК20 1 мг/мл, то конечная вероятность БА
очень высока и равна 96%; если ПК20 равна 4 мг/мл, то конечная вероятность — 80%;
если ПК20 — 16 мг/мл, то конечная вероятность — 12% (см. рис. 6). Этот пример демонстрирует, что в клинической практике при ПК20 >16 мг/мл БА можно исключить с высокой степенью достоверности. Если ПК20 находится в «пограничной» зоне (см. рис. 6),
то следует с осторожностью делать вывод о наличии БА. При этом возникновение во
время провокации симптомов, подобных тем, о которых пациент сообщал до проведения теста, существенно увеличивает вероятность БА. Считается, что тест наиболее информативен, если исходная вероятность равна 50% (в этом случае комбинация положительной и отрицательной прогностической значимости максимальная) [35].
При отсутствии у пациента симптомов БА (вероятность того, что такому пациенту будет назначен бронхоконстрикторный тест с метахолином, невысока) и ПК20
между 4 и 16 мг/мл возможны следующие варианты: 1) наличие легкой интермитти-
рующей БА, но пациент «слабо» воспринимает или недооценивает свои симптомы;
2) после ингаляции метахолина пациент испытывает сдавление в груди, но не расценивает это как патологию [36]; 3) пациент никогда не испытывал бронхоспазма;
4) легкая степень бронхиальной гипервосприимчивости вызвана вирусной инфекцией дыхательных путей, курением и т.п.; 5) наличие бессимптомной БА, клинические проявления которой появятся в будущем [37, 38]. Исследования показали, что
Вероятность БА до исследования
Рис. 6. Вероятность наличия БА у пациента до и после выполнения бронхоконстрикторного теста при ПК20, равной 1, 4, 8 и
16 мг/мл метахолина. Эти кривые отражают подход к интерпретации результатов и не предназначены для точного вычисления
вероятности БА у конкретного больного. Серым закрашена область сомнительных значений ПК2() («пограничная» зона). (По
Crapo et al. [26].)
74
Бронходилатационные и бронхоконстрикторные тесты
у 15-45% пациентов без симптомов БА, но с бронхиальной гипервосприимчивостью
через 2-3 года развивается клинически значимая БА [39, 40].
У больных с диагнозом БА существует тесная корреляция между степенью восприимчивости дыхательных путей и тяжестью БА, но она недостаточно сильная,
чтобы исходя из степени бронхиальной гипервосприимчивости определить тяжесть БА у конкретного пациента [32]. Воздействие факторов, вызывающих воспаление дыхательных путей, или эффекты последействия противовоспалительной
терапии могут изменить степень восприимчивости дыхательных путей в ту или
иную сторону таким образом, что ПК70 не будет соответствовать исходной тяжести БА.
Большие трудности в интерпретации результатов бронхопровокационного теста
возникают у больных с исходной обструкцией дыхательных путей и низкой ПК20
[26]. Например, у большинства пациентов с ХОБЛ и у курильщиков с обструктивными нарушениями легочной вентиляции имеется бронхиальная гипервосприимчивость, но отсутствуют значимая реакция на бронходилататор и клинические симптомы БА [41, 42]. Еще более трудно интерпретировать динамику ПК2() при повторных
бронхопровокационных тестах, когда исходная легочная функция изменилась, что
достаточно часто встречается на фоне лечения.
При интерпретации результатов применяют и другой метод, который игнорирует возможность изменения восприимчивости дыхательных путей, вероятность «сомнительного» диагноза БА и отсутствие «золотого стандарта» для ее клинической
диагностики. Суть этого популярного метода — это выбор альтернативы: 1) бронхиальная гипервосприимчивость есть или отсутствует; 2) БА есть или отсутствует;
3) существует «золотой стандарт» диагностики БА. В этом случае оценивают чувствительность (доля (или процент) пациентов с болезнью (БА), у которых тест положительный) и специфичность (доля пациентов без БА, у которых тест отрицательный) провокационного теста. С помощью ROC-анализа определена пороговая
точка («пограничная» концентрация), позволяющая разграничить положительный
и отрицательный результаты (наличие или отсутствие БА), которая находится в диапазоне 8-16 мг/мл метахолина [26, 35]. Наиболее часто в качестве «пограничной»
концентрации применяют 8 мг/мл метахолина. Таким образом, тест с метахолином
считается положительным, если ПК20 <8 мг/мл, и отрицательным, если ПК
>8 мг/мл.
Этот метод может приводить к ложноположительным результатам в диагнос-
20
тике БА, т.е. когда ПК2() оказывается
<8 мг/мл у пациента без БА. При обследовании широкой популяции, включающей пациентов с аллергическим ринитом
и курильщиков с ХОБЛ, процент ложноположительных результатов относительно высокий, поэтому провокационный
тест в популяции в целом имеет слабую
положительную прогностическую значимость [26]. Приблизительно у 30% пациентов, страдающих аллергическим ринитом, но не имеющих БА, ПК2() попадает в
Таблица 3. Определение гипервосприимчивости дыхательных путей
пк20,
мг/мл
Интерпретация
>16
Нормальная бронхиальная
восприимчивость
4-16
Пограничные значения
бронхиальной восприимчивости
<4
Бронхиальная гипервосприимчивость
Примечание. Этот алгоритм применим в случаях,
когда отсутствует исходная обструкция дыхательных путей; спирометрия выполнена технически
удовлетворительно и ОФВ, полностью восстановился после исследования.
75
Гпава 3
«пограничные» значения [43, 44], поэтому ATS рекомендует расширить «пограничный» диапазон от 4 до 16 мг/мл (табл. 3), что позволит повысить специфичность теста [26]. Снизить частоту ложноположительных результатов также помогает учет исходной вероятности БА.
При ложноотрицательных результатах теста у пациента с БА ПК20 будет
>8—16 мг/мл. Ложноотрицательные результаты встречаются намного реже ложноположительных. В клинической практике (исходная вероятность БА находится в
диапазоне 30—70%) отрицательная прогностическая значимость провокационного
теста составляет более 90% [45, 46], поэтому большинство существующих рекомендаций гласят, что отрицательный результат провокационного теста обоснованно
исключает БА у пациентов, имевших симптомы, подозрительные в отношении этого заболевания в течение предыдущих 2 нед. При исключении БА по результатам
теста с метахолином необходимо учитывать следующие факторы: 1) восприимчивость дыхательных путей, возможно, была подавлена предшествующей интенсивной противовоспалительной терапией. Эта проблема, скорее всего, неактуальна,
если у пациента на фоне лечения сохраняются симптомы БА; 2) симптомы БА отсутствуют, поскольку прекратилось воздействие аллергенов окружающей среды
(например, закончился период цветения) [47, 48]; 3) наличие профессиональной
БА, когда пациент реагирует на определенный производственный аллерген или химический сенсибилизатор [49, 50].
При интерпретации результатов повторных исследований необходимо учитывать воспроизводимость теста. При повторении провокационного теста в течение 1—8 нед у пациента с БА в клинически стабильном состоянии воспроизводимость достаточно высока: 95% доверительный интервал для повторных измерений
ПК20 равен удвоенной дозе, т.е. достоверным считается увеличение либо уменьшение ПК20 более чем в 2 раза (стандарты). Так, если первоначальная ПК20 равна
4 мг/мл, то при повторной провокации метахолином через 2 нед в 95% случаев при
той же степени бронхиальной гипервосприимчивости ПК20 может измениться от 2
до 8 мг/мл.
Кроме того, при повторных исследованиях следует учитывать факторы, влияющие на восприимчивость дыхательных путей (это позволит улучшить воспроизводимость результатов). К таким факторам относятся аллергены и химические сенсибилизаторы (в значительной степени влияют на восприимчивость дыхательных путей),
инфекции дыхательных путей (умеренное влияние), изменения проводимости дыхательных путей (незначительное влияние) и изменения лекарственной терапии БА
(степень влияния может быть различной).
Выраженность гипервосприимчивости дыхательных путей оценивают по показателю ПК2(). Если в качестве провоцирующего агента был использован метахолина хлорид, то при ПК20, равной 0,25 мг/мл или ниже, говорят о тяжелой степени
гипервосприимчивости дыхательных путей. Если ПК20 находится в пределах
0,25-2 мг/мл, то гипервосприимчивость дыхательных путей средняя. При ПК20 от
2 до 8 мг/мл гипервосприимчивость имеет легкую степень.
Бронхоконстрикторный тест с физической нагрузкой
В клинической практике также часто используют бронхоконстрикторные тесты с
физической нагрузкой. Известно, что нагрузка является фактором, провоцирующим приступ удушья у 70—80% больных БА. В клинических ситуациях нагрузочные
76
Бронходилатационные и бронхоконстрикторные тесты
тесты не очень чувствительны, но достаточно специфичны для диагностики БА,
особенно у детей.
Нагрузку следует давать в течение 6—8 мин. Постоянно следует мониторировать
число сердечных сокращений, а при обследовании пациентов старше 40 лет следует
регистрировать электрокардиограмму на протяжении всего теста и в течение 5 мин
после его завершения. В ходе теста строится кривая время—эффект. Тест считается
положительным при падении ОФВ, более чем на 15% от исходного. Как и при проведении фармакологической провокации, после завершения теста с нагрузкой пациенту необходимо провести ингаляцию бронходилататора и добиться восстановления легочной функции (ОФВ, не менее 90% от исходного уровня).
Клинические случаи
Клинический случай 1
Мужчина 29 лет. Рост 185 см, масса тела 78 кг, индекс массы тела 22,8 кг/м2. Никогда не курил. Десять лет назад была диагностирована БА. Однако пациент не получал базисной терапии, а периодически (при необходимости) пользовался только
короткодействующими (32-агонистами. При первичном осмотре жалобы на приступы сухого кашля и затрудненного дыхания днем и по ночам. При аускультации выслушивались сухие свистящие хрипы на выдохе с обеих сторон. На рентгенограмме
не выявлено очаговых и инфильтративных изменений в легочной ткани.
Результаты спирометрии представлены в табл. 4.
Исходная спирометрия выявляет обструктивные нарушения вентиляционной
способности легких, на что указывает снижение ОФВ,/ФЖЕЛ до 63%. ФЖЕЛ в пределах возрастной нормы (94% от должной). Выраженность обструктивных нарушений легкой степени, поскольку ОФВ, составляет 70,4% от должного. Отмечается генерализованное снижение скорости выдоха. Кривая поток—объем указывает на то,
что потеряна значительная доля нормальной площади под кривой и у пациента имеется ограничение легочной вентиляции по обструктивному типу (рис. 7).
Через 15 мин после ингаляции 400 мкг сальбутамола абсолютный прирост ОФВ,
составил 780 мл (4,02-3,24 = 0,78 л), а коэффициент бронходилатации (КБД) 24%
Таблица 4. Результаты спирометрического исследования (клинический случай 1)
Показатель
До ингаляции
сальбутамола
После
ингаляции
сальбутамола
Показатель
До ингаляции
сальбутамола
После
ингаляции
сальбутамола
ФЖЕЛ, л
5,17(94)
5,48 (99)
МОС50, л/с
2,23 (39)
3,61 (63)
(% от должной)
(% от должной)
ОФВ,, л
3,24 (70)
4,02 (87)
МОС75, л/с
0,56(21)
1,30 (48)
(% от должного)
(% от должной)
ОФВ,/ФЖЕЛ, %
63
73
ПОСвыд.л/с
9,68 (95)
10,13(99)
СОС25 75, л/с
1,61 (32)
3,01 (60)
(% ОТ должной)
(% от должного)
АЕХ, л л/с
14,83 (47)
21,66 (68)
МОС25, л/с
4,47 (51)
6,36 (73)
(% от должной)
(% от должной)
Время выдоха, с
9,12
6,07
Обозначения: АЕХ - площадь под экспираторной кривой поток-объем.
77
Гпава 3
Выдох — До ингаляции
Рис. 7. Кривые поток-объем. Вогнутый характер нисходящего колена кривых пациента
указывает на наличие обструктивных нарушений. Расположение нисходящей части
кривой пациента под должной означает наличие ограничения легочной вентиляции.
После ингаляции сальбутамола отмечается
существенное увеличение как скорости выдоха (по оси ординат), так и объема легких
(по оси абсцисс).
Рис. 8. Кривые поток—объем. Линейность
нисходящей части кривой поток—объем в
дистальном отделе нарушена: она становится
вогнутой. После ингаляции сальбутамола отмечается небольшое увеличение скорости
выдоха.
((4,02—3,24)/3,24 х 100%). Таким образом, абсолютный прирост превышает 200 мл,
относительный прирост более 12%, следовательно, проба с сальбутамолом (400 мкг)
положительная. Выраженная бронходилатация при исходной обструкции легкой
степени характерна для больных с неадекватным контролем БА.
Клинический случай 2
Мужчина 38 лет. Рост 186 см, масса тела 115 кг, индекс массы тела 33,2 кг/м2.
Никогда не курил. Музыкант-виолончелист. Имеет доказанную гиперчувствительность к бытовым (домашняя и библиотечная пыль) аллергенам. Общий IgE равен
151,5 МЕ/мл (норма 0—130). Наследственность отягощена по БА. В течение последних 4 лет наблюдается в НИИ пульмонологии по поводу БА, получает базисную терапию. При контрольном осмотре был назначен бронходилатационный тест,
результаты которого представлены в табл. 5.
Исходная спирометрия выявляет обструктивные нарушения легочной вентиляции,
на что указывает снижение отношения ОФВ,/ФЖЕЛ до 72%. ФЖЕЛ не снижена и
составляет 108% от должной. Степень обструктивных нарушений легкая, поскольку
ОФВ, составляет 95% от должного. Отмечается снижение скорости воздушных потоков на уровне 75% выдоха ФЖЕЛ. Изменение формы экспираторной кривой поток-объем (рис. 8) и снижение скоростных показателей, измеренных при низких легочных объемах (СОС25 75, МОС75), являются ранним признаком обструкции дыхательных путей.
После ингаляции 400 мкг сальбутамола абсолютный прирост ОФВ, составил
400 мл (4,60 - 4,20 = 0,40 л), КБД равен 9,5% ((4,60 - 4,20)/4,20 х 100%). Таким образом, абсолютный прирост составляет более 200 мл, однако относительный при-
78
Бронходилатационные и бронхоконстрикторные тесты
Таблица 5. Результаты спирометрического исследования (клинический случай 2)
Показатель
До ингаляции
сальбутамола
После
ингаляции
сальбутамола
Показатель
До ингаляции
сальбутамола
После
ингаляции
сальбутамола
ФЖЕЛ, л
5,87 (108)
6,25(116)
МОС50, л/с
3,97 (72)
4,39 (79)
i% от должной)
(% от должной)
ОФВ,, л
4,20 (95)
4,60 (104)
МОС75, л/с
0,95 (37)
1,26 (49)
(% от должного)
(% от должной)
ОФВ,/ФЖЕЛ, %
72
74
П0С„ыд’ Л/С
11,81 (118)
12,60 (122)
СОС25_75, л/с
2,75 (58)
3,35 (71)
(% от должной)
(% от должного)
АЕХ, л л/с
25,15 (84)
28,75 (96)
МОС25, л/с
6,65 (77)
7,70 (89)
(% от должной)
(% от должной)
Время выдоха, с
13,22
12,60
Таблица 6. Результаты спирометрического исследования (клинический случай 3)
Показатель
До ингаляции
сальбутамола
После
ингаляции
сальбутамола
Показатель
До ингаляции
сальбутамола
После
ингаляции
сальбутамола
ФЖЕЛ, л
3,36 (102)
3,38 (102)
МОС50, л/с
0,54(14)
0,86 (23)
(% от должной)
(% от должной)
ОФВ,, л
1,58 (61)
1,81 (70)
МОС75, л/с
0,14(12)
0,15(12)
(% от должного)
(% от должной)
ОФВ,/ФЖЕЛ, %
47
54
П0С,ЬШ’ Л/С
4,86 (67)
5,28 (72)
СОС25_75, л/с
0,38(12)
0,53(17)
(% от должной)
(% от должного)
АЕХ, л л/с
4,01 (32)
4,87 (39)
МОС25, л/с
1,57 (24)
1,96(30)
(% от должной)
(% от должной)
Время выдоха, с
19,68
15,29
рост не превышает 12%, следовательно, положительной реакции на ингаляцию
400 мкг сальбутамола не выявлено. В заключении желательно не писать «бронходилатационная проба отрицательная», поскольку в другие дни реакция может быть и
положительной. У этого же пациента неоднократно наблюдалась положительная
реакция на сальбутамол. Отсутствие достоверного прироста может свидетельствовать об адекватной базисной терапии.
Клинический случай 3
Мужчина 65 лет, курит в течение 42 лет не менее 20 сигарет в день, жалуется на
надсадный малопродуктивный кашель, особенно по утрам, и одышку при физической нагрузке. При аускультации выявлялось небольшое ослабление дыхания с обеих
сторон, рассеянные сухие хрипы на выдохе. Результаты, полученные при исследовании ФВД, приведены в табл. 6.
Исходная спирометрия выявляет обструктивные нарушения вентиляционной способности легких, на что указывает снижение отношения ОФВ,/ФЖЕЛ до 47%. ФЖЕЛ
не снижена и составляет 102% от должной. Обструктивные нарушения умеренно выражены (ОФВ1 составляет 61% от должного), но носят генерализованный характер
(рис. 9). После ингаляции бронхолитика абсолютный прирост ОФВ, составил
79
Глава 3
Выдох
Рис. 9. Кривые поток—объем. Вогнутый характер нисходящего колена кривой указывает на наличие обструктивных нарушений.
Расположение большей части кривой выдоха
пациента под должной означает наличие
ограничения легочной вентиляции. После
ингаляции сальбутамола происходит увеличение скорости выдоха.
230 мл (1,81 - 1,58 = 0,23 л), а КБД -
14,6% ((1,81 - 1,58)/1,58 х 100%), т.е. проба с сальбутамолом (400 мкг) положительная. Несмотря на то что пациенту
был поставлен диагноз ХОБЛ, обструкция оказалась обратимой, следовательно,
у этого пациента регулярный прием
бронхолитических средств может привести к клиническому улучшению. Но даже
отсутствие существенной динамики
бронхиальной проходимости после однократной ингаляции бронхолитика во время лабораторного исследования не исключает клинической эффективности
бронхолитической терапии у больных
ХОБЛ.
Приведенные примеры показывают,
что у больных БА и ХОБЛ результаты
бронходилатационного теста могут быть
как положительными, так и отрицательными. Бронходилатационный тест без
проведения других исследований не позволяет четко дифференцировать эти заболевания.
Выдох
(а)
(б)
Рис. 10. Спирометрия и провокационный тест с метахолином, а — исходная кривая поток-объем, нормальная форма кривой, б — кривая доза—эффект, построенная в ходе провокационного теста с метахолином; гиперчувствительность дыхательных путей легкой степени,
при ингаляции сальбутамола практически восстанавливается исходный ОФВ,.
80
Бронходилатационные и бронхоконстрикторные тесты
Таблица 7. Результаты спирометрического исследования (клинический случай 4)
Показатель
Исходно
Физиологический
раствор
Раствор метахолина хлорида
После
БД
2 мг/мл
4 мг/мл
8 мг/мл
ФЖЕЛ, % от должной
107
ОФВ,, % от должного
П6
И6
ПО
100
87
113
ОФВ,, л
5,08
5,08
4,84
4,41
3,84
4,97
ОФВ,/ФЖЕЛ, %
91
СОС25_75, % от должного
ИЗ
МОС25, % от должной
137
МОС50, % от должной
П6
МОС75, % от должной
П4
ПОСвыд, % от должной
132
Обозначения: БД - бронходилатация (ингаляция 200 мкг сальбутамола).
Клинический случай 4
Пациент 18 лет (рост 177 см, масса тела 74 кг), обратился с жалобами на приступообразный непродуктивный кашель в ночное время, сопровождаемый дистантными свистящими хрипами. При физикальном обследовании и рентгенологическом
исследовании не было выявлено никаких отклонений от нормы. При проведении
спирометрии показатели легочной вентиляции в норме (табл. 7, рис. 10а), бронходилатационный тест с 400 мкг сальбутамола отрицательный. Для исключения БА рекомендовано проведение провокационного теста с метахолином.
Исходно не выявлено нарушений легочной вентиляции, ОФВ, составлял 116% от
должного и не снизился после ингаляции физиологического раствора, поэтому первая ингалируемая концентрация метахолина составила 2 мг/мл. На представленном
графике (рис. 106) видно, что падение ОФВ, после ингаляции 2 мг/мл метахолина
составило 4,7%, после ингаляции 4 мг/мл метахолина - 13,2% и лишь после ингаляции раствора метахолина с концентрацией 8 мг/мл падение ОФВ, составило 24,4%
(более 20%), в связи с чем тест был прекращен.
Сделано заключение о том, что в бронхопровокационном тесте с метахолином выявлена гиперчувствительность дыхательных путей легкой степени (ПК2() = 6,1 мг/мл
метахолина хлорида).
Заключение
Бронхоконстрикторные тесты позволяют выявить наличие бронхиальной гипервосприимчивости и оценить ее степень тяжести. Отличительной чертой гипервосприимчивости дыхательных путей при БА является ее присутствие даже при исходно нормальной легочной функции, благодаря чему при наличии клинических симптомов и положительного ответа на бронхоконстриктор можно с высокой долей вероятности диагностировать БА.
Список литературы
1. Guyatt G.H., Townsend М., Nogradi S. et al. Acute response to bronchodilator, an imperfect guide for bron-
chodilator therapy in chronic airflow limitation//Arch. Intern. Med. 1988. V. 148. P. 1949-1952.
81
Гпава 3
2. Pellegrino R., Viegi G., Brusasco V. et al. Interpretative strategies for lung function tests. Series «ATS/ERS
task force: standardisation of lung function testing» // Eur. Respir. J. 2005. V. 26. P. 948-968.
3. Brand P.L., Quanjer Ph.H., Postma D.S. et al. Interpretation of bronchodilator response in patients with
obstructive airways disease // Thorax. 1992. V. 47. P. 429-436.
4. Eliasson O., Degraff A.C. Jr. The use of criteria for reversibility and obstruction to define patient groups for
bronchodilator trials: influence of clinical diagnosis, spirometric and anthropometric values // Amer. Rev.
Respir. Dis. 1985. V. 132. P. 858-864.
5. Черняк A.B., Науменко Ж.К., Неклюдова Г.В. и др. Этапы исследования респираторной функции:
Пособие для врачей. М., 2005.
6. Pellegrino R., Rodarte J.R., Brusasco V. Assessing the reversibility of airway obstruction // Chest. 1998.
V. 114. P. 1607-1612.
7. Черняк A.B., Авдеев C.H., Пашкова Т.Л., Айсанов З.Р. Бронходилатационный тест у больных с хронической обструктивной болезнью легких // Пульмонология. 2003. № 1. С. 51-56.
8. Belman M.J., Botnick W.C., Shin J.W. Inhaled bronchodilators reduce dynamic hyperinflation during exercise in patients with chronic obstructive pulmonary disease // Amer. J. Respir. Crit. Care Med. 1996. V. 153.
P. 967-975.
9. O’Donnell D.E., Lam M., Webb K.A. Spirometric correlates of improvement in exercise performance after
anticholinergic therapy in chronic obstructive pulmonary disease // Amer. J. Respir. Crit. Care Med. 1999.
V. 160. P. 542-549.
10. Cerveri I., Pellegrino R., Dore R. et al. Mechanisms for isolated volume response to a bronchodilator in
patients with COPD // J. Appl. Physiol. 2000. V. 88. P. 1989-1995.
11. Wang Y.T., Thompson L.M., Ingenito E.P., Ingram R.H. Jr. Effects of increasing doses of (3-agonists on airway and parenchymal hysteresis//J. Appl. Physiol. 1990. V. 68. P. 363-368.
12. Dales R.E., Spitzer W.O., Tousignant P. et al. Clinical interpretation of airway response to a bronchodilator:
epidemiologic considerations//Amer. Rev. Respir. Dis. 1988. V. 138. P. 317-320.
13. Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for Diagnosis, Management, and
Prevention of COPD. Bethesda, 2006.
14. Tashkin D.P, Celli B., Decramer M. et al. Bronchodilator responsiveness in patients with COPD // Eur.
Respir. J. 2008. V. 31. № 4. P. 742-750.
15. Soriano J.B., Mannino D.M. Reversing concepts on COPD irreversibility // Eur. Respir. J. 2008. V. 312.
P. 695-696.
16. Calverley PM.A., Burge PS., Spencer S. et al. Bronchodilator reversibility testing in chronic obstructive pulmonary disease // Thorax. 2003. V. 58. P. 659-664.
17. American Thoracis Society. Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease (COPD) and asthma//Amer. Rev. Respir. Dis. 1987. V. 136. P. 225-244.
18. Eiser N.M., Kerrebijn K.F., Quanjer Ph.H. Guidelines for standardization of bronchial challenges with
(non-specific) bronchoconstricting agents // Bull. Eur. Physiopathol. Respir. 1983. V. 19. P. 495-514.
19. Sterk P.J., Fabbri L.M., Quanjer Ph.H. et al. Airway responsiveness // Eur. Respir. J. 1993. V. 6. Suppl. 6.
P. 55-64.
20. Barnes PJ. New concepts in the pathogenesis of bronchial responsiveness and asthma // J. Allergy Clin.
Immunol. 1989. V. 83. P. 1013-1026.
21. O’Connor G.T., Sparrow D., Weis S.T. The role of allergy and nonspecific airway hyperresponsiveness in the
pathogenesis of chronic obstructive pulmonary disease //Amer. Rev. Respir. Dis. 1989. V. 140. P. 225-252.
22. Paoletti P, Viegi G., Carrozzi L. Bronchial hyperresponsiveness, genetic predisposition and environmental
factors: importance of epidemiological research // Eur. Respir. J. 1992. V. 5. P 910-912.
23. Brand P.L., Postma D.S., Kerstjens H.A., Koeter G.H. Relationship of airway hyperresponsiveness to respiratory symptoms and diurnal peak flow variation in patients with obstructive lung disease. The Dutch
CNSLD Study Group//Amer. Rev. Respir. Dis. 1991. V. 143. P.916-921.
24. Britton J. Is hyperreactivity the same as asthma? // Eur. Respir. J. 1988. V. 1. P. 478-479.
25. Britton J. Airway hyperresponsiveness and the clinical diagnosis of asthma: histamine or history // J. Allergy
Clin. Immunol. 1992. V. 89. P. 19-22.
26. Crapo R.O., Casaburi R., Coates A.L. et al. Guidelines for methacholine and exercise challenge testing-
1999. This official statement of the American Thoracic Society was adopted by the ATS Board of Directors,
July 1999//Amer. J. Respir. Crit. Care Med. 2000. V. 161. № 1. P. 309-329.
27. Jensen E.J., Dahl R., Steffensen F. Bronchial reactivity to cigarette smoke in smokers: repeatability, relationship to methacholine reactivity, smoking, and atopy // Eur. Respir. J. 1998. V. 11. P. 670-676.
28. Manning P.J., Jones G.L., O’Byrne P.M. Tachyphylaxis to inhaled histamine in asthmatic subjects //J. Appl.
Physiol. 1987. V. 63. P. 1572-1577.
82
Бронходилатационные и бронхоконстрикторные тесты
29. Beckett W.S., Marenberg М.Е., Расе Р.Е. Repeated methacholine challenge produces tolerance in normal
but not in asthmatic subjects // Chest. 1992. V. 102. P. 775-779.
30. Stevens W.H., Manning P.J., Watson R.M., O’Byrne PM. Tachyphylaxis to inhaled methacholine in normal
but not asthmatic subjects //J. Appl. Physiol. 1990. V. 69. P. 875-879.
31. Gilbert R.. Auchincloss J.H. Post-test probability of asthma following methacholine challenge // Chest.
1990. V. 97. P.562-565.
32. Woolcock A.J., Peat J.K., Salome C.M. et al. Prevalence of bronchial hyperresponsiveness and asthma in a
rural adult population //Thorax. 1987. V. 42. P. 361-368.
33. Lebowitz M.D., Spinaci S. The epidemiology of asthma // Eur. Respir. Rev. 1993. V. 3. P. 415-423.
34. Weiss K.B., Gergen P.J., Hodgson Т.А. An economic evaluation of asthma in the United States // N. Engl.
J. Med. 1992. V. 326. P.862-866.
35. Perpina M., Pellicer C., de Diego A. et al. Diagnostic value of the bronchial provocation test with methacholine in asthma: Bayesian analysis approach // Chest. 1993. V. 104. P. 149-154.
36. Salome C.M., Xuan X., Gray E.J. et al. Perception of airway narrowing in a general population sample //
Eur. Respir. J. 1997. V. 10. P. 1052-1058.
37. Hopp R.J., Townley R.G., Biven R.E. et al. The presence of airway reactivity before the development of asthma//Amer. Rev. Respir. Dis. 1990. V. 141. P. 2-8.
38. Jansen D.F., Timens W., Kraan J. et al. (A)symptomatic bronchial hyper-responsiveness and asthma //
Respir. Med. 1997. V. 91. P. 121-134.
39. Zhong N.S., Chen R.C., Yang M.O. et al. Is asymptomatic bronchial hyperresponsiveness an indication of
potential asthma? A two year follow-up of young students with bronchial hyperresponsiveness // Chest. 1992.
V. 102. P. 1104-1109.
40. Laprise C.. Boulet L.P. Asymptomatic airway hyperresponsiveness: a three year follow-up // Amer. J. Respir.
Crit. Care Med. 1997. V. 156. P. 403-409.
41. Tashkin D.P., Altose M.D., Bleecker E.R. et al. |and the Lung Health Research Group]. The Lung Health
Study: airway responsiveness to inhaled methacholine in smokers with mild to moderate airflow limitation //
Amer. Rev. Respir. Dis. 1992. V. 145. P. 301—310.
42. Greenspon L.W., Gracely E. A discriminant analysis applied to methacholine bronchoprovocation testing
improves classification of patients as normal, asthma or COPD//Chest. 1992. V. 102. P. 1419-1425.
43. Fish J.E., Kelley J.F. Measurements of responsiveness in bronchoprovocation testing // J. Allergy Clin.
Immunol. 1979. V. 64. P. 592-596.
44. Townley R.G., Ryo U.Y., Kolotkin B.M., Kang B. Bronchial sensitivity to methacholine in current and former asthmatics and allergic rhinitis patients and control subjects // J. Allergy Clin. Immunol. 1975. V. 56.
P. 429-442.
45. Cockcroft D.W., Murdock K.Y., Berscheid B.A., Gore B.P. Sensitivity and specificity of histamine PC-20
determination in a random selection of young college students // J. Allergy Clin. Immunol. 1992. V. 89.
P. 23-30.
46. Nieminen M.M. Unimodal distribution of bronchial hyperresponsiveness to methacholine in asthmatic
patients//Chest. 1992. V. 102. P. 1537-1543.
47. Boulet L.P, Cartier A., Thomson N.C. et al. Asthma and increases in nonallergic bronchial responsiveness
from seasonal pollen exposure //J. Allergy Clin. Immunol. 1983. V. 71. P. 399-406.
48. Platts-Mills T.A., Tovey E.R., Mitchell E.B. et al. Reduction of bronchial hyperreactivity during prolonged
allergen avoidance // Lancet. 1982. V. 2. P. 675-678.
49. Hargreave F.E., Ramsale E.H., Pugsley S.O. Occupational asthma without bronchial hypo-responsiveness//
Amer. Rev. Respir. Dis. 1984. V. 130. P. 513—515.
50. Banks D.E.. Sastre J., Butcher B.T. et al. Role of inhalation challenge testing in the diagnosis of isocyanate-
induced asthma // Chest. 1989. V. 95. P. 414-423.
83
Цветные иллюстрации к главе 2
Рис. 9. Перфузионная сдинтиграфия легких:
резкое снижение перфузии в нижней доле левого легкого, а — передняя проекция, б — левая
боковая проекция.
Гпава 4
Диффузионная
способность легких
Исследование диффузионной способности легких — наиболее часто используемый в клинической практике функционально-диагностический тест после спирометрии. Это исследование позволяет судить, насколько легкие справляются со своей
основной функцией переноса кислорода из атмосферного воздуха в кровь. Способность легких транспортировать газ через альвеолярно-капиллярный барьер определяется их структурными и функциональными свойствами [1]. Структурные свойства
включают объем газа в легких; длину пути в газовой фазе, толщину и площадь альвеолярно-капиллярной мембраны, любые изменения, влияющие на просвет (закрытие) дыхательных путей, объем капиллярной крови, поступающей к вентилируемым
альвеолам. Функциональные свойства включают: объемы вентиляции и кровотока в
легких; вентиляционно-перфузионное отношение; состав альвеолярного газа; диффузионные характеристики мембраны; концентрацию гемоглобина (НЬ) в альвеолярных капиллярах и его способность связываться с газом; парциальное давление газа в крови, поступающей в альвеолярные капилляры, где происходит газообмен.
В европейских странах предпочитают использовать термин «фактор переноса»
(«трансфер-фактор») вместо термина «диффузионная способность легких», который
применяют в странах Северной Америки [2, 3]. Это связано с тем, что на результаты
исследования оказывают влияние многие факторы, а не только процесс диффузии.
Кроме того, измерение проводят, как правило, в состоянии покоя, тогда как результат существенно зависит от скорости метаболизма. Таким образом, измеренная величина не является максимальной и не может быть истинной «способностью». Однако термин «диффузионная способность легких» традиционно используют в России, поэтому в этой главе мы также будем применять его и обозначать как DL. В рекомендациях ERS и ATS 2005 г., учитывая историческое значение термина, также
использовали обозначение DL [1].
Физиологические основы
измерения диффузионной способности легких
Процесс переноса кислорода из вдыхаемого воздуха в капиллярную кровь легких
включает: 1) поступление газа в дыхательные пути и альвеолярное пространство;
2) смешивание и диффузию газа в альвеолярных протоках, воздушных мешочках и
альвеолах; 3) перенос газа через альвеолярно-капиллярную мембрану; 4) смешивание
и диффузию газа в легочной паренхиме и плазме альвеолярных капилляров; 5) диффузию через мембрану эритроцита; 6) химическую реакцию связывания с НЬ [1—5].
Кислород и углекислый газ более растворимы в крови, чем в жидкости, выстилающей альвеолярно-капиллярную мембрану, и имеют высокое сродство к гемоглобину [6]. Но присутствие этих газов в венозной крови не позволяет использовать их для
84
Диффузионная способность легких
Альвеолярный
воздух
РадСО —
X
со
Капиллярная
кровь
РакапСО * О
Рис. 1. Схема переноса оксида углерода из
альвеолярного воздуха в кровь легочных капилляров.
определения диффузионной способности. Благодаря своим характеристикам
для оценки диффузии больше подходит
оксид углерода (СО; синонимы — окись
углерода, угарный газ, монооксид углерода). Концентрация СО слабо зависит
от сердечного выброса (сродство НЬ к СО
очень высокое - в 210 раз выше, чем к
кислороду), оксид углерода растворим в
крови, и его концентрация в капиллярной крови ничтожна, так что можно принять ее равной нулю и точно вычислить
так называемое движущее давление [6].
При связывании большого количества НЬ с СО развиваются токсические эффекты,
но во вдыхаемом воздухе концентрация СО невысока, поэтому тест является безопасным. Таким образом, при исследовании диффузионной способности легких оценивают захватывание (потребление) СО кровью из альвеолярного воздуха и называют
эту характеристику «диффузионная способность легких по оксиду углерода» (DLco).
Потребление СО упрощенно можно охарактеризовать двумя процессами: диффузией СО через альвеолярно-капиллярную мембрану, проводимость которой (DM)
отражает диффузионные свойства мембраны, и соединение СО с гемоглобином.
Скорость процесса определяется: 1) площадью поверхности для диффузии; 2) расстоянием, которое должна преодолеть молекула газа; 3) коэффициентом растворимости газа в жидкости; 4) градиентом парциального давления СО между альвеолярным воздухом и капиллярной кровью (движущее давление - the driving pressure:
АРаСО = РаАСО — РакапСО); 5) плотностью газа (рис. 1). Учитывая, что парциальное
давление СО в капиллярах очень мало (Ра„ СО « 0), АРаСО = РадСО — Ра„ СО ~
= РаАСО. Таким образом, DM снижается при увеличении объема интерстициальной и
внутриальвеолярной жидкости, фибротических изменениях ткани, нарушении вен-
тиляционно-перфузионного отношения, легочной эмболии и снижении вентиляции.
Соединение СО и НЬ зависит от скорости химической реакции CO-НЬ (О) и объема крови альвеолярных капилляров (Vc), что может быть выражено следующей
формулой [1]:
0
Многие физиологические процессы могут изменять DM или 0 х Vc, а следовательно, и DLco. При наполнении легких происходит увеличение DM вследствие растяжения мембраны и увеличения площади поверхности, тогда как изменения Vc могут быть различными (в связи с особенностями растяжения и сдавления альвеолярных и экстраальвеолярных капилляров). Итогом является увеличение DL при наполнении легких [2]. Нагрузка, горизонтальное положение тела и маневр Мюллера
(инспираторные усилия при закрытой голосовой щели) могут приводить к увеличению количества функционирующих альвеолярных капилляров и их просвета, увеличивая Vc и DLco [7—9]. Возникновение кровотока через ранее нефункционирующие
альвеолярные капилляры наблюдается после резекции легких, когда сердечный вы-
85
Гпава 4
Таблица 1. Физиологические и патологические изменения, влияющие на диффузионную способ-
ность легких по оксиду углерода (DLco)
Снижение DLco
Повышение
Внелегочные состояния с уменьшением наполнения
легких (снижение VA), влияющие на DM или О х Vc
• сниженное усилие или слабость дыхательных мышц
• деформация грудной клетки, не позволяющая сделать полный вдох
Болезни и состояния, которые уменьшают 0 х Vc
• анемия
• легочная эмболия
• изменение связывания гемоглобина (например, кар-
боксигемоглобин)
• маневр Вальсальвы (приводит к увеличению внутри-
грудного давления)
Легочная патология, которая уменьшает (в разной степени) DM или 0 х V.
• резекция легких (при этом, однако, 0 х Vc компенсаторно увеличивается)
• эмфизема
• интерстициальные заболевания легких
• отек легких
• легочный васкулит
• легочная артериальная гипертензия
Болезни и состояния, которые увеличивают 0 х Vc
• полицитемия
• шунт слева направо
• легочное кровотечение (не увеличивает 0 х Vc, но повышает концентрацию гемоглобина в легких)
• бронхиальная астма
• изменение связывания гемоглобина
(например, уменьшение Fi02)
• маневр Мюллера (приводит к снижению внутригрудного давления)
• нагрузка (также возможно влияние на
• горизонтальное положение тела (возможно также небольшое увеличение
DM)
• ожирение (также возможно влияние
HaDM)
Обозначения: Fi02 - фракция кислорода во вдыхаемой смеси.
брос распределяется в оставшейся ткани легких. Поэтому после операции Vc снижается гораздо в меньшей степени, чем можно было бы предположить, учитывая объем удаленной ткани. Напротив, маневр Вальсальвы (экспираторные усилия при закрытой голосовой шел и) может уменьшить Vc и DL [9].
На потребление СО также оказывает влияние распределение вентиляции (потребление СО может быть измерено только в тех ацинусах, в которые молекулы СО
попали во время вдоха, а на выдохе были удалены). Это особенно важно при заболеваниях с неравномерной вентиляцией легких (эмфизема), когда вдыхаемый СО может попасть только в вентилируемые отделы легких, и измеренное потребление СО
будет определяться, главным образом, потреблением в этих отделах. В таких условиях разведение индикаторного газа, используемого для вычисления альвеолярного
объема (VA) и общей емкости легких (OEJlsb, определяется методом однократного
вдоха с задержкой дыхания — single-breath), тоже отражает в первую очередь региональное разведение и недооценивает истинный объем легких. Таким образом, следует учитывать, что расчетная итоговая DL прежде всего отражает газообмен в вентилируемых отделах легких.
Помимо этого на DM и/или 0 х Vc, а следовательно, и на DL(,() могут влиять многие патологические состояния (табл. 1) [1].
При исследовании диффузионной способности легких для вычисления DL
умножают удельное (т.е. рассчитанное на единицу движущего давления) потребление СО в единицу времени в легких (Ксо) на объем, в котором содержится СО (аль¬
86
Диффузионная способность легких
веолярный объем — VA). Полученная величина определяет полное потребление СО
в легких за единицу времени из расчета на единицу движущего давления. Математически это можно выразить следующей формулой:
Dlco = ^СО Х
При этом Ксо измеряется как падение концентрации альвеолярного СО (Д[СО])
за единицу времени из расчета на единицу ДРаСО (движущего давления для СО), которое, как показано выше, практически совпадает с парциальным альвеолярным
давлением СО (РадСО):
Ксо = A[CO]/(At х РаАСО).
Показания и противопоказания
к исследованию DLco
Измерение DL необходимо для подтверждения или исключения любого из патологических процессов, влияющих на перенос газа из альвеолярного воздуха в
кровь (см. табл. 1). Кроме того, динамика DL помогает контролировать течение таких заболеваний.
Основные показания к проведению диффузионного теста [10|:
• диагностика и динамическое наблюдение при паренхиматозных легочных заболеваниях;
• диагностика и динамическое наблюдение при эмфиземе легких, а также дифференциальная диагностика эмфиземы с хроническим бронхитом и БА у больных с
обструктивными нарушениями;
• диагностика и оценка тяжести сосудистых заболеваний малого круга кровообращения (первичная легочная гипертензия, острые и повторные тромбоэмболии,
отек легких);
• диагностика вовлечения в патологический процесс легких при системных заболеваниях (ревматоидный артрит, системная красная волчанка);
• выявление нежелательных эффектов лекарственных препаратов (например, ами-
одарон, блеомицин), которые могут вызывать легочные нарушения, и химиотерапии;
• диагностика легочных геморрагий.
Абсолютные противопоказания и побочные эффекты диффузионного теста отсутствуют. К относительным противопоказаниям относят:
• отравление угарным газом;
• опасно низкий уровень насыщения гемоглобина кислородом при дыхании комнатным воздухом;
• обильную еду или энергичные физические упражнения непосредственно перед
исследованием;
• курение менее чем за 2 ч до исследования.
Методика измерения DLco
В клинической практике существуют различные методики измерения диффузионной способности легких по СО [11 — 14]. Наиболее известными из них являются: ме-
87
Гпава 4
Таблица 2. Критерии правильного измерения диффузионной способности легких по оксиду углерода
Для получения достоверных результатов следует тщательно контролировать качество оборудования и методику измерения.
Объем вдоха должен быть более 85% от измеренной максимальной ЖЕЛ (полученной или при
форсированной спирометрии, или при измерении статических легочных объемов).
Длительность вдоха не должна превышать 4 с*.
Длительность задержки дыхания должна составлять 10 ± 2 с. При задержке дыхания не должно
быть признаков утечки газа, значительного повышения или снижения внутригрудного давления
(маневра Вальсальвы или Мюллера).
Длительность выдоха не должна превышать 4 с (необходимая длительность забора выдыхаемого
воздуха для анализа менее 3 с)* при адекватных объемах мертвого пространства (не анализируются) и объемах забора альвеолярного газа (анализируются).
* Измерения с временными отклонениями могут иметь клиническое значение, но отклонения от принятых стандартов должны быть отражены в протоколе с учетом возможных факторов воздействия и способов коррекции.
тод возвратного дыхания (rebreathing techniques); метод устойчивого состояния
(steady-state); метод однократного вдоха без задержки дыхания (intra-breath) и метод
однократного вдоха с задержкой дыхания (single-breath). Последний является наиболее распространенным в мировой практике [1—3, 6]. Впервые DLco была измерена методом однократного вдоха с задержкой дыхания Марией и Августом Крог (Marie
Krogh, August Krogh) в 1914 г. [12]. R.E. Forster et al. модифицировали методику Крог
и использовали во вдыхаемой смеси инертный газ гелий, что позволило измерить
объем легких [15]. Методику продолжали совершенствовать, меняя длительность задержки дыхания, внося коррекцию по гемоглобину и карбоксигемоглобину и т.д., что
улучшало качество результатов. ATS и ERS рекомендуют метод однократного вдоха с
задержкой дыхания как наиболее предпочтительный тест, поскольку он является самым надежным, доступным и хорошо стандартизированным (табл. 2) [1—3].
ERS рекомендует выражать DLco в единицах СИ (ммоль мин-1 кПА-1), в то время как ATS предпочитает традиционные единицы измерения — мл мин-1 мм рт. ст.-1
(объем измеряют в условиях STPD: стандартные температура (0°С) и давление
(760 мм рт. ст.), сухой газ (без водяных паров). Различия в единицах измерения не
представляют существенной проблемы, поскольку при всех повторных исследованиях в каждой лаборатории используются одни и те же единицы. Чтобы перевести
единицы СИ в традиционные единицы измерения, следует умножить их на 2,987.
Время задержки дыхания и его расчет важны для получения точных и воспроизводимых результатов. Согласно первоначальной методике, предложенной
С.М. Ogilvie et al. [16], время задержки дыхания отсчитывалось от начала вдыхания
смеси газов до начала сбора пробы выдыхаемого воздуха. Это приводило к завышению показателя DLc() у пациентов с ограничением воздушного потока, поскольку реальное время контакта газа с поверхностью альвеол было больше. Предпочтительнее
использовать методику Джонса-Мида (R.S. Jones, F.A. Meade) [17], которая учитывает 70% времени вдоха и 50% времени сбора пробы и в любых ситуациях дает более
точный результат DLco (рис. 2). После задержки дыхания пациент делает быстрый
выдох. Первая порция выдыхаемого газа (воздух из проводящей зоны дыхательных
88
Диффузионная способность легких
Задержка дыхания =8 с
Рис. 2. Схематическое изображение маневра измерения диффузионной способности легких
по оксиду углерода методом однократного вдоха с задержкой дыхания. На высоте вдоха следует задержать дыхание примерно на 8 с. Эффективное время задержки дыхания больше и
должно составлять 10 ± 2 с. (По Jones & Meade [17].)
путей, или объем мертвого пространства) не анализируется, после чего забирается
проба для расчета разведения инертного газа и потребления СО. Как правило, объем первой порции составляет 0,75—1,0 л (измерение в условиях BTPS: температура
тела (37°С), окружающее давление и полное насыщение водяными парами). У пациентов с ЖЕЛ менее 2 л этот объем можно уменьшить до 0,5 л. Объем газа, забираемого для анализа, определяется техническими характеристиками оборудования и
обычно составляет 0,5—1,0 л. Если ЖЕЛ менее 1 л, то объем для анализа может быть
менее 0,5 л (при условии, что не будет забираться газ из мертвого пространства).
Для итогового заключения необходимо рассчитать среднее значение как минимум двух приемлемых измерений, которые соответствуют критериям воспроизводимости (разница между значениями не должна превышать 3 мл мин-1 мм рт. ст.-1 (или
1 ммоль мин-1 кПА-1) или находиться в пределах 10% от максимального измеренного значения). В отличие от других показателей легочной функции при оценке диффузионной способности легких пользуются именно средним, а не максимальным
полученным значением, потому что результат подвержен влиянию в большей степени технических, а не физиологических факторов [2]. Не рекомендуется проводить
более пяти измерений во время одного исследования, поскольку после пяти измерений концентрация карбоксигемоглобина (СОНЬ) увеличивается примерно на 3,5%
[18], что приводит к уменьшению измеренной DLco примерно на 3—3,5% (см. ниже).
Интервал между измерениями должен быть не менее 4 мин; для пациентов с обструктивными заболеваниями органов дыхания интервал между измерениями следует
увеличить до 10 мин [1].
У больных с ограничением воздушного потока иногда трудно добиться быстрого
вдоха и выдоха. Это ведет к ошибкам и вариабельности результатов. Предварительное назначение бронходилататоров перед исследованием может уменьшить эти
89
Гпава 4
Прерывистый Прерывистый
Рис. 3. Основные ошибки при измерении диффузионной способности легких по оксиду углерода методом однократного вдоха с задержкой дыхания (пунктирные и штрихпунктирные линии). (По Macintyre et al. [ 1 j.)
ошибки (рис. 3). Однако следует помнить, что Р-агонисты могут увеличивать частоту сердечных сокращений и сердечный выброс и, таким образом, влиять на DLco [6].
На результат измерения DLco влияют многие физиологические факторы: возраст
(Dl уменьшается с возрастом), пол (DLco ниже у женщин), рост, концентрации гемоглобина и карбоксигемоглобина, объем легких, парциальное давление альвеолярного кислорода (Рад02), нагрузка (непосредственно после нагрузки DLc() повышается из-за увеличения объема легочного кровотока) и положение тела (DLcq выше в
положении лежа на спине, так как при этом увеличивается перфузия верхних долей
легких). Эти факторы необходимо учитывать при интерпретации потребления СО.
Чтобы гарантировать правильную интерпретацию результатов, ERS и ATS рекомендуют всегда делать коррекцию по концентрации гемоглобина/карбоксигемоглобина
иРаА02[1].
Коррекция по гемоглобину
Важным фактором транспорта СО является соединение СО с НЬ, поэтому величина DLc() зависит от концентрации гемоглобина [19, 20]. Для коррекции DLco по гемоглобину ERS и ATS [1] рекомендуют использовать формулы, предложенные Коутсом [21]:
должная Dk() коррсктированная нь = должная Dk.G х (1,7НЬ/( 10.22 + НЬ)),
где НЬ выражена в г/дл.
Эта формула применяется у мужчин и подростков, при этом по умолчанию в качестве должной концентрации НЬ используется величина 14,6 г/дл (9 ммоль/л веди-
90
Диффузионная способность легких
ницах СИ) - тогда численное значение корректирующего множителя равно 1. Таким
образом, у мужчин с гемоглобином выше 146 г/л после коррекции значение DLc() в
процентах от должного значения будет ниже. И наоборот, у мужчин с концентрацией гемоглобина ниже 146 г/л после коррекции значение DL в процентах от должного значения будет выше. Изменение НЬ на 1 г/дл приводит к соответствующему
изменению DLco примерно на 2,5% от должного значения.
У женщин и детей младше 15 лет должная концентрация гемоглобина по умолчанию равна 13,4 г/дл (8,26 ммоль/л в единицах СИ), и формула для коррекции будет
иной:
должная DLco коррсктировамная нь = Должная DLt0 х (1,7НЬ/(9,38 + НЬ)).
В итоговом протоколе обязательно следует представлять значение DL как до,
так и после коррекции [3].
Коррекция по карбоксигемоглобину
В большинстве лабораторий не измеряют концентрацию карбоксигемоглобина
(СОНЬ) и не пересчитывают измеренную DL((). В норме концентрация карбоксигемоглобина не превышает 1—2% [22|, однако сигаретный дым или профессиональный контакт с угарным газом может значительно повысить уровень СО в крови [23].
Чтобы избежать ложных результатов, связанных с внешним воздействием, следует
воздержаться от курения перед исследованием. Кроме того, концентрация карбоксигемоглобина может немного повыситься за счет вдыхания газовой смеси, содержащей СО, при исследовании DL . Frey et al. обнаружили, что после каждого измерения DLc() методом однократного вдоха с задержкой дыхания концентрация карбоксигемоглобина увеличивается примерно на 0,7% [18]. При повышении концентрации карбоксигемоглобина измеренная диффузионная способность снижается как
в результате увеличения остаточного парциального давления СО в крови (следовательно, уменьшается градиент парциального давления между альвеолярным воздухом и кровью), так и за счет уменьшения числа участков НЬ, доступных для соединения с СО [22, 23].
При коррекции Dl по карбоксигемоглобину ERS и ATS [1] рекомендуют учитывать, что каждое повышение концентрации карбоксигемоглобина на 1% приводит к снижению измеренной DL примерно на 0,8—1% [4, 5]. Для коррекции можно использовать следующую формулу:
должная DLto коррсктирова|1ная сонь = Должная DLc() х (102% - СОНЬ%)/ЮО%.
Таким образом, если концентрация карбоксигемоглобина ниже 2%, коррекция
не требуется (должные значения учитывают такой уровень СО в крови). При возрастании или подозрении на возрастание концентрации карбоксигемоглобина необходима коррекция результатов перед их интерпретацией.
Коррекция по парциальному давлению альвеолярного кислорода
Парциальное давление кислорода в легочных капиллярах РаА02 влияет на потребление СО и определяется, главным образом, парциальным давлением кислорода во
вдыхаемом воздухе (Ра,02). За нормальные значения принимают Рад02 = 100 мм рт. ст.
и Ра,02 = 150 мм рт. ст. (при дыхании атмосферным воздухом на уровне моря). При изменении парциального давления кислорода (оно повышается при ингаляции кисло¬
91
Гпава 4
рода или снижается при подъеме над уровнем моря) DLco изменяется примерно на
0,35% на 1 мм рт. ст. РаА02 (на 0,31% на 1 мм рт. ст. Ра,02) [24, 25]. Математические
формулы для коррекции DLc() выглядят следующим образом:
должная 0Ьсокорректированная Рал02 = должная DLa)/(l + 0,0035 х (РаА02 - 100))
или
должная Ок.окоррсктиро|)ашшя Ра|02 = должная DLa)/(l + 0,0031 х (Ра,02 - 150)).
Основные элементы интерпретации результатов
Должные значения и вариабельность
Как и другие функциональные параметры, измеренную DLc() сравнивают с должными значениями, полученными при обследовании здоровых добровольцев. Существует много работ, в которых предлагаются различные подходы к определению
должных значений DLa) [21, 26—29]. При выборе уравнений для расчета должных
значений следует отдавать предпочтение исследованиям с аналогичными методиками измерения и вычисления DLco и популяцией обследованных людей, при этом разница между должными и собственными измеренными значениями должна быть минимальной. Должное значение диффузионной способности легких составляет от 20
до 30 мл мин-1 мм рт. ст.-1, т.е. в норме за минуту переносится 20—30 мл СО в расчете
на 1 мм рт. ст. разницы парциального давления СО в альвеолярном воздухе и в крови.
Нормальное значение DLc() зависит от возраста (уменьшается с возрастом), пола
(ниже у женщин, чем у мужчин), роста (у лиц с высоким ростом DLa) выше). Кроме
того, DLcq зависит от объема вдыхаемого газа (чем меньше объем, тем ниже диффузионная способность).
Кроме единичного измерения и сравнения с должными значениями, с клинической точки зрения более важна оценка индивидуальных изменений DLa) в процессе
лечения или в течение какого-либо отрезка времени. При оценке диффузионной способности особое значение имеет вариабельность исследования, поскольку небольшие
ошибки при измерении инспираторных потоков или концентрации газов на выдохе
приводят к существенным отклонениям в значении DLcq. Было показано, что разброс
в результатах при повторных измерениях у здоровых добровольцев составляет =3% и
увеличивается до 4,0—4,4% у пациентов с нарушениями легочной вентиляции [30].
При повторном измерении DLco через год вариабельность увеличивается до 9% [31].
Классификация степени тяжести
Для оценки выраженности нарушений диффузионной способности легких в
большинстве случаев используют отклонение измеренной величины DLcq от должного значения (табл. 3). Диапазон нормальных значений для DLco и DLco/VA (при
использовании этого параметра) — это диапазон между 5-м и 95-м процентилями гистограммы должных значений.
Таблица 3. Степень снижения диффузионной способности легких (DLcq)
Степень тяжести
D^.Q, % от должной
Степень тяжести
D| , % от должной
Норма
Более НГН и менее ВГН
Средняя
40-60
Легкая
Более 60 и менее НГН
Тяжелая
Менее 40
92
Диффузионная способность легких
Интерпретация результатов
Для правильной интерпретации результатов измерения DL консенсус ERS и
ATS рекомендует учитывать показатели спирометрии и статических легочных объемов [32]. Например, при нормальных значениях скоростных показателей и легочных
объемов снижение DLcq может подтверждать диагноз анемии, легочных сосудистых
нарушений, начальных проявлений интерстициального заболевания легких или эмфиземы (рис. 4). При рестриктивных нарушениях нормальные значения DLco могут
быть следствием нейромышечной патологии или заболеваний грудной клетки, а
снижение DLcq - проявлением интерстициальных легочных заболеваний [32]. При
обструктивных нарушениях снижение DL может быть признаком эмфиземы [33]
или других заболеваний (например, лимфангиолейомиоматоза или облитерирующего бронхиолита) [34].
Важно скорректировать DLco по гемоглобину и карбоксигемоглобину, особенно
при подозрении на возможную токсичность лекарственных средств и при значительных изменениях концентрации гемоглобина (например, на фоне химиотерапии
у онкологических больных).
Обычно исследователя интересует снижение DLco, однако при некоторых клинически значимых состояниях диффузионная способность может повышаться [35]:
• БА: повышение DLc() вследствие более равномерного распределения легочного
кровотока;
Рис. 4. Упрощенный алгоритм интерпретации функциональных методов исследования. ЛСН -
легочные сосудистые нарушения, НМН - нейромышечные нарушения, ЗГК — заболевания
грудной клетки, ИЗЛП - интерстициальные заболевания легких и пневмониты. (По Pellegrino
et al. [32].)
93
Гпава 4
• выраженное ожирение: DL может повышаться у тучных больных, возможно, из-
за увеличения объема легочного кровотока;
• полицитемия: повышение DLco обусловлено увеличением количества эритроцитов;
• легочное кровотечение: при внутрилегочной геморрагии (например, при синдроме Гудпасчера) DLco может повышаться вследствие дополнительного соединения
гемоглобина в альвеолах с СО, что приводит к увеличению расчетного DLa);
• внутрисердечный шунт слева направо: повышение DL при наличии внутрисер-
дечного шунта слева направо связано с увеличением объема крови в легочных капиллярах;
• левожелудочковая недостаточность: повышение DLco связано с увеличением объема крови в легочных капиллярах.
Низкие показатели DLc() могут наблюдаться у пациентов с различными нарушениями легочной вентиляции и даже при их отсутствии: диффузионный тест может
быть первым функциональным тестом, при котором выявляются патологические
изменения. Изолированное снижение DL встречается при следующих состояниях:
• анемия: уменьшение концентрации гемоглобина в легочных капиллярах приводит
к уменьшению площади диффузионной поверхности;
• хроническая рецидивирующая легочная эмболия: множественные эмболы в ветвях легочной артерии, препятствуя кровотоку в альвеолярных капиллярах, уменьшают перфузионную площадь;
• заболевания соединительной ткани и васкулиты (например, склеродермия, ревматоидный артрит и системная красная волчанка): повреждение капиллярной
стенки увеличивает диффузионный барьер;
• первичная легочная гипертензия;
• ранние стадии интерстициальных заболеваний легких и эмфиземы (когда показатели спирометрии еще находятся в пределах нормы). Так, у больных с интерстициальными заболеваниями легких, подтвержденными в биопсийном материале, и
с нормальной рентгенограммой нарушение диффузионной способности было выявлено более чем в 70% случаев, тогда как снижение ЖЕЛ в 57% случаев, а снижение ОЕЛ только в 16% [36].
При наличии рестриктивных нарушений легочной вентиляции DL снижена
при следующих заболеваниях:
• редукция легочной ткани: при редукции небольшой части легких (например, доли) снижение DL(.Q не наблюдается, но будет иметь место при пульмонэктомии;
• идиопатический легочный фиброз: толщина альвеолярно-капиллярной мембраны увеличивается, и уменьшается объем легких;
• застойная сердечная недостаточность: пропотевание жидкости в интерстициальное пространство или в альвеолы приводит к увеличению диффузионного пути;
• асбестоз: накопление асбеста вызывает легочный фиброз;
• саркоидоз: при вовлечении легочной паренхимы в патологический процесс;
• альвеолиты или фиброзы, вызванные лекарственными препаратами (амиодарон,
блеомицин, метотрексат);
• гиперчувствительные пневмониты (например, «легкое фермера»);
• альвеолярные протеинозы: утолщение альвеолярно-капиллярной мембраны в результате заполнения альвеол фосфолипидами.
У больных с обструктивными нарушениями оценка DL помогает дифференцировать эмфизему и БА/хронический бронхит. Для диагностики эмфиземы диффузи¬
94
Диффузионная способность легких
онная способность легких является более информативной, чем легочная растяжимость [37], и сравнима в этом плане с компьютерной томографией легких [38]. Снижение DLcq у больных с обструктивными нарушениями может быть выявлено в следующих случаях:
• эмфизема: снижение общей площади альвеолярной поверхности и дисфункция
альвеолярной мембраны;
• бронхиальная обструкция, обусловленная опухолью: опухоль, обтурирующая
бронхиальный просвет, уменьшает объем легких и диффузионную площадь;
• лимфангиолейомиоматоз;
• гистиоцитоз X.
Кроме того, DLcq может снижаться по следующим причинам:
• у злостных курильщиков при высоком парциальном давлении оксида углерода в
крови снижается градиент парциального давления СО между альвеолярным газом
и кровью легочных капилляров, что приводит к снижению DL ;
• при беременности обычно происходит падение DLc() примерно на 15% [39].
Согласно представленной выше формуле для DLco (DLco = Ксо х VA), значение
Dl пропорционально величине альвеолярного объема VA: при увеличении VA DLc()
будет увеличиваться, и наоборот, при уменьшении VA DL будет снижаться. Поскольку величина Ксо зависит от многих параметров, зависимость между DLco и VA
нелинейна, причем отношение DLt() к VA заметно меньше, чем 1 : 1 [40—42]. Поэтому Dlco/Va или DLc()/OEJlsb не являются адекватными показателями диффузионной
способности легких, нормализованными по легочному объему. Тем не менее анализ
Dl и Dlco/Va может дать полезную информацию о патофизиологии заболевания.
Например, снижение DLc(), выраженное гораздо в меньшей степени, чем снижение
объема (низкая DLc(), но высокое DLcq/Va), позволяет предположить внелегочные
расстройства газообменной функции, такие как пульмонэктомия или ограничение
подвижности грудной клетки. В то же время снижение DLc(), выраженное гораздо в
большей степени, чем снижение объема (низкая DLco и низкое DLcq/Va), наблюдается при паренхиматозных нарушениях.
Исследование диффузионной способности легких позволяет измерить OEJlsb, но
оценивать таким способом ОЕЛ в клинической практике не рекомендуется, поскольку у пациентов с ограничением воздушного потока истинная ОЕЛ может быть значительно больше вследствие выраженной неравномерности распределения вдыхаемого
газа (см. главу 2, подраздел «Другие методы разведения»). Этот показатель можно
применять для оценки неравномерности легочной вентиляции: Roberts et al. показали, что ОЕЛьЬ/ОЕЛ >0,85 указывает на нормальное распределение вентиляции (если
ЖЕЛ^/ЖЕЛ^ *1 (ЖЕЛСП - ЖЕЛ, измеренная при спирометрии), а ОЕЛ измерена
методом разведения гелия) [43], а значительное превышение истинной ОЕЛ над
ОЕЛ^ свидетельствует о неравномерной вентиляции легких.
Клинические случаи
Клинический случай 1
Мужчина 56 лет, жалуется на выраженную одышку при минимальной физической нагрузке, кашель с мокротой. Из анамнеза: кашель с мокротой более 10 лет,
одышка при физической нагрузке около 5 лет. Курил 40 лет по 20—30 сигарет в день,
в течение года не курит.
95
Гпава 4
Выдох Время, с
Рис. 5. Функциональное исследование. Маневр форсированного выдоха. 1 — кривая поток-объем, 2 — спирограмма, 3 — должная кривая поток—объем. Резкое снижение скорости
экспираторного потока сразу после пика отражает ранний экспираторный коллапс дыхательных путей и свидетельствует о выраженных обструктивных нарушениях. Кривая смещена влево, что указывает на выраженную гиперинфляцию легких.
При аускультации в легких выслушивается ослабленное дыхание, небольшое количество рассеянных сухих свистящих хрипов на выдохе. Перкуторный звук с коробочным оттенком по всем полям. Частота дыхания 16 в 1 мин. Sa02 при дыхании атмосферным воздухом 95% в покое.
При функциональном исследовании получены следующие результаты (табл. 4).
При анализе спирометрических и бодиплетизмографических параметров выявлены обструктивные нарушения легочной вентиляции, на что указывает снижение
ОФВ,/ФЖЕЛ до 19% и увеличение ОЕЛ до 145% от должной. Обструктивные нарушения можно оценить как крайне тяжелые, поскольку ОФВ, составляет 14% от
Таблица 4. Результаты функционального исследования (клинический случай 1)
Параметр
Значение
Параметр
Значение
ФЖЕЛ, % от должной
56
ООЛ/О ЕЛ, %
70
ОФВ,, % от должного
14
DLco, % от должной
26,3
ОФВ,/ФЖЕЛ, %
19
DLco/Va, % от должного
28,6
ФОЕ, % от должной
229
НЬ, г/л
157
ЖЕЛ, % от должной
66
°кокор>%отдолжной
25,6
ОЕЛ, % от должной
ООЛ, % от должного
145
316
DkoKOp/Vv % ОТ должного
27,8
Обозначения: DLco - диффузионная способность легких по СО после коррекции по гемоглобину.
96
Диффузионная способность легких
должного. Отмечается генерализованное
снижение скорости выдоха. Кривая поток-объем свидетельствует о том, что
пациент потерял значительную долю
нормальной площади под кривой и имеет существенное ограничение легочной
вентиляции (рис. 5). Резкое снижение
скорости экспираторного потока сразу
после пика сменяется пологим участком
кривой, отражающим ранний экспираторный коллапс дыхательных путей.
Увеличение ФОЕ до 229% от должной Рис. 6. КТ грудной клетки. Эмфизема легких.
при наличии обструкции свидетельствует о гиперинфляции легких в покое, увеличение ООЛ до 316% от должного и его доли в общей емкости легких (70%) — о наличии «воздушных ловушек». ЖЕЛ снижена
до 66% от должной (следствие выраженных обструктивных нарушений).
Исследование диффузионной способности легких выявило выраженное снижение как DLc(), так и E)Lcq/Va (после коррекции по гемоглобину DLcq составляет
26% от должной, DLc()Kop/VA — 28% от должного). Такое сочетание бронхиальной
обструкции, гиперинфляции с «воздушными ловушками» и равного снижения обоих показателей диффузионной способности легких характерно для больных с эмфиземой.
Снижение диффузионной способности легких отразилось на газовом составе артериальной крови: у данного пациента выявлены гипоксемия (Ра02 64,6 мм рт. ст.),
гиперкапния (РаС02 46,9 мм рт. ст.), снижение pH до 7,37.
При компьютерной томографии в легочном «окне» определяются выраженные и
распространенные буллезные эмфизематозные изменения (рис. 6).
Таким образом, значительные нарушения структуры легких в виде распространенной эмфиземы нашли свое отражение в снижении диффузионной способности
легких на фоне выраженных обструктивных нарушений с изменением легочных
объемов.
Учитывая данные проведенных исследований, был поставлен диагноз: Хроническая обструктивная болезнь легких IV (крайне тяжелой) стадии, преимущественно
эмфизематозный вариант. Множественные буллы обоих легких. Хронический обструктивный бронхит. Хроническая дыхательная недостаточность III степени.
Клинический случай 2
Пациентка 47 лет, жалуется на одышку при умеренной физической нагрузке, кашель со скудной слизистой мокротой, слабость. Вредных привычек и контакта с неблагоприятными производственными факторами не было.
При аускультации в легких выслушивается жесткое дыхание по всем легочным
полям, обильная крепитация в нижних и средних отделах легких с обеих сторон, ин-
спираторные свистящие хрипы. Перкуторный звук легочный.
При функциональном исследовании получены следующие результаты (табл. 5).
Выявлены рестриктивные нарушения легочной вентиляции, на что указывает
повышение ОФВ,/ФЖЕЛ до 82% и снижение ОЕЛ и ЖЕЛ до 77 и 62% от должных
соответственно. Отмечается снижение скорости форсированного выдоха в средне-
97
Гпава 4
Таблица 5. Результаты функционального исследования (клинический случай 2)
Параметр
Значение
Параметр
Значение
ФЖЕЛ, % от должной
61
ОЕЛ, % от должной
77
ОФВ,, % от должного
57
ООЛ, % от должного
112
ОФВ,/ФЖЕЛ, %
82
ООЛ/ОЕЛ, %
41
СОС25_75, % от должного
43
DL , % от должной
12,2
МОС25, % от должной
78
DLco/Va, % от должного
21,1
МОС50, % от должной
59
НЬ, г/л
163
DLf nKon’ % ОТ ДОЛЖНОЙ
п,з
МОС75, % от должной
26
LCO кор7
D. „on/VA, % от должного
19,5
ФОЕ, % от должной
81
410 кор' А’
ЖЕЛ, % от должной
62
дистальном отделе кривой поток—объем (МОС50 составляет 58% от должной,
МОС75 — 26% от должной) (рис. 7). ОЕЛ снижена за счет уменьшения ЖЕЛ, ООЛ остается в пределах нормальных значений; т.е. произошло перераспределение структуры ОЕЛ. Такие функциональные изменения характерны для фиброза легких.
Выдох Время, с
Рис. 7. Функциональное исследование. Маневр форсированного выдоха. 1 — кривая поток-объем, 2 - спирограмма, 3 — должная кривая поток—объем. Кривая поток—объем сужена и размещается под должной кривой, указывая на существенное ограничение вентиляции.
98
Диффузионная способность легких
Диффузионный тест выявил выраженное снижение DL при одновременном снижении DLco/Va (после коррекции по гемоглобину DLco составляет 26%
от должной, DLcq/Va — 28% от должного), что характерно для паренхиматозных заболеваний легких.
При исследовании газового состава артериальной крови выявлена гипоксемия
(Ра02 52,3 мм рт. ст.), гиперкапния (РаС02
54,3 мм рт. ст.), снижение pH до 7,335.
Для подтверждения или исключения
паренхиматозного заболевания легких
было рекомендовано провести КТ органов грудной клетки, где были выявлены
признаки интерстициальных изменений
легких (рис. 8).
При иммунологическом анализе выявлено повышение альвеоломуцина (3EG5)
до 79,5 Ед (норма до 70).
Патогистологическое исследование открытой биопсии легких (рис. 9, см.
цветную вкладку нас. 181): деформация легочной ткани за счет выраженного фиброза с образованием микросот, выстланных однорядным кубическим эпителием. Данные изменения характерны для интерстициального легочного фиброза.
Учитывая данные проведенных исследований, был поставлен диагноз: Идиопатический фиброзирующий альвеолит (вариант: обычная интерстициальная пневмония), интерстициальный легочный фиброз, сотовое легкое, хроническая дыхательная недостаточность II степени.
Клинический случай 3
Больная 52 лет, жалуется на одышку при физической нагрузке, сухой кашель.
При аускультации в легких выслушивается равномерно ослабленное дыхание.
Результаты функционального исследования представлены в табл. 6.
Спирометрия и общая боди плетизмография не выявили нарушений легочной
вентиляции (ОФВ,/ФЖЕЛ, ОЕЛ и ЖЕЛ выше нижней границы нормы (рис. 10)).
Рис. 8. КТ органов грудной клетки. Признаки диффузного «матового стекла»; множественные полостные образования по всем легочным полям обоих легких до 1 см (преимущественно в заднебазальных отделах).
Таблица 6. Результаты функционального исследования (клинический случай 3)
Параметр
Значение
Параметр
Значение
ФЖЕЛ, % от должной
124
ООЛ/ОЕЛ, %
38
ОФВ,, % от должного
120
DLc(), % от должной
65,9
ОФВ/ФЖЕЛ, %
82
DLco/Va, % от должного
76,2
ФОЕ, % от должной
91
НЬ, г/л
132
ЖЕЛ, % от должной
126
01.шкор-%ОТДОЛЖНОЙ
66,2
ОЕЛ, % от должной
117
DL( OK(>p/VA’ ^ ОТ Д°лжн°гО
76,7
ООЛ, % от должного
119
99
Гпава 4
Выдох
Рис. 10. Функциональное исследование. Маневр форсированного выдоха. 1 - измеренная
кривая поток—объем, 2 — должная кривая. В дистальном отделе нисходящей части экспираторной кривой поток—объем отмечается нарушение линейности; у пожилых людей это может
быть вариантом нормы (с возрастом эластичность легочной ткани уменьшается, и скорость
выдоха снижается в большей степени, чем объем легких).
Рис. 11. КТ органов грудной клетки, а — легочное «окно»: узелковые изменения, б - медиастинальное «окно»: на уровне аортального «окна» определяется увеличение лимфоузлов пара-
аортальной группы до 1,3 см.
Диффузионный тест выявил снижение DLc() легкой степени при одновременном
незначительном снижении DL /VA (см. табл. 6). Снижение диффузионной способности легких, вероятно, обусловлено нарушением транспорта газа через альвеолярно-капиллярную мембрану. Такие изменения могут встречаться как при паренхиматозных заболеваниях легких, так и при вовлечении в патологический процесс легочных сосудов (при легочной гипертензии, ТЭЛА, легочных васкулитах).
Для уточнения состояния легочной паренхимы было рекомендовано провести
КТ органов грудной клетки. При КТ в легочном «окне» определяются узелковые изменения (нодулярный паттерн) (рис. 11а). В медиастинальном «окне» на уровне аортального «окна» видны увеличенные до 1,3 см лимфоузлы парааортальной группы
(рис. 116) и до 0,7 см - бифуркационной группы. Заключение: КТ-признаки сарко-
идоза легких II стадии и лимфаденопатии средостения.
100
Диффузионная способность легких
Рис. 13. ЭКГ. Отклонение электрической оси сердца вправо, признаки перегрузки правого
предсердия и правого желудочка.
Таким образом, снижение диффузионной способности легких явилось наиболее
ранним функциональным проявлением заболевания легких, в то время как легочные объемы и бронхиальная проходимость оставались неизмененными.
Для подтверждения диагноза была выполнена трансбронхиальная биопсия.
В ткани легких в стенке бронхиолы и периваскулярно выявлены несколько эпите-
лиоидноклеточных гранулем с гигантскими многоядерными клетками (рис. 12, см.
цветную вкладку на с. 181).
Учитывая результаты проведенных исследований, был поставлен диагноз сарко-
идоза легких и внутригрудных лимфоузлов II стадии.
Клинический случай 4
Женщина 43 лет, жалуется на одышку при умеренной физической нагрузке, сердцебиение, повышенную утомляемость, слабость.
При аускультации дыхание везикулярное, хрипы не выслушиваются, определяется систолический шум вдоль левого края грудины, акцент II тона над легочной артерией. Границы легких перкуторно не изменены.
На ЭКГ синусовый ритм, отклонение электрической оси сердца вправо, признаки перегрузки правого предсердия и правого желудочка (рис. 13).
На рентгенограмме органов грудной
клетки легочные поля прозрачные, легочный рисунок обеднен по периферии
легочных полей, корни легких расширены, в прямой проекции полевому контуру выбухает II дуга, тень сердца увеличена за счет правого желудочка (рис. 14).
При КТ органов грудной клетки выявлена дилатация ствола (рис. 15) и ветвей легочной артерии.
При эхокардиографии аорта не расширена, размеры левого предсердия и левого желудочка не увеличены, гипертрофии стенок левого желудочка не выявлено. Показатели насосной и сократительной функции миокарда левого желудочка
не изменены. Правые отделы сердца и
Рис. 14. Рентгенограмма органов грудной
клетки в прямой проекции: полевому контуру выбухает II дуга, тень сердца увеличена за
счет правого желудочка.
101
Гпава 4
ствол легочной артерии дилатированы.
При допплерэхокардиографии определяется систолическая регургитация III степени в полость правого предсердия; систолическое давление в легочной артерии
повышено (расчет по скорости трикуспидальной регургитации) до 128 мм рт. ст.
(рис. 16, см. цветную вкладку на с. 181).
Полученные при функциональном
исследовании результаты представлены
в табл. 7.
При анализе спирометрических и
бодиплетизмографических параметров
выявлены обструктивные нарушения
вентиляционной способности легких
(снижение ОФВуФЖЕЛ до 73%, ОЕЛ и
ЖЕЛ выше нижней границы нормы и
равны 126 и 119% от должных соответственно). Отмечается изолированное снижение скорости форсированного выдоха в дистальном отделе кривой поток—объем
(см. табл. 7). Обструктивные нарушения имеют легкую степень, поскольку ОФЕ^ составляет 114% от должного. Объемы легких находятся в пределах возрастной нормы.
Исследование диффузионной способности легких выявило легкое снижение как
DLco, так и DLco/Va (после коррекции по гемоглобину DLco кор составляет 66% от
должной, DLco KOp/VA - 48% от должного).
Учитывая практически нормальные показатели легочной вентиляции и снижение диффузионной способности легких при наличии клинических и инструментальных признаков высокой легочной гипертензии, было решено применить инвазивные методы диагностики (ангиопульмонография, катетеризация правых отделов
сердца) для исключения пороков сердца и тромбоэмболической формы легочной
гипертензии. При ангиопульмонографии обнаружено значительное расширение основного ствола легочной артерии и ее крупных ветвей, резкое сужение периферических ветвей легочных артерий с обеих сторон (синдром «обгоревшего дерева»); дан-
Таблица 7. Результаты функционального исследования (клинический случай 4)
Параметр
Значение
Параметр
Значение
ФЖЕЛ, % от должной
134
ЖЕЛ, % от должной
126
ОФВ,, % от должного
114
ОЕЛ, % от должной
119
ОФВ,/ФЖЕЛ, %
73
ООЛ, % от должного
106
COC25_7S, % от должного
65
ООЛ/ОЕЛ, %
29
MOC2V % от должной
105
DLco, % от должной
66
МОС5(), % от должной
73
DLco/Va, % от должного
48
МОС75, % от должной
51
НЬ, г/л
135
ПОСпыд, % от должной
95
°кокор- %0ТД°ЛЖН0Й
66
ФОЕ, % от должной
124
01сокор/УА-%ОТДОЛЖНОГО
48
Рис. 15. КТ органов грудной клетки, медиастинальное «окно»: выявлена дилатация
ствола легочной артерии до 4,2 см.
102
Диффузионная способность легких
ных за эмболию и пороки сердца не получено. При катетеризации правых отделов
сердца (термодилатационный катетер Свана—Ганца) систолическое давление в легочной артерии составило 130 мм рт. ст.; давление заклинивания в легочной артерии
9 мм рт. ст. (в норме до 12 мм рт. ст.).
Учитывая данные проведенных исследований, был поставлен диагноз идиопатической легочной гипертензии.
Заключение
Исследование диффузионной способности легких — хорошо воспроизводимый и
чувствительный тест, который применяется как для диагностики и выработки тактики лечения, так и для контроля эффективности лечения больных идиопатическим
фиброзирующим альвеолитом, саркоидозом и другими заболеваниями легочной паренхимы. При некоторых заболеваниях легочной паренхимы изменение диффузионной способности легких может быть единственным функциональным нарушением, выявляемым у больного.
Список литературы
1. Macintyre N., Crapo R.O., Viegi G. et al. Standardisation of the single-breath determination of carbon
monoxide uptake in the lung // Eur. Respir. J. 2005. V. 26. P. 720-735.
2. Cotes J.E., Chinn D..J, Quanjer P.H. et al. Standardization of the measurement of transfer factor (diffusing
capacity). Report working party standardization of lung function tests. European Community for Steel and
Coal // Eur. Respir. J. 1993. V. 6. Suppl. 16. P. 41-52.
3. American Thoracic Society. Single-breath carbon monoxide diffusing capacity (transfer factor).
Recommendations for a standard technique: 1995 update // Amer. J. Respir. Crit. Care Med. 1995. V. 152.
P. 2185-2198.
4. Comroe J.H. Jr. Pulmonary diffusing capacity for carbon monoxide (DL(o) // Amer. Rev. Respir. Dis. 1975.
V. 111. P 225-240.
5. Roughton F.J.W., Forster R.E. Relative importance of diffusion and chemical reaction rates in determining
rate of exchange of gases in the human lung, with special reference to true diffusing capacity of pulmonary
membrane and volume of blood in the lung capillaries // J. Appl. Physiol. 1957. V. 11. 290—302.
6. Wanger J. Single breath carbon monoxide diffusing capacity // Pulmonary Function Testing: a Practical
Approach. Philadelphia etc.: Lippincott Williams and Wilkins, 1992.
7. Huang Y.C., Helms M.J., MacIntyre N.R. Normal values for single exhalation diffusing capacity and pulmonary capillary blood flow in sitting, supine positions and during mild exercise // Chest. 1994. V. 105.
P. 501-508.
8. Cotes J.E., Snidal D.P, Shepard R.H. Effect of negative intra-alveolar pressure on pulmonary diffusing
capacity //J. Appl. Physiol. 1960. V. 15. P. 372-376.
9. Smith T.C., Rankin J. Pulmonary diffusing capacity and the capillary bed during Valsalva and Muller maneuvers//J. Appl. Physiol. 1969. V. 27. P. 826-833.
10. Черняк А.В., Науменко Ж.К., Неклюдова Г.В. и др. Этапы исследования респираторной функции:
Пособие для врачей. М., 2005.
11. Leathart G.L. Steady-state diffusing capacity determined by a simplified method // Thorax. 1962. V. 17.
P. 302-307.
12. Krogh M. The diffusion of gases through the lungs of man //J. Physiol. 1914. V. 49. P. 271-300.
13. Meyer M., Scheid P, RieplG.etal. Pulmonary diffusing capacities for C02 and CO measured by a rebreathing technique//J. Appl. Physiol. 1981. V. 51. P. 1643-1650.
14. Newth C.J.L., Cotton D.J., Nadel J.A. Pulmonary diffusing capacity measured at multiple intervals during
a single exhalation in man //J. Appl. Physiol. 1977. V. 43. P. 617-623.
15. Forster R.E., Fowler W.S., Bates D.V., van Lingen B. The absorption of carbon monoxide by the lungs during breath-holding//J. Clin. Invest. 1954. V. 33. P. 1135-1145.
16. Ogilvie C.M., Forster R.F., Blakemore W.S., Morton J.W. A standardized breath holding technique for the
clinical measurement of the diffusing capacity of the lung for carbon monoxide//J. Clin. Invest. 1957. V. 36.
P. 1-17.
103
Гпава 4
17. Jones R.S., Meade F. A theoretical and experimental analysis of anomalies in the estimation of pulmonary
diffusing capacity by the single breath method // Q. J. Exp. Physiol. Cogn. Med. Sci. 1961. V. 46. P. 131-143.
18. Frey T.M., Crapo R.O., Jensen R.L., Elliott C.G. Diurnal variation of the diffusing capacity of the lung: is it
real? //Amen Rev. Respir. Dis. 1987. V. 136. P. 1381-1384.
19. Viegi G., Baldi S., Begliomini E. et al. Single breath diffusing capacity for carbon monoxide: effects of
adjustment for inspired volume dead space, carbon dioxide, hemoglobin and carboxyhemoglobin //
Respiration. 1998. V. 65. P. 56-62.
20. Marrades R.M., DiazO., RocaJ.etal. Adjustment of DLco for hemoglobin concentration//Amer.J. Respir.
Crit. Care Med. 1997. V. 155. P. 236-241.
21. Cotes J.E. Lung Function: Assessment and Application in Medicine. 4th ed. Oxford: Blackwell Scientific
Publications, 1979. P. 203, 329.
22. Coburn R.F., Forster R.E., Kane P.B. Considerations of the physiological variables that determine the blood
carboxyhemoglobin concentration in man // J. Clin. Invest. 1965. V. 44. P. 1899—1910.
23. Viegi G., Paoletti P, Carrozzi L., Baldacci S. et al. CO diffusing capacity in a general population sample:
relationship with cigarette smoking and airflow obstruction // Respiration. 1993. V. 60. P. 155-161.
24. Kanner R.E., Crapo R.O. The relationship between alveolar oxygen tension and the single-breath carbon
monoxide diffusing capacity//Amer. Rev. Respir. Dis. 1986. V. 133. P. 676-678.
25. Gray C., Zamel N., Crapo R.O. Effect of a simulated 3,048 meter altitude on the single-breath transfer factor // Bull. Eur. Physiopath. Respir. 1986. V. 22. P. 429-431.
26. Crapo R.O., Morris A.H. Standardized single breath normal values for carbon monoxide diffusing capacity //
Amer. Rev. Respir. Dis. 1981. V. 123. P. 185-189.
27. Paoletti P, Viegi G., Pistelli G. et al. Reference equations for the single-breath diffusing capacity. A cross-
sectional analysis and effect of body size and age // Amer. Rev. Respir. Dis. 1985. V. 132. P. 806-813.
28. Knudson R.J., Kaltenborn W.T., Knudson D.E., Burrows B. The single-breath carbon monoxide diffusing
capacity. Reference equations derived from a healthy nonsmoking population and effects of hematocrit //
Amer. Rev. Respir. Dis. 1987. V. 135. P. 805-811.
29. Miller A., Thornton J.C., Warshaw R. et al. Single breath diffusing capacity in a representative sample of the
population of Michigan, a large industrial state. Predicted values, lower limits of normal, and frequencies of
abnormality by smoking history//Amer. Rev. Respir. Dis. 1983. V. 127. P. 270-277.
30. Punjabi N.M., Shade D., Patel A.M., Wise R.A. Measurement variability in single breath diffusing capacity
of the lung //Chest. 2003. V. 123. P. 1082-1089.
31. Hathaway E.H., Tashkin D.P., Simmons M.S. Intraindividual variability in serial measurements of DLt() and
alveolar volume over one year in eight healthy subjects using three independent measuring systems // Amer.
Rev. Respir. Dis. 1989. V. 140. P. 1818-1822.
32. Pellegrino R., Viegi G., Brusasco V. et al. Interpretative strategies for lung function tests // Eur. Respir. J.
2005. V. 26. P.511-522.
33. McLean A., Warren P.M., Gillooly M. et al. Microscopic and macroscopic measurements of emphysema:
relation to carbon monoxide gas transfer//Thorax. 1992. V. 47. P. 144-149.
34. Kitaichi M., Nishimura K., Itoh H., Izumi T. Pulmonary lymphangioleiomyomatosis: a report of 46 patients
including a clinicopathologic study of prognostic factors // Amer. J. Respir. Crit. Care Med. 1995. V. 151.
P. 527-533.
35. Айсанов З.Р, Черняк A.B., Калманова E.H. и др. Функциональные методы исследования. Респираторная медицина / Под ред. А.Г. Чучалина. М., 2007. С. 374—380.
36. Epler G.R., McLoud Т.С., Gaensler Е.А. et al. Normal chest roentgenograms in chronic diffuse infiltrative
lung disease // N. Engl. J. Med. 1978. V. 298. P. 934-939.
37. Morrison N.J., Abboud R.T., Ramadan F. et al. Comparison of single breath carbon monoxide diffusing
capacity and pressure-volume curves in detecting emphysema // Amer. Rev. Respir. Dis. 1989. V. 139.
P. 1179-1187.
38. Gould G.A., Redpath A.T., Ryan M. et al. Lung CT density correlates with measurements of airflow limitation and the diffusing capacity//Eur. Respir. J. 1991. V. 4. P. 141-146.
39. Hyatt R.E., Scanlon P.D., Nakamura M. Diffusion capacity of the lungs // Interpretation of Pulmonary
Function Test: a Practical Guide. Philadelphia etc.: Lippincott Williams and Wilkins, 2003.
40. Cotton D.J., Taher F., Mink J.T., Graham B.L. Effect of volume history on changes in DL SB-3EQ with
lung volume in normal subjects // J. Appl. Physiol. 1992. V. 73. P. 434-439.
41. Huang Y.-C., O’Brien S.R., MacIntyre N.R. Intrabreath diffusing capacity of the lung in healthy individuals at rest and during exercise // Chest. 2002. V. 122. P. 177-185.
42. Horstman M., Mertens F., Stam H. Transfer factor for carbon monoxide // Eur. Respir. Monograph. 2005.
V. 10. №31. P. 127-135.
43. Roberts C.M., McRae K.D., Seed W.A. Multiple breath and single breath helium dilution lung volumes as a
test of obstruction // Eur. Respir. J. 1990. V. 3. P. 515—520.
104
Цветные иллюстрации к главе 4
Рис. 9. Гистологическое исследование био- Рис. 12. Саркоидные гранулемы в стенке
птата легочной ткани. Интерстициальный бронхиолы и периваскулярно. Окраска гема-
легочный фиброз: микросоты, утолщение токсилином и эозином, х 100.
межальвеолярных перегородок с пролиферацией альвеолоцитов II типа. Окраска гематоксилином и эозином. х25.
* ы
р 108.62 mmHg
5.15 m s
р 105.97 mmHg
t F
-m-
Рис. 16. Эхокардиография, a — В-режим: дилатация правых отделов сердца, б — цветовая
допплерэхокардиография: выраженная трикуспидальная регургитация.
Оценка силы
дыхательных мышц
Дыхательные мышцы создают градиент давления между атмосферой и альвеолами, в результате чего создается поток воздуха и осуществляется альвеолярная вентиляция. Нарушение функции дыхательной мускулатуры влияет на работу дыхательной
помпы, приводя к развитию одышки, снижению переносимости физических нагрузок, ночной гиповентиляции, дыхательной недостаточности, гиперкапнии и даже к
необходимости проведения респираторной поддержки [1—3]. Несмотря на несомненную важность дыхательных мышц в патогенезе многих респираторных заболеваний
(например, обструктивных заболеваний легких), большинство клиницистов и специалистов по функциональной диагностике плохо знают методы оценки их функции.
Данная глава посвящена основным методам оценки функции дыхательных
мышц, которые могут применяться не только в специализированных лабораториях,
но и в клинической практике, в том числе у постели больного.
Анатомия и физиология дыхательных мышц
Дыхательные мышцы относятся к скелетной поперечно-полосатой мускулатуре и
по своему гистологическому строению практически не отличаются от других скелетных мышц, например мышц конечностей [4—6]. В зависимости от функции дыхательные мышцы делят на инспираторные (основные и вспомогательные) и экспираторные (рис. 1, см. цветную вкладку на с. 182). Основную инспираторную группу
мышц составляют: диафрагма, наружные межреберные и парастернальные (внутренние межхрящевые) мышцы, к вспомогательным относятся лестничные, грудиноключично-сосцевидные, трапециевидная, большая и малая грудинные мышцы.
Экспираторную группу составляют абдоминальные (внутренняя и наружная косые,
прямая и поперечная мышцы живота) и внутренние межреберные мышцы.
Диафрагма - куполообразная скелетная мышца, разделяющая грудную и брюшную полости. При сокращении диафрагмы органы брюшной полости смещаются
вниз и вперед и вертикальные размеры грудной полости возрастают. Кроме того, при
этом поднимаются и расходятся ребра, приводя к увеличению ее поперечного размера. При спокойном дыхании диафрагма является единственной активной инспи-
раторной мышцей и ее купол опускается примерно на 1 — 1,5 см. При глубоком форсированном дыхании, например при физической нагрузке, увеличивается амплитуда движений диафрагмы (экскурсия может достигать 10 см) и активизируются наружные межреберные и вспомогательные мышцы [7]. Из вспомогательных мышц у
человека наиболее значимыми являются лестничные и грудино-ключично-сосцевидные мышцы.
Наружные межреберные мышцы соединяют соседние ребра. Их волокна ориентированы наклонно вниз и вперед от верхнего к нижнему ребру. При сокращении этих
105
Гпава 5
мышц ребра поднимаются и смещаются вперед, что приводит к увеличению объема
грудной клетки в переднезаднем и боковом направлениях. Паралич межреберных
мышц не вызывает серьезных расстройств дыхания, поскольку диафрагма обеспечивает вентиляцию. Вклад диафрагмы в обеспечение вдоха у здорового человека составляет примерно 70% [8].
Лестничные и грудино-ключично-сосцевидные мышцы при спокойном дыхании практически не задействованы, однако при увеличении легочной вентиляции
могут очень интенсивно работать (рис. 2, см. цветную вкладку на с. 182). При их сокращении (лестничные мышцы поднимают два верхних ребра, а вместе с ними грудину и реберную клетку; грудино-ключично-сосцевидные — поднимают I ребро и
грудину) увеличивается объем грудной клетки, что вносит свой вклад в создание отрицательного внутригрудного давления, благодаря чему во время вдоха не происходит коллапса верхней части грудной клетки [9].
В отличие от вдоха выдох при спокойном дыхании происходит пассивно (см.
рис. 2). Легкие и грудная клетка обладают упругостью, и поэтому после активного
растяжения на вдохе они стремятся вернуться в прежнее положение. При физической нагрузке или у больных ХОБЛ, когда сопротивление дыхательных путей повышено, выдох становится активным. Наиболее важными и сильными экспираторными мышцами являются абдоминальные мышцы, образующие переднебоковую
стенку брюшной полости. При их сокращении повышается внутрибрюшное давление, диафрагма поднимается вверх, объем легких снижается, т.е. создается «запас»
эластичной энергии для облегчения последующего инспираторного усилия [10].
В активном выдохе также участвуют внутренние межреберные мышцы. При их
сокращении ребра опускаются и объем грудной клетки уменьшается. Помимо этого
сокращение этих мышц способствует укреплению межреберных промежутков; в
противном случае при напряжении мягкие ткани выпячивались бы через них. Кроме того, экспираторные дыхательные мышцы играют важнейшую роль в таких физиологических процессах, как чихание, кашель, рвота, дефекация.
Сила, развиваемая дыхательными мышцами во время их сокращения, зависит от
числа активированных волокон, частоты стимуляции, длины мышц во время стимуляции и степени свободы движения мышц. Все эти закономерности описываются соотношениями, общими для всех скелетных мышц: сила-частота, сила—длина и сила-скорость, при этом в контексте рассмотрения дыхательных мышц соотношение
сила—длина является наиболее важным. Другими словами, сила, развиваемая мышцами, является функцией длины. Максимальная сила достигается при оптимальной
длине мышцы (ее еще называют эффективной длиной покоя мышцы). Любые сокращения или растяжения мышцы, изменяющие эту длину, уменьшают мышечную силу.
Для дыхательных мышц изменение длины тесно связано с изменением объема легких.
Силу дыхательных мышц можно оценить опосредованно, измеряя создаваемое
ими давление. Оптимальная длина диафрагмы соответствует объему легких после
глубокого выдоха (на уровне ООЛ), при таком легочном объеме диафрагма развивает максимальную силу сокращения и, как следствие, большее трансдиафрагмальное
давление. Уплощение диафрагмы (например, при ХОБЛ вследствие гиперинфляции) приводит к снижению силы, генерируемой мышцей, а значит, и к меньшему
трансдиафрагмальному давлению [11, 12]. Для экспираторных мышц оптимальная
длина соответствует максимальному легочному объему (на уровне ОЕЛ), при таком
объеме эти мышцы могут развить максимальную силу [13].
106
Оценка силы дыхательных мышц
Таким образом, максимальную силу инспираторных мышц следует измерять на
уровне ООЛ, экспираторных мышц - на уровне ОЕЛ.
Дисфункция дыхательных мышц
Нарушение функции дыхательной мускулатуры (дисфункцию дыхательных
мышц) условно подразделяют на утомление и слабость дыхательных мышц. Утомление дыхательных мышц - это состояние, при котором сила и скорость сокращения
мышц снижаются в результате их чрезмерной работы. Утомление — процесс обратимый, после отдыха функции мышц могут восстановиться [14]. Причиной утомления
дыхательных мышц является внезапное увеличение нагрузки на аппарат дыхания:
повышение бронхиального сопротивления (резистивная нагрузка) или снижение
растяжимости легких или грудной клетки (эластичная нагрузка) [2]. Утомление дыхательной мускулатуры в клинической практике (не в условиях эксперимента) практически всегда относится к критическим состояниям и при отсутствии своевременного отдыха дыхательных мышц (респираторной поддержки) может привести к
остановке дыхания и гибели больного [15]. В клинических условиях утомление
дыхательных мышц встречается у больных отделений интенсивной терапии (ОИТ),
либо нуждающихся в проведении искусственной вентиляции легких (ИВЛ) [16],
либо при неудачном «отлучении» от респиратора [15, 17].
Под слабостью дыхательной мускулатуры понимают состояние, при котором сила дыхательных мышц снижена даже в состоянии «покоя» [18]. Спектр заболеваний
и состояний, при которых встречается слабость дыхательных мышц, чрезвычайно
широк. В большинстве случаев причиной слабости дыхательной мускулатуры являются метаболические, воспалительные и дегенеративные изменения, приводящие к
нарушению функции либо самих мышц, либо нервов, либо нейромышечных соединений. Многие причины слабости дыхательных мышц, за исключением очевидных
(нейропатии, мышечные дистрофии), часто упускаются из вида, например, слабость
дыхательных мышц развивается при приеме глюкокортикостероидов [19], кахексии
[20], застойной сердечной недостаточности [21]. Особой проблемой в настоящее
время являются нейропатии/миопатии критических состояний, которые сопровождаются генерализованной мышечной слабостью (в том числе и
дыхательных мышц) у
25—33% больных, получавших ИВЛ [22].
Далеко не полный перечень заболеваний,
при которых снижается сила дыхательных
мышц, приведен в
табл. 1. Таким образом,
измерение силы дыхательных мышц при
комплексном функциональном исследова-
Эластическая отдача
грудной клетки i=J>y
направлена внутрь
Укорочение
мышечных волокон
Снижение
кровоснабжения
Ребра
горизонтальны
Уменьшается
зона аппозиции
Медиальная ориентация
волокон диафрагмы
$
Снижается
радиус
кривизны
диафрагмы
Рис. 3. Влияние гиперинфляции легких на работу дыхательных
мышц. (По Hill N.S. Current concepts in mechanical ventilation for
chronic obstructive pulmonary disease // Semin. Respir. Crit. Care
Med. 1999. V. 20. P.375.)
107
Гпава 5
Таблица 1. Заболевания и состояния, сопровождающиеся слабостью дыхательных мышц (по
Gibson, 1995 [23], с дополнениями)
Группы заболеваний
Заболевания
Заболевания
ЦНС
Паркинсонизм
Квадриплегия
Рассеянный склероз
Полиомиелит
Боковой амиотрофический склероз
Периферические нейропатии
Синдром Гийена—Барре
Наследственные моторные и сенсорные нейропатии
(Ш арко- М ари-Тута)
Патология
нейромышечного синапса
Миастения
Синдром Ламберта-Итона
Заболевания грудной клетки
Кифосколиоз
Синдром ожирения-гиповентиляции (Пиквика)
Мышечные дистрофии
Дистрофия Дюшенна
Дистрофия плечевого пояса
Миотоническая дистрофия
Нарушения питания
Общий дефицит питательного статуса (кахексия)
Гипомагниемия
Гипокалиемия
Эндокринные заболевания
Токсические миопатии
Системные заболевания
соединительной ткани
Респираторные заболевания
Гипертиреоидизм
Гипотиреоидизм
Надпочечниковая недостаточность
Сахарный диабет
Алкогольная миопатия
Стероидная миопатия
Системная красная волчанка
Полимиозит/дерматомиозит
Системная склеродермия
Ревматоидный артрит
ХОБЛ
Интерстициальные заболевания легких
Другие
Хроническая сердечная недостаточность
Хроническая почечная недостаточность
Острые вирусные респираторные инфекции
Обозначения: ЦНС - центральная нервная система.
нии позволяет выявить причину рестриктивных нарушений: поражения паренхимы
легких, приводящие к ограничению расширения грудной клетки, нервно-мышечные расстройства или недостаточные усилия пациента.
При ХОБЛ и других обструктивных заболеваниях легких снижение силы дыхательных мышц связано с гиперинфляцией (воздушной ловушкой), которая ставит
диафрагму в невыгодные условия (рис. 3). Во-первых, при гиперинфляции длина
волокон диафрагмы укорачивается и они смещаются на кривой сила—длина в менее
выгодную позицию [24]. Во-вторых, гиперинфляция меняет геометрию диафрагмы,
108
Оценка силы дыхательных мышц
которая уплощается, а следовательно, увеличивается радиус ее кривизны [25]. В-третьих, при гиперинфляции уменьшается или даже практически исчезает зона аппозиции — область, которой диафрагма прилегает к внутренней поверхности грудной
клетки. Эта зона играет важную роль в экспансии диафрагмой нижних отделов грудной клетки во время вдоха [26, 27].
Показания и противопоказания
для измерения силы дыхательных мышц
Основными показаниями для измерения силы дыхательных мышц являются:
1. Изолированное снижение ЖЕЛ или МВЛ (при технически правильно выполненных спирометрии или исследовании максимальной вентиляции). Такое снижение может быть ранним симптомом дисфункции дыхательных мышц и может объяснять жалобы пациентов на одышку.
2. Наличие одышки у больных с нервно-мышечными заболеваниями. Исследование силы дыхательных мышц у 10 пациентов с ранними проявлениями нервно-мышечных заболеваний (боковым амиотрофическим склерозом, миастенией и полимиозитом) показало, что у 8 пациентов была выраженная одышка, тогда как ЖЕЛ была
снижена только у 2 пациентов, М ВЛ у 5 пациентов, а сила дыхательных мышц у 9 пациентов (сила экспираторных мышц в группе в среднем составила 47% от должной,
инспираторных — 34% от должной) [28]. На ранних стадиях заболеваний тяжесть
одышки лучше всего коррелировала со снижением силы дыхательных мышц, а не с
силой других скелетных мышц (которая была снижена незначительно) [28].
3. Необходимость оценки эффективности кашля. Эффективный кашель невозможен, если максимальное экспираторное давление ниже 40 см вод. ст. [28] (перевод в
систему СИ: 1 см вод. ст. = 98 Па, 1 кПа =10 см вод. ст.). У пациентов с тяжелым хроническим бронхитом кашель может вызывать синкопальные состояния. Во время
пароксизмов кашля давление в дыхательных путях может превышать 300 см вод. ст.,
что приводит к снижению венозного возврата и падению сердечного выброса, вызывая потерю сознания [28] даже у пациентов, лежащих на спине.
4. Необходимость оценки возможности отлучения больных от ИВЛ. У неинтуби-
рованных пациентов, находящихся в ОИТ, — оценка риска развития дыхательной
недостаточности при слабости дыхательных мышц. Исследование противопоказано
при патологических состояниях, в которых желательно избегать большого колебания давления в грудной или брюшной полости (например, аневризма, неконтролируемая гипертензия или недержание мочи).
Основные методы оценки силы дыхательных мышц
Основной задачей дыхательных мышц является создание отрицательного (во время вдоха) и положительного (во время выдоха) давлений, поэтому для оценки силы
дыхательных мышц измеряют давление, создаваемое ими в результате волевой активации пациентом или электрической либо магнитной стимуляции диафрагмального
нерва. Давление можно измерять в ротовой полости, в носу, в грудной клетке (при помощи пищеводного катетера) и в брюшной полости (при помощи желудочного катетера) [10, 29]. Тесты со стимуляцией диафрагмальных нервов являются более объективными, тогда как тесты без стимуляции, как правило, лучше переносятся пациен¬
109
Гпава 5
тами, но требуют понимания больными сути маневра и желания участвовать в исследовании.
Максимальное инспираторное
и экспираторное давление в полости рта
Наибольшее клиническое применение получил неинвазивный метод измерения
максимального инспираторного (MIP, или P!max) и экспираторного (МЕР, или РЕтах)
давления в ротовой полости. Данный метод является одним из самых старых функциональных тестов, он был разработан английским терапевтом J. Hutchinson, который впервые ввел в практику измерение ЖЕЛ [30]. Однако широкое распространение метод начал приобретать лишь с 60-х годов прошлого века [31—33].
Измерять давление в ротовой полости следует в течение квазистатических коротких (несколько секунд) максимальных инспираторных (проба Мюллера) и экспираторных (проба Вальсальвы) маневров. Во время данных тестов пациенты
обычно находятся в сидячем положении, для предотвращения утечки воздуха через
нос можно использовать зажим. При выполнении экспираторного маневра ладони
следует прижать к щекам для уменьшения вклада сокращения буккальных мышц
[34]. Как правило, инспираторное давление оценивают на уровне ООЛ, экспираторное - на уровне ОЕЛ. При проведении маневров пациент должен прилагать
максимальное усилие. Следует использовать жесткий загубник. Чтобы предотвратить закрытие глотки во время маневра Р|тах и снизить давление, генерируемое
мышцами околоротовой области и щек во время маневра РЕтах, в измерительной системе должна быть небольшая утечка (трубка длиной 20—30 мм с внутренним диаметром 2 мм) [29, 32].
Следует учитывать, что на давление, измеренное при максимальных инспираторных и экспираторных маневрах, оказывает влияние эластическая отдача легких и
грудной стенки (Рге), которая может достигать —30 см вод. ст. во время маневра Pimax
и 40 см вод. ст. во время маневра РЕтах [29, 35, 36]. При измерении максимального
экспираторного давления — полученное давление является результатом сокращения
экспираторных мышц и эластической отдачи легких, при измерении максимального инспираторного давления — результатом сокращения инспираторных мышц и
эластической отдачи грудной стенки. Несмотря на такие значительные поправки,
современные руководства по-прежнему рекомендуют измерять ротовые давления от
уровней ООЛ и ОЕЛ, так как такие маневры более просты для понимания больными, поэтому техника их выполнения обычно более правильная [29]. Тем не менее в
некоторых центрах измерение ротовых давлений проводят при выполнении инспираторных и экспираторных маневров от уровня ФОЕ, что более правильно с позиций механики дыхания [37].
Как правило, при измерении Р,тах и РЕтах выполняется не менее пяти маневров
(часто и больше). При получении трех максимальных значений, различающихся менее чем на 20%, исследование прекращают и регистрируют максимальное значение
ротового давления. Выполнение таких маневров относительно просто и удобно для
пациентов. Однако, к сожалению, хорошая воспроизводимость показателей давления не всегда гарантирует регистрацию максимального усилия пациента [38].
Во всех современных нормативах указывается, что условием для регистрации
максимальных инспираторного и экспираторного давлений служит их поддержание
не менее 1 с. Недавно были разработаны нормативы для пикового инспираторного
110
Оценка силы дыхательных мышц
Таблица 2. Расчет должных значений максимальных инспираторных и экспираторных ротовых давлений [40,41]
Категория пациентов
р1т,х> см “ОД- ст.
PEmas, см вод. ст.
Мужчины
18—65 лет
142 - 1,03 х возраст
180-0,91 х возраст
65-85 лет
-153+ 1,3 х возраст — 0,29 х МТ
219 - 2,12 х возраст + 0,34 х МТ
Женщины
18-65 лет
—43 + 0,71 х рост
3,5 + 0,55 х рост
65—85 лет
-96 + 0,81 х возраст — 0,29 х МТ
347 — 0,295 х возраст + 0,26 х МТ
Мальчики 7-17 лет
44,5 + 0,75 х МТ
35 + 5,5 х возраст
Девочки 7—17 лет
40 + 0,57 х МТ
24 + 4,8 х возраст
Обозначения: МТ - масса тела.
Примечание. В уравнения вводится возраст в годах, масса тела в кг, рост в см.
ротового давления: в целом уровень PImax составляет 82-86% от пикового инспира-
торного давления [37].
Достоинствами тестов оценки ротовых давлений являются их относительная простота, хорошая переносимость больными, возможность проведения исследований во
всех возрастных группах, включая детей и пожилых, а также наличие принятых нормативов (табл. 2). Нормальные значения Р1тах и РЕтах для мужчин и женщин, полученные в 8 исследованиях в 1966—2004 годах, представлены в табл. 3. Измерение максимальных ротовых давлений может производиться в любых условиях: в лаборатории,
поликлинике, стационаре, у постели больного, в том числе и в ОИТ. Эти тесты не требуют сложного оборудования, а благодаря технологии с использованием микросхем
всё большее распространение получают простые портативные устройства [23, 39]
(рис. 4).
На практике уровни Р,тах более 80 см вод. ст. у мужчин и более 60 см вод. ст. у
женщин исключают наличие значимой слабости дыхательных мышц [9]. Измерения Р,тах и РЕтах в динамике позволяют выявлять прогрессирование или уменьшение слабости дыхательных мышц (например, при синдроме Гийена-Барре, отлучении больного от респиратора) или утомление дыхательных мышц. Больные с Р!п1ах
менее 25 см вод. ст. имеют очень высокий риск развития вентиляционной дыхательной недостаточности, а при РЕтах
менее 30 см вод. ст. эффективность кашля резко снижается, что ведет к скоплению секрета в бронхиальном дереве с
риском последующего развития ателектазов и пневмоний [10].
Давление, генерируемое дыхательными мышцами, является ценным прогностическим показателем при отлучении
больных от респиратора. В ряде работ
было показано, что больные с инспира-
торным давлением ниже —20 см вод. ст.
[46, 47] и экспираторным давлением вы-
Манометр
Клапан
Утечка
воздуха
Рис. 4. Измерение максимального давления в
полости рта при помощи портативного аппарата.
111
Гпава 5
Таблица 3. Нормальные значения для РЕтах и Р,П1ах
Исследование
Источник
Число
больных
^Emax’
см вод. CT.
Pfmax’
см вод. CT.
Тип
мундштука
Мужчины
Rinqvist, 1966
[33]
106
238 ± 46
129 ± 32
Трубка
Black & Hyatt, 1969
[32]
60
232 ± 42
123 ± 21
Трубка
Rochester & Arora, 1983
[42|
80
216 ± 45
126 ± 28
Трубка
McElvaney et al., 1989
[43 J
40
173 ± 41
108 ± 26
Трубка
Leech et al., 1983
[44]
325
154 ± 82
ИЗ ± 36
Загубник
Wilson et al., 1984
|4l I
80
148 + 34
106 ±31
Загубник
Vincken et al., 1987
[45]
46
140 ± 38
105 ± 25
Загубник
Windisch et al., 2004
[37]
229
-
107 ± 35
Загубник
Женщины
Rinqvist, 1966
[33]
40
164 ± 30
98 ± 24
Трубка
Black & Hyatt, 1969
[32]
26
152 ± 26
87 ± 15
Трубка
Rochester & Arora, 1983
[42]
41
138 ± 68
91 ±24
Трубка
McElvaney et al., 1989
[43]
64
П5 ± 34
75 ± 24
Трубка
Leech et al., 1983
[44]
42
94 ±33
71 ±26
Загубник
Wilson et al., 1984
[41 ]
43
93 ± 16
73 ± 21
Загубник
Vincken et al., 1987
[45]
44
89 ±23
70 ±23
Загубник
Windisch et al., 2004
[37]
304
-
74 ± 32
Загубник
Примечание. Все данные представлены как среднее ± стандартное отклонение (SD); во всех исследованиях маневры Р1|шх были выполнены от уровня ООЛ, а маневры РЕтах - от уровня ОЕЛ.
ше 50 см вод. ст. [28] имеют хорошие шансы отлучения от ИВЛ. Для оценки Р|тах у
интубированных больных предложено использовать однонаправленный клапан,
позволяющий производить только выдох, благодаря чему больной в несколько приемов выдыхает до уровня ООЛ, а затем делает максимальный вдох [48]. Однако не
рекомендуется принимать решение об отлучении пациента от ИВЛ только на основании значений максимального давления в ротовой полости. Необходимо учитывать, что способность дышать без респиратора зависит от баланса между способностью дыхательных мышц выполнять работу и нагрузкой, возлагаемой на дыхательные мышцы грудной стенкой и легкими.
Недостатком метода оценки ротовых давлений является его зависимость от мотивации и кооперации больного, т.е. низкие значения давлений могут означать как
наличие слабости дыхательных мышц, так и недостаточное усилие больного. Другим
недостатком метода является его «неестественный» характер, т.е. в реальной жизни
пациент обычно никогда не выполняет подобный маневр максимального усилия
при окклюзии дыхательных путей. Многие пациенты находят такой маневр неприятным, а иногда и болезненным.
Трансдиафрагмальное давление
Диафрагма является единственной дыхательной мышцей, силу которой можно измерить отдельно от всех других дыхательных мышц. Данная задача решается при измерении трансдиафрагмального давления (Pdi), которое рассчитывается как разница
112
Оценка силы дыхательных мышц
внутрижелудочного (Pga) и внутриэзофагеального (Pes) давлений: Pdi= Pga - Pes [49].
Для измерения Pdj требуется установка двух катетеров — в пищевод и желудок, поэтому тест является инвазивным и чаще всего выполняется в специализированных лабораториях. Измерение Pdi производится обычно во время маневра Мюллера от уровня
ФОБ [29]. Недостатками метода, кроме его инвазивности, являются достаточно высокая вариабельность значений и отсутствие признанных нормативов. Значения Pdi
более 100 см вод. ст., как правило, исключают наличие клинически значимой слабости дыхательных мышц [10].
Sniff-тесты
Еще одним методом для оценки давлений в дыхательных путях, создаваемых при
сокращении инспираторных дыхательных мышц, является так называемый sniff-
тест [50, 51]. «Sniff» в переводе с английского означает «сопение, шмыганье носом»,
однако подобрать удачный перевод этого термина сложно, поэтому многие неанглоязычные специалисты предпочитают оставлять данный термин без перевода [52, 53].
Маневр sniff заключается в очень быстром и мощном вдохе через нос при закрытом
рте больного (как при шмыгании носом). Очень высокое сопротивление в полости
носа во время такого маневра препятствует какому-либо значимому изменению легочных объемов. Измерение давлений во время sniff-теста практически всегда производится от уровня ФОБ. Достоинством данного маневра является то, что с ним
знаком практически каждый пациент, благодаря чему sniff-тест является более простым заданием для пациента, чем, например, маневр Р!тах [54].
Впервые sniff-тест был предложен в 1927 г. для выявления паралича диафрагмы во
время рентгеноскопии [55]. В середине 80-х годов прошлого столетия маневр sniff
был использован для оценки трансдиафрагмального давления, и оказалось, что Pdi
во время sniff выше, чем при статическом инспираторном усилии, что, вероятно,
связано с более быстрой и полной координацией инспираторных дыхательных
мышц [54]. S.N. Nava et al. показали, что активация диафрагмы происходит в большей степени во время максимального маневра sniff: электромиографическая активность диафрагмы при максимальном статическом инспираторном усилии составляла 61 % от уровня активности во время sniff-теста [56]. Важным достоинством sniff-теста является его более высокая воспроизводимость по сравнению с максимальными
статическими тестами [54]. Коэффициент вариабельности давлений, измеренных во
время маневра sniff, составляет около 7%, тогда как во время максимального статического усилия - около 13% [50].
Показатель Pes, измеренный во время sniff-теста (Pessniff), оказался более надежным и более чувствительным параметром, чем PImax, при оценке общей силы дыхательных мышц [54]. В дальнейшем N. Koulouris et al. показали, что давления в носоглотке и во рту во время sniff-теста очень близки к значениям Pes snifT: корреляция
между результатами составляла 0,94-0,99 [57]. Однако измерение давлений в носоглотке и во рту не требует установки катетеров в пищевод или желудок, что позволило значительно уменьшить инвазивность метода и сделать его более доступным для
клинической практики.
Еще большим прогрессом в диагностике силы дыхательных мышц явилась разработка нового метода, основанного на измерении давления в полости носа во время
sniff-теста (SNIP — sniff nasal inspiratory pressure) [58]. Во время этого исследования в
одну ноздрю пациента вводится катетер, который фиксируется при помощи плотно
113
Гпава 5
обтурирующей пробки (катетер проходит сквозь эту пробку). В качестве носовых пробок были предложены ушные обтураторы [58], резиновые подушечки от
СРАР-маски [59], катетер Фолея [53], и,
наконец, совсем недавно появились носовые обтураторы разных размеров, специально разработанные для этой цели
компанией Micro Medical Ltd (Великобритания) (рис. 5). Во время измерения
SNIP пациент обычно находится в сидячем положении, выполняется серия маневров от уровня ФОБ с интервалами
между маневрами не менее 30 с [60]. Маневры выполняют до тех пор, пока давление не перестанет увеличиваться (т.е.
до достижения плато), — обычно около
5—10 маневров. Регистрируется лучшая
попытка пациента.
Значения SNIP обычно несколько ниже значений Pcssniff (в среднем на 4,5 см вод. ст.),
их отношение составляет 0,91—0,92, при этом они тесно коррелируют между собой
(г = 0,96; р < 0,001) (см. рис. 4) [58]. Различие между параметрами отражает небольшую потерю давления от альвеол к верхним дыхательным путям, данный градиент
описывается постоянной времени, представляющей собой произведение сопротивления дыхательных путей на растяжимость верхних дыхательных путей. У больных
ХОБЛ из-за увеличения сопротивления, а следовательно, и постоянной времени,
отношение SNIP/Pcssnifr снижается и составляет около 0,8 [61]. При сравнении значений SNIP и Р,|шх наблюдается обратная закономерность: SNIP, как правило, выше
Р||ШХ на 6—9 см вод. ст., а отношение SNIP/P,max составляет 1,08-1,17 [60]. Эти различия объясняются большей комфортностью больного во время sniff-теста, а также
различными типами активации дыхательных мышц при выполнении маневров.
В некоторых ситуациях, например у больных с тяжелыми нервно-мышечными заболеваниями и ЖЕЛ менее 40%, отношение SNIР/Р|тач может быть <1 [62].
Многие эксперты подчеркивают, что параметры SNIP и Р,тах являются комплементарными, т.е. могут дополнять друг друга; так, у некоторых больных полная активация дыхательных мышц и получение надежного результата возможны лишь при
использовании одного изданных методов (чаше маневра sniff) [61, 63].
Ввиду простоты теста SNIP, его высокой надежности и воспроизводимости он
получает все большее признание в клинической практике. Метод можно использовать для оценки силы дыхательных мышц у таких сложных пациентов, как больные
с нервно-мышечными заболеваниями, в том числе и с бульбарными нарушениями
[59, 62, 64, 65], больные с деформациями грудной клетки 165], с ХОБЛ [61], с обострением бронхиальной астмы [66]. К достоинствам метода SNIP также можно отнести разработанные должные величины как для взрослых [60], так и для детей [67]
(табл. 4). Принято считать, что значения SNIP более 70 см вод. ст. у мужчин и более
60 см вод. ст. у женщин позволяют исключить значимую дисфункцию дыхательных
мышц [10].
Рис. 5. Измерение SNIP при помощи портативного аппарата. (По Авдеев С.Н. Оценка
силы дыхательных мышц в клинической
практике // Атмосфера. Пульмонология и
аллергология. 2008. № 4. С. 15.)
114
Оценка силы дыхательных мышц
Таблица 4. Должные величины SNIP для взрослых [66] и детей [63]
Категория пациентов
SNIP, см вод. ст.
должное значение*
нижняя граница нормы
Мужчины 20-80 лет
-0,42 х возраст + 126,8
должное - 39,0
Женщины 20-80 лет
-0,22 х возраст + 94,9
должное — 28,0
Мальчики 6—17 лет
0,30 х возраст + 70,0
должное — 39,9
Девочки
6—12 лет
92 ±22
13— 16 лет
97 ± 26
-
*У девочек не выявлено корреляционной зависимости между SNIP, возрастом, ростом и массой
тела, поэтому регрессионное уравнение не выведено.
Недостатками sniff-тестов, в том числе и SNIP, является их произвольный характер, т.е. зависимость результата от кооперации с пациентами. Данные тесты зависят
от проходимости верхних дыхательных путей и практически невозможны при полной обструкции носа [58]. Кроме того, эти методы неприменимы во время ИВЛ, так
как такие больные не способны осуществить маневр sniff [26].
Сгпимуляционные шесты
Наиболее надежным методом оценки силы дыхательных мышц являются стиму-
ляционные тесты. Данные тесты проводятся у больных, не способных выполнить
статические или sniff-маневры, а также в тех ситуациях, когда нет полной уверенности в том, что больной прикладывает максимальное усилие при исследовании. Главным достоинством стимуляционных тестов является их объективность, т.е. результаты теста не зависят от кооперации с пациентом и могут быть использованы даже у
крайне тяжелых больных, например находящихся на ИВЛ или в состоянии комы
[29]. Данные тесты заключаются в приложении электрического или магнитного стимула на область диафрагмальных нервов или шейного сплетения; в ответ происходит сокращение только одной дыхательной мышцы - диафрагмы, что регистрируется при помощи эзофагеальных и желудочных катетеров. Стимуляционные методы
позволяют оценить функцию не только всей диафрагмы, но и каждого из ее куполов
в отдельности [68], а также определить время проведения нервного импульса по диафрагмальному нерву [69].
Самый ранний тип стимуляции диафрагмальных нервов - электрический [70].
Электрический стимул прямоугольной формы и продолжительностью 0,1 с наносят
в области заднего края грудино-ключично-сосцевидных мышц на уровне щитовидного хряша [71]. Однако такой метод целиком зависит от умения оператора найти
нужную точку, иногда данная задача не может быть решена даже при участии самых
опытных специалистов. Другим недостатком электрической стимуляции является ее
болезненность, что также затрудняет широкое использование метода.
Более совершенный способ — шейная магнитная стимуляция, предложенная в
1988 г. Similowski [72]. Во время этого теста магнитное поле длительностью менее
100 мкс прикладывается с помощью кольца диаметром 9—10 см на заднюю область
шеи (позвонки С5-С7) [73]. Данный метод безболезненный, не зависит от умения
лаборанта найти точку n. phrenicus (магнитное поле имеет большую площадь) и ха-
115
Гпава 5
растеризуется лучшей воспроизводимостью [74]. Нормальными значениями трансдиафрагмальных давлений (Pdi twitch) при электрической стимуляции считается
25—35 см вод. ст., а при магнитной стимуляции — 30—35 см вод. ст. [10].
Кроме шейной, существуют и другие разновидности магнитной стимуляции —
двусторонняя передняя (используются два магнитных электрода, каждый из которых накладывается спереди над точкой n. phrenicus) и передняя (один электрод, который накладывается на рукоятку грудины). Эти методы могут применяться у больных, находящихся в лежачем положении, например в ОИТ [75, 76]. Хотя при магнитной стимуляции измерение Pditwitch является «золотым стандартом», предложено
измерять уровни давлений в эндотрахеальной трубке (Pentwilch) У больных во время
ИВЛ (требуется кратковременная окклюзия трубки) [77] и в полости рта (Pmotwilch)
[78, 79]. Такие модификации делают метод менее инвазивным.
Несмотря на многие достоинства магнитных стимуляционных тестов, необходимо обратить внимание и на некоторые недостатки: аппаратура очень дорогая и доступна лишь в немногих специализированных центрах, а сложность и комплексность метода, за редким исключением, не позволяют вынести тесты за пределы
функциональных лабораторий и приблизить их к постели больного.
Клинические случаи
Клинический случай 1
Мужчина в возрасте 38 лет (рост 173 см, масса тела 108 кг, ИМТ 36,1 кг/м2). Жалуется на постоянно учащенное дыхание, усиливающееся при любом резком движе-
Время, с Время, с
Рис. 6. Максимальное давление в полости рта: а — инспираторное (Р|тах), б — экспираторное
(PEmJ.
116
Оценка силы дыхательных мышц
нии, резкой смене положения тела, разговоре, в положении лежа на левом боку. Заболел за 4 мес до обращения, когда без явных причин внезапно появилось ощущение невозможности сделать полный вдох, необходимость прикладывать усилие при
дыхании, одышка (учащенное дыхание) при любом резком движении, разговоре,
резкой смене положения тела (вставание из положения сидя или лежа), в положении лежа на спине и особенно на левом боку, боль в правой половине шеи и правом
плече при движениях в плечевом поясе. Ранее ничем не болел. По результатам врачебного осмотра и рентгенологического обследования у больного диагностирован
паралич правого купола диафрагмы (аналогичный случай см. в главе 1, клинический случай 2). При функциональном исследовании выявлены рестриктивные нарушения легочной функции и значительная разница при измерении ФЖЕЛ в положении больного сидя и лежа, что подтверждало этот диагноз.
Для оценки выраженности дисфункции диафрагмы измерили силу дыхательных
мышц.
При измерении максимального инспираторного и экспираторного ротового
давления было выявлено снижение силы инспираторных мышц: Р,тах составило
79,97 см вод. ст. (у мужчин в норме Р,тах >80 см вод. ст.) (рис. 6), что свидетельствовало о дисфункции диафрагмы и объясняло рестриктивные нарушения функции
дыхания.
Клинический случай 2
Мужчина 57 лет (рост 168 см, масса тела 50 кг, ИМТ 17,7 кг/м2). Жалуется на выраженную одышку при минимальной физической нагрузке, кашель с мокротой. По
данным анамнеза (курильщик со стажем 42 пачек-лет, кашель в течение 10 лет, постепенное нарастание одышки в течение последних лет), врачебного осмотра (бочкообразная грудная клетка, ослабленное дыхание по всем легочным полям, скудные
рассеянные сухие свистящие хрипы на выдохе с обеих сторон, перкуторный звук с
коробочным оттенком по всем полям), результатов функционального исследования
(резко выраженные обструктивные нарушения легочной вентиляции: генерализованное снижение скорости форсированного выдоха, «воздушные ловушки», гиперинфляция легких; умеренное снижение диффузионной способности легких (низкая
DLco и низкое DLco/Va)) и КТ органов грудной клетки (выраженные и распространенные эмфизематозные изменения, уплощение диафрагмы, увеличение объема
легких) больному выставлен диагноз ХОБЛ IV стадии, преимущественно эмфизематозного варианта, диффузной эмфиземы легких.
При измерении силы дыхательных мышц было выявлено снижение максимального статического инспираторного ротового давления, тогда как значение максимального статического экспираторного ротового давления было в пределах возрастной нормы (рис. 7).
Таким образом, у данного пациента значительные нарушения структуры легких в
виде распространенной эмфиземы привели к выраженной гиперинфляции легких.
Это вызывает необходимость дышать при более высоком легочном объеме, увеличивает работу дыхания для преодоления эластических сил и потребность инспираторных мышц в кислороде. Негативное воздействие на инспираторные мышцы при гиперинфляции легких обусловлено несколькими причинами. Во-первых, уплощение
диафрагмы перемещает ее в более невыгодную часть на кривой сила—длина, вызывая функциональную слабость. Во-вторых, увеличение скорости сокращения ин-
117
Гпава 5
Рис. 7. Максимальное давление в полости рта: а - инспираторное, б — экспираторное.
спираторных мышц в результате ускорения вдоха (вынужденная мера, направленная
на увеличение времени выдоха) перемещает инспираторные мышцы в более невыгодную часть на кривой сила—скорость. Кроме того, поскольку выдох заканчивается раньше, чем достигается объем легких, уравновешивающий давление в легких и
грудной клетке, в легких возникает внутреннее положительное конечно-экспираторное давление (PEEPi), поэтому для того, чтобы начать вдох, мышцы должны преодолевать дополнительную нагрузку.
В исследовании, проведенном в НИИ пульмонологии, снижение Р1тах отмечалось у 86 из 137 больных ХОБЛ (63%), РЕтах - у 40 пациентов из 137 (29%). По мере
нарастания гиперинфляции легких функция дыхательных мышц прогрессивно
ухудшалась.
Заключение
Дыхательные мышцы являются важнейшим компонентом респираторного аппарата: нормальное дыхание возможно только при условии их сохранной силы и выносливости. Измерение силы дыхательных мышц вносит важный вклад в диагностику причин дыхательной недостаточности у больных с тяжелыми респираторными
заболеваниями. В настоящее время достигнут определенный прогресс в функциональном исследовании силы дыхательных мышц. Использование простых тестов
(Рimax’ Ре,шх’ SNIP) позволяет оценить функцию дыхательных мышц в реальных клинических условиях, у постели больного. В сложных случаях может потребоваться
проведение более сложных и дорогих методов исследования, таких как магнитная
стимуляция диафрагмы.
118
Оценка силы дыхательных мышц
Список литературы
1. Begin R, Grassino A. Inspiratory muscle dysfunction and chronic hypercapnia // Amer. Rev. Respir. Dis.
1991. V. 143. P.905-912.
2. Roussos C. Respiratory muscle and ventilatory failure // Chest. 1990. V. 97. P. 89S-96S.
3. Roussos C.H., Macklem PT. The respiratory muscles // N. Engl. J. Med. 1982. V. 307. P. 786-797.
4. Исаев Г.Г. Физиология дыхательных мышц // Физиология дыхания / Под ред. И.С. Бреслава.
Г.Г. Исаева. СПб., 1994. С. 178-197.
5. Чучалин А.Г., Покровский В.М. Дыхание // Физиология человека / Под ред. В.М. Покровского,
Г.Ф. Коротько. М., 2003. С. 347-385.
6. Green М., Moxam J. The respiratory muscles // N. Engl. J. Med. 1988. V. 42. P. 827-835.
7. Уэст Дж. Физиология дыхания. Основы. М., 1988.
8. Mead J., Loring S.H. Analysis of volume displacement and length changes of the diaphragm during breathing//J. Appl. Physiol. 1982. V. 53. P. 750-755.
9. Polkey M.I., Moxam J. Clinical aspects of respiratory muscle dysfunction in the critically ill // Chest. 2001.
V. 119. P.926-939.
10. Flaminiano L.E., Celli B.R. Respiratory muscles testing//Clin. Chest Med. 2001. V. 22. P. 661-677.
11. Hamnegard C.-H., Wragg S., Mills G.H. et al. The effect of lung volume on transdiaphragmatic pressure //
Eur. Respir. J. 1995. V. 8. P. 1532-1536.
12. Similowski T, Yan S., Gauthier A.P. et al. Contractile properties of the human diaphragm during chronic
hyperinflation // N. Engl. J. Med. 1991. V. 325. P. 917-923.
13. Rahn H., Otis A.B., Chadwick L.E. et al. The pressure-volume diagram of the thorax and lung // Amer. J.
Physiol. 1946. V. 146. P. 161-178.
14. NHLBI Workshop on Respiratory Muscle Fatigue: Report of the Respiratory Muscle Fatigue Workshop
Group// Amer. Rev. Respir. Dis. 1990. V. 142. P. 474-480.
15. Cohen C.A., Zagelbaum G., Gross D. et al. Clinical manifestation of inspiratory muscle fatigue // Amer. J.
Med. 1982. V. 73. P.308-316.
16. Efthimiou J., Fleming J., Spiro S.G. Sternomastoid muscle function and fatigue in breathless patients with
severe respiratory disease//Amer. Rev. Respir. Dis. 1987. V. 136. P. 1099—1105.
17. VassilakopoulosT., Zakynthinos S., Roussos C. The tension-time index and the frequency/tidal volume ratio
are the major pathophysiologic determinants of weaning failure and success // Amer. J. Respir. Crit. Care
Med. 1998. V. 158. P. 378-385.
18. Epstein S. An overview of respiratory muscle function // Chest Clin. North Amer. 1994. V. 15. P 619—639.
19. Decramer M., Lacquet L.M., Fagard R., Rogiers P Corticosteroids contribute to muscle weakness in
chronic airflow obstruction // Amer. J. Respir. Crit. Care Med. 1994. V. 150. P. 11-16.
20. Schols A.M., Soeters P.B., Mostert R. et al. Physiologic effects of nutritional support and anabolic steroids
in patients with chronic obstructive pulmonary disease: a placebo-controlled randomized trial // Amer. J.
Respir. Crit. Care Med. 1995. V. 152. P. 1268-1274.
21. McParland C., Khrishnan B., Wang Y., Gallagher C. Inspiratory muscle weakness and dyspnea in chronic
heart failure //Amer. Rev. Respir. Dis. 1992. V. 146. P. 467-472.
22. Deem S., Lee C.M., Curtis J.R. Acquired neuromuscular disorders in the intensive care unit // Amer. J.
Respir. Crit. Care Med. 2003. V. 168. P. 735-739.
23. Gibson G.J. Measurement of respiratory muscle strength // Respir. Med. 1995. V. 89. P. 529-535.
24. De Troyer A. Effect of hyperinflation on the diaphragm // Eur. Respir. J. 1997. V. 10. P. 708-712.
25. Whitelaw W.A., Hajdo L.E., Wallace J.A. Relationships among pressure, tension, and shape of the
diaphragm//J. Appl. Physiol. 1983. V. 62. P. 180-186.
26. Similowski T, Duguet A., Prodanovic H., Straus C. Exploration du diaphragme en reanimation // Reanimation. 2003. V. 12. P.6-18.
27. Tobin M.J. The respiratory muscles in disease // Clin. Chest Med. 1988. V. 9. P. 263-286.
28. Hyatt R.E., Scanlon P.D., Nakamura M. Interpretation of Pulmonary Function Test: a Practical Guide.
Philadelphia etc.: Lippincott Williams and Wilkins, 2003.
29. ATS/ERS Statement on Respiratory Muscle Testing // Amer. J. Respir. Crit. Care Med. 2002. V. 166.
P. 518-624.
30. Hutchinson J. On the capacity of the lung, and on the respiratory functions, with a view of establishing a precise and easy method of detecting disease by the spirometer // Med. Chir. Trans. 1846. V. 29. P 137-252.
31. Плетнев Д.Д. Исследование органовдыхания // Основы клинической диагностики. 4-е изд. / Под
ред. А.М. Левина, Д.Д. Плетнева. М., 1928. С. 115—189.
32. Black L., Hyatt R. Maximal respiratory pressures: normal values and relationship to age and sex // Amer.
Rev. Respir. Dis. 1969. V. 99. P. 696-702.
119
Гпава 5
33. Rinqvist Т. The ventilatory capacity in healthy subjects: an analysis of causal factors with special reference to
the respiratory forces // Scand. J. Clin. Lab. Invest. 1966. V. 18. P. 8-170.
34. Clanton T.L., Diaz P.T. Clinical assessment of the respiratory muscles // Phys. Then 1995. V. 75. P. 983-995.
35. Polkey M., Moxam J. Terminology and testing of respiratory muscles dysfunction // Monaldi Arch. Chest
Dis. 1999. V. 6. P.514-519.
36. Rochester D.F. Tests of respiratory muscle function // Clin. Chest Med. 1988. V. 9. P. 249-261.
37. Windisch W., Hennings E., Sorichter S. et al. Peak or plateau maximal inspiratory mouth pressure: which is
best? // Eur. Respir. J. 2004. V. 23. P. 708-713.
38. Aldrich T.K., Spiro P. Maximal inspiratory pressure: does reproducibility indicate full effort? // Thorax.
1995. V. 50. P.40-43.
39. Hamnegard C.H., Wragg S., Kyroussis D. et al. Portable measurement of maximum mouth pressures // Eur.
Respir. J. 1994. V. 7. P.398-401.
40. Enright P.L., Kronmal R.A., Monolio Т.А. et al. Respiratory muscle strength in the elderly // Amer. J.
Respir. Crit. Care Med. 1994. V. 149. P. 430-438.
41. Wilson S.H., Cooke N.T., Edwards R.H.T., Spiro S.G. Predicted normal values for maximal respiratory pressures in Caucasian adults and children // Thorax. 1984. V. 39. P. 535-538.
42. Rochester D.F., Arora N.S. Respiratory muscle failure // Med. Clin. North Amer. 1983. V. 67. P. 573-598.
43. McElvaney G., Blackie S., Morrison N.J. et al. Maximal static respiratory pressures in the normal elderly //
Amer. Rev. Respir. Dis. 1989. V. 139. P. 2772-2781.
44. Leech J.A., Ghezzo H., Stevens D., Becklake M.R. Respiratory pressures and function in young adults //
Amer. Rev. Respir. Dis. 1983. V. 128. P. 17-23.
45. Vincken W., Ghezzo H., Cosio M.G. Maximal static respiratory pressure in adults: normal values and their
relationship to determinants of respiratory function // Bull. Eur. Physiopathol. Respir. 1987. V. 23. P. 435-439.
46. Sahn S.A., Lakshminarayan S. Bedside criteria for discontinuation of mechanical ventilation // Chest. 1973.
V. 63. P. 1002-1005.
47. Yang K.L., Tobin M.J. A prospective study of indexes predicting the outcome of trials of weaning from
mechanical ventilation // N. Engl. J. Med. 1991. V. 324. P. 1445-1450.
48. Marini J.J., Smith T.C., Lamb V. Estimation of inspiratory muscle strength in mechanically ventilated
patients: the measurement of maximal inspiratory pressure //J. Crit. Care. 1986. V. 1. P. 32—38.
49. Laporta D., Grassino A. Assessment of transdiaphragmatic pressure in humans // J. Appl. Physiol. 1985.
V. 58. P. 1469-1476.
50. Miller J.M., Moxham J., Green M. The maximal sniff in the assessment of diaphragm function in man //
Clin. Sci. 1985. V. 69. P.91-96.
51. Verin E., Delafosse C., Straus C. et al. Effects of muscle groups recruitment on sniff transdiaphragmatic pressure and its components // Eur. J. Appl. Physiol. 2001. V. 85. P. 593-598.
52. Fitting J.W., Heritier F., Uldry C. Evaluation de la force musculaire inspiratoire par la pression nasale lors du
sniff // Rev. Mai. Respir. 1996. V. 13. P. 479—484.
53. Normand H., Straus C., Morelot-Panzini C. et al. Variante pratique de la mesure de la pression nasale lors
du «sniff-test» // Rev. Mai. Respir. 2001. V. 18. P. 450—452.
54. Laroche C.M., Mier A.K., Moxham J., Green M. The value of sniff esophageal pressures in the assessment
of global inspiratory muscle strength // Amer. Rev. Respir. Dis. 1988. V. 138. P. 598-603.
55. Hitzenberger K. Das Zwerchfell in gedunden und beranben Zustand. Vienna: Springer, 1927.
56. Nava S.N., Ambrosino P, Crotti P. et al. Recruitment of some respiratory muscles during three maximal
inspiratory manoeuvers//Thorax. 1993. V. 48. P. 702—707.
57. Koulouris N., Vianna L.G., Mulvey D.A. et al. Maximal relaxation rates of esophageal, nose, and mouth pressures during a sniff reflect inspiratory muscle fatigue //Amer. Rev. Respir. Dis. 1989. V. 139. P. 1213-1217.
58. Heritier F., Rahm F., Pasche R, Fitting J.W. Sniff nasal pressure: a non-invasive assessment of inspiratory
muscle strength//Amer. J. Respir. Crit. Care Med. 1994. V. 150. P. 1678-1683.
59. Chaudri M.B., Liu C., Watson L. et al. Sniff nasal inspiratory pressure as a marker of respiratory function in
motor neuron disease // Eur. Respir. J. 2000. V. 15. P. 539-542.
60. Uldry C., Fitting J.-W. Maximal values of sniff nasal inspiratory pressure in healthy subjects//Thorax. 1995.
V. 50. P. 371-375.
61. Uldry C., Janssens J.P., de Meralt B., Fitting J.W. Sniff nasal inspiratory pressure in patients with chronic
obstructive pulmonary disease // Eur. Respir. J. 1997. V. 10. P. 1292-1296.
62. Hart N., Polkey M.I., Sharshar T. et al. Limitations of sniff nasal pressure in patients with severe neuromuscular weakness//J. Neurol. Neurosurg. Psychiatry. 2003. V. 74. P. 1685-1687.
63. Iandelli I., Gorini M., Misuri G. et al. Assessing inspiratory muscle strength in patients with neurologic and
neuromuscular diseases (comparative evaluation of two non invasive techniques) // Chest. 2001. V. 119.
P. 1108-1113.
120
Оценка силы дыхательных мышц
64. Fitting J.W., Paillex R., Hirt L. et al. Sniff nasal pressure: a sensitive respiratory test to assess progression of
amyotrophic lateral sclerosis //Ann. Neurol. 1999. V. 46. P. 887-893.
65. Stefanutti D., Benoist M.-R., Scheinmann P. et al. Usefulness of sniff nasal pressure in patients with neuromuscular or skeletal disorders //Amer. J. Respir. Crit. Care Med. 2000. V. 162. P. 1507-1511.
66. Stell I.M., Polkey M.I. et al. Inspiratory muscle strenth in acute asthma//Chest. 2001. V. 120. P. 757-764.
67. Stefanutti D., Fitting J.W. Sniff nasal inspiratory pressure. References values in Caucasian children // Amer.
J. Respir. Crit. Care Med. 1999. V. 159. P. 107-111.
68. Mills G.H., Kyroussis D., Hamnegard C.H. et al. Unilateral magnetic stimulation of the phrenic nerve //
Thorax. 1995. V. 50. P. 1162-1172.
69. Markand O.N., Kincaid J.C., Pourmand R.A. et al. Electrophysiologic evaluation of diaphragm by transcutaneous phrenic nerve stimulation // Neurology. 1984. V. 34. P. 604-614.
70. Sarnoflf S.J., Hardenberg E., Whittenberger J.L. Electrophrenic respiration // Science. 1948. V. 108. P. 482.
71. Similowski T, Derenne J.P. Stimulation phrfcnique // Rev. Mai. Respir. 1995. V. 12. P. 503-504.
72. Similowski T, Fleury B., Launois S. et al. Stimulation magn6tique cervicale (SMC). Une nouvelle m6thode
de stimulation phitnique bilatfcrale utilisable en clinique // Rev. Mai. Respir. 1988. V. 5. P. 609-614.
73. Similowski T, Fleury B., Launois S. et al. Cervical magnetic stimulation: a new painless method for bilateral phrenic nerve stimulation in conscious humans//J. Appl. Physiol. 1989. V. 67. P. 1311-1318.
74. Wragg S., Aquilina R., Moran J. et al. Comparison of cervical magnetic stimulation and bilateral percutaneous electrical stimulation of the phrenic nerves in normal subjects // Eur. Respir. J. 1994. V. 7.
P. 1788-1792.
75. Mills G., Kyroussis D., Hamnegard C. et al. Bilateral magnetic stimulation of the phrenic nerves from an
anterolateral approach //Amer. J. Respir. Crit. Care Med. 1996. V. 154. P. 1099-1105.
76. Polkey M.I., Duguet A., Luo Y. et al. Anterior magnetic phrenic nerve stimulation: laboratory and clinical
evaluation // Intensive Care Med. 2000. V. 26. P. 1065-1075.
77. Mills G.H., Ponte J., Hamnegard C.H. et al.Tracheal tube pressure change during magnetic stimulation of
the phrenic nerves as an indicator of diaphragm strength on the intensive care unit // Br. J. Anesth. 2001.
V. 87. P. 876-880.
78. Hamnegard C.H., Wragg S., Kyroussis D. et al. Mouth pressure in response to magnetic stimulation of the
phrenic nerves//Thorax. 1995. V. 50. P. 620—624.
79. Hughes P.D., Polkey М.1., Kyroussis D. et al. Measurement of sniff nasal and diaphragm twitch mouth pressure in patients // Thorax. 1998. V. 53. P. 96-100.
121
Цветные иллюстрации к главе 5
Мышцы вдоха
Г рудино-ключично-сосцевидные
мышцы
Трапециевидная
мышца
Лестничные
мышцы
Наружные межреберные
мышцы
Окологрудинная
Мышцы выдоха
Диафрагма
Внутренние межреберные
мышцы
Наружная косая
мышца живота
Прямая мышца живота
Внутренняя косая
мышца живота
Поперечная
мышца живота
Рис. 1. Дыхательные мышцы, обеспечивающие альвеолярную вентиляцию. (По Hill N.S.
Current concepts in mechanical ventilation for chronic obstructive pulmonary disease // Semin.
Respir. Crit. Care Med. 1999. V. 20. P. 375.)
Рис. 2. Упрощенная схема работы дыхательных мышц при изменении объема легких.
(По Черняк А.В. Тренировка инспираторных
мышц у больных обструктивными заболеваниями легких //Атмосфера. Пульмонология
и аллергология. 2009. № 2. С. 6.)
Гпава 6
Анализ газов
артериальной крови
Анализ газов артериальной крови (АГАК) является важнейшим методом оценки
функции респираторного аппарата [1]. Современные газоанализаторы непосредственно измеряют парциальное давление кислорода (Ра02), парциальное давление
углекислого газа (РаС02), концентрацию ионов водорода (pH), общее количество
гемоглобина, степень насыщения гемоглобина кислородом (Sa02, синоним: сатурация артериальной крови; сатурация оценивается как отношение в процентах количества оксигемоглобина (02НЬ) к общему количеству гемоглобина в данном объеме
крови), насыщение других форм гемоглобина, таких как карбоксигемоглобин
(СОНЬ) и метгемоглобин (MetHb). Все остальные показатели обычно являются расчетными, т.е. производными от измеренных (например, уровень бикарбонатов плазмы и избыток/дефицит оснований) [2]. Нормальные значения параметров АГАК
представлены в табл. 1.
Исследование газового состава артериальной крови позволяет ответить на ряд
клинических вопросов: есть ли нарушения газообмена? есть ли гипоксемия? существует ли задержка двуокиси углерода в организме больного? каков кислотно-основной статус?
Принципы исследования
газового состава артериальной крови
Большинство газоанализаторов для измерения Ра02 используют электрод Кларка, или полярографический тип электрода [3]. В этой системе электроны, исходящие из катода, вступают в реакцию с растворимым кислородом:
02 + 2Н20 + 2е- -> Н202 + 20Н"
Н202 + 2е- 20Н-
Для восстановления каждой молекулы кислорода используется 4 электрона, таким образом, генерированный общий ток пропорционален количеству растворен-
Таблица 1. Нормальный газовый состав артериальной крови*
Параметр
Нормальные значения
Параметр
Нормальные значения
pH
7,35-7,45
MetHb, %
<2,0
РаС02, мм рт. ст.
35-45
СОНЬ, %
<3,0
Ра02, мм рт. ст.
70—100**
Избыток оснований
(-2)-(+2)
Sa02, %
93-98
(BE), мэкв/л
НСО/, мэкв/л
22-26
Са02, мл 0-,/дл
16-22
Обозначения: НСО/ - бикарбонаты, Са02 - содержание кислорода.
* На уровне моря.
** Зависят от возраста.
122
Анализ газов артериальной крови
ного кислорода, т.е. Ра02. В электроде Кларка катод и анод находятся в растворе
электролита, отделенного от крови (или другой исследуемой жидкости) мембраной,
проницаемой для кислорода.
Для измерения РаС02 и pH используется тот же базисный принцип. В рН-элект-
роде кровь поступает в капиллярную трубку из pH-чувствительного стекла, омываемого буферным раствором, который поддерживает pH снаружи трубки на постоянном уровне. Электрический потенциал, создающийся при прохождении через стекло, пропорционален pH образца крови внутри капилляра [3J.
С02-электрод — электрод из pH-чувствительного стекла, погруженный в бикар-
бонатный раствор и покрытый мембраной, проницаемой для С02. Когда кровь проходит с внешней стороны мембраны, С02 диффундирует в бикарбонатный буфер и
взаимодействует с водой:
со2 + н2о -> Н2С03 -эНН НС03-
Затем измеряется pH, как описано выше, и система может калиброваться для
РаС09, потому что pH изменяется в линейной зависимости от логарифма РаС02.
Оценка оксигенации
Насыщение артериальной крови кислородом
Основной способ переноса кислорода от альвеол к легочным капиллярам — в виде его соединения с гемоглобином внутри эритроцита. Степень насыщения артериальной крови кислородом (Sa02, сатурация) - это выраженная в процентах доля гемоглобина, связанного с кислородом. Чаще всего сатурация оценивается неинвазивно при помощи пульсоксиметра, но также может измеряться и газоанализатором.
Критический уровень Sa02, ниже которого наступает тканевая гипоксия, неизвестен, что связано с множеством причин гипоксии. Снижением считают Sa02 <93% в
покое или десатурацию (т.е. падение Sa02) на 4-5% и более при физической нагрузке, однако данные параметры нельзя рассматривать изолированно от других клинических и функциональных признаков [4]. Например, Sa02 95% в покое может считаться сниженной, если ранее у пациента она составляла 99%.
Парциальное давление кислорода в артериальной крови
Лишь небольшое количество кислорода, растворенного в плазме крови, переносится от альвеол к легочным капиллярам. Парциальное давление кислорода в артериальной крови (Ра02) — это давление кислорода, растворенного в плазме, которое
измеряется при помощи газоанализатора. Как и для сатурации, критический порог
Ра02, при котором наступает тканевая гипоксия, не установлен. Однако считается,
что Ра02 <80 мм рт. ст. является патологическим, хотя данный показатель, как и
Sa02, нельзя рассматривать обособленно от других параметров [5]. Необходимо подчеркнуть, что вклад величины Ра02 в содержание кислорода в артериальной крови
несущественный, но измерение Ра02 целесообразно для оценки эффективности газообмена в легких.
Ра02 зависит от возраста — для нормальных (должных) значений применяется
следующая формула [6]:
Ра02 = 104,2 - 0,27 х возраст (в годах).
123
Гпава 6
Взаимоотношения Ра02 и Sa02
Зависимость Sa02 от Ра02 можно представить графически в виде кривой диссоциации оксигемоглобина. Кривая имеет сигмовидную форму, при этом ее левая
часть (Ра02 <60 мм рт. ст.) имеет крутой наклон, а правая (Ра02 >60 мм рт. ст.) относительно пологая. Нижний участок кривой диссоциации оксигемоглобина показывает, что при снижении Ра02 продолжается насыщение гемоглобина кислородом,
т.е. ткани продолжают извлекать достаточное количество кислорода из крови. Верхняя пологая часть кривой демонстрирует относительное постоянство насыщения гемоглобина кислородом, а следовательно, и содержания кислорода в крови независимо от изменений Ра02 (рис. 1).
Положение кривой диссоциации оксигемоглобина зависит от сродства гемоглобина к кислороду. При снижении сродства гемоглобина к кислороду, т.е. при облегчении перехода кислорода в ткани, кривая сдвигается вправо. Повышение сродства
гемоглобина к кислороду означает меньшее высвобождение кислорода в тканях, при
этом кривая диссоциации сдвигается влево. Важным показателем, отражающим
сдвиги кривой диссоциации оксигемоглобина, является параметр Р50, т.е. такое парциальное давление кислорода, при котором гемоглобин насыщен кислородом на
50% (см. рис. 1). У человека в нормальных условиях (при температуре 37°С, pH 7,4 и
РаС02 40 мм рт. ст.) Р5() = 27 мм рт. ст. При сдвиге кривой диссоциации вправо Р50
увеличивается, а при сдвиге влево снижается.
На сродство гемоглобина к кислороду оказывают влияние множество метаболических факторов, к числу которых относятся pH, РС02, температура, концентрация
2,3-дифосфоглицерата (2,3-ДФГ) в эритроцитах. Снижение pH, повышение РС02 и
температуры приводят к уменьшению сродства гемоглобина к кислороду и смещению кривой вправо. Такие метаболические условия создаются в работающих мышцах, и такой сдвиг кривой является физиологически выгодным, так как повышенное
высвобождение кислорода необходимо для активной мышечной работы. В противоположность этому повышение pH, снижение температуры и РС02 (такие условиях
создаются в легких) смещают кривую диссоциации оксигемоглобина влево и повышают сродство гемоглобина к кислороду, т.е. способствуют переходу деоксигениро-
ванного гемоглобина в оксигемоглобин. Влияние pH и РаС02 на кривую диссоциации называется эффектом Бора.
Ра02, мм рт. ст. Ра02, мм рт. ст. Ра02, мм рт. ст.
Рис. 1. Кривая диссоциации оксигемоглобина. а - зависимость сатурации (Sa02) от парциального давления кислорода (Ра02). Р50 - уровень Ра02 при котором Sa02 равна 50%. По этим
данным рассчитаны зависимости содержания кислорода Са02 от Ра02 для двух разных концентраций гемоглобина: 6-15 г/дл, в - 10 г/дл. (По West J.B. Respiratory Physiology - The
Essentials. 7th ed. Baltimore: Lippincott Williams & Wilkins, 2005.)
124
Анализ газов артериальной крови
Содержание кислорода в артериальной крови
Содержание кислорода в крови (Са02) складывается из кислорода, связанного с
гемоглобином, и кислорода, растворенного в плазме:
Са02 = (1,34 х НЬ х SaO2/100) + (0,0031 х Ра02),
где 1,34 — число Гюфнера, которое показывает, сколько миллилитров кислорода может связать 1 г гемоглобина; 0,0031 — коэффициент растворимости кислорода, т.е.
объем кислорода (в мл), растворенного в 100 мл крови, в расчете на единицу парциального давления (НЬ выражен в г/дл, Sa02 в %, Ра02 в мм рт. ст., Са02 в мл 02/дл
крови). Легко видеть, как уже отмечено выше, что вклад величины Ра02 в содержание кислорода в артериальной крови несущественный (второе слагаемое составляет
при нормальном значении НЬ около 1 % от первого), поэтому часто для простоты используют только первую часть формулы.
Са02 имеет ключевое значение для определения фактического обеспечения органов кислородом [7]. Недостаточное понимание значения Са02 в интенсивной медицине, по-видимому, связано с тем, что в клинической практике нет простых прямых
методов измерения данного показателя. Отсутствуют стандарты нормальных значений Са02. В норме Са02 составляет 18 мл О2/Ю0 мл крови (т.е. 18 объемных процентов; см. табл. 1). Предельно низкими значениями Са02 являются те, при которых организм на периферии переключается на анаэробный обмен и гипоксия достигает
критического предела. Нижняя граница Са02 при острых заболеваниях приблизительно составляет 8 мл 02/100 мл, при хронических заболеваниях — 5 мл О2/Ю0 мл.
Доставка кислорода и потребление кислорода
Одним из центральных понятий физиологии дыхания является транспорт, или
доставка, кислорода (Dq2) - объем кислорода, доставляемого тканям в единицу времени. Dq2 является интегральным показателем и зависит от содержания кислорода в
крови и сердечного выброса (О, синоним: минутный объем крови; это объем крови,
прокачиваемый сердцем в единицу времени):
Dq2 = Са02 х Q.
Поскольку сердечный выброс пропорционален поверхности тела, для сравнения
транспорта кислорода у разных людей его значения обычно приводят из расчета на
единицу поверхности тела, при этом нормальное значение Dq2 колеблется от 520 до
720 мл 02/мин/м2 [8].
Заключительным этапом транспорта кислорода является потребление кислорода
тканями (V0 ). С помощью правила Фика (хотя его часто называют уравнением
Фика, по сути это просто следствие закона сохранения вещества) Vq2 рассчитывается как произведение сердечного выброса и артериовенозной разницы в содержании
02 (Са02 - Cv02):
V02 = Q х (Ca02 - Cv02), или
V02 = О х (13,4 х НЬ) х (Sa02 - SvO2)/100,
где Sv02 — насыщение кислородом смешанной венозной крови, Sa02 и Sv02 выражены в %, О в л/мин, НЬ в г/дл, V02 в мл/мин.
Для сравнения потребления кислорода у разных людей его значения обычно приводят из расчета на единицу поверхности тела. Для этого достаточно вместо сердеч-
125
Гпава 6
ного выброса использовать сердечный индекс, т.е. сердечный выброс на единицу поверхности тела. При нормальных значениях сердечного индекса 2,5—3,5 л/мин/м2
величина Vq2 колеблется от 110 до 160 мл/мин/м2.
Большинство тканей не в состоянии запасать кислород впрок (за исключением
мышечной; так, скелетные мышцы сохраняют кислород при помощи миоглобина,
способного связывать до 14% общего количества кислорода в организме), поэтому
поглощение кислорода из капилляров зависит от метаболических потребностей
(кроме случаев нарушения способности извлекать кислород из капиллярной крови).
Когда поглощение кислорода ухудшается, показатель V02 будет определять скорость
метаболических процессов. Обычно такая ситуация возникает у больных, находящихся в критическом состоянии, и подробно описана при сепсисе, множественных
травмах, ожогах.
Теоретически величина D02 является максимумом потребления кислорода V02.
Однако на практике ткани не могут использовать весь доставленный кислород, и в
стабильном состоянии доставка кислорода примерно в 4 раза превышает Vq2. Коэффициент тканевой экстракции кислорода (КЕ02) определяется как выраженное в
процентах отношение V02 к Dq2:
KeO2 = VO2/DO2x100%.
В норме примерно 25% кислорода экстрагируется из артериальной крови тканями, а остальной кислород возвращается к сердцу в составе смешанной венозной крови. Это позволяет тканям приспосабливаться к снижению Dq2 за счет увеличения его
утилизации. КЕ02 при тяжелой мышечной работе может повышаться до 60-80%.
Альвеолярное артериальный градиент по кислороду
Альвеолярно-артериальный градиент по кислороду (Р[А-а]02) — это разница
между парциальным давлением кислорода в альвеолах (Рад02) и в артериальной
крови (Ра02):
Р[А-а]02 = РаА02 - Ра02.
При этом Ра02 измеряется при помощи газоанализатора, а Рад02 рассчитывается
по формуле
РаА02 = FiO, х (Ратм - РН2о) - PaCO,/RQ,
где Fi02 — фракция кислорода во вдыхаемой смеси (в воздухе 0,21), Ратм — атмосферное давление (760 мм рт. ст. на уровне моря), PHlQ - парциальное давление паров воды (при температуре 37°С составляет 47 мм рт. ст.), RQ — дыхательный (респираторный) коэффициент (в стабильном состоянии равен 0,8, но зависит от утилизации углеводов, белков, жиров и т.д.).
Возможно использование упрощенной формулы
Р[А-а]02 = 147 - (Ра02 + 1,25 х РаС02).
В норме Р[А-а]0-> равен 8—15 мм рт. ст. Альвеолярно-артериальный градиент по
кислороду с возрастом увеличивается — для нормальных (должных) значений применяется следующая формула [9]:
Р[А-а]02 = 2,5 + 0,21 х возраст (в годах).
126
Анализ газов артериальной крови
Кроме того, Р[А-а]02 возрастает при повышении Fi02. Когда больной получает
кислородно-воздушные смеси с высоким Fi02, увеличиваются и Рад02, и Ра02. Однако РаА02 повышается диспропорционально, что и приводит к увеличению альвеолярно-артериального градиента. В одном из исследований было показано, что при
дыхании 100% кислородом у мужчин моложе 40 лет Р[А-а]02 варьировал от 8 до
82 мм рт. ст., а у мужчин старше 40 лет — от 3 до 120 мм рт. ст. [10].
Отношение Pa02/Fi02
Отношение Pa02/Fi02 — еще один широко используемый параметр оксигенации.
В норме Pa02/Fi02 равно 300—500 мм рт. ст., значения менее 300 мм рт. ст. говорят о
наличии гипоксемии, а менее 200 мм рт. ст. — о тяжелой гипоксемии [11]. Например,
у больного с Ра02 60 мм рт. ст., получающего кислород с Fi02 0,50 (т.е. 50%),
Pa02/Fi02 составляет 120 мм рт. ст.
Pa02/Fi02 является наиболее популярным параметром оксигенации, используемым в интенсивной терапии, и на нем основаны некоторые диагностические критерии (например, при остром респираторном дистресс-синдроме - ОРДС), но, как недавно показали некоторые исследования, данный показатель имеет очень высокую
вариабельность и сравнивать Pa02/Fi02 возможно только при сходных Fi02 [12].
Альвеолярно-артериальное отношение
Альвеолярно-артериальное отношение (Ра02/Рад02) часто используется для прогнозирования сдвигов Ра02 при изменениях Fi02 [11, 13, 14]. Нижняя граница отношения равна 0,77—0,82, и данный показатель более надежен при Fi02 менее 0,55 (т.е.
55%) [13].
Насыщение смешанной венозной крови кислородом
Насыщение смешанной венозной крови кислородом (Sv02) используется не
только для оценки оксигенации, но и для оценки баланса между доставкой и потреблением кислорода.
Выражение, определяющее Sv02, легко получить из уравнения Фика:
V0, = Q х (13,4 х Hb) х (Sa02 - SvO2)/100,
откуда следует, что
Sv02 = Sa02 — ЮО х V0l/(13,4xQx Hb),
где Hb выражен в г/дл.
Таким образом, снижение Sv02 может быть связано со снижением Sa02, гемоглобина, сердечного выброса или с повышениемУ0,. Наиболее важным фактором
в формуле для Sv02 является отношение потребления кислорода к сердечному
выбросу (Vq2/0). Sv02 служит суррогатным маркером тканевой экстракции кислорода:
Sv02 = 100- кЕо2.
При изменении КЕ07, что наблюдается при септическом шоке, Sv07 больше не
гарантирует корректную интерпретацию тканевой оксигенации.
Sv02 в норме равно 68—77%. При Sv02 <65% у больных с шоком необходимо проведение мероприятий, направленных на повышение доставки кислорода (повыше¬
127
Гпава 6
ние сердечного выброса, Sa02, гемоглобина крови) и предотвращение тканевой гипоксии [15].
Sv02 измеряется прямым способом. Это обусловлено S-образной формой кривой
диссоциации оксигемоглобина: Sv02 попадает на крутую часть кривой и может существенно варьировать даже при незначительной ошибке в измерении. Sv02 определяют с помощью спектрофотометрии: in vitro (при помощи газоанализатора) или
in vivo (при помощи специального фиброоптического катетера, находящегося в легочной артерии), с помощью данного метода можно осуществлять постоянное мо-
ниторирование уровня Sv02.
Альтернативой измерению насыщения смешанной венозной крови кислородом
может быть измерение насыщения кислородом центральной венозной крови
(Scv02). Этот показатель определяется намного проще, чем Sv02, поскольку не требует катетеризации легочной артерии. В нескольких исследованиях показана хорошая корреляция между Sv02 и Scv02. Показатель Scv02 недавно был использован для
назначения ранней «направленной терапии» у больных с тяжелым сепсисом [16].
При Scv02 <70% рекомендовано проведение мероприятий, способствующих повышению доставки кислорода.
Патофизиологические механизмы
артериальной гипоксемии
Основными механизмами гипоксемии являются [17]:
• снижение парциального давления кислорода во вдыхаемом воздухе;
• общая гиповентиляция легких;
• нарушения диффузии газов через альвеолярно-капиллярную мембрану;
• нарушение вентиляционно-перфузионных отношений;
• шунт (прямой сброс венозной крови в артериальную систему кровообращения);
• снижение парциального давления кислорода в смешанной венозной крови.
Снижение парциального давления кислорода во вдыхаемом воздухе
Низкое парциальное давление кислорода во вдыхаемом воздухе может отмечаться в результате уменьшения барометрического давления на больших высотах, при
ингаляции отравляющих газов, а также вблизи огня из-за поглощения кислорода
при горении.
Общая гиповентиляция легких
При гиповентиляции легких отмечается увеличение парциального давления
С02 в альвеолах. Поскольку общее давление газа в альвеолах должно оставаться
постоянным, то чем больше в них С02, тем ниже парциальное давление 02 в
альвеолярном воздухе (Рад02). Известно, что каждый миллиметр давления С02 в
альвеолах фактически «вытесняет» 1,25 мм парциального давления 02. При уменьшении содержания кислорода в альвеолах снижается и Ра02. Между парциальным
давлением кислорода и углекислого газа существуют реципрокные взаимоотношения, которые описываются приведенным выше «уравнением альвеолярного
газа»:
РаА02 = Fi02 х (Ратм - 47) - PaC02/RQ,
128
Анализ газов артериальной крови
где в скобках от величины атмосферного давления вычитается величина парциального давления паров воды (РН2о) ПРИ температуре 37°С.
Нарушения диффузии газов через альвеолярно-капиллярную мембрану
При нарушении диффузии газов через альвеолярно-капиллярную мембрану за
время прохождения крови через легочные капилляры не достигается оптимального
равновесия в содержании газов в крови и альвеолах. Этот феномен получил название синдрома «альвеолярно-капиллярного блока». Данный механизм развития ги-
поксемии имеет место при интерстициальных заболеваниях легких — альвеолитах,
интерстициальных фиброзах, саркоидозе, асбестозе, альвеолярном карциноматозе.
Однако нарушение диффузии не является ведущим механизмом развития гипоксе-
мии за исключением большой физической нагрузки, когда уменьшается время нахождения эритроцитов в легочных капиллярах и, соответственно, время, в течение
которого осуществляется диффузия.
Нарушения вентиляционно-перфузионного баланса
Вентиляционно-перфузионный дисбаланс, т.е. нарушение вентиляционно-пер-
фузионных отношений (VA/Q), является наиболее частым механизмом, ведущим к
развитию гипоксемии. Среднее значение VA/Q в нормальных легких составляет
0,8—1,0. При заболеваниях легких отношение VA/Q может колебаться от 0 (перфузи-
руемые, но невентилируемые альвеолы, или шунт) до бесконечности (вентилируемые, но неперфузируемые альвеолы, или «мертвое» пространство). Неравномерность вентиляционно-перфузионных отношений может увеличиваться с возрастом,
при изменении позиции тела, объема легких, а также при заболеваниях дыхательных
путей, альвеол или интерстициальной ткани легких.
Рис. 2. Трехкомпонентная модель для анализа воздействия различных вентиляционно-перфузионных отношений VA/Q на Ра02 и РаС02 (сделано допущение: парциальное давление
02 во вдыхаемом воздухе Р,02 = 150 мм рт. ст.; на рисунке все парциальные давления выражены в мм рт. ст.). а - крайне низкое VA/Q (т.е. ~0), шунт: альвеола перфузируется, но не вентилируется; давление альвеолярных газов равно таковому в смешанной венозной крови, б —
нормальное VA/Q (т.е. ~1): вентиляция альвеолы соответствует перфузии, в - высокое VA/Q
(т.е. -оо), «мертвое» пространство: альвеола вентилируется, но не перфузируется; давление
альвеолярных газов равно таковому во вдыхаемом воздухе. (По Grippi М. Pulmonary Pathophysiology — A Problem-oriented Approach. Baltimore: Lippincott Williams & Wilkins, 2005.)
129
Гпава 6
При различных заболеваниях соответствие процессов вентиляции и перфузии
нарушается, и в этом случае в легких возможно появление двух патологических зон:
с преобладанием участков с высоким (>1) или низким (<1) VA/Q. В первом случае
(«high pattern») альвеолы легких вентилируются при недостатке перфузии (рис. 2).
Эти участки создают объем так называемого «физиологического «мертвого» пространства» (VD). Для эффективной вентиляции важна не сама величина VD, а отношение объема «мертвого» пространства к дыхательному объему (VT). Увеличение
VD/VT означает, что организм в большей мере расходует энергию «вхолостую» и в
меньшей мере — на альвеолярную вентиляцию. Гипоксемия при этом, как правило,
не развивается, однако значительно возрастают энергетические затраты на дыхание.
Примером вентиляционно-перфузионного дисбаланса с высоким отношением
Va/Q являются больные ХОБЛ с преобладанием эмфиземы легких.
Во втором случае («low pattern») в легких присутствуют участки, где есть кровоток, но практически нет вентиляции, а следовательно, и нет газообмена. Притекающая в эту зону венозная кровь оттекает от нее неартериализованной. Смешиваясь с
кровью, оттекающей от вентилируемых участков, она создает так называемое «венозное примешивание» к артериальной крови и становится причиной гипоксемии.
Примером такого распределения вентиляции и перфузии в легких являются больные ХОБЛ с преобладанием бронхита.
Шунтирование крови
При шунтировании обедненная кислородом венозная кровь или полностью минует легочное циркуляторное русло — анатомический шунт (например, при внутри-
сердечных и внутрилегочных сосудистых дефектах), или проходит через сосуды в участках легких, где отсутствует газообмен, - альвеолярный шунт (например, в зонах
полного ателектаза). В этом случае отношение VA/Q приближается к нулю (истинный, или абсолютный шунт) (см. рис. 2). Величина легочного шунта в норме не превышает 5% от сердечного выброса и обусловлена наличием бронхиальной легочной
циркуляции (сосудистой системы, питающей бронхи), благодаря которой оксигенированная в легких кровь возвращается в
левые отделы сердца неоксигенирован-
ной (анатомический шунт). Легочный
шунт несколько увеличивается с возрастом и не зависит от половых различий.
Гипоксемия, причиной которой является внутрилегочный шунт справа налево, плохо поддается кислородотерапии
даже с высокой Fi02 (рис. 3). Величина
внутрилегочного шунта обычно рассчитывается при дыхании 100% кислородом, который устраняет нарушения оксигенации, если они были связаны с нарушением диффузии и низким (но выше
нуля) Va/Q. Шунтовой кровоток рассчитывается с помощью уравнения:
Qs/Q« = (Ссар02 - Са02)/(Ссар02 - Cv02),
Рис. 3. Ответ Ра02 на 100% 02 при различных механизмах развития гипоксемии. (По
West J.В. Respiratory Pathophysiology — The Essentials. 6th ed. Baltimore: Lippincott Williams
& Wilkins. 2003.)
130
Анализ газов артериальной крови
где Qs — шунтовой кровоток; Qt — общий легочный кровоток; Ссар02 — содержание
кислорода в крови легочных капилляров; Са02 — содержание кислорода в артериальной крови; Cv02 — содержание кислорода в смешанной венозной крови.
Для упрощения расчетов в этом уравнении при вычислении Ссар02 парциальное
давление кислорода в капиллярной крови принимают равным парциальному давлению кислорода в альвеолах (рассчитывается по уравнению альвеолярного газа - см.
выше), Cv02 рассчитывают, вычитая 4,5 мл/дл из Са02 при условии нормального
сердечного выброса. Если Ра02 превышает 150 мм рт. ст., т.е. весь гемоглобин насыщен кислородом, то, применяя приведенные выше формулы для содержания кислорода в крови, уравнение шунта можно представить так:
Qs/Qt = 0,0031 х Р[А-а]02/(0,0031 х Р[А-а]02 + C[a-v]02),
где C[a-v]02 = 4,5 мл 02/дл.
Если при дыхании 100% кислородом Ра02 остается ниже 100 мм рт. ст., то величина шунта превышает 30%. Как правило, при быстром повышении шунтового кровотока более чем на 20% требуется проведение респираторной поддержки. При кар-
диогенном отеке легких гиперкапния наблюдается довольно часто, в то время как
при ОРДС гиперкапния встречается только в терминальных стадиях заболевания.
Элиминация С02 происходит в основном через участки легких, где обеспечивается
нормальное отношение вентиляции и перфузии. При величине шунта до 50% от сердечного выброса РаС02 повышается в среднем лишь на 8 мм рт. ст., если отсутствует компенсаторное повышение общей вентиляции, и совсем не повышается, если
происходит даже незначительное увеличение вентиляции.
Снижение парциального давления кислорода
в смешанной венозной крови
Десатурация венозной крови, или «венозная примесь», не является самостоятельной причиной гипоксемии, если отсутствуют другие причины нарушения газообмена. Однако этот фактор имеет большое значение для больных с уже существующими нарушениями газообмена и снижением сердечного выброса. Содержание
кислорода в смешанной венозной крови зависит от нескольких параметров согласно приведенной выше формуле:
Sv02 = Sa02 - 100 х Vq2/(13,4 х Q х Hb).
Из данного математического выражения ясно, что Sv02 зависит от баланса
между доставкой и потреблением кислорода, поэтому любой фактор, нарушающий этот баланс, может привести к снижению Sv02. Этот механизм играет важную
роль в формировании гипоксемии при тромбоэмболии легочных артерий и при
физической нагрузке у больных с различными хроническими легочными заболеваниями.
Основные заболевания, приводящие
к гипоксемической дыхательной недостаточности
Наиболее частыми клиническими ситуациями, приводящими к гипоксемической дыхательной недостаточности (ДН), являются заболевания легочной паренхимы (пневмония, ателектаз, кардиогенный отек легких, ОРДС и др.), диффузные интерстициальные заболевания легких (альвеолиты) и др. (табл. 2) [17].
131
Гпава 6
Таблица 2. Причины острой гипоксемической дыхательной недостаточности
Кардиогенный
отек легких
Левожелудочковая недостаточность
Острая ишемия левого желудочка
Гипертонический криз, злокачественная артериальная гипертензия
Митральная регургитация
Митральный стеноз
Перегрузка объемом, особенно при сочетании с почечной
или сердечной недостаточностью
Отек легких, связанный
с повышенной
проницаемостью
альвеолярнокапиллярной мембраны
(ОРДС)
Наиболее часто:
сепсис и синдром системной воспалительной реакции
аспирация
массивные гемотрансфузии
Менее часто:
утопление
панкреатит
воздушная или жировая эмболия
аортокоронарное шунтирование
пневмония
передозировка лекарств
ингаляционное повреждение
острая интерстициальная пневмония (синдром Хаммена—Рича)
ишемия-реперфузия (например, посттромбэктомический период,
посттрансплантационный период)
Отек легких неясного
или смешанного генеза
Реэкспансионный отек легких
Нейрогенный отек легких
Отек легких после токолиза
Диффузные
альвеолярные
геморрагии
Микроскопический ангиит
Системные заболевания соединительной ткани
Синдром Гудпасчера
Тяжелая коагулопатия и трансплантация костного мозга
Поражение легочного
интерстиция
Поражение легочных
сосудов
Экзогенный аллергический альвеолит
Вирусная или атипичная пневмония
Тромбоэмболия
Легочные васкулиты
Интракардиальный или интрапульмональный шунт
Очаговые поражения
легких
Долевая пневмония
Контузия легких
Ателектаз доли легкого
Поражение плевры
Пневмоторакс
Массивный плевральный выпот
Оценка двуокиси углерода в артериальной крови
Величина РаС02 зависит от метаболических и, главным образом, от респиратор-
ных факторов:
PaC02 = KxVc02/VA,
132
Анализ газов артериальной крови
где К — коэффициент, VC02 — продукция углекислого газа, VA — альвеолярная вентиляция. Учитывая, что альвеолярная вентиляция является разницей между общей
вентиляцией легких (VT) и вентиляцией «мертвого» пространства (VD),
Va = Vt-Vd = Vt(1-Vd/Vt),
где VD/VT - отношение «мертвого» пространства к дыхательному объему.
Следовательно, основными механизмами гиперкапнии являются [18]:
• снижение минутной вентиляции легких (гиповентиляция);
• увеличение физиологического «мертвого» пространства;
• повышение продукции углекислого газа.
Синдром альвеолярной гиповентиляции
Гиповентиляция — снижение альвеолярной вентиляции легких, не соответствующее продукции углекислого газа (см. раздел «Патофизиологические механизмы артериальной гипоксемии»).
Альвеолярная гиповентиляция является следствием нарушения сложных взаимоотношений между центральной регуляцией дыхания (так называемым центральным
респираторным стимулом, или драйвом) и механической работой грудной клетки по
раздуванию легких, которая зависит от функции дыхательной мускулатуры и податливости грудной клетки (рис. 4).
Увеличение объема физиологического «мертвого» пространства
Еще одним важным патофизиологическим нарушением при заболеваниях легких
является повышение физиологического «мертвого» пространства. Физиологическое
«мертвое» пространство слагается из анатомического и альвеолярного «мертвого»
пространства - регионов легких с высоким отношением VA/Q, т.е. с так называемой
«холостой» вентиляцией. Для вычисления физиологического «мертвого» пространства используется уравнение Бора:
VD/VT = (РаС02 - PetC02)/PaC02,
где PctC02 — парциальное давление углекислого газа в конечной порции выдыхаемого воздуха. У здоровых людей почти все функциональное «мертвое» пространство
представлено анатомическим «мертвым» пространством и примерно равно массе тела, выраженной в фунтах. Например, у здорового человека при VT 450 мл и функциональном «мертвом» пространстве 150 мл VD/VT = 0,3. При обострении бронхиальной астмы или ХОБЛ VD/VT может увеличиваться вдвое, а иногда достигает 0,80.
Для поддержания нормального уровня РаС02 требуется значительное повышение
Рис. 4. Взаимоотношения между Ра02 и
РаС02 при гипо- и гипервентиляции, при
условии, что альвеолярно-артериальный
градиент по 02 не меняется и R равен 0,8.
(По Pierson D.J., Hill N.S. Acute Ventilatory
Failure // Murray & Nadel’s Textbook of Respiratory Medicine. 4th ed. / Ed. by Mason R.J.,
Broaddus V.C., Murray J.F., Nadel J.A. Philadelphia: Saunders, 2005.)
133
Гпава 6
Таблица 3. Клиническая классификация вентиляционной ДН
Локализация
или тип
поражения
Механизм
Клинический пример
Респираторный
Фармакологический
Передозировка препаратов (опиоиды,
драйв
седативные, алкоголь); общая анестезия
Врожденный
Первичная альвеолярная гиповентиляция
(синдром «проклятия Ундины»)
Приобретенный
Инсульт, опухоли мозга;
резекция каротидного синуса
Комбинированный
Синдром ожирения—гиповентиляции
Нейрогенные
Повреждение спинного мозга
Травма, опухоль, сосудистая патология
причины
Демиелинизирующие
периферические нейропатии
Синдром Гийена—Барре
Поражение передних рогов
Полиомиелит, боковой амиотрофический
спинного мозга
склероз
Поражение n. phrenicus
Травма; операции на сердце, опухоли,
идиопатический паралич n. phrenicus
Дыхательные
Фармакологический
Миорелаксанты
мышцы
Первичное поражение мышц
Мышечная дистрофия, полимиозит,
дерматомиозит
Нарушения нейромышечной
передачи
Миастения, столбняк, ботулизм
Электролитные
Гипофосфатемия, гипокалиемия,
и метаболические расстройства
гипомагниемия, микседема
Грудная клетка
Ригидность грудной клетки
Кифосколиоз, тяжелое ожирение,
травматическая асфиксия, тугие повязки
на грудной клетке
Заболевания
Экстрапул ьмональная
Пневмоторакс, плевральный выпот,
плевры
рестрикция
шварты
Обструкция
Обструкция верхних
Эпиглоттит, инородное тело, паралич
дыхательных
дыхательных путей
голосовых связок, трахеомаляция
путей
Обструкция нижних
дыхательных путей
ХОБЛ, тяжелое обострение астмы
Повышение
Высокое отношение VA/Q
ХОБЛ
вентиляции
Очень низкое отношение VA/Q;
ОРДС
«мертвого»
шунт справа налево
пространства
Генерализованная легочная
Гиповолемический или кардиогенный
гипоперфузия
шок, гиперинфляция легких
(чрезмерный внешний PEEP; auto-PEEP)
Локализованная легочная
гипоперфузия
Тромбоэмболия*; воздушная эмболия
Повышение
Воспаление, гиперметаболизм
Лихорадка, сепсис, ожоги, тяжелая травма
продукции
Мышечная активность
Судороги, злокачественная гипертермия
со2*
Чрезмерное калорийное питание
Повышенный прием углеводов
Ингаляция
Повышение РаС02
Несчастные случаи (транспорт,
экзогенного
со2
во вдыхаемом воздухе
лаборатория)
* При отсутствии компенсаторного повышения альвеолярной вентиляции.
134
Анализ газов артериальной крови
Таблица 4. Взаимоотношения между pH и
концентрацией ионов водорода
минутной и альвеолярной вентиляции,
и, если аппарат дыхания не в состоянии
повысить вентиляцию до требуемого
уровня, развивается гиперкапния.
У больных с уменьшенным дыхательным объемом вследствие мышечной слабости или рестриктивного заболевания
легких газообмен может улучшиться после наложения трахеостомы, что связано
с уменьшением анатомического «мертвого» пространства (при этом часть отделов верхних дыхательных путей выключается из газообмена). Уменьшение анатомического «мертвого» пространства
происходит и при обширной обструкции легочных сосудов, которая первоначально
ведет к альвеолярной гипокапнии, вызывая рефлекторное сужение дыхательных путей (гипокапническая бронхоконстрикция).
pH
Концентрация
ионов
водорода,
нмоль/л
pH
Концентрация
ионов
водорода,
нмоль/л
6,8
160
7,5
32
7,0
100
7,6
25
7,1
80
7,7
20
7,2
63
7,8
16
7,3
50
8,0
10
7,4
40
Увеличение продукции С02
Следует учитывать определенные ситуации, в которых повышается VC02‘ лихорадка (повышение температуры на каждый градус ведет к повышению VCp2 на 9-14%),
судороги, конвульсии, ажитация (основным механизмом повышения VC02 при этом
является усиление мышечной активности), чрезмерное парентеральное питание,
особенно с высоким содержанием углеводов.
Основные заболевания, приводящие к вентиляционной ДН
К заболеваниям, которые могут быть ассоциированы с гиперкапнической ДН,
относят нарушения центральной регуляции дыхания, нейромышечные заболевания,
болезни грудной клетки и плевры и обструктивные заболевания дыхательных путей
(табл. 3) [18].
pH артериальной крови
Измерение pH позволяет оценить нарушения кислотно-основного состояния метаболического или респираторного генеза. pH — это отрицательный десятичный логарифм концентрации ионов водорода. Это означает, что при ацидозе происходит
увеличение концентрации ионов Н+ и pH снижается, а при алкалозе, соответственно, концентрация Н+ уменьшается и pH увеличивается. Взаимоотношения между
pH и концентрацией ионов водорода представлены в табл. 4. Так как данная зависимость является логарифмической, то она линейна, и поэтому большие изменения
концентрации ионов Н+ могут сопровождаться лишь небольшими изменениями pH.
Изменения pH меняют аффинность кислорода к гемоглобину: ацидемия ослабляет,
а алкалемия усиливает сродство кислорода к гемоглобину [19].
Анализ кислотно-основного состояния крови проводится с использованием
уравнения Гендерсона—Гассельбальха для системы бикарбонатного буфера:
pH = рК + lg ([НС03-]/(0,03 х РаС02)),
135
где рК — константа диссоциации угольной кислоты, равная 6,1.
Диаграмма pH—[НСО^] (рис. 5) представляет собой графическое изображение
уравнения Гендерсона—Гассельбальха и
может быть полезна при оценке реакции
организма на изменение кислотно-основного состояния. Точка А отображает
нормальное состояние: pH 7,4; [НСО^-] =
= 24 мэкв/л; РаС02 = 40 мм рт. ст.
Нарушение вентиляционной способности легких в поддержании кислотноосновного равновесия отражается на
процессе выведения двуокиси углерода.
Метаболические изменения, однако,
вызывают либо увеличение (накопление), либо потерю «связанных кислот»
или бикарбоната в околоклеточной жидкости. Метаболические изменения в
кислотно-основном равновесии могут
быть быстро компенсированы выведением двуокиси углерода за счет увеличения вентиляции. Вслед за этим происходит
медленное выведение почками излишка кислоты или основания.
Повышение РаС02 снижает pH (вызывает ацидоз), и наоборот, снижение РаС02
за счет повышения вентиляции вызывает алкалоз (повышение pH).
Существует четыре формы первичных кислотно-основных расстройств: респираторный ацидоз, респираторный алкалоз, метаболический ацидоз, метаболический
алкалоз.
1. Респираторный ацидоз: результат острой гиповентиляции; РаС02 увеличивается, pH уменьшается. Устойчивое повышение РаС02 стимулирует клетки почечных
канальцев секретировать большее количество водородных ионов, задерживая бикарбонат, в результате содержание бикарбоната в плазме увеличивается, то есть почки компенсируют ацидоз за счет сохранения [НС03~]. В результате pH возвращается
к норме (см. рис. 5: на диаграмме точка В-точка D).
2. Респираторный алкалоз: результат острой гипервентиляции; РаС02 уменьшается, pH увеличивается. Если гипервентиляция сохраняется, например при акклиматизации к высоте, почки выделяют [HCOf], нормализуя pH (см. рис. 5: на диаграмме точка С—точка F).
3. Метаболический ацидоз: результат накопления связанных кислот и снижения
[НС03-] (например, при передозировке аспирина, диабетическом кетоацидозе, лактат-ацидозе или почечной недостаточности). Респираторная система за счет увеличения вентиляции (снижение РаС02) пытается компенсировать эти изменения
(см. рис. 5: на диаграмме точка G—точка F).
4. Метаболический алкалоз: уменьшение связанных кислот, увеличение
[НС03_] (например, при многократной рвоте, приеме внутрь щелочей (антацидов),
избыточной задержке бикарбоната почками) [20]. Респираторная система отвечает на эти изменения уменьшением вентиляции, что приводит к увеличению РаС09
о К
ver В.Н. Acid-base balance and control of ventilation // Clinical Respiratory Medicine / Ed. by
Albert R.K., Spiro S.G., Jett J.R. 3rd ed.
St. Louis: Mosby, 2008.)
136
Анализ газов артериальной крови
(см. рис. 5: на диаграм- Таблица 5. Первичные и вторичные нарушения кислотно-основ-
ме точка Е-точка D). ного состояния
Однако объем дыха- Первичные нарушения
Компенсаторная реакция
тельной компенсации ,, „
Увеличение РаС07
метаболического алка- (респираторный ацидоз)
лоза ограничен, РаС02 Снижение РаСО
не возрастает выше (респираторный алкалоз)
55 мм рт. ст. Взаимоот- снижение содержания НСО“
ношения между РаС02 (метаболический ацидоз)
и pH можно предста- Увеличение содержания НСО^
вить в виде следующих (метаболический алкалоз)
Увеличение содержания НСО^
(метаболический алкалоз)
Снижение содержания НСО^-
(метаболический ацидоз)
Снижение РаС02
(респираторный алкалоз)
Повышение РаС02
(респираторный ацидоз)
правил:
• при повышении РаС02 на 20 мм рт. ст. происходит снижение pH на 0,1;
• при снижении РаС02 на 10 мм рт. ст. происходит повышение pH на 0,1.
Компенсаторные механизмы
Система газообмена обеспечивает компенсацию метаболических изменений в
форме немедленных реакций. На фоне метаболического ацидоза вентиляция легких
усиливается, в результате уменьшается РаС02, противодействующее первичному
снижению концентрации НС03_ в плазме крови. При метаболическом алкалозе легочная вентиляция подавляется, и увеличение РаС02 будет уравновешивать повышение концентрации НС03~ [19].
В процессах компенсации важна также роль почек — регулирование реабсорбции
НС03“ в проксимальных канальцах. При дыхательном (респираторном) ацидозе усиливается реабсорбция анионов бикарбоната и увеличивается содержание НС03_ в
плазме, что препятствует накоплению углекислого газа в крови. На фоне респираторного алкалоза подавляется реабсорбция анионов бикарбоната, а снижение концентрации НС03_ в плазме крови выравнивает пониженное РаС02. В отличие от дыхательной системы компенсаторный ответ почек не немедленный, он начинает развиваться только через 6—12 ч, достигая максимума через несколько суток. В этот период респираторные нарушения компенсируются лишь частично.
Изменение концентрации водородных ионов на 1 мэкв/л приводит к изменению
pH на 0,01. Отношение РаС02/НСО^ указывает на то, что содержание Н+ в плазме
крови прямо пропорционально уровню РаС02 и обратно пропорционально концентрации НС03~. Данное отношение лежит в основе первичных и вторичных нарушений
кислотно-основного состояния, приведенных в табл. 5, при этом биологический
смысл компенсаторных процессов состоит в поддержании указанного отношения на
постоянном уровне. В случае изменения одного из компонентов отношения лечебные
мероприятия следует направить на изменение другого компонента в соответствующем
направлении. Важно подчеркнуть, что компенсаторные механизмы приводят только к
ограничению сдвигов pH плазмы крови, но не предотвращают полностью их развития.
Процедура взятия крови
для анализа газового состава
Артериальную кровь забирают во время чрескожной пункции артерии или через
артериальный катетер. Обычно для пункции используют радиальные, плечевые или
137
Гпава 6
бедренные артерии, т.е. те, которые расположены более поверхностно и доступны
пальпации. Во многих руководствах перед пункцией рекомендуется выполнять местную анестезию лидокаином [21] для уменьшения болезненности процедуры, что
не влияет на ее технику [22]. Некоторые специалисты, однако, придерживаются правила, что «одна болезненная пункция лучше двух». Так как пункция артерии может
вызвать гипервентиляцию, необходимо предпринять попытки для ее минимизации:
использовать иглы малого диаметра, правильную технику процедуры, локальную
анестезию. Обычно образец полученной крови помещают на лед. Все пузырьки воздуха должны быть «выдавлены» из шприца, и шприц должен быть закрыт. Пузырьки
воздуха, попавшие в шприц для забора крови, могут повлиять на результаты АГАК:
сместить Ра02 в сторону значений комнатного воздуха и снизить РаС02.
Осложнения после перкутанной пункции артерии возникают редко и включают
продолжающееся кровотечение, образование кровоподтеков и повреждение артерий — нарушение циркуляции дистальнее места пункции вследствие тромбоза
in situ.
Время от взятия крови до выполнения АГАК должно быть минимальным. Образцы крови должны транспортироваться к газоанализатору в емкости со льдом. Такая
мера снижает потребление кислорода лейкоцитами, приводящее к ложному снижению Ра02 [23]. Данный эффект особенно велик у больных с выраженным лейкоцитозом. Если АГАК выполняется в течение 15 мин после взятия образца крови, использование льда не является необходимым [24]. Для АГАК должно быть получено
как минимум 2 мл крови.
Гепарин в шприце в качестве антикоагулянта может привести к искусственному
снижению результатов pH и «разбавить» РаС02, что также занижает его истинное
значение [25, 26], поэтому количество гепарина в шприце необходимо минимизировать.
Пластиковые шприцы обычно проницаемы для диффузии газов через их стенку,
особенно если Ра02 высок. Стеклянные шприцы, хотя используются нечасто, в этом
плане более предпочтительны, так как позволяют в условиях «ледяной бани» сохранять стабильный состав газов в пробе до 3 ч [27].
Исследователь должен всегда указывать в протоколе исследования, дышал ли пациент комнатным воздухом или кислородом в повышенных концентрациях, а также
положение пациента в момент взятия крови (лежа на спине или вертикальное), поскольку парциальное давление кислорода в артериальной крови в положении лежа
на спине может быть ниже, чем в вертикальном положении [2, 3].
Список литературы
1. Cerveri I., Zoia М.С., Fanfulla F. et al. Reference values of arterial oxygen tension in the middle-aged and
elderly//Amer. J. Respir. Crit. Care Med. 1995. V. 152. P. 934-941.
2. Arunabh A., Feinsilver S.H. Respiratory monitoring// Respir. Care Clin. North Amer. 2000. V. 6. P. 523-543.
3. Zimmerman J.L., Dellinger PL. Blood gas monitoring// Crit. Care Clin. 1996. V. 12. P. 865-874.
4. ATS/ACCP Statement on cardiopulmonary exercise testing//Amer. J. Respir. Crit. Care Med. 2003. V. 167.
P.211-277.
5. Hansen J.E., Sue D.Y., Wasserman K. Predicted values for clinical exercise testing //Amer. Rev. Respir. Dis.
1984. V. 129. P. S49.
6. Delclaux B., Orcel B., Housset B. et al. Arterial blood gases in elderly persons with chronic obstructive pulmonary disease (COPD) // Eur. Respir. J. 1994. V. 7. P. 856-861.
7. Кёлер Д. Показатель Ca02 для оценки обеспечения органов кислородом. Клиническое значение содержания кислорода // Пульмонология. 2008. № 3. С. 102-106.
138
Анализ газов артериальной крови
8. Van Woerkena E.C.S.M., Trouwborst A., van Lanschott J.J.B. Profound hemodilution: what is the critical
level of hemodilution at which oxygen delivery-dependent oxygen consumption slarts in an anesthetized
human?//Anesth. Analg. 1992. V. 75. P. 818-821.
9. Mellemgaard K. The alveolar-arterial oxygen difference: its size and components in normal man // Acta
Physiol. Scand. 1966. V. 67. P. 10-20.
10. Kanber G.J., King F.W., Eshchar Y.R., Sharp J.T. The alveolar-arterial oxygen gradient in young and elderly men during air and oxygen breathing // Amer. Rev. Respir. Dis. 1968. V. 97. P. 376-381.
11. Covelli H.D., Nessan V.J., Tuttle W.K. Oxygen derived variables in acute respiratory failure // Crit. Care
Med. 1983. V. 11. P.646-649.
12. Karbing D., Kjaergaard S., Smith B. et al. Variation in the Pa02/Fi02 ratio with Fi02: mathematical and
experimental description, and clinical relevance // Crit. Care. 2007. V. 11. P. R118.
13. Gilbert R., Keighley J.F. The arterial/alveolar oxygen tension ratio. An index of gas exchange applicable to
varying inspired oxygen concentrations //Amer. Rev. Respir. Dis. 1974. V. 109. P. 142.
14. Peris L.V., Boix J.H., Salom J.V. et al. Clinical use of the arterial/alveolar oxygen tension ratio // Crit. Care
Med. 1983. V. 11. P.888-891.
15. Ousmane M.L., Lebuffe G., Vallet B. Utilisation de la Sv02 // Reanimation. 2003. V. 12. P. 109—116.
16. Rivers E., Nguyen B., Havstad S. et al. Early Goal-Directed Therapy Collaborative Group: early goal-directed therapy in the treatment of severe sepsis and septic shock // N. Engl. J. Med. 2001. V. 345. P. 1368-1377.
17. Авдеев C.H. Острая гипоксемическая дыхательная недостаточность, включая острый респираторный дистресс-синдром // Респираторная медицина: Руководство / Под ред. А.Г. Чучалина. М., 2007.
Т. 2. С. 668-681.
18. Авдеев С.Н. Острая вентиляционная дыхательная недостаточность// Респираторная медицина: Руководство / Под ред. А.Г. Чучалина. М., 2007. Т. 2. С. 681-699.
19. Марино П. Алгоритмы интерпретации показателей кислотно-основного состояния // Интенсивная
терапия. М., 1998. С. 383-392.
20. Javaheri S., Kazemi Н. Metabolic alkalosis and hypoventilation in humans//Amer. Rev. Respir. Dis. 1987.
V. 136. P. 1011-1016.
21. Guidelines for the measurement of respiratory function: recommendations of the British Thoracic Society
and the Association of Respiratory Technicians and Physiologists // Respir. Med. 1994. V. 88. P. 165.
22. Lightowler J.V., Elliott M.W. Local anaesthetic infiltration prior to arterial puncture for blood gas analysis: a
survey of current practice and randomized double-blind placebo-controlled trial // J. R. Coll. Physicians
Lond. 1997. V. 31. P.645-646.
23. Hess C.E., Nichols A.B., Hunt W.B., Suratt P.M. Pseudohypoxemia secondary to leukemia and thrombocytosis//N. Engl. J. Med. 1979. V. 301. P. 361.
24. Hansen J.E. Arterial blood gases [review] // Clin. Chest Med. 1989. V. 5. P. 227-237.
25. Bageant R.A. Variations in arterial blood gas measurements due to sampling techniques // Respir. Care.
1975. V. 20. P.565.
26. Hansen J.E., Simmons D.H. A systematic error in the determination of blood PC02 // Amer. Rev. Respir.
Dis. 1977. V. 115. P. 1061-1063.
27. Canham E.M. Interpretation of arterial blood gases // Critical care secrets / Eds. PE. Parsons, J.P. Weiner-
Kronish. 3rd ed. Philadelphia: Hanley and Belfus, Inc., 2003. P. 21-24.
139
Лабораторные
нагрузочные тесты
Физическая нагрузка требует существенного напряжения и тесного взаимодействия основных физиологических механизмов, которые позволяют сердечно-сосудистой и респираторной системам поддерживать возрастающие метаболические потребности организма. Оценка функционального состояния системы транспорта газов, необходимой для поддержания тканевого (клеточного) дыхания, очень важна,
так как при многих патологических состояниях функционирование этой системы
нарушается.
Для удовлетворения возрастающих во время нагрузки энергетических потребностей мышечной клетки необходимо тесное взаимодействие физиологических
компенсаторных механизмов на уровне легких, легочного кровообращения, сердца и системного кровообращения (рис. 1). Значительное повышение утилизации
Мышечная Транспорт Вентиляция
активность 02 и С02 (VA + VD = VE)
Периферическая Легочная
циркуляция циркуляция
То0г Тчсс Тчд
Рис. 1. Механизмы газового транспорта и взаимосвязи тканевого (или клеточного) и легочного (или внешнего) дыхания. (По Wasserman et al. [ 1 ].) Зубчатые колеса означают функциональную взаимосвязь отдельных компонентов системы.0С)2 — утилизация 02 мышцами, QCOl - продукция С02, Мито - митохондрия, ЛЖ - левый желудочек, ПЖ - правый желудочек, УО -
ударный объем, ЧСС — частота сердечных сокращений, VT - дыхательный объем, ЧД - частота дыхания, VE — легочная вентиляция, VA — альвеолярная вентиляция, VD — вентиляция
«мертвого» пространства, V0l - потребление 02, VC02 - продукция С02, измеренная эргоспирометрическим методом.
Лабораторные нагрузочные тесты
кислорода мышцами (0о2) достигается увеличением экстракции кислорода из
крови, снабжающей эти мышцы, селективной дилатацией периферических сосудов, усилением легочного кровотока путем мобилизации и дилатации сосудов малого круга и, наконец, повышением уровня вентиляции. Кислород захватывается
кровотоком из альвеол пропорционально скорости кровотока и обратно пропорционально степени насыщения гемоглобина кислородом. В устойчивом состоянии потребление кислорода V02 = Qo2- Минутная вентиляция (дыхательный объем VT, умноженный на частоту дыхания f) возрастает в зависимости от количества
вновь образованного углекислого газа (0со2)> поступающего в легкие, и центральных механизмов регуляции pH и парциального давления С02 в артериальной крови [1].
Для чего проводят кардиореспираторное
нагрузочное тестирование?
Лабораторные тесты с физической нагрузкой находят все более широкое применение в клинической практике по двум основным причинам:
• их результаты способны влиять на принятие клинических решений;
• исследование кардиореспираторной функции в покое не дает возможности полностью оценить функциональный статус пациента.
Снижение толерантности к физической нагрузке можно определить как неспособность успешно выполнить требуемую физическую работу. Другими словами, с
клинической точки зрения это состояние, когда пациент не может выполнить нагрузку, которую способен выполнить здоровый человек. В то же время снижение толерантности к физической нагрузке (часто оцениваемое по показателю максимального потребления кислорода V02 тах) ПРИ легочных и сердечных заболеваниях не всегда может прогнозироваться по физиологическим параметрам, измеренным в покое
(таким как ОФВр диффузионная способность легких, фракция выброса, индекс
массы тела и др.) [2—6]. Поэтому в каждом случае, когда это возможно, необходимо
индивидуально исследовать толерантность к физической нагрузке и определять
причины ее снижения.
Эргоспирометрическое исследование (ЭСМ), или кардиореспираторный нагрузочный тест (КРЫТ), считается «золотым стандартом» оценки причин снижения толерантности к физической нагрузке у пациентов с легочными и сердечными заболеваниями [7, 8]. Исследование основано на принципе, что системная недостаточность обычно возникает, когда система (мышечная, сердечно-сосудистая, легочная)
находится в состоянии стресса. КРЫТ представляет собой тест с нарастающей физической нагрузкой с мониторированием кардиореспираторных параметров (например, потребление кислорода, продукция углекислого газа, минутная вентиляция,
ЧСС и др.) при каждом дыхательном цикле, с одновременным мониторированием
ЭКГ в 12 отведениях, артериального давления (АД) и субъективной симптоматики
(одышка, усталость ног). При необходимости можно оценивать и другие параметры,
такие как степень насыщения гемоглобина артериальной крови кислородом (сатурация, Sa02), динамическая гипервоздушность и др.
КРИТ позволяет получить информацию, которую невозможно получить при
проведении внелабораторных нагрузочных тестов:
1) объективно определить функциональные возможности (V02 тах);
141
Гпава 7
2) установить механизмы нарушения физической работоспособности, или вклад
различных систем организма в выполнение нагрузки (сердце, легкие, кровь, скелетные мышцы);
3) провести дифференциальный диагноз между сердечной и легочной патологией;
4) выявить причины снижения толерантности к физической нагрузке и диспноэ
при нагрузке;
5) мониторировать прогрессирование заболевания и ответ на лечение;
6) определить уровень интенсивности, необходимый для поддержания длительной нагрузки;
7) выбрать нагрузочные режимы для проведения кардиореспираторной реабилитации [9—11].
При тщательном мониторировании ЭКГ и показателей сатурации максимальные
нагрузочные тесты могут проводиться достаточно безопасно у большинства пациентов с респираторными заболеваниями [12, 13].
Основные параметры
и их физиологическое значение
Потребление кислорода. Факторы, обеспечивающие достаточный уровень потребления кислорода, зависят от характеристик крови, определяющих транспорт
кислорода (уровень гемоглобина, Sa02), функции сердца (ЧСС, УО), перераспределения периферической крови и экстракции кислорода тканями (плотность капилляров, митохондрий, адекватность перфузии, тканевая диффузия).
Зависимость потребления кислорода от нагрузки. В норме Vq2 возрастает почти
линейно по мере увеличения нагрузки. Заданная скорость увеличения нагрузки достаточно точно измеряется на велоэргометре, но только приблизительно может
быть оценена при использовании бегущей дорожки (тредмила). Отношение изменения V02 к изменению мощности нагрузки (W) отражает эффективность метаболических процессов перехода потенциальной химической энергии в механическую
работу и механическую эффективность мышечно-скелетной системы. Отношение
изменения Vg2 к изменению мощности нагрузки W во время теста с возрастающей
нагрузкой (AVq2/AW) в норме обычно составляет от 8,5 до 11 мл/мин/Вт и зависит
от пола, возраста и роста.
Vo2max и ^о2 peak* Поскольку V02 возрастает при увеличении нагрузки, любой из
факторов, определяющих потребление кислорода (например, ударный объем сердца, и/или число сердечных сокращений, и/или экстракция кислорода тканями), может достигать своего физиологического предела. Прекращение увеличения V02 и достижение истинного плато этого показателя являются признаком того, что достигнут максимальный уровень V02 (V02 max). V02 max является наилучшим показателем
аэробной способности и «золотым стандартом» в кардиореспираторном нагрузочном тесте. Он отражает максимально достижимый уровень аэробного метаболизма,
в том числе в большой группе мышц. Однако в конкретных клинических ситуациях
истинное плато иногда не достигается из-за появления ограничивающих нагрузку
симптомов. Поэтому для оценки Vq2 max часто используют величину потребления
кислорода при появлении ограничивающих нагрузку симптомов (V02 peak)- Таким образом, Vo2 max и Vo2Peak ПРИ практическом использовании взаимозаменяемы. Они надежны и воспроизводимы у здоровых лиц и у пациентов, зависят от генетических
142
Лабораторные нагрузочные тесты
факторов, мышечной массы, возраста, пола, роста, массы тела, а также от тренированности субъекта.
Показатель Vq2 max часто соотносится с некоторыми антропометрическими индексами, наиболее часто — с массой тела. Однако при этом не учитывается различная скорость метаболизма у индивидуумов разного роста и массы тела, так как здоровый человек небольшого роста и массы тела имеет более высокое значение V02 на
килограмм массы тела, чем крупный индивидуум. Поскольку метаболизм жиров не
оказывает значительного влияния на V02 max, его оценка относительно массы тела у
тучных людей приводит к занижению показателя.
Рекомендуется выражать показатели V02 max и V02 peak как в абсолютных значениях, так и в процентах от должных величин. Кроме того, в протоколе исследования
необходимо указывать отношение V02 max к массе тела в килограммах и/или к росту,
чтобы было очевидным влияние размеров тела на результаты нагрузочного теста.
Это особенно важно для тех пациентов, у которых реальная масса тела значительно
больше идеальной.
Потребление кислорода у человека в состоянии покоя составляет в среднем
250 мл/мин, в расчете на килограмм массы тела 3,5 мл/мин/кг, а на фоне нагрузки может повышаться в 15 раз (от 30 до 50 мл/мин/кг). У спортсменов при нагрузке Vo2max
может повышаться в 20 раз (до 80 мл/мин/кг) по сравнению с состоянием покоя.
Снижение V02 max (V02peak) может свидетельствовать о нарушении транспорта кислорода (изменения сердечного выброса, свойств крови, отвечающих за транспорт
кислорода), о легочной патологии (нарушения механических свойств легких, центральной регуляции дыхания, газообмена), нарушении экстракции кислорода тканями (изменения тканевой перфузии и диффузии), нейромышечной и мышечно-скелетной патологии и, конечно, о недостаточном усилии при выполнении нагрузочного теста. Таким образом, изменение V02 max зависит от множества самых различных
факторов.
Снижение V02max или V02peak отражает, главным образом, снижение способности
выполнять физическую работу. В клинической практике оба показателя будут отражать максимальный уровень V02: V02 max — при достижении плато, V02 peak — при появлении ограничивающих нагрузку симптомов, даже если плато V02 не определяется.
Продукция углекислого газа, измеренная эргоспирометрическим методом (VC02)
во время физической нагрузки, определяется теми же факторами, которые обусловливают уровень потребления 02. Это в первую очередь сердечный выброс и характеристики крови, определяющие транспорт С02, от которых зависит газообмен в тканях. Однако поскольку С02 более, чем 02, растворим в тканях и в крови, то VC02 зависит от вентиляции в большей степени, чем V02. Кроме того, поскольку раствор С02
является слабой кислотой, организм включает механизмы регуляции уровня С02
для устранения острого метаболического ацидоза, который влияет на паттерн VC02
при возрастании интенсивности физической нагрузки после достижения точки перехода на анаэробный метаболизм.
Для получения энергии во время кратковременных физических нагрузок используется гликоген непосредственно из мышечной ткани, и соотношение между потреблением 02 и выделением С02 практически эквимолярное. При нарастании физической нагрузки VCo2 повышается почти так же, как и V02, со средним отношени-
ем VCo2/Vo2 чуть меньше 1 (рис. 2, отрезок кривой S,). Более крутой отрезок кривой
S2 отражает ситуацию, когда С02 генерируется в большем количестве, чем при
143
Гпава 7
аэробном метаболизме, вследствие увеличения продукции молочной кислоты при
высоких нагрузках и ее связывания бикарбонатным буфером. Точка, в которой кривые S, и S2 пересекаются, соответствует анаэробному порогу (см. ниже). При анаэробном метаболизме VCo2 возрастает в результате химической реакции между ионами водорода (из лактата) и растворенным С02:
[Н+] + [НСО3-] <-> [Н2С03] <-> [С02] + [Н20].
Поскольку продукция молочной кислоты (лактата) в тканях возрастает (Н+), pH
смещается вправо, при этом продуцируется больше С02, чем при аэробном метаболизме. Увеличение выделения С02 возможно также вследствие снижения накопления углекислого газа в организме в результате гипервентиляции (которая проявляется артериальной гипокапнией).
Во время физической нагрузки вентиляция (VE) обычно тесно связана с VC02, поэтому полезно анализировать изменения VE по отношению к VC02, хотя для клинической интерпретации этих изменений отсутствуют общепринятые должные значения.
Большое значение имеет аккуратное и точное измерение продукции С02, поскольку на этом показателе основан расчет других значимых параметров, включая
отношение респираторного обмена (газообмена), респираторный коэффициент,
альвеолярно-артериальный градиент (разность) по кислороду (Р[А-а]02), отношение «мертвого» пространства к дыхательному объему (VD/VT), альвеолярную вентиляцию (VA) и т.д.
Отношение респираторного обмена. Отношение Усо2Ло2 называется отношением
респираторного обмена (RER), или газообмена. При устойчивом равновесии RER
равно респираторному коэффициенту (RQ), значения которого определяются субстратом, используемым для метаболических процессов. Если RQ = 1, то метаболизм
осуществляется преимущественно за счет углеводов, а при RQ < 1 преобладает смешанный метаболизм за счет углеводов и
жиров (если RQ ~ 0,7) или углеводов и
протеинов (RQ ~ 0,8). Показатель RQ
применяется для характеристики процессов, происходящих на тканевом уровне, которые трудно измеряются и не
определяются во время нагрузочного тестирования. Показатель RER обычно
оценивают в выдыхаемом воздухе во время исследования газообмена. При истинном состоянии устойчивого равновесия система транспорта кислорода работает синхронно с системой метаболизма
в тканях; таким образом, RER может использоваться как грубая оценка показателя метаболических процессов RQ. Однако если RER > 1, то это может быть
вызвано выделением С02 из молочной
кислоты или гипервентиляцией, поскольку С02 в 20 раз лучше растворяется
в тканях, чем 02. Разница в растворимо-
(АТ) методом V-slope. Потребление 02 и продукция С02 определяются при 0°С, барометрическом давлении 101,3 кПа и нулевой
влажности (условия STPD). Объяснения в
тексте. (По Wasserman et al. [ 1 ].)
144
Лабораторные нагрузочные тесты
сти обусловлена тем, что растворимость С02 в воде в 20 раз выше, чем у 02. Кроме
того, НСО^ и белки поставляют значительную часть С02 в ткани организма, в то
время как транспорт кислорода происходит только за счет его соединения с гемоглобином. Таким образом, при проведении нагрузочного теста молочнокислый ацидоз
и гипервентиляция должны приниматься во внимание, если RER > 1.
Анаэробный порог. Циркуляторно-метаболическое ограничение физической нагрузки, которое регистрируется и у здоровых людей, может быть определено во время нагрузочного теста путем регистрации так называемого анаэробного порога (АТ —
anaerobic threshold), известного также как лактатный порог, порог молочной кислоты, газообменный порог, вентиляционный порог [14, 15]. Показатель АТ всегда определяется тем значением V02, при котором появляются признаки анаэробного метаболизма, и выражается в процентах от должных значений Vo2max- АТ означает уровень Vq2, при котором концентрация молочной кислоты в артериальной крови быстро возрастает [16—18]. АТ широко используется в клинической практике.
Аналогичный термин «порог молочной кислоты» предпочтителен в тех случаях, когда уровень лактата измеряется непосредственно в крови. Другой синоним — «вентиляционный порог» — подразумевает, что вследствие метаболического ацидоза меняется вентиляция. Независимо от того, какой термин выбирается для описания явления анаэробного порога, необходимо уточнять метод определения АТ.
Повышение уровня молочной кислоты в крови во время интенсивного нарастания физической нагрузки независимо от механизма имеет важные физиологические
последствия:
• увеличение концентрации молочной кислоты снижает pH крови и интерстициальной жидкости и в конечном счете нарушает функцию клеток;
• снижение pH или любые процессы, имеющие отношение к снижению pH, стимулируют вентиляцию из-за попыток организма нивелировать возрастание кислотности за счет снижения РаС02. Так как повышение концентрации молочной кислоты оказывает влияние на функцию клеток, динамика концентрации лактата по
отношению к Vq2 во время физической нагрузки может служить важным показателем при проведении нагрузочного теста [19, 20].
У нормальных индивидуумов АТ обычно наступает при потреблении кислорода
на уровне 40—60% от должного V02 max. При выполнении нагрузки в положении сидя (на велоэргометре) нормальные значения имеют более широкий диапазон — от 35
до 80% должного V02 max- Показатель АТ зависит от возраста, вида нагрузки и других
характеристик протокола. Показатель АТ высокоспецифичен при определенных видах нагрузки: например, при нагрузке в основном на верхние конечности АТ ниже,
чем при нагрузке на ноги. Показатели потребления кислорода, полученные при нагрузке на велоэргометре, на 5—11% ниже значений, полученных натредмиле; это отражает разную мышечную массу, участвующую в выполнении работы, и, возможно,
доминирование различных типов мышечных волокон при том или ином виде физической нагрузки.
АТ определяет верхний предел физической нагрузки, которого можно достигнуть
аэробно; он может снижаться при различных клинических состояниях и заболеваниях, и, таким образом, значение АТ в дифференциальной диагностике ограничено.
Снижение АТ, как и Vo2max, неспецифично, и для выявления причин изменения этих
показателей часто требуется оценка других параметров реакции на нагрузку. Значения Vq2 max ниже 40% от должного могут указывать на недостаточное обеспечение тка¬
145
Гпава 7
ней кислородом (сердечная, легочная (десатурация) либо другая этиология) или нарушения на митохондриальном уровне (например, мышечная дисфункция при сердечно-легочных заболеваниях, митохондриальные миопатии и другие состояния).
АТ используется как индикатор тренированности, для подбора тренировочных
или реабилитационных нагрузочных режимов и мониторирования их результатов.
Однако если АТ не достигается, как, например, у некоторых пациентов с ХОБЛ, или
не может быть определен по вентиляционному ответу, то уровень нагрузки, используемый для тренировки или реабилитации, можно подбирать исходя из должных величин пиковых показателей нагрузки, потребления кислорода или ЧСС. У пациентов с
заболеваниями сердца, участвовавших в реабилитационных программах, несмотря на
значительное улучшение У0з и увеличение ЧСС до субмаксимальных/максимальных
значений, АТ, определенный неинвазивно, существенно не увеличился [21].
В заключение необходимо отметить, что существует несколько методов для определения АТ:
1) инвазивный (молочная кислота и стандартный бикарбонат);
2) неинвазивные:
а) метод вентиляционного эквивалента (повышение вентиляционного эквивалента по кислороду (Ve/V02) без соответствующего повышения вентиляционного
эквивалента по углекислому газу (VE/VC02), повышение конечно-экспираторного
парциального давления кислорода (Paet02) без соответствующего повышения парциального давления углекислого газа в конце выдоха (PaetC02);
б) метод определения наклона кривой зависимости выделения С02 к потреблению 02 (метод V-slope) и модифицированный метод V-slope.
Если одновременно исследуется газовый состав крови, то АТ по времени совпадает с падением pH и уровня бикарбонатов. Появление признаков АТ означает, по
мнению большинства авторов, наступление циркуляторно-метаболического ограничения физических возможностей.
Клинические аспекты применения
нагрузочных тестов
Тестирование во время физической нагрузки, моделирующей стресс, может предоставить ценную информацию об адаптационных возможностях сердечно-сосудистой системы для принятия серьезных решений (например, о возможном оперативном вмешательстве) и тем самым позволяет получить дополнительные данные об основном механизме возникновения одышки, происхождение которой иногда трудно
установить с помощью исследований в состоянии покоя. Характер изменения параметров вентиляции и газообмена во время нагрузки отражает конкретные метаболические условия возникновения диспноэ. Кроме того, с каждым годом возрастает
число больных со смешанной сердечно-сосудистой и легочной патологией, и в этих
случаях требуется определить вклад респираторного и циркуляторного компонентов
в ограничение физической работоспособности и в соответствии с этим принимать
индивидуальное решение о терапии и оценке ее эффективности.
Изменение вентиляции во время нагрузки
Одним из основных ответов на физическую нагрузку является повышение вентиляции. Оценка возрастающей вентиляции обычно производится путем измере-
146
Лабораторные нагрузочные тесты
ния объема выдыхаемого воздуха в единицу времени (VE). VE состоит из изменения альвеолярного объема и «мертвого» пространства в единицу времени,
т.е. из альвеолярной вентиляции (VA) и
вентиляции «мертвого» пространства
(VD), и это взаимоотношение описывается уравнением VE = VA + VD. Также
измеряют число дыхательных движений
в 1 мин (ЧД, или 0 и дыхательный объ-
ем (VT).
При низкой и средней нагрузке вен-
тиляция возрастает линейно практически до тех пор, пока V02 не достигнет 50%
otVq, max- Другими словами, в норме при
Мощность нагрузки
Рис. 3. Зависимость вентиляции от мощности физической нагрузки (мощность — работа, выполняемая в единицу времени). (По
Wasserman et al. [9].)
30
60
*02 max
увеличении мощности физической нагрузки вентиляция возрастает линейно
до точки, когда метаболизм становится
анаэробным, после чего возрастание
вентиляции происходит с относительно
большей скоростью, чем увеличение
мощности нагрузки, — до достижения
вентиляционного предела (рис. 3). Этот
предел определяется как максимальный
объем вентиляции, который достигается
во время интенсивной механической работы, выполняемой мышцами пациента,
и примерно соответствует тому объему,
который достигается при измерении
максимальной вентиляции легких
(МВЛ), когда пациент дышит как можно
более глубоко и часто в течение 10-15 с.
Общее количество воздуха, выдыхаемого
в течение этого короткого периода, затем
пересчитывается в литры в минуту. Альтернативой тесту МВЛ является определение вентиляционного предела путем
умножения ОФВ, на 35. Во время физической нагрузки человек не может в течение долгого периода дышать на уровне МВЛ (или близком к нему). У здорового
человека V0,max достигается при вентиляции, равной 60-70% от МВЛ.
Первоначально повышение вентиляции достигается за счет увеличения VT. Однако объем вдоха ограничен — VT возрастает почти до 60% ЖЕЛ, поэтому вслед за
увеличением VT повышается и ЧД — до 50—60 1/мин. На рис. 4 показано соотношение ЧД и VT при увеличении вентиляции.
При возрастании нагрузки работающие мышцы требуют больше 02 и выделяют
больше С09 [24, 25]. Взаимосвязь между V02 и мощностью нагрузки носит линей-
Дыхательный объем, % от должной ЖЕЛ
Рис. 4. Соотношение ЧД и VT при увеличении
вентиляции. Если соотношение ЧД и VT на
графике смещается вверх и влево (пунктирная линия), дыхание становится более частым и поверхностным, что обычно встречается у пациентов с рестриктивными процессами в легких. (По Burdon et al. [22] и Hsia [23].)
147
Гпава 7
Максимум Vq2
Рис. 5. Зависимость потребления кислорода от
мощности нагрузки. (По Wasserman et al. [9].)
Потребление кислорода
Рис. 6. Зависимость вентиляции от потребления кислорода. Стрелкой показано начало
анаэробного метаболизма (анаэробный порог) — после этой точки вентиляция возрастает быстрее, чем потребление кислорода.
(По Wasserman et al. [9].)
физической нагрузки отношение VD/VT
увеличения Ут [26].
ный характер (рис. 5). Зависимость
между вентиляцией и Vq2 также носит
линейный характер при низких и средних нагрузках. В точке, где начинает
преобладать анаэробный механизм,
вентиляция начинает расти быстрее,
чем У<э2 (которое, как уже говорилось,
линейно зависит от мощности нагрузки), и зависимость становится нелинейной (рис. 6). В результате парциальное
давление С02 в артериальной крови у
здоровых людей остается относительно
стабильным до включения анаэробного
метаболизма, а затем начинает снижаться.
При каждом вдохе часть вдыхаемого
воздуха достигает альвеол, а часть остается в проводящих дыхательных путях. Проводящие дыхательные пути и
респираторные участки, где нет перфузии, не принимают участия в газообмене и называются «мертвым» пространством (VD). «Мертвое» пространство
включает в себя проводящие дыхательные пути и главные бронхи (анатомическое «мертвое» пространство), а также
неперфузируемые респираторные участки (физиологическое «мертвое» пространство).
В норме в состоянии покоя VD составляет почти 30% от Ут. Например, если Ут равняется 700 мл, то анатомическое и физиологическое «мертвое» пространство составит почти 210 мл. Во время
в норме снижается до 5—25% как результат
Реакция сердечно-сосудистой системы на физическую нагрузку
Нагрузочные тесты в течение многих лет применяются у больных кардиологического профиля в упрощенном варианте (велоэргометрия) для определения толерантности сердечно-сосудистой системы к физической нагрузке, выявления скрытой коронарной патологии и определения ее функционального класса. Между тем
для получения полного представления о реакции сердечно-сосудистой системы на
физическую нагрузку необходимо углубленное исследование ее способности поддерживать адекватный легочный и тканевый газообмен в стрессовых условиях [7, 8].
Для того чтобы увеличить приток крови к работающим мышцам, возрастает сердечный выброс, и это главный кардиоваскулярный ответ организма на нагрузку.
148
Лабораторные нагрузочные тесты
Сердечный выброс — это объем крови, который выбрасывается желудочками каждую минуту; он рассчитывается умножением ударного объема (УО) на ЧСС. При физической нагрузке возрастают и УО, и ЧСС, однако степень их увеличения зависит
от характера нагрузки и физического состояния пациента.
Если ЧСС возрастает до 110—130 ударов/мин, скорость увеличения УО замедляется. Взаимоотношение ЧСС и V02 индивидуально и выражается линейной зависимостью. У здоровых испытуемых во время физической нагрузки также повышается
системное АД.
Систолическое АД (САД) при максимальной физической нагрузке превышает
САД в состоянии покоя на 80—150 мм рт. ст. Диастолическое АД (ДАД) возрастает
незначительно и, как правило, остается на том же уровне, что и в покое.
Из-за повышения Vq2 во время нагрузки сердечно-сосудистая система должна
увеличивать сердечный выброс и экстракцию кислорода тканями. Повышение Vq2
во время нагрузки осуществляется за счет трех основных механизмов: увеличения
ЧСС, УО и артериовенозной разницы по кислороду (Са02 — Cv02) (см. главу 6). Эта
зависимость нашла отражение в формуле Фика:
V02 = УО х ЧСС х (Са02 - Cv02).
Как видно из представленной формулы, отношение V02 к ЧСС, или так называемый кислородный пульс (Vq2/4CC), изменяется прямо пропорционально УО и может служить его неинвазивным эквивалентом [1].
Общая работа, осуществляемая сердечной мышцей при каждом сокращении, состоит из двух компонентов: первый — это работа, требуемая для поддержания сердечного выброса, второй — статический компонент, необходимый для поддержания
напряжения миокарда. Таким образом, общая работа в единицу времени = (работа
выброса + работа напряжения) х ЧСС. Точная формула для определения средней
механической мощности сердца учитывает сердечный выброс, средние давления в
аорте и легочной артерии, а также площади поперечного сечения аорты и легочной
артерии.
Для клинических целей (например, для разделения больных ишемической
болезнью сердца на функциональные классы) используют отражающий работу
миокарда эмпирический параметр, называемый двойным произведением (ДП):
ДП = САД хЧСС/100.
УО может увеличиваться вследствие повышения конечно-диасголического или
снижения конечно-систолического объема. Эластическая работа существенно повышается в том случае, если наполнение сердца кровью превышает соответствующий уровень и резко вырастает давление наполнения. Кроме того, наполнение сердца требует времени, удлинение которого приводит к укорочению времени сокращения миокарда [27].
При возрастании нагрузки наряду с увеличением ЧСС может повышаться сердечный выброс. Для того чтобы минимизировать работу, миокард в зависимости от
конкретных обстоятельств и сердечного выброса, необходимого для данной работы,
выбирает оптимальные УО и ЧСС. Факторы, определяющие выбор наиболее эффективной комбинации УО и ЧСС, включают: растяжимость сердечной мышцы; соотношение напряжения и давления в соответствии с законом Лапласа, которое зависит от размера сердца и сопротивления, преодолеваемого во время сокращения; давление наполнения желудочков; время наполнения желудочков; ламинарность или
149
Гпава 7
где VE STPD — объем воздуха, выдыхаемого каждую минуту, при условиях STPD;
FeC02 — фракционная концентрация сухого выдыхаемого С02; FiC02 — фракционная концентрация сухого вдыхаемого С02 (обычно 0,04%).
Респираторный коэффициент (RQ), или отношение газообмена (RER) измеряет отношение продукции С02 к продукции 02: RQ = Vc02/Vo2-
Кислородный пульс (Уо2/ЧСС) - показатель, который определяет количество кислорода в мл, потребляемое за каждое сокращение сердца:
Vo2/4CC (мл) = V02 (л/мин) х 1000/ЧСС (1/мин).
Вентиляционный эквивалент по кислороду (VE/V02) определяет вентиляционные
потребности при данном потреблении кислорода. Вентиляционный эквивалент по углекислому газу (Ve/VCo2) определяет вентиляционные потребности при данном количестве выделенного С02. Эти два показателя с учетом «мертвого» пространства
клапана рассчитываются следующим образом:
VE/Vo2 = (VE-fxVDM)/Vo,,
VVco2 = (VE-fxVDM)/Vc02,
где VE — вентиляция (л/мин) при условиях BTPS; f — частота дыханий (1/мин);
VDM — «мертвое» пространство клапана (л); V02 — потребление кислорода (л/мин)
при условиях STPD; VC02 — продукция углекислого газа (л/мин) при условиях STPD.
Физиологическое «мертвое» пространство (VD) — часть дыхательного объема в каждом дыхательном цикле, которая не принимает участие в газообмене (см. выше).
VD = VT х (PaC02 - РЕС02)/РаС02 - VDM,
где VT — дыхательный объем (л) при условиях BTPS; РаС02 — парциальное давление
углекислого газа в артериальной крови (мм рт. ст.); РЕС02 — смешанная концентрация углекислого газа в выдыхаемом воздухе, выраженная в мм рт. ст.; VDM — «мертвое» пространство клапана.
Отношение объема физиологического «мертвого» пространства к дыхательному объ-
ему (VD/VT).
Методология и протоколы
КРИТ проводят с помощью специальной аппаратуры, позволяющей автоматически осуществлять анализ газообмена во время каждого дыхательного цикла. Для мо-
ниторирования показателей в покое и при физической нагрузке пациент подключается к дыхательному контуру, в состав которого входят измеритель потока и анализаторы 02 и С02, а также к электрокардиографу. Для получения расчетных кардио-
респираторных параметров компьютер обрабатывает сигналы отдатчиков [34, 35].
Для дозирования нагрузки в соответствии со стандартными протоколами применяются два типа устройств: велоэргометр и тредмил.
Выполнение нагрузочного теста в соответствии с наиболее применяемыми протоколами обычно заканчивается при появлении симптомов, не позволяющих продолжать исследование. Интенсивность нагрузки увеличивается ступенчато (обычно
на 5—25 Вт каждую минуту) или непрерывно (т.е. каждую секунду), но с таким же
средним приращением на 5-25 Вт каждую минуту (ramp). Оба типа нагрузочных
протоколов должны планироваться таким образом, чтобы максимальное потребле¬
152
Лабораторные нагрузочные тесты
ние кислорода V02 max
достигалось в течение
8—12 мин. Сопоставимость этих протоколов
для кардиореспиратор-
ных нагрузочных тестов хорошо изучена
[9]. В последующем результаты тестирования
могут использоваться
для правильного дозирования нагрузки в
тестах с постоянной
нагрузкой высокой интенсивности, или тестах на выносливость
(high intensity constant
work rate «endurance»
tests). Последовательность действий при КРЫТ с возрастающей нагрузкой представлена на рис. 7.
Рис. 7. Последовательность действий при проведении КРИТ со
ступенчато возрастающей или постоянной нагрузкой [7].
Тесты с постоянной нагрузкой высокой интенсивности,
или тесты на выносливость
Такие тесты проводятся после максимального КРЫТ и определения V02max- Ре~
комендуемая величина нагрузки для данных тестов составляет 75—80% от V02 max
или пиковой нагрузки, измеренных предварительно при максимальном КРЫТ.
Важными параметрами данного исследования являются время выполнения теста на
выносливость (Tlim), динамика различных показателей (VE, V02, VC02 и др.) и выраженности симптомов в стандартизированные моменты времени (isotime). Параметры, полученные в тесте на выносливость, являются воспроизводимыми и надежными при оценке динамики состояния пациента [36].
Интерпретация результатов КРИТ
Ограничение физической работоспособности со снижением Vq2 max может быть
обусловлено:
• сердечно-сосудистыми причинами: миокардиальный фактор, системная и легочная циркуляция, а также состав крови (анемия, уровень СОНЬ);
• респираторными причинами: вентиляционные (механические) и газообменные
факторы;
• периферическими причинами: широкий спектр нарушений, связанных с состоянием нейромышечного аппарата и микроциркуляции и влияющих на доставку
кислорода к тканям и утилизацию кислорода тканями, а также с механизмами мышечного сокращения [37, 38].
Необходимо также принимать во внимание такой важный фактор, как нарушение субъективного восприятия симптомов (одышка, утомление и др.), что играет
важную роль в правильной оценке результатов исследования [39].
153
Таблица 1. Типичные изменения кардиореспираторного ответа при максимальной нагрузке [40]
Гпава 7
о А
S- н
S О
S о
« х
Рг *
£ g
Л
Q.
0
1
X
X
X
X
<и
<D
X
4>
СП
СП
СП
СП
СП
*
X
о
X
£
S
2
X
X
ь
X
Q.
о.
о.
о.
о.
X
X
4>
X
о
о
о
о
о
и
и
I
и
X
X
X
X
X
J0
CJ
4>
а
Оч
СП
CJ
4>
J0
S
X
а>
о.
о
X
эХ
О
X
X
<и
н
4)
X
о
S
к
н
СП
X
а.
CQ
X
X
J0
§
4)
X
X
3
3
со
4)
J0
н
СП
X
X
о
О
<U
СП
X
СП
сп
о
СП
сп
СП
э
н
X
X
S
2
О.
о
>
Q.
о.
с
S
а.
£
О.
О.
3
4)
X
X
У
О
<и
О
О
с—
о
о
О
о
о
и
§
X
X
X
X
X
X
X
X
с
X
X
X X
4>
X £
X
X
X
X
* «
X
4>
X
4)
X
X
X
<и
СП
4)
3
4)
3
X
4)
4>
3
2 о
X
X
и
X
3
3
X
3
о 3
X
X
н"
X
о.
со
ас
X
ас
С «
^ о
о
X
X
<и
X
о
о
О
X
О
и
и
X
и
X
X
X
и
X
X
4>
X
s
X
X
5
X
X
<и
X
ч>
X
X
X
X
ГГ)
X
X
4>
о
СП
4)
Э
СП
X
х
СП
X
X
<и
3
4)
3
X
4)
4)
3
X
£
3
£
о
S
о
3
3
X
3
X
о.
со
о.
22
о,
22
ос
ас
X
ас
X
о
О
о
Е^
о
е;
О
О
X
О
и
X
С
X
X
X
X
X
X
и
X
«
н
эХ
X
4)
О
4)
к
е?
и
Uh
3
а>
4>
3
Ч
|=:
со
4>
Q.
с
X
о.
о
с
ез
О
с
о
ГО
«и
X
X
мч
О
X
а
<и
X
X
У
3
X
о
X
4)
ю
4>
X
X
*
о
X
X
X
со
X
о
X
«=:
X
X
о
X
X
X
4)
Е?
X
4)
Е?
X
4>
о
СП
4>
э
X
х
X
СП
X
«=;
4)
3
4)
3
5
ю
5
ю
X
3
<и
2
X
3
3
СН
5
СП
5;
X
О.
CQ
X
а
н
со
со
О.
о
X
О
О
4>
о
4>
о
О
СП
СП
и
X
X
н
о
X
X
X
X
QQ
CQ
н
4)
>>
СО
4)
Н
S
О
X
4>
о.
о
X
X
о
(—
3
X
и
«=:
о
3
X
X
ас
X
4>
X
4>
4)
Ю
о
т1
X
<и
со
о
СП
4)
3
4)
3
СП
О
X
X
X
СП
JU
т
X
с
3
3
X
X
р,
X
D.
со
ас
о.
3
X
X
СП
ю
о
X
г;
о
О
О
о
ю
и
и
0Q
и
X
X
X
X
X
О
X О
!>
•>61
и
и
X
ос
Q.
4>
м
О- ?.
° *
о ?s
5 3
О
■> > г,
'"ш "Ъ ^
> > £
о
СП
<
0-
с
>
5!;
со <
I £
СГ СО
| а
2 >*
\ оз
X О
S и
й о
<и с
4 ь
i I
= 5
СП со
II
5 *
5 «
II
Ё 1
s о
S >
ja сп
О Ц
= Б.
5 Ч
а?
8 I
I =г
п 5
О Р
ю t
О §
154
Иногда ограничение
физической работоспособности может быть обусловлено одновременно несколькими механизмами.
Интегрированный подход к интерпретации КРИТ
включает в себя:
• правильное определение
основных параметров
(V02,4CC,VE,Sa02) в совокупности с другими показателями; необходимо
всегда принимать во внимание основное показание к проведению КРИТ
у данного пациента;
• оценку показателей в
сравнении с должными
величинами [40];
• учет динамики показателей от субмаксимального
до максимального уровня
при анализе графических
изображений;
• оценку характера ответа
на нагрузку и механизма
ограничения работоспособности;
• учет всех патологических
состояний и клинических
ситуаций, которые могут
быть причиной наблюдаемого ответа на нагрузку;
• изучение связи между
результатами КРИТ и
клинической информацией, приведенной в истории болезни, включая
результаты других тестов
(исследование ФВД в
покое).
Изменения основных
эргоспирометрических параметров при различных заболеваниях представлены в
табл. 1.
Лабораторные нагрузочные тесты
Рекомендации по проведению нагрузочных тестов
в клинической практике
Члены специальной Рабочей группы ERS обозначили классы рекомендаций для
проведения нагрузочных тестов в клинической практике. С этой целью была использована классификация уровней доказательств, используемая в современных
клинических рекомендациях [41]. Классы (синонимы: уровень, сила) рекомендаций
(А - максимальный, D - минимальный) для кардиореспираторных нагрузочных тестов, базирующиеся на уровне доказательств, приведены в табл. 2. Следует учитывать, что при использовании этой жесткой системы класс А для данного вида диагностических тестов может быть достигнут в очень редких случаях, а класс В обычно рассматривается как максимально достижимый.
В клинической практике применение одного лишь КРИТ не позволяет поставить
конкретный клинический диагноз. Однако типичный профиль изменения показателей, характеризующих кардиореспираторный и газообменный ответы, позволяет
провести дифференциальную диагностику легочного и сердечно-сосудистого механизмов ограничения физической толерантности.
При оценке максимальной или ограниченной симптомами физической толерантности у больных с заболеваниями легких и сердца КРЫТ можно считать «золотым стандартом». Очень важно, что кардиореспираторный и газообменный ответы
при КРЫТ являются воспроизводимыми в течение короткого времени, а при длительном наблюдении они могут отражать динамику прогрессирования заболевания.
Эргоспирометрические параметры важны для прогностической оценки пациентов с
Таблица 2. Сила рекомендаций для использования КРИТ в клинической практике [7]
Показания
Сила
рекомендаций
Выявление бронхоконстрикции, вызванной физической нагрузкой
А
Выявление десатурации, вызванной физической нагрузкой
В
Функциональная оценка лиц с неясной этиологией одышки при нагрузке
и/или непереносимостью физической нагрузки при нормальной функции
легких и сердца
D
Выявление специфических ответов на нагрузку, помогающих
в дифференциальной диагностике вентиляционных и циркуляторных
причин ограничения физической толерантности
Функциональная и прогностическая оценка при:
С
ХОБЛ
В, С
ИЗЛ
В, В
муковисцидозе
С, С
первичной легочной гипертензии
В, В
хронической сердечной недостаточности
Оценка эффективности лечебных мероприятий:
В, В
максимальный нагрузочный тест
с
тест с постоянной нагрузкой высокой интенсивности
в
Назначение физических тренировок
в
155
Гпава 7
легочными и сердечными заболеваниями, и это является одним из основных показаний к проведению тестирования у таких больных.
Поданным литературы, физическая работоспособность и показатели ЭСМ являются более хорошими прогностическими факторами, чем показатели легочной или
сердечной функции в покое. Эти параметры имеют большое значение и в клинических исследованиях, оценивающих эффективность различных медицинских вмешательств у пациентов с легочными и сердечными заболеваниями. Показатели КРИТ
важны для индивидуального назначения реабилитационных режимов и терапии
кислородом, а также для оценки безопасности физических тренировок.
Пиковый уровень потребления кислорода и время физической нагрузки в тестах
с постоянной нагрузкой высокой интенсивности (T|im) более чувствительны при
оценке эффективности медицинских вмешательств, чем параметры легочной и сердечной функций, измеренные в покое. Тесты с постоянной нагрузкой высокой интенсивности с измерением Tljm, других показателей ЭСМ и с оценкой симптомов в
строго определенные моменты времени позволяют выявлять существенное улучшение физической толерантности, которое не всегда определяется в тестах с возрастающей физической нагрузкой.
В последнее десятилетие существенно выросла доказательная база значимости
нагрузочных тестов для функциональной оценки, прогноза и выявления динамики
при различных видах лечения легочных и сердечных заболеваний. В то же время, как
следует из табл. 2, в некоторых случаях низкий уровень доказательств обусловлен не
столько недостаточной статистической мощностью исследований, сколько неоднородностью исследуемых популяций.
Список литературы
1. Wasserman К., Whipp B.J. Exercise physiology in health and disease //Amer. Rev. Respir. Dis. 1975. V. 112.
P. 219-249.
2. Risk C., Epler G.R., Gaensler E.A. Exercise alveolar-arterial oxygen pressure difference in interstitial lung
disease // Chest. 1984. V. 85. P. 69-74.
3. Carlson D.J., Ries A.L., Kaplan R.M. Prediction of maximum exercise tolerance in patients with COPD //
Chest. 1991. V. 100. P. 307-311.
4. Keogh B.A., Lakatos E., Price D. et al. Importance of the lower respiratory tract in oxygen transfer: exercise
testing in patients with interstitial and destructive lung disease // Amer. Rev. Respir. Dis. 1984. V. 129.
P. S76-S80.
5. Myers J., Froelicher V.F. Hemodynamic determinants of exercise capacity in chronic heart failure // Ann.
Intern. Med. 1991. V. 115. P.377-386.
6. Weber K.T., Janicki J.S. Cardiopulmonary Exercise Testing: Physiologic Principles and Clinical Application.
Philadelphia: W.B. Saunders, 1986.
7. Palange P, Ward S.A., Carlsen K.H. et al. Recommendations on the use of exercise testing in clinical practice // Eur. Respir. J. 2007. V. 29. P. 185-209.
8. ATS/ACCP Statement on Cardiopulmonary Exercise Testing // Amer. J. Respir. Crit. Care Med. 2003.
V. 167. P. 211-277.
9. Principles of Exercise Testing and Interpretation / Eds. K. Wasserman, J.E. Hansen, D.Y. Sue et al.
Philadelphia: Lea & Febiger, 2004.
10. Weisman I.M., Zeballos R.J. An integrated approach to the interpretation of cardiopulmonary exercise testing // Clin. Chest Med. 1994. V. 15. P. 421 -445.
11. Jones N.L. Clinical Exercise Testing. Philadelphia: W.B. Saunders, 1997.
12. American College of Sports Medicine. Guidelines for Exercise Testing and Prescription. Philadelphia: Lea
& Febiger, 1991.
13. American Heart Association. Exercise standards. A statement for healthcare professionals // Circulation.
1995. V. 91 P.580-615.
156
Лабораторные нагрузочные тесты
14. Wasserman К., Mcllroy М.В. Detecting the threshold of anaerobic metabolism in cardiac patients during
exercise //Amer. J. Cardiol. 1964. V. 14. P. 844-852.
15. Wasserman K., Whipp P.J., Koyal S.N. et al. Anaerobic threshold and respiratory gas exchange during exercise //J. Appl. Physiol. 1973. V. 35. P. 236-243.
16. Jones N.L. Exercise testing in pulmonary evaluation: rationale, methods, and the normal respiratory
response to exercise // N. Engl. J. Med. 1975. V. 293. P. 541-544.
17. Jones N.L., Campbell E.J. Clinical Exercise Testing. Orlando: Grune & Statton Inc., Harcourt Brace
Jovanovich Publishers, 1982.
18. Kanarek D., Kaplan D., Kazemi H. The anaerobic threshold in severe chronic obstructive lung disease //
Bull. Eur. Physiopathol. Respir. 1979. V. 15. P. 163-169.
19. Whipp B.J., Davis J.A., Torres F., Wasserman K. A test to determine the parameters of aerobic function during exercise //J. Appl. Physiol. 1981. V. 50. P. 217-221.
20. Gladden L.B. Lactate metabolism: a new paradigm for the third millennium //J. Physiol. 2004. V. 558. P. 5-30.
21. Gosker H.R., Lencer N.H., Franssen F.M. et al. Striking similarities in systemic factors contributing to
decreased exercise capacity in patients with severe chronic heart failure or COPD // Chest. 2003. V. 123.
P. 1416-1424.
22. Burdon J.G., Killian K.J., Jones N.L. Pattern of breathing during exercise in patients with interstitial lung
disease //Thorax. 1983. V. 38. P. 778-784.
23. Hsia C.C. Cardiopulmonary limitations to exercise in restrictive lung disease // Med. Sci. Sports Exerc.
1999. V. 31.P. S28-S32.
24. Wetter T.J., Harms C.A., Nelson W.B. et al. Influence of respiratory muscle work on V02 and leg blood flow
during submaximal exercise //J. Appl. Physiol. 1999. V. 87. P. 643-651.
25. Younes M. Determinants of thoracic excursions during exercise // Lung Biology in Health and Disease /
Eds. B.J. Whipp, K. Wasserman. V. 42: Exercise: Pulmonary Physiology and Pathophysiology. N.Y.: Marcel
Dekker, 1991. P. 1-65.
26. Johnson B.D., Weisman I.M., Zeballos R.J. et al. Emerging concepts in the evaluation of ventilatory limitation during exercise: the exercise tidal flow-volume loop // Chest. 1999. V. 116. P. 488-503.
27. Steele I.C., Moore A., Nugent A. M. et al. Non-invasive measurement of cardiac output and ventricular ejection fractions in chronic cardiac failure: relationship to impaired exercise tolerance // Clin. Sci. 1997. V. 93.
P. 195-203.
28. Clinical Exercise Testing / Eds. S.A. Ward, P. Palange. [Eur. Respir. Monograph. 2007. V. 40].
29. Gold W.M. Pulmonary function testing // Textbook of Respiratory Medicine / Eds. J.F. Murray, J.A. Nadel.
Philadelphia: Saunders, 2005.
30. Gibbons R.J., Balady G.J., Bricker J.T. et al. ACC/AHA 2002 guideline update for exercise testing: summary article. A report of the American College of Cardiology/American Heart Association Task Force on
Practice Guidelines (Committee to Update the 1997 Exercise Testing Guidelines) // Circulation. 2002.
V. 106. P. 1883-1892.
31. Wasserman K., VanKessel A.L., Burton G.G. Interaction of physiological mechanisms during exercise //
J. Appl. Physiol. 1967. V. 22. P. 71-85.
32. Handbook of Physiology. Section 12: Exercise: Regulation and Integration of Multiple Systems / Eds.
L.B. Rowell, J.T. Shepherd. Bethesda: American Physiological Society, 1996.
33. Biochemistry of Exercise and Training / Eds. R. Maughan, M. Gleeson, P.L. GreenhafT. Oxford: Oxford
University Press, 1997.
34. Jones N.L. Clinical Exercise Testing. Philadelphia: W.B. Saunders, 1997.
35. Zeballos R.J., Weisman I.M. Behind the scenes of cardiopulmonary exercise testing // Clin. Chest Med.
1994. V. 15. P. 193-213.
36. O’Donnell D.E., Lam M., Webb K.A. Measurement of symptoms, lung hyperinflation, and endurance
during exercise in chronic obstructive pulmonary disease // Amer. J. Respir. Crit. Care Med. 1995. V. 158.
P. 1557-1565.
37. Evans A.B., Al-Himyary A.J., Hrovat M.I. et al. Abnormal skeletal muscle oxidative capacity after lung
transplantation by 31P-MRS //Amer. J. Respir. Crit. Care Med. 1997. V. 155. P. 615-621.
38. Richardson R.S., Sheldon J., Poole D.C. et al. Evidence of skeletal muscle metabolic reserve during whole
body exercise in patients with chronic obstructive pulmonary disease // Amer. J. Respir. Crit. Care Med.
1999. V. 159. P.881-885.
39. Killian K.J., Jones N.L. Mechanisms of exertional dyspnea // Clin. Chest Med. 1994. V. 15. P. 247-257.
40. Weisman I.M., Zeballos R.J. Clinical evaluation of unexplained dyspnea//Cardiologia. 1996. V. 41. P. 621-634.
41. Harbour R., Miller J. A new system for grading recommendations in evidence based guidelines// Br. Med. J.
2001. V. 323. P. 334-336.
157
Внелабораторные
нагрузочные тесты
Одним из важных проявлений большинства хронических легочных заболеваний
является одышка, которая, в свою очередь, становится основной причиной ограничения переносимости физических нагрузок, или физической толерантности.
Снижение физической толерантности у легочных больных связано с неспособностью организма обеспечивать максимальное поступление кислорода во время нагрузки, а в клиническом отношении — с невозможностью для пациента выполнять
ту физическую работу, которую он мог бы выполнить, если бы был здоров, или которую мог выполнять ранее.
Методы оценки переносимости физических нагрузок делятся на две большие
группы: лабораторные, позволяющие провести полный анализ реакции организма на
физическую нагрузку и выявить основную причину снижения физической толерантности (кардиопульмональное нагрузочное тестирование на велоэргометре (ВЭМ),
тредмиле, кардиологический стресс-тест), и внелабораторные (англ. field tests), в ходе
которых можно проанализировать только отдельные показатели, отражающие интегральную реакцию на нагрузку всех систем, участвующих в ее выполнении (дыхательной, сердечно-сосудистой, системной и периферической циркуляции, крови, нервно-мышечной системы и мышечного метаболизма). К внелабораторным тестам относятся степ-тест и различные тесты с ходьбой.
Выбор конкретной методики зависит от клинической задачи и технических возможностей врача.
Степ-тест
Степ-тест для оценки физического состояния используется с 40-х годов прошлого века. В последующие десятилетия степ-тест показал клиническую значимость
при оценке переносимости физической нагрузки, риска послеоперационных осложнений, индуцированной нагрузкой гипоксемии при различных заболеваниях. Это
один из множества тестов, предназначенных для безопасной и удобной в практическом отношении оценки анаэробного порога [6].
Степ-тест удобен тем, что требует минимума пространства и оборудования. Метаболические затраты во время проведения этого теста эквивалентны таковым при
проведении других внелабораторных исследований физической толерантности при
бронхолегочных заболеваниях [57] и соответствуют уровню повседневной активности, поэтому степ-тест можно проводить у большинства пациентов.
Существует множество модификаций степ-теста: степ-тест Данди, степ-тест Королевского колледжа, Гарвардский степ-тест и др.
Для проведения степ-теста требуются ступенька, монитор для подсчета частоты
сердечных сокращений, звуковоспроизводящее устройство (магнитофон или проиг¬
158
Внелабораторные нагрузочные тесты
рыватель для компакт-дисков) и шкала
оценки состояния пациента, также можно использовать пульсоксиметр.
Высота ступеньки варьирует от 15 до
41,3 см, частота шагов — от 15 до 35 в
1 мин в зависимости от возраста пациента, уровня его тренированности и физической активности. Иногда частоту
подъемов на ступеньку регулирует сам
пациент. Ступеньки могут быть оборудованы поручнями. Длительность тестирования составляет от 2 до 10 мин, но иногда не имеет строгих временных рамок и
определяется самочувствием пациента,
однако меньшая продолжительность тестирования снижает его чувствительность по
сравнению с исследованием натредмиле, в частности при выявлении постнагрузочного бронхоспазма.
Максимальное потребление кислорода (V02 max), рассчитанное в результате степ-
теста, тесно коррелирует с таким же показателем, измеряемым при эргометрии [6],
однако, по данным некоторых авторов, существенно - на 10-15% - может превышать последний [57].
Степ-тест может проводиться в двух режимах: с постоянной либо с возрастающей
нагрузкой (степ-тест Честера) [6].
Степ-тест Честера состоит из 5 этапов, на каждом из которых увеличивается частота шагов. Исходя из этого и с учетом выбранной высоты ступеньки рассчитывается максимальное потребление кислорода (V02max) (табл. 1).
Частота шага регулируется, как правило, метрономом. На каждом этапе тестирования измеряют ЧСС, оценивают в баллах самочувствие пациента, рассчитывают
максимальную ЧСС соответственно возрасту пациента и V02 max. Интенсивность нагрузки в степ-тесте Честера зависит от высоты ступеньки и частоты шагов с пола на
ступеньку и обратно, поэтому крайне важно правильно подобрать высоту ступеньки в каждом конкретном случае. Лучше «занизить» ступеньку, чтобы пациент мог
безопасно для здоровья пройти больше стадий и, следовательно, выполнить максимально возможную для себя нагрузку. Тест прекращается, когда пациент достигает
субмаксимальной ЧСС, равной 80% от максимальной соответствующей возрасту,
либо когда балльная оценка физического усилия достигает 14 баллов по 20-балльной шкале Борга [5]. Таким образом, степ-тест Честера с возрастающей нагрузкой,
как и другие модификации этого исследования, позволяет достичь только субмаксимальной нагрузки. По результатам степ-теста Честера можно рассчитать V02 max
для оценки аэробной мощности пациента и подобрать для него тренирующий режим физической нагрузки.
Недостатком всех степ-тестов является непривычность такого вида нагрузки для
многих пациентов, особенно имеющих патологию опорно-двигательного аппарата,
которая может влиять на их результаты, а также отсутствие стандартизации всех параметров теста (высоты ступеньки, длительности исследования, скорости подъема
на ступеньку, причин прекращения теста и т.д.), хотя в последние годы ведутся попытки стандартизовать степ-тест.
Таблица 1. Расчет максимального потребления кислорода (Vq2 max’ мл/кг/мин) в степ-те-
сте Честера [6]
Высота
ступеньки,
м
Стадия теста
I
II
III
IV
V
частота шагов
15
20
25
30
35
0,15
11
14
18
21
25
0,20
12
17
21
26
29
0,25
14
19
24
28
33
0,30
16
21
27
32
37
159
Гпава 8
Тесты с ходьбой
Тесты с ходьбой — это функциональные нагрузочные тесты, которые главным образом оценивают способность пациента переносить повседневные физические нагрузки, поскольку ходьба — это нагрузка, выполняемая ежедневно всеми, кроме наиболее тяжелых больных. Тесты с ходьбой весьма распространены в клинической
практике, и в частности в пульмонологии, благодаря простоте выполнения, хорошей переносимости пациентами, сопоставимости с повседневными нагрузками и
удовлетворительной корреляции результатов теста с состоянием пациента.
Основные цели тестов с ходьбой:
1) оценка функционального состояния пациента и степени снижения его физических возможностей;
2) оценка эффективности проводимого лечения;
3) определение индивидуального прогноза выживаемости, в том числе перед хирургическими вмешательствами на легких (резекцией, трансплантацией и т.д.);
4) определение сроков трансплантации легких и установление очередности пациентов в листе ожидания.
Разработано множество разновидностей тестов с ходьбой: с фиксированным временем (2-, 5-, 6-, 9- и 12-минутный), с фиксированным расстоянием (например,
100 м, полмили, 2 км), с различной регуляцией скорости ходьбы (когда скорость выбирает сам пациент или скорость задается исследователем; когда скорость ходьбы
остается постоянной в течение всего тестирования или постепенно возрастает). Выбор этих параметров зависит от целей исследования. Так, в тестах с постоянной скоростью ходьбы нагрузка не меняется в течение исследования, при этом оценивают
время, в течение которого пациент может выполнять нагрузку такой величины (выносливость), а тесты с возрастающей нагрузкой определяют максимальный уровень
физических возможностей пациента. Традиционно тесты с возрастающей нагрузкой
проводятся на велоэргометре или тредмиле, но существуют эквивалентные модификации тестов с ходьбой (шаттл-тест).
Несмотря на хорошую воспроизводимость, результаты тестов с ходьбой подвержены влиянию двух факторов, таких как выработка у пациента навыков и настроение больного. При повторных тестированиях с небольшими интервалами времени у
пациентов улучшается координация движений при ходьбе по заданной траектории,
исчезает волнение и тревога, он подбирает оптимальную длину шага. Влияние «тренировочного» эффекта на результаты повторных тестирований через месяц и более
не изучалось. Скорее всего, этот эффект исчезает через несколько недель [2].
Не менее значимо на результаты тестов с ходьбой влияет настроение больного.
Так, устная стимуляция пациента во время тестирования увеличивает пройденное
расстояние на 30 м, что сравнимо с воздействием некоторых видов лечения. Подобная стимуляция нежелательна еще и потому, что навязанное ускорение темпа ходьбы влечет раннюю усталость и создает стресс у больных с сердечно-сосудистой патологией. В связи с этим не рекомендуется ни словами, ни даже жестами заставлять
больного ускорять ходьбу во время исследования, а общение между исследователем
и больным во время тестирования ограничить стандартными фразами, приведенными в клинических рекомендациях ATS по проведению 6-минутного теста (6-МТ):
«Вы всё делаете хорошо. До конца теста осталось 5 минут», «Продолжайте так же хорошо выполнять задание. До конца теста осталось 4 минуты», «Все идет хорошо. Вы
уже прошли половину», «Продолжайте так же. До конца теста осталось всего 2 ми¬
160
Внелабораторные нагрузочные тесты
нуты», «Вы всё делаете правильно. До конца теста осталась только 1 минута» [2]. Некоторые исследователи вообще не используют ободряющих фраз во время проведения теста, чтобы никоим образом не влиять на его результат.
В каждом лечебном учреждении желательно выработать единый стандарт общения медперсонала с больным во время проведения тестов с ходьбой и соблюдать его
при всех тестированиях, чтобы полученные результаты можно было корректно сравнивать как в динамике у одного и того же пациента, так и у разных больных.
12-минутный тест
12-минутный тест (12-МТ) был впервые предложен К.Н. Cooper в 1968 г. для
оценки уровня физической подготовленности молодых мужчин и позднее был адаптирован C.R. McGavin et al. для определения физической толерантности больных
хроническим бронхитом.
Методика проведения 12-МТ аналогична той, что применяется при 6-МТ (см.
ниже). Результаты 12-МТ достаточно хорошо коррелируют с V02 max и с результатами других тестов с ходьбой — 2-, 4- и 6-минутного, но не коррелируют с легочной
функцией.
По мнению отдельных авторов, большая продолжительность этого исследования
негативно влияет на результат: пациенты могут испытывать беспокойство в связи с
необходимостью выполнять физическую нагрузку в течение такого продолжительного времени. С другой стороны, более продолжительное исследование может лучше
выявлять снижение физической толерантности, а у более короткого эта способность
ниже, поэтому разумным компромиссом, скорее всего, является 6-МТ. По этим причинам на основе 12-МТ было разработано несколько модификаций:
• 6-минутный тест;
• 2- и 4-минутные тесты с ходьбой;
• 20-метровый шаттл-тест;
• 10-метровый шаттл-тест с возрастающей нагрузкой (incremental shuttle test);
• шаттл-тест с постоянной нагрузкой (endurance shuttle test).
В данной главе будут рассмотрены тесты с ходьбой, наиболее распространенные
в клинической практике.
6-минутный тест
6-МТ — самый распространенный как в клинической практике, так и в научных
исследованиях внелабораторный нагрузочный тест. Это тест с ходьбой в произвольном темпе в течение 6 мин. Результатом теста является расстояние, которое больной
может быстро пройти по ровной твердой поверхности за 6 мин. Большинство больных за это время не достигают максимальной нагрузки, а наоборот, сами выбирают
ее интенсивность; им разрешается останавливаться и отдыхать во время исследования. В то же время большинство повседневных видов физической активности выполняются на субмаксимальном уровне нагрузки, поэтому 6-минутный тест лучше
отражает функциональные возможности пациента в повседневной жизни. Шестиминутный тест можно проводить в отделении функциональной диагностики, отделении стационара, отделениях реабилитации и врачебно-физкультурных диспансерах, поликлиниках, санаториях и т.д.
Показания к проведению 6-МТ. Самым главным показанием для 6-МТ является
определение эффективности лечения (трансплантации легких, хирургической редук¬
161
Гпава 8
ции объема легких, реабилитационных программ, лекарственной терапии и кисло-
родотерапии у больных с различными бронхолегочными и сердечно-сосудистыми
заболеваниями) [2].
6-МТ используется для однократной оценки функционального состояния больного
при различных заболеваниях респираторной и сердечно-сосудистой систем, периферических сосудов, нервно-мышечной системы, у пожилых пациентов, которым
противопоказано максимальное нагрузочное тестирование), в том числе для выявления десатурации на фоне физической нагрузки у больных, у которых в покое показатели газообмена в норме.
Расстояние, пройденное в 6-МТ, имеет прогностическое значение при сердечной
недостаточности, ХОБЛ, муковисцидозе, первичной легочной гипертензии, хирургических вмешательствах на грудной клетке, трансплантации легких и ряде других
заболеваний и состояний.
Противопоказания для проведения 6-МТ. Согласно рекомендациям ATS, абсолютными противопоказаниями к проведению 6-МТ являются нестабильная стенокардия в
течение предыдущего месяца и инфаркт миокарда в течение предыдущего месяца [2].
К относительным противопоказаниям для проведения 6-МТ относят: 1) тахикардию с частотой сердечных сокращений в покое более 120 в 1 мин; 2) артериальную
гипертензию с систолическим давлением в покое более 180 мм рт. ст. и диастолическим давлением более 100 мм рт. ст. [2]; 3) неспособность пациента выполнить тест
из-за слабости, боли, лихорадки, одышки, дискоординации или психических нарушений; 4) неконтактность пациента либо неспособность его выполнять указания
медперсонала при проведении теста.
Теоретически больные с относительными противопоказаниями имеют повышенный риск развития аритмий и острой сердечно-сосудистой недостаточности во время тестирования, поэтому для пациентов с любыми из этих состояний специалист
по функциональной диагностике и лечащий врач должны индивидуально решать
вопрос о проведении теста. Перед тестированием также необходимо проанализировать электрокардиограмму пациента за последние 6 мес, а больным со стабильной
стенокардией тест следует проводить после приема антиангинальных средств. Также
необходимо иметь наготове нитраты для оказания срочной помощи при необходимости [2].
Каждый пациент при проведении 6-МТ самостоятельно определяет интенсивность нагрузки, поэтому тест проводился у пожилых пациентов и больных с сердечной недостаточностью, включая пациентов, ожидающих трансплантации сердца по
поводу тяжелой сердечной недостаточности, без серьезных побочных эффектов, что
позволяет рекомендовать его в ситуациях, когда противопоказано лабораторное нагрузочное тестирование.
Меры предосторожности [2]. Тестирование следует проводить в условиях, где в
случае необходимости возможно быстрое оказание экстренной помощи.
Необходимые медикаменты включают кислород, сублингвальную форму нитроглицерина, аспирин и (32-агонист короткого действия в виде дозированного ингалятора либо небулизированного раствора. Врач, проводящий тестирование, должен
иметь возможность воспользоваться телефоном для вызова помощи.
Согласно рекомендациям ATS, 6-МТ может проводиться специально обученным
средним медицинским персоналом. В то же время требуется, чтобы медицинский работник, проводящий тестирование, имел навыки оказания неотложной помощи и ре¬
162
Внелабораторные нагрузочные тесты
анимационных мероприятий. Должна
быть легкодоступна помощь квалифицированного специалиста.
Если пациент получает длительную
кислородотерапию, то ингаляции кислорода во время тестирования продолжаются в прежнем режиме.
Больные со стабильной ишемической болезнью сердца перед исследованием должны
принять антиангинальные препараты.
Исследование немедленно прекращают в следующих ситуациях: 1) при появлении
боли в грудной клетке, удушья либо резкого усиления одышки, судорог в мышцах
ног, шаткости походки, выраженной потливости, резкой бледности, головокружения; 2) при снижении сатурации <80% или на 10% от исходного значения; 3) при
требовании пациента завершить тест.
При прекращении тестирования по любой из этих причин следует посадить пациента либо положить на спину, в зависимости от тяжести его состояния и риска потери сознания, измерить артериальное давление, частоту пульса, сатурацию кислорода, при необходимости следует дать кислород.
Методика проведения 6-МТ. 6-МТ проводят в ровном прямом закрытом коридоре с твердым полом, по которому легко ходить. В хорошую погоду тест можно проводить на открытом воздухе. Коридор маркируют через каждые 3 м. Начало и конец
дистанции отмечают конусами (аналогичными оранжевым конусам, используемым
при ремонте дорог), которые ставят на расстоянии 0,5 м от концов коридора (рис. 1).
Стартовая линия отмечается на полу яркой лентой [2].
Более короткий коридор требует больше времени на повороты и более частой
смены направления движения, что уменьшает общее пройденное расстояние. Рекомендуемая длина дистанции составляет 30 м [2], хотя некоторые исследователи используют 20-, 50- и даже 90-метровые коридоры. В то же время в крупном многоцентровом исследовании NETT у больных с эмфиземой расстояние, пройденное за
6 мин, было примерно на 10% меньше, если больные шли только по прямой, а не
проходили несколько раз по одному коридору [52].
Отсутствует единое мнение о том, можно ли пользоваться тредмилом при проведении 6-МТ. Использование тредмила экономит пространство, позволяет мониторировать частоту сердечных сокращений и сатурацию кислорода во время нагрузки,
а при обследовании больных, получающих длительную кислородотерапию, устраняет необходимость передвигания кислородного концентратора по коридору вслед за
пациентом. В большинстве публикаций расстояние, пройденное по коридору, было
больше, чем расстояние, пройденное теми же пациентами на тредмиле, и разница
составляла от 49 [56] до 84 м [55]. Такие различия клинически значимы (см. подраздел «Интерпретация результатов 6-МТ»), поэтому был сделан вывод, что эти варианты 6-МТ неэквивалентны. Значительные различия в результатах одного и того же
теста, выполненного в разных условиях, объясняются тем, что, во-первых, для любого человека более привычна ходьба по коридору, чем по бегущей дорожке; во-вторых, любое изменение скорости ходьбы в коридоре практически не требует усилий
пациента, а тот же процесс на тредмиле сопровождается дополнительным умственным и физическим усилием, поскольку на тредмиле как для увеличения, так и для
уменьшения скорости пациент должен был нажать соответствующую кнопку. И на¬
Скорость произвольная
' 30 м
_ (15-100 м) _
Рис. 1. Схема 6-минутного теста.
163
Гпава 8
Таблица 2. Шкала Борга для оценки одышки [5]
Баллы
Тяжесть одышки
0
Нет одышки совсем
0,5
Очень-очень легкая
(почти неощутимая)
I
Очень легкая одышка
2
Легкая (слабая) одышка
3
Средняя одышка
4
Умеренная одышка
5
Тяжелая одышка
6
Достаточно тяжелая одышка
7
Очень тяжелая одышка
8
Очень-очень тяжелая одышка
9
Чрезвычайно тяжелая одышка
10
Невыносимая (предельно тяжелая)
одышка
конец, не исключено, что при тестировании на тредмиле снижалась мотивация
больного, опять же в связи с присутствием дополнительных трудностей [55, 56].
Необходимое оборудование для проведения 6-МТ включает [2]: 1) хронометр
либо секундомер; 2) два небольших конуса для обозначения точек поворота;
3) механический счетчик расстояния
(шагомер); 4) кресло, которое легко передвигается вдоль дистанции; 5) источник кислорода; 6) тонометр; 7) телефон;
8) портативный дефибриллятор; 9) средства экстренной помощи (см. подраздел
«Меры предосторожности»).
Подготовка пациента к 6-МТ [2]:
1) удобная одежда, не стесняющая движений; 2) обувь, удобная для ходьбы;
3) пациенту разрешается использовать
приспособления для ходьбы (трость
и т.д.), которыми он пользуется повседневно; 4) сохраняется обычный для больного
режим приема медикаментов; 5) перед проведением теста пациенту разрешается
принять легкий завтрак (обед); 6) не рекомендуются энергичные физические нагрузки в течение 2 ч до проведения теста.
Тестирование [2]. До начала исследования пациент должен спокойно посидеть в
кресле около стартовой линии как минимум 10 мин. В течение этого времени необходимо оценить противопоказания к исследованию, измерить пульс и давление и
убедиться, что одежда и обувь пациента подходят для выполнения теста.
Целесообразность измерения сатурации кислорода состоит в том, что толерантность
к физической нагрузке определяется не только пройденным расстоянием, но и симптомами заболевания на фоне нагрузки. Пульсоксиметрию желательно проводить в
течение всего тестирования. Следует обратить внимание на регулярность пульса и
приемлемое качество сигнала пульсоксиметра. Для мониторирования сатурации исследователю не нужно проходить с пациентом всю дистанцию. Пульсоксиметр должен крепиться к одежде пациента, быть легким (не более 900 г) и удобной формы,
чтобы пациенту не приходилось удерживать его и чтобы он не мешал ходьбе.
Для оценки одышки при нагрузке используют шкалу Борга (табл. 2) либо визуально-аналоговую шкалу (рис. 2, см. цветную вкладку на с. 183). Их следует напечатать
на твердой бумаге (желательно ламинированной) крупным шрифтом. Перед началом 6-МТ нужно показать шкалу пациенту и попросить по ней определить степень
дыхательного дискомфорта и общего утомления. В конце тестирования следует напомнить пациенту выбранные им исходно баллы и попросить вновь оценить эти
симптомы.
Исследователь должен проинструктировать пациента следующим образом: «Цель
этого исследования — ходить настолько быстро, насколько возможно, в течение
6 минут. Это достаточно большое время для ходьбы, поэтому вы сами определяете
интенсивность своей нагрузки. Возможно, у вас усилится одышка или появится
164
Внелабораторные нагрузочные тесты
усталость. При этом вы можете замедлить темп ходьбы, а если нужно, остановиться
и отдохнуть. Во время отдыха можно прислониться к стене, но затем вам следует
продолжать ходьбу. Ходить нужно вперед и назад по коридору, обходя конусы. Поворачивать вокруг конусов нужно быстро и затем без задержки продолжать движение
в обратном направлении». Рекомендуется пройти один круг, чтобы продемонстрировать пациенту, как надо ходить.
В течение всего тестирования исследователь должен стоять рядом со стартовой
линией. Не следует ходить вместе с пациентом. Когда пациент начнет ходьбу, нужно
включить таймер.
Не следует разговаривать с пациентом во время ходьбы. Можно лишь использовать стандартные ободряющие фразы. Каждый раз, когда пациент поворачивает на
стартовой линии, исследователь однократно нажимает на кнопку счетчика либо отмечает пройденный круг на листе бумаги. Рекомендуется делать это заметно для пациента.
Нельзя даже жестами требовать от больного увеличить скорость ходьбы.
Если пациент во время исследования остановился и нуждается в отдыхе, таймер
на это время не выключают. Если пациент отказывается продолжать ходьбу (или исследователь считает, что тест следует прекратить), нужно подвинуть кресло и усадить
в него пациента и отметить в протоколе пройденное расстояние, время и причину
преждевременного прекращения исследования.
За 15 с до завершения теста следует предупредить пациента, чтобы после просьбы
остановиться он остановился там, где будет находиться в этот момент, после чего исследователь сам подходит к пациенту и при необходимости подкатывает к нему кресло. Точку остановки отмечают на полу куском яркой ленты либо другим маркером.
После завершения теста снова измеряют сатурацию, частоту пульса, степень
одышки и усталости по шкале Борга либо визуально-аналоговой шкале, а также
спрашивают пациента о причинах, которые мешали ему ходить быстрее, и указывают их в протоколе.
Для подсчета пройденного расстояния используют показания шагомера или раз-
метку на стене коридора.
Особенности пульсоксиметрии во время нагрузочного тестирования. Пульсоксимет-
рия во время нагрузочного тестирования имеет следующие особенности [2]: 1) не все
пульсоксиметры на фоне физической нагрузки дают результаты, сопоставимые с газовым анализом артериальной крови; 2) пульсоксиметры имеют некоторую инертность и не сразу отражают изменения сатурации; 3) при использовании некоторых
моделей пульсоксиметров снижение тканевой перфузии при сердечно-сосудистых
заболеваниях, спазме сосудов или гипотермии может исказить результат; при этом
рекомендуется использовать для измерения другие участки тела (например, ухо, лоб)
либо разогреть пальцы рук; 4) снижение сатурации менее 83% может уменьшить
точность измерения из-за того, что большинство пульсоксиметров калиброваны по
85% уровню сатурации; 5) на точность пульсоксиметрии влияют изменения концентрации гемоглобина, в частности, у пациентов с гемоглобином ниже 80 г/л происходит существенное занижение результатов пульсоксиметрии; 6) возможно появление
артефактов, связанных с движением; некоторые пульсоксиметры снабжены устройством, устраняющим такие артефакты; 7) некоторые пульсоксиметры реагируют на
пигментацию кожи, хотя специальных исследований этой проблемы не проводилось; 8) на результат пульсоксиметрии может влиять окружающее освещение.
165
Гпава 8
Причины вариабельности результатов теста. Шестиминутный тест обладает хорошей воспроизводимостью с коэффициентом корреляции между результатами повторных тестов от 0,83 [32] до 0,98 [25] и разницей при повторных исследованиях в
пределах 20 м [2], поэтому в большинстве случаев повторение теста для получения
достоверного результата не требуется, однако многие исследователи проводят тест
как минимум дважды.
В то же время существует много причин для вариабельности результатов 6-МТ,
которые в основном кроются в разной технике и кратности проведения исследования. ATS в рекомендациях по 6-МТ указывает, что в большинстве ситуаций достаточно однократного тестирования, но если существует необходимость в повторном
исследовании, то интервал должен составлять не менее 1 ч, при этом регистрируют
лучший из полученных результатов [2]. Повторное тестирование рекомендуется выполнять в то же время дня, что и первое, во избежание внутрисуточной вариабельности результатов, хотя некоторые исследователи не получили статистически значимой разницы между результатами повторных 6-МТ, проводимых в разное время
суток [4].
Если во время тестирования пациент ингалирует кислород, особенно когда планируются повторные исследования (например, для оценки эффективности других
видов лечения), то при проведении всех тестов пациент должен получать кислород в
одном и том же режиме. Если скорость подачи кислорода во время последующих тестирований увеличивают из-за ухудшения газообмена, это должно быть отмечено в
протоколе и учитываться при интерпретации результатов. Также в протоколе следует указать тип прибора для длительной кислородотерапии: например, пациент получает жидкий кислород из портативного баллона, либо передвигает рядом с собой
концентратор кислорода, либо медицинский работник с источником кислорода
идет за пациентом (что не рекомендуется); доставка кислорода постоянная либо в
пульсовом режиме. Пульс и сатурацию измеряют спустя как минимум 10 мин после
изменения режима подачи кислорода [2].
Интерпретация результатов 6-минутного теста. На результат 6-МТ могут влиять некоторые факторы, не связанные с сердечно-сосудистыми и респираторными заболеваниями (табл. 3).
В большинстве случаев 6-МТ выполняется до и после лечебных мероприятий, и
главный вопрос состоит в том, получено ли у данного больного клинически значимое улучшение. Сегодня нет достоверных сведений о том, что лучше коррелирует с
Таблица 3. Факторы, влияющие на результат 6-МТ (по [2])
Уменьшают расстояние
Увеличивают расстояние
Маленький рост
Высокий рост
Пожилой возраст
(более длинные ноги)
Избыточная масса тела
Мужской пол
Женский пол
Сильная мотивация
Снижение интеллекта
Повторное тестирование
Негроидная раса [ 161
Лекарственные препараты,
Короткий коридор (большее число поворотов)
принятые непосредственно
Заболевания крупных суставов
перед тестированием
166
Внелабораторные нагрузочные тесты
клиническим улучшением: увеличение пройденного расстояния в абсолютных величинах, либо в процентах от исходного уровня, либо в процентах от должных значений. ATS рекомендует оценивать динамику пройденного расстояния в абсолютных
величинах (в метрах) [2].
Статистически достоверное улучшение результатов 6-МТ на фоне лечения не обязательно означает, что и состояние пациента при этом значимо улучшилось. Окончательно не установлено, насколько должен улучшиться результат внелабораторных нагрузочных тестов, чтобы пациент заметил, что его переносимость повседневных физических нагрузок тоже улучшилась. При этом следует иметь в виду, что статистически достоверное среднее увеличение 6-минутного расстояния (6-МР) в группе
пациентов зачастую гораздо меньше, чем клинически значимое улучшение у каждого отдельного больного. В метаанализе М.А. Puhan et al. у больных со среднетяжелой
и тяжелой ХОБЛ увеличение 6-минутного расстояния на 35 м соответствовало минимальному значимому улучшению качества жизни, оцененного по вопросникам
Chronic Respiratory Questionnaire и St. George’s Respiratory Questionnaire [46]. R.A. Wise
и C.D. Brown получили минимальную клинически значимую разницу в 6-минутном
расстоянии для больных ХОБЛ 54-80 м [61].
Для больных с хронической сердечной недостаточностью минимальное увеличение 6-минутного расстояния, соответствующее улучшению качества жизни и уменьшению клинических проявлений хронической сердечной недостаточности, составило 24 м, а минимальное уменьшение 6-минутного расстояния с соответствующим
ухудшением клинических показателей и качества жизни —43 м [38].
Недавно опубликованы результаты единственного пока исследования, оценившего минимальную клинически значимую разницу в 6-минутном расстоянии для
больных с идиопатической легочной артериальной гипертензией, которая составила 39 м (разброс 12,7-77,9 м) [21].
Должные величины 6-МТ. Оптимальные должные величины для стандартизованного 6-МТ на основании исследования здоровой популяции пока не разработаны.
Проведенные в этом направлении исследования охватывают недостаточно большие
популяции либо ограниченные возрастные группы.
В 1998 г. P.L. Enright и D.L. Sherrill по результатам обследования 117 практически
здоровых мужчин и 173 практически здоровых женщин в возрасте от 43 до 79 лет
[16], отобранных методом случайной выборки из 3805 человек, вывели формулы для
вычисления должных величин:
для мужчин: (7,57 х рост в см) — (5,02 х возраст) — (1,76 х масса тела в кг) — 309 м;
для женщин: (2,11 х рост в см) - (2,29 х масса тела в кг) — (5,78 х возраст) + 667 м,
которые объясняли 42 и 38% вариации результатов 6-МТ для мужчин и женщин соответственно. Нижняя граница нормы определялась при вычитании из полученной
нормы 153 м для мужчин и 139 м для женщин. Однако общая популяция составила
всего 290 человек, и в нее не вошли лица моложе 40 лет.
Годом позже Т. Troosters et al. вывели другое уравнение для расчета должного расстояния в 6-МТ:
218 + (5,14 х рост в см - 5,32 х возраст) - (1,8 х масса тела в кг + 51,31 х пол),
где пол равен 1 для мужчин и 0 для женщин. Однако исследование включало всего
54 здоровых людей в возрасте 50-85 лет [59].
167
Гпава 8
В 2003 г. P.L. Enright et al. провели многоцентровое исследование с участием
2281 человека, отобранного из когорты численностью 5201 человек [15]. Средний
возраст составил 77 лет для 2117 человек, которые могли полностью выполнить
6-МТ, и 78 лет для 164 человек, которые выполнили исследование лишь частично.
В этой популяции 437 женщин и 315 мужчин были здоровыми, остальные страдали
различными заболеваниями сердечно-сосудистой системы, перемежающейся хромотой, сахарным диабетом, артритами. По результатам, полученным у здоровой части популяции, авторы вывели новые формулы для расчета должных величин:
для женщин: 493 + (2,2 х рост в см) - (0,93 х масса тела в кг) — (5,3 х возраст);
для мужчин: та же формула + 17 м.
Нижняя граница нормы в этой группе определялась как 5-й процентиль, что составило примерно 75%, или на 100 м меньше должного расстояния.
Неоспоримым преимуществом этого исследования стало подтверждение безопасности 6-МТ у пожилых: из 2281 участника 75% не отметили какого-либо ухудшения
в самочувствии к концу теста, а у остальных чаще всего встречались жалобы на боль
в ногах (34%) или общую усталость (43%).
При сопоставлении этих уравнений их специфичность (67,1 и 69,1% соответственно) и чувствительность (67,1 и 67,5% соответственно) при прогнозе летальности
у больных ХОБЛ были сходными [11].
Должные величины 6-МТ для детей и подростков рассчитаны A.M. Li et al. по результатам обследования 1445 здоровых китайских детей от 7 до 16 лет [31]:
для мальчиков: 554,16 + (ДЧСС х 1,76) + (рост в см х 1,23);
для девочек: 526,79 + (ДЧСС х 1,66) + (рост в см х 0,62),
где ДЧСС — разница в частоте сердечных сокращений до и после 6-МТ.
Из всех клинических и антропометрических параметров авторы включили в это
уравнение только рост и разницу в ЧСС до и после нагрузки, поскольку в пошаговой
мультивариантной регрессионной модели эти показатели имели наиболее сильную
положительную корреляцию с 6-минутным расстоянием.
В 2009 г. выполнено аналогичное исследование в Северной Африке с участием
200 здоровых детей в возрасте от 6 до 16 лет, получено следующее уравнение:
6-МР в м = (4,63 х рост в см) - (3,53 х масса тела в кг) +
+ (10,42 х возраст в годах) + 56,32,
где 6-МР - расстояние, пройденное в 6-МТ [3]. Однако следует помнить, что, по
данным PL. Enright et al., лица пожилого возраста негроидной расы проходили за
6 мин меньше, чем лица белой расы [15], хотя среди детей подобного сравнения не
проводилось.
Таким образом, до настоящего времени не существует универсального уравнения
для расчета должных величин 6-МТ, которое могло бы использоваться в любых клинических ситуациях подобно расчету должных величин легочных функциональных
показателей. Вероятно, в клинической практике врачи могут применять приведенные выше уравнения с учетом возраста больных.
Расстояние, пройденное в 6-МТ, хорошо коррелирует с Vq2 max, измеренным во
время максимального нагрузочного тестирования на велоэргометре либо тредмиле
(коэффициент корреляции г от 0,59 [40] до 0,78 [7]). J.J. Laskin et al. на основании со-
168
Внелабораторные нагрузочные тесты
Таблица 4. Средние величины расстояния, пройденного в 6-МТ
Исследование
Численность
Возраст,
Состояние здоровья
Среднее
популяции
годы
расстояние, м
P.L. Enright et al., 1998
290
43-79
Здоровые
576 для мужчин,
494 для женщин
D. Stevens et al., 1999
21
35-79
Хронические
бронхолегочные
заболевания
374,3 ± 77,7
T. Troosters et al., 1999
53
50-85
Здоровые
631 ±93
W.J. Gibbons et al., 2001
79
20-80
Здоровые
698 ± 96
P.L. Enright et al., 2003
752
Средний
Здоровые
400 для мужчин,
возраст
77-78
367 для женщин
2281
Смешанная популяция
362 для мужчин,
(здоровые, лица
с различной
сердечно-сосудистой
патологией, сахарным
диабетом, артритами)
332 для женщин
B. Camarri et al., 2006
70
55-75
Здоровые
659 ± 62
A. Chetta et al., 2006
102
20-50
Здоровые
638 ± 44
для мужчин,'
593 ± 57
для женщин
H. Poh et al., 2006
35
45-85
Здоровые
560 ± 105
A.M. Li et al., 2007
1445
7-16
Здоровые
680,9 ± 65,3
для мальчиков,
642,7 ± 58,9
для девочек
поставления результатов 6-МТ и тестирования на велоэргометре 20 здоровых людей
составили уравнения для расчета V02 max по итогам 6-МТ:
Vq2 max (л/мин) = -1,732 + (масса тела в кг х 0,049) +
+ (расстояние в м х 0,005) + (ЧСС х (-0,015)) [28].
Средние величины 6-минутного расстояния, полученные в разных исследованиях, приведены в табл. 4.
Во всех исследованиях среднее 6-минутное расстояние снижалось с возрастом,
причем у мужчин 6-МР было несколько больше, чем у женщин, а у здоровых больше,
чем у лиц, имеющих какие-либо хронические заболевания. Различия в средних значениях 6-минутного расстояния среди здоровых лиц сходного возраста могут объясняться разницей в численности обследованных групп и методике выполнения 6-МТ (тип
и частота ободряющих фраз, форма траектории (круг, прямая линия, прямоугольник),
поставленная перед участниками исследования задача, кратность тестирования).
Низкие величины 6-минутного расстояния неспецифичны и не имеют диагностического значения, и при получении такого результата необходим тщательный анализ возможных причин этого снижения с учетом легочной и сердечной функций.
169
Гпава 8
мышечной силы, состояния питания и опорно-двигательного аппарата, интеллекта,
особенностей телосложения и т.д. [2].
Результаты 6-минутного теста умеренно коррелируют с показателями качества
жизни и выраженностью одышки.
Десатурацией во время 6-МТ считают снижение сатурации, измеренной пульсок-
симетром, на >4%, что определяется при вычитании величины сатурации до нагрузки из величины, полученной после нагрузки [24].
Помимо десатурации, связанной с сердечно-легочными заболеваниями, описаны случаи десатурации при физической нагрузке (как высокой, так и умеренной интенсивности) у здоровых спортсменов [20], что объясняют либо гиповентиляцией
при умеренных нагрузках, вызванных повышенной выносливостью, либо повышенным депонированием крови в мышечной ткани, либо другими, пока не изученными
особенностями адаптации кардиореспираторной системы.
Динамика результатов 6-минутного теста на фоне лечения. Бронходилататоры при
ХОБЛ. Исследования по влиянию бронхолитиков на переносимость физических нагрузок в подавляющем большинстве ограничиваются больными ХОБЛ, и результаты
их противоречивы. Данные некоторых исследований о влиянии (32-агонистов короткого и длительного действия на результат 6-МТ, как в однократных дозах, так и при
длительном лечении, в виде монотерапии и в комбинации с антихолинергическими
препаратами, приведены в табл. 5.
В последние годы увеличивается объем информации о положительном влиянии
тиотропия на переносимость физической нагрузки при ХОБЛ, что объясняется его
способностью существенно и стабильно уменьшать гиперинфляцию легких во время нагрузки у больных ХОБЛ.
Глюкокортикостероиды при ХОБЛ. В исследовании P.L. Paggiaro et al. больные
ХОБЛ, получавшие ингаляционные стероиды, улучшили результаты 6-минутного
теста в среднем на 33 м (8%) [41]. Однако М.М. Schuurmans et al. показали, что при
среднетяжелой и тяжелой стабильной ХОБЛ пероральный преднизолон существенно увеличивал 6-минутное расстояние (в среднем на 55 м, или 12,3% от исходного)
только у больных с обратимой на фоне стероидной терапии бронхиальной обструкцией [51].
Другие препараты для лечения ХОБЛ. Влияние теофиллина на результаты 6-МТ
изучалось всего в одном двойном слепом рандомизированном плацебоконтролиру-
емом исследовании с участием больных хроническим бронхитом; при этом ни пероральная доза теофиллина от 200 до 800 мг при однократном приеме, ни соответствующая концентрация его в плазме не коррелировали с 6-минутным расстоянием [17].
Лечение легочной артериальной гипертензии. Изменение 6-минутного расстояния
под влиянием лечения у больных легочной артериальной гипертензией оценивалось
в 17 крупных рандомизированных контролируемых исследованиях. В целом бозен-
тан улучшал результат 6-МТ на 26—76 м (хотя в одном исследовании 6-минутное расстояние на фоне лечения бозентаном уменьшилось на 10 м), силденафил — на
28,8—65,5 м, эпопростенол — на 45—108 м, ситаксентан — на 31,4—34 м. Влияние других препаратов для лечения легочной артериальной гипертензии (берапрост, ило-
прост, трепростинил) оценивалось в единичных исследованиях, все они увеличивали пройденное расстояние на 16—45 м [19].
Ингаляционный оксид азота у больных с легочной артериальной гипертензией в
«остром» тесте не влиял на физическую толерантность [43], но при длительном ле-
170
Внелабораторные нагрузочные тесты
Таблица 5. Влияние бронхолитиков на результат 6-МТ
Исследование
Дизайн
Препарат
Изменение
6-минутного расстояния
S.S. Shah et al.,
Двойное слепое
Сальбутамол
Значительное увеличение
1983
плацебоконтрол ируе мое
перекрестное
200 мкг
однократно
(данные не приведены)
С.К. Connolly,
Рандомизированное
Сальбутамол +
Увеличение на 39 м
N.S. Chan, 1987
двойное слепое
+ ипратропия
по сравнению с монотерапией
перекрестное
бромид
теми же препаратами
A.F. Mohammed
Многоцентровое
Сальбутамол
Отсутствие достоверных
et al., 1991
рандомизированное
медленного
различий между группами
двойное слепое
плацебоконтролируемое
в параллельных группах
высвобождения
в таблетках,
16 мг/сут, 6 нед
сальбутамола и плацебо
G. Boyd et al.,
Многоцентровое
Салметерол
Увеличение в среднем на 21 м
1997
рандомизированное
100 и 200 мкг/сут,
во всех группах, включая
двойное слепое
плацебоконтролируемое
в параллельных группах
16 нед
плацебо
A. Grove et al.,
Рандомизированное
Салметерол
Отсутствие достоверных
1996
двойное слепое
плацебоконтролируемое
перекрестное
100 мкг/сут, 4 нед
различий между группами
салметерола и плацебо
как после однократной дозы,
так и после длительного
лечения
D.A. Mahler
Многоцентровое
Салметерол
Достоверное увеличение
et al., 1999
рандомизированное
84 мкг/сут
на 12,8 ± 6,4 м
двойное слепое
vs ипратропия
в группе ипратропия
с двойным
бромид
vs плацебо, остальные
плацебоконтролем
в параллельных группах
144 мкг/сут
vs плацебо, 12 нед
различия недостоверны
J.G. Hay et al.,
Двойное слепое
Окситропия
Достоверное увеличение
1992
плацебоконтролируемое
бромид,
на 24 м (7%) по сравнению
перекрестное
однократная доза
с плацебо
D.P. Spence
Рандомизированное
Окситропия
Достоверное увеличение
et al., 1993
двойное слепое
плацебоконтролируемое
перекрестное
бромид 200 мкг
однократно
на 22 м
N. Okudan
Рандомизированное
Тиотропия
Достоверное увеличение
et al., 2006
двойное слепое
бромид 18 мкг
на 14,6 м по сравнению
плацебоконтролируемое
перекрестное
однократно
с плацебо
чении больных с тяжелой легочной гипертензией улучшал переносимость ими физической нагрузки [44].
Лечение сердечно-сосудистых заболеваний. Большинство исследований по влиянию лекарственных препаратов на результат 6-МТ у больных с хронической сердечной недостаточностью посвящено ингибиторам ангиотензинпревращающего фермента (ИАПФ). Среднее увеличение 6-минутного расстояния на фоне лечения
ИАПФ составляет 24,2 м [39].
171
Гпава 8
Кислородотерапия респираторных заболеваний. R.M. Leach et al. показали, что в
группе больных с различными хроническими бронхолегочными заболеваниями ингаляция кислорода 2, 4 и 6 л/мин во время 6-МТ увеличивает пройденное расстояние
на 19,2; 34,5 и 36,3% соответственно. Перенос портативного цилиндра для кислорода
при дыхании обычным воздухом уменьшает пройденное расстояние на 14,1% по
сравнению с исходным, а та же работа на фоне ингаляции кислорода увеличивает
этот показатель на 2,3; 15,5 и 17,0% соответственно [29]. В работе D. Delample et al.
«острый» эффект кислорода в дозе 2—5 л/мин у больных ХОБЛ был менее выраженным и составил 5—7% от исходного 6-минутного расстояния [13]. Однако в целом доказательств влияния кислорода на 6-минутное расстояние на сегодняшний день недостаточно, и результаты метаанализа 5 рандомизированных контролируемых исследований из базы данных Cochrane свидетельствуют об отсутствии значимого влияния
ингаляций кислорода на переносимость физических нагрузок у больных ХОБЛ [37].
Физическая реабилитация. У больных тяжелой ХОБЛ 3-месячная легочная реабилитация улучшила 6-минутное расстояние на 30 м (11% от исходного) [12], а в исследовании P.J. Wijkstra et al. после 18 мес реабилитации у таких же тяжелых больных
6-минутное расстояние почти не изменилось и достоверно не отличалось от показателя группы контроля [60]. Тем не менее большинство авторов сходятся во мнении,
что более продолжительные реабилитационные программы в большей степени улучшают переносимость физических нагрузок [50].
У больных тяжелой легочной гипертензией физическая реабилитация в течение
15 нед в рандомизированном контролируемом исследовании улучшила 6-минутное
расстояние на 85 м (20%), а еще через 15 нед — на 96 м (22%) по сравнению с исходным уровнем [35], но проведенные в этой области исследования немногочисленные.
При хронической сердечной недостаточности II—111 функционального класса по
классификации NYHA (New York Heart Association) физическая реабилитация может улучшить результат 6-МТ в среднем на 40,9 м [47].
Хирургические методы лечения респираторных заболеваний. Билатеральная хирургическая редукция объема легочной ткани (ХРОЛ) у больных крайне тяжелой ХОБЛ
может увеличить 6-минутное расстояние: в работах [11, 13] отмечено увеличение
6-МР на 61—63,8 м (17,7—23,5% от исходного) в течение года; в работе [23] — на
14—16 м (3,6—4% от исходного) в течение 6 мес после операции.
Существенно улучшает переносимость физических нагрузок трансплантация
легких как в ранние, так и в отдаленные сроки независимо от пересадки одного или
двух легких и развития в посттрансплантационном периоде облитерирующего бронхиол ита.
Прогностическое значение 6-МТ. Результаты 6-МТ позволяют прогнозировать течение многих легочных заболеваний, исход торакальных хирургических вмешательств и даже эффективность некоторых методов лечения, например реабилитационных программ.
ХОБЛ. Исследования последних лет показали, что 6-минутное расстояние у больных ХОБЛ более точно оценивает тяжесть заболевания и прогноз течения, чем
ОФВ,, на котором основана принятая во всем мире классификация тяжести ХОБЛ
[22] и который является основным мониторируемым показателем при этой болезни.
Риск летального исхода при ХОБЛ составил 0,82 на каждые 50 м увеличения
6-минутного расстояния [45], а снижение 6-минутного расстояния менее 289 м повышало риск летального исхода вдвое [33].
172
Внелабораторные нагрузочные тесты
Тенденция изменения 6-минутного
расстояния у больных ХОБЛ по мере
прогрессирования заболевания противоположна тенденции снижения ОФВ,: на
II стадии заболевания ОФВ, снижается
на 40 мл/год, на III стадии — на 10 мл/год
и на IV стадии практически перестает изменяться с течением времени, тогда как
6-МР на II стадии ХОБЛ уменьшается на
6 м/год (2% от исходного), на III стадии -
на 16 м/год (19% от исходного), а на
IV стадии — на 15 м/год (26% от исходного) (рис. 3) [8].
6-МТ вошел в новую систему оценки
состояния больных ХОБЛ — индекс
BODE, включающий индекс массы тела,
ОФВ,, выраженность одышки по шкале МЯСи расстояние, пройденное в 6-МТ; индекс более точно прогнозирует летальность, чем ОФВ, [9].
Хирургическое лечение респираторных заболеваний (ХРОЛ и трансплантация легких). Расстояние <200 м, пройденное в 6-МТ, наряду с гиперкапнией (РаС02 в покое
>45 мм рт. ст.) прогнозирует летальность в течение 6 мес после ХРОЛ с чувствительностью 100% и специфичностью 69% [58].
Шестиминутное расстояние менее 400 м может служить маркером, при котором пациент должен включаться в список ожидающих трансплантацию легких при любой легочной патологии, с чувствительностью 80% и специфичностью 27% [26], при этом
риск летального исхода при уменьшении 6-МР на 152 м повышается почти на 50% [34].
Легочная гипертензия. При легочной артериальной гипертензии выживаемость
значительно ухудшалась у больных, проходивших в 6-МТ менее 332 м, и хотя 6-МР
не коррелировало с давлением в легочной артерии, но четко уменьшалось по мере
нарастания функционального класса по NYHA [36].
Интерстициальные заболевания легких. При идиопатическом легочном фиброзе
прогноз выживаемости не зависит от расстояния, пройденного за 6 мин, но в большей степени определяется десатурацией в ходе 6-МТ: при нормальных показателях
газообмена в покое, но снижении сатурации менее 88% во время ходьбы длительность жизни больных сокращается более чем в 2 раза [18, 27]. Однако для больных с
интерстициальными заболеваниями легких, ожидающих трансплантацию легких,
«пороговым» значением 6-МР, определяющим выживаемость в течение 6 мес, является 207 м с прогностической ценностью, превышающей таковую для ФЖЕЛ [30].
Хроническая сердечная недостаточность. Для больных с хронической сердечной
недостаточностью неблагоприятным прогностическим признаком, повышающим
риск летального исхода, является 6-МР <300 м [1]; существует мнение, что этот же
признак может служить основанием для направления больного на трансплантацию
сердца [7].
Шаттл-тест
Шаттл-тест, используемый в медицине, модифицирован из 20-метрового шаттл-
теста, разработанного для оценки максимальной аэробной мощности у спортсменов.
-5
2
-10 QL
-15
CD
<
-20
Рис. 3. Динамика 6-минутного расстояния
в зависимости от тяжести ХОБЛ. (По
Casanova С. et al. [8].)
173
Гпава 8
Скорость регулируемая
’ 10 м
Рис. 4. Схема шаттл-теста.
~Ь
Основное отличие шаттл-теста от
других тестов с ходьбой заключается в
том, что скорость ходьбы регулируется
не пациентом, а исследователем. Пациент ходит вперед и назад по 10-метровой
дистанции, на концах которой, как и в
6-минутном тесте, расставляются конусы-маркеры на расстоянии 0,5 м от каждого
конца дистанции (рис. 4). Скорость ходьбы регулируется звуковыми сигналами, записанными на магнитофон. Пациент получает инструкции ходить уверенным шагом с такой скоростью, чтобы к моменту следующего звукового сигнала достичь
противоположного конца дистанции (противоположного конуса-маркера) [54].
Нагрузка в шаттл-тесте может постепенно нарастать, а может оставаться на одном уровне в течение всего исследования.
Шаттл-тест с возрастающей нагрузкой. В шаттл-тесте с возрастающей нагрузкой
начальная скорость составляет 0,5-0,62 м/с и увеличивается каждую минуту на
0,10—0,17 м/с, при этом время между звуковыми сигналами соответственно укорачивается.
Подобно максимальному нагрузочному тестированию на велоэргометре или
тредмиле, шаттл-тест с возрастающей нагрузкой состоит из нескольких уровней
(табл. 6). Каждый уровень продолжается в течение 1 мин. Нагрузка может наращиваться относительно медленно («облегченный» вариант шаттл-теста, при котором
тестирование заканчивается на 10-м уровне) либо более активно (модифицированный вариант шаттл-теста, который насчитывает 12 уровней, при этом к концу тестирования скорость ходьбы и суммарная нагрузка будут выше, чем в первом варианте).
Соответственно темпам повышения нагрузки увеличивается число кругов, которые
пациент должен пройти на каждом уровне. Так, в течение 1-й минуты пациент должен пройти 3 круга, или 1 круг за 20 с, а
Таблица 6. Протокол шаттл-теста (по [54]) на 2-й минуте он должен ускорить темп
ходьбы соответственно звуковому сигналу и пройти 4 круга и т.д. Если пациент достиг конца дистанции раньше,
чем прозвучал сигнал, он должен остановиться и продолжать ходьбу только
после сигнала.
В течение 1-й минуты, когда скорость ходьбы самая медленная, исследователь может идти рядом с больным,
чтобы помочь ему понять суть теста, но
уже со 2-й минуты пациент должен ходить самостоятельно. Во время шаттл-
теста не рекомендуется произносить
никаких ободряющих фраз, но в течение первых 1—2 мин разрешается напоминать пациенту о необходимости немного увеличить скорость.
Максимальная продолжительность
исследования составляет 10 мин для об¬
Уровень
«Облегченный»
Модифицированный
скорость,
м/с
число
кругов
в одном
уровне
скорость,
м/с
число
кругов
в одном
уровне
I
0,62
3
0,50
3
2
0,72
4
0,67
4
3
0,82
4
0,84
5
4
0,92
5
1,01
6
5
1,02
6
1,18
7
6
1,12
6
1,35
8
7
1,22
7
1,52
9
8
1,32
7
1,69
10
9
1,41
8
1,86
11
Ю
1,52
9
2,03
12
П
-
-
2,20
13
12
-
-
2,37
14
174
Внелабораторные нагрузочные тесты
легченного варианта и 12 мин для модифицированного варианта, но тест может закончиться и раньше, если пациент: а) из-за одышки не может сохранять необходимую скорость; б) не успевает пройти дистанцию за требуемое время (то есть к моменту очередного звукового сигнала оказывается дальше чем на 0,5 м от конца дистанции); в) достигает субмаксимальной ЧСС (85% от максимальной), рассчитанной по формуле
210 - (0,65 х возраст) [54].
Результатом теста является пройденное расстояние.
Таким образом, шаттл-тест с возрастающей нагрузкой похож на нагрузочное тестирование на велоэргометре или тредмиле, но в отличие от последних нагрузка в
шаттл-тесте не достигает максимального уровня.
Тест хорошо воспроизводим: разница между повторными исследованиями составляет 2 ± 10 м [54], и многие авторы считают, что для получения достоверных результатов достаточно однократного исследования.
Навязывание скорости ходьбы извне повышает объективность шаттл-теста и
улучшает его воспроизводимость по сравнению с 6-МТ и другими тестами с ходьбой, в которых скорость регулируется самим пациентом, позволяет стандартизировать величину физической нагрузки у разных больных и у одного и того же больного при повторных исследованиях. Однако недостатком этого теста является больший, чем в тестах с произвольной скоростью ходьбы, риск развития сердечно-сосудистых осложнений, что обусловливает менее широкое его применение.
Шаттл-тест с постоянной нагрузкой. В этом варианте шаттл-теста, как и в предыдущем, скорость ходьбы задается звуковым сигналом, но частота его остается неизменной на протяжении всего исследования. Пациент должен ходить по 10-метровой
дистанции, поворачивая вокруг конусов по сигналу, записанному с одинаковыми
интервалами времени.
Перед тестированием пациенту ставят задачу ходить максимально дольше с одинаковой скоростью; во время теста не рекомендуется произносить никаких ободряющих фраз.
В начале теста пациент ходит с более медленной скоростью в течение 100 с для
«привыкания» к дистанции. Затем после специального сигнала (тройной зуммер)
скорость звуковых сигналов увеличивается до заранее выбранной и далее не меняется до конца исследования (максимум 20 мин, исключая период «привыкания»).
Тест продолжается, пока пациент не устанет либо пока не появится одышка, препятствующая дальнейшей ходьбе. Если этого не происходит, то продолжительность
теста ограничивается 20 мин, но пациенту об этом заранее не сообщают [48].
Результатом этот варианта шаттл-теста является продолжительность ходьбы с заданной скоростью, т.е. время, в течение которого пациент способен переносить данную нагрузку. Таким образом, шаттл-тест с постоянной нагрузкой определяет выносливость пациента.
Оптимальная интенсивность нагрузки в шаттл-тесте с постоянной нагрузкой составляет 85% от максимальной.
Тест обладает хорошей воспроизводимостью: при втором исследовании время
ходьбы увеличивается на 9,7—109,2 с по сравнению с первым, при третьем — на
0,6—28 с по сравнению со вторым. Таким образом, желательно выполнять два исследования с интервалом 40 мин и учитывать лучший из полученных результатов [48].
Однако если шаттл-тест с постоянной нагрузкой выполняется после шаттл-теста с
175
Гпава 8
возрастающей нагрузкой, результаты меняются всего на 12 с, что делает необязательным повторное тестирование [49].
Нагрузка в шаттл-тесте с постоянной скоростью ходьбы очевидно высокая, но
она стабильная и соответствует проанализированным ранее физическим возможностям пациента. Данный тест также представляет собой компромисс между интенсивностью и продолжительностью нагрузки, поскольку окончание теста не программируется заранее. Этот момент можно рассматривать как недостаток, потому
что тест может продолжаться очень долго, если интенсивность нагрузки недостаточно высока. По этой причине шаттл-тесты не подходят для здоровых лиц, так как для
достижения субмаксимальной и тем более максимальной нагрузки здоровым людям
потребуется слишком большая скорость ходьбы и длительное время исследования.
Другой недостаток шаттл-теста с постоянной нагрузкой — необходимость предшествующего максимального нагрузочного тестирования. В связи с этими причинами
шаттл-тест с постоянной нагрузкой в клинической практике используется нечасто.
Шаттл-тест хорошо воспроизводим и хорошо коррелирует с Vq2 max.
Результаты шаттл-теста с возрастающей нагрузкой достоверно улучшаются после
ХРОЛ у больных с тяжелой эмфиземой, на фоне легочной реабилитации у больных
ХОБЛ, но мало меняются на фоне бронхолитической терапии.
Шаттл-тест с возрастающей нагрузкой может прогнозировать риск повторных
госпитализаций по поводу обострений ХОБЛ в течение 12 мес с отношением риска
0,8 (0,67—0,97) на каждые пройденные Юм [14], определять прогноз у больных хронической сердечной недостаточностью, в том числе перед трансплантацией сердца,
и предоперационный риск у больных раком легкого.
Минимальная клинически значимая разница в результатах шаттл-тестов, как с
возрастающей, так и с постоянной нагрузкой, изучалась в единственном исследовании S.J. Singh et al. и, по данным этих авторов, составляет 47,5 м [53].
Все основные внелабораторные нагрузочные тесты хорошо сопоставимы друг с
другом и с максимальным нагрузочным тестированием на велоэргометре или тред-
миле. Величина нагрузки и реакция кардиореспираторной системы сходны в 6-МТ
и шаттл-тесте с возрастающей нагрузкой, за исключением того, что тесты с ходьбой
более чувствительно, чем ВЭМ, выявляют гипоксемию во время нагрузки у больных
ХОБЛ [42]. Это связано с тем, что при ходьбе вентиляционные потребности у больных ХОБЛ выше, чем при ВЭМ. При ходьбе работают мышцы не только ног, но и
рук, которые при ВЭМ зафиксированы на поручнях в неподвижном положении.
С другой стороны, при ходьбе вертикальное положение тела усиливает гравитационное воздействие на диафрагму и другие дыхательные мышцы, а от двигающихся при
ходьбе рук идет дополнительная нейрогенная импульсация в дыхательный центр и
его гемодинамическая стимуляция, за счет чего возрастают вентиляционные потребности, усиливаются гипоксемия и одышка. Кроме того, у 50% больных ХОБЛ
дыхание десинхронизировано, т.е. сокращения дополнительных дыхательных мышц
при ходьбе не синхронны сокращениям диафрагмы, что тоже усиливает одышку. Таким образом, при ХОБЛ повышение вентиляционных потребностей раньше и в
большей степени отражается на переносимости ходьбы, а не других видов нагрузки,
поэтому ВЭМ у таких больных не выявляет в полной мере вентиляционные и метаболические нарушения, и у больных ХОБЛ внелабораторные тесты (6-МТ, шаттл-
тест) более объективно определяют ограничение переносимости повседневных физических нагрузок [42].
176
Внелабораторные нагрузочные тес ^ь.
Заключение
Внелабораторные нагрузочные тесты представляют собой хорошую альтернативу
в условиях, когда отсутствует возможность проведения кардиореспираторного нагрузочного тестирования.
Преимущества внелабораторных тестов:
• простота методики и доступность в любых условиях;
• отсутствие необходимости в сложном дорогостоящем оборудовании, специальных
помещениях и участии специально подготовленного персонала;
• уровень повседневной физической активности, который более важен для пациента, чем максимальная нагрузка;
• хорошая корреляция с показателями максимального нагрузочного тестирования;
• хорошая воспроизводимость;
• минимальное число противопоказаний.
Недостатки внелабораторных тестов:
• неполная информация о реакции организма на физическую нагрузку и невозможность измерения параметров газообмена, легочной функции и ЭКГ непосредственно на фоне нагрузки;
• результат тестов с произвольным темпом ходьбы или подъема на ступеньку значительно зависит от мотивации пациента;
• отсутствие должных величин.
По сравнению с традиционными лабораторными способами исследования функциональных резервов больного, такими как тредмил и велоэргометрия, тесты с ходьбой требуют меньшего технического оснащения, что делает их недорогими и простыми в практическом применении, и, что более важно, они могут использоваться у
пожилых и у тех пациентов, которым по тяжести состояния противопоказано тестирование с максимальной нагрузкой на тредмиле или велоэргометре.
Разнообразие существующих методик внелабораторного нагрузочного тестирования предоставляет врачу широкие возможности выбора.
Список литературы
1. Arslan S., Erol М.К., Gundogdu F. et al. Prognostic value of 6-minute walk test in stable outpatients with
heart failure //Tex. Heart Inst. J. 2007. V. 34. P. 166-169.
2. ATS statement: guidelines for the six-minute walk test // Amer. J. Respir. Crit. Care Med. 2002. V. 166.
P. 111-117.
3. Ben Saad H., Prefaut C., Missaoui R. et al. Reference equation for 6-min walk distance in healthy North
African children 6-16 years old // Pediatr. Pulmonol. 2009. V. 44. № 4. P. 316-324.
4. Beriault K., Carpentier A.C., Gagnon C. et al. Reproducibility of the 6-minute walk test in obese adults //
Int. J. Sports Med. 2009. Jul. 7. Epub. ahead of print.
5. Borg G.A.V. Psycho-physical bases of perceived exertion // Med. Sci. Sports Exerc. 1982. V. 14. P. 377—381.
6. Buckley J.P, Sim J., Eston R.G. et al. Reliability and validity of measures taken during the Chester step test
to predict aerobic power and to prescribe aerobic exercise // Br. J. Sports Med. 2004. V. 38. P. 197-205.
7. Cahalin L.P., Mathier M.A., Semigran M.J. et al. The six-minute walk test predicts peak oxygen uptake and
survival in patients with advanced heart failure // Chest. 1996. V. 110. P. 325—332.
8. Casanova C., Cote C.G., Martin J.M. et al. The 6-min walking distance: long-term follow-up in patients
with COPD // Eur. Respir. J. 2007. V. 29. P. 535-540.
9. Celli B.R., Cote C.G., Martin J.M. et al. The body-mass index, airflow obstruction, dyspnea, and exercise
capacity index in chronic obstructive pulmonary disease // N. Engl. J. Med. 2004. V. 350. P. 1005—1012.
10. Ciccona A.M., Meyers B.F., Guthrie T.J. et al. Long-term outcome of bilateral lung volume reduction in
250 consecutive patients with emphysema // J. Thorac. Cardiovasc. Surg. 2003. V. 125. № 3. P. 513—525.
11. Cote C.G., Casanova C., Martin J.M. et al. Validation and comparison of reference equations for the 6-min
walk distance test // Eur. Respir. J. 2008. V. 31. P. 571-578.
177
Гпава 8
12. Criner G.J., Cordova F.C., Furukawa S. et al. Prospective randomized trial comparing bilateral lung volume
reduction surgery to pulmonary rehabilitation in severe COPD // Amer. J. Respir. Crit. Care Med. 1999.
V. 160. P.2018-2027.
13. Delample D., Sabate M., Prefaut C., Durand F. Does prior training affects acute 02 supply responses during
exercise in desaturator COPD patients? // The Open Respiratory Medical Journal. 2008. V. 2. P. 29-34.
14. Emther M.I., Arnardottir H.R., Hallin R. et al. Walking distance is a predictor of exacerbations in patients
with chronic obstructive pulmonary disease // Respir. Med. 2007. V. 101. № 5. P. 1037—1040.
15. Enright P.L., McBurnie M.A., Bittner V. et al. The 6-min walk test. A quick measure of functional status in
elderly adults // Chest. 2003. V. 123. № 2. P. 387-398.
16. Enright P.L., Sherrill D.L. Reference equations for the six-minute walk in healthy adults // Amer. J. Respir.
Crit. Care Med. 1998. V. 158. P. 1384-1387.
17. Evans W.V. Plasma theophylline concentrations, six minute walking distances, and breathlessness in patients
with chronic airflow obstruction // Brit. Med. J. 1984. V. 289. P. 1649—1651.
18. Flaherty K.R., Andrei A.-C., Murray S. et al. Idiopathic pulmonary fibrosis: prognostic value of changes in
physiology and six-minute-walk test // Amer. J. Respir. Crit. Care Med. 2006. V. 174. P. 803-809.
19. Galie N., Manes A., Negro L. et al. A meta-analysis of randomized controlled trials in pulmonary arterial
hypertension // Eur. Heart J. 2009. V. 30. P. 394—403.
20. Garrido-Chamorro R.P., Gonzalez-Lorenzo M., Sirvent-Belando J. et al. Desaturation patterns detected by
oximetry in a large population of athletes // Res. Q. Exerc. Sport. 2009. V. 80. № 2. P. 241-248.
21. Gilbert C., Brown M.C., Cappelleri J.C. et al. Establishing a minimally important difference in 6-minute
walk distance and SF-36 among patients with pulmonary artery hypertension // Chest Meeting Abstracts.
2005. V. 128. 365S.
22. Global Initiative for Chronic Obstructive Pulmonary Disease. 2006. www.goldcopd.org
23. Goldstein R.S., Todd T.R.J., Guyatt G. et al. Influence of lung volume reduction surgery (LVRS) on health
related quality of life in patients with chronic obstructive pulmonary disease //Thorax. 2003. V. 58. P. 405-410.
24. Hadeli K.O., Siegel E.M., Sherill D.I. et al. Predictors of oxygen desaturation during submaximal exercise
in 8,000 patients // Chest. 2001. V. 120. P. 88-92.
25. Hamilton D.M., Haennel R.G. Validity and reliability of the 6-minute walk test in a cardiac rehabilitation
population //J. Cardiopulm. Rehabil. 2000. V. 20. № 3. P 156-164.
26. Kadikar A., Maurer J., Kesten S. The six-minute walk test: a guide to assessment for lung transplantation //
J. Heart Lung Transplant. 1997. V. 16. P. 313-319.
27. Lama V.N., Flaherty K.R., Toews G.B. et al. Prognostic value of desaturation during a 6-minute walk test in
idiopathic interstitial pneumonia //Amer. J. Respir. Crit. Care Med. 2003. V. 168. P. 1084-1090.
28. Laskin J.J., Bundy S., Marron H. et al. Using a treadmill for the 6-minute walk test: reliability and validity //
J. Cardiopulm. Rehabil. Prev. 2007. V. 27. № 6. P. 407-410.
29. Leach R.M., Davidson A.C., Chinn S. et al. Portable liquid oxygen and exercise ability in severe respiratory
disability // Thorax. 1992. V. 47. P. 781-789.
30. Lederer D.J., Arcasoy S.M., Wilt J.S. et al. Six-minute distance predicts waiting list survival in idiopathic
pulmonary fibrosis // Amer. J. Respir. Crit. Care Med. 2006. V. 174. P. 659-664.
31. Li A.M., Au J.T., So H.K. et al. Standard reference for the six-minute-walk test in healthy children aged 7 to
16 years // Amer. J. Respir. Crit. Care Med. 2007. V. 176. № 2. P. 174-180.
32. Mador M.J., Bozkanat E., Aggarwal A. et al. Endurance and strength training in patients with COPD //
Chest. 2004. V. 125. P. 2036-2045.
33. Martinez F.J., Foster G., Curtis J.L. Predictors of mortality in patients with emphysema and severe airflow
obstruction //Amer. J. Respir. Crit. Care Med. 2006. V. 173. P. 1326-1334.
34. Martinu T, Babyak M.A., O’Connell C.F. et al. Baseline 6-min walk distance predicts survival in lung transplant candidates // Amer. J. Transplant. 2008. V. 8. № 7. P. 1498-1505.
35. Mereles D., Ehlken N., Kreuscher S. et al. Exercise and respiratory training improve exercise capacity and
quality of life in patients with severe chronic pulmonary hypertension // Circulation. 2006. V. 114.
P. 1482-1489.
36. Miyamoto S., Nagaya N., Satoh T. et al. Clinical correlates and prognostic significance of six-minute walk
test in patients with primary pulmonary hypertension // Amer. J. Respir. Crit. Care Med. 2000. V. 161.
P. 487-492.
37. Nonoyama M.L., Brooks D., Lacasse Y. et al. Oxygen therapy during exercise training in chronic obstructive pulmonary disease // Cochrane Database Syst. Rev. 2007. V. 18. № 2. CD005372.
38. O’Keeffe S.T., Lye M., Donnellan C., Carmichael D.N. Reproducibility and responsiveness of quality of life
assessment and six minute walk test in elderly heart failure patients // Heart. 1998. V. 80. P. 377-382.
39. Olsson L.G., Swedberg K., Clark A.L. et al. Six minute corridor walk test as an outcome measure for the
assessment of treatment in randomized, blinded intervention trials of chronic heart failure: a systematic
review // Eur. Heart J. 2005. V. 26. P. 778-793.
178
Внелабораторные нагрузочные тесты
40. Opasich С., Pinna G.D., Mazza A. et al. Six-minute walking performance in patients with moderate-to-
severe heart failure. Is it a useful indicator in clinical practice? // Eur. Heart J. 2001. V. 22. P. 488—496.
41. Paggiaro P.L., Dahle R., Bakran I. et al. Multicentre randomised placebo-controlled trial of inhaled fluticasone propionate in patients with COPD // Lancet. 1998. V. 351. P. 773-780.
42. Palange P, Forte S., Onorati P. et al. Ventilatory and metabolic adaptations to walking and cycling in patients
with COPD//J. Appl. Physiol. 2000. V. 88. P. 1715-1720.
43. Parsons S., Celermajer D., Savidis E. et al. The effect of inhaled nitric oxide on 6-minute walk distance in
patients with pulmonary hypertension // Chest. 1998. V. 114. 70S-72S.
44. Pfcrez-Penate G.M., Julte-Serda G., Ojeda-Betancort N. Long-term inhaled nitric oxide plus phosphodiesterase 5 inhibitors for severe pulmonary hypertension // J. Heart Lung Transplant. 2008. V. 27. № 12.
P. 1326-1332.
45. Pinto-Plata V.M., Cote C., Cabral H. et al. The 6-min walk distance: change over time and value as a predictor of survival in severe COPD // Eur. Respir. J. 2004. V. 23. P. 28-33.
46. Puhan M.A., Mador M.J., Held U. et al. Interpretation of treatment changes in 6-minute walk distance in
patients with COPD // Eur. Respir. J. 2008. V. 32. P. 637-643.
47. Rees K., Taylor R.S., Singh S. et al. Exercise based rehabilitation for heart failure // Cochrane Database Syst.
Rev. 2004. V. 3. CD003331.
48. Revill S.M., Morgan M.D.L., Singh S.J. et al. The endurance shuttle walk: a new field test for the assessment
of endurance capacity in chronic obstructive pulmonary disease // Thorax. 1999. V. 54. P. 213—222.
49. Revill S.M., Williams J., Sewell L. et al. Within-day repeatability of the endurance shuttle walk test //
Physiother. 2009. V. 95. № 2. P. 140-143.
50. Ries A.L., Bauldoff G.S., Casaburi R. et al. Pulmonary rehabilitation. Joint ACCP/AACVPR evidence-
based clinical practice guidelines // Chest. 2007. V. 131. P. 4S-42S.
51. Schuurmans M.M., Botha P, Steyn D. et al. Time to spirometric and exercise response in a 4-week oral corticosteroid trial for stable COPD patients // Swiss Med. Wkly. 2005. V. 135. P. 562-568.
52. Sciurba F., Criner G.J., Lee S.M. et al. Six-minute walk distance in chronic obstructive pulmonary disease.
Reproducibility and effect of walking course layout and length // Amer. J. Respir. Crit. Care Med. 2003.
V. 167. P. 1522-1527.
53. Singh S.J., Jones P.W., Evans R., Morgan M.D.L. Minimum clinically important improvement for the incremental shuttle walking test // Thorax. 2008. V. 63. P. 775-777.
54. Singh S.J., Morgan M.D.L., Scott S. et al. Development of a shuttle-walking test of disability in patients with
chronic airways obstruction //Thorax. 1992. V. 47. P. 1019—1024.
55. Stevens D., Elpern E., Sharma K. et al. Comparison of hallway and treadmill six-minute walk tests // Amer.
J. Respir. Crit. Care Med. 1999. V. 160. P. 1540-1543.
56. Swerts P.M.J., Mostert R., Wouters E.F.M. Comparison of corridor and treadmill walking in patients with
severe chronic obstructive pulmonary diseases // Phys. Ther. 1990. V. 70. P. 439-442.
57. Swinburn C.R., Wakefield J.M., Jones PM. Performance, ventilation, and oxygen consumption in three different types of exercise test in patients with chronic obstructive lung disease // Thorax. 1985. V. 40.
P. 581-586.
58. Szekely L.A., Oelberg D.A., Wright C. et al. Preoperative predictors of operative morbidity and mortality in
COPD patients undergoing bilateral lung volume reduction surgery // Chest. 1997. V. 111. P. 550-558.
59. Troosters T, Gosselink R., Decramer M. Six minute walking distance in healthy elderly subjects // Eur.
Respir. J. 1999. V. 14. P. 270-274.
60. Wijkstra P.J., TenVergert E.M., van Altena R. et al. Long term benefits of rehabilitation at home on quality
of life and exercise tolerance in patients with chronic obstructive pulmonary disease // Thorax. 1995. V. 50.
P. 824-828.
61. Wise R.A., Brown C.D. Minimal clinically important differences in the six-minute walk test and the incremental shuttle walking test // COPD. 2005. V. 2. № 1. P. 125—129.
179
Цветные иллюстрации к главе 8
Рис. 2. Визуально-аналоговая шкала.
Нет
одышки
1
Научно-практическое медицинское издание
Функциональная диагностика в пульмонологии
Практическое руководство
Под редакцией А.Г. Чучалина
Ответственный редактор Г.В. Ходасевич
Технический редактор К.Л. Хлебов
Корректор Л.С. Бражникова
Обработка иллюстраций Н.Ю. Милосердова, Ю.В. Милосердое
ООО «Издательский холдинг «Атмосфера»,
127473 г. Москва, ул. Селезневская, д. 11а, стр. 1
тел./факс: (499) 973-14-16
Подписано к печати 19.11.2009 г.
Формат 60 х 90 1/i6
Печать офсетная
Печ. л. 12,0
Тираж 2000 экз.
Заказ 7988
Отпечатано в ОАО «Можайский полиграфкомбинат=
143200 г. Можайск, ул. Мира, д. 93
Первое в отечественной литературе практическое руководство,
посвященное современным методам исследования легочной функции,
их применению в повседневной клинической работе.
Излагаются физиологические основы каждого метода 0
и особенности интерпретации результатов.
Обобщен международный опыт использования и интерпретации
различных методов функциональной диагностики легочных заболеваний,
в том числе сравнительно мало применяемых в нашей стране, но крайне
необходимых при диагностике функциональных тестов: измерение
легочных объемов, оценка диффузионной способности легких и силы
дыхательной мускулатуры, внелабораторные методы определения
толерантности больных с бронхолегочной патологией к физической
нагрузке и т.п.
Особую ценность придают руководству собственные клинические
наблюдения авторов.
Книга предназначена для пульмонологов, терапевтов, врачей общей
практики, семейных врачей, а также для специалистов
по функциональной диагностике.
ISBN 978-5-902123-32-3