Автор: Хаджиев О.Ч. Ходырев В.Н.
Теги: хирургия ортопедия офтальмология медицина
ISBN: 978-966-687-053-0
Год: 2010
Текст
ЛУГАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра общей хирургии
ХАДЖИЕВ О.Ч., ХОДЫРЕВ В.Н.
ПОСОБИЕ ПО ОБЩЕЙ ХИРУРГИИ
ОРГАНИЗАЦИЯ УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ
СТУДЕНТОВ МЕДИЦИНСКИХ ФАКУЛЬТЕТОВ
ПРИ ИЗУЧЕНИИ ОБЩЕЙ ХИРУРГИИ
ПО КРЕДИТНО-МОДУЛЬНОЙ СИСТЕМЕ
МОДУЛЬ 1
Под редакцией профессора О.Ч. Хаджиева
Для студентов медицинских ВУЗов
3-4 уровней аккредитации
Луганск, 2010 г.
ОГЛАВЛЕНИЕ
УДК 617
ББК 54.5 я73
П Х-14
П Х-14
Профессор Хаджиев О.Ч., доцент Ходырев В.Н. Учебное пособие
по общей хирургии. Организация учебной деятельности студентов медицинских факультетов при изучении общей хирургии по кредитномодульной системе. Модуль 1. Для студентов медицинских ВУЗов
3-4 уровней акредитации. — Луганск: ЛГМУ, 2010. — 360 с.
ISBN 978-966-687-053-0
УДК 617
ББК 54.5 я73
Рецензенты:
В.И. Бондарев — заведующий кафедрой хирургии Луганского государственного медицинского университета, доктор медицинских наук, профессор;
И.В. Йоффе — заведующий кафедрой анестезиологии, реаниматологии и хирургии ФПО Луганского государственного медицинского университета, доктор
медицинских наук, профессор.
Представленное пособие соответствует требованиям кредитно-модульной
системы и программы по общей хирургии (Киев 2007) для студентов ІІІ курсов
медицинских университетов III — IV уровней акредитации. В учебном пособии
имеется большое количество иллюстраций (126), таблиц (9), схем (3).
Модуль 1 содержит 14 тем к каждому практическому занятию, кроме того,
имеются тесты, задачи с ответами для улучшения усвоения определенного раздела общей хирургии. Данное пособие будет полезно для студентов всех факультетов медицинских заведений.
Утверждено к печати на заседании Ученого Совета
Луганского государственного медицинского университета
от 01.10.09 г. (протокол № 2) г. Луганск
ISBN 978-966-687-053-0
© Проф. О.Ч. Хаджиев, доц. В.Н. Ходырев, 2010
© Луганский государственный
медицинский университет, 2010
ВВЕДЕНИЕ
5
ОПИСАНИЕ УЧЕБНОГО ПЛАНА
ПО ДИСЦИПЛИНЕ «ОБЩАЯ ХИРУРГИЯ»
6
Ориентированная структура зачетного кредита Модуля 1: Хирургическая профилактика. Основы анестезиологии. Операция. Неотложные
хирургические состояния
7
Тематический план лекций Модуля 1
8
Тематический план практических
занятий Модуля 1
9
Виды самостоятельной работы студентов (СРС) и ее контроль в Модуле 1
10
Распределение баллов, присваеваемых студентам в Модуле 1
10
МОДУЛЬ 1.
Хирургическая профилактика, введение в хирургию, основы анестезиологии и реанимации, операция, неотложные хирургические состояния
11
ТЕКСТОВЫЙ МОДУЛЬ 1.
Введение в хирургию. Асептика и антисептика. Особенности ухода за больными в хирургическом отделении
13
Тема №1. Введение в хирургию. Инфекция, пути ее распространения,
значение в хирургии. Госпитальная
инфекция и борьба с ней. Контроль
за бациллоносительством. Хирургический стационар и организация
в нем работы
13
Тема №2. Антисептика, ее виды.
Химическая, физическая, механическая, биологическая. Препараты
для химической антисептики
28
Тема №3. Асептика. Методы стерилизации и дезинфекции. Стерилизация шовного материала. Автоклавная. Стерилизация операционного
белья, перевязочного материала.
Стерилизация
инструментария.
Операционный блок, зоны стерильности, виды уборки. Обработка рук
хирурга. Одевание операционного
белья. Обработка операционного
поля
32
ТЕКСТОВЫЙ МОДУЛЬ 2.
Кровотечение, кровопотеря. Основы
гемотрансфузиологии
45
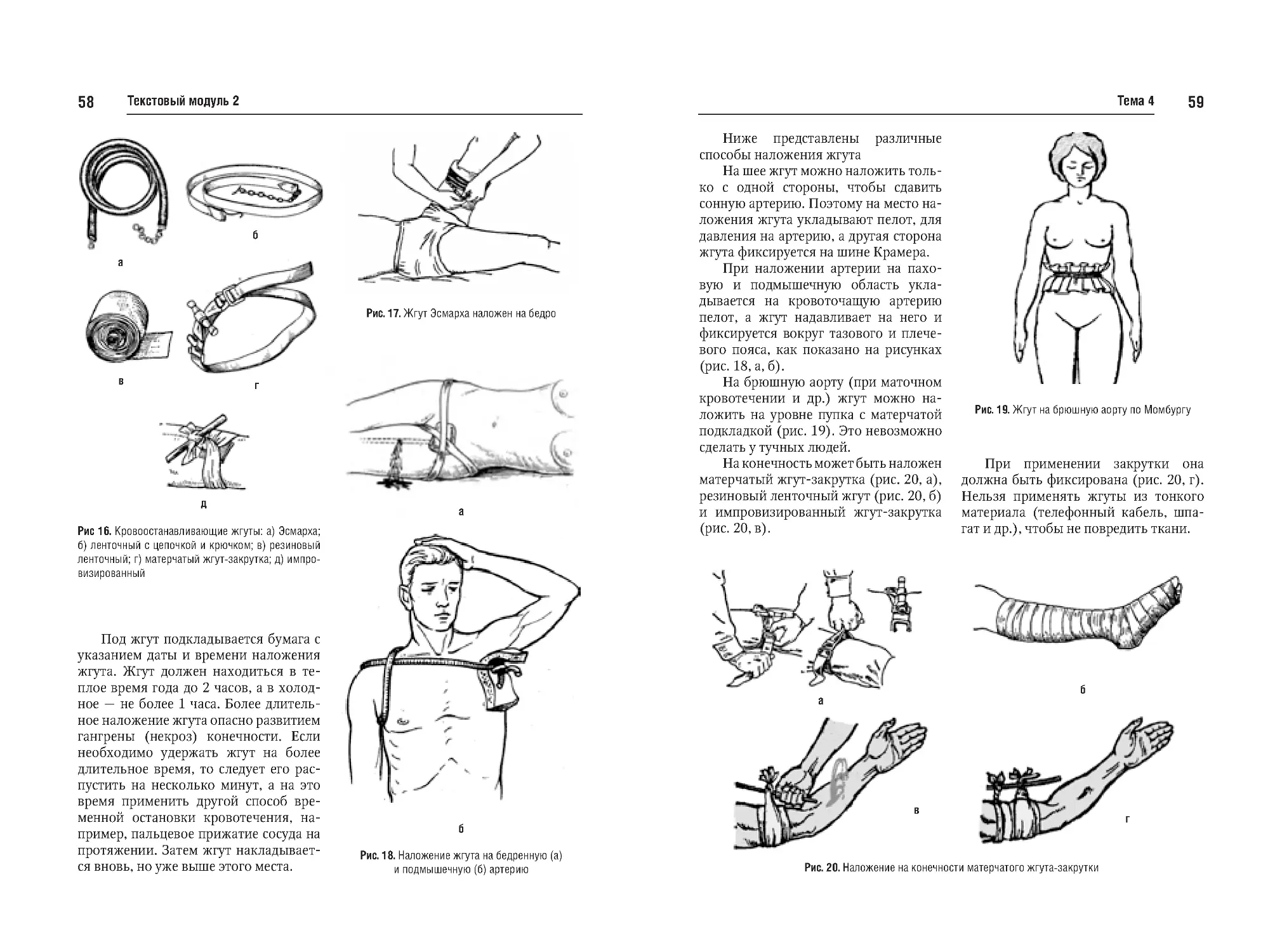
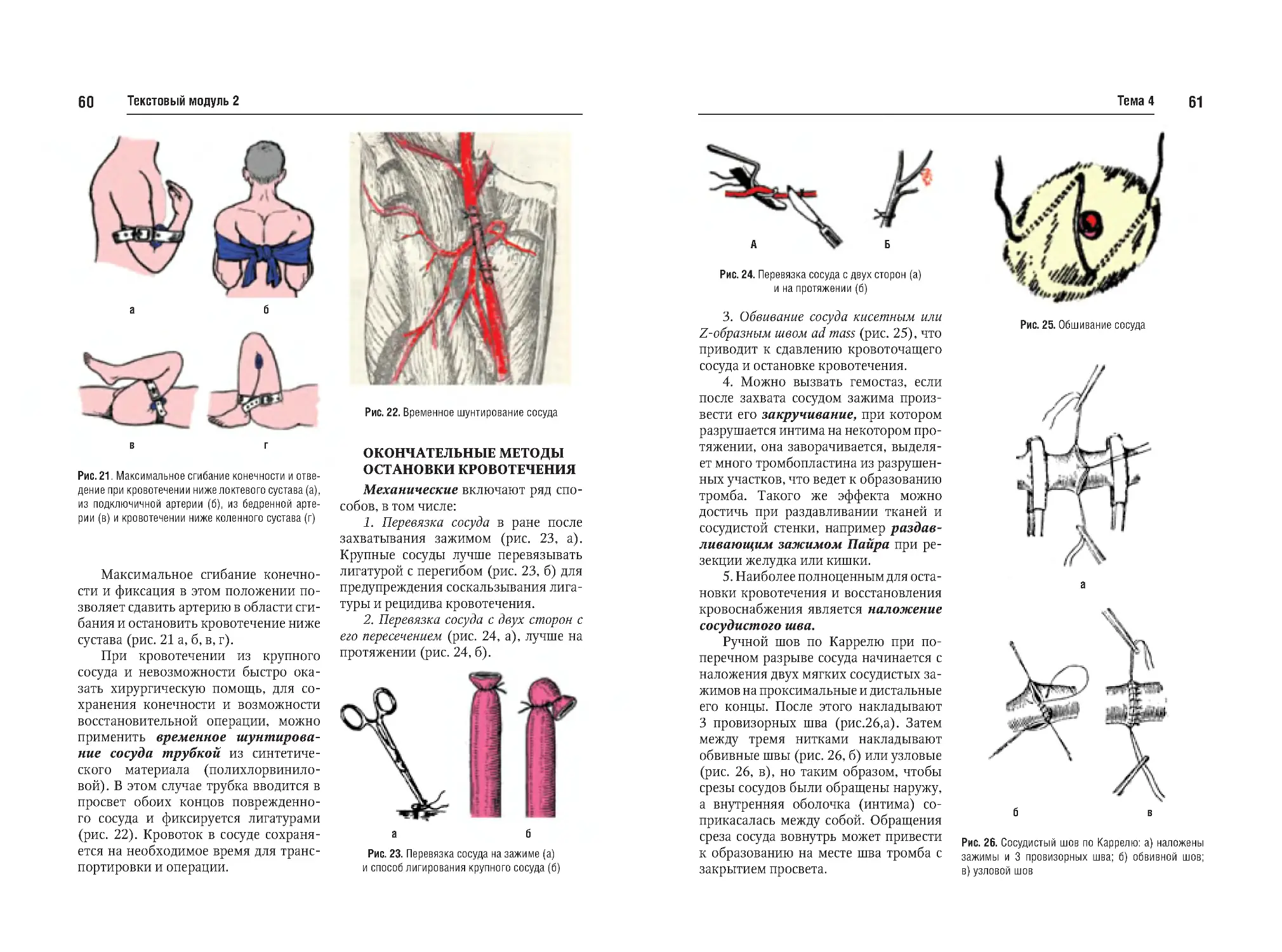
Тема №4. Кровотечение, кровопотеря. Временная и окончательная
остановка кровотечения
45
Тема №5. Учение о крови. Группы крови и резус-принадлежность.
Методы определения групп крови.
Ошибки определения групп крови. Определение резус-принад
лежности. Показания и противопоказания к переливанию крови.
Механизм действия и судьба перелитой крови. Консервирование и
стабилизация крови, ее хранение
68
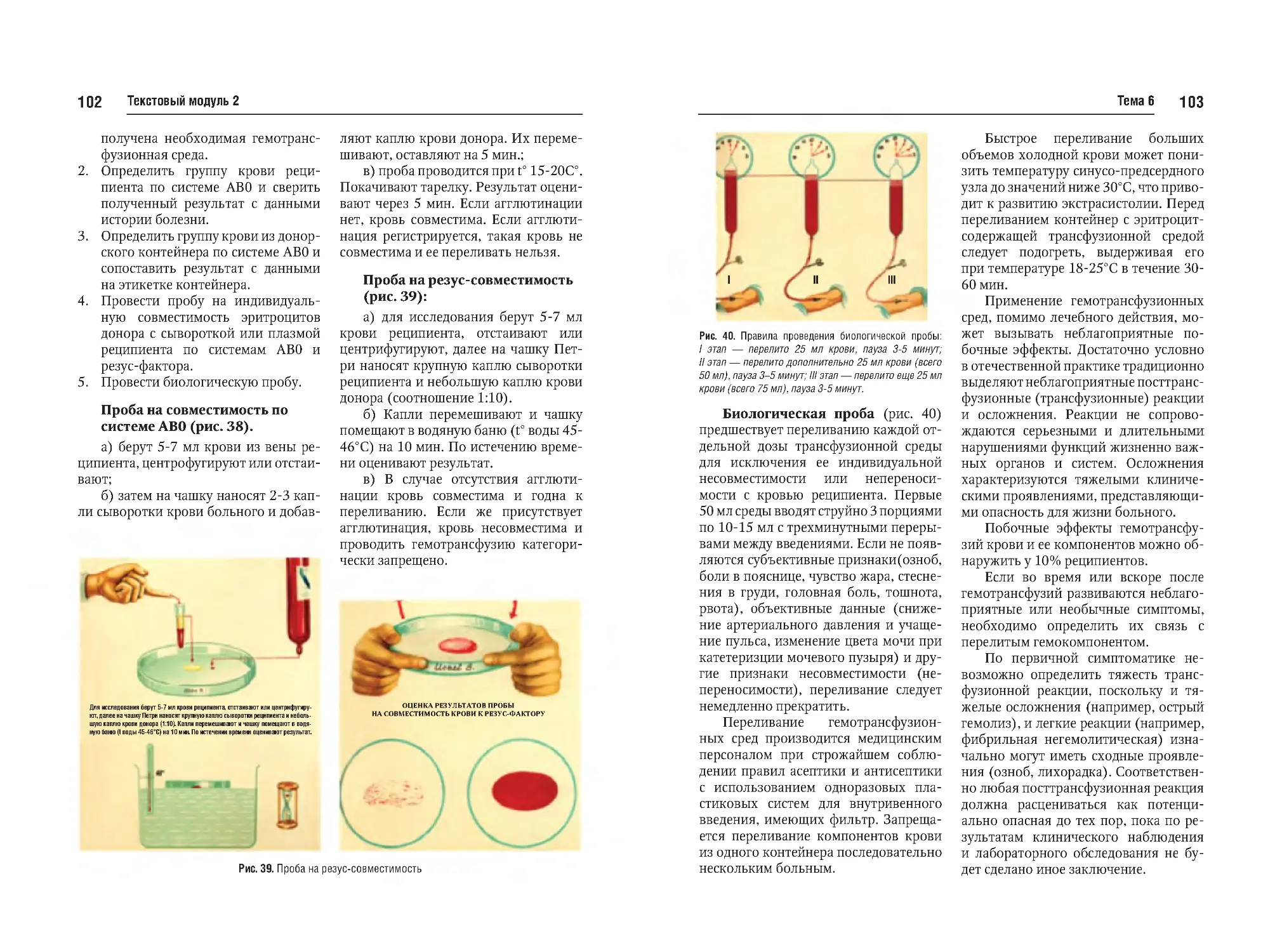
Тема №6. Переливание крови: мероприятия врача перед переливанием крови, пробы на совместимость.
Пути и методы переливания крови.
Осложнения при переливании крови и их профилактика. Переливание компонентов крови. Источники
получения крови, искусственная
кровь, препараты крови, кровезаменители
98
ТЕКСТОВЫЙ МОДУЛЬ 3.
Общая анестезиология и реанимация.
Хирургическая операция
127
Тема №7. Ингаляционный и неингаляционный наркоз. Понятие о
премедикации. Препараты для ингаляционного, в том числе эндотрахеального наркоза. Стадии эфирного
наркоза. Масочный наркоз, аппараты для ингаляционного наркоза.
Типы дыхательных контуров. Методика проведения эндотрахеального
наркоза. Виды неингаляционного
наркоза и препараты для них. Классификация осложнений и помощь
при них. Работа в операционной
127
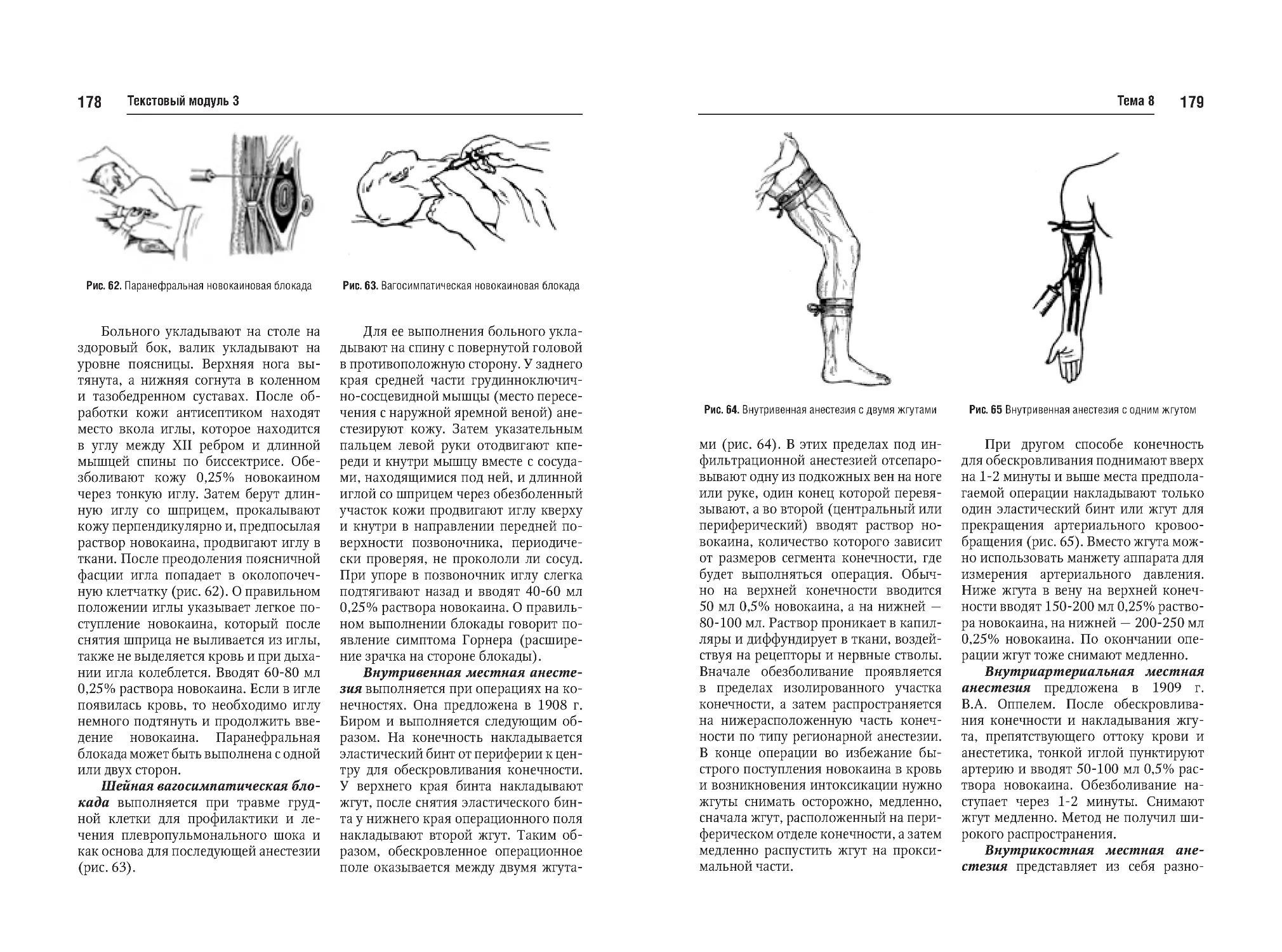
Тема №8. Местная анестезия, показания и противопоказания, ее виды.
Препараты и их дозировка. Различные блокады. Эндолюмбальная и
эпидуральная анестезия. Осложнения и помощь при них. Выбор метода обезболивания
169
ТЕКСТОВЫЙ МОДУЛЬ 4.
Травматизм и повреждение
195
Тема №9. Понятие о травматизме.
Классификация травм. Повреждения мягких тканей. Травматический
шок. Синдром длительного сдавления, позиционный синдром
195
Тема №10. Раны. Классификация
ран. Асептические и гнойные раны.
Течение раневого процесса. Виды
заживления ран. Методы лечения
чистых и гнойных ран. Работа в перевязочной
212
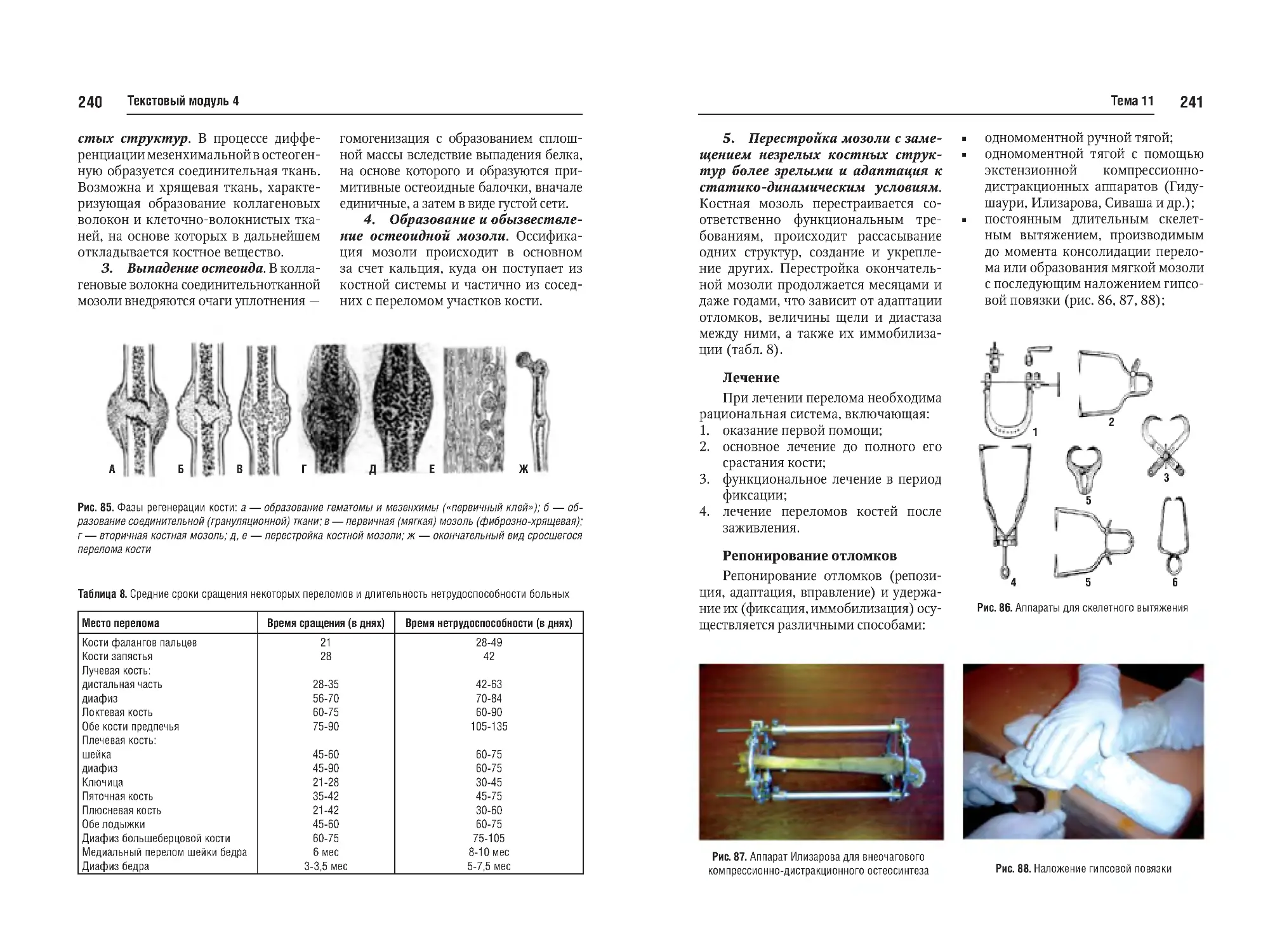
Тема №11. Переломы. Классификация. Фазы сращения перелома и
слои костной мозоли. Клиника, диагностика и методы лечения переломов. Гипсовые повязки. Осложнения
и последствия. Лечение переломов.
Транспортная иммобилизация повреждений. Вывихи, классификация,
механизм возникновения, клиника и
лечение
235
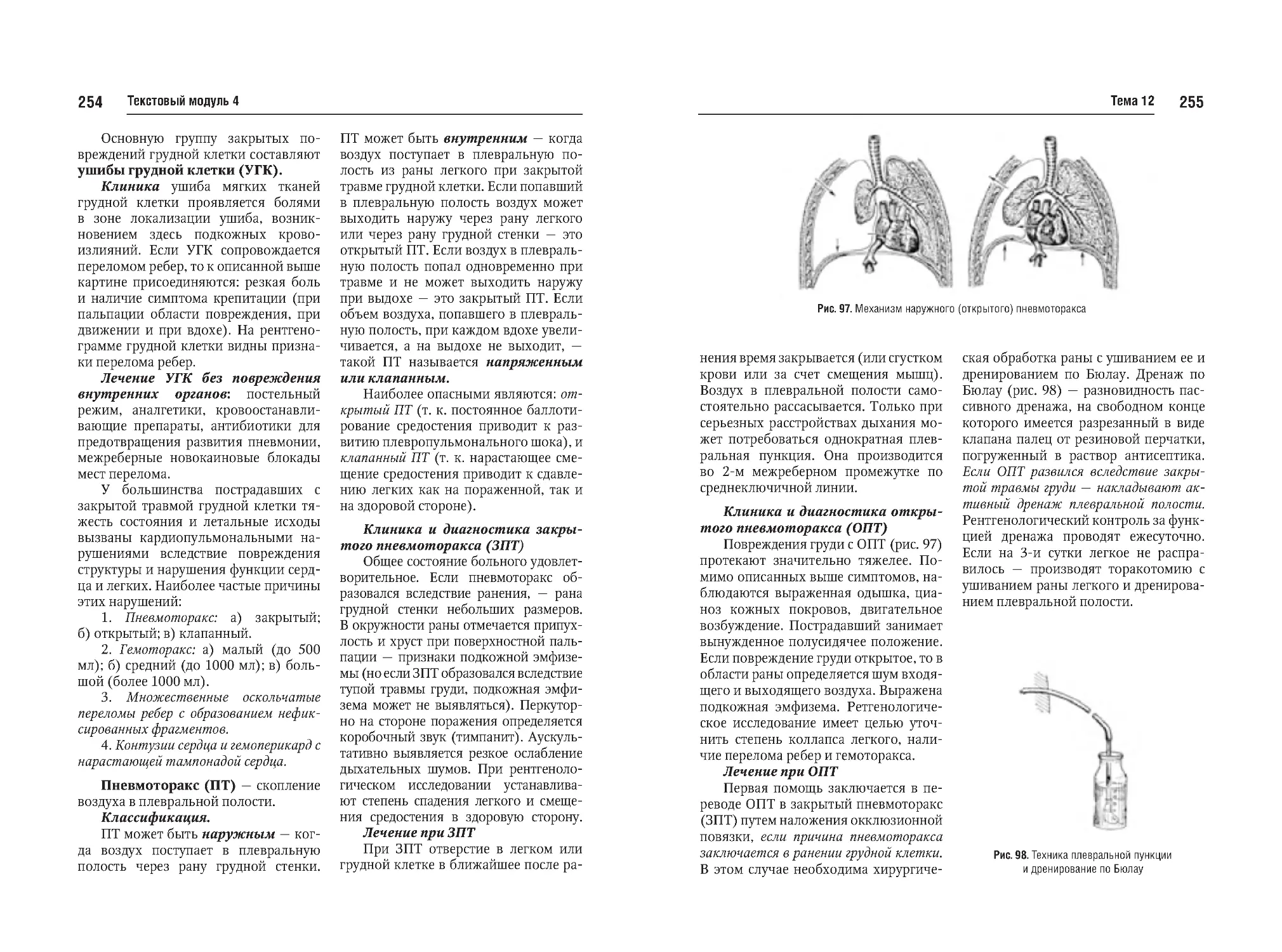
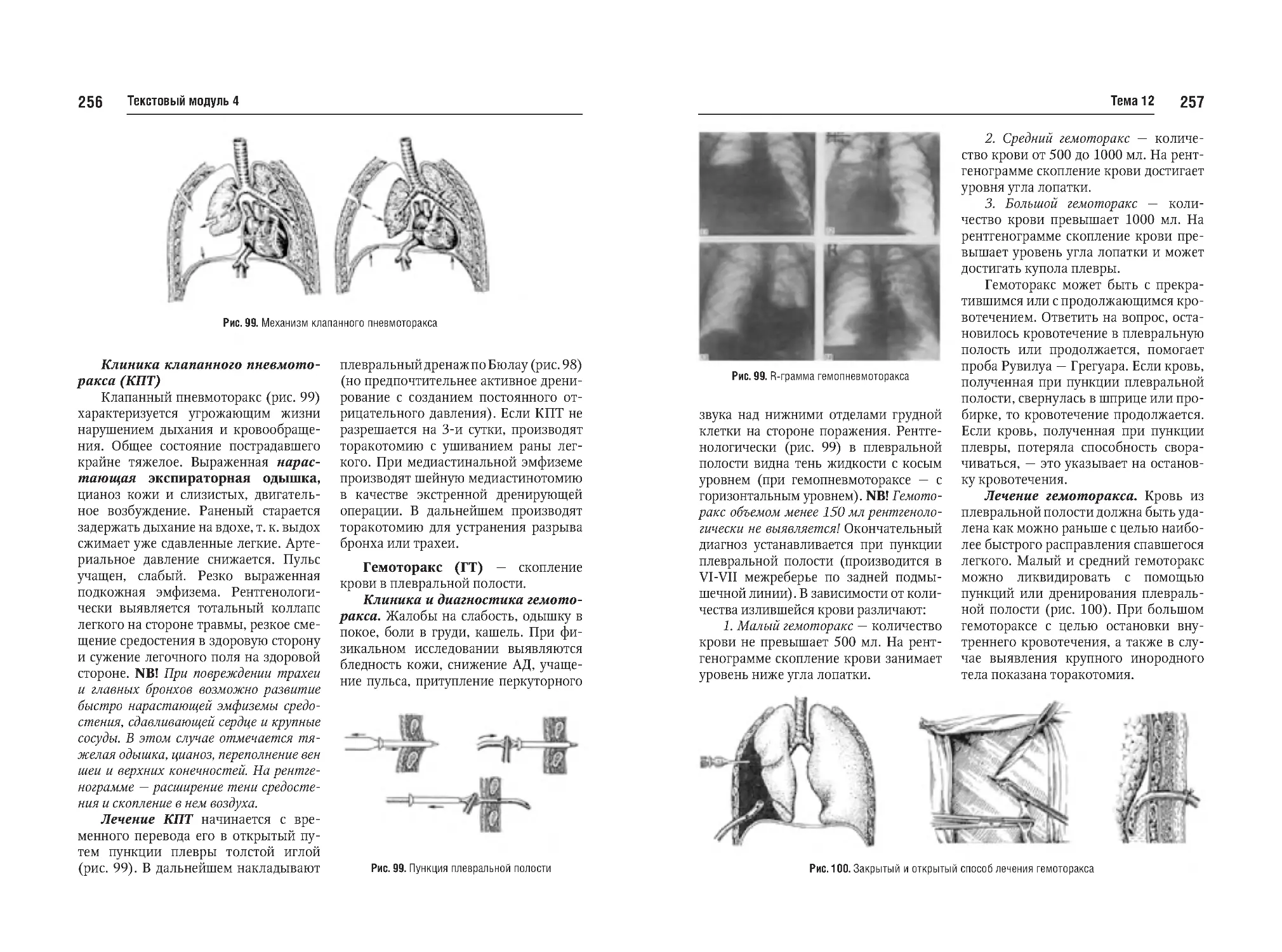
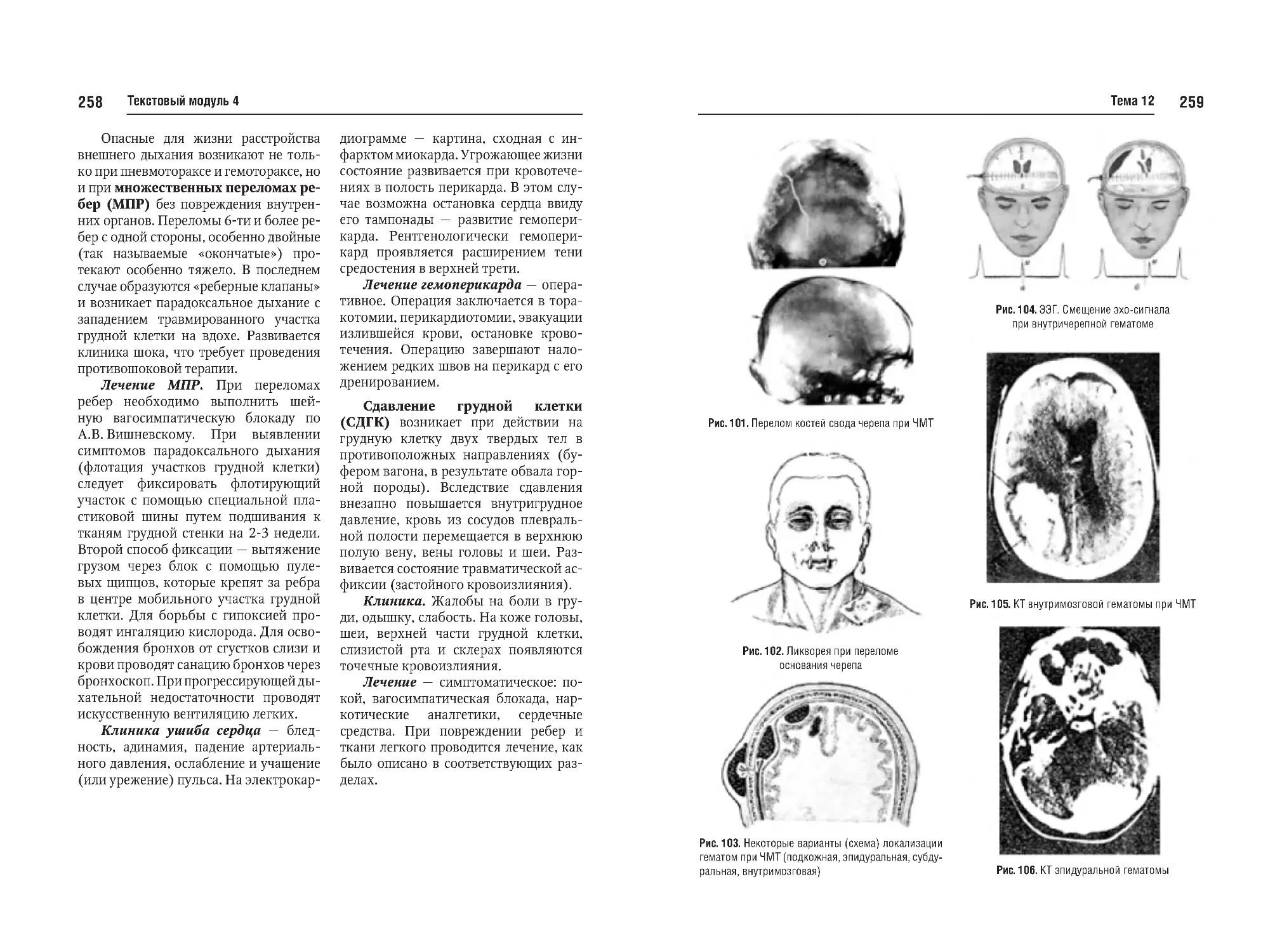
Тема №12. Закрытая черепномозговая травма (перелом костей,
сотрясение, ушиб мозга, кровоизлияния). Закрытая травма грудной
клетки и органов грудной клетки
247
Тема №13. Закрытая травма живота. Перитонит, клиника, диагностика, лечение
263
Тема №14. Ожоги (термические,
химические, лучевые). Классификация, стадии ожоговой болезни.
Первая помощь и методы лечения
ожогов. Ожоговое истощение. Электротравма и отморожения
289
Тестовый контроль по теме занятий
318
Задачи по темам занятий
341
Ответы на тестовый контроль
351
Ответы к задачам
353
Список рекомендованной литературы
357
ВВЕДЕНИЕ
ЦЕЛЬ И ЗАДАЧИ
ДИСЦИПЛИНЫ
В системе медицинской подготовки врача курс хирургии занимает значительное место. Он последовательно
изучается на 2, 3, 4, 5 и 6 курсах. Это
обеспечивает подготовку студентов по
хирургии в объеме учебной программы
медицинского ВУЗа.
Курс общей хирургии с уходом за
хирургическими больными является
первым при изучении хирургии в медицинском университете. В нем рассматриваются важные практические,
теоретические и клинические основы
хирургии. В этом разделе хирургии
изучаются вопросы организации хирургической помощи, ухода за хирургическими больными, особенности
обследования хирургических больных,
асептика и антисептика, общие вопросы анестезиологии и реаниматологии,
кровотечения, переливания крови, хирургическая операция, пред- и послеоперационный периоды. Также изучаются общие вопросы хирургической
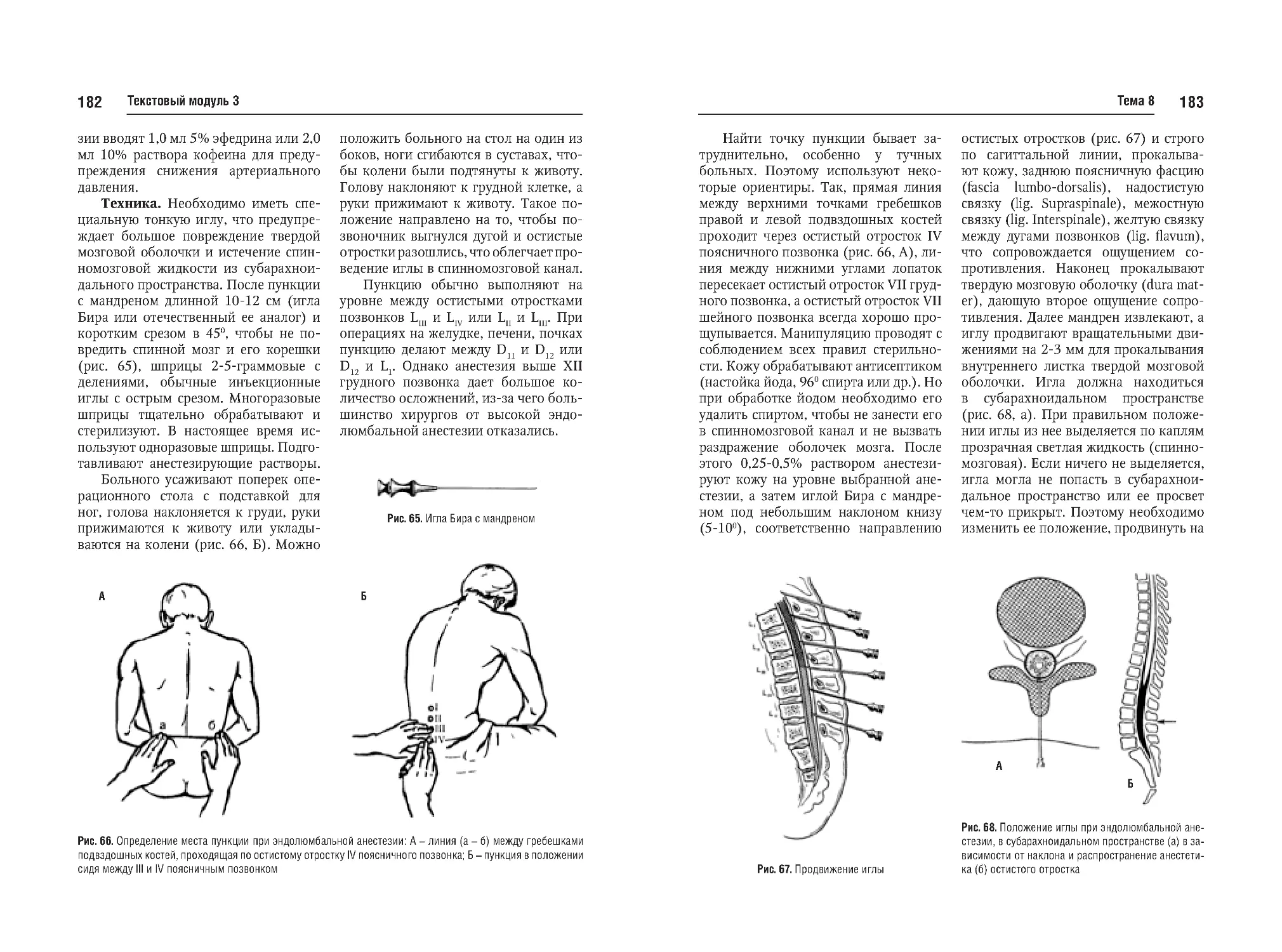
патологии и отдельные хирургические
заболевания. Необходимо отметить,
что много разделов общей хирургии,
особенно такие как, асептика, антисептика, обезболивание, переливание крови, кровотечения, шок, раны и другие,
имеют большое значение не только для
изучения хирургии, но и для освоения
акушерства, гинекологии, урологии,
глазных болезней, заболеваний уха,
горла, носа и др.
Достаточное освоение хирургии
возможно при использовании современных методов преподавания (лекции, практические занятия, самостоятельная работа с учебником, дежурство
в клинике, занятия в студенческом
научном кружке, широкое внедрение
в учебный процесс игровых методик
преподавания: конкурсы, викторины,
опрос на компьютере).
В результате изучения дисциплины студенты должны ЗНАТЬ:
■ Современные концепции отечественной и заграничной теоретической и практической хирургии;
■ Основы организации рационального режима и деятельности хирургического больного в процессе лечения и после его выздоровления;
■ Клинико-лабораторные симптомы
хирургических заболеваний организма (в пределах учебной программы);
■ Причины возникновения патологических процессов в организме,
их патогенез, клинические проявления хирургических заболеваний,
принципы их предупреждения и
лечения;
■ Основы взаимодействия организма
и окружающей среды, особенности
влияния различных факторов среды на возникновение и развитие
хирургических заболеваний;
■ Основные принципы организации
хирургической помощи населению.
■
■
■
Студент должен УМЕТЬ:
Осуществлять уход за хирургическими больными;
Проводить основные методы общего клинического обследования
хирургического больного (осмотр,
перкуссия, пальпация, аускультация, лабораторные исследования)
и анализировать полученные данные для постановки диагноза;
Выполнять общелечебные манипуляции и операции (перевязки,
остановка кровотечения, инъекции, переливание крови и кровезаменителей, промывание желудка
и кишечника, местную инфильтрационную анестезию, транспортную
и лечебную иммобилизацию при
вывихах и переломах костей) и ре-
■
■
■
■
шать вопрос о направлении больного к специалисту;
Оказывать первую помощь при
кратковременной потере сознания,
коллапсе, шоке, коме, аллергических
реакциях, остром животе, травме,
ожогах, отморожениях, переломах,
кровотечениях, укусах змеями;
Проводить реанимационные мероприятия при клинической смерти
и направлять больных в специализированные отделения;
Ассистировать на экстренных операциях;
Показывать умение пользоваться морально-деонтологическими
принципами врача в общении с
больными, их родственниками и
коллегами.
ОПИСАНИЕ УЧЕБНОГО ПЛАНА ПО ДИСЦИПЛИНЕ
«ОБЩАЯ ХИРУРГИЯ»
Структура учебной
дисциплины
Кредитов ECTS
Количество часов, из них
Аудиторных
ПрактиВсего
Лекций
ческих
занятий
180
30
80
6
СРС
Год
обучения
Тема
Количество часов
Лекции
Практ.
занятия
СРС
Индивид. СРС
Тематический модуль 1. Хирургическая профилактика.
1. Химическая антисептика.
2. Асептика. Стерилизация и дезинфекция.
Стерилизация перевязочного материала и операционного белья. Организация работы в операционной.
3. Организация работы в стерилизационной. Подготовка и стерилизация режущих, оптических
общехирургических инструментов. Стерилизация
шовного материала.
4. Хирургическая обработка рук хирурга и операционного поля.
2
2
1
2
1
2
1
2
1,5
2
На протяжении модуля
обзор научной литературы по темам на выбор:
«Современные химические антисептики»
«Современные методы
подготовки и стерилизации хирургического
инструментария»
Тематический модуль 2. Кровотечение, кровопотеря. Основы гемотрансфузиологии.
5. Кровотечение и кровопотери. Методи временной и окончательной остановки кровотечения.
6. Основи гемотрансфузиологии. Антигенные
системы крови. Группы крови.
7. Переливание крови, препаратов крови, кровезаменителей. Осложнение при гемотрансфузии.
2
2
1,5
2
2
1,5
2
2
1,5
«Осложнение
при переливании крови
и ее компонентов»
Тематический модуль 3. Общая анестезиология. Хирургическая операция.
Вид контроля
70
Модуль 1
98 ч./3,27
кредит ЕСТ5
18
44
36
Текущий и итоговый
(стандартный)
Модуль 2
82 ч./2,73 кредит ЕСТ5
12
36
34
Текущий и итоговый
(стандартный)
В том числе
итоговый контроль
по 2 модулям
8 ч.
8
9
Аудиторных часов — 60,1%, СРС — 39,9%
Ориентированная структура зачетного кредита Модуля 1:
Хирургическая профилактика. Основы анестезиологии.
Операция. Неотложные хирургические состояния
8. Местная анестезия.
9. Ингаляционный наркоз. Неингаляционный
наркоз.
10. Хирургическая операция, подготовка больных
к операциям.
11. Уход за больными в послеоперационном
периоде.
2
1
2
1
2
1
2
1
«Малоинвазивные
оперативные
внедрения»
Тематический модуль 4. Травматизм и повреждения
12. Травма. Травматизм. Закрытые повреждения
мягких тканей, травматический токсикоз.
13. Переломы. Вывихи. Первая помощь при переломах и вывихах.
14. Принципы лечения переломов и вывихов.
15. Механическая и физическая антисептика.
16. Биологическая антисептика.
17. Раны и раневый процесс. Профилактика развития инфекции в ране. Лечение чистых ран.
18. Гнойные раны. Лечение гнойных ран.
Итоговый модульный контроль:
Теоретической подготовки
Практической подготовки
ВСЕГО
6
2
18
2
1
2
1
2
2
2
1
1
1
2
1
2
4
1
6
40
31
Тематический план практических занятий 1 Модуля
«Антибиотикопрофилактика в хирургии»
«Лечение гнойных ран
по стадиям раневого
процесса»
Тема
Количество
часов
Тематический модуль 1. Хирургическая профилактика.
1. Химическая антисептика.
2. Асептика. Стерилизация и дезинфекция. Стерилизация перевязочного материала и
операционного белья. Организация работы в операционной.
3. Организация работы в стерилизационной. Подготовка и стерилизация режущих, оптических общехирургических инструментов. Стерилизация шовного материала.
4. Хирургическая обработка рук хирурга и операционного поля.
2
2
2
Тематический модуль 2. Кровотечение, кровопотеря. Основы гемотрансфузиологии.
3
5. Кровотечение и кровопотеря. Методы временной и конечной остановки кровотечения
6. Основи гемотрансфузиологии. Антигенные системы крови. Группы крови.
7. Переливание крови, препаратов крови, кровезаменителей.
Осложнение при гемотрансфузии.
Аудиторные часы 62%, СРС — 38%
2
2
2
Тематический модуль 3. Общая анестезиология. Хирургическая операция.
8. Местная анестезия.
9. Ингаляционный наркоз. Неингаляционный наркоз.
10. Хирургическая операция, подготовка больных к операции.
11. Уход за больными в послеоперационном периоде.
Тематический план лекций 1 Модуля
№ п/п Тема
Количество
часов
1
Антисептика.
2
2
3
4
5
6
Асептика.
2
2
2
2
2
7
8
9
Кровотечение. Классификация. Кровопотеря. Остановка кровотечения.
Основи трансфузиологии. Донорство. Обозначение групп крови.
Показания к переливанию крови и техника гемотрансфузии.
Хирургическая операция. Пред- и послеоперационный периоды.
Закрытые повреждения мягких тканей, грудной клетки, брюшной полости,
черепа.
Переломы, вывихи. Клиника, диагностика, лечение.
Раны. Клиника. Классификация. Первичная и вторичная хирургические обработки. Гнойные раны, их лечение.
Всего
2
2
2
18
2
2
2
2
Тематический модуль 4. Травматизм и повреждения
12. Травма. Травматизм.
Закрытые повреждения мягких тканей, травматический токсикоз.
13. Переломы. Вывихи. Механизм. Травмы. Первая помощь при переломах и вывихах.
14. Принципы лечения переломов и вывихов.
15. Механическая и физическая антисептика.
16. Биологическая антисептика.
17. Раны и раневый процесс. Профилактика развития инфекции в ране.
Лечение чистых ран.
18. Гнойные раны. Лечение гнойных ран.
Итоговый модульный контроль
Теоретические подготовки
Практические подготовки
ВСЕГО
2
2
2
2
2
2
2
2
2
40
Виды самостоятельной работы студентов (СРС)
и ее контроль в 1 Модуле
№ п/п
ТЕМА
Количество
часов
Вид контроля
1.
Подготовка к практическим занятиям — теоретическая
подготовка и обработка практического обучения
Индивидуальная самостоятельная работа студентов по
одной из тем на выбор. Осмотр научной литературы по
выбору:
- «Современные методы подготовки и стерилизации хирургического инструментария»
- «Малоинвазивные оперативные вмешательства»
- «Осложнение при переливании крови и ее компонентов»
- «Лечение инфицированных ран согласно стадии раневого процесса»
- «Антибиотикопрофилактика в хирургии»
Подготовка к итоговому модульному контролю
25
Текущий контроль на
практических занятиях
Текущий контроль на
практических занятиях
ВСЕГО
34
2.
3.
3
МОДУЛЬ 1
6
Итоговый модульный
контроль
Распределение баллов, присваеваемых студентам в Модуле 1
При освоении темы по традиционной системе студенту присваиваются баллы: «5», «4»,
«3» и «2».
Максимальное количество баллов в течении учебной деятельности студента — 120.
Студент допускается к итоговому модуль
ному контролю при условии выполнения требований учебной программы и если за текущую
учебную деятельность он набрал минимальную
конвертированную сумму баллов текущей успеваемости, составляющую 72 балла.
Конвертация оценки по традиционной
4-балльной шкале в многобалльную (максимум 120 баллов) конвертированную суммарную
оценку текущей успеваемости по модулю проводится лишь после текущего занятия, которое
предшествует итоговому модульному контролю. Конвертация проводится по следующим
алгоритмам:
1) подсчитывается средняя оценка студента по традиционной 4-балльной шкале,
полученная на протяжении текущих занятий,
которые принадлежат к данному модулю (с точностью до сотых баллов).
2) Для получения конвертированной
многобалльной суммарной оценки текущей
успеваемости по модулю средняя оценка, полученная по традиционной 4-балльной шкале,
умножается на коэфициент 24. Предположение, что средняя определяемая традиционной
4-балльной шкалой оценка определяется 2 балла. В этом случае студент получает 0 баллов по
многобалльной шкале.
Итоговый модульный контроль засчитывается студенту, если он набрал не меньше 50
баллов из 80 баллов.
Максимальное количество баллов за модуль составляет 200 баллов.
Хирургическая профилактика,
введение в хирургию,
основы анестезиологии и реанимации,
операция, неотложные хирургические
состояния
ТЕКСТОВЫЙ МОДУЛЬ 1
Введение в хирургию. Асептика и антисептика.
Особенности ухода за больными в хирургическом отделении
Конкретные цели:
■
■
■
■
■
Определить основные этические и деонтологические положения в хирургии.
Описать структуру хирургической клиники и организацию работы медицинского персонала.
Изучить методы современной антисептики и асептики.
Продемонстрировать методы подготовки к использованию перевязочного материала, операционного белья, хирургического инструментария и шовного материала.
Продемонстрировать методы обработки рук хирурга и операционного поля,
одевание хирургического халата.
ТЕМА №1.
Введение в хирургию. Инфекция, пути ее распространения,
значение в хирургии. Госпитальная инфекция и борьба с ней.
Контроль за бациллоносительством. Хирургический стационар
и организация в нем работы
1. Актуальность темы
В истории хирургии имели и имеют ведущее значение три вопроса:
а) борьба с инфекцией; б) борьба с
болью; в) борьба с кровотечением.
Поэтому знание проблем и их роли
в хирургии является важнейшим вопросом в современной хирургии для
предупреждения
инфекционных
осложнений и борьбы с ними. Этому вопросу подчинено устройство
хирургического стационара и орга-
низация работы в нем, соблюдение
санитарно-эпидемиологического режима.
■
■
■
2. Учебные цели
Понятие о хирургии как о науке и
хирургических заболеваниях.
Виды хирургической инфекции и
пути ее распространения.
Понятие о внутрибольничной инфекции, методы лечения и профилактики.
14
■
■
■
■
■
Текстовый модуль 1
Устройство и виды лечебно-профи
лактических учреждений, организация работы в них.
Организация работы в хирургическом отделении (права и обязанности медперсонала).
Методы соблюдения гигиены в хирургическом отделении и его подразделениях.
Способы контроля за соблюдением
стерильности, выявление, профилактика и лечение бациллоносительства.
Понятие о лечебно-охранительном
режиме в хирургическом отделении.
3. Самостоятельная
работа студентов
Хирургия (от греч. cheir — рука,
ergon — действую) — в буквальном
смысле рукодействие. В настоящее
время она охватывает широкий диапазон лечебных воздействий (операций)
и заключается не только в удалении
больного органа, но и в восстановлении
утраченного или его замене. Внедряются новые методики диагностики и хирургических вмешательств (эндоскопические, рентгенэндоваскулярные др.).
Сейчас нет такой области человеческого организма, где бы нельзя было применить хирургические методы лечения.
Хирургическими обычно принято называть заболевания, требующие
для своего лечения применения хирургического метода, т.е. выполнения
кровавых или бескровных операций.
Однако такое определение нельзя считать точным, так как с развитием науки
и появлением новых средств и методов
лечения, некоторые заболевания, ранее лечившиеся только хирургическим
путем, в настоящее время успешно излечиваются терапевтическими методами, и наоборот. Так, с введением антибиотиков, при раннем их применении
Тема 1
некоторые гнойные заболевания могут
быть излечены без операции, а такие
заболевания, как приобретенные и
врожденные пороки сердца, гнойные
заболевания легких и др., которые
раньше лечились только консервативно, в настоящее время в связи с развитием хирургии успешно излечиваются
оперативным путем. Следовательно,
с развитием медицинской науки и ее
разделов изменяется и состав хирургических больных.
Различают хирургические заболевания, обусловленные:
1) повреждением (травма);
2) развитием хирургической инфекции;
3) новообразованием (опухолью);
4) нарушением кровообращения
(омертвения, гангрены);
5) пороками развития (косолапость, волчья пасть, заячья губа, врожденные пороки сердца и т.д.).
Хирургия существует с давних
времен, но официально специальности
хирургии не существовало. Лица, использовавшие хирургические методы
лечения, были просто врачами или их
называли «цирюльниками», «резальниками» (на Руси), «знахарями» и др.
Хирургов даже не допускали к чтению
лекций. И только в XVIII веке впервые
во Франции допустили хирурга Лафранши к чтению лекций по хирургии в
Парижском университете (Сорбонна),
а в 1731 году была открыта Французская хирургическая академия. Это
позволило объединить хирургов и обеспечить быстрое развитие хирургии
как науки.
Понятие об инфекции
Окружающая среда содержит очень
много возбудителей различных заболеваний. Некоторые из них вызывают
болезни, которые лечатся в хирургиче-
ском отделении (фурункул, абсцесс, панариций, рожистое воспаление, столбняк, анаэробная инфекция и др.), или
представляют опасность в возникновении различных послеоперационных
осложнений (перитонит, воспаление
легких, нагноение раны, сепсис и другие), которые порой являются даже
более опасными, чем основное заболевание.
В период становления хирургии
они наблюдались после операции более чем у 80% больных. Большинство
из них умирало. Поэтому для борьбы
с инфекцией необходимо знать, какие
микроорганизмы представляют опасность для хирургических больных и
каковы пути их распространения. Необходимо также помнить о вирулентности микробов, которая проявляется с большей силой у оперированных,
ослабленных больных, при кровотечениях и т.п., а также учитывать иммунологический статус пациентов.
У хирургических больных воспалительный процесс может быть вызван
кокковой флорой (стрептококк, стафилококк, пневмококк), кишечной и синегнойной палочкой, протеем, спорообразующими (возбудители столбняка и
др.) и неспорообразующими бактериями (бактероиды, пептококки, фузобактерии и др.), кандидами. В условиях
снижения защитных сил организма и
иммунитета у больных могут проявлять патогенную активность и сапрофиты. На месте попадания инфекции
развивается гнойно-воспалительный
процесс, характеризующийся появлением пяти признаков по Цельсу:
боль, отек, гиперемия, повышение температуры, изменение функций органа,
а также явлениями интоксикации и другими нарушениями, представляющими
опасность для человека. Инфекция может протекать как остро, так и хрони-
15
чески. Знание путей инфицирования
позволяет применять адекватные меры
предупреждения и борьбы с инфекцией и ее осложнениями, особенно в послеоперационном периоде.
Распространение инфекции происходит как эндогенным, так и экзогенным путем.
Эндогенный путь предполагает,
что в организме имеются острый или
хронический очаги инфекции, и микробы из него попадают к месту операции
с циркулирующей кровью (гематогенный путь), по лимфатическим сосудам
(лимфогенный путь) или контактным
путем. В последнем случае инфекция
может попадать, например, когда во
время операции происходит вскрытие
просвета кишки и излияние содержимого в брюшную полость.
Экзогенный путь предполагает
попадание инфекции в организм больного (рану) из внешней среды. В этом
случае различают воздушно-капельный,
контактный и имплантационный пути
распространения инфекции. При воз
душно-капельном распространении
инфекция попадает в рану из загрязненного воздуха. Контактная инфекция
вносится в рану при работе нестерильным инструментарием, перевязочным
материалом, руками хирурга, попадании в нее при ранении земли, обрывков
одежды и пр. Имплантационная инфекция возникает при использовании
нестерильного шовного материала, из
инородных тел, оставшихся в ране после повреждения и др.
Знание этих особенностей позволяет выработать стройную систему профилактики и борьбы с инфекцией.
Впервые научную систему борьбы с
инфекцией предложил Д.Листер в 1867
году и назвал ее антисептикой.
Антисептика — это способ уничтожения инфекции путем воздействия
16
Текстовый модуль 1
на нее в самой ране или в организме
больного.
Различают следующие виды антисептики:
1. Химическая антисептика — применение различных химических
антисептиков (спирт, йод, хлорамин, хлоргексидин и др.) непосредственно на рану или через
организм больного (прием сульфаниламидов: фузидин, бисептол
и др.).
2. Физическая антисептика, при
которой используются различные
физические явления (капиллярность, гигроскопичность перевязочного материала, явления осмоса
и диффузии, сифона при применении дренажей, применение лазера,
ультразвука,
ультрафиолетовых
лучей и др.).
3. Механическая, к которой относится первичная хирургическая обработка раны, рассечение гнойной
раны, проточное промывание раны
и пр.
4. Биологическая антисептика —
применение антибиотиков, плазмы, сыворотки, вакцины, бактериофагов, энзимов и других веществ,
имеющих биологическое происхождение от различных организмов
(человека, животных, микробов,
растений и пр.).
В 1890 г. Э.Бергман предложил
способ борьбы с инфекцией — асептику, суть которого состоит в уничтожении инфекции на всем, что соприкасается с раной (инструменты,
перевязочный, шовный материал и
пр.), а также в ряде организационных
мероприятий, позволяющих не допустить попадания микробов в рану
(разделение больных, операционных
помещений на гнойные и чистые, применение бахил, масок и др.).
Тема 1
В настоящее время эти два метода
применяются совместно. На занятиях
будут рассмотрены различные мероприятия по борьбе с инфекцией с целью создания гигиенических условий
окружающей среды для больного и выполнения оперативных вмешательств в
асептических условиях.
В хирургическом стационаре может возникнуть внутрибольничная
госпитальная инфекция.
Понятие внутрибольничной (госпитальной) инфекции (инфекционного госпитализма) существует с давних
времен, однако причину ее возникновения долго не могли установить.
Вследствие госпитальной инфекции
даже успешные операции в более чем
80% случаев заканчивались присоединением нагноения и смертельными
исходами. Поэтому уже на заре хирургии пытались применить простейшие мероприятия, предупреждающие
перенос инфекции от одного больного
к другому (применение чистого перевязочного материала, уничтожение загрязненного материала, проветривание
помещения и др.).
В дальнейшем выяснилось, что
причиной инфекции являются микроорганизмы, которые могут быть патогенными и непатогенными. Большую
роль играет состояние защитных сил
организма, так как при снижении иммунитета непатогенная флора может
привести к развитию хирургической
инфекции.
В доантибиотическую эру основными возбудителями гнойной госпитальной (нозокомиальной) инфекции
были стрептококки (гемолитические и
негемолитические).
Позже гнойные процессы чаще всего стали вызываться различного вида
стафилококками (золотистый, белый,
желтый и др.), которые более устой-
чивы к антибиотикам и наиболее распространены в природе. Большое их
количество находится на предметах,
окружающих человека, и на нем самом: одежде, волосах, коже, слизистых
оболочках и т. п., что способствует инфицированию раны. Госпитальная инфекция вызывается в основном этими
возбудителями. Однако, стафилококк,
бывший основной причиной госпитальной инфекции до 60-х гг. ХХ в.,
в настоящее время уступил место грамотрицательным микроорганизмам.
Современная госпитальная инфекция вызывается в основном грамотрицательными микроорганизмами
(непатогенные облигатные и факультативные микроорганизмы). Наряду
с другими, к ним можно отнести кишечную палочку, протей, являющиеся
обитателями кишечника, синегнойную
палочку — в обычных условиях сапрофит, живущий в местах обильного потоотделения (подмышечные впадины и
др.), но очень вирулентную. От одного
больного инфекция может перейти на
всех больных с чистыми ранами, находящихся в хирургическом отделении,
если не соблюдать строгие профилактические мероприятия.
После широкого применения антибиотиков в результате их неправильного назначения вероятность увеличения антибиотикоустойчивых штаммов,
приводит к усилению внутрибольничной инфекции.
Под этим понятием подразумевается инфицирование больного существующей в лечебном учреждении
флорой, вирулентной и устойчивой ко
многим антибиотикам. Внутрибольничной инфекции наиболее подвержены новорожденные, старики, больные
сахарным диабетом или со сниженной
иммунобиологической защитой организма.
17
Источниками госпитальной инфекции являются в первую очередь
больные с гнойно-воспалительными
заболеваниями, бациллоносители и медицинский персонал. Эта инфекция передается различными путями больным:
при контакте между ними через предметы, постельные принадлежности,
через воздушную среду, при перевязках и т.д. При многократном инфицировании, в условиях широкого применения антибиотиков, у этих микробов
вырабатывается большая устойчивость
ко многим из них. Заболевания, вызываемые этими микробами, протекают
более тяжело и лечение их значительно затруднительно. Носителями этой
флоры являются не только больные,
но и персонал (врачи, медицинские
сестры, санитарки и др.), которые могут заболеть или являются носителями
(бациллоносителями) и распространителями антибиотикоустойчивой мик
рофлоры, т.е. могут заражать больных
и своих коллег-медиков. Бациллоносителями могут быть также сами
больные и их посетители. Они тоже
являются источниками госпитальной
инфекции. Нельзя забывать и об инфекционных заболеваниях, которые
могут иметь место в хирургических
стационарах (грипп, аденовирусные
заболевания, кишечные инфекции, вирусный гепатит, СПИД и другие). Внутрибольничная инфекция в лечебном
учреждении возникает и в результате
неправильного распределения больных в палатах, нарушения санитарноэпидемиологического режима, правил
текущей дезинфекции персоналом хирургического отделения.
Практически, борьба против внутрибольничной инфекции — бескомпромиссное, строгое следование правилам противоэпидемического режима
и контроль за ним во всех подразде-
18
Текстовый модуль 1
лениях хирургического стационара:
строжайшее выполнение мероприятий,
направленных на соблюдение больничной гигиены, антисептики и асептики, путем проведения дезинфекции, правильной вентиляции палат,
обеззараживания воздуха, в том числе
бактерицидными лампами, влажной
уборки с применением химических веществ, дезинфекции выделений больного. Гигиена в больнице, и особенно
в операционном блоке, невозможна
без сознательной дисциплины всех сотрудников. Большинство осложнений
в виде раневой инфекции можно избежать или уменьшить их вероятность
возникновения до минимума.
Для предупреждения развития
внутрибольничной инфекции в хирургическом отделении необходимо изолировать источник гнойной
инфекции. Поэтому выделяют специализированные чистые и гнойные хирургические отделения. Все
санитарно-эпидемиологические мероприятия в чистом и гнойном отделениях направлены на уменьшение переноса
микробной инфекции из гнойного отделения в чистое и внутри этих отделений. С этой целью разработана стройная система санитарных мероприятий,
разобщающая работу персонала в этих
отделениях. Совершенным методом
профилактики распространения внутрибольничной инфекции является организация входа больных и персонала
в отделения, операционные и другие
смежные кабинеты через шлюзы. Для
этого в больнице необходимо иметь
должное материальное обеспечение,
позволяющее строго выполнять все
требования службы СЭС.
Немаловажное значение в современных условиях для профилактики
внутрибольничной инфекции имеет
сокращение сроков пребывания боль-
Тема 1
ного в стационаре, что уменьшает вероятность его заражения госпитальной инфекцией. Для этого плановые
(несрочные) больные обследуются в
амбулаторных условиях, кроме специальных методов (лапароскопия и др.),
по возможности сокращается предоперационная подготовка, применяются
малоинвазивные методы оперативных
вмешательств (эндоскопические холецистэктомии, аппендэктомии, грыжесечения, операции из малых доступов и
др.), после которых больные как можно
раньше выписываются из стационара.
Во избежание внутрибольничной
инфекции, в хирургических стационарах ограничивается посещение пациентов, так как может заноситься инфекция
извне, а также выноситься за пределы
отделения гноеродная микрофлора,
устойчивая к антибиотикам и циркулирующая в больнице. Это ведет к распространению и возникновению заболеваемости ею за пределами медицинского
учреждения. Поэтому посещение больных разрешается в отдельных случаях
по пропускам и посетители должны
иметь сменную обувь, халаты, головные уборы (колпаки, белые косынки).
Они не должны находиться у больных
длительное время и обязаны сидеть на
стульях, а не на постели больного.
Если хирургическое отделение небольшое, в нем выделяют палаты для
чистых и гнойных больных. При появлении гнойного осложнения после
чистой операции, больные немедленно переводятся на гнойную половину отделения, а палата, кровать, прикроватный столик, все постельные
принадлежности и вещи больного подвергаются дезинфекции.
Организационные
мероприятия,
разобщающие поток гнойных и чистых
больных, необходимы и в амбулаторных условиях: прием больных, лече-
ние, перевязки и операции выполняют
в специальных кабинетах.
Для выявления бациллоносителей — возбудителей гнойной инфекции
среди персонала хирургического отделения, т.е. лиц практически здоровых,
но выделяющих в окружающую среду
патогенную микрофлору, не реже одного раза в месяц берут посевы из носа
или глотки. С этой целью получают в
баклаборатории стерильную герметично закрытую пробирку с питательной
средой и металлической или пластиковой палочкой с прикрепленным на конце кусочком ваты. Палочку извлекают
из пробирки, делают мазок из носа и
погружают в пробирку с питательной
средой. Пробирку герметично закрывают стерильной пробкой и отправляют в
бактериологическую лабораторию.
При положительном результате исследования (наличие патологической
микрофлоры) эти лица отстраняются
от работы в хирургических отделениях
и операционной на время соответствующего лечения. После этого проводится повторный бактериологический
контроль и только при отсутствии в
посевах патогенной микрофлоры им
разрешается вновь вернуться к работе
в хирургическое отделение.
Все случаи гнойной госпитальной
инфекции подвергаются всестороннему анализу специальной комиссии врачей с участием сотрудников
санитарно-эпидемиологической службы для выяснения причин осложнений
и составления мероприятий по их профилактике.
При
появлении
воздушнокапельной инфекции (грипп), во избежание распространения и заражения
в стационаре больных и персонала,
вводится карантин. Персонал должен
постоянно носить маски, запрещается посещение больных родственника-
19
ми, ограничивается выход больных за
пределы отделения. При появлении у
больных инфекционного заболевания,
их изолируют в отдельные палаты, или
переводят, если позволяет состояние
по хирургическому статусу, в инфекционное отделение. Палаты подвергаются
дезинфекции, а соседи по палатам, если
имеется необходимость, подвергаются
профилактическим прививкам.
Санитарно-эпидемиологическая
станция изучает не только результаты
исследований на бациллоносительство
персонала, но ежемесячно проверяет качество стерилизации, для чего проводятся посевы на стерильность с инструментов, перевязочного, шовного материала,
берутся посевы у врачей и медицинских
сестер, участвующих в операциях, при
обработке рук, операционного поля. На
загрязненность исследуют предметы,
находящиеся в операционной, перевязочной, в палатах, предметах ухода за
больными, посуды в буфетах. Лиц, участвующих в раздаче пищи, обследуют на
носительство кишечной палочки.
Взаимодействие медицинского персонала больницы и работников СЭС
позволяет добиться устранения внутрибольничной инфекции при условии,
если все службы будут четко выполнять
свои служебные обязанности.
Устройство
хирургического
отделения
Хирургическое отделение рекомендуется проектировать так, чтобы окна выходили на южную, юговосточную или юго-западную сторону.
Это способствует хорошему естественному освещению, попаданию в палаты
солнечных ультрафиолетовых лучей,
являющихся гибельными для многих
микробов.
20
Текстовый модуль 1
В хирургических отделениях размещение помещений различного назначения должно предусматривать
профилактику внутрибольничной (госпитальной) инфекции.
Хирургический стационар состоит
из основных и вспомогательных помещений. К основным относятся: обычные палаты, палаты интенсивной терапии, операционный блок.
Палаты рассчитаны на 1-2-4 койки,
при площади на одну койку 6,5-7,5 кв.м.
Желательно выделять 1-2-х местные
палаты для послеоперационных больных, куда их помещают сразу после
операции или после перевода из отделения интенсивной терапии. В палатах
интенсивной терапии лечатся больные
в тяжелом состоянии, которым требуется проведение интенсивной терапии,
норма площади составляет 30-42 кв. м
на 1 койку.
Койки для больных должны быть
удобными, с упругими матрасами.
Возле каждой кровати должна располагаться прикроватная тумбочка.
В палате также необходимы стол и
стулья из материала, который можно подвергать санитарной обработке.
Для тяжелых больных используются
функциональные кровати, позволяющие придать больному необходимое
положение и облегчающие уход (прикроватные столики для кормления,
подставки для внутривенных вливаний, ниша для установки подкладного
судна). Койки должны располагаться
вдоль стен, чтобы было легко транспортировать в палату и перекладывать
больных. Искусственное освещение в
палате не должно быть ярким, чтобы
не раздражало глаза. Ночью при оказании помощи должен использоваться
индивидуальный светильник, во избежание беспокойства остальных пациентов палаты.
Тема 1
В палаты отделения интенсивной
терапии больные доставляются из операционного блока на функциональных
кроватях (на колесиках) для постоянного наблюдения и интенсивной терапии. Эти палаты оснащены кардиомониторами, дыхательной аппаратурой с
централизованной подачей кислорода,
электростимуляторами и пр. Обычно
больные находятся здесь 3-5 дней, после чего переводятся в послеоперационную палату хирургического отделения.
Операционный блок должен быть
расположен, по возможности, на значительном удалении от палат или в
отдельном помещении в целях предупреждения попадания инфекции.
В операционном блоке выделяют операционные для чистых и гнойных хирургических вмешательств.
В настоящее время на один операционный стол должно приходиться от
20 до 40 кв. м площади операционной
комнаты. Она должна иметь хорошую
освещенность.
Раньше для этой цели операционные
имели стеклянный купол, широкие окна,
площадь которых относилась к площади
пола как 1:2. С распространением электрического освещения это имеет меньшее значение. Пол не должен впитывать
жидкость (шлифованный цемент или
плитка), потолок окрашивают масляной
краской, стены также покрыты масляной
краской или выложены кафелем, чтобы
можно было их обрабатывать антисептиками, не должно быть лепных украшений, в неровностях которых может скапливаться пыль (инфекция). Отопление
должно быть устроено так, чтобы не загрязнять операционную: батареи должны быть встроены в стену или иметь
самую простую форму, чтобы их можно
было легко обрабатывать. Вентиляция
должна быть приточно-вытяжная, в операционных для трансплантации орга-
нов и тканей — с ламинарным потоком
воздуха, пропущенного через фильтр.
В операционной поддерживается температура 18-250С (наиболее оптимально 22-25С), относительная влажность
воздуха 55-60%. Для поддержания этих
параметров существуют кондиционеры.
Окраска стен должна быть в светлых,
например, голубых или светло-зеленых
тонах. Белая окраска утомляет зрение,
а черная — угнетающе действует на персонал и больного. Только в операционных, где операции делают с применением
лазера, окраска стен может быть темная
(для поглощения света).
В оснащение операционной комнаты входит: операционный универсальный стол, лампы дневного света (стационарные, передвижные, с аварийным
аккумуляторным освещением), большой и малый инструментальный стол,
подставки для биксов, тазиков, столик
для растворов, аппарат для диатермии,
электроотсос, тазики для сбора грязного материала и использованного
инструментария, винтовые табуреты
для выполнения операции сидя, столик
анестезиолога, наркозный аппарат, дефибриллятор и др. Все оборудование
должно выдерживать обработку антисептиками.
К операционному блоку также относятся: предоперационная, стерилизационная, аппаратная, материальная,
инструментальная, наркозная, предоперационная комнаты, помещения для
врачей, старшей медицинской сестры
и прочие вспомогательные помещения. Все они должны быть устроены
так, чтобы их можно было обрабатывать дезинфицирующими растворами
для соблюдения особого санитарно
эпидемиологического режима.
Хирургический стационар может
иметь также эндоскопическую операционную, которая оснащена специаль-
21
ной аппаратурой. Окна затемненные,
чтобы посторонний свет не мешал хирургу во время операции, и был хорошо виден экран телевизора (дисплея).
В хирургическом отделении кроме
основных помещений должны быть
вспомогательные: перевязочные (чистая и септическая), пост медицинской
сестры, манипуляционная, кабинет заведующего отделением, ординаторская,
кабинет старшей медсестры, сестрыхозяйки, буфет-раздаточная, столовая,
комната отдыха больных, помещение
для встречи с родственниками, санузел,
санитарная комната, комната для чистого и грязного белья, раздевалки для
медицинского персонала; могут быть
и другие помещения в зависимости от
профиля отделения.
Стены в манипуляционных и перевязочных покрываются масляной краской, а пол — материалом, не впитывающим влагу, чтобы их можно было
регулярно обрабатывать антисептическими средствами. В перевязочной
должны быть: перевязочный стол,
кушетка, покрытые клеенкой или полихлорвиниловой пленкой, столик для
инструментов, на котором стерильная
простынь и инструменты заменяются
два раза в сутки, сухожаровая камера,
медицинский шкаф для растворов, лекарств и др., подставки для биксов и
сами биксы со стерильным материалом,
специальные емкости для обработки
использованных инструментов, закрытые емкости для сбора использованного
перевязочного материала, клеенчатые
фартуки и халаты, резиновые перчатки,
маски, используемые во время перевязок персоналом. Освещение электрическое (можно бестеневой лампой).
Должны быть бактерицидные лампы.
Остальные вспомогательные помещения (ординаторская, комнаты
для хранения белья, санузлы, ванные
22
Текстовый модуль 1
и др.), по характеру отделки могут отличаться от палат, но они, по крайней
мере, должны иметь панели, окрашенные масляной краской, и полы, которые
можно обрабатывать антисептиками.
Остальная часть стен и потолок могут
покрываться немоющимся материалом
(известь и др.).
Во избежание внутрибольничной
инфекции в хирургическом отделении
выделяют чистую и септическую (гнойную) половину, а в небольших отделениях — палаты для чистых и гнойных
больных.
В клинических больницах также
имеются кабинет заведующего кафедрой, учебные и вспомогательные помещения для обучения студентов и работы сотрудников кафедры.
Организация работы
в хирургическом
отделении
Функциональные обязанности сотрудников хирургического отделения
определены стандартом аккредитации
медицинских работников.
Заведующий отделением осуществляет организацию всей административной и лечебно-диагностической
работы. Упорядочивает работу врачей,
медицинских сестер, санитарок и других сотрудников, следит за качеством
диагностики и лечения больных. Он
также организует проведение клинических конференций в отделении, повышение квалификации врачей, среднего
и младшего медицинского персонала.
В клинических учреждениях лечеб
но-методические вопросы, совершенствование лечебно-диагностического
процесса, проведение научных исследований, повышение знаний врачей,
проведение конференций и пр. возложено на профессора, заведующего кафедрой хирургии. Заведующий
Тема 1
отделением выполняет, в основном,
административные функции, а мероприятия медицинского характера осуществляет по согласованию с заведующим кафедрой.
Старшая медицинская сестра,
подчиняясь заведующему отделением, организует и контролирует работу
среднего и младшего медицинского
персонала, организует обеспечение
отделения медикаментозными препаратами и средствами ухода за больными, обеспечивает правила хранения и
учета наркотических веществ, контролирует организацию питания больных
в отделении, ведет учет поступления и
выписки больных, составляет отчет о
движении больных в отделении, контролирует в отделении режим работы,
санитарно-эпидемиологический
режим, вместе с заведующим организует
занятия со средним и младшим медицинским персоналом и пр. На должность старшей медицинской сестры
обычно назначают медсестру первой
или высшей аттестационной категории, имеющую стаж работы не менее
трех лет, приказом главврача по согласованию с заведующим отделением.
Права и обязанности медицинской сестры регламентированы стандартом аккредитации медсестер.
Медицинская сестра обязана выполнять все назначения врача. По назначению врача она имеет право и
должна уметь проводить следующие
манипуляции:
■ измерять температуру тела, артериальное давление, считать пульс;
■ проводить функциональные пробы
(спирометрия и др.);
■ проводить простые лабораторные
анализы: анализ крови на гемоглобин и СОЭ, анализ мочи на белок;
■ брать мазки из зева и половых органов;
■
■
■
■
■
■
■
■
■
■
■
■
■
■
■
■
■
■
■
■
■
■
■
■
промывать уши для удаления серных пробок;
смазывать глотку;
втирать лекарственные вещества;
разводить туберкулин для туберкулезной диагностики;
выполнять внутрикожные, подкожные, внутримышечные, внутривенные инъекции (последние —
по разрешению врача);
производить аутогемотерапию;
ставить банки, горчичники, пиявки;
использовать припарки и компрессы;
ставить клизмы всех видов;
применять газоотводную трубку;
спринцевать влагалище;
делать катетеризацию мочевого
пузыря мягким резиновым катетером;
промывать мочевой пузырь;
промывать и зондировать желудок;
проводить физиотерапевтические
процедуры по назначению врача;
обеспечивать переноску и транспортировку больных и раненых;
оказывать первую медицинскую
помощь при травмах, ожогах, отморожениях, отравлениях и пр.;
накладывать шину, кровоостанавливающие жгуты;
выполнять перевязки;
производить искусственное дыхание и наружный массаж сердца;
следить за своевременным и правильным приемом больным лекарств в ее присутствии;
при оказании помощи, соблюдать
правила деонтологии;
обязана поддерживать у больного
хорошее настроение, уверенность в
скором выздоровлении;
поддерживать ровные, благожелательные отношения со старшим
и младшим медицинским персо-
23
налом, так как спокойная обстановка положительно действует на
больных;
■ вести необходимую медицинскую
документацию;
■ проводить
санитарно-просвети
тельную работу.
В поликлинике (амбулатории) и
на участке обслуживания медицинская
сестра обеспечивает условия для приема врача, ведет документацию, обеспечивает прием вне очереди больных с
высокой температурой и нарастающей
тяжестью состояния, оказывая им при
необходимости первую помощь, осуществляет с врачом диспансеризацию
больных, посещает больных на дому,
ведет санитарно-просветительную работу и обучает пациентов мерам индивидуальной профилактики.
В хирургических отделениях на
50 и более коек назначается старшая
операционная медицинская сестра,
подчиняющаяся заведующему хирургическим отделением или операционным блоком. Это наиболее опытная
операционная сестра, которая совместно с заведующим отделения организует
всю работу оперблока. Ее распоряжения для медсестер и санитарок являются обязательными. Она участвует в
приеме на работу операционных сестер
и санитарок, обучает их правилам соблюдения асептики и антисептики,
обучает ассистированию на операциях,
проведению уборки в оперблоке, обработке и стерилизации инструментов,
операционного белья, перевязочного
материала и т.д.
Старшая медсестра является материально ответственным лицом, следит за пополнением и своевременным
ремонтом оборудования, использованием расходных материалов, медикаментов; два раза в год организует профосмотры персонала с исследованием
24
Текстовый модуль 1
на бациллоносительство, взятие посевов с рук, инструментов, перевязочного
и шовного материалов на стерильность,
с воздуха — на обсемененность микробами. Все эти сведения регистрируются
в специальном журнале. Она контролирует своевременность подготовки
операционных сестер к предстоящим
операциям и качество их работы.
Операционная сестра ассистирует во время выполнения врачами
оперативных вмешательств (подает
инструменты и материалы), следит за
соблюдением стерильности в операционной, за работой санитарок в оперблоке. Она готовит для стерилизации
операционное белье, операционный
материал, инструменты и контролирует их стерильность. Сестра отвечает
за качество различных видов уборки
операционного блока, сохранность аппаратуры и пр. Она должна следить за
личной гигиеной. Перед началом работы и в конце рабочего дня обязана
принимать душ, регулярно проходить
обследование на бациллоносительство.
При выявлении патогенной микрофлоры медсестра не допускается к работе
в оперблоке, направляется на лечение
к отоларингологу. Затем делается повторный бакпосев, и при отсутствии
патогенной микрофлоры она может
приступить к работе.
Медицинская сестра процедурного кабинета выполняет в свое рабочее время все внутривенные вливания
и забор крови для анализов, помогает
врачу при переливании крови, проводит некоторые виды обследования и др.
Она следит за соблюдением санитарноэпидемиологического режима на своем
рабочем месте.
Перевязочная медицинская сестра организует условия для выполнения перевязок и некоторых операций
(процедур) (пункция, наложение шва
Тема 1
и др.) врачами. Она готовит для стерилизации перевязочный материал, стерилизует инструментарий и контролирует их стерильность. Помогает врачу
производить перевязки и процедуры,
а также сама выполняет по поручению
врача простейшие перевязки. Отвечает
за санитарно-эпидемиологическое состояние перевязочной.
Сестра-хозяйка
обеспечивает
персонал и больных спецодеждой, постельными принадлежностями, столовой посудой, предметами и дезинфицирующими растворами для уборки
отделения, контролирует качество
санитарной обработки больных и помещений, следит за работой сантехнического, электрического оборудования
и пр. Для их ремонта привлекает соответствующих специалистов лечебного
учреждения. Она является материально ответственным лицом.
Буфетчица обеспечивает кормление больных соответственно порционному меню, составленному постовой
медицинской сестрой, согласно назначений врача. Она отвечает за соблюдение санитарно-гигиенических и эпидемиологических норм при кормлении
больных в столовой, раздаточной и не
имеет права заниматься другой (грязной) работой.
Младшая медицинская сестра
(санитарка) хирургического отделения проходит необходимое обучение
по техминимуму и помогает среднему
медперсоналу в уходе за больными,
иногда выполняет простейшие процедуры: клизмы, гимнастику и др. Участвует в соблюдении больными личной
гигиены, гигиены окружающей среды,
нательного и постельного белья, помогает в отправлении естественных
потребностей, участвует в транспортировке больных в операционную и обратно, а также на различные исследо-
вания. Она обеспечивает правильную
обработку, использование и хранение
предметов ухода за больными. Вместе
с медицинской сестрой следит за соблюдением режима дня в хирургическом отделении, посещением больных
родственниками, контролирует соответствие передаваемых продуктов, назначенной врачом диеты.
В хирургическом стационаре лицом, имеющим наиболее частые и
близкие контакты с больным при его
лечении является палатная (постовая) медицинская сестра. Нагрузка
для нее составляет 20-25 больных. Для
выполнения ее обязанностей создается
пост медицинской сестры, который располагается таким образом, чтобы был
обеспечен беспрепятственный обзор и
доступ к палатам, где лежат больные.
В палатах интенсивной терапии пост
медицинской сестры располагается непосредственно в палатах и нагрузка на
сестру уменьшается до 2-4 больных.
Пост имеет манипуляционную.
На посту должен быть стол и стул
для работы сестры. Пост оборудуется
телефоном, сюда выводятся средства
сигнализации от больных, а в палатах
интенсивной терапии — мониторы,
показывающие основные жизненные
параметры больных, за которыми ведется постоянное наблюдение. Лекарства доставляются палатной сестре на
ее рабочее место. Это позволяет медицинской сестре неотлучно находиться
при больных. На посту должен быть
рукомойник и дезинфицирующий раствор (0,5-1% раствор хлорамина) для
обработки рук медицинской сестры после каждой манипуляции. Здесь должен
быть шкаф для медикаментов, маркированных и разложенных по полкам.
Важным моментом при уходе является оказание помощи при удовлетворении естественных потребностей
25
больного (питание, движение, опорожнение кишечника и т.д.), соблюдении
гигиены тела, постели и пр. В этих случаях медицинская сестра опирается на
помощь младшего медицинского персонала, которым она руководит.
Медицинская палатная сестра почти все время находится при больном,
поэтому она постоянно наблюдает за
ним, считает частоту пульса, измеряет
артериальное давление и температуру
тела, определяет диурез, констатирует
изменения состояния больного, чем
оказывает большую помощь врачу. Но
наблюдательность сама по себе не приходит. Ее необходимо вырабатывать,
учиться постоянно фиксировать внимание на мельчайших изменениях в
состоянии больного.
Работа медицинской сестры весьма
ответственна, она должна быть влюблена в свое дело, внимательно относиться
к больным, всегда быть приветливой и
спокойной. Известный хирург-онколог
Н.Н. Петров (1876-1964 гг.) утверждал, «что медицинских сестер надо
выбирать из числа женщин, носящих в
своей душе огонь бескорыстной любви к
своему делу и к тем людям, для которых
оно делается. Ни в одной профессии не
ощущается такой острой необходимости в гармоничности сочетания сердца
и разума, как в труде медика».
Постовая медицинская сестра совместно с младшим персоналом создает и поддерживает в отделении
санитарно-гигиеническую обстановку,
лечебноохранительный режим, следит
за соблюдением распорядка дня.
Она присутствует при обходе больных ординатором, дежурным врачом,
фиксирует произведенные изменения
назначений и выполняет их.
Сестра производит по назначению
врача сбор материалов для анализов
и подклеивает их результаты в исто-
26
Текстовый модуль 1
рию болезни. Она знакомит вновь поступивших больных с режимом дня и
правилами личной гигиены, проверяет
качество санитарной обработки в санпропускнике. По распоряжению врача
проводит подготовку больных к операции и различным исследованиям.
В обязанность постовой медсестры входит составление порционных
требований по листам назначений, где
врач указывает больному необходимую диету и передает старшей медсестре. Палатная сестра составляет также
требования на лекарства и предметы
ухода за больными.
Необходимо контролировать посещение больных родственниками.
Во избежание нарушений санитарноэпидемиологического режима, контролировать приносимые больному из
дома продукты: они должны соответствовать разрешенной врачом диете.
Хранящиеся в холодильнике продукты
больных должны ежедневно осматриваться, а скоропортящиеся или испорченные — уничтожаться в целях предупреждения отравления.
Медицинская сестра отвечает за
работу младшего медицинского персонала, который привлекается к уходу за
больными.
Медицинская постовая сестра по
окончании дежурства должна передавать смену у постели больного, а также
передавать документацию, инструменты, медикаменты, пустые ампулы использованных наркотиков. При невыполнении каких-либо назначений она
обязана сообщить об этом своей сменщице, чтобы та могла их выполнить.
Постовая медицинская сестра должна
обладать такими качествами, как чрезвычайная добросовестность, доброта,
честность, скрупулезность, так как в
ряде случаев от этого зависит судьба и
здоровье хирургического больного.
Тема 1
В хирургическом отделении
должен соблюдаться лечебноохранительный режим
Порядок и чистота в отделении
имеют немаловажное значения для соблюдения санитарного режима, а также
играют роль в эстетическом отношении. Светлые, не перегруженные палаты благоприятно действуют на психику как больных, так и обслуживающего
персонала, являясь как бы стимулом
для поддержания порядка в отделении. Этим самым создаются условия
сохранения хорошего эмоциональнопсихологического состояния больного,
благоприятного влияния на течение
заболевания и быстрейшего выздоровления. Большое значение имеет соблюдение тишины, деловой спокойной
обстановки, что можно объединить в
понятие лечебно-охранительного режима, при котором создается физический и психологический покой. Этому
способствует и режим дня в хирургическом отделении, пример которого
представлен ниже:
Время
07.00
07.00 — 07.30
07.30 — 08.00
08.00 — 08.30
08.30 — 09.30
09.30 — 12.00
12.00 — 14.00
14.00 — 14.30
14.30 — 16.30
16.30 — 17.00
17.00 — 17.30
17.30 — 19.00
19.00 — 19.30
19.30 — 20.00
20.00 — 21.30
21.30 — 22.00
22.00
Мероприятие
Подъем
Измерение температуры
Утренний туалет
Раздача лекарств
Завтрак
Обход врачей
Выполнение врачебных
назначений
Обед
Послеобеденный отдых
Измерение температуры
Послеобеденный чай
Посещение родственников
Раздача лекарств
Ужин
Свободное время
Вечерний туалет
Отход ко сну
Поступающих больных знакомят с
режимом дня в отделении (больнице) и
требуют его выполнения, как в интересах быстрейшего выздоровления самого больного, так и в интересах других
пациентов. После чего они ставят свою
подпись в истории болезни в графе: «С
режимом ознакомлен». За нарушение
режима больной может быть выписан из отделения. За его соблюдением
следит медицинский персонал. Приведенный режим дня обычно называют общим. Он рассчитан на больных,
которые самостоятельно себя обслуживают. В зависимости от состояния
больного режим может быть изменен
на строгий постельный, постельный
или полупостельный режим.
Строгий постельный режим заключается в том, что больные постоянно находятся в постели неподвижно и
не могут сами подниматься (крайне тяжелое состояние, кома), или больным
запрещено вставать (в первые дни после
тяжелых операций на грудной, брюшной полости, на черепе и пр.). Физиологические отправления, уход за телом,
27
полостью рта, кормление и пр. происходят в постели с помощью медицинского
персонала. В постели выполняются все
назначения врача и процедуры.
Больные с постельным режимом
тоже находятся в постели, им не разрешают вставать, но они могут вести
себя более активно, поворачиваться,
а соблюдать личную гигиену им помогает медперсонал. Обычно это больные
в состоянии средней тяжести, после
перенесенных полостных операций
к концу раннего послеоперационного
периода (3-5 сутки), больные после ампутации нижней конечности и др.
С полупостельным режимом
больные уже могут подниматься с постели, ходить в туалет, самостоятельно
соблюдать личную гигиену, принимать
пищу. После операций на брюшной полости это обычно 5-8 сутки. В теплое
время года больным, которые ходят,
разрешается выходить во двор больницы. Нельзя покидать пределы больницы без разрешения врача.
Контрольные вопросы по теме занятия
1. Какие существуют основные пути распространения инфекции в хирургии?
2. Что такое асептика и антисептика?
3. Что такое внутрибольничная инфекция?
4. Как проводится оздоровление медперсонала при бациллоносительстве?
5. В каких случаях надевают хирургическую марлевую маску?
6. Как устроено хирургическое отделение?
7. Организация работы персонала в хирургическом отделении.
8. Обязанности и права медицинской сестры.
9. Какие манипуляции может выполнять медицинская сестра?
10. Какие обязанности сестры-хозяйки и буфетчицы?
11. Каковы обязанности младшей медицинской сестры и санитарки?
12. Какими качествами должна обладать медицинская сестра?
13. В чем заключается охранительный режим в хирургическом отделении?
14. Какие вы знаете виды антисептики?
15. Каковы меры профилактики внутрибольничной инфекции?
Тема 2
ТЕМА №2.
Антисептика, ее виды. Химическая, физическая, механическая, биологическая.
Препараты для химической антисептики
1. Актуальность темы
Неуклонный рост гнойных заболеваний, послеоперационных осложнений и
случайных ран заставляет задуматься над
вопросами соблюдения правил асептики и
антисептики. Эти вопросы касаются медицинских работников всех специальностей.
Актуальность этих занятий диктуется и
тем обстоятельством, что вопросы, касающиеся этой темы, будут затрагиваться
и на старших курсах при обучении на кафедрах хирургического профиля. Вопросу
соблюдения правил асептики и антисептики придается огромное значение.
■
■
■
■
■
■
■
2. Учебные цели
Основные виды антисептики, правила и показания к их использованию.
Выполнение перевязок с использованием наиболее часто применяемых
антисептиков;
Определить показания к использованию антисептических препаратов в различных ситуациях.
Виды дренажей, показания к применению.
Методы дренирования (активное,
пассивное).
Первичная хирургическая обработка
ран (ПХО), ее значение.
Показания, виды, техника ПХО.
3. Самостоятельная работа
студента
Антисептика — комплекс лечебных мероприятий, направленных на
уничтожение микробов в ране или организме в целом.
Еще в древности многие врачи эмпирически пришли к выводу о необ-
ходимости обеззараживания ран. Для
этой цели они применяли прижигание
раскаленным железом, уксусом, известью, бальзамическими мазями и другими веществами.
В 1843 году Холмс, а в 1947 году
Земмельвейс предложили для обеззараживания рук акушеров применять
раствор хлорной извести. Н.И. Пирогов использовал для обеззараживания
ран настойку йода, раствор нитрата серебра и др.
Происхождение антисептики во
многом связано с именем Пастера,
который в 1863 году доказал, что процессы брожения и гниения обусловливаются жизнедеятельностью микроорганизмов. Перенеся идеи Пастера в
хирургию, Листер дал научное обоснование нагноению ран, объяснив его
попаданием в рану и развитием в ней
микроорганизмов.
Своим трудом «О новом способе лечения переломов и гнойников с замечаниями и причинах нагноения»(1867) Листер произвел переворот в хирургии.
Он предложил использовать для
обеззараживания воздуха операционной, инструментов, рук хирурга 2-5%
раствор карболовой кислоты, операционное поле отграничивать марлей,
пропитанной таким же раствором.
Применение этой методики привело к
быстрому снижению числа нагноений.
В России она впервые была применена
Бурцевым в 1870 г.
Широкое использование метода Листера выявило и его негативные
стороны: фенол вызывал некрозы ран,
дерматиты, отравления при вдыхании.
В настоящее время Антисептика
(А) развилась в важное направление
хирургической науки и является неотъемлемой частью хирургического лечебное процесса.
Различают следующие виды А.: химическая, физическая, механическая и
биологическая, а также смешанная.
Химическая А. — применение различных химических веществ, обладающих бактерицидным или бактериостатическим действием. Кроме воздействия
на микрофлору, эти вещества в большинстве случаев оказывают и биологическое действие на ткани в месте применения и на организм в целом. Наиболее
целесообразно применять средства максимального бактериотропного действия
при минимальном органотропном.
Среди средств химической антисептики следует выделять следующие
группы:
1. группа галоидов — препараты
йода, хлора;
2. окислители — перекись водорода,
перманганат калия;
3. кислоты — бензойная , борная, салициловая, уксусная;
4. щелочи — аммиак, окись кальция,
сода;
5. соединения тяжелых металлов —
серебра, свинца, висмута, ртути;
6. спирты — этиловый, изопропиловый, некоторые гликоли;
7. альдегиды — формалин, уротропин;
8. фенолы;
9. продукты перегонки органических веществ — смолы, дегти, ихтиол;
10. красители — метиленовый синий,
бриллиантовый зеленый, этакридин, фуксин;
11. производный нитрофурана —
фурацилин, фурадонин, фуразолидон и др.;
12. детергенты — мирамистин, хлоргексидин;
29
13. сульфаниламиды — мадрибон,
сульфален, бисептол и др. (рис. 1).
Физическая А. — один из важнейших способов профилактики и лечения
раневой инфекции путем применения
различных физических факторов: использование гигроскопических повязок, гипертонических растворов, света,
тепла, ультразвука, ультрафиолетовых
лучей, дренирование ран — хотя их
действие нельзя объяснить только физическими механизмами, здесь присутствуют также биологические и физикохимические компоненты.
Механическая А. Одной из важнейших составных частей предупреждения
и лечения раневой инфекции является
механическое удаление инфицированных и нежизнеспособных тканей. Первичная хирургическая обработка
(ПХО) ран — один из наиболее часто
применяемых способов. Она может быть
выполнена в случае, если с момента повреждения прошло не более 6-8 часов,
когда рана считается инфицированной,
т.к. находящиеся в ней микроорганизмы
еще не начали выделять токсины. При
правильном выполнении ПХО случайная инфицированная рана превращается
в асептическую операционную, заживающую первичным натяжением. Как
лечебное мероприятие, направленное
на уменьшение числа микробов в ране
Рис. 1. Обработка п/о раны спиртовым раствором
йода
30
Текстовый модуль 1
и создание неблагоприятных условий
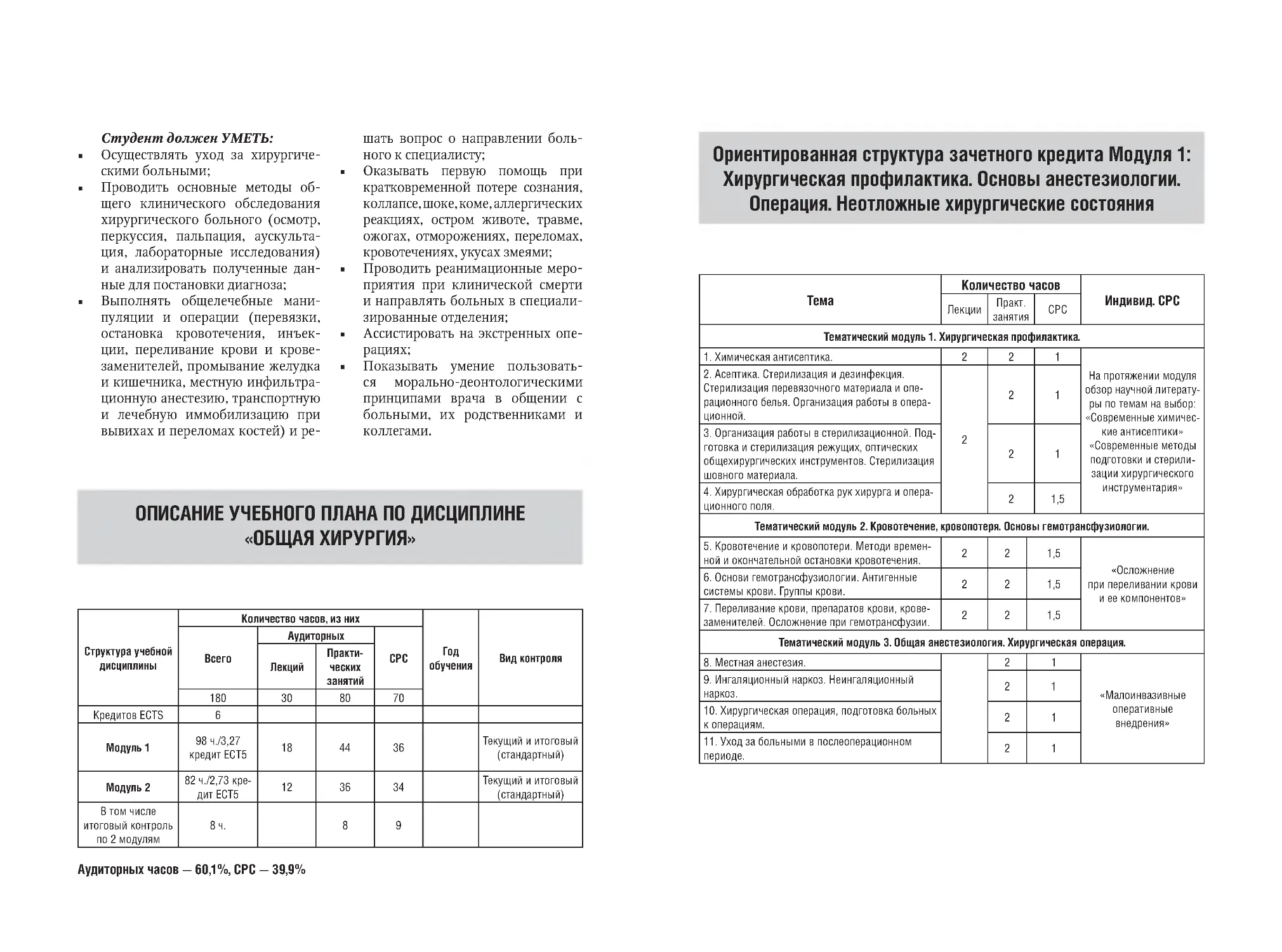
для их жизнедеятельности, механическая А. широко применяется в виде хирургического вмешательства (удаление
инородных тел, некротизированных и
нежизнеспособных тканей, вскрытие затеков и карманов, промывание раны).
ПХО и листеровский метод при их лечении впервые применил русский хирург
Рейер во время русско-турецкой войны
1877-1878 годов. Обязательным условием после выполнения ПХО раны является наложение швов, чтобы в ней не осталось полостей, а также ее дренирование
(одним из методов) (рис. 2).
Биологическая А. — применение
группы препаратов, действующих как
непосредственно на микробную клетку или ее токсины, так и на группу веществ, действующих опосредованно
через макроорганизм. К первой группе
относятся антибиотики, бактериофаги,
антитоксины. Ко второй группе относят средства, влияющие на иммунитет
(специфические и неспецифические
иммуномодуляторы).
Классификация антибиотиков:
1. пенициллины — естественные и полусинтетические
2. аминогликозиды
3. макролиды
Тема 2
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
тетрациклины
цефалоспорины
группа левомицетина
группа стрептомицина
рифамицины
антибиотики разных групп (линкомицин, полимиксин, фузидин нат
рий, грамицидин)
противоопухолевые
противогрибковые
хинолосодержащие (норфлоксацин, ципробай, ципролет)
карбопенемы (имипенем, меропенем, тиенам)
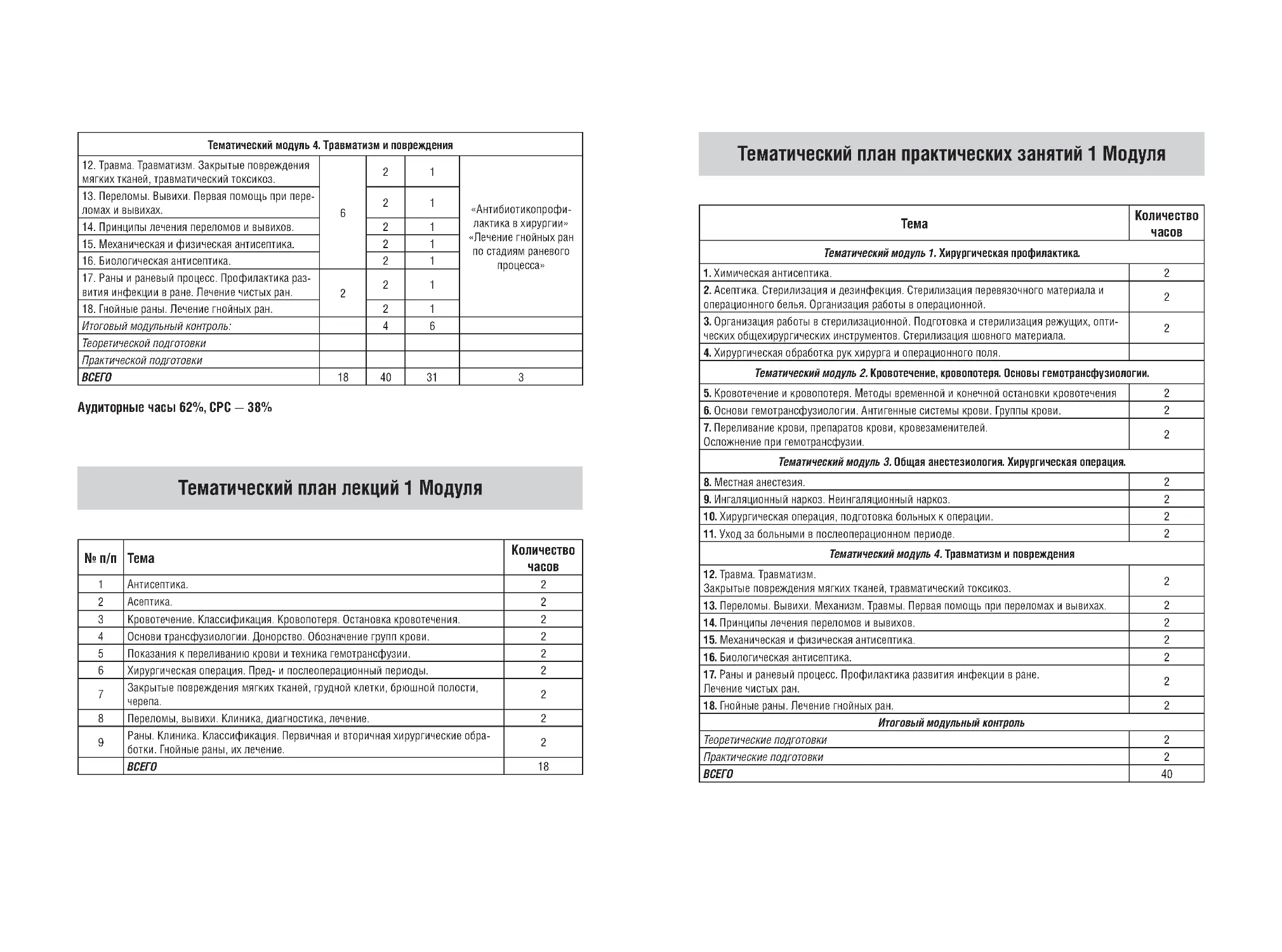
гликопептиды (ванкомицин) (рис. 3)
Правила назначения
антибиотиков:
Сначала назначают антибиотики
широкого спектра действия;
Необходимо проверить чувствительность;
Выбирать антибиотик строго по
чувствительности;
Назначать достаточно высокие терапевтические дозы препарата и
применять его столько времени,
сколько необходимо для лечения, в
среднем курс лечения — 7-8 суток;
При назначении двух и более антибиотиков необходимо учитывать
их взаимодействие;
■
■
■
■
■
«ÁÉÄÒÄÇÇÄÉ×
²ÁмÇÊÍËÊÌÄÉ×
«ÊÇÄÈÄÆÍÄÉ
ªÇÁ¼ÉÀÊÈÄÒÄÉ
ÈÄÉÊ¿ÇÄÆÊÃÄÀ×
®ÁÎ̼ÒÄÆÇÄÉ×
±ÇÊ̼ÈÐÁÉÄÆÊÇ
¨¼ÆÌÊÇÄÀ×
§ÄÉÆÊÈÄÒÄÉ
°ÏÃÄÀÄÉ
Рис. 2. Дренирование брюшной полости
*
**
***
Рис. 3. Механизм действия основных антибиотиков
(1 — рибосомы; 2 — цитоплазматическая мембра
на; 3 — митохондрии; 4 — оболочка)
Помнить о возможных осложнениях, своевременно прекращать при
появлении симптомов побочного
действия и немедленно приступать
к коррекции нарушенных функций.
Особого внимания заслуживают
также протеолитические ферменты, относящиеся к этой группе.
■
РАЗЛИЧАЮТ ФЕРМЕНТЫ:
а) животного происхождения:
трипсин, химотрипсин, химопсин, рибонуклеаза, коллагеназа;
б) бактериальной этиологии:
террелитин, стрептолиаза, аспераза,
ируксол (мазь, фермент которой выделен из CL. Histolyticum);
в) растительного происхождения: папаин, бромелаин.
Протеолитические ферменты лизируют некротические ткани, снимают отек
и усиливают действие антибиотиков.
Фаготерапия: Бактериофаги —
вирусы внедряют в микробные клетки
и вызывают их лизис.
Различают бактериофаги специфические в отношении стафилокков
31
и стрептококков, а также антиколибациллярные. Кроме того, используются поливалентные бактериофаги, когда
этиология инфекции неясна.
Иммунотерапия: Применяют различные анатоксины для активной
иммунизации. Столбнячный анатоксин применяется для плановой и
экстренной профилактики столбняка.
Антистафилококковая плазма.
Жидкая или замороженная плазма
крови доноров, иммунизированных
адсорбированным стафилококковым
анатоксином.
В хирургии также широко используются препараты, повышающие
неспецифический иммунитет: полиоксидоний, ронколейкины, продигиозан, левамизол, лизоцим, тималин,
Т-активин и др.
Под общей антисептикой или
«большой стерилизующей терапией» понимают насыщение организма
антисептическим средством, поступающим в очаг инфекции с током крови
или действующим на микрофлору, находящуюся в крови.
Контрольные вопросы по теме занятия
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
Что такое антисептика?
Классификация антисептики?
Какие мероприятия относят к механической антисептике?
Какие вещества относят к физической антисептике?
Какие препараты относят к химической антисептике?
Какие мероприятия относят к биологической антисептике?
Какие мероприятия относят к смешанной антисептике?
Профилактика СПИДа в хирургии.
Меры безопасности персонала при работе с ВИЧ-инфицированными пациентами.
Что такое ферменты и их роль в хирургии?
Что такое бактериофаги? Их назначение и применение в медицине.
Каково значение иммунотерапии?
Каково отличие специфического и неспецифического иммунитета?
В чем заключается отличие активного и пассивного иммунитета?
В чем заключается суть первичной хирургической обработки ран?
В чем различия активного и пассивного дренирования?
Тема 3
ТЕМА №3.
Асептика. Методы стерилизации и дезинфекции. Стерилизация шовного материала.
Автоклавная. Стерилизация операционного белья, перевязочного материала.
Стерилизация инструментария. Операционный блок, зоны стерильности,
виды уборки. Обработка рук хирурга. Одевание операционного белья.
Обработка операционного поля
1. Актуальность темы
Неуклонный рост гнойных заболеваний, послеоперационных осложнений и случайных ран заставляет задуматься над вопросами соблюдения
правил асептики и антисептики. Эти
вопросы касаются медицинских работников всех специальностей. Актуальность этих занятий диктуется и тем
обстоятельством, что вопросы, касающиеся этой темы, будут затрагиваться
и на старших курсах при обучении на
кафедрах хирургического профиля.
Вопросу соблюдения правил асептики и антисептики придается огромное
значение.
■
■
■
■
■
■
2. Учебные цели
Определить источники и виды инфекции, пути ее передачи;
Усвоить устройство операционного
блока и организацию различных видов уборок в операционной;
Знать правила одевания операционного белья;
Продемонстрировать методику изготовления салфеток, тампонов,
шариков, подготовку операционного белья и перевязочного материала
для стерилизации;
Изучить устройство, принцип и
режим работы автоклава, правила
безопасности при работе с автоклавом;
Изучить способы и методы обработки рук хирурга и операционного поля;
■
■
■
■
1.
2.
3.
4.
5.
6.
7.
Организовать подготовку хирургического инструментария для стерилизации;
Провести пробы на качество предстерилизационной обработки инструментов;
Определить и классифицировать
методы стерилизации режущих,
оптических, общехирургических инструментов;
Изучить и продемонстрировать методы стерилизации шовного материала.
3. Самостоятельная работа
студентов
История вопроса;
Устройство оперблока и организация работы в нем;
Стерилизация хирургического инструментария;
Стерилизация шовного материала,
перчаток, перевязочного материала, операционного белья;
Обработка рук хирурга;
Обработка операционного поля;
Демонстрация правил одевания
операционного белья.
Профилактика воздушнокапельной инфекции
Основной путь инфицирования ран
в операционной — контактный (около
90% случаев) и лишь в 10% случаев инфицирование происходит воздушным
путем. Каждый член хирургической
бригады, несмотря на специальную
подготовку к операции, стерильное
операционное белье, соблюдение режима работы в операционной, ношение
маски, выделяет в окружающий воздух
до 1500 микроорганизмов в 1 мин.;
За 1-1,5 ч. работы одной хирургической бригады бактериальная загрязненность воздуха в операционной
увеличивается на 100%. Допустимое
количество в 1 м3 воздуха операционной
перед началом работы не должно превышать 500 микроорганизмов и во
время операции 1000, при условии отсутствия в воздухе патогенных микроорганизмов. Достигнуть такого уровня удается с помощью специальных
устройств системы вентиляции, режима работы и уборки операционной, дезинфекции воздуха и предметов.
Хирургический стационар включает несколько основных функцио
нальных подразделений: операционный блок, хирургические отделения,
перевязочные, процедурные.
Операционный блок. Это набор
специальных помещений для выполнения операций обеспечивающих их проведения. Операционный блок должен
располагаться в отдельном помещении
или крыле здания, соединенном коридором с хирургическими отделениями,
или — на отдельном этаже многоэтажного хирургического корпуса. В нем
выделяют, разделенные между собой,
операционные для выполнения чистых
и гнойных операций. Более целесообразно иметь при гнойных хирургических отделениях отдельный, изолированный операционный блок.
Операционный блок изолирован
от хирургических отделений специальным тамбуром, чаще всего это часть коридора, в которую выходят помещения
операционного блока общего режима.
Для обеспечения режима стерильности
33
в операционном блоке выделяют специальные функциональные зоны.
1. 3она стерильного режима
объединяет операционную, предоперационную и стерилизационную.
В помещениях этой зоны производят
непосредственно операции — в операционной, подготовку рук хирурга
к операции — в предоперационной и
стерилизацию инструментов, которые
понадобятся в ходе операции или используются повторно — в стерилизационной (рис. 4).
2. В зону строгого режима входят
такие помещения, как санпропускник,
состоящий из комнат для раздевания
персонала, душевых установок, кабин
для надевания стерильной одежды.
Эти помещения располагаются последовательно и персонал выходит из
кабины для одевания прямо или через
коридор в предоперационную. В эту же
зону входят помещения для хранения
хирургических инструментов и аппаратов, наркозной аппаратуры и медикаментов, кабинет переливания крови,
помещения для дежурной бригады.
З. Зона ограниченного режима,
или техническая зона, объединяет производственные помещения для обеспечения работы операционного блока:
здесь находятся аппаратура для кон-
Рис. 4. Вид современной операционной
34
Текстовый модуль 1
диционирования воздуха, вакуумные
установки, установки для снабжения
операционной кислородом и наркотическими газами, здесь же располагаются аккумуляторная подстанция для
аварийного освещения, фотолаборатория для проявления рентгеновских
пленок.
4. В зоне общего режима находятся кабинеты заведующего, старшей
медицинской сестры, помещения для
разбора грязного белья и др.
Режим работы операционного
блока предусматривает ограничение
его посещений, а в зоне стерильного
режима должны находиться только
участвующие в операции хирурги и их
ассистенты, операционные сестры, анестезиологи и анестезисты, санитарка
для уборки операционной. В зону стерильного режима допускаются студенты, стажирующиеся врачи. Работники
операционного блока носят специальную одежду: халаты или куртки и брюки, отличающиеся по цвету от одежды
сотрудников других отделений.
Контроль за режимом стерильности операционного блока проводится периодически бактериологическими
исследованиями воздуха операционной, смывов со стен, потолка, аппаратов и приборов. Забор материала для
посева производят один раз в месяц:
еженедельно берут выборочно посевы
с рук работников блока для контроля
стерильности.
Стерильный режим в операционной достигается вследствие пре
дупреждения занесения микроорганизмов в операционную из других
помещений и распространения микроорганизмов в операционной.
Специальное устройство операционного блока, использование стерильных шлюзов перед входом в операционную, подготовка больного к операции
Тема 3
(мытье, смена белья, сбривание волос
в области операционного поля), подготовка к операции персонала (обязательное переодевание, использование
стерильного белья, надевание бахил,
шапочек, масок, обработка рук) значительно ограничивают проникновение
микроорганизмов в операционную.
Микроорганизмы в воздухе, на
предметах очень редко находятся в
изолированном виде, в основном они
фиксированы на микроскопических
частицах пыли. Поэтому тщательное
удаление пыли, как и предупреждение
проникновения ее в операционную,
уменьшает степень микробного загрязнения.
В операционной предусмотрены
следующие виды уборки: предварительная, текущая, послеоперационная,
заключительная и генеральная. Перед
началом операции влажной тряпкой
протирают все предметы, приборы, подоконники, удаляют осевшую за ночь
пыль (предварительная уборка). В ходе
операции постоянно убирают упавшие
на пол салфетки, шарики, инструменты
и др. (текущая уборка). В промежутке между операциями, когда больной
вывезен из операционной, убирают
белье, салфетки, инструменты. Влажной салфеткой, смоченной раствором
антисептических средств, протирают
операционный стол и накрывают его
простыней, пол протирают влажной
тряпкой (послеоперационная уборка).
По окончании рабочего дня производят заключительную уборку, которая
включает влажную уборку с протиранием потолка, стен, подоконников,
всех предметов и аппаратуры, пола
с использованием дезинфицирующих
растворов: 1-3% раствора перекиси
водорода с синтетическим моющим
средством, раствора дезоксона и др.
с последующим включением бакте-
рицидных ламп. В конце недели осуществляют генеральную уборку операционной.
Начинают уборку с дезинфекции операционной: потолок, стены, все предметы, пол опрыскивают
дезинфицирующими растворами, а
затем распыленный раствор удаляют
путем протирания. После этого проводят общую влажную уборку и включают бактерицидные ультрафиолетовые
лампы. Генеральная уборка может
быть и внеочередной при загрязнении
операционной гноем, кишечным содержимым, после операции у больных
с анаэробной инфекцией — газовой
гангреной.
Для облучения воздуха и предметов, находящихся в операционной, используют напольные (передвижные),
настенные, потолочные бактерицидные ультрафиолетовые лампы различной мощности (Рис. 5). Бактерицидные
лампы, снабженные специальными
экранами, защищающими от прямого действия ультрафиолетовых лучей,
могут работать при наличии людей
в операционной.
Предупреждение загрязнения воздуха в операционной достигается механической системой вентиляции,
Рис. 5. Настенная, потолочная и напольная лампы
35
осуществляемой путем подачи воздуха
с улицы или за счет его рециркуляции. Приточная вентиляция создает
нагнетание воздуха через фильтры
в операционную. С оседающей на
фильтры пылью удаляются фиксированные на ней микробы. Воздух выходит из операционной через естествен
ные щели. Такое направление потока
воздуха позволяет избежать проникновения загрязненного воздуха из
соседних операционных помещений,
в том числе из хирургического отделения. При отсутствии централизованной системы очистки воздуха от пыли
и микробов могут быть использованы
специальные передвижные воздухоочистители. За 15 мин. работы аппарата
количество микробов в операционной
уменьшается в 7-10 раз. Для производства некоторых операций, таких
как пересадка органов, требующая в
последующем применения иммунодепрессивных средств, или операций
имплантации протезов, операций при
обширных ожогах используют операционные с ламинарным потоком стерильного воздуха.
Количество микроорганизмов в таких операционных в десятки раз ниже,
чем в операционных с обычной системой
кондиционирования воздуха. Ламинарный поток обеспечивает обмен воздуха
до 500 раз в 1 ч. Воздух нагнетается в
операционную под давлением 0,2-0,3 атм
через специальный фильтр, представляющий потолок операционной, и выходит через отверстия в полу. Этим создается постоянный вертикальный поток:
в операционную поступает стерильный
воздух, направленный его поток уносит
из операционный микроорганизмы, попавшие в воздух от больного или от лиц,
участвующих в операции. Ламинарный
поток воздуха может быть как вертикальным, так и горизонтальным.
36
Текстовый модуль 1
Профилактика
контактной инфекции
Для предупреждения контактного инфицирования необходимо,
чтобы было стерильным все, что соприкасается с раной. Это достигается
стерилизацией операционного белья, перевязочного и шовного материала, перчаток, инструментов, обработкой рук
хирурга и операционного поля. Стерилизация шовного материала направлена на профилактику как контактного,
так и имплантационного инфицирования раны.
Стерилизация инструментов, перевязочного материала и белья включает следующие основные этапы: I —
предстерилизационная
подготовка
материала; II — укладка и подготовка к
стерилизации; III—стерилизация; IV—
хранение стерильного материала.
Стерилизация инструментов
Этап I — предстерилизационная
подготовка. Ее цель — тщательная
механическая очистка инструментов,
шприцев, инъекционных игл, удаление
пирогенных веществ и уничтожение
вируса гепатита.
Этап II — укладка и подготовка к
стерилизации.
Этап III — стерилизация. Стерилизацию инструментов и предметов, не
подлежащих термической обработке
(эндоскопы, торакоскопы, лапароскопы, аппараты или блоки аппаратов для
искусственного кровообращения, гемосорбции), осуществляют в специальном
газовом стерилизаторе. Предметы для
стерилизации помещают в герметичную стерилизационную камеру, которую наполняют окисью этилена. Время
экспозиции — 16 ч. при температуре
20-24 °С. Стерилизация может проводиться также смесью окиси этилена и
бромистого метилена при температуре
Тема 3
55°С в течение 6 ч. Стерилизация инструментов и оптических аппаратов
(лапароскоп, торакоскоп) может быть
проведена в спиртовом растворе хлоргексидина 0,5% или первомуре 4,8%.
Стерилизацию аппаратов и инстру
ментов химическими средствами следует проводить в металлических коробках с крышками, что предупреждает
испарение препарата и загрязнение
воздуха помещений. При отсутствии
специальной посуды стерилизуют в
эмалированной или стеклянной посуде. Инструменты заливают раствором
так, чтобы он полностью покрывал их
и закрывают крышкой.
В последние десятилетия стерилизация общехирургического инструментария осуществляется в сухожаровых
шкафах при температуре 180°С в течение одного часа (рис. 6). Сухожаровый
шкаф представляет собой металлический коробок с двойными стенками.
Внутри его расположены полки в виде
металлических сеток. Инструменты после предстерилизационной обработки
укладывают на полки раскрытыми таким образом, чтобы действие горячего
воздуха охватывало их со всех сторон.
В экстренных случаях, когда невозможно обеспечить стерилизацию инструментов по одному из указанных
Рис 6. Сухожаровый шкаф
способов, используют стерилизацию
инструментов обжиганием. В металлический тазик или лоток наливают 1520 мл спирта, несколько инструментов
укладывают на дно и спирт поджигают.
Метод обжигания недостаточно надежен, пожаро- и взрывоопасен (наличие
кислорода, паров наркотических веществ в воздухе помещений). Поэтому
к нему прибегают в исключительных
случаях, строго соблюдая меры пожарной безопасности. При стерилизации
режущих инструментов (скальпели,
ножницы) обычными методами они
затупляются, поэтому их лучше стерилизовать без термической обработки.
После предстерилизационной подготовки инструменты погружают в 96%
этиловый спирт на 30 мин. или в тройной раствор на 3 ч. Допускается лишь
краткосрочное кипячение режущих
инструментов. Скальпели укладывают
в отдельную сетку, их лезвия обертывают марлей и кипятят в дистиллированной воде без добавления натрия
гидрокарбоната в течение 10 мин., затем помещают в 96% этиловый спирт
на 30 мин.
Этап IV — хранение стерильного
материала. Стерильный материал хранят в специальном помещении. Не допускается хранение в одном помещении
нестерильных и стерильных материалов. Стерильность материала в биксах
(если они не открывались) сохраняется
в течение 72 ч. При централизованной
стерилизации шприцы сохраняют стерильность в течение 25 дней.
Стерилизация
перевязочного материала,
операционного белья
Этап I — предстерилизационная
подготовка материала. К перевязоч
ному материалу относятся марлевые
шарики, салфетки, тампоны, турунды,
37
бинты. Применяют их во время операций и перевязок с целью осушения
раны, остановки кровотечения, для
дренирования (крайне редко) или тампонады раны. Перевязочный материал
готовят из марли и ваты, реже из вис
козы и лигнина. Он должен обладать
следующими свойствами: 1) быть биологически и химически интактным, не
оказывать отрицательного влияния
на процессы заживления; 2) обладать
хорошей гигроскопичностью; 3) быть
минимально сыпучим, так как отделившиеся нити могут остаться в ране
как инородные тела; 4) быть мягким,
эластичным, не травмировать ткани;
5) легко стерилизоваться и не терять
при этом своих свойств; 6) быть дешевым в производстве, учитывая боль
шой расход материала. Норма расхода
за год на одну хирургическую койку —
200 м марли и 225 штук бинтов. Только на такую небольшую операцию, как
аппендэктомия, расходуется около 7 м
марли.
Перевязочный материал готовят из
марли, предварительно разрезанной на
кусочки. Марлю складывают так, чтобы края были ее подвернуты внутрь и
не было свободного края, из которого
могут осыпаться волокна ткани. Материал заготавливают впрок, пополняя
его запасы по мере расходования. Для
удобства подсчета расходуемого во время операции материала, его укладывают перед стерилизацией определенным
образом: шарики — в марлевые мешочки по 50-1000 штук, салфетки связывают по 10 штук. Перевязочный материал, кроме бинтов, незагрязненных
кровью, после применения сжигают.
К операционному белью относятся хирургические халаты, простыни,
пеленки, полотенца, маски, шапочки,
бахилы. Материалом для их изготовления служат хлопчатобумажные тка-
38
Текстовый модуль 1
ни — бязь, полотно. Операционное
белье многоразового пользования
должно иметь специальную метку и
сдаваться в стирку отдельно от другого
белья в специальных мешках. На халатах не должно быть карманов, поясов.
Простыни должны быть подшиты. Халаты, простыни, пеленки, полотенца
для стерилизации складывают в виде
рулонов, чтобы их легко можно было
развернуть при использовании.
Этап II — укладка и подготовка
материала к стерилизации. Перевязочный материал и операционное белье
укладывают в биксы (рис. 7). При отсутствии биксов допускается стерилизация в полотняных мешках.
При универсальной укладке в
бикс помещают материал, предназначенный для одной небольшой типичной операции (аппендэктомия, грыжесечение, флебэктомия и др.). При
целенаправленной укладке в бикс закладывают необходимый набор перевязочного материала и операционного
белья, предназначенного для конкретной операции (пневмонэктомия, ре
зекция желудка и др.). При видовой
укладке в бикс укладывают определенный вид перевязочного материала или
белья (бикс с халатами, бикс с салфетками, бикс с простынями и т. д.).
Рис. 7. Укладка перевязочного материала в биксе
Тема 3
Вначале проверяют исправность
бикса, затем на его дно помещают развернутую простыню, концы которой
находятся снаружи. Перевязочный
материал укладывают вертикально по
секторам пачками или пакетами. Материал укладывают неплотно, чтобы обеспечить доступ пара, внутрь помещают
индикаторы режима стерилизации,
края простыни заворачивают, бикс
закрывают крышкой и защелкивают
замок. На крышке бикса прикрепляют бирку из клеенки, на которой указывают название материала, а после
стерилизации — дату ее проведения и
фамилию человека, осуществлявшего
стерилизацию.
Этап III — стерилизация. Перевязочный материал и операционное
белье стерилизуют автоклавированием
в течение 30 мин. при давлении 2 атм.
(температура 132,9°С), перчатки — в
течение 20 мин.
Этап IV — хранение стерильного
материала. По окончании стерилизации
и сушки белья стерилизационную камеру разгружают, биксы вынимают,
сразу закрывают решетку и переносят
на специальный стол для стерильного
материала. Хранят стерильные биксы
в шкафах под замком в специальной
комнате. Допустимый срок хранения
перевязочного материала и белья, если
бикс не вскрывался — 72 ч. с момента
окончания стерилизации.
Контроль за стерильностью
материала и режимом стерилизации
в автоклавах проводится прямым и
непрямым (косвенным) способами.
Прямой способ — бактериологический: посев с перевязочного материала
и белья или использование бактериологических тестов. Посев производят
следующим образом: в операционной
вскрывают бикс, маленьким кусочком
марли, увлажненной изотоническим
раствором хлорида натрия, несколько раз проводят по белью, после чего
кусочки марли опускают в пробирку,
которую направляют в бактериологическую лабораторию.
Для бактериологических тестов используют пробирки с известной спороносной непатогенной культурой микроорганизмов, которые погибают при
определенной температуре. Пробирки
вкладывают в глубь бикса, по окончании стерилизации извлекают и направляют в лабораторию. Отсутствие роста
микробов свидетельствует о стерильности материала.
Получение и исследование посевов с перевязочного материала и белья
производятся один раз в 10 дней.
Непрямые способы контроля стерильности материала применяют постоянно при каждой стерилизации.
Существуют вещества с определенной
точкой плавления: бензойная кислота
(120°С), резорцин (119°С), антипирин
(110°С). Эти вещества выпускаются в
ампулах. Их применяют также в пробирках (по 0,5 г), закрытых марлевой
пробкой. Учитывая режим стерилизации методом пара под давлением с t°С
в автоклаве равной 132,9°С, эти вещества не могут быть использованы.
В данных условиях применяется мочевина с температурой плавления 132°С.
Ее укладывают в бикс между слоями
стерилизуемого материала в количестве 1-2 ампулы. Расплавление порошка и превращение его в сплошную
массу указывают на то, что температура в биксе была равна точке плавления
контрольного вещества или превышала ее. Для контроля режима стерилизации в сухожаровых стерилизаторах используют порошкообразные вещества
с более высокой точкой плавления:
аскорбиновую кислоту (187-192°С),
янтарную кислоту (180-184°С), пило-
39
карпина гидрохлорид (200°С), тиомочевину (180°С).
Подготовка рук к операции.
Обработка рук — важное средство
профилактики контактной инфекции. Врачи-хирурги, операционные и
перевязочные сестры должны постоянно заботиться о чистоте рук, ухаживать за кожей и ногтями. Наибольшее количество микроорганизмов
скапливается под ногтями, в области
ногтевых валиков, в трещинах кожи.
Уход за руками предусматривает
предупреждение трещин и омозолелостей кожи, подстригание ногтей (они
должны быть короткими), удаление
заусениц. Работу, связанную с загрязнением и инфицированием кожи
рук, следует выполнять в перчатках.
Правильный уход за руками следует
рассматривать как этап в подготовке
их к операции. Обработка рук любым
способом начинается с механической
очистки.
К классическим способам обработки рук относятся способы Фюрбрингера, Альфельда, Спасокукоцкого–
Кочергина. Способы Фюрбрингера,
Альфельда и др. предусматривают
предварительное мытье рук стерильной щеткой и мылом. Щетку, которую
держат в правой руке, намыливают мылом, затем мыло укладывают на тыльную поверхность щетки и удерживают
ладонью, в которой находится щетка
(рис. 8). Щетка или салфетка должны
перемещаться в направлении от пальцев к предплечью. Кисти находятся
выше предплечий и поток теплой проточной воды направляется от пальцев
к локтю. В таком положении начинают
и заканчивают мытье щеткой, не допуская оттекания воды от локтя к кисти.
Вначале моют ладонную поверхность
каждого пальца, затем тыльную поверхность и ногтевые ложа, межпальцевые
40
Текстовый модуль 1
Тема 3
Рис 8. Обработка рук хирурга. Мытье с мылом
под проточной водой
Рис 9. Обработка рук первомуром (С-4)
промежутки левой кисти, затем правой,
потом ладонь и тыл левой и правой кис
тей, предплечья до границы их верхней
и средней трети. Мыльную пену постоянно смывают проточной водой, щетку
намыливают по мере необходимости.
За все время мытья рук не прикасаются
к кранам, поток воды и ее температуру
регулируют перед мытьем. По окончании мытья щетку и мыло укладывают
на столик, руки ополаскивают водой и,
по-прежнему держа кисти рук на уровне груди, просушивают кожу стерильными марлевыми салфетками или полотенцем, не прикасаясь к невымытым
участкам кожи. Далее (в зависимости
от способа обработки) пальцы, кисти,
нижнюю треть предплечий протирают салфетками, обильно смоченными
спиртом, раствором церигеля или другим антисептиком. По способу Альфельда руки протирают 96% спиртом в
течение 5 мин. По Фюрбрингеру после
механической очистки руки протирают в течение 1 мин. раствором сулемы
1 : 1000 и затем 96% спиртом в течение
3 мин.; в заключение ногтевые ложа
смазывают 5% настойкой йода.
В настоящее время наиболее распространенными способами мытья рук
являются способ Спасокукоцкого —
Кочергина и обработка рук первомуром (препарат С-4), гибитаном
(хлоргексидином).
Способ Спасокукоцкого — Кочер
гина предусматривает механическую
очистку рук 0,5% раствором нашатырного спирта. Руки моют в двух тазах по
3 мин. салфеткой, выполняют последовательно движения, как при мытье
щеткой, начиная с пальцев левой руки.
В первом тазу руки моют до локтей, во
втором — до границы верхней и средней трети предплечья. По окончании
мытья руки ополаскивают раствором
нашатырного спирта и кисти поднимают кверху так, чтобы капли раствора стекали к локтям. С этого времени
кисти рук постоянно находятся выше
предплечий. Кожу рук осушают стерильными салфетками: вначале обе
кисти (эту салфетку бросают), затем
последовательно нижнюю и сред
нюю треть предплечий. Обеззараживают кожу салфетками, смоченными
96% спиртом, обрабатывая дважды по
2,5 мин. кисти и нижнюю треть предплечий, затем кончики пальцев, ногтевые валики; ногтевые ложа и складки
кожи пальцев смазывают 5% спиртовым раствором йода.
Обработка рук первомуром (препарат С-4). Первомур — смесь, состоящая из муравьиной кислоты и перекиси водорода. Вначале готовят основной
раствор в соотношении 81 мл 85% му
равьиной кислоты и 171 мл 33% раствора перекиси водорода, которые смешивают в стеклянной посуде с притертой
пробкой и помещают в холодильник на
2 ч., периодически встряхивая бутыль.
При взаимодействии муравьиной кислоты и перекиси водорода образуется
надмуравьиная кислота, обладающая
сильным бактерицидным действием.
Из данного количества основного раствора можно приготовить 10 л рабочего раствора первомура, смешав его
с дистиллированной водой. Рабочий
раствор годен к применению в течение дня. При приготовлении раствора необходимо работать в резиновых
перчатках для предупреждения ожогов
концентрированными растворами муравьиной кислоты или перекиси водорода. Обработка рук предусматривает
предварительное мытье их в течение
1 мин. проточной водой с мылом (рис.
9). Затем кисти и предплечья до уровня
средней трети моют салфетками в тазу
41
с раствором первомура в течение 1 мин.
и осушают стерильными салфетками.
В одном тазу обработку рук могут производить 5 человек.
Обработка рук хлоргексидина
биглюконатом. Он выпускается в
виде 20% водного раствора. Для обработки рук готовят 0,5% спиртовой раствор: к 500 мл 70% спирта добавляют
12,5 мл 20% раствора хлоргексидина
биглюконата. Предварительно моют
руки проточной водой с мылом, осушают стерильными салфетками или
полотенцем, а затем протирают марлевым тампоном, смоченным приготовленным раствором, в течение 2-3 мин.
дважды.
Ускоренные способы обработки
рук применяют в амбулаторной практике. Для ускоренного обеззараживания рук используют пленкообразующий препарат церигель, отличающийся
сильным бактерицидным действием.
В его состав входят поливинилбутирол
и 96% этиловый спирт. Руки моют водой с мылом, тщательно осушают. На
ладонь наливают 3-4 мл церигеля и
тщательно в течение 10 с. смачивают
им пальцы, ногтевые ложа и валики,
кисти и нижнюю часть предплечья.
Полусогнутые пальцы держат в разведенном положении в течение 2-3 мин.,
пока на коже не образуется пленка
церигеля. Образовавшаяся пленка обладает защитными и бактерицидными
свойствами, по окончании операции
она легко снимается марлевыми шариками, смоченными спиртом.
Обработка рук может быть произведена путем протирания кожи 96%
этиловым спиртом в течение 10 мин.
(способ Бруна) или в течение 3 мин.
2% спиртовым раствором йода.
Подготовка операционного поля.
Предварительная подготовка места
предполагаемого операционного раз-
42
Текстовый модуль 1
реза (операционного поля) начинается
накануне операции и включает общую
гигиеническую ванну, смену белья,
сбривание волос сухим способом непосредственно в месте операционного
доступа. После сбривания волос кожу
протирают спиртом. Бритье волос проводится не раньше, чем за 2 часа до
операции.
Перед хирургическим вмешательством на операционном столе поле
операции широко смазывают 5% спиртовым раствором йода дважды. Непосредственно место операции изолируют
стерильным бельем и вновь смазывают
5% спиртовым раствором йода (рис.
10). Перед наложением и после наложения швов на кожу ее обрабатывают
тем же спиртовым раствором. Этот
способ известен как способ Гроссиха — Филончикова.
При непереносимости йода кожей
у взрослых больных и у детей обработку операционного поля проводят 1%
Рис. 10. Обработка операционного поля
Тема 3
спиртовым раствором бриллиантового
зеленого (способ Баккала).
Для обработки операционного поля
используют 0,5% спиртовой раствор
гибитана (хлоргексидина биглюконата), а также раствор первомура 4,8%,
как и для обработки рук хирурга перед
операцией.
При экстренной операции подготовка операционного поля заключается в
сбривании волос, в обработке кожи 0,5%
раствором нашатырного спирта, а затем
одним из применяемых способов (Гроссиха — Филончикова, Баккала и др.).
Профилактика
имплантационной инфекции
Наибольшее значение в возникновении имплантационной инфекции
имеет шовный материал.
Для соединения тканей во время операции используют различного
происхождения нити, металлические
скрепки, скобки, проволоку. Существует более 40 видов шовного материала; наибольшее распространение,
имеют шелк, лавсан, капрон, кетгут,
металлические скобки.
Применяют как рассасывающиеся,
так и нерассасывающиеся нити. Рассасывающимися натуральными нитями
являются нити из кетгута. Удлинение
сроков рассасывания кетгута достигается импрегнацией нитей металлами
(хромированный, серебреный кетгут).
Используют синтетические рассасывающиеся нити — нити из дексона,
викрила, окцилона и др. К нерассасывающимся натуральным нитям относятся нити из натурального шелка,
хлопка, конского волоса, льна, к синтетическим — нити из капрона, лавсана,
дакрона, нейлона, фторлона и др.
Шовный материал должен соответствовать следующим основным
требованиям:
он должен иметь гладкую, ровную
поверхность и не вызывать дополнительного повреждения тканей
при их проколе;
■ обладать хорошими манипуляционными свойствами — хорошо
скользить в тканях, быть эластичным (достаточная растяжимость
предупреждает сдавление и некроз
тканей при их нарастающем отеке);
■ быть прочным в узле, не обладать
гигроскопическими свойствами и
не разбухать;
■ быть биологически совместимым
с живыми тканями и не оказывать
аллергического воздействия на организм;
■ разрушение нитей должно совпадать срокам заживления раны.
Нагноение ран происходит значительно реже при использовании
шовных материалов, обладающих
антимикробной активностью, за
счет введенных в их структуру противомикробных препаратов (летиланлавсановые, фторлоновые, ацетатные
и другие нити, содержащие нитрофурановые препараты, антибиотики и т. д.).
Синтетические нити, содержащие антисептические средства, обладают всеми достоинствами шовных материалов
как таковых и в то же время оказывают
антибактериальное действие.
Шовный материал может быть
простерилизован гамма-излучением в
заводских условиях. Ампулированные
мотки шелка, кетгута, капрона и др.
хранят при комнатной температуре
и используют по мере необходимос
ти. Металлический шовный материал (проволока, скобки) стерилизуют
в сухожаровом шкафе, автоклаве или
кипячением, льняные или хлопчатобумажные нити, нити из лавсана, капрона — в автоклаве. Шелк, капрон,
лавсан, лен, хлопок стерилизуют так■
43
же по способу Кохера. Последний
предусматривает
предварительную
тщательную механическую очистку
шовного материала горячей водой с
мылом. Мотки нитей моют в мыльной
воде в течение 10 мин., дважды сменяя воду, затем отмывают от моющего раствора, высушивают стерильным
полотенцем и наматывают на специальные стеклянные катушки, которые помещают в банки с притертой
пробкой и заливают эфиром на 24 ч.
для обезжиривания, после чего перекладывают в банки с 70% спиртом на
тот же срок. По извлечении из спирта
шелк кипятят в течение 10-20 мин. в
растворе сулемы 1 : 1000 и перекладывают в герметически закрывающиеся
банки с 96% спиртом. Через 2 сут. проводят бактериологический контроль:
при отрицательном результате посева
материал готов к применению. Синтетические нити можно стерилизовать
кипячением в течение 30 мин.
Стерилизация кетгута. Термическая обработка кетгута не применяется.
В заводских условиях кетгут стерилизуют гамма-лучами. Методы стерилизации кетгута химическими способами предусматривают предварительное
обезжиривание, для чего свернутые
колечками нити кетгута помещают в
герметически закрывающиеся банки
с эфиром на 24 ч. При стерилизации
по Клаудиусу сливают из банки эфир
и колечки кетгута заливают водным
раствором Люголя (йода чистого 10
г, йодида калия 20 г, дистиллированной воды до 1000 мл) на 10 сут., затем
заменяют раствор Люголя свежим и
вновь оставляют в нем кетгут на 10 сут.
После этого хранят в растворе Люголя.
Через 4-6 сут. производят посев на стерильность.
Метод Губарева предусматривает
стерилизацию кетгута спиртовым рас-
44
Текстовый модуль 1
твором Люголя (чистого йода и йодида
калия по 10 г, 96% этилового спирта до
1000 мл). После обезжиривания эфир
сливают и кетгут заливают раствором
Люголя на 10 сут., после замены раствора новым кетгут оставляют в последнем
еще на 10 сут. После бактериологического контроля при благоприятных
результатах разрешают использование
материала. Хранят в растворе Люголя.
Метод Ситковского. После обезжиривания в стерильных условиях
стандартные нити кетгута разрезают
на 3 части по 1,25 м длиной, протирают раствором сулемы 1 : 1000 и свертывают в колечки, которые опускают в
2% водный раствор йодида калия: для
нитей № 0 — на 30 с., № 1 — 1 мин.,
№ 2 — 2 мин., № 3 — 3 мин. и т. д. (время
в минутах соответствует номеру нити).
После пропитывания нитей йодидом
калия колечки кетгута нанизывают на
толстые нити и подвешивают на расстоянии 7-8 см от дна стеклянной банки, на которое насыпают кристаллический йод из расчета: в банку емкостью
З л — 40 г йода, емкостью 5 л — 60 г
йода. Банки герметически закрывают.
Сроки экспозиции кетгута различные в
зависимости от толщины нитей (№ 0 и
1 готовы через 3 сут., № 2, № 3, № 4 —
через 4 сут., № 5, № 6 — через 5 сут).
После бактериологического контроля
нити пригодны к использованию.
Контрольные вопросы по теме занятия
1.
2.
3.
4.
5.
6.
7.
Что такое асептика?
Какие виды инфекции в хирургии вы знаете?
Каковы пути распространения инфекции в хирургии?
Каковы методы профилактики хирургической инфекции вы знаете?
Методы предстерилизационной подготовки хирургического инструментария.
Методы стерилизации различных видов хирургических инструментов.
Какие виды операционного белья и перевязочного материала вы знаете? Назовите области их применения.
8. Какие виды шовного материала и методы его стерилизации вы знаете?
9. Способы контроля за стерелизацией перевязочного материала и инструментария.
10. Какие существуют принципы обработки рук хирурга?
11. Методика обработки рук хирурга.
12. Методы обработки рук хирурга различными способами.
13. Подготовка антисептических растворов.
14. Подготовка операционного поля к операции.
15. Какие существуют способы обработки операционного поля?
ТЕКСТОВЫЙ МОДУЛЬ 2
Кровотечение, кровопотеря. Основы гемотрансфузиологии
Конкретные цели:
■
■
■
■
■
■
■
■
■
Знать классификацию видов кровотечений и степень тяжести кровопотери.
Уметь применять методы временной и окончательной остановки кровотечения.
Продемонстрировать методы определения группы крови и резус-фактора.
Продемонстрировать проведение проб на совместимость крови донора и реципиента.
Уметь определять показания и противопоказания к переливанию крови, компонентов и препаратов крови, изучить методы гемотрансфузии.
Провести гемотрансфузию и наблюдение за пациентом во время ее выполнения.
Классифицировать группы кровезаменителей.
Классифицировать возможные ошибки и осложнения при гемотрансфузии.
Овладеть профилактическими и лечебными мероприятиями при гемотрансфузионных осложнениях.
ТЕМА №4.
Кровотечение, кровопотеря. Временная и окончательная остановка кровотечения
1. Актуальность темы
Кровотечения являлись и являются одним из важнейших вопросов в
истории хирургии. Они сопровождают
любые травмы, особенно во время различных катастроф, войн, оперативных
вмешательств, некоторых заболеваний,
например, желудочно-кишечные язвенные кровотечения, опухоли, некоторые
воспалительные процессы в легких и
другие заболевания. Кровотечения сопровождаются довольно значительной
летальностью. Поэтому изучение причин, видов, клиники кровотечений, методов остановки кровотечений и путей
восполнения дефицита крови является
обязательным для медицинского работника, чтобы своевременно оказать
помощь больному и спасти его жизнь.
■
■
■
■
■
2. Учебные цели
Дать определение и назвать виды
кровотечений;
Определение величины кровопотери;
Механизмы адаптации организма
при кровопотере;
Механизм самостоятельной остановки кровотечения;
Методы временной остановки кровотечения (пальцевое прижатие,
46
■
■
Текстовый модуль 2
давящая повязка, закрутка, жгут и
т.д.);
Методы окончательной остановки
кровотечения: механические, химические, биологические, физические,
смешанный;
Сосудистый шов (виды, показания,
техника).
3. Самостоятельная работа
студента
Кровотечение (haemorrhagia) —
это истечение крови из кровеносного
сосуда при повреждении или нарушении проницаемости его стенки.
КЛАССИФИКАЦИЯ
КРОВОТЕЧЕНИЙ:
По причине кровотечения:
а) от разрыва сосуда при повреждении — Haemorrhagia per rhexin.
Механические повреждения сосудов: при открытых и закрытых травмах
(разрывы, ранения), при ожогах, отморожениях, огнестрельных ранениях.
б) от разъедания (аррозии) сосуда — Haemorrhadia per diabrosin.
Аррозивные кровотечения: при нарушении целости стенки сосудов опухолью с ее распадом, разрушение стенки сосуда некрозом, разрушение стенки
сосуда гнойным воспалительным процессом и др.
в) вытекание крови при нарушении проницаемости стенки сосуда
(диапедезное кровотечение) — Haemorrhagia per diapedesin
Диапедезное кровотечение наблюдается при повышении проницаемости
стенки сосуда (авитаминоз С, геморрагический васкулит (болезнь ШенлейнаГеноха, уремия, сепсис, оспа, отравление фосфором и др.
г) при нарушении химизма крови, свертывающих и антисвертывающих свойств.
Тема 4
Нарушения свертывающей системы
крови: гемофилия (отсутствие фактора
VIII — гемофилия А, фактора IX — гемофилия В), болезнь Верльгофа, ДВС синдром вследствие истощения факторов
свертывания, действие некоторых лекарственных веществ (антикоагулянты
прямого и непрямого действия, ацетилсалициловая кислота, бутадион, реопирин и др.), холемические кровотечения
при механической желтухе (снижается
синтез факторов свертывания крови —
V, VII, IX, X, XIII в печени).
По виду кровоточащего сосуда
(анатомическая):
а) артериальное;
б) артериовенозное (смешанное);
в) венозное;
г) капиллярное;
д) паренхиматозное.
Артериальное кровотечение сопровождается пульсирующей струей алой
крови с центрального конца сосуда.
Венозное кровотечение. Кровь вытекает с периферического конца, темная.
Смешанное кровотечение возникает при одновременном повреждении
артерии и вены.
Капиллярное кровотечение. Обычно
смешанное при повреждении артериол
и венул, капилляров (ссадина и др.).
Паренхиматозное кровотечение во
зникает при повреждении паренхима
тозных органов. Внутридольковые
сосуды печени (артерии и вены) не спадаются — кровоточит вся поверхность
повреждения. Паренхиматозное кровотечение может быть также из селезенки, почки, поджелудочной железы.
По отношению к внешней среде
и клиническим проявлениям:
а) внутреннее;
б) наружное;
в) скрытое.
Внутреннее кровотечение сопровождается излиянием крови в полости
или ткани больного. При этом различают
образование кровоизлияния и гематомы.
При кровоизлиянии происходит
пропитывание тканей кровью.
При гематоме кровь скапливается
между тканями с образованием полости. Об этом говорит наличие припухлости, возможно и флюктуации. При
пункции в шприц поступает кровь.
Пульсирующая гематома сообщается с просветом артерии. На этом месте
имеется припухлость, в области которой визуально определяется пульсация
или она определяется при пальпации.
Пульсация артерий ниже гематомы может быть ослаблена или отсутствовать,
а кожа становится бледной.
При наружном кровотечении
кровь изливается во внешнюю среду.
Кровотечение во внутренние
полые органы с выделением крови
наружу:
Кровотечение в полость носа (носовое кровотечение — Epistaxis).
Кровавая рвота (hаеmotemesis)
возникает при кровотечении из верхних отделов пищеварительного канала:
(пищевод, желудок, 12-перстная кишка). Кровь под влиянием соляной кислоты меняет цвет, поэтому рвота будет
иметь вид «кофейной гущи».
Кишечное кровотечение (мелена —
melena) возникает из кишечника и
верхних отделов желудочно-кишечного
тракта.
Кровотечение из легких или кровохаркание (haemoptoe) сопровождается
выделением крови при кашле, обычно пенистого вида. Оно может быть
вызвано ранением легкого, распадом
опухоли в легком, трахее или бронхе,
аррозией сосуда при бронхоэктазах,
абсцессе легкого и др.
47
Кровотечение из желчевыводящих
путей (haemobilia) может происходить
при ранении печени, распаде опухоли,
гемангиомы печени и др. Из мочевыводящих путей кровотечение наблюдается при патологии почек, мочеточников,
мочевого пузыря, мочеиспускательного
канала. В этом случае кровь выделяется с мочой (haematuria) в виде микроиммакрогематурии.
Кровотечение из матки называется
метроррагией (metrorrhagia).
Кровотечения в полости: в брюшную
полость (haemoperitoneum), бывает из
любых органов; в грудную (плевральную) полость (haemothorax).
При кровоизлиянии в полость перикарда (haemopericardium) (ранение
сердца и др.) кровь растягивает перикард, что может вызвать блокаду сердца (тампонаду). На рентгенограмме изменяется рисунок (границы) сердца.
Кровоизлияние в полость сустава
(haemartrosis) сопровождается увеличением объема сустава, появлением симптомов, указывающих на наличие жидкости
в суставе (флюктуация, баллотирование
надколенника, получение крови при
пункции сустава), на рентгенограмме появляются признаки кровоизлияния, увеличение внутрисуставной полости.
Кровотечение в серозные полости
сопровождается осаждением фибрина
плазмы на серозный покров. Кровь становится дефибринированной и не сворачивается. Но выпавший фибрин образует спайки и нарушает функцию органа.
Кровоизлияние в полость черепа
(haemocranion) бывает эпидуральное,
субдуральное, субарахноидальное, в
желудочки мозга и саму ткань мозга.
Скрытое кровотечение — кровотечение во внутренние органы без общих и местных симптомов. Выявляется
лабораторными исследованиями: кал
на скрытую кровь и др.
48
Текстовый модуль 2
По времени возникновения:
а) первичные — связаны непосредственно с травмой и возникают сразу
или в первые часы после повреждения;
б) вторичные — ранние и поздние.
Ранние возникают через несколько
часов и до 4-5 суток после повреждения. Причины их:
а) соскальзывание лигатуры наложенной при операции; на сосуд;
б) вымывание тромба при улучшении состояния больного в связи с
повышением артериального давления,
ускорением кровотока, уменьшением
спазма сосуда, наступающего при кровопотере.
Поздние вторичные кровотечения,
или аррозивные, наступают из-за развития в ране инфекции и деструкции
стенки сосуда. Из-за этого они часто
рецидивируют.
По объему и темпу
кровопотери:
а) острые — проявляются в течение короткого промежутка времени;
б) хронические — протекают длительное время, небольшими порциями
(геморрой, фибромиома матки и др.).
ФАКТОРЫ, ВЛИЯЮЩИЕ
НА ИСХОД КРОВОТЕЧЕНИЯ
Решающее значения имеют:
1. Объем и скорость кровопотери.
Опасна для жизни быстрая потеря
около трети объема циркулирующей
крови (ОЦК).
Смертельна — около половины
ОЦК.
2. Вид сосуда (опаснее ранение артерии, чем вены или капилляра) и его
диаметр.
3. Характер ранения сосуда:
поперечный разрыв менее опасен
(быстрее остановка), боковой — кровотечение длительное (интима не вво-
Тема 4
рачивается, спазм не наступает, плохо
образуется тромб).
4. Общее состояние организма.
Неблагоприятно влияют травматический шок, предшествующая анемия,
тяжелая операция, голодание, истощающие заболевания, заболевания
сердечно-сосудистой системы и др.
5. Нарушения в свертывающей и
антисвертывающей системе.
6. Быстрота адаптации организма к кровопотере (легче доноры,
женщины).
7. Условия внешней среды (пере
охлаждение и др.).
8. Возраст и пол пострадавших.
9. Орган, в который произошло
кровоизлияние (небольшие количества крови без анемии могут вызвать
сдавление жизненно важных органов
и даже смерть больного — мозг, околосердечная сумка).
ОСТРАЯ КРОВОПОТЕРЯ
Кровопотеря приводит к развитию
анемии и появлению общих и местных
симптомов.
Общие симптомы: субъективные
и объективные.
К субъективным относят жалобы
больных на слабость, недомогание,
головокружение, мелькание перед глазами (кругов, сетки и др.), тошнота и
даже рвота, сухость во рту, жажда и др.
К объективным можно отнести бледность кожных и слизистых покровов,
учащенное поверхностное дыхание, зевание из-за недостатка кислорода при
анемии, учащение пульса и сердечных
сокращений для компенсации ОЦК,
ухудшение качества пульса (слабого
наполнения, нитевидный и др.), снижение артериального давления и др.
Местные симптомы представлены симптомами наружного кровотечения из раны, кровоизлияния в ткани,
наличие гематомы, пульсирующей гематомы, ложной аневризмы и др. Ложная
аневризма образуется из пульсирующей
гематомы, когда ее полость сообщается
с просветом сосуда, а выпавший фибрин
создает фиброзную оболочку гематомы.
При истинной аневризме стенка аневризмы образована растянутой стенкой
сосуда. При внутреннем кровотечении
симптомы определяются местом кровоизлияния, органом, где оно произошло.
Так при гемотораксе имеются при перкуссии притупление, при аускультации
отсутствует проведение дыхательных
шумов и др., при кровотечении из пищевода, желудка, двенадцатиперстной
кишки появляется кровавая рвота, при
них же и кровотечении из кишечника —
мелена.
Методы диагностики применяемые при кровотечении все известные и
необходимые: физикальные (анемнез,
жалобы, осмотр, пальпация, перкуссия,
аускультация, дополнительные исследования), инструментальные (рентгенологические, эндоскопические, пункции и др.), лабораторные и др.
Методы определения
кровопотери:
В клинике оценивают объем кровопотери по основным лабораторным
показателям (по отклонениям от нормы). Нормальные показатели крови:
±ËÍÉÂÊÊØÂ
ÚÈÂÉÂÊÏØ
®®®
■
■
■
■
■
■
Количество эритроцитов (4-5х1012 л).
Гемоглобин (125-160 г/л).
Гематокрит (44-47%).
Удельный вес крови (1057-1060 ед.).
Ретикулоциты при хронической
анемии. Коагулограмма (состояние
свертывающей системы).
ОЦК (синька Эванса, изотопы I131 и
I132, полиглюкин, для определения
массы эритроцитов Cr51 , Cr52 и др.).
Определяется степень тяжести
кровопотери:
А) легкая степень — потеря до
10% ОЦК (до 500 мл), удельный вес
1057-1054 ед., гемоглобин 120-100 г/л,
гематокрит 44-40%;
Б) средняя степень — потеря
10-20% ОЦК (500-1000 мл), удельный
вес 1053-1050 ед., гемоглобин 99-85
г/л, гематокрит 39-32%;
В) тяжелая степень — потеря
21-30% ОЦК (1000-1500 мл), удельный вес 1049-1044 ед., гемоглобин
84-70 г/л, гематокрит 31-23%;
Г) массивная кровопотеря — потеря более 30% ОЦК (более 1500 мл),
удельный вес 1044 ед., гемоглобин <
70г/л, гематокрит <23%.
Распределение крови в сосудистом
русле (схема 1).
Ориентировочно определяют ОЦК:
1. По центральному венозному
давлению (ЦВД). В норма ЦВД 50150 мм вод.ст.
«¾×ÂÉ
ÓÅÍÇÐÈÅÍÐÛÖÂÆ
ÇÍË¿Å
¬½ÍÂÊÒÅɽÏËÄÊØÂ
ËÍÀ½ÊØ
49
ÂÊØ
ÍÏÂÍÅÅ
¬È½Äɽ
§½ÌÅÈÈÜÍØ
Схема 1. Составляющие ОЦК, их распределение в сосудистом русле
50
Текстовый модуль 2
2. Клиницисты используют полиглюкиновый тест: в/в струйно
вводят 200 мл полиглюкина и измеряют ЦВД. Если низкое ЦВД повышается — умеренная кровопотеря, не повышается — массивная.
3. Используют индекс шока Allgower. В норме отношение частоты
сердечных сокращений к величине артериального давления составляет 0,5.
При кровопотере он возрастает.
Прямые способы определения кровопотери:
А) учитывают количество крови
при наружном кровотечении;
Б) по весу перевязочного материала (во время операции определяют
разность веса материала до использования и после операции). Однако эти
методы не совсем точны и малоинформативны.
При потери более 20-30% ОЦК
может развиться геморрагический шок.
Имеет значение исходное состояние
больного.
Тема 4
Петров С.В выделяет три стадии геморрагического шока:
I стадия — компенсированный обратимый шок, характеризуется объемом
кровопотери, хорошо восполняемый с
компенсаторно-приспособительными
возможностям организма больного.
II стадия — декомпенсированный
обратимый шок, который сопровождается более глубокими нарушениями
кровообращения, спазм артериол не
поддерживает центральную гемодинамику. В дальнейшем из-за накопления
метаболитов происходит парез капиллярного русла и развивается децентрализация кровотока.
III стадия — необратимый шок
сопровождается длительной (более
12 часов) неуправляемой гипотонией,
неэффективностью
трансфузионной
терапии, развитием полиорганной недостаточности.
Геник С. (1999) разделяет геморрагический шок на четыре уровня
(табл. 1).
Потеря крови
30 — 35% ОЦК
(1500 — 1700 мл)
Потеря крови
35 — 40% ОЦК
(1750 — 2000 мл)
Потеря крови
более 50% ОЦК
(2500 мл)
Симптоматика
Ощущение слабости, тахикардия —100-110 уд./мин., холодный пот, жажда.
Снижается систолическое давление, уменьшается систолодиастолическая разница артериального давления, а также наполнение вен, уменьшается диурез
(олигурия).
Двигательное беспокойство, бледность кожи и слизистых оболочек, тахикардия – более 120 уд./мин., падение систолического артериального давления до
70 мм рт.ст. Шоковый индекс — 1,5. Поверхностное и частое дыхание, гемоглобин – 60-80 г/л. Центральное венозное давление (ЦВД) снижается до ноля,
выраженная олигурия.
Состояние крайне тяжелое, заострены черты лица, обильный холодный пот,
цианоз, похолодание конечностей, снижение температуры, безразличие, состояние дезориентации, сонливость, расширяются зрачки. Тахикардия – 140150 уд./мин., систолическое давление падает до 50-60 мм рт.ст. Шоковый
индекс – более 2,0, гемоглобин — 50 г/л, ЦВД характеризуется негативными
значениями, анурия, развивается потеря сознания, могут возникнуть непроизвольное мочеиспускание и дефекация.
На фоне одышки артериальное давление не определяется, ЦВД отрицательное.
Тахикардия – более 160 уд./мин., которая переходит в трепетание желудочков
или асистолию, на протяжении нескольких минут наступает смерть.
■
■
■
олигурию
гипервентиляцию
периферический артериолоспазм.
Сосудистые изменения связаны с
рефлекторной реакцией с волюмо-, баро- и хеморецепторов сосудов. Большую роль при этом играет симпато-адреналовая система
(см. схему 2).
¾ÅĸÄÁ»Â¾Õ
¥¶º»Ã¾»¶ÆȻƾ¶ÁÒÃĹ嶸Á»Ã¾Õ
§ÄÇɺ¾ÇÈѻ˻Âľ·¶ÆÄƻ̻ÅÈÄÆÑ
§¾ÂŶÈĶºÆ»Ã¶Áĸ¶ÕǾÇȻ¶
£¶ºÅÄÍ»ÍþÀ¾
ÄÆÀĸѿÇÁÄ¿
¢Ä½¹Ä¸Ä¿ÇÁÄ¿
ÁÔÀÄÀÄÆȾÀľºÑ
¶È»ËÄÁ¶Â¾ÃÑ
ÁÒºÄÇÈ»ÆÄÃ
Таблица 1.
Потеря 20-25%
ОЦК (1000 —
1200 мл)
Компенсаторноприспособительные механизмы
при кровотечении:
Включаются в ответ на гиповолемию — повышение ОЦК и включают:
■ веноспазм
■ приток тканевой жидкости (естественная гемодилюция)
■ тахикардию
51
¶ºÃÕÕºÄÁÕ¹¾ÅÄʾ½¶
ºÆ»Ã¶Á¾Ã
£ÄƶºÆ»Ã¶Á¾Ã
ÃȾº¾ÉƻȾͻÇÀ¾¿
¹ÄÆÂÄÃ
β¶ºÆ»ÃÄƻ̻ÅÈÄÆÑ
α¶ºÆ»ÃÄƻ̻ÅÈÄÆÑ
§Å¶½Â¶ÆȻƾ¿¾¸»Ã
§Å¶½Â¶ÆȻƾÄÁ¾¸»ÃÉÁ
¾ºÆ»Â¾ÕÈÀ¶Ã»¿
¬»ÃÈƶÁ¾½¶Ì¾ÕÀÆĸÄÈÄÀ¶
¥Ä¸Ñλþ»¤¥§
¥Ä¸Ñλþ»
¹¾ºÆÄÇȶȾͻÇÀĹ嶸Á»Ã¾Õ
¸ÈÀ¶ÃÕË
ÆĸÄÇö·¼»Ã¾»
¹ÄÁĸÃĹÄÂĽ¹¶¾Ç»ÆºÌ¶
©¸»Á¾Í»Ã¾»©¤§¢¤
¥Ä¸Ñλþ»
¶ÆȻƾ¶ÁÒÃĹ嶸Á»Ã¾Õ
ÉÈĹ»Âĺ¾ÁÔ̾Õ
»½¶¹Æ»¹¶Ì¾ÕÓƾÈÆÄ̾Èĸ
©¸»Á¾Í»Ã¾»¤¬¥
§Ã¾¼»Ã¾»¸Õ½ÀÄÇȾÀÆĸ¾
ÑÂѸ¶Ã¾»
ÓƾÈÆÄ̾Èĸ
¸ÀÆĸÄÈÄÀ
ÄÇÇȶÃĸÁ»Ã¾»
¾ÀÆÄ̾ÆÀÉÁÕ̾¾
©¸»Á¾Í»Ã¾»¤¬³
¥Ä¸Ñλþ»
À¾ÇÁÄÆĺÃÄ¿
»ÂÀÄÇȾÀÆĸ¾
Схема 2. Роль симпатоадреналовой системы в выработке компенсаторно-приспособительных реакций
52
Текстовый модуль 2
Веноспазм: в венах 70-75% крови,
веноспазм компенсирует 10-15% потерянного ОЦК не нарушая венозный
возврат к сердцу.
Приток тканевой жидкости. Изза малого сердечного выброса и спазма
артериол снижается гидростатическое
давление в капиллярах, и это ведет к
переходу в них межклеточной жидкости. В первые 5 минут приток в сосуды
10-15% ОЦК.
Роль аутодилюции:
■ компенсирует гиповолемию;
■ улучшает реологические свойства
крови;
■ способствует вымыванию из депо
эритроцитов и восстанавливает
кислородную емкость крови.
Депо — нефункционирующие капилляры — 90% (в скелетной мускулатуре), печень — до 20% ОЦК, селезенка — 16% (табл. 2).
Тахикардия. Снижение ОЦК приводит к снижению сердечного выброса.
Через симпатико-адреналовую систему
учащается сокращение сердца, что позволяет поддерживать на нормальном
уровне минутный сердечный объем.
Олигурия. Она развивается при
гиповолемии вследствие стимуляции
секреции антидиуретического гормона
гипофиза и альдостерона. Это вызы-
Тема 4
вает увеличение резорбции воды, задержку ионов натрия и хлоридов.
Гипервентиляция. Это приспособительная реакция организма, ведущая к увеличению присасывающего
действия грудной клетки и увеличению
притока крови к сердцу.
Артериолоспазм. Спазм периферических артерий — переходный этап
между компенсаторными и патологическими реакциями при кровопотере.
Это поддерживает артериальное давление и кровоснабжение мозга, сердца, легких. Если объем кровопотери
превышает компенсаторные возможности, то возникают патологические
расстройства.
Централизация кровообращения. Острая кровопотеря ведет к гиповолемии, уменьшению венозного возврата и снижению сердечного выброса.
Централизация кровообращения
возникает вследствие повышения тонуса вен, периферического артериолоспазма (под влиянием α-адренергической
стимуляции). Суживаются сосуды
кожи, брюшной полости и почек, где
много α-адренорецепторов. А где их
мало (коронарные и мозговые сосуды)
вазоконстрикции практически нет.
Централизация кровообращения—
это защитный механизм при крово-
Таблица 2. Сроки компенсации потерянной крови
Сроки компенсации объема кровопотери
Изучаемый объем
Время восполнения
Объем крови
24-48 ч.
Объем плазмы
24-48 ч.
Концентрация белков плазмы
- максимальное разжижение
- восстановление до исходного уровня
- восстановление нормального состава
2 ч.
48-42 ч.
72-96 ч.
Масса эритроцитов
20-25 с.
£¶ÆÉλþ»
Æ»ÄÁĹ¾Í»ÇÀ¾Ë
ǸĿÇȸÀÆĸ¾
§Ã¾¼»Ã¾»
ǻƺ»ÍÃĹÄ
¸Ñ·ÆÄǶ
§»À¸»ÇÈƶ̾Õ
ÀÆĸ¾
¾ÅĸÄÁ»Â¾Õ
Рис. 11. Порочный круг по А.П. Зильберу
потере, поддерживающий системный
кровоток и кровоток в мозге, сердце,
легких. Однако длительный периферический спазм ведет к дальнейшему
снижению сердечного выброса, нарушению реологии крови, секвестрации
крови и нарастанию гиповолемии —
порочный круг (рис. 11).
Децентрализация кровотока происходит из-за того, что при длительной
централизации нарушается кровоток
в печени, подкожной клетчатке, что
ведет к органной недостаточности и
нарушению метаболизма. В тканях повышается гистамин, молочная кислота,
развивается ацидоз, что способствует
расширению капилляров и секвестрации в них 10% и более ОЦК. Наступает
децентрализация, неуправляемая гипотония и смерть.
Причины изменения
реологии крови:
Cужение пре- и посткапилляров,
уменьшение кровотока являются
условиями для агрегации эритроцитов и тромбоцитов и развития сладжа
(склеивания) форменных элементов.
53
Гипоксия и нарастание ацидоза открывает прекапилляры, происходит
приток крови и повышение в них давления. Это ведет к выходу жидкости
в интерстициальное пространство, в
результате чего возрастает гемоконцентрация и вязкость крови. Идет своеобразная секвестрация крови, что еще
больше снижает ОЦК.
При кровотечении наступают метаболические изменения.
Нарушение гемодинамики ухудшает перфузию тканей, уменьшается доставка кислорода и наступает гипоксия.
Метаболизм из аэробного цикла смещается в сторону анаэробного, развивается ацидоз тканей. Ацидоз нарушает
микроциркуляцию и функцию органов
и систем. Активируется кининовая система, протеолитические ферменты.
Все это нарушает функцию внутренних органов.
В сердце — снижается сократительная способность миокарда, уменьшается сердечный выброс.
В легких — нарастает интерстициальный отек и формируется «шоковое легкое» вследствие нарушения
легочно-мембранной проницаемости.
В почках — снижается кортикальный кровоток, вызывая снижение клубочкового давления и уменьшение или
прекращение клубочковой фильтрации,
что ведет к олигурии или анурии и даже
острой почечной недостаточности.
В печени — от снижения кровотока,
в основном артериального, образуется
центролобулярный некроз, возрастают
трансаминазы, снижается протромбин,
альбумины, иногда развивается желтуха.
ЗАДАЧИ ВРАЧА
ПРИ КРОВОТЕЧЕНИИ
1. В короткий срок, хотя бы временно остановить кровотечение, чтобы
устранить угрозу жизни больного.
54
Текстовый модуль 2
2. Окончательно остановить кровотечение с минимальными нарушениями в организме.
3. Восстановить в организме нарушения, появившиеся вследствие произошедшего кровотечения.
Самостоятельный
гемостаз
Организм в состоянии справиться
с небольшим кровотечением самостоятельно.
Для этого существует ТРИ основных механизма:
1. Реакция сосудов;
2. Активация тромбоцитов (клеточный механизм);
3. Свертывающая система крови
(плазменный механизм).
Реакция сосудов:
При повреждении сокращаются
гладкие мышцы сосуда, что уменьшает кровопотерю.
Травма эндотелия (воспалительная, аллергические изменения)
приводит к возникновению отека, нарушению проницаемости. Это снижает
гидрофобные свойства стенки, препятствует внутрисосудистому свертыванию и способствует быстрому растворению сгустка.
При кровотечении изменяются
реологические свойства крови, снижается артериальное давление и скорость кровотока и улучшаются условия
для образования сгустка.
■
Запускается
клеточный механизм:
адгезия тромбоцитов происходит в течение нескольких секунд
(прилипание от изменения электропотенциала, контакта с коллагеном в зоне травмы, участвуют
гликопротеиды Ib, фактор фон
Тема 4
Виллебранда, ионы кальция, тромбоспондин, фибронектин);
■ агрегация тромбоцитов. Начальная агрегация — происходит связывание с фибриногеном
(участвуют биологически активные вещества— АДФ, адреналин,
тромбин);
■ вторичная агрегация — по мере
накопления тромбоцитов они активируются, образуются метаболиты
арахидиновой кислоты, выделяется серотонин. Он ограничивает
приток крови;
■ образование эйкозаноидов. Арахидиновая к-та циклооксигеназой
превращается в циклические эндоперекиси (простогландины G2 и
H2);
■ тромбоксансинтетаза превращает простогландин Н2 в тромбоксан А2, что усиливает освобождение
АТФ и усиливает агрегацию тромбоцитов.
При взаимодействии агрегированных тромбоцитов с тромбином и фибрином образуется тромбоцитарный
сгусток. Это создает поверхность для
сборки комплекса белков коагуляции.
Далее включается свертывающая система, в основе которой лежит
ферментативная система А.А. Шмидта
(1861).
Происходит свертывание
крови, состоящее из ТРЕХ ФАЗ:
1-ая фаза — образование кровяного сгустка и тканевого тромбопластина (3-5 мин.);
2-ая фаза — переход протромбина в тромбин;
3-я фаза — образование фибрина.
Действие этого механизма представлено на схеме 3.
Уравновешивается свертывающая
система — противосвертывающей.
55
Схема 3. Основные механизмы свертывания крови
СПОСОБЫ ВРЕМЕННОЙ
ОСТАНОВКИ КРОВОТЕЧЕНИЯ
Давящая повязка накладывается
на рану с небольшим кровотечением
(рис. 12, а). Небольшое сдавление тканей и мелких сосудов приводит к прекращению кровотечения, иногда эта
повязка способствует и окончательной
его остановке.
При наличии кровотечения из
раны, в которой затруднительно при-
менить давящую повязку, жгут и другие способы (кровоточащая рана ягодичной области и др.) применяется
тугая тампонада раны (рис. 12, б), при
которой плотно введенный тампон
сдавливает все сосуды и кровотечение
останавливается. Этот способ может
быть и окончательным.
При кровотечении из вен конечностей можно применить возвышенное
положение конечности, что улучшает
56
Текстовый модуль 2
Тема 4
а
Рис. 13. Возвышенное положение
конечности при венозном кровотечении
б
Рис. 12. Давящая повязка (а) и тампонада
полости раны (б)
отток крови и может наступить самостоятельное прекращение кровотечения (рис. 13).
При артериальном кровотечении
можно для временной остановки произвести пальцевое прижатие артерии проксимальнее от места кровотечения (рис. 14 а, г).
Во время операции кровоточащий
сосуд можно прижать в ране непосредственно или его ствол на протяжении
(рис. 14 б, в).
С целью временной остановки
кровотечения можно наложить кровеостанавливающий зажим на сосуд в
ране во время операции и при оказании
первой помощи (рис. 15). В последнем
случае необходимо зажим обложить
салфетками, тампонами и прикрыть
асептической повязкой. Больного отправить немедленно в хирургическое
отделение для окончательной остановки кровотечения.
Эффективным способом временной остановки кровотечения является
наложение жгута.
Для этой цели применяются различные жгуты: Эсмарха, состоящий из
резиновой трубки с металлической цепочкой и крючком для фиксации жгута
(рис. 16, а), ленточный кровоостанавливающий жгут с цепочкой и крючком
(16, б), ленточный резиновый (рис. 16,
в), матерчатый жгут-закрутка (16, г),
импровизированный жгут (рис. 16, д).
Правила наложения жгута
Жгут накладывается чаще всего на
конечности, но в некоторых случаях и
на другие участки тела. Накладывают
жгут не на голое тело, а на одежду или
подкладывают прокладку из какого-то
материала, чтобы не было ущемления
тканей. Наложение производят проксимальнее места кровотечения. На конечности он лучше сдавливает кровоточащий сосуд, если наложен на участок,
где имеется одна кость (плечо, бедро),
но можно и на другом уровне (предплечье, голень). Перед наложением жгута
конечность необходимо приподнять
вверх, чтобы кровь централизовалась, а
не изливалась наружу. Растягивая жгут,
его равномерно накладывают на тело
и фиксируют, чтобы не распустился
(рис. 17). Если применяется закрутка,
в
а
г
б
то ее постепенно закручивают до остановки кровотечения. При правильно
наложенном жгуте кровотечение останавливается, конечность ниже жгута
становится бледной и пульс не прощупывается, на ощупь холодная. Нельзя
с большим усилием накладывать жгут,
так как могут быть повреждены под
ним кожа, мягкие ткани, нервы.
Рис 14. Пальцевое пережатие артерии
на протяжении (а; г) и в ране (б; в)
во время операции)
Рис. 15. Наложение кровеостанавливающего
зажима на сосуд
57
58
Текстовый модуль 2
Тема 4
б
а
Рис. 17. Жгут Эсмарха наложен на бедро
в
г
д
а
Рис 16. Кровоостанавливающие жгуты: а) Эсмарха;
б) ленточный с цепочкой и крючком; в) резиновый
ленточный; г) матерчатый жгут-закрутка; д) импровизированный
Под жгут подкладывается бумага с
указанием даты и времени наложения
жгута. Жгут должен находиться в теплое время года до 2 часов, а в холодное — не более 1 часа. Более длительное наложение жгута опасно развитием
гангрены (некроз) конечности. Если
необходимо удержать жгут на более
длительное время, то следует его распустить на несколько минут, а на это
время применить другой способ временной остановки кровотечения, например, пальцевое прижатие сосуда на
протяжении. Затем жгут накладывается вновь, но уже выше этого места.
Ниже представлены различные
способы наложения жгута
На шее жгут можно наложить только с одной стороны, чтобы сдавить
сонную артерию. Поэтому на место наложения жгута укладывают пелот, для
давления на артерию, а другая сторона
жгута фиксируется на шине Крамера.
При наложении артерии на паховую и подмышечную область укладывается на кровоточащую артерию
пелот, а жгут надавливает на него и
фиксируется вокруг тазового и плечевого пояса, как показано на рисунках
(рис. 18, а, б).
На брюшную аорту (при маточном
кровотечении и др.) жгут можно наложить на уровне пупка с матерчатой
подкладкой (рис. 19). Это невозможно
сделать у тучных людей.
На конечность может быть наложен
матерчатый жгут-закрутка (рис. 20, а),
резиновый ленточный жгут (рис. 20, б)
и импровизированный жгут-закрутка
(рис. 20, в).
Рис. 19. Жгут на брюшную аорту по Момбургу
При применении закрутки она
должна быть фиксирована (рис. 20, г).
Нельзя применять жгуты из тонкого
материала (телефонный кабель, шпагат и др.), чтобы не повредить ткани.
б
а
в
б
Рис. 18. Наложение жгута на бедренную (а)
и подмышечную (б) артерию
59
Рис. 20. Наложение на конечности матерчатого жгута-закрутки
г
60
Текстовый модуль 2
Тема 4
А
61
Б
Рис. 24. Перевязка сосуда с двух сторон (а)
и на протяжении (б)
а
б
Рис. 22. Временное шунтирование сосуда
в
г
Рис. 21. Максимальное сгибание конечности и отведение при кровотечении ниже локтевого сустава (а),
из подключичной артерии (б), из бедренной артерии (в) и кровотечении ниже коленного сустава (г)
Максимальное сгибание конечности и фиксация в этом положении позволяет сдавить артерию в области сгибания и остановить кровотечение ниже
сустава (рис. 21 а, б, в, г).
При кровотечении из крупного
сосуда и невозможности быстро оказать хирургическую помощь, для сохранения конечности и возможности
восстановительной операции, можно
применить временное шунтирование сосуда трубкой из синтетического материала (полихлорвиниловой). В этом случае трубка вводится в
просвет обоих концов поврежденного сосуда и фиксируется лигатурами
(рис. 22). Кровоток в сосуде сохраняется на необходимое время для транспортировки и операции.
ОКОНЧАТЕЛЬНЫЕ МЕТОДЫ
ОСТАНОВКИ КРОВОТЕЧЕНИЯ
Механические включают ряд способов, в том числе:
1. Перевязка сосуда в ране после
захватывания зажимом (рис. 23, а).
Крупные сосуды лучше перевязывать
лигатурой с перегибом (рис. 23, б) для
предупреждения соскальзывания лигатуры и рецидива кровотечения.
2. Перевязка сосуда с двух сторон с
его пересечением (рис. 24, а), лучше на
протяжении (рис. 24, б).
а
б
Рис. 23. Перевязка сосуда на зажиме (а)
и способ лигирования крупного сосуда (б)
3. Обвивание сосуда кисетным или
Z-образным швом ad mass (рис. 25), что
приводит к сдавлению кровоточащего
сосуда и остановке кровотечения.
4. Можно вызвать гемостаз, если
после захвата сосудом зажима произвести его закручивание, при котором
разрушается интима на некотором протяжении, она заворачивается, выделяет много тромбопластина из разрушенных участков, что ведет к образованию
тромба. Такого же эффекта можно
достичь при раздавливании тканей и
сосудистой стенки, например раздавливающим зажимом Пайра при резекции желудка или кишки.
5. Наиболее полноценным для остановки кровотечения и восстановления
кровоснабжения является наложение
сосудистого шва.
Ручной шов по Каррелю при поперечном разрыве сосуда начинается с
наложения двух мягких сосудистых зажимов на проксимальные и дистальные
его концы. После этого накладывают
3 провизорных шва (рис.26,а). Затем
между тремя нитками накладывают
обвивные швы (рис. 26, б) или узловые
(рис. 26, в), но таким образом, чтобы
срезы сосудов были обращены наружу,
а внутренняя оболочка (интима) соприкасалась между собой. Обращения
среза сосуда вовнутрь может привести
к образованию на месте шва тромба с
закрытием просвета.
Рис. 25. Обшивание сосуда
а
б
в
Рис. 26. Сосудистый шов по Каррелю: а) наложены
зажимы и 3 провизорных шва; б) обвивной шов;
в) узловой шов
62
Текстовый модуль 2
63
Тема 4
Можно наложить циркулярный
ручной обвивной шов по Горслею.
При боковом ранении сосуда при
отсутствии дефекта стенки сосуда
накладывают обвивной или матрасный шов.
Поперечный разрыв сосуда можно
соединить с помощью колец Донецкого. Они представляют из себя металлические кольца с шипами. Кольцо одевается на сосуд и на него наворачивается
стенка сосуда, которая зацепляется за
шипы. Сюда надвигается другой конец
сосуда и тоже цепляется за шипы.
Сосудистый шов можно наложить
механическим способом с помощью
танталовых скрепок специальным сосудосшивающим аппаратом, один из
которых представлен на рис. 27.
При наличии дефекта сосуда, с целью остановки кровотечения и восстановления кровотока, сохранения
кровоснабжения органа, выполняются
различные способы пластических операций на сосудах.
Дефект боковой стенки требует
применения боковой заплаты за счет
собственных тканей из вены или дру-
Б
А
В
Рис. 27. Сосудистый сшивающий механический аппарат (общий вид и наложение шва)
гой ткани, т. е. аутопластики. Можно
применить консервированный сосуд,
взятый у трупа (аллососуд), синтетический материал.
При повреждении сосуда на какомто протяжении приходится делать
резекцию сосуда, но если натяжения
нет, то возможно наложение обычного
циркулярного шва одним из указанных
способов. Большой дефект требует применения сосудистого протеза (эмплантата) из гофрированной синтетической
трубки, обладающей несмачиваемой
(отталкивающей) внутренней поверхностью для предупреждения тромбирования. Если концы сосуда соединить
не удается, то можно применить шунт
из синтетического материала, гомотрансплантат или из собственной вены
больного аутотрансплантат, например
большой подкожной вены, но венозные клапаны должны быть разрушены
и трансплантат располагаться таким
образом, чтобы ток крови в шунте был
направлен по ходу открывающихся
клапанов вены.
При пульсирующей гематоме могут
быть выполнены вышеприведенные
операции, но часто по прошествии некоторого времени и особенно при сформировавшейся аневризме применяют
различные специфические операции.
Это может быть операция по Гунтеру, при которой перевязывают приводящую артерию на протяжении (рис. 28,
а), по Анелю, когда приводящую артерию перевязывают у самой аневризмы
(рис. 28, б), по Антиллусу — перевязывают артерию возле аневризмы приводящую (проксимально) и отводящую
(дистально) части. Аневризму вскрывают и тампонируют с целью выполнения
ее грануляциями и заживления вторичным натяжением (рис. 28, в). Можно
перевязать и пересечь все артериальные
веточки, как приводящие, так и отводя-
А
Б
В
Рис. 28. Операции при ложной аневризме:
а) по Гунтеру; б) по Анелю; в) по Антиллусу
щие по Филагриусу. Артерио-венозная
аневризма по Кикуци-Матасу ликвидируется после рассечения аневризмы
и наложения обвивного шва на соустье
со стороны аневризмы. Подобнным образом ликвидируется артерио-венозная
аневризмапоРадушкевичу-Петровскому.
Само же сращение артерии и вены сохраняется.
Применяются для остановки кровотечения специальные механические методы.
Эмболизация. Это эндоваскулярная хирургия. По Сельдингеру подводят
катетер к месту кровотечения и затем
по нему же вводят эмбол (спираль, химическое вещество: спирт, полистирол), закрывающий просвет сосуда.
Применяют при кровотечении из ветвей легочных артерий, конечных ветвей брюшной аорты и др.
Для предупреждения кровотечения
эмболизацию проводят и до операции
на печени, почках (гемангиома, опухоль и др.).
Зонд Блэкмора применяют при
кровотечении из расширенных вен пищевода (рис. 29).
64
Текстовый модуль 2
Рис. 29. Этапы введения зонда Блэкмора
С целью остановки кровотечения выполняют некоторые виды
операций, при которых удаляется
часть или весь орган вместе с кровоточащим сосудом (спленэктомия, резекция печени, желудка, легкого).
ФИЗИЧЕСКИЕ МЕТОДЫ
ОСТАНОВКИ КРОВОТЕЧЕНИЯ
В качестве физических способов
остановки кровотечения применяются низкие и высокие температуры
(термические факторы). Они используются обычно при кровотечении из
мелких сосудов, капилляров, паренхиматозных органов.
Низкая температура вызывает
спазм сосудов, замедление кровотока и
тромбоз сосудов.
Местная гипотермия применяется в виде пузыря со льдом.
Пузырь укладывается на пораженный участок, завернутый в пеленку
(полотенце) на 30 минут. При необходимости более длительного применения делают перерыв на 20-30 минут и
вновь прикладывают.
При кровотечении из желудка
можно использовать введение холод-
Тема 4
4. Препараты желатина (геласпон) — губка. Обладает тампонирующим эффектом и тромбоциты при
контакте с желатином повреждаются,
выделяя факторы тромбообразования.
5. Воск — тампонирующий эффект в большинстве случаев в плоских
костях (залепляют) например, при операциях на черепе.
6. Карбазохром — при капиллярных и паренхиматозных кровотечениях уменьшает проницаемость,
нормализует микроциркуляцию. Смачивают этим раствором кровоточащую
поверхность.
7. Капрофер — орошают слизистую оболочку желудка при кровотечении из эрозий при эндоскопии.
8. М е с т н о - к о а г у л и р у ю щ и е
(алюминиевые квасцы, полуторахлористое железо (в виде карандашей).
ных растворов (+4° С) в желудок через
зонд, обычно с химическими и биологическими препаратами, способствующими остановке кровотечения.
Можно ввести в желудок резиновый
мешок, сообщающийся через трубки
с холодильной установкой, или наложить емкость на пораженный участок, связанной с холодильной установкой (кулинг), которая вызывает
циркулирование в мешке (емкости)
охлажденной воды.
Криохирургия (замораживание)
применяется для остановки и предупреждения кровотечения при операциях на мозге, печени, при лечении сосудистых опухолей.
Высокая температура приводит
к коагуляции белка сосудистой стенки,
ускорению свертывания крови и остановке кровотечения.
Горячие растворы (физраствор,
раствор фурацилина и др.) с температурой более 56°С применяются во время
операции при диффузных и паренхиматозных кровотечениях. Экспозиция
5-7 мин.
Диатермокоагуляция под воздействием токов высокой частоты приводит к коагуляции стенки сосуда и образованию тромба (рис. 30).
Из новых технологий применяются лазерная фотокоагуляция и
плазменный скальпель. Они, как и диатермия, применяются и в эндоскопической хирургии.
ХИМИЧЕСКИЕ МЕТОДЫ
Местного действия:
1. Перекись водорода. Ускоряет
тромбообразование.
2. Сосудосуживающие (адреналин) останавливают кровотечение за
счет спазмирования сосуда. Применяются при желудочном, носовом кровотечение, из зуба и др.
65
Рис. 30. Остановка кровотечения диатермией
(электронож)
3. Ингибиторы фибринолиза:
5% аминокапроновая кислота, например, вводится в желудок при желудочном кровотечении.
Препараты
резорбтивного действия:
1. Ингибиторы фибринолиза
(5% аминокапроновая кислота).
2. Хлорид кальция (глюконат
кальция) — ионы кальция — один
из факторов свертывающей системы
крови.
3. Вещества, ускоряющие образование тромбопластина — дицинон, этамзилат. Они еще нормализуют проницаемость стенки сосуда и
микроциркуляцию.
4. Вещества специфического
действия. Так, питуитрин (окситоцин)
сокращает мышцу матки, что приводит
к сдавлению в ней сосудов и остановке
кровотечения.
5. Синтетические аналоги витамина К (викасол).
6. Вещества, нормализующие
проницаемость сосудистой стенки
(аскорбиновая кислота, рутин, карбазохром).
66
Текстовый модуль 2
БИОЛОГИЧЕСКИЕ МЕТОДЫ
Местные:
Использование собственных тканей (сальник, мышцы), богатых тромбопластином. Берут свободный участок тканей или на ножке и фиксируют
в нужном месте.
При этом имеет место и тампонирующий эффект (рис. 31, а, б).
Местное применение
биологических препаратов:
1. Тромбин применяется только
местно в порошке или растворе. Входит в состав гемостатической губки,
гемостатической ваты и др. Может вводиться в охлажденной смеси в желудок
с 5% аминокапроновой кислотой, фибриногеном.
2. Фибриноген в чистом виде
местно не применяется. Вместе с тромбином входит в состав гемостатических
средств. Клеи состоят из тромбина, фибриногена, солей кальция, XIII фактора
и готовятся ex tempore. Клеи применяются при ссадинах, повреждениях печени, селезенки, легких (Тиссель, Берипласт, Тиссукол, Фибрин-Клебер).
Тема 4
3. Гемостатическая губка —
это лиофилизированная плазма. Может содержать также тромбин, ионы
кальция, иногда — ингибиторы фибринолиза (гемостатическая губка с
5% аминокапроновой кислотой), антисептики (биологический антисептический тампон), могут иметь тканевую
основу (гемостатическая марля). Применяют при паренхиматозных и капиллярных кровотечениях.
Для общего парэнтерального
применения используются:
1. Ингибиторы фибринолиза
(трасилол, контрикал и др.).
2. Фибриноген.
3. Переливание цельной свежецитратной крови (гемостатическая
доза — 250 мл).
4. Переливание плазмы крови.
5. Переливание тромбоцитарной массы (особенно при болезни
Верльгофа и пр.).
6. Антигемофильная плазма,
антигемофильный
криопреципитат (применяют при лечении гемофилии А и В, болезни Виллебранда).
КОМПЛЕКСНАЯ
ГЕМОСТАТИЧЕСКАЯ ТЕРАПИЯ
ПРИ КРОВОТЕЧЕНИИ
1. Заместительная терапия
(ОЦК эритроцитов) с учетом кровопотери.
2. Собственно гемостатическая
терапия (применение химических
и биологических препаратов общего
действия).
Степень кровопотери
Легкая (до 10% ОЦК)
Средняя (10-20% ОЦК)
Тяжелая (21-30% ОЦК)
Массивная (30% ОЦК)
Рис. 31. Биологический способ остановки кровотечения:
а) тампонада раны печени большим сальником на ножке; б) тампонада раны голени участком мышцы
Общий объем трансфузии (в % к величине
кровопотери)
До 500 мл
300
500-1000 мл
200
1000-1500 мл
180
Более 1500 мл
170
Объем
кровопотери
Донорская кровь
(в % к величине
кровопотери)
50
70
Соотношение
солевых и коллоидных р-ров
Только сол-е
2:1
1,5:1
1:1
Контрольные вопросы по теме занятия
1.
2.
3.
4.
5.
7.
8.
9.
А
3. Борьба с ацидозом (в/в 150300 мл 4% раствора соды).
4. Симптоматическая терапия.
Таким образом, кровотечение сопровождается сложными патогенетическими процессами в организме, которые могут привести к гибели больного.
Поэтому необходимо срочно применять меры к остановке кровотечения
временного и окончательного, необходимо восполнять кровопотерю в достаточном объеме.
Таблица 3. Расчет трансфузионных растворов при кровотечении
6.
Б
67
10.
11.
12.
13.
14.
15.
Какая имеется классификация кровотечений по анатомическому признаку?
Какие причины возникновения кровотечения вы знаете?
Как различаются кровотечения по времени их возникновения?
Какова классификация наружных и внутренних кровотечений?
Каковы клинические проявления кровотечений: общие, местные, наружные и
внутренние?
Какие лабораторные и инструментальные методы диагностики кровотечений
вы знаете?
Что такое геморрагический шок?
Какие существуют степени кровопотери?
Какие существуют компенсаторно-приспособительные механизмы при кровотечении?
Методы восполнения кровопотери, количественный и качественный расчет
растворов.
Какие имеются методы временной остановки кровотечения?
Какие существуют способы окончательной остановки кровотечения?
В чем заключается комплексная гемостатическая терапия?
Какие лабораторные и инструментальные признаки кровотечения вы знаете?
Помощь при внутреннем кровотечении.
Тема 5
ТЕМА №5.
Учение о крови. Группы крови и резус-принадлежность. Методы определения групп
крови. Ошибки определения групп крови. Определение резус-принадлежности.
Показания и противопоказания к переливанию крови. Механизм действия и судьба
перелитой крови. Консервирование и стабилизация крови, ее хранение
1. Актуальность темы
Переливание крови является мощным средством лечения самых разнообразных заболеваний, а при ряде патологических состояний (кровотечения,
шок, большие хирургические операции) — единственным и незаменимым
средством спасения жизни больных.
Препараты крови, ее компоненты, а
также цельную кровь переливают не
только врачи хирургических специальностей (акушеры-гинекологи, травматологи), но и терапевты, инфекционисты, педиатры и др., поэтому знание
основ гемотрансфузиологии является
неотъемлемой частью подготовки будущего врача.
■
■
■
■
■
■
■
2. Учебные цели
Усвоить учение о группах крови;
Изучить историю развития гемо
трансфузиологии;
Классифицировать и продемонст
рировать методы определения группы крови и резус-фактора;
Продемонстрировать определение
индивидуальной, резус- и биологической совместимости крови донора и
реципиента;
Изучить показания и противопоказания к переливанию крови, методы
гемотрансфузии;
Пояснить механизм действия перелитой крови и ее компонентов;
Изучить методы стабилизации и
консервирования донорской крови,
условия ее хранения.
3. Самостоятельная
работа студента
Человечество с древних времен
отождествляет понятия «кровь» и
«жизнь». В Ветхом Завете сказано:
«Потому что душа тела в крови, и Я назначил ее вам для жертвования, чтобы
очищать души ваши, ибо кровь сия
душу очищает» (Левит, XVII, 11).
В Коране можно найти такие строки: «Мы уже создали человека из эс
сенции глины, потом поместили мы
его каплей в надежном месте, потом
создали из капли сгусток крови, и
создали из сгустка крови кусок мяса,
создали из этого куска кости и облекли кости мясом, потом Мы вырастили
его в другом творении» (Сура 23 «Верующие»). История переливания крови
весьма драматична, а подчас и трагична. Первое лечебное применение крови документировано в 1492 г., когда
для продления жизни римский папа
Иннокентий VIII принимал ванну с
кровью троих молодых добровольцев.
Безуспешность такой процедуры была
предопределена ее эмпирическим характером — в силу отсутствия знаний
о научных основах переливания крови
(стерильность, механизмы свертывания, иммунологические характеристики и др.). Предпосылкой к внедрению
внутривенного вливания жидкостей, в
том числе и крови, послужило открытие в 1616 г. (опубликован в 1628 г.)
Уильямом Гарвеем (1578-1657) закона кровообращения. Ричард Лоуэр
(1631-1691) несколько лет проводил
эксперименты по переливанию крови,
соединяя яремные вены собак. Из-за
свертывания крови в соединительной
трубке эти эксперименты были безрезультатны. Успешное переливание
крови было продемонстрировано в
Оксфорде в феврале 1665 г. Кровь из
разреза шейных артерий двух крупных
мастиффов вводилась в яремную вену
обескровленной собаки среднего размера.
Сведения о первом переливании
крови человеку разноречивы. По одним
данным, в октябре 1666 г. в Лейпциге
Иоганн-Даниель Майор впервые пе
релил кровь своему парализованному
учителю. Сведения об этом были опуб
ликованы в 1667 г. Большинство источников сообщает, что в этом же году
15 июня Жан-Батист Дени произвел
успешную трансфузию около 300 мл
крови ягненка 15-летнему мальчику с
лихорадкой и геморрагическим синдро
мом. Среди пациентов Ж.-Б. Дени был
сын премьер-министра Швеции, помочь которому, правда, не удалось. Лечение одного из реципиентов крови —
Антуана Моро — имело исторические
последствия. Этот 34-летний молодо
жен вскоре после свадьбы ушел из
дома и проводил время в увеселительных заведениях Парижа. Покровитель
Ж-Б. Дени, высокопоставленный вельможа Генри де Монморт, сжалившись
над супругой А. Моро, дабы укротить
нрав последнего, предложил перелить
ему кровь ягненка, что и было сделано в декабре 1667 г. После повторной
трансфузии у пациента развились боль
в пояснице, давящее ощущение в груди,
носовое кровотечение, моча приобрела
темно-кровавый цвет (по всей видимости, это было первое описание посттрансфузионного осложнения). Тем не
менее пациент не только выжил, но и
69
2 мес. спустя возвратился к разгульному образу жизни. Последовавшая
вскоре смерть А. Моро (по слухам, отравленного супругой мышьяком) послужила основанием для фактического запрета на трансфузии человеку в
крупнейших столицах Европы.
Перерыв в широких клинических и
экспериментальных исследованиях по
проблеме переливания крови составил
около 150 лет.
Доверие к гемотрансфузиям было
восстановлено 22 декабря 1818 г.,
когда известный врач и физиолог
Джеймс Бланделл (1790-1877) доложил на заседании лондонского медикохирургического общества о переливании
крови от человека человеку, которое он
выполнил совместно с прославленным
хирургом Генри Кляйном. У 35-летнего
мужчины-пациента с карциномой желудка, получившего 400-500 мл крови
от нескольких доноров, после времен
ного улучшения через 56 ч. наступил
летальный исход. Первые трансфузии выполнялись с помощью медного шприца, а в 1824 г. Дж. Бланделл
описал изобретенный им специальный
прибор для прямого переливания крови
под давлением. Дж. Бланделл выступал
против переливания человеку крови
животных, тем не менее такая практика
сохранялась и во второй половине XIX
века. Весьма сложную для трансфузиологии XIX века проблему свертывания
крови первыми преодолели в 1821 г.
французские химики Жан-Луи Прево и Жан-Батист-Андре Дюма. Они не
только обнаружили, что после выпаде
ния фибрина кровь хранится в жидком
состоянии, но и в эксперименте на животных показали клиническую эффективность дефибринированной крови,
полученной оригинальным методом.
В России первая работа, посвященная
переливанию крови, была опубликована
70
Текстовый модуль 2
в 1830 г. в «Военно-медицинском журнале» Степаном Фомичом Хотовицким
(1796-1885). Первое успешное переливание крови при массивной кровопотере в родах произвел в Обуховской больнице Санкт-Петербурга акушер Андрей
Мартынович Вольф 8 апреля 1832 г.
В 1846 г. профессор Илья Васильевич
Буяльский (1789-1866), учитывая запрет на проведение гемотрансфузий в
ряде стран Европы вследствие нередких
летальных исходов, обратился с письменным запросом на имя директора
Медицинского департамента Военного
министерства о возможности переливания крови в России и получил положительный ответ.
Первая в России монография, посвященная переливанию крови — «Трактат
о переливании крови как единственном средстве во многих случаях спа
сти угасающую жизнь, составленный
в историческом, физиологическом и
хирургическом отношениях» — была
подготовлена Алексеем Матвеевичем
Филомафитским (1807-1849), профессором физиологии Московского
университета, и издана в 1848 г.
В XIX веке в мире было осуществлено около 600 переливаний крови,
в том числе в России — 145.
Василий Васильевич Сутугин (18391900) в диссертации на соискание
степени доктора медицины «О пере
ливании крови» (1865) подчеркивал
важное значение гемотрансфузий на
войне, связав эту проблему с необ
ходимостью сбора крови, излившейся при кровотечении. Он же высказал
идею о возможности хранения дефиб
ринированной крови в течение недели
при температуре 0°С.
Исследования по консервированию крови продолжил В. Раутенберг
(1867), доказавший, что добавление
минимального количества углекисло-
Тема 5
го натрия задерживает свертываемость
крови, не лишая ее необходимых для
переливания свойств.
Особое место в истории трансфузиологии занимают работы профессора Сергея Петровича Коломнина
(1842-1886), который первым в русской
армии переливал дефибринированную
кровь раненым в условиях боевых дей
ствий (1876-1877). По его мнению,
при ампутации конечности «кровь ук
репляет раненого, для того чтобы оперировать, и поддерживает угасающую
жизнь после операции». Николай Иванович Пирогов (1810-1881), основы
ваясь на опыте С.П. Коломнина, подчеркивал, что гемотрансфузии должны
явиться составной частью хирургического пособия раненым в госпиталях.
Профессор Виктор Васильевич Пашутин (1845-1901), основатель первой
в России научной школы патофизиологов, в «Лекциях по общей патологии»
(1881) подробно описал симптомы
посттрансфузионного осложнения.
Не без причины немецкий хирург
Р. Фолькман в 1970 г. иронически заметил, что для переливания крови необходимы три барана — один, который
даст кровь, второй, позволивший ее
себе перелить, и третий, осмелившийся
это сделать. Причиной многих смертельных исходов была групповая несовместимость крови.
Эмпирический подбор доноров
до начала XX века делал переливание
крови весьма рискованной процедурой. Базисом развития современной
науки о переливании крови послужило
объяснение Карлом Ландштейнером
(1868-1943) причин агглютинации
эритроцитов одного человека сывороткой другого. Ранее этот феномен
расценивали как проявление заболевания. В 1900 г. сотрудник Института
патологической анатомии университе-
та Вены К. Ландштейнер опубликовал
результаты исследования взаимодействия эритроцитов и сыворотки крови
22 человек и сделал заключение о существовании трех групп крови: 0, А и В
(Нобелевская премия в 1930 г.).
Вскоре в 1902 г. коллеги К. Ландштейнера по университету Альфред
фон Декастелло Речвер (1872-1960) и
Адриано Стурли (1872-1960) описали
группу крови АВ. Позднее В.Л. Маос
(w. Mass) и Я. Янский открыли четвертую группу крови (1907 г.). Для решения проблемы поддержания донорской
крови в жидком состоянии, кроме дефибринирования, разными учеными
были предложены различные способы: покрытие трубок и контейнеров
для крови парафином, антикоагулянты
(сульфат и оксалат аммония, фосфат,
сульфат и йодид натрия, сульфарсенол, арсфенамин, гирудин). Практически одновременно ряд специалистов, в
том числе русские врачи Вадим Александрович Юревич (1872-1963) и Николай Константинович Розенгардт
(1876-1933) в 1914-1915 гг. предложили для стабилизации донорской крови
использовать нетоксичный цитрат натрия, связывающий кальций и тем самым препятствующий свертыванию.
Первую в мире гемотрансфузию с
учетом групп крови произвел амери
канский хирург Джордж Крайль в
1907 г. Впервые в России такую проце
дуру 23 июня 1919 г. в клинике факультетской хирургии Военно-медицинс
кой академии выполнил приват-доцент
Владимир Николаевич Шамов (18821962) при участии Николая Николаевича Еланского (1894-1964) и Иоакима
Романовича Петрова (1893-1970).
В 1921 г. В.Н. Шамов писал в журнале «Новый хирургический архив»:
«В бытность свою в Америке я имел
возможность многократно наблюдать
71
благодетельные результаты переливания крови как в клинике самого Крайля, так и у других хирургов. Что касается моего собственного опыта, то он
пока очень мал, так как в наше голодное время, к сожалению, крайне трудно
найти лицо, которое бы согласилось
дать кровь для переливания. Я имею
пока всего три случая переливаний, и
они всецело подтверждают результаты
других авторов». Очевидно, проблемы
донорства и послужили стимулом для
того, чтобы В.Н. Шамов первым в мире
тщательно изучил и обосновал возможность переливания крови, взятой
от трупа (кадаверная фибринолизированная кровь) и в 1928 г. предложил
использовать этот метод трансфузии
в клинике. Он увлек этим профессора
С.С. Юдина, который впервые в мировой практике 23 марта 1930 г. произвел
успешное переливание трупной крови. В 1962 г. В.Н. Шамов и С.С. Юдин
за разработку и внедрение в практику
метода заготовки и использования фибринолизированной крови были удостоены Ленинской премии.
Военные конфликты и необходимость лечения большого количества
раненых, начиная с франко-прусской
войны 1870 г., стимулировали развитие
трансфузионной медицины. Первый в
истории банк крови был создан в первую
мировую войну в американском базовом
госпитале Освальдом Робинсоном.
Первый в мире Институт переливания крови был открыт 26 февраля
1926 г. в Москве по инициативе Александра Александровича Богданова
(1873-1928), который и стал его первым директором. Будучи врачом по
образованию, А.А. Богданов (Малиновский) приобрел широкую известность как революционер, философ и
литератор. Еще в 1908 г. в своем романе «Красная звезда» он выразил мне-
72
Текстовый модуль 2
ние, что есть возможность дополнить
политический социализм взаимным
обменом крови, тем самым создав из
человечества братство, соединенное не
только общей идеей, но и общей кровью. Работая в Институте, А.А. Богданов интересовался эффектами взаимных переливаний крови (500-1000 мл)
между больными и между больными и
здоровыми лицами.
В марте 1928 г. у студента МГУ
Л.И. Колдомасова сотрудники Инсти
тута обнаружили скрытую форму туберкулеза и последствия перенесенной
ранее малярии. А.А. Богданов предложил ему взаимный обмен крови
на основании того, что он, как врач с
многолетним стажем, имеет сопротивляемость к туберкулезу. Трансфузия
могла бы передать Л.И. Колдомасову эту сопротивляемость, избавив его
от болезни. У обоих была одинаковая группа крови — 0(1) — и вечером
24 марта 1928 г. было проведено взаимное переливание, каждому около
литра. Вскоре у обоих развились тяжелые гемолитические осложнения.
Л.И. Колдомасов неделю лечился
в Институте, затем в течение 2 мес. —
в туберкулезном санатории. В 1983 г.
76-летний Колдомасов жил в Новоси
бирске, приписывая свое излечение эффекту от переливания крови А.А. Богданова. А.А. Богданов скончался 7 апреля
1928 г. Причина смерти: интоксикация,
почечная недостаточность в результате
гемолиза донорской крови после несовместимой трансфузии.
Пионеры научного подхода к переливанию крови активно участвовали в
создании организационных структур
службы крови. В 1930 г. по инициативе
В.Н. Шамова был организован Институт переливания крови в Харькове, а
Н.Н. Еланский возглавлял комиссию по
формированию в Ленинграде станции
Тема 5
переливания крови, реорганизованной
в 1932 г. в институт (ныне — Российский научно-исследовательский институт гематологии и трансфузиологии).
В Ленинградском институте переливания крови Н.Г. Карташевский и
А.М. Филатов (1932-1934) разработали методы переливания эритроцитной массы и нативной плазмы.
М.С. Малиновский (1934) разработал
переливание плацентарной, а С.И. Спасокукоцкий (1935) переливание утилизированной крови.
Вскоре после создания Института
ленинградские ученые Антонин Нико
лаевич Филатов (1903-1974) и Николай
Георгиевич Карташевский (1905-1982)
приобрели мировой приоритет производства и применения компонентов
крови: эритроцитной массы и плазмы.
26-29 сентября 1935 г. в Риме состоялся первый международный конгресс
по переливанию крови. На втором таком конгрессе 20 сентября — 2 октября 1937 г. в Париже было основано
Международное общество перелива
ния крови. В 1938 г. Бернард Фантус
впервые использовал фильтрацию крови для удаления свертков (сгустков)
и клеточных агрегатов. В 1930-е гг.
в нашей стране была сформирована
структура службы крови как единой государственной организации и созданы
принципы ее работы, сохраняющиеся
в настоящее время. В начале Великой
Отечественной войны полевые госпитали планировалось централизованно
снабжать консервированной кровью,
заготовленной в тылу станциями и институтами переливания крови. 7 июля
1941 г. главным военно-санитарным
управлением была направлена в войска
«Инструкция по переливанию крови
в Красной Армии».
Уже к сентябрю 1941 г. выявилась
необходимость создания в действую
щей армии специальной организации,
руководящей переливанием крови в
лечебных учреждениях. На СевероЗападном фронте были созданы вне
штатные «группы переливания крови»
(Н.Н. Еланский). Только год спустя
(осенью 1942 г.) в составе санитарного управления Западного фронта было
образовано отделение переливания
крови (ОПК), подчинявшееся главному хирургу (С.И. Банайтис). Позднее
во главе отделов на всех фронтах и отделений при санитарных отделах армий встали специалисты переливания
крови, руководившие работой врачейинструкторов, начальников складов
крови (доставка, хранение и распределение поступавшей крови). Им же под
чинялись в последующем фронтовые и
армейские станции переливания крови.
Во всех лечебных учреждениях фронта и эвакогоспиталях были выделены
врачи, ответственные за переливание
крови (проведение гемотрансфузий,
обучение медицинского персонала,
комплектование доноров для заготовки крови, доставка консервированной
крови, ее хранение и учет). На флотах
и при госпиталях военно-морских баз
имелись пункты переливания крови,
которые обеспечивали переливание
крови, снабжали консервированной
кровью, плазмой, кровезамещающими
растворами, изогемагглютинирующими сыворотками корабли и воинские
части данной базы (Н.Г. Карташевский). Централизованные поставки
консервированной крови и заготовка
свежестабилизированной крови в госпиталях не могли полностью обеспечить потребности этапов медицинской
эвакуации. Трудности транспортировки на дальние расстояния приводили к
поступлению крови длительных сроков
хранения, потерям ее в результате боя
посуды. Были организованы армейские
73
и фронтовые станции переливания крови на базе крупных госпиталей, которые
могли накапливать перед боевой операцией до 200-300 л крови (В.Н. Шамов, Н.Н. Еланский, М.Н. Ахутин).
Большую роль в укреплении службы
крови действующей армии сыграло вышедшее к концу 1943 г. «Руководство
по переливанию крови» (В.Н. Шамов).
К концу Великой Отечественной войны
на этапах специализированной медицинской помощи стали применять компоненты крови (Н.Г. Карташевский).
В 1945 г. частота переливания крови в
медсанбатах достигла 10-12% от числа
поступивших раненых, в госпитальных
базах армии — 7-9%, в госпитальных
базах фронта — 13-14%. Всего в военных лечебных учреждениях в годы
войны было произведено около 7 млн.
гемотрансфузий.
Во второй половине XX века практика производственной и клинической
трансфузиологии впитывает достижения фундаментальной науки: при про
ведении гемотрансфузий учитывается
совместимость по системе группы кро
ви Резус, открытой К. Ландштеинером
и А. Винером, а также совместимость
по системе антигенов лейкоцитов человека, открытой Ж. Доссе в середине
1950-х гг.
Изучение метаболизма эритроцитов послужило основой для включения в состав гемоконсервантов таких
веществ, как глюкоза, фосфат, аденин,
что позволило увеличить срок хранения донорских эритроцитов до 42 сут.
Ключевым элементом современной
гемокомпонентной терапии является
разработанный в 1950 г. Карлом Уолтером (США) пластиковый контейнер
для крови. Производство препаратов
плазмы крови (альбумина, иммуноглобулинов, факторов свертывания)
базируется на методе фракционирова-
74
Текстовый модуль 2
ния плазмы, разработанном Эдвином
Коном в начале 1940-х гг.
Параллельно
совершенствованию производства компонентов и
препаратов крови проводилась разработка и широкое внедрение плазмозамещающих растворов. 1 октября
1960 г. был открыт Кировский научноисследовательский институт гематологии и трансфузиологии — третий профильный институт в России. Все более
значимой в современной трансфузионной медицине становится проблема
безопасности. В 1962 г. был разработан
первый фильтр для удаления лейкоцитов из крови с целью профилактики аллоиммунизации. В течение последних
20 лет, особенно с открытием вирусов
иммунодефицита человека и гепатита
С, радикально изменилась система обследования доноров на гемотрансмиссивные инфекции, перечень тестируемых маркеров увеличился.
Основные антигенные
системы крови
Установлено, что антигенная структура человеческой крови сложна, все
форменные элементы крови и плазменные белки разных людей отличаются
по своим антигенам. Уже известно около 500 антигенов крови, которые образуют свыше 40 различных антигенных
систем.
Под антигенной системой понимают совокупность антигенов крови,
которые наследуются (контролируются) аллельными генами.
Все антигены крови делят на клеточные и плазменные. Основное значе
ние в трансфузиологии имеют клеточные антигены.
1. Клеточные антигены
Клеточные антигены представляют
собой сложные углеводно-белковые
Тема 5
комплексы (гликопептиды), которые
являются структурными компонента
ми мембраны клеток крови. От других
компонентов клеточной мембраны они
отличаются иммуногенностью и серологической активностью.
Иммуногенность — способность
антигенов индуцировать выработку ан
тител, если они попадают в организм,
у которого эти антигены отсутствуют.
Серологическая активность —
способность антигенов соединяться с
одноименными антителами.
Молекула клеточных антигенов состоит из двух компонентов:
■ шлеппер (белковая часть антигена, расположенная во внутренних
слоях мембраны), определяющий
иммуногенность;
■ гаптен (полисахаридная часть
антигена, расположенная в поверхностных слоях клеточной мембраны), определяющий серологическую активность.
На поверхности гаптена имеются антигенные детерминанты (эпитопы) — молекулы углеводов, к которым
присоединяются антитела. Известные
антигены крови отличаются друг от
друга эпитопами. Например, гаптены
антигенов системы АВО имеют следующий набор углеводов: эпитопом
антигена 0 является фукоза, антигена
А — N-ацетилгалактозамин, антигена
В — галактоза. С ними и соединяются
групповые антитела. Различают три
вида клеточных антигенов:
■ эритроцитарные;
■ лейкоцитарные;
■ тромбоцитарные.
Эритроцитарные антигены
Известно более 250 антигенов эритроцитов, образующих свыше 20 анти
генных систем. Клиническое значение
имеют 11 систем: АВО, резус-фактор
(Rh-Hr), MNSs, Келл (Kell), Лютеран
(Lutheran), Кидд (Kidd), Диего (Diego),
Даффи (Duffy), Домброк (Dombrock),
ферментные группы эритроцитов.
У человека в эритроцитах есть
одновременно антигены нескольких
антигенных систем.
Основными в трансфузиологии
являются антигенные системы АВО и
Rh-фактора. Другие антигенные системы эритроцитов в настоящее время существенного значения в клинической
трансфузиологии не имеют.
Антигенная система АВО
Система АВО является основной серологической системой, определяющей
совместимость или несовместимость
переливаемой крови. Ее составляют
два генетически детерминированных
агглютиногена (антигена) — А и В и
два агглютинина (антитела) — α и β.
Агглютиногены А и В содержатся
на поверхности эритроцитов, а агглютинины α и β — в сыворотке крови.
Агглютинин α является антителом по
отношению к агглютиногену А, а агглютинин β — по отношению к агглютиногену В. В эритроцитах и сыворотке
крови одного человека не может быть
одноименных агглютиногенов и агглютининов. При встрече одноименных
антигенов и антител возникает реакция изогемагглютинации. Именно эта
реакция является причиной несовместимости крови при гемотрансфузии.
В зависимости от сочетания α и β в
эритроцитах антигенов А и В и соответ
ственно в сыворотке антител все люди
разделяются на четыре группы: 0(І)α,
β; А(ІІ)β; В(ІІІ)α; АВ(ІV).
Антигенная система
резус-фактора
Резус-фактор (Rh-фактор), названный так вследствие того, что впервые
75
был обнаружен у макак резус, встречается у 85% людей, а у 15% отсутствует.
В настоящее время известно, что
система резус-фактора достаточно
сложна и представлена 6-ю антигенами. Роль резус-фактора при гемотрансфузии, а также при беременности
крайне велика. Ошибки, приводящие
к развитию резус-конфликта, вызывают тяжелые осложнения, а иногда и
смерть больного.
Резус-фактор (Rh) открыли в
1940 году К. Ландштейнер и А. Винер
(А. Wiener). Это сильный антиген, который наследуется. Резус-фактор находят в эритроцитах, а также в лейкоцитах, тромбоцитах, в разных органах
и тканевых жидкостях, околоплодных
водах. Если кровь с положительным
резус-фактором попадает человеку с
резус-отрицательной кровью (Резусфактор (Rh-фактор) отсутствует), то
образуются специфические антитела —
антирезус-агглютинины, которые могут образоваться у резус-отрицательной
беременной от резус-положительного
плода. В связи с этим может погибнуть
ребенок или резус-отрицательный человек, если ему повторно переливать
резус-положительную кровь. У резусотрицательных женщин при беременности резус-положительным плодом
может быть фатальным и первое переливание крови.
Практическое значение при переливании крови имеют в антигенной системы Rh-Hr (Д, С, Е, d, с, е). Первые
три антигена являются разновидностями резус-фактора — Д (Rhо), С (rh¹), Е
(rh¹¹). Наиболее антигенен и является
наиболее частой причиной изосерологических конфликтов при гемотрансфузиях и беременности антиген Д
(Rhо), наиболее слаб — Е (rh¹¹).
В эритроцитах есть также антигены
системы Hr — Hro, hr¹, hr¹¹, которые
76
Текстовый модуль 2
вызывают образование специфических
антител, однако их антигенные свойства слабее, чем у резус-фактора.
По современным представлениям
(Fischer, Race), резус-система, по сути,
комплекс шести антигенов Rh-Hr систем, связанных в одной паре хромосом. У человека могут быть антигены
обеих систем (Rh и Hr) или только системы (Rh или Hr), но нет таких людей,
у которых не было бы одной из двух
антигенных систем. В настоящее время
известны более 27 комбинаций типов
антигенов.
Перед переливанием крови обязательно следует установить резус принадлежность донора и реципиента и
провести пробу на резус-совместимость.
При переливании крови следует строго
придерживаться принципа использования крови, одноименной по резусфактору.
Второстепенные
антигенные системы
Второстепенные эритроцитарные
групповые системы представлены боль
шим количеством антигенов. Знание
этого множества систем имеет значение
для решения некоторых вопросов в антропологии, для судебно-медицинских
исследований, а также для предотвращения развития посттрансфузионных
осложнений и предотвращения развития некоторых заболеваний у ново
рожденных.
Ниже представлены наиболее изученные антигенные системы эритроцитов.
Система MNSs включает факторы М, N, S, s. Доказано наличие двух
тесно сцепленных между собой генных
локусов MN и Ss. В дальнейшем были
выявлены другие многообразные варианты антигенов системы MNSs. По
химической структуре MNSs являются
гликопротеидами.
Тема 5
Система Р. Одновременно с антигенами М и N К. Ландштейнер и
Ф. Левин в 1927 г. открыли в эритроцитах человека антиген Р. Это имеет
определенное клиническое значение.
Отмечены случаи ранних и поздних
выкидышей, причиной которых явились изоантитела анти-Р. Описано не
сколько случаев посттрансфузионных
осложнений, связанных с несовмести
мостью донора и реципиента по системе антигенов Р.
Система Келл. Эта система представлена тремя парами антигенов.
Наибольшей иммуногенной активностью обладают антигены Келл (К) и
Челлано (ч). Антигены системы Келл
могут вызывать сенсибилизацию организма во время беременности и при
переливании крови, служить причиной гемотрансфузионных осложнений
и развития гемолитической болезни
новорожденных.
Система Лютеран. Один из доноров по фамилии Лютеран имел в
эритроцитах крови какой-то ранее
неизвестный антиген, приведший к
иммунизации реципиента. Антиген
был обозначен буквами Lu а. Через
несколько лет был открыт второй антиген этой системы Lu b. Частота их
встречаемости: Lu а — 0,1%, Lu b —
99,9%. Антитела анти-Lu b являются
изоиммунными, что подтверждается и
сообщениями о значении этих антител
в происхождении гемолитической болезни новорожденных. Клиническое
значение антигенов системы Лютеран
невелико.
Система Кидд. Антигены и антитела системы Кидд имеют определенное практическое значение. Они
могут быть причиной развития гемолитической болезни новорожденных и
посттрансфузионных осложнений при
многократном переливании крови, не-
совместимой по антигенам этой системы. Частота встречаемости антигенов
около 75%.
Система Диего. В 1953 г. в Венесуэле в семье Диего родился ребенок
с признаками гемолитической болезни. При выяснении причины этого
заболевания у ребенка был обнаружен
ранее неизвестный антиген, который
был обозначен фактором Диего (Di).
В 1955 г. проведенные исследования
выявили, что антиген Диего является
расовым признаком, характерным для
народов монголоидной расы.
Система Даффи. Состоит из двух
основных антигенов — Fy а и Fy b. Антитела анти-Fy-а являются неполными
антителами и проявляют свое действие
только в непрямом антиглобулиновом
тесте Кумбса. Позднее были обнаружены антигены Fy-x, Fy3, Fy4, Fy5. Частота встречаемости зависит от расовой
принадлежности человека, что имеет
большое значение для антропологов.
В негроидных популяциях частота
встречаемости фактора Fy-a 25%, среди китайского населения, эскимосов,
аборигенов Австралии — почти 100%, у
людей европеоидной расы — 60-82%.
Система Домброк. В 1973 г. были
выявлены антигены Do-а и Do-b. Фактор Do-а встречается в 55-60% случаев, а фактор Do-b — в 85-90%. Такая
частота встречаемости выдвигает эту
серологическую систему крови на 5-е
место по информативности в аспекте
судебно-медицинского исключения отцовства (система резус, MNSs, AB0 и
Даффи).
Ферментные группы эритроцитов. Начиная с 1963 г. стало известно
значительное количество генетически
полиморфных ферментных систем
эритроцитов крови человека. Эти открытия сыграли значительную роль в
развитии общей серологии групп кро-
77
ви человека, а также в аспекте судеб
но-медицинской экспертизы спорного
отцовства. К ферментным системам
эритроцитов относятся: фосфатглюкомутаза, аденозиндезаминаза, глутаматпируваттрансаминаза, эстераза-Д и др.
Лейкоцитарные антигены
В мембране лейкоцитов имеются
антигены, аналогичные эритроцитарным, а также специфические для этих
клеток антигенные комплексы, кото
рые называют лейкоцитарными антигенами. Впервые сведения о лейкоци
тарных группах получил французский
исследователь Ж. Доссе в 1954 г. Первым был выявлен антиген лейкоцитов, встречающийся у 50% европей
ского населения. Этот антиген был
назван «Мак». В настоящее время на
считывают около 70 антигенов лейкоцитов, которые разделяют на три группы:
■ общие
антигены
лейкоцитов
(HLA — Human Leucocyte Antigen);
■ антигены
полиморфно-ядерных
лейкоцитов;
■ антигены лимфоцитов.
Система HLA
Система HLA имеет наибольшее
клиническое значение. Она включает
более 120 антигенов. Только по этой
антигенной системе насчитывают
50 млн лейкоцитарных групп крови.
HLA-антигены являются универсальными. Они содержатся в лимфоцитах,
полиморфно-ядерных
лейкоцитах
(гранулоцитах), моноцитах, тромбоцитах, а также в клетках почек, легких,
печени, костного мозга и других тканях и органах. В связи с этим данные
антигены еще называют антигенами
гистосовместимости.
По рекомендации ВОЗ используют следующую номенклатуру системы
HLA:
78
Текстовый модуль 2
HLA — Human Leucocyte Antigen —
обозначение системы;
■ А, В, С, D — генные локусы или
регионы системы, 1, 2, 3 — номера
аллелей внутри генного локуса системы HLA;
■ W — символ для обозначения недостаточно изученных антигенов.
Система HLA — наиболее сложная
из всех известных систем антигенов.
Генетически HLA-антигены принадлежат к четырем локусам (А, В, С, D),
каждый из которых объединяет аллельные антигены. Иммунологическое
исследование, позволяющее определить антигены гистосовместимости,
называют тканевым типированием.
HLA-система имеет большое значение при трансплантации органов и тка
ней. Аллоантигены системы HLA локусов А, В, С, D, а также агглютиногены
классических групп крови системы
АВО представляют собой единственно
достоверно известные антигены гистосовместимости. Для предупреждения
быстрого отторжения пересаженных
органов и тканей необходимо, чтобы
реципиент имел ту же, что и донор,
группу крови системы АВО и не имел
антител к аллоантигенам HLA-генных
локусов А, В, С, D донорского орга
низма.
HLA-антигены имеют значение также при переливании крови, лейкоци
тов и тромбоцитов. Различие матери и
плода по антигенам HLA-системы при
повторных беременностях может привести к выкидышу или гибели плода.
■
Антигены полиморфноядерных лейкоцитов
Другой системой антигенов лейкоцитов являются антигены гранулоцитов (NA-NB). Эта система является
органоспецифической. Антигены гранулоцитов обнаружены в полиморфно-
Тема 5
ядерных лейкоцитах и клетках костного
мозга. Известно три гранулоцитарных
антигена: NA-1, NA-2, NB-1. Антитела
против антигенов гранулоцитов имеют
значение при беременности, вызывая
кратковременную нейтропению новорожденных, они играют важную роль
в развитии негемолитических трансфузионных реакций, могут вызывать гипертермические посттрансфузионные
реакции и укорочение жизни гранулоцитов донорской крови.
Антигены лимфоцитов
Третью группу антигенов лейкоцитов составляют лимфоцитарные анти
гены, которые являются тканеспецифическими. К ним относятся антиген
LY и другие. Выделены 7 антигенов
популяции В-лимфоцитов: HLA-DRw,
НLA-DRw.. Значение этих антигенов
остается малоизученным.
Тромбоцитарные антигены
В мембране тромбоцитов имеются
антигены, аналогичные эритроцитарным и лейкоцитарным, а также свойственные только этим клеткам крови —
тромбоцитарные антигены. Известны
антигенные системы Zw, PL, Ко. В на
стоящее время особого клинического
значения не имеют.
2. Плазменные антигены
Плазменные (сывороточные) антигены представляют собой определен
ные комплексы аминокислот или углеводов на поверхности молекул белков
плазмы (сыворотки) крови.
Антигенные различия, свойственные белкам плазмы крови, объединяют
в 10 антигенных систем (Нр, Gc, Tf, Inv,
Gm и др.). Наиболее сложной из них и
клинически значимой является антигенная система Gm, присущая иммуноглобулинам (включает 25 антигенов).
Различия людей по антигенам плазменных белков создают плазменные
(сывороточные) группы крови.
3. Понятие о группе крови
Согласно современным данным
иммуногематологии можно следующим образом сформулировать понятие
«группа крови»:
Группа крови — это сочетание
нормальных иммунологических и
генетических признаков крови, которое наследственно детерминировано
и является биологическим свойством
каждого индивидуума.
Группы крови передаются по наследству, формируются на 3-4-м месяце
внутриутробного развития и остаются
неизменными в течение всей жизни.
Считается, что у человека группа крови включает несколько десятков анти
генов в различных сочетаниях. Этих
сочетаний — групп крови — реально
может быть несколько миллиардов.
Практически они одинаковы лишь у од
нояйцовых близнецов, имеющих один
и тот же генотип. Такое понятие о группе крови является наиболее общим.
В практической медицине термин
«группа крови», как правило, отражает
сочетание эритроцитарных антигенов
системы АВ0 и резус-фактора и соот
ветствующих антител в сыворотке крови.
4. Групповые антитела
Для каждого известного антигена
обнаружены одноименные антитела
(анти-А, анти-В, анти-резус, анти-Келл
и т. д.). Групповые антитела крови — не
такое постоянное свойство организма
человека, как антигены. Лишь в групповой системе АВ0 антитела являются
нормальным врожденным свойством
плазмы крови. Эти антитела (агглютинины α и β) постоянно присутствуют в
плазме крови человека, определенным
79
образом сочетаясь с агглютиногенами
(антигенами) эритроцитов.
Групповые антитела бывают врожденными (например, агглютинины α и
β) и изоиммунными, образующимися
в ответ на поступление чужеродных
групповых антигенов (например, антитела системы Rh-фактора).
Врожденные антитела являются
так называемыми полными антителами — агглютининами, вызывающими
агглютинацию (склеивание) эритроци
тов, содержащих соответствующий
антиген. Они относятся к холодовым
антителам, так как лучше проявляют свое действие in vitro при низких
температурах и слабее реагируют при
высокой температуре.
Полные антитела относятся к иммуноглобулинам класса М. Молекуляр
ная масса этих антител 900-1000 дальтон, наибольший размер — 100 нм.
Молекула содержит 4 цепочки аминокислот, участки между концами их
цепей являются активными центрами
(паратопами, антидетерминантами),
которыми антитела соединяются с
антигенными детерминантами, рас
положенными на клетках крови. Антитела класса М имеют 10 активных центров, поэтому они могут соединяться
одновременно с антигенными детер
минантами большого числа клеток
крови.
Изоиммунные антитела являются
неполными. Они с трудом поддаются абсорбции и не разрушаются при нагревании. Эти антитела являются тепловыми
(наиболее активны при температуре
37°С и выше) и агглютинируют клетки крови только в коллоидной среде.
Неполные антитела относятся к
классу Ig G. Молекулярная масса по
рядка 150-160 тыс. дальтон, наибольший размер — 25 нм. Строение моле
кулы схоже со строением молекулы
80
Текстовый модуль 2
полных антител, но отличается последо
вательностью аминокислот и количеством активных центров: у неполных
антител их два (каждое антитело связывает две антигенных детерминанты).
5. Механизм взаимодействия
«антиген-антитело»
Механизм взаимодействия антигена и антитела состоит из двух фаз:
собственно взаимодействия и его проявления.
В первой фазе антитело одним активным центром соединяется с антиген
ной детерминантой одной клетки крови
(фиксируется на клетке). На этом этапе
реакции никаких видимых глазом или
в световом микроскопе изменений еще
нет. После этого начинается фаза проявления либо в виде агглютинации (склеивание эритроцитов), либо в виде цитолиза (разрушение клеток крови). После
фиксации антител на поверхности клеток крови к комплексу «антиген— антитело» присоединяется комплекс белков
из плазмы крови (комплемент), и комплекс «антиген — антитело — комплемент» лизирует мембрану клетки. При
взаимодействии антител с эритроцитами это проявляется гемолизом. Для
каждой фазы реакции «антиген — ан-
Рис. 32. Набор стандартных
изогемагглютинирующих сывороток
Тема 5
титело» требуются строго определенные условия: рН, температура, ионный
состав и коллоидность среды, наличие
активного комплемента, определенное
соотношение числа молекул антител и
антигенов.
Стандартные
изогемагглютинирующие
сыворотки для определения
групп крови системы АВ0
Стандартными изогемагглютинирующими сыворотками являются сыво
ротки, приготовленные из крови людей
и некоторых других жидкостей, со
держащие групповые антитела (агглютинины). Сыворотки предназначаются
для определения групповой принадлежности крови людей по системе АВ0
(рис. 32).
Стандартные изогемагглютинирующие сыворотки представляют собой
прозрачную жидкость, окрашенную в
соответствии с групповой принадлеж
ностью и расфасованную в ампулы
или флаконы. На этикетке указывают
название учреждения, изготовившего сыворотку, специфичность, титр
агглютининов и срок годности, а также
маркировку.
Источниками для получения стандартных сывороток служат:
■ кровь, заготовленная без консерванта от донора, предварительно
обследованного и содержащего в
крови групповые антитела с тит
ром, достаточным для изготовления стандартных сывороток;
■ плазма, полученная при проведении плазмафереза или отделенная
из донорской крови, по какимлибо причинам не использованная
для лечебных целей и содержащая
групповые антитела с титром, достаточным для изготовления стандартных сывороток;
дополнительный источник —
плевральный транссудат, асцитическая жидкость, если в них содержатся групповые антитела с
титром, достаточным для изготовления стандартных сывороток.
К стандартной изогемагглютинирующей сыворотке предъявляются
следующие требования:
■ должна быть специфичной,
т. е. содержать определенные групповые антитела — α (анти-А), — β
(анти-В), или оба антитела вместе
и не вызывать неспецифической
агглютинации эритроцитов одно
именной группы и группы 0(I). Сыворотка группы АВ (IV), не содержащая групповых агглютининов, не
должна вызывать агглютинацию;
■ должна быть активной, что выражается в наступлении первых
признаков агглютинации со стандартными эритроцитами групп
А и В в течение первых 30. с и со
стандартными эритроцитами А2 —
в течение 1-й минуты и титром агглютининов по отношению к эритроцитам групп А и В не ниже 1:32
и группы А2 — не ниже 1:16;
■ не должна оказывать на эритроциты гемолизирующее действие;
■ должна быть прозрачной; допускается небольшая опалесценция,
что не влияет на качество сыворотки;
■ должна быть окрашена: группа
А (II) — в светло-синий цвет, группа В (III) — в красный цвет, группа
АВ (IV) — в желтый цвет;
■ должна быть предохранена от
инфицирования
прибавлением
консервирующих веществ (борная
кислота или азид натрия);
■ должна иметь точную паспортизацию, т. е. обозначение груп■
81
повой принадлежности, титра,
срока годности, номера серии и
наименования учреждения, ее изготовившего. Все эти сведения должны быть обозначены на этикетке,
наклеиваемой на флакон (ампулу)
со стандартной сывороткой.
Срок годности стандартной сыворотки устанавливается 6 мес. с момента
ее розлива.
Сыворотку, срок годности которой
истек, можно проверить, и при усло
вии, если она сохранила без изменения
свои свойства, продлить срок годности
еще на 2 мес.
При проверке в специализированной лаборатории подтверждают, что
сыворотка:
■ специфична, т. е. содержит агглютинины α, β (3 или оба вместе) и не
вызывает неспецифической агглютинации эритроцитов);
■ активна, т. е. вызывает первые признаки агглютинации в течение пер
вых 30 с — с эритроцитами групп
А, и В и в течение 1 мин. — с эритроцитами группы А2 и имеет титр
агглютининов не ниже 1:32 по отношению к эритроцитам А и В и не
ниже 1:16 — по отношению к эритроцитам А2;
■ не оказывает на эритроциты гемолизирующего действия;
■ прозрачная; допускается небольшая опалесценция;
■ предохранена от инфицирования
консервированием;
■ имеет точную паспортизацию.
В стандартный комплект включают
в равных количествах сыворотки групп
0 (I), А (II) и В (III). Сыворотку группы
АВ (IV) выдают по 1 мл на 15 мл общего количества сыворотки других трех
групп. При выдаче сыворотки к ней
обязательно прикладывают инструкцию по использованию.
82
Текстовый модуль 2
Определение групповой
принадлежности крови
по системе АВ0
Возможны два способа определения группы крови.
1. Определение группы крови при помощи стандартных изогемагглютинирующих сывороток.
При этом способе в крови устанавливают наличие или отсутствие агглютиногенов и, исходя из этого, делают
заключение о групповой принадлежности исследуемой крови.
2. Определение группы крови перекрестным способом, т. е.
одновременно при помощи стандартных изогемагглютинирующих сывороток и стандартных эритроцитов.
При этом способе, так же как и при
первом, определяют наличие или отсутствие агглютиногенов и, кроме того,
О (I)
Тема 5
при помощи стандартных эритроцитов
устанавливают наличие или отсутствие
групповых агглютининов.
Группа крови у больных и других
лиц, которым предполагается сделать
переливание крови, определяется сертифицированным специалистом, имею
щим специальную подготовку. Во избежание ошибки процедуру взятия крови
и определения группы повторяют.
Результат определения группы
крови записывается в правом верхнем
углу лицевого листа истории болезни
с указанием даты, номера сывороток
двух серий и за подписью специалиста,
производившего определение.
Группа крови у доноров определяется два раза сертифицированным
специалистом: один раз при первичном обращении донора при помощи
стандартных сывороток двух различ-
А (II)
Кровь 0 (I группы) — отсутствие агглютинации
с сыворотками групп 0 (I), А (II), В (III)
В (III)
Кровь А (II группы) — наличие агглютинации
с сыворотками групп 0 (I), В (III)
АВ (IV)
Кровь B (III группы) — наличие агглютинации
с сыворотками групп 0 (I), А (II)
Кровь AB (IV группы) — наличие агглютинации
с сыворотками групп 0 (I), А (II), В (III)
Рис. 33. Определение группы крови при помощи стандарных сывороток на плоскости
ных серий каждой группы, и второй
раз при окончательном зачислении
в доноры — перекрестным способом,
т. е. одновременно при помощи стандартных сывороток (также двух различных серий каждой группы) и стандартных эритроцитов. Результаты
обоих определений записываются на
лицевой стороне донорского журнала
(карты) с указанием даты и за подписью лиц, определявших группу крови.
Определение группы крови
системы АВ0 простой реакцией
Методика определения.
Определение группы крови производят при хорошем освещении и темпе
ратуре от 15 до 25°С на планшетах. На
левой стороне планшета надписывают
0 (I), в середине — А (II), на правой
стороне — В (III) группы крови. В середине верхнего края планшета отмечают фамилию донора или номер исследуемой крови. Используют активные
стандартные сыворотки трех групп (0,
А, В) с титром не ниже 1:32 двух серий.
Сыворотки располагают в специальных
штативах в два ряда (рис. 32). Каждой
сыворотке соответствует маркированная пипетка. Для дополнительного
контроля используют сыворотку группы АВ (IV). Сыворотка первой группы
бесцветная, второй — синего, третьей—
красного, четвертой — желтого цвета.
На этикетке первой группы сыворотки
нет полос, на второй — две синие полосы, на третьей — три красные полосы,
на четвертой — четыре желтые полосы.
На планшет наносят по 1-2 капли
стандартных сывороток двух серий в
два ряда: сыворотку группы 0 (I) — слева, сыворотку группы А (II) — в середину, сыворотку группы В (III) — справа.
Капли крови из пальца или пробирки наносят пипеткой или стеклянной палочкой около каждой капли сы-
83
воротки и смешивают в каждой лунке
отдельно палочкой. Количество крови
должно быть в 8-10 раз меньше, чем
сыворотки. После смешивания тарелку
или планшет осторожно покачивают в
руках, что способствует более быстрой
и четкой агглютинации эритроцитов.
По мере наступления агглютинации,
но не ранее чем через 3 мин., к каплям
сыворотки с эритроцитами, где наступила агглютинация, добавляют по 1-2
капли 0,9% раствора хлорида натрия и
продолжают наблюдение до истечения
5 мин. Через 5 мин. читают реакцию в
проходящем свете. Если агглютинация
нечеткая, к смеси сыворотки и крови
дополнительно добавляют по 1 капле
0,9% раствора хлорида натрия, после
чего дают заключение о групповой
принадлежности
Результаты реакции.
1. Отсутствие агглютинации во
всех 3 каплях указывает на то, что в ис
следуемой крови нет агглютиногена,
т. е. кровь относится к группе 0 (I).
2. Наступление
агглютинации
в каплях с сыворотками 0 (I) и В (III)
указывает на то, что в крови имеется
аггглютиноген А, т. е. кровь относится
к группе А (II).
3. Наличие агглютинации в кап
лях с сыворотками группы 0 (I) и А (II)
указывает на то, что в исследуемой крови имеется агглютиноген В, т. е. кровь
группы В (III).
4. Агглютинация во всех 3 каплях
указывает на наличие в исследуемой
крови агглютиногенов А и В, т. е. кровь
относится к группе АВ (IV). Однако в
этом случае, учитывая, что агглютинация со всеми сыворотками возможна за
счет неспецифической реакции, необходимо нанести на планшет или тарелку
2-3 капли стандартной сыворотки группы АВ (IV) и добавить к ним 1 каплю
исследуемой крови. Сыворотку, а также
84
Текстовый модуль 2
Тема 5
Определение группы крови
системы АВ0 двойной реакцией
(по стандартным сывороткам
и стандартным эритроцитам)
Стандартные эритроциты представляют собой 10-20% взвесь свежих
нативных эритроцитов (или отмытых
от консерванта тест-клеток) группы
0 (I), А (II) и В (III) в 0,9% растворе
хлорида натрия или цитратно-солевом
растворе. Нативные стандартные эритроциты могут быть использованы в
течение 2-3 дней при условии хранения
их в изотоническом солевом растворе
при температуре 4°С. Консервированные стандартные эритроциты хранят
при температуре 4°С в течение 2 мес. и
отмывают от консервирующего раствора перед использованием.
Ампулы или флаконы со стандартными сыворотками и стандартными
эритроцитами располагают в специальных штативах с соответствующей мар
кировкой. Для работы с типирующими
реагентами используют сухие чистые
пипетки, отдельные для каждого реаген-
Испытуемая сыворотка содержит агглютинины α
и β, т.е. принадлежит к группе крови 0 (I) — агглю
тинация со стандартными эритроцитами групп А и В
и отсутствие агглютинации со стандартными эри
троцитами группы 0.
Испытуемая сыворотка содержит агглютинин β, т.е.
принадлежит к группе крови Аβ (II) — агглютинация
со стандартными эритроцитами группы В и отсут
ствие агглютинации со стандартными эритроцитами
групп 0 и А.
кровь перемешивают и результат реакции наблюдают в течение 5 мин.
Если агглютинация не наступила,
то исследуемую кровь относят к груп
пе АВ (IV). Если же агглютинация появляется с сывороткой группы АВ (IV),
значит, реакция неспецифическая. При
слабой агглютинации и во всех сомни
тельных случаях кровь заново проверяют со стандартными сыворотками
других серий (рис. 33).
та. Для промывания стеклянных (пла
стмассовых) палочек и пипеток подготавливают стаканы с 0,9% раствором
хлорида натрия.
Для определения группы берут 3-5
мл крови в пробирку без стабилиза
тора. Кровь должна отстояться в течение 1,5-2 ч при температуре 15-25°С.
Методика определения
На планшет наносят по 2 капли
(0,1 мл) стандартных сывороток групп
0 (I), А (II), В (III) двух серий. Соответственно каждой группе сывороток
располагают по 1 маленькой капле
(0,01 мл) стандартных эритроцитов
групп 0 (I), А (II), В (III). В стандартные
сыворотки добавляют по 1 капле иссле
дуемой крови, а в стандартные эритроциты — по 2 капли исследуемой сыво
ротки. Количество крови должно быть в
8-10 раз меньше, чем сыворотки. Капли
перемешивают стеклянными палочками
и, покачивая планшет в руках в течение
3 мин., следят за наступлением агглютинации. Если агглютинация нечеткая, к
смеси сыворотки и крови дополнительно добавляют по 1 капле 0,9% раствора хлорида натрия (0,1 мл), после чего
ожидают еще 2 мин. и делают заключение о групповой принадлежности.
1. Наличие агглютинации со стандартными эритроцитами А и В и отсут
ствие агглютинации в трех стандартных
сыворотках двух серий указывает на то,
что в исследуемой сыворотке присутствуют оба агглютинина: α и β, а в исслеТаблица 4. Оценка групп крови при определении
с помощью моноклониальных антител
Испытуемая сыворотка содержит агглютинин α, т.е.
принадлежит к группе крови Вα (III) — агглютинация
со стандартными эритроцитами группы А и отсут
ствие агглютинации со стандартными эритроцитами
групп 0 и В.
Испытуемая сыворотка не содержит агглютининов,
т.е. принадлежит к группе крови АВо (IV) — отсутст
вие агглютинации со стандартными эритроцитами
групп 0, А и В.
Рис. 34. Оценка результатов определения группы крови системы АВ0
Анти А
Анти В
Группа
–
–
0 (I)
+
–
A (II)
–
+
B (III)
+
+
AB (IV)
85
дуемых эритроцитах нет агглютиногенов, т. е. кровь относится к группе 0 (I).
2. Наличие агглютинации со стандартными сыворотками групп 0 (I), В
(III) и со стандартными эритроцитами
группы В (III) указывает на то, что в
исследуемых эритроцитах имеется агглютиноген А, а в исследуемой сыво
ротке — агглютинин β . Следовательно,
кровь относится к группе А (II).
3. Наличие агглютинации со
стандартными сыворотками групп 0
(I), А (II) и со стандартными эритроцитами группы А (II) указывает на то, что
в исследуемых эритроцитах имеется
агглютиноген В, а в исследуемой сыво
ротке агглютинин α. Следовательно,
кровь относится к группе В (III).
4. Наличие агглютинации со
всеми стандартными сыворотками
и отсутствие агглютинации со всеми
стандартными эритроцитами указывает на то, что в исследуемых эритроцитах имеются оба агглютиногена, т. е.
кровь относится к группе АВ (IV).
Кроме того, существует методика
определение группы крови с помощью
моноклониальных антител — стандартных цоликлонов анти-А, анти-В
(табл. 4).
Ошибки при определении
групповой принадлежности
Ошибки при определении групп
крови могут зависеть от трех причин:
1. технических;
2. неполноценности стандартных сывороток и стандартных эритроцитов;
3. биологических особенностей исследуемой крови.
■
■
1. Ошибки
по техническим причинам:
неправильное расположение сывороток на планшете;
неправильные количественные соотношения сывороток и эритроцитов;
86
■
■
■
■
■
■
Текстовый модуль 2
применение недостаточно чистых
планшетов и других предметов,
соприкасающихся с кровью. Для
каждой сыворотки должна быть отдельная пипетка; для промывания
пипеток следует применять только
0,9% раствор хлорида натрия;
неправильная запись исследуемой
крови;
несоблюдение положенного для
реакции агглютинации времени;
при поспешности, когда реакцию
учитывают до истечения 5 мин.,
агглютинация может не наступить,
если в исследуемой крови имеются
слабые агглютиногены; при передержанной более 5 мин., реакции
может произойти подсыхание капель с краев, симулирующее агглютинацию, что также приведет к
ошибочному заключению;
отсутствие агглютинации из-за высокой (выше 25°С) температуры
окружающего воздуха. Во избежание этой ошибки целесообразно:
использовать специально приготовленные сыворотки для работы
в условиях жаркого климата; производить определение групп крови
на тарелке или пластмассовом подносе, внешняя поверхность дна которых опущена в холодную воду;
неправильное центрифугирование:
недостаточное — может привести
к ложноотрицательному результату, а избыточное — к ложноположительному.
2. Ошибки от применения еполноценных стандартных сывороток и стандартных эритроцитов:
слабые стандартные сыворотки с титром ниже 1:32 или с истекшим сроком годности могут вызывать позднюю или слабую агглютинацию;
Тема 5
■
■
■
применение негодных стандартных
сывороток или эритроцитов, кото
рые были приготовлены нестерильно и недостаточно законсервированы, ведет к возникновению
неспецифической «бактериальной»
агглютинации.
3. Ошибки от биологических
особенностей исследуемой
крови:
А) Ошибки от биологических особенностей исследуемых эритроцитов:
поздняя и слабая агглютинация
объясняется «слабыми» формами
антигенов эритроцитов, чаще — наличием в группах А и АВ слабого
агглютиногена А2. При этом в случае определения группы крови без
исследования сыворотки на наличие агглютининов (простая реакция) могут наблюдаться ошибки,
вследствие которых кровь группы
А2В определяют как группу В (III),
а кровь А2 — как группу 0 (I). Поэтому во избежание ошибок определение группы крови как доноров, так
и реципиентов необходимо проводить с использованием стандартных эритроцитов (двойная, или
перекрестная реакция). Для идентификации агглютиногена А2 рекомендуется повторить исследова
ние с другими видами (сериями)
реагентов, используя другую лабораторную посуду, с увеличением времени регистрации реакции.
Специфическими реагентами уточнения группы крови при наличии
слабых вариантов антигена А (А1,
А2, А3) методом прямой реакции
агглютинации являются цоликлон
анти-Асл и реагент анти-А1;
«панагглютинация» или «аутоагглютинация» — это способность
крови давать одинаковую неспец-
■
ифическую агглютинацию со всеми
сыворотками и даже со своей собственной. Интенсивность подобной
реакции после 5 мин. ослабевает, в
то время как истинная агглютинация усиливается. Наиболее часто
встречаются у гематологических,
онкологических больных, обож
женных и др. Для контроля рекомендуется оценить, происходит ли
агглютинация тестируемых эритроцитов в стандартной сыворотке
группы АВ (IV) и в физиологическом растворе. Группа крови при
«панагглютинации» может быть
определена после трехкратного
отмывания эритроцитов. Для ус
транения неспецифической агглютинации планшет помещают в
термостат при температуре 37°С на
5 мин., после чего неспецифическая
агглютинация исчезает, а истинная
остается. Целесообразно повторить
определение с использованием моноклональных антител, постановки
пробы Кумбса. В том случае, когда
отмывание эритроцитов не дает
желаемого результата, необходимо
произвести повторное взятие образца крови в предварительно согретую пробирку, поместить пробу
в термоконтейнер для поддержания
температуры 37°С и доставить в лабораторию на исследование. Определение группы крови необходимо
производить при температуре 37°С,
для чего используют реактивы, физиологический раствор и планшет,
предварительно подогретые;
эритроциты тестируемой крови
складываются в «монетные столбики», которые при макроскопии
можно принять за агглютинаты.
Прибавление 1-2 капель изотонического раствора 0,9% хлорида натрия с последующим мягким пока-
■
■
■
87
чиванием планшета, как правило,
уничтожает «монетные столбики»;
смешанная или неполная агглютинация: часть эритроцитов агглюти
нирует, а часть остается свободной.
Результат «химеры» определяется
состоянием, при котором в крови
содержится две или более популяции клеток — продуктов различных
источников эритропоэза. Возможны
генетические химеры (анастомоз
или соединение тканей близнецов
в раннем эмбриональном периоде).
К этой категории относят проявляющийся тканевой мозаикой химеризм, вследствие оплодотворения
одной яйцеклетки двумя разными
сперматозоидами. Чаще встречаются
«искусственные» химеры — последствие переливания крови, пересадки
аллогенного костного мозга или фетоматеринского кровотечения;
«полиагглютинация» — эритроциты агглютинируются АВ0 — совместимыми сыворотками (за
исключением сыворотки плода).
Аутоконтроль, как правило, отрицательный. В обычной сыворотке
крови нормальных людей при
сутствуют полиагглютинины, реагирующие с аномальными структурами поверхности эритроцита.
Эти аномальные структуры могут
возникать в результате: действия
микробных ферментов; соматических мутаций кроветворной ткани;
наследственных заболеваний;
чаще полиагглютинация регистрируется в период вирусной или
бактериальной инфекции (а по
выздоровлении исчезает), когда
микробные ферменты, действуя на
эритроциты, «обнажают» скрытые
антигены (криптантигены) — Т, Тк,
ТЬ, VА. Анти-Т содержится во всех
сыворотках взрослых и отсутству-
88
■
■
■
■
Текстовый модуль 2
ет в большинстве сывороток пуповинной крови, что позволяет ис
пользовать последнюю в качестве
реагента для дифференциальной
диагностики;
еще одной причиной полиагглютинации может быть «приобретенный»
антиген В, который обнаруживают у
А1-позитивных лиц с заболеваниями дистального отдела кишечника,
карциномой прямой кишки, кишечной непроходимостью, грамотрицательной бактериемией, гангреной
нижних конечностей.
Б) Ошибки, происходящие от биологических особенностей исследуемой
сыворотки:
выявление антител другой спе
цифичности при рутинном тести
ровании является результатом
предшествующей сенсибилизации.
Целесообразно определить специ
фичность антител и подобрать типи
рованные эритроциты без антигена,
к которому выявлена иммунизация.
Иммунизированному реципиенту
обязателен индивидуальный подбор совместимой донорской крови;
при выявлении образования «монетных столбиков» стандартных
эритроцитов в присутствии тестируемой сыворотки аномальный
результат целесообразно подтвердить, используя стандартные эритроциты группы 0 (I). Для дифференцировки «монетных столбиков»
и истинных агглютинатов добав
ляют 1-2 капли изотонического
раствора хлорида натрия и покачивают планшет, при этом «монетные столбики» разрушаются;
отсутствие анти-А или анти-Вантител. Возможно у новорожденных и пациентов с угнетением гуморального иммунитета;
Тема 5
■
■
агглютинация стандартных эритроцитов, в том числе группы 0 (I), при
наличии исследуемой сыворотки,
связана с присутствием специфических и неспецифических холодовых антител. Исчезновение
агглютинации при проведении исследования при температуре 37°С
верифицирует
неспецифические
холодовые агглютинины. Если
исследуемая сыворотка взаимодействует с некоторыми образцами
эритроцитов группы 0 (I), то это
свидетельствует о присутствии в
сыворотке специфических холодовых антител. Для установления
специфичности антител проводят
тестирование с панелью эритроцитов, типированных по системам Р,
МNS и др.;
наличие в плазме АВ-подобных
субстанций (секретируемых некоторыми опухолями), которые
связываются с диагностическим
реагентом, препятствуя взаимодействию последнего с эритроцитом.
В этом случае необходимо отмыть
эритроциты.
Метод определения резуспринадлежности крови
Существует метод определения
резус-фактора с помощью стандартных
сывороток анти-резус, и 10% желатина, подогретого до 46-48ОС и др.
Реакцию с помощью стандартных
антирезусных сывороток двух серий
производят в центрофужных пробирках (рис. 35).
В пробирку вносят 1 каплю исследуемых эритроцитов, 2 капли сыворотки анти-резус и 2 капли 10%
желатина, подогретого до 46-48ОС.
Содержимое встряхивают, помещают
в водяную баню с t° 46-48ОС и через
5 мин. добавляют физ. раствор, подо-
а
89
в
б
д
е
г
+37°
ж
Рис. 35. Необходимые принадлежности для определения Rh: а — 5% раствор лимоннокислого натрия,
б — стандартные сыворотки антирезус двух серий, в —
специальные пробирки (высота — 2–2,5 см, диаметр —
0,5-0,6 см) в штативе, г — матовая лампа, д — стан
дартные резус-положительные и резус-отрицательные
эритроциты групп крови О, А и В, е — физиологический
раствор NaCl, ж — лупа с 6-кратным увеличением
гретый до t° 46-48ОС и оценивают результат (рис. 36).
Реакция гемагглютинации на
плоскости с помощью анти-D
IgM (полные антитела) моноклонального реагента
Определение производят в нативной крови, стабилизированной с помощью консервантов; в крови без антикоагулянта, в том числе взятой из пальца.
Наиболее четкая реакция агглютинации наблюдается при использовании
высокой концентрации эритроцитов и
температуре около 37°С, поэтому желательно применять подогретую пластинку.
Методика определения:
■ на пластинку со смачиваемой поверхностью наносят большую каплю (около 0,1 мл) реагента;
■ рядом помещают маленькую каплю
(0,01-0,05 мл) исследуемой крови;
Рис. 36. Трактовка результатов. Положительный ре
зультат: при наличии агглютинации в виде красных зерен или хлопьев на прозрачном, почти обесцвеченном
фоне жидкости, т. е. кровь содержит Rh. Отрицатель
ный результат: в пробирке видна равномерно окрашенная в розовый цвет, слегка опалесцирующая жидкость
смешивают кровь с реагентом стеклянной палочкой;
■ через 10-15 с. покачивают пластинку в течение 20-30 с.;
■ реакция агглютинации начинает
развиваться через 10-15 с., четко
выраженная
крупнолепестковая
агглютинация наступает через 3060с. Результат агглютинации следует учитывать через 3 мин., поскольку с эритроцитами, несущими
антиген Du, реакция агглютинации
происходит медленнее.
Наличие агглютинации свидетельствует о присутствии в исследуемых
эритроцитах антигена D (кровь —
резус-положительная). Отсутствие аг
глютинации свидетельствует о том, что
исследуемые эритроциты не содержат антигена D (кровь — резус-отрицательная).
В случае слабой агглютинации делают
предположение о наличии на эритроцитах слабого антигена D и проводят
исследование фенотипа эритроцитов в
непрямом антиглобулиновом тесте (непрямой пробе Кумбса) с использованием
IgG (неполных) анти-О-антител.
Сразу же после определения записывают результаты реакции.
■
90
Текстовый модуль 2
Современная трансфузионная терапия, согласно определению выдаю
щегося советского трансфузиолога и
хирурга А.Н. Филатова (1973), есть
раздельное или сочетанное применение
крови, ее компонентов и препаратов,
а также кровезамещающих растворов.
Прежде чем приступить к переливанию крови и ее компонентов, каждый врач должен помнить, что гемотрансфузия не является безразличным
вмешательством и иногда представляет серьезную опасность для состояния здоровья и даже жизни больного.
Кровь — одна из тканей организма,
поэтому переливание крови от одного
индивидуума другому может рассмат
риваться как операция по трансплантации ткани.
Правило Оттенберга
Закон Оттенберга, согласно которому агглютинируют только эритроциты
перелитой донорской крови ( а не эритроциты реципиента), учитывая, что
агглютинины донорской крови разводятся в крови реципиента и не способны агглютинировать его эритроциты.
Это обстоятельство разрешает переливать наравне с одногруппной и кровь
другой группы, сыровотка которой не
агглютинировала эритроциты реципиента.
На практике использовалась следующая схема: реципиенту 0(І) группы
допустимо переливать донорскую кровь
только 0(І) группы, реципиентами А(ІІ)
группы — донорскую кровь А(ІІ) и 0(І)
групп, реципиентам В(ІІІ) группы — донорскую кровь В(ІІІ) и 0(І) групп, реципиентам АВ(ІV) групп — донорскую
кровь всех четырех групп. Доноров с
0(І) группой крови еще называют «универсальными донорами», а реципиентов
с АВ(ІV) группой — «универсальными
реципиентами».
Тема 5
Показания к гемотрансфузии
Для определения показаний к гемотрансфузии необходимо знать меха
низм влияния на организм пациента
перелитой крови.
Механизм действия
перелитой крови
Биологические эффекты гемотрансфузии обусловлены сложнейшими регуляторными механизмами. Перелитая кровь действует на элементы
нервной рецепции, а также ферментные и гормональные системы обмена,
изменяя его на всех уровнях: от молекулярного до органотканевого.
Перелитая кровь оказывает
на организм реципиента
следующие воздействия:
■ заместительное;
■ гемодинамическое;
■ иммунологическое;
■ гемостатическое;
■ стимулирующее.
Заместительный эффект
Заместительное действие заключается в возмещении утраченной организ
мом части крови. Введенные в организм
эритроциты восстанавливают объем
крови и ее газотранспортную функцию.
Лейкоциты повышают иммунные способности организма. Тромбоциты корригируют систему свертывания крови.
Плазма и альбумин обладают гемодинамическим действием. Иммуноглобулины плазмы создают пассивный иммунитет. Факторы свертывания крови
и фибринолиза регулируют агрегатное
состояние крови. Вводимые вместе с
кровью питательные вещества (жиры,
белки и углеводы) включаются в цепь
биохимических реакций.
Эритроциты перелитой крови
функционируют в сосудистом русле
91
реципиента до 30 и более суток. Клетки белой крови покидают сосудистое
русло вскоре после переливания, белки плазмы донорской крови циркулируют в сосудистом русле реципиента
18-36 дней.
тистафилококковая, антисинегнойная
и противоожоговая плазма, иммуноглобулины направленного действия
(антистафилококковый,
противококлюшный, противостолбнячный иммуноглобулины и др.).
Гемодинамический эффект
Переливание крови оказывает всестороннее воздействие на сердечно-со
судистую систему. У больных с острой
кровопотерей и травматическим шоком
оно приводит к стойкому увеличению
ОЦК, увеличению венозного притока к
правым отделам сердца, усилению работы сердца и повышению минутного
объема крови.
Оживляется микроциркуляция: расширяются артериолы и венулы, рас
крывается сеть капилляров, в них ускоряется движение крови, сокращаются
артериовенозные шунты, в результате
чего редуцируется утечка крови из артериальной системы в венозную. Через
24-48 ч. после переливания крови у реципиента начинается усиленный приток
тканевой лимфы в кровеносное русло,
что также увеличивает ОЦК. Поэтому
иногда после трансфузии прирост ОЦК
превосходит объем перелитой крови.
Гемостатический эффект
Переливание крови оказывает стимулирующее действие на систему гемо
стаза реципиента, вызывая умеренную
гиперкоагуляцию, обусловленную увеличением тромбопластической и снижением антикоагулянтной активности
крови. Переливание небольших доз
(обычно 250 мл) теплой крови или
крови с малым сроком хранения (до
3 сут.) оказывает существенное гемостатическое действие благодаря активности вводимых с ней тромбоцитов и
прокоагулянтов — факторов свертывающей системы.
Особым гемостатическим действием обладают специальные виды плазмы (антигемофильная, викасольная) и
гемостатические препараты (фибрино
ген, криопреципитат, протромбиновый
комплекс, тромбоцитная масса и плаз
ма, обогащенная тромбоцитами).
В то же время переливание массивных доз донорской крови,в отдельных
случаях может нарушить гемостатический баланс вплоть до развития диссеминированного внутрисосудистого
свертывания крови (ДВС-синдром).
Иммунологический эффект
Гемотрансфузия усиливает иммунологические свойства организма
реципиента. Вводятся гранулоциты,
макрофагальные клетки, лимфоциты,
комплемент, иммуноглобулины, цитокины, различные антибактериальные и антитоксичные антитела и пр.,
возрастает фагоцитарная активность
лейкоцитов, активируется образование
антител.
Особенно высоким иммунобиологическим действием обладают гипериммунные препараты плазмы, полученные
от иммунизированных доноров, — ан-
Стимулирующий эффект
После переливания крови в организме развиваются изменения, аналогичные стрессу. Происходит стимуляция
гипоталамо-гипофизарноадреналовой систем, что подтверждается увеличением содержания кортикостероидов в крови и моче реципиентов в посттрансфузионном периоде.
У реципиентов повышается основной
92
Текстовый модуль 2
обмен, увеличивается дыхательный
коэффициент, повышается газообмен. Переливание крови оказывает
стимулирующее действие на факторы
естественного иммунитета: повышается фагоцитарная активность гранулоцитов и выработка антител в ответ на
действие тех или иных антигенов.
Абсолютные и относительные
показания к гемотрансфузии
Все показания к переливанию крови и ее компонентов можно разделить
на: абсолютные и относительные.
Абсолютные показания
К абсолютным показаниям относятся случаи, когда выполнение гемо
трансфузии обязательно, а отказ от нее
может привести к резкому ухудшению
состояния больного или даже смерти.
К абсолютным показаниям относятся:
■ острая кровопотеря (более 21%
ОЦК);
■ травматический шок II — III степени.
Относительные показания
Все остальные показания к трансфузии, когда переливание крови играет
лишь вспомогательную роль среди других лечебных мероприятий, являются
относительными.
Основные относительные показания к гемотрансфузии:
■ анемия;
■ заболевания воспалительного характера с тяжелой интоксикацией;
■ продолжающееся кровотечение;
■ нарушения свертывающей системы;
■ снижение иммунного статуса организма;
■ длительные хронические воспалительные процессы со снижением
регенерации и реактивности;
■ некоторые отравления.
Тема 5
Учитывая распространенность кровезамещающих препаратов, выполня
ющих большую часть функций крови,
в настоящее время основным относи
тельным показанием к гемотрансфузии
является анемия. Ориентировочным
уровнем анемии, при котором переливание крови становится методом
выбора, считают снижение гемоглобина ниже 80 г/л и гематокрита — ниже
30%.
Противопоказания
к гемотрансфузии
Гемотрансфузия связана с введением в организм значительного количе
ства продуктов распада белков, что приводит к увеличению функциональной
нагрузки на органы дезинтоксикации и
выделения. Введение дополнительного
объема жидкости в сосудистое русло
существенно увеличивает нагрузку на
сердечно-сосудистую систему. Гемотрансфузия приводит к активизации
всех видов обмена в организме, что
делает возможным обострение и стимуляцию патологических процессов
(хронические воспалительные заболевания, опухоли и пр.).
Выделяют абсолютные и относительные противопоказания к перелива
нию крови.
Абсолютным
противопоказанием к гемотрансфузии является
острая сердечно-легочная недостаточность, сопровождающаяся отеком
легких.
Однако при наличии массивной
кровопотери и травматического шока
II—III степени абсолютных противопоказаний для переливания нет, и кровь
следует переливать всегда.
Относительными противопоказаниями являются: свежие тромбозы и эмболии, тяжелые расстройства
мозгового кровообращения, ишемиче-
ская болезнь сердца, септический эндокардит, пороки сердца, миокардиты
с недостаточностью кровообращения
IIб-III степени, гипертоническая болезнь III стадии, тяжелые функциональные нарушения печени и почек,
заболевания, связанные с аллергизацией организма (бронхиальная астма,
поливалентная аллергия), остротекущий и диссеминированный туберкулез,
ревматизм, особенно с ревматической
пурпурой. При указанных заболеваниях прибегать к гемотрансфузии следует
с особой осторожностью.
Донорство
Заготовку крови, ее консервацию,
разделение на компоненты и изготовление препаратов осуществляют
станции переливания крови или специальные отделения в больницах. Для
получения препаратов крови используют специальные сепарирующие, морозильные, лиофилизирующие установки. Основным источником крови
являются доноры.
Любой здоровый гражданин может
стать донором. В нашей стране донорство добровольное. Состояние здоровья доноров проверяют при обследовании. Обязательно проводят реакцию
Вассермана на сифилис, исследование
на носительство вирусов гепатита и
СПИДа.
Забор крови у доноров
93
Для переливания может быть использована утильная кровь, при этом
первостепенное значение имеет плацентарная кровь. Ее собирают сразу
же после рождения ребенка и перевязки пуповины. С соблюдением асептики вытекающую из сосудов пуповины
кровь собирают в специальные сосуды
с консервантом. Из утильной крови
готовят препараты: протеин, тромбин,
фибриноген и др. Из одной плаценты
получают до 200 мл крови.
Существует методика заготовки,
хранения и переливания трупной крови, идея которой принадлежит В.Н.
Шамову. Много сделал для ее широкого практического применения С.С.
Юдин. Используют кровь от трупов
практически здоровых людей, умерших внезапно, без длительной агонии, от случайных причин (закрытые
травматические повреждения, острая
сердечно-сосудистая недостаточность,
поражения электрическим током и
др.). Кровь внезапно умерших отличается тем, что в течение 1-4 ч. после
смерти она не свертывается вследствие
выпадения фибрина (дефибринированная кровь). Кровь берут в сроки не
позже 6 ч. после смерти. Вытекающую
из вен самотеком кровь с соблюдением
правил асептики собирают в специальные емкости и используют для переливания или приготовления компонентов или препаратов крови. От трупа
можно получить от 1 до 4 л крови. Полученную из разных источников кровь
на станциях заготовки расфасовывают, проверяют на групповую (система
АВ0) и резус-принадлежность, а также
проводят полное обследование. Ампулы или пакеты с кровью маркируют с
указанием объема, даты изготовления,
групповой и резус-принадлежности.
Важным источником крови является больной, у которого в предопераци-
94
Текстовый модуль 2
онном периоде производится изъятие
крови с последующей ее консервацией
и переливанием ему же во время операции (аутогемотрансфузия).
Возможно использование крови,
излившейся в серозные полости (плевральную, брюшную) при заболеваниях
или травматических повреждениях, —
аутокровь. Такая кровь не нуждается
в проведении проб на совместимость
и вызывает меньше реакций при переливании.
Гемоконсерванты
и взвешивающие растворы
Вскоре после открытия стабилизирующего действия цитрата в 1915 г.
Р. Льюисон определил его минимально
необходимое количество, что снизило
потенциальную токсичность и повысило безопасность гемотрансфузий.
Добавление к консервированной
крови декстрозы (глюкозы) П. Роусом
и П. Турнером в 1916 г. позволило повысить жизнеспособность хранящихся эритроцитов. В 1943 г. Д. Лутит и
П. Моллисон создали ACD (acid-citrate-de- xtrose), с которым консервированную кровь можно было хранить в
течение 21 дня. В состав этого гемоконсервирующего раствора входили:
■ трехзамещенная натриевая соль лимонной кислоты — средний цитрат;
■ лимонная кислота;
■ декстроза.
Кислые консервирующие растворы
более благоприятны для сохранения
эритроцитов жизнеспособными и обеспечивают возможность совместной
стерилизации цитрата и глюкозы без
наступления карамелизации. Лимонная
кислота применяется как стабилизатор
при приготовлении глюкозоцитратных
консервантов вместе с подщелачивающими веществами в целях достижения
нужного рН консерванта.
Тема 5
На смену ACD в конце 1950-х гг.
пришел раствор CPD (citrate-phosphatedextrose), созданный Д. Гибсоном в
1957 г. Менее кислый CPD обеспечивал более высокий уровень 2,3-ДФГ в
эритроцитах по сравнению с ACD в течение 21 дня.
Добавление аденина к CPD в 1978г.
(раствор CPDA-1) позволило увеличить
срок хранения консервированной крови и приготовленного из нее концен
трата эритроцитов до 35 дней. Аденин
быстро диффундирует в эритроциты,
связывается с фосфорибозилпирофосфатом и образует аденозинмонофосфат
(АМФ). Последний фосфорилируется
до АТФ, таким образом, в хранящихся
клетках компенсируется необратимая
потеря адениновых групп из распадающегося АМФ.
Следует иметь в виду, что при приготовлении концентрата эритроцитов
половина аденина остается в плазме,
а некоторое его количество выходит из
эритроцитов. Таким образом, аденин
попадает в организм реципиента, где
может частично трансформироваться
в 2,8-гидроксиаденин — плохо растворимый и в больших количествах потенциально нефротоксичный метаболит.
Логичнее добавлять аденин не в
раствор с антикоагулянтом для цельной крови, а в раствор, взвешивающий
(ресуспендирующий) эритроциты. Поэтому следующий шаг по повышению
эффективности разделения крови и
качества консервированных гемокомпонентов был предпринят в 1983 г. —
созданием систем с дополнительными взвешивающими растворами для
эритроцитов. После разделения крови
эритроцитная масса (концентрат) стерильно смешивается с дополнительным раствором, при этом образуется
эритроцитная взвесь, которую можно
хранить до 42 суток.
95
В нашей стране утверждены к применению следующие отечественные
растворы для консервирования крови:
Раствор стерилизуют в автоклаве
при 106°С 45 мин.
Срок хранения 35 дней.
1. «Глюгицир» — кислый глюкозоцитратный раствор:
- Цитрата натрия кислого 2,0 г
- Глюкозы безводной 3,0 г
- Воды бидистиллированной до 100,0 мл
- рН раствора 5,0
- 20 мл раствора на 80 мл крови
- рН крови в день заготовки 6,9-7,1
Раствор стерилизуют в автоклаве
при 120°С 30 мин.
Срок хранения 2 года.
«Цитроглюкофосфат» имеет ряд
преимуществ перед гемоконсервантом
«глюгицир». Наличие фосфатного буфера и повышение рН раствора до 5,7
обеспечивают более высокие значения
рН крови во все сроки наблюдения. Помимо этого, включаясь в обмен, неорганический фосфор стимулирует гли
колиз. В крови, заготовленной на этом
растворе, более длительно поддержи
ваются близкий к нормальному уровень 2,3-ДФГ и кислородтранспортная
функция эритроцитов.
Для консервирования крови широко применяют глюкозоцитратные растворы — ЦОЛИПК №7б; №8; №9312А,
Л-6; 14; 15 и др.
Также большое клиническое значение имеет консервирование катионитной крови без стабилизаторов. Обработанная катионообменной смолой
кровь приводит к поглощению Ca+ и
отдаче в кровь Na+, что в свою очередь
предотвращает свертывания.
В качестве биологических стабилизаторов используют гепарин и гирудин.
Гепарин чаще применяют при заготовке крови для аппаратов искусственного
кровообращения. Максимальный срок
хранения такой крови 1 сут. Гепаринизированная кровь — 50-60 мг гепарина
на 1 л. крови обеспечивают ее хорошую
стабилизацию.
Замораживание крови до ультранизких температур (-196°С) с защитными прибавками, такими как глюкоза, глицерин, поливинил-пирролидон
способствует хранению до 5 лет.
К сожалению, после распада
СССР прекратился выпуск «Циглюфада». «Цитроглюкофосфат» выпускается только в стеклянных бу-
2. «Цитроглюкофосфат» — глю
козо-фосфатный раствор с лимонной
кислотой:
- Кислоты лимонной в пересчете на
100% безводной 1,0 г
- Глюкозы безводной 3,0 г
- Натрий фосфата трехзамещенного
0,75 г
- Раствора едкого натра н. 1 до рН
5,5-5,9
- Воды бидистиллированной до 100,0 мл
- рН раствора 5,7
- 20 мл раствора на 80 мл крови
- рН крови в день заготовки 7,2
Раствор стерилизуют в автоклаве
при 106°С 45 мин.
Срок хранения 2 года.
3. Циглюфад — цитроглюкофосфат с аденином:
- Кислоты лимонной в пересчете на
100% безводной 12,0 г
- Глюкозы безводной 3,0 г
- Натрия фосфата трехзамещенного
0,75 г
- Аденина 0,034 г
- Раствора едкого натра 1н. до рН
5,5-5,9
- Воды бидистиллированной до 100,0 мл
- рН раствора 5,7
- рН крови в день заготовки 7,2
96
Текстовый модуль 2
тылках. Отечественные пластиковые
контейнеры для консервирования
крови — «Гемакон» — выпускаются
с «Глюгициром».
Исследования по совершенствованию технологии консервирования кро
ви продолжаются. Так, J.D. Sweeney и соавт. (2001) установили, что L-карнитин
(15 ммоль) уменьшает гемолиз хранящихся эритроцитов.Н.R. Hill и соавт. (2001) разработали экспериментальный взвешивающий раствор
EAS-61 (experimental additive solution),
позволяющий сохранять эритроциты
до 9 нед.
Изменения
в хранящейся крови
Изменения эритроцитов
при хранении цельной крови
Эритроциты цельной крови, стабилизированной любым антикоагулянтом без глюкозы, спустя 48 ч. хранения утрачивают жизнеспособность.
В растворы для хранения крови вводят
вещества, поддерживающие функциональное состояние клеток крови.
Поддержание жизнеспособности
эритроцитов при хранении коррелирует с внутриклеточным содержанием
аденозинтрифосфата (АТФ), потребление которого сокращается в 40 раз
при уменьшении температуры хранения до 4°С. Добавление в консервирующий раствор аденина повышает
уровень АТФ и жизнеспособность
эритроцитов.
Кислородтранспортная
функция
эритроцита коррелирует и связана с
промежуточным компонентом гликолиза — 2,3-дифосфоглицератом (2,3ДФГ), однако его использование в качестве маркера сохранности эритроцитов
дискутабельно, поскольку есть данные
о восстановлении уровня 2,3-ДФГ в
сосудистом русле реципиента от кри-
Тема 5
тического уровня (<50%) до нормы в
течение 8 ч.
Морфология эритроцитов изменяется: от дискоцитов к эхиноцитам
(шиповатая клетка, обратимая форма)
и далее — к сфероцитам (необратимая
форма). К необратимым изменениям
ведет «отпочкование» шипов с образо
ванием частиц размером 50-200 нм, содержащих гемоглобин и все компоненты клеточной мембраны, за исключе
нием спектрина. Как следствие,
происходит снижение деформируемости и увеличение вязкости клетки.
Кроме того, в мембране эритроцитов
изменяется распределение фосфолипидов, и при увеличении времени
хранения утрачивается комплементрегуляторная активность клеточной
поверхности.
На поверхности клетки снижается
содержание двух важных белков: фактора ускорения распада (CD55) и мембранного ингибитора реактивного лизиса, присоединяющихся к мембране
с помощью гликанфосфатидилинозитола (отсутствие последнего — причина острого внутрисосудистого гемо
лиза при пароксизмальной ночной
гемоглобинурии). Соответственно на
клетках накапливаются компоненты
комплемента, а устойчивость клетки
к комплементопосредованному лизису
снижается.
Изменения тромбоцитов
и лейкоцитов при хранении
цельной крови
Дискоидные тромбоциты цельной
крови, хранящейся при 4°С, быстро
трансформируются в сферические формы и их жизнеспособность утрачивается. При кратковременном хранении
эти изменения частично обратимы, но
выживаемость в организме реципиента
тромбоцитов цельной крови, храня-
щейся при 4°С в течение 8 ч., сокращается до 2 сут. Функциональная активность гранулоцитов и моноцитов резко
сокращается в течение 8 ч., независимо
от температуры хранения, а через 24 ч.
наступает дезинтеграция этих клеток.
Протеазы и другие продукты разрушения лейкоцитов активизируют гемолиз. Также лейкоциты и тромбоциты
формируют микроагрегаты, содержание которых к 35-м суткам хранения
цельной крови в 1 мл достигает 2000.
Контрольные вопросы по теме занятия
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
97
Основные антигенные системы крови.
Клеточные антигены.
Эритроцитарные антигены.
Лейкоцитарные антигены.
Способы определения группы крови.
Определение группы крови перекрестным способом.
Возможные ошибки, возникающие при определении групп крови.
Антигенная система резус-фактора.
Способы определения резус-фактора в условиях клиники.
Правило Оттенберга.
Показания к гемотрансфузии.
Противопоказания к гемотрансфузии.
Механизм действия перелитой крови.
Принципы консервации и стабилизации донорской крови.
Хранение донорской крови.
Тема 6
ТЕМА №6.
Переливание крови: мероприятия врача перед переливанием крови, пробы на совместимость. Пути и методы переливания крови. Осложнения при переливании крови и
их профилактика. Переливание компонентов крови. Источники получения крови, искусственная кровь, препараты крови, кровезаменители
1. Актуальность темы
Переливание крови является мощным средством лечения самых разно
образных заболеваний, а при ряде патологических состояний (кровотечения,
шок, большие хирургические операции) — единственным и незаменимым
средством спасения жизни больных.
Препараты крови, ее компоненты, а
также цельную кровь переливают не
только врачи хирургических специальностей (акушер-гинекологи, травматологи), но и терапевты, инфекционисты,
педиатры и др., поэтому знание основ
гемотрансфузиологии является не
отъемлемой частью подготовки будущего врача.
2. Учебные цели
■
■
■
■
■
■
■
Определить макроскопическую пригодность донорской крови;
Классифицировать препараты и
компоненты крови;
Организовать гемотрансфузию и
наблюдение за больным;
Классифицировать группы кровезаменителей;
Классифицировать возможные ошибки и осложнения при переливании
кампонентов и препаратов крови;
Обобщить меры профилактики
осложнений при гемотрансфузии.
Знать источники получения крови,
методы заготовки крови.
3. Самостоятельная работа
студентов
В настоящее время принято считать,
что единственным действием гемотерапевтических средств является заместительное — «протезирование» дефицита
структурно-функционального компонента крови пациента (эритроцитов,
тромбоцитов, белков плазмы). Из этой
парадигмы современной трансфузионной медицины вытекают несколько
важных следствий:
■ Недостаточно выработанные показания для переливания цельной
крови;
■ переливание гемокомпонентов с целью детоксикации, парентерального
питания, стимуляции защитных сил
организма и т. д. — недопустимо;
■ основными требованиями к компонентам и препаратам крови
являются безопасность, биологическая полноценность и клиническая
эффективность;
■ необходимо стремиться к использованию гемокомпонентов, максимально очищенных от «балластных» клеточных и гуморальных
примесей, не направленных на
реализацию замещения дефицита
функций крови;
■ срок непосредственного действия
гемотрансфузионного
средства
ограничен временем структурной
полноценности и функционально-
■
го эффекта перелитого компонента
крови (например, для эритроцитов — не более 120 дней);
учитывая потенциальную опасность аллогенных гемокомпонентов, необходимо строго ограничить
показания к их применению, максимально использовать методы,
альтернативные аллогенным гемотрансфузиям.
Н. И. Афонин (1999) рекомендует врачу перед назначением гемотрансфузии задать себе 10 вопросов.
1. Какое улучшение в состоянии больного ожидается в результате транс
фузии компонентов крови?
2. Можно ли минимизировать кровопотерю и избежать трансфузию
компонентов крови?
3. Можно ли использовать в данном
случае аутогемотрансфузию, реинфузию?
4. Какие абсолютные клинико-лабора
торные показания имеются у паци
ента для назначения трансфузии
компонентов крови?
5. Учтен ли риск передачи ВИЧ-ин
фекции, гепатита, сифилиса и другой инфекции при трансфузии компонентов крови?
6. Ожидается ли лечебный эффект
от трансфузии более значимый, чем
риск возможных осложнений, вызванных переливанием компонентов
крови данному пациенту?
7. Есть ли альтернатива переливанию
компонентов крови?
8. Предусмотрено ли наблюдение квалифицированного специалиста за
пациентом после трансфузии и его
немедленное реагирование в случае
появления реакции (осложнения)?
9. Сформулировано и записано ли показание (обоснование) в историю
99
болезни и заявка на компоненты
крови?
10. Если бы переливание потребовалось
мне в подобных обстоятельствах,
назначил бы я его себе?
Основными показаниями для
трансфузии компонентов крови являются восстановление или
поддержание:
■ объема крови;
■ кислородтранспортной
функции
крови;
■ гемостаза;
■ функции лейкоцитов.
Мероприятия, проводимые
при переливании крови
При поступлении больного в стационар и взятии на учет в поликлинике
группу крови по системе АВ0 определяет в плановом порядке врач-лаборант
или врач кабинета переливания крови. Бланк с результатом определения
вкладывается в историю болезни и переносится лечащим врачом на титульный лист истории болезни с обязательной подписью врача.
Накануне переливание крови врач,
готовящийся к переливанию, обязан
выяснить и отметить в истории болезни трансфузионный анамнез (когда ранее и сколько раз переливалась кровь и
какие наблюдались реакции). Больного следует опросить об аллергических
реакциях, у женщин дополнительно
следует выяснить число беременностей, в том числе и те, которые закончились абортом, так как и они влияют
на иммунизацию. Срок анализов крови и мочи не должен превышать один
день. В истории болезни отмечают показания к переливанию крови.
Перед переливанием крови осматривают кожу и слизистые оболочки
больного, определяют пульс на луче-
100
Текстовый модуль 2
вой артерии, измеряют артериальное
давление и температуру тела. Мочевой
пузырь должен быть опорожнен, при
необходимости его катетеризируют.
Трансфузию крови или ее компонентов производит лечащий врач,
дежурный врач, врач отделения или
кабинета переливания крови, во время операции — хирург или анестезиолог, непосредственно не участвующие
в операции или наркозе, или специальный врач-трансфузиолог.
Перед тем как приступить к переливанию компонента крови или цель
ной крови, необходимо убедиться в их
пригодности для переливания и иден
тичности групповой принадлежности
донора и реципиента по системам АВ0
и резус. Визуально, непосредственно
врачом, переливающим трансфузионную среду, проверяется герметичность
упаковки, правильность паспортизации, макроскопически оценивается
качество гемотрансфузионной среды.
Определять годность гемотрансфузионной среды необходимо при достаточном освещении непосредственно
на месте хранения, не допуская взбалтывания, так как оно может привести к
ошибочному заключению. Критериями годности для переливания являются: для цельной крови — прозрачность
плазмы при отсутствии в ней мути и
хлопьев, красного окрашивания плазменного слоя (гемолиз), равномерность
верхнего слоя эритроцитов, наличие
четкой границы между эритроцитами
и плазмой; для плазмы — прозрачность. При возможном бактериальном
загрязнении цельной крови или эритроцитной массы цвет плазмы будет
тусклым, с серо-бурым оттенком, она
теряет прозрачность, в ней появляются
взвешенные частицы в виде хлопьев
или пленок. Такие гемотрансфузионные среды переливанию не подлежат.
Тема 6
При подозрении на развитие гемолиза неотстоявшуюся кровь (эритроцитарную взвесь) перемешивают в контейнере, после чего берут в пробирку
8-10 мл и центрифугируют. Яркое
розовое окрашивание плазмы после
центрифугирования свидетельствует о
недоброкачественности гемотрансфузионной среды. Для проверки эритроцитного концентрата (массы) в пробирку в 2-3 мл 0,9% раствора хлорида
натрия вносят 5 капель эритроцитсодержащей среды, перемешивают и после центрифугирования (для оседания
эритроцитов) убеждаются в отсутствии
яркого розового окрашивания физиологического раствора. Наличие такого окрашивания указывает на гемолиз
проверяемой среды и, следовательно,
на непригодность ее для переливания.
Паспорт (этикетка) должен содержать все необходимые сведения: (рис. 37).
■ наименование среды;
■ название учреждения-изготовителя;
дату заготовки;
срок годности;
групповую и резусную принадлежность (цветную маркировку);
■ регистрационный номер;
■ фамилию и инициалы донора;
■ фамилию врача, заготовившего кровь;
■ отметку «Стерильно»;
■ указание, что среда проверена на
ВИЧ-1/2, гепатиты В и С, сифилис.
Учреждение службы крови, заготовившее гемотрансфузионную среду и
выдавшее ее в клинику, является гарантом качества этой среды и несет за нее
полную юридическую ответственность.
Запрещается использовать для
переливания трансфузионные среды:
■ если отсутствует или неправильно оформлена этикетка, паспорт,
а также если истек срок годности;
■
■
■
101
при наличии гемолиза или других
признаков недоброкачественности
среды;
■ при нарушении герметичности контейнера.
Врач, производящий трансфузию
эритроцитов или цельной крови, обязан, независимо от произведенных
ранее исследований и записей, лично
провести следующие контрольные исследования непосредственно у постели
реципиента.
1. Убедиться, что перед ним именно тот пациент и для трансфузии
■
А
Берут 5-7 мл крови из вены реципиента,
центрофугируют или отстаивают;
Б
В
На тарелку наносятся 1–2 капли сыворотки больного (взятой из пробирки) и капля крови донора (взятой из ампулы)
Через 5 минут к смеси добавляют 1–2 капли физраствора и производят наблюдение. Если кровь не агглютинируется, она пригодна
к переливанию. Если регистрируется агглютинация, кровь к переливанию непригодна.
Рис. 37. Внешний вид гемокона,
пригодного для переливания
Рис. 38. Этапы проведения пробы на совместимость
102
2.
3.
4.
5.
Текстовый модуль 2
получена необходимая гемотрансфузионная среда.
Определить группу крови реципиента по системе АВ0 и сверить
полученный результат с данными
истории болезни.
Определить группу крови из донорского контейнера по системе АВ0 и
сопоставить результат с данными
на этикетке контейнера.
Провести пробу на индивидуальную совместимость эритроцитов
донора с сывороткой или плазмой
реципиента по системам АВ0 и
резус-фактора.
Провести биологическую пробу.
Проба на совместимость по
системе АВ0 (рис. 38).
а) берут 5-7 мл крови из вены реципиента, центрофугируют или отстаивают;
б) затем на чашку наносят 2-3 капли сыворотки крови больного и добав-
Для исследования берут 5-7 мл крови реципиента, отстаивают или центрифугируют, далее на чашку Петри наносят крупную каплю сыворотки реципиента и небольшую каплю крови донора (1:10). Капли перемешивают и чашку помещают в водяную баню (t воды 45-46°С) на 10 мин. По истечении времени оценивают результат.
Тема 6
ляют каплю крови донора. Их перемешивают, оставляют на 5 мин.;
в) проба проводится при t° 15-20С°.
Покачивают тарелку. Результат оценивают через 5 мин. Если агглютинации
нет, кровь совместима. Если агглютинация регистрируется, такая кровь не
совместима и ее переливать нельзя.
Проба на резус-совместимость
(рис. 39):
а) для исследования берут 5-7 мл
крови реципиента, отстаивают или
центрифугируют, далее на чашку Пет
ри наносят крупную каплю сыворотки
реципиента и небольшую каплю крови
донора (соотношение 1:10).
б) Капли перемешивают и чашку
помещают в водяную баню (t° воды 4546°С) на 10 мин. По истечению времени оценивают результат.
в) В случае отсутствия агглютинации кровь совместима и годна к
переливанию. Если же присутствует
агглютинация, кровь несовместима и
проводить гемотрансфузию категорически запрещено.
ОЦЕНКА РЕЗУЛЬТАТОВ ПРОБЫ
НА СОВМЕСТИМОСТЬ КРОВИ К РЕЗУС-ФАКТОРУ
Рис. 39. Проба на резус-совместимость
I
II
III
Рис. 40. Правила проведения биологической пробы:
I этап — перелито 25 мл крови, пауза 3-5 минут;
II этап — перелито дополнительно 25 мл крови (всего
50 мл), пауза 3–5 минут; III этап — перелито еще 25 мл
крови (всего 75 мл), пауза 3-5 минут.
Биологическая проба (рис. 40)
предшествует переливанию каждой отдельной дозы трансфузионной среды
для исключения ее индивидуальной
несовместимости или непереносимости с кровью реципиента. Первые
50 мл среды вводят струйно 3 порциями
по 10-15 мл с трехминутными перерывами между введениями. Если не появляются субъективные признаки(озноб,
боли в пояснице, чувство жара, стеснения в груди, головная боль, тошнота,
рвота), объективные данные (снижение артериального давления и учащение пульса, изменение цвета мочи при
катетеризции мочевого пузыря) и другие признаки несовместимости (непереносимости), переливание следует
немедленно прекратить.
Переливание
гемотрансфузионных сред производится медицинским
персоналом при строжайшем соблюдении правил асептики и антисептики
с использованием одноразовых пластиковых систем для внутривенного
введения, имеющих фильтр. Запрещается переливание компонентов крови
из одного контейнера последовательно
нескольким больным.
103
Быстрое переливание больших
объемов холодной крови может понизить температуру синусо-предсердного
узла до значений ниже 30°С, что приво
дит к развитию экстрасистолии. Перед
переливанием контейнер с эритроцитсодержащей трансфузионной средой
следует подогреть, выдерживая его
при температуре 18-25°С в течение 3060 мин.
Применение гемотрансфузионных
сред, помимо лечебного действия, может вызывать неблагоприятные побочные эффекты. Достаточно условно
в отечественной практике традиционно
выделяют неблагоприятные посттрансфузионные (трансфузионные) реакции
и осложнения. Реакции не сопровождаются серьезными и длительными
нарушениями функций жизненно важных органов и систем. Осложнения
характеризуются тяжелыми клиническими проявлениями, представляющими опасность для жизни больного.
Побочные эффекты гемотрансфузий крови и ее компонентов можно обнаружить у 10% реципиентов.
Если во время или вскоре после
гемотрансфузий развиваются неблаго
приятные или необычные симптомы,
необходимо определить их связь с
перелитым гемокомпонентом.
По первичной симптоматике невозможно определить тяжесть трансфузионной реакции, поскольку и тяжелые осложнения (например, острый
гемолиз), и легкие реакции (например,
фибрильная негемолитическая) изначально могут иметь сходные проявления (озноб, лихорадка). Соответственно любая посттрансфузионная реакция
должна расцениваться как потенциально опасная до тех пор, пока по результатам клинического наблюдения
и лабораторного обследования не будет сделано иное заключение.
104
Текстовый модуль 2
Во время трансфузии крови больного наблюдает врач, он и оформляет
специальную документацию (переливание крови регистрирует в специальном журнале, заполняет протокол
переливания крови).
Температуру тела необходимо измерять непосредственно после переливания крови и затем через 1 ч. в
течение 6 часов. Необходимо макроскопически оценить первую порцию
мочи после гемотрансфузии, в течение
последующих трех дней после переливания крови необходимо диурез.
В истории болезни отметить время окончания переливания крови и
основные показатели: пульс, артериальное давление, 210, t° тела, количество мочи (АД) первой порции. На
следующий день после переливания
берут анализ крови и мочи.
По клиническим проявлениям
посттрансфузионные реакции и
осложнения подразделяют на:
- острые, развивающиеся в течение трансфузии или в течение 1-2 ч.
после нее;
- отсроченные, не проявляющиеся
в течение нескольких дней, месяцев
или даже лет.
Острые иммунные
реакции и осложнения
Острый гемолиз — редко встречающееся, но одно из наиболее опасных осложнений гемотрансфузии,
обусловленное несовместимостью эритроцитов по системе АВ0 или резусфактора. Симптомы острого гемолиза
могут появляться и при переливании
10-15 мл несовместимой крови. Наиболее тяжелые осложнения развиваются
при переливании 200 мл и более АВ0несовместимой крови.
Тема 6
Клинические проявления при
остром гемолизе:
■ повышение температуры;
■ озноб;
■ общая слабость;
■ боли в пояснице;
■ гемоглобинурия;
■ гипотензия;
■ тахикардия, отдышка;
■ геморрагический синдром;
■ боль в месте инфузии;
■ тошнота;
■ покраснение лица;
■ светобоязнь;
■ головная боль;
■ боль за грудиной;
■ свободный гемоглобин в плазме;
■ анемия.
На ранних стадиях острого гемолиза яркие симптомы могут отсутствовать, пациент жалуется на небольшую
слабость или боль в пояснице. Иногда первым проявлением может быть
гемоглобинурия изолированно или в
сочетании с болями в пояснице. Для
тяжелого гемолиза характерны: одышка и гипотензия, развивающиеся в шок.
У пациентов без сознания или при общем обезболивании первыми проявлениями внутрисосудистого гемолиза
могут быть геморрагический синдром,
гипотензия, гемоглобинурия и анурия.
Стертость начальных клинических
признаков несовместимости крови
характерна также для больных, которым проводится длительная лучевая
терапия. Характерно не только снижение диуреза, но и низкая (менее 1012)
плотность мочи.
При благоприятном течении острой
почечной недостаточности восстанов
ление диуреза наступает на 10-25-й
день после трансфузии и продолжается
10-16 дней и более. Постепенное восстановление выделительной функции
почек приводит к нарастанию суточного
диуреза с переходом в полиурию, после
чего отмечается нормализация диуреза.
Восстановление диуреза относится к хорошим прогностическим признакам.
Важно еще раз подчеркнуть, что
тяжесть острой гемолитической реакции осложнения коррелируется с дозой перелитой несовместимой крови.
Поэтому важно правильно выполнять
биологическую пробу, контролировать
температуру и состояние реципиента в
процессе гемотрансфузии и др.
Лечебные мероприятия
При подозрении на острый гемолиз — немедленно прекратить
трансфузию. Сохранить внутривенный инфузионный тракт для предстоящих инфузий. Основная задача
в этой ситуации — профилактика почечной недостаточности. Необходимо
корригировать гипотензию и поддерживать перфузию почек. С этой целью
продолжают введение жидкостей (физиологический раствор и др.). В стадии шока вводят до 150 мг преднизолона или до 1250 мг гидрокортизона,
400 мл 5% раствора гидрокарбоната
натрия, 0,5-1 мл 0,06% раствора корглюкона в 20 мл 40% раствора глюкозы, 25-50 мг пипольфена, 20-40 мг
промедола, 2 мл кордиамина; среднеи низкомолекулярные коллоидные
растворы — 1л; диуретики (фуросемид, маннитол).
При развитии ДВС проводят специфическое лечение.
Профилактика
Наиболее часто трансфузии несовместимой крови — это следствие
ошибки идентификации образца крови, гемокомпонента реципиента и т. д.
Более того, практика показывает, что
осложнения развиваются как результат
системной ошибки — сочетания двух
или более неверных манипуляций.
105
В Великобритании создан Комитет
по нарушениям при гемотрансфузии
(Serious Hazards of Transfusion, SHOT),
на основе анонимности собирающий
информацию об ошибках при переливании крови. D. Provan (1999) сооб
щает, что в результате первого года
работы получено 169 сообщений. В 81
случае (47%) реципиент получил гемотрансфузионную среду, предназначенную для другого пациента (1 летальный
исход и 9 тяжелейших осложнений).
Поэтому необходимо строго соблюдать установленные правила на
всех этапах заготовки, производства,
хранения, транспортировки и переливания гемокомпонентов. Особое внимание следует уделить надлежащему
оформлению документации. Надежный заслон острой гемолитической
реакции — надлежащее выполнение
всех манипуляций при переливании
крови.
Фебрильные
негемолитические реакции
Фебрильные
негемолитические
посттрансфузионные реакции регистрируют при подъеме температуры
до 38°С и выше в течение гемотрансфузии или вскоре (обычно в течение
2 ч) после ее окончания, если не выявлено других причин гипертермии.
Повышение температуры может сопровождаться ознобом. Реакции развиваются вследствие взаимодействия
HLA-антигенов I класса, экспрессированных на лейкоцитах или тромбоцитах донора, с антителами в крови аллосенсибилизированного реципиента.
Лечебные мероприятия
Лечебные мероприятия — симптоматические. Лихорадка обычно корри
гируется жаропонижающими средствами и др.
106
Текстовый модуль 2
Профилактика
Для профилактики аллоиммунизации следует использовать гемотрансфузионные среды, обедненные лейкоцитами. Современные лейкоцитарные
фильтры позволяют сократить количество лейкоцитов в гемокомпоненте
менее минимальной иммуногенной
дозы (5x106 клеток). У пациентов с
трансфузионными реакциями в анамнезе целесообразно применять среды,
обедненные лейкоцитами. Эффективно профилактическое введение антипиретиков.
Аллергические реакции
Аллергические реакции в основном бывают умеренными, но могут
протекать и тяжело. Основные клинические проявления — эритема, зуд,
крапивница. Наличие лихорадки нехарактерно.
Вероятная причина аллергических
реакций — иммунный ответ на белки
плазмы донора.
Лечебные мероприятия
При появлении признаков аллергии — немедленно прекратить трансфузию. Ввести антигистаминные средства (димедрол 25-100 мг) per os или
внутимышечно (внутривенно). После
устранения симптомов (обычно через
15-30мин.) трансфузию можно продолжить.
Профилактика
Пациентам с трансфузионными аллергическими реакциями в анамнезе
показано профилактическое введение
антигистаминных препаратов. Может
быть эффективно использование отмытых эритроцитов.
Анафилактический шок
Анафилаксия — наиболее тяжелая
форма аллергической реакции. Уже
Тема 6
при трансфузии нескольких миллилитров гемокомпонента развиваются ги
перемия, тошнота, боли в животе, рвота, диарея, отек гортани, бронхоспазм,
гипотензия, потеря сознания и шок.
А.С. Лопатин (1983), изучив 520
случаев лекарственного анафилакти
ческого шока, предложил выделить
5 клинических разновидностей его
течения:
1) типичная форма — 55,4%;
2) варианты:
■ асфиксический — 20%;
■ гемодинамический — 11,5%;
■ абдоминальный — 8,1%;
■ церебральный — 5,0%.
Типичная форма лекарственного анафилактического шока протекает
остро, с неопределенными тягостными
ощущениями («обдало жаром», «обожгло крапивой»), появляются тошнота и страх смерти. Больные могут
жаловаться на резкий кашель, резкую
слабость, ощущения покалывания и
зуда кожи лица, рук, чувство тяжести
за грудиной или сдавливания грудной
клетки. Затем, как правило, наступает
расстройство сознания. При быстропротекающем «молниеносном» шоке
больной может не успеть предъявить
каких-либо жалоб.
Из объективных признаков следует
отметить: покраснение кожи лица, полиморфную экзантему по всему телу,
обильное потоотделение, отек век или
лица. У многих больных развиваются
клонические судороги, двигательное
беспокойство, непроизвольное выделение мочи и кала.
При асфиксическом варианте
через несколько минут после введения
анафилактогенного вещества в клинической картине начинает доминировать острая дыхательная недостаточность. Дыхательная недостаточность
может быть связана с отеком слизистой
оболочки гортани с частичным или
полным закрытием ее просвета (ложный круп), ларинго-, бронхо- и, особенно, бронхиолоспазмом. При этом
может развиться интерстициальный
и внутриальвеолярный отеки легких,
клинические проявления которых впоследствии доминируют. Особенностью
возникновения данного варианта является то, что он развивается у лиц с
какой-либо патологией легких (бронхитом, пневмонией и др.).
При гемодинамическом варианте также через несколько минут после инъекции препарата на первое место в клинической картине выступают
симптомы нарушения кровообращения: сильные боли в области сердца,
аритмия, гемодинамический коллапс.
Наблюдается дисфункция микроциркуляции в виде мраморного рисунка
кожи, сочетающаяся с цианозом. При
этом варианте признаки декомпенсации внешнего дыхания и центральной
нервной системы выражены меньше.
Для абдоминального варианта
лекарственного
анафилактического
шока характерно появление симптомов острого живота (резкие боли в
эпигастральной области, симптомы
раздражения брюшины), что нередко
приводит к ошибочной диагностике
перфорации или кишечной непроходимости. Этот вариант характеризуется
неглубоким расстройством сознания,
незначительным снижением АД, отсутствием дыхательной недостаточности.
Характерным оказывается появление
болей в животе только через несколько
десятков минут (20-30) после инъекции анафилактогенного вещества.
Реже встречается церебральный
вариант анафилактического шока.
Клиническая картина при нем характеризуется преимущественным поражением центральной нервной системы
107
с психомоторным возбуждением, страхом, нарушением сознания, судорогами, дыхательной аритмией. В тяжелых
случаях может развиться набухание и
отек головного мозга с последующей
остановкой дыхания и сердца.
Этиологическими факторами развития анафилактического шока являются более 100 препаратов из различных фармакологических групп.
Наиболее частыми из них оказываются
антибиотики, по убывающей активности провокации шока образующие следующий ряд: пенициллин, бициллин,
стрептомицин, олететрин, тетрациклин, левомицетин, мономицин, карбенициллин, морфоциклин, оксациллин,
эритромицин, олеандомицин.
За антибиотиками по частоте воз
никновения анафилактического шока
стоят пиразолоновые препараты (анальгин, амидопирин), местноанестезирующие средства (новокаин, дикаин, анестезин), витамины и их синтетические
аналоги, сульфаниламидные препараты,
рентгеноконтрастные средства (кардиотраст, билигност, билитраст, уротраст),
противотуберкулезные препараты (тубазид), вакцины и гормоны (питуитрин,
маммофизин, преднизолон).
Анафилактические трансфузионные реакции в основном опосредованы
антителами к IgA. По наблюдениям
американских врачей, дефицит IgA от
мечается у 1 человека из 700. Эти пациенты вследствие предшествующих беременностей, трансфузий или неясных
причин могут быть иммунизированы к
тяжелым (а) или легким (к или X) цепям IgA.
Лечебные мероприятия
При появлении признаков анафилаксии следует немедленно прекратить
трансфузию и начать внутривенное
введение физиологического раствора
108
Текстовый модуль 2
с добавлением или без вазопрессорных
средств. Необходимо подкожно ввести
0,3 мл адреналина (1:1000) или, если
реакция тяжелая, 3-5 мл адреналина
(1:1000) внутривенно быстро. Димедрол 25-100 мг внутривенно. Ранитидин 50 мг внутривенно. Гидрокортизон
100-250 мг внутривенно каждые 6 ч.
Назначают кислород, возможно применение интубации трахеи и искусствен
ной вентиляции легких.
Под контролем артериального
давления при шоке вводят дофамин
5-20 мкг/кг/мин. или норадреналин
2 мкг/мин.
Профилактика
Оптимально отследить пациентов
с дефицитом IgA и переливать им гемокомпоненты от доноров с дефицитом
IgA (плазму можно переливать только
от таких доноров). Тщательное отмывание эритроцитов позволяет удалить
IgA.
Цитратная интоксикация
Цитратная интоксикация может
развиться при быстром введении и
переливании больших количеств консервированной крови. Цитрат натрия,
введенный в организм, быстро разрушается и выводится, причем при
медленных капельных трансфузиях
никаких осложнений не наблюдается.
Однако при быстром (струйном) переливании больших доз консервированной крови может проявиться цитратная интоксикация. В основе патогенеза
лежит прямое токсическое действие
консерванта цитрата натрия, а также
изменение в крови содержания ионов
калия и кальция. Повышение концентрации калия в переливаемой крови
может быть связано с повышенным гемолизом, возникающим при длительных сроках хранения. Цитрат натрия
Тема 6
способен связывать ионы кальция в
крови реципиента, приводя тем самым
к гипокальциемии. Опасной дозой для
возникновения цитратной интоксикации, особенно у больных с заболеваниями печени и почек, является 10 мг/кг/
мин. Таким образом, при переливании
больному массой тела 70 кг струйно
150-200 мл консервированной крови
в 1 мин. почти всегда имеется возможность возникновения цитратной интоксикации.
Клинически тяжелая цитратная
интоксикация проявляется во время
или к концу трансфузии в виде коллаптоидных реакций, обусловленных
ослаблением сократительной способности и нарушениями проводимости
миокарда, вплоть до остановки сердца. Эти нарушения связаны в первую
очередь с дисбалансом электролитов
(гиперкалиемией, гипокальциемией) в
крови реципиента. Подозрение на возникновение цитратной интоксикации
возникает при развитии коллаптоидной реакции во время или сразу после
введения крови при отсутствии клинических и морфологических признаков, свойственных другим гемотрансфузионным конфликтам, при наличии
фоновых заболеваний печени и почек,
метаболизирующих и выводящих соли
лимонной кислоты.
Лечебные мероприятия
Ввести внутривенно 10 мл 10% раствора глюконата кальция.
Профилактика
Соблюдение скорости гемотрансфузии. Особое внимание — пациентам
с аритмией.
При переливании более 4 доз эритроцитной массы или свежезаморожен
ной плазмы со скоростью более 1 дозы
за 5 мин. для предупреждения цитрат
ной интоксикации и гипокальциемии
показано введение 5 мл 10% раствора
хлористого кальция.
Переливание
свежезамороженной
плазмы (СЗП)
Свежезамороженную плазму (СЗП)
оттаивают при 37°С в водяной бане или
специальном размораживателе. За рубежом практикуется размораживание
плазмы в микроволновых инкубаторах, однако российские специалисты
полагают, что при таком способе в контейнере с плазмой образуются участки
интерференции микроволн с резким
повышением температуры.
Трансфузию СЗП производят в течение 2 ч. после оттаивания.
Появление необычной мутности в
оттаявшей СЗП является противопоказанием к ее переливанию.
В основном начальная доза трансфузии составляет 10-15 мл/кг массы
тела реципиента. Эта доза определяется эмпирически, соответственно,
необходим последующий диагностический мониторинг.
Надлежит
использовать
АВ0совместимую плазму, однако специальные пробы на совместимость не проводятся. В плазме присутствуют антитела
(анти-А и анти-В), поэтому:
■ плазма группы 0 может быть перелита реципиентам только этой
группы;
■ плазма групп А(II) и В(III) может
быть перелита реципиентам того
же фенотипа и группы 0;
■ плазма группы АВ(IV) не содержит
групповых антител и в экстренной
ситуации может быть перелита
даже реципиентам с неизвестным
фенотипом.
Учитывая редкость группы АВ(IV),
СЗП этой группы надлежит резервиро
вать.
109
Небольшое количество стромы
эритроцитов, содержащееся в плазме,
может в определенных условиях усиливать иммунный ответ у аллоиммунизированных к антигену D системы
резус. Поэтому женщинам детородного
возраста СЗП нужно назначать с учетом резус-принадлежности.
Показания к применению СЗП
Количество перелитой СЗП в последние годы возрастает во всем мире.
Тем не менее тщательно изученных и
общепринятых показаний к трансфузиям СЗП довольно немного. К ним
относятся отдельные нарушения свертывания, тромботическая тромбоцитопеническая пурпура (ТТП) или гемолитический уремический синдром (ГУС),
а также, возможно, другие дефициты
комплемента и антителонезависимой
опсонизации. С учетом возможного
использования отдельных факторов
свертывания СЗП остается применять
в трех случаях:
■ при неясном механизме коагулопатии;
■ при отсутствии необходимых концентратов факторов свертывания;
■ при наличии противопоказаний к
концентратам факторов свертыва
ния (например, концентратам протромбинового комплекса).
Определенные показания
к применению СЗП
Коррекция передозировки
производных кумарина
Передозировка
антикоагулянтов — производных кумарина может
быть причиной тяжелого кровотечения. В этих случаях СЗП вводят в дозе
10-15 мл/кг массы тела реципиента.
При отсутствии должного клинического эффекта введение СЗП повторяют. Аналогично можно использо-
110
Текстовый модуль 2
Тема 6
вать концентраты протромбинового
комплекса (факторов II, VII, IX, X), но
следует учитывать, что некоторые концентраты протромбинового комплекса
не содержат фактора VII — ключевого
компонента быстрого гемостаза. Небольшое кровотечение корригируется
внутривенным введением витамина К.
гося вследствие активации системы
гемостаза и фибринолиза. Чрезмерная
активация системы гемостаза ведет
к избыточной генерации тромбина
(тромбинемии) и ускоренному внутрисосудистому образованию фибрина с
вторичной активацией фибринолиза
(см. главу 5).
Дефицит витамина К
Витамин К поступает с пищей (например, зелеными овощами), а также
синтезируется бактериями в кишечнике. Это жирорастворимый витамин,
содержание которого зависит от липаз
поджелудочной железы, наличия желчи, всасывающей способности кишечника (поступление в кровообращение)
и утилизации гепатоцитами. Дефицит
витамина К возникает в результате
неадекватного питания, заболеваний
поджелудочной железы, закупорки
желчных путей, нарушенного всасывания, лечения антибиотиками, а также
в результате применения антикоагулянтов.
Витамин К необходим на заключительных стадиях синтеза факторов X,
IX, VII и II, протеинов С и S. Перорально принимаемые антикоагулянты (на
пример, кумарины) ингибируют образование активной ферментной формы
витамина К.
Соответственно, при нарушении
обмена витамина К может развиться
коагулопатия, как и при передозировке
антикоагулянтов — производных ку
марина. Коррекция кровотечения аналогична описанной выше.
Принципы лечения острого ДВС заключаются в следующем:
■ лечение основного заболевания;
■ поддерживающие меры, например,
активная коррекция гипоксемии и
гиповолемии;
■ лечение гепарином для прекращения активации свертывания крови;
■ заместительная терапия концентратами АТШ, ПС, СЗП, криопреципитатом и тромбоцитами.
Лечение должно быть направлено
на устранение этиологического факто
ра. Важнейшая составляющая терапии — введение СЗП, криопреципитата,
концентрата тромбоцитов. Мониторинг эффективности лечения проводят
по динамике клинической картины и
лабораторных показателей. Традиционно начальная доза СЗП — 10-15 мл/
кг массы тела реципиента. При очень
низком содержании фибриногена вводят криопреципитат. Для профилактики и коррекции гиперфибринолиза
применяют апротинин (контрикал).
Острый синдром диссеминированного внутрисосудистого
свертывания (ДВС-синдром)
ДВС-синдром — результат дефицита фактора V, фибриногена, фибронектина и тромбоцитов, развивающе-
Тромботическая тромбоцитопеническая пурпура (ТТП)
Терапия выбора при ТТП — СЗП
в сочетании с плазмообменом. У не
которых пациентов более эффективным может быть введение криосупернатантной плазмы. Необходимое
количество СЗП (порядка 40 мл/кг
массы тела пациента в день) может
быть введено только при процедуре
плазмообмена с использованием СЗП
в качестве замещающей жидкости.
Мониторинг эффективности лечения
проводят по динамике клинической
картины и лабораторных показателей.
В ряде случаев требуется интенсивное
и длительное (недели) лечение.
Врожденный дефицит
ингибиторов свертывания
СЗП используют у пациентов с
врожденным дефицитом антитромбина III и протеина С при высоком
риске тромбоза (например, во время
хирургической операции), либо у пациентов, получающих гепарин для лечения спонтанного тромбоза. Более
эффективно в такой ситуации введение
концентратов антитромбина III и протеина С соответственно.
Дефицит C1-ингибитора
При развитии ангионевротического
отека у пациентов с врожденным или приобретенным дефицитом С1-ингибитора
оптимально использовать частично очищенный концентрат этого белка. Введение СЗП в такой ситуации — дискуссионный вопрос, поскольку с плазмой
вводится комплемент, поддерживающий
воспаление и отек тканей. СЗП показана
для профилактики ангионевротического
отека, например, перед лечением зубов.
Для взрослого обычно достаточно двух
доз плазмы. Полупериод циркуляции
ингибитора — около 65 часов.
Относительные показания
к применению СЗП
Синдром массивных трансфузий
Массивное переливание крови —
трансфузия одного ОЦК в течение 24ч.
В такой ситуации нарушения гемостаза связаны не только с коагулопатией
разведения, но и с основным заболеванием, длительной гипотензией, тромбоцитопенией, нестероидными про-
111
тивовоспалительными препаратами,
врожденной патологией. Коагулопатия разведения вследствие трансфузии
консервированной крови приобретает
клиническое значение при переливании объема около двух ОЦК. В отсутствие ДВС-синдрома увеличение протромбинового времени (ПВ) и АЧТВ
обусловлено главным образом гипофибриногенемией. Значимое разведение тромбоцитов происходит ранее —
при трансфузии одного ОЦК. Таким
образом, осложнения массивной гемотрансфузии обусловлены потреблением тромбоцитов, факторов свертывания крови и возможным развитием
ДВС-синдрома. Клинические проявления — кровоточивость повреждений,
хирургических ран, мест инъекций.
Лечение следует начинать, не дожидаясь результатов лабораторных ис
следований. Показаны трансфузии концентратов тромбоцитов (значимость
мониторинга количества тромбоцитов
в крови пациента ограничена вследствие весьма вероятной тромбоцитопатии). СЗП вводят в дозе 10-15 мл/
кг массы тела реципиента для восполнения фибриногена и других факторов
свертывания. Клинически очень значимое снижение содержания фибриногена в плазме (менее 0,8 г/л) оптимально восполнить криопреципитатом.
У взрослого 10 единиц криопреципитата увеличивают уровень фибриногена на 1 г/л. Введение СЗП необходимо
при увеличении MHO более 1,8.
Может потребоваться использование препаратов кальция, поскольку
растворы, содержащие цитрат и применяемые в качестве антикоагулянта для
компонентов крови, могут связывать
кальций плазмы пациента и вызывать
гипокальциемию.
Суммируя вышеизложенное, можно заключить, что коррекцию син-
112
Текстовый модуль 2
дрома массивной трансфузии следует
начинать эмпирически с переливания
тромбоцитов, СЗП в дозе 10-15 мл/кг. В
дальнейшем ориентируются на клини
ческие и лабораторные показатели.
Заболевания печени
У пациентов с тяжелой патологией
печени коагулопатия приводит к ге
моррагическому синдрому в сочетании
с другим патологическим процессом
или хирургическим вмешательством
(биопсия печени, разрыв варикозных
вен пищевода). Трансфузии СЗП у таких пациентов показаны при угрозе
или развившемся кровотечении. Для
остановки кровотечения или коррекции дефекта гемостаза необходима
трансфузия 6-8 доз СЗП. Сложность
лечения таких пациентов — изначально увеличенный ОЦП.
При сильном кровотечении (во
время или после хирургического
вмешательства) для обеспечения гемостаза необходимо вводить СЗП каждые
6-12 ч. В некоторых случаях требуются
дополнительные меры для достижения гемостаза, например, обменные
трансфузии, применение концентратов
протромбинового комплекса (активированный ФХ может вызвать ДВС),
введение концентратов АТШ.
При профилактических трансфузиях СЗП достаточно достичь MHO
порядка 1,6-1,8. Может возникнуть
необходимость трансфузии тромбоцитов для коррекции их дисфункции
и тромбоцитопении. Трансфузии КТ
при подготовке к эндоскопии, торацентезу, лапарацентезу и люмбальной
пункции показаны пациентам с количеством тромбоцитов менее 50 000
клеток/мкл.
Больным с тяжелыми дефектами
функции тромбоцитов можно вводить
десмопрессин. Перед удалением зубов
Тема 6
пациентам целесообразно назначить
антифибринолитические препараты,
например ЭАКК.
Подготовка к большой хирургической операции может включать:
— парентеральное введение витамина
К и СЗП;
— трансфузии КТ для поддержания
количества тромбоцитов на уровне
около 100 000 клеток/мкл.
Искусственное кровообращение
Изменения гемостаза, происходящие при операциях с АИК, чаще обус
ловлены дисфункцией тромбоцитов,
чем дефицитом факторов свертывания.
Поэтому при аномальной кровоточивости во время операции или послеопера
ционном кровотечении, не связанном
с хирургическим дефектом, к терапии
первого ряда относят трансфузии КТ.
Необходимо убедиться, что введенный
до операции гепарин надежно нейтрализован протаминсульфатом. Введение
СЗП показано только при кровотече
нии у пациентов с верифицированной
аномалией гемокоагуляции. Нет данных, подтверждающих эффективность
профилактического введения СЗП перед операцией с экстракорпоральным
кровообращением.
Состояния, при которых
нет доказательств
эффективности СЗП
Эффективность трансфузий СЗП не
доказана при следующих состояниях:
■ гиповолемии;
■ плазмообмене у пациентов без аномалий коагуляции;
■ сопровождении трансфузий эритроцитов;
■ нутриционной поддержке;
■ коррекции дефицита антител (при
наличии препаратов иммуногло
булина).
Использование замороженной
и криосупернатантной плазм
Плазма, отделенная от эритроцитов и замороженная позднее чем через 8 ч., называется замороженной.
Как и криосупернатантная (оставшаяся после получения криопреципитата), замороженная плазма содержит
меньшее количество факторов V и
VIII, однако достаточное — факторов
VII, IX и X. В криосупернатантной
плазме также снижено содержание
фибриногена. Эти виды плазмы могут
с успехом применяться у пациентов
с дефицитом стабильных факторов
свертывания (например, коагулопатия вследствие передозировки производных кумарина).
Неблагоприятные эффекты
трансфузий СЗП
При трансфузиях СЗП имеется риск
развития побочных эффектов.
Аллергические реакции. Проявления аллергии отмечаются у 1-3%
реципиентов СЗП. Возможно развитие
анафилаксии. В качестве меры предос
торожности не рекомендуется увеличивать скорость переливания СЗП более
30 мл/мин.
Инфекционные осложнения. Вирусы гепатитов В и С, ВИЧ, парвовирус
могут передаваться с СЗП так же, как
и с цельной кровью. Крайне невелика
возможность передачи с СЗП микроорганизмов, локализующихся внутриклеточно (цитомегаловирус, другие вирусы герпеса, плазмодии малярии).
Гемолиз.
Антиэритроцитарные
антитела в плазме могут лизировать
эритроциты реципиента (наиболее
безопасна плазма группы АВ(IV).
Редкое осложнение — гемолиз после
трансфузии СЗП у новорожденных с
некротическим энтероколитом, обусловленный участием комплемента
113
плазмы в аутоиммунной гемолитической реакции.
Циркуляторная перегрузка. Ее
следует предполагать при необходимо
сти трансфузий больших объемов СЗП.
В этом случае особо надлежит рас
смотреть возможность использования
концентратов факторов свертывания.
Плазмозамещающие
растворы
Общие положения
Кровезаменители (гемокорректоры, плазмозамещающие растворы) —
лечебные растворы, предназначенные
для временного замещения функций
крови и для целенаправленного воздействия на морфологический или
химический состав внутрисосудистой
жидкости.
В основу классификации кровезаменителей положены особенности их
лечебного действия и химического состава.
■
■
■
■
■
■
■
■
I. Кровезаменители гемодинамического действия (противошоковые):
препараты на основе декстрана;
препараты желатина;
растворы гидроксиэтилкрахмала;
препараты на основе полиэтиленгликоля.
II. Кровезаменители дезинтоксикационного действия:
препараты
низкомолекулярного
поливинилпирролидона;
препараты на основе низкомолекулярного поливинилового спирта.
III. Регуляторы водно-солевого
и кислотно-основного обмена:
солевые растворы;
осмодиуретики.
114
■
■
Текстовый модуль 2
IV. Кровезаменители —
переносчики кислорода
растворы гемоглобина;
эмульсии перфторуглеродов.
V. Кровезаменители комплексного действия.
Гемодинамические препараты
Гемодинамические (волемические,
противошоковые)
кровезаменители
объединяют препараты, нормализующие гемодинамику, главным образом
за счет увеличения объема циркулирующей крови (ОЦК). Выраженность гемодинамического эффекта во многом
зависит от химического состава раство
ров, в частности от молекулярной массы
коллоидов. В настоящее время в клинической практике применяют среднемолекулярные и низкомолекулярные
препараты на основе декстрана, желатина, полиэтиленгликоля и растворы
гидроксиэтилкрахмала.
Основными показаниями к инфузии гемодинамических кровеза
менителей являются:
■ коррекция
гиповолемии
(при
острой кровопотере, шоке, ожогах,
интоксикациях);
■ терапевтическая гемодилюция, в
том числе интраоперационное резервирование аутокрови;
■ заполнение аппаратов экстракорпорального кровообращения.
Основными механизмами лечебного действия гемодинамических кровезаменителей являются волемический,
реологический и гемостазиологический эффекты.
Волемический эффект обусловлен
способностью высокомолекулярных
растворов удерживать в сосудистом
русле жидкость и за счет разницы
коллоидно-осмотического
давления
Тема 6
изменять градиент транскапиллярного обмена жидкости. Количественно
этот эффект характеризуется объемным (волемическим) коэффициентом — отношением прироста ОЦК к
объему введенного кровезаменителя,
выраженным в процентах. Объемный
коэффициент свыше 100% свидетельствует о способности кровезаменителя
мобилизовать из внесосудистого пространства жидкость, т. е. об активации
аутогемодилюции. Введение таких растворов целесообразно сочетать с интерстициальной регидратацией за счет
инфузии изотонических солевых растворов. Объемный коэффициент менее
100% указывает на быстрое выведение
коллоида из организма (через почки)
или его утилизацию.
Реологический эффект связан со способностью кровезаменителей умень
шать вязкость крови, влиять на агрегационные свойства форменных элементов. Введенные кровезаменители
снижают гематокрит (каждые 500 мл в
среднем на 0,04-0,06 г/л) и тем самым
уменьшают вязкость крови. Кроме того,
применение кровезаменителя с вязкостью меньше, чем периферическая
кровь, улучшает текучесть внутрисосудистой жидкости за счет плазменной
составляющей. К тому же коллоиды после инфузии образуют молекулярный
слой на поверхности форменных элементов крови и на сосудистом эндотелии, что сопровождается уменьшением
процессов агрегации и адгезии.
Гемодинамические кровезаменители при массивных объемах инфузии
могут оказывать влияние на гемостаз.
При выполнении терапевтической гемодилюции этот механизм является
лечебным, так как способствует профи
лактике ДВС-синдрома и тромбоэмболических осложнений. В то же время
при лечении острой массивной крово-
потери или во время хирургической
операции чрезмерное введение коллоидных растворов повышает риск развития гемодилюционной коагулопатии,
а при неостановленном кровотечении
может способствовать его усилению. В
этих случаях необходимо по показаниям применять СЗП, тромбоцитную массу (концентрат) или криопреципитат.
Основные побочные эффекты связаны с индивидуальной непереносимос
тью, нарушением техники инфузии или
превышением суточной дозы. Основ
ными относительными соматическими противопоказаниями для введения
гемодинамических кровезаменителей
являются декомпенсированная сердечная недостаточность, выраженная почечная недостаточность (концентрация
креатинина сыворотки крови превышает 177 мкмоль/л), тяжелые нарушения
гемокоагуляции (гемофилия, 3-я и 4-я
фазы ДВС-синдрома), гиперволемия,
некомпенсированная дегидратация.
Полезно помнить о несовместимости лекарственных препаратов с
коллоидными
кровезаменителями.
В частности, с растворами декстранов
несовместимы аминокапроновая кислота, ампициллин, аскорбиновая кислота, антибиотики тетрациклинового
ряда, барбитураты, стрептокиназа.
Кроме того, декстраны усиливают нефротоксическое действие аминогликозидов, а препараты желатина ослабляют антимикробную эффективность
антибиотиков группы пенициллина.
Синтетические
кровезаменители оказывают влияние на результаты лабораторных тестов. Декстраны
снижают достоверность определения
содержания билирубина в крови, завышают значения концентрации сахара и общего белка в плазме крови.
Растворы гидроксиэтилкрахмала и
декстраны снижают достоверность им-
115
муногематологических исследований
(псевдоагглютинация при определении
групповой принадлежности крови).
После введения коллоидных растворов могут появляться аллергические и анафилактические реакции. Вероятность их возникновения зависит
от особенностей технологического процесса получения коллоидов, химической природы соединений и варьирует
для декстранов в пределах 0,032-0,5%,
препаратов желатина — 0,0077-0,155%,
растворов гидроксиэтилкрахмала —
0,047-0,085%. С целью профилактики
этих реакций следует проводить биологическую пробу: после введения
первых 5-10 капель инфузию прекращают на 2-3 мин., затем вводят еще
30 капель, снова прекращают вливание
на 3 мин. При отсутствии реакций (изменения пульса, АД, частоты дыхания,
покраснения кожных покровов) введение кровезаменителя продолжают.
Результаты биологической пробы регистрируют в истории болезни или амбулаторной карте.
Препараты
на основе декстрана
Декстран — водорастворимый
высокомолекулярный полимер глюкозы, образующийся из сахарозы при
действии на нее бактерий. Он становится пригодным для клинического
применения после радиационного воздействия или кислотного гидролиза до
молекулярной массы 80 кДа и ниже.
Среднемолекулярные
препараты декстрана с молекулярной массой
80-60кДа оказывают быстрый гемодинамическии эффект, повышают кол
лоидно-осмотическое давление плазмы
крови, ускоряют приток жидкости из
внесосудистого пространства. Растворы
декстрана имеют достаточно высокие
показатели волемического коэффици-
116
Текстовый модуль 2
ента — для 10% раствора декстрана-40
(реополиглюкина) — 140-150%, для
6% раствора декстрана-70 (полиглюкина) — 120-130% и продолжительность объемного действия (3-6 ч.).
Низкомолекулярные препараты декстрана улучшают реологические свойства крови, уменьшают опасность внутрисосудистого тромбообразования,
усиливают периферический кровоток.
Кроме того, они создают высокий уровень коллоидно-осмотического давления и способствуют быстрому перемещению жидкости в сосудистое русло.
Развивающаяся при этом гемодилюция
ускоряет и усиливает реологический
эффект. В то же время относительная
мелкодисперсность препаратов обусловливает быстрое выведение их из
организма через почки, увеличивая
тем самым диурез и ускоряя выведение
токсических метаболитов.
Полиглюкин — 6% раствор среднемолекулярного декстрана в 0,9%
растворе хлорида натрия. Он обладает относительно продолжительной
циркуляцией в кровеносном русле и
оказывает выраженный гемодинамический эффект. При легкой кровопотере полиглюкин переливают в среднем
в дозах 200-400 мл, при кровопотере
средней степени — 800 мл, при тяжелой — 1200мл. При реанимационной
помощи полиглюкин следует вводить
струйно до повышения АД до безопасного уровня, после чего можно переходить на капельное вливание.
Реополиглюкин — 10% раствор
декстрана в 0,9% растворе хлорида натрия. За счет содержания низкомолекулярной фракции декстрана он гиперонкотичен и привлекает в кровеносное
русло большое количество интерстициальной жидкости. Дезагрегирующее действие на форменные элементы
крови позволяет применять раствор
Тема 6
при наличии стаза и других нарушений
микроциркуляции.
Реополиглюкин показан при:
■ нарушениях регионарного артериального и венозного кровообращения (тромбозы, тромбофлебит,
болезнь Рейно, облитерирующие
заболевания сосудов);
■ операциях на сосудах и при пластической хирургии для улучшения
местного кровообращения и уменьшения опасности тромбообразования в шунтах и трансплантатах;
■ заполнении аппарата искусственного кровообращения;
■ нарушениях микроциркуляции при
шоке, ожогах, жировой эмболии,
перитоните и кишечной непроходимости;
■ заболеваниях сетчатки и зрительного нерва;
■ проведении терапевтической гемодилюции.
При шоке и острой кровопотере
реополиглюкин, как правило, применяют после выведения больного из
критического состояния и устранения
критической гипотензии.
При лечении ожогов инфузии реополиглюкина необходимо сочетать с
вливанием достаточного количества
для профилактики дегидратации крис
таллоидных растворов.
Средняя суточная доза препарата
составляет 400-600 мл.
Реомакродекс и реохем представляют собой 8-10% раствор декстрана
с молекулярной массой 40 кДа в 0,9%
растворе хлорида натрия и обладают
аналогичными реополиглюкину свойствами.
В НИИ гематологии и переливания крови МЗ Республики Беларусь
(г. Минск) разработан неорондекс —
кровезаменитель на основе радиаци
онно-химически модифицированного
декстрана, обладающий сочетанным
гемодинамическим,
гемореологическим, дезинтоксикационным и интерфероногенным действием.
Показано, что по сочетанности действия неорондекс (молекулярная масса
62 500±7500) не только объединяет в
себе основные свойства кровезамещающих растворов на основе средне- и низкомолекулярного декстрана (полиглюкин, реополиглюкин), но и существенно
превосходит их по возможности оказания направленного дезинтоксикационного действия, а также стимуляции образования факторов неспецифической
резистентности организма.
Следует заметить, что декстран в
наибольшей степени среди всех колло
идных препаратов негативно влияет на
свертывающую систему крови, а так
же способен вызывать снижение клубочковой фильтрации в почках за счет
повышения вязкости мочи. Поэтому
максимальные суточные дозы инфузии
декстранов ограничены 20 мл на 1 кг
массы тела для 6% раствора декстрана70 (полиглюкина) и 15 мл на 1 кг массы тела для 10% раствора декстрана-40
(реополиглюкина).
Для профилактики анафилактических реакций после введения декст
ранов предложены их моновалентные
формы. Внутривенное медленное вве
дение 20 мл моновалентного декстрана
«промит» за 1-2 мин. до инфузии декстранов позволяет предотвратить возникновение анафилактического шока.
Препараты на основе желатина
Желатин — денатурированный бе
лок, выделенный из коллагена костей
крупного рогатого скота нагреванием
или гидролизом, с молекулярной мас
сой 20-40 кДа.
Производные желатина применяют
для терапии геморрагического, трав
117
матического шока 1-2-й степени, умеренной острой кровопотере, при подго
товке больных к операциям, при ожогах
и интоксикациях, для терапевтической
гемодилюции, а также для заполнения
АИК.
Волемические свойства препаратов
желатина несколько уступают таковым
декстрана, поэтому их используют как
дополнение к противошоковой инфузионной терапии, особенно при необходимости длительных капельных
вливаний.
При инфузии растворов желатина
их объемный эффект составляет для
желатиноля 60%, для гелофузина —
100%. Объемозамещающий эффект
продолжается в среднем 2-4 ч., что объясняется наличием большого количе
ства низкомолекулярных фракций, быстро покидающих сосудистое русло.
Желатиноль — 8% раствор желатина с молекулярной массой 20 кДа в
0,9% растворе хлорида натрия. После
введения больших объемов раствора
(до 2 л) он восстанавливает АД и ОЦК,
вызывает активный приток интерстициальной жидкости в сосудистое русло,
однако этот эффект непродолжителен.
Гелофузин — 4% раствор сукцинированного желатина (модифициро
ванный жидкий желатин) со средней
молекулярной массой 30 кДа.
Инфузии гелофузина увеличивают
ОЦК, венозный возврат, сердечный
выброс и АД. При кровопотере, не превышающей 20% ОЦК, для стабилиза
ции гемодинамики достаточно перелить 2000-3000 мл гелофузина, однако
в случае необходимости суточная доза
препарата может быть увеличена до
10 000 мл.
Модежель — 8% раствор модифицированного
деионизированного
желатина, содержащий 0,1% двухзамещенного цитрата натрия. Модежель
118
Текстовый модуль 2
используется не только как консервирующий и ресуспендирующий раствор
для эритроцитов, но и как низкомолекулярный кровезаменитель гемодинамического действия и гемодилютант
для АИК.
Относительными противопоказаниями к инфузии препаратов желатина
являются наличие острого или хронического гломерулонефрита, гиперчувствительность к желатину, гипернатриемия.
Кроме того, нет четких доказательств, что растворы желатина не могут представлять опасность заражения
пациентов прионами.
Растворы гидрокси
этилированного крахмала
Наиболее впечатляющие достижения в последние годы получены в раз
работке и применении синтетических
коллоидных растворов на основе гидроксиэтилкрахмала (ГЭК), которые
наряду с растворами декстрана, желатина, а также природными коллоидами
(альбумин) относятся к группе плазмозаменителей гемодинамического (противошокового) действия.
Инфузионные средства создаются
на основе ГЭК — высокомолекуляр
ного полисахарида, получаемого из
крахмала картофеля, зерен кукурузы,
пшеницы, риса, и состоящего из полимеризованных остатков глюкозы. Для
защиты от быстрого гидролитического
расщепления сывороточной амилазой
препарат крахмала подвергают гидро
ксиэтилированию. Фракционирование
позволяет разделить субстанцию ГЭК
на низко- (40-70 кДа), средне- (около 200 кДа) и высокомолекулярные
(около 450 кДа) препараты. Кроме
длины полимерной цепи, фармакологическая активность препаратов ГЭК
определяется степенью замещения
Тема 6
гидроксиэтиловыми группами остатков глюкозы, характером замещения,
концентрацией раствора.
От степени молекулярного замещения зависит скорость элиминации
препарата из кровеносного русла: увеличение степени замещения с 0,5 до 0,7
сопровождается выраженным возрастанием длительности циркуляции ГЭК.
Величина молекулярной массы ГЭК
определяет динамику процесса воспол
нения объема внутрисосудистой жидкости. После введения низкомолекуляр
ных препаратов их объемозамещающее
действие наступает быстро, однако они
интенсивно покидают сосудистое русло
(порог почечной проницаемости около
70 кДа). Инфузия растворов высокомолекулярного ГЭК проявляется более
замедленным терапевтическим эффектом, обусловленным формированием
активных
коллоидно-осмотических
низкомолекулярных фракций под дей
ствием сывороточной сс-1,4-амилазы.
Изменение концентрации раствора
ГЭК, одинакового по молекулярной
массе и степени замещения, обусловливает его онкотическую активность.
10% раствор ГЭК (HES 200/0,5) является гиперонкотическим по отношению
к плазме крови, в то время как 6% раствор HES 200/0,5 — изоонкотическим.
Следует подчеркнуть важную особенность современных препаратов
ГЭК: увеличенная продолжительность
объемзамещающего действия: растворы ГЭК выводятся в основном через
почки, период полувыведения фракции, подверженной быстрой элиминации, в среднем около 3 ч.
Медленно элиминирующаяся фракция ГЭК, образующаяся в процессе рас
щепления его высокомолекулярных
соединений, задерживается в организме гораздо дольше (период полувыведения — около 30 ч.). Интенсивность
выделения продуктов ГЭК через почки
зависит от степени молекулярного за
мещения. Как и другие синтетические
коллоиды, ГЭК способен после инфузии накапливаться в клетках печени,
селезенки и ретикулоэндотелиальной
системы, однако по сравнению с декстранами и производными желатина
этот эффект менее выражен по интенсивности и по длительности. Токсическое повреждение паренхиматозных
органов продуктами ГЭК отсутствует. В целом препараты ГЭК, особенно
препараты второго поколения, например Инфукол ГЭК (HES 200/0,5),
отличаются исключительно высокой
переносимостью и практически полным отсутствием побочного действия.
Растворы ГЭК по объемному коэффициенту не уступают декстранам:
волемический коэффициент 10% HES
200/0,5 составляет 145%, а 6% HES
200/0,5 — 100%. Использование растворов HES 200/0,5 при гиповолемии
сопровождается отчетливым терапевтическим эффектом. Инфузия всего
480 мл 10% раствора HES 200/0,5 при
гиповолемии сопровождается увели
чением сердечного индекса на 23%,
транспорта кислорода — на 14%, его
потребления — на 28%. Рекомендуемая
суточная доза для препаратов ГЭК со
ставляет 20 мл на 1 кг массы тела для
10% раствора и до 33 мл на 1 кг массы
тела для 6% раствора, однако даже ее
значительное превышение (до 55 мл на
1 кг) не оказывало заметных отрицательных последствий.
Преимущества растворов ГЭК по
сравнению с другими коллоидами так
же определяются низкой иммуногенностью. Частота аллергических реакций при инфузии ГЭК ниже в 2-3 раза
по сравнению с растворами желатина и
декстрана, составляя в среднем 0,115%.
При этом тяжелые анафилактические
119
осложнения встречаются крайне редко
(0,00047%).
При оказании реанимационной помощи пациентам с кровопотерей и шо
ком растворы ГЭК имеют существенные
преимущества и перед натуральными
коллоидами, в частности растворами
альбумина или донорской плазмой.
Донорская плазма, например, обладает волемическими и гемодинамическими свойствами, не превышающими
аналогичных показателей растворов
ГЭК. Кроме того, инфузия больших
объемов донорской плазмы увеличивает вероятность развития инфекционных и иммунологических посттрансфузионных реакций. К тому же для начала
трансфузий донорской плазмы требуется время для ее подготовки (размораживание). Сравнительный анализ
гемодинамического действия инфузии
равных количеств (500 мл) 5% раствора альбумина, свежезамороженной
плазмы и 6% раствора ГЭК у больных
с гиповолемией выявил повышение
сердечного индекса соответственно на
0,46, 0,50 и 0,53 л/мин/м2, а увеличение
парциального давления кислорода в
тканях после инфузии ГЭК было почти
в 2 раза выше, чем после переливания
альбумина. Растворы ГЭК в несколько
раз дешевле препаратов донорской крови (альбумин, протеин), что имеет важное экономическое значение.
Негативное влияние на свертывающую систему крови иногда способны
оказывать в основном высокомолекулярные препараты ГЭК, имеющие
большую степень замещения. Среднемолекулярные препараты ГЭК со средней степенью замещения при обычных дозах введения не оказывают
существенного влияния на показатели
гемостаза. Только после введения в
объеме 1000 мл и более за счет первичной гемодилюции могут снижаться
120
Текстовый модуль 2
уровни фибриногена, фактора VIII:С и
количество тромбоцитов.
В целом было установлено, что
патологические изменения в системе
свертывания крови, возникающие после внутривенного введения инфузионных растворов на основе ГЭК, имеют
строгую зависимость от молекулярной
массы субстанции, а также от характера и степени молекулярного замещения. Более высокая молекулярная
масса (выше 400 кДа), более высокая
степень замещения вообще (выше 0,6)
и более высокое отношение замещений
С2/С6 (выше 6) однозначно связано с
выраженными изменениями гемостаза
(плазмастерил, элохаес, стабизол).
Влияние плазмозамещающих растворов на основе ГЭК на систему свер
тывания крови было установлено уже
при первых попытках их клинического
применения в начале 1980-х гг. Более
того, вызванные введением раство
ров на основе ГЭК нарушения системы гемостаза (от диссеминированного
внутрисосудистого свертывания крови
до молниеносно развивающегося ге
нерализованного
геморрагического
статуса) в ряде случаев служили причи
ной гибели больных.
По мере накопления опыта специалисты встретились с противоречивыми результатами экспериментальной
оценки безопасности и эффективности
препаратов, приготовленных из различных субстанций ГЭК, в том числе и
в пределах одной фармакологической
группы HES 200/0,5 (пентакрахмалы).
Показано, что при применении
этих препаратов (ХАЕС-стерил 6% и
10%, гемохес 6 и 10%, рефортан, рефортан плюс и др.) уже при кровопотере в 30 ОЦК в соответствии с инструкциями по применению производителей
этих лекарственных средств и терапевтическими схемами инфузионно-
Тема 6
трансфузионной терапии на основе
применения этих препаратов необходима дополнительная трансфузионная
терапия. Многочисленные клинические исследования показали, что эти
растворы снижают активность и содержание фактора VIII, а также фактора
Виллебранда, увеличивают показатель
протромбинового времени и длительность кровотечения, нарушают агрегацию тромбоцитов; после введения их в
дозе 1500-2000 мл развивается патологическая кровоточивость, вследствие
чего уже после введения 1500 мл инфузионного раствора рекомендовано
дополнительное введение СЗП. После
применения растворов ГЭК при хирургическом лечении ишемической
болезни сердца и при онкологических
операциях по поводу рака желудка у
пациентов были отмечены эпизоды повышенной кровоточивости, связанной
с тромбоцитопатией. Необходимая дополнительная трансфузионная терапия
применения этих препаратов вызвана
и рядом других нежелательных побочных эффектов на систему гемостаза и
систему свертывания крови и прямо
связана с физико-химическими параметрами субстанции.
Так, получены дополнительные
лабораторные и клинические данные
в пользу того, что максимальной безопасной дозой для растворов ГЭК (в
пересчете на 6% раствор) является доза
30 мл на 1 кг массы тела больного. При
превышении этой дозы могут возникать клинические признаки значимой
кровоточивости, которые согласуются с данными об обязательном включении продуктов донорской крови в
терапевтические схемы инфузионнотрансфузионной терапии на основе
применения этих препаратов (ХАЕСстерил, эло-ХАЕС и др). При этом необходимо учитывать, что у больных,
относящихся к группе крови 0(I), со
держание комплекса фактор VIII —
фактор Виллебранда снижено по сравнению с другими группами крови. Таким образом, у них существует предрасположенность к развитию синдрома,
имитирующего болезнь Виллебранда,
которую необходимо учитывать после
введения растворов на основе ГЭК. Требует внимания и введение соответствующих контролей проявления системы
коагуляции и системы тромболизиса в
процессе оперативного вмешательства
и в раннем (1-2 ч.) послеоперационном
периоде при проведении инфузионной
терапии растворами на основе ГЭК.
В этот период могут наблюдаться возрастание кинетики образования сгустков, рост продукции и утилизации
тромбина, продукции и деградации фибрина, послеоперационное повышение
содержания фактора Виллебранда.
Указанные особенности фармакодинамики и результаты клинических
исследований способствовали более
широкому применению в хирургической практике растворов ГЭК с молекулярной массой около 200 кДа и степенью замещения 0,5 (HES 200/0,5), в
частности инфукол ГЭК (HES 200/ 0,5)
(Serum-Werk Bernburg AG, Германия).
Препарат инфукол ГЭК (HES 200/0,5)
представляет собой второе поколение
растворов гидроксиэтилкрахмала. Технология его получения позволяет производить субстанцию с максимально
узким распределением молекулярной массы и точно заданными моле
кулярными параметрами (степень и
характер замещения). По сравнению
с другими гидроксиэтилкрахмалами
инфукол ГЭК (HES 200/0,5) не только имеет оптимальное распределение
молекулярной массы, но и максимально высокие стандарты качества и
воспроизводимости, обеспечивающие
121
оптимальное волемическое действие и
стандартно высокую терапевтическую
эффективность, что делает его универсальным препаратом первоочередного
применения.
Растворы HES 200/6,5 широко
применяются в кардиохирургии при
операциях на сердце в условиях искусственного кровообращения: их
используют как для заполнения АИК,
так и для стабилизации гемодинамики в раннем послеоперационном периоде.
Показана хорошая переносимость
6 и 10% растворов инфукола ГЭК и
практически полное отсутствие побочных эффектов, в том числе и на систему
гемостаза. Предсказуемость и управляемость терапией позволяют врачу
вводить достаточное количество этих
растворов вплоть до суточной дозы ребенку по жизненным показаниям (до
120 мл/кг массы тела). Это позволяет
не ограничиваться суточным объемом
в 500-1000 мл, как это предписано
для растворов ХАЕС-стерил и рефортан, для обеспечения необходимой
степени операционной гемодилюции
и стабильного поддержания объема
циркулирующей жидкости без введения плазмы и растворов альбумина.
Растворы на основе гидрокси
этилированного крахмала второго поколения инфукол ГЭК 6 и 10%
являются
единственными
лекарственными средствами в ряду других
растворов гидроксиэтилированного
крахмала, разрешенными к медицинс
кому применению у детей, включая
новорожденных, и у беременных женщин во II и III триместрах (решение
Фармакологического комитета МЗ РФ
от 13.07.2000 г.).
Проводимые в различных странах
исследования
продемонстрировали
терапевтическую ценность растворов
122
Текстовый модуль 2
ГЭК, в частности HES 200/0,5, в кор
рекции расстройств микроциркуляции
при нарушениях мозгового кровооб
ращения, окклюзиях периферических
артерий конечностей, расстройствах
кровообращения в органах зрения и
слуха. При плацебо-контролируемом
исследовании у больных облитерирующими заболеваниями сосудов нижних
конечностей достоверное увеличение
прохождения расстояния, которое пациент проходил до появления ишемических болей, после лечения ГЭК
(200-500 мл/сут. 2 раза в нед. в течение
6 нед.) наблюдалось в 50% случаев, а
при использовании декстрана по аналогичной схеме — только в 28%.
Растворы на основе гидрокси
этилированного крахмала второго
поколения инфукол ГЭК 6 или 10%
позволили значительно повысить эф
фективность и безопасность не только
операционной, но и терапевтической
гемодилюции при лечении нарушений
кровоснабжения плаценты (фетоплацентарная недостаточность), органов
слуха и зрения, легких, нижних конечностей при окклюзионных заболеваниях периферических артерий, в том числе и у больных диабетом, а также при
интенсивной терапии ишемического
церебрального инсульта. Известно,
что устойчивость макро- и микрогемодинамики к выраженному снижению
показателя гематокрита существенно
зависит от того, какие именно инфузионные коллоидные растворы используют для проведения терапевтической
гемодилюции. Так, в частности, показано, что после введения испытуемым
двух групп с исходными значениями
гематокритного числа около 40% по
500 мл 10% раствора инфукола ГЭК и
10% ХАЕС-стерил показатели гематокрита снижались соответственно до 37
и 34% (снижение показателей гемато-
Тема 6
крита на 8-11 и 18% соответственно)
[Ф. Асскали, X. Фестер, 1998]. Это подтверждает большую терапевтическую
эффективность и большой гемодилюционный ресурс растворов инфукола
ГЭК 6 и 10%, обеспечивающих высокие показатели макро- и микрогемодинамики при относительно низкой нагрузке системы циркуляции крови.
Противопоказания
к применению растворов ГЭК
характерны для коллоидных
кровезаменителей:
■ декомпенсированная сердечная недостаточность;
■ почечная недостаточность (концентрация креатинина сыворотки
крови превышает 177 мкмоль/л);
■ состояния гиперволемии и выраженной интерстициальной дегид
ратации;
■ внутричерепные кровотечения;
■ геморрагический синдром;
■ индивидуальная непереносимость
продуктов крахмала.
Таким образом, использование растворов ГЭК в клинической практике
позволяет констатировать следующие
преимущества этих препаратов:
■ быстрый и продолжительный объемзамещающий эффект;
■ увеличение сердечного выброса и
давления перфузии;
■ усиление транспорта и потребления кислорода;
■ минимальное депонирование и иммуногенность;
■ улучшение микроциркуляции;
■ профилактика синдрома повышенной проницаемости капилляров;
■ снижение экспрессии и блокады
циркуляции молекул адгезии;
■ не угнетают экспрессию поверхностных антигенов моноцитов;
■ не активируют систему комплемента.
В России разработаны и опубликованы следующие терапевтические планы базовой инфузионнотрансфузионной терапии на основе
гидроксиэтилированного крахмала
(пентакрахмала) второго поколения инфукола ГЭК:
■ в интенсивной терапии на догоспитальном этапе;
■ в реанимации новорожденных;
■ при кровотечениях в акушерской и
гинекологической практике;
■ в случае кровопотери при операциях у детей и взрослых;
■ при острой кровопотере;
■ при ортопедических операциях у
детей;
■ при ортопедических операциях у
взрослых;
■ при онкологических операциях;
■ при гинекологических операциях;
■ в сердечно-сосудистой хирургии,
включая операции АКШ (арте
рио-коронарное шунтирование) с
применением АИК;
■ в интенсивной терапии у пострадавших от ожогов детей и взрослых;
■ при операциях у больных гемофилией;
■ при операциях у больных с сахарным диабетом;
■ при эндоскопических операциях;
■ при операциях резекции и трансплантации печени;
■ при нейрохирургических операциях;
■ в интенсивной терапии панкреонекрозов;
■ в интенсивной терапии больных с
облитерирующими поражениями
сосудов нижних конечностей;
■ в интенсивной терапии церебральных ишемических инсультов;
■ в интенсивной терапии астматических состояний;
■ при лечебном плазмаферезе и др.
123
Описание и инструкция по
применению лекарственного
средства инфукол ГЭК 6 и 10%.
Инфузионные растворы инфукола
ГЭК 6 и 10% — это 6 и 10% изотони
ческие растворы синтетического коллоида гидроксиэтилкрахмала, получаемого из картофельного крахмала.
Физико-химические параметры оригинальной субстанции препарата инфукол
ГЭК обеспечивают высокую эффективность при гиповолемии и шоке, а также
при использовании для терапевтической гемодилюции за счет нормализации гемодинамики, микроциркуляции,
улучшения доставки и потребления
кислорода органами и тканями, восстановления порозных стенок капилляров. За счет способности связывать
и удерживать воду препарат обладает
волемическим действием в пределах
85-100 и 130-140% введенного объема
для 6 и 10% растворов соответственно, которое устойчиво сохраняется в
течение 4-6 ч. Кроме того, препарат
улучшает реологические свойства крови за счет снижения показателя гематокрита, уменьшает вязкость плазмы,
снижает агрегацию тромбоцитов и
препятствует агрегации эритроцитов.
Инфукол ГЭК депонируется в клетках
ретикулоэндотелиальной системы без
проявлений токсического действия на
печень, легкие, селезенку и лимфоузлы. Под действием амилазы сыворотки
инфукол ГЭК расщепляется до низкомолекулярных фрагментов (менее
70 кДа), которые удаляются почками.
Сходство структуры инфукола ГЭК со
структурой гликогена объясняет высокий уровень переносимости и практическое отсутствие побочных реакций.
Фармакокинетика. Время полувыведения составляет 4,94 ч. Максимальная концентрация препарата в сы-
124
Текстовый модуль 2
воротке соответствует 11,1±2,7 мг/л.
В течение первых 12 ч. после начала
введения препарата в моче присутствует 24,48±3,93 г гидроксиэтилкрахмала
(49% от введенного количества). На
3-й день после введения в сыворотке
определяются следовые количества
гидроксиэтилкрахмала.
Показания к применению. Профилактика и лечение гиповолемии и
шока в связи с операциями, острыми
кровопотерями, травмами, ожогами и
инфекциями. Нарушения микроциркуляции. Терапевтическое разведение
крови (гемодилюция).
Способ применения и дозы. Препарат инфукол ГЭК 6 и 10% предназ
начен для внутривенных инфузий. При
отсутствии других предписаний препарат вводят внутривенно капельно в соответствии с потребностью замещения
объема циркулирующей жидкости.
Суточная доза и скорость внутривенного введения рассчитываются в
зависимости от кровопотери и концентрации гемоглобина. У молодых больных без риска поражения сердечнососудистой системы и легких пределом
применения коллоидного объемзамещающего препарата считается гематокрит, равный 30% и менее.
Максимальная суточная доза: до
33 и 20 мл 6 и 10% раствора соответ
ственно на 1 кг массы тела в сут. (2,0 г
гидроксиэтилкрахмала на 1 кг массы
тела в сут.).
Максимальная скорость инфузии
зависит от исходных показателей гемо
динамики и составляет примерно 20 мл
на 1 кг массы тела в 1 ч.
Предупреждение. У новорожденных и детей до 3 лет рекомендуется
придерживаться среднесуточной дозы
препарата. В связи с особенностями
водно-электролитного статуса у детей
Тема 6
рекомендуется тщательное наблюдение за уровнем гидратации и содержанием электролитов.
Учитывая возможные анафилактические реакции, первые 10-20 мл инфукола ГЭК 6 или 10% следует вводить
медленно, при тщательном наблюдении за состоянием больного.
Следует учитывать риск перегрузки
системы кровообращения при слишком
быстром введении или слишком высокой дозе препарата.
Важно не смешивать препарат с
другими лекарственными средствами в
одной емкости и в одной системе.
Противопоказания. Гипергидра
тация, гиперволемия, декомпенсированная сердечная недостаточность,
почечная недостаточность с олигурией или анурией, аллергия на крахмал,
кардиогенный отек легких, внутричерепные кровотечения, выраженные нарушения свертываемости крови.
Применение во время беременности. В первые 3 мес. беременности
противопоказан!!!
■
■
■
■
■
Побочное действие:
возможны анафилактические реакции на гидроксиэтилкрахмал;
слишком быстрое внутривенное вве
дение, так же как применение слиш
ком больших доз, могут приводить
к нарушениям гемодинамики;
изредка может возникать упорный,
но обратимый кожный зуд;
введение препарата оказывает влияние на результаты определения
активности амилазы сыворотки
крови, что не связано с клиническими проявлениями панкреатита.
Меры предосторожности:
необходимо контролировать ионо
грамму сыворотки и баланс жид
кости;
следует проявлять осторожность
при геморрагических диатезах;
■ необходимо проявлять осторожность при состояниях дегидратации
(требуется проведение предварительной корригирующей терапии);
■ необходимо следить за достаточным введением жидкости;
■ при проведении лечения следует
контролировать функцию почек;
■ при возникновении реакций непереносимости следует немедленно
прекратить внутривенное введение
препарата и провести необходимые
неотложные мероприятия.
Особенности применения. Введение препарата больным сахарным диа
бетом не сопровождается повышением
уровня глюкозы в крови, вследствие
чего препарат инфукол ГЭК 6 и 10%
может быть использован при проведении инфузионной терапии у пациентов
данной группы.
■
Препараты на основе
полиэтиленгликоля
Из кровезаменителей на основе
полиэтиленгликоля (ПЭГ) используют полиоксидин — 1,5% раствор ПЭГ
с молекулярной массой 20 кДа в 0,9%
растворе хлорида натрия с добавлением 0,05 г йодида калия. Полиоксидин
обладает противошоковым действием,
125
способностью вызывать аутогемодилюцию и удерживать жидкость в сосудистом русле. Кроме того, он обладает
дезагрегирующим действием, что приводит к восстановлению капиллярного
кровотока. Период полувыведения из
сосудистого русла (в основном через
почки) равен 8 ч., при этом 90% препарата выводится в течение 7 сут. Ско
рость и дозы (3-8 мл/мин) внутривенного введения зависят от показаний и
состояния больного.
Кровезаменителем будущего должен стать комплексный препарат, выполняющий в организме ряд функций:
гемодинамическую, газотранспортную,
регулирующую водно-солевой обмен и
кислотно-основное состояние, что особенно важно при лечении тяжелого
шока и кровопотери. Эмульсии фторуглеродов представляют пятую группу
кровезаменителей, с которой связаны
надежды на использование искусственной крови.
Углеродные соединения (фторкарбон, перфторан) являются хорошими растворителями для кислорода и
углекислого газа и в связи с этим представляются идеальными для создания
искусственных эритроцитов. В эксперименте получены хорошие результаты при исследовании некоторых соединений углерода.
Контрольные вопросы по теме занятия
1.
2.
3.
4.
Показания к гемотрансфузии.
Противопоказания к гемотрансфузии.
Как выполнять биологическую пробу?
Предвидеть возможные осложнения при переливании крови и ее компонентов
и пути их профилактики и коррекции.
5. Механизмы развития гемотрансфузонного шока.
126
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
Текстовый модуль 2
Цитратный шок. Патогенез. Клиника. Первая помощь.
Современное компонентное переливание крови.
Основные кровозаменители. Классификация. Механизм действия.
Назовите источники получения крови.
Кем предложена методика трупной крови? Условия ее заготовки.
Пробы на индивидуальную и резус-совместимость.
Препараты крови: классификация, механизмы их действия.
Кровезаменитель — искусственная кровь.
Оформление документации при переливании крови, кровезаменителей.
Компоненты крови: классификация, механизмы действия.
ТЕКСТОВЫЙ МОДУЛЬ 3
Общая анестезиология и реанимация. Хирургическая операция
ТЕМА №7.
Ингаляционный и неингаляционный наркоз. Понятие о премедикации. Препараты
для ингаляционного, в том числе эндотрахеального наркоза. Стадии эфирного наркоза. Масочный наркоз, аппараты для ингаляционного наркоза. Типы дыхательных
контуров. Методика проведения эндотрахеального наркоза. Виды неингаляционного
наркоза и препараты для них. Классификация осложнений и помощь при них. Работа
в операционной
1. Актуальность темы
Выполнение оперативных вмешательств в настоящее время немыслимо
без обезболивания, которое может осуществляться различными путями. Ведущее место занимает при этом ингаляционный и неингаляционный наркоз.
Ингаляционный наркоз является
основой современной анестезиологии.
Только с появлением этого вида обезболивания стало возможным проводить крупные и сложные операции.
Наркотическое вещество в виде летучей жидкости или в виде газа вводится в организм через дыхательные пути
вместе с кислородом. Они вводятся с
помощью аппаратов или маски, а в настоящее время вводятся через специальную трубку в трахею или бронхи.
В этом случае говорят об интубационном наркозе (эндотрахеальном, эндобронхиальном).
Применяют также другие пути введения препаратов для наркоза (внутривенный, внутрикостный, инъекционный и др.). В этом случае говорят о
неингаляционном наркозе. Все виды
наркоза могут сочетаться между собой.
Но без наркоза, обезболивания операция практически немыслима.
■
■
■
■
■
■
2. Учебные цели
Изучить стадии эфирного наркоза,
препараты и технические средства
для выполнения ингаляционного наркоза, типы дыхательных контуров;
Продемонстировать методику проведения масочного наркоза;
Пояснить методику проведения эндотрахеального наркоза;
Классифицировать разновидности
неингаляционного наркоза;
Пояснить методику применения
различных неингаляционных средств
для наркоза;
Обобщить возможные осложнения
наркоза по стадиям и уровням.
3. Самостоятельная
работа студентов
Боль — это защитная реакция организма, но до какого-то определенного
128
Текстовый модуль 3
Тема 7
порога, превышение которого порой
грозит жизни больного. Боль — это
сигнал о грозящей организму опасности. Она является препятствием на пути
хирургического вторжения во внутреннюю среду организма. Поэтому борьба
с болью, история обезболивания неотделима от истории хирургии, как один
из трех главных вопросов (обезболивание, борьба с кровотечением, борьба с
инфекцией), без решения которых невозможно было бы успешное развитие
хирургических вмешательств.
Еще на заре развития хирургии в
родовой и рабовладельческий периоды, а затем и феодальный период лекари прибегали к простейшим общим и
местным воздействиям, чтобы уменьшить боль при производстве хирургических вмешательств. Больным применяли сдавливание сосудов на шее,
кровопускание, давали принять внутрь
спиртные напитки, настои и экстракты,
содержащие вещества, понижающие болевую чувствительность: мак, опий, гашиш, мандрагору. За 1200 лет до нашей
эры греческие врачи (Эскулап и др.)
применяли обезболивающие лекарства
при операциях. Гиппократ за 470 лет до
нашей эры с этой целью давал вдыхать
пары индийской конопли. Это производилось при помощи сонных губок.
Из древних рукописных книг видно,
что и на Руси знания в области обезболивания находились на том же уровне
развития, что и у других народов. В далекие времена «резальника» (хирурга)
не представляли себе без усыпляющих
средств.
Местное снижение боли также использовалось с древних времен. Для
этого применялось пережатие конечности с нервами, охлаждение льдом,
холодной водой. В Египте применяли
втирание одного из видов мрамора с
уксусной кислотой. Выделяющаяся
при этом углекислота вызывала местное охлаждение тканей.
Однако все применяемые методы
были несовершенны, не приводили
к полному обезболиванию. Поэтому
хирургические вмешательства на протяжении тысячелетий требовали у
больных большой выносливости, а у
хирургов очень крепких нервов.
Только с успехами естественных
наук и химии были сделаны открытия,
позволившие успешно развивать учение об обезболивании. Это отражено
в нижеприведенной таблице 4.
Таблица 4. Основные этапы развития учения об обезболивании
Год
Открытие, применение
Х век до н. э.
Обезболивание с помощью охлаждения конечностей
1275
1523
1547
1791—1792
1800
1806
Выделение этилового эфира
Установление наркотических свойств эфира
Синтез эфира и включение его в европейскую фармакопею
Открытие кислорода, углекислого газа и закиси азота
Открытие обезболивающих свойств закиси азота
Открытие морфина
Сотни операций под наркозом тсусенсаном (комплекс алкалоидов — гиосциамин, атропин и др.)
Первая операция под эфирным наркозом
1800—1835
1842, 30 марта
1844
1846, 16 октября
1847
1847
1847
1847
1847
1851—1857
1869
1880
1880
1885
1897
1903
1904
1905
1909
1914
1922
1932
1937
1942
1949
1950
1950
1959
1959
Автор
Авиценна
(Абу ибн Сина)
Люллиус
Парацельс
Кордус
Пристли
Дэви
Сертюрнер
Ханаока
Лонг
Первый наркоз закисью азота
Первая публичная демонстрация операции
под эфирным наркозом
Эндотрахеальный наркоз и спинальная анестезия
в эксперименте
Ректальный, внутривенный и внутриартериальный наркоз
в эксперименте и клинике
Наркоз хлороформом
Описание стадий наркоза эфиром
Применение наркоза в военно-полевых условиях
Исследование кураре в эксперименте
Эндотрахеальный наркоз в клинике
Открытие местно обезболивающих свойств кокаина
Современная методика эндотрахеального наркоза
Проводниковая анестезия
Спинальная (эндолюмбальная) анестезия
Синтез барбитуратов
129
Уэллс
Мортон
Н.И. Пирогов
Н.И. Пирогов
Симпсон
Сноу
Н.И. Пирогов
Бернар, Пеликан
Тренделенбург
В.К. Анреп
Мак Ивен
Холстед, Лукашевич
Бир
Фишер
Н.Ф. Кравков,
Неингаляционный внутривенный наркоз (гедонал)
С.П. Федоров
Синтез новокаина
Эйнгорн
Н.Ф. Кравков,
Комбинированный наркоз
С.П. Федоров
Сочетание наркоза с местным обезболиванием
Крайль
Местное обезболивание по методу тугого ползучего инфильтрата А.В. Вишневский
Внутривенный наркоз гексеналом
Визе
Классификация стадий наркоза
Гуэдел
Комбинированный наркоз с кураре
Гриффит, Джонсон
Искусственная гибернация
Лабори и Юнгар
Искусственная гипотермия
Бигелоу
Искусственная гипотония
Эндерби
Многокомпонентная анестезия
Грей
Де Кастро,
Нейролептанальгезия
Мунделер
Однако, как отображено на таблице, открытие обезболивающих веществ
еще не означало их широкое применение. Прошло много лет, прежде чем их
стали применять в медицине с целью
обезболивания при оперативных вмешательствах.
Так, закись азота, открытая в 1774
году Пристли, вызывающая приятное
ощущение эйфории (за что была назва-
на «веселящим газом»), использована
впервые Уэлсом при удалении у себя
зуба 11 декабря 1844 года. Однако отсутствие знаний о механизме действия
закиси азота, возможных осложнений
привело к тому, что после нескольких
наркозов при удалении зубов обезболивание оказалось неудачным. И наркоз этим газом был на долгие годы дискриминирован и фактически забыт.
130
Текстовый модуль 3
Этиловый эфир был открыт Люллиусом в 1275 году.
Парацельсом были выявлены наркотические свойства его в 1523 году, а после синтеза эфир включен в фармакопею
в 1547 году. И только в 1842 году Лонг
впервые применил его при операции
удаления опухоли головы, причем он
не придал значения своему открытию
и сообщил об этом только через 10 лет.
Поэтому справедливо считать днем открытия наркоза 16 октября 1846 года,
когда зубной врач Томас Мортон продемонстрировал обезболивающее действие
эфира при удалении рака молочной железы. Эти открытия легли уже на подготовленную почву, и спустя несколько
месяцев эфирный наркоз начали применять в других странах (Англии, России,
Франции)(рис. 41).
В 1847 году в Петербурге он был
использован Н.И. Пироговым во время
удаления опухоли молочной железы, а
также Ф.И. Иноземцевым в Москве. Однако еще в 1844 году в газете «Русский
инвалид» Я.А. Чистович опубликовал
статью «Об ампутации бедра при посредстве серного эфира». Н.И. Пирогов
заложил основу экспериментального
изучения различных методов обезболивания: эндотрахеального, внутривенного, ректального наркоза, спинальной
анестезии. Он одним из первых применил в России хлороформ. В 1853-1854
Рис. 41. Мортон проводит эфирный наркоз
Тема 7
годах он же использовал на поле боя
во время Кавказской и в 1854-1855 годах Крымской войн у большого числа
раненых наркоз эфиром. Но уже тогда
он отметил некоторые отрицательные
стороны действия наркоза, необходимость знания клиники наркоза, возможность тяжелых осложнений.
Далее обезболивание быстро завоевало свое место в хирургии и стало
ее неотъемлемой частью. Появились
специалисты-анестезиологи, первым
из которых в 1847 году стал Джон Сноу
в Англии. В 1893 году было создано
первое общество анестезиологов.
Для развития ингаляционного наркоза большую роль сыграло применение кислорода (С.К. Кликович, 1884;
Эндрюс, 1868), выяснение роли углекислого газа, разработка способов его
поглощения (Джексон, 1915), внедрение эндотрахельного метода (Тренделенбург, 1869 и др.).
Появление курареподобных препаратов (Гриффит и Джонсон, 1942)
потребовало разработки новой дыхательной аппаратуры, позволяющей
проводить искусственную вентиляцию
легких (ИВЛ), существенно раздвинувшей границы оперативных вмешательств, в том числе и на сердце. Для
снижения обменных процессов, увеличения переживаемости мозга при
кислородном голодании во время операции на «сухом» сердце предложено
комбинированное обезболивание с гипотермией (Бигелоу, 1950), а для поддержания кровообращения применен
аппарат искусственного кровообращения (С.С. Брюхоненко, 1924; Гибон,
1953). Для борьбы с гипоксией начала
использоваться гипербарическая оксигенация (Борема, 1960).
Гедоналовый наркоз, предложенный фармакологом Н.П. Кравковым,
и использованный С.П.Федоровым
в 1909 году, приобрел мировую известность под названием «русский наркоз».
Он послужил прологом к внутривенному применению в 30-е годы гексенала,
тиопентала натрия, затем стероидных
препаратов (виадрил, продион и др.).
В 60-е годы синтезированы и внедрены
в практику оксибутират натрия, пропанидил (эпонтон, сомбревин), кетамин
(кеталар), диприван и др.
Продолжалось развитие и ингаляционного наркоза. Появились новые
ингаляционные анестетики: циклопропан, фторотан, флюотан, наркотан, метоксифлуран (пентран).
В дальнейшем разрабатывалась
идея многокомпонентного наркоза,
предложенная Грейем в 1959 году, при
котором используется комбинация
препаратов для наркоза с другими препаратами (ганглиоблокаторы, транквилизаторы и др.), что позволяет целенаправленно воздействовать на разные
структуры нервной системы.
Сюда можно отнести методы гибернации и нейроплегии (Лабари и Юнгари, 1949). Однако из-за подавления
компенсаторных реакций организма
аминазином (этизином), входящим в
состав «коктейлей», в настоящее время не применяются. Но разновидность
нейроплегии — нейролептаналгезия
(НЛА), поддерживаемая дроперидолом, фентанилом и желательно закисью кислорода с кислородом, получила
широкое распространение. НЛА дает
достаточное обезболивание без глубокой депрессии.
Обезболивающее действие электронаркоза впервые в эксперименте
выявлено в 1902 году Лемоном. Сейчас используется для этой цели прибор «Электронаркоз» в комбинации с
небольшим количеством аналгетиков,
противосудорожных и седативных
средств.
131
С развитием естественных наук получила толчок к применению и местная анестезия, которая, не нарушая деятельности жизненно важных органов,
позволяет добиться обезболивания
только в области операционного поля.
После открытия кокаина В.К. Анреп использовал его в 1880 году для
местной инфильтрационной анестезии
и блокады, Колер в 1881 году применял
его для обезболивания при операциях
на глазу. Кокаин был использован у раненых на поле боя под Гаген-Торном
и Тилле в 1897 году во время грекотурецкой войны в Афинах. Однако
высокая токсичность препарата не
позволила его применять в широких
масштабах. И только после открытия новокаина Эйнгорном в 1905 году
местная анестезия получила широкое
распространение. Этому способствовали работы А.В. Вишневского (1922),
его предложение применять местную
анестезию малыми концентрациями
новокаина методом тугого ползучего
инфильтрата, который используется и
в настоящее время, вместо инфильтрационной анестезии по Реклю (1889).
В ХХ столетии синтезировано много препаратов для местной анестезии
(лидокаин, ксилокаин, тримекаин,
кортикаин и др). Арсенал этих средств
постоянно пополняется.
Разработаны и другие способы местной анестезии: проводниковая (А.И.
Лукашевич, 1886; Оберст, 1888), спинальная, эндолюмбальная (Бир, 1897),
перидуральная, эпидуральная (А. Сикард, Ф. Кателин, 1901), которая практически выполнена Ф. Паже (1921).
Применяется иглоанестезия (акупунктура), однако требуется добавление аналгетиков, так как полного обезболивания не достигается.
Во время Великой Отечественной
войны (1941-1945) обезболивание с
132
Текстовый модуль 3
Тема 7
успехом применялось в виде местной
инфильтрационной анестезии и масочного эфирного наркоза.
В развитие отечественной анестезиологии большой вклад внесли видные хирурги А.А. Амосов, А.Н. Бакулев, А.А. Вишневский, И.С. Жоров,
Е.Н. Мешалкин, Б.В. Петровский и др.,
которые воспитали многочисленных
учеников, возглавивших анестезиологическую службу.
Анестезиология выделилась в самостоятельную дисциплину в 60-х годах
ХХ столетия. Начали организовываться кафедры анестезиологии в медицинских институтах, стали готовиться
квалифицированные кадры анестезиологов и внедряться современные методы анестезиологии и реанимации в
медицинскую практику. Анестезиологи
стали неотъемлемым звеном в каждом
хирургическом стационаре. Созданы
общества анестезиологов в различных
городах, в том числе и на Украине.
Всю анестезиологическую и реанимационную службу на Украине возглавляет главный республиканский специалист по анестезиологии и реанимации.
■
КЛАССИФИКАЦИЯ МЕТОДОВ
ОБЕЗБОЛИВАНИЯ
Все методы обезболивания можно
разделить на следующие группы:
ОБЩЕЕ ОБЕЗБОЛИВАНИЕ
(НАРКОЗ)
Наркозом называется состояние
торможения центральной нервной системы, сопровождающееся потерей сознания, чувствительности, движений,
условных и некоторых безусловных
рефлексов.
I.
1.
■
■
Общее обезболивание (наркоз):
Ингаляционный наркоз:
Масочный;
Интубационный (эндотрахеальный,
эндобронхиальный).
2. Неингаляционный:
■ Внутрисосудистый (внутривенный,
внутриартериальный);
■ Внутрикостный;
■ Через рот;
■ Инъекционный (подкожный, внутримышечный);
Внутриполостной (внутрибрюшинный, внутриплевральный);
■ Прямокишечный;
■ Нейролептаналгезия.
3. Комбинированные виды наркоза:
■ Интубационный комбинированный наркоз (вводный, базисный
(основной)).
■ Интубационный многокомпонентный комбинированный наркоз;
■ Искусственная гибернация;
■ Искусственная гипотония;
■ Искусственная гипотермия.
■
■
■
■
■
■
■
■
■
II. Местное обезболивание
(местная анестезия):
Терминальная (поверхностная);
Инфильтрационная (по Реклю),
методом тугого ползучего инфильтрата (по А.В. Вишневскому);
Внутрисосудистая (внутривенная,
внутриартериальная);
Внутрикостная;
Проводниковая;
Эндолюмбальная (спинномозговая);
Эпидуральная (перидуральная);
Местным охлаждением (хлорэтил);
Иглоанестезия (акупунктура).
Теории наркоза
Механизм действия наркотических
веществ сложен и в настоящее время
до конца не изучен, но некоторые проявления их воздействия позволили по
мере полученных научных фактов в
различные временные периоды пред-
ложить некоторые теории действия
наркотических веществ.
Липидная теория (Г. Майер, 1889;
Ч. Овертон, 1901) основана на свойстве
наркотических веществ растворять
жиры и жироподобные вещества, которых много в мозговой ткани (лецитин, холестерин). Проникая в клетку,
анестезирующие средства вызывают их
избирательное «отравление», что проявляется состоянием наркоза. Однако
наркотические вещества действуют и на
клетки, лишенные липидов, а с другой
стороны, есть анестезирующие средства, которые не растворяют жиры.
Адсорбционная теория (Траубе,
1904; О. Варбург, 1914) объясняет действие наркотических препаратов способностью их адсорбироваться на поверхности клеточных мембран в ЦНС.
Это изменяет физико-химические
свойства клеток, нарушает ферментативные процессы, внутриклеточный
обмен, т.е. их жизнедеятельность, что
вызывает состояние наркоза.
Теория проницаемости (Х. Гебер и Винтерштейн, 1924) основана на
том, что под влиянием наркотических
средств происходит набухание коллоидов белков клеток и уменьшение воды
в них. Уплотнение коллоидной оболочки клетки и уменьшение или исчезновение потенциала приводит к потере
возбудимости и состоянию наркоза.
Эти изменения в клетке наблюдал еще
в 1875 году Клод Бернар, и они были
подтверждены в 1931 году Банкрофтом
и Рихтером. Они назвали ее коагуляционной теорией. Однако эти изменения
(коагуляция) обратимы. При большой
концентрации наркотического вещества может наступить еще и выпадение
коллоидных растворов (липидов), в результате чего возникают необратимые
изменения проницаемости клеточных
мембран и клетки погибают. Приве-
133
денная теория рассматривает действие
анестетических средств в отрыве от
всего организма и его центральной
нервной системы.
Теория нарушения окислительных процессов (М. Ферворн, 1912),
или в настоящее время по Р. Макинтошу теория удушения объясняет состояние наркоза тем, что наркотические
вещества блокируют ферменты, регулирующие в клетках мозга окислительновосстановительные процессы. Клетки
теряют способность использовать кислород, наступает гипоксия и асфиксия
клеток. Однако только этим объяснить наступление наркоза нельзя, так
как гипоксия при наркозе наступает не
только в клетках мозга, но еще сильнее в клетках крови, тканях организма.
Это является не причиной, а следствием, что признавал и сам Р. Макинтош.
Нарушение деятельности центральной
нервной системы при наркозе происходит значительно глубже, чем при
кислородном голодании.
П.К. Анохин (1959) предложил
для объяснения механизма действия
наркотических веществ мембранную
теорию возбуждения, согласно которой анестетики вызывают сдвиг потенциала мембран, что приводит к торможению и возникает состояние наркоза.
Молекулярная теория предложена Л. Полингом (1961) и пользуется с
успехом за рубежом. За нее автор получил Нобелевскую премию. Согласно
этой теории, наркотические вещества в
водной среде организма вызывают образование микрокристаллогидратов,
что препятствует распространению
электрических колебаний.
Физиологическую теорию наркоза разрабатывали отечественные
ученые: И.М. Сеченов, И.П. Павлов,
Н.Е. Введенский, В.С. Галкин и др.
О центральном происхождении тор-
134
Текстовый модуль 3
можения спинномозговых рефлексов
указывают опыты на лягушках Клода
Бернара и И.М. Сеченова. Последний
укладывал кристалик хлорида натрия
на срез зрительного бугра и тем самым
вызывал торможение спинальных рефлексов, т.е. торможение из головного
мозга распространялось на нижележащие центры и спинной мозг. Это заложило основу современной теории наркоза.
Н.Е. Введенский показал, что торможение в нервной клетке развивается при
сверхсильных раздражителях, которые
превышают уровень ее функциональной подвижности (лабильности). Анестетическое вещество снижает границу
лабильности клетки, и так склонной к
торможению, наступает парабиотическое состояние коры мозга, т.е. наркоз.
И.П. Павлов исходил из позиций
теории физиологического сна. По его
мнению, сон наступает при уменьшении числа раздражающих импульсов
(пассивный сон). При действии наркотических средств наступает процесс
безусловнорефлекторного разлитого
торможения коры и подкорковых центров (активный сон).
В.С. Галкин исходит тоже из позиций взаимоотношения процессов возбуждения и торможения, но считает,
что процесс торможения в коре головного мозга развивается рефлекторно
под влиянием импульсов, исходящих
от сосудистых хеморецепторов, вызванных раздражением наркотическим
веществом. Остается неясным, какие
же именно соединения действуют на
сосудистые хеморецепторы.
Школа П.К. Анохина считает, что
местом приложения наркотического препарата является ретикулярная
формация мозга. При этом снижается
ее активность, что нарушает корковоподкорковые связи, обеспечивающие
Тема 7
бодрствующее состояние. Наступает
состояние наркоза.
Таким образом, имеются многие
факты физико-химического, условнорефлекторного и прочих воздействий,
приводящих к состоянию наркоза, но в
каждом конкретном случае тонкий, детальный механизм действия наркотического вещества недостаточно изучен.
Но это не препятствует практическому
применению наркоза. Для профессионального проведения общего обезболивания необходимо знание клиники
наркоза, его стадий.
Стадии наркоза
В настоящее время пользуются
клиническими проявлениями в виде
стадий, описанными в 1937 году Гуэделом, при эфирном наркозе. Имеется IV
стадии наркоза.
I стадия — аналгезии. Ее еще называют стадией опьянения или стадией
оглушения. Сознание вначале сохранено, а затем постепенно угнетается. Болевая чувствительность значительно
уменьшается, тактильная и температурная остаются. Тонус мышц сохраняется,
а напряжение отсутствует. Поэтому в
этой стадии возможно выполнение кратковременных вмешательств (вскрытие
гнойника, вправление вывиха и др.)
под «рауш-наркозом», при котором в
маску наливают 10-15мл эфира и дают
несколько раз вдохнуть. В первой стадии наркоза пульс слегка учащается,
незначительно повышается артериальное давление, дыхание немного учащается, может быть неравномерным, как
реакция на наркотическое вещество.
Цвет кожных покровов остается без изменений, исчезает ресничный рефлекс,
реакция зрачка на свет прямая и содружественная сохранены, его ширина
остается прежней или слегка увеличивается, сохраняется роговичный реф-
лекс. Длительность стадии составляет
при эфирном наркозе 3-4 мин.
Дж. Артузио в 1954 году предложил разделить эту стадию на три фазы:
первая — начало усыпления, когда нет
полной аналгезии и нет амнезии, вторая — полная аналгезия и частичная
амнезия. Третья — полная аналгезия
и амнезия. Он предложил проводить
наркоз в стадии аналгезии, когда сохраняются компенсаторные реакции
организма. Благодаря внедрению в
практику мышечных релаксантов, стало возможным использовать наркоз в
стадии аналгезии даже при больших
операциях.
II стадия — возбуждение. Происходит выключение коры головного мозга и возбуждение подкорковых
центров («бунт подкорки»). Это проявляется речевым и двигательным
возбуждением. Больной говорит бессвязно, бесконтрольно. Появляется
напряжение мышц, непроизвольные
резкие движения, что может привести
к разрыву мышц, падению со стола.
Поэтому пациента фиксируют на операционном столе. Наступает спазм жевательных мышц. Дыхание становится
поверхностным, учащенным, неравномерным, появляется кашель. Возбуждается вегетативная нервная система.
Расширяются сосуды кожи, она становится красной, резко усиливается потливость, слезотечение, саливация. То
же происходит и с другими железами,
в том числе бронхиальными, поэтому
до наркоза в момент премедикации вводится атропин. У больного возбуждается
рвотный центр и возникает рвота. Может наступить аспирация рвотных масс
и асфиксия. Пульс резко учащается,
становится напряженным. Повышается
артериальное давление. Зрачок расширяется, но сохраняется реакция на свет.
Сохраняется роговичный рефлекс. Бо-
135
левая чувствительность отсутствует,
однако оперировать из-за возбуждения
не представляется возможным. Длительность стадии 7-15 мин.
III стадия — хирургическая, или
наркозная. Она подразделяется на
4 уровня: уровень движения глазных
яблок, уровень роговичного рефлекса,
уровень расширения зрачка и уровень
диафрагмального дыхания.
Уровень движения глазных яблок
(III1). В этот период больной успокаивается, сознание отсутствует, отсутствует болевая, тактильная и тепловая чувствительность. Напряжения мышц нет,
за исключением мышц брюшного пресса. Тонус мышц сохранен, но несколько ослабевает тонус отводящей мышцы
глаза, из-за чего появляется непроизвольное движение глазных яблок. Они
движутся (плавают) в горизонтальном
направлении. Гиперемия кожи, потливость, слезотечение уменьшаются, но
не проходят. Снижается частота пульса,
уменьшается артериальное давление,
но к исходному не приходит. Дыхание
становится равномерным. Зрачок сужается, реакция на свет и роговичный,
глоточно-гортанный рефлексы сохраняются. Операция может выполняться,
но если она производится на органах
брюшной полости, требуется применение релаксантов.
Уровень роговичного рефлекса (III2).
Движения глазных яблок прекращается.
Сознание и болевая чувствительность
отсутствуют. Исчезает напряжение
мышц брюшного пресса и тонус жевательных мышц. Происходит западение
нижней челюсти, а так как к ней крепятся мышцы языка, то западает язык,
что нарушает проходимость дыхательных путей и может вызвать асфиксию.
Пульс, артериальное давление, дыхание
приходят к нормальному, исходному
состоянию. Прекращается слезотече-
136
Текстовый модуль 3
ние, кожа приобретает обычный цвет.
Зрачок еще больше сужается, становится с булавочную головку, но на свет
хорошо реагирует. Исчезает роговичный
рефлекс. На этом уровне выполняются
оперативные вмешательства.
Уровень расширения зрачка (III3)
характеризуется дальнейшим углублением наркоза. В этот период зрачок
начинает расширяться, реакция зрачка на свет сохранена, но снижена. Отсутствует роговичный рефлекс, а также глоточно-гортанный. Этот момент
важен для интубации трахеи при отсутствии миорелаксантов. Отсутствие
глоточного рефлекса предупреждает
отрицательные рефлексы с глотки на
жизненно важные органы и в первую очередь на сердце. Напряжения
мышц нет, теряется тонус поперечнополосатых мышц. Сохраняется только тонус сфинктеров. Артериальное
давление снижается, пульс учащается,
становится мягким, появляется частое
поверхностное дыхание. Кожные покровы становятся бледными, уменьшается секреция слезы, хотя глаза еще
сохраняют блеск. В этом уровне уже
начинают проявляться признаки передозировки наркоза. Введение в этот
уровень проводят или для интубации
трахеи, или для выполнения операции
в наиболее рефлексогенных, болезненных зонах. Больше 20 минут в этом
уровне поддерживать наркоз не нужно, так как может наступить четвертый
уровень, уровень передозировки.
Уровень диафрагмального дыхания
(III4). Это уровень передозировки наркоза, когда анестезирующее вещество
начинает воздействовать на жизненно
важные центры продолговатого мозга
(сосудисто-двигательный и дыхательный). В этом уровне пульс нитевидный,
частый на периферических артериях
и может отсутствовать, сохраняясь на
Тема 7
крупных сосудах. Артериальное давление падает. Все сфинктеры и мышцы (в том числе дыхательные), кроме
диафрагмы, потеряли тонус. Поэтому
имеет место диафрагмальное дыхание,
частое, поверхностное с постепенным
нарастанием глубины, затем ее уменьшением и паузой (Чейна — Стокса) или
редкое с паузами (Куссмауля). Кожные
покровы бледные с мраморным оттенком, слизистые бледные. Глазные
яблоки уменьшены в размерах (энофтальм), роговицы сухие, мутные, зрачки расширены и на свет не реагируют.
Могут наступить непроизвольное мочеиспускание и дефекация. Этот уровень
наркоза опасен для жизни. Больной не
должен в нем оказаться. При дальнейшем поступлении наркотического вещества (эфира) наступает IV стадия.
IV стадия —агональная, при которой наступает паралич дыхательного и сосудисто-двигательного центра и
наступает клиническая смерть. Отсутствуют дыхание, сокращения сердца,
нет пульса на сонной артерии, зрачки
широкие, не реагируют на свет.
Наркоз обычно проводят в I, II, III
уровне III стадии наркоза и после прекращения введения наркотического
вещества вместо агональной наступает
стадия пробуждения, название которой дал И.С. Жоров. В ней все стадии
и уровни проявляются в обратном порядке, но более медленно. Отсутствует выраженное возбуждение. Больной
сонлив, спит, пока наркотическое вещество не разрушится в организме и не
выведется из него. Обычно сон продолжается от 2 до 6-12 часов.
Принципиально при всех видах
наркозов в клиническом течении наблюдаются все четыре стадии. Однако
при использовании различных препаратов, специальных способов обезболивания отмечаются особенности кли-
нических проявлений этих стадий как
по длительности, так и по выраженности и другим признакам.
Подготовка больного
к наркозу
Анестезиолог наравне с хирургом отвечает за подготовку больного
к операции. Он осматривает пациента
за несколько дней до плановых вмешательств и непосредственно перед
экстренными вмешательствами. Он
должен знать не только о том, какое
основное заболевание имеется у больного, но и сопутствующие заболевания, которые могут существенно повлиять как на исход наркоза, так и на
исход операции. Потому анестезиолог
тщательно осматривает больного, выясняет результаты обследования всех
систем организма. При наличии сопутствующих заболеваний, нарушений деятельности жизненно важных органов
необходимо их корригировать заблаговременно, а при неотложных вмешательствах до и во время наркоза.
В процессе подготовки к обезболиванию необходимо санировать ротовую
полость, выяснить аллергологический
анамнез: были ли раньше операции и
под каким наркозом, как больной его
перенес.
Анестезиолог должен определить
вид наркоза, способ его проведения,
показания и противопоказания.
Он должен психологически подготовить больного к наркозу, успокоить его.
Готовится к наркозу и желудочнокишечный тракт. Накануне и утром в
день операции ставится очистительная
клизма, вечером больной принимает
легкий ужин, а утром не разрешается прием ни пищи, ни жидкости. Если
имеется задержка эвакуации из желудка, то перед подачей в операционную
зондом удаляется его содержимое,
137
чтобы во время наркоза не произошла
рвота или регургитация с аспирацией в
дыхательные пути и асфиксия.
Назначают премедикацию. На ночь
и утром назначаются снотворные, седативные средства, транквилизаторы,
чтобы пациент был перед операцией
спокоен.
За 30-40 минут до наркоза больному вводят внутримышечно или подкожно препараты: антигистиминные
(димедрол, супрастин или др.), аналгетики (промедол 1-2% 1 мл или фентанила 2,0 мл или др.), атропин. После
этого больной становится сонлив, вял
и более чувствителен к веществам для
наркоза, что позволяет уменьшить их
дозировку и снизить токсичность применяемого наркотического вещества.
Больной подается в операционную на
каталке, чтобы не возник ортостатический коллапс. Непосредственно перед
подачей в операционную необходимо
освободить мочевой пузырь. Съемные
зубы и протезы должны быть сняты
перед наркозом.
При экстренных вмешательствах из
желудка удаляют содержимое зондом,
при необходимости промывают его.
Премедикацию проводят внутривенно
на операционном столе.
Ингаляционный наркоз
При ингаляционном наркозе анестезирующие средства вводятся через
дыхательные пути. Наркоз может быть
чистый, если применяется один препарат от начала до конца операции;
смешанный — используются для наркоза несколько веществ одновременно;
и комбинированный — вещества применяются вначале одни (вводный наркоз), затем другие (основной или базисный наркоз).
Ингаляционный наркоз может
проводиться летучими, легко испа-
138
Текстовый модуль 3
ряющимися анестетиками (эфир, хлороформ, фторотан и др.), или газообразными веществами (закись азота,
циклопропан).
Препараты
для ингаляционного наркоза
Эфир (этиловый, диэтиловый, серный эфир). Применяется очищенный
медицинский эфир для наркоза (Аеther
pro narcosi), который представляет из
себя бесцветную жидкость со специфическим запахом, плотность 0,714 г\см3
при температуре 25оС, точка кипения
35оС, взрывоопасен в смеси с кислородом и воздухом и поэтому ограничивает его применение в современной
анестезиологии. Его нельзя применять
при открытом огне (лампа, диатермия,
электронож, статическое электричество). Он растворяется в воде, смешивается с хлороформом, спиртом и др.
веществами, разлагается на свету, воздухе и в тепле, образуя вредные примеси, из-за чего хранится во флаконах из
темного стекла с герметичной упаковкой. Технический эфир не применяется, но и медицинский может разлагаться. Потому применяются пробы для
определения чистоты эфира: 1) Берется
10 частей эфира и 1 часть 10% раствора
йодистого калия, сбалтываются на свету и через 1 час оценивают результат.
Если смесь остается неокрашенной, то
эфир чистый. А если смесь окрашена в
желтый цвет, то эфир разложившийся
и применять его нельзя; 2) Эфир наносят на часовое стеклышко. После испарения на нем не должно быть кислого
осадка; 3) Наносят эфир на фильтровальную бумагу. После испарения не
должно быть пятна и запаха сивушных
масел; 4) Плотность эфира не должна
превышать 0,725 г\см3.
Эфир достаточно сильный анестетик. Для поддержания наркоза на пер-
Тема 7
вом уровне 3 стадии требуется подача
дыхательной смеси в концентрации
2-5 объемных % (в крови 0,18-0,35 г\л;
а для более глубокого наркоза требуется 10-12 об. % эфира (концентрация в
крови 1,3-1,7 г\л). Широта терапевтического действия достаточно большая.
Он обладает раздражающим действием
на слизистые оболочки, поэтому может
вызвать кашель, ларингоспазм, слюнотечение и др.
Обладает токсическим действием на печень, почки, поэтому при декомпенсации их функции применять
эфир нельзя. Опасно его применение
при тяжелых обменных нарушениях
(сахарный диабет, тяжелой кахексии,
анемии), при деструктивных процессах
в легких (пневмония, бронхоэктатическая болезнь, тяжелые формы туберкулеза легких), декомпенсации сердечной деятельности, резком повышении
артериального давления (200 и более
мм рт. ст.), тяжелом общем состоянии
больного с понижением артериального давления (шок, коллапс, острая
анемия, интоксикация), заболеваниях,
сопровождающихся повышением внутричерепного давления (травмы, опухоли и др.).
Хлороформ (трихлорметан) со
специфическим сладковатым запахом
и вкусом. Имеет плотность 1,476 г\см3,
точку кипения 61-62оС, может легко
смешиваться с эфиром и спиртом. Он
не взрывоопасен, на свету разлагается
с образованием токсических веществ
(соляная кислота, хлор, фосген), на
коже вызывает раздражение вплоть
до ожога. Хлороформ в несколько раз
превышает наркотическое действие
эфира, без выраженного возбуждения
и быстро больного вводит в наркоз,
однако имеет небольшую широту терапевтического действия и представляет
опасность для передозировки. Облада-
ет токсическим действием на печень и
почки, может вызвать фибрилляцию
сердца. Поэтому в настоящее время для
наркоза практически не применяется.
Отдельные авторы за рубежом применяли его в смеси с закисью азота и кислородом.
Фторотан (флюотан, наркотан,
галотан) — это прозрачная бесцветная
жидкость со сладковатым запахом, напоминающим хлороформ. Температура кипения 50,2оС, плотность — 1,87г\
см3 при 20о С. Растворимость в жирах в
100 раз выше, чем эфира, давление паром над жидким фторотаном высокое,
поэтому требует применения специальных испарителей. Не взрывоопасен.
Обладает сильным наркотическим действием, не раздражает слизистые оболочки, расширяет бронхи, из-за чего
используется при заболеваниях легких.
Введение в наркоз происходит быстро
(2-3 мин.) и для поддержания наркоза требуется небольшая доза (0,5-1,0
об. %). Но препарат обладает токсичностью в 3 раза большей, чем эфир,
угнетает сердечно-сосудистую систему,
урежает сердцебиение и даже может
возникнуть фибрилляция сердца. Он
повышает чувствительность сердца к
адреналину и норадреналину, поэтому
их применять на фоне фторотанового
наркоза не следует. Фторотан снижает
артериальное давление, из-за чего при
гипотонии (шок, кровотечение, снижение ОЦК) применение опасно. Препарат токсичен для печени. На свету
препарат разлагается, поэтому выпускается во флаконах темного цвета со
стабилизатором (0,01% тимола).
Метоксифлуран (пентран) представляет из себя прозрачную бесцветную жидкость с фруктовым запахом.
Температура кипения — 104,6оС, плотность при 25оС — 1,42 г\см3. Препарат
имеет низкое давление паров (25 мм
139
рт. ст. при 20оС), что позволяет использовать обычные испарители. Он
не воспламеняется, не взрывается и
не разлагается на воздухе и при свете.
Наркотическая сила выше эфира и хлороформа. Для вводного наркоза в чистом виде практически не применяется,
так как медленно наступает усыпление
(через 8-10 мин.), уже 0,5-0,8 об. %
вызывает аналгезию. Применяется
для поддержания (основного) наркоза с подачей 0,5-1,0 об. % вдыхаемой
смеси с кислородом. Препарат имеет
свойство адсорбироваться резиновыми
деталями наркозного аппарата с обратной диффузией, что требует отключения подачи анестетика за 10-20 минут
до окончания операции.
Трилен (трихлорэтилен, наркоген) — прозрачная бесцветная жидкость со сладковатым специфическим
запахом с точкой кипения 87,5оС и
плотностью 1,47 г\см3 при температуре
20оС. Препарат при соприкосновении с
натровой известью разлагается на фосген и угарный газ, в связи с чем применяется без адсорбера по полуоткрытому контуру. Иногда его окрашивают
в синий цвет, чтобы не было ошибки.
Выпускается в бутылках из темного
стекла и хранится в прохладном месте.
Трилен обладает сильным анестетическим действием, быстро приводящим
к хирургической стадии. Однако уже
при 2-3 об. % может вызвать учащение
сердцебиения и дыхания, нарушение
ритма сердца и др. Поэтому в настоящее время он применяется как компонент комбинированной анестезии или
в чистом виде, но в концентрациях, не
превышающих 1,5 объемных %.
Хлорэтил (этилхлорид) в условиях низкой температуры и под повышенным давлением представляет
бесцветную жидкость с температурой
кипения 12-12,5оС и плотностью при
140
Текстовый модуль 3
0оС 0,921 г\см3, имеет эфирноподобный запах, может гореть зеленоватым
пламенем и взрываться в присутствии
воздуха и кислорода. Терапевтическая
широта очень ограничена (в хирургической стадии в крови концентрация
0,3 г\л, а летальная 0,4 г\л. Токсичен,
особенно для сердца. Поэтому в хирургической стадии не используется,
и редко для кратковременного наркоза
(рауш-наркоз).
Хлорэтил легко испаряется с кожи
и слизистых, вызывая их замораживание в поверхностных слоях, что позволяет его использовать как местное анестезирующее средство при небольших
поверхностных хирургических манипуляциях.
Закись азота («веселящий газ»)
представляет из себя газообразное вещество, без запаха, не взрывоопасен, но
может поддерживать горение в смеси
с кислородом и эфиром. Под давлением 40 атмосфер переходит в жидкое состояние с температурой кипения 55оС
и хранится в металлических баллонах
серого цвета. Плотность жидкого азота — 0,9 г\см3, газообразного — 1,52
кг\м3. Обладая инертными свойствами
в организме, не вступает во взаимодействие ни с какими тканями и органами
и выделяется в неизмененном виде через легкие. Применяется для наркоза
в смеси с кислородом в соотношении:
1:1, 2:1, 3:1, 4:1 (в последнем случае
20% кислорода и 80% закиси азота).
Снижать концентрацию кислорода
ниже 20% во вдыхаемой смеси нельзя,
так как наступает тяжелая гипоксия у
больного.
При проведении наркоза закисью
азота больной спокойно и быстро засыпает без возбуждения, после прекращения подачи препарата пробуждение
наступает сразу. Однако препарат оказывает слабое наркотическое действие,
Тема 7
вследствие чего при чистом наркозе
можно выполнить только небольшие
хирургические вмешательства, а при
больших и длительных закись азота
применяют в сочетании с другими наркотическими препаратами.
Циклопропан (триметилен) —
это бесцветный индифферентный газ
со специфическим запахом и плотностью 1,46 кг\м3, переходящий в жидкое состояние под давлением 5 атм.
Хранится в металлических баллонах,
окрашенных в красный цвет. Газ в смеси с воздухом или кислородом может
взрываться, поэтому в операционной
не должно быть открытого огня и источников статического электричества.
Из-за большой огнеопасности его применяют ограничено. Он не оказывает
токсическое воздействие на печень и
почки.
Препарат обладает сильным наркотическим действием, быстро вводит
больного в наркоз (2-3 мин.). При прекращении введения пациент быстро
пробуждается. Циклопропан не оказывает раздражающего действия на дыхательные пути, но, раздражая блуждающий нерв, может вызывать аритмию,
фибрилляцию сердца. Он повышает
восприимчивость сердца к действию
адреналина и норадреналина, поддерживает и стабилизирует артериальное
давление, из-за чего можно применять
при шоке и кровопотере.
Нарцилен и этилен — газообразные препараты для наркоза, которые
применяются в смеси с кислородом,
концентрация которого должна быть
не ниже 20%. Терапевтическая концентрация их 60-66%, а токсическая —
85-90%
Их действие напоминает клинику
закиси азота: больной быстро вводится
в хирургическую стадию и быстро просыпается. Но наркотическое действие
несколько глубже, чем закиси азота;
несколько повышают артериальное
давление; токсического действия на
паренхиматозные органы не оказывают. Недостатком их является огнеопасность, взрывоопасность не только при
открытом огне, но и под влиянием статического электричества, возникающего в наркозных аппаратах.
Маски и аппараты для наркоза
Для проведения ингаляционного
наркоза после его открытия вначале
применялись различные маски и приспособления, а затем и наркозные аппараты все время подвергались совершенствованию.
Маска Эсмарха представляет из
себя проволочный каркас с кольцом,
легко стерилизуется. Перед использованием покрывается марлей, которая
прижимается кольцом. Так как она имеет грушевидную форму, при накладывании на лицо закрывает рот и нос. Во
избежание попадания наркотического
вещества в глаза последние закрываются полотенцем. Маска по окружности
закрывается полотенцем или большой
салфеткой, чтобы остался свободный
участок на выступающей части маски.
На это место капельно наносится анестетик, и больной его вдыхает вместе с
воздухом. Через маску больной делает
выдох в окружающую среду (рис. 42).
Маска Шиммельбуша отличается
от предыдущей тем, что в ней у основания каркаса имеется металлический
желобок, который предотвращает попадание наркотического вещества на
кожу лица. Этим предупреждается раздражение кожи.
Маска Жийяра состоит из проволочного каркаса, обшитого марлей и
клеенкой, а на дне имеется марлевый
шарик, на который наливают 40-50 мл
эфира. Маской закрывают лицо боль-
141
2
1
4
3
Рис 42. Виды наркозных масок:
1 – маска Эсмарха; 2 – маска Жийяра; 3 – маска
Шиммельбуша; 4 – маска Омбредана – Садовенко
ного и проводят «оглушающий» наркоз при кратковременных вмешательствах. Длительно применять ее нельзя,
так как развивается гиперкапния (накопление в крови углекислого газа).
Маска Омбредана — Садовенко
представляет металлический резервуар с войлоком. Вверху сделано отверстие, через которое заливается эфир
(100-150 мл). Для контроля за дыханием присоединен сбоку дыхательный
мешок. Маска плотно прилегает к лицу
и сообщается отверстием с резервуаром, ширина которого регулируется
ручкой со стрелкой. Этим дозируется
подача наркотика. Однако при применении этой маски имеется опасность
развития гипоксии и гиперкапнии.
Могут применяться портативные
аппараты с масками для дачи наркоза,
например, трилен.
Вышеприведенные маски и подобные приспособления не позволяют
точно дозировать поступление жидких
наркотических средств, а тем более
применять газообразные вещества и
кислород. Поэтому были сконструированы аппараты, позволяющие исключить частично или полностью указан-
142
Текстовый модуль 3
Тема 7
ные недостатки, а также производить
вспомогательное дыхание, искусственную вентиляцию легких (ИВЛ). Так,
например, был предложен наркозный
аппарат ЭМО (Эпштейн — Макинтош — Оксфорд). Он состоит из маски
с выдыхательным клапаном (внизу),
камеры испарителя в водяной камере
и камеры для смешения паров эфира и
воздуха (справа), дыхательного мешка
в виде меха с дыхательными клапанами и шлангами (слева).
Он применяется для открытого
способа наркоза как масочным, так и
интубационным методом. По такому
же типу был сконструирован отечественный аппарат АН-4.
Для полуоткрытого способа наркоза
сконструирован портативный складной
аппарат АН-2 завода «Респиратор».
Современные наркозные аппараты
имеют однотипное строение основных
частей с особенностями конструкторского решения:
1. Баллоны для наркотических веществ, кислорода и углекислоты с
редукторами;
2. Система дозиметров с обогатительным устройством;
3. Адсорбер;
4. Испаритель для жидких наркотических веществ;
5. Дыхательный мешок или мех;
6. Дыхательные шланги;
7. Система для регулирования движения газов;
8. Маска.
Примерами таких аппаратов может быть аппарат «Красногвардеец»,
конструктивно более совершенный
«Полинаркон-2» и др.(рис. 43).
Все перечисленные части можно
объединить в три блока:
а) баллоны с газообразными веществами; б) блок дозиметров и испарителей; в) дыхательная система.
Дозиметры служат для определения
объема подаваемой больному дыхательной смеси (кислород, газообразное
вещество) в л\мин. В настоящее время
испарители имеют в наркозном аппарате термокомпенсаторы и позволяют
дозировать наркотическое вещество в
объемных процентах. Дыхательная система включает дыхательные шланги,
клапаны, адсорбер, маску, мех, мешок.
В современной анестезиологии необходимо во время наркоза с применением мышечных релаксантов проводить искусственную вентиляцию
легких (ИВЛ). Для проведения наркоза
аппарат ИВЛ соединен с наркозным
аппаратом и позволяет регулировать
многие параметры: частоту, глубину
дыхания, давление подающейся смеси,
объем дыхательной смеси, увлажнение
ее и др. Аппарат может применяться не
только для наркоза, но и для длительной вентиляции легких.
С помощью масок и наркозных аппаратов можно проводить наркоз по
одному из четырех способов (контуров — по Р.И. Савченко и В.А. Мастрюкову).
Открытый способ (открытый
контур) дачи наркоза (рис. 44). Вдох
осуществляется воздухом окружающей
среды вместе с парами анестетика и
выдох в окружающую среду с остатками наркотического вещества. Это приводит к загрязнению воздуха в опера-
ционной и вдыханию наркотического
вещества персоналом. При этом способе не дозируется применение наркотического вещества и идет большой его
расход. Для осуществления открытого
способа используется масочный наркоз. Можно применять наркозные аппараты (ЭМО и другие).
Полуоткрытый способ (контур) (рис. 45). В этом случае производится вдох с наркотическим веществом из наркозного аппарата, а выдох
с остатками анестетика в окружающую
среду. Положительным является отсутствие условий для гиперкапнии и гипоксии, однако может быть апноэ при
гипервентиляции в связи с уменьшением в крови естественного раздражителя дыхательного центра — углекислого
газа. При восстановлении его концентрации дыхание восстанавливается.
В данном случае идет значительный расход наркотического вещества,
и вследствие выдоха в атмосферу операционной отравление персонала.
Полузакрытый способ (контур)
наркоза (рис. 46) В этом случае дыхательный контур полностью изолирован от внешней среды. В его составе
должен быть обязательно поглотитель
углекислоты (натронная известь). Вдох
«ПОЛИНАРКОН»
«НАРКОН»
Рис. 43. Аппараты для наркоза
Рис. 44. Открытый способ (контур)
143
Рис. 45. Полуоткрытый контур
144
Текстовый модуль 3
Тема 7
Рис. 47. Закрытый контур
Рис. 46. Полузакрытый контур
дыхательной смеси с наркотическим
веществом производится через аппарат, выдох частично в окружающую
среду, а частично в аппарат. В поглотителе удаляется углекислота и очищенная дыхательная смесь поступает в дыхательный мешок вместе с оставшимся
анестетиком. При следующем вдохе
очищенная дыхательная смесь с наркотическим веществом и новая порция
этой смеси из наркозного аппарата поступает к больному. Так продолжается
в течение всего наркоза. В данном случае уменьшается расход наркотического вещества, но несколько возрастает
опасность развития гипоксии и гиперкапнии (рис. 46).
Закрытый способ (контур) наркоза состоит в том, что дыхательная
система, включающая поглотитель
углекислоты (адсорбер), полностью
изолирована от внешней среды и больной вдыхает наркотическую смесь с
кислородом из аппарата. Выдох полностью осуществляется в наркозный
аппарат, где дыхательная смесь очищается от углекислоты в поглотителе и с
выдыхаемыми остатками анестетика
поступает в дыхательный мешок (рис.
47), затем при новом вдохе поступает в
дыхательные пути. Небольшая свежая
порция смеси с наркотиком добавляется к очищенной смеси. Тем самым
уменьшается расход наркотического вещества, а больной в этом случае
дышит увлажненной теплой газовой
смесью. Недостатком является то, что
увеличивается опасность развития гипоксии и гиперкапнии, особенно при
эмфиземе легких, регидности грудной
клетки. Из-за этого в последнее время
предпочитают проведение наркоза по
полуоткрытому контуру.
В дыхательном закрытом контуре
движение дыхательной смеси может
быть по циркуляторному или маятникообразному (реверсионному) типу.
При циркуляторной системе дыхательная смесь движется по кругу: из
наркозного аппарата к больному, затем
от больного через адсорбер к дыхательному мешку. При следующем вдохе
из мешка и аппарата вновь к пациенту
и дальше повторяется ее движение по
кругу. Это позволяет располагать наркозный аппарат на разном расстоянии
от больного, т.к. не создается «мертвого пространства» с нерегенерированной дыхательной смесью. При маятникообразной (реверсионной) системе
дыхательная смесь поступает из аппарата к больному, а затем по этому же
пути идет от больного через адсорбер
к мешку. По этому же пути новый вдох
с дыхательного мешка и наркозного
аппарата идет с частью неочищенной
дыхательной смеси из «мертвого пространства» дыхательной системы, находящейся между больным и адсорбером. Поэтому адсорбер и дыхательный
мешок расположены вблизи больного
для уменьшения «мертвого пространства» и снижения опасности развития
гипоксии и гиперкапнии. Оба эти способа можно использовать при полузакрытом и закрытом способе наркоза.
Техника проведения
ингаляционного наркоза
Масочный наркоз можно выполнить капельным способом и аппаратным. При капельном способе используются маски Эсмарха, Шиммельбуша
и другие. Наиболее часто в этом случае
применяют эфир, который имеет большую широту терапевтического действия.
После вышеуказанной подготовки
больного укладывают на спину на операционном столе и фиксируют к нему
во избежание травм во время наркоза
в стадии возбуждения. Руки отводят
в стороны на подставках для контроля
за пульсом и артериальным давлением, а также для подключения системы
внутривенного вливания. Для предупреждения раздражающего действия
анестетика (эфира) глаза больного
укрывают полотенцем, а кожу лица
смазывают вазелином. В маску, обшитую марлей, наливают 1-2 мл эфира и
подносят к лицу для адаптации к его
145
запаху. Маску накладывают на лицо
так, чтобы были закрыты рот и нос.
Полотенцем окутывают маску так,
чтобы осталось небольшое отверстие,
на которое капают анестетик, вначале
медленно, а затем до 60 капель в минуту. Доводят глубину наркоза до третей
стадии 2 уровня, реже и кратковременно до 3 уровня. Так как на этих уровнях
западает нижняя челюсть и язык, что
может привести к асфиксии, приходится запрокидывать голову назад и удерживать челюсть рукой.
Можно ввести через рот воздуховод
(резиновый, пластиковый или из проволочного каркаса), иногда через нос.
В конце операции подачу эфира
или другого летучего анестетика прекращают.
Капельный масочный наркоз в настоящее время используется очень редко. Его применяют иногда при кратковременных вмешательствах (вправление
вывиха, вскрытие гнойника и др.) в
виде «рауш-наркоза» в первой стадии.
Для этого в маску наливают 10-15 мл
эфира и прикладывают к лицу больного. После нескольких вдохов наступает торможение коры головного мозга
(оглушение), снижается чувствительность и расслабляются мышцы. Это позволяет выполнить кратковременную
манипуляцию.
Лучше применять аппаратный масочный наркоз, при котором в дыхательной смеси подается не только анестетик, но и кислород, что уменьшает
опасность гипоксии (кислородного
голодания) и благоприятно действует
на функцию жизненно важных органов
(сердце, мозг, легкие и др.). Масочный
наркоз позволяет применять не только
летучие наркотические вещества, но и
газы (закись азота и другие).
Масочный аппаратный наркоз
готов к работе после проверки исправ-
146
Текстовый модуль 3
ности аппарата, его герметичности,
наличии в баллонах газов. Затем в испаритель заливают анестетик (испаритель предназначен только для применяемого препарата — эфир, фторотан
и т. д.). На лицо накладывается маска
от наркозного аппарата, фиксируется
лямками к голове, дыхательный мешок
заполняется наполовину кислородом.
Сначала больной несколько минут дышит кислородом, а затем подключают
эфир или какой-нибудь другой препарат в малой концентрации, постепенно доводя до определенной глубину
наркоза, как и при капельном способе,
до третьей стадии (при использовании
эфира концентрация обычно составляет 5 — 7 об. % ). При этом доза устанавливается индивидуально для каждого
больного и удерживается до конца операции на одном уровне.
Западающую нижнюю челюсть
выдвигают за ее угол вперед, чтобы
нижние резцы были впереди верхних,
а затем удерживают 3-5 пальцами во
избежание западения языка и развития
асфиксии. Более удобно ввести воздуховод, чтобы не удерживать челюсть в
течение всей операции. Следует помнить, что при длительном использовании во время операции третьего уровня
3 стадии наркоза возникает опасность
передозировки.
После окончания наркоза больной
еще некоторое время вдыхает кислород; при адекватном дыхании снимают
маску с лица и наблюдают еще некоторое время на операционном столе. Затем на каталке в сопровождении анестезиолога (медсестры-анестезистки)
больного отправляют в палату, где
2-12 часов за ним наблюдает дежурный
персонал. Из аппарата сливают остатки
жидких наркотических веществ. Маску,
шланги, мешок снимают с аппарата и
подвергают стерилизации.
Тема 7
При масочном аппаратном наркозе
можно применять не только летучие
жидкие анестетики, но и газообразные
вещества (закись азота, циклопропан). Особенностью газового наркоза
является быстрое его наступление и
быстрое пробуждение, что связано с
быстрой диффузией в кровь и ткани.
Эти вещества в организме не вступают
в химические реакции, не разлагаются, не повреждают паренхиматозные
органы и выделяются из организма
в неизмененном виде. Поэтому газовый наркоз, особенно с закисью азота, применяется у тяжелых больных
при истощении, анемии, заболеваниях
сердца, легких, печени, почек, уремии,
диабете, сепсисе и других как более
безопасный. Закись азота применяют
вначале в соотношении с кислородом
1:1, постепенно повышая до 4:1. Однако кислород должен составлять не
менее 20%. При низком содержании
последнего может наступить тяжелая
гипоксия. В этом случае наркоз прекращается, организм обеспечивается
кислородом. Закись азота не дает достаточного расслабления мышц, поэтому ее комбинируют с другими наркотическими веществами.
Циклопропан в концентрации с кислородом 4:1 тоже быстро приводит к
хирургической стадии наркоза. Превышение этого соотношения до 35-42% во
вдыхаемой смеси является токсическим
и может вызвать паралич дыхательного центра. Кроме того, в нетоксической концентрации он может вызвать
фибрилляцию желудочков сердца и
при его заболеваниях противопоказан.
Токсичность циклопропана устраняется при снижении его концентрации
в сочетании с другими анестетиками.
С этой целью предложена смесь Шейна — Ашмана: 11,7% циклопропана,
58,9% кислорода, 29,4% закиси азота.
Нужно помнить, что смесь кислорода
с циклопропаном может привести к
взрыву.
Жидкие и газообразные наркотические вещества применяют не только
в виде масочного, но и интубационного
наркоза.
Интубационный наркоз бывает
эндотрахеальный и эндобронхиальный.
При этом виде обезболивания наркотическое вещество вводится с помощью
специальных интубационных трубок в
трахею (эндотрахеально) или в один из
главных бронхов (эндобронхиально).
Применяется чистая анестезия, когда
вводится один препарат от начала до
конца обезболивания; смешанная — с
начала до конца вводится смесь наркотических веществ; и комбинированная, когда разные вещества вводятся по
очереди (вводный и базисный наркоз).
Дыхательный контур может быть полуоткрытый, полузакрытый и закрытый.
После доставки в операционную
больной укладывается на операционный стол, фиксируется на нем, измеряется артериальное давление, подсчитывается частота пульса и дыхания,
подключается система для внутривенного вливания, проверяется исправность наркозного аппарата, герметичность его систем, подсоединяется
кислород, при газовом наркозе — баллон с наркотическим газом или заправляется анестетиком испаритель. Укладывают и фиксируют маску от аппарата
на лице. Начинают давать для дыхания
кислород, так же как при масочном аппаратном наркозе, изложенном выше.
При чистом наркозе (чаще эфир) больного погружают в третьей стадии наркоза до третьего уровня, когда исчезает
глоточный рефлекс и неблагоприятное
рефлекторное влияние на сердце, выполняют интубацию трахеи. Размер
интубационной трубки подбираются
147
заблаговременно. Диаметр ее берется
с учетом возраста, толщины трахеи,
конституции больного и окончательно
определяется при ларингоскопии, длина — размером от одной мочки уха до
другой, через верхнюю губу. Интубационные трубки имеют раздувные манжеты, которые позволяют создать замкнутое пространство между наркозным
аппаратом и легким и предупреждают
потерю части дыхательной смеси (выходит между трубкой и трахеей) и
аспирацию желудочного содержимого
при регургитации в дыхательные пути.
Если трубка без манжеты или нарушена целость надувной манжеты, то приходится тампонировать стерильным
тампоном с антисептиком (фурацилин
или др.) ротоглотку для создания герметичности. Трубки бывают для интубации трахеи и одного из бронхов.
Для проведения интубации необходим ларингоскоп с прямым или изогнутым клинком (рис. 48).
После достижения третьего уровня
третьей стадии наркоза голова больного запрокидывается, вводится клинок
ларингоскопа с осветителем, которым
язык и надгортаник отжимаются кпереди. Видна голосовая щель, в которую вводят интубационную трубку так,
чтобы манжетка была ниже голосовой
связки. Очень трудной интубация бывает при короткой шее, смещении трахеи опухолевидными образованиями,
рубцами, деформированном шейным
отделом позвоночника, особенностях
анатомического строения. Трубка может попасть не в трахею, а в пищевод.
В этом случае необходимо обратить
внимание на экскурсию грудной клетки при вдувании ртом или аппаратом
воздуха (кислорода). Если при этом
раздувается не грудная клетка, а живот
(желудок), то трубка в пищеводе. Необходимо ее извлечь и ввести в трахею.
148
Текстовый модуль 3
Тема 7
После окончания интубации необходимо проверить, правильно ли
стоит трубка в трахее. Она должна находиться над бифуркацией трахеи, чтобы в дыхании одинаково участвовали
оба легких. С этой целью производят
аускультацию обеих легких. Трубка
может находиться в правом главном
бронхе, так как он является как бы
продолжением трахеи. В этом случае
трубку подтягивают и добиваются одинакового дыхания в обоих легких. Если
будет удаляться правое или левое легкое, то интубируют соответствующий
главный бронх специальной эндобронхиальной трубкой.
Наркоз проводят газовым или жидким наркотическим веществом. В конце операции прекращают введение
наркотического вещества, удаляется
интубационная трубка, санируется ротовая полость (удаляется тампоном
или электроотсосом слизь, слюна и
т.п.). Больной транспортируется в присутствии анастезиолога и медсестры в
палату интенсивной терапии (хирургическое отделение, реанимационное отделение) для дальнейшего наблюдения.
Рис. 48. Схема интубационного наркоза
Манжетка для создания герметичности
раздувается, а при ее отсутствии — производится тампонада ротоглотки. Подключается наркозный аппарат. Изредка интубацию выполняют вслепую, с
помощью пальца.
Современный интубационный
комбинированный
(многокомпонентный) наркоз
Cовременный интубационный наркоз проводится не одним анестетиком, а
сочетается с другими препаратами, чтобы добиться быстрого введения в третью стадию наркоза без возбуждения
(вводный наркоз). После релаксации с
введением миорелаксантов и интубации
трахеи (бронха) необходимо перейти
на поддерживающий наркоз (основной,
базисный), во время которого выполняется оперативное вмешательство. При
этом могут применяться не только препараты для ингаляционного наркоза, но
и для неингаляционного. Комбинация
различных способов общей анестезии
является комбинированным наркозом.
В поддерживающей фазе наркоза применяется искусственная вентиляция
легких с помощью аппаратов для ИВЛ
(РО-6 и др.), очень редко, особенно в
начальный период развития анестезиологии, ручным методом (сжимание
дыхательного мешка, мехом), так как
больным вводят миорелаксанты. Это
позволяет проводить наркоз на первом уровне третьей стадии, уменьшая
дозировку и тем самым токсичность
анестетика. Кроме того, можно вводить разные препараты так, чтобы избежать их неблагоприятного действия
на сердце, легкие, печень и другие органы. Кроме того, представляется возможность регулировать деятельность
жизненно важных органов, применяя
соответствующие
медикаментозные
средства, влиять на гемодинамику, обеспеченность организма кислородом и
т.п. Поэтому наркоз в настоящее время
является многокомпонентным. Интубация трахеи предупреждает при рвоте,
регургитации попадание желудочного
кислого содержимого в трахею и развитие асфиксии (синдрома Мендельсона),
обеспечивает свободную проходимость
дыхательных путей.
При его проведении можно выделить несколько этапов.
Первый этап — премедикация.
Она в большинстве случаев проводится
в палате перед подачей в операционную.
Внутримышечно вводятся аналгетик
(обычно промедол или омнопон 2% —
1,0 мл), антигистаминный препарат
(димедрол, супрастин или др.) и обязательно атропин (0,1 мл раствора на 10
кг массы тела) за 30-40 минут до операции. Происходит седатирование больного, исчезает страх перед вмешательством, повышается чувствительность
к действию наркотического препарата,
149
способствуя тем самым снижению его
дозы. Атропин в этой смеси обязателен,
так как снижает секрецию желез, особенно бронхиальных. У тяжелых больных при экстренных вмешательствах
премедикация может выполняться на
операционном столе путем внутривенного введения указанных препаратов.
Для премедикации можно использовать фентанил (аналгетик) и дроперидол (нейролептик), но обязательно
добавляют атропин. При длительных
тяжелых операциях на операционном
столе в мочевой пузырь вводят катетер. Проверяют состояние ротовой полости: нет ли съемных протезов зубов,
челюстей (их нужно снять).
Второй этап — введение в наркоз. На операционном столе подключают систему для внутривенного вливания, лучше с дополнительным портом
для многократного введения в вену
лекарственных препаратов или с применением специальной иглы с портами
(vasofix). При длительных травматичных операциях у тяжелых больных выполняют катетеризацию центральной
вены (обычно подключичной).
Проверяют готовность аппаратуры к проведению наркоза. Определяют
исходные показатели артериального
давления, пульса, дыхания, ширину
зрачков, их реакцию на свет и т. д. Начинают вводный наркоз препаратом,
который быстро приводит к третьей
стадии наркоза без возбуждения. Для
этой цели наиболее часто применяются
барбитураты (гексенал или тиопентал
натрия в 1% растворе, приготовленном
перед введением в вену). Используется
400-600 мг сухого вещества (40 — 60 мл
1% раствора), но не более 1000 мг.
Скорость введения медленная —
1,0 мл за 10-15 сек. При быстром введении может наступить гипоксия и
остановка дыхания, а затем сердечной
150
Текстовый модуль 3
деятельности из-за угнетающего действия препарата на дыхательный центр
продолговатого мозга. Поэтому организм больного насыщают кислородом
через маску наркозного аппарата. По
мере углубления наркоза происходит
потеря тонуса жевательных мышц и западение языка. Чтобы сохранить проходимость дыхательных путей, голову
запрокидывают, а челюсть выдвигают
вперед. Можно ввести в рот воздуховод.
Ингаляцию кислорода осуществляют и
для того, чтобы насытить им организм
и тем самым предупредить гипоксию
на время интубации трахеи, когда под
влиянием релаксантов дыхание будет
выключено.
Для вводного наркоза можно применить и другие препараты, быстро
приводящие ко сну почти без возбуждения. Применяют закись азота, циклопропан, наркотан и другие.
После достижения 1 или 2 уровня
третьей стадии наркоза приступают
к следующему этапу — интубации
трахеи.
Больному внутривенно вводят миорелаксант деполяризующий (короткого
действия: 5-7 мин.).
Эти препараты напоминают действие яда кураре (урари, тикунас, ворара), находящегося в коре и корнях южноамериканских растений Strychnos,
Chondrodendron и др. Кураре изучали
Клод Бернар (1851) и Е.В. Пеликан
(1857), однако из-за отсутствия очищенных препаратов и высокой токсичности применения не получил. Только
после выделения Кингом в 1935 году
чистого алкалоида тубокурарина хлорида (тубарина) позволило применить
в клинике. В дальнейшем были синтезированы препараты, по действию
подобные яду кураре, но обладающие
меньшей токсичностью. Впервые их
применили во время комбинирован-
Тема 7
ного наркоза для релаксации мышц
Гриффит и Джонсон в 1942 году.
Действие релаксантов досконально не изучено. Считается, что они действуют на нервно-мышечные синапсы,
где происходит передача импульса на
мышцу. Нормальное состояние синапсов — состояние поляризации, когда
ионы калия находятся на внутренней
части концевой нейро-мышечной пластинки, а ионы натрия — на наружной.
Под влиянием ацетилхолина происходит деполяризация, в результате
перемещения ионов калия и натрия потенциал передается на мышцу, которая
сокращается. Но ацетилхолин действует 1\1000 доли секунды, так как он разрушается находящейся в крови холин
эстеразой на холин и уксусную кислоту.
Наступает снова поляризация.
Механизм действия деполяризующих релаксантов близок к ацетилхолину. Поэтому при введении коротких
(деполяризующих) релаксантов (дитилин, листенон, миорелаксин и др.)
наступает деполяризация и потеря тонуса мышц. Продолжительность их
действия 5-7 минут. По мере накопления холинэстеразы миорелаксант разрушается и появляется поляризация,
а следовательно, восстанавливается
тонус мышц. В случае врожденной недостаточности псевдохолинэстеразы в
крови наступает длительное апноэ. Необходимо перелить свежую цитратную
кровь, где она содержится. Это приведет к разрушению релаксанта и поляризации синапсов. Дыхание больного
восстановится.
Как описано выше, при интубации
запрокидывают голову больного, с помощью ларингоскопа для прямой ларингоскопии отжимают корень языка и надгортанник, находят голосовую щель и
вводят интубационную трубку в трахею.
Проверяют, находится ли она в трахее
и прослушивается ли дыхание в обоих
легких. Манжетку на трубке раздувают
и подключают к наркозному аппарату и
аппарату для ИВЛ. Трубка фиксируется
вокруг головы. Переходят на поддерживающий (основной) наркоз.
Третий этап — поддержание
наркоза. После интубации и подключения искусственной вентиляции легких переходят на поддерживающий
(основной, базисный наркоз). Для этой
цели используют как препараты ингаляционного, так и неингаляционного
наркоза. Можно применять эфир, фторотан, трилен и другие жидкие летучие
наркотические вещества; закись азота
в сочетании с другими анестетиками,
циклопропан, а в настоящее время
многокомпонентное сочетание неингаляционных препаратов (дроперидол, фентанил, кетамин, оксибутират
натрия, виадрил и прочие) при одновременно проводимой ИВЛ и введении
миорелаксантов. Это позволяет проводить наркоз на более поверхностном
уровне, вводить наркотические препараты в меньших дозах, снижая их токсический эффект, при одновременной
хорошей релаксации мышц курареподобными препаратами, что создает хорошие условия для выполнения операции хирургом.
Для поддержания релаксации применяют недеполяризующие релаксанты, которые при внутривенном введении действуют длительно, 30-60 минут.
Считают, что механизм действия их
заключается в том, что они блокируют
чувствительность нервно-мышечных
синапсов к воздействию ацетилхолина.
Только по мере накопления ацетилхолина в крови происходит преодоление
блока и движения восстанавливаются.
Антагонистом недеполяризующих релаксантов является прозерин, который
подавляет действие псевдохолинэсте-
151
разы, разрушающей ацетилхолин. Тем
самым ацетилхолин накапливается в
крови быстрее и нарастает его концентрация, которая способна преодолеть
блокаду нервно-мышечного синапса.
Прозерин вводят внутривенно медленно вместе с атропином в конце наркоза
дробно по 1 мг каждые 10 минут (для
предупреждения
перераздражения
парасимпатического отдела нервной
системы, сопровождающегося возбуждением, коллапсом и пр.) до получения
эффекта, восстановления движений.
Введение его в более ранний период,
и только однократно, может привести
при окончании его действия раньше,
чем релаксанта, к повторной остановке дыхания, рекураризации. Подобное
возникает также при передозировке
релаксанта при повторном введении
или его кумуляции. В этом случае необходима повторная интубация трахеи, искусственная вентиляция легких
до полного восстановления спонтанного дыхания, переливание крови,
повторное введение антагониста. Поэтому в настоящий момент стараются
прозерин не вводить, а искусственную
вентиляцию проводить до появления
адекватного спонтанного дыхания.
В конце обезболивания можно внутривенно вводить эуфиллин и хлорид
кальция. Иногда применяют как антагонист аналог прозерина — тексилон
(эдрофоний).
К недеполяризующим релаксантам
относят: парамион, диплацин, анатруксоний, тубарин, ардуан и др.
При кратковременных операциях
или отсутствии релаксантов длительного действия применяют повторное
введение через 5-7 минут деполяризующих релаксантов. Действие каждой
последующей дозы препарата удлиняется, поэтому при многократном введении может наступить так называемый
152
Текстовый модуль 3
«двойной блок» (Черчил-Дэвидсон,
В.П. Смольников). Препарат будет
действовать не только напоминая ацетилхолин, но и как «блок», то есть невосприимчивость к релаксанту, как при
использовании недеполяризующего релаксанта, на длительное время. Дифференцировать наступление длительного
апноэ от врожденной недостаточности
псевдохолинэстеразы и возникшего
«блока» можно с учетом частоты введения короткого релаксанта. Если длительное апноэ возникло после первого
введения, то это результат недостаточности псевдохолинэстеразы, а если после повторных введений, то возникла
блокада. Двойной блок может наступить при одновременном использовании релаксантов деполяризующих и
недеполяризующих.
Четвертый этап — выведение из
наркоза. В конце операции прекращают введение мышечных релаксантов,
чтобы по завершению вмешательства
их действие уменьшилось или прекратилось. Прекращают вводить наркотические препараты, но искусственную вентиляцию легких продолжают
проводить до исчезновения признаков
действия релаксантов и появления сознания. У больного появляются движения, он может выполнять некоторые
команды (появляется тонус жевательных мышц, может по команде высунуть
язык, закрыть-открыть глаза, появляется движение мышц конечностей, самостоятельное дыхание, хотя еще и не
адекватное). Поэтому вспомогательное
дыхание кислородом еще оставляют,
затем отключают больного от аппарата, и он дышит через трубку самостоятельно атмосферным воздухом. Затем
при отсутствии гипоксии, адекватном
самостоятельном дыхании и при беспокойном поведении больного из-за
раздражающего действия интубаци-
Тема 7
онной трубки манжету на трубке распускают и трубку удаляют. Санируют
ротовую полость отсосом или тампоном на корнцанге, больного заставляют активно освободить ротоглотку от
слизи, крови (покашлять, выплюнуть).
Еще некоторое время наблюдают за
больным, его состоянием, дыханием,
гемодинамикой и при отсутствии нарушений отправляют в сопровождении
анестезистки, медсестры, врача в палату отделения для наблюдения.
В случаях, когда выполнена тяжелая травматичная операция или само
заболевание сопровождается тяжелым
состоянием и больному требуется продолженная искусственная вентиляция
легких, полного выхода из наркоза не
ожидают, дезинтубацию не производят.
Больного перекладывают с интубационной трубкой на каталку или функциональную кровать из операционной и в
сопровождении врача-анестезиолога,
анестезистки и сестер отделения транспортируют в реанимацию. Все время проводят искусственное дыхание,
обычно саморасправляющимся мешком «Амбу». В палате реанимации
интубационную трубку подключают к
аппарату для ИВЛ и вводят седативные
препараты.
Осложнения
ингаляционного наркоза
Осложнения
ингаляционного
наркоза можно разделить на три
группы:
1. Осложнения, связанные с техническими проблемами;
2. Осложнения, связанные с клиническим течением наркоза;
3. Посленаркозные осложнения.
К осложнениям технического
плана можно отнести следующие:
■ Технические нарушения в наркозном аппарате (разрыв дыхатель-
ного шланга, неполадки в испарителе, адсорбере, поломка клапана
и др.); аппарате искусственного
дыхания;
■ Отключение электричества по разным причинам;
■ Аспирация сломанного или съемного зуба;
■ Травматические повреждения гортани, трахеи, голосовых связок, зубов и пр. при интубации;
■ Введение интубационной трубки
не в трахею, а в правый главный
бронх, пищевод;
■ Перегиб интубационной трубки
или ее выхождение из трахеи.
Для профилактики указанных
осложнений необходим осмотр и подготовка аппаратов к наркозу, следует иметь аварийный запасной блок
электропитания или быть готовым к
проведению искусственного дыхания
без аппарата, осмотреть и удалить из
ротовой полости зубные протезы, шатающийся кариозный зуб, проводить
тщательный контроль за проведением
интубационной трубки, аккуратно проводить интубацию трахеи для профилактики повреждений. Врач и анестезистка должны неотступно находиться
возле больного, чтобы своевременно
выявить отклонения в течении наркоза, появление осложнений и принять
немедленно меры по их устранению.
К осложнениям, связанным с клиникой наркоза, относятся те, которые появляются в различных стадиях
в процессе проведения обезболивания,
и наиболее ярко они проявляются при
эфирном наркозе.
В первой стадии наркоза появляются осложнения, обычно связанные с рефлекторным, раздражающим
действием анестетика. Вследствие
этого у больного может наступить ларингоспазм от сокращения мышц гор-
153
тани и голосовых связок. Необходимо убрать анестетик, дать подышать
больному воздухом или кислородом,
а затем вновь подключить наркотическое вещество, но начать с меньшей
концентрации, постепенно ее увеличивая, чтобы пациент привык к его запаху. Изредка наступает рефлекторный
бронхоспазм. При бронхоспазме наступает повышенное сопротивление при
вдохе, гипоксия. Необходимо применить спазмолитики, например, эуфил
лин, атропин, и производить вдох при
несколько повышенном давлении дыхательной смеси, гипервентиляцию.
Грозным осложнением в первой стадии
наркоза является рефлекторная остановка сердца (синкопе — syncope) при
раздражении блуждающего нерва, от
рефлекса со слизистых оболочек дыхательных путей, от большого количества
адреналина вследствие страха перед
операцией. В связи с этим необходимо
прекратить введение наркотического
вещества и начать все мероприятия как
при клинической смерти (искусственное дыхание, наружный массаж сердца,
внутрисердечное введение адреналина
или норадреналина, дефибрилляция
сердца и др.).
Во второй стадии наркоза может
наступить рвота вследствие возбуждения рвотного центра, или регургитация,
при которой происходит пассивное забрасывание желудочного содержимого, особенно при переполнении желудка, с аспирацией кислого содержимого
в дыхательные пути. Это приводит к
механической асфиксии или асфиксии,
связанной с развитием синдрома Мендельсона. В последнем случае кислое
желудочное содержимое, содержащее
соляную кислоту, вызывает отек слизистой бронхов из-за наличия хлора.
Наступает закрытие их просвета и асфиксия. В дальнейшем развивается тя-
154
Текстовый модуль 3
желая пневмония, часто с летальным
исходом. Поэтому при рвоте, регургитации необходимо снять маску, раскрыть рот роторасширителем.
Открыть рот без инструмента часто
не удается из-за спазма жевательных
мышц. Рот и ротоглотку очистить от
желудочного содержимого электроотсосом или тампоном на корнцанге. Если
содержимое попало в дыхательные
пути, то обязательно ввести в трахею
стерильный катетер и через него отсосать содержимое, а трахею промыть
раствором фурацилина, физраствора и
отсосать, чтобы удалить кислое содержимое и предупредить развитие синдрома Мендельсона. После этого углубить наркоз до третьей стадии.
В этой стадии может наступить
фибрилляция желудочков и остановка
сердца от наличия большого количества адреналина в крови вследствие
возбуждения. Необходимо немедленно
прекратить введение наркотического вещества, обеспечить достаточное
снабжение организма кислородом и
провести мероприятия как при клинической смерти (искусственное дыхание, массаж сердца, дефибрилляция и
др.). Иногда при сильном возбуждении
(эфирный наркоз) может наступить,
из-за сильного сокращения мышц, разрыв мышц и другие повреждения.
В третьей стадии наркоза
осложнения зависят от его течения по
уровням. Первый уровень («движение
глазных яблок») не сопровождается осложнениями, связанными с его
клиническими проявлениями, но при
введении релаксантов может быть регургитация и при масочном наркозе
аспирация.
При втором уровне («роговичного
рефлекса») наступает потеря тонуса
жевательных мышц и западение языка.
Корень языка закрывает проходимость
Тема 7
дыхательных путей и наступает асфиксия. Для восстановления проходимости
выдвигают нижнюю челюсть вперед,
запрокидывают голову назад или вводят за корень языка воздуховод. При
интубационном наркозе, после интубации трахеи (бронха), сама трубка препятствует нарушению проходимости.
На третьем уровне наркоза («расширение зрачка») происходит тоже
западение языка с развитием асфиксии (при масочном наркозе). Действия
анестезиолога будут такие же, как во
втором уровне. Нужно помнить, что
длительно (более 20 минут) проводить
в третьем уровне нельзя, так как неизбежно наступит передозировка и разовьется четвертый уровень. Необходимо
своевременно вывести больного из третьего уровня во второй или первый. При
глубоком наркозе или введении релаксантов может произойти расслабление
сфинктеров и наступает регургитация с
описанными выше последствиями.
Четвертый уровень наркоза («диафрагмального дыхания») — это передозировка, вызванная действием наркотического препарата на продолговатый
центр. Наступает полная потеря тонуса мышц, резкое нарушение дыхания,
сердечной деятельности, гемодинамики. Необходимо прекратить введение
наркотического вещества, провести
ингаляцию кислорода, мероприятия по
стабилизации гемодинамики и деятельности сердца и др. Если немедленно не
принять экстренных мер, то наступает
клиническая смерть.
Признаками клинической смерти
являются: широкие зрачки, не реагирующие на свет, отсутствие пульсации на
сонной артерии, отсутствие дыхания,
а на кардиограмме отсутствие сердечных комплексов.
В этом случае и при рефлекторной
остановке сердце проводится комплекс
реанимационных мероприятий. Если
наркоз был интубационный, то продолжают аппаратное искусственное
дыхание (ИВЛ). При масочном наркозе или рефлекторной остановке сердца в начале наркоза снимают маску,
ротовую полость очищают от слизи,
крови тупфером или отсосом, повернув голову набок. Голову забрасывают
кзади, чтобы освободить дыхательные
пути от корня языка. Можно ввести
обычный или S-образный воздуховод
и начинать искусственное дыхание рот
в рот, рот в нос или через S-образную
трубку. В выдыхаемом врачом воздухе
содержится 16% кислорода, что достаточно для поддержания жизнедеятельности пострадавшего. Искусственное
дыхание проводят также саморасправляющимся мешком «Амбу». Возможна также быстрая интубация трахеи и
проведение аппаратной ИВЛ. Частота
дыхательных движений составляет
обычно 14-16 в минуту.
Одновременно с искусственной
вентиляцией начинают наружный массаж сердца. Врач становится справа
от больного, производит резкий толчок в области сердца («прекардиальный удар»), укладывает ладонь одной
руки на нижний край грудины в области сердца, а вторую руку на первую,
и производит сильное надавливание
на грудную клетку, чтобы при ее деформации сдавливалось сердце. Такой
массаж сердца по некоторым данным
позволяет поддержать давление в сосудистом русле до 60 мм рт. ст. Частота
сдавления грудной клетки (наружного
массажа) примерно 70 раз в минуту.
Если выполняется операция на органах
брюшной полости, то проводят массаж
сердца через диафрагму, а если на грудной клетке, то прямой массаж сердца.
При проведении реанимационных мероприятий двумя врачами один
155
врач делает искусственное дыхание,
а другой — наружный массаж сердца.
В этом случае врач, выполняющий искусственное дыхание, должен следить за
руками врача, проводящего наружный
массаж сердца, чтобы больному вдох
делать в тот момент, когда при массаже расправляется грудная клетка. Если
помощь оказывает один врач, то после
каждых 4-5 нажиманий на грудную клетку нужно делать одно вдыхание в легкие.
Внутрисердечно вводят 1,0 мл адреналина или норадреналина, лучше в
смеси с 10 мл 10% хлорида кальция, для
предупреждения фибрилляции сердца,
т.е. появления сокращения отдельных
мышечных волокон сердца (неэффективные сокращения). Длинной иглой
со шприцем с препаратом делают прокол в IV межреберье на 0,5-1,0 см от
грудины под углом 60 градусов. Признаком проникновения в полость сердца служит появление в шприце крови.
При неэффективности этих мероприятий проводят дефибрилляцию
сердца с помощью дефибрилляторов
различной конструкции при напряжении электрического тока от 2 до 6
тыс. вольт, при силе тока в несколько
миллиамперов и длительности в доли
секунды. Электроды с влажной прокладкой можно установить на область
лопатки и область сердца, или один
электрод на верхушку сердца, а другой — на его основание. Электроды, которые удерживает врач, должны иметь
изоляцию, а окружающему персоналу
необходимо отойти от операционного
стола в целях безопасности, чтобы не
было поражения током. Разряд тока
приводит к появлению сердечных сокращений. Его можно повторять.
С целью реанимации можно внутриартериально нагнетать кровь в крупные сосуды, а если операция на органах брюшной полости, грудной клетки,
156
Текстовый модуль 3
то и в аорту. Вливают до 500 мл крови
под давлением 220 мм рт. ст. (100 мл в
минуту). Это приводит к растяжению
(раздражению) луковицы аорты и может способствовать появлению сокращений сердца.
Признаками эффективности реанимационных мероприятий являются: сужение зрачка, реакция его на свет; наличие пульсации сонной артерии и сердца,
подтвержденное появлением на ЭКГ
сердечных комплексов, появление самостоятельного дыхания, восстановление
гемодинамики. После этого различные
лекарственные препараты вводят внутривенно. Больной должен находиться
в реанимационном отделении.
В четвертой стадии (пробуждение) наркоза происходит обратное проявлений уровней и стадий наркоза. Может быть рвота с аспирацией. Поэтому
больной должен находиться под наблюдением до полного разрушения или
вывода из организма наркотического
вещества (от 2 до 12 часов), без подушки, чтобы не было аспирации. При появлении рвоты голову поворачивают
набок, протирают рот салфеткой или
удаляют содержимое электроотсосом.
Кроме того, у больных от разных
причин может наступить повышение артериального давления (волнение перед
предстоящей операцией, возбуждение
во второй стадии, наличие симптоматической гипертензии при атеросклерозе,
заболевании почек и др.), выявляемое
уже на операционном столе. Это требует
введения перед наркозом гипотензивных
препаратов (магния сульфата, ганглиоблокаторов, дроперидола и др.), а при
плановых вмешательствах проведение в
предоперационном периоде соответствующего лечения с участием кардиолога.
Снижение артериального давления (гипотензия) может быть в различные стадии наркоза. Причинами
Тема 7
ее могут быть наркотические препараты, воздействующие на сосудистодвигательный центр и сердце, передозировка анестетика (фторотан или др.)
при низком исходном ОЦК и оптимальной дозе наркотиков. Поэтому перед
наркозом нужно восполнить дефицит
ОЦК, а во время наркоза, особенно при
кровопотере, переливать кровь, препараты крови, коллоидные и другие кровезамещающие растворы.
Во время наркоза нарушение ритма
сердца может быть вызвано гипоксией
и гиперкапнией (недостаточная ИВЛ);
при интубации трахеи (длительной);
передозировкой наркотических веществ
(фторотан, барбитураты и др.); применением адреналина во время наркоза
фторотаном, что повышает чувствительность фторотана к катехоламинам.
Необходимо во время наркоза проводить электрокардиографический контроль. При возникшей аритмии проводить лечение в зависимости от причины,
ее вызвавшей. Устраняют гипоксию,
уменьшают дозу анестетика, применяют антиаритмичные препараты.
Как изложено выше, одним из грозных осложнений является гипоксия, которая может быть трех видов:
1. Дыхательная, связанная с нарушением внешнего дыхания;
2. Циркуляторная, связанная с нарушением транспортировки газов;
3. Гистотоксическая — нарушение
внутриклеточного дыхания.
В
послеоперационном
периоде могут возникнуть посленаркозные осложнения. К ним относятся: 1) охлаждение больного, озноб;
2) острая сосудистая недостаточность;
3) отек мозга; 4) трахеит, бронхит;
5) повреждение периферических нер
вов; 6) ателектаз легкого и другие, требующие специальной и интенсивной
терапии.
Во время общего обезболивания
происходит небольшое снижение температуры тела из-за воздействия наркотического вещества на центры терморегуляции и охлаждения больного
в операционной. Организм больного
пытается нормализовать терморегуляцию за счет увеличения метаболизма.
Поэтому в конце наркоза и после него
у больного возникает озноб. Для профилактики необходимо поддерживать
оптимальную температуру в операционной (21-220С), укрывать больного, переливать внутривенно растворы, согретые
до температуры больного, контролировать температуру тела больного.
При острой сосудистой недостаточности совместно с кардиологом
проведение мероприятий, направленных на компенсацию сердечной деятельности, нормализацию гемодинамических нарушений.
Отек мозга после анестезии является результатом длительной гипоксии
во время наркоза. Сразу же начинают
лечение, заключающееся в дегидратации, гипервентиляции, локальном
охлаждении головного мозга.
Трахеит и бронхит связаны с раздражающим действием интубационной
трубки и проявляются после наркоза в послеоперационном периоде кашлем, выделением мокроты, небольшим повышением температуры тела больного. С целью
профилактики используют стерильные
интубационные трубки, которые перед
интубацией смазывают гормональной
мазью (гидрокортизон, преднизолон). В
послеоперационном периоде проводят
ингаляции (содовые, масляные и др.), назначают в необходимых случаях антибиотики, горчичники и др.
Повреждение периферических нер
вов верхней конечности связано с
неправильным положением на операционном столе во время наркоза
157
(запрокинутая за голову рука отведена
на подставке более чем на 900 от туловища, фиксация к дуге операционного
стола). На нижней конечности повреждение бывает связано с укладкой ног
на держателе без прокладки. Обычно
повреждение нервов выявляется через
сутки и более после наркоза. Лечением этого осложнения занимается невропатолог.
Ателектаз легких возникает во время наркоза при аспирации желудочного содержимого, инородных тел (зуб
и др.), при недостаточном раздувании
легкого после торакальных операций.
Приходится выполнять бронхоскопию
для удаления инородных тел, попавшего в бронхиальное дерево содержимого,
воспалительного экссудата, раздувание
легкого, ингаляции кислорода с гипервентиляцией. Бронхоскопическую
санацию повторяют. Назначают ингаляции с бронхолитиками, ферментами,
антибиотиками и другие мероприятия.
Производят контрольные рентгеноскопии и графии органов грудной клетки.
У этих лиц может развиться пневмония, лечение которой часто представляет трудности.
НЕИНГАЛЯЦИОННЫЙ
НАРКОЗ
К неингаляционному наркозу относятся все виды общего обезболивания,
при которых анестезирующее вещество
вводится в организм больного любыми
путями, кроме дыхательных.
Классификация
В зависимости от пути введения наркотического вещества неингаляционный наркоз подразделяется на:
А) внутривенный;
Б) внутриартериальный;
В) внутрикостный;
158
Текстовый модуль 3
Г) через рот;
Д) инъекционный (подкожный,
внутримышечный);
Е) в серозные полости;
Ж) прямокишечный;
З) электронаркоз.
Внутривенный наркоз
Первые попытки внутривенного
введения наркотического вещества
были сделаны в 1847 году Н.И. Пироговым. Он вводил в вену эфир. Только
после того, как Н.П. Кравков открыл
первый препарат барбитуровой кислоты — гедонал, С.П. Федоров в 1904 году
применил его в клинике больному, а в
1909 году — в комбинированном наркозе. Так как это было впервые сделано в России, то этот наркоз получил
название «русский». Однако из-за токсичности препарат не получил широкого распространения. После получения
других, менее токсичных препаратов:
гексенал (Beeзе, 1932), тиопентал натрия (Ланди и Товелл, 1934), пентотал, — барбитуровый наркоз начали
применять широко. Он используется и
в настоящее время. Внутривенно вводятся и другие препараты, которые будут рассмотрены в этом разделе.
Гексенал и тиопентал натрия
выпускаются во флаконах в сухом виде,
так как в растворе быстро разрушаются. Разводят перед применением (ex
tempore) физиологическим раствором.
Раньше препарат разводили до 5-10%
концентрации и вводили шприцем
со скоростью 1,0 мл за 30-45 секунд.
В настоящее время его разводят до 1%.
Доза, максимальная для больного —
1,0 г сухого вещества. Скорость введения шприцем в вену сейчас выполняется со скоростью 1,0 мл за 10-15 сек.
Вначале вводят 3-5 мл в течение 30 секунд для определения чувствительности больного к барбитуратам. За-
Тема 7
тем введение препарата продолжают.
В первой стадии наступает быстрое торможение коры головного мозга, снимается психическое возбуждение, может
быть небольшое речевое возбуждение,
но двигательное возбуждение почти
отсутствует, наступает арефлексия и
больной погружается в третью стадию
наркоза через 2-3 мин. Аналгезия продолжается до окончания введения препарата, как говорят, «на кончике иглы»,
длительностью 10-15 мин. Так как доза
анестетика на наркоз ограничена, то в
чистом виде он обычно применяется
при небольших операциях и с целью
вводного наркоза (доза снижается до
0,4-0,6 г сухого вещества). Отрицательное действие его связано с тем, что
барбитураты действуют угнетающее
на продолговатый мозг, а именно — на
дыхательный и сердечно-сосудистый
центры. Поэтому при проведении наркоза необходимы ингаляции кислорода. Без кислорода проводить его опасно. В связи с угнетающим действием на
дыхательный центр нельзя быстро вводить в вену растворы гексенала и тиопентала натрия, также нельзя их вводить больше максимальной дозы из-за
возможности передозировки. Препараты опасно вводить при значительной
гипотонии (кровотечение, шок и др).
Противопоказано их применять при
нарушении функции печени, почек.
Удлинить действие препаратов
можно фракционным методом. В этом
случае после введения больного в третью стадию наркоза делают перерыв на
несколько минут, пока он спит. Затем
вновь вводят раствор препарата и затем
вновь перерыв. Повторяют введение
несколько раз до получения больным
максимальной дозы препарата (1,0 г).
Можно использовать капельное
вливание 1% раствора препарата с помощью системы для внутривенного
вливания. В этом случае вначале вводят анестетик со скоростью 100-200
капель в минуту, а после достижения
третьей стадии наркоза поддерживают
со скоростью 20-40 капель в минуту.
Однако и при этих способах введения наркоз протекает ограниченное
время. Поэтому при тяжелых и длительных операциях барбитураты используют в качестве вводного наркоза.
Для наркоза внутривенно можно
вводить и другие препараты. Историческое значение имеет применение в
40-х годах ХХ века алкогольного наркоза (в 300-500 мл 30% 960 этилового
спирта и 70% 5% глюкозы на 3 часа) и
в 60-х годах новокаинового (8,0-10,0 г
сухого вещества новокаина в виде 1%
раствора). Так как они имеют ряд отрицательных проявлений, в настоящее
время практически не применяются.
Стероидный наркоз (виадрил,
предион, меаверин и др.). Обезболивающее действие стероидных препаратов
открыл в 1941 году Селье. Применены
в клинике в 1955 году. Виадрил вводят
в вену, лучше в центральную, медленно,
с целью предупреждения вызываемого
им флебита и тромбофлебита. Применяют в виде 2,5% раствора из расчета
10-15 мг\кг со средней дозой 1000 мг.
Вливают в вену медленно, в небольших
дозах в сочетании с ингаляцией закиси
азота с кислородом. Большие дозы препарата могут привести к гипотензии.
Наркоз оксибутиратом натрия
(ГОМК). Гамма-оксибутират является нормальным компонентом любой
клетки человеческого организма и
является предшественником гаммааминомасляной кислоты (ГАМК). Он
синтезирован в 1929 г. и в дальнейшем
изучен А. Лабори (1964). Препарат вызывает релаксацию скелетной мускулатуры, не угнетает дыхания, оказывает
антигипоксический эффект, действует
159
успокаивающе и в больших дозах является снотворным. Но во время сна сохраняется способность реакции на болевые раздражения, что ограничивает
ценность применения его в операционной и требует сочетания с другими наркотическими препаратами. Препарат
разрушается в организме полностью до
воды и углекислого газа. Доза препарата 50 мг\кг.
Пропанидид (эпонтол, сомбревин). В вену вводится сразу быстро за
30 секунд вся доза пропанидида, примерно 500 мг. Рассчетная доза 7-10 мг\
кг. Выпускается в 5% растворе в 10 мл
ампулах. Наркоз без возбуждения наступает почти сразу, но кратковременный — 5-6 минут. Пробуждение спокойное и быстрое. Поэтому его обычно
используют для вводного наркоза.
Сразу после выключения сознания может наступить гипервентиляция с остановкой дыхания (апноэ) и гипоксия.
Необходим контроль за пульсом и артериальным давлением.
Кетамин (кетолар, калипсол, кетажест, веталар) был синтезирован и
внедрен в медицине в 1965 г. Домино.
Он вызывает анестезирующее действие,
преимущественно угнетая ассоциативную зону и подкорковые образования
таламуса. Действие наступает быстрое,
без возбуждения, непродолжительное
с сохранением самостоятельного дыхания. Метаболизируется в организме
и почти полностью выделяется с мочой
в течение 2 часов. Не обладает кумулятивными свойствами при повторных
введениях. Доза препарата для наркоза 2-5 мг\кг. Вводится внутривенно и
внутримышечно. Нельзя смешивать с
барбитуратами из-за выпадения осадка. Препарат вызывает учащение сердечных сокращений и повышает артериальное давление, поэтому нельзя
применять при высокой гипертензии.
160
Текстовый модуль 3
Применяют в виде мононаркоза и при
комбинированном наркозе, особенно при гипотонии. Обычно кетамин
не угнетает дыхание, но при быстром
введении возможно его угнетение.
При пробуждении дает психомоторное возбуждение, непродолжительную
дезориентацию и галлюцинации. Противопоказан лицам не только с гипертензией, но и с нарушением мозгового
кровообращения, эклампсии, эпилепсии и других заболеваниях, сопровождающихся судорогами, при тяжелой
декомпенсации кровообращения.
Диприван. Один из новых препаратов для внутривенного наркоза. Выпускается в ампулах по 20 мл 1% раствора.
Вызывает наступление наркотического
сна через 20-30 сек. после внутривенного введения 2,5-3,0 мг\кг препарата.
Длительность наркоза 5-7 мин. Применяется для вводного наркоза, так как
действие наступает быстро без возбуждения. Но продолжительность наркоза,
как указано, небольшая. Можно использовать как самостоятельный вид
обезболивания при малых хирургических вмешательствах (вскрытие гнойников, вправление вывихов и т. п.).
Иногда может наступить кратковременное апноэ (до 20 сек.). В этом случае
требуется проведение искусственной
вентиляции легких с помощью наркозного аппарата или другим методом.
Иногда может наступить брадикардия.
Для длительных операций требуется
применение дополнительных способов
аналгезии.
Рекофол (международное название — пропофол). Препарат включает
пропофола 10 мг в мл и вспомогательные вещества, которые образуют белую
жировую эмульсию. Механизм действия недостаточно изучен. Вводится
внутривенно в инъекциях или непрерывно в виде внутривенных инфузий,
Тема 7
при которых разводится в 5% глюкозе
(декстрозе). Выпускается в ампулах по
20 мл и во флаконах по 100 мл. Применяется для вводного наркоза в дозе
1,5-2,5 мг/кг (всего 40 мг). Обезболивание наступает обычно через 30-60 секунд. Для поддержания анестезии препарат вводится со скоростью 6-12 мг/
кг/час. Может использоваться для
проведения хирургических диагностических процедур (вначале 0,5-1,0 мг/
кг на протяжении 1-5 минут, а затем
1-4,5 мг/кг/час) и для седатации во время интенсивной терапии (0,3-4,0 мг/
кг/час). При внутривенной инъекции
может отмечаться боль, которую снимают добавлением одной части 1%
лидокаина к 20 частям рекофола. Из
побочных проявлений может быть
гипотензия, иногда аллергическая реакция на вещества, входящие в состав
рекофола. При длительном введении
моча может изменять цвет от зеленого
до красно-коричневого из-за хиноловых метаболитов пропофола, изменение цвета не является опасным.
Нейролептанальгезия
(НЛА)
обоснована в 1948 году Лабори, как
необходимость нейровегетативной защиты организма при хирургическом
вмешательстве. В клиническую практику внедрена в 1959 г. Де Кастро и
Мунделером (Бельгия). Она осуществляется при внутривенном введении
препаратов, действующих на ту часть
центральной нервной системы, которая
стимулируется болевым раздражением.
Точкой приложения являются ретикулярная формация мозга, таламус, гипоталамус, гамма-нейроны. При этом
возникает своеобразное состояние у
больного. Он и не спит и не бодрствует.
Наступает безразличие к окружающему, больной заторможен, двигательное
беспокойство отсутствует, происходит
снижение вегетативных и метаболиче-
ских реакций на оперативное вмешательство. Происходит потеря болевой
чувствительности. Вводимые препараты оказывают ничтожную токсичность
на внутренние органы, особенно на печень. Наступает стабилизация гемодинамики (дроперидол снижает артериальное давление, фентанил — частоту
пульса). Анестезиолог может вступить
в контакт с больным, который может
отвечать на вопросы, исполнять приказания при утрате болевой чувствительности. Поэтому нейролептанальгезия
может иногда проводиться с самостоятельным дыханием, в сочетании с
местной анестезией. Обычно она проводится при комбинированном наркозе с выключенным дыханием и искусственной вентиляцией легких. Может
сочетаться с ингаляцией закиси азота и
кислорода.
Для нейролептанальгезии применяются дроперидол (дегидробензперидол), являющийся нейроплегиком
и вызывающий вышеуказанное состояние, и фентанил — аналгетик
(наркотик сильнее морфина), вызывающий аналгезию. Выпускался и комбинированный препарат таламонал
(в 1,0 мл дроперидола 5 мг, фентанила — 0,05 мг).
При этом виде обезболивания сохраняется в послеоперационном периоде выраженная анальгезия, состояние
психического покоя, отсутствуют тошнота, рвота, происходит быстрый выход из наркоза. Отрицательным является то, что в период введения в наркоз
иногда отмечается угнетение дыхания
вплоть до остановки, учащение пульса.
В дальнейшем дыхание восстанавливается, гемодинамика стабилизируется.
Атаралгезия (термин предложен в 1957 г. Хайуорд-Баттом). Это
состояние, наступающее у больного
под действием атарактиков: транк-
161
вилизаторов (диазепам, седуксен, реланиум, валиум) и аналгетиков (пентазоцин, фентанил и др.). Возникает
так называемое состояние атараксии
(«обездушивание») и аналгезии, что
во многом напоминает клинику нейролепанальгезии, но отличается меньшими нарушениями дыхания и гемодинамики при вводном наркозе.
Диазепам вводят внутривенно из расчета
0,1-0,2 мг\кг, с предварительным разведением в 10-20 мл физиологического
раствора в течение 1-2 минут. Эффект
наступает сразу и проявляется устремленным в одну точку взглядом, некоторым урежением дыхания, снижением
артериального давления в пределах
10 мм рт.ст., незначительным урежением пульса; вскоре наступает наркотический сон практически без возбуждения.
Применяется в составе комбинированной анестезии. Для угнетения сознания
добавляют ингаляции закиси азота
с кислородом, для нейровегетативной
защиты — дроперидол, для релаксации
мышц — миорелаксанты.
Пробуждение наступает быстро,
без выраженной сонливости.
Диазепам может быть использован
для снятия судорожного синдрома в послеоперационном периоде, при бронхологических исследованиях и т. д.
Тотальная внутривенная анестезия подразумевает применение
различных средств для внутривенной
анестезии, которые действуют как суммирующе или потенцирующе по отношению друг к другу. Это позволяет
достичь результата при введении небольших, субнаркотических доз анестетиков и уменьшить токсическое
воздействие каждого из них. Могут
применяться препараты для внутривенного введения, такие как: нейролептики, аналгетики, транквилизаторы,
гипнотики и др. При этом их сочетания
162
Текстовый модуль 3
могут быть самыми разнообразными,
например, кетамин и промедол, пропофол и морфин и т. п.
Внутриартериальная общая ане
стезия проводится подобно внутри
венной барбитуратами (гексенал, тиопентал натрия) и в такой же дозировке
(до 1,0 г сухого вещества). Однако в
настоящее время не проводится из-за
более простого и приемлемого внутривенного наркоза, дающего меньше
осложнений при пункции сосуда.
Внутрикостный наркоз возможен путем введения барбитуратов в
губчатое вещество кости (эпифиз) в
той же дозировке через специальную
костную иглу (Кассирского и др.). Но
процедура болезненна, наркоз достаточной глубины наступает не всегда и
неуправляем: действие прекращается
после полного всасывания анестетика.
Поэтому в настоящее время не применяется.
Введение наркотических препаратов в серозные полости для
наркоза в клинических условиях не
применяется. Он используется некоторыми авторами при экспериментальных операциях. Обычно вводят
(в брюшную полость, плевру) полную
дозу барбитуратов в виде раствора. Однако, как и в предыдущем случае, не
всегда наступает наркоз достаточной
глубины, а при больших операциях недостаточной длительности, что требует
применения дополнительных методов
обезболивания. Кроме того, он тоже
неуправляем.
Пероральный наркоз. В настоящее время нет наркотических веществ,
которые при приеме через рот вызывают полный наркоз. Им иногда пользуются для вводного наркоза, когда дают
выпить 1,0 г порошка гексенала, пентотала или тиопентала натрия, растворенного в 10-20 мл воды за 20-25 мин.
Тема 7
до операции или для получения базиснаркоза. У больного развивается ретроградная амнезия. Операцию выполняют под местной анестезией или под
наркозом с другим препаратом.
Инъекционный наркоз. Предложено для этой цели в 1938 г. М.А. Топчибашевым подкожное введение эфира
в масле. Однако метод не приводит к
глубокому наркозу, вызывает образование болезненных инфильтратов
и является неуправляемым. Не наступает достаточной глубины анестезии
и при введении внутримышечно 10%
раствора гексенала. Доза препарата
удваивается, так как всасывание происходит медленно (20 мл 10% раствора или 2,0 г сухого вещества). Поэтому осложнения, возникающие как при
внутривенном введении, встречаются
значительно реже. При вводном наркозе вводят 10 мл, а для более длительного — 20 мл раствора. В связи с неглубоким наркозом приходится прибегать
к комбинированному обезболиванию.
Инъекционный наркоз в настоящее
время не применяют.
Прямокишечный наркоз. Этот
вид обезболивания впервые был предложен Н.И. Пироговым в 1847 году, однако распространения не получил, так
как имеет много недостатков. Только
после открытия в 1927 году авертина
и при использовании в последние годы
ректизона, тиопентала натрия и др. изредка используется как базис-наркоз
при комбинированном обезболивании.
Иногда используется при судорожном
синдроме (столбняк, эпилепсия и др.),
возбуждении больного. Противопоказаниями являются заболевания прямой кишки, тяжелое общее состояние,
нарушения функции печени и почек.
Подготовка к наркозу заключается
в том, что больной накануне операции
не принимает пищу, а для очистки ки-
шечника дают слабительное. За 2-3 часа
до вмешательства делают очистительную клизму. В палате больного укладывают на левый бок и вводят в прямую
кишку на глубину 12-15 см резиновый
катетер и шприцем Жане или резиновой
грушей (баллоном) вливают только что
приготовленный 3% раствор авертина,
нарколана (0,1 г/кг сухого вещества)
с температурой 37-380 С. Можно использовать барбитураты до 2,0 г.
Почти у 1/5 больных наркоз не наступает, а если и наступает, то в большинстве случаев неглубокий. При выключенном сознании некоторое время
сохраняется болевая чувствительность.
Через 30-40 минут наступает глубокий
сон продолжительностью до 4 часов.
Подают в операционную на каталке.
Нужно помнить, что этот наркоз недостаточной глубины, и требуется дополнительное введение анестетиков.
Однако введение их полной дозы может привести к передозировке и тяжелым осложнениям, в первую очередь
к поражению печени. Сопровождается
и другими осложнениями: геморрагическим или язвенным колитом. Наркоз
неуправляем и при пробуждении может развиться сильное двигательное
возбуждение. Он сопровождается значительной летальностью (более 1%),
в связи с чем распространения не получил.
ЭЛЕКТРОНАРКОЗ
Для электронаркоза применяются
аппараты, создающие прямоугольные
токи низкой частоты.
При самостоятельном применении глубина наркоза недостаточна,
особенно при больших операциях,
из-за чего его применяют в комбинированном наркозе. Электроды через
влажную салфетку укладываются на
затылок и глазницу. Больной спокой-
163
но засыпает. Этот вид обезболивания
имеет положительное действие у тех
лиц, которым противопоказано введение релаксантов, например, при
миастении. Однако у пациентов может
возникать судорожная реакция, спазм
мускулатуры, нарушение дыхания и
кровообращения, повышение артериального давления, неприятные болевые ощущения и даже ожоги на месте
приложения электродов.
УПРАВЛЯЕМАЯ
ИСКУССТВЕННАЯ
ГИПОТОНИЯ
Она применяется в сочетании с
общим обезболиванием. При больших, кровавых операциях может возникнуть ситуация, когда необходимо
работать на так называемом «сухом»
операционном поле, уменьшить кровопотерю, особенно при гипертонии.
С этой целью во время наркоза можно снизить артериальное давление.
Раньше для этой цели делали кровопускание, которое не применяется в настоящий момент. Используют обычно
ганглиоблокаторы, воздействующие
на вегетативные ганглии, что сопровождается гипотонией. Применяют арфонад, гексаметоний, гексоний, пентамин
и др. При этом расслабляется мускулатура сосудов: артерий, артериол,
что увеличивает емкость сосудистого
русла, уменьшает скорость кровотока.
Кровь депонируется в нижерасположенных тканях и органах больного, а
в вышерасположенных ее количество
уменьшается. Поэтому, создавая соответствующее положение больному,
можно добиться значительного снижения кровенаполнения и кровотечения на месте оперативного вмешательства. Но нужно помнить о допустимом
уровне гипотонии. В головном мозге
нормальный обмен происходит при
164
Текстовый модуль 3
систолическом давлении 40 мм рт. ст.,
клубочковая фильтрация в почках нарушается при давлении ниже 50 мм рт. ст.
Поэтому снижать систолическое давление нельзя ниже 60-70 мм рт. ст., а
лучше не ниже 80-90 мм рт. ст.
Снижают артериальное давление
во время операции на короткое время. Так, при внутривенном введении
арфонада (0,1-0,2 г/кг в 0,1% растворе) эффект наступает через 3-5 минут
и длится 4-6 минут. Через 10-25 минут
давление нормализуется. Чтобы удлинить действие ганглиоблокаторов, их
вводят внутривенно капельно. Однако
при длительном введении вследствие
замедления кровотока и тромбоза сосудов могут появиться очаги размягчения в мозге, а изменения в почках приведут к олигурии и даже анурии.
ИСКУССТВЕННАЯ
ГИБЕРНАЦИЯ
Это искусственно вызванное состояние, напоминающее зимнюю спячку у
животных. Искусственная гибернация
(от франц. hibernation) направлена на
защиту человека от вредных влияний,
в том числе и операционной травмы.
Естественная зимняя спячка и возможность ее применения привлекали
внимание еще в ХIХ веке (А.П. Вальтер, П.И. Бахметьев и др.). Но только
французскими учеными А. Лабори и
П. Югенаром в 1948 г. был разработан
способ искусственной «зимней спячки».
Гибернация достигается комбинацией фармакологических средств, оказывающих симпатолитическое, парасимпатолитическое, антигистаминное
и седативное действие. Эти препараты
применяются в виде смесей, получивших название «литических смесей»
или «литических коктейлей». Состав
смесей различный. Они включают
нейроплегики, например, аминазин,
Тема 7
дипразин, этизин; антигистаминные
препараты (димедрол, супрастин и
др.), наркотики (промедол, омнопон
и др.), атропиноподобные препараты
(атропин, скополамин и др.) и прочие.
Примерный состав литической смеси
следующий: аминазин 2% — 2,0 мл;
димедрол 1% — 2,0 мл; промедол 2%—
2,0 мл; сернокислый атропин 0,1% —
1,0 мл и новокаин 1% — 5,0 мл. Вечером накануне операции назначают
снотворное с димедролом. Литический
коктейль вводят за 30 минут до операции внутримышечно в палате. В операционную доставляют на каталке во избежание ортостатического коллапса.
Под действием введенных препаратов угнетаются различные звенья центральной и периферической нервной
системы, снижается нейрогуморальная
регуляция, угнетается эндокринная
система, снижается температура тела,
обмен веществ, ослабевают рефлекторные защитные реакции организма, наступает сон, дыхание и пульс урежаются, несколько снижается артериальное
давление. Далее проводится основной
способ обезболивания. Однако при
больших дозах наркотических веществ
могут быть нарушены физиологические
компенсаторные реакции, которые не
нарушаются при всех вышеприведенных методах обезболивания. Поэтому
глубокая гибернация широкого распространения не получила.
Поверхностную гибернацию —
нейроплегию иногда используют с наркозом (потенцированный наркоз) и
местной анестезией.
ИСКУССТВЕННАЯ
ГИПОТЕРМИЯ
Этот вид обезболивания тоже относится к комбинированному. Снижения общей температуры тела человека
добиваются фармакологическими, фи-
зическими и комбинированными способами.
При искусственной гипотермии
снижение общей температуры сопровождается понижением обмена веществ,
окислительных процессов, снижением
кровотока в тканях и мозге, артериального давления, снижается реакция на
различные воздействия, в том числе на
операционную травму, увеличивается
переживаемость тканей на кислородное
голодание. Особенно ценно последнее
по отношении к мозгу. Если в обычных
условия после прекращения крово
обращения с кислородным голоданием
кора мозга может не погибнуть 4 минуты, то при гипотермии в 260С она может не погибнуть в течение 12-15 мин.
Этот факт используется в хирургии при
операциях на «сухом сердце» (вшивание искусственных клапанов, операции по поводу врожденных пороков
сердца, на крупных сосудах, на мозге).
Метод небезопасен. При охлаждении
происходит выключение защитных
рефлекторных реакций на воздействие
неблагоприятных факторов. Поэтому
выявить их и бороться с ними представляет большие трудности.
165
Искусственную гипотермию создают под общим наркозом. После введения в наркоз больного охлаждают,
применяя фармокологические препараты, как при искусственной гибернации, и физические методы.
В этом случае больного можно погрузить в ванну с температурой 8-100С,
применить специальный комбинезон,
покрывало, пузыри со льдом, поместить больного в камеру для гипотермии, промыть слизистые желудка, прямой кишки холодной водой, которая
циркулирует в специальном баллоне,
подсоединенном к холодильной установке. Применяют аппарат искусственного кровообращения (АИК), в котором производят охлаждение крови. По
глубине снижения температуры тела
выделяют три уровня: поверхностная
гипотермия до 300С, умеренная — до
280С и глубокая — ниже 250С. Снижение ниже 25 градусов опасно, так как
может привести к нарушению функции
продолговатого мозга. Каждый уровень гипотермии имеет свои показания
(рис. 49).
Длительность охлаждения составляет примерно 1,5-2 часа.
Рис. 49. Общая гипотермия в ванне под наркозом
166
Текстовый модуль 3
После окончания операции больного согревают. При поверхностном
охлаждении производят пассивное согревание пациента. Для этого его помещают в палату с температурой 20-210С
и укутывают одеялами на 12-20 часов.
При гипотермии ниже 300С проводят
активное согревание больного. В этом
случае его погружают в ванну с температурой воды до 450С или обкладывают
грелками с укутыванием одеялами на
3-6 часов. По достижении температуры 340 С продолжают согревать, но уже
без грелок. Быстро согревать больного
нельзя, так как может развиться гипертермия, приводящая к тяжелому состоянию с нарушением деятельности сердца, дыхания, артериального давления и
пр. Приходится применять повторное
охлаждение, нейроплегические препараты, введение больших количеств
40% глюкозы с инсулином, препаратов,
понижающих температуру тела.
Во время охлаждения может наступить нарушение ритма сердца и даже
фибрилляция желудочков сердца, осо-
Рис. 50. Дефибриллятор
Тема 7
бенно в тех случаях, когда температура больного снижается ниже 250С. При
экстрасистолии применяют гипервентиляцию легких для увеличения доставки кислорода, внутривенно вводят хлорид калия, простигмин, а при
фибрилляции делают массаж сердца и
дефибрилляцию (рис. 50). Охлаждение
может вызвать гипотонию, а выключение компенсаторных механизмов
повышает чувствительность к кровопотере и увеличивает опасность послеоперационных кровотечений. При
гипотермии происходит повышение
венозного давления параллельно с замедлением сердечной деятельности,
что создает опасность при переливании
крови в случаях низкого артериального давления.
Поэтому гипотермия пока остается
методом с иногда возникающими опасными осложнениями.
ГИПНОНАРКОЗ
Гипнонаркоз в чистом виде в хирургической практике не применяется. Были отдельные попытки его применить в сочетании с другими видами
обезболивания.
Наблюдение за больным
во время и после наркоза
При проведении общего обезболивания постоянно осуществляют наблюдение за клиникой наркоза, дыханием,
состоянием гемодинамики. Пульс,
артериальное давление определяют
каждые 5-10 минут. При больших оперативных вмешательствах, операциях
на органах грудной клетки, на сердце,
крупных сосудах, мозге и других органах используют мониторы для постоянного наблюдения (рис. 51). Следят за
работой наркозного аппарата, аппарата
для искусственной вентиляции легких,
адекватностью самостоятельного или
Рис. 51. Кардиокомплекс — дефибриллятор
и электрокардиограф
аппаратного дыхания. С целью контроля за вентиляцией легких и возможных
метаболических нарушений в ходе наркоза и операции выполняют исследование кислотно-щелочного состояния
(Ро2, Рсо2, рН, ВЕ).
Для наблюдения за больным обязательно ведется наркозная карта, в
которой повременно отмечаются все
вышеуказанные показатели. В ней отмечаются все этапы наркоза (премедикация, вводный, базисный наркоз,
выведение из наркоза). Записывается,
какие препараты, когда вводятся, их
доза, причем не только препараты для
наркоза, но и такие, как физиологиче-
167
Рис. 52. Вид современной палаты
интенсивной терапии
ский раствор, глюкоза, плазма, кровь и
др. Делается отметка и об этапах операции: когда прекращен наркоз, когда
произведена дезинтубация, восстановилось самостоятельное дыхание.
В карте записывается в конце операции
и наркоза количество каждого введенного препарата. Делается запись о всех
возникших осложнениях в течение
операции и наркоза. И только после
восстановления всех жизненно важных
параметров больной переводится в хирургическое отделение или в реанимационное отделение (рис. 52), как было
сказано выше. Наркозная карта вкладывается в историю болезни.
Контрольные вопросы по теме занятия
1. Какие меры предпринимали в древности, чтобы уменьшить болевой синдром при
хирургических вмешательствах?
2. Что требовалось от больного и хирурга при таких операциях?
3. Когда и кто открыл и применил эфир?
4. Когда и кто открыл и применил закись азота?
5. Какова роль Н.И. Пирогова в развитии обезболивания?
6. Что такое «русский» наркоз?
7. Кто и когда впервые применил в наркозе мышечные релаксанты?
8. Показания и противопоказания для различных видов наркоза.
9. Как классифицируются виды наркоза?
168
Текстовый модуль 3
10. Какие существуют теории наркоза?
11. Какие имеются стадии наркоза и их характеристика?
12. Какие препараты применяются для ингаляционного и неингаляционного наркоза?
13. Схемы подготовки больного к наркозу и премедикация.
14. Как проводится масочный наркоз?
15. Как проводится современный комбинированный ингаляционный наркоз?
16. Какие имеются мышечные релаксанты и какой механизм их действия?
17. Какие имеются осложнения ингаляционного наркоза и помощь при них?
18. Какая существует классификация неингаляционного наркоза?
19. Какие препараты применяются при неингаляционном наркозе?
20. Как выполнить внутривенный наркоз барбитуратами?
21. Какие особенности применения наркоза рекофолом?
22. Для чего и как выполняется искусственная гипотензия?
23. Для чего и как проводится искусственная гипотермия?
24. Что такое искусственная гибернация?
25. Чем и как проводится нейролептанальгезия?
26. Что такое атаралгезия?
27. Кто предложил использовать прямокишечный наркоз и почему в настоящее время он не применяется?
ТЕМА №8.
Местная анестезия, показания и противопоказания, её виды. Препараты и их дозировка. Различные блокады. Эндолюмбальная и эпидуральная анестезия. Осложнения и помощь при них. Выбор метода обезболивания
1. Актуальность темы
Среди многих разнообразных методов обезболивания при хирургических вмешательствах местная анестезия прочно вошла в перечень методов
обезболивания как в стационаре, так и
в поликлинике. Это объясняется простотой выполнения. Она не требует
дорогой и сложной аппаратуры, подготовленных анестезиологов. Для ее осуществления достаточно иметь шприцы,
иглы и растворы анестетиков. При ней
крайне редко встречаются осложнения.
Реже для обезболивания применяется эндолюмбальная и эпидуральная
анестезия.
■
■
■
■
■
■
2. Учебные цели
Классифицировать виды местного
обезболивания;
Изучить препараты для местной
анестезии;
Определить показания и противопоказания к различным видам местной анестезии;
Продемонстрировать технику выполнения инфильтрационной, проводниковой анестезии;
Знать методику спинномозговой и
перидуральной анестезии;
Обобщить возможные осложнения
при проведении различных видов
местной анестезии и оказания медицинской помощи.
3. Самостоятельная
работа студентов
Местная анестезия применяется
для обезболивания какой-либо части
тела человека. Она вызывается при помощи механических, физических и химических средств при сохранении сознания. В настоящее время более 50%
операций выполняется под местной
анестезией, как правило, с помощью
различных химических препаратов.
Местные анестетики должны отвечать следующим требованиям:
1) Доступность в применении;
2) Достаточное обезболивающее
действие;
3) Достаточно длительное воздействие;
4) Отсутствие токсичности;
5) Отсутствие вредного влияния на
ткани.
Для различных видов местной анестезии использовались разнообразные
препараты.
Кокаин открыт в 1860 году и после
обнаружения местноанестезирующей
активности в 1879 году был применен
Анрепом у больных. Проводилось наблюдение за больными и выяснилось,
что он оказывает влияние не только
на центральную нервную систему, но
и на сердечно-сосудистую, дыхательную системы, а также желудочнокишечный тракт и вызывает болезненное пристрастие (кокаинизм).
Поэтому из-за высокой токсичности
кокаин не получил широкого применения. Чрезвычайно редко кокаин
гидрохлорид используют в 1-2% растворе для поверхностной анестезии
конъюктивы, роговицы, слизистой
оболочки рта, носа, гортани.
170
Текстовый модуль 3
Новокаин открыт А. Эйнхорном
в 1905 году. Имеет анестезирующее
действие меньшее, чем кокаин, но обладает в столько же раз меньшей токсичностью и не вызывает наркоманию, поэтому применяется широко и
в настоящее время. Некоторые лица
имеют непереносимость к новокаину,
которую выясняют из анамнеза и при
помощи внутрикожной пробы. Применяется новокаин в концентрациях
0,25-0,5%, 1-2%, 5% и 10%. При увеличении концентрации анестетика его
токсичность возрастает в геометрической прогрессии. Поэтому большие
концентрации новокаина токсичны.
Он не обладает кумулятивным действием, быстро разлагается в печени
и сыворотке крови, образуя парааминобензойную кислоту и диэтиламиноэтанол, не всасывается через кожу
и плохо всасывается слизистыми. При
всасывании в кровь оказывает общее
воздействие на организм: снижает образование ацетилхолина, уменьшает
возбудимость периферических холинореактивных систем, блокирует вегетативные ганглии, уменьшает спазмы
гладкой мускулатуры, возбудимость
моторных зон коры головного мозга
и мышцы сердца. Имеется много синонимов новокаина: аллокаин, аминокаин, анестокаин, изокаин, марекаин,
панкаин, прокаин, синкаин, синтокаин, цитокаин, этокаин и др.
Применяется для поверхностной,
инфильтрационной, сосудистой, внутрикостной, проводниковой, эндолюмбальной, эпидуральной анестезий, различных блокад и др.
Лидокаин (анестакон, доликаин,
ксилокаин, лигнокаин и др.) обладает
в 4 раза более сильным, чем новокаин,
анестезирующим действием, в то же
время в 2 раза токсичнее при повышении концентрации. Используют в 0,25-
Тема 8
0,5% растворе, 1-2% растворе и 10%
растворе. Лидокаин более медленно
метаболизируется в организме без образования парааминобензойной кислоты, снижающей активность сульфаниламидов, действует более длительно,
чем новокаин. Он оказывает выраженный антиаритмический эффект.
Для обезболивания применяется
при поверхностной, инфильтрационной, проводниковой, сосудистой, внутрикостной, эпидуральной анестезии,
для проведения блокад.
Тримекаин (синонимы: тримекаина гидрохлорид, мезокаин и др.) по
структуре и действию близок к лидокаину. Он вызывает быструю и в 3 раза
более глубокую и продолжительную
анестезию, чем новокаин, с незначительно большей токсичностью (в 1,5
раза). Применяется в концентрациях 0,25-0,5% для инфильтрационной
анестезии, в 1-2% растворе для проводниковой, в 2,5-3% растворе для эпидуральной и до 5% — поверхностной
анестезии.
Цегнокаин (соль новокаина и
целлюлозо-гликолевой кислоты) применяется как новокаин в 0,25-0,5%
растворе для инфильтрационной анестезии, в 1-2 % — проводниковой и
2-3% — эпидуральной анестезии. Обладает более длительным действием.
Ультракаин (кортикаин) обладает более сильным и продолжительным
действием, но более токсичным, чем
новокаин. Используется чаще в стоматологической практике, редко для
инфильтрационного и эпидурального
обезболивания. Обычно применяют
для проводниковой (регионарной)
анестезии.
Дикаин (синонимы: аметаин, интеркаин, пантокаин, рексокаин, тетракаина гидрохлорид, феликаин, фонкаин
и др.) обладает сильным местноанесте-
зирующим действием (в 15 раз сильнее
новокаина), но и токсичность выше
кокаина в 2 раза, а новокаина — в 10
раз. Применяется для поверхностной
анестезии в 0,25%, 0,5%, 1-2% растворе и для эпидуральной анестезии — в
0,3% растворе. Нужно отметить, что
при ошибочном введении в субарахноидальное пространство при эпидуральной анестезии проявляет свое действие
как и при эндолюмбальном обезболивании.
Совкаин (синонимы: бутилкаин,
дибукаин, квинокаин, оптокаин, перкаин, цинкаин и др.) более активен, чем
новокаин (15-20 раз), длительность
действия продолжительнее в 3 раза, но
токсичнее его тоже в 15-20 раз. Медленно выводится из организма. Применяется при эндолюмбальной анестезии.
Показания к применению
местной анестезии
Местная анестезия не требует специальной длительной подготовки,
применения сложной аппаратуры и
наблюдения в послеоперационном периоде, как после наркоза. Она является
наиболее безопасным методом обезболивания и в принципе может применяться при всех операциях, когда
не нужен наркоз или к нему имеются
противопоказания. Широко используется при небольших вмешательствах,
аппендэктомии, грыжесечении, операциях на периферических сосудах,
щитовидной железе и многих других
операциях, в амбулаторных условиях.
Если хирургическое вмешательство
под наркозом представляет опасность
для жизни больного, то тоже возникает необходимость в местной анестезии,
например, у лиц пожилого и старческого возраста, страдающих сердечнососудистой и дыхательной недостаточностью и др.
171
Противопоказаниями
к местной анестезии являются:
1) детский возраст менее 10 лет;
2) психические больные;
3) при психическом возбуждении
больного (делирий);
4) при грубых рубцах и воспалении
на месте предстоящей операции, препятствующих выполнению инфильтрационной анестезии;
5) при ожогах;
6) при операциях, связанных с нарушением газообмена, при которых необходимо «управляемое дыхание»;
7) продолжающееся внутреннее
кровотечение, требующее экстренного
вмешательства для его остановки;
8) непереносимость больным местных анестезирующих средств.
Местную анестезию не применяют
у лиц, которые категорически отказываются от нее, несмотря на разъяснения врача о механизме ее действия.
Перед проведением местного обезболивания необходима психологическая подготовка. Больному объясняют,
что при местной анестезии сознание
будет сохранено, спать он не будет, тактильная и глубокая чувствительность
сохранятся, но боль не будет чувствоваться. Больным назначают снотворные, транквилизаторы, а за 30 минут до
операции проводят премедикацию (промедол, атропин, димедрол, дроперидол).
СПОСОБЫ
МЕСТНОЙ АНЕСТЕЗИИ
Местная анестезия осуществляется различными способами. К ней относятся:
1. Поверхностная (терминальная) анестезия;
2. Инфильтрационная анестезия;
3. Инфильтрационная анестезия методом тугого ползучего инфильтрата по А.В. Вишневскому;
172
Текстовый модуль 3
4. Проводниковая анестезия;
5. Внутрисосудистая (внутривенная,
внутриартериальная);
6. Внутрикостная;
7. Блокады;
8. Анестезия охлаждением;
9. Эндолюмбальная анестезия;
10. Эпидуральная анестезия.
Поверхностная или терминальная анестезия получила свое название
потому, что анестетик наносится на поверхность слизистой, при всасывании
воздействует на терминальные нервные окончания и вызывает анестезию.
Нанесение на кожу не приводит к обезболиванию, так как эти препараты через кожу не всасываются. Применяется
в глазной практике для обезболивания
слизистой (конъюнктивы), роговицы.
В этом случае оттягивают пальцами кисти нижнее веко книзу, а пипеткой наносят у внутренного угла глаза
(рис. 53) 2-3 капли 0,25% или 0,5% раствора дикаина или другого поверхностно действующего препарата (см. выше
их описание). В отоларингологии (нос,
ротоглотка и др.) для обезболивания
применяют 1-2% раствор дикаина путем смазывания или прикладывания
смоченного анестетиком тампона.
Однако нужно помнить, что препарат токсичен, особенно это выражено у
детей, в связи с чем его наносят осторожно из-за возможного проявления
тяжелых осложнений. При эндоскопических исследованиях (бронхоскопия,
эзофагогастродуоденоскопия),
ларингоскопии, введении желудочного зонда можно применять 10% раст
вор новокаина или лидокаина в виде
орошения аэрозолем слизистой ротоглотки вследствие уменьшения рвотного рефлекса и болевого ощущения.
В меньшей концентрации эти препараты не действуют.
173
Тема 8
Рис. 53. Нанесение препарата
на конъюнктиву глаза в виде капель
Инфильтрационная анестезия
кокаином, предложенная в 1879 г.
Анрепом и разработанная в 1887 г.
В.А. Орловым слабым раствором препарата, а также использованная во время греко-турецкой войны в Афинах
Гоген-Торном, не получила распространения из-за высокой токсичности
препарата. Только после появления
новокаина в 1905 году (Эйнгорн) этот
вид обезболивания начал применяться
повсеместно.
При инфильтрационной анестезии
производят пропитывание тканей анестетиком в области операции. Обезболивающее средство действует в этом месте на нервные рецепторы и проходящие
здесь же нервные стволики, вызывая
нарушение передачи импульсов. Кроме
прямой инфильтрации тканей, возможно применение непрямой инфильтрационной анестезии, при которой после
введения препарата в области операции
расчитывают на диффузию раствора изза разности осмотического давления и
пропитывания всех тканей.
Инфильтрационная анестезия про
изводится 0,5-1% раствором новокаина
(лидокаина, тримекаина и др.) снаружи
вовнутрь послойно. Сначала тонкой небольшой острой иглой вводят раствор
Рис. 54. Инфильтрационная анестезия кожи
в виде «лимонной корочки»
анестетика внутрикожно на протяжении будущего разреза в виде «лимонной корочки» (рис. 54). Кожа в этом
месте становится нечувствительной.
После смены небольшой иглы на длинную через «лимонную корочку» производят анестезию на месте операции во
всю глубину, продвигая иглу вглубь в
подкожную клетчатку, мышцы и т. д.
При большом операционном поле раствор новокаина вводят в виде ромба
или четырехугольника, чтобы пропитать боковые стороны операционного
поля и нервные образования, идущие
к центру места операции. Пропитывают раствором новокаина связки того
брюшного органа, на котором выполняется операция. Длительность анестезии 1-1,5 часа. При более длительной
операции возвращается болевая чувствительность. Приходится применять
дополнительное обезболивание.
Разновидностью этого способа инфильтрационной анестезии является
поперечная анестезия конечности на
определенном уровне (рис. 55), когда
пропитываются 0,25% раствором новокаина все ткани от кожи до кости.
При этом вводят в каждый мышечный
футляр (сгибатели, разгибатели, при-
а
б
в
г
Рис. 55. Поперечная анестезия конечности:
а – плеча; б – предплечья;
в – бедра; г – голени
водящие мышцы и др.) по 50-60 мл
новокаина. Такую анестезию можно
выполнить на любом сегменте верхней
или нижней конечности.
Применяют ее при ампутации или
тяжелой травме конечности с целью
профилактики травматического шока.
Поэтому ее называют еще поперечной
(футлярной) блокадой конечности.
Учитывая возрастание токсичности
новокаина при увеличении концентрации и вводимого его количества,
а следовательно, и ограничение времени его обезболивающего действия,
А.В. Вишневский предложил использовать слабый раствор анестетика —
0,25% и способ его введения по типу
«тугого ползучего инфильтрата».
В этом случае после создания по ходу
будущего разреза кожи «лимонной корочки» с помощью тонкой острой иглы
и небольшого шприца (2,0 или 5,0 мл)
берут большую иглу с большим шприцем (10 мл или 20 мл) и вводят в области
операционного поля большое количество 0,25% раствора новокаина. Вводят так, чтобы создать тугой плотный
174
Текстовый модуль 3
инфильтрат в клетчатке. По клетчаточному пространству (футляру) новокаин
распространяется в стороны, приводя к
гидравлической препаровке тканей, нервов, сосудов, что позволяет их хорошо
дифференцировать и не повредить, легко остановить кровотечение. Тугое наполнение фасциального пространства
ведет к быстрому и тесному контакту
анестетика с нервными окончаниями,
в связи с чем обезболивание наступает
почти мгновенно. Это позволяет разрез тканей производить сразу же после
введения новокаина. Раствор анестезирующего вещества изливается наружу, не всасывается, что предупреждает
его токсическое действие. Затем снова
в следующее пространство вводят слабый раствор новокаина в виде тугого
ползучего инфильтрата, ткани вновь
рассекают, и так продолжают в течении всей операции. Вводить новокаин
необходимо до вскрытия футляра, так
а
в
б
Рис. 56. Инфильтрационная анестезия по А.В. Вишневскому при операции на щитовидной железе: а —
лимонная корочка на коже; б — введение новокаи
на под мышцы; в — введение раствора анестетика
вокруг щитовидной железы
Тема 8
как после его рассечения раствор будет
выливаться в рану, и создать плотный
ползучий инфильтрат в этом случае невозможно. Хирург работает поочередно
шприцем и скальпелем (рис. 56). Для
операции используют 0,25% новокаин
из расчета 2,0 г сухого вещества в час,
т. е. 800 мл 0,25% раствора за один час,
1600 мл — за 2 часа и т. д. При введении анестетика в футляры происходит
контакт не только с нервными окончаниями, но и с нервами, проходящими
в футлярах. Поэтому анестезия по
А.В. Вишневскому является не только
инфильтрационной, но и проводниковой. По мнению А.В. Вишневского и
его учеников, этот вид обезболивания
сопровождается слабым раздражением
нервной системы, что оказывает положительной влияние на трофику тканей.
После создания данного способа
анестезии стало возможным оперировать почти на всех участках человеческого тела.
Проводниковая (регионарная)
анестезия — это анестезия, при которой новокаин или другой анестетик
(лидокаин, тримекаин, цегнокаин, ультракаин) прерывает проводимость чувствительного нерва, т. е. создает блок в
каком-то его участке. Препарат вводится в нерв (эндоневрально), если он
крупный, или в мягкие ткани возле нерва (периневрально), если он представлен тонкими веточками. Производят
анестезию нервных стволов, нервных
сплетений, нервных узлов (паравертебральных). Учитывая, что нерв покрыт
оболочкой, для воздействия на него
применяют анестетик более высокой
концентрации (1-2%). Количество вводимого раствора зависит от места проведения анестезии и составляет от 2,0
до 35,0 мл.
Техника проведения проводниковой анестезии сложна из-за трудности
175
определения расположения нерва в
глубине тканей, а расположение вблизи нервов кровеносных сосудов делает
ее опасной в связи с возможностью повреждения сосуда и возникновением
кровотечения или введением анестетика в кровь. Поэтому иглу к месту расположения вводят без шприца, что позволяет заметить кровотечение, а при
прикосновении иглы к нервному ствола вызывает острую боль. После этого
вводят анестетик. При эндоневральном
введении анестезия наступает через
3-5 мин., а при периневральном — через 10-15 мин.
Некоторые виды проводниковой
анестезии представлены ниже.
Проводниковая анестезия пальца по Лукашевичу — Оберсту применяется при операциях на пальцах
(вскрытие панариция, ампутация, обработка раны и др.). На основание
пальца накладывают резиновый или
марлевый жгутик (предложение Барского), который сдавливает сосуды и
предупреждает кровотечение, а также
не позволяет распространяться анестетику в проксимальном направлении. Затем дистальнее жгутика вводят
2-3 мл 1% или 2% раствора новокаина.
При этом введение можно произвести
двумя способами. При первом прокалывают кожу дистальнее жгутика на
тыле пальца, после чего проводят иглу
в подкожной клетчатке на одну боковую его сторону с введением анестетика, а затем на другую сторону. Второй
способ предполагает отдельный прокол
с одной стороны с введением препарата, а затем с другой (рис. 57). Анестезия
наступает примерно через 10 минут.
Проводниковая анестезия применяется в стоматологии при лечении и
экстирпации зубов. В этом случае в настоящее время чаще применяется ультракаин 1,0 мл в 1-2% растворе, который имеет более выраженный и более
продолжительный обезболивающий
эффект, чем новокаин. Препарат вводят небольшим одноразовым шприцем
(1-2 мл) с тонкой небольшой иглой в
местах прохождения нервов (рис. 58).
Межреберная анестезия используется при операциях на грудной клетке, при переломе ребер.
При переломе ребра берут шприц
с иглой и 1-2% раствором новокаина.
В нескольких сантиметрах от места перелома, ближе к позвоночнику, в перпендикулярном направлении к сломанному ребру производят прокол кожи и
продвигают иглу до ребра, затем соскальзывают под нижний край ребра,
где проходит межреберный нерв и периневрально вводят 3-5 мл раствора
новокаина (рис. 59). Затем иглу слегка
Рис. 57. Проводниковая анестезия
по Лукашевичу-Оберсту
Рис 58. Проводниковая анестезия в стоматологии
176
Текстовый модуль 3
Тема 8
Рис. 59. Межреберная анестезия
Рис. 60. Анестезия по Куленкампфу
подтягивают, смещая ее на переднюю
поверхность ребра, и продвигают путем соскальзывания на верхний край
того же ребра. Вводят 2-3 мл 1-2% раствора новокаина и иглу удаляют.
Паравертебральная анестезия
выполняется при множественных переломах ребер, при операциях на грудной
клетке. В последнем случае комбинируется с общей анестезией. При этой анестезии создают блокаду у места выхода
нервных стволов из межпозвоночных
отверстий. Техника ее заключается в
том, что на середине расстояния между остистым отростком и внутренним
краем лопатки соответственно уровню
каждого ребра вводят внутрикожно
раствор новокаина и прокалывают мягкие ткани до ребра. Иглу проводят под
нижний край ребра на глубину 0,3-0,5
см, предпосылая струю новокаина. Затем вводят 10-15 мл 0,5% раствора
анестетика. Хорошая анестезия наступает при блокаде нескольких сегментов
выше и ниже предполагаемого разреза.
Анестезия плечевого сплетения по Куленкампфу применяется
при операциях на верхней конечности.
Больного укладывают на операционный стол на спину со свисающей рукой
и повернутой в противоположную сто-
рону головой. В средней части ключицы по верхнему ее краю определяют
пульсацию подключичной артерии.
Плечевое сплетение находится кнаружи от артерии. Инфильтрируют кожу
раствором новокаина, через это место
длинную иглу без шприца вкалывают
кнаружи от пульсирующей артерии на
1,0 см выше ключицы и продвигают в
направлении І и ІІ грудных позвонков,
скользя по верхнему краю І ребра. О попадании в нерв говорит появление неприятных ощущений в руке, ее онемение или острая боль. Если игла попала
в артерию, то необходимо ее оттянуть
и изменить направление. Если кровь не
выделяется, то вводят 30-35 мл 1% раствора лидокаина, после чего анестезия
наступает через 10-15 минут и длится
2-6 часов (рис. 60). Можно вводить и
новокаин, но длительность анестезии
значительно уменьшается.
Анестезия чревных нервов по
Брауну применяется во время внутрибрюшных операций как дополнение
к местной инфильтрационной анестезии при вмешательстве на желудке. Ее
применяют при неоперабельном раке
желудка для уменьшения болевого
синдрома в виде спирт-новокаиновой
блокады. Для ее выполнения припод-
нимают крючком левую долю печени
кверху и вправо, а желудок — книзу
и влево. В области малого сальника
выше отхождения чревной артерии
упираются пальцем в позвоночник,
чтобы он располагался между аортой
(справа) и нижней полой веной (слева). Длинной иглой со шприцем проходят по верхнему краю пальца до ХІІ
грудного позвонка, иглу слегка оттягивают назад (до 0,5 см), убеждаются, что
кровь при подтягивании поршня не поступает, и вводят в клетчатку 50-70 мл
0,5% раствора новокаина. Анестетик
распространяется по клетчатке, захватывая солнечное сплетение. Анестезия
наступает через 5-10 минут и длится
1,5-2 часа. При спирт-новокаиновой
блокаде наступает еще алкоголизация
чревного сплетения, что способствует
у неоперабельных раковых больных
уменьшению болевого синдрома в послеоперационном периоде.
Блокады оказывают разностороннее действие: снимают болевой синдром, что служит профилактикой шо
ка; действуют противовоспалительно,
снимают спазмы гладкой мускулатуры,
улучшают трофику тканей. Некоторые
уже приведены выше (поперечная циркулярная анестезия или блокада конечностей, блокада чревного сплетения по
Брауну).
Короткий новокаиновый блок
применяется при переломе костей, воспалительном инфильтрате. Так, при переломе ребра к месту перелома вводится 2-5 мл 1% раствора новокаина. Это
уменьшает боль и позволяет больному
свободно дышать. При воспалительном
инфильтрате (фурункул, карбункул и
др.) под инфильтрат вводят 0,5% раствор новокаина (10-40 мл или более)
с антибиотиком, чтобы создать как бы
подушку, оказывающую противовоспалительное и трофическое влияние.
177
Частным выражением этого метода
является ретромаммарная блокада
при инфильтративной стадии данного
мастита. Она может быть использована
как этап местной анестезии при операции на молочной железе (рис. 61).
Блокаду делают из трех или четырех точек (сверху, снизу и с боков).
Анестезируют кожу 0,5% раствором
новокаина в местах прокола, а затем,
приподнимая молочную железу, проводят длинную иглу в ретромаммарную
клетчатку и через каждый прокол вводят по 50 мл 0,25% раствора новокаина. При введении анестетика не должно
быть сопротивления, а после извлечения иглы он не должен изливаться наружу. В конце манипуляции молочная
железа должна быть приподнята как на
подушке.
Поясничная (паранефральная)
блокада применяется при гемотрансфузионном шоке, парезе кишечника,
инфильтратах брюшной полости, почечной колике, как основа для последующей местной анестезии при
операциях в поясничной области и забрюшинном пространстве.
Рис. 61. Ретромаммарная блокада
178
Текстовый модуль 3
Тема 8
Рис. 62. Паранефральная новокаиновая блокада
Рис. 63. Вагосимпатическая новокаиновая блокада
Больного укладывают на столе на
здоровый бок, валик укладывают на
уровне поясницы. Верхняя нога вытянута, а нижняя согнута в коленном
и тазобедренном суставах. После обработки кожи антисептиком находят
место вкола иглы, которое находится
в углу между ХІІ ребром и длинной
мышцей спины по биссектрисе. Обезболивают кожу 0,25% новокаином
через тонкую иглу. Затем берут длинную иглу со шприцем, прокалывают
кожу перпендикулярно и, предпосылая
раствор новокаина, продвигают иглу в
ткани. После преодоления поясничной
фасции игла попадает в околопочечную клетчатку (рис. 62). О правильном
положении иглы указывает легкое поступление новокаина, который после
снятия шприца не выливается из иглы,
также не выделяется кровь и при дыхании игла колеблется. Вводят 60-80 мл
0,25% раствора новокаина. Если в игле
появилась кровь, то необходимо иглу
немного подтянуть и продолжить введение новокаина. Паранефральная
блокада может быть выполнена с одной
или двух сторон.
Шейная вагосимпатическая блокада выполняется при травме грудной клетки для профилактики и лечения плевропульмонального шока и
как основа для последующей анестезии
(рис. 63).
Для ее выполнения больного укладывают на спину с повернутой головой
в противоположную сторону. У заднего
края средней части грудинноключич
но-сосцевидной мышцы (место пересечения с наружной яремной веной) анестезируют кожу. Затем указательным
пальцем левой руки отодвигают кпереди и кнутри мышцу вместе с сосудами, находящимися под ней, и длинной
иглой со шприцем через обезболенный
участок кожи продвигают иглу кверху
и кнутри в направлении передней поверхности позвоночника, периодически проверяя, не прокололи ли сосуд.
При упоре в позвоночник иглу слегка
подтягивают назад и вводят 40-60 мл
0,25% раствора новокаина. О правильном выполнении блокады говорит появление симптома Горнера (расширение зрачка на стороне блокады).
Внутривенная местная анестезия выполняется при операциях на конечностях. Она предложена в 1908 г.
Биром и выполняется следующим образом. На конечность накладывается
эластический бинт от периферии к центру для обескровливания конечности.
У верхнего края бинта накладывают
жгут, после снятия эластического бинта у нижнего края операционного поля
накладывают второй жгут. Таким образом, обескровленное операционное
поле оказывается между двумя жгута-
179
Рис. 64. Внутривенная анестезия с двумя жгутами
Рис. 65 Внутривенная анестезия с одним жгутом
ми (рис. 64). В этих пределах под инфильтрационной анестезией отсепаровывают одну из подкожных вен на ноге
или руке, один конец которой перевязывают, а во второй (центральный или
периферический) вводят раствор новокаина, количество которого зависит
от размеров сегмента конечности, где
будет выполняться операция. Обычно на верхней конечности вводится
50 мл 0,5% новокаина, а на нижней —
80-100 мл. Раствор проникает в капилляры и диффундирует в ткани, воздействуя на рецепторы и нервные стволы.
Вначале обезболивание проявляется
в пределах изолированного участка
конечности, а затем распространяется
на нижерасположенную часть конечности по типу регионарной анестезии.
В конце операции во избежание быстрого поступления новокаина в кровь
и возникновения интоксикации нужно
жгуты снимать осторожно, медленно,
сначала жгут, расположенный на периферическом отделе конечности, а затем
медленно распустить жгут на проксимальной части.
При другом способе конечность
для обескровливания поднимают вверх
на 1-2 минуты и выше места предполагаемой операции накладывают только
один эластический бинт или жгут для
прекращения артериального кровообращения (рис. 65). Вместо жгута можно использовать манжету аппарата для
измерения артериального давления.
Ниже жгута в вену на верхней конечности вводят 150-200 мл 0,25% раствора новокаина, на нижней — 200-250 мл
0,25% новокаина. По окончании операции жгут тоже снимают медленно.
Внутриартериальная местная
анестезия предложена в 1909 г.
В.А. Оппелем. После обескровливания конечности и накладывания жгута, препятствующего оттоку крови и
анестетика, тонкой иглой пунктируют
артерию и вводят 50-100 мл 0,5% раствора новокаина. Обезболивание наступает через 1-2 минуты. Снимают
жгут медленно. Метод не получил широкого распространения.
Внутрикостная местная анестезия представляет из себя разно-
180
Текстовый модуль 3
видность внутривенной. Анестетик,
введенный в кость, попадает в вены и
диффундирует в ткани. Применяется
при операциях на костях конечностей
(повреждение костей, остеомиелит
и др.). Конечность обескровливают,
выше места операции накладывают
жгут или манжетку от тонометра до
прекращения пульсации в периферических артериях. Анестезируют кожу,
клетчатку, надкостницу в эпифизарном
отделе одной из костей, затем специальной костной иглой с мандреном
прокалывают корковый слой и в губчатое вещество на глубине 1-1,5 см вводят, после извлечения мандрена, 0,25%
раствор новокаина в количестве, зависящем от сегмента конечности. Для
анестезии стопы вводят 50-60 мл, голени – 100-120 мл, бедра — 120-150 мл
новокаина, кисти — 35-40 мл, предплечья — 70-80 мл и всей верхней конечности — 90-120 мл 0,25% раствора новокаина. При быстром снятии жгута в
конце операции может проявиться токсическое действие новокаина. Поэтому
жгут снимают медленно и перед его снятием вводится подкожно 2 мл кофеина.
Для потенцирования (усиления
действия) местной анестезии применяют нейролептаналгезию (дроперидол,
фентанил), центральную аналгезию
(метоксифлуран, пентран) без утраты больным сознания. Одновременно
уменьшается доза и токсичность не
только местных анестетиков, но и наркотических веществ.
Осложнения при местной анестезии могут быть связаны с аллергическими проявлениями на препарат в
виде кожной сыпи, отека Квинке, ларингоспазма и др. В этом случае применяют антигистаминные средства,
кортикостероиды, спазмолитики. Вторая группа осложнений — это передозировка препарата, которая обычно
Тема 8
наступает при массированном поступлении анестетика в кровеносное русло и проявляется беспокойством, гиперемией кожи, учащением пульса,
повышением артериального давления.
Может развиться коллапс, кома, остановка дыхания и сердца, что требует
трансфузии противошоковых препаратов искусственной вентиляции легких,
массажа сердца.
Анестезия охлаждением. Эта
анестезия осуществляется применением хлорэтила, который выпускается в
ампулах с тонким отводом (носиком),
имеет температуру кипения 120С. При
направлении струи (охлаждающей
жидкости) на болезненный участок
происходит быстрое ее испарение, при
котором отнимается температура от
тканей. Это приводит к замораживанию и потере чувствительности в данной области, что позволяет выполнять
некоторые кратковременные операции
(вскрытие абсцессов, флегмон). Однако
этот метод анестезии не обеспечивает
полного обезболивания, а при оттаивании тканей возникают сильные боли.
Иногда развивается некроз тканей. Изза этого способ анестезии охлаждением
почти полностью оставлен.
ЭНДОЛЮМБАЛЬНАЯ
(спинномозговая) АНЕСТЕЗИЯ
Впервые в 1885 году Леонард Корнинг в Нью-Йорке провел опыт по
кокаинизации спинного мозга и ввел
термин “Spinal”, хотя, как выяснилось
позже, анестезия получилась эпидуральная. Открыл поясничную пункцию
Квинке.
Спинномозговая или, как ее сейчас
называют, эндолюмбальная анестезия
относится к регионарным видам обезболивания. Она предложена в 1899 г.
А. Биром и в этом же году начала применяться в России (Я.Б. Зельдович из
клиники Г.Ф. Цейдлера из Петербурга). К 1902 г. Бир опубликовал сведения о проведенном обезболивании у
6 больных. Особенно многими вопросами эндолюмбальной (спинномозговой) анестезии занимались В.Н. Томашевский (1906) и С.С. Юдин (1925).
Написанные ими монографии способствовали распространению этого вида
обезболивания.
При этой анестезии раствор анестетика вводится в субарахноидальное
пространство спинного мозга. Когда анестезирующий раствор входит в
контакт с задними (чувствительными)
и передними (двигательными) корешками спинного мозга, он всасывается нервной тканью, вследствие чего
в них нарушается нервная проводимость. Задние корешки чрезвычайно
чувствительны к анестезии, поэтому
сначала исчезает чувство боли, потом
температуры, и наконец тактильная
чувствительность. Анестезия передних
корешков развивается медленнее, но
вследствие ее наступает паралич мускулатуры. Прекрасная релаксация при
операциях на органах брюшной полости. Но при высокой анестезии может
наступить паралич межреберных и
диафрагмального нервов, что приведет
к остановке дыхания (апноэ) и даже к
летальному исходу. Одновременно с
корешками спинного мозга анестезируются коммуникантные (симпатические
вегетативные) веточки, проводящие
сосудосуживающие импульсы из вазомоторного центра к периферии, что
ведет к параличу вазомоторов в анестезированной зоне, органах брюшной
полости, таза, нижних конечностей.
Расширяются артериолы и снижается
общее артериальное давление. Таким
образом, понижение артериального
давления является естественным следствием спинномозговой анестезии. Ги-
181
потония возникает тем отчетливее, чем
выше уровень анестезии и чем больше
доза введения анестетика. Сознание у
больного сохраняется.
Показания к эндолюмбальной
анестезии. Заболевания, которые локализуются ниже диафрагмы и требуют
хорошей релаксации и длительного выполнения. Введение анестетика выше
уровня ХІІ грудного позвонка может
привести к нарушению деятельности
сосудодвигательного и дыхательного
центра из-за распространения обезболивающего препарата к продолговатому мозгу и паралича указанных центров.
Противопоказания к эндолюмбальной анестезии:
1. низкое кровяное давление;
2. кровотечение;
3. тяжелый травматический шок;
4. операции на черепе, шее, грудной
клетке и верхних конечностях;
5. наличие опухоли головного и спинного мозга;
6. внутричерепное или внутриспинальное кровоизлияние;
7. менингит, энцефалит;
8. тяжелая интоксикация при перитоните и сепсисе, сопровождающаяся
гипотензией;
9. воспалительные поражения кожи в
поясничной области;
10. костная деформация позвонков;
11. у больных с психическими заболеваниями и возбуждении различного генеза;
12. во время психозов различного происхождения;
13. у детей малого возраста;
14. у лиц с высокими цифрами артериального давления (атеросклероз и др.);
15. миокардит.
Подготовка больного ничем не отличается от подготовки к обычному
наркозу, но за 10-15 минут до анесте-
182
Текстовый модуль 3
зии вводят 1,0 мл 5% эфедрина или 2,0
мл 10% раствора кофеина для предупреждения снижения артериального
давления.
Техника. Необходимо иметь специальную тонкую иглу, что предупреждает большое повреждение твердой
мозговой оболочки и истечение спинномозговой жидкости из субарахноидального пространства. После пункции
с мандреном длинной 10-12 см (игла
Бира или отечественный ее аналог) и
коротким срезом в 450, чтобы не повредить спинной мозг и его корешки
(рис. 65), шприцы 2-5-граммовые с
делениями, обычные инъекционные
иглы с острым срезом. Многоразовые
шприцы тщательно обрабатывают и
стерилизуют. В настоящее время используют одноразовые шприцы. Подготавливают анестезирующие растворы.
Больного усаживают поперек операционного стола с подставкой для
ног, голова наклоняется к груди, руки
прижимаются к животу или укладываются на колени (рис. 66, Б). Можно
А
Тема 8
положить больного на стол на один из
боков, ноги сгибаются в суставах, чтобы колени были подтянуты к животу.
Голову наклоняют к грудной клетке, а
руки прижимают к животу. Такое положение направлено на то, чтобы позвоночник выгнулся дугой и остистые
отростки разошлись, что облегчает проведение иглы в спинномозговой канал.
Пункцию обычно выполняют на
уровне между остистыми отростками
позвонков LIII и LIV или LII и LIII. При
операциях на желудке, печени, почках
пункцию делают между D11 и D12 или
D12 и L1. Однако анестезия выше ХІІ
грудного позвонка дает большое количество осложнений, из-за чего большинство хирургов от высокой эндолюмбальной анестезии отказались.
Рис. 65. Игла Бира с мандреном
Найти точку пункции бывает затруднительно, особенно у тучных
больных. Поэтому используют некоторые ориентиры. Так, прямая линия
между верхними точками гребешков
правой и левой подвздошных костей
проходит через остистый отросток IV
поясничного позвонка (рис. 66, А), линия между нижними углами лопаток
пересекает остистый отросток VII грудного позвонка, а остистый отросток VII
шейного позвонка всегда хорошо прощупывается. Манипуляцию проводят с
соблюдением всех правил стерильности. Кожу обрабатывают антисептиком
(настойка йода, 960 спирта или др.). Но
при обработке йодом необходимо его
удалить спиртом, чтобы не занести его
в спинномозговой канал и не вызвать
раздражение оболочек мозга. После
этого 0,25-0,5% раствором анестезируют кожу на уровне выбранной анестезии, а затем иглой Бира с мандреном под небольшим наклоном книзу
(5-100), соответственно направлению
183
остистых отростков (рис. 67) и строго
по сагиттальной линии, прокалывают кожу, заднюю поясничную фасцию
(fascia lumbo-dorsalis), надостистую
связку (lig. Supraspinale), межостную
связку (lig. Interspinale), желтую связку
между дугами позвонков (lig. flavum),
что сопровождается ощущением сопротивления. Наконец прокалывают
твердую мозговую оболочку (dura mater), дающую второе ощущение сопротивления. Далее мандрен извлекают, а
иглу продвигают вращательными движениями на 2-3 мм для прокалывания
внутреннего листка твердой мозговой
оболочки. Игла должна находиться
в субарахноидальном пространстве
(рис. 68, а). При правильном положении иглы из нее выделяется по каплям
прозрачная светлая жидкость (спинномозговая). Если ничего не выделяется,
игла могла не попасть в субарахноидальное пространство или ее просвет
чем-то прикрыт. Поэтому необходимо
изменить ее положение, продвинуть на
Б
А
Б
Рис. 66. Определение места пункции при эндолюмбальной анестезии: А – линия (а – б) между гребешками
подвздошных костей, проходящая по остистому отростку IV поясничного позвонка; Б – пункция в положении
сидя между III и IV поясничным позвонком
Рис. 67. Продвижение иглы
Рис. 68. Положение иглы при эндолюмбальной анестезии, в субарахноидальном пространстве (а) в зависимости от наклона и распространение анестетика (б) остистого отростка
184
Текстовый модуль 3
1-2 мм или повернуть по оси. Жидкость
может не поступать при низком давлении из субарахноидального пространства. Необходимо заставить больного
покашлять, натужиться или надавить
больному на живот, что способствует
некоторому повышению давления в
спинномозговом канале. При глубоком
введении иглы она может проколоть сосуды венозного сплетения между твердой оболочкой мозга и телом позвонка,
и появится выделение крови из иглы.
Вводить анестетик нельзя, так как он
попадет в сосудистое русло. В этом случае иглу извлекают и вводят ее на один
позвонок выше. После извлечения
мандрена присоединяют шприц с анестетиком, набирают в него 2,0-3,0 мл
спинномозговой жидкости и медленно
вводят весь раствор. Извлекают иглу,
отверстие обрабатывают анестетиком
и закрывают стерильным материалом.
Применяют для эндолюмбальной анестезии: совкаин 1% 0,3-0,9 мл; новокаин 5% 2,0 мл. Раньше применяли и
дикаин 0,25% 1,5 мл. Да и сейчас при
эпидуральной анестезии, если случайно проколота твердая мозговая оболочка и введен дикаин, он действует
подобно эндолюмбальной анестезии.
После окончания введения в субарахноидальное пространство анестетика больного необходимо уложить
на операционном столе так, чтобы раствор анестетика не распространился на
вышерасположенные отделы спинного
мозга (рис. 68, б), к продолговатому
мозгу и не вызвал паралич сосудодвигательного и дыхательного центра, т. е. не привел к гибели больного.
Учитывая, что удельная плотность
ликвора составляет 1,007, а 2 и 5% новокаина — значительно выше, голову
больного необходимо приподнять, а
ноги опустить. Тем самым раствор новокаина будет опускаться к крестцу, и к
Тема 8
продолговатому мозгу не попадет. Растворы совкаина и дикаина имеют меньшую плотность, поэтому во избежание
всплытия их к продолговатому мозгу
головной конец стола опускают. Длительность анестезии при новокаине 1-2
часа, совкаине 2-3 часа и дикаине 5 часов. Поэтому, в зависимости от предполагаемой длительности операции, применяют тот или иной анестетик.
Течение эндолюмбальной анестезии делят на три стадии. В первой стадии сразу после введения анестетика у больного появляется чувство
теплоты («жара») в ногах. Затем выпадает болевая чувствительность, за ней
температурная и тактильная. Эта стадия
у разных больных длится от 3 до 20 минут. Тактильная чувствительность иногда сохраняется долго, поэтому больные ощущают прикосновение. Вначале
чувствительность выпадает на промежности, затем на нижних конечностях и
после этого на более высоком уровне
до места произведенной пункции. Исчезают также кожные и сухожильные
рефлексы. Мышцы теряют свой тонус и
появляется их релаксация.
Вторая стадия наступает через
10-15 минут и продолжается до окончания действия анестетика. В этот период
наступает полная анестезия и расслабление мышц, выполняется хирургическое вмешательство. Релаксация мышц
является положительным моментом,
облегчающим выполнение операции.
Третья стадия связана с окончанием действия обезболивания. Происходит восстановление движений,
чувствительности и рефлексов в обратном порядке. Сначала восстанавливаются движения, затем тактильная и болевая чувствительность. Длительность
стадии 20-30 минут.
Осложнения при эндолюмбальной анестезии могут быть: 1) в процес-
се выполнения; 2) в процессе обезболивания; 3) поздние осложнения.
Во время выполнения анестезии может сломаться игла; может
появиться капля крови, что связано с
проколом венозного сплетения; при
пункции выше 2-го поясничного позвонка может быть поврежден иглой
спинной мозг или корешки мозга и
развиться соответствующие изменения
(паралич и др.). Иглу необходимо вводить медленно, и эти образования будут отодвигаться вследствие короткого
среза на игле Бира. Иногда у пожилых
людей из-за склероза связок после извлечения иглы на месте прокола образовавшийся канал может не спадаться,
вследствии этого происходит вытекание спинномозговой жидкости, что может служить воротами попадания инфекции и причиной неврологических
расстройств. В некоторых случаях (от
3 до 5%) эндолюмбальная анестезия
вообще не наступает, что может быть
связано с выхождением иглы из суб
арахноидального пространства. При
слишком длинном срезе кончика иглы
часть его может находиться в субарахноидальном пространстве, а часть — в
эпидуральном, и поэтому спинномозговая жидкость может вытекать из иглы,
и анестетик частично или весь попадает в эпидуральное пространство.
В процессе обезболивания в любой стадии анестезии могут возникнуть следующие осложнения: а) падение артериального давления вплоть
до коллапса, что может быть связано с
действием самой анестезии на симпатическую нервную систему. Необходимо
до операции, как указано выше, ввести
кофеин или эфедрин; во время операции должна быть подключена система
для внутривенного введения растворов,
противошоковых кровезаменителей.
Для централизации кровообращения
185
можно поднять и бинтовать нижние
конечности; б) при распространении
анестетика на грудной отдел спинного
мозга возможна анестезия передних корешков спинного мозга и выключение
межреберных мышц и диафрагмы, что
приводит к дыхательной недостаточности или остановке дыхания. Необходима оксигенация или искусственная
ветиляция легких с интубацией; в) при
неправильном положении больного и
распространении анестетика к продолговатому мозгу может наступить расстройство кровообращения и дыхания
даже с развитием клинической смерти,
что требует немедленной интубации
и искусственной вентиляции легких и
проведения всех реанимационных мероприятий; г) может появиться тошнота, рвота, холодный пот, бледность
кожных покровов, связанные с нервнорефлекторными воздействиями. Они
вскоре проходят самостоятельно.
Поздние осложнения: а) гнойный
менингит; б) двигательные параличи и
парезы (диплопия, косоглазие) на срок
1-2 месяца и более; в) менингизм вследствие раздражения мозговых оболочек
йодом, детергентами, металлами и др.
(головная боль, тошнота, рвота, сонливость, повышение температуры) или
при длительном истечении спинномозговой жидкости через место пункции;
г) постпункционные изменения: головные боли, которые иногда сопровождаются тошнотой, рвотой, даже длительное время нарушением равновесия. Все
перечисленное ограничивает применение эндолюмбальной анестезии. В настоящее время более широко используют эпидуральную анестезию.
ЭПИДУРАЛЬНАЯ АНЕСТЕЗИЯ
Эпидуральная анестезия (перидуральная, экстрадуральная) относится
к регионарной местной анестезии. Она
186
Текстовый модуль 3
предложена французскими врачами
А. Сикадом (A. Sicard) и Ф. Кателином
(F. Cathelin) в 1901 году. Только после
работ Ф. Паже (F. Pages, 1920) и Дольотти (A.M. Doliotti, 1925) получила
практическое распространение.
Эпидуральная анестезия основана на блокаде спинномозговых нервов
и их корешков раствором местного
анестетика, введенного в эпидуральное пространство, находящееся между
твердой мозговой оболочкой и надкостницей спинномозгового канала позвоночника (рис. 69). Это узкая щель,
в которой находятся клетчатка, сосуды
и через нее проходят корешки спинного мозга и нервы. Поэтому анестетик и
вызывает их блокаду.
Показания. Эпидуральная анестезия является отличным способом
обезболивания операций на нижних
конечностях. Обеспечивая полное
обезболивание, расслабление муску-
А
Тема 8
латуры и минимальную кровоточивость, этот метод создает оптимальную экспозицию операционного поля.
Эпидуральная анестезия может быть
использована при различных внутрибрюшных, гинекологических, урологических и проктологических вмешательствах, при операциях на брюшной
стенке и нижних конечностях, а также
как компонент обезболивания в торакальной хирургии. Показана у больных
с «высокой степенью риска», при сопутствующих заболеваниях сердечнососудистой и дыхательной систем, эндокринных нарушениях, в пожилом
и старческом возрасте, в экстренной
анестезиологии. Применяется для послеоперационного обезболивания, лечения динамической непроходимости
Б
Рис. 69. Эпидуральное пространство и положение иглы при его пункции:
А — эпидуральное пространство, анатомические слои: 1 — кожа; 2 — подкожная жировая клетчатка; 3 —
надостистая связка; 4 — межостистая связка; 5 — желтая связка; 6 — эпидуральное пространство; 7 —
твердая мозговая оболочка; 8 — остистый отросток.
Б — взаимоотношение эпидурального и субарахноидального пространства: 1 — эпидуральное простран
ство; 2 — субарахноидальное пространство; 3 — игла в эпидуральном пространстве; 4 — игла в субарах
ноидальном пространстве
кишечника, острого панкреатита, периферических сосудистых и неврологических расстройств, для обезболивания родов.
Практическая безопасность эпидуральной корешковой блокады, достаточной для обезболивания органов
таза, превосходное расслабление брю
шного пресса и тазового дна объясняют
широкое распространение проводникового обезболивания в оперативной
гинекологии. Отсутствие токсического
влияния на плод, расслабление мускулатуры шейки матки и влагалища
оправдывает применение метода при
акушерских операциях. Эпидуральная
анестезия широко распространена в
урологической практике.
Длительной эпидуральной анестезией пользуются в лечебных целях при
поражениях периферических сосудов
нижних конечностей. Благодаря тому,
что симпатические волокна обладают наибольшей чувствительностью к
местным анестетикам, применяя 2%
раствор новокаина, можно получить
избирательный симпатический блок
без чувствительного и двигательного
паралича (Sarnoff, Arrwood).
Противопоказания почти такие
же, как и при эндолюмбальной анестезии, т. е.:
1. низкое артериальное давление;
2. кровотечение;
3. тяжелый травматический шок;
4. операции на черепе, шее;
5. наличие опухоли головного и спинного мозга;
6. внутричерепное или внутриспинальное кровоизлияние;
7. менингит, энцефалит;
8. тяжелая интоксикация при перитоните и сепсис, сопровождающиеся
гипотензией;
9. воспалительные поражения кожи
спины;
187
10. костная деформация позвонков;
11. у больных с психическими заболеваниями и при возбуждении;
12. во время психозов различного происхождения;
13. у детей младшего возраста.
Инструментарий: обычная тонкая игла длиной 8-10 см, игла Бира
или иглы с боковым расположением
среза типа Туохи (T.B. Tuohy) толщиной 1,5-2,0 мм, шприцы «Рекорд»
емкостью 5 и 10 мл, катетеры силиконовые диаметром 0,9-1,2 мм, длиной
60-80 см.
Анестезирующие средства. Используют лидокаин 0,75%-20 мл, 3%
раствор тримекаина — 60-80 мл, и 0,3%
раствор дикаина (1:300) — 20-25 мл.
В последние годы за рубежом нашли
применение новые анестезирующие
средства — мепивакаин, бупивакаин.
Техника эпидуральной анестезии. Больному, находящемуся в положении как для спинномозговой анестезии, выбирают место пункции.
Эпидуральная анестезия может
быть выполнена на всем протяжении
позвоночного столба, так как эпидуральное пространство не сообщается с
субарахноидальным, но выбор уровня
для ее проведения зависит от области
хирургического вмешательства. При
торакальных операциях это Th5-7, верхнеабдоминальных — Th5-11, нижнеабдоминальных — Th12 — L2, при операциях
на органах малого таза, промежности и
нижних конечностях — L2-5.
Обрабатывают кожу антисептиками, анестезируют ее и прилежащие
ткани на месте, где будут произведена
пункция. Затем берется шприц с изотоническим раствором хлорида натрия и
пузырьком воздуха в 3-4 мл. Пункция
производится иглой, одетой на шприц.
Вкалывается в сагиттальном направлении с наклоном книзу, угол которого
188
Текстовый модуль 3
зависит от уровня прокола и направления остистых отростков, как при эндолюмбальной анестезии. После прокола
кожи игла проходит клетчатку, lig. supraspinale, lig. interspinale, lig. flavum,
во втором — подкожную клетчатку и
lig. flavum. При продвижении иглы надавливают на поршень. При этом ощущают сопротивление, и происходит
деформация пузырька воздуха. После
прокола указанных слоев игла попадает в эпидуральное пространство и
сопротивление исчезает. Физиологический раствор свободно поступает в
эпидуральное пространство, исчезает
деформация пузырька воздуха (Dogliо
tti), из павильона иглы не вытекает
жидкость, а втягивается в просвет иглы
(Guttierez). Кроме того, при подключении к игле водного манометра давление
в эпидуральном пространстве будет отрицательным. Техника продленной
эпидуральной анестезии предусматривает последующее введение катетера
через иглу, на несколько позвонков
вверх или вниз.
Перед введением анестетика нужно убедиться, что из иглы не поступает
спинномозговая жидкость, так как повреждение твердой мозговой оболочки
и введение анестезирующих препаратов
в полном объеме в субарахноидальное
пространство чревато тяжелейшими
осложнениями. С этой целью выше
указанные растворы анестетиков вводят не одномоментно, а фракционно по
5,0 мл. Первое введение является тестдозой. Если не наступило обезболивание, а появились только парастезии, то
через 5 минут вводят следующую дозу,
и так до введения остального количества анестетика. У больного полная
анестезия и релаксация мышц развивается постепенно, на что уходит до
20-30 мин. Если же при введении тестдозы анестезия наступила быстро в
Тема 8
течении нескольких минут, то, вероятно, игла проколола твердую мозговую
оболочку и препарат введен субарахноидально, т. е. выполнена эндолюмбальная анестезия и больше вводить
анестетик нельзя. Длительность эпидуральной анестезии составляет от 1,5 до
6 часов в зависимости от использованного препарата.
При продленной эпидуральной
анестезии анестезирующий раствор
вводят через катетер, который сохраняют в эпидуральном пространстве до
нескольких суток.
В связи с тем, что при эпидуральной анестезии анестетик распространяется вверх и вниз по эпидуральному
пространству и имеет четко выраженный сегментарный характер обезболивания (рис. 70), уровень пункции имеет
первостепенное значение.
Рис. 70. Сегментарное обезболивание
при эпидуральной анестезии
Физиологический эффект эпидуральной анестезии представляет собой
суммарный результат одновременного
выключения чувствительных, двигательных и симпатических волокон в
зоне иннервации блокированных корешков.
Существенной особенностью эпидуральной анестезии является блокада
проходящих в составе передних корешков преганглионарных симпатических волокон. Низкая анестезия, блокирующая крестцовые и поясничные
сегменты, не оказывает влияния на
симпатическую иннервацию, так как
симпатический аппарат спинного мозга располагается между VII шейным и
II поясничным сегментами. По мере
подъема раствора анестезирующего
вещества выключаются корешки, несущие симпатические нервные волокна. Блокада до уровня Th10 выключает
n. splanchnicus minor, распространение
анестезии до уровня Th5 выключает
n. splanchnicus mayor. При этом развивается парез сосудов брюшной полости, таза, забрюшинного пространства
и нижних конечностей, приводящий к
ортостатическому перераспределению
крови, уменьшению объема циркулирующей крови (ОЦК), снижению артериального давления.
В 5-10% случаев анестезия не наступает, что может быть связано с
введением недостаточной дозы анестетика, или введением его за пределы
эпидурального пространства (но не в
субарахноидальное), или при наличии
перемычек, ограничивающих распространение анестетика.
Осложнения
1. Выраженная гипотония встречается в 2-5% случаев.
2. Тяжелые расстройства дыхания
и кровообращения (0,1-0,3%) могут
189
быть: а) при нераспознанном проколе
твердой мозговой оболочки и субарахноидальном введении всей дозы
анестетика; б) при распространенной
эпидуральной блокаде вследствие относительной или абсолютной передозировки анестезирующего раствора.
Помощь заключается в применении
искусственной вентиляции легких,
введении вазопрессоров, коррекции
гиповолемии. Предупреждение этих
осложнений связано с обязательным
применением тест-дозы и постоянным
контролем за состоянием больного.
3. К осложнениям можно отнести
гематомы в эпидуральном пространстве, инфицирование с развитием эпидурита.
4. Токсические реакции и неврологические осложнения отмечаются
редко.
Разновидностью эпидуральной является каудальная анестезия.
В этом случае раствор анестетика
вводится в дистальную часть эпидурального пространства через hiatus
canalis sacralis. Анестезию выполняют
в положении больного на боку. Иглу
с мандреном вводят в канал на глубину 2-3 см под углом 450 к поверхности
кожи. Извлекают мандрен и проверяют
правильность нахождения иглы в эпидуральном пространстве. После этого
медленно вводят раствор анестетика,
который распространяется до I поясничного позвонка и анестезирует все
пояснично-крестцовые сегменты. Для
анестезии применяют те же препараты,
что и для обычной эпидуральной анестезии.
Тяжелым осложнением этого вида
обезболивания является инфицирование экстра- и субдурального пространства, для предупреждения которого
необходимо строго соблюдать правила
асептики и антисептики.
190
Текстовый модуль 3
Тема 8
ВЫБОР МЕТОДА
ОБЕЗБОЛИВАНИЯ
Выбор метода обезболивания проводится анестезиологом по согласованию с хирургом. Учитывается много
факторов, которые могут служить риском в каждом конкретном случае обезболивания, наркоза: не должны быть
опаснее самого заболевания и характера операции, должны снять у больного
страх и боль во время вмешательства,
а хирургу обеспечить благоприятные
условия для выполнения операции.
При оценке риска обезболивания и
риска операции учитывается наличие
аллергии, возраста больного, состояние больного, состояние его основных
жизненно важных органов и систем,
характер заболевания, его проявлений, характер и особенности действия
наркотического препарата, объем и тяжесть хирургического вмешательства.
Имеются различные способы оценки операционного риска и наркоза, но
все они учитывают вышеприведенные
моменты. Ниже приводятся некоторые
из них (табл. 5).
Имеются и другие, более сложные
способы определения степени операционного риска, которыми пользуются
отечественные анестезиологи с учетом
физического состояния больного, тяжести оперативного вмешательства
(В.А. Гологорский, 1982; Московское
Таблица 5. Оценка факторов операционного риска в баллах по Н.Н. Малиновскому с соавт., 1973
РИСК: незначительный 1 степени (1,5-2,0 балла); 2 степени (2,5-3,0 балла); значительный 3 степени
(3,5-5,0 баллов); 4 степени (5,5-6,5 баллов); крайний 5 степени (7,0-9,5 баллов)
Объем
операции
Баллы
Небольшой:
Грыжа, аппендицит
1
Умеренный:
Холецистит,
резекция желудка
Значительный:
Гастрэктомия,
пневмонэктомия
Особые условия операции,
повышающие
риск операции (применение искусственного
кровообращения – АИК)
Хирургическая
БалСопутствующие
патология
лы
заболевания
Неосложненная хроническая патология,
Заболевания в основном
0,5
доброкачественные
функциональные
опухоли
2
Неосложненная
острая патология,
злокачественные
опухоли
3
Осложненная хирургическая патология
(калькулезный холецистит с желтухой)
4
Крайне тяжелая
осложненная хиругическая патология
(рак с выраженной
анемией, интоксикацией)
Баллы
Возраст
годы
Баллы
0,5
Молодой,
средний
(до 50 лет)
0,5
1
Заболевания с органическими и фунциональными нарушениями
(ИБС, стенокардия)
1
Переходный
(51 – 59
года)
0,5
1,5
Органические заболевания со стойкой декомпенсацией (гипертония
3 ст.)
1,5
Пожилой
(70 – 74
года)
1
2
Сочетание общих органических изменений
со стойкими функциональными нарушениями
(тяжелая форма диабета, постинфарктный
кардиосклероз с недостаточностью кровообращения)
2
Старческий
(75 – 89
года)
1,5
общество анестезиологов, 1989); и в
дальнем зарубежье, например, по решению Американской ассоциации анестезиологов, представленному ниже.
Физическое состояние больного.
1. Больные без органических заболеваний или с локализованным заболеванием без системных расстройств.
2. Больные с легкими или умеренными системными расстройствами,
которые связаны с хирургическим
заболеванием и умеренно нарушают
нормальную жизнедеятельность и
общее физиологическое равновесие.
3. Больные с тяжелыми системными
расстройствами, которые связаны
или не связаны с хирургическим
заболеванием, и в значительной
степени нарушающими жизнедеятельность.
4. Больные с крайне тяжелыми системными расстройствами, которые связаны и не связаны с хирургическим заболеванием и резко
нарушают нормальную жизнедеятельность, становясь опасными для
жизни.
5. Больные, предоперационное состояние которых настолько тяжелое, что можно ожидать их смерти
в течение 24 часов даже без дополнительного воздействия операции.
Тяжесть оперативного вмешательства.
А. Малые операции на поверхности
тела и полостных органах:
а) удаление поверхностно расположенных доброкачественных и злокачественных опухолей;
191
б) вскрытие небольших гнойников;
в) ампутации пальцев кистей и
стоп;
г) неосложненные аппендэктомии
и грыжесечения;
д) перевязка и удаление геморроидальных узлов.
Б. Операции средней тяжести на поверхности тела и полостных органах:
а) удаление поверхностно расположенных злокачественных опухолей,
требующих расширенного вмешательства (например, на молочной железе);
б) вскрытие гнойников, расположенных в полостях (эмпиема плевры,
межкишечные и аппендикулярные абсцессы и др.);
в) ампутации сегментов верхних и
нижних конечностей;
г) операции на периферических сосудах;
д) осложненные аппендэктомии и
грыжесечения, требующие расширенного вмешательства;
е) пробные лапаротомии и торакотомии.
В. Обширные хирургические вмешательства:
а) радикальные операции на органах брюшной полости (кроме перечисленных выше);
б) радикальные операции на органах грудной клетки;
в) расширенные ампутации конечностей (например, чрезподвздошно
крестцовая ампутация нижней конечности).
Г. Операции на сердце и крупных сосудах.
Д. Экстренные оперативные вмешательства.
(Обозначения цифрами 1а, 4б и т.д.
Экстренные + Д-1 АД).
192
Текстовый модуль 3
Классификация операционноанестезиологического риска
(принята Московским обществом
анестезиологов и реаниматоров
в 1989 г. и выражается в баллах
по трем критериям).
І. Оценка общего состояния
больных.
Удовлетворительное (0,5 балла):
соматически здоровые пациенты с локализованными хирургическими заболеваниями без системных расстройств
и сопутствующих заболеваний.
Средней тяжести (1 балл): больные
с легкими или умеренными системными расстройствами, связанными или
не связанными с основным хирургическим заболеванием.
Тяжелое (2 балла): больные с выраженными системными расстройствами,
которые обусловлены или не обусловлены хирургическим заболеванием.
Крайне тяжелое (4 балла): больные
с крайне тяжелыми системными расстройствами, которые связаны или не
связаны с хирургическим заболеванием и представляют опасность для жизни больного без операции и во время
операции.
Терминальное (6 баллов): больные
в терминальном состоянии с выраженными явлениями декомпенсации
функции жизненно важных органов и
систем, при котором можно ожидать
смерти во время операции или в ближайшие часы без нее.
ІІ. Оценка объема и характера
операции.
Малые полостные или небольшие
операции на поверхности тела (0,5
балла).
Более сложные или длительные
операции на поверхности тела, позвоночнике, нервной системе и операции
на внутренних органах (1 балл).
Тема 8
Обширные или продолжительные
операции в различных областях хирургии, нейрохирургии, урологии, травматологии, онкологии (1,5 балла).
Сложные или продолжительные
операции на сердце, крупных сосудах
(без применения ИК), а также расширенные и реконструктивные операции в
хирургии различных областей (2 балла).
Сложные операции на сердце и магистральных сосудах с применением
ИК (искусственное кровообращение) и
операции по пересадке внутренних органов (2,5 балла).
ІIІ. Оценка характера анестезии.
Различные виды местной потенцированной анестезии (0,5 балла).
Регионарная,
эпидуральная,
спинномозговая, внутривенная или
ингаляционная анестезия с сохранением спонтанного дыхания или с кратковременной вспомогательной вентиляцией легких через маску наркозного
аппарата (1 балл).
Обычные стандартные варианты наркоза с использованием ингаляционных, неингаляционных или немедикаментозных средств анестезии (1,5
балла).
Комбинированный
эндотрахеальный наркоз с применением
ингаляционных,
неингаляционных
анестетиков и их сочетаний с методами регионарной анестезии, а также специальных методов анестезии
и корригирующей интенсивной терапии (искусственная гипотермия,
инфузионно-трансфузионная терапия,
управляемая гипотония, вспомогательное кровообращение, электрокардиостимуляция и др.) (2 балла).
Комбинированный эндотрахеальный наркоз с использованием ингаляционных и неингаляционных анестетиков в условиях ИК, ГБО и др. при
193
комплексном применении специальных методов анестезии, интенсивной
терапии и реанимации (2,5 балла).
5. можно ожидать смерти больного
в течение 24 часов после операции
или без нее (moribund).
Степень риска:
І степень (незначительная) — 1,5
балла;
ІІ степень (умеренная) — 2-3 балла;
ІІІ степень (значительная) — 3,5-5
баллов;
IV степень (высокая) — 5,5-8 баллов;
V степень (крайне высокая) — 8,5-11
баллов. При экстренной анестезии допустимо повышение риска на 1 балл.
С учетом экстренных операций
эта классификация расширяется, включая еще две градации:
6. больные 1-2 категорий физического статуса, оперируемые в экстренном порядке;
7. больные 3-5 категории, оперируемые в экстренном порядке.
1.
2.
3.
4.
Риск наркоза АsА по физическому состоянию больных.
Для плановой анестезиологии:
практически здоровые пациенты;
легкие заболевания без нарушения
функций;
тяжелые заболевания с нарушением функций;
тяжелые заболевания, которые в
сочетании с операцией или без нее
угрожают жизни больного;
Физическое состояние больного
является важнейшим фактором риска,
влияющем на конечный результат хирургического лечения больного. По
данным специальных компьютерных
исследований, в ближайшие 7 суток после операции летальность прогрессивно возрастает от 1-ой до 5-ой категории
физического статуса, достигая более
чем 80-кратного увеличения. Поэтому
определение риска операции и наркоза
перед вмешательством является обязательным с записью в историю болезни
больного.
Контрольные вопросы по теме занятия
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Что такое местная анестезия?
Как классифицируются все виды местной анестезии?
Какие препараты применяются при местной анестезии?
Когда впервые была предложена местная анестезия?
Противопоказания для местной анестезии.
Какие существуют виды блокад?
Как выполняется инфильтрационная местная анестезия методом тугого ползучего инфильтрата по А.В. Вишневскому?
Как выполняется проводниковая анестезия?
Когда и как выполняется короткий новокаиновый блок?
Какие могут быть осложнения при местной анестезии?
Кто впервые предложил выполнять эндолюмбальную и эпидуральную анестезию?
Где находится эпидуральное пространство?
Как правильно технически выполнить эндолюмбальную анестезию?
194
Текстовый модуль 3
14.
15.
16.
17.
18.
Какие клинические проявления эндолюмбальной анестезии?
Какие препараты и их дозы применяются при эндолюмбальной анестезии?
Какие препараты и их дозы применяются при эпидуральной анестезии?
Как выполнить эпидуральную анестезию?
Какое должно быть положение больного на операционном столе после выполнения эндолюмбальной и эпидуральной анестезии?
19. Какие противопоказания существуют при эндолюмбальной и эпидуральной анестезии?
20. Какие могут быть осложнения при эндолюмбальной и эпидуральной анестезии и
их профилактика?
21. В чем заключается операционный риск, его характеристика?
ТЕКСТОВЫЙ МОДУЛЬ 4
Травматизм и повреждение
ТЕМА №9.
Понятие о травматизме. Классификация травм. Повреждения мягких тканей. Травматический шок. Синдром длительного сдавления, позиционный синдром
1. Актуальность темы.
Учитывая социальные, экономические и технические сложности, которые
переживает наше государство, возросло
число больных с травмами различного
происхождения, локализации и степени тяжести. Общеизвестно, что такая
группа больных требует особого внимания с момента получения травмы и
оказания первой помощи в целях профилактики осложнений и утяжеления
состояния больного.
■
■
■
■
■
■
2. Учебные цели.
Понятие о травме, травматологии,
травматизме, травматическом шо
ке, синдроме длительного раздавли
вания;
Классификация травмирующих факторов;
Классификация повреждений мягких
тканей, их причины, клиническая
картина, дифференцировка;
Травматический шок, синдром длительного сдавления, клиническая
картина при данной патологии;
Виды медицинской помощи;
Дифференциальная диагностика видов травматических повреждений;
■
■
■
■
Оказание первой помощи пострадавшим с травмами;
Выполнение транспортной иммобилизации при помощи различных
видов как специальными, так и подручными средствами;
Особенности транспортировки пострадавших с повреждениями мягких тканей, позвоночного столба.
Оказание медицинской помощи пострадавшим с травмами.
3. Самостоятельная
работа студентов
Травмой (греч. Trauma — повреждение) называется одномоментное воздействие внешнего фактора, вызывающее в тканях местные анатомические и
функциональные нарушения, сопровождающиеся общими реакциями организма.
Травматология — наука о травмах.
Травматизм — совокупность травм
на определенной территории (в стране,
городе) или среди определенного контингента людей (в сельском хозяйстве,
на производстве, в спорте). Травматизм
разделяют на производственный и
непроизводственный. Такое деление
196
Текстовый модуль 4
имеет важный социальный и юридический аспекты. Если непроизводственный травматизм является в какой-то
мере несчастьем пострадавших, то при
производственной травме определенную долю вины несет предприятие,
организация, где травма произошла.
Производственный травматизм обычно является следствием несоблюдения
на предприятии правил техники безопасности. Поэтому руководство производства может получать серьезные
административные и материальные
взыскания. Кроме того, предприятие в
большинстве случаев полностью оплачивает расходы по лечению пострадавшего, выплачивает специальную пенсию и компенсацию.
О важности лечения пациентов
свидетельствуют следующие факты. Травматизм делит с онкологическими заболеваниями 2-3-е место
в общей структуре летальности (на
первом месте — смертность от заболеваний сердечно-сосудистой системы). Травматизм занимает 3-е место
среди причин нетрудоспособности.
У мужчин травмы встречаются вдвое
чаще, чем у женщин, а у мужчин моложе 40 лет занимают 1-е место в
структуре общей заболеваемости. До
8-10% пациентов с травмами нуждаются в госпитализации. Частота
травм значительно выше у лиц, страдающих алкоголизмом.
При травме причиной происходящих в организме изменений является
воздействие внешнего фактора. Характер этого фактора может быть различным:
■ Механическая сила;
■ Высокая или низкая температура
(термический фактор);
■ Электрический ток;
■ Радиоактивное излучение;
■ Химические вещества.
Тема 9
■
■
■
■
■
■
■
■
РАЗЛИЧАЮТ ТРАВМАТИЗМ:
промышленный
сельскохозяйственный
уличный
бытовой
детский
спортивный
авиационный
железнодорожный
1. Промышленный
травматизм
Под промышленным травматизмом принято понимать повреждения,
возникающие в условиях производственного труда на промышленных
предприятиях. Чаще такие повреждения открытые.
Характер травм зависит от вида
производства. Так, в металлургической
и химической промышленности часто
встречаются ожоги. Для точного выявления причин каждой травмы представителем администрации, с участием
бригадира или мастера, производится
расследование, как правило, в присутствии врача и инженера по технике
безопасности. Составляется акт о несчастном случае и сигнальное извещение для отдела техники безопасности и
медико-санитарной части.
Все случаи промышленной травмы
разбираются на производственных совещаниях рабочих цеха, а в отдельных
случаях — на заседаниях завкома в присутствии главного инженера завода.
Промышленный травматизм относительно легко поддается профилактике.
Первая помощь при промышленных травмах оказывается на месте происшествия (в цехе у станка) в порядке
само- и взаимопомощи. В каждом цехе
имеется санитарный пост.
Санитарный пост должен иметь:
носилки для тяжело пострадавших,
аптечку первой помощи, санитарную
сумку.
В шкафчике должна находиться памятка по оказанию первой помощи.
При поражении эл. током в цехах
рекомендуется иметь рядом с аптечкой
набор приспособлений для безопасности освобождения пострадавшего от
действия током. Набор должен состоять из резиновых перчаток, резиновых
бот или сапог, резинового коврика и
щипцов-кусачек с длинными деревянными или эбонитовыми ручками для
перерезки электропроводов.
Следующим этапом для оказания
помощи на промышленном предприятии является здравпункт.
На крупных предприятиях создаются врачебные амбулатории, поликлиники или медико-санитарные части.
2. Сельскохозяйственный
травматизм
Он составляет примерно 30% всех
видов травм и около 5% всех заболеваний на селе. Он имеет свои особенности:
■ сезонность;
■ частая возможность загрязнения открытых повреждений землей и навозом и, следовательно, опасность
развития анаэробной инфекции и,
главным образом, столбняка.
Для с/хозяйственного травматизма
характерны нетяжелые повреждения —
80-85%. Эти травмы не сопровождаются утратой трудоспособности и лишь
около 9% пострадавших нуждаются в
госпитализации. Встречаются типичные травмы для с/х травматизма: от
удара ручкой трактора.
Первая помощь:
Такая же, как и при промышленном
травматизме, но имеются свои особенности:
■ разбросанность отдельных бригад
и звеньев;
197
отдаленность медицинских учреждений от места получения травмы;
■ сезонность.
Первую помощь оказывают, как
правило, санпосты, которые должны
быть организованы в каждой полевой
тракторной бригаде, на животноводческих фермах, на полевых станах, в
ремонтных мастерских. Контроль и наблюдение за работой санпостов возлагается на фельдшерские и фельдшерскоакушерские медпункты.
После оказания первой помощи пострадавший направляется в медпункт,
который на селе возглавляется фельдшером. На ФАП допускается лечение
больных, утративших трудоспособность до 7 дней.
Предусматривается иметь в медпункте 1-2 ампулы полиглюкина для
переливания при острой кровопотере.
Следующим этапом в оказании помощи является участковая больница.
Вводится ПСС. Проводятся противошоковые мероприятия, и, если больной нуждается в специализированной
помощи, то он направляется в районную больницу, где оказывается окончательная квалифицированная помощь,
а сейчас и специализированная. Деятельность районной больницы контролируется областной больницей.
■
3. Уличный травматизм
Это наиболее тяжелый вид травматизма.
Его принято делить на 2 группы:
1. Травмы, причиненные транспортом
(автомобильные, трамвайные и др.);
2. Травмы, обусловленные неблагоустройством тротуаров, плохое
ограждение траншей и котлованов.
Причинами транспортного травматизма являются: несоблюдение правил
уличного движения, недостаточная
подготовка шоферов, дефекты сигна-
198
Текстовый модуль 4
лизации и недостатки в планировании
крупных городов.
Транспортный травматизм отличается значительной тяжестью. Очень
часто наблюдаются множественные и
комбинированные травмы. Чаще всего
повреждаются нижние конечности и
голова (75% всех уличных травм). При
этом травматизме больничная летальность составляет 6%, инвалидность 1-2
группы — 3%, смерть на месте происшествия — 7%.
В оказании первой помощи должны принимать участие ближайшие медицинские учреждения. Крайне желательно оказать первую помощь еще до
прибытия «скорой помощи». Для этого
обучаются милиция, водители автомашин и т. д.
4. Бытовая травма
К ним относятся повреждения,
главным образом связанные с условиями быта. По данным различных авторов, бытовые травмы в различные годы
составляли от 6 до 72% всех травм. До
20% бытовых травм прямо или косвенно связаны с алкоголизмом.
Особенность бытового травматизма — преобладание легких травм. 92%
пострадавших не нуждаются в госпитализации, только 8% доставляется в
стационары.
Особую группу травм составляют
травмы, связанные с укусом домашних
животных, змей. Первая помощь оказывается в порядке само- и взаимопомощи с последующей доставкой пострадавшего в ближайшую поликлинику, а
в тяжелых случаях в стационар. Профилактика травматизма связана с улучшением быта, борьбой с алкоголизмом.
5. Детский травматизм
Травмы у детей встречаются от 20
до 30% всех бытовых повреждений.
199
Тема 9
Детский травматизм имеет анатомофизиологические особенности, что
приводит к некоторым специфическим
особенностям повреждений. У детей
часто возникает эпифизеолиз, поднад
костничный перелом, реже вывих.
Проведение всевозможных предупредительных мероприятий способствует
снижению детского травматизма.
6. Спортивный травматизм
Он среди других видов травм встречается от 2 до 5%. Среди этих травм
встречаются легкие повреждения (ссадины, ушибы, растяжения), чаще нижних конечностей, реже встречаются
переломы и вывихи.
Чаще встречается у мужчин (6175%).
Необходимо отметить, что каждому виду спорта характерны определенные повреждения. Так, травмы лица и
головы бывают у хоккеистов, верхних
конечностей — у гимнастов, нижних
конечностей — у футболистов.
У футболистов, баскетболистов и
гимнастов наиболее часто встречаются
повреждения крестообразных связок и
менисков.
У лыжников и конькобежцев часто
встречаются винтообразные переломы
костей голени и бедра, переломы лодыжек.
Мероприятия по профилактике
спортивного травматизма должны включать в себя:
■ правильно составленный план тренировочных занятий и соревнований;
■ врачебный контроль и отбор спорт
сменов;
■ контроль за санитарно-гигиеничес
ким и техническим соблюдением
норм занятий спортом;
■ правильная организация соревнований;
строжайший судебный контроль за
соблюдением правил соревнований
и тренировок;
■ постоянный медико-тренировоч
ный контроль;
■ проведение постоянной воспитательной и санитарно-просвети
тельной работы среди физкультурников;
■ контроль за здоровьем спортсменов;
■ обеспечение медицинской помощи
при травмах.
В профилактике спортивного травматизма имеется тесная взаимосвязь
■
организаторов спорта, врачей и преподавательского состава (табл. 6, 7).
7. Авиационный травматизм
К нему относятся повреждения, возникшие у летного, технического и вспомогательного персонала, а также у парашютистов при подготовке к прыжкам.
У технического персонала преобладают травмы правой кисти, ушибы
и переломы костей от ударов работающего винта самолета.
У летного состава встречаются переломы шейного отдела позвоночни-
Таблица 6. Локализация повреждений при различных видах травм
Локализация
Травматизм в %
Промышленный
Сельскохозяйственный
Спортивный
Уличный
Голова
3,5
13%
7,1
35,6
Глаза
10,0
-
-
-
Туловище
1,9
3,0
15,7
13,1
Верхние конечности;
из них пальцы и кисть
Нижние конечности
Не указана
ВСЕГО
57,3
39,3
15,9
11,4
100
57,1
25,5
0,9
100
32,5
44,7
100
11,4
39,9
100
Таблица 7. Характер повреждений при различных видах травматизма
Характер повреждений
Травматизм в %
Промышленный
Сельскохозяйственный
Спортивный
Уличный
Ранения
43,8
52,2
8,6
38,0
Ожоги
4,8
7,7
-
-
Отморожения
-
-
0,6
-
Ушибы и растяжения
15,5
18,4
73,1
16,8
Инородное тело в глазах
Переломы
Вывихи и растяжения
Ссадины
Прочие
ВСЕГО
17,1
0,5
0,3
17,4
0,6
100
1,9
0,5
19,3
100
11,0
4,0
3,7
100
35,9
1,7
7,6
100
200
Текстовый модуль 4
ка при катапультировании самолета.
Переломы верхних и нижних конечностей при неудачных посадках, разрыв
барабанной перепонки, ожоги лица,
кистей рук и туловища.
Травмы при парашютировании.
Часто встречаются переломы диафизов длинных трубчатых костей и позвоночника.
Профилактика
авиационного
травматизма должна включать:
■ организационно-техническую линию;
■ строгий контроль техники безопасности;
■ расследование обстоятельств каждого несчастного случая;
■ овладение навыками само- и взаимопомощи.
8. Железнодорожный
травматизм
Он выделен в особую группу ввиду
тяжести и массовости повреждений.
При нем очень часто бывают тяжелые
и комбинированные повреждения.
Классификация
травм мягких тканей
Все повреждения по механизму
возникновения делят на прямые и
непрямые в зависимости от соотношения места повреждения и точки приложения силы. Существует деление на
поверхностные, или кожные (ушиб,
рана), подкожные (разрыв связок,
мышц, вывихи, переломы) и полостные повреждения (разрывы и сотрясение внутренних органов).
В зависимости от сохранности
покровных тканей все травмы могут
быть закрытыми и открытыми.
Закрытые повреждения
мягких тканей
К закрытым повреждениям мягких тканей относятся:
Тема 9
■
■
■
■
ушиб;
растяжение;
разрыв;
сотрясение.
Ушиб (contusio)
Это тупая травма мягких тканей
или органов без нарушения целости покровов кожи или слизистых. Наиболее
часто этот вид повреждений отмечается на конечностях, так как последние
наименее защищены и являются наиболее активными в функциональном
отношении.
Механизм травмы самый разнообразный: падение, удар предметом и
т.д. Нужно учитывать, что ушибы часто
комбинируются с другими повреждениями, даже более тяжелыми. В то же
время и сами ушибы бывают различными по тяжести.
Последнее зависит от ряда моментов:
■ характера травмирующего агента,
быстроты его действия и др;
■ от вида тканей, ее физиологического состояния (напряжение, наполнение и др.).
Патологоанатомические изменения
в поврежденных тканях бывают самые
разнообразные: разрушение жировой
клетчатки, мышц, мелких сосудов. Последнее ведет к появлению кровотечения в мягкие ткани с образованием петехий, экхимозов или гематом.
При скользящих ушибах тупым
предметом может происходить отслойка кожи вследствие отделения ее
от фасции и апоневроза. В эту полость
изливается, как правило, не только
кровь, но и лимфа. Последняя может
накапливаться в больших количествах.
Клиника. Сопровождается появлением болей, кровоподтека, нарушением функции ушибленной области тела.
Очень скоро появляется припухлость,
которая появляется вследствие изменения сосудистых реакций, увеличения
проницаемости сосудистой стенки и
развития отека. При пальпации отмечается разлитая болезненность. Если
образовалась гематома или скопление
лимфы под отслоенной кожей, то выявляется флюктуация. При локализации кровоизлияний в подкожной клетчатке синюшное окрашивание кожи
появляется сразу после травмы, а если
кровь скапливается глубоко, то оно
появляется в течение нескольких дней
после травмы. При ушибе крупных нервов может развиться шок или паралич
области, иннервируемой этим нервом.
Диагностика обычно не представляет трудностей. Однако встречаются
и трудности. Так, при ушибе брюшной
стенки иногда трудно решить: имеется
ли повреждение внутренних органов?
А это требует оперативного вмешательства. При подозрении на гематому
в некоторых случаях делают пункцию
(лучше под контролем УЗИ).
Лечение. Проводится в определенной последовательности. Вначале после травмы необходимо добиться прекращения кровотечения и уменьшения
отека, т.е. сосудистых нарушений. С
этой целью больному назначается покой, желательно с возвышенным положением поврежденного участка и
прикладыванием холода (в течение 1-2
дней). После этого проводят лечение,
направленное на быстрейшее рассасывание. Для этого применяют тепло, согревающие компрессы, грелки, физиотерапевтические процедуры — солюкс,
кварц, парафин и др. При наличии гематомы — пункция с отсасыванием содержимого и введением антибиотиков.
На месте ушиба после рассасывания
образуется рубец. Функция обычно
восстанавливается полностью, но если
ушиб тяжелый с гематомой, отслойкой
201
кожи, располагающейся в области сустава, восстановление функции может
быть неполным из-за образовавшейся
контрактуры.
Растяжение (distorsio)
Это закрытая травма, сопровождающаяся частичным разрывом тканей.
Наиболее часто бывает растяжение
связок в области суставов, например,
голеностопного, коленного и др.
Механизм. Заключается в том, что
на ткань или орган действуют 2 разнонаправленные силы, или одна сила при
фиксированном другом конце образования. Происходит надрыв не только
отдельных волокон связок, но и других
анатомических образований, например, мелких сосудов. Образуются кровоизлияния, отек тканей.
Клиника. Появляется припухлость,
наступает нарушение функции. При
пальпации определяется болезненность,
особенно в области поврежденной связки, пассивные и активные движения
болезненны, отмечается некоторое повышение местной температуры.
Лечение. Заключается в создании
покоя и применении холода на 2-3 дня,
остановке кровотечения и уменьшении отека. Нужно наложить давящую
бинтовую повязку. Через 5-7 дней после травмы переходят к лечению гимнастикой, массажу, физиопроцедурам,
например, ионофорез с йодистым
калием, кварц, солюкс, УВЧ и др. На
месте надрывов связок образуются маленькие рубчики, функция, как правило, восстанавливается полностью.
Разрыв (ruptura)
Разрыв органа или ткани происходит при чрезмерном действии силы.
Это приводит, как правило, к одновременному повреждению сосудов с
последующим кровотечением. Отмеча-
202
Текстовый модуль 4
ются разрыв связок, мышц, сухожилий
и т. п.
При разрыве связок обычно происходит чрезмерное сгибание или разгибание сустава или же перерастяжение
боковых связок.
Симптомы. В области поврежденного сустава отмечаются боли.
Движение в нем резко ограничено или
полностью отсутствует. Иногда могут
определяться не свойственные данному суставу движения, например, в коленном суставе — боковые, «симптом
выдвижного ящика». Там, где имеются внутрисуставные мениски, может
быть повреждение последних. Сустав
имеет припухлость, сглаженные контуры. Разрыв связок сопровождается
часто кровоизлиянием в сустав, т. е.
гемартрозом. Наличие крови можно
определять с помощью флюктуации; в
коленном суставе с помощью симптома
«баллотирование надколенника». На
рентгенограмме можно иногда отметить некоторое расширение суставной
щели. В сомнительных случаях показана пункция сустава, во время которой
обнаруживается кровь.
Лечение. Необходим покой на
10-12 дней, а на некоторых крупных
суставах до 3 недель. Покой обеспечивается наложением шины или гипсовой повязки. Одновременно первые
2-3 дня назначают холод. За это время
наступает рассасывание кровоизлияний, иногда сращение связок. Полного
восстановления функции, как правило,
не наступает. Остается чрезмерная или
необычайная подвижность в суставе.
При наличии разрыва связок, важных в
функциональном отношении (крестовидная в коленном суставе и т. д.); сочетания полного разрыва с повреждением менисков требуется оперативное
лечение, которое заключается в восстановлении целости связок путем их
Тема 9
сшивания или пластики собственными
тканями, чужеродными или синтетическими (капроновая лента). Нужно при
этом отметить, что впервые восстановление связки из полоски широкой
фасции бедра предложил И.И. Греков,
а модифицировал М.И. Ситенко.
Для ликвидации гемартроза приходится делать пункции. После рассасывания крови, излившейся в ткани и сустав,
начинают осторожные движения в суставе. Нагрузку постепенно увеличивают, проводят массаж, физиопроцедуры.
Исход. Характеризуется тем, что
на месте разрыва образуется рубец.
Излившаяся кровь рассасывается или
организуется с образованием рубца
и сморщиванием суставной капсулы.
Это ведет к ограничению движений.
Изредка отделившиеся участки организующегося фибрина пропитываются солями и превращаются в свободно
расположенные инородные тела сустава, называемые «суставной мышью».
Последние могут попадать в различные
участки сустава, вызывая его «блок» и
болевой синдром.
Разрыв мышц
Полный или частичный разрыв
мышц происходит обычно при резких
чрезмерных движениях или прямой
травме тупым предметом.
Одновременно нарушается целостность суставов, что сопровождается
кровоизлиянием.
Клиника. Во многом близка с ушибом, т.е. имеется боль в области повреждения, которая может усилиться
при ходьбе, движении. Нарушения
функции бывают полные или частичные. Последние выявляются при неполном разрыве. В области повреждения
отмечается отечность, болезненность,
может быть синюшность кожного покрова. Иногда имеется деформация в
области разрыва мышц. Это выявляется вследствие сокращения и диастаза
(расхождения) краев поврежденных
мышц. Очень демонстративно последнее определяется при разрыве, например, двуглавой мышцы плеча (m. Biceps brachii).
Лечение. Консервативное может
проводиться только в случаях неполного разрыва мышцы. В первые 7-10 дней
создается покой поврежденного участка
с помощью шины или гипсовой повязки.
Для остановки кровотечения, уменьшения отека 1-2 дня назначается холод, а
затем проводится рассасывающая терапия (тепловые процедуры, физиотерапия — УВЧ, солюкс, кварц, процедуры
др.). После прекращения иммобилизации — ЛФК, массаж и др. Наиболее часто применяется оперативное лечение,
во время которого соединяются края
разорванной мышцы. В конце операции производят иммобилизацию на 2-3
недели, а затем восстановительную и
рассасывающую терапию.
Разрыв сухожилий
При резком сокращении мышц, во
время работы, поднятия тяжести, прямой травме и других факторах может
наступить разрыв сухожилий. Это повреждение может быть в любом отделе и наиболее часто в месте перехода
в мышцу или у места прикрепления к
кости. В последнем случае иногда сухожилие отрывается вместе с кусочком
кости (эпифиза).
Симптомы. Близки к разрыву
мышцы. В месте травмы будет сильная
боль, усиливающаяся при движении.
Последнее отсутствует в том участке, где функционирует эта мышца.
При этом выявляется преобладание
мышцы-антагониста. Так, если наступил разрыв сухожилия сгибателя,
то преобладает разгибатель, и наобо-
203
рот — при повреждении разгибателя
преобладает сгибатель. В области травмы отмечается болезненность, иногда
определяются разошедшиеся края сухожилия от сокращения мышц.
Лечение. Оперативное. Края сухожилий сшивают с помощью шелковых
или синтетических нитей. Если сухожилия проходят в синовиальных влагалищах, последние стремятся меньше
травмировать и даже восстановить.
Это предупреждает образование обширных рубцовых процессов, которые
могут служить причиной длительного
и стойкого нарушения функции. После
наложения шва на сухожилие требуется иммобилизация в функционально
выгодном положении с помощью гипсовых или шинных повязок примерно
на 2 недели. В дальнейшем проводят
лечебную гимнастику, тепловые, физиотерапевтические процедуры и др.
Разрыв фасции
Бывает при прямой травме тупым
предметом. В этой области выявляют
все симптомы ушиба и, кроме того,
пальпаторно может определиться дефект фасции, обычно щелевидной формы. При сокращении мышцы через это
отверстие выпячивается мышца. Такое
образование называется «мышечной
грыжей».
Лечение. Обычно оперативное, состоит в ушивании дефекта фасции.
Разрыв нерва
Наступает в большинстве случаев
при прямой травме тупым предметом,
ранении, как осложнение после перелома или вывиха.
Клиника. Проявляется нарушением его функции: потерей чувствительности, парезом или параличом мышц.
При диагностике необходимо знать
функцию нерва и зону иннервации.
204
Текстовый модуль 4
Нужно отметить, что изолированный
разрыв нерва бывает редко.
Лечение. Заключается в восстановлении его целости.
Во время операции выделяют концы нерва. Если последние размозжены,
то их оживляют после обезболивания
новокаином с помощью очень острого
скальпеля или лезвия. Шов накладывается за периневрий до соприкосновения краев. В настоящий момент применяют микрохирургическую технику,
сшивая отдельные пучки нерва.
После операции производят иммобилизацию на 2 недели и проводят восстановительную терапию: витамины
группы В, глютаминовая кислота, прозерин, массаж, ЛФК, физиопроцедуры,
электростимуляцию и др.
Регенерация нерва идет очень медленно, поэтому и функция мышц, чувствительность остается нарушенными
длительное время.
ТРАВМЫ могут приводить к разрыву сосудов, внутренних органов, таких как легкие, паренхиматозные и полые органы брюшной полости и другие
структурные образования организма
человека.
К повреждениям мягких тканей относятся сотрясения (commotio).
Сотрясения — это такие закрытые
повреждения, при которых не выявляется значительных морфологических
изменений.
В последнее время в связи с развитием техники большое значение придается вибрационной болезни, которая
возникает при длительной работе с
сильно вибрирующими механизмами.
Синоним этого названия — вибрационный ангионевроз. Болезнь относится к профессиональным заболеваниям.
Действие вибрации зависит от силы
и спектра вибрации, от длительности
Тема 9
непрерывного контакта в течение рабочей смены, рабочей площади тела,
соприкасающейся с вибрирующими
поверхностями или инструментами, от
состояния организма и индивидуальной чувствительности. Усиливают действие вибрации высокие уровни шума,
охлаждение, вынужденное положение
тела, мышечное напряжение и др.
Симптомы. Разнообразны и зависят от места приложения вибрации
и от ряда сопутствующих факторов.
В основе заболевания лежат рефлекторные воздействия вибрации на различные отделы периферической и
центральной нервной системы. Различают общее воздействие вибрации
(при колебании всего рабочего места,
пола, сидения) и местное, при передаче вибрации руками работающего с
ручным инструментом.
Вначале местное воздействие характеризуется различными функциональными расстройствами в виде спазма
капилляров пальцев руки, постепенно
захватывая кисть, которая проявляется
нарушением различных видов чувствительности (болевая, вибрационная, температурная). Вне приступов ангиоспазма
сосудов кисти — она отечна, цианотична, пальцы немеют, теряют способность
удерживать предметы.
В дальнейшем развиваются морфологические изменения в нервномышечном и костно-суставном аппарате в виде атрофии мышц, деформации
суставов, ломкости костей, миофасцикулитов, тендовагинитов. Отмечается
болезненность по ходу нервов и сплетений. В тканях развиваются склеротические процессы. Наступает ограничение трудоспособности.
При общем воздействии преобладают симптомы со стороны центральной и вегетативной системы: головная
боль, головокружение, бессонница,
повышенная утомляемость, раздражительность, боли в пояснице, желудке,
груди. Нарушается деятельность эндокринных желез, внутренних органов,
обменных процессов.
Лечение. Наиболее эффективно в
ранних стадиях; назначают сосудорасширяющие вещества, ганглиоблокаторы, витамины, физиотерапию, ЛФК,
санаторно-курортное лечение. Необходимо трудоустройство, перевод на
другую работу.
Профилактика. Заключается в
ограничении длительной работы в течение дня до 2/3 рабочего времени.
Остальное время рабочий выполняет
труд, не связанный с вибрацией. Работа
должна проводиться в помещении, где
температура не ниже 16о. Запрещаются
сверхурочные работы, а также допуск
к вибрационной технике лиц моложе
18 лет. Кроме того, рекомендуется проводить лечебную гимнастику, массаж,
гидропроцедуры, ежедневный прием
витаминов В и С. Рабочие подвергаются профилактическому обследовании
не реже 1 раза в год.
ТРАВМАТИЧЕСКИЙ ШОК
Шоком называется резкое прогрессирующее снижение всех жизненных
функций организма, развивающееся в
результате травмы. В основе изменений, наблюдающихся при шоке, лежат
тяжелые нарушения функций ЦНС.
Шок встречается у 5-10% с тяжелыми травмами и нередко является осложнением течения тяжелой операции.
Как осложнение травмы шок известен давно. В начале 18 века французский врач Ле Дран описал симптомы,
ввел название «шок» и применил для
его лечения согревание, покой, алкоголь и опий.
В начале ХIХ века П. Савенко (1834)
определил шок как тяжелое поражение
205
ЦНС больного. Для правильного понимания причин развития и течения шока
очень много сделал Н.И. Пирогов. Он
дал классическое описание клинической картины шока и доказал необходимость его как особого состояния.
Н.И. Пирогов выделил эректильный и
торпидный шок и наметил пути предупреждения и его лечения. Огромный
вклад в понимание изменений, происходящих в организме при шоке, внесли
И.М. Сеченов, И.П. Павлов, Н.С. Введенский и др.
Классификация шока
Существует несколько классификаций шока в зависимости от принципа,
положенного в его основу.
1. В зависимости от причины:
■ травматический — развивающийся
после травмы;
■ операционный;
■ гемолитический — при переливании несовместимой крови;
■ геморрагический;
■ психический;
■ анафилактический и др.
2. По тяжести клинических
проявлений:
■ легкий;
■ средний;
■ тяжелый.
■
■
■
■
■
■
1 степени — при максимальном артериальном давлении выше 90 мм
рт. ст
2 степени — при АД 90-70 мм рт. ст.
3 степени — при АД 70-50 мм рт. ст.
4 степени — при АД ниже 50 мм
рт. ст.
3. По времени развития :
первичный (ранний), возникающий в момент повреждения или
сразу после него;
вторичный (поздний) шок, который обычно возникает через несколько часов после травмы.
206
Текстовый модуль 4
Раньше шок подразделяли на эректильный и торпидный, но в настоящее время принято считать, что это не
отдельные виды шока, а последовательно развивающиеся фазы единого
патологического процесса.
Клиническая картина
Н.И. Пирогов дал классическое
описание клинической картины эректильной и торпидной фаз шока, к которому можно добавить только данные
результатов специальных методов исследования (артериальное и венозное
давление, скорость кровотока, обмен
веществ и пр.).
Клиническая картина торпидной
фазы шока характеризуется резко выраженным снижением реакции на раздражители, вялостью, апатией, понижением рефлексов, угнетением функций
ЦНС при сохранении сознания.
Со стороны сердечно-сосудистой
системы резкое ухудшение ее деятельности, выражающееся в бледности, частом и малом пульсе, снижении
температуры тела, глухости тонов и
прогрессирующем снижении АД, что
является ведущим симптомом шока.
Наблюдается снижение венозного давления и скорости кровотока. Отмечается сгущение крови, выражающееся
в уменьшении количества плазмы и
увеличении числа эритроцитов. Нарушаются функции почек — отмечается
олигурия и даже анурия. Для торпидной фазы характерно нарастающее кислородное голодание тканей, обусловленное нарушением микроциркуляции.
Лечение шока
Основными задачами лечения шока
являются:
1. Прекращение потока нервных
импульсов с периферии в центр, т. е.
потока болевых импульсов из области
Тема 9
травмы в ЦНС. Эта задача решается различными видами новокаиновой блокады (вагосимпатическая, паранефральная, поднадключичная, поперечного
сечения конечности), прекрасно разработанной школой А.В. Вишневского. Это
же мероприятие является важной профилактикой шока, когда блокада проводится рано, до развития его, особенно перед транспортировкой больного.
2. Уменьшение
возбудимости
ЦНС путем создания абсолютного покоя, назначением промедола, бромидов, алкоголя, жидкости Асратяна, содержащей бромиды, гедонала и пр., а
также путем применения других мероприятий, расчитанных на охранительную целебную роль процессов торможения.
3. Борьба с факторами, отягощающими течение шока. Для борьбы
с токсемией, гипоксемией, плазмокровопотерей прибегают к введению больших доз растворов глюкозы, полиглюкина, гемодеза и др. кровезамещающих
жидкостей, вдыханию кислорода, переливанию крови, плазмы, введению
хлорида кальция и др. Дозировка, а
также то или иное сочетание из факторов, отягощающих шок, решаются в
каждом случае отдельно.
4. Гормональные препараты оказывают стабилизирующее действие,
для однократного введения — 10 мг
кортизона или гидрокортизона.
Все лечебные мероприятия нужно
проводить комплексно, одновременно
и энергично. Однако следует подчеркнуть, что пока не прекращен поток болевых импульсов с периферии в ЦНС,
применение средств, обеспечивающих
выполнение трех остальных задач, малоэффективно.
Противошоковая терапия должна быть индивидуальной для каждого
больного.
ДЛИТЕЛЬНОЕ РАЗДАВЛИВАНИЕ МЯГКИХ ТКАНЕЙ
Синонимы: травматический токсикоз, синдром сжатия конечности, синдром размозжения, синдром освобождения, краш-синдром и др.
Это своеобразный комплекс расстройств в тканях и во всем организме, который возникает вследствие повреждений мягких тканей, и особенно
мышц конечностей в результате длительного сдавливания обломков при
обвалах шахт, при землетрясениях,
сдавлении обломками разрушенных
зданий, железнодорожных и авиакатастроф и т. п.
В условиях современной войны с
применением оружия массового уничтожения синдром сдавления приобретает серьезное значение.
Эта патология еще в 1865 году была
описана Н.И. Пироговым как «местная травматическая окоченелость»,
«травматическое напряжение тканей»,
«местная асфиксия». В 1909 году Зильберштейн описал впервые состояние
почек при сдавлении. В 1-ю мировую
войну были опубликованы отдельные
работы, но никто не описал это состояние в целом, и лишь Байуотер и Билли
в начале Второй мировой войны (1941)
описали это состояние подробно.
Заболевание протекает весьма своеобразно и тяжело.
Летальность значительно выше,
чем при так называемой травме. По
данным М.И. Кузина (115 наблюдений) летальность достигла 30%, а у пациентов с выраженной почечной недостаточностью — 70%.
Патогенез
Патогенез имеет ряд факторов:
1. Нейро-рефлекторный и нейрогуморальный, обусловленный воздействием на организм тяжелой механиче-
207
ской травмой (явления шока, тяжелые
психические переживания).
2. Токсикоз, связанный с всасыванием из раздавленных мышц токсических продуктов распада мышц — мочевой и фосфорной кислоты, калия,
миоглобина, креатинина. Ишемический
некроз мышц поврежденной конечности.
3. Плазмопотеря в результате
нарастающего массивного отека поврежденных мягких тканей. Нарушение гемодинамики, особенно сильное
повышение проницаемости сосудов с
выходом плазмы в межтканевые пространства, трофические расстройства
(кровотечения в ЖКТ и др.).
4. Нарушение функции печеноч
но-почечного барьера (уремия, дегенерация печени и почек).
5. По данным М.И. Кузина и
Ю.М. Максимова, объем циркулирующей крови (плазмы) снижается на 2256%, а гематокрит увеличивается до
65-70%.
Мышечная ткань травмированной
конечности теряет 75% миоглобина,
75% фосфора, 66% калия, 70% креатинина. Мышечный сок содержит до 400мг
% калия, а венозная кровь, оттекающая
из поврежденных мышц, до 60 мг %.
В эксперименте содержание калия
в крови после освобождения тканей от
сдавления увеличивается до абсолютно
смертельной дозы: 10-20 мэкв/л.
Согласно современным представлениям, синдром травматического
сдавления конечностей представляет
собой ишемический некроз мышц с
дальнейшим развитием острой недостаточности печени и почек, а также
ССН. Вследствие массивного сдавления
мышц наступает значительное разрушение тканей, в результате которого
освобождается ряд токсических продуктов (гистаминоподобных и миоглобин). Сразу после освобождения ука-
208
Текстовый модуль 4
занные вещества поступают в систему
циркулирующей крови, вызывают развитие тяжелой интоксикации — токсикоза. Развивается ацидоз. Выпавшие
кристаллы миоглобина закупоривают
просвет канальцев почек. В результате
этого развивается прогрессирующая
почечная недостаточность (типа обструктивной анурии) и нарушение обезвреживающей функции печени. Токсическое повреждение нервной системы.
Большая роль принадлежит также
сдавлению нервных стволов, в связи с
чем в раннем периоде заболевания развиваются симптомы, напоминающие
картину травматического шока.
Для болезни сдавления характерно
также развитие гемоконцентрации в
результате значительной плазмопотери и обезвоживания.
Патанатомия
При вскрытии трупа пострадавшего обнаруживают: в мышцах поврежденной конечности наличие резко
выраженного отека, очаговый коагуляционный некроз, имбибиция поврежденных мышц кровью. Мышцы
бледны, серы, некротизированы, обескровлены. Со стороны внутренних
органов: в почках — они увеличены в
объеме, отмечается жировое перерождение, кровоизлияния, острый некроз
канальцев, которые наполнены мышечным пигментом (миоглобином),
выпавшим в осадок в связи с раздавливанием мышц, и белковыми массами —
результат токсико-инфекционного поражения почек.
В печени отмечается жировое перерождение, дистрофия, кровоизлияния,
некрозы.
Полнокровие внутренних органов
и кровоизлияния в слизистой желудка
и кишечника, отек мозга и легких. Все
как при уремии.
Тема 9
Клиника
По ряду признаков эта болезнь
имеет черты, схожие с ожоговым и
гемотрансфузионным шоком. В клинической картине схематически различают 3 периода (или фазы) по
М.И. Кузину.
1. Ранний период. Охватывает
2-3 дня заболевания, характеризуется шокоподобными расстройствами с
преобладанием ССН.
2. Промежуточный период — с
4 до 10 дня травмы, характеризуется
преобладанием симптомов почечной
недостаточности.
3. Поздний период — от 11 дня до
конца 1-2 месяца, преобладают местные явления над общими, анемия.
Формы:
■ крайне тяжелая — раздавливание
обеих конечностей свыше 8 часов;
■ тяжелая — одна или две конечности 6-7 часов;
■ средняя — менее 6 часов;
■ легкая — раздавливание менее 4
часов.
В раннем периоде, сразу после
извлечения конечности, состояние
пострадавшего в течение нескольких
часов может оставаться удовлетворительным. Однако через 3-5 часов развивается картина тяжелого травматического и олиговолемического шока с
нарушением функции ЦНС, возбуждением, страхом, беспокойством, а затем апатией, сонливостью, указывающими на развитие нарушения почек и
в будущем уремию. Через 1-2 часа начинают развиваться отеки. В течение
суток достигает максимальной величины. Отек мягких тканей имеет характерную особенность: он твердый,
т. е. вмятин не оставляет, т.к. отекают
не только клетчатка, но и мышцы. Нередко отек настолько значителен, что
исчезает пульсация периферических
сосудов. Движения конечности обычно невозможны. Конечность багровосинюшного цвета, пятна, образуются
пузыри с прозрачным и геморрагическим содержимым. Артериальное давление падает. Иногда наблюдается
жажда, повторная рвота, появляется
желтуха, боли в пояснице. Снижается
диурез (олигурия), моча приобретает красную или темно-бурую окраску
(миоглобинурия,
гемоглобинурия),
фосфатемия, гиперкалиемия. Состояние, аналогичное кровотечению, но
теряется только жидкая часть крови.
По мере развития отека идет плазмопотеря и гемоконцентрация (сгущение
крови), увеличивается гематокрит.
При прогрессировании процесса
нарастает токсическое перерождение
паренхиматозных органов, особенно
печени и почек (азотемия, гиперкалиемия). Почки перестают функционировать (установлено, что без почек
человек может жить 1-2 дня, а затем
наступает смерть). Продолжительность первой фазы 1-3 дня. В течение
этого времени при тяжелых формах
часть пострадавших погибает в первом
периоде при нарастающих явлениях
острой ССН.
Промежуточный период характеризуется коротким «светлым» промежутком (3-4 день после освобождения), вслед за которым начинает
все ярче проявляться картина острой
почечной недостаточности: олигурия,
переходящая в анурию, появление белка, цилиндров и эритроцитов в моче,
нарастание остаточного азота крови
(до 200-300 мг %) и особенно мочевины уровень которой достигает 500
мг% и выше. Растут и другие биохимические показатели — калий, фосфор.
Характерно развитие ацидоза. Общее
состояние больного резко ухудшается.
Прогрессирует уремия, которая может
209
привести к смерти в начале второй недели заболевания. В этом периоде значительное число пострадавших (около
20-25%) с тяжелыми формами сдавления погибают от явления уремии.
В более легких случаях, если фун
кция почек восстанавливается, начинается третий период (выздоровление).
Поздний период характеризуется
преимущественно рядом местных симптомов. Начинается обратное всасывание отечной жидкости (уменьшение
отеков), кожа частично некротизируется и отторгается. Идет отторжение
мышц. Иногда омертвение пальцев
или сегментов конечности. Возникают
травматические невриты, что вызывает появление жгучих болей. В ряде
случаев развивается гнойная инфекция
(в связи с ослаблением общего и местного иммунитета). К концу первого месяца развивается атрофия мышц, тугоподвижность и контрактуры суставов.
Прогрессирует анемия.
Лечение
При оказании помощи больному
при сдавлении следует помнить, что
наиболее тяжелые расстройства возникают после освобождения сдавленной
конечности, и что сама поврежденная
конечность является источником болевых шокогенных импульсов и интоксикации (токсикоза).
Суть лечения состоит:
1. Освобождение пострадавшего изпод завала (прерывание патологических импульсов из поврежденной
конечности);
2. Ликвидация гемодинамических нарушений (борьба с шоком);
3. Уменьшение плазмопотери и токсемии;
4. Восстановление функции почек и
печени;
210
Текстовый модуль 4
5. Восстановление нормального обмена;
6. В позднем периоде — своевременное оперативное лечение.
Разрешение этих задач достигается
следующими мероприятиями:
Первая помощь на месте обвала
сводится к извлечению пострадавшего
и как можно более быстрому наложению жгута и иммобилизации сдавленной конечности. Если возможно, целесообразно наложить жгут на корень
конечности, выше места сдавления,
не извлекая пострадавшего. Для снятия болевых ощущений вводят аналгетики, морфин, пантопон, сердечнососудистые и дыхательные аналептики
(камфора, кофеин, эфедрин). Ряд авторов считают, что нецелесообразно
накладывать жгут всем пострадавшим,
только проводить тугое бинтование от
стопы до пупартовой связки. Показанием для наложения жгута они считают:
– артериальное
кровотечение
вследствие травмы из сосудов среднего
и крупного калибра;
– в том случае, если конечность
находилась под сдавлением длительное время и в ней произошли необратимые изменения, в связи с чем в последующем будет выполнена высокая
ампутация или экзартикуляция.
Лечение в стационаре:
1. Борьба с плазмопотерей — тугое бинтование конечности (от периферии к центру) в течение нескольких
дней эластическими бинтами. При
выраженном отеке и наличии значительных гематом производят широкие
разрезы с обязательным вскрытием
собственной фасции для уменьшения
отека и интоксикации. Раны оставляют
открытыми и обрабатывают тампонами, смоченными в гипертоническом
растворе поваренной соли (5-10%).
Для уменьшения всасывания токси-
Тема 9
нов из очага повреждения и снятия
явлений интоксикации целесообразно
применить местную гипотермию (обкладывание поврежденной конечности
пузырями со льдом в течение 2-3 дней
с перерывами в 1-2 часа через каждые
4-5 часов). Это ведет к угнетению ферментативных процессов и уменьшению
травматического отека. В тяжелых
случаях до наступления печеночнопочечного синдрома производят ампутацию для спасения жизни больного.
2. Проводят борьбу с шоком и
спазмом сосудов:
■ новокаиновые блокады поперечного сечения конечности и паранефральные;
■ в/в капельно вливают 0,1% р-р
новокаина (300-500 мл);
■ при отсутствии рвоты назначают обильное питье;
■ в/в вводят полиглюкин, плазму, можно переливать кровь (свежецитратную или прямое переливание
крови, т. к. необходимо обеспечить
хорошую оксигенацию тканей). Суточное количество вводимой в вену
жидкости определяется степенью
гемоконцентрации и размером почасового диуреза. Почасовый диурез
определяют при тяжелых поражениях
путем введения в мочевой пузырь постоянного катетера — здоровый человек в норме выделяет в час 50-60 мл
мочи. В течение суток рекомендуется
ввести в/в до 4 л жидкости в том числе
глюкозы 5% р-ра 1-1,5 л с инсулином
в соответствующих дозах;
■ дают кислород, вводят алкоголь,
назначают бромиды, хлоралгидрат;
■ для борьбы с развивающимся
ацидозом и угрозой почечной недостаточности производят двустороннюю
паранефральную новокаиновую блокаду. Моча должна иметь щелочную
реакцию. При щелочной реакции мочи
предупреждается закупорка извитых
канальцев почек миоглобином, высвобождающимся из раздавленных мышц.
Щелочность мочи достигается восстановлением резервной щелочности
крови путем в/в введения бикарбоната
натрия (соды) 3-5% р-ра 150-200 мл 2
раза в день или 20-25 г соды в 3 л физ.рра — через рот, в/в капельно, в клизме.
Щелочное обильное питье. Вводят натриевую соль гамма-оксимасляной
кислоты. Эуфиллин 2-3 раза 2,4% —
10,0. Целесообразно применение комплекса витаминов С, В;
■ Назначают
слабительные.
Усиливают диурез с помощью мочегонных средств (форсированный диурез) с помощью манитола, гемодеза,
лазикса и др., нормализующих почечный кровоток;
■ При нарастании концентрации
фибриногена с целью профилактики
211
тромбозов назначают антикоагулянты
(гепарин);
■ Поскольку в связи с травмой
и раздавливанием увеличивается дефицит стероидов, рекомендуется в малых дозах гидрокортизон (150-200 мг),
преднизолон (30-90 мг);
■ Ввиду опасности развития инфекции с первых дней назначают антибиотики внутрь и местно;
■ Если эти меры не помогают, то
при развитии почечной недостаточности, нарастании азотемии, гиперкалиемии показано применение гемодиализа
аппаратом «искусственная почка», который может спасти жизнь. Пересадка
почек — проблема пока сложная и не
всегда разрешимая.
В позднем периоде применяются
физиотерапевтические и общехирургические методы лечения ран, тугоподвижности суставов и мышечной атрофии.
Контрольные вопросы по теме занятия
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
Что такое травма, травматология, травматизм?
Классификация травматизма.
Какие существуют травмирующие факторы?
Классификация повреждений мягких тканей.
Что такое ушиб, каковы клинические проявления ушиба?
Что такое растяжение, каковы клинические проявления растяжения?
Первая помощь при растяжении связок голеностопного сустава.
Что такое разрыв? Разрывы каких анатомических образований чаще всего
встречаются? Каковы клинические проявления разрывов?
Методы первой медицинской помощи пострадавшим с закрытыми повреждениями.
Какие существуют виды транспортной иммобилизации, средства транспортной иммобилизации, правила транспортировки пострадавших с повреждениями мягких тканей?
Повреждения, при которых применяется шина Дитерихса.
Особенности оказания помощи при массовых травмах.
Что такое синдром длительного сдавливания?
Каковы особенности при оказании первой помощи пострадавшим с СДС?
Патогенез синдрома длительного сдавления.
Клиническая характеристика СДС.
В чем заключается патогенетическое лечение СДС?
Тема 10
ТЕМА №10.
Раны. Классификация ран. Асептические и гнойные раны. Течение раневого процесса. Виды заживления ран. Методы лечения чистых и гнойных ран. Работа в перевязочной
1. Актуальность темы.
Учение о ране относится к числу
актуальных проблем хирургии и отражает уровень развития теоретической
и практической медицины. В условиях нарастающего числа больных с повреждениями различной локализации,
прогрессирующей антибиотикорезистентности гноеродной микрофлоры
проблемы лечения и профилактики
осложнений ран становятся более сложными и требуют дальнейшего мультидисциплинарного изучения.
■
■
■
■
■
■
■
■
■
■
■
■
■
2. Учебные цели:
Раны, определение, классификация;
Структура раны и течение раневого
процесса в чистой ране;
Характеристика отдельных видов
ран и первая помощь при них;
Условия, при которых возникает
инфекция в ране и их профилактика;
Структура чистой раны;
Первичная хирургическая обработка
раны;
Виды первичных швов;
Лечение чистой раны в послеоперационном периоде;
Инфицированные раны;
Течение раневого процесса в гнойной
ране;
Хирургическая обработка гнойной
раны, виды вторичных швов;
Лечение гнойной раны в зависимости от фазы раневого процесса;
Виды дренирования гнойной раны.
3. Самостоятельная работа
студентов.
История лечения ран и раневой
инфекции уходит своими корнями в
глубину веков. Еще доисторичекий
человек лечил раны и различные пов
реждения, полученные на охоте и во
время военных столкновений. Находки археологов показали, что в неолити
ческом периоде уже производили трепанацию черепа и другие операции.
С тех пор предложено неисчислимое
множество способов и методов лечения
ран. По этому поводу С.С. Гирголав
в монографии «Огнестрельная рана»
(1956) писал: «Вряд ли для какой-либо
другой цели в медицинской практике
было предложено большее число как
отдельных средств и их сочетаний (рецептов), так и целых методов и систем,
чем для лечения ран». По этим причинам изложить многовековую историю
лечения ран нет никакой возможности.
Да в этом, наверное, и нет необходимости, так как большинство старых способов лечения ран сейчас уже потеряло
свое значение.
Гораздо важнее, по нашему мнению, проследить, как возникли и развились основные принципы лечения
ран, сохранившие свое значение до нас
тоящего времени. Это, прежде всего,
хирургическая обработка раны, мето
ды ее дренирования, способы закрытия
раны и воздействия на раневую инфекцию. Знакомство с историей хирургии
показывает, что эти основополагающие
принципы возникли в глубокой древности. Так, из папируса Эверса, найденного в XIX веке, стало известно, что
за 3000 лет до н. э. египтяне использовали для лечения ран мед, масло и вино
и даже закрывали раны с помощью
швов и склеивающих веществ. В Вавилоне и Ассирии существовало сословие
врачей-хирургов, сопровождавших войска, т. е. зародилась военно-полевая
хирургия как специальность. Об этом
сообщается в вавилонском кодексе
царя Хаммурапи (Навуходоносора),
написанном в XVIII в. до н. э. Кстати,
упомянем, что врачами в Вавилоне
считали только хирургов.
На высоком уровне (за 500 лет
до н.э.) находилась хирургия в Древ
ней Индии. К этому времени относит
ся наиболее известное произведение
индийской медицинской литературы
«Ayur-Veda» («Книга жизни»). Хирурги
Древней Индии успешно лечили раны,
зашивая их наглухо после очищения
от инородных тел. Кроме того, они
умели лечить переломы, производили
ампутации, лапаротомии (в частности,
при кишечной непроходимости), нак
ладывали кишечный шов. В Индии были
заложены основы пластической хирургии («индийская пластика»): успешно
выполнялась пластика носа, губ и ушей
(необходимость таких операций диктовалась практиковавшимся наказанием — отсечением носа и ушей). На протяжении многих последующих веков
достоверные литературные источники о
лечении ран отсутствуют и появляются
снова в Древней Греции. Как явствует из
«Илиады», в Древней Греции существовало сословие врачей и сами гомеровские герои Ахилл, Нестор и др. имели
понятие о наложении повязок.
Чрезвычайно много для своего
времени внес в учение о ранах отец ме-
213
Рис. 71. Гиппократ (460-377 до н. э.)
дицины Гиппократ (460—377 гг. до
н.э.) (рис. 71). Книги, написанные его
учениками и собранные в дошедший
до нас «Гиппократов сборник», стали источником медицинских знаний
на многие столетия вплоть до средних
веков. С Гиппократа фактически начинается наука о заживлении раны, так
как именно он сформулировал понятия первичного заживления раны без
нагноения и вторичного с нагноением.
Им же впервые был применен металлический дренаж для дренирования
ран. Гиппократом заложены и основы
гнойной хирургии: описана клиника
флегмон и абсцессов, выдвинут основной принцип — «ubi pus, ubi evacua».
Многие хирурги и в настоящее вре
мя, к сожалению, ограничиваются только этим правилом при лечении острых
гнойных хирургических заболеваний.
Кроме того, Гиппократ подозревал, что
гнойные осложнения возникают в результате «загрязнения» раны. Он требовал, чтобы операционное поле было
чистым и покрыто чистой тканью. Во
время операции он пользовался только кипяченой водой. Кажется невероятным, что хирургии понадобилось
24 века (!), чтобы заново к этому вернуться и полностью осознать значение
асептики.
214
Текстовый модуль 4
Тема 10
Расцвет Древнего Рима определил
перемещение центра медицины в Рим.
Наиболее крупными представителями
римской медицины был Цельс (I в. н.
э.) (рис. 72) и Клавдий Гален (II в. н. э.)
(рис. 73). Сочинение К. Цельса «De medicina» и трактаты Галена до средних
веков были основным руководством
для медиков Западной Европы.
Цельс первый предложил для пере
вязки сосудов применять лигатуру, использовал при лечении ран свинцовые
дренажи. Клавдий Гален применял
наложение швов на рану и бронзовые
трубки для дренирования. Однако он
считал нагноение обязательной состав
ной частью процесса заживления раны
(заживление через нагноение), смешивая осложнение с процессом излечения.
Кроме того, он придавал чрезвычайное
значение поискам «чудодейственного»
средства, которое способствовало бы
нагноению и быстрому излечению любой раны. Эти взгляды Галена надол
го утвердились в медицине, а поиски
«чудодейственного» средства в том или
ином виде иногда ведутся и в настоящее время. Исторические данные показывают, что великие врачи древности
имели представление о некоторых важных принципах лечения ран: вскрытии
гнойного очага, дренировании раны и
наложении швов. Они знали также о заживлении с нагноением и без нагноения
и догадывались о «заражении» раны.
Однако практически врачи того времени эти принципы применяли редко.
Широкое распространение получило
прижигание ран каленым железом и кипящим маслом для предотвращения тех
осложнений при ранениях, которые мы
называем инфекционными. В дальнейшем раны лечили под повязками с различными маслами, вином, мазями и др.
С упадком Римской империи меди
цина, а вместе с ней и хирургия дви
нулись назад. Религия чинила непрео
долимые препятствия на пути развития
науки и особенно медицины. Запрещались хирургические операции с пролитием крови, вскрытие трупов и т. п.
Достаточно вспомнить, что великий
анатом Андрей Везалий (1514—1564)
был отдан в руки инквизиции за
утверждение, что у мужчины 12 ребер,
а не 11 (согласно церковным легендам,
бог использовал одно ребро Адама для
создания Евы). В то время обширными
Рис. 72. Корнелий Цельс (I век н. э.)
Рис. 73. Клавдий Гален (II век н. э.)
знаниями по медицине обладали только врачи в Византии и арабские врачи.
Наиболее видными представителями последних были Павел Эгинский
(VII в.), для своего времени блестяще
владевший хирургической техникой,
и Абу Али ибн-Сина (Авиценна, 980—
1037 гг.), создавший крупнейший тео
ретический труд «Канон медицины».
В XII в. этот труд был переведен на латинский язык и до конца XVII в. оставался основным учебником для студентов и врачей (рис. 74).
Великому арабскому ученому Рази
(Абу-Бекр Мухамед бен Закария, 850—
923 гг.) принадлежит честь первой попытки объяснения причин развития заразных заболеваний и нагноения ран.
Выбирая место для больницы в Багдаде, он приказал развесить по всему городу куски мяса и выбрал то место, где
гниение началось позже. Понадобилось
более 500 лет, чтобы врачи снова задумались над этой проблемой. В 1546 г.
Д. Фракасторо (1478—1553) напечатал
трехтомный труд «О контагии, контагиозных болезнях и лечении», где доказал контактную природу инфекционных заболеваний. В качестве самого
215
действенного средства борьбы против
распространения заразы он выдвинул изоляцию больного, тщательную
уборку и очистку того помещения, в
котором он находится. Фактически эти
предложения послужили основой асептики и борьбы с внутригоспитальной
инфекцией. Удивительно, что только
через 300 лет эти принципы были использованы в хирургии и лечении ран.
В средние века учение о ране полу
чило развитие благодаря итальянским
врачам из университетов в Падуе, Салерно, Болонье и парижским хирур
гам, хотя их социальное положение
было весьма тяжелым. Между хирур
гами и обучавшимися в университетах
«учеными» врачами лежала громадная
пропасть. «Доктора» были уравнены
в правах с рыцарями, хирурги же обучались ремеслу у цирюльников. К самому
низкому сословию врачей принадлежали также палачи, которые приобретали
некоторые хирургические познания для
лечения измученных пыткой людей.
Несмотря на это, в Средневековье —
в период полного застоя творческой
мысли и косности в хирургии, когда
раны лечили в основном прижигани
Рис. 74. Авиценна (980-1037 гг. н. э.) и его «Канон медицины»
216
Текстовый модуль 4
ем каленым железом, именно в учении
о ране наметился определенный прог
ресс. В это время Роджер из Салерно
(1177 г.) предлагал после удаления
инородных тел сближать края раны
шелковыми швами. Другой ведущий
хирург Салернской школы епископ
Теодорико Боргоньони (1205—1296),
являясь противником прижигания ран,
рекомендовал «сухой» метод лечения,
без нагноения: «Нет необходимости в
образовании гноя в ранах. Нет ошибки
большей, чем эта. Такое лечение противно природе, служит продлению болезней и препятствует склеиванию и
заживлению раны» [Труэта X., 1947].
Эти взгляды разделял Бруно де
Лонгобурго, который в своей работе
«Chirurgia Magna» (1252 г.), подчер
кивая необязательность нагноения, пи
сал о первичном и вторичном натяже
нии и ставил вопрос о наложении шва
на рану. Несколько позже Николай
Флорентийский (1350 г.) впервые произвел иссечение краев раны с наложением швов. Ги де Шолиак рекомендовал
наложение швов на рану и применение
дренажей для лечения гнойной раны.
В эпоху Возрождения господство
вали те же методы лечения ран, что и
в Средневековье,— прижигание ка
леным инструментом и кипящим мас
лом, лечение различными мазями и
«чудодейственными» средствами. Они
получили даже большее распространение в связи с появлением огнес
трельного оружия, резко изменившего
характер боевых травм. Раны стали более тяжелыми и чрезвычайно часто нагнаивались. Причиной такого явления
считали «отравление» тканей порохом
и свинцом и боролись с этим путем выжигания раны.
Однако и в этот период ряд врачей
высказывали интересные соображения
относительно лечения ран. Некоторые
Тема 10
из них прямо высказывались о необходимости первичной эксцизии ран.
В XIV в. военный хирург Мондевиль
утверждал, что раны могут и должны
заживать без нагноения; для механического удаления инородных тел их
следует промывать теплым вином, а
края соединить для защиты глубжележащих тканей от раздражающего и
вызывающего нагноение действия воздуха. Фактически здесь сформулирована концепция о том, что наилучшим
способом защиты раны от инфекции
является наложение швов. Для того
времени это была недюжинная мысль,
особенно если учесть, что до сих пор
этот вопрос дискутируется хирургами,
а средства, надежно подавляющего инфекцию в ране, еще не найдено. Мондевиль в известной степени сформулировал требования о бережном отношении
к травмированным тканям и общем
усиленном питании раненых. Он под
черкивал, что раны следует зашивать
в определенные сроки, зависящие от
факторов окружающей среды: при теплой погоде в первые 24 ч., при холодной — в течение 48 ч.
В XV в. Пьетро д’ Аргиллата, про
фессор Болонского университета, разработал схему показаний и проти
вопоказаний к наложению первичных
швов. «Первичный шов,— писал он,—
не может применяться, если: 1) рана
глубокая, и в случае образования нагноения в глубине раны гною будет
трудно найти выход; 2) изъян вещества
настолько велик, что трудно соединить
края, чтобы можно было надеяться на
первичное натяжение; 3) рана сильно
изменена вследствие «влияния воздуха» (но, впрочем, при слабом повреждении краев раны, в особенности
если она неглубокая, шов может быть
наложен); 4) рана сильно размозжена;
5) в ране развивалась apostema (вос-
паление, отек); 6) область ранения
очень болезненна; 7) травмированные
участки омертвели; 8) в рану предлежат концы переломанных костей;
9) рана носит язвенный характер.»
(по Н.Н. Бурденко, 1938). Многие из
этих положений правомерны и сегодня. Привлекает внимание определение
понятий «воспаление в ране» (выделены боль, отек, гноетечение, омертвение тканей) и «допустимость шва при
малой зоне повреждения».
Выдающийся хирург XVI в. Амбруаз Паре (1509—1590) доказал, что
раны лучше заживают, если их не прижигать железом или кипящим маслом.
Он лечил раны мазью из скипидара,
розового масла и яичных желтков, применял при перевязках сулему и широко
использовал зашивание ран. Через 15
веков после Цельса он возродил лигирование сосудов в ране и впервые применил их перевязку на протяжении.
В это же время другой выдающий
ся врач и хирург — Леонардо Боталло
(1530) доказал, что порох не содержит
ядовитых веществ, а нагноению в огнестрельной ране способствуют инородные тела, в первую очередь размозженные и разорванные ткани и сгустки
крови. Отсюда он сформулировал важное положение, гласящее, что омерт
вевшие ткани подлежат иссечению.
Значение этого утверждения трудно
переоценить. В дальнейшем оно стало
одним из краеугольных камней в учении о лечении ран.
В XVII в. прогресс хирургии был невелик, что в определенной мере связано с
социальным положением хирургов. Особенно унизительным было положение
военных врачей, в Германии называвшихся фельдшерами, которые по приказу Фридриха II в случае смерти военно
служащих королевской гвардии от ран
подвергались телесным наказаниям.
217
Значительный переворот совершил
ся в середине XVIII в., когда началось
преподавание хирургии в университетах
и появились школы для обучения полевых хирургов. В 1731 г. Марешаль
основал в Париже Хирургическую
академию, которая 11 лет спустя была
уравнена в правах с медицинским факультетом. Этим была устранена существенная помеха для развития хирургии
и результаты не замедлили сказаться.
Особой славы достигли французские
и английские хирурги. Этому способствовало открытие во Франции «Школы практической хирургии». Среди
французских хирургов выделялись
Дезо (1744—1795), П.Ф. Перси (1764—
1825) и Д.-Ж. Ларрей (1766—1842).
Развитию учения о ранах в немалой
степени способствовали многочислен
ные войны XVII—XVIII вв. Несмотря
на большой опыт военных хирургов,
результаты лечения ран все еще ос
тавляли желать лучшего. Главным бичом являлась гнойная и гнилостная инфекция ран, сводившая на нет усилия
хирургов и заставлявшая прибегать к
первичным ампутациям при ранениях
конечностей. Продолжало господствовать мнение о вредном действии воздуха на раны, рекомендовалось накладывать на них герметические повязки.
Однако уже в это время, в доантисептический период, ряд хирургов предложили вместо ампутации
рассекать или иссекать рану с целью
предупреждения развития гнойных
осложнений. Одним из первых стал
широко рассекать раны и затем проводить лечение тампонами, смоченными
камфорным спиртом или нашатырем,
военный хирург И. Бильгер (1720—
1796). Следующий шаг в этом направлении сделал П. Дезо, который, кроме
рассечения, настаивал на обязательном
иссечении омертвевших и размозжен-
218
Текстовый модуль 4
ных тканей раны, считая это основным
принципом хирургической обработки.
Сторонником рассечения и иссече
ния ран был также Д. Ларрей, ученик
П. Дезо. Кроме того, во время египетской кампании Наполеона он применял
первичный шов при ранениях груди.
Д. Ларрей придавал большое значение оказанию помощи раненым. Чтобы сократить время между ранением
и хирургической помощью, он создал
перевязочные отряды (ambulances),
которые оказывали пострадавшим соответствующее пособие в ближайшее
время после ранения. Несмотря на то,
что Д. Ларрей придерживался взглядов
П. Дезо о целесообразности рассечения
и иссечения ран, а помощь была максимально приближена к раненым, он вынужден был очень часто ампутировать
конечности из-за боязни смертельных
гнойных осложнений.
Английские хирурги во главе с Дж.
Хантером (1728—1793), боясь высо
кой летальности и гнойных осложне
ний, предпочитали воздерживаться от
активной тактики лечения ран. Тем не
менее в монографии Дж. Хантера, изданной в 1817 г., швы на огнестрельную
рану рекомендуется накладывать через
3—4 сут. после ранения. Вероятно, это
первое указание на перспективность
наложения
первично-отсроченных
швов. Кроме того, Дж. Хантер выделял
заживление под струпом как особый
вид заживления раны.
Принципа рассечения раны и нало
жения швов придерживался русский
хирург А. Чаруковский. В книге «Во
енно-походная медицина» (1836) он
писал, что рану надо очищать от сгустков крови, удалять инородные тела, хорошо «уравнить и сблизить края раны.
Ушибленную рану надо превратить в
порезанную и сию лечить скоросоединительно».
Тема 10
Рис. 75. Н.И. Пирогов (1810-1881)
Большое значение для развития
военно-полевой хирургии и учения о
ране имела деятельность Н.И. Пирогова (1810—1881) (Рис. 75), который
не только сформулировал основные
принципы организации помощи раненым, блестяще подтвердившиеся
во время Великой Отечественной войны 1941—1945 гг. но и, являющиеся
основополагающими до настоящего
времени, кроме того, ввел в практику
полевой хирургии операции под наркозом и впервые применил гипсовую
повязку для транспортной и лечебной
иммобилизации.
Н.И. Пирогов высказал предполо
жение о заразной природе раневых
осложнений («госпитальные миазмы»).
В знаменитых «Началах общей военнополевой хирургии» (1865) он писал:
«Гнойное заражение распространяется
не столько через воздух, который делается явно вредным только при скучивании раненых в закрытом про-
странстве, сколько через окружающие
раненых предметы: белье, матрацы,
перевязочные средства, стены, пол и
даже санитарный персонал». Однако
это была только гениальная догадка.
Хотя Н.И. Пирогов применял хлорную известь, спирт и йодную настойку,
все же системы борьбы с «миазмами»
еще не было. Наблюдая большое количество инфекционных осложнений
и высокую смертность среди раненых,
Н.И. Пирогов выдвинул принцип «сберегательного лечения» ран, который
заключался в резком сокращении показаний к первичным ампутациям и
удалению инородных тел из раны, зондированию и исследованию ран пальцами. На первое место выдвигались
покой раны, иммобилизация раневого
участка и всей конечности и рассечение раны как метод лечения гнойных
осложнений: «Следует спешить с надрезами при острейших и занимающих
глубокий подапоневротический слой
соединительной ткани затеках».
Эти принципы и в настоящее время лежат в основе лечения почти любой раны. Однако ни чрезвычайная
активность французских хирургов,
призывавших к первичной ампутации,
ни сберегательное лечение не могли в
то время победить самого страшного
врага — раневую инфекцию. Именно
от нее гибло огромное число раненых.
Н.И. Пирогов с горечью констатиро
вал: «Как во время Амбруаза Паре свирепствовали миазмы между ранеными
солдатами, так точно они свирепствуют и теперь в каждую войну».
К середине XIX в. в работах выдаю
щихся хирургов предыдущих столетий
были обоснованы главные принципы
лечения ран:
1. Необходимость широкого рассе
чения раны и иссечения нежизне
способных тканей.
219
2. Целесообразность хорошего дре
нирования ран.
3. Ускорение заживления раны при
наложении швов.
Конечно, до понимания важности
этих мероприятий врачи дошли чисто
эмпирическим путем, далеко не всегда
сознавая их необходимость. Однако
это не умаляет их заслуг. Наоборот,
время подтвердило исключительное
значение этих принципов лечения ран.
Вероятно, именно этот период можно
считать «вторым рождением» учения о
ране (после древних индусов, египтян
и Гиппократа). В это время фактически
впервые было сформулировано понятие о классических типах заживления,
зародилось учение о хирургической
обработке ран и первичном шве (эти
вопросы дискутируются по настоящее
время). Однако в доантисептическую
эпоху перечисленные принципы активного лечения ран не могли найти
широкого применения, так как все усилия хирургов сводила на нет раневая
инфекция.
Решающее влияние на развитие
учения о ранах оказало возникновение в XIX веке антисептики и асептики,
связанное с именами И. Земмельвейса,
Д. Листера, Т. Бильрота, Э. Бергмана и
К. Шиммельбуша.
В 1848 г. И. Земмельвейс установил,
что послеродовые осложнения имеют инфекционную природу, и с целью
обеззараживания ввел в акушерскую
практику применение хлорной извести.
Однако антисептика по-настоящему
получила признание только после работ Д. Листера. Решающее влияние на
учение об антисептике оказали исследования Л. Пастера (рис. 76). Д. Листеру удалось доказать, что причиной
нагноения раны являются попавшие
в нее из воздуха микробы (рис. 77).
В результате многолетних опытов он
220
Текстовый модуль 4
Рис. 76. Луи Пастер (1822-1895)
Рис. 78. Эрнст фон Бергман (1836-1907)
разработал методику профилактики
нагноения ран с применением карболовой кислоты, впервые описанную в
1867 г., что способствовало развитию
антисептики.
В хирургии эру асептики открыл
Т. Бильрот, который первым одел
врачей в белые халаты, и ввел обяза
тельное мытье рук перед операцией.
Очень много в этом направлении сделали Э. Бергман (рис. 78), К. Шиммельбуш и М.С. Субботин, трудами
которых разработана стройная система
профилактики раневой инфекции —
асептика. С этого момента асептика и
антисептика стали развиваться бурны-
Тема 10
Рис. 77. Дж. Листер (1827-1912)
ми темпами и оказали решающее влияние на развитие хирургии вообще и на
учение о ранах в частности.
В связи со сказанным любопытно
вспомнить, что еще в IX в. арабский
врач Рази объяснял развитие нагное
ния влиянием воздуха, в XVI в. Д. Фракасторо создал учение о «контагии».
В XVII в. А. ван Левенгук описал бактерии. В XVIII в. Л. Спалланцани доказал факт размножения микробов и
Э. Дженнер создал первую противоинфекционную вакцину. На протяжении
многих веков ученые не смогли связать
все эти открытия с нагноением раны, и
только на исходе XIX в. фактически зародилось учение о раневой инфекции.
Несмотря на огромное значение антисептики и асептики, данные методы,
как нередко случается в науке, сыграли не только положительную роль, но
и имели определенное отрицательное
влияние на развитие тактики лечения
ран. При лечении ран главным с точки
зрения антисептики представлялось
уничтожение микробов в них. Это как
бы отодвигало на задний план вопросы хирургической обработки раны,
дренирования и наложения швов; рана
обрекалась на заживление вторичным
натяжением. На первое место выдвигалось применение антисептических препаратов (перманганат калия, нитрат серебра, ксероформ, йодоформ, алкоголь
и др). Создавалась иллюзия, что можно
найти такое средство, которое «убьет»
всех микробов в ране и обеспечит ее заживление.
Лишь немногие хирурги пытались
использовать возможности антисепти
ки и асептики для расширения хирур
гической активности при лечении
ран. К ним относилась группа русских
хирургов (К.К. Рейер, Н.В. Склифосовский, С.П. Коломнин), впервые
применивших метод антисептики в
военно-полевой хирургии во время
русско-турецкой войны 1877—1878 гг.
Особенно надо выделить К.К. Рейера,
который возглавлял на Кавказском
фронте созданный впервые в истории
военной хирургии госпиталь, специ
ально для изучения антисептического
метода обработки огнестрельных ран.
Пользуясь методом Листера, он начал
практиковать ранние активные вмешательства, заключавшиеся в рассечении
огнестрельной раны, удалении из нее
инородных тел, костных отломков и рациональном дренировании. В этих операциях была заложена идея первичной
хирургической обработки ран [Вишневский А.А., Шрайбер М.И., 1975].
Работавший на другом фронте
участник той же русско-турецкой войны Э. Бергман, исходя из принципов
асептики, пришел к противоположным
выводам. Применив асептические окклюзионные повязки, он достиг отличных результатов при лечении 14
больных с пулевыми ранениями коленного сустава. Э. Бергман утверждал,
что огнестрельные раны практически
стерильны, поэтому активное хирургическое вмешательство при свежих ранениях следует предпринимать только
221
по специальным показаниям (например, с целью остановки кровотечения).
Развитие асептики еще более утвердило консервативное направление. Этому
способствовали и работы Ф. Эсмарха,
предложившего в 1876 г. индивидуальный перевязочный пакет.
Сторонники асептического метода
главной целью лечения считали, пре
жде всего, защиту раны от попадания
микробов. Иными словами они на более высокой научной основе вернулись
к концепции хирургов Средневековья.
Отсюда возник известный постулат:
«первичная повязка решает судьбу раненого». В военно-полевой хирургии
концепция Э. Бергмана и Ф. Эсмарха господствовала вплоть до второго периода Первой мировой войны.
Этому способствовало изменение характера пулевых ранений. В конце
XIX века изобретение бездымного пороха привело к усовершенствованию
огнестрельного оружия, почти вдвое
уменьшился калибр винтовок, увели
чилась их скорострельность. Ранения
оболочечной малокалиберной пулей,
имевшей сравнительно высокую на
чальную скорость, характеризовалось
точечным входным и небольшим вы
ходным отверстиями и сравнительно
незначительным разрушением тканей
по периферии раневого канала. Кон
траст между ранениями старым круп
нокалиберным и новым оружием ока
зался столь разительным, что во время
англо-бурской войны 1899—1902 гг.
новые пули обрели репутацию «гуманных», а пулевые ранения стали называть «благоприятными», так как в
условиях открытой местности они наносились со значительных расстояний,
а сухой климат Африки часто способствовал заживлению ран под струпом.
Немаловажное значение имело и
преобладание пулевых ранений (до
222
Текстовый модуль 4
95%) над осколочными в ходе войн
конца XIX— начала XX в. Это привело к недооценке поражающего оружия в будущей мировой войне, когда
частота осколочных ранений достигла
70—75%, и к провалу господствовавшей
консервативной лечебной тактики уже
на второй год Первой мировой войны.
В значительной степени «консерва
тизм» хирургической тактики опре
делялся и развитием физической анти
септики, точнее, широким применением
тампонов с антисептическими веществами. Л.П. Пелехин в 1868 г. рекомендовал использовать для лечения
гнойных ран отсасывающие тампоны
(марля, льняная ткань) с антисептическими растворами (ксероформ, йодоформ и др.). Н.В. Склифосовский в
1872 г. на основании физических законов капиллярности и осмотических
свойств перевязочного материала из
льняных тканей доказал их отсасывающее действие и охарактеризовал тампоны как «конгломерат дренажей». Он
рекомендовал тампонировать раны «с
сильно ушибленными, раздавленными
тканями, пропитанными кровоподтеками» [Поляков Н.Г., 1978].
Особое значение в этом плане имела работа М.Я. Преображенского «Физическая антисептика при лечении ран»
(1894). В ней даны теоретические обоснования лечения инфицированных
ран асептическими повязками, что в
немалой степени повлияло на утверждение концепции Э. Бергмана. Фактически до настоящего времени основы
учения М.Я. Преображенского о физической антисептике находят широкое
применение в клинической практике.
Рана — механическое повреждение
органов и тканей, сопровождающееся
нарушением целостности кожи и слизистых оболочек (покровных тканей).
Тема 10
В оценке клинического течения
раневого процесса, прогнозирований
вида заживления большое значение
имеет правильный выбор ее критериев, объективная классификация как
определенной стадии заживления, так
и характера самой раны.
В основу классификации ран
положены различные признаки.
По условиям возникновения раны
делятся на 4 группы:
1. Хирургические (операционные) раны — наносимые при соблюдении правил асептики и антисептики, с
учетом анатомо-физиологических особенностей, особенностей разъединя
емых тканей, с использованием методов обезболивания.
2. Случайные раны, наносимые
в различных условиях бытовой, производственной обстановки, уличная
травма.
3. Раны, нанесенные в боевой
обстановке. Во-первых, они отличаются от всех ран рядом характерных
особенностей, во-вторых, они часто
носят массовый характер.
4. Умышленные раны — нанесенные с суицидальной целью или целью членовредительства.
Классификация ран
в зависимости
от инфицирования
1. Асептические раны.
2. Контаминированные или мик
робно-загрязненные раны.
2.1. первично контаминированные;
2.2. вторично контаминированные.
3. Инфицированная рана.
Асептическая рана — это понятие не столько микробиологическое,
сколько клиническое. Оно обозначает,
что в данных условиях опасность развития хирургической инфекции минимальна.
К асептическим ранам относятся
операционные раны, не связанные со
вскрытием гнойников. В этих ранах
микрофлора либо отсутствует, либо
высеваются непатогенные микроорганизмы в небольшом количестве (менее
1х102 микробных тел на 1 грамм ткани). Кроме того, в разряд асептических
ран могут переходить случайные резаные раны мягких тканей вследствие
«очищения» их от микробов истекающей из раны кровью.
Микробно-загрязненная или контаминированная рана — это состояние,
когда в рану попали микроорганизмы, но
общие и локальные механизмы защиты способны сдерживать их на стадии
инкубационного процесса и в ране никаких клинических признаков инфекционного процесса нет. Принято различать
первичное и вторичное микробное
загрязнение раны. Первичное загрязнение наступает в момент нанесения повреждения и характерно для травматических и огнестрельных ран. Вторичное
загрязнение раны, как правило, связано
с нарушением правил асептики во время
перевязок и часто является проявлением
внутрибольничной инфекции.
Вместе с тем присутствие микробов
в ране (патогенных) в количестве до
1х104 г/ткани еще не делает развитие
инфекционного процесса или нагноения раны обязательным. Все случайные, умышленные раны и раны, полученные в боевой обстановке, являются
микробнозагрязненными.
Инфицированная рана — это
рана, в которой происходит развитие
инфекционного процесса, обусловленного нарушением равновесия между
микробами, попавшими в рану и защитными силами организма, что проявляется клиническими симптомами
воспаления. При этом микробы начинают размножаться в глубь жизне-
223
способных тканей, в лимфатические и
кровеносные пути.
В экспериментальных и клинических условиях было установлено, что
для развития инфекционного процесса
в ране необходимо, чтобы общее количество микробов в 1 гр ткани превысило некий «критический уровень»,
который составил от 1х105 — 106 бактерий в 1 грамме ткани.
По механизму нанесения повреждения и характеру ранящего предмета выделяют раны:
1. Резаные (vulnus incisum);
2. Колотые (vulnus punctum);
3. Рубленые (vulnus caesum);
4. Ушибленные (vulnus contusum);
5. Рваные (vulnus laceratum);
6. Раздавленные;
7. Скальпированные;
8. Размозженные (vulnus conqu
assatum);
9. Укушенные (vulnus morsum);
10. Огнестрельные (vulnus sclo
petarium).
Резаная рана наносится острым
предметом, характеризуется ровными
краями, минимальным объемом поврежденных тканей, незначительным
воспалением в краях раны и невыраженными расстройствами трофики.
При этом длина раны преобладает над
ее глубиной (рис. 79).
Колотая рана отличается от резаной значительным преобладанием глубины над длиной, т. е. глубоким, узким
раневым каналом, который нередко
может проникать в различные полости организма и повреждать жизненно
важные органы. Это обуславливает высокую опасность таких ран.
Рубленая рана возникает от удара тяжелым острым предметом, имеет
большую глубину и большие размеры,
чем резаные раны.
224
Текстовый модуль 4
Тема 10
Рис. 80. Рваная рана стопы
Рис. 79. Травматическая рана
Ушибленная рана возникает от
удара тупым предметом или при ударе
о тупой предмет. Приводит к небольшим нарушениям целостности покровных тканей, но вызывает значительные
расстройства трофики в краях поврежденных тканей в результате их ушиба,
что приводит к их некрозу.
Рваная рана сопровождается разрывами кожи и подлежащих тканей, в
том числе сосудов и нервов, что обуславливает обширные регионарные
расстройства кровотока и иннервации
(рис. 80).
Раздавленная рана — небольшие
по площади дефекты кожи, образующиеся вследствие длительного действия тяжелого предмета. При этом
все подлежащие ткани в зоне действия
сдавливающего агента подвергаются
разрушению.
Скальпированная рана характеризуется полной или частичной отслойкой кожи от подлежащих тканей.
Такие раны возникают при попадании
конечностей во вращающиеся механизмы машин, под колеса транспорта.
Эти раны обычно сильно загрязнены.
Размозженные раны возникают
под действием большой силы, вызывающей разрыв и размозжение тканей.
При таких ранах создаются условия
для накопления и всасывания огромного количества токсинов в организм
человека, что обусловливает тяжелый
эндотоксикоз.
Укушенная рана образуется вследствие укуса животными или человеком,
отличается обильным микробным загрязнением. Нередко через раневой
дефект заносится яд, вирус бешенства
и другие опасные ингредиенты, в том
числе и анаэробы.
Огнестрельная рана возникает в
результате воздействия огнестрельных
ранений пулями, осколками снарядов
и др. предметами, имеющими высокую
кинетическую энергию ранящего снаряда, что обуславливает сложную форму раневого канала, обширность зоны
поражения, высокую степень микробного загрязнения.
Огнестрельная рана имеет три зоны
повреждения:
1. Зона раневого канала в центре.
2. Зона ушиба тканей и первичного
некроза по краям раневого канала.
3. Зона молекулярного сотрясения
или вероятного вторичного некроза (вокруг зоны ушиба тканей).
Основной отличительной особенностью их является различный объем
разрушения тканевых элементов в момент ранения, расстройство крово- и
лимфооттока и иннервации в области
краев раны.
Раны резаные, колотые и раны рубленые относят к ранам с малой зоной
повреждения, т. к. расстройство кровотока, лимфообращения и иннервации
при такого рода повреждениях минимальны.
К ранам с большой зоной повреждения относятся раны ушибленные,
рваные, раздавленные, скальпированные, размозженные, укушенные и
огнестрельные. Все они характеризуются значительными расстройствами
трофики в краях ран, обусловленными
плохим кровообращением, нарушенным лимфооттоком и иннервацией, что
осложняет их способность быстро заживать и почти всегда инфицироваться.
Кроме того, различают раны касательные, сквозные, слепые, проникающие и непроникающие в полости;
с повреждением и без повреждения
внутренних органов; одиночные, множественные, сочетанные и комбинированные.
При касательном ранении образовавшийся раневой канал не имеет
одной стенки. При слепом ранении нет
выходного отверстия, и раневой канал слепо заканчивается в тканях; при
сквозном ранении имеются входное и
выходное отверстия.
Проникающим называют ранение,
при котором ранящий предмет попадает в какую-либо полость (плевральную,
брюшную, суставную полости, полость
сердца, камеры глаза, придаточные пазухи носа и др.).
Множественное ранение возникает
при повреждении двух и более органов
или областей тела несколькими агентами одного и того же вида оружия (пулями, осколками).
При сочетанном ранении имеется
поражение двух и более органов или
225
смежных областей одним и тем же ранящим предметом.
Комбинированное ранение возникает в результате действия на организм
человека двух и более повреждающих
агентов (механических, физических,
термических, психических).
Клиническая картина ран слагается из ряда клинических симптомов,
главными из которых являются:
1. Боль.
2. Кровотечение.
3. Зияние.
4. Местные и общие функциональные
расстройства.
Боль в момент ранения определяется повреждением рецепторов и нервных стволов, ее интенсивность зависит
от локализации и вида раны, а также от
состояния пострадавшего.
Пульсирующая боль, появившаяся в области раны спустя некоторый
промежуток времени после ранения,
характеризует присоединение инфекционного процесса в ране.
Кровотечение зависит от характера и диаметра поврежденного при
ранении сосуда. Наиболее интенсивны
и опасны кровотечения из полостей
сердца и крупных артериальных и венозных стволов.
Зияние — расхождение краев раны,
связанное с эластическими свойствами
кожи, более выражено в ране, расположенной перпендикулярно направлению эластических волокон кожи (лангеровских линий), носящих название
гребешков кожи, мышечных и фасциальных волокон.
Функциональные расстройства
при открытых повреждениях могут быть:
1. Местные, они обусловлены местом
ранения и поврежденным органом.
2. Регионарные, вызванные нарушением крово- и лимфооттока и иннервации.
226
Текстовый модуль 4
3. Расстройства, связанные с нарушением функций жизнеобеспечения
(повреждение жизненно важных органов, развитие коллапса, шока).
4. Расстройства, связанные с присоединением хирургической инфекции, вторичной альтерацией (развитие
эндотоксикоза, токсического шока).
Течение раневого процесса
Совокупность биологических явлений, последовательно развивающихся в ране, принято называть раневым
процессом. Раны различных областей
и органов сходны по своим признакам
и имеют общие закономерности развития и течения раневого процесса. Клиническое течение раневого процесса
определяется зоной повреждения, степенью микробного загрязнения раны,
иммунологическими особенностями
организма и обычно заканчивается заживлением раны.
Длительное время в клинической
практике преобладала классификация
И.Г. Руфанова (1954), разделявшая течение раневого процесса на две фазы:
первая фаза — гидратация, переход геля
в золь, очищение раны от мертвых тканей; вторая фаза — фаза дегидратации,
гранулирования и регенерации, которая
характеризуется дегидратацией тканей.
В настоящее время общепризнанна
классификация течения раневого процесса, предложенная R. Ross (1968), который выделяет три фазы:
1. Воспалительная фаза.
2. Фаза пролиферации.
3. Фаза реорганизации и ремоделирования рубца.
Воспалительная фаза продолжается около 3-5 суток. Это фаза направлена на очищение раны от нежизнеспособных тканей, продуктов их распада
и подготовку поврежденных тканей к
процессу заживления дефекта.
Тема 10
Первый период этой фазы отражает
систему последовательных сосудистых
реакций, характеризующих механизм
острого воспаления. При этом важную
роль играют вещества, катализирующие сосудистую реакцию:
1. Протеаза — плазмин, калликреин,
глобулиновый фактор проницаемости;
2. Полипептиды — лейкотоксин, брадикинин, каллидин;
3. Амины — гистамин, серотонин.
Одновременно происходит местная гемостатическая реакция, локализирующая воспалительную реакцию
в пределах тканей, окружающих рану.
Активное участие при этом принимают
нейтрофилы, макрофаги.
Вторая фаза — пролиферативная —
начинается с 3-4-х суток после нанесения ранения. Она тем короче, чем
меньше были повреждены при ранении
клетки и ткани. По мере того, как фибрин подвергается местному фибринолизу, он замещается капиллярными и
вновь образованными коллагеновыми
волокнами. При этом бурно размножающийся эндотелий капилляров формирует петли капилляров, в которые
проникают фибробласты, где они размножаются и продуцируют коллаген.
Эта фаза заживления продолжается от
2-х до 4-х недель в зависимости от локализации и величины раны.
В заживающей ране формируются следующие слои грануляционной ткани:
1. Поверхностный слой — лейкоци
тарно-некротический.
2. Слой капиллярных петель с ги
стиоцитами и полибластами.
3. Слой вертикальных сосудов с фибробластами.
4. Созревающий слой — вертикальные сосуды с фибробластами и
коллагеновыми волокнами (при-
мерное соотношение фибробластов
и коллагена 4:1).
5. Слой горизонтальных сосудов —
горизонтально
расположенные
сосуды по отношению к раневому
каналу с фибробластами и коллагеном (соотношение которых 1:1).
6. Слой фиброзной ткани, среди которой имеются фибробласты и фиброциты (соотношение которых
1:6; 1:8).
Морфологическая последовательность развития фиброзной ткани (рубцовой) следующая:
1. Коллаген структуируется в волокна.
2. Волокна структуируются в пучки.
3. Пучки коллагеновых волокон
гиалинизируются и превращаются в
фиброзную ткань.
Так, безо всякого перехода начинается третья фаза течения раневого процесса — фаза реорганизации и ремоделирование рубца.
В зависимости от объема образующейся грануляционной ткани и
времени заживления клиницисты
выделяют 3 вида заживления ран:
1. Заживление первичным натяжением.
2. Заживление под струпом.
3. Заживление вторичным натяжением.
Заживление первичным натяжением — это такой процесс, когда в ране
отсутствуют нежизнеспособные ткани,
т. е. рана характеризуется малой зоной
повреждения, количество микробных
тел меньше 1х105 — 1х106 в 1см2 ткани,
края раны плотно соприкасаются, а резистентность макроорганизма высокая.
В этих условиях петли вновь образующихся капилляров в краях раны переплетаются между собой, а формирующийся один ряд грануляционной ткани
обеспечивает быстрое и надежное заживление раны в течение 6-8 дней.
227
Заживление под струпом является разновидностью заживления раны
первичным натяжением. Так заживают
поверхностные раны, которые покрываются корочкой, состоящей из свернувшейся или высохшей крови, лимфы,
детрита клеток. Этот струп (корочка)
защищает рану от вторичной контаминации и неблагоприятных воздействий
внешней среды.
Поскольку дефект тканей при этом
небольшой, образующийся один слой
грануляционной ткани восполняет
его. Одновременно с образованием
грануляций происходит размножение
покровного эпителия и наступает эпителизация. Корочка при этом отпадает
самостоятельно к 6-8 суткам, когда под
ней уже образуется кожный белесоватый рубец.
Вторичным натяжением заживают раны с большой зоной повреждения, содержащие нежизнеспособные
ткани; раны инфицированные, в которых происходит процесс развития хирургической инфекции; зияющие раны,
в которых их края находятся на значительном удалении друг от друга. В этих
условиях рана выполняется многослойной грануляционной тканью, и
заживление затягивается на длительный срок — 2-3 недели и более. При
вторичном заживлении эпителизация
отсутствует до тех пор, пока полностью
не завершится замещение раневого дефекта грануляциями до уровня кожи.
Прочность рубцовой ткани по
отношению к исходной прочности
ткани:
■ на 3-4 день составляет около 10%;
■ на 5-6 день составляет около
30-40%;
■ на 7-9 день составляет около
50-60%;
■ на 14-15 день составляет около
80-85%.
228
1.
2.
3.
4.
5.
6.
7.
8.
9.
Текстовый модуль 4
Особенности регенерации
клеток и заживление
поврежденных тканей:
Нейрон не регенерируется. Нервное волокно регенерирует очень
медленно — 1-2 мм в сутки.
Мышцы — истинная регенерация
возможна при небольших повреждениях, при наличии дефекта заживление осуществляется рубцеванием.
Сухожилия заживают через образование рубца.
Хрящи — при повреждении волокнистого рубца происходит его регенерация; гиалиновые хрящи заживают через рубцевание.
Кости хорошо регенерируют.
Паренхиматозные органы — возможна регенерация истинная и
ложная; дефекты органов заживают рубцеванием.
Кровеносные сосуды: капилляры и мелкие сосуды регенерируют
быстро, крупные (эластические,
мышечно-эластические) заживают
рубцом. Возможна трансформация
мелких сосудов в крупные и восстановление кровотока за счет коллатерального кровоснабжения.
Лимфатические капилляры и ретикулярные сосуды регенерируют,
трункулярные сосуды с клапанным
аппаратом образуются вследствие
трансформации ретикулярных сосудов в течение 3-4 месяцев.
Эпителий, эндотелий, мезотелий
регенерируют довольно быстро.
Лечение ран
Целью лечебных мероприятий при
наличии раны является восстановление в кратчайшие сроки первоначальной формы и функций поврежденного
органа и ткани.
Тема 10
Для того чтобы добиться поставленной цели, необходимо решить ряд
задач: осуществить окончательную
остановку кровотечения; предупредить
развитие раневой инфекции или подавить уже развившийся инфекционный
процесс в ране; при наличии соответствующих показаний и условий выполнить частичное или полное восстановление нарушенных и анатомических
соотношений тканей.
Лечение больных с открытыми
повреждениями представляет собой
систему мероприятий, включающую
в себя: первую медицинскую помощь;
хирургическую обработку раны; комплекс мер, направленных на повышение резистентности организма; предупреждение инфекции или борьбу с ней
и другими осложнениями; применение методов физиотерапии, лечебной
физкультуры и др. Степень использования этих мероприятий, их последовательность, время выполнения определяются характером и локализацией
раны и состоянием больного, а в военное время — боевой и медицинской
обстановкой.
Выделяют:
1. Оперативный метод лечения ран.
2. Консервативный метод лечения ран.
3. Комбинированный метод лечения
ран.
Хирургическое и медикаментозное
лечение гнойной раны не являются
конкурирующими или взаимозаменяющими методами лечения. Их нужно
рассматривать только как взаимодополняющие компоненты комплексной
терапии гнойной раны. Лишь в редких
случаях, при незначительной степени
развития гнойного процесса, удается добиться эффекта только с помощью антибактериальной терапии или
каких-либо химиопрепаратов. Точно
так же лечение нагноившейся раны
редко ограничивается оперативным
лечением без направленной антибиотикотерапии.
И все же в подавляющем большинстве случаев лишь оперативное лечение может обеспечить необходимые
условия для оптимального течения
раневого процесса и заживления раны
первичным натяжением. Адекватное
хирургическое вмешательство создает и наилучшие условия для действия
антибактериальных средств, ликвидируя возможности для развития раневой
микрофлоры.
Оперативный метод
лечения ран
Основой оперативного метода
лечения ран является хирургическая
обработка раны — оперативное вмешательство с применением режущих
инструментов, направленное на предупреждение или лечение раневой инфекции, остановку кровотечения, частичное или полное восстановление
анатомических соотношений поврежденных тканей.
Хирургическая обработка подразделяется на частичную (неполную) и
полную. В принципе хирургическая
обработка должна быть полной, т. е.
обеспечивать для данных конкретных
условий предупреждение или ликвидацию хирургической инфекции, окончательную остановку кровотечения,
частичное или полное восстановление
анатомических соотношений поврежденных тканей. Хирургическая обработка в зависимости от характера повреждения, срока, прошедшего после
ранения, наличия или отсутствия раневой инфекции может быть выполнена
различными техническими приемами:
1. Рассечение раны.
2. Рассечение с частичным иссечением раны.
229
3. Частичным иссечением раны.
4. Полным иссечением раны.
Компоненты (составные части) хирургической обработки:
1. Ревизия раны (часто сочетается с
рассечением ее краев).
2. Временная остановка кровотечения.
3. Удаление инородных тел.
4. Иссечение нежизнеспособных тканей.
5. Окончательная остановка кровотечения.
6. Промывание раны.
7. Наложение швов или (и) дренирование раны (рис. 81).
Хирургическая обработка раны,
в принципе, никогда не ликвидирует
полностью микробное ее загрязнение,
но уменьшает количество микробных
тел в 1 см2 ткани на 2-3 порядка.
Современная классификация
хирургической обработки ран
Первое по счету оперативное вмешательство у пострадавшего по поводу
данного ранения называется первичной
хирургической обработкой (рис. 82).
Опыт Второй мировой войны
(1941—1945 гг.) показал, что сроков,
ограничивающих выполнение первичной хирургической обработки ран, нет.
Вместе с тем, чем раньше по сроку проводится хирургическая обработка, тем
ее результаты лучше (Т.Я. Арьев, 1950;
С.С. Гирголав, 1950; Н.Н. Еланский,
А.Н. Беркутов, 1965).
Повторное оперативное вмешательство у пострадавшего по поводу
данного ранения называется вторичной хирургической обработкой.
Цель и задачи первичной и вторичной хирургической обработки одни и те
же. Наиболее часто вторичная хирургическая обработка ран производится в
тех случаях, когда первичная обработ-
230
Текстовый модуль 4
Тема 10
а
б
в
г
Рис. 82. Схема ПХО раны
ка оказалась неэффективной. Поэтому
частота вторичной хирургической обработки является своеобразным критерием уровня квалификации сотрудников данного лечебного учреждения.
Существуют две классификации
хирургической обработки ран, в основе
одной из них лежит временной критерий (планово-организационная классификация), в основе другой — состояние раневого процесса.
Планово-организационная
классификация хирургической
обработки ран.
1. Первичная обработка (первая
по счету).
1.1. Ранняя — операция, выполняемая
в первые 24 часа после ранения.
1.2. Отсроченная — операция, выполняемая в сроки 24-48 часов после
ранения при условии назначения
антибактериальных препаратов с
профилактической целью.
1.3. Поздняя — операция, выполняемая
спустя 24 часа после ранения, если
не проводилась антибактериальная
терапия или спустя 48 часов, если
таковая проводилась.
2. Вторичная обработка — вторая
операция, выполняемая по поводу
данного ранения.
д
Рис. 83. Основные виды швов ран: а, б) узловой;
в) многостежковый; г) по Донати; д) П-образный
3. Повторная вторичная обработка — операция, выполняемая повторно при неэффективности вторичной хирургической обработки.
Клиническая классификация
хирургической обработки ран
1. Первичная обработка
1.1. Ранняя — операция, выполняемая до развития раневой инфекции.
Эта операция интегрально включает
отсроченную первичную обработку,
поскольку она тоже выполняется до
развития раневой инфекции.
1.2. Поздняя — операция, выполняемая в условиях развившейся раневой инфекции.
2. Вторичная обработка —
вторая (третья, четвертая…) операция
по поводу данного ранения, выполняемая при неэффективности первичной
хирургической обработки или развитии вторичных изменений в ране.
Следовательно, все повторные оперативные вмешательства у пациента по
поводу данного ранения с клинической
точки зрения относятся к вторичной
хирургической обработке.
Обе приведенные классификации
имеют право на существование, поскольку и та, и другая позволяют объективно оценивать результаты оказания помощи больным с открытыми
повреждениями, выявлять недостатки
работы отдельных этапов эвакуации
или лечебных учреждений. Попытка
свести обе классификации в единую порождает неразрешимые противоречия.
В целях ускорения заживления
раны, уменьшения ее площади широко
применяется наложение швов.
Классификация швов в зависимости от сроков их наложения.
1. Первичные швы накладываются сразу после хирургической обработки раны (рис. 83).
Показания к первичным швам: в
ране не должно быть некротических
тканей и инородных тел; стабильный
(надежный) гемостаз.
2. Отсроченные первичные швы
накладываются через 3-6 суток после
хирургической обработки раны.
Если после хирургической обработки остаются сомнения в жизнеспособности оставляемых тканей (огнестрельная рана), если рана исходно
была значительно загрязнена (земля,
органические вещества), если в ране
остаются инородные тела, имеется нестабильный гемостаз или признаки развития раневой инфекции — такие раны
оставляют открытыми, осуществляя
дренаж и консервативное лечение. Через 3-6 дней, при благоприятном течении раневого процесса (отсутствие вторичного некроза и признаков раневой
инфекции), рана закрывается швами.
Такие швы называются отсроченными
первичными швами.
231
Провизорные швы — это один из методов технического выполнения отсроченных первичных швов. Сразу после
хирургической обработки накладываются швы, но они не затягиваются и не
завязываются, рана остается открытой.
Осуществляют дренирование и консервативное лечение. При благоприятном
течении раневого процесса лигатуры
затягиваются, рана закрывается.
Вторичные швы могут быть ранними и поздними.
Ранние вторичные швы накладываются через 10-15 дней после хирургической обработки раны. Если после хирургической обработки в ране возник
вторичный некроз, такие раны либо
подвергаются вторичной хирургической обработке, либо ведутся консервативно до очищения раны и появления грануляций, затем накладываются
швы, по возможности не повреждая
грануляций.
Поздние вторичные швы накладываются через 20-30 и более дней после
ранения. Если в ране с большой зоной
повреждения фаза очищения затягивается на 3-4 и более недель, то образуется рубцовая ткань, фиксирующая
края раны. Поэтому закрыть рану с помощью обычных швов не удается. Производится иссечение рубцовой ткани,
грануляций, освобождение краев, а затем послойное закрытие раны.
При наложении вторичных швов
обязательно выполняют дренирование раны трубчатым дренажом через
отдельный разрез (прокол) кожи и
тканей.
Факторы, определяющие характер и объем хирургического
вмешательства при оперативном лечении ран:
1. Целевая установка — главная для
данных условий задача.
232
Текстовый модуль 4
2. Характер повреждения, в том числе
наличие радиоактивного и токсического загрязнения раны.
3. Срок, прошедший после ранения.
4. Общее состояние больного.
5. Условия оказания помощи (квалификация хирурга, обстановка,
учреждение, где оказывается помощь).
Общие принципы реализации
хирургической обработки ран.
1. Раны с малой зоной повреждения, как правило, не иссекаются.
2. Раны с большой зоной повреждения, как правило, иссекаются.
3. Раны в области лица, головы,
кисти, пальцев либо не иссекаются,
либо проводится частичное иссечение.
4. В поздние сроки, в связи с развитием инфекционного процесса, рану
полностью иссекать нельзя. В основе
хирургической обработки в этих случаях лежит рассечение раны или рассечение с частичным иссечением некротических тканей.
5. Раны, загрязненные радиоактивными и токсическими веществами,
по возможности иссекаются полностью.
6. Огнестрельную рану полностью иссечь практически невозможно.
7. Первичная хирургическая обработка не показана при следующих
огнестрельных ранах (В.А. Долинин,
Н.П. Басенков, 1982; Ю.Г. Шапошников, 1984).
7.1. Сквозные пулевые ранения
мягких тканей конечностей с точечными входным и выходным отверстиями, при отсутствии отека и признаков
повреждения крупного кровеносного
сосуда.
7.2. Пулевые и мелкоосколочные
раны груди, если нет видимой гематомы, раздробления кости, открытого
Тема 10
клапанного пневмоторакса или значительного гемоторакса.
7.3. Поверхностные (не глубже
подкожной клетчатки), часто множественные раны, полученные вследствие
действия мелких осколков.
Особенности хирургической
помощи при минно-взрывных
повреждениях конечностей
Минно-взрывные травмы характеризуются грубыми разрушениями всех
тканей, значительной кровопотерей,
тромбозами сосудов, загрязнениями
токсическими продуктами взрыва не
только в области повреждения, но и
далеко за ее пределами, особенно проксимальной части пораженной конечности. Учитывая изложенное, имеются
особенности оказания помощи подобным пострадавшим.
1. При минно-взрывных повреждениях конечности, вне зависимости
от наличия кровотечения, обязательно накладывается жгут на расстоянии
8-10 см от линии повреждения.
2. Ампутация поврежденных частей конечности производится, как
правило, после стабилизации основных параметров гемодинамики.
3. Ампутация выполняется как
экстренное оперативное вмешательство не позже 3-4 часов после ранения.
4. Жгут, наложенный при оказании первой помощи в целях остановки
кровотечения и/или предупреждения
развития раннего эндотоксикоза, во
время ампутации конечности не снимается.
5. Уровень ампутации конечности во всех случаях должен быть не менее 5-6 см выше уровня наложенного
жгута.
6. Первичные швы при минновзрывных травмах конечностей не накладываются.
1.
2.
3.
4.
5.
6.
Особенности обработки ран,
загрязненных радиоактивными
веществами
До ревизии раны производятся:
первичный дозиметрический контроль и промывание, которое может обеспечить удаление из раны
примерно 20% радионуклидов.
Удаление инородных тел является
обязательным компонентом.
Иссечение раны производится по
возможности полностью (края и
дно).
После завершения хирургической
обработки производится вторичный дозиметрический контроль.
При неэффективности хирургической обработки раны производится повторная хирургическая обработка.
При достаточной эффективности
обработки рана обязательно должна быть закрыта первичными или
отсроченными первичными швами.
Компоненты (способы)
консервативного лечения ран
1. Туалет раны и ее закрытие (повязка, коагулирующие вещества, ме-
2.
3.
4.
5.
6.
7.
8.
9.
1.
2.
3.
4.
5.
6.
Рис. 81. Различные виды дренирования
233
дицинский клей, клеол, лейкопластырь, наложение швов).
Очищение раны: гипертонические
растворы, протеолитические ферменты, гидрогели; проточная, вакуумная, ультразвуковая кавитация.
Антибактериальная терапия — антибиотики, антисептики.
Стимуляция регенерации — местная, общая.
Гипербарическая оксигенация.
Применение аэротерапевтических
установок (АТУ).
Высушивание некротических тканей проточным теплом, сухим очищенным воздухом.
Гнототерапия — лечение в регулируемой абактериальной среде.
Применение радиопротекторов в
стадии первичной лучевой реакции
или в латентный период лучевой
болезни.
Препараты, применяемые
в качестве радиопротекторов:
Цистамин дегидрохлорид.
Батилол.
Мексамин.
Антиоксиданты (витамины А, В5,
С, Е).
Антигистаминные (пипольфен, димедрол, супрастин, диазолин).
Анаболиты (ретаболил, феноболил,
метандростенолон, оротат калия).
Комбинированный метод лечения — наиболее распространенный и
наиболее эффективный, он включает
в себя оперативный метод и элементы
консервативного. Как правило, лечение
начинается с оперативного метода, а
потом назначается консервативная
терапия. В других случаях лечение начинается с консервативного, но на какомто этапе включается оперативное, а
затем снова консервативное лечение.
234
1.
2.
3.
4.
5.
Текстовый модуль 4
Основные принципы лечения
ран, осложнившихся инфекционным процессом
Хирургическая обработка раны,
дренирование.
Местное и общее воздействие на
возбудителей инфекционного процесса: антибиотики, антисептики,
иммунопрепараты.
Система комплексной детоксикации: гемодилюция, форсированное
выведение, связывание, нейтрализация, разрушение токсинов, метаболитов, биологически активных
веществ.
Регуляция метаболизма: анаболические стероиды (ретаболил, феноболин), переливание глюкозы с
инсулином, белковых препаратов
(смеси аминокислот, гидролизаты,
альбумин, плазма).
Регуляция водно-электролитного
баланса.
6. Стимуляция иммунологической и
неспецифической устойчивости организма.
Воздействие на течение раневого процесса при гнойных ранах
В фазу очищения — усиление реактивной гиперемии, эксудации и отторжения (расплавления) некротических
тканей. Применяются гипертонические
растворы, мазь Вишневского, гидрогели, протеолитические ферменты, УВЧ,
различные способы кавитации, лазерная и плазменная обработка раны.
В стадию пролиферации (гранулирующая рана) целесообразна стимуляция регенерации и эпителизации,
защита раны от повреждения. Используются мази, содержащие соли цинка,
витамины, облепиховое, шиповниковое масла, индифферентные мази,
УФО, широко применяется наложение
вторичных швов.
Контрольные вопросы по теме занятия
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
Понятие раны.
Классификация ран по причине повреждения.
Классификация ран по характеру повреждения.
Классификация ран по отношению к полостям тела.
Классификация раневых осложнений.
Фазы течения раневого процесса.
Клиническая картина ран.
Признаки проникающего характера ран.
Хирургическое лечение ран.
Медикаментозное лечение ран.
Первичная хирургическая обработка.
Вторичный шов: показания к наложению.
Инфекционные осложнения ран.
Методы лечения чистых ран.
Методы лечения гнойных ран.
ТЕМА №11.
Переломы. Классификация. Фазы сращения перелома и слои костной мозоли. Клиника, диагностика и методы лечения переломов. Гипсовые повязки. Осложнения
и последствия. Лечение переломов. Транспортная иммобилизация повреждений.
Вывихи, классификация, механизм возникновения, клиника и лечение
1. Актуальность темы
Среди разнообразных повреждений человеческого тела, с которыми
приходится сталкиваться врачу, значительное место занимают вывихи суставов и переломы костей.
Важность этих видов повреждений
(травм) заключается не только в их
частоте (в связи с ростом травматизма, особенно дорожного), но особенно
в их влиянии на здоровье и трудоспособность, а иногда и на жизнь пострадавшего.
От правильности и своевременности оказания первой помощи во многом зависит результат лечения.
Правильно наложенная шина предупреждает развитие шока, вторичного
смещения и повреждения соседних органов.
■
■
■
■
■
■
■
■
2. Учебные цели.
Определение перелома. Классификация;
Механизмы возникновения переломов;
Виды смещения костных отломков;
Механизм образования костной мозоли;
Клиническая картина перелома;
Методы диагностики переломов;
Оказание первой помощи при переломах, ее задачи;
Средства транспортной иммобилизации. Конструкция шин Дитерихса
и Крамера;
■
■
■
■
■
■
■
■
■
■
■
Оказание первой доврачебной помощи пострадавшему с переломом:
наложение шин из подручного материала, шин Крамера и Дитерихса;
Основные задачи лечения переломов
в стационаре;
Основные виды закрытого и открытого методов лечения. Обезболивание;
Фиксационный и вытяжной методы
лечения;
Показания к оперативному лечению
переломов;
Способы оперативного лечения при
переломах;
Исходы лечения переломов;
Вывихи, определение, классификация. Механизм возникновения;
Клиническая картина вывихов;
Дифференциальная
диагностика
между переломом и вывихом;
Методы лечения вывихов.
3. Самостоятельная
работа студентов
ПЕРЕЛОМЫ
Переломы (fractura) — нарушение целостности кости, вызванное насилием или патологическим процессом
(опухоль, воспаление и т. д.).
Классификация
1. По происхождению и причинам развития — врожденные
(внутриутробные) и приобретенные.
Приобретенные подразделяют на травматические и патологические.
236
Текстовый модуль 4
2. По состоянию покровных
тканей:
■ открытые (f. Aperta)
■ закрытые (f. Clausa)
3. По локализации переломы
делятся на :
■ эпифизарные
■ метафизарные
■ диафизарные
4. По особенностям линии перелома:
■ поперечные (f. Transvetrsa)
■ косые (f. Obliqna)
■ винтообразные (f. Spiralis)
■ оскольчатые (f. Comminuta)
■ вколоченные (f. Impacta)
■ звездчатые (f. Stellata)
■ в детском возрасте по типу «зеленой ветки» и т. д.
Открытый перелом, при котором
имеется повреждение кожных покровов или слизистых, при этом область
перелома сообщается с внешней средой.
Закрытый перелом — без нарушения целостности кожных покровов
над областью повреждения кости.
Травматический
перелом
(f. Traumatica) — перелом здоровой кости вследствие прямого или косвенного
внешнего воздействия.
Патологический (f. Pathologica) — перелом патологически измененной кости, возникший от незначительного механического воздействия (при
остеомиелите, туберкулезе и т.д.).
Компрессионный
перелом
(f. Compressione) — перелом губчатой кости, возникший под действием
сжатия.
Косой перелом — при котором поверхность излома расположена под
углом к продольной оси кости.
Бывает краевой (f. Marginalis) перелом, он характеризуется отделением
отломка от стенки кости.
Тема 11
Поперечный перелом — при котором
поверхность излома расположена перпендикулярно к продольной оси кости.
Продольный перелом (f. Longitudinalis) — поверхность излома параллельна
продольной оси кости.
Как и вывихи, переломы могут быть
осложненными (f. Complicata), когда перелом сопровождается повреждением
близлежащих сосудов и нервов и комбинированными, когда есть еще дополнительная травма каких-либо органов
еще одним повреждающим фактором.
В зависимости от количества поврежденных костей бывают одиночные
и множественные (раздробленные —
чаще при огнестрельных ранениях).
Патанатомия
и патфизиология
переломов
Патологоанатомически
перелом
представляет собой сложный комплекс, состоящий из сломанной кости,
поврежденных мышц, сосудов, нередко
нервных проводников и кожи, а иногда и спинного мозга (при некоторых
переломах позвоночника), мочевого
пузыря, уретры, прямой кишки (при
некоторых переломах костей таза).
Целая кость препятствует сближению точек прикрепления мышц. После
перелома и, следовательно, устранения
этого препятствия мышцы сокращаются вследствие эластической ретракции,
а раздражение различных рецепторных
окончаний повышает их тонус. Наступает нарушение физиологического
равновесия мышц. Помимо того, при
переломе повреждается и сама мышечная ткань, а излившаяся кровь (гематома), имбибируя мышцы и другие ткани,
затрудняет крово- и лимфообращение
тканей, возникают дегенеративные изменения в них и появляется отек поврежденной поверхности конечности.
Повреждение острыми концами отломков крупных сосудов с развитием
наружного кровотечения при наличии
раны или внутритканевого кровотечения при закрытой травме ведет к острой
анемии. При повреждении крупных сосудов гематома может достигнуть больших размеров, что впоследствии может
обусловить образование ложной травматической аневризмы. Повреждения
сосудов в форме контузий, разрывов
ведут к развитию тромбоза. Поэтому
при переломах обязательно надо исследовать пульс на периферических отделах поврежденной конечности. Точно так же могут повреждаться лучевой
и малоберцовый нервы. Следствием
повреждения нервов могут быть шок и
нарушение движений и чувствительности в дистальных отделах конечности.
Повреждение кожи внешней силой,
производящей перелом, или одним из
отломков кости делают перелом открытым и практически всегда бактериально загрязненным (инфицированным) — флегмона, остеомиелит, сепсис.
Повреждения спинного мозга нередко ведут к непоправимым параличам. Нарушение целостности мочевого
пузыря и прямой кишки, если своевременно не будут приняты необходимые
меры (наложение противоестественного заднего прохода, цистостомы) дают
тяжелые, угрожающие жизни осложнения. Могут иметь место и повреждения
жизненно важных органов (мозг, легкие, печень, селезенка).
Клиника переломов,
симптоматика и диагностика
Непосредственно после травмы,
связанной со значительной болью, наступает ограниченное или полное нарушение функции поврежденного сегмента конечности. Постепенно в течение
нескольких часов быстро нарастает ге-
237
матома, соответствующая области повреждения или распространяющаяся
вдоль фасциальных футляров. Так как
сходная клиническая картина может
наблюдаться и при менее глубоких повреждениях, например, при ушибах, то
клинические признаки переломов принято делить на относительные и абсолютные.
■
■
■
Относительные (недостоверные) признаки переломов:
локализованная болезненность в
области повреждения;
нарушение функции;
опухоль (гематома).
Абсолютные (достоверные)
признаки переломов:
■ деформация (укорочение);
■ крепитация;
■ патологическая подвижность.
Из общих явлений может наблюдаться травматический шок (травматический токсикоз), развивающийся
в связи с сильными болями в области
перелома. Всасывание продуктов распада травмированных тканей может
сопровождаться нарушением функции
почек, что выражается в проявлении в
моче белка, жира, форменных элементов крови и т. д., а также повышением
температуры тела до 37-38°С.
Диагноз перелома
Лечение может быть начато только при установлении диагноза. Самый
ответственный этап лечения — репозиция отломков, следует обычно сразу
же за установлением диагноза, затем
следует период удержания отломков
во вправленном положении и репаративной регенерации костной ткани с
сопутствующими процессами в мягких
тканях — «клиническое течение перелома». Диагностика не всегда легка,
238
Текстовый модуль 4
особенно переломов в области плечевого и локтевого суставов и стопы —
даже для специалистов. Для лечения
мало поставить диагноз — необходимо точно определить направление, характер смещения периферического и
центрального отломков и их взаимное
расположение, а также другие детали.
Решение этих задач возможно только при полном клиническом обследовании больного: жалобы, анамнез,
осмотр, пальпация, перкуссия, лабораторные данные и рентгенологическое
исследование.
Жалобы: время появления болей,
локализация, причина усиления, сос
тояние функции конечности, механизм
травмы. Тщательно собранный анамнез
позволяет оценить состояние больного,
оценить механизм травмы, ее особенности и состояние в момент повреждения
и до поступления в стационар: подвертывание стопы вовнутрь может быть
причиной разрыва наружных связок,
одно- или двухлодыжечного перелома;
подвертывание стопы кнаружи (пронация) — дюпиитреновского перелома костей голени; падение на большой
вертел — вертикального или шеечного
перелома бедра (рис. 84).
Осмотр: выявляет основные симптомы перелома: припухлость и деформацию,
нарушение
функции,
ненормальную подвижность, укорочение, вид кожи и слизистой места перелома — на поверхности кожи могут
появиться пузыри, наполненные прозрачной, а при инфицировании мутной
жидкостью или гноем. Гематомы вызывают нарушение лимфо- и кровообращения (отек) и асептическое воспаление. Окружность сегмента может
увеличиваться в 1,5 раза.
Пальпация: осторожная, одним
пальцем, позволяет выявить, начиная
с отдаленного участка, локальную бо-
Тема 11
лезненность, а иногда патологическую
подвижность и крепитацию. Характерный признак — боль при нагрузке по
оси (давление или легкий удар). Пальпируют пульс, измеряют температуру.
Рентгенологическое исследование
необходимо во всех случаях, даже при
полной уверенности в переломе, т. к.
дает истинное представление о характере повреждения, уточняет плоскость
излома и смещения отломков, их количество, трещины и т. д. Рентгенологическое исследование особенно
необходимо при вколоченных, поднадкостничных и др. трудно распознаваемых переломах.
Заживление переломов.
Репаративная регенерация и их заживление делятся на три периода:
1. Связан непосредственно с травмой
и развитием асептического воспаления.
2. Период костеобразования.
3. Период перестройки костной мозоли.
А
В
Б
Г
Рис. 84. Различные виды
внутрисуставных переломов
Кровь и травматическая отечная
жидкость образуют вокруг костных отломков экстравазат, происходит образование клеток соединительной ткани,
развитие асептического воспаления и
отека. В зоне воспаления — миграция
лейкоцитов и воспалительная экссудация. Явления выражены тем больше, чем выраженнее травма тканей;
при выраженном асептическом воспалении экссудат может скопиться под
эпидермисом области перелома в виде
пузырей, наполненных жидкостью.
Организация и рассасывание экстравазата заканчивается к 5-7 дню (вокруг
отломков), а в щели между отломками
еще остается жидкая кровь и тканевой
детрит. Обширная гематома замедляет
процессы организации и задерживает
консолидацию, одновременно с очищением зоны перелома от погибших
клеток происходит размножение клеток мезенхимы, к 5-7 дню образуется
рыхлая соединительная ткань, соединяющая отломки — первичная мягкая
костная мозоль, которая затем заменяется губчатой костью и потом зрелой
костью. Образование костной мозоли
происходит путем размножения клеток надкостницы (периоста), эндоста,
гаверсовых каналов и параостальных
тканей вокруг места перелома. Все эти
ткани обладают способностью превращаться в остеогенную или остеобластическую ткань, причем каждый из этих
источников обладает способностью
приводить к образованию особого слоя
костной мозоли.
1. Периостальный слой костной мозоли начинает образовываться
с первых дней перелома за счет размножения клеток камбиального, внутреннего слоя надкостницы. К 5-6 дню
дефект между костными отломками
заполняется большим количеством
фибробластов, вновь образованных
239
сосудов, остеобластов, что приводит к
образованию остеоидной ткани, молодой не обызвествленной костной ткани
(первичная костная мозоль). Этот слой
самый массивный, основной. При сохранившейся надкостнице могут восстанавливаться значительные дефекты
костной ткани.
2. Эндостальный, внутренний
слой костной мозоли развивается за
счет клеток эндоста, отломков костного мозга, заполняется дефект между отломками, но слой слабый, менее богат
сосудами — это эндостальный слой.
Чем точнее сопоставлены отломки и
лучше иммобилизация, тем меньше образуется хрящ из первичной клеточной
инфильтрации. При хорошем сопоставлении эндостальная мозоль едва
заметна.
3. Интермедиарный или промежуточный слой костной мозоли
развивается из элементов гаверсовых
каналов костных отломков и занимает
промежуток между периостальным и
эндостальным слоями. Выраженность
этого слоя зависит от толщины коркового слоя кости.
4. Параоссальный слой мозоли
развивается из мягких тканей, окружающих перелом. Формирование значительной параоссальной мозоли обычно
при плохом состоянии отломков и тем
выраженнее, чем большему разрушению подвергались окружающие ткани.
Могут быть нежелательные последствия нейродистрофического характера.
Различают 5 фаз в восстановлении
кости (рис. 85):
1. Образование мезенхимальной ткани. В области перелома из гематомы, отечной жидкости и фибрина
образуется желеподобный «первичный
клей».
2. Дифференциация клеточных
элементов и образование волокни-
240
Текстовый модуль 4
стых структур. В процессе дифференциации мезенхимальной в остеогенную образуется соединительная ткань.
Возможна и хрящевая ткань, характеризующая образование коллагеновых
волокон и клеточно-волокнистых тканей, на основе которых в дальнейшем
откладывается костное вещество.
3. Выпадение остеоида. В коллагеновые волокна соединительнотканной
мозоли внедряются очаги уплотнения —
А
Б
В
гомогенизация с образованием сплошной массы вследствие выпадения белка,
на основе которого и образуются примитивные остеоидные балочки, вначале
единичные, а затем в виде густой сети.
4. Образование и обызвествление остеоидной мозоли. Оссификация мозоли происходит в основном
за счет кальция, куда он поступает из
костной системы и частично из соседних с переломом участков кости.
Г
Д
Е
Ж
Рис. 85. Фазы регенерации кости: а — образование гематомы и мезенхимы («первичный клей»); б — об
разование соединительной (грануляционной) ткани; в — первичная (мягкая) мозоль (фиброзно-хрящевая);
г — вторичная костная мозоль; д, е — перестройка костной мозоли; ж — окончательный вид сросшегося
перелома кости
Таблица 8. Средние сроки сращения некоторых переломов и длительность нетрудоспособности больных
Место перелома
Кости фалангов пальцев
Кости запястья
Лучевая кость:
дистальная часть
диафиз
Локтевая кость
Обе кости предпечья
Плечевая кость:
шейка
диафиз
Ключица
Пяточная кость
Плюсневая кость
Обе лодыжки
Диафиз большеберцовой кости
Медиальный перелом шейки бедра
Диафиз бедра
241
Тема 11
Время сращения (в днях)
Время нетрудоспособности (в днях)
21
28
28-49
42
28-35
56-70
60-75
75-90
42-63
70-84
60-90
105-135
45-60
45-90
21-28
35-42
21-42
45-60
60-75
6 мес
3-3,5 мес
60-75
60-75
30-45
45-75
30-60
60-75
75-105
8-10 мес
5-7,5 мес
5. Перестройка мозоли с замещением незрелых костных структур более зрелыми и адаптация к
статико-динамическим условиям.
Костная мозоль перестраивается соответственно функциональным требованиям, происходит рассасывание
одних структур, создание и укрепление других. Перестройка окончательной мозоли продолжается месяцами и
даже годами, что зависит от адаптации
отломков, величины щели и диастаза
между ними, а также их иммобилизации (табл. 8).
■
■
■
одномоментной ручной тягой;
одномоментной тягой с помощью
экстензионной
компрессионнодистракционных аппаратов (Гидушаури, Илизарова, Сиваша и др.);
постоянным длительным скелетным вытяжением, производимым
до момента консолидации перелома или образования мягкой мозоли
с последующим наложением гипсовой повязки (рис. 86, 87, 88);
Лечение
При лечении перелома необходима
рациональная система, включающая:
1. оказание первой помощи;
2. основное лечение до полного его
срастания кости;
3. функциональное лечение в период
фиксации;
4. лечение переломов костей после
заживления.
Репонирование отломков
Репонирование отломков (репозиция, адаптация, вправление) и удержание их (фиксация, иммобилизация) осуществляется различными способами:
Рис. 87. Аппарат Илизарова для внеочагового
компрессионно-дистракционного остеосинтеза
2
1
3
5
4
5
6
Рис. 86. Аппараты для скелетного вытяжения
Рис. 88. Наложение гипсовой повязки
242
Текстовый модуль 4
Тема 11
ВЫВИХИ
Вывихом (luxatio) называется
стойкое смещение суставных концов
сочленяющихся костей за пределы их
физиологической подвижности, вызывающее нарушение функции сустава.
Рис 89. Оперативный метод лечения переломов —
очаговый, экстрамедулярный остеосинтез
открытым вправлением отломков и
фиксацией различными средствами
остеосинтеза (рис. 89);
■ склеивание костей;
■ использование ультразвука;
■ электросварка.
Репонированные отломки должны быть фиксированы до полного
сращения.
■
1.
2.
3.
4.
5.
Исходы переломов
Сращение с нарушением анатомического строения, функции конечности.
Сращение с нарушением анатомического строения, но с восстановлением функции.
Сращение с восстановлением анатомического строения, но с плохой
функцией.
Сращение с нарушением анатомического строения (укорочение, искривление и т. д.) и плохой функцией.
Отсутствие сращения — псевдоарт
роз.
Классификация
1. По отношению к суставным
поверхностям различают вывих:
■ полный (luxatio completa)
■ неполный (-\\- incompleta)
Полным вывихом считается тот,
при котором суставные поверхности не
соприкасаются.
Неполным или подвывихом считается тот, при котором сохраняется
частичное соприкосновение суставных
поверхностей.
2. По характеру возникновения различают вывихи:
■ Врожденные (l. Congenita) — обусловленные неправильным внутриутробным развитием элементов
сустава (чаще тазобедренный).
■ Приобретенные, развившиеся в
результате травмы (l. Teaumatics)
или патологические — в результате
какого-либо заболевания, приводящего к нарушению сустава (рис. 90).
Также можно выделить привычный вывих (l. habitualis), который систематически повторяется в одном и
том же суставе, он обусловлен слабостью связочного аппарата и окружающих его мышц или анатомическими изменениями суставных концов костей.
Застарелый (l. Inveterata) — оставшийся невправленным после травмы
и неподдающийся закрытому вправлению в связи с изменениями в тканях,
окружающих сустав.
Описаны случаи возникновения паралитических вывихов, которые относятся к патологическим и обусловлены параличом группы мышц конеч-
А
Б
Рис. 90. Вынужденное положение конечности
при различных видах вывиха бедра
ности, дающим перевес группе мышцантагонистов.
3. Анатомическая классификация включает в себя описание,
где произошел вывих (плечо, бедро и
т.д.). Так, вывих бедра подразделяется
на подвздошный, седалищный, лонный
и запирательный.
4. По характеру осложнений
вывихи подразделяются:
■ неосложненный;
■ осложненный;
■ комбинированный.
Этиопатогенез
Уже ясен из приведенной классификации. Принято считать, что происходит вывих в той кости, суставная
поверхность которой располагается
дистальнее по отношению к другим костям, принимающим участие в формировании данного сустава, исключением
являются вывихи позвонков.
243
Патанатомия
Может сопровождаться как изменениями только в тканях самого сустава, так и в окружающих тканях.
При травматических вывихах выявляются разрывы капсулы сустава — в
виде щели или значительного дефекта
ткани.
Вывихи в блоковидных суставах
(коленный, локтевой, голеностопный)
всегда сопровождаются разрывом связочного аппарата. Возможны разрывы
сухожилий в местах прикрепления их
к кости. Также наблюдаются кровоизлияния в сустав и окружающие ткани.
При осложненных вывихах могут быть
повреждения крупных сосудов, нервов,
а также переломы близких к суставу
участков кости. При открытом вывихе
будут повреждены кожные покровы.
Нередко наблюдаются гематомы.
Клиника
Жалобы — боль в суставе, нарушение его функции, могут быть при сдавлении нерва, онемение в конечности.
При осмотре — вынужденное положение конечности, фиксация ее в неправильном положении и деформация
в области сустава (рис. 91). Так, при
Рис. 91. Изменение формы сустава при вывихе
(ключицы)
244
Текстовый модуль 4
Рис. 92. Изменение оси конечности
подвздошном вывихе бедра конечность несколько согнута и приведена к
противоположной конечности.
При ощупывании отмечается пружинящая фиксация.
Для разрыва передних или задних
крестообразных связок коленного сустава будет характерен симптом «выдвижного ящика». При вывихах любой
локализации необходимо произвести
рентгенографию — это позволит уточнить диагноз, а также выбрать правильный метод лечения (рис. 92).
Лечение
Гиппократ (в 4 веке до н. э.) предложил различные способы вправления вывихов плеча — пяткой, плечом,
круглой палкой по методу рычага и
посредством планки. Также им были
предложены приспособления для лечения вывихов бедра методом вытяжения, основанном на мышечном утомлении (релаксации).
Принципы лечения заключаются в следующем:
1. Оказание первой помощи — адекватная транспортная иммобилизация (шинирование, фиксирующая
повязка).
2. Профилактика шока.
3. При открытых вывихах — асептическая повязка.
Тема 11
245
4. Далее — вправление вывиха, после
рентгенографического исследования, проводится в специализированном отделении или травмпункте.
Вывихи 2-5-дневной давности
вправляются очень тяжело, а через 3-4
недели уже требуется оперативное лечение. При вправлении вывихов необходимо хорошее обезболивание, а при
2-5-дневной давности даже мышечных
релаксантов.
При повреждении суставной капсулы может развиться привычный вывих, который нередко требует хирургической коррекции.
Вправление различных видов
вывиха плеча
Вправление вывиха плеча по
способу Джанилидзе. Метод основан
на физиологическом расслаблении
мышц. Больного укладывают на край
стола так, чтобы рука свисала с него.
Голову кладут на стоящий рядом другой стол. В таком положении больной
лежит 25-30 мин. (рис. 93). После этого
хирург сгибает руку пациента в локте-
Рис. 93. Вправление вывиха плеча
по способу Джанилидзе
Рис. 94. Вправление вывиха плеча по Кохеру
вом суставе и сильно, но не резко тянет
ее книзу, производя легкую наружную
ротацию. В момент вправления раздается характерный щелчок, и сустав становится подвижным.
Вправление вывиха плеча по Кохеру. Больного укладывают на стол
или усаживают на табурет (рис. 94).
После обезболивания, становясь со
стороны вывиха лицом к голове больного, при участии помощника хирург
осуществляет вправление. Техника состоит из 4-х этапов:
1. Помощник фиксирует плечевой пояс с помощью полотенца. Хирург охватывает плечо над локтевым
суставом одной рукой, кисть другой
руки кладет на область лучезапястного
сустава пострадавшего. После сгибания
предплечья больного под углом хирург
оттягивает плечо книзу и медленно приводит локоть к туловищу. Этим самым
головка плеча поворачивается кнаружи.
2. Прижатое к туловищу плечо с
помощью согнутого под прямым углом
предплечья (используемого как рычаг),
медленно ротируют кнаружи до тех пор,
пока ладонная поверхность предплечья
не приблизится к фронтальной плоскости тела. При этом головка плеча становится против суставной поверхности.
3. Если после 2-го этапа вывих не
устранен, то, не ослабляя вытяжения,
приведения локтя к туловищу и вращения плеча кнаружи, переходят к выполнению 3-го этапа. Хирург медленно
подвигает прижатый локоть к средней
линии тела и кверху, вследствие чего
головка плеча устанавливается против
разрыва сумки.
246
Текстовый модуль 4
4. После тщательного выполнения 3-го этапа предплечье резко поворачивают внутрь и кладут на грудь,
чтобы пострадавшая конечность касалась здорового надплечья.
Вправление вывиха плеча методом Мухина — Моту (рис. 95).
ТЕМА №12.
Закрытая черепно-мозговая травма (перелом костей, сотрясение, ушиб мозга,
кровоизлияния). Закрытая травма грудной клетки и органов грудной клетки
Рис. 95. Вправление вывиха плеча
методом Мухина — Моту
Контрольные вопросы по теме занятия
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
Этиопатогенез вывиха.
Классификация вывиха.
Клиника, диагностика вывиха.
Оказание первой помощи при вывихах.
Лечение вывихов плеча.
Лечение вывиха предплечья.
Лечение вывихов бедра.
Виды транспортных шин.
Основные правила наложения транспортных шин.
Способы наложения транспортных шин на верхнюю и нижнюю конечности.
Этиопатогенез переломов кости.
Классификация переломов.
Относительные и абсолютные признаки переломов.
Образование костной мозоли.
Принципы лечения переломов.
Методы лечения переломов.
Виды гипсовых повязок и правила их наложения.
Осложнения в лечении переломов.
«Ложный сустав», причина, клиника, лечение.
Восстановление трудоспособности при переломах различных костей.
1. Актуальность темы.
Во всех развитых странах мира отмечается тенденция к росту травматизма, который обусловлен бурным развитием автомобильного транспорта и
механизацией труда. По данным ВОЗ,
смертность от травматизма стоит на
3-ем месте после сердечно-сосудистых
и онкологических заболеваний, причем гибнут главным образом люди трудоспособного возраста.
Особенностью современного травматизма является рост тяжелых и множественных видов повреждения — сочетанный травматизм, приводящий
к увеличению летальности. Закрытая
травма черепа и мозга, а также повреждения грудной клетки относятся
к категории тяжелых травматических
повреждений. Они быстро ухудшают
состояние больного и при запоздалой
диагностике зачастую ведут к летальному исходу травмированных. При
этом они составляют существенную
часть от всех пострадавших в дорожнотранспортных происшествиях, индустриальных авариях и природных катастрофах.
■
■
■
■
2. Учебные цели занятия.
Классификация ЗЧМТ (закрытой
черепно-мозговой травмы);
Патологические изменения в мозге,
происходящие при сотрясении, ушибе, внутричерепном кровотечении;
Особенности диагностики ЧМТ;
Симптомы сотрясения мозга и тактика лечения сотрясения мозга;
■
■
■
■
■
■
■
Симптомы ушиба мозга и лечение;
Симптомы внутреннего кровотечения, дополнительные методы обследования и тактика лечения таких
больных;
Классификация травм (закрытых
повреждений) грудной клетки и ее
органов;
Патологические изменения в мягких тканях и скелете грудной клетки, ее внутренних органах, происходящие при их сотрясении, ушибе и
сдавлении;
Клиническая симптоматика, прин
ципы диагностики и лечения множественных переломов ребер и других
костей грудной клетки;
Патоморфологические изменения,
клинический
симптомокомплекс,
диагностика и лечение при различных видах пневмоторакса;
Клинический
симптомокомплекс,
принципы диагностики и лечения гемоторакса.
3. Самостоятельная работа
студента.
ЗАКРЫТАЯ ЧЕРЕПНОМОЗГОВАЯ ТРАВМА
Этиопатогенез
Травмы черепа и мозга составляют
от 25 до 30% всего количества травм.
Среди причин летального исхода их
удельный вес достигает 60%. Возможны следующие механизмы травмы
головы: 1) прямое воздействие травмирующего агента на голову (удар по
248
Текстовый модуль 4
голове, удар головой о предмет при падении, сдавление головы между двумя
действующими силами); 2) непрямое
воздействие на голову через позвоночный столб.
Основные деструктивные
механические факторы
при черепно-мозговой травме:
1) ударная волна, распространяющаяся от места травмы через мозг к
противоположному полюсу;
2) перемещение больших полушарий относительно более фиксированного ствола мозга.
При противоударе головной мозг
травмируется о плотные внутричерепные образования на стороне, противоположной месту приложения силы.
Важную роль играет гидродинамический удар, связанный с перемещением
цереброспинальной жидкости в желудочках мозга и субарахноидальном
пространстве.
1.
2.
3.
4.
При травме головы возможны:
ушибы мягких тканей, часто с образованием гематом;
ранения мягких тканей;
переломы костей свода черепа, основания черепа и лицевого скелета;
повреждения головного мозга, часто возникают при травме головы с
переломами костей черепа.
Как результат, в ответ на повреждение мозга последовательно развиваются:
1. нарушения церебрального кровообращения;
2. нарушения ликвороциркуляции;
3. расстройство гипоталамо-гипофи
зарно-надпочечниковых функций;
4. отек и набухание мозга;
5. повышение внутричерепного давления;
6. развертывание процессов смещения и сдавления мозга;
Тема 12
7. вклинение ствола мозга в отверстие мозжечкового намета или в
затылочно-шейную воронку (большое затылочное отверстие).
Классификация
Черепно-мозговая травма (ЧМТ)
делится на открытую и закрытую.
К открытой ЧМТ относят:
1. переломы костей свода черепа, сопровождающиеся ранением прилежащих мягких тканей;
2. переломы основания черепа, сопровождающиеся кровотечением
или ликвореей из носа или из уха;
3. раны мягких тканей головы с повреждением апоневроза.
Открытая ЧМТ делится на:
1. непроникающую (если целость
твердой мозговой оболочки сохранена);
2. проникающую (если целость твердой мозговой оболочки нарушена).
К закрытой ЧМТ относят повреждения, при которых:
1. отсутствуют нарушения целости
покровов головы;
2. имеются раны мягких тканей без
повреждения апоневроза;
3. имеются переломы костей свода
черепа, не сопровождающиеся ранением прилежащих мягких тканей
и апоневроза.
Классификация (воз)
закрытой черепномозговой травмы (зчмт)
А. Ушибы и ранения мягких тканей черепа без сотрясений и ушиба.
Б. Собственно закрытая травма черепа:
1) сотрясение мозга;
2) ушиб мозга;
3) травматические внутричерепные кровоизлияния:
эпидуральные (экстрадуральные);
субдуральные;
субарахноидальные;
внутримозговые;
внутрижелудочковые.
В. Сочетанные повреждения черепа и мозга:
■ ушибы и ранения мягких тканей
в сочетании с травмой мозга, его
оболочек и сосудов;
■ закрытые переломы костей свода
черепа в сочетании с повреждением
мозга (ушиб, сотрясение), его оболочек и сосудов;
■ переломы основания черепа в сочетании с повреждениями мозга,
оболочек (кровотечение, ликворея), сосудов и черепно-мозговых
нервов.
Некоторые авторы добавляют в
качестве отдельной формы диффузное
аксональное повреждение головного
мозга, но большинство считают эту
форму лишь синдромом при других
формах.
■
■
■
■
■
По тяжести закрытые ЧМТ делят на легкие, средние и тяжелые.
1) К легким ЗЧМТ относят: а) сотрясение головного мозга; б) ушиб головного мозга легкой степени.
2) К ЗЧМТ средней тяжести относят ушиб головного мозга средней тяжести.
3) К тяжелой ЗЧМТ относят:
а) ушиб головного мозга тяжелой
степени;
б) сдавление мозга без его ушиба;
в) сдавление мозга с его ушибом.
Сотрясение головного мозга
(СГМ) — функционально обратимая
легкая форма ЧМТ.
Патогенез СГМ заключается в
нарушении гистологических связей
клеток на субклеточном и клеточном
уровне. Развивается функциональный
249
блок синапсов и разлитое торможение,
захватывающее кору мозга и его нижележащие отделы.
Морфологически
выявляются
диффузные дистрофические изменения
в нейронах мозга, спазм и расширение
сосудов, мелкие диапедезные кровоизлияния, умеренный общий отек мозга.
Клиника и диагностика СГМ.
Кратковременная потеря сознания
(от нескольких секунд до 30 минут).
Характерна ретроградная амнезия
на предшествующие события, исчезающая в последующие несколько
дней. Головная боль, головокружение.
Тошнота, рвота (одно-, двукратная).
Спонтанный нистагм. Вегетативные
нарушения: тахикардия, артериальная
гипертензия, субфебрилитет. Пульс замедлен, дыхание частое, поверхностное. При исследовании глазного дна
выявляется только расширение вен.
На рентгенограмме черепа отсутствует
повреждение его костей. На электроэнцефалограмме (ЭЭГ) — альфа-ритм
сохранен, но усилена выраженность
бета-волн (раздражение коры головного мозга). Реоэнцефалография (РЭГ):
пульсовое кровенаполнение мозговых
сосудов снижено. Эхоэнцефалография:
отсутствие смещения эхо-сигнала. Давление цереброспинальной жидкости
(ЦСЖ) — в пределах нормы. ЦСЖ прозрачная, бесцветная.
NB! При сотрясении головного мозга отсутствуют грубые очаговые нев
рологические симптомы.
Лечение СГМ. Постельный режим
не менее 7 дней. Седативные препараты (феназепам, рудотель). Ноотропные
препараты (ноотропил, пирацетам).
Спазмолитики (но-шпа, папаверин с
дибазолом). Аналгетики (аналгин, триган). Десенсибилизирующие средства
(димедрол, пипольфен). Дегидратационные препараты внутривенно (40%
250
Текстовый модуль 4
раствор глюкозы, 25% раствор магнезии сульфата, фуросемид).
После выписки в течение 1-2 недель
продолжается амбулаторное лечение.
Прогноз: у 80% пациентов благоприятный. У 20% больных развивается
астенический синдром: эмоциональная
лабильность и повышенная утомляемость.
Ушиб мозга (УМ) — более тяжелая форма повреждения головного
мозга. Она характеризуется: 1) развитием очагов деструкции ткани мозга;
2) субарахноидальными кровоизлияниями; 3) возможными переломами
костей свода черепа.
Патогенез. В качестве основной
теории патогенеза рассматривают теорию градиента давления Гросса. Согласно этой теории, в момент ушиба в
полости черепа давление распределяется по градиенту: в месте приложения
силы оно резко повышено, на противоположном полюсе — резко отрицательно вплоть до вакуума. В проекции зоны
отрицательного давления в веществе
мозга образуются разрывы мозговой
ткани и кровоизлияний.
Патологическая
анатомия.
Мелкоочаговые паренхиматозные кровоизлияния с микронекрозами, иногда — размозжение мозговой ткани на
поверхности мозга, а также в стенках
четвертого желудочка. Очаги ушиба
часто имеют клиновидную форму с верхушкой, направленной вглубь мозга.
Клиника УМ по тяжести делится
на три степени: легкую, среднюю и тяжелую. Помимо общемозговых симптомов, рассмотренных при описании клиники СГМ, ушибу мозга дополнительно
присуща локальная неврологическая
симптоматика, выражающаяся в выпадении функций того или иного участка
мозга.
Тема 12
1. При УМ легкой степени обнаруживаются четкие очаговые неврологические симптомы, которые быстро
регрессируют (ко 2-3 неделе после травмы). Сознание утрачивается обычно
больше, чем на 30 минут. Типичным является субарахноидальное кровоизлияние, нередко в сочетании с переломами
костей свода черепа. Давление ликвора (ЦСЖ) незначительно повышено.
2. УМ средней степени тяжести проявляются потерей сознания до
4-6 часов. Очаговые неврологические
симптомы грубые (вплоть до афазии,
гемианестезии, гемиплегии), стойкие
(регрессируют к 5-й неделе). Наблюдаются преходящие нарушения стволовых и жизненно важных функций.
Давление ЦСЖ повышено.
3. УМ тяжелой степени проявляются глубоким нарушением сознания (от сопора до комы) длительностью более 6 часов (нередко несколько
суток). Выявляются неврологические
симптомы повреждения ствола мозга и
симптомы повреждения полушарий головного мозга. При переломах основания
черепа может наблюдаться ликворея из
носа и ушей. Развиваются угрожающие
нарушения жизненно важных функций.
Регресс очаговых симптомов замедлен. Часто остаются грубые нарушения
в двигательной и психической сфере.
Давление ЦСЖ резко повышено (более
250 мм водного столба).
При ушибе мозга разных локализаций отмечается разнообразная
очаговая симптоматика.
1. При повреждении лобных долей
наблюдаются
психопатологические
симптомы (быстрые немотивированные переходы эмоций: от эйфории к
приступам ярости).
2. При повреждении премоторной
области — потеря способности к тонким дифференцированным движениям.
3. При повреждении лобно-теменной
области — пирамидный гемипарез или
гемиплегия.
4. При повреждении правой височной
области — двигательное возбуждение,
при поражении левой височной области — афазия, апраксия, агностические
расстройства.
5. При поражении базальных отделов
мозга (ствола, гипоталамо-гипофизарной
области) — длительная потеря сознания, расстройства дыхания, сердечной деятельности и терморегуляции.
Лечение ушибов головного мозга
1. В острой стадии УМ — лечение
нарушений дыхания, гемодинамики и
метаболизма.
2. При вдавленных переломах —
оперативное вмешательство с удалением отломков кости. NB! Люмбальную пункцию применяют при резком
повышении внутричерепного давления,
но только при отсутствии признаков
сдавления и дислокации мозга!
3. С целью предотвращения прогрессирования отека и дислокации
мозга — в первые двое суток установить
показания к декомпрессивной трепанации черепа и удалении нежизнеспособных участков мозга.
4. В поздних стадиях УМ: а) при парезах конечностей — физиотерапия и
лечебная гимнастика; б) при местном
эпилептическом синдроме — противосудорожная терапия, средства с эффектом дегидратации.
Прогноз при УМ чаще сомнительный: у 30% пострадавших остаются
стойкие неврологические нарушения.
Синдром диффузного аксонального повреждения (ДАП) головного мозга. В его основе лежит
натяжение и разрыв аксонов в подкорковых и стволовых образованиях.
Синдром ДАП характеризуется дли-
251
тельным (до 3-х недель) коматозным
состоянием. Характерным для ДАП
является переход из комы в стойкое вегетативное состояние.
Сдавление головного мозга
(СдГМ) более чем в 90% случаев развивается на фоне его ушиба. Наиболее часто СдГМ является следствием
кровотечения при повреждении сосудов мозговых оболочек и венозных
синусов или острого прогрессирующего отека мозга. Из внутричерепных
кровотечений наиболее опасно кровотечение из средней оболочечной артерии (a. meningea media). Скопление
излившейся крови может располагаться: 1) над твердой мозговой оболочкой — эпидуральная гематома; 2) под
твердой мозговой оболочкой — субдуральная гематома; 3) в подпаутинном
пространстве — субарахноидальная гематома; 4) внутри желудочков мозга —
интравентрикулярная гематома.
Известно, что разница между объемом полости черепа и объемом головного мозга составляет от 40 до 50 куб.
см. Эта разница называется резервным
пространством. Именно поэтому клинические симптомы в случаях сдавления мозга не проявляются сразу. Они
проявляются только через несколько
часов или дней в зависимости от темпа (скорости) сдавления. Минимальное
количество крови, вызывающее клинику
сдавления мозга: 1) при эпидуральной гематоме, — от 40 до 50 мл; 2) при субдуральной гематоме, — около 100 мл; 3) при
внутрижелудочковой — от 3 до 5 мл.
Патогенез СдГМ. В результате сдавления мозга в нем развиваются: 1) венозный застой; 2) гипоксия; 3) нарушение окислительно-восстановительных
процессов; 4) увеличение продукции
ЦСЖ/ликвора/ и уменьшение ее всасывания. Вышеописанные сдвиги ведут
к гидроцефалии, усиливающей сдав-
252
Текстовый модуль 4
ление мозга. Развивается дислокация
мозга со стволовыми нарушениями
(остановкой дыхания и сердечной деятельности).
Клиника СдГМ
1. В зависимости от преобладающего фона (сотрясение мозга или ушиб
мозга) первоначально доминируют общемозговые или очаговые симптомы.
Как правило, пострадавший теряет сознание на несколько минут или часов,
что обусловлено собственно травмой
мозга.
2. Светлый промежуток, в течение
которого может восстановиться сознание.
Больной может ходить, разговаривать, отвечать на простые вопросы.
Длительность этого промежутка индиА
Тема 12
видуальна и зависит от объема, локализации и скорости образования внутричерепной гематомы.
3. По окончании светлого промежутка усиливаются головные боли,
больной вновь теряет сознание вследствие нарастания компрессии мозга.
Нарастают очаговые симптомы (гемипарезы и параличи конечностей, анизокория, фокальные эпилептические
припадки). Появляются стволовые нарушения (повышение артериального
давления, брадикардия, парез взора
вверх, усиливается спонтанный нистагм, двусторонние патологические
знаки, развиваются угрожающие жизни нарушения дыхания и кровообращения).
Инструментальная диагностика сдавления головного мозга
1. При ультразвуковом исследовании мозга отмечают смещение срединного эхо-сигнала в здоровую сторону.
2. На электроэнцефалограмме
наблюдают локальное снижение биоэлектрической активности соответсвенно патологическому очагу.
3. Ангиография выявляет смещение основных стволов мозговых артерий (рис. 96).
Б
4. Компьютерная томография
дает точную информацию о локализации патологического очага.
NB! Спинномозговая пункция при
подозрении на сдавление головного мозга не применяется, так как снижение
давления ликвора после пункции может
привести к вклинению мозга.
Лечение СдГМ
Главный компонент лечения —
оперативное вмешательство.
Оно включает в себя следующие
моменты:
1) декомпрессивную трепанацию черепа;
2) удаление гематомы;
3) перевязку поврежденных сосудов;
4) профилактику и лечение дислокации мозга, в том числе обязательное дренирование остаточной полости на месте гематомы, пункцию
желудочков мозга.
В послеоперационном периоде проводится интенсивная медикаментозная
терапия, искусственная вентиляция
легких.
Прогноз при тяжелой черепномозговой травме сомнительный — летальность колеблется от 40 до 90%.
Среди выживших больных этой группы трудоспособность утрачивается у
50% больных.
ЗАКРЫТЫЕ ПОВРЕЖДЕНИЯ
ГРУДНОЙ КЛЕТКИ
30% всех случаев травмы со смертельным исходом приходится на повреждение грудной клетки и ее органов.
Как правило, смерть травмированных
наступает вследствие развития острой
дыхательной недостаточности.
Рис. 96. ЭЭГ (а) и ангиография (б) головного мозга при сдавлении
Классификация
Повреждения грудной клетки делятся на открытые и закрытые.
253
I. Открытые повреждения (или
раны) могут быть:
1) непроникающими в плевральную
полость (т. е. без повреждения париетальной плевры);
2) проникающими (с повреждением
париетальной плевры). Проникающие
ранения всегда сопровождаются пневмотораксом (т. е. вхождением воздуха
в плевральную полость) и гемотораксом (т. е. скоплением крови в полости
плевры).
II. Закрытые повреждения грудной клетки (встречаются чаще)
делятся на:
1) сотрясение грудной клетки;
2) ушиб грудной клетки:
а) с повреждением костей грудной
клетки и гемотораксом или без него;
б) с повреждением органов грудной
клетки и пневмо-, гемотораксом, гемоперикардом или без него;
в) без повреждения костей и органов грудной клетки;
3) сдавление органов грудной клетки:
а) с повреждением костей грудной
клетки и гемотораксом или без него;
б) с повреждением органов грудной
клетки и пневмо-, гемотораксом или
без него;
в) без повреждения костей грудной
клетки и органов грудной полости.
Сотрясение грудной клетки
(сгк) возникает при воздействии на
человека взрывной волны.
Патогенез. Вследствие резкого
раздражения блуждающего и симпатического нервов происходит нарушение
функции сердечно-сосудистой, дыхательной и нервной систем.
Клиника СГК: одышка, бледность
или цианоз, холодный пот, рефлекторное падение сердечной деятельности и,
как результат, — потеря сознания.
Лечение СГК : постельный режим,
согревание, оксигенотерапия, сердечные средства.
254
Текстовый модуль 4
Основную группу закрытых повреждений грудной клетки составляют
ушибы грудной клетки (угк).
Клиника ушиба мягких тканей
грудной клетки проявляется болями
в зоне локализации ушиба, возникновением здесь подкожных кровоизлияний. Если УГК сопровождается
переломом ребер, то к описанной выше
картине присоединяются: резкая боль
и наличие симптома крепитации (при
пальпации области повреждения, при
движении и при вдохе). На рентгенограмме грудной клетки видны признаки перелома ребер.
Лечение УГК без повреждения
внутренних органов: постельный
режим, аналгетики, кровоостанавливающие препараты, антибиотики для
предотвращения развития пневмонии,
межреберные новокаиновые блокады
мест перелома.
У большинства пострадавших с
закрытой травмой грудной клетки тяжесть состояния и летальные исходы
вызваны кардиопульмональными нарушениями вследствие повреждения
структуры и нарушения функции сердца и легких. Наиболее частые причины
этих нарушений:
1. Пневмоторакс: а) закрытый;
б) открытый; в) клапанный.
2. Гемоторакс: а) малый (до 500
мл); б) средний (до 1000 мл); в) большой (более 1000 мл).
3. Множественные оскольчатые
переломы ребер с образованием нефиксированных фрагментов.
4. Контузии сердца и гемоперикард с
нарастающей тампонадой сердца.
Пневмоторакс (пт) — скопление
воздуха в плевральной полости.
Классификация.
ПТ может быть наружным — когда воздух поступает в плевральную
полость через рану грудной стенки.
Тема 12
ПТ может быть внутренним — когда
воздух поступает в плевральную полость из раны легкого при закрытой
травме грудной клетки. Если попавший
в плевральную полость воздух может
выходить наружу через рану легкого
или через рану грудной стенки — это
открытый ПТ. Если воздух в плевральную полость попал одновременно при
травме и не может выходить наружу
при выдохе — это закрытый ПТ. Если
объем воздуха, попавшего в плевральную полость, при каждом вдохе увеличивается, а на выдохе не выходит, —
такой ПТ называется напряженным
или клапанным.
Наиболее опасными являются: открытый ПТ (т. к. постоянное баллотирование средостения приводит к развитию плевропульмонального шока), и
клапанный ПТ (т. к. нарастающее смещение средостения приводит к сдавлению легких как на пораженной, так и
на здоровой стороне).
Клиника и диагностика закрытого пневмоторакса (ЗПТ)
Общее состояние больного удовлетворительное. Если пневмоторакс образовался вследствие ранения, — рана
грудной стенки небольших размеров.
В окружности раны отмечается припухлость и хруст при поверхностной пальпации — признаки подкожной эмфиземы (но если ЗПТ образовался вследствие
тупой травмы груди, подкожная эмфизема может не выявляться). Перкуторно на стороне поражения определяется
коробочный звук (тимпанит). Аускультативно выявляется резкое ослабление
дыхательных шумов. При рентгенологическом исследовании устанавливают степень спадения легкого и смещения средостения в здоровую сторону.
Лечение при ЗПТ
При ЗПТ отверстие в легком или
грудной клетке в ближайшее после ра-
255
Рис. 97. Механизм наружного (открытого) пневмоторакса
нения время закрывается (или сгустком
крови или за счет смещения мышц).
Воздух в плевральной полости самостоятельно рассасывается. Только при
серьезных расстройствах дыхания может потребоваться однократная плевральная пункция. Она производится
во 2-м межреберном промежутке по
среднеключичной линии.
Клиника и диагностика открытого пневмоторакса (ОПТ)
Повреждения груди с ОПТ (рис. 97)
протекают значительно тяжелее. Помимо описанных выше симптомов, наблюдаются выраженная одышка, цианоз кожных покровов, двигательное
возбуждение. Пострадавший занимает
вынужденное полусидячее положение.
Если повреждение груди открытое, то в
области раны определяется шум входящего и выходящего воздуха. Выражена
подкожная эмфизема. Ретгенологическое исследование имеет целью уточнить степень коллапса легкого, наличие перелома ребер и гемоторакса.
Лечение при ОПТ
Первая помощь заключается в переводе ОПТ в закрытый пневмоторакс
(ЗПТ) путем наложения окклюзионной
повязки, если причина пневмоторакса
заключается в ранении грудной клетки.
В этом случае необходима хирургиче-
ская обработка раны с ушиванием ее и
дренированием по Бюлау. Дренаж по
Бюлау (рис. 98) — разновидность пассивного дренажа, на свободном конце
которого имеется разрезанный в виде
клапана палец от резиновой перчатки,
погруженный в раствор антисептика.
Если ОПТ развился вследствие закрытой травмы груди — накладывают активный дренаж плевральной полости.
Рентгенологический контроль за функцией дренажа проводят ежесуточно.
Если на 3-и сутки легкое не расправилось — производят торакотомию с
ушиванием раны легкого и дренированием плевральной полости.
Рис. 98. Техника плевральной пункции
и дренирование по Бюлау
256
Текстовый модуль 4
Тема 12
Рис. 99. Механизм клапанного пневмоторакса
Клиника клапанного пневмоторакса (КПТ)
Клапанный пневмоторакс (рис. 99)
характеризуется угрожающим жизни
нарушением дыхания и кровообращения. Общее состояние пострадавшего
крайне тяжелое. Выраженная нарастающая экспираторная одышка,
цианоз кожи и слизистых, двигательное возбуждение. Раненый старается
задержать дыхание на вдохе, т. к. выдох
сжимает уже сдавленные легкие. Артериальное давление снижается. Пульс
учащен, слабый. Резко выраженная
подкожная эмфизема. Рентгенологически выявляется тотальный коллапс
легкого на стороне травмы, резкое смещение средостения в здоровую сторону
и сужение легочного поля на здоровой
стороне. NB! При повреждении трахеи
и главных бронхов возможно развитие
быстро нарастающей эмфиземы средостения, сдавливающей сердце и крупные
сосуды. В этом случае отмечается тяжелая одышка, цианоз, переполнение вен
шеи и верхних конечностей. На рентгенограмме — расширение тени средостения и скопление в нем воздуха.
Лечение КПТ начинается с временного перевода его в открытый путем пункции плевры толстой иглой
(рис. 99). В дальнейшем накладывают
плевральный дренаж по Бюлау (рис. 98)
(но предпочтительнее активное дренирование с созданием постоянного отрицательного давления). Если КПТ не
разрешается на 3-и сутки, производят
торакотомию с ушиванием раны легкого. При медиастинальной эмфиземе
производят шейную медиастинотомию
в качестве экстренной дренирующей
операции. В дальнейшем производят
торакотомию для устранения разрыва
бронха или трахеи.
Гемоторакс (гт) — скопление
крови в плевральной полости.
Клиника и диагностика гемоторакса. Жалобы на слабость, одышку в
покое, боли в груди, кашель. При физикальном исследовании выявляются
бледность кожи, снижение АД, учащение пульса, притупление перкуторного
Рис. 99. Пункция плевральной полости
Рис. 99. R-грамма гемопневмоторакса
звука над нижними отделами грудной
клетки на стороне поражения. Рентгенологически (рис. 99) в плевральной
полости видна тень жидкости с косым
уровнем (при гемопневмотораксе — с
горизонтальным уровнем). NB! Гемоторакс объемом менее 150 мл рентгенологически не выявляется! Окончательный
диагноз устанавливается при пункции
плевральной полости (производится в
VI-VII межреберье по задней подмышечной линии). В зависимости от количества излившейся крови различают:
1. Малый гемоторакс — количество
крови не превышает 500 мл. На рентгенограмме скопление крови занимает
уровень ниже угла лопатки.
257
2. Средний гемоторакс — количество крови от 500 до 1000 мл. На рентгенограмме скопление крови достигает
уровня угла лопатки.
3. Большой гемоторакс — количество крови превышает 1000 мл. На
рентгенограмме скопление крови превышает уровень угла лопатки и может
достигать купола плевры.
Гемоторакс может быть с прекратившимся или с продолжающимся кровотечением. Ответить на вопрос, остановилось кровотечение в плевральную
полость или продолжается, помогает
проба Рувилуа — Грегуара. Если кровь,
полученная при пункции плевральной
полости, свернулась в шприце или пробирке, то кровотечение продолжается.
Если кровь, полученная при пункции
плевры, потеряла способность сворачиваться, — это указывает на остановку кровотечения.
Лечение гемоторакса. Кровь из
плевральной полости должна быть удалена как можно раньше с целью наиболее быстрого расправления спавшегося
легкого. Малый и средний гемоторакс
можно ликвидировать с помощью
пункций или дренирования плевральной полости (рис. 100). При большом
гемотораксе с целью остановки внутреннего кровотечения, а также в случае выявления крупного инородного
тела показана торакотомия.
Рис. 100. Закрытый и открытый способ лечения гемоторакса
258
Текстовый модуль 4
Опасные для жизни расстройства
внешнего дыхания возникают не только при пневмотораксе и гемотораксе, но
и при множественных переломах ребер (МПР) без повреждения внутренних органов. Переломы 6-ти и более ребер с одной стороны, особенно двойные
(так называемые «окончатые») протекают особенно тяжело. В последнем
случае образуются «реберные клапаны»
и возникает парадоксальное дыхание с
западением травмированного участка
грудной клетки на вдохе. Развивается
клиника шока, что требует проведения
противошоковой терапии.
Лечение МПР. При переломах
ребер необходимо выполнить шейную вагосимпатическую блокаду по
А.В. Вишневскому. При выявлении
симптомов парадоксального дыхания
(флотация участков грудной клетки)
следует фиксировать флотирующий
участок с помощью специальной пластиковой шины путем подшивания к
тканям грудной стенки на 2-3 недели.
Второй способ фиксации — вытяжение
грузом через блок с помощью пулевых щипцов, которые крепят за ребра
в центре мобильного участка грудной
клетки. Для борьбы с гипоксией проводят ингаляцию кислорода. Для освобождения бронхов от сгустков слизи и
крови проводят санацию бронхов через
бронхоскоп. При прогрессирующей дыхательной недостаточности проводят
искусственную вентиляцию легких.
Клиника ушиба сердца — бледность, адинамия, падение артериального давления, ослабление и учащение
(или урежение) пульса. На электрокар-
Тема 12
диограмме — картина, сходная с инфарктом миокарда. Угрожающее жизни
состояние развивается при кровотечениях в полость перикарда. В этом случае возможна остановка сердца ввиду
его тампонады — развитие гемоперикарда. Рентгенологически гемоперикард проявляется расширением тени
средостения в верхней трети.
Лечение гемоперикарда — оперативное. Операция заключается в торакотомии, перикардиотомии, эвакуации
излившейся крови, остановке кровотечения. Операцию завершают наложением редких швов на перикард с его
дренированием.
Сдавление
грудной
клетки
(сдгк) возникает при действии на
грудную клетку двух твердых тел в
противоположных направлениях (буфером вагона, в результате обвала горной породы). Вследствие сдавления
внезапно повышается внутригрудное
давление, кровь из сосудов плевральной полости перемещается в верхнюю
полую вену, вены головы и шеи. Развивается состояние травматической асфиксии (застойного кровоизлияния).
Клиника. Жалобы на боли в груди, одышку, слабость. На коже головы,
шеи, верхней части грудной клетки,
слизистой рта и склерах появляются
точечные кровоизлияния.
Лечение — симптоматическое: покой, вагосимпатическая блокада, наркотические аналгетики, сердечные
средства. При повреждении ребер и
ткани легкого проводится лечение, как
было описано в соответствующих разделах.
259
Рис. 104. ЭЭГ. Смещение эхо-сигнала
при внутричерепной гематоме
Рис. 101. Перелом костей свода черепа при ЧМТ
Рис. 105. КТ внутримозговой гематомы при ЧМТ
Рис. 102. Ликворея при переломе
основания черепа
Рис. 103. Некоторые варианты (схема) локализации
гематом при ЧМТ (подкожная, эпидуральная, субдуральная, внутримозговая)
Рис. 106. КТ эпидуральной гематомы
260
Текстовый модуль 4
Тема 12
261
1
3'
3
2
4
6
Рис. 109. Открытый пневмоторакс.
Фаза вдоха (схема)
5
Рис. 112. Внешний вид больного
с подкожной эмфиземой
7
8
Рис. 113. Перелом ребер с ранением ткани легкого,
как причина развития гемопневмоторакса.
Диагностическая пункция
8'
Рис. 107. Трепанация черепа и эвакуация гематомы
при эпи- и субдуральной гематоме (схема)
1
2
3
Рис. 110. Открытый пневмоторакс. Фаза выдоха.
Баллотирование средостения
4
Рис. 114. Пассивное (по Бюлау)
и активное дренирование плевральной полости
5
6
Контрольные вопросы по теме занятия
6'
Рис. 108. Прошивание веток а. meningea media
и пункция внутримозговой гематомы
Рис. 111. Клапанный пневмоторакс. Смещение
средостения и сдавление здорового легкого
1. Как действуют основные механизмы травмы головы и какие факторы являются деструктивными при этом виде повреждений?
2. Какие анатомические структуры могут быть повреждены при травме головы и
какие основные патофизиологические сдвиги развиваются при черепно-мозговой
травме (в чем опасность закрытой травмы черепа и мозга)?
3. Какие используются классификации черепно-мозговой травмы? Что такое проникающая и непроникающая ЧМТ, а также открытая и закрытая ЧМТ?
262
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
Текстовый модуль 4
Как черепно-мозговая травма подразделяется по тяжести?
Каковы этиопатогенез и клиническая картина при сотрясении головного мозга?
Какие основные направления лечения при сотрясении головного мозга?
Что такое ушиб мозга? Каков этиопатогенез этого состояния и какие патологоанатомические нарушения развиваются в ткани мозга при его ушибе?
В чем клиническое отличие между ушибами мозга разной степени тяжести?
В чем различаются клиническая картина сотрясения мозга и его ушиба? Какая
неврологическая симптоматика может проявляться при ушибе мозга разных
локализаций?
Каковы принципы лечения и прогноз при ушибе мозга?
Что такое сдавление головного мозга? Каковы основные причины и механизмы
развития этого состояния?
В чем особенности клинических проявлений сдавления головного мозга? Какие
методы инструментальной диагностики применяются в случае подозрения на
сдавление головного мозга (и при черепно-мозговой травме вообще)?
Как проводится лечение при сдавлении головного мозга и каков прогноз при данном виде черепно-мозговой травмы?
Как классифицируются травмы грудной клетки (ТГК) и ее органов? Что такое
открытая и закрытая, проникающая и непроникающая ТГК?
Каковы этиопатогенез, клиническая картина и принципы лечения сотрясения и
ушиба грудной клетки без повреждения ее внутренних органов?
Какие осложнения могут развиваться при ушибе грудной клетки с повреждением ее внутренних органов и костного каркаса? Каковы причины развития, клинические проявления и принципы лечения закрытого пневмоторакса?
Этиопатогенез, клиническая симптоматика, диагностика и принципы лечения
открытого пневмоторакса.
Этиопатогенез, клиническая симптоматика, диагностика и принципы лечения
клапанного пневмоторакса.
Каковы причины развития, виды (классификация), клиника, диагностика и
принципы лечения гемоторакса?
В чем опасность множественных переломов ребер и каковы принципы лечения
при данном виде травмы?
Что такое гемоперикард, его причины, клиника, диагностика и принципы
лечения?
Каковы этиопатогенез, клинические проявления и принципы лечения сдавления
грудной клетки?
ТЕМА №13.
Закрытая травма живота. Перитонит, клиника, диагностика, лечение
1. Актуальность темы.
Лечение больных с тупой травмой
живота остается на сегодняшний день
актуальной задачей современной хирургии. Клиническая картина при данной патологии характеризуется многообразием проявлений, основными из
которых являются внутрибрюшное
кровотечение и перитонит. Оба осложнения относятся к тяжелым и требуют
неотложного оперативного лечения,
от своевременности оказания которого зависит жизнь больного. Исходя из
вышесказанного, знание основ клиники и тактики лечения необходимо для
оказания своевременной и квалифицированной помощи.
■
■
■
■
■
■
2. Учебные цели занятия.
Тупая травма живота: определение,
основные понятия, классификация,
осложнения.
Тупая травма живота без повреждения внутренних органов: травма
передней брюшной стенки; забрюшинная гематома: этиопатогенез,
клиника, диагностика, лечение.
Тупая травма живота с повреждением внутренних органов: травма
желудка, 12-перстной кишки.
Тупая травма живота с повреждением тонкой и толстой кишки: этиопатогенез, клиника, диагностика,
лечение.
Тупая травма живота с повреждением мочевого пузыря: этиопатогенез, клиника, диагностика и лечение.
Тупая травма живота с повреждением паренхиматозных органов:
■
■
■
■
печени, селезенки, поджелудочной
железы: этиопатогенез, клиника,
диагностика, лечение.
Перитонит: определение, этиология, патогенез.
Классификация перитонита.
Клиника, диагностика перитонита.
Лечение перитонита: объем пред
операционной подготовки, основные
этапы оперативного лечения, послеоперационный период.
3. Самостоятельная работа
студента.
1. Тупая (закрытая)
травма живота
1.1. Определение, общие понятия
К закрытым повреждениям относят травмы живота, при которых
покровные ткани (кожа, подкожная
клетчатка, апоневроз) остаются неповрежденными. Первое место занимают
дорожно-транспортные травмы, затем
идут бытовые повреждения, падения
с высоты, производственные и спортивные травмы.
Закрытые травмы живота тяжелые,
опасные для жизни, нередко сочетаются с тяжелыми повреждениями других
областей, ведут к высокой (57,5%) летальности. Так, почти у 20% всех пострадавших повреждения живота сочетаются с черепно-мозговой травмой,
у 70% — переломами костей конечностей, ребер, таза, позвоночника.
1.2. Классификация
Закрытые повреждения живота подразделяются на 2 группы (рис. 115):
264
Текстовый модуль 4
1. Без повреждения внутренних органов:
a) повреждения брюшной стенки;
б) забрюшинные гематомы.
2. С поврежденем внутренних
органов:
a) паренхиматозных;
б) полых.
Ведущими патогенетическими факторами при травмах с повреждением
внутренних органов являются шок,
кровотечение и перитонит: при повреждениях паренхиматозных органов — шок и кровотечение; полых органов — перитонит.
1.3. Тупая травма живота без
повреждения внутренних органов
1.3.1. Повреждения брюшной
стенки
При этом виде травмы отмечаются
значительные межмышечные гематомы и кровоизлияния в предбрюшинную клетчатку, иногда повреждения
эпигастральных сосудов, надрывы или
поперечные разрывы мышц. Сама по
Рис. 115. Варианты закрытых травм живота
Тема 13
себе травма брюшной стенки значительной опасности для пострадавшего
не представляет. Чаще всего гематомы
рассасываются, реже нагнаиваются.
Клиника. Повреждения брюшной
стенки проявляются болью и рефлекторным сокращением мышц. Боль
сначала может локализоваться у пупка, затем становится разлитой, иногда иррадиирует в спину и боковые
поверхности грудной клетки соответственно стороне повреждения. Перед
няя брюшная стенка в акте дыхания
не участвует (у мужчин). Спустя 3-4 ч.
с момента травмы боль стихает, появляясь вновь при перемене положения
тела. Перистальтические шумы прослушиваются, признаки раздражения
брюшины отсутствуют. Печеночная тупость сохранена. При диагностических
сомнениях показана лапароскопия или
лапароцентез.
Лечение. Гематому брюшной стенки при значительных размерах можно
пунктировать с аспирацией излившейся крови. Показана местная гипотермия, введение гемостатических
препаратов (викасола, 10% раствора
хлорида кальция).
1.3.2. Забрюшинная гематома
Забрюшинная гематома — скопление крови в забрюшинной клетчатке.
Чаще всего являются следствием
переломов костей таза, в особенности заднего его полукольца. Источниками кровотечения являются венозные сплетения
и магистральные сосуды тазовой области, обильно развитый сосудистый аппа
рат костей таза. Второй причиной забрюшинных гематом являются повреждения
позвоночника. Величина кровопотери
может достигать 2-3 л и больше.
Клиника забрюшинных гематом
многообразна и складывается из симптомов шока, внутреннего кровотечения и синдрома «острого живота».
Наиболее характерны постоянные тупые боли в животе, локальное
мышечное напряжение, ограниченное
притупление перкуторного звука, не
меняющее границ при перемене поло
жения тела пострадавшего (симптом
Джойса). Очень рано возникает выраженный парез кишечника. В условиях
массивной кровопотери перечисленные признаки весьма нечеткие, что
усложняет дифференциальный диагноз
и тактику хирурга.
Лечение заключается в кровезамещающей терапии, применении гемостатических препаратов, лечении костных
повреждений. Гемотрансфузии производят под контролем гемодинамических и гематологических показателей.
1.4. Тупая травма живота
с повреждением внутренних
полых органов
1.4.1. Повреждения двенадцатиперстной кишки
Это преимущественно прямая
травма: двенадцатиперстная кишка
придавливается к позвонку и, не имея
возможности сместиться, разрывается. Бывают внутри- и забрюшинные
повреждения, причем чаще встречаются разрывы внебрюшинного отдела
кишки. При этом, если брюшина над
местом разрыва кишки не повреждена,
дуоденальное содержимое поступает
только в забрюшинное пространство
и клинические проявления в первые
часы после травмы нечеткие.
Клиника. Больные предъявляют
жалобы на не очень сильные, неопределенные боли в правой половине живота, правом подреберье, правой поясничной области. Постепенно боли
усиливаются. Больные бледны, заторможены или возбуждены. Появляются
общая слабость, жажда, тошнота, рвота, тахикардия, нерезкая артериаль-
265
ная гипотензия, в крови лейкоцитоз.
Лишь спустя 8-16 ч. с момента травмы
отмечаются признаки раздражения
брюшины. Это связано с постепенным
проникновением в свободную брюшную полость содержимого двенадцатиперстной кишки путем пропотевания
и вследствие аутолиза окружающих
кишку тканей.
Диагностика. Обзорная рентге
нограмма брюшной полости может
установить забрюшинную эмфизему.
В случае подозрения на повреждение
двенадцатиперстной кишки для разрешения диагностических сомнений показана фибродуоденоскопия, УЗИ, КТ.
Особенности оперативного лечения. Для забрюшинного повреждения кишки патогномонична триада
Лафите: забрюшинная гематома, эмфизема и желто-зеленая окраска заднего листка брюшины. Найдя место
разрыва кишки, ее ушивают двухрядным швом. Если края раны кишечной
стенки размозжены, их экономно иссекают. Забрюшинную клетчатку тщательно осушивают и дренируют через
дополнительный разрез в правой поясничной области. В случаях полного
разрыва двенадцатиперстной кишки,
если трудно сшить ее без натяжения
краев, целесообразно наглухо ушить
оба конца и наложить гастроэнтероанастомоз.
1.4.2. Повреждения желудка
Различают ушибы, неполные и полные разрывы желудка. При ушибах отмечаются подслизистые или субсерозные гематомы. При неполных разрывах
повреждаются серозная и мышечная
оболочки без дефекта слизистой, при
полных — все слои желудка с образованием отверстия в нем. Чаще эти повреждения локализуются на передней
стенке желудка по малой кривизне и
в зоне привратника.
266
Текстовый модуль 4
Клиника. Закрытые повреждения
желудка проявляются шоком, очень
сильными болями в эпигастральной
области, тошнотой, рвотой, иногда с
примесью крови. Боль при полном разрыве желудка по своей силе и внезап
ности напоминает таковую при перфоративной язве. Ушибы и неполные
разрывы желудка по клиническому
течению подразделяются на 3 периода: шока, мнимого благополучия и последующих явлений. Второй период
характеризуется удовлетворительным
общим состоянием, умеренными болями в эпигастрии, реже рвотой. В третьем периоде могут формироваться
рубцовый стеноз, изъязвления, иногда
перфорация желудка.
Лечение оперативное. При закрытых повреждениях желудка достаточно эффективно ушивание разрыва его
стенки двухрядным швом.
1.4.3. Повреждения тонкой кишки
Непосредственной причиной, вызывающей закрытые повреждения
тонкой кишки, как правило, является быстро нанесенная тупым предметом травма на ограниченном участке
брюшной стенки, в частности удар
доской, прикладом ружья, кулаком,
сапогом и т. д. К повреждению кишки
и ее брыжейки может также привести
ушиб живота при падении, прижатии
к неподвижному массивному предмету
двигающейся автомашиной, удар воздушной волной.
Клиника закрытой травмы тонкой
кишки складывается из 3-х патогенетических факторов: шок, кровотечение и перитонит. Явления шока и внутреннего кровотечения, выраженные
в разной степени,— почти постоянные
спутники закрытых повреждений тонкой кишки. Однако быстро развивающийся перитонит в значительно боль-
Тема 13
шей степени определяет в конечном
итоге и клиническую картину, и прогноз заболевания.
Лечение. Экстренная операция —
единственный метод лечения повреждений тонкой кишки.
В случае одиночного повреждения
тонкой кишки, когда дефект стенки ее
не превышает 10 мм, рану ушивают
двухрядными швами в поперечном направлении по отношению к продольной оси кишки. При полных циркулярных разрывах кишки, дефектах более
10 мм, множественных повреждениях,
близко расположенных один от другого, при отрыве кишки от брыжейки
производят резекцию кишки в пределах здоровых тканей с наложением
энтероанастомоза конец в конец или
бок в бок. Перед ушиванием дефекта
кишечной стенки экономно иссекают
размозженные края раны.
После устранения повреждений
проводят дальнейшее лечение как при
перитоните.
1.4.4. Повреждения ободочной
кишки
Основные причины этих повреждений: автодорожная травма, сдавление
между двумя массивными предметами,
прямой удар в живот, падение с высоты.
Чаще отмечаются в сочетании с другими повреждениями органов, реже —
изолированные. Нарушение целостности ободочной кишки, в силу высокой
вирулентности содержащейся в ней
микрофлоры, быстро ведет к развитию
очень тяжело протекающего и дающего
быструю летальность воспаления брюшины — калового перитонита.
Лечение оперативное. При сравнительно небольших повреждениях,
когда края кишечной раны кровоточат
(хорошее состояние кровообращения
в кишечной стенке), дефект ушивают
трехрядным швом. При более обширных повреждениях простое ушивание кишки может привести к образо
ванию стриктуры. Поэтому в случаях
минимальных явлений перитонита и
удовлетворительном состоянии больного производят первичную резекцию
кишки с формированием анастомоза
конец в конец. Если это касается правого фланга ободочной кишки, резекция носит характер гемиколонэктомии
с наложением илеотрансверзоанастомоза. Проксимальнее анастомоза для
создания условий его заживления можно наложить временную илеостому.
При позднем оперативном вмешательстве и выраженном перитоните
допустимо в показанных ситуациях
первичное ушивание поврежденной
кишки с обязательным выведением декомпрессивной колостомы.
1.4.5. Повреждения мочевого пузыря.
Чаще всего встречаются при переломах костей таза. Однако при прямом
ударе в надлонную область, если мочевой пузырь переполнен, нередко возникают изолированные его повреждения. По локализации травмы мочевого
пузыря подразделяют на внутри- и внебрюшинные. Преобладают последние
(до 70%). В целом же изолированный
разрыв мочевого пузыря составляет
12—15% всех повреждений органов
живота при его закрытой травме. Чаще
внутрибрюшинный разрыв мочевого
пузыря бывает у лиц, находящихся в
алкогольном опьянении. Это связано с
тем, что отсутствие рефлекса мочевого
пузыря способствует его переполнению, а защитные способности передней
брюшной стенки понижены.
Внутрибрюшинный разрыв мочевого пузыря — очень опасная травма
ввиду быстрого развития разлитого
267
перитонита. В то же время ранняя диагностика мочевого перитонита трудна,
так как практически стерильная моча в
первые 10-12 ч. вызывает очень слабое
раздражение брюшины.
Клиника. При внутрибрюшинных
разрывах мочевого пузыря пострадавшие предъявляют жалобы на постоянные позывы к мочеотделению, принимающие нередко характер тенезмов
с невозможностью опорожнить мочевой пузырь. Часто из мочеиспускательного канала выделяется несколько
капель крови — «кровавая задержка»
мочи, патогномоничный симптом
внутрибрюшинного повреждения мочевого пузыря. Самостоятельное мочеотделение при этом наблюдается
чрезвычайно редко. Больные вначале
беспокойны, затем вялы и апатичны.
Принимают положение лежа на спине
с приведенными к животу нижними конечностями. Отмечаются выраженная
сухость губ, языка, отсутствие аппетита. Пульс учащен, АД имеет тенденцию
к понижению. Живот несколько вздут,
в акте дыхания участвует, за исключением нижних его отделов. При пальпации можно определить незначительное
напряжение передней брюшной стен
ки в эпигастральном отделе. Симптом
Щеткина — Блюмберга нередко положительный, перистальтические шумы
отсутствуют или ослаблены.
Явления перитонита медленно
прогрессируют. К концу 1-х суток с
момента травмы четко определяется
притупление перкуторного звука в отлогих местах живота. При пальцевом
исследовании через прямую кишку обнаруживается нависание ее передней
стенки, что указывает на скопление
жидкости в дугласовом пространстве.
При внебрюшинных разрывах мочевого пузыря моча изливается в околопузырную клетчатку, вызывая ее
268
Текстовый модуль 4
некроз с быстрым развитием мочевой
флегмоны и тромбоза вен таза. Богатое
развитие клетчатки таза создает благоприятные условия для резорбции мочи
и инфекции, которая, поступая в кровеносное русло, вызывает общую интоксикацию и септическое состояние.
Быстро развиваются явления пиелонефрита и почечной недостаточности,
что в сочетании с септическим состоянием дает клиническую картину уросепсиса.
При внебрюшинных разрывах мочевого пузыря наряду с расстройствами мочеотделения на первый план
выступает инфильтрация паховоподвздошных областей, где четко
определяются припухлость и резкая
болезненность во время пальпации.
В сомнительных ситуациях можно
прибегнуть к цистоскопии.
Диагноз. Катетеризацией мочевого пузыря устанавливается отсутствие
мочи в мочевом пузыре или очень
малое ее количество, нередко с примесью крови. При прохождении катетера через перфорационное отверстие
в брюшную полость может выделиться
большое количество мутной с примесью крови мочи с очень высоким (до
10 г/л) содержанием белка. Очень информативен метод контрастной рентгеноцистографии.
Рентгенограммы
следует выполнять в 2-х проекциях,
это позволяет увидеть затекание контрастного вещества в свободную брюшную полость, дополнительные тени вне
проекции мочевого пузыря.
Лечение — оперативное. Доступ —
нижняя срединная лапаротомия. Дефект в стенке мочевого пузыря ушивают двухрядным кетгутовым швом без
захвата слизистой оболочки. Мочевой
пузырь дренируют посредством наложения надлобкового свища. При внутрибрюшинных повреждениях необхо-
Тема 13
димо тщательно удалить жидкость из
брюшной полости и промыть ее большим количеством (6-8 л) раствора фурацилина 1:5000. Целесообразно оставлять микроирригаторы для введения
антибиотиков. Помимо ушивания раневого отверстия в мочевом пузыре и
наложения цистостомы необходимо
широко дренировать околопузырное
пространство и места затеков мочи.
В послеоперационном периоде показаны интенсивная детоксикационная терапия, антибиотики и уросептики.
1.5. Тупая травма живота
с повреждением внутренних
паренхиматозных органов
1.5.1. Повреждения печени
Травматические повреждения правой доли печени наблюдаются гораздо
чаще, чем левой (соотношение 5:1).
Повреждения печени могут быть в
виде размозжения, разрывов, трещин,
отрывов. В зависимости от целостно-
Техника лапароцентеза
2
1
0
3
4
5
Направление «шарящего»
катетера для ревизии различных
отделов брюшной полости
Методика введения зонда
в брюшную полость
и выявления жидкости
Рис. 116. Диагностика внутрибрюшного
кровотечения при помощи «шарящего» катетера
сти капсулы печени ее повреждения
подразделяют на подкапсульные травмы паренхимы и полные травмы. При
последних возникает массивное кровотечение с примесью желчи в свободную
брюшную полость, что обуславливает
перитонит, тяжело протекающий на
фоне выраженной кровопотери. Субкапсулярные и центрально расположенные гематомы иногда завершаются
формированием абсцесса и кисты. Одним из методов диагностики внутрибрюшинных кровотечений является
метод лапарацентеза с применением
шарящего катетера (рис. 116).
При подкапсульных и внутрипеченочных гематомах спустя несколько часов или суток с момента травмы может
внезапно возникать разрыв капсулы
с массивным кровотечением в брюшную полость (двухфазный разрыв).
Синдром травматической гемобилии
характеризуется тремя ведущими симптомами: острыми приступообразными болями в правом подреберье,
желудочно-кишечным кровотечением,
желтухой. Причиной периодически
возникающих болей является обтурация общего желчного протока сгустком крови, что вызывает преходящую
желчную гипертензию с растяжением
глиссоновой капсулы. Для внешних
проявлений кровотечения при травматической гемобилии можно считать
характерным обнаружение в рвотных
массах кровяных слепков желчного
протока. Желтуха интермиттирующая,
умеренно выраженная.
Лечение травматической гемобилии оперативное. Применяют:
1. ушивание раневой полости печени
с предварительным лигированием
кровоточащих сосудов;
2. тампонаду и наружное дренирование;
3. резекцию доли или сегмента печени;
269
4. наружную декомпрессию желчных
путей;
5. перевязку собственно печеночной
артерии или ее ветвей;
6. сочетание перечисленных выше
вмешательств.
Клиника. При травматических
повреждениях печени на первый план
выступают симптомы острого внутрибрюшного кровотечения и шока. Общее состояние больных уже с первых
часов, а иногда и минут тяжелое. Продолжающееся кровотечение усугубляет шоковые явления, прогрессируют
гиповолемия, гипоксия, артериальная
гипотензия, тахикардия.
При внешнем осмотре пациента нередко обнаруживаются ссадины и подкожные кровоподтеки соответственно
проекции печени, закрытые переломы ребер справа. Видимые слизистые
оболочки бледны, кожа покрыта холодным потом. Часть пострадавших
ареактивна, но нередко отмечаются
беспокойное поведение, возбуждение
больных. Как правило, пульс учащен
до 110-120 уд/мин., но иногда бывает
брадикардия, что связано, вероятно,
с ваготропным действием излившейся
в свободную брюшную полость желчи.
Пострадавшие предъявляют жалобы на боли различной интенсивности
в правом подреберье с иррадиацией
в правое плечо. Болезненность при
пальпации правой подреберной области отмечается не всегда, это относится
и к защитному напряжению мышц передней брюшной стенки. Часто наблю
дается вздутие живота, перистальтические шумы при этом или отсутствуют,
или резко ослаблены. В отлогих местах живота определяется меняющаяся при повороте больного на бок зона
притупления перкуторного звука, что
свидетельствует о внутрибрюшном
кровотечении. Симптом Щеткина —
270
Текстовый модуль 4
Рис. 117. Диагностическая лапароскопия травматического разрыва печени. Видна кровь в подпеченочном пространстве
Блюмберга выявляется примерно у половины больных.
При двухмоментных разрывах печени правильный диагноз чаще устанавливается во время прорыва субкапсулярной гематомы в брюшную
полость. Заподозрить субкапсулярную
гематому печени до ее прорыва можно
с помощью лапароскопии (рис. 117), а
также на основании косвенных клинических признаков (выраженной одышки, высокого лейкоцитоза, стойкого
снижения АД) при отсутствии других
признаков интраабдоминального кровотечения. Определенное значение в
распознавании закрытых травм печени
имеют лабораторные и рентгенологи
ческие методы исследования. Динамическое (ежечасное) наблюдение за
уровнем гемоглобина, эритроцитов,
величиной гематокрита и удельного
веса крови дает в этом плане ценные
сведения. Нередко в первые часы после
травмы печени определяется лейкоцитоз, вскоре уменьшающийся.
При субкапсулярных и глубоких
гематомах печени разрешить диагно-
Тема 13
стические сомнения помогают селективная рентгеноангиография, данные
сканирования печени.
Лечение. Консервативное лечение
может применяться при достоверно
диагностированных субкапсулярных и
центральных гематомах печени. Оно
должно осуществляться в хирургическом стационаре при строго почасовом
наблюдении врача и динамическом
лабораторном контроле. Больной в
течение 2 нед. должен соблюдать постельный режим. Назначают гемостатические препараты. При ухудшении
состояния больного показано оперативное вмешательство. Большинству
больных с закрытой травмой печени
показана экстренная операция.
При обнаружении места повреждения печени производят его ушивание. Для постоянной остановки кровотечения наиболее целесообразно
укладывать на глубину раны печени
участок большого сальника на ножке с последующим наложением швов.
Проводят гемостаз и дренирование
брюшной полости у места повреждения. При обширных повреждениях
печени во время ревизии раны удаляют сгустки крови, свободно лежащие
участки паренхимы, проводят гемостаз, рану по возможности ушивают
кетгутовыми швами от дна, подводят
и фиксируют участок большого сальника на ножке и марлевые тампоны.
Иногда прибегают к клиновидной
резекции печени или лобэктомии.
Последняя показана, если вся доля
печени нежизнеспособна. Это вмешательство очень травматично и сопровождается высокой летальностью
(более 50%).
В
послеоперационном
периоде проводят консерватиную коррекцию кровопотери, нарушений водноэлектролитного баланса.
1.5.2. Повреждения желчного
пузыря и внепеченочных желчных
протоков
Выделяют 4 вида этой травмы:
1) разрыв желчного пузыря;
2) отрыв желчного пузыря;
3) разрыв гепатикохоледоха;
4) сочетанные повреждения.
Клиника. Повреждение желчного пузыря и внепеченочных желчных
протоков сопровождается массивным
поступлением в брюшную полость
желчи, что приводит к желчному перитониту. Клиническая картина развивается бурно, быстро прогрессируют
желтуха, перитонит, появляются судороги, теряется сознание. При несвоевременно проведенной операции через
2-3 дня наступает смерть.
Диагноз изолированных закрытых
повреждений желчных протоков в первые часы после травмы затруднен из-за
отсутствия специфичных симптомов.
Только появление желтухи, обесцве
ченного кала, скопление в брюшной
полости жидкости дают возможность
предположить это повреждение.
Отмечаются сильная боль в правой
подреберной области, напряжение
мышц передней брюшной стенки, ограничение ее подвижности в акте дыхания, положительные симптомы Ортнера, Мюсси, Щеткина — Блюмберга,
притупление перкуторного звука над
правым боковым каналом, отсутствие
перистальтических шумов.
Чаще же диагноз устанавливается
во время операции. Лапароцентез и в
большей степени лапароскопия могут
оказать значительную помощь в дооперационной диагностике.
Диагностические сомнения следует
решать в пользу операции.
Лечение — оперативное. Предоперационная подготовка, обезболивание
271
и операционный доступ аналогичны
таковым при травмах печени.
Во время операции удаляют из
брюшной полости излившуюся желчь,
производят лаваж, используя для оттока промывной жидкости контрапертуры в подвздошных областях. Дренируют брюшную полость резиновыми
или пластиковыми трубками достаточного диаметра. Обязательно оставляют микроирригаторы для введения
антибиотиков. При разрыве желчного
пузыря или его отрыве от пузырного
протока производят холецистэктомию;
при повреждении гепатикохоледоха —
его восстановливают на жестком удаляемом каркасе типа дренажей по Керу
или Фелькеру. К винслову отверстию
подводят дренажную трубку.
1.5.3. Повреждения поджелудочной железы
Чаще наблюдаются у мужчин. Механизм повреждения, как правило,—
прямой удар в живот, автотравма, падение с высоты, сдавление. Наиболее
часто (57%) повреждается тело поджелудочной железы.
Выделяют 3 вида закрытых повреждений поджелудочной железы:
1) ушиб поджелудочной железы
при сохранности ее капсулы;
2) неполный разрыв или разрыв
капсулы железы;
3) полный разрыв поджелудочной
железы, отрыв железы или ее части.
Клиника. Патогномоничные признаки данной травмы отсутствуют,
симптомы сходны с таковыми при других травмах живота. Поэтому диагноз,
как правило, устанавливается во время
лапаротомии по поводу острого пери
тонита или внутрибрюшного кровотечения из-за повреждения полых или
паренхиматозных органов брюшной
полости.
272
Текстовый модуль 4
В большинстве случаев непосредственно после травмы появляются
очень сильные боли в эпигастральной
области. Выражен шок. Боли иррадиируют в лопатку, поясницу, реже бывают опоясывающими. Общее состояние
тяжелое. Кожные покровы и видимые
слизистые оболочки бледные. Тахикардия, артериальная гипотензия. Иногда
болевой синдром сопровождается многократной рвотой, в рвотных массах
примесь крови. Живот резко напряжен
и болезнен при пальпации в верхних
отделах, отстает в акте дыхания. Симптом Щеткина — Блюмберга положителен. Перистальтические шумы едва
прослушиваются. Показатели красной крови без изменений, отмечается
лейкоцитоз со сдвигом влево.
При ушибах или надрывах капсулы
поджелудочной железы клиническая
картина может носить двухфазный
характер. В этих случаях острая боль
стихает, а спустя несколько часов или
даже дней появляется вновь, что связано с развивающимся травматическим
панкреатитом и перитонитом.
Лечение закрытых повреждений
поджелудочной железы оперативное.
Рис. 118. Лапароскопическая картина повреждения
поджелудочной железы. Видны бляшки стеато
некроза
Тема 13
Предоперационная подготовка кратковременна, направлена на выведение
больного из шока. Наркоз эндотрахеальный, доступ срединный.
На париетальной и висцеральной брюшине нередко обнаруживают
бляшки жирового некроза (рис. 118), в
брюшной полости — сравнительно небольшое количество геморрагической
жидкости, иногда с грязно-серым оттенком. В брыжейке ободочной попереч
ной кишки, в желудочно-ободочной
связке и малом сальнике иногда находят гематомы. Для осмотра поджелудочной железы вскрывают желудочноободочную связку, полость малого
сальника освобождают от сгустков крови и выпота.
При ушибе железы без нарушения
целостности капсулы производят инфильтрацию
парапанкреатического
пространства 0,25% раствором новокаина с антибиотиками, сальниковую
сумку дренируют резиновой трубкой.
При изолированном повреждении капсулы железы ее следует зашить и подвести марлевый тампон и резиновую
трубку.
В случаях неполных разрывов паренхимы железы самыми простыми методами являются тампонада и дренаж.
При полном поперечном разрыве
поджелудочной железы наиболее целесообразно удалить ее дистальную часть
или, что более сложно, сшить железу
над дренажем в вирсунговом протоке.
Возможна и перевязка главного панкреатического протока прочной нерассасывающейся лигатурой.
Существует мнение (А.Е. Аталиев, Г.Л. Василенко), что при полном
поперечном разрыве поджелудочной
железы целесообразно на ее центральную часть наложить узловые кетгутовые швы, а между телом железы и
тощей кишкой — задний панкреатоэн-
тероанастомоз конец в бок на длинной
петле с брауновским межкишечным
соустьем, а затем подшить сальник на
ножке к зоне панкреатоэнтероанастомоза.
В послеоперационном периоде
обязательно 4-5-дневное полное голодание. В инфузионную программу
необходимо включать: плазму крови,
альбумин, интралипид, 20% раствор
глюкозы, 4% раствор хлорида калия.
Оправдала себя инфузия полиглюкинновокаиновой смеси. Необходимо вводить ингибиторы протеаз в больших
дозировках (до 200 000 ЕД), антибио
тики широкого спектра действия, витамины С и группы В, анаболические
гормоны.
1.5.4. Повреждения почек
Закрытые повреждения почек различают:
1. по виду повреждения:
a) разрыв паренхимы без повреждения полостной системы;
b) разрыв с повреждением чашечек
или лоханки;
c) размозжение почки;
d) повреждение сосудистой ножки;
e) отрыв почки от кровеносных сосудов и мочеточника.
2. по локализации:
a) тело почки;
b) полюс почки;
c) сосудистая ножка.
3. по тяжести поражения:
a) легкие — надрывы фиброзной и
жировой капсул с формированием
околопочечной гематомы;
b) средней тяжести — сравнительно
небольшие разрывы паренхимы
вместе с капсулой без повреждения
полостной системы;
c) тяжелые — обширные повреждения паренхимы вплоть до размозжения, повреждения полостной
системы с образованием больших
273
гематом и мочевой инфильтрации
забрюшинной клетчатки, повреждения элементов почечной ножки,
полный отрыв от ножки.
Клиника. Наиболее постоянный
симптом закрытой травмы почек —
боли в пояснице (тупые, острые, не иррадиирующие и с четкой иррадиацией
в паховую область и промежность).
В зависимости от тяжести травмы
болевой синдром продолжается от
2-3 сут. до нескольких недель.
Не менее редкий симптом закрытой травмы почки — гематурия
(60-98% всех пострадавших). Степень
ее различна — от микро- до макрогематурии со значительной кровопотерей. Уровень гематурии зависит от
тяжести повреждения и проходимости мочеточника. Так, например, при
очень тяжелой травме, полном отрыве
почки от ее ножки гематурии может и
не быть. Макрогематурия сопутствует закрытым повреждениям почек у
50-72% пострадавших. Длительность
гематурии — от 4-5 дн. до 2-3 нед. Изредка отмечается вторичная (поздняя) гематурия спустя 1-3 нед. после
травмы.
Третьим наиболее постоянным
признаком закрытой травмы почки
является припухлость в поясничной
или подреберной области, обусловленная скоплением крови (гематома) или
крови вместе с мочой (урогематома) в
паранефральной и забрюшинной клетчатке. Определить эту припухлость
чаще всего удается на 2-3-й день после
травмы. В редких случаях при разрыве
париетальной брюшины урогематома
дренируется в свободную брюшную
полость, вызывая перитонит.
Реже отмечаются боли в гипогастральной области, дизурические явления, метеоризм, отсутствие перистальтических шумов, притупление в
274
Текстовый модуль 4
отлогих местах живота, положительный симптом Щеткина — Блюмберга.
Диагноз закрытых повреждений
почек основывается на анамнестических, клинических, лабораторных и
специальных методах исследования.
Триада патологических симптомов в
сочетании с фактом травмы дают возможность с достаточной степенью достоверности поставить диагноз травмы почки. В сомнительных ситуациях
можно использовать: обзорную рентгенографию почек, инфузионную урографию, ретроградную пиелографию,
селективную ангиографию, сканирование почек. Наиболее доступна обзорная рентгенография почек, позволяю
щая при травме почки у ряда больных
отметить стертость или отсутствие тени
края подвздошно-поясничной мышцы,
что обусловлено забрюшинной гематомой. Метод инфузионной урографии
может дать ценную информацию о положении, форме и величине почек, чашечек, лоханки и мочеточника. Однако
применение метода ограничено, так
как в 1-е сутки после травмы функциональное состояние почек нередко резко нарушено (так называемая шоковая
почка) и получить контрастное изображение не удается. Ретроградную пиелографию можно осуществить лишь после
ликвидации гематурии. Селективная
ангиография позволяет точно установить локализацию, размеры повреждения почки и величину околопочечной гематомы. Сканированием почек
уточняются локализация повреждения
и функциональная способность почек
даже при незначительной травме.
Лечение. У 90—98% пострадавших
с закрытой изолированной травмой
почки проводят консервативное лечение. Показаниями к нему служат общее
удовлетворительное состояние, отсутствие признаков внутреннего крово-
Тема 13
течения, профузной гематурии, нарастающей урогематомы.
Консервативное лечение осуществляют в урологическом или хирургическом стационаре при динамическом
наблюдении за состоянием больного,
строгом постельном режиме в течение 12—15 сут., применении гемостатических, болеутоляющих и анти
септических средств.
В случаях выраженного внутреннего кровотечения, интенсивной и
длительной гематурии, ухудшения состояния пострадавшего, признаков
раздражения брюшины, сочетания
повреждения почек и органов брюшной полости показана операция.
В порядке предоперационной подготовки проводят комплекс противошоковых мероприятий (переливание
крови, кровезаменителей и др). Если в
течение 2—3 ч. устранить шок не удается, оперативное лечение откладывать
не следует. Обезболивание — современный комбинированный эндотрахеальный наркоз. Если хирург уверен в
изолированном повреждении почки, в
качестве оперативного доступа избирается люмботомия. При обоснованном
подозрении на сочетанную травму почки и органов брюшной полости показана срединная лапаротомия, при которой
возможны широкая ревизия и любые
манипуляции как на органах живота,
так и в забрюшинном пространстве.
При обширных полных травмах
почки, ее размозжении, отрыве от сосудистой ножки производят нефрэктомию, при этом предварительно
проверяют, имеется ли вторая почка.
В случаях разрыва или отрыва одного
из полюсов почки, одиночных трещин,
разрыва тела почки, одновременного
повреждения обеих почек и травмы
единственной почки производят органосохраняющие операции: резекцию
полюса почки, тампонаду раны почки.
Тампонаду осуществляют аутотканями больного. Для этой цели можно
использовать мышцу, жировую клетчатку, сальник, фасцию. Швы накладывают кетгутом на круглой игле. В швы
обязательно захватывают весь корти
кальный слой и большую часть мозгового. Кровотечение при этом надежно
останавливается. Отдельные швы можно наложить на фиброзную капсулу.
При операции из люмботомического доступа рану зашивают с обязательным оставлением дренажа из пластиковой трубки в паранефральном
пространстве. Если операция на почке
выполнена через лапаротомный доступ,
в поясничной области обязательно накладывают контрапертуру для дренирования околопочечного пространства.
Следует тщательно ушить задний листок париетальной брюшины над оперированной почкой. В брюшной полости оставляют микроирригатор для
последующего введения антибиотиков.
В послеоперационном периоде показаны гемостатические средства, уросептики, антибиотики, переливания
крови, реополиглюкина. Суточное количество выделенной мочи, уровень
мочевины, электролитов, белков проверяют в первые несколько дней после
операции.
1.5.5. Повреждения селезенки
Наблюдаются при закрытой травме
как левой половины грудной клетки,
так и верхнего отдела живота. Наиболее предрасположена к повреждению
патологически измененная и увеличенная селезенка вследствие перенесенных
ранее заболеваний (малярия и др.).
Отмечаются единичные и множественные разрывы селезенки. Зона повреждения может ограничиться только разрывом ее капсулы или только
275
паренхимы с сохраненной капсулой.
Чаще бывает одновременный разрыв
капсулы и паренхимы. Нередки множественные разрывы. Отрыв селезенки
от сосудистой ножки встречается редко. Наиболее часто травма селезенки
бывает изолированной, но иногда сочетается с повреждением диафрагмы,
почек, поджелудочной железы, желудка. Травматические повреждения
селезенки подразделяют на одно- и
двухмоментные. При одномоментных
разрывах одновременно повреждаются
паренхима и капсула органа. При этом
непосредственно после травмы возникает профузное кровотечение в брюшную полость. Для двухмоментных
разрывов характерно вначале изолированное повреждение паренхимы с образованием субкапсулярной гематомы.
Спустя какое-то время, от нескольких
часов до месяца и больше, под влиянием даже незначительного физического
воздействия, натуживания, кашля, чихания происходит разрыв растянутой
капсулы и опорожнение гематомы в
свободную брюшную полость. Сущест
вует мнение, что около трети всех закрытых повреждений селезенки протекает по типу двухмоментных.
Клиника. Клинические проявления закрытых повреждений селезенки
чрезвычайно многообразны и зависят
от тяжести травмы, времени ее возникновения и повреждений других органов. Определяющий синдром включает
признаки острой кровопотери, шока и
раздражения брюшины. Одним из самых ранних симптомов можно считать
обморочное состояние в течение нескольких минут или часов, возникающее сразу после травмы или через несколько часов после нее. Боли в животе
появляются также вскоре после травмы
и локализуются вначале в левом подреберье, реже в эпигастральной обла-
276
Текстовый модуль 4
сти, часто иррадиируют в левое плечо,
лопатку. Постепенно боли становятся
распространенными.
Отмечается выраженная бледность
кожных покровов и видимых слизистых
оболочек. Может, хотя и редко, иметь
место рвота. Пульс учащен, малого наполнения и напряжения, АД понижено,
тоны сердца глухие. Живот умеренно
вздут, передняя брюшная стенка нерезко напряжена. Симптом Щеткина —
Блюмберга наблюдается не часто, выражен нерезко, брюшная стенка отстает
от акта дыхания или не участвует в нем.
Перистальтические шумы примерно у
половины больных ослаблены или отсутствуют. В отлогих местах живота,
чаще по левому боковому каналу, можно заметить притупление перкуторного
звука. Живот при пальпации, как правило, болезненный. При пальцевом исследовании через прямую кишку можно
обнаружить нависание и болезненность
передней стенки кишки. Весьма характерен симптом Розанова. При скоплении
крови в левой половине живота больные
часто лежат на левом боку с поджатыми
к животу бедрами. При попытке повернуть больного на спину или на правый
бок он стремится принять прежнее положение, жалуясь на резкое увеличение
болей в ином положении. Этот симптом
ценен, хотя и не строго специфичен для
травмы селезенки. В крови уменьшено
количество эритроцитов, гемоглобина,
понижены гематокрит и удельный вес,
часто наблюдается лейкоцитоз.
При двухмоментных травмах селезенки и так называемом замедленном
разрыве клинический симптомокомплекс менее выражен. При этих разрывах между моментом травмы и раз
витием внутрибрюшной катастрофы
проходит определенное время.
Двухмоментную травму селезенки
можно заподозрить на основании са-
Тема 13
мого факта и характера травмы, перелома IX—XI ребер слева, иррадиации
болей в лопатку и плечо, некоторых
локальных признаков и динамики лабораторных показателей. Особо важное диагностическое значение придают
динамическому (почасовому) наблюдению за величиной селезенки.
При подозрении на ее травму следует обрисовать контуры, полученные
в результате перкуссии. Расширение
площади перкуторной тупости селезенки убедительно свидетельствует о ее
травматическом повреждении. Иногда
увеличенную и болезненную селезенку
удается пропальпировать в левом подре
берье. Обзорная рентгеноскопия в некоторых случаях позволяет отметить неподвижность левого купола диафрагмы.
Исследование гемоглобина и эритроцитов крови в первые часы наблюдения при субкапсулярных гематомах
неинформативно.
Для диагностики двухмоментных
разрывов селезенки с успехом используют селективную рентгеноангиографию. Однако гораздо проще и
не менее достоверно вопрос о своевременной диагностике всех разновидностей травматических повреждений селезенки можно решить применением
лапароцентеза с последующей (в показанных случаях) лапароскопией.
Лечение. При травматическом повреждении селезенки, независимо от его
характера, показана экстренная операция. Это касается и достоверно установленного субкапсулярного ее разрыва.
Предоперационная подготовка заключается в восстановлении кровопотери. Причем не следует добиваться
полного ее восстановления. Это и не
осуществимо при продолжающемся
внутреннем кровотечении. Даже при
отсутствии стабилизации показателей
гемодинамики нельзя медлить с опе-
рацией, необходимо осуществлять ее
под защитой гемотрансфузии. Обез
боливание — предпочтительнее общее.
Если хирург уверен в изолированном повреждении селезенки, можно
произвести разрез параллельно левой
реберной дуге. В противном случае показана верхнесрединная лапаротомия,
которая позволяет произвести широкую ревизию органов брюшной полости и забрюшинного пространства.
В случае технических трудностей при
иммобилизации селезенки можно срединный разрез дополнить поперечным
разрезом левой прямой мышцы живота.
В брюшной полости при одномоментной травме селезенки всегда в том
или ином количестве (от 500 мл до 3 л)
имеется кровь. Ее осторожно собирают
специальной ложкой и, убедившись в
отсутствии признаков инфицированности, используют для реинфузии пострадавшему. Эту кровь перед введе
нием в вену следует профильтровать
через 5 слоев стерильной марли и стабилизировать раствором ЦОЛИПК.
При
повреждениях
селезенки
единственно рациональной операцией
является спленэктомия. Органосохраняющие вмешательства небезопасны
ввиду реальной возможности послеопе
рационных кровотечений. После удаления селезенки и тщательного гемостаза
брюшную полость осушают и зашивают наглухо. Путем дополнительного
прокола в левом подреберье вводят резиновую или пластиковую трубку для
применения антибиотиков, удаления
серозного выпота и контроля гемостаза. Через 3 сут. дренаж удаляют.
1.6. Повреждения брыжейки
Примерно в 10% случаев закрытой
травмы живота отмечаются разрывы
и гематомы брыжейки. Повреждения
брыжейки подразделяют на:
277
ушиб с повреждением мелких сосудов;
■ разрыв и полный отрыв брыжейки.
Опасность указанных повреждений заключается в значительном внутрибрюшном кровотечении и в угрозе
жизнеспособности сегмента кишки, соответствующего поврежденному участку брыжейки.
Клиника складывается из признаков острой кровопотери и динамической кишечной непроходимости
(бледность, жажда, умеренные боли в
животе, тахикардия, артериальная гипотензия, снижение показателей эритроцитов, гемоглобина, гематокрита,
удельного веса крови, метеоризм, исчезновение перистальтических шумов), что диктует необходимость
экстренного оперативного вмешательства. При малой выраженности указанного синдрома производят лапароскопию или лапароцентез, позволяющие
подтвердить предположение о внутри
брюшном кровотечении.
Диагноз этого вида травмы до операции почти невозможен.
Лечение. Предоперационная подготовка должна быть кратковременной (до 1 ч.), заключается в адекватных гемотрансфузиях. Обезболивание
общее, операционный доступ — срединная лапаротомия. Гематому брыжейки удаляют, поврежденные сосуды
лигируют, дефект брыжейки ушивают.
При сомнении в жизнеспособности соответствующего травме сегмента кишки производят резекцию в пределах
безусловно жизнеспособных тканей.
В послеоперационном периоде возме
щают кровопотерю.
■
2. Перитонит
Перитонит (peritonitis) — воспаление париетальной и висцеральной
брюшины, сопровождающееся выра-
278
Текстовый модуль 4
женными местными изменениями и
интоксикацией.
В подавляющем большинстве случаев перитонит является следствием
или этапом развития различных хирургических заболеваний, открытых
или закрытых повреждений органов
брюшной полости. Практически любой деструктивный процесс в брюшной
полости сопровождается воспалительной реакцией, и, в зависимости от ряда
условий, осложняется ограниченным
или распространенным перитонитом.
Перитонит — очень тяжелое заболевание, сопровождающееся выраженными патологическими нарушениями
со стороны всех органов и систем организма. Летальность при распространенной форме составляет 20—30%.
2.1. Этиология и патогенез
перитонита
Различают первичный перитонит,
когда первичный воспалительный
очаг расположен вне брюшной полости (гайморит, отит и другие гнойные
заболевания) и инфекция попадает в
брюшную полость гематогенным или
лимфогенным путями. К этому виду
также относят криптогенный перитонит, когда первичный инфекционный
очаг не удается обнаружить (наиболее
часто встречается у детей).
К вторичному перитониту относят
воспалительные процессы брюшины,
источником возникновения которых
послужили острые хирургические заболевания брюшной полости.
Развитие перитонита обуславливают разнообразные гноеродные
микроорганизмы (стафилококк, протей, кишечная палочка, неспорообразующие анаэробы и т. д.). Чаще всего
(85—90%) его вызывает бактериальная
флора, попавшая в брюшную полость
из внешней среды при ранениях, чрево-
Тема 13
сечениях или из полых органов брюшной полости при их воспалении, перфорации, травматических повреждениях.
При
смешанной
микрофлоре,
встречающейся обычно при перито
ните, ведущее значение имеет какойлибо один вид микроба. Так, наиболее
часто встречаются перитониты, при которых ведущую роль играют кишечная
палочка, неспорообразующие анаэробы, реже стрептококк, стафилококк.
Видом возбудителя определяются некоторые особенности течения гнойного перитонита: стрептококковый
перитонит обычно имеет тенденцию
к распространению, воспалительный
процесс не ограничивается спайками,
гной жидкий, фибрина в нем мало. Колибациллярный перитонит склонен к
отграничению, осумкованию, экссудат
содержит много фибрина.
Специфические
воспалительные
процессы в кишечнике — брюшной
тиф, дизентерия, туберкулез и др. —
вызывают развитие специфических
язв кишечной стенки, что также может
привести к перфорации кишки. Для
развития перитонита не всегда необходимо нарушение целости всех слоев стенки полого органа: иногда для
проникновения микробов в брюшную
полость и развития перитонита достаточно нарушения целости только слизистой или серозной оболочки.
Установлено, что в возникновении
острого воспаления брюшины играют
роль:
■ Количество поступивших микроорганизмов;
■ Вирулентность микробов;
■ Снижение реактивности организма
по отношению к патогенным микроорганизмам;
■ Наличие повреждения брюшины.
В зависимости от состояния иммунобиологических систем организма
инфекция распространяется преимущественно или по поверхности брюшины с резорбцией токсинов в кровь
или, наряду с поверхностным распространением, быстро проникает через
все слои брюшины в межклеточные
пространства и лимфатические щели
(лимфогенный путь), или же, проникая в открытые сосуды, разносится по
системе воротной вены.
В начале развития воспаления
брюшины первичный очаг редко бывает отграничен спайками от свободной
брюшной полости. В процессе развития воспаления происходят склеивание
листков брюшины на границах воспалительного очага и развитие спаек, которые при быстром образовании могут
привести к отграничению воспалительного процесса.
При перитоните развивается гиперемия висцеральной и париетальной
брюшины и сальника, появляются небольшие кровоизлияния и происхо
дит пропитывание брюшинного листка
воспалительным экссудатом, богатым
лейкоцитами и фибрином. Последний
покрывает воспалительную поверхность тонкой пленкой (фибринозной
сеткой), в брюшине образуются очаги круглоклеточной инфильтрации,
брюшина становится шероховатой и
тусклой. Воспаление более резко выражено в области источника инфицирования. При дальнейшем развитии
воспаления экссудация усиливается
и накапливается в брюшной полости.
Общее количество экссудата колеблется от нескольких миллилитров при
местных перитонитах до нескольких
литров — при общих.
Бактерицидные вещества, содержащиеся в экссудате брюшной полости,
разрушают бактерии, а форменные
элементы фагоцитируют их. В результате гибели грамотрицательных бак-
279
терий (кишечная палочка, протей, синегнойная палочка) высвобождается
огромное количество эндотоксинов.
Эндотоксины, смешиваясь с токсинами, образовавшимися вследствие
распада тканей организма, делают перитонеальный экссудат чрезвычайно
токсичным. Токсины и эндотоксины
всасываются из брюшной полости по
кровеносным сосудам, попадая по системе воротной вены в печень и вызывая ее дегенеративное изменение. Часть
токсинов попадает в большой круг кровообращения, оказывая токсическое
воздействие на все органы и ткани —
возникают явления эндотоксического шока. При шоке наступает паралич
вазомоторных центров, возникает недостаточность надпочечников, а также
геморрагический некроз слизистой кишечника. Эндотоксины способствуют
выделению катехоламинов, гистамина,
кортикоидов, которые в совокупности
вызывают тяжелое повреждение паренхиматозных органов, глубокие гемодинамические расстройства, снижение
насыщенности крови кислородом. Отмечается выраженный ацидоз, гиперкалиемия, гипонатриемия, азотемия, в
условиях которых происходит активация процессов протеолиза. Возрастает
активность сывороточной амилазы,
пепсина, уропепсина, аминотрансфераз. Повышение уровня протеолитических ферментов вызывает активацию
калликреин-кининовой системы.
Накопление кининов сопровождается расширением мелких сосудов,
стазом и повышением проницаемости.
Капилляры органов брюшной полости расширяются, в них скапливается значительное количество крови,
практически полностью выключенное из кровообращения. Уменьшается коронарный кровоток, что, в свою
очередь, вызывает ослабление сер-
280
Текстовый модуль 4
дечной деятельности на фоне нарушения метаболизма сердечной мышцы.
При уменьшении сердечного выброса уменьшается и общее количество
кислорода, проходящее через ткани в
единицу времени — возникает циркуляторная гипоксия. На фоне снижения
рН крови происходит спазм периферических сосудов с развитием шунтирования крови по артериовенозным анастомозам. При недостатке кислорода в
организме уменьшается энергообразование за счет перехода аэробного гликолиза в анаэробный.
По мере развития перитонита понижается центральное и периферическое венозное давление, артериальное
давление и минутный объем сердца.
Уменьшается объем циркулирующей
крови за счет повышения проницаемости сосудов для белка и воды и увеличения периферической сосудистой
емкости — развивается выраженная
гиповолемия.
Нередко возникают микротромбозы на фоне резкого нарушения перфузии органов и тканей.
С самого начала заболевания наблюдаются нарушения функции пищеварительной системы. Возникает стойкий парез кишечника. Основными
причинами пареза являются:
■ раздражение интерорецепторов органов брюшной полости токсинами, содержащимися в воспалительном экссудате;
■ нарушения микроциркуляции в кишечной стенке вследствие сосудистых нарушений;
■ структурные повреждения нервномышечного аппарата кишечника в
условиях интоксикации.
Возникший парез кишечника сопровождается растяжением в ширину
кишечных петель, что приводит к раздражению механорецепторов с разви-
Тема 13
тием тормозного энтеро-энтерального
рефлекса и ослаблению перистальтики.
На фоне продолжающейся секреции
пищеварительных соков и снижения
перистальтики возникает переполнение кишечника и перерастяжение кишечной стенки, что вызывает сдавление кишечных сосудов и почти полное
прекращение всасывания. В застойном
кишечном содержимом усиливаются
процессы гниения и брожения с образованием чрезвычайно токсических
веществ, которые при повышении
внутрикишечного давления начинают
«пропотевать» в брюшную полость,
усиливая интоксикацию.
С прогрессивно возрастающим образованием газов пропорционально
возрастает внутрибрюшное давление,
вздутие живота, что приводит к прекращению брюшного и диафрагмального дыхания за счет высокого стояния
диафрагмы, затруднению прохождения крови по воротной и нижней полой венам.
Катаболические процессы сопровождаются большими затратами белка.
Состояние усугубляется нарушением
в условиях перитонита нормального
питания. При гнойном перитоните абсолютные потери белка (с экссудатом,
рвотными массами и др.) колеблются
от 50 до 250 г в сутки. Уровень белка
в крови резко снижается. Нарушения
белкового обмена сопровождаются
дефицитом азотистого баланса, гиповолемией, гипотензией, изменениями
кислотно-основного состояния. Скопление жидкости в брюшной полости
и потери ее с рвотными массами приво
дят к нарушению соотношения между
внеклеточным и внутриклеточным водным бассейном, к развитию синдрома
клеточной дегидратации, а в дальнейшем к водному дефициту как во внутриклеточной, так и во внеклеточной
среде. Одновременно с водой теряется
большое количество солей, к водной недостаточности присоединяется солевая.
Таким образом, патогенез острого
перитонита складывается из взаимо
связанных функциональных и органических изменений в ряде систем организма и патологических синдромов
(О.С. Кочнев, 1981):
1. нарушение
нейрогуморальной регуляции, характеризующееся
изменением соотношения биогенных
аминов — катехоламинов, серотонина,
гистамина, плазматических протеаз,
кининов, а также тканевых метаболитов — молочной, пировиноградной,
адениловой и других кислот;
2. изменения в микро- и лимфомикроциркуляции,
развивающиеся
вследствие диспротеинемии (гипоаль
буминемии, гиперглобулинемии), гиповолемия и гемоконцентрация, замедление скорости кровотока, изменения
формы и объема эритроцитов;
3. изменения в состоянии сер
дечно-сосудистой системы, появляющиеся в результате нарушений сосудистого тонуса, сократительной функции
миокарда и массы циркулирующей
крови;
4. динамическая (функциональ
ная) кишечная непроходимость, связанная с интоксикацией, нарушением
нейрогуморальной
регуляции,
микроциркуляции и кровообращения;
5. нарушения в эндокринной системе и обменных процессах (белковом, углеводном, жиролипидном, электролитном и др.);
6. интоксикация:
a) аутокаталитическая (гистамин,
серотонин, кинины);
b) метаболическая (аммиак, молочная, пировиноградная, адениловая
кислоты);
c) микробная.
281
2.2. Классификация
В настоящее время существует
классификация, которая вобрала в себя
несколько характеристик перитонита.
1. По причине:
a) Вследствие острых заболеваний органов брюшной полости и забрюшинного пространства;
b) Вследствие травм живота и забрюшинного пространства;
c) Вследствие послеоперационных осложнений.
2. По характеру экссудата
брюшной полости:
a) Серозный;
b) Серозно-фибринозный;
c) Фибринозно-гнойный;
d) Гнойный;
e) Асцетический, ферментативный, мочевой;
f) Хиллезный;
g) Желчный;
h) Каловый.
3. По
распространенности
(В.С. Маят и В.Д. Федоров, 1973):
a) Местный (ограниченный и неограниченный);
b) Распространенный (диффузный, разлитой, общий).
4. По фазам течения (К.С. Симонян, 1971):
a) Реактивная фаза;
b) Токсическая фаза;
c) Терминальная фаза.
Наиболее частыми причинами перитонита являются:
1. воспалительные процессы различных органов брюшной полости —
червеобразного отростка, желчного
пузыря, придатков матки и др.;
2. перфорация полых органов
брюшной полости (желудка или двенадцатиперстной кишки при прободной язве; червеобразного отростка
при гангренозном или флегмонозном
282
Текстовый модуль 4
аппендиците; желчного пузыря при
остром деструктивном, чаще всего
калькулезном холецистите; ободочной
кишки при неспецифическом язвенном
колите или дизентерии, подвздошной
кишки при брюшном тифе и т. д.);
3. открытые и закрытые повреж
дения полых и паренхиматозных органов брюшной полости (желудка, кишечника, селезенки, печени, мочевого
пузыря, комбинированные);
4. расстройства кровообращения
в сосудах брыжейки кишечника при:
a) ущемленных грыжах (внутренних и наружных);
b) странгуляционной кишечной
непроходимости (заворот, узлообразование и др.);
c) артериальных, венозных и смешанных тромбозах кишечника;
5. деструктивные формы острого
панкреатита (геморрагический некроз
поджелудочной железы, гнойный панкреатит);
6. деструктивные формы острого
холецистопанкреатита;
7. операции на органах брюшной
полости по поводу хронических заболеваний (резекция желудка при язвенной
болезни, раке желудка, холецистэктомия
при желчнокаменной болезни и др.);
8. гематогенные и криптогенные
перитониты (пневмококковые, стрептококковые и др.);
9. воспалительные процессы раз
личного происхождения, не связанные
с органами брюшной полости (гнойные процессы в забрюшинной клетчатке — паранефриты, натечные абсцессы,
флегмоны брюшной стенки, паразитарные кисты и др.).
В зависимости от распространенности выделяют следующие основные
формы острого перитонита:
Тема 13
1. местный (процесс занимает не
более 2 анатомических областей):
a) отграниченный (воспалительный инфильтрат, абсцесс);
b) неотграниченный (ограничивающих сращений нет, но процесс локализуется только в одной или двух
анатомических областях живота);
2. распространенный:
a) диффузный (брюшина поражена на значительном протяжении, но
процесс охватывает менее чем 2 этажа
брюшной полости);
b) разлитой (поражена брюшина
более чем 2 этажей брюшной полости);
c) общий (тотальное воспаление
всего серозного покрова органов и сте
нок брюшной полости).
Продолжающееся распространение воспаления по брюшине сопровождается и углублением его стадии
(фазы). Местному неотграниченному и
диффузному перитониту соответствует
реактивная фаза, которая быстро переходит в токсическую, а по мере распространения процесса и перехода его в
разлитой и общий перитонит заболевание переходит в терминальную фазу.
2.3. Клиника перитонита
Клинически перитонит протекает
в виде трех последовательно сменяющихся фаз, имеющих относительно
четкие временные характеристики.
Реактивная фаза перитонита
(первые 24 ч.) определяется нарастанием воспалительных изменений в
брюшине. Больные жалуются на интенсивные боли в животе, которые вначале локализуются в месте расположения
источника перитонита, а затем распространяются на соседние области, могут захватывать половину живота или
весь живот. Довольно часто отмечается
рвота желудочным содержимым, затем желчью. Общие клинические про
явления заболевания выражаются в
повышении температуры тела до 38°С
и выше, тахикардии (пульс учащается до 120 в 1 мин.), повышении ар
териального давления, учащении дыхания (до 24—28 в 1 мин.), беспокойстве,
двигательном возбуждении.
Лицо вначале гиперемировано, а
затем становится бледным. Живот втянут или умеренно вздут, брюшная стенка или ее половина в акте дыхания не
участвует. При пальпации живота отмечаются выраженная болезненность и
напряжение мышц всей брюшной стенки либо в том или ином ее отделе в зависимости от распространенности воспаления по брюшине. Кишечные шумы
при аускультации выслушиваются.
При лабораторном исследовании
крови отмечается лейкоцитоз с уме
ренным сдвигом лейкоцитарной формулы влево.
Токсическая фаза перитонита (от
24 до 72 ч.) характеризуется тяжелой
интоксикацией и парезом желудочнокишечного тракта. Больной становится
адинамичным, черты лица заострены,
кожа бледная, глаза ввалившиеся. Частота пульса превышает 120 в 1 мин.,
наполнение его слабое, артериальное
давление снижено. Температура тела
высокая (39—40°С), носит гектический
характер, иногда отмечается озноб. Живот вздут, при пальпации его болезненность и напряжение мышц выражены
меньше, чем в реактивной фазе, при перкуссии живота отмечается метеоризм,
кишечные шумы не выслушиваются.
Рвота частая с кишечным содержимым.
В крови лейкоцитоз с выраженным
сдвигом лейкоцитарной формулы влево
(появление юных форм) и токсической
зернистостью лейкоцитов.
Терминальная фаза (полиорганной
недостаточности — свыше 72 ч.) характеризуется крайней степенью интоксика-
283
ции. Больной заторможен, адинамичен,
безучастен к окружающему, сознание
может быть спутанным, нередко развивается токсический психоз (неадекватное поведение, возбуждение, галлюцинации). Лицо землисто-серого цвета,
осунувшееся (лицо Гиппократа). Отмечается обильная рвота с каловым запахом.
Пульс очень частый, нитевидный,
артериальное давление снижено. Живот
резко вздут, болезнен при пальпации на
всем протяжении. Перистальтические
кишечные шумы не выслушиваются
(симптом гробовой тишины). Температура тела снижается, кожа покрыта
холодным липким потом. В крови выраженный лейкоцитоз с резким сдвигом
лейкоцитарной формулы влево. Количество мочи уменьшено, в ней определяется
высокое содержание белка, цилиндров.
2.4. Особенность обследования
больного перитонитом
При переходе воспаления на брюшину с органов брюшной полости клинические признаки перитонита присоединяются к признакам заболевания,
явившегося источником перитонита.
В последующем при распространении
воспаления по брюшине и переходе
процесса в токсическую или терминальную фазу признаки заболевания,
явившегося источником перитонита,
не всегда удается определить.
Больные перитонитом жалуются на
боли в животе, жажду, слабость, рвоту, одышку. Боли носят постоянный
характер, локализация их в начале заболевания может быть различной в зависимости от источника воспаления,
затем боли распространяются на половину этажа, целый этаж живота или
на весь живот. При скоплении экссудата в поддиафрагмальном пространстве
боли могут иррадиировать в плечо, лопатку, при скоплении в малом тазе — в
284
Текстовый модуль 4
прямую кишку, промежность. Нара
стание болей может быть постепенным
(при воспалении того или иного органа) или боли появляются сразу, носят
резкий характер («удар кинжалом»),
как это бывает при прободении язвы
желудка или двенадцатиперстной кишки. Характер болей и их локализация
определяются основным заболеванием: например, при остром холецистите
они носят схваткообразный характер
и локализованы в правом подреберье,
при острой кишечной непроходимости
боли сильные, схваткообразные, а при
развитии перитонита и пареза кишечника интенсивность их уменьшается,
но они становятся постоянными.
При осмотре больных отмечаются заострение черт лица, бледность,
учащение дыхания. Пульс частый, наполнение его изменяется по мере нарастания перитонита, артериальное давление снижается, язык сухой, обложен.
Живот при осмотре в начале заболевания не изменен или умеренно
вздут. Выраженное вздутие живота отмечается при развившемся перитоните.
В акте дыхания он не участвует или
отстает в дыхании одна его половина,
определяется грудной тип дыхания.
При прободном перитоните в начале
заболевания живот может быть втянут.
Перистальтические кишечные шумы
при перитоните в токсической или
терминальной фазе не выслушиваются.
При перкуссии живота выслушивается
высокий тимпанический звук, в отлогих местах живота он укорочен вследствие скопления экссудата.
При пальпации живота болезненность вначале определяется в
области локализации источника перитонита, а затем распространяется на
несколько областей, половину живота
или на весь живот.
Важным симптомом перитонита
является напряжение мышц брюшной
Тема 13
стенки. Для определения этого симптома следует проводить нежную паль
пацию двумя руками, положив ладони
на симметричные области брюшной
стенки. Перемещая руки с легким нажатием на брюшную стенку, сравни
вают состояние мышц: уплотнение,
сопротивление стенки при пальпации
указывают на напряжение мышц. Резко выражено напряжение мышц при
перфоративном перитоните (живот как
доска). Причиной напряжения мышц
является рефлекторная, защитная реакция брюшной стенки, обусловленная
болью. Наряду с напряжением мышц
брюшной стенки к постоянным симптомам перитонита относится симптом
Щеткина — Блюмберга. В основе его
лежит усиление болей в животе при
сотрясении брюшины. Для выявления
этого симптома осторожно надавливают на брюшную стенку пальцами и
резко отдергивают руку. Возникающее
сотрясение брюшной стенки и брюшины приводит к усилению болей при наличии воспаления брюшины.
При лабораторном исследовании
крови обнаруживают лейкоцитоз, достигающий при распространенном перитоните 15,0—20,0 х109/л со сдвигом
лейкоцитарной формулы влево, анемию; СОЭ увеличена; в моче — белок,
цилиндры.
При обзорной рентгенографии
брюшной полости при перитоните можно определить свободный газ, вследствие прободения полого органа; при
развившемся парезе кишечника — вздутие кишечных петель и жидкость в них.
2.5. Лечение
2.5.1. Предоперационная подготовка
Лечение больных с перитонитом
начинается с предоперационной подготовки, которая должна быть краткой
(не более 2 часов):
1. купирование болевого синдрома
(внутримышечное введение анал
гетиков, спазмолитиков) — только
после установки диагноза!
2. декомпрессия желудка (аспирация
содержимого желудка через толстый зонд);
3. устранение метаболического ацидоза;
4. коррекция нарушения сердечнососудистой деятельности;
5. коррекция водно-электролитного
баланса с возмещением дефицита
жидкости под контролем диуреза;
6. устранение нарушений микроциркуляции;
7. коррекция белковых расстройств;
8. антибактериальная терапия (внутримышечное, внутривенное введение максимальных доз антибиотиков широкого спектра действия,
препаратов группы метронидазола);
9. терапия, направленная на улучшение функции паренхиматозных органов;
10. антиферментная терапия (введение
ингибиторов протеаз: контрикал,
трасилол);
11. премедикация (см. раздел Обезболивание).
Устранение метаболического ацидоза, нарушений микроциркуляции,
коррекция
расстройств
сердечнососудистой
деятельности,
водноэлектролитного баланса, белковых
расстройств проводится посредством
инфузий белковых, реологических, солевых растворов и препаратов крови.
Для проведения инфузионной терапии
следует канюлировать подключичную
вену. Объем инфузии зависит от величины обезвоживания и колеблется в
пределах от 1,5 до 2,5 л растворов (полиглюкин, реополиглюкин, альбумин,
плазма, полиионные растворы, растворы глюкозы с инсулином, витамины
285
группы В и С, кокарбоксилаза, панангин, сердечные гликозиды).
2.5.2. Оперативное лечение
Основными принципами оперативного лечения перитонита являются:
■ устранение источника инфекции;
■ полноценная санация;
■ дренирование желудочно-кишеч
ного тракта с использованием закрытого метода — назогастрального и назогастроеюнального зонда;
■ дренирование брюшной полости
с учетом распространения и фазы
перитонита.
При общем перитоните лучшим
хирургическим доступом является срединная лапаротомия.
Устранение источника перитонита предусматривает удаление органа при его воспалении (аппендэктомия
(рис. 119), удаление желчного пузыря
(рис. 120), маточной трубы, резекция
кишки и др.), ушивание перфоративного отверстия при перфорации язвы желудка или двенадцатиперстной кишки.
Санация брюшной полости
предусматривает удаление экссудата с
помощью электроотсоса или высушивания брюшной полости марлевыми
салфетками.
Для борьбы с парезом желудочнокишечного тракта необходима декомпрессия кишечника. При резекции
кишечника ее выполняют через открытые концы резецированной кишки: их
выводят за пределы брюшной полости,
снимают зажимы и выдавливающими
движениями удаляют из кишки жидкое
содержимое и газы. Если один или два
конца кишки выводят в виде кишечного
свища, то декомпрессия будет осуществляться и после операции через этот
свищ (энтеростому или колостому).
В тех случаях, когда источник перитонита устранен без вскрытия просвета
кишечника (аппендэктомия, холеци-
286
Текстовый модуль 4
стэктомия, ушивание перфоративного
отверстия), то декомпрессию во время
операции и в послеоперационном периоде осуществляют с помощью длинных
мягких тонкокишечных зондов с множественными боковыми отверстиями,
которые проводят через нос, пищевод,
желудок в тонкую кишку во время
операции. Зонд продвигают по кишке
во время лапаротомии и удаляют по
нему кишечное содержимое, оставляя
для длительной декомпрессии в пос
леоперационном периоде.
Цель декомпрессии, продолжающейся после операции, — удалить кишечное содержимое, чтобы предупредить его всасывание и интоксикацию
организма, а также уменьшить нарушение кровообращения и питания в
растянутой газами стенке кишки. Кроме того, вздутие живота ограничивает
движение диафрагмы, приводит к смещению сердца и легких, нарушая тем
самым их деятельность. После декомпрессии кишечника в брыжейку тонкой
кишки вводят 150 мл 0,25% раствора
новокаина.
Заключительный этап операции — дренирование брюшной полости. Для дренирования применяют
силиконовые хлорвиниловые трубки
диаметром до 0,8 см. Дренажи выводят
через отдельные проколы брюшной
стенки. Рану брюшной стенки чаще
зашивают наглухо.
При распространенном перитоните
устанавливают дренажи для периодического (фракционного) промывания
брюшной полости в послеоперационном
периоде антисептическими растворами.
Метод проточного перитонеального диализа применяют лишь в случаях,
когда не полностью удалось санировать
брюшную полость при перитоните.
Устранение источника перитонита,
санация брюшной полости во время
Тема 13
операции, интубация кишечника не
останавливают сразу воспалительный
процесс в брюшине. Воспаление может продолжаться, постепенно стихая,
под воздействием проводимого в послеоперационном периоде лечения.
Дренирование и лаваж брюшной полости (перитонеальный диализ), дезинтоксикационная терапия способствуют окончательной ликвидации
воспаления. Однако в тяжелых случаях распространенного перитонита при
прогрессирующем течении воспаления
приходится прибегать к повторной
операции — релапаротомии с целью
санации брюшной полости.
Повторные плановые санации
брюшной полости после операции
можно обеспечить с помощью лапаростомии, которая используется при рапространенном гнойном перитоните.
Для обеспечения повторных санаций
операцию заканчивают вшиванием в
края лапаротомной раны молнии или
на рану накладывают редкие швы, которые завязывают на бантик (рис. 121),
или накладывают аппарат (рис. 122).
В послеоперационном периоде под
внутривенным наркозом молнию раскрывают или развязывают швы, проводят осмотр и санацию брюшной полости: аспирируют отсосом экссудат
из брюшной полости, промывают ее
раствором антисептических средств,
удаляют некрозы и вновь закрывают.
Такие процедуры повторяют несколько раз до полной ликвидации воспалительного процесса в брюшине, а затем
молнию удаляют, рану брюшной стенки ушивают.
2.5.3. Лечение в послеоперационном периоде
Лечение больных с гнойным перитонитом в послеоперационном периоде
предусматривает:
■ антибактериальную терапию;
дезинтоксикационную терапию;
восстановление обменных нарушений (водно-электролитного баланса, кислотно-основного состояния,
белкового состава крови, ОЦК);
■ восстановление моторно-эвакуа
торной функции кишечника.
Антибиотики широкого спектра
действия применяют внутримышечно,
внутривенно в сочетании с внутрибрюшинным введением через дренажи с
учетом чувствительности микробной
флоры и соблюдением других правил
антибиотикотерапии (см. раздел Антисептика).
■
■
287
В послеоперационном периоде
до момента восстановления функции
кишечника проводят полное парентеральное питание. По мере восстановления функции кишечника постепенно переходят на энтеральное питание.
С целью дезинтоксикации вводят кровезамещающие жидкости дезинтоксикационного действия, используют метод форсированного диуреза, средства
экстракорпоральной детоксикации.
Рис. 119. Большое количество фибринозного
налета на кишечнике при перитоните, вызванном
деструктивным аппендицитом
Рис. 120. Геморрагический выпот в брюшной
полости в большом количестве при деструктивном
холецистите с разлитым перитонитом
Рис. 121. Временное закрытие брюшной стенки
(лапаростомия) для повторных санаций (программированных) при запущенном перитоните
Рис. 122. Временное закрытие брюшной стенки
(аппаратная лапаростомия) для повторных санаций
(программированных) при запущенном перитоните
288
Текстовый модуль 4
Контрольные вопросы по теме занятия
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
Дайте определение тупой травмы живота.
Классификация тупой травмы живота.
Механизм повреждения абдоминальных структур при тупой травме живота.
Клинические проявления при повреждении паренхиматозных органов.
Клинические проявления при повреждении полых органов.
Лабораторная и инструментальная диагностика тупой травмы живота.
Принципы лечения пострадавших с тупой травмой живота.
Определение перитонита.
Этиология, патогенез и классификация перитонита.
Клинические проявления перитонита.
Лабораторная и инструментальная диагностика перитонита.
Принципы лечения больных с перитонитом.
ТЕМА №14.
Ожоги (термические, химические, лучевые). Классификация, стадии ожоговой болезни. Первая помощь и методы лечения ожогов. Ожоговое истощение. Электротравма
и отморожения
1. Актуальность темы.
Актуальность проблемы ожогов
определяется значительной частотой
поражения, трудностями лечения и
высоким процентом летальности и инвалидности.
В настоящее время от ожогов ежегодно погибает в мире около 50 тысяч
человек.
Актуальность проблемы отморожений значительна, она определяется
частотой поражения, особенно среди
социально необеспеченного населения,
а также трудностямями, порой возникающими в оценке степени отморожений, имеющими большое значение для
выбора лечения. Электротравма среди
гражданского населения достаточно
велика, особенно там, где не учитываются элементарные правила техники
безопасности.
■
■
■
■
■
■
■
■
■
2. Учебные цели занятия.
Ожоги, определение;
Классификация по глубине, площади,
тяжести ожога;
Клинические проявления термических ожогов;
Симптоматика ожогов химическими веществами;
Лучевые ожоги;
Периоды течения ожоговой болезни;
Первая помощь при различных видах
ожогов;
Лечение ожоговой болезни согласно
стадиям течения;
Основные методы лечения ожогов
в стационаре;
■
■
■
■
■
Виды оперативных вмешательств
при ожогах;
Отморожения, определение;
Степени отморожения, клинические проявления;
Особенности оказания первой помощи пострадавшему с отморожением
в дореактивном периоде;
Лечение отморожений в стационаре.
3. Самостоятельная работа
студентов.
Ожогами (combustio) называется повреждение тканей, вызванное
воздействием высокой температуры
(пламя, горячие жидкости, газообразные вещества, расплавленные вещества), химические анаэробное вещества
(кислотные, щелочи, соли тяжелых металлов, фосфор, зажигательные смеси
типа напалм, термит и др.), электротока, лучевой энергии.
Таким образом, учитывая поврежденный фактор, ожоги можно различить на термические, химические,
лучевые и поражения электрическим
током.
Наиболее часто встречаются термические ожоги. Наибольшей тяжестью (до 35% в мирное время и 70% в
военное время) отличаются ожоги пламенем, возникающие на производстве и
в быту и усугубляющиеся возгоранием
одежды на пострадавшем. Затем следуют ожоги кипятком и другими горячими жидкостями. Ожоги жидкостями и
паром вызываются не очень высокой
290
Текстовый модуль 4
температурой (в пределах 100°С) и
кратким воздействием. Чаще они бывают более обширными, но менее глубокими, тогда как ожоги раскаленным
металлом, как правило, глубокие, но
носят ограниченный локальный характер, благодаря чему при их поражении
ожоговая болезнь развивается редко.
Классификация ожогов
В зависимости от глубины поражения и характера патологических изменений в тканях выделяется несколько
степеней ожога. Классификациями Циглера и Крейбиха в настоящем время
не пользуются. С 1960 года в практику
введена классификация предложенная А.А. Вишневским, Г.Д. Вилявиным
и М.И. Шрайбером и утвержденная
27-ым Всесоюзным съездом хирургов
в 1961 г. Согласно этой классификации
по глубине поражения тканей выделено 4 степени (рис. 123):
I степень — эритема и отек кожи
(эритематозная форма с поверхностным эпидермальным ожогом);
II степень — образование пузырей
(буллезная форма с поражением верхнего слоя кожи);
III А степень — неполный некроз кожи с сохранением ее ростковой
зоны;
Рис. 123. Глубина поражения тканей при ожогах
Тема 14
III Б степень — поражение кожи
на всю ее толщину, а нередко частичное поражение клетчатки;
IV степень — некроз кожи и подлежащих тканей (сухожилий, мышц,
костей) вплоть до обугливания.
Ожоги I, II, III А степени относятся к поверхностным и могут заживать
самостоятельно, так как сохраняется
полностью или частично ростковый
слой кожи, а также эпителий, выстилающий протоки потовых желез и волосяных луковиц, за счет которого и
осуществляется в последующем спонтанная эпителизация. Ожоги III Б и IV
степеней относятся к глубоким ожогам,
при которых самостоятельное закрытие дефекта невозможно, больные с такими ожогами нуждаются в оперативном восстановлении кожного покрова.
Диагностика глубоких ожогов
Глубина поражения тканей в первые дни после ожогов может быть
установлена в ряде случаев только
предположительно. Истинную глубину поражения можно определить не
ранее, чем через 24-48 часов, а иногда
значительно позже (через 5-7 дней)
после получения травмы.
Диагностика ожога 1 степени не
представляет трудности; для нее характерны гиперемия и умеренная припухлость (отек) кожи, местное повышение
температуры, повышенная болезненность (гиперестезия).
Ожоги 2 степени сопровождаются
одним или несколькими (в зависимости от площади ожогов) небольшими
и напряженными пузырями, наполненными светло-желтым содержимым.
В отличие от ожога III А степени, при
котором также образуется пузырь, подлежащая ткань после удаления пузыря
при прикосновении резко болезненна.
Ожог III А характеризуется одним
или несколькими большими резко на-
А
В
Б
Г
291
Рис 124. Ожог I (а), II (б), III А (в), III Б (г) ст.
пряженными или лопнувшими пузырями с густой жидкостью интенсивно желтого цвета, а ткань под вскрывшимся
пузырем местами с сохраненной, местами с пониженной чувствительностью.
Ожог III Б степени содержит пузыри темного цвета за счет геморрагического содержимого, а дно раны после
удаления пузыря тусклое, с мраморным
рисунком, болевая чувствительность на
большей части отсутствует, что свидетельствует о глубоком характере ожога
(рис. 124).
Ожог IV степени характеризуется
наличием струпа коричневого или черного цвета, толщина которого зависит
от глубины поражения (рис. 125).
Однако тяжесть состояния больного зависит не только от глубины поражения, но и от площади ожога. Имеются многочисленные схемы и расчеты,
позволяющие вычислить площадь ожоговых повреждений в абсолютных и
относительных величинах. Способы
Беркова (1924 г.) и Б.Н. Постникова
(1938 г.) в настоящее время не используются, т. к. имеют ряд отрицательных
характеристик, в частности, они не дают
качественной характеристики по степени и локализации ожогов. Кроме этого,
методика Б.Н. Постникова сложна из-
за стерилизациеи и хранения листов
целлофана или рентгеновской пленки,
а также необходимости укладывать ее
на ожоговую поверхность, что не исключает дополнительного инфицирования, а также опасности болевого
шока. Для примерного определения
площади ожоговой поверхности используют «способ ладони» и «правило
девяток», предложенные А. Уоллесом.
«Способ ладони» основан на том,
что площадь ладони человека примерно равна 1,2% от общей поверхности
тела. Врач визуально как бы прикла-
Рис. 125. Ожог IV ст.
292
Текстовый модуль 4
дывает ладонь больного к обожженной
поверхности, а затем подсчитывает общее количество процентов.
«Правило девяток» основано на
том, что вся поверхность тела делится
на участки, площадь которых составляет
9% или кратное 9 поверхности тела. Так,
поверхность головы и шеи равна 9%,
передняя поверхность туловища— 18%,
задняя поверхность туловища — 18%,
верхние конечности по 9%, нижние конечности по 18% и промежность 1%.
Оба эти способа очень приблизительны и используются в основном
для сортировки больных при большом
количестве пораженных или для предварительного определения процента
поражения. Так как эти способы не отражают качественной характеристики
и локализации ожогов, используя их,
можно этот недостаток восполнить
формулой Ю.Ю. Джанелидзе. В этой
формуле площадь ожогов в процентах
отражается в числителе, а степень ожога в знаменателе цветными карандашами, например 30%.
Первая степень ожога изображается желтым цветом, вторая степень—
красным, третья — синим, четвертая—
черным.
Более точные способы, что является
существенным моментом для прогноза
и лечения этих больных, разработаны
Г.Д. Вилявиным и В.А. Долининым.
Способ Г.Д. Вилявина заключается
в графическом изображении обожженной поверхности на силуэте передней
и задней поверхности тела человека,
отпечатанные типографским способом
в масштабе 1:10 по сравнению с нормальными размерами. Контуры изображены на фоне разграфленной сетки
с квадратами 25 и 100 мм2, которые
соответствуют на теле человека 25 и
100 см2 . Не прикасаясь к обожженной
поверхности, на силуэтах очерчивают
Тема 14
контуры пораженных участков. Затем
подсчитывают количество целых и
частей квадратов по отдельным степеням, и подсчитывают общую площадь
в см2. Учитывая, что общая площадь
тела равна 16.000 — 17.000 см2 и зная
общую сумму в см2 или по степеням см2
имеющегося ожога, легко по уравнению или по готовым таблицам, которые готовятся заранее для облегчения
работы комбустиолога, высчитать процент обожженной поверхности. Контур ожога наносят на схему цветными
карандашами. I степень закрашивается
желтым цветом, II — красным, III А —
синими штрихами, III Б — сплошным
синим, IV — черным. В.А. Долинин
(1960) разработал новую форму, на
которой передний и задний силуэты
изображены на фоне сетки, площадь
квадратов которой соответствует 1%,
что исключает дополнительную работу
врача по переводу см2 в %.
Оба эти способа имеют преимущества:
1. Сокращается время определения
площади ожога;
2. Отсутствует контакт с ожоговой поверхностью;
3. Дается качественная характеристика ожоговой поверхности;
4. Отражается более точно локализация ожога;
5. Наиболее точно подсчитывается
процент ожога.
Имеется ряд других способов и методик, в частности, достаточно точный
метод, разработанный в Чехии. Заготавливают рулон бумаги и хранят ее
при постоянной температуре и влажности. Тестируют определенной площади
лист бумаги, взвешивая ее на торсионных весах. Например, 100 см2 бумаги весит 10 грамм. При поступлении
больного над обожженной поверхностью (не прикасаясь к ней), вырезают
контур ожога, бумагу сминают и взвешивают. По весу определяют плошать
в см2, а затем по таблицам или уравнению — процент ожога.
Клиника ожогов
Клиническая картина ожогов складывается из симптомов местного и
общего характера. При поверхностных ожогах превалируют в основном
местные явления. Чем больше площадь
поражения и глубже ожог, тем больше
выражены общие явления, когда страдает общее состояние больного.
Местные явления зависят от степени поражения. Наиболее выраженным симптомом является жгучая боль,
которая вызывается раздражением
чувствительных кожных нервов. При
ограниченных ожогах боль через несколько часов стихает, но может держаться и в течение нескольких дней
даже при поверхностных ожогах, но с
большей площадью поражения. Местная реакция при ожогах I и II степеней
характеризуется асептическим воспалением, которое выражается гиперемией и отечностью кожи за счет расширения капилляров с пропотеванием
через их стенки жидкой части крови.
Появляется повышенная болевая чувствительность (гиперестезия).
При II степени наступает отслойка
верхних слоев эпидермиса с образованием пузырей. Область ожога более
болезненна, чем при ожоге I степени.
Через 4-6 дней краснота и отек исчезают, а пузыри, если они мелкие, могу
сливаться, а если лопаются, то обнажаются участки ярко-красного цвета
со значительным количеством серозного отделяемого. Небольшие пузыри
подсыхают без вскрытия и под ними
быстро образуется эпителиальный покров. Обычно содержимое пузыря стерильное, но может инфицироваться и
293
тогда заживление задерживается на 2-3
недели. При благоприятном течении
процесса при ожогах I степени верхний
слой эпидермиса через несколько дней
высыхает, становится более темным,
морщинистым и слущивается, а при II
степени заживление происходит в течение 10-14 дней без образования рубца.
Таким образом, если при ожогах I степени заживление протекает по асептическому типу, то при ожогах II степени
возможно развитие инфекции, что потребует дополнительных лечебных мероприятий.
При ожоге III А и III Б степеней происходит частичное или полное поражение сосочкового слоя, что клинически
проявляется образованием пузырей,
кожа пятнистого бледного или мраморного цвета, иногда черные пятна.
Резко выраженная гиперестезия этой
зоны или полная анестезия при ожоге
III Б степени. Мертвые ткани образуют
струп, на границе с которым постепенно, очень медленно формируется демаркационная линия, но чаще струп не
отграничен от окружающих тканей и
отторгается с явлениями нагноения.
Ожоги III А степени заживают за
счет грануляций с образованием нежного рубца, ожоги III Б степени заживают,
образуя грубые коллоидные рубцы.
При ожогах IV степени ткани
темно-коричневого или черного цвета,
ломкие.
Лечение ожоговых ран
Лечение любой степени ожога начинается с оказанием первой помощи,
которую очень редко может оказать
медицинский персонал, но от которой
зависит не только эффективность дальнейшего лечения, но часто и сама жизнь
больного. В связи с этим все действия
при оказании первой помощи независимо от того, кем они оказываются, долж-
294
Текстовый модуль 4
ны быть максимально щадящими. Прежде всего больного необходимо удалить
из зоны воздействия повреждающего
фактора, загасить горящую одежду и
удалить ее с обожженных частей тела,
лучше срезая кусками. Участок ожога
охладить в течение 10-15 мин. струей
холодной воды, чтобы быстро снять
боль; закрыть ожоговую поверхность
стерильными салфетками или проглаженной тканью. Из подручных средств
можно использовать влажные повязки,
смоченные холодной водой или слабым раствором соды, они значительно
уменьшают боль. Затем больного необходимо согреть, укутывая одеялом,
и напоить горячим чаем или дать немного алкоголя. Если первая помощь
оказывается медицинским персоналом,
то основное усилие должно быть направлено на уменьшение боли, исключение дополнительного механического
воздействия на раневую поверхность и
вторичного микробного загрязнения.
С целью обезболивания применяют
1—2% промедол, димедрол, морфин в
адекватных дозах, может применяться противоожоговая жидкость, включающая в себя новокаин 100, анестезин
20, дикаин 0,5, ментол 0,5, фурацилин
0,4 и спирт 1000. Раневую поверхность закрывают повязками, смоченными противоожоговой жидкостью,
но лучше — стерильными простынями. Можно использовать аэрозоли
(олазоль, пантенол, диоксидин и др.).
Нельзя применять различные присыпки (соду, пудру, крахмал), которые
не оказывают никакого положительного действия. Вредны наложенные
повязки с различными жирами (растительное, кукурузное, сливочное масло),
которые очень трудно потом удалить с
ожоговой поверхности. При оказании
первой помощи не следуют применять
р-р марганца, метиленовый синий,
Тема 14
бриллиантовый зеленый и другие красящие антисептики, так как они могут
углубить ожог и усилить боль, а изменение цвета обожженной поверхности
затрудняет определение степени ожога.
Не рекомендуется накладывать повязки, смоченные спиртом, водкой, одеколоном в надежде, что они уменьшат
боль и предотвратят инфицирование.
Такая тактика совершенно ошибочна,
подобная повязка боль только усилит,
а если она будет наложена на место
лопнувшего или удаленного с одеждой
пузыря, то боль становится просто невыносимой и может привести к шоку.
Ожоги I степени в лечении фактически не нуждаются, исключая ожоги
с площадью поражения 80-90%, особенно у детей и стариков. Эти больные
должны направляться в стационар.
Остальные больные могут лечиться амбулаторно, лечение в основном
симптоматическое, направленное на
купирование болевого синдрома в первые сутки. Затем первоначальные явления быстро ликвидируются и больные
больше не обращаются.
При поступлении больного с ожогом II и III А степени лечение начинают
с «туалета ожоговой поверхности». Существовавший длительное время метод
первичной хирургической обработки,
разработанный Н. Вильтушевичем
(1893) и заключающийся в тщательной
механической очистке раневой поверхности и удалении хирургическим путем
зон некроза с целью предотвращения
развития инфекции, по аналогии с
травмами и огнестрельными ранениями, в настоящее время большинством
специалистов отвергается. Во-первых,
при ожогах вообще каких-либо активных хирургических вмешательств
при первичной обработке не производится, во-вторых, раневая поверхность
настолько обширная, что предотвра-
тить инфицирование практически невозможно, также как и невозможно
дренирование раны, которое является
составной частью первичной хирургической отработки.
В настоящие время при первичной
обработке ожоговой раны (рис. 126)
проводится щадящая ее обработка, которая заключается в осторожном освобождении раны от механических включений и висячих лоскутов эпидермиса.
Затем кожу вокруг очищают физиологическим раствором, теплой мыльной
водой, 0,5% раствором аммиака или
бензином, а потом протирают спиртом
или 2% йодом, хотя обработка йодом
затрудняет в последующем определение степени ожога, так как изменяет
цвет кожи. Пузыри не вскрываются,
вскрывать можно только большие и напряженные. Их прокалывают у основания после обработки 2% йодом. Ожоговую рану, образующуюся на месте
вскрывшихся или удаленных пузырей,
лечат открытым, закрытым или комбинированным способом. Открытый
(бесповязочный) способ используют
в основном для лечения ожогов лица,
шеи, промежности. При этом методе
ожоговую поверхность несколько раз
в день покрывают стерильным вазелиновым маслом или синтомициновой
эмульсией после обработки антибак-
Рис. 126. ПХО ожоговой раны
295
териальными препаратами в виде орошения йодопероном, сульфанилоном
и другими антисептиками. Эффективно действует масляно-бальзамическая
эмульсия А.В. Вишневского, которая
включает в себя дёготь березовый —
20, ксероформ — 2,0, анестезин — 0,5,
касторовое масло — 100. Эмульсия обладает выраженным антисептическим
и болеутоляющим эффектом и в настоящее время используется при лечении всех степеней ожога, несмотря
на то, что появился ряд новых, современных препаратов в виде аэрозолей
(ампровизоль, олазоль, пантенол, олеол и другие). Для лечения открытым
способом используют также палатки с
инфракрасным излучением и ламинарным потоком подогретого до 30-320С
воздуха. Ламинирование подогретого
воздуха способствует быстрому подсыханию раневой поверхности с образованием струпа, что резко снижает плазмопотерю, уменьшает катаболические
процессы, восстанавливает щелочной
и водно-электролитный баланс, уменьшает степень инфицирования. Образованный струп неглубокий и легко
удаляется на 6-8 сутки с помощью 40%
мази салициловой кислоты, которая
накладывается на 2-3 дня, после чего
струп легко отделяется от подлежащих
тканей, открывая слой грануляционной ткани. Небольшие раны заживают
самостоятельно под мазевыми повязками (переходят на закрытый способ),
или производится аутопластика.
При закрытом способе, который используется при ожогах туловища и конечностях, после туалета ожоговой раны
на нее накладывается мазевая повязка
со стерильным вазелином, 5% синтомициновой эмульсией или маслянобальзамической эмульсией А.В. Вишневского. В последние годы появился
ряд мазей, которые обладают выражен-
296
Текстовый модуль 4
ной гидрофильностью (левосиновая,
диоксидиновая, йодопероновая, сульфанилоновая и другие), которые не только
активно поглощают влагу, но и активизируют пассаж экссудата из раны, что
способствует подсушиванию раны, более
быстрому образованию струпа, очищению раны от некротических участков и
снижению возможности нагноения. Повязку стараются менять один раз в 8-10
дней, производя перевязку под адекватным обезболиванием. Если удается
избежать нагноения, то ожог II степени
заживает в течение 2-3 недель, а ожог III
А степени — 3-4 недели.
При глубоких ожогах (III Б и IV
степени) раневая поверхность представляет собой безжизненную зону некроза, которая в последующем превращается в зону влажного некроза при
инфицировании его, или сухого струпа, который формируется в течение
4-5 дней. Местно используют порошок
ксероформа, антибиотики, сульфаниламиды. При наступлении разграничения между струпом и живыми тканями
производят раннюю некрэктомию (начиная с 5-6 дня) (рис. 126), или струп
проходит стадии отторжения путем
нагноения и расплавления его (7-10
дней). В этот период необходимо применять влажно-высыхающие повязки
с растворами антисептиков и антибио-
Рис. 126. Некрэктомия при глубоких ожогах
Тема 14
тиков (фурацилин, хлораципт, этакридин). После очищения раны и появления грануляций накладывают мазевые
повязки. Для ускорения очищения
раны и ускорения расплавления и отторжения струпа можно использовать
ванны с температурой воды 35-36°С, а
также литические ферменты трипсин,
химотрипсин, леграферм, ируксоловую мазь, которые особо эффективны
при применении высушивания УФО
ожоговой раны. Особое значение в этот
период приобретает использование
местно антимикробных препаратов,
так как имеется значительная раневая
поверхность. Для подавления раневой
инфекции, особенно грамотрицательной флоры, необходимо использовать
10% сульфамилоновый крем, повидонйод, 10% раствор мафенида (В.К. Салагут и другие, 1977), а для борьбы с
синегнойной палочкой используется
борная кислота и полимиксин. Для
уменьшения воспалительной реакции
Рис. 127. Некрэктомия
с немедленной дермопластикой
используют глюкокортикоиды (гидрокортизон, преднизолон, сеналар) в растворах или аэрозолях.
При перевязках производят этапную некрэктомию (рис. 127) с удалением той части струпа, которая не имеет
прочной связи с подлежащими тканями, при попытке удалить остальную
часть струпа возможно значительное
кровотечение. После полного удаления
струпа раневая поверхность готова к
пересадке собственной кожи (аутотрансплантации), в том числе если раневая
поверхность покрыта мелкозернистыми, яркими грануляциями, без выраженной кровоточивости при удалении
повязки, а раневое отделяемое скудное
без гноя.
Ожоги III Б степени заживают самостоятельно, если площадь их составляет не более 100 см2, во всех остальных
случаях дефект необходимо закрывать
оперативным методом с помощью пересадки собственной кожи (аутодермопластика), трупной кожи (аллотрасплантация), которую заготавливают
заранее и хранят в замороженном виде.
Гомокожа является временным покрытием, так как она окончательно не при-
Рис. 128. Отсроченная дермопластика при ожогах
297
живается и со временем отторгается.
Применяется при обширных ожогах,
когда аутокожи не хватает для одномоментного закрытия дефекта. По мере
заживления донорских мест возникает
возможность повторного взятия кожи.
Часто используется комбинированный
способ ауто- и аллотрасплантантов, которые чередуют на ожоговой поверхности (рис. 128).
Для временного покрытия используют также консервированную кожу
эмбриона (рефопластика) или искусственную кожу. Искусственная кожа
имеет 2 слоя коллагена и силиконированную пленку, которая проницаема
для воздуха, но не пропускает микроорганизмы. В последнее время, а особенно за рубежом, широко используют
кожу, выращенную из культуры клеток эпителия кожи самого больного.
Это позволяет в течение достаточно
короткого времени закрывать аутокожей огромные ожоговые поверхности.
Жизнеспособность аутотрансплантатов определяют через 6–8 суток после
пересадки. Лоскут в течение первой недели может быть бледным, серым или
умеренно синюшным, на его поверхности могут образоваться мелкие пузыри, наполненные прозрачной серозной
жидкостью, но если он хорошо удерживается на раневой поверхности, то
он жизнеспособен и концу второй недели принимает нормальную окраску,
а пузыри опадают или лопаются.
Забор аутокожи производят дерматомом. В настоящее время используют
клеевые дерматомы, дисковые с электрическим или механическим приводом и
дерматомы с возвратно-поступательным
механизмом (рис. 129).
Клеевой дерматом состоит из барабана и свободно вращающегося параллельно его поверхности ножа, просвет
между которыми можно изменять, что
298
Текстовый модуль 4
Тема 14
скут с ровной и плоской поверхностью
по всей его длине.
Рис. 129. Разные конструкции дерматомов (механические и электрические)
позволяет брать лоскут кожи нужной
толщины. На кожу, предварительно
обезжиренную эфиром, наносят слой
клея, состоящий из каучука и канифоли, или используют клеол. Клею дают
возможность подсохнуть, к этому месту плотно прижимают край барабана
и выжидают 1-2 мин., после чего приклеенный край кожи приподнимают и
пилящими движениями срезают кожный лоскут. Этим способом можно
получить лоскуты площадью до 100 —
150 см 2.
Принцип работы дискового электрического или механического дерматома основан на вращающихся ножах,
расположенных по краю диска. В качестве ножей используют лезвия безопасной бритвы. Край рабочего диска
плотно прижимают к коже под углом
45° и медленно продвигают по направлению к себе. В просвете над вращающимся диском появляется край кожного лоскута, который подхватывают
пинцетом или мягким зажимом. Таким
способом возможно получить лоскут
шириной до 5 см, длина определяется возможностью донорского места, а
толщина регулируется от 0,2 до 1 мм.
Дерматом с возвратно-поступа
тельным механизмом работает по
принципу машинки для стрижки волос.
В качестве ножей также используется
лезвие безопасной бритвы, обломанное соответствующим образом. Этот
аппарат работает от сети и дает возможность получить лоскут толщиной
от 0,1 до 1 мм и шириной от 8 до 10 см.
Кроме электрических и механических аппаратов для получения кожных лоскутов используют различные
ручные приспособления в виде ножей,
оснащенных калибрующим ограничителем для срезания лоскутов различной толщины. Для получения кожного
лоскута нож прикладывают к донорскому месту под углом и делают надрез кожи, затем лезвие укладывают на
кожу плашмя и пилящими движениями срезают лоскут заданной длины и
ширины. Недостатком этого способа
является то, что сложно получить ло-
ОЖОГОВАЯ БОЛЕЗНЬ
Выше рассматривалось лечение
местных изменений, которые возникают при поверхностных и ограниченных
по площади ожогах и не сопровождаются каким-либо существенным ухудшением общего состояния пострадавшего. При глубоких ожогах III Б и IV
степени, превышающих 15% у взрослых и 10% у детей и стариков, развивается ожоговая болезнь, которая сопровождается тяжелыми нарушениями
гомеостаза.
В течении ожоговой болезни выделяется 4 стадии или периода:
1 стадия — ожоговый шок;
2 стадия — острая ожоговая токсемия;
3 стадия — септикотоксемия;
4 стадия — реконвалесценция.
Деление это не имеет в большинстве случаев четкой клинической картины, но помогает более предметно
осмыслить патогенез ожоговой болезни, что способствует более четкому и
последовательному подходу к лечению
этого тяжелого состояния.
Стадии ожогового шока
Патогенез ожогового шока достаточно сложен и до конца полностью
не выяснен. Диагностика его не всегда
легка. Это связано с особенностью ожогового шока по сравнению с травматическим шоком. Механическая травма
обычно действует на ограниченном
пространстве и ограничена небольшими сроками своего действия, при ожоговом поражении травмирующий агент
действует на большой площади и продолжается после получения травмы в
виде деструкции обожженных тканей и
реактивных изменений в прилежащих
299
неповрежденных участках, что резко
расширяет зону действия патологических раздражителей на поля чувствительной иннервации. Сверхсильные
болевые воздействия вызывают перераздражение центральной нервной
системы, которое переходит в запредельное торможение. Неадекватное
раздражение ЦНС нарушает не только
функцию коры головного мозга и подкорковых образований, но и в частности подкорковые таламические центры
боли и ужаса.
Одной из характеристик особенностей ожогового шока является различный срок его наступления после получения травмы. Шок может развиться
сразу после получения ожога, но может
наступить и через несколько часов. Чем
раньше развивается шок, тем тяжелее
и опаснее его проявления. К раннему
возникновению шока склонны люди
легко возбудимые, с неуравновешенной психикой, дети младшего возраста и старики. Одним из определяющих
факторов ожогового шока являются
глубокие ожоговые поражения, которые в этом отношении превалируют
над площадью ожога.
Следующей особенностью ожогового шока является маловыраженная
эректильная фаза, а торпидная стадия
запаздывает и протекает как бы скрытно. Больные с ожогами поступают в состоянии эйфории, психического и двигательного возбуждения, иногда даже с
повышенным артериальным давлением, жалоб почти не предъявляют, считают свое состояние хорошим.
Однако вскоре у больных можно наблюдать более или менее выраженную эректильную фазу шока,
что подтверждают многие авторы
(А.А. Вишневский, М.И. Шрайбер,
1967; Б.Н. Постников, 1957), и период с нормальным или повышенным
300
Текстовый модуль 4
артериальным давлением следует расценивать как компенсированную форму эректильной стадии шока согласно
функциональной классификации Б.Н.
Постникова и Г.Л. Френкеля (1950).
Для практических целей вопрос наличия или отсутствия ожогового шока
в первые минуты или часы после получения травмы чрезвычайно важнен.
Запоздалая диагностика представляет собой значительную опасность для
больного. Состояние декомпенсации
может развиться очень быстро за счет
шокогенных факторов, обусловленных продолжающимся патологическим процессом, а также в результате
дополнительной травмы, полученной
больным при оказании первой помощи, транспортировке и обработке ожоговой поверхности в стационаре, когда
персоналом по какой-либо причине не
создаются для больного максимально
щадящие условия.
По тяжести клинического состояния больного ожоговый шок можно
разделить, согласно классификации
Р.И. Муразяна, на 4 степени.
1 степень — легкий шок, который
возникает у больных с поверхностными
ожогами, не превышающими 25% поверхности тела или глубокими ожогами 8-10% (исключая детей и стариков).
Больные в сознании, адекватны, кожа
бледная. Могут быть тошнота или рвота, жалобы на жажду. При умеренной
тахикардии АД устойчиво в пределах
нормы, при возбуждении может быть
повышено. У больных незначительное
сгущение крови, кислотно-щелочное
равновесие и электролитный баланс не
нарушены, функция почек практически
не страдает. Шок может длиться в течение суток.
2 степень — шок средней тяжести,
возникающий при площади глубоких
ожогов до 15% и общей площади ожо-
Тема 14
гов до 35-40% поверхности тела. Общее
состояние больных тяжелое, они, как
правило, в сознании, возбуждены, но
возбуждение быстро сменяется заторможенностью. Кожа бледная и холодная вне зоны ожога, сухая. Жалобы на
сильную жажду, тошнота, может быть
рвота, иногда частая и длительная, что
усиливает обезвоживание больного
и ухудшает его гемодинамику, озноб,
одышка. Гемодинамика нестабильна,
но в достаточной степени поддается
коррекции, АД снижается, особенно
значительно у стариков, пульс учащается до 100-110 ударов в минуту. Усиливается сгущение крови (эритроциты
5,5*106), гематокрит превышает 50 г/л,
ОЦК снижается до 10-15%, нарушается
функция почек с развитием олигурии,
повышением остаточного азота, мочевины, возможно гематурия и альбуминурия. Шок может длиться в течение
2 суток.
3 степень — тяжелый шок. Возникает при ожогах на площади (общей) до 60% тела пострадавшего,
включая до 35-40% глубоких ожогов.
Состояние больных очень тяжелое,
сознание спутанное, резко заторможено. Кожные покровы сухие, бледные,
холодные, с цианотичным оттенком,
выражен акроцианоз. Жалобы на сильную жажду, частую рвоту. У больных
озноб, тахикардия до 130-140 уд. в
минуту. АД значительно снижается
(100-90 мм рт. ст.), вздутие живота за
счет выраженного пареза кишечника,
мышечные судороги. ОЦК снижен на
25-35%, гемоконцентрация (эритроциты 6,0*1012), повышается гематокрит
до 0,6-0,65 г/л, нарушается электролитный баланс, который характеризуется снижением ионов натрия и возрастанием ионов калия. У больного
выраженные нарушения функции почек, развивается олигурия вплоть до
анурии, повышается плотность мочи до
1,021–1,025, в моче кровь, альбумин,
уробилин, высокие показатели остаточного азота. Выведение больных из
этой степени шока представляет большие трудности, нередко они погибают.
4 степень — крайне тяжелый шок,
который возникает у больных с общей ожоговой поверхностью свыше
60–70%, где глубокие ожоги превышают 40% общей ожоговой площади. Состояние больных крайне тяжелое, сознание чаще отсутствует. Кожа
вне ожоговой поверхности холодная,
бледная, сухая, синюшная или с мраморным оттенком, на конечностях
землистого цвета. Пульс на периферии нитевидный или не определяется,
АД ниже 80-70 мм рт. ст. с тенденцией
к снижению. ОЦК снижен на 35-45%,
гемоконцентрация достигает критического уровня (эритроциты свыше
6,6-7,0*1012). Выражена одышка (до
40 и выше в минуту), частая или неукротимая рвота «кофейной гущей»,
парез кишечника. Цвет мочи от темновишневого и коричневого до черного за счет гематурии и уробелинурии.
Количество мочи снижено до 300-500
мл в сутки, при уменьшении количества мочи за сутки до 200–250 мл расценивается как анурия. Большая часть
больных погибает в первые сутки или
ближайшие дни.
В определении и течении ожогового шока особенное внимание должно
быть обращено на объективные признаки, так как субъективное состояние больного и его жалобы не всегда
отражают, как это указывалось выше,
истинное состояние больного. Не
всегда соответствует наличию шока и
уровень АД, как это наблюдается при
травматическом шоке. Артериальное
давление в течение достаточно длительного времени ожогового шока
301
может быть нормальным или даже
повышенным (степень компенсации),
но если оно снижается, то это указывает на недостаточность компенсации
и свидетельствует об угрожающем состоянии больного. Более достоверным
признаком развития ожогового шока
является венозная гипотония, которая
как симптом шока встречаются чаще,
чем артериальная гипотония (Е.И. Парис, 1967). Венозное давление падает
до 60-50 мм водного столба, в особо
тяжелых случаях до 0, или, наоборот,
поднимается до 150-170 мм водного
столба, а иногда до 240-300.
Центральное венозное давление
(ЦВД) характеризует венозный возврат
и сердечный отток крови, достаточно
постоянная величина для человека, в
норме составляет 60-140 мм водного
столба. Измерение ЦВД производят в
верхней полой вене, куда через вену в
локтевом сгибе вводят под контролем
рентгена сосудистый катетер. Важность
измерения ЦВД у ожоговых больных
состоит не только в определении наличия ожогового шока и тяжести его, но
и в том, что оно позволяет безопасно и
эффективно, а главное, адекватно проводить инфузионную коррекцию. Прогностически плохо, когда ЦВД падает
до низких цифр, но еще хуже, если оно
резко повышается до высоких показателей, что свидетельствует о необратимом шоке.
Важным показателем гемодинамики при ожоговом шоке является объем
циркулирующей крови (ОЦК). В настоящее время ОЦК определяют методом разведения в крови синьки Эванса.
Синьку 0,5-1% раствор вводят внутривенно из расчета 0,2 мг на 1 кг веса.
Через 10 минут кровь берут из вены и
определяют в плазме концентрацию
краски с помощью фотоэлектроколориметра. При этом методе в норме ОЦК
302
Текстовый модуль 4
у мужчин 75 мл/кг, у женщин 65 мл/кг.
В состоянии ожогового шока ОЦК резко уменьшается.
Кардинальным и самым ранним
симптомом ожогового шока является
олигурия (меньше 30 мм мочи в час),
которая развивается у 90-95% ожоговых больных с последующим полным
прекращением выделения мочи (анурия) или выделением не более 200-250
мл мочи в сутки, что также расценивается как анурия. Механизм олигурии связан с нарушением почечного кровотока,
уменьшением клубочковой фильтрации
и усилением канальцевой реабсорбции.
Количество выделяемой мочи, особенно
в первые сутки имеет диагностическое и
прогностическое значение, так как оно
зависит от функциональных изменений
почек, которые, в свою очередь, обусловлены глубиной и обширностью ожоговой поверхности. У тяжелых больных
в моче определяется гемоглобин, белок,
цилиндры, лейкоциты, эритроциты, общий азот. Отрицательный азотистый
баланс свидетельствует о выраженном
катаболическом процессе в организме
как реакции на травму и прогностически
является неблагоприятным признаком.
Характерным для этого периода ожоговой болезни является также
гиперкалиемия и гипонатриемия, которые являются результатом общей
катаболической реакции организма,
обусловленной активацией передней
доли гипофиза и минералокортикоидной секреции коры надпочечников.
Благодаря такой активации калий в
значительных количествах выходит из
клеток различных органов и поврежденных тканей и поступает в кровь,
а натрий, наоборот, задерживается в
тканях и его содержание в крови снижается. На фоне резкого снижения
диуреза избыток калия в крови оказывает токсическое воздействие на серд-
Тема 14
це вплоть до его остановки и вызывает
ряд других расстройств в организме, а
задержка натрия в тканях способствует
развитию отеков.
Следующим важным объективным
фактором является гемоконцентрация
(полиглобулия) и повышение гематокрита, которые связаны со значительным и резким уменьшением количества
плазмы крови. Потеря плазмы происходит из раневой поверхности (наружная плазмопотеря), а также вследствие
скопления в тканях (внутренняя плазмопотеря). В результате этих потерь
ОЦК снижается, по разным авторам,
на 20-40% уже в первые часы и дни
ожоговой болезни, нарастает сгущение
крови (гемоконцентрация), количество
эритроцитов и гемоглобина в единице
объема крови, гематокрит. Показатели эти не являются постоянными, но
играют значительную роль в правильной оценке состояния больного при
ожоговом шоке.
Стадия острой
ожоговой токсемии
Определить переход 1 стадии ожоговой болезни во 2-ю весьма трудно,
так как этот переход происходит постепенно и не имеет четко выраженных
границ, тем более что стадия токсемии
может развиваться без предшествующего шокового состояния. Ожоговая токсемия, особенно при тяжелых
ожогах, имеет более определенную
клиническую картину. Длительность
этого периода не поддается четкому
определению и по различным авторам составляет от 2-4 до 10-12 дней,
т. е. до момента выраженного нагноения ожоговых ран. Патогенетически
острая ожоговая токсемия характеризуется выраженными иммунологическими сдвигами в организме в виде
аутосенсибилизации, которая вызыва-
ется поступлением в кровь продуктов
распада белков, токсических веществ
из обожженных тканей и продуктов
метаболизма микрофлоры, которая
обсеменяет раневую поверхность. Токсические вещества, поступающие из
поврежденной ткани, обладают антигенными свойствами, которые приводят к развитию аутоинтоксикации и образованию аутоантител, которые могут
носить как защитный, так и деструктивный характер. Кроме этого, продолжают действовать гистаминоподобные
вещества, обладающие деструктивными свойствами, которые образовались
в результате дегенеративных процессов в паренхиматозных органах в стадии ожогового шока. Всё это вызывает
усиленную интоксикацию организма в
первые 8-10 дней после ожога.
Течение этого периода зависит
от характера ожоговой травмы, особенно от глубины и обширности повреждения, наличия сухого струпа или
влажного некроза, возраста и общего
состояния организма, состояния его
иммунной системы, так как в этот период отсутствует защитный раневой
барьер и идет активное всасывание
патологических продуктов распада поврежденных тканей.
В начале этой стадии еще сохраняются некоторые симптомы ожогового
шока. К ним относятся продолжающаяся олигурия, гемоконцентрация,
нарушения электролитного обмена, сохраняются заторможенность, вялость,
сонливость, на первый план выступает
лихорадка, которая является одним
из наиболее ранних и кардинальных
симптомов острой ожоговой токсемии. Лихорадка появляется с 3-4 суток
и длится 2-3 недели у больных с поверхностными ожогами и до нескольких месяцев у больных с глубокими и
обширными ожогами, особенно когда
303
присоединяются различные осложнения (пневмония, артрит и другие).
В большинстве случаев уровень лихорадки держится в пределах 38,5-39°С,
но может достигать 39-40°С и выше,
что в этой стадии ожоговой болезни
свидетельствует о тяжелом течении
патологического процесса и является
неблагоприятным прогнозом. Причиной сверхвысокой температуры тела
некоторые исследователи связывают
с гипоксией центра терморегуляции в
результате расстройства кровообращения и отека головного мозга.
После самопроизвольного очищения ран или раневой некрэктомии лихорадка постепенно начинает снижаться.
Гипертермия сопровождается частым пульсом, артериальное давление в норме или понижено. Тяжелая
интоксикация и отек головного мозга
приводят к нарушениям функций ЦНС,
проявляющимся нарушением сна, возбуждением, спутанностью сознания,
иногда бредом, судорогами, коматозным состоянием, слуховыми и зрительными галлюцинациями.
В течение острой ожоговой токсемии наблюдаются выраженные изменения со стороны различных органов и
систем. У больных развивается токсический миокардит, сопровождающийся тахикардией, аритмией, расширением границ сердца, тоны становятся
глухие, появляется систолический шум
и резко снижается сократительная
функция, за счет чего снижается артериальное давление.
Изменения со стороны дыхательной системы проявляются в виде застойных явлений в легких, что способствует скоплению бронхиального
секрета с последующим развитием микроателектазов, пневмонии, бронхита,
экссудативного плеврита и отека легких. Клинически эти нарушения про-
304
Текстовый модуль 4
являются в виде одышки, сухого кашля или кашля с выделением мокроты,
цианоза, акроцианоза, множественных
влажных хрипов в легких.
Со стороны органов пищеварения
наблюдается отсутствие аппетита, тошнота, рвота, которая у тяжелых больных приобретает характер неукротимой, понос, боли в животе, резкое
вздутие живота за счет развивающего
метеоризма или пареза кишечника.
У больного развивается паралитическая динамическая непроходимость, в
результате чего кишечник резко увеличивается в объеме за счет скопившихся
газов и жидкостей, что приводит к нарушению кровообращения и возникновению язв, эрозий в стенке кишки и
очаговых некрозов, приводящих к перфорации и развитию «острого живота»
или кровотечения в просвет кишечника. У больных с большой площадью
поражения возникают такие множественные острые ожоговые язвы в кишечнике (стрессовые), которые могут
приводить к массовым кровотечениям.
Такие же изменения могут возникать
в желчном и мочевом пузырях, что
может привести к кровотечению или
перфорации этих органов с развитием желчного перитонита, гематурии и
мочевых затеков. Нарушается функция печени с развитием токсического
гепатита, который протекает достаточно тяжело, с нарушением пигментной,
белковообразующей и детоксикационной функций, выраженной желтухой.
Гемоконцентрация в этот период ожоговой болезни снижается за счет поступления жидкости в кровяное русло
из тканей, но продолжается активный
генерализованный протеолиз за счет
катаболической реакции организма и
нарушения синтеза белка в печени, что
проявляется гипопротеинемией и отрицательным азотистым балансом, по-
Тема 14
нижением содержания белка в плазме.
Снижение уровня белка в крови происходит в основном за счет альбуминов.
Остается выраженным метаболический ацидоз и гипохлоремия. Со стороны крови наблюдается лейкоцитоз,
снижение гемоглобина, сдвиг формулы
крови влево, в моче белок, цилиндры,
эритроциты, азотемия. При бактериологическом исследовании крови в первую неделю ожоговой болезни у более
чем 30% больных с обширными поражениями обнаруживается бактериемия, которая носит в основном транзиторный характер и не свидетельствует
об ожоговом сепсисе, хотя не исключено его развитие. В основном высевается стафилококк, латентная форма,
что сопровождается благоприятным
клиническим течением и активным
регенеративным процессом. Процесс
протекает благоприятно и при своевременной некрэктомиии, в результате
чего инфекция не имеет возможности
перейти в активную форму. При неблагоприятных условиях инфекция
переходит в активную форму, а транзиторная бактериемия приводит к развитию сепсиса, который развивается,
по разным авторам, у 2-5% больных с
площадью поражения ожогами до 10%
поверхности тела, и у 20-25% больных
с площадью поражения 10-15% поверхности тела.
Течение стадии септикотоксемии,
так же как и при токсемии, характеризуется ремиттирующей лихорадкой, которая в среднем продолжается 2-3 нед.,
а в тяжелых случаях длится 2-3 мес. и
больше. Гнойное отделяемое из раны
значительно увеличивается, больные
жалуются на резкую слабость, адинамию, потерю аппетита, бессонницу.
Нарушения со стороны сердечнососудистой системы проявляются тахикардией, расширением границ серд-
ца, появлением систолического шума,
АД снижается.
Еще более усиливаются по сравнению со 2 стадией ожоговой болезни
нарушения со стороны желудочнокишечного тракта, проявляющиеся в
нарушениях секреторной и эвакуаторной функций желудка и кишечника. Эти
нарушения прямо пропорциональны
тяжести и длительности течения ожоговой болезни. На слизистой желудка и кишечника у больных возникают
острые эрозии и язвы, приводящие к
кровотечениям и перфорации. У большинства больных наблюдается метеоризм, а при обширных ожогах могут
возникать острое расширение желудка
и паралитическая непроходимость кишечника за счет стойкого пареза.
Со стороны печени отмечаются
признаки гепатодистрофии и гепатита,
сопровождающиеся нарушениями дезинтоксикационной, белковообразующей, пигментообразующей и других
функций печени, которые проявляются желтухой, увеличением или уменьшением печени, повышением уровня
сывороточных трансаминаз (АСТ и
АЛТ) и появлением в крови противопеченочных антител.
Олигурия во 2 стадии сменяется в 3
стадии ожоговой болезни полиурией и
развитием воспалительного процесса в
почках и нарушением концентрационной функции их, что в анализах мочи
проявляется понижением удельного
веса, повышением белка, лейкоцитов,
эритроцитов.
Со стороны дыхательной системы
возникают бронхиты, но особенно часты пневмонии (до 30-40%), которые
носят двусторонний, сливной характер.
Для этой стадии также характерной
является трудновосполняемая и стойкая гипопротеинемия. Суточная потеря белка может доходить до 80-90 г
305
в сутки, что является прогностически
неблагоприятным признаком, так как
падение белка в сыворотке крови до
40 г/л резко снижает иммунологическую реактивность больных, кроме
того, снижаются или полностью прекращаются процессы репарации и регенерации, что неминуемо ведет к ожоговому истощению.
Снижение белка в крови идет за
счет снижения альбуминовой и увеличения глобулиновой фракции, что свидетельствует об активности раневой
инфекции и нарушении синтеза белка.
Неблагоприятным фактором является
также лимфоцитопения и эозинофилия. Снижение функции кроветворных
органов и разрушение эритроцитов
приводит у больных к развитию стойкой анемии. Еще более утяжеляется
состояние больного при развитии сепсиса.
При длительном течении ожоговой
болезни за счет обширности поражения и невозможности восстановления
целостности кожных покровов у больных развивается ожоговое истощение,
которое характеризуется прогрессивным ухудшением состояния. Ожоговые
раны покрыты бледными, вялыми и
атрофичными, местами некротизированными грануляциями, гнойными
пленками, под которыми находятся
протей, синегнойная палочка и гнилостные анаэробы. Эпителизация
очень вялая или полностью отсутствует, а образовавшийся эпителиальный
покров частично или полностью расплавляется. У таких больных наблюдается прогрессирующее похудение, кахексия, мышцы атрофируются, суставы
малоподвижны вплоть до анкилоза, наблюдаются множественные пролежни,
безбелковые отеки, геморрагический
диатез. Больные адинамичны и апатичны, тяжелые расстройства сна и ап-
306
Текстовый модуль 4
петита. Нарастает почечно-печеночная
недостаточность, возникает тяжелая
пневмония, кровотечения и перфорации желудочно-кишечного тракта, которые приводят к смерти больного.
Лечение ожоговой болезни
Лечение ожоговой болезни начинается с лечения ожогового шока, а также
проведения мер, предупреждающих его
развитие. Особенно это касается больных с ограниченными ожогами, когда
возникает легкая степень шока, которая вначале протекает нечетко (стадия
компенсации), что может ввести в заблуждение. В случае несвоевременной
и неадекватной терапии в этот период
или грубого оказания первой помощи и
неблагоприятных условий транспортировки легкая степень может перейти в
тяжелую, а тяжелая в крайне тяжелую.
К общим противошоковым мероприятиям относится согревание больного путем укутывания его одеялами или,
что гораздо эффективнее и асептичнее,
помещением его под каркас с электрическими лампочками, где происходит
не только согревание больного бесконтактным способом, но и подсушивание
раневой поверхности, что уменьшает
потерю жидкости. Согревание грелками
нежелательно, так как отвлекается часть
крови от внутренних органов. Больного
необходимо напоить горячим сладким
чаем, кофе, минеральной водой или
приготовленным щелочно-солевым раствором, где на 1 литр воды добавляется
2 г пищевой соды и 4 г поваренной соли.
Противошоковую терапию начинают с введения обезболивающих средств.
Чаще всего для этих целей используют
аналгетики (2-5 мл 50% анальгина,
1-2 мл 2% промедола, 1-2 мл 1% морфина) в сочетании с антигистаминными препаратами (1-2 мл 1% демидрола,
1-2 мл 2,5% пипольфена).
Тема 14
Хороший успокаивающий и обезболивающий эффект оказывает дроперидол из расчета 0,5 мг/кг массы тела
больного, а также инфузии 0,1% раствора новокаина из расчета 8–10 мл на
1 кг веса больного, который вводится
больному в течении суток в 2–3 приема.
Также инфузии резко снижают поток
болевых импульсов из ожоговой поверхности, уменьшают проницаемость
капилляров, а следовательно, потерю
жидкой части крови, что предотвращает выраженную гемоконцентрацию.
Кроме этого, р-р новокаина оказывает
антиаллергическое и антигистаминное
действие, снижает спазм почечных сосудов, что благоприятно оказывается на функции почек. Благоприятное
действие оказывает паранефральная
двухсторонняя блокада теплым 0,25 %
р-ром новокаина по 60–80 мл с каждой
стороны, можно с добавлением антибиотиков, вагосимпатическая двухсторонняя блокада 0,25% раствора
новокаина по 40 мл с каждой стороны,
футлярные блокады, которые выполняются на конечностях.
Основным методом лечения ожогового шока является инфузионнотрансфузионная терапия, которая
направлена на стабилизацию центральной региональной и периферической
гемодинамики с учетом огромных потерь жидкости (потери плазмы, рвоты, испарения с поверхности тела),
гемоконцентрации и гиповолемии. Для
этого используют компоненты и препараты крови (протеин, альбумин),
синтетические коллоиды (полиглюкин,
поливинил, перролидон, желатиноль,
декстраны, гемофузин), солевые растворы, глюкоза. Актуальным вопросом
инфузионной терапии является расчет адекватного количества вводимой
жидкости. Для этого были предложены
различные формулы и расчеты.
Формула Эванса: количество коллоидов (крови и плазмы) в 1-е сутки
определяется из расчета:
1) 1 мл коллоида * вес тела * %
площади ожога;
2) 1 мл электролитов (физ. раствор) * вес тела * площадь ожога;
3) 2000 мл 5% глюкозы. Общее
количество вводимой жидкости не
должно превышать 8-10 литров;
В первые 8 часов вводится 50%
жидкостей, а остальное за оставшееся
время суток.
Формула Брока: 2 мл * на массу
тела * площадь ожога + 2.000 мл 5%
раствора глюкозы. Отличительная
разница расчетов от формулы Эванса
в том, что по формуле Брока только ¼
часть жидкости составляют коллоиды
(кровь и плазма), а ¾ кристаллоиды +
глюкоза.
Формула Мура: объем жидкости
в течение 48 часов должен составить
10% массы тела и распределяется следующим образом: ½ объема первые 12
часов, ¼ следующие 12 часов и ½ следующие 24 часа + 2000 мл глюкозы.
Мильтон предлагает руководствоваться показателями гематокрита и,
кроме плазмы и солевых растворов, переливать декстрозу или полиглюкин.
Однако все расчеты переливаемой
жидкости по формулам достаточно
приблизительны по этому ряд авторов
(А.А. Вишневский, 1962; Т.Я. Арьев,
1966 и др.) предложили количество
вводимой жидкости определять в каждом конкретном случае исходя из степени сгущении крови. Показателями
гемоконцентрации являются увеличенные содержания гемоглобина и эритроцитов у данного больного, а также
данного гематокрита. Расчет производят следующим образом: 100 мл плазмы необходимо перелить пострадавшему на каждое деление гематокрита
307
свыше 45 г/л, по 40 мл плазмы на каждую единицу гемоглобина свыше 100
или каждые 10.000 эритроцитов свыше
5.000.000. По другим расчетам, на каждые 2% гемоглобина свыше 100% вводят 100 мл плазмы.
Переливание альбумина, плазмы и протеина при ожогах многими
авторами рассматривается как патогенический метод лечения, так как
эти препараты обладают высоким
коллоидно-осмотическим давлением,
благодаря чему в русло крови поступает значительное количество жидкости из экстраваскулярного русла. Так,
один грамм альбумина привлекает в
сосудистое русло 18 мл жидкости. Кроме этого, альбумины плазмы снижают
вязкость крови и гемоконцентрацию,
нормализуют рН крови и увеличивают
диурез, что очень важно в борьбе с олигурией и анурией, это является одной
из основных задач противошоковой терапии. Для борьбы с острой почечной
недостаточностью, выражающейся в
олигурии или анурии, не всегда достаточно введения указанных белковых
препаратов или низкомолекулярных
коллоидов типа гемодеза, желатиноля,
гемофузина. Необходимо применять
осмодиуретики, к которым относятся
соли калия (нитрат, хлорид, сульфат и
др.), соли натрия (хлорид, сульфат, гипосульфит, и др.), синтетические вещества (трисамин (ТНАМ, трисбуфер)),
продукты метаболизма (мочевина,
креатинин), углеводы (глюкоза, фруктоза, маннит и др.).
Наиболее широкое распространение получили мочевина, маннит и маннитол, при использовании которых
острая почечная недостаточность при
ожоговом шоке стала вполне преодолимой. Маннит и маннитол назначают
при внеклеточной гипергидратации, а
мочевину при клеточной гипергидра-
308
Текстовый модуль 4
тации. Клинические признаки внеклеточной гипергидратации выражаются
сильной жаждой и сухостью во рту,
а при клеточной гипергидратации у
больного влажный язык и он испытывает отвращение к воде на фоне снижения общего количества жидкости в
организме. Маннит и маннитол назначают в виде 20% раствора по 150-200
мл 2-3 раза в сутки в зависимости от
тяжести почечной недостаточности.
Мочевину вводят из расчета 1 гр на кг
сухого вещества в виде 30% раствора
в вену.
Для точного учета диуреза больному вводят катетер и измеряют количество мочи за каждый час, т. к. показателем адекватного лечения ожогового
шока является функция почек. Нормальным считается, если количество
выделяемой каждый час мочи не ниже
30 мл и не выше 60 мл. Такой почасовой диурез не только отражает функцию почек, но и состояние регионарного кровотока и микроциркуляции.
Для коррекции больших потерь
жидкости и микроэлементов кроме
коллоидных препаратов необходимо
введение адекватного количества кристаллоидных растворов в виде 5-10%
глюкозы, раствора Рингера — Локка,
лактосола, раствора Хортмана, Рингерлактата, 10% раствора хлорида натрия,
а для коррекции КЩС и устранения
ацидоза необходимо введение 5% раствора бикарбоната натрия, трис-буфер
раствора. Вводимый раствор глюкозы
восполняет не только потери жидкости,
но и большие энергетические потери
для стабилизации и обменного процесса, особенно в сердечной мышце. Также необходимо применять кокарбоксилазу 50-100 мл 2 раза в сутки и АТФ
по 1 мл 1% раствора 1-2 раза в сутки.
Кроме этого, назначают сердечные
гликозиды: корглюкон 1,0 мл 0,06% на
Тема 14
глюкозе 2-3 в сутки, кордиамин 1-2 мл
2-3 в сутки. Для снижения сосудистого спазма, улучшения микроциркуляции вводят 5-10 мл 2,4% эуфиллина
1-2 раза в день, новокаина 0,1-0,25%
по 80-150 мл внутривенно. У тяжелых
больных с ожоговым шоком необходимо применение кортикостероидов в
течение нескольких дней, которые способствуют увеличению сердечного кровотока, снижению периферического
сопротивления, что улучшает микроциркуляцию, нормализует гемодинамику, устраняет гипотонию, которую
трудно корригировать инфузионной
терапией. Назначают гидрокортизон
по 50–100 мг 2–3 раза в день.
До полного выведения больного
из шока не следует проводить никаких лечебных мероприятий, способствующих дополнительной травме.
Необходимо грамотно корригировать
гемодинамику, водно-солевой баланс,
КЩС и расстройства функции почек и
других органов и систем, что позволит
успешно преодолеть тяжелую стадию
ожоговой болезни и сохранить жизнь
больного.
Лечение в стадии токсемии
и септикотоксемии
После выведения больного из шока
его состояние остается тяжелым и требует комплексного, тщательно сбалансированного лечения. Лечение в этих
стадиях сводится к борьбе с интоксикацией всасывающимися продуктами из
зоны термического поражения тканей,
инфекцией и интоксикацией, обусловленной продуктами метаболизма инфекции, анемией, гипопротеинемей, а
также возникающими осложнениями.
С целью дезинтоксикации назначают
низкомолекулярные и плазмозамещающие препараты (гемодез, неокомпенсан, реополиглюкин, полифенол,
серотрансфузин), которые вводят
внутривенно капельно 400-800 мл в
сутки. Характерной их особенностью
является быстрое связывание молекул
токсинов и быстрое их выведение. Вещества с низким молекулярным весом
(до 40000) способствуют быстрому выведению токсинов из организма. Для
поддержания водно-электролитного
баланса применяют глюкозу 5%, физраствор, раствор Рингера — Локка и
другие кристаллоиды. Объем их определяется состоянием больного, величиной диуреза, количеством жидкости,
принимаемой энтерально.
С целью дезинтоксикации, а также для борьбы с анемией и гипопротеинемией применяется переливание
крови, плазмы, альбумина, протеина,
где особое место занимает применение плазмы ожоговых реконвалесцентов. Этот метод разработан А.Н.
Федоровым и С.В. Скурковичем. При
обширных ожогах и тяжелой интоксикации иммунную плазму вводят до
400-500 мл, в более легких случаях до
150-200 мл. Получают ее от доноров,
перенесших 2-3-ю степени ожогов с
площадью не менее 10%, а контроль
иммунной активности и определение
ее антитоксического титра производят
серологически и методом гемокультуры. При развитии анемии необходимо переливать свежезамороженные, а
лучше отмытые эритроциты, эритроцитарную взвесь. Однако максимальный эффект дают прямые гемотрансфузии. Для белкового питания при
гипопротеинемии применяют белковые препараты (гидролизатор казеина,
гидролизин Л-103, аминопептид), растворы аминокислот (аминоплазмоль),
смеси кристаллических аминокислот
(мориамин-2, полиамин-С и др.). При
тяжелых ожогах белковые гидролизаты вводят ежедневно не менее 1
309
литра. Однако введение этих препаратов не исключает назначения высококалорийного перорального питания,
исключая больных с ожогами лица,
ротовой полости, дыхательных путей и пищевода. Диеты содержат сбалансированное соотношение белков,
жиров и углеводов, в которые входят
и синтетические препараты виватекс,
сустокол, 5% аминазола, 8,5% р-р свободных аминокислот, электролиты и
витамины.
Для хорошего усвоения белка больным необходимы витамины, а особенно витамин С, который водят по 3-4 мл
5% раствора в сутки, витамин В1, РР,
В6, В12.
Для борьбы с интоксикацией в
первые дни необходимы антибиотики
широкого спектра действия, а после
получения данных о чувствительности
бактериальной флоры те антибиотики,
к которым данная флора чувствительна. Необходимо также использовать
сульфаниламиды, которые могут использоваться как самостоятельный
вид лечения, так и в сочетании с антибиотиками. Чаще всего из раневой поверхности высеивается стафилококк.
Для его подавления используют оксациллин, диклоксациллин 250-500 гр
3-4 раза в сутки внутривенно или в/м
и перорально 250-500 гр 4-5 раз в сутки. При появлении грамотрицательной
флоры лучше применять канамицин
по 500 гр 2-3 раза в/м, ампициллин
250-500 гр 4 раза. Длительно и в значительных дозах для профилактики
дисбактериоза необходимо назначить больным нистатин, леворин, а
также антигистаминные препараты
(димедрол, пипольфен), кроме этого,
необходимо стимулировать иммунную защиту организма. С этой целью
назначают гамма-глобулин, антистафилококковую плазму, полезна
310
Текстовый модуль 4
экспресс-иммунизация нативным или
адсорбированным стафилококковым
анатоксином, который вводится однократно подкожно 0,5 мл.
При развитии аллергических реакции и ожоговой интоксикации показано применение преднизолона по
5-25 мл в сутки с последующим постепенным снижением дозы вплоть до
полного закрытия раневой поверхности. Гормонотерапия должна сочетаться с антибактериальной терапией и витамином Д. Гидрокортизон назначают
по 75-100 мг в сутки.
Длительное существование инфицированных ран на большой площади
приводит к ожоговому истощению, что
усложняет лечение и ухудшает прогноз.
Лечить ожоговое истощение сложно.
При этом осложнении необходимо
комплексную терапию проводить весьма интенсивно, уделяя особое внимание антибактериальной терапии, а также устранению нарушений белкового
обмена и повышению реактивности организма. Необходимо усилить лечение
кортикостероидами, при этом обязательно назначение анаболических гормонов, а также адекватное содержание
в пище белков, жиров и углеводов. Из
анаболических стероидов назначают
метандростиналон по 1 таблетке 1-2
раза или метиландростиол 1 таблетку
1-2 раза в течение 1-1,5 месяца, феноболин или ретаболил в/м по 50 мг 1 раз
в течение 10-15 дней. Из нестероидных
анаболиков применяют оротат калия.
При прогрессивном развивающемся истощении показаны ингибиторы
протеолитических ферментов — трасилол, контрикал, которые вводят по
25-100 тыс. единиц в сутки. Необходимо также использовать антигистаминные препараты (димедрол, пипольфен,
супрастин), которые уменьшают реакцию на гистамин, что снимает спазм
Тема 14
гладкой мускулатуры, уменьшает проницаемость сосудов, снижает токсичность гистаминоподобных веществ, а
также тканевые стимуляторы (производные пиримидина), стимулирующие лейкопоэз, выработку антител и
оказывающие противовоспалительное
действие, что способствует более быстрому заживлению ран.
Переохлаждение, замерзание, холодовая травма —
это все термины, отражающие состояние организма, возникающее в
результате действия на человека низкой температуры окружающей среды.
В то время как высокотемпературные
термические агенты, воздействуя на
живые клетки и ткани организма, являются непосредственной причиной
их гибели, низкая температура сама по
себе не вызывает разрушения живой
ткани. Это связано с тем, что белок,
который является основным компонентом клетки, очень чувствителен к
действию высокой температуры и несравненно более стоек к воздействию
низких температур.
Если охлаждению подвергается
определенная часть тела и температура
тканей значительно снижается, в последующем может возникнуть омертвение
тканей. Характерно, что при смертельном охлаждении структура охлажденных тканей не отличается от структуры нормальных. Дело в том, что при
низкой температуре тканей не могут
нормально функционировать физиологические системы, обеспечивающие
кровообращение, тканевое дыхание,
обмен веществ, нервную регуляцию.
Это приводит к повреждению тканей
вплоть до их омертвения. При общем
охлаждении на первый план выступают резкие нарушения функций центральной нервной системы, сердечно-
сосудистой и дыхательной систем.
Если своевременно не устранить причину этих нарушений, наступают необратимые изменения жизненно важных
органов и систем, ведущие к смерти
пострадавших. Патологические процессы, связанные с охлаждением, начинают развиваться уже при снижении
тканевой температуры ниже 35-33°С,
причем холодовые поражения могут
возникать не только при температуре
среды ниже 0°С, но и при температуре
выше 0°С, если имеются неблагоприятные метеоусловия — ветер, повышенная влажность воздуха. Необходимо
также учитывать, что развитию холодовых поражений способствует понижение сопротивляемости организма
вследствие переутомления, истощения,
авитаминоза, голодания, перенесенных
заболеваний и ранений, кровопотери и
т. д. Особая роль в возникновении холодовой травмы принадлежит одежде
и обуви. Тесные, плохо подобранные
одежда и обувь, сдавливая ткани, нарушают кровообращение в соответствующих участках, что приводит к их
отморожению в первую очередь. Значительно возрастает опасность таких
поражений при ношении промокшей
обуви и влажной одежды. Наконец,
способствуют появлению холодовых
поражений заболевания, понижающие
местную сопротивляемость тканей:
ранее перенесенные отморожения,
нервно-трофические расстройства, патологические изменения сосудов и др.
Местные холодовые поражения,
при которых снижается температура
лишь в какой-либо части тела, принято
называть отморожениями.
Поражения,
сопровождающиеся
понижением температуры всего тела
человека — замерзанием.
В развитии как отморожения, так
и замерзания различают два периода
311
патологического процесса: первый —
скрытый (период до начала согревания) и второй — реактивный (после
согревания).
Общее охлаждение
В отличие от отморожений, при
которых тяжесть поражения выявляется лишь в реактивном периоде, общее
охлаждение имеет характерную клиническую симптоматику именно в первом
периоде, т. е. до согревания организма.
Скрытый период соответствует сроку, в
течение которого сохраняется сниженная температура тела пострадавшего.
Первыми клиническими признаками
этого состояния являются озноб, чувство общей усталости, сонливость, апатия, затруднение активных движений.
У пострадавшего появляется жажда.
В самом начале общего охлаждения обнаруживается «гусиная кожа», холодная на ощупь, бледная или синюшная
окраска открытых участков тела. Пульс
и дыхание существенно не нарушаются,
АД часто повышено. При продолжающемся воздействии холода неуклонно
снижается температура тела, наступает
утрата сознания, возникают судороги,
угнетается функция основных физиологических систем организма вплоть до
полного прекращения их деятельности.
Различают три степени тяжести
общего охлаждения:
1. Легкая степень (адинамическая) — клинически характеризуется
снижением температуры в прямой кишке до 35-33°С, побледнением или умеренно выраженной синюшностью кожных покровов, мраморной их окраской,
появлением «гусиной кожи», ознобом.
Движения медленные, вялые, конечности как бы «скованные». Пострадавший ощущает сильную слабость. Речь
его затруднена — он растягивает слова,
произнося их по слогам (скандирован-
312
Текстовый модуль 4
ная речь). Чаще отмечается урежение
пульса до 60-58 ударов в минуту, но он
может быть нормальным или даже учащенным. Артериальное давление либо
нормальное, либо умеренно повышенное. Дыхание не нарушено.
2. Средней степени тяжести (ступорозная форма) температура тела от
32 до 29°. Кожные покровы бледные,
синюшные, холодные на ощупь, иногда
имеют мраморный оттенок. Обращает
на себя внимание резкая сонливость,
угнетение сознания, бессмысленный
взгляд, отсутствие мимики. Движения
резко затруднены — начинающееся окоченение. Пульс урежен до 52-32 уд. в
1 мин., слабого наполнения. Артериальное давление в норме или незначительно понижено. Дыхание становится редким (8-10 в 1 мин.) и поверхностным.
3. Тяжелая степень (судорожная
форма), температура тела ниже 29°.
Сознание отсутствует, судороги. Особенно характерно длительное судорожное сокращение жевательных мышц,
может быть прикушен язык. Верхние
конечности согнуты в локтях, попытки их распрямить встречают сильное
сопротивление, иногда это сделать не
удается (окоченение). Нижние конечности полусогнуты, реже вытянуты.
Мышцы брюшного пресса напряжены.
Кожа бледная, синюшная, холодная
на ощупь. Пульс редкий, менее 32-30
ударов в 1 мин., слабого наполнения.
Иногда он прощупывается только на
сонных или бедренных артериях. Тоны
сердца глухие. АД резко снижено или
не определяется вообще. Дыхание редкое до 3-4 в 1 мин., поверхностное,
прерывистое, иногда хриплое. Зрачки
сужены, слабо реагируют или вовсе не
реагируют на свет. Возможна рвота, непроизвольное мочеиспускание.
Выведение пострадавшего из состояния гипотермии еще не означа-
Тема 14
ет его выздоровление. В реактивном
периоде отмечается вялость, чувство
усталости, сохраняется скованность
движений. Пострадавшие жалуются на
болевые ощущения во всем теле, особенно в конечностях, головную боль.
Возможны катаральные изменения в
зеве, носоглотке. Развивается бронхит,
трахеобронхит, реже — пневмония, нефрит. В этом периоде возможно кратковременное выраженное повышение
температуры тела, сопровождающееся
нарушениями деятельности сердечнососудистой системы (учащение и изменение ритма пульса, боли в области
сердца), нервно-психическими расстройствами (бред, заторможенность,
судороги). Наиболее тяжелыми осложнениями этого периода, требующими
неотложных лечебных, а порой и реанимационных мероприятий, являются
отек мозга, легких, острая почечная
недостаточность. Нередко в периоде
после согревания выявляются отморожения конечностей различной степени
тяжести, но преимущественно 2 степени. Следует еще раз подчеркнуть, что в
клинической картине общего охлаждения основным объективным признаком
тяжести поражения является снижение
температуры тела. Это снижение не
может быть зафиксировано обычными
медицинскими термометрами, т.к. с их
помощью невозможно определить температуру ниже 35°С. Поэтому для диагностики и суждения об эффективности проводимого лечения необходимо
иметь специальные термометры, градуировка которых позволяет измерять
температуру в подмышечной области
или в прямой кишке в пределах от 20
до 42°С.
Лечение общего охлаждения
Основная цель и главная задача неотложной помощи больным с общим
охлаждением заключается в скорейшем восстановлении нормальной температуры тела посредством рационального его согревания. При правильной
методике согревания эта процедура не
приносит вреда и чем быстрее она будет проведена, тем лучше для больного, так как тяжесть поражения зависит
не только от степени снижения температуры тела, но и от длительности воздействия низких температур. Только
быстрое согревание способно предотвратить дальнейшую теплопотерю у
охлажденного.
Наилучшим способом согревания
является помещение пострадавшего в
ванну с температурой воды 36°С и постепенно, в течение 15-20 мин., повышение температуры воды до 38-40°С.
На таком уровне температура воды
поддерживается до окончания согревания больного. В ванне производится
массаж тела пострадавшего с помощью
намыленных мочалок. Согревание в
ванне продолжается до тех пор, пока
температура не достигает 35°С в прямой кишке. В большинстве случаев
вся эта процедура занимает около 1,5
часов. Нельзя согревать пострадавшего в ванне с температурой воды выше
40°С. Если пострадавший может глотать, его следует напоить горячим чаем
или кофе. Одновременно ему вводится
40-60 мл 40% р-ра глюкозы, подогретого до 35-40°С, внутривенно.
Для ускорения согревания, уменьшения проницаемости сосудов и для
сенсибилизации пострадавшего необходимо в/в ввести 5-10 мл 10% хлорида
кальция, а для нормализации кислотнощелочного равновесия 200-300 мл 5%
р-ра бикарбоната натрия.
При остановке дыхания применяется искусственная вентиляция легких,
в наиболее тяжелых случаях — с помощью специальной аппаратуры. По мере
313
согревания по показаниям вводятся
сердечно-сосудистые средства (корглюкон, коразол, кофеин, камфора),
дыхательные аналгетики (кордиамин,
лобелин, цититон), назначают аналгетики, антигистаминные препараты.
При появлении начальных признаков развивающегося отека мозга и
легких назначаются кортикостероидные гормоны (гидрокортизон, преднизолон), осматические диуретики (маннит, маннитол, лазикс, мочевина).
Отморожения
Классификация отморожений
1. По глубине поражения:
I степень — расстройство кровообращения с развитием реактивного
воспаления;
II степень — повреждение эпителия
до росткового слоя;
III степень — некроз всей толщи
кожи и частично подкожной клетчатки;
IV степень — некроз кожи и глубже
лежащих тканей.
2. По периодам течения:
а) дореактивный; б) реактивный.
При отморожениях дореактивный
период клинически проявляется неприятными и болезненными ощущениями в пораженной области, ее покраснением, сменяющимся побледнением,
утратой чувствительности, «одеревенением». Второй период — реактивный характеризуется восстановлением нормальной температуры тканей
в пораженной области, появлением
отека, боли, застойной гиперемии или
некроза в соответствующих участках.
Именно в реактивном периоде становится возможной диагностика глубины
(степени) отморожения, в то время как
в скрытом периоде ее можно лишь заподозрить.
314
Текстовый модуль 4
По глубине и тяжести поражения
отморожения делятся на несколько
степеней.
Отморожения 1 степени
Наиболее легкий вид местной холодовой травмы. Они проявляются
багрово-синюшной окраской и умеренной отечностью пораженной области.
Обычно бывает достаточно 5-7 дней
консервативного местного лечения для
того, чтобы рассосался отек, нормализовалась окраска пораженного участка. При микроскопическом исследовании признаков некроза не выявляется
(рис. 130).
Отморожения 2 степени
Клинически проявляются образованием пузырей на багрово-синюшной
коже, которые наполнены прозрачной
желтоватой жидкостью. Пузыри могут
появляться в течение нескольких дней
после согревания пораженной области.
При микроскопическом исследовании
выявляется омертвение поверхностных слоев кожи. Дно пузырей составляет обнаженный жизнеспособный
сосочковый слой кожи, сохраняющий
болевую чувствительность. Поскольку при таком отморожении ростковый
слой практически не повреждается, заживление происходит самостоятельно
при консервативном лечении в течение
2-3 недель без образования рубцов.
Рис. 130. Отморожение 2-3 степени
Тема 14
Отморожения 3 степени
Омертвению подвергается вся
толща кожи. Также поражение характеризуется появлением пузырей, наполненных, в отличие от таковых при
отморожениях 2 степени, темным кровянистым содержимым. Дном их является омертвевший сосочковый слой
кожи, лишенный чувствительности.
Различия между отморожениями 2 и 3
степени выявляются более отчетливо
после вскрытия и удаления пузырей.
При этом следует обратить внимание
не только на разный характер содержимого пузырей, но и на их дно. При
отморожении 2 степени дно пузырей
розового или красного цвета, иногда
покрыто фибринозным налетом, прикосновение к нему марлевым шариком,
смоченным спиртом, или укол иглой
вызывает выраженную болевую реакцию. Дно пузырей при отморожении
3 степени сине-багрового цвета, не
чувствительно к уколам и раздражающему действию спирта. Поскольку при
таких отморожениях гибнет кожа вместе с кожными придатками, на месте
поражения после отморожения омертвевших участков развивается грануляционная ткань, превращаемая в рубец.
Лечение отморожений 3 степени длится 5-7 недель.
Отморожения 4 степени
Характеризуется омертвением всех
слоев мягких тканей, а порой и костей. В
первые дни после травмы по внешнему
виду такие поражения мало отличаются
от отморожений 3 степени. Так же, как
и при последних, пострадавший участок при отморожении 4 степени бледной или синюшной окраски, холоден
на ощупь, часто покрыт дряблыми пузырями, наполненными темным кровянистым содержимым. Лишь на 5-7 день,
когда начинает спадать отек и появляются первые признаки отграничения
мертвых тканей от жизнеспособных, и
особенно к 9-10 дню, когда по мере отторжения омертвевшей кожи участки
отморожения 3 ст. начинают заполняться грануляционной тканью, а в зоне поражения 4 степени этого не происходит,
можно с уверенностью различить эти
степени отморожения. В последующем
при отморожении 3 степени грануляционная ткань подвергается рубцеванию
и эпителизации, а при отморожениях 4
степени развивается влажная или сухая
гангрена (мумификация). Постепенно
происходит отграничение (демаркация)
омертвевшего участка и его отторжение.
Этот процесс может затянуться на несколько месяцев.
Характерна локализация местных
холодовых поражений. Отморожению подвергаются главным образом
конечности (более 95% всех случаев),
преимущественно нижние. Чаще поражение не распространяется выше голеностопного или луче-запястного суставов, ограничивается пальцами или их
фалангами. Это связано с тем, что здесь
ткани хуже кровоснабжаются, кроме
этого, нередко обувь и перчатки могут быть увлажнены, что способствует
охлаждению.
Лечение отморожений
Делится на местное и общее.
Местное лечение отморожений
1–2 степени консервативное, состоит
в регулярной смене повязок каждые
2-3 дня. При этом осуществляется туалет раны (орошение фурацилином или
другим антисептиком, удаляются обрывки эпидермиса, а кожа вокруг обрабатывается спиртом) и накладываются
повязки с масляно-бальзамической мазью Вишневского или синтомициновой
эмульсией. Пузыри, возникающие при
отморожении 2 степени, можно удалять, подрезать у основания или остав-
315
лять нетронутыми — в любом случае
происходит полная эпителизация пораженной поверхности без каких либо
функциональных или косметических
дефектов. В случае нагноения содержимое пузыря нужно обязательно
удалить, после чего наложить повязку
с раствором антисептика (фурацилин,
риванол и др.).
Лечение отморожения 3 степени
Также преимущественно консервативное. Оно должно способствовать
более скорому отторжению омертвевшей кожи и предупреждению местных
инфекционных осложнений. После
очищения раны от нежизнеспособных
тканей и заполнения раны грануляциями местное лечение направлено на
создание условий для ее рубцевания и
эпителизации. Если дефект кожи невелик, происходит самостоятельное заживление раны с образованием рубца,
если площадь более обширная, следует осуществить оперативное восстановление кожного дефекта. Для этого
подготовленная грануляционная поверхность закрывается кожным дерматомным аутотрансплантатом.
Лечение отморожения 4 степени
Консервативное лечение в этой стадии представляет собой лишь предварительный этап, целью которого является создание благоприятных условий
для ограничения омертвевших тканей,
предупреждения и ликвидации инфекционных осложнений. При осуществлении первичного туалета необходимо вскрыть пузыри, полностью удалить
отслоившийся эпидермис, обработать
антисептиками, а в последующем производить частые перевязки с применением антисептиков. Однако длительное
консервативное лечение отморожений
4 ст. не оправдано, т. к. омертвению
316
Текстовый модуль 4
может подвергаться вся масса мягких
тканей, включая и кости, в результате
чего восстановить функциональную
полноценность не представляется возможным. Кроме этого, длительное существование зоны некроза вызывает
интоксикацию организма и возможно
развитие сепсиса. Поэтому уже к концу первой недели после травмы следует приступить к выполнению первого
этапа оперативного лечения — некротомии. Рассечение некротических тканей способствует оттоку жидкости из
раневого отделяемого, благодаря чему
влажная гангрена переводится в сухую.
Раны, образующиеся после некротомии, рыхло тампонируют салфетками,
смоченными растворами фурацилина,
риванола, гипертона. В обезболивании
нет необходимости, т. к. ткани нечувствительны. В результате некротомии
уменьшается отек в ране и окружающих тканях, четче выявляется граница
омертвения (демаркационная линия).
Это позволяет осуществить второй
этап оперативного лечения — некрэктомию (удаление явно омертвевших
тканей), которая проводится через 1-2
недели после некротомии. Отсечение
нежизнеспособных тканей производится на 1-2 см ниже демаркационной
линии, чтобы не удалить ни миллиметра здоровых тканей. Некрэктомия
улучшает местное течение раневого
процесса, облегчает общее состояние
пострадавшего и создает необходимые
предпосылки для завершающего этапа
оперативного лечения отморожений
4 степени — ампутации конечности и
формирования полноценной культи.
Описанная тактика трехэтапного хирургического лечения отморожений
4 ст. (некротомия — некрэктомия —
ампутация) позволяет уменьшить интоксикацию и предупреждает тяжелые
инфекционные осложнения, макси-
Тема 14
мально реализовать принципы культи
конечности, что способствует ее лучшей функции в последующем и создает
более благоприятные условия для протезирования. Лечение пострадавших
с отморожениями включает в себя не
только мероприятия, направленные на
быстрое восстановление нормальной
температуры охлажденных тканей, но
и некоторые общие действия. Таких
больных необходимо накормить горячей пищей, можно после согревания
дать выпить 100-150 гр водки. С целью
предупреждения лечения инфекционных осложнений пострадавшему вводят 3000 ед. АЕ противостолбнячной
сыворотки и 1 мл столбнячного анатоксина, начинают антибактериальную терапию антибиотиками и сульфаниламидами. Наряду с ними назначают
обезболивающие средства (омнопон,
пантопон, промедол), витамины С и В1,
сосудорасширяющие препараты (платифиллин, но-шпа), средства, препятствующие тромбообразованию (гепарин, фраксипарин).
ПОРАЖЕНИЕ
ЭЛЕКТРИЧЕСКИМ ТОКОМ
При поражении электрическим
током прежде всего необходимо прекратить дальнейшее воздействие электрической энергии. При этом обязательно соблюдение спасающим личной
безопасности: пользование резиновыми перчатками (можно обмотать руки
сухой шерстяной тканью); при размыкании электрической цепи — пользование инструментами с изолированными
рукоятками или сухими деревянными
предметами; электроизоляция от земли
(использование резиновой обуви, сухих
досок, фанеры, ковриков и пр.); оттаскивание пострадавшего одной рукой,
ухватившись за сухую часть одежды
или поясной ремень; уменьшение силы
тока и его напряжения путем шунтирования или заземления электроцепи с
помощью проволоки, металлического
троса, цепи, мокрой веревки.
ВНИМАНИЕ! При высоком напряжении и сырой почве вокруг упавшего
проводника образуется зона электризации до 4-8 метров в диаметре, входить в
которую без соблюдения мер предосторожностей опасно. В случае остановки
сердечной деятельности необходимо
сразу же, не медля ни минуты, приступить к оживлению пострадавшего
317
(см. раздел «Реанимация»). После восстановления сердечной деятельности
и дыхания на ожоговые поверхности
накладываются стерильные повязки,
и пострадавший должен быть срочно
транспортирован в лечебное учреждение для последующего обследования и
лечения.
ВНИМАНИЕ! Практикуемое иногда
в быту закапывание пораженного электрическим током или молнией в землю
противопоказано как бессмысленное и
опасное для его жизни мероприятие.
Контрольные вопросы по теме занятия
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
Как называется ожог по-латыни?
Классификация ожогов.
Как оценить площадь ожогов?
Клиника и диагностика поверхностных и глубоких ожогов.
Клиника ожоговой болезни.
Какой объем оказания первой помощи при поверхностных ожогах?
Какая помощь при ожоге химическими веществами?
В чем особенность лучевого ожога?
Какое проводится местное лечение ожогов?
Оптимальные сроки осуществления некрэктомии при хирургическом лечении
ожогов.
Патогенез, клиника, лечение химических ожогов.
Особенности ожогов фосфором и негашеной известью.
Какое действие оказывает эл. ток на организм человека?
Какое действие оказывает ионизирующее излучение на ткани человеческого организма?
Первая помощь при электротравме.
Тип некроза, возникающего при поражении эл. током.
Первая помощь, оказываемая при электротравме.
Лечебная тактика при поражении эл. током.
Лечебная тактика при лучевых поражениях.
Лечение эл. ожогов.
Лечение лучевых ожогов.
Где располагаются «метки» при поражении эл. током?
В чем заключается реанимация в случае клинической смерти при электротравме?
Тестовый контроль по теме занятий
ТЕСТОВЫЙ КОНТРОЛЬ ПО ТЕМЕ ЗАНЯТИЙ
Тема №1.
1. Что вызывает появление у больных гнойной инфекции?
а) амебы; б) гельминты; в) микробы; г) вирусы; д) кандиды.
2. Как называется инфекция, возникшая при попадании стафилококков в рану из
окружающей среды?
а) лимфогенная; б) эндогенная; в) гематогенная; г) смешанная; д) экзогенная.
3. Как называется инфекция, попавшая в рану из кариозных зубов?
а) эндогенная; б) экзогенная; в) имплантационная; г) смешанная; д) гастрогенная.
4. Как называется путь передачи инфекции, если у больного с рожистым воспалением левой голени появилось увеличение паховых лимфатических узлов?
а) имплантационный; б) энтеральный; в) лимфогенный; г) гематогенный;
д) контактный.
5. Как переносится инфекция гематогенным путем?
а) лимфой; б) при соприкосновении с раной одежды больного; в) при кровотечении в рану; г) по кровеносным сосудам; д) с инородными телами, попавшими в рану.
6. Что относится к механической антисептике?
а) применение антибиотиков при наличии гнойного очага; б) стерилизация
инструментов перед операцией; в) иссечение раны, полученной вне больницы;
г) облучение воздуха в операционной бактерицидной лампой; д) применение
при перевязке раны перекиси водорода, раствора фурацилина.
7.
Какие мероприятия относятся к асептике?
а) применение при лечении ран ферментов; б) стерилизация шовного материала; в) обработка рук хирурга перед операцией; г) применение дренажей;
д) одевание хирурга в стерильный халат, перчатки.
8. Что такое внутрибольничная инфекция?
а) занесение инфекции при посещении больных родственниками; б) передающаяся в хирургическом отделении от одного больного другому инфекция;
в) внесение инфекции в рану при перевязке; г) нагноение раны у больного после создания калового свища; д) появление постинъекционного абсцесса.
9. Кто является бациллоносителем в хирургическом отделении?
а) посетители больных; б) вновь поступившие в отделение больные; в) медперсонал; г) длительно находящиеся в больнице больные; д) врачи-консультанты
из других лечебных учреждений.
319
10. Какими свойствами обладают микробы, вызывающие внутрибольничную инфекцию?
а) малоконтагиозными; б) устойчивостью к антибиотикам; в) легко уничтожаются дезинфицирующими растворами; г) могут вызывать у посетителей
трудно поддающиеся лечению заболевания; д) часто вызывают послеоперационные осложнения.
11. Какая должна быть температура в палате летом и зимой?
а) 15 — 17°С; б) 18 — 20°С; в) 21 — 22°С; г) 23 — 24°С; д) 25 — 28°С.
12. Кто проводит отбор для госпитализации плановых больных в хирургическое
отделение?
а) заведующий хирургическим отделением; б) дежурная медицинская сестра;
в) дежурный врач приемного покоя больницы; г) врач-терапевт; д) главный
врач.
13. Старшая медицинская сестра выполняет работу:
а) выписывает и получает медикаменты в аптеке; б) заполняет историю болезни; в) организует дежурства медицинских сестер; г) обеспечивает спецодеждой
медицинский персонал; д) составляет порционное требование для кормления
больных.
14. Что входит в обязанности постовой медицинской сестры?
а) участие в операциях; б) участие в санпросветработе; в) уборка палаты;
г) выполнение назначений врача; д) подготовка больного к рентгенологическому обследованию.
15. Что входит в обязанности сестры-хозяйки?
а) уборка в палатах, коридорах; б) кормление больных; в) сбор грязного белья
и отправка его в прачечную; г) обеспечение санитарок инвентарем; д) проведение санпросветработы.
16. Младшая медицинская сестра (санитарка) может производить:
а) инъекции; б) очистительные клизмы; в) отпускать физиопроцедуры; г) ставить банки; д) переодевать больных.
17. Мазок на бациллоносительство берется:
а) из конъюктивы глаза; б) с пальцев рук; в) из прямой кишки; г) из полости
носа; д) из маски хирурга.
18. Создал стройную систему антисептики:
а) Бергман; б) Пирогов; в) Пастер; г) Листер; д) Земмельвейс.
19. Кто получает из аптеки лекарства для больных стационара?
а) главврач; б) постовая медсестра; в) лечащий врач; г) заведующий отделением; д) старшая медицинская сестра.
20. Что относится к асептике?
а) обработка вокруг раны йодом; б) введение в вену антистафилококковой
плазмы; в) работа при перевязке стерильными инструментами; г) наложение
на рану мазевой повязки; д) промывание раны раствором фурацилина.
320
Тестовый контроль по теме занятий
21. Какая норма площади должна быть в палате на одну койку?
а) 4,0 — 5,0 кв. м; б)5,0 — 5,5 кв. м; в) 5,5 — 6,0 кв. м; г) 6,5 — 7,5 кв. м;
д) 8,0 — 9,0 кв. м.
22. В чем заключается охранительный режим в хирургическом отделении?
а) в применении наркотиков; б) в частом посещении больных родственниками; в) в стремлении избежать применения хирургического метода лечения; г)
в сокращении срока пребывания больного в стационаре; д) в создании условий для покоя и тишины в отделении.
23. Кто организует работу в хирургическом отделении?
а) профессор кафедры; б) старшая медицинская сестра; в) постовая медицинская сестра; г) заведующий отделением; д) врач-ординатор.
24. Какие функции выполняет профессор, заведующий кафедрой хирургии?
а) выполняет административные функции; б) организует работу врачей;
в) следит за санитарно-эпидемиологическим режимом в клинике; г) отвечает
за лечебно-методические вопросы; д) читает лекции для медперсонала.
Тема №2.
1. Какой из препаратов следует рекомендовать при кандидомикозе?
а) мономицин; б) сульфадимезин; в) нистатин; г) стрептомицин; д) пенициллин.
2. Укажите антисептик, относящийся к окислителям:
а) борная кислота; б) карболовая кислота; в) хлорамин; г) оксицианид ртути;
д) пероксид водорода.
3. Гнойная рана дренирована тампоном с гипертоническим раствором натрия
хлорида. Какой вид антисептики использован?
а) химическая; б) биологическая; в) механическая; г) физическая; д) смешанная.
4. Какой из перечисленных методов относится к физической антисептике?
а) первичная хирургическая обработка раны; б) удаление некротических тканей из раны; в) дренирование раны тампоном; г) промывание раны антисептиком; д) повязки на рану с ферментсодержащей мазью.
5. Что относится к механической антисептике?
а) орошение раны раствором пероксида водорода; б) дренирование раны марлевым тампоном; в) удаление из раны нежизнеспособных тканей; г) иммобилизация конечности гипсовой повязкой.
6. Какое действие пероксида водорода выражено наиболее слабо?
а) антимикробное; б) пенообразующее; в) дезодорирующее; г) механическое
очищение раны; д) органолептическое.
7.
Какое из перечисленных лечебных мероприятий относится к методам биологической антисептики?
а) первичная хирургическая обработка раны; б) промывание раны раствором
пероксида водорода; в) внутримышечное введение стрептомицина; г) назначение внутрь сульфадиметоксина; д) белковая диета.
Тестовый контроль по теме занятий
321
8. Гипертонический раствор натрия хлорида применяется при:
а) ПХО раны; б) наложении рассасывающего компресса; в) стерилизации режущего инструмента; г) дренировании гнойных полостей и ран; д) в качестве
примочек.
9. В какой концентрации применяют раствор фурацилина для промывания ран?
а) 1:200; б) 1:500; в) 1:2000; г) 1:5000; д) 1:10000.
10. Что из нижеперечисленного не относят к биологической антисептике?
а) вакцины; б) специфические сыворотки; в) антибиотики; г) сульфаниламиды; д) переливание крови.
Тема №3.
1. В течение какого минимального времени стерилизуются инструменты в автоклаве при давлении 2 атм и температуре 132 С°.
а) 20 мин.; б) 35 мин.; в) 45 мин.; г) 1 ч.; д) 1 ч. 30 мин.
2. Как стерилизуют синтетический материал (капрон, нейлон, тефлон и др.)?
а) кипячением; б) паром под давлением; в) замачиванием в спирте; г) замачиванием в растворе Люголя; д) сухим жаром.
3. Посевы для контроля за эффективностью стерилизации шовного материала
следует производить 1 раз в:
а) 3 дня; б) 5 дней; в) 10 дней; г) 15 дней; д) 20 дней.
4. Какой способ стерилизации хирургического инструментария наиболее надежный и быстрый в условиях больницы?
а) в автоклаве текучим паром; б) в автоклаве при повышенном давлении;
в) в сухожаровом шкафу; г) бактерицидными лампами; д) радиационная стерилизация.
5. Какой метод контроля за стерильностью содержимого биксов является наиболее достоверным?
а) метод Микулича; б) плавление серы; в) плавление антипирина; г) бактериологический; д) плавление бензойной кислоты.
6. Парами формалина следует стерилизовать:
а) режущие инструменты; б) резиновые перчатки; в) оптические инструменты; г) марлевые салфетки; д) шприцы.
7.
Что из перечисленного не относится к профилактике воздушной инфекции?
а) ультрафиолетовое облучение воздуха; б) обработка операционного поля;
в) проветривание; г) приточно-вытяжная вентиляция; д) ношение маски.
8. При какой температуре (в градусах по Цельсию) стерилизуют инструменты
в сухожаровом шкафу?
а) 120; б) 150; в) 180; г) 200; д) 220.
9. Какое минимальное число раз обрабатывается операционное поле антисептиком по способу Гроссиха — Филончикова?
а) 1; б) 2; в) 3; г) 4; д) 5.
10. Обработка рук хирурга первомуром длится не менее:
а) 1 мин.; б) 2 мин.; в) 3 мин.; г) 5 мин.; д) 10 мин.
322
Тестовый контроль по теме занятий
Тема №4.
1. Какое кровотечение является смешанным?
а) при ранении вены; б) капиллярное; в) паренхиматозное; г) при ранении
артерии; д) при ранении правого предсердия; е) при ранении одновременно
вены и артерии.
2. Какое возникло кровотечение у больного, если ему сделана ампутация конечности по поводу влажной гангрены и через 2 часа повязка на культе обильно промокла кровью?
а) травматическое; б) раннее вторичное; в) первичное; г) позднее вторичное;
д) тромбоэмболическое; г) не имеет названия.
3. Что такое скрытое кровотечение?
а) кровотечение в закрытую плевральную полость; б) кровоизлияние в закрытую полость сустава; в) кровоизлияние в кишечник без общих и явных
местных проявлений; г) кровоизлияние значительное в брюшную полость;
д) кровоизлияние субдуральное в количестве 15-20 мл без признаков сдавления мозга; е) образование пульсирующей гематомы.
Тестовый контроль по теме занятий
323
10. Какой процент восполнения потерянного ОЦК должен быть при кровопотере
1500 мл крови, сколько необходимо в процентах перелить крови и какое должно
быть соотношение солевых и коллоидных растворов?
а) 200%, крови 90%, соотношение солевых и коллоидных растворов 2:1;
б) 300%, только солевые; в) 180%, крови 50%, соотношение солевых и коллоидных растворов 1,5:1; г) 170%, крови 70%, соотношение солевых и коллоидных
растворов 1:1; д) 200%, кровь не переливается, соотношение солевых и коллоидных растворов 2:1; е) 150%, крови 20%, солевых и коллоидных растворов 2,5:1.
Тема №5.
1. Какие элементы крови содержат агглютинины?
а) сыворотка крови; б) лейкоциты; в) эритроциты; г) тромбоциты; д) моноциты.
2. В каких элементах крови находятся агглютиногены?
а) сыворотка крови; б) лейкоциты; в) эритроциты; г) тромбоциты; д) плазма
крови.
4. Что не относится к проявлениям острого малокровия?
а) головокружение; б) бледность кожных покровов; в) повышение артериального давления; г) частый нитевидный пульс; д) гиперемия видимых слизистых; е) низкое артериальное давление.
3. При определении группы крови реакция изогемагглютинации была положительной со стандартными сыворотками 0(I) и В(III) групп и отрицательной с А(II).
Какая группа исследуемой крови?
а) 0(I); б) А(II); в) В(III); г) AB(IV).
5. Какое кровотечение считается средней тяжести?
а) потеря до 10% ОЦК; б) потеря 500-1000 мл крови, 10-20% ОЦК ; в) потеря
21-30% ОЦК; гемоглобин 84 — 70 г/л, гематокрит 31-23 %; г) потеря 35%
ОЦК, гемоглобин 60 г/л, гематокрит 20%; д) гемоглобин 100 г/л, гематокрит
44%, потеря 400 мл крови; е) потеря 2000 мл крови, гемоглобин 50 г/л, гематокрит 18%.
4. При определении группы крови реакция изогемагглютинации была положительной со стандартными сыворотками 0(I) и А(II) групп. Укажите, к какой группе
относится исследуемая кровь.
а) 0(I); б) А(II); в) В(III); г) AB(IV).
6. Какой вид остановки кровотечения относится к временной?
а) наложение зажима на сосуд; б) применение на кровоточащей поверхности
раны гемостатической губки; в) наложение кровоостанавливающего жгута;
г) применение пузыря со льдом; д) закручивание сосуда; е) применение давящей повязки.
7.
Сколько времени можно удерживать кровоостанавливающий жгут в холодное
время года?
а) 0,5 часа; б) 1 час; в) 1,5 часа; г) 2 часа; д) 3 часа; е) 4 часа.
5. При определении группы крови оказалась положительной реакция изогемагглю
тинации со стандартными сыворотками А(II) и В(III) групп и отрицательной
с 0(I) и AB(IV) групп. О чем свидетельствует подобный результат?
а) о группе 0(I) исследуемой крови; б) о группе А(II); в) о группе В(III);
г) о AB(IV) группе; д) о непригодности стандартных сывороток.
6. При определении группы крови с помощью цоликлонов агглютинация отсут
ствует с цоликлонами анти-А и анти-В. Какой группы исследуемая кровь?
а) 0(I); б) А(II); в) В(III); г) AB(IV).
7.
Агглютинация наблюдается с цоликлонами анти-А, отсутствует с цоликлонами анти-В. Какой группы исследуемая кровь?
а) 0(I); б) А(II); в) В(III); г) AB(IV).
8. Какой способ окончательной остановки кровотечения из крупной артерии наиболее эффективен?
а) применение давящей повязки; б) применение пузыря со льдом; в) применение гемостатической губки; г) наложение ручного сосудистого шва; д) применение эмболизации сосуда; е) наложение механического сосудистого шва.
8. Агглютинация наблюдается с цоликлонами анти-А и анти-В. Какой группы исследуемая кровь?
а) 0(I); б) А(II); в) В(III); г) AB(IV).
9. Какие препараты можно вводить внутривенно для остановки кровотечения?
а) тромбин; б) кальция хлорид; в) фибриноген; г) галаспон; д) свежезамороженная плазма; е) трасилол.
9. Агглютинация наблюдается с цоликлонами анти-В. Какой группы исследуемая
кровь?
а) 0(I); б) А(II); в) В(III); г) AB(IV).
324
Тестовый контроль по теме занятий
10. Контроль за реакцией при определении группы крови с помощью цоликлонов осуществляется в течение:
а) 3-5 с.; б) 20-30 с.; в) 1 мин.; г) 2 мин.; д) 5 мин.
11. Проба на индивидуальную совместимость крови проводится между:
а) плазмой или сывороткой крови больного и кровью донора; б) плазмой донора и кровью больного; в) форменными элементами крови больного и кровью донора; г) форменными элементами крови донора и кровью больного;
д) цельной кровью донора и цельной кровью больного.
12. Показания к переливанию крови определяются:
а) аллергическим состоянием больного; б) состоянием шока; в) наличием
печеночно-почечной недостаточности; г) необходимостью восполнения кровопотери; д) наличием у больного авитаминоза.
13. Симптомами ухудшения состояния больного при переливании недоброкачественной крови являются:
а) увеличение гематокрита; б) озноб; в) гипертермия; г) боли в поясничной
области; д) тахикардия.
14. Внутрикостное переливание крови производят в:
а) гребень подвздошной кости; б) диафиз бедренной кости; в) пяточную кость;
г) грудину; д) метафиз большеберцовой кости.
15. Показаниями к переливанию крови являются:
а) острая кровопотеря; б) гнойная интоксикация; в) острый тромбофлебит;
г) острый туберкулез; д) шок.
16. Оптимальная температура хранения консервированной крови:
а) от 0 до +2°С; б) от +4 до +6°С; в) от +8 до +10°С; г) -1°С; д) -2°С.
17. Какие из следующих патологических состояний позволяют получить кровь, годную для реинфузии?
а) внематочная беременность; б) разрыв кишки; в) разрыв селезенки; г) разрыв аневризмы аорты; д) разрыв желчного пузыря.
18. Показаниями для внутриартериального переливания крови служат:
а) тяжелый шок; б) предагональное состояние в результате острой кровопотери; в) клиническая смерть; г) предоперационная подготовка; д) хирургическая операция.
Тестовый контроль по теме занятий
325
Тема №6.
1. Какие из следующих патологических состояний позволяют получить кровь, годную для реинфузии?
а) внематочная беременность; б) разрыв кишки; в) разрыв селезенки; г) разрыв аневризмы аорты; д) разрыв желчного пузыря.
2. Показаниями для внутриартериального переливания крови служат:
а) тяжелый шок; б) предагональное состояние в результате острой кровопотери; в) клиническая смерть; г) предоперационная подготовка; д) хирургическая операция.
3. При определении группы крови реакция изогемагглютинации была положительной со стандартными сыворотками 0(I) и В(III) групп и отрицательной с А(II).
Какая группа исследуемой крови?
а) 0(I); б) А(II); в) В(III); г) AB(IV).
4. При определении группы крови реакция изогемагглютинации была положительной со стандартными сыворотками 0(I) и А(II) групп. Укажите, к какой группе
относится исследуемая кровь.
а) 0(I); б) А(II); в) В(III); г) AB(IV).
5. При определении группы крови оказалась положительной реакция изогемаг
глютинации со стандартными сыворотками А(II) и В(III) групп и отрица
тельной с 0(I) и AB(IV) групп. О чем свидетельствует подобный результат?
а) о группе 0(I) исследуемой крови; б) о группе А(II); в) о группе В(III);
г) о AB(IV) группе; д) о непригодности стандартных сывороток.
6. При определении группы крови с помощью цоликлонов агглютинация отсутствует с цоликлонами анти-А и анти-В. Какой группы исследуемая кровь?
а) 0(I); б) А(II); в) В(III); г) AB(IV).
7.
Агглютинация наблюдается с цоликлонами анти-А, отсутствует с цоликлонами анти-В. Какой группы исследуемая кровь?
а) 0(I); б) А(II); в) В(III); г) AB(IV).
8. Агглютинация наблюдается с цоликлонами анти-А и анти-В. Какой группы исследуемая кровь?
а) 0(I); б) А(II); в) В(III); г) AB(IV).
19. У больного с травмой (черепно-мозговая и перелом бедра) травматический шок
III степени (АД 70/40 мм рт. ст., ЧСС 120 в 1 мин.). Интенсивная терапия на
догоспитальном этапе включает:
а) гемотрансфузию; б) иммобилизацию конечности; в) инфузию кровезаменителей (полиглюкин, реополиглюкин, желатиноль); г) обезболивание ненаркотическими аналгетиками; д) введение сосудосуживающих средств для
повышения АД.
9. Агглютинация наблюдается с цоликлонами анти-В. Какой группы исследуемая
кровь?
а) 0(I); б) А(II); в) В(III); г) AB(IV).
20. Клинические проявления гемотрансфузионного шока следующие:
а) боли в животе; б) тахикардия; в) брадикардия; г) падение артериального
давления; д) боли в пояснице.
11. Проба на индивидуальную совместимость крови проводится между:
а) плазмой или сывороткой крови больного и кровью донора; б) плазмой донора и кровью больного; в) форменными элементами крови больного и кро-
10. Контроль за реакцией при определении группы крови с помощью цоликлонов осуществляется в течение:
а) 3-5 с.; б) 20-30 с.; в) 1 мин.; г) 2 мин.; д) 5 мин.
326
Тестовый контроль по теме занятий
вью донора; г) форменными элементами крови донора и кровью больного;
д) цельной кровью донора и цельной кровью больного.
12. Показания к переливанию крови определяются:
а) аллергическим состоянием больного; б) состоянием шока; в) наличием
печеночно-почечной недостаточности; г) необходимостью восполнения кровопотери; д) наличием у больного авитаминоза.
13. Симптомами ухудшения состояния больного при переливании недоброкачественной крови являются:
а) увеличение гематокрита; б) озноб; в) гипертермия; г) боли в поясничной
области; д) тахикардия.
14. Внутрикостное переливание крови производят в:
а) гребень подвздошной кости; б) диафиз бедренной кости; в) пяточную кость;
г) грудину; д) метафиз большеберцовой кости.
15. Показаниями к переливанию крови являются:
а) острая кровопотеря; б) гнойная интоксикация; в) острый тромбофлебит;
г) острый туберкулез; д) шок.
16. Оптимальная температура хранения консервированной крови:
а) от 0 до +2°С; б)от +4 до +6°С; в) от +8 до +10°С; г) -1°С; д) -2°С.
17. Противопоказанием к реинфузии крови служат:
а) гемоторакс с повреждением крупных бронхов; б) гемоперитонеум с повреждением желудка и кишечника; в) гемоперитонеум при злокачественных
новообразованиях; г) кровь, находившаяся в брюшной полости более 24 ч.;
д) нарушенная внематочная беременность.
18. Осложнения, вызванные переливанием несовместимой по резус-фактору крови,
могут произойти при следующих условиях:
а) при повторном введении резус-отрицательным реципиентам резусположительной крови; б) при беременности резус-отрицательной женщины резус-положительным плодом; в) при повторном переливании
резус-положительным реципиентам резус-отрицательной крови; г) при беременности резус-положительной женщины резус-отрицательным плодом;
д) при переливании резус-отрицательным реципиентам плазмы крови резусположительных доноров.
19. У больного с травмой (черепно-мозговая и перелом бедра) травматический шок
III степени (АД 70/40 мм рт. ст., ЧСС 120 в 1 мин.). Интенсивная терапия на
догоспитальном этапе включает:
а) гемотрансфузию; б) иммобилизацию конечности; в) инфузию кровезаменителей (полиглюкин, реополиглюкин, желатиноль); г) обезболивание ненаркотическими аналгетиками; д) введение сосудосуживающих средств для
повышения АД.
20. Клинические проявления гемотрансфузионного шока следующие:
а) боли в животе; б) тахикардия; в) брадикардия; г) падение артериального
давления; д) боли в пояснице.
Тестовый контроль по теме занятий
327
Тема №7.
1. Кто впервые применил внутривенное введение препаратов для наркоза?
а) Визе; б) Пирогов; в) Холстед; г) Вишневский; д) Федоров.
2. Как удлинить действие тиопентала натрия для наркоза, если длительность
операции предполагается в течение одного часа?
а) увеличить дозу препарата более 1,0 г; б) использовать капельное введение
препарата; в) применить другой вид обезболивания; г) использовать тиопентал в качестве вводного наркоза; д) применить смесь тиопентала и калипсола.
3. Какие препараты используются для стероидного наркоза?
а) предион; б) пропанидид; в) сомбревин; г) рекофол; д) оксибутират натрия.
4. Для проведения нейролептаналгезии применяют:
а) морфин и дитилин; б) тавегил и атропин; в) фентанил и дроперидол; г) гексенал и рекофол; д) аминазин и калипсол.
5. Какие из перечисленных препаратов применяют при атаралгезии?
а) аминазин, атропин; б) сомбревин, оксибутират; в) диазепам, фентанил;
г) калипсол, тиопентал; д) димедрол, кетанов.
6. Препараты, применяемые для прямокишечного наркоза:
а) авертин; б) хлоралгидрат; в) предион; г) седуксен; д) промедол.
7.
Для снижения артериального давления при комбинированном наркозе с искусственной гипотонией применяются:
а) гипотиазид; б) клофелин; в) платифиллин; г) гексаметоний; д) фенигидин.
8. Когда наиболее целесообразно использовать электронаркоз?
а) при всех малых операциях; б) в военно-полевых условиях; в) при резекции
желудка; г) при миастении; д) при операциях на щитовидной железе.
9. Когда показано применение искусственной гипотермии?
а) при вшивании искусственного митрального клапана сердца; б) при удалении почки; в) при тромбэмболэктомии; г) при удалении опухоли мозга; д) при
операции по поводу боталлова протока.
10. Какие препараты из перечисленных используются для искусственной гибернации?
а) гексенал; б) физраствор; в) этизин; г) дроперидол; д) гексенал.
11. Какие из перечисленных веществ применяются для газового ингаляционного
наркоза?
а) эфир; б) метан; в) трилен; г) пентран; д) закись азота.
12. Кто предложил молекулярную теорию наркоза?
а) Макинтош; б) Анохин; в) Майер и Овертон; г) Полинг; д) Траубе и Варбург.
13. Какой из перечисленных препаратов для ингаляционного наркоза огнеопасен?
а) рекофол; б) наркотан; в) закись азота; г) циклопропан; д) хлороформ.
14. Какой уровень и стадия наркоза у больного, если у него отсутствует сознание,
болевая чувствительность, тонус мышц сохранен, но наблюдается напряжение
328
Тестовый контроль по теме занятий
Тестовый контроль по теме занятий
329
мышц брюшного пресса, пульс и дыхание приближаются к исходному, зрачок
глаза узкий, глазные рефлексы сохранены?
а) первая стадия наркоза; б) вторая стадия наркоза; в) первый уровень третьей
стадии; г) второй уровень третьей стадии; д) третий уровень третьей стадии.
5. Какие факторы являются противопоказанием для местной анестезии?
а) порок сердца; б) дети младшего возраста; в) возбуждение больного; г) повышение температуры тела; д) непереносимость к анестетику; е) отказ больного от местной анестезии.
15. Какое приспособление может использоваться для наркоза по открытому контуру?
а) полинаркон; б) интубационный наркоз; в) наркоз закисью азота; г) аппарат
трилен с маской; д) любое из перечисленных.
6. Субарахноидальное пространство находится между:
а) костями позвоночного канала и твердой мозговой оболочкой; б) между
надкостницей позвоночного канала и твердой мозговой оболочкой; в) между
твердой мозговой оболочкой и паутинной; г) между паутинной и мягкой оболочкой; д) между мягкой оболочкой и спинным мозгом; е) между паутинной
оболочкой и спинным мозгом.
16. Что такое комбинированный наркоз?
а) применение одного препарата для введения в наркоз и введения во время
операции; б) применение в различные периоды наркоза одновременно препаратов для ингаляционного наркоза и внутривенного; в) использование во
время наркоза одновременно двух препаратов для ингаляционного наркоза;
г) использование одновременно для наркоза препаратов для неингаляционного наркоза; д) использование для наркоза вначале одного препарата для введения в наркоз, а затем другого для поддержания наркоза во время операции.
17. Какой из препаратов относится к деполяризующим релаксантам?
а) диплацин; б) дитилин; в) парамион; г) тубарин; д) ардуан.
18. Какие препараты относятся к недеполяризующим релаксантам?
а) миорелаксин; б) сексинил; в) дитилин; г) ардуан; д) листенон.
19. Какое осложнение может быть связано с клиническими проявлениями наркоза?
а) аспирация выпавшего зуба; б) прекращение подачи кислорода; в) острый
бронхит; г) повреждение трахеи при интубации; д) западение языка.
20. Какие осложнения относятся к посленаркозным осложнениям наркоза?
а) западение языка; б) ларингоспазм; в) клиническая смерть; г) бронхоспазм;
д) отек мозга.
Тема №8.
1. Какие препараты из перечисленных применяются для местной инфильтрационной анестезии?
а) пентран; б) лидокаин; в) совкаин; г) фентанил; д) новокаин; е) тримекаин.
2. Какое количество 0,25% раствора новокаина можно использовать при анестезии методом тугого ползучего инфильтрата по А.В. Вишневскому, если длительность операции будет 2 часа?
а) 400 мл; б) 800 мл; в) 200 мл; г) 1600 мл; д) 2400 мл; е) 1200 мл.
3. Через какое время наступает обезболивание после периневрального введения новокаина при проводниковой анестезии?
а) 10-15 минут; б) 1-2 минуты; в) 5-8 минут; г) 3-4 минуты; д) 16-20 минут;
е) 21-25 минут.
4. Какие анестетики применяются при терминальной анестезии?
а) совкаин; б) ультракаин; в) дикаин; г) лидокаин; д) дроперидол; е) новокаин.
7.
Где находится эпидуральное пространство в позвоночном канале?
а) между костями позвоночного канала и твердой мозговой оболочкой; б)
между надкостницей позвоночного канала и твердой мозговой оболочкой; в)
между твердой мозговой оболочкой и паутинной; г) между паутинной и мягкой оболочкой; д) между мягкой оболочкой и спинным мозгом; е) между паутинной оболочкой и спинным мозгом.
8. Какая игла применяется для эндолюмбальной анестезии?
а) игла Кассирского; б) пункционная игла; в) игла Бира; г) обычная длинная
игла; д) игла Вереша; е) игла Иверсена — Рохольма.
9. Какую из местных (регионарных) анестезий допустимо применить при удалении кисты нижней доли правого легкого?
а) инфильтрационная анестезия; б) проводниковая межреберная анестезия;
в) эндолюмбальная анестезия; г) анестезия по Вишневскому методом тугого
ползучего инфильтрата; д) эпидуральная анестезия; е) внутриартериальная
местная анестезия.
10. Какие из перечисленных моментов являются противопоказанием для эндолюмбальной анестезии?
а) экзема в поясничной области; б) гангрена стопы; в) алкогольный делирий;
г) массивное кровотечение; д) острая задержка мочи; е) ребенок 8 лет.
11. Какие из перечисленных препаратов применяются для эндолюмбальной анестезии?
а) дроперидол; б) новокаин; в) атропин; г) совкаин; д) дикаин; е) фентанил.
12. Какие из перечисленных препаратов применяются при эпидуральной анестезии?
а) новокаин; б) дикаин; в) тримекаин; г) совкаин; д) лидокаин; е) мепивакаин.
13. После введения какого препарата больной укладывается на операционный стол
с опущенной головой при выполнении эндолюмбальной анестезии?
а) новокаина; б) дикаина; в) кокаина; г) промедола; д) совкаина; е) ксилокаина.
14. Какие из перечисленных осложнений могут быть после эндолюмбальной анестезии?
а) менингит; б) остеомиелит; в) повреждение спинного мозга; г) гипертония;
д) гипотония; е) апноэ.
15. Какие осложнения из перечисленных могут быть при эпидуральной анестезии?
а) повреждение спинного мозга; б) эпидуральная анестезия превратится в эндолюмбальную; в) гипертензия; г) гипотония; д) воспаление твердой мозговой оболочки; е) воспаление паутинной оболочки.
330
Тестовый контроль по теме занятий
Тема №9.
1. Повреждение (травма) — это:
а) одномоментное воздействие на организм механического объекта, вызывающее повреждение тканей; б) воздействие на органы и ткани физического
агента; в) внезапное воздействие химического объекта, вызывающее повреждение тканей; г) вызывающее нарушение функций организма воздействие
психического агента; д) как внезапное, так и хроническое воздействие всех
перечисленных агентов.
2. Какой процент составляют механические повреждения среди общей заболеваемости населения:
а) 5,5-6%; б) 8-9%; в) 13-15%; г) до 20%.
3. Что относится к собственно производственной травме:
а) спортивная травма; б) бытовая; в) железнодорожная; г) промышленная.
4. Характерные возможные признаки ушиба мягких тканей:
а) гематома; б) отек; в) кровоподтек; г) все вышеперечисленное.
5. Первая помощь при ушибе мягких тканей в первые часы после травмы:
а) сухое тепло; б) холод на место ушиба; в) полуспиртовый компресс; г) новокаиновая блокада места повреждения.
6. Клинические признаки гематомы мягких тканей:
а) крепитация; б) резко болезненная, гиперемированная кожа с четкими границами; в) увеличение в объеме травмированного участка с положительными
симптомами флюктуации; г) наличие эпидермальных пузырей с геморрагическим содержимым.
7.
Необходима ли рентгенография пораженного участка при наличии гематомы:
а) нет; б) необходима по мере обращения больного за медицинской помощью;
в) имеет смысл только в первые 6 часов с момента получения травмы; г) имеет
смысл только в первые 3 суток с момента получения травмы.
8. Наиболее важный компонент первой медицинской помощи при разрыве связочного аппарата, мышц:
а) введение аналгетиков; б) сухое тепло; в) холод; г) иммобилизация пораженного участка.
9. Предпочтительная тактика лечения при полном повреждении связочного аппарата:
а) длительная иммобилизация; б) ранние активные движения; в) новокаиновые блокады; г) оперативное лечение.
Тестовый контроль по теме занятий
331
12. При полном разрыве мышцы будет выявляться:
а) крепитация в области разрыва; б) локальная деформация в зоне разрыва,
определяемая пальпаторно; в) увеличение длины конечности; г) отсутствие
гематомы в месте разрыва.
13. С целью остановки капиллярного кровотечения при наличии поверхностного
ранения необходимо:
а) выполнить транспортную иммобилизацию; б) обработать рану фурацилином; в) наложить асептическую давящую повязку; г) согреть пораженный
участок.
14. Активные разгибательные движения в голеностопном суставе при неполном
разрыве ахиллова сухожилия:
а) ограничены в объеме из-за боли; б) отсутствуют; в) безболезненны, в полном объеме; г) возможны после выполнения транспортной иммобилизации.
15. Аутоиммобилизация — это:
а) бинтование поврежденной нижней конечности к здоровой или верхней
конечности к туловищу; б) использование шины Крамера; в) использование
шины Дитерихса; г) использование подручных материалов.
16. Шина Дитерихса используется:
а) при повреждениях верхней конечности; б) при повреждениях позвоночника; в) при повреждениях нижней конечности; г) во всех вышеперечисленных
случаях.
17. Наиболее частое применение пневматических шин:
а) иммобилизация при повреждениях позвоночника; б) иммобилизация при
повреждениях бедра; в) иммобилизация при повреждениях предплечья и голени; г) как наиболее оптимальный способ иммобилизации при повреждениях в области плечевого сустава.
18. Какие шины относятся к импровизированным:
а) лыжа; б) Крамера; в) Дитерихса; г) сетчатая.
19. Какая из шин не относится к средствам транспортной иммобилизации:
а) Белера; б) Крамера; в) Дитерихса; г) пневматическая.
20. Какое осложнение может быть, если не использовать мягкий материал в качестве прокладки между шиной и кожей:
а) кровотечение; б) пролежни; в) гипертермия; г) парезы, параличи.
Тема №10.
10. Возможны ли пассивные движения при разрывах сухожилий:
а) возможны; б) невозможны; в) ограничены.
1. Необходимым условием для первичного заживления ран является:
а) наличие в ране кровяных сгустков; б) адаптация краев раны; в) наличие
инфекции; г) присутствие дренажа; д) введение антибиотиков.
11. В скольких суставах должна быть выполнена неподвижность при разрыве ахиллова сухожилия:
а) 1; б) 2; в) 3; г) 4.
2. Какие из перечисленных ранений протекают более благоприятно?
а) нанесенные топором; б) осколочные ранения; в) пулевые ранения; г) нанесенные острыми режущими предметами; д) нанесенные тупыми предметами.
332
Тестовый контроль по теме занятий
3. В какие сроки надо произвести ПХО у больного, доставленного в состоянии
шока:
а) сразу при поступлении; б) после выведения больного из состояния шока;
в) через 2 часа после поступления; г) на следующий день; д) после переливания крови.
4. Какие манипуляции входят в первичную хирургическую обработку раны?
а) иссечение краев раны; б) остановка кровотечения; в) удаление инородных
тел из раны; г) промывание раны антибиотиками; д) все верно.
5. Противопоказания к ПХО раны предплечья:
а) загрязнения раны; б) размозжение краев раны; в) наличие открытого перелома лучевой кости; г) шок 3 степени; д) повреждение сухожилий.
6. Ранняя хирургическая обработка раны производится:
а) в течение 24 часов; б) в течение 36 часов; в) в течение 48 часов; г) позже
4 суток на фоне введения антибиотиков.
7.
Характерными признаками стафилококковой инфекции при нагноении ран являются:
а) бурное развитие раневого процесса; б) вялое течение раневого процесса;
в) сильные боли в ушитой ране; г) выраженная интоксикация; д) отсутствие
болей в ране.
Тестовый контроль по теме занятий
333
Тема №11.
1. Вывихнутой считается кость:
а) центральная; б) периферическая; г) дистальная.
2. Вывихи в позвоночнике обозначают по позвонку:
а) вышележащему; б) нижележащему; г) не имеет значения.
3. Вывих до 3 сут считается:
а) свежим; б) несвежим; в) застарелым.
4. Переломовывихом называется состояние, характеризующееся одновременным:
а) переломом и смещением костных отломков; б) переломом и интерпозицией
мышц между отломками; в) переломом с вколачиванием отломков; г) вывихом одной кости и переломом другой; д) вывихом и переломом суставных и
околосуставных отделов кости.
5. Можно ли отнести к переломовывиху так называемый центральный вывих бедра?
а) да; б) нет.
6. Наиболее часто встречается вывих:
а) нижней челюсти; б) ключицы; в) плеча; г) бедра; г) в голеностопном суставе.
7.
По этиологическому признаку к вывихам относятся все нижеуказанные, кроме:
а) травматических; б) привычных; в) врожденных; г) полных; д) патологических.
8. Необходимыми условиями для наложения раннего вторичного шва являются:
а) максимальная адаптация краев раны; б) съемные швы; в) несъемные швы;
г) иссечение грануляций; д) сохранение грануляций.
8. Чаще всего встречается врожденный вывих:
а) плеча; б) предплечья; в) в лучезапястном суставе; г) бедра; д) основной фаланги 1 пальца.
9. Какие средства способствуют удалению из раны гнойного отделяемого?
а) дренажи; б) протеолитические ферменты; в) гипертонические растворы;
г) растворы антибиотиков; д) верно все.
9. Обследуя сустав при вывихе, в нем можно выявить все симптомы, кроме:
а) отсутствия активных движений; б) резкого ограничения пассивных движений; в) пружинящего сопротивления; г) ложной подвижности; д) ступенчатого западения.
10. Какие из указанных методов целесообразно применять для местного лечения
гнойных ран в фазе воспаления?
а) мазевые повязки; б) протеолитические ферменты; в) иммунизация; г) промывание антисептиками; д) повязки с гипертоническими растворами.
10. Допустима ли после вправления вывиха плеча иммобилизация верхней конечности повязкой Дезо или Вельпо?
а) да; б) нет; в) только Дезо; г) только Вельпо.
11. Клиническая картина ран состоит из:
а) боли; б) кровотечения; в) отека; г) зияния; д) все верно.
11. Исключите неверно указанный вид смещения костных отломков при переломе:
а) по длине; б) боковое; в) под углом; г) касательное; д) ротационное.
12. Воспалительная фаза раневого процесса длится:
а) 1-2 сут.; б) 3-5 сут.; в) 24 ч.; г) 5-7 сут.; д) зависит от площади раны.
12. У больного имеется открытый перелом костей голени вследствие удара передним бампером легкового автомобиля. Какого вида перелом при этом наиболее
вероятен?
а) вколоченный; б) компрессионный; в) многооскольчатый; г) отрывной;
д) винтообразный;
13. Фаза заживления длится:
а) 24-48 ч.; б) 36-72 ч.; в) 2-4 нед.; г) 6-8 нед.; д) 5-6 нед.
14. Сроки наложения ранних вторичных швов:
а) 10-15 дней; б) 1-3 дня; в) 4-8 дней; г) 17-20 дней; д) 20-25 дней.
15. Методы лечения ран:
а) хирургический; б) консервативный; в) комбинированный; г) радикальный;
д) паллиативный.
13. Верно ли, что источниками образования костной мозоли являются клетки эндоста, каналов остеона, надкостницы и окружающей кость соединительной
ткани?
а) да; б) нет; в) только эндоста; г) только надкосницы; д) только каналов
остеона.
334
Тестовый контроль по теме занятий
Тестовый контроль по теме занятий
335
14. Назовите симптом закрытого перелома кости:
а) подкожная эмфизема; б) патологическая подвижность; в) увеличение абсолютной длины конечности; г) кровотечение; д) пружинящее сопротивление в
ближайшем суставе.
3. Вид черепно-мозговой травмы, симптомом которой является истечение спинномозговой жидкости из носа:
а) сотрясение головного мозга; б) сдавление головного мозга; в) перелом
основания черепа; г) внутричерепное кровотечение.
15. Обследование пострадавшего с жалобами на боли в области плеча следует начинать с:
а) опроса; б) рентгенологического исследования плеча; в) определения уровня
гемоглобина крови; г) выявления крепитации в области плеча; д) определения
патологической подвижности плечевой кости.
4. Меры при резком повышении внутричерепного давления:
а) спинномозговая пункция; б) кровопускание; в) введение достаточного количества аналгетиков; г) введение изотонического раствора.
16. Укажите элемент первой помощи на месте происшествия пострадавшему с
переломом длинной трубчатой кости:
а) использовать шину Белера; б) обезболить место перелома; в) выполнить
репозицию отломков; г) иммобилизировать конечность транспортной шиной;
д) выполнить скелетное вытяжение.
17. Транспортировать больного с переломом поясничного отдела позвоночника необходимо на мягких носилках в положении:
а) на спине; б) на животе; в) на боку; г) «лягушки»; д) не имеет значения.
18. Укажите шину, не предназначенную для транспортной иммобилизации:
а) пневматическая; б) Дитерихса; в) Белера; г) Крамера; д) сетчатая.
19. В какие средние сроки при переломах наблюдается образование первичной костной мозоли:
а) до 2 недель; б) 2-3 недели; в) 4-6 недель; г) 7-8 недель; д) 9-10 недель.
20. Оперативное лечение при свежих переломах показано во всех случаях, кроме наличия:
а) поперечного перелома бедра; б) открытого перелома с большим диастазом
отломков; в) интерпозиции мягких тканей между отломками; г) сопутствующего шока, острой кровопотери, инфекции; д) сдавления отломками жизненно важных органов.
21. Чрезмерно длительная иммобилизация при переломе приводит к:
а) контрактуре; б) псевдоартрозу; в) интерпозиции мягких тканей; г) эпифизеолизу; д) гемартрозу.
22. Причиной замедленного сращения костей является:
а) плохая иммобилизация; б) развитие инфекции; в) интерпозиция мягких тканей; г) нарушение кровоснабжения костных отломков; д) все вышеуказанное.
Тема №12
5. Симптом, характерный для сдавления мозга:
а) ясное сознание; б) сужение зрачков; в) равномерное снижение сухожильных рефлексов; г) парезы и параличи конечностей.
6. Минимальное количество крови, вызывающее сдавление головного мозга при
эпидуральной гематоме:
а) 10 мл; б) 20 мл; в) 40 мл; г) свыше 50 мл.
7.
Результат спинномозговой пункции при сотрясении мозга:
а) без патологии; б) спинномозговая жидкость с примесью крови; в) спинномозговая жидкость с примесью гноя; г) спинномозговая жидкость с примесью
хлопьев.
8. Характеристика пульса и дыхания при сотрясении мозга:
а) без отклонения от нормы; б) пульс замедлен, дыхание частое, поверхностное; в) пульс учащен, дыхание частое, поверхностное; г) пульс частый, дыхание ступорозное.
9. Меры при сдавлении мозга:
а) спинномозговая пункция; б) кровопускание; в) операция — трепанация черепа; г) введение 40% раствора глюкозы внутривенно.
10. При каких видах черепно-мозговой травмы в клинической картине заболевания
может быть «светлый промежуток»?
а) при сотрясении мозга; б) при ушибе мозга; в) при сдавлении мозга; г) при
сочетанном сотрясении и ушибе мозга.
11. Характерный признак сдавления грудной клетки:
а) затруднен глубокий выдох; б) свободное везикулярное дыхание; в) гиперемия кожи грудной клетки; г) точечные кровоизлияния в кожу верхней части
туловища.
12. Симптом закрытого пневмоторакса:
а) гиперемия кожи лица и грудной клетки; б) урежение пульса; в) коробочный
звук при перкуссии; г) усиление дыхательных шумов.
1. Основной симптом сотрясения головного мозга:
а) ретроградная амнезия; б) усиление рефлексов; в) расширение зрачков;
г) поверхностное аритмичное дыхание.
13. Состояние, при котором требуется наложение акклюзионной повязки:
а) перелом ребер; б) сильное кровотечение; в) обширное повреждение мягких
тканей; г) открытый пнемоторакс.
2. Основной симптом ушиба головного мозга:
а) головокружение; б) рвота; в) учащение пульса; г) выпадение функции одного участка головного мозга.
14. Симптом клапанного пневмоторакса:
а) бледность кожи; б) нарастающая одышка; в) урежение пульса; г) отечность
тканей.
336
Тестовый контроль по теме занятий
15. Меры, облегчающие состояние больного с клапанным пневмотораксом:
а) дренаж по Бюлау; б) паранефральная блокада; в) межреберная блокада;
г) трахеостомия.
16. Меры первой помощи у больного с открытым пневмотораксом:
а) наложение акклюзионной повязки; б) иммобилизация грудной клетки;
в) возвышенное положение головного конца; г) трахеостомия.
17. Причины тампонады сердца:
а) обширный инфаркт миокарда; б) опухоль средостения; в) гемоперикард;
г) эмпиема плевры.
18. Какой из перечисленных методов обследования является наиболее информативным при пневмотораксе?
а) рентгенография грудной клетки; б) торакоскопия; в) плевральная пункция;
г) пункция средостения; д) селективная ангиограмма легких.
19. Какова основная причина смерти при закрытых травмах груди?
а) острая сердечная недостаточность; б) медиастинит; в) острая дыхательная
недостаточность; г) падение внутриплеврального давления; д) угнетение кашлевого рефлекса.
20. Какое количество крови в плевральной полости не выявляется на рентгенограмме?
а) до 150 мл; б) до 600 мл; в) до 300 мл; г) до 450 мл; д) до 750 мл.
Тема №13.
1. Какое положение характерно для пациента с внутрибрюшным кровотечением?
а) лежачее; б) полусидячее; в) сидячее; г) стоя.
2. Какого вида перитонита по виду экссудата не существует?
а) серозный; б) гнойный; в) гнилостный; г) лимфатический; д) фибринозный;
е) хилезный.
3. Какой метод диагностики разрыва печени наиболее информативный?
а) ирригоскопия; б) ФГДС; в) рентгенография живота; г) лапароскопия; д) физикальное обследование.
4. Положительный симптом «ваньки-встаньки» характерен для повреждения:
а) желудка; б) печени; в) поджелудочной железы; г) почек; д) тонкой кишки.
5. В каком случае наблюдается положительный симптом Куленкампфа?
а) клапанный пневмоторакс; б) закрытый пневмоторакс; в) ушиб мозга;
г) внутрибрюшное кровотечение; д) перитонит.
6. Что необходимо сделать перед реинфузией крови из брюшной полости при разрыве селезенки?
а) определить уровень гемоглобина крови; б) измерить пульс и АД; в) определить уровень билирубина крови; г) исключить бактериальное загрязнение и
гемолиз; д) определить концентрацию мочевины крови.
Тестовый контроль по теме занятий
7.
337
Микрогематурия наблюдается только при травме почек. Так ли это?
а) да; б) нет.
8. При разрыве печени в брюшную полость изливается только желчь. Так ли это?
а) да; б) нет.
9. В какой стадии перитонита исчезают кишечные шумы:
а) реактивная; б) токсическая; в) терминальная.
10. Какой метод лечения эффективен при разрыве селезенки?
а) гемостатическая терапия; б) переливания крови; в) ушивание селезенки;
г) тампонада повреждения большим сальником; д) спленэктомия.
11. В каком месте живота выполняется лапароцентез?
а) вблизи мечевидного отростка по срединной линии; б) слева от пупка;
в) справа от пупка; г) в правой паховой области; д) между пупком и лобковым
симфизом по срединной линии.
12. Какой вид операции показан при перитоните?
а) экстренная; б) отсроченная; в) срочная; г) плановая.
13. Какие лабораторные изменения характерны для перитонита?
а) эозинофилия; б) лейкопения; в) сдвиг лейкоцитарной формулы вправо;
г) моноцитоз; д) сдвиг лейкоцитарной формулы влево.
14. Чем обычно сопровождается разрыв нисходящей ветви двенадцатиперстной кишки?
а) внутрибрюшным кровотечением; б) перитонитом; в) забрюшинной флегмоной; г) сочетанным с разрывом правой почки; д) ничем.
15. Какой разрез необходим для полноценной ревизии брюшной полости при закрытой травме?
а) параректальный; б) срединная лапаротомия; в) переменный косой МакБурнея; г) разрез Кохера; д) Пфанненштиля.
16. Какой метод исследования наиболее информативен при подозрении на разрыв
мочевого пузыря?
а) рентгенография живота; б) лапароскопия; в) контрастная цистография;
г) ирригоскопия; д) анализ мочи.
17. Сколько трубчатых дренажей используют для дренирования брюшной полости
при тотальном перитоните?
а) 1; б) 2-3; в) 4-5; г) 7-8; д) 10-12.
18. Какой симптом нехарактерен для ушиба передней брюшной стенки?
а) изменение цвета кожных покровов; б) местное напряжение брюшной стенки в месте локализации гематомы; в) наличие опухолевидного образования в
мягких тканях; г) возникновение боли после приведения вытянутой ноги.
19. Назовите постоянный симптом перитонита:
а) наличие газа под диафрагмой на рентгенограмме; б) влажный язык; в) дизурия; г) икота; д) болезненность прямой кишки при пальцевом ректальном
исследовании.
338
Тестовый контроль по теме занятий
20. Какой препарат не применяется при лечении кишечного пареза?
а) питуитрин; б) эфедрин; в) неостигмин; г) гипертоническая клизма; д) в/в
введение 10% NaCl.
Тема №14.
1. При каких ожогах наблюдается более глубокое поражение ткани?
*а) щелочами; б) неорганическими кислотами (серная, азотная); в) органическими кислотами (лимонная); г) солями тяжелых металлов (азотнокислое
серебро).
2. Какие повязки можно применять при ожогах фосфором?
*а) с раствором медного купороса; б) с мазью Вишневского; в) с раствором
фурацилина; г) с противоожоговой жидкостью.
3. Какие степени ожога относятся к глубоким?
*а) 4 ст.; б) 3-б ст.; в) 3-а ст.; г) 2 ст.; д) 1 ст.
4. При какой наименьшей площади ожогов 2 и 3 степени уже может развиться
ожоговая болезнь?
*а) 10%; б) 5%; в) 30%; г) 20%; д) 50%.
5. Сколько стадий различают в ожоговой болезни?
*а) 4; б) 2; в) 3; г) 1; д) 5.
6. При каких ожогах может развиться ожоговое истощение?
*а) 4 степени; б) 3-б степени; в) 2 степени; г) 1 степени; д) 3-а степени.
7.
Какую повязку необходимо наложить на обожженную поверхность при оказании первой помощи на месте происшествия?
*а) асептическую; б) с синтомициновой эмульсией; в) с мазью Вишневского,
г) гидрокортизоновую.
8. Применяется ли общее лечение при ограниченных ожогах 2 — 3-а степени площадью 2-3%?
*а) нет; б) да; в) иногда.
9. При ожогах какой степени применяется пересадка кожи?
*а) 4 степени; б) 3-б степени; в) 3-а степени; г) 2 степени.
10. Какое количество жидкости необходимо ввести в/в больному в первые сутки
поле ожога 3-а — 3-б степени, если масса его тела составляет 50 кг, площадь
поражения 50%?
а) 7000 мл; б) 5000 мл; в) 2500 мл; г) 9000 мл.
11. Ожоговая токсемия продолжается:
*а) 7-8 дней; б) 2-72 часа; в) 10-15 дней; г) 15-20 дней; д) более 20 дней.
12. Характерными особенностями ожогового шока являются:
*а) возбуждение в первые часы после ожога; б) интоксикация в первые часы
после ожога; в) гиперкапния; г) потеря сознания; д) полиурия.
Тестовый контроль по теме занятий
339
13. На основании каких данных в первые часы можно предположить глубокий
ожог?
*а) болевая чувствительность отсутствует; б) болевая чувствительность сохранена; в) имеется отек непораженных нижележащих отделов конечностей;
г) отек отсутствует.
14. Ожоговая болезнь развивается у детей при площади поражения:
*а) 6%; б) 3%; в) 10%; г) 20%; д) 30%.
15. Какая первая помощь при попадании негашенной извести на кожу?
*а) механическое очищение кожи; б) промывание мыльной водой; в) промывание водой; г) наложение асептической повязки.
16. Какая первая помощь при попадании на кожу фосфора?
*а) погрузить этот участок в воду и удалить пинцетом фосфор; б) закрытие
этого участка бинтовой повязкой; в) присыпать землей и стереть бинтом фосфор; г) обильное промывание водой для удаления фосфора.
17. Сколько необходимо перелить в/в жидкости больному массой тела 70 кг, при
ожоге 3-а — 4 степени и площади ожога 40%?
*а) 7600 мл; б) 4100 мл; в) 2600 мл; г) 8500 мл; д) 10000 мл;
18. Ожоговое истощение развивается:
*а) вместо 4 стадии; б) во 2-ой стадии ожоговой болезни; в) в 3 стадии ожоговой болезни; г) в 1 стадии ожоговой болезни.
19. Каким способом лучше лечить ожог 1-2 степени на лице?
*а) открытым; б) смешанным; в) закрытым способом; г) пересадкой кожи.
20. После ожога носа пламенем 4 степени какой способ пересадки кожи лучше применить:
*а) итальянский на ножке; б) Девиса; в) Тирша; г) Яновича-Чайнского.
21. Ранний реактивный период продолжается от момента согревания:
*а) 12 часов; б) 24 часа; в) 18 часов; г) 48 часов; д) 16 часов.
22. По глубине поражения различают поверхностные поражения:
*а) 1-2 ст.; б) 3-а — 3-б ст.; в) 3-4 ст.; г) 2-3-б ст.; д) 2-3-А ст.
23. При отморожении 2 ст. разрушенные элементы кожи восстанавливаются:
*а) спустя 1-2 недели; б) спустя 3-4 недели; в) через 5 дней. г) через 5 недель;
д) через 1 мес.
24. При развитии анурии после электротравмы проводят:
*а) гемодиализ; б) в/в введение 2000 мл гемодеза; в) в/в введение 2500 мл 5%
глюкозы; г) введение осмодиуретиков; д) в/в введение декстранов.
25. Особенностью электрических ожогов является:
*а) их полная безболезненность; б) интенсивная болезненность через 60-120
минут после травмы; в) жгучая боль; г) постепенное нарастание болезненности; д) появление болезненности через 30 минут после травмы.
340
Тестовый контроль по теме занятий
ЗАДАЧИ ПО ТЕМАМ ЗАНЯТИЙ
26. Отличительной чертой электроожогов является:
*а) прогрессирующий некроз глубжележащих тканей; б) отсутствие некроза
глубжележащих тканей; в) медленное развитие и распространение некрозов;
г) некроз только кожных покровов; д) возникновение коликвационного некроза.
27. Электроожоги при воздействии тока высокого напряжения составляют по
степеням:
*а) 3-б — 4 ст.; б) 2-3-а. ст.; в) 2-3-б ст.; г) 1-3-а ст.
28. При поражении костей выполняют:
*а) раннюю остеонекроэктомию; б) рассечение мягких тканей; в) в/артериальное введение спазмолитиков; г) лампасные разрезы; д) выжидательная
тактика до образования демаркации.
29. Какое соотношение коллоидов и кристаллоидов при формуле Брокка?
*а) 1:3; б) 1:6; в) 2:2; г) 3:1; д) равные части.
30. При согревании конечности при отморожениях температуру воды доводят:
*а) до 39-40°С ; б) до 18-20°С; в) до 20-32°С; г) до 25-36°С; д) до 28-38°С.
Тема №2
1. В больницу поступил больной с ушибленной раной правой кисти, полученной
на работе 2 часа назад. Какой вид антисептики следует применить?
2. У больного при вскрытии флегмоны из раны выделился газ, отделяемое скудное, серозно-геморрагическое, зловонное — заподозрена газовая анаэробная
инфекция. Какие химические антисептики надо применить?
3. У больного имеется рожа правой конечности. Какие показаны физические методы антисептики?
4. Больной поступил в травмпункт с раной, полученной во время земляных работ. Какой метод антисептики надо применить для профилактики столбняка
и в каком виде?
5. Больной поступил в стационар с колотой точечной раной на конечности без
признаков кровотечения и повреждения нерва, рана получена 1 час назад. Показана ли ПХО раны? Показаны ли другие антисептические мероприятия?
6. Больной поступил в стационар с укушенной раной на конечности без признаков кровотечения и повреждения нерва, рана получена 1 час назад. Показана
ли ПХО раны? Показаны ли другие антисептические мероприятия?
7. Больной поступил в стационар с резаной раной на конечности без признаков
кровотечения и повреждения нерва, рана получена 4 час назад. Показана ли
ПХО раны? Показаны ли другие антисептические мероприятия?
Тема №3
1. В клинику поступил больной с ушибленной раной правой кисти, получил на
работе 2 часа назад. Какой вид антисептики следует применить?
2. В стерилизационной производилась стерилизация белья. Стерилизовали паром под давлением 132,9 кПа/1,5 атм в течение 45 минут. После того как весь
пар был выпущен, стерилизационные коробки герметически закрыли и отнесли в операционную. Допущенная ошибка? Ваши дальнейшие действия?
3. В операционной длительное время шла операция, при которой была вскрыта
гнойная полость. Подготовка операционной к дальнейшей работе?
4. После операции по поводу гнойного процесса хирургический инструмент тщательно промыли под проточной водой «ершом» с мылом, ополоснули и положили в кипятильник для стерилизации. Стерилизация длилась 45 минут,
после чего инструменты отнесли в операционную. Допущенные ошибки? Необходимые действия?
342
Задачи по темам занятий
5. Почему при стерилизации в автоклаве в начале автоклавирования необходимо
полностью удалить из стерилизационной камеры воздух с помощью пара?
6. Какой основной недостаток контроля стерилизации методом Микулича?
7. Почему нельзя стерилизовать перчатки кипячением в содовом растворе?
8. Операционная м/с открыла бикс с бельем, чтобы накрыть стол перед операцией. Белье влажное, сера не расплавилась. Можно ли пользоваться таким бельем, почему?
9. Во время наложения швов на рану студент рукой в перчатке поправил маску на
своем лице и продолжал дальше ассистировать. Никто этого не заметил. Мог
ли студент продолжать ассистировать? Какие осложнения могут развиться у
больного, и к какому виду инфекции они относятся?
Тема №4.
1. Больной К., 25 лет, поступил в хирургическое отделение после автодорожного происшествия. Получил удар в область грудной клетки. Сейчас отмечается одышка, боли при дыхании в правой половине грудной клетки, бледность
кожи и слизистых, головокружение, мелькание перед глазами. Пульс у больного слабого наполнения, 120 ударов в одну минуту, артериальное давление
80/40 мм рт. ст. Грудная клетка слабо участвует в дыхании, справа определяется притупление и не прослушивается дыхание. Какая предположительная
травма у больного? Как уточнить диагноз? Какие необходимы меры помощи?
2. Больной А., 34 лет, в потасовке получил удар ножом в живот. Скорой помощью доставлен в хирургический стационар. При осмотре больной бледен, в
сознании, пульс слабого наполнения, артериальное давление 70/40 мм рт.
ст. Живот несколько поддут, слабо участвует в дыхании, в правом подреберье имеется рана 2,0х1,0 см, из которой выделяется при дыхании небольшое
количество крови. При пальпации болезненность в правом подреберье и при
перкуссии в правой половине живота притупление. Какое предположительно у
больного повреждение? Какие необходимы дополнительные методы диагностики? Какая необходима помощь?
3. У больного С. с закрытой травмой живота при операции выявлено повреждение селезенки. Селезенка удалена, но у больного остается бледность кожи
и слизистых, тахикардия 150 ударов в минуту, артериальное максимальное
давление 50 мм рт. ст., шоковый индекс 2,0. Гемоглобин 60 г/л, центральное
венозное давление снизилось практически до 0 мм водного столба, моча через введенный во время операции катетер не выделяется. Установлено, что
потеря крови составляет 2000 мл, ОЦК снизилось на 40%. Какое состояние
у больного, обусловленное кровопотерей и какая его тяжесть? Как восполнить
кровопотерю?
Задачи по темам занятий
343
Тема №5.
1. В приемное отделение хирургического стационара в ургентном порядке поступил больной М., 34 лет, с диагнозом проникающего ножевого ранения органов брюшной полости. Состояние больного средней степени тяжести, больной в сознании, адекватен. Объективно: АД 90/65 мм рт. ст., пульс 120 уд.
в мин., аритмичен, кожные покровы бледные. После кратковременных интенсивных предоперационных мероприятий больной был оперирован. При лапаротомии обнаружено в брюшной полости до 1,5 л крови без сгустков. При
ревизии установлено повреждение селезенки, нисходящей ободочной кишки
в области селезеночного изгиба. Можно ли использовать кровь из брюшной полости для реинфузии? Почему?
2. Больной А., 76 лет, находился в реанимационном отделении по поводу острого нарушения мозгового кровообращения, аневризмы инфраренальной
части брюшной аорты, гипертонической болезни 3 ст., сахарного диабета
2 типа. Внезапно почувствовал резкую боль в мезогастральной области, после чего потерял сознание. Был предположен разрыв аневризмы. Больной по
жизненным показаниям был взят в операционную, где во время лапаротомии
в брюшной полости было обнаружено до 2,5 л крови, разрыв аневризматического мешка. Можно ли использовать кровь из брюшной полости для реинфузии? Почему?
3. В приемное отделение поступила больная Л., 23 лет с диагнозом внематочной беременности. При определении группы крови оказалась положительной
реакция изогемагглютинации со стандартными сыворотками А(II) и В(III)
групп и отрицательной с 0(I) и AB(IV) групп. О чем свидетельствует подобный
результат?
Тема №6.
1. В приемное отделение хирургического стационара в ургентном порядке поступил больной М., 34 лет, с диагнозом проникающего ножевого ранения органов брюшной полости. Состояние больного средней степени тяжести, больной в сознании, адекватен. Объективно: АД 90/65 мм рт. ст., пульс 120 уд. в
мин., аритмичен, кожные покровы бледные. После кратковременных интенсивных предоперационных мероприятий больной был оперирован. При лапаротомии обнаружено в брюшной полости до 1,5 л крови без сгустков. При
ревизии установлено повреждение селезенки, нисходящей ободочной кишки
в области селезеночного изгиба. Можно ли использовать кровь из брюшной полости для реинфузии? Почему?
2. Больной А., 76 лет, находился в реанимационном отделении по поводу острого нарушения мозгового кровообращения, аневризмы инфраренальной части
брюшной аорты, гипертонической болезни 3 ст., сахарного диабета 2 типа.
Внезапно почувствовал резкую боль в мезогастральной области, после чего потерял сознание. Был предположен разрыв аневризмы. Больной по жизненным
показаниям был взят в операционную, где во время лапаротомии в брюшной
344
Задачи по темам занятий
полости было обнаружено до 2,5 л крови, разрыв аневризматического мешка.
Можно ли использовать кровь из брюшной полости для реинфузии? Почему?
3. В приемное отделение поступил больная Л.,23 лет с диагнозом внематочной
беременности. При определении группы крови оказалась положительной реакция изогемагглютинации со стандартными сыворотками А(II) и В(III) групп
и отрицательной с 0(I) и AB(IV) групп. О чем свидетельствует подобный результат?
Тема №7.
1. Больному начали масочный эфирный наркоз. И вдруг прекратилось дыхание,
он не может вдохнуть, кожа стала синюшная, напряглись вены шеи. Что произошло? Какие меры предпринять?
2. Больному с целью базисного наркоза решено произвести прямокишечный
наркоз. Как выполнить эту процедуру? Какое вещество необходимо ввести для
этой цели и его доза?
Тема №8.
1. Больной доставлен в хирургическое отделение с переломом правого бедра и
проявлениями травматического шока. Какой вид анестезии лучше применить
и как ее выполнить?
2. При выполнении эндолюмбальной анестезии в игле появилась кровь. Почему
в игле появилась кровь? Что нужно после этого сделать?
3. При выполнении эпидуральной анестезии введена только тестовая (первая)
доза 5,0 мл 0,3% раствора дикаина. Через 7 минут наступило полное обезболивание нижнего отдела живота и нижних конечностей. Что произошло? Вводить ли остальной раствор дикаина?
Тема №9.
1. Больной М. во время физических упражнений в тренажерном зале почувствовал резкую боль в области правого бицепса. При осмотре по передней поверхности правого плеча визуализируется слабая припухлость, деформация по
типу углубления. При пальпации области травмы боль значительно усиливается. Активные движения невозможны вследствие боли, пассивные ограничены и затруднены по той же причине. Какая травма, на ваш взляд, у больного в
данном случае? Какую необходимо оказать первую помощь?
2. У больной Н. во время бега подвернулась правая стопа кнутри, после чего
появилась боль в области голеностопного сустава. Ходьба крайне затруднительна из-за боли. При осмотре по наружной поверхности правого голеностопного сустава слабая припухлость. При пальпации области припухлости боль усиливается. Активные движения ограничены вследствие боли,
пассивные безболезненны, возможны в полном объеме. Какая травма, на
Задачи по темам занятий
345
ваш взляд, у больной в данном случае? Какую необходимо оказать первую помощь?
Тема №10.
1. В хирургическое отделение доставлен больной В., 43 лет, с рубленой раной
левого бедра. При осмотре раны на дне ее выявлен проходящий сосудистонервный пучок. Ваша тактика при выполнении ПХО?
2. В хирургическое отделение в ургентном порядке доставлен больной М., 32 лет,
получивший огнестрельное ранение плеча. Объективно: состояние больного
крайне тяжелое, без сознания, АД 50/35 мм рт. ст., повязка обильно промокла
кровью. Показана ли в таком случае ПХО раны?
3. Больная С., 56 лет после выполнения первичной хирургической обработки
резаной раны левого предплечья, на 3 сутки после операции предъявляет жалобы на резкие боли в ране, повышение температуры тела до 38°С, головные
боли, слабость. При осмотре отмечается бурное развитие воспалительного
процесса в ране. Какова причина развившегося состояния?
Тема №11.
1. Молодая женщина во время мытья окна выпала из него. Падение произошло
с высоты второго этажа. Жалуется на боли в верхне-поясничном отделе позвоночника, усиливающиеся при попытке сесть или повернуться на бок. Активные движения в суставах нижних конечностей сохранены. Пальпаторно
отмечается болезненность при надавливании на остистый отросток первого
поясничного позвонка. Ваш предварительный диагноз? Какой объем первой помощи необходимо оказать больной?
2. К Вам обратился больной с жалобами на боли в правом плечевом суставе. Боли
появились 3 часа назад, когда он, сняв пальто, хотел повесить его на вешалку.
Год назад перенес травматический вывих правого плеча. При осмотре отмечается вынужденное положение конечности, ступенчатая деформация в области
правого плечевого сустава. Головка плеча пальпируется в подмышечной впадине. При попытке произвести пассивные движения в суставе определяется
пружинящее сопротивление, сопровождающееся усилением болей. Ваш диагноз? Какую помощь Вы окажете больному?
3. В стационар поступил больной с уточненным диагнозом: закрытый винтообразный перелом обеих костей левой голени в средней трети. Какой вид лечения рациональнее применить?
4. Мальчик 14 лет, играя в волейбол, упал на вытянутую левую руку. Беспокоят боли в области левой ключицы. Положение пострадавшего вынужденное:
тело наклонено в сторону повреждения, здоровая рука поддерживает согнутое
в локте предплечье поврежденной руки и прижимает ее к туловищу. Пульс на
левой лучевой артерии удовлетворительного наполнения, чувствительность
пальцев кисти сохранена. Отмечается умеренная припухлость и болезнен-
346
Задачи по темам занятий
ность при пальпации в области левой ключицы. Активные и пассивные движения в левом плечевом суставе сильно ограничены из-за болей. Ваш диагноз?
В чем заключается первая помощь, которая должна быть оказана больному?
Какие дополнительные обследования обязательно необходимо провести пострадавшему и какова дальнейшая лечебная тактика?
Тема №12.
1. Больной А. поступил в приемный покой больницы после травмы головы. Из
анамнеза: был травмирован ударом в участок лицевого черепа, после чего
утратил сознание на 2 минуты, была одноразовая рвота. Больной не может
рассказать детально об обстоятельствах травмы. Жалуется на головную боль,
слабость, головокружение, звон в ушах. Объективно: пульс в границах нормы,
непостоянный мелкоразмашистый нистагм, ассимметрия мимической мускулатуры. Ваш диагноз и план лечебно-диагностических мероприятий?
2. В клинику доставлен ребенок 8 лет. Упал с дерева, ударился головой. Была
наложена повязка, которая постоянно промокает. При осмотре: ребенок
сонлив, капризен, очаговая неврологическая симптоматика четко не выявляется, менингеальных знаков нет. На голове повязка, обильно промокшая
прозрачно-геморрагическим отделяемым. Под повязкой в теменной области
слева имеется линейное повреждение кожи до 1 см, апоневроз поврежден, из
раны постоянно выделяется сукровичная жидкость. На рентгенограммах черепа: линейный перелом левой теменной кости. Каков Ваш предварительный
диагноз?
3. Врач скорой помощи доставил больного с места катастрофы. Больной самостоятельно поднялся, самостоятельно зашел в машину. Бригаде скорой помощи сообщил паспортные данные, место работы. По пути следования в больницу у пациента возникла рвота, судорожный приступ. После этого больной
в сознание не приходил, появилась анизокория, нарушился тип дыхания,
артериальное давление 180/120 мм рт.ст. При осмотре: состояние больного
крайне тяжелое, сознание нарушено вплоть до сопора, дыхание шумное, лицо
гиперемировано, тонические судороги. В правой височной области — ссадина,
припухлость мягких тканей подкожная гематома, анизокория, D>S, на уколы
реагирует движениями в правых конечностях, слева движения отсутствуют,
положительный симптом Бабинского с двух сторон. Поставьте предварительный диагноз.
4. Вечером накануне поступления в клинику больной был избит, наблюдалась
кратковременная потеря сознания. Самостоятельно пришел домой, жаловался на головную боль, принял обезболивающую таблетку, лег спать. Утром не
проснулся, родственники вызвали карету скорой помощи. Доставлен в клинику в бессознательном состоянии с очаговыми симптомами поражения правой
половины тела. Каков предварительный диагноз и план лечения?
5. В приемное отделение поступил пациент 19 лет с колото-резаным ранением
правой половины грудной клетки. На обзорной рентгенограмме грудной клет-
Задачи по темам занятий
347
ки установлено наличие небольшого правостороннего гемоторакса. Укажите
оптимальную хирургическую тактику.
6. В составе бригады скорой помощи Вы прибыли на место происшествия.
У пострадавшего обнаружен открытый наружный пневмоторакс слева. Какой объем первой медицинской помощи Вы окажете? Как поступите с больным
дальше?
7. У пострадавшего закрытая травма грудной клетки слева. Отмечается боль в
левой половине грудной клетки при вдохе. Аускультативно слева — ослабление дыхания, перкуторно — также притупление звука. Какова причина изменений, выявленных при обследовании больного? Какие исследования необходимо
выполнить для уточнения диагноза? План лечения?
8. Вы — врач скорой помощи. Вас срочно вызвали к 34-летнему больному, страдающему эмфиземой легких, который жалуется на «пронизывающую» боль в
правой половине грудной клетки. Боли появились внезапно около часа назад
во время приступа кашля. Больной лежит на правом боку. Кожные покровы
бледные. Легкий акроцианоз. Дыхание поверхностное, 28 в минуту. Температура тела 36,7°С. Артериальное давление — 120/85 мм рт.ст. Справа над
легкими дыхание не прослушивается, перкуторно определяется коробочный
звук. Живот мягкий, безболезненный. Ваш предположительный диагноз? Как
Вы поступите с больным? Какое лечение показано больному?
9. Мужчина 30 лет поступил с огнестрельным ранением левой половины грудной клетки по средней подмышечной линии. АД 90/60 мм рт. ст., пульс 120 уд.
в 1 минуту, частота дыхательных движений 30 в мин. После внутривенного
вливания 2 литров солевых растворов ЦВД (центральное венозное давление)
возросло до 30 см водного столба, но гипотензия сохранялась. Рентгенологически — плевральная полость чистая, аускультативная картина дыхания нормальная. Наиболее вероятный диагноз? План лечения?
Тема №13.
1. Пациент (49 лет) на четвертые сутки после резекции желудка отметил появление постоянных интенсивных болей в животе и сухость во рту. Общее состояние тяжелое. Положение в постели вынужденное: на спине с приведенным к
животу ногами. Температура тела 37,80С. АД — 100/60 мм рт. ст. Пульс — 104
в мин. Язык сухой, живот симметричен, несклько напряжен, ограниченно
участвует в дыхании, болезненный преимущественно в правой подреберной
области. Симптом Щеткина — Блюмберга положительный, перистальтика
значительно ослаблена. При пальцевом ректальном исследовании — болезненность при пальпации передней стенки. Какое послеоперационное осложнение наиболее вероятно? а) перитонит; б) кишечная непроходимость; в) кровотечение; г) панкреатит; д) абсцесс малого таза.
2. Мужчина (27 лет) доставлен с ножевой раной живота через 4 часа после травмы. Состояние тяжелое: пульс 120 уд. в мин., слабого наполнения,
АД 70/40 мм рт. ст. Выполнена лапаротомия: повреждений полых органов не
348
Задачи по темам занятий
выявлено, большое количество крови в брюшной полости вследствие повреждения мезентериальных сосудов. Кровотечение остановлено. Какой метод
возмещения кровопотери наилучший? а) инфузии СЗП; б) переливание эритромассы; в) переливание отмытых эритроцитов; г) реинфузия крови; д) инфузии
реополиглюкина.
3. Дежурный доктор вызван в приемное отделение к потерпевшему. Пациент жаловался на боль в поясничной области, общую слабость, тошноту. Объективно: живот мягкий, перитонеальных симптомов нет, симптом Пастернацкого
положительный справа. В общем анализе крови без патологии, в общем анализе мочи — гематурия. Какая патология может быть заподозрена? а) травматический разрыв печени; б) разрыв мочевого пузыря; в) ушиб правой почки;
г) экстраперитонеальный разрыв правой почки; д) травматический разрыв слепой кишки.
4. Пациент госпитализирован через 4 дня после закрытой травмы живота. Жалобы: общая слабость, головокружение, потеря сознания за два часа до поступления, постоянные умеренные боли в животе (больше слева). Объективно:
состояние средней степени тяжести, вынужденное положение сидя, при попытке лечь возникает сильная боль в области левого надплечья, кожные покровы бледные, пульс 117 уд. в мин., слабого наполнения; передняя брюшная
стенка умеренно болезненна вдоль левого латерального канала и над лобком,
положительные перитонеальные симптомы. Перкуторно — притупление звука, аускультативно — ослабление перистальтики. Каков наиболее вероятный
диагноз? а) разрыв абдоминальной части аорты; б) забрюшинная гематома;
в) разрыв нисходящей ободочной кишки; г) двухмоментный разрыв селезенки;
д) тромбоз мезентериальных сосудов.
5. Пациент (40 лет) госпитализирован через 1 час после ДТП. Жалобы: острая
постоянная боль в области живота, жажда. Объективно: общее состояние тяжелое, язык сухой, кожа бледная, ЧСС 102 уд. в мин, АД 130/80 мм рт. ст.;
живот незначительно вздут, передняя брюшная стенка не участвует в акте
дыхания; при пальпации мышечное напряжение и положительный симптом
раздражения брюшины по всему животу; перкуторно — печеночная тупость
отсутствует; аускультативно — перистальтика ослаблена. Рентгенография живота — серповидные просветления под куполами диафрагмы. Какой наиболее
вероятный диагноз? а) внутрибрюшное кровотечение; б) забрюшинная гематома;
в) разрыв полого органа; г) разрыв мочевого пузыря; д) разрыв желчного пузыря.
6. Пациент (16 лет) был госпитализирован через 3 часа после получения тупой
травмы живота. Во время транспортировки трижды терял сознание. Объективно: тяжелое состояние, бледность кожных покровов, ЧСС 120 уд. в мин.,
ритмичный слабый пульс, АД 80/40 мм рт. ст.; брюшная стенка ограниченно участвует в дыхании, болезненна при пальпации во всех отделах, симптом
Щеткина — Блюмберга положительный; притупление перкуторного звука
вдоль обоих латеральных каналов; перистальтика ослаблена; дефекация и отхождение газов отсутствует. В ОАК: Эр-3,0х1012/л; Нb — 80 g/l; Нt — 22 г/л.
Какова вероятная причина патологии? а) забрюшинное кровотечение; б) вну-
Задачи по темам занятий
349
трибрюшное кровотечение; в) травматический оментит; г) разрыв полого органа; д) острая кишечная непроходимость.
7. Пациент был госпитализирован с жалобами на боли в животе (преимущественно в надлобковой области), тошноту, рвоту, отсутствие мочевыделения.
Из анамнеза — ударился нижней частью живота при наполненном мочевом
пузыре. Объективно — положительные симптомы раздражения брюшины.
Какое заболевание можно заподозрить? а) разрыв кишки; б) разрыв селезенки;
в) разрыв почки; г) травма мочеточника; д) экстраперитонеальный разрыв мочевого пузыря; е) интраперитонеальный разрыв мочевого пузыря.
8. Машиной скорой помощи в приемное отделение доставлен пациент с жалобами на боли в правой поясничной области и поясничной части позвоночника. 1 час назад упал с лестницы. Объективно: состояние тяжелое, ЧСС 120 уд.
в мин., АД 70-40 мм рт. ст., живот мягкий и болезненный, отмечается болезенность при пальпации остистого отростка XII грудного позвонка и правой
поясничной области, где определяется некоторая припухлость. ОАМ — 4-5 эр
в поле зрения. Какой вероятный диагноз? а) разрыв почки, перелом XII грудного
позвонка, травматический шок I степени; б) разрыв желудка, ушиб поясничных
мышц, краш-синдром; в) разрыв почки, перелом XII грудного позвонка, травматический шок II степени; г) разрыв мочеточника, сдавление поясничных мышц,
краш-синдром; д) разрыв pancreas, ушиб поясничных мышц, травматический
шок IV степени.
Тема №14.
1. В стационар доставлен пострадавший с ожогами пламенем. Обе верхние конечности циркулярно гиперемированы, покрыты пузырями с янтарного цвета жидкостью. Передняя поверхность туловища имеет «мраморный вид»,
раневая поверхность безболезненна. На правом бедре по всей поверхности
(циркулярно) отмечается обугливание эпидермиса, просвечиваются тромбированные вены. Как Вы сформулируете диагноз? Определив степень и площадь
поражения, как Вы запишите формулу ожога?
2. В палату интенсивной терапии из реанимации доставлен пострадавший в состоянии ожогового шока. Площадь поражения 50% поверхности тела, масса
тела больного 80 кг. Вы — палатный врач. Какие растворы для в/в инфузионной противошоковой терапии Вы назначите больному в первые сутки? С какой
скоростью будете вводить растворы?
3. В поликлинику обратился больной с жалобами на длительную незаживающую ожоговую рану тыла стопы. При опросе установлено, что два месяца назад он опрокинул на ногу сковородку с кипящим жиром. Лечился народными
средствами. Визуально на тыле правой стопы определяется гранулирующая
рана с остатками плотного некротического струпа черного цвета и умеренным
гнойным отделяемым. Какая степень ожога? Ваша лечебная тактика?
4. В приемное отделение больницы с места пожара доставлен пострадавший. Сознание помрачено. Лицо и кисти закопчены, нос и губы обожжены. Дыхание
350
Задачи по темам занятий
поверхностное, периодически отмечаются кашель, отхаркивание мокроты с
примесью гари. Ваш диагноз и действия?
5. Женщина кипятила белье. В воду добавила стиральный порошок и отбеливатель. При снятии емкости с плиты пострадавшая по неосторожности опрокинула ее на себя и получила ожоги. Передняя поверхность туловища предплечья и кисти гиперемированы, раневая поверхность белесоватая со сниженной
болевой чувствительностью. Определите степень и площадь ожога, сформулируйте диагноз. Какую первую помощь необходимо оказать?
6. Пострадавший на протяжении нескольких лет работал в котловане по строи
тельству водохранилища. Последнее время стала возникать ноющая боль в
ногах, жжение, чувство одеревенения. При осмотре стопы бледные, отечные,
холодные на ощупь. Отмечается потеря всех видов чувствительности. Имеются пузыри с геморрагическим содержимым. Высокая температура тела, тахикардия, общая слабость. Предположительный диагноз? Лечение.
7. Электромонтер на высоковольтной линии был поражен разрядом эл. тока высокого напряжения. Место выхода тока отмечалось в эпигастральной области.
Пострадавший был госпитализирован в ожоговый центр, где проводилось соответствующее лечение. Через 10 дней появилась резкая «кинжальная» боль
в животе, рвота. Пульс частый, напряжённый, язык сухой, как «щетка». Живот отстает в дыхании, при пальпации напряжен и болезненный в верхних
отделах, симптом Щеткина — Блюмберга положительный. Что произошло
в данном случае? Предварительный диагноз. Окончательный диагноз. Лечение.
ОТВЕТЫ НА ТЕСТОВЫЙ КОНТРОЛЬ
Тема №1.
1—в
2—д
3—а
4—в
5—г
6—в
7 — б, в, д
8—б
9—в
10 — б
11 — б, г
12 — а
13 — а, в
14 — г
15 — в, г
16 — б, д
17 — г
18 — г
19 — д
20 — в
21 — г
22 — д
23 — г
24 — г
4—в
5—в
6—а
7—в
8—г
9—г
10 — г
4—в
5—г
6—в
7—б
8—в
9—г
10 — а
4 — в, д
5—б
6 — а, в, е
7—б
8 — г, е
9 — б, в, д, е
10 — в
6—а
7—б
8—г
9—в
10 — д
11 — а
12 — б, г
13 — б, в, г, д
14 — а, в, г
15 — а, б, д
16 — б
17 — а, в, г
18 — а, б, в
19 — б, в, г, д
20 — б, г, д
6—а
7—б
8—г
9—в
10 — д
11 — а
12 — б, г
13 — б, в, г, д
14 — а, в, г
15 — а, б, д
16 — б
17 — а, б, в, г
18 — а, б,
19 — б, в, г, д
20 — б, г, д
6—а
7—г
8—г
9—а
10 — в
11 — д
12 — г
13 — г
14 — в
15 — г
16 — д
17 — б
18 — г
19 — д
20 — д
Тема №2.
1—в
2—д
3—г
Тема №3.
1—а
2—б
3—в
Тема №4.
1 — б, в, е
2—б
3 — в, д
Тема №5.
1—а
2—в
3—б
4—в
5—д
Тема №6.
1 — а, в, г
2 — а, б, в
3—б
4—в
5—д
Тема №7.
1—д
2—б
3—а
4—в
5—в
352
Ответы на тестовый контроль
Тема №8.
ОТВЕТЫ К ЗАДАЧАМ
1 — б, д, е
2—г
3—а
4 — в, г, е
5 — б, в, д, е
6—г
7—б
8—в
9—д
10 — а, в, г, е
11 — б, г, д
12 — б, в, д, е
13 — д
14 — а, в, д, е
15 — б, г, д
Тема №9.
1—д
2—б
3—г
4—г
5—б
6—в
7—б
8—г
9—г
10 — а
11 — б
12 — б
13 — в
14 — а
15 — а
16 — в
17 — в
18 — а
19 — а
20 — б
Тема №10.
2.
3.
4.
5.
6.
1—б
2—г
3—б
4—д
5—г
6—а
7 — а, в, г
8 — а, б, д
9 — а, б, в
10 — б, г, д
11 — а, б, г
12 — б
13 — в
14 — а
15 — а, б, в
Тема №11.
1—б
2—а
3—а
4—д
5—а
6—в
Тема №2.
1.
7—г
8—г
9—г
10 — а
11 — г
12 — в
13 — а
14 — б
15 — а
16 — г
17 — б
18 — в
19 — в
20 — г
21 — а
22 — д
6—в
7—а
8—б
9—в
10 — в
11 — г
12 — в
13 — г
14 — б
15 — а
16 — а
17 — в
18 — а
19 — в
20 — а
7.
Тема №3.
1.
2.
3.
4.
Тема №12.
1—а
2—г
3—в
4—а
5—г
Тема №13.
1—б
2—г
3—г
4—б
5—г
6—г
7—б
8—б
9—б
10 — д
11 — д
12 — а
13 — д
14 — в
15 — б
Тема №14.
В тексте тестов правильные ответы отмечены звездочкой.
16 — в
17 — в
18 — г
19 — д
20 — б
Химическую — края раны обработать первомуром, промыть рану антисептиками и положить антисептическую повязку.
Из класса окислителей — перекись водорода или раствор перманганата калия.
Показано УФО воспалительного очага, т. к. стрептококки чувствительны к ультрафиолетовой части спектра.
Следует применить активно-пассивную профилактику столбняка с введением противостолбнячной сыворотки в дозе 3000 МЕ по методу Безредка и столбнячного анатоксина в дозе 1 мл в/м в левое плечо.
ПХО не показана, следует ограничиться наложением асептической повязки и профилактикой столбняка.
Показана химическая антисептика — обработка раны раствором гидрокарбоната натрия с наложением асептической повязки и проведением антирабических мероприятий, если это необходимо.
ПХО показана с обязательным применением антисептической обработки раны.
5.
6.
7.
8.
9.
Необходимо применить химическую антисептику: края раны обработать раствором йодоната, промыть рану антисептическим раствором и наложить асептическую повязку.
После того, как был выпущен весь пар, белье необходимо оставить в паровом стерилизаторе на 20-25 мин. для того, чтобы оно высохло, а затем уже герметически закрыть
стерилизационные коробки и отнести в операционную. В данном случае необходима
повторная стерилизация белья.
Следует провести генеральную уборку и продезинфицировать воздух в операционной
с помощью бактерицидных ламп в течение 2-4 час.
Были допущены следующие ошибки: инструменты после мытья не замочили в моющем
растворе на 15 мин., стерилизация инструментария после использования при гнойных
процессах должна длится 60 мин. Необходима повторная предстерилизационная обработка и стерилизация инструментария.
При неполном вытеснении воздуха пар будет его обтекать, и эта зона не будет подвергаться действию высокой температуры, что приведет к нарушению режима стерилизации.
Различные виды крахмала переходят в декстраны и, следовательно, обесцвечиваются,
что указывает на достаточность обработки при гораздо более низких температурах,
которые не соответствуют режиму
Резина при кипячении в соде склеивается.
Бельем пользоваться нельзя, так как контроль стерилизации показывает, что сера не
прошла соответствующий режим стерилизации при необходимой температуре и, следовательно, белье в биксах не стерильно.
а) Продолжать ассистировать студент не мог; б) после операции у больного может развиться нагноение операционной раны; в) относится к контактному виду инфекции.
Тема № 4.
1.
У больного предположительно закрытая травма грудной клетки с внутриплевральным
кровотечением. Для уточнения диагноза необходима рентгенография грудной клетки,
плевральная пункция. При подтверждении диагноза проводят повторные пункции плевральной полости с введением антибиотиков, гемостатическая терапия, а при их неэффективности операция торакотомия для остановки кровотечения и восполнение кровопотери.
354
2.
3.
Ответы к задачам
Предположительно при ножевом ранении повреждена печень. Необходимо дополнительно сделать общий анализ крови, определить гематокрит, а если возможно, то и
ОЦК. Больной должен быть экстренно оперирован под прикрытием восполнения кровопотери.
У больного кровопотеря вызвала тяжелый геморрагический шок третьего уровня тяжести. Для восполнения кровопотери необходимо перелить трасфузионных сред 70%
от потерянной крови, т. е. 3400 мл, в том числе крови 70%, т. е. 2380 мл, а остальное
кровезаменители — 1020 мл, при этом соотношение солевых и коллоидных как 1:1
(510 и 510 мл).
Ответы к задачам
Тема №10.
1.
2.
3.
Нельзя, т. к. имеет место повреждение полого органа.
Нельзя, т. к. у больного ОНМК.
Это говорит о негодности стандартных сывороток.
1.
2.
3.
Нельзя, т. к. имеет место повреждение полого органа.
Нельзя, т. к. у больного ОНМК.
Это говорит о негодности стандартных сывороток.
Тема № 6.
2.
Тема № 7.
1.
2.
Произошел ларингоспазм. Необходимо снять маску, дать подышать больному воздухом, а затем снова начать наркоз, но увеличивать подачу эфира очень медленно, чтобы
больной приспособился к запаху эфира.
Необходимо за 2-3 часа до наркоза сделать очистительную клизму. Приготовить 3%
раствор авертина из расчета 0,1 г/кг и затем ввести катетер в прямую кишку на глубину
12-15 см. Раствор авертина ввести через катетер шприцем Жане или резиновой грушей.
Оставить больного в палате и через 30-40 минут на каталке подать в операционную.
3.
4.
Тема № 8.
1.
2.
3.
Лучше произвести поперечную циркулярную блокаду. С этой целью в каждый мышечный футляр (сгибатели, разгибатели, приводящие, отводящие мышцы) необходимо
ввести по 50-60 мл 0,25% раствора новокаина.
Кровь появилась в игле из-за того, что она попала в венозное сплетение позвоночного
канала, обычно при глубоком введении иглы Бира. Вводить анестетик нельзя, так как
он попадет в сосудистое русло. Необходимо извлечь иглу и сделать спинномозговую
пункцию на один позвонок выше.
При пункции эпидурального пространства была проколота твердая мозговая оболочка.
Дикаин введен в субарахноидальное пространство. Наступила эндолюмбальная анестезия. Больше вводить препарат нельзя, так как введение большого количества приведет
к распространению его и возможно воздействие на жизненно важные центры (сердечнососудистый, дыхательный). Операция будет выполнена под эндолюмбальной анестезией.
2.
У больного разрыв двуглавой мышцы плеча. Необходимо выполнить иммобилизацию верхней конечности с помощью шины Крамера или из подручных средств, местно применить
холод, доставить больного в хирургический стационар.
У больного частичный разрыв связок правого голеностопного сустава. Необходимо
выполнить иммобилизацию при помощи шины Крамера, либо при помощи подручных
средств, местно — холод, доставить больного в травматологический пункт.
Учитывая жалобы больной, анамнез, объективные данные, следует предположить
компрессионный перелом первого поясничного позвонка. Пострадавшей при возможности надо ввести обезболивающее и организовать доставку в ЛУ, уложив ее на спину
или живот. Если больная лежит лицом вниз, не следует поворачивать ее на спину, а
осторожно приподняв, уложить на мягкие носилки с подложенными под голову руками. Больную можно транспортировать на щите или носилках с твердым покрытием
в положении на спине, подложив под поясничный отдел позвоночника валик в целях
создания гиперлордоза.
У больного привычный вывих правого плеча. Необходимо немедленно вправить вывих,
на конечность наложить иммобилизирующую повязку сроком до 3 недель, рекомендовать массаж плечевого пояса справа и электропроцедуры (УВЧ, диатермию и др.). В подобных случаях лучше сразу после поступления больного ввести в места переломов 20-25
мл 2% раствора новокаина и выполнить скелетное вытяжение. Дело в том, что гипсовая
повязка при винтообразных переломах голени не предупреждает вторичного смещения
костных отломков.
Исходя из клинических данных, у мальчика закрытый травматический перелом левой ключицы. В целях оказания первой помощи необходимо ввести обезболивающее
средство и зафиксировать левую руку так, чтобы плечевой сустав, а значит, и отломки
ключицы стали неподвижными. Этого можно достигнуть наложением иммобилизирующих бинтовых повязок (Дезо, Вельпо и др.) или подвешиванием руки на косынке.
Для уточнения диагноза обязательно следует выполнить R-снимок ключицы. При переломах ключицы без смещения или при небольшом смещении можно ограничиться
наложением восьмиобразной повязки или колец Дельбе на 2-3 недели.
Тема №12.
1.
2.
3.
4.
Тема №9.
1.
Выполнить иссечение краев и стенок раны, не затрагивая сосудисто-нервный пучок,
удалить инородные тела и некротические ткани, ввести антибиотики.
Показана после выведения больного из шокового состояния.
Имеет место осложнение — стафилококковая инфекция.
Тема №11.
1.
Тема № 5.
1.
2.
3.
355
5.
6.
7.
Закрытая черепно-мозговая травма, сотрясение головного мозга. Больной обязательно должен быть осмотрен невропатологом. Показаны покой, седативные средства, дегидратационная терапия.
Открытая проникающая черепно-мозговая травма. Ушиб головного мозга легкой степени тяжести. Линейный перелом левой теменной кости. Ушибленно-рваная рана левой теменной области. Ликворея.
Закрытая черепно-мозговая травма. Сдавление головного мозга травматической внутричерепной гематомой.
Закрытая черепно-мозговая травма. Сдавление головного мозга травматической внутричерепной гематомой над левой гемисферой головного мозга. Показана экстренная
трепанация черепа, эвакуация гематомы, лигирование кровоточащего сосуда, дренирование полости гематомы.
Пункция правой плевральной полости в VII межреберье по задней подмышечной линии. При получении более 100 мл крови — дренирование полости по Бюлау.
Необходимо наложить окклюзионную повязку и госпитализировать больного в хирургический стационар.
Гемоторакс слева. Для подтверждения диагноза необходимо выполнить рентгенографию грудной клетки. Лечение — дренирование плевральной полости слева.
356
8.
9.
Ответы к задачам
У больного спонтанный пневмоторакс. Показана экстренная госпитализация пациента
в хирургическое отделение. При безуспешности пункционного метода лечения необходимо дренирование правой плевральной полости во II-м межреберье по средней подмышечной линии.
Тампонада сердца вследствие гемоперикарда. Показана торакотомия, перикардиотомия, эвакуация излившейся крови, остановка кровотечения.
Тема №13.
1 — a; 2 — г; 3 — в; 4 — г; 5 — в; 6 — б; 7 — е; 8 — в
Тема №14.
1.
2.
3.
4.
5.
6.
7.
Диагноз: ожоговая болезнь, период шока, термические ожоги пламенем верхних конечностей, передней поверхности туловища и правого бедра.
45% (27%)
Формула ожога S =------------------1-2-3А- 3б-4
В первые сутки противошоковой терапии пострадавшему необходимо перелить до
4 л коллоидных и кристаллоидных растворов. Расчет производится раздельно для коллоидных и кристаллоидных растворов. По формуле: 1 мл раствора х массу тела (кг) х
% ожога. В первые 8 часов вводится 50% суточной дозы (4 л) и в оставшееся время —
остальное количество (4 л).
У пострадавшего глубокий ожог правой стопы. Ему показаны иссечения остатков некротического струпа (некрэктомия) и аутодермопластика. Поэтому в поликлинике на
стопу надо наложить повязку с раствором антисептика и направить больного в хирургический стационар.
У больного термический ожог лица и кисти, ингаляционная травма (ожог дыхательных путей и токсическая дымовая ингаляция). После забора материала для общего
анализа крови и мочи, выполнения ЭКГ, рентгеновского исследования легких и осмотра терапевтом по экстренным показаниям больной должен быть госпитализирован в
отделение реанимации и интенсивной терапии.
Пострадавшему с ожогами необходимо ввести обезболивающее, наложить асептические повязки с раствором новокаина и организовать транспортировку в стационар.
Диагноз: ожоговая болезнь, шок, термические ожоги передней поверхности туловища,
предплечий и кистей.
(27%)
Формула: S =----------1-2-3А
У пострадавшего особый вид местной холодовой травмы — так называемая «траншейная стопа». Отмечаются признаки интоксикации: высокая температура, тахикардия,
слабость. Продолжить общее лечение — дезинтоксикационное и местное лечение. Отморожение 2 ст.
Ток прошел через брюшную стенку и поразил желудок с образованием коагуляционного некроза в области передней стенки, образовалась его перфорациия, перитонит.
Предположительный диагноз: перитонит. Окончательный диагноз: перфорация желудка. Лечение: экстренная операция — ушивание перфоративного отверстия желудка.
Дренирование брюшной полости.
СПИСОК РЕКОМЕНДОВАННОЙ ЛИТЕРАТУРЫ
Основная литература:
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
Волколаков Я.В. Общая хирургия. Рига, 1989. — 617 с.
Вовк Ю.Н., Ходырев В.Н. Учебное пособие по общей хирургии. Луганск, 2009. — 231 с.
Гостищев В.К. Общая хирургия. // М.: Медицина, 1993. — 575 с.
Грандо А.А. Врачебная этика и медицинская деонтология. // К.: «Вища школа»,
1988. — 192 с.
Гребенев А.Л., Шептулин А.А. Основы общего ухода за больными. // М.: Медицина,
1991. — 256 с.
Дмитрієв Б.І. Загальна хірургія. Вибрані лекції. Одеса, 1999.
Дронов А.Ф., Лелюшкин А.И., Кондратьева Л.М. Общий уход за детьми с хирургическими заболеваниями. // М.: Медицина, 1987. — 224 с.
Еренков В.А., Еренкова Н.В. Этика труда среднего медицинского работника. // К.:
Здоров’я, 1981. — 100 с.
Жученко С.П., Желіба М.Д., Хіміч С.Д. Загальна хірургія. Київ: «Здоров’я», 1999.
Заликина Л.С. Общий уход за больными. // М.: Медицина, 1984. — 223 с.
Касевич Н.Н. Практикум із сестринської справи. // Київ: Здоров’я — 2000. — 222 с.
Козицкий В.М., Корж Н.А. Десмургія. Київ, 1999.
Костина В.В., Меньков Н.В. Основы общего ухода за больными в терапевтической клинике. // Нижний Новгород: изд-во «Нижненовгородской государственной медицинской академии». — 1998. — 222 с.
Кузнецова В. Сестринское дело в хирургии // Ростов н/Д: «Феникс» — 2000. — 416 с.
Лупальцов В.И., Цыганенко А.Я., Лях А.В., Сенников И.А. Элементы общего ухода за
больными в хирургическом стационаре. // Харьков: Изд-во ХГМУ, 1999. — 230 с.
Ляпіс М.О. Методика обстеження хірургічного хворого. Тернопіль, 2000.
Петров Н.Н. Вопросы хирургической деонтологии // Л.: Медицина, 1957. — 64 с.
Петров С.В. Общая хирургия. // С-Пб.: «Лань», 1999. — 667 с.
Петров С.В. Общая хирургия. Санкт-Петербург, 2002. — 750 с.
Стерилизация и дезинфекция изделий медицинского назначения (методы, средства и
режимы). Отраслевой стандарт ОСТ 42-21-2-85. Приказ МЗ СССР № 770 от 10.VI.85 г.
Стручков В.И., Стручков Ю.В. Общая хирургия. // М.: Медицина, 1988. — 466 с.
Харди И. Врач, сестра, больной. // Будапешт, из-во Академии наук Венгрии, 1987. —
338 с.
Хирургические манипуляции (под ред. Б.О.Милькова, В.И.Круцяка). // К. «Вища школа», 1985. — 207 с.
Цитовская Л.В. Руководство к практическим занятиям по хирургии (Учебное пособие для учащихся медицинских училищ). // К.: Головное издательство объединения
«Вища школа», 1988. — 349 с.
Шабад А.Л. Учебное пособие по урологии с уходом за больными. // М.: Медицина,
1983. — 237 с.
Шевчук М.Г., Хохоля В.П. Хирургические манипуляции (пособие для фельдшеров и
медсестер). // К.: Здоров’я, 1987. — 132 с.
Юрихин А.П. Десмургия. Ленинград, 1986.
Дополнительная литература:
1.
2.
Архангельская-Левина М.С. Основные этапы ведения хирургических больных. // М.:
Медицина, 1964. — 227 с.
Бабалич А.К., Шестопалов Д.В., Петрова Т.А. Уход за больными в стационаре хирургического профиля. Симферополь: ИАО КГМУ, 2004. — 240 с.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
Бунятян А.А., Рябов Г.А., Маневич А.З. Анестезиология и реаниматология. // М.: Медицина, 1977. — 432 c.
Василенко В.Х., Гребенева А.Л. Пропедевтика внутренних болезней. // М.: Медицина,
1982. — 640 с.
Веденко Б.Г. Старшая медицинская сестра. // К. «Здоров’я», 1986. — 120 с.
Жизневский Я.А. Основы инфузионной терапии. Минск, 1994.
Iнструкцiя МЗ України з профiлактики внутрiшньолiкарняного та професiйного зараження ВIЛ-iнфекцiєю. // Київ, приказ № 120 вiд 25.05.2000 р.
Кабаков Б.Д., Руденко А.Т. Питание больных с травмой лица и челюстей и уход за
ними. // Л.: Медицина, 1977. — 135 с.
Краткая медицинская энциклопедия.(Отв. редактор А.Н. Шабанов) т. 1., М., Советская
энциклопедия, 1972. — 584 с.
Краткая медицинская энциклопедия.(Отв. редактор А.Н. Шабанов) т. 2., М., Советская
энциклопедия, 1973. — 600 с.
Краткая медицинская энциклопедия.(Отв. редактор А.Н. Шабанов) т. 3., М., Советская
энциклопедия, 1974. — 544 с.
Макаренко Т.П., Богданов А.В. Свищи желудочно-кишечного тракта. // М.: Медицина,
1986. — 244 с.
Мухин М.В. Послеоперационный период у челюстно-лицевых больных. // Л.: Медицина, 1977. — 140 с.
О мерах по снижению заболеваемости вирусными гепатитами в стране. Приказ МЗ
СССР № 408. — М., 1989.
Об организации и проведении санитарно-гигиенических мероприятий по профилактике внутрибольничных инфекций в лечебно-профилактических учреждениях (отделениях хирургического профиля, в палатах и отделениях реанимации и интенсивной
терапии. Приказ МЗ УССР от 31.07.78, № 720. — Киев, 1978.
Рычагов Г.П., Крумень В.Е. Ситуационные задачи и тестовые вопросы по общей хирургии: Учебное пособие. — Мн.: Выш. шк., 1998. — 461 с.
Санитарные правила устройства, оборудования и эксплуатации больниц, родильных домов и других лечебных стационаров. (Под руководством Главного санитарнопрофилактического Управления Минздрава СССР). М., 1991. — 43 с.
Cавчук Б.Д. Гнойный перитонит. // М.: Медицина, 1979. — 192 с.
Средства и методы стерилизации, применяемые в медицине.//М.: Медицина, 1973. —
96 с.
Сумин С.А. Неотложные состояния (5 издание). М., МИА, 2005.– 751 с.
Терновский С.Д. Хирургия детского возраста. // М.: Медгиз, 1959. — 496 c.
Шевченко Ю.Л., Жибурт Е.Б. Безопасное переливание крови. Санкт-Петербург, 2000
Beare P.G., Myers J.L. Principles and practice of Adult Health Nursing (Second edition) //
Moshy. St. Louis Baltimore Chicago London Madrid Philagelphia Sydney Toronto, 1994.
2202 p.
Elkin M.K., Perry A.G., Potter P.A. Nursing Interventions and Clinical Skills. Moshy. St.
Louis Baltimors Boston Carishad Chicago Napies New York Philadelphia Portland, London
Madrid Mexico City Singapore Sydney Tokyo Toronto Wiesbadtn, 1996. — 812 p.
Gostishev V. K. General surgery The manual. Moskow Geotar — Media, 2006. — 218 p.
Luckmann J., Sorensen K.C. Medical-Surgical Nursing — A Psychophysiologic Approach. //
W.B. Saunders Company (Philadelphia) London/Toronto, 1974. — 1380 p.
Nursing Procedures. Student version. (Advisory board: M.B. Dolan, W.R. Donovan,
E.A. McConell, S.A. McNulty, M. Reimer, M.K. Schlag). Springhouse Corporation. Springhouse, Pennsylvania. 1992. — 788 p.
Хаджиев
Оразгельды
Чарыевич
д.м.н., профессор.
Заведующий кафедрой общей
хирургии ЛГМУ
Имеет печатных работ — 150
Патентов Украины — 8
Монографий — 4
Ходырев
Владимир
Николаевич
к.м.н., доцент кафедры
общей хирургии ЛГМУ
Имеет печатных работ — 65
Патентов Украины — 5
Монографий — 3
Навчальне видання
Хаджиев О.Ч.,
Ходырев В.Н.
ПОСОБИЕ ПО ОБЩЕЙ ХИРУРГИИ
МОДУЛЬ 1
(російською мовою)
Комп’ютерна верстка: Г.О. Конкіна
Технічний редактор: А.Г. Ілюшин
Коректор: А.В. Севостьянова
Підписано до друку 27.08.2010
Формат 70х100/16. Папір офсет.
Друк офсетний. Ум.-друк. арк. 29,03.
Наклад 1000 прим.
Луганський державний медичний університет
91045, м. Луганськ, кв. 50-річчя Оборони Луганська, 1г