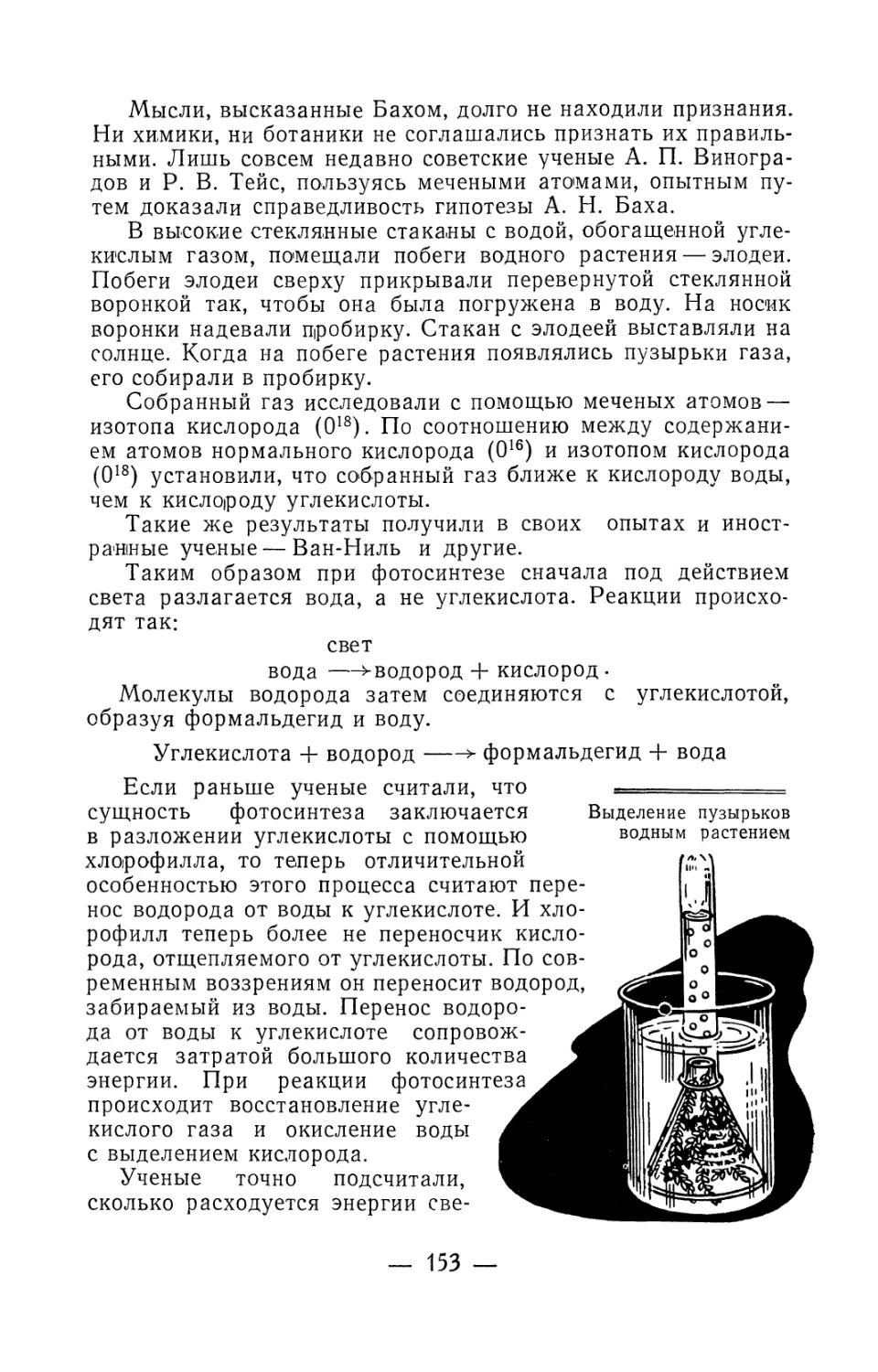
Текст
11 ! еловек познакомился с огнем и научился
ib||j его добывать в незапамятные времена,
но прошло м.ного тысячелетий прежде
чем была разгадана природа огня и понята сущность процес-
сов го-рения. Трудами выдающихся химиков восемнадцатого
века — Ломоносова и Лавуазье было доказано, что горение —
это соединение горящего вещества с кислородом, т. е. химиче-
ская реакция окисления.
Дальнейшие успехи науки показали, что реакции окисления
и восстановления лежат в основе почти безграничного круга
явлений, с которыми кроме обычного горения приходится нам
сталкиваться в окружающем нас мире.
Беспламенное горение и дыхание, тление и гниение, ржав-
ление и коррозии металлов неразрывно связаны с протеканием
окислительно-восстановительных реакций.
Эти же реакции служат причиной возникновения столь от-
личающихся друг от друга явлений, как самовозгорание угля
— 5 —
и торфа и высыхания масляных красок, скисания молока и
самосвечения гнилушек, взрывов и «старения» каучука.
Сотни видов разных растений, заполняющих поля и леса
нашей планеты, обязаны своим существованием этим реак-
циям.
Реакции окисления и восстановления являются источником
большей части энергии, используемой человеком в промыш-
ленности и на транспорте. Без использования этих реакций
немыслима успешная работа металлургических заводов и мно-
гих химических производств — пластических масс, удобрений,
моторного топлива, медикаментов.
В этой книге рассказывается, как ученые и естествоиспыта-
тели, инженеры и изобретатели в разных странах в течение
столетий шаг за шагом раскрывали загадки химии явного и
тайного огня.
В ней повествуется и о том, как люди, изучив реакции окис-
ления и восстановления, поставили их на службу промышлен-
ности, на службу прогрессу и созиданию лучшей счастливой
жизни.
GO Е I? © A SI
ПОКОРЕННАЯ
СТИХИЯ
а вершине высокого утеса лежит распро-
стертый титан. Он пригвожден к скале
стальным, несокрушимым острием, прон-
зающим его могучую грудь. Руки и ноги его опутаны железны-
ми цепями. Это Прометей. Жгут тело Прометея палящие лучи
солнца, проносятся над ним бури, хлещут его ливни. Зимой же
хлопья снега покрывают титана белым саваном, мороз леде-
нит его кровь. Но и этих мук мало. День за днем в один и тот
же час слышится шум крыльев могучей птицы. Большой орел
садится на грудь Прометея и острыми когтями терзает ее.
Орел рвет своим клювом печень титана, потоками льется
кровь, обагряя скалу. Закончив кровавую трапезу, орел улета-
ет. За ночь вновь вырастает печень, а утром опять прилетает
громадная птица и снова начинаются страдания Прометея.
Годы, века длятся эти невыносимые муки.
За что же так жестоко наказан был Зевсом Прометей? Мо-
гучий титан, вопреки воле всемогущего громовержца, похитил
огонь из кузницы бога Гефеста и дал его людям. Прометей
— 7 —
не только принес его на землю, но и
научил людей им пользоваться. Зевс
же хотел навеки спрятать огонь от че-
ловека.
В этом поэтическом мифе о мятеж-
ном титане, похитившем ради счастья
людей «небесный огонь», отражены взгляды древних греков
на происхождение огня.
Огонь рассеял мрак ночи, он согрел своим жаром человека
в стужу. Огонь обеспечил ему защиту против диких зверей, он
дал возможность готовить вкусную горячую пищу, из бесфор-
менных кусков глины изготовлять прочные обожженные кир-
пичи, из похожей на камень руды выплавлять блестящий
и звонкий металл.
Яркий блеск, свет, тепло — все это поражало воображение
человека и заставляло считать огонь небесным даром.
Греки были не одиноки, создавая миф о Прометее. У мно-
гих народов сохранились легенды, в которых герои приносят
людям огонь с неба.
У африканских племен, которые с давних времен обитают
в районе озера Виктория, сохранилось предание о воине, ко-
торый был особенно искусен в метании копья. Однажды он
так сильно метнул копье, что оно пронзило облако и, упав на
землю, принесло с собой кусочек солнца — частицу «солнеч-
ного огня».
В некоторых других районах Африки существует иная ле-
генда о появлении на земле огня. Люди в поисках огня —
рассказывается в ней — решили
добраться до солнца и принести
с него огонь. Они отправились
рано утром на запад и шли це-
лый день, пока наконец не на-
стигли заходящее солнце и не от-
кололи от него кусочек. Не всег-
да в сказаниях, легендах и
мифах, созданных многими наро-
дами в разных частях света, по-
хитителями небесного огня ока-
зываются титаны, герои или про-
стые смертные. Часто посредни-
ками в передаче людям огня
выступают птицы, животные, зве-
ри. По преданию, древний рим-
ский царь Нума Помпилий, по
наущению нимфы Эгерии, напоил
вином допьяна черного дятла
— 8 —
с красным пятном на голове (красная отметина была симво-
лом огня или молнии), чтобы разузнать у него, как достать
с неба огонь. У индейцев племени тлинкитов, живущих на
Аляске, рассказывают красивую легенду о вороне, принесшем
издалека в своем клюве тлеющую головню.
В большинстве сказаний и мифов происхождение огня свя-
зывается с небом, откуда падает молния и солнце посылает
свои горячие лучи. Но в некоторых легендах рассказывается,
что огонь был добыт из-под земли, из преисподней.
Такие сказания зарождались лишь в местностях, где были
вулканы. Огненный столб, вырывавшийся из жерла вулкана,
и раскаленные потоки лавы, сжигавшие все на своем пути,
устрашали людей и обращали их в стремительное бегство.
Как же в действительности люди познакомились с огнем
и научились пользоваться его благодатным жаром? Где и когда
загорелся первый костер по воле человека?
На тайну открытия человеком огня некоторый свет проли-
вают древние сказания и легенды.
Так, в мифе о Прометее говорится, что он будто бы похи-
тил огонь с острова Лемнос из вулкана. Более того, он будто
бы принес огонь в стебле растения, называемого вонючкой,
сердцевина которого и по сей день жителями некоторых сел
на Балканах употребляется в качестве трута для высекания
огня.
В сказаниях обитателей многих островов в Тихом океане
часто упоминается о собаке, принесшей своему хозяину голо-
вешку из огня лесного пожара, будто бы вспыхнувшего от
трения ветвей бамбука друг о друга. Жители острова Буру на
Малайском архипелаге утверждают, что у них в лесах имеет-
ся дерево кино, которое в очень засушливое лето самовозго-
рается от трения собственных ветвей.
Но чаще всего лесные пожары возникали из-за дерева,
зажженного молнией. Молнии, как огромные черные стрелы,
пронзали небо, покрытое черными мрачными тучами, приводя
в ужас людей в далекие времена. Сухое дерево, в которое уда-
ряла молния и зажигала его, часто горело очень долго, как
яркий факел, раздуваемый порывами ветра. Несомненно, что
такое горящее дерево должно было привлекать к себе живу-
щих в лесу людей. Они могли не только любоваться языками
яркого пламени, лижущего ствол и ветви дерева. Они могли
и поднимать падающие горящие куски дерева или сучья, пы-
1 Б. Я. Розен
— 9 —
стать горячая
местах, где
извержения
с их
сухой валеж-
всегда
таться поджигать
помощью
ник, которого
в лесу много. Так мог воз-
никнуть первоначальный
костер, вокруг которого
। люди могли греться.
А в тех
случались
вулканов, источником ог-
ня могла
лава. В первый момент
извержения, когда огнеды-
шащая гора выбрасывала
из своих недр огромный
jggig столб пламени и рас-
плавленная лава неудер-
жимыми потоками кати-
лась по склонам вулкана вниз, испепеляя все попадавшееся
ей на пути, никто не осмеливался взять от нее огня.
Но вот кончилось извержение, лава постепенно сверху за-
стывает, покрывается твердой коркой. Однако под ней все еще
чувствуется горячее дыхание. Теперь уже можно без страха
приблизиться к вулкану. И быть может тогда-то и нашелся
смельчак, зажегший головню от расплавленной лавы. Воз-
можно, что кто-нибудь подобрал горящий сук в объятом по-
жаром лесу, зажженном раскаленной лавой.
И вполне естественно, что люди, которые боялись огня, на-
блюдая его разрушительное действие в бушевавших иногда
неделями лесных пожарах, считали героями или полубогами
тех смельчаков, которые приносили им огонь и научили их им
пользоваться.
Хотя во всех легендах и сказаниях открытие огня связы-
вается с именем отважного героя, разгадавшего пользу огня,
или с мудрым животным, знавшим его благодетельные свой-
ства, тем не менее подлинная история открытия огня, каю
— 10 —
и раскрытия многих тайн природы связана с большим коллек-
тивом людей.
Несомненно, в основе всех достижений, которыми гордится
наша современная культура, лежит прежде всего повседнев-
ный труд. Только труд помог человеку выйти победителем
в борьбе со стихиями, покорить силы природы, подчинить
себе огонь.
При раскопках стоянок древнейшего человека — синантро-
па были найдены груды золы. Позднее, у неандертальцев на-
ходят уже кучи древесного и костного угля, вырытые в земле
очаги.
В каменном веке значительно увеличивается число очагов,
совершенствуется их устройство, появляются ямы-печи, камен-
ные светильники.
Хотя археологам и не удалось до сих пор найти при рас-
копках поселений каменного века никаких остатков древней-
ших приспособлений для добывания огня, вероятно, основой
его получения служило трение.
Люди каменного века умели хорошо тесать и сверлить де-
рево, долбить и обтачивать камень. Доказательством тому
служат находимые при раскопках кремневые проколки, рез-
цы и долотца разных размеров, костяные и роговые Шилья.
При высверливании каменных молотков или кремневых
пластинок часто выскакивали огненные искры. В пещере или
стойбище, где жили люди, всегда могли быть сухой мох, су-
хая трава. Они могли легко вспыхнуть от попавшей искры.
Заметив пламя, человек не испугался, а воспользовался не-
ожиданным появлением огня и сохранил его.
Заметив, что при сверлении дерева или камня можно полу-
чить искру, человек в дальнейшем уже сознательно пользовал-
ся этим способом для добывания огня. Он был известен
разным народам во всех частях света и широко распростра-
нен в Азии и Африке, Америке и Австралии. Добывание огня
с помощью сверления знакомо и европейцам. Брали две па-
лочки сухого дерева. В одной из них было небольшое углубле-
ние. Палочку с ямкой (иногда ее заменяли маленькой дощеч-
кой) клали на землю. Вторую палочку вставляли в углубле-
ние, крепко сжимали ладонями рук и быстро вращали, все
время прижимая ее. Спустя некоторое время в результате
быстрого вращения в ямке деревянной палочки появляются
дымящиеся опилки. Их высыпали на трут и раздували
в пламя.
Некоторые племена добывали огонь, пользуясь не «сверле-
нием», а «выпиливанием». «Огневая пила» была широко рас-
пространена в Австралии, в Новой Гвинее, на Филиппинских
1*
— 11 —
островах, в Индонезии. Известен был этот способ добывания
огня многим жителям Индии и Западной Африки.
Из куска бамбукового дерева вырезали пластинку, похо-
жую на нож с лезвием. Она служила «пилой», которой пилили
или, вернее, скоблили деревянную дощечку поперек волокна.
От трения соскобленные частицы дерева начинали тлеть.
Иногда вместо деревянной «пилы» пользовались для «пиле-
ния» гибким растительным шнуром.
В районах, богатых бамбуком, чаще всего дощечкой слу-
жил кусок расщепленного на двое ствола бамбука. Древесина
его богата кремнеземом, очень тверда и потому быстрёе на-
гревается от трения.
На фреске одного из залов Исторического музея в Москве
изображена бытовая картинка из жизни человека каменного
века. Она принадлежит кисти знаменитого русского художни-
ка Васнецова. На ней мы видим одного из наших далеких
предков, прижимающего к земле тонкое поленце, и с помощью
заостренной палочки, вставленной в бороздку, добывающего
огонь. Такой способ добывания огня называют «выскаблива-
нием» или «выпахиванием», потому что палочка движется по
желобку полена подобно плугу по борозде поля.
Важную роль в истории добывания огня человеком сыгра-
ли, кроме дерева, камень и железо.
У многих племен и народов огонь высекали с помощью
кремня и металла. Иногда железо заменялось железной ру-
дой, преимущественно серным колчеданом или пиритом. При
раскопках древних могильников в Европе нередко находили
небольшие куски пирита в виде шариков, размером с китай-
ское яблочко.
Эскимосы, айны, некоторые племена северо-американских
индейцев, жители Огненной земли получали искры, ударяя
куском кремня о кусок серного колчедана. Недаром эскимосы
называют пирит «огненным камнем». Искра, полученная вы-
секанием, падала на трут, который воспламенялся. Такой спо-
соб добывания огня был хорошо известен древним грекам
и римлянам.
С развитием техники у разных народов появляются желез-
ные огнива \ в которых искра высекается ударом кремня о же-
лезо или сталь. Подобные приспособления для добывания
огня до изобретения спичек имели широкое распространение
в ряде стран Азии и Европы.
1 Среди европейских курильщиков были в ходу небольшие мешочки,
в которых находились стальное огниво, чаще в форме дужки или пряжки,
маленький кубик или овальный шарик из кремня, трут, щипчики и тонкое
шило для чистки трубки.
— 12 —
Появление спичек, позволившее значительно проще и бы-
стрее добывать огонь, вытеснило огниво из обихода европей-
ских и азиатских народов.
Способ высекания огня с помощью камня и металла, со-
хранившийся лишь кое-где в Австралии, да у некоторых ма-
лайских племен, неожиданно возродился и в Европе лет три-
дцать назад в бензиновых зажигалках.
Изучая способы добывания огня у разных народов, ученые
долгое время не могли прийти к единому мнению, какой же из
способов следует считать древнейшим. Одни считали, что лю-
ди раньше всего научились добывать огонь трением кусков
дерева, другие полагали, что древнейшим способом следует
признать высекание искры из кремня.
В качестве доказательства того, что высекание огня стало
известно человечеству позже, чем добывание его посредством
трения, приводится распространенный у многих народов и
в позднейшие эпохи обычай получать «священный огонь» для
религиозных целей с помощью «огневого сверла».
Такой, добытый трением огонь, называемый в Германии,
Шотландии, Англии «диким», применялся в некоторых селени-
ях при эпидемиях и падеже скота. Темные, невежественные
крестьяне думали, что он обладает чудотворной силой. В Рос-
сии такой огонь в разных местностях называли по-разному —
«живым», «новым», «летним». По рассказам очевидцев, обряд
добывания «живого» огня в
— 13 —
старину сопровождался «опахиванием» селения, а иногда
и пропусканием всех жителей и скота сквозь земляные ворота.
Однако, добывание «дикого» или «священного» огня у раз-
ных народов с помощью сверления или «выпиливания» дере-
ва, как показали новые исследования советских ученых, не
может служить убедительным доказательством появления
способа получения искры трением раньше, чем высеканием.
Советский этнограф М. С. Андреев почти тридцать лет сво-
ей жизни посвятил сбору сведений о народных способах добы-
чи огня в Иране и в Средней Азии. Оказалось, что там повсе-
местно умели высекать огонь двумя камнями.
Недавние исследования другого советского ученого-архео-
лога, профессора Б. Ф. Поршнева, также подтверждают
мнение, что высекание огня является, по-видимому, древней-
шим способом его добывания.
Все народы и племена умели пользоваться огнем, но неко-
торые из них не добывали огня, а, получив его однажды, ка-
ким-то способом, бережно хранили и тщательно поддерживали.
Ученые и путешественники встречали в разных частях
света такие племена, в жилищах которых всегда горел неуга-
симый огонь. Если пламя замирало, то ему не давали совсем
потухнуть, подкладывая в очаг сухие листья, хворост, сучья.
Об обычае постоянного поддержания огня сообщают люди,
побывавшие в прошлом веке на многих островах Меланезии
и Полинезии в Тихом океане, в некоторых областях Восточ-
ной Африки и Австралии.
Как-то жарким тропическим утром в сентябре 1870 г.
в залив Астролябии на северо-восточном берегу острова Но-
вой Гвинеи вошло русское военное судно «Витязь». С ко-
рабля сошел на берег известный путешественник Н. Н. Миклу-
хо-Маклай. Почти четыре года прожил он здесь среди дикой
пышной природы, изучая быт и нравы папуасов.
Папуасы в то время жили еще в каменном веке. Они не
знали ни железа, ни меди, ни золота. Различные орудия и
предметы обихода выделывали из камня, кости, дерева. Па-
пуасы умели обрабатывать землю, имели домашних живот-
ных— собак и свиней, занимались рыбной ловлей и охотой.
Посещая селения папуасов, Миклухо-Маклай знакомился
с обычаями жителей, убранством их жилищ, изучал язык.
Однажды он пришел к своему другу папуасу Тую, кото-
рый был болен. Туй, желая отблагодарить Маклая за визит,
— 14 —
захотел угостить его вареным таро. Он послал своего сына за
огнем к соседям, но огня у них не было. Не оказалось его и
в других домах деревни. Ничего — сказал Туй — скоро все вер-
нутся домой с плантации и принесут огонь.
Это навело Маклая на мысль, что папуасы не добывают
огня, а хранят его и переносят с места на место.
Он еще больше укрепился в своем мнении, когда как-то
к нему пришли в гости жители из разных деревень. Все они при-
несли с собой головешки или горящие связки тростника, ко-
торые сложили в один костер.
Папуасы брали зажженные сучья или головни с собой на
рыбную ловлю и на плантации, в лес, где они возделывали
ямс, бататы и другие съедобные растения. Они носили огонь
в путешествиях по суше и по морю, при экскурсиях в сосед-
ние селения. Огонь у папуасов никогда не потухал, а если по-
тухал, то его всегда зажигали снова, заняв у соседей.
Возможно, что папуасы Берега Маклая и умели добывать
огонь, однако никогда не пользовались известными им спосо-
бами получения огня, предпочитая сохранять однажды уже
полученный огонь.
У многих первобытных племен огонь почитался, как свя-
тыня. Его хранили, как зеницу ока. У кочевых народов при
перемене кочевья раскаленные угли перевозили в специаль-
ных корзинках. Почитание огня было распространено и у более
культурных народов — древних гре-
ков, римлян, средневековых германцев,
славян.
Греческий историк
сказывает, что в вой-
сках царей Спар-
ты была учрежде-
на должность спе-
циального огненос-
ца, который обязан
был тщательно хра-
нить огонь в течение
всего
кому
огонь,
брать
носца.
В
похода. Тот,
нужен был
должен был
его у огне-
жертвенниках
греческих
день и ночь
угасимый
ный огонь.
Ксенофонт рас-
храмов
горел не-
священ-
В Риме
— 15 —
в храме богини Весты постоянно поддерживался «вечный
огонь». Наблюдать за ним и поддерживать его было поручено
весталкам, девушкам из лучших семей и наиболее знатных фа-
милий. Их предавали смертной казни, если пламя гасло. Огонь
в храме Весты, раз в год— 1 марта — вновь зажигали жрецы,
добывая его высверливанием дерева.
Неугасимое пламя священного огня пылало и в храмах
древнего Перу. Перуанские жрецы делали золотые вогнутые
зеркала и, собирая с их помощью в фокусе солнечные лучи,
зажигали священный огонь в жертвеннике храма.
Чаще всего огонь добывали таким путем в присутствии
толпы прихожан. Зрелище «нисходящего с неба огня» произ-
водило неизгладимое впечатление на невежественных и негра-
мотных молящихся и помогало укреплять авторитет жрецов.
Подобное «чудо» устраивали и египетские жрецы, зажи-
гавшие жертвенное пламя с помощью длинного металлическо-
го шеста, которым они ловили молнию.
Первобытные люди сталкивались с грозными силами при-
роды, считали их за разумные, живые существа. Огонь, разру-
шающий и созидающий, огонь, друг и враг человека, казался
древним людям могущественным божеством.
С развитием религиозных представлений у многих народов
в сонме различных божеств появляются и боги огня. У древ-
них индусов — Агни, у египтян — Попа, у греков — Гефест,
у римлян — Вулкан, у скандинавских народов — Локи,
в Мексике — Кенотекутли.
Они, как и другие боги в древних религиозных культах,
окружаются поклонением. Им молятся, приносят жертвы, их
считают всемогущими и благодетельными. В культе всех
времен и народов был распространен обычай бросать в огонь
жертвенника куски мяса, лить в него масло, вино.
Еще лет восемьдесят назад неподалеку от Баку возле се-
ления Сураханы можно было увидеть необыкновенное камен-
ное здание. В центре небольшого дворика высилась квадрат-
ная башня с четырьмя колоннами. В верхушках колонн были
укреплены светильники. Днем и ночью, зимой и летом, в яр-
кую солнечную погоду и в дождь в них пылали языки пламени.
Плотной каменной стеной окружали двор низенькие четы-
рехугольные строения. Это были анфилады небольших комна-
ток-келий, двери которых открывались все во двор к башне
с вечными огнями.
Много сотен лет назад появились на Апшеронском полу-
острове эти здания. Построили их огнепоклонники. В течение
веков сюда приходили пешком, приезжали на лошадях
и верблюдах паломники из соседней Персии и далекой Индии,
чтобы молиться перед неугасимыми светильниками.
— 16 —
У многих племен и народов огонь считался благотворной
стихией, обладающей могущественной очистительной силой,
предохраняющей от злых духов.
Священный религиозный характер огня кое-где связыва-
ли с молнией или солнцем.
Летний или зимний солнцеповорот отмечали праздниками.
При праздновании зажигали костры, бегали вокруг них или
прыгали через пламя. В России в царское время в ночь на
Ивана-Купалу (7 июля) молодежь прыгала через костры,
а в Германии подобные празднества раньше устраивали также
на рождество, масляницу, пасху. Огонь почитали, как «сына»
или «дочь» солнца, олицетворяющего его на Земле.
Еще в далекой древности у многих племен и народов на-
ряду с религиозным культом огня появился «семейный» культ
огня. Неугасимый огонь в очаге становится символом един-
ства семьи.
Широко распространенное почитание огня и религиозный
культ огня у разных племен и народов свидетельствуют
о неизмеримо важной роли, которую сыграла эта грозная и бла-
годетельная стихия в жизни человеческого общества на про-
тяжении тысячелетий, на его тернистом и в то же время свет-
лом пути к прогрессу.
?аава □wosaa
ТАЙНЫ ЯВНОГО
ОГНЯ
^^^^жизний8дЬвекд7
МГй 31 0К0Рение огня человеком — первая круп-
\1 1 Л ная победа над силами природы. Откры-
тие огня, овладение различными спосо-
бами его добывания — важнейший шаг на пути «очеловечи-
вания» наших далеких предков.
Вся история появления и развития материальной культу-
ры йа протяжении тысячелетий неразрывно связана с огнем.
Освоение огня дало толчок к развитию важнейших отраслей
древней техники—гончарного дела и металлургии. Огонь по-
мог неизвестному древнему гончару превратить кусок пла-
стичной глины в первый глиняный горшок, он дал возмож-
ность спустя века создать русскому технику Ползунову пер-
вую паровую машину.
Паровая машина позволила поставить на службу челове-
честву энергию пара, что способствовало бурному развитию
производительных сил в последующем столетии. Она послу-
жила толчком к промышленной революции. С помощью огня
стало возможным заменить энергию воды и ветра, заставить
— 18 —
вертеться колеса локомотивов, вращаться гребные винты па-
роходов, работать станки и машины.
Но что такое огонь? Какова его природа?
Вопрос этот задавали себе не раз люди каменного века,
жители античной Греции и средневековой Европы. Он в оди-
наковой степени волновал умы мыслителей в древнем Египте,
Китае, Индии и европейских и американских ученых в более
поздние эпохи.
Путь познания природы огня человеком извилист и сло-
жен, противоречив и запутан. Некоторый свет на историю
развития представлений об огне на протяжении тысячелетий
проливают рисунки на стенах пещер, в которых некогда
обитали первобытные люди, древние легенды и народные ска-
зания, глиняные и каменные «книги», страницы старинных
рукописей.
Первые попытки объяснить природу огня делались уже
в глубокой древности. Их можно обнаружить в пожелтевших
от времени китайских манускриптах, в полуистлевших индий-
ских старинных свитках.
Обстоятельные суждения об огне и его роли в мире мы на-
ходим уже в творениях древнегреческих философов. Антич-
ная Греция — колыбель европейской науки — дала миру вы-
дающихся мыслителей, заложивших основы стихийного мате-
риализма.
Выдающийся философ древности Гераклит из Эфеса был
одним из первых ученых, кто рассматривал создание и суще-
ствование мира без участия сверхъестественных сил.
Мир казался ему вечным, неугасимым огнем. «Мир, еди-
ный из всего, не создан никем из богов и никем из людей,
а был, есть и будет вечно живым огнем»,— говорил он.
Огонь, по мнению Гераклита, основа всех явлений в при-
роде, первоначало всего сущего. Круговорот явлений в при-
роде, изменения, которые непрерывно происходят в окружаю-
щем нас мире — все это тесно связано с изменением огня.
Он считал, что «все обменивается на огонь и огонь на все,
подобно тому как на золото — товары и на товары — золото».
По представлениям Гераклита огонь «сгущался» в воздух,
воздух в свою очередь превращался в воду, вода — в землю,
а из земли снова появлялся огонь.
Существует легенда, что Гераклит проводил опыты с за-
жигательными стеклами, стремясь доказать возможность
— 19 —
превращения воздуха
в огонь. Исходя из мысли
о «рождении» огня из воз-
духа, он считал небесные
светила — солнце и звез-
ды— огромными линзами,
которые воспламеняют
воздух.
Современник Геракли-
та известный в древней
Греции мыслитель Эмпе-
докл видел в огне лишь
один из четырех «кор-
ней» или элементов
(огонь, воздух, вода, зем-
ля), из которых состоит
все существующее. По
его мнению из них состо-
ят камни и растения, жи-
вотные и человек; раз-
нообразие предметов в
окружающем нас мире зависит от неодинакового содержания
в них этих элементов. Эмпедокл считал, что в крови присут-
ствуют все четыре элемента в равных пропорциях, а в костях
наполовину содержится огонь, на одну четверть земля и на
одну четверть вода.
Огонь, как одно из четырех первоначал, слагающих все
тела в мире, неизменно фигурирует в учениях греческих фи-
лософов более позднего времени — Платона и его ученика Ари-
стотеля.
Платон, следуя в своем учении за Эмпедоклом, вкладыва-
ет в понятие о четырех элементах другое содержание. Он ис-
ходит из мысли, что природа стремится создавать все пре-
красное. Развивая свои взгляды на строение мира на основе
подобной концепции, Платон отводит огню весьма важ-
ную роль.
Огонь и земля — вот основа основ, по мнению Платона,
а вода и воздух лишь связующие звенья между землей и ог-
нем. В то же время Платон считает, что элементы могут
превращаться друг в друга.
Платон, допуская превращения элементов друг в друга,
связывал это, по-видимому, с тремя различными состояния-
ми вещества: твердым, жидким и газообразным.
Развивая взгляды своего учителя Платона, выдающийся
древнегреческий естествоиспытатель Аристотель вкладывал
в учение о четырех элементах иное содержание.
— 20 —
У Аристотеля огонь,
воздух, вода и земля—так-
же основные формы ма-
терии, которые способны
превращаться друг в дру-
га. Они также входят в со-
став различных тел в раз-
ных пропорциях и сообща-
ют им те или иные свой-
ства. Например, огонь
у Аристотеля — это нечто
такое, что содержится во
всех горючих телах — де-
реве, угле, масле, что при-
дает им способность го-
реть. Когда же подобное
вещество горит, то огонь,
выделяется из него в фор-
ме пламени, которое мо-
жет быть неодинаковым
в различных случаях и при
разных обстоятельствах.
По иному природу огня
кий древнегреческий мыслитель — отец атомистики Демокрит.
Каждое вещество состоит из мельчайших, твердых, непрони-
цаемых и неделимых частиц — атомов.
Самыми маленькими и самыми гладкими атомами Демо-
крит считал частицы огня. Они, как и все другие атомы, нахо-
дятся в бесконечном движении. Соединяясь, частицы огня
образуют пламя. Когда же они рассеиваются среди других
атомов живого или мертвого тела, они нагревают его.
По мнению Демокрита, атомы огня составляют «душу»
людей и животных. Но «душа» по его учению отнюдь не обла-
дает какими-либо сверхъестественными качествами, она так
же материальна, как и тело. Она лишь построена из атомов
другой формы и другого размера.
Ни Демокрит, ни его ученики не могли опытным путем
доказать свои атомистические представления, этого не позво-
лял уровень тогдашней науки и техники.
Учение древних философов-атомистов о строении вещест-
ва и природе огня было надолго забыто. В основу объясне-
ния стихий природы и окружающего мира легло учение Ари-
стотеля, отрицавшего существование атомов. Оно позволяло
идеалистически толковать все явления, с которыми сталкивал-
ся человек. Учение Аристотеля было позднее освящено цер-
ковью и поддерживалось светскими властями в разных стра-
— 21 —
нах, так как в своем учении Аристотель выступал в защиту
рабства.
Многовековое господство этого учения в науке и слепое
поклонение авторитету Аристотеля мешало развитию пра-
вильных взглядов на природу огня и надолго задержало про-
явление иных мнений, подкрепленных убедительными
опытами.
Началом активной борьбы против старых воззрений в нау-
ке становится семнадцатый век. Он знаменуется дальнейшим
расширением опытных исследований природы, все большим
накоплением практических знаний.
Учение Аристотеля о четырех элементах-первоначалах,
все больше сдает свои позиции, так как все больше появляет-
ся опытных данных, которые вступали с ними в проти-
воречие.
По-иному был поставлен и вопрос о природе огня.
В 1661 г. вышел в свет научный труд выдающегося англий-
ского химика Роберта Бойля «Скептический химик».
Талантливый автор «Скептического химика» резко и
остроумно критиковал схоластические воззрения Аристотеля.
«Вряд ли можно отрицать,— писал Бойль,— что большая
часть сложных веществ состоит более, чем из трех или четы-
рех элементов». Строение сложных веществ Бойль сравнивал
со словами, которые состоят из нескольких букв. По его мне-
нию, элементы — это «некоторые первоначальные или простые
тела, иначе говоря, не смешанные, которые не будучи в со-
стоянии образоваться ни из других тел, ни друг из друга, яв-
ляются составными частями, из которых непосредственно
слагаются или на которые в конечном счете разлагаются тела,
совершенным образом смешанные».
Критикуя древние учения о первоначалах и вводя новое
понятие элемента, Роберт Бойль неправильно объясняет при-
роду огня, как поток каких-то материальных частиц или, ско-
рее, движение корпускул, образующих весомое тело.
К этому выводу он приходит на основе своих интересных
опытов по изменению веса металлов при нагревании.
Почему металл увеличивается в весе, если его нагреть до
высокой температуры, и превращается в темную, серую мас-
су— окалину? Теперь на этот вопрос ответит любой школь-
ник. Потому что,— скажет он,— металл при сильном нагре-
вании легко окисляется — соединяется с кислородом воздуха.
— 22 —
Но в те времена на этот вопрос не могли правильно отве-
тить и самые выдающиеся ученые.
Для того чтобы понять почему увеличивается вес металла,
когда он становится окалиной, химики в течение двух столе-
тий повторяли много раз один и тот же опыт.
Кусок свинца или олова клали в тигель или реторту и на-
гревали на огне.
В 1673 г. такой опыт произвел и Роберт Бойль.
В небольшую стеклянную реторту он положил кусочек
•свинца и, чтобы в реторту не мог проникнуть воздух извне,
шейку ее запаял.
Затем ученый взвесил реторту и поставил ее на огонь. Спу-
стя два часа Бойль прекратил нагревание, дал реторте остыть.
Остывшую реторту Бойль вскрыл, поставил на весы и
взвесил. Оказалось, что она весила больше, чем до опыта.
Когда Бойль вскрывал реторту, в нее со свистом проник на-
ружный воздух. Это явление ученый истолковал только как
доказательство того, что реторта была хорошо запаяна.
Но что же могло увеличить вес металла, поскольку ретор-
та была тщательно запаяна? — думал Бойль. По-видимому,.
решил ученый, сквозь стенки реторты проникает «огненная
материя». Она соединяется с металлом, и образуется ока-
лина.
Может показаться странным, что столь искусный экспе-
риментатор, каким был Бойль, мог допустить такую грубую-
ошибку в толковании процесса обжига металлов. По-видимо-
му, роковую роль сыграли здесь убежденность Бойля в весо-
мости огня и невнимание к тому, что воздух врывался со сви-
стом при вскрытии реторты после нагрева. Ведь, если бы
Бойль внимательно проанализировал это явление, он несом-
ненно дал бы ему правильное объяснение. От него не усколь-
знуло бы тогда, что воздух врывался в реторту потому,
что в ней при прокаливании металла менялось давление
воздуха.
Бойль был не первым ученым в XVII в., кто пытался ис-
толковать явления, наблюдаемые при обжиге металлов. Поч-
ти за сорок пять лет до опытов Бойля по прокаливанию ме-
таллов в запаянных ретортах в свет вышла книга француз-
ского врача и химика Жана Рея «Очерки отыскания причины,
от которой олово и свинец увеличиваются в весе, когда их
обжигают».
Взгляды, высказываемые Жаном Реем в своей книге, на-
ходятся в резком противоречии с тогдашними философскими
воззрениями па огонь и процессы горения.
По мнению Рея, металлы при прокаливании увеличивают-
ся в весе потому, что воздух в сосуде загустел и стал тяже-
— 23 —
лее. Этот воздух становится к тому же некоторым образом
липким, смешивается с окалиной и пристает к ее мельчайшим
частицам.
Такое объяснение, неправильное с точки зрения современ-
ных взглядов, было несомненно прогрессивным в то время.
Увеличение веса металлов при обжиге Жан Рей рассматрива-
ет, как два разных явления. Он полагает, что сначала обра-
зуется окалина, за счет воздействия какой-то невесомой суб-
станции, а затем к окалине присоединяется воздух, который,
как вещество весомое, придает окалине добавочный вес.
Жан Рей был не одинок в своих догадках об участии
воздуха в процессах горения. Подобного взгляда держался и
знаменитый английский физик Роберт Гук. В 1655 г. в печати
появилось его замечательное сочинение «Микрография», по-
священное изображению и описанию разнообразных тел, рас-
сматриваемых под микроскопом. В этой же работе приводи-
лась характеристика состава воздуха и была сделана попыт-
ка объяснить участие воздуха при горении.
Гук рассматривал воздух как своеобразный раствори-
тель различных горючих субстанций. Но не весь воздух цели-
ком, а лишь какая-то определенная часть его может обла-
дать подобными свойствами. Эту часть он отождествляет
с газом, образующимся при нагревании селитры.
Гук считал также, что в селитре гораздо больше содер-
жится этой субстанции, чем в воздухе. Потому, говорил он,
для поддержания горения больших количеств горючих мате-
риалов достаточно малых количеств селитры, тогда как воз-
духа нужно гораздо больше.
Близким к Гуку по взглядам на процессы горения был
его соотечественник врач Джон Мэйоу.
В 1674 г. в Оксфорде было опубликовано его сочинение
«Пять физико-медицинских трактатов». Подобно Гуку, он
полагал, что в воздухе содержится «некоторая универсальная
субстанция», которая входит и в состав селитры. Он на-
зывал ее «живительный воздух» или «селитрянно-огненный
воздух».
«Селитрянно-огненный воздух», по мнению Мэйоу, содер-
жится не только в обыкновенном воздухе, в селитре, но и
в азотной кислоте, которую можно получить из селитры. Он
провел много остроумных и точных опытов, которыми и до-
казал свои утверждения.
Поскольку поддерживающее огонь активное начало воз-
духа исчезает при горении, а остающаяся часть не поддержи-
вает горения, Мэйоу делает очень важный вывод: воздух, ко-
торый со времен Аристотеля считался элементом, на самом
деле представляет собой сложное тело.
— 24 —
Мэйоу даже предпринимает попытку сделать анализ возду-
ха и количественно определить содержание активной и неак-
тивной частей.
При взаимодействии с «селитрянно-огненным воздухом»
сурьма и железо дают при обжиге окалину, а при соприкос-
новении с водой— ржавчину. Те же явления, по мнению
Мэйоу, лежат в основе образования серной кислоты из серы.
Мэйоу впервые обнаруживает сходство между горением и
дыханием. Он утверждает, что одна и та же материя поддер-
живает горение и дыхание в легких животных и человека.
Блестящими опытами Мэйоу доказывает это утверждение.
Под стеклянный колпак, отделенный водой от окружаю-
щей атмосферы, он ставит зажженную свечу. Спустя некото-
рое время свеча тухнет, а воздух под колоколом резко меняет
свои свойства. Горючие тела в нем больше не горят, живот-
ные не могут дышать и погибают.
Чтобы еще больше убедиться в правильности своей гипо-
тезы, Мэйоу ставит и другой опыт. Под колокол помещались
одновременно зажженная свеча и мышонок. Через некоторый
промежуток времени потухла свеча и вскоре издохла мышь.
Оказалось, что свеча во втором опыте потухла почти вдвое
быстрее, чем в первом опыте.
Следовательно, рассуждает ученый, воздух, из которого
исчезла его активная часть, непригоден ни для горения, ни
для дыхания.
Считая «селитрянно-огненный воздух» необходимым на-
чалом для процессов горения и дыхания, Мэйоу в своих вы-
водах идет еще дальше. Опережая взгляды своих современ-
ников более чем на сто лет, он с необыкновенной проница-
тельностью высказывает мнение, что превращение вина в ук-
сус и скисание пива относятся к тем же процессам, что
и образование ржавчины или превращение серы в серную
кислоту.
Несомненно, из всех ученых той эпохи, Мэйоу ближе всех
подошел к разгадке тайны горения, к объяснению истинной
его причины. Однако столь ценные и передовые для того вре-
мени мысли о процессе горения оставались надолго в забве-
нии. Прошло почти столетие, прежде чем о нем вспомнили.
Не для всех современников Мэйоу его работа осталась
незамеченной. Некоторые видные ученые, как, например, Ро-
берт Бойль, встретили ее весьма скептически. Они считали
опыты молодого ученого мало доказательными. Теоретиче-
ские взгляды, развиваемые Мэйоу, они считали туманными
и сумбурными.
Но, по-видимому, пренебрежительное отношение к работе
Джона Мэйоу имело и другую подоплеку. В это время уже
— 25 —
начала развиваться теория флогистона, которая пыталась
объяснить процессы горения с других позиций, более близких
к владевшим еще тогда умами ученых,— учению Аристотеля
и воззрениям алхимиков. Взгляды же Мэйоу находились
в резком противоречии с обветшалыми схоластическими
взглядами древних и средневековых ученых.
В середине XVII в. немецкий ученый Бехер высказал
мысль, что при горении из горящего тела удаляется какая-то
его составная часть. Ее он назвал «горючей» или жирной
землей. Эта земля является носителем горючести.
Развивая идеи Бехера, его соотечественник, врач Шталь,
около 1700 г. создал стройную теорию горения, получившую
в науке название теории флогистона. Он говорил, что все
вещества, которые могут гореть,— уголь, дерево — состоят из
особой «невесомой материи» — флогистона (от греческого
слова флогистос — гореть) и золы. Когда дерево или уголь го-
рят, пламя их как бы пожирает, унося с собой большую часть
вещества, из которого они состоят. После сгорания остается
лишь горсть золы, а флогистон улетучивается. Точно так же,
когда металл прокаливается на огне, то флогистон исчезает,
и остается «зола» — окалина.
Окалину можно снова превратить в металл, если нагре-
вать ее с веществом, в котором содержится много флогистона.
Таким веществом считался уголь. При накаливании с окали-
ной он отдает часть своего флогистона и сам убывает в ве-
се,— говорил Шталь.
Теперь, когда мы достоверно знаем сущность процессов
горения, такие объяснения кажутся не только фантастиче-
скими, но даже просто нелепыми. В те же времена теория
флогистона являлась прогрессивной и позволила дать, хотя и
неправильное, но четкое и ясное объяснение многим химиче-
ским явлениям.
Вот потому-то теория флогистона быстро распространи-
лась среди европейских ученых и более ста лет являлась
господствующей в науке.
Блестящий успех теории флогистона может быть объяснен
еще одним обстоятельством. Шталь сделал два чрезвычай-
но важных для понимания процессов горения обобщения.
Даже научный противник Шталя, выдающийся француз-
ский (ученый Лавуазье, разгадавший тайны горения, давал
весьма высокую и лестную оценку заслугам Шталя.
— 26 —
«Мы обязаны Шталю,— писал он,— двумя важными от-
крытиями, которые останутся вечными истинами: во-первых,
что металлы являются телами горючими, что кальцинация
(т. е. обжиг) есть настоящее горение. Второе открытие, кото-
рым мы также обязаны Шталю и которое является еще более
важным, заключается в том, что способность гореть, быть
воспламеняемым, может передаваться от одного тела к дру-
гому. Если, например, смешать горючий уголь с негорючей
купоросной (серной) кислотой, то последняя превращается
в серу и приобретает способность гореть, которую в то же
время теряет уголь».
Будучи несомненным шагом вперед для своего времени,
теория флогистона находилась в плену некоторых старых
воззрений. В ней еще сохранялись пережитки схоластических
учений древности, и в первую очередь, учения Аристотеля.
Шталь не считает огонь определенным веществом. Это
лишь скопление каких-то маленьких телец, которые непрерыв-
но находятся в сильном вихревом движении. Флогистон мо-
/кет, по мнению Шталя, в определенных случаях принимать
форму огня. Однако для этого необходимо наличие некой
материальной среды, в которой флогистон мог бы раство-
риться.
Какое же вещество могло бы быть таким растворителем?
Это воздух,— говорит Шталь, которому было хорошо извест-
но, что воздух поддерживает горение. Но подобно тому, как
в воде может раствориться лишь определенное количество
той или иной соли, в воздухе растворяется также только ка-
кое-то максимальное количество флогистона. Потому, делает
заключение Шталь, свеча, внесенная под небольшой стеклян-
ный колпак, быстро тухнет.
Казалось, что наконеп-то найдена окончательная разгад-
ка природы огня и процесса горения. Однако чуть ли не
с первых дней появления теории флогистона возникли проти-
воречия.
По мнению Шталя и его последователей, которых называ-
ли флогистиками, при обжиге металл должен уменьшаться
в весе, так как улетучивается флогистон. На самом же деле,
образующаяся при накаливании металла окалина весит боль-
ше, чем обжигаемый металл.
Для того чтобы разрешить это недоумение, флогистики
придумали такое объяснение.
Флогистон,— говорили они,— является невесомой матери-
ей, он обладает отрицательным весом, всегда стремится квер-
ху. Входя в состав металла, флогистон как бы уменьшает его
истинный вес, делает его легче. Когда же под действием вы-
сокой температуры флогистон улетучивается, а металл ста-
— 27 —
Михаил Васильевич Ломоносов
(1711—1765 гг.)
Флогистики толковали это
новится окалиной, то она
приобретает свой подлин-
ный вес, который больше
веса чистого металла.
В подтверждение пра-
вильности такого объясне-
ния, некоторые флогистики
приводили результаты одно-
го, неправильно истолко-
ванного опыта.
К коромыслу чашечных
весов вместо одной чашки
подвесили стеклянный шар,
на другую чашку положили
гири и уравновесили шар.
Затем под шар подстави-
ли зажженную свечу и ста-
ли его подогревать. Когда
шар нагрелся, равновесие
нарушилось, и он поднялся
кверху.
явление так: при нагревании
шара в него «вселяется» флогистон, который находится в со-
ставе пламени. Поскольку же он имеет отрицательный вес,
то он и облегчает шар. На самом деле шар поднимается вверх
не потому, что теряет в весе, а вследствие того, что омывает-
ся потоками теплого воздуха, нагреваемого свечой.
С течением времени все больше накапливалось опытных
фактов, росло число возражений против теории Шталя. Из-
под ног флогистиков все больше уходила почва. Серьезный
удар по теории флогистона нанесли опыты великого русского
ученого Михаила Васильевича Ломоносова.
Все выдающиеся естествоиспытатели и химики неизменно
пытались в прошлом разгадать тайну процессов горения и
дать им то или иное объяснение. Не мог пройти мимо этой
волнующей проблемы и М. В. Ло1моносов. Объяснения фло-
гистиков и сторонников Бойля он считал вздорными. По его
мнению, незачем было привлекать для разгадки тайны горе-
ния «невесомые материи».
— 28 —
и
Опыт с весами, стеклянным шаром
и зажженной свечой
Уже в 1748 г. Ломоносов в письме к свое-
му другу, талантливому математику Леонар-
ду Эйлеру, писал: «Нет никакого
сомнения, что частички воздуха,
непрерывно текущего над обжига-
емым телом, соединяются с ним
увеличивают его вес».
В том же году Академией
наук была одобрена к печа-
ти диссертация Ломоносова
«Размышления о причине
тепла и холода». В ней вы-
сказываются сомнения в пра-
вильности точки зрения Бой-
ля об увеличении веса ме-
талла при прокаливании за
счет присоединения «материи
огня».
Развивая эту мысль, Ломоносов указывает, что окалина,
восстановленная в металл, теряет приобретенный вес. По-
скольку как восстановление, так и прокаливание произ-
водятся посредством огня, нет никаких оснований счи-
тать, что один и тот же огонь то проникает в тела, то из
них уходит.
В своих рассуждениях Ломоносов опирается и на опыты
немецкого химика Г. Бургаве, который прокаливал железо и
не нашел никакого увеличения веса после остывания раска-
ленного металла.
Из результатов своих опытов Бургаве сделал ряд важных
выводов в отношении процесса горения. Прежде всего он
считал, что огонь не входит в состав обжигаемого тела, не
делает его ни легче, ни тяжелее.
Возможно, что на высказывания Ломоносова повлияли и
опыты французского химика Дюкло, который, наблюдая уве-
личение веса минералов при прокаливании, приписал эго
серным частичкам и воздуху. Он полагал, что эти частички
непрерывно обтекают минералы при обжиге и проникают
в них при разложении на огне.
Спустя восемь лет после того, как высказывания Ломоно-
сова были опубликованы, он поставил в своей лаборатории
опыты по проверке выдвинутых им представлений о процессе
горения. Он хотел проверить «прибывает ли вес металлов от
чистого жару».
Прежде всего он решил повторить опыт Бойля. Прочитав
в сочинении английского ученого описание опыта, Ломоно-
сов положил кусок свинца в реторту, запаял ее отверстие и
взвесил. Затем он поставил реторту на горящие угли и, когда
— 29 —
весь свинец превратился в окалину, не вскрывая реторты, сно-
ва взвесил ее.
Как он и предполагал раньше, вес реторты не изменился,
он оставался таким, каким был до прокаливания. Никаких
признаков испарившегося флогистона, разумеется, заметить
не удалось. Точно так же никакая «огненная материя» не со-
единялась с металлом.
«Оными опытами нашлось,— писал Ломоносов тогда в ла-
бораторном журнале,— что славного Роберта Бойля мнение
ложно, ибо без пропущения внешнего воздуха вес сожженно-
го металла остается в одной мере».
Когда Бойль вскрывал реторту, то воздух врывался в нее
со свистом. Это свидетельствует о том, что при нагревании
в реторте воздуха стало меньше. Вес же окалины по сравне-
нию с первоначальным весом металла увеличился, в то же
время общий вес реторты, воздуха и металла не изменился.
Значит, сколько убыло воздуха,— рассуждал Ломоно-
сов,— столько же прибыло окалины. Одно уменьшалось, дру-
гое увеличивалось. Следовательно, привес металла при про-
каливании обусловлен соединением его с воздухом, а не с «ог-
ненной материей».
Эти опыты не только блестяще подтвердили правильность
высказанного им еще в 1748 г. взгляда на существо процес-
сов горения, они явились убедительным доказательством
сформулированного им закона сохранения материи и дви-
жения.
«Все перемены в натуре случающиеся такого суть состоя-
ния, что сколько чего у одного тела отнимется, столько
присовокупится к другому. Так, ежели где убудет несколько
материи, то умножится в другом месте», гласила формули-
ровка этого важного закона, который стал могучим орудием
познания природы.
Опыты Ломоносова, расшатывая позиции флогистиков, за-
кладывали одновременно основы новой теории горения, кото-
рая пришла на смену теории флогистона. Завершить разгром
теории флогистона суждено было великому французскому
химику Антуану Лорану Лавуазье.
Париж — прекрасный город. Со всех концов земли стека-
ются в него тысячи чужестранцев, чтобы полюбоваться его
красотами. Гигантским факелом пылает среди ночи Эйфелева
башня, морем электрических огней залиты все улицы.
— 30 —
Но не таков был Париж
двести лет назад. Город осве-
щался сальными свечами, ко-
торые горели в развешанных
кое-где фонарях. Их зажигали
фонарщики с наступлением
темноты, но уже через час,
другой свечи оплывали, заду-
вались порывами ветра. И бли-
же к ночи Париж погру-
жался в полный мрак, кото-
рый изредка прорезывали от-
блески свечей из окон или на-
рушал бледный свет луны.
В 1763 г. в Париже появил-
ся новый начальник полиции,
генерал-лейтенант де-Сартин.
Он энергично взялся за наве-
дение порядка в городе. Преж-
де всего ОН решил улучшить Антуан Лоран Лавуазье
освещение в Париже. Он обра- (1743—1794 гг.)
тился в Парижскую Академию
наук с просьбой объявить конкурс на «Наилучший способ
ночного освещения улиц большого города, совмещающий
в себе яркость света, удобство обращения и экономичность».
На премирование лучшего предложения полиция ассигновала
две тысячи ливров, по тем временам весьма крупную сумму.
В конкурсе приняло участие большое число фабрикантов
и изобретателей, среди участников конкурса был двадцати-
двухлетний Антуан Лоран Лавуазье, представивший Акаде-
мии наук объемистый труд под девизом «И он путь свой от-
метит огнями».
Академия наук высоко оценила научный труд молодого
ученого и 9 апреля 1765 г. вручила ему на торжественном
заседании золотую медаль.
Так начался славный путь выдающегося французского
химика XVIII в.
Лавуазье ставит задачу проследить роль воздуха в про-
цессах горения, брожения и других реакциях, в самых раз-
личных комбинациях и вариантах.
20 октября 1772 г. Лавуазье представляет в Парижскую
Академию наук свое небольшое исследование о горении
фосфора.
В начале сентября того же года фармацевт-химик Миту-
ар, приехавший из Германии, продал Лавуазье унцию фос-
фора. Лавуазье отломил кусочек фосфора и бросил его
— 31 —
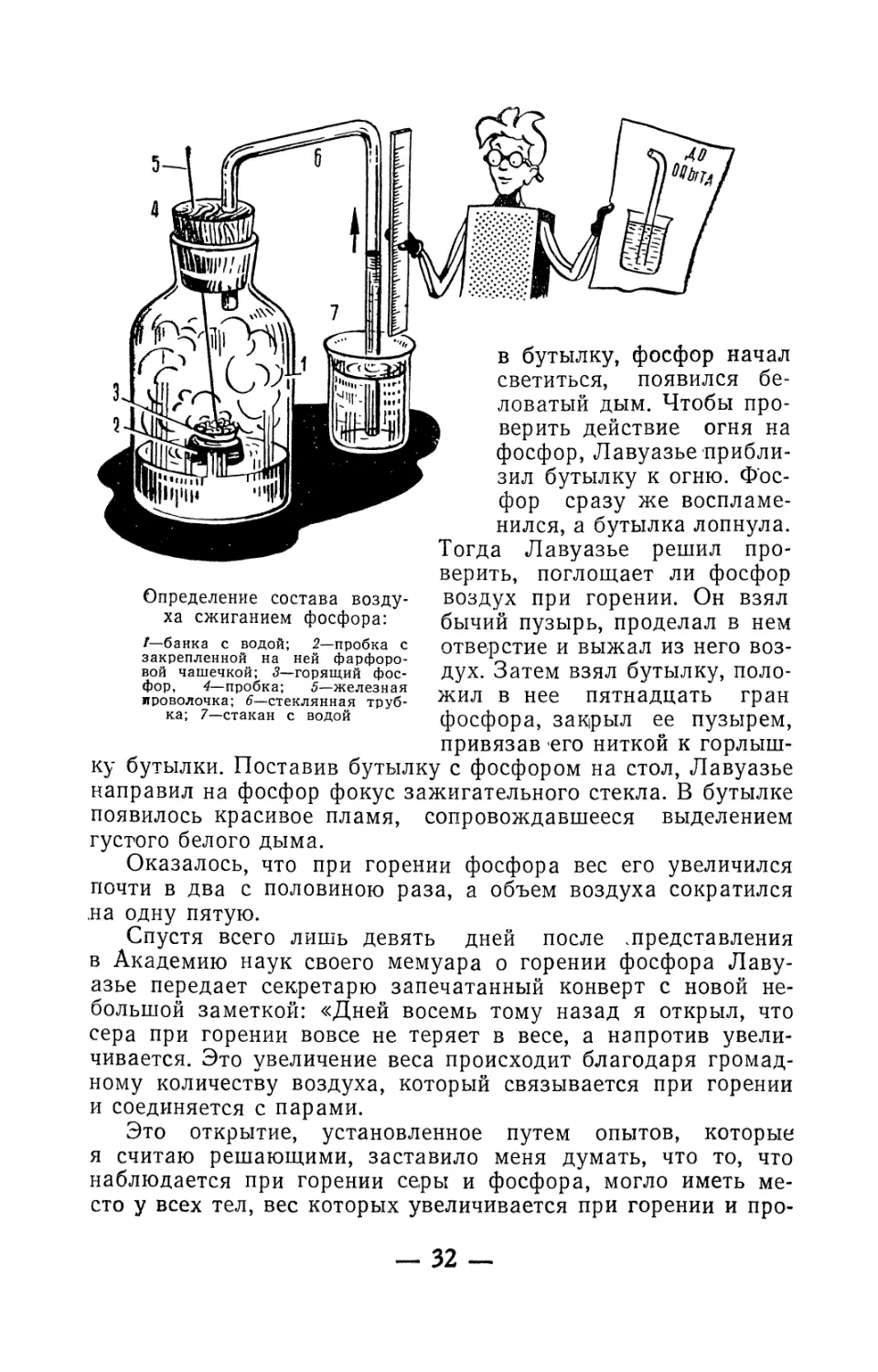
Определение состава возду-
ха сжиганием фосфора:
Г—банка с водой; 2—пробка с
закрепленной на ней фарфоро-
вой чашечкой; 3—горящий фос-
фор, 4—пробка; 5—железная
проволочка; 6—стеклянная труб-
ка; 7—стакан с водой
ку
в бутылку, фосфор начал
светиться, появился бе-
ловатый дым. Чтобы про-
верить действие огня на
фосфор, Лавуазье прибли-
зил бутылку к огню. Фос-
фор сразу же воспламе-
нился, а бутылка лопнула.
Тогда Лавуазье решил про-
верить, поглощает ли фосфор
воздух при горении. Он взял
бычий пузырь, проделал в нем
отверстие и выжал из него воз-
дух. Затем взял бутылку, поло-
жил в нее пятнадцать гран
фосфора, закрыл ее пузырем,
привязав его ниткой к горлыш-
бутылки. Поставив бутылку с фосфором на стол, Лавуазье
направил на фосфор фокус зажигательного стекла. В бутылке
появилось красивое пламя, сопровождавшееся выделением
густого белого дыма.
Оказалось, что при горении фосфора вес его увеличился
почти в два с половиною раза, а объем воздуха сократился
на одну пятую.
Спустя всего лишь девять дней после .представления
в Академию наук своего мемуара о горении фосфора Лаву-
азье передает секретарю запечатанный конверт с новой не-
большой заметкой: «Дней восемь тому назад я открыл, что
сера при горении вовсе не теряет в весе, а напротив увели-
чивается. Это увеличение веса происходит благодаря громад-
ному количеству воздуха, который связывается при горении
и соединяется с парами.
Это открытие, установленное путем опытов, которые
я считаю решающими, заставило меня думать, что то, что
наблюдается при горении серы и фосфора, могло иметь ме-
сто у всех тел, вес которых увеличивается при горении и про-
— 32 —
наливании; и я убедился, что увеличение веса металлов, при
превращении их в металлические земли, происходит от той
же причины».
В 1774 г., спустя два года после написания этих строк,
Лавуазье ставит опыты по обжигу олова и свинца в запаян-
ных сосудах. Он наблюдает увеличение веса за счет воздуха
и этими опытами опровергает мнение Бойля об «огненной ма-
терии», будто бы проникающей через стенки реторты.
Для еще большего доказательства правильности своих
взглядов на природу горения Лавуазье проводит опыты на-
каливания окислов металлов с углем и обнаруживает выде-
ление пузырьков газа, который он считает «воздухом» (это
был углекислый газ).
В то время воздух рассматривался учеными как эле-
мент, и Лавуазье еще пользуется в своих опытах этой терми-
нологией. Но уже через несколько месяцев он приходит к вы-
воду о сложном составе воздуха.
Что же представляет из себя та часть воздуха, которая
способна связываться с металлами и другими телами при го-
рении, которая необходима для дыхания животных и расте-
ний? Чем опа отличается от остальной массы воздуха?
Ответ на эти вопросы раньше всех пришел из Швеции и
Англии.
Первые смутные представления о сложном составе возду-
ха и его роли в процессе горения мы находим в трудах ки-
тайских ученых. Китайский философ Мао-Хоа, живший в
VIII в. нашей эры, высказывал мысль, что все вещества
в окружающем нас мире состоят из двух начал. Одно из них,
называемое «янг» — более сильное, преобладающее, дру-
гое— «ин» более слабое, имеет подчиненное значение. Чем
больше в веществе «янга», тем* оно лучше, совершеннее.
Воздух можно сделать более совершенным, если увели-
чить в нем количество «янга» и уменьшить количество «ина».
Для этого достаточно нагревать в нем металлы, уголь, серу.
«Ин» же никогда не удается получить в чистом виде, однако
образование его наблюдается при прокаливании некоторых
каменистых пород.
Расшифровать название веществ, которые имел в виду ки-
тайский ученый, до сих пор не удалось. Нужно думать, чго
это была селитра, которая при нагревании разлагается с вы-
делением кислорода. Селитру же в Китае знали давно, так
как там был изобретен порох.
4 Б. я. Розен
— 33 —
В Европе первая догадка о сложном составе воздуха
была высказана лишь спустя семьсот лет, в эпоху Возрож-
дения, великим итальянским художником, талантливым инже-
нером и ученым Леонардо да Винчи.
Он также считал, что воздух состоит из двух составных
начал и при горении и дыхании расходуется лишь частично.
Леонардо да Винчи совсем близко подошел к разгадке про-
цессов горения и истинной роли в них воздуха, но эти замеча-
тельные мысли не нашли тогда дальнейшего развития. Потре-
бовалось еще более двухсот лет, чтобы, наконец процесс го-
рения получил бы окончательное и правильное объяснение.
В августе 1774 г. английский священник и философ Джо-
зеф Пристли, который наряду с занятиями по философии,
увлекался естественными науками, как и большинство то-
гдашних философов, получил впервые кислород.
Он поместил немного красной окиси ртути под стеклянной
банкой над столбом металлической ртути. Затем взял зажи-
гательное стекло и направил через него пучок солнечных лу-
чей. Когда лучи солнца нагрели окись ртути, из нее стал
выделяться газ, который вытеснил ртуть из банки.
Пристли еще не называет этот газ кислородом. Вначале
он думал, что это просто воздух. И он записывает в своем
лабораторном журнале:
«Я принялся изучать этот воздух. И меня удивило, даже
взволновало до самой глубины моей души, что в этом воздухе
свеча горит лучше и светлее, чем в обычной атмосфере».
Еще более удивило его то, что мышь, посаженная под
стеклянный колокол, где находился открытый им «воздух»,
жила гораздо дольше, чем под колпаком с обыкновенным
воздухом.
Вначале Пристли полагал, что полученный им «воздух»
содержит какую-то примесь азотистого вещества. Он думал
так потому, что окись ртути была приготовлена им из азотно-
кислой ртути. Но в конце концов, выделив кислород из сури-
ка, селитры и других веществ и убедившись, что для превра-
щения закиси азота в окись его «воздуха» требуется в 4—
5 раз меньше, чем обыкновенного, Пристли окончательно при-
шел к выводу, что полученный им газ представляет собой
чистое вещество.
Как и многие его современники, Пристли находился в
плену флогистонных воззрений. Поэтому найденный им кис-
лород он назвал «дефлогистированным воздухом».
Хотя Пристли и не смог правильно назвать открытое им
вещество, он понял важное значение сделанного им открытия.
Он тщательно изучает свойства кислорода, находит его удель-
ный вес (который оказался выше, чем у воздуха и азота),
— 34 —
рекомендует пользовать-
ся им в медицине для
вдыхания, в металлургии
для получения очень вы-
соких температур.
Почти одновременно с
Пристли, кислород был
получен шведским хими-
ком Шееле. Правда, он
шел другим путем, чем
Пристли. Шееле выделил
кислород путем нагрева-
ния азотнокислой магнезии
разложением углекислого
серебра, прокаливанием
селитры. Шееле назвал
кислород «огненным воз-
духом». Он также был
сторонником теории фло-
гистона и потому не мог
дать правильное название
Джозеф Пристли
(1733—1804 гг.)
открытому им газу.
Полную ясность в эту
запутанную проблему суж-
дено было внести Лавуазье. В октябре 1774 г. Пристли прибыл
в Париж, где встретился с Лавуазье и некоторыми другими
выдающимися физиками и рассказал им о поразительных
свойствах «дефлогистированного воздуха».
Лавуазье вскоре повторил опыты Пристли по нагреванию
ртути и количественно измерил продукты реакции.
В отличие от Шееле и Пристли, Лавуазье правильно понял
сущность открытия кислорода.
Для Пристли воздух представлялся однородным вещест-
вом. Он считал, что атмосферный воздух лишь «загрязнен»
флогистоном», т. е. огненной материей, а полученный им «де-
флогистированный воздух» очищен от флогистона.
И для Шееле «огненный воздух» казался лишь атмосфер-
ным воздухом, освобожденным от примесей.
Лавуазье же совершенно ясно представлял себе, что воз-
дух состоит из двух различных газов.
5 сентября 1777 г. в докладе, представленном Академии
наук, Лавуазье сказал: «Отныне дефлогистированный воз-
дух, или удобовдыхаемый воздух в состоянии соединения
или фиксации я буду обозначать именем кислотообразующего
начала, или, если это же обозначение греческим словом
нравится более, я назову его началом оксиген».
4*
— 35 —
Так родилось название кислород1.
В 1777—1778 гг. Лавуазье опубликовал свои работы о ды-
хании животных, о природе кислот, о горении. В них выясня-
лась химическая сущность горения и окисления и роль в них
кислорода.
По мнению Лавуазье, горение сопровождается выделе-
нием тепла и света. Оно происходит только в «чистом» или
«дефлогистированном» воздухе (т. е. кислороде). Горючие
вещества не могут гореть ни в пустоте, ни в любом другом
виде воздуха (т. е. газе), кроме «чистого» воздуха. Во время
горения «чистый» воздух разлагается на составные части,
а сожженное вещество увеличивается в весе как раз настолько,
насколько исчезло «чистого» воздуха.
При сгорании тело превращается в кислоту, например
сера — в серную, фосфор — в фосфорную, «углеобразные» те-
ла — в меловую кислоту (т. е. углекислоту). Металлы же
при обжиге образуют особые вещества—«металлические из-
вести».
Такое толкование опытов было грубейшей ошибкой вели-
кого французского ученого. Ведь далеко не все кислоты со-
держат в своем составе кислород. Например, его нет ни
в синильной, ни в соляной кислоте. Теория кислот, созданная
Лавуазье, просуществовала недолго. В начале XIX в. фран-
цузский химик Гей-Люссак и английский химик Деви нанесли
ей окончательный удар. Они показали полную ее несостоя-
тельность. От нее осталось в наследство название — кислород.
Кислородная же теория горения Лавуазье пережила
своего творца. Она стала основой современных взглядов на
горение. Эта теория не только принесла разгадку природы
огня, она послужила толчком к применению кислорода в тех-
нике— для ускорения плавки металлов, создания горелок
с очень горячим пламенем.
Новая теория горения довершила разгром воззрений фло-
гистиков. Она прочно вошла в наш обиход.
1 По гречески: окси — кислота, ген — рождаю.
?айэа третья
НАСЛЕДНИКИ
СОЛНЕЧНОЙ
ЭНЕРГИИ
II • Bl еловек, познакомившись в незапамятные
времена с огнем, научился с его помо-
щью готовить себе разнообразную горя-
чую пищу, печь хлеб, обогревать свои жилища. С течением
времени огонь стал «слугой» человека не только в быту, но
и в различных отраслях промышленности. Огонь принес людям
тепло, он принес им и свет. Горящая ветка или головня перво-
бытного костра была и первым источником света.
Заметив, что смолистая ветка горит лучшей дольше, люди
стали специально обмазывать один конец ветви смолой. По-
явился более усовершенствованный источник света — факел.
Позднее смолу помещали ibi углубление, сделанное в верхней
части деревянной палки, которая служила рукоятью факела.
Такими факелами освещались еще в середине века многие
города в Западной Европе. Факел стал родоначальником дру-
гих, более совершенных светильников: масляных ламп, свечей.
Эти источники света в отличие от факела имеют фитиль.
- 37 -
Светильник с фитилем еще был далек от совершенства,
сильно коптил, давал слабое пламя, часто угасал. Но это уже
был лучший источник света по сравнению с факелом и изо-
бретательская мысль в последующие столетия продолжала
его совершенствовать.
Вначале масло наливали в глиняную плошку, фитиль опу-
скали в масло и поджигали верхний его конец, лежавший на
краю плошки. Позднее стали делать закрытые глиняные
плошки с носиком, похожие на чайник. Фитиль пропускали
через носик такого «чайника».
Факел превратился в масляную лампу. В течение многих
сотен лет она исправно служила людям. Ее можно было
•встретить во дворцах царей и вельмож, в залах театров и
библиотек, в лавках и магазинах. На протяжении веков она
считалась лучшим источником света.
В конце XV в. знаменитый итальянский ученый и худож-
ник Леонардо да Винчи изобрел приспособление к масляной
лампе, прообраз лампового стекла. Оно уменьшило копоть,
повысило яркость пламени. Это была небольшая жестяная
трубка, которая помещалась над пламенем масляной лампы.
Прикрывая верхнюю часть пламени трубка создавала луч-
шую тягу, увеличивала приток воздуха к пламени.
Изобретение Леонардо да Винчи не получило значитель-
ного распространения. Потребовалось почти три столетия,
чтобы избавить масляную лампу от копоти и сделать ее пла-
мя ровным и еще более ярким. Во второй половине XVIII в.
появилось ламповое стекло, которое полностью вытеснило
жестяную трубку и стало применяться во всех странах.
Из факела «родился» и другой источник света, которому
суждено было сыграть большую роль в истории освещения —
свеча.
Но ни сальные, ни восковые, ни даже самые лучшие стеа-
риновые свечи не давали такого яркого света, чтобы одной
свечой можно было осветить комнату, а тем более большие
залы. Поэтому пользовались канделябрами и сразу зажи-
гали много свечей.
Масляная лампа светила ярче, заменяя несколько свечей,
но стоила она дорого.
Однако пока не появилось новых источников света, мас-
ляная лампа наряду со свечами имела повсеместное распро-
странение.
На смену масляным лампам пришли керосиновые. Они
горели ярче и стоили дешевле. Керосин оказался прекрасным
материалом для освещения.
Девятнадцатый век принес людям еще один ценный источ-
ник света — газовый светильник.
— 38 —
Еще алхимики в поисках несуществующего философского
камня, нагревая уголь без доступа воздуха (т. е. при сухой
перегонке угля) заметили, что при этом выделяется горю-
чий газ.
Однако увлеченные идеей превращения неблагородных
металлов в золото, они даже не помышляли о практическом
использовании горючего газа.
Лишь в 1792 г. впервые газу было найдено применение:
немецкий аптекарь Пикель осветил газом свою аптеку.
В начале XIX в. англичанин Фредерик Винзор разработал
конструкцию ряда аппаратов для производства газа из ка-
менного угля и сконструировал приборы для освещения
газом.
Но его предложение ввести в Лондоне газовое освещение
было встречено в штыки многими консервативно настроенны-
ми государственными и общественными деятелями. Особенно
резкое противодействие этому новшеству оказали свечные
фабриканты, которые боялись потерять свои прибыли.
Изобретатель оказался настойчивым, и в 1807 г. на ули-
цах одного из районов Лондона засветились яркие огни
газовых фонарей.
Зародившись на берегах Темзы, газовое освещение нача-
ло триумфальное шествие по странам Европы.
В 1816 г. в Балтиморе задымили трубы первого американ-
ского газового завода, а спустя четыре года газовые рожки
засветились на площадях и улицах Парижа.
В тридцатых годах прошлого века светильным газом, как
назвали горючий каменноугольный газ, стали освещаться зда-
ния и улицы в Петербурге.
Отчего керосиновые лампы горят ярче масляных, а масля-
ные лампы — ярче свечей? Чем отличается пламя газа от
пламени свечи? Каким должно быть пламя, чтобы оно давало
яркий свет?
Долгое время эти вопросы оставались без ответа. Разви-
вая науки, познавая законы физики и химии, люди нашли
правильное объяснение явлениям, связанным с горением.
Оказалось, что яркое, светящееся пламя всегда содержит
частички угля. На первый взгляд может показаться стран-
ным, что копоть и сажа являются необходимыми спутниками
яркого пламени. Но в этом очень легко убедиться. Зажгите
керосиновую лампу, отрегулируйте горелку. Лампа горит
— 39 —
ровным, светящимся пламенем, без всякой копоти. Возьмите
чайное блюдце и подержите над стеклом несколько минут.
Поверхность блюдца покроется тонким черным налетом. Это
сажа — мельчайшие частицы угля. Почему же черный уголь
становится источником яркого света?
Ответ на этот вопрос дадут нам физика и химия.
Процесс горения — это быстропротекающая химическая
реакция, идущая с участием кислорода, при которой выде-
ляется тепло и свет. Все виды топлива, которыми мы поль-
зуемся в быту и технике: дрова, торф, уголь — содержат
углерод и водород. Эти же элементы находятся в составе раз-
личных сортов горючего: нефти, бензина, керосина, газа.
При горении водород и углерод соединяются с молекула-
ми кислорода воздуха, образуя воду и углекислоту.
Когда горит керосиновая лампа, то керосин всасывается
фитилем из резервуара и постепенно испаряется с поверхно-
сти фитиля. Испаряясь, керосин смешивается с воздухом и
сгорает. Однако количество воздуха внутри пламени оказы-
вается недостаточным, чтобы все атомы углерода, содержа-
щиеся в керосине, соединились бы с кислородом. Происходит
неполное сгорание, т. е. неполное окисление. В пламени
остаются -мельчайшие частицы углерода. Эти твердые частич-
ки раскаливаются и делают пламя ярким и светящимся.
Неполное сгорание происходит и при горении свечей, фа-
келов, масляных ламп. Потому и у этих источников света
пламя бывает ко-птягцим и ярким.
Если же горение происходит при достаточном количестве
воздуха для полного сгорания, то вместо желтого светящего-
ся пламени может быть голубое или фиолетовое несветящее-
ся пламя.
Посмотрите на пышущий жаром примус и сравните его
с керосинкой. У керосинки пламя ничем не отличается от лам-
пы. Керосин также поступает по фитилю, испаряется и сме-
шивается с воздухом, сгорая неполностью. Потому керосинка
коптит, если чуть-чуть поднять повыше фитиль.
У примуса же керосин поступает в горелку под давлением.
Из нагретой горелки его пары вырываются через форсунку.
Они хорошо перемешиваются с воздухом. Здесь уж нет не-
достатка в кислороде и сгорание керосина происходит пол-
ное; потому примус не коптит и пламя у него не желтое.
Пламя газового рожка обязано своим ярким светом тем же
мельчайшим частичкам угля, что и пламя свечи и керосиновой
лампы.
Изучая процессы горения различных веществ, ученые за-
метили, что не только частички угля придают яркость пламени,
но и раскаленные частицы других твердых веществ.
— 40 —
CL
Например, если поджечь фос-
фор, он будет гореть ярким пламе-
нем. При сгорании
куска фосфора обра-
зуется белый дым,
состоящий из мель-
чайших твердых ча-
стичек.
Точно
взять
соль,
мелко
так же, ес-
бертолето-
смешать ее
истолчен-
ли
ву
с
НЫМ сахаром и капнуть на Горящая свеча:
смесь каплю серной КИСЛОТЫ, а-правильно; б - неправильно
то она вспыхнет ярким пламе-
нем. Здесь яркое пламя тоже указывает на то, что в нем при-
сутствуют твердые раскаленные частички.
Способность твердых частиц, нагреваемых в пламени,
увеличивать его яркость использовалась изобретателями при
изготовлении усовершенствованных горелок для газового
освещения. Появились газокалильные горелки. Из тончайших
проволок сплава редких тугоплавких металлов изготовляли
сетчатые колпачки. Их помещали в газовые горелки. При
нагревании до высокой температуры колпачки излучали яркое
белое или зеленоватое пламя.
Разгадав причину яркого свечения при горении источни-
ков света, ученые нашли и объяснение тем процессам, кото-
рые происходят при нагревании в пламени твердых частиц и
излучении ими яркого света.
Возьмем обыкновенную стеариновую свечу и зажжем ее.
Для того чтобы движение 1воздуха, которое есть в каждой
комнате, в каждом помещении, не мешало бы горению, вста-
вим свечу в ламповое стекло. В старину так делали уличные
торговцы, чтобы получить ровное пламя от свечей.
Свеча под стеклом горит равномерным, спокойным пла-
менем. Пламя имеет форму блестящего, несколько вытяну-
того вверх конуса.
Рассматривая внимательно этот конус, можно заметить,
что в верхней части он ярче, чем внизу. В середине конуса,
ближе к фитилю, явственно видна темная полоса в пламени.
3 Б Я. Розен
- 41 —
Известный английский ученый Фарадей, посвятивший
много внимания изучению строения пламени, проводил опы-
ты, наглядно показывающие влияние движения воздуха на
форму и строение пламени.
На штативе укреплялась небольшая стеклянная изогну-
тая трубка. В нижнее колено трубки наливался спирт. Спирт
зажигался. Для того чтобы сделать пламя более заметным,
Фарадей окрашивал его (растворение в спирте щепотки хло-
ристой меди окрашивает пламя в зеленый цвет).
Пламя спирта, появлявшееся при горении, поднималось
кверху, под действием восходящего тока воздуха, поддержи-
вавшего горение. Фарадей дул на пламя сверху. Направление
тока воздуха менялось, и пламя опускалось в трубку.
Изучая длинное пламя, Фарадей показал, что оно не со-
храняет постоянную форму, а всегда ветвится. Он взял боль-
шой ком ваты, смочил его хорошенько спиртом и зажег. Вата
моментально вспыхнула. Длинные, огненные языки пламени
взвились кверху. Это пламя непохоже на пламя свечи. Хотя-
общее направление пламени одинаковое, однако здесь много
языков пламени, которых нет при горении свечи.
Языки пламени образуются при горении ваты потому, что*
сильный приток воздуха и неравномерное горение мешают
образованию единой ровной струи пламени.
Бели же свеча или лампа защищены от случайных движе-
ний воздуха, то форма пламени будет правильной.
Что же происходит в пламени свечи при горении?
Когда горят жидкие горючие вещества: спирт, керосин,,
бензин или газообразное топливо: водород, ацетилен, светиль-
ный газ, то пламя представляет собой газовую оболочку,
в которой и происходит горение. Газы пламени нагреваются до1
очень высокой температуры за счет теплоты, которая выде-
ляется при сгорании горючих веществ.
Если горючим служат твердые тела: дерево, торф, стеа-
рин, жиры, то они сначала должны превратиться в пары или
же разложиться с выделением горючих газов.
Свеча изготовлена из твердого вещества—сала, воска,
стеарина. Рассматривая пламя горящей свечи, мы легко об-
наружим в нем три оболочки или зоны. В середине пламени
находится темная оболочка. Если мы внесем в темную часть
пламени свечи небольшую стеклянную изогнутую трубочку,
то заметим, что из наружного конца трубочки будут выходить
какие-то пары.
Это не что иное, как стеарин, превратившийся в газооб-
разные продукты под действием высокой температуры в тем-
ной оболочке пламени свечи. Здесь не происходит горения
потому, что сюда попадает недостаточное количество воздуха.
— 42 -
Горение образовавшихся газообразных продуктов проис-
ходит в центральной светящейся оболочке пламени. Темпе-
ратура здесь выше, чем в темной зоне, однако горение здесь
происходит лишь частичное. Одновременно в этом месте
происходит и распад газов.
При разложении газов выделяется углерод в виде мель-
чайших частичек угля. Накаляясь, они светят и придают
пламени яркость.
Не менее важна и последняя, наружная оболочка пламени
свечи. Это самая горячая зона пламени. Температура пла-
мени достигает здесь почти тысячи градусов. В этой оболочке
происходит окончательное химическое взаимодействие горю-
чих газов и паров с воздухом. Здесь осуществляется полное
сгорание веществ, из которого изготовлена свеча.
При горении свечи образуется пламя. А во всех ли слу-
чаях горение сопровождается пламенем? Не горят ли какие-
нибудь вещества, не выделяя пламени?
Если поджечь порох, то он вспыхнет ярким пламенем.
Возьмем немного железного порошка или мелких железных
опилок, смешаем их вместе в небольшой фарфоровой чашке
и подожжем. Порох вспыхнет, а раскаленные частички желе-
за будут только светиться и сгорят без пламени.
Однажды один из ученых, желая лучше рассмотреть сия-
ние грани бриллианта, навел на него лупу. И вдруг алмаз
загорелся и... растаял в воздухе. Камень горел без пламени,
испуская тонкие струйки сизого дыма.
Без пламени горят антрацит и древесный уголь, сажа и
кокс. Беспламенное горение наблюдается у всех тугоплавких
металлов — вольфрама, ванадия, хрома.
Почему же каменный уголь горит пламенем, а древесный
уголь горит без пламени?
Ответ на этот вопрос, как и на многие другие вопросы,
связанные с горением, дает химия.
Ученые установили, что если при температуре воспламене-
ния твердое тело не выделяет достаточного количества лету-
чих веществ, способных гореть, то горение происходит без вы-
деления пламени.
Каменный уголь представляет собой смесь сложных ве-
ществ, богатых углеродом. В составе каменного угля имеются
также кислород, водород, сера. Древесный уголь, который по-
лучается при сжигании дерева без доступа воздуха, — это»
з*
- 43 —
почти чистый углерод, в нем есть лишь небольшая примесь
минеральных солей, образующих золу.
При горении каменного угля сложные вещества расщепля-
ются на более простые, образуются горючие газы и пары.
Сгорая, они выделяют пламя.
Когда же горит древесный уголь, то газы и пары не выде-
ляются, сгорает чистый углерод, потому пламя не образуется.
То же самое происходит и с коксом, который представляет
собой чистый углерод.
А почему без пламени горят тугоплавкие металлы и неко-
торые легкоплавкие металлы, как например олово? Они ведь
состоят не из атомов углерода?
Химики, изучая горение различных веществ, заметили, что
пламя выделяется тогда, когда образуются горючие газы и
пары. Когда горит вольфрам, плавящийся при температуре
3370 градусов или молибден, который плавится при 2625 гра-
дусах, то выделяющегося при горении тепла недостаточно,
чтобы превратить эти металлы в пар.
По той же причине сгорает без пламени олово, хотя темпе-
ратура плавления у него и невысока — всего лишь 231,8 гра-
дусов.
Можно ли заставить вещества, которые горят обычно с
выделением пламени, сгорать без пламени? Оказывается,
можно. Читатель спросит, а зачем это нужно? Горит газ или
горючая жидкость — бензин, керосин — пламенем, ну и пусть
горит. Зачем принуждать их гореть без пламени?
Расчеты показали, что во многих случаях беспламенное
горение обычных горючих газов и жидкостей дает возмож-
ность лучше использовать топливо, получить больше тепла.
1В топки фабричных и заводских печей подают смесь воз-
духа и горючего газа или же смесь воздуха с парами горючей
жидкости под небольшим давлением, немногим более одной
атмосферы. Топку заполняют кусками огнеупорной глины,
карборунда, алунда или другим огнеупорным материалом.
Давно было замечено, что подобные вещества при накали-
вании ускоряют горение различных горючих веществ. Они
являются катализаторами процесса горения.
Горючая смесь, поступающая в топку, сгорает на поверх-
ности огнеупорной массы совсем без пламени. Опытный коче-
гар по свечению кусков огнеупорной массы в топке может
безошибочно определить температуру и регулировать по-
дачу горючей смеси.
При беспламенном горении горючей смеси вся поверхность
огнеупорной массы сильно нагревается и излучает тепло. Под-
считано, что если топливо сгорает без пламени, то бесполез-
ные потери тепла уменьшаются на 10—15 процентов.
— 44 —
Пользуясь знанием законов физики и химии, можно заста-
вить вещества, горящие пламенем, сгорать без пламени, мож-
но и наоборот, заставить пылать ярким огнем твердые тела,
которые обычно характеризуются беспламенным горением.
На уроках химии в школе часто показывают такой опыт:
тонкую стальную иглу прикрепляют к куску железной прово-
локи. На конце иглы укрепляют обломок спички или малень-
кий кусочек пробки. Затем проволоку с иглой вносят в пламя
горелки. Когда спичка или пробка загорится, иглу опускают
в банку с кислородом. Игла ярко вспыхивает ослепительно бе-
лым пламенем, разбрасывая искры.
Точно так же древесный уголь, который на воздухе горит
без пламени, в кислороде вспыхнет ярким огнем.
Вспомним другой школьный опыт. В железную ложечку
кладут немного толченой серы и поджигают от спиртовки. Над
ложечкой стелется едкий дым с острым, неприятным запахом
сернистого газа, и мерцают синие язычки. Внесем теперь ло-
жечку с горящей серой в банку с кислородом и синие язычки
станут фиолетовыми. Пламя окрасилось в другой цвет.
Оказывается, различные вещества горят разным пламенем.
Яркость пламени зависит, главным образом от того, сколько
кислорода содержится в горящем веществе.
Воздух состоит из смеси кислорода, азота и инертных га-
зов. Но кислорода в нем со- ==============
держится немного, всего лишь гОрение раскаленной железной
75 часть (2L% по объему). Азот проволочки в кислороде
и инертные газы мешают горе-
нию, они уносят с собой тепло, образую-
щееся при химической реакции горения.
Свеча горит на воздухе желтым пла-
менем, но если опустить ее в банку, на-
полненную кислородом, то она подобно
стальной проволочке будет гореть ярким,
белым пламенем. Частицы углерода, ко-
торые делают пламя свечи светящимся,
сильно раскаляются в кислороде и пото-
му желтое пламя становится белым.
Пламя свечи можно сделать даже
красным и синим. Эти чудесные метамор-
фозы осуществляются очень просто. Из-
менить цвет пламени свечи может
любой школьник. Возьмите стеклянную
— 45 —
В хлоре свеча го-
рит тусклым, коп-
тящим, красным
пламенем
банку, пропустите из баллона хлор и поме-
стите в нее горящую свечу. Яркое желтое
пламя станет тусклым, коптящим и крас-
ным.
А для того что(бы сделать его синим, не
нужен ни хлор, ни кислород, достаточно
обыкновенной паяльной трубки. Если вду-
вать в пламя свечи воздух с помощью этой
трубки, то оно станет 1несветящим1ся, про-
зрачным и не будет коптить. Цвет же его
станет синеватым, как в газовой плите.
Синим несветящимся пламенем горят на
воздухе многие вещества, в которых содер-
жится не менее пятидесяти процентов кис-
лорода. Среди них древесный (метиловый)
спирт и уксусная кислота, формалин и гли-
церин. Если поджечь спичкой кусок сахара
(а сделать это можно, запачкав край куска
пылинками золы), то он будет гореть ровным синим пламенем.
Когда догорают дрова в печке, то на золотисто-красных углях
видны синие огоньки. Это горит окись углерода. Если закрыть
теперь печку, то можно угореть, потому что остается несгорев-
ший угарный газ.
Цвет раскаленных углей не всегда одинаков, он зависит от
температуры. Угли в вольтовой дуге слепят глаза, они светят-
ся ярким белым пламенем. Но как только ток будет выклю-
чен, цвет их станет сначала оранжевым, затем темно-вишне-
вым и, наконец, темно-красным. Пламя пожара кажется багро-
вым потому, что угли от сгорания дерева имеют по большей
части вишнево-красный цвет. Горящие угли испускают крас-
ные лучи, которые окрашивают пламя и окружающие пред-
меты в красный цвет.
Кто из читателей це любовался гирляндами цветных огней,
взлетающими в небеса в праздничный салют. Кто с восхище-
нием не следил за причудливыми огненными фигурами фейер-
верка, рассыпающимися гроздьями разноцветных искр по
вечернему небу.
Немало радости доставляют ребятам бенгальские огни.
Так называют в пиротехнике смеси веществ, которые при сго-
рании дают пламя, окрашенное в различные цвета. В «цвет-
ном» пламени присутствуют пары того или иного вещества,
которое испускает лучи определенной длины волны. Вот эти-
то лучи и окрашивают пламя в тот или иной цвет.
Горючей основой бенгальских огней служит сера или уголь.
К мелко измельченному углю или толченой сере добавляют
бертолетову соль и вещество, окрашивающее пламя. Бертоле-
— 46 —
това соль является окислителем. При сгорании она разлагает-
ся, выделяет кислород, который поддерживает горение смеси.
Желтый бенгальский огонь получают, если добавить
в смесь безводную соду, зеленый — с помощью углекислого ба-
рия или борной кислоты, красный — пользуясь карбонатами
кальция или стронция. Если же желают приготовить фиолето-
вый бенгальский огонь, то берут алюмо-калиевые квасцы и
поташ.
Когда мы говорим «пламя», то нам представляется огонь,
который не только светит, но и обжигает. Пламя — это свет и
тепло. Но оказывается, что так бывает не всегда. Пламя мо-
жет быть несветящимся (пламя газовой горелки), но оно бу-
дет обжигать и согревать. Огонь может быть и без пламени
(тлеющий уголек), но он дает тепло.
Бывает в природе и так, что горение сопровождается та-
ким незначительным выделением тепла, что пламя светит, но
не греет.
Если нагреть платиновую проволочку и опустить ее в пары
этилового эфира на воздухе, то можно заметить вокруг про-
волочки синеватое сияние. Это холодное пламя, оно настолько
слабое, что увидеть его можно только в темноте.
Как известно, эфир — вещество летучее и легко воспламе-
няющееся, тем не менее для самовоспламенения паров эфира
с выделением горючего пламени нужна температура свыше
трехсот градусов. Горение же паров эфира с образованием
холодного пламени происходит примерно около двухсот
градусов.
Холодным пламенем в определенных условиях могут го-
реть и многие другие органические вещества — углеводороды,
спирты.
Любой процесс горения — без выделения пламени, с обра-
зованием горячего или холодного пламени представляет собой
окисление, но протекает оно по-разному. В холодном пламени,
так же как в горячем, выделяется вода, углерод соединяется
с кислородом, но процесс окисления не доходит до конца.
Когда пары эфира сгорают при температуре ста семидеся-
ти градусов, чувствуется запах формальдегида. При нагрева-
нии же эфира до трехсот двадцати градусов образуются
конечные продукты окисления — углекислый газ и вода.
Огонь издавна верно служит человеку. Горячее пламя по-
могает нам печь хлеб, варить стекло, выплавлять из руд ме-
- 47 —
талл. А кому нужно холодное пламя? Оказалось, что оно
подобно своему ^родственнику» горячему пламени, может
приносить пользу людям.
Так, пары моторного топлива, получаемого в виде побочно-
го продукта на заводах синтетического каучука, не находили
себе применения. Несколько лет назад московский профессор
Нейман разработал эффективный способ использования этих
отходов.
Была построена опытная установка, в которой сжигались
исследуемые отходы при температуре 400—415 градусов. При
сжигании паров моторного топлива холодным пламенем уда-
лось получить смесь альдегидов, которая служит прекрасным
сырьем для производства искусственных смол. Эта смесь ока-
залась пригодной для протравливания семян, которое обычно
производится формалином. Полученные продукты позволяют
успешно заменить формалин и во многих других назначениях.
Применение метода холодно-пламенного горения даст воз-
можность сэкономить значительные средства и найти отходам
полезное применение.
Если каким-либо составом, содержащим фосфор, намазать
циферблат часов, то цифры в темноте будут светиться. Как и
при сгорании органических веществ с выделением холодного
пламени, окисление здесь происходит менее /интенсивно.
Кому не пришлось бывать теплой летней ночью в лесу.
Сказочными исполинами кажутся мохнатые ели, застывшие
в дремотной истоме. Чуть слышно шепчутся молодые березки,
словно невесты с распущенными волосами. Ничто не нарушает
покоя лесных обитателей. Тишина, все объято сном, лишь не-
угомонные светлячки, словно несущие вахту дозорные, то там,
то тут вспыхивают зелеными искорками. Эти маленькие жи-
вые фонарики светятся повсюду — в траве, во мху, на листьях
деревьев.
Долгое время люди не знали, почему светлячки светят хо-
лодным огнем. Многие ученые еще в прошлые века отмечади
в своих трудах, что и некоторые другие живые организмы —
черви, жуки, рыбы излучают холодный свет. В глубинах морей
и океанов живут кораллы, медузы, несущие на своем теле
«лампы» холодного света. Есть и светящиеся бактерии.
Разгадку таинственному свечению гнилушек, насекомых,
рыб принесла химия. Оказалось, что свечение у них возникает
без нагревания. Свет возбуждается не тепловой энергией,
а химической энергией, которая выделяется в результате окис-
ления. Превращение химической энергии в свет называете,я
хемилюминесценцией.
Изучая внимательно тело светлячка, ученые обнаружили
у него на спине небольшое пятнышко. Оно-то и служит
— 48 —
«фонариком», освещающим лесной мрак. С помощью химиче-
ского анализа в «пятнышке» было обнаружено вещество, назы-
ваемое люциферином. Оно окисляется кислородом воздуха,
а при окислении выделяется химическая энергия, превращаю-
щаяся в световую.
До сих пор химикам не удалось еще в лаборатории полу-
чить люциферин искусственным путем, но они могут из неко-
торых веществ приготовлять такие смеси, которые будут све-
титься холодным светом. Химики знают много таких реакций,
когда химическая энергия превращается в световую.
Например, в большой стакан наливают немного 10-процент-
ного раствора пирогаллола (это вещество применяется в фо-
тографии для приготовления проявителя). Затем последова-
тельно приливают к этому раствору столько же 40-процентно-
го раствора формалина и в три раза больше 30-процентного
раствора поташа и добавляют какой-нибудь окислитель, на-
пример перекись водорода (в два раза больше, чем пирогал-
лола). Раствор перемешивают как можно энергичнее стеклян-
ной палочкой. Он начинает бурно пениться. Пузырьки розово-
красной пены заполняют весь стакан и бегут через край.
В темноте они светятся нежным розовым светом в течение
нескольких минут.
Перекись водорода окисляет формальдегид и пирогаллол.
При взаимодействии этих веществ с перекисью водорода обра-
зуются муравьиная кислота, окись и двуокись углерода.
И здесь красный холодный свет, как и зеленый холодный свет
светлячков, возник в результате реакции окисления.
Советскими химиками за последние годы открыты и такие
окислительные реакции, когда свечение длится не минутами,
а часами, даже сутками.
Окисляя перекисью водорода некоторые сложные органи-
ческие вещества, можно заставить их светиться небесно-голу-
бым или ярко-зеленым светом очень длительное время.
Химические светящиеся составы теперь часто используют-
ся в технике для разнообразных нужд. Светящиеся надписи
на дорогах предупреждают аварии автомашин ночью; стрелки
и цифры часов, покрытые светящимся составом, дают возмож-
ность узнать точное время во мраке ночи; театральные деко-
рации, написанные светящимися красками, позволяют ставить
эффектные сказочные балеты и пьесы.
Теперь все шире светящиеся краски начинают применять
в текстильной промышленности для окраски тканей. Несколько
лет назад советский инженер П. Н. Воронцов разработал спо-
соб изготовления светящихся тканей, покрытых несмываемы-
ми красками. Необычайно красиво выглядят платья, пошитые
из этих тканей, в темноте. Светящиеся краски очень прочны.
— 49 —
Текстильные изделия, окрашенные ими, можно стирать и гла-
дить; они не теряют способности светиться.
Необыкновенно феерично выглядят комнаты и залы, стены
которых обиты тканевыми обоями, окрашенными светящими-
ся красками. Ночью светящиеся стены кажутся прозрачными,
стеклянными. Создается впечатление, что свет струится изнут-
ри, словно он скрыт где-то в глубине комнаты.
Светящиеся составы помогают археологам и палеонтоло-
гам успешнее изучать находимые при раскопках предметы
обихода и вооружения древних людей, кости вымерших жи-
вотных и остатки исчезнувших с лица земли растений.
Исследуемые предметы покрывают светящимися красками
и облучают рентгеновыми или ультрафиолетовыми лучами.
Под действием облучения становятся заметными невидимые
при обычном свете детали строения изучаемого предмета.
Пригодились они и микробиологам. Рассматривая под мик-
роскопом препарат, окрашенный светящимися красками,
удается заметить такие детали строения у растительных и жи-
вотных тканей, которые обычно остаются невидимыми. Неко-
торые виды болезнетворных бактерий не удается увидеть под
микроскопом, но достаточно воспользоваться светящимися
красками, как картина резко меняется. Теперь можно обна-
ружить даже одну бактерию, потому что она светится.
Светящиеся составы позволяют обнаружить изъяны и де-
фекты в самых сложных и крупных деталях машин, предупре-
дить аварию мощных турбин и блюмингов, спасти рабочих,
обслуживающих эти агрегаты, от увечья и гибели.
Прежде чем сдать деталь заказчику, ее проверяют с по-
мощью светящихся красок. Поверхность детали покрывают
раствором светящегося состава, а затем ветошью или мягкой
тряпкой тщательно стирают с поверхности капли раствора.
Обтерев насухо деталь, ее освещают ультрафиолетовыми лу-
чами. Раствор, оставшийся в трещинах, начинает светиться,
и все трещины становятся ясно видны.
Наука помогла нам установить причину образования хо-
лодного света и возникновения холодного пламени.
Горячее пламя обжигает, а холодное только светит, но не
греет. Можно ли холодное пламя сделать горячим? Оказывает-
ся можно и даже разными способами.
Пары эфира в смеси с воздухом горят холодным пламенем,
если смесь нагрета до 200—400 градусов. Синие языки этого
- 50 -
пламени, невидимые днем, прекрасно видны в темноте. Если
же температуру смеси повысить до 700 градусов, то синее
пламя становится желтым, быстро развивается процесс горе-
ния, который заканчивается сильным взрывом. Того же ре-
зультата можно добиться, поджигая спичкой мерцающие си-
ние языки холодного пламени.
Температура пламени или иначе, температура горения за-
висит от многих условий: скорости распространения огня, пол-
ноты сгорания, избытка воздуха. На температуру пламени
влияет и температура горючего вещества и воздуха.
Температура пламени стеариновой свечи не превышает
940 градусов, а у парафиновой свечи она достигает почти по-
лутора тысяч градусов. Температура горения у дерева —
1100—1200 градусов, светильного газа — 1300—1400 градусов,
серы— 1800 градусов.
Пламя ацетилена имеет еще более высокую температуру —
2127 градусов. Но и это пламя еще не самое «горячее».
Температура пламени тем выше, чем больше тепла выде-
ляется в процессе горения.
Различные горючие вещества — каменный уголь, дерево,
бензин — при сгорании выделяют разное количество тепла.
Например, при горении одного килограмма каменного угля
выделяется 6000—8000 калорий, при горении дерева — не бо-
лее 4000 калорий. Когда же горит бензин, то тепла выделяет-
ся гораздо больше— 11 200 калорий.
Количество тепла, которое выделяется при полном сгора-
нии одного килограмма горючего вещества, называется тепло-
творной способностью. Чем она выше, тем больше тепла выде-
лится при горении горючего вещества. Особенно высока тепло-
творная способность некоторых газов: пропана, бутана. Их
теплотворность в два-три раза выше, чем у бензина.
При сжигании газов можно получить весьма высокую тем-
пературу пламени: для метана — 1880 градусов, для этилена —
1975 градусов, для бутана и пропана еще выше.
Температуру пламени можно искусственно повысить. Для
этой цели пользуются разными типами горелок. В лаборато-
риях всего мира широко применяется горелка Бунзена, извест-
ного немецкого химика, в которой светильный газ сгорает
вместе с воздухом. В нижней части горелки просверлены от-
верстия, через которые в горелку поступает воздух и переме-
щается со светильным газом.
Если газ сжигать в чистом кислороде, то можно еще боль-
ше повысить его температуру пламени. При горении горючего
газа в смеси с чистым кислородом часто происходили опасные
взрывы. Для того чтобы устранить взрывы, была сконструиро-
вана специальная горелка, в которой имеются две трубки,
— 51 —
вставленные одна в другую. По одной трубке подается кисло-
род, а в пространство между трубками пропускается горючий
газ. Оба газа смешиваются лишь у выходного отверстия
горелки.
С помощью таких горелок удается получить пламя с очень
высокой температурой. Если горючим газом служит ацетилен
или водород, то температура пламени Достигает трех тысяч-
градусов.
В таком горячем пламени плавятся почти все металлы, да-
же самые тугоплавкие, — молибден, осмий, иридий. Кусок
железной или стальной проволоки сгорает в этом пламени, как
в чистом кислороде, разбрасывая во все стороны мириады
блестящих искр. Если в водородно-кислородное пламя внести
кусок негашеной извести, он раскалится добела и начнет све-
титься ослепительно ярким светом.
Но еще более горячее пламя получается, если в горелку
вместо этих газов вводить дициан. Температура дицианово-
кислородного пламени достигает 4500 градусов, а под неболь-
шим давлением даже 5000 градусов. А заменяя кислород озо-
ном, удается повысить температуру пламени даже до
6000 градусов.
Шесть тысяч градусов! Это температура поверхности
Солнца. Такого жара не может выдержать ни одна печь, по-
тому что любой материал, из которого она может быть сдела-
на, не только плавится, но даже испаряется при подобной
температуре.
И все же такая огромная температура не является пре-
дельной. Сейчас мы еще не умеем при горении достигать бо-
лее высоких температур, но в недалеком будущем сможем.
Необходимо только найти подходящие горючие вещества,
создать наиболее эффективные условия горения.
Расчеты показывают, что температура пламени премучего
газа— 10 000 градусов, хотя в горелках, применяемых для
сварки и резки металла температура водородно-кислородного
пламени не превышает 3000 градусов.
Когда водород при сгорании соединяется с кислородом, об-
разуя воду, на каждые 18 граммов (одну грамм-молекулу) во-
ды выделяется 57,8 килокалорий тепла. Водяной пар при этом
сильно нагревается. Хорошо известно, что многие химические
реакции в определенных условиях обратимы.
Например, если смешать поваренную соль с серной кисло-
той, то в результате их взаимодействия образуются сернокис-
лый натр и хлористый водород. Однако эта реакция не идет до
конца, в какой-то момент хлористый водород и сернокислый
натр начнут между собой реагировать и будут вновь полу-
чаться поваренная соль и серная кислота.
— 52
Точно такая же картина наблюдается и при горении гре-
мучего газа. Капельки воды, /рожденные при соединении кис-
лорода с водородом, не выдерживают такого сильного жара и
распадаются на кислород и водород, забирая тепло. Для раз-
рушения грамм-молекулы воды нужно 57,8 больших калорий
тепла, т. е. ровно столько, сколько выделяется при ее обра-
зовании.
Чем выше становится температура пламени гремучего га-
за, тем сильнее идет обратная реакция, т. е. тем больше моле-
кул воды распадается на .водород и кислород.
Поскольку обратная реакция идет с поглощением тепла,
то температура пламени гремучего газа становится ниже.
При 2200 градусах распадается шесть процентов образо-
вавшихся молекул воды, при 2500 градусов — вдвое больше.
Когда же температура пламени достигает 2700 градусов, то
количество распавшихся молекул воды исчисляется уже
23 процентами.
А если температура превысит три тысячи градусов, то бу-
дет так много разрушаться молекул воды, что температура
пламени резко понизится.
Вот в этом и кроется причина столь большого расхожде-
ния между теоретически возможной и практически достижи-
мой температурой пламени гремучего газа. Возникновение об-
ратимых реакций наблюдается при горении многих горючих
веществ и мешает получать очень высокие температуры на
практике.
Несколько лучше обстоит дело при горении ацетилена
в кислороде. Ацетилен сначала распадается на углерод и водо-
род, которые затем соединяются с кислородом, образуя угле-
кислоту и воду.
Реакция разложения ацетилена на составные элементы
необратима. Поэтому эффективность ацетиленовых горелок
выше, и ацетилен дает более «горячее» пламя по сравнению
с другими горючими газами — метаном, коксовым и водяным
газом.
Следовательно, главным условием создания пламени
с очень высокой температурой является образование таких про-
дуктов реакции, которые не вступают между собой во взаи-
модействие, т. е. отсутствие обратной реакции.
К числу самых стойких продуктов реакции принадлежат
азот и окись углерода. Они не «любят» друг друга и не пыта-
ются соединиться.
Следовательно, рассуждали ученые, если сжигать какие-
нибудь вещества, содержащие в своих молекулах только угле-
род и азот, то можно значительно превысить температуру во-
дородно-кисл ородного и ацетиленово-кислородного пламени.
— 53 —
Расчеты оказались правильными, ожидания полностью»
оправдались.
Еще в 1815 г. знаменитым французским физиком и хими-
ком Гей-Люссаком был получен нагреванием цианистой рту-
ти ядовитый бесцветный газ — циан или дициан, молекула
которого состоит из двух атомов углерода и двух атомов азота.
Сгорая красивым оранжевым пламенем с синей каемкой,,
дициан дает возможность получить температуру в полтора-
два раза выше, чем при сжигании ацетилена и водорода.
Горячее пламя теперь широко используется в технике.
С его помощью сваривают металл, т. е. спаивают его без при-
поя, режут толстые металлические листы, просверливают от-
верстия в железных болванках и деталях.
Лед и пламя — символы мороза и жара. Трудно себе пред-
ставить понятия, обладающие большими противоположностя-
ми. Кажется совершенно невозможным соединить их воедино.
Однако скоро жители городов и сел, расположенных на бе-
регах крупных рек, смогут зимой любоваться эффектным зре-
лищем горящего льда.
Иногда во время ледостава на реках образуются большие-
заторы льда, которые мешают движению судов. Можно разру-
шить ледяные торосы с помощью ледокола, но это дорого и
долго. Гораздо проще зажечь лед.
А разве лед может гореть? Ведь вода гасит огонь. Вот тут-
то и пришли на помощь современные «чародеи».
На улицах городов нередко по ночам можно увидеть на
трамвайных путях ослепительное сияние расплавленного ме-
талла. Это ремонтные рабочие сваривают рельсы. Сварку ве-
дут они не с помощью ацетилена или водорода. Источником
горючего служат им не газы, сгорающие в кислороде, а тер-
мит— смесь алюминиевого порошка с измельченной окисью
железа (вместо железа можно брать и окислы других ме-
таллов).
Если термитную смесь сильно разогреть или поджечь, та
начинается бурная химическая реакция, алюминий отнимает
у окиси железа (или другого металла) кислород, превраща-
ясь в окисел, а железо выделяется в чистом виде. Атомы алю-
миния вытесняют атомы железа из молекул окиси и сами ста-
новятся на их место.
Алюминий с такой «жадностью» отнимает кислород, что
реакция протекает очень быстро. При этом выделяется столь-
- 54 -
ко тепла, что вся масса термита мгновенно плавится. Она на-
столько сильно раскаляется, что светится ярким, ослепитель-
но белым пламенем. Температура расплавленного металла
достигает трех тысяч градусов.
Вот этот термит и поможет зажечь лед и ликвидировать
ледяные заторы.
Как только подожгут термитный порошок, насыпанный
на лед, и расплавленное железо, вытесненное из окиси железа
алюминием, огненными струйками потечет по льду, про-
изойдет новая химическая реакция. Железо разложит замерз-
шую воду на составные элементы — кислород и водород. Кис-
лород немедленно соединится с железом, образуя окисел, а
водород загорится. Лед растечется, разрыхлится и «сгорит».
Если в толщу льда заложить термитную мину и поджечь
ее, то она вспыхнет ослепительно белым пламенем. Издали
кажется, что вся глыба льда раскалилась добела.
«Горение» льда, вызываемое термитом, происходит почти
бесшумно. Устранение ледяных заторов с помощью термита
не может повредить мостовые быки или другие сооружения,
оно не глушит рыбы и не приносит водникам никаких не-
приятностей.
Используя особенности разных видов горячего пламени,
современная техника успешно решает разнообразные и слож-
ные задачи, имеющие важное народнохозяйственное значение.
глава чв^вар^аа
ИЗ ПОДЗЕМНЫХ
ГЛУБИ Н
‘,горят:гОЛУБ1’Геогнй’’
Оочти полтора столетия прошло с тех пор,
как люди научились пользоваться горю-
чим газом, добываемым при превраще-
нии каменного угля в кокс. Для того чтобы получить газ,
уголь нагревают без доступа воздуха до 1000—1100 градусов
в больших высоких печах, сложенных из огнеупорного кирпи-
ча. Из тонны угля добывается 300—325 кубометров светиль-
ного или коксового газа (так называется газ, когда он полу-
чается на коксохимическом заводе), 4—5 килограммов ка-
менноугольной смолы, 2,5—3 килограмма аммиака.
В состав каменного угля, кроме углерода, водорода, азо-
та, входит еще небольшое количество серы и воды. При нагре-
вании часть углерода соединяется с кислородом и образует
горючий газ — окись углерода. Водород частично соединяет-
ся с кислородом, образуя воду. Некоторое количество водоро-
да вступает во взаимодействие с углеродом, образуя много
разных летучих органических веществ. При охлаждении па-
ров этих веществ получается темно-бурая жидкость с неприят-
— 56 -
ным запахом — каменноугольная смола. Свыше ста ценных
органических соединений извлекают химики из нее — нафта-
лин, карболовую кислоту, антрацен.
Светильный, или коксовый газ — это смесь разных газов.
В нем больше половины водорода, немногим более трети ме-
тана, остальное окись углерода и газообразные углеводороды.
Горючий газ можно получить не только при сухой перегон-
ке каменного угля, но и при сжигании его в высоких цилиндри-
ческих печах — генераторах.
Когда уголь горит в топке паровоза или на колосниках за-
водской печи, то горючее вещество угля — углерод соединяет-
ся с кислородом воздуха, и образуется углекислый газ.
По-иному происходит горение угля в газогенераторе.
Обычно слой угля в нем достигает полутора метров. Воздуха,
продуваемого через колосники, не хватает для окисления все-
го слоя в углекислый газ. Сгорает лишь нижняя часть слоя
угля. Раскаленный углекислый газ поднимается вверх и на-
гревает куски угля в
градусов. Нагретый
уголь жадно реаги-
рует с кислородом,
отнимая его у угле-
кислого газа. Обра-
зуется новое веще-
ство— окись углеро-
да, иначе называе-
мое угарным газом.
Его название про-
изошло от угара —
ядовитого действия,
которое он оказыва-
ет на наш организм,
проникая из печи
в помещения. У чело-
века, находящегося
в этом помещении,
сначала появляется
головная боль и го-
ловокружение, за-
шахте газогенератора почти до тысячи
4^
установки для
J^^tA
Схема газогенераторной
получения горючего газа из твердого
топлива
1—загрузочное отверстие; 2—твердое топливо;
3—колосниковая решетка; 4—отверстие для по-
дачи воздуха; 5—выход генераторного газа
— 57 —
тем наступает потеря сознания и удушье. Это происходит
вследствие того, что окись углерода вступает в химическую
реакцию с гемоглобином, который находится в красных кро-
вяных шариках и служит переносчиком кислорода от легких
к тканям.
При вдыхании угоревшим свежего воздуха гемоглобин
снова обретает способность поглощать кислород.
Угарный газ является очень опасным газом еще и вследст-
вие того, что его трудно обнаружить в воздухе. Он не имеет
ни цвета, ни запаха. А почему пахнет угаром? — спросит чи-
татель. Ответ на этот вопрос дает химический анализ, кото-
рый обнаруживает в нем примеси некоторых органических
веществ. Они-то и придают угару запах.
Как же обезвредить угарный газ, лишить его ядовитых
свойств? Его надо превратить в углекислый газ. Ведь при
обычной температуре и атмосферном давлении он окисляется
кислородом воздуха. Но его можно заставить взаимодейство-
вать с ним, если найти катализатор, который заставил бы
«угарный» газ окисляться. И такой катализатор был найден
учеными. Это гопкалит — смесь, окислов марганца и меди. Че-
рез слой гопкалита просасывают -воздух с примесью угарного
газа. И угарный газ послушно превращается в неядовитый
углекислый газ.
При вдувании воздуха в газогенератор вместе с кислоро-
дом попадает и азот, которого в воздухе содержится в четы-
ре раза больше, чем кислорода.
Этот газ не поддерживает жизни и горения, и сам не го-
рит. В печи он смешивается с окисью углерода. Эта смесь
называется генераторным, или воздушным газом. В ней око-
ло одной трети угарного газа, а остальное — азот.
Генераторный газ горит не таким ярким пламенем, как
светильный или коксовый газ и тепла дает в четыре с лиш-
ним раза меньше, чем они. Потому его часто называют «бед-
ным» газом. Тем не менее им широко пользуются для нагрева
плавильных печей на металлургических и стекольных за-
водах.
Но в газогенераторах можно получать и более «богатый»
газ, если вместо воздуха пропускать через раскаленный
уголь пар. Тогда углерод будет отнимать атом кислорода
у воды. Получится смесь окиси углерода и водорода — двух
горючих газов, которая называется «водяным газом». При
его сгорании выделяется тепла почти в три раза больше, чем
дает воздушный газ.
Водяной газ, подобно светильному и коксовому, горит яр-
ким голубым огнем в кухонных плитах во многих городах
Советского Союза, облегчая труд домохозяек.
— 58 —
Если под колосники газогенератора вдувать смесь пара
с воздухом, то выделяется также горючий газ, но более бед-
ный по сравнению с водяным. В этом газе, называемом паро-
воздушным, много негорючего материала — азота и двуокиси
углерода; им часто разбавляют более богатый природный газ.
Такая смесь вполне пригодна для газификации квартир,
а стоит дешевле, потому что паровоздушный газ можно полу-
чать из бурого угля и других низких сортов углей.
Но для того чтобы превратить уголь в горючий газ в ге-
нераторах, надо затратить немало труда. Прежде всего надо
добыть его из недр, поднять на поверхность земли, погрузить
в вагоны и перевезти на газогенераторные станции. Здесь
уголь нужно раздробить на куски одинакового размера, от-
сортировать от пыли и мелочи и засыпать в шахту газо-
генератора.
Для добычи угля необходимы дорогостоящие шахты, тре-
буется много машин и людей, нужно сложное подземное
хозяйство.
А нельзя ли получить горючий газ, не вынимая угля на
поверхность? Ведь как упростилось бы извлечение скрытой в
каменном угле солнечной энергии, какая огромная экономия
сил и средств была бы достигнута!
Эта замечательная мысль впервые зародилась у великого
русского химика Д. И. Менделеева, около 70 лет назад.
Д. И. Менделеев живо интересовался отечественной про-
мышленностью. Особенно его занимали вопросы развития
нефтяного дела и угольных бассейнов в России. Он ездил на
Кавказ и в Донбасс, знакомился с техникой добычи нефти
и угля.
Побывав на донецких шахтах, Менделеев окончательно
укрепился в идее подземной газификации каменного угля.
В своих книгах и статьях он доказывал, что стоимость
каменноугольного топлива станет в несколько раз дешевле,
если уголь будут под землей превращать в горючие газы
Кроме того, можно будет использовать тонкие пласты угля,
которые невыгодно добывать обычными способами. А таких
пластов есть довольно много в нашей стране.
Еще более ясно и четко оформилась у Менделеева мысль
о промышленном получении горючих газов из угля под зем-
лей, когда он узнал о грандиозных подземных пожарах, ко-
торые часто возникали в шахтах. Гениальный ученый увидел
— 59 —
в этом бедствии путь,
по которому в буду-
щем будет разви-
ваться угольная про-
мышленность.
Выдвинув впер-
вые свою замеча-
тельную идею — пре-
вращать уголь под
землей в газ, Мен-
делеев предложил простой технический
способ ее претворения в жизнь.
«Пробурив в пласту несколько от-
верстий,— говорил он,— одно из них
должно назначать для введения — да-
же вдувания — воздуха, другие для вы-
хода— даже вытягивания (например
инжектором) —горючих газов,
рые затем легко уже провести
кото-
даже
Схема газификации
угля по способу Мен-
делеева: вверху — об-
щий вид станции под-
земной газификации;
внизу — схема подзем-
ного газогенератора.
на далекие расстояния к печам».
На протяжении почти 12 лет вели-
кий ученый не раз обращался к шах-
товладельцам и углепромышленникам
с предложением поставить хотя бы
начальные опыты подземной газифи-
кации углей.
Однако все его попытки оказались
напрасными. Передовые начинания Менделеева не нашли под-
держки.
Спустя 25 лет другой известный химик, на этот раз ан-
глийский, Вильям Рамсей (тот самый, который открыл инерт-
ные газы — аргон, неон, криптон, ксенон) также выступил
с идеей превращения угля в газ под землей.
Он даже разработал технический проект подземной гази-
фикации.
В угольном пласте пробуривают скважины, располагая их
в два или более рядов вдоль пласта. Опускают в них широ-
кие трубы, в которые вставляют одна в другую еще две более
узких трубы. В предварительно зажженный пласт угля по
одной из них подают сжатый воздух, а по другой — водя-
ной пар.
Горючий газ, образовавшийся в угольном пласте,
пойдет по широкой трубе наверх и будет собираться в при-
соединенном к ней газгольдере. Отсюда охлажденный и
очищенный от пыли газ по газопроводу поступит к потреби-
телям за десятки и сотни километров.
— 60 —
В начале зажженного пласта угля или, как его называют
в технике, огневого забоя, кислород воздуха вступает в реак-
цию с углеродом пласта, окисляя его в углекислый газ.
При этом выделяется много тепла, оно нагревает угольный
пласт и углекислый газ.
Нагретая углекислота движется вдоль огневого забоя
и сама вступает в реакцию с углеродом каменноугольного
пласта.
Образуется горючий газ — окись углерода.
Водяной пар, поступающий в толщу каменноугольного пла-
ста. также вступает в реакцию с углеродом. Образуется,
как в генераторе водяной газ — смесь водорода и окиси уг-
лерода.
В процессе этих реакций расходуется часть тепла, полу-
чаемого при сжигании угля.
Другая же часть тепла уходит на прогревание угольного
пласта.
Под действием высокой температуры, которая развивается
в огневом забое, происходит сухая перегонка угля. Как и при
сухой перегонке угля, при получении кокса или светильного
газа образуются летучие органические вещества, уносимые из
огневого забоя окисью углерода.
Предложение талантливого английского химика постигла
судьба его русского коллеги.
Оно было встречено промышленниками так же холодно.
Хотя Рамсею удалось договориться с одним углепромышлен-
ником о подготовке испытания его способа, ц все было уже
подготовлено к проведению опыта, однако вскоре интерес
к подземной газификации у шахтовладельцев пропал, и опыт
был оставлен.
Смелая идея двух великих химиков привлекла внимание
В. И. Ленина, который, находясь в то время в эмиграции,
с живейшим интересом следил не только за всеми политиче-
скими событиями, но и за развитием техники.
4 мая 1913 г. газета «Правда» напечатала статью Влади-
мира Ильича «Одна из великих побед техники».
Разбирая подробно все выгоды и преимущества получения
горючего газа из угля непосредственно под землей, он ука-
зывал:
«Громадная масса человеческого труда, употребляе-
мого теперь на добывание и развозку каменного угля, была
бы сбережена. Использовать можно было бы даже наиболее
бедные и неразрабатываемые ныне залежи каменного угля.
Расходы на освещение и отопление домов понизились бы
чрезвычайно. Переворот в промышленности, вызванный этим
открытием, будет огромен».
— 61 —
Осуществление идеи Менделеева — Рамсея, столь высоко
оцененной Лениным, стало возможным только в нашей стра-
не после Великого Октября.
Советские люди впервые в истории мировой техники ус-
пешно разрешили эту задачу и разработали способ произ-
водства дешевого подземного газа.
Бесшахтный способ получения газов под землей позволя-
ет еще больше удешевить его и широко эксплуатировать ма-
лоценные пласты угля.
Подсчитано, что при замене угля или торфа подземным
газом, стоимость топлива уменьшится в 2,5 раза. Почти
в 5,5 раза увеличивается производительность труда ра-
бочих.
Электростанции, пользующиеся подземным газом вместо
твердого топлива, получают экономию, исчисляющуюся
в десятки миллионов рублей.
В ближайшие пять-десять лет будут построены новые
станции Подземгаза в Кузбассе и в Подмосковном угольном
бассейне, которые будут вырабатывать свыше десяти милли-
ардов кубометров газа в год.
Каменный уголь — ценное топливо. Но еще более ценное
топливо — нефть. 10 500 калорий тепла можно получить, если
сжечь один килограмм нефти. Только 7000 калорий тепла
дает один килограмм угля при сжигании.
Но нефть в нашу эпоху не только высококалорийное топли-
во, это — важный источник ценного химического сырья. Из
буро-черной жидкости с неприятным запахом получают
ароматные духи и эссенции, яркие краски и прочные пласт-
массы, гибкую резину и чудодейственные лекарства.
Все же большая часть добываемой нефти расходуется на
производство бензина.
Если вытянуть в одну линию цистерны с бензином, выра-
батываемом на наших нефтеперегонных заводах в год, то та-
кой железнодорожный состав протянулся бы от Москвы до
Владивостока.
С каждым годом все больше становится в мире самолетов,
автомобилей, тракторов, теплоходов и все больше расхо-
дуется нефти и бензина.
Хотя мировые запасы нефти весьма велики, но они почти
в тысячу раз меньше запасов каменного угля на земном
шаре.
62 —
А потребляется нефти ежегодно во всем мире примерно
в четыре раза меньше, чем каменного угля. Если даже по-
требление нефти останется на том же уровне., что в настоящее
время, то все же запасы нефти будут во много раз скорее
истощены, чем каменного угля.
Запасов нефти хватит человечеству еще на сотни лет, так
как все время открываются новые месторождения, тем не
менее, ученые уже давно стали задумываться над тем, как
найти заменители нефти.
Особенно энергично стали работать ученые и инженеры
над созданием искусственного жидкого топлива в тех стра-
нах, где нет вовсе нефти. В ка- ....
честве источника получения Схема получения синтетического
искусственной нефти ученые
решили использовать каменный уголь. На
первый взгляд может показаться, что
нет ничего общего между куском черного
угля и каплями прозрачного бензина. Од-
нако изучение химического состава нефти
и каменного угля показало, что они близ-
кие «родственники».
В обоих веществах содержатся четыре
основных элемента: углерод, водород,
кислород и азот. Больше всего содержит-
ся углерода и водорода, однако процент-
ное содержание этих элементов в угле и
нефти различно. Например, в каменном
угле на одну часть водорода приходится
от 15 до 20 частей углерода, в сырой неф-
ти в 2—3 раза меньше — только 6,5 час-
тей углерода, а в бензине еще меньше —
5,7 частей углерода на одну часть водо-
рода.
Следовательно, рассуждали ученые,
для того чтобы уголь сделать жидким, на-
до прежде всего изменить соотношение
между атомами углерода и водорода так,
чтобы оно не превышало 6,5: 1 или даже
было бы еще меньше, т. е. насытить уголь
водородом.
Оказалось, что нужное количество во-
дорода можно присоединить к атомам
углерода, пользуясь услугами верных по-
мощников химиков — высокой температу-
ры и большого давления. Такой способ
превращения угля в жидкое топливо в тех-
- 63 —
нике называют гидрогенизацией (от латинского слова — гид-
рогениум— водород). Уголь измельчают в порошок, смеши-
вают с тяжелыми маслами, которые получают также из угля
при сухой перегонке, в густую пасту. Мощные насосы, рабо-
тающие под высоким давлением, подают смесь в аппарат,
называемый теплообменником. Здесь к пасте добавляют во-
дород и ее подогревают.
Подогретая смесь переходит в высокую стальную башню —
реакционную колонну. В этой башне, высотою в пятиэтажный
дом, весом почти в 100 тонн, паста превращается в жидкость.
Сложные молекулы веществ, образующих уголь под дей-
ствием высокой температуры — 500 градусов — и огромного
давления — 700 атмосфер, разрушаются, распадаясь на от-
дельные части. К «осколкам» присоединяются атомы водоро-
да, образуются новые молекулы.
Для того чтобы уголь стал жидким, мало дать большое
давление и создать в реакторе высокую температуру, нужно
обеспечить правильное соотношение между водородом и уг-
леродом в угольной пасте.
Но и этого еще недостаточно. Большое значение имеют
размеры и «конструкция» вновь образующихся молекул.
В них должно быть не менее пяти атомов углерода.
Строить молекулы нужной архитектуры помогают катали-
заторы, чаще всего окись железа, которую в виде тонкого по-
рошка подмешивают к угольной пасте.
Жидкость, полученная из угольной пасты, в реакторе под-
вергается дальнейшей переработке. Ее направляют в разде-
литель, в этом аппарате части жидкости с более высокой
температурой кипения отделяются от паров более легких
фракций, воды и катализатора.
Пары более легких частей жидкости отводят в холодиль-
ник, отделяют от них газы и сгущают. Жидкость, полученную
в холодильнике, подвергают перегонке. При этом извлекает-
ся уже небольшое количество бензина. Большая же часть
этой жидкости — среднее и тяжелое масло — направляется
в другой реактор. Здесь к ней добавляют немного водорода и
продолжают нагревание, но уже при меньшем давлении и
температуре. Среднее масло в процессе вторичной гидрогени-
зации, как называют производственники эту операцию, прев-
ращается в бензин. Тяжелое масло, которое находится в ос-
татке, поступает обратно в смеситель, где приготовляется
угольная паста.
Бензин, получаемый при вторичном гидрировании, еще
содержит газы и примеси неполностью прореагировавшего
с водородом среднего масла. Поэтому пары из реактора сна-
чала пропускают через холодильник, где они сгущаются
— 64 —
в жидкость, и сепаратор, в котором происходит отделение
газов — пропана, бутана. Эти газы затем используются для
получения многих ценных химических продуктов. Теперь
еше нужно отделить примеси среднего масла. Для этого жид-
кость подвергают еще раз перегонке, выделяют чистый бен-
зин, а остаток направляют снова на гидрогенизацию.
Поступая таким образом, удается около 85 процентов со-
держащегося в каменном угле углерода превратить в жидкое
топливо, т. е. получить из одной тонны угля 800—850 кило-
граммов искусственного бензина и других видов моторного
топлива.
Для гидрогенизации одной тонны каменного угля требует-
ся около ста килограммов водорода.
Бензин и другие виды жидкого топлива химики научились
получать не только непосредственно из твердого угля, но и
из каменноугольной смолы.
Уголь загружают в специальную печь и там нагревают без
доступа воздуха до 500—600 градусов. Под действием тепла
выделяется каменноугольная смола и горючий газ. В остатке
накапливается твердое черное вещество — полукокс. Такой
процесс сухой перегонки угля называется полукоксованием,
в отличие от коксования угля, когда уголь накапливается
в камерах при температуре свыше 750 градусов.
Если обычная каменноугольная смола — это густая ма-
слянистая жидкость почти черного цвета, то смола, которая
получается при полукоксовании — темно-коричневого или зо-
лотисто-красного цвета, легче по весу и отличается по
запаху.
По своему составу она гораздо ближе к нефти, чем твер-
дый уголь. В ней на одну часть водорода приходится восемь
частей углерода.
Для того чтобы получить из смолы бензин, керосин, ди-
зельное масло и другие виды искусственного жидкого топли-
ва, ее подвергают обыкновенней перегонке. Однако прежде
всего надо удалить из смолы фенолы, органические вещества,
в состав которых входит кислород. Они являются химическим
сырьем — из них изготовляются пластмассы, краски, взрыв-
чатые вещества.
При перегонке смолы удается получить до 50—60 процен-
тов жидкого топлива от веса смолы. В реторте остается гу-
стая, как тесто, масса — пек. Но и эта масса не пропадает
даром. Из пека делают дорожные покрытия, применяют для
производства толя. Еще больше можно извлечь жидкого топ-
лива из смолы, если ее подвергнуть гидрогенизации — почти
всю смолу удается превратить в ценную жидкость.
Огромны нефтяные ресурсы Советского Союза. Почти
6 Б Я. Розен
— 65 —
половина мировых запасов нефти скрыта в недрах Кавказа и
Средней Азии, Башкирии и Поволжья, Прикамья и Припе-
чорья. Несмотря на то, что нефти много в нашей стране,
производство «жидкого» угля имеет и для нас важное значе-
ние. Есть много областей в Советском Союзе, которые дале-
ко расположены от нефтяных промыслов. Бензин и нефтепро-
дукты будут стоить лгам в несколько раз дороже, чем на ме-
стах добычи нефти.
Залежи же угля встречаются гораздо чаще, чем месторож-
дения нефти. Они есть почти в каждой нашей республике,
в каждом крае — на Юге и на Севере, на Западе и на Востоке.
Значит, превращая уголь в жидкое искусственное топли-
во, можно освободить транспорт от ненужных перевозок, со-
кратить расходы на перевозку горючего.
Превращать в жидкое топливо можно любой уголь, даже
самого низкого качества, который не может быть использо-
ван для металлургических заводов. А такой уголь имеется
у нас почти во всех районах и областях.
Вот потому Коммунистическая Партия и Советское Пра-
вительство уделяют большое внимание развитию производст-
ва жидкого искусственного топлива в нашей стране.
?&&&& й З'й'ЛЙ
ХИМИЯ АКТИВНЫХ
МОЛЕКУЛ
0 небольшом китайском городке Ланьч-
жоу 31 декабря 1956 г. с раннего утра
царило неописуемое возбуждение. По
обычно малолюдным улицам в сторону северных ворот дви-
гались какие-то повозки, шли небольшие группы горожан.
Необычное волнение, охватившее тихий город в это мо-
розное декабрьское утро, имело веские основания. В близле-
жащем горном кряже должны были открыть новый карьер
для добычи залегающих в недрах гор полезных ископаемых.
На одном из высоких холмов, расположенных к северу от
Ланьчжоу, разместилась группа китайских горняков и совет-
ских специалистов-консультантов, окруженная плотным
кольцом горожан, прибывших на торжество.
«Напряженные взоры всех присутствующих были направ-
лены вдаль,— рассказывает один из очевидцев.— Вдруг из-
за гряды гор, в километрах 12 от холма, как будто начал ра-
сти новый горный хребет. Зазубренные вершины его стреми-
тельно поднимались все выше и выше, а достигнув высоты
6
— 67 —
примерно шестисот метров, стали вытягиваться словно лепе-
стки гигантского цветка. Сказочные лепестки оперлись свои-
ми концами на горы, и в местах их соприкосновения с Землей
в воздух стали подниматься облака пыли. В этот момент
земля глухо и сильно содрогнулась, а затем послышался
грозный рокот взрыва.
Так произошел величайший в истории человечества взрыв,
осуществленный для мирных целей».
Применение взрывчатых веществ в горном деле для раз-
рушения массивов гор и рудных залежей имеет давнюю исто-
рию. Еще в XVII в.— в 1627 г.— тирольский горняк Вейндл
воспользовался черным порохом для подрыва пластов руды
в шахтах. Спустя два года дымный порох стал. применяться
для взрывных работ в горном деле в Чехии, а позднее и
в других странах.
В XIX в. на смену черному пороху пришли динамит, ам-
монал и другие взрывчатые вещества.
Но никогда еще не закладывали сразу столько взрывчат-
ки, не взрывали такого огромного количества камня, как
в Ланчьжоу.
Три тысячи грузовиков взрывчатки были доставлены к ме-
сту взрыва. Взрывом было поднято в воздух и выброшено
около двух миллионов тонн горной породы.
Силой взрыва было разрушено около восьми миллионов
кубометров горной породы. После взрыва образовалась во-
ронка глубиною более ста метров и диаметром в полки-
лометра.
При больших взрывах, применяемых для разрушения гор-
ных кряжей, создания котлованов или каналов иногда жела-
тельно, чтобы горная порода или грунт, взлетающие в воздух,
отбрасывались бы только в одну какую-нибудь сторону. Та-
кой взрыв называют в технике направленным.
При подготовке направленного взрыва в грунт или в гор-
ную породу закладывают два ряда зарядов. Первый ряд со-
стоит из слабых зарядов, второй ряд — из более сильных.
Сначала взрывают более слабые заряды, которые дробят,
подбрасывают вверх грунт. Спустя 2—3 секунды взрывают
второй ряд зарядов.
Мощная взрывная волна отбрасывает поднятые вверх мас-
сы породы в желательном направлении.
За последние годы направленным взрывом стали пользо-
ваться и при гидротехнических работах — при постройке пло-
тин, молов, портовых сооружений. Пригодились они и для
борьбы с паводками на реках. Взрывы помогают нам быстрее
добывать уголь, извлекать из недр земли ценные металлы,
каменную соль, строительный камень.
— 68 —
Подсчитано, что угольная промышленность ежегодно рас-
ходует во всем мире более ста тысяч тонн взрывчатых
веществ.
За годы пятилеток на крупных реках^ нашей Родины —
Волге, Каме, Днепре появились мощные гидроэлектростан-
ции, которые дают миллиарды киловатт электроэнергии
фабрикам и заводам, колхозам и совхозам.
В текущей семилетке войдут в строй новые гигантские
гидроэлектростанции в восточных районах Союза: Иркутская
и Братская (первая очередь) на Ангаре, Красноярская на
Енисее.
На карте Советского Союза появились новые моря и ка-
налы. Волго-Донской канал имени В. И. Ленина превратил
столицу нашей Родины — Москву в порт пяти морей: Белого,
Балтийского, Черного, Азовского и Каспийского.
Главный Туркменский канал протяжением более тысячи
километров превратит черные пески пустыни в плодородные
поля и цветущие сады.
И в каждой из этих строек, осуществленных и осущест-
вляемых в нашей стране, взрыв служит неизменным помощ-,
ником гидротехников и строителей.
Взрыв, позволяющий на небольшом пространстве создать
огромную силу удара, приложить на небольшом участке
грандиозную мощность, широко используется современной
техникой и при строительстве жилых домов и общественных
зданий, прокладке дорог и сооружении рельсовых путей.
Взрывные методы находят себе применение и в нефтяной,
и в металлургической и машиностроительной промышлен-
ности.
Когда нефтяная скважина перестает давать нефть, то ее
теперь не забрасывают, а «оживляют» с помощью взрыва. На
дне скважины закладывают заряд взрывчатки и подрывают.
В скважине вновь появляется нефть. Взрыв помог вернуть
в строй много буровых скважин, которые считались нефтяни-
ками уже выработанными.
В доменных печах при выплавке чугуна из руды иногда
образуются «козлы», т. е. большие глыбы застывшего метал-
ла. «Козлы» нарушают нормальную работу печи, могут даже
вызвать аварию. Как же избавиться от «козлов»? Можно ос-
тановить печь и извлечь их оттуда. Это слишком сложно и
дорого. Гораздо проще и быстрее пробурить в «козле» не-
большие отверстия, заложить в них патроны взрывчатки и
взорвать их. Взрыв разобьет глыбу металла на мелкие ку-
сочки, но не причинит никакого вреда самой печи.
При постройке судов и самолетов часто приходится ус-
танавливать большое количество заклепок, исчисляемое
— 69 —
сотнями тысяч и даже миллионами. Обычный способ клепки
требует много времени и является весьма трудоемким.
Изобретатели уже давно задались целью
облегчить эту длительную и трудоемкую
операцию. Помог взрыв. Ведь силу взрыва
можно регулировать. Можно создавать ги-
гантские взрывы, когда нужно разрушать
горы, рыть котлованы, прокладывать кана-
лы. Можно создавать и совсем миниатюр-
ные взрывы.
При взрывном способе клепки в цилин-
дрическом конце заклепки помещается в уг-
лублении небольшой заряд взрывчатого ве-
щества. Заклепки вставляют в отверстия
в металлических листах. Рабочий разогре-
вает металлический стержень и по очереди
прикладывает к головке заклепки. Стер-
жень разогревает заклепку, под действием
тепла заряд взрывается. Взрыв расширяет
цилиндрический конец заклепки, и она ока-
зывается прочно закрепленной в своехМ
гнезде.
Неоценимые услуги оказывает взрыв
геологам при разведке полезных ископае-
; мых. Не одно новое месторождение нефти,
каменного угля, металлических руд было
открыто с помощью взрыва. В районе пред-
полагаемой залежи в земле выкапывают не-
глубокие ямки. В них закладывают неболь-
шие заряды взрывчатого вещества. Когда за-
ряды взорвутся, то они вызовут распростра-
нение волн, подобно волнам, возникающим
при землетрясении. Взрывные волны, встре-
чая на своем пути горные породы, пласты угля или каменной
соли, отражаются от них и возвращаются на поверхность зем-
ли. Однако отражаются они по-разному в зависимости от плот-
ности породы. Распространение взрывной волны и ее отраже-
ние регистрируется специальными чувствительными прибора-
ми. По характеру кривых, полученных с помощью этих
приборов, опытный глаз специалиста легко может определить,
есть ли в данном районе месторождение полезных ископаемых.
Много убытков народному хозяйству приносят лесные по-
жары. Иногда из-за брошенного окурка папиросы, незату-
шенных углей костра гибнут огромные массивы леса. Вспых-
нувший в лесу пожар трудно быстро потушить, особенно
летом в жаркую и сухую погоду.
— 70 —
Лучшим средством борьбы с огнем является взрыв. С по-
мощью взрыва можно в максимально короткие сроки создать
широкие просеки, которые преграждают путь бушующему
в лесной чаще пламени.
Еще несколько десятков лет назад, когда скопившийся при
ледоходе в верховьях рек лед мешал сплаву леса, его пилили
пилами. Можно себе представить, сколько времени и труда
затрачивалось на такую трудоемкую операцию. А теперь до-
статочно нескольких часов и некоторого количества взрывча-
того вещества, чтобы расчистить ледяные заторы.
Неминуемая гибель грозит кораблю, затертому во льдах
суровой Арктики. Мощные льдины с огромной силой сжимают
корпус судна и вот-вот его раздавят. Но отважные моряки,
закаленные в борьбе с грозными стихиями природы, смело
вступают в бой со льдом. Они закладывают в ледяном поле,
окружающем корабли, небольшие заряды взрывчатки, и
вскоре воздух потрясают разрывы, напоминающие грохот ар-
тиллерийских орудий. Эхо разносит тысячеголосый гул по
ледяным просторам. Взрыв расчищает путь кораблю, уверен-
но идущему вперед к чистой воде.
Верный помощник и друг человека, взрыв иногда превра-
щается в его злейшего врага.
Был знойный июльский полдень. Палящие лучи солнца не-
стерпимо жгли лицо, шею, руки. Жители испанского портово-
го города Сантандер, как и жители многих других южных
городов, укрывались от зноя в прохладных стенах белых до-
мов, спасались от жары в тенистых садах.
Вдруг со стороны моря показался огромный столб пламе-
ни, заволакиваемый густым черным дымом.
Многие горожане бросились на набережную, чтобы разуз-
нать в чем дело; собралась большая толпа.
Неподалеку от мола горел пароход, пришедший с грузом
железа и динамита. Когда начался пожар, на берег спешно
были выгружены ящики с динамитом. Представитель паро-
ходства, наблюдавший за разгрузкой, заявил портовым вла-
стям, что динамит выгружен полностью. Пароход продолжал
гореть, а толпа зевак на набережной все увеличивалась.
Вдруг, часа через два после начала пожара, раздался оглу-
шительный взрыв. Полкорабля взлетело на воздух, разбра-
сывая тысячи осколков. Пятьсот убитых и почти в два раза
больше тяжелораненых — таков результат этой катастрофы.
— 71 —
Произведенным расследованием было установлено, что
причиной взрыва корабля был недосмотр пароходного агента,
забывшего выгрузить несколько ящиков с динамитом.
Еще более ужасный взрыв произошел в сентябре 1921 г.
на германском химическом заводе в Оппау. На этот раз при-
чиной катастрофы было даже не взрывчатое вещество, а обык-
новенная удобрительная смесь, состоящая из безобидных со-
лей— аммиачной селитры и сернокислого аммония
На заводе производили удобрительную смесь в течение все-
го года, а отправляли ее потребителям только осенью. Поэто-
му готовый продукт длительное время хранился на заводских
складах. Аммиачная селитра, которая является весьма цен-
ным удобрением, обладает большим недостатком — она сле-
живается и становится плотной монолитной массой.
Когда наступила осень и пришло время отгрузить удобри-
тельную смесь заказчикам, то оказалось, что она преврати-
лась в огромную глыбу. Сначала попробовали ломами и кир-
ками откалывать куски и дробить их. Однако это потребова-
ло бы слишком много времени для разгрузки складов. Тогда
решили подорвать слежавшуюся смесь, предварительно про-
верив, не взрывается ли она сама. Испытания дали отрица-
тельный результат. Бригада подрывников немедленно присту-
пила к работе.
Утром 21 сентября подрывники, как обычно, заложили
в толщу застывшей глыбы патроны взрывчатки и подожгли
бикфордов шнур. И вдруг раздался оглушительный взрыв, в
воздух взлетели склад и весь завод. Большие разрушения бы-
ли произведены взрывом и в городке. От завода остались одни
руины, а на месте склада образовалось озеро — шириной око-
ло 100 метров и глубиной Почти в двадцать метров. От взры-
ва погибло свыше пятисот человек.
Произведенное расследование не смогло обнаружить при-
чину взрыва. Лишь спустя несколько лет исследования удоб-
рительной смеси показали, что при некоторых условиях —
определенной влажности воздуха, температуре — она может
взорваться сама по себе.
В прошлом веке химики создали бездымный порох. Может
показаться невероятным, что основой новой взрывчатки стали
безобидные, тонкие, пушистые волоконца хлопка.
Хлопковое волокно обработали смесью азотной и серной
кислот, тщательно промыли его и подсушили. Получилось
новое вещество—нитроцеллюлоза, или нитроклетчатка!,
1 При нитрации, как называют в технике подобную обработку, обра-
зуется наряду с нитроклетчаткой вода, которая задерживает процесс, по-
этому и применяют серную кислоту, обладающую способностью погло-
щать воду.
— 72 —
легко взрывающееся от удара и нагревания. В чем причина
столь неожиданного превращения? Ответ на этот вопрос дает
химия.
Хлопок представляет собой почти чистую клетчатку, или
целлюлозу. В молекулах целлюлозы много атомов углерода
и водорода, а в азотной кислоте много атомов кислорода.
Когда целлюлозу обрабатывают азотной кислотой, то про-
исходит химическая реакция. В молекулу целлюлозы внед-
ряются атомы азота и кислорода. Количество атомов кисло-
рода увеличивается. Однако ато-мы кислорода, находящиеся
в окислах азота, связываются с атомами углерода в молекуле
нитроцеллюлозы непрочно, потому что они связаны не непос-
редственно, а через атом азота. При ударе или нагревании
эта связь легко разрывается, атомы кислорода отрываются
от атомов азота и соединяются <с атомами водорода и угле-
рода. Образуется углекислый газ и вода (которые являются
более прочными соединениями). Когда происходит взрыв, вы-
деляется огромное количество тепла — температура достигает
3500 градусов. Газы и пары, образующиеся при разложении
нитроклетчатки, создают давление, доходящее до ста тысяч
атмосфер.
В производстве бездымного пороха пользуются пирокси-
лином, нитроклетчаткой, в которой содержится 12,5—13,5 про-
центов азота Г
Еще более совершенный вид бездымного пороха был раз-
работан великим русским химиком Д. И. Менделеевым. Он
назвал его пироколлодийным порохом. Как это часто случа-
лось со многими открытиями русских ученых в царской Рос-
сии, открытие Д. И. Менделеева не нашло себе ни признания,
ни применения у себя на родине. Зато его с успехом исполь-
зовали американцы, организовавшие крупное производство
пироколлодийного пороха на военных заводах США.
В наш век источником получения сильных взрывчатых ве-
ществ, кроме клетчатки, стали многие органические жидкости:
толуол, нитробензол, соли азотной и гремучей кислот1 2. Сырь-
1 Нитроклетчатку с содержанием 11—1'2% азота называют коллоксили-
ном. Она применяется в производстве искусственного шелка, пластмасс.
2 Органическая кислота с запахом миндального масла. В состав моле-
кулы входит водород, кислород, углерод и азот. Соли этой кислоты легко
разлагаются и взрываются, поэтому ее назвали «гремучая кислота».
5 Б я. Розен
— 73 —
Образование продуктов
при взрыве нитроглице-
рина (схема)
ем служат и различные измельченные
в порошок горючие вещества: камен-
ный уголь, торф, древесные опилки.
Если пропитать их жидким кислородом,
то они приобретают способность взры-
ваться при ударе или поджигании. Их
называют оксиликвитами и широко
используют на подрывных рабо-
тах.
Основой сильных взрывчатых ве-
ществ стала бесцветная, напоминаю-
щая сахарный сироп, сладковатая
жидкость — глицерин. Она хорошо
знакома текстильщикам и кожевни-
кам, мыловарам и печатникам. Издав-
на пользуются глицерином при приго-
товлении различных косметических
средств благодаря его способности
смягчать кожу.
Сто десять лет назад итальянский
химик Асканио Собреро, смешав гли-
церин с азотной и серной кислотами,
получил густую, похожую на расти-
тельное масло, жидкость. Ее назвали
нитроглицерином, потому что в ее
молекулах содержатся нитрогруппы.
Достаточно слабого удара или легко-
го нагревания, чтобы эта жидкость взорвалась бы со страшной
силой.
Взрывчатые свойства нитроглицерина обусловлены, как и
в нитроклетчатке, присутствием в его молекулах непрочно свя-
занного кислорода, который стремится соединиться с углеро-
дом и водородом.
Нитроглицерином заинтересовались артиллеристы и гор-
няки. Но пользоваться им в жидком виде неудобно. Стали
смешивать нитроглицерин с некоторыми твердыми вещест-
вами.
Около ста лет назад русский артиллерист В. Ф. Петру-
шевский приготовил динамит, смешав 75 процентов нитрогли-
церина и 25 процентов магнезии.
Примерно в те же годы известный шведский инженер-изо-
бретатель А. Нобель предложил заменить магнезию более
удобным и дешевым материалом — инфузорной землей. Это
темно-серый порошок, состоящий из остатков панцирей низ-
ших водорослей. Он прекрасно поглощает и удерживает
нитроглицерин.
— 74 —
Позднее были (разработаны и другие сорта динамита. Не-
которые сорта нитроклетчатки с определенным количеством
азота пропитывали нитроглицерином.
Получалась пластическая масса, похожая на желатин.
К ней добавляли селитру, древесную муку и другие примеси.
Добавки удешевляют динамит и снижают его слишком боль-
шую взрывную силу.
Динамит ввцду слишком сильного дробящего действия
непригоден для снаряжения боеприпасов — снарядов, патро-
нов, млн. Непригоден и нитроглицерин. Но если нитроклет-
чатку растворить в нитроглицерине, то получается бездым-
ный порох. Приготовление нитроглицеринового пороха гораз-
до проще и в несколько раз быстрее, чем пирокосилинового
пороха.
Сильным взрывчатым веществом служит и тротил. Тротил,
или тринитротолуол, получают, обрабатывая смесью азотной
и серной кислот толуол — бесцветную органическую жидкость,
образующуюся при сухой перегонке каменного угля. Тысячи
тонн толуола получаются при производстве кокса для метал-
лургических заводов.
Наряду с толуолом на коксохимических заводах при раз-
гонке каменноугольной смолы добывается и фенол — белое
кристаллическое вещество, хорошо известное читателям под
названием карболовой кислоты.
Белые кристаллики карболки служат основой производ-
ства многих лекарств и пластмасс. При взаимодействии
с азотной кислотой они превращаются в светло-желтый поро-
шок пикриновой кислоты, которая по силе взрыва превосхо-
дит тротил.
Имеется много органических жидкостей и твердых ве-
ществ, которые обработкой азотной кислотой могут быть пре-
вращены во взрывчатые вещества. Однако большинство из
них обладают малой химической стойкостью, быстро разла-
гаются, обращение с ними чрезвычайно опасно, потому они
не находят пока практического применения.
Тротил, пикриновая кислота, тринитробензол и другие
сходные с ними взрывчатые вещества содержат в своих моле-
кулах гораздо меньше атомов кислорода, чем нужно для
полного окисления атомов углерода и водорода, имеющихся
в молекулах.
Так, например, в тринитротолуоле имеется всего шесть
атомов кислорода, а нужно шестнадцать с половиною. Ведь
на каждый атом углерода для окисления его в углекислый газ
нужно два атома кислорода, а для превращения водорода
в воду расходуется пол-атома кислорода на каждый атом
водорода. Следовательно, если увеличить число атомов кисло-
5*
— 75 —
рода и нитрогрупп в молекулах подобных взрывчатых веществ,
то тем самым можно повысить их взрывную силу.
Как же это можно сделать? Можно в их молекулы (ввести
еще одну, четвертую нитрогруппу. Но сделать это нелегко.
Оказалось, что при обычной обработке смесью крепкой азот-
ной и серной кислот четвертая нитрогруппа не внедряется
в молекулу. А если ее удается присоединить с помощью других
способов, то она держится в молекуле непрочно и легко отры-
вается, особенно при соприкосновении взрывчатого вещества
с водой.
Но химики не отказались от мысли внести в молекулы уг-
леводородов, способных после нитрации взрываться, большее
число нитрогрупп. И попытки их В' конце концов увенчались
успехом. Они прибегли к своебразной хитрости. Они поста-
рались внедрить нитрогруппу так, чтобы она не была прямо
связана с атомом углерода, а была соединена с ним через
атом азота. Теперь уже нитрогруппа прочно «сидела» в моле-
куле углеводорода.
В поисках новых взрывчатых веществ химики стремятся
не только к повышению их стойкости, увеличению взрывной
силы, уменьшению чувствительности к удару и нагреванию,
но и к использованию более дешевых и доступных источников
сырья.
Газы, которые получаются при переработке нефти, в по-
следние десятилетия стали для химиков неиссякаемой «кладо-
вой». Особенно широко используются в промышленности
ацетилен и этилен.
Оказалось, что из этилена при обработке его азотной ки-
слотой получаются сильные взрывчатые вещества, обладаю-
щие удовлетворительной химической стойкостью.
Все взрывчатые вещества независимо от своего .происхож-
дения и типа при взрыве превращаются в газы. Такое пре-
вращение, как и в реакциях горения топлива, сопровождается
выделением большого количества тепла. При взрыве, как и
ири горении, атомы углерода и водорода соединяются
с атомами кислорода и образуют углекислый газ и водяной
пар. Наряду со сходством есть и существенное различие
между горением и взрывом. Горение происходит медленно,
а химическая реакция при взрыве протекает с невероятной
быстротой, почти мгновенно. Иногда бывает достаточно
— 76 —
тысячных долей секунды,
чтобы взорвать тонну взрыв-
чатого вещества.
В чем причина столь
огромной скорости реакций
при взрыве? Ведь они почти
одинаковы с реакциями, ко-
торые протекают при горе-
нии разнообразных горю-
чих веществ—нефти, торфа,
дерева. Исчерпывающий от-
вет на этот вопрос дали ис-
следования ряда выдающих-
ся зарубежных и советских
химиков.
В конце прошлого века
голландский химик Вант
Гофф заинтересовался яв-
лениями самовозгорания и
самовоспламенения. Неред-
ко на заводских дворах за-
горались кучи угольной пы-
ли, вспыхивали штабеля
Якоб Гендрик Вант-Гофф
(1852—1911 гг.)
торфа, воспламенялись влажные опилки. Иногда на складах,
где хранились растительные жидкие масла вспыхивали без
видимой причины пожары. В стогах и скирдах на полях го-
рели сено и солома.
Ученый выяснил причину самовозгорания подобных ве-
ществ. Оказалось, что все дело в том, что химическая реакция
окисления происходит при температурах, значительно более
низких, чем при обычном горении. Например, в штабеле угля
окисление начинается при 15—20 градусах. Окисление вызы-
вает разогревание угля. Температура все больше повышается,
а с повышением температуры ускоряется реакция окисления.
Наконец скорость окисления становится такой большой, что
вспыхивает огонь L
При самовозгорании торфа, сена, соломы разогревание
сильно ускоряется бактериями и микроорганизмами. Они бы-
стро размножаются в большие колонии и выделяют при ды-
хании много тепла. Как торф, так и сено и солома и другие
растительные продукты, плохо проводят тепло. Оно остается
внутри куч и разогревает их до температуры горения.
1 Каменный и древесный уголь, как и некоторые другие твердые веще-
ства, обладают большой поверхностью и способны поглощать пары и газы,
которые сжижаются в их порах. При этом выделяется тепло, которое так-
же способствует разогреванию.
— 77 —
Изучая поведение различных веществ, способных к само-
возгоранию, Вант-Гофф сделал чрезвычайно важное открытие.
Он заметил, что при повышении температуры на каждые
десять градусов скорость химической реакции возрастает
в два-три раза. Если увеличить температуру еще на десять гра-
дусов, то скорость реакции повысится в 2x2 = 4 раза, при
возрастании температуры на тридцать градусов — в 2Х2Х
X 2 = 8 раз, а при повышении на сорок градусов — в 16 раз.
А когда температура достигнет точки кипения воды, т. е.
ста градусов, то скорость превращения веществ, участвующих
в реакции, изменится в 210 раз, т. е. в 1024 раза.
Открытие Вант-Гоффа нашло широкий отклик среди уче-
ных разных стран и специальностей. Виднейшие физики от-
мечали в своих трудах, что нет в природе другого такого про-
цесса, который бы так быстро изменялся с повышением тем-
пературы, как химическая реакция.
В многочисленных работах химиков открытие Вант-Гоффа
склонялось на сотни ладов и ему приводились все новые и но-
вые подтверждения.
Открытием голландского химика заинтересовались биологи
и медики. Теперь стало ясно, писали биологи, почему тепло-
кровные животные победили холоднокровных в борьбе за
жизнь. Ведь в их теле химические реакции протекают значи-
тельно быстрее. А врачи нашли теперь правильное объясне-
ние действию повышенной температуры на больных.
Однако ни физики, ни биологи, ни врачи, ни химики не
могли понять, почему скорость реакции увеличивается гораздо
быстрее, чем повышается температура. Например, когда тем-
пература увеличивается в десять раз от 10 до 100 градусов,
скорость реакции увеличивается в 500 с лишним раз, а от ста
до тысячи градусов — в миллиард раз. Как же объяснить эту
странную на первый взгляд закономер-
ность?
«Весь окружающий нас мир — цве-
ты и деревья, песок и камни, вода и
воздух — состоит из мельчайших неде-
лимых частиц — атомов», — говорил
греческий ученый Демокрит, живший
в пятом веке до нашей эры.
Атомы в различных веществах сое-
диняются в более крупные частицы —
молекулы.
Атомы и молекулы настолько ма-
лы, что их не только нельзя увидеть
простым глазом, но они даже не вид-
ны в самые сильные микроскопы.
— 78 —
Если все молекулы, которые находят-
ся в капле воды, вытянуть в ленту,
толщиной в одну молекулу, то такой
лентой можно было бы опоясать земной
шар несколько тысяч раз.
Сто миллионов атомов водорода мож-
но уложить на нитке, длиною в 1 санти-
метр.
Несмотря на свои ничтожно малые
размеры атом имеет очень сложное уст-
ройство.
В 1827 г. английский ботаник Броун,
рассматривая под микроскопом кусочек
стебля какого-то растения, заметил, что
в его соке непрерывно и беспорядочно
движутся мельчайшие частички. Ученый
заинтересовался этим явлением. Ему за-
хотелось узнать, что вызывает «пляску»
этих частичек, какие силы заставляют их
беспорядочно двигаться в разных на-
правлениях.
Он поместил на стеклышко каплю во-
Броуновское
движение
ды, в которой были взмучены частички
твердого «неживого» вещества — глины.
Оказалось, что и эти «неживые» частички ни секунды не оста-
ются в покое. Они непрерывно налетают друг на друга, раз-
бегаются в разные стороны и снова сталкиваются в беспоря-
дочной пляске. Целые дни проводил ученый у микроскопа, но
ни разу не заметил, чтобы частички прекратили свое суетли-
вое движение.
Броун умер так и не найдя ответа. Спустя полвека ученые
поняли, что хаотическое движение частиц в капле жидкости
происходит под влиянием толчков, получаемых от молекул
этой жидкости.
Молекулы никогда не остаются в покое. Они вечно движут-
ся в разных направлениях и притом с огромной скоростью.
Если тело нагреть, то его частицы ускоряют свое движе-
ние. Они все чаще и сильнее сталкиваются друг с другом.
Химики давно знали, что вещества взаимодействуют друг
с другом тем скорее, чем чаще сталкиваются между собой их
молекулы. Молекулы же газов и жидкостей сталкиваются тем
чаще, чем быстрее они движутся. В то же время при повыше-
нии температуры скорость реакции возрастает гораздо быст-
рее, чем скорость движения молекул.
Известно, что скорость движения молекул весьма велика.
При обычной комнатной температуре молекулы углекислого
— 79 —
Скорость движения молекулы
водорода
газа мчатся со скоростью 372 мет-
ра в секунду. Скорость молекул
водяного пара еще выше —
582 метра в секунду, а скорость
молекул водорода— 1740 метров
в секунду, но это их средняя ско-
рость.
Английский ученый Максвелл
выяснил, что молекулы движутся
не с одинаковой скоростью. Сре-
ди них есть отдельные сверхбыст-
рые молекулы, которые мчатся
так, как будто вещество нагрето
не на 10—20 градусов, а на не-
сколько тысяч градусов. При по-
вышении температуры количество
таких сверхскоростных молекул
быстро увеличивается. Другой
ученый, сделавший ряд ценных
открытий в химии, Аррениус до-
казал, что в реакцию же вступа-
ют не все молекулы, а главным
образом «сверхбыстрые»1.
Вот почему скорость химиче-
ской реакции возрастает быст-
рее, чем повышается темпера-
тура.
Такие молекулы стано»вятся
теми точками, или центрами, во-
круг которых разгорается хими-
ческая реакция. Они были назва-
ны активными. Чем больше образуется активных молекул, тем
быстрее соединяются между собой вещества.
Если тысяча активных молекул столкнется с тысячей дру-
гих молекул, то получится тысяча молекул нового вещества,
а если две тысячи активных молекул столкнутся с двумя ты-
сячами других молекул, то получится две тысячи молекул но-
вого вещества.
Казалось, что это непреложный закон, что здесь все так
же ясно, как в таблице умножения.
В 1913 г. немецкий химик Боденштейн проводил исследова-
ние взаимодействия хлора с водородом на свету. Как и при
1 Такие молекулы обладают в момент столкновения большой энергией
(имея повышенный запас внутренней энергии), т. е. находятся в возбуж-
денном состоянии.
— 80 —
нагревании, активные молекулы образуются при поглощении
порций или квантов солнечного света.
Выдающийся физик нашего времени Альберт Эйнштейн,
впервые обнаруживший, что при химических реакциях на све-
ту поглощение света происходит квантами, считал, что каж-
дая молекула поглощает только один квант.
Следовательно, сколько будет поглощено при разложении
или соединении веществ квантов света, столько будет и новых
молекул.
Количество поглощенных квантов света нетрудно подсчи-
тать, измерив частоту падающего света и время освещения.
Точно так поступил и Боденштейн, желая определить ко-
личество образовавшихся молекул хлористого водорода.
Но когда он стал подсчитывать результаты реакции, то он,
к своему удивлению, обнаружил странное явление. Иногда на
один квант поглощенной энергии «рождалась» тысяча моле-
кул, иногда — десять тысяч.
Химики, изучавшие вслед за Боденштейном другие реак-
ции на свету, отмечали, что в некоторых случаях вместо одной
ожидаемой молекулы при поглощении кванта света «рожда-
лось» пятьдесят и даже сто тысяч.
Теория Аррениуса не могла объяснить этого загадочного
явления.
Боденштейн создал новую теорию. Он пришел к выводу,
что молекулы могут передавать свою энергию друг другу, а
потому один квант энергии может сделать активными сотни и
тысячи молекул.
Точно так же при химических реакциях, ускоряющихся при
нагревании, энергия от одной возбужденной молекулы пере-
дается другим. Активная молекула порождает много подоб-
ных ей молекул.
Изучая химическую реакцию соединения хлора с водоро-
дом на свету, ученые обратили внимание, что молекулы хло-
ра, поглощая квант света, сначала распадаются на свобод-
ные атомы (молекулы хлора состоят из двух атомов). Они
энергичнее вступают в реакцию, чем нераспавшиеся молеку-
лы. Это происходит потому, что они имеют свободную валент-
ность, т. е. они ненасыщены.
Свободный атом хлора вступает в реакцию с молекулой
водорода (она тоже состоит из двух атомов) и отнимает у нее
один атом, образуя хлористый водород, освобожденный атом
— 81 —
Схема разветвленной
цепной реакции (на при-
мере реакции окисления
водорода)
водорода сталкивается с молекулой
хлора, разрушает ее и забирает
у нее атом хлора, другой ненасы-
щенный атом хлора сталкивается
опять с молекулой водорода и т. д.
Так в химии возникло новое по-
нятие— цепные реакции. Вскоре те-
ория Боденштейна была дополнена
новыми наблюдениями. Английский
химик Нернст заметил, что цепные
реакции могут иметь место не толь-
ко при передаче энергии молекула-
ми (такие цепи называют энергети-
ческими), но и при возникновении
промежуточных веществ, облегчаю-
щих соединение между собой моле-
кул (такие цепи называются веще-
ственными).
Например, при медленном раз-
ложении пороха выделяются окис-
лы азота. Они ускоряют реакцию
разложения. Поэтому к пороху при-
мешивают вещества, которые погло-
щают окислы азота, иначе его нель-
зя было бы долго хранить.
Появление теории цепных реак-
ций Боденштейна — Нернста, каза-
лось, давало ключ к пониманию
явлений, происходящих при различ-
ных химических реакциях. Казалось,
что теперь уж найдено правильное
объяснение многочисленным загад-
кам, с которыми сталкивались ра-
нее химики.
Изучая реакции горения и взрыва, ученые столкнулись
с новыми загадками, которые невозможно было разрешить
с помощью теории Боденштейна — Нернста. Было замечено,
что большинство взрывчатых веществ при нагревании разла-
гаются со взрывом не сразу, не мгновенно, а лишь спустя не-
которое время, т. е. имеется какой-то скрытый период в реак-
ции взрыва. Сходные явления наблюдаются и при всех реак-
циях горения.
Например, если мы заложим ампулу с небольшим количе-
ством тротила в слегка нагретую печь, то взрыв произойдет
только через несколько часов.
По теории Боденштейна — Нернста химические реакции
— 82 —
не должны непрерывно ускоряться, а должны, дойдя до из-
вестного предела, постепенно затухать, так как постепенно
количество активных центров будет уменьшаться.
Поэтому многие ученые считали, что этой теорией нельзя
объяснить реакции горения и взрыва.
Выдающиеся советские ученые академики Н. Н. Семенов,
Ю. Б. Харитон и Я. Б. Зельдович, а также некоторые зару-
бежные ученые—английский физико-химик С. Хиншельвуд,
американский химик Б. Льюис, немецкий физик Г. Фон-
Эльбе и другие не разделяли этого взгляда.
Ведь всякое горение или взрыв представляет собой хими-
ческую реакцию, которая происходит между составными ча-
стями горючего или взрывчатого вещества. Она сопровож-
дается выделением тепла, которое по закону Аррениуса
в свою очередь повышает скорость реакции. Следовательн.0,
рассуждали эти ученые, вследствие вызываемого нагревом уве-
личения скорости химической реакции возникает тепловая са-
моускоряющаяся лавина, рассматриваемая как самовоспла-
менение, и число активных молекул должно непрерывно
возрастать.
«Цепи активных молекул могут разветвляться — писал
академик Н. Н. Семенов, — одна активная молекула порож-
дает иногда несколько одновременно».
Предположения Семенова блестяще подтвердились на
практике.
В 1926 г. ученики Н. Н. Семенова — Ю. Б. Харитон и
3. Ф. Вальта изучали свечение паров фосфора в присутствии
кислорода при низких давлениях.
В своих опытах они обнаружили интересное явление. Све-
чение наблюдалось лишь при достижении определенной вели-
чины давления. Ниже окисление шло с практически несоизме-
римо малой скоростью. Выше же этого давления реакция бур-
но развивалась.
Оказалось, что при низких давлениях активные молекулы
дезактивировались на стенках колбы, и реакция шла очень
медленно. При повышенном же давлении активные частицы
быстро «размножались». Возникали новые цепочки. Ско'
рость реакции быстро нарастала, вплоть до воспламенения
фосфора.
Было замечено, что воспламенение фосфора в колбе уско-
ряется, если к кислороду добавить немного инертного газа —
аргона или азота, неона или криптона. Это происходит пото-
му, что активные частицы, сталкиваясь с молекулами инертно-
го газа, позднее добираются до стенки колбы, где они «умира-
ют», успевая ранее создать разветвленные цепочки.
Подобно тому, как при снежных обвалах в горах, неболь-
— 83 —
шие комья снега, опускаясь по склону горы, превращаются в
грозную лавину, так и активные центры, порождая новые и но-
вые активные молекулы, так сильно ускоряют реакцию, что
или вспыхивает яркое пламя или раздается оглушительный
взрыв.
Взяв за основу теорию неразветвленных цепных реакций,
Семенов и его ученики дополнили его представлением о раз-
ветвленных цепях. Они составили формулы, которые дают воз-
можность с математической точностью рассчитать, как долж-
но идти образование новых активных центров в зависимости
от температуры, давления, размеров реакционного сосуда.
Цепная теория позволила раскрыть многие загадки огня,
объяснить реакции горения и взрыва.
Раньше считали, что распространение пламени происходит
вследствие поджигания горящим слоем соседних холодных
слоев за счет теплопроводности, причем в тот момент, когда
слой нагревается до температуры самовоспламенения. Такое
представление полностью игнорировало химическую сторону
процесса горения.
Теперь доказано, что в основе процесса горения лежат цеп-
ные химические реакции.
Большое практическое значение имеет горение водорода
в кислороде. Водородно-кислородное пламя, достигающее тем-
пературы трех тысяч градусов, применяется для резки и свар-
ки металлов. Как и при окислении фосфора кислородом, в про-
цессе горения водорода в кислороде образуются разветвлен-
ные цепи.
Активными частицами могут быть не только свободные
атомы, но и труппы атомов — радикалы. Например, при окис-
лении водорода кислородом образуется свободный радикал
ОН. В этой реакции в «рождении» разветвленных цепочек
участвуют три активных частицы — свободные атомы водоро-
да и кислорода и радикал ОН.
Сначала молекулы водорода под действием тепла распа-
даются на свободные атомы. Они сталкиваются с молекула-
ми кислорода и разрушают их, соединяясь с одним из атомов
кислорода. Возникают свободные атомы кислорода и радика-
лы (ОН), которые сталкиваются с молекулами водорода. Об-
разуется конечный продукт горения — молекулы воды и сво-
бодные атомы водорода. Одновременно свободные атомы кис-
лорода сталкиваются с молекулами водорода и порож-
дают новые радикалы (ОН) и свободные атомы водорода
и т. д.
Формулы, созданные на основе теории цепных реакций,
позволяют заранее точно вычислить температуру самовоспла-
менения при любом давлении, если известна константа скоро-
— 84 —
сти химической реакции. Это дает возможность правильно рас-
считывать тепловой режим в топках печей и котлов, в двига-
телях внутреннего сгорания, в реактивных двигателях, и эко-
номить топливо.
С помощью теории цепных реакций стало возможным рас-
считывать ход взрывных реакций и во многих случаях управ-
лять ими.
Наполним сосуд горючей смесью газов и подожжем ее
с одного конца. Пламя начнет постепенно распространяться,
двигаясь все быстрее и быстрее. Сначала скорость пламени не
будет превышать несколько метров в секунду, но в конце кон-
цов достигнет нескольких тысяч метров в секунду. Произойдет
взрыв.
Можно ли ускорить или замедлить взрывную реакцию?
Теория цепных реакций отвечает на этот вопрос утвердительно.
Если из горячей газовой смеси, уже готовой взорваться,
в которой быстро растут и разветвляются цепочки активных мо-
лекул, удалить небольшое количество газа, то взрыв замед-
лится.
Если же некоторое количество этой газовой смеси внести
в другой сосуд с горячей смесью, то взрыв произойдет раньше
положенного срока.
«Химические реакции со скрытым периодом очень напоми-
нают человека, зараженного микробами», — часто говорил
своим сотрудникам академик Н. Н. Семенов.
Подобно тому как микробы, размножаясь в теле человека,
вызывают и усиливают болезнь, активные центры служат на-
чалом новых цепей и ускоряют реакцию.
Следовательно, перенося «затравку», содержащую актив-
ные центры, в горячую газовую смесь, мы ускоряем реакцию
и вызовем появление взрыва раньше обычного.
Много неприятностей приносит водителям автомашин и
тракторов, пилотам и мотористам детонация — взрыв горючей
смеси в двигателях внутреннего сгорания. Это грозный враг
моторов: детонация вызывает снижение мощности двигателя,
повышает расход топлива, приводит к быстрому износу
мотора.
Иногда нормально горящая смесь в цилиндре двигателя
внутреннего сгорания вдруг начинает гореть с огромной ско-
ростью. В камере сгорания возникает мощная взрывная волна,
она ударяется о стенки цилиндра, отражается от них и мечет-
— 85 —
ся по горящему газу. Температура стенок мотора резко возра-
стает, мотор, как говорят автомобилисты, «лихорадит».
Вот эту-то картину детонации во всех подробностях уда-
лось запечатлеть на фотоснимках сотрудникам академика
Н. Н. Семенова — А. Н. Воинову и А. С. Соколику.
Учеными были сделаны также анализы проб газовых сме-
сей, которые отбирались из цилиндров двигателей. Анализы
помогли обнаружить нестойкие промежуточные соединения —
перекиси, которые образуются при химической реакции, вы-
зывающей детонацию. Изучая различные цепные реакции,
ученые установили, что перекиси ускоряют горение. Когда же
концентрация перекисей достигает определенного предела, то
еще несгоревшая часть газа бурно воспламеняется и происхо-
дит детонация.
Для устранения детонации к моторному топливу добав-
ляют некоторые вещества — тетраэтилсвинец1, называемые
антидетонаторами. Они мешают накоплению перекисей.
Другим способом борьбы с детонацией в двигателях внут-
реннего сгорания служит приготовление специальных сортов
горючего, которые при сгорании не образуют перекисей.
Цепные реакции лежат в основе многих технологических
процессов в разных химических производствах — синтетиче-
ского каучука, искусственного волокна, пластических масс.
Превращение маленьких молекул в молекулы-гиганты,
т. е. полимеризация молекул мономера также происходит
с участием перекисей, свободных радикалов. В некоторых слу-
чаях полимеризация идет только в присутствии кислорода.
Например, молекулы хлористого винила «сшиваются» в цепи
молекул поливинилхлорида (из которого делают непромо-
каемые плащи) с помощью атомов кислорода. Молекула
кислорода, сталкиваясь с молекулами хлористого винила,
образует перекиси, которые приводят к иницированию, т. е.
началу цепной реакции. Немаловажную роль играют моле-
кулы кислорода и при полимеризации стирола, который яв-
ляется сырьем для получения синтетического каучука.
За последние годы советским ученым Б. А. Долгоплоском
доказано участие кислорода во многих реакциях полимериза-
ции синтетического каучука. Эти исследования позволили
найти новые более выгодные способы производства разных
видов искусственного каучука. Теория цепных реакций помо-
1 Тетраэтилсвинец считается самым лучшим антидетонатором. Однако
он имеет ряд существенных недостатков. При добавке его к горючему в
избытке в моторе появляется металлический осадок, который ухудшает
работу двигателя и ведет к преждевременному износу мотора. Кроме того,
это вещество ядовито. Попадая внутрь организма и даже на кожу, оно вы-
зывает сильное поражение центральной нервной системы, а иногда и смерть.
— 86 —
гает химикам поставить на службу промышленности многие
окислительные процессы и получать ценные химические про-
дукты: спирты, альдегиды, эфиры.
Особенно большое практическое значение имеют цепные
реакции при окислении различных углеводородов, которые
образуются при расщеплении нефти (крекинге). Они актив-
но участвуют в процессах приготовления многих органиче-
ских растворителей, производства ядохимикатов для борьбы
с вредителями сельского хозяйства, изготовления средств для
тушения пожаров. Продуктами окисления углеводородов, про-
текающего по цепным реакциям, являются жирные кислоты,
которые заменяют пищевые жиры в производстве мыла, мою-
щих средств, смазок.
Немало внимания посвятили ученые тщательному изуче-
нию условий, в которых «рождаются» свободные радикалы и
атомы при протекании цепных реакций. Оказалось, что во
многих случаях свет, электроразряд, добавление небольшого
количества веществ, которые легко распадаются на свобод-
ные радикалы, дает толчок к началу реакции.
Недавно член-корреспондент Академии наук СССР
Н. М. Эммануэль показал, что окислы азота инициируют ре-
акцию окисления углеводородов даже при низкой темпе-
ратуре. Небольшая добавка окислов азота при окислении уг-
леводородов при высокой температуре ускоряет образование
свободных радикалов.
Достаточно через жидкий парафин продувать в течение
небольшого промежутка времени воздух с ничтожной при-
месью окислов азота, чтобы началась реакция. Начавшись,
эта реакция идет уже сама за счет образующихся перекисей,
и дальше можно уже продувать чистый воздух.
Активные молекулы и промежуточные вещества — переки-
си, свободные радикалы и атомы, — которые не существуют
ни до, ни после реакции, а появляются лишь на какие-то
ничтожные доли секунды в процессе протекания реакции, за
свою короткую жизнь совершают титаническую работу.
роза о @
БЕЗ ОГНЯ И ПЛАМЕНИ
еловек и животные для своей жизнедея-
тельности требуют пищи, воды, кислоро-
да. Наш организм растет, ткани посте-
пенно изнашиваются и должны быть ’заменены новыми. Из
пищи образуются «строительные материалы», необходимые
для ремонта изношенных тканей, для созидания новых клеток
при росте организма. В составе нашей разнообразной пищи —
хлеба, мяса, молока, овощей, фруктов — имеются бедки,
жиры, углеводы, витамины.
Подсчитано, что взрослому человеку нужно в среднем
в день 100—110 граммов белков, 90—100 граммов жиров,
420—450 граммов углеводов. При значительном уменьше-
нии этого рациона организм начинает'расходовать свои за-
пасные вещества, человек худеет.
Белковые вещества, которые мы получаем с пищей, слу-
жат «ремонтными» и «строительными» материалами для
мышц, нервов, кожи и других тканей. Но пища служит не
только «строительным» материалом, без которого немыслимы
— 88 —
жизнь и рост животных и человека. Она также — источник
энергии, необходимой организму для его жизнедеятельности.
Ученые подсчитали, что для нормальной работы человече-
ского организма в среднем нужно около трех тысяч килока-
лорий в сутки. Этим теплом можно нагреть от нуля градусов
до кипения почти тридцать литров воды. «Топливом» служат
главным образом жиры и углеводы. При сгорании в организ-
ме одного грамма углеводов получается четыре больших
калории, а одного грамма жира — девять больших калорий.
Сложные молекулы углеводов в результате разнообраз-
ных пищеварительных процессов распадаются на более
простые. Они всасываются тонкими кишками и прямо из
кишечника попадают в печень. Там они накапливаются в виде
животного крахмала — гликогена. По мере надобности он
превращается в простые углеводы — глюкозу, или виноград-
ный сахар, которые кровь разносит во все уголки нашего
тела.
Больше всего энергии для работы требуют наши мышцы,
следовательно, им нужно и больше топлива. Потому и превра-
щения углеводов происходят главным образом в мышцах.
Много чудесных превращений претерпевают углеводы
в мышцах, прежде чем их молекулы превратятся в молекулы
воды и углекислоты. Сначала глюкоза превращается обрат-
но в гликоген, который ничем не отличается от того гликоге-
на, из которого она образовалась в печени. Пока мышца на-
ходится в покое, гликоген не изменяется. Но вот мышцы на-
чали сокращаться, стала расходоваться энергия. Начинается
«горение» гликогена, его молекулы постепенно распадаются.
Возникают новые органические вещества, появляется молоч-
ная кислота. Но и она существует недолго, кислород окисляет
ее молекулы и превращает их в конечные продукты распада
углеводов — углекислоту и воду.
°гЯоги^:?
Живые организмы представляют собой как бы большие
«химические лаборатории», в которых совершаются самые
разнообразные превращения. Одни вещества распадаются на
составные части, другие заново создаются.
Реакции распада и созидания тесно переплетены между
собой. Они так прочно между собой связаны, что не могут про-
текать друг без друга. Их нельзя рассматривать как самостоя-
тельные явления — это две стороны одного процесса, который
называется обменом веществ.
— 89 —
Исключительно велика роль окислительных процессов
в обмене веществ. Жизнь живых существ немыслима без кисло-
рода (за исключением некоторых видов бактерий). То боль-
шое количество энергии, которое необходимо для роста и раз-
вития, работы -и движения животных и человека, получается
главным образом при дыхании.
Человек может четыре недели голодать, три дня быть без
воды, но не может более трех минут пробыть без воздуха.
Суть дыхания заключается в том, что, входящие в состав
нашей пищи богатые энергией углеродистые вещества — жи-
ры, белки, сахара — превращаются в бедные энергией хими-
ческие соединения.
Наш организм не только днем поглощает энергию, когда
он бодрствует и работает, но она нужна ему и ночью во сне.
Это значит, что организм дышит непрерывно. Вот потому-то
человек и животные могут в течение некоторого времени
оставаться без пищи и воды, но не могут быть более не-
скольких минут без воздуха. Ведь в теле всегда есть запас
питательных веществ и воды, но нет запаса кислорода.
Как же происходит окисление пищи в животных организ-
мах кислородом? Этим вопросом еще семьдесят пять лет на-
зад заинтересовались многие ученые.
Ученым было хорошо известно, что при горении пищи
в организме образуются углекислый газ и вода. Только сое-
динение атомов кислорода с атомами углерода и водорода,
которые содержатся в молекулах белков, жиров, углеводов,
происходит очень медленно. Потому такое горение и назы-
вается в науке медленным окислением.
Неясным оставался механизм этого процесса. Загадочным
было поведение кислорода. Ведет ли он себя так же, как и при
обычном горении, когда окисление происходит быстро и вы-
деляется огонь и пламя, или иначе?
Для того чтобы ответить на этот вопрос, были поставлены
опыты медленного сгорания различных легкоокисляющихся
веществ: терпентиного масла, фосфора. Такие вещества могут
окисляться без участия внешней энергии, например света,
тепла или электричества. Медленное сгорание не нуждается
в посторонней энергии, это самопроизвольное окисление.
Немецкий ученый Шенбейн, проводя эти опыты, обнару-
жил, что кислород становится более сильным окислителем,
чем в обычных условиях. Он приобретает какую-то необык-
новенную активность и может окислять такие вещества, кото-
рые не только не окисляются воздухом, но даже и свободным
кислородом. Например, если через банку с раствором синей
краски (индиго) продувать струю воздуха, то сколько бы ни
продували, цвет раствора не меняется. Но достаточно опу-
— 90 —
стать в банку кусочек фосфора или влить немного терпенти-
нового масла, как спустя короткое время раствор индиговой
краски из темно-синего станет оранжево-желтым.
В чем же причина изменения цвета? Что за чудесная сила
скрыта в фосфоре и терпентиновом масле? Почему в их при-
сутствии происходит такое на первый взгляд странное пре-
вращение?
Оказывается, виновником изменения цвета является кис-
лород, который окисляет синее„ индиго в другое органическое
вещество — изатин, окрашенное в желто-оранжевый цвет. Но
он не мог бы превратить индиго в изатин, если бы к раствору
не добавили фосфора или терпентинового масла! Как же эти
вещества, которые сами легко окисляются на воздухе, пре-
вращают довольно «ленивый» кислород воздуха в столь ак-
тивный окислитель?
В те времена химики знали, что если через кислород про-
пустить электрический разряд без искр, иначе называемый ти-
хий разряд, то образуется газ, молекулы которого состоят из
трех атомов кислорода. Он сильно отличается по своим свой-
ствам от обычного кислорода, молекулы которого состоят из
двух атомов. За его характерный запах газ назвали озоном
(от греческого слова озон — пахучий)1. Озон легко распадает-
ся при нагревании, отдавая один атом кислорода. При разру-
шении молекулы озона выделяется много тепла. Он очень силь-
ный окислитель. Если подержать серебряную пластинку в струе
озона, она моментально чернеет — ее блестящая поверхность
покрывается налетом перекиси серебра. Под действием озона
соли сернистой кислоты превращаются в сернокислые соли,
аммиак — в азотистую и азотную кислоты. Бумага, смочен-
ная скипидаром, вспыхивает в озоне ярким пламенем, а са-
мые яркие краски обесцвечиваются. Озон убивает бактерии и
микробы, потому воздух хвойных лесов и прибрежных райо-
нов, где в воздухе содержится больше озона, очень полезен
для здоровья.
Замечательные свойства озона были хорошо известны и
Шенбейну. Он к тому же обнаружил, что озон образуется не
только при тихом электрическом разряде, но и при медлен-
ном сгорании многих легкоокисляющихся веществ, например
фосфора, терпентинового масла. Поэтому первой мыслью
Шенбейна было, что озон и есть тот самый активный кисло-
род, который так энергично окислял индиго в изатин, и был
в его опытах виновником изменения цвета раствора краски.
1 Газообразный озон — газ голубоватого цвета, растворяется в воде
значительно лучше, чем кислород. Легко взрывается от удара. В лабора-
тории его получают в специальных приборах-озонаторах.
— 91 —
Эта гипотеза казалась вполне справедливой и на первых
порах не встречала возражений. Ведь озон действительно об-
разуется в процессе медленного окисления различных органи-
ческих веществ. Он действительно является сильным окисли-
телем, не в пример обычному кислороду.
И все-таки Шенбейн не был доволен, его мучили сомне-
ния. Исследуя продукты, которые получались при медленном
сгорании фосфора, Шенбейн нашел среди них наряду с озо-
ном перекись водорода.
Сначала он не придавал этому никакого значения. Но пе-
рекись водорода сопутствовала озону во всех опытах медлен-
ного сгорания с другими веществами, которые проводил
Шенбейн.
Однажды Шенбейн взбалтывал на воздухе свинцовые
стружки с водою, подкисленной немного серной кислотой.
Как и в других опытах медленного окисления, здесь получи-
лась перекись водорода. Другим продуктом реакции был
сернокислый свинец.
Взвесив продукты реакции, Шенбейн обнаружил, что сер-
нокислый свинец и перекись водорода образовались в строго
определенных соотношениях. Это было чрезвычайно важное
открытие. Оно позволяло ближе подойти к разгадке чудесных
превращений кислорода при медленном сгорании, дать пра-
вильное объяснение роли активного кислорода.
Иными словами, половина кислорода, принимавшего уча-
стие в реакции, окислила свинец и прочно внедрилась в мо-
лекулу сернокислого свинца, другая же половина оказалась
в молекулах перекиси водорода, т. е. в виде активного кисло-
рода, непрочно связанного с молекулами воды.
Шенбейн, помня, что в некоторых опытах медленного
окисления, которые он проводил вместе с перекисью водорода,
присутствовал озон, решил приписать образование перекиси
водорода действию озона на воду.
Но никогда ни один ученый не станет делать окончатель-
ного вывода, пока не подтвердит его многочисленными опы-
тами.
Эксперименты, поставленные Шенбейном для проверки
действия озона на воду, дали отрицательные результаты. При
пропускании озона через воду или взбалтывании озона с во-
дой, перекиси водорода не получалось.
Но если не озон окисляет воду в перекись водорода в опы-
те со свинцовыми стружками, — рассуждал Шенбейн, — то
должна существовать какая-то другая форма активного кис-
лорода, которая помогает образованию перекиси водорода.
Ведь перекись водорода всегда образуется при медленном
окислении легко окисляющихся органических веществ.
— 92 —
Следовательно, приходит Шенбейн к выводу, «ленивый»
кислород воздуха при медленном сгорании претерпевает ка-
кие-то такие изменения, что одна половина его превращается
в-положительно-активную форму, а другая — в отрицательно-
активную форму.
Отрицательно-активный кислород Шенбейн отождеств-
ляет с озоном, а положительно-активный кислород называет
антиозоном. Озон он считает более энергичным окислителем,
чем антиозон. Ему Шенбейн приписывает основную роль
в окислении легкоокисляющихся веществ, а антиозону — спо-
собность превращать воду в перекись водорода.
По-иному пытались объяснить превращение кислорода
воздуха в активный энергичный окислитель другие ученые —
Клаузиус, Вант-Гофф, Траубе. Однако теории Шенбейна,
Клаузиуса, Вант-Гоффа оказались недолговечными. Появи-
лись новые важные открытия, были сделаны новые наблюде-
ния, которые не могли быть объяснены с помощью теорий,
предложенных этими учеными.
Гораздо ближе к раскрытию тайны медленного окисления
подошел позднее русский ученый академик А. Н. Бах и немец-
кий ученый К- Энглер.
Когда ученик Киевской гимназии Алексей Бах приезжал
на каникулы в родную Золотоношу, он неизменно отправлял-
ся на винокуренный завод, где много лет работал его отец.
Мальчику нравилось заглядывать в огромные деревянные
бочки, в которых совершались таинства превращения карто-
фельного месива сначала в сахар, а потом в спирт.
Чудесные превращения поражали воображение юного
Алексея, и он засыпал отца вопросами. Почему сначала полу-
чается сахар, а затем спирт? Как это происходит? Какая сила
помогает этому процессу?
Отец Баха был опытным виноделом, к нему приезжали за
советом со всей округи, но он не мог ответить на вопросы
сына. Точно так же, как и многие химики в то время не мог-
ли удовлетворить любознательность Алексея.
Он не раз спрашивал у отца о брожении, слышал он и от
других, что брожение — «виновник» чудесных превращений
картофеля в спирт. Ему недостаточно было такого объясне-
ния, ему хотелось проникнуть в сущность загадочного процес-
са, разгадать его механизм.
— 93 —
Алексей Николаевич Бах
(1857—1946 гг.)
Алексей Бах обратился
к книгам, однако и в них тог-
да он не нашел желаемого
ответа. Химия брожения бы-
ла полна противоречий и
неясностей. Он решил сам
искать разгадку, спросить
ее у самой природы.
Детские мечты осущест-
вились спустя много лет.
Окончив в 1875 г. гим-
назию, Бах поступает на
физико-математический фа-
культет Киевского универ-
ситета.
В 1878 г. в Киевском
университете возникли
«студенческие беспорядки»,
как царское правительство
называло выступления ре-
волюционного студенчества.
Их активным участником
был студент Бах.
Царское правительство жестоко расправилось с «бунтовщи-
ками». Многие были сосланы, в том числе и Бах. Лишь спустя
4 года ему удалось вернуться в Киев.
Он снова поступает в университет и одновременно всту-
пает в Киевскую организацию партии «Народная воля».
Недюжинные способности, любовь к науке завоевали ему
высокое уважение у профессоров, которые прочили ему боль-
шую будущность и смотрела на него как на своего преемни-
ка. В то же время он член подпольной революционной орга-
низации и должен выполнять ее поручения.
«И настал момент,— вспоминал впоследствии А. Н. Бах,—
когда нужно было делать выбор, и с болью в душе я принес
в жертву научную работу».
Три года Алексей Николаевич выполнял самые трудные
задания «Народной воли». Он ездил по городам России, ор-
ганизовывал подпольные типографии, выпускал листовки и
брошюры, передавал шифры, руководил пропагандистскими
кружками.
В 1885 г. после разгрома «Народной воли» он уезжает
в Париж с мыслью вновь заняться любимой наукой.
Неприветливо встретила французская столица молодого
эмигранта. Устроиться на работу в лабораторию сразу не
удалось. Пришлось поступить в редакцию научно-техниче-
— 94 —
ского журнала. Вычитывая гранки, правя корректуры статей,
приносимых авторами, Бах не переставал мечтать об актив-
ной экспериментаторской работе в лаборатории. Он весь по-
лон широких замыслов, волнующих научных идей и гранди-
озных планов.
Неужели ему не удастся претворить в жизнь свои мечты?
Он был готов работать в лаборатории даже бесплатно,
лишь бы заниматься любимым делом. Помог случай. Как-то
в редакцию журнала зашел известный французский про-
фессор — химик Шютценберже.
Бах, представленный редактором профессору, попросил
его взять к себе в лабораторию, прибавив, что он не требует
никакой платы за свой труд.
Шютценберже понравился молодой человек с открытым
мужественным лицом. Его ровный, спокойный голос и твер-
дый взгляд умных глаз свидетельствовали о настойчивости и
целеустремленности.
«Если Вы будете усердно работать и покажете себя спо-
собным химиком, я похлопочу о жалованьи Вам», — сказал
на прощание профессор.
Бах не только оправдал доверие Шютценберже, но и сни-
скал его дружбу. Четыре года плодотворно работал Бах
у французского академика, исследуя процессы брожения. Шют-
ценберже не мог нахвалиться своим новым сотрудником.
«О, это настоящий химик», — говорил он.
Болезнь заставила Баха расстаться с Шютценберже и поки-
нуть Париж. Врачи советовали ему уехать в Швейцарию.
Там чистый горный воздух быстро поставит Вас на ноги,—
говорили они.
А. И. Бах переселился в Женеву. Он снял на окраине ма-
ленький домик и в кухне устроил небольшую лабораторию.
Здесь с утра до вечера горела синим огнем газовая горелка,
в колбах булькали разные химические составы. В этой «соб-
ственной лаборатории», из окон которой открывался незабы-
ваемый по красоте вид на окрестные горы, Бах находил объ-
яснение загадочным процессам, совершающимся не только
в тиши и мраке винных подвалов, но и протекающих в клетках
растений, животных и человека.
В этой скромной женевской лаборатории родилась его
знаменитая теория медленного окисления, которая, наконец,
дала правильное объяснение процессам медленного горения,
над разгадкой которых столько лет бились ученые разных
стран.
На основе своих многочисленных опытов Бах пришел
к выводу, то молекула кислорода не расщепляется на два ато-
ма, как думали некоторые зарубежные ученые. Слишком мно-
— 95 —
го энергии нужно, чтобы разрушить молекулу кислорода. По
его мнению, сохраняется целостность молекулы, а разрывает-
ся только одна связь. Оба атома кислорода, связанные еще
одной связью, присоединяются к окисляемому телу, образуя
перекись.
«Всюду, — писал Бах, — где свободный кислород встре-
чается со способными к окислению веществами, первичными
продуктами окисления являются перекиси, которые во многих
случаях с водой дают соответствующие окиси и перекись во-
дорода».
Свойства перекиси хорошо известны. Достаточно оставить
бутылку с перекисью водорода на некоторое время открытой,
чтобы убедиться в том, что она «выдохлась», т. е. раз-
ложилась.
Это нестойкое вещество выделяет кислород и превращает-
ся в воду.
Такой атомарный кислород является сильным окис-
лителем.
Таким образом при окислении легкоокисляющих веществ
«ленивые» молекулы атмосферного кислорода становятся ак-
тивными. Процесс самопроизвольного окисления протекает
в несколько стадий, причем кислород активируется за счет об-
разования перекисей. Они в свою очередь подвергаются раз-
личным изменениям. Их окислительная способность усили-
вается под действием различных катализаторов.
Опыты, которые проводили ученые по окислению разнооб-
разных неорганических соединений и органических веществ,
убедительно показали, что действительно при этом образуют-
ся перекиси, способствующие дальнейшему окислению имен-
но так, как это предполагал Бах.
На основе гипотезы Баха была развита теория холодного
пламени, объяснено явление детонации и многие другие хи-
мические реакции.
Перекисная теория медленного окисления Баха помогла
нам проникнуть глубже в сущность важнейших жизненных
процессов, совершающихся в нашем организме, и, в первую
очередь, дыхания.
В ту эпоху, когда Бах создавал свою теорию, ученые еще
не имели достаточно ясного представления ни о строении ве-
ществ, которые образуются в живых клетках, ни об их превра-
щениях в организме животных и человека.
Многие ученые цепко держались за старую, обветшалую
теорию «виталистов». Они считали, что существует какая-то
особая жизненная сила («вис виталис»), присущая только жи-
вым организмам. Но Бах считал, что разгадку тайны жизни
надо искать в другом. Нужно изучать химические превраще-
— 96 —
ния, которые происходят в живых организмах, нужно иссле-
довать химические явления, которые происходят в клетках
животных и растений.
Ученый смешивал в пробирках несколько химически чи-
стых веществ, выделенных из живых клеток. Но никакой ре-
акции не произошло. Эти же самые вещества быстро и энер-
гично взаимодействуют в живой клетке. В чем же причина
бездействия этих веществ в пробирке? Почему они не хотят
соединяться друг с другом вне живых организмов?
Значит в живых клетках есть еще что-то, что заставляет
органические вещества энергично взаимодействовать друг
•с другом. Но это не «таинственная жизненная сила», как это
утверждают виталисты, а это особые вещества, вырабатывае-
мые живыми организмами — ферменты.
Химики давно заметили, что многие вещества реагируют
между собой с разной скоростью в зависимости от условий
протекания реакции.
Вода, как известно, состоит из водорода и кислорода. Если
смешать эти два газа, то можно ждать долгие годы, прежде
чем появятся несколько капелек воды. Но достаточно бросить
в колбу, наполненную смесью этих газов, микроскопическую
крупинку платины, как произойдет бурная реакция — взрыв, и
образуется вода.
Точно так же кусок сахара нельзя поджечь спичкой. Он бу-
дет плавиться, трещать, но не загорится. Но лишь только мы
слегка испачкаем край куска сахара несколькими пылинками
золы, как он послушно будет гореть ровным синим пламенем.
Платина не входит в состав воды, а зола — не горючее ве-
щество: тем не менее они заставили «упрямые» газы вступить
во взаимодействие, а сахар — гореть.
Такие вещества, которые не изменяются после реакции, но
ускоряют или замедляют ее, называются катализаторами. По-
добные вещества применяются теперь в разных химических
производствах — при изготовлении красок и лекарств, кислот
и аммиака, удобрений и каучука.
Исследуя работу пищеварительных органов, ученые заме-
тили, что расщепление сложных молекул жиров, углеводов,
белков, составляющих нашу пищу, происходит под действием
особых веществ — ферментов и энзимов.
Ферменты — это катализаторы, без которых все превраще-
ния в нашем теле осуществлялись бы настолько медленно, чго
жизнь была бы невозможной.
Ферменты — это двигатели жизненных процессов, они по-
могают нам усваивать пищу, строить наши клетки и ткани.
Если в организме нет ферментов, он гибнет от истощения,
даже при избытке самых лучших питательных веществ, так
8 Б. Я. Розен
— 97 —
как без них пища не усваивается. Но для нормальной жизни
людей, животных и растений нужна не только пища, необхо-
дим еще и воздух. Для дыхания так же, как и для усвоения
пищи, нужны ферменты.
Долгое время ученые не знали, как управляют ферменты
процессами дыхания, какова природа дыхательных ферментов.
Разгадку принесли исследования А. Н. Баха. Он показал,
что в живых клетках все процессы медленного окисления ус-
коряются во много раз потому, что в организме действуют
окислительные ферменты — оксидазы. Они ускоряют и про-
цесс дыхания.
В противовес существовавшему ранее взгляду на этот фер-
мент как на самостоятельное вещество Баху удалось доказать,
что оксидазы состоят из двух начал — пероксидазы и оксигена-
зы. Если их разделить, то оксигеназа не будет окислять, а пе-
роксидаза сохраняет свою окислительную способность только
в присутствии перекиси водорода. Но достаточно их соединить
вновь, как сразу восстанавливается их чудодейственная сила.
Вначале Бах считал, что оксигеназа, как и пероксидаза,
является ферментом, однако в дальнейшем он отказался от
этого взгляда. А. И. Опарин, Онслоу и некоторые другие уче-
ные доказали, что оксигеназа не фермент, а лишь способное к
окислению органическое вещество, которое окисляется атмос-
ферным кислородом и превращается в перекись.
Эта перекись активируется пероксидазой и способствует
ускорению окисления в живых клетках.
Когда человек или животное дышит, кислород воздуха окис-
ляет способные к самоокислению вещества. Образуются пе-
рекиси, и активированный кислород с помощью пероксидазы
окисляет вещества, которые непосредственно не окисляются
молекулярным кислородом.
Пероксидаза словно носильщик переносит атомы кислоро-
да, отрывающиеся от молекул перекиси к веществам, кото-
рые надо окислить.
Когда мы дышим, кислород из окружающего воздуха (в ко-
тором его содержится немногим более одной пятой) поступает
в легкие.
Если легкие лягушки представляют собой просто две меш-
кообразных полости, у которых внутренняя и внешняя поверх-
ность почти одинаковы, то легкие человека при полном напол-
нении воздуха имеют поверхность, равную ста квадратным
— 98 —
метрам. Иначе говоря, внутренняя поверхность легких в пять-
десят раз больше всей поверхности нашего тела.
Внутренняя поверхность легких потому так велика, что
она образована крохотными мешочками, соединенными мель-
чайшими трубочками — бронхами. Число этих мешочков дости-
гает огромной цифры — трехсот миллионов.
Раньше думали, что все окислительные процессы в организ-
ме, при которых образуется вода и углекислота, происходят
в легких. Теперь хорошо известно, что окисление внутри орга-
низма происходит во всех его клетках и тканях.
Воздух, согретый в носу и очищенный от посторонних приме-
сей, поступает в легкие. Кровь переносит кислород из легких
к тканям и возвращается обратно, насыщенная углекислым
газом.
Поглощение кислорода легкими из воздуха называется
внешним дыханием, а расход кислорода в клетках на окисле-
ние— внутренним дыханием.
В легких находится огромное количество волосных крове-
носных сосудов. Их так много, что через них может пройти
сразу вся кровь, которая имеется в нашем теле.
Стенки легочных мешочков и кровеносных сосудов очень
тонки. Углекислый газ и кислород могут легко проникать че-
рез эти тончайшие перегородки.
Проникновению газов из крови в легкие и обратно способ-
ствует разница в концентрации. В воздухе, поглощенном лег-
кими, кислорода будет больше, чем в крови волосных сосудов.
Кровь зато содержит больше углекислого газа, чем воздух.
Поэтому и происходит дйффузия, т. е. выравнивание кон-
центраций— кислород стремится проникнуть в кровь, а угле-
кислый газ уйти из крови в легкие.
Как известно, кровь состоит из жидкости — плазмы и пла-
вающих в ней телец — красных кровяных шариков. Кислород
плохо растворяется в жидкостях, поэтому плазма поглощает
очень мало кислорода, большая часть его связывается с крас-
ными кровяными шариками.
В крови содержится органическое вещество, называемое
гемоглобином. Ему красные кровяные шарики обязаны своим
цветом. Это сложный белок, содержащий в своем составе
железо.
В легочных волосных сосудах гемоглобин образует с кис-
лородом новое вещество — оксигемоглобин. В этом соедине-
нии гемоглобин очень непрочно связан с кислородом. Оксиге-
моглобин легко распадается, отдавая клеткам кислород.
Чем больше в крови кислорода, тем больше образуется
оксигемоглобина. С уменьшением количества кислорода
в крови, все большее количество оксигемоглобина распадается.
8*
— 99 -
По мере удаления кислорода из крови и перехода его в клет-
ки и ткани организма, оксигемоглобина будет становиться все
меньше и меньше.
Кровь, насыщенная кислородом и богатая оксигемоглоби-
ном, алого цвета. Это артериальная кровь. Из легких она по-
ступает в сердце и по кровеносным сосудам — артериям —
разносится по всему телу.
По мере распада оксигемоглобина и удаления кислорода,
кровь становится все более темного цвета. Обедненная кисло-
родом— кровь — венозная — возвращается в сердце и приго-
няется в легкие.
Венозная кровь не только обеднена кислородом, она насы-
щена углекислотой, которая образовалась в процессе внутрен-
него дыхания, т. е. при окислении пищи в тканях.
Углекислота из крови в легких переходит в воздух, вслед-
ствие разности концентрации, т. е. по той же причине, по ка-
кой кислород из воздуха переходит в кровь.
Проникая все глубже в тайны процессов дыхания, ученые
обнаружили, что открытый Бахом фермент пероксидаза не
окисляет углеводы, жиры и белки. Оказалось, что они не
присоединяют к себе при дыхании непосредственно кислород
воздуха, а окисляются за счет кислорода воды с помощью
особых дыхательных ферментов.
Эти дыхательные ферменты, называемые дегидразами, от-
рывают атомы водорода у молекул воды и у молекул органи-
ческих веществ, составляющих нашу пищу при окислении их
в клетках. Ведь в нашем организме в процессе обмена веществ
образуется наряду с углекислотой и вода.
Дыхательный фермент, химический состав которого теперь
уже хорошо изучен, содержит в своих молекулах атомы же-
леза. Железо, как известно, легко окисляется и восстанавли-
вается, т. е. легко отдает и присоединяет кислород.
Когда кровь приносит кислород к тканям, он вступает во
взаимодействие с железом дыхательного фермента и стано-
вится более активным. Но активность его еще недостаточна
для того, чтобы соединиться с водородом и образовать моле-
кулы воды — конечный продукт обмена веществ в организме.
В тканях, кроме дыхательного фермента, имеются еще три
различных вещества, очень похожих по своему строению на
дыхательный фермент. В них также содержится железо. Их
называют цитохромами, т. е. клеточными красителями.
Дыхательный фермент, несущий в себе кислород воздуха,
передает его первому цитохрому. Он забирает кислород и пе-
редает его второму цитохрому. Сам он не может вступать
в соединение с кислородом, он может только его передавать,
правда при этом несколько его активируя. Второй цитохром
— 100 —
тоже служит только переносчиком кислорода, и лишь третий
окончательно придает кислороду нужную активность.
Теперь кислород в полной боевой готовности, он готов не-
медленно соединиться с водородом. Но нужно сперва еще
оторвать атомы водорода от тех веществ, которые окисляют-
ся в тканях. Это делают ферменты — дегидразы. Но этого еще
мало. Водород тоже должен стать сначала достаточно актив-
ным, чтобы он мог соединиться с кислородом и образовать
воду. Прежде всего атомы водорода встречаются с желтым
ферментом, обязанным своей окраской рибофлавину—вита-
мину В2. Он подобно цитохромам, переносящим кислород, слу-
жит энергичным переносчиком водорода. Он может даже за-
бирать водород и у некоторых других веществ, которые спо-
собны переносить водород, например у витамина С.
Вот теперь-то, после того как все переносчики кислорода
и водорода хорошо поработали, может состояться наконец
долгожданное соединение этих газов.
Вам и в голову, вероятно, не приходило, что образование
воды в животных организмах протекает так сложно, требует
стольких разнообразных химических реакций, стольких по-
мощников.
Но ведь когда мы смешиваем в банке кислород и водород
и поджигаем смесь, капли воды «рождаются» со взрывом.
Иными словами, при взаимодействии этих газов выделяется
огромное количество энергии.
В банке реакция произошла мгновенно. А что же будет,
если эти газы с такой же скоростью будут соединяться в на-
шем организме?
Тогда в каком-то месте выделится много энергии, произой-
дет сильное местное нагревание. Выделившаяся энергия
в большей своей части будет бесполезной для организма. Он не
сможет ее правильно использовать. Вот потому-то вода обра-
зуется в организме не мгновенно, а постепенно. На каждой ста-
дии выделяется некоторое количество энергии, которое исполь-
зуется организмом по мере необходимости.
Не менее сложным оказывается и образование другого
конечного продукта обмена веществ — углекислоты.
В результате длительного постепенного окисления в тканях
углекислого газа содержится больше, чем в крови. Поэтому
углекислый газ проникает через стенки клетки в кровь и
с водой кровяной плазмы образует угольную кислоту. Неболь-
шое количество угольной кислоты остается в плазме, большая
же часть превращается в бикарбонат и соединяется с гемо-
глобином, образуя новое вещество — карбогемоглобин.
Еще в прошлом веке немецкий ученый Пуунтц весьма про-
стыми и остроумными опытами показал, что бикарбоната
— 101 —
содержится в крови в три раза больше, чем углекисло-
го газа.
На основании этих опытов Пуунтц сделал вывод, что крас-
ные кровяные шарики способствуют повышению содержания
бикарбоната в крови.
Дальнейшие опыты дали возможность установить, как это
происходит.
Угольная кислота распадается на бикарбонат-ионы и ионы
водорода, которые могут соединяться с гемоглобином. Моле-
кулы гемоглобина, присоединяя к себе ионы водорода, стано-
вятся хорошими переносчиками угольной кислоты. Часть же
угольной кислоты соединяется с гемоглобином, образуя кар-
богемоглобин.
Долгое время ученые считали, что этим и объясняется пере-
нос кровью углекислого газа.
Недавно датский ученый Генрике показал, что эти процес-
сы не могут объяснить, почему перенос углекислого газа совер-
шается в организме с такой большой скоростью.
Он детально исследовал кровь и обнаружил в кровяных
шариках фермент, который ускоряет в тысячи раз образова-
ние угольной кислоты из углекислого газа и воды, и обратный
ее распад на эти вещества.
Этот фермент был назван карбоангидразой (от латинского
слова карбон — уголь). Он, как и все другие ферменты, яв-
ляется белком.
Благодаря этому открытию удалось выяснить, как же
.в действительности происходит в организме перенос углекис-
лого газа.
А как происходит удаление из крови углекислого газа, ког-
да венозная кровь поступит в легкие?
Прежде всего угольная кислота должна снова совершить
химическое превращение — распасться на углекислый газ и
воду. Вот здесь-то и сказывается важная роль гемоглобина.
Как только гемоглобин в легких окисляется в оксигемоглобин,
он теряет способность реагировать с угольной кислотой. По-
этому начинается обратный процесс — из бикарбоната обра-
зуется снова угольная кислота.
Она с помощью фермента карбоангидразы моментально
распадается на воду и углекислый газ, который благодаря раз-
ности концентрации в крови и во вдыхаемом воздухе немед-
ленно диффундирует в легкие. Одновременно освобождается
и углекислый газ, который приносится кровью в виде карбо-
гемоглобина.
Весь этот газовый обмен — поглощение свежего кислорода
и удаление углекислого газа в легких — происходит в течение
всего лишь полсекунды. Угольная кислота в крови служит
— 102 —
важным регулятором дыхания: работы сердца и кровенос-
ных сосудов.
Накопление угольной кислоты приводит к ускорению рабо-
ты сердца и расширению сосудов, благодаря чему происходит
более быстрый перенос конечных продуктов обмена веществ.
Кроме того, от содержания угольной кислоты и бикарбо-
ната в крови зависит нормальное соотношение между кислот-
ностью и щелочностью в организме.
Обнаружение различных окислительных и восстановитель-
ных ферментов позволило раскрыть секреты дыхания и объяс-
нить разные механизмы дыхания у различных животных.
Оказалось, что различные окислительные ферменты — пе-
роксидазы, оксидазы, каталазы, тирозиназы — играют важ-
ную роль в жизни растений.
Изучение ферментов позволило усовершенствовать техно-
логию многих производств пищевой промышленности.
Они помогают получать ароматный табак и высококачест-
венный чай, сладкое вино и вкусный хлеб.
На некоторых хлебозаводах наблюдалось странное явле-
ние. Мякиш хлеба оказывался непропеченным. Тщетно иска-
ли пекари причину брака. Пекли этот хлеб из нормальной му-
ки; воды давали стандартное количество, температуру в печи
поддерживали обычную, а хлеб получали необычный.
Обратились пекари за советом к биохимикам. Ученые сде-
лали анализ муки. Оказалось, что она была смолота из слегка
проросшего зерна. А в нем присутствует особый фермент.
Ученые не только разгадали причину брака печеного хлеба,
но и помогли пекарям его исправить. Институт биохимии Ака-
демии наук разработал способ, позволяющий выпекать хлеб
нормального качества из муки, смолотой из проросшего зерна.
Изучили биохимики и поведение зерна при хранении. Ока-
залось, что если свежеубранное зерно посеять, то наблюдается
низкая всхожесть. Это происходит потому, что оболочка его
плохо проницаема для воды и растворенного в воде кислоро-
да. Из такого зерна получается и плохая мука.
Если же зерно после уборки хранить некоторое время
в сухом и прохладном месте, то оно дозревает. При этом закан-
чивается синтез белка, который сопровождается уменьшением
активности окислительных ферментов.
На сахарных заводах сахар извлекают из корней свеклы.
Казалось бы, причем туг ферменты? Но ведь корень свеклы —
—103—
это живой растительный организм. Как всякое растение, он
дышит. При дыхании теряется сахар. Чем дольше хранить
свеклу, тем больше будет потерь сахара. Старые производст-
венники знают, что нельзя больше трех месяцев хранить свек-
лу. Она становится темной и теряет много сахара. Потому
раньше сахарные заводы работали не более ста дней в году.
Советские ученые задались целью удлинить срок работы
сахарных заводов. Ведь если сахарный завод будет работать
целый год, то это равносильно работе трех заводов. А это зна-
чит, что без значительного расширения количества существу-
ющих сахарных заводов можно во много раз увеличить их
продукцию — дать населению больше сахара.
Биохимики внимательно изучили все изменения, которые
происходят в свекловичном корне при хранении. Наблюдения
вели за нормальными и поврежденными клубнями при разной
температуре и при различной влажности.
Теперь сахарную свеклу можно хранить гораздо дольше,
чем раньше. Ее можно хранить даже весь год, если создать
условия, при которых действие окислительных ферментов бу-
дет замедлено.
Изучение поведения окислительных ферментов дало воз-
можность разработать такие способы копки и перевозки свек-
лы, которые обеспечивают минимальные потери сахара.
Знание «характера» окислительных ферментов пригоди-
лось и табаководам. С тех пор как люди стали курить и раз-
водить табак, высушенные табачные листья складывали в тю-
ки и держали их на складе целый год и даже дольше. Никто
не знал, что происходит с табаком в процессе хранения, но
давно заметили, что табак становился лучше.
Ученые полагали, что улучшение качества табака при дли-
тельном хранении связано с действием каких-то ферментов.
Некоторые считали, что вещества, которые содержатся в та-
бачных листьях, изменяются под действием бактерий, которые
селятся на листьях.
Относительно недавно профессор А. И. Смирнов в Инсти-
туте табаковедения в Краснодаре, пользуясь учением Баха о
ферментах, установил, что в табачном листе окислительные
ферменты сохраняют свою силу. Они-то и являются виновни-
ками изменений, которые происходят в листе. Им-то и обязаны
и ароматом и душистостью табака.
Потому изменение свойств табачных листьев при хранении
стали называть ферментацией. Когда выяснилось, что качест-
во табака улучшается благодаря действию ферментов, стали
искать способы сократить продолжительность ферментации.
Эти поиски не пропали даром. Изучая действие ферментов
внутри листа, удалось подобрать такую температуру и создать
— 104 —
такую влажность воздуха, чтобы ферментация заканчивалась
в кратчайший срок. Ферментацию табачных листьев стали
проводить в специальных камерах. Теперь мы умеем искусст-
венно управлять ферментацией и можем сокращать или удли-
нять её срок по нашему усмотрению. Лучшие сорта табака
могут быть приготовлены всего лишь за несколько недель.
Ферменты оказались могущественными рулевыми и уди-
вительных превращений, которые происходят в чайном листе.
Им мы обязаны и цветом и ароматом чайного напитка.
Родина чая — Китай. Недаром чай называли «китайской
травкой». Китайцы познакомились с чаем еще за несколько ве-
ков до нашей эры. В четвертом веке чай стали возделывать
в Японии. В Европу китайский чай был привезен португальски-
ми моряками впервые в XVII в. Примерно в то же время чай
появился и в России.
Чай благотворно действует на нервную систему, придает
бодрость усталому, прогоняет сонливость.
Каждый из нас на себе испытал замечательное действие
стакана ароматного, крепкого чая. Однако, покупая пачку
чая в магазине, никто не задумывался над тем, как длинен и
сложен ее «жизненный» путь.
На чайных плантациях с кустов срезают вручную или с по-
мощью чаеуборочных машин зеленые листья. Собранный мо-
лодой чайный лист разбрасывают на деревянных рамах, обтя-
нутых материей и сушат на воздухе. Такую сушку производ-
ственники называют завяливанием. Завяленный чайный лист
не будет ломким и в нем повышается активность ферментов.
После завяливания лист скручивают. Это делают на осо-
бых машинах-роллерах. При скручивании раздавливаются жи-
вые клетки листа, нарушается дыхание, изменяется последова-
тельность окислительных и восстановительных процессов.
Но ферменты, которые придают готовым чаинкам вкус,
аромат, крепость, цвет, сохраняют свою чудодейственную силу.
Влажную массу раздавленных листьев переносят в дере-
вянных ящиках в специальное помещение и оставляют на не-
сколько часов. Здесь происходит самая важная операция чай-
ного производства — ферментация. В чайном листе содержит-
ся много разных органических веществ—белков, витаминов,
дубителей. За несколько часов листья сильно темнеют, стано-
вятся почти коричневыми. Окислительные ферменты энергич-
но «работают». Одни окисляют дубильные вещества, другие
7 Б я. Розен
— 105 —
разлагают перекись водорода на воду и кислород. До сих пор
роль отдельных ферментов в придании чаю аромата, цвета,
крепости, терпкости была неясна.
Советские ученые — А. Опарин, А. Курсанов, М. Бокуча-
ва — выяснили поведение каждого из окислительных фермен-
тов. Оказалось, что характерный цвет чайного настоя и его
аромат вызваны действием оксидазы, а вкусом готовый чаи
обязан другому окислительному ферменту — пероксидазе.
Последняя операция переработки чайного листа — сушка.
Ферменты хорошо «поработали». Они превратили зеленые
листья чайного куста в ароматную светло-коричневую массу,
обладающую уже всеми свойствами готового чая. Но если
эту массу не высушить, то ферменты будут продолжать свою
работу, окисление будет продолжаться и вскоре исчезнет и
цвет и аромат. При сушке же, под действием температуры
ферменты будут разрушены, и чаинки сохранят свои чудесные
свойства.
Изучив действие окислительных ферментов при переработ-
ке чая, советские биохимики разработали точные методы конт-
роля чайного производства, которые позволяют значительно
улучшить технологию переработки чайного листа и повысить
качество готового чая.
Так ученые, раскрывая секреты природы, заставляют окис-
лительные ферменты работать на пользу человеку. Изучив
строение ферментов, мы сможем приготовить их в лаборато-
рии. Сначала — те, которые имеются в растениях и живых ор-
ганизмах, а со временем — и такие, которых нет в природе.
И это даст нам возможность управлять биологическими и
химическими процессами, которые непрерывно совершаются
в окружающем нас мире.
рааеа маемая
НЕВИДИМЫЕ
ВРАГИ И ДРУЗЬЯ
590 г. Рим поразило тяжелое бедствие.
В городе вспыхнула эпидемия чумы. Лю-
ди умирали тысячами. Из Рима эпиде-
мия чумы проникла в Египет, Византию, Европу. Несколько
десятков лет бушевала «черная смерть», как называли чуму,
унося тысячи жертв. Некоторые города совсем обезлюдели,
а многие страны превратились в пустыню.
Спустя восемь столетий — в XIV в. — «черная смерть» со-
брала еще более обильную жатву. Возникнув в Китае, она
перекинулась в Европу.
Грозным гостем у жителей разных стран была не раз и
другая заразная болезнь — тиф. За тысячу лет до нашей эры
с ней были уже знакомы в Египте и Эфиопии. Позднее она
появилась в Греции и Турции. В XVII в.— во время тридца-
тилетней войны — тиф свирепствовал в Германии и во Фран-
ции. Обычно эпидемии тифа вспыхивали во время войн и го-
лода. В Отечественную войну 1812 г. эпидемия тифа разрази-
лась в обеих армиях — русской и французской.
7*
— 107 —
Возбудители возвратного тифа
и холеры
Из далеких лесных
дебрей и степных просто-
ров Азии с давних времен
нередко наползало на Ев-
ропу и Россию страшное
поветрие — эпидемия хо-
леры. Особенно широкие
размеры приняли заболе-
вания холерой в России
XIX в. Не проходило двух-
трех лет, чтобы в каком-
нибудь из российских го-
родов не объявились больные холерой. Особенно сильной была
вспышка холерной эпидемии в Петербурге в 1848 г. Ежеднев-
но умирало так много людей, что не хватало гробов, чтобы
их хоронить.
С глубокой древности человека преследовала еще одна
заразная болезнь — оспа. Никто не знает точно, где она заро-
дилась. Но уже более пяти тысяч лет назад она поражала
людей в Африке, Индии, Китае.
Вторжение арабов в Европу в седьмом веке наградило ев-
ропейцев оспой. С тех пор она из поколения в поколение да-
вала о себе знать. В XVI—XVII вв. в Европе трудно было
встретить человека, не имевшего оспин на лице. А ведь мно-
гие и умирали от оспы. Историки считают, что в Германии и
Франции в XVIII в. умирало от оспы около ста тысяч че-
ловек в год.
Из Европы оспа перекочевала и в Америку и Австралию,
неся с собой смерть. Известны случаи поголовного вымира-
ния местных жителей в целых районах.
Но есть и другие, может быть не менее гибельные для
человека болезни. Они не совершают таких страшных по-
вальных нападений на людей, как это делают чума, холера,
тиф. Они работают втихомолку, но действуют непрерывно и
не менее безжалостно. Они постепенно разрушают организм
больного, неустанно подтачивают его силы. Таков, например,
туберкулез.
А сколько страданий причиняет человеку трахома, дифте-
рит, энцефалит, дизентерия.
В течение многих веков люди не знали, откуда берутся
эти страшные враги. Не знали, почему они нападают вдруг,
без всякой видимой причины. Потому эпидемии и считались
«наказанием божьим» за грехи или проявлением гнева злых
духов. И боролись с ними крестными ходами, религиозными
процессиями, шаманскими заклинаниями, молитвами. Несут
гибель заразные болезни и верным друзьям человека —
— 108 —
домашним животным. В знойных прериях Южной Аме-
рики, на ледяных просторах Чукотки, на полях Италии и
Франции не раз вспыхивали губительные эпидемии среди
скота. Тысячи голов мелкого и крупного рогатого скота гибли
от сибирской язвы, сапа, столбняка, туберкулеза.
Шли века. Пытливый ум человека настойчиво проникал
в тайны природы. Человек разгадал законы, управляющие
вселенной. Он подчинил себе мощные силы природы и на-
учился управлять ими. Могучее оружие науки помогло обна-
ружить невидимых врагов и уничтожить их. Но тернист и тру-
ден был путь ученых — борцов с назойливыми и злыми «де-
монами». Начало этого славного пути, приведшего к новым
триумфам человеческого гения, было положено открытием
скромного голландского служащего — Антони Левенгука.
Антони Левенгук служил в небольшом городке — Дельфте
сторожем судебной палаты. В свободное от работы время он
занимался изготовлением увеличительных стекол. Он так ис-
кусно шлифовал линзы и достиг в этом такого совершенства,
41 о его стекла, величиною с булавочную головку, увеличива-
ли в 200 раз.
Из этих стекол Левенгук соорудил прибор, отдаленно на-
поминающий современные микроскопы, но позволивший про-
никнуть в тайны незримого мира.
Отличаясь от природы любознательностью и обладая пыт-
ливым умом и настойчивостью, Левенгук стал рассматривать
в свои стекла самые разнообразные мелкие существа — кло-
пов, мух, комаров.
Однажды он взял каплю воды из дождевой бочки, поме-
стил ее на маленькое стеклышко и направил на него свой
«микроскоп».
Каково же было его удивление, когда он увидел в капле
воды огромное количество маленьких существ, двигавшихся
в разных направлениях. Несметное количество этих «ани-
малькулей», как Левенгук называл увиденные им в увеличи-
тельные стекла существа, он обнаружил и в капле настойки
из загнившего сена.
Как-то Левенгук исследовал под микроскопом зубной на-
лет. «С величайшим изумлением,— писал он,— я видел в этом'
материале — множество крошечных созданий, весьма ожив-
ленно двигавшихся». Их было так много, что он записал:
— 109 —
Антони Левенгук (1632—1723 гг.)
«В моем рте их больше,
чем людей в Соединенном
Королевстве» (тогда так
называли Голландию).
Многие годы с неисся-
каемым рвением изучал
Левенгук под микроско-
пом «зверюшек». О сво-
их открытиях он писал
в Лондонское королевское
общество, которое тогда
было самым известным
научным учреждением
в мире.
В 1695 г. он опублико-
вал свои наблюдения над
«зверюшками» в написан-
ной им на латинском язы-
ке книге «Тайны приро-
ды, открытые при помощи
микроскопа». В книге были
приведены зарисовки, по которым без труда можно узнать
гигантов и карликов в мире невидимых существ. Были тут и
палочки, и шарики, были и жгутики. Некоторые были изви-
ты наподобие штопора, а другие напоминали каких-то мор-
ских чудовищ со щупальцами.
Наблюдая и описывая «зверюшек», Левенгук еще не по-
нимал значения своих открытий, он был безмерно счастлив
тем, что открыл что-то новое и продолжал наблюдать под
микроскопом своих «зверюшек», которых находил повсюду —
в капле алой крови и в зеленой болотной тине, в слизи с де-
сен и в гнилом зубе.
Открытие Левенгука привлекло к себе внимание всего
ученого мира, оно обогатило науку новым оружием, позволив-
шим заглянуть в мир незримых существ Г
1 Открытием Левенгука интересовались тогда не только ученые, но и
все образованные и любознательные люди. Петр I, путешествуя по
Голландии весной 1698 г., проезжал через Дельфт. Остановив яхту непода-
леку от города, он просил пригласить к нему Левенгука, о замечательных
открытиях которого слышал еще на родине.
Левенгук, явившись к русскому царю со своими увеличительными
стеклами, показал ему невидимых обитателей капли воды и белой массы,
соскобленной с зубов. По свидетельству очевидцев Петр провел за микро-
скопом около двух часов. Прощаясь, Петр пожал Левенгуку руку и горячо
поблагодарил за предоставленную ему возможность познакомиться с мель-
чайшими живыми существами.
— 110 —
Оно пробудило стремление ученых по-
больше узнать о мельчайших обитателях
нашей планеты. Ученые разных стран изу-
чали и описывали наблюдаемых ими под
микроскопом микроорганизмов. Однако
они, как и Левенгук, не понимали значе-
ния этих, незримых простым глазом су-
ществ и не представляли себе, в чем заклю-
чается их деятельность.
Одновременно с накоплением знаний,
шло и совершенствование увеличительных
стекол и микроскопов. Ведь современный
микроскоп так же сильно отличается от ле-
венгуковского, как современный океанский
корабль от каравеллы Колумба.
Почти до середины прошлого века в науке сохранялись
неверные представления о происхождении, строении и жизни
незримых существ. Одни считали, что все они принадлежат
к одному роду, другие наделяли их чуть ли не фантастически-
ми свойствами.
Трудами многих русских и зарубежных ученых — Терехов-
ского, Ценковского, Мюллера, Эренберга, Коха,— была соз-
дана новая наука — микробиология. Представители новой на-
уки изучали микробов везде, где их только находили.
А микробы имеются повсюду: в воде и в воздухе, в почве и
в горных породах, на ко-
же и в теле животных и
Стрептококки-а и стафилококки-б
человека.
К концу прошлого века
были открыты возбудители многих за-
разных болезней — сибирской язвы,
холеры, туберкулеза.
Замечательные открытия Коха, Па-
стера, Мечникова раскрыли многие
тайны из жизни незримых существ.
Страшные враги человека были опоз-
наны, с ними научились бороться. Бы-
ли обнаружены и возбудители болез-
ней у растений и животных.
Среди них оказались и такие, кото-
рые даже не видны в самые сильные
оптические микроскопы. Это крошеч-
ные частицы, диаметром в стотысячные
и даже миллионные доли сантиметра.
Их назвали фильтрующимися вируса-
ми, потому что они проходят через
под микроскопом
— 111 —
Илья Ильич Мечников
(1845—1916 гг.)
фильтры, которые задерживают
даже самых мелких бактерий.
Наукой теперь доказано, что
большинство заболеваний у че-
ловека, животных и растений вы-
зывается вирусами. Даже насе-
комые заболевают .из-за вирусов.
Фильтрующиеся вирусы — воз-
будители оспы, энцефалита,
гриппа, кори, бешенства. Рас-
крытию тайны вирусов наука
обязана двум выдающимся рус-
ским ученым — Д. И. Иванов-
скому и Н. Ф. Гамалея Г
Заглянув поглубже в мир не-
видимых, микроскопических су-
ществ, ученые обнаружили в нем
наряду с вредными и множество
полезных микроорганизмов. Од-
ни помогают растениям лучше
расти, другие — защищают жи-
вотных от болезней, третьи — по-
могают нам варить пиво, квасить капусту, делать сыр, чет-
вертые— вырабатывать лекарства.
Несметны полчища микробов, населяющих нашу планету,
чудовищна скорость их размножения, велико их разно-
образие.
Но могущественны и научные методы познания природы,
неизмеримо упорство ученых. Успехи молодой науки — микро-
биологии— позволили навести порядок в хаосе огромного
1 В 1886 г. Н. Ф. Гамалея пытался обнаружить возбудителя чумы ро-
гатого скота. Он пропускал кровь больного теленка через очень плотный
фильтр, задерживавший самые мелкие бактерии. Отфильтрованную кровь
вспрыснул в вену здоровому животному. Теленок, к изумлению ученого,
заболел чумой. Значит, возбудитель болезни так мал, сделал вывод ученый,
что он проходит даже через мельчайшие поры фильтра. Однако дальше
исследований Гамалея не проводил.
Доказательства существования вирусов принесли исследования
Д. И. Ивановского. В Крыму в те годы на листьях табака появились стран-
ные пятна, напоминавшие мозаику. Ивановский делал с листьев срезы и
рассматривал их под микроскопом, однако возбудителя не нашел. Тогда он
отжал сок больного растения, пропустил через фильтр. Отфильтрованным
соком смазал листья здоровых растений. Вскоре на листьях появились ха-
рактерные мозаичные пятна. Полагая, что заражение вызвано не самим
возбудителем, а только выделяемым им ядом, Ивановский разбавил сок и
заразил им еще несколько растений. Однако предположение не оправда-
лось. Мозаичные пятна были гораздо ярче, чем раньше. Следовательно,—
сделал вывод ученый,— в соке находится живой возбудитель — вирус, ко-
торый размножается в больном растении.
— 112 —
числа наблюдений, которые были сделаны ботаниками и фи-
зиологами, биологами и химиками в царстве микроскопиче-
ских существ.
Многочисленная армия микроорганизмов состоит из не-
скольких основных подразделений: бактерий, микроскопиче-
ских грибов (плесневые, лучистые), дрожжей, фильтрую-
щихся вирусов и простейших одноклеточных животных (ин-
фузории, амебы).
Микроорганизмы, как и все другие живые существа,
рождаются, размножаются, умирают. А для того чтобы раз-
виваться и расти, микробам, как и всем другим существам,
нужно питаться и дышать. Движение, рост, размножение
микроорганизмов требуют непрерывного расхода энергии.
Откуда же добывают микроскопические живые существа
нужную им энергию? Источниками энергии для них, как и
для высших животных, служат химические реакции, проте-
кающие при разложении белков, окислении жиров и углево-
дов. А реакции эти идут с выделением тепла. Многие микро-
организмы берут нужный им для построения своих клеток
азот и углерод из неорганических соединений.
Процесс дыхания у человека, животных и растений сво-
дится к окислению углеводов свободным кислородом воздуха.
Углеводы превращаются в воду и углекислоту, выделяя при
этом тепловую энергию.
Микроорганизмы же могут окислять не только углеводы,
но многие другие органические соединения — спирты, ами-
нокислоты. Те микробы, которые для окисления пользуются
кислородом воздуха, называют аэробными (от латинского
слова аэр — воздух).
Многие ученые, основываясь на теории медленного окисле-
ния Баха — Энглера, считают, что и у микроорганизмов при
добывании ими энергии все процессы
протекают так же, как и у высших жи-
вотных и растений. Молекулярный кис-
лород сначала окисляет вещество, спо-
собное легко окисляться, и становится
сам активным. Образующиеся при этом
органические перекиси еще больше уве-
личивают активность атомов кислорода
и способствуют окислению трудно окис-
ляющихся соединений.
В настоящее время в науке существу-
ет и другая точка зрения на характер
протекания окислительных процессов
у микробов.
Некоторые ученые полагают, что
Плесневый гриб мукор
— 113 —
не атомы кислорода становятся активными в процессе окисле-
ния, а атомы водорода.
Само собой разумеется, что вещества, которые подвер-
гаются окислению, должны содержать водород. Так, напри-
мер, когда происходит окисление спирта в уксусную кисло-
ту бактериями, то образуется вода благодаря поглощению
водорода кислородом.
Точно так же выделяется вода при окислении глюкозы
-в углекислоту.
Атомы кислорода принимают в свои объятия атомы водо-
рода из молекул глюкозы, соединяются с ними в молекулы
воды. (Поэтому их называют акцепторами — от латинского
слова acceptor, что значит «приемщик»).
Окисление микробами неорганических веществ — аммиа-
ка, сероводорода, азотистой кислоты, сторонники «водород-
ной» теории окисления объясняют точно таким же образом.
Среди аэробных микроорганизмов есть и друзья и враги
человека. Одни из них помогают нам приготовлять уксус,
получать лекарства, другие вызывают загнивание рыбы, мяса,
третьи служат причиной возникновения болезней.
Существует немало микроорганизмов, которые вовсе не
нуждаются для дыхания в свободном кислороде. Наоборот,
кислород для них — сущий яд. В присутствии этого газа они
погибают. Откуда же эти микробы добывают нужную им для
жизни энергию? Они расщепляют молекулы сложных орга-
нических веществ. Окисление и выделение энергии происхо-
дит за счет отщепления атомов водорода, которые входят
в состав молекул этих соединений. Такие микробы называют-
ся анаэробами. Среди них много полезных и вредных
бактерий.
А есть и такие микробы, которые будучи аэробами, могут
жить и размножаться в отсутствие кислорода. Таковы, напри-
мер, бактерии брюшного тифа.
Некоторые дрожжевые грибки ведут себя по-разному на
воздухе и без воздуха. Окисление виноградного сахара в при-
сутствии кислорода проходит до конца — образуется вода и
углекислота, а в чанах, где бродит вино, куда нет доступа
воздуха, не до конца — образуется спирт и углекислота.
Некоторые анаэробы, как например уксусно-кислые бак-
терии, и на воздухе производят окисление не до конца. Вместо
углекислоты они окисляют спирт в уксусную кислоту. Точно
так же некоторые плесневые грибки окисляют сахар в щаве-
левую и лимонную кислоты.
Разложение органических веществ микробами без досту-
па воздуха долгие годы было загадкой.
— 114 —
^^ЗНИК^*«рДЕЛОВ^пйВОВАРО^
Еще в глубокой древности люди умели приготовлять из
виноградного сока вино. На некоторых египетских пирами-
дах сохранились изображения важнейших операций виноде-
лия. Собранный виноград древние виноделы давили но-
гами, отжимали в мешках, и полученное сусло оставляли
бродить.
Виноградный сок терял при брожении свой сладкий вкус.
Жидкость приобретала опьяняющие свойства. На поверхно-
сти виноградного сусла образовывалась грязная пена, а на
дне сосудов накапливался осадок.
Виноделы давно заметили, что этот осадок при внесении
его в сахаристую жидкость вызывает брожение. Сахар прев-
ращается в спирт.
С давних пор люди научились готовить спирт не только
из вина, но и из картофеля, хлебных злаков, сахарной пато-
ки. Познакомившись поближе со спиртом, люди заметили, чго
у него есть много замечательных свойств. Оказалось, что он
не только служит источником сильного опьянения и незаме-
нимым средством приготовления крепких напитков. Во мно-
гих случаях он является ценным лекарством и может прино-
сить исцеление больным.
По-видимому, на первых порах спирт получали перегон-
кой вина. Потому его по латыни называли «спиритус вини»,
т. е. дух вина. Алхимики считали спирт чудодейственным ве-
ществом. Они полагали, что он не только может излечивать
все болезни, но и возвращать молодость старикам и делать
жизнь человека более долговечной.
В нашу эпоху значительно расширились области примене-
ния спирта. Он нужен химикам для при- =====
готовления лаков, синтетического каучука, Пивные дрожжи
органических красителей, фармацев-
там— для изготовления лекарствен-
ных препаратов и настоек. В некоторых
странах спирт служит горючим для
двигателей внутреннего сгорания.
Естествоиспытатели и философы
още в древности пытались разгадать
секреты брожения. Было замечено, что
брожение сахаристых жидкостей уско-
ряется, если добавить к ним дрожжей.
Когда же брожение закончится, то
всегда в жидкости образуется обиль-
— 115 —
ный осадок дрожжей на ее поверхности в виде плотной
пены или же на дне сосуда.
В XVII в. Левенгук, рассматривая под микроскопом кап-
лю виноградного сусла, заметил какие-то зернышки овальной
формы. Они были гораздо крупнее анималькулей. В начале’
XIX в. было уже установлено, что дрожжи состоят из не-
больших яйцевидных зернышек. Уже тогда многие ученые-
считали, что дрожжи — живые организмы. Вскоре это пред-
положение было доказано опытным путем.
Какова же роль дрожжей в брожении? Ведь до сих пор*
мы не знаем никаких химических способов, с помощью кото-
рых можно было бы сахар превратить в спирт. И в нашу эпоху,,
как и тысячи лет тому назад, спирт получают брожением, не-
зависимо от того, что служит сырьем — картофель или хлеб-
ное зерно, древесина или солома.
Дрожжи,— говорили тогда ученые,— хорошо размножа-
ются в сахаристых жидкостях потому, что сахар служит им
прекрасной пищей. Размножаясь, дрожжи постепенно отми-
рают. Белковые вещества, которые входят в состав их телаг
попадают в жидкость. Молекулы белка распадаются. Распав-
шиеся частицы находятся в непрерывном колебании. Эти
колебания расшатывают молекулы сахара, которые распада-
ются на спирт и углекислый газ.
Этот взгляд на брожение разделяли в те времена круп-
нейшие химики. Но как это не раз бывало в истории науки,
ложные теории рано или поздно рушились под напором убе-
дительных наблюдений из жизни и точных опытов.
Такая судьба постигла и теорию брожения, созданную вы-
дающимся немецким химиком Либихом.
В 1854 г. молодой французский химик, впоследствии все-
мирноизвестный Луи Пастер был назначен деканом вновь
открытого естественного факультета в Лилльском универси-
тете, на юге Франции.
С давних пор в южных областях Франции культивирова-
лись лучшие сорта винограда для виноделия. Французские
вина славятся своим высоким качеством далеко за пределами
своей родины.
Виноделы за сотни лет накопили громадный практический
опыт. Они прекрасно знали, какие нужно брать сорта вино-
града, чтобы получить мадеру или херес, как готовить сто-
ловые или десертные вина.
— 116 —
Луи Пастер (1822—1895 гг.)
ПОМОЧЬ
отрасли
каким
было виноделие в Южной
Они также знали, что
сусло лучше и быстрее
сбраживается в присут-
ствии дрожжей, но уп-
равлять процессом бро-
жения они как следует не
могли. Нередко бывали
случаи, когда в бочках
вместо вкусного и аро-
матного вина оказыва-
лась кислая, дурно пах-
нущая жидкость. Вино-
делы обратились за по-
мощью в Лилльский уни-
верситет.
Ректор вызвал к себе
Пастера и предложил
ему заняться исследова-
нием брожения вина. Па-
стер горячо принялся за
дело. Им руководило не
только желание
этой важной
промышленности,
Франции, ему страстно хотелось вырвать у природы еще одну
тайну — разгадать сущность процесса брожения. Он пони-
мал, что принятая тогда учеными теория брожения не отра-
жает истинного положения вещей.
Одна из первых научных работ Пастера была посвяще-
на изучению двух близких по составу органических веществ —
двух разновидностей виноградной кислоты.
Исследуя эти кислоты, Пастер сделал интересное наблю-
дение: одна кислота с течением времени мутнела и разлага-
лась, а другая сохранялась в открытом сосуде месяцами, да-
же годами и никак не изменялась.
В чем же причина такого странного поведения двух столь
близких по химическому составу веществ?
Оказалось, что повинны в этом микробы. В колбе, где на-
ходилась одна разновидность кислоты, размножалось бесчис-
ленное количество микробов. Они вызывали помутнение и
разложение кислоты.
А в другой колбе, где была вторая разновидность кислоты,
микробы не могли жить и развиваться. Она оказалась для
них ядом. Потому эта кислота не изменяла ни своего внеш-
него вида, ни своих свойств даже при стоянии в течение дол-
гого времени.
— 117 —
Из этого открытия Пастер сделал вывод, что существует
определенная связь между появлением микробов и протека-
нием химической реакции. Выходит, что микробы подобно не-
которым химикатам могут разрушать сложные молекулы и
превращать их в частицы простых веществ.
Но если микробы могут разрушать виноградную кислоту,
то почему бы им не участвовать в химических реакциях меж-
ду другими веществами?
Приступив к исследованию брожения виноградного сока,
Пастер вспомнил о своих наблюдениях и размышлениях.
И прежде всего стал искать микробов в бродильных чанах.
Его поиски не остались напрасными.
В ароматном виноградном сусле Пастер находил только
округлые микроскопические клетки дрожжевых грибков. За-
то в бочках с прокисшим вином, в которых кроме спирта,
было и много уксуса, всегда присутствовали наряду с дрож-
жами и другие микробы.
Теперь уже Пастер был твердо убежден, что бурное прев-
ращение веществ при брожении вызывается только микроба-
ми, а отнюдь не колебанием белковых частиц или молекул
каких-либо других веществ. Это был сокрушительный удар
по старым воззрениям на брожение. И немедленно, после
опубликования Пастером своих представлений на него обру-
шились немецкий химик Либих и французский химик Пуше..
Либих был талантливый экспериментатор, замечательный
педагог и смелый новатор. Он был одним из первых ученых,
доказавших необходимость применения минеральных удобре-
ний для повышения плодородия. Но открытия Пастера Ли-
бих оценить не сумел.
Он решительно возражал против того, что микробы могут
вызывать брожение сока. По его мнению, эти микроскопиче-
ские живые существа зарождаются в виноградном соке само-
произвольно, точно так, как это имеет место и в других жид-
костях, которые подвергаются брожению.
Идеи самозарождения микробов поддержал и Пуше. В из-
данной им в 1859 г. толстой книге он приводил ряд своих
опытов, которые будто бы доказывали возможность самоза-
рождения микробов.
Пуше высмеивал Пастера, справедливо утверждавшего,
что каждый вид микробов вызывает определенную химиче-
скую реакцию, например, винные дрожжи являются виновни-
ками брожения вина, а уксуснокислые бактерии могут прев-
ращать вино в уксус.
Пуше был убежден в неправильности этого взгляда и ут-
верждал, что в любой колбе могут появиться любые микробы.
Сторонники теории самозарождения в один голос тверди-
— 118 —
ли, что микробы не только будто бы зарождаются при броже-
нии из мертвого материала, но что они легко переходят из
одной формы в другую. Так дрожжи сами собой становятся
плесенями, а плесени превращаются в дрожжи.
Противники Пастера подкрепляли свои утверждения ре-
зультатами многих, но далеко не точных опытов. Для того
чтобы опровергнуть аргументы своих противников, Пастер
поставил ряд остроумных опытов. Прежде всего он задался
целью доказать, что микробы, подобно узким специалистам-
химикам производят превращения только определенных ве-
ществ. У них существует своеобразное разделение труда. Од-
ни выполняют одни операции, другие их продолжают, а тре-
тьи заканчивают.
Дрожжи сбраживают сахар в спирт, но дальше разло-
жить его не могут. Он является для них отбросом, и при на-
коплении в бродильной жидкости большого количества спирта
брожение прекращается. Но достаточно внести в чан немного
уксуснокислых бактерий, как они начнут превращать спирт
в уксусную кислоту.
Для того чтобы опровергнуть взгляды своих противников
на брожение, как на процесс, идущий только в присутствии
белка, Пастер поставил опыты без белка. Белок он заменил
солями азотной кислоты. Оказалось, что дрожжи отнюдь не
разлагались, а напротив, размножа-
лись с исключительной быстротой.
Итак, было доказано, что спирто-
вое брожение вызывают только дрож-
жи, и никакие белковые вещества его
вызвать не могут.
С тех пор как человек научился
приготовлять из виноградного сока ви-
но, он познакомился и с уксусом. Ведь
слабое вино очень легко скисает и
становится уксусом. Потому французы
и называли уксус — винегр — кислое
вино. Издавна виноделы в разных
странах готовили уксус, заливая ви-
ном или разбавленным спиртом напол-
ненные древесными стружками чаны
при обильном доступе воздуха. Спирт
при этом превращается в уксусную ки-
Уксуснокислые бактерии
— 119 —
слоту. Одновременно образуются и некоторые ароматические
вещества, которые придают уксусу приятный вкус. Противни-
ки Пастера считали, что виновником брожения служат не
бактерии, а древесные стружки. И здесь, как и при спиртовом
брожении, Пастер доказал, что белки не причем, неповинны
в нем и стружки, а вызывают брожение уксуснокислые микро-
бы. Они охотно селятся в стружках, потому у виноделов и
сложилось мнение, что для превращения вина или спирта в
уксус нужны древесные стружки.
Пастер не ограничился опытами по исследованию спир-
тового и уксуснокислого брожений. Он решил заодно выяс-
нить и сущность молочнокислого брожения и показать своим
противникам, что и здесь дело не в белке, а в микробах.
Он приготовил чистый раствор сахара в воде, добавил
к нему немного аммиака и минеральных солей, необходимых
для развития и жизни микробов. Затем тщательно прокипя-
тил смесь для того, чтобы уничтожить в ней всех бактерий.
В колбу внес каплю жидкости, в которой уже началось молоч-
нокислое брожение. Раствор сахара начал быстро превра-
щаться в молочную кислоту, а на дне постепенно накапли-
вался какой-то осадок.
Пастер исследовал осадок под микроскопом и обнаружил
в нем неизвестные ранее молочнокислые бактерии. Они-то и
были виновниками превращения сахара в молочную кислоту.
Без них не обходится ни превращение кобыльего молока
в кумыс, ни образование простокваши, ни производство ке-
фира. Молочнокислые бактерии принимают участие в процес-
се созревания сыра, играют главную роль при квашении ка-
пусты, засолки огурцов.
Расщепление сахара молочнокислыми бактериями проис-
ходит без участия свободного кислорода.
Точные опыты Пастера нанесли сокрушительный удар по
старым воззрениям на брожение. Они убедительно доказали,
что брожение это не колебание молекул, а проявление жиз-
ненных процессов невидимых микроскопических живых
существ.
Для чего же нужно брожение самим микроорганизмам?
На этот вопрос Пастер ответил своим знаменитым изречени-
ем: «Брожение — это дыхание без кислорода».
При дыхании живые существа поглощают кислород из
воздуха и с его помощью превращают пищу в углекислый
газ и воду, причем выделяется тепло. Дыхание и необходимо
для живых организмов только потому, что оно происходит
с выделением тепла. Если бы нужную для жизнедеятельности
энергию организм мог бы получать каким-либо другим путем,
отпала бы необходимость в дыхании. А при брожении все-
— 120 —
гда выделяется тепло, потому оно и заменяет бактериям ды-
хание.
Под давлением неоспоримых доказательств противники
Пастера были вынуждены признать справедливость его ут-
верждения.
Старая теория брожения рухнула, но ее сторонники еще
окончательно не сдавались. Они говорили: брожение вызы-
вается микробами. Но откуда берутся микробы в молоке,
в вине, в пиве? — они самозарождаются.
Для того чтобы опровергнуть и это утверждение и упро-
чить окончательно созданную им теорию брожения, Пастер
поставил новые опыты. Он не сомневался в том, что природа
даст ему четкий и ясный ответ, если суметь спросить ее ис-
кусно. А Пастер был блестящим экспериментатором. Он
умел ставить опыты с исключительной точностью.
Прежде всего Пастер доказал, что зародыши микробов но-
сятся в воздухе, существуют в воде, присутствуют в почве.
А для того чтобы они не проникали туда, где желательно
обойтись без них, следует нагревать или обеззараживать со-
суды с жидкостями, с которыми проводятся опыты.
Пастер взял круглую колбу с узким горлом, наполнил ее
легко портящейся жидкостью и нагрел на огне. Горлышко
колбы соединил с длинной стеклянной трубкой, конец кото-
рой пропустил в газовую печь. Образующийся при нагрева-
нии жидкости пар выходит наружу по этой трубке. Когда на-
гревание жидкости заканчивается, то пар оседает каплями на
стенках колбы, а в колбу по трубке устремляется наружный
воздух. Поскольку он проходит через часть трубки, находя-
щейся в газовой печи, то все имеющиеся в нем зародыши
микробов уничтожаются.
Затем ученый охлаждал колбу, запаивал ее и ставил
в теплое место. Обычно в таких условиях микробы быстро
размножаются. Однако Пастер при самом тщательном анализе
не смог обнаружить в своей колбе никаких живых существ.
Но стоило только внести в колбу капли жидкости, в которой
находились бактерии, как в колбе начинала бурно развивать-
ся жизнь. Микробы появлялись в колбе, даже если ее просто
оставляли на некоторое время на воздухе.
Пастер показал, что можно и без всякого нагревания
предохранить жидкости от попадания в них микробов, если
колбы закрывать ватными пробками. Наружный воздух будет
проходить через вату, как через фильтр. В вате останутся все
микробы. И не было такого случая, чтобы в колбе с ватной
пробкой стали развиваться бактерии.
Свои опыты Пастер повторял многократно и всегда по-
лучал те же самые результаты.
— 121 —
Пал последний оплот приверженцев старой теории бро-
жения. Нет самозарождения в природе, нет его ни у высших
животных, ни у низших, нет его и у микробов. Бактерии, как
и все живое на свете, развиваются из своих зародышей. Па-
стер оказался победителем в споре о самозарождении Ч
Открытия Пастера утвердили правильные взгляды на по-
явление и развитие микробов, они произвели переворот в су-
ществовавших ранее представлениях на процесс дыхания.
Раньше считали, что жизнедеятельность всего живого
неразрывно связана с процессом окисления при участии
кислорода воздуха. Недаром кислород в XVIII в. называли
«жизненным газом» или «здоровым воздухом», а жизнь рас-
сматривали, как «медленное горение».
Результаты опытов Пастера заставили ученых пересмот-
реть свои взгляды на жизнь. Формула: «нет жизни без сво-
бодного кислорода» оказалась несостоятельной. Пришлось
пересмотреть заново и понятие о дыхании. Пришлось согла-
ситься с Пастером, что дыхание возможно при любой хими-
ческой реакции, которая протекает с выделением тепла,
независимо от того, будет ли она реакцией окисления или
разложения.
Тайна брожения была окончательно разгадана, и люди
научились им управлять.
Теперь наука сделала наших случайных помощников —
полезных микробов, верными и покорными слугами. Озорные
проказники, превращавшие сладкий свекловичный сок в гу-
стую клейкую кашицу, ароматное вино в кислый уксус, неж-
ное на вкус сливочное масло в прогорклую, с отвратительным
запахом массу, стали послушно исполнять волю человека.
Раньше, когда еще не знали, что уксусное брожение вы-
зывается особыми бактериями, производство уксуса было со-
пряжено со многими случайностями. Обычно прокисшее
вино или другую какую-либо жидкость, содержащую спирт,
1 Успешные опыты Пастера, доказавшие, что самозарождение не про-
исходит, не опровергают существующих в науке представлений о возник-
новении живого из неживого в отдаленные геологические эпохи. Возможно,
со временем мы сможем воспроизвести в наших лабораториях те условия,
какие были когда-то на Земле. Не подлежит сомнению, что пионерами жиз-
ни были какие-то микроскопические живые существа, которые умели из не-
органических веществ — углекислоты, кислорода и азота воздуха строить
свои клетки.
— 122 —
разливали в большие чаны и ждали пока не образуется
пленка. Производители уксуса по опыту знали, что пленка
обеспечивает получение уксуса хорошего качества.
Бывали случаи, что спрос на уксус сокращался, тогда
хозяин должен был бы уменьшить число чанов. Но если спрос
на уксус снова возрастал, то пришлось бы опять увеличить
число чанов и терпеливо ждать, когда вырастет пленка. По-
этому обычно даже при временном уменьшении спроса про-
изводство уксуса продолжалось тем же темпом. И часто при-
ходилось делать много лишних и непроизводительных затрат.
К тому же бывали случаи, когда вместо высококачествен-
ного, ароматного уксуса получался негодный к употреблению,
дурно пахнущий продукт.
Открытия Пастера дали возможность вести производство
уксуса без малейшего риска. Теперь к услугам производст-
венников целый ряд уксуснокислых бактерий, и они могут
пользоваться той или иной, по своему усмотрению. Они пре-
красно знают, при каких условиях та или иная бактерия
будет лучше развиваться и обеспечит большой выход уксуса.
Необозримые горизонты раскрылись и для многих дру-
гих производств, основанных на брожении. Для производства
вина, приготовления спирта, варки пива стали искусствен-
ным путем получать различные виды дрожжей, которые да-
ют возможность получать различные сорта напитков по на-
шему выбору и усмотрению.
Неоценимые услуги оказала молодая наука — микробио-
логия — и хлебопечению. Еще несколько тысячелетий тому
назад люди научились печь хлеб. Уже в древних восточных
государствах — в Египте, Греции, Палестине — знали, что
хлебное тесто хорошо поднимается, если к нему подмешать
немного забродившего виноградного сока или добавить кусок
старого теста. Однако люди тогда не знали, что брожение,
которое делает тесто пористым и дает припек, вызвано ми-
кробами.
При выпечке пшеничного хлеба в брожении участвуют не
только дрожжи, но и молочнокислые бактерии. Дрожжи раз-
лагают сахар, который содержится в муке или образуется из
мучного крахмала, и превращают его в спирт и углекислоту.
Пузырьки газа раздувают и поднимают тесто.
Молочнокислые же бактерии также разлагают сахар те-
ста, но превращают его в молочную кислоту.
Эта кислота — верная союзница хлебопеков. Она усили-
вает деятельность дрожжевых грибков, убивает вредных ми-
кробов, которые портят вкус пшеничного хлеба. Теперь на
дрожжевых заводах производят различные виды дрожжей,
которые позволяют хлебозаводам печь вкусные булки и хлеб.
— 123 —
Молочная кислота играет важную роль не только во мно-
гих отраслях пищевой промышленности, она нужна кожевни-
кам— для удаления извести с кож, текстильщикам — для
крашения тканей, где она служит протравой, фармацевтам —
для приготовления некоторых лекарств.
За границей еще до первой мировой войны было налажено
производство этой, столь нужной промышленности, кислоты
в широких масштабах. Главным поставщиком молочной кис-
лоты почти во все страны мира, в том числе и в Россию, была
тогда Германия.
После великого Октября в нашей стране возникли многие
производства, которых не знала царская Россия. Решено
было наладить у нас и производство молочной кислоты.
В 1920 г. Высший Совет народного хозяйства поручил
доктору биологических наук, профессору В. Н. Шапошникову
разработать наиболее простой способ получения молочной
кислоты.
Прежде всего нужно было найти подходящую молочно-
кислую бактерию. Ведь в природе существуют сотни видов,
этих микробов. Каждый из них имеет свою любимую пищу,
развивается при определенной температуре, обладает разной
способностью превращать сахар в молочную кислоту.
Какую же из бактерий следовало выбрать? Где нужно
искать ее? Ответ на эти вопросы мог дать только опыт.
Сначала попробовали искать нужную бактерию в молоч-
ных продуктах. Но оказалось, что бактерии, обитающие
в молоке, сметане, простокваше, непригодны для промышлен-
ного производства молочной кислоты. Они дают слишком
мало кислоты.
Тогда решили поискать нужную бактерию в муке. В ла-
боратории были испытаны сотни проб самой разнообразной
муки — ржаной, пшеничной, кукурузной. На этот раз труды
не пропали даром. Но нужно было не только найти бактерию,
но и выделить ее в чистом виде, заставить ее размножаться.
И, что самое главное, необходимо было выяснить, каков бу-
дет выход кислоты при сбраживании сахара.
Для опытов взяли бактерию Дельбрюка. Это весьма
крупная бактерия, примерно в семь раз длиннее своих род-
ственниц. К тому же она прекрасно переносит температуру
в 50 градусов, тогда как другие бактерии уже погибают при
36—38 градусах.
Теперь оставалось еще выяснить, чем ее лучше всего кор-
мить й при какой температуре она будет лучше всего разви-
ваться и давать наибольшее количество молочной кислоты.
Снова ставятся бесчисленные опыты с различными пита-
тельными растворами. И наконец в лаборатории создается
— 124 —
нужный промышленности технологический процесс приготов-
ления молочной кислоты.
В бродильный чан, в котором поддерживается нужная
температура, наливают экстракт богатой белками виковой
муки и раствор чистого сахара. Теперь достаточно внести
в чан небольшое количество молочнокислых бактерий, чтобы
начался процесс образования молочной кислоты.
Молочнокислые бактерии не нуждаются в кислороде для
своей «работы» — переделки сахара в молочную кислоту. Ды-
хание им заменяет брожение.
Вместо виковой муки можно брать мелассу (черную пато-
ку), подсолнечные и конопляные жмыхи.
С давних пор эти бактерии оказывают неоценимые услуги
и земледельцам, и животноводам. Во многих странах еще
в глубокой древности запасали корм для домашних животных
не только высушивая траву, но и заквашивая свежесобран-
ную зеленую массу.
Свекольную и картофельную ботву, капустные листья или
стебли подсолнечника и кукурузы измельчают и закладывают
в ямы или траншеи. Часто предназначенные для консервиро-
вания растения помещают в специальные деревянные или
каменные башни.
Во влажной растительной массе развивается брожение.
Его называют силосованием, а заквашенный корм — силосом.
В силосовании кормов принимают участие разные микробы,
но сильнее всего развиваются молочнокислые бактерии. Они
придают силосуемой массе кислый вкус и убивают гнилост-
ных бактерий, которые населяют зеленую массу растений.
Иногда в силосные ямы добавляют немного поваренной соли;
силосуемые растения при этом быстрее отдают свой сок. До-
бавка соли ускоряет развитие молочнокислых бактерий, по-
тому что вместе с соком выделяется сахар, содержащийся
в клетках растений.
Если силосуемая масса уложена очень плотно, то броже-
ние происходит довольно медленно, без значительного разо-
гревания. При рыхлой укладке измельченных растений мас-
са разогревается гораздо сильнее. Температура повышается
до 60—70 градусов. Это объясняется присутствием небольшо-
го количества кислорода, который значительно ускоряет бро-
жение. Освобождающееся при этом тепло вызывает сильное
разогревание зеленой массы.
В силосе размножаются и маслянокислые бактерии, те
самые, которые вызывают прогоркание масла. Они могут
придать силосуемым кормам неприятный привкус. Но подав-
ляют молочнокислые бактерии. И если силосование произво-
дится правильно, то через несколько месяцев получаются
— 125 —
сочные корма, охотно поедаемые скотом. Силос является более
питательным кормом, чем обыкновенное сено.
Маслянокислые бактерии широко распространены в при-
роде. Их можно встретить и в почве, и в навозе, в грязной
воде и в пыли. Они присутствуют в молоке и в сыре, селятся
на хлебных зернах, бобах и горохе.
Эти бактерии вызывают маслянокислое брожение. Они1
разлагают сахар и углеводы и некоторые высшие спирты.
Главным продуктом их «работы» является масляная кислота,
но одновременно выделяется и углекислый газ и водород
(иногда метан). Маслянокислое брожение протекает без уча-
стия кислорода, лучше всего при температуре 35 градусов.
Наряду с масляной кислотой при брожении образуются
разные органические вещества: ацетон, бутиловый спирт,
пропионовая кислота. Изучая поведение маслянокислых бак-
терий, ученые заметили, что можно по нашему желанию ре-
гулировать брожение и направлять его по тому или иному
руслу. Например, если в бродильный чан добавить мела, то
будет получаться больше масляной кислоты и совсем немного
ацетона и бутилового спирта, а в отсутствии мела — на-
оборот. Ацетон и бутиловый спирт широко применяются в про-
мышленности в качестве растворителей при изготовлении
лаков, красок, пластмасс. Из бутилового спирта теперь гото-
вят также синтетический каучук.
С незапамятных времен люди в разных странах расстила-
ли лен, коноплю, джут на лугах под открытым небом. Стебли
мочила роса и дожди, сушило солнце. Росяная мочка пря-
дильных растений, как в технике называют этот процесс,
помогала разъединить лубяные волокна, склеенные между
собой, как цементом, особыми пектиновыми веществами.
При мочке лубяные пучки освобождались от кожицы и дре-
весинной части стебля (костры), которые затем легко уда-
лялись.
Во время мочки стеблей льна или конопли на открытом
воздухе на них развивается множество аэробных микробов.
В присутствии кислорода воздуха они энергично размножа-
ются и, вызывая брожение пектиновых веществ, склеивающих
лубяные волокна, разрушают их. При брожении выделяются
масляная и уксусная кислота, водород и углекислый газ.
Значительно быстрее идет разложение пектиновых ве-
ществ, если мочка льна производится в прудах или водоемах
со стоячей водой. В этих условиях в брожении принимают
участие главным образом маслянокислые бактерии, которые
не нуждаются в кислороде.
Раньше лимонную кислоту получали исключительно из ли-
монов и других цитрусовых. Она обходилась очень дорого.
— 126 —
А теперь раствор сахара окисляют с помощью некоторых
плесневых грибков. Лимонная кислота получается гораздо
быстрее и стоит дешевле.
Микробы служат верно не только производственникам
в разных отраслях промышленности, они пригодились и
энергетикам.
Немало и других ценных услуг оказывают микробы сель-
скому хозяйству. Они ревностно несут службу на полях и лу-
гах, в лесах и садах. Плодородие почвы во многом обязано
микробам. Они словно вечно бодрствующие могильщики раз-
лагают трупы животных, птиц, насекомых, растительные
остатки, превращая их в ценную составную часть почвы —
перегной.
Микробы ничтожно малы, но их так много находится
в почве, что они в состоянии проводить свою гигантскую
работу. В одном грамме чернозема можно обнаружить не-
сколько миллиардов микробов.
Растительные остатки, которые скапливаются в почве,
в основном состоят из клетчатки. Бактерии по-разному рас-
правляются с клетчаткой. Одни разлагают ее с выделением
метана и углекислоты. Другие сбраживают целлюлозу, выде-
ляя водород и углекислый газ \ Эти процессы идут по типу
маслянокислого брожения, без доступа воздуха.
Есть множество бактерцй, грибков, плесеней, которые раз-
рушают клетки в почве и в присутствии кислорода. Из про-
дуктов разложения клетчатки образуется гумус — черное ве-
щество почвы, которое придает ей плодородие.
В рационе питания растений важное место занимает азот.
Без него немыслимо построение белков, составляющих часть
тела растений. В окружающем нашу планету воздушном
океане содержатся миллиарды тонн азота. Однако растения
не могут усваивать из воздуха нужный им для жизни азот.
Не могут они забирать азот и из трупов животных, остатков
отмерших растений, попадающих в почву. Вот тут им на по-
мощь приходят незримые помощники урожая — микро-
бы. Гнилостные бактерии нападают на белковые вещества,
1 Целлюлозные бациллы иногда наносят большой вред книгохранили-
щам. В одной из крупных библиотек они испортили много книг. На стра-
ницах книг появлялись разноцветные пятна и налеты, листы стали ломки-
ми и выцвели. Особенно часто эти бактерии развиваются в сырых и плохо
отапливаемых помещениях архивов и библиотек.
— 127 —
Сергей Николаевич Виноградский
(1856—1953 гг.)
Долгое время думали, что
происходит кислородом воздуха
оставленные на водухе, и бы-
стро расправляются с ними.
Разлагая белки, микробы
освобождают азот в виде
аммиачных солей, легко ус-
ваиваемых растениями. Но
еще лучше усваивают ра-
стения соли азотной кисло-
ты. И природа, словно идя
навстречу желаниям расте-
ний, превращает аммоний-
ные соли в почве с помо-
щью бактерий в азотноки-
слые.
Микробы, окисляющие
соли аммиака в селитры, на-
зываются нитрифицирую-
щими. В некоторых странах
этот окислительный про-
цесс происходит настолько
интенсивно, что на поверх-
ности земли в отдельных
местах образуются налеты
Кристаллической селитры.
окисление аммиака в почве
или озоном, т. е. химическим
путем.
В 1862 г. Пастер высказал предположение, что виновника-
ми такого окисления должны быть какие-то микробы. Спу-
стя 16 лет догадка выдающегося ученого была доказана опыт-
ным путем.
Два французских ученых Шлезиыг и Мюнц пропускали
струю сточной воды через стеклянный фильтр, наполненный
кварцевым песком и мелом. В сточных водах всегда содер-
жатся аммонийные соли. В профильтрованной воде ученые
вместо аммонийных солей обнаружили селитру.
При нагревании сточной воды выше ста градусов и до-
бавке хлороформа селитры не получилось.
Кто же был виновником этого превращения?
Ответ мог быть только один — микробы. Шлезинг и Мюнц
безуспешно пытались получить их в чистом виде. Не удалось
выделить в чистом виде нитрифицирующих микробов и мно-
гим другим ученым.
По-иному подошел к решению этой задачи русский микро-
биолог С. Н. Виноградский, который в 1889 г. внес полную
ясность в сущность нитрификации и нашел ее возбудителей.
— 128 —
Он не стал разводить микробов на чистых бульонах, как
это делали его предшественники, изучавшие до него нитри-
фикацию. Небольшие комочки почвы, в которых он предпо-
лагал присутствие этих микробов, вносил в раствор аммоний-
ных и других необходимых для питания растений солей.
Успех не замедлил себя ждать. Нитрификация в этих раство-
рах шла вполне исправно. Выделив нитрифицирующие бакте-
рии, Виноградский установил, что превращение аммонийных
солей происходит не сразу, а в две стадии. Сначала аммиак
превращается в азотистую кислоту, которая окисляется
в азотную кислоту. И делают это два разных микроба. Од-
ного называют нитрозией, а другого — азотобактером.
Эти микробы не только непрерывно удобряют почву, помо-
гая растениям получать нужный им для питания азот. Они
запасают азотные удобрения и впрок.
Им человечество обязано созданием крупных залежей
селитры в Египте, Индии, Чили. Нитрифицирующие микробы
произвели титаническую работу, начатую ими еще в отдален-
ные геологические эпохи. И труды их пригодились земле-
дельцам, помогая повышать урожай.
Новейшие исследования показали, что эти бактерии обла-
дают еще одним качеством. Они могут подобно зеленым ра-
стениям забирать углерод из углекислоты. Они не могут, как
растения, пользоваться для разложения углекислоты солнеч-
ной энергией. У них ведь нет хлорофильных зерен. Откуда
же бактерии берут необходимую для этого энергию?
Оказывается, за счет реакции окисления аммиака и азо-
тистой кислоты, которая идет с выделением тепла.
В почве живут и такие микробы, которые могут усваивать
азот непосредственно из воздуха и превращать его в азоти-
сто-аммонийные соли. Если бы не было этих микробов, то не
росла бы трава на лугах без удобрения, не поднимались бы
леса на одних и тех же участках в течение многих лет.
Знаменитый французский химик Бертло еще в середине
прошлого столетия отмечал в своих трудах, что почвенный
слой лесов и лугов давно оскудел бы азотом, если бы невиди-
мые «работники» не пополняли его запасы в почве. В 1893 г.
эти микробы были открыты русским ученым С. Н. Виноград-
ским. Оказалось, что они разлагают сахар на масляную
и уксусную кислоты, бутиловый спирт, водород и углеки-
слоту.
Среди ученых нет пока единого взгляда на процесс усвое-
ния атмосферного азота микробами. Одни полагают, что из
воды и азота образуется азотисто-аммонийная соль. Другие
считают, что при взаимодействии азота с водой образуется
аммиак и выделяется свободный кислород.
|Q Б я. Розен
— 129 —
Нитрифицирующие бактерии
в них «квартиран-
В 1901 г. немецкий
ученый Бейеринг нашел
в садовой земле другой
микроб — усвоитель
азота. Его назвали азо-
тобактером.
Этот микроб—аэроб.
Потому он чаще всего
встречается в хорошо
проветриваемых почвах.
Как и другие нитрифи-
цирующие микробы, он
может усваивать азот
только в присутствии
органических веществ — углеводов, спиртов, кислот. Разлагая
их до воды и углекислоты, он получает нужную ему для жиз-
ни энергию. Азот, который азотобактер забирает из воздуха,
служит строительным материалом для его тела. Когда микроб
отмирает, то его клетки подвергаются гниению. Азот превра-
щается в азотистые соли и становится доступным для усвое-
ния растениями.
Издавна земледельцы и ученые замечали на корнях бобо-
вых растений — клевера, вики, фасоли — какие-то маленькие
наросты — клубеньки. Но никто не обращал на них внима-
ния, не задумывался над их значением в жизни растений.
Лишь в шестидесятых годах прошлого века ими заинте-
ресовалось несколько зарубежных и русских ученых — Воро-
нин, Гелльригель, Вилльфарт. Они тщательно исследовали
под микроскопом клубеньки и обнаружили
тов»— микробов, которые могут
усваивать азот из воздуха. Клубень
Вначале эти микробы, быстро
размножаясь, поедают у растения нуж-
ные им для питания органические веще-
ства. Постепенно, когда растение ок-
репнет, то роли меняются. «Хозяин»
своими соками убивает «квартиран-
тов» и забирает собранный микробами
запас азота.
Клубеньковые бактерии приносят
столь большую пользу земледелию, что
в некоторых странах устроены специаль-
ные фабрики, на которых готовят в огром-
ных количествах их специальные развод-
ки— нитрагин. Достаточно смочить се-
мена бобовых растений жидкостью с ни-
на корнях бобовых
растений
— 130 —
трагином, чтобы обеспечить растению необходимое азотное
питание до конца его жизни.
В Советском Союзе производство «живых» удобрений за
последние годы сильно возросло. В Москве, Ленинграде,
Свердловске, Кузнецке и многих других городах готовят для
колхозов и совхозов нитрагин и азотоген — препарат азото-
бактера с мелкоизмельченным торфом. Миллионы гектаров
земли удобряют теперь у нас «живыми» удобрениями.
А ведь каждый килограмм азота, усвоенный растениями,
дает нам добавочно с гектара до 5—10 килограммов зерна,
до 50 килограммов картофеля и сахарной свеклы, до 3—
4 килограммов волокон хлопка.
Азотные запасы почвы непрерывно истощают растения, их
вымывает вода, уничтожают бактерии. Оказывается, в почве
живут не только микробы — друзья земледельцев, превра-
щающие атмосферный азот в усваиваемые растениями азот-
ные соли, в ней квартируют и враги урожая. Их называют
денитрифицирующими бактериями. Большинство из них
анаэробы. Не имея свободного кислорода, они забирают его
из солей азотной и азотистой кислот, превращая их в свобод-
ный азот. Одновременно они окисляют различные органиче-
ские вещества, добывая при окислении нужную им энергию.
Ученые полагают, что разложение азотных солей проис-
ходит не сразу, а в три стадии. Сначала азотная соль теряет
кислород и превращается в азотистую, которая также отщеп-
ляет молекулу кислорода. Образуется промежуточный про-
дукт, в котором еще содержится азот и кислород. Наконец он
тоже разлагается на воду и азот.
В рационе питания растений большое место занимают
фосфорные и калийные соли. Без фосфора не может расти
ни одно растение. Без него не появятся на полях всходы пше-
ницы, не созреет лен, не начнет колоситься рожь. Но доста-
точно внести в почву фосфорные соли, как сразу повысится
урожай.
Если в почве будет мало калийных солей, растения боле-
ют и хиреют. Листья у них становятся чахлыми, стебель вя-
лым, зерна и клубни содержат мало крахмала.
Калийные удобрения не только избавят растения от неду-
гов, но помогут им быстрее и лучше развиваться. На каждый
килограмм внесенной в почву калийной соли урожай сахар-
10*
— 131 —
Гигантская серо-
бактерия
ной свеклы и картофеля увеличится на
40—50 килограммов, пшеницы на 3—
4 килограмма.
Несколько лет назад советский ученый
Р. А. Менкина обнаружила в почве бак-
терии, которые разлагают вещества, со-
держащие фосфор. Они накапливают
фосфорную кислоту, необходимую для
нормального питания растений. Их дея-
тельность приносит неоценимую пользу
земледельцам, повышая урожай.
На наших заводах из этих бактерий
приготовляют новый препарат — фосфо-
робактер. Удобряя почву этим препара-
том, удается повысить урожай овса, пше-
ницы, ржи на 15—30 процентов.
В отряде незримых помощников урожая известностью
пользуются и силикатные бактерии. Они могут разрушать
горные породы — алюмосиликаты — сложные соединения,
в которых, наряду с кремнием, алюминием и кислородом, со-
держится калий. Если этими бактериями заражать перед
посевом семена или почву, то значительно увеличивается
урожай.
При гниении белков, кроме аммиака, всегда выделяется
сероводород — газ с запахом тухлых яиц. Целебная грязь
одесских лиманов пропитана сероводородом, который обра-
зуется гнилостными микробами, уничтожающими остатки жи-
вотных и растений, некогда скопившихся на дне этих закры-
тых водоемов. Потому много сероводорода и в соленых озерах
и прудах с застойной водой.
В пучинах Черного моря, лазурные волны которого в яр-
кий солнечный день соревнуются по цвету с небом, не могут
жить ни растения, ни животные. Ниже 200 метров- от поверх-
ности вода отравлена сероводородом, несущим смерть расти-
тельному и животному миру.
Почему же на поверхности моря всегда такая чистая и
прозрачная вода без всякого запаса сероводорода?
Этим мы обязаны снова бактериям. День и ночь, из года
в год трудятся невидимые химики — серобактерии. Одни из
них бесцветные — это аэробы, другие окрашены в различ-
ные цвета — от кирпично-красного до бледно-розового. Есть
среди них и пурпурные и зеленые1 — это анаэробы.
1 В природе встречаются бактерии, окрашенные в самые различные
цвета: синий, фиолетовый, оранжевый, желтый, коричневый. Мореплавате-
ли, посещавшие берега Гренландии и Новую Землю, были не раз свидете-
— 132 —
Сначала они окисляют сероводород в серу, при этом выде-
ляется водород. Капельки жидкой серы они откладывают про-
запас в своем теле. А затем серу они окисляют в серную кис-
лоту. Этот процесс заменяет серобактериям дыхание. Из этой
реакции они получают энергию.
Подобно азотобактериям, серобактерии — благодетели ра-
стений, они переводят ядовитый газ — сероводород в серную
кислоту, которая легко усваивается растениями.
Их всегда можно найти в прудах и болотах, встретить
в серных ключах и источниках, обнаружить в неглубоких мор-
ских заливах и соленых озерах.
Ученые считают, что некоторые крупные залежи серы на
нашей планете «(родились» при отмирании серобактерий, на-
пример на Кавказе, в Средней Азии, в США.
Кроме серы и азота, растениям для построения белковых
молекул нужен фосфор. При отмирании растений в почву по-
падают различные органические соединения, в которых име-
ются атомы фосфора, содержащиеся в корнях и стеблях.
Некоторая часть фосфора, нужного растениям, попадает
в почву из белков при разложении их гнилостными бактерия-
ми. Для того чтобы растения могли бы извлечь из почвы фос-
фор, он должен быть в виде солей фосфористой и фосфорно-
ватистой кислот. Вот тут-то на помощь зеленому царству и
приходят бактерии. Они переводят соединения фосфора, по-
падающие в почву, в такие вещества, которые легко усваива-
ются растениями.
Наукой теперь доказано, что для нормального развития
растений нужно несколько десятков различных элементов,
в том числе: медь, бор, марганец, железо.
Железо и его соединения встречаются повсюду — в горных
породах, в глине, песке. Железистые соли есть в прудах и бо-
лотах, озерах и источниках.
Часто в водоемах можно встретить ржавчину — это массы
железобактерий, покрытых, словно средневековые рыцари,
панцирями, тонкой пленкой гидрата окиси железа. Это микро-
бы выискивают и притягивают крупинки железа. Они извлекают
лями феерического зрелища — снег на скалах был окрашен в кроваво-крас-
ный и зеленый цвет.
Палочки безвредного микроба кроваво-красного цвета, названного
«чудесной кровью», стяжали себе в истории печальную известность. Из-за
них в XIV в. в Германии погибли тысячи невинных людей. В 1329 г. в од-
ной из церквей города Франкфурта на «гостиях» (лепешки, которые упот-
ребляли католики для «причастия») появились кровавые пятна. Духовен-
ство это истолковало, как знак «гнева божья», который требует искупитель-
ной жертвы. Более десяти тысяч человек, обвиненных в колдовстве, было
сожжено на кострах и убито тогда в германских городах — Франкфурте,
Вюрцбурге, Нюрнберге.
— 133 —
Железобактерии
из воды растворенную в ней закис-
ную углежелезную соль и превра-
щают ее в гидрат окиси железа.
Эта реакция заменяет желе-
зобактериям дыхание и дает им
энергию для жизни.
Трудами этих неутомимых
собирателей железа ежегодно на
дне озер и болот, в реках и морях
отлагаются миллионы тонн же-
лезной руды.
Иногда в воде совместно
с железистыми солями содержится двууглекислая соль мар-
ганца. Железобактерии окисляют и эту соль. Так образуются
некоторые залежи марганцевых руд. Советские ученые обна-
ружили железомарганцевые «лепешки» — конкреции, создан-
ные железобактериями в Черном, Балтийском, Баренцовом и
других морях. Особенно много таких конкреций в централь-
ной части Карского моря. Одни из них похожи на большие
бобы, другие напоминают ватрушки. Накапливаясь в течение
тысячелетий, они образуют крупные месторождения железо-
марганцевых руд.
Велико и многообразно наследство, оставленное микроба-
ми человечеству.
Нефть, каменный уголь, торф, горючие сланцы и даже из-
вестняк и мел обязаны своим происхождением жизнедеятель-
ности неутомимых невидимых тружеников.
Если рассмотреть тонкий срез каменного угля под микро-
скопом, то можно увидеть мелкие зернышки — это кокки. Эги
бактерии окаменели вместе с остатками растений, которые
они разрушали миллионы лет назад.
В маленьком кусочке торфа можно обнаружить несколько
сот тысяч живых микробов.
Много споров среди ученых вызывало происхождение
нефти.
В настоящее время твердо установлено, что нефть образо-
валась в отдаленные геологические эпохи из остатков расте-
ний и животных. В их разложении деятельное участие прини-
мали разнообразные микробы. Под большим давлением, без
доступа воздуха в недрах Земли образовались углеводороды,
смесь которых и представляет собой нефть.
В горячих источниках, пресных и соленых озерах живут
микробы, которые выделяют углекислый кальций. Из отложе-
ний этих бактерий образуются залежи мела и известняка.
В США неподалеку от берегов Флориды есть острова, соз-
данные микробами за много миллионов лет.
— 134 —
Создавая горные породы, микробы и разрушают их. Азот-
ная и азотистая кислоты, которые выделяются при окислении
микробами аммиака, разъедают известняки, растворяя угле-
кислый кальций.
Выветривание пород ускоряется серной кислотой, которую
готовят серобактерии, окисляя сероводород.
Есть в природе микробы, называемые сапрофитами. Отли-
чительная их особенность — способность выделять в атмосфе-
ру углекислоту. Попадая с пылью на гранитные или базальто-
вые скалы, они участвуют в их выветривании, так как углекис-
лота растворяет самые твердые горные породы.
Микробы разрушают и каменный уголь и нефть.
Так, созидая и разрушая, незримые обитатели нашей пла-
неты вносят свою лепту в круговорот жизни на Земле.
Всюду мы встречаем результаты их бурной деятельности,
неразрывно связанной с окислительно-восстановительными
процессами.
ошед © О £ G> GQ а я
ЗЕЛЕНАЯ
ЛАБОРАТОРИЯ
HPACLSil^? ГДtifTaj^P
0 середине семнадцатого века во Фландрии
славился своим искусством врач Иоганн
Ван-Гельмонт. Страстно любя медицину,
он в то же время увлекался химией. В небольшой домашней
лаборатории он неоднократно засиживался ночами, проводя
тот или иной опыт. Его пытливый ум стремился проникнуть в
тайны химических прев|ращений, постигнуть законы, управля-
ющие химическими реакциями.
Однажды он взял несколько кусочков серебра, взвесил их
и нагрел в реторте. Серебро после прокаливания преврати-
лось в окалину, в темную, землистую массу. Окалину Вач-
Гельмонт опустил в колбу с серной кислотой. Проходило не-
много времени и раствор становился прозрачным, как вода.
Содержимое колбы ученый подвергал перегонке. На дне ее
оставалось серебро в прежнем весе.
То же самое наблюдалось и тогда, когда он вместо серной
кислоты брал азотную.
— 136 —
Изучая состав и свойства разных минералов, металлов, со-
лей, Ван-Гельмонт заинтересовался и растениями.
Из каких «кирпичиков» строит растение свое тело, что слу-
жит ему пищей, почему из маленького семечка может вырасти
высокое и толстое дерево?
Он пытался найти разгадку этой тайны в книгах древних
и современных ему естествоиспытателей, но напрасно — в них
рост растений объяснялся «божественной силой».
Тогда Ван-Гельмонт решил проделать следующий опыт. Он
взял большой глиняный горшок, насыпал в него 91 кило-
грамм сухой земли. Затем слепка полил землю чистой дожде-
вой водой и посадил в горшок иво-вую ветвь. Горшок плотно
закрыл железной крышкой. Ветку ивы Ван-Гельмонт предва-
рительно взвесил на точных весах. Она весила два с четвертью
килограмма. Каждый день ученый поливал ивовую ветвь во-
дой. Прошло пять лет/Маленький побег разросся в стройное
деревце.
Ван-Гельмонт вынул иву и землю из горшка и взвесил их
отдельно. Оказалось, что ива весила 77 килограммов, т. е.
прибавила в весе почти 75 килограммов, а почва потеряла
в весе всего лишь 57 граммов.
Очень странно, — думал Ван-Гельмонт, — вес ивы увели-
чился почти в сорок раз, а вес земли совсем не изменился.
Ведь 57 граммов земли, которая исчезла из горшка, это ведь
ничтожная доля взятой мною для опыта почвы. Выходит, что
ствол, ветки, корни деревца выросли, питаясь чистой водой.
В то время такой вывод никому из ученых не показался
неправильным, так как они были убеждены, что в растениях
богом заложена жизненная сила. А потому для роста растения
достаточно и чистой воды.
Только спустя двести лет ученые разгадали, наконец, чем
в действительности питается растение, из чего строит оно свои
стебли и листья, ветви и корни.
Еще в XVIII в. первый русский химик М. В. Ломоносов вы-
сказал догадку, что растения получают пищу из воздуха. Од-
нако тогда на это предположение никто не обратил вни-
мания.
Жизнь растений интересовала и многих других ученых и
естествоиспытателей.
Тайны растительного мира привлекли к себе внимание из-
вестного английского ученого Пристли (того самого, который
открыл кислород).
Гуляя в лесу, он не раз задумывался над тем, почему там
дышится вольготнее, чем в городе. Изучая состав воздуха, он
знал, что в городе воздух загрязняется дыханием людей, ко-
потькг дымящихся труб фабрик и заводов.
9 Б. Я. Розен
—137—
Но ведь воздух как-то очищается, — думал Пристли,—
иначе все горожане давно погибли бы от удушья. Быть может,
растения и очищают воздух. Но это была только догадка.
А как же это доказать? — Только опытами.
В начале августа 1771 г. Пристли проделал такой опыт:
в большой стеклянный колпак, в который не попадал свежий
воздух, была посажена мышь. Вначале она вела себя нормаль-
но, но через некоторое время мышь стала широко открывать
рот, движения ее стали медленнее. Наконец, мышь начала су-
дорожно корчиться, вытянулась и издохла. Мышь забирала
из воздуха под колпаком кислород и выдыхала углекислый
газ, который непригоден для дыхания. Как только весь кисло-
род был использован, мышь издохла.
А что будет, — подумал ученый, — если под стеклянный
колпак снова посадить живую мышь и поставить туда побег
мяты. Ведь в лесах и полях дышится гораздо легче, чем
в прокопченных стенах фабрик и заводов. Значит растения как-
то очищают воздух.
Опыт был повторен. На этот раз мышь вела себя по-иному.
Она ровно и спокойно дышала, неустанно бегала, иногда сво-
ими острыми коготками царапала стены колпака. Наблюдая
за резвящейся мышью, Пристли записал в своем дневнике:
«...я нашел, что мышь прекрасно могла жить под колпаком,
где находилась ветка мяты... А побег мяты вырос за эти дни
почти на три дюйма на старых ветвях, и, кроме того, образова-
лось несколько новых». Значит, сделал вывод Пристли, рас-
тение очищает воздух во время своего роста.
Открытие Пристли произвело очень большое впечатление
на ученых во всей Европе. Год спустя Лондонское Королев-
ское Общество (Английская Академия наук), членом которо-
го он был избран еще в 1765 г., наградило его большой золо-
той медалью. Позднее, в 1781 г. -важность открытия англий-
ского ученого была отмечена и Петербургской Академией
наук, которая избрала его своим почетным членом.
Сделав замечательное открытие, Пристли не сумел, однако,
правильно его истолковать.
На первых порах он даже не заметил влияния солнечного
света. Правда, позднее он обратил внимание на значение све-
та для роста растений. Но в последующих опытах исследова-
лись не обыкновенные растения, а зеленый налет, появивший-
ся на стенках стеклянного сосуда с водой.
К числу его заблуждений относительно истинной роли рас-
тений относится убеждение, что растения очищают воздух
только при росте.
Наблюдая в своих опытах очищение растениями «испор-
ченного» дыханием животных воздуха, Пристли высказывает
— 138 —
предположение, что растение питается «испорченным» воз-
духом.
Выдающийся химик, талантливый физик и широко обра-
зованный ученый (он был и философ), Пристли несомненно
раскрыл бы тайну «зеленой лаборатории», если бы этому не
помешали некоторые непредвиденные обстоятельства.
У Пристли было много врагов среди аристократов и церков-
ников, которые ненавидели талантливого ученого за незави-
симый образ мыслей, за резкие антиклерикальные статьи. Они
решили расправиться с ученым.
В один из торжественных праздников они натравили на
Пристли уличную толпу. Несколько десятков темных, одура-
ченных людей ворвались в загородный домик ученого. С кри-
ками «за церковь и короля» они с диким остервенением лома-
ли мебель, рвали на куски книги, уничтожали ценные при-
боры. Уничтожив лабораторию, библиотеку, переломав всю
мебель, хулиганы подожгли дом.
Предупрежденный вовремя друзьями, Пристли со своей
семьей спрятался в соседнем доме. Из окон гостеприимного
дома он с горечью наблюдал, как в пламени гибли плоды его
долголетних трудов.
Потеряв все свое имущество, Пристли вынужден был
с женой и двумя детьми уехать из Англии в Америку. Здесь он
был недосягаем для своих врагов, бешенство которых только
росло от того, что они не имели законного повода с ним по-
кончить.
До конца жизни он продолжал обличать ханжество и неве-
жество аристократов и служителей церкви. Но для науки он
уже был потерян, он уже не смог в Америке продолжать сво-
их опытов.
Опыты Пристли по изучению влияния растений на очище-
ние воздуха нашли себе много продолжателей как при жизни,
так и после смерти ученого.
В 1773 г. голландский врач Ингенхауз, служивший при
дворе австрийского императора в Вене, прочел речь прези-
дента Лондонского королевского общества по случаю награж-
дения Пристли. Он загорелся желанием проникнуть в тайны
очищения воздуха растениями. Но более шести лет по разным
обстоятельствам ему не удавалось осуществить свое намерение.
Лишь в 1779 г., переселившись в Лондон, Ингенхауз смог
приступить к проведению желанных опытов. В течение лета,
9:
— 139 —
работая непрерывно с утра до вечера, он провел пятьсот
опытов.
Голландский ученый своими опытами показал, что в очи-
щении воздуха растениями играет роль не рост растений, как
думал Пристли, а солнечный свет. Однако лучи солнца сами
по себе не оказывают никакого действия. Он подметил, что
очищать воздух могут только зеленые части растений. Незеле-
ные же части растений: корни, цветы, плоды — на свету и в тем-
ноте, так же как и животные, забирают из воздуха кислород.
Ингенхауз высказал мысль, что растения дышат кис-
лородом.
Это была несомненно прогрессивная мысль, вполне под-
твердившаяся впоследствии исследованиями других ученых.
Но в то же время Ингенхауз сделал ошибочный вывод из
Своих опытов. Он считал, что растения, выделяя углекислоту
при дыхании, сами готовят себе пищу, т. е. они снова перера-
батывают ее <в своих клетках. А отсюда следует, что растения
быстрее должны расти в темноте, когда они выделяют боль-
ше всего углекислого газа.
Проводя опыты с растениями, Ингенхауз сделал много
ценных наблюдений, которые до сих пор представляют боль-
шой интерес для науки. Он заметил, что очищение воздуха
растением происходит неодинаково в разные времена года и
даже в различные часы суток. Этот процесс протекает по-раз-
Н'ому и в зависимости от силы света.
Более правильное толкование опытов Ингенхаузом объ-
ясняется не только его наблюдательностью, но и тем, что он
воспользовался результатами исследований женевца Бонне,
опубликованных в середине восемнадцатого века. Эти иссле-
дования, по-видимому, не были известны Пристли.
Как-то в солнечный день, сидя на берегу пруда, Бонне за-
метил, что листья растений, погруженные в воду и освещенные
солнцем, покрыты мелкими пузырьками воздуха.
Откуда берется воздух на листьях, — задал себе вопрос
ученый, — из растения или из воды?
Для того чтобы ответить на этот вопрос, ученый поставил
опыт. Он налил в стеклянную банку кипяченой воды (в ней не
было воздуха), и опустил в нее несколько срезанных веток
дерева. Банку с ветками выставил на солнце. Пузырьков на
листьях не было. Не появились они ни через несколько минут,
ни через несколько часов. Следовательно, — сделал заключе-
ние Бонне,— пузырьки выделяются не из листьев, а только на
поверхности листьев — из воды.
Для того чтобы убедиться в справедливости своего заклю-
чения, он несколько минут дышал через трубку в воду. На
листьях снова появились пузырьки.
— 140 —
Значит, — рассуждал Бонне, — образование пузырьков не
связано с жизнью листа. Оно представляет собой чисто физи-
ческое явление.
Приступая к своим исследованиям, Ингенхауз тщательно
повторил опыты Бонне, но для определения состава воздуха
воспользовался более совершенными приемами, которые были
разработаны Пристли для газов.
И результаты получились поразительные. Выделявшиеся
на свету пузырьки оказались кислородом, который тогда на-
зывали дефлогистированным воздухом. Ингенхауз измерил
объем этого «воздуха». Он был гораздо больше объема самих
листьев.
Это было еще одно веское доказательство несостоя-
тельности мнения Бонне. Пузырьки кислорода не возникали
просто из воды, они рождались на свету и существенно отли-
чались от воздуха, растворенного в воде.
Теперь уже не было никакого сомнения, что пузырьки вы-
делившегося на свету газа, неразрывно связаны с жизнедея-
тельностью растений.
Опыты Пристли и Ингенхауза приоткрыли краешек завесы
над тайной процесса, который мы теперь называем фотосинте-
зом (от греческих слов: фото — свет, синтез — соединение). Но
многое еще оставалось неясным. Прежде всего напрашивался
вопрос, зачем самому растению нужно очищать воздух? Если
оно использует углекислый газ как пищу, то как оно это
делает?
В 1782 г., спустя три года после выхода в свет книги Инген-
хауза, внимание ученых привлек трехтомный трактат женев-
ского аббата Сенабье — «Физико-химические мемуары о влия-
нии солнечного света на изменение тел трех царств природы,
и в особенности царства растений».
Заинтересовавшись жизнью растений, Сенабье также на-
чал свои исследования с повторения опытов Бонне, но сделал
полный химический анализ пузырьков воздуха. Оказалось,
чю газ, собранный им с поверхности листьев, был вовсе не по-
хож на газ, растворенный в воде.
Следовательно, рассуждал Сенабье, эти пузырьки не могли
выделиться из воды. Не могли они выделиться и из листьев,
потому что объем образовавшегося газа оказался больше
листьев.
Откуда же взялись пузырьки газа на поверхности листьев?
Чтобы ответить на этот вопрос, ученый поставил много раз-
нообразных опытов. Труды не пропали даром. Тайна проис-
хождения пузырьков была раскрыта.
Оказалось, что для появления на листьях пузырьков «чис-
того» воздуха (т. е. кислорода) необходимо, чтобы в воде
— 141 —
находился воздух, содержащий углекислоту. Чем больше будет
углекислого газа в воде, тем больше будет появляться на
листьях пузырьков кислорода. Больше того, ему удалось по-
казать, что пузырьки выделяются не поверхностью листа, а из
глубины его, мякотью листа.
А это значит, что листья, забирая из воды растворенную
в ней углекислоту, перерабатывают ее в своих тканях и выде-
ляют кислород.
Углерод же растение использует для своего питания.
Несмотря на высказывавшиеся ранее догадки о воздушном
питании растений, мысль Сенабье была весьма смелой для
своего времени. Ведь тогда, да и много позднее, вплоть до
второй половины прошлого века, многие ученые называли этот
процесс дыханием — «дневным дыханием» в отличие от под-
линного дыхания, которое происходит в темноте у растений и
было названо ими «ночным дыханием».
Смутны были и представления об источнике углекислоты.
Одни считали, что растения берут ее из воды, а другие — из
воздуха.
Вскоре эти сомнения были окончательно разрешены.
В 1804 г. на полках книжных магазинов появился небольшой
томик, озаглавленный «Химические исследования над расте-
ниями», принадлежавший перу женевского ботаника Сос-
сюра.
Для доказательства разложения растениями углекислого
газа, содержащегося в воздухе, он поместил несколько расте-
ний баранника в атмосферу со значительным содержанием
углекислоты.
Спустя несколько дней Соссюр сделал точный анализ
газов. Оказалось, что углекислоты стало меньше, а кислоро-
да— больше. Но он не ограничился анализом газов, а опре-
делил содержание углерода в растении до и после опыта: пос-
ле опыта его оказалось гораздо больше.
Однако и Соссюру не удалось еще устранить сомнение, ко-
торое высказывалось и в адрес его предшественника и земля-
ка— женевского аббата Сенабье.
Может ли растение улавливать из обыкновенного атмос-
ферного воздуха углекислоту, рассеянную в нем в ничтожных
количествах?
А между тем четкий ответ на этот вопрос, подкрепленный
убедительными доказательствами, заставил бы скептиков и
досужих критиков прекратить свои нападки на фотосинтез.
Они не могли бы тогда более утверждать, что процесс погло-
щения углекислого газа растениями в опытах исследователей
вовсе не тождественен тем, что происходит в природе в дейст-
вительности. Такой ответ и был дан Буссенго в 1840 г. Он
— 142 —
вместе с .известным французским химиком Дюма 1 проводил
опыт поглощения углекислоты из воздуха виноградной лозой.
Исключительная точность измерений и пользование специаль-
ным прибором для учета поглощаемой углекислоты позволили
доказать, что растение полностью разлагает поглощаемый им
углекислый газ.
Почти семьдесят лет продолжались споры среди ученых
о том, служит ли углекислый газ «пищей» растениям.
Опыты Буссенго положили им конец. Это был значитель-
ный шаг вперед в развитии учения о фотосинтезе. Но еще мно-
го оставалось неясных вопросов, над разрешением которых не-
мало пришлось поработать ботаникам и физиологам, физикам
и химикам.
В Москве, на Тверском бульваре стоит на гранитном пье-
дестале высокая фигура, с гордо поднятой головой. На плечи
накинута мантия. Глаза задумчиво смотрят вдаль. На памят-
нике лаконичная надпись: «К. А. Тимирязеву — борцу и
мыслителю».
В этой краткой надписи, как в зеркале, отражена много-
летняя деятельность выдающегося ученого и общественного
деятеля. С детских лет К. А. Тимирязев любил природу. Его
глубоко интересовали явления в окружающем мире. Он хотел
проникнуть и в тайны превращения веществ. С огромным ув-
лечением он помогал своему старшему брату смешивать соли
и растворы, перегонять, выпаривать и кристаллизировать
1 К. А. Тимирязев в своей книге «Солнце, жизнь и хлорофилл» приво-
дит любопытный анекдот, слышанный им от самого Буссенго по поводу
этого опыта.— «Мы предприняли исследование — рассказывал Буссенго —
вместе с г. Дюма, но так, что каждый производил взвешивание, вел жур-
нал опытов отдельно, не сообщая другому, для того чтобы лучше контро-
лировать полученные результаты. Сначала все шло хорошо; растение, как
и следовало ожидать, разлагало углекислоту. Вдруг картина изменилась.
Несмотря на ясные солнечные дни, оно закапризничало и вместо того, что-
бы разлагать углекислоту, стало ее выделять. С недоумением подводили
мы в своих записных книжках вечерние итоги, бросая друг на друга немые
вопросительные взгляды. Обоим невольно приходила на память неудача,
испытанная Пристли, когда он хотел повторить свой знаменитый опыт.
Так продолжалось несколько дней. Наконец, в одно прекрасное утро Реньо,
знаменитый физик, внимательно за нами следивший, видя наши вытянутые
физиономии, разразился хохотом и покаялся нам, что причиной нашего
горя был он; каждый день, когда мы уходили завтракать, он подкрадывал-
ся к прибору и немного в него дышал для того чтобы убедиться, как он вы-
разился, что вы не шарлатаните, а действительно можете учитывать такие
малые количества углекислоты».
— 143 —
различные вещества в устроенной им небольшой домашней
лаборатории.
Восемнадцатилетним юношей поступил он в Петербургский
университет, сначала на камеральный (юридический) факуль-
тет, а затем перешел на естественный. В тот год в университе-
те разразились крупные студенческие беспорядки. Тимирязев,
воспитанный в семье, отличавшейся свободомыслием и рево-
люционными настроениями, не мог не принять участия в этих
беспорядках. Любовь к народу, ненависть к самодержавию
не позволяли ему остаться в стороне.
Университетское начальство за участие в студенческих
волнениях исключило Тимирязева из университета. Однако
он не бросил любимой науки, а продолжал заниматься вольно-
слушателем.
Окончив университет, Тимирязев выбрал своей специаль-
ностью физиологию растений. Он начал свою деятельность под
руководством известного русского ботаника А. Н. Бекетова.
В 1868 г. был направлен в заграничную командировку. В тече-
ние двух лет работал в лабораториях крупнейших ученых
Германии и Франции. В 1870 г. Тимирязев занял кафедру бо-
таники в Петровско-Разумовской (ныне Тимирязевской) сель-
скохозяйственной академии, а спустя шесть лет был избран на
кафедру анатомии и физиологии растений Московского уни-
верситета.
Тимирязев пользовался исключительной популярностью
и любовью у студентов. Аудитория на его лекциях была всегда
переполнена. Молодежь ценила его знания, его умение заин-
тересовать слушателей, его горячую веру в науку.
Страстный патриот своей Родины, ож был грозным обличи-
телем царского строя. В своих лекциях и статьях он гневно
выступал против несправедливости и лжи буржуазного
общества.
Великую Октябрьскую социалистическую революцию Ти-
мирязев встретил с огромной радостью. В то время он уже
был старым, больным человеком. Тем не менее, он с юношес-
кой энергией стал работать для укрепления Советской власти,
в которой он видел воплощение своих чаяний, создания спра-
ведливого общественного строя, развивающегося на основе
науки и демократии.
Он выступал с лекциями перед рабочими и красноармей-
цами, писал статьи, в которых увлекательно и просто расска-
зывал о своей науке. Выступал он в печати и как публицист,
ратуя за новую власть.
В. И. Ленин, прочитав сборник его статей «Наука' и демо-
кратия», прислал ему в апреле 1920 г. прочувствованное
письмо:
— 144 —
«Большое спасибо Вам за Вашу книгу и добрые слова.
Я был прямо в восторге, читая Ваши замечания против бур-
жуазии и за Советскую власть».
Публицистические статьи Тимирязева сохранили и сейчас
еще свою актуальность. Они — прекрасное оружие для борьбы
с врагами мира и демократии.
Посвятив свою жизнь ботанике, Тимирязев занялся проб-
лемой фотосинтеза.
Редко бывает в науке, чтобы ученый всю свою жизнь по-
святил бы изучению одного вопроса. Вот таким-то ученым
оказался К. А. Тимирязев. И это не случайно. Проблема фото-
синтеза— воздушного питания растений, имеет столь важное
значение для жизни не только растений, но и всего животного
мира, что на раскрытие ее тайн стоило потратить целую
жизнь. И тем более, что она не была потрачена даром.
Наука обязана Тимирязеву раскрытием тайны происхож-
дения зеленого цвета у растений, выяснением связи между
зеленой окраской у растений и солнечным светом.
Все предшественники Тимирязева, которые занимались изу-
чением фотосинтеза — Пристли, Ингенхауз, Сенабье, Буссен-
го — наблюдали в своих опытах благотворное действие сол-
нечных лучей на разложение углекислоты растениями, одна-
ко никто из них не понимал и не мог объяснить истинной роли
посланцев солнца в этом процессе.
В сороковых годах прошлого века два выдающихся уче-
ных— создатели закона сохранения энергии1 — Роберт Май-
ер и Гельмгольц — высказали мысль, что свет, падающий на
живые растения, используется ими иначе, чем при освещении
мертвых тел.
Роберт Майер пришел к этому выводу на основе своих
наблюдений над цветом венозной крови. Работая врачом на
острове Ява, он заметил, что венозная кровь у его пациентов
имеет более яркий красный цвет, чем кровь у европейцев, жи-
вущих в более холодном климате.
В жарком климате, — рассуждал Роберт Майер, — орга-
низм меньше охлаждается, значит он затрачивает меньше
энергии на поддержание температуры тела. Стало быть, тепла
1 Закон сохранения энергии гласит: «Энергия не возникает из ничего и
не исчезает бесследно; но отдельные ее виды могут переходить друг в дру-
га по строго определенным эквивалентным соотношениям».
— 145 —
освобождается меньше, и теплота должна быть скрыта внут-
ри организма. Значит нет никакой жизненной силы, а есть си-
ла, которая получается за счет превращения веществ.
Когда мы сжигаем в печи дрова, выделяется теплота. Но
откуда же берется эта теплота? Она ведь не может возник-
нуть из ничего, растение ее должно было откуда-то получить?
В ту пору уже было хорошо известно, что для существования
растений одного тепла недостаточно, что нужен еще солнеч-
ный свет. Следовательно, — говорит Роберт Майер, — солнеч-
ные лучи, поглощаемые растением при разложении углекис-
лоты, откладываются в нем в запас, принимают твердую фор-
му. А когда мы сжигаем растение, то оно возвращает нам
тепло, похищенное им у солнца.
Количество углерода, которое накапливает растение в сво-
их клетках, не может быть больше того количества углерода,
которое растение извлекает из поглощаемой им углекислоты.
Точно так же количество теплоты, которое запасает в своих
тканях растение, не может превышать количества теплоты,
поступающего с падающим на растение солнечным лучом.
А отсюда невольно напрашивается вывод, что количество
углерода, накапливаемого растением, точно определяется ко-
личеством падающего солнечного света. Итак, налицо нераз-
рывная связь между солнечной энергией и веществами, обра-
зующими тело растения.
Такую же мысль о связи солнечной энергии с накоплением
углерода растением высказал несколько позднее и Гельм-
гольц.
Однако это были только гениальные умозаключения. Ведь
ни тот, ни другой никаких опытов не ставили. Проверить эти
выводы на опыте было заманчивой и в то же время весьма
трудной задачей.
За решение этой интересной и важной задачи со всей
страстностью взялся К. А. Тимирязев.
Более полувека своей жизни посвятил ученый опытам,
которые позволили «превратить» блестящую мысль двух
великих ученых в несомненную истину, доказать солнечный
источник жизни.
Для решения этой задачи Тимирязев наметил широкую
программу исследований. Прежде всего надо было изучить
физические и химические условия, при которых происходит
фотосинтез. Нужно было выяснить, что происходит с солнеч-
ным лучом внутри растения? Как солнечная энергия превра-
щается в работу в клетках и тканях растений?
Ведь солнечный луч только кажется нам белым, на самом
деле он состоит из нескольких цветных лучей. Если разложить
стеклянной призмой свет солнца на составные части, то
— 146 —
в спектре будут красный,
желтый, голубой, синий и
фиолетовый лучи.
Не все части спектра
обладают одинаковой
тепловой энергией. Силь-
нее всего греют красные
лучи. Неодинаково погло-
щают солнечный свет и
тела, окрашенные в раз-
ные цвета. В белой одеж-
де летом всегда прохлад-
нее, чем в черной, потому
что от нее полностью от-
ражаются лучи спектра.
Желтые тела задержи-
вают только фиолетовые,
синие, голубые лучи и
некоторую часть зеленых
лучей, а зеленые — крас-
ные, оранжевые и жел-
TT.TQ пхгтттх Климент Аркадьевич Тимирязев
гые лучи. (1843—1920 гг.)
Вот потому-то расте-
ние и окрашено в зеленый цвет. Крупинки хлорофилла, рас-
сеянные в листьях растений, забирают у солнечного луча боль-
шую часть его энергии. Зеленая окраска растительного мира
помогает его представителям наиболее полно использовать
солнечную энергию.
Все это Тимирязев доказал весьма простыми опытами.
Он взял растение, выдержал его несколько часов в темной
комнате, срезал лист и наблюдал его под микроскопом. В поле
зрения были рассыпаны крупинки хлорофилла в виде неболь-
ших палочек и лент. Затем растение было выставлено на
свет. Спустя несколько .минут был опять срезан лист и иссле-
дован под микроскопом. Вокруг хлорофилловых зерен появи-
лись какие-то точки, которые с течением времени продолжали
расти и увеличиваться в размерах.
Это были зернышки крахмала. В этом можно было легко
убедиться, капнув на них йодной настойкой. Крахмал окрасил-
ся в темно-синий цвет.
Продолжая опыт, Тимирязев снова поместил растение
в темную комнату. Через два дня в листьях исчезли отложения
крахмала. Они переместились в другие части тела растения.
Не отделяя теперь листа, ученый стал облучать его солнеч-
ным спектром так, чтобы одна часть получила бы только лучи
красного цвета, другая — синего, третья — зеленого и т. д.
— 147 —
Спустя три часа лист был срезан. На него капнули раство-
ром йода. Окрашенные зернышки крахмала образовали тем-
ные полосы. Гуще всего окрасилась та часть листа, которая
освещалась красным цветом.
Так лучи красного цвета помогают хлорофиллу во всех
уголках нашей планеты поглощать из атмосферы углекислый
газ, освобождать из него углерод и строить углеводы — крах-
мал, клетчатку, сахар.
Это было открытие первостепенной важности. Еще больше
был приподнят край завесы, скрывающей от нас таинства,
творящиеся в недрах зеленых лабораторий. Ведь до опытов
Тимирязева ученые считали, что углекислоту разлагают от-
нюдь не красные, а синие, фиолетовые, желтые, оранжевые
лучи.
Выдающийся физик прошлого века Гельмгольц утверждал,
что главенствующую роль в фотосинтезе играют «фотографи-
ческие» сине-фиолетовые лучи. Убеждение это проистекало ив
того, что такие лучи вызывают химическое разложение бро-
мистых и йодистых солей серебра, которые входят в состав
светочувствительного слоя фотопластинки или фотопленки.
Потому фотограф обычно производит свои операции по прояв-
лению и закреплению фотопластинок при желтом свете, т. е.
с фонарем, в котором вставлено желтое стекло.
Гельмгольц был не одинок в оценке роли синих и фиоле-
товых лучей в фотосинтезе, его мнение разделяли и многие
химики и ботаники — Дюма, Буссенго.
Несколько позднее англичанин Добэни, американец Драпер
и немец Пфеффер выступили с заявлением, что разложение
углекислоты в растениях вызывается действием отнюдь не
«фотографических» лучей, а как раз тех, которые не оказы-
вают действия в фотографии, — желтых лучей.
Яркость света, — говорил Драпер, — увеличивается с крас-
ного конца спектра, достигая своей наибольшей величины
в желто-зеленой части спектра. Следовательно, самым ярким
будут желтые лучи, и они-то и должны разлагать угле-
кислоту.
Между тем яркость лучей воспринимается только нашим
глазом, в природе же она не существует. Для растения света,
как такового, не существует. Нет для него и различия в ярко-
сти лучей. Свет воспринимается растением лишь как световая
энергия.
Тимирязев своими опытами доказал ошибочность взглядов
своих предшественников. Отныне никто более не сомневался в
том, что усвоение солнечного света растением представляет
процесс поглощения хлорофилльными зернами энергии крас-
ных лучей солнечного спектра.
— 148 —
Мало было установить, какие лучи из солнечного спектра
помогают зернышкам хлорофилла производить невидимую
созидательную работу. Нужно было еще показать, как пере-
носится солнечная энергия хлорофилльными зернышками на
бесцветные вещества — углекислоту.
Ботаники долгое время считали, что зеленый цвет расте-
ний происходит от смеси двух цветов — синего и желтого. Ду-
мали они так потому, что художники с давних пор готовили
так зеленую краску.
Тимирязев опроверг и это заблуждение своими замечатель-
ными опытами. Никакого синего пигмента в природе не суще-
ствует, а зеленый цвет хлорофилла — это смесь зеленого, и
иногда сопровождающего его желтого красителя L
В первой половине прошлого века многие ученые, находив-
шиеся в плену виталистических воззрений, были твердо убеж-
дены, что хлорофилл можно разрушить и разложить на со-
ставные части в лаборатории, но нельзя его синтезировать.
Лишь растение обладает способностью создавать его в своих
клетках при помощи какой-то таинственной силы.
И это заблуждение было опровергнуто Тимирязевым.
Прежде всего он изучил условия, при которых образуется
в растении хлорофилл. Оказалось, что растению нужна обиль-
ная азотистая пища, соли железа и кислород.
Если в почве не будет солей железа, растение вырастет бе-
лое, как полотно. Но достаточно смочить растение раствором
этих солей, как растение немедленно зазеленеет.
Для того чтобы доказать необходимость кислорода для
образования хлорофилла, Тимирязев проделал такой опыт.
В стеклянные банки он наливал питательный раствор и
опускал в него семена какого-либо растения. Банки ставил в
темную комнату. Спустя некоторое время появлялись ростки.
Они были не зеленые, а желтые. Ростки Тимирязев расклады-
вал на две кучки. Одну кучку выставлял на свет, а другую по-
мещал под колпак, из которого был удален кислород. Расте-
ния, которые находились на воздухе, через несколько минут за-
зеленели, а растения под колпаком так и остались желтыми.
1 Зеленый пигмент хлорофилла Тимирязев назвал хлорофиллином,
а желтую составную часть — ксантофиллом. Хлорофиллин легко разру-
шается, тогда как ксантофил более устойчив; этим объясняется пожелте-
ние листьев осенью.
— 149 —
Но как только под колпак вводили кислород, желтое рас-
тение становилось зеленым.
Опыты показали, что для образования хлорофилла недо-
статочно питания и кислорода, нужны еще тепло и свет. Рас-
тение зеленеет только при температуре не ниже плюс пять гра-
дусов. Но и тепло не поможет, если растение будет расти
в темноте. Света же достаточно самого малого. Хлорофилл
«рождается» даже при свете газовой горелки и керосиновой
лампы.
Хлорофилльные зерна окрашены в зеленый цвет, они при-
дают зеленую окраску растению. Но ведь существуют крас-
ные, черные и пестролистные растения. Существуют и бурые
и красные водоросли — обитатели морского дна. Они ведь
тоже разлагают углекислоту. Как же они это делают?
Ответ дает нам микроскоп. Оказывается, в листьях этих
растений так же, как и у зеленых растений, рассыпаны зерна
хлорофилла. Они только замаскированы окрашенным клеточ-
ным соком. Это можно обнаружить и не прибегая к помощи
микроскопа —химическим путем. Если срезать красный или
черный лист какого-либо пестролистного растения и обмак-
нуть его в слабый раствор сернистой кислоты, то он немедлен-
но позеленеет. Ларчик открывается просто. Сернистая кисло-
та обесцвечивает окрашенные соки, но не действует на зеле-
ные зерна хлорофилла.
Микроскоп помог Тимирязеву проследить и за таинством
«рождения» углеводов — за процессом образования при фото-
синтезе мельчайших крупинок крахмала.
«Это превращение простых, неорганических веществ угле-
кислоты и воды в органическое, в крахмал, есть единствен-
ный, существующий на нашей планете, естественный процесс
органического вещества, — писал Тимирязев. — Все органиче-
ские вещества, как бы они ци были разнообразны, где бы они
ни встречались, в растении ли, в животном или человеке, про-
шли через лист, произошли из веществ, выработанных
листом».
Лист — это и есть та «зеленая лаборатория», в которой соз-
дается органическое вещество. Во всех других органах расте-
ния оно только преобразуется. Крупинки нерастворимого
крахмала, образовавшегося в листе, превращаются в раство-
римый сахар. Из него строятся клетки — твердый остов расте-
ния, из него в соединении с неорганическим веществом амми-
аком образуются еще более сложные органические вещест-
ва — белки.
Как уже устроена эта замечательная естественная «лабо-
ратория», без которой немыслимо существование всего орга-
нического мира?
— 150 —
Чаще всего эта расширенная плоская пластинка с узким
черенком. Если внимательно посмотреть на лист, то можно
заметить две разные части — нервы или жилки и между ними
листовую мякоть. Верхняя и нижняя поверхности листа
покрыты кожицей, которая легко отстает, если лист вымочить
в воде. Верхняя кожица листа совершенно бесцветная и про-
зрачная. Нижняя же кожица покрыта тонким пушком.
Под микроскопом листок покажется нам огромной сеткой,
сотканной из бесчисленных ячеек самой разнообразной формы.
Есть тут и продолговатые, и квадратные, и закругленные, и
изогнутые дугой. А пушок на нижней кожице под микроскопом
покажется настоящим лабиринтом, состоящим из громадного
числа мельчайших отверстий. Это отдушины, ведущие во внут-
ренность листа. Их называют устьицами. Ученые подсчитали,
сколько таких устьиц на листе. Оказалось, миллионы. На лис-
те липы более одного миллиона, а на листе подсолнуха даже
несколько миллионов. Лист своими устьицами поглощает из
атмосферы углекислый газ и через устьица выделяет кисло-
род. Через устьица в растении происходит обмен газов, испа-
рение воды, которая поступает из стебля в лист.
Устьица являются регуляторами тех чудесных превраще-
ний, которые происходят с углекислым газом и водой. У каж-
дого устьица есть по две так называемых «замыкающих
клетки». Когда крахмал внутри растения превращается в рас-
творимый сахар, количество которого увеличивается, замыка-
ющая клетка становится упругой. Она, словно тугая пружина,
поддерживает устьице открытым. Когда ж.е растворимый са-
хар обратно превращается в крахмал, то замыкающая клетка
теряет упругость, и устьице закрывается.
Опыты Тимирязева дали возможность глубже проникнуть
в недра зеленой лаборатории, ознакомиться с ее устройством,
лучше понять принципы ее работы. Но мало было доказать
образование крахмала в хлорофилльных зернах на свету,
надо было еще объяснить, как происходит его «рождение»?
Как углекислота и вода превращаются в углеводы?
Углеводы состоят из углерода, водорода и кислорода. Сле-
довательно, рассуждал Тимирязев, чтобы получить их из угле-
кислоты и воды, нужно отнять весь кислород от углекислоты.
Сначала под действием света двуокись углерода отщепля-
ет кислород и образует окись углерода: углекислота + свет->
угарный газ + кислород.
— 151 -
Затем окись углерода присоединяется к окисленному хло-
рофиллу, т. е. к молекулам хлорофилла, в которые внедряется
атом кислорода: (окисленный хлорофилл + окись углерода +
+ свет) (хлорофилл + окись углерода) + кислород.
Далее, по мнению К. А. Тимирязева, хлорофилл, связанный
с окисью углерода, вступает во взаимодействие с водой. Об-
разуется простейшее органическое вещество — формальдегид
(муравьиный альдегид) и снова высвобождается окисленный
хлорофилл: (хлорофилл + окись углерода) + вода->формаль-
дегид + окисленный хлорофилл.
Из формальдегида путем уплотнения шести его молекул
получалась глюкоза.
Эту точку зрения на природу промежуточных веществ, ко-
торые получаются при фотосинтезе, разделяли тогда многие
выдающиеся ботаники и химики.
В конце прошлого века проблемой фотосинтеза заинтересо-
вался А. Н. Бах. Поглощение углекислоты зелеными растения-
ми, кроме образования органических веществ, сопровождается
выделением кислорода. Как же образуется этот свободный
кислород? За счет какого промежуточного вещества происхо-
дит выделение этого газа? В настоящее время хорошо извест-
но, что весь кислород, который содержится в воздухе, образо-
вался благодаря дыханию растений. Подсчитано, что расте-
ния выделяют в сутки более одного миллиарда тонн кислорода.
А общее количество кислорода в атмосфере составляет около
1 500 000 миллиардов тонн. Поистине астрономическая цифра.
А. И. Бах, приступая к изучению волновавшей его пробле-
мы, внимательно и детально познакомился с существовавши-
ми тогда теориями фотосинтеза. Однако они его не удовлет-
ворили.
Упорно и настойчиво добиваясь решения поставленной за-
дачи, он провел ряд остроумных опытов. Ему удалось слож-
ный биологический процесс, протекающий в клетках растения,
разложить на ряд отдельных химических реакций. Каждую из
них он воспроизвел в пробирках. Эти опыты показали, что об-
разование свободного кислорода в недрах зеленых лаборато-
рий происходит совсем по-иному, чем думали другие ученые.
Когда растение поглощает углекислоту, то не отщепляется
атом кислорода и не образуется окись углерода, а одна молеку-
ла углекислоты соединяется с двумя атомами водорода, а две
другие — с гидроксилами воды. Образуется формальдегид и
перекиси.
А перекиси, будучи нестойкими соединениями, вскоре рас-
падаются и выделяют молекулярный кислород. Следователь-
но, кислород, поступающий из недр растения в атмосферу, —
это кислород воды, а не углекислоты.
- 152 —
Мысли, высказанные Бахом, долго не находили признания.
Ни химики, ни ботаники не соглашались признать их правиль-
ными. Лишь совсем недавно советские ученые А. П. Виногра-
дов и Р. В. Тейс, пользуясь мечеными атомами, опытным пу-
тем доказали справедливость гипотезы А. Н. Баха.
В высокие стеклянные стаканы с водой, обогащенной угле-
кислым газом, помещали побеги водного растения — элодеи.
Побеги элодеи сверху прикрывали перевернутой стеклянной
воронкой так, чтобы она была погружена в воду. На носик
воронки надевали пробирку. Стакан с элодеей выставляли на
солнце. Когда на побеге растения появлялись пузырьки газа,
его собирали в пробирку.
Собранный газ исследовали с помощью меченых атомов —
изотопа кислорода (О18). По соотношению между содержани-
ем атомов нормального кислорода (О16) и изотопом кислорода
(О18) установили, что собранный газ ближе к кислороду воды,
чем к кислороду углекислоты.
Такие же результаты получили в своих опытах и иност-
ранные ученые — Ван-Ниль и другие.
Таким образом при фотосинтезе сначала под действием
света разлагается вода, а не углекислота. Реакции происхо-
дят так:
свет
вода —^водород + кислород.
Молекулы водорода затем соединяются с углекислотой,
образуя формальдегид и воду.
Углекислота + водород----> формальдегид + вода
Если раньше ученые считали, что
сущность фотосинтеза заключается
в разложении углекислоты с помощью
хлорофилла, то теперь отличительной
особенностью этого процесса считают пере-
нос водорода от воды к углекислоте. И хло-
рофилл теперь более не переносчик кисло-
рода, отщепляемого от углекислоты. По сов-
ременным воззрениям он переносит водород,
забираемый из воды. Перенос водоро-
да от воды к углекислоте сопровож-
дается затратой большого количества
энергии. При реакции фотосинтеза
происходит восстановление угле-
кислого газа и окисление воды
с выделением кислорода.
Ученые точно подсчитали,
сколько расходуется энергии све-
Выделение пузырьков
водным растением
— 153 —
та, поглощаемой хлорофиллом при различных химических
реакциях фотосинтеза.
Если сжечь одну грамм-молекулу формальдегида, т. е. три-
дцать граммов этого вещества, то выделится 112 килокалорий.
Столько же тепла требуется для синтеза такого же количе-
ства формальдегида в листьях растения.
Теперь с помощью специальных приборов можно точно
подсчитать, сколько солнечной энергии падает в одну минуту
или в час на квадратный сантиметр площади растения. Мож-
но подсчитать и сколько граммов углекислоты поглощает рас-
тение в одну секунду, в минуту или в час. Нетрудно вычис-
лить и сколько органического вещества образуется в единицу
времени.
По современным воззрениям свет излучается не непрерыв-
ным потоком, а отдельными порциями — квантами. Энергия
одного кванта очень мала. Тем не менее энергии 3—4 квантов
достаточно для того, чтобы превратить одну молекулу угле-
кислоты в формальдегид в растении.
Для восстановления же одной грамм-молекулы углекис-
лоты (в которой 6,06 • 1023 молекул) потребуется в три раза
больше квантов.
Подсчеты показывают, что растения поглощают на одну
грамм-молекулу углекислоты не 112 килокалорий, а примерно
600 килокалорий. По-видимому, остальная энергия затрачи-
вается растениями на образование каких-то нестойких орга-
нических веществ.
Таким образом, коэффициент полезного использования све-
та составляет около двадцати процентов или восемь-десять
процентов от всей падающей на листья энергии солнца. Теперь
уже нетрудно подсчитать и прирост зеленой массы растения
в сутки. А следовательно, можно подсчитать и урожай хле-
бов, картофеля, сахарной свеклы или любого другого
растения.
В летние дни на гектар почвы попадает 25 миллионов кало-
рий солнечной энергии. Поглощается же растением из этого
количества около двадцати процентов. Такое количество
энергии может обеспечить урожай сельскохозяйственных куль-
тур в 50—60 тонн общей сухой массы с гектара.
Эти расчеты основаны на реальных возможностях. Они
подтверждаются рекордными урожаями передовиков нашего
сельского хозяйства. В некоторых совхозах выращивали до
двух тысяч центнеров сахарной свеклы, до тысячи трехсот
центнеров картофеля, до ста пятидесяти центнеров кукурузы
с гектара. Такие огромные урожаи соответствуют накоплению
солей органической массы в несколько десятков тонн на
гектар.
— 154 —
Уже более столетия ученые всего мира неустанно трудятся
над раскрытием тайн фотосинтеза. Усилия большого коллек-
тива ученых разных стран не п-ропали даром. Многое, что ра-
нее казалось необъяснимым выдающимся ученым, стало по-
нятным теперь любому школьнику. Но еще немало придется
поработать ботаникам и физиологам, физикам и химикам,
чтобы окончательно раскрыть все тайны фотосинтеза.
Постигая тайны этого процесса — основы жизни на нашей
планете, мы сможем управлять урожаем растений. Урожай
мож1но будет увеличить в два-три раза, а в некоторых районах,
где много влаги, даже в пять раз.
Такие урожаи не только покроют с избытком потребность
растущего населения земного шара в пище, они обеспечат
нужными кормами и животных. Они позволят широко исполь-
зовать отходы растительных продуктов, пригодных для про-
изводства пластических масс, синтетических волокон и искус-
ственных каучуков.
Со временем мы научимся искусственным путем осуществ-
лять реакции фотосинтеза вне растений.
Тогда с помощью даровой энергии солнца из углекислого
газа, известняков, воды и азота воздуха будут получаться ты-
сячи разнообразных органических веществ. И это будет еще
одна великая победа науки.
ОСНОВА
ПРОГРЕССА
Индии, в одной из провинций стоит же-
лезный столб, изготовленный полторы
тысячи лет назад. В египетских пирами-
дах был найден учеными обломок серпа, возраст которого
определен в три тысячи лет. Есть на свете и еще более древ-
ние изделия из железа.
В незапамятные времена люди подбирали падающие с не-
ба метеориты. Из «небесного» железа изготовляли нужные им
предметы.
Но более двух тысяч лет назад люди научились сами вы-
плавлять железо из руды. В небольшие ямы, вырытые на
склонах гор — древние горны,— закладывали поленья дров и
их поджигали. Когда дрова разгорались, насыпали краснова-
то-коричневые камни — железную руду,— пересыпанные дре-
весным углем. Для того чтобы пламя лучше разгоралось,
делались выступающие наружу глиняные трубы, по которым
в горн поступал воздух. Верным помощником металлургов
древних времен был ветер. Он раздувал пламя горна и делал
— 156 —
его более жарким.
Но температура пла-
мени все же остава-
лась недостаточной
для плавления желе-
за: слишком мало
кислорода поступало
в горн при естествен-
ной тяге. Для того
чтобы получить рас-
плавленную массу
Схематическое изображение
древнеегипетского горна
железа, нужно на-
греть руду до полутора тысяч градусов. Древние метал-
лурги получали не чистое железо, а ноздреватую массу, за-
грязненную шлаком и золой.
Прошло много времени, прежде чем наши предки научи-
лись создавать искусственный ветер.
Из шкур животных стали делать меха и вдувать ими в гор-
ны воздух.
На первых порах изобретение мехов мало способствовало
улучшению качества металла. По-прежнему в горнах получа-
лись пористые, похожие на губку лепешки.
Потребовалось еще много столетий, прежде чем был сде-
лан новый шаг вперед.
В начале XIII в. меха стали приводить в действие не мус-
кульной силой человека и животных, как это делали в древ-
ности, а с помощью энергии падающей воды.
В плавильные печи теперь уже попадало достаточно воз-
духа, чтобы пламя могло расплавить железо.
Примитивные древние горны уступили место более совер-
шенным плавильным печам — домницам. Сложенные из кам-
ня, они чаще всего имели форму усеченного конуса.
Домницы строились разных размеров. Были среди них
большие и маленькие. Некоторые домницы были высотой до
пяти метров.
Губчатую, ноздреватую массу, полученную в домницах, на-
зывали крицей.
В течение многих веков металлурги и кузнецы в разных
странах плавили в горнах и домницах железную руду.
Из поколения в поколение, от деда к отцу, от отца к сыну
передавался накопленный веками опыт, но сущность происхо-
дящих при плавке руды химических процессов оставалась
тайной.
Лишь в нашу эпоху ученые, занимаясь изучением древних
способов получения железа, выяснили, какие химические ре-
акции протекали в горных домницах.
— 157 —
Руда — химическое соединение железа с кислородом — при
нагревании отдавала свой кислород, который соединялся
с углеродом топлива, образуя углекислый газ. Постепенно
кусок руды превращался в ноздреватую лепешку — железную*
массу, насыщенную углеродом. В сыродутном горне всегда
оставалось немного руды, которая не успела восстановиться,
т. е. превратиться в железо. Этот железистый шлак, соприка-
саясь с крицей, окислял своим кислородом содержавшийся
в ней углерод.
Раскаленную крицу кузнец проковывал тяжелым молотом.
Под ударами молота из крицы удалялись ненужные приме-
си— шлаки и пустая порода.
С развитием промышленности все больше требовалось же-
леза.
Сыродутные горны и маленькие домницы не могли
удовлетворить все возрастающий спрос на металл. Для того
чтобы выплавлять больше металла, стали строить все более
крупные и высокие плавильные печи — домницы.
Но тут обнаружилось странное явление. Наряду с крич-
ным железом в печи получалось какое-то невиданное доселе
вещество. Оно было похоже на железо, но не ковалось.
В огне становилось таким хрупким, что даже от слабого уда-
ра разлеталось на куски. Чем выше выкладывали металлурги
домницы, тем больше получалось этого необычного вещества,
тем меньше выплавлялось из руды кричного железа. Металл,
приносивший кузнецам и металлургам столько огорчений, на-
зывали «свиным», «диким камнем»,
«гусем» и выбрасывали как ненужный.
Слитки этого металла называ-
домница
ли тогда в России чушками, от-
сюда и произошло впоследствии
слово «чугун».
Температура в домницах
была гораздо выше, чем в сы-
родутных горнах, поэтому об-
разовывалось меньше шлака,
окислявшего углерод в кричном
железе. Часть металла содер-
жавшегося в руде, оставалась
насыщенной углеродом и выте-
кала в виде чугуна.
Трудно сказать, как долго
чугун считался бесполезным
отходом. Но вот кто-то подме-
тил, что «свиное железо» обла-
дает замечательными свойст-
— 158 —
вами. Если расплавленный чугун вылить в какую-нибудь
форму, то металл, застывая, точно повторяет все ее очертания.
Смекалистые кузнецы не замедлили воспользоваться
этим открытием. Из чугуна стали отливать горшки, чугуны,
сковороды.
Достоинства нового металла быстро оценили и в промыш-
ленности, и в военном деле. Из чугуна стали лить ядра и
стволы пушек.
В XVI в. в России своими железными изделиями славилась
Устюжна. Там работали сотни горнов и домниц. Железо и чу-
гун получали и во многих других русских городах: Серпухове,
Коломне, Туле, Можайске, Казани.
Познакомившись поближе с чугуном, металлурги обнару-
жили у него еще одно замечательное свойство. Оказалось,
что чугун можно перерабатывать в железо. И это было го-
раздо выгоднее, чем получать кричное железо из руды.
На первый взгляд может показаться странным, как двой-
ная плавка может быть выгоднее одной плавки. Но если
вникнуть в сущность химических реакций, которые при этом
происходят, то все станет понятным.
Для того чтобы получить хорошую крицу в горне или дом-
нице, нужны были железистые шлаки для окисления углерода.
В них содержалось около цятидесяти процентов окислов желе-
за. Следовательно, вместе со шлаками пропадало и много
железа, находившегося в руде.
При выплавке же чугуна из руды потери железа почти
не было. Кроме того, на выплавку тонны чугуна затрачива-
лось гораздо меньше угля, потому что металла получалось
больше, а шлаков гораздо меньше.
По подсчетам некоторых зарубежных металлургов расход
топлива при получении полосового железа из чугуна был вдвое
меньше, чем при выплавке его из кричного железа.
Производство чугуна стало быстро расти. Если к началу
XVIII в. в России выплавляли всего сто пятьдесят тысяч пудов
чугуна, то к концу этого столетия производство «свиного
железа» достигло почти девяти миллионов пудов. По выплав-
ке металла Россия заняла тогда первое место в мире. Сотни
тысяч пудов русского железа вывозились за границу. Одна
только Англия в тридцатых годах восемнадцатого века вво-
зила до двухсот тысяч пудов железа из России.
Сибирское железо с прославленным на весь мир клеймом
«Старый соболь» затмило славу шведского железа, которое
тогда считалось самым лучшим.
Заметив, что из чугуна выгодно получать железо, метал-
лурги стали чугун выплавлять из руды в домницах,
а переплавлять его в железо в особых плавильных печах —
— 159 —
кричных горнах,— мало чем от-
личавшихся от древних сыро-
дутных горнов.
Углерод, насыщавший чу-
гун, окислялся в них кислоро-
дом воздуха и отчасти кисло-
родом окислов железа, вхо-
дивших в состав железистых
шлаков.
Теперь уже основные метал-
лургические процессы, «рож-
дающие» железо, протекали
раздельно — в двух разных
плавильных печах. В дом-
нице происходило восстановле-
ние металла из руды, в горне —
окисление углерода чугуна.
С ростом потребности в ме-
талле росли размеры домниц.
Постепенно они превратились в современные домны — огром-
ные сооружения, высотой с десяти-, пятнадцатиэтажный дом.
Первые домны в России появились в 1632 г. в районе
Тулы. Они были построены голландскими предпринимателя-
ми, получившими царскую грамоту на устройство железоде-
лательных заводов.
Петровская эпоха ознаменовалась усиленным строитель-
ством железоделательных заводов и доменных печей. В осно-
ву петровских заводов была положена забота о снабжении
вооружением армии и флота. Петр, будучи рачительным хо-
зяином и дальновидным политиком, не забывал и мирных
нужд своего государства.
15 октября 1701 г. на Урале задымили трубы первого пет-
ровского завода — Каменского. Спустя два года в строй
вступили Алапаевский и Уктусский заводы. А вслед за ними
появились на Урале Машуевский, Кунгурский, Екатерин-
бургский и многие другие. Более двух десятков доменных пе-
чей было построено еще при жизни Петра.
Русский металл, завоевавший мировое признание к концу
XVIII в., был и самым лучшим, и самым дешевым. Уральская
металлургия славилась тогда не только качеством железа и
чугуна, но и мощностью и совершенством доменных печей.
— 160 —
Механик-самоучка Иван Ползунов изобрел цилиндриче-
ские воздуходувные меха, которые вдували гораздо больше
воздуха, чем все известные ранее конструкции мехов.
Сибирские домны отличались в те времена от зарубежных
и многими другими новшествами — большей высотой, широ-
ким горном.
Иностранцы признавали бесспорные достоинства русских
домен и долгое время считали их образцом для себя.
Вторая половина прошлого века ознаменовалась непре-
рывным ростом высоты и размеров домен. Появились домен-
ные печи высотой 20 метров, а затем и 25, 26 и 27 метров.
Металлургам казалось, что пропорционально объему печи бу-
дет возрастать и количество выплавляемого из руды металла.
Но практика опрокинула расчеты доменщиков. Печь объемом
в 20 тысяч кубических футов не имела вдвое большей произ-
водительности, чем печь объемом вдвое меньшим.
Какие же причины вызывали такое ==
несоответствие? Над ЭТИМ вопросом за- Схематический разрез
думывалось немало металлургов, но
не могли найти ответа. Раз-
гадку принесли позднее ис-
следования французского
ученого Луи Грюнера, под-
робно изучавшего окисли-
тельно - восстановительные
реакции, которые происхо-
дят в доменной печи при
плавке руды.
Домна похожа на два
гигантских усеченных кону-
са, поставленных основания-
ми друг на друга.
Верхняя половина печи
называется шахтой. Вверху
шахты находится отверстие,
через которое в домну за-
гружают руду, уголь и раз-
ные добавки, облегчающие
плавку — флюсы. Его на-
зывают колошником — от
слова «колоша» — плетеная
корзина, в которой когда-то
на Урале носили в домну
древесный уголь.
Самая широкая часть
доменной печи, представля-
доменной печи
12 Б. я. Розен
— 161 —
ющая собой основание нижнего усеченного конуса — распар.
Нижняя цилиндрическая часть домны — горн. В горне имеют-
ся отверстия для подачи воздуха — фурмы, и для выпу-
ска чугуна и шлака — летки.
Рядом с домной высятся огромные стальные башни —
воздухонагреватели. Мощные воздуходувки прогоняют через
башни холодный воздух, который нагревается в них до 500—
800 градусов. Горячий воздух вдувается через фурмы в дом-
ну. Он поддерживает горение и необходимую для выплавки
чугуна температуру. Кислород воздуха окисляет углерод кок-
са, превращая его в углекислоту. Температура при горении
кокса около фурм достигает 1600—1800 градусов.
Углекислый газ, поднимаясь вверх, проходит через слой
раскаленного угля и превращается в окись углерода. Она
восстанавливает в верхней части печи руду — окись железа
в закись железа, а сама превращается снова в углекислый
газ. Здесь температура не превышает 500 градусов.
По мере сгорания кокса в горне шихта — смесь руды, кок-
са и плавней — опускается все ниже и ниже. В средней части
печи, где температура достигает 700—800 градусов, начи-
нается восстановление закиси железа до металла.
Часть кусков руды не успевает еще восстановиться до
железа. Окись углерода отнимает у них кислород в распаре.
Восстановление завершается примерно при температуре
1100 градусов, и железо превращается в твердую губчатую
массу. В нижней части распара железо вступает во взаимо-
действие с окисью углерода и образует железоуглеродистый
сплав — чугун.
Опускаясь еще ниже, где температура достигает 1200—
1250 градусов, чугун плавится и стекает струйками в ниж-
нюю часть горна.
В процессе работы домны пустая порода, которая содер-
жится в руде, вступает во взаимодействие с плавнями. Обра-
зуются жидкие шлаки. Они накапливаются на поверхности
расплавленного чугуна, предохраняя его от окисления.
Когда в горне скопится много чугуна, то горновой электри-
ческим бурильным молотком пробивает летку, замазанную
глиной.
Окутанный облаками дыма, с шумом и грохотом выры-
вается из домны огненный поток. Расплавленный металл
льется по желобам в ковши чугуновозов.
Как только из печи вытечет большая часть расплавленно-
го чугуна, появляются струйки шлака. Его выпускают через
другое отверстие — шлаковую летку. Обжигая своим горя-
чим дыханием, шлак стремительно заполняет шлаковые ковши.
В старину металлурги называли шлак «доменным соком».
— 162 —
Когда-то из него лили пушечные ядра. Теперь шлаку нашли
новое применение — из шлаковых блоков строят дома, шла-
ком мостят дороги.
Изучая работу доменных печей, Луи Грюнер сделал важ-
ное наблюдение. Шихта опускается вниз в высоких печах
гораздо медленнее, чем в низких. А это значит, что газы, под-
нимающиеся навстречу руде и, в первую очередь, окись угле-
рода, восстанавливающая железо из руды,— будут дольше
соприкасаться с рудой.
При более продолжительном взаимодействии газов с ру-
дой, она лучше прогревается и полнее происходит восстанов-
ление железа.
Доменная печь тем экономичнее, чем больше выплавляет-
ся в ней чугуна и чем меньше расходуется топлива.
Если домна будет очень высокой, то оседание шихты в печи
будет идти слишком медленно и расход топлива будет боль-
ше, так как углекислый газ соприкасается слишком долго
с коксом и сжигает его.
А если домна будет низкой, то окись углерода не успевает
достаточно полно отнять кислород у руды в верхней части
печи.
Следовательно, нужно так подобрать размеры домны,
чтобы скорость движения плавильных материалов в печи бы-
ла такой, при которой расход кокса будет наименьшим.
Исследования Грюнера пролили свет на многие запутан-
ные явления сложного процесса выплавки чугуна в домнах.
Теперь доменщикам стало понятным, почему увеличение
высоты домны не сопровождается пропорциональным ростом
ее производительности.
Изучая работу доменных печей разных размеров, Грю-
нер пришел к выводу, что наилучшие результаты получатся,
если плавку чугуна проводить в домнах, отношение высоты
которой к самой широкой части (распару) равняется 4 : 5.
Дальнейшая практика выплавки чугуна в домнах полно-
стью подтвердила вывод французского ученого. Доменные
печи стали строить высокие. Много лет жизни посвятил ис-
следованию доменного процесса выдающийся русский метал-
лург М. А. Павлов, ставший при Советской власти ака-
демиком.
Он тщательно изучил все реакции окисления и восстанов-
ления, которые протекают в разных частях печи. Оказалось,
что домна выдает больше всего чугуна, если руда главным
образом восстанавливается в верхней части печи, где темпе-
ратура не слишком высока. И лишь небольшое количество
окислов железа отдает свой кислород в тех частях домны,
где царит высокая температура.
12*
— 163 —
Михаил Александрович Павлов
(1863—1958 гг.)
Но для того чтобы
создать такой режим
плавки, необходимо что-
бы куски кокса, руды и
плавней были бы пример-
но одинаковы по разме-
ру. Нужно, чтобы они
были бы и достаточно по-
ристы, тогда газы будут
равномерно восстанавли-
вать руду по всей ее
толще.
Знакомясь с работой
домен разных профилей,
М. А. Павлов разработал
расчетную формулу, ко-
торая позволяет по высо-
те печи определить ее
объем или, наоборот, по
заданному объему опре-
делить высоту.
Формула М. А. Пав-
лова помогла нашим до-
менщикам построить мощные печи, которые работают лучше
зарубежных и выдают больше чугуна. За годы Советской влас-
ти много домен появилось в нашей стране. Есть среди них и
домны-гиганты в Магнитогорске — на Урале, в Кузнецке —
в Сибири. Из чугуна делают теперь не только кухонную посуду,
но отливают детали разных станков и машин. Однако большая
часть чугуна — примерно восемьдесят пять процентов — идет
в переработку на железо и сталь.
Более трех тысяч лет назад в разных странах древнего
Востока — Китае, Индии, Японии, Иране — люди умели ва-
рить сталь. Древние мастера-оружейники изготовляли из ста-
ли острые сабли и кинжалы.
В средние века особенно славились дамасские булатные
клинки. Они были тверды, как камень, упруги, как резина,
остры, как бритва. Булатным клинком можно было рубить
кости и гвозди, разрезать тончайшую шелковую ткань.
Дамасскую саблю можно было согнуть, но нельзя было
сломать, она со звоном распрямлялась.
— 164 —
Как же смогли древние оружейники и металлурги создать
такую совершенную сталь, если они не понимали и не знали,
что происходит в тиглях и горнах, какие химические реакции
превращают руду в металл?
Трудно было получить древним металлургам и высокую
температуру — свыше полутора тысяч градусов,— необходи-
мую для выплавки стали.
Ценой упорного труда, тысяч опытов накопили они практи-
ческие знания, которые дали возможность им приготовить
твердый и прочный булат.
В глубокой тайне хранили мастера секреты производства
булатной стали, передавая их по наследству своим детям.
В XIV в. в Сирию вторглись полчища алчного монголь-
ского завоевателя Тамерлана. Огнем и мечом отмечал он свой
путь. Спасаясь от врагов, многие оружейники бежали в дру-
гие страны. Прошло немного времени, и производство дамас-
ских клинков было забыто. А потомки мастеров и вовсе утра-
тили секреты выделки булатного оружия.
Спустя три столетия, производство булатной стали нена-
долго возродилось на Руси. В XVII в. в Москве славился
оружейный мастер Богдан Ипатьев, который делал булат-
ные ножи.
Но уже в следующем веке способы производства булат-
ного оружия были снова забыты.
XIX в. принес миру много новых открытий в технике и
химии. Металлурги проникли в сущность многих реакций,
протекающих при выплавке металла, и научились управ-
лять ими.
Булатные клинки, хранившиеся в Оружейной Палате и
Британском музее, привлекли внимание инженеров и ученых.
Булатную сталь изучали немцы, французы, англичане,
шведы, русские.
В 1820 г. английский путешественник Скотт привез из
Индии знаменитому физику и химику Фарадею несколько
клинков из индийской стали (ее называли там вутц). На них
были какие-то узоры.
Фарадей сделал химический анализ индийского булата и
обнаружил в нем кроме железа алюминий. По-видимому,—
рассуждал ученый,— алюминий, сплавляясь с железом, при-
дает булату его замечательные качества.
Чтобы убедиться в справедливости своего предположения,
Фарадей приготовил смесь железа и алюминия и сплавил ее
со сталью, которую тогда выплавляли в Англии. Ожидания
ученого оправдались. Он действительно получил металл,
у которого на поверхности были узоры, похожие на узорчатые
рисунки индийского булата. Но как позднее выяснилось, это
— 165 —
была ошибка ученого. Он не сделал анализа свойств получен-
ных им слитков. Полученный им металл обладал только внеш-
ним сходством с булатом.
Ни к чему не привели и попытки французского ученого Бре-
ана раскрыть тайну булата.
Однако ученые разных стран упорно и настойчиво продол-
жали исследовать старинные булатные клинки, надеясь в конце
концов раскрыть секрет их изготовления. Посчастливилось это
сделать русскому металлургу Павлу Петровичу Аносову. Ис-
следуя множество древних булатных клинков, Аносов, как и
зарубежные ученые, обратил внимание на то, что узоры на
булате не стирались и не исчезали ни при шлифовке, ни при
полировке, ни при точке.
Зная из опытов Фарадея, что сплавление стали с алюми-
нием дает металл с узорами, русский ученый сплавил в тиг-
ле английскую сталь с добавками кремния, магния, платины,
марганца, хрома.
Вынутые из тиглей слитки были расцвечены узорами, но
тщательный их анализ показал, что они по своему харак-
теру отличны от узорчатых линий настоящей булатной
стали. И еще больше эти сплавы отличались от булата по
качеству.
Опыты привели Аносова к убеждению, что рисунок узора
тесно связан с внутренним строением и химическим составом
булатной стали. Из своих наблюдений он сделал и другой
важный вывод: примеси, которые всегда содержатся в желе-
зе, оказывают влияние на свойства стали, вырабатываемой
из этого железа.
Для того чтобы сталь была бы высококачественной, ее
надо получать из чистого железа, а не железной руды. Уче-
ный переплавил в тигле железо и медленно охладил по-
лученную сталь. На поверхности металла не видно было
узоров.
Может быть, я ошибся,— подумал Аносов. Для того чтобы
разрешить возникшие у него сомнения в правильности своего
первоначального вывода, он снял со слитка тонкую стружку
и рассмотрел под микроскопом. Под окуляром микроскопа на
металле отчетливо вырисовывались мелкие узоры, очень похо-
жие на булатные.
Следовательно,— сделал новое заключение ученый,— узоры
на стали зависят не только от добавки к железу различных
металлов, но и прежде всего от присутствия углерода.
Булат—‘Это такой же сплав железа с углеродом, как и
обыкновенная сталь, но получающийся при каких-то особых
условиях. Значит, для того чтобы разгадать тайну изготовле-
ния дамасского клинка, нужно выяснить эти условия.
— 166 —
Павел Петрович Аносов
(1797—1851 гг.)
И вот ставится новый
опыт. В маленький тигель
кладут несколько фунтов
чистого железа, поверх
металла насыпают пол-
фунта графита и ставят
в плавильную печь. Пос-
ле плавки тигель разби-
вают, слиток вынимают и
проковывают. На конце
стальной полосы явствен-
но виден точно такой же
узор, каким славился
древний булат.
Тайна, над разгадкой
которой столько лет би-
лись ученые в разных
странах, наконец, раскры-
та. Пришла награда мно-
голетним трудам и поис-
кам. А самое главное, най-
ден способ выработки вы-
сококачественной стали.
Раскрыв тайну булат-
ной стали, Аносов выяснил и сущность многих физических
и химических превращений, которые происходят при выплавке
стали из железа. Он заметил, что твердость стали зависит от
количества углерода, насыщающего железо. Сталь, в которой
меньше углерода, плавится при более высокой температуре.
При увеличении содержания углерода сталь становится менее
тугоплавкой.
Оказалось, что железо при переплавке вступает в хими-
ческую реакцию со шлаком, который очищает железоуглеро-
дистый сплав от вредных примесей.
В тридцатых годах прошлого века Аносов организовал
на Златоустовском заводе на Урале производство стали по
своему способу. Златоустовская сталь тогда считалась луч-
ше самой первоклассной английской стали. Изделия из этой
стали — косы, сабли, клинки — отличались необыкновенной
твердостью и гибкостью.
Исследования Аносова позволили создать в России произ-
водство высококачественной стали. Они дали также толчок
к развитию новых способов выплавки стали, разработанных
во второй половине прошлого столетия английским изобрета-
телем Генри Бессемером и французскими инженерами — Эми-
лем и Полем Мартенами.
— 167 —
Металлурги долгие годы занимались поисками способов
получения дешевой и качественной стали. Давно знали, что
из чугуна можно получить сталь, если удалить из нее часть
углерода и. некоторые примеси. Излишек углерода отнимали
кислородом воздуха и при помощи шлака. Так выплавляли
сталь в начале XIX в. в так называемых пудлинговых печах.
Спрос на сталь все возрастал, ее нужно было выплавлять
быстрее. Многие изобретатели предлагали различные спосо-
бы окисления чугуна кислородом воздуха, но все они оказа-
лись практически непригодными.
В 1854 г. англо-французская армия высадилась в Крыму
и начала военные действия против русских войск. Союзникам
нужно было много артиллерийских орудий. А тогда уже на-
чали стволы пушек отливать из стали.
Металлургические заводы в Англии и Франции были за-
валены военными заказами. В эти годы выплавкой стали за-
интересовался Генри Бессемер. Он решил найти быстрый и
дешевый способ переработки чугуна в сталь. И поиски увен-
чались успехом.
Бессемер сконструировал особую плавильную печь. Она
не похожа ни на горн, ни на пудлинговую печь. Это большая
железная груша, изнутри выложенная огнеупорным кирпичом,
обмазанным кварцевым песком и глиной. Ее называют кон-
вертором Бессемера, по имени изобретателя. Она может
автоматически наклоняться и поворачиваться в горизонталь-
ное положение. Конвертор вмещает 50—60 тонн чугуна.
Ко дну конвертора, пронизанному мелкими дырочками,
прикреплена воздушная камера, через которую продувают под
=====^ большим давлением воздух. Кис-
Конвертор Бессемера (схема) лород воздуха, проходя через
толщу расплавленного чугуна,
окисляет примеси.
Прежде всего пре-
вращаются в шла-
ки кремний и марга-
нец, а затем уже уг-
лерод окисляется в
углекислоту.
Не проходит де-
сяти-пятнадцати ми-
нут, как сталь уже
готова. Конвертор поворачивают отверстием вниз и выливают
сталь в изложницы.
Изобретение Бессемера было встречено металлургами
всего мира с восторгом. По новому способу литую сталь мож-
но было приготовлять с невероятной быстротой, с малыми за-
тратами труда и топлива.
Но вскоре наступило разочарование. Не всякий чугун да-
вал хорошую сталь. Если в нем было много фосфора, то его
не удавалось удалить и сталь получалась хрупкой. Из-за
слишком быстрого окисления при продувке воздухом полу-
чался большой угар металла. Уменьшалось количество вы-
плавляемой стали. Было замечено, что при сильном продува-
нии воздухом в железо попадает часть шлака, который при
остывании остается в стали и ухудшает ее качество. Наконец,
сталь, выливаемая из конвертора, содержит так мало угле-
рода, что с трудом подвергается закалке.
Для того чтобы получить сталь с нужным содержанием
углерода, в бессемеровские конверторы стали добавлять чу-
гун. Углерод чугуна науглероживал металл. Если хотели по-
лучить более твердую сталь, то добавляли больше чугуна.
К концу семидесятых годов прошлого столетия десятки
конверторов выдавали сталь на многих заводах Англии, Шве-
ции, Франции и Германии. И тем не менее металлурги были
не совсем довольны бессемеровским способом получения ста-
ли. Нередко получалась плохая сталь и ее приходилось пу-
скать в переплавку. А это приносило крупные убытки.
Изобретатели снова взялись за работу. Надо было найти
способ плавки стали, который сохранял бы преимущества бес-
семеровского, но не имел его недостатков.
Во Франции Мартены, отец и сын, задались целью разра-
ботать способ получения стали из металлургического лома и
чугуна. В те времена на всех металлургических заводах на-
капливались горы различных обрезков железа, кусков стали.
Они захламливали цехи, заводские дворы, мешали работе.
Заводчики платили большие деньги за вывозку этих отходов
с территории заводов. Мартены пытались плавить металличе-
ский лом с чугуном в отражательных печах, т. е. таких печах,
в которых тепло от сгорающего топлива сначала отражается
от пода и стен, выложенных огнеупорным кирпичом.
Изобретателей на первых порах постигла неудача. Тогда
температура в этих печах не превышала 1100 градусов. А для
того чтобы происходили нужные для выплавки стали реакции,
нужна была температура не менее 1800 градусов.
Опыты Мартенов с переплавкой железного лома и чугу-
на, казалось, были обречены на провал. Но изобретатели
изыскивали способы повышения температуры. Было замечено,
11 Б. Я. Розен
— 169 —
что п-ри вдувании в топку избытка кислорода ускоряется реак-
ция горения и увеличивается температура в печи. Однако и
таким путем не удалось получить больше 1400 градусов.
Погоня за градусами продолжалась, казалось, ей не бу-
дет конца. Но вот из Германии в Париж пришло известие, что
там появилась какая-то новая, необычная печь, в которой
создается такой жар, что плавятся стальные напильники, сго-
рают самые тугоплавкие тигли.
Это была сконструированная немецким инженером Ф. Си-
менсом регенеративная плавильная печь. Высокая темпе-
ратура в печи достигалась тем, что в топку поступал предва-
рительно нагретый воздух. Тепло, принесенное воздухом,
складывалось с теплом, образующимся при горении топлива,
и обеспечивало сильный жар в печи.
Новая печь принесла Мартенам успех. Их опыты дали те-
перь положительные результаты. Из железного лома получа-
лась прекрасная сталь. Химия помогла сталеварам научиться
управлять процессом плавки.
Какие же химические реакции происходят при плавке ме-
талла в мартеновской печи? Сначала металлический лом
окисляется кислородом воздуха и плавится — железо превра-
щается в закись железа. Одновременно окисляются и приме-
си, которые содержатся в металле — кремний, марганец, уг-
лерод. Их окислы в виде шлака всплывают на поверхность
расплавленного железа. Шлак, словно одеяло, закрывает
расплавленный металл от воздействия воздуха.
Между тем окисление примесей металла продолжается и
под шлаковым «одеялом». Откуда же берется кислород, ведь
пузырьки воздуха не в состоянии пробить шлаковую обо-
лочку.
Но ведь в самом шлаке содержатся окислы кремния, мар-
ганца и железа. Среди них есть и высшие окислы, т. е. такие,
в которых больше кислорода. Вот они-то, соприкасаясь с рас-
плавленным металлом, и передают ему часть своего кисло-
рода. Железо окисляется в закись железа, а она, в свою
очередь, вступает в реакцию с примесями, еще оставшимися
в расплавленном металле,— передает молекулы кислорода
атомам марганца, кремния, фосфора, серы, углерода.
Окислы металлов и неметаллов поднимаются вверх и,
достигнув поверхности шлака, захватывают из воздуха, на-
ходящегося в печи, новые порции кислорода. А пузырьки
образовавшейся углекислоты перемешивают шлак и металл,
ускоряя работу переносчиков кислорода и убыстряя переме-
щение закиси железа в массе расплавленного металла. При-
меси в металле будут лучше и полнее окисляться, а сталь бу-
дет качественнее.
— 170 —
При выплавке стали в мартенах теперь часто к железному
лому добавляют руду. Кислород руды позволяет ускорить
окисление примесей чугуна и тем самым убыстрить плавку.
Стремясь еще больше ускорить выплавку стали в марте-
новских печах, советский инженер Н. И. Мозговой предложил
продувать струю чистого кислорода через расплавленный
металл. Опыты, поставленные в производственных масштабах
на московском заводе «Серп и молот», киевском заводе
«Большевик» и некоторых других заводах дали положитель-
ные результаты. На украинском заводе «Запорожсталь» мар-
теновская печь № 10 дала за год на 32 тысячи тонн ста-
ли больше. Продувка кислородом на два часа ускорила
плавку.
Американцы, узнав о новом советском способе выплавки
стали, применили его у себя. Теперь на многих заводах
в США вдувают в мартеновские печи чистый кислород.
В СССР на некоторых машиностроительных заводах ра-
ботают и бессемеровские конверторы, чугун в которых проду-
вается вместо воздуха чистым кислородом.
Мартеновский способ выплавки стали оказался лучше бес-
семеровского. Он позволяет лучше управлять ходом плавки,
поскольку она происходит дольше — несколько часов вместо
15—20 минут — и получать качественную сталь.
Но еще лучше по качеству сталь можно «сварить» в элек-
трической печи. Электросталь, как в технике называют сталь,
выплавленную с помощью электрического тока, обладает
особой твердостью и прочностью. Из нее изготовляют дви-
гатели реактивных самолетов, детали мощных электри-
ческих машин и генераторов, атомные котлы и режущие ин-
струменты.
Выплавка стали в электропечах во многом напоминает
процесс ее варки в мартеновских печах. Металл плавится,
примеси окисляются кислородом, закись железа и сера, вред-
ные для металла, удаляются. Но есть и существенное от-
личие, которое и позволяет получать особенно качественную
сталь.
Нагревание металла в электропечи производится не окис-
лительным пламенем (содержащим много кислорода), обра-
зующимся при сгорании жидкого или твердого топлива,
а электрической дугой. Электродами дуги обычно служат
угольные или графитовые стержни, иногда один электрод из-
готовляется из угля, а вторым является металлическая шихта,
загружаемая в печь. В атмосфере электрической дуги содер-
жится много углерода, что способствует восстановлению заки-
си железа, которая портит готовую сталь, делая ее хрупкой.
Высокая температура электропечи позволяет полнее изба-
11*
— 171 —
виться от примесей серы, фо-сфора и других вредных веществ.
Кроме того, в электропечи гораздо легче регулировать про-
цесс плавки, что дает возможность получать всегда однород-
ную сталь.
С каждым годом в нашей стране вступают в строй все но-
вые и новые электропечи, которые выдают все больше высо-
кокачественной стали разных сортов. Одни из них обладают
магнитными свойствами, другие, наоборот, лишены их, тре-
тьи необычайно тверды, четвертые выдерживают непомерно
большие нагрузки.
За годы пятилеток выплавка стали у нас во много раз
превысила дореволюционную. Советский Союз обогнал по вы-
плавке стали и передовые капиталистические страны — Ан-
глию, Францию, Бельгию и занял первое место в Европе.
Советские сталевары обогнали своих зарубежных товари-
щей по профессии и по производительности сталеплавильных
печей, На лучших американских металлургических заводах
снимают с квадратного метра пода мартеновской печи 5,3 тон-
ны стали, а на советских заводах — 7—10 тонн.
55 миллионов тонн стали было выплавлено в СССР
в 1958 г. Еще больше стали — 86—91 миллион тонн должны
дать наши сталевары стране в 1965 г.
Химия помогала металлургам овладевать и управлять
процессами выплавки металла из руд, она может создать
еще более совершенные способы превращения руды в железо
и сталь.
Железо и сталь — основа техники нашей эпохи. Но совре-
менная техника не может обойтись и без многих других ме-
таллов— меди, цинка, олова, свинца, никеля, алюминия. Без
них не построить теперь ни автомобилей и самолетов, ни тур-
бин и теплоходов, ни паровых котлов и атомных реакторов.
Медь редко встречается в природе в самородном состоя-
нии, чаще в соединениях с кислородом, железом и серой. Со-
ветский Союз богат разными медными рудами. Залежи мед-
ных руд обнаружены на Урале, в Казахстане, в Армянской и
Узбекской Союзных республиках. Месторождение медной ру-
ды— Коунрадское—находится у озера Балхаш в Казахстане.
Далеко за пределами нашей Родины славится Балхашский
медеплавильный комбинат.
Руды, в которых медь находится в виде окисла, накали-
вают с углем. Уголь отнимает кислород и восстанавливает
— 172 —
металл. Получение меди из сернистых руд гораздо сложнее.
Сначала руду обжигают. Часть серы превращается в серни-
стый газ, который используется для производства серной
кислоты. Если в руде содержится сернистое железо, то оно
при обжиге переходит в закись железа.
Обожженную руду загружают в отражательную печь. К ру-
де добавляют немного кремнезема и кокса. Шихта при нагре-
вании плавится. На дне печи собирается медь в виде сернистой
меди и сернистое железо, которое еще оставалось в руде. Над
«штейном», как производственники называют такой металл,
всплывает шлак, в который из руды переходит большая часть
железа,
Для того чтобы удалить из «штейна» оставшееся в нем
железо и восстановить в металл сернистую медь, его помеща-
ют в конвертор (похожий на конвертор, применяемый стале-
варами). К расплавленному штейну добавляют немного пес-
ка. Через конвертор продувают воздух.
Кислород окисляет серу в сернистый газ, а медь превра-
щает в закись. Но на этом реакция не заканчивается. Закись
меди вступает .во взаимодействие с сернистой медью, которая
не успела еще окислиться кислородом воздуха. Теперь атомы
серы забирают кислород у закиси меди и восстанавливают
медь. Одновременно сернистое железо окисляется кислородом
воздуха в закись железа, которая взаимодействует с песком,
образуя шлак — силикат железа.
Все эти реакции идут с выделением тепла, которое поддер-
живает всю массу в раскаленном состоянии. Благодаря это-
му температура в конверторе достигает 1100—1200 градусов,
делая излишним расход топлива.
Расплавленную медь из конвертора выливают в песчаные
формы, в которых она застывает. Но это еще не чистая медь.
Она содержит от двух до трех процентов примесей разных
металлов — цинка, никеля, свинца. Ее называют сырой, или
черновой медью. Для того чтобы очистить от примесей, ее
сплавляют в токе воздуха. Часть меди окисляется в закись,
которая растворяется в расплавленной массе металла. Закись
меди отдает свой кислород металлам, которые загрязняют
медь, окисляющий их в окислы. Избыток закиси меди вос-
станавливают, добавляя к расплавленному металлу немно-
го угля.
После такой обработки медь содержит не более полупро-
цента примесей. Для некоторых промышленных нужд, напри-
мер для изготовления электрических проводов, требуется со-
вершенно чистая медь. Тогда очистку черновой меди или, как
говорят в технике, рафинирование производят с помощью
электрического тока.
— 173 —
Цинк и свинец, подобно меди, чаще всего получают из сер-
нистых руд. Их сначала обжигают в отражательных печах.
Образовавшиеся окиси восстанавливают при высокой темпера-
туре углем и очищают металлы от примесей.
Производство никеля и олова, как и многих других метал-
лов, основано на использовании окислительно-восстановитель-
ных реакций. Окислителем обычно служит кислород, а восста-
новителем — уголь.
В 1955 г. на всемирной выставке ib Париже в витрине, где
были выставлены сервизы и чашки из севрского фарфора1,
лежало несколько маленьких слитков и полосок серебристого
металла — алюминия. В те времена килограмм алюминия
стоил более тысячи рублей, а теперь он стоит меньше руб-
ля. За сто лет его производство увеличилось в несколько
сот раз.
Алюминий прочно вошел в наш обиход. Его иногда назы-
вают «крылатым металлом» и не случайно. Алюминий и его
сплавы помогли человеку покорить воздушную стихию, завое-
вать воздушные пространства. Современные самолеты строят-
ся, главным образом, из алюминия и его сплавов. Без них не
обходится теперь и строительство железнодорожных вагонов
и морских судов, изготовление автомашин и каркасов стан-
дартных домов.
Незаменим алюминий и в быту. Из него делают кастрюли
и чайники, кружки и ложки, кресла и кровати.
Алюминий — один из самых распространенных металлов
в природе. В земной коре его содержится более семи процентов.
Этот химический элемент можно встретить повсюду, но он ни-
когда не бывает «в одиночестве». Алюминий очень активен и
легко вступает в соединения с разными элементами — кисло-
родом, кремнием, калием, натрием, фтором. Насчитывается
около 250 разных минералов, в составе которых заключены
атомы этого чудесного элемента. Его можно обнаружить
в обыкновенной глине, в ледяном камне — криолите, в драго-
ценных самоцветах — красном рубине и синем сапфире, в твер-
дом, как алмаз, корунде.
В Советском Союзе первый алюминиевый завод был по-
строен в 1932 г., а в настоящее время наша страна по произ-
водству алюминия занимает одно из первых мест в Европе.
Почти в три раза увеличится производство алюминия в 1965 г.
по сравнению с 1958 г.
Алюминий на наших заводах получают преимущественно
из бокситов, богатые залежи которых имеются на Урале, в
Башкирской АССР, Казахстанеи другихрайонах нашей страны.
1 Изделия знаменитой французской фабрики фарфора в Севре.
— 174 —
Бокситы, в составе которых находятся окислы алюминия,
кремния, железа и вода, по внешнему виду похожи на обык-
новенную глину. Но есть у них и существенное отличие. Если
замешать глину с водой, то получится пластичное тесто, а бок-
ситы не образуют пластической массы.
Для того чтобы выделить из бокситов окись алюминия, из
которой получают на заводах алюминий, необходимо отделить
ее прежде всего от «соседей» — окислов желоза и кремния.
А сделать это не так легко.
Еще в прошлом столетии многие ученые пытались найти
способ разделения окислов, содержащихся в бокситовых ру-
дах, но безуспешно. Лишь в конце XIX в. этого удалось до-
биться химику К. И. Байеру, работавшему на Тентелевском
химическом заводе в Петербурге.
На основе многих опытов он разработал промышленный
способ выделения окиси алюминия из бокситов.
Если руду нагревать в растворе натриевой щелочи в закры-
тых сосудах при повышенном давлении, то почти весь глино-
зем из бокситов переходит в раствор.
Но мало отделить глинозем от других окислов, нужно вы-
делить его из щелочного раствора. Байер нашел и тут простой
и остроумный способ.
Химикам давно было известно, что если бросить кристал-
лик соли в насыщенный раствор, то быстро начнется выпаде-
ние твердого вещества из раствора, или говоря иными слова-
ми, начнется кристаллизация растворенной соли.
Следовательно, если в раствор глинозема в натриевой ще-
лочи внести «затравку» — несколько кристалликов чистой оки-
си алюминия, то и будут выпадать в осадок кристаллы гли-
нозема. Однако это еще не чистая окись алюминия. К молеку-
лам, из которых сложены выпавшие в осадке кристаллы,
присоединились молекулы воды (такую воду называют в хи-
мии кристаллизационной водой). Для того чтобы от нее изба-
виться, кристаллы глинозема прокаливают.
XX в. принес нам и другие способы переработки бокситов.
Богатые алюминиевые руды содержат 60—70 процентов окиси
алюминия, но таких руд немного. Чаще встречаются место-
рождения бокситовых руд, в которых содержание глинозема
составляет 35—50 процентов.
Еще в 1915 г. профессор А. Н. Кузнецов и Е. И. Жуков-
ский разработали способ получения глинозема не только из
таких руд, но даже из простой глины, в которой содержится
не более 20—30 процентов окиси алюминия. Боксит или глину
смешивают с чистой известью и углем и плавят в электриче-
ской или доменной печи. Глинозем под действием высокой тем-
пературы вступает в реакцию с окисью кальция. Образуется
— 175 —
шлак, всплывающий на поверхность расплавленной массы. По-
лученный шлак растворяют в водном растворе соды. Из этого
раствора выделяют кристаллы глинозема, которые отделяют
от воды прокаливаем так же, как и при выделении окиси
алюминия из бокситов по способу Байера.
Можно выделить глинозем из бокситовых руд, нагревая их
с известняком и содой в больших вращающихся печах. Окись
алюминия вступает в реакцию с содой, образуя хорошо рас-
творимое в воде вещество — алюминат натрия. Другие же со-
ставные части смеси, загруженной в печь, остаются нераство-
римыми. Это дает возможность отделить окись алюминия от
примесей, растворяя алюминат натрия. Из раствора алюмина-
та затем выделяют кристаллы водного глинозема, которые
прокаливают.
Недавно советские металлурги одержали выдающуюся
победу. На Волховском алюминиевом заводе впервые в ми-
ре стали получать алюминий из нефелинов, отходов в произ-
водстве фосфорных удобрений из минералов апатитов.
Из этих отходов, которые в производстве называют «хвос-
тами», сначала получают концентрат. В нем содержится при-
мерно 30 процентов глинозема.
Немало пришлось поработать советским ученым и инжене-
рам, прежде чем удалось разработать такой процесс перера-
ботки «хвостов» на алюминий, который был бы экономически
выгодным и целесообразным.
Дело в том, что бокситов для получения одинакового ко-
личества алюминия нужно вдвое меньше, чем нефелинового
концентрата. К тому же извлечь алюминий из нефелина го-
раздо труднее, чем из бокситов. Очень трудно разрушить моле-
кулы нефелина -и «вытянуть» из них молекулы окиси алюминия.
На помощь металлургам пришли их постоянные союзни-
ки— высокая температура и химические реакции.
Нефелиновый концентрат дробят на мелкие кусочки и сме-
шивают с раздробленным известняком. Смесь размалывают на
мельницах в присутствии определенного количества воды. По-
лученную кашицу, называемую в технике пульпой, загружают
в большую вращающуюся печь — длинный железный барабан.
Пульпа поступает в барабан с холодного конца, а навстречу
ей с другого конца движется струя мелко измельченного горя-
щего угля. Температура раскаленного угля достигает
1500 градусов.
Сначала испаряется вода, затем разлагается известняк — на
окись кальция и углекислый газ, который отсасывается из печи.
Молекулы извести вступают теперь в реакцию с молекула-
ми нефелина и разрушают их. Образуется спек — плотная
масса, которая состоит, главным образом, из силиката каль-
— 176 —
Электролизная ванна для получения
алюминия
/—подвод тока к катоду; 2—подвод тока
к аноду; 3—аноды; 4—катоды; 5—расплав-
ленный электролит; 6—расплавленный алю-
миний
ция и алюминатов натрия и калия. Они
жадно соединяются с молекулами крем-
незема. Одновременно окись алюминия,
которая содержится в пульпе, реагирует
с окислами калия и на-
трия и превращается
в алюминаты этих метал-
лов.
Спек охлаждают до
100 градусов и размалы-
вают на мельницах в по-
рошок, который затем за-
сыпают в большие чаны и
заливают раствором соды.
Алюминаты натрия и ка-
лия растворяются в соде,
а силикат кальция остает-
ся на дне чана.
Алюминатные растворы
отделяют от осадка в спе-
циальных аппаратах. Оса-
док тоже не пропадает.
Его промывают и направ-
ляют в другой цех. Там из
него приготовляют цемент.
Очищенные растворы алюминатов перекачивают в аппара-
ты, называемые карбонизаторами. Здесь они взаимодействуют
с углекислым газом. В осадок теперь выпадает гидрат окиси
алюминия — белый пушистый порошок, а в растворе остается
поташ и сода. Гидрат окиси алюминия прокаливают во вра-
щающихся печах, где он, теряя воду, превращается в глино-
зем. А сода и поташ снова используются для растворения
соединений алюминия, содержащихся в нефелине.
Извлечение окиси алюминия из нефелиновых «хвостов» не-
обычайно расширяет сырьевую базу производства крылатого
металла. Ведь запасы бокситовых руд у нас ограничены, тогда
как запасы апатитовых руд почти неисчерпаемы. Особенно
много их на Кольском полуострове, в Красноярском крае,.
Армении.
Алюминиевый завод совсем непохож на металлургические
предприятия, где из железной руды добывают чугун и пере-
плавляют его в сталь. Здесь не видно ни дышащих огнем до-
мен, ни пышущих жаром мартеновских печей. Нет здесь и
стальных крутобоких башен — воздухонагревателей, нет и бес-
семмеровских конверторов.
— 177 —
Сердце алюминиевого завода — электролизный цех. Вдоль
широких пролетов в несколько рядов установлены на камен-
ном фундаменте большие железные ящики — электролизные
ванны. Они выложены внутри графитом или угольными пли-
тами, которые служат катодом. Сверху в ванны спущены мас-
сивные угольные пластины — аноды. Электролизные ванны на-
полняют окисью алюминия. К ней добавляют немного крио-
лита, который снижает температуру плавления. Когда вклю-
чают ток, криолит плавится и растворяет окись алюминия.
Электролиз ведется при температуре около тысячи градусов.
При пропускании через ванну электрического тока на ано-
де выделяется кислород, который окисляет уголь в окись
углерода. На дне ванны, на катоде, собирается расплавлен-
ный алюминий. Несколько сот килограммов крылатого метал-
ла дает в сутки каждая ванна.
Извлечение металлов из руд с помощью электрического
тока, как и выплавка их при нагревании до высокой темпера-
туры в домнах и плавильных печах, неразрывно связано
с окислительно-восстановительными реакциями.
Если опустить тоненькую полоску алюминия в банку, на-
полненную хлором, он загорится ярким пламенем. Еще ярче
будет гореть в хлоре сурьма. Прекрасно горят многие метал-
лы в парах серы, в жидком броме. Так же, как и при горении
веществ в присутствии кислорода, сверкает пламя.
При горении металлы соединяются с металлами, и полу-
чаются соли. По сходству этого процесса с горением в кисло-
роде химики стали называть его окислением, а выделение
металла — восстановлением.
Когда же физики установили, что атом состоит из положи-
тельно заряженного ядра и вращающихся вокруг него отрица-
тельных электронов, химики пересмотрели понятия — окисле-
ние и восстановление.
Теперь уже окислительно-восстановительные реакции ста-
ли связывать с перемещением электронов. Когда какое-либо
вещество окисляется, то его атомы отдают электроны атомам
того вещества, которое восстанавливается. Например, когда
железо восстанавливается из руды углем, то это значит, что
атомы углерода отдали свои электроны ионам железа.
Точно также при горении натрия в хлоре его атомы отдают
свои электроны атомам хлора. Металл окисляется, а хлор вос-
станавливается.
Еще в 1887 г. знаменитый шведский ученый Сванте Арре-
ниус заметил, что если какую-нибудь соль — хлористый маг-
ний, сернокислый натрий или азотнокислый калий — раство-
рить в воде, то ее молекулы распадаются на положительно за-
ряженные ионы металлов и отрицательно заряженные ионы
— 178 —
неметаллов. Это явление было названо электрической диссо-
циацией.
Если в раствор электролита, как называются вещества,
распадающиеся в растворах на ионы, опустить электроды и
пропустить электрический ток, то положительно заряженные
ионы будут двигаться к отрицательно заряженному электро-
ду— катоду, а отрицательные ионы будут притягиваться к по-
ложительному электроду — аноду.
Когда катионы (положительные ионы) попадут на пласти-
ну отрицательного электрода, то они присоединят к себе
электроны, которые всегда в избытке 'находятся на электро-
дах, и превратятся в нейтральные атомы. Металлические ионы
восстановятся, и на катоде выделится чистый металл. На ано-
де будет происходить обратный процесс — ионы неметаллов
будут окисляться, отдавать свои избыточные электроны и так-
же превращаться в нейтральные атомы.
Вот потому-то и пользуются электролизом для выделения
металла из расплавленных солей и окислов.
Электрический ток помогает нам теперь получать и магний,
и медь, и некоторые другие металлы из руд.
Электрометаллургия еще очень молодая наука. Ей около
пятидесяти лет. Но ей промышленность обязана тем, что алю-
миний стал дешевым и распространенным металлом.
В развитие новой науки ценный вклад внесли русские уче-
ные, и прежде всего Павел Павлович Федотьев. Еще в 1912 г.
он опубликовал ряд своих исследований, заложивших основы
электрометаллургии алюминия. Капитальный труд русского
ученого, вышедший в свет в 1921 г. «Электрометаллургия»,
служит до сих пор научным руководством для металлургов
многих стран мира.
Немалую работу по усовершенствованию производства
алюминия электролизом проделали и другие русские и совет-
ские ученые: Н. А. Пушин, А. Н. Кузнецов и Е. И. Жуковский,
А. А. Яковкин. Результаты их исследований сыграли важную
роль в развитии советской алюминиевой промышленности.
Успехи электрометаллургии помогли увеличить выплавку
и многих других цветных металлов — магния, цинка, никеля.
К концу текущей семилетки по сравнению с 1958 г. произ-
водство в СССР меди возрастет в 1,9 раза, алюминия-—
в 2,8 раза. В 1965 г. значительно увеличится на наших метал-
лургических заводах и производство свинца, никеля, магния,
молибдена.
глава as® as? а а
ВРАГИ МЕТАЛЛОВ
Шри раскопках одного из древнерусских
городищ археологи обнаружили много
старинного оружия. Чего тут только не
было: стальные кольчуги, секиры, мечи. Верно они послужили
нашим предкам, помогая им отражать набеги печенегов и
половцев.
Некогда искрились они в лучах солнца, отливали сереб-
ристым блеском, а теперь лежали они покрытые толстым сло-
ем ржавчины. Когда археологи стали счищать с оружия бурые
корочки, оно рассыпалось на сотни мелких кусочков.
Кто же превратил изделия древнерусских умельцев-ору-
жейников в груду трухи? Это сделал главный враг железа и
стали — кислород. Присутствуя в воздухе, воде, в земной коре,
кислород поражает металлы тяжелой болезнью. Называют
эту болезнь в технике коррозией. Одним из проявлений этого
недуга служит ржавление.
С тех пор как люди научились из железа и стали делать
разные изделия, ржавчина неотступно следует за ними, выби-
— 180 —
рая лишь удобный момент для нападения. Оставьте нож или
топор на несколько дней в сыром помещении, на поверхности
металла появятся бурые пятна ржавчины. А при долгом пре-
бывании во влажной атмосфере образуются язвочки и даже
сквозные отверстия.
Кислород не щадит и цветные металлы — медь, латунь,
бронзу, алюминий. Медные кастрюли зеленеют, а алюминие-
вые изделия тускнеют при коррозии.
Много огорчений и убытков приносит коррозия нам и
в быту, и в технике. Проржавела крыша, капли дождя проника-
ют на чердак, просачиваются через потолок в жилые помеще-
ния. Водопроводная труба дала течь, вода заливает квартиры,
виновником снова является ржавчина. А если проржавеет
отросток городской водопроводной магистрали, то бед будет
еще больше. Для того чтобы найти повреждение, придется
вскрыть асфальт или брусчатку на мостовой, выкопать тран-
шею и тщательно проверить весь трубопровод. Замена «боль-
ной» трубы здоровой требует затраты большого количества
труда и времени.
Еще большие убытки приносит коррозия при ржавлении
отдельных деталей мостов, паровых котлов, турбин. А сколько
труда и усилий приходится затрачивать, чтобы удалить про-
ржавевшие детали из крупной и сложной машины.
А если разрушится какая-нибудь деталь в генераторе
электростанции, то фабрики и заводы целого района будут
лишены электрического тока в течение некоторого времени.
Еще опаснее коррозия на химическом заводе. Она не только
может вывести из строя какой-нибудь важный агрегат, но вы-
звать и ухудшение качества продукции, благодаря загрязне-
нию продуктами коррозии.
Вычислено, что коррозией разрушается ежегодно более
четверти всего добываемого железа. Около одной трети всех
других металлов и сплавов выходит из строя. Десятки милли-
онов тонн металла гибнут безвозвратно.
Коварный враг металлов — коррозия — подстерегает свои
жертвы на каждом шагу. Вот потому-то уже несколько десят-
ков лет ученые всего мира занимаются исследованием причин
коррозии металлов и изыскивают способы защиты от этой
болезни.
В Советском Союзе зачинателями изучения коррозии и
борьбы с ней стали академик В. А. Кистяковский, члены-кор-
респонденты Академии наук СССР Г. В. Акимов и Н. А. Из-
гарышев.
В 1927 г. начала работать первая исследовательская лабо-
ратория по изучению коррозии, организованная Г. В. Аки-
мовым.
— 181 —
За тридцать лет выросли многочисленные кадры талантли-
вых и усердных исследователей, которые успешно борются
с тяжелым недугом металлов.
Исследователи изучили не только внешние признаки забо-
левания металлов, они проникли в сущность химических реак-
ций, которые происходят при коррозии. Подобно врачам, ис-
следователи коррозии сначала устанавливают в каждом
отдельном случае «диагноз» болезни, а затем «прописывают
лекарство».
Все металлы, которые находят в земной коре, за исключе-
нием золота, серебра, платины, всегда соединены с какими-
либо неметаллами: кислородом, серой, хлором. Когда металл
получают в чистом виде из его руд, то путем затраты элект-
рической, тепловой или химической энергии отрывают из мо-
лекул соединений (окислов, солей) атомы связанных с метал-
лом других элементов.
Освобожденный металл однако стремится снова вернуться
в исходное состояние, поэтому коррозию можно рассматривать
как процесс перехода металла в естественное состояние,
в котором он встречается в природе.
Металлические изделия — ножи, вилки, ложки — даже
в сухом помещении постепенно теряют свой блеск и становят-
ся матовыми. На поверхности металла образуется тончайшая
окисная пленка, состоящая из продуктов химической реакции
атомов кислорода с атомами металла. В самом начале взаи-
модействия кислорода с металлом, пленка невидима даже
в микроскоп, толщина ее не превышает нескольких сот милли-
онных долей сантиметра. В дальнейшем пленка быстро растет.
Атомы кислорода проходят через пленку и движутся навстре-
чу атомам металла, которые в свою очередь движутся на-
встречу кислороду.
В конце концов получается настолько прочная пленка, что
дальнейшее окисление металла кислородом прекращается.
Особенно прочные пленки образуются на поверхности алюми-
ния и цинка.
Эти пленки, словно броня, защищают металлы от атак их
врагов — кислорода, сероводорода, углекислоты и других
газов. Потому такие пленки называют защитными.
Защитные пленки имеют разную толщину. Тончайшие не-
видимые пленки — не более 400 ангстремов (ангстрем — одна
десятимиллионная миллиметра); пленки, образующие на по-
— 182 —
верхности металла «цвета побежалости» 1 — от 400 до 500 анг-
стремов, а толстые, видимые пленки — свыше 5000 ангстремов.
Еще более толстые пленки получаются на поверхности
стали или железа при нагревании до высокой температуры —
1200—1300 градусов. Окалина, как принято называть такие
пленки, может достигать толщины в несколько миллиметров,
а иногда и одного сантиметра.
Если сделать химический анализ окалины, то окажется, что
она состоит из различных окислов железа. Есть рреди них низ-
шие и высшие окислы. Защитное действие оказывает только
закись железа, которая плотно прилегает к поверхности ме-
талла. Трехокись и закись железа очень пористы, изборож-
дены трещинами и легко пропускают к металлу кислород из
воздуха.
Но не все окисные пленки одинаково хорошо защищают
металлы от разрушения. Прочность пленок зависит от хими-
ческой активности металлов и от их внутреннего строения.
Такие металлы, как калий, натрий, литий очень быстро окис-
ляются на воздухе. Буквально на глазах блестящая поверх-
ность металла тускнеет и становится матовой. Кроме окисла
металла, в составе пленки, покрывающей поверхность этих
металлов, присутствует продукт взаимодействия металла
с углекислотой, всегда содержащейся в небольшом количестве
в воздухе.
Эта пленка не предохраняет ни литий, ни калий, ни натрий
от разрушения, потому обычно эти металлы хранят в ке-
росине.
Защитные пленки на поверхности металлов могут образо-
ваться и без участия кислорода воздуха. Если стальную или
железную пластинку опустить в крепкую азотную кислоту, то
на поверхности металла появится окисная пленка, и металл не
будет разрушаться. Азотная кислота — сильный окислитель,
потому она и создает на металле тончайшую прочную пленку.
Сильные окислители, поражая металл тяжелым недугом —
коррозией, одновременно создают против нее надежное лекар-
ство — прочную окисную пленку.
1 Если нагреть стальную полоску до температуры в 250—300 градусовг
то ее поверхность расцветится всеми цветами радуги. Появление «цветов
побежалости», как называют это явление, не связано с окраской пленки,
а зависит от лучепреломления света. Часть лучей падающего на металл
света отражается от поверхности пленки, а часть проходит через нее и от-
ражается от поверхности металла. Поскольку толщина пленки находится
в определенном соотношении к длине волны падающего луча света, то
оба отраженные луча уничтожают друг друга. Поэтому часть лучей опре-
деленного цвета из пучка «белого» цвета будет сильно ослаблена, а пленка
в отраженном свете покажется нам ярко окрашенной в тот или иной до-
полнительный цвет. Чем толще станет пленка, тем резче будут изменяться
цвета — от желтого до серо-зеленого.
— 183 —
Защитные пленки на металле надежно предохраняют его
при невысоких температурах. При повышении температуры
скорость окисления большинства металлов заметно увеличи-
вается. При температуре свыше 800 градусов скорость корро-
зии резко возрастает. Кислород, углекислый газ энергично
«атакуют» поверхность металла. Особенно сильно разрушает
в этих условиях металлы сернистый газ.
В наш век появилось много машин в разных областях тех-
ники, которые работают при температурах от 500 до 1500 гра-
дусов.
Так например, клапаны у автомобильных и авиационных
моторов работают при температурах 800—900 градусов. Вы-
хлопные газы энергично окисляют металл в этих условиях.
Некоторые детали химических аппаратов подвергаются дав-
лению в тысячу атмосфер и более при температуре в несколь-
ко сот градусов.
При высоких температурах (до 1300 градусов) обычно про-
водится горячая обработка металла — ковка, прокатка, штам-
повка. Поверхность металла соприкасается с воздухом или
с газами, образующимися в печи при сгорании топлива, и бы-
стро разрушается под действием газовой коррозии.
Коварные враги металлов — химическая и газовая корро-
зия— наносят большой ущерб народному хозяйству и, в пер-
вую очередь, машиностроительной промышленности.
Но еще более грозным врагом является так называемая
электрохимическая коррозия.
Если в стакан с серной кислотой погрузить цинковую и
медную пластинки и соединить их проволокой, то получится
источник электрического тока — гальванический элемент.
Цинк, вступая в реакцию с серной кислотой, вытесняет поло-
жительные ионы водорода, которые оседают на медной пла-
стинке. Медная пластинка заряжается положительно. Если
теперь соединить эти два электрода проводником, то по нему
потечет ток.
В 1800 г. итальянским физиком и химиком Алессандро
Вольта был впервые создан прибор, в котором химическая
энергия окислительно-восстановительной реакции превраща-
лась в электрическую. По фамилии изобретателя его назвали
Вольтовым столбом. Он состоял из большого числа цинковых
и медных дисков, разделенных тканью пропитанной раство-
ром электролита.
— 184 —
Спустя два года русский ученый В. В. Петров построил
Вольтов столб из 2100 пар цинковых и медных кружков. С по-
мощью этого прибора он открыл электрическую дугу и впер-
вые разложил воду на кислород и водород.
На смену Вольтову столбу вскоре пришли другие источни-
ки тока — гальванические элементы. Первый такой прибор для
превращения химической энергии в электрическую состоял из
цинковой и медной пластинок, погруженных в раствор серной
кислоты. Позднее появился медно-цинковый элемент, в кото-
ром цинковый электрод погружен в раствор сернокислого
цинка, а медный электрод в раствор сернокислой меди. Он
был одновременно предложен русским ученым Б. С. Якоби
и французским физиком Даниэлем.
Можно построить гальванический элемент, в котором
электродами будут другие разнородные металлические пла-
стинки.
Если через гальванический элемент пропустить электриче-
ский ток, то реакции пойдут в обратном направлении, т. е.
электрическая энергия превратится в химическую.
Это наблюдение позволило создать приборы, которые на-
капливают электрическую энергию и могут расходовать ее по
мере надобности. Их называют аккумуляторами (от латинско-
го слова аккумулятор — собиратель). Наиболее широкое при-
менение в технике имеет свинцовый аккумулятор.
Он состоит из двух или ========
нескольких решетчатых свин- Схема действия гальванического
цовых пластин, заполненных
тестом из окиси свинца.
Пластины погружены в 25—30-про-
центный раствор серной кислоты.
Окись свинца постепенно раство-
ряется в кислоте и превращается
в сернокислый свинец.
Когда включают аккумуля-
тор в цепь постоянного тока,
то на аноде сернокислый сви-
нец превращется в двуокись
свинца, т. е. окисляется, отда-
вая два электрона ионам свин-
ца на катоде, которые восста-
навливаются в металлический
свинец. Теперь аккумулятор
заряжен.
Если замкнуть цепь заря-
женного
будет давать ток и разряжать-
элемента
ПОТОК ЭЛЕКТРОНОВ
2 SO
Zn*2
Zn+2
so;2
аккумулятора, то он
Свинцовый аккумулятор (схема)
ся. При разрядке акку-
мулятора окислительно-
восстановительные реак-
ции будут протекать
в обратном направлении.
На катоде, который стал
теперь отрицательным
электродом, свинец отда-
ет электроны — окисляет-
ся, а на аноде, превратив-
шемся в положительный
электрод, свинец присое-
диняет электроны — вос-
станавливается.
Напряжение свинцового аккумулятора около двух вольт.
По мере превращения двуокиси свинца в сернокислый свинец
напряжение падает. Когда процесс восстановления закончит-
ся, аккумулятор разрядится и его нужно заряжать снова.
Большое распространение за последние годы получили
в народном хозяйстве и железо-никелевые аккумуляторы. Од-
ним электродом в них служит железная пластина, вторым —
металлическая пластина, покрытая слоем трехоки-си никеля.
В качестве электролита применяется 23-процентный раствор
едкого калия или гидрата окиси лития. Электродвижущая
•сила этого аккумулятора не превышает 1,35 вольта.
В послевоенные годы применение аккумуляторов в технике
значительно расширилось. Их можно встретить на самолетах
и на теплоходах, в вагонах электропоездов и на подводных
лодках. Без них не обходятся при монтаже небольших радио-
станций, установке телеграфных аппаратов, пуске в ход двига-
телей внутреннего сгорания.
Большинство металлических изделий во время своей служ-
бы в той или иной степени соприкасается с водными раствора-
ми кислот, солей и щелочей. А как известно, тдкие растворы,
называемые электролитами, способны проводить электриче-
ский ток.
Такое соседство не сулит ничего хорошего металлам, а
иногда оно заканчивается трагически. Газовые и водопровод-
ные металлические трубы перед укладкой в траншею тщатель-
но покрывают специальными смолами и обертывают бумагой,
иначе они быстро придут в негодность во влажной почве. Мно-
— 186 —
гие металлы сравнительно быстро разрушаются даже в воз-
духе, насыщенном влагой. Еще быстрее протекает коррозия
металлов, если воздух загрязнен пылью, примесями серы,
углерода.
Изучая коррозию металлов в электролитах, ученые замети-
ли, что она непохожа на обычное химическое окисление. Элек-
трохимическая коррозия больше напоминает работу гальвани-
ческих элементов.
Более ста лет назад швейцарский химик Де-ля-Рив, кото-
рый занимался изучением различных гальванических элемен-
тов, обратил внимание на то, что разные сорта цинка раство-
ряются в серной кислоте с неодинаковой скоростью. Чем боль-
ше цинк содержит примесей других металлов — меди, железа,
свинца, — тем быстрее идет растворение. Чистый же цинк
может довольно долго находиться в концентрированной сер-
ной кислоте, не растворяясь.
Одновременно ученый сделал и другое важное наблюдение.
Пузырьки водорода выделяются неравномерно на поверхно-
сти цинковой пластинки. В одних местах их больше, в дру-
гих— меньше. Де-ля-Рив сделал предположение, что поверх-
ность цинка состоит из множества мельчайших гальваниче-
ских элементов, коротко замкнутых через металл. Катодом
служат примеси, а анодом — сам цинк.
Швейцарский ученый не ограничился лишь высказывани-
ем гипотезы. Как всякий настоящий ученый, он прекрасно
знал, что теория, не подтвержденная опытом, остается мерт-
ворожденной. Для того чтобы убедиться в справедливости
своих выводов, он приготовил небольшие полоски, вырезан-
ные из чистого цинка и загрязненного различными примесями
(оловом, свинцом, медью, железом), и опускал их в сосуды
с серной кислотой. Оказалось, что примеси не только ускоряют
коррозию металла, но и действуют на металл по-разному, од-
ни меньше усиливают коррозию, другие — больше.
В то время идеи Де-ля-Рива не получили признания. Про-
шли десятилетия, возникла и развилась наука о металлах.
Электрохимия завоевала прочные позиции в науке и технике.
Вот тогда-то вспомнили об опытах и выводах швейцарского
химика.
Тоерия электрохимической коррозии получила широкое
признание. Она позволила объяснить поведение металлов
в электролитах и выяснить причины их разрушения.
Теперь уже общепризнано, что коррозия металлов в элек-
тролитах возникает в результате работы множества микроско-
пических гальванических элементов.
Чем больше у металла примесей, тем больше образуется
мельчайших гальванических элементов. Потому чистый цинк
— 187 —
растворяется в кислоте медленнее, чем загрязненный примеся-
ми металл.
Замечено, что и загрязненный цинк сначала растворяется
медленно, но потом постепенно скорость растворения увели-
чивается.
Объяснение этому явлению дает теория электрохимической
коррозии.
Когда цинк начинает растворяться, то на его поверхности
имеется сравнительно немного частиц посторонних металлов,
поскольку часть примесей заключена в толще цинковой пла-
стинки и еще не соприкасается с кислотой. Однако постепен-
но кислота все больше разъедает цинк, и на поверхность ме-
талла поднимаются из толщи все новые и новые частицы при-
месей. Увеличивается количество микрокатодов, все больше
образуется гальванических элементов и все быстрее идет раст-
ворение цинка, который служит анодом.
Пройдет некоторый промежуток времени и на поверхности
металла появится довольно толстый, рыхлый слой примесей.
Металловеды называют его «губкой». К этому моменту ско-
рость растворения достигает своего высшего предела и далее
уже не изменяется. Возьмем стеклянную палочку и осторож-
но отделим «губку» от поверхности металла. Немедленно со-
кратится число пузырьков водорода, выделяющихся из кис-
лоты на поверхности растворяемого цинка. А это знайит, что
уменьшается и скорость коррозии.
Если же снятый стеклянной палочкой кусок «губки» соеди-
нить с поверхностью погруженного в кислоту металла, ско-
рость коррозии снова возрастет. На «губке» будет обильна
выделяться водород.
«Губка» в данном случае играет роль катода. Она состоит
из тысяч мельчайших частиц примесей, представляющих со-
бой микрокатоды.
Гипотеза Де-ля-Рива о микрокатодах прекрасно объясняет
растворение и других металлов в кислотах, кроме цинка.
Электрохимическая коррозия зависит во многом и от
структуры самого металла.
Если разломить па две части алюминиевый или стальной
прутик, то в месте излома явственно видны мельчайшие зер-
нышки. Металл в твердом состоянии — кристаллическое тело.
Атомы металла, как и многих других веществ, имеющих кри-
сталлическое строение (серы, углерода, фосфора), распола-
гаются в определенном порядке в пространственной решетке.
Металл состоит из огромного числа мельчайших кристалли-
ков, называемых кристаллитами.
Однако кристаллики, образующиеся при выплавке метал-
лов, совсем неодинаковы с «идеальным» кристаллом. Отдель-
— 188 —
ные участки пространственной решетки могут быть деформи-
рованы, искажены. Некоторые узлы кристаллической решетки
пусты, в них нет атомов металла. В решетке можно обнару-
жить трещины, поры включения газа, примеси различных ве-
ществ — металлов и неметаллов.
Рассматривая под микроскопом тонкую стружку, снятую
с поверхности металла (шлиф), можно заметить, что грани
кристаллитов сильно искажены, а границы между кристалли-
тами неправильны. Пространственная решетка на границе
между кристаллитами теряет свой нормальный облик. Здесь
чаще всего скапливаются примеси, заключенные в металле.
Они служат микрокатодами. Между гранью и ребром кристал-
ла возникает гальванический элемент и на пограничных
участках между кристаллитами выделяются пузырьки во-
дорода.
Это нетрудно доказать весьма простым опытом. Возьмем
стальную пластинку, тщательно отшлифуем и отполируем ее.
Затем смочим азотной кислотой со спиртом, чтобы снять окис-
ную пленку. Подготовленную таким образом пластинку опу-
стим в стакан с серной кислотой. Если пластинку, покрытую
кислотой, рассмотреть под микроскопом, то можно увидеть
на ней пятна, окруженные темным кольцом. Это пузырьки
водорода.
Виновниками электрохимической коррозии не всегда бы-
вают только мельчайшие гальванические элементы, возникаю-
щие на поверхности металла. Во многих случаях металл раз-
рушается в результате работы весьма крупных гальваниче-
ских элементов, которые образуются в разных металлических
изделиях.
Иногда при сборке металлических конструкций, листы
скрепляют болтами или заклепками, изготовленными из дру-
гого металла. На одном заводе изготовили для заводской сто-
ловой несколько алюминиевых баков для питьевой воды на
медных заклепках. Как известно, алюминий при соприкосно-
вении с водой не ржавеет и алюминиевая посуда служит
очень долго. А в этих баках вскоре алюминий стал разрушать-
ся. Алюминиевые листы стали анодами, а медные заклепки —
катодами.
При проектировании морских и речных судов, при построй-
ке мостов и крупных металлических сооружений конструкто-
ры и инженеры должны всегда считаться с возможностью об-
разования гальванических пар из некоторых металлов. Ни
в коем случае не следует допускать соприкосновение алюминия
с медными сплавами или нержавеющими и специальными
сталями, содержащими примеси хрома, ванадия, молибдена.
Нежелательно и соседство стальных изделий и деталей
— 189 —
с медными и никелевыми сплавами, с серебром, золотом,
платиной.
Невыполнение этих условий иногда может привести к ро-
ковым последствиям. Незадолго до первой мировой войны
жители Петербурга, гуляя по набережной Невы, не раз лю-
бовались красавицей яхтой. Надводная часть ее ярко сверка-
ла позолотой. На носу красовалась выведенная крупными зо-
лотыми буквами надпись «Штандарт».
Для того чтобы яхта была красивой, обшивку ее сделали
из медных, позолоченных листов, а чтобы сделать ее корпус
более прочным, подводную часть изготовили из стали.
Вскоре «Штандарт» ушла в заграничное плавание. Много
морей и океанов прошла красавица яхта. По возвращении
в Петербург был сделан осмотр киля яхты и обнаружены боль-
шие разрушения. Железные и медные листы образовали мощ-
ный гальванический элемент, электролитом для работы кото-
рого служила морская вода.
Когда медь находится в воде в соседстве с алюминием, то
атомы алюминия, растворяясь, отдают свои электроны ионам
водорода (вода в незначительной степени распадается на ионы
водорода и гидроксильные ионы) и восстанавливают их в мо-
лекулы свободного водорода. Положительно заряженные
ионы алюминия соединяются с гидроксильными ионами, ко-
торые заряжены отрицательно, образуя молекулы гидрооки-
си алюминия.
Гораздо сложнее происходит коррозия железа в соседстве
с медью или другим менее активным металлом.
Железо посылает в раствор двухвалентные ионы. Они сое-
диняются с гидроксильными ионами в гидроокись закиси же-
леза (зеленого цвета), которая кислородом воздуха в присут-
ствии воды окисляется в ржавчину — гидроокись трехвалент-
ного железа (бурого цвета).
Когда при разрушении металла выделяются пузырьки во-
дорода, такой процесс называется коррозией с выделением
водорода. Она чаще всего наблюдается при растворении ме-
талла в кислотах.
Если при взаимодействии металла с электролитом по-
глощается кислород, то это явление называется коррозией
с поглощением кислорода. Чаще всего такая коррозия встре-
чается при нахождении металлов в воде, насыщенной кисло-
родом.
В первом случае скорость коррозии зависит от быстроты
разряжения ионов водорода на микрокатодах и выделения
пузырьков газа, а во втором — от скорости проникновения
кислорода воздуха через толщу электролита к катодным уча-
сткам металла.
— 190 —
Металлы и металлические изделия, применяемые в быту
и технике, чаще всего «работают» не в воде и не в растворах
электролитов, а на воздухе. Паровозы, железнодорожные ва-
гоны, мосты, рельсы, крыши домов и общественных зданий —
непрерывно соприкасаются с воздухом. В атмосферных усло-
виях эксплуатируются многие станки и машины, телефонно-
телеграфные линии, провода высоковольтных передач.
Воздух в той или иной степени всегда насыщен водяными
парами. В сухом климате их меньше, во влажном — гораздо-
больше. Особенно высока влажность воздуха на побережьях
морей и океанов.
Когда температура воздуха понижается, мельчайшие ка-
пельки влаги выделяются, образуя туман.
Туман своим влажным покрывалом накрывает деревья,
стены зданий, электрические провода. Капельки влаги осаж-
даются на поверхности разнообразных металлических изде-
лий, они постепенно растекаются по гладкой поверхности
металла. Металл, покрытый нежной водной пленкой, стано-
вится влажным. Влага служит электролитом, и микрогальва-
нические элементы энергично принимаются за работу. На
поверхности металла сначала появляются пятна, затем язвоч-
ки. Электрохимическая коррозия шаг за шагом разрушает
металл.
Еще быстрее расправляется с металлом атмосферная кор-
розия в больших городах и промышленных районах, где
в воздухе содержатся примеси различных вредных газов: угле*
кислоты, окислов азота, двуокиси серы. Молекулы этих газов,
растворяясь в капельках влаги, образуют кислоты, которые
оседают на поверхности металла и усиливают коррозию.
Особенно жестоким врагом металла является сернистый
газ. Его можно всегда обнаружить в дыме заводских труб,
если топливом служит каменный уголь. Сера, загрязняющая
каменный уголь, окисляется при горении кислородом, образуя
сернистый газ. В воздухе сернистый газ окисляется и, раство-
ряясь в воде, «рождает» серную кислоту.
Если воздух загрязнен пылью, то частицы пыли, оседая на
поверхности металла, жадно притягивают к себе влагу, обра-
зуя тонкий слой электролита. Союзники коррозии — дождь,
снег, резкие перемены температуры. Сильный дождь может
растворить или даже смыть защитную окисную пленку на по-
верхности металла. А если мороз сменяется теплом, то за-
щитная пленка может растрескаться и будет отваливаться
кусками.
— 191 —
Подсчитано, что больше всего металла выходит из строя
из-за атмосферной коррозии. Она атакует металлы в любом
состоянии и в любом месте — на открытом воздухе, в закры-
тых помещениях, в деталях машин и станков.
Современная техника пользуется металлическими конст-
рукциями и изделиями не только на земле, на воде и в возду-
хе, но часто и под землей.
Водопроводные и канализационные трубы, нефте- и газо-
прО!воды, электрические кабели и телеграфно-телефонные ча-
сти изготовляют из металла и прокладывают глубоко под
землей.
Почва — не однородное вещество. Она имеет сложный хи-
мический состав — есть в ней минералы и соли, имеются и
различные органические соединения. Почвенные воды всегда
содержат примеси солей, растворенные кислоты и газы. Со-
седство металла с почвенными водами, которые являются
электролитами, приводит к электрохимической коррозии.
Для того чтобы спасти металлические трубы и кабели
в земле от разрушения, их покрывают довольно толстым слоем
смолы или асфальта, преграждающего влаге доступ к по-
верхности металла.
Но не всегда такая изоляция надежно предохраняет ме-
таллические изделия от разрушения. В больших городах под-
земные кабели и трубопроводы часто разрушаются блужда-
ющими токами, которые попадают в почву.
Каким же образом электрический ток проникает под зем-
лю? Источниками блуждающих токов служат установки,
которые пользуются постоянным током,— трамвайные электро-
станции, электролизные ванны, электросварочные аппараты.
Когда трамвай движется по рельсам, то постоянный ток
по воздушному проводу поступает в мотор вагона и через
колеса уходит в рельсы, которые служат как бы обратным
проводом. Обычно трамвайные рельсы недостаточно хорошо
изолированы от земли.
Потому часть тока по-
падает в почву и на-
чинает «блуждать».
Встречая на своем пу-
ти металлические пред-
меты, электрический
ток потечет по ним,
как по проводникам.
Если неподалеку от
трамвайных рельсов
проложена водопро-
водная или канализационная железная труба, то блуждающий
ток медленно устремляется к ней. На трубе появляются катод-
ная и анодная зоны. Первая, через которую электрический
ток переходит из почвы на трубу, — не подвергается кор-
розии, зато вторая быстро разрушается. На трубе появляются
глубокие язвы и трещины. Вычислено, что ток силой в 1 ампер
может разрушить в течение года около 9 килограммов железа,
11 килограммов меди, свыше 30 килограммов свинца.
По закону Фарадея, зная силу блуждающего тока, можно
легко подсчитать, сколько металла разрушается в резуль-
тате электрохимической коррозии в любой промежуток вре-
мени.
Разрушения, причиняемые металлу коррозией, будут тем
больше, чем выше сила блуждающего тока. В крупных горо-
дах она достигает иногда нескольких сот ампер. Иногда блуж-
дающие токи из почвы возвращаются на рельсы трамвая или
электрической железной дороги и разрушают их.
Блуждающие токи зачастую наносят городскому хозяй-
ству большой ущерб и нередко приводят к тяжелым ката-
строфам. Бывали случаи, когда струя таза, вырвавшись из
поврежденного коррозией газопровода, воспламенялась, вызы-
вая большой пожар. Потому борьба с этим врагом металлов
имеет огромное значение.
Для того чтобы блуждающие токи не уходили бы с рель-
сов в почву, под шпалы подкладывают слой щебня или како-
го-либо другого материала, который плохо проводит электри-
ческий ток.
Рельсы электрических железных дорог теперь сваривают,
это улучшает их проводимость и препятствует ответвлению
тока.
Для защиты трубопроводов, прокладываемых в земле, от
вредного действия блуждающих токов их покрывают биту-
мами, причем тщательно следят за тем, чтобы в покрытии не
было бы ни пор, ни трещин. Ток, проникая через поры и тре-
щины, будет особенно сильно разрушать металл в этих ме-
стах, и труба быстро придет в негодность.
Надежным средством защиты металлических сооружений
под землей от атак блуждающего тока служит так называе-
мый электродренаж. Трубы, кабели, металлические конст-
рукции соединяют между собой проводниками и ток отводят
14 Б Я- Розен
— 193 —
по специальному проводу на отрицательный полюс электро-
станции.
Разрабатывая способы защиты металлов от коррозии под
землей, ученые и инженеры не забывают о врагах металли-
ческих изделий на земле, в воздухе и в воде.
Еще в глубокой древности люди научились наносить на
поверхность металлов тонкие золотые и серебряные пленки,
покрывать металлические изделия лаком и красками, предо-
храняющими их от разрушения.
За триста лет до нашей эры в Египте пользовались раст-
ворами смолы в спирте и в растительных маслах для защи-
ты меди и бронзы от «атак» воздуха и влаги.
Широкое применение металлов в нашу эпоху потребовало
и новых методов борьбы с их врагами. Ведь часто станкам
и машинам, котлам и различным аппаратам приходится ра-
ботать при повышенной влажности воздуха, высокой темпера-
туре, в соседстве с вредными газами и жидкостями.
Несколько десятков лет назад на одном из заводов при
осмотре стенок парового котла были обнаружены небольшие
язвочки. Доискиваясь причины повреждений стенок котла,
прежде всего сделали анализ воды. В ней оказался раство-
ренный кислород. Виновник коррозии был найден. Для того
чтобы его обезвредить, воду стали пропускать через слой же-
лезных стружек. Кислород окислял железные стружки, и кот-
лы стали работать гораздо дольше.
Но в воде все же оставалось немного кислорода. Чтобы
окончательно избавиться от этого злейшего врага металлов,
придумали специальные аппараты — деаэраторы. Внутри ап-
парата имеется множество трубок, по которым проходит пар.
Вода, пропускаемая через деаэратор, омывает трубки и нагре-
вается. Как известно, растворимость газов в воде при повы-
шении температуры уменьшается. Поэтому растворенный в во-
де кислород при нагревании выделяется. Из аппарата он отса-
сывается с помощью специального приспособления.
Железо и железные изделия хорошо растворяются в ра-
створах серной и соляной кислот. Для защиты химической
аппаратуры, соприкасающейся с кислотами, пользуются
свинцовыми покрытиями. На железе образуется прочная плен-
ка сернокислого свинца, надежно предохраняющая металл от
дальнейшего разрушения. Защитить металл от вреднего дей-
ствия кислот можно и другим путем. Изучая поведение метал-
лов в разных кислотах, ученые заметили, что если в кислоту
внести ничтожное количество некоторых особых веществ, на-
зываемых ингибиторами (от латинского слова ингибире—
тормозить), то растворение металлов замедляется в сотни раз.
Ингибиторы приготовляют из некоторых веществ, которые
— 194 —
входят в состав многих растений, — чистотела, тысячелистни-
ка, мака. Ингибиторами могут служить также вытяжки из
веток и листьев березы, сосны, картофельной ботвы.
Однако практика показала, что растительные ингибиторы
имеют много недостатков — малоэффективны, неудобны
в применении. Поэтому советские и зарубежные ученые созда-
ли ряд сильнодействующих искусственных ингибиторов.
Соляную кислоту обычно перевозят в стеклянных бутылях,
вставленных в плетеные корзинки. При доставке заказчикам
крупных количеств заводы иногда пользуются стальными ци-
стернами, выложенными изнутри тонкими листами натураль-
кого каучука.
Как-то в 1942 г. нужно было срочно доставить из Подмос-
ковья в Ишимбаево цистерну с соляной кислотой.
Цистерн с каучуковым покрытием в тот момент у завода
не было. Заводские инженеры решили залить кислоту в обык-
новенную железную цистерну, в которых перевозят нефть, ке-
росин, бензин, добавив
туда немного «унико-
ла» —нового советско-
го ингибитора.
Железнодорожники
Схема деаэратора — аппарата для уда-
ления из воды растворенного кислорода
с
враг
Если
то не
местной
станции, узнав о решении заводских
работников, пришли в ужас. Ведь
соляная кислота — злейший
металлических сооружений,
кислота попадет на рельсы,
миновать аварии. Известны случаи,
когда из-за неосторожной перевоз-
ки соляной кислоты разрушались
железнодорожные рельсы и проис-
ходили крушения поездов.
Дирекция завода убеждала же-
лезнодорожников в полной безопас-
ности отправки кислоты с ингиба-
тором, но они не соглашались от-
править цистерну. Наконец была
создана комиссия, под наблюдени-
ем которой злополучная цистерна
тронулась в свой далекий рейс.
Страхи железнодорожников оказа-
лись напрасными. Ни длительная
тряска, ни резкие толчки, ни дол-
гое стояние на солнцепеках — ничто
не отразилось на необычной путе-
шественнице. Цистерна с кислотой
К КОТАЧ
34*
— 195 —
прибыла на место назначения в полном порядке. Ингибиторы
с честью выдержали испытание. С тех пор кислоту стали
перевозить в обычных железнодорожных цистернах.
Замедляя действие кислоты на металл, ингибиторы не из-
меняют ее свойств. До сих пор еще точно неизвестно, в чем
заключается чудодейственная сила ингибиторов. Ученые по-
лагают, что ингибиторы вступают с металлом в химическую
реакцию и образуют на его поверхности защитные пленки.
С давних пор для снятия ржавчины с поверхности метал-
ла или очистки ее от окалины пользуются кислотами — чаще
серной, реже соляной. Сущность происходящих при этом про-
цессов заключается в том, что окислы металла растворяются
в кислоте. Такая очистка металлов называется травлением.
Одновременно с окалиной и ржавчиной растворяется и металл.
Если же к раствору кислоты добавить немного ингибитора,
то потерь металла не будет, так как растворяются только
окислы металлов.
В 1942 г. группой советских ученых были созданы новые,
весьма эффективные ингибиторы, которые замедляют раство-
рение в кислотах не только железа и стали, но и некоторых
цветных металлов — цинка, олова, свинца.
Заслуженным успехом пользуются у наших производст-
венников ингибиторы «ЧМ» для травления в серной кислоте и
«ПБ» — для травления в соляной кислоте. Добавка «ЧМ»
к травильной кислоте уменьшает почти в два раза расход кис-
лоты и снижает потери металла.
Применение этих ингибиторов при травлении позволяет
почти в четыре раза снизить стоимость снятия окалины.
Ингибиторами пользуются в современной технике также
для защиты металлов от ржавления на воздухе. Такие инги-
биторы называются атмосферными или летучими ингибито-
рами. Чаще всего это сложные органические вещества, в мо-
лекулах которых имеется амидная группа (группа, состоящая
из атома азота и двух атомов водорода).
У летучих ингибиторов есть одна особенность. Одни из них
защищают от коррозии только черные металлы, а другие —
только цветные металлы. Все летучие ингибиторы хорошо
растворяются в воде. Если бы летучие ингибиторы были бы
нерастворимы в воде, то они не смогли бы защитить поверх-
ность металла от коррозии. Растворяясь в тонкой пленке влаги,
которой всегда покрыты металлы, ингибитор создает защит-
ный слой, который, как броня предохраняет поверхность ме-
талла от дальнейшего разрушения.
Однако «броня», создаваемая летучим ингибитором, обере-
гает металл лишь до тех пор, пока его поверхность соприка-
сается с ингибитором.
— 196 —
Если стальные изделия — ножницы, ножи, иголки — обра-
ботать ингибиторами, а затем поместить в атмосферу с вы-»
сокой влажностью, то они начинают постепенно ржаветь,
правда коррозия протекает медленнее, чем у необработан-^
ных стальных изделий.
Современная техника предоставляет нам много различ-
ных способов защиты металла от коррозии. Детали точных
приборов, части некоторых машин и станков, дула винтовок
и автоматов часто защищают от ржавления оксидированием —
нанесением искусственной окисной пленки. Защитное покры-
тие на стали состоит преимущественно из окиси железа и при-
дает изделиям красивый черный или синий оттенок. За сход-
ство окраски окисных пленок с «вороньим крылом»
оксидирование стали называют в технике воронением.
Искусственные окисные пленки на алюминии или магнии
получаются серебристого цвета и обладают исключительной
твердостью.
Оксидирование стальных изделий производится погруже-
нием их в специальный раствор. Обычно его готовят из смеси
едкого натра и азотнокислых солей калия или натрия. Воро-
ненную сталь получают и иначе— 10—20 минут выдерживают
в печи, нагретой до 300—450 градусов.
Алюминиевые детали помещают на 10—30 минут в горя-
чий раствор, приготовленный из смеси соды, бихромата натрия
или калия и едкой щелочи. Чаще для оксидирования алюми-
ния и его сплавов пользуются 20-процентным раствором сер-
ной кислоты, через который пропускают электрический ток
На поверхности алюминия, который служит анодом, выде-
ляется кислород. Он реагирует с металлом, образуя защитную
окисную пленку.
Еще надежнее предохраняет металл от его врагов защит-
ная пленка, образуемая фосфорнокислыми солями железа и
марганца. Фосфатирование чаще всего применяется для за-
щиты стальных и чугунных изделий. Фосфатную пленку мож-
но сделать еще устойчивее против коррозии, если ее прома-
зать маслом или лаком. Фосфатирование несложно, обходит-
ся дешево, потому и получило широкое распространение
в разных отраслях промышленности.
Для защиты железа, меди, стали от разрушения широко
пользуются металлическими покрытиями. Много сотен лет на-
зад уже было известно лужение посуды — железные и медные
— 197 —
валики
олово
Схема устройства лудильной машины
кастрюли покрывали тонким слоем олова. До
сих пор половина всего добываемого в мире
олова расходуется на приго-
товление белой жести — лу-
женого железа.
Немало идет и цинка на
оцинкование кровельного
железа и различных пред-
метов домашнего
да — тазов, ванночек, ведер,
корыт.
При лужении и цинко-
вании изделия опускаются
в ванны, наполненные рас-
плавленным металлом. Ино-
гда пользуются специальны-
ми лудильными или цин-
горячем методе нанесения ме-
МАСЛО -
обихо-
ковальными аппаратами. При
таллических покрытий расходуется много лишнего металла
и не удается получить тонкую, ровную пленку.
Поэтому теперь чаще металлические защитные слои полу-
чают гальваническим путем. Изделие помещают в электро-
лизную ванну. Электролитом служит соль металла, которым
желают защитить изделие. В ванну вставляют анод — пла-
стинку того же металла и пропускают электрический ток. На
поверхности защищаемого изделия, которое является като-
дом, осаждается тончайшая металлическая пленка. Она очень
прочно сцепляется с металлом, не имеет пор, долговечна.
Для покрытий гальваническим способом применяются
различные металлы: хром, никель, кадмий, цинк, олово. Галь-
ванические покрытия экономят металл и придают защищае-
мому изделию красивый внеш-
ний вид. Иногда покрытия
наносят распылением
плавленного металла,
ще всего этим методом поль-
зуются для создания покрытий
из алюминия, цинка, меди.
В некоторых случаях для
борьбы с коррозией применя-
ют протекторы (от латинского
слова протекторе — защищать)
листы или пластины ка-
кого-нибудь активного
металла, чаще всего цин-
ка. Например, в паровые
рас-
Ча-
Схема установки для гальва-
нического покрытия
«X» J
— 198 —
котлы вводят цинковые пластники, которые образуют со стен-
ками котла гальваническую пару. Пока цинк, который является
здесь анодом, весь не растворится, медные стенки не будут раз-
рушаться. Точно так же защищают от коррозии бронзовые греб-
ные винты морских судов. Надежным методом защиты ме-
таллов от коррозии, как и много сотен лет назад, «служат
различные лаки и краски. Нанесение лакокрасочных покры-
тий на поверхность металла гораздо проще и дешевле метал-
лических. Потому не менее восьмидесяти процентов всех ме-
таллических изделий покрывают лаками и красками. В на-
стоящее время имеется несколько тысяч разных лаков
и красок, которыми пользуются для защиты от коррозии. Чаще
всего применяются масляные краски. Их готовят на олифе,
а олифу варят из льняного масла.
Свежее льняное масло представляет янтарного цвета жид-
кость, в состав которой входят молекулы разных веществ —
жирных кислот, белков.
Важнейшей составной частью этой смеси является лино-
левая кислота. В молекуле этой кислоты имеется 31 атом во-
дорода и 17 атомов углерода. Однако не все соседние атомы
углерода соединены между собой одной связью.
Линолевая кислота, подобно многим другим ненасыщен-
ным органическим соединениям, имеет две двойных связи. По-
этому она способна полимеризоваться.
Если льняное масло оставить на воздухе, то оно под дейст-
вием света и тепла начинает постепенно загустевать.
Оно окисляется кислородом воздуха и увеличивается в ве-
се. Атомы кислорода присоединяются по месту двойных
связей.
глава (^^laaaoaavaa
НА СЛУЖБЕ
ХИМИКОВ
огда говорят «масло», то невольно пред-
ставляется густая светло-желтая или ян-
тарного цвета жидкость. Если смочить ею
ткань или бумагу, то на них появятся жирные пятна. Но если
капля купоросного масла попадет на книгу или костюм, то
вместо жирных пятен в бумаге и ткани будут дырки.
И происходит это потому, что эта жидкость вовсе не мас-
ло, а серная кислота. Назвали ее так потому, что она похожа
на масло.
Впервые купоросное масло получили алхимики в XIII в.,
прокаливая железный купорос. При нагревании серно-же-
лезная соль распадалась на окись железа и серный ангид-
рид. Поглощая газ водой, получали серную кислоту. Купо-
росное масло готовили и прокаливанием квасцов.
Приготовлением серной кислоты в средние века и позд-
нее, вплоть до середины XVIII в., занимались аптекари. Ку-
поросное масло употребляли тогда главным образом в меди-
цине. С давних пор красильщики при крашении шерсти
— 200 —
пользовались квасцами в качестве протравы. Шерстяная ткань,
смоченная раствором квасцов, окрашивалась быстрее и ровнее.
К тому же некоторые очень прочные, не выгорающие на солн-
це краски вовсе не ложились на сукно без протравления
квасцами.
В пятидесятых годах XVIII в. какой-то суконщик, красив-
ший шерсть синей краской — индиго, заметил, что если эту
краску обработать купоросным маслом, то крашение идет го-
раздо быстрее.
Вскоре было сделано еще одно открытие. Оказалось, что
серная кислота может с успехом заменить кислое молоко, ко-
торое применяли тогда для подкисления отбеливаемых льня-
ных и хлопчатобумажных тканей.
Купоросное масло позволило сократить время отбелки
с трех недель до 12 часов. С тех пор текстильщики стали широ-
ко использовать серную кислоту. Прошло еще полстолетия и
купоросным маслом заинтересовались химики.
25 сентября 1791 г. французскому изобретателю Никола
Леблану был выдан патент на способ производства соды из
глауберовой соли. А спустя год задымили трубы первого со-
дового завода в Сан-Дени, близ Парижа.
Судьба самого Леблана сложилась трагически (он умер
в нищете в 1806 г.), но его изобретение привело со временем
к созданию крупного производства соды в разных странах
мира.
При изготовлении соды по способу Леблана требовалось
много серной кислоты для приготовления сульфата натрия из
поваренной соли.
Непрерывно увеличивавшийся спрос на серную кислоту со
стороны текстильных фабрик и содовых заводов требовал
создания крупного производства купоросного масла. В разных
странах EiBponbi возникают сернокислотные заводы.
Прошлый век значительно расширил области применения
серной кислоты. Ею стали пользоваться для очистки керосина
и различных продуктов перегонки нефти, применять в произ-
водстве других кислот — соляной, уксусной, фосфорной. Она
понадобилась для производства взрывчатых веществ и кра-
сок, эфира и растворителей. Нужна она и металлургам в про-
изводстве магния, алюминия, ртути. Большие количества сер-
ной кислоты потребляют теперь и заводы удобрений.
Сырьем для получения серной кислоты в наше время слу-
жит не железный купорос и не квасцы, а серный колчедан,
в котором содержится минерал пирит и примеси сернистых ме-
таллов— меди, цинка, свинца, мышьяка, сурьмы.
Серный колчедан дробят на небольшие куски, которые по-
мещают в специальные обжигательные печи. Это огромные
13 Б. Я. Розен
— 201 —
стальные цилиндры, высо-
той с двухэтажный дом, вы-
ложенные изнутри огне-
упорным кирпичом. Обжиг
производится при темпера-
туре 700—800 градусов и
продолжается несколько
часов.
Кислород воздуха окис-
ляет железо в окись, а се-
ру — в двуокись — сер-
нистый газ. Окись железа,
которую на сернокислотных
заводах называют «огарок»,
ссыпается через нижнее от-
Получение серного ангидрида из сер- верстие в печи В вагонетку,
нистого газа и кислорода (схема) а сернистый газ направляет-
ся в специальные аппараты
циклоны для очистки от пыли. Очищенный газ окисляют
кислородом воздуха в серный ангидрид в большом желез-
ном цилиндре с несколькими решетчатыми полками — кон-
тактном аппарате. На полках насыпан слой катализатора —
пятиокиси ванадия, нанесенной на крупинки обезвоженной и
высушенной кремнекислоты (силикагеля).
На поверхности катализатора протекает ряд химических
реакций. Частички катализатора привлекают к себе молеку-
лы сернистого газа и кислорода. Сначала пятиокись ванадия
отдает один из своих атомов кислорода молекуле сернистого
ангидрида, превращая его в серный ангидрид. Обедневшая
кислородом молекула соединяется с другой молекулой дву-
окиси серы и временно образует новое соединение. Оно вскоре
разрушается, отщепляя серный ангидрид. Так происходит все
время, пока через контактный аппарат проходит струя серни-
стого газа. Катализатор непрерывно переносит кислород из
воздуха к сернистому газу.
Серный ангидрид, выходящий из контактного аппарата,
поглощается крепкой серной кислотой. Для этой цели обычно
пользуются 96—97-процентной кислотой. Получается олеум,
т. е. серная кислота, в которой растворен избыток серного ан-
гидрида,— около 20 процентов. Олеум выгоднее готовить, чем
серную кислоту, потому что меньше расходы на перевозку
с завода к потребителям, меньше места нужно для его хране-
ния. Из олеума может быть на месте при смешивании с водой
получена серная кислота любой, нужной концентрации.
Большое распространение получил в настоящее время
другой способ получения серной кислоты из серного колчеда-
— 202 —
на — нитрозный, или башенный. Окисление сернистого газа
происходит с помощью окислов азота, которые служат здесь
переносчиками кислорода воздуха.
Сернистый газ пропускают через высокие башни, напол-
ненные кислотоупорными керамиковыми кольцами. Чаще все-
го установка состоит из пяти башен. В первых трех башнях,
называемых продукционными, осуществляется окисление га-
за, а в последних башнях — адсорберах, происходит поглоще-
ние окислов азота.
Сернистый газ, продуваемый через башни встречает на
своем пути нитрозу—раствор окислов азота в крепкой сер-
ной кислоте. Окислы азота не только растворяются в кисло-
те, но и вступают с ней во взаимодействие, образуя сложные
химические соединения — нитрозил, серную кислоту и азоти-
стую кислоту.
Будучи сильным окислителем, азотистая кислота отдает
часть своего кислорода сернистому газу. Газ превращается
в серный ангидрид, который, реагируя с водой, образует серную
кислоту. А азотистая кислота, поделившись своим кислородом
с сернистым газом, переходит в окись азота. Это вещество
в присутствии воздуха немедленно окисляется и превращается
в двуокись азота. Окислы азота, растворяясь в серной кисло-
те, снова образуют нитрозу. Так окислы азота совершают кру-
говорот, забирая кислород воздуха и передавая его сернисто-
му газу.
Потери окислов азота, которые служат катализаторами,
ничтожны. Первая установка для получения серной кислоты
по башенному способу была построена в СССР в 1927 г. на
Урале. За годы пятилеток в разных областях нашей страны
появилось много новых продукционных и адсорбционных
башен.
Серную кислоту можно получать не только из серного кол-
чедана. Еще в прошлом веке выдающийся русский химик ака-
демик Н. Н. Бекетов разработал способ получения серной кис-
лоты из гипса. Гипс нагревают в печах с углем, выделяется
сернистый газ, который нетрудно уже превратить в серный
ангидрид и серную кислоту.
Небольшие количества серной кислоты образуются в при-
родных условиях, в залежах самородной серы.
В тридцатых годах небольшая геологическая экспедиция
во главе с академиком А. Е. Ферсманом обследовала в пу-
стыне Кара-Кум в Туркмении серные бугры. Геологи собрали
большое количество различных образцов серы. Образцы за-
вернули в бумагу, на каждом образце сделали надпись с ука-
занием места и времени отбора. Затем все образцы запако-
вали в большие деревянные ящики и отправили в Ленинград.
13*
— 203 —
Каково же было удивление геологов, когда при вскрытии
ящиков в Ленинграде, у большинства образцов бумага ока-
залась изъеденной, а в некоторых ящиках доски были
прожжены. Внимательный осмотр показал, что виновником
повреждения бумаги и дерева была серная кислота.
Оказалось, что образование кислоты в серных буграх про-
исходит непрерывно. Хорошо известно, что сера легко окис-
ляется. Как же сернистый газ в пустыне превращается
в серный ангидрид? Оказалось, что недостающий атом кислоро-
рода присоединяется к молекуле сернистого газа с помощью
мелких зернышек песка, которые служат катализатором.
Успешному ходу реакции помогает и температура — ведь пе-
сок летом в Кара-Кумах накаляется на солнце до 80 градусов.
В царской России серной кислоты по сравнению с зару-
бежными странами вырабатывали ничтожно мало. В 1913 г.
производство ее составляло всего 120 тысяч тонн. В настоя-
щее время у нас производится несколько миллионов тонн сер-
ной кислоты. Она стала главным продуктом химической про-
мышленности. Не менее важным продуктом, вырабатывае-
мым на химических заводах, является и азотная кислота.
В начале нашей эры на берегах Нила, в Александрии, воз-
никло учение о превращении неблагородных металлов в золо-
то. Последователи этого учения — алхимики — в течение мно-
гих столетий в Европе безуспешно пытались получить драго-
ценный металл из свинца, олова, меди.
«Алхимия есть наука, — писал в XIII в. известный англий-
ский алхимик Роджер Бекон, — указывающая, как пригото-
вить и получить некоторое средство, эликсир, которое, бро-
шенное на металл или несовершенное вещество, делает его
совершенным в момент прикосновения».
Закрывшись в темных кельях и мрачных подвалах, окру-
жив глубокой тайной свои опыты, алхимики упорно и настой-
чиво искали чудодейственный эликсир или «философский ка-
мень», который помог бы им добиться желанной цели.
Однако все их старания были напрасны. Они не нашли
несуществующего «философского камня» и не смогли превра-
тить неблагородные металлы в золото.
Несмотря на всю ложность их учения, алхимики внесли
важный вклад в дальнейшее развитие химии. Им принадлежит
честь открытия многих солей и химических соединений, в том
числе и азотной кислоты.
— 204 —
Получали они эту кислоту из селитры. Селитру в смеси
с железным купоросом и квасцами прокаливали в небольших
глиняных горшочках, закрытых шлемом с отводной трубкой.
Кислые пары собирали в глиняных приемниках, в которых
они превращались в капли «селитряного спирта» (по латыни
спиритус нитри). С древних времен существовало поверье,
что у селитры есть «душа». По мнению алхимиков при нагре-
вании селитры ее «душа» улетучивалась в виде паров. Про-
каливая селитру в закрытых сосудах и конденсируя выделяв-
шиеся пары в приемнике, алхимики ловили «дух селитры».
Потому азотную кислоту и называли «селитряным спиртом».
Лишь в XVIII в. была наконец разгадана таинственная «душа
селитры». Изучая горение, ученые заметили, что в воздухе,
кроме кислорода, содержится еще какой-то газ. Он не под-
держивает горения, живые существа, помещенные в атмосфе-
ру этого газа, умирают. Его назвали азотом, от греческого сло-
ва «азоос» — безжизненный.
Ученые, открывшие азот, и не подозревали, что он имеет
какое-либо отношение к азотной кислоте и к селитре.
Но ведь наука не стоит на месте, а непрерывно развивает-
ся и движется вперед и постепенно срывает с тайн природы
одну завесу за другой.
Английский ученый Кавендиш задался целью исследовать
состав воздуха. Но опыты он проводил не так, как это делали
тогда другие ученые — он не сажал под стеклянный колпак
мышей, не сжигал в воздухе фосфора, серы, сурьмы. Кавен-
диш через трубку с воздухом пропустил электрический ток.
Вскоре в трубке появились какие-то бурые пары. Они были
очень похожи на пары, которые получаются при растворении
меди в азотной кислоте. Они легко растворялись в воде, обла-
дали таким же кислотным запахом.
Ученый сделал анализ состава полученной им жидкости
и к своему удивлению обнаружил, что она представляет собой
такую же кислоту, какую получают из селитры. Открытие
Кавендиша окончательно раскрыло тайну «души» селитры.
Теперь уже более никто не сомневался в том, что это и есть
азот, присутствующий и в селитре, и в азотной кислоте. С тех
пор азотную кислоту стали называть «селитряной кислотой».
В России ее называли в XVIII в. также «крепкой водкой».
Промышленное производство азотной кислоты у нас началось
в 1720 г.
К концу XVIII в. азотную кислоту стали получать, нагре-
вая смесь селитры с серной кислотой в чугунных ретортах.
В те времена «крепкую водку» применяли для разделения
серебра и золота, для приготовления оловянной протравы для
крашения тканей. Азотной кислотой широко пользовались
— 205 —
при изготовлении фармацевтических препаратов и лекарств,
в оружейном деле.
В нашу эпоху значительно расширились области примене-
ния азотной кислоты. Большие ее количества расходуются
в производстве искусственных красителей, для выработки цел-
люлозных лаков, бездымного пороха, кинопленки.
Немало «крепкой водки» требуется химикам для приготов-
ления различных солей и соединений. Без азотной кислоты не
могут теперь обойтись и в производстве удобрений. Искусст-
венные азотные удобрения пользуются заслуженным призна-
нием у земледельцев и огородников.
XX в. расширил число производств, в которых применяет-
ся азотная кислота, принес новые способы ее приготовления.
Не нужны более ни селитра, ни железный купорос, ни сер-
ная кислота. Сырьем служат газы, которые получают из воз-
духа. А что может быть дешевле воздуха?
Первый завод азотной кислоты, получаемой окислением
аммиака кислородом воздуха, был построен у нас в 1917 г.
Основоположником нового способа производства этой кислоты
был русский инженер И. И. Андреев.
Очищенный вентилятором от пыли воздух подают в боль-
шой железный цилиндр — смеситель, куда пропускают и
струю аммиака. Из смесителя газы попадают в контактный ап-
парат— два металлических конуса, скрепленные между со-
бой основаниями. В широкой части аппарата имеется несколь-
ко решетчатых полок, изготовленных из платиновых и родие-
вых проволок, которые служат катализатором. Здесь в мгно-
вение ока, в течение десятитысячных долей секунды, происхо-
дит окисление азота в окись азота, а водорода, входящего
в состав молекулы аммиака, в воду. Окись азота из контактного
аппарата поступает в стальные или гранитные поглотитель-
ные башни, которые изнутри выложены кислотоупорными
плитками. В башнях окись азота окисляется в двуокись азота
и поглощается водой, превращаясь в азотную кислоту.
Миллионы тонн азотной кислоты вырабатывают ежегодно
на химических заводах в разных странах мира.
Азотная кислота — сильный окислитель, потому она при-
меняется во многих окислительных реакциях в химических
производствах. Опустите тлеющий уголек в стакан с азотной
кислотой, он разгорится ярким пламенем и вместо сизого дыма
будут выделяться бурые пары. Уголь окислился кислородом,
— 206 —
содержащимся в молекуле кислоты, и сгорел. Одновременно
уголь восстановил кислоту, выделив окислы азота. Иногда
при окислении азотной кислотой реакция протекает так бурно
и так много выделяется тепла, что вещество воспламеняется
без предварительного подогрева.
Возьмите фарфоровую чашечку, налейте в нее немного
крепкой азотной кислоты. Поставьте чашку на дно большого
стакана или глубокой миски. Затем наберите пипеткой немно-
го скипидара и осторожно, по каплям пускайте в чашку с кис-
лотой. Скипидар будет гореть ярким пламенем, а из чашки
будет подниматься густой, черный дым, как из паровозной
трубы.
Кислород азотной кислоты окисляет углерод, который на-
ходится в составе углеводородов, образующих скипидар.
В 1834 г. было сделано химиками важное открытие. Было
замечено, что бензол может вступать в реакцию с азотной кис-
лотой. Оказалось, что один из атомов водорода в молекуле
бензола замещается нитрогруппой, т. е. группой, состоящей из
двух атомов кислорода и атома азота.
В дальнейшем выяснилось, что и многие другие углеводо-
роды при взаимодействии с азотной кислотой легко «меняют»
атомы водорода на нитрогруппы. Такую реакцию стали на-
зывать нитрованием.
В сороковых годах прошлого века нитросоединениями за-
интересовался выдающийся русский химик Н. Н. Зинин. Он
в течение нескольких лет систематически изучал их свойства.
Желая выяснить действие на них различных веществ, Зинин
обрабатывал их щелочами, аммиаком, сероводородом. Много
раз он ставил такой опыт. В стеклянную реторту наливал нит-
робензол и по трубке пропускал в жидкость струю сероводо-
рода. Под реторту подставлял жаровню с горящими углями.
Жидкость закипала, но никакого нового соединения не полу-
чалось.
Но вот однажды ученый решил предварительно насытить
нитробензол аммиаком. Когда жидкость закипела, из нее
стал выпадать осадок. Пропустив ее пары через холодильник,
он собрал некоторое количество какой-то другой жидкости.
Она была бесцветна, кипела при более низкой температуре
и имела меньший удельный вес, чем нитробензол. Отлича-
лась она от него и другими свойствами.
При долгом стоянии на свету эта жидкость становилась
сперва зеленой, затем фиолетовой, и в конце концов черной.
Полученное им новое вещество ученый назвал бензидамом.
Оно оказалось тождественным с органическим соединением,
выделенным в 1840 г. академиком Фритцше из индиго
и названным анилином (от испанского, слова анил-индиго).
— 207 —
Николай Николаевич Зинин
(1812—1880 гг.)
Потому в дальнейшем
бензидам Зинина стали
называть анилином.
Найденная Н. Н. Зи-
ниным в 1842 г. реакция
превращения нитросое-
динений в анилин—вос-
становлением нитробен-
зола'водородом — поло-
жила начало созданию
промышленности искус-
ственных красителей.
Спустя 14 лет на бе-
регах Темзы, в столице
Англии, появился на
свет первый анилино-
вый краситель.
В те годы в Лондон-
ском химическом кол-
ледже учился ВильяхМ
Перкин. Как-то профес-
сор Гофман, у которого
молодой студент слушал
лекции, дал ему зада-
ние получить искусст-
венным путем хинин. В те времена его получали только
из коры хинного дерева, которое растет в Перу, Чили, Бразилии.
Выполняя это поручение, Перкин взял для опыта анилин.
Он пробовал обрабатывать эту бесцветную жидкость различ-
ными кислотами, солями и щелочами. Однажды он стал на-
гревать анилин вместе с серной кислотой и хромовокалиевой
солью, в надежде на этот раз окончательно получить желае-
мый препарат.
Но каково же было его удивление, когда вместо кристал-
лов хинина на дне колбы к концу опыта образовалась густая,
смолистая масса, плотно приставшая к стеклу.
Юный химик — ему в то время было всего восемнадцать
лет — стал отмывать эту массу спиртом и вдруг спирт окра-
сился в пурпурный цвет. Такую же окраску приобрел и моток
шерстяной пряжи, опущенной в раствор.
Новый искусственный краситель, полученный Перкиным,
назвали мовеином. Оказалось, что он прекрасно красит и
шерсть, и шелк. Окрашенные мовеином ткани не изменяют цве-
та при стирке и не выгорают на солнце.
Высокие достоинства мовеина вызвали большой спрос на
него, хотя тогда он стоил очень дорого, почти на вес золота.
— 208 —
Блестящий успех Перкина побудил многих химиков за-
няться поисками способов получения из анилина различных
красителей. Труды их не пропали даром. В 1858 г. окислением
неочищенного анилина хлорным оловом был получен ярко-
красный краситель — фуксин.
Его назвали так за сходство окраски с цветом фуксии. По
сравнению с ним природный кармин казался невзрачным и
тусклым.
Вскоре вслед за фиолетовым мовеином и красным фукси-
ном появились малахитовая зелень и метил-виолет, из которо-
го делают обыкновенные чернила.
А к концу прошлого века уже были синтезированы сотни
различных искусственных красителей самых разнообразных
цветов и оттенков. И сырьем для их производства стали так-
же: антрацен, нафталин, фенол, толуол.
Окисление и восстановление органических соединений про-
исходит по-разному: иногда легко, при обыкновенной темпе-
ратуре и атмосферном давлении, в других случаях с большим
трудом — в присутствии катализатора и при нагревании до
нескольких сот градусов и высоком давлении.
Химики в разных странах уже в течение нескольких десят-
ков лет упорно и настойчиво изучают, как протекают окисли-
тельно-восстановительные реакции у углеводородов и различ-
ных органических веществ, в составе которых кроме углерода
и водорода имеются атомы кислорода, азота, серы.
Эти исследования дали возможность создать производство
новых продуктов: пластмасс, искусственного волокна, синте-
тических жиров. Они помогли во многих случаях получить
ценные химические продукты из дешевого сырья.
Если метиловый или древесный спирт просто сжигать на
воздухе, то получится углекислый газ и вода. Однако, как это
показал еще пятьдесят лет назад русский химик Е. И. Орлов,
из метилового спирта можно получить ценный продукт —
формальдегид. Для этого нужно пропустить смесь паров
спирта с воздухом над нагретой до 400—500 градусов медной
сеткой.
Метиловый спирт получают теперь главным образом не из
продуктов сухой перегонки дерева, а восстановлением окиси
углерода водородом. Смесь газов пропускают под давлением
в несколько сот атмосфер над окисью цинка или другим ката-
лизатором при температуре 220—300 градусов.
— 209 —
40-процентный раствор формальдегида в воде называется
формалином. Он обладает сильным дезинфицирующим дейст-
вием: он убивает гнилостные бактерии и микроорганизмы, вы-
зывающие разложение.
Формальдегид широко применяется в медицине для из-
готовления медикаментов, в сельском хозяйстве — для про-
травливания семян перед посевом. Но больше всего он тре-
буется в промышленности пластмасс. Широкую извест-
ность в народном хозяйстве получили фенопласты и амино-
пласты.
Раньше уксусную кислоту добывали только из дерева, те-
перь же сырьем для ее получения служит газ ацетилен.
Семьдесят лет назад русский химик М. Г. Кучеров нашел
способ превращения газа ацетилена в летучую жидкость
с резким запахом — ацетальдегид. Окислением ацетальдегида
в присутствии катализатора получают уксусную кислоту.
Твердые жиры — баранье сало, куриный и гусиный жир и
жидкие растительные масла — подсолнечное, хлопковое —
входят в наш рацион питания, служат необходимым «топли-
вом» для получения нужной нашему организму энергии.
Но жиры и масла не только продукты питания. Без них не
могут обойтись ни кожевники, ни текстильщики, ни красиль-
щики. Без них нельзя сварить мыло, приготовить линолеум,
изготовить клеенку. Большинство станков и машин не смогло
бы работать без жировой смазки.
Изучая состав жиров, химики установили, что они пред-
ставляют собой сложные вещества. Они состоят главным об-
разом из глицерина и различных органических кислот, назы-
ваемых жирными. В твердых жирах преобладают пальмити-
новая и стеариновая кислоты, а в жидких — олеиновая.
Молекулы жирных кислот — это длинные цепочки, образо-
ванные углеродными атомами. Пальмитиновая и стеариновая
кислоты относятся к классу предельных углеводородов. Все
атомы, составляющие молекулу этих кислот, полностью насы-
щены. А олеиновая кислота имеет одну двойную связь, т. е.
является ненасыщенным соединением. Ученые заметили, что
если к олеиновой кислоте присоединить молекулу водорода, то
она превратится в стеариновую кислоту и жидкий жир станет
твердым.
Такой способ превращения жидких масел и жиров в твер-
дые называют гидрогенизацией (от латинского слова гидроге-
ниум — водород). Продувая через ворвань или китовый жир
струю водорода в присутствии катализатора — платиновой
черни или мелкораздробленного никеля — получают салолин,
саломас и т. п. Из смеси различных растительных масел
и животных жиров приготовляют маргарин.
— 210 —
А нельзя ли природ-
ные жиры и масла заме-
нить синтетическими? Ведь
это позволит всю массу
пищевых жиров использо-
вать для питания, даст
возможность улучшить
снабжение населения жи-
рами.
Советские ученые энер-
гично взялись за поиски
заменителей природных
масел и жиров и успешно
решили эту благородную
задачу.
Еще несколько десят-
ков лет назад академик
Н. Д. Зелинский, изучая
насыщенные жирные кис-
лоты, выделенные из нату-
ральных жиров, обратил
внимание на удивительное
Николай Дмитриевич Зелинский
(1861—1953 гг.)
сходство в их строении
со строением так называемых парафиновых углеводородов,
входящих в состав нефти. У них были одинаковые цепи угле-
родных атомов, с одинаковым числом атомов водорода.
У жирных кислот было только еще два атома кислорода в мо-
лекуле. Значит, для того чтобы получить из нефтяных углеводо-
родов жирные кислоты, нужно ввести в их молекулы два до-
полнительных атома кислорода. Н. Д. Зелинский тщательно
исследовал условия присоединения кислорода и разработал
способ превращения парафиновых углеводородов в жирные
кислоты и даже в жиры.
Но еще много пришлось потрудиться советским химикам,
прежде чем на заводах стали вырабатывать жирные кислоты
из нефти в больших количествах.
Сначала попробовали внедрять в молекулы углеводородов
чистый кислород при высокой температуре и при большом
давлении. Эти попытки не дали желаемого результата. Выход
искусственных кислот был невелик.
Тогда решили пойти по другому пути. Вспомнили о верных
помощниках химика — катализаторах. И действительно, они
не подвели. Окисление с помощью катализаторов стали прово-
дить кислородом воздуха без высокого давления. Теперь
удается почти восемьдесят пять процентов углеводородов пре-
вратить в жирные кислоты.
— 211 —
В огромные алюминиевые реакторы — высокие цилинд-
ры— заливают расплавленный парафин. Мощная воздухо-
дувка нагнетает по трубам воздух в реактор.
Пузырьки воздуха перемешивают расплавленную массу
парафина и окисляют углеводороды в жирные кислоты. Окис-
ленный парафин перекачивают в большие баки-мешалки,
куда добавляют раствор щелочи. Щелочь связывается с жир-
ными кислотами, образуя «мыльный» раствор. Его отделяют
от парафина, не вступившего в реакцию, и направляют в дру-
гие аппараты-смесители. Здесь «мыльный» раствор обрабаты-
вают серной кислотой. Молекулы кислоты отнимают молеку-
лы щелочи, и жирные кислоты выделяются в свободном
виде.
Но еще много различных операций должны пройти жир-
ные кислоты, прежде чем они станут полноценными замени-
телями пищевых и природных жиров и масел.
Их освобождают от примесей, разделяют на фракции —
отдельные составные части, которые успешно заменяют жиры
в том или ином производстве. Например, при изготовлении
туалетного мыла пользовались кокосовым маслом, привози-
мым из жарких стран, а для жировки кож — ворванью, посту-
пающей с берегов Ледовитого океана. Теперь их можно заме-
нить синтетическими жирными кислотами.
Смазка, приготовленная из искусственных жирных кис-
лот, с успехом применяется в токарно-винторезных и шлифо-
вальных станках, в дробилках и подъемных кранах, в автобу-
сах и тролейбусах, поездах и теплоходах.
Жирные кислоты можно добавлять и к смазочным маслам,
получаемым при обычной перегонке нефти. Они повышают их
качество, улучшая их стойкость.
В последнее время в качестве добавок к смазочным мас-
лам стали применять различные высшие спирты, т. е. такие,
в молекулах которых содержится 10—12 атомов углерода.
Они используются и в производстве разных моющих
средств.
Пригодились эти спирты и для изготовления огнетушите-
лей. Они помогают вспенивать жидкости, которыми пользуют-
ся при тушении пожаров. А чем обильнее пена, которая выде-
ляется цз огнетушителя, тем и быстрее гасится пламя.
Нередко руды ценных металлов — меди, свинца, цинка —
содержат много бесполезных примесей. Например, в одной
— 212 —
тонне бедной руды содержится всего 20—30 килограммов ме-
ди, остальное пустая порода — песок, глина, известняк. Для
того чтобы получить одну тонну чистой меди, нужно было бы
переплавить около пятидесяти тонн руды.
Теперь бедные руды сначала обогащают. Большую по-
мощь металлургам оказывают при обогащении руд различные
вещества, которые образуют хорошую пену в воде. Раньше
чаще всего применяли для этой цели сосновое масло, кото-
рое получали из канифоли. Теперь все больше пользуются
высшими спиртами, получаемыми при окислении нефтяных
углеводородов.
Кому теперь не знакомы капрон и найлон. Эти новые син-
тетические волокна прочно вошли в наш обиход. Из них де-
лают чулки, носки, блузки, изготовляют легкие и прочные тка-
ни, из которых шьют нарядные платья.
Рыболовные сети и снасти из капрона служат гораздо
дольше, они могут месяцами находиться в воде не портясь,
тогда как пеньковые и хлопчатобумажные неводы уже спустя
четыре-пять недель теряют почти 60 процентов своей проч-
ности.
На реках и каналах нашей страны можно увидеть букси-
ры, тянущие за собой караван груженных разными товарами
барж. Раньше для буксировки пользовались толстыми пень-
ковыми канатами, иногда стальными тросами, а теперь их за-
менили капроновыми. Они в два раза тоньше и гораздо
легче их.
В наши дни нередко можно увидеть капроновые или най-
лоновые тросы и под землей. Они поднимают из подземных
глубин тяжелые клети.
Прочность капроновых нитей, из которых изготовляют
канаты и тросы такова, что их надо сравнивать не с шелком и
другими волокнистыми веществами, а с металлическими про-
волоками. Капроновая нить толщиною в полтора миллиметра
выдерживает тяжесть взрослого человека. Она в 3,5 раза
крепче алюминиевой проволоки такого же сечения, в полтора
раза крепче медной и равна по прочности железной холодно-
тянутой проволоке.
Исходным веществом для приготовления капрона служит
карболовая кислота (фенол). Она же служит источником
сырья для изготовления ценных пластических масс — фено-
пластов. Совсем еще недавно фенол получали довольно слож-
ным способом из бензола, затрачивая много серной кислоты
и каустической соды. Советские ученые впервые в мире раз-
работали новый способ получения этого важного и ценного
продукта из нефтяного углеводорода — изопропилбензола пу-
тем окисления его воздухом в присутствии катализатора.
— 213 —
Капрон можно получать теперь и из циклогексана, другого
нефтяного углеводорода. Окислением этого углеводорода по-
лучают теперь адипиновую кислоту, исходный продукт для
синтеза найлона, называемого у нас анидом. Разработан спо-
соб производства и другой ценной органической кислоты -—
себациновой, окислением нефтяных углеводородов.
Эти кислотц! нужны и в производстве пластических масс.
Они служат хорошими пластификаторами, увеличивают эла-
стичность пластмасс.
С каждым, годом в нашей стране добывается все больше
нефти. В 1958 г. ее добыча уже перевалила за сто тринадцать
миллионов тонн. В 1965 г. согласно директивам XXI съезда
КПСС нефти у нас будет добываться 230—240 миллионов
тонн. Если даже лишь два процента ее будут перерабатывать-
ся на различные химические продукты, то и тогда будут полу-
чены сотни тысяч тонн капрона и анида.
В решениях XXI съезда КПСС предусмотрено значитель-
ное расширение выпуска шелковых и шерстяных тканей.
В 1965 г. наши потребители получат в два раза больше тка-
ней, чем в 1958 г. И почти на девять десятых они будут изго-
товлены из химических волокон.
В арсенале химиков окислительно-восстановительные ре-
акции играют важную роль, помогая им расширять ассорти-
мент веществ, создаваемых по воле человека.
АИЛ 10ЧЕ~Н
ревращение химической энергии в элек-
трическую сопровождается переносом
электронов. То же самое происходит и
при горении топлива. Атомы углерода, входящие в состав ве-
ществ, из которых состоит нефть, каменный уголь, торф, дере-
во, горючие газы, отдают при окислении свои электроны ато-
мам кислорода. Но электрического тока здесь не возникает
потому, что происходит «короткое замыкание» — перенос
электронов осуществляется при тесном соприкосновении топ-
лива с кислородом.
Вот если бы удалось научиться управлять движением элек-
тронов при горении, заставить их бежать по проводам, то
можно было превратить химическую энергию горения непо-
средственно в электрическую без предварительного превра-
щения ее в тепло и работу.
А это сулит огромные выгоды народному хозяйству. Ведь
современные машины, превращающие тепловую энергию, по-
лучаемую при сгорании топлива в работу, используют ее
— 215 —
Схема топливного элемента Э. Горина
/—топливный элемент; 2—воздуходув-
ка; 8—теплообменник; 4—бункер; 5—
газогенератор
лишь в незначительной
степени. Коэффициент
полезного действия у па-
ровоза не превышает
6—8 процентов, у паро-
вой машины—10 про-
центов, у теплоэлектро-
централи—20—25 про-
центов. И лишь у двига-
телей внутреннего сго-
рания, работающих на
самом лучшем жидком
горючем, — около 40
процентов.
А вот топливный
гальванический элемент,
в котором химическая
энергия горения будет
сразу превращаться в
электрический ток, мо-
жет работать с коэффи-
циентом полезного дей-
ствия, близким к ста
процентам.
Создание такого ап-
парата дало бы возмож-
ность получать деше-
вую электроэнергию без
дополнительных затрат, вдвое-втрое увеличить добычу
каменного угля.
Эта заманчивая и важная проблема уже более ста лет
привлекает к себе внимание выдающихся русских и зарубеж-
ных ученых. К числу их принадлежат: английский химик и фи-
зик Г. Дэви, французский физик А. Беккерель, русский уче-
ный П. Н. Яблочков.
Однако до сих пор еще не создан такой топливный эле-
мент. Много еще трудностей стоит на пути изобретателей и
конструкторов.
За последние годы появились у нас и за границей новые
проекты подобных аппаратов.
Советский ученый О. К. Давтян сконструировал элемент,
превращающий энергию горения водорода в электрическую
энергию. В этом топливном элементе один электрод (носитель
водорода) состоит из смеси угля и серебра, а другой — кисло-
родный, из угля и никеля. Элемент Давтяна имеет коэффи-
циент полезного действия 60 процентов.
— 216 —
В одном из наших исследовательских институтов заканчи-
вают создание топливного элемента, в котором электриче-
ская энергия получается за счет окисления угля. В расплав-
ленную смесь буры и двуокиси марганца опущена графито-
вая пластина, окруженная кусками кокса. Другой электрод
изготовлен из тонких золотых пластинок, располагаемых на
поверхности расплава и соприкасающихся с воздухом. Кисло-
род окисляет кокс в углекислый газ, графитовый электрод за-
ряжется отрицательно, а золотая пластинка — положительно.
Весьма простая и остроумная конструкция топливного эле-
мента предложена американским изобретателем Э. Гориным.
В нижнюю часть аппарата засыпают мелко измельченный
уголь и через слой угля продувают смесь водяного пара
с воздухом или кислородом. Часть топлива при этом сжи-
гается до углекислоты. При горении угля выделяется так мно-
го тепла, что он раскаляется и вступает в химическую реакцию
с водяным паром. Образуется водяной газ, т. е. смесь водорода
и окиси углерода.
Горючие газы поступают в верхнюю часть аппарата, где
расположены электроды и твердый электролит — окись маг-
ния, пропитанная щелочью. Один из электродов, который
служит газовым носителем, изготовлен из окиси железа, же-
лезных опилок и шамотной глины. Другой электрод—ки-
слородный— состоит из раз-
ных окислов железа, смешан-
ных с шамотной глиной. Нагре-
тые горючие газы всту-
пают во взаимодейст-
вие с предварительно
подогретым (за счет
тепла горючих газов)
кислородом, образуется
вода и углекислота.
Энергия, которая выде-
ляется при этой реак-
ции непосредственно,
превращается в элек-
трический ток.
Пройдет немного
времени и топливные
гальванические элемен-
ты заменят сложное
оборудование электри-
ческих станций. Для Д)
получения электричес- / j
кого тока не нужны ®
Установка для газификации угля
в «кипящем» слое (схема)
ИСЛОРОД
0 КИСЛОРОД
0 УГЛЕРОД
О ВОДОРОД
ВТОРИЧНОЕ
КИСЛОРОДНОЕ
ПЕРВИЧНОЕ
КИСЛОРОДНОЕ
ДУТЬЕ
будут более паровые котлы, генераторы, турбины. Это будет
подлинная революция в энергетике.
Еще совсем недавно в газогенераторах можно было прев-
ращать в горючие газы только в крупных кусках каменный
уголь или торф. Газификация угольной мелочи, легко разру-
шающихся бурых углей, мелкого фрезерного торфа наталки-
валась на непреодолимые трудности. А между тем эти виды
топлива имеют немаловажное значение для народного хо-
зяйства.
Советские ученые задались целью создать такие газогене-
раторы, в которых успешно можно было бы газифицировать
подобное топливо. Они внимательно изучили процесс горе-
ния угля в газогенераторе.
Горение угля в газогенераторе несколько отличается от
сжигания его в топке печи. Оно происходит при недостатке
кислорода, потому что вместо негорючей углекислоты обра-
зуется горючий газ — окись углерода. Окисление углерода
при горении протекает на поверхности топлива. Следователь-
но, чем больше поверхность сжигаемого угля, тем быстрее
пойдет газификация. Но этого еще мало. Для того чтобы
реакция горения шла быстрее, нужно увеличить скорость вду-
вания кислорода в газогенератор.
Казалось бы, все очень просто. Достаточно заменить круп-
ные куски угля, загружаемые в газогенератор, мелочью, уси-
лить поступление окислителя — воздуха или чистого кисло-
рода— и скорость образования горючего газа увеличится.
Но когда засыпали в шахту газогенератора мелкозерни-
стый уголь, то сильно возросло сопротивление струе проду-
ваемого воздуха. Попробовали усилить дутье, воздух проры-
вался в отдельных местах через слой топлива. А это
нарушало равномерное горение.
Но как же все-таки повысить производительность газоге-
нератора? Необходимо заменить неподвижный слой крупно-
кускового топлива подвижным слоем мелко измельченного
угля. Это новшество позволяет увеличить пропускную спо-
собность газогенератора почти в десять раз.
В нижнюю часть высокого металлического цилиндра, су-
живающегося книзу, шнеком подают мелкораздробленное
топливо. По мере движения угля через колосники продувают
воздух, обогащенный кислородом или смесь пара с кислоро-
дом. По внешнему виду движущийся слой топлива, окутан-
ный паром, напоминает кипение жидкости. В «кипящем» слое
топлива и происходит окисление его в горючий газ.
Газификация в «кипящем» слое повышает производитель-
ность газогенераторов не только благодаря увеличению по-
верхности топлива, на которой молекулы кислорода взаимо-
— 218 —
действуют с атомами углерода. Не менее важно непрерывное
удаление с поверхности тонкого слоя, образующейся при горе-
нии золы. Это облегчает молекулам окислителя доступ к ато-
мам углерода.
Не менее важно непрерывное удаление с поверхности тон-
кого слоя, образующейся при горении золы. Это облегчает
молекулам окислителя доступ к атомам углерода.
Пройдет немного времени и новые газогенераторы повсе-
местно вступят в строй, выдавая гораздо больше газа хими-
ческим и металлургическим заводам. Они помогут химикам и
металлургам в свою очередь увеличить выпуск продукции на
своих предприятиях.
Принцип работы в «кипящем» слое может быть успешно
использован во многих отраслях техники, где пользуются ре-
акциями горения,— при обжиге извести и гипса, при восста-
новлении руд, в производстве активированного угля, в про-
цессах химической переработки нефти.
Окислительно-восстановительные реакции лежат в осно-
ве многих производств и технологических процессов. Одни
уже существуют сотни лет, другие насчитывают лишь десятки
лет от роду, а третьи только станут на службу человеку в бли-
жайшем будущем.
Решения майского Пленума (1958 г.) ЦК КПСС и
XXI съезда партии наметили грандиозную программу роста
нашей химической промышленности в ближайшие годы.
Достижения советских ученых, вскрывших многие законо-
мерности разнообразных окислительно-восстановительных ре-
акций, дают возможность шире и лучше использовать их
в промышленности, повышая во многих случаях производи-
тельность труда, уменьшая расходы по производству, снижая
себестоимость продукции. Немалую службу сослужат они
и в развитии сельского хозяйства, являясь действенными по-
мощниками урожая. Дальнейшее изучение их позволит по-
лучать все новые и новые вещества, создавать с помощью их
новые материалы. Они явятся крупным вкладом в дело вы-
полнения решений майского Пленума (1958 г.) ЦК КПСС и
XXI съездом партии реализации начертанных планов создания
изобилия товаров широкого потребления, невиданного подъе-
ма советской химии. Это будет новый важный шаг на пути
развития индустриальной мощи нашей Родины, на пути от
социализма к коммунизму.
ГЛАВЛЕНИЕ
Предисловие ............................
Глава первая
Покоренная стихия
Похитители огня.........................................
Искра и пламя . ........................................
«Вечное» пламя................................„ . . . .
Глава вторая
Тайны явного огня
Огонь в жизни человека..................................- .
Суждение греческих философов............................
Материя огня............................................ ~~
«Невесомая» материя ... о...............................
Ошибка Роберта Бойля . .................................. ^8
История одного открытия .................................. 30
«Огненный воздух» . . ............................... 33
Глава третья
Наследники солнечной энергии
Победители тьмы.......................................... 37
Секрет яркости.......................................... 39
Рождение пламени......................................... 41
— 220 —
Без пламени............................................
Цветное пламя............................................. ™
Светит, но не греет . ................................... 47
Соперники солнца ...»................................. 50
Горящий лед............................................. 54
Глава четвертая
Из подземных глубин
«Горят голубые огни» . ................................. 56
Предсказания великого химика............................ 59
Жидкий уголь............................................. 52
Глава пятая
Химия активных молекул
Созидающий взрыв .................................... 57
Несущий смерть и разрушения............................
«Механика» взрыва...................................... 73
Открытие голландского химика............................. '5
Цепные реакции........................................... 31
«Химические микробы»..................................... 35
Глава шестая
Без огня и пламени
Пища — наше «топливо».................................... 38
Химия тайного огня....................................... 39
Волшебный носильщик..................................... 93
Загадки дыхания ......................................... 98
Рулевые удивительных превращений.......................... ЮЗ
Пачка чая................................................ 155
Глава седьмая
Невидимые враги и друзья
Черная смерть.......................................... J97
В мире незримых .... ....................> • 199
Союзники виноделов и пивоваров . ...................... 115
Секрет брожения...................................... 115
Пастер находит разгадку................................ 119
На службе промышленности............................... 122
Невидимые помощники урожая . ....................... 127
Разрушая и созидая..................................... 131
Глава восьмая
Зеленая лаборатория
Раскрытая тайна ......................................... 135
Газ кормит растения...................................... 139
Борец и мыслитель........................................ }43
Почему лист зеленый...................................... {45
Ответ дает микроскоп..................................... 149
Торжество передовой теории.............................. 151
— 221 —
Глава девятая
Основа прогресса
От горнов к домнам .... ................................
Домны меняют профиль....................................
Тайна дамасского клинка....................... . . . .
Химия помогает сталеварам...............................
Крылатый металл.........................................
Глава десятая
Враги металлов
Злейший враг металлов .................................. 180
Отчего ржавеют металлы ................................. 182
Превращения энергии..................................... 184
Губительное соседство................................... 186
Ток разрушает трубопровод .... 191
Друзья металла........................................ 193
Металл защищает металл...................................197
Глава одиннадцатая
На службе химиков
«Купоросное масло»................................ 200
«Селитряный спирт»................................. 204
Из угля и нефти..................................... 206
Создавая новые вещества............................. 209
Прочнее шелка, крепче проволоки..................... 212
Заключение......................................... 215
Борис Яковлевич Розен
химия явного И ТАЙНОГО огня
Редактор И. В. Хаджиева
Редактор издательства Г. Е. Перковская
Технический редактор В. А. Павлова
Корректоры: Г. И. Кузнецова,
С. И. Батулина
Оформление художника В. Я. Батищева
Рисунки художников А. А. Шкрабо,
А. С. Даниленко, В С. Иванова, Б. А. Макина
Сдано в набор 20/VI-60 г. Подписано к печати
25/1-61 г. Бумага 60X92716-==4 4 печ. л. 13,07 уч.-
изд. л. Тираж 13 000. Т—02611. Цена 49 к.
Заказ 595.
Государственное издательство «Высшая школа».
Москва, Б-62, Подсосенский пер., 20.
Полиграфический комбинат Ярославского совнархоза,
Ярославль, ул. Свободы, 97.
вного
ТАЙНОГО