Автор: Кон Л.
Теги: классическая литература повседневная жизнь человеческое общество значение химии производственная деятельность
Год: 1935
Текст
ЛАССАР КОИ
гго®СЕ?НЕВИой
ЛАССАР-КОН
ХИМИЯ
В ПОВСЕДНЕВНОЙ
ЖИЗНИ
Перевод с 12-го немецкого издания
Дополнения и примечания
В. Г. АНДРЕЕВА
онти
ГЛАВНАЯ РЕДАКЦИЯ НАУЧНО-ПОПУЛЯРНОЙ
И ЮНОШЕСКОЙ ЛИТЕРАТУРЫ
МОСКВА • 1935 • ЛЕНИНГРАД
Scan AAW
Редактор А. Берлин
Технич. редактор О. Подобедова
Переплет худ. Ф. Мулляр
★
Сдано в набор 20/III—35 г. Подписано к печати 8/VI1—35 г.
Формат бум. 82ХП0/з>. 17,1 уч. авт. л. Изд. № 19.
Уполном. Главлита № В-20929.
Тираж 15 000.
Заказ тип. № 8700.
Фабрика книги «Красный пролетарий» Партиздата ЦК ВКП(б).
Москва, Краснопролетарская, 16.
Отпеч. с матриц в 1-й Жури. тип. ОНТИ. Денисовский, 30.
ПРЕДИСЛОВИЕ ПЕРЕВОДЧИКА
Книга проф. Лассар-Кона принадлежит к числу классических по-
пуляризаций и пользуется мировой известностью. Она выдержала
12 немецких изданий, переведена на 13 языков, на русском языке
выходит четвертым изданием. Такой ее успех обусловлен тем, что
автору удалось в доступной и интересной форме в сравнительно
небольшой книге дать достаточно полное и всестороннее представле-
ние о значении химйй в производственной деятельности человеческого
общества и в так называемой «повседневной жизни».
Два последних немецких издания книги вышли уже после смерти
автора и переработаны д-ром Мехлингом. Переработку эту нужно
признать очень удачной, так как, с одной стороны, из книги исклю-
чены непредставляющие никакой ценности места натурфилософского
характера и некоторые «патриотические» рассуждения автора, а с
другой,—включены сведения о витаминах, отвердении жиров, жид-
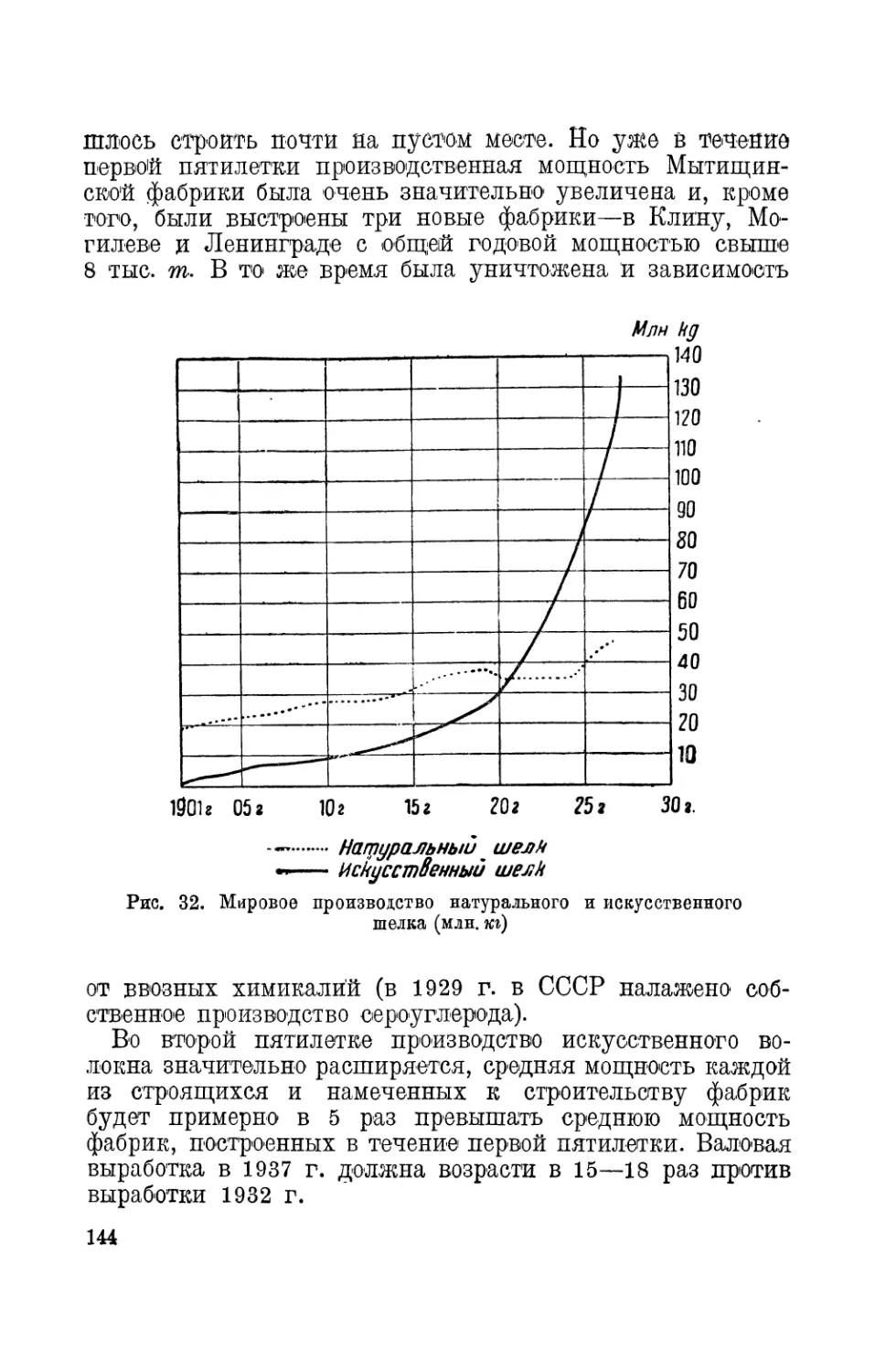
ком воздухе, озоне, нефти, искусственном шелке, алюминии, не-
ржавеющей стали ит. д., делающие книгу вполне отвечающей
современному уровню химических знаний и химической технологии.
При переводе книги на русский язык в некоторых сравнительно
немногих местах приходилось несколько отступать от оригинала.
Делалось это в тех случаях, когда автор в целях популяризации
слишком упрощал изложение (например, отождествлял понятия «про-
стое вещество» и «химический элемент», гремучую вату с пироксили-
ном, песок с кремнекислотой и т. д.), употреблял неточную химиче-
скую терминологию и т. п. Некоторые места, не представляющие
интереса для советского читателя, выпущены (например, подробности
о различных сортах немецкого пива, длинные рассуждения по поводу
буржуазного патентного права, неудовлетворительное и мало умест-
ное в этой книге изложение истории биметаллизма и золотой ва-
люты и т. п.). С другой стороны, где возможно, сделаны неболь-
шие вставки о состоянии в СССР различных областей промышлен-
ности, описываемых в книге. Кроме того, местами сделаны не-
большие добавления, отмечающие некоторые успехи химии и химиче-
1»
3
скои промышленности со времени выхода последнего немецкого изда-
ния (1930 г.), упущенные автором важные технические применения
различных веществ и т. п. Все такие изменения и .добавления,
Принадлежащие переводчику, помещены между звездочками. Поясне-
ния терминов, имен, названий и пр., могущих быть не -совсем
Понятными читателю, сделаны иногда в форме примечаний, боль-
шей же частью непосредственно в самом тексте.
В настоящем издании дано значительно больше рисунков, чем
в оригинале.
К Андреев
ЛЕКЦИЯ ПЕРВАЯ
Дыхание. Вес воздуха. -Барометр. Анализ воздуха. Кислород. Азот. Бла-
городные газы. Жидкий воздух. Различие между вдыхаемым и выдыхаемым
воздухом. Поддержание теплоты тела. Горение. Окисление. Спички.
Наши лекции должны показать, что понимание много-
численных явлений повседневной жизни возможно лишь на
основе химических знаний. Ко многим этим явлениям мы
так привыкли, что не обращаем на них внимания, и по-
этому лишь в редких случаях даем себе труд поразмыс-
лить над их взаимной связью.
Начнем с дыхания, так как оно совершается нами не-
прерывно в течение всей нашей жизни: ведь продолжи-
тельность нашего существования на земле может быть
определена отрезком времени между первым и последним
вздохом. Чем именно и для чего мы дышим?
Разумеется, чем мы дышим, знает всякий: мы дышим
окружающим’ нас воздухом. Но что такое воздух? Представ-
ляет ли он собою нечто вещественное или же он существует
лишь в 'нашем воображении?
Хотя все мы говорим, что воздух обладает весом, однако,
вряд ли кто-нибудь в состоянии сказать, сколько весит
определенное количество воздуха,—сколько, например, ки-
лограммов воздуха заключается в том помещений, в кото-
ром мы находимся? Мы производим движения рукой в
воздухе в разных направлениях—и, повидимому, не встре-
чаем сопротивления; мы без затруднений передвигаемся
в воздухе. Факты эти как будто идут вразрез с представле-
нием о вещественности и тяжести воздуха, однако, теперь
все знают, что, воздух имеет какой-то вес.
Что воздух обладает весом, что он представляет опреде-
ленный вид вещества, в этом можно убедиться очень легко,
без всяких предварительных познаний. Для этого мы про-
делаем несложный опыт. Возьмем стеклянную колбу, но
5
не простую, а с краном на шейке’, откроем этот кран,
соединим его с воздушным насосом, посредством: насоса
выкачаем из колбы воздух и затем закроем кран. Колба
теперь лишена воздуха. Поставим ее на весы и уравнове-
сим соответствующими гирьками (рис. 1). Стоит1 после
этого’, оставив колбу на весах, снова открыть кран, как
тотчас же чашка с колбой опустится, хотя сама колба,
конечно’, не стала тяжлее оттого, что мы открыли в
ней кран. Отчего’ же произошло изменение В1 весе колбы?
Причина заключается в том, что через открытый кран в
нее снова устремился воздух. Таким образом тот факт, что
Рис. 1. Доказательство весомости
воздуха
воздушного давления
воздух Обладает некоторым: весом, стал очевидным благо-
даря опусканию чашки весов.
Вес воздуха в колбе можно определить точно, если снова
привести весы в равновесие добавлением соответствующих
гирек. Зная объем колбы, с помощью простых вычислений
можно установить, что 1 л воздуха весит 1,295 г.
Раз воздух имеет вес, то своей тяжестью о!н должен ока-
зывать давление на все предметы, над которыми он нахо-
дится. В правильности этого’ предположения мы можем тот-
час же убедиться при помощи следующего’ простого, опыта.
Возьмем снова нашу колбу, выкачаем из нее воздух, опу-
стим ее горлышко в воду, как показано на рис. 2, и затем
откроем кран. Мы сейчас же увидим, что вода с большой
силой будет врываться в колбу и наполнять ее. Отчего
6
это происходит? Оттого, что воздух, находящийся вокруг
колбы, давит на поверхность воды в сосуде, и вода как бы
вдавливается в открытый кран колбы: ведь в колбе-то
никакого воздуха нет, а потому и нет внутри нее давления,
которое могло бы противостоять давлению внешнего
воздуха.
Если бы вместо' колбы мы взяли очень длинную стеклян-
ную трубку, закрытую с одного конца, а на другом снаб-
женную краном, выкачали бы из нее воздух и поступили
с ней точно так же, как с колбой, мы увидели бы, что
после открытия крана под водой давление воздуха вогнало
бы воду в трубке до высоты свыше 10 м. А если вместо
воды взять другую жидкость, ртуть, которая приблизи-
тельно в 13,6 раза тяжелее воды, то воздух поднимет 'ее в
трубке на высоту, во столько же раз меньшую, т. е.—
около 760 мм. Таким образом находящийся в трубке ртут-
ный столбик высотой в 760 мм уравновешивает воздушное
(атмосферное) давление. Если затем атмосферное давление
почему-либо усилится или ослабеет, ртуть в трубке тот-
час же поднимется или упадет. Для измерения атмо-
сферного давления мы и пользуемся обычно таким ртутным
столбиком под названием барометр (от греческого слова
Ъагуз—тяжелый); с Ним гораздо удобнее обращаться, чем
с водяным столбом высотой свыше 10 м (рис. 3).
Итак, мы узнали, что воздух есть нечто вещественное,
что он обладает вполне определенным весом и производит
давление.
С химической точки зрения важно знать: состоит ли
воздух из одного вещества или же он представляет смесь
различных веществ. Проанализировать, т. е. разложить на
составные части, то, что мы не можем ни ощупать руками,
ни увидеть глазами, является задачей далеко не легкой.
Поэтому-то решить ее удалось всего только сто с лишним
лет тому назад. При подобном анализе большинство пред-
ставляющихся сначала чрезвычайно сложными явлений
после исследования их взаимной связи оказываются срав-
нительно простыми. И в данном случае можно, не обладая
никакими химическими познаниями, убедиться, что воздух
должен состоять по крайней мере из 'Двух частей, из кото-
рых одна поддерживает горение, а другая этой способ-
ностью не обладает.
Чтобы доказать это, нам нужно только зажечь Неболь-
7
шой кусочек жейтого фосфора. Если мы это сделаем просто
в комнате, то увидим, что фосфор горит, образуя густой
белый дым (рис. 4, А). Но в Такой форме наш опыт еще не
может служить для анализа воздуха. Другое дело, если мы
зажжем фосфор в каком-нибудь небольшом замкнутом
объеме воздуха.
Для этой цели достаточно, например, погрузить опроки-
нутый стеклянный цилиндр в воду, кая:
показано на рис. 4, В. Воздух, заключен-
ный в цилиндре, отделен теперь от осталь-
ного воздуха водой.
Поместим в металлическую чашечку
небольшое количество фосфора, зажжем
его и накроем опрокинутым стеклян-
Рис. 3. Ртутный
барометр
Рис. 4. Горящий фосфор и определение с его
шмощыо. содержания кислорода в воздухе
ным цилиндром В (рис. 4). В этих условиях фосфор будет
некоторое время энергично гореть, соединяясь с ча-
стью находящегося внутри цилиндра воздуха, а затем
потухнет.
На место потратившейся на горение части воздуха внеш-
нее давление вгонит в цилиндр воду, которая займет около
одной пятой объема всего находившегося раньше в ци-
линдре воздуха.
В результате соединения части воздуха с фосфором обра-
зовалось твердое тело—белый дым, который занимает го-
раздо меньше места, чем исчезнувшая часть воздуха, а
вскоре дым и вовсе исчезает, растворившись! в в,оде и обра-
зовав с нею фосфорную кислоту.
Ь
Если мы исследуем теперь находящийся в цилиндре! оста-
ток воздуха, то обнаружим, что он отличается от обыкно-
венного, окружающего нас воздуха, а именно: в нем ничто
не горит, ведь даже столь горючее вещество, как фосфор,
в нем погасло. Да и вообще он почти не обнаруживает
стремления химически соединяться с другими веществами
и образовывать с ними новые вещества. Всякое живое
А. Лавуазье
существо, помещенное в этот газ, задыхается. В связи с
этим он и получил название азот, что по-гречески значит
«непригодный для жизни» (азотос).
Та часть воздуха, которая в 'нашем опыте соединилась
с фосфором, называется кислородом, хотя этот газ вовсе не
обладает ни кислым вкусом, ни кислым запахом. Такое
название дал ему около1 150 лет назад французский химик
Лавуазье, который был убежден, что кислород содержится
во всех кислотах. Кстати, мы тоже видели, что фосфор
9
после соединения с кислородом, растворившись в воде,
образовал фосфорную кислоту.
Вообще кислород в противоположность азОту обнаружи-
вает чрезвычайную способность химически соединяться с
другими веществами. Горение фосфора с образованием пла-
мени, которое мы только что наблюдали, является приме-
ром такого соединения кислорода. И вообще горение в
огромном большинстве случаев есть не что иное, как соеди-
нение горящих веществ с кислородом (происходящее с зна-
чительным выделением тепла и света) и образование новых
веществ, отличающихся от сгоревших. Такое соединение
двух или нескольких веществ в нечто новое химики назы-
вают синтезом.
Кислород может соединяться о многими веществами и
медленно, без образования пламени. Примером такого про-
цесса является ржавление железа. Ржав-
( чина, или окись железа, образуется именно
rfa ют соединения этого металла с кислородом1.
Такие процессы соединения самых разнооб-
S разных веществ с кислородом нельзя назвать
горением в обычном смысле слова, так как
с понятием горения мы связываем образова-
ние пламени и развитие высокой темпера-
туры.
Рис. 5. Горе- Процесс, при Котором происходит прцсо-
пие железа в единение кислорода к другим веществам (с
кислороде образованием пламени или без него), в хи-
мии называется окислением.
Что окисление и горение по своим конечным результатам
действительно представляют собой одно и то же, можно
легко убедиться На опыте. Мы уже знаем, что железо
ржавеет благодаря окислению и что при этом образуется
химическое соединение—окись железа. Мы знаем также из
опыта, что ржавчина на железе образуется годами, Не
давая Никакого пламени. А вот .если мы, раскалив кончик
тонкой железной проволоки, опустим его в бутылку, на-
полненную кислородом (рис. 5), то проволока будет гореть
в кислороде. Вместо медленного ржавления железо сгорит
1 Ржавление железа, впрочем, является более сложным процессом. Для
ржавления необходимо еще присутствие влаги, отчего образуются более
сложные химические соединения. (Прим, персе.)
10
в кислороде в течение какой-нибудь минуты, разбрасывая
искры, причем получится та же окись железа. Этим самым
мы доказали, что окисление и горение приводят к одинако-
вым результатам.
Горение и медленное окисление отличаются друг от друга
только длительностью процесса. То, что при горении про-
исходит в течение нескольких минут, при медленном оки-
слении может потребовать многих лет. Теперь нам совер-
шенно ясно, почему в чистом кислороде все горит лучше,
чем в воздухе: ведь в воздухе одна часть кислорода раз-
бавлена четырьмя частями азота, а такое сильное разбавле-
ние должно ослабить действие кислорода.
Произведенный нами опыт сжигания железа в кисло-
роде, известный уж>е с 1780 г., получил с 1907 г. чрезвы-
чайно важное техническое применение. Применяя кисло-
род, с 1907 г. Научились с необыкновенной быстротой
сверлить и резать даже самые твердые сорта стали. Этим
методом удается в 10 ми'нут прорезать стальную пластину
толщиной в 13сл и длиной в 1 м. Для «резки кислородом»
нужно только' предварительно нагреть стальную болванку
в определенном месте пламенем гремучего газа1 (смесь
кислорода1 с Водородом, о |ней будет речь, во второй лекции)
до температуры горения железа, а затем направить на это
место тонкую струю чистого кислорода уже без примеси
водорода. По стали медленно ведут горелк|у-резак, кислород
сжигает, окисляет сталь, и юна прогорает насквозь, по на-
меченной линии. Любопытно, что изобретателем этого спо-
соба был преступник-взломщик, который впервые приме-
нил его в 1890 г. в Ганновере, просверлив таким путем
стенку денежного шкафа.
Наш анализ показал, что воздух состоит примерно на
одну пятую из кислорода; и на четыре пятых из азота. Вме-
сте с тем в воздухе всегда; находится очень небольшое ко-
личество (0,03%) углекислого газа. Это было известно' уже
давно), а в конце прошлого века было открыто1, что* к азоту,
выделенному из воздуха химическим путем; (мы его полу-
чили с помощью сжигания фосфора в замкнутом объеме
воздуха), примешаны в небольших количествах еще не-
сколько других газообразных веществ: аргон, гелий, крип-
1 Теперь гораздо чаще применяют ацетиленовое пламя, о котором будет
речь во второй лекции. (Прим. перев.)
11
тон, неон и ксенон. Все эги газы относятся к группе
«благородных газов».
Благородные газы еще белее инертны, чем азот, ни ' в
какие соединения с другими веществами они вообще не
вступают. Они, например, неспособны гореть. Это их свой-
ство в последнее время используют в США, наполняя
гелием дирижабли, которые становятся благодаря этому
безопасными в пожарном отношении, а также в случае
удара молнии и т. п.
На 100 объемных частей воздуха приходится:
Кислорода................................... 20,77 частей
Азота....................................... 78,26 »
Благородных газов............................ 0,94 »
Углекислого газа............................. 0,03 »
100,00 частей
Особенно наглядное доказательство вещественности воз-
духа было получено, когда удалось превратить его в‘жид-
кость. В 1895 г. профессор Линде сконструировал аппа-
рат, в котором под влиянием высокого давления и сильного
охлаждения получается воздух в жидком виде и притом
в таких количествах, которые позволяют применять его
для практических целей. Жидкий воздух—синеватая на
вид жидкость—используется главным образом при изго-
товлении взрывчатых веществ, а также в холодильном
деле. Из него могут быть легко выделены отдельные его
составные части, которые также используются в технике:
азот для наполнения лампочек накаливания, а кислород
для резки и сварки металлов.
Итак, мы изучили состав воздуха. Теперь спросим себя:
почему воздух необходим нам для жизни? Почему недо-
статок воздуха ведет к удушению, к прекращению жизни?
Вдыхаемый нами воздух поступает в легкие. Здесь через
стенки тончайших кровеносных сосудов он приходит в
соприкосновение с кровью. Тонкие перепонки, каковыми
являются стенки мельчайших легочных сосудов, непро-
ницаемы для жидкостей, но вполне проницаемы для газов;
газы через них, как говорят, диффундируют. Кислород
воздуха, диффундируя через эти стенки, приходив в сопри-
косновение с красными кровяными тельцами; кровь по-
глощает из 'воздуха кислород и выделяет содержащийся в
12
ней углекислый газ. В выдыхаемом воздухе мы должны,
следовательно, находить большее количество углекислого
газа, чем во вдыхаемом. В том, что это так, мы можем убе-
диться очень легко.
Для этой Тцели пропустим обыкновенный воздух через
известковую воду в колбе В, всасывая его ртом через
трубку А (рис. 6). Ничтожное количество содержащегося
в воздухе углек!ислого газа, которое мы пропускаем через
трубку С и затем через известковую воду, не оказывает на
нее почти никакого действия:
она не мутнеет. Наоборот, если д........ . . с
я буду продувать через прозрач- "Ж"
ную известковую воду выдыха-
емый мною воздух, взяв для и
этого в рот трубку С, то очень I
скоро появится муть, заметная х
даже издали. Это происходит ' \
оттого, -что находящаяся в рас- (<-----------
творе известь соединяется с
углекислым газом выдыхаемого
мною воздуха и образует нерас-
творимый В ВОДе ОСаДОК угле- Рис. 6. Доказательство присут-
кальциевой СОЛИ, который И ила- ствия углекислого газа в выды-
вает теперь в жидкости в виде хаемом воздухе
белого порошка.
Насколько велико это содержание углекислого газа в
выдыхаемом воздухе, видно из следующих данных анализа
этого воздуха. В нем находится;
в %
Азота вместе с благородными газами.............. 79,58
Кислорода....................................... 16,04
Углекислого газа.................................. 4,38
100,0)
Таким образом содержание кислорода в выдыхаемом воз-
духе уменьшилось на одну пятую часть, между тем как
содержание углекислого газа увеличилось более чем в
140 раз по сравнению с вдыхаемым воздухом.
Поглощенный кровью кислород разносится ею по всему
телу и окисляет растворенные в ней питательные вещества.
Особенно велика его роль в окислении углерода питатель-
ных веществ в углекислый газ. Этот газ, образующийся в
13
самых различных частях тела, поглощается циркулирую-
щей кровью, приносится к легким и здесь выделяется в
воздух в обмен на кислород, которым кровь здесь снова
насыщается. Благодаря этому выходящая из легких и
обогащенная кислородом кровь имеет всем знакомый ярко-
красный цвет, тогда как богатая углекислым газом кровь,
текущая к легким, отличается темной окраской. Взрослый
человек ежедневно поглощает при процессе дыхания при-
мерно 750 г, или 580 4, кислорода, что соответствует вдыха-
нию приблизительно 3000 л воздуха.
Благодаря дыханию в нащем тел1е идей 'непрерывный про-
цесс окисления, которое, как й горение, связано с выделе-
нием теплоты; оно-то и поддерживает температуру тела
на одном уровне—около 37°.
Если мы примем во внимание, что обращение крови в
теле, начиная от сердца и до обратного поступления ее
в сердце, длится у человека каких-нибудь десять секунд,
мы легко поймем, почему теплота нашего тела во всех его
частях поддерживается путем окисления на одном уровне,
хотя мы непрерывно отдаем довольно значительную часть
тепла в более холодную окружающую среду.
В пятой лекции мы точнее определим то количество угле-
рода, которое необходимо ежедневно сжигать для сохране-
ния теплоты тела. Однако уже из сказанного совершенно
ясно, что запас соединений углерода в нащем теле очень
скоро должен был бы истощиться, если бы не происходило
в достаточной мере его возмещения. Вот почему для по-
полнения углерода, а также и других выделяющихся из
организма веществ, нам необходимо вводить в организм
достаточные количества питательных веществ.
Уже с древних времен стали применять для сжигания в
качестве топлива различные материалы, богатые углеро-
дом, например дерево или торф, к которым позже присоеди-
нились каменные и бурые угли. В главных чертах про-
цесс горения заключается в следующем: углерод горючего
материала соединяется с кислородом воздуха и образует
углекиолЫй газ; содержащийся в этих материалах (обычно
в гораздо меньшем количестве) водород сгорает в «окись
водорода», т. е. в воду, которая улетучивается в виде во-
дяного пара. На холоде углерод никогда не соединяется
с кислородом. Но если горение по какой-либо причине
началось, то в дальнейшем оно идет само собой: горящие
14
вещества дают так. много теплоты, что и прилегающие
части материала сильно нагреваются и загораются, дру-
гими словами, они нагреваются настолько, что их углерод
начинает соединяться с кислородом.
Но как зажечь горючий материал? Как вообще получить
огонь?
В настоящее время это делается с большим удобством:
для добывания огня мы пользуемся спичками. Но спички
вошли в употребление всего лишь около 100 лет тому на-
Рис. 7. Добывание огня с помощью трения
зад. Вероятно никогда не будет разрешен вопрос о том,
добыли ли первобытные люди впервые огонь посредством
трения друТ о друга двух кусков сухого дерева или же они
получили его случайно, от дерева, загоревшегося вслед-
ствие удара молнии. Конечно, добыть огонь посредством
трения двух кусков дерева вполне возможно,—этот способ
путешественники наблюдают еще и в настоящее время
у первобытных народов (рис. 7). Но этим приемом можно
воспользоваться лишь при наличии такого почти абсолютно
сухого дерева, какое в наших климатических условиях
едва ли встречается в естественном состоянии. Трудность
получения, а стало быть и важность сохранения уже до-
бытого огня и явились причиной того, что у древних
15
народов очаг (в котором сохранялась такая драгоценность,
как огонь) считался священным.
В период позднего средневековья был Найден гораздо
более удобный способ «высекания огня». При этом искру,
получаемую от удара куска стали о кремень, заставляли
падать на трут (рис. 8). Лишь с начала прошлого столе-
тия задумались над тем, как добывать огонь чисто химиче-
ским путем и как сделать соответствующий прибор, удоб-
ный для широкого употребления. Сначала результаты по-
добных стремлений' были весьма незначительны, способы
Рис. 8. Принадлежности для добывания огня высеканием
(кремень, сталь, трут)
в высшей степени неудобны, а предложенные приборы к
тому же опасны. Удовлетворительный результат был полу-
чен только в 1830 г., когда с «этой целью стали применять
фосфорх.
Студенту Иринию пришлось в то время на 'одной лекции
наблюдать, как смешивают серу, с перекисью свинца; смесь
эта при растирании в ступке должна была загореться, но
по случайным причинам не загоралась. Это навело Ириния
на мысль смешать перекись свинца с фосфором, и получен-
ная им смесь всегда загоралась от трения. Загорались
1 О применении фосфора для огнива впервые говорится в «Journal de
1’Empire» от 20 вандемьера XIV года (12 октября 1805 г.).
16
также й маленькие деревянные палочки, к которым он
приклеивал небольшое количество этой смеси. Ириний не
смог, однако, оценить значения своего изобретения и не
взял на него патента. Впоследствии уже другие стали
изготовлять спички для продажи и очень их усовершен-
ствовали.
Для добывания огня фосфорные спички очень удобны,
но у них имеются и некоторые неприятные свойства. Фос-
фор чрезвычайно ядовит, и благодаря спичкам в руках
широких слоев населения оказалось в высшей степени
опасное' вещество, явившееся причиной многочисленных
случайных, профессиональных и умышленных отравлений.
В 1847 г. Шреттер открыл, что наряду
тым фосфором имеется еще неядовитый
красный фосфор. Уже в следующем году
Христиан Веттер стал изготовлять 1вО'
Франкфурте из этого материала первые
неядовитые спички. Но он не мог в сла-
бой тогда экономически* Германии из-
влечь пользу из своего изобретения и
направился в Швецию, откуда эти новые
спички появились потом в Германии под
названием «шведских спичек».
О том, что изобретателем «шведских»
спичек был Бетгер, теперь почти забыли,
хотя Германия является чуть ли не
крупнейшей в мире производительницей
спичек1. В 1927 г. в Германии было из-
готовлено 132 млрд, спичек. Это соста-
вляет 2200 млн. коробок, для доставки
которых потребовался бы поезд из 3300
вагонов. От спичечного налога государ-
ство извлекает до 22 млн. марок еже 1 2
годного дохода.
Обыкновенный фосфор—желтого цвета; нагретый на от-
крытом воздухе он, как мы знаем, сгорает. Но если его
нагреть до 250° в замкнутом пространстве, например в
1 Это теперь уже не так. Наиболее крупным спичечным производством
обладает СССР (свыше 10 млрд, коробок в год), за ним идут: Швеция,
Бельгия, а затем уже Германия. Спичечная продукция СССР составляет
около 2О°/о всей мировой продукции. (Прим перед.)
2 Химия повседневной жизни.
17
котле с плотной крышкой, то он переходит в красный
порошок; это и есть красный фосфор. Переход желтого
фосфора в красный можно легко наблюдать (рис. 9). В за-
паянную снизу стеклянную трубочку А поместим немножко
желтого фосфора и запаяем затем и верхний ее конец.
В таком виде мы подвешиваем нашу трубочку внутри
другой стеклянной трубки, в которую налита какая-нибудь
жидкость, кипящая при 250°. Когда эта жидкость на-
греется пламенем до кипения, то и трубочка А, подвешен-
ная в ее парах, нагреется до 250°; тогда мы увидим, как
желтый фосфор будет постепенно превращаться в красную
массу.
48
1930а
Рис. 10. Рост потребления спичек в СССР (в коробках на душу в год)
Красный фосфор не ядовит и загорается гораздо труднее
желтого; его нельзя воспламенить простым трением. Крас-
ный фосфор загорается при трении только в том случае,
если его воспламенению будет способствовать какое-нибудь
вещество, очень богатое кислородом.
Смеси, применяемые для головок так называемых швед-
ских спичек, не содержат вообще никакого фосфора—ни
желтого,’ни красного. Одна из самых несложных смесей
состоит из 32 частей перекиси свинца, 32 частей бертоле-
товой соли, 12 частей хромовокалиевой соли и 24 частей
сернистого свинца. Первые три вещества характеризуются
богатым содержанием кислорода, что же касается красного
фосфора, то он, смешанный со связывающими веществами,
наносится на боковую поверхность спичечной коробки.
18
Если потереть об эту поверхность богатую кислородом
смесь, укрепленную на головке спички, то на месте тре*
ния произойдет воспламенение входящего в состав «на-
мазки» на коробке красного фосфора, переходящее затем
и на всю спичку.
* Составы, применяемые для спичечных головок и для
намазки бочков коробок, бывают различные и обычно более
сложные, чем было только что указано. Вот, например,
обыкновенный рецепт Ленинградского спичечного треста
для таких составов:
Головко в 0 0
Бертолетова соль .... 46,5
Хромпик................... 1,5
Сера.................... 4,25
Цинковые белила .... 3,75
Сурик или мумия .... 15,30
Молотое стекло......... 17,20
Клей костяной ..... 11,50
Намазка в %
Красный фосфор....... 30,76
Трехсернистая сурьма . . 41,03
Сурик или мумия .... 12,83
Мел............... 2,56
Цинковые белила .... 1,54
Молотое стекло....... 3,59
Клей костяной..... 6,69
О размерах производства спичек в СССР было сказано
выше. В связи с бурным развитием промышленности, ро-
стом городов, газификацией и т. д. потребление спичек в
СССР с (каждым годом возрастает (рис. 10). Вместе с этим
растет и вывоз советских спичек за границу: уже в
1927/28 г. он в два с (половиной раза превысил довоенный*.
ЛТЛЩИЯ ВТОРАЯ
[Трирода пламени. Свечи. Состав жиров. Масла. Керосин. Уьлеводо, оды»
Химическая чистка. Элементы. Химические формулы. Атом и молекула.
Перегонка. Бензин. Сжижение угля. Вазелин. Парафин. Озон. Производство
светильного газа и его побочные продукты. Варка на газе. Газокалильное
освещение. Карбид кальция. Ацетилен. Автогенная сварка.
Сжигание веществ, содержащих углерод, служит, как
известно, не только для получения тепла, но и для осве-
щения. Однако давать пламя и свет могут лишь те горю-
чие углеродистые материалы, которые при горении пре-
вращаются в газы или в пары. Очень богатые углеродом
вещества—дерево, каменный уголь, сало—дают при горе-
нии пламя именно потому, что под влиянием высокой тем-
пературы из них выделяются горючие пары и газы. Пламя
есть не что иное, как горящая смесь газов, непрерывно
образующаяся под влиянием теплоты горения из соответ-
ствующего горючего материала, который при этом тратится.
Зажженный кусок дерева горит с образованием пламени.
Но если мы предварительно удалим из дерева все то, что
может улетучиться (путем сильного нагревания дерева без
доступа воздуха), то получим древесный уголь; будучи
зажжен, древесный уголь уже не дает пламени, а только
тлеет. Это происходит оттого, что древесный уголь не
содержит летучих веществ.
Из пламени мы можем извлечь образующий его газ и
затем зажечь последний отдельно. Введем для этого в
пламя свечи стеклянную трубку с оттянутым кончиком,
другой конец которой проходит сквозь пробку, закрываю-
щую наполненный доверху, водой стеклянный цилиндр;
этот конец находится непосредственно под пробкой. Через
ту же пробку до самого дна нашего сосуда проведена вто-
рая стеклянная трубка, соединенная с каучуковой труб-
кой, тоже наполненной водой и потому действующей как
сифон (рис. 11). Если открыть несколько зажим, которым
снабжена каучуковая трубка, то через нее начнет медленно
вытекать вода из сосуда; над 1юдой образуется разрежен-
ное пространство, почему у кончика другой трубки, нахо-
дящегося в пламени свечи, начнется всасывание; тогда
часть газов и паров из пламени будет втянута в наш сосуд.
Само пламя при этом заметно ослабеет, так как мы отняли
у него часть питающих его веществ. Всасывание нужно
производить медленно, чтобы в сосуд не проник также и
воздух.
Когда газы наполнят, наконец, сосуд, открывают пробку
и зажигают их. Газы, взятые из пламени свечи, спокойно
Рио. 11. Доказательство присутствия газов
в пламени свечи
Рис. 12. Сальная свеча
с «шляпкой» от нагара
горят. Это доказывает правильность нашего утверждения,
что в светящем пламени находятся горючие газы.
Между прочим, заметим, что слово «газ» ввел лет 300
тому назад химик Ван-Гельмонт, образовав его от грече-
ского слова «хаос». Словом «хаос», обозначающим первич-
ную бесформенную массу, первым стал называть газообраз-
ные вещества Парацельс1.
Рассмотрим теперь подробнее те три вещества, которые
1 Ван-Гельмонт —• знаменитый голландский естествоиспытатель (род. в
1577 г., ум. в 1644 г.); Парацельс — немецкий химик и врач (род. в
1493 г., ум. в 1541 г.), о котором не раз еще будет упоминаться в книге.
(Прим, персе.)
2Л
служат главным образом для освещения, а именно: свечи,
масла и светильный газ. Электричества как источника
света мы здесь касаться не будем, так как оно, относится
к области физики.
Свечи—это твердый осветительный материал. В прежние
времена для их изготовления расплавляли в сосуде сало
Вап-Гельмонт
и погружали в Него фитиль. После многократного погруже-
ния фитиля в горячее сало и последующего остывания
получались сальные свечи. Эти свечи горели, по нашим
представлениям, очень неудовлетворительно: на кончике
фитиля в них скоро образовывалась от нагара «шляпка»
(рис. 12), которую нужно было часто снимать при помощи
особых, теперь уже забытых свечных щипцов, имевших
форму ножниц.
22
Отчего появляется эта шляпка в сальных свечах? Под
влиянием высокой температуры пламени сало превращается
прежде всего в газ. Этот процесс происходит, конечно, в
фитиле, всасывающем в себя расплавленный около него
жир. Пламя дает при этом необходимую для образования
газа теплоту. Появляющиеся газы поступают в окружаю-
щий воздух и в нем сгорают: кислород воздуха переводит
содержащийся в них углерод в углекислый газ, а водо-
род—в воду. Но сам фитиль непосредственно не соприка-
сается при этом с воздухом, он отделен от последнего
подымающимися газами. Поэтому содержащийся в фитиле
углерод не может гореть вследствие недостатка кислорода,
и фитиль только обугливается. Обугленный конец фитиля
(т. е. образовавшаяся от нагара шляпка) задерживает Даль-
нейшее равномерное горение пламени. Только после удале-
23
ния этой шляпки (после «снимания нагара», как говорили
раньше) свеча снова горит спокойным и светлым пламенем.
Все это в настоящее время представляется нам не имеющим
значения пустяком, так как мы не страдаем от необходи-
мости постоянно возиться со сниманием нагара, но знаме-
нитый поэт Гёте еще говорил, что он не знал бы лучшего
изобретения, чем свечи, которые горели бы без нагара.
Итак, сальные свечи изготовляются из природного жира.
Химические исследования показали, что все жиры как
животного, так и растительного происхождения, могут быть
разложены на две главные составные части, а именно—
на жирные кислоты и глицерин. В животном жире (напри-
мер в коровьем) с глицерином связаны три жирных
кислоты, получившие названия стеариновой, пальмитино-
вой и олеиновой. Первые две при обычных температурах—
твердые вещества, а третья—жидкость. Чем больЩе в жире
содержится соединения глицерина с олеиновой кислотой
(такие соединения называются в химии глицеридами), тем
жир мягче. Очень богаты глицеридом олеиновой кислоты,
например свиное и гусиное сало.
На заводе при помощи простых приемов разлагают жиры
на их составные части—жирные кислоты и глицерин. От-
жав из смеси всех трех жирных кислот олеиновую кислоту,
получают твердую белую массу, подвергаемую дальнейшей
очистке. Она состоит таким образом из стеариновой и паль-
митиновой кислот. Хотя по своему внешнему виду такая
смесь еще похожа на жир, но она уже не представляет
собой жира. Эта смесь и является материалом для выделки
стеариновых свечей. До отливки свечей к ней прибавляют
еще 10% парафина, что придает свечам равномерный бе-
лый цвет (который мы привыкли видеть в стеариновых све-
чах), а также уменьшает их хрупкость; без прибавки
парафина смесь стеариновой и пальмитиновой кислот при
охлаждении приобретает кристаллическое строение.
В сальных свечах фитиль скручен из ниток, а в гораздо
более твердых стеариновых свечах он, по чрезвычайно про-
стому и в то же время необыкновенно удачному предложе-
нию Камбасере, сплетен из скрученных шнуров. Благодаря
напряжению, возникающему в нитках такого плетеного
фитиля, во время горения свечи он, наклоняясь в одну
сторону, высовывается своим кончиком из пламени и горит
так же хорошо, как и вещество самой свечи; высунувшийся
24
кончик фитиля вне пламени полностью сгорает за счет
кислорода окружающего воздуха. Так как при этом не
образуется нагара, то и нет никакой надобности в удалении
фитильных шляпок; свеча горит ровным пламенем. В саль-
ных свечах плетеные фитили применять нельзя, ибо, на-
клоняясь в одну сторону, они вызовут здесь чрезмерное
одностороннее плавление сала, которое гораздо мягче
стеарина.
Кроме этих свечей упомянем еще о свечах из чистого па-
рафина и из воска. В химическом отношении пчелиный
воск несколько напоминает животный жир. Его главной
составной частью также являются жирные кислоты. Воско-
вые свечи не могут быть отлиты, и их изготовление в об-
щем похоже на изготовление сальных свечей.
Из жидких горючих материалов еще лет 50 тому назад
пользовались главным образом оливковым и сурепным мас-
лом. Они горели в специально приспособленных лампах
при помощи погруженных в них фитилей, напоминающих
свечные фитили. По своему химическому составу оба эти
растительные масла очень близки к животным жирам.
Они также состоят из соединений жирных кислот с глице-
рином, особенно много в них глицерида олеиновой кис-
лоты—олеинач , При обыкновенных температурах они
являются жидкими жирами.
Напротив, нечто совершенно иное представляет собой
керосин, который как осветительный материал: теперь так-
же уже устарел. Керосин—это смесь углеводородов. Чтобы
правильно понять это слово, нам необходимо несколько
отступить от нашего изложения.
Химия изучает химические элементы и их соединения.
Элементами называются такие вещества, которые не могут
быть разложены на другие вещества никакими искусст-
венными химическими приемами1. Таких элементов из-
1 Не следует смешивать два разных понятия — химический элемент и
простое вещество. Разницу между ними легко видеть на примере угле-
рода. Углерод — это химгьческий элемент, а в свободном состоянии мы
его знаем в виде трех простых веществ — угля, графита и алмаза. В хими-
ческих соединениях углерода есть углерод, связанный с другими элемен-
тами, но нет ни угля, ни графита, ни алмаза. Следовательно, определение
понятия «элемент», данное в тексте, относится собственно не к «элементу»,
а к «простому веществу». (Прим, персе.)
25
вестно около 90. Большинство элементов встречается очень
редко и только около двадцати имеют значение в повседнев-
ной жизни. Из этих немногих кирпичиков-элементов по-
строена вся вселенная. Возможность их разнообразнейших
соединений друг с другом чрезвычайно велика. Своей спо-
собностью образовывать многочисленные химические сое-
динения особенно отличается углерод. Число разнообраз-
ных возможных соединений его атомов (так называются
наименьшие частицы какого-нибудь элемента) с атомами
других элементов или между собой в присутствии атомов
других элементов превосходит число соединений всех дру-
гих элементов, вместе взятых. В бесчисленном множестве
углеродных соединений можно однако легко разобраться,
если в качестве исходного пункта взять соединения угле-
рода с водородом.
Один атом углерода способен удержать четыре атома во-
дорода; поэтому говорят, что атом углерода четырелвален-
т&н. Мы можем эго изобразить в следующем виде:
водород
I
водород — углерод — водород
I
водород
Выше мы уже упомянули, что атомы углерода могут
также соединяться и друг с другом. Благодаря этому об-
разуются углеводороды (соединения углерода с водородом),
в которых атомы углерода соединены как друг с другом,
так. и с атомами водорода:
водор. водор.
водор. — углор. — углер. — водор. и
водор. водор.
в в в
в — у — у — у — В
I I I
в в в
Мы имеем здесь в первом случае два, а во втором случае
три связанных друг с другом атома углерода. Ряд подоб-
ных соединений мы могли бы продолжить и дальше. В ла-
боратории действительно получены углеродные «цепи»,
содержащие до 70 атомов углерода. Эти цепи углеродных
атомов могут также разветвляться в разные стороны, нако-
нец, даже замыкаться наподобие кольца.
86
В изображенных нами выше трех углеводородах мы обо-
значали названия обоих элементов сначала полностью, за-
тем сокращенно! и, наконец, только их начальными
буквами, отчего их понятность нисколько не пострадала.
Таким путем мы приходим к химическим формулам. Спо-
соб изображения третьего из данных нами углеводородов
есть уже настоящая химическая формула. Впрочем, в. хи-
мических формулах применяют почти всегда начальные
буквы латинских или греческих названий элементов. Так,
например, углерод обозначается сокращенно буквой С (от
латинского Carboneum), а водород буквой Н (от гре-
ческого Hydrogenium). Пользуясь этими двумя буквами,
мы получим формулы наших трех углеводородов в том
виде, в каком они встречаются во всяком учебнике химии:
Н НН
I I I
Н — С — Н Н — С-С — II
I ! I
Н НН
н н н
I I I
н—с—с—с—н
I I I
н н н
Химики называют эти три углеводорода:
Me гая Эган Пропан
Большое количество углеводородов, вроде метана, этана
и пропана, находится в американской нефти. Первый член
этого ряда углеводородов—метан—представляет собой газ.
Он очень богат водородом, самым легким из всех веществ.
Меган образуется при гниении в присутствии большого1 ко-
личества воды, он поднимается, например, из болот. По-
этому В старину его называли болотным газом. Он назы-
вается также* рудничным газом, так как часто скопляется
в рудниках, в которых он бывает причиной взрывов.
Следующий углеводород, этан,'молекула которого1 состоит
из 8 атомов, также еще газообразен, как и пропан, моле-
кула которого составлена из 11 атомов.
Однако прежде чем продолжать дальнейшее изложение,
необходимо объяснить значение только что употребленного
нами термина «молекула». Наименьшие частицы элементов
МЫ вызываем ато.цами; это слово греческого происхожде-
27
ния и обозначает «неделимый» х. Самые маленькие частицы
не-элементов, т. е. сложных веществ, всегда состоят из
атомов тех или иных элементов. Такие мельчайшие частицы
сложного вещества мы и называем молекулами1 2. Самой
маленькой частицей какого-нибудь углеводорода (еще со-
храняющей его химические свойства), например метана,
таким образом, будет молекула, потому что она состоит из
одного атома углерода и четырех атомов водорода.
Следующий углеводород, в котором содержится четыре
атома углерода, называется бутаном; это уже жидкость,
испаряющаяся при температуре в 1°; ее точка кипения
есть, следовательно, 1°. Так дело идет и дальше: чем
больше в молекуле углеводорода углеродных атомов, тем
выше его точка кипения. Например, находящийся в сырой
нефти пентан, с пятью атомами углерода, кипит при 36°,
а гексан, содержащий шесть атомов углерода,—при 69°.
Седьмой углеводород кипит при 98°. По мере повышения
содержания углерода эти соединения становятся все более
вязкими и, наконец, совсем твердыми.
Углеводороды добываются из сырой нефти посредством
особого процесса, который называется «фракционированной
перегонкой» (рис. 13 и 14). Если нагревать в котле сырую
нефть, из нее начнут выделяться газы. Их можно собрать
и по трубам направить в холодильник. Это и есть те угле-
водороды, которые были описаны выше: метан, этан и т. д.
Те из них, которые при обычной температуре газообразны,
выходят и из холодильника в виде газов: ведь они были
только растворены в нефти. Те же углеводороды, которые
1 Неделимыми атомы считались примерно до конца прошлого века, но
теперь известно, что атомы тоже представляют собой сложные образова
ния, которые могут распадаться. При этом само собой разумеется, что
если, например, распадается атом элемента радия или какого-нибудь дру-
гого элемента, то он уже перестает быть мельчайшей частичкой именно
радия или соответствующего другого элемента. (Прим, перев.)
2 Молекулами называют также самые мелкие частички простых веществ,
причем большинство таких молекул состоит из нескольких атомов соответ-
ствующего элемента. Например, молекула простого вещества, газа водо-
рода, состоит из двух атомов химического элемента — водорода, молекула
серы (при некоторых условиях)—-из четырех атомов серы и т. п. Таким
образом разница между молекулами простых веществ и молекулами хими-
ческих соединений заключается в том, что первые состоят из атомов
одного химического элемента, а вторые —• из атомов разных элементов.
(Прим, перев.)
as
при обычной температуре представляют собой жидкости,
после перегонки снова сгущаются в холодильнике в жид-
кость и собираются в особых сосудах, называемых прием-
никами. После удаления всех газообразных веществ темпе-
Р тс. 13. Перегонный аппарат, применяемый в лабораториях. В нагревае-
мой стеклянной колбе Н из кипящей жидкости выделяются пары, которые
поступают через припаянную сбоку трубку во внутреннюю трубку холодиль-
ника А, вставленную в более широкую трубку В. Эта последняя плотно
соединена с трубкой А посредством двух пробок С так, что между обеими
трубками может постоянно циркулировать холодная вода, входящая через
отверстие D и выходящая через Е. Вследствие охлаждения пар в трубке
А снова превращает *я в жидкость, которая каплями стекает в приемник К
Термометр, укрепленный в колбе Н, позволяет определять температуру,
при которой происходит перегонка. Подобные же по принципу действия
установки применяются и на заводах только с изменениями, связанными
с размерами производства. Разумеется, аппаратура делается там из ме-
тала, а но из стекла.
ратура повышается п начинают выделяться углеводороды
с низкими точками кипения.
Смесь пятого и шестого углеводорода называется петро-
лейным эфиром, а смесь шестого, седьмого и восьмого
углеводородов известна под названием бензина.
29
Рис. 14. Нефтеперегонный завод
Бензин часто бывает причиной взрывов. Благодаря своей
сильной летучести бензин рассеивается в воздухе; стоит
только образовавшейся таким образом смеси притти в со-
прикосновение с пламенем, как пары бензина с кислоро-
дом воздуха моментально сгорают в углекислый газ и воду.
Такое очень быстрое сгорание мы и называем взрывом.
В настоящее время бензин получил чрезвычайно важное
значение в качестве горючего для автомобильных и авиа-
ционных двигателей и именно благодаря его взрывчатости.
Ведь в автомобильном двигателе при помощи электриче-
ской искры взрывается смесь паров бензина с воздухом.
Образующиеся при этом газообразные продукты горения,
стремясь чрезвычайно быстро расшириться внутри ци-
линдра, толкают поршень, который передает свое движение
колесам.
Бензин является также средством для химической
чистки. Раньше в соответствующих предприятиях удаляли
пятна из тканей, погружая нерасяоротое платье целиком
последовательно в ряд сосудов с бензином. Но наибольшее
значение получила химическая чистка только тогда, когда
с 1894 г. стали употреблять бензиновые мыла, т. е. мыла,
легко растворимые в бензине. Таким образом бензин, ко-
торый до тех пор применялся только как растворитель жи-
ров, приобрел большое значение и в качестве моющего
средства.
После отгонки из нефти бензина температура кипения
жидкости продолжает в дальнейшем все повышаться; это
можно видеть по укрепленному в аппарате термометру.
Между 150 и 300° перегоняются в приемник углеводороды,
составляющие наш обыкновенный керосин. По закону он
должен удовлетворять определенным требованиям относи-
тельно воспламеняемости, а именно: он не должей давать
вспышки ниже 21° *.
Еще выше кипящие части дают горючее для дизельных
и газовых двигателей. Остаток в кубе от американской
нефти, после отгонки собственно керосина, имеет консистен-
цию масла и перерабатывается на вазелин и парафин. Из
так называемой русской нефти после отгонки керосина
* Температурой вспышки называется та температура, при которой жид-
кость (бензин, керосин и др.) выделяет такое количество паров, что под-
несение огня к жидкости вызывает легкую вспышку. По законам СССР
температура вспышки керосина не должна быть ниже 28° (Прим, персе.).
31
получаются остатки, дающие при дальнейшей обработке
смазочные масла.
* В СССР есть также нефти, больше подходящие к пер-
вому типу (например сураханская) и промежуточные
между обоими типами (большинство грозненских).'*
Нефть, или горное масло, из года в год приобретает
все большее значение (рис. 15), так как в результате
технических усовершенствований все больше расширяется
область применения этого превосходного источника энер-
гии. Если прежде нефть шла главным образом в пере-
работку на керосин для целей освещения, то теперь огром-
ные ее количества потребляются в качестве горючего для
дизельных двигателей, которыми снабжена чуть ли не
целая треть всех судов. Кроме того большие ее количе-
ства перерабатываются на бензин. И так как в настоящее
время по земле ездят уже около 30 млн. ’автомобилей
(из них в одной только Германии около миллиона), то
82
потребность в бензине настолько повысилась, что возни-
кает вопрос: каким образом спрос на бензин будет удо-
влетворен в будущем? Ведь бензин дают только низко
кипящие составные части сырой нефти!
Это затруднение преодолевается теперь тем, что бен-
зин получают с помощью «крекинг-процесса» из менее
ценных составных частей нефти, кипящих при более высо-
кой температуре. Молекулы высоко кипящих тяжелых
фракций действием повышенного давления и температуры
в присутствии особых ве-
ществ, благоприятствующих
химическому процессу \ рас-
щепляются и переводятся
в молекулы низкокипящих
составных частей бензина.
Малоценные вещества та-
ким путем, как говорят,
«облагораживаются».
* Рост д обычи нефти в
СССР показан на рис. 16,
а рост выпуска автомоби-
лей на рис. 17. Этот рост
особенно характерен на фо-
не сокращения производст-
ва автомобилей в капита-
листических странах. Так, в
США в 1933 г. выпуск авто-
мобилей по сравнению с
1930 г. сократился на 42%,
во Франции на 17%, в Ита-
лии на 10%. Автомобили вы-
Миллионы тонн
---------------------------
5
1913 г 192/28 1932 1934
Рис. 16. Рост добычи нефти в СССР
пускают в СССР Московский, Горьковский и Ярославский
автозаводы. Согласно решению XVII съезда партии, будут
построены три новых автозавода: в Уфе и Сталинграде
мощностью по 100 тыс. трехтонных грузовиков в год каж-
дый и в Куйбышеве мощностью в 25 тыс. пятитонных
грузовиков в год.
1 Такие вещества, и (меняющие скорость химической реакции обычно
в сторону увеличения и сами остающиеся после реакции неизменными,
называются в химии катализата ламгб. Они применяются далеко на при
всех методах крекинг-процесса. (Прин, перво.)
3 Химия повседневной жизни.
33
Большое развитие получает в СССР и крекинг-процесс.
Первая установка для крекинга появилась в 1929 г. в
Баку, а теперь они работают—в Баку, в Батуне, в Гроз-
ном, в Туапсе, в Ярославле и других местах, строится
ряд новых установок. А что дает их работа, видно из
следующих цифр: в 1913 г. в старой России было до-
быто бензина и лигроина 204 тыс. т, а в 1931 г. со-
ветские заводы дали 2677 тыс. т, т. е. в 13 раз больше.
9?
Рио. 17. Выпуск автомобилей в СССР (в тыс. шт.)
И это при росте добычи нефти за соответствующие годы
с 9 млн. т до 18 млн. :т, т. е. в два раза. й
В последнее время в странах, не имеющих нефтенос-
ных земель, делаются попытки совсем освободиться от
нефтяной зависимости, получая горючее масло из камен-
ного угля, т. е. сжижая его. Таким путем получают неочи-
щенное масло, из которого путем перегонки можно полу-
чить все вещества, извлекаемые из сырой нефти, и прежде
всего бензин. Для Германии этот метод имеет огромное
значение, так как он позволяет сэкономить около 200 млн.
марок, которые приходится платить за границу за вво-
зимый бензин.
Из способов сжижения угля мы упомянем здесь только
о методе Бергиуса. По этому методу уголь сначала разма-
лывается в мелкий порошок и к нему добавляется камен-
ноугольная смола. Полученная густая паста нагревается
затем до 400—500° и подвергается воздействию водорода
при давлении в 200 атмосфер. Водород при таких усло-
Ф Бергиус
виях присоединяется к молекулам твердых углеводородов,
содержащихся в угле, причем последние расщепляются
с образованием молекул жидких углеводородов; это про-
исходит опять-таки в присутствии катализаторов. Из
1000 кг угля получается таким путем 490 кг масла, ко-
торые дают при перегонке 150 кг бензина, 200 кг дизель-
ного горючего и, кроме того, смазочное масло и жидкое
топливо.
Мы имеем уже понятие о том, что такое атомы и моле-
кулы. В связи с этим дополним наши сведения о кисло-
*•
85
роде. Дело, в том, что наряду с обыкновенным кислородом
существует еще его видоизменение, известное под назва-
нием озона. Как же возможно существование двух видо-
изменений кислорода?
Исследования показывают, что каждая мельчайшая ча-
стица свободного кислорода, находящегося в воздухе,
должна состоять по крайней мере из двух атомов, т. е.
должна всегда представлять собой молекулу. Однако в
известных условиях с кислородом может произойти то,
что вместо двух атомов в молекулу соединятся три атома
(например, при пропускании через него1 электрических
искр). В природе это происходит всегда во время грозы.
Впрочем, такое соединение трех атомов, кислорода не очень
прочно, и, как только представляется благоприятный слу-
чай, третий атом опять отрывается, чтобы соединиться
с чем-нибудь другим. Поэтому озон отличается особенно
сильным окисляющим действием. Этот вид кислорода, ча-
стицы которого состоят из трех атомов, получил название
озон, потому что он обладает запахом и его можно обо-
нять, а по-гречески обонять—ozein.
0=0 0—0
о
молекула кислорода молекула озона
В настоящее время озон получают с помощью электри-
чества—тихими разрядами высокого напряжения. Он имеет
широкое техническое применение. Озон разрушает вредные
примеси в воздухе, окисляя их в безвредные газы. При
помощи особых аппаратов, выделяющих озон, освежают
испорченный воздух в учреждениях, театрах, пароходах,
гостиницах; озон уничтожает плохой запах в кухнях, на
бойнях. Он уничтожает зародыши микроорганизмов, и с
его помощью стерилизуют питьевую воду. В прачечных
озон применяют для беления, так как он меньше разру-
шает ткани, чем хлорная известь. Отбелка тканей на
лугах основана также на действии озона.
В объявлениях о курортах часто можно читать о «бога-
том озоном воздухе». Это, конечно, бессмыслица. Богатым
озоном воздухом никто не может дышать, так как озон
сильно раздражает слизистые оболочки. Да и воздух не
может быть «богат озоном»: как только при солнечном
36
свете в лесах, богатых смолистыми деревьями, образуется
озон, он тотчас же и исчезает вследствие своего1 окисляю-
щего и стерилизующего действия.
Из- осветительных материалов мы скажем еще о све-
тильном газе и ацетилене.
Если в замкнутой железной трубке А (рис. 18) сильно
нагревать на газовой печи В такие материалы, как дрова
или каменный уголь (подвергать их, следовательно, «сухой
перегонке»), то из них начнет выделяться в виде газов
и паров все, что может улетучиваться под влиянием вы-
сокой температуры. Через трубопровод выделяющиеся ве-
Рис. 18. «Газовый завод» для лекционных целей
В нашей установке пары сгустятся в сосуде С в виде
дегтя и так называемой аммиачной воды. Напротив, те
вещества, которые остаются в газообразном состоянии и
при обыкновенной температуре, пройдут дальше через со-
суд D и будут собраны в стеклянном цилиндре Е, слу-
жащем здесь газгольдером (газоприемником).
Наш аппарат представляет собой в основных чертах ма-
ленький газовый завод. На городских газовых заводах
в качестве исходного материала пользуются почти исключи-
тельно каменным углем, а вместо1 больших железных труб
употребляют реторты из огнеупорной глины (так называе-
мого шамота) или сложенные из шамотных камней ка-
меры, потому что они выдерживают длительное действие
37
жара лучше, чем железо. 100 кг хорошего каменного угля
дают свыше 30 тыс. л газа (весом около 18 кг), а кроме
того, около 5 кг дегтя и 4 кг аммиачной воды, да еще
70 кг кокса в виде нелетучего остатка в реторте.
Деготь отделяется из перегоняющейся смеси путем охла-
ждения, которое в нашей установке происходит в колбе С.
После освобождения от дегтя газ пропускают через воду
(промывают).
В воде растворяются некоторые из его составных частей,
важнейшей из которых (также и по количеству) является
аммиак. Если бы он оставался в светильном газе, он зна-
чительно ухудшал бы качества последнего.
Аммиак представляет собой соединение азота и водорода.
Оба эти элемента находятся в каменном угле в составе
чрезвычайно сложных веществ. Аммиак образуется из них
в условиях высокой температуры реторт при распадении
этих сложных веществ на сравнительно простые соедине-
ния. В воде аммиак очень легко растворяется и в таком
водном растворе известен как жидкость с очень резким
запахом, называемая нашатырным спиртом.
В наш аппарат (рис. 18) мы включили еще сосуд D.
Если в него поместить гидрат окиси железа, то этот сосуд
будет соответствовать особому приспособлению, применяе-
мому на газовых заводах для дальнейшей очистки газа.
Газовые заводы употребляют для этого болотную руду;
она имеет сходный с гидратом окиси железа химический
состав и требует только предварительно тонкого размола.
Гидрат окиси железа применяют здесь с целью удалить
из светильного газа те газы, в состав которых входит
сера; она при этом поглощается почти целиком, обра-
зуя сернистое железо. Если бы сера оставалась в газе,
то она сгорала бы в сернистый газ (двуокись серы)—газо-
образное вещество, известное каждому по резкому запаху
горящей серы; в пламени светильного газа сернистый
газ частично превращался бы даже и в серную кислоту.
Более точное представление о составе светильного газа
могут дать следующие данные анализа одного из его сортов:
в %
Окиоь углерода.............. 8,6
Азот....................... 4,8
Углекислый газ.............. 2,0
в о/°
Водород..................... 45,2
Метан................. 85,)
Другие углеводороды . . , 4,4
100,0^
3?
При горении светильного газа из содержащегося в нем
углерода образуется углекислый газ, а из водорода—вода,
которая при высокой температуре горения получается в
парообразном состоянии. Таким образом в процессе го-
рения светильный газ, видимо, полностью исчезает, пере-
ходя в два других газообразных вещества, лишенных цвета
и запаха. Однако вследствие содержания в светильном
газе небольших количеств сернистых соединений при его,
горении всегда получается также немного сернистого газа.
Этот последний является причиной того, что в помещениях,
где применяется светильный газ, не могут развиваться
комнатные растения. Сернистый газ губительно отражается
на росте всякого растения, хотя для человека такие ни-
чтожные его количества, к счастью, оказываются совер-
шенно безвредными.
Выделение сернистого газа происходит не только при
горении светильного газа, но и во всех тех случаях, когда
сжигается уголь и образуются дымовые газы,—из фабрич-
ных труб, паровозов и т. д. Это причиняет большой вред
растительности, страдают от этого также и строения.
В воде сернистый газ растворяется и химически соеди-
няется с ней, образуя сернистую кислоту, которая путем
присоединения кислорода воздуха окисляется в серную
кислоту. О количествах освобождающейся из дымовых га-
зов сернистой кислоты обычно имеют ошибочное пред-
ставление, но его может уточнить одна цифра: паровоз
за час работы выделяет в окружающее пространство
2—2,5 кг свободной сернистой и серной кислоты.
*По подсчетам Мосэнергостроя, только две электроцен-
трали г. Москвы, которые будут работать на подмосковном
угле, в час будут сжигать 1000 т угля. В этом коли-
честве содержится 20 т серы, следовательно в сутки
здесь будет сжигаться 480 т серы, что соответствует
1450 т серной кислоты. В год это составит больше
500 тыс. т серной кислоты, которая с атмосферными осад-
ками падала бы в Москве и окрестностях на землю, раз-
рушая растительность и строения. Электроцентраль в Бат-
терси (близ Лондона), работавшая на аналогичном топливе,
ежегодно уплачивала сотни тысяч рублей на покрытие
убытков, причинявшихся населению. Вот почему улавли-
вание сернистого газа из дымовых газов представляет
чрезвычайно важную задачу, которая при современном
39
состоянии техники, несмотря на трудности, вполне раз-
решима. ☆
О природе светящего пламени, как впервые установил
английский физик Дэви, легче всего составить себе ясное
представление на примере горящего газа. Что в светящемся
пламени содержится очень много углерода,—можно вполне
убедиться, введя в него фарфоровую тарелку: вследствие
вызываемого ею охлаждения углерод осаждается на ней
в виде копоти. Углерод выделяется благодаря высокой
температуре пламени углеводородов и, накалившись до-
бела, вызывает свечение пламени. Приходя у краев пла-
мени в соприкосновение с кислородом воздуха, он сгорает
в углекислый газ, который улетучивается. Чем больше
кислорода (заключающегося в воздухе) притекает к го-
рящему пламени, тем больше сгорает в нем углерода,
пламя делается вместе с тем более горячим, меньше коптит
и в то же время теряет свою яркость, потому что в нем
уже не накаливается много углерода. Химики употре-
бляют поэтому для нагревания горелку, изобретенную Бун-
зеном, которая с необходимыми изменениями применяется
в настоящее время и в газовых плитах.
На рис. 19 изображена бунзеновская горелка в собранном
виде (В) и ее отдельные части (A, D и Н). Газ поступает
в подставку горелки А через отверстие В и резиновую
трубку. Он устремляется вверх и выходит через отвер-
стие С. Если его здесь зажечь, он горит обычным светя-'
щимся пламенем. Однако в таком виде горелка никогда
не применяется. Для пользования ею к кончику С при-
крепляют при помощи винтовой нарезки трубку D, снаб-
женную отверстиями В на высоте кончика С. Благодаря
этой трубке газ по выходе из отверстия С устремится даль-
ше по трубке, засасывая воздух через отверстия В; у конца
трубки теперь будет уже выходить смесь светильного
газа с воздухом. На трубку D надета подвижная муфта В,
также снабженная отверстиями и дающая возможность регу-
лировать приток воздуха, излишек которого действовал бы
уже охлаждающе. Если теперь зажечь горелку у ее про-
долженного трубкой D конца, то пламя не будет уже све-
титься, потому что в нем находится теперь столько воз-
духа, что кислород вызовет сгорание всего содержащегося
в светильном газе углерода. Вместе с тем благодаря та-
кому сильному горению достигается и высокое тепловое
40
действие. Если же мы закроем отверстие наружной трубки
и таким образом прекратим доступ воздуха в горелку,
пламя, как и следует ожидать, начнет снова, светиться.
Совершенно такое же устройство имеется и во всех
газовых плитах. Там также из отверстия за краном выте-
кает газ, а рядом через несколько отверстий через более
широкую трубку поступает воздух. Эта' трубка подводит
с
Рис. 20. Газокатильная
горелка
Рис. 19. Бунзеповская горелка и ее отдель-
ные части
смесь воздуха с газом к месту горения, где газ и сгорает
несветящимся пламенем.
* Теперь делают горелки в газовых плитах и с несколько
иным устройством, но принцип горения остается тот же. *
Несветящееся пламя вследствие быстрого сгорания всего
поступающего в него углерода дает очень высокую темпе-
ратуру. Если, например, ввести в это пламя пучок пла-
тиновой проволоки (платина даже при такой темпе-
41
ратуре химически ни в малейшей степени не изменяется),
то он сильно раскалится и начнет ярко светиться.
Газокалильное освещение (рис. 20) основано на подобном
же устройстве, но только с большими усовершенствова-
ниями. Здесь, как и в бунзеновской горелке, пламя обес-
цвечивается притоком воздуха; для этого внизу горелки
имеется несколько (большей частью четыре) маленьких
отверстий у того места, куда притекает газ. Несветящееся,
очень горячее пламя приводит в сильно раскаленное со-
стояние висящую в горелке сетку, состоящую из окислов
редких металлов, а именно из 1%' окиси церия и 99%
окиси тория. Химикам давно уже было известно, что эти
окислы при сильном нагревании излучают очень яркий
свет, но использовать эти свойства для обыденной жизни
удалось лишь Ауэру фон-Вельсбах. Изобретенный им спо-
соб изготовления гаэокалильной сетки состоит в том, что
ткань в форме чулка погружают в раствор азотноцериевой
и азотноториевой солей и затем сжигают. Образующиеся
при этом окислы церия и тория сохраняют форму ткани
и образуют хрупкую калильную сетку. Уже в 1885 г.
Ауэр получил калильный свет для комнатного освещения,
однако годным для практического применения его изо-
бретение сделалось только в 1891 г. С тех пор здесь были
произведены еще многие улучшения. Правильным сме-
шением обоих окислов постепенно добились того, что
прежний бледный, похожий на лунный, свет сменился
приятным для глаз белым светом. Таким образом в прежнем
газовом освещении свет получался от выделяющегося и
накаляющегося в пламени углерода; в современных же
ауэровских горелках раскаляются окислы названных выше
металлов, которые при этом по своим природным свойствам
излучают совершенно особенный яркий свет. •
Повседневный опыт показывает, что различные тела при
высоких температурах изменяются. Химия пользуется
этим, с одной стороны, для разложения веществ, а о дру-
гой,—для их соединения. С тех пор как научились полу-
чать температуры, превосходящие все ранее известные,
создалась возможность получать и такие соединения, ко-
торые раньше не могли быть получены. Особенно высокие
температуры получаются между концами угольных стер-
48
жней в электрической дуговой лампе, представляющей
собой но что иное, как электрическую печь.
Если поместить между угольными электродами смесь
извести с углем, то в этих веществах развивается на-
столько высокая температура, что они плавятся и всту-
пают во взаимодействие друг с другом, чего не бывает
в других условиях. Таким путем в электрической печи
из угля и извести получается новое вещество, называе-
мое карбидом кальция.
Карбид кальция весьма устой-
чив при нагревании, по отно-
шению. же к воде он неустой-
чив, обнаруживая здесь сходство
с одним из исходных материа-
лов для его получения, а именно
с жженой известью, которая
«гасится» водой. При обливании
карбида кальция водой образу-
ется газ, который уже давно
был получен химиками другим
Рис. 22. Прибор для получе-
ния ацетилено-кислородного
пламени: слева — аппарат для
получения ацетилена, справа—
стальной цилиндр со сжатым
кислородом, внизу — горелка
Рис. 21. Горелка для ацетиленового
пламени с кислородом
способом и назван ацетиленом. Раньше он добывался со
значительными трудностями и стойл поэтому очень дорого,
но с 1895 г., когда для получения ацетилена достаточно
было облить водой дешевый карбид кальция, он приобрел
значение как осветительный материал. Правда, в настоя-
щее время ацетилен применяется для освещения только
в велосипедных и экипажных фонарях, зато он получил
теперь огромное техническое значение в такой области,
о которой никто вначале не мог думать. Если ацетилен
43
Рис, 23. Автогенная сварка
зажечь не в воздухе, а в кислороде (который легко до-
бывается из жидкого воздуха и дешево продается в сталь-
ных баллонах), то получается чрезвычайно горячее пламя.
Применяемая в этом случае горелка та же, что и при
дутье гремучим газом (с ее помощью производится и без-
опасное сжигание гремучего газа, т. е. смеси водорода
с кислородом). Горелка эта (рис. 21) устроена следующим
образом.
Ацетилен (а при дутье гремучим газом—водород) впу-
скают в горелку через трубку С и зажигают его- у отвер-
стия А, через трубку же В впускают кислород. Оба газа не
перемешиваются внутри горелки, а соединяются только
у отверстия А, т. е. в месте горения. Благодаря этому
у отверстия А получается пламя ацетилена (при дутье
гремучим газом—водорода), раздуваемое кислородом. В аце-
тиленовом пламени очень быстро расплавляются даже тол-
стые куски стали. На этом основана «автогенная сварка»
(рис. 22 и 23), которая позволяет удобно спаивать два
куска железа.
Для подобного спаивания железа по старому способу
нужно накалить добела подлежащие спайке места и затем
«сваривать» их ударами молота. Проделать это с двумя
большими металлическими листами, разумеется, чрезвы-
чайно трудно. Теперь эту работу может произвести с по-
мощью автогенной сварки без большого труда каждый
опытный рабочий, совершенно не пользуясь при этом мо-
лотом. Он складывает оба куска, на стык помещает желез-
ную проволоку и направляет сюда раздуваемое кислородом
ацетиленовое пламя. Оно имеет температуру около 3500°,
и поэтому края железных листов, а также и железная
проволока, почти моментально плавятся и сливаются во-
едино. По охлаждении получаются безукоризненно сва-
ренные куски железа.
Насколько велика температура ацетиленового пламени,
видно из wo, что железо при красном калении имеет
температуру 600°, а при белом 1300°.
ЛЕКЦИЯ ТРЕТЬЯ
Питание растений. Удобрение. Плодосмен. Пар. Поддержание плодоро-
дия почвы с помощью искусственных удобрений. Пости. Суперфосфат.
Томасова мука. Калиевые соли. Азотные удобрения. Синтетический ам-
миак. Искусственная селитра. Цианамид кальция. Питание человека и
животных. Белок. Жиры. Углеводы. Молоко и его свертывание. Сыр.
Фибрин. Антидифтерийная сыворотка. Кормовые средства. Клей. Опыты
воспроизведения пищеварительных процессов.
Земля состоит из минеральных веществ и окружена воз-
духом и водой. Растения добывают все, необходимое для
своего существования, из минеральных веществ, животные
же лишены этой возможности, и их питание прямо или
косвенно зависит от растительного мира. Дерево, например,
веками стоит на одном месте, и природа доставляет ем,у
все необходимое для жизни. Дождь обеспечивает его тре-
буемой влагой, из углекислого газа воздуха дерево чер-
пает углерод, в котором оно- нуждается для построения
древесины и других сложных веществ, необходимых для
жизни. Листья—вернее находящиеся в них зеленые зерна,
называемые хлорофилловыми зернами,—обладают загадоч-
ной способностью при помощи солнечной энергии и в при-
сутствии воды разлагать углекислый газ воздуха, со-
стоящий из углерода и кислорода, таким образом, что
углерод поглощается растением, а кислород выделяется
обратно. Это тем более замечательно, что углекислый газ
отличается чрезвычайной прочностью; в лабораторных
условиях его удается разложить на составные части лишь
с большими трудностями. Ведь он образуется, как мы
знаем, как раз при высокой температуре пламени. Изуче-
ние этого процесса показывает, что, например, весь древес-
ный уголь, доставляемый нам лесом, происходит из
воздуха!
Все нужные растению минеральные вещества (т. е. про-
исходящие из неживой природы) доставляются почвой,
4в
на которой оно произрастает. Мы можем видеть эти веще-
ства при сжигании дерева. Содержащийся в нем углерод
при этом снова уходит в воздух в виде углекислого газа,
вода испаряется, а минеральные составные части остаются
в виде золы. На золу раньше смотрели, как на нечто
второстепенное, и только великий химик Либих в 1850 г.
впервые установил, что зола является ключом для пони-
мания условий жизни растения. Это навело Либиха на
мысль об искусственных удобрениях и сделало его одним
из величайших благодетелей человечества.
Ржаной колос во время цветения дает 6,88% золы от
всего веса растения, а спелые зерна ржи 1,93%. Самая же
зола характеризуется следующим составом (в процентах):
Состав золы
Ржаного колоса Ржаных верен
Фосфорной кислоты 20,35 47,52
Калиевых солей 37,16 34,50
Кремнезема 24,88 2,75
Окиси кальция и окиси магния , . 12,32 14,13
Серной кислоты . , 4,03
Поваренной соли 0,76 0,90
Окиси железа .......... 0,50 С,20
Все эти составные части должна содержать в себе почва,
чтобы на ней хорошо росла рожь. В некоторых из них,
например в кремнеземе (химическое обозначение чистого
кварцевого песка) или окиси железа, никогда не бывает
недостатка, но другие истощаются по мере снятия уро-
жаев, и почва вследствие этого делается менее плодород-
ной. Из исследований Либиха следует, что для предупре-
ждения истощения почвы в нее необходимо вводить со-
единения фосфора, калиевые соли, известь и азотные со-
единения.
Все культурные народы с древних времен занимались
земледелием, но ясного представления о процессах роста
растений они не имели. Конечно, попытки выяснить эти
процессы делались давно, но до 1850 г. к ясному их по>
ниманию не пришли. Даже Тэер, этот великий реформа-
47
тор земледелия, один из первых ученых, пытавшихся
научно объяснить эти процессы, считал вещества, золы
только второстепенными составными веществами и не при-
знавал их необходимым условием роста растений. Он по-
лагал, что растения произрастают тем лучше, чем толще
в почве слой перегноя, т. е. количество истлевших там
остатков живых существ. В настоящее время без преуве-
личения можно сказать, что до установления Либихом
Ю. Либих
истинного положения дела все земледелие было хищни-
ческим, так как почве не возвращались те минеральные
части, которые уносились из нее вместе с урожаем. Неко-
торые области, бывшие некогда высококультурными и пло-
дородными, оказались из-за такого хищнического ведения
хозяйства совершенно истощенными.
Уже с давних времен заметили, что урожайность почвы
все более и более падает, если засевать одно и то же
растение на поле в течение нескольких лет под ряд. По-
этому возделывание растений стали производить в опреде-
48
ленной очередности. Уже в книгах, дошедших до нас от
классической древности и занимавшихся вопросами земле-
делия, мы находим советы применять плодосмен; в сель-
скохозяйственной литературе до второй половины XVIII сто-
летия нет в сущности ничего такого, о чем не тракто-
вали бы старинные книги, написанные около 2000 лет
тому назад. Причина более высокой урожайности при
плодосменной системе заключается в том, что различные
растения неодинаково используют разные минеральные со-
ставные части почвы: одни берут, например, больше со-
единений фосфора, другим фосфора требуется меньше,
зато нужно больше калия и т. д.
С древнейших времен земледельцы удобряли свои поля
отбросами хозяйства и таким образом частично возвращали
почве то, что она им давала: они видели, что таким пу-
тем повышается производительность почвы. Но земледелец
многое из своего хозяйства продает, а потому ежегодно
из почвы извлекается известное количество минеральных
веществ без соответствующего возмещения, и ее плодо-
родие, несмотря на удобрение, падает. Это также выявля-
лось на результатах урожая, но истинной причины дан-
ного явления не понимали.
Такого рода наблюдения привели к применению так
называемого «пара». После снятия урожаев в течение не-
скольких лет, поля оставляли на один год незасеянными,
и это повышало на ближайшее время их плодородие. На
чем же основано действие пара?
Фосфорные соединения и калиевые соли находятся в
почве в виде обломков горных пород, большею частью
нерастворимых в воде. В таком виде они не могут быть
усвоены корнями растений, так как последние способны
всасывать только растворенные вещества. Но влага со-
вместно с циркулирующей в почве углекислотой посте-
пенно воздействует на нерастворимые вещества, переводя
их в растворимое состояние. Обломки горных пород таким
путем постепенно благодаря химическим реакциям пре-
вращаются в другие вещества или, как говорят, подвер-
гаются химическому «выветриванию».
Углекислота поступает в почву не только из воздуха,
ио большей частью—до 75 № на 1 га ежедневно—также
благодаря жизнедеятельности бактерий, содержащихся в
почве в количестве 200—400 кг на 1 га плодородного
4 Химия повседневной жиз^и.
49
верхнего слоя. Эти почвенные бактерий разлагают отмер-
шие части растений и навоз и образуют таким образом
перегной (гумус). Большое количество образующейся при
этом углекислоты переводит в почве нерастворимые соли
фосфорной кислоты в растворимые, а кроме того, и само
оказывается очень полезным для роста растений. На этом
основано преимущество богатой перегноем почвы перед
песчаной.
Если, значит, в течение года не извлекать из почвы
запаса минеральных веществ, ставших благодаря выветри-
ванию пригодными для питания растений (т. е. раствори-
мыми в воде), то этого запаса (вместе с тем, который обра-
зуется каждый год при выветривании) оказывается до--
статочно для получения в течение, некоторого времени
урожая.
Только примерно в 1750 г. сделали наблюдение, что
если поля в тот год, в который они предназначались для
пара, засеять клевером, то урожай зерна в следующем
году нисколько не страдает. Это происходит оттого, что
длинные корни клевера добывают себе минеральные ве-
щества из таких глубин почвы, которые недоступны для
хлебных злаков. Для тогдашнего времени это было боль-
шим шагом вперед, так как усиленное поступление кормов
позволяло держать гораздо больше скота, а это в свою
очередь давало возможность иметь больше удобрения.
Когда же почва мало-по-малу утомлялась от клевера (как
это вскоре показала практика), на ней сеяли горох, бобы,
картофель и т. п. Таким путем пришли к правильному
плодосмену, включая время от времени в него культуру
клевера. ;
С прекращением применения пара эта система стала воз-
можной только потому, что различные растения извлекают
из почвы отдельные питательные неорганические соли в
различных количествах, и притом—одни из более глубо-
ких, другие из более поверхностных ее слоев. Таким об-
разом при правильном плодосмене особенно сильно потре-
бляемые определенными растениями минеральные вещества
в предшествующие годы извлекались из почвы другими
растениями в слабой степени. При четырехлетнем плодо-
смене пшеницы, картофеля, ячменя и клевера один гектар
пахатной земли давал минеральных веществ в среднем
(в килограммах): -
50
Пшеница Картофель Ячмень Клевер Всего за 4 года
Фосфорной кислоты .... 35,2 27,3 30,5 36,2 129,2
Калиевых солей 61,5 102,7 60,5 144,0 368,7
Кремнезема 175,4 10,8 138,6 26,0 350,8
Окиси кальция и магния . . 34,9 25,5 35,3 206,4 302,1
В настоящее время потери почвы, вызванные уборкой
урожая, поскольку они не возмещаются естественным
удобрением, покрываются искусственными удобрениями.
Величайшая заслуга Либиха и заключается в том, что
он открыл и указал единственно правильный путь к по-
стоянной поддержке плодородия почвы возвратом ей тех
составных минеральных частей, которые уносятся из нее
растениями. Он как бы научил «приготовлять хлеб из
камня».
Перейдем теперь к изготовлению искусственных удобре-
ний. Большинство применяемых для этого сырых мате-
риалов непригодны для удобрения в том виде, в каком
их дает природа, и должны быть переработаны на хими-
ческих заводах, для того чтобы они сделались пригодными
для земледелия.
Главнейшими источниками для добывания дешевых фос-
форных удобрений являются кости, фосфориты и томасова
мука.
Кости в большей своей части состоят из фосфорнокаль-
циевой соли, кроме того, в них содержится еще жир и ве-
щество, дающее клей. Жир удаляется из костей посред-
ством выварки с бензином и применяется для выделки све-
чей или мыла. Точно так же и клей (так называемый ко-
стяной клей) извлекается из костей химическим путем.
Если кости сильно нагревать в замкнутом сосуде, снаб-
женном только отводной трубкой для газов и паров
(т. е. если поступать с костями так же, как поступают
61
е каменным углем при получении светильного газа), то
в сосуде образуется густая черная масса, так называемый
костяной уголь, соответствующий коксу на газовых заво-
дах. Этот уголь обладает замечательной способностью обес-
цвечивать окрашенные растворы. Если взболтать с костя-
ным углем, например, красное вино и затем профиль-
тровать, то получится прозрачная, как вода, жидкость,
отличающаяся от красного вина только тем, что она бес-
цветна. Этой обесцвечивающей способностью костяного
угля пользуются в различных отраслях промышленности,
например, таким путем получают совершенно белый цвет
у сахара.
Если тонко размолоть костяной уголь и смешать его
с подходящими смазочными материалами, то получится
сапожная вакса.
Если нагревать кости не в замкнутом сосуде, а на от-
крытом воздухе,—они делаются белыми, так как весь
углерод при этом сгорает. Такие добела обожженные кости
служат исходным материалом в производстве костяной муки
для удобрения. Они также применяются для добывания
фосфора и для изготовления молочного стекла.
Источником для получения фосфорных удобрений слу-
жит кроме костей в гораздо большей степени фосфорно-
кальциевая соль, встречающаяся в виде минерала во мно-
гих местностях. Этот минерал называется фосфоритом, или
также апатитом, и всегда1 содержит большее или мень-
шее количество примесей. Во Флориде (Северная Америка)
он находится в больших количествах, причем содержит
в среднем до 82% фосфорнокальциевой соли. Так как со-
держащиеся во флоридском фосфорите примеси мало за-
трудняют его переработку на удобрение—«суперфосфат»,
то этот минерал имел широкий сбыт по всему миру вплоть
до 1895 г. Но с этого времени у него появился конкурент
в Америке со стороны вновь открытых залежей в Теннеси,
в Европе же его сбыт уменьшили весьма ценные место-
рождения, открытые в Северной Африке.
*По запасам фосфоритов на первом месте среди всех
стран мира стоит СССР. Залежи фосфоритов здесь имеются
в различных местностях, наиболее крупные из них—
Актюбинское месторождение (Казакстан), Подмосковное,
Вятское, Уральское, Средневолжское, Кинешемское, По-
дольское и Чувашское. Запасы только первых трех круп-
52
нейших месторождений составляют 1200 млн. т. В 1926 г.
в СССР были открыты мощные залежи высокоценных апа-
титов в Хибинах (Кольский полуостров), крупнейшие в
мире. Одни только разведанные запасы в Хибинах со-
ставляют сотни миллионов тонн, а вероятный запас—мил-
лиард тонн.
Хибинская апатитовая руда
вначале не получила за гра-
ницей признания, но уже с
1929 г. начался ее экспорт за
границу, который с каждым
годом все возрастает (рис. 24).
Заграничные специалисты
считали, что хабинская руда
непригодна для приготовле-
ния из нее удобрений из-за
содержащихся в ней приме-
сей. Однако коллектив совет-
ских научных институтов на-
шел способ использования
апатита для удобрений. Трест
«Апатит» построил в Кировске
(бывш. Хибиногорск) един-
ственную в мире мощную обо-
гатительную фабрику для от-
деления большей части при-
месей из апатита. Полученный
обогащенный продукт был
тщательно проверен на совет-wpo/on ]qn?
ских суперфосфатных заводах. ‘-3/JU 13 Jl K’JJs
С его появлением на внеш- Рис. 24. Рост экспорта хибинской
нем рынке началось победное апатитовой руды (в тыс. т)
шествие советского апатита.*
Большую роль играло в прежнее время также гуано, но
вследствие исчерпания залежей его теперь оно все больше
отходит на задний план. Гуано состоит из разложившихся
экскрементов морских птиц и встречается крупными от-
ложениями на берегах Перу и на близлежащих островах.
Гуано особенно богато фосфорной кислотой и, кроме
того, содержит много азота.
Наконец, открытый в 1879 г. процесс дефосфоризации
железа, который мы рассмотрим в одиннадцатой лекции,
63
дает так называемую томасову муку, получившую свой
название от имени одного из двух изобретателей этого про-
цесса. Томасова мука является для сельского хозяйства
весьма ценным и притом чрезвычайно дешевым фосфорным
удобрением.
В большинстве названных материалов фосфор находится
в том же соединении, как и В почве, т. о. в виде нераство
римой фосфорнокальциевой соли. Если подвергнуть эти
материалы тонкому размолу и в таком виде внести в почву,
то их действие оказывается неудовлетворительным, так
как они лишь очень медленно переходят путем выветри*
вания в растворимое и, следовательно, усвояемое расте-
ниями состояние1.
Так как процесс выветривания богатых фосфором гор-
ных пород длится в почве целые века, то для земледельца
такие материалы потеряли бы всякую ценность: растения
могли бы их использовать лишь по истечении многих
столетий. Совсем другое дело, если подвергнуть эти фос-
фаты, так сказать, искусственному выветриванию, т. е.
превратить их в растворимые соединения путем химической
переработки. Искусственное «выветривание» фосфатов, т. е.
их химическая переработка, согласно указаниям Либиха,
заключается в том, .что их тонко измельчают и в таком
виде обрабатывают крепкой серной кислотой. Производство
это было организовано в Англии в 1841 г. и с тех пор
лучшего способа не было найдено. Получаемое таким
путем искусственное удобрение было названо суперфос-
фатом, потому что его действие лучше (выше) фосфата
(super—выше). То, что циркулирующая в почве углеки-
слота вместе с водой совершают путем выветривания в
продолжение столетий, достигается на химических заво-
дах при помощи серной кислоты чрезвычайно быстро.
☆ В настоящее время из фосфоритов готовят и более цен-
ные удобрения, чем простой суперфосфат,—например двой-
ной суперфосфат, преципитат и др. *
В томасовой муке содержится такое соединение фосфора,
1 Молотый фосфорит, так называемая «фосфоритная мука», во многих
случаях является все же ценным фосфорным удобрением, например на
кислых почвах (болотистые, заболачивающиеся и т. п, заключающие
в себе свободные кислоты). Особенно «отзывчивы» на фосфоритную
муку такие растения, как конопля, горох, вика, люпин, гречиха и др.
(tipuM. перев.)
54
которое может быть усвоено корнями растений без пред-
варительной обработки серной кислотой. Таким образом
эти отбросы железоделательной промышленности путем
одного лишь тонкого размола становятся чрезвычайно де-
шевым фосфорным удобрением, так как здесь отпадают
расходы по химической обработке. Томасова мука в боль-
ших (количествах применяется в луговодстве, где она
оказывает особенно хорошее действие.
Однако опыты показали, что в почве растворимый фос-
фат, содержащийся в суперфосфате, очень быстро пре-
вращается в нерастворимый. Но и в этом состоянии он
находится в почве в чрезвычайно раздробленном виде,
что весьма облегчает его усвоение корнями растений.
Поэтому теперь поступают так: вместо дорогого (вслед-
ствие обработки серной кислотой) суперфосфата вводят
в почву только третью часть последнего, а остальные две
трети заменяют молотым фосфоритом; последний в тонко
размолотом виде легче усваивается корнями, чем в виде
обломков горной породы. Применение этой смеси, ока-
зывается, дает не худшие результаты, чем удобрение чи-
стым суперфосфатом, потому что за время, пока действует
растворимый суперфосфат, молотый фосфорит успевает вы-
ветриваться. Для доказательства этого приведем несколько
цифр:
Урожай репы
в кг
Без каких-либо искусственных удобрений .... 13 850
Сульфат аммония, калиевая соль, суперфосфат . . 20 600
Сульфат аммония, калиевая соль, 1/3 суперфосфата
и 2/3 тонкоразмолотого фосфорита ................. 20 400
Рассмотрим теперь калиевые удобрения.
Примерно до 1860 г. калиевые соли стоили очень до-
рого. В более значительных количествах они добывались
только в виде поташа, представляющего собой в химиче-
ском отношении углекалиевую соль. Прежде его получали
вывариванием древесной золы в горшках с последующим
выпариванием раствора.
Из анализа растительной золы мы уже знаем о содержа-
нии в ней калия. Еще в 1850 г. торговцы скупали дре-
весную золу в тех местах, где она получалась в весьма
чистом виде при отоплении комнат сжиганием дров в
55
открытых каминах; зола шла затем в переработку на
заводы. Очень много поташа потребляется стекольными,
мыловаренными заводами и красильнями, почему цены
на него до сих пор еще довольно высоки, и для удобрения
применять его не приходится. В девятой лекции мы под-
робнее остановимся на современной фабрикации поташа
в связи с содовым производством.
Другие, гораздо более дешевые в настоящее время ка-
лиевые соли, служащие для целей удобрения (например
хлористый калий и сернокалиевая соль), большею частью
добывались в германских соляных шахтах—в Ганновере,
Тюрингии, Гессене, Бадене и в отошедшем от Германии
Эльзасе. Эти шахты обеспечивают калиевыми солями почти
все мировое сельское хозяйство. Наиболее известны, без
сомнения, Стассфуртские соляные копи. Там было много
соляных источников, веками служивших для выварки по-
варенной соли. Эго послужило поводом для закладки здесь
буровых скважин на каменную соль. Во время работ сна-
чала наткнулись на вид соли, имевшей горький вкус,
для которой не знали тогда никакого применения. Ее
приходилось сваливать как отброс, чтобы добраться до
лежащего ниже пласта каменной соли. Отсюда и ее не-
мецкое название «отбросная соль» (Abraumsalz). Возле Стас-
сфурта благодаря этому образовались огромные кучи этих
отбросных солей. И вот химик Франк в 1861 г. нашел, что
эти соли, считавшиеся лишенными всякой ценности, очень
богаты калием, на значение которого для удобрения полей
указывал раньше Либих. Так в этой местности расцвела
калийная промышленность.
Разумеется, для того чтобы стать пригодной для удобре-
ния, сырая соль должна быть предварительно очищена на
заводах, но и получаемые при этом побочные продукты
тоже имеют некоторую техническую ценность.
Предполагают, что эти соляные залежи представляют
собой остаток высохшего морского залива, который затем
не раз вновь наполнялся морской водой, чем и объясняют
нахождение здесь таких огромных масс солей.
В морской воде среди многих других элементов нахо-
дится между прочим бром. Из нее он и был впервые
получен в южной Франции. Теперь бром играет боль-
шую роль в фотографии при изготовлении бромосеребряной
желатиновой бумаги и пластинок. Но если наше пред-
66
положение о происхождении стассфургских солей пра-
вильно, то и в них должен содержаться бром. Действи-
тельно, бром получается те-
перь из стассфуртских солей
в очень больших количествах
в качестве одного из побоч-
ных продуктов калийной про-
мышленности.
* В 1926 г. в СССР было
открыто огромное Соликам-
ское калийное месторождение
(рис. 25), крупнейшее в мире.
В то время как мировой за-
пас калийных солей кроме
СССР исчисляется в 6 млрд, т
(из которых на долю Германии
приходится около 4 млрд, т
ина долю Франции—Эльзас—
1,8 млрд, т), только разведан-
ная часть месторождения в
Соликамско! - Березниковском
районе определяется в 15—
16 млрд, т, т. е. в два с по-
ловиной раза больше, чем весь
мировой запас калия. В на-
стоящее время близ г. Со-
ликамска работает огромный
калийный рудник, крупней-
ший в мире,—его мощность
1,5 млн. т калийных солей
в год или 4500 т в сутки! На
основе разработки Соликам-
ского месторождения можно
получать кроме калийных со-
лей хлористый магний, бром,
бертолетову ; соль и метал-
лический магний.*
Перейдем теперь к потреб-
ности растений в азоте. Азот
им нужен для образования
растительного белка, который
Рис. 25. Карта Со 1икамского ка-
лийного месторождения
57
является подлинным носителем их жизненных функций,
так как он выступает во всех тех случаях, когда живое
вещество образуется или растет. Отсюда ясно, что недо-
статок азота гибельно отражается на растениях. Азот, сле-
довательно, есть одна из наиболее существенных состав-
ных частей живой природы; уловить его и овладеть им
было одной из важнейших задач, которую человечество
стремилось разрешить и теперь разрешило.
Говоря о составных частях золы, мы не упоминали азота,
потому что почти ни одно его соединение не устойчиво
по отношению к огню. При той высокой температуре, какая
требуется для получения из растений золы, азот улетучи-
вается в свободном виде или в соединении с другими эле-
ментами. Нам уже знакомо его соединение с водородом—•
это аммиак, получаемый при нагреваний каменного угля
для добывания светильного газа.
Можно подумать, что растения никогда не испытывают
недостатка азота, так как они ведь всегда окружены азо-
том воздуха. Мы видели, что свою потребность в угле-
роде растения удовлетворяют за счет углекислого газа,
содержащегося в воздухе, причем на 10 000 частей воз-
духа приходится всего 3 части углекислого газа, а азот
в этом же количестве воздуха составляет целых 8000 ча-
стей! И все-таки растения, усваивающие при помощи ли-
стовой зелени (хлорофилла) углерод из углекислого газа
воздуха, не обладают никакими средствами для усвоения
азота воздуха. Усваивать азот растение может только в
виде растворов солей, находящихся в почве, с помощью
своих корней. Исключение составляют лишь мотыльковые
растения, как горох, бобы, вика, клевер, люпин и др.
В клубеньках, образующихся на корнях таких растений,
живут бактерии, обладающие способностью усваивать азот
непосредственно из воздуха и при посредстве кислорода
и некоторых составных частей почвы переводить его в
азотную кислоту и ее соли (нитраты). Благодаря жизне-
деятельности таких бактерий в корнях мотыльковых ра-
стений откладывается много азотистых веществ. Эти ра-
стения не только отлично произрастают сами без всякого
азотистого удобрения (конечно, при наличии в почве до-
статочного количества фосфора и калия), но их корни,
остающиеся в почве после снятия урожая, еще обога-
щают ее азотистыми соединениями. Эти растения поэтому
58
называются азотособирателями. Посеянное в следующем
году на том же участке поля растение, не обладающее
способностью собирать азот, находит в почве необходимый
для своего роста азот в готовом виде и не нуждается
поэтому в азотном удобрении. Обогащение почвы азотом
после культуры мотыльковых растений составляет около
100—200 кг азота в год На 1 га.
Еще задолго до открытия аэотособирающях бактерий
было известно из практического опыта, что росту растений
в 'высшей степени способствует введение в почву азоти-
стых веществ. Наиболее усвояемыми являются, конечно,
азотистые соединения, растворимые в воде, так как они
непосредственно всасываются корнями растений. Из искус-
ственных азотных удобрений в настоящее время применя-
ются главным образом пять видов: серноаммониевая соль
(сульфат аммония), чилийская селитра, цианамид кальция,
азотнокальциевая соль и мочевина.
Для сельскохозяйственных целей аммиак всегда соеди-
няют с серной кислотой; в таком виде его действие наиболее
испытано. Серная кислота соединяется с аммиаком в бе-
лую твердую соль—серноаммониевую соль, которая и раз-
брасывается в поле в качестве удобрения. Поставщиками
аммиака были раньше только коксовые заводы, произво-
дящие из каменного угля кокс для доменных печей (об
этом подробнее см. в одиннадцатой лекции), а также газо-
вые заводы. Пока существовали только эти источники,
количества аммиака, поставляемые для сельского хозяй-
ства, находились в зависимости от того количества камен-
ного угля, которое шло на коксование и на добычу газа.
В настоящее время положение дела совершенно измени-
лось. Своими замечательными научными работами извест-
ный немецкий химик Габер в 1910 г. доказал возмож-
ность непосредственного получения аммиака из двух со-
ставляющих его элементов, а именно из азота и водорода.
В предприятиях общества красочной промышленности в
Людвигсгафене на Рейне инженеру Бошу удалось осу-
ществить не менее замечательное применение лаборатор-
ных достижений в производственной практике. Синтез этот
производится следующим образом.
Газовая смесь, состоящая из 1 части азота и 3 частей
водорода, вводится в стальные сосуды (контактные печи)
и подвергается давлению в 200 атмосфер (паровозные котлы
59
имеют наивысшее давление в 15, а другие котлы в 30—
50 атмосфер) при температуре в 500° (т. е. при температуре
начинающегося красного каления) и в присутствии железа
в качестве катализатора (см. стр. 33). В этих условиях
газы вступают в соединение. Однако процесс соединения
прекращается после того, как 8°/о газовой смеси соедини-
лись в аммиак. Поэтому, чтобы процесс мог совершаться
дальше, необходимо эти 8°/о’ готового аммиака удалять.
Аммиак затем перерабатывается главным образом в суль-
• фат аммония (серноаммониевую соль). Часть аммиака пере-
рабатывается в мочевину.
В обеих фабриках вышеупомянутого общества красочней
промышленности—в Оппау (близ Людвигсгафена) и в Лейна
(близ Мерзебурга) производится в год свыше 1 млн. т
удобрений, которые складываются в огромные силосы
(рис. 26).
Вторым источником азота является известная всем се-
литра. Она представляет калиевую или натриевую соль
азотной кислоты, в связи с чем различают калиевую и
натриевую селитру.
Налиевая селитра известна с давних времен. Она шла
из Индии и до появления бездымного пороха служила
главной составной частью огнестрельного пороха. Но для
применения в сельском хозяйстве калиевая селитра слиш-
ком дорога. Более дешевая натриевая селитра представ-
ляет белую, легко растворимую «в воде соль и по месту
своего происхождения называется также чилийской се-
литрой. В Чили встречаются огромные пространства, в ко-
торых почти никогда не бывает дождей; эти-то пространства
и богаты селитрой. Залежи чилийской селитры начали
разрабатывать с 1830 г. Раствор натриевой селитры .полу-
чают обработкой сырой селитры горячей водой; после очи-
стки раствора фильтрацией и охлаждения кристаллизуется
чистая селитра, представляющая рыночный продукт. Жид-
кость, остающаяся после кристаллизации селитры (как и
всякая жидкость, из которой что-либо выкристаллизова-
лось), называется маточным раствором. Если такой ма-
точный раствор подвергать выпариванию (это практикуется
только в некоторых местах, например в соляных копях
близ Крейцнаха), то выпадают еще оставшиеся в раство-
ренном виде соли, так называемые маточные соли. Маточ-
ные растворы чилийской селитры не выпаривают, но зато
60
Рис. 26. Завод синтетического аммиака в Лейна близ Мерзебурга. Мощный завод, вырабатывающий свыше 1 млн. т
сульфата аммония в год. На переднем плане видны мощные заводские установки, сзади слева—новый город с жили-
щами для рабочих и служащих, справа —р. Ваале
на них добывают иод, который содержится там в неболь-
шом количестве. Таким образом Чили стало главным до-
ставщиком этого сравнительно редкого элемента.
Многочисленные опыты показали, что селитра, содержа-
щая свыше 1б°/о азота, снабжает растения азотом скорее
всех других азотных удобрений. ;
Третьим источником азота для удобрений является каль-
ций-цианамид. С карбидом кальция мы уже знакомы. Если
(как это открыли Франк и Каро) пропускать в печь с
сильно нагретым карбидом кальция газообразный азот (его
дешево можно получить испарением жидкого воздуха), то
азот и карбид кальция химически соединяются, причем
этот процесс распространяется по всей массе от нагретого
места карбида кальция. Новое вещество, получающееся
при этом, было названо кальций-цианамидом.
Кальций-цианамид оказался годным не для всех куль-
тур. Поэтому на некоторых заводах его стали нагревать
в паровых котлах с водой, причем он распадается и его
азот переходит в аммиак, который затем уже переводится
в сульфат аммония.
Совершенно другим путем разрешили задачу использо-
вания азота воздуха для земледелия норвежцы Бирке-
ланд и Эйде в 1905 г. Они исходили из того факта, что
во время грозы, как ц при северных сияниях, из азота
и кислорода воздуха образуются окислы азота, которые
попадают вместе с атмосферными осадками на землю в
виде азотной кислоты. Таким путем на каждый гектар
поверхности в Европе вносится около 12,5 кг связанного
азота в год, а в тропических странах, где грозы гораздо
сильнее, даже до 50 кг. Упомянутые исследователи искус-
ственно воспроизводили грозу, пропуская электрическую
световую (вольтову) дугу через влажный воздух (рис. 27);
при этом из воздуха образуется около 1 % азотной кислоты,
которая затем взаимодействием с известью переводится в
кальциевую селитру, известную на рынке под названием
норвежской селитры. Однако метод вольтовой дуги, тре-
бующий исключительно большой водной энергии, заметно
уступает место методу Габер-Боша.
Благодаря этим трем завоеваниям химии, т. е. искус-
ственному аммиаку, цианамиду кальция и норвежской се-
литре, мировое сельское хозяйство перестало зависеть от
чилийской селитры. Вследствие истощения залежей чи-
62
лийской селитры, которое должно наступить через не-
сколько сот лет, сделалось бы невозможным дальнейшее
ведение сельского хозяйства в современных масштабах.
А какое значение для питания человечества имел бы не-
достаток искусственных азотных удобрений, показывает,
например, тот факт, что Германия удвоением количества
применяемых теперь азотных удобрений не только удовле-
творила бы всю свою потребность в зерне и картофеле,
но получила бы еще и значительный остаток для экспорта.
Рис. 27. Разрез печи Биркеланда и Эйде
В какой мере применение искусственных удобрений во-
обще повысило производительность земледелия, показы-
вает следующая таблица:
Средний урожай на 1 га в килограммах (в Термании)
Годы Пшеница Рожь Овес Карто- фель Луговое сено
1885—1890 . . 1510 1180 1410 10180 3 270
1905-1910 . . 2 000 1670 1920 13 900 4 330
1913 2 390 1 920 2 190 15 860 4 910
63
Наряду с указанными удобрениями в продаже под на-
званием цветочных удобрений, имеются еще растворимые
в воде смеси всех ценных для растений питательных вее
ществ, особенно подходящие для садовых и комнатных
растений. При пользовании подобными удобрениями сле-
дует соблюдать большую осторожность в отношении при-
меняемых количеств: излишек удобрений действует очень
вредно. На 1 кг горшечной земли нужно брать примерно
1 г удобрения и растворить его в 1 л воды. При более
концентрированных растворах возникает опасность, что
корни растений могут быть изъедены и умерщвлены; на-
меренно указанное нами сильное разведение исключает
всякое вредное действие. Приведенного количества хватает
на целый год. Его можно разделить также на две части—
на каждые полгода. В садоводстве нужное количество пита-
тельных солей исчисляется в зависимости от глубины,
на которую вспахивается (перекапывается) земля. Если,
например, квадратный метр вспахивается на глубину
20 см, то применяют 100 г этих солей в растворе той же
крепости, какая указана выше.
* Потребность СССР в азотных удобрениях очень велика.
Вычисления показывают, что с ежегодным урожаем здесь
уносится из почвы 2,5 млн. т азота. Если вычесть отсюда
естественное возобновление азота в почве за счет бакте-
риальных и иных процессов, то все же непокрываемая
часть расхода составит около 1,3 млн. т (цифры относятся
к 1930 г.). Вполне понятно поэтому, что создание круп-
ной азотной промышленности в СССР привлекает особое
внимание партии и правительства.
К настоящему времени в СССР работают уже мощные
азотные заводы, среди которых находятся такие гиганты,
как, например, Сталиногорский завод, Березниковский
и др. Во второй пятилетке будут построены азотные ги-
ганты в составе Окского комбината, комбинатов в УССР,
Средней Азии, Урало-Кузнецкого комбината и др.
Что касается общего развития производства всех видов
удобрений в СССР, то к концу первой пятилетки оно уже
в девять раз1 превысило выработку удобрений в довоенной
России. Во второй пятилетке поставлена задача полностью
химизировать посевную площадь технических культур,
а также свыше 23 млн. га зерновых культур, для чего
понадобится 12 млн. т одних только калийных удобрений.
64
Во второй пятилетке советская химпромышленность, со-
гласно постановлению XVII съезда ВКП(б), по сравнению
с первой пятилеткой должна «производство всех видов
удобрений за годы второй пятилетки повысить в 10 раз».
(Резолюции XVII съезда ВКП(б), Партиздат, 1934, стр. 12.)
Это поставит СССР на первое место в мире по производству
удобрений.
Нужно еще указать, что наряду с бурным количествен-
ным ростом в производстве советских удобрений намечается
и большой качественный рост. Кроме обычных удобрений
в СССР уже начато производство концентрированных удо-
брений, а также сложных удобрений, содержащих в своем
составе сразу два, а то и три необходимых для растений
химических элемента.*
Для построения человеческого организма нужны те орга-
нические вещества, которые выработаны в растениях. Для
этого человек потребляет хлеб, овощи, плоды, картофель
и т. д., а также яйца, мясо и молоко животных. Но живот-
ные сами также живут за счет растений или других живот-
ных, так что питание всех животных и человека имеет
в конце концов своим источником мир растений, хотя бы
и не непосредственно.
В химическом отношении все питательные вещества рас-
падаются на три главных класса: 1) белковые вещества,
2) жиры и 3) углеводы (крахмал и сахар). Сюда присоеди-
няются еще минеральные вещества, вода и добавочные
вещества.
Белки представляют собой содержащие азот вещества
чрезвычайно сложного состава. Они образуются в растениях
и являются истинными носителями жизненных процессов.
Продукты распада белков, возникающие благодаря их
перевариванию, попадают в кровяной ток животных орга-
низмов, которые строят из них еще более сложные белковые
вещества. Последние затем потребляются в процессе жиз-
недеятельности животного организма и, таким образом,
разрушаются. Продукты распада белковых веществ, не-
прерывно образующиеся в организме, должны быть из него
удалены, так как, продолжая накапливаться, они сделали
бы невозможной дальнейшую жизнь организма. Это уда-
ление может быть, конечно, произведено только током
| Химия повседневной ЖИЗНИ,
65
крови. Вместе с кровью эти продукты (все они растворимы
в воде и благодаря этому могут циркулировать в кровя-
ном токе) в конце концов попадают в почки, назначе-
ние которых заключается в выведении из организма1
излишков жидкости вместе с растворенными в ней продук-
тами распада. Время от времени эта жидкость удаляется
из организма в виде мочи. В моче поэтому находится весь
азот потребленных нами белков, большею частью в виде
вещества весьма простого состава, получившего название
мочевины. Если определить количество азота, выделяемого
человеком в моче в течение суток, то можно вычислить и
количество белков, потребленных им за этот период времени.
Название «белок» произошло, конечно, от яичного белка,
но с течением времени оно получило гораздо более широ-
кое значение. Существуют растворимые и нерастворимые
в воде белки. Белковые вещества растворимые в воде
например яичный белок, при варке свертываются. Это пре-
вращение заслуживает большого внимания: среди бесчис-
ленного множества полученных химиками веществ нет ни
одного, обладающего этим свойством.
Среди пищевых продуктов выдающееся место занимает
молоко. Его важнейшее белковое вещество, так называемый
казеин, переносит варку не свертываясь. Но стоит только
попасть в молоко ничтожному количеству кислоты, и ка-
зеин выпадает тотчас же в виде хлопьев. Молоко сверты-
вается, например, после прибавления к нему капли уксуса.
В теплые летние дни молоко скисает само по себе и часто
свертывается против нашего желания. Это скисание про-
исходит по следующей причине. Помимо казеина в молоке
содержится еще особое вещество—молочный сахар, кото-
рый, как и большинство других видов сахара, может бро-
дить, т. е. превращаться в другие вещества как будто бы
совершенно самостоятельно. Но вызывается это явление
особыми живыми существами, так называемыми бакте-
риями, распространенными повсюду в воздухе, однако про-
являющими свое действие лишь при наличии определенных
условий. Так, молочнокислые бактерии (их называют так
потому, что они превращают молочный сахар в молочную
кислоту) начинают сильно действовать на молоко только
при температуре в 20—30°, и поэтому оно свертывается
благодаря образующейся в нем молочной кислоте только
в очень теплые дни. Молочная кислота обладает замеча-
66
тельной способностью уничтожать гнилостные бактерии,
и поэтому молоко не так скоро загнивает.
Когда молоко свертывается (створаживается) благодаря
скисанию, то при этом выделяется содержащийся в нем
казеин. Но его можно и намеренно створаживать другим
путем, а именно посредством закваски, получаемой из сли-
зистой оболочки четвертого отдела (сычуга) телячьего же-
лудка. Добываемое таким путем вещество после соответ-
ствующей обработки и есть сыр, который является хорошим
питательным продуктом.
О точном составе молока дает понятие следующая таб-
лица. На 100 частей молока приходится:
Коровье молоко Сливки Женское молоко
Воды .... 87 68 87
Казеина .... 3 1 А 0,8
Альбумина .... 0,5 / 4: 1,2
Жиров .... 4 23 4
Молочного сахара . . .... 5 4 6
Солей .... 0,7 0,5 о,з
Женское молоко является единственно правильным пита-
нием для грудного младенца, так как оно содержит в тре-
буемом соотношении все питательные вещества—белки,
жиры, углеводы и минеральные соли. Важнейшим отли-
чием коровьего молока от женского является различное со-
держание казеина. В коровьем молоке его в 4 раза больше,
чем в женском. Так как казеин является главнейшим строи-
тельным материалом для растущего организма, а теленок
растет гораздо быстрее человеческого младенца, то ему
требуется и больше казеина. Кормление младенца цельным
коровьим молоком вызвало бы перегрузку его организма
казеином, поэтому коровье молоко должно употребляться
для этой цели в сильно разведенном виде.
Благодаря большому содержанию альбумина, представ-
ляющего собой другой вид белка, женское молоко не так
легко створаживается, как коровье. Наличие большего ко-
личества солей в коровьем молоке обусловлено более бы-
стрым ростом теленка.
Мы узнали такие белковые вещества, которые сверты-
ваются при высокой температуре или при действии кис-
лоты. Но существуют еще и такие белки, которые оста-
5*
67
ются в растворенном виде только в то время, пока они
находятся в живом организме; по выходе из организма
они очень скоро затвердевают. Подобные вещества име-
ются в крови. Вне организма кровь на воздухе очень
скоро разделяется на твердую массу и жидкость. Твердая,
окрашенная в красный цвет пластичная масса после про-
мывания водой обесцвечивается и называется тогда фи-
брином.
Остающаяся после отделения из крови фибрина жидкость
называется сукровицей, или кровяной сывороткой. Беринг
в 1894 г. указал способ, посредством которого кровяная
сыворотка животных превращается в лекарство для лечения
дифтерии—болезни, вызываемой особыми бациллами. С этой
целью сначала размножают дифтерийные бациллы на пита-
тельном бульоне, в котором они образуют сильный яд.
После этого бульон фильтруют и получают жидкость, в ко-
торой количество яда уже больше не увеличивается, так
как бациллы из него удалены. Если этот раствор яда
впрыснуть теперь в умеренном количестве под кожу здо-
ровым животным, то они заболевают; но в то же время
в их организме вырабатывается противоядие, которое при
повторных впрыскиваниях накапливается в кровяной сы-
воротке все в большем количестве. Эта богатая противо-
ядием сыворотка и является лечебной антидифтерийной
сывороткой, которая может быть впрыснута заболевшему
дифтерией человеку. Гигиена учит бороться с бациллами,
возбудителями болезней, вне организма человека при по-
мощи антисептики (см. двенадцатую лекцию). В данном
случае мы имеем гораздо большее достижение: зародыши
болезни, уже проникшие в организм человека, мы уби-
ваем, конечно, без вреда для самого больного.
Белковые вещества, как мы уже знаем, образуются в ра-
стениях. Так, в пшеничной муке они содержатся в коли-
честве около 10%, даже в траве—в среднем от 2 до 3%,
а в сене приблизительно от 10 до 12%. В картофеле,
высушенном для кормовых целей (что производится в осо-
бых нагревательных аппаратах, а не просто на воздухе,
как это делается с сеном), содержится около 6% белка,
вследствие чего питательная ценность такого картофеля
выше, чем, например кукурузы. Если сельские хозяева
не могут обойтись собственными кормами, они прикупают
в настоящее время кормовые вещества, которые, как содер-
68
жащие много питательного материала, называют уси-
ленными кормами. Это преимущественно отруби, а также
плитки из жмыхов, получающихся в остатке от прессова-
ния семян масличных растений при добывании из послед-
них масла. Эти кормовые средства ценятся по содержанию
в них белковых веществ, которое может достигать почти
50%, как, например, в обезжиренном и прессованном
остатке семян подсолнуха. Такая оценка кормов очень
удобна и разумна, так как содержание белка в них очень
легко может быть определено химическим анализом.
Чтобы избежать термина «белок», который невольно вызы-
вает представление о яичном белке и у несведущих людей
звучит очень странно в применении к составу раститель-
ных семян, белковые вещества кормов в торговом обиходе
называют протеиновыми веществами. Это название про-
исходит от греческого слова proteuo «занимаю первое место».
Оно появилось в 1840 г. । f
В химическом отношении белки представляют собой чрез-
вычайно сложные вещества. И все же известному немец-
кому химику Эмилю Фишеру удалось в самом начале
900-х годов получить в лаборатории вещества, подобные
белку. Фишер исходил из аминокислот—соединений, на
которые распадаются все белковые тела (как, например, ка-
зеин молока, гемоглобин крови, кератин наших ногтей и
волос), если их подвергать продолжительному кипячению
с кислотой. Эти аминокислоты, которые могут быть полу-
чены также искусственным путем, Фишеру в результате
невероятно хлопотливой работы удалось химически соеди-
нить друг с другом. Так он получил в конце концов со-
единения, которые содержали больше дюжины аминокис-
лот, и создал этим путем тела, подобные белкам. Белковых
веществ существует многие тысячи; каждый вид живот-
ных, даже каждая отдельная особь имеет свой специфиче-
ский белок. Отсюда видно, какую огромную проблему
представляет собой проблема белковых веществ.
В связи с белками нам надо сказать еще о клее. Хрящи,
кости и вся так называемая соединительная ткань живот-
ного организма содержат вещества, которые при варке в
воде переходят в раствор и сообщают полученной жидкости
способность застывать при охлаждении в студень (жела-
тинироваться). Высушиванием такого студня получают
клей, который и поступает в таком виде в продажу. В нем
69
также содержится много азота, по процентному содержанию
которого он мало уступает настоящему белку. Поэтому
клеевые вещества, получающиеся при варке костей, от-
ЭмИЛЬ ФпПЛЗР
части могут заменить белок для питательных целей, как
это видно из следующей таблицы процентного состава не-
которых белков и клея.
Яичный белок , Растительный белок Клей
из пшеницы
Углерод . 52,25 54,3 50,1
Водород . 6,90 7,2 7,5
Азот . . 15,25 16,2 17,5
Сера . . 1,93 1,0 —
Кислород 23,67 21,3 24,9
Все вещества, которые должны служить для питания
нашего организма, поступают в желудок. В желудке и за-
то
тем в кишечнике составные части пищи' перевариваются,
т. е. переводятся в растворимое состояние. Благодаря этому
они путем диффузии могут проникать в кровь, которая
в своем потоке разносит их по телу и доставляет всем
отдельным его частям то, что им требуется. Процесс пище-
варения можно в существенных частях выяснить экспери-
ментальным путем. Воспроизведем в нескольких стаканах
переваривание пищи желудочным соком.
Стенки желудка жи-
вотных и человека вы-
деляют особое веще-
ство, так называемый
7 епсин. Он относится к
ферментам, т. е. к ве-
ществам, напоминаю-
щим белок и обладаю-
щим способностью чрез-
вычайно ускорять хи-
I мические превраще-
ния, которые без них
1 протекают медленно,
причем сами они в
этих процессах не под-
вергаются изменениям.
В нормальном содер-
жимом желудка, кроме
пепсина, всегда нахо-
дится еще немного со-
ляной кислоты, в сред-
нем 0,2%. Пепсин вме-
сте с соляной кислотой
переводят нераствори-
мые белковые вещества
вращают их в пептоны,
мые белки.
Рис. 28. Опыт с воспроизведением пище-
варения
в растворимое состояние, пре-
как называются такие раствори-
Если желудок поместить в глицерин, то находящийся
в желудке пепсин переходит в раствор. Вот такой глице-
рин, содержащий пепсин, мы и используем для нашего
опыта с пищеварением. Опыт производится следующим
образом (рис. 28).
В небольшом шкафу, в котором укреплен термометр,
поддерживается постоянная температура около' 37°, т. е.
71
температура человеческого тела. В шкаф ставятся 4 ста-
кана с небольшим количеством воды. В один стакан мы
прибавляем немного пепсинового раствора, во второй—соля-
ной кислоты, а в третий и четвертый—немного пепсина
и соляной кислоты вместе.
В качестве веществ, подлежащих в нашем опыте пере-
вариванию, возьмем легко переваримый фибрин и несколько
кусочков крутого яйца. Небольшие количества обоих этих
материалов положим в первый и второй стаканчики, в тре-
тий положим только фибрин, а в четвертый—только кусо-
чек крутого яйца.
Процесс растворения белковых веществ протекает не так
быстро, как многие другие химические реакции,—потре-
буется по крайней мере полчаса, чтобы он стал ясно
заметным.
Если через некоторое время посмотрим на результаты
нашего опыта, то мы увидим, что в первом стакане один
пепсин не оказал никакого действия ни на фибрин, ни на
крутое яйцо. Во втором стакане одна соляная кислота вы-
звала, правда, разбухание фибрина, но не переход его
в раствор, крутое же яйцо не подверглось изменениям.
Наоборот, совершенно другое действие произвела в тре-
тьем и четвертом стаканах смесь из пепсина и солянюй
кислоты. В этой смеси, соответствующей пищеварительным
сокам желудка, фибрин в третьем стакане исчез, он раство-
рился. Если ближе исследовать этот раствор, то окажется,
что фибрин перешел в белковое вещество, растворимое в
воде, в так называемый пептон. Крутое яйцо в четвертом
стакане также подверглось сильному воздействию, хотя
и не вполне еще растворилось и не превратилось полностью
в пептон; это произошло оттого, что оно труднее пере-
варивается, чем фибрин. Если бы мы посвятили нашему
опыту больше времени, то увидели бы, что и оно в конце
концов тоже полностью перешло бы в раствор в виде пеп-
тона. В действительности, разумеется, так же происходит
и пищеварение. Крутые яйца совершенно правильно счи-
таются трудно переваримыми, но здоровому человеку не
причинит вреда, если они будут перевариваться в желудке
несколько больше времени, чем другие пищевые продукты,
например мясо.
Действие находящегося в желудке пепсина проявляется
только в присутствии кислот. Пепсин вместе с кислотами
72
пептонизирует белковые вещества, т. е. превращает их в
растворимое в воде состояние. Дальнейшее и не менее важ-
ное для питания переваривание пищи происходит в кишеч-
нике, в который изливается желчь; переваривание пищи
обусловливается здесь особым веществом—трипсином. Его
действие расщепляет оставшиеся неразрушенными белки
и углеводы. Все те вещества пищевых материалов, которые
не могут быть усвоены организмом путем переваривания
в желудке и в верхнем отделе кишечника и которые, сле-
довательно, не представляют собой уже питательной ценно-
сти, продвигаются дальше как ненужные отбросы и выбра-
сываются из организма. Буроватый цвет этих отбросов
обусловливается желчью.
Мы представили как нечто само собой разумеющееся,
что в желудке и кишечнике происходят процессы пище-
варения. Однако желудок ведь и сам состоит из мяса,
значит, из белковых веществ, почему ясе он не подвергается
самоперевариванию, почему он может противостоять дей-
ствию пищеварительных соков?
В настоящее время нам известно, что в клетках же-
лудка содержится защитный фермент, противодействую-
щий пепсину, так называемый антипепсин, так же как
в стенках кишечника имеется антитрипсин, парализующий
действие трипсина.
Но как может пищеварительный аппарат выбирать из
всех питательных веществ именно то, что требуется всему
организму и, в частности, отдельным его частям? От-
куда берется у пищеварительного аппарата в целом «по-
нимание» того, сколько питательного материала нужно
отдать крови, чтобы его хватило и на рост—до 22-летнего
возраста,—а затем соответственно сократить эту отдачу?
Современная наука приписывает эту загадочную способ-
ность опять-таки химическим веществам, которые выде-
ляются внутри организма в определенных местах и которым
свойственно воздействовать определенным образом на раз-
личные органы и функции тела. Эти вещества называются
гормонами, а процесс их выделения—«внутренней секре-
цией». Наряду с нервной системой, гормоны регули-
руют целесообразное взаимодействие различных органов
и функций организма. Недостаток гормонов вызывает тя-
желые заболевания.
ЛЕКЦИЯ ЧЕТВЕРТАЯ
Смешанная пища. Масло. Маргарин. Искусственные пищевые жары. Крах-
мал. Сахаристые вещества. Образование сахара в плодах. Питание боль-
ных сахарной болезнью. Виноградный сахар. Конфеты. Сахарный кулер.
Тростниковый сахар. Свекловичный сахар. Сахарин. Поваренная соль.
Железо в пищевых продуктах. Витамины. Значение варки пигии. Суп.
Закваска. Хлебопечение. Пекарные порошки.
Белки, воспринимаемые нами в пище, служат для воз-
мещения организму белковых веществ, израсходованных
на жизненные процессы. Но кроме белка организм ну-
ждается еще и в других питательных веществах, которые
дают ему возможность дальнейшей затраты энергии и дли-
тельного поддержания необходимой для жизни темпера-
туры тела.
Люди на основании опыта предпочитают смешанную
пищу; в течение дня они съедают ряд блюд, которые содер-
жат достаточное количество белка для замены израсходо-
ванного и достаточное количество безазотистых веществ для
поддержания работы тела и его температуры. Безазотистые
пищевые вещества распадаются на две больших группы:
1) жиры и 2) углеводы.
Как в жирах, так и в углеводах нет азота,—для питания
имеет значение только содержащийся в них углерод. По-
этому жиры и углеводы могут заменять друг друга в пище,
что очень важно. Однако жиры и углеводы не могут
заменить азотсодержащий белок, белок же, наоборот, может
заменить жиры и углеводы, так как он содержит также
и углерод. Доказательством этому служат хищные живот-
ные, которые питаются почти исключительно мясной пи-
щей, состоящей из белковых веществ.
Большая часть жиров, потребляемых нами в пищу,—
животного происхождения, но часть их происходит и из
растительного мира. Жиры растительного происхождения
не-химики называют обычно маслами,—стоит лишь напом-
71
пить о льняном и оливковом масле. Все углеводы, имею-
щие пищевое значение, происходят из растительного мира.
На основании только' что сказанного становится понят-
ным, почему, например, гренландцы пьют в большом коли-
честве ворвань, т. е. жир. Об этом путешественники по-
стоянно рассказывают как о достопримечательном явлении.
В виду того, что климат не позволяет в Гренландии зани-
маться земледелием и жители не имеют в своем распо-
ряжении ни муки, ни сахара и т. п., им приходится по-
крывать всю свою потребность в безаэотистых продуктах
питания жирами. В наших же странах в пищу употребляют
безазотистые вещества обеих групп: жиры в форме то-
пленого сала или масла и углеводы в виде хлеба, мучных
блюд, картофеля и т. п. Южнее в пищу начинают упо-
треблять растительные жиры, например оливковое масло.
Как мы видим, человек сумел повсюду приспособить свои
потребности в жирах и углеводах к условиям обитаемых
им местностей. Европа, однако, теперь настолько перена-
селена, что она уже не может обойтись без привозных
жиров. Только в тропических странах все произрастает
настолько быстро, что местные жители потребляют меньше
того, что они собирают. Поэтому оттуда в наше распоря-
жение поступает много масла, которое мы по большей
части употребляем в виде маргарина.
В наших широтах очень значительная часть жира потре-
бляется в форме коровьего масла, получаемого из молока.
Если оставить молоко спокойно стоять, то через некоторое
время в нем отделяется слой жира (сливки) от остальных
составных частей: творога и раствора молочного сахара
и солей (так называемой молочной сыворотки). Это разде-
ление достигается быстрее всего в центрифугах. Под
влиянием энергичного сбивания сливок в маслобойке от-
дельные жировые шарики слипаются вместе, образуя масло,
причем они переходят из жидкого- состояния в твердое.
Задача получения дешевого искусственного масла с
целью замены им дорогостоящего натурального была раз-
решена в 1870 г. Меж-Мурье. До 1904 г. искусственное
масло изготовлялось только из говяжьего сала. Последнее
растапливается при 60°, и после длительного отстаивания
маслянистая часть сцеживается с пленок, которые за это
время успевают осесть на дно. К полученной прозрачной
жидкости прибавляют соли и оставляют стоять в течение
75
суток при температуре около 25°; при этом она снова
частично застывает. Тогда ее отжимают в прессах при той
же температуре. Остаток от прессования, состоящий глав-
ным образом из самой твердой составной части сала—
тристеарина,—идет на производство стеариновых свечей1,
а жидкая часть поступает в продажу под названием олео-
маргарина.
Для превращения олеомаргарина в искусственное масло,
к нему прибавляют одну треть по весу хлопкового и кун-
жутного масла и половину (по весу) коровьего молока;
получение желтой окраски достигается прибавкой неболь-
шого количества куркумы. Растительное масло служит
здесь для того, чтобы придать довольно твердому при
комнатной температуре олеомаргарину консистенцию ко-
ровьего масла. К хорошим сортам маргарина прибавляют
цельное молоко, к более дешевым—снятое. При энергичной
обработке в особых метальных аппаратах вышеописанная
смесь постепенно разделяется на две части: на искусствен-
ное масло, или маргарин, и водянистую жидкость. К при-
готовленному таким способом маргарину прибавляют еще
немного бензойной кислоты для предохранения его от бы-
строй порчи.
С 1898 г. к маргарину стали прибавлять яичный желток,
который устранил неприятное свойство этого продукта—
давать брызги при поджаривании. Дальнейшим шагом
вперед была замена коровьего молока миндальным, полу-
чаемым при растирании зерен миндаля с водой. Приба-
влением этой совершенно свободной от бактерий жидкости
получают особенно устойчивые сорта маргарина. Непрерыв-
ный рост цен на животные жиры привел, наконец, к тому,
что стали получать прекрасно намазывающееся искусствен-
ное масло и из жира кокосовой пальмы, так называемого
кокосового масла, путем сбивания его с миндальным моло-
ком; этот сорт маргарина продается под названием расти-
тельного маргарина.
Раньше кокосовое масло умели перерабатывать лишь на
мылю, о чем подробнее мы поговорим позднее.
1 Сырьем для производства стеариновых свечей служат твердые жиры,
к числу которых относится и тристеарин. Из них получают жирные кислоты,
ГЛ1ВНЫМ образом стеариновую, пальмитиновую и олеиновую. Смесь пер-
вых двух и представляет собой тот стеарин, который идет для выделки
стеариновых свечей. (Прим, персе.)
76
Что касается питательности разных сортов маргарина,
то при правильном приготовлении все они являются полно-
ценными заместителями натурального масла, если не при-
нимать во внимание дополнительные вещества (о них
см. ниже), которые, впрочем, в достаточном количестве
содержатся в других употребляемых в пищу продуктах.
я В СССР сырьем для производства маргарина служат
главным образом растительные масла (подсолнечное, хлоп-
ковое, соевое) как в натуральном, так и в «отвержденном»
виде (см. девятую лекцию) Л
Кроме масла широко применяется в качестве питатель-
ного средства жир, доставляемый в свежем виде вместе
с мясом. Сюда же относятся свиное сало (шмальц), ко-
торое вывозится для продажи в огромных количествах из
Северной Америки, и искусственные пищевые жиры. Эти
последние состоят большей частью из олеомаргарина или
из хорошо очищенного кокосового масла. К ним прибавляют
еще столько хлопкового масла, чтобы смесь имела конси-
стенцию шмальца.
Переходим теперь к углеводам. Сюда относятся крахмал,
сахаристые вещества, декстрин и клетчатка, или целлю-
лоза. Все они содержат лишь три элемента—углерод, во-
дород и кислород. Например молекула сахара, содержа-
щегося в винограде и называемого поэтому виноградным
сахаром, состоит из следующих атомов:
6 атомов углерода (сокращенно—С)
12 атомов водорода (сокращенно—Н)
6 атомов кислорода (сокращенно—О)
Поэтому формула виноградного сахара, написанная легко
понятными нам теперь сокращенными символами, ’будет
СвН1?ОБ.
Отношение между атомами водорода и кислорода соста-
вляет здесь 2:1. То же отношение встречается и в воде,
формула которой, как известно, Н2О. Так как в прежнее
время полагали, что в этих соединениях углерод соединен,
так сказать, с водой, то их и назвали углеводами, ибо
во всех веществах этой группы отношение атомов водо-
рода к атомам кислорода равно 2:1.
77
☆ В настоящее время, впрочем, известны и такие угле-
воды (как природные, так и искусственно полученные),
в которых указанное отношение не имеет места. *
Крахмал—вещество, широко распространенное в расти-
тельном царстве. Он является самым важным для питания
человека углеводом, так как мы потребляем его в составе
всех пищевых продуктов растительного происхождения.
Как мы уже говорили, хлорофилловые зерна листьев обла-
дают способностью использовать углекислый газ воздуха
для построения тела растения. Поэтому мы находим крах-
мал во всех зеленых частях листа. Он накапливается в
течение жизни растения главным образом в тех его органах,
которые служат как бы складами запасных веществ. Осо-
бенно обильные запасы крахмала мы находим поэтому в
клубнях и корнях, в плодах и семенах. Хотя химическая
формула крахмала, происходящего из различных растений,
и одинакова—С6Н10О5 (т. е. каждая молекула его состоит
из шести атомов углерода, десяти атомов водорода и пяти
атомов кислорода), но крахмальное зернышко различных
растений, рассматриваемое под микроскопом, имеет раз-
личный вид, обладает, так сказать, своим особым строе-
нием1. Из формулы С6Н10О5 можно вычислить, что ра-
стению на каждые 72 г углерода нужно 90 г воды для
того, чтобы образовать 162 г крахмала. Но так как растения
в процессе своей жизнедеятельности еще испаряют значи-
тельное количество воды, то становится понятной их боль-
шая потребность в воде.
Крахмал употребляется в пищу большею частью в смеси
с другими веществами. Для некоторых технических целей
его добывают и в чистом виде; у нас он получается
главным образом из картофеля, пшеницы, риса и кукурузы.
В общих чертах получение крахмала происходит таким
образом, что картофель, например, растирают и получен-
ную кашицу промывают через сито с мелкими отвер-
стиями. Все грубые составные части остаются при этом
на сите, а взвешенные крахмальные зернышки вместе
1 Формула крахмала — (С6Н10О5)и, причем чему здесь равно п неиз-
вестно. Поэтому приведенные в тексте числа выражают лишь количествен-
ные соотношения атомов углерода, водорода и кислорода, но отнюдь не
абсолютное количество атомов этих элементов в молекуле крахмала. (Прим,
перев.)
78
с водой проходят через отверстия. Приготовленную таким
путем молочнобелую жидкость оставляют стоять в чанах,
в которых крахмальные зерна постепенно оседают на дно.
Осадок после спуска имеющейся над ним жидкости по
возможности освобождают от воды и затем сушат при не
слишком высокой температуре.
Если влажный крахмал подвергнуть нагреванию до
50—60°, то он сильно изменяется, совершенно теряет свое
строение и переходит в так называемый клейстер. Подобно
тому, как яичный белок при такой температуре свер-
тывается,—влажный крахмал также изменяется под ее
влиянием. ’
' В зависимости от растения, из которого добывается крах-
мал, он называется картофельным, пшеничным и т. п.
Крахмалы, приготовленные из материалов неевропейского
происхождения, носят соответствующие названия—маисо-
вого крахмала, саго, аррорута.
Приведенные ниже результаты анализов (в процентах)
показывают, сколько крахмала содержится в семенах и
клубнях растений, наиболее потребляемых нами в пищу.
(В отношении злаков приводится анализ семян в молотом
виде, так как в пищу идет только приготовленная из
них мука).
Первосорт- ная пшеничная мука Ржаная мука (средний состав) Картофель (средний состав)
Воды 14,86 15,06 75,48
Белковых веществ . . . 8,91 11,52 1,0
Жира 1,11 1,79 0,15
Углеводов:
Крахмала 65,93 62,0 20,69
Сахара 2,23 0,95 —
Декстрина 6,03 4,86 —
Клетчатки 0,33 2,01 0,75
Золы 0,55 1,71 0,98
79
Выше уже упоминалось о том, что отруби, предста-
вляющие собой смесь оболочек зерна с теми его остатками,
которые после помола не проходят сквозь тонкое сито в
форме муки, служат кормом для скота. Приводим ана-
лиз состава отрубей (в процентах).
Пшеничпые Ржаные
отруби отруби
Воды.............................. 13,2 12,5
Белковых веществ................. 14,1 14,5
Жира............................... 3,7 3,4
Углеводов......................... 56,0 59,0
Клетчатки.......................... 7,2 6,0
Волы................................ 5,8 4,6
Из этих анализов видно, что отруби богаче белковыми
веществами, чем мука, и потому хлеб с большим коли-
чеством отрубей следует считать более питательным. Хлеб
с отрубями темнее, чем обычный, но он содержит наряду
с большим количеством белковых веществ и много добавоч-
ных пищевых веществ, или витаминов. Вследствие повы-
шенного содержания белка хлеб этот рекомендуется для
питания больных сахарной болезнью.
Клетчатка (или целлюлоза), содержащаяся, как видно
из анализов, во всех сортах муки, тоже принадлежит к
группе углеводов и имеет формулу С6Н10О51. Но так как
клетчатка совершенно не переваривается в пищеваритель-
ных органах человека, то в противоположность другим
углеводам она и не представляет никакой питательной
ценности.
Переходим теперь к сахарам. Мы говорим о них во
множественном числе, потому что в природе существует
целый ряд сахаристых веществ, хотя число их все же
значительно меньше, чем число видов крахмала. По ка-
ждодневному потреблению все мы знаем тростниковый
(или свекловичный) сахар, а из других сахаров мы уже
познакомились с молочным и виноградным сахаром/.
Крахмал и сахар с химической точки зрения предста-
вляют собой очень близко стоящие друг к другу углеводы.
Крахмал с большой легкостью переходит в сахар, а именно
в виноградный сахар. Это мы часто видим в жизни. Не-
1 Формула клетчатки, или целлюлозы, тоже будет (СвН10О3)ге где п —
другое, чем у крахмала, но также неизвестное число. (Прим, перев.)
80
спелые плоды, например клубники, не сладки на вкус, но
они могут приобрести сладость в течение немногих часов.
Это превращение происходит оттого, что часть содержа-
щегося в клубнике крахмала при созревании ягод пере-
ходит в сахар. Этому превращению способствует не только
процесс созревания,—оно может наступить и в результате
охлаждения до 0°. Как известно, мерзлый картофель имеет
сладкий вкус. И здесь причина изменения вкуса кроется
в переходе крахмала в сахар.
Переход крахмала в сахар легко воспроизвести путем
опыта. Если к воде прибавить немного кислоты (напри-
мер соляной), всыпать в нее крахмал и кипятить в те-
чение короткого времени, то часть крахмала перейдет в
сахар. Это можно доказать следующей химической
реакцией.
Прибавим к воде раствор едкого натра и раствор мед-
ного купороса: получится голубой осадок гидрата окиси
меди, который при кипячении почернеет, перейдя в окись
меди. Прибавление крахмала не меняет этой реакции.
Если же мы возьмем жидкость, полученную при кипячении
крахмала с соляной кислотой, и прибавим к ней раствор
едкого натра и медного купороса, то мы не получим, как
раньше, голубого осадка, а будем иметь прозрачную не-
бесно-голубого цвета жидкость. При кипячении она не
почернеет от образования окиси меди, а покраснеет бла-
годаря тому, что в ней получится осадок красной закиси
меди. Образование в данном случае закиси меди является
характерной реакцией для виноградного сахара1.
Таким образом при кипячении крахмала с соляной кис-
лотой образуется виноградный сахар. С химической точки
зрения этот перевод крахмала в сахар легко понять, ибо
крахмал должен лишь присоединить элементы воды, Н20,
чтобы превратиться в виноградный сахар.
Крахмал, состоящий из:
6 атомов углерода
10 » водорода
5 » кислорода
присоединяет воду:
(2 атома водорода
1 атом кислорода)
и переходит в виноград-
ный сахар:
6 атомов углерода
12 » водорода
6 » кислорода
1 Эту реакцию дает не только виноградный сахар (или глюкоза, как его
еще называют в химии), но и ряд других сахаров. (Прим, перев.)
6 Химия повседневной жизни.
81
Короче это можно' записать так:
ода + н.2о = едл-1
крахмал -f- вода = виноградный сахар
По красному окрашиванию, получаемому при кипячении,
жидкости, содержащей виноградный сахар, после приба-
вления к ней растворов едкого натра и медного купороса,
врач может судить о том, содержит ли моча человека вино-
градный сахар, т. е. страдает ли больной сахарной бо-
лезнью. Больные этой болезнью выделяют с мочой ви-
ноградный сахар, образующийся в организме из крах-
мала пищи. Впрочем, моча больных сахарной болезнью
при обработке вышеуказанными реактивами и нагревании
вследствие влияния других ее составных частей дает не
чисто красную, а желто-красную окраску осадка.
Еще в древние времена врачи обратили внимание на
больных, страдавших сильнейшей жаждой. Они полагали,
что это зависит от слишком быстрого прохождения через
почки выпитой воды, и поэтому назвали эту болезнь диа-
бетом (от греческого слова diabaino—протекать). В борьбе
с этой болезнью они были совершенно беспомощны. Лишь
в 1770 г. Добсон обнаружил наличие сахара в моче по-
добных больных, а вскоре после этого врачом Ролло
(в 1797 г.) была рекомендована белковая диэта, которой
должны придерживаться больные сахарной болезнью.
Его теория необычайно проста и на основании приобре-
тенных нами теперь сведений вполне понятна. Ведь
белок не может перейти в сахар, ибо между ними
нет химической связи. Точно так же отсутствует тесная
химическая связь между жирами и сахаром. Таким обра-
зом белки и жиры не могут служить материалами для
образования сахара в организме. С другой стороны, мы
уже убедились в том, насколько близки в химическом
отношении крахмал и сахар и как легко крахмал пре-
вращается в сахар.
При употреблении в пищу, например хлеба, содержа-
щийся в нем крахмал, перевариваясь в кишечнике, пере-
ходит в сахар; последний, будучи легко растворим в воде,
1 Правильнее, конечно, это уравнение написать так: (C6IIwO3)n -f-
-р п Н2О = п С6Н12О6 (Прям, пеуев.)
путем диффузии выходит из кишечника и попадает в
ток крови. Крахмал, превращаясь в организме в сахар,
становится, таким образом, питательным веществом. Здо-
ровый организм потребляет весь сахар целиком на под-
держание энергии тела; весь содержащийся в сахаре угле-
род выдыхается им в виде углекислого газа, водород
окисляется в воду, и мы не находим поэтому сахара в
моче. В организме же человека, больного сахарной бо-
лезнью, часть сахара остается неусвоенной и выделяется
вместе с мочой, где его присутствие и обнаруживается
с помощью химического анализа. Организм больного са-
харной болезнью не работает нормально, вследствие чего
он не использует всего попавшего в кровяное русло
сахара.
Следовательно, больной сахарной болезнью не будет вы-
делять сахара в том случае, если станет питаться только
мясом, яйцами, маслом и тому подобными продуктами,
т. е. пищей главным образом животного происхождения.
Поэтому он должен, насколько возможно, принимать в
пищу лишь белки и жиры. В качестве жиров может
служить также оливковое масло и другие растительные
масла. Наоборот, сахар, мучные кушанья, хлеб или кар-
тофель, а также плоды и вообще, все пищевые вещества,
которые содержат большое количество крахмала, будут
вызывать у больных сахарной болезнью выделение са-
хара с мочой.
По -современным воззрениям врачей сахарная болезнь
связана с «внутренней секрецией». Лищь в последние
годы стало известно, что поджелудочная железа отдает
непосредственно в кровяное русло гормон, так называемый
инсулин, который определяет нормальный углеводный об-
мен. Если поджелудочная железа работает неудовлетво-
рительно, и этот гормон отсутствует, то сахар проходит
через организм нетронутым и выделяется вместе с мочой.
Гормон инсулин получают теперь из поджелудочной же-
лезы убойного скота и вводят в кровяное русло больным
сахарной болезнью, что дает хорошие результаты. Это
средство нельзя употреблять внутрь, так как оно раз-
рушается под действием пепсина и трипсина.
Между крахмалом и виноградным сахаром существуют
еще промежуточные продукты. Из них наиболее изве-
стен декстрин, который можно получить нагреванием
S3
крахмала до 170—200°. Он служит для замены гумми-
арабика.
Сахар, получаемый путем кипячения крахмала с кисло-
тами, добывается и фабричным путем. Под названием
крахмального сахара он поступает в продажу в форме не-
правильных желтоватых кусков. Его открыл в 1811 г.
Кирхгоф, и это открытие привело тогда ученый и торговый
мир (последний вследствие континентальной системых)
в такое возбуждение, какое не наблюдалось до тех пор
ни при каком другом открытии.
В промышленном производстве раствор крахмального са-
хара выпаривают часто только до тех пор, пока он не
приобретет консистенции сиропа. В таком виде он про-
дается под названием крахмальной патоки. Сироп этот
служит подходящим заменителем меда, поэтому его в
большом количестве употребляют для изготовления пря-
ников и т. п. Но главное применение он находит в конфет-
ном производстве. Так как конфеты не должны быть осо-
бенно твердыми, то при их фабрикации к тростниковому
(свекловичному) сахару прибавляют крахмальную патоку.
Эта примесь дает возможность изготовлять конфеты любой
твердости. Кроме того, крахмальная патока служит для
приготовления сахарного кулера. Если нагреть в стеклян-
ной пробирке небольшое количество крахмального сахара
до побурения и после охлаждения прилить к нему немного
воды, то последняя тотчас же окрасится в желто-коричне-
вый цвет, похожий на цвет коньяка. Этот так называемый
сахарный кулер является прекрасным средством для под-
крашивания пищевых и вкусовых продуктов и широко
применяется вместо красок ввиду полной его безвред-
ности.
Гораздо больше виноградного сахара нас интересует
тростниковый сахар, который служит для придания слад-
кого вкуса многим блюдам. До введения его в общее
употребление для этой цели служил лишь мед. Однако
1 Континентальная система — система экономической политики, прово-
дившаяся Наполеоном I в интересах французской промышленной буржуазии
и заключавшаяся в полном запрещении европейским странам торговых
сношений с Англией. Так как в то время но умели еще выгодно добывать
в большом масштабе сахар из свеклы, а главным поставщиком тростнико-
вого сахара была Англия, то на европейских рынках ощущался вследствие
этого острый недостаток сахара. (Прим, персе.)
84
весьма сомнительно, чтобы нам могли особенно понра-
виться те сладкие блюда, которые подавались на зна-
менитых пирах древних римлян или даже у нюренберг-
ских патрициев раннего средневековья; ведь не всякому
нравятся тонкие турецкие сладости именно потому, что
они приготовлены на меду.
•Тростниковый сахар, как указывает его название, яв-
ляется продуктом, доставляемым особым растением, так на-
зываемым сахарным тростником. Он растет только в южных
широтах, и европейцы познакомились с сахаром (в форме
очень сладкого сиропа) лишь в эпоху крестовых походов.
Однако еще со времен индийского похода Александра Ве-
ликого в Европе было известно, что в Индии особый вид
тростника «производит мед без пчел».
Рафинирование (очищение от посторонних примесей)
добытого из сахарного тростника сахара было открыто
лишь в XII в. в Персии. Для этого к выжатому сахарному
соку прибавляют известь, которая осаждает большое ко-
личество различных примесей; после выпаривания остав-
шейся жидкости выкристаллизовывается твердый сахар.
Если растворить этот тростниковый сахар еще раз в воде
и затем выкристаллизовать его, то получается извест-
ный всем чисто белый сахар, который впервые появился
в европейской торговле в Венеции. Один килограмм са-
хара стоил тогда около 22 марок (т. е. больше 10 зол. руб.).
Вскоре сахар сделался очень распространенным товаром
по всей Европе. Производство его достигло поэтому высо-
кого подъема, и вое страны, в которых климат благоприят-
ствовал разведению сахарного тростника (например тро-
пическая Азия), стали его усиленно культивировать.
Так, в Центральной Америке, особенно на Антильских
островах, куда сахарный тростник был завезен через не-
сколько лет после открытия Америки, с помощью пере-
правленных из Африки рабов в XVI и XVII вв. изготовля-
лось столько сахара, что его производство в остальном
мире, даже в климатически особо благоприятной для этого
Ост-Индии, временно почти или совершенно прекратилось.
В настоящее время в Европе сахарный тростник разво-
дится лишь в некоторых прибрежных местах Южной Испа-
нии, окруженных высокими горами Сьерры Невады; места
эти освещены лучами южного солнца и совершенно защи-
щены от холодных ветров.
85
Открытие берлинского химика Маркграфа, который в
1747 г. сообщил о том, что свекла содержит такой же
сахар, как и сахарный тростник, имело громадное значе-
ние для европейского сельского хозяйства. Благодаря
тому, что из свеклы, произрастающей всюду в Европе,
удалось получить такой же сахар, как из сахарного трост-
ника, требующего почти тропического климата, сельское
хозяйство Европы получило новую весьма выгодную куль-
туру. Маркграф ясно понимал значение своего открытия.
Его родственник Ахар попробовал в 1802 г. ввести круп-
ное производство сахара в поместье Кунера (в Силезии),
но потерпел неудачу, ибо дешевизна колониального са-
хара побивала дорогостоящее европейское производство:
свекла тогда была еще бедна сахаром, а применявшиеся
методы добывания оказывались слишком примитивными
и нерациональными.
Такое положение дела изменилось лишь благодаря поли-
тическим событиям. Вследствие континентальной системы
Наполеона I с 1806 г. все цены на колониальные про-
дукты, ввозившиеся в Европу англичанами, необычайно
поднялись, и стоимость 1 фунта сахара дошла до 2 та-
леров (около 2 р. 75 к. золотом). При таких условиях
производство свекловичного сахара должно было вновь
сделаться выгодным и оно действительно усиленно стало
развиваться. С прекращением континентальной системы
в 1813 г. большинство европейских свеклосахарных заво-
дов вновь стало закрываться. Однако в производстве све-
кловичного сахара достигли таких успехов, что в борьбе
с колониальным сахаром удалось, наконец, стать на твер-
дую почву, тем более что последний при ввозе в европей-
ские государства стал облагаться высокой пошлиной.
Выход сахара из свеклы с течением времени непрерывно
повышался, причем наука и техника здесь дополняли
друг друга. Следующие цифры очень ярко это подтвер-
ждают.
Для получения 100 г сахара расходовали:
в 1836 г.................................... 1800 кг свеклы
» 1842 » ................................ 1600 » »
» 1871 »................................. 1100 » »
» 1900 ».................................. 700 » . »
» 1910 »................................. 660 » »
» 1922 ».................................. 679 » *
86
Разведение сахарной свеклы вообще крайне выгодно,
так как она дает нри одинаковых почвенных условиях в
три раза больше питательных веществ, чем картофель,
и в четыре раза больше, чем пшеница.
Маркграф в свое время определял содержание сахара
в свекле несколько выше 6%; соответствующим отбором
семян и применением удобрений это содержание было до-
Рис. 29. Мировое произвэдетво тростникового и свеклови шого
сахара с 1888 г. по 1928 г. в млн. т
ведеио к 1890 г. в среднем до 14%1, а ю 1910 г.—до 18°/о.
Стоимость искусственных удобрений свекловичных полей
доходила в это время в Германии до 120 марок (около
55 »зол. руб.) на 1 га. И мы видим, что производство
свекловичного сахара до 1900 г. значительно превосходило
добычу тростникового сахара (рис. 29). Но начиная с
1900 г., производство сахара из сахарного тростника рас-
тет снова быстрее, чем производство сахара из свеклы.
К тому же еще следует отметить, что в Германии с 1 га
свекловичного поля в настоящее время можно добыть са-
мое большое 5000 кг сахара (в 1870 г. 1 га давал лишь
2000 кг), между тем как голландские колонисты на
острове Ява с такого же участка земли получали 15 000 кг
сахара из сахарного тростника. '
Для извлечения сахара из свеклы ее режут на стружки,
которые помещают затем в так называемую диффузионную
батарею, где в течение нескольких часов из них извле-
кается весь сахар. Добытый таким путем сахаристый сок
должен подвергнуться выпариванию. Последнее предста-
вляет большие затруднения, так как при долгом кипяче-
нии сахар изменяется и теряет способность затвердевать,
т. te. превращаться в кристаллический сахар. Однако
это затруднение давно научились преодолевать, выпаривая
раствор сахара не в открытых сосудах, а в закрытых,
в которых воздух очень разрежен. Благодаря этому сильно
снижается температура кипения жидкости и вот по какой
причине.
В первой лекции мы наглядно познакомились с давле-
нием воздуха. При кипении воды водяной пар должен
преодолеть давление воздуха,—лишь тогда он сможет сво-
бодно выделяться из жидкости. Если же из закрытого
сосуда, содержащего немного воды, с помощью воздуш-
ного насоса удалить воздух, то водяному пару не при-
дется теперь уже преодолевать давления воздуха и вода
сможет кипеть не при своей обычной температуре кипе-
ния в 100°, а при значительно более низкой. Быть может
это явление станет более понятным на следующем примере.
На Монблане вода кипит уже при 85°, потому что' в горах
на воду давит тем меньший столб воздуха, чем более
возвышается вершина горы над уровнем моря, где вода
кипит при 100°.
В сахарной промышленности для выпаривания употреб-
ляют большие железные котлы. В аппарате, где воздух
разрежен, резко снижается и температура кипения жид-
кости, вследствие чего сахарный сок переносит процесс
выпаривания без всякого вреда.
Когда сахарный сок достаточно сгущен, то он выделяет
сахар в форме кристаллов, окрашенных в бледножелтый
цвет. Такой сахар носит название сахара-сырца. Он очи-
щается рафинированием и поступает в продажу в форме
сахарных голов или прямоугольных кусочков. Для цол-
88
ного обесцвечивания сахара употребляют знакомый уже
нам животный уголь.
После выкристаллизования сахара остается маточный
раствор, называемый в свеклосахарной промышленности
черной патокой, или мелассой. Однако в противополож-
ность патоке, получаемой из остатков тростникового сахара
производства, она несъедобна для человека вследствие
своего неприятного вкуса. Долгое время вопрос об извлече-
нии остающегося в мелассе сахара оставался неразрешен-
ным. Но и эта задача была разрешена химиками в 1882 г.,
так что теперь из остатков свеклосахарного производства
может быть извлечен весь сахар. Однако значительные
количества мелассы применяются с 1896 г. с большим
успехом также для корма скота. Сначала мелассу смеши-
вали для этой цели с торфяной мукой; теперь последнюю
заменяют мелкоизмолотой соломой с прибавкой экстракта
дешевых горьких трав для возбуждения аппетита у скота.
Большие количества перерабатываются также брожением
на спирт.
* За время первой пятилетки в СССР была произведена
полная реконструкция как сырьевой базы сахарной про-
мышленности, так и технической. В то время как до войны
и революции главными поставщиками свеклы являлись
крупные хозяйства сахарных заводов и помещичьи именья,
теперь основная часть сырья поставляется колхозами.
Раньше все производство сахара было сосредоточено в
определенных районах Украины и лишь два завода были
отдалены от этого центра (один на Кубани и один в Турке-
стане). В настоящее время построены и строятся ряд новых
заводов в Сибири, Казакстане, Грузинской АССР, Армян-
ской АССР, на Дальнем Востоке и в других районах,
в которых раньше не существовало сахарной промышлен-
ности. Кроме того, в СССР практически поставлена про-
блема превращения сахарного производства из сезонного в
постоянное, что достигается разрешением вопроса длитель-
ного хранения свеклы путем ее сушки. Разрешение этой
проблемы должно повести к коренной ломке всей эконо-
мики сахарной промышленности, в несколько раз увеличив
годовую производительность заводов. К концу второй пяти-
летки продукция сахарной промышленности СССР, согласно
постановлению XVII съезда ВКП(б), должна возрасти до
2500 тыс. т, т. е. втрое превысить продукцию 1932 г. *
89
В заключение беседы о сахаре упомянем еще об одном
сладком веществе, которое начали изготовлять в новое
время,—о сахарине,. Из бесчисленного множества извест-
ных нам химических соединений многие обладают совер-
шенно определенным вкусом. Кроме настоящего сахара
издавна были известны некоторые химические соедине-
ния со сладковатым вкусом, например, глицерин, глико-
коль и др. Но вот в 1885 г. Фальберг открыл вещество,
которое в 300 раз слаще сахара: он назвал это, вещество
сахарином.
Химически сахарин обладает сложным строением и пред-
ставляет собой сульфйнид бензойной кислоты. Он не имеет
никакого питательного значения и не только потому, что
его вообще употребляют лишь в ничтожных количествах,
но и по самой своей химической природе. Однако сахарин
можно употреблять вместо сахара для подслащивания раз-
личных кушаний. Мы должны рассматривать его как своего
рода пряность, ибо он, не повышая питательности пищи,
уже в самых Небольших количествах может вызвать значи-
тельное изменение ее вкуса, что облегчает усвоение пищи.
Наибольшую пользу получили от сахарина больные сахар-
ной болезнью, которые могут теперь подслащивать им свои
блюда; до 'открытия сахарина такие больные были лишены
возможности есть сладкое. Значение подобного подслащива-
ния пищи вовсе не так уже маловажно, ибо при принятии
пищи Несомненно кроме чисто физиологической потребности
большую роль играют и вкусовые ощущения. Мы можем
длительно потреблять только такую пищу, которая благо-
даря приправе какими-либо веществами сделалась вкус-
ной. Невидимому, такие вещества, как соль, перец, гор-
чица, Необходимы для возбуждения и усиления пищева-
рительного процесса.
Наш организм для поддержания своего существования
требует кроме белков, жиров и углеводов еще введения
воды и минеральных веществ. Из последних мы непосредст-
венно употребляем в пищу лишь поваренную соль, кото-
рую сознательно прибавляем к большинству блюд.
Что же касается остальных минеральных веществ, Необ-
ходимых для нашего' организма (например фосфорнокаль-
циевой соли для костей и т. и.), то они содержатся в
пище в достаточном количестве, 'как это видно из выше-
ЭО
приведенных анализов. Общее количество этих минераль-
ных составных частей показано там в виде золы.
Одна из минеральных составных частей пищи пред-
ставляет особый интерес. Это—железо. Ежедневная по-
требность организма человека в железе очень незначи-
тельна, ее можно оценить примерно в 0,15 мг на 1 кг веса
тела.- Например, при весе тела в 50 кг потребность в же-
лезе в год не достигает и 3 г. Содержание в пище извести
важно главным образом в период роста ребенка. Следующая
таблица дает цифры, указывающие содержание железа и
извести в некоторых важнейших пищевых продуктах:
В 10Э г Содержится (в мг)
железа извести
Сахара 0 0
Яичного белка .... — 18,8
Вишен ........ 0,24 27,2
Женского молока . . . 0,28—0,37 29,2
Коровьего молока , . . 0,3 29,2
Яблок 0,3 10.6
Риса 0,88—2,20 90,6
Белого хлеба 0,98 29,5
Спаржи 1,2 —
Картофеля 1,6 25,0
Ржи 3,2—4,2 52,7—60,4
Шпината 4,0—4,7 27,6
Говядины 4,7 8,1
Пшеницы 4,84 189,0
Яичного желтка . . . 5,0—11,9 189,0
Еще в меньшем количестве, чем минеральные соли, в
пище содержатся некоторые дополнительные вещества. На
их след напали лишь в последние десятилетия путем опы-
тов над животными. Когда в 1881 г. попробовали искус-
ственно выкармливать мышей при помощи химически чи-
стых казеина, жира, молочного сахара и солей, то мыши
погибали. Те же из них, Которые в добавление к названной
пище получали несколько кубических сантиметров све-
жего молока, выживали. Из этого был сделан вывод, что
к основным группам питательных веществ присоединяются
еще определенные дополнительные вещества, необходимые
для поддержания жизни организма. Их особенность заклю-
91
чается в том, что они оказывают влияние уже в таких
ничтожных количествах, которые отнюдь не могут служить
источниками энергии. Казимир Функ назвал их витами-
нами, т. е. необходимыми для жизни азотистыми веще-
ствами. Исследования последних лет доказали, что суще-
ствует пять важнейших витаминов, обозначаемых буквами
от А до Е; состав их еще довольно слабо изучен1. Отсут-
ствие в пище этих веществ вызывает болезни, называемые
в медицине общим именем «авитаминозы».
У восточно-азиатских народов, питающихся исключи-
тельно полированным рисом, т. е. рисом, освобожденным
от всякой шелухи, появляются тяжелые расстройства нерв-
ной системы,—развивается болезнь, называемая «бери-
бери». Но эта болезнь никогда не наблюдается у народов,
потребляющих рис вместе с шелухой. Рисовая шелуха
и содержит именно антиневритический витамин, или вита-
мин В. Он содержится также в семенах растений, в яй-
цах, в дрожжевых клетках, в клетках печени и мозга,
в молоке.
При длительном питании консервами, сушеными ово-
щами и тому подобными продуктами наступают изменения
в мускулах и костях, называемые цынгой. Она быстро про-
ходит при употреблении в пищу свежего' мяса и свежих
овощей, например капусты, моркови, салата-латука, тома-
тов, или фруктов—лимонов, апельсинов и т. п. Они содер-
жат противоцинготный витамин, или витамин С.
У детей, вскармливаемых исключительно сгущенным мо-
локом и детской мукой, образуются определенные измене-
ния в костях, так называемая английская болезнь, или
рахит. И эта болезнь возникает на почве недостатка вита-
минов, особенно антирахитического витамина, или вита-
мина D, который принимает очень большое участие в
отложении извести в костях. Он содержится в таких цен-
ных в биологическом отношении жирах, как масло, сливки,
рыбий жир, баранье сало, говяжье сало, но его нет в расти-
тельных жирах. В яйцах, в печени рыб, в свежих овощах
и в молоке тоже имеется витамин D. Это единственный ви-
тамин, который до сих пор науке удалось приготовить
1 В настоящее время в изучении химической природы витаминов до-
стигнуты уже большие успехи, и некоторые из. них приготовлены даже
искусственно. При этом оказалось, что вовсе не все витамины содержат
азот. (Прим, перев.)
92
искусственным путем. Он получается облучением ультра-
фиолетовыми лучами эргостерина и поступает в продажу
под названием вигантоля1.
Толл сало растит мела
коровье масло
Сливки
Говядина
Жир ный сыр
Яйцо
Селедка
Гощий сыр
курица
Нарп
Молоко
Стручковые плоды
Хлеб
Рис
Сахар
картофель
Плоды
Накао
Жира
Углевода Воды
Рис. 30. Содержание в некоторых пищевых продуктах белков,
жиров, углеводов, воды
Близко к витамину D стоит витамин А. Если в пище не-
достает витамина А, то возникают нарушения правиль-
ности роста, повышается восприимчивость к заразным бо-
1 Эргостерин — сложное органическое вещество, встречающееся в зна-
чительных количествах в дрожжах, в плесневых грибках, применяющихся
в промышленности при получении лимонной кислоты, в спорынье. Азота
не содержит. Кроме витамина D получен искусственно витамин С
в 1933 г.). — исходным продуктом для его приготовления теперь служит
виноградный сахар. Все данные говорят за то, что в недалеком будущем
будут получены искусственно также витамин А и витамин В. (Прим, перев.)
93
лезпям и может Наступить заболевание глаз, которое иногда
влечет за собою даже слепоту.
Витамин Е является витамином размножения, он, неви-
димому, влияет на плодовитость и на пол. Найден в са-
лате-латуке и в некоторых породах рыб.
При составлении меню нужно принимать во внимание эти
новейшие данные и позаботиться о большем разнообразии
пищи. Кроме того, в пищевой рацион нужно вводить боль-
шее количество сырых продуктов, так как установлено, что
некоторые витамины разрушаются под влиянием длитель-
ной варки. Этим фактом произносится также приговор ящи-
кам-термосам, употребляемым для доваривания пищи и
длительного сохранения ее в горячем виде.
Рассмотрев различные категории веществ, необходимых
для питания, а также витамины, перейдем к варке пищи.
Варка действует на пищевые продукты животного и ра-
стительного происхождения довольно различно. Для пита-
тельной ценности продуктов животного происхождения,
особенно для тощего мяса, варка и поджаривание не имеют
большого значения. Ведь сырые скобленые бифштексы,
приправленные перцем, солью и тому подобными вещест-
вами, считаются особенно питательными. Мясо рыб и птиц
мы, конечно, не можем употреблять в пищу сырым, однако
и их питательность не изменяется под влиянием варки и
жарения. Но при жарении, когда мясо нагревается с ра-
стопленным жиром и небольшим количеством воды, обра-
зуются приятные по запаху и вкусу вещества, возбуждаю-
щие аппетит и способствующие этим пищеварению.
Следующие пять анализов подтверждают эти положения
цифрами:
Воды (в %) Белковых 1 веществ (В %) Жира (в %) Экстрактив- ных ве- ществ (в % Золы (в %)
Свежее сырое мясо .... 70,83 22,51 4,52 0,86 1,23
Вареное мясо 56,82 34,13 7,50 0,40 1,15
Бифштекс Телячьи отбивные котлеты 55,39 34,23 8,21 0,72 1,45
сырые Телячьи отбивные котлеты 71,55 20,24 6,38 0,68 1,15
жареные 57,59 29,00 11,95 0,43 1,43
94
В этих анализах особенно бросается в глаза тот факт, что
мясо после варки становится беднее водою, чем в сыром
виде. Объясняется эго тем, что волокна мяса сокращаются
под влиянием высокой температуры. Еще более удиви-
тельно, что состав вареного мяса (мяса из супа) очень не-
много отличается от состава бифштекса,—содержание белка
в обоих далее одинаково. Большую разницу мы видим в со-
держании экстрактивных веществ, количество которых в
бифштексе почти в два раза превышает содержание их в
вареном мясе. Под экстрактивными веществами подразу-
мевают такие вещества', которые при варке переходят в
воду и не принадлежат к группе белковых тел или жиров.
Они-То' и влияют возбуждающим образом на вкус, как мы
это знаем по опыту. Если часть этих веществ теряется, как
это бывает при вываривании мяса в супе, то мясо1 приобре-
тает пресный вкус, и его едят пе так охотно. С по-
мощью приправ можно улучшить вкус супового мяса, при-
чем в отношении питательных свойств оно не уступает дру-
гому мясу.
Теперь мы подходим к вопросу о том, как нужно варить
мясо при готовке супа. Во многих местностях вообще не
знают супа, у нас же принято есть суп в начале обеда.
Возникает вопрос: в какую воду нужно опускать мясо при
гбтовке супа: в холодную или в горячую? Постараемся
выяснить этот вопрос опытным путем.
С этой целью мы прибавляем к небольшому количеству
рубленого мяса холодной воды и хорошенько1 промешиваем
эту смесь (рубленое мясо мы берем для того, чтобы полу-
чить большую поверхность его). После фильтрования
массы мы получаем бледнорозовую (от небольшой примеси
крови) жидкость. Прокипятим теперь фильтрат в стакане.
Мы замечаем, что его окраска очень быстро переходит
в серую, ибо красящее вещество крови не выносит высо-
кой температуры и изменяется. Кроме того, при этом
выделяется большое количество хлопьев; это, как показы-
вает исследование,—белок. Холодная вода, таким образом,
извлекла из мяса наряду с минеральными веществами
также и растворимый белок, который при кипячении дол-
жен свернуться. Но так как с супов всегда снимают пену,
то вместе с нею удаляют также и свернувшийся белок;
таким образом ради получения более «красивого» супа
отказываются от этих питательных веществ.
95
Теперь вторую порцию рубленого мяса обольем кипят-
ком и прокипятим непродолжительное время. Мясо тот-
час же окрашивается в серый цвет (т. е. принимает окраску
вареного мяса), так как красящее вещество крови не выно-
сит высокой температуры. В кипящей жидкости мы заме-
чаем очень мало хлопьев свернувшегося белка. Если мы
профильтруем этот суп, то получим прозрачную жидкость,
которая от дальнейшего кипячения не помутнеет.
Здесь процесс протекал таким образом, что под влиянием
кипятка белок на поверхности мяса почти моментально
свернулся; благодаря этому закупорились тонкие поры в
мясе, и экстрактивные вещества почти не могли выде-
литься из него.
Наши опыты подтверждаются и опытом кухни: если хо-
тят получить вкусный суп, мясо следует опускать в холод-
ную воду, так как последняя извлекает из него в изобилии
экстрактивные вещества; суповое мясо тогда будет не очень
вкусно. Если же хотят получить вкусное мясо, то его опу-
скают в кипяток,—зато суп при этих условиях получится
менее приятным на вкус.
В супе главным образом ценится всегда его вкус, пита-
тельного же значения он почти не имеет, что убедительнее
всего доказывают опять-таки цифры. Суп, анализ которого
приведен ниже, был приготовлен из 500 г говядины и
190 г телячьих костей; он содержал в себе:
в °/0
Воды................................ 95,18
Протеиновых веществ.................. 1,19
Жира................................. 1,48
Экстрактивных веществ................ 1,83
Золы ................................ 0,32
100,00
Мы видим, что главной составной частью супа является
вода. Протеиновые вещества, находящиеся в нем, главным
образом клеевого характера, так как белки ведь сверты-
ваются от высокой температуры и снимаются вместе с пе-
ной. Количество жира в супе тоже крайне незначительно.
И если мы тем не менее охотно едим супы, если на основа-
нии опыта им приписывают возбуждающее действие на
нервную систему, то это обусловливается присутствием
в них экстрактивных веществ и калиевых солей. Напри-
96
мер зола супа, анализ которого был приведен выше, со-
стояла наполовину из калия и на четверть из солей
фосфорной кислоты. Всякая зелень, которую прибавляют
в суп, служит лишь для улучшения его вкуса, а введение
в него овощей, яиц и тому подобных продуктов повышает
его питательные свойства.
Варка, печение и жарение имеют гораздо большее зна-
чение для пищевых продуктов растительного происхожде-
ния. Большинство' из них за исключением плодов слишком
жестки для употребления в сыром виде, поэтому ткани,
обусловливающие их прочность, до употребления в пищу
должны быть предварительно разварены.
Хлебные зерна, эти главные питательные продукты ра-
стительного происхождения, нужно предварительно осво-
бодить помолом от их твердых оболочек, чтобы извлечь
затем залегающую под ними муку. Твердые оболочки и
представляют главную составную часть отрубей. Однако
и мука сама по себе мало пригодна в пищу для человека,
так как стенки клеток, содержащие сырые крахмальные
зерна, состоят из клетчатки и с трудом поддаются действию
пищеварительных соков. Совершенно иначе обстоит дело
после нагревания муки с водой. Благодаря разбуханию
крахмальных зерен при варке мучнистых блюд клетки сте-
нок лопаются, и освобожденный крахмал переходит в со-
стояние, подобное клейстеру, и в таком виде уже хорошо
переваривается. Подобный же процесс происходит и при
варке картофеля.
Печение хлеба преследует ту же цель, а именно,—этим
достигается чрезвычайная рыхлость хлеба, которая и де-
лает его очень легко усваиваемым. При размешивании
муки с водой образуется очень тягучее тесто вследствие
содержания в муке клейковины. Это и есть то белковое
вещество муки, которое обусловливает ее тягучесть при
увлажнении. Если такое тесто прямо испечь, то получится
твердая масса, по своим свойствам напоминающая кора-
бельные сухари (галеты); если же тесто некоторое время
постоит в сыром виде, то постепенно оно изменится. Из
воздуха в него попадут дрожжевые клетки, мельчайшие
живые существа, которые сбраживают сахар муки (к этому
мы сейчас вернемся); кроме того, в тесте содержатся и
различные бактерии, попавшие в него с мукою. При дрож-
жевом брожении, вызывающем также и образование всех
7 Химия повседневной жизни.
97
крепких напитков, сахар распадается па углекислый газ
и винный спирт.
1 молекула сахара, 2 молек. спирта,
состоящая из: состоящие из:
образует
6 атомов углерода 2 атомов углерода
12 » водорода 6 » водорода
6 » кислорода 1 » кислорода
или сокращенно:
CgH^Og = 2 C2HgO -j- 2 СО2
2 молекулы угле-
кислого газа,
состоящие из:
1 атома углерода
2 атомов кислорода
1 молекула сахара = 2 молекулам винного -f- 2 молекулы углекислого
спирта
газа
Таким образом 1 молекула сахара под влиянием- брожеь
ния превращается в 2 молекулы винного' спирта и 2 моле-
кулы углекислого газа.
Тягучая консистенция теста препятствует улетучиванию
образующегося под влиянием брожения углекислого газа,
и последний наполняет -все тесто пузырями. Когда тесто
попадает, наконец, в печь, то под влиянием тепла испа-
ряется и образовавшийся под влиянием брожения сцирт,
что еще более усиливает рыхлость хлеба. Высокая темпе-
ратура, кроме того, разрывает клетки сырых зерен крах-
мала, которые тотчас же начинают превращаться в
клейстер.
В наружных же слоях хлеба температура постепенно
становится настолько высокой, что крахмал начинает уже
переходить в декстрин. Вследствие клейкой консистенции
декстрина крахмальные зернышки вместе с другими со-
ставными частями склеиваются на поверхности хлеба в ту
твердую корку, которую мы привыкли видеть на хлебе.
Если сырое тесто долго стоит на воздухе, то оно стано-
вится кислым. В течение того1 времени, которое необходимо
для сбраживания теста под влиянием попавших в него из
воздуха дрожжей, оно не может избежать действия много-
численных имеющихся в нем бактерий. Под их влиянием
образуются незначительные количества молочной и уксус-
ной кислот, придающих тесту кислый вкус. Молочная
кислота и является причиной давно известного названия
такого теста—«кислое тесто», или «закваска».
98
Конечно, проходит довольно много времени, пока в тесто
попадет из воздуха достаточное количество дрожжевых кле-
ток и бактерий. Но если такое тесто уже получено, то при-
бавка его к свежеприготовленному тесту вызывает довольно
быстрое поднятие последнего, так как дрожжевые клетки и
бактерии, как известно, быстро размножаются. Вот почему
всегда сохраняют немного закваски, чтобы прибавлять ее
к свежеприготовленному тесту.
Вкус закваски передается хлебу. В настоящее время с
закваской пекут почти исключительно черный хлеб, кото-
рый и обязан ей своим кисловатым вкусом. Для брожения
же (или, что одно и то же, для поднятия) пшеничного
хлеба чаще применяют чистые дрожжи и таким образом
избегают квашения теста. Раньше дрожжи для этого до-
ставляли пивоваренные заводы, получавшие их в качестве
побочного продукта. Но насколько мало удовлетворял Даже
такой сравнительно усовершенствованный способ произ-
водства, показывают многие заявления пекарей, обращен-
ные к правительствам, например в Вене и Берлине в
1840 г. В этих заявлениях настоятельно указывалось на
крайнюю необходимость получения специально пригодных
для приготовления хлеба дрожжей. В результате были на-
значены премии, благодаря которым постепенно и возникло
современное производство прессованных дрожжей; подроб-
нее о них будет сказано при описании напитков, получае-
мых с помощью брожения.
Иногда для поднятия теста применяют взамен дрожжей
другие средства, влияние которых основано на совершенно
иных принципах, ничего общего не имеющих с брожением
теста. К таким средствам относится, например углеаммо-
ниевая соль, которая употребляется главным образом при
печении пряников. При обычной температуре она пред-
ставляет собой твердую соль белого цвета, при высокой же
температуре печи эта соль распадается на углекислый газ
и аммиак; оба эти газа во время печения и поднимают тесто.
Некоторые хозяйки употребляют для печения поташ,
т. е. углекалиевую соль. Сама по себе эта соль вполне огне-
стойка, и на нее, следовательно, не влияет высокая тем-
пература. Но и поташ выделяет углекислый газ в тех слу-
чаях, когда тесто, к которому он прибавлен, содержит
кислоту. Молочная кислота вытесняет углекислоту из ее
солей, и таким образом>, с одной стороны, образуется молоч-
7*
99
нокалиевая соль, а с другой,—освобождается углекислота;
последняя распадается на воду и углекислый газ, который
и поднимает тесто. Однако действие поташа может быть
удовлетворительным лишь в том случае, когда тесто со-
держит достаточное количество кислоты.
Итак, мы видим, что вызываемое дрожжами поднятие
теста благодаря распаду сахара, происходящему при вся-
ком брожении, связано с потерей питательных веществ.
Такого рода потери происходят, следовательно, при вся-
ком хлебопечении. С помощью так называемых пекарных
порошков, предложенных впервые Либихом, пытались из-
бегнуть этих потерь благодаря получению необходимого
для рыхления теста углекислого газа иными путями.
Главной составной частью современных пекарных по-
рошков является обычно смесь виннокалиевой соли и кис-
лой угленатриевой соли. Когда эта смесь замешивается
с сырым тестом, то ее составные части взаимодействуют
друг с другом й в результате выделяется углекислый
газ. По окончании замешивания тесто благодаря действию
газа становится настолько рыхлым, что его сейчас же
можно печь. Но изготовленному таким путем хлебу нехва-
тает определенных вкусовых веществ, которые вырабаты-
ваются дрожжами при поднятии теста. Пекарные порошки
употребляют обычно лишь для домашнего печенья.
ЛЕКЦИЯ ПЯТАЯ
Количество необходимых питательных веществ. Питательная ценность
важнейших пищевых продуктов. Брожение. Вино. Фруктовое вино. Без-
алкогольные напитки. Шампанское. Мед. Кумыс. Пиво. Солод. Спирт.
Прессованные дрожжи. Хлебный спирт. Картофельный спирт. Барда.
Очистка спирта. Спирт из дерева. Денатурированный спирт. Спирт-
ные напитки. Винный уксус. Спиртовый уксус. Древесный уксус. Ацетон.
Перейдем теперь к очень важному вопросу: сколько’ че-
ловеку нужно пищи для поддержания своих сил? Мы уже
знаем, что его пища должна быть смешанной и содержать
белковые вещества, жиры и углеводы.
Взгляды вегетарианцев1 не могут заставить нас отсту-
питься от убеждения о необходимости для человека сме-
шанной пищи. Так как вегетарианцы отказываются от упо-
требления пищи животного происхождения, они должны
всю свою потребность в белке покрывать за счет раститель-
ных продуктов. Последние содержат, однако, слишком
много углеводов, и для получения от них необходимого
количества белка приходится перегружать желудок совер-
шенно ненужным баластом большого излишка углеводов.
Такой пищевой режим можно переносить, как это доказы-
вают вегетарианцы на самих себе, но ссылки на травоядных
животных, делаемые в подтверждение его целесообраз-
ности, явно несостоятельны. Конечно, лошадь или слон—
животные сильные, хотя они и питаются исключительно
растительной пищей,—но ведь природа снабдила их го-
1 Вегетарианец — человек, питающийся только растительной пищей и
отвергающий мясную потому, что она, якобы, вредна (а иногда и потому, что
считает, что убой скота «безнравственен»). Так называемые неполные
вегетарианцы допускают употребление яиц, масла и сыра. Взгляды вегета-
рианцев научно не обоснованы. Современная медицина считает наиболее
полезной смешанную пищу, т. е. состоящую из продуктов как раститель-
ного, так и животного происхождения. (Прим, персе.)
101
раздо бойее длинным кишечным трактом, необходимым для
лучшего использования углеводов. Кроме того, многие
из травоядных имеют по нескольку желудков и пережевы-
вают свою пищу по нескольку раз.
В то время как вегетарианцы могут так или иначе
переносить свой пищевой режим, питание исключительно
белковой пищей для человека представляется почти не-
возможным. Это мы видим на больных сахарной болезнью.
Такие больные должны были бы, собственно говоря, со-
вершенно отказаться от пищи растительного происхожде-
ния, но провести эту диэту в течение долгого времени
они не могут.
Либих, Фойт и Рубнер произвели многочисленные иссле-
дования для выяснения вопроса о том, какое количество
питательных веществ необходимо человеку в день. Эти
исследования дали следующие результаты:
Сильному рабочему нужно было в день 137 г белка,
173 г жиров и 352 г углеводов (крахмала и сахара).
Для питания молодого врача требовалось 127 г белка,
89 г жиров и 362 г углеводов.
Как средние цифры были получены: 127 г белка, 88,4 г
жиров и 392,3 г углеводов. Указанное количество белка
соответствует 18,3 г азота и содержится в:
272 г сыра 2 650 г сливок
520 » гороха 2 905 » молока
5^8 » тощего мяса 4 575 » картофеля
796 » пшеничной муки 4 796 » сала
905 » яиц 7 625 » капусты
1430 » черного хлеба 17 000 » пива
1868 » риса
Углерода человеку нужно ежедневно. 328 г, которые
содержатся в приведенном выше (в качестве средних цифр)
количестве жиров и углеводов. Они могут быть доставлены:
450 г сала 2 231 г яиц
824 пшеничной муки 2 620 » тощего мяса
896 рдса 3124 » картофеля
919 » гороха 4 652 » молока
1160 сыра 9138 » капусты
1346 черного хлеба 13 160 » пива
1410 сливок
Если бы мы попробовали взвесить потреб'ное нам коли-
чество углерода (328 г) в форме, скажем, древесного угля,
W?
то мы удивились бы: это количество показалось бы нам
более подходящим для обогревания небольшой печки, чем
для «отопления» (если можно так выразиться) человече-
ского тела хотя бы и в течение целых суток. Оказы-
вается, что для поддержания жизнедеятельности и обыч-
ной температуры (37°) тела человека весом около 70 кг
нужно гораздо больше углерода, чем мы обычно себе
представляем.
Расход тепловой энергии и произведенную телом работу
можно измерить в калориях1,—поэтому 'и энергию, за-
ключенную в необходимых для этого питательных веще-
ствах, теперь часто выражают также в калориях. За
основу при этом берут тот факт, что сжигание 1 г белка
дает 4,1 калории, 1 г жира—9,3 калории и 1 г углево-
дов—4,1 калории. Таким путем вычислено, что взрослому
человеку нужно в среднем ежедневно около, 3000 кало-
рий. Это примерно соответствует указанному выше сред-
нему количеству необходимых человеку питательных
веществ.
Если мы разберемся в приведенных выше цифрах не-
сколько внимательнее, то заметим, что большая их часть
согласуется с нашим жизненным опытом, однако среди
них есть и такие, которые противоречат ему. Так, напри-
мер, горох с салом обычно считается очень питательным
блюдом. И действительно, наши цифры показывают, что
ежедневную потребность в питательных веществах можно
удовлетворить небольшим количеством этих продуктов.
Другой результат получился бы, если бы мы попробовали
«питаться» одним пивом. Как видно из таблицы, питатель-
ное значение пива очень ничтожно: наша потребность в
белке покрывалась бы только 17 л пива, а в углероде-—
13 л. Поэтому, пиво нужно рассматривать лишь как вкусо-
вое вещество, не лишенное, правда, некоторой питатель-
ности.
Наиболее полноценным из всех названных выше пище-
вых продуктов является черный хлеб. Примерно полтора
килограмма его достаточно для покрытия дневной потреб-
ности взрослого работающего человека в питательных
веществах.
1 Калория — единица количества теплоты. Калория—количество теплоты,
необходимое для нагревания 1 кг воды на 1°. (Дрим. vepee.)
ЮЗ
Обычно человек потребляет больше пищевых продуктов,
чем указано в нашей таблице в качестве нормы. Объяс-
няется это тем, что' невозможно ведь составить паек, точно
соответствующий найденному соотношению теоретических
чисел. Из принятой пищи организм берет себе необходи-
мое, а излишки частью отлагает про запас, частью же
выбрасывает неиспользованными.
Перейдем теперь к напиткам, получаемым путем бро-
жения.
Если оставить мясо или мучнистые кушанья длитель-
ное время лежать, то они, как известно, плесневеют. По-
падающие в них из воздуха споры плесневых грибков
прорастают, образуют голубовато-зеленый налет, и пищевые
продукты становятся от этого негодными к употреблению.
Иначе, однако, происходит дело с жидкостями, содержа-
щими в растворе сахар. Они также изменяются при стоя-
нии на открытом воздухе, но при этом не плесневеют и не
становятся негодными к употреблению, а наоборот,—пре-
вращаются в бродильные напитки.
Когда оставляют стоять на воздухе сахаристые жидко-
сти, то они, как известно, постепенно начинают пениться
и со временем превращаются в жидкости с совсем иными
свойствами. Это становится заметным по образованию в
них осадка, который получил название дрожжей. Если
такую жидкость выпить, то она производит опьяняющее
действие.
Очень концентрированные растворы сахара не подвер-
гаются брожению,—они обладают даже консервирующими
свойствами, чем и пользуются, например, при пригото-
влении варенья из фруктов.
Необходимо, впрочем, заметить, что не все виды сахаров
способны к непосредственному сбраживанию,—неспособны
к нему, например тростниковый и молочный сахар. Но
последние сами по себе превращаются в способные к бро-
жению сахары, если только вместе с ними в растворе
содержатся такие вещества, которые начали бродить.
Брожение вызывается находящимися повсюду в воздухе
микроорганизмами, попадающими в сахаристые жидкости.
Грибок, обусловливающий при брожении превращение са-
хара в спирт и углекислый газ, называется Sacharomyces
104
cerevisiae (сахаромицет). Он производит бродильной фер-
мент1 зимазу, который и расщепляет молекулу сахара.
Следовательно, брожение обычно является не чисто хими-
ческой реакцией, а связано с жизнедеятельностью микро-
организмов.
* Не нужно, однако, думать, что и самое действие фер-
ментов тоже связано с жизнедеятельностью микроорганиз-
мов. В прежнее время все ферменты делили на неоргани-
зованные (их называли энзимами) и организованные; к пер-
вым относили такие, которые проявляют свое действие
вне вырабатывающих их клеток (например, пищеваритель-
ные ферменты), а ко вторым такие, действие которых счи-
тали связанным с жизнедеятельностью клеток (например
дрожжевые клетки). Теперь, однако, доказано, что из
дрожжевых клеток, бактерий уксуснокислого или молочно-
кислого брожения и т. п. могут быть выделены энзимы,
способные действовать и после смерти вырабатывающих
их клеток. *
Легче всего подвергается брожению жидкость, полу-
ченная путем прессования винограда. Она называется вино-
градным суслом и содержит легко сбраживаемый вино-
градный сахар (глюкозу), а также все вещества, необхо-
димые для развития дрожжей, например неорганические
соли и пр. При брожении виноградного сусла полу-
чается вино.
Содержание сахара в разных сортах винограда очень
меняется (это мы можем определить уже по вкусу), со-
ответственно чему колеблется и содержание спирта в раз-
личных сортах вин. Но оно имеет определенный высший
предел, так как если содержание спирта в бродящей жид-
кости достигает примерно 16 объемных процентов, то
дрожжи умирают, вследствие чего брожение останавли-
вается.
Есть, однако, вина, в которых спирта больше 16%. Это
значит, что к ним искусственно добавлен спирт, отчасти
для удовлетворения вкусов потребителей.
В винах, полученных из богатых сахаром сортов вино-
1 Ферментами, или энзимами, называются сложные органические веще-
ства, образующиеся в животных и растениях и способные в ничтожных
количествах сильно ускорять различные химические реакции, т. е. действо-
вать каталитически. (Прим, персе.)
10о
града, сахар сброжен не целиком, в противоположность
винам, приготовленным из винограда с меньшим содержа-
нием сахара. Например, портвейн содержит 4—о °/о сахара,
малага около. 15 о/о, а в кавказских винах сахара обычно
нет.
Химические вещества, обусловливающие так называе-
мой «букет» вина, т. е. особый тонкий аромат, усиливаю-
щийся по мере выдерживания вина, еще не все точно
установлены. Некоторые из них относятся к сложным эфи-
рам органических кислот (для понимания их химического
состава нужны более глубокие сведения по химии). Они
также образуются здесь под влиянием бактерий, неболь-
шие количества которых находили даже в вине, хранив-
шемся в течение 40 лет в закупоренной бутылке.
Перейдем теперь к плодовым винам. Эти сорта вин по-
лучаются подобным же путем, как и виноградные. Соот-
ветствующие плоды (яблоки, груши) отжимают, и полу-
ченный сок («мост», сидр) подвергают брожению. Но так как
в таких плодах мало сахара, то и полученные из них вина
содержат лишь незначительное количество спирта. С це-
лью увеличения этой существенной составной части вина
к соку, разбавленному водой, часто прибавляют сахар,
который тоже сбраживается вместе со всей жидкостью.
Такая добавка необходима для изготовления вина из смо-
родины и других бедных сахаром ягод, если хотят полу-
чить напиток со сколько-нибудь заметным содержанием
спирта.
Кроме обычных вин из виноградного сусла готовят также
гаампанское, которое получило свое название от француз-
ской провинции Шампань, где его впервые начал изго-
товлять в 1670 г. Периньон, заведующий погребами аб-
батства1 Отвилье. В настоящее время шампанское гото-
вят следующим образом. К вину прибавляют определенное
количество лучшего сахара, разливают в бутылки и кла-
дут последние в горизонтальном положении. Благодаря
добавке сахара вино в бутылках начинает снова бродить;
в нем образуется углекислый газ, который и обусловли-
вает потом вспенивание вина. Брожение вызывается со-
хранившимися еще в молодом вине остатками дрожжей.
1 Аббатство — католический монастырь с принадлежащими ему владе-
ниями. (Прим, перев.)
106
Но иногда оно и не возникает, почему вино тогда снова
приходится выливать из бутылок. Во избежание этого
в настоящее время к молодому вину перед разливом в
бутылки прибавляют чистых дрожжей, что обеспечивает
брожение уже наверняка. Когда вино вполне перебродит,
и дрожжи в нем осядут, бутылки ставят горлышком вниз
и время от времени встряхивают, отчего дрожжи посте-
пенно оседают плотным слоем на пробке. Затем бутылки
откупоривают, и давлением углекислого газа дрожжи вы-
брасываются из бутылки вместе с частью вина. После
этого бутылки доливают доверху так называемым ликером
и снова закупоривают. Состав этого ликера, оказываю-
щего огромное влияние на вкус готового вина, является
секретом фабриканта. После добавки ликера шампанское
готово, но для облагораживания вкуса его необходимо еще
длительное время выдержать.
В прежние времена во время процесса приготовления
шампанского сильное давление разрывало до четверти всех
бутылок; теперь, когда давление углекислого газа можно
точно высчитать, разрывается не больше 1% бутылок.
Как видно- из сказанного, шампанское можно, собственно
говоря, фабриковать везде, где готовят вино; но благо-
даря сложности] изготовления оно о-бходится недешево.
И если, несмотря на это, существуют все-таки очень де-
шевые сорта шампанского, то такие напитки с настоящим
шампанским не имеют ничего общего кроме названия и
готовятся они другим способом. Для их получения легкое
белое вино подслащивают слегка сахаром и затем совер-
шенно так же, как при изготовлении сельтерской воды,
насыщают под давлением углекислым газом, отчего1 и
получается шипучее вино.
С 1901 г. в продаже появились под различными назва-
ниями и безалкогольные напитки, приготовленные из
фруктов. Их получают без брожения,—иначе ведь обра-
зовался бы спирт. Американские фабрики в больших ко-
личествах экспортируют сушеные яблоки, очищенные от
кожуры, а также кожуру, высушенную отдельно. В Ев-
ропе ее варяг с водой, полученную жидкость фильтруют,
растворяют в ней немного углекислого газа, разливают
в бутылки, стерилизуют,—и напиток готов. Углекислый
газ служит здесь для улучшения вкуса, иначе напиток
получается довольно безвкусным»
107
Жители тех стран, где произрастает виноград, знали
вино уже) с древнейших времен. Обитатели более северных
местностей нашли другие пути изготовления спиртных
напитков. Тага, например, жители местностей, располо-
женных к северу от Альп, к которым виноград попал
только послйе покорения их римлянами1, с давних вре-
мен знали спиртный напиток—мед. Его приготовление
также несложно. В качестве исходного продукта берут
пчелиный мед, который ведь очень сладок и, следова-
тельно, содержит много сахара1. Сам по себе мед благодаря
высокому содержанию сахара не бродит. Но если его раз-
бавить водой, то попавшие в жидкость из воздуха заро-
дыши дрожжей вызывают брожение, результатом которого
является опьяняющий напиток—мед. Теперь он почти за-
быт; вкус этого напитка трудно назвать приятным1 2.
Таким же древним является употребление кумыса. Это—
перебродившее кобылье молоко, брожение которого вы-
зывается с помощью кефирного грибка. Кумыс пригото-
вляется почти исключительно в прикаспийских местностях,
восточных районах Куйбышевского края, Южном Урале.
-Так как обычно молоко при стоянии не превращается
дрожжами в опьяняющий напиток, а скисает под влия-
нием молочнокислых бактерий, то мы должны сказать не-
сколько слов о приготовлении кумыса.
Для его получения молЪко разбавляют примерно десяти-
кратным количеством воды и добавляют в него немного
готового кумыса. Содержащийся в последнем кефирный
грибок быстро превращает часть молочного сахара в мо-
лочную кислоту. Эта кислота действует затем на остав-
шийся сахар таким образом, что он превращается в спо-
собные к брожению виды сахаров, которые и сбраживаются
затем дрожжами с (образованием спирта и углекислого газа.
* Кумыс представляет собой шипучий напиток прият-
ного кисловатого вкуса. В зависимости от продолжитель-
ности брожения принято различать по возрасту три сорта
кумыса: слабый (однодневный), средний (двухдневный)
и крепкий (трехдневный). Содержание спирта в кумысе
очень незначительно, даже в трехдневном кумысе оно
1 Примерно около двух тысяч лет назад. (Прим, перев.)
2 Мед в старинные времена был очень распространен в России. (Прим,
перев.)
Ю8
составляет всего около 2°/о. Кроме спирта в нем есть мо-
лочный сахар (1—4%), молочная кислота (0,75—1%), соли
и пр. Помимо кобыльего молока, для приготовления ку-
мыса применяют иногда верблюжье, козье (в Крыму),
а также коровье молоко (в Москве). По физико-химическим
и другим свойствам такой кумыс, однако, отличается от
кобыльего, и говорить об их равноценности не приходится.
Кумыс отличается большой питательностью и обладает
ценными лечебными свойствами. Особенно хорошо он дей-
ствует при малокровии, хлорозе, рахите, цынге, туберку-
лезе, хроническом бронхите и ряде других заболеваний. &
В тех местностях Европы, где не произрастает вино-
град, научились делать пиво. Для выяснения процесса
его приготовления нужно сказать следующее.
Если семя попадает в сырую землю, то оно при благо-
приятной температуре скоро прорастает, пуская корешок,
а затем и листья. Но корешок неспособен доставить рас-
теньицу все нужные питательные вещества. Для этого на
первое время служат запасы крахмала и белка, содержа-
щиеся в семени. Одновременно с прорастанием в семени
образуется такое вещество, которое способно превращать
крахмал в сахар и декстрин и переводить белки в раство-
римое состояние. Растворы всех этих веществ и служат
для питания растеньица1 до тех пор, пока зеленые листья
не разовьются настолько, что смогут взять доставку необ-
ходимого питания на себя.
Для приготовления пива, как установлено опытом, наи-
более подходящими являются зерна ячменя. Можно го-
товить пиво и из пшеницы с ячменем (так готовят, напри-
мер, берлинское пиво). Но наиболее распространенным
является все-таки ячменное пиво, почему мы в дальней-
шем рассмотрим именно его производство.
Для приготовления пива ячменные зерна замачивают
и оставляют в течение двух суток набухать, после чего
их переносят в неслишком холодный погреб. Там они
прорастают, выпуская корешки, и в них образуется то
вещество, которое обладает способностью превращать крах-
мал в сахар. Это вещество называется диастазом. Оно
переводит такж)е в растворимое состояние и азотистые
вещества—белки.
109
Когда корешки достигнут определенной длины, устано-
вленной опытным путем, дальнейшее прорастание ячменя
прерывают высушиванием. Полученный таким образом
продукт называется солодом. Если высушивание произ-
водят на воздухе, то получают так называемый воздуш-
ный солод. Но обычно сушку ведут в специальных со-
лодосушилках—сильно нагретых помещениях. Чем более
высокая температура применяется при этом, тем темнее
получается потом цвет пива. Для получения очень тем-
ных сортов пива часть солода даже поджаривают в особых
барабанах.
Готовый продукт затем дробят на вальцовых дробилках и
заливают в чанах теплой водой, имеющей температуру
50—70°. При такой температуре быстрее всего происходит
процесс превращения крахмала в Сахар и декстрин под
влиянием образовавшегося при прорастании (зерна диа-
стаза. Таким образом из крахмала ячменных зерен полу-
чается сахар, из которого потом образуется при брожении
содержащийся в пиве спирт. Только что описанный про-
цесс называется «затиранием солода» и дает в результате
богатую сахаром жидкость—пивное сусло. Оно соответствует
суслу, полученному выжиманием виноградного сока, но
разница здесь в том, что в последнем были уже готовые
виды сахара, способные к брожению, в то время как в
пивном сусле человек искусственно превратил крахмал
ячменных зерен в сбраживаемый сахар.
Если сусло оставить бродить в таком виде, то образовав-
шееся из него пиво было бы совершенно негодным к упо-
треблению. Для получения напитка с приятным вкусом
жидкость надо сначала прокипятить с чем-нибудь горь=
ким. В качестве такого вещества теперь повсюду приме-
няют хмель, который на Рейне стали разводить с этой
целью еще с IX в. Раньше для этого применяли дубовую
кору (например, в Восточной Пруссии).
После варки с хмелем сусло нужно как можно быстрее
охладить, для чего теперь пользуются холодильными ап-
паратами. В противном случае есть опасность, что сбра-
живание сахара пойдет в нежелательном направлении:
при температурах между 25 и 30° может наступить уксус-
нокислое и молочнокислое брожение, отчего пиво получи-
лось бы кислым и было бы испорчено.
В заключение достаточно охлажденная жидкость посту-
110
пает в погреба, где она после добавления дрожжей начи-
нает бродить в больших чанах.
Если не добавлять в сусло дрожжей, а ждать (как это
делают в Бельгии), пока в него попадет достаточно дрож-
жевых спор из воздуха, то процесс брожения идет очень
медленно и ненадежно. Добавленные же дрожжи размно-
жаются в сладкой жидкости очень быстро и вызывают
превращение сахара в 'спирт и углекислый газ. Если вести
брожение при температуре 12—15°, то наряду с быстрым
образованием спирта происходит настолько бурное выде-
ление углекислого газа, что поднимающиеся газовые пу-
зырьки увлекают с собой на поверхность и дрожжевые
клетки. При этом получается пиво «верхового брожения».
Гораздо чаще применяют, однако, «низовое брожение»,
которое ведут при 6—8°. Оно идет на много медленнее,
и дрожжи здесь остаются в виде осадка на дне чана, так
как углекислый газ в этом случае выделяется медленно
и постепенно. Пиво это гораздо лучше сохраняется, по-
этому оно особенно пригодно для пересылки и хранения.
Для того чтобы пиво приобрело приятный вкус, мало
одной горьковатости его. В противоположность вину и
другим спиртным напиткам пиво должно содержать до-
статочно углекислоты, иначе оно будет невкусным.
С целью получения нужного количества углекислоты
в пиве его после окончания основного брожения сливают
в бочки, где продолжается потом дображивание, хотя и
очень медленное. Незадолго перед употреблением пива
бочки закрывают. Так как образующийся при дальнейшем
брожении углекислый газ не может больше улетучиваться,
то он растворяется в пиве и насыщает его. Весовое количе-
ство углекислоты в пиве очень незначительно, оно со-
ставляет около двух десятых процента. Кроме того, пиво
содержит от 2,5 до 4,8 весовых процента спирта, 0,4—1,3°/о
сахара и 0,2—0,4% золы, остальное составляет вода.
Теперь поговорим о спирте и приготовляемых из него
напитках.
Опьяняющее действие вина было известно с давних вре-
мен, но выделить его составную часть, обусловливающую
это действие, удалось только в XI в. в Италии, после
того как там был изобретен дестидляционный аппарат
ш
в виде реторты. Если мы в колбу перегонного аппарата,
изображенного на рис. 13 (см. стр. 29), нальем вино
и будем его кипятить, то получим в приемнике светлый,
прозрачный, как вода, дестиллат (погон) с приятным осве-
жающим запахом. В те времена думали, что этот дестил-
ь лат содержит «дух» вина, почему его и на-
\ звали по-латыни spiritus vini («спиритус
/ вини», т. е. «дух вина»); отсюда и произошло
название спирт. Другое название—алко-
голь—по-арабски значит «тонкое вещество».
Впервые назвал так спирт Парацельс в 1525 г.
Остаток от перегонки, который считали ни
к чему не пригодным, получил название
«флегмы». Вот откуда, между прочим, и про-
исхождение строки одного стихотворения
Шиллера:
«К чорту пошел спирт, осталась одна флегмам.
Рис. 31. Опыт
с выделением
спирта из пива
Пользуясь горючестью спирта, можно легко
доказать его наличие во всяком бродильном
напитке. Выльем, например, бутылку пива в
стеклянную колбу, в горлышко которой с по-
мощью пробки вставлена стеклянная трубка
длиной около 1,5 м (рис. 31). Нагрев пиво
до бурного кипения, поднесем к верхнему
отверстию трубки зажженную спичку: выхо-
дящие из трубки пары спирта вспыхнут и
будут продолжать гореть длинным светлого-
лубым пламенем. Это пламя, конечно, скоро
потухнет, так как в пиве содержится мало
спирта.
Таким путем мы как бы «выжгли» спирт
из пива. Это наиболее удобный для наших
целей способ доказательства содержания
спирта в пиве. Но если бы мы не сожгли
спирт, а сгустили бы его пары охлаждением, то получили
бы, конечно, жидкость. Химик может легко доказать,
что эта жидкость совершенно сходна с тем спиртом, кото-
рый получается при дестилляции вина.
Из вина и теперь еще готовят много спирта дестилля-
цией в металлических аппаратах, принцип устройства ко-
112
торых тот же, что и стеклянного аппарата, описанного
на стр. 29. Этот спирт служит теперь главным образом
для приготовления коньяка, но когда-то им покрывалась
вообще вся потребность в спирте. Наоборот, пивом поль-
зовались для получения спирта очень редко, так как уже
давно нашли способ приготовления спирта из хлебных
зерен («хлебное вино»). Этот способ, гораздо менее слож-
ный, чем пивоварение, был изобретен, невидимому, в Юж-
ной Германии около 1500 г. Сущность его в главных
чертах заключается в следующем.
Исходным материалом служит большей частью рожь,
которую почти всегда перерабатывают при этом вместе с
ячменем. Начало производства совершенно сходно с пиво-
варенным: замоченную рожь оставляют прорастать в по-
гребах. Полученный зеленый солод в спиртовом производ-
стве чаще всего непосредственно перерабатывают дальше,
реже его предварительно высушивают.
Содержащийся в солоде диастаз, обусловливающий пре-
вращение крахмала в сахар и декстрин, может осахарить
гораздо больше крахмала, чем его есть в солоде. Поэтому,
если раздробленную и разваренную (для лучшего высвобо-
ждения крахмальных зерен) рожь облить теплой водой
(около 60°) и добавить туда солода, то будет осахарен
и весь крахмал 'ржи.
Полученная таким путем сахаристая жидкость, соответ-
ствующая примерно виноградному суслу, подвергается за-
тем брожению. Необходимые для этого дрожжи готовят
обычно тут же на винокуренном заводе. Это так называе-
мые прессованные дрожжи, которые в настоящее время
применяются всюду для вызывания брожения: при выпечке
пшеничного хлеба, в кулинарном деле и т. п.
Долгое время прессованные дрожжи готовились следую-
щим образом.
Для получения большого количества дрожжей на вино-
куренных заводах применяли верховое брожение. Для
этого приготовляли сусло из одной части солода и пяти
частей раздробленной ржи. После добавления дрожжей бро-
жение вели при температуре около 30°, т. е. слишком высо-
кой для обычного брожения. С 1895 г. через бродящее сусло
начали пропускать, кроме того, еще воздух, так как оказа-
лось, что это очень благоприятствует развитию дрожжей
и, следовательно, увеличивает их выход. Высокая темпера-
8 Химия повседневной жизни.
ИЗ
тура брожения была нужна для получения в смеси необхо-
димого количества молочной кислоты, которая тоже благо-
приятствует процессу брожения.
Но с 1900 г. молочная кислота сделалась уже здесь не-
нужной, так как ее заменили серной кислотой. Это ново-
введение позволило вести процесс гораздо скорее и надеж-
нее, а кроме того, очень значительно увеличило выход
дрожжей.
Плавающую наверху дрожжевую массу счерпывают, про-
мывают несколько раз водой, добавляют 20% крахмала и
прессуют. Полученная таким образом масса и поступает на
рынок под названием прессованных дрожжей. Успехи этой
части старого промышленного процесса брожения лучше
всего рисуют следующие цифры. Из 100 кг зерна раньше
получали 14—15 кг дрожжей и 30—32 кг спирта; с введе-
нием продувания воздуха выход дрожжей повысился до
20 кг, а спирта стало получаться тоже 20 кг; наконец, с
применением серной кислоты выход дрожжей достиг 40 кг,
спирта же при этом образуется только 12 кг.
При приготовлении спирта из ржи сахаристую жидкость,
полученную с помощью диастаза солода, подвергают до-
вольно быстрому сбраживанию, добавляя в нее крепкие
дрожжи. После этого перебродившую жидкость перего-
няют. Дестиллат, имеющий подобно винному спирту прият-
ный запах и вкус, может прямо служить для приготовления
водок и ликеров. Остаток в перегонном кубе называется
бардой; о нем мы еще поговорим позже.
Примерно! с 1820 г. научились приготовлять спирт также
из картофеля. Мы уже знаем, что картофель содержит
много крахмала. Поэтому легко понять, что путем осаха-
ривания этого крахмала и сбраживания полученного сахара
можно приготовить спирт. Средние цифры урожая пока-
зывают, что с определенной площади, засеянной картофе-
лем, можно получить гораздо больше спирта, чем с такой
же площади, засеянной рожью. Рожь дает уже многие
годы средние урожаи примерно в 1600 кг с 1 га, что соот-
ветствует 1040 кг крахмала (зерна ржи содержат 65%
крахмала). Урожай картофеля с 1 га составляет в среднем
16 000 кг, а так как крахмала в картофеле около 18%, то
указанное количество картофеля соответствует 2880 кг
крахмала. Поэтому-то приготовление спирта из картофеля
и получило большое развитие, особенно в таких местностях,
114
где почва очень благоприятна для разведения картофеля
(например в Германии—к востоку от р. Эльбы).
• Мы знаем, что крахмальные зерна картофеля заключены
в оболочки. Для того чтобы их освободить, картофель при
получении из него спирта нужно разварить. Но опыт по-
казал, что таким простым путем не удается освободить
зерна крахмала настолько, чтобы они все сделались доступ-
ными осахариванию диастазом солода. Это очень важное
для хорошего выхода спирта требование может быть,
однако, выполнено варкой картофеля не в открытых, а в
закрытых сосудах.
При нагревании воды в наглухо закрытом котле (в паро-
вом котле) она закипает труднее, чем в открытом сосуде.
Почему?
Если из сосуда выкачать воздух, находящийся над во-
дой, то точка кипения воды упадет значительно ниже
100“—температуры кипения воды при атмосферном давле-
нии. Если же образующемуся пару не дают возможности
уходить из сосуда, то он оказывает давление на воду и
этим повышает ее точку кипения. Так, например, при дав-
лении, в четыре раза превышающем атмосферное (или как
говорят при давлении в 4 атмосферы), вода закипает только
при температуре около 150°. До этой'именно температуры
(а следовательно, и соответствующего 'давления) нагревают
картофель в так называемом парнике. Когда опа будет
достигнута, сразу открывают находящийся в дне сосуда
вентиль, и содержимое с силой выбрасывается в чан.
Теперь, следовательно, давление 'внезапно падает до атмо-
сферного, и перегретая на 50° вода, в том числе и нахо-
дящаяся внутри клеток картофеля, бурно превращается
в пар. От этого все клетки разрываются и из Пих осво-
бождается крахмал, превращенный в клейстер и вполне
подготовленный для осахаривания диастазом.
Полученная картофельная кашица затирается с водой
при температуре около 60° и в нее добавляется зеленый
солод, который, как и при получении спирта из ржи, осаха-
ривает затем крахмал. После этого сахаристая жидкость
(«бражка») сбраживается уже известным нам способом при
помощи дрожжей. Перегонка перебродившей жидкости дает
спирт, а остаток представляет собой тоже барду.
Барда, полученная как при винокурении из ржи, так и
при винокурении из картофеля, представляет собой пре-
«•
из
красный корм для скота. Простые соображения показывают,
что на получение спирта из картофеля или зерна тратится
только крахмал, а бывшие в исходном сырье азотистые
вещества—белки—должны остаться большей частью в
барде. Белки же, как мы знаем, являются превосходным
питательным средством, и вот почему винокурение позво-
ляет сельскому хозяйству держать больше скота. Богатая
белками барда служит здесь прекрасным дополнением к
обычным кормам, которые содержат много углеводов, но
относительно бедны белковыми веществами.
Дестиллат, полученный из вина или зерна, может слу-
жить, как мы уже сказали, непосредственно для приго-
товления водок и ликеров, так как он обладает хорошим
вкусом и запахом. Что касается картофельного спирта, то
предназначенный для употребления в качестве напитка
спирт приходится предварительно очищать, или, как гово-
рят в технике, подвергать ректификации. Дело в том, что
при сбраживании картофельной бражки из сахара обра-
зуются не только обыкновенный спирт и углекислый газ,
но и ряд других веществ. Последние получаются из про-
дуктов распада белка; химики относят зги вещества тоже
к классу спиртов; большую часть из них составляют
амиловые спирты. Но действие всех этих веществ на чело-
веческий организм очень отличается от действия обыкно-
венного спирта,—они сильно ядовиты. Обычное название
смеси этих продуктов—сивушное масло.
Ядовитое сивушное масло необходимо удалить из спирта-
сырца. Сырой картофельный спирт содержит обыкновенно
80% спирта и 20% воды; в нем растворено и сивушное
масло. Если же его разбавить водой настолько, чтобы со-
держание спирта упало до 50%, то он замутится. Произой-
дет это по той причине, что сивушное масло в разбавленном
спирте растворяется плохо и поэтому выделяется в виде
мельчайших капелек.
Пятидесятипроцентный спирт фильтруют через древес-
ный уголь, который задерживает в себе мелкие капельки
сивушного масла, а также все красящие и дурно пахну-
щие вещества. Профильтрованную жидкость превращают
затем в 'Особых аппаратах в 96%-ный спирт следующим
образом.
Вспомним, что мы могли зажечь спирт, содержащийся
в пиве, после того как мы укрепили в горлышке колбы с
116
кипящим пивом длинную стеклянную трубку. Тогда мы не
объяснили, почему здесь нужна была такая длинная
трубка. Дело в том, что именно в ней происходило отделе-
ние паров спирта от паров воды. Если бы мы попробовали
зажечь пары спирта прямо у горлышка колбы, то это нам
не удалось бы, так как здесь к ним примешано еще много
водяного пара. В длинной же трубке пары воды, охлаж-
даясь, сгущаются скорее, чем пары спирта, отчего и про-
исходит их разделение. Вот почему последние выходили
из трубки в довольно чистом виде и были способны гореть.
Подобным же способом и на заводах стараются полу-
чить возможно более высокопроцентный спирт, чтобы уде-
шевить тем самым его перевозку. Это делают в высоких,
так называемых колонных аппаратах. В них сгущается
почти вся вода, и в приемник попадают главным образом
только пары спирта.
Однако и в этих аппаратах получают спирт не крепче,
чем 96%-ный, в нем остаются еще растворенными 4°/о воды.
Получить 100%-ный, т. е. безводный спирт удалось впер-
вые всего только около 100 лет назад. Это достигается с
помощью негашеной извести. Добавленная в 96%-ный
спирт негашеная известь гасится за счет содержащейся в
нем воды (т. е. химически соединяется с ней). Если обез-
воженный таким путем спирт подвергнуть перегонке, то
получится 100%-ный спирт. *В последнее время для по-
лучения безводного спирта применяют главным образом
перегонку водного спирта в смеси с бензолом. При этом
сначала отгоняется низкокипящая смесь спирта, бензола и
воды с Температурой кипения 64,8°, затем отходит остаток
бензола, смешанный со спиртом (при 68,2°), и, наконец,
перегоняется безводный спирт с температурой кипе-
ния 78,3°. *
С 1904 г. в Америке в большом промышленном масштабе
начали получать спирт из дерева. Сущность соответствую-
щего способа заключается в том, что измельченное дерево
нагревается короткое время в паровом котле с серной
кислотой, причем образуется сахар. После этого котел
должен быть быстро' опорожнен. Образовавшийся из целлю-
лозы сахар извлекается водой и полученный водный ра-
створ его после нейтрализации серной кислоты известью
подвергается непосредственно сбраживанию с помощью
дрожжей.
117
Способ получения спирта из дерева;, применяемый в
Европе, коренным образом отличается от американского.
В Европе основной целью производства служит приго-
товление целлюлозы. И только с 1908 г. из отходов целлю-
лозного производства здесь начали готовить в качестве
побочного продукта также спирт.
Сущность этого европейского способа будет нам ясна
из следующего.
Мы знаем, что сахар (получают главным образом из сахар-
ного тростника и из сахарной свеклы, но он встречается
И В других растениях. '-Его много, например, в соке клена:
в Канаде добывают ежегодно около 9 млн. кг кленового
сахара, отличающегося приятным ароматическим привку-
сом. Немного сахара есть также в ели и сосне. При варке
древесины этих деревьев с кислой сернистокальциевой
солью для получения целлюлозы (об этом мы будем под-
робнее говорить в восьмой лекции) сахар переходит в ва-
рочные щелока—так называемые сульфитные щелока. Если
в эти щелока после нейтрализации их известью добавить
дрожжей, то содержащийся в них сахар будет сбражи-
ваться в спирт. 100 кг древесины дают при этом около
2 л спирта; стоимость 100 л такого спирта составляет около
16 марок (т. о. около 7 р. 50 к. золотом).
Теперь мы перейдем к добыванию спирта из еще более
дешевых веществ, чем дерево. Это поразительное достиже-
ние, относящееся к 1916 г., знаменует собой начало осу-
ществления давнишней мечты о возможности получения
из минеральных материалов в любом количестве тех про-
дуктов, которые до сих пор могли добываться только с
помощью растений. Производство таких продуктов нахо-
дится в зависимости от меняющихся урожаев, но химия
все время ищет путей, которые могли бы избавить нас от
этой зависимости.
Исходным материалом для нового способа получения
спирта, а также и большого количества других продук-
тов, вплоть до искусственного каучука, служит знакомый
уже нам газ ацетилен. Удобнее всего получать ацетилен из
Sоплавленного в электрической печи карбида кальция,
ыло найдено (и многочисленные патенты являются дока-
зательством ревностной работы в этой области), что аце-
тилен присоединяет элементы воды, если его пропу-
скать через подкисленную воду, содержащую соединения
118
ртути. При этом он переходит в ацетальдегид (уксусный
альдегид).
1! = С-С = Н
о
н\
н— с — с
н/
\н
Странное название «альдегид» придумано Либихом, ко-
торый произвел его от начальных слогов двух латинских
слов: alkohol dehydrogenatus (алкоголь дегидрогенатус),
что значит—алкоголь, лишенный некоторых атомов во-
дорода.
Так как каждому так называемому «первичному» спирту
соответствует свой альдегид, то число последних очень
велико.
Характерная для альдегидов группа атомов
обладает 'большой реакционной способностью. Поэтому,
исходя из альдегидов, можно получить различными путями
большое количество новых соединений. Например, тот
альдегид, о котором мы говорим, т. е. ацетальдегид, можно
перевести в спирт, присоединяя к нему водород. Такое
присоединение водорода называют восстановлением. При
этом получается тот же самый спирт, который добывается
из картофеля, зерна или древесины. В Людвигсгафене на
Рейне есть завод, изготовляющий ежегодно 30 тыс. гл
спирта из карбида, а Швейцария покрывает всю свою по-
требность спиртом, добытым таким путем.
Весь спирт, употребляемый для изготовления напитков,
облагается акцизом, спирт же, идущий для промышлен-
ных целей, от акциза полностью или частично освобо-
ждается. Так как и тот, и другой спирт обычно одинако-
вого происхождения, то нужно было найти средство, кото-
рое обеспечивало бы государство от возможности тайного
потребления для питьевых целей спирта, предназначенного
для промышленности или продаваемого в качестве горю-
чего. Такой спирт нужно было сделать непригодным для
питья, «денатурировать» его, сохранив в то же время его
технические свойства. Это достигается прибавлением к
спирту таких веществ, запах и вкус которых не позволяют
употреблять его в качестве напитка и которые можно уда-
119
лить из спирта только с помощью сложных приемов и имея
специальные химические познания. В Германии закон пред-
писывает применять для денатурирования так Называемые
пиридиновые основания. Что ото такое?
При производстве светильного таза в качестве побочных
продуктов получаются, как мы знаем, аммиак и каменно-
угольный деготь. В 'этом дегте содержатся азотистые веще-
ства, которые химически можно рассматривать как произ-
водные аммиака и которые, как и сам аммиак, обладают
сильным, иногда очень неприятным запахом. Некоторые из
таких веществ и представляют собой применяемые для
денатурирования пиридиновые основания1.
Приготовление водок или ликеров из чистого спирта—
дело несложное. Эти напитки готовят путем разбавления
спирта водой и добавления сахара и фруктовых эссенций.
Такие эссенции фабрикуются на соответствующих химиче-
ских заводах из фруктов. Но в настоящее время можно го-
товить так называемые фруктовые эфиры искусственно, об-
ходясь при этом совершенно без фруктов; такие приго-
товленные чисто1 химическим путем вещества все больше и
больше вытесняют теперь эссенции растительного проис-
хождения. Некоторые водки готовят настаиванием спирта
на подходящих цветах; через определенное время спирт
принимает их запах и вкус.
Другим путем готовятся жоньяк, арак, ром и виски. Их
получают [непосредственной перегонкой перебродивших
жидкостей. Своим вкусом они обязаны только тем летучим
веществам, которые попали в них при перегонке. Пере-
численные напитки представляют собой как бы сырой спирт
очень приятного вкуса.
Коньяк получается перегонкой вина; окраска коньяка
зависит от того, что его выдерживают в дубовых бочках,
откуда он постепенно выщелачивает желтый краситель.
Арак готовят на Востоке главным образом перегонкой пере-
бродившего риса; при этом переработка самого риса с целью
получения из него спиртного напитка соответствует, ко-
нечно, в общих чертах нашему винокурению из ржи. Ром
1 Кроме пиридиновых оснований для денатурации применяются еще
древесный спирт (содержащий ацегон и другие примеси), так называемые
кетоновые масла, имеющие отвратительный вкус, керосин, бензин, деготь
и пр. Для резкого отличия денатурированного спирта от обыкновенного
часто прибавляют еще краску. (Прим, перев.)
120
производят на Антильских островах из перебродившего
сиропа сахарного тростника. Виски делают в Америке из
кукурузы. Вот таблица, показывающая состав некоторых
спиртных напитков1:
Спирт Сахар
в % в %
Коньяк ..............................
Арак ................................
Ром..................................
Кюммель (ликер).............; . - . .
Бенедиктин (ликер) ..................
53,82
60,74
77,62
3?,9J
46,2
31,18
32,57
* Раньше уже упоминалось, что спирт употребляется
не только для изготовления спиртных напитков; его про-
изводство имеет и очень важное промышленное значение.
Спирт широко применяется в качестве растворителя в лако-
вом производстве, в парфюмерии, в производстве лекарст-
венных веществ и т. д. Он служит исходным сырьем для
приготовления уксуса, эссенций, эфира, хлороформа и мно-
гих других органических препаратов. В тех странах, где
дорог бензин, спирт употребляется в качестве горючего
для двигателей внутреннего сгорания. Его применяют так-
же как материал для освещения и нагревания в домашнем
хозяйстве. Особенно важное промышленное значение полу-
чил спирт в СССР как исходное сырье для широкого за-
водского изготовления синтетического каучука по методу,
разработанному проф. Лебедевым.
Мировое производство винного спирта оценивается сей-
час примерно в 10—12 млн. гл (около 1 млн. т по весу) в
год—по пересчету на безводный спирт. Примерно две трети
этого количества расходуется на приготовление напитков,
а остальное идет для технических целей в виде чистого
или денатурированного спирта. ☆
Посмотрим теперь, как готовится из спирта уксус.
Опыт показывает, что если вино или пиво оставить
стоять открытыми на воздухе, то они через некоторое время
скисают. Они теряют при этом свое опьяняющее действие
и приобретают настолько резкий вкус, что становятся не-
годными для питья. Но изменившиеся таким образом жид-
1 Здесь приведены средние цифры, которые в разных сортах названных
напитков, особенно в приготовленных искусственным путем, очень колеб-
лются. (Прим, перев.)
121
костя служат приправой к кушаньям, которым они при-
дают приятный кисловатый вкус.
При скисании жидкостей, содержащих спирт, последний
переходит в уксусную кислоту; получающуюся при этом
жидкость мы называем уксусом.
Как мы видели, виноградный сок очень легко превра-
щается в вино; последнее нетрудно- превратить в так назы-
ваемый винный уксус. Переход спирта в уксус основан на
окислении, т. е. на присоединении кислорода. Поэтому в
лаборатории можно легко получить из спирта уксусную
кислоту с помощью окислителей. Но обычно кислород воз-
духа действует на спирт только в присутствии особого
грибка, называемого Mycoderma aceti1. Он находится, как
и многие другие микроорганизмы, повсюду в воздухе и об-
ладает способностью особенно быстро размножаться там,
где уже есть немного- уксуса. Изготовление винного уксуса
и до настоящего времени производится следующим
образом.
В дубовую бочку сначала наливают кипящий уксус, что-
бы -она хорошо им пропиталась. Затем бочку наполняют до
двух третей ее высоты вином. На этой высоте в бочке
Имеется ряд отверстий, которые облегчают доступ воздуха
к поверхности жидкости. Примерно через 14 дней вино пол-
ностью превращается в уксус. Половину этого уксуса берут
для потребления, бочку снова доливают вином и так про-
должают изготовление уксуса годами, пока не понадо-
бится почистить бочку. Основным условием успеха является
при этом то, чтобы содержание спирта в вине не превышало
10%; в случае применения более крепких вин их нужно
разбавлять водой.
Подобным же путем можно готовить уксус из плодовых
вин, а также из пива. Последнее придает уксусу, естест-
венно, горьковатый привкус, происходящий от горьких
составных частей хмеля, которые при этом способе не уда-
ляются из пива. Поэтому в прежние времена готовили
также пиво- и без прибавления хмеля; оно было непригодно
в качестве напитка и сейчас же шло на изготовление
уксуса.
Так как при процессе фабрикации уксуса все дело за-
1 Mycoderma aceti является, собственно говоря, бактерией, но обычно
ее называют «уксусным грибком». (Прим, перев.)
122
ключается в окислении спирта, то для получения уксуса
может служить, конечно, и спирт, приготовленный из
зерна или картофеля. Из такого1 спирта и готовится в на-
стоящее время большая часть поступающего на рынок
уксуса.
Для приготовления уксуса из спирта последний разба-
вляют водой настолько, чтобы содержание спирта не пре-
вышало 10%. Потом его можно попытаться перевести в
уксус тем же путем, как и вино, но результат при этом
получится очень неудовлетворительный: насколько легко
скисает в подобных условиях вино, настолько трудно пе-
реходит в уксус разбавленный спирт;—в нем нет веществ,
необходимых для литания грибка. Поэтому здесь разрабо-
тан другой способ, который начали применять примерно
с 1820 г. Это—так называемый скорый способ.
Высокую бочку с ложным дном (деревянная решетка,
помещенная несколько выше дна) наполняют буковыми
стружками, хорошо пропитанными старым уксусом, и
сверху заставляют медленно капать на стружки разбавлен-
ный спирт. По бокам бочки есть много отверстий, которые
просверлены так, что они хорошо пропускают внутрь воз-
дух, но не дают вытекать из бочки жидкости. Таким об-
разом спирт имеет здесь очень большую поверхность со-
прикосновения с воздухом и окисляется кислородом по-
следнего в уксусную кислоту. Под ложным дном собирается
поэтому жидкость, содержащая уксусную кислоту. Для
того чтобы добиться полного окисления спирта, жидкость
нужно пропустить через бочку три-четыре раза. Наиболее
крепкий уксус, полученный по этому способу, называют
спиртовым уксусом.
Анализы различных сортов уксуса дают следующее содер-
жание уксусной кислоты: , , .
в •/,
Спиртовый уксус............................ 10,30
Винный уксус................................. 5,37
Обыкновенный белый уксус..................... 4,63
» темный уксус...................... 3,53
☆ Уксус получают также из солода и отходов виноделия
и фруктов. Для приготовления солодового уксуса солод
подвергают сначала спиртовому брожению и полученную
бражку, содержащую около 6,5% спирта, хранят затем
ш
в особых чайах в течение нескольких недель. За это
время в ней успевают образоваться некоторые вещества,
улучшающие вкусовые качества уксуса. Потом бражку
перерабатывают на уксус по только что описанному спо-
собу. Солодовый уксус содержит 5,1—6,1% уксусной ки-
слоты и имеет слабый соломенножелтый цвет. Его не-
редко подкрашивают жженым сахаром.
Сырьем для получения уксуса являются и виноградные
выжимки, прокисшее вино, поврежденные фрукты и т. п.
В зависимости от исходного сырья в разных сортах уксуса
содержатся особые ароматические вещества, придающие ему
своеобразные вкус и запах. ☆
В настоящее время в продаже есть также «уксусная
эссенция», которая содержит до 80% уксусной кислоты.
Перед употреблением ее нужно соответственно разбавлять
водой. Конечно, она не может быть приготовлена теми
способами, о которых мы только что говорили, так как
при них применяются жидкости, содержащие не больше
10% спирта, а значит, и полученный из них уксус не
может содержать больше соответствующего количества
уксусной кислоты. Способ получения уксусной эссенции
иной,—она готовится из продуктов сухой перегонки дерева.
Сухая перегонка каменного угля, о которой мы подробно
говорили в одной из прошлых лекций, дает главным обра-
зом газ, водянистую жидкость (аммиачную воду), деготь
и кокс. Соответствующие же продукты получаются и при
сухой перегонке дерева, только древесный газ по своему
качеству несравненно хуже каменноугольного (светиль-
ного) газа. Древесный деготь применяется преимуще-
ственно для обмазки речных судов и деревянных заборов.
Водянистая жидкость, получаемая при сухой перегонке
дерева, обладает кислой реакцией в противоположность
аммиачной воде, имеющей щелочные свойства. Именно из-
за добывания этой кислой жидкости и ведут в огромном
промышленном масштабе сухую перегонку дерева. Жид-
кость эта содержит, как установил еще в 1794 г. Фуркруа1,
ценную уксусную кислоту, правда, в смеси с рядом дру-
гих веществ, которые, однако, тоже находят практическое
применение. '
1 Антуан Фуркруа (род. в 1755 г,, ум. в 1809 г.) известный французский
химик и политический деятель. Научные труды Фуркруа посвящены глав-
ным образом популяризации учения Лавуазье. (Прим, пврев.)
124
Остаток в ретортах после сухой перегонки дерева пред-
ставляет собой, конечно, не кокс, а древесный уголь.
Из кислой жидкости получают кроме уксуса еще дре-
весный спирт. Это простейший по химическому составу
из всех спиртов. Очищенный он называется метиловым
спиртом. Для питья древесный спирт непригоден (ядо-
вит), так же как и спирты сивушного масла; он служит
для денатурирования обыкновенного (этилового) спирта.
Другой составной частью кислой жидкости является
ацетон. Но содержание ацетона здесь невелико, почему
его получают также и иными путями. Ацетон имеет в
технике значение как растворитель,* а также и большое
значение в военной промышленности, а именно—при фа-
брикации бездымных порохов и при приготовлении неко-
торых слезоточивых веществ. Кроме того, он служит для
приготовления искусственного шелка по одному из спосо-
бов и для искусственного каучука. *
Метиловый спирт и ацетон выделяют из жидкости путем
перегонки, в то время как древесный уксус осаждают га-
шеной известью в виде уксуснокальциевой соли. Обра-
батывая последнюю серной кислотой, получают уксусную
кислоту, из которой и готовят уксусную эссенцию разба-
влением водой до содержания 8О°/о кислоты.
В качестве новейшего источника для приготовления
уксусной кислоты выступает карбид кальция, так как
ацетальдегид, полученный из ацетилена, можно перевести
путем окисления в уксусную кислоту. При этом упомя-
нутая выше альдегидная группа t ,
-с€°
переходит в характерную для всех органических кислот
карбоксильную группу
\оп
И в настоящее время вероятно уже многие употребляли
с кушаньями уксус, приготовленный из минеральных ве>-
ществ, так как его изготовление этим путем (так же как и
спирта) получило уже значительное распространение.
ЛЕКЦИЯ ШЕСТАЯ
Порох. Греческий огонь. Гремучая ртуть. Пироксилин. Динамит. Гре-
мучий студень. Хлоратные взрывчатые вещества. Нитролаки. Целлюлоид.
Кинопленка. Шерсть. Хлопок. Шелк. Искусственная шерсть. Карбони-
зация. Мерсеризированный хлопок. Искусственный шелк.
Нам приходилось ужо упоминать о селитре, когда мы
говорили о том значении, которое приобрела натриевая
селитра для сельского хозяйства. Совершенно другое при-
менение имеет близкая к ней по химическому составу ка-
лиевая селитра. Она являлась главной составной частью
всех прежний порохов, которые с 1886 г. начали все
больше и больше вытесняться бездымными порохами.
Приступая к ознакомлению со взрывчатыми веществами,
мы должны вспомнить, что азотная кислота представляет
собой продукт окисления азота и содержит много кисло-
рода. Калиевая селитра., которую химики называют азотно-
калиевой солью, образуется взаимодействием азотной ки-
слоты и едкого кали.
Едкое кали—это основание, т. е. относится к третьей
большой группе химических соединений, которые разли-
чает химия наряду с кислотами и солями. Вое эти три
группы находятся между собой в зависимости, а именно—
когда кислота взаимодействует с основанием, то образуется
соль. Например, при взаимодействии соляной кислоты и
едкого натра получается поваренная соль (хлористый на-
трий), при взаимодействии азотной кислоты и едкого кали,
как только что было сказано,—калиевая селитра (азот-
нокалиевая соль) и т. д.
Если подействовать азотной кислотой не на калиевую
селИТру, а на такое вещество, как клетчатка (целлюлоза),
то и здесь образуется новое химическое соединение, при-
чем содержащиеся в молекулах азотной кислоты «нитро-
группы» войдут в молекулы клетчатки. (Название нитро-
126
групп происходит от латинского слова Nitrum—«нитрум»,
что значит «селитра».) Полученная таким путем нитроклет-
чатка и подобные ей вещества являются основой почти всех
новейших взрывчатых веществ и бездымных порохов.
Нитрогруппа состоит в свою очередь из одного атома
азота и двух атомов кислорода. Будучи связанной в ка-
лийной селитре, группа атомов азота и кислорода содер-
жалась уже во всех старых порохах, а теперь в форме
«нитрогруппы» она осталась существеннейшей составной
частью почти всех бездымных порохов.
Древние греки и римляне не имели селитры, а потому
они не знали и никаких смесей, подобных пороху. Невиди-
мому, только в V в. селитра попала из далеких Индии
или Китая в Византию—столицу греческой империи. В ви-
зантийском арсенале открыли, что если примешать селитру
к горючим веществам и поджечь, то они горят чрезвы-
чайно энергично,' и при этом огонь не удается потушить
до тех пор, пока они полностью не сгорят. Это свойство
селитры обусловливается большим содержанием в ней ки-
слорода, которое составляет 47,5 о/о. При смешивании с
горючими веществами селитра доставляет им как бы кон-
центрированный кислород, который является важнейшим
элементом для всякого горения.
В Византии открыли также, что наиболее подходящая
для быстрого и энергичного сгорания смесь должна содер-
жать селитру, уголь и серу. Эта смесь и представляла
собой «греческий огонь», с помощью- которого город дол-
гое время отражал нападение врагов. Пользуясь грече-
ским огнем, жители Византии сожгли в VII в. многочис-
ленные корабли арабов, вследствие чего последние должны
были приостановить свои завоевательные походы. А в то
же время страны Западной Европы, где этого средства
защиты не знали, не могли, как известно, противостоять
арабам: последние пришли в 711 г. в Испанию и завла-
дели этой страной на много столетий. В X в. Византия
отразила с помощью греческого огня нашествия болгар.
Таким образом греческий огонь со времени его изобре-
тения имел большое значение в мировой истории. Это
значение все более и более увеличивалось с тех пор, как
начали пользоваться его дальнейшим видоизменением, ко-
торое мы называем порохом.
Замечателен тот факт, что византийцам почти в течение
127
500 лет удавалось сохранять в тайне секрет состава гре-
ческого огня, несмотря на то, что испытавшие на себе его
действие враги, несомненно, стремились раскрыть этот се-
крет. Наиболее древние письменные сообщения о составе
греческого огня мы находим только у византийского писа-
теля Марка Грека, который выпустил около 1200 г. со-
чинение.' «Книга об огнях, с помощью которых можно
сжигать врагов». Интересно, что смесь, которую он реко-
мендует для греческого огня, по своему составу довольно
близко подходит к прежнему прусскому военному пороху:
Состав греческого огня
(по Марку Греку)
Серы ........ 11
Угля ........ 22
Селитры ...... 67
Прусский военный порох
(1866 г.)
в о/о
Серы................. 10
Угля................. 16
Селитры.............. 74
Когда и где удалось открыть огромную метательную
силу, как бы скрытую в этой смеси, остается неизвестным
и до сих нор. Но как только это свойство было открыто,
его скоро научились использовать для военных целей.
В 1326 г. во Флоренции (Италия) были отлиты первые ме-
таллические пушки, заряжавшиеся железными ядрами.
В описаниях сражений и осад, относящихся к ближайшему
после этого события периоду, мы уже находим данные
о числе бывших в деле пушек. Гораздо медленнее шло
дело с применением пороха для ручного огнестрельного
оружия.
На много позже, чем для военных целей, порох стал
применяться в качестве взрывчатого вещества в мирной
практике, а именно в горном деле; начало этого приме-
нения относится к 1627 г. Молот, долото и огонь были до
тех пор единственными средствами, употреблявшимися для
разработки горных пород. Огнем при этом пользовались
так: твердую породу сильно нагревали и обливали за-
тем холодной водой, отчего она растрескивалась и легче
поддавалась долоту и молоту.
Черный порох отличался удобством приготовления:
нужно было только смешать три его составные части в
мелкюраздробленном состоянии, и порох готов. Пригото-
вление подобных порохов, которые и теперь еще приме-
128
няются в горном деле, было доведено до высокой степени
совершенства; давно уже были установлены также наи-
более выгодные размеры зерен. В качестве примера достиг-
нутых с помощью черного пороха результатов приведем
следующий. На всемирной выставке в Чикаго Крупп
выставил орудие, которое заряжалось 115 кг черного по-
роха и бросало свой снаряд весом в 215 кг на расстояние
20 226 м. Это расстояние снаряд пролетал в 71 сек., дости-
гая в высшей точке своего пути высоты 6 540 м, что пре-
вышает высоту Чимборасо1.
В 1912 г. дальность стрельбы достигала уже 32 км,
а орудия, обстреливавшие в 1916 г. Париж, бросали свои
снаряды даже на 128 км, но, правда, все это было достиг-
нуто применением других сортов пороха.
Очень далеко летящие орудийные снаряды испытывают
на своем пути огромное сопротивление воздуха и поэтому
из-за трения настолько раскаляются, что даже превос-
ходно закаленные головки снарядов теряют свою твердость
и пробивную способность. В 1903 г. один шведский инже-
нер сделал простое, но чрезвычайно важное открытие:
он предложил надевать на головки таких снарядов сталь-
ные колпачки. В этом случае будет раскаляться кол-
пачок, а стальная головка снаряда останется твердой.
Снабженные колпачками снаряды показали невиданную
раньше пробивную способность по отношению к броневым
плитам. Впервые их применили японцы в морском бою с
русской эскадрой близ острова Цусима.
Но успехи новейшей химии произвели полный перево-
рот и в области взрывчатых веществ.
В лабораториях давно уже были получены различные
взрывчатые вещества, но они, однако, не годились для
огнестрельного оружия. Дробящая сила взрыва их была
так велика, что они разнесли бы? в куски само орудие, пока
из него успел бы вылететь снаряд. Лишь одно из этих
веществ получило применение в военном деле, а именно
гремучая ртуть, которая взрывает уже от легкого удара.
1 Всемирная выставка в Чикаго была в 1893 г. Крупп—один из круп-
нейших германских заводчиков, на заводах которого производится огром-
ное количество пушек из высокосортной стали.
Чимборасо — высочайшая горная вершина в Андах Экуадора (Южная
Америка), 6 421 м высоты. (Прим, перев.)
9 Химия аовседневной жизни, 129
Помещенная в особые капсюли, она служила и служит для
воспламенения пороха в огнестрельном оружии с помощью
удара. До 1804 г. это воспламенение производилось го-
раздо менее удобным и надежным путем сначала с по-
мощью фитиля, а много позднее посредством кремневого
замка. В последнем искра, необходимая для зажигания
пороха, получалась при ударе стального курка о кремень.
При взрыве черного пороха образуется много дыма. Он
происходит от содержащегося в составе селитры калия,
который при взрыве переходит главным образом в твердый
сернистый калий. Последний раздробляется при этом в
мельчайшие частички, долго плавающие во взвешенном
состоянии в воздухе и образующие густой пороховой дым.
Совсем по иному обстоит, однако, дело у современных
порохов. Они взрывают без образования дыма и называются
поэтому бездымными порохами (примером может служить
пироксилиновый порох). На чем же основывается это огром-
ное различие между старыми и новыми порохами?
Хлопок представляет собой почти чистую клетчатку.
Молекула) клетчатки состоит из 6 атомов углерода,
10 атомов водорода и 5 атомов кислорода, следовательно
ее формула будет СбЩ^1. По своему химическому ха-
рактеру клетчатка относится к классу углеводов. При
обработке ее азотной кислотой в смеси с серной (этот про-
цесс называется «нитрованием») в молекулу целлюлозы
вступают нитрогруппы, и получается пироксилин1 2.
В то время как черный порох представлял собой тес-
ную смесь составляющих его веществ, новое взрывчатое
вещество, о котором мы говорим, является уже химическим
соединением. Порох сгорает при взрыве относительно мед-
ленно, как бы слоями. Пироксилин же разлагается при
взрыве чрезвычайно быстро, в ничтожные доли секунды.
Для сгорания 1 кг черного пороха требуется примерно
1 Здесь для простоты понимания опять приведена упрощенная форму-
ла клетчатки, — правильная ее формула, как было уже сказано раньше
(CeH10O5)w. (Прим. перев.)
2 Пироксилин является продуктом полной нитрации клетчатки и содержит
три нитрогруппы по расчету на формулу С6Н10О5. При этом каждая нитро-
группа (NO2) замещает в молекуле клетчатки соответствующий атом водо-
рода. Но кроме пироксилина можно получить также и продукты неполной
нитрации клетчатки, содержащие меньшее количество питрогрупп: о не-
которых из этих продуктов будет рассказано ниже. (Прим, перев.)
130
0,01 сёк., а такое же количество пироксилина разлагается
всего лишь в течение 0,00002 сек.
При взрыве пироксилина его углерод переходит в угле-
кислый газ, а водород—в воду; необходимый для этого
превращения кислород частично был уже в составе моле-
кулы клетчатки, но главным поставщиком его здесь слу-
жат все-таки нитрогруппы, вошедшие в новую молекулу.
Азот нитрогрупп выделяется при этом в свободном виде.
Само собой разумеется, что при высокой температуре
взрыва вода тоже получается в газообразном состоянии.
Все эти три газа (углекислый газ, азот, водяной пар)
бесцветны, а значит, и невидимы. Вот почему пирокси-
лин сгорает без образования дыма и как будто бы бес-
следно исчезает после взрыва.
Пироксилин был первым новым взрывчатым веществом,
оказавшимся пригодным для практических целей. Вскоре
после его открытия (1846 г.) некоторые государства начали
изготовлять пироксилин в больших количествах. Но за-
готовленные запасы его часто взрывались без всяких види-
мых причин и причиняли большие опустошения. Это подо-
рвало доверие к новому взрывчатому веществу, и только
почти через тридцать лет удалось выработать условия для
изготовления стойкого, вполне безопасного в обращении
продукта.
К сказанному нужно добавить еще следующее. Было
найдено, что пироксилин во влажном состоянии также
пригоден для подрывных работ и разрывных снарядов,—
даже, пожалуй, еще больше, чем сухой. Первые торпеды
были наполнены 12 кг влажного, спрессованного под огром-
ным давлением пироксилина. В настоящее время торпеды
заряжают 150 кг еще более сильного взрывчатого веще-
ства—трингтротполуола1. Немудрено поэтому, что колос-
сальной разрушительной силе такого большого количе-
ства взрывчатого вещества не могут противостоять даже
наилучшим образом защищенные военные суда. При этом
сам процесс снаряжения торпед подобными взрывчатыми
веществами совершенно безопасен.
1 Торпеда представляет собой самодвижущуюся стальную мину сигаро-
образной формы и является одним из главных оружии современного мор-
ского флота. Длина торпеды составляет 5—8 м, диаметр 45—55 см, а вес
заряда достигает в некоторых даже до 300 кг. (Прим, перев.)
131
Большинство современных взрывчатых веществ, напри-
мер пироксилин, при зажигании на открытом воздухе бы-
стро сгорают, но не взрывают при этом (если их взято
не слишком большое количество). Для того чтобы вызвать
их взрыв, нужны так называемые гтициирующие веще-
ства1 (это важное открытие сделано шведским инженером
Альфредом Нобелем).
Если какое-либо вещество взрывает лишь под влиянием
инициирующего вещества, то это значит, другими словами,
что оно взрывает только от невероятно быстрого и силь-
ного физического толчка. Такой толчок получается, напри-
мер, при взрыве гремучей ртути.
В торпеде, наполненной влажным пироксилином, нахо-
дится капсюль с гремучей ртутью. При взрыве последней
образуется взрывная волна, которая производит колоссаль-
ной силы толчок. Этот мощный толчок действует на мо-
лекулы пироксилина таким образом, что связи их атомов
друг с другом нарушаются, молекулы мгновенно распа-
даются с образованием других атомных группировок,
и происходит взрыв; при этом безразлично, был ли здесь
влажный или сухой пироксилин.
☆ Для большей надежности взрыва капсюль с гремучей
ртутью вставляют обычно в шашки сухого пироксилина
и с его помощью взрывают уже влажный пироксилин. ☆
Гремучая ртуть при взрыве развивает давление в 27 400
атмосфер, возникающий при этом толчок настолько си-
лен, что он способен вызвать взрыв любого взрывчатого
вещества, если только оно заслуживает этого названия.
Но прибавкой азида свинца инициирующее действие гре-
мучей ртути можно еще удесятерить.
Еще до того, как удалось сделать пироксилин удобным
в обращении, вошло в употребление для мирных целей
(горное дело и пр.) другое новое взрывчатое вещество.
Его название известно теперь каждому,—это диналшт.
Из чего же состоит это взрывчатое вещество?
Мы уже познакомились раньше е глицерином как с со-
ставной частью жиров. Если обработать глицерин смесью
1 Инициирующие вещества — это такие вещества, взрыв небольшого
количества которых вызывает сильный взрыв (детонацию) другого взрыв-
чатого вещества. К ним относятся, например, гремучая ртуть, азид свинца
и некоторые другие. (Прим, перев.)
132
азотной и серной кислот, то в его молекулу войдут три
нитрогруппы; другими словами, он будет тогда очень
богат той составной частью, которая имеет большое зна-
чение для возникновения взрывчатых свойств. Получен-
ный продукт, называемый нитроглицерином, представляет
собой тоже жидкость (как и глицерин). Но в таком виде
он мало пригоден для использования в подрывной тех-
нике: жидкий нитроглицерин со страшной силой взрывает
при нагревании, ударе, а иногда и без всякой видимой
причины, почему он чрезвычайно опасен в обращении.
Но эта маслянистая жидкость сделалась прекрасным
подрывным средством после открытия шведского инженера
Нобеля. Он нашел вещество, легко впитывающее в себя
нитроглицерин и делающее его этим безопасным в обра-
щении. Нобель смешивал нитроглицерин с таким количе-
ством тонко измельченной инфузорной земли (кизельгура),
что в результате получалась твердая пластическая масса.
В этой форме нитроглицерин получил потом широкое рас-
пространение в подрывной технике под именем динамита.
Им пользовались, например, при прорытии знаменитого
Сен-Готтардского туннеля (в Швейцарии) и при бесчис-
ленных других сооружениях мирного характера.
☆ Инфузорная земля, или кизельгур представляет со-
бой рыхлую, легко растирающуюся, похожую на мел гор-
ную породу. Она состоит из кремнистых оболочек особых,
так называемых диатомовых, водорослей. Вместо кизель-
гура для приготовления динамита применяли также другие
порошки, например древесноугольную мелочь, опилки
и т. п., получая таким образом динамиты с деятельным
основанием (в данном случае способным гореть). ☆
Баллистика (наука, изучающая законы полета снарядов)
путем вычислений показала, что гораздо лучшие резуль-
таты должны получаться с уменьшением калибра (диаметра
внутреннего канала) ручного огнестрельного оружия, если
только применить для выталкивания снаряда более силь-
ное метательное средство, чем черный порох. После этого
и начались поиски более сильных порохов для огне-
стрельного оружия. Естественно, что эти поиски напра-
вились в сторону соединений, содержащих нитрогруппы.
Все знают фенол—обеззараживающее средство, добывае-
мое из каменноугольного дегтя и обычно называемое кар-
боловой кислотой. Если фенол обработать смесью азотной
133
и серной кислот, то в его молекулу войдут три нитро-
группы, и получится тринитрофенол. Это соединение
было давно уже известно и применялось раньше для- окра-
ски пряжи в желтый цвет. Благодаря присущему ему
горькому вкусу тринитрофенол назвали пикриновой кисло-
той («пикрос» по-гречески значит «горький»).
Пикриновую кислоту можно без всякой опасности спла-
вить, и в таком виде она является превосходным взрыв-
чатым веществом, так как способна взрывать только от
взрыва инициирующих веществ. В свое время пикрино-
вая кислота нашла некоторое применение для изготовления
бездымных порохов, но главным образом ею пользовались
в качестве разрывного заряда для артиллерийских сна-
рядов.
Продолжались поиски еще более удобных взрывчатых
веществ. С этой целью обратились к нитрованию толуола,
который также добывается из каменноугольного дегтя. Ни-
трование ведет здесь к получению тринитротолуола.
Последний тоже взрывает лишь от инициирующих ве-
ществ и может храниться очень долго без опасности само-
воспламенения.
☆ .Тринитротолуол, называемый еще часто тротилом, на-
чал прим)еняться в Германии в 1902 г. в качестве разрыв-
ного заряда для снарядов. Другие страны перешли к
тринитротолуолу гораздо позже, главным образом на осно-
вании опыта мировой войны.
Благодаря большой силе взрыва, безопасности в обра-
щении, нечувствительности к удару, неядовитости и пр.
тринитротолуол является почти идеальным взрывчатым ве-
ществом, несмотря на то, что его плотность несколько
меньше плотности пикриновой кислоты. Но по сравнению
с последней он имеет и еще одно важное преимущество.
Дело в том, что пикриновая кислота образует с метал-
лами чрезвычайно сильно взрывчатые соли—пикраты. Вот
почему при-наполнении ею снарядов внутренность послед-
них приходится лакировать, а заряд пикриновой кислоты
помещать в папковые футляры. Что касается тринитро-
толуола, то он не образует с металлами никаких солей
и, значит, может применяться в снарядах и храниться
без всякой предохранительной оболочки.
Как и пикриновая кислота тринитротолуол применяется
главным образом для ааподаения разрывных снарядов,
134
мин, торпед ит. п., но попытки применить их в качестве
метательного средства, т. е. пороха, благоприятных ре-
зультатов не дали. Хорошие бездымные пороха удалось
приготовить только из пироксилина, а затем для этой дели
сумели использовать и нитроглицерин.
Первым получил отличный пироксилиновый бездымный
порох французский химик Вьель. Он превратил пирокси-
лин с помощью спирта и эфира в тестообразное состояние
и затем после прессования, вальцовки и сушки получил
желатинообразную массу, пригодную для употребления в
качестве пороха. Для этого полученную массу нарезают
в виде пластинок, лент, трубок, кубиков и т. п., причем
крупнозернистые сорта идут для орудий, а мелкозерни-
стые Для винтовок. Зажженный на воздухе, пироксили-
новый порох сгорает спокойно, без взрыва, в дуле же
винтовки или орудия он взрывает от капсюля с большой
силой, но сгорает при этом не сразу всей массой, а как
бы слоями. Так как при его горении образуются только
газообразные продукты, то после выстрела, если не счи-
тать легкой рассеивающейся дымки сгустившихся водя-
ных паров, дыма не получается, откуда и произошло назва-
ние «бездымного пороха».
Другие сорта бездымных порохов изготовляются из
смеси некоторых сортов пироксилина с нитроглицерином.*
Одно из наиболее сильных взрывчатых веществ, приме-
няемых в горном и военном деле, получается путем
обливания нитроклетчатки нитроглицерином. Нитроклет-
чатка не растворяется при этом, а сильно набухает, вслед-
ствие чего образуется желатинообразная масса, называемая
гремучим студнем. Это—самое мощное взрывчатое веще-
ство из имеющихся в нашем распоряжении. Путем изме-
нения процентного содержания нитроклетчатки его силу
можно по желанию увеличивать или уменьшать. Что ка-
сается мощности этого взрывчатого вещества, то она едва
ли может быть превзойдена: ведь в противоположность
обычному динамиту, где сила нитроглицерина понижается
прибавкой кизельгура, здесь она, наоборот, значительно
увеличивается за счет нитроклетчатки.
В мировую войну применялось еще много различных
нитросоединений, а также и других взрывчатых веществ.
Действие их в общем основано на тех же принципах,
о которых мы. уже говорили.
Ж
Итак, мы познакомились со старым огнестрельным по-
рохом и причинами перехода к употреблению новейших
бездымных порохов и взрывчатых веществ. Были предпри-
няты многочисленные опыты и в совершенно других на-
правлениях с целью получить подходящие пороха или
взрывчатые вещества. Если заменить, например, в формуле
калййной селитры атом азота атомом хлора, то мы получим
соответствующую формулу нового вещества—хлорновато-
калиевой соли. Химический символ азота—N (от латинского
Nitrogenium—азот), а хлора—Cl (Chlorum—хлор). Напи-
санные рядом химические формулы азотнокалиевой соли
и хлорноватокалиевой соли показывают сходство их состава:
NO3K С1О3К.
азотнокалиевая соль хлорповатокалиевая соль
ХлорИоватокалиевая соль была впервые получена в конце
XVIII в. знаменитым французским химиком Бертолле, по-
чему ее также называют бертолетовой солью. Ее сейчас
же предложили в качестве заменителя селитры, и фран-
цузское правительство вскоре организовало на одном госу-
дарственном заводе выделку из нее пороха. Утром нача-
лось новое производство, а после обеда взрывом было убито
несколько рабочих и одна случайно присутствовавшая
женщина. Чрезвычайная чувствительность смесей, содер-
жавших хлориоватокалиевую соль, к трению или удару
в течение более 100 лет делала почти невозможным исполь-
зование этой соли для приготовления технически приме-
нимых взрывчатых веществ. И. только в 1908 г. в Гер-
мании из нее были приготовлены чрезвычайно сильные
взрывчатые вещества (так называемые хлоратные) путем
добавления к соответствующим смесям масел или воска,
которые устраняют трение. Эти вещества взрываются тогда
лишь (От инициирующих веществ и становятся, таким
образом, безопасными в обращении.
Впрочем, смеси хлорноватокалиевой соли и подобных ей
веществ, полученные обычным путем, давно уже приме-
нялись в пиротехнике, главным образом для изготовления
фейерверков. Ими наполняли чаще всего трубки и в нуж-
ный момент поджигали.
В заключение нужно указать еще на значение взрывча-
ты? веществ в мирной технике, В первый же год приме»
13©
нения динамита в горном деле и в постройке туннелей
Пруссия сэкономила 12 млн. марок (около 5,5 млн. золо-
тых руб.). Это было обусловлено тем обстоятельством,
что для динамита нужно бурить в породе отверстия го-
раздо меньших размеров, чем для пороховых зарядов.
Между прочим, такие отверстия должны быть сделаны
очень тщательно, чтобы динамитный патрон сидел в них
плотно и хорошо. '
Динамит нельзя, однако, применять в каменноуголь-
ных шахтах, потому что он, во-первых, слишком дробит
уголь, а во-вторых, воспламеняет рудничный газ. Здесь
пользуются теперь поэтому так называемыми «антигри-
зутными» (предохранительными) взрывчатыми веществами.
В них содержатся такие добавки, которые сильно понижают
температуру образующихся при взрыве газов, благодаря
чему рудничный газ уже не может воспламениться.
Поиски различных видов взрывчатых веществ для спе-
циальных задач будут долго еще представлять широкое
поле деятельности для изобретательской мысли.
•й Кроме указанных до сих пор мирных применений взрыв-
чатыми веществами еще широко пользуются для дорож-
ного строительства, дренирования и,осушки болот, корче-
вания пней, рубки леса, выкапывания ям для посадки
деревьев, освежения почв для сельскохозяйственных ра-
бот, для борьбы с полярными льдами и пр. В одних только
США 'ежегодно производится для мирных целей более
200 млн. кг взрывчатых веществ. Нетрудно себе предста-
вить, как много взрывчатых веществ нужно для гигант-
ского размаха социалистического строительства в СССР.
И как значительно' они ускоряют темпы этого строительства.
Громадное количество взрывчатых веществ применяется
повсюду для военных целей и особенно возрастает их по-
требление, конечно, во1 время войн. Например, только ан-
глийская и французская армии в мировую войну произво-
дили 12,5 млн. выстрелов в месяц! ☆
То, что было сказано до сих пор о нитроклетчатке, отно-
силось главным образом к применению ее для военных
целей. Теперь рассмотрим некоторые из ее мирных при-
менений1.
1 Здесь будет итти речь о тех сортах нитроклетчатки, которые являются
продуктами неполной нитрации клетчатки, — ем. прим0чади§ 19 стр. 132.
(Прим, перев,)
Ш
В настоящее время из нитроклетчатки готовят превос-
ходные лаки (так называемые нитролаки), которые упо-
требляются в автомобильной промышленности. Для полу-
чения этих лаков нитроклетчатку растворяют в смеси эфира
и спирта или спирта и бензола. Такой раствор оставляет
после испарения растворителя прочную цельную пленку.
При покрытии поверхностей нитролаками их не нужно
обязательно наносить кистью, а можно применять распи-
ливание (пульверизацию), что значительно сокращает по-
требное для этого рабочее время. * Можно также и просто
окунать предметы в ванну из лака, что значительно упро-
щает и ускоряет отделку их лаком. *
В 1867 г. Гиатт нашел, что смесь нитроклетчатки И
камфары после нагревания превращается в роговидную
массу, которой можно придать любую форму и которая от-
личается ценными для различных практических целей
свойствами. Под названием целлюлоида этот новый материал
получил самое широкое распространение в виде всевоз-
можных поделок для домашнего обихода и в технике.
К сожалению, целлюлоид обладает одним очень сущест-
венным недостатком,—он чрезвычайно легко воспламе-
няется, так как в его состав входит нитроклетчатка. По-
следняя, как уже было сказано раньше, получается обра-
боткой клетчатки азотной кислотой (в смеси с серной).
После многочисленных опытов в 1907 г. удалось, обраба-
тывая клетчатку вместо азотной кислоты уксусной, полу-
чить соединение, называемое ацетилцеллюлозой (acetum—
значит уксус), которое очень похоже на нитроклетчатку.
Из этого соединения можно тоже приготовить массу, по-
хожую на целлюлоид,—она была названа целлитом. В про-
тивоположность целлюлоиду целлит загорается лишь с
большим трудом.
Целлюлоид является также исходным сырьем для при-
готовления кинематографических и фотографических пле-
нок. С этой целью его в жидком состоянии наливают на
горячий вращающийся цилиндр, где масса застывает в
виде ленты. Одну сторону этой ленты делают шерохова-
той и потом обливают ее на вращающихся вальцах в темной
комнате бромистым серебром. Получается светочувствитель-
ный слой, который и служит для съемок.
Обрезки, остающиеся при изготовлении различных пред-
метов из аеллюлеиаа, цодадают на фабрики «искусственной
188
кожи». Здесь их растворяют в спирте1, добавляют неболь-
шое количество масла и получившейся жидкостью пропи-
тывают хлопчатобумажные ткани. После испарения спирта
приготовленные куски приобретают свойства кожи—гиб-
кость, растяжимость, водонепроницаемость и пр. Их про-
пускают между горячими вальцами, которые наносят на
поверхность рубцы, придающие кускам внешний вид того
или иного сорта кожи, и искусственная кожа готова. Это
изобретение принадлежит Гевэрту. Потребность в таком
превосходном заменителе кожи благодаря постоянному
росту цен на натуральную кожу все время возрастает.
В больших количествах применяет искусственную кожу
автомобильная промышленность, ее употребляют даже и
для выделки верха дешевых сортов обуви.
☆ Есть и другие сорта искусственной кожи, которые по-
лучают нанесением на хлопчатобумажную, льняную или
иную ткань различных составов (например, клейстера,
олифы и краски) или пропитыванием ткани клеевым и кау-
чуковым растворами и т. п. Это все разные сорта легкой
искусственной кожи, к которым относится и заменитель,
приготовленный из целлюлоида. Кроме них готовят еще
тяжелую искусственную кожу из измельченных кожаных
обрезков, растительных и животных волокон, асбеста и т. п.,
применяя в качестве связующих материалов клей, желатину,
целлюлоид, канифоль и др. К разновидностям искусствен-
ной кожи можно отнести также дерматин—род клеенки,
на одной стороне которой находится прочная пленка из
цветной мастики, изготовленной на касторовом масле. При-
меняется он для обивки мебели, сидений в экипажах,
аэропланах, обивки стен в комнатах, железнодорожных
вагонах, для переплетов и т. п. ☆
Поговорим теперь о нашей одежде. Для ее изготовления
служат ткани, выделанные из растительных и животных
волокон, а также кожа.
Волокна животного происхождения химически резко от-
личаются от растительных тем, что они содержат азот,
1 Для растворения обычно употребляют так называемый уксусно-этило-
вый эфир с прибавлением 30—40% спирта. Для окрашивания массы в нее
соответствующую минеральную краску. (Прим, перев.)
189
которого в растительных волокнах нет. При горении жи-
вотных волокон образуются скверно пахнущие продукты,
содержащие азот. Они распространяют, как говорят, запах
горелого рога, в то время как горящие растительные во-
локна пахнут горелой бумагой.
О самих волокнах мы будем здесь говорить, конечно,
немного, причем из животных волокон остановимся глав-
ным образом на шерсти и шелке, а из растительных—на
хлопке и льне.
Шерстяные волокна обладают очень грубой поверхностью,
имеющей много выступов («чешуек»). Из волокон делают
нитки. При выделке ткани часть этих ниток натягивают
в качестве так называемой «основы»; между нитями основы
проскакивает туда и сюда челнок, образуя «уток». Таким
путем получается ткань, по внешнему виду не очень отли-
чающаяся от приготовленной из прочных льняных нитей.
Но после смачивания1 и так называемого валяния чешуйки
отдельных волокон сцепляются друг с другом, и ткань
приобретает тот внешний вид, который мы наблюдаем у
шерстяных сукон. Для получения гладкой поверхности
ткань еще подвергают стрижке и т. д., но мы здесь в эти
технические подробности вдаваться не будем.
Шелк совершенно не способен к сваливанию, и поэтому
на готовой шелковой ткани можно различить отдельные
волокна. Так же обстоит дело у льна и хлопка. Сколько
бы ни мыли льняную или хлопчатобумажную ткань, от-
дельные волокна всегда остаются в ней лежать друг подле
друга и могут быть в конце концов выдернуты рукой.
Гораздо больше, чем естественные прядильные волокна,
нас интересуют здесь М1врсеризированный хлопок, искус-
ственный шелк и искусственная шерсть. Так как послед-
нюю начали выделывать раньше других, то мы и начнем
с нее.
Когда шерстяные изделия после длительной носки де-
лаются уже негодными к употреблению, в них остается,
однако, еще большая часть пошедшей на их выделку
шерсти; от носки пострадал ведь главным: образом только
1 Смачивание производится мыльной водой или водой, g которой рас-
пущена особая сукновальная! гдцвд, (iJwm. перев,)
14Q
внешний вид ткани. Изношенные изделия, вроде, напри-
мер, чулочных (вязальных), можно «расщипать». При этом
получается годная для прядения шерсть. Правда, по
своим качествам она не так хороша, как свежая, но все
же вполне пригодна к употреблению.
Расщипыванию подвергают, однако, не только такие
изделия, как чулочные,—в гораздо большем количестве
для этого идет изношенное платье. Для того чтобы его
можно было расщипать машиной, работницы предвари-
тельно удаляют из него все швы. Получающиеся куски
различной величины сортируют и затем передают в машину
для расщипывания. Шерстяные волокна выходят здесь,
конечно, гораздо короче, чем были в платье, но все же
и они вполне пригодны в качестве примеси для выделки
более дешевых сортов тканей.
Такая фабрикация искусственной шерсти была бы весьма
удобной, если бы не следующее обстоятельство.
Хлопок гораздо дешевле, чем шерсть, и поэтому при
выделке шерстяных изделий его добавляют перед пря-
дением к шерсти с целью удешевления готового продукта.
Впрочем, простое смешивание применяется довольно редко,
так как шерсть и хлопок окрашиваются неравномерно
(о причинах этого мы узнаем позже). По большей части
поступают таким образом, что основу ткани делают из
хлопчатобумажных нитей, а уток из шерсти. При валянии
шерстяные волоконца сцепляются, шерсть сваливается и
прикрывает бумажную основу. Но во время носки, в таких
местах, которые подвергаются быстрому изнашиванию (на-
пример на обшлагах рукавов), шерсть скоро' вытирается,
и обнажаются сильно скрученные, несваленные нити бу-
мажной основы.
Когда такая ткань попадет после изнашивания на вы-
делку искусственной шерсти (называемой также шодди или
мунго), то она будет, следовательно, содержать хлопчато-
бумажные волокна. И если подобный процесс повторится
с течением времени несколько раз, то в искусственной
шерсти в конце концов почти не будет шерсти.
Чтобы сделать пригодной для дальнейшего использо-
вания искусственную шерсть, содержащую хлопчатую бу-
магу, Кэбер изобрел в 1840 г. способ, позволяющий уда-
лить последнюю из шерсти. Этот способ называется карбо-
низацией. Для удаления хлопчатой бумаги шерсть обра-
141
батывают разбавленной серной кислотой; вместо Нее Могут
быть употреблены и другие действующие подобным же
образом средства. Все эти средства настолько сильно разъ-
едают хлопчатую бумагу, что после высушивания при
90—95° она распадается в пыль, в то время как шерсть
остается почти совершенно неповрежденной. Обработанная
таким способом шерсть может быть потом полностью осво-
бождена на машинах от содержавшейся в ней хлопчатой
бумаги, которая удаляется в виде пыли.
В настоящее время фабрики искусственной шерсти есть
во всех промышленных странах. Уже в 1880 г. только
34% всего произведенного в Англии сукна было сделано
из свежей шерсти. Применение искусственной шерсти по-
лучило с тех пор еще более широкое распространение.
Мерсеризированный хлопок отличается от обыкновенного
своим шелковистым блеском. Его производство кажется
очень простым. Хлопок в сильно натянутом состоянии
погружают в крепкий раствор едкого натра и после этого
хорошо промывают. Самое существенное в этом изобре-
тении (сделанном в 1856 г. Джоном Мерсером) заключается
в сильном вытягивании хлопчатобумажных нитей; без та-
кого вытягивания нити скручиваются, и хлопок становится
негодным к употреблению.
Гораздо сложнее и интереснее производство искусствен-
ного шелка, сущность которого заключается в следующем.
Клетчатку растворяют в том или ином растворителе. Полу-
ченный раствор продавливают через колпачки с мелкими
отверстиями (так называемые «фильеры»), но не в воздух,
а в какую-нибудь жидкость, тотчас восстанавливающую
клетчатку1. Последняя выделяется при этом в форме бле-
стящих нитей, которые из-за этого блеска и получили на-
звание искусственного шелка.
В качестве растворителя для хлопка служит, например,
жйдкость, полученная растворением окиси меди в большом
1 При производстве некоторых сортов искусственного шелка нити дают
отвердеть и на воздухе. (Прим, перев.)
142
количестве аммиака1 и называемая поэтому медиоаммиач-
ным раствором. Полученный этим путем искусственный
шелк называется медноаммиачным. Но есть и другие жид-
кости, которые растворяют хлопок, например уксусная
кислота. При растворении образуется химическое соеди-
нение—ацетилцеллюлоза, которое выпадает в осадок. Оса-
док растворяют затем в летучих растворителях и раствор
продавливают через фильеры. * Получающиеся при этом
нити омываются током теплого воздуха, который заста-
вляет улетучиваться испаритель. * Полученный этим спо-
собом продукт называется ацетатным шелком.
Но больше всего теперь производится так называемый
вискозный шелк. Его получают обработкой клетчатки дре-
весины едким натром, а затем сероуглеродом и продавлива-
нием полученного продукта (вискозы) в химическую ванну,
в которой восстанавливается целлюлоза и целлюлозные
нити застывают.
Почти никакого промышленного значения не имеет те-
перь нитратный шелк, готовящийся переработкой в нити
раствора нитроклетчатки в смеси эфира и спирта. Этот вид
искусственного щелка был изобретен первым по времени
в 1890 г. Шардонне.
Если растворы перерабатывать в более грубые нити, то
вместо искусственного шелка получаются хорошие имита-
ции человеческого волоса. Удалось также получить по-
добным же путем превосходный искусственный конский
ВОЛОС.
Насколько перегнали масштабы производства искусствен-
ного шелка выделку натурального шелка, добываемого
с помощью шелковичного червя, хорошо показывает диа-
грамма, изображенная на рис. 32.
* В довоенной России производства искусственного шел-
ка почти не было, если не считать небольшую Мытищин-
скую фабрику (под Москвой) с суточной производитель-
ностью максимум в 500 кг вискозного шелка. Но и эта
фабрика в 1916 г. была закрыта вследствие отсутствия
технического персонала.
Советскую промышленность искусственного шелка при-
1 Вернее водного раствора аммиака, который известен каждому под
именем нашатырного спирта. (Пргил. перев.)
U3
шлось строить почти па пустом месте. Но уже й течение
первой пятилетки производственная мощность Мытищин-
ской фабрики была очень значительно увеличена и, кроме
того, были выстроены три новые фабрики—в Клину, Мо-
гилеве и Ленинграде с общей годовой мощностью свыше
8 тыс. т. В ТО' же время была уничтожена и зависимость
Рис. 32. Мировое производство натурального и искусственного
шелка (млн. кг)
от ввозных химикалий (в 1929 г. в СССР налажено соб-
ственное производство сероуглерода).
Во второй пятилетке производство искусственного во-
локна значительно расширяется, средняя мощность каждой
из строящихся и намеченных к строительству фабрик
будет примерно в 5 раз превышать среднюю мощность
фабрик, построенных в течение первой пятилетки. Валовая
выработка в 1937 г. должна возрасти в 15—18 раз против
выработки 1932 г.
144
Теперь нужно сказать еще несколько слов о причинах
быстрого роста промышленности искусственного волокна
в капиталистических странах. Дело в том, что она имеет
большое военное значение. Ведь сырьем для производства
искусственного волокна служит клетчатка, которую в-слу-
чае надобности легко превратить в нитроклетчатку, иду-
щую на производство различных видов взрывчатых ве-
ществ. *
10 Химия повседневной жизни.
ЛЕКЦИЯ СЕДЬМАЯ
Дубление корьем. Кожа. Сгонка волоса. Мягчение. Дубильные вещества.
Сорта корья. Квебрахо. Сумах. Дубильные экстракты. Подошвенная кожа.
Квасцовое дубление. Лайка. Меновые изделия. Хромовая кожа. Жировое
дубление. Замшевая кожа. Пергамент. Луговая отбелка. Подсинивание
белья. Беление хлором. Хлорная известь. Антихлор. Жавелева вода. Сер-
нистый газ. Перекись водорода. «Персиль». Крашение. Протравливание.
Красильные лаки. Субстантивные красители. Каменноугольные краси-
тели. Индиго. Ализарин. Краски в виде пасты. Экстракты из красиль-
ных деревьев. Синий сандал. Набивка тканей. Зернила. Духи.
Кожа—это шкура животного, которая путем дубления
переведена в такое состояние, что она после высушивания
не поддается гниению и сохраняет свою гибкость. Что
касается свежей шкуры, то она очень легко загнивает.
Правда, это ее свойство теряется уже при высушивании,
но после простого высушивания шкура становится твердой
и ломкой вследствие склеивания ее волокон. Во время
процесса дубления между волокнами вводится дубильное
вещество, которое препятствует их склеиванию. Гибкость
кожи соответствует более или менее (смотря по применен-
ному способу дубления) гибкости шкуры живого живот-
ного.
Например подошвенная кожа очень стойка по отноше-
нию к гниению, чрезвычайно плотна, эластична и гибка,
причем она не ломается даже при сильном изгибании. При
нагрузке всей тяжестью человеческого тела подошвенная
кожа не теряет своей формы, ее волокна упруги, она плохо
проводит тепло, очень стойка по отношению к истиранию,
легка, хорошо поддается шитью и прибивке гвоздями. Кожа
для верха обуви отличается еще мягкостью, она также
мало проницаема для воды и хорошо обрабатывается до
форме ноги.
С предназначенных для выделки кожи шкур нужно сна-
чала согнать волос. Старейшим из употреблявшихся для
146
этого способов, который, впрочем, в усовершенствованном
виде применяется еще и теперь, является так называемое
швицевание, или потение. Оно заключается в том, что
шкуры оставляют в течение некоторого времени висеть во
влажном помещении. При этом они слегка загнивают, от-
чего корни волос настолько разрыхляются, что после этого
волос без особого труда можно согнать. Как только это
будет достигнуто, швицевание прекращают.
Но волос легко можно ослабить и с помощью химикалий.
Для этого с давних времен служит негашеная известь.
Если ее погасить большим количеством воды, то полу-
чается так называемое известковое молоко, в которое и
погружают шкуры. Еще сильнее действует сернистый
кальций (химическое соединение серы и кальция) или
химически близкий к нему сернистый натрий (соединение
серы и натрия). Последний в настоящее время специально
производят для кожевенных предприятий1.
Лишенные волоса шкуры подвергаются затем мягчению.
Необходимую кислую ванну приготовляют с помощью зна-
комого уже нам молочнокислого брожения. Для этого
смешивают с водой пшеничные отруби, прибавляют за-
кваску и оставляют бродить при 50°. Кроме молочной
кислоты, здесь образуется и немного других кислот (на-
пример масляной). В перебродившую и охлажденную жид-
кость («кисель») кладут шкуры, которые набухают в ней
примерно до двойной толщины.
С 1912 г. многие кожевенные предприятия покупают
молочную кислоту в готовом виде. Она тоже оказалась
прекрасным средством для мягчения и набухания шкур,
так как ее действие раскрывает поры лишенной волос
шкуры и тем самым хорошо подготовляет ее для равно-
мерного поглощения дубильного вещества.
Дубильные вещества, т. е. вещества, превращающие
шкуру в кожу, содержатся в очень многих растениях.
Известно, например, что дубильные кислоты есть в чае
1 Сгонка волоса при помощи намазывания сернистым натрием в СССР
теперь воспрещена (кроме жесткой подошвы и морского зверя), так как
она ведет к потере шерсти. У нас для этой цели применяют или чистую
известь или известь, смешанную с другими веществами, — с кислой сер-
нисто-нвтриевой солью, с серноаммониевой солью, наконец, с тем же
сернистым натрием. (Прим, перев.)
ю»
147
и в кофе. Но само собой разумеется, что дубильные ве-
щества таких растений не имеют никакого значения для
дубления из-за их высокой цены. Основным материалом
для дубления и до настоящего времени остается кора де-
ревьев. Наибольшим содержанием дубильных веществ от-
личается дубовая кора, называемая в измельченном со-
стоянии корьем. Количество коры по отношению к коли-
честву древесины у дуба наиболее благоприятно' в возрасте
от 15 до 30 лет, когда (обычно й снимают кору с дерева.
Кроме дубовой коры применяют еще кору ели, сосны,
а в некоторых местах и кору орешника (грецкого), но
последнюю по большей части в смеси с дубовой.
При том огромном количестве кожи, которое выраба-
тывается в настоящее время, для замены нехватающего
местного сырья приходится применять для дубления и
растущие в других странах деревья и кустарники; дубиль-
ные вещества содержатся в них не только в коре, но и в
древесине, в плодах, листьях, корнях и т. д. Из этих
растений мы упомянем здесь квебрахо.
Темнокрасная, очень твердая древесина квебрахо экспор-
тируется в больших количествах из Бразилии. После раз-
мельчения в машинах она применяется так же, как и
дубовое корье.
Часто применяют еще сумах—порошок, получаемый рас-
тиранием высушенных молодых побегов и листьев сумаха
(кустарники и небольшие деревья, растущие в южноевро-
пейских странах, в Крыму, на Кавказе, а также в Турке-
стане). Применяют также кору мангрове (тропические де-
ревья), которая содержит до 35°/о дубильных веществ.
Процесс дубления ведут следующим образом. Набухшие
шкуры кладут в яму и между каждыми двумя шкурами
насыпают слой корья. Наполненную таким образом яму
заливают водой. Дубильные вещества постепенно раство-
ряются в воде и медленно впитываются шкурами. Толстые
шкуры, идущие, например, для выделки подошвенной
кожи, требуют для своего насыщения очень много дуби-
теля; поэтому их приходится несколько раз пересыпать
свежим корьем, и для полного1 продубливания таких шкур
требуется примерно около1 двух лет. Зато продукт полу-
чается при этом превосходный, ч Но этот способ, как слиш-
ком медленный, теперь не применяют. *
Естественно, что давно уже начали искать способов
148
ускорения процесса. Этого можно- достичь предваритель-
ным извлечением дубильных веществ из корья и т. д.
водой; в полученный «сок» кладутся затем шкуры. По
такому способу удается приготовить кожу в течение при-
мерно трех месяцев.
Теперь мы переходим к дубильным экстрактам. Давно
уже некоторые из них поступают на рынок из Индии,
где их готовят вывариванием в воде богатой дубильными
веществами древесины или листьев. Для уменьшения
расходов на перевозку полученные растворы потом упа-
ривают. Важнейшими из этих экстрактов были гамбир
и катехо.
С 1882 г. дубильные экстракты начали приготовлять
и в Европе, например из древесины дуба и каштана.
В Аргентине, а также в европейских морских портах,
куда привозят много древесины квебрахо, готовят экстракт
квебрахо. Самый процесс изготовления и здесь ведется
таким образом, что дубильные вещества извлекаются из
измельченного тем или иным путем материала водой; по-
лученный водный раствор затем упаривается. Только упа-
ривание происходит при этом не в открытых сосудах,
а в закрытых аппаратах при сильно уменьшенном давле-
нии (о подобном приеме мы говорили при ознакомлении
с сахарным производством). При таком способе сгущения
не страдает качество экстракта, что неизбежно имеет место
при выпаривании в открытых сосудах на голом огне.
Само собой разумеется, что приготовление кожи с по-
мощью экстрактов гораздо удобнее, чем по старым спосо-
бам, и, кроме того, оно при этом поразительно ускоряется.
В одном германском патенте, выданном в 1892 г., есть
указание, что даже самая толстая подошвенная кожа
продубливается в течение 36 час., если набухшую шкуру
обрабатывать дубильным соком, в 8 раз более крепким,
чем применявшийся до тех пор.
Приготовление дубильного сока с помощью экстрактов
значительно упрощается.
С 1912 г. готовят искусственные дубители из продуктов
переработки каменноугольной смолы. Такие дубители, на-
пример нерадоли, употребляют в смеси с натуральными
(в целях экономии последних).
Кроме 'описанных способов для выделки кож применяют
с древнейших времен квасцовое ц лрировое дубление.
149
Алюминиевые квасцы химически представляют собой
двойную соль, соединение сернокалиевой и серноалюминие-
вой соли1. При погружении набухшей шкуры в водный
раствор квасцов и поваренной соли, глинозем (окись алю-
миния) действует на шкуру так же, как рассмотренные
нами до сих пор дубильные вещества: окись алюминия
впитывается в шкуру и, отлагаясь между ее волокнами,
препятствует затвердеванию ее. Если хорошо обработать
после этого изделие жиром, то последний также впиты-
вается в шкуру, и получается кожа, которая по своей
способности растягиваться превосходит все другие сорта
кожи.
В квасцовом дублении дубителями являются основные
соли алюминия, образующиеся в процессе самого дубления
из серноалюминиевой соли; иногда их получают до вне-
сения шкуры в раствор, прибавляя к нейу щелочи.
При применении шкурок молодых животных (козлят и
ягнят) и при очень осторожной работе (во избежание пятен)
описанным путем получают кожу для лайковых перчаток.
Набухшие шкурки дубят при этом раствором квасцов,
к которому добавлено небольшое количество яичных желт-
ков и муки. Желток состоит главным образом из белка,
в котором распределены чрезвычайно мелкие частички
жира. Эти мельчайшие частички, впитываясь в шкуру,
и обусловливают ту чрезвычайную гибкость и мягкость,
которые требуются от перчаточной лайки.
Но квасцовое дубление все-таки далеко не дает таких
результатов, как дубление корьем. Его применяют в тех
довольно многочисленных случаях, когда особенно .хоро-
шего дубления не требуется. Меньшая добротность квасцо-
вого дубления проявляется в отношении выделанной кожи
к воде. На подошвенную кожу вода не оказывает ника-
кого влияния, а из кожи, дубленой квасцами, большое
количество воды выщелачивает почти целиком дубильные
вещества. Вот почему сильно промокшие лайковые пер-
чатки сморщиваются и становятся похожими на недубле-
ную кожу.
С помощью квасцов производится также дубление мехов.
1 Кроме того, в состав алюминиевых квасцов входит еще кристаллиза-
ционная вода. Химическая формула этого соединения A12(SO4)3.K2SO4.
24Н2О. (Прим, перев.}
160
Применяемые для этого способы довольно значительно от-
личаются друг от друга, но в общем они состоят все-таки
из дубления квасцами и жиром. Работу ведут примерно
таким путем.
Шкуры очищают мылом, снова сушат и затем натирают
с внутренней стороны жиром. Когда шкура после размина-
ния впитает возможно большее количество жира, ее нама-
зывают хлебным киселем, отчего в течение 24 час. шкура
слабо набухает. По удалении киселя ее дубят раствором
квасцов и поваренной соли. Часто, однако, обходятся и без
квасцов, применяя только поваренную соль и серную ки-
слоту.
Для дубления применяют и другие химикалии. Кожу
можно приготовить с помощью окиси железа и окиси хрома.
Практическое значение получила только последняя.
Хромовая кожа обладает мягкостью, гибкостью и пре-
восходит все известные сорта кожи стойкостью по отноше-
нию к влаге и высоким температурам. В выделке мягкой
кожи, применяемой для верха обуви, хромовое дубление
постепенно получило настолько широкое распространение,
что в 1908 г. три самые большие германские фабрики мяг-
кой кожи заявили лесничествам о своем отказе от даль-
нейших поставок им дубового корья.
При жировом дублении со шкур сгоняют волос, под-
вергают их мягчению, затем натирают жиром, именно вор-
ванью, и размягчают на разбивальной машине. Процесс
повторяют до тех пор, пока жир еще впитывается. Но
поглощение жира происходит при этом не только механиче-
ским путем,—здесь идут и химические превращения, кото-
рые позволяют установить окончание процесса по появле-
нию особого обусловленного ими запаха. По достижении
этого шкуры оставляют в течение некоторого времени ле-
жать в больших кучах, причем благодаря продолжающимся
химическим изменениям они нагреваются. Повышение тем-
пературы в свою очередь благоприятствует течению хими-
ческих процессов, под влиянием которых шкуры в конце
концов начинают окрашиваться в желтый цвет. При этом
жир постепенно' обволакивает волокна шкуры так, что они
не могут уже больше склеиваться; получается, следова-
тельно, настоящая кожа. С другой стороны, жир настолько
прочно связывается с волокнами, что он не выщелачи-
вается потом даже горячей водой. Вот почему приготов-
151
ленная этим способом кожа, называемая замшей, по-не-
мецки носит еще и другое название—«Waschleder», что бук-
вально значит «моющаяся кожа».
Когда после начавшегося окрашивания хотят удалить из
кожи излишек жира, несвязанный химически, ее моют
раствором поташа. Поташ образует с излишним жиром
эмульсию, которая и переходит в воду.
Способ жирового дубления применяют также и при из-
готовлении меховых товаров.
В заключение этого раздела скажем несколько слов о
пергаменте, хотя он, собственно говоря, сюда отношения
не имеет. Пергамент вовсе не представляет собой кожи,
как это многие думают. Для его получения со шкурок
совсем молодых животных сгоняют известью волос и затем
их не дубят, а после тщательной очистки туго натягивают
и в таком состоянии высушивают. Чтобы получить ту
гладкую поверхность, которую мы привыкли видеть на
изделиях подобного рода, шкурки посыпают мелом и шли-
фуют пемзой. Приготовленный таким способом пергамент
пригоден для книжных переплетов, барабанов и т. п. Если
же пергамент предназначается для письма, то его покры-
вают тонким слоем белой масляной краски.
Текстильные волокна (например лен или хлопок) в нату-
ральном виде имеют по большей части белый или почти
белый цвет; шерсть также чаще бывает едва окрашена.
Но употребление в течение продолжительного времени оде-
жды из совершенно белых материй было бы весьма не-
практичным. Кроме того, окрашенные ткани отличаются
более красивым видом.
Текстильным волокнам присущ чаще всего желтоватый
оттенок, который стремятся устранить белением на солнце.
Солнечный свет, как известно, заставляет большинство кра-
сок «выцветать», разрушает их,—вот почему его действие
устраняет и желтоватый оттенок волокон. Превращению
желтоватого оттенка в чисто белый цвет помогают еще
подсиниванием, как это делают, например, после стирки
белья. Желтый и голубой—это так называемые дополни-
тельные цвета, которые вместе дают белый цвет.
152
В старые времена льняные и хлопчатобумажные ткани
производились исключительно в домашних хозяйствах. Но
после того как это производство начало сосредоточиваться
на фабриках, для беления потребовались большие площади,
что было для фабрикантов и неудобно и дорого. При совре-
менном росте текстильной промышленности, которая осо-
бенно быстро развивается в определенных районах, найти
нужные для беления площади было бы прямо невозможно.
Но тут пришла на помощь химия, открывшая способы
искусственного беления. И в настоящее время все льняные
и хлопчатобумажные ткани отбеливаются на самих фабри-
ках искусственными белильными материалами.
Главнейшее из таких средств—это хлорная, или белиль-
ная известь. Действующим началом является в ней хлор,
который в свободном состоянии представляет собой зелено-
вато-желтый газ, обладающий ярко выраженной способ-
ностью вступать в химические реакции с другими веще-
ствами. Но так как в фабричном производстве иметь дело
с газами неудобно, то для беления применяют не свободный
хлор, а тот химический продукт, который образуется при
действии хлора на гашеную известь. Этот продукт и назы-
вается хлорной известью.
Хлорная известь была впервые приготовлена Теннантом
в Глазго (Англия). 1 000 кг ее стоили сначала около
1 300 зол. руб., в 1825 г. эта цена снизилась до 250 руб.,
а в 1900 г.—до 50 руб.
Если разболтать хлорную известь с водой и оставить за-
тем спокойно стоять, то нерастворимые части осаждаются,
а над ними остается в конце концов прозрачный раствор
хлорной извести.
Отбеливающее действие хлорной извести основано на оки-
слении. Оно в самый короткий срок устраняет упомянутый
выше желтоватый оттенок льняных и хлопчатобумажных
волокон так же хорошо, как и луговое беление. Но дей-
ствие хлорной извести на этом не прекращается: за раз-
рушением окраски следует и разрушение самих волокон.
Вот почему беление хлорной известью не смогло найти при-
менения в домашних хозяйствах.
На фабриках дело обстоит иначе. Здесь, как только
ткань будет отбелена, излишек хлора связывают действием
так называемого «антихлора», вследствие чего волокна при
белении остаются оовершенло неповрежденными. В качестве
153
антихлора; применяют различные вещества, чаще всего сер-
новатистонатриевую соль (гипосульфит). Эта соль сама по
себе никакого действия на ткань не оказывает. Как только
раствор ее придет в соприкосновение с хлорной известью,
то при их взаимодействии образуются также совершенно
безвредные для ткани соединения. Хлорная известь при
действии гипосульфита образует безвредный хлористый
кальций.
Кроме хлорной извести в торговле есть и другое беля-
щее средство—оюавелева вода. В химическом отношении ее
действие такое же, как и хлорной извести. Разница между
этими двумя веществами заключается в том, что вместо
кальция хлорной извести жавелева вода содержит натрий.
В случае применения жавелевой воды для вывода пятен,
материю надо потом тоже обработать антихлором (например,
смочить очищенное место небольшим количеством раствора
гипосульфита), иначе волокна ткани пострадают, и на тех
местах, где были пятна, скоро окажутся дыры.
Хлорную известь нельзя применять для беления шерсти,
так как при взаимодействии с последней образуется желтое
соединение. Для обесцвечивания шерстяных тканей приме-
няют сернистый газ, хотя он и не является таким сильным
белящим средством, как хлорная известь.
Сернистый газ—это тот самый газ с резким запахом,
который образуется при горении серы. Так как сернистый
газ очень легко растворяется в воде, то с ним работают
следующим образом. Отбеливаемые ткани смачивают водой
и развешивают в помещении, где сжигается сера. Обра-
зующийся сернистый газ и попадает на влажные ткани.
Особого средства для уничтожения излишка здесь не тре-
буется, потому что при таком способе на ткани попадает
очень немного сернистого газа.
Для беления применяют также перекись водорода. Само
название «перекись» показывает, что это соединение со-
держит много кислорода, который и обусловливает его
отбеливающее действие. Пользуясь этим средством, с 1830 г.
добиваются таких результатов, которых нельзя достичь с
помощью хлора или сернистого газа. Перекись водорода
полностью отбеливает, например, перья, слоновую кость;
волосы от ее действия становятся светлыми.
Но в настоящее время большее практическое значение
имеют другие перекиси, которые с 1907 г. позволяют при-
154
менять искусственное беление в каждой прачечной, в ка-
ждом домашнем хозяйстве. Из таких средств особенно боль-
шим успехом пользуется «персиль», содержащий кроме
мыла, соды и растворимого стекла еще 10% перекиси
бора. Действие последней на белье отличается особенной
мягкостью. Персиль очищает белье, одновременно отбели-
вает его и, кроме того, дезинфицирует.
Приготовление недорогих перекисей для стирки и от-
беливания белья стало возможным только при использова-
нии для этого электрической энергии. Вот почему такие
средства стали дешевыми массовыми товарами лишь через
сто лет после появления хлорной извести.
После отбеливания ткани часто окрашивают. При этом
процессе красители в растворенном состоянии должны дей-
ствовать на волокна тканей, другими словами, окрашивае-
мые ткани должны быть погружены в растворы красителей.
Между волокнами животного происхождения (шерстью и
шелком) и растительными волокнами (главным образом
хлопчатобумажными) наблюдается очень значительная раз-
ница в их отношении к большинству красителей.
Если растворить какой-нибудь краситель, например ани-
линовый красный, в воде и протягивать через этот раствор
шелк или шерсть, то краситель постепенно будет перехо-
дить из воды в волокна, причем последние окрасятся в
красивый красный цвет. Волокна при этом процессе играют
примерно ту же роль, что и животный уголь при обесцвечи-
вании (о чем нам пришлось говорить раньше). Как жи-
вотный уголь может извлекать и собирать в себе красящее
вещество из окрашенных жидкостей, так и животные во-
локна обладают способностью извлекать из растворов кра-
ситель и прочно задерживать его.
Но окрасив таким же способом в растворе анилинового
красного хлопчатую бумагу, мы увидим, что растительные
волокна неспособны прочно удерживать этот краситель:
если промыть большим количеством воды окрашенную
шерсть или шелк, то они сохранят свою окраску, в то
время как хлопчатая бумага при мытье опять совершенно
обесцветится.
Окрасить шерсть и шелк таким удобным путем, как
только что было описано, можно не всеми красителями.
155
И здесь также приходится часто применять обходный путь,
который до 1884 г. был единственно употребительным в кра-
шении хлопчатобумажных тканей, а именно—пользоваться
протравами. Что- они собой представляют?
Если добавить к слегка подкисленному раствору жел-
той кровяной соли раствора соли окиси железа, то полу-
чится осадок, имеющий великолепный синий цвет; этот
осадок называется берлинской лазурью.
Предположим, что мы хотим покрасить берлинской ла-
зурью ткань. Для этой цели лучше всего сначала окунуть
ткань в один раствор, а йотом в другой,. В первой жид-
кости ткань хорошо пропитается раствором соли железа и,
когда мы перенесем ее затем в раствор желтой кровяной
соли, синий осадок станет образовываться на волокнах,
следовательно, внутри ткани. Так как он нерастворим в
воде, то его нельзя, значит, вымыть из ткани водой, он
не будет также и выцветать. Короче говоря, взятая нами
ткань окажется окрашенной, хотя эта окраска и не будет
прочной по отношению к трению.
Подобно описанному процессу происходит и окрашива-
ние с протравами. Если хотят красить с их помощью, то
ткань нужно сначала пропитать особой жидкостью, которая
и представляет собой протраву, ч или вернее раствор про-
травы. Сами протравы представляют собой легко раствори-
мые в воде вещества—сопи различных металлов, жирные
кислоты, естественные или искусственные дубильные ве-
щества. ч Раствор протравы по большей части бесцветен,
но он может быть и окрашен (например зеленые хромовые
протравы). При протравливании в волокна попадает та-
кое вещество, которое потом образует с собственно краси-
телем нерастворимое окрашенное соединение. Слово «про-
трава» имеет, следовательно, в красильном деле иное
значение, чем обычно. Здесь оно не связано с понятием «ед-
кости». Будь это свойство присуще красильным протра-
вам, они разрушали бы или по крайней мере ослабляли
бы волокна, чего они, конечно, не делают.
Для протравливания очень часто применяется сама по
себе бесцветная окись алюминия. Уже при знакомстве с
дублением мы говорили, что она химически соединяется
с волокнами животной шкуры. Подобным же образом она
обладает способностью соединяться с тканями как живот-
ного, так и растительного происхождения. Так как в преж-
де
ийо времена единственной легко доступной, растворимой
в воде солью алюминия были квасцы (двойная соль, со-
единение серноалюминиевой и сернокалиевой соли), то они
издавна играли большую роль в красильном деле.
Квасцы с незапамятных времен добывали легким cnoi-
ообом из особых минералов, встречающихся в некоторых
местах Европы. Но содержащаяся в квасцах сернокалиевая
соль для процесса крашения совершенно излишня. Вот
почему уже давно химия заменила в красильном деле
квасцы более дешевыми соединениями алюминия, раство-
римыми в воде.
Итак, если протравить, например хлопок раствором алю-
миниевой соли и выварить его затем в растворе ализа-
ринового красного, то ткань прочно окрасится в красный
цвет. Теперь красный краситель, образовавший с окисью
алюминия нерастворимое в воде соединение, прочно свя-
зан с волокнами, подобно тому как это было в нашем
примере с берлинской лазурью; поэтому красную окраску
ткани уже нельзя больше удалить водой.
Соединение протравы с красителем называется красиль-
ным лаком. Такой лак мы можем, конечно, получить и
без волокна. Если, например, слить вместе растворы алю-
миниевой соли и ализаринового красного, то выпадет в виде
красного осадка лак. Высушив и растерев его потом с
олифой, мы получим малярную масляную краску. Бла-
годаря прочности многих новейших каменноугольных кра-
сителей в настоящее время многочисленные красильные
лаки применяются в качестве малярных красок.
Окись алюминия представляет собой основной окисел;
подобно ей в красильном деле может применяться и целый
ряд других основных окислов. В то время как при вы-
делке кожи издавна употреблялась только окись алюми-
ния,—здесь, следовательно, дело обстоит иначе. В кра-
сильной промышленности очень важную роль в качестве
протрав играют упомянутые уже выше окиси железа и
хрома, но не только они. Для удержания красителя на
волокне может быть использовано большое число других
окислов, среди них, например, окись олова, которая при-
меняется в форме так называемой оловянной композиции.
* Оловяными композициями называются протравы разного
состава, получаемые растворением олова в смеси концентри-
рованной азогнОй и соляной кислот. В настоящее время
157
они почти ие применяются; раньше ими пользовались для
оживления тонов при крашении ализарином и кошенилью.
Из оловянных протрав наиболее употребительны хлористое
олово, уксуснооловянная соль, оловяннонатриевая соль
и др. В виду дороговизны их применяют обычно в смеси
с другими протравами. &
Олово еще и теперь не очень дешевый металл, а раньше
оно ценилось дорого. В Англии в первой половине XVI в.
олово было в одной цене с серебром, так что оловянные
кубки служили не меньшим украшением стола, чем сере-
бряные. В 1640 г. в Голландии было сделано открытие,
что ткань, протравленная предварительно раствором оло-
вянных солей и окрашенная затем кошенилью1, приобре-
тает великолепный, невиданный до тех пор, яркоалый
цвет. После этого олово начало играть большую роль
в красильном деле, тем более, что позднее было обнаружено
его свойство увеличивать яркость и многих других краси-
телей. Хотя в настоящее время с помощью каменноуголь-
ных красителей можно получить гораздо более красивые
яркоалые оттенки, чем с кошенилью, олово удержало все
же свое значение в крашении, так как оно является пре-
красной протравой для самых различных красителей.
Кроме осаждающихся на волокнах окислов металлов,
с важнейшими из которых мы теперь познакомились, боль-
шое значение в качестве протравы имеет еще таннин.
Он содержится в количестве до 50% в так называемых
дубильных орешках—болезненных наростах на дубовых
листьях, образующихся вследствие укола насекомыми.
С растворами многих красителей таннин также дает не-
посредственно лаки, почему ткани, пропитанные таннином,
способны к прочному окрашиванию. Но пропитанные тан-
нином ткани можно еще пропустить через растворы солей
сурьмы,—тогда па волокнах сначала осядет соединение,
получившееся благодаря взаимодействию таннина с солью
сурьмы. Протравленные таким двойным путем ткани дают
с растворами многочисленных красителей лаки, состоящие,
следовательно, из таннина, окиси сурьмы и красителя.
Мы уже сказали выше, что до 1884 г. не было известно
практически применимых красителей (кроме некоторых ра-
1 Кошениль—.это особые насекомые, из высушенных самок которых
готовят красную краску кармин. (Прим, перев.)
158
стительных), которыми можно было бы окрашивать хлоп-
чатобумажные ткани без протравы. Крашение же с про-
травами требует большого опыта, хотя по описанию оно
и кажется несложным. Очень трудно, например, добиться
тех превосходных результатов, которые в умелых руках
получаются при окрашивании хлопка ализариновым крас-
ным. Этот род окрашивания своеобразен в том отношении,
что здесь для приготовления протравы необходимо приме-
нять масло. Протравленная ткань окрашивается затем в
ализариновой ванне (об ализарине мы еще будем говорить
ниже). Описанный способ был издавна известен еще на
Востоке, но свое полное развитие получил значительно
позже в Европе. Окрашенные этим способом ткани в боль-
шом количестве экспортируются в восточные страны.
Опасным конкурентом для ализаринового красного явился
открытый в 1884 г. красный краситель, который непо-
средственно, без протравы, окрашивает хлопчатобумажные
ткани; этот краситель называется конго красный. И если
индийская женщина захочет, например, иметь красный
платок, то ей нужно теперь только растворить в воде
немного конго красного и положить туда белый хлопчато-
бумажный платок; через короткое время она может уже
вынуть из раствора этот платок окрашенным в красный
цвет. Не беда, что эта окраска в противоположность али-
зариновой будет очень непрочной: ведь для получения
желаемого красного платка стоит только еще раз повто-
рить несложный процесс окрашивания.
Такие красители, которые непосредственно, т. е. без
протравы, окрашивают ткани, называются субстантив-
ными. Конго красный был первым субстантивным кра-
сителем для хлопка, за ним скоро последовали многочис-
ленные другие красители всех оттенков. С 1898 г. появи-
лись каменноугольные субстантивные красители, содер-
жащие в своем составе серу и выгодно отличающиеся от
своих более старых собратьев прочностью по отношению
к свету и стирке.
Каменноугольные красители представляют собой не со-
всем то, что думает о них широкая публика. Ту густую
черную массу, которая называется каменноугольной смо-
лой, нельзя непосредственно перерабатывать на краски.
169
Для этой цели ее нужно сначала подвергнуть перегонке;
для перегонки каменноугольной смолы мы можем исполь-
зовать, например, тот аппарат, с которым вы познако-
мились при перегонке вина.
Впервые перегонку каменноугольной смолы произвел
в 1834 г. с 'научными целями Рунге. Его работы послужили
основой для современной промышленной переработки ка-
менноугольной смолы. При нагревании ее в перегонном
аппарате сначала отгоняются светлые, как вода, масла,
из которых выделяют бензол или толуол, а эти два веще-
ства служат исходными продуктами для получения ка-
менноугольных красителей. Дальше идут погоны, которые
при охлаждении уже частично' застывают; из них получают
фенол, или карболовую кислоту, открытую также Рунге,
и нафталин, служащий теперь исходным продуктом для
приготовления искусственного индиго. Наконец, перегонка
•дает и ряд других продуктов, из которых мы назовем
здесь только антрацен. Если продолжать перегонку доста-
точно долго, то в перегонном аппарате остается, наконец,
твердая, похожая на кокс масса, употребляемая в качестве
горючего материала.
Каменноугольные красители нередко называют также
анилиновыми, потому что для получения некоторых из
них исходным продуктом служит анилин, в свою очередь
легко получаемый из бензола. Эти анилиновые красители
играли роль не только в крашении, но совершенно неожи-
данно получили применение также и в медицине, именно
для борьбы с бактериями—возбудителями заразных бо-
лезней.
При рассматривании в микроскоп различных выделений
больных (например мокроты), содержащих бактерии, рас-
познавание отдельных видов последних часто становится
затруднительным, а то и просто невозможным, особенно
когда число бактерий очень велико. Но в конце 70-х годов
прошлого столетия Вейгерт открыл, что отдельные виды
бактерий обладают способностью окрашиваться анилино-
выми красителями, в то время как окружающая их среда
не окрашивается. Пользуясь этим, бактерии можно сделать
легко различимыми под микроскопом в виде окрашенных
палочек, и тогда они становятся доступными для более
160
подробного исследования. Опираясь на этот способ, Кох
открыл в 1882 г. бациллу туберкулеза, которую обычно
окрашивают фуксином в красный цвет.
Метод окрашивания бактерий анилиновыми красителями
лег, таким образом, в основу борьбы с инфекционными
заболеваниями.
Известный с древнейших времен синий краситель индиго
издавна добывался в Индии из сока некоторых близко-
родственных между собой растений. Сок этих растений сам
по себе бесцветен, но при стоянии на воздухе из него
вследствие брожения и окисления (следовательно, под
влиянием кислорода воздуха) постепенно выпадает синий
краситель. Индиго не без основания называют «королем
красителей», так как его великолепный синий цвет с лег-
ким красноватым оттенком чрезвычайно прочен по отно-
шению к действию света и воздуха, кислот и щелочей,
а также к усиленной стирке с Мылом; такая стойкость
почти не встречается у других красителей.
В Средней Европе встречается растение, называемое вай-
дой, сок которого при стоянии также дает некоторое коли-
чество индиго, но гораздо меньшее, чем индийские расте-
ния, а именно всего 0,3 %’. Тем не менее в Европе в ста-
рину пользовались исключительно красителем, полученным
из ’Вайды, что объясняется затруднительностью сообщения
о Востоком в те времена. Так как потребность в синем
красителе была очень велика, то разведение вайды достигло
в некоторых местностях широкого развития и было очень
выгодным делом. Например в Тюрингии (Германия) около
1600 г. культурой вайды занималось несколько сот дере-
вень. Но когда сообщение с Индией улучшилось, вайда
не смогла уже конкурировать с более дешевым привозным
индиго, несмотря на то, что князья и города старались
спасти положение охранительными пошлинами. Привоз-
ное индиго скоро завоевало весь свет.
Чтобы добиться независимости от индийского индиго,
Наполеон объявил в 1800 г. премию в 1 млн. франков
за открытие способа получения искусственного индиго.
Но синтез индиго удался лишь почти через 100 лет после
этого. В конце 80-х годов прошлого столетия немецкий
химик Байер установил, что стойкий по отношению к свету
11 Химия повседневной жизни.
151
синий краситель индиго может быть приготовлен в ко-
нечном счете из нафталина или бензола, получаемых из
каменноугольной смолы. И в самом конце прошлого сто-
летия был найден, наконец, технически выгодный способ
приготовления искусственного индиго.
С 1897 г. на рынке появилось искусственное индиго,
и крестьяне далекой Бенгалии (провинция в Индии)
А. Байер
должны были постепенно заменять культуру индигоносных
растений культурами других растений. В то время как
еще в 1894 г. Индия экспортировала индиго на 32 млн.
руб. золотом, в 1910 г- вывоз упал до 2,3 млн. руб. 1 кг
искусственного индиго стоил в этом году 8 марок (3 р.
70 к.), себестоимость его составляла только 6 марок,
и искусственное индиго покрывало уже 85 °/о мировой по-
требности в этом красителе.
162
Индиго представляет собой так называемый кубовый
краситель. Он получается уже на самом волокне с по-
мощью окисления кислородом воздуха. Красильная ванна
(«куб») состоит из раствора красителя, восстановленного
гашеной известью и железным купоросом (в настоящее
время для восстановления гораздо чаще применяют гидро-
сернистонатриевую соль Na2S2O4); этот раствор обладает
довольно невзрачным цветом. И только, когда окрашен-
ная в ванне ткань пробудет некоторое время на воздухе,
на волокнах благодаря действию кислорода образуется тем-
носиний краситель.
* Кубовые красители сами по себе нерастворимы в воде
и поэтому-то их переводят восстановлением в присутствии
щелочей в растворимые, так называемые лейкосоединения.
Ткань, погруженная в соответствующий раствор, извлекает
из него лёйкосоединение, которое связывается с волокнами
и лод влиянием кислорода воздуха переходит потом в
первоначальный нерастворимый краситель. *
Кубовыми красителями являются также индантроновые
краски, впервые приготовленные Рене Боном. Они отлича-
ются высшей степенью стойкости, совершенно не подда-
ются разрушению под влиянием обычных воздействий и
переживают даже те ткани, которые ими окрашены. Их
название происходит от сложения первых слогов слов
«индиго» и «антрацен». Как показывает это название, исход-
ным продуктом для их приготовления служит антрацен,
о котором мы узнали, когда говорили о перегонке каменно-
угольного дегтя.-
С помощью другого красильного растения—краппа, или
марены, ткани окрашивали в разнообразнейшие цвета, но
главным образом в красивый красный цвет. Эго растение
разводили во всей Южной Европе вплоть до Бадена,
а также в Малой Азии и других местах. Для окраши-
вания пользовались корнями растения, которые на Востоке
называли «ализари», откуда И произошло название кра-
сителя ализарин.
В корне марены содержится целый ряд красителей. Но
хотя уже с 1823 г. начали усердно заниматься их хими-
ческим исследованием, из-за сложности задачи резуль-
таты долгое время оставались очень ничтожными. И только
в 1868 г. немецким химикам Гребе И Либерману удалось
установить, что главный краситель марены, ализарин, свя-
п»
163
зап по своему химическому строению с антраценом, о ко-
тором мы говорили выше. Оказалось, что ализарин хими-
чески представляет собой так называемый диоксиантра-
хинон. Опираясь на это чисто научное достижение, уда-
лось тогда перевести антрацен в диоксиантрахинон, т. е.
получить искусственный ализарин.
Промышленность сейчас же занялась изготовлением
этого красителя. После того как лабораторный способ no-
к. Греве
лучения был приспособлен для промышленного примене-
ния, а затем в течение ряда лет усовершенствован, при-
родный продукт не мог уже конкурировать с искусственным
ализарином. Из-за дешевизны последнего разведение ма-
рены должно было во всем мире прекратиться.
Выше уже было сказано, что при крашении природным
краппом, а следовательно, и ализарином, можно получить
целый ряд различных цветов. Цвета и оттенки окрашен-
ных этими красителями тканей зависят от тех протрав,
164
которые были применены перед крашением. Например, алю-
миниевые и оловянные протравы дают великолепный крас-
ный цвет, железные—темнофиолетовые тона, которые при
большом содержании железа переходят в совершенно чер-
ные, хромовая протрава дает цвет бордо и т. д. С помощью
таких протрав можно получать удивительные эффекты.
Пропитаем, например, кусок хлопчатобумажной ткани раз-
личными протравами так, чтобы одна его полоса была
пропитана одной протравой, другая—другой и т. д. После
высушивания все полосы куска окажутся бесцветными или
почти бесцветными, и потому они почти не будут заметны.
Опустим . подготовленную таким образом ткань в воду,
к которой добавлена желтоватая ласта искусственного али-
зарина, и немного прокипятим: на куске вдруг выступят
полосы разных цветов и оттенков.
Ализарин поступает в продажу, как и многие другие
красители, в виде пасты, содержащей много воды. Делается
это потому, что сухой ализарин плохо распределяется по-
том в воде, и красильщикам пришлось бы затрачивать
много труда для получения нужной ванны.
В красильном деле для окрашивания протравленных тка-
ней используются также водные вытяжки из древесины
некоторых тропических растений, например кампешевого
дерева, фернамбукового дерева и др. Древесину кампеше-
вого дерева называют синим сандалом, фернамбукового—
красным сандалом. Во избежание излишних транспорт-
ных расходов из такой древесины в приморских городах
приготовляют обычно сгущенные экстракты тем же спосо-
бом, с которым мы познакомились, говоря о дублении,
и затем эти экстракты используют уже красильные пред-
приятия. Но каменноугольные красители являются опас-
ными конкурентами и для красильных деревьев, и воз-
можно, что последние со временем тоже совершенно исчез-
нут с рынка.
Наряду с окрашиванием следует еще упомянуть о на-
бивке тканей.
Первоначально различные узоры прямо рисовали на
ткани. Позднее изобрели способ, заключающийся в том,
что места ткани, не подлежащие окрашиванию, покрывали
непроницаемой для красильного раствора массой. Эту
165
массу готовили по большей части сплавлением воска со
смолой. Обработанные по этому способу ткани опускали
целиком в красильный раствор, и таким образом на окра-
шенной ткани получался белый увор. Подобным же путем
работают в настоящее время при способе, называемом
батик Ч
Позже узоры начали печатать. Для этого их выре-
зали на деревянной доске, последнюю, прижимая к нама-
занному краской куску сукна, покрывали слоем краски,
и затем оттискивали узор на ткани. В ситцепечатании руч-
ная работа давно уже вытесняется машинами, которые в
настоящее время работают различными способами. Они либо
печатают красками, к которым во избежание растекания
по ткани добавлен клейстер, гуммиарабик или декстрин,
либо печатают сначала уэор протравами, так что потом
при крашении краситель будет впитан только протрав-
ленными местами. Можно, наконец, наносить на протрав-
ленную целиком ткань такие вещества, которые разру-
шают протраву в определенных Местах; такие места либо
вовсе не воспринимают потом краситель, либо, если вос-
принимают, то он удаляется с них простым промыванием
окрашенной ткани водой.
Поговорим теперь о такой красильной жидкости, ко-
торая употребляется чаще, чем всякая другая; это—
чернила. Издавна зарекомендовавшие себя черные чернила
представляют взвесь в воде соединения таннина йли ду-
бильных кислот с солями закиси железа. Их готовят при-
ливанием раствора железного купороса к водной вытяжке
из чернильных орешков. Чтобы сделать получающийся
черный осадок более устойчивым во взвешенном состоянии
и чтобы получить более густые чернила, к жидкости до-
бавляют раствор гуммиарабика.
Простым растворением в воде какого-нибудь красителя,
например красного анилинового (фуксина, эозина), нельзя
1 При этом способе белые узоры получают, защищая соответствующие
места сплавом воска и канифоли. Иногда белые места закрашиваются
потом другими красителями, и тогда получается расцветка. Этот способ и
теперь еще применяется на острове Яве, в Японии и некоторых других
местах в ремесленных или кустарных производствах. (Прим, персе.)
еще приготовить годных чернил, потому что такая жид-
кость будет слишком легко сiекать с пера и давать кляксы.
Для получения необходимой вязкости (но в такой степени,
чтобы чернила все же достаточно легко стекали с пера)
необходимы добавки, в качестве которых служат клей,
сахар или декстрин.
Копировальные чернила или чернила для гектографа от-
личаются от обыкновенных только тем, что к ним добав-
лено довольно значительное количество клея, глицерина
и сахара. При писании такими чернилами их задержи-
вается на бумаге настолько много, что потом в копироваль-
ном прессе получается ясно читаемый оттиск с рукописи.
Упомянем еще о так называемых симпатических черни-
лах, которые играют, впрочем, большую роль в романах,
чем в действительной жизних. Например, разведенный рас-
твор желтой кровяной соли окрашен в слабый желтый
цвет. Если написать этим раствором что-нибудь на бумаге,
то после высыхания текст совершенно не будет заметен.
Но посвященному стоит лишь провести по бумаге кисточ-
кой, смоченной раствором хлорного железа, и сейчас же
выступит синий текст, так как благодаря взаимодействию
желтой кровяной соли и хлорного железа образуется бер-
линская, лазурь. Подобным путем, подбирая подходящие
жидкости, сами по себе очень слабо или вовсе не окра-
шенные, но дающие при взаимодействии друг с другом
темные осадки, можно получить проявляющийся текст
почти любого цвета.
Однако настоящие симпатические чернила должны за-
ключать в себе нечто гораздо более таинственное. В рас-
смотренном нами случае текст после проявления остается
уже видимым и закрепленным на долгое время; при упо-
треблении же настоящих симпатических чернил текст,
после того как адресат его прочел, должен исчезать.
В качестве таких чернил применяют обычно раствор хло-
ристого кобальта. Раствор этой соли почти не окрашен
и написанный им текст на белом фоне не заметен. (Лучше
брать для этой цели слегка желтоватую бумагу.) Но если
бумагу нагреть, то хлористый кобальт отдает воду, с ко-
торой он был химически связан, и переходит в безводное
1 Такими чернилами нередко пользовались для нелегальных сообщений
революционеры в царской России. (Прим, перев.)
167
соединение, окрашенное в темносиний двет: текст стано-
вится легкочитаемым. Поело охлаждения безводный хло-
ристый кобальт постепенно притягивает влагу воздуха,
переходит снова в бесцветную соль, содержащую кристал-
лизационную воду, и текст опять Исчезает.
Мы видели, .что так называемая анилинокрасочная про-
мышленность Производит не только красители, искус-
ственно созданные в химической лаборатории, но и кра-
сители, встречающиеся в природе, например индиго или
ализарин.
Благовонные запахи, так же как и краски, тоже должны
быть связаны с какими-нибудь определенными химиче-
скими соединениями. Действительно, некоторые из души-
стых веществ, встречающихся в растениях, удалось уже
выделить из них в химически чистом виде. Например
вещество, обусловливающее запах горькоминдального мас-
ла, оказалось химически очень просто построенным. Это—
бензойный альдегид, простое производное содержащегося
в каменноугольном дегте бензола. Поэтому, искусственное
горькоминдальное масло в настоящее время очень дешево.
Вещество с запахом фиалкового масла готовится теперь
также искусственно. Для этого понадобилась огромная
исследовательская работа, не меньшая, чем для получения
искусственного индиго. 1 кг ионона (так называется ве-
щество с запахом фиалки) в течение многих лет оцени-
вался в 8000 марок (около 3700 зол. руб.)1.
И точно так же, как теперь удалось искусственно со-
здать бесчисленное множество каменноугольных красите-
лей, которых в природе вовсе не существует, удалось
искусственно получить и очень большое количество ду-
шистых веществ. Потребность в них Настолько значительна,
что их производством давно уже занимаются специальные
большие фабрики.
Основными работами по искусственному получению ду-
шистых веществ были работы Фердинанда Тимана и Отто
Валлаха, выполненные в конце прошлого столетия. Эти
1 Ионон в природных продуктах не встречается. Запахом фиалки он
обладает только при сильном разбавлении, в концентрированном же виде
ему присущ запах кедрового дерева. (Прим, перев.)
163
химики полумили ванилин, душистое вещество ванили,
затем эвгенол—составную часть гвоздичного масла, лотом
кумарин, обусловливающий аромат пахучего ясминника
(asperula odorata), и наконец, коричное масло. Эти души-
стые вещества были приготовлены, исходя из бензола.
Другая группа душистых веществ, например уже упо-
мянутый (выше ионон, пахнущий сиренью терпинеол,
а также вещества, обусловливающие запах масел: лимон-
ного, тминного, мятного, укропного, терпентинного, кам-
фарного,—получены искусственно из терпенов, которые
представляют собой относительно просто построенные угле-
водороды..
☆ Производства каменноугольных красителей, промежу-
точных продуктов, искусственных дубителей, душистых
веществ, а также фотохимических И ряда других продук-
тов входят в состав так называемой анилинокрасочной
промышленности.
Еще Маркс оценил важное значение этой отрасли про-
мышленности, отметив в III т. «Капитала» в качестве круп-
нейшей победы химии в области использования отходов
получение ализарина из каменноугольного дегтя.
Анилинокраоочная промышленность в довоенное время
особенно быстрыми темпами развивалась в Германии. Гер-
манская анилинокраоочная промышленность имела почти
монопольное мировое значение и еще в 1913 г. произвела
около 240 млн. кг органических красителей. Именно эта
отрасль промышленности позволила Германии в 1916 г.
начать применять в широком масштабе химические сред-
ства борьбы—боевые отравляющие вещества, которые с
этого времени появлялись на полях сражений все в боль-
ших и больших количествах. И союзники отстали в этом
отношении от Германии именно потому, что их химическая
промышленность, главным образом анилинокраоочная, была
развита в мирное время значительно слабее, чем гер-
манская.
Учтя на основании опыта мировой войны военное зна-
чение анилинокрасочной промышленности, Англия, Фран-
ция, Италия, США, Япония стали усиленно развивать
ее. Особенных успехов добились в этом отношении США,
где уже в 1929 г. было выработано больше 160 млн. кг
169
красителей, промежуточных и других каменноугольных
продуктов.
В царской России анилинокрасочной промышленности
не существовало, если не считать нескольких мелких пред-
приятий, перерабатывавших германские полуфабрикаты и
являвшихся собственно отделениями германских фирм.
Стоимость продукции этих предприятий оценивалась всего
в 11 млн. руб., включая сюда и те предприятия, которые
существовали на территории Польши, Латвии и т. д. Серь-
езная анилинокраоочная промышленность у нас создана
только после Октября, главным образом в годы первой
пятилетки. Она сосредоточена на ряде крупных заводов,
основной капитал которых составляет 100 млн. руб. и ко-
торые уже в конце первой пятилетки давали в 10 раз
больше продукции, чем все заводы царской России.
За годы первой пятилетки советская анилинокрасочная
промышленность освоила производство целого ряда новых
красителей на базе собственных полупродуктов и к 1932 г.
сумела освободиться от ввоза иностранных полупродуктов
(еще в 1928/29 г. на это было затрачено 2566 тыс. руб.),
выпускает красители в более концентрированном виде, чем
до войны, значительно увеличила число марок производи-
мых красителей. Уже в 1933 г. анилинокрасочная промыш-
ленность СССР вышла на третье место в мире непосред-
ственно за США и Германией, оставив позади Францию,
Италию, Японию, Англию и другие страны.
Во второй пятилетке при значительном количественном
росте советской анилинокрасочной промышленности в ее
развитии отмечаются и важные качественные сдвиги—
в направлении освоения таких сложных красителей, как
индиго, индантрены и ряда других. *
ЛЕКЦИЯ ВОСЬМАЯ
Малярное дело. Высыхающие и невысыхающие масла. Льняное масло.
Олифа. Лак. Целлюлоза. Бумага. Проклеивание бумаги. Бумага из соломы.
Бумага из древесной массы. Натронная целлюлоза. Сульфитная целлюлоза.
В малярном деле лишь в последние годы начали при-
менять стойкие по отношению к свету каменноугольные
краски. До недавнего времени здесь пользовались только
минеральными красками, которые наносились на окраши-
ваемую поверхность растертыми с маслом; последнее и
скрепляло их с поверхностью. Если, например, тонко раз-
молоть кирпич, то полученный порошок дает почти нераз-
рушимую красную краску, которую можно растереть с мас-
лом. Подобным же образом используются некоторые встре-
чающиеся в природе минералы. Прокаливанием или спла-
влением различных веществ также получают окрашенные
массы, дающие после размалывания краски. Например,
если во время плавки стекла добавить к нему соединения
кобальта, то стекло окрашивается в синий цвет (это было
известно уже 400 лет тому назад). Такое стекло в размо-
лотом виде представляет чрезвычайно прочную краску,
называемую «шмальтой». В качестве красок применяются
также многие нерастворимые в воде осадки, получающиеся
при сливании растворов двух разных солей. Например,
раствор хромовокалиевой соли при взаимодействии о ра-
створом уксусносвинцовой соли дает хромовосвинцовую
соль, которая находит применение под названием хромовой
желтой.
Масляные краски нельзя готовить на любом масле.
Вспомним, например, об оливковом масле: мы знаем, что
оно образует так называемые масляные пятна, которые
потом не высыхают. Значит, растертые с таким маслом
краски вообще не будут сохнуть.
Масла разделяются на две большие группы: 1) высыхам-
17J
щие и 2) невысыхающие. В состав невысыхающих масел,
например оливкового, входят главным образом олеиновая
кислота и глицерин,—та самая олеиновая кислота, которая
является и составной частью животных жиров1. Высыхаю-
щие масла содержат вместо олеиновой кислоты другие
кислоты, которые чаще всего называют по имени соответ-
ствующего масла. Например, принадлежащее к этой группе
льняное масло содержит льняную кислоту. Получают это
масло прессованием льняного семени. Все семена вообще
богаты содержанием масел, например льняное семя дает
при холодном прессовании 22°/о, а при горячем—даже
28°/о масла. *
Оба вида масел—как высыхающие, так и невысыхающие—
не остаются при длительном стоянии на воздухе неизме-
ненными. Оливковое и подобные ему масла горкнут. Что
касается высыхающих масел, то они при нанесении
очень тонким слоем на такую поверхность, которая их не
впитывает (стекло, металл), превращаются в твердую
пленку. Когда с высыхающими маслами растирают краску,
то последние при высыхании масла плотно пристают
вместе с пленкой к поверхности. Затвердевшая масса бы-
вает совершенно суха, и краска с поверхности уже не
стира ет'ся.
Прогоркание невысыхающих масел происходит оттого,
что они постепенно распадаются частично на жирные ки-
слоты и глицерин. Затвердевание же высыхающих масел
основано на окислении кислородом воздуха; при этом
льняная и подобные ей кислоты совершенно изменяются,
переходя в твердые соединения.
Нужно еще добавить, что существуют и такие масла
(как, например, хлопковое), которые содержат одновре-
менно кислоты того и другого рода. Эти масла называют
полувысыхающими, потому что на воздухе они только
сгущаются, не затвердевая при этом и Не становясь сухими.
Замечателен тот факт, что высыхающие масла высыхают
значительно скорее, если ускорить их окисление искус-
ственно. Для этого их варят с такими веществами, как,
например, окислы свинца (сурик, глет). Сваренное с по-
1 Здесь и дальше речь идет, конечно, не о свободных кислотах, а об их
сложных эфирах — глицеридах, которые содержатся в жирах. (Прим,
перев.)
172
добными веществами льняное масло называется оливой;
при растирании с соответствующими красками олифа дает
масляные краски, применяющиеся в малярном деле.
Льняным маслом, окисление которого ускорено окислами
свинца или (с 1910 г.) льнянокобальтовой солью, можно,
конечно, покрывать любые поверхности, не растирая его
предварительно с красками; поверхности могут при втом
быть неокрашенные или окрашенные клеевой краской1.
Окисляющееся льняное масло тогда высыхает, образует
прочную прозрачную стекловидную пленку. Обработанную
таким образом поверхность мы называем лакированной.
Но понятие «лаки» имеет, впрочем, более широкое зна-
чение. Обычно мы называем лаком не само вареное льняное
масло, а растворы смолы в олифе или в легко испаряющих-
ся растворителях. Например, в качестве лака употребляется
раствор шеллака в спирте; он удобен тем, что очень скоро
сохнет, так как спирт на воздухе быстро испаряется. Од-
нако гораздо прочнее оставляемых таким лаком тонких
пленок покрытия масляными лаками. Последние получают
растворением в олифе (а -также в других высыхающих
маслах) естественных смол (янтаря, копала) или продук-
тов их переработки.
Янтарь, как известно, представляет собой ископаемую
смолу. Перед приготовлением лака янтарь нужно предва-
рительно расплавить, так как иначе он не растворится
в вареном льняном масле. Копал—это тоже смола, полу-
чаемая из некоторых деревьев, растущих в жарких стра-
нах. Смолами вообще называют такие вещества, которые
получаются после постепенного застывания на воздухе
жидкостей, вытекающих из растений самопроизвольно или
после ранений.
Если сварить олифу-с тонкоразмолотой Пробкой, к ко-
торой примешаны канифоль и другие смолы, и покрыть
полученной смесью джутовую ткань, то получится лино-
леум. Его производство развилось из давно известное
1 Клеевой краской называется краска, смешанная с клеем, предва-
рительно разведенным в воде. (Прим, перев.)
ПЗ
производства клеенки; способ приготовления впервые был
разработан англичанином Уольтоном в i860 г.
Перейдем теперь к бумаге. В древнейшие времена для
письма употреблялись только природные материалы—
камни, дерево, кожа. Египтяне очень давно уже научи-
лись приготовлять бумагу из папируса. Стебли этого ра-
стения нарезали в виде возможно более тонких и широких
листочков, которые клали друг подле друга. Второй слой
таких листочков клался сверху поперек первого, и все
поступало под пресс, где после высыхания получался
сплошной лист. После тщательной полировки он служил
затем для письма. Кроме этого материала, в древности и
в начале средних веков для письма пользовались еще
пергаментом. Но уже в VIII в. из полотняных тряпок на-
чали приготовлять то, что мы называем теперь бумагой.
Наиболее древними документами, написанными в Ев-
ропе на бумаге, являются папские буллы, относящиеся
к VIII и IX вв. Бумагу для них доставили, невидимому,
испанские сарацины, так как вообще наиболее древним
документом, написанным на бумаге из льняных тряпок,
был мирный договор между Кастилией и Арагонией1.
В Настоящее время гораздо большее количество бумаги
потребляется для печатания, чем для письма.
Бумага состоит из тонкого слоя сильно перепутанных
волокон растительного происхождения. Животные волокна
для изготовления бумаги непригодны, так как они дают
слишком мягкий продукт, напоминающий сукно.
Для изготовления дешевой бумаги никогда не употре-
бляли волокнистый Материал в том виде, в котором он
получается из растений. Растительные волокна шли для
фабрикации бумаги лишь В виде тряпок, получавшихся
после того, как льняные и хлопчатобумажные изделия ста-
новились вследствие изнашивания негодными к употре-
блению.
1 Булла—старинное западноевропейское название’государственных актов,
изданных в торжественной форме, с прикрепленной на ленте печатью;
название это и теперь применяется к торжественным актам, исходящим
от папской власти. Сарацинами в Европе называли арабов, а позже и всех
мусульман вообще. Кастилия и Арагония — королевства в Испании в сред-
ние века. В VIII в. Испания была завоевана арабами. (Прим, перев.)
174
Растительные волокна состоят из клетчатки, которая
образует коротенькие волоконца, и склеивающих эти во-
локонца веществ (или, как говорят, «инкрустирующих»
веществ).
Первоначально бумага изготовлялась следующим обра-
зом. Мокрые тряпки оставляли два-три дня загнивать.
После этого слегка загнившие тряпки продолжительное
время кипятили, добавляя немного извести, и наконец,
толкли с большим количеством воды. Инкрустирующие ве-
щества при всех этих операциях настолько разрыхлялись,
что в результате отделялись свободные волоконца клет-
чатки. Полученная кашица зачерпывалась тонким ситом,
которое рабочий равномерно встряхивал. Большая часть воды
стекала при этом сквозь отверстия, а на сите оставался
тонкий слой перепутанных между собой волоконец клет-
чатки. Второй рабочий сейчас же клал этот слой на тол-
стое сукно и накрывал его другим куском сукна и т. д.
Когда получалась достаточной толщины пачка таких
слоев, ее помещали под пресс, чтобы удалить из бумаги
возможно большее количество воды; одновременно вслед-
ствие этого увеличивалась и прочность отдельных слоев.
Затем их вынимали и хорошо высушивали.
Полученная этим способом бумага имеет губчатое строе-
ние (как пропускная бумага). Она может, конечно, служить
для печати или упаковки, но писать на ней нельзя. Такая
бумага пронизана порами и канальцами, в которые чернила
будут впитываться, вследствие чего они станут растекаться
и написанное иногда даже невозможно будет прочесть.
Если эту бумагу погрузить в холодную крепкую серную
кислоту (8О°/о) и затем хорошенько отмыть, то клетчатка
на поверхности превратится в крахмалх, и Получится пер-
гаментная бумага.
Для того, чтобы придать бумаге бблыпую прочность
и уничтожить ее способность легко впитывать жидкости,
ее, как говорят, «проклеивают». Это слово не совсем пра-
вильно обозначает соответствующий процесс. Ведь если
просто добавить к богатой влагой бумажной кашице клея,
то он растворится в воде и в самую бумагу попадет лишь
очень незначительное количество клея. Но иначе будет
обстоять дело, если к бумажной кашице добавить еще
1 Вернее — в так называемый амилоид. (Прим, перев.)
175
кроме клея квасцов. Мы познакомились уже со сродством
содержащейся в квасцах окиси алюминия к волокнам, когда
говорили о дублении и крашении. Здесь также наблюдается
это явление: волокна связывают окись алюминия, а по-
следняя в свою очередь связывает клей. Когда бумажная
кашица, обработанная обоими названными веществами, по-
падает потом на сито, то из нее, как и прежде, стекает
вода, но |в волоконцах остается связанный окисью алюминия
клей. После высушивания волоконца в такой бумаге скле-
иваются между собой, и теперь уже на ней можно писать,
так как она потеряла способность легко впитывать жид-
кости. Содержащиеся в бумаге проклеивающие вещества,
которые нерастворимы в воде, делают ее и менее чувстви-
тельной к сырости.
Поверхность бумаги, приготовленной ручным способом
на ситах, никогда не может быть очень ровной. Поэтому
такую бумагу, для придания ей красивого вида, подвер-
гают еще лощению. С этой целью ее или прессуют в сыром
виде между двумя гладкими поверхностями, или, как го-
ворят, сатинируют, пропуская между двумя полирован-
ными валами, безупречная гладкость которых передается
при этом бумаге.
В производстве бумаги постепенно уДаЛось полностью
заменить ручной труд машинным. Прежде наибольшая ве-
личина бумажного' листа ограничивалась величиной наи-
большего сита, с которым еще мог управляться один ра-
бочий. С применением машин стало возможным готовить
бумажный лист значительной ширины, а длина его при
машинном производстве вообще неограничена.
Для получения бумажной массы из тряпок, последние
уже не подвергают предварительному гниению и толче-
нию. Теперь инкрустирующие вещества разрушают варкой
с крепкой щелочью, после чего тряпки поступают в удли-
ненную ванну, В которой вращается усаженный ножами
вал. В качестве щелочи обычно применяется раствор едкого
натра, с которым мы познакомимся ближе, когда будем
говорить о мыловарении.
На дне ванны в подходящем положении по отношению
к валу также укреплен ряд ножей. Такие аппараты на-
зывают голлендерами, или роллами. При вращении вала
механической силой вываренные тряпки постепенно пол-
ностью размельчаются и размалываются с водой в кашицу.
176
Полученная масса отбеливается хлорной известью, после
чего вредное действие излишка отбеливающего средства
уничтожается с помощью антихлора. Затем массу подвер-
гают проклеиванию, но при машинном производстве для
этого вовсе не употребляют собственно клея. Теперь пред-
варительно готовят раствор подходящих смол, например
канифоли, в едком натре (смолы гораздо дешевле клея)
и добавляют его вместе с ’квасцами к массе. Окись алю-
миния здесь также связывается с клетчаткой и в свою
очередь связывает составные части смолы, которые де-
лают бумагу пригодной для письма. * При смоляной про-
клейке склеивания волокон не происходит и поры остается
вполне открытыми. Суть дела здесь заключается в том,
что соединения клетчатки со смоляными кислотами, обра-
зующиеся на поверхности волокон, делают волокна не сма-
чивающимися, что И противодействует прониканию в поры
растворов. В случае животной (желатинной) проклейки
раствор желатины, впитанный бумагой, при последующей
сушке бумаги, испаряясь на ее поверхности, закрывает
поры тонкой пленкой, которая и препятствует проникно-
вению в них не только жидкостей, но и воздуха. *
Вполне готовая теперь для фабрикации бумаги масса
разбавляется большим количеством воды и направляется
на так называемую бесконечную, непрерывно движущуюся
вперед сетку бумагоделательной машины (рис. 33). Эта
сетка, изготовленная из тонкой латунной проволоки, при-
водится в движение вращающимися валами. Свойлачива-
нию волокон способствуют происходящие одновременно
непрерывные сотрясательные движения сетки. Если в сетке
вытканы какие-нибудь рисунки, то они 1выходят на гото-
вой бумаге в виде водяных знаков.
Бумажная масса, с которой стекла' большая часть воды,
отбрасывается с сетки на бесконечное суконное полотно.
Очень скоро к Ней подходит другое суконное полотно,
также Находящееся в движении, и заключенная между
ними масса проводится между двумя валами, которые
отжимают из нее воду. С валов лист переходит на поли-
рованный прогреваемый цилиндр, где он сохнет и в то
же время приобретает вполне гладкую поверхность. На
втором цилиндре получает надлежащий вид и обратная
сторона листа. Готовая бумага наматывается машиной в
форме рулонов на валики.
12 Химия повседневной жизни.
177
Огромная потребность в бумаге давно уже не покры-
вается использованием тряпок. В наше время отдельный
человек далеко не дает столько льняных и хлопчатобумаж-
ных отходов в виде изношенного платья и т. п., сколько
приходится в среднем на его долю клетчатки в виде газет,
писчей бумаги и пр. Производство бумаги растет быстрее
всех других промышленных производств. Ежегодный рост
последних до мировой войны оценивался в среднем при-
Рис. 33. Бумагоделательная машина
мерно в з°/о, в то время как ежегодный рост производства
бумаги составлял 53/4°/о. Вот чем объясняется также то
обстоятельство, что уже около 1870 г. Р некоторых стра-
нах, например в Пруссии, были подняты вывозные пош-
лины на тряпки, чтобы обеспечить этим—тогда незаме-
нимым—сырьем свои фабрики.
Но и такая мера сама ото себе не увеличивала коли-
чества тряпок. Поэтому ввиду все острее и острее ощу-
щавшегося недостатка тряпок начали усиленно искать
подходящую замену их для бумажной промышленности.
В наше время благодаря использованию увеличдвщихся
178
химических знаний, в этом направлении достигнуты такие
большие успехи, что теперь существует много бумажных
фабрик, в которые тряпки вообще никогда не попадают.
Сырым материалом для льняных тряпок, а следовательно,
и для бумаги, служил лен. Но клетчатка, из которой
состоят стебли льна, содержится, ведь, и в бесчисленных
других растениях. Однако и здесь имеет место! то же обстоя-
тельство, о котором мы узнали при ознакомлении! с разными
сортами крахмала: хотя химический состав содержащихся
в разных растениях сортов клетчатки и одинаков, физиче-
ские свойства их могут быть очень различны.
Пригодную для производства бумаги клетчатку дает
соответствующим образом разваренная солома. Очень под-
ходящей для этой цели оказалась также клетчатка из
травы альфа—особого растения, дико растущего в боль-
ших количествах в Северной Африке (особенно в Алжире).
Но Оба эти вида сырья являются во всяком случае далеко
не таким хорошим материалом для бумаги, как льняные
тряпки.
Клетчатка содержится, наконец, и во всяком дереве,
иначе говоря, во всякой древесине; и действительно, боль-
шие успехи достигнуты теперь именно в переработке дре-
весины на бумагу.
Еще в 1765 г. некто Шеффер рекомендовал использо-
вать для производства бумаги измельченную древесину.
На мысль заменить тряпичные волокна растительными Ца-
вели его, якобы, наблюдения над осиными гнездами. Но
осуществление этой идеи на деле затянулось до 1846 г.,
когда в Саксонии начали производить очень простым спо-
собом так называемую древесную массу. Этот способ за-
ключался в том, что древесину размалывали мокрым вра-
щающимся жерновом. Полученная таким образом масса,
естественно, почти не имеет волокнистого1 строения, по-
чему способность ее свойлачиваться крайне незначи-
тельна. Кроме того, она содержит много смолистых ве-
ществ соответствующего дерева, что делает очень затруд-
нительным, а и иногда И вовсе невозможным, ее отбелива-
ние. Вот почему такую массу можно перерабатывать только
вместе с тряпками. Древесная масса увеличивает прй этом
количество бумаги, а длинные тряпичные волокна придают
бумаге необходимую прочность.
Следовательно, древесная масса является здесь скорее
12*
179
«наполнителем», чем заменителем тряпья. В отношении
наполнителей, между прочим, пошли еще гораздо дальше.
К бумажной массе добавляют гипс и подобные ему веще-
ства белого цвета. Сами по себе эти вещества не обладают
никакой способностью к свойлачиванию, они только рас-
пределяются между, волокнами бумаги, что увеличивает
ее количество, но в то же время неблагоприятно отра-
жается на прочности. ' .
Наряду с чисто механическим размалыванием древе-
сины скоро обратились также и к использованию соломы.
Ее научились разваривать с раствором едкого натра до
такого состояния, что образовавшуюся массу после тща-
тельного промывания с водой можно было размалывать
в голлендерах, как и бумажную массу. Полученный про-
дукт поддается белению хлорной известью и при фабри-
кации бумаги может быть добавлен в большом количестве
к собственно клетчатке.
Подобным же способом готовится соответствующая масса
и из травы альфа. Эта масса очень рыхла и объемиста,
почему выделанная из нее бумага при одинаковом весе
толще, чем бумага из других материалов.
Разваривание соломы или травы альфа с подходящими
химическими .материалами не представляет большого труда.
Много сложнее обстоит дело с древесиной, если ее хотят
сделать годной для фабрикации бумаги не путем раз-
мельчения, а путем разваривания: древесина представляет
собой гораздо более прочный и плотный материал. Раньше
всего для этой цели был разработан так называемый на-
тронный способ.
Натронный способ, открытый в конце шестидесятых го-
дов прошлого столетия Уаттом, состоит в следующем.
Древесина, главным образом еловая или сосновая, раз-
варивается под очень большим давлением с раствором
едкого натра. Котлы, в которых производится варка, обо-
греваются голым огнем наподобие паровых котлов. Дре-
весина закладывается в котел в проволочных корзинах и
затем туда впускается щелок. Для достаточного развари-
вания древесины давление в котлах должно доходить
до 10 атмосфер. Вынутые из котла круги древесины имеют
темнобурый цвет. После варки все вещества, обволаки-
вающие и склеивающие волокна клетчатки в древесине,
сделались растворимыми в воде. 1
180
Коллекционер, собирающий Марки, отклеивает погашен-
ные марки простым погружением конверта в холодную
воду; такая вода уже растворяет приклеивающий марку
клей. Древесину же, для того чтобы сделать растворимым
в воде тот сорт «клея», который мы называем инкрусти-
рующими веществами, приходится варить с раствором ед-
кого натра в паровых котлах.
Если растолочь теперь проваренную древесину с боль-
шим количеством воды и перенести на сито, то на' сите
останется только клетчатка; все инкрустирующие веще-
ства растворятся в воде и будут удалены вместе с ней.
Подученные таким путем довольно длинные волокна клет-
чатки (так называемой «натронной целлюлозы») очень хо-
рошо отбеливаются и в смеси с друрими материалами идут
на выработку бумаги.
С 1884 г. в качестве опасного конкурента натронной
целлюлозы выступила «сульфитная целлюлоза»; ее конку-
ренция оказалась настолько успешной, что в настоящее
время готовится уже гораздо больше сульфитной деллю-
лозы, чем натронной.
Можно было заранее предполагать, что кроме едкого
натра есть и другие вещества, способные переводить р
растворимое состояние инкрустирующие вещества и в то
же время не действующие слишком сильно на целлюлозу.
С течением времени таких средств стало известно! очень
много, но практически ценным оказалось только одно из
них—кислая сернистокальциевая соль.
В связи с тем, что соли сернистой кислоты называются
в химии сульфитами, новый вид целлюлозы, в отличие
ст натронной, и получил упомянутое уже выше название
«сульфитной». Практически применимый способ ее полу-
чения впервые разработал Митчерлих; до него были про-
изведены многочисленные опыты в этом направлении, Но
вое они остались безрезультатными.
Что же представляет собой кислая сернистокальциевая
соль?
Если зажечь серу, то она, как мы знаем, сгорает, рас-
пространяя едкий запах, и при этом как таковая исче-
зает. Подобно тому, как исчезает при горении! уголь, со-
единяясь с кислородом воздуха в бесцветный углекислый
газ, так исчезает при горении и сера, тоже соединяясь
с кислородом воздуха и тоже образуя при этом бесцветный
131
газ, называемый сернистым газом, а иногда и сернистой
кислотой Ч Предположим, что у нас в печи сгорает сера,
и в трубу, следовательно, идет образующийся при этом
сернистый газ. Но это'не обычная, пустая внутри труба,—
она наполнена кусками известняка, орошаемыми сверху
водой. Поэтому сернистый газ не уходит из трубы в воз-
дух. ☆ Известняк представляет собой утлекальциевую соль
СаСО3, которая легко разлагается огромным большинством
других кислот, в том числе и сернистой, и выделяет при
этом углекислый газ СО2. Образующаяся при этом окись
кальция дает с сернистой кислотой сернистокальциевую
соль. * Так как из нижней части трубы продолжает
поступать большое количество легко растворимого серии--
стоге газа, то последний растворяется в медленно сте-
кающей по кускам известняка воде. В этой кислой жид-
кости растворяется успевшая образоваться раньше сер-
нистокальциевая соль, превращаясь при этом в кислую
сернистокальциевую соль.
Раствор кислой сернистока!льциевой соли разъедает боль-
шинство металлов. Из всех достаточно дешевых для про-
мышленных целей металлов наиболее. стойким в хими-
ческом отношении является свинец. Вот почему в большой
химической промышленности имеют широкое применение
аппараты, сделанные из свинца или освинцованные
изнутри.
Для переработки древесины на целлюлозу ее нужно ва-
рить с раствором кислой сернистокальциевой соли примерно
при 3 атмосферах давления. Однако из свинца нельзя
приготовить таких котлов, которые выдержали бы это
давление,—свинец слишком мягкий металл. Вот почему
изготовление сосудов для получения целлюлозы по суль-
'фитному способу «'казалось трудной задачей. Теперь ра-
ботают следующим образом.
• Железный паровой котел обмазывается изнутри смолой
и затем выкладывается свинцовыми пластинами. Послед-
1 Химическая формула сернистого газа SO2. Самой, конечно, не является
кислотой, а образует сернистую кислоту H2SO3, соединяясь химическ-
с водой: SO2 -|- Н2О = H2SO3. В свободном состоянии эта кислота не из-
вестна, но она содержится в водных растсорах сернистого газа. Следо-
вательно, сернистый газ является ангидридом сернистой кислоть,.
Ангидриды кислот, взаимодействуя с основаниями, образуют соли. (Прим,
перев.)
183
ние покрываются двумя слоями кислотоупорных камен-
ных плит так, чтобы швы одного слоя были сдвинуты
относительно швов другого на половину плитки. Только
такая защитная обкладка надежно предохраняет стенки
железного котла от разъедания. Нагревание котла произ-
водится с помощью паровых змеевиков.
Разваренная с кислой серниотокальциевой солью древе-
сина выходит из котла более светлой, чем была раньше
(в противоположность натронному способу, где древесина
после варки темнеет). Мы уже знаем, что сернистый газ
сам по себе является отбеливающим средством, и поэтому
полученную таким путем целлюлозу нетрудно в конце
концов полностью отбелить хлором. '
Наилучшую целлюлозу дает переработанная по суль-
фитному1 способу европейская пихта!. Но северная граница1
ее распространения проходит уже около Майна1. Севернее,
особенно в Северной Германии, Норвегии и Финляндии,
перерабатывают сосну.
Насколько больших Масштабов достигла теперь выра-
ботка сульфитной целлюлозы, показывает тот факт, что
крупные предприятия этого рода ежедневно перерабаты-
вают от 3 до 4 га хорошего соснового леса. Сульфитная
целлюлоза не только превосходит по качеству натронную,
но и почти целиком вытесняет Из бумажного производства
его первоначальное сырье—тряпки.
О получении спирта из отходов этой отрасли промыш-
ленности (так называемых сульфитных щелоков) мы ужо
говорили, когда знакомились со способами получения
спиртных напитков.
* Рост мирового производства бумаги показан на рис. 34.
Но в связи с экономическим кризисом производство ^бу-
маги в капиталистических странах после 1929 г. начало
резко снижаться, дав по отдельным странам к 1932 г.
уменьшение продукции на 30—40%.
Особенное значение имеет бумажная промышленность для
СССР в связи с гигантской культурной революцией, во-
влекшей в культурную жизнь широчайшие массы трудя-
щихся. Бумага является важнейшей материальной базой
этой революции. Небывалый рост тиража газет И журналов,
1 Большой правый приток р. Рейна в Западной Германии. (При*'}
перев.)
183
усиливающийся с каждым месяцем поток книг, далеко1 еще
не может, однако, удовлетворить полностью спрос. Обя-
зательное всеобщее обучение, школы взрослых, вечерние
университеты, курсы техминимума, курсы заочного обуче-
ния и т. д. й т. д.—все это предъявляет огромные ггребо-
вания к советской бумажной промышленности. Не нужно
еще забывать, что бумага имеет, кроме того, и важное про-
мышленное и оборонное значение. Достаточно вспомнить,
например, о кабельной, телефонной, шпульной, наждач-
ной, гильзовой, упаковочной бумаге, о масленке, фибре,
кожкартоне и т. д.
Рис. 34. Рост мирового производства бумаги и картона (в млн. т)
Удовлетворить все эти потребности с тем наследством
в области бумажной промышленности, которое досталось
пролетариату от старой России, было невозможно. До .ре-
волюции в пределах нынешнего СССР производилось не
больше 200 тыс. т бумаги и картона; да примерно такую
же продукцию даваПа Финляндия. В 1926/27 г. довоенная
выработка была уже превышена (248 тыс. т), а к концу
первой пятилетки, к 1932 г., она1 достигла' 471 тыс. т.
Были построены мощные комбинаты (Балахнинский, Сясь-
ский, Кондопогский и др.)/ целлюлозные заводы (Доб-
рушинский, Лялинский), на действующих предприя-
тиях установлены новые машины. Крупнейшим из этих
предприятий является Балахна, самая Мощная бумаж-
184
нал фабрика в Европе, с суточной производительностью
до 340 т.
Во второй пятилетке рост бумажной промышленности
СССР продолжается, строятся новые комбинаты вблизи
сырьевой базы, т. е. на востоке и .северо-востоке страны.
Кроме того, в план второй пятилетки включен выпуск
собственных бумагоделательных машин, которые позволят
еще быстрее увеличивать продукцию советской бумажной
промышленности. *
ЛЕКЦИЯ ДЕВЯТАЯ
Жженая известь. Поташ. Сода. Серная кислота. Глауберова соль. Азот-
ная кислота. Хлорная известь. Кристаллическая сода. Аммиачная сода.
Искусственный поташ. Бардяная зола. Поташ из жиропота. Мыло. Ед-
кое кали. Едкий натр. Жидкое мыло. Наполненное мыло. Канифольное
мыло. Мягкая и жесткая вода. Пластырь.
Мыло готовится действием; растворенных в воде едких
щелочей на жиры. Поэтому, прежде чем: говорить о при-
готовлении мыла, мы должны несколько ближе ознако-
миться с едкими щелочами. Их получение раньше было
непосредственно связано с приготовлением так называемых
углекислых щелочей, почему оно и может быть разъяс-
нено только в связи с последними. В настоящее время
едкие щелочи получают с помощью электричества' (путем
электролиза). Важнейшей из углекислых щелочей яв-
ляется сода.
В прежние времена из едких щелочей знали только жже-
ную (негашеную) известь1.
Если поставить для лучшего удержания тепла вокруг
огня камни, т. е. построить нечто вроде очага, то после
угасания огня и охлаждения камни в большинстве случаев
останутся такими же, как были раньше. Но есть один
вид камней, свойства которых после этого совершенно из-
меняются. Если после обжигания полить такой камень
водой или его намочит дождь, то попавшая на него вода
нагреется, от нее пойдет Пар, а твердый прежде камень
рассыпется и в конце концов расплывется в .тесто. Камен-
ная порода, обладающая такими свойствами, чрезвычайно
широко распространена в природе. Это—известняк, более
чистые разновидности которого мы называем мрамором,
1 Как будет сказано ниже, едкой щелочью является собственно гашеная
известь. Негашеная дзвесть представляет собою окись кальция СаО.
(Прим, перев.)
186
известковым пшатем или мелом. Жженый йзвестняк, или
Короче—жженая известь, служит для приготовления це-
мента, о котором мы будем говорить позже.
С помощью приобретенных уже Нами знаний мы можем
легко объяснить явления, совершающиеся при обжиге из-
вестняка. Известняк по химическому составу является
углекальциевой солью. При обжиге из него выделяется
углекислый газ и остается негашеная известь.
Природный известняк представляет собой прекрасный
строительный материал, так как он хорошо противостоит
атмосферным влияниям; но в обожженном виде он, на-
против, как мы только что узнали, совершенно распа-
дается от действия воды,—«гасится» водой, как говорят.
При этом «гашении» вследствие энергичного химического
взаимодействия между негаше|ной известью и водой вы-
деляется настолько много тепла, что вода нагревается .и
образует большое количество пара. Вследствие того, что
при обливании холодного камня холодной водой полу-
чается такое большое количество тепла, сам процесс га-
шения кажется незнающему, химии человеку чем-то таин-
ственным.
Негашеная известь—это окись Металла кальция; она
легко связывается химически с водой, причем выделяется
большое количество тепла. При этом окись кальция .пере-
ходит в гидрат окиси кальция, или гашеную известь:
СаО +Н2О= Са(ОН)9
окись кальция -ф- вода = гидрат окиси кальция
Гашеная известь обладает очень едкими, т. е. разру-
шающими свойствами, почему ее называют еще «едкой
известью». Так как при взаимодействии с кислотами она
образует соли (например фосфорнокальциевую соль, упо-
требляющуюся в качестве удобрения), то, следовательно,
она относится к основаниям.
Несмотря на то, что гашеная известь с излишком воды
образует тесто, соединяясь еще при этом химически с не-
которой частью воды, в воде она все же очень мало раство-
рима. Химическое сродство к воде й растворимость . в
воде—это ведь две совершенно различные вещи.
С помощью гашеной извести мыловары еще в средние
века научились готовить легко растворимую в воде ще-
187
лочь для варки мыла. Эта щелочь издавна называется
едким кали. Она И теперь, как в прежние времена, гото-
вится еще действием едкой Извести на поташ. Употре-
бляемый для этого способ мы узнаем, выяснив предвари-
тельно, что1 та<гое поташ.
Мы уже знаем, что все наземные растения берут из
почвы соли калия, и поэтому соли эти содержатся во вся-
кой древесине. После сжигания древесины калийные соли
остаются в золе по большей части в виде легко раство-
римой углекалиевой соли. Если прокипятить, следова-
тельно, золу с большим количеством воды, то калийные
соли перейдут в раствор. Этот раствор сливают с осевших
нерастворимых частей золы и досуха выпаривают, полу-
чая таким образом сухой остаток—поташ.
Поташ имел прежде очень широкое применение. Он упо-
треблялся (да и теперь ещб употребляется) для варки
мыла; юн нужен еще, как мы увидим дозже, для стекло-
делия, а также для крашения и пр. ,
По мере уменьшения лесных площадей в Европе и свя-
занного с ним уменьшения количества получаемой дре-
весной Золы, сокращалось и производство поташа. Недо-
статок поташа серьезно почувствовался прежде всего во
Франции, почему, уже в 1775 г. французская академия
назначила премию в 2500 ливров (около 4,5 тыс. зол. руб.)
за лучший способ получения не искусственного поташа,
а соды из поваренной соли, потому что сода в большинстве
случаев вполне может Заменить поташ.
В этом отношении дело обстоит так. Потащ, как мы
только что узнали, химически представляет собой угле-
калиевую соль, сода же—это угленатриевая соль. В ка-
честве источников калия ко времени объявления премии
знали только поташ и дорогую калиевую селитру; следо-
вательно, тогда не было возможности наметить какие-ни-
будь дешевые соединения калия в качестве сырья для
приготовления искусственного поташа: стассфуртские за-
лежи калийных солей начали ведь эксплоатироваться
только с 1863 г.
Для получения соды в то время тоже, существовал лишь
один источник, а именно зола некоторых морских растений,
которую готовили главным образом в Северной Испании
под названием барильи. Морские растения вместо солей
калия содержат в большинстве случаев соли натрия, источ-
188
никбм которых служит хлористый натрий морской воды;
вот почему. после выварки волы таких растений с водой
раствор содержит не углекалиевую соль (поташ), а угле-
натриевую соль (соду). Барилья часто являлась очень
плохим продуктом,—содержание соды в ней не превы-
шало иногда 5°/о.
Итак, сода представляет собой соединение натрия. 'А для
получения соединений натрия на; земле есть неисчерпае-
мый источник, именно повареннал соль, или хлористый
натрий—химическое соединение натрия и хлора. Вот по-
чему. в 1775 г. и была объявлена; премия за лучший спо-
соб превращения поваренной соли в соду,; искусственный
поташ по приведенным выше причинам тогда приготовить
в больших количествах было нельзя.
Понятие о тогдашней стоимости соды могут дать сле-
дующие цифры: еще в 1814 г. 1 т кристаллической соды
стоила 550 зол. руб., 5 1824 г. ее стоимость упала до
275 руб., а в 1900 г. до ,28 руб. золотом. Прежние цены
позволяли, следовательно, надеяться на очень большие
выгоды, которые может принести приготовление искус-
ственной соды. 1
Задачу, приготовления искусственной соды разрешил Ле-
блан, после того как многие безуспешно работали над ней.
Способ Леблана был запатентован в 1791 г., вскоре по
вступлении в силу французского закона о патентах. Этот
способ был очень сложен. Для своего осуществления на
практике он требовал не только разнообразных химических
знаний, но и напряженных технических изысканий, кото-
рые позволили реализовать многие улучшения в заводском
масштабе и использовать постепенно открывавшиеся все
новые возможности для создания многочисленных побоч-
ных производств. Леблановский способ явился поэтому не
только началом, но и, так сказать, школой современной
большой химической промышленности. Его значение для
химической промышленности не будет забыто никогда.
Для Леблана, как и для всякого другого его современ-
ника, было невозможно непосредственно перевести в соду
поваренную соль. Ему удалось, однако, превратить в соду
сернонатриевую соль, получаемую без большого труда из
поваренной соли. Леблан нашел, что из сернонатриевой
соли легко получается сода, если эту соль сплавить с ме-
лом и углем. Мел представляет собой, как мы знаем,
189
углекальциевую ооль, которая является здесь источником
необходимой углекислоты. При выщелачивании сплавлен-
ной массы водой сода переходит в раствор'; после выпа-
ривания из последнего выкристаллизовывается тот про1-
дукт, который обращается в продаже под именем кристал-
лической соды. Натрий для ее получения дала поваренная
ооль, а углекислоту—мел.
Итак, для получения соды из поваренной соли по спо-
собу Леблана последнюю нужно перевести сначала в оер»-
нонатриевую соль. Эту соль называют еще, по имени от-
крывшего ее впервые Глаубера,—глауберовой солью Ч Но
для приготовления сульфата нужно иметь специальный
завод серной кислоты, производство' которой было также
одновременно освоено на содовых заводах, работавших по
способу Леблана.
При сгорании серы образуется, как Мы знаем, сернйстйй
газ. Соединяясь химически с водой, он дает сернистую
кислоту. Для превращения сернистой кислоты в серную
к ней нужно присоединить еще один атом кислорода:
H,SO3 + О = H2SO4.
сернистая кислота + кислород = серная кислота
Но сернистая кислота лишь с очень большим трудом
присоединяет кислород прямо да воздуха; однако этот
процесс легко! идет в присутствии! азотной кислоты. Лучше
всего, как учит опыт, пользоваться для получения сер-
ной кислоты большими свинцовыми камерами (рис. 35),
которые противостоит се разрушающему действию.
Азотная кислота окисляет в таких камерах сернистую
кислоту в серную и сама теряет, следовательно, при этом
кислород. Но так как одновременно в камеры Проводят
воздух и водяной пар, то получающиеся из азотной кис-
лоты вещества под их действием снова переходят в азот-
ную кислоту. Поэтому теоретически последняя не расхо-
дуется, так как она является лишь переносчиком кисло-
1 Сернонатриевую соль Na2SO4 в технике называют сульфатом, а глау’
берова соль представляет собой сернонатриевую соль, содержащую кри-
сталлизационную воду (Na2SOt. 10Н20). (Прим, перев)
190
рода для сернистой кислоты; в действительности же, ко-
нечно, имеют место неизбежные заводские потери, которые
составляли в 1800 г. 16% от взятой кислоты, а теперь
только 0,6%.
Образующаяся серная кислота собирается на дне камер
в виде жидкости Ч
Рис. 35. Свинцовая камера в разрезе
Как .видно из сказанного, этот способ получения серной
кислоты требует еще в качестве побочного производства
завода азотной кислоты. Последнюю получают действием
серной кислоты на селитру, причем в целях дешевизны
здесь применяют натриевую (чилийскую) селитру1 2.
В течение почти 100 лет работали над возможно более
полным усовершенствованием способа получения серной
1 В целях популярности процесс производства серной кислоты по камер-
ному способу описан здесь очень упрощенно, — в действительности про-
исходящие здесь химические процессы гораздо сложнее и полностью они
до сих пор еще не разъяснены. (Прим, персе.)
2 Теперь, как было уже сказано в третьей лекции, большие количества
азотной кислоты готовятся путем окисления синтетического аммиака.
(Прим, персе.)
191
кислоты с помощью азотной кислоты, но с ,1880 г. у, этого
способа появился серьезный соперник. Был разработан но-
вый способ получения серной кислоты, который заклю-
чается в следующем.
Очень тонко раздробленная платина обладает свойством
значительно ускорять некоторые химические реакции, ко-
торые без нее идут очень медленно. Такие вещества, ко-
торые действуют как бы только" своим присутствием ,и
сами остаются по окончании реакции неизменными, назы-
ваются катализаторами. Так, например, в присутствии
тонко раздробленной платины из сернистого газа и кисло-
рода воздуха легко образуется серный ангидрид (путем
присоединения еще одного атома кислорода к молекуле
сернистого газа); энергично соединяясь с водой, серный
ангидрид образует серную кислоту.
Этот способ кажется простым и Давно уже известен
в лаборатории. Но осуществление его в заводских усло-
виях оказалось очень трудным и удалось в .конце концов
только благодаря-упорной работе двух химиков Баденской
фабрики анилина и соды—Кныча и Брунка.
Серная кислота готовилась сначала на содовых заво-
дах из серы. В Пределах Европы большие залежи серы
есть, однако, только в Сицилии, и лишь с 1906 г. д каче-
стве серьезного конкурента сицилианской серы начала вы-
ступать на рынке североамериканская сера, добывающаяся
в Луизиане и Техасе. В 1838 г. король Неаполя и Сицилии
объявил монополию на сицилианскую серу и закрепил эту
монополию за одной марсельской фирмой. Последняя сей-
час же повысила цену за тонну серы с 46 зол. руб. до
109 руб. Владельцы английских заводов серной кислоты
обратились по этому поводу с представлениями к своему
правительству, и из-за серы грозила возникнуть война,
почему монополия была отменена.
Но нужда тем временем заставила заинтересованных быть
изобретательными. Если в Европе мало залежей свободной
серы, то зато здесь во многих местах есть огромные за-
пасы сернистых соединений, особенно двусернистого же-
леза, который минералоги называют серным колчеданом,
или пиритом. Пирит подобно сере можно сжигать в печах.
При этом входящая в 'его состав сера (содержание ее
в пирите около 48%) сгорает в сернистый газ, который
и перерабатывается в серную 'кислоту; железо, соединяясь
192
при горении пирита с кислородом воздуха, переходит в
окись железа, используемую для получения металличе-
ского железа.
Встречаются также медистые пириты, которых много,
например, в Испании. Такие пириты особенно выгодно
перерабатывать на сернокислотных заводах, так как по-
путно из них извлекается медь, что удешевляет расходы
производства, приходящиеся на серу.
Все описанные производства выросли первоначально
опять-таки в качестве побочных производств прежней со-
довой промышленности.
Серная кислота изготовляется в промышленности в
огромных количествах. Она служит для получения многих
других кислот, которые можно приготовить только с ее
помощью, в то время как для Получения самой серной
кислоты не требуется никаких кислот, а лишь сера и
кислород воздуха. Потребление серной кислоты громадно,—
нужно лишь представить себе, какие большие количества
ее расходуются ежегодно только на обработку фосфоритов
с целью получения из них ценных для сельского хозяй-
ства удобрений и на выработку служащей для этой же
цели серноаммониевой соли.
Мировая выработка серной кислоты составляет около
8 млн. т, из которых 2х/з млн. т приходится на долю
США, по 1,5 млн. т—на Францию и Германию, li/з
млн. т—на Англию и т. д. Следовательно, в одной только
Германии, например, за каждый час вырабатывается около
150 тыс. кг серной кислоты! И если широкая публика
имеет обычно слабое представление о масштабах производ-
ства серной кислоты, то объясняется это тем, что большая
часть кислоты потребляется тут же в местах ее производ-
ства. Серная кислота является необходимым вспомогатель-
ным продуктом в целом ряде разнообразнейших отраслей
промышленности для получения других важных продуктов.
При действии серной кислоты на поваренную соль обра-
зуется необходимая для производства соды по старому
способу сернонатриевая соль и одновременно получается
еще хлористый водород:
2NaCl + H2S0. = NaaSO, + 2НС1
хлористый натрий Ц- серная кислота = сернонатриевая -4- хлористый
(поваренная соль) соль водород
13 Химия повседневной жизни.
193
Хлористый водород—газ, как аммиак или сернистый газ.
Как и оба эти газа, он тоже „легко растворим: bi .воде.
Водный раствор хлористого водорода представляет собой
соляную кислоту. Крепкая продажная соляная кислота
содержит обычно около 33% хлористого водорода.
Соляная кислота, как известно, слабо дымит на,воздухе.
Это ее свойство объясняется тем, что из нее улетучивается
хлористый водород, который с влагой, воздуха образует
туман.
Хлористый водород в прежние времена был для разви-
вающейся содовой промышленности крайне досадным по-
бочным продуктом. Промышленного применения он не
имел, и поэтому его выпускали вместе с топочными га-
зами в тр/бу, и он уничтожал' в окрестностях заводов всю
растительность, что давало повод к .многочисленным жа-
лобам жителей. Постройка соответствующего завода в одном
из предместий Брюсселя (столица Бельгии) привела даже
к тому, что инструменты всех живших вблизи завода ре-
месленников стали очень быстро тупиться. Для удаления
газа один завод выстроил громадную трубу в 150 м высотой,
но и это не помогло: газ не рассеивался в воздухе, осо-
бенно в сырую погоду, а тяжелым облаком спускался на
землю. Чтобы избежать постоянных жалоб, некоторые за-
воды были перенесены даже на маленькие острова в Ан-
глийском канале. И все это происходило в то время,
когда легкая растворимость хлористого водорода в воде
была уже очень хорошо известна химикам. Но ведь и lee
нельзя было использовать для избавления от досадного
газа: если выпускать его водный раствор в реки, то он
убил бы там всех рыб.
Таким образом хлористый водород оставался настоящим
бедствием для заводчиков, пока с течением времени об-
стоятельства коренным образом не изменились. Соляная
кислота нашла постепенно основное применение для изго-
товления хлорной извести, употреблявшейся в больших
количествах для беления.
Чтобы переработать хлористый водород в хлорную из-
весть, его сначала пропускают в воду, которой он погло-
щается. Тем самым уничтожается и вредное влияние его
на .окрестности завода. Водный раствор нагревается затем
с перекисью (вернее двуокисью) марганца, молекула ко-
торой состоит из одного атома марганца и двух атомов
194
кислорода. Когда это богатое кислородом соединение дей-
ствует на хлористый водород, то водород последнего соеди-
няется с частью кислорода двуокиси 'Марганца, образуя
воду, и выделяется свободный газообразный хлор. Если
последний пропускать затем над гашеной известью, то по-
лучается хлорная известь:
MnOg + 4НС1 = MnClg +2ЩО + С1.
двуокись марганца -|- хлор хтый водород = хлористый марганец 4- вода + хлор.
Для постройки содового завода по своему способу Ле-
блан нуждался в большой сумме денег. Эти деньги дал
ему герцог Орлеанский (его во время революции называли
Эгалитэ) после тоге, как профессор химий д’Арсэ признал
способ вполне пригодным для применения (Леблан был
в то время домашним врачом герцога Орлеанского). Но
в 1793 г. герцог Орлеанский окончил свою жизнь на эша-
фоте, и вместе с другим ’его имуществом был конфискован
и содовый завод. Вскоре вследствие все продолжавшихся
войн республики, которые мешали развитию морской тор-
говли, во Франции почувствовали острый недостаток по-
таша. Ввиду этого Комитет общественного' спасения решил
сделать все способы искусственного получения соды обще-
ственным достоянием. Но таким образом терял силу и
патент Леблана. Только' в 1799 г. ему был возвращен его
завод, но недостаток средств помешал Леблану вести пред-
приятие с успехом, и в заключение в 1806 г. отчаявшийся
изобретатель покончил жизнь самоубийством.
Способ Леблана хотя и не был забыт, однако не имел
особенного успеха до тех пор, пока его- в совершенстве
Не разработали на английских заводах. Но так как в
Англии до 1824 г. взыскивался налог с поваренной соли,
даже применявшейся в промышленности (в размере 46 зол.
руб. со 100 кг), то и там содовая промышленность полу-
чила широкий размах только после отмены этого налога.
Первое время заводскую продукцию раздавали в Лон-
доне даром, для того чтобы Приучить мыловаренные пред-
приятия к соде и отучить их от барильи. Положение
это очень быстро изменилось. С чистой содой работать
было гораздо удобнее и вернее, чем с ненадежной в отно-
шении содержания соды барильей. Скоро предприниматели
были довольны, даже получая необработанный содовый
13*
195
плав—таким, как ой выходит из печи. Неизбалованные
барильей, они сами выщелачивали соду из плава. Сода,
таким образом, завоевала себе прочный сбыт на рынке.
В Германии заводское изготовление соды началось
в 1843 г. в ТПенебеке Па Эльбе.
Итак, для получения соды сплавляли сульфат с мелом
и углем. Выщелачивание сплава водой переводит соду
в водный раствор. Если этот раствор выпарить до такого
состояния, что оставшейся воды уже не будет хватать
для растворения всей заключенной в Нем соды, то по-
следняя выкристаллизовывается. Выделяющийся продукт
не будет, однако, состоять из одной лишь угленатриевой
соли,—он содержит еще почти 63% воды, которая свя-
зана в нем в виде ’кристаллизационной воды. Такая спо-
собность связывать кристаллизационную воду свойственна
очень многим солям.
Если кристаллическую соду долго держать открытой на
воздухе, то» она изменяется, а именно—теряет часть своей
кристаллизационной воды. Кристаллы вследствие этого' На-
чинают распадаться в порошок.
Большое содержание кристаллизационной воды удоро-
жает транспорт соды, если опа должна пересылаться с за-
вода. Поэтому на заводах готовят также безводную соду
путем нагревания кристаллов до полного улетучивания
всей воды. В результате остается белый порошок, который
называется кальцинированной содой (сам процесс ее полу-
чения называется кальцинированием).
Мы познакомились теперь в общих чертах с производ-
ством соды по Леблану и с некоторыми (далеко не всеми)
вызванными им к жизни другими производствами. Лебла-
новский способ, который так много дал промышленности,
в течение примерно 60 лет (если считать началом его
широкого применения 1824 г.) казался стоящим на вполне
прочной основе. Однако с начала 80-х годов прошлого
века его положение поколебалось, и теперь этот способ
почти совсем уже не 'Применяется.
Дело в том, что уже давно узнали гораздо- более про-
стой способ получения соды из поваренной соли, чем ле-
блановский. Этот способ, легко осуществимый в, лабора-
тории, заключается в следующем.
Аммиак, соединяясь химически с углекислым газом и во-
дой, образует углеаммониевую соль. Связываясь с двойным
196
количеством углекислоты, он дает кислую углеаЛшониевую
соль. Если раствор последней добавить к раствору пова-
ренной соли (хлористого натрия), то вследствие их взаимо-
действия выпадает относительно трудно' растворимый в
воде осадок кислой угленатриевой соли, а в растворе
остается хлористый аммоний:
NHJICO3 + NaCl = NaHCO3 +
кислая угле аммониевая соль -f- хлористый натрий = кислая угленатриевая соль Ц-
+ NHjCl
хлористый аммоний.
Следовательно, здесь поваренная соль в холодном вод-
ном растворе сразу] переводится в кислую угленатриевую
соль—без гигантской аппаратуры леблановского способа
(производство серной кислоты, использование хлористого
водорода, печи для получения плава и т. д.).
Итак, в теории этот второй способ очень прост. Впер-
вые на него был заявлен патент уже в 1838 г. В 1855—
1857 гг. на одном французском заводе даже производилась
по этому способу сода, но при этом выявились такие боль-
шие трудности, что завод в конце концов должен был
прекратить производство, как менее выгодное ПО’ сравнению
с леблановским. Трудности эти заключались в том, что
выделяющаяся в твердом виде кислая угленатриевая соль
закупоривала трубы, по- которым в раствор поваренной
соли накачивались аммиак и углекислый газ. Однако- все
затруднения были в конце концов удачно- преодолены
Оольвеем1, по способу которого в настоящее время про-
изводится вся сода, необходимая для покрытия гигантски
возросшей мировой потребности в этом продукте.
Производственный процесс при сюльвеевском способе про-
текает примерно так. В раствор поваренной соли, находя-
щийся в закрытом аппарате, накачивается достаточное
количество газообразного аммиака,«а затем впускается
углекислый газ. В жидкости образуется кислая угле-
аммониевая соль, которая сейчас же взаимодействует с хло-
ристым натрием, вследствие чего- выпадает в -осадок кис-
лая угленатриевая соль.
1 Бельгийский инженер, бывший директором газового завода в Бельгии.
(Прим, перец.)
197
Для производства необходимы, следовательно, соляной
рассол, аммиак и углекислый газ. Соль дают соляные
копи, а также природные рассолы, которые удобны тем,
что содержат соль уже в растворенном виде. Аммиак до-
ставляют заводы сухой перегонки каменного угля; при-
меняется также и синтетический аммиак. Кроме того,
потребляется очень много углекислого газа:, который по-
лучают из известковых обжигательных печей, накачивая
выходящие из них газы в раствор. При обжигании из-
вестняка в так называемых шахтных печах он распадается
Рис. 36. Вращающаяся печь для прокаливания кислой углеяатриевой соли.
Через трубу А подается кислая ^глснатриевая соль, через трубу В к ней
подмешивается готовая сода, чтобы при ^прока 1иваиии она не сделалась бы
слишком плотной: Г—мешалка. И — це1ь, разбивающая куски соды, Д—
’ ~ыход готовой соды.
на негашеную известь и углекислый газ. Так как сжи-
гаемое при этом топливо тоже дает углекислый газ, по-
лучающийся благодаря сгоранию углерода топлива, то
выходящие из шахтной печи газы содержат особенно' много
углекислого газа.
Полученный описанным путем при сольвеевском процессе
продукт—кислая угленатриевая соль—должен быть еще
пере веден в соду, т. е. в угленатриевую соль. Это не пред-
ставляет1 никаких затруднений: кислую угленатриевую соль
нужно только слабо прокалить (рис. 36), и она, выделив
определенное количество1 углекисйоты, превратится в соду
(угленатриевую соль).
198
В растворе, из которого- выпала кислая угленатриевая
соль, остается при сольвеевско-м процесс© хлористый аммо-
ний. Из него- необходимо* выделить дорогой аммиак, кото-
рый снова должен быть использован в производстве,—иначе
сольвеев-ский процесс был бы невыгодным. Аммиак выте-
сняется из солей аммония всяким сильным основанием.
Поэтому, если кипятить раствор хлористого аммония с
известью (которую дают шахтные печи одновременно- с угле-
кислым газом), то известь будет вытеснять аммиак. Вы-
деляющийся газ сейчас же накачивают, конечно, снова
в соляной рассол и, таким образом, он циркулирует ц про-
цессе непрерывно:
1) 2NH4C1 +Са(ОН)2= СаС12 + 2NII4OH
хлористый аммоний 4- известь = хлористый кальции 4" гидрат окиси
аммония.
2) NH4OH = 2NH3 + 2Н.2О
гидрат окиси = аммиак 4- вода
аммония
В заключение как последний побочный продукт остается
еще прокипяченный с известью раствор, который содер-
жит теперь хлористый кальций. Для этого раствора или
для получаемого из него выпариванием хлористого каль-
ция—пока не найдено1 достаточного применения. * В по-
следнее время его начинают использовать в качестве из-
весткового удобрения и для некоторых других целей. *
Итак, мы видим, что при сольвеевском способе не [исполь-
зуется содержащийся в поваренной соли хлор, который
удаляется прочь в составе хлористого кальция. В’лебла-
новском способе хлор входил в состав хлористого водо-
рода, который представлял значительную ценность или
сам по себе, или переработанный на хлорную известь.
В настоящее время от леблановского способа сохрани-
лась только начальная стадия—получение соляной кислоты
путем нагревания поваренной соли с серной кислотой.
Но соответствующие заводы не перерабатывают уже остаю-
щейся при этом сернонатриевой соли (называемой в тех-
нике сульфатом) на соду. Сульфат они поставляют сте-
кольным заводам, где эта соль применяется для выработки
199
стекла. Заводам соляной кислоты невыгодно также пере-
рабатывать кислоту на хлор; соляная кислота приме-
няется как таковая в ряде других отраслей промышлен-
ности.
Причиной невыгодности получения хлора из соляной
кислоты послужило следующее. С помощью электрического
тока многие вещества можно разложить на те элементы,
из которых они состоят. И вот этим-то путем, т. е. с по-
мощью электричества, теперь получают хлор независимо
от производства соды—прямым разложением растворов хло-
ристого натрия или хлористого калия (последнего много
добывается например из стассфуртсйих залежей). Одно-
временно используются при этом также натрий или калий,
которые выделяются в виде ценных соединений—едкого
натра или едкого кали. О применении этих щелочей в про-
изводстве бумаги мы уже узнали, а с гораздо более широ-
ким использованием их в мыловаренном производстве нам
скоро придется познакомиться.
Но с 1914 г. содовые заводы, работающие по способу
Сольвея, тоже начинают становиться поставщиками хлора;
при этом они также используют электричество. Такие за-
воды дают теперь, следовательно, все то, что делало в свое
время столь ценным способ Леблана.
Современные содовые заводы разлагают с помощью элек-
трического тока растворы поваренной соли, получая хлор
и едкий натр. С раствором едкого натра (вместо извести)
кипятят теперь упомянутый выше раствор хлористого
аммония с целью выделения аммиака для продолжения
процесса. Но вместо прежнего не имеющего применения
раствора хлористого кальция, который спускали в реку,
здесь образуется раствор хлористого натрия. Его снова
разлагают электрическим током, получая хлор и едкий
натр,—последний опять идет на выделение аммиака и т. д.
Добытый путем электролиза хлор здесь также либо сжи-
жается и поступает в продажу в баллонах, либо перера-
батывается на хлорную известь.
Вот каким путем замена необходимого для разных от-
раслей поташа содой дала толчок к развитию ранее не
существовавшей большой химической промышленности.
Причиной того, что очень скоро химическая промышлен-
ность начала производить в большом количестве и целый
ряд других продуктов, послужил огромный рост англий-
200
ской хлопчатобумажной промышленности, начавшийся
в 1780 г. Последняя предъявила невиданный прежде спрос
на красители, отбеливающие средства и на многие другие
химические продукты.
Хотя потребление соды сейчас чрезвычайно велико и
она вытеснила поташ из многих отраслей промышленности,
тем не менее существует еще и достаточно большая по-
требность в поташе. Он добывается и теперь главным
образом из древесной золы, причем значительным постав-
щиком поташа сделался в новейшее время Северный Кав-
каз1. С середины прошлого столетия появились, кроме
того, два новых очень интересных источника поташа—
меласса и овечий пот.
Меласса представляет собой отброс свеклосахарного про-
изводства, черную патоку, которая содержит некристалли-
зующийся больше сахар. Она идет главным образом на
корм скоту. Теперь из мелассы умеют выделять сахар,
но тем не менее большие ее количества перерабатываются
на спирт, получаемый сбраживанием содержащегося в ней
сахара. После отгонки этого спирта остается так называе-
мая барда. Последняя не имеет уже никакого питательного
значения, так как в ней остались только соли, перешедшие
в свое время в раствор вместе с сахаром при выщелачива-
нии свеклы водой для целей сахароварения. Эта смесь со-
лей очень богата калием: ведь соли попали в свеклу из
почвы. Если выпарить барду досуха и затем обуглить ее, то
получится остаток, называемый бардяным углем. Из него,
как и вообще из остатков сожженных растений, можно по-
лучить поташ выщелачиванием водой.
Еще более интересным источником поташа является
овечий пот. Предприятия, которые заняты мытьем гряз-
ной овечьей шерсти (огромное количество овечьей шерсти
отправляют например в Европу из Австралии, Африки,
Южной Америки), получают много промывных вод, со-
держащих так называемый жиропот. В виду того, что
жиропот, как показали исследования, содержит большое
количество солей калия, промывные воды перерабатывают
1 На Северном Кавказе поташ готовится не из древесной золы, а из
золы подсолнечника. (Прим, перев.)
20J
на. поташ. Для этого их выпаривают и остаток прокали-
вают. Получившийся уголь богат поташом и идет для
добывания последнего заводским путем.
☆ Производство серной, соляной и других минеральных
кислот, соды, едкого натра и едкого кали, минеральных
удобрений и некоторых солей относится к области так
называемой основной химической промышленности. Про-
дукты этой отрасли являются основными, наиболее важ-
ными продуктами химпромышленности, необходимыми как
для выработки разнообразнейших других химических про-
дуктов, так и для целого ряда других отраслей про-
мышленности, для сельского хозяйства, для обороны
страны. Вот почему СССР, быстрыми темпами развивающий
собственную химическую промышленность, особенное вни-
мание обращает при этом на рост производств основной
химии. В течение первой пятилетки из общей суммы капи-
таловложений в тяжелую химию (куда кроме основной хи-
мии относятся еще производства органических красителей,
продуктов перегонки каменного угля, лесохимических про-
дуктов и др.), составивших 1344,5 млн. руб., 819 млн. руб.
приходится на долю тяжелой химии.
Серная кислота является одним из важнейших продук-
тов основной химической промышленности. В царской Рос-
сии производство серной кислоты было развито1 слабо и
в 1913 г. составляло, например, всего около 110 тыс. т.
При этом сернокислотные заводы были по большей части
карликовые: лишь один из них имел годовую мощность
в 10 тыс. т, а были и заводы 'мощностью «всего в 1 тыс. ж.
После Октября советская сернокислотная промышленность
была заново перестроена. СССР построил такие заводы-
гиганты, как Невский, Воскресенский, Сталиногорскйй, Бе-
резниковский, Актюбинский, Капитанский и др., годовая
мощность которых выражается цифрами 40, 50, 80 тыс. т.
К началу первой пятилетки общая установочная мощность
советских сернокислотных заводов равнялась 350 тыс. т,
к началу второй она уже составляла 839 тыс. т, а к
1935 г.—968 тыс т.
Выработка серной кислоты в Союзе неуклонно возра-
стала, как это показывает рис. 37. Занимая в начале
первой пятилетки одно из последних мест в производстве
серной кислоты, к началу второй пятилетки СССР вышел
уже на пятое место, обогнав Италию, Испанию, Бельгию
202
и уступая лишь США, Германии, Англ;ии и Японии.
И в то время как сернокислотные заводы старой России
использовали главным образом иностранное сырье, совет-
ские заводы работают исключительно на отечественном:
сырье.
Кроме серного колчедана (или пирита) сырьем для про-
изводства серной кислоты в СССР служат также отходя-
щие газы заводов цветной металлургии, так называемые
«флотационные хвосты» и углистые колчеданы.
Рис. 37. Рост выработки серной кислоты в СССР (в тыс. т)
При выплавке меди и других цветных металлов из сер-
нистых руд—сера этих руд сгорает в сернистый газ, .ко-
торый раньше просто выпускался в воздух и отравлял
окрестности заводов, убивая вокруг них растительность.
Теперь этот газ используется в СССР для производства
серной кислоты (например на Алагирском, Калатинскс-м,
Константиновском заводах).
Медные сернистые руды теперь перед плавкой часто
подвергаются обогащению способом так называемой фло-
тации. Способ этот заключается в том, что тонко- раз-
молотый медистый колчедан (медная руда) обрабатывается
в специальных аппаратах при помощи некоторых хими-
ческих реагентов. При такой обработке получается Медный
концентрат с гораздо более высоким содержанием меди,
а серный колчедан образует побочный продукт, называемый
203
«флотационными хвостами». Этот отход теперь все в боль-
шем и большем масштабе служит в СССР сырьем для
производства серной кислоты (во второй пятилетке «хвосты»
должны дать не менее 5О°/о всего сырья).
Во многих угольных месторождениях, в частности в
Подмосковном, Уральских, в некоторых районах Донбасса,
содержится серный колчедан. Когда его отделяют от углей,
то в него попадает, конечно, много угля, почему такой
колчедан называется углистым. Его используют теперь
в качестве сырья для сернокислотной промышленности
путем сжигания в смеси с обыкновенным колчеданом.
Скажем теперь несколько слов о советской содовой про-
мышленности.
Производительность содовых заводов СССР к концу Цер-
вой пятилетки составляла немного больше 500 тыс. т,
к концу второй пятилетки она превысит 2 млн. т. Все
содовые заводы работают по способу Сольве, но в СССР
есть данные и для возрождения старого леблановского
способа.
Как было сказано! выше, при леблановском способе сна-
чала действием серной кислоты на поваренную соль по-
лучают сернонатриевую соль. Но СССР обладает огром-
ными запасами природной сернонатриевой соли, которая
миллиардами тонн выпадает ежегодно зимой в Карабу-
гаэском заливе Каспийского моря в виде «мирабилита»,
или глауберовой соли (т. е. сернонатриевой соли, содер-
жащей кристаллизационную воду). Таким образом первая
стадия леблановского процесса здесь отпадает,—сернона-
триевая соль имеется в готовом виде, что значительно
удешевит процесс и сделает его экономически выгодным.
Теперь в советских научно!-исследовательских учреждениях
разработаны и некоторые видоизменения леблановского
процесса, делающие осуществление его на базе карабугаз-
ского сульфата еще более выгодным, чем в старой его
форме.
Мощным источником для выработки поташа и едкого
кали (кроме использовавшихся раньше) явятся в СССР,
Соликамские калийные залежи. ☆
Познакомимся теперь с тем, как готовится мыло.
Для приготовления мыла непосредственно не пригодны
204
пи поташ (углекалиевая ооль), пи сода (углеиатри'овая
соль). Мыла получаются из жиров, а на жиры обе эти
соли химически не действуют. Для применения в мылова-
рении соду или поташ нужно перевести сначала в соот-
ветствующие едкие щелочи, т. е. едкий натр или едкое
кали, которые (если они не получаются прямо электро-
литическим путем) готовятся следующим образом.
Несколько раз1 мы уже говорили о том, что- встречаю-
щийся во многих местах известняк (углекальциевая соль)
при обжиге распадается на углекислый газ1 И негашеную
известь (окись кальция). Казалось бы, что таким же
путем можно было бы разложить углекалиевую соль на
углекислый газ и окись калия, или угленатриевую соль—
на углекислый газ и окись натрия. На деле ,это, однако,
неосуществимо' по той простой причине, что поташ и сода
очень огнестойки и не распадаются на свои составные
части цри температуре обжиговой печй.
Однако' в противоположность известняку, которой Нера-
створим в воде, поташ и сода хорошо растворяются в ней.
Если добавить к таким растворам гашеную известь, то
последняя соединяется с углекислотой, превращаясь в
углекальциевую соль, т. е. в то же самое соединение, ,|из
которого раньше получалась в обжиговой печи негашеная
известь. Так как углекальциевая соль нерастворима в воде,
то она выпадает в осадок, и оставшуюся жидкость можно!
слить с нее. В этой жидкости уже не будет углекислоты,
так как она вся связалась химически с кальцием.
Таким образом жидкость, полученная после обработки
раствора поташа или соды гашеной известью, будет пред-
ставлять собой уже раствор' едкого кали или едкого Натра.
Следующие уравнения коротко передают происходящие
при этом реакции: >
1) К9СО3 + Са(0Н)2 = 2К0Н + СаСО3
углекалиевая соль 4- гашеная известь — едкое кали 4- углекальциевая соль,
2) Na2C03 + Са(ОН)2 =2NaOH+ СаС08
угленатриевая соль 4“ гашеная известь = едкий натр 4- углекальциевая соль.
Этим путем получали едкие щелочи мыловары. При
кипячении о едким кали или едким натром жиров (которые,
как мы знаем, являются соединениями, образовавшимися
205
из жирных кислот и глицерина) происходят следующие
химические реакции:
жир+елкое кали = ралийные соли жирных кислот-рг 1инерин (жидкое мыло),
жир-редкпй натр=натрпевые соли жирных кислот-рглицерин (твердое мыло),
Впервые мыло начали готовить кельты, но сначала оно
служило лишь косметическим средством, и только гер-
манцы, как говорит Гален, стали употреблять его для
стирки и мытья1. Около 800 г. мыловарение сделалось
ремесленным производством и постепенно начало распро-
страняться по всему свету.
Но так как о химических процессах, происходящих при
мыловарении, не имели никакого представления, то оно
долгое время оставалось чисто кустарным производством,
пока Шеврелю1 2 не удалось исследовать природу жиров,
т. е. узнать, что они представляют собой соединения, обра-
зованные из жирных кислот и глицерина. Этим была вне-
сена ясность и в производство мыла. А после того как
появилась возможность замены дорогого поташа дешевой
содой, начала развиваться крупная мыловаренная про-
мышленность, сделавшая теперь мыло таким дешевым и
доступным продуктом.
Очищающее действие мыла основано на том, что его
водные растворы обладают очень большой способностью
к смачиванию; они легко обволакивают частицы грязи,
приставшие к ткани, почему последние и можно удалить
при стирке. Благодаря способности мыльных растворов
легко давать эмульсии с жирами, с тканей без труда
смываются при стирке и загрязнения жиром.
Многочисленные попытки выдающихся специалистов по
мыловаренной промышленности возместить различными
суррогатами недостаток жиров для мыловарения в Герма-
нии во время мировой войны потерпели неудачу; это по-
казывает, что жиры являются наилучшим материалом для
приготовления мыла. Только мыла из жиров обладают
всеми теми свойствами, которые делают их прекрасным
1 Кэльты— индоевропейское племя, насе явпгэе в древности нынешние
Францию и Англию. Гален — зна,менитый римский врач, живший во II в.
нашего летоисчисления. (Прим, перев.)
2 Шеврель — крупный французский химик, род. в 1788 г., ум. в 1889 г.
(Прим, перев.)'*
2С6
средством для стирки и мытья: слабой щелочностью, не
раздражающей кожу и не разрушающей волокон тканей,
растворимостью, неядовитостью и способностью хорошо пе-
ниться.
В старинные времена для мыловарения применяли только
сало и оливковое масло, но с ростом торговых сношений
появлялись в качестве сырья все новые и новые жиры и
масла, которые ввозились в Европу из других частей
света. Кроме того, теперь жиры получают в качестве По-
бочного продукта и некоторые отрасли промышленности.
Таким побочным продуктом является например костя-
ной жир.
Мы уже подробно говорили об использовании костей.
Для рассмотренных нами в третьей лекции применений
жир не нужен, и потому его перед переработкой костей
извлекают. В прежние времена кости для этого хорошо
вываривали о водой, причем жир всплывал на поверхность.
Но этот способ довольно несовершенен, почему теперь
жир извлекают из предварительно' измельченных костей
в соответствующих аппаратах бензином (бензин хорошо
растворяет жиры). Таким путем удается извлечь из ко-
стей весь их жир, содержание которого составляет там
почти 10%.
Разница между мылами из жиров, обработанных едким
кали, ц жиров, обработанных едким натром, заключается
в том, что в первом случае получаются мазеобразные, так
называемые жидкие мыла, а во втором—твердые мыла.
Для приготовления жидкого мыла применяют самые де-
шевые масла—ворвань, конопляное масло, льняное масло
(а с 1910 г. также соевое масло), которые варят в железном
котле с раствором едкого кали. Щелочь постепенно дей-
ствует на жир, содержимое котла принимает консистен-
цию клея, и жидкое мыло готово. Оно состоит из калиевых
солей жирных кислот (т. е. собственно мыла) и смешанных
с ними глицерина (получившегося из жира) и воды. Такое
мыло никогда не застывает на воздухе, оно постоянно!
остается мягким. Его> можно также «наполнить», т. е.
добавить к нему различные примеси, что, не изменит' его
внешнего вида. Так, к мылу можно прибавить большое
количество растворимого стекла (кремненатриевая соль),
можно также применить для этого растворы сернокалиевой
соли. Эти примеси ничуть не повышают моющего дей-
207
ствия мыла, но они увеличивают его массу и вес; а так
как примеси еще дешевле самого жидкого мыла, то такие
«наполненные мыла» могут продаваться по очень дешевой
цене.
Как мы теперь знаем, до изобретения способа пригото-
вления искусственной соды—для варки мыла пользова-
лись раствором едкого кали, полученным из поташа. Та-
ким образом в прежние времена могли непосредственно
готовить только жидкие мыла. Но очень давно уже было
выяснено, что добавление поваренной соли к приготовлен-
ному этим путем мыльному клею производит в нем боль-
шие изменения. Вследствие «высаливания» из него выде-
ляется жидкость, которой дают стечь. Мыльный клей,
содержащий теперь гораздо меньше воды, превращается
в белую массу, которая при охлаждении застывает.
Сколько мыловаров прежних веков ломало себе голову
над причиной этого отверждающего действия соли! Мы
теперь знаем эту причину. Дело заключается в том, что
здесь поваренная соль (хлористый натрий) взаимодействует
с жидким мылом (калиевыми солями жирных кислот),
в результате чего получаются хлористый калий и натрие-
вые соли жирных кислот:
калиевые натриевые
соли жирных . хлористый соли жирных . хлористый
кислот (жид- натрий кислот (твер- *" калий
кое мыло) дое мыло)
Натриевые соли жирных кислот не могут связать всей
воды, оставшейся от раствора едкого кали, с помощью
которого омыливался жир. Эта вода поэтому выделяется,
а одновременно выделяются также растворенные в ней гли-
церин, получившийся от омыления жира, и хлористый
калий. Они удаляются затем вместе с водой.
Если однократное высаливание оказывается недостаточ-
ным, то процедуру повторяют еще раз. Обработанный
таким образом поваренной солью мыльный клей дает после
застывания настоящие туалетные мыла. Так как высали-
вание все же никогда не удается провести полностью,
то туалетные мыла содержат немного калиевых солей,
т. е. жидкого мыла, которое сообщает им приятную мяг-
кость. 100 частей сала, обработанные этим сложным спосо-
бом, дают около 160 частей так называемого ядрового мыла.
208
Теперь натриевые мыла готовят непосредственно варкой
жиров с растворами едкого натра, которые стали легко
доступными с изобретением способов приготовления искус-
ственной соды. Этим путем прямо получают твердые мыла.
Их также можно «наполнить»—и именно водой. Если про-
должать еще некоторое время кипятить полученный после
омыления мыльный клей с водой, то он также потом за-
стывает в твердую массу, причем никакой жидкости не
выделяется. Полученный при этом продукт называется
шлифованным мылом,—он содержит около 50% воды. Но
еще более «наполненные» мыла готовятся с помощью ко-
косового масла.
В тех тропических областях, где растет много кокосовых
пальм, белые ядра кокосовых орехов высушивают и под
именем копры отправляют их в Европу. Здесь прессованием
добывают из копры масло, которое составляет до 68% от
ее веса. Это масло' плавится только при 21°, так что при
обычных температурах оно довольно твердо.
Как мы уже говорили выше, кокосовое масло может
быть с успехом использовано для приготовления марга-
рина. Пропусканием сжатого пара в растопленное масло
из последнего удаляют легко летучие вещества. После
этого его размешивают еще с небольшим количеством ра-
створа соды, отчего в раствор переходят свободные жир-
ные кислоты в форме натриевых солей. По отделении ра-
стопленного масла от раствора оно снова застывает. Теперь
масло потеряло прогорклый вкус и представляет собой
превосходный материал для приготовления маргарина.
Пальмовое масло добывается из плодов и семян масля-
ной пальмы, часто встречающейся на западном побережьи
Африки и в Средней Америке. Мясистая часть плода этой
пальмы, а также семена содержат много масла. Для до-
бывания масла из мякоти плодов ее вываривают с водой
на месте, а очень твердые семена пересылаются в Европу,
где из них получают прессованием так называемое пальмо-
ядерное масло. Семена дают около 40%' масла от своего
веса, остаток же после прессования представляет собой
прекрасный корм для молочного скота.
Кокосовое масло чрезвычайно легко омыляегся, й это
свойство присуще также его смесям с другими жирами.
Для полного омыления такую смесь нужно нагреть при
помешивании о крепким раствором едкого натра (к кото-
14 Химия в повседневной жизни.
209
Ёому добавлено немного соды) всего лишь примерно до 40°.
jo охлаждении получается твердое мыло: мыльный клей
из кокосового масла обладает способностью впитывать в
себя всю жидкость и застывать вместе с ней. В виду этого
из 100 частей жировой смеси получается от 300 до 600 ча-
стей мыла, т. е. в 2—4 раза больше, (чем из сала.
В мыловаренном производстве в настоящее время при-
меняются также «отвержденные» жиры. Что они собой
представляют?
Как мы знаем, встречающиеся в жирах кислоты явля-
ются в свободном состоянии при обычных температурах
частью жидкостями, частью твердыми телами. Соединения
жидких жирных кислот (например олеиновой) с глице-
рином тоже обычно представляют собой жидкости (напри-
мер оливковое масло). Но жидкие жирные кислоты по
химическому составу отличаются от твердых лишь отно-
сительно меньшим содержанием водорода.
В лабораториях сравнительно давно уже удалось пре-
вратить жидкие жиры в твердые путем присоединения
водорода, но в течение 60 лет попытки провести этот
процесс в заводском масштабе оставались безуспешными.
И только в 1902 г. это удалось Нордману. Он добавлял
к жидким жирам мелко раздробленный никель, нагревал
их и пропускал через них водород, который присоеди-
нялся химически к жидким жирам, превращая их в гораздо
более ценные твердые жиры. При этом исчезал также
неприятный запах жидких жиров, так как содержащиеся
в них скверно пахнущие свободные жидкие кислоты тоже
превращались в твердые кислоты, не имеющие запаха.
Таким путем удалось также получить твердый, не имею-
щий запаха жйр из китовой ворвани. Во время мировой
войны, когда в Германии ощущался острейший недостаток
жиров, этот жир перерабатывали даже на маргарин, и в
такой форме он шел для пищевых целей.
В продаже встречаются еще так называемые смоляные
'мыла. Из одной смолы (в качестве таковой применяется
главным образом канифоль) нельзя приготовить пригод-
ного для практических целей мыла, так как оно слишком
недостаточно выделяется из раствора (а также и по ряду
'других причин). С раствором! смоляного мыла мы уже
210
познакомились, когда' говорили о производстве бумаги;
там этот раствор служит для проклеивания. Во время
приготовления мыла из сала или пальмового масла варкой
о раствором едкой щелочи к кипящему мыльному клею
можно добавить канифоли до половины от веса взятого
жира. Канифоль при этом тоже будет химически взаимо-
действовать с едким натром и в результате получится
вполне пригодное для употребления и дешевое смоляное
мыло.
Ита,к, при кипячении различных жиров с едким кали
или едким натром получаются соответствующие мыла—
калиевые или натриевые соли жирных кислот. Но мы
знаем, что кроме только что названных двух существуют
и другие щелочи, а значит, можно получить и продукты
взаимодействия последних’ с жирными кислотами, анало-
гичные калиевым или натриевым мылам. При этом прежде
всего обращают на себя наше внимание кальциевые соли
жирных кислот, которые можно получить действием из-
вести на эти кислоты.
Но кальциевые соли жирных кислот в воде нераство-
римы, не дают с ней никакого мыльного раствора, не
пенятся и, следовательно, не обладают очищающими свой-
ствами. Эти соли нередко образуются при стирке с мылом,
и здесь их появление является весьма нежелательным.
. При . соприкосновении мыла с обычной водой всегда1
образуются кальциевые соли жирных кислот. Происходит
это вследствие действия кальциевых солей, содержащихся
во всякой воде (кроме дестиллированной),.на натриевые или
калиевые соли жирных кислот, составляющие мыло. Из-за
образования кальциевых солей жирных кислот мутится
также всегда вода, когда мы моемся с мылом. Чем'больше
кальция содержится В воде, тем большее количество мыла
бесполезно тратится при стирке и мытье.. Происходит этр
потому, что пока не будет -химически связан в виде солей
$кирных кислот весь кальций, содержащийся в воде, до
тех пор Мыло не • дает мыльного раствора, не. пенится л
не’действует Очищающим образом.
В. повседневной жизни различают мягкую И жесткую
воду. Мягкая вода, например дождевая, содержит мало
кальция, она дает пену уже с небольшим количеством
мыла. Жесткая же вода, например ключевая, в которой
много кальция, бесполезно расходует большое количество
и»
211
мыла на образование кальциевых солей жирных кислот,
и лишь после этого она начинает давать пену. Например,
каждые 1000 л воды, потребляемые больницей им. Вир-
хова в Берлине, тратят около 3 кг мыла на связывание со-
держащихся в них кальциевых солей.
При стирке кальциевые соли жирных кислот пристают
к белью, делают волокна ткани ломкими, способствуют
пожелтению белья и сообщают ему также своеобразный
прогорклый запах. Во всех прачечных поэтому перед стир-
кой добавляют к воде соду. Последняя осаждает кальций
в виде углекальциевой соли, почему кальциевых солей
жирных кислот уже не может образоваться. Мыло тогда
не тратится понапрасну, и белье, выстиранное в такой
воде, имеет значительно лучший вид.
Итак, кальциевые соли жирных кислот, встречающихся
в мылах, практического применения не имеют. Иначе,
однако, обстоит дело, если взять в качестве основания
например окись свинца. При нагревании жиров с окисью
свинца (вместо натровой щелочи) образуются свинцовые
соли жирных кислот, т. е. свинцовое мыло, которое при-
меняется под именем пластыря.
Под пластырем мы подразумеваем массу, более вязкую
и твердую, чем мазь, употребляемую в качестве наружного
лечебного средства. Как пластырем пользуются чистым
свинцовым мылом, а также смесями его с различными
веществами. Например, немецкий пластырь состоит из
смеси (по большей части намазанной на холст) 500 частей
нагретого до 60—§0° свинцового мыла, 50 частей воска,
50 частей расплавленных даммара1 и канифоли и 5 пастей
скипидар^.
Нечто иное представляет собой так называемый англий-
ский пластырь. Его готовят, намазывая на растянутую
Тафту1 2 раствор лучшего клея в разведенном спирте, пока
проба после увлажнения не будет хорошо прилипать к
руке. Добавлением небольшого количества) раствора бен-
зойной смолы и тому подобных веществ ему сообщается
приятный запах.
1 Даммар — смолы, поступающие в Европу из Индии, с МалапскгГх,
МолуккскйХ и Зондских островов. Главная область их применения — при-
готовление светлых лаков. (Прим, перев.)
2 фер'бая шелковая ткань простого переплетения. (Прим, перев.)
212
й Мирово© производство мыла в настоящее время соста-
вляет около з млн. т в год, из КОТОр-ЫХ' около половины
приходится на долю США. Производство мыла в СССР
гуже в 1927/28 г. превысило довоенное (около 200 тыс. т
в 1913 г.) и с ЗДх пор неуклонно увеличивается, достигая
особенного развития во втором пятилетии. В качестве
сырья для мыловаренной промышленности СССР наиболь-
шее значение имеют отвержденные жиры (так называемый
саломас) с добавкой к ним канифоли (10—80°/о) И солей
нафтеновых кислот, получаемых в качестве побочного про-
дукта на нефтеочистительных заводах. Такая добавка не-
обходима потому, что мыло, приготовленное из одних от-
вержденных жиров, 'отличается хрупкостью и плохо пе-
нится. Для производства отвержденных жиров в СССР идут
подсолнечное и хлопковое, реже (для целей Мыловарения)
конопляное и льняное масла, а также жиры морских жи-
вотных. й ‘ "
ЛЕЕЦИЯ ДЕСЯТАЯ.
Стекло, Зеркала. Калиевые и натриевые. стекла. Кварцевое стекло. Ис-
кусственные драгоценные камни. Молочное стекло. Глины. Кирпич. Изве-
стковый раствор. Известково-песчаный кирпич. Цемент. Глазурь. Гор-
шечные изделия. Фаянс. Майолика. Фарфор. Фотография. Адский камень:
Хлористое, бромистое и иодистое серебро. Дагерротипия. Проявление
негативов. Тальботипия. Альбуминный способ. Мокрый коллодионный
процесс. Сухие пластинки с бромосеребряной эмульсией. Фотография
спектра. Ретушь. Цветочувствителъные пластинки. Цветная фотогра-
фия. Хроможелат/инный способ. Пигментное печатание. Рентгенбвые
лучи. Радий.
Говоря о мыловарении, мы упоминали между, прочим
oi растворимом стекле, которое по химическому составу
представляет собой кремненатриевую соль. Эта соль легко
растворяется в воде и применяется для наполнения мыла1.
Кремненатриевая и кремнекалиевая соли—единственные
соли кремниевой кислоты, растворяющиеся в воде, но и
они теряют эту способность, если их сплавить с другими
кремниевыми солями. Например, при сплавлении кварце-
вого песка (представляющего собой двуокись кремния)
с окисью калия и окисью кальция получается нераство-
римая в воде смесь кремнекалиевой и кремнекальциевой
солей.
Полученную при этом массу, если она приготовлена с
соблюдением известных Правил, мы называем стеклом.
Издавна уже для изготовления стекла сплавляли песок
с поташом (углекалиевой солью) и углекальциевой солью.
При высокой температуре стеклоплавильной печи двуокись
1 Техническое применение растворимого стекла очень обширно. Кроме
наполнения мыла оно служит еще для приготовления силикагеля (высушен-
ный кремневый студень), в качестве протравы при крашении, для выделки
искусственных камней, для проклейки бумаги, пропитки тканей (в целях
водонепроницаемости), дерева (для повышения Огнестойкости), для так
называемого силикатирования дорог, как вагусток для красок, для консер-
вирования яиц и других целей. (Прим, перев.)
214
кремния вытесняет из солей двуокись углерода, которая
улетучивается в виде углекислого газа. Оставшийся сплав,
состоящий из кремнекалиевой и кремнекалъциевой солей,
после охлаждения и представляет собой стекло:
Sio2 + К2СО3 = K2Si 0g + со2
двуокись кремния углекалиевая соль кремнекалиевая силь двуокись углерода
SiO2 + СаСО3 = CaSiOg + со2
двуокись кремния углекальциевая соль кремнекальциевая соль двуокись углерода
Так как химики обозначают соли кремниевых кислот
общим именем силикаты, то, значит, стекло является
сплавленной смесью нескольких силикатов. И, как должно
быть ясно из сказанного, вовсе необязательно брать для
получения стекла именно песок, поташ и углекальциевую
соль. Действительно, в разных сортах изготовляемых те-
перь стекол то одна, то другая прежняя составная часть
целиком или частично заменена другой кислотой или
основанием, которые оказались подходящими: для целей
стекловарения. О важнейших материалах, употребляемых
теперь в стекольном производстве, мы будем говорить в
дальнейшем.
Для сплавления применяемых в стеклоделии: сырых ма-
териалов всегда нужна очень высокая температура. Уже
одно это обстоятельство достаточно для того, чтобы отнести
к области басен рассказ Плиния1 об изобретении стекла1.
Согласно этому рассказу дело обстояло якобы так: фини-
кийские купцы развели огонь под сосудом, устроив очаг
из кусков соды1 2; когда сода расплавилась, то она образо-
вала с песком и другими составными частями почвы
стекло. Но обычная температура огня в очаге совершенно
недостаточна, как мы только что сказали, для выплавки
стекла. И если все жй различные находки при раскопках
показывают, что стекло известно с древнейших времен,
то это не должно нас удивлять: выплавляя металлы, люди
давно уже научились получать высокие температуры.
1 Кай Секунд Плиний Старший — римский писатель и ученый, род. в 23 г.
ум. в 79 г. и. в. (Прим, персе.)
2 Так переводят соответствующее слово филологи (языковеды). Но,
конечно, Плиний совсем не мог знать того, что мы теперь называем содой.
215
В классической древности стекло было очень дорого.
Наиболее знаменитые стекольные заводы средних веков
находились в Мурано, близ Венеции (Италия). В на-
стоящее время стекло изготовляется почти в каждой
стране.
К применению стекла для оконных рам мы настолько
привыкли, что этот материал кажется нам здесь совершенно
незаменимым; но на самом деле оконные стекла вследствие
высокой пены входили в употребление лишь очень посте-
пенно. Ни в одном древнегреческом или древнеримском
доме не было оконных стекол, не встречались они также
в дворцах Карла Великого или Вильгельма Завоевателя1.
В то время как в зданиях церквей стекла появились уже
в X в., в богатых частных домах они стали входить в
употребление лишь в XIV в. Но прошло еще несколько
столетий, прежде чем они окончательно вытеснили натя-
нутый животный пузырь, промасленную бумагу и оконные
ставни. Особенный восторг, с которым немецкие поэты на-
чала средних веков воспевали наступление весны, частично
связан, быть может, с крайне несовершенным устройством
тогдашних окон.
Итак, для выработки стекла нужна двуокись кремния,
или кремнезем’ который имеется почти повсюду в виде
песка или кварца. Чем чище эти материалы, тем более
они пригодны для стеклоделия. Особенно нежелательно
заметное содержание в песке окислов железа, так как
кремнекислое железо, образующееся в этом случае при
варке стекла, окрашено в очень темный цвет. Именно
окислы железа и являются причиной темной окраски де-
шевых стекол (например стекла, из которого изготовляются
винные бутылки). В прежние времена были зеленоватыми
и все оконные стекла, так как совершенно свободный от
содержания железа песок встречается редко, а во многих
местностях его и вовсе нет. Теперь, с усовершенствова-
нием средств сообщения, такой песок перевозится иногда
для стекольных заводов на большие расстояния.
Лишь в очень редких случаях частично заменяют в
стеклоделии кремнезем гораздо более дорогой борной ки-
слотой. Она сообщает стеклу сильный блеск и делает его,
1 Карл Великий — король (потом император) франков, жил в VIII в.
Вильгельм Завоеватель — английский король, жил в XI в. (Прим, перев.)
113
кроме того, особенно пригодным для некоторых оптиче-
ских целей.
Так как каждое стекло должно содержать калий или
натрий, а в прежние времена можно было иметь только
калий—в форме поташа, то тогда и умели готовить лишь
калиевые стекла. Потребность в поташе была одной из
Причин того обстоятельства, что в Германии стекольные
заводы строили обычно в лесистых местностях. Леса до-
ставляли необходимое топливо для стекловарных печей,
а получавшаяся в последних зола служила в то же время
для приготовления поташа.
На смену поташу пришла потом сода. Но заводский
процесс производства соды дал и другой еще более деше-
вый материал для стеклоделия. Как мы знаем, в содовом
производстве по способу Леблана первой стадией процесса
было получение сернонатриевой соли (сульфата) из пова-
ренной соли. Этот сульфат и применяется в стеклоделии
вместо соды; его не нужно для этой цели предварительно
подвергать дорогой переработке на соду,—достаточно лишь
прибавить угля к шихте (т. е. к массе, предназначенной
для плавки); тогда из сернонатриевой соли и песка тоже
образуется кремненатриевая соль1.
Углекальциевая соль применяется в стеклоделии боль-
шей частью в Виде мела, так как последний, если он
совершенно чист, представляет собой почти химически
чистую углекальциевую соль; мел можно легко получить
свободным от всяких нежелательных примесей, в нем почти
или совсем нет железа.
Вместо окиси кальция в стеклоделии можно1 применить,
как было сказано раньше, целый ряд других основных
окислов. Особенно часто применяется здесь окись свинца.
Наконец, на стекольных заводах снова переплавляют и
стекольный бой, для чего последний обычно привозят на
заводы в больших количествах.
1 Химический процесс вдет при этом так. Окись натрия связывается
с кремнезэмом, а уголь в то же время действует на другую составную
часть сульфата — серный ангидрид. При высокой температуре плавки уголь
сгорает за счет части кислорода серного ангидрида в углекислый газ,
который улетучивается. Серный ангидрид превращается при этом в серни-
стый газ, также улетучивающийся. Вот почему, несмотря на применение
для плавления стекла сернонатриевой соли (сульфата), в готовых стеклах
почти не содержится серы. (Прим, перев.)
217
Сырые Материалы после тщательного смешивания с по-
мощью машин плавят в больших ванных печах. От пла-
вильных печей требуется, конечно, высокая температура
при возможно меньшем расходе топлива; поэтому теперь
на стекольных заводах применяют генераторы различных
систем, об устройстве которых мы расскажем, когда будем
говорить о производстве железа.
Когда плавление окончено, стеклодув берет небольшое
количество стекломассы на конец выдувальной трубки и
выдуванием придает расплавленному стеклу всевозможные
формы; если выдуваемый предмет имеет более значитель-
ные размеры, то стеклодуву помогает второй рабочий.
Сама выдувальная трубка представляет собой металличе-
скую трубку, которая по середине своей длины одета сверху
деревянной трубкой (это делается для того, чтобы трубку,
легко можно было держать, когда она сделается горячей).
С 1908 г. обыкновенные бутылки делаются с помощью
Машины, изобретенной Оуэнсом. Разработка конструкции
этой машины, сделавшая ее практически применимой,
обошлась в 2 млн. марок (около 920 тыс. зол. руб.).
Правда, после этого только одни европейские заводы за-
платили за приобретение патента на нее 12 млн. марок
(около 5,5 млн. зол. руб.).
С помощью машины Оуэнса два взрослых рабочих с
тремя помощниками-подростками вырабатывают ежедневно
20 тыс. бутылок, в то время как прежде для выработки
такого количества нужно было 80 стеклодувов.
Готовые стеклянные изделия горячими поступают в охла-
дительные печи, так называемые «каленицы», в которых
они очень медленно охлаждаются. Если горячее стекло
охладить слишком быстро, то оно становится настолько
хрупким, что делается совершенно непригодным для прак-
тических применений.
С 1920 г., машинным способом выделывается и оконное
стекло.
Открытием, имеющим большое значение и сделанным
уже в XVII в., была отливка стекла. При этом расплавлен-
ное стекло выливается на достаточно большие металличе-
ские столы, снабженные по краям бортами. Те большие
и толстые зеркальные стекла, за которыми помещаются
витрины магазинов, приготовлены- шлифовкой стеклянных
пластин, полученных отливкой. Такие пластины можно
218
отливать любой толщины, что позволяет применять их
для верхнего света, например в потолках верхних этажей.
Само собой разумеется, что шлифовать пластины для по-
добных целей не ну-жно.
Стеклянные пластины служат.также для приготовления
стеклянных, зеркал, .которые давно уже вытеснили метал-
лические, .бывшие ' в. употреблении в прежние времена.
В качестве- металлических зеркал пользовались хорошо
отполированными серебряными диетами или пластинами,
отлитыми ив. очень белого сплава меди (2 части) и олова
(1 часть).’ Йо ..такие зеркала-были очень неудобны из-за
большой чувствительности.’ металлов к внешним влияниям
(особенно серебра, которое, легко чернеет). Совсем иначе
обстоит дело в этом отношении со стеклянными зеркалами,
у которых отражающая ’ поверхность вполне защищена
стеклом.
Чтобы превратить стеклянную пластину в зеркало, одну
ее сторону покрывают листом оловянной фольги (т. е. тонко
разбитого олова) июблицаШ батеМ рТутью; образуется сплав
олова с ’ртутью, так называемая амальгама, которая, во-
первых, превосходно огражаЖ. свет и, во-вторых, прочно
держится на стекле.. Постепенно увеличивая наклон пла-
стины, сначала лежавшей:* горизонтально, дают стечь из-
лишку ртути. • На 'это требуется, около четырех недель,
после -чего зеркало-'готово. \
По своим качествам ’ подобные зеркала' почти не оста-
вляют жейать ничего, лучшего,..цо'их .изготовление чрез-
вычайно опасно .для занятых'- И производстве рабочих:
последние отравляются постепенно парами ртути. Делю
в том, чтО ртуть', как . и вода,гйой'емн'огу испаряется уже
при комнатной темйературе,-."хотя и гораздо медленнее,
чем вода. ' ’ ’’ . .
В описанном Способе' производства зеркал в качество
отражательной ’ поверхности' прййеняют- оловянную амаль-
гаму’ Но'давно'уже существует И другой способ, при ко-
тором вместо амальгамы осаждают на стекле серебро, обра-
зующее' отражательную •пдверхноот'ь.. Этот способ основан
на возможности получать‘Такие* раствбры соединений се-
ребра, из которых с [помощью определенных веществ очень-
легко осаждается металлическое серебро. Выбирая под-
ходящие средства, можно .добиться того, что серебро не
будет осаждаться быстро в виде порошка, а станет выде-
219
литься лишь очень постепенно, покрывая стенки сосуда,
в котором находится раствор, великолепным зеркальным
налетом.
Чтобы посеребрить по этому способу одну сторону стек-
лянной пластины, ее обливают соответствующей смесью;
через некоторое время стекло оказывается посеребренным,
И так как серебро является самым белым металлом, то
приготовленные с его помощью зеркала превосходят по
своим качествам все прежние: зеркало с амальгамой, по-
вешенное рядом с посеребренным, кажетсц по сравнению
с последним более темным, Производство подобных зеркал
вследствие отсутствия ртутных паров впюлне безопасно
для занятых в нем рабочих, сами Зеркала, несмотря на
применение серебра, обходятся недорого, так как на 1 м2
зеркальной поверхности трйиТся при этом всего1 около
2,5 г металла1.
Калиевые стекла гораздо1 более ту-гблдавкй, чем натрие-
вые, почему стеклянная посуда для Хйнических и физи-
ческих лабораторий изготовляется йреимущеетвенно из
калиевых стекол. Особенна веЛики успехи новейшего вре-
мени в изготовлении такой химической стеклянной посуды,
которая предназначена для частого нагревания; эти успехи
основаны на полном использований цапТИх современных
знаний о физических и химических 'свойствах стекла. Сте-
клянные сосуды, предназначенные для сильного нагрева-
ния, должны быть очень тонкими, чтобы они прогревались
быстро и равномерно. Несмотря на это, при умелом обра-
щении они вовсе не таю маета бьются Или Трескаются., как
это можно было ожидать.
Тем не менее нагревание в химический шоеуде нужно
было производить все же очень ойторожне.. С 1895 г. стали
выделывать такие стеклянные сосуды, Которые можно опу-
скать с содержащимися в них жидкостями, нагретыми
ДО 180—200°, прямо в холодку® воду, и стекло при этом
не трескается. Подобное достижение техники стеклоделия
раньше считалось едва ли возможным. Рднайо и это- До-
стижение было оставлено далеке позади, когда удалось
расплавить в электрической печи кварц, в достаточно под-
1 В нашем серебряном полтиннике В г чистого реребра, стедовательно
его хватало бы на покрытие 3,6 лЯ аеукальнбп'поверхноеди^С/Трилг. перев.)
220
вижную жидкость, из которой можно вырабатывать изде-
лия, как из стекла.
Расплавленный кварц собственно не является стеклом в
том смысле, как мы говорили выше, но по внешности
сосуды из «кварцевого стекла» совершенно не отличаются
от обыкновенных стеклянных. Вследствие сложности изго-
товления кварцевые изделия обходятся очень дорого. Они
совсем нечувствительны к резким температурным коле-
баниям: сосуд из кварцевого стекла можно раскалить и
потом сразу погрузить в холодную воду без всякого1 для
него вреда Ч
В 1922 г. в Европе появился еще новый сорт стекла
(но уже настоящего), изобретенный в Америке; он назы-
‘ Вается «пайрекс», или, правильнее, «пирекс». Пирекс также
состоит на 8О°/о из кварца, который сплавлен здесь с борной
кислотой, окисью алюминия и окисью натрия1 2. Изделия
из пирекса' тоже отличаются удивительной нечувствитель-
ностью к жару, и, кроме того, настолько прочны, что не
разбивается при падении на пол. Этими свойствами объ-
ясняется очень хороший сбыт, которым пользуются сде-
ланные из пирекса кастрюли, сковородки и т. п. Для
химических целей пирекс не применяется, так как он
отличается большей растворимостью сравнительно с йен-
ским стеклом3.
Рассмотрев тугоплавкие сорта стекол, перейдем теперь
к легкоплавким. Последние изготовляются заменой боль-
шей части окиси кальция окисью свинца. Такое стекло
прекрасно поддается обработке. Из него делают прессо-
ванием те широко распро-етр.аненнрге, часто не особенно
изящно украшенные, тарелки, бдюда и столовые сервизы,
которые должны имитировать «хрусталь». Конечно, прес-
сованные стекла никогда йе будут иметь острых граней
1 В СССР была проведена болщпая работа >в- области овладения техникой
производства и обработки плав-ЦэнНогр кварца, Я В 1934 г. открылся пер-
вый в стране кварцевого стекла npir Ленинградском фарфоровом за-
воде пм. Ло^опЬсфва. (tfpm. n&W.J
2 Кроме того, в сосшН иирвкпа вводят небольшие количества окпслов
калйя, кальции, мышьяка И магдвя. (Тфщк перев.)
3 Особый сорт химц^бски стойкого калиевого стекла, вырабатываемый
в Германий, (ирим. wpveO
221
шлифованных'изделий, но зато и цена нх невысока сравни-
тельно о ценой дорогих предметов, сделанных из шлифо-
Сито
Сосуд для
глинозема
Глинозем,
смешанный
с. кислородом
водород
, Цепная
' передача
; для иста
»ноЬкипечи
Печь
Держатель
ванного стекла.
Если совесем отказаться от
кальция И взять для выплавки
стекла только кремнезем, по-
таш И окись свинца, то полу-
пится так называемый «страз».
Этот сорт стекла обладает на-
столько сильным блеском, что,
добавляя к ' стекломассе соот-
ветствующие красящие веще-
ства, из нее можно делать
искусственные драгоценные
камни. Хорошо отшлифован-
ные и отполированные, они
так похожи на алмазы или
на цветные драгоценные ка-
мни, что .отличить их друг от
друга только1 по внешнему
виду невозможно. Однако при
частом употреблении «стразы»
. быстро покрываются царапи-
нами,' так как свинцовое стек-
ло. отличается большой мягко-
стью,- в то время как
Настоящие драгоцен-
ные камни чрезвы-
вцнтдля чаинщ.тверды. '
юредЬиъпния Окрашивание раз-
мрмателя ных’ сортов стетол
производится' добав-
лением к стекломас-
се соответствующих
веществ при плавке.
J Наиболее красивым
1 —ив ОК.ПЯ.ПТАТТИЬТТ ЛТ1А-
Ридин
------------------из окрашенных . сте-
Рис. 38. Печь для изготовления искусственных КОЛ является, не-
драгоценнцх камне# оомненно, рубиновое
ствк/р для -ей? при-
готовления к расплавленной массе прибавляют подходя-
щие химические соединения золота, йапример так называ-
222
емый «кассиев пурпур»1. Великолепно окрашенное рубино-
вое стекло применяется для изготовления дорогих чайных
сервизов и т.*п. Количество затрачиваемого при этом на
окрашивание золота совершенно ничтожно.
Стразы, о которых мы только что говорили, являются
почти не имеющей ценности подделкой драгоценных кам-
ней. Но химики давно уже стремились получить искус-
ственным путем настоящие драгоценные камни так же,
как им удалось, например, приготовить искусственным
путем природные краски—крапп, индиго и др. Впервые
полного успеха в этом направлении удалось добиться Вер-
нейлю, который получил в 1902 г. искусственный рубин.
Анализы рубина показывают, что он состоит из чистой
окиси алюминия, которая окрашена ничтожным количе-
ством окиси хрома. Чистая окись алюминия чрезвычайно
тугоплавка. Свойства рубина она приобретает при после-
дующей обработке.
В тигелек, внутри которого находится шарик из окиси
алюминия, направляют пламя гремучего газа (рис. 38);
сверху в это время на шарик падает через сито очень
небольшое количество порошкообразной смеси окиси алю-
миния и окиси хрома. Они при этом сплавляются с шари-
ком, образуя столбик, который скоро начинает расти в
вышину; вес сплавленной массы можно довести при этом
до 50 каратов (10 г). До величины примерно в 5 каратов
искусственные рубины нельзя отличить по виду от при-
родных, но по мере дальнейшего увеличения размеров
искусственные камни становятся гораздо менее красивы,
чем природные.
Искусственный рубин весом в 5 каратов стоит около
10 марок (4 р. 80 к.), в то время как природный такого
же веса стоил раньше 500 марок (230 зол. руб.); теперь
цена природных рубинов упаЛа. С 1910 г. на рынке по-
явился -и искусственный сапфир, который никаким спо-
собом невозможно отличить от природного, 1 карат искус-
1 Кассиев пурпур — это не химическое соединение золота, а смесь
коллоидального золота с окисью олова, алюминия или магния. Кроме окра-
шивания стекол он применяется также для живописи по стеклу и фарфору,
давая при прокаливании различные оттенки — от слаборозового до ярко-
красного. (Прим, перев,)
223
ственного сапфира стоит только 10 марок, а цена природ-
ного составляла прежде 200 Марок (96 руб.).
Появились затем и другие искусственные драгоценные
камни. Они отличаются, следовательно, от природных
только тем, что обязаны своим возникновением не про-
должавшейся в течение тысячелетий работе природы, а ра-
боте химической лаборатории, чрезвычайно ускорившей
процесс их рождения. В настоящее время ежедневно вы-
делывается уже около 15 тыс. каратов драгоценных камней.
Можно подумать, что для такого большого количества
едва ли даже найдутся покупатели. Это было бы верно,
если бы искусственные камни применялись только для
украшения. Но для этой цели служат лишь наиболее
удачные изделия, все же остальные благодаря своей исклю-
чительной твердости находят широкий сбыт в производстве
часов и электротехнических принадлежностей.
Так называемое молочное стекло изготовляется приба-
влением к стекломассе фосфорнокальциевой соли, большей
частью в виде костяной золы. При высокой температуре
И здесь получается прозрачный плав, который обрабаты-
вается, как и всякое другое стекло. Но при охлаждении
в нем снова выделяется фосфорнокальциевая соль, делая
готовое стеклянное изделие непрозрачным. Подобно фос-
форнокальциевой соли действуют и некоторые другие ве-
щества, например криолит. Этот минерал встречается
только в Гренландии1; химически он представляет соеди-
нение фтористого алюминия и фтористого натрия и совеем
не содержит, следовательно, железа. Изготовленное с кри-
олитом молочное стекло особенно пригодно для ламповых
абажуров, так как через него не видно светящегося пла-
мени; если же абажур сделан из молочного стекла, изго-
товленного о фосфорнокальциевой солью, то пламя про-
свечивает через него кровавокрасным светом.
Перейдем теперь к керамическим изделиям, В природе
во многих местах встречаются горные породы, называв
1 Небольшие месторождения криолита есть на Урале (в Ильменских
горах) и в Колорадо (США.). (Прим, перев.)
224
мые глинами. Глина в сухом состоянии представляет со-
бой землистую, мягкую, легко растирающуюся между
пальцами и липнущую на языке массу; во влажном со-
стоянии она обладает пластичностью. Цвет глин бывает
белый, серый, зеленоватый, голубой или коричневый. Об-
ласти применения разных сортов глин, а также названия
этих сортов зависят от примесей. Чаще всего в природе
встречается кирпичная глина, которая содержит довольно
много песка и окрашена в; желто-бурый цвет гидратом
окиси железа. Если придать ей форму удлиненных кусков
с прямоугольным сечением, то получится так называемый
кирпич-сырец. Высушенный на воздухе, он обладает очень
небольшой прочностью и распадается от первого дождя.
Тем не менее в некоторых местностях такой кирпич при-
меняется для заполнения простенков в каркасных сооруже-
ниях.
Обжиганием высушенный на воздухе сырец превращают
в прочный камень, который мы и называем собственно
кирпичом. В прежние времена обжигание кирпича произ-
водилось так.
Из чередующихся слоев сырца и дров (илй угля) скла-
дывали кучу и забрасывали ее сверху глиной, которая
прикрывала все это сооружение. Полученную таким образом
примитивную печь разжигали снизу. Теперь обжиг кир-
пича производится в больших кольцевых печах.
После обжига кирпич делается стойким по отношению
к воде, так как легкоплавкие частички примесей в глине
при обжиге почти расплавляются и по остывании связы-
вают неплавкий скелет кирпича в прочное целое. Вслед-
ствие высокой температуры обжига содержащийся в глине
гидрат окиси железа превращается в окись железа, ко-
торая и обусловливает красный цвет большей части изго-
товляемых кирпичей.
В течение тысячелетий красный кирпич не имел со-
перников, но теперь с ним конкурирует известково-пес-
чаный кирпич.
В постройках отдельные кирпичи связывают друг с дру-
гом с помощью так называемого строительного раствора.
Для кирпичных построек в качестве такого «раствора»
применяют обычно смесь гашеной извести с песком.
При обжиге известняк распадается на негашеную известь
•(окись кальция) и углекИслЫй газ. Негашеная известь
15 Химия повседневной жизни.
225
представляет собой массу, мало уступающую по твердости
необожженному известняку. Но она обладает замечатель-
ным свойством совершенно изменяться при соприкосно-
вении с водой. Несмотря на свою твердость в сухом со-
стоянии, под влиянием воды она полностью распадается.
Получающаяся при этом гашеная известь может быть за-
мешана с водой в густую массу, так называемое известковое
'тесто, смесь которого с песком и представляет собой
обыкновенный известковый строительный «раствор».
Известковый раствор между, кирпичами постепенно полг
ностью затвердевает, причем его известь, благодаря взаимо-
действию с углекислым газом воздуха, снова медленно
переходит (начиная с наружных слоев) в твердую угле-
кальциевую соль. Для ускорения этого процесса в новых
постройках ставят жаровни с горящим коксом, который
дает много углекислого газа, облегчая этим превращение
извести в углекальциевую соль. Кроме того, обогревание
способствует удалению содержащейся в растворе воды.
В течение столетий на известь действует химически и
песок (который представляет собой двуокись кремния),
вследствие чего образуется кремйекалъциевая соль, т. е.
вещество, обладающее чрезвычайной прочностью. Этим и
объясняется большая прочность очень старых кирпичных
построек. Следовательно, здесь главную роль играет воз-
раст, а вовсе не то, что в старину якобы умели готовить
более прочные растворы.
Прочность сплошных кусков кремПекальциевой соли
была известна очень давно, но практически Использовать
это знание сумели лишь, начиная с 1896 г. Кремнекаль-
циевая соль образуется в «растворе» на холоду чрезвычайно
медленно; но стоит лишь сильно нагреть песок с гашеной
известью, и образование этого вещества пойдет очень
быстро. На этом основано производство известково-песча-
ного кирпича. Для его приготовления смесь песка с га-
шеной известью прессуют в форме кирпичей и нагревают
их затем в закрытой печи до температуры выше 100°. По
охлаждении получаются почти белые кирпичи, очень
прочные и стойкие, которые вполне можно применить при
постройках для возведения внутренних стен.
Обыкновенный известковый раствор непригоден для под-
водных сооружений.
226
Но если раствор содержит определенные! примеси, со-
державшиеся в том материале, который подвергся обжи-
ганию, например много глины (а в состав глины входят
двуокись кремния и окись алюминия), то он приобретает
способность затвердевать и под водой. Такие растворы
теперь называют цементами.
Цемент представляет собой смесь, которая уже не га-
сится водой подобно' негашеной извести. Смешанный с во-
дой в тонкоразмолотом состоянии, он образует кашицу,
которая через некоторое время затвердевает в чрезвычайно
прочную массу.
Рис. 39. Древнеримский акведук (водопровод), сохранившийся во Франции
Цементом пользовались для подводных построек еще
древние римляне (рис. 39), которые приготовляли его из
встречающихся в разных местах природных известняков,
содержащих много глины1. Теперь, когда потребность в
цементе для огромного числа подводных и бетонных соору-
жений чрезвычайно возросла, его готовят искусственным
1 Горные породы, представляющие природные смеси известняка с глиной,
называются мергелями. В некоторых из них соотношение обеих со-
ставных частей как раз такое, какое требуется для цемента. Ботыпие
залежи таких мергелей есть, например, в СССР недалеко от Новороссийска,
где работает большой цементный завод. (Прим, перев.)
15*
227
путей. Примешивая перед обжигом глину к известняку,
можно независимо от природных месторождений глинистых
известняков получить любой сорт гидравлического це-
мента (т. е. обладающего способностью затвердевать под
вюдой). В обжиговой печи при температуре около 1400°
негашеная известь действует на глину как сильный
основной окисел, благодаря чему получается цемент, ко-
торый нужно лишь потом тонко размолоть.
В другом способе производства цемента пользуются в
качестве сырого материала шлаками доменных печей. По
своему составу эти шлаки отличаются от цемента только
меньшим содержанием извести. Поэтому их теперь тонко
размалывают, смешивают с известняком, и смесь прока-
ливают. После размалывания образовавшегося продукта
получается цемент. Такое применение бесполезных до тех
пор шлаков началось примерно с 1890 г., и оно пред-
ставляет собой огромное достижение техники в деле ис-
пользования отходов производства.
*В довоенной России в 1913 г. было 35 цементных за-
водов с общей производительностью около 10 млн. ббчек,
которая тогда уже не удовлетворяла строительных по-
требностей, почему приходилось ввозить еще цемент из-за
границы. Бурный рост строительства в СССР потребовал
и соответствующего развертывания цементной промышлен-
ности. К началу 1933 г. было выстроено и частично пу-
щено 17 новых заводов общей мощностью в 18,2 млн. бо-
чек и, кроме того, реконструировано 16 старых заводов
с увеличением производительности до 7 млн. бочек.
К 1935 г. СССР имеет 49 цементных заводов с произво-
дительностью в 40 млн. бочек цемента. Крупнейшими
центрами цементного производства в СССР являются: Ново-
российск, Вольск и Амвроеиевка (Украина), которые дают
около 40% всего производства в Союзе. Рост цементного
производства в довоенной России и в СССР показан на
рис. 40. -йт
Главной составной частью всех глин является кремне-
алюминиевая соль. В чистом состоянии она при температуре
печи не плавится, но примеси песка (двуокиси кремния),
окиси калия, окиси железа сильно понижают ее стойкость
по отношению к нагреванию. Ведь мы уже узнали, когда
говорили о стекольном производстве, что кремнекалйевая
228
и кремнекальциевая соли, а также кремнежелезная соль
сплавляются друг с другом в стекло. Все эти вещества,
находящиеся в глине в качестве примесей, плавятся, сле-
довательно, при обжигании. Кирпич вследствие этого спе-
кается. После охлаждения полужидкие частички отекла
застывают и обусловливают этим прочность кирпича.
Наоборот, если глина бедна содержанием названных
выше веществ, то она будет очень огнестойка. Из такого
сырья (которое тоже часто встречается в природе) изгото-
Рис. 40. Рост цементного производства в СССР (в млн. бочек)
вляют огнеупорный кирпич, идущий для промышленных
топочных устройств. Эти кирпичи называют также ша-
мотными.
Пластичность глины позволяет изготовлять из нее самые
разнообразные предметы. При обработке на вращающемся
круге легко удается формовать из глины различные сосуды
с кругообразным сечением. Гончарный круг у некоторых
народов, например у китайцев, является настолько древ-
ним изобретением, что оно было в употреблении еще до того
времени, от которого дошли до нас первые письменные
памятники (рис. 41).
При обжиге в печи изготовленных таким способом гон-
чарных изделий они хотя и становятся довольно прочными
наподобие кирпича, но остаются пористыми. В этом виде
229
они мало пригодны к употреблению и могут быть исполь-
зованы, пожалуй, только для цветочных горшков. Налитые
в них жидкости впитываются в стенки, даже просачи-
ваются через последние, почему такие сосуды нельзя потом
хорошо очистить; все это делает их непригодными для
употребления в качестве посуды для варки и еды. Для
устранения этого недостатка подобные изделия поэтому
глазируют, т. е. покрывают слоем стекла.
Мы уже знаем, что свинцовые стекла очень легкоплавки.
Поэтому наиболее дешевой глазурью для горшечных изде-
лий будет какое-нибудь подходящее природное соединение
свинца; его тонко размалывают вместе с небольшим коли-
чеством глины, разбалтывают в воде и этой смесью обли-
вают подлежащий глазурованию сосуд. При последующем
обжиге поверхность сосуда покрывается расплавленным
Рис. 41. Гончарный круг в древнем Египте
свинцовым стеклом, которое образуется из двуокиси крем-
ния, содержащейся в глине, и свинца. Теперь сосуд уже
не будет пористым, и он готов после однократного обжига.
Применяемое горшечниками соединение свинца—это
свинцовый блеск, встречающийся на земле во многих ме-
стах. Но в виду ядовитости этого соединения изготовленную
описанным способом посуду нельзя употреблять для кухни,
потому что кушанья, приготовляемые с уксусом, будут
растворять свинец. В настоящее время продажа- такой ку-
хонной посуды воспрещена. Поэтому теперь пытаются из-
менить состав подобных глазурей с тем, чтобы при обжиге
изделий весь свинец переходил в очень прочные химиче-
ские соединения, на которые не действовали бы кислые
кушанья (в химическом смысле кушанья обладают, ведь,
лишь слабой кислотностью).
Гораздо прочнее обыкновенных горшечных изделий—так
называемые каменные изделия (в большинстве случаев на-
зываемые фаянсом). Для их изготовления применяется
230
очень пластичная глина, которая вполне спекается при не
слишком высоких температурах и после этого образует
твердую, непроницаемую для жидкостей массу. Поэтому,
например, дешевые коричневые или светлокоричневые кув-
шины, которые изготовляются таким путем, совершенно не
нуждаются в глазуровании, чтобы быть водонепроницае-
мыми. Однако их, как и другие каменные изделия, тоже
покрывают глазурью—с целью получения блестящей по-
верхности. Делается это следующим простым способом.
Когда в печи, в которой обжигается изделие, будет до-
стигнута необходимая высокая температура и произойдет
достаточное спекание глины, в огонь сыплют поваренную
соль и закрывают на некоторое время вытяжные отверстия.
Вследствие этого печь наполняется парами поваренной
соли. По химическому составу, как мы знаем, поваренная
соль представляет соединение натрия и хлора. Когда ее
пары приходят в соприкосновение с поверхностью обжи-
гаемых изделий, то здесь образуется некоторое количество
кремненатриевой соли, которая дает с другими силикатами,
содержащимися в глине, стекло. Таким образом для гла-
зурования дешевых каменных изделий достаточно лишь
ввести в печь поваренную соль, и, следовательно, эти изде-
лия тоже подвергаются обжигу только один раз.
Если взять для изготовления каменного товара очень
чистую, т. е. почти не содержащую железа глину, то
сделанный из' нее сосуд после однократного обжига будет
почти белым. После нанесения на него красивой белой
глазури и повторного обжига получится настоящий ка-
менный товар, который, следовательно, в противополож-
ность простому каменному товару подвергся обжигу два
разах. По внешности такое изделие почти не отличается
от фарфорового, но оно сильно уступает последнему по
прочности. Дело в том, что нанесенная на него при сравни-
тельно низкой температуре глазурь по своему качеству
не может итти ни в какое сравнение с фарфоровой.
Глазурь на изделиях из каменного товара при употре-
блении скоро покрывается мелкими трещинами, которые
1 Здесь и дальше автор говорит о таких изделиях, которыэ обычно на-
зываются у нас ф яисовыми, фаянсом же автор называет (см. стр. 232) только
дорогие художествен ине изделия из лучших сортов соответствующего сырья.
(Луин, перев.)
231
не поддаются уже чистке; столовая посуда становится по-
этому не только некрасивой на вид, но и прямо-таки, если
можно так выразиться, «неаппетитной».
Такое качество глазури каменных изделий обусловлено
тем, что ее наносят при сравнительно невысокой темпера-
туре, чем достигается очень большая экономия топлива.
При этом для получения достаточно легкоплавкой гла-
зури в ее состав вводят буру и—очень ядовитую саму по
себе—окись свинца. Но благодаря соответственно подобран-
ным другим составным частям смеси окись свинца связы-
вается в конце концов химически настолько прочно, что
она уже не может растворяться в кислотах; поэтому при-
готовленную таким путем посуду, несмотря на содержание
в ней свинца, можно употреблять и для варки пищи.
Каменные изделия приобретают свою полную прочность
уже после первого обжига, следовательно, еще не покры-
тые глазурью. При гораздо более низкой температуре, по-
требной для расплавления и нанесения на них глазури, не
может быть и речи о новом спекании. Вот почему здесь,
в противоположность фарфору, после вторичного обжига
не происходит никакого увеличения прочности. С другой
стороны, тут отсутствует зато опасность размягчения изде-
лий и потери ими правильной формы при вторичном об-
жиге, как это случается при изготовлении фарфоровых из-
делий. Поэтому на нижней сплошь глазурованной поверх-
ности каменных изделий видны большей частью только- три
небольших углубления на тех местах, в которых изделие
(например тарелка) соприкасалось с подставкой во- время
вторичного обжига (при нанесении глазури). Нижняя же
поверхность фарфоровой тарелки, напротив, совершенно
свободна от глазури; причину этого мы скоро узнаем.
Поговорим теперь о фаянсе. Свое название этот сорт гли-
няных изделий получил от итальянского города Фаэнца,
где искусство их изготовления было заимствовано с Во-
стока. Ценность фаянсовых изделий обусловлена их формой
и живописью. Такой же сорт изделий обозначается назва-
нием майолика, напоминающим об острове Майорке, где
в прежние времена тоже выделывалось много такой посуды.
Для фаянса нужна очень пластичная, легко поддаю-
щаяся формовке глина, из которой можно было бы изго-
товить такие изделия, как блюда, тарелки и т. п., с очень
рельефными украшениями. Эти украшения часто состав-
232
ляют главную ценность фаянсовых изделий,—достаточно
вспомнить лишь, например, о почти неоценимых теперь
блюдах Палисси1 (рис. 42).
Фаянсовые изделия подвергают лишь слабому обжигу;
благодаря огнеупорности применяемой здесь глины, она
при этом мало спекается, почему рельефные фигуры очень
хорошо сохраняются. Но с другой стороны, как мы знаем,
недостаточно спекшаяся глина остается пористой. Поэтому
фаянс после первого обжига должен быть покрыт глазурью
и подвергнут вторичному обжигу в печи. Состав глазури
можно выбрать такой, что она образует или непрозрачное
белое или окрашенное стекло. Непрозрачную белую гла-
1 Палисси—французский керамист и живописец по стеклу, живший
в XVI в. В 1555 г. он открыл особый способ живописи на фаянсе. Кера-
мические произведения Палисси отличаются изяществом форм, чистотой
тонов росписи и блеском глазури. Большое собрание их хранится в Париже.
(Прим, перев.)
233
зурь получают добавлением к обычной смеси окиси олова,
но в этом случае к фаянсовой глине нужно прибавить еще
извести, так как иначе оловянная глазурь будет иметь
трещины.
Обратимся теперь к самым совершенным из всех г линя--
ных изделий—к фарфоровым. Фарфор обладает некоторыми
денными свойствами, общими у него со стеклом, а по не^
которым качествам он даже превосходит стекло: он, на-
пример, тверже и гораздо лучше переносит изменения
температуры, не растрескиваясь при этом. Но зато фарфор
нельзя обрабатывать столь разнообразными способами, как
стекло, и вместо полной прозрачности стекла здесь прихо-
дится удовлетворяться лишь просвечивающей белизной.
Б Китае и Японии фарфор знали давно, в Европе же
способ его приготовления изобрел вероятно алхимик Бегг-
гер в 1703 г. Сначала он получил фарфор коричневой
окраски, но в 1710 г. ему удалось уже изготовить чисто
белые сосуды, которые, начиная с этого года, начали про-
изводить в фабричном масштабе в Мейссене (в Саксонии).
В этом именно городе Беттгер, наполовину как заключенный,
должен был по поручению короля Августа Сильного отыс-
кивать пути искусственного изготовления золота, и потому
производил всевозможные опыты1.
1 Алхимия (так называлась химия в средние века) главной своей целью
ставила отыскание «философского камня», т. е. такого чудодейственного
средства, которое якобы способно превращать дешевые металлы в золото,
возвращать старикам молодость и т. п. В то время все верили в возмож-
ность существования такого средства, чем пользовались различные шарла-
таны, уверявшие, что они раскрыли тайну его изготовления. Но среди
алхимиков немало было и честных людей, добросовестно искавших такое
средство, производивших с этой целью множество различных опытов, дав-
ших ценные научные и практические результаты, конечно, нэ в смысле
отыскания несуществующего «философского камня», а в области изготовле
ния различных новых химических соединений, выработки новых приемов
химического исследования и т. д. Судьба алхимиков нередко бывала пе-
чальна. Сильные люди того времени — короли, князья, герцоги, знатные
попы,—нуждавшиеся в деньгах для своей роскошной жизни, держали алхи-
миков в тюрьмах и применяли другие подобные средства с целью выпытать
у них секрет искусственного изготовления золота, который те, якобы,
скрываш. Попал под стражу и Беттгер за невыполнение обещания приго-
товить искусственное золото, и только изобретение способа изготовле-
ния фарфора (которое, кстати, он сделал совместно с Чирнгаузеном) изба-
вило его от заключения в Мейссенском замкэ. (Прим, перев.)
2'4.
От фарфора требуется совершенно чистый белый цвет,
а обжиг, для получения высокого качества изделий, дол-
жен производиться здесь при возможно более высокой тем-
пературе. Поэтому единственным сырьем для изготовления
фарфора может служить лишь чистая, совершенно сво-
бодная от железа глина, способная выдержать чрезвычайно
Иоганн Беттгер
высокую температуру обжиговой печи. В новейшее время
в производстве фарфора применяется также и тальк.
Глина, обладающая только что перечисленными свой-
ствами, называется каолином. С целью очистки ее отмучи-
вают, т. е. разбалтывают с очень большим количеством
воды. По прекращении размешивания все более грубые
примеси быстро оседают на дно, а тонкие частички остаются
во взвешенном состоянии. Если отделить теперь жидкость
со взвешенными частичками от осадка и перевести ее в
другой бассейн, то в последнем начнет осаждаться чистая
23&
глина. Вследствие своей чистоты такая глина настолько
огнеупорна, что она почти не спекается даже при очень
высокой температуре печи; поэтому для возможности обжи-
гания фарфоровых изделий к глине необходимо добавлять
небольшое количество плавней. В качестве плавня здесь
служит тонко размолотый и взмученный полевой шпат,
часто встречающийся в природе минерал, который при очень
высокой температуре плавится в стекловидную массу; этот
факт не должен нас особенно удивлять, если мы узнаем,
что полевые шпаты являются двойными силикатами алю-
миния и калия (или натрия), а также кальция, т. е. ча-
стично состоят из тех же веществ, которые входят в
состав стекла.
Если приготовить изделия из смеси взмученного каолина
и полевого шпата без всяких добавок, то при обжигании
они настолько сильно искривились бы и опали,’ что по-
теряли бы свою форму. Этого избегают добавлением к слу-
жащей для изготовления фарфора массе кварца, который
является здесь так называемым «отощающим» средством.
Из приготовленной таким образом фарфоровой массы, со-
стоящей из трех перечисленных выше частей, на гончар-
ном круге изделия формуются так же, как и горшечные;
изготовленные предметы постепенно высушиваются, после
чего 'Они делаются чрезвычайно ломкими. Затем изделия
поступают в печь на первый обжиг при температуре ярко-
красного каления.
Однократно обожженный фарфор находит применение
собственно только лишь для внутренних сосудов гальва-
нических элементов. Такие сосуды настолько пористы, что
находящаяся в них жидкость легко приходит в соприкосно-
вение с другой жидкостью, помещенной во внешнем сосуде,
не перемешиваясь, однако, с ней в собственном смысле
слова; а это как раз и нужно для получения гальваниче-
ского тока по такому способу.
После первого обжига фарфоровые изделия подвергаются
глазурованию. В противоположность всем другим глиня-
ным изделиям здесь применяют чрезвычайно тугоплавкую
глазурь, которая потом покрывает фарфор настоящим, хотя
и мутным, стеклом, обусловливающим превосходные ка-
чества фарфоровых предметов.
Для глазурования применяют ту же фарфоровую массу,
к которой добавляют лишь в качестве плавня большее
236
количество полевого шпата, необходимого для ее расплав-
ления. Тонко размолотую глазурную массу размешивают
с водой в жидкую кашицу и в нее окунают подлежащие
глазурованию изделия. На их поверхности остается при
этом достаточное количество массы. На тех местах нижней
поверхности изделия, которыми оно будет прикасаться при
обжиге к подставке, глазурная масса должна быть снята,
иначе изделие при обжиге приплавится к подставке. Вот
почему у фарфоровых тарелок (в противоположность фаян-
совым) мы никогда не видим плоского дна,—его края
всегда выступают. Благодаря этому глазурную массу на
них не приходится счищать со всего дна, ее можно снять
только с выступающего края. Такие неглазурованные места
на-ощупь шероховаты и при употреблении предмета легко
загрязняются, так как их гораздо труднее очистить про-
стым обтиранием, чем глазурованную поверхность. По этим
непокрытым глазурью местам на дне легко можно отли-
чить даже самые лучшие, близко стоящие к фарфору
каменные (фаянсовые) изделия от настоящего фарфора; на
фаянсовых изделиях таких мест никогда не бывает.
Для нанесения глазури фарфоровые изделия поступают
в печь на второй обжиг, температура которого в проти-
воположность процессу изготовления каменных изделий
очень сильно повышается. Каменный товар уже после пер-
вого обжига приобретает свою полную прочность, которая
затем при расплавлении глазури ничуть не увеличивается.
У фарфора же, напротив, полученный при первом обжиге
уже довольно прочный черепок (так называют обожженный
один раз материал) при втором обжиге окончательно спе-
кается. И только здесь образуется та твердая масса, кото-
рая сплавляется с глазурью в одно целое и которая приоб:
ретает столь значительную сопротивляемость всяким внеш-
ним воздействиям.
Вынимая от времени до времени из печи отдельные проб-
ные изделия, следят за ходом обжигания. Расплавляю-
щаяся постепенно глазурь становится все более гладкой.
Когда, наконец, по образованию просвечивающей массы
замечают, что черепок уже достаточно остеклялся, печи е
ее содержимым дают медленно охладиться.
Можно, конечно, подвергнуть и неглазурованный фарфор
такому же сильному обжигу, какой употребляется для
глазурования. Фарфор при этом настолько спекается, что
237
теряет свою Пористость. Его поверхность остается, однако,
несколько шероховатой и имеет матовый вид. Такой фарфор
носит название фарфорового бисквита. Он служит для изго-
товления бюстов, статуэток и тому подобных предметов,
внешность которых теряла бы от блеска глазури.
Живопись по фарфору может быть выполнена двояким
способом: можно рисовать под глазурью или на глазури.
Для живописи под глазурью (т. е. для нанесения рисунков
на обожженный фарфор) могут применяться лишь те немно-
гие окислы металлов, которые переносят высокую темпера-
туру вторичного обжига, например окись кобальта—для
синего цвета, окись хрома—для зеленого, окись урана
(уран—редкий элемент)—для черного. Преимущество этого
способа заключается в неразрушимости рисунка. Так как
последний защищен глазурью, то он может быть уничто-
жен лишь тогда, когда фарфоровое изделие разобьется в
куски.
В то время как при живописи под глазурью налицо
имеется известное ограничение в выборе красок, при втором
способе дело обстоит иначе. Живопись на глазури может
быть выполнена теперь во всех желательных тонах и оттен-
ках; на больших фарфоровых пластинах можно воспроиз-
вести, например, целые картины, писанные масляными
красками,—это искусство культивируется в Севре1. Соот-
ветствующие краски, тоже, конечно, окислы металлов, сме-
шиваются с тонко размолотым, бесцветным и большей ча-.
стью содержащим свинец стеклом (в приготовлении такого
стекла большую роль играет окись свинца); затем они
растираются с маслом. Расписанные такими красками изде-
лия нагреваются потом в муфельной печи 1 2 до тех пор, пока
покрытая живописью эмаль не начнет плавиться; живопись
в это время прочно сплавляется с эмалью.
Совершенно таким же способом производят золочение,
т. е. нанесение на фарфор различных украшений с по-
1 Город Севр представляет теперь собственно юго-западный пригород
Парижа. Здесь находится, основанный в XVIII в., знаменитый фарфоро-
вый завод, художественные изделия которого пользуются мировою извест-
ностью. (Прим, перев.)
2 Муфель представляет собой сделанную из огнеупорной глины коробку,
наружная поверхность которой при нагревании омывается огнем:; таким
образом помещенные внутри муфеля предметы не соприкасаются ни с
копотью, ни с топочными гьзами.
238
мощью золота. Для этого пользуются жидкостью, приго-
товляемой растворением золота в царской водке; с подхо-
дящими добавками ее наносят на фарфор, и после обжига
получают блестящие золотые украшения.
☆ Фарфоро-фаянсовое производство в России возникло во
второй половине XVIII в. и к XX в. достигло большого
совершенства. Но в сырьевом отношении оно целиком зави-
село от заграницы, так как каолин, например, ввозился из
Англии, полевой пшат и кварц из Норвегии и т. д. Лишь
после революции и окончания гражданской войны нача-
лись поиски собственного сырья и снабжение им советских
заводов.
Выработка фарфоро-фаянсовых изделий; в СССР в 1932 г.
достигла 63,7 тыс. т и после этого она из года в год все
возрастает. Особенно увеличился в стране спрос на техни-
ческие и хозяйственные фарфоро-фаянсовые изделия, что
объясняется широким развитием электрификации, коллек-
тивизацией сельского хозяйства, ростом городского и сель-
ского жилищного строительства, развитием и реконструк-
цией линий связи и т. д., и т. д. По сравнению с довоенным
временем значительно увеличилось и количество сортов
разных фарфоро-фаянсовых изделий, особенно техниче-
ских. *
Обращаясь теперь к фотографии, мы положим в основу
нашего изложения исторический процесс ее развития.
В XIII в. в Италии была открыта азотная кислота. В этой
кислоте легко растворяется серебро, причем получается
прозрачная жидкость. После выпаривания раствора остает-
ся белая ооль, представляющая собой азотносеребряную
соль. С давних времен эту ооль называют в обыденной
жизни адским камнем1. Такое название объясняется тем,
что все, намазанное раствором этой соли, на дневном свету
очень быстро чернеет (например кожа человека,—врачи
часто применяют азотносеребряную соль в качестве при-
жигающего средства). Такого же цвета становятся через
короткое время буквы, написанные раствором этой соли;
их после этого почти нельзя удалить, особенно, например
1 Это название было дано в свое время азотносеребряной соли алхими-
ками. У нас ее гораздо чаще называют ляписом. (Прим, перев.)
239
на белые. Таким образом раствор «адского камня» предста-
вляет собой неразрушимые чернила.
Причиной почернения во всех описанных случаях
является способность азотносеребряной соли легко распа-
даться с выделением серебра в виде чрезвычайно тонкого
черного порошка. И как показывают эти случаи, такое
распадение может уже вызвать дневной свет.
Вся современная фотография основана на подобном раз-
ложении солей серебра. Но адский камень сам по себе не
может служить для получения изображений, так как его
разложение происходит слишком медленно. Получение изо-
бражений удается лищь с такими солями серебра, кото-
рые изменяются под влиянием света гораздо скорее, чем
азотносеребряная соль. В фотографии применяются для
этой цели главным образом три соли серебра—хлористое
серебро, бромистое серебро и иодистое серебро. Все эти три
соли можно легко получить. Так как все они в воде не-
растворимы, то, как только к раствору азотносеребряной
соли будет прибавлен раствор хлористого натрия (поварен-
ной соли), или бромистого калия, или наконец, йодистого
калия, они сейчас же выпадают в осадок. С поваренной
солью, например, образуются хлористое серебро и азотно-
натриевая соль:
AgNO3 -f- NaCl = AgCl -f- NaNO3
азотносеребряная хлористый хлористое азотнонатриевая
соль натрий серебро соль
Азотнонатриевая соль остается при этом в растворе, так
что осадок хлористого серебра после промывания водой
получится совершенно чистым.
Хлористое серебро знали очень давно, что же касается
бромистого и йодистого серебра, то эти соли , были получены
впервые Лишь в первой четверти прошлого столетия, когда
были открыты бром и иод1. С хлористым серебром очень
много работали еще алхимики. Оно чрезвычайно чувстви-
тельно по отношению к свету: под действием света хлори-
стое серебро сейчас же начинает изменять свой чисто бе-
лый цвет сначала на фиолетовый, а затем и на совершенно
черный.
Хлористым серебром прежде всех воспользовался для
1 Бром был открыт даже несколько позже, а именно в 1828 г. (Прим, перев.)
240
получения изображений в 1727 г. Шульце, работавший
врачом в Гаале1. Он клал бумажные буквы на подложку,
покрытую слоем хлористого серебра, причем от действия
света темнели только незакрытые бумагой места. Когда он
убирал затем бумагу, то на темном фоне были видны свет-
лые буквы. Но через короткое время буквы тоже чернели,
так как хлористое серебро здесь уже не было больше за-
щищено от действия света бумагой. Это наблюдение не
получило, однако, практического применения.
Только в 1839 г. Тальбот действительно получил настоя-
щие отпечатки с помощью хлористого серебра по следую-
щему способу. Он погружал бумагу в раствор поваренной
соли и после' этого смазывал ее раствором азотносеребряной
соли. Вследствие взаимодействия этих двух солей в порах
бумаги образовывалось хлористое серебро, и она станови-
лась светочувствительной. На приготовленный таким обра-
зом бумажный лист Тальбот клал просвечивающие рисунки
и выставлял на солнечный свет. Под влиянием света хло-
ристое серебро чернело больше всего в тех местах, куда
сильнее проникал свет через верхний рисунок. Если бы
теперь Тальбот просто убрал верхний рисунок, то у него,
как и у Шульце, благодаря продолжающемуся действию
света вскоре почернел бы весь лист целиком. Но большая
заслуга Тальбота и заключается именно в том, что он сумел
закрепить, зафиксировать полученный отпечаток.
Светочувствительную бумагу, на которой солнце отпе-
чатало наложенный сверху рисунок, Тальбот клал в кипя-
щий раствор поваренной соли, проделывая это в темной
комнате, чтобы исключить возможность дальнейшего воз-
действия света. Кипящий раствор поваренной соли раство-
ряет хлористое серебро. Поэтому все оставшееся неизменен-
ным хлористое серебро удаляется из бумаги, и на ней
остается лишь рисунок, так как продукты, получившиеся
вследствие химического изменения хлористого серебра под
действием света, кипящим раствором поваренной соли не
растворяются.
Ясно, однако, что полученный? в данном случае отпечаток
будет «негативным» по отношению к первоначальному ри-
сунку. Ведь темные места рисунка пропускали свет меньше
всего, следовательно, на последних хлористое серебро оста-
1 Город в Пруссии. (Прим, перев)
16 Химия повседневной жизни.
241
лось почти неизмененным и при фиксировании оно было
удалено кипящим раствором поваренной соли. Поэтому тем-
ные места рисунка выходят на копии белыми, или почти
белыми, в то время как светлые места—черными. Но когда
Тальбот клал потом эту копию на другой лист бумаги,
сделанный светочувствительным с помощью хлористого се-
ребра, и повторял весь процесс еще раз, то он получал } ..:е
точную копию оригинала: ведь теперь образовывался нега-
тивный1 отпечаток негатива первоначального рисунка, дру-
гими словами, точная копия последнего в том же масштабе.
Способ Тальбота был еще ничем иным, как фотографиче-
ским копированием уже готовых писмнков. и -'O 'bfn V'Tin
Рис. 43. Получение изображения в камере-обскуре
(тоже в конце 30-х годов) получил настоящие снимки
предметов с помощью фотографирования. Поэтому Дагерр
собственно и является изобретателем того, что мы теперь
называем фотографией.
Для прямого получения изображений Дагерр применял
камеру-обскуру (рис. 43), следовательно, при своей работе
он уже не брал больше готовых рисунков. Камера-обскура
представляет собой аппарат, в котором при помощи опти-
ческих линз получаются на матовой стеклянной пластинке
изображения находящихся перед ним предметов. Камера-
обскура позволяет в то же время в любой степени умень-
шать изображения расположенных перед линзой предметов.
Все это является огромным усовершенствованием по срав-
нению с изобретенным Тальботом способом копирования.
242
На моею матовой стеклянной пластинки, с помощью ко-
торой в аппарате получается резкое изображение фото-
графируемого предмета, Дагерр ставил серебряную пла-
стинку; на поверхности последней с помощью паров иода
он получал небольшое количество йодистого серебра.
В фотографической камере линза вместе со светочувст-
вительной пластинкой представляет собой, так сказать,
искусственный глаз, причем светочувствительную пла-
стинку можно сравнить с сетчатой оболочкой (ретиной)
нашего' глаза.
Дагерр, после воздействия света в течение нескольких
часов, получал на фотографической пластинке видимое
изображение находящихся перед камерой предметов. Но
закрепление изображения (фиксирование) представляло
огромные трудности, преодолеть которые помог случай.
Когда иодированную серебряную пластинку, на которую
свет действовал не в течение часов, а лишь очень короткое
время, Дагерр поместил в ртутные пары, то- больше всего
последних осело на тех местах пластинки, которые под-
верглись наибольшему воздействию света; таким образом
на пластинке появилось фотографическое изображение, вос-
произведенное блестящей ртутью. Ртуть «проявила» на
серебряной пластинке изобр- гение, бывшее до тех пор
невидимым для человеческого глаза. Вот чем обусловлен
кажущийся нам теперь таким странным блестящий вид
старинных «дагерротипов».
Таким образом была создана возможность получать «фо-
тографические изображения живых людей». После изобре-
тения Дагерра, для того чтобы сняться, нужно* было сидеть
неподвижно в течение короткого времени. В настоящее
время можно фотографировать людей и во время самого
быстрого движения.
Самое важное в изобретении Дагерра заключается в сле-
дующем. Если человеческий глаз и не замечает никаких
изменений на светочувствительной пластинке, подвергшей-
ся в течение самого короткого времени освещению в ка-
мере-обскуре, то все же действие световых лучей вызвало
уже распад некоторого количества соединений серебра.
И теперь уже не нужно доводить этот распад до конца
продолжающимся воздействием света. Его можно* исполь-
зовать, чтобы с помощью подходящих химических средств
(из которых мы пока узнали только пары ртути) «проя-
16*
243
вить» негативное изображение без дальнейшего действия
света.
Впечатление, произведенное фотографическими сним-
ками, полученными по этому державшемуся в тайне спо-
собу, было огромно. После блестящей речи физика Араго
французский парламент в июле 1839 г. назначил из го-
сударственных средств Дагерру и его сотруднику Ньепсу
пожизненную пенсию с тем, чтобы они опубликовали свой
способ. Вскоре после этого начались поиски подходящей
замены для дорогих серебряных пластинок. Тальбот с
успехом использовал вместо них в камере-обскуре свою
светочувствительную бумагу. Исходя из изобретения Да-
герра, он стал применять взамен хлористого серебра йоди-
стое серебро, которое получал погружением бумаги в
раствор серебра и последующим проведением ее через
раствор йодистого калия. Для удаления из освещенной
бумаги оставшегося неразложенным йодистого серебра
Тальбот воспользовался (вместо применявшегося им раньше
кипящего раствора поваренной соли) раствором серновати-
стонатриевой соли, обычно называемой гипосульфитом. Эта
соль очень легко растворяет уже на холоду как хлористое
серебро, так и бромистое и иодистое серебро; с тех пор она
и служит повсюду для этой цели.
Но на снимках, полученных по способу Тальбота, очень
неприятно давала себя чувствовать шероховатость, при-
сущая даже лучшим сортам бумаги, почему дагерротипы на
полированных серебряных пластинках должны были, каза-
лось, победить. Однако положение изменилось с того дня,
когда Ньепс ввел в фотографию раствор белка.
Если прибавить к раствору белка йодистого калия,
облить этой жидкостью стеклянную пластинку и погру-
зить последнюю после высушивания в раствор азотно-
серебряной соли, то на стекле получится вполне гладкий
слой белка, обладающий светочувствительностью благодаря
содержанию йодистого серебра. Такие пластинки позво-
лили уже получать превосходные снимки.
Уменьшенные изображения на снимках, полученных с
помощью камеры-обскуры, представляют собой, следова-
тельно, негативы (рис. 44). Для получения позитива, т. е.
прямого изображения снятого предмета, негативы копируют
на светочувствительной бумаге подобно тому, как это делал
раньше Тальбот с рисунками. Светочувствительная бу-
244
мага для копирования негативов также готовилась нане-
сением на бумагу светочувствительного слоя белка; благо-
даря гладкости и блеску^ изображения на такой бумаге
были превосходного качества.
Неприятная склонность растворов белка к загниванию
привела позже к замене его коллодием (эта замена была
предложена Фрайем). Коллодий представляет собой рас-
твор нитроклетчатки в смеси эфира и спирта. Его название
произошло оттого, что этот раствор Маннар сначала реко-
мендовал в качестве склеивающего средства и поэтому на-
звал его коллодием (от французского colle—клей).
Рис 44. Негатив и позитив
Невидимое для глаза изображение, которое получается
на пластинке после короткого ее освещения, Дагерр про-
являл когда-то с помощью ртути. Само собой разумеется,
что оно должно быть и может быть проявлено, как мы уже
говорили, и па применявшихся позже серебряных пласти-
нок стеклянных пластинках, покрытых светочувствитель-
ным белковым или коллодионным слоем. Служащие для
этого' вещества называют общим именем—«проявители».
Сначала в качестве проявителей пользовались щавелево-
железистой солью и пирогаллолом, позже стали приме-
нять с этой целью самые различные другие химические
245
соединения, из которых особенно пригодным оказался гид-
рохинон.
При коллодионном способе стеклянную пластинку по-
крывали с одной стороны слоем коллодия, содержавшего
бромистый и иодистый калий, и погружали ее затем в раст-
вор азотносеребряной соли. После этого мокрую пластинку,
на которой была, следовательно, смесь бромистого и йоди-
стого серебра, а также задержавшийся излишек азотносе-
ребряиой соли, помещали в камеру и производили снимок.
Когда затем экспонированную пластинку опускали в тем-
ной комнате в раствор пирогаллола, то последний восста-
навливал серебро из излишка азотносеребряной соли (на,
бромистое и йодистое серебро пирогаллол не действует).
Выделявшееся при этом порошкообразное серебро (как пары
ртути при способе Дагерра) осаждалось па подвергшихся
освещению в камере-обскуре местах пластинки соответ-
ственно силе их освещения; таким путем становилось види-
мым негативное изображение.
Фиксирование негатива, т. е. удаление из него неизме-
ненного действием света йодистого и бромистого серебра,
производится погружением в раствор гипосульфита, кото-
рый растворяет их.
Попытки изготовления сухих коллодионных пластинок,
пригодных для длительного хранения, остались безуспеш-
ными, и приходилось работать с мокрыми пластинками,
которые только что были погружены в раствор азотносе-
ребряной соли.
Но в 60-х годах прошлого столетия Руссель сделал за-
мечательное наблюдение. Он иаше.л, что так называемое
скрытое изображение, полученное при экспонировании пла-
стинки в камере-обскуре, может быть сделано видимым и
без осадка серебра), Образующегося из излишка азотносе-
ребряной соли. Для этого нужно полностью отмыть водой
из мокрой пластинки всю задержавшуюся на ней азогно-
ееребряную соль, экспонировать пластинку в камере-об-
скуре и погрузить ее затем в «щелочной» раствор пиро-
галлола (т. е. в раствор пирогаллола, к которому
прибавлена щелочь). Такой раствор, как оказалось, раз-
лагает бромистое и иодистое серебро пропорционально сте-
пени освещения в камере, чего не в состоянии сделать рас-
твор пирогаллола без щелочи. Этим путем изображение
получается в отсутствии излишка серебра; проявленный
848
негатив нужно потом только отфиксировать в гипосуль-
фите, чтобы удалить неразложившееся бромистое и йоди-
стое серебро.
Таким образом подошли уже гораздо ближе к возмож-
ности изготовления сухих пластинок, так как теперь не
нужно было иметь на пластинке необходимый раньше из-
лишек раствора азотносеребряной соли; другими словами,
экспонируемая пластинка не должна была больше быть
мокрой. Вскоре, кроме того, было еще установлено, что
щелочной раствор пирогаллола гораздо лучше действует
на бромистое серебро, чем на иодистое; это наблюдение
послужило основой того большого значения, которое при-
обрело бромистое серебро в современной фотографии.
В 1871 г. Мэддокс предложил применять для пластинок
вместо коллодия желатину; с помощью желатины и до
настоящего времени изготовляют сухие пластинки, кото-
рые так давно уже стремились иметь фотографы. Но изо-
брел сухие пластинки собственно Беннет в 1878 г. Он
показал, что готовая, так называемая броможелатинная
эмульсия приобретает свою высокую светочувствитель-
ность только лишь после нагревания; этот факт имеет
здесь решающее значение.
Способ изготовления сухих пластинок заключается в
следующем.
* Приготовление эмульсии начинается с размачивания
желатины проточной водой. После того как желатина раз-
бухнет, к ней прибавляют в сосуде водный раствор броми-
стого аммония (иногда бромистого калия) и йодистого ка-
лия. После этого сосуд переносят в помещение, освещае-
мое только красным светом, и ставят его там на водяную
баню (которая нагревает, как известно, не выше 100°).
Когда желатина расплавится, то для равномерного рас-
пределения солей ее тщательно перемешивают и только
лишь тогда приливают раствор азотносеребряной соли, при-
чем образуется бромистое серебро. Затем полученную
эмульсию нагревают 1—2 часа при температуре 85—50°;
в это время эмульсия «созревает», т. е. приобретает высо-
кую светочувствительность. После созревания эмульсию
охлаждают, тщательно промывают в течение нескольких
часов холодной водой, подвергают при 35—40° вторичному
созреванию (от часа до нескольких дней), фильтруют (для
удаления слишком крупных верен бромистого серебра,
247
пыли и т. п.) и лишь после всего этого применяют для
полива пластинок. *
Последние быстро высушиваются после полива в сушиль-
ных шкафах, и они готовы к употреблению.
Пластинки упаковываются затем в темном помещении
таким образом, что исключается всякая возможность дей-
ствия на них света вплоть до момента употребления. По-
добные сухие пластинки обладают примерно в десять раз
большей светочувствительностью, чем прежние мокрые
коллодионные пластинки.
После открытия способа изготовления сухих пластинок
началось широкое распространение любительской фото-
граф ии. Самое трудное раньше в области фотографии—из-
готовление светочувствительных пластинок—перешло из
рук отдельных фотографов к специальным фабрикам.
Сухая пластинка легко дает в снабженной хорошей лин-
зой камереьобскуре отличные негативы. Ее светочувстви-
тельность, как известно, настолько велика, что позволяет
делать на открытом воздухе моментальные снимки1. Крат-
ковременное воздействие света вызывает на освещенных
в камере местах пластинки начинающееся разложение бро-
мистого серебра. На пластинках, вынимаемых в темной
комнате (при красном свете), это разложение еще неза-
метно для глаза; его доводят до желаемой степени с по-
мощью проявителя. Когда изображение проявлено и соот-
ветствующая сила его достигнута (в чем убеждаются
осмотром пластинки в темной комнате при красном свете),
пластинку кладут в раствор гипосульфита для удаления
из нее неразложившегося бромистого серебра. После про-
мывания водой негатив готов. Изготовляя с него отпен
чатки на светочувствительной бумаге, содержащей серебро,
мы получаем те изображения, которые называются фото-
графиями.
Следовательно, фотография основана на химическом воз-
действии света на такие соли, которые под его действием
разлагаются; в настоящее время в качестве такой соли
применяется главным образом бромистое серебро.
Из физики известно, что белый свет является сложным
И состоит из смеси различных цветов (так называемых ра-
1 Теперь изготовляются и такие светосильные объективы, которые позво-
ляют производить моментальные снимки и в помещениях. (11рим. перев.)
248
дужйых цветов). Если разложить белый свет с помощью
призмы на составные цвета и сфотографировать обычным
способом полученный спектр, то мы увидим следующее:
красная часть спектра не оказывает никакого действия
на фотографическую пластинку, в то время как наиболее
сильное действие наблюдается на другом конце, т. е. в
фиолетовой и ультрафиолетовой частях (ультрафиолетовой
называют ту часть спектра, которая непосредственно при-
мыкает к фиолетовой и невидима для человеческого глаза,
т. е. представляется ему черной; однако на фотографиче-
скую пластинку ультрафиолетовая часть оказывает дей-
ствие). Различное действие разных цветов спектра на све-
точувствительную пластинку делает для нас понятным тот
факт, что проявление вынутых из камеры пластинок, столь
чувствительных к белому свету, можно производить в
темной комнате при красном свете. Этим объясняется так-
же и то, что красные, желтые, даже зеленые цвета очень
мало действуют на фотографическую пластинку, что
создает большие препятствия, например, при репродукции
масляных картин, и дает себя неприятно чувствовать и
при снимании портретов.
Однако Фогель нашел, что указанный недостаток можно
устранить слабым окрашиванием определенными красите-
лями самих светочувствительных пластинок. Тогда они
становятся чувствительными и к таким цветам, которые
без этого на них не действовали. Применение их дало
возможность получать прекрасные фотографические ре-
продукции с цветных картин; современные репродукции
отличаются превосходными качествами, в то время как на
прежних, или на сделанных с помощью обыкновенных
фотопластинок, целые части картин переданы с непра-
вильной градацией тонов1.
Таким образом задача правильной фотографической
репродукции цветных объектов в различных оттенках чер-
ного цвета с применением цветочувствительных власти-
1 Фотографические пластинки, чувствительные к зеленому и желтому
цветам, называются ортохроматическими, а чувствительные, кроме того,
и к красному цвету — панх- оматическими. Нужно, однако, заметить, что
такие пластинки сами по себе еще не дают вполне правильной градации
тонов, соответствующей оптической яркости цветов, это достиг ется лишь
с помощью одновременного применения светофильтров - плоскопараллельных
пластинок, окрашенных специальными красителями. (Прим, перев,)
249
нок может считаться в основном разрешенной. Но совсем
другой задачей является, однако, получение собственно
цветных фотографий. Об удачном разрешении ее в 1907 г.
мы сейчас расскажем подробнее.
Превосходные окрашенные изображения цветных объек-
тов можно получить с помощью давно известного способа
пигментного печатания, который, однако, как показывает
само название, не является чисто фотографическим спо-
собом. Заключается он в следующем.
Кроме упомянутых нами до сих пор светочувствительных
солей существуют еще различные светочувствительные
смеси. Если добавить, например, к раствору желатины
раствор двухромовокалиевой соли, покрыть этой смесью
какой-нибудь предмет и выставить его на солнечный свет,
то желатина, обычно столь легко растворимая в воде,
очень быстро сделается совершенно нерастворимой. При-
чина этого явления заключается в том, что двухромово-
калиевая соль под действием света частично изменяется
с выделением окиси хрома, которая оказывает на жела-
тину дубящее действие и переводит ее в нерастворимое
состояние.
Положим полученный обыкновенным фотографическим
способом негатив какого-нибудь изображения на бумагу,
покрытую в темной комнате хромовой желатиной, и выста-
вим на свет. В тех местах бумаги, куда проникнут лучи
света, желатина сделается нерастворимой. Если из бумаги
вымыть затем водой в темной комнате неподвергшуюся
действию света желатину, то получится изображение; но
оно не будет, конечно, темным, как на бумагах, содержа-
щих серебро. Такое изображение мало заметно, так как
оно имеет лишь цвет желатины.
Но ж|елатиН’у можно ведь предварительно окрасить
каким-нибудь Подходящим пигментом (красящим веще-
ством). Желтая желатина дает тогда желтое изображение,
голубая—голубое, красная—красное. Если наложить три
изготовленные таким способом прозрачные изображения
различного цвета друг на друга (это можно сделать со-
вершенно точно, так как вое они получены! с 'одного и того
же негатива), то эффект, объясняемый теорией смешения
цветов, получится поразительный.
Однако как ци прост кажется этот способ в, нашем изло-
жении, в действительности для получения хороших
Я50
результатов здесь приходится преодолевать большие труд-
ности.
Часто работают и так: делают с объекта один за другим
три снимка на трех различных пластинках, причем в. пер-
вый раз перед объективом камеры помещают красное
стекло, во второй.раз синее и в третий—желтое. С получен-
ных негативов печатают позитивы, причем каждый из
них окрашивают в тот цвет, с помощью которого была
сделана цветочувствительной соответствующая пластинка.
Затем позитивы накладывают друг на друга1.
Кроме рассмотренных, существует -еще целый ряд других
способов репродукции. Поскольку их основой, как и пиг-
ментного печатания, является полученный в камере-
обскуре негатив (т. е. изготовленное фотографическим пу-
тем с помощью солей серебра изображение предмета),—
постольку и сами эти способы являются истинными дети-
нцами фотографии.
Многочисленные первоклассные исследователи много лет
работали над разрешением упомянутой выше задачи непо-
средственного фотографирования предмета в его натураль-
ных цветах. Но в доступной для всех форме эту задачу
удалось разрешить только братьям Люмьер в 1907 г. Для
изготовления своих пластинок они тесно перемешивают
две части крахмальных зернышек, окрашенных в зеле-
ный цвет, с одной частью зернышек, окрашенных в крас-
ный цвет, и с одною такою же частью, окрашенной в
синий цвет. Готовая смесь, имеющая почти белый цвет,
наносится на покрытую клеющим веществом пластинку из
зеркального стекла и притом так, что ни одно- зернышко
не покрывает другого. Равномерное распределение зерны-
шек достигается с помощью пресса, и они образуют тогда
сплошной слой. Этот слой, представляющий собой свето-
фильтр, лакируется, а на слой лака наносится затем цвето-
чувствительная броможелатинная эмульсия.
Приготовленная этим путем сухая пластинка вставляет-
ся при снимании в камеру непокрытою эмульсией сторо-
ною к -объективу так, что свет из объектива, прежде чем
достичь эмульсии, должен пройти через стеклянную пла-
стинку и светофильтр из крахмальных зернышек. При
1 Пластинки при этом способе берут цветочувс гвительные, а позитивы
печатают на тонких прозрачных пленках. (Прим, иерее.)
£51
проявлении такой пластинки получают цветную фотогра-
фию, которая в отношении блеска красок едва ли оставляет
желать чего-нибудь лучшего.
Описанный способ настолько прост в выполнении, что
им могут пользоваться без затруднений и фотографы-люби-
тели. С 1910 г. в продаже появились и пленки для цвет-
ной фотографии.
Конечно, при цветной фотографии получается только
одно изображение, которое нельзя уже копировать.
Фотография является весьма ценным вспомогательным
средством на службе науке. Здесь мы остановимся только
еще на фотографировании с помощью рентгеновых лучей.
Мы все знаем, что электрическая искра, проскакиваю-
щая через воздух в виде молнии или произведенная элек-
трической машиной, идет не прямым путем, а зигзагами.
Причиной этого явления служит сопротивление воздуха.
Возьмем стеклянную трубку, в оба конца которой впаяны
проволоки, служащие электрическими полюсами, и выка-
чаем из нее насосом воздух до давления в одну тысячную
атмосферы; при пропускании тока через такую трубку
вообще уже не проскакивает никакой искры между полю-
сами. Запаянная с обоих концов трубка, сопротивление
воздуха внутри которой очень ничтожно, под влиянием
электричества начинает вместо этого светиться по всей
своей длине цветным светом; окраска этого света зависит
от природы того разреженного г за, который наполняет
трубку. Такие трубки называются по имени знаменитого
немецкого мастера-стеклодува, который впервые изготовлял
их в очень совершенном виде, гейслеровыми трубками.
Если, однако, разредить в таких трубках воздух до дав-
ления меньше одной миллионной атмосферы (т. е. добиться
гораздо большего разрежения, чем в гейслеровых труб-
ках), то при пропускании через них электричества будут'
наблюдаться уже другие явления. Теперь не будет уже
светиться вся трубка, а лишь из того полюса, который назы-
вается катодом, будут исходить в виде пучка лучи, полу-
чившие название катодных лучей; на другом полюсе
(аноде) световые явления при этом почти незаметны.
При применении сосуда такой формы, какая представлена
на рис. 45, катодные лучи вообще не пойдут больше в
252
аноду, а будут распространяться дальше в направлении,
перпендикулярном к месту их входа. Анод при этом не
будет оказывать на них влияния. Там, где катодные луни
встречают противоположную стенку сосуда, образуется
светлое пятно, причем катодные лучи частично дают
рентгеновы лучи.
В 1895 г. Рентген предпринял иссле-
дование катодных лучей вне той
трубки *, в которой они возникали,
и производил эти опыты в темном
помещении. Он закрывал всю трубку
целиком черной материей и помещал
в направлении невидимых теперь ка-
тодных лучей бумажный лист, покры-
тый раствором бариевой соли плати-
НИСТОСИНерОДОВОДО'рОДНОЙ кислоты.
Этот экран начинал тогда флюорес-
цировать, (светиться) желтым светом
и, следовательно, внезапно стано-
вился видимым в темной комнате.
Здесь обнаруживалось, значит, новое,
в высшей степени замечательное дей-
ствие лучей, которые должны были
•исходить из вполне закрытой и по-
этому невидимой трубки. Обнаружи-
лось, следовательно, существование
нового вида лучей, воспринимаемых
человеческим глазом не непосред-
ственно, а лишь в форме вызываемых
Рис. 45. Направление
катодных и рентгеновых
лучей
ими явлений флю-
оресценции.
Флюоресценцией называют свойство некоторых веществ,
к которым принадлежит и бариевая соль платинистосинеро-
доводородной кислоты, превращать ультрафиолетовые лучи
в видимые световые лучи1 2. Например слабое зеленоватое
1 Сначала Рентген пользовался трубками такой формы, какая изображена
на рис. 45. С тех пор рентгеновские трубки подверглись значительным
усовершенствованиям. Но так как основной принцип их устройства остался
тот же, то мы здесь приводим старую, но в то же время наиболее нагляд-
ную форму трубки.
2 Флюоре‘ценцией называют собственное свечение тела под влиянием
освещения вообще, продолжающееся только во время освещения или лишь
253
Рис. 46. Рентгеновский снимок
шрапнельной пули, застрявшей
в ступне ноги
свечение большинства сортов керосина основано на флюо-
ресценции. Вновь открытые рентгеновы лучи, так же как
и содержащиеся в обычном свете давно уже известные
ультрафиолетовые лучи, тоже вызывают явления флюорес-
ценции.
Флюоресцирование бариевой соли платинистосинеродово-
дородной кислоты в темном помещении могло иметь своей
причиной только вполне закры-
тую трубку, в которой возникали
катодные лучи. Флюоресценцию
мог здесь вызывать лишь такой
вид лучей, который возникает в
трубке вместе с катодными луча-
ми, но отличен от последних; эти
лучи наш глаз не в состоянии
воспринимать, иначе они осве-
щали бы темное помещение. Кни-
га или деревянная доска, поме-
щенные на продолженном напра-
влении пути катодных лучей, не
препятствовали свечению поме-
щенного за ними бумажного ли-
ста, покрытого раствором барие-
вой соли платинистосинеродово-
дородной кислоты. Следователь-
но, новый вид лучей может про-
никать и сквозь эти препятствия.
Когда Рентген поместил на
место экрана, покрытого барие-
вой солью пластинистосинеродоводородной кислоты, фото-
графическую сухую пластинку, то после проявления ее
он обнаружил, что эти невидимые для глаза лучи дейст-
вовали на пластинку в совершенно темной комнате так
же, как действует на нее обыкновенный, видимый свет;
следовательно, с помощью новых лучей можно тоже полу-
чать фотографические изображения. Между фотографиче-
ской пластинкой и трубкой Рентген начал тогда помещать
чрезвычайно короткое время после него. Поэтому флюоресценция может
вызываться не только светом, содержащим ультрафиолетовые лучи, но п
другим свеюм, свободным от этих лучей, например желтым, зеленым ит.д.
(Прим, персе.)
254
гораздо более плотные предметы, [чем бумага и дерево:
после проявления пластинки обычным способом на ней
были видны изображения этих предметов.
Так как новые лучи проходят через сравнительно мяг-
кие мышцы, но задерживаются гораздо более плотными
костями, то, например, от кисти руки, помещенной на пути
рентгеновых лучей, на фотографической пластинке полу-
чается изображение скелета кисти. Рентгеновы лучи про-
ходят здесь через мышцы так же, как обыкновенный свет
проходит через стекло, и задерживаются костями так же,
как обыкновенный свет задерживается каким-нибудь мало
прозрачным предметом (рис. 46).
Ввиду того, что рентгеновы лучи не преломляются лин-
зами, все получаемые с их помощью фотографии пред-
ставляют собой лишь точные теневые изображения соот-
ветствующих предметов в натуральную величину. Этим они
резко отличаются от обычных фотографий, где на пло-
щади в несколько квадратных сантиметров можно передать
изображение целого ландшафта, благодаря тому что обы-
кновенные световые лучи преломляются линзами.
Невидимые для человеческого глаза рентгеновы лучи
действуют, следовательно, на светочувствительные соли
серебра так же, как и обычный свет, т. е., другими сло-
вами,—в отношении этого чисто химического действия они
сходны с солнечным светом. Но они не представляют собой
чего-нибудь вроде ультрафиолетовых или ультракрасных
лучей, т. е. тех составных частей обычного света, которые
мы не можем непосредственно воспринимать, но которые
преломляются линзами и отклоняются призмами. Они не
являются и светом! в обычном смысле слова, так как мы их
не видим. Наконец, они не могут быть и катодными лу-
чами, так как последние, как и обычный свет, светятся в
трубке; катодные лучи, падая на стеклянную стенку рент-
геновой трубки, служат лишь причиной возникновения
рентгеновых лучей.
Следовательно, рентгеновы лучи представляют собой не-
что совершенно новое. ☆ Они являются одним из видов
электромагнитных волн, подобных световым волнам, но бо-
лее коротких, чем световые. ☆ Какую огромную ценность
имеют они для науки и жизни, в этом мы убеждаемся все
больше и больше с каждым днем. Неизмеримо важное зна-
255
чение приобрели рентгеновы лучи в хирургии, где с их
помощью просвечивают переломы костей, чужеродные тела
в организме и т. д. Широко применяют их и для распозна-
вания некоторых болезней; они играют также выдающуюся
роль как лечебное средство при кожных заболеваниях, на-
пример волчанке, при раке и др.
* Рентгеновы лучи имеют также широкое техническое
применение для просвечивания металлических изделий с
целью обнаруживания в них различных дефектов, для
анализа металлов и сплавов и т. д. В науке с их помощью
достигнуты поразительные результаты в области иссле-
дования кристаллического состояния вещества, в опреде-
лении расположения атомов различных веществ и пр.*.
В 1896 г. французский ученый Беккерель задался во-
просом: не существует ли обратного порядка явлений в
связи с рентгеновыми лучами, т. е. нельзя ли, основываясь
на том, что рентгеновы лучи вызывают флюоресценцию,
получить рентгеновы лучи, исходя из явлений флюорес-
ценции. Для выяснения этого вопроса он клал самые раз-
личные флюоресцирующие вещества на фотографическую
пластинку, защищенную от действия обычного света чер-
ной бумагой. При этом он нашел, что химические соедине-
ния элемента урана действуют сквозь черную бумагу на
фотографическую пластинку: на ней после проявления
получается’их отпечаток. Следовательно, соединения урана
должны испускать какие-то неизвестные до сих пор лучи.
Эти лучи показали свое отличие от рентгеновых, напри-
мер, уже в том, что при снимании с их помощью фото-
графии руки хотя и получается контур последней, но кости
на изображении остаются невидимыми.
Начались поиски других подобно же действующих радио-
активных веществ (от слова radius, что значит луч). Ока-
залось, что в особенно ярко выраженной форме этим свой-
ством обладает минерал, называемый урановой смоляной
обманкой, который богат содержанием урана и встречается
в Иоахимстале (Богемия). В состав этого минерала входят
соединения целого ряда химических элементов. При его
разложении были добыты соединения сильно радиоактив-
ного элемента, который был назван открывшими его фран-
цузскими исследователями супругами Кюри радием. За-
пасы этого драгоценного вещества на земле чрезвычайно
ограничены. До сих пор его добыто всего около 300 г.
256
1 г радия ЮценйвШгся в настоящее время Около 100 тыс.
зол. руб. До 1928 г. во воем мире было добыто всего
лишь около 600 г радия * .
Самым удивительным в радие является то, что он не-
прерывно распадается, допуская при этом в высшей сте-
пени замечательные лучи. В результате излучения здесь
образуется вещество с особыми свойствами, подучившее
Мария Кюри
название эманации радия. Когда удалось установить, что
эманация представляет собой газ, то стало ясно, что она
является особым видом вещества.
Эманация радця содержится во всех тех минеральных
источниках, которые издавна славились своими особенно
целебными для человека свойствами. Но последние не
могли быть, однако, раньше объяснены на основании иссле-
дования химического состава вод этих источников. Тайна
целебного Действия вод Гаштейна, Баден-Бадена, Крейц-
17 Химия повседневной жизни.
257
наха.1 и других объяснилась только с открытием присут-
ствия в них эманации радия. Вместе с тем стал понятным
и тот факт, что эти воды обладают целебным действием
лишь в местах своего природного местонахождения: эма-
нация оказалась очень мало устойчивым веществом,—в те-
чение короткого времени она исчезает из воды.
Радиоактивное излучение действует чрезвычайно сильно,
даже разрушающе, на кожу, почему оно теперь подобно
рентгеновым лучам играет значительную роль при лечении
кожных болезней или заболевании расположенных неглу-
боко под кржей частей организма.
1 Курорты с минеральными источниками—первый в Австрии, другие два
в Германии. {Прим, перев.)
ЛЕКЦИЯ ОДИННАДЦАТАЯ
Благородные и неблагородные металлы. Руды, Золото. Платина. Цар-
ская водка. Серебро. Соотношение между ценностью золота и серебра.
Золотая валюта. Восстановление окислов металлов. Чугун. Сталь. Ков-
кое железо. Доменная печь. Кокс. Пудлинговый процесс. Прокатное ж -
лево. Рельсовые пути. Цементная сталь. Тигельная сталь. Бессемеровская
сталь. Зеркальный чугун. Марганец. Освобождение железа от фосфора.
Литая сталь. Газообразное топливо. Использование торфа. Регенератор.
Пламенные печи. Цинк. Гальванопластика. Калий. Натрий.* Алюминий.
Железо, свободное от углерода.
Мы разделяем обычно все металлы на две большие
группы: так называемые «благородные» и «неблагородные»
металлы. Главное различие между этими группами заклю-
чается в том, что благородные металлы очень мало подда-
ются воздействию других простых веществ, главным обра-
зом кислорода и серы, в то время как неблагородные Легко
химически соединяются с кислородом и серой.
Поэтому благородные металлы встречаются большей ча-
стью на земле в самородном состоянии, и добывать их
сравнительно легко. Неблагородные металлы, напротив,
в течение огромного промежутка времени существования
Земли успели превратиться в окислы металлов (соединяясь
с кислородом) или в сульфиды (соединяясь с серой),
а то даже и в гораздо более сложные соединения.
Для того чтобы неблагородные металлы могли служить
потребностям человека, их нужно р помощью какого-либо
процесса выделить из природных соединений. Если такие
природные соединения встречаются в больших скоплениях,
выгодных для технического получения из них соответ-
ствующих металлов, то их называют металлическими
рудами.
Золото и платина, которые являются и в химическом
смысле благородными металлами, встречаются на земле
17* 859
почти только в самородном состоянии. Золото, а также
платину, находят в речных песках или вообще в песчаных
породах, откуда они извлекаются с помощью промывки
водой. Такие пески, содержащие золото, называют россы-
пями. Если же золото включено в твердую породу, то
породу дробят, размалывают и извлекают из нее металл
промывкой водой или же с помощью ртути или цианистого
калия, которые растворяют золото.
Так, например, золотоносные породы в Южной Африке,
содержащие на каждые 1000 кг примерно 15—20 г золота
ценностью в 40—50 марок (18,5—23 зол. руб.), перераба-
тывались следующим образом. Материал, к которому доба-
влялись вода и ртуть, измельчался в толчеях. Золото при
этом растворялось в ртути. Получившуюся золотую амаль-
гаму подвергали дистилляции, причем ртуть отгонялась,
а золото оставалось в реторте. Но благодаря особенностям
строения африканской золотоносной породы значительная
часть золота задерживалась после такой обработки в раз-
дробленной породе и, казалось, была потеряна. Но в 1891 г.
Форест изобрел способ извлечения золота из этих отходов
с помощью раствора цианистого калия, который выщела-
чивает из них почти все золото целиком. Для этого отходы
заливаются в чанах слабым раствором цианистого калия,
и через смесь одновременно продувается воздух, окисляю-
щее действие которого необходимо для процесса; золото
переходит тогда в раствор. Отделенная от отходов жидкость
обрабатывается затем цинковой пылью. Цинк переходит
в раствор, вытесняет оттуда золото, и оно снова выде-
ляется в виде металла.
Этот способ оказался настолько рациональным, что те-
перь он используется во многих местах для переработки
бедных золотоносных руд, которые раньше вовсе не могли
эксплоатироваться из-за невыгодности прежних способов
переработки. Он представляет собой, без сомнения, вели-
чайший успех во всей истории золотопромышленности и
явился одной из важных причин огромного роста добычи
золота. С 1910 г. на многих разработках даже совершенно
отказались от промежуточного применения ртути и прямо
выщелачивают мелкораздробленную руду раствором циани-
стого калия *. В настоящее время на практике вместо
цианистого калия применяют почти исключительно циа-
нистый натрий. Кроме того, практиковалось и применение
260
смеси обеих этих солей в различных пропорциях. Наконец,
для ^обработки некоторых трудно перерабатываемых по
этому способу руд стали применять раствор бромистого
циана *. j
Золото имеет в мировом хозяйстве двоякое значение.
Часть его, меньшая (около 40%), потребляется на раз-
личные технические надобности—в ювелирном деле, зубо-
врачевании, в часовом производстве и т. п. Большая же
часть золота (около 60%) идет на нужды денежного обра-
щения в форме монет и слитков.
* После империалистической войны 1914—1918 гг. миро-
вая добыча золота уменьшилась (как это видно из диа-
граммы на рис. 47), что объясняется истощением месторо-
ждений, падением покупательной силы золота и другими
причинами. Первое место по добыче золота занимает сейчас
Южноафриканский союз, второе—СССР, третье—США и чет-
вертое—Канада. Но в дальнейшем только Канада и СССР
имеют шансы на рост своей золотопромышленности, так
как месторождения других стран начинают уже исто-
щаться. В СССР на пути развития золотопромышленности
приходится преодолевать довольно значительные затруд-
нения, обусловленные главным образом отдаленностью
главнейших районов добычи золота и отсутствием в них
удобных путей сообщения. Значение отдельных,, золото-
261
промышленных районов СССР в добыче золота видно из
следующей таблички (по данным 1927 г.):
в %
Ленский район......................... 40,9
Алдан .................................. 20,0
Урал.................................. 11,6
Сибирь (без Ленского района) и Казакстан ... 10,4
Дальневосточный край и новые районы .... 17,1
Что касается платины, то ее месторождения в СССР на
Урале являются единственными в мире по богатству, не-
смотря на то, что там уже добыто очень большое количество
платины. Не исключена возможность нахождения новых
платиновых районов в Малоисследованных частях Урала.
На втором месте по добыче платины стоит Колумбия (Юж-
ная Америка), дающая около 20%. мировой добычи.
В остальных странах добыча платины незначительна.
Применяется платина для выделки лабораторной посуды
(тиглей, чаш), проволоки; в электротехнике она служит
для изготовления электродов, контактов и пр. Большое
значение имеет платина для получения катализаторов в
химической промышленности (например в контактном про-
изводстве серной кислоты, в производстве азотной кислоты
из аммиака); она применяется также в ювелирном деле,
в зубоврачебной технике и пр.*.
Добывание серебра уже не так просто, чтобы можно было
здесь подробно на нем останавливаться. Поэтому, хотя в
химическом отношении способы добывания серебра очень
интересны и их усовершенствование много содействовало
падению цен на серебро,—мы не будем их здесь рассма-
тривать, тем более, что эти способы применяются только
в |металлургии серебра.
Золото и серебро издавна' служили платежным средством,
почему мы несколько остановимся теперь на взаимном со-
отношении ценностей этих металлов.
Наиболее ранний из дошедших до нас источников о со-
отношении их ценностей относится к 710 г. до н. э. В фун-
даментах дворца короля Саргона в ассирийском городе
Хорзабаде, закладка которых относится к названному году,
были найдены золотая и серебряная пластинки с надпи-
сями. Из этих надписей следовало, что фунт золота по
ценности равнялся в то время 13,5 фунтам серебра. Инте-
ресно, «то приблизительно то же соотношение встречаем
263
мы и в позднейшие времена, например в древнем Риме,
а также в средние века.
Совершенно точное соотношение ценности серебра и зо-
лота известно непрерывно с 1687 г., когда купцы начинают
отмечать цену обоих металлов на лондонской и гамбургской
биржах. По этим записям видно, что в течение почти
двухсот лет, начиная с указанного года до 1874 г., это
соотношение колебалось очень мало; в среднем фунт золота
равнялся по ценности 15,5 фунтам серебра. Но с 1874 г.
положение изменилось. Огромное увеличение добычи се-
ребра, начавшееся в Америке, а затем еще более возрос-
шее в течение некоторого времени в Австралии, выбро-
сило на мировой рынок так много белого металла, что пред-
ложение сильно превысило спрос. Вследствие этого за фунт
золота стали платить до 46 фунтов серебра, вместо прежних
15,5 фунтов.
Из 1 кг золота чеканилось 2784 золотых марки1, 1 кг
серебра стоил в 1914 г. 72 Марки.
Древние греки и римляне долгое время имели вполне
достаточное количество золота для чеканки монет, почему
у их писателей не встречается жалоб на недостаток этого
металла для денежного обращения. Однако так называемое
великое переселение народов, происходившее в первых сто-
летиях нашей эры, разорило все тогдашние культурные
страны и вызвало полный упадок горного дела; постепенно
это привело к истощению прежних запасов золота и со-
временем почувствовался острый недостаток его. Нужда
в золоте вызвала к жизни алхимию, возбудив у исследова-
телей стремление найти, по возможности, способы искус-
ственного изготовления золота, чтобы получить тем самым
это легко перевозимое средство обмена для всех товаров
и наиболее удобную основу всего товарного обращения.
Поставленная цель, как известно, не была достигнута, так
как получение искусственного золота невозможно. Но
благодаря огромной работы, проделанной при этом, накопи-
лось множество химических сведений, из которых разви-
лась потом научная химия.
Только при Карле Великом, в созданном им огромном
государстве, политические отношения около 800 г. опять
настолько установились, что появилась потребность в обще-
1 1 золотая марка = 46,2 коп. золотом. (Цргш. перев.)
263
признанных монетах. Но металлом для их чеканки могло
служить тогда лишь серебро, та!к как необходимого коли-
чества волюта достать было нельзя. Карл Великий создал
новую ‘.монетную систему, названную серебряной валю-
той, так как ее основой служило серебро. Фунт се-
ребра делился на 20 кусков, которые назывались солидами
(шиллингами). Каждый солид делился в свою очередь на
12 частей, называемых динарами (пфенниги, пенсы). Как
мы .видим, это то же самое деление, которое до настоящего
времени применяется в Англии: фунт стерлингов равен
20 шиллингам по 12 пенсов ,в каждом. Но теперь это
деление английских денег является уже чем-то внешним,
так как в прежнее время и в Англии была чисто серебря-
ная валюта, а сейчас там уже больше ста лет существует
золотая .валюта. Основная разница с тем, что было 1100 лет
назад, заключается главным образом в следующем: теперь
золотей фунт стерлингов стоит лишь Юколо 20 зол. марок
(около 9 р. 60 к. золотом), тогда как со времен Карла
Великого и примерно до 60-х и 70-х годов прошлого сто-
летия фунт серебра стоил круглым счетом 90 зол. марок.
Причиной этого падения ценности фунта стерлингов со
времени средних веков послужило то обстоятельство, что
английские короли, когда они испытывали нужду в день-
гах, ухудшали качество монеты. Еще значительно дальше
пошли в этом отношении французские короли: к началу
Великой французской революции они снизили действи-
тельную ценность ливра до 4 зол. марок (около' 2 зол. руб.),
а итальянская лира упала даже до 80 пфеннигов (около
40 зол. коп.).
Золотые монеты начали снова чеканить в Европе впервые
в верхне-итальянских городских республиках (Пива, Ге-
нуя, Венеция). Оживленные торговые сношения этих горо-
дов с Малой Азией доставили им постепенно столько зо-
лота, что его чеканка сделалась выгодной. Начало здесь
положила Флоренция в 1252 г., откуда и пошло название
золотых монет—флорины. Несколько позже появились ду-
каты, которые чеканили итальянские герцоги. В Германии
золотые монеты назывались гульденами.
Пока соотношение ценности серебра и золота почти не
колебалось, следовательно, примерно до 1874 г., было без-
различно, иметь ли фунт золотых монет или 15,5 фунтов
серебряных монет (считая на' чистый вес золота и серебра) :
264
во всякое время можно было обменять золотые монеты на
соответствующее количество серебряных, и наоборот. Это
было время вполне обоснованного биметаллизма. Так как
оба металла из-за их высокой ценности служили подходя-
щим материалом для монет, то государства чеканили зо-
лотые и серебряные монеты в весовом соотношении 1 :15,5.
☆ Но в дальнейшем, когда соотношение стоимостей этих
двух металлов начало резко колебаться, биметаллизм уже
не мог обеспечить нормального обслуживания мирового
рынка. История биметаллизма, как говорит Маркс, пред-
ставляет ряд нарушений, вызываемых коллизией (столк-
новением) между установленным законом отношением стои-
мости золота и стоимости серебра! и действительными коле-
баниями их стоимости—то золото ценилось слишком вы-
соко, то серебро. Металл, цена которого устанавливалась
слишком низко, извлекался из обращения, переплавлялся
и вывозился за границу. Затем отношение стоимости обоих
металлов вновь изменялось законом. Но и новая номи-
нальная стоимость скоро вступала с действительным отно-
шением стоимости в такой же конфликт, как и старая.
Все это вынудило в конце концов перейти к «золотой ва-
люте», при которой за основание всей денежной системы
принимается один металл—золото. Впервые она была вве-
дена в 1816 г. в Англии, а затем постепенно к ней начали
переходить и другие государства с развитой промышлен-
ностью и торговлей. ☆.
Неблагородные металлы добываются из руд, которые по
большей части представляют собой или кислородные со-
единения металлов (окислы) или их сернистые соединения
(сульфиды). Выделение Металлов из их окислов произво-
дится нагреванием последних с урлем в соответствующих
печах. Уголь восстанавливает металл из окисла, что изо-
бражается, например, следующим уравнением: „
FegOg 30 2Fe 300
окисел железа -f- уголь = железо 4- окись углерода.
При получении металлов из сернистых соединений по-
следние сначала обжигаются на воздухе, причем сера сго-
рает в сернистый газ и образуется окисел металла. Вторым
285
рабочим процессом будет восстановление металла нагрева-
нием окисла с углем. Например, процесс добывания цинка
из сернистого цинка происходит следующим образом:
ZnS + зо = so2 + ZnO
1) сернистый цинк -р ислород — сернистый газ -р окись цинка
(соответствующая руда (из
называется цинковой воздуха)
обманкой)
ZnO -j” = ~Н СО
2) окись цинка -f- уголь — цинк -|- окись углерода.
Если сернистый газ выпускается при этом в воздух, то
он портит всю растительность в окрестностях. Поэтому,
в настоящее время его перерабатывают в серную кислоту.
В приведенных выше уравнениях указано, что при вос-
становлении окислов металлов уголь при температуре печи
переходит лишь в окись углерода, тогда как обычно (как
мы видели раньше) он сгорает прямо в углекислый газ.
Так как для понимания дальнейшего совершенно необхо-
димо знать, как взаимодействует углерод с кислородом,
другими словами, как уголь сгорает, то мы остановимся
на этом несколько подробнее.
Причина того, что при получении металлов уголь сго-
рает лишь в окись углерода, заключается в следующем.
Для восстановления металлов из их окислов нужна такая
высокая температура, при которой атом углерода может
уже связаться только с одним атомом кислорода, почему
здесь и получается окись углерода. Молекула этого газа
может потом при подходящих условиях присоединить вто-
рой атом кислорода, и тогда окись углерода превратится
в углекислый газ. Следующие уравнения очень наглядно
изображают эти процессы:
со + о = со2.
1 молекула окиси углерода3-1 атом кислорода=1 молекула углекислого газа
Перейдем теперь к получению железа. Издавна разли-
чают три сорта технического железа:
1) чугун, содержащий от 2,3°/о и более углерода,
2) сталь, содержащая от 1,6°/^ и меньше углерода, но
все же больше, чем
263
3) ковкое, железо, с содержанием около 0,5% углерода1.
Для понимания дальнейшего это нужно твердо за-
помнить.
Чугун относительно легкоплавок и может служить для
литья, но он не обладает ковкостью, так как при нагрева-
нии непосредственно переходит из твердого состояния в
жидкое. Сталь и ковкое железо при нагревании, на-
против, размягчаются и поэтому поддаются ковке. Раз-
мягченная сталь может быть расплавлена только при очень
высокой температуре, а ковкое железо в пламени обычных
печей совершенно не плавится. Выкованные из стали пред-
меты быстрым охлаждением можно закалить, т. е. придать
им большую твердость; предметы же, изготовленные из
ковкого железа, закалки не принимают.
Ковкостью стали и ковкого железа называется свойство
их настолько размягчаться при яркокрасном калении, что
они становятся способными принимать любую форму под
ударами молота или под влиянием давления, оказывае,-
мого на них каким-либо иным способом.
Оба сорта способны также к свариванию. Это значит,
что два стальных или железных куска, находящиеся при
белом калении в мягком, тестообразном состоянии, могут
быть соединены друг с другом в один кусок одной лишь
сильной проковкой, без расплавления и без применения
какого-либо связывающего средства или припоя. Они ведут
себя при этом так же, как два размягченные между паль-
цами куска пчелиного воска, которые давлением можно
соединить в один кусок.
В Настоящее время производится так много ковких про-
межуточных сортов между сталью и ковким железом, что
часто трудно сказать, представляет ли собой данный сорт
сталь или ковкое железо. Поэтому вместо того, чтобы
делить ковкие сорта железа на одаль и ковкое железо,
Лучше будет, пожалуй, различать их в зависимости от
конечного процесса их получения. Ковкие сорта железа
частично получаются превращением: исходного материала
в ковкую массу без помощи плавки. Такие сорта называют
сварочным железом, или сварочной сталью. При других
способах исходный материал подвергается плавке, т. е.
1 Железо с содержанием углерода между 1,6% и 2,3% технического
применения не находит. (Прим, автора).
367
превращению в текучую классу, которая по охлаждении
становится ковкой. Такие сорта носят название литой
стали или литого железа.
Для получения сварочного железа! и стали (когда ма-
териал, следовательно, не подвергается плавке) в настоя-
щее время служат главным образом пудлингование, цемен-
тация и отпуск. Для получения литой стали и литого
железа применяются бессемеровский процесс и способ Си-
менс-Мартена.
Мы уже сказали, что технические сорта железа содер-
жат углерод. Исключение составляет только электролити-
ческое железо, которое начали производить с 1911 г. Все
другие металлы стремятся получить в возможно более
чистом состоянии, так как лишь в этом случае их спе-
цифические качества выступают наиболее резко,—с желе-
зом же дело обстоит иначе. Именно «загрязнение» углеродом
совершенно необходимо для придания железу тех разно-
образных ценных свойств, которые делают его наиболее
применяемым из всех металлов.
Свыше 2,3% углерода железо принимает в себя лишь
при очень высоких температурах, и поэтому в древности
вообще не знали чугуна. Но ковкое железо известно уже
с незапамятных времен. Теперь считают, что способ его
изготовления был изобретен филистимлянами1 примерно
за полторы тысячи лет до начала нашего летоисчис-
ления. !
Уменье получать ковкое ж!ел!езо находилось в полной
зависимости от культурного состояния страны. Так, на-
пример, Цезарь1 сообщает, что когда он пришел в Бри-
танию (это было в середине 50-х годов до н. э.), то золото
и железо были там приблизительно в одной цене, так как
жители обладали лишь небольшими количествами этих
металлов, попавшими к ним от торговцев. Следовательно,
в Англии, в стране, где впоследствии были сделаны ве-
личайшие изобретения в области изготовления железа и
где столетиями его добывали больше, чем в других стра-
нах,—во времена Юлия Цезаря изготовлять железо еще
не умели.
Только в конце XIX в. Англию обогнали по производ-
1 Народ, живший на южном побережьи Сирии. (Прим. перев.)
1 Юлий Цезарь—римский политический деятель, полководец и писатель;
род. в 102 г., ум. в 44 г. до и. э. (Прим, перев.)
268
етву железа СЩА (которые по своей территории гораздо
больше Англии) и вскоре после этого—Германия. Выплавка
чугуна по важнейшим странам показана на рис. 48, а по
СССР—на рис. 49.
О выплавке железа из руд нельзя говорить без одно-
временного рассмотрения способов получения необходимых
для этого высоких температур. Достижение таких тем-
----Великобритания —— Франция
——Германия ------------США
Рис. 48. Выплавка чугуна по важнейшим странам (в млн. т)
ператур в специально сконструированных печах—одна из
интереснейших задач техники. Поэтому в соответствую-
щих местах мы будем описывать и способы применения
горючих материалов для получения высоких темпе-
ратур. 1
Если мы зажжем дрова, уголь или какое-нибудь другое
топливо прямо на земле, то получим лишь мило пригод-
ное колеблющееся пламя, так как недостаточен доступ
воздуха, необходимого для полного сжигания углерода.
Иначе будет обстоять дело, если мы поместим топливо
на снабженное отверстиями основание так, чтобы доступ
269
воздуха к нему был обеспечен и снизу. Этого мы достигаем
сжиганием топлива в топках с колосниками. Если мы
позаботимся, кроме того, о быстром удалении продуктов
горения (т. е. углекислого газа и др.), укрепив над топкой
для усиления тяги достаточно высокую трубу, то устре-
мляющийся через колосники воздух будет поддерживать
равномерное энергичное горение материала. Тяга в трубе
здесь создается потому, что сильно нагретые газы (а имен-
но: образовавшийся при горении углекислый газ, попав-
ший с воздухом! в топку азот и др.) расширяются и ста-
Рис. 49. Рост выплавки чугуна в СССР (в млн. т)
новятся легче, чем окружающий воздух; опи стремятся,
следовательно, подниматься вверх и тем самым постоянно
как бы всасывают в топку .через колосники свежий воздух.
В подобной топке можно уже восстанавливать углем
некоторые металлы из их окислов, но для восстановления
железа она все-таки непригодна. Железо может быть вос-
становлено из окислов только при вдувании в печь воз-
духа, что вызывает очень энергичное горение. Такое при-
способление мы видим у каждого кузнечного горни, где
в огонь вдувается воздух с помощью мехов.
Именно кузнечным горном пользовались в древности
для восстановления железа! из руд, получая, смотря по
способу работы, куски железа или стали. В зависимости
от переработки, которой подвергались окислы железа при
270
этом так называемом сыродутном способе, с железом свя-
зывалось то больше, то меньше углерода, что и обусловли-
вало образование ковкого железа или стали (рис. 50).
Смотря по чистоте руд, которыми пользовались для
работы, и в зависимости от искусства работников, знания
Рис. 50. Сыродутный горн. Рисунок изображает старинный испанский
сыродутный горн, в котором меха заменены механической водяной воздухо-
дувкой. Воздух засасывается падающей по трубе водой через отверстия А,
отделяется от воды в нижнем воздушном резервуаре и отсюда под сильным
давлением поступает в открытую топку горна
и приемы которых переходили по наследству от отца к
сыну, результаты получались иной раз хорошие, а иной
раз и Мало удачные. Слава, которой пользовались по-
всюду дамасские или толедские клинки, объяснялась тем,
что искусство производства стали достигло в этих местно-
271
стах особого расцвета;. Так же объясняется и слава от-
дельных искусных мастеров по обработке железа.
Этот очень древний, давно оставленный способ непо-
средственного получения железа из руды в кузнечном
горне называют, как мы говорили, сыродутным способом.
В сыродутном, т. е. обыкновенном кузнечном горне же-
лезо можно получать только из сравнительно легко1 восста-
Ряс. 51. Домзнная печь (в 1830 г.)
навливающихся железных руд. Но с постепенным рас-
пространением производства железа в различных странах
все сильнее ощущалась нехватка таких руд, почему
пришлось итти по пути усиления жара. Это было до-
стигнуто тем, что горн обложили камнями И превратили
его в шахтную печь (рис. 51), перейдя, таким образом,
от прежних низких печей к высоким, т. о. к домнам.
Теперь тепло пламени не рассеивалось сейчас же в окру-
жающее пространство, а задерживалось раскаленными
272
камнями. Поэтому температура поднималась настолько вы-
соко, что восстановленное в печи железо принимало более
2 % углерода и выходило из печи в виде жидкого чугуна.
Это изобретение было сделано, повидимому, в южной
части Эльзаса, недалеко от нынешнего города Мюльгау-
зена,—по крайней мере наиболее древние куски чугуна,
относящиеся примерно к 1490 г., происходят из этой ме-
стности. Значит, изобретение чугуна совпадает примерно
со временем открытия Америки. Дальнейшее распростра-
нение его изготовления шло довольно медленно. В Англии
чугун начали выплавлять только в 1547 г., в Пруссии
(границы которой тогда значительно отличались от со-
временных) в первый раз он был выплавлен в 1667 г.
Рис. 51 изображает доменную печь, относящуюся при-
мерно к 1830 г., и служит нам лишь для облегчения
понимания процесса выплавки чугуна. Вид современной
доменной печи показан на рис. 52 и 53. В современной
установке имеется около дюжины труб, подводящих воз-
дух, в то время как на рис. 51 мы видим только одну
такую трубу.
На рис. 51 верх печи показан открытым и из него выры-
вается пламя. Теперь и с этим дело обстоит иначе: воз-
дух перед поступлением в домну предварительно подо-
гревается особыми воздухонагревателями и затем вдувается
в печь воздуходувными машинами. Он сейчас же сжигает,
конечно, уголь, с которым встречается в печи, в углекис-
лый газ. Однако раскаленный углекислый газ действует
на лежащие выше горячие слои угля таким образом, что
образуется окись углерода:
со2 + С = 2СО
углекислый газ углерод окись углерода
Следовательно, через верхнее отверстие печи, так Назы-
ваемый колошник, выходит смешанная с азотом из воз-
духа) окись углерода, которая способна гореть. Вместо
того чтобы давать этой смеси, содержащей от 24 до 34%
горючего газа, бесполезно сгорать в воздухе (как это дела-
лось в прежние времена), теперь колошник закрывают
особым кожухом и колошниковые газы улавливают. Часть
их используют для нагревания воздуха, поступающего в
домну (это изобретение принадлежит Фабру дю-Фору),
другая же часть сжигается в топках паровых котлов.
18 Химия повседневной жизни.
273
Рве. 52. Современная доменная печь
Рис. 53. Доменная печь металлургического завода в Обергаузене (Реннская область). Н — доменная печь; А — на-
клонные подъемники; W—воздухонагреватель (каупер); St—пылеуловители для очистки колошниковых газов от бо-
лее грубых пылевых частиц; G-W—промывные башни, в которых колошниковые газы очищаются перед употре-
блением в газовых силовых установках от тонкой пыли; Schl — вагонетки, отвозящие шлаки в отвал
Однако для указанных целей используется не все коли-
чество выходящих из домны колошниковых газов. Поэтому,
Люрман уже в 1886 г. предложил применить их для
газовых двигателей, но осуществлено его предложение было
только в 1898 г. Этот новый источник энергии мощностью
в сотни тысяч лошадиных сил по своей дешевизне может
поспорить с водопадами. Насколько велики количества вы-
деляющихся из домен колошниковых газов, можно видеть
из того, что, например, в 1910 г. из домен одной только
Германии получалось круглым числом 7650 тыс. кубо-
метров газа в час.
Когда железо в печи восстанавливается углем1 из руды,
то металл постепенно опускается вниз. Он доходит до
настолько горячей эоны печи, что воспринимает доста-
точное количество углерода и делается вследствие этого
жидким. После этого металл должен пройти еще ту эону
домны, где в нее вдувается воздух. При царящей здесь
высокой температуре железо снова окислилось бы, если
бы против этого не были приняты особые меры. Окислению
железа препятствуют «шлаки», которые представляют собой
особый вид стекла, т. е. являются, как мы уже знаем,
силикатами.
Вот почему в домну загружают не только уголь и руду,
но еще известняк и глину, (кремнекислый алюминий),
а когда нужно, то и песок. Эти «добавки» (так называемые
флюсы или плавни) меняются в зависимости от примесей,
содержащихся в руде, а также в зависимости от того,
какие подходящие и возможно более дешевые материалы
можно найти в данной местности. Из плавней, чаще всего
применяемых при высокой температуре печи, образуется
двойной силикат кальция и алюминия, следовательно, род
стекла, который и называют шлаком.
Состав смеси для плавней всегда подбирается так, что
они сплавляются в стекло лишь тогда, когда железо успеет
уже вобрать в себя достаточное для превращения в чугун
количество углерода. Это стекло обволакивает тогда от-
дельные капли жидкого металла и защищает его от оки-
сляющего действия вдуваемого в домну воздуха, благодаря
чему металл проходит не окисляясь через раскаленную
1 Главную роль в процессе восстановления играет здесь окись углерода.
(Прим, перев.)
276
зону печи, содержащую много горячего воздуха;. Под эт^й
зоной тяжелый металл отделяется от легкого стекла, они
собираются отдельными слоями и отдельно выпускаются
из печи жидкими. Застывший затем металл носит назва-
ние чугуна, а застывшее стекло называется шлаками.
О применении шлаков для изготовления цемента мы уже
говорили.
Только после изобретения чугуна добывание железа сде-
лалось крупным промышленным производством. Раньше
кузнец на своем сыродутном горне мог получить в день
всего два-три куска железа, весом около 80 фунтов каждый,
и затем он прерывал работу до следующего дня. Совер-
шенно иначе обстоит депо с выплавкой чугуна. Пущенная
раз в ход домна должна гореть день и ночь, иначе в ней
вообще не будет достаточной для выплавки железа тем-
пературы. Вследствие непрерывности процесса она дает
очень большие количества чугуна, почему последний и
сделался дешевым продуктом. Для обслуживания домны
много рабочих посменно работают день и ночь.
Итак, чугун содержит больше 2,3 °/о углерода. Если
удастся выжечь из него часть углерода, то чугун пре-
вратится в сталь или ковкое железо. И это действительно
удается сделать. При нагревании чугуна в кузнечном
горне, куда обильно поступает воздух, он теряет способ-
ность переходить в жидкое состояние и становится тесто-
образным. Смотря по искусству мастера, при этом полу-
чается либо сталь, либо ковкое железо. Гораздо легче
получить во всяком случае последнее, ибо очень трудно
вести процесс так, чтобы в желюзе оказалось как раз
характерное для стали содержание углерода. Для получе-
ния же ковкого железа нужно только возможно полнее
выжечь углерод,—его все же останется еще такое коли-
чество, которое сообщит куску свойства ковкого железа.
Этот способ получения ковкого железа из чугуна называют
«фришеванием» или кричным способом.
Получать ковкое железо фришеванием выплавленного
в домнах чугуна несравненно дешевле, чем добывать его
старым сыродутным способом непосредственно из руд. По-
этому сыродутный способ—наиболее древний способ про-
изводства ковкого железа, который тысячелетиями давал
человеку нужное ему железо и в который не могла внести
каких-либо усовершенствований вся классическая древ-
277
несть,—теперь был сравнительно скоро оставлен. Большая
дешевизна нового способа основывается на том, что при
сыродутном способе 40—50% железа, содержащегося в
руде, уходит в шлаки, тогда как в домне эта потеря
составляет самое большее 4—5%. Вот почему выплавлен-
ный в домне чугун сделался основой всей железоделатель-
ной промышленности вплоть до настоящего времени.
Так обстояло дело уже около 1620 г. К этому времени
производство чугуна получило широкое развитие в Ан-
глии, так как здесь были тогда более подходящие для
этого условия, чем в какой-либо другой стране. Жители
Англии усиленно разрабатывали многочисленные залежи
железных руд, а большое число прорезающих страну рек
облегчало вывоз готового металла во все страны. Это имело
в то время прямо-таки решающее значение для перевозки
больших количеств чугуна, так как тогда еще почти не
знали мощеных дорог, а грунтовые дороги делались не-
проезжими после каждого сильного дождя; вот почему
и выгодное производство чугуна в отдаленных от рек
или морей местностях было невозможным. Такое положение
изменилось только с постройкой железных дорог.
В качестве топлива' для домен долгое время пользова-
лись древесным углем. Вследствие огромного потребления
последнего, в Англии начали заметно уничтожаться леса,
почему повелительно выявилась необходимость перейти к
другому топливу. Если бы в настоящее время вздумали
выплавлять весь чугун на древесном угле, то вое леса
земного шара были бы сожжены за десять лет. Древесный
уголь в Англии можно было бы заменить каменным углем,
но последний не годится для домен. Если мы понаблюдаем,
как он горит, то увидим, что перед сгоранием каменный
уголь наполовину размягчается, так как в жару из него
выплавляются дегтеобразные вещества. В доменной печи
эти полужидкие массы склеили бы отдельные куски друг
с другом, вследствие чего через них не смог бы прохо-
дить вдуваемый воздух и работа домны сделалась бы не-
возможной.
Поэтому каменный уголь начали превращать в кокс,
т. е. нагревать его в закрытых сосудах, где он не может
сгорать из-за недостатка воздуха; другими словами, ка-
менный уголь начали перерабатывать так же, как при-
выкли перерабатывать дерево для получения древесного
278
угля. Этим путем из каменного угля удаляют Все легко-
летучие и легкоплавкие составные части; остаток в сосуда
представляет собой твердое, вполне пригодное для домен-
ных печей топливо.
Около 1700 г. в Англии началось производство чугуна
в изобретенных Дэдлеем домнах, работающих на коксе.
С тех пор добыча чугуна стала сильно возрастать, так
как теперь для нее можно было найти сколько угодно
топлива, а примерно с 1800 г. начался тот огромный рост
этого производства, которому в настоящее время не видно
предела.
Твердость кокса позволяет строить домны до 30 м высо-
той, и содержимое таких печей при работе не сплющи-
вается. Огромную массу сырых материалов, потребляемую
ежедневно подобной домной, старыми способами нельзя
было бы ни подвезти к домне, ни подать к ее верхней
части. Это сделалось возможным только с изобретением
паровых машин и железных дорог.
Доменные печи на древесном угле, вроде работавших,
например, в Штирии (Австрия) около 1800 г., давали
4 т чугуна в сутки. Первая германская домна в Глейвице
(Силезия), которая с 1796 г. работала продолжительное
время на коксе, производила ежедневно 4,5 т чугуна.
Но печи больших размеров давали уже в 1875 г. 100 т,
а теперь до 400 т чугуна в сутки. Для питания такой
печи нужно 1000 т железной руды, 400 т кокса и 330 т
плавней в сутки. Эти материалы наполнили бы 175 же-
лезнодорожных вагонов.
Высшим типом развития современных доменных печей
с такой производительностью является домна, снабжен-
ная броней. Она почти целиком сконструирована из чу-
гуна или стали, под которыми находится слой огнеупор-
ного кирпича толщиной всего в 10 см. Ее железную броню
приходится непрерывно охлаждать, для чего на каждый
квадратный метр поверхности требуется 6 литров воды
в минуту.
В то время как около 1800 г. на выплавку одной тонны
чугуна затрачивалось 8 т кокса, в 1850 г. для этого нужно
было только 3 т, а в 1900 г. лишь 1 т, что составляет
в общем уже предельную достижимую величину.
Какое значение имеет железо в современной хозяйствен-
ной жизни, видно лу,чше всего из следующего факта: уже
279
в 1900 г. стоимость производившегося в мире за год же-
леза в полтора раза превышала стоимость всех других
добытых за это время металлов, включая сюда золото и
серебро,—а ведь железо является самым дешевым ме-
таллом!
Недостаток древесного угля обусловил переход к домнам,
работающим на коксе, прежде всего в Англии. Но полу-
ченный чугун, поскольку он не потребляется для литья,
должен быть переработан на сталь и ковкое железо. Пере-
работка же чугуна на ковкое железо производилась в куз-
нечном горне при сильном дутье (этот способ, как мы уже
знаем, называется кричным способом). При этом углерод
из чугуна выгорает, его содержание падает с 2,5 при-
мерно до 0,5%, и обрабатываемый чугун превращается в
ковкое железо.
В качестве топлива для кричного способа можно при-
менять только древесный уголь, так как некоторые со-
ставные части каменного угля, особенно сера, оказывают
неблагоприятное действие на качество готового продукта.
При переработке чугуна в горне эти составные части все
время находились бы в непосредственном соприкосновений
с железом и в конце концов сделали бы его совершенно не-
пригодным к употреблению.
Следовательно, в то время как давно уже начали полу-
чать большие количества дешевого чугуна в промыш-
ленном масштабе, ковкое железо (которое теперь можно
также называть сварочным железом) оставалось попреж-
нему дорогим продуктом. Происходило это оттого, что,
во-первых, производство его попрежнему оставалось ре-
месленным, ибо нужно было, как и в старые времена,
перерабатывать один за другим отдельные куски чугуна,
а во-вторых,—для получения железа нужен был дорогой
древесный уголь.
Переворот в этой отрасли произвело изобретение Корта,
На которое был взят патент в 1784 г. Корт нашел способ
отделить топку от чугуна во время процесса получения
ковкого железа; таким образом зола топлива не прихо-
дила больше в соприкосновение с железом и не могла
уже оказывать влияния на его качество. Для этой цели
Корт отказался от старинного горна и перенес процесс
280
переработки чугуна .в пламенную печь. Способ Корта,
получивший название пудлингования, применяется и до
сих пор, хотя во многих местах 'теперь устраивают уже
иные топки печей (об этом мы скажем несколько позже).
Следовательно, в пламенной печи, как это видно из
рис. 54, на чугун действует только пламя горящего на
колосниковой решетке топлива. Здесь на' поду печи С,
который отделен от топлива топочным порогом В, можно
нагревать одновременно довольно большое число чугунных
болванок. При систематическом переворачивании послед-
Рис. 54. Пудлинговая пламенная печь. А — колосниковая решетка, на ко-
торой горит топливо; В — топочный порог, отделяющий топливо от пода
печи; С — под, на котором нагревается и пудлингуется чугун; D — отделяет
под от части Е, называемой боровом, через которую газообразные продукты
горения проходят в дымовую трубу F
них ручным способом (по-английски—to pudlle—переме-
шивать) большая часть их углерода постепенно выгорает,
после чего печь дает довольно значительные количества
железа. А так как пудлинговая печь для сохранения высо-
кой температуры должна тоже работать день и ночь, то
и производство ковкого железа сделалось с ее появлением
промышленным процессом. Одно и то же количество рабо-
чих при пудлинговании производит примерно в 10 раз
больше ковкого железа, чем при старом кричном способе,
а кроме того к этому нужно прибавить еще значительную
экономию топлива.
До изобретения пудлингования отдельные куски железа,
полученные сыродутным способом в кузнечном горне, про-
281
ковывали ручным способом или же с помощью молотов
несколько большего размера, работавших от водяного ко-
леса. Поэтому на старинных изделиях из ковкого железа
мы никогда не находим вполне гладких поверхностей.
Даже на предметах, изготовленных из шинного железа
(которое теперь отличается настолько гладкой поверхно-
стью, что она кажется полированной), можно различить
следы отдельных ударов молота.
То большое количество железа, которое давали пуд-
Рас. 55. Прокатные вады
линговые печи, вообще уже
нельзя было обработать ста-
рыми способами проковки.
Поэтому Корт ввел для про-
ковки железа прокатные ва-
лы. Он придавал выходящим
из печи болванкам желае-
мую форму, пропуская их в
раскаленном состоянии ме-
жду двумя валами (рис. 55).
Если оба вала при этом тесно
соприкасаются друг с дру-
гом, и в первом и во втором
сделаны соответственные
кольцевые вырезы, то с их
помощью получается шин-
ное или квадратное железо,
которое выходит совершен-
но гладким. Если вырезать
в верхнем и нижнем валах
соответствующие половины
профиля современного железнодорожного рельса, то
такой прокатный стан будет давать рельсы. Если про-
пускать железную болванку между двумя гладкими ва-
лами, отстоящими друг от друга на некотором расстоя-
нии, то она примет форму листового железа.
Корт, как и многие другие великие изобретатели, не
получил для себя никаких выгод от своих работ. Много-
численные опыты, необходимые для их проведения, по-
глотили все его средства, и он в конце концов умер
в бедности. Но его изобретение имело огромное значение
для развития машинного производства вообще.
В конце XVIII в. Джемс Уатт дзобрел в Англии свою
282
Рис. 56. Йистовои прокатный стан на металлообрабатывающем заводе в Дортмунде. Раскаленный железный блок
продвигается механически приводимыми в движение катками между двумя валами прокатного стана
паровую машину. Однако ее мощность была очень Огра-
ничена, так как необходимый для своих установок пар
Уатт мог получать только в чугунных котлах, которые
тогда еще не умели делать очень больших размеров. Это
изменилось лишь с появлением больших равномерной тол-
щины листов ковкого железа, приготовленных с помощью
прокатки. Теперь можно было клепать и большие котлы,
в которых получалось очень много пара; тем самым уве-
личивалась мощность машин.
Как мы уже говорили, английские рудники были рас-
положены большей частью поблизости от рек. Для облег-
чения доставки туда значительных тяжестей издавна упо-
треблялись деревянные пути. Для их устройства на грунт
укладывали поперечные брусья, а поверх последних клали
длинные бревна. Чтобы не возобновлять постоянно бревен
(между которыми шли лошади), к ним приколачивали
гвоздями доски, по которым и катились колеса; когда
доски изнашивались, их заменяли новыми.
Но вот в 1767 г. железоделательная промышленность
стала испытывать чрезвычайно сильный кризис сбыта. На
одном большом предприятии, где скоро скопился значи-
тельный запас железа, его отлили в длинные пластины.
Чтобы не оставлять железо бесполезно лежать в ожидании
покупателя, эти пластины прибили гвоздями к верхнему
настилу деревянных путей вместо досок. Таким образом
получился своего рода рельсовый путь. Этот опыт дал
блестящие результаты: на гладком железном основании
лошади могли транспортировать гораздо более тяжелые
грузы, чем на досках, причем изнашивание железа было
совершенно ничтожным. И по окончании кризиса не только
сохранился этот первый рельсовый путь, но к постройке
подобных сооружений постепенно перешли и другие пред-
приятия.
Таким образом в буквальном смысле слова было поло-
жено основание для вагонов, передвигаемых паровой тягой.
Первый локомотив, пригодный и для пассажирского со-
общения, был построен в 1812 г. Стефенсоном. Если про-
следить по английским патентам того времени бесчислен-
ные неудачные предложения и связанные с Ними опыты
постройки паровозов, то станет вполне понятным высо-
кое уважение современников к изобретателю, нашедшему,
наконец, правильное разрешение трудной задачи, над ко-
284
торой до тех пор изобретатели работали так много, по
безуспешно. ‘
Ковкое железо после изобретения пудлингового процесса
сделалось легко доступным продуктом, но что касается
стали, этого наиболее ценного технически вида железа,
то здесь обстоятельства все еще оставались очень небла-
гоприятными. Получить сталь из чугуна пудлингованием
так же трудно, как и при помощи старого кричного спо-
соба, хотя теоретически и здесь для этого нет никаких
препятствий. Ведь казалось бы, что для получения стали
нуж'но лишь прекратить пудлингование как раз в тот
момент, когда железо будет еще содержать достаточное
количество углерода,—но технически это невозможно
сделать.
Но уже в конце XVIII в., т. е. задолго до изобретения
пудлингового процесса, на севере Франции был найден
способ изготовления так называемой цементной стали.
Если удастся ввести в ковкое железо столько углерода,
что содержание последнего возрастет с 0,5 до 1,5о/о, то
ковкое железо превратится в сталь (как мы об этом уже
говорили в заключительной части нашего введения к на-
стоящей лекции); на этом принципе и основано изготовле-
ние цементной стали. Для ее получения брусья ковкого
железа, пересыпанные древесноугольным порошком, поме-
щают в ящики из огнеупорной глины, вмещающие около
8 т металла, и нагревают в пламенной печи в течение
6—8 суток до 1000°. При этой операции часть углерода
поглощается железом, и последнее превращается в сталь.
Но, конечно, эта сталь не может быть однородной, так
как верхние ее слои будут более богаты углеродом, чем
нижние. Указанный недостаток стремятся устранить по-
следующей основательной проковкой полученной стали
молотом.
С 1811' г. цементную сталь начали производить и
в Германии.
Скажем теперь о способе превращения чугуна в ковкое
железо путем отжига. Дело в том, что многие предметы,
например многочисленные угольники и тройники, кото-
рые нужны для устройства газовых проводок в домах,
ключи или оконные и дверные приклады и т. и., трудно
285
получить обработкой ковкого железа или стали в кузнеч-
ном горне, и обходятся онй тогда слишком дорого. По-
этому такие сложные по форме предметы изготовляют бо-
лее удобным путем, а именно—литьем; после этого чу-
гунные изделия помещают вместе с окисью железа в огне-
упорные ящики (окись железа применяют здесь в виде
естественных руд) и нагревают в течение 10—20 дней в
зависимости от толщины изделий. Во время нагревания
кислород окиси железа химически взаимодействует с угле-
родом чугуна, сжигая его, вследствие чего отлитые из-
делия становятся беднее углеродом. Когда их по окон-
чании нагревания вынимают из ящиков, то они уже обла-
дают свойствами ковкого железа и могут подвергаться
соответствующей обработке.
Но позже постепенно отжиг был вытеснен стальным фа-
сонным литьем, при котором предметы отливаются прямо
из стали.
Английский часовых дел мастер Гэнстман изобрел в
1730 г. способ изготовления действительно однородной
стали, которую по качеству и в настоящее время превосхо-
дит лишь сталь, полученная электролитическим путем.
Гэнстман выделывал из цементной стали часовые пружины,
причем большая часть их при фабрикации вследствие не-
однородности стали ломалась. При опытах, произведенных
с целью улучшения качества материала, он в конце кон-
цов нашел, что небольшие количества1 цементной стали
можно переплавить в тиглях при очень высокой темпе-
ратуре. Это должно быть для нас понятно: ведь железо,
содержащее 2,3% углерода, т. е. чугун, плавится срав-
нительно легко; почему же, если температура будет под-
нята достаточно высоко, нельзя добиться расплавления
более бедного углеродом железа?
Изобретенная Гэнстманом литая сталь вследствие того,
что она была получена путем расплавления металла, пред-
ставляла собой вполне однородный материал, и при том
такой, который во многих отношениях оказался незаме-
нимым. Способ Гэнстмана оставался тайной нескольких
английских заводов, которые назначали за свою сталь
прямо-таки фантастические цены. И этй цены приходи-
лось уплачивать, так как для некоторых целей нигде
нельзя было найти более подходящего материала. Само
собой разумеется, что во многих местах стремились рас-
286
крыть тайпу изготовления этого сорта английской стали.
С особенным упорством работал в указанном направлении
основатель крупповских заводов, который с 1810 г. пустил
в ход небольшой завод литой стали в Эссене.
Литую сталь этого сорта называют тигельной. По своим:
качествам тигельная сталь не оставляет желать лучшего,
но вследствие большого числа необходимых для ее изго-
товления операций она обходится дорого. Для получения
тигельной стали нужно сначала выжечь из чугуна часть
углерода в пудлинговой печи и превратить ее тем самым
в ковкое железо. После этого ковкое железо приходится
нагревать в течение многих дней с древесноугольным по-
рошком, чтобы оно снова восприняло некоторое количество
углерода и превратилось в цементную сталь. Наконец,
цементную сталь необходимо еще переплавить при очень
высокой температуре в тиглях, вмещающих самое боль-
шее 45 кг металла. И только в новейшее время было
установлено, что безупречную литую сталь можно приго-
товлять переплавкой в тиглях (вместо цементной стали)
гораздо более дешевой стали, полученной по способу Си-
менс-Мартена (о ней подробнее мы будем говорить пе-
сколько дальше).
Способ изготовления дешевой стали, довольно близко
подходящей по качествам к литой тигельной стали, изо-
брел только Бессемер, который в своем докладе 13 августа
1856 г. сообщил пораженным слушателям, что сталь,
стоившую до сих пор 1000—1200 марок (460—550 зол.
руб.) за тонну, можно теперь изготовлять по цене 120—
140 марок (55—65 зол. руб.) за тонну. По способу Бес-
семера жидкий чугун превращается: в литую сталь «без
применения топлива». В то время как пудлинговая печь
перерабатывает за сутки в ковкое железо только з -т чу-
гуна, требуя при этом большого количества угля и много
рабочей силы, бессемеровский процесс превращает 30 т
чугуна в сталь в течение 15 мин.
Для получения стали Бессемер помещал расплавленный
чугун в грушеобразный резервуар (конвертор), дно кото-
рого было снабжено рядом отверстий. Этот резервуар скле-
пывается из железных листов. Чтобы он мог выдержать
высокую температуру, развивающуюся при процессе пере-
работки чугуна, резервуар должен быть выложен изнутри
возможно более огнеупорным материалом, в качестве кото-
287
рого долгое время применяли почти чистую двуокись крем-
ния в виде песчаника.
В наклоненный на бок резервуар, т. н. конвертор или бес-
семеровскую грушу (рис. 57), наливают предназначенный
для переработки на сталь расплавленный чугун. Затем
конвертор ставят в вертикальное положение и с помощью
Рис. 57. Бессемеровская груша
(конвертор). А — подача воздуха
воздуходувных машин вдувают в него через нижние отвер-
стия воздух (рис. 58). Тотчас же из чугуна начинает
выгорать углерод, причем развивается чрезвычайно вы-
сокая температура; тут же выгорает и кремний—химиче-
ский элемент, похожий по своим свойствам на углерод.
Кремний попадает в чугун
при доменном процессе, так
как при высокой температуре
домны часть двуокиси крем-
ния, состоящей из кремния и
кислорода, разлагается, и вос-
станавливающийся при этом
кремний растворяется в же-
лезе. В конверторе окисляется
и содержащийся в железе
марганец; вместе с кремнием
и небольшой частью окислив-
шегося железа он переходит
в шлаки. * Выгорание приме-
сей в конверторе идет в оп-
ределенной последовательно-
сти: сначала горят главным
образом кремний и марганец,
а под конец выгорает преиму-
щественно углерод. После вы-
горания большей части углерода начинает уже гореть
само железо. ☆
Развивающаяся при этом процессе температура, дости-
гающая 1800—2000°, достаточна для поддержания содер-
жимого конвертора в жидком состоянии во все время про-
цесса. Вот почему при бессемеровском способе превращения
чугуна в сталь не требуется Никакого топлива.
В продолжение примерно 10 мин. углерод из чугуна уже
почти полностью выгорает. Но содержимое груши пред-
ставляло бы собой никуда негодный qppr железа, если бы
теперь в него не добавлялось новое количество чугуна,
288
Рис. 58. Бессемеровская груша в действии
и притом такое, что его углерода было бы как раз доста-
точно для того, чтобы смесь этого чугуна и почти обез-
углероженного железа получила характерное для стали
содержание углерода.
Добавляемый чугун намеренно берут богатый марган-
цем—похожим на железо элементом, который восстана-
вливает железо из оставшейся еще в конверторе закиси
железа. Чугун, содержащий марганец, называют зеркаль-
ным чугуном, потому что куски его в изломе имеют зер-
кальную поверхность. В настоящее время, впрочем, суще-
ствуют заводы, изготовляющие чистый металлический мар-
ганец, который также находит применение в бессемеровском
процессе. Сам по себе чистый марганец пока не нашел
технического применения.
Итак, бессемеровский процесс с 1856 г. позволяет вести
массовую выплавку дешевой стали. Теперь превращение
чугуна в готовые стальные рельсы не требует больше ни-
какой затраты топлива: для этого достаточно вылитую из
бессемеровской груши расплавленную сталь после неко-
торого охлаждения подвергнуть прокатке, пока она' еще
находится в раскаленном состоянии. Вот почему для пре-
вращения железной руды в стальные рельсы теперь нужно
всего лишь три часа.
Бессемеровский процесс применим, конечно, только для
чугуна, свободного от фосфора. Но в природе чаще встре-
чаются железные руды, содержащие немного фосфора. Вы-
плавленный из них чугун получается очень плохого каче-
ства, если только содержание фосфора в нем не исчезающе
мало. Такой чугун пригоден разве лишь для самых грубых
литых изделий, от которых не требуется особенной проч-
ности, например, для решеток около памятников и т. п.
О возможности переработки его на сталь или ковкое же-
лезо не приходится и думать, так как вследствие большой
ломкости последние оказались бы совершенно негодными
к употреблению.
Что причиной плохого качества этого чугуна является
фосфор,—это было выяснено между 1830—1840 гг. ана-
лизами соответствующих сортов чугуна. Тогда знали уже
также, что нет никакого средства, которое могло бы вос-
препятствовать соединению фосфора с железом при домен-
ном процессе; такого средства не знают и теперь.
Над разрешением вопроса об удалении фосфора из чу-
290
гуна работали бесконечно много, но все эти работы не
давали сколько-нибудь заметных результатов до тех пор,
пока задача не была окончательно и просто разрешена
Томасом и Гильхристом.
Многочисленные опыты показали, что при бессемеров-
ском процессе—в том виде, в каком его разработал изо-
бретатель,—нельзя удалить из чугуна даже самого
ничтожного количества фосфора. Поэтому фосфор, содер-
жавшийся в чугуне, целиком переходит в стальные бол-
ванки, а значит, и в выделанные из них железнодорож-
ные рельсы, оси, бандажи и т. д. Для рельсов еще
допустимо содержание фосфора от 0,1 до, самое боль-
шее, О,2°/о, но для всех других стальных изделий недопу-
стима даже десятая часть этого количества.
Сырье для старого бессемеровского способа, который мо-
жет применять лишь не содержащие фосфора руды, встре-
чается (поскольку речь идет о снабжении европейских
железоделательных заводов) лишь в виде совершенно сво-
бодных от фосфора красных железняков Кемберленда и
Вестморленда на западном побережья Северной Англии,
а также в Испании, Алжире, Швеции и Штирии1. По-
этому в 1879 г. вызвало огромнейшую сенсацию сообще-
ние, что самому большому в Кливленде железоделатель-
ному заводу (на восточном побережьи Англии), не имев-
шему свободных от фосфора руд, удалось получить в
бессемеровской груше не содержащую фосфора сталь из
фосфористого чугуна.
До изобретения бессемеровского процесса рельсы для
железных дорог выделывали только из ковкого железа,
которое можно добывать лишь из свободных от фосфора
руд. Стальные рельсы в то время вообще не было воз-
можности выделывать. Но такое положение скоро изме-
нилось. Стальные рельсы, которые можно дешево и в
больших количествах производить из бессемеровской стали,
давно уже вытеснили прежние, значительно менее прочные
И долговечные железные рельсы.
На западном побережьи Англии в Кемберленде на основе
1 Свободные или почти свободные от фосфора (так называемые бессеме»
ровские) руды встречаются и в СССР, например на Урале (гора Магнит-
ная, руда горы Высокой и др.), на Украине (Кривой Рог), в Закавказье
(Дашкесанское месторождение), в Сибири (на Алтае) и в других местах.
(Прим. перев.)
291
местных свободных от фосфора руд развилось мощное про-
изводство рельсов из бессемеровской стали; в Кливленде
же, руды которого непригодны для бессемеровского про-
цесса из-за примеси фосфора, о таком производстве не
приходилось думать. Но содержание фосфора в кливленд-
ских рудах очень незначительно и потому оно допускало
производство рельсов из ковкого железа. Однако это про-
изводство, в свое время получившее развитие в Клив-
ленде, должно было прекратиться, так как железные до-
роги постепенно все больше стали заменять железные
рельсы стальными.
Поэтому упомянутый выше завод, расположенный На
восточном побережья Англии, в целях использования
своего оборудования для производства рельсов решил при-
менять в качестве исходного сырья совершенно свободные
от фосфора привозные испанские руды. Из этих руд вы-
плавлялся чугун для бессемеровской стали. Работа завода
пошла вполне успешно, однако организаторы производства
не были удовлетворены достигнутыми результатами; про-
должались усиленные поиски пути, который сделал бы
возможным использование для бессемеровского процесса
находящихся под руками богатых залежей местных руд.
И упомянутым, выще техникам этого завода удалось в
конце концов разрешить задачу следующим образом.
Мы уже отмечали, что в целях необходимой жароустой-
чивости Бессемер облицовывал изнутри (футеровал) свои
груши В'Озможню более огнеупорным материалом, который
содержал много кремнекислоты. В химическом смысле та-
кая футеровка является кислой. Томас и Гильхрист, на-
оборот, применили для футеровки груши материал основ-
ного характера, а именно кирпичи, содержащие много из-
вести. Кроме того, одновременно с чугуном они задавали
в грушу также много извести.
При господствующей в груше высокой температуре угле-
род чугуна сгорает в углекислый газ; сгорает, конечно,
И фосфор, причем образуется ангидрид фосфорной кис-
лоты—пятиокись фосфора. Углекислый газ улетучивается
в воздух, что же касается пятиокиси фосфора, то она, как
вещество вполне огнестойкое, остается в расплавленной
массе. Но так как теперь внутренняя облицовка груши
содержит известь, а кроме того известь задается еще и
в грушу, то пятиокись фосфора химически соединяется
292
с 'известью, образуя фосфорнокальциевую соль, и пере-
ходит в таком виде в шлаки. Этим путем И удаляется
фосфор из получающейся в груше стали.
Таким образом была разрешена задача удаления фос-
фора из чугуна в; бессемеровской груше. Образующиеся
при этом шлаки, содержащие фосфорнокальциевую соль,
в размолотом виде представляют собой томаоову муку,
которая применяется в качестве удобрения в сельском
хозяйстве. Фосфор, прежде бывший досадной помехой при
процессе, теперь получил полезное 'применение, благодаря
чему, производство стали еще удешевляется. Соответствую-
щие заводы даже берут теперь в качестве добавки при
основном процессе не чистую известь,' а содержащие фос-
фор известняки (подходящие сорта их встречаются, на-
пример, ,в Алжире), и этим увеличивают содержание фос-
фора в шлаках. Стоимость томасовОй муки, полученной в
качестве побочного продукта при выплавке 1 т стали, со-
ставляла в 1910 г. около 5 марок (2 р. 30 к. золотом).
К тому же фосфористые железные руды сами по себе де-
шевле руд,, свободных от фосфора, так как зале-жй их во
многих местах особенно1 удобны для разработки. А нужно
принять еще во внимание, что 9 0 «/о всех железных руд
из-за высокого содержания фосфора были непригодны для
прежнего «кислого» бессемеровского процесса. Наконец, то-
масироваНие позволяет получать очень бедные углеродом
ковкие 'сорта железа, которые напоминают больше ковкое
железо, чем сталь, и которые поэтому лучше называть
литым железом, а не литой сталью. Следовательно, тома-
сировапие явилось и конкурентом дорогого пудлингова-
ния, специального поставщика ковкого Железа.
Не нужно, однако, думать, 'что способ переработки фос-
фористых руд был открыт счастливыми изобретателями
сразу, как это может 'показаться; из предыдущего изложе-
ния. Совершенно напротив,—он явился плодом долго-
летних ’ работ. Одно только изготовление достаточно
огнеупорных кирпичей, необходимых для основной футе-
ровки груши, потребовало многих лет работы и большой
затраты средств, причем еще не было полной уверенности
в том, что процесс будет итти хорошо и в крупном мас-
штабе.
Так как большинство великих изобретений являются
обычно результатом долголетних поисков многих иссле-
293
ДойаТеЛей, а Не плодом гениальных догадок отдельных
людей, то, как правило, после опубликования таких изо-
бретений всегда возникают споры о приоритете. Так же
обстояло дело и здесь. Предложение использовать основную
футеровку для бессемеровского конвертора появилось еще
в 6О-х годах прошлого столетия, а в 1875 и еще раз в
1878 г» оно подробно обсуждалось в соответствующей спе-
циальной литературе различных стран. При этом казалось,
что речь идет о чем-то невыполнимом, однако уже в 1879 г.
задача была разрешена описанным выше путем.
Но кроме томасирования можно представить себе и со-
вершенно иной способ изготовления стали.
Чугун содержит свыше 2,8% углерода, а ковкое же-
лезо—около 0,5%. Если их сплавить вместе, то полу-
чится продукт со средним содержанием углерода. При
выбранном соответствующим образом соотношении состав-
ных частей должны образоваться либо литая сталь, либо
литое железо (в зависимости от содержания углерода).
Трудность практического осуществления этой мысли за-
ключалась в следующем. Ковкое железо само ’по себе не
плавится в пламенной печи. И вот, долгое время не могли
сконструировать такую печь, температура которой была бы
достаточна для растворения неплавкого железа в расплав-
ленном чугуне, что необходимо здесь для образования
стали. Впервые удалось выплавить такую литую сталь
французу Мартену, но печь, в которой этот процесс легко
осуществляется, сконструировал только Сименс в 1865 г.
Мы уже узнали, что пудлинговый способ со времени
его изобретения Кортом не претерпел существенных изме-
нений (если не считать некоторых изменений в конструк-
ции топки). Корт мог использовать для своих печей (где
нужную температуру давало пламя, пробивавшееся с ко-
лосников) только те очень хорошие и потому дорогие сорта
каменного угля, которые горят длинным пламенем. Теперь
Нагревание производят сжиганием газа, который полу-
чается тут же в специальных газогенераторах (рис. 59).
Для получения газа топливо помещают очень высоким
слоем на колосниковую решетку, причем само топливо
вовсе не должно быть обязательно хорошего сорта. Так
как проходящего через колосники воздуха далеко не до-
статочно для полного сжигания углерода, то последний
сгорает здесь не в углекислый газ, а в горючую окись
294
углерода. Она выходит ив генератора вместе с другими
горючими газами, которые образовались из топлива при
высокой температу-
ре печи и не могли
сгореть вследствие
недостаточного до-
ступа воздуха. С эти-
ми горючими газами
смешан еще весь
азот, со держ авший-
ся 'в прошедшем че-
рез 'колосники воз-
духе.
Монд сконструи-
ровал 11 генераторы
для сжигания наи-
более дешевых ка-
менноугольных от-
бросов, остающихся
п осле обогащения
каменного угля про-
мывкой; эти отбросы
содержат много кам-
ней. Генераторы
Монда отличаются
той особенностью,
что через них дли-
тельное время про-
пускается водяной
пар. Они дают чрез-
вычайно дешевый
газ для силовых дви-
гателей (с и л о в о й
газ). f
С помощью гене-
раторов, сконструи-
рованных по прин-
Рис. 59. Генератор для получения газа
ципу генератора
Монда, в 1909 г. пы-
тались разрешить,
наконец, задачу технического использования торфа. Воору-
женные всей современной теорией и практикой техники^
295
хорошо знавшие бесчисленные неудачные попытки, сде-
!ланные до тех пор в этом направлении, годами испыты-
вали работу, подобных генераторов в Вестфалии. Но и это
большого масштаба предприятие кончилось, полнейшей не-
удачей, принеся одни убытки. Вследствие этого техниче-
ское использование торфа кажется возможным лишь в
Исключительных случаях, так как его теплотворная спо-
собность слишком низка1.
Выходящие из генератора горячие газы долгое время
тотчас же сжигались в пламенных печах с помощью по-
даваемого туда воздуха. Значительным усовершенствова-
нием в их использовании явились затем изобретенные
Сименсом регенераторы.
В Прежнее время, когда гав выполнил свою работу, в
пламенной печи, т. е. нагрел при горении содержимое печи,
он уходил в трубу в виде раскаленной смеси продуктов
горения. В настоящее время эта смесь направляется сна-
чала в особые камеры, заполненные в определенном порядке
(в виде решетки) огнеупорным кирпичом. И только после
Этот пессимистический вывод автора объясняется тем, что в Германии
более выгодна добыча и переработка для химических и иных целей бурого
угля, имеющегося там в громадных количествах, чем более сложное и
технически еще не освоенное торфяное производство. Но в СССР, в на-
родном хозяйстве которого энергетическое использование торфа является
важнейшим хозяйственно-политическим моментом (так как торф в качестве
местного топлива заменяет дальнепривозные уголь и нефть), в этом отно-
шении достигнуты уже большие успехи. Торф прежде всего используется
как топливо в котельных электростанций, заводов, центрального отопления
и в домашних печах. Многие его разновидности представляют хорошее
малозольное топливо с большей теплотворной способностью, чем у бере-
зовых дров. Некоторые сорта торфа дают прекрасный торфяной кокс для
металлургии, имеющий то преимущество перед каменноугольным коксом,
что он содержит лишь незначительное количество серы. На кусковом торфе,
как показали опыты, можно вести и доменную плавку непосредствзнно,
без коксования. Используются в СССР и газогенераторы для газификации
торфа (например, на стекольном заводе в Гусе-Хрустальном Ивановской
области, на Уральском машиностроительном заводе под Свердловском).
Торфяной газ заменяет собой нефтяное топливо и дает чистое пламя, не
уступающее нефтяному. При коксовании или газификации торфа получается
торфяная смола, из которой можно добыть воск, карболовую кислоту,
креозолы, горючие масла (бензин и керосин), пек и др. Наконец, путем
механической переработки из торфа можно получать торфяные брикеты,
торфяную пыль и строительные изоляционные плиты. Таким образом торф,
который не может использовать капиталистическое хозяйство, в условиях
социалистического хозяйства подучает самое широкое примеаение. (Прим,
перев.)
296
того, как газы отдадут своо тепло кирпичам и раскалят
последние, они выпускаются уже в трубу. Эти раскален-
ные камеры и есть газогенераторы, представляющие собой
собственно аккумуляторы тепла.
Полученный в генераторе и предназначенный для сжи-
гания гав пропускается сначала через одну из упомяну-
тых камер. Здесь он делается гораздо более горячим и по-
падает затем в пламенную печь, где встречается с необ-
ходимым для горения воздухом. Но и этот воздух был
также предварительно пропущен через раскаленный реге-
нератор и, следовательно, тоже приносит с собой тепло
из аккумулятора обратно в печь.
Камеры регенератора с помощью заслонок можно по жела-
нию включать и выключать, другими словами, нагревать
попеременно. Поэтому для подогревания газа и воздуха
постоянно имеются налицо раскаленные камеры, в то время
как другие камеры, только что отдавшие свое тепло, на-
греваются снова. Экономия топлива по' сравнению с преж-
ним способом использования газа составляет здесь от
40 до 50%.
Раньше думали, что с применением генераторов й реге-
нераторов вообще |уже достигнута граница возможного
использования топлива. Но в 1895 г. Фридриху Сименсу
удалось еще раз превзойти самого себя. В только что
описанной системе вое продукты горения топочных газов
улетают в трубу, следовательно, теряется и весь углерод,
превратившийся в конце концов в,углекислый газ. Что
же делает теперь Сименс? Он пропускает продукты пол-
ного сгорания газа (в таком количестве, которое позволяет
использовать установка), смешанные с воздухом, необхо-
димым для поддержания горения в генераторе, еще раз
через генератор. Здесь раскаленный углекислый газ дымо-
вых газов встречается с горящими углями. Благодаря их
взаимодействию образуется снова горючая окись углерода,
которая направляется опять в печь для получения там
высокой температуры. Таким образом Сименс сумел ис-
пользовать часть углекислого газа из дымовых газов для
того, чтобы снова превратить его углерод в окись угле-
рода и еще раз сжечь последнюю.
Однако и в оборудованных генераторами и регенерато-
рами пламенных печах почти не удается получить литую
сталь или литое железо путем сплавления чугуна с ломом
297
из ковкого железа. Это удалюсь лишь тогда, когда Си-
менс ввел конструкцию, позволяющую пользоваться для
нагрева свободным пламенем.
В 1885 г. Сименс на основании теоретических расчетов
пришел к заключению, что наиболее высокую темпера-
туру можно получить от пламени в том' случае, когда
оно не бьет в стенки печи, а горит в виде огромного языка.
До этого времени печи всегда строили такой величины,
чтобы пламя по возможности заполняло всю печь. Сименс
построил печь соответственно больших размеров и достиг
этим поразительных результатов. Температура в такой
печи настолько высока, что ее едва выдерживают даже
самые огнеупорные кирпичи. И в такой печи относительно
легко можно1 получать литую сталь и литое железо.
При сименс-мартеновском способе вначале также рабо-
тали с применением кислой футеровки печи, но потом и
здесь перешли к основной футеровке, которая позволяла
перерабатывать содержащие фосфор сырые материалы и
одновременно освобождать их от фосфора1. С 1899 г. на-
чали также конструировать непрерывно работающие печи.
Литое железо, полученное основным сименс-мартенов-
ским способом, отличается настолько высокой способно-
стью к свариванию, что оно сделалось чрезвычайно опас-
ным конкурентом собственно ковкого железа, получаемого
с помощью пудлингования. Производство литого железа,
являющегося превосходным сортом железа,j обходится осо-
бенно дешево, во-первых, потому, что в качестве доба-
вочного сырья здесь можно переплавлять вместе с чугу-
ном железный и'чугунный лом, а, во-вторых, потому, что
в настоящее время жидкий чугун из домны непосред-
ственно направляют в мартеновскую печь. Можно не сом-
неваться, что все эти новейшие усовершенствования пол-
ностью вытеснят дорогое пудлингование. Местами это уже
случилось, например в Верхней Силезии пудлингование
совершенно не применяется уже с 1910 г.
☆ В СССР пудлингование также совершенно не при-
меняется. *
1 Кислая мартеновская сталь по сравнению с основной обладает обычно
рядом преимуществ и поэтому применяется для наиболее ответственных
изделий. Однако, как показывает опыт заграничных и лучших з(кодов
СССР, н основная мартеновская сталь в случае правильного ее изготовле-
ния не уступает кислой. (Прим. перев.)
298
Мы рассмотрели историю развития железоделательной
промышленности с древних времен вплоть до наших дней.
В настоящее время выступает на сцену новый способ из-
готовления стали—с помощью электрических печей; об
этом способе мы скажем, несколько позже.
Добывание других металлов—меди, свинца, никеля
и т. д.—заключается, как было уже сказано, в общих
чертах в том, что природные руды переводятся в окислы
металлов и эти окислы восстанавливаются углем. Исклю-
чение составляет только алюминий и в известном смысле
также цинк.
Украшением многих старинных церквей и замков явля-
ются их красиво патинированные1 медные крыши. Когда
мы применяем металлические листы для крыш в настоящее
время (а это делается теперь гораздо чаще, чем раньше),
то мы редко берем для этого почти не поддающиеся износу
медные листы. Теперь для крыш почти всегда идет оцин-
кованная жесть, которая, правда, с течением времени при-
обретает некрасивую серую окраску. Делается это из-за
большей дешевизны цинка, хотя сравнительно дешевым
металлом он стал только, примерно, лет тридцать тому
назад. Прежде же применять цинк для подобных целей
было нельзя, так как он был дорог; его вообще научились
добывать всего лишь сто с лишним лет тому назад.
Причина того, что металлический цинк и цинковые
листы стали известны так поздно, заключается в следую-
щем. Если нагревать окись цинка с углем, то происходит,
правда, восстановление окиси, причем образуются цинк и
окись углерода. Но температура, при которой происходит
это превращение, настолько высока, что цинк вследствие
его летучести получается уже в газообразном состоянии.
Следовательно, если нагревать окись цинка с углем в
одной из обычно применяемых для восстановления ме-
таллов печей, то цинк очень скоро улетучится в воздух.
В воздухе же вследствие сильной нагретости он сейчас же
опять сгорит в окись цинка. Короче говоря, этим путем
металлического цинка получить нельзя.
1 Патина — коричневато-зеленый налет на старой бронзе (сплав меди
с оловом), образующийся под влиянием внешней среды. (Црим. перев.)
299
Только примерно около 1750 г. началось производство
цинка в Европе (китайцы, невидимому, знали этот металл
раньше), причем окись цинка нагревалась с углем не
в открытой печи, а в реторте, т. е. в закрытом сосуде,
обогреваемом огнем снаружи. Образующиеся в такой ре-
торте пары цинка не могуг сгореть из-за недостатка воз-
духа, и цинк получается как дестиллирующийся из ре-
торты металл. Но лишь в 1805 г. научились отливать
и прокатывать из самого по себе очень хрупкого цинка
те большие листы, которые в настоящее время находят та-
кое широкое применение.
Наиболее Молодой цз всех металлов!, применяемых в
повседневной жизни—алюминий—очень отличается от
всех рассмотренных нами до сих пор. Этот металл является
самым распространенным в доступной нашему исследо-
ванию части земной коры, но он никогда не встречается
в самородном .состоянии. Его кислородное соединение—
окись—химики с давних времен называют глиноземом.
Само название алюминий происходит от латинского назва-
ния алюминиевых квасцов (alumen), так как давно уже
было известно, что эти квасцы являются двойной солью,
состоящей из серноалюминиевой и сернокалиевой солей (ко-
торые связаны еще с кристаллизационной водой).
Мы знаем также, что всякая глина является силикатом
алюминия, соединением окиси алюминия с двуокисью, крем-
ния (и водой). Поэтому каждый кирпич содержит много
алюминия и каждый черепок разбитого глиняного горшка
мог бы служить сырьем для добывания алюминия, если
бы окись алюминия, подобно окислим других металлов,
восстанавливалась бы углем. Но в данном случае это не
имеет места, и такой способ добывания металла здесь
совершенно исключается. Происходит это потому, что со-
единение алюминия е кислородом чрезвычайно прочно' и
не может быть разложено нагреванием с углем.
Но в лаборатории Металлы можно получать не только
путем восстановления из окислов углем. Для этого’ можно
воспользоваться и другими способами, правда, гораздо
более сложными. По одному из таких способов впервые
получил несколько мельчайших шариков чистого метал-
лического алюминия немецкий химик Велер в 1827 г.
В 1852 г. Бунзен приготовил чистый алюминий с помощью
разложения электролизом одного химического соединения,
300
содержащего алюминий, хлор и натрий. Первые опыты
в заводском: масштабе, потребовавшие больших средств,
были поставлены bio Франции по распоряжению Напо-
леона III. Это было время перед грозившей тогда раз-
разиться Крымской войной, и Наполеон надеялся получить
возможность снабдить своих солдат панцырями из легкого
металла.
Однако добывание алюминия таким путем никогда не
сделалось бы дешевым, если бы вдруг не стало возмож-
ным дешевое использование электрической энергии, обу-
словленное изобретением динамомашины. До появления
динамомашины электрический ток получали с помощью
гальванических элементов, работа которых стоила, однако,
очень дорого. В области обработки металлов гальваниче-
ские элементы могли применяться только лишь для по-
крытия дешевых металлов более дорогими. Этот способ,
изобретенный в 1839 г., называется гальванопластикой;
начиная с середины прошлого столетия, с его помощью
начали производить большое количество посеребренных
изделий. Теперь играет большую роль гальваническое ни-
келирование, так как никель тоже настолько стоек по
отношению к действию воздуха и влаги, что покрытые
им металлические предметы долгое время сохраняют свой
красивый блеск.
Впрочем, действие электричества нН химические соеди-
нения было исследовано задолго до изобретения гальвано-
пластики. Еще в 1775 г. знаменитый английский химик
Кристлей сообщил, что искры электрической машины
(единственный источник электричества, который он знал)
разлагают газообразный аммиак. Мы знаем, что аммиак
представляет собой соединение водорода' и азота. Если
пропускать через газообразной аммиак электрические
искры, то он будет, следовательно, разлагаться на водород
и азот. В 1872 г. было обнаружено, что электрические
разряды разлагают также и воду на ее составные части—
водород и кислород. ' :
Так как получение электричества с помощью гальвани-
ческих элементов несравненно удобнее, чем пользование
разрядами электрической машины, то с развитием их при-
менения стали еще усерднее изучать действие электри-
чества на химические соединения. Уже в 1806 г. был
добыт путем электролиза поразительно легкий металл
301
калий, а вскоре вслед за ним и металл натрий; при
этом электрический ток пропускался через соединения
калия (соответственно—натрия) и разлагал их на состав-
ные части.
С помощью электричества подобным же образом можно
добыть и легкий алюминий. Глинозем, т. е. окись алю-
миния, вносят в расплавленную в электрической печи
(рис. 33) смесь двух минералов—криолита и плавикового
шпата—и через эту раскаленную массу пропускают электри-
ческий ток. Он разлагает окись алюминия на составные
части, а именно на алюминий, который в расплавленном
состоянии собирается на дне ванны, и на кислород. В ка-
честве источника окиси алюминия применяют минерал
боксит, который кроме алюминия содержит еще железо
и кремнезем.
Цена алюминия с течением времени непрерывно падала.
В 1855 г. 1 кг алюминия стоил 1000 марок (460 зол. руб.),
в 1856 г.—300 марок (138 зол. руб.), в 1886 г.—100 марок
(46 зол. руб.), а в 1911 г. ужо 1 марку 10 пфеннигов
(около 50 коп.). В 1928 г. мировая продукция алюминия
превышала 200 тыс. т. По производству алюминия впереди
идут США, Германия, а также Норвегия, обладающая
богатыми ресурсами водной энергии для получения деше-
вого электричества.
Кроме применения для выделки разнообразной хозяй-
ственной посуды, алюминий приобрел в настоящее время
чрезвычайно важное значение в некоторых отраслях про-
мышленности. Малый удельный вес, который составляет
всего около трети удельного веса железа, делает алюминий
идеальным материалом для дирижаблей самолетострое-
ния, а также для автомобилей,—особенно с тех пор, как
применение его в виде сплавов увеличило его прочность
и очень облегчило его литье.
Уже давно известна алюминиевая бронза—сплав алюми-
ния с медью, обладающий золотисто-желтой окраской. Но
особенно важное значение для промышленности получил
дуралюмин. Этот материал, состоящий из алюминия с не-
большим содержанием магния1, получается сильным на-
гревом и последующим закаливанием.
1 Дуралюмин содержит 3,5 — 5,5% меди, О,5°/о магния, 0,5 — О,8®/о
марганца, остальное—алюминий. В СССР сплав, аналогичный дуралюмину,
называется кольчугалюминием. (Прим перев.}
302
Для получения 1 кг алюминия необходимо затратить
29,5 киловатт-часов мощности, почему в алюминии и за-
ключен огромный запас энергии. Как мы знаем, уголь
восстанавливает окись железа, связываясь с ее кислоро-
дом в окись углерода и освобождая металлическое железо.
Заключенная же в алюминии энергия достаточна для вос-
становления таких окислов, которые не восстанавливаются
углем. С помощью алюминия можно легко получить, на-
пример, хром или молибден из их окислов, причем сам
алюминий переходит, конечно, в окись алюминия, которая
плавает затем в виде шлака на расплавленном хроме или
молибдене.
С 1911 г. удалось также получить с помощью электро-
лиза растворов солей железа, нагретых до 120°, техни-
чески пригодное железо. Это единственный сорт железа,
который не содержит ни малейшей примеси углерода.
Электролитическое железо является поэтому очень важным
достижением. Оно представляет собой прямо-таки идеаль-
ный металл для электромагнитов: электромотор с нормаль-
ной мощностью в 0,5 л. с. при применении электролити-
ческого железа месяцами давал 1,3 л. с., не обнаруживая
явлений старения.* Электролитическое железо применяет-
ся для высококачественных сплавов, для изготовления сна-
рядных поясков, труб для изготовления радиаторов и т. п.
Особенно интересно применение электролитического железа
для покрытия изношенных или поврежденных частей раз-
личных изделий. Покрытие получается настолько проч-
ным, что осажденный слой железа не отстает даже при
изгибании, скручивании и ударах молотком по «залечен-
ному» месту. *
*В области добычи чугуна и стали СССР достиг за
последние годы больших успехов. По чугуну Советский
Союз, как это видно из рис. 49, занимает первое место
в Европе, дав за один лишь 1934 г. прирост в 3332 тыс. т,
чего ни одна страна в прошлом не давала. Стали в 1934 г.
выплавлено 9565 тыс. т (прирост по отношению к 1930 г.—
163%), а проката произведено 7034 тыс. т, в том числе
железнодорожных рельсов 786 тыс. т, в то время кай
довоенная металлургия давала только 4200 тыс. т стали
и 4813 тыс. т проката.
В своем докладе VII Всесоюзному съезду советов т. Ор-
джоникидзе говорил о черной металлургии следующее:
зоз
«Мы развернули в огромных размерах строительство но-
вых и реконструкцию старых заводов... Едва ди когда-
нибудь какая-либо страна строила одновременно столько
металлургических заводов... Мы ввели в действие за эти
четыре года 24 новых доменных печи, из них емкостью
от 800 до 1000 куб-, м—13 печей и свыше 1000 куб. м—
6 печей. Увеличили общий объем доменных печей с 27 тыс.
куб. м в 1930 г. до 49 тыс. куб. м. Ввели в эксплоатацию
80новых мартеновских печей...» («Правда», 1935 г., №32).
Огромная работа была проделана и по реконструкции
железорудной промышленности: в довоенное время раз-
веданные запасы ж-елфной руды в -СССР, оценивались
в 1,4 млрд, т, а ж 1935 г. запасы эти достигают до
10 млрд, ml В эту цифру не включены еще колоссальные
запасы Курской магнитной аномалии, которые исчисля-
ются в 200 млрд. т. В прежнее время СССР занимал среди
других стран одиннадцатое место по запасам железа, а те-
перь он вышел на первое место и владеет 52°/о всех ми-
ровых запасов. i
Большие успехи достигнуты И в области производства
алюминия, цинка, свинца и других так называемых цвет-
ных металлов. Йроизводства алюминия до 1933 г. в СССР
не было, а теперь на вновь построенных Волховском и
Днепровском заводах получаем уже тысячи тонн алюминия.
В -связи со строительством новых алюминиевых заводов
к концу Второй пятилетки мощность советских заводов по
алюминию достигнет таких размеров, что СССР займет
первое'.место в Европе.
Вновь поставлено в СССР также производство никеля
И магния. Магниевые заводы строятся в Соликамске и
Запорожье. :
Увеличение выпуска металлов и улучшение их качества
имеют огромное значение для всех других отраслей народ-
ного хозяйства СССР. Благодаря этому Союз превратился
из страны, ввозящей машины, в страну, экспортирующую
их, производящую самые сложные агрегаты. С этим тесно
связано также и укрепление обороноспособности страны,
ибо на основе развитой металлургии и машиностроения
можно изготовить все современные орудия обороны. *
304
ЛЕКЦИЯ ДВЕНАДЦАТАЯ
Сплавы. Монеты. Бронза. Патина. Латунь. Томпак. Золото таль ми.
Новое серебро. Альфенид. Британский металл. Типографский металл.
Никелевая сталь. Хромистая сталь. Редкие металлы. Алкалоиды. Мор-
фий. Метан. Бензол. Пиридин. Кониин. Хинолин. Антипирин. Фенаце-
тин. Наркотики. Хлораль. Эфир. Хлороформ. Антисептические средства.
Йодоформ. Карболовая кислота. Сулема. Ментол. Бензойная кислота.
Салициловая кислота. Германии. Сальварсан
Уже из беседы об алюминий мы узнали, что металлы
используются не только в чистом виде, но й в виде спла-
вов, часто обладающих более ценными свойствами, чем
их отдельные составные части.
Древнейшим из всех сплавов является, конечно, бронза1.
Это—сплав меди с оловом, в котором медь всегда преобла-
дает. По мнению многих исследователей, люди до полу-
чения железа вое металлические сосуды изготовляли из
бронзы; поэтому соответствующая историческая эпоха и
получила название «бронзового века» (рис. 60). Еще и те-
перь бронза применяется в больших количествах и служит
для самых разнообразных целей. Наиболее известным было
раньше применение бронзы для церковных колоколов. Пре-
жде из нее изготовляли также и пушки. В разных госу-
дарствах было проделано бесконечное число опытов с целью
получения наилучшей бронзы для литья пушек; книги,
подробно трактующие вопросы этой области, составляют
целую библиотеку. I
Великолепные литейные качества' бронзы делают ее чрез-
вычайно пригодной для отливки произведений искус-
ства. Большие статуи всадников и т. п. из бронзы пока-
зывают, каких художественных эффектов можно добиться
с ее помощью. При этом изделия из бронзы не страдают от
1 Считают, что слово «бронза» происходит от названия итальянского го-
рода Бриндизи (в древносги Брундувий), так же как латинское название
меди — купрум (cuprum)—от острова Кипра.
20 Химия в повседневной жизни. 805
времени даже на открытом воздухе. Наоборот, они при-
обретают особый красивый налет, который называется па-
тиной. В химическом отношении это—основная углемед-
ная соль. Наряду с коричневато-зеленым цветом, напоми-
нающим малахит, патина сохраняет своеобразный метал-
лический отблеск, просвечивающий через ее цветные
отливы, чем она и отличается от покрытия краской. По-
следней тоже можно придать блеск посредством лакировки,
но этот блеск останется чисто поверхностным и не будет
исходить из глубины.
Если вблизи бронзовых статуй сжигается много камен-
ного угля, то вследствие содержания в нем серы в воз-
духе всегда появляется немного сернистой кислоты, ко-
торая мешает образованию патины. В таких местностях
патина вообще не образуется.
* Сравнительно не так давно бронза (так называемая
зеркальная, богатая оловом) применялась для изготовления
больших зеркал в телескопах. В настоящее время она
служит для изготовления трущихся частей машин (поршне-
вых колец, подшипников и т. п.) и для частей, подвер-
гающихся ржавлению (котельная арматура, насосные кла-
паны, гребные винты и пр.). Во многих государствах она
служит также для чеканки монеты.*
Подобно олову, медь хорошо сплавляется и с цинком.
Такой сплав называется латунью. Потребность в нем также
очень велика. Хотя цинк известен только с XVIII в., но
давно уже знали, что если при выплавке меди из руды
прибавить к ней другой руды, носившей в древностп
название кадмия, а позднее—галмея, то полученная после
этого медь имеет не красный, а желтый цвет. Кадмий или
галмей—это руда, содержащая цинк.
Уже Аристотель примерно в 330 г. до начала нашего
летоисчисления сообщал: «В Индии встречается медь, ко-
торая отличается от золота только вкусом. В то время
как напиток имеет великолепный вкус в золотых кубках,
он приобретает неприятный металлический привкус в по-
суде, содержащей в себе медь». Аристотель, таким обра-
зом, предлагает этот прием для различения золота и меди,
в качестве наиболее подходящего для его времени анали-
тического метода.
Латунь при определенном соотношении составляющих
ее металлов приобретает дочти такой же вид, как золото;
806
под названием томпака в обиходе распространены разно-
образные предметы, изготовленные из этого сплава. Осо-
бенно похожим по цвету на золото становится сплав после
прибавления к нему свинца. Однако такая латунь мало
устойчива на воздухе, быстро окисляется и приобретает
Рис. 60. Нронзовое оружие и украшения, выде-
лывавшиеся в Скандинавии за 2 500 лет до нашего
времени. 1 — верхняя часть бронзового меча;
2 — шейное украшение; 3,4,5—бронзовые тоноры;
в — наконечник копья; 7 — бролзовып кинжал
поэтому невзрачный вид. Но если ее покрыть очень тонким
слоем золота, то получится золото тальми.
йВ технике различные сорта латуни применяются для
неответственных деталей машин, арматуры, различной
аппаратуры, для обшивки морских судов, для выделки
посуды, гильз, проволоки и т. Д. й
20*
307
Сплавлением меди, цинка и никеля получают новое се-
ребро («нейзильбер»). Этот сплав играл значительную роль
с 1820 по 1860 гг., но затем он был вытеснен изделиями,
посеребренными с помощью гальванопластики. Посеребрен-
ный нейзильбер назван был альфенидом. Однако вскоре
для подобных изделий стали серебрить более дешевые бе-
лые металлические сплавы, например британский металл,
состоящий из 90 частей олова и 10 частей сурьмы; в на-
стоящее время и он заменен еще более дешевыми ма-
териалами.
☆ Сам по себе нейзильбер довольно широко применяется
и в настоящее время. Он служит для выделки различных
изделий в машиностроении (клапаны, вентили, краны
и т. п.), музыкальных инструментов, частей пишущих
машинок, для отделки автомобилей, мебели, часов, а так-
же в качестве электросопротивлений и пр.-*
Скажем еще о составе того сплава, который мы не часто
имеем возможность видеть сами, но который, так сказать,
приумножает нашу «духовную пищу». Я говорю о типо-
графском металле. Его важнейшей составной частью
является свинец, к которому добавлены сурьма, небольшое
количество олова и др.
Мы видим, что такие употребительные металлы, как
медь, цинк и др., в форме сплавов приобретают новые
ценные качества. На этом пути стали искать и способов
улучшения качества железа. Однако эти попытки оста-
вались довольно безуспешными до 1895 г., когда удалось,
наконец, увеличить твердость стали прибавлением к ней
совершенно чистого никеля. Твердость наилучшей литой
стали относится к твердости никелевой стали как 4 к 7,—
никелевая сталь, следовательно, почти вдвое тверже. Из
такой стали, несмотря на ее дороговизну, стали вскоре
изготовлять орудия и броневые плиты для военных судов.
В 1909 г. в Германии был сооружен первый мост, по-
строенный только из никелевой стали. Она сделала воз-
можным также сооружение больших паровых турбин,
получивших теперь столь широкое распространение. Ко-
леса таких турбин диаметром от 2 до 3 м должны делать
до 4000 оборотов в минуту. Обыкновенное железо под
влиянием центробежной силы было бы при этом разор-
вано, но колеса из никелевой стали могут выдержать
в четыре-пять раз большее напряжение на разрыв.
308
На парижской выставке 1900 г. были показаны быстро-
режущие токарные резцы из вольфрамовой стали. Их про-
изводительность раз в семь превышала производительность
известных до тех пор токарных резцов, так что снабженные
ими механические станки могли за одинаковое время вы-
полнять в семь раз большую работу. Новейшие быстро-
режущие стали, наряду с вольфрамом и хромом, почти
всегда содержат еще некоторое количество молибдена и
ванадия, а также кобальта.
Большие требования к прочности и работоспособности
со ^тороны автомобиле-
материала предъявляются также
строения. Здесь применяются
такие сорта стали, о которых
даже нельзя было и думать в
1900 г. В виду огромной проч-
ности этих сталей и малых раз-
меров действующих взрывами
двигателей, на выделку которых
они иду1?, их высокая стоимость
не играет никакой роли. Такие
сорта стали могут быть изготов-
лены в тигле или в пламени
электрической печи. Одной из
наиболее простых электрических
сталеплавильных печей является
печь Геру, которую мы сейчас
Рис.
61. Электрическая печь
для получения стали
коротко и опишем.
На рис. 61 Р—огнеупорный сосуд, А—угольный элек-
трод, S—всплывший расплавленный шлак, М—расплав-
ленный металл, С—два металлических контакта, через ко-
торые в цепь тока вводится расплавляемый металл в ка-
честве одного из электродов (как это показано двумя
стрелками).
Раньше теплотехника предоставляла железоделательной
промышленности возможность получать температуры не
выше 2000°, а теперь в электрической печи достигается
температура, .превышающая 8500°. Электрическая стале-
плавильная печь делает возможным массовое производство
продукта, равноценного тигельной стали. Получаемое в
бессемеровских конверторах или в ..мартеновских печах
литое железо переплавляется только' в электрической печи.
Материал при этом получается совершенно! однообразный,
309
равномерный, потому что он не подвергался действию раз-
личных газов, выделяющихся при горении (совершенно
так же, как в процессе изготовления тигельной стали).
В такого рода печи возможно также включение в состав
стали хрома, ванадия, кремния, титана и пр., что придает
различным сортам стали особенно ценные качества, имею-
щие значение для специальных применений. Наибольшего
успеха в этой области достиг завод Круппа, который
с 1912 г. изготовляет благородную сталь посредством при-
бавки хрома и молибдена или циркония. Такая сталь не
только не разрушается и не просверливается никакими
инструментами, сделанными из другого материала, но не
проплавляется даже автогенным резаком.
Подобные сорта стали решили длительную борьбу между,
снарядом и броней. Твердость современных стальных гра-
нат, снабженных железными колпачками, настолько ве-
лика, что в состязании между орудием и броней решающим
является не само орудие, а снаряд. Дело в том, что со-
временные орудия могут сообщать снаряду такую силу,
что он в состоянии пробить любую судовую броню; сталь-
ные гранаты теперь обладают уже требуемой для этого
прочностью. Это показало морское сражение в Скагерраке
(в мировую войну), в котором крупное английское воен-
ное судно уже через 6 минут пошло ко дну, так как гра-
ната из хромовой стали, невидимому, пробила его броню
и взорвалась в камере боевых припасов.
Железо и сталь в технике часто подвергаются большим
разрушениям (коррозии), например под действием кислот
или горячего пара. На них появляется ржавчина, кре-
пость железа ослабевает, получаются разломы и т. д. Хотя
с этими явлениями борются посредством окраски и покры-
тия особым защитным слоем, однако идеалом был бы такой
металл, который вообще не подвержен ржавчине.
После длительных опытов Штраусу удалось, наконец,
получить на крупповских заводах действительно нержа-
веющую сталь. * (Почти одновременно, около 1915 г., она
была получена и в Англии Беарлеем). * Стойкость такой
стали основана на ее химическом составе (значительное
содержание кремния, хрома и никеля), а также на особой
термической обработке. В то время как обыкновенная
310
сталь, подвергнутая в течение 100 час. действию горячего
пара при 1000°, теряет в весе 416 г, такое же количество
нержавеющей стали при тех же условиях теряет всего 6 г.
Поэтому теперь из нержавеющей стали изготовляют тур-
бинные лопатки, шпинделя для вентилей и т. п., а также
и предметы широкого потребления—ножи, вилки, ложки,
ножницы, пивные бочки, хирургические инструменты, зуб-
ные коронки, посуду для варки пищи и многое другое.
Названия редких металлов—молибдена и циркония—ши-
рокой публике сравнительно мало известны. Но некоторые
редкие металлы в течение последних лет стали довольно
обычными, особенно благодаря применению их в электри-
ческих лампочках накаливания (вольфрамовые й осрамовые
лампочки). Когда Эдиссон изобрел электрокалильный свет,
он помещал в безвоздушное пространство лампочки тон-
кую угольную нить. Эта нить настолько сильно нагре-
валась электрическим током, что начинала светиться. Но
светосила раскаленной угольной нити слишком мала по
сравнению с количеством потребляемой электрической энер-
гии. Отсюда возникло стремление заменить угольную нить
какой-либо другой, лучшей. Это удалось лишь после
25-летней работы Ауэру.
Сама собой напрашивалась мысль применить тонкую
металлическую нить. Но обычные, широко употребляемые
в повседневной жизни металлы, как, например, железо,
медь ит. п., расплавляются, когда их нагревают электри-
ческим током в безвоздушном пространстве лампочки.
Ввиду этого нужно было найти такие металлы, которые
плавятся при значительно более высокой температуре.
Начали исследовать с этой целью осмий и вольфрам, ко-
торые встречаются в рудах лишь в очень небольших
количествах и были получены химиками только в лабо-
раториях. В химических отделениях электротехнических
предприятий впервые были добыты более значительные
количества этих металлов и исследованы свойства приго-
товленных из них тонких проволок. Чрезвычайно большие
трудности были связаны с получением тонкой проволоки
из таких металлов, которые плавятся лишь при очень
высокой температуре, отличаются необыкновенной хруп-
костью и плохо поддаются обработке. Однако все эти
311
трудности были преодолены, и теперь в вольфрамовых
лампочках светит проволока из вольфрама, а в осрамовых—
из сплава осмия с вольфрамом. Преимущества этих лампо-
чек состоят в том, что при затрате одинакового коли-
чества электрической энергии они дают по крайней мере
вдвое больше света, чем лампочки с угольной нитью.
Иначе говоря, они дают то же количество света за поло-
вину цены.
В заключение наших лекций коснемся еще медицинской
химии, науки столь же старой, как и сама медицина.
Человечество обязано ей чрезвычайно многим. В этой об-
ласти химия, начиная с прошлого столетия, достигла таких
Й спехов, которые затмили все, что было сделано раньше,
ачало этому было положено открытием алкалоидов, ве-
ществ растительного происхождения, содержащих азот и
обладающих основным характером. Название их введено
Мейснером в 1818 г. До открытия алкалоидов думали,
что из растений можно добыть лишь кислоты (винную,
лимонную и др.) и нейтральные вещества, например крах-
мал, сахар и пр. Но при исследовании лекарственных
веществ растительного происхождения Дерон в 1804 г.
нашел «ооль опия», как он назвал добытое им вещество,
обладавшее щелочной реакцией. Это обстоятельство на-
столько его поразило, что он стал называть полученный
продукт особым «животно-растительным» веществом. Лишь
в 1817 г. немецкий аптекарь Сертюрнер добыл из выше-
упомянутой «соли опия» чистый морфий и выяснил его
щелочной характер.
О значении таких алкалоидов много говорить не прихо-
дится. Почти каждому известен хинин—как вещество1 про-
тиволихорадочное, морфий—как снотворное и болеутоля-
ющее, атропин—как вещество, расширяющее зрачок, ко-
каин—как местнообезболивающее средство, т. е. вещество,
делающее нечувствительным ограниченный участок тела.
Еще и до знакомства с чистыми алкалоидами применяли
лекарства, в состав которых входили эти вещества. Хотя
иногда алкалоиды содержатся в таких лекарствах лишь
в самых небольших количествах, они оказывают тем не
менее очень сильное и своеобразное действие. Так, напри-
мер, попадание в организм мухомора вызывает ощущение
312
головокружения или летания, на чем: и основаны, вероятно,
средневековые представления о летании ведьм.
Однако алкалоиды в таких лекарствах часто бывают
смешаны с большим количеством других веществ, которые
оказывают на их свойства такое влияние, что их специ-
фическое действие иногда совсем не может проявиться.
Так обстоит дело, например, с морфием по сравнению
с опиумом, добываемым непосредственно из растения и слу-
жащим для получения морфия. Опий благодаря совокуп-
ному действию всех своих составных частей применяется
для разных других целей, но не как болеутоляющее, не-
смотря на содержание в нем морфина. 1 кг морфия стоил
в 1912 г. около 360 марок (около 166 вол. руб.), а 1 кг
опиума всего лишь 25 марок (11 р. 50 к.).
' Химическое исследование алкалоидов показало, что со-
ставляющие их молекулы построены чрезвычайно сложно.
Мы уже говорили раньше, что недостаточно знать* род и
число атомов, из которых составлена молекула вещества;
для полного химического знакомства с этим веществом
необходимо знать также и способ, каким эти атомы со-
единяются в молекуле друг с другом. Только после того,
как разрешена эта чрезвычайно трудная задача, можно
заняться в лаборатории работой противоположного харак-
тера, т. е. начать искусственно составлять такие молекулы
из атомов, другими словами, искусственно получать при-
родные продукты.
Мы указывали выше, что все органические соединения
производятся цт углеводорода, который носит название
метана или рудничного газа' и который состоит из одного
атома углерода и четырех .атомов водорода:
водород
I
водород — углерод — водород
водород
сокращенно
Н
1
н —С —н
I
н
Если мы хотим получить новые соединения, то нам
нужно лишь заместить водородные атомы другими ато-
313
мами или атомными группами; при этом каждый одно-
валентный остаток может замещать тоже одновалентный
остаток, двухвалентный—один двухвалентный или два
одновалентных и т. д.
Так например
н
н —4 —
I
н
есть одновалентный остаток метана, так как у него недо-
стает одновалентного атома водорода. Два таких остатка
могут соединиться и друг о другом, и тогда получится
молекула
н н
I I
H-о—о—н
которая является молекулой углеводорода О2Н6, знакомого
уже нам этана.
Цепи атомов углерода, которые могут быть при желании
продолжены путем повторения замещения атомов водо-
рода остатком СН3, могут также разветвляться и даже
замыкаться в кольцо. Так, например, строение молекулы
углеводорода с цепью из шести углеродных атомов,
в котором к каждому атому углерода присоединен лишь
один атом водорода (остальные связи, обусловленные че-
тырехатомностью углерода, находятся здесь в форме так
называемых «двойных связей» и обозначены двойными
черточками), будет иметь такой вид:
н н н н п н
4=4—4=с—4=с
Но в таком изображении строения молекулы четвертая
единица сродства обоих конечных атомов углерода остается
как бы висящей в воздухе; она ненасыщена, ибо каждому,
атому углерода присущи четыре связи. Профессору Бонн-
ского университета Кекуле в 1866 г. пришла в голову
314
замечательная мысль о том, что оба конечных атома угле-
рода здесь взаимно связаны. Из этого следует, что в моле-
А. Кекуле
куле углеводорода С6Нб шесть атомов углерода связаны
между собою в форме кольца:
н н
бензопдая кислота
315
Условились соединять в схеме молекулы бензола атомы
углерода прямыми линиями, благодаря чему получается
та шестиугольная фигура., которую так часто приходится
встречать в химических статьях и книгах.
Воспроизведенный на нашей схеме в форме шестиуголь-
ника углеводород имеет, как сказано, формулу С6Н6. Он
был найден в 1826 г. Фарадеем в сжатом светильном
газе и носит название, бензола (от бензойной кислоты, из
которой он вначале был получен и формула которой при-
ведена выше). Много бензола содержится в каменноуголь-
ном дегте, откуда он добывается в очень больших коли-
чествах. Бензол служит исходным материалом для изго-
товления бесчисленного множества важных соединений.
Из него могут быть приготовлены, например, все настоя-
щие анилиновые краски; без представления о кольцеобраз-
ной структуре бензола анилинокрасочная промышленность
никогда не достигла бы своего современного расцвета.
Бензол служит также исходным продуктом для многих
лекарственных веществ, которые изготовляются искусствен-
ным путем тоже на основе нащих знаний о его строении.
Примерно с 1880 г. стало известно, что замкнутые цепи
не обязательно должны состоять исключительно из ато-
мов углерода и водорода; в состав таких колец могут
входить и атомы других элементов, например атомы азота.
Азот трехвалентен, и его атом сокращенно обозначается
символом N (от латинского названия азота—Nitrogenium).
Одно цз простейших соединений такого рода будет
c5h5n. ‘
н
с
H-0./V-H
N
Оно называется пиридином и также содержится в ка-
менноугольном дегте. Все алкалоиды, другими словами,
все сильно действующие на человеческий организм ве-
щества растительного происхождения, за некоторыми ис-
ключениями, являются производными пиридина. Таков,
например, кониин, ядовитый алкалоид цикуты, формула
которого C8H17N. Эти 25 атомов расположены в ядре пи-
ридина и вокруг него следующим образом:
Такой способ распределения атомов в молекуле кониина
был изучен Ладенбургом. Ему удалось в 1888 г. пригото-
вить в лаборатории искусственным путем этот алкалоид
из пиридина,—до этого кониин добывался лишь из рас-
тений.
Исследование хинина C20H24N2O2, самого известного из
всех противолихорадочных средств, лишь в 1909 г. продви-
нулось настолько далеко, что удалось выяснить распре-
деление всех его 48 атомов. Изучение распределения ато-
мов хинина было значительно сложнее, чем изучение
распределения атомов кониина.
Еще 85 лет тому назад умели путем сухой перегонки
добывать из хинина хинолин. Молекула хинолина, как
показали исследования, представляет собой комплекс ато-
мов, состоящий из соединения двух колец, бензольного
и пиридинового:
н в
I
н
Хотя хинин и значительно подешевел с прежних вре-
мен, все же в 1912 г. 1 кг его еще стоил 40 марок (18 р.
40 к.). Судя по этому, производное хинина, хинолин,
«17
должно было бы отбить Още дороже. Однако, несмотря на
высокую цену хинина, 1 кг хинолина тогда уже можно
было приобрести меньше чем за 10 марок. Эго объясняется
тем, что хинолин добывается теперь в любом количестве
из каменноугольного дегтя, а не из дорого стоющего
хинина.
Давно уже считали, что хинолин является, так сказать,
скелетом хинина. Поэтому у исследователей возник сле-
дующий вопрос: действительно ли безусловно необходимо
присоединить к хинолину атомы и атомные группы та-
ким же образом, как ото имеет место у хинина, для полу-
чения противолихорадочного средства? Может быть можно
получить новое соединение, похожее на хинин, которое
по своему строению будет приблизительно напоминать его
и тоже обладать свойством снижать высокую температуру
лихорадящего больного?
После многих опытов в этом направлении, в 1881 г.
впервые было получено искусственное противолихорадоч-
ное средство. Это вещество теперь давно уже забыто,
так как оно заменено другими средствами, действующими
более энергично; с тех пор был приготовлен целый ряд
новых искусственных противолихорадочных средств, наи-
более надежными из которых оказались антгширин, пира-
мидон и фенацетин.
Выше мы упоминали уже о морфии. Его введение в
качестве снотворного, успокаивающего средства явилось
огромным шагом вперед в истории терапии, особенно с
1885 г., когда морфий стали впрыскивать под кожу; бла-
годаря этому действие его намного ускорилось и стало
надежнее, ибо таким путем морфий попадает непосред-
ственно в ток крови. Однако, принимая во внимание
опасность морфинизма, наступающего, к сожалению, при
употреблении морфия, было потрачено много усилий для
того, чтобы найти ему подходящую замену. Первым таким
веществом явился хлораль, который в химическом отноше-
нии стоит в довольно близкой связи с хлороформом.
С течением времени количество веществ, заменяющих
морфий, чрезвычайно возросло. Оказалось, что снотворным
действием обладают самые различные вещества. Обычный
спирт тоже является снотворным средством, но употребле-
ние его в значительных количествах влечет за собою не-
приятные последствия на следующий день. Такие же
818
явления наблюдались и при употреблении многих дру-
гих новых снотворных средств. Они действительно вызы-
вали сон, но влекли за собою и некоторые неприятные
последствия. Прекрасным снотворным веществом оказался
веронал, открытый Эмилем Фишером во время его работ
над мочевой кислотой.
Назначение снотворных средств заключается в том, чтобы
искусственно' вызвать сон, по возможности приближаю-
щийся к естественному. Но теперь, как известно, можно
производить самые тяжелые операции во время столь глу-
бокого сна, что больной ничего не чувствует. Первым
таким глубоко усыпляющим средством был эфир, веще-
ство, легко получаемое из спирта. Так как и в настоя-
щее время эфир готовят путем перегонки спирта с серной
кислотой, то его называют еще серным эфиром, хотя он
не содержит ни малейших следов серы. Эфир открыт в
1530 г. Кордом, и уже в 1541 г. Парацельс знает сно-
творное действие этого вещества. Парацельс пишет об
эфире следующее: «Ко всему прочему эта сера (т. е.
эфир) обладает сладостью, так что ее пьют и куры; они
при этом засыпают без вреда на время, а затем опять
просыпаются».
Правильный вывод из этого опыта Парацельса над жи-
вотными был сделан, к сожалению, лишь через 300 лет.
Опыт этот показал, что эфир вызывает глубокий сон,
после которого без всякого вреда просыпаются вновь.
Лишь в 1846 г. американский химик Джексон предло-
жил применять эфир как средство, усыпляющее больного,
И посоветовал зубному врачу Мортону применить его при
операции удаления зубов. Результаты оказались настолько
хорошими, что вслед за этим хирург Варрен усыпил 17 ок-
тября 1846 г. одного больного до полной потери чувстви-
тельности и затем оперировал его. С этого дня было поло-
жено начало производству совершенно безболезненных
операций. •
Тотчас же начались поиски таких веществ, которые,
по возможности, действовали бы еще лучше, чем легко
воспламеняющийся эфир; последний непригоден, напри-
мер, в случаях хирургических операций с прижиганием
раскаленным железом. Уже в 1847 г. Симпсон предложил
хлороформ, который с тех пор довольно прочно утвер-
дился в медицинской практике, хотя все время его пы-
319
таются заменить лучшими средствами или смесью эфира
и хлороформа.
Хлороформ был открыт в 1831 г. Либихом, получившим
его из хлораля. В настоящее время хлороформ готовят
гораздо более дешевым способом, а именно действием хлор-
ной извести на спирт.- В химическом отношении хлоро-
форм представляет весьма просто построенное вещество.
Если в хорошо известном нам углеводороде метане заме-
нить три атома водорода хлором (что очень легко можно
сделать в лаборатории), то мы и получим хлороформ.
Связь между этими веществами можно выразить следую-
щими формулами:
н
I
Н—С —н
I
н
метан
хлор
I
Н — С — хлор
I
хлор
трихлорметан
иод
I
Н — 0 — иод
I
иод
трииодметан
или
или
С1
I
Н - С —С1
01
хлороформ
J
I
Н—С —J
I
J
йодоформ
Под формулой хлороформа мы поместили формулу йодо-
форма, вещества, весьма близкого'’к нему по химической
структуре. Вместе с этим мы переходим от класса нар-
котических веществ к классу антисептических веществ.
В то время как наркотические вещества обусловливают
безболезненность хирургических операций, вещества анти-
септические обеспечивают быстрое заживление ран. Этот
огромный успех в деле лечения ран достигнут благодаря
открытию английского врача Листера, который руково-
дился в своих гениальных работах исследованиями Па-
стера над микроорганизмами.
Мельчайшие организмы, носящиеся повсюду в воздухе,
как пылинки на солнечном свете, могут попасть в раны
320
и вызвать в них нагноения и тяжелые, даже смертель-
ные, общие заболевания. Едва ли возможно отделить окру-
жающий нас воздух с примесью пыли от ран. Поэтому,
по предложению Листера, начиная с середины 70-х годов
прошлого столетия, стали умерщвлять бактерии воздуха,
соприкасающиеся с ранами, с помощью дезинфецирующих
средств. Листер применял с этой целью карболовую
кислоту.
В благоустроенных больницах пошли еще дальше в
этом направлении. В них совершенно отказались от анти-
септического метода работы и перешли к асептике. По-
следняя заключается в том, что хирургические инстру-
менты кипятят с целью уничтожения на них бактерий,
«стерилизуют» халаты хирургов в струе водяного пара,
а руки хирургов освобождают от бактерий обмыванием
их спиртом; тем же способом обеззараживают участки
кожи больных, где предстоит операция, а затем рану
перевязывают повязкой из стерилизованной ваты и т. д.
Таким образом удается избежать соприкосновения больного
с ядовитыми в большинстве случаев антисептическими
веществами. Современные методы хирургии применимы
даже вне хорощо обставленных операционных помещений
больниц. При родах также стараются действовать асеп-
тически, чтобы избежать родильной горячки, которая, как
доказал Земмельвейс, также является инфекционной бо-,
лезнью.
Карболовая кислота, называемая химиками фенолом,
представляет собой вещество, весьма близко стоящее к
бензолу, [и добывается также путем перегонки из каменно-
угольного дегтя. Молекула ее содержит лишний по срав-
нению с бензолом атом кислорода и имеет следующее
строение:
I
н
бензол
с —н
с —н
Н
Н —с^\с —О~Н
н—cL Jo —н
V
А
фенол (карболовая кислота)
21 Химия в повседневной жизни
321
Значение достижений, введенных Листером, станет осо-
бенно ясным, если мы вспомним, например, о франко-
прусской войн® 1870 г. Хотя медицина стояла в то время
уже на достаточной высоте, тем не менее и тогда еще всюду
щипали корпию из старою полотна без всяких мер пре-
досторожности, как это делалось в течение целою ряда
столетий; при этом и не подозревали, какая масса инфек-
ционных начал вносится в раны [корпией, содержащей мно-
жество бактерий, попадавших в нее с рук. Не подлежит
сомнению, что из-за применения корпии погибло много
раненых, которые в настоящее время могли бы быть легко
спасены. Теперь применяют стерилизованную, т. е. осво-
божденную ,от бактерий, перевязочную марлю и вату. Так
как, кроме тою, вое, что соприкасается с раной—руки и
инструменты хирурга, теперь дезинфецируется, то раны и
заживают большею частью без нагноения. Конечно, боль-
шие i операции связаны, как и прежде, с опасностью,
однако «горячку» от заражения крови можно считать устра-
ненной. Ведь многие операции, которые вследствие после-
дующего заражения крови оканчивались смертью, стали
выполнимыми лишь о момента введения антисептики,
исключающей нагноение.
Существует ; очень много различных антисептических
средств. У карболовой кислоты появилось много конку-
рейтов, тем более, что в [связи с успехами бактериологии
И гигиены спрос на антисептические вещества все возра-
стает. Прекрасным антисептическим веществом является
крепкий спирт, так как он поглощает из бактерий воду,
необходимую для их существования. Упомянутый выше
йодоформ, Несмотря на свой неприятный запах, приме-
няется особенно охотно при 'заживлении ран и поцрежнему
употребляется хирургами. Бактериологи для своих целей
часто (применяют гораздо более сильное, и не обладающее
притом (запахом, антисептическое средство—сулему. С хи-
мической точки зрения сулема представляет собою хлор-
ную ртуть. Водный раствор ее даже при большом разведе-
нии обладает необычайно сильным антисептическим дей-
ствием; не будь сулема так ядовита для человеческого
организма, она вытеснила бы вероятно все остальные анти-
септические средства. Дезинфецирующим действием об-
ладают также почти вое эфирные масла, о которых шла
речь в главе об искусственных ароматических веществах.
822
Так, паПр'Имер, мятное масло, Обязанное своим ароматом
ментолу, является важной составной частью антисепти-
ческих Полосканий, зубных паст и 'зубного порошка, так
же как тимол и салол.
В кухне Для консервирования пищевых продуктов
нужны не только безвредные, ио и совершенно безвкусные
антисептические вещества. Для этого особенно Охотно при-
меняют теперь бензойную кислоту, которую, как было
сказано выше, примешивают также к маргарину, изго-
товляемому из животных жиров. Она является совершенно
безвредным и в данном случае незаменимым консервирую-
щим средством.
Бензойная кислота встречается и в некоторых растениях,
например в ягодах брусники. После употребления этих
ягод в моче человека всегда находят небольшое количе-
ство бензойной кислоты. Раньше бензойную кислоту добы-
вали из привозимой к нам из Индии дорогостоящей бензой-
ной смолы; в настоящее время она готовится искусствен-
ным путем из каменноугольного дегтя, причем способ ее
добывания настолько совершенен, что 1 кг ее обходится
всего около 2,5 марок (1 р. 15 к.). При консервировании
фруктов применяют салициловую кислоту, которая сое-
диняет в себе свойства карболовбй и бензойной кислот.
Для дезинфекции часто применяют также и продукты
перегонки каменноугольного дегтя; на практике доказано,
что они также обладают сильными обеззараживающими
свойствами. Таков, например, крезол, который продается
в смеси с мыльным раствором, под названием лизола. Он
Настолько дешев, что каждый может с его помощью убе-
речь себя от инфекции.
Под инфекцией подразумевают внедрение в человеческий
организм мельчайших живых существ, различимых только
под микроскопом. Размножение и дальнейшее их развитие
в теле человека влечет за собою заболевания. Как раз
эти-то мельчайшие существа и могут быть убиты антисеп-
тическими средствами, пока они 'не успели еще проникнуть
в кровяной ток.
Но даже и в тех случаях, когда бактерии уже проявляют
свое вредное действие внутри человеческого организма, со-
временная медицинская химия предоставляет средства для
уничтожения возбудителей болезни. Отметим здесь лишь
имевшие 'огромное значение работы Эрлиха, которому уда-
31»
323
лось с помощью некоторых красящих веществ, получен-
ных из бензола (фуксин, метилвиолет, малахитовая зе-
лень), убить в крови человека страшного возбудителя сон-
ной болезни. А в последнее время было изготовлено из-
вестное средство против сонной болезни—«Байер 205» или
германии, которое производит чудеса при борьбе с этой
болезнью в тропических странах. Состав указанного сред-
ства держался в секрете; известно (было лишь, что оно не
содержит ни ртути, ни мышьяка, ни сурьмы. А кто не слы-
шал о сальварсане, средстве для лечения опаснейшей бо-
лезни, сифилиса! Это лекарственное вещество построено из
двух бензольных колец и содержит наряду с обычными
органогенными элементами (углерод, водород, кислород,
азот) еще и мышьяк. Приводим [здесь его формулу, которую
внимательный читатель легко поймет после всего сказан-
ного раньше,—если он примет во внимание, что As это
химический ,символ мышьяка: ,
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
А Антигризутные взрывчатые веще- ства 137
Автогенная сварка 20, 45 Адский камень 239, 240 Азид свинца 132 Азот 9, И, 12, 13, 38, 53, 57, 58, 59, 62, 65, 66, 70, 102, 126 Азотная кислота 58, 62, 126, 190, 191, 239 Азотнокалиевая соль 126, 136 Азотнокальпиевая » 59 Азотносеребряная » 239, 240, 241, 246, 247 Азотноториевая соль 42 Азотноцериевая » 42 Азотные удобрения 46, 57—63, 65 Азотособиратели 59 Ализарин 158, 163—164, 169 Ализариновый красный 157, 159 Алкалоиды 312—313, 316 Алкоголь 112 Алмаз 25 Алхимия 234 Альбумин 67 Альдегиды 119, 125 Альфенид 308 Алюминиевая бронза 302 Алюминий 299, 300—303, 304, 305 Амальгама 219 Амиловые спирты 116 Аминокислоты 69 Аммиак 38, 46, 58, 59—60, 62, 120, 143, 191, 196, 197, 198, 199, 301 Аммиачная вода 37, 38, 124 Ангидриды кислот 182 Анилин 160 Анилиновые красители 160,161, 317 Анилиновый красный 155 Анилинокрасочная промышленность 168, 169-170 Антидифтерийная сыворотка 46, 68 Антипепсин 73 Антипирин 318 Антисептические вещества 320, 321 Антитрипсин 73 Антихлор 153, 154, 177 Антрахинон 164 Антрацен 160, 163, 164 Апатит 52, 53 Араго 244 Арак 120, 121 Аргон 11 Аррорут 79 Атом 20, 26, 27, 28 Атропин 313 Ауэр-фон-Вельсбах 42 Ацетальдегид 119, 125 Ацетилен 20, 37, 43, 45, 118, 125 Ацетилцеллюлоза 138, 143 Ацетон 101, 125 Б Байер 161, 162 «Байер 205» 324 Барда 101, 114, 115—116, 201 Бардяной уголь 201 Барилья 188, 189, 195, 196 Батик 165 Безалкогольные напитки 101, 107 Бездымный порох 125, 126, 127, 130, 134, 135 Беккерель 256 Беление 36, 152—155 Белила цинковые 19 Белильная известь 153 Белки 46, 57, 65—74, 82, 83, 95, 96, 101, 102,103,109,116, 244,245
825
Бенедиктин 121
Бензин 20, 29, 31—35, 51, 121, 207
Бензиновые мыла 31
Бензойная кислота 76, 90, 315, 316,
323
Бензойный альдегид 168
Бензол 117, 160, 162, 169, 316,
317
Беннет 247
Бергиус 35
Беринг 68
Берлинская лазурь 156, 166, 167
Бертолле 136
Бертолетова соль 18, 19, 57
Бессемер 287
Бессемеровский процесс 268, 287—
292
Беттгер 234, 235
Биметаллизм 265
Биркеланд 62
Благородные газы 12
Болотная руда 38
Болотный газ 27
Борная кислота 216, 221
Бош 59, 62
Бражка 115, 123, 124
Британский металл 308
Бродильные напитки 104
Брожение 97, 98, 101, 104, 105, 106,
108, ПО, 113, 114
Брожение верховое 111, 113
Брожение молочнокислое 105, 108,
110
Брожение низовое 111
» уксуснокислое 105, 110
Бром 56, 57, 240
Бромистое серебро 138, 240, 244,
246, 247, 248
Бромистый аммоний 247
» калий 246, 247
Броможелатинная эмульсия 247—248,
251
Бронза 305—307
Бумага 174—185
Бунзен 40, 300
Бунзеновская горелка 40—41
Бура 232
Бутан 28
В
Вазелин 20, 31
Вайда 161
Вакса 52
Валлах 168
Ван-Гельмонт 21, 22
Ванилин 169
Варенье 104
Варка пищи 94, 97
Велер 300
Веронал 319
Взрывчатые вещества 12, 126—137,
145
Вигантоль 93
Виннокалиевая соль 100
Винный спирт 98
» уксус 122, 123
Вино 101, 105—108, 111, 112, 120,
121, 122, 123, 124
Вино хлебное 113
Виноградное сусло 105
Виноградный сахар 77, 80, 81, 82,
93, 105
Виски 120, 121
Вискова 143
Витамины 80, 92—94
Внутренняя секреция 73, 83
Вода 14, 23, 39, 65, 77, 81, 90,
115, 301
Вода жесткая 211
» мягкая 211
Водка 114, 116, 120
Водород 14, 23, 26, 27, 28, 35, 38,
39, 45, 59, 70, 77, 78, 81, 210
Водяная баня 247
Воздух 5—12, 46, 49, 58, 62
Вольфрам 313
Воск 25, 165
Восстановление 119
Выветривание 49, 54
Высаливание 208
Вьель 135
Г
Габер 59, 62
Газ 22
Газовые плиты 41
Газовый завод 37, 38, 59
Газокалильное освещение 20, 42
Галмей 307
Гальванопластика 301, 308
Гамбир 149
Гашеная известь 125, 153, 186—187,
205, 225, 226
326
Гейслеровы трубки 252
Гексан 28
Гелий 11, 12
Гемоглобин 69
Генераторы 218, 297
Германии 324
Гидрат окиси аммония 199
» » железа 38, 225
» » кальция 187
> » меди 81
Гидросернистонатриевая соль 163
Гидрохинон 246
Гильхрист 291, 292
Гипосульфит 154, 244, 246, 247, 248
Гипс 180
Глазурь 230, 231, 232, 233, 234,
236, 237
Глаубер 190
Глауберова соль 190, 204
Глет 172
Гликоколь 90
Глина 225, 227, 228, 300
Глинозем 150, 300, 302
Глицериды 24, 25
Глицерин 24, 25, 71, 90, 132, 172,
206, 207
Глюкоза 81, 105
Горение 10, 11, 14, 127
Гормоны 73, 83
Горное масло 32
Графит 25
Гребе 163
Гремучая ртуть 126, 129—130, 132
Гремучий газ 11, 45, 223,
» студень 126, 135
Греческий огонь 126, 127—128
Гуано 53
Гумус 50
д
Дагерр 242, 243, 244, 245, 246
Дагерротипы 243
Даммар 212
Двуокись крзмния 214, 215, 216,
227, 288
Двуокись марганца 194, 195
» серы 38
Двухромокалиевая соль 250
деготь 38, 124
екстрдн 77, 83, 98, 109, 165
Денатурированный спирт 101, 119—
ПО, 121
Дерматин 139
Диастаз 109, 110, ИЗ, 114, 115
Динамит 126, 132—133, 1J5, 137
Диоксиантрахинон 164
Доменная печь 272—^76, 279
Дополнительные вещества (вита-
мины) 77, 80, 91, 92—94
Драгоценные камни искусственные
222-224
Древесина 46
Древесная масса 179
Древесный деготь 124
> спирт 125
» уголь 20, 25, 43, 46,116,
125, 127, 128, 280
Дрожжи 93, 97, 98, 99, 100, 104,
105, 107, 108, 111, 113, 114, 115,
118
Дрожжи прессованные 99, 101, 113,
114
Дубильные вещества 146, 147—149,
156
Дубильные экстракты 149
Дубители искусственные 149, 169
Дубление 146—152
» жировое 149, 151—152
> квасцовое 149—150
» хромовое 151
Дур алюмин 302
Душистые вещества 168—169
Дыхание 12—14
Дэви 40
Е
Едкая известь 187, 188
Едкие щелочи 186, 205
Едкий натр 81, 82, 126, 142, 143,
200, 205, 206
Едкое кали 126, 188, 200, 204,
205, 206
Ж
Жавелева вода 154
Желатина 247, 250
Железный купорос 163, 166
Железо 10, 11, 45, 60, 91, 192, 193,
265, 267—299, 304
827
Железо литое 268, 293, 294, 298
» сварочное 268
» электролитическое 268, 303
Желтая кровяная соль 156, 166
Живопись по фарфору 238
Животный уголь 89, 155
Жидкий воздух 12, 62
Жидкое топливо 35
Жирные кислоты 24, 25, 156, 172,
206, 207, 210, 211
Жиропот 201
Жиры 20, 31, 46, 65, 67, 74—77,
82, 83,101,102, 103, 205, 206,207
Жиры отвержденные 210, 213
Жмыхи 69
3
Закваска 98, 99
Закись меди 81
Замша 152
Зеркала 219—220
Зимаза 105
Зола 47, 48, 55, 56, 58, 188, 201
Золотая валюта 264, 265
Золото 222, 223, 239, 259—265
» тальми 307
И
Известковая вода 13
Известковое молоко 147
Известковое тесто 226
Известковый шпат 187
Известняк 182, 186, 187, 198, 205,
225 227
Известь 13, 43, 47, 85, 117,147, 292
» белильная 153
» едкая 187, 188
» гашеная 125, 153, 186, 187,
205, 225, 226
Известь негашеная 117, 147, 186,
187, 198, 205, 225
Индантроновые краски 163, 170
Индиго 160, 161—163, 170
Инициирующие вещества 132, 134,
136
Инкрустирующие вещества 175, 176,
181
Инсулин 83
Инфузорная земля 133
328
Иод 62, 240, 243
Йодистое серебро 240, 243, 244,
246, 247 ,
Йодистый калий 244, 246, 247
Йодоформ 320, 322
Ионон 168, 169
Ириний 16
Искусственная кожа 138, 139
» шерсть 126, 140—142
Искусственные драгоценные камни
222—224
Искусственные удобрения 46, 47,
51-65
Искусственный каучук 118, 121, 125
» шелк 125,126,142—145
К
Кавказские вина 106
Кадмий 307
Казеин 66, 67, 69
Калиевая селитра 60, 126, 127, 128,
130, 136, 188
Калиевые соли 46, 47, 49, 51, 55—
57, 96
Калиевые удобрения 55—57, 64
Калий 49, 55, 57, 97, 302
Калория 103
Кальциевая селитра 62
Каменноугольная смола (каменно-
угольный деготь) 35, 120, 134,
149, 159-160, 316, 318
Каменноугольные красители 158,
159—164
Каменные изделия 230—232
Каменный уголь 14, 20,34, 37,38, 59
Камфара 138
Канифоль 139, 173, 177, 210, 211,
212 213
Каолин 235, 236, 239
Карбид кальция 20, 43, 62, 125
Карбоксильная группа 125
Карболовая кислота 133, 160, 321
Карбонизация 126, 141—142
Кассиев пурпур 223
Катализаторы 33, 35, 60, 192, 262
Катехо 149
Катодные лучи 252—253, 254
Каучук искусственный 118, 121, 125
Кварц 220, 221, 236, 239
Кварцевое стекло 221
Квасцы алюминиевые 150, 157, 303
Квебрахо 148, 149
Кекуле 314, 315
Керамические изделия 224—239
Кератин 69
Керосин 20, 25, 31, 32
Кизельгур 133
Кинопленка 126
Кирпич 225—229
» пзвестково-песчаный 225, 226
» огнеупорный 229
» сырец 225
» шамотный 229
Кирхгоф 84
Кис zoo тесто 98
Кислород 9—11, 12, 13, 14, 15, 19,
23, 36, 39, 40, 45, 46, 58, 62, 70,
- 77, 78, 81, 126, 127
Кислоты 126
Клей 19, 46, 69—70, 175, 176
Клейковина 97
Клейстер 79, 97, 98, 115, 139, 165
Кленовый сахар 118
Клетчатка 77, 80, 97, 126, 130, 14°,
143, 145, 175, 181
Кобальт 171
Кожа 146, 147, 149
Кокаин 313
Кокосовое масло 76, 77, 209, 210
Кокс 38, 59, 124, 278—279
Коллодий 245, 246
Кольчугалюминий 302
Конго красный 159
Кониин 317, 318
Конопляное масло 207, 213
Конфеты 84
Коньяк 113, 120, 121
Копал 173
Копра 209
Коричное масло 169
Кормовые средства 46, 69
Коровье масло 75, 76
Корт 280, 281, 282'
Корье 148, 149
Кости 46, 51—52, 69, 70, 207
Костяная зола 224
» мука 52
Костяной жир 51, 207
» клей 19, 51
» уголь 52
Кох 161
Кошениль 158
Крапп 163, 164
Красильные лаки 157
Краски индантроновые 163
» каменноугольные 171
» клеевые 173
« малярные 157
» масляные 171, 173
» минеральные 171
Крахмал 65, 77, 78—80, 81, 82, 83,
97, 98, 109, 115, 116
Крахмальная патока 84
Крахмальный сахар 84
Крезол 323
Крекинг 33, 34
Кремень 130
Кремнеалюминиевая соль 228
Кремнезем 47, 50, 216
Кремнекалиевая соль 214, 215
Кремнекальциевая соль 214, 215, 226
Кремнекислое железо 216
Кремненатриевая соль 207, 214,
217, 231
Кремний 288
Криолит 224, 302
Криптон 11
КриЯный способ 277, 280
Кр(вь 12, 13, 14, 66,68, 71, 73, 83
Кровяная сыворотка 68
Ксенон 12
Кубовые красители 163
Кулер сахарный 84
Кумарин 169
Кумыс 101, 108—109
Кунжутное масло 76
Куркума 76
Кюммель 121
Кюри 256, 257
Л
Лавуазье 9, 124
Лаки 173
Лаковое производство 121
Латунь 307
Леблан 189, 190, 195, 193, 200
Лейкосоединения 163
Лекарственные вещества 121
Лен 140, 152
Либерман 163
Либих 47, 48, 51, 54, 56, 100, 102,
119, 320
32 9
Лигроин 34
Лизол 323
Ликер 107, 114, 117, 120, 121
Лимонная кислота 93
Лпнолеум 173
Листер 320, 321, 822
Льняная кислота 172
Льняное масло 75, 172, 173, 207,213
Ляпис 239
м
Магний 304
Майолика 232
Малага 106
Мангрове 148
Марганец 288, 290
Маргарин 75—77, 210
Марена 163, 164
Маркграф 86, 87
Мартен 294
Масла 20, 22, 25, 207
» высыхающие 171—172
» невысыхающие 172
» полувысыхающие 172
Масло кокосовое 76, 77, 209, 210
» конопляное 207, 213
» коровье 75, 76
» кунжутное 76
» льняное 75, 172,173,207, 213
» мятное 324
» оливковое 25, 75, 83, 171,
172, 207
Масло пальмовое 209, 211
» пальмоядерное 209
» подсолнечное 77, 213
» соевое 77, 207
» сурепное 25
» хлопковое 76, 77, 172, 213
Ма ляная кислота 147
Маточные соли 60
Маточный раствор 60
Мед (напиток) 101, 108
Мед пчелиный 84, 85, 108
Медный купорос 81, 82
Медь 193, 203, 219, 299, 305, 307
Меж-Мур ье 75
Меласса 89. 201
Мел 19, 152. 187, 189, 217
Мергель 227
Металлы 259
Метан 27, 28, 38, 813
Метиловый спирт 125
Миндальное молоко 76
Мирабилит 204
Mycoderma aceti 122
Митчерлих 181
Молекула 20, 27—28
Молибден 303, 311
Молоко 46, 66, 67, 75, 76, 91, 93, 109
> миндальное 76
Молочная кислота 66, 98, 99, 108,
109, 114, 147
Молочнокалиевая соль 99—100
Молочный сахар 66, 67, 75, 80, 104,
108, 109
Морфий 312, 813, 318
Мост 106
Моча 66
Мочевина 59, 60, 66
Мрамор 186
Мумия 19
Мыла жидкие 207, 208
» наполненные 208, 209
> смоляные 210—211
» твердые 207, 209
> туалетные 208
Мыло 51, 76, 186, 188, 204—213
» шлифованное 209
> ядровое 208
Мэддокс 247
Мясо 78
И
Набивка тканей 165
Натриевая селитра 60, 126, 191
Натрий 189, 302
Натронная целлюлоза 180, 181
Нафталин 160, 162
Нафтеновые кислоты 213
Нашатырный спирт 38, 143
Нейзильбер 308
Неон 12
Нерадоли 149
Нефть 27, 28, 31—34
Никель 210, 299, 801, 304, 307
Нитраты 58
Нитрование 130
Нитроглицерин 133, 135
Нитрогруппы 126, 127, 130, 133
Нитроклетчатка 127, 137, 138, 145
830
Нитролаки 126, 138
Нобель 132, 133
Йотое серебро 308—309
Норвежская селитра 62
Ньепс 244
О
Огня добывание 15—19
Озон 20, 36
Окисление 10, 11, 14, 122, 153
Окислы азота 62, 63
» свинца 172, 173
Окись алюминия 150, 156, 157, 176,
177, 221, 227, 300, 302
Окись железа 10, 11, 47, 151, 156,
157, 193, 225
Окись калия 214
» кальция 51, 182, 186, 187, 214
» кобальта 238
» магния 51
» меди 81, 142
» натрия 221
» олова 157
» свинца 212, 217, 221, 238
» сурьмы 158
» тория 42
» углерода 38, 266
» урана 238
» хрома 151, 157, 238, 250
» церия 42
» цинка 299
Олеин 25
Олеиновая кислота 24, 25, 172
Олеомаргарин 76
Оливковое масло 25, 75, 83, 171,
172, 207
Олифа 139, 157, 173
Олово 157, 158, 219, 306
Оловявнонатриевая соль 158
Оловянные композиции 157
Опиум 314
Органические вещества 65
Ортохроматические пластинки 249
Осмии 313
Основания 126, 182
Основная химпромышленность 202
Отбросные соли 56
Отвержденные жиры 210, 213
Отруби 69, 80, 97, 147
Оуэнса машина 218
П
Пайрекс 221
Палисси 233
Пальмитиновая кислота 24
Пальмовое масло 209, 211
Пальмоядерное масло 209
Панхроматические пластинки 249
Папирус 174
Пар (с. х.) 46, 49
Парафин 20, 24, 25, 31
Парацельс 22, 23, 112, 320
Пастер 321
Патина 307, 308
Патока крахмальная 84
» черная 89
Пекарные порошки 100
Пентан 28
Пепсин 71, 72, 83
Пептоны 71, 72
Пергамент 152
Пергаментная бумага 175
Перегнои 48, 50
Перегонка 20, 124, 125
» сухая 37
» фракционированная 28
Перекись водорода 154
> марганца 194
» свинца 16, 18
Персиль 155
Песок 47, 214, 215, 216, 225
Петролейный эфир 29
Печение хлеба 97—100
Пиво 101, 103, 109—111, 112, 113,
121, 122
Пигментное печатание 250
Пикраты 134
Пикриновая кислота 134
Пирамидон 319
Пирекс 221
Пиридин 317
Пирит 192, 193, 203
Пирогаллол 245, 246, 247
Пироксилин 126, 130, 131, 132, 135
Пироксилиновый порох 130, 135
Пищеварение 71—73
Питание 46, 65, 101—104
Плавни 236, 276
Пламя 20, 21, 23, 40
Пластырь 212
Платина 41, 192, 259, 260, 262
Плодовые вина 106, 122
3 31
Плодосмен 47, 49, 50
Поваренная соль 56, 90, 126, 150
151, 189, 193, 197, 200, 231/
241
Подсолнечное масло 77, 213
Полевой шпат 236, 237, 239
Порох бездымный 125, 126, 127, 130,
134, 135
Порох пироксилиновый 130, 135
» черный 60, 126, 127—129,
130—131
Портвейн 106
Поташ 55, 56, 99, 100, 152, 188,
201—202, 204, 205, 214
Почва 47, 49, 50, 51, 58
Преципитат 54
Пристлей 301
Пропан 27
Простые вещества 25, 28
Протеиновые вещества 69, 96
Протравы 156—159, 164, 165
Проявители 245—246, 248
Пудлингование 268, 281—282, 298
Р
Радий 28, 256—258
Радиоактивные вещества 256
Раствор строительный 225—226
Растворимое стекло 155, 207, 214
Регенераторы 296—297
Ректификация спирта 116
Рентген 253, 254, 255
Рентгеновы лучи 252, 253—256
Ржавление 10
Ром 120, 121
Ртуть 118, 219, 243, 263
Рубин 223
Рубнер 102
Рудничный газ 27, 127
Руды 259
Рунге 160
Рыбий жир 92
С
Саго 79
Салициловая кислота 323
Сало 20, 24, 25, 207, 211
» говяжье 75, 92
832
Сало гусиное 24
» свиное 24, 77
Саломас 213
Сальварсан 325
Сальные свечи 22—25
Сандал красный 165
» синий 164
Сапфир 223, 224
Сахар 52, 65, 66, 77, 80, 81, 97. 98,
104,105,106, 108,109,110, 117,'118
Сахар виноградный 77, 80, 81, 82,
93, 105
Сахар кленовый 118
» крахмальный 84
» молочный 66, 67, 75, 80, 104,
108, 109
Сахар свекловичный 80, 84, 85—89
» тростниковый 80, 84—88, 104
Сахарин 90
Сахарная болезнь 82—83, 90, 102
Сахарная промышленность 87, 89
Сахарный кулер 84
Sacharomyces cerevisiae 104—105
Сахаромицет 105
Светильный газ 20, 22, 37, 38, 39,
40, 120
Светофильтры 249
Свечи 20, 22, 24, 51
» восковые 25
» сальные 22—25
» стеариновые 24—25
Свинец 182, 230, 299, 304, 305
Свинца окислы 172, 173
Свинцовый блеск 230
Сгонка волоса 146—147
Селитра искусственная 46
» калиевая 60, 126, 127, 128,
130, 136, 188
Селитра кальциевая 62
х> натриевая 60, 126, 191
» норвежская 62
5> чилийская 59, 60, 62, 63,191
Сера 16, 19, 28, 38, 39, 70, 127, 128,
154, 182, 192
Серебро 219, 220, 239, 240, 246,
262—265
Серебряная валюта 264
Серная кислота 38, 39, 54, 55,
59, 114, 117, 125, 151, 190—193,
202—204, 266
Сернистая кислота 39, 182, 190,
191
Сернистое железо 38
Сернистокальциевая соль кислая 118,
181—182
Сернистонатриевая соль кислая 147
Сернистый газ 38, 39, 154, 182, 190,
192, 203, 266
Сернистый калий 130
» кальций 147
» натрий 147
» свинец 18
Серноалюмпниевая соль 150, 193
Серноаммониевая соль 59, 60, 147
Серноватистонатриевая соль 154,244
Сернокалиевая соль 56, 150, 157, 207
Сернонатриевая соль 189, 190, 193
Серный ангидрид 192
» колчедан 192, 203, 204
Сероуглерод 143, 144
Сжижение угля 20
Сивушное масло 116, 125
Сидр 106
Силикагель 214
Силикаты 215, 236
Сименс 294, 296, 297, 298
Сименс-Мартена способ 268, 298
Синтез химический 10
Синтетический ал^иак 46
» каучук (см. искус-
ственный каучук)
Ситцепечатание 165 •
Слезоточивые вещества 125
Сливки 75, 92
Сложные вещества 28
» удобрения 65
Смазочное масло 32, 35
Смолы 173
Смоляные кислоты 177
» мыла 210—211
Сода 186, 188—190, 195-200, 204,
205, 212
Сода кальцинированная 196
Соевое масло 77, 207
Соединения химические 25—26, 28
Соли 12^, 182
Соликамское месторождение 58, 204
Солод 101, 110, 113, 114, 115,
123
Солодовый уксус 123, 124
Сольвэ 197, 200, 204
Соляная кислота 71, 72, 81, 126, 194,
200
Спирт 89, 98, 101, 104, 105, Ш,
112—121, 122, 123, 125, 183, 318,
322
Спирт древесный 125
» из дерева 110, 117—118
» метиловый 125
» этиловый 125
Спиртные напитки 101, 108, 111
Спиртовый уксус 123
Сличенная промышленность 17, 18,
19
Спички 15, 16—19
Сталь 267, 270, 271, 285, 287-294,
303
Сталь быстрорежущая 310
» вольфрамовая 310
» литая 268, 286—287, 293, 294,
298
Сталь нержавеющая 311—312
» никелевая 309
» сварочная 268
» тигельная 287
» цементная 285, 287
Стассфуртские залежи 56, 57, 188
Стеарин 25
Стеариновая кислота 24
Стеариновые свечи 24—25
Стекло 200, 214—224
» йенское 221
» кварцевое 221
» молочное 224
» растворимое 155, 207, 214
» рубиновое 222, 223
Стразы 222,^223
Строительный раствор 225—226
Субстантивные красители 159
Сулема 323
Сульфат 190, 199, 217
» аммония 55, 59, 60, 62
Сульфиды 259,265
Сульфитная целлюлоза 181—183
Сульфитные щелока 118
Сульфиты 181
Сумах 148
Суперфосфат 46, 52, 54
Сурепное масло 25
Сурик 19, 172
Сурьма 158
Сусло 105, 110, 113
Сухая перегонка 37
Сыр 46, 67
Сыродутный способ 271—272, 277
278
333
т
Тальбот 241, 244
Тальк 235
Таннин 158, 166
Температура вспышки 31
Теннант 153
Тиман 168
Типографский металл 309
Томас 291, 292
Томасова мука 46, 51,
54, 35, 293
Толуол 134, 160
Тротил 134
Томпак 308
Торпеда 131, 132
Торф 14, 296
Трава-альфа 179, 180
Трехсернистая сурьма 19
Тринитротолуол 131, 134
Тринитрофенол 134
Трипсин 73, 83
Тристеарин 76
Тростниковый сахар 80,
84—88, 104
Тэер 47
Тяжелая химия 202
У
Углеаммониевая соль 99, 196
Углеаммониевая соль кислая 197
Углеводороды 20, 25, 26, 27, 28, 35,
38, 40
Углеводы 46, 65, 67, 73, 74, 75,
77-89, 101, 102, 103, 116, 130
Углекалиевая соль 55, 188, 205
Углекальциевая соль 13, 182, 205,
226
Углекислота 49, 50, 54, 111
Углекислый газ 11, 12, 13, 14, 23,
38, 39, 40, 46, 47, 58, 78, 98, 104,
107, 111, 182, 198, 266
Углемедная соль основная 307
Угленатриевая соль 188, 198, 205
Угленатриевая соль кислая 100, 188,
197 198
Углерод 13, 14, 15, 20, 23, 25, 26,
27, 40, 42, 46, 47, 58, 70, 74,
77, 78, 81, 102, 103
Углеродные соединения 26
» цепи 26
Углистый колчедан 203—204
Уголь древесный 20, 25, 43, 46, 116,
125, 127, 128, 280
Уголь животный 89, 155
Удобрения 46, 47, 49, 50—65, 87
> концентрированные 65
» сложные 65
» цветочные 64
Уксус 66, 101, 121—125, 230
»• белый 123
» винный 122
» солодовый 123, 124
» спиртовый 124
» темный 123
Уксусная кислота 98, 122, 123, 124,
125, 138
Уксусная эссенция 124, 125
Уксуснокальциевая соль 125
Уксуснооловянная соль 158
Уксусносв инцовая соль 171
Уксусный альдегид 119
» грибок 122
Уран 256
Урановая смоляная обманка 256
Ф
Фарадей 317
Фарфор 232, 234—239
Фарфоровый бисквит 238
Фаянс 230, 231, 232—234
Фенацетин 319
Фенол 133, 160, 322
Ферменты 71, 73, 105
Фибрин 46, 68, 72
Философский камень 234
Фильеры 142, 143
Фишер Эмиль 69 70, 320
Флегма 112
Флотационные хвосты 203, 204
Флотация 203
Флюоресценция 253, 254, 256
Формулы химические 20, 27
Фосфор 16, 47, 49, 54, 55, 290, 291,
292, 293
Фосфор желтый 8, 9, 16, 17, 18, 19
> красный 17, 18, 19
Фосфоритная мука 54
Фосфориты 51, 52, 55, 193
Фосфорная кислота 8,10, 50, 51, 53,97
Фосфор нокальциевая соль 51, 52, 54,
91, 224, 293
334
Фосфорные удобрения 51—55, 65
Фотография 59, 233—252
Франк 56 62
Фришевание 277
Фруктовое вино 101
Фруктовые эссенции 120, 121
» эфиры 120
Фуксин 161, 166
Фуркруа 124
X
Хибинские апатиты 53
Химическая чистка 20, 31
Химические соединения 25—26, 28
» формулы 20, 27
» элементы 20, 25, 26,
27 28
Хинин 313, 318, 319
Хинолин 318, 319
Хлопковое масло 76, 77, 172, 213
Хлопок 126, 130, 140, 141, 142, 143,
152, 159
Хлопок мерсеризированный 126,
140, 142
Хлор 136, 153, 189, 195, 200
Хлораль 319, 321
Хлоратные взрывчатые вещества
126, 136
Хлористое олово 158
» серебро 240, 241, 242, 244
Хлористый аммоний 197, 198, 200
» водород 193, 194, 195
» калий 56, 200
» кальций 154, 199
» кобальт 167, 168
» магний 57
» марганец 195
» натрий 126,189,193, 200
Хлорная известь 36, 153, 154, 155,
177, 194, 195, 200
Хлорная ртуть 323
Хлорноватокалиевая соль 136
Хлорное железо 166
Хлорофилл 46, 58, 78
Хлороформ 121, 319, 320, 321
Хром 303
Хромовая желтая 171
Хромовокалиевая соль 171
Хромюв о свинцовая соль 171
Хромпик 19
ц
Царская водка 239
Цветная фотография 250—252
Цветочные удобрения 64
Целлит 138
Целлюлоза 77, 80, 117, 118, 126, 143
> натронная 180, 181
> сульфитная 181—183
Целлюдоид 126, 138, 139
Цементация железа 268
Цементы 227—228
» гидравлические 228
Цианамид кальция 46, 59, 62
Циик 260, 266, 299—300, 304, 305,
308
Цинковые белила 19
Ч
Черная патока 89
Чернила 166
» копировальные 166
> симпатические 166—168
Черный порох 60, 126, 127—129,
130—131
Чилийская селитра 59, 60, 62, 63,
191
Чугун 266, 273—280, 288, 290, 291,
303
Чугун зеркальный 290
ш
Шамот 37
Шампанское 101, 106—107
Шардонне 143
Шведские спички 17, 18
Швицевание 147
Шеврель 206
Шелк 126, 140, 143, 155
> ацетатный 143
» вискозный 143
> искусственный 125, 126
142—145
> медноаммиачный 143
> нитратный 143
Шеллак 173
Шерсть 126, 140—142, 152, 155
> искусственная 126,140—142
335
Шлаки 228, 276, 277
Шмальта 171
Шмальц 77
Шреттер 17
щ
Щавелевожелез истая соль 245
Щелочи едкие 186
Э
Эвгенол 169
Эйде 62
Экстрактивные вещества 95, 96
Элементы химические 20, 25, 26, 27,
28
Эманация радия 257, 258
Энзимы 105
Эозин 166
Эргостерин 93
Эрлих 324
Эссенции фруктовые 120, 121
Эссенция уксусная 124, 125
Этан 27, 28, 315
Этиловый спирт 125
Эфир 121, 320
Я
Янтарь 173
СОДЕРЖАНИЕ
Стр.
Предисловие переводчика.................................. 3
Лекция первая............................................ 5
Дыхание. Вес воздуха. Барометр. Анализ воздуха. Кислород.
Азот. Благородные газы. Жидкий воздух. Различие между вды-
хаемым и выдыхаемым воздухом. Поддержание теплоты тела.
Горение. Окисление. Спички.
Лекция вторая............................................. 20
Природа пламени. Свечи. Состав жиров. Масла. Керосин. Угле-
водороды. Химическая чистка. Элементы. Химические формулы.
Атом и молекула. Перегонка. Бензин. Сжижение угля. Вазелин.
Парафин. Озон. Производство светильного газа и его побочные
продукты. Варка на газе. Газокалильное освещение. Карбид
кальция. Ацетилен. Автогенная сварка.
Лекция третья........................................... 46
Питание растений. Удобрение. Плодосмен. Пар. Поддержание
плодородия почвы с помощью искусственных удобрений. Кости.
Суперфосфат. Томасова мука. Калиевые соли. Азотные удоб-
рения. Синтетический аммиак. Искусственная селитра. Циан-
амид кальция. Питание человека и животных. Белок. Жиры. Угле-
воды. Молоко и его свертывание. Сыр. Фибрин. Антидифтерий-
ная сыворотка. Кормовые средства. Клей. Опыты воспроизве-
дения пищеварительных процессов.
Лекция четвертая.......................................... 74
Смешанная пища. Масло. Маргарин. Искусственные пищевые
жиры. Крахмал. Сахаристые вещества. Образование сахара
в плодах. Питание больных сахарной болезнью. Виноградный
сахар. Конфеты. Сахарный кулер. Тростниковый сахар. Свекло-
вичный сахар. Сахарин. Поваренная соль. Железо в пищевых
продуктах. Витамины. Значение варки пищи. Суп. Закваска.
Хлебопечение. Пекарные порошки.
Лекция пятая..............................................101
Количество необходимых питательных веществ. Питательная
ценность важнейших пищевых продуктов. Брожение. Вино. Фрук-
товое вино. Безалкогольные напитки. Шампанское. Мед. Кумыс.
22 Химия в повседневной жизни
337
(Jmp.
Пиво. Солод. Спирт. Прессованные дрожжи. Хлебный спирт.
Картофельный спирт. Барда. Очистка спирта. Спирт из дере-
ва. Денатурированный спирт. Спиртные напитки. Винный
уксус. Спиртовый уксус. Древесный уксус. Ацетон.
Лекция шестая ....................... 126
Порох. Греческий огонь. Гремучая ртуть. Пироксилин. Дина-
мит. Гремучий студень. Хлоратные взрывчатые вещества. Нитро-
лаки. Целлюлоид. Кинопленка. Шерсть. Хлопок. Шелк. Искус-
ственная шерсть. Карбонизация. Мерсеризированный хлопок.
Искусственный шелк.
Лекция седьмая................................. 146
Дубление корьем. Кожа. Сгонка волоса. Мягчение. Дубильные
вещества. Сорта корья. Квебрахо. Сумах. Дубильные экстракты.
Подошвенная кожа. Квасцовое дубление. Лайка. Меховые изде-
лия. Хромовая кожа. Жировое дубление. Замшевая кожа. Пер-
гамент. Луговая отбелка. Подсинивание белья. Беление хлором.
Хлорная известь. Антихлор. Жавелева вода. Сернистый газ.
Перекись водорода. «Персиль». Крашение. Протравливание.
Красильные лаки. Субстантивные красители. Каменноугольные
красители. Индиго. Ализарин. Краски в виде пасты. Экстракты
из красильных деревьев. Синий сандал. Набивка тканей. Чер-
нила. Духи.
Лекция восьмая...................................171
Малярное дело. Высыхающие и невысыхающие масла. Льняное
масло. Олифа. Лак. Целлюлоза. Бумага. Проклеивание бумаги.
Бумага из соломы. Бумага из древесной массы. Натронная
целлюлоза. Сульфитная целлюлоза.
Лекция девятая...................................186
Жженая известь. Поташ. Сода. Серная кислота. Глауберова
соль. Азотная кислота. Хлорная известь. Кристаллическая сода.
Аммиачная сода. Искусственный поташ. Бардяная зола. Поташ
из жиропота. Мыло. Едкое кали. Едкий натр. Канифольное мыло.
Мягкая' И жесткая вода. Пластырь.
Лекция десятая ....................... 214
Стекло. Зеркала. Калиевые и натриевые стекла. Кварцевое
стекло. Искусственные драгоценные камни. Молочноэ стекло.
Глины. Кирпич. Известковый раствор. Известково-песчаникд-
вый кирпич. Цемент. Глазурь Горшечные изделия. Фаянс. Май-
олика. Фарфор. Фотография. Адский камень. Хлористое, броми-
стое и иодистое серебро. Дагерротипия. Проявление негативов.
Тальботипия. Альбуминный способ. Мокрый коллодионный про-
цесс. Сухие пластинки с бромосеребряной эмульсией. Фотогра-
фия спектра. Ретушь. Цветочувствительные пластинки. Цветная
фотография. Хроможелатинный способ. Пигментное печатание.
Рентгеновы лучи. Радий.
338
Стр.
Лекция одиннадцатая.........................».........259
Благородные и неблагородные металлы. Руды. Золото. Платина.
Серебро. Соотношение между ценностью золота и серебра.
Золотая валюта. Восстановление металлических окислов. Чугун.
Сталь. Ковкое железо. Доменная печь. Шлаки. Кокс. Пудлинго-
вание. Прокатное железо. Рельсовые пути. Цементная сталь.
Тигельная сталь. Бессемеровская сталь. Зеркальный чугун.
Марганец. Удаление фосфора из железа. Литая сталь. Газо-
образное топливо. Использование торфа. Регенератор. Пла-
менные печи. Цинк. Гальванопластика. Калий. Натрий. Алюми-
ний. Железо, свободное от углерода.
Лекция двенадцатая....................................305
Сплавы. Монеты. Бронза. Патина. Латунь. Томпак. Золото
тальми. Новое серебро. Альфенид. Британский металл. Типо-
графский металл. Никелевая сталь. Хромистая сталь. Редкие
металлы. Алкалоиды. Морфий. Метан. Бензол. Пиридин. Кониин.
Хинолин. Антипирин. Фенацетин. Наркотики. Хлораль. Эфир.
Хлороформ. Антисептические средства. Йодоформ. Карболовая
кислота. Сулема. Ментол. Бензойная кислота. Салициловая кис-
лота. Германии. Сальварсан.
Предметный указатель..................................315
Замеченные опечатки
Стр. Строка Напечатано Нужно читать
199 15 сверху 2) NH4OH=2NH34-2H2O 2) 2NHft0H=2N,H3-|-2H2O
296 6 снизу креозолы крезолы
Лассар-Кон—Химия в повседневной жизни