Автор: Зимина В.Н. Кравченко А.В. Викторова И.Б. Кошечкин В.А.
Теги: инфекционные заболевания инфекционные лихорадки медицина руководство практическая медицина издательство гэотар медиа спид вич
ISBN: 978-5-9704-5824-2
Год: 2020
В.Н. Зимина, А.В. Кравченко,
И.Б. Викторова, В.А. Кошечкин
ТУБЕРКУЛЕЗ
И ВИЧ-ИНФЕКЦИЯ
У ВЗРОСЛЫХ
2-е издание, переработанное и дополненное
РУКОВОДСТВО
Москва
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
2020
УДК 616.98(083)
ББК55.145я81
Т81
01-УПС-3609
Авторы:
Зимина Вера Николаевна — доктор медицинских наук, профессор кафедры
инфекционных болезней с курсами эпидемиологии и фтизиатрии Медицин-
ского института ФГАОУ ВО «Российский университет дружбы народов»;
Кравченко Алексей Викторович — доктор медицинских наук, профессор, веду-
щий научный сотрудник ФБУН «Центральный НИИ эпидемиологии» Роспо-
требнадзора;
Викторова Ирина Борисовна — кандидат медицинских наук, доцент кафедры
фтизиопульмонологии Новокузнецкого государственного института усовер-
шенствования врачей — филиала ФГБОУ ДПО «Российская медицинская
академия непрерывного профессионального образования» Минздрава России;
Кошечкин Владимир Анатольевич — доктор медицинских наук, профессор
кафедры инфекционных болезней с курсами эпидемиологии и фтизиатрии
медицинского института ФГАОУ ВО «Российский университет дружбы на-
родов».
Т81 Туберкулез и ВИЧ-инфекция у взрослых / В. Н. Зимина, А. В. Крав-
ченко, И. Б. Викторова, В. А. Кошечкин. — 2-е изд., перераб. и доп. —
Москва : ГЭОТАР-Медиа, 2020. - 256 с. : ил. - DOI: 10.33029/9704-
5824-2-THIA-2-2020-1 -256.
ISBN 978-5-9704-5824-2
Руководство посвящено актуальной проблеме — сочетанной инфекции
ВИЧ/туберкулез. В издании кратко изложены иммунопатогенез заболева-
ний, клинико-рентгенологические проявления туберкулеза в зависимости
от степени иммуносупрессии, методы его диагностики у больных ВИЧ-
инфекцией. Представлены современные стандарты лечения и профилак-
тики туберкулеза у ВИЧ-инфицированных пациентов. В руководстве также
приведены основные принципы дифференциальной диагностики туберку-
леза с другими заболеваниями легких и схемы их лечения.
Издание предназначено фтизиатрам, инфекционистам, терапевтам, со-
трудникам территориальных центров по профилактике и борьбе со СПИДом,
а также врачам других специальностей, оказывающим медицинскую помощь
ВИЧ-инфицированным пациентам.
УДК 616.98(083)
ББК55.145я81
Права на данное издание принадлежат ООО Издательская группа «ГЭОТАР-
Медиа». Воспроизведение и распространение в каком бы то ни было виде части
или целого издания не могут быть осуществлены без письменного разрешения ООО
Издательская группа «ГЭОТАР-Медиа».
© Коллектив авторов, 2020
© ООО Издательская группа «ГЭОТАР-Медиа», 2020
ISBN 978-5-9704-5824-2 © ООО Издательская группа «ГЭОТАР-Медиа»,
оформление, 2020
ОГЛАВЛЕНИЕ
Список сокращений и условных обозначений 7
Глава 1. Этиология и патогенез туберкулеза 10
1.1. Характеристика микобактерии туберкулеза 10
1.2. Пути и способы заражения туберкулезом 13
1.3. Иммунопатогенез туберкулезного воспаления 15
1.3.1. Роль неспецифического (врожденного) иммунитета
в борьбе с туберкулезом 17
1.3.2. Специфический (адаптивный, приобретенный)
иммунный ответ 21
1.4. Патоморфология туберкулезного воспаления
у иммунокомпетентных лиц 27
1.4.1. Патоморфология первичного туберкулеза легких 28
1.4.2. Патоморфология вторичного туберкулеза легких 29
1.5. Клиническая классификация туберкулеза 31
1.5.1. Характеристика основных клинических форм
туберкулеза органов дыхания у взрослых 33
Глава 2. ВИЧ-инфекция 38
2.1. Этиология ВИЧ-инфекции 38
2.2. Пути и способы заражения ВИЧ 40
2.3. Патогенез ВИЧ-инфекции 42
2.4. Естественное течение ВИЧ-инфекции 46
2.5. Классификации ВИЧ-инфекции 48
2.5.1. Клинические стадии Всемирной организации
здравоохранения для взрослых
и подростков не менее 15 лет 48
2.5.2. Российская клиническая классификация
ВИЧ-инфекции 52
2.5.3. Международная классификация болезней
10-го пересмотра 57
2.6. Патогенез сочетанной инфекции 59
Глава 3. Клинические проявления туберкулеза органов дыхания
у больных ВИЧ-инфекцией в зависимости
от степени иммуносупрессии 63
3.1. Клинические проявления туберкулеза
органов дыхания на различных стадиях ВИЧ-инфекции 63
Оглавление
3.2. Клинико-рентгенологические проявления туберкулеза
органов дыхания у больных ВИЧ-инфекцией
в зависимости от степени иммуносупрессии 66
3.3. Туберкулез внутригрудных лимфатических узлов 69
3.4. Туберкулезный плеврит/эмпиема 81
3.5. Острый милиарный туберкулез 87
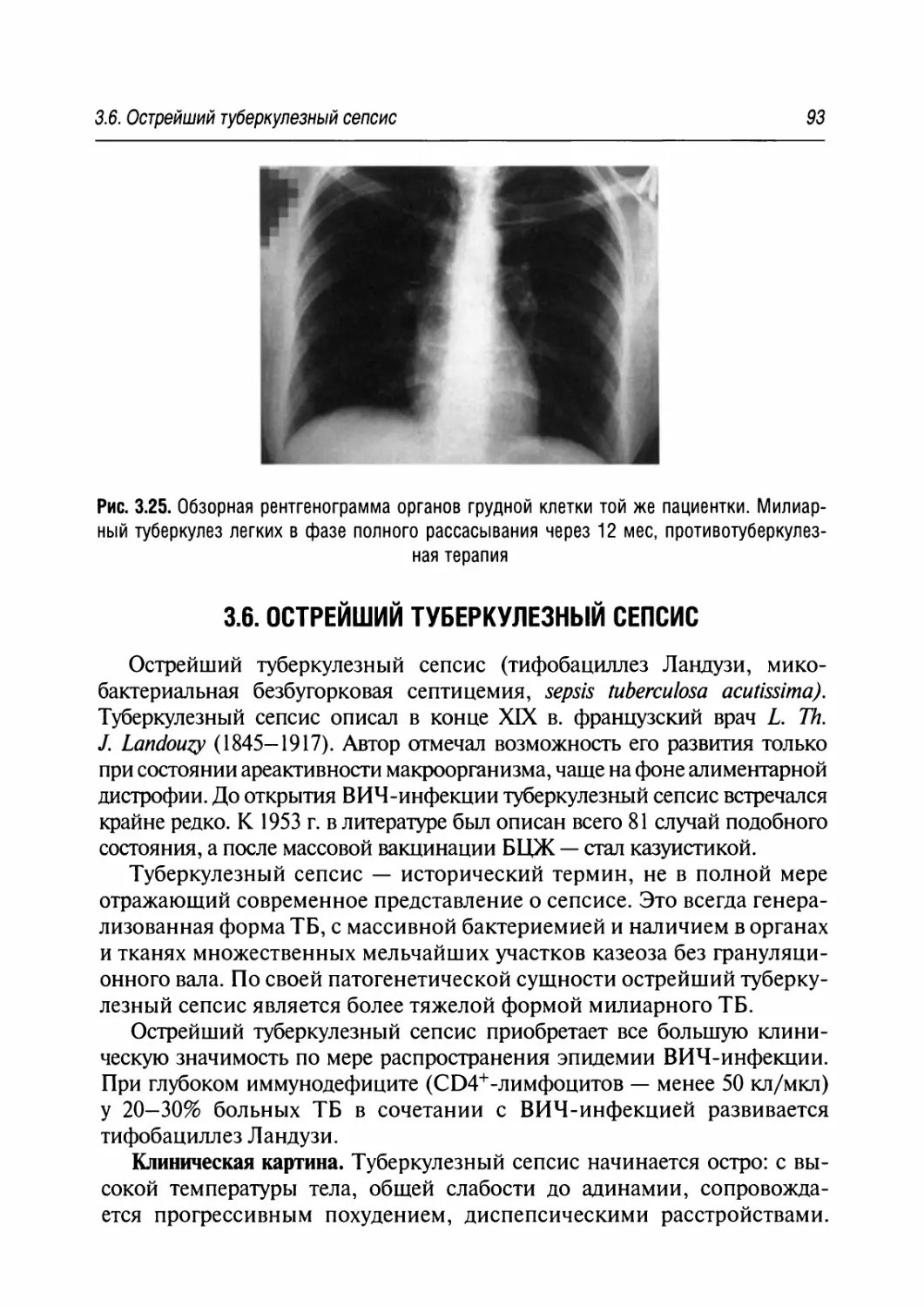
3.6. Острейший туберкулезный сепсис 93
Глава 4. Внеторакальные проявления туберкулеза
у больных ВИЧ-инфекцией 96
4.1. Туберкулез периферических лимфатических узлов 97
4.2. Туберкулез мозговых оболочек,
центральной нервной системы 99
4.3. Туберкулез органов брюшной полости (абдоминальный
туберкулез) 104
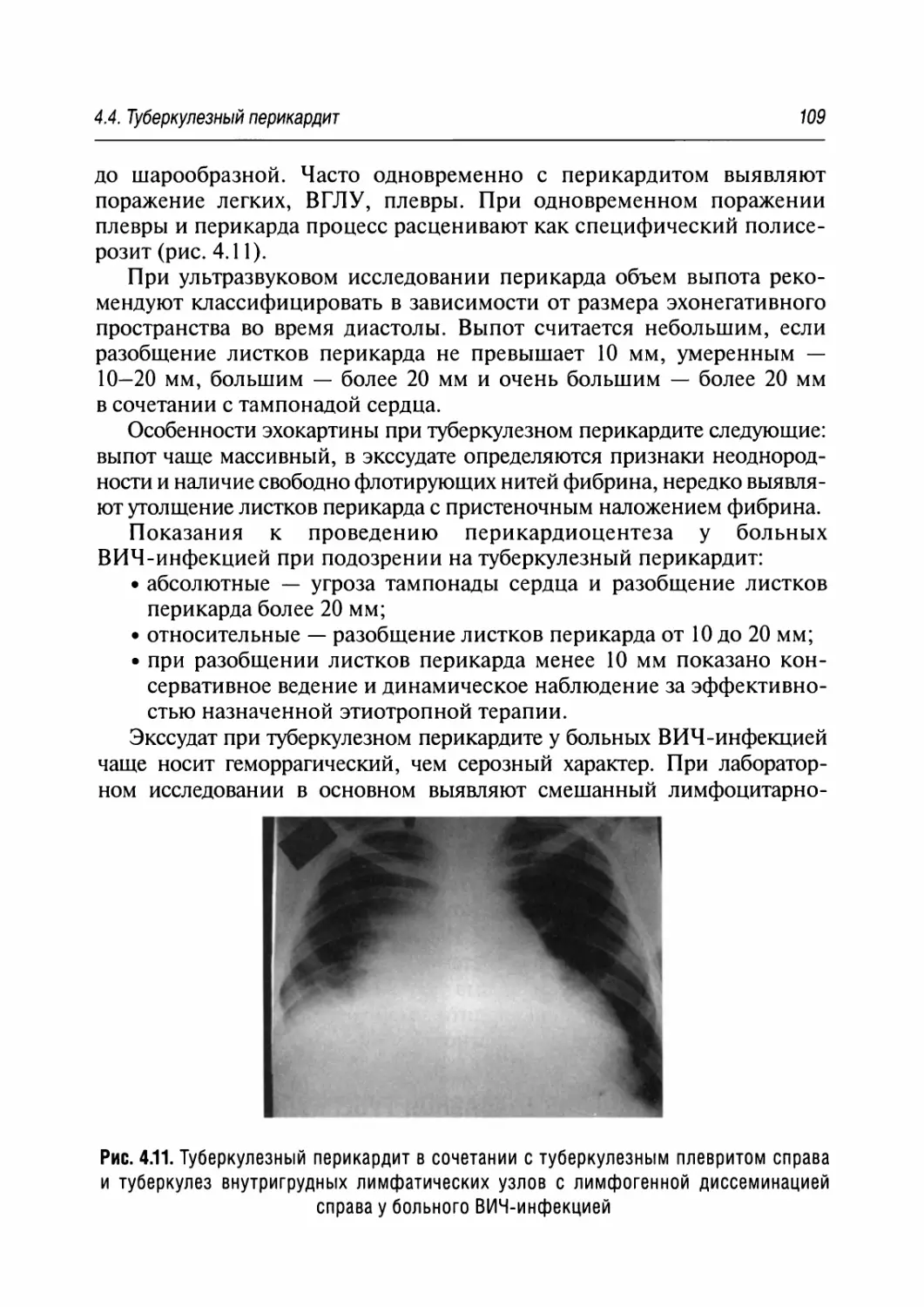
4.4. Туберкулезный перикардит 106
4.5. Костно-суставной туберкулез 110
4.6. Туберкулез мочеполовой системы 115
Глава 5. Макро- и микроскопическая патоморфологическая
характеристика туберкулеза у больных ВИЧ-инфекцией 117
5.1. Особенности макроскопической картины
ВИЧ-ассоциированного туберкулеза по данным аутопсии 117
5.1.1. Поражение легких 117
5.1.2. Поражение лимфатических узлов 118
5.1.3. Поражение кишечника 118
5.1.4. Поражение мочеполовой системы 119
5.1.5. Поражение центральной нервной системы 119
5.2. Особенности микроскопической картины
ВИЧ-ассоциированного туберкулеза по данным аутопсии 120
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией 123
6.1. Постановка диагноза ВИЧ-инфекции 123
6.1.1. Установление факта инфицирования ВИЧ 123
6.1.2. Лабораторное подтверждение диагноза
ВИЧ-инфекции 126
6.1.3. Обоснование и формулировка диагноза
ВИЧ-инфекции 129
Оглавление
5
6.2. Диагностика туберкулеза у больных ВИЧ-инфекцией 131
6.2.1. Выявление возбудителя (микобактерии туберкулеза) . 132
6.2.2. Морфологическая диагностика 138
6.2.3. Иммунологические туберкулезные тесты 140
6.2.4. Диагностика других, помимо туберкулеза,
вторичных заболеваний 144
6.2.5. Пробная противотуберкулезная тест-терапия
(exjuvantibus) 144
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией 147
7.1. Режимы химиотерапии туберкулеза
у больных ВИЧ-инфекцией 147
7.2. Антиретровирусная терапия у больных
с сочетанной инфекцией 159
7.3. Нежелательные реакции при лечении туберкулеза
и ВИЧ-инфекции у больных коинфекцией 172
7.4. Хирургическое лечение туберкулеза
у больных ВИЧ-инфекцией 183
7.5. Синдром восстановления иммунной системы 183
7.6. Формирование приверженности к лечению туберкулеза
и ВИЧ-инфекции 188
7.6.1. Общие принципы 188
7.6.2. Формирование приверженности
к противотуберкулезной терапии 190
7.6.3. Формирование приверженности
к антиретровирусной терапии 192
Глава 8. Профилактика туберкулеза у больных ВИЧ-инфекцией ... 195
8.1. Антиретровирусная терапия как инструмент профилактики
туберкулеза у больных ВИЧ-инфекцией 195
8.2. Химиопрофилактика туберкулеза у больных ВИЧ-
инфекцией (лечение латентной туберкулезной инфекции) 196
8.3. Инфекционный противотуберкулезный контроль 203
Глава 9. Эпидемиология туберкулеза, ВИЧ-инфекции
и сочетанной инфекции (ВИЧ/туберкулез) в РФ и в мире 208
6 Оглавление
Глава 10. Дифференциальная диагностика туберкулеза органов
дыхания при ВИЧ-инфекции 214
10.1. Общие принципы дифференциальной диагностики
легочных поражений при ВИЧ-инфекции 215
10.2. Бактериальная пневмония 217
10.3. Пневмоцистная пневмония 222
10.4. Цитомегаловирусная инфекция 224
10.5. Другие легочные микозы 225
10.5.1. Криптококкоз 225
10.5.2. Гистоплазмоз 227
10.5.3. Кандидоз 229
10.6. Нетуберкулезный микобактериоз 230
10.7. Злокачественные поражения легких
при ВИЧ-инфекции 232
10.8. Лимфома 235
Список литературы 237
СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
4 — торговое название лекарственного средства и/или фарма-
цевтическая субстанция
р — лекарственное средство не зарегистрировано в Российской
Федерации
АБП — антибактериальные препараты
APT — антиретровирусная терапия
AT — абдоминальный туберкулез
АТР — проба с аллергеном туберкулезным рекомбинантным
БАЛ — бронхоальвеолярный лаваж
БАЛЖ — бронхоальвеолярная лаважная жидкость
ВГЛУ — внутригрудные лимфатические узлы
ВГН — верхняя граница нормы
ВИЧ — вирус иммунодефицита человека
ВОЗ — Всемирная организация здравоохранения
ГКС — глюкокорткостероиды
ГЛАП — персистирующая генерализованная лимфаденопатия
ГМ-КСФ —гранулоцитарномакрофагальный колоний стимулирующий
фактор
ДНК — дезоксирибонуклеиновая кислота
ИЛ — интерлейкин
ИП — ингибиторы протеазы
КСТБ — костно-суставной туберкулез
КТ — компьютерная томография
ЛЖВ — люди, живущие с ВИЧ
ЛТИ — латентная туберкулезная инфекция
ЛУ — лекарственная устойчивость
МБТ — микобактерии туберкулеза
МЛУ — множественная лекарственная устойчивость
НХЛ — неходжкинские лимфомы
НЯ — нежелательное явление
ОГК — органы грудной клетки
ПАСК — парааминосалициловая кислота
ПЛУ — периферические лимфатические узлы
ПТП — противотуберкулезные препараты
ПТТ — противотуберкулезная терапия
ПЦП — пневмоцистная пневмония
ПЦР — полимеразная цепная реакция
РГЧ — реакция гиперчувствительности
8
Список сокращений и условных обозначений
РНК — рибонуклеиновая кислота
РУ — устойчивость к рифампицину
СВИС — синдром восстановления иммунной системы
СПИД — синдром приобретенного иммунодефицита
ТБ — туберкулез
ТЛЧ — тест лекарственной чувствительности
Ф-АЗТ — фосфазид
ХП — химиопрофилактика
ЦВКК — центральная врачебная контрольная комиссия
ЦМВ — цитомегаловирус
ЦНС — центральная нервная система
ШЛУ — широкая лекарственная устойчивость
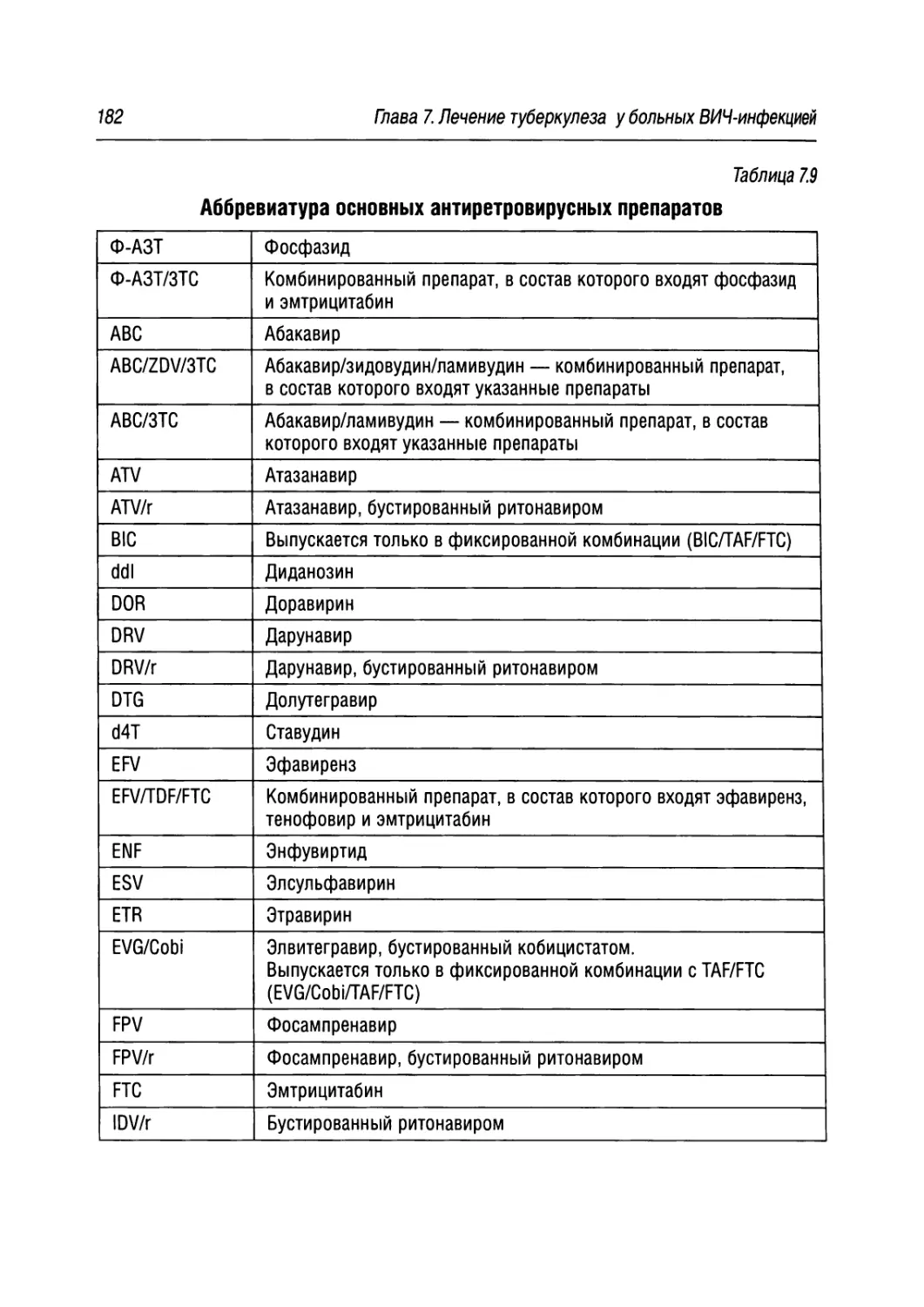
ЗТС — ламивудин
ABC — абакавир
Am — амикацин
ATV — атазанавир
ATV/r — атазанавир, бустированный ритонавиром
BIC — биктегравир
Bq — бедаквилин
CDC — Центр по контролю и профилактике заболеваний США
Cfz — клофазимин
Cm — капреомицин
Cs — циклосерин
ddl — диданозин
Dim —деламанид
DRV/r — дарунавир, бустированный ритонавиром
DTG — долутегравир
Е — этамбутол
EFV — эфавиренз
ESV — элсульфавирин
Eto — этионамид
ETR — этравирин
EVG — элвитегравир
FPV — фосампренавир
FPV/r — фосампренавир, бустированный ритонавиром
FTC — эмтрицитабин
Н — изониазид
Hh — изониазид в высокой дозе (10—15 мг/кг в сутки)
Ну-ТБ — изониазид-устойчивый туберкулез
Список сокращений и условных обозначений
9
IGRA-тест
Imp
Km
Lfx
LPV
LPV/r
Lzd
MAC
Mfx
Mp
MVC
NVP
PAS
Pto
R
RAL
Rb
Rpt
S
Sfx
SQV/r
TDF
Tpp
Trd
Z
ZDV
Ну-ТБ
РУТБ
' — тест высвобождения у-интерферона
— имипенем/циластатин
— канамицин
— левофлоксацин
— лопинавир
— лопинавир/ритонавир, лопинавир + ритонавир
— линезолид
— Mycobacterium avium complex
— моксифлоксацин
— меропенем
— маравирок
— невирапин
— аминосалициловая кислота
— протионамид
— рифампицин
— ралтегравир
— рифабутин
— рифапентин
— стрептомицин
— спарфлоксацин
— саквинавир, бустированный ритонавиром
— тенофовир
— тиоуреидоиминометилпиридиния перхлорат
— теризидон
— пиразинамид
— зидовудин
— изониазид-устойчивый ТБ
— рифампицин-устойчивый ТБ
Глава 1
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ТУБЕРКУЛЕЗА
1.1. ХАРАКТЕРИСТИКА МИКОБАКТЕРИИ ТУБЕРКУЛЕЗА
Туберкулез (ТБ) (от лат. tuberculum — бугорок) — инфекционное
заболевание, способное поражать любые органы и ткани человека.
Заболевание вызывается микобактериями ТБ (МБТ) и характеризуется
полиморфной клинической картиной с образованием специфических
фанулем в местах локализации возбудителя и развитием иммунных
реакций замедленного типа. Фтизиология (от греч. phthysis — чахотка,
истощение тела) — учение о ТБ.
24 марта 1882 г. на заседании Берлинского физиологического обще-
ства немецкий ученый Роберт Кох сделал доклад «Этиология туберку-
леза», в котором сообщил, что обнаружил и выделил возбудителя ТБ
в чистой культуре. В этом же докладе он определил систему доказа-
тельств причастности этих микроорганизмов к этиологии заболевания,
сформулировав три условия, которые впоследствии были названы
в честь него триадой Коха. Для доказательства того, что причиной ТБ
является заражение бациллами, а также их рост и размножение в орга-
низме, необходимо выделить бациллы из организма, вырастить их
в виде чистой культуры и путем введения выделенных бацилл живот-
ным воспроизвести аналогичное заболевание.
В честь Р. Коха возбудитель ТБ получил название «бацилла Коха»
{bacillus Kochii), которое долгое время использовалось в системати-
ке микроорганизмов. За это открытие в 1905 г. он был удостоен
Нобелевской премии. В настоящее время академическим таксономи-
ческим названием бациллы Коха является МБТ.
МБТ — грамположительные, прямые или слегка изогнутые непод-
вижные палочки. Отличительным свойством М. tuberculosis является
устойчивость к кислотам, спиртам и щелочам, что обусловлено высо-
ким содержанием в клеточных стенках микобактерий липидов и вос-
ков. Клеточная стенка МБТ — причина одной из основных детерми-
нант вирулентности. Она состоит из нескольких слоев. Миколовые
кислоты формируют толстый внешний слой. Внутренние слои
1.1. Характеристика микобактерии туберкулеза
11
мембраны состоят из арабиногликана, липоманнана и пептидоглика-
нов. На поверхности клеток присутствуют маннановые гликопротеиды,
которые также могут секретироваться в период роста, и корд-фактор
(фактор вирулентности), придающий микроколониям бактерий вид
кос и оказывающий токсическое действие на макрофаги при фагоци-
тозе (рис. 1.1, см. цветную вклейку).
Микобактерия ТБ относится к порядку Actinomycetales, к семей-
ству бактерий Mycobacteriaceae, содержащему 2 рода: Mycobacterium
и Amycolicicoccus. В 1975 г. род Mycobacterium включал около 30 видов.
На момент написания руководства в соответствии с номенклату-
рой микроорганизмов род Mycobacterium насчитывает уже 186 видов
и 13 подвидов. Большинство видов микобактерии относится к сапро-
фитным микроорганизмам, широко распространенным в окружающей
среде. В последнее время значительно возросло количество видов
микобактерии, вызывающих заболевания человека, — микобактерио-
зы. Это связано с большей осведомленностью о заболевании, с появ-
лением новых, более точных и совершенных диагностических методик
идентификации микобактерии до вида, ежегодным ростом числа
людей, входящих в группы риска по развитию заболевания [пациенты
с инфекцией, вызываемой вирусом иммунодефицита человека (ВИЧ),
с трансплантированными органами, лица с хронической обструктив-
ной болезнью легких, бронхоэктазами, муковисцидозом, получаю-
щие иммуносупрессивную терапию и др.), а также с «освобождением
ниши» для нетуберкулезных микобактерии в развитых странах в связи
со значительным уменьшением числа пациентов с ТБ. ТБ вызывается
лишь несколькими видами микобактерии: М. tuberculosis (в 95-98%
случаев), М. bovis, M. bovis BCG, M. caprae, M. pinniped77, М. africanum,
М. microti, M. canettii. Эта группа микобактерии отличается выражен-
ным генетическим сходством и составляет единый комплекс микобак-
терии (М. tuberculosis complex). Представленные в дальнейшем мате-
риалы о ТБ имеют отношение только к заболеванию, вызываемому
М. tuberculosis complex.
К основным видовым свойствам МБТ относятся: высокая рези-
стентность к факторам внешнего воздействия, выраженный полимор-
физм, медленное размножение и патогенность — способность жить
и размножаться в тканях живого организма и вызывать специфическое
туберкулезное воспаление.
Высокая резистентность к факторам внешнего воздействия. МБТ обла-
дают устойчивостью к физическим и химическим агентам, сохраня-
ют жизнеспособность при очень низких температурах, а повышение
12
Глава 1. Этиология и патогенез туберкулеза
до 80 °С могут выдерживать в течение 5 мин. Во внешней среде
МБТ также достаточно устойчивы. В воде они могут сохраняться
до 150 дней. Высохшие микобактерии вызывают ТБ у морских свинок
через 1—1,5 года. Вне живого организма они остаются жизнеспособны-
ми в течение многих месяцев, особенно в темных, сырых помещениях.
Для МБТ губительны прямые солнечные лучи, искусственное ультра-
фиолетовое облучение и хлорсодержащие дезинфицирующие средства.
В искусственных условиях МБТ растут только на специальных твердых
и жидких питательных средах. МБТ по своей природе нечувствительны
ко многим антибиотикам: |3-лактамам, макролидам, цефалоспоринам
и тетрациклинам. Это свойство в первую очередь связано с тем, что
высокогидрофобная клеточная поверхность служит своего рода физи-
ческим барьером для терапевтических агентов и антибиотиков.
Главная причина устойчивости закодирована в структуре генома
туберкулезной палочки, и даже в отношении противотуберкулезных
препаратов (ПТП) МБТ способны формировать устойчивость (рези-
стентность). Одновременная лекарственная устойчивость (ЛУ) МБТ
к нескольким препаратам, и прежде всего к основным — изониазиду
и рифампицину, в последние годы значительно снижает эффектив-
ность лечения ТБ. В результате современное здравоохранение имеет
дело не просто с опасным возбудителем ТБ, а с целым набором его
штаммов, устойчивых к разным противотуберкулезным лекарственным
средствам. На практике для организации эффективного лечения ТБ
важно не только обнаружить МБТ, но и определить их резистентность,
причем достаточно быстро — в течение 2-3 дней, чтобы вовремя назна-
чить эффективную химиотерапию.
Выраженный полиморфизм. Форма и размеры МБТ непостоянны,
что зависит от возраста клеток и меняющихся условий среды. Помимо
изогнутых палочек, форма МБТ может быть нитевидной, кокковидной,
мелкозернистой фильтрующейся и, наоборот, гигантской ветвящейся.
Одним из важных видов изменчивости МБТ является формирова-
ние так называемых L-форм, связанных со структурой клеточной мем-
браны возбудителя. L-формы характеризуются сниженным уровнем
метаболизма, подавленной вирулентностью. Оставаясь жизнеспособ-
ными, они могут длительное время находиться в организме и индуци-
ровать противотуберкулезный иммунитет. L-формы МБТ способны
при соответствующих условиях реверсировать (модифицироваться)
в палочковидный вариант, вызывая тем самым реактивацию туберку-
лезного процесса. Многообразные формы возбудителя характеризуют
его большие адаптационные возможности.
1.2. Пути и способы заражения туберкулезом
13
МБТ размножаются медленно, простым клеточным делением (1 раз
в 20—24 ч). МБТ могут размножаться как в макрофагах, так и вне кле-
ток. Для роста на твердой питательной среде МБТ, полученной в кли-
нических условиях, необходимо от 4 до 6 нед. Для нормального развития
МБТ нуждаются в кислороде, поэтому их относят к аэробам.
Патогенность МБТ — способность жить и размножаться в тканях
живого организма и вызывать специфическое туберкулезное воспале-
ние. Патогенность проявляется в вирулентности (степени болезнетвор-
ное™). Вирулентность может существенно изменяться в результате
воздействия на МБТ факторов внешней среды и по-разному прояв-
ляться в зависимости от состояния макроорганизма, который подвер-
гается бактериальной агрессии.
Геном МБТ. В 1998 г. была завершена расшифровка генома МБТ.
Геном кольцевой хромосомы МБТ H37Rv (стандартный штамм) содержит
примерно 4000 последовательностей, кодирующих белки. Геном МБТ
чрезвычайно консервативен. Его представители обладают гомологией
ДНК (дезоксирибонуклеиновой кислоты) на уровне 85—100%, в то время
как ДНК других видов микобактерий гомологичны МБТ лишь на 4—26%.
1.2. ПУТИ И СПОСОБЫ ЗАРАЖЕНИЯ ТУБЕРКУЛЕЗОМ
Основным резервуаром туберкулезной инфекции являются люди,
больные ТБ легких, распространяющие МБТ (бактериовыделители),
значительно реже — некоторые виды животных, которых поражают
МБТ (крупный рогатый скот, собаки, мыши). Особое значение при
заражении ТБ имеет длительный и тесный контакт здорового человека
с бактериовыделителем. Заражение происходит чаще всего в семье,
в месте проживания или коллективе, в которых находится больной ТБ,
выделяющий микобактерий. Опасность рассеивания заразного аэро-
золя устраняется, если бактериовыделитель своевременно выявлен
и изолирован. Возникновение и течение инфекции зависят не только
от вирулентности возбудителя, но и от состояния устойчивости и реак-
тивности макроорганизма. Основными факторами риска заражения
являются массивное вдыхание инфицированного воздуха, несостоя-
тельность мукоцилиарного аппарата или длительный контакт с бакте-
риовыделителем.
Заражение ТБ происходит в момент проникновения МБТ в орга-
низм, где возникает первичный контакте микроорганизмом. Различают
следующие пути передачи туберкулезной инфекции.
14
Глава 1. Этиология и патогенез туберкулеза
• Аэрогенный (через дыхательные пути), который включает воздуш-
но-капельный и чрезвычайно редко — воздушно-пылевой пути.
• Алиментарный (через пищеварительную систему).
• Контактный. Описаны редкие случаи заражения через конъюн-
ктиву и поврежденную кожу.
• Вертикальный (от матери к плоду). Внутриутробное заражение
ребенка возможно гематогенно трансплацентарно через пупоч-
ную вену (характерно для ВИЧ) или путем аспирации инфици-
рованных МВТ околоплодных вод при туберкулезном поражении
плаценты матери. Такой путь заражения ТВ встречается редко,
преимущественно у ВИЧ-инфицированных женщин.
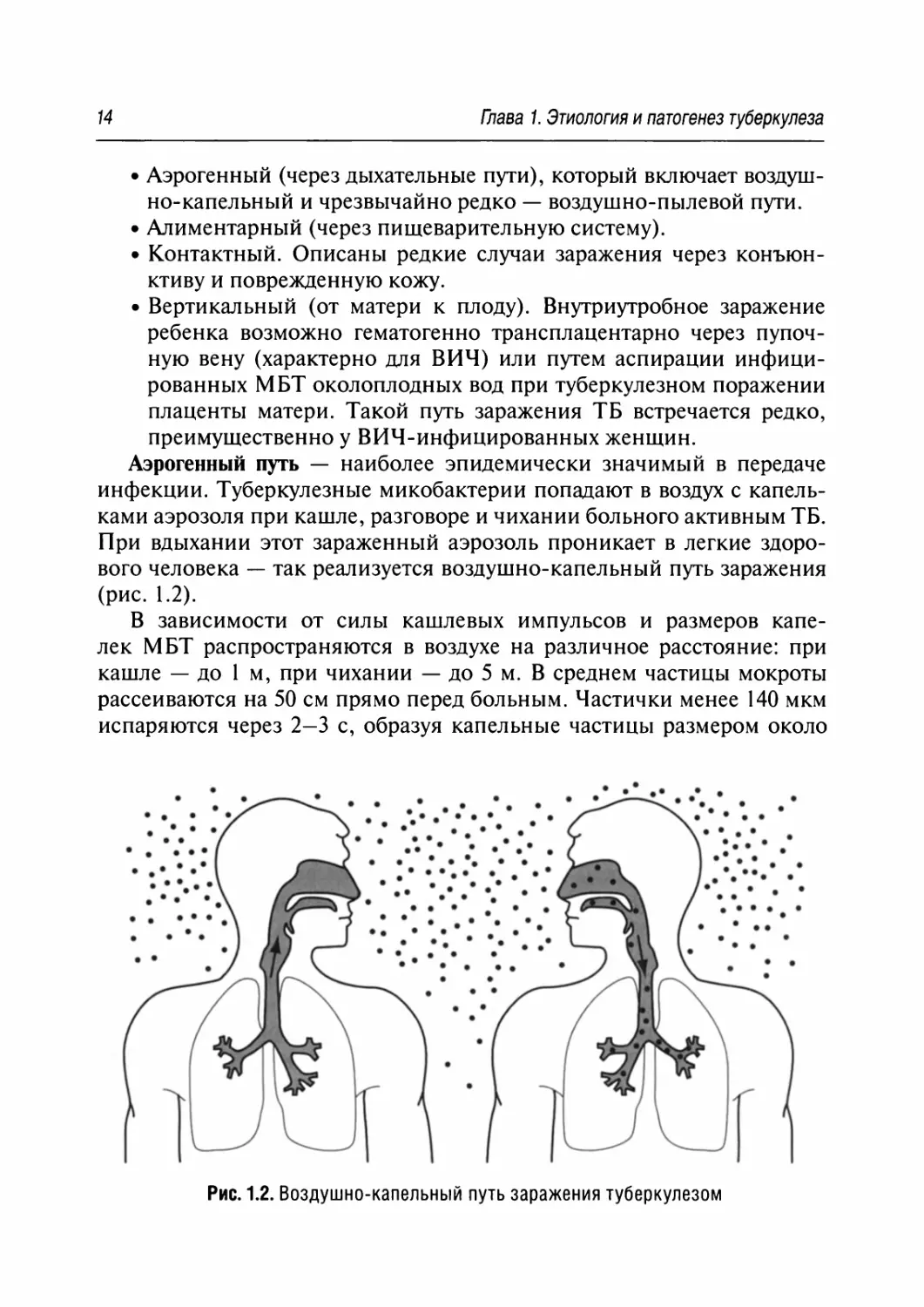
Аэрогенный путь — наиболее эпидемически значимый в передаче
инфекции. Туберкулезные микобактерии попадают в воздух с капель-
ками аэрозоля при кашле, разговоре и чихании больного активным ТВ.
При вдыхании этот зараженный аэрозоль проникает в легкие здоро-
вого человека — так реализуется воздушно-капельный путь заражения
(рис. 1.2).
В зависимости от силы кашлевых импульсов и размеров капе-
лек МВТ распространяются в воздухе на различное расстояние: при
кашле — до 1 м, при чихании — до 5 м. В среднем частицы мокроты
рассеиваются на 50 см прямо перед больным. Частички менее 140 мкм
испаряются через 2—3 с, образуя капельные частицы размером около
Рис. 1.2. Воздушно-капельный путь заражения туберкулезом
1.3. Иммунопатогенез туберкулезного воспаления
15
5 мкм, которые содержат 2—3 МБТ. Такие капельные частицы несколь-
ко дней остаются в воздухе и легко переносятся потоками воздуха.
Большие частички аэрозоля (> 140 мкм) быстро оседают на поверх-
ности, высыхают и превращаются в пылинки. Находящиеся в них
туберкулезные микобактерии некоторое время остаются в пыли жиз-
неспособными. Установлено, что к 18-му дню в высушенной мокроте
остается до 1% живых бактерий. Теоретически при сильном движении
воздуха, подметании пола, перемещении людей инфицированные
пылинки, содержащие туберкулезные микобактерии, могут подни-
маться в воздух и проникать в легкие и вызывать заражение — так реа-
лизуется воздушно-пылевой путь заражения. Однако в реальной жизни
реализация такого пути заражения маловероятна. Остальные пути зара-
жения встречаются значительно реже.
1.3. ИММУНОПАТОГЕНЕЗ ТУБЕРКУЛЕЗНОГО ВОСПАЛЕНИЯ
При вдыхании инфицированного воздуха МБТ проникают в дыха-
тельные пути и скапливаются в альвеолах. Важно отметить, что при
адекватном функционировании мукоцилиарного аппарата значитель-
ная доля возбудителя элиминируется из организма (до 90%), не при-
водя к заражению. Мукоцилиарный клиренс обеспечивает врожден-
ную иммунную защиту организма первого уровня. Выполнение этой
функции зависит от состояния внутренних стенок дыхательных путей,
оптимального взаимодействия ресничек и слизи. Нарушение муко-
цилиарного клиренса при остром и хроническом воспалении дыха-
тельных путей, трахеи и крупных бронхов, а также под воздействием
токсических веществ делает возможным проникновение микобакте-
рии в бронхиолы и альвеолы, после чего вероятность инфицирования
и заболевания ТБ значительно увеличивается. Те МБТ, которые
достигли респираторных бронхиол, оседают на поверхности слизистой
оболочки. Здесь они окутываются слизью, выделяемой бокаловидны-
ми клетками, плазменными опсонинами, фиксируются рецепторами
внешних клеточных мембран.
Связь между иммунным ответом и патогенезом. Дальнейшему раз-
витию туберкулезной инфекции препятствуют два этапа иммунного
реагирования (реакции): неспецифический (врожденный) и специфи-
ческий (адаптивный, приобретенный) иммунитет. Неспецифический
(врожденный) иммунитет относят ко второму уровню, а адаптивный —
к третьему уровню иммунной защиты.
16
Глава 1. Этиология и патогенез туберкулеза
Возможность развития и объем туберкулезного повреждения в орга-
низме определяются защитными реакциями, которые вырабатываются
иммунной системой макроорганизма против МБТ. При попадании
в альвеолы МБТ поглощаются альвеолярными макрофагами неимму-
низированного организма. Если альвеолярные макрофаги способны
уничтожить МБТ, инфекция не развивается. Если макрофагальное
звено не справляется, МБТ выживают и начинают размножаться
в альвеолярных макрофагах, приводя частично к их гибели. Макрофаги
распадаются, высвобождая хемокины, привлекающие к очагу пора-
жения новые макрофаги, и МБТ взаимодействуют с новыми клетка-
ми. Макрофаги, уже «знакомые» с МБТ, приобретают способность
синтезировать у-интерферон, который привлекает к очагу поражения
Т-лимфоциты. МБТ продолжают размножаться, в результате формиру-
ется локальное воспаление (на участке своего первоначального внедре-
ния). Затем МБТ, имея филогенетическую тропность к лимфоидной
ткани, проникают в региональные, чаще внутригрудные и лимфатиче-
ские узлы, откуда по лимфатическим путям могут попасть в системное
кровообращение и различные органы.
У подавляющего большинства людей (в 90% случаев) в схватке
между микро- и макроорганизмом побеждает последний. Размножение
МБТ останавливается, а их количество резко уменьшается. Первичный
фокус воспаления и его дочерние фокусы заживают, оставляя мини-
мальные остаточные изменения. При этом инфекционный агент ста-
новится известным для иммунологической памяти макроорганизма.
В результате формируется противотуберкулезный иммунитет, который
является приобретенным, активным, нестерильным, относительным.
Все описанные изменения в организме клинически происходят неза-
меченными, а на иммунологическую перестройку указывают положи-
тельный кожный тест (реакция Манту, или диаскинтест) либо положи-
тельные тесты высвобождения уинтерферона (IGRA-тесты).
Описанные изменения произошли по крайней мере у 1/3 населе-
ния мира, которое инфицировано МБТ, о чем может свидетельствовать
положительная кожная реакция Манту. Подобное состояние характе-
ризуется как латентная туберкулезная инфекция (ЛТИ).
Считается, что среди людей с ВИЧ-негативным статусом, инфициро-
ванных МБТ, только 10% заболеютТБ, причем половина из них — в пер-
вые 5 лет от момента инфицирования, а остальные — в течение жизни.
Вместе с тем риск развития активного ТБ у ВИЧ-инфицированных
повышается приблизительно на 10% в течение одного года жизни.
1.3. Иммунопатогенез туберкулезного воспаления
17
1.3.1. РОЛЬ НЕСПЕЦИФИЧЕСКОГО (ВРОЖДЕННОГО) ИММУНИТЕТА
В БОРЬБЕ С ТУБЕРКУЛЕЗОМ
При первичном заражении организма МБТ, достигшие перифе-
рических отделов легких, где внутренние стенки выстланы плоским
эпителием, распознаются макрофагами, дендритными клетками
и В-лимфоцитами. Захват МБТ происходит с помощью антигенсвязы-
вающих рецепторов, расположенных на поверхностной мембране ука-
занных клеток. Следующие антигенсвязывающие рецепторы участвуют
в процессе распознавания и фиксации МБТ: комплементарный рецеп-
тор 3, маннозный рецептор, скавенджер-рецептор, толл-подобные
рецепторы. Указанный набор антигенсвязывающих рецепторов при-
сутствует вне зависимости от того, встречался ли ранее организм с дан-
ным антигеном или нет. Макрофаги, которые первично фагоцитируют
МБТ, неактивированные, в них происходит репликация микобактерий,
нарушается процесс их элиминации из легких. На этой стадии зара-
жения инфицированные МБТ макрофаги накапливаются в местах
специфического воспаления, при этом формируются специфические
бугорки, в далеко зашедших случаях — участки казеозного некроза.
Макрофаги и дендритные клетки, первично вступая в борьбу с анти-
геном, одновременно инициируют развитие адаптивного иммунитета.
Взаимодействие врожденной и адаптивной фаз иммунитета макроорга-
низма направлено на предотвращение размножения проникших в него
МБТ и развития активного ТБ.
Основной способ начала иммунного ответа — фагоцитоз. Существует
несколько механизмов фагоцитоза, цель которого — захват и пере-
работка чужеродных антигенов, но все они сводятся к тому, что МБТ
оказываются заключенными в мембрану макрофага. Фагосома, обра-
зующаяся при этом, передвигается к центру клетки, где сливается
с лизосомами, в результате чего появляется фаголизосома. В фаголизо-
соме МБТ подвергаются перевариванию, в результате чего происходит
распад крупных молекул на составные части. Если после попадания
в фаголизосому МБТ уничтожаются — это так называемый завершен-
ный фагоцитоз. Но, к сожалению, при первичном попадании МБТ
в организм часто имеет место незавершенный фагоцитоз, когда фаго-
цитируемые М БТ могут жить и развиваться в фагоците. Таким образом,
макрофаги служат основным резервуаром патогена в тканях, так как
особенностью МБТ является способность инфицировать макрофаги
и размножаться внутри них за счет блокирования естественного меха-
низма нормального протекания фагоцитоза.
18
Глава 1. Этиология и патогенез туберкулеза
Врожденный иммунитет запускается сразу же после попадания
микроорганизма в макроорганизм. В качестве барьеров врожденно-
го иммунитета служат лимфоциты, макрофаги, плазменные клет-
ки, натуральные киллеры, цитокины/хемокины, плазменные белки
(система комплемента, факторы коагуляции, толл-подобные рецеп-
торы). При этом основную роль играют макрофаги и дендритные
клетки, которые выполняют функцию фагоцитоза и переваривания
микобактерий, тем самым проявляют способность непосредственно
подавлять рост бактерий.
Макрофаги на ранних стадиях инфекционного заболевания секре-
тируют провоспалительные цитокины: интерлейкины-1 (ИЛ-1), -2, -6,
-12 и фактор некроза опухоли, а также хемокины. С действием экспрес-
сии генов, ответственных за продукцию цитокинов и хемокинов, свя-
зывают и процесс растущей миграции макрофагов, Т- и В-лимфоцитов,
нейтрофилов в очаг воспалительного процесса.
Распознавание антигенов Т-клетками. Захват МБТ макрофагами
или дендритными клетками стимулирует синтез эндосомальных актив-
ных антигенных азотистых радикалов, активных антигенных кисло-
родных радикалов и антибактериальных пептидов, таких как кате-
лицидин [cathelicidin (LL37)], непосредственно убивающих патоген.
В дополнение к прямому уничтожению, разрушению и удалению МБТ
эндосомный путь в макрофагах служит связью между врожденной
и адаптивной иммунной системой. Небольшие микобактериальные
пептидные фрагменты (12—16 аминокислот) микобактерий презен-
тируются главному комплексу гистосовместимости (МНС класса II),
где они загружаются в молекулы этого класса МНС. В свою очередь,
МНС класса II + пептидные комплексы высвобождаются из везикул
и встраиваются в плазменную мембрану клетки макроорганизма, служа
маяками для циркулирующих Т-лимфоцитов, которые контролируют
ткани макроорганизма на наличие чужеродных пептидов (рис. 1.3).
Этот процесс называется процессингом антигена, в результате кото-
рого антигены МБТ экспрессируются в комплексе с белками главного
комплекса гистосовместимости на поверхности макрофага и начинает
формироваться адаптивный иммунитет.
Формирование гранулемы. Эволюционно сложившейся морфоло-
гической реакцией организма человека на МБТ является образование
клеточного вала в результате пролиферации и трансформации способ-
ных к фагоцитозу клеток вокруг воспалительного очага (гранулемы,
узелка) в целях ограничения туберкулезного воспаления.
1.3. Иммунопатогенез туберкулезного воспаления
19
Пролиферация
Т-клеток
CCL-2, CCL-3,\
CCL-5, TNF
Активация CD4
Т-клеток
Антимикробная
активность "*"
RNI, ROI,
LL-37
TCR
МНСП
Подавление
активности
Т-клеток
'ИЛ-IO.TGF-p
ИЛ-12, ИЛ-18
Реакция
Th-клеток
Рис. 1.3. Функции макрофагов и дендритных клеток во время инфицирования
микобактериями туберкулеза при распознавании антигена
В ответе на микобактериальную инфекцию участвует комплекс
иммунных механизмов, до конца еще не изученный. Однако имею-
щиеся данные позволяют создать примерную картину этого процесса.
Альвеолярные макрофаги и эпителиоидные клетки или гигантские клет-
ки Пирогова-Лангханса (образовавшиеся в результате слияния эпите-
лиоидных клеток), содержащие внутри себя микобактерии, формируют
центр гранулемы. Эти клетки презентируют Т-лимфоцитам антигены,
с помощью которых активируется продукция цитокинов и хемокинов.
Хемокины активируют дополнительные клетки, находящиеся в кровото-
ке, близком к участку первичной инфекции, у-интерфероны активируют
макрофаги и другие антигенпрезентирующие клетки, способные раз-
рушать внутриклеточные МБТ, посредством реактивных кислородных
или азотистых медиаторов. С04+-лимфоциты продуцируют TNF-cc
и лимфотоксин-аЗ, которые необходимы для формирования клеточно-
го окружения гранулемы. Активированные С08+-лимфоциты убивают
микобактерии с помощью гранулизина и перфорина. Процесс ликвида-
ции МБТ контролируем, поскольку может быть нарушено равновесие
между скоростью образования клеточного вала и формированием казе-
озных масс. Активность антигенспецифических Т-лимфоцитов и спо-
собность активированных макрофагов уничтожать МБТ способствуют
20
Глава 1. Этиология и патогенез туберкулеза
замедлению размножения МБТ или его прекращению в участках тубер-
кулезного воспаления и некроза.
В течение 2—3 нед после первичного заражения начинает развивать-
ся Т-клеточный иммунитет как проявление адаптивного иммунитета.
Этот процесс характеризуется миграцией в места воспаления антиген-
специфических Т-лимфоцитов, которые начинают захватывать ранее
первично инфицированные макрофаги и одновременно высвобождают
провоспалительные цитокины, такие как уинтерфероны, которые,
в свою очередь, активируют макрофаги для уничтожения внутрикле-
точных МБТ.
Макрофаги могут уничтожать микобактерии с помощью различных
механизмов, таких как производство кислорода и азота, окисление
фагосомы и слияние фагосомы с лизосомой.
В зависимости от адекватности неспецифического иммунного отве-
та развитие туберкулезного процесса может происходить в двух вариан-
тах: благоприятном и неблагоприятном.
Вариант благоприятный. У большинства пациентов имеется доста-
точная защита, чтобы подавлять развитие ТБ на протяжении всей
жизни. Размножение МБТ останавливается, а их количество резко
уменьшается. Первичный участок воспаления и его дочерние фокусы
оставляют минимальные остаточные изменения. При этом туберкули-
новый кожный тест становится положительным.
Эпидемиологическими исследованиями доказано, что у 90% пер-
вично инфицированных МБТ врожденный иммунитет достаточно
эффективен, чтобы самостоятельно остановить туберкулезную инфек-
цию, без поддержки адаптивного иммунитета. Недостаточная эффек-
тивность врожденного иммунитета в ликвидации МБТ может быть
обусловлена программой выживания МБТ. Ключевым моментом этой
программы является предотвращение созревания фагосомы, в которой
находится МБТ, с помощью высвобождения растворимой киназы PrnG
и выделения в фагосому белка — Coronin 1. Эти вещества создают усло-
вия для выживания МБТ.
Вариант неблагоприятный. При недостаточно активной иммун-
ной реакции происходит прогрессирование туберкулезного процесса.
Формирование туберкулезной гранулемы и ее дальнейшая судьба
зависят от баланса между способностью высокоактивных макрофагов
уничтожать МБТ и способностью МБТ разрушать макрофаги, остава-
ясь жизнеспособными. Если в этом процессе побеждают МБТ по раз-
ным причинам (например, под воздействием иммуносупрессии), то все
больше и больше макрофагов мигрируют в данный участок воспаления.
1.3. Иммунопатогенез туберкулезного воспаления
21
Разрушенные макрофаги становятся материалом для формирования
казеозных масс. Если МБТ размножаются настолько быстро, что могут
выйти за пределы гранулемы, макрофаги начинают выделять в боль-
шом количестве цитокины в окружающее легочное пространство,
а не в саму гранулему. Среди цитокинов, продуцируемых активиро-
ванными макрофагами, наиболее значимым является фактор некроза
опухоли, который способен разрушать все клетки окружающих тканей
по принципу «выжженной земли», что приводит к разжижению вос-
палительного материала, альтерации окружающих тканей и формиро-
ванию в этом участке деструкции, а в дальнейшем — полости распада
в легких.
1.3.2. СПЕЦИФИЧЕСКИЙ (АДАПТИВНЫЙ, ПРИОБРЕТЕННЫЙ)
ИММУННЫЙ ОТВЕТ
Основная характеристика специфического (адаптивного) иммун-
ного ответа — распознавание и выработка факторов защиты, направ-
ленных специально против МБТ. Специфический иммунный ответ
состоит из двух типов: клеточного и гуморального.
Клетки иммунной системы, на которые возложены ключевые функ-
ции по осуществлению приобретенного иммунитета, относятся к лим-
фоцитам, которые являются подтипом лейкоцитов. Большая часть лим-
фоцитов отвечает за специфический (приобретенный) иммунитет, так
как могут распознавать возбудителей инфекции внутри или вне клеток,
в тканях или в крови. Основными типами лимфоцитов являются В-
и Т-клетки, которые происходят из гемопоэтических стволовых клеток.
У взрослого человека они образуются в костном мозге, а Т-лимфоциты
дополнительно проходят часть этапов дифференцировки в тимусе.
В-клетки отвечают за гуморальное звено приобретенного иммунитета,
т.е. вырабатывают антитела, в то время как Т-клетки представляют
собой основу клеточного звена специфического иммунного ответа.
Иммунные клетки имеют специфические белки, расположенные
на поверхностных мембранах, определяющие их функции:
• В-клетки - IgM, B7, CD19, CD20, CD21, CD40, МНС класса II;
• Т-хелперы - CD4, TCR, CD3, CD40L;
• цитотоксические Т-клетки — CD8, TCR, CD3;
• макрофаги - МНС класса II, В7, CD40, CD14;
• клетки-киллеры — рецепторы для МНС класса I, CD16, CD56.
Распознавание антигенов В-клетками. В-лимфоциты распозна-
ют антигены посредством своих иммуноглобулиновых рецепторов.
22
Глава 1. Этиология и патогенез туберкулеза
Антигены также могут подвергаться повторному процессингу при вза-
имодействии с В-лимфоцитами. Продукты процессированных анти-
генов помещаются на поверхность В-клеток, где они распознаются
активированными Т-хелперами. В-лимфоциты не способны к самосто-
ятельному ответу на антигенную стимуляцию, поэтому им необходимо
получить второй сигнал от Т-хелперов.
Распознавание антигенов Т-клетками. Как уже отмечалось выше, пред-
шественники Т-клеток формируются в костном мозге, после чего транс-
портируются в тимус, где они дифференцируются на С08+-лимфоциты
(клетки, содержащие CDS-трансмембранный гликопротеин) и CD4+-
лимфоциты (клетки, содержащие С04-мономерный трансмембранный
гликопротеин). CD8+- и С04+-лимфоциты поступают в лимфатические
узлы, где они снова дифференцируются. Клетки, содержащие CD8+,
дифференцируются в цитотоксические Т-клетки посредством связыва-
ния с главным комплексом гистосовместимости класса I. Если процесс
связывания происходит, формируются зрелые цитотоксические клетки.
Клетки, содержащие CD4+, дифференцируются в Т-хелперы посред-
ством связывания с главным комплексом гистосовместимости класса II.
Если процесс связывания происходит успешно, формируются зрелые
Т-хелперные клетки, дифференцировка которых идет по двум типам —
ТЫ или Th2 (рис. 1.4, см. цветную вклейку).
Характеристика СБ8+-лимфоцитов. Зрелые цитотоксические CD8+-
лимфоциты секретируют молекулы, способные разрушать клетки,
с которыми они сцеплены. Основной функцией С08+-лимфоцитов
является цитотоксичность, т.е. способность убивать клетки-мишени,
инфицированные соответствующими по специфичности патогена-
ми, поэтому их называют цитотоксинескымы Т-лимфоцитами. Таким
образом, роль С08+-лимфоцитов состоит в выявлении и уничтожении
только тех клеток, которые содержат инородные антигены, до того,
как эти антигены, в свою очередь, могут разрушить клетку хозяина
и высвободиться в окружающее пространство.
Характеристика СБ4+-лимфоцитов. С04+-лимфоциты (Т-лимфоци-
ты, Т-хелперы; от англ. help — помощь) выполняют одну из главных
функций иммунной противотуберкулезной защиты. Эта функция
состоит в оказании помощи В-клеткам продуцировать антитела,
стимулировать макрофаги к повышенной микроцидной активности,
активизировать нейтрофилы, эозинофилы и базофилы в участках
инфекции и воспаления. Наконец, С04+-лимфоциты с помощью
продукции цитокинов и хемокинов способствуют регуляции процесса
иммунной реакции в целом.
1.3. Иммунопатогенез туберкулезного воспаления
23
Т-хелперы распознают комплекс, состоящий из чужеродных и соб-
ственных антигенов. Для иммунного ответа необходимо одновремен-
ное распознавание как чужеродных антигенов, так и антигенов соб-
ственной мононуклеарной системы.
Т-хелперы 1-го типа (ТЫ) преимущественно способствуют развитию
клеточного иммунного ответа, активируя Т-киллеры. ТЫ вырабатыва-
ют ИЛ-2, ИЛ-3 и ГМ-КСФ, стимулируют пролиферацию цитотоксиче-
ских Т-лимфоцитов и активируют макрофаги. В зависимости от того,
насколько активны макрофаги, при уничтожении МБТ в центре любой
туберкулезной гранулемы содержатся свободные МБТ или их остатки.
Высокоактивные макрофаги в гранулеме окружены ТЫ-клетками,
которые продолжают продуцировать у-интерфероны. Таким образом,
ТЫ-клетки постоянно способствуют поддержанию высокой активно-
сти макрофагов, что делает их способными уничтожать МБТ. Вместе
с тем ТЫ -лимфоциты окружаются дополнительными макрофагами,
которые подвергаются дифференцировке, превращаясь в фибробласто-
подобные клетки, формирующие гранулему.
Т-хелперы 2-го типа (Th2) активируют В-лимфоциты, способствуя
развитию гуморального иммунного ответа, продуцируют ИЛ-4, -5 и -13.
Если иммунологический баланс склоняется в сторону патогена,
центр гранулемы может разжижаться, приводя к деструкции легочной
ткани. Если иммунологический баланс склоняется в сторону защитных
функций макроорганизма, происходят разрастание соединительной
ткани, инкапсуляция гранулемы, заживление с последующим расса-
сыванием, кальцинацией и т.д., иногда происходит переход процесса
в торпидно текущую хроническую форму.
Гуморальный иммунный ответ опосредован В-лимфоцитами, которые
после распознания микроорганизма начинают активно синтезировать
антитела (иммуноглобулины) по принципу «один тип антигена — один
тип антитела». На поверхности одного микроорганизма может быть
множество различных антигенов, поэтому обычно вырабатывается
целая серия антител, направленных на определенный антиген.
У человека различают пять основных классов иммуноглобулинов:
IgA, IgG, IgM, IgE, IgD. Все они имеют как общие, так и специфиче-
ские детерминанты. Иммуноглобулины способны прилипать к опреде-
ленной структуре микобактерии, вызывая ее разрушение или скорей-
шее выведение из организма. Теоретически возможно формирование
антител к любому химическому веществу, имеющему достаточно боль-
шую молекулярную массу.
24
Глава 1. Этиология и патогенез туберкулеза
МБТ, поступившие в легкие во время вдоха, захватываются макро-
фагами или дендритными клетками как часть процесса, регулируемого
рецепторами, расположенными на внешних мембранах клеток, такими
как лектины. Макрофаги дендритных клеток переваривают микобакте-
рии и транспортируют содержащиеся в них антигены в дренирующий
лимфатический узел. Здесь антигены презентируются Т-клеткам, кото-
рые становятся зрелыми, быстро размножаются, затем направляются
в участки инфекции, где поддерживают макрофаги в уничтожении
патогена. Это взаимодействие также происходит в гранулеме, содержа-
щей макрофаги и гигантские клетки, которые, в свою очередь, окруже-
ны слоем лимфатических клеток. Реагирующие популяции Т-клеток
являются в большой степени гетерогенными CD4+ и СЭ8+-клетками.
Цитокины как модуляторы иммунитета. Для включения реакций
врожденного иммунитета недостаточно простой связи МБТ с рецеп-
торами лимфоцитов. Для этого требуется довольно сложная цепь
межклеточного взаимодействия. Необходимы антигенпредставляющие
и регуляторные клетки. Распознавание и поглощение МБТ макрофа-
гами вызывает первый выброс цитокинов, включая ИЛ-12, ИЛ-15,
ИЛ-18. Это приводит к формированию Thl-клеток, которые продуци-
руют интерферон-у, а также активируют антибактериальные функции
макрофагов, включая стимулирование процесса созревания фагосом
и автофагии.
ИЛ-12, ИЛ-15, ИЛ-18 способствуют активации цитотоксических
Т-лимфоцитов, включая С08+-лимфоциты и натуральные киллеры.
Гранулы, содержащиеся внутри указанных лимфоцитов, включают
различные вещества, в том числе перфорины, которые, координи-
рование взаимодействуя, убивают патоген. Общее использование
рецепторных компонентов является взаимозаменяемой функцией
с ИЛ-1, ИЛ-23 и ИЛ-27. При хроническом течении ТБ ИЛ-12 необ-
ходимы для долговременного нахождения Thl в легких. ИЛ-27 обе-
спечивают продукцию интерферона-у клетками Thl и ограничивают
воспалительные реакции, а ИЛ-23 необходимы для обеспечения
активности Th-17-клеток.
К антигенпредставляющим клеткам относятся моноциты и макро-
фаги, эндотелиальные клетки, пигментные клетки кожи (клетки
Лангерганса) и др. К регуляторным клеткам относятся Т- и В-хелперы,
супрессоры, контрсупрессоры, Т-лимфоциты памяти. Наконец,
к эффекторам иммунного ответа принадлежат Т- и В-киллеры,
В-лимфоциты, являющиеся в основном антителопродуцентами.
1.3. Иммунопатогенез туберкулезного воспаления
25
Антигенпредставляющие клетки активируют только определен-
ный клон Т-хелперов, имеющий рецептор к определенному виду
антигенов. После активации Т-хелперы начинают активно делиться
и выделять цитокины, с помощью которых активизируются фагоциты
и другие лейкоциты, в том числе Т-киллеры. Дополнительная акти-
вация некоторых клеток иммунной системы происходит при контак-
те их с Т-хелперами. В-клетки (только клона, имеющего рецептор
к тому же антигену) при активации размножаются и превращаются
в плазматические клетки, которые начинают синтезировать множе-
ство молекул, схожих с рецепторами. Такие молекулы называются
антителами. Эти молекулы взаимодействуют с антигенами, которые
активировали В-клетки. В результате этого чужеродные частицы ней-
трализуются, становятся более уязвимыми для фагоцитов. Т-киллеры
при активации убивают чужеродные клетки. Таким образом, в резуль-
тате иммунного ответа малочисленная группа неактивных лимфоцитов,
встретившая свой антиген, активируется, размножается и превращает-
ся в эффекторные клетки, способные бороться с антигенами и причи-
нами их появления. В процессе иммунного ответа включаются супрес-
сорные механизмы, регулирующие иммунные процессы в организме.
Таким образом, весь инфекционный процесс в отношении МВТ
по признаку доминирующего участия различных форм иммунной
защиты можно разделить на три этапа:
• первый (ранний) — механическое удаление микобактерий из дыха-
тельных путей;
• второй — инициируется ранним этапом и характеризуется немед-
ленной реакцией факторов неспецифической защиты;
• третий (более поздний) — включение в реакцию защиты от патоге-
на участников специфического иммунитета с последующим фор-
мированием памяти о первой встрече с возбудителем инфекции.
Интенсивность иммунного ответа во многом определяется состоя-
нием нервной и эндокринной систем. Установлено, что раздражение
различных подкорковых структур (таламуса, гипоталамуса, серого
бугра) может сопровождаться как усилением, так и торможением иммун-
ной реакции на введение антигенов. Показано, что возбуждение сим-
патического отдела автономной (вегетативной) нервной системы, как
и введение адреналина, усиливает фагоцитоз и интенсивность иммун-
ного ответа. Повышение тонуса парасимпатического отдела вегетатив-
ной нервной системы приводит к противоположным реакциям. Стресс,
а также депрессии угнетают иммунитет, что сопровождается повышен-
ной восприимчивостью к различным заболеваниям, в том числе к ТБ.
26
Глава 1. Этиология и патогенез туберкулеза
После первичного проникновения МБТ в легкие ситуация может
развиваться в соответствии с четырьмя основными вариантами:
• I — неспецифическая иммунологическая компетенция макроорга-
низма может оказаться достаточной для полной элиминации всех
МБТ — инфицирования и заболевания ТБ не происходит;
• II — неспецифическая иммунологическая компетенция макроор-
ганизма может оказаться недостаточной. При этом часть мико-
бактерий выживает, в результате имеет место скрытое проявление
ограниченного туберкулезного воспаления, которое спонтан-
но подавляется макроорганизмом. Заболевание не развивается,
но микобактерии персистируют (постоянно находятся) в орга-
низме в так называемом покоящемся (дормантном) состоянии,
и их присутствие проявляется лишь в виде положительной кожной
реакции на туберкулин. Такое состояние трактуется как ЛТИ;
• III — специфическая иммунологическая компетенция макроорга-
низма может оказаться недостаточной, вследствие чего развива-
ется туберкулезное воспаление с клинико-рентгенологическими
проявлениями ТБ;
• IV — в результате снижения иммунитета или под воздействием
суперинфекции микобактерии способны переходить из состояния
покоя в фазу роста, и латентная инфекция сменяется реактива-
цией ТБ.
В зависимости от адекватности специфического иммунного ответа
развитие туберкулезного процесса может происходить в трех вариантах.
Первый вариант развития ТБ. Прогрессирование туберкулезного
процесса, которое переходит в заболевание первичным ТБ. Это более
характерно для маленьких детей, а также для лиц с низкой степенью
врожденной резистентности к ТБ. При терапии происходит излечение,
чаще с остаточными изменениями в виде кальцинатов во внутригруд-
ных лимфатических узлах (ВГЛУ) и легких. При отсутствии лечения
либо неадекватной химиотерапии процесс может трансформировать-
ся в хронически текущий первичный ТБ. В 5-10% случаев возможно
спонтанное самопроизвольное излечение.
Второй вариант развития ТБ. Эндогенная реактивация ЛТИ из за-
живших первичных туберкулезных очагов, которая развивается в более
поздние сроки (через несколько лет или даже десятилетий). Это пре-
имущественно происходит на фоне длительного психологического
или физиологического стресса. В результате ослабления иммунологи-
ческой защиты МБТ активируются, их метаболизм и вирулентность
повышаются, в результате происходит активное воспаление в области
1.4. Патоморфология туберкулезного воспаления у иммунокомпетентных лиц 27
постпервичных очагов, которое прогрессирует, очаги подвергаются
некротизированию с формированием казеозных масс (экзацербация
очагов). Так развивается вторичный ТБ. Реактивация чаще происходит
в легких, реже — в других органах (почках, костях, матке и др.).
Третий вариант развития ТБ. Экзогенная суперинфекция (реин-
фекция) — развитие вторичного ТБ в результате повторного зара-
жения МБТ. Это возможно при столкновении с массивной и высо-
ковирулентной инфекцией либо при значительном ослаблении
противотуберкулезного иммунитета человека, например на фоне
ВИЧ-ассоциированной иммуносупрессии. В данном случае специфи-
ческое воспаление развивается уже на фоне имеющегося противо-
туберкулезного иммунитета. Для вторичного ТБ характерно пораже-
ние легких, преимущественно задних и субкортикальных отделов,
с формированием полостей распада и бронхогенным распростране-
нием инфекции. Важная особенность вторичного ТБ — длительное
бессимптомное начало (до нескольких месяцев) и частое отсутствие
ярких клинических проявлений. Степень выраженности клинических
симптомов ТБ зависит от объема поражения органа.
1.4. ПАТОМОРФОЛОГИЯ ТУБЕРКУЛЕЗНОГО ВОСПАЛЕНИЯ
У ИММУНОКОМПЕТЕНТНЫХ ЛИЦ
Туберкулезное воспаление, как и всякое другое, складывается
из явлений альтерации, экссудации, пролиферации, приводящих к обра-
зованию специфического воспаления, минимальная морфологическая
единица которого — туберкулезная гранулема (туберкулезный бугорок).
Название «гранулема» происходит от лат. granulum — зернышко и греч.
oma — приставка для обозначения опухолей. Впервые его использовал
Рудольф Вирхов (1818) для описания опухолей, которые способны
изъязвляться и давать рост грануляционной ткани. Туберкулезная гра-
нулема — не просто скопление клеток, характерных для воспаления,
а участок активного действия многочисленных ферментов и цитокинов
в очень сложном процессе борьбы с инфекционным агентом — МБТ.
В формировании туберкулезной гранулемы принимают участие
гематогенные (лимфоциты, моноциты, полиморфно-ядерные лейко-
циты) и гистиогенные (гистиоциты, макрофаги, фибробласты, рети-
кулярные клетки, эндотелий кровеносных сосудов, плазматические
и тучные клетки) лимфоциты. Туберкулезная гранулема имеет следу-
ющую структуру. В центре ее содержится аморфный тканевый детрит
28
Глава 1. Этиология и патогенез туберкулеза
(следствие альтерации и некроза), по периферии частоколом распо-
ложен вал из нескольких слоев эпителиоидных клеток. Во внешних
слоях бугорка в небольшом количестве обнаруживаются лимфоидные
и плазматические клетки. Среди эпителиоидных клеток имеются мно-
гоядерные гигантские клетки Пирогова—Лангханса.
Гистогенез туберкулезного бугорка зависит от того, как развивается
воспалительный процесс — прогрессирует или, наоборот, регрессиру-
ет. При снижении резистентности макроорганизма происходит про-
грессирование туберкулезного воспаления, развивается экссудативная
тканевая реакция с появлением творожистого некроза — самого специ-
фичного из всех элементов туберкулезной гранулемы. Творожистый
некроз может развиться в бугорке и окружающей его ткани, пропитан-
ной серозно-фибринозным экссудатом. При дальнейшем прогрессиро-
вании специфического туберкулезного воспаления, помимо бугорков,
возникают различной величины очаги творожистого некроза. Они могут
расплавляться, сливаться в крупные очаги, из которых формируются
фокусы с участками казеоза (инфильтраты). Казеоз подвергается раз-
жижению под воздействием протеолитических ферментов и откашли-
вается через бронхи. В этих участках легких появляются полости рас-
пада — каверны, а на слизистых оболочках — язвы.
Возможность развития и объем туберкулезного повреждения в орга-
низме определяются защитными реакциями, которые производит иммун-
ная система макроорганизма против МВТ, о которых рассказано выше.
1.4.1. ПАТ0М0РФ0Л0ГИЯ ПЕРВИЧНОГО ТУБЕРКУЛЕЗА ЛЕГКИХ
При недостаточно активной иммунной реакции или высокой виру-
лентности (степени патогенности) возбудителя происходит тубер-
кулезный процесс, который прогрессирует и переходит в заболева-
ние первичным ТБ. При адекватно подобранной терапии происходит
излечение, чаще с остаточными изменениями в виде кальцинатов во
ВГЛУ и легких. При отсутствии лечения либо неадекватной химиотерапии
процесс может трансформироваться в хронически текущий первичный
ТБ. В 5-10% случаев возможно спонтанное самопроизвольное излечение.
Классическая форма морфологического проявления первичного
ТБ — первичный туберкулезный комплекс.
В 90% случаев формирование первичного туберкулезного ком-
плекса происходит в верхних и средних отделах легких, но может быть
и вне легких.
1.4. Патоморфология туберкулезного воспаления у иммунокомпетентных лиц 29
В первичном легочном очаге развивается альвеолит, который быстро
сменяется типичным развитием творожистого некроза. В центре пер-
вичного аффекта формируется казеоз, по периферии — элементы
неспецифического воспаления. Первичный легочный очаг чаще всего
расположен непосредственно под плеврой, поэтому в специфический
процесс нередко вовлекается плевра. В лимфатических сосудах про-
исходят расширение и инфильтрация их стенок и появление бугорков.
В регионарных лимфатических узлах возникают элементы воспаления,
переходящие в специфические казеозные изменения с некрозом.
Перифокальное воспаление вокруг лимфатических узлов распро-
страняется на клетчатку средостения и прилежащую легочную ткань.
По тяжести поражения процесс в лимфатических узлах превосходит
изменения в области первичного аффекта, поэтому репаративные изме-
нения в лимфатических узлах протекают медленнее. Воспалительные
изменения в легком, лимфатических узлах (лимфаденит) и лимфати-
ческих сосудах (лимфангиит) в совокупности называются первичным
туберкулезным комплексом.
Наиболее частый исход первичного туберкулезного комплекса —
заживление с инкапсуляцией, обызвествлением или окостенением.
Со временем на месте очага бронхолобулярной пневмонии кальци-
нация становится компактной, очаг приобретает округлую форму
и ровные, четкие контуры, величина его не превышает 3—5 мм. Такое
образование называется очагом Гона.
При прогрессировании первичного туберкулезного комплекса могут
развиться различные варианты генерализации, а также присоединение
неспецифических осложнений в гиповентилируемой части легкого.
Чаще проявления первичного ТБ остаются неактивными (молчащи-
ми) в течение десятилетий или всей жизни индивида. Реактивация ТБ
чаще бывает спровоцирована ВИЧ-инфекцией, недоеданием, злокаче-
ственной опухолью, использованием иммуносупрессоров и интеркур-
рентными инфекционными заболеваниями.
1.4.2. ПАТОМОРФОЛОГИЯ ВТОРИЧНОГО ТУБЕРКУЛЕЗА ЛЕГКИХ
Разделение двух последовательных периодов развития ТБ на пер-
вичный и вторичный отражает патоморфологическую и клиническую
картину болезни.
Постпервичный (вторичный) ТБ — ТБ, который возник в организ-
ме, имеющем первичные туберкулезные очаги, ранее излеченные.
30
Глава 1. Этиология и патогенез туберкулеза
Возникновение и развитие вторичного ТБ может происходить двумя
способами:
• эндогенной суперинфекцией (реактивацией) остаточных пост-
первичных очагов (частично кальцинированных лимфатических
узлов);
• экзогенной суперинфекцией (реинфекцией) — повторным тубер-
кулезным инфицированием.
Вторичный ТБ у людей с ВИЧ-негативным статусом в 90% случаев
является ТБ легких. Вторичный ТБ часто диагностируют с помощью
флюорографии или рентгенографии, которые проводят при профилак-
тическом обследовании у пациентов, не предъявляющих каких-либо
жалоб. Эта тенденция — одно из косвенных доказательств, что пациент
не ощущает болезни, поскольку ТБ на начальных этапах развивается
бессимптомно.
Распространение инфекции при прогрессировании вторичного ТБ,
как правило, идет бронхогенным путем.
Наиболее важными признаками, определяющими, будет ли боль-
ной, особенно в старшем возрасте, иметь клинически выраженный
ТБ, являются размягчение и разжижение творожистого некротиче-
ского материала и реверсия МБТ из дормантных в активно размно-
жающиеся. В этот период происходит быстрое увеличение популя-
ции МБТ.
Развитие вторичного ТБ у ВИЧ-отрицательных взрослых пациентов
условно можно разделить на следующие этапы.
• Формирование очагов преимущественно в верхних субкортикаль-
ных отделах легких.
• Постепенное распространение в легких туберкулезных поврежде-
ний, формирование казеоза.
• Откашливание жидких творожистых казеозных масс, в результате
чего на этом месте формируется полость распада. Диссеминация
МБТ из полости бронхогенным путем приводит к распростра-
нению процесса в близлежащие отделы и контралатеральное
легкое.
• На фоне эффективного лечения специфического воспаления
происходит его частичное рассасывание, в результате чего очаги
уплотняются, полости рубцуются. При развитии массивного
фиброза происходит уменьшение объема легочной ткани, неред-
ко со смещением средостения и трахеи в сторону наибольших
повреждений (рис. 1.5).
1.5. Клиническая классификация туберкулеза
31
Рис. 1.5. Этапы развития вторичного туберкулеза у взрослых (пояснения в тексте)
Кальцинация начинает формироваться на самых ранних этапах
образования туберкулезных очагов, расположенных в верхушках лег-
ких. Вместе с тем полости могут сохраняться. Эта форма хронического
ТБ — главный источник инфекции.
Разнообразие патоморфологических проявлений в легких стало
основой для классификации ТБ органов дыхания на формы.
1.5. КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ ТУБЕРКУЛЕЗА
В основу клинической классификации ТБ, используемой в Рос-
сийской Федерации, положено несколько принципов. Это клини-
ко-рентгенологические особенности туберкулезного процесса (в том
числе локализация и распространенность), его течение, т.е. фазы, нали-
чие бактериовыделения. Классификация состоит из четырех основных
разделов: клинических форм ТБ, характеристики туберкулезного про-
цесса, осложнений ТБ, остаточных изменений после излеченного ТБ.
Клинические формы ТБ различаются по локализации и клини-
ко-рентгенологическим признакам с учетом патогенетической и пато-
морфологической характеристики туберкулезного процесса. Основные
клинические формы ТБ:
32
Глава 1. Этиология и патогенез туберкулеза
• туберкулезная интоксикация у детей и подростков;
• ТБ органов дыхания;
• первичный туберкулезный комплекс;
• ТБ ВГЛУ;
• диссеминированный ТБ легких;
• милиарный ТБ;
• очаговый ТБ легких;
• инфильтративный ТБ легких;
• казеозная пневмония;
• туберкулема легких;
• кавернозный ТБ легких;
• фиброзно-кавернозный ТБ легких;
• цирротический ТБ легких;
• туберкулезный плеврит (в том числе эмпиема);
• ТБ бронхов, трахеи, верхних дыхательных путей;
• ТБ органов дыхания, комбинированный с пылевыми профессио-
нальными заболеваниями легких;
• ТБ мозговых оболочек и центральной нервной системы (ЦНС);
• ТБ кишечника, брюшины и брыжеечных лимфатических узлов;
• ТБ костей и суставов;
• ТБ мочевыводящих, половых органов;
• ТБ кожи и подкожной клетчатки;
• ТБ периферических лимфатических узлов (ПЛУ);
• ТБ органа зрения;
• ТБ прочих органов.
Характеристика туберкулезного процесса дается по локализации пора-
жения, клинико-рентгенологическим признакам и по наличию или отсут-
ствию в диагностическом материале, полученном от больного МБТ.
Локализация и распространенность: в легких по долям, сегментам,
а в других органах — по локализации поражения.
Фаза:
а) инфильтрации, распада, обсеменения;
б) рассасывания, уплотнения, рубцевания, обызвествления.
Бактериовыделение:
а) с выделением МБТ+;
б) без выделения МБТ—.
Осложнения ТБ:
• кровохарканье и легочное кровотечение, спонтанный пневмото-
ракс, легочно-сердечная недостаточность, ателектаз, амилоидоз,
свищи и др.
1.5. Клиническая классификация туберкулеза
33
Остаточные изменения после излеченного ТБ:
• в органах дыхания: фиброзные, фиброзно-очаговые, буллезно-
дистрофические, кальцинаты в легких и лимфатических узлах,
плевропневмосклероз, цирроз;
• в других органах: рубцовые изменения в различных органах
и их последствия, обызвествление и др.
1.5.1. ХАРАКТЕРИСТИКА ОСНОВНЫХ КЛИНИЧЕСКИХ ФОРМ
ТУБЕРКУЛЕЗА ОРГАНОВ ДЫХАНИЯ У ВЗРОСЛЫХ
Очаговый ТБ легких характеризуется наличием многочисленных
очагов, преимущественно продуктивного характера, локализующихся
в ограниченном участке одного или обоих легких и занимающих 1—2 сег-
мента, и малосимптомным клиническим течением. К очаговым формам
относятся как недавно возникшие, свежие (мягкоочаговые) процессы
с размером очагов менее 10 мм, так и более давние (фиброзно-очаговые)
образования с явно выраженными признаками активности процесса.
Свежий очаговый ТБ характеризуется наличием слабоконтурированных
(мягких) очаговых теней со слегка размытыми краями. При рентгеноло-
гическом выявлении фиброзно-очаговых изменений необходимо про-
вести тщательное обследование больных для исключения активности
процесса. При отсутствии признаков активности фиброзно-очаговые
изменения расцениваются как остаточные изменения излеченного ТБ.
Инфильтративный ТБ легких (наиболее частая клиническая форма
ТБ у больных с ВИЧ-негативным статусом) характеризуется наличием
в легких воспалительных изменений, преимущественно экссудативного
характера, с казеозным некрозом и наличием или отсутствием деструк-
ции легочной ткани. Клинические проявления инфильтративного ТБ
зависят от распространенности и выраженности воспалительных изме-
нений в легких, которые могут быть сходными с неспецифическими
воспалительными заболеваниями органов дыхания. У большинства
больных в основном подострое начало заболевания.
Диссеминированный ТБ легких объединяет процессы различного
генеза, развившиеся в результате распространения МБТ гематогенным,
бронхогенным и лимфогенным путями, с чем связано многообразие
клинических и рентгенологических проявлений. Трудность определе-
ния генеза туберкулезных диссеминаций обусловила необходимость
объединения их под общим названием.
Диссеминированный ТБ легких протекает как острый, подострый
и хронический.
34
Глава 1. Этиология и патогенез туберкулеза
Острый диссеминированный ТБ гематогенного генеза характерен
для милиарного ТБ. Милиарный ТБ характеризуется острым течением
с быстрой диссеминацией (генерализацией) процесса и поражением
легких, печени, селезенки, кишечника, мозговых оболочек, других
органов и тканей. Туберкулезные бугорки имеют преимуществен-
но продуктивный характер. В клинической картине на первый план
выступает выраженная интоксикация. При рентгенологическом иссле-
довании легких определяют двустороннюю мелкоочаговую диссемина-
цию по всем полям.
Подострый диссеминированный ТБ развивается постепенно, харак-
теризуется выраженными симптомами интоксикации. При гематоген-
ном генезе подострого диссеминированного ТБ полиморфная очаговая
диссеминация локализуется в верхних и кортикальных отделах легких,
при лимфобронхогенном генезе очаги располагаются группами в при-
корневых и нижних отделах легких на фоне выраженного лимфан-
гиита с вовлечением в процесс как глубокой, так и периферической
лимфатической сети легкого. На фоне очагов при подостром диссеми-
нированном ТБ могут определяться тонкостенные каверны со слабо-
выраженным перифокальным воспалением. Чаще они располагаются
на симметричных участках легких, эти полости называют штампован-
ными кавернами.
Хронический диссеминированный ТБ — в основном гематогенно-
го генеза. Для него характерно апико-каудальное распространение
процесса. При хроническом диссеминированном ТБ могут последо-
вательно поражаться различные органы и системы. Хронический дис-
семинированный ТБ характеризуется волнообразным течением, при
котором симптомы интоксикации в период ремиссии менее выражены,
при вспышке процесса бывают явления интоксикации, а также локаль-
ные признаки легочного и внелегочного туберкулезного процесса.
Рентгенологически обнаруживают очаги различной величины и плот-
ности, при этом более плотные очаги локализуются в вышележащих
отделах. На любом этапе болезни могут образоваться каверны в одном
или обоих легких. Очаговые и деструктивные изменения определяются
на фоне деформированного легочного рисунка, признаков пневмо-
склероза, бронхоэктазов и эмфиземы. Несвоевременно распознанный,
а также неэффективно леченный хронический диссеминированный ТБ
может привести к фиброзно-кавернозному ТБ легких.
Казеозная пневмония характеризуется развитием в легочной ткани
воспалительной реакции с преобладанием казеификации, причем казе-
озно-пневмонические очаги по величине занимают до доли и более.
1.5. Клиническая классификация туберкулеза
35
Клиническая картина характеризуется тяжелым состоянием больного,
выраженными симптомами интоксикации. При обследовании больно-
го определяются лейкоцитоз, резкий сдвиг лейкоцитарной формулы
влево, бактериовыделение. При быстром разжижении казеозных масс
происходит формирование гигантской полости или множественных
небольших каверн.
Туберкулема легких — понятие, объединяющее разнообразные
по генезу инкапсулированные казеозные фокусы диаметром более
1 см. Различают туберкулемы инфильтративно-пневмонического типа,
гомогенные, слоистые, конгломератные и так называемые псевдоту-
беркулемы — заполненные каверны. На рентгенограмме туберкуле-
мы выявляются в виде тени округлой формы, с четкими контурами.
В фокусе могут определяться серповидное просветление за счет рас-
пада, иногда аперифокальное воспаление и небольшое количество
бронхогенных очагов, а также участки обызвествления. По размеру
туберкулемы бывают мелкими (1—2 см), средними (2—4 см) и крупны-
ми (диаметром >4 см). Выделяют три клинических варианта течения
туберкулем:
• регрессирующее — медленное уменьшение туберкулемы с после-
дующим образованием на ее месте очага или группы очагов, инду-
рационного поля или сочетания этих изменений;
• стабильное — отсутствие рентгенологической динамики измене-
ний в процессе наблюдения за больным;
• прогрессирующее — наличие распада туберкулемы, перифокаль-
ного воспаления и бронхогенного обсеменения окружающей
легочной ткани.
Кавернозный ТБ легких характеризуется сформированной кавер-
ной и отсутствием выраженных фиброзных изменений в окружаю-
щей каверну легочной ткани. Развивается кавернозный ТБ у больных
инфильтративным, диссеминированным, очаговым ТБ, при распаде
туберкулем; при позднем выявлении заболевания, когда фаза распада
завершается формированием каверн, а признаки исходной формы
исчезают.
Фиброзно-кавернозный ТБ легких (хроническая форма ТБ) характе-
ризуется фиброзной каверной, фиброзными изменениями в окружаю-
щей каверну легочной ткани. Для него характерны очаги бронхогенно-
го отсева различной давности. Как правило, поражается дренирующий
каверну бронх. Развиваются и другие морфологические изменения
в легких: пневмосклероз, эмфизема, бронхоэктазы. Формируется
фиброзно-кавернозный ТБ из инфильтративного, кавернозного
36
Глава 1. Этиология и патогенез туберкулеза
или диссеминированного процесса при прогрессирующем течении
заболевания. Протяженность изменений в легких может быть раз-
личной; процесс бывает одно- и двусторонним, с одной или мно-
жеством каверн. Клинические проявления фиброзно-кавернозного
ТБ многообразны, обусловлены самим туберкулезным процессом,
а также развившимися осложнениями. Различают два клинических
варианта течения фиброзно-кавернозного ТБ легких: ограниченный
и относительно стабильный фиброзно-кавернозный ТБ, когда бла-
годаря химиотерапии наступает определенная стабилизация про-
цесса, и обострение может отсутствовать в течение нескольких лет;
прогрессирующий фиброзно-кавернозный ТБ, который характеризуется
сменой обострений и ремиссий, причем периоды между ними могут
быть разными. В период обострения могут появляться новые участки
воспаления с образованием новых каверн вплоть до полного разруше-
ния легкого. Прогрессирующий фиброзно-кавернозный ТБ нередко
сопровождается развитием неспецифической инфекции и различных
осложнений, что усугубляет течение заболевания.
Цирротический ТБ легких (хроническая форма) характеризуется раз-
растанием грубой соединительной ткани в легких и плевре в результате
инволюции фиброзно-кавернозного, хронического диссеминирован-
ного, инфильтративного ТБ легких, поражений плевры, ТБ ВГЛУ,
осложненного бронхолегочными поражениями. К цирротическому ТБ
относят процессы, при которых сохраняются туберкулезные изменения
в легких с клиническими признаками активности процесса, склонно-
стью к периодическим обострениям и спорадическому скудному бак-
териовыделению. От цирротического ТБ необходимо отличать цирроз
легких, который представляет собой посттуберкулезные изменения
без признаков активности. В классификации цирроз легких отнесен
к остаточным изменениям после клинического излечения.
Туберкулезный плеврит (в том числе эмпиема). Диагноз плеврита
устанавливают по совокупности клинических и рентгенологических
признаков, а характер плеврита — по результатам исследования диа-
гностического материала, полученного при пункции плевральной
полости или биопсии плевры. Характер выпота при туберкулезных
плевритах бывает серозным, серозно-фибринозным, гнойным, реже —
геморрагическим. ТБ плевры, сопровождаемый накоплением гнойного
экссудата, представляет собой особую форму экссудативного плев-
рита — эмпиему. Она развивается при распространенном казеозном
поражении плевры, а также в результате перфорации каверны или суб-
плеврально расположенных очагов.
1.5. Клиническая классификация туберкулеза
37
Морфологически изменения в плевре проявляются Рубцовым пере-
рождением, развитием специфической грануляционной ткани в толще
утратившей свою функцию плевры. Эмпиема должна быть обозначена
в диагнозе.
ТБ органов дыхания, комбинированный с пылевыми профессиональ-
ными заболеваниями легких (кониотуберкулез). В эту группу включены
все формы ТБ легких при одновременном наличии пылевых профес-
сиональных заболеваний: силикоза, асбестоза и др. При формулирова-
нии диагноза следует вначале указать «кониотуберкулез», а затем дать
развернутую характеристику кониоза и туберкулезного процесса.
Глава 2
ВИЧ-ИНФЕКЦИЯ
2.1. ЭТИОЛОГИЯ ВИЧ-ИНФЕКЦИИ
ВИЧ-инфекция — длительно текущая инфекционная болезнь, раз-
вивающаяся в результате инфицирования ВИЧ. Важной особенностью
ВИЧ является способность поражать и вызывать гибель некоторых
клеток иммунной системы, в результате чего развивается и медлен-
но прогрессирует иммунодефицитное состояние (откуда и название
заболевания). Через несколько лет после заражения этот иммуноде-
фицит приводит к появлению у больного заболеваний, вызванных
условно-патогенными микроорганизмами. По мере прогрессирования
иммунодефицита эти заболевания становятся все более тяжелыми
и при отсутствии лечения приводят к гибели больного. Под термином
«СПИД» («синдром приобретенного иммунодефицита») подразумева-
ют некоторые тяжелые оппортунистические заболевания (инфекци-
онной, паразитарной или онкологической природы), развивающиеся
у больных ВИЧ-инфекцией.
ВИЧ относят к подсемейству лентивирусов семейства ретровирусов.
Особенностью ретровирусов является способность осуществлять реак-
цию матричного синтеза в обратном направлении — от рибонуклеи-
новой кислоты (РНК) к ДНК. Вирионы ВИЧ имеют вид сферических
частиц, диаметр которых составляет около 100-120 нм. Это приблизи-
тельно в 60 раз меньше диаметра эритроцита.
Вирион окружен внешней мембраной, в которой заякорены поверх-
ностные белковые комплексы. Часть этих комплексов кодируется
геномом самого вируса (как продукты гена Env — белки gpl20/gp41),
а часть (например, белки ICAM-1, HLA-DR1, CD55 и ряд других),
как и сама мембрана, захватывается из клетки хозяина. Мембранные
белки ВИЧ позволяют вирусной частице взаимодействовать с рецеп-
торами на поверхности клеток-мишеней. После этого мембраны
частицы и клетки сливаются, а содержимое вириона попадает внутрь
цитоплазмы.
2.1. Этиология ВИЧ-инфекции
39
Вирион содержит белковый капсид конической формы, в котором
находятся РНК-геном вируса и ферменты, обеспечивающие его раз-
множение в клетке. Во внешнюю мембрану встроены 72 гликопроте-
иновых комплекса, каждый из которых образован тремя молекулами
трансмембранного гликопротеина (gp41), служащими «якорем» ком-
плекса, и тремя молекулами поверхностного гликопротеина (gpl20).
С помощью gpl20 вирус присоединяется к С04-рецептору и хемоки-
новому корецептору (CCR5 или CXCR4), находящимся на поверхности
мембраны клеток. Гликопротеины gp41 и особенно gpl20 интенсивно
изучают в целях разработки лекарственных средств и вакцины против
ВИЧ. На рис. 2.1 представлено схематичное изображение структуры
вируса ВИЧ.
В настоящее время различают два типа вируса — ВИЧ-1 и ВИЧ-2,
отличающиеся по своим структурным и антигенным характеристи-
кам. ВИЧ-1 преобладает во всем мире, в том числе на территории
Российской Федерации, а ВИЧ-2 до сих пор циркулирует преимуще-
ственно в отдельных районах Западной Африки, а также в некоторых
других странах, куда вирус был завезен выходцами из этого региона.
Каких-либо данных, убедительно свидетельствующих о связи выра-
женности клинических проявлений с различными субтипами ВИЧ,
пока не опубликовано. Определение субтипов имеет пока в основном
эпидемиологическое значение.
Жизненный цикл ВИЧ представляет собой период времени (около
3 ч) от момента прикрепления вируса к клетке-мишени до образования
Поверхностные (envelope) белки Стержневые (core) белки
др120 —
др41 —
Антиген главного
комплекса
гистосовместимости
класса 1
РНК_
Клеточная
мембрана
Рис. 2.1. Схематичное изображение структуры вируса ВИЧ
40
Глава 2. ВИЧ-инфекция
новых вирусных частиц. В течение 1 дня в организме может образоваться
до миллиарда вирусных частиц, а каждая инфицированная ВИЧ-клетка
за время жизни успевает сформировать около 250 новых вирионов.
Поскольку у ВИЧ нет специальных механизмов коррекции генетических
ошибок, то он, как и другие лентивирусы, имеет выраженную склонность
к мутациям. За длительный период нахождения вируса в организме может
накапливаться значительное количество мутантных вариантов ВИЧ.
ВИЧ, в отличие от МВТ, чрезвычайно чувствителен к внешним
воздействиям. Он гибнет при незначительной концентрации всех
известных дезинфицирующих химических агентов и теряет активность
при нагревании выше 56 °С в течение получаса. Губительны для него
солнечное и искусственное ультрафиолетовое облучение, а также все
виды радиационного облучения. ВИЧ теряет активность под воздей-
ствием защитных ферментов, содержащихся в слюне и поте. В то же
время ВИЧ в некоторых естественных для него ситуациях проявляет
тенденцию к относительно длительному выживанию.
Устойчивость ВИЧ во внешней среде изучали в эксперименталь-
ных условиях и наблюдали исчезновение вирусной активности при
высушивании клеточных культур при температуре 23-27 °С только
через 3—7 дней. В жидкой среде при температуре 23-27 °С ВИЧ сохра-
нял активность 15 дней, при 36—37 °С — 11 дней. Можно предполо-
жить, что он довольно долго сохраняет жизнеспособность в высохшей
крови. Многочисленные эпидемиологические наблюдения показали,
что в крови, предназначенной для переливания, вирус переживает
годы, а в замороженной сыворотке его активность может сохраняться
до 10 лет. В замороженной сперме ВИЧ также сохраняется как мини-
мум несколько месяцев.
2.2. ПУТИ И СПОСОБЫ ЗАРАЖЕНИЯ ВИЧ
ВИЧ-инфекция — антропоноз. Животные в естественных услови-
ях ВИЧ-инфекцией не заражаются, а попытки экспериментально-
го заражения обезьян заканчиваются их быстрым выздоровлением.
Источником ВИЧ-инфекции является инфицированный ВИЧ человек.
Наиболее вероятна передача ВИЧ от человека во время первичных
клинических проявлений и на поздних стадиях инфекции, когда кон-
центрация вируса достигает максимума.
ВИЧ распространяется при половых контактах (вагинальных
и анальных), переносе инфицированной крови от зараженного лица
2.2. Пути и способы заражения ВИЧ
41
неинфицированному (переливание крови или ее компонентов, пере-
садка органов, парентеральные вмешательства, выполняемые конта-
минированными инфицированной кровью инструментами), от инфи-
цированной матери к плоду во время беременности, при прохождении
ребенка по родовому пути и грудном вскармливании. Восприимчивость
к ВИЧ у людей всеобщая. Вместе с тем в последнее время рассматри-
вают возможность существования незначительных, генетически отлич-
ных групп людей, встречающихся особенно часто среди североевропей-
ского населения, реже заражающихся при половых контактах (наличие
мутации 632, в результате которой на поверхности СЭ4+-лимфоцитов
отсутствуют хемокиновые рецепторы CCR5). Однако этот признак
не ассоциируется с невосприимчивостью к ВИЧ при переливании
крови и употреблении наркотиков. В табл. 2.1 представлены данные
о вероятности заражения ВИЧ при различных ситуациях.
Таблица 2.1
Вероятность заражения ВИЧ-инфекцией при различных ситуациях
Путь передачи
От мужчины к женщине при незащищенном вагиналь-
ном контакте
От женщины к мужчине при незащищенном вагиналь-
ном контакте
I От мужчины к мужчине при незащищенном анальном
контакте
I Вертикальная передача от матери к ребенку [без при-
менения специальных мер химиопрофилактики (ХП)]
| При уколе контаминированной ВИЧ иглой
Использование нестерильного инструментария для
инъекционного употребления наркотиков
| При переливании инфицированных продуктов крови
Вероятность передачи
ВИЧ-инфекции, %
0,01-0,2
0,003-0,01
0,03-0,5
25-50
0,03-0,3
0,7-70
80-100
Исключительно редки случаи заражения ВИЧ при попадании
инфицированной крови на открытую рану или слизистую оболочку.
В медицинских учреждениях не было зарегистрировано ни одного слу-
чая заражения медицинского работника после попадания слюны, мочи
или крови ВИЧ-инфицированного пациента на неповрежденную кожу.
Результаты всех исследований, в которых изучалась возможность пере-
дачи ВИЧ через насекомых, были однозначными — это невозможно.
42
Глава 2. ВИЧ-инфекция
2.3. ПАТОГЕНЕЗ ВИЧ-ИНФЕКЦИИ
В связи с тем что вирусы являются внутриклеточными патогенами,
каждый представитель мира вирусов имеет тропность к определенному
типу клеток. Тропизм вируса определяется наличием на клетке-мише-
ни рецептора для данного вируса, а также возможностью генома виру-
са встроиться в геном клетки. В организме человека имеется целый
ряд иммунокомпетентных, соматических и ряд других клеток, имею-
щих рецепторы для ВИЧ (С04+-лимфоциты, С08+-лимфоциты, ден-
дритные клетки, моноциты, эозинофилы, мегакариоциты, нейроны,
микроглия, сперматозоиды), и наблюдается цитопатический эффект
во многих из них в случае проникновения вируса. Основные рецепторы
для ВИЧ-1 расположены на С04+-лимфоцитах.
Проникнув в С04+-клетки, ВИЧ сразу же начинает репликацию, при
этом, чем активнее С04+-клетки, тем выше процесс репродукции виру-
са. Все регуляторы, активирующие С04+-клетки, обеспечивают уве-
личение репликации вируса. К подобным регуляторам относятся фак-
тор некроза опухоли, колониестимулирующий фактор гранулоцитов/
макрофагов, ИЛ-6. К негативным регуляторам, тормозящим реплика-
цию вируса, относятся интерферон и трансформирующий фактор роста.
Выделены два типа С04+-клеток: Т-хелперы-1 (Th 1) и Т-хелперы-2
(Th2). Thl продуцируют цитокины, стимулирующие клеточный
иммунитет, a Th2 — цитокины, усиливающие антителообразование.
Соотношение ТЫ и Th2 взвешенно и конкурентно; суперэкспрессия
цитокинов одного типа клеток ведет к супрессии другого. У больных
ВИЧ-инфекцией идет угнетение ТЫ, чем обеспечиваются и вирусная
патология, и онкогенез, и значительное ослабление противотуберку-
лезного иммунитета.
Жизненный цикл ВИЧ после проникновения в организм имеет
последовательный характер (рис. 2.2):
• связывание вириона с поверхностью клетки, слияние мембран
вириона и клетки;
• проникновение вируса внутрь клетки, высвобождение нуклеотида
и геномной РНК вируса;
• интеграция генома вируса в геном инфицированной клетки;
• активация транскрипции с ДНК провируса и последующая тран-
скрипция белков вируса;
• наработка всех компонентов вируса с формированием новых
вирионов;
• высвобождение вируса из клетки, влекущее за собой гибель клет-
ки-мишени.
2.3. Патогенез ВИЧ-инфекции
43
Обратная
транскрипция
Проникновение ВИЧ
в клетку хозяина
Проникновение
вируса в ядро
Высвобождение
вируса из клетки
Интеграция
Незрелый
ВИЧ-
вирион
Миграция вируса
в клеточную
мембрану
Транскрипция
Сборка
вируса
Вирусная
РНК
Интеграза
Провирусная
ДНК
Протеаза
ДНК клетки
хозяина
Структурные
белки ВИЧ
Обратная
транскриптаза
Рис. 2.2. Жизненный цикл ВИЧ после проникновения в организм
Сродство вирусного мембранного гликопротеида gpl20 (gpl05 в слу-
чае ВИЧ-2) к клеточному рецептору CD4 определяет высокую степень
избирательного поражения клеточных структур, поэтому в патологи-
ческий процесс вовлекаются в первую очередь и в большей степени
С04+-лимфоциты, а также моноциты крови, макрофаги тканей, ден-
дритные клетки крови, лимфатических узлов, селезенки, кожи, альве-
олярных и интерстициальных макрофагов легких, микроглия и другие
клетки нервной системы, имеющие СЭ4-рецепторы. Также поража-
ются В-лимфоциты, ретикулярные, эпителиальные клетки кишечни-
ка, клетки Лангерганса, причем последние инфицируются легче, чем
С04+-лимфоциты. Именно клеткам Лангерганса придается большое
44
Глава 2. ВИЧ-инфекция
значение в распространении ВИЧ по организму, поскольку в них вирус
сохраняется длительное время, иногда годы. Для ВИЧ характерны
высокая скорость репликации и, соответственно, большой оборот
вирусных частиц: в среднем за сутки образуется и разрушается 1 млрд
вирусных частиц.
Если на С04+-лимфоциты вирус оказывает цитопатическое дей-
ствие с лизисом клетки или слиянием в синцитий, то в моноцитах/
макрофагах ВИЧ реплицируется с умеренной интенсивностью; вири-
оны оформляются в округлые частицы еще в цитоплазме клетки
и по выходе из нее не оказывают цитонекротического действия.
С момента интеграции генома вируса в геном клетки начинается
стадия латентной инфекции. В этот период вирус находится в клетке
в виде интегрированного в геном ДНК провируса. В расшифровке пато-
генеза ВИЧ-инфекции многие вопросы решены, установлены основ-
ные этапы развития процесса в клетке после инфицирования ее виру-
сом. Выявлен ряд факторов, активирующих экспрессию генов ВИЧ.
К ним относятся факторы, активирующие Т-лимфоциты: специфические
антигены (например, вирусы группы Herpes), неспецифические антигены
(например, митогены типа фитогемагглютинина), цитокины (например,
фактор некроза опухоли, некоторые ИЛ, у-интерфероны), бактериаль-
ные иммуномодуляторы (например, монофосфат липида из сальмонелл).
К активаторам экспрессии ВИЧ относятся глюкокортикоидные гормоны,
в частности дексаметазон и гидрокортизон, ультрафиолетовое облучение,
перекись водорода, свободные кислородные радикалы. Активируется
инфекционный процесс во время беременности.
Иммунопатогенетически ВИЧ-инфекция проявляется дефици-
том Т- и В-звеньев иммунной системы, дефицитом комплемента,
фагоцитов, снижением функции неспецифических факторов защиты.
В результате идет формирование анергии с проявлениями аллергиче-
ского, аутоаллергического и иммунокомплексного патологического
процесса. Изменения гуморального звена иммунитета проявляются
нарастанием IgG+ В-лимфоцитов и 4—5-кратным ростом уровня сыво-
роточных IgE.
Для изменений В-звена иммунитета характерна активация
В-лимфоцитов. Несмотря на увеличение количества циркулирующих
в крови В-лимфоцитов, их функциональная активность на митогены
остается относительно сниженной, что позволяет В-систему иммуни-
тета у больных ВИЧ-инфекцией расценивать как супрессированную.
К тому же на стадиях СПИДа количество В-клеток в периферической
крови больных может быть снижено в 3 раза и более.
2.3. Патогенез ВИЧ-инфекции
45
Формирование иммунодефицита при ВИЧ-инфекции не ограничи-
вается только поражением С04+-лимфоцитов. Так, нарушение синтеза
белков HLA-I ведет к ингибированию функции С08+-лимфоцитов,
т.е. Т-супрессоров. Белок вируса р15 оказывает супрессивное действие
на продукцию Т-клетками ИЛ-2 и у-интерферона. Известно, что для
дифференцировки Т-эффекторов из Т-предшественников необходимы
ИЛ-2, ИЛ-6 и Y-интерферон. А с продукцией ИЛ-2 и других цитокинов
тесно связана функция цитотоксических Т-лимфоцитов, ответствен-
ных за противовирусную, противотуберкулезную и противоопухолевую
защиту организма. Все это патогенетически определяет характер-
ную для ВИЧ-инфекции ассоциированную вирусную, бактериальную,
грибковую и онкопатологию.
Особое место в иммунопатогенезе ВИЧ-инфекции специалисты
отводят бактериальной транслокации, в результате которой в крови
больных ВИЧ-инфекцией обнаруживают значительное количество
продуктов бактериального распада. В пейеровых бляшках кишеч-
ника расположена особая категория С04+-лимфоцитов (Т-хелперы
17-го типа), обеспечивающих антибактериальную и противогрибковую
защиту кишечника. При ВИЧ-инфекции в кишечнике пациентов эта
категория Т-хелперов практически отсутствует, в результате чего раз-
вивается бактериальная транслокация, что приводит к хронической
активации иммунной системы. Поскольку активная репликация ВИЧ
происходит в интенсивно делящихся СЭ4+-лимфоцитах, иммунная
активация приводит к прогрессированию ВИЧ-инфекции, индуцирует
апоптоз и гибель С04+-клеток. Об иммунной активации свидетель-
ствует появление на поверхности CD4+- и С08+-лимфоцитов акти-
вационных маркеров (HLA-DR, CD38, CD25 и др.). Установлено, что
экспрессия Т-лимфоцитами CD38 прямо коррелирует с количеством
РНК ВИЧ в плазме и находится в обратной корреляционной связи
с количеством С04+-лимфоцитов.
Наряду с поражением иммунной системы в патологический про-
цесс вовлекается и кроветворная ткань. Для заболевания характерны
лейкопения, анемия, тромбоцитопения. Угнетается функциональная
активность гранулоцитов. У больных ВИЧ-инфекцией в костном
мозге резко снижено содержание колониеобразующих единиц грану-
лоцитов, макрофагов, мегакариоцитов. Однако дисфункция стволо-
вых клеток не связана с их прямым инфицированием, а подавление
кроветворения в результате действия ВИЧ связано с усилением про-
дукции костномозговыми моноцитами/макрофагами фактора некро-
за опухоли.
46
Глава 2. ВИЧ-инфекция
Таким образом, поражение иммунной системы при ВИЧ-инфекции
носит системный характер, проявляясь глубокой супрессией
Т- и В-звеньев клеточного иммунитета. В ходе развития ВИЧ-инфекции
происходят закономерные изменения гиперчувствительности немед-
ленного и замедленного типов, гуморального иммунитета и факторов
неспецифической защиты, функциональной активности лимфоцитов
и моноцитов/макрофагов. Нарастает уровень сывороточных иммуно-
глобулинов, циркулирующих иммунных комплексов. Наряду с дефи-
цитом С04+-лимфоцитов в динамике болезни нарастает функцио-
нальная недостаточность С08+-лимфоцитов, натуральных киллеров,
нейтрофилов. Нарушение иммунного статуса клинически проявляется
инфекционным, аллергическим, аутоиммунным и лимфопролифера-
тивным синдромами иммунологической недостаточности, синдромом,
свойственным болезни иммунных комплексов. Все это определяет
в целом клиническую картину ВИЧ-инфекции.
2.4. ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ ВИЧ-ИНФЕКЦИИ
После заражения вирусом и после инкубационного периода первым
проявлением ВИЧ-инфекции обычно бывает непродолжительная лихо-
радка, которая проходит без лечения (острая лихорадочная реакция).
Для этого периода наиболее характерны лимфаденопатия, лихорадка,
сыпь и миалгии. Как правило, длительность клинических проявлений
в период острой ВИЧ-инфекции не превышает 1 мес. Вслед за этим
наступает длительный период, для которого характерны отсутствие
каких-либо клинических проявлений и постепенное развитие иммуно-
дефицита (хроническая ВИЧ-инфекция). В этот период единственным
клиническим проявлением у большинства пациентов является гене-
рализованная персистирующая лимфаденопатия, которая не достав-
ляет беспокойства пациентам. У большинства ВИЧ-инфицированных
бессимптомная фаза длится 5—10 лет. Длительность бессимптомного
периода зависит от многих причин, в первую очередь от исходного
состояния иммунной системы человека, факторов, негативно влияю-
щих на состояние здоровья инфицированного (наркомания, алкого-
лизм, низкий социально-экономический статус и др.). Затем латент-
ный период сменяется симптомными стадиями ВИЧ-инфекции,
которые возникают на фоне роста виремии ВИЧ, снижения коли-
чества С04+-лимфоцитов и проявляются манифестацией вторич-
ных заболеваний и, прежде всего, оппортунистических инфекций
2.4. Естественное течение ВИЧ-инфекции 47
ю7
106
ю5
ю4
103
ю2
с;
£
>s
S
п.
о
*
m
узк
Q.
I-
са
X
03
X
о
Q.
S
DQ
6 12 1 2 3 4 5 6 7 8 9 10 11 12
Недели Годы
Рис. 2.3. Естественное течение ВИЧ-инфекции
и ВИЧ-ассоциированных опухолей, которые без лечения всегда при-
водят к гибели больного. До эпохи антиретровирусной терапии (APT)
с момента первых проявлений СПИДа до наступления смерти в сред-
нем проходило 2-4 года. Естественное течение ВИЧ-инфекции (при
отсутствии APT) показано на рис. 2.3.
Клинические проявления на стадиях СПИДа крайне разнообразны,
что обусловлено как прямым действием вируса на организм, так и сим-
птоматикой различных вторичных заболеваний, частота развития кото-
рых тесно коррелирует с количеством С04+-лимфоцитов. В организме
здорового человека содержание С04-клеток колеблется в диапазоне
от 600 до 1800 кл/мкл. Чем ниже их абсолютное число, тем выше риск
развития СПИД-индикаторных заболеваний. Так, если количество
С04-клеток уменьшается до 200 кл/мкл, необходимо начинать профи-
лактику пневмоцистной пневмонии и церебрального токсоплазмоза.
При снижении менее 50 кл/мкл резко возрастает риск цитомегалови-
русной (ЦМВ) инфекции и нетуберкулезного микобактериоза. Важно
отметить, что МВТ — истинно патогенный микроорганизм, способный
вызывать заболевание у иммунокомпетентных лиц. Следовательно,
ТБ не является оппортунистическим заболеванием и может развиться
в любой период течения ВИЧ-инфекции. Однако по мере прогрес-
сирования иммунодефицита вероятность его развития увеличивается
в 20-30 раз по сравнению с общепопуляционными показателями.
г- 1200
^-1000
о
о
§ 800
н
§ 500
с;
о
со
? 200
§
* о
400
48
Глава 2. ВИЧ-инфекция
2.5. КЛАССИФИКАЦИИ ВИЧ-ИНФЕКЦИИ
В вопросе клинической классификации, оценке стадии болез-
ни, определении понятий «СПИД-ассоциируемые заболевания»,
«СПИД-индикаторные болезни», «стадия СПИДа» много оста-
ется спорного, неоднозначно трактуемого и условного. К примеру,
нет единства в определении состояний, расцениваемых как СПИД
или СПИД-ассоциируемый комплекс. Так, ТБ вызывается истинно
патогенным микроорганизмом (МБТ) и может возникнуть в любой
период течения ВИЧ-инфекции и даже предшествовать ей.
В одной из первых классификаций, рекомендованных ВОЗ
(Всемирной организацией здравоохранения) в 1988 г., рассматрива-
лись 4 стадии болезни, и все классификации более позднего времени
практически модернизировали ее, сохраняя основные положения.
В этой классификации выделены следующие стадии:
• I — начальная (острая) ВИЧ-инфекция;
• II — персистирующая генерализованная лимфаденопатия (ГЛАП);
• III — СПИД-ассоциированный комплекс — преСПИД;
• IV — развернутый СПИД.
Последняя классификация ВОЗ была значительно дополнена и об-
новлена в 2006 г. и опубликована для стран Европы в «Протоколах ВОЗ
по лечению и предупреждению ВИЧ/СПИДа».
2.5.1. КЛИНИЧЕСКИЕ СТАДИИ ВСЕМИРНОЙ ОРГАНИЗАЦИИ
ЗДРАВООХРАНЕНИЯ ДЛЯ ВЗРОСЛЫХ И ПОДРОСТКОВ НЕ МЕНЕЕ 15 ЛЕТ
• Острая ВИЧ-инфекция:
— асимптоматическая;
— острый ретровирусный синдром.
• Клиническая стадия 1:
— асимптоматическая;
— персистирующая генерализованная лимфаденопатия.
• Клиническая стадия 2:
— себорейный дерматит;
— ангулярный хейлит;
— рецидивирующие язвы полости рта (2 эпизода или более в тече-
ние 6 мес);
— опоясывающий (распространенный) лишай;
2.5. Классификации ВИЧ-инфекции
49
— рецидивирующие инфекции дыхательных путей — синусит,
средний отит, фарингит, бронхит, трахеит (2 эпизода или более
в течение 6 мес);
— грибковые поражения ногтей;
— папулезный зудящий дерматит.
• Клиническая стадия 3:
— волосатая лейкоплакия полости рта;
— необъяснимая хроническая диарея продолжительностью более
1 мес;
— рецидивирующий кандидоз полости рта (2 эпизода или более
в течение 6 мес);
— тяжелая бактериальная инфекция (пневмония, эмпиема, гной-
ный миозит, инфекции костей или суставов, менингит, бакте-
риемия);
— острый язвенно-некротический стоматит, гингивит или пери-
одонтит.
• Клиническая стадия 41:
— легочный ТБ;
— внелегочный ТБ (исключая лимфаденопатию);
— необъяснимая потеря массы тела (более 10% в течение 6 мес);
— ВИЧ-истощающий синдром;
— ПЦП;
— тяжелая или рентгенологически подтвержденная пневмония
(2 эпизода или более в течение 6 мес);
— ЦМВ ретинит (с колитом или без него);
— вирус простого герпеса (хронический или персистирующий
более 1 мес);
— энцефалопатия;
— прогрессирующая мультифокальная лейкоэнцефалопатия;
— саркома Капоши и другие ВИЧ-обусловленные злокачествен-
ные новообразования;
— токсоплазмоз;
— диссеминированная грибковая инфекция (кандидоз, гисто-
плазмоз, кокцидиоидомикоз);
— криптоспоридиоз;
— криптококковый менингит;
1 Если подкрепляются достаточными доказательствами, могут быть включены
карцинома заднепроходного отверстия и лимфома (Т-клеточная ходжкинская).
50
Глава 2. ВИЧ-инфекция
— инфекция, вызванная нетуберкулезными микобактериями,
диссеминированная микобактериемия.
По мнению специалистов Центра по контролю и профилактике
заболеваний США (CDC), наиболее объективный критерий прогрес-
сирования ВИЧ-инфекции — это количество С04+-лимфоцитов,
а не клинические критерии, поскольку многие из этих состоя-
ний часто встречаются у лиц, не инфицированных ВИЧ. В 1991 г.
Центр предложил расширить список СПИД-ассоциированных
заболеваний и определил, что постановка диагноза «СПИД»
может быть в случаях, если у инфицированного имеется одно
из 23 СПИД-ассоциированных состояний или он ВИЧ-инфицирован
и имеет количество С04+-лимфоцитов менее 200 кл/мкл.
С 1993 г. в США стали применять классификацию, разработанную
CDC и рассчитанную на взрослых и подростков (табл. 2.2).
Таблица 2.2
Классификация стадий ВИЧ-инфекции
и расширенное определение случая СПИДа у взрослых и подростков
Клинические категории
Количество (%)
С04+-лимфоцитов,
мкл
>500 (>29%)
200-499 (14-28%)
<200 (<14%) —
индикатор СПИДа
А
бессимптомная
острая (первичная)
или ГЛАП*
А1
А2
A3**
В
манифестная
ни-А, ни-С
В1
В2
ВЗ**
С
СПИД-индикатор-
ные заболевания
С1**
С2**
СЗ**
* ГЛАП.
** Категория, определяющая СПИД.
Клинические проявления в подгруппах
A. Острый ретровирусный синдром:
- ГЛАП;
- бессимптомное течение.
B. Синдромы СПИД-ассоциированного комплекса:
- кандидоз полости рта;
- дисплазия шейки матки;
- опоясывающий герпес;
2.5. Классификации ВИЧ-инфекции
51
— идиопатическая тромбоцитопения;
— листериоз;
— лейкоплакия;
— периферическая нейропатия.
С. Собственно СПИД:
— кандидоз легких или пищевода;
— рак шейки матки;
— кокцидиоидоз;
— криптоспоридиоз;
— ЦМВ-инфекция;
— герпетический эзофагит;
— ВИЧ-энцефалопатия;
— гистоплазмоз;
— изоспориоз;
— саркома Капоши;
— лимфома;
— микобактериоз;
— пневмоцистоз;
— бактериальная пневмония;
— прогрессирующая многоочаговая лейкоэнцефалопатия;
— сальмонеллез.
Категории A3, ВЗ, CI, C2, СЗ являются определяющими для случая
СПИДа и подлежат в США учету как больные СПИДом.
В категорию А входят бессимптомная, острая ВИЧ-инфекция и пер-
систирующая ГЛАП в случаях диагноза, подтвержденного лабораторно.
Категория В включает все те клинические варианты ВИЧ-инфекции,
которые нельзя включить в категории А и С, т.е. переходная от ГЛАП
к СПИД-ассоциируемому комплексу, не отяжеленному генерализо-
ванной инфекцией или опухолевым процессом. Сюда относятся рото-
глоточный кандидоз, бациллярный ангиоматоз, диарея или лихорадка
длительностью свыше 1 мес, волосатая лейкоплакия языка, опоясы-
вающий или простой герпес. К категории С подпадают все те случаи,
когда хотя бы однократно выявлялось одно из 12 СПИД-индикаторных
заболеваний, включенных в официальный перечень.
Определение случая СПИДа. Во многих странах в целях эпиде-
миологического надзора регистрируют не случаи ВИЧ-инфекции
(как в России), а случаи СПИДа, т.е. случаи, когда у больного
ВИЧ-инфекцией развивается хотя бы одно из заболеваний или состо-
яний, определенных экспертами как индикаторные для СПИДа (пере-
чень СПИД-индикаторных состояний несколько различается в разных
52
Глава 2. ВИЧ-инфекция
национальных практиках). При этом критерии, предложенные экс-
пертами ВОЗ и CDC, различны. Особенностью классификации США
является, что случаи СПИДа регистрируют также у всех пациентов
с уровнем С04+-лимфоцитов менее 200 кл/мкл.
В России используют классификацию ВИЧ-инфекции, предложен-
ную В.И. Покровским в 1989 г. в редакции от 2006 г.
2.5.2. РОССИЙСКАЯ КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ ВИЧ-ИНФЕКЦИИ
1. Стадия инкубации.
2. Стадия первичных проявлений.
Варианты течения:
а) бессимптомное;
б) острая инфекция без вторичных заболеваний;
в) острая инфекция с вторичными заболеваниями.
3. Субклиническая стадия.
4. Стадия вторичных заболеваний.
4А. Потеря массы тела менее 10%, грибковые, вирусные, бакте-
риальные поражения кожи и слизистых оболочек, повторные
фарингиты, синуситы, опоясывающий герпес. Фазы: про-
грессирование при отсутствии APT, на фоне APT; ремиссия
(спонтанная, после APT, на фоне APT).
4Б. Потеря массы тела более 10%, необъяснимая диарея или лихо-
радка более 1 мес, повторные стойкие вирусные, бакте-
риальные, грибковые, протозойные поражения внутрен-
них органов, локализованная саркома Капоши, повторный
или диссеминированный опоясывающий герпес. Фазы: про-
грессирование при отсутствии APT, на фоне APT; ремиссия
(спонтанная, после APT, на фоне APT).
4В. Кахексия. Генерализованные вирусные, бактериальные,
микобактериальные, грибковые, протозойные, паразитар-
ные заболевания, в том числе кандидоз пищевода, бронхов,
трахеи, легких, ПЦП, злокачественные опухоли, поражения
ЦНС. Фазы: прогрессирование при отсутствии APT, на фоне
APT; ремиссия (спонтанная, после APT, на фоне APT).
5. Терминальная стадия.
Характеристика стадий ВИЧ-инфекции
Стадия 1 — стадия инкубации. Это период от момента заражения
до начала реакции организма в виде клинических проявлений острой
2.5. Классификации ВИЧ-инфекции
53
инфекции и/или выработки антител. Продолжительность ее обычно
составляет от 4 нед до 3 мес, но в единичных случаях может затяги-
ваться и до 1 года. В этот период идет активное размножение ВИЧ,
однако клинических проявлений заболевания нет и антитела к ВИЧ
еще не отмечены. Диагноз ВИЧ-инфекции на данной стадии ставят
на основании эпидемиологических данных, он может быть лабора-
торно подтвержден обнаружением в крови пациента ВИЧ, его антиге-
нов, нуклеиновых кислот.
Стадия 2 — стадия первичных проявлений. В этот период активная
репликация ВИЧ продолжается, однако уже замечен первичный ответ
организма на внедрение возбудителя в виде клинических симптомов
и/или выработки антител. Считается, что пациент находится в стадии
острой ВИЧ-инфекции в течение 12 мес после сероконверсии (появле-
ния антител к ВИЧ).
Стадия первичных проявлений может протекать в нескольких
формах.
• Стадия 2А — бессимптомная. Отсутствуют какие-либо клиниче-
ские проявления ВИЧ-инфекции или оппортунистических забо-
леваний, развивающихся на фоне иммунодефицита. Ответ орга-
низма на внедрение ВИЧ проявляется при этом лишь выработкой
антител.
• Стадия 2Б — острая ВИЧ-инфекция без вторичных заболеваний.
Характеризуется разнообразными клиническими симптома-
ми. Чаще всего это увеличение лимфатических узлов, лихо-
радка, фарингит, высыпания (уртикарные, папулезные, пете-
хиальные) на коже и слизистых оболочках. Может отмечаться
увеличение печени, селезенки, появляется диарея. Иногда развива-
ется так называемый асептический менингит, для которого харак-
терен менингеальный синдром, однако спинномозговая жидкость
визуально и цитологически не изменена, хотя ее давление и повы-
шено. Изредка может развиваться серозный менингит. Поскольку
клиническая картина острой ВИЧ-инфекции часто напоминает
корь, краснуху, инфекционный мононуклеоз, ее иногда называют
«мононуклеозоподобный синдром», «краснухоподобный синдром».
Сходство с инфекционным мононуклеозом усиливает и появле-
ние в крови больных острой ВИЧ-инфекцией широкоплазменных
лимфоцитов (мононуклеаров). Мононуклеозоподобная или крас-
нухоподобная картина отмечается у 15—30% больных острой ВИЧ-
инфекцией. У большинства же развивается 1—2 перечисленных
выше симптома в любых сочетаниях. У отдельных больных могут
54
Глава 2. ВИЧ-инфекция
возникать поражения аутоиммунной природы. В целом острую ста-
дию ВИЧ-инфекции регистрируют у 50—90% инфицированных лиц
в первые 3 мес после заражения. Начало периода острой инфекции,
как правило, опережает сероконверсию, поэтому при появлении
первых клинических симптомов в сыворотке крови больного
можно не обнаружить антител к белкам и гликопротеидам ВИЧ.
В стадии острой инфекции часто отмечается транзиторное сниже-
ние уровня С04+-лимфоцитов.
• Стадия 2В — острая ВИЧ-инфекция с вторичными заболеваниями.
В 10—15% случаев у больных острой ВИЧ-инфекцией на фоне
снижения уровня С04+-лимфоцитов и развившегося вследствие
этого иммунодефицита появляются вторичные заболевания раз-
личной этиологии (ангина, бактериальная пневмония, кандидозы,
герпетическая инфекция и др.). Эти проявления, как правило,
слабо выражены, кратковременны, хорошо поддаются терапии,
но могут быть тяжелыми (кандидозный эзофагит, ПЦП) и в ред-
ких случаях даже имеют смертельный исход. Продолжительность
клинических проявлений острой ВИЧ-инфекции варьирует
от нескольких дней до нескольких месяцев, однако обычно она
составляет 2—3 нед. Исключение — увеличение лимфатических
узлов, которое может сохраняться на протяжении всего заболе-
вания. Клинические проявления острой ВИЧ-инфекции могут
рецидивировать. У преобладающего большинства пациентов ста-
дия первичных проявлений ВИЧ-инфекции переходит в субкли-
ническую, однако у некоторых может, минуя ее, сразу переходить
в стадию вторичных заболеваний.
Стадия 3 — субклиническая. Характеризуется медленным прогрес-
сированием иммунодефицита, компенсируемого за счет модификации
иммунного ответа и избыточного воспроизводства С04-клеток. В крови
обнаруживают антитела к ВИЧ; скорость репликации вируса, в сравне-
нии со стадией первичных проявлений, замедляется. Единственным
клиническим симптомом заболевания служит увеличение лимфати-
ческих узлов, которое, однако, может отсутствовать. Иногда (чаще
у детей) отмечаются такие лабораторные изменения, как анемия, тром-
боцитопения, в том числе приводящая к клиническим проявлениям
нарушения гемостаза. Продолжительность субклинической стадии
может варьировать от 2-3 до 20 лет и более, в среднем 6-7 лет. В этот
период отмечается постепенное снижение уровня С04+-лимфоцитов
в среднем со скоростью 50—70 кл/мкл в год.
2.5. Классификации ВИЧ-инфекции
55
Стадия 4 — стадия вторичных заболеваний. Продолжается реплика-
ция ВИЧ, которая сопровождается гибелью С04-клеток и истощением
их популяции. Это приводит к развитию на фоне иммунодефицита
вторичных (оппортунистических) инфекционных и/или онкологи-
ческих заболеваний. Клинические проявления оппортунистических
заболеваний наряду с лимфаденопатией, сохраняющейся у большин-
ства больных, обусловливают клиническую картину стадии вторичных
заболеваний.
В зависимости от степени тяжести вторичных заболеваний выделяют:
• Стадию 4А (обычно развивается через 6—7 лет от момента зараже-
ния). Для нее характерны бактериальные, грибковые и вирусные
поражения слизистых оболочек и кожных покровов, воспалитель-
ные заболевания верхних дыхательных путей. Обычно стадия 4А
развивается у пациентов с уровнем СЭ4+-лимфоцитов около
350 кл/мкл.
• Стадию 4Б (развивается через 7—10 лет от момента заражения).
Кожные поражения носят более глубокий характер и склонны
к затяжному течению. Развиваются поражения внутренних органов.
Кроме того, могут отмечаться локализованная саркома Капоши,
умеренно выраженные конституциональные симптомы (поте-
ря массы тела, лихорадка), поражение периферической нервной
системы, ТБ. Обычно стадия 4Б развивается у пациентов с уровнем
СЭ4+-лимфоцитов 200—350 кл/мкл.
• Стадию 4В (через 10—12 лет от момента заражения). Характери-
зуется развитием тяжелых, угрожающих жизни вторичных (оп-
портунистических) заболеваний, их генерализованным характе-
ром, поражением ЦНС. Обычно стадия 4В развивается у пациен-
тов с уровнем С04+-лимфоцитов менее 200 кл/мкл.
Характерные для стадии 4 вторичные заболевания могут исчезать,
по крайней мере на какое-то время. Именно поэтому в течении стадии
вторичных заболеваний выделяют фазы прогрессирования (при отсут-
ствии APT или на фоне APT при ее недостаточной эффективности)
и ремиссии (спонтанной, после ранее проводимой APT, на фоне APT).
Стадия 5 — терминальная. Была введена в клиническую класси-
фикацию ВИЧ-инфекции в 1989 г., когда APT еще не существовало,
и имеющиеся у больных вторичные заболевания приобретали необра-
тимый характер, пациент погибал в течение нескольких месяцев после
развития тяжелых вторичных заболеваний. В настоящее время даже
у пациентов с уровнем С04-клеток, близким к нулю, и тяжелыми вто-
ричными заболеваниями лечение ВИЧ-инфекции не бесперспективно,
56
Глава 2. ВИЧ-инфекция
поэтому постановка диагноза «ВИЧ-инфекция, терминальная стадия»
не рекомендуется.
Ниже приведен перечень состояний (всего 28), которые, соглас-
но Российской классификации, свидетельствуют о развитии у паци-
ента СПИДа (перечень определен на основе рекомендаций ВОЗ).
Его применяют в первую очередь для эпидемиологического надзора
за распространением ВИЧ в мире, поскольку случаи заболевания
ВИЧ-инфекцией регистрируют не во всех странах.
Перечень состояний, свидетельствующих о развитии у пациента
синдрома приобретенного иммунодефицита
1. Бактериальные инфекции (множественные или возвратные)
у ребенка в возрасте до 13 лет.
2. Кандидоз пищевода.
3. Кандидоз трахеи, бронхов или легких.
4. Рак шейки матки (инвазивный).
5. Кокцидиомикоз (диссеминированный или внелегочный).
6. Внелегочный криптококкоз.
7. Криптоспоридиоз кишечника с диареей более 1 мес.
8. ЦМВ-инфекция (с поражением других органов, кроме печени,
селезенки, лимфатических узлов) у пациента в возрасте старше
1 мес.
9. ЦМВ ретинит с потерей остроты зрения.
10. Энцефалопатия, обусловленная действием ВИЧ.
11. Инфекция, обусловленная вирусом простого герпеса: хрониче-
ские язвы, сохраняющиеся более 1 мес, или бронхит, пневмо-
ния, эзофагит у пациента в возрасте старше 1 мес.
12. Гистоплазмоз (диссеминированный или внелегочный).
13. Изоспороз кишечника (с диареей длительностью более 1 мес).
14. Саркома Капоши.
15. Интерстициальная лимфоидная пневмония у ребенка в возрасте
до 13 лет.
16. Лимфома Беркитта.
17. Иммунобластная лимфома.
18. Лимфома мозга первичная.
19. Микобактериозы, вызванные М. kansasii, M. avium-intracellulare
(диссеминированные или внелегочные).
20. ТБ легких у взрослого или подростка старше 13 лет.
21. ТБ внелегочный.
2.5. Классификации ВИЧ-инфекции
57
22. Другие недифференцированные диссеминированные или вне-
легочные микобактериозы.
23. Пневмоцистная пневмония.
24. Пневмонии возвратные (2 эпизода и более в течение 12 мес).
25. Прогрессирующая многоочаговая лейкоэнцефалопатия.
26. Сальмонеллезные (нетифоидные) септицемии возвратные.
27. Токсоплазмоз мозга у пациента в возрасте старше 1 мес.
28. Синдром истощения, обусловленный ВИЧ.
Из существующих классификаций нетрудно убедиться, что
ВИЧ-инфекция не имеет собственного, клинически очерченного
статуса, ее клинические проявления в развернутой фазе болезни —
это клиническая картина тех преимущественно оппортунистических
инфекций или опухолей, которые наслаиваются на иммунологически
дефицитный организм. Именно поэтому сформировалось понятие
«СПИД-ассоциируемые заболевания», куда входят наиболее часто раз-
вивающиеся инфекционные, паразитарные, грибковые или неопласти-
ческие процессы, которые чаще всего бывают клиническим проявлени-
ем ВИЧ-индуцированного вторичного иммунодефицита.
2.5.3. МЕЖДУНАРОДНАЯ КЛАССИФИКАЦИЯ БОЛЕЗНЕЙ 10-ГО ПЕРЕСМОТРА
МКБ-10 — Международная статистическая классификация
болезней и проблем, связанных со здоровьем (International Statistical
Classification of Diseases and Related Health Problems). Она является веду-
щей статистической и классификационной основой здравоохранения.
Этот нормативный документ обеспечивает единство методических
подходов и международную сопоставимость материалов. Авторство
создания документа принадлежит центральному офису ВОЗ (Женева,
Швейцария). Классификация периодически (раз в 10 лет) пересматри-
вается под руководством ВОЗ. В настоящее время действует МКБ 10-го
пересмотра (МКБ-10). В России органы и учреждения здравоохране-
ния осуществили переход статистического учета на МКБ-10 в 1999 г.
МКБ-10, в отличие от приведенной выше Российской классификации
ВИЧ-инфекции и аналогичных зарубежных классификаций, наиболее
известными из которых являются классификации ВОЗ и CDC (класси-
фикации такого типа иногда называются классификациями стадий ВИЧ-
инфекции), предназначена в основном не для определения стадии ВИЧ
и прогноза течения заболевания, а для статистических целей. Именно
поэтому прямых параллелей между ней и клиническими классификаци-
ями стадий ВИЧ-инфекции нет. Например, стадии 3 (субклинической)
58
Глава 2. ВИЧ-инфекция
в МКБ-10 могут соответствовать следующие состояния: В23.1 — болезнь,
вызванная ВИЧ, с проявлениями персистентной ГЛАП; В23.2 — болезнь,
вызванная ВИЧ, с проявлениями гематологических и иммунологических
нарушений, не классифицированных в других рубриках. С другой сторо-
ны, такое состояние, как В20.4 — болезнь, вызванная ВИЧ, с проявлени-
ями кандидоза, может отмечаться и при стадии 2В, и 4А, и 4Б, и 4В, и 5.
Примечание. С 2010 г. из МКБ-10 исключены острый инфекционный
синдром, вызванный ВИЧ (В23.0), и бессимптомная инфекция, вызванная
BH4(Z21).
Ниже приведены состояния и медицинские услуги, связанные
с ВИЧ-инфекцией, имеющиеся в МКБ-10.
• В20. Болезнь, вызванная ВИЧ, появляющаяся в виде инфекцион-
ных и паразитарных болезней.
• В20.0. Болезнь, вызванная ВИЧ, с проявлениями микобактери-
альной инфекции.
• В20.1. Болезнь, вызванная ВИЧ, с проявлениями других бактери-
альных инфекций.
• В20.2. Болезнь, вызванная ВИЧ, с проявлениями ЦМВ заболевания.
• В20.3. Болезнь, вызванная ВИЧ, с проявлениями других вирусных
инфекций.
• В20.4. Болезнь, вызванная ВИЧ, с проявлениями кандидоза.
• В20.5. Болезнь, вызванная ВИЧ, с проявлениями других микозов.
• В20.6. Болезнь, вызванная ВИЧ, с проявлениями пневмонии,
вызванной Pneumocystis carina.
• В20.7. Болезнь, вызванная ВИЧ, с проявлениями множественных
инфекций.
• В20.8. Болезнь, вызванная ВИЧ, с проявлениями других инфекци-
онных и паразитарных болезней.
• В20.9. Болезнь, вызванная ВИЧ, с проявлениями неуточненных
инфекционных и паразитарных болезней.
• В21. Болезнь, вызванная ВИЧ, проявляющаяся в виде злокаче-
ственных новообразований.
• В21.0. Болезнь, вызванная ВИЧ, с проявлениями саркомы Капоши.
• В21.1. Болезнь, вызванная ВИЧ, с проявлениями лимфомы Бер-
китта.
• В21.2. Болезнь, вызванная ВИЧ, с проявлениями других
неходжкинских лимфом (НХЛ).
• В21.3. Болезнь, вызванная ВИЧ, с проявлениями других злокаче-
ственных новообразований лимфатической, кроветворной и род-
ственных им тканей.
2.6. Патогенез сочетанной инфекции
59
• В21.7. Болезнь, вызванная ВИЧ, с проявлениями множественных
злокачественных новообразований.
• В21.8. Болезнь, вызванная ВИЧ, с проявлениями других злокаче-
ственных новообразований.
• В21.9. Болезнь, вызванная ВИЧ, с проявлениями неуточненных
злокачественных новообразований.
• В22. Болезнь, вызванная ВИЧ, проявляющаяся в виде других уточ-
ненных болезней.
• В22.0. Болезнь, вызванная ВИЧ, с проявлениями энцефалопатии.
• В22.1. Болезнь, вызванная ВИЧ, с проявлениями лимфатического
интерстициального пневмонита.
• В22.2. Болезнь, вызванная ВИЧ, с проявлениями изнуряющего
синдрома.
• В22.7. Болезнь, вызванная ВИЧ, с проявлениями множественных
болезней, классифицированных в других рубриках.
• В23. Болезнь, вызванная ВИЧ, проявляющаяся в виде других состо-
яний.
• В23.1. Болезнь, вызванная ВИЧ, с проявлениями персистентной
ГЛАП.
• В23.2. Болезнь, вызванная ВИЧ, с проявлениями гематологиче-
ских и иммунологических нарушений, не классифицированных
в других рубриках.
• В23.8. Болезнь, вызванная ВИЧ, с проявлениями других уточнен-
ных состояний.
• В24. Болезнь, вызванная ВИЧ, неуточненная.
• F02.4. Деменция при болезни, вызванной ВИЧ [В22.0].
• R75. Лабораторное обнаружение ВИЧ.
• Z11.4. Специальное скрининговое обследование в целях выявле-
ния инфицирования ВИЧ.
• Z20.6. Контакт с больным и возможность заражения ВИЧ.
• Z71.7. Консультирование по вопросам, связанным с ВИЧ.
• Z83.0. В семейном анамнезе — болезнь, вызванная ВИЧ.
2.6. ПАТОГЕНЕЗ СОЧЕТАННОЙ ИНФЕКЦИИ
Уже первые клинические наблюдения относительно взаимосвязи
МБТ и ВИЧ обнаружили влияние ВИЧ-инфекции на профессирование
ТБ. К настоящему времени накоплено большое количество информа-
ции, свидетельствующей, в свою очередь, о том, что иммунологические
60
Глава 2. ВИЧ-инфекция
реакции макроорганизма на присутствие МВТ усиливают репли-
кацию ВИЧ, тем самым способствуют прогрессированию
ВИЧ-инфекции. Именно поэтому взаимосвязь данных патогенов
следует учитывать при профилактических и лечебных мероприятиях
ТБ у ВИЧ-инфицированных. Изучение иммунных реакций больных
ТБ подтверждает наличие копатогенеза (взаимосвязанного патоге-
неза) при сопутствующей ВИЧ-инфекции.
Как описывалось выше, в популяции Т-лимфоцитов различа-
ют клетки с индуцирующей функцией (хелперы, С04+-лимфоциты
или Th), усиливающие иммунные реакции, и клетки с цитотоксической
способностью (С08+-лимфоциты). В зависимости от набора секрети-
руемых цитокинов С04+-лимфоциты делят на Т-хелперы-1 (ТЫ)
и Т-хелперы-2 (Th2). Thl секретируют ИЛ-2 и у-интерферон, и имен-
но эта субпопуляция лимфоцитов ответственна за активирование
макрофагов в ответ на воздействие различных микобактериальных
агентов, обеспечивая противотуберкулезный клеточный иммунный
ответ, который характеризуется гиперчувствительностью замедленно-
го типа. Клетки субпопуляции Th2 секретируют ИЛ-4, -5, -10, которые
стимулируют В-лимфоциты, а те, в свою очередь, индуцируют каскад
реакций, обеспечивающих гуморальный иммунный ответ гиперчув-
ствительности немедленного типа. Эти две субпопуляции лимфоцитов
у здорового человека находятся в антагонистических отношениях
между собой.
С течением времени у больных ВИЧ-инфекцией прогрессивно
снижается количество ТЫ-клеток, соответственно, нарушается баланс
между ТЫ и Th2, который смещается в сторону последних. В этот
период происходит переключение иммунного противотуберкулезного
ответа с клеточного на гуморальный. Одновременно с этим возрас-
тает количество активированных С08+-лимфоцитов, стимулируется
образование антител к клеткам хозяина (аутоантител) и иммунных
комплексов. Лишенные помощи С04+-лимфоцитов, В-лимфоциты
проявляют повышенную спонтанную антителообразующую и цито-
кинсинтезирующую активность. В результате повышается уровень
продукции фактора некроза опухоли, который относится к мощ-
ным индукторам репликации ВИЧ, ускоряющим прогрессирование
ВИЧ-инфекции. Определение темпов снижения количества ТЫ-
лимфоцитов — ключевой фактор в понимании нарушений реактив-
ности макроорганизма при ТБ у больных ВИЧ-инфекцией. Это объ-
ясняется тем, что иммунитет, формирующийся у человека к МБТ,
связан с ТЫ-лимфоцитами и макрофагами. Клинические исходы
2.6. Патогенез сочетанной инфекции
61
ТБ в значительно большей степени зависят от действий клеточного,
а не гуморального иммунитета. В основе механизмов иммунного отве-
та на МВТ лежит гиперчувствительность замедленного типа. Она осно-
вана на взаимном влиянии ТЫ-лимфоцитов и макрофагов, которые
приобретают антибактериальную активность через у-интерфероны,
синтезируемые ТЫ-лимфоцитами.
ТБ при отсутствии ВИЧ-инфекции вызывает снижение CD4+-
лимфоцитов пропорционально степени распространенности специ-
фического процесса. Доказано, что у 80—90% больных казеозной
пневмонией без ВИЧ-инфекции возникают признаки вторичного
иммунодефицита.
ВИЧ-инфекция — самый мощный из всех известных факторов,
приводящих к С04-лимфопении. В результате истощения пула
С04-клеток (примерно на 50—80 кл/мкл в год) происходит блоки-
рование описанных механизмов иммунного противотуберкулезного
надзора, что, в свою очередь, приводит к развитию заболевания при
активации дремлющих микобактерий или в результате реинфекции
(повторного заражения). С течением времени иммунная система стано-
вится не в состоянии предотвратить распространение МБТ в организме.
Если у взрослого человека с ВИЧ-негативным статусом меха-
низм возникновения ТБ в большинстве случаев связан с реактивацией
латентной инфекции, то в развитии ТБ у больных ВИЧ-инфекцией
при прогрессировании иммунодефицита одинаково важное патоге-
нетическое значение имеют как реактивация имеющейся в организме
инфекции, так и реинфекция МБТ. В России при высокой инфициро-
ванное™ взрослого населения МБТ и наличии огромного так называ-
емого бациллярного ядра (на активном учете в противотуберкулезных
учреждениях страны состоит примерно 100 тыс. бактериовыделителей)
люди, живущие с ВИЧ (ЛЖВ), особенно уязвимы в отношении ТБ. Для
больного ВИЧ-инфекцией с выраженным иммунодефицитом опасен
даже кратковременный контакт с бактериовыделителем, в отличие
от здоровых людей, когда к заболеванию может привести лишь дли-
тельный, постоянный контакт.
Концепция патогенеза ТБ у больных ВИЧ-инфекцией наиболее
полно представлена в работах A.M. Пантелеева. Считается, что пер-
вично в воспалительный процесс вовлекаются ВГЛУ. Это может быть
как реактивация существующих изменений во ВГЛУ, так и развитие
первичного ТБ в результате свежего заражения. Степень поражения
ВГЛУ находится в широком диапазоне — от малых форм бронхоадени-
та до туморозного поражения нескольких групп лимфатических узлов
62
Глава 2. ВИЧ-инфекция
с развитием аденофлегмоны средостения и формированием аденоброн-
хиальных, аденоперикардиальных, аденопищеводных свищей. При
морфологическом исследовании в большинстве случаев лимфатиче-
ские узлы представляются тотально разрушенными. Лимфогенное рас-
пространение ТБ приводит к поражению серозных оболочек, активно
участвующих в лимфообращении. Из пораженных лимфатических
узлов МБТ по лимфатическим дренажам проникают в висцеральную
плевру или перикард, приводя к экссудативному плевриту и/или
перикардиту.
Прогрессирование ТБ во ВГЛУ средостения приводит к замещению
лимфоидной ткани казеозом. Увеличенные, напряженные лимфати-
ческие узлы теряют свою дренажную функцию и блокируют движение
лимфы, в результате наступает лимфостаз, а затем ретрофадно лимфа
оттекает по легочному интерстицию. Рентгенологически это проявля-
ется в виде усиления прикорневого рисунка. Кроме того, пораженные
лимфатические узлы становятся вторичным источником генерали-
зации (лимфогенной генерализацией). По лимфатическим сосудам
инфицированная лимфа проникает в лимфатические узлы других обла-
стей (мезентериальные лимфатические узлы, брюшную полость, лим-
фатические узлы шеи и др.). По степени и частоте вовлечения
в специфическое воспаление лимфатические узлы можно разделить
на три зоны. Первой зоной являются лимфатические узлы средостения,
где чаще всего развивается туберкулезное воспаление. Второй зоной —
региональные над- и подключичные лимфатические узлы и лимфати-
ческие узлы ворот печени, а также мезентериальные. Более отдаленные
группы лимфатических узлов (третья зона), такие как паховые, куби-
тальные и другие, значительно реже вовлекаются в воспалительный
специфический процесс.
Одновременно с органной лимфогенной генерализацией проис-
ходит гематогенное распространение МБТ. Один из первых признаков
бактериемии — поражение селезенки. На фоне повторных волн гема-
тогенного распространения при глубоком иммунодефиците может раз-
виться туберкулезный сепсис (тифобациллез Ландузи).
Этапы развития процесса могут протекать с различной интенсивно-
стью и длительностью, которые в большей степени зависят от степени
иммуносупрессии. Чем глубже иммунодефицит, тем чаще к лимфоген-
ной присоединяется гематогенная генерализация.
Глава 3
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ТУБЕРКУЛЕЗА
ОРГАНОВ ДЫХАНИЯ У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
В ЗАВИСИМОСТИ ОТ СТЕПЕНИ ИММУНОСУПРЕССИИ
Течение ТБ у больных ВИЧ-инфекцией зависит от длительности
заболевания и определяется степенью утраты иммунного ответа, поэто-
му нетипичные клинико-рентгенологические особенности ТБ у таких
больных начинают появляться в периоды значительного снижения
количества С04+-лимфоцитов.
3.1. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ТУБЕРКУЛЕЗА
ОРГАНОВ ДЫХАНИЯ НА РАЗЛИЧНЫХ СТАДИЯХ ВИЧ-ИНФЕКЦИИ
ВИЧ-инфекция на стадии первичных проявлений до сих пор
остается малоизученной проблемой. В 40—90% случаев острая фаза
ВИЧ-инфекции протекает с выраженной преходящей симптоматикой,
совпадающей по времени с активной репликацией ВИЧ и нарастанием
специфического иммунного ответа на вирус.
В большинстве случаев острая ВИЧ-инфекция остается ^диагности-
рованной, ее симптомы приписывают острой респираторной вирусной
инфекции, гриппу, а антитела к ВИЧ еще могут не определяться. В этот
период, когда происходит транзиторное снижение количества CD4+-
лимфоцитов, у лиц, инфицированных МБТ, возрастает вероятность
развития ТБ как вторичного заболевания. В таком случае устанавли-
вается стадия 2В ВИЧ-инфекции (острая ВИЧ-инфекция с вторичны-
ми заболеваниями). Ввиду умеренной иммуносупрессии (количество
С04+-лимфоцитов редко снижается менее 200 кл/мкл) в большинстве
случаев ТБ характеризуется типичными проявлениями.
Длительное наблюдение за больными ТБ (получавшими проти-
вотуберкулезную химиотерапию) в стадии первичных проявлений
ВИЧ-инфекции показало, что после транзиторного снижения количе-
ства СЭ4-клеток происходит их восстановление, а эффективность ПТТ
64 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
у большинства пациентов не отличается от таковой у больных ТБ
без ВИЧ-инфекции. После завершения основного курса лече-
ния еще несколько лет общее состояние пациентов остается удов-
летворительным, рецидивы ТБ возникают не чаще, чем у больных
с ВИЧ-негативным статусом, в иммунной системе отсутствуют выра-
женные изменения и не развиваются другие вторичные заболевания.
Однако у небольшой части больных течение острой ВИЧ-инфекции
может сопровождаться значительным угнетением Т-клеточного имму-
нитета, тогда специфический процесс приобретает симптомы, харак-
терные для ТБ на поздних стадиях, что значительно затрудняет опре-
деление стадии ВИЧ-инфекции. Нередко у этой категории больных
развитие ТБ врачи ошибочно расценивают как проявление 4Б, или 4В
ВИЧ-инфекции. Кроме того, помимо ТБ, у таких пациентов могут
развиться другие СПИД-индикаторные заболевания. Выраженный
иммунодефицит в период острой ВИЧ-инфекции с развитием вто-
ричных заболеваний — прогностически плохой фактор для течения
ВИЧ-инфекции. Доказано, что чем тяжелее протекает острый период
ВИЧ-инфекции, тем быстрее скорость ее профессии.
Для окончательного суждения о стадии ВИЧ-инфекции необходим
тщательный сбор эпидемиологического анамнеза. Больной считается
находящимся в стадии начальной ВИЧ-инфекции в течение 1 года
после появления симптомов острой инфекции или сероконверсии.
В субклинической стадии ВИЧ-инфекции (стадия 3), когда количе-
ство СЭ4+-лимфоцитов превышает 500 кл/мкл, заболевание ТБ также
возможно, однако вероятность его развития немногим превышает
общепопуляционныи показатель и часто связана с тесным контактом
с бактериовыделителем. В этот период ВИЧ-инфекция практически
не оказывает влияния на течение ТБ. У таких пациентов заболевание
нередко выявляют при плановом флюорографическом исследова-
нии, еще до клинической манифестации. Специфический процесс
чаще ограничен поражением легких с излюбленной локализацией
в сегментах SI, S2, S6 и характерной рентгенологической семиотикой:
инфильтрацией из сливающихся очаговых теней с формированием
полостей распада. Из клинических форм наиболее часто встречаются
инфильтративный и подострый диссеминированный ТБ (рис. 3.1).
На фоне не вполне адекватной терапии или низкой приверженности
к лечению имеется тенденция к хронизации ТБ с трансформацией про-
цесса в фиброзно-кавернозный ТБ, хронический диссеминированный
либо цирротический.
3.1. Клинические проявления туберкулеза органов дыхания...
65
Рис. 3.1. Обзорная рентгенограмма больного Д., 39 лет (ВИЧ-инфекция, количество
С04+-лимфоцитов — 970 кл/мкл). Инфильтративный туберкулез верхней доли правого
легкого в фазе распада МБТ+
На поздних стадиях ВИЧ-инфекции, по мере прогрессирования
иммунодефицита, ТБ проградиентно степени угнетения клеточного
иммунитета приобретает характер первичного со склонностью к пора-
жению лимфоидной ткани, серозных оболочек и лимфогематогенной
диссеминации. Наибольшие различия с классическим течением ТБ
у больных без ВИЧ-инфекции замечены при снижении содержа-
ния СЭ4+-лимфоцитов менее 200 кл/мкл. Клиническая картина ТБ
в этот период теряет типичность проявлений, процесс характеризуется
злокачественностью и быстропрогрессирующим течением. Острота
и скорость развития ТБ напоминают течение неспецифической бак-
териальной инфекции, при этом темпы развития развернутой клини-
ческой картины зависят от степени выраженности иммунодефицита.
В структуре клинических форм начинают преобладать ТБ ВГЛУ с брон-
холегочным компонентом (60—80%), диссеминированные милиар-
ные процессы (50-60%), поражение плевры (до 40%), туберкулезный
сепсис (5—15%). Особенность клинического течения ТБ на поздних
стадиях ВИЧ-инфекции — выраженный изнуряющий интоксикацион-
ный синдром с лихорадочными реакциями до фебрильных и высоких
значений.
Чем глубже проявления иммунодефицита, вызванного ВИЧ-инфек-
цией, тем чаще встречается ТБ множественных локализаций. Внелегочные
66 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
проявления ТБ регистрируются у 30—70% больных с выраженным
иммунодефицитом (С04+-лимфоцитов — менее 200 кл/мкл). При
этом частота поражения легких и/или ВГЛУ при генерализованном
ТБ составляет 93—100%. Течение ТБ в этот период характеризуется
развитием самых грозных во фтизиатрической практике состояний:
менингоэнцефалита, ТБ кишечника, брюшины, абсцедирующего
мезаденита, в результате чего значительно увеличивается вероятность
летального исхода.
При глубоком иммунодефиците (С04+-лимфоцитов — менее
100 кл/мкл) течение туберкулезной инфекции часто (до 40%) сопро-
вождается развитием других вторичных и СПИД-индикаторных
заболеваний (ПЦП, ЦМВ-инфекция, церебральный токсоплазмоз,
системный кандидоз, церебральная лимфома и др.), наличие которых
определяет клиническую картину и еще более осложняет диагностику.
3.2. КЛИНИК0-РЕНТГЕН0Л0ГИЧЕСКИЕ ПРОЯВЛЕНИЯ ТУБЕРКУЛЕЗА
ОРГАНОВ ДЫХАНИЯ У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
В ЗАВИСИМОСТИ ОТ СТЕПЕНИ ИММУНОСУПРЕССИИ
Рентгенологическая картина отображает морфологические изме-
нения в легочной ткани. В многочисленных работах подчеркивается,
что скиалогический симптомокомплекс ТБ легких на поздних стадиях
ВИЧ-инфекции бывает атипичным. Наиболее часто (до 70%) на рент-
генограммах, компьютерной томографии (КТ) отмечают увеличение
корней легких и верхнего средостения за счет поражения ВГЛУ, часто
с прикорневой инфильтрацией или диссеминацией. Частота регистра-
ции распада в легочной ткани зависит от степени иммуносупрессии,
и у пациентов с количеством С04+-лимфоцитов менее 350 кл/мкл рас-
пад выявляют только у 20—30% больных.
У больных ВИЧ-инфекцией при глубоком иммунодефиците (менее
50 кл/мкл) в 20—25% случаев яркая клиническая картина опережает
появление диссеминации, а у ряда пациентов изменений на рентгено-
грамме вообще не удается выявить. При этом у 5—15% таких больных
можно обнаружить бактериовыделение. Значительно большую инфор-
мацию о состоянии легочной ткани и ВГЛУ дает КТ, разрешающая
способность которой позволяет выявить субмилиарную диссемина-
цию, имитирующую усиление легочного рисунка на обзорной рент-
генограмме органов грудной клетки (ОГК) (рис. 3.2, 3.3). Подобное
состояние во фтизиатрической практике принято характеризовать как
3.2. Клинико-рентгенологические проявления туберкулеза органов дыхания... 67
туберкулезный сепсис (тифобациллез Ландузи, микобактериальная
безбугорковая септицемия). Важно отметить, что туберкулярный сеп-
сис — исторический термин и не в полной мере отвечает современным
представлениям о сепсисе.
Рис. 3.2. Обзорная рентгенограмма больного Ж., 29 лет (ВИЧ-инфекция, количество
С04+-лимфоцитов — 80 кл/мкл). Туберкулез внутригрудных лимфатических узлов,
фаза инфильтрации. Милиарная диссеминация в легких
Рис. 3.3. Срез компьютерной томографии легких того же больного. Субтотальная
мельчайшая мономорфная диссеминация
68 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
По мере прогрессирования иммунодефицита туберкулезная инток-
сикация проявляется более выраженными изменениями со сторо-
ны крови: железодефицитной анемией средней и тяжелой степени
тяжести, значительным повышением скорости оседания эритроцитов
(до 50 мм/ч и выше), лимфопенией. Не очень характерны лейкоцитоз
и палочкоядерный сдвиг в лейкоцитарной формуле.
В табл. 3.1 представлены основные, наиболее часто встречающие-
ся клинические, рентгенологические и лабораторные проявления ТБ
у больных ВИЧ-инфекцией в зависимости от выраженности иммуно-
дефицита.
Таблица 3.1
Основные клинико-рентгенологические критерии туберкулеза
у больных ВИЧ-инфекцией при различной степени иммуносупрессии
Критерий
Начало заболе-
вания
Лихорадка
Полиорганное
поражение
Рентгеноло-
гические про-
явления
Анемия
Лимфопения
CD4 <200 кл/мкл
Острое, подострое
Высокая и фебриль-
ная
Часто (у 50% боль-
ных). Нередко с пора-
жением трех локали-
заций и более
Внугригрудная лимфа-
денопатия. Милиарная
и лимфогенная дис-
семинация.
При CD4 <50 кл/мкл
нередко диссеми-
нация проявляется
усилением легочного
рисунка (субмилиар-
ная). Отсутствие рас-
пада в легочной ткани.
Признаки гидроторакса
и/или гидроперикарда
Средней степени
тяжести и тяжелая
Характерна
CD4:200-349 кл/мкл
Подострое
Фебрильная
Иногда.
Наиболее часто вто-
рой локализацией
является ТБ перифе-
рических узлов
Внутригрудная лим-
фаденопатия.
Сегментарное
и долевое бронхоле-
гочное поражение.
Очаговая диссеми-
нация. Признаки
гидроторакса
Легкой степени
I тяжести
Нехарактерна
CD4 >350 кл/мкл
Подострое мало- I
симптомное |
Субфебрильная I
Редко I
Инфильтратив- I
ное затемнение
с распадом.
Полиморфная
очаговая дис-
семинация с рас-
падом
Легкой степени
I тяжести
Нехарактерна
3.3. Туберкулез внутригрудных лимфатических узлов
69
Таким образом, клинические проявления ТБ у больных
ВИЧ-инфекцией в большей степени зависят от степени утраты иммун-
ного ответа. На фоне ВИЧ-ассоциированной иммуносупрессии с боль-
шой вероятностью о туберкулезной этиологии заболевания следует
думать при лихорадке, ночной повышенной потливости, сухом кашле,
снижении массы тела, поражении ПЛУ шеи, поднижнечелюстных, над-
и подключичных, а также подмышечных областей.
К основным клиническим формам ТБ органов дыхания на фоне
ВИЧ-ассоциированной иммуносупрессии относят:
• ТБ ВГЛУ;
• туберкулезный плеврит/эмпиема;
• острый милиарный ТБ;
• острейший туберкулезный сепсис.
Остальные формы ТБ органов дыхания, согласно клинической
классификации (очаговый, инфильтративный, диссеминированный
ТБ, туберкулема, кавернозный, фиброзно-кавернозный, цирротиче-
ский ТБ), встречаются у ВИЧ-инфицированных, чаще в субклиниче-
ской стадии ВИЧ-инфекции, при этом их проявления не отличаются
от ТБ больных с ВИЧ-негативным статусом.
3.3. ТУБЕРКУЛЕЗ ВНУТРИГРУДНЫХ ЛИМФАТИЧЕСКИХ УЗЛОВ
ТБ ВГЛУ (ТБ ВГЛУ, бронхоадениты) — специфическое заболевание
лимфатических узлов корней легких и средостения, преимущественно
форма первичного ТБ. Однако на фоне ВИЧ-ассоциированной имму-
носупрессии нередко происходит реактивация ранее зажившей эндо-
генной инфекции во ВГЛУ, и в таких случаях развитие ТБ патогенети-
чески относится к вторичному ТБ, а по клинико-рентгенологическим
проявлениям напоминает первичный.
По своему анатомическому строению лимфожелезистая система легко-
го регионарна к лимфососудистой системе легкого, а лимфатические узлы
корня являются коллекторами, в которых собирается лимфа. При раз-
витии ТБ в легком лимфатические узлы корня легкого реагируют на него
воспалительным процессом. Вместе с тем у больных ВИЧ-инфекцией
в большинстве случаев первоначально возникает специфическое воспа-
ление в лимфатических узлах средостения и корня легкого, а поражение
бронхов и легких происходит вторично, как осложнение.
По распространенности и характеру изменений в лимфатических узлах
бронхоадениты делятся на малые, инфильтративные и туморозные. Если
70 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
Рис. 3.4. Обзорная рентгенограмма больного С, 34 года (ВИЧ-инфекция, количество
С04+-лимфоцитов —123 клетки/мкл). Инфильтративный бронхоаденит
размеры лимфатических узлов увеличены незначительно (диаметром
не более 10-15 мм) и поражаются 1—2 группы, то процесс протека-
ет по типу малого бронхоаденита. При наличии вокруг увеличенных
лимфатических узлов выраженной зоны перифокального воспаления
бронхоаденит называется инфильтративным (рис. 3.4).
Туморозный, или опухолевидный, бронхоаденит представляет собой
тотальный казеоз лимфатических узлов со значительным их увеличени-
ем и слабым перифокальным воспалением (рис. 3.5). Особенностью
туберкулезного поражения ВГЛУ у ВИЧ-инфицированных является
одинаково частое поражение всех групп лимфатических узлов средо-
стения (бронхопульмональные, бифуркационные, трахеобронхиаль-
ные, паратрахеальные, парааортальные), в то время как при первичном
ТБ у людей с ВИЧ-негативным статусом наиболее характерно воспа-
ление бронхопульмональной группы. Нередко в специфический про-
цесс бывают вовлечены одновременно все ВГЛУ с формированием так
называемой аденофлегмоны средостения. Часто туберкулезное пора-
жение затрагивает лимфатические узлы преимущественно верхнего
средостения (паратрахеальной группы), при этом рентгенологическая
картина характеризуется синдромом «дымовой трубы» и напоминает
скиалогическую картину при лимфогранулематозе (рис. 3.6).
3.3. Туберкулез внутригрудных лимфатических узлов
71
Рис. 3.5. Обзорная рентгенограмма больной А., 26 лет (ВИЧ-инфекция, количество CD4+-
лимфоцитов — 56 кл/мкл). Туморозный туберкулез внутригрудных лимфатических
узлов справа
Рис. 3.6. Обзорная рентгенограмма больного А., 28 лет (ВИЧ-инфекция, количество CD4+-
лимфоцитов — 106 кл/мкл). Туморозный туберкулез внутригрудных лимфатических
узлов справа (паратрахеальная группа справа)
Нормальные лимфатические узлы имеют небольшие размеры
(3-7 мм, максимально — до 10 мм) и рентгенологически не опреде-
ляются. Только значительно увеличенные или обызвествленные лим-
фатические узлы хорошо видны на обзорной рентгенограмме ОГК.
Линейная томофафия средостения через бифуркацию дает больше
72 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
информации, чем обзорная рентгенография. Тем не менее на обычных
томограммах не всегда удается обнаружить увеличенные лимфатиче-
ские узлы. Наиболее точную информацию о топике, объеме и характере
поражения ВГЛУ дает КТ ОГК.
С учетом рентгенологической картины определяются фазы процесса:
инфильтрации (размытость наружных контуров), рассасывания (посте-
пенное уменьшение тени при обследовании в динамике), уплотнения
(повышение интенсивности тени и четкость контуров), кальцинации
(очень высокая интенсивность тени и выраженная четкость контуров).
Клинические проявления ТБ ВГЛУ у больных ВИЧ-инфекцией в зна-
чительной степени определяются объемом специфического поражения
и наличием осложнений. Туберкулезный бронхоаденит, как правило,
начинается с интоксикации с присущими ей клиническими симпто-
мами: фебрильной и высокой температурой тела, ухудшением общего
состояния, снижением аппетита, потерей массы тела. Иногда отмечаются
повышенная потливость, плохой сон. При прогрессировании появляется
респираторная симптоматика: сухой, приступообразный, надсадный,
щекочущий кашель. Он вызывается раздражением слизистой оболочки
бронхов в результате их сдавления увеличенными в объеме лимфатиче-
скими узлами, содержащими казеозные массы, или появляется вслед-
ствие формирования аденобронхиального свища. В результате пораже-
ния нервных сплетений, находящихся в зоне туберкулезных изменений,
может возникнуть бронхоспазм, имитирующий приступ бронхиальной
астмы. При значительном объеме поражения ВГЛУ и легочной ткани
присоединяется одышка, однако тахипноэ редко превышает 30 в минуту.
Рентгенологические проявления бронхоаденита
Малый бронхоаденит. Рентгенологические изменения незначи-
тельные. При раннем выявлении отмечаются деформация легочного
рисунка в прикорневой зоне, некоторое расширение и незначительная
инфильтрация корня легкого. Изменения не всегда видны на рентгено-
грамме. Необходимы томограммы в прямой и боковой проекциях, наи-
более информативна КТ ОГК. Малый бронхоаденит без лечения про-
грессирует с переходом в инфильтративную или туморозную форму.
Инфильтративный бронхоаденит. Характеризуется более выражен-
ной рентгенологической семиотикой: увеличением корней легких
с размытыми контурами.
Туморозная форма. Рентгенологически при туморозных бронхо-
аденитах тень корня легкого бывает более интенсивной, чем при
инфильтративных. При обширном поражении бронхопульмональных
3.3. Туберкулез внутригрудных лимфатических узлов
73
групп лимфатических узлов ширина тени корня легкого достигает зна-
чительной величины. Наружные контуры корня — четкие, волнистые
или полициклические.
Деление ТБ ВГЛУ на малые, инфильтративные и туморозные фор-
мы условно. Это последовательные периоды одного процесса.
Обнаружение МБТ при ТБ ВГЛУ. При изолированном туберкулез-
ном поражении ВГЛУ вероятность выявления МБТ в мокроте невысо-
ка (до 20%). При осложненном течении ТБ ВГЛУ возможность обна-
ружить возбудителя значительно повышается, особенно при наличии
аденобронхиальных свищей (до 75%). Существенно большую инфор-
мативность, по сравнению с исследованием мокроты, имеет щеточ-
ная биопсия со стенок пораженного бронха при фибробронхоскопии
и исследование бронхоальвеолярного лаважа (БАЛ).
В большинстве случаев ТБ ВГЛУ у ВИЧ-инфицированных приоб-
ретает осложненное течение. Наиболее частым осложнением являет-
ся распространение процесса по лимфатическим узлам средостения
с последующим переходом на стенки бронхов. К основным специфиче-
ским осложнениям ТБ ВГЛУ относятся:
• ТБ бронхов;
• долевые или сегментарные бронхолегочные поражения, ателектаз;
• лимфогематогенная диссеминация.
Туберкулез бронхов
Близкое анатомическое расположение лимфатических узлов к круп-
ным бронхиальным стволам создает благоприятные условия для
контактного перехода процесса на долевые и сегментарные бронхи.
Воспалительный процесс чаще распространяется с капсулы лимфати-
ческого узла на перибронхиальную легочную ткань, затем на стенку
самого бронха с последующим выходом грануляций в его просвет.
Иногда трахеобронхиальный ТБ развивается вследствие спутогенного
или интраканикулярного проникновения туберкулезной инфекции
из легких, значительно реже — гематогенным путем. Иногда бронхи
сами по себе могут быть источником последующего бронхогенного рас-
пространения инфекции. Так образуется порочный круг, где следствие
превращается в причину.
Классификация туберкулеза бронхов
• Активный ТБ бронхов:
- локальный туберкулезный эндобронхит;
- инфильтративный ТБ бронхов;
74 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
— язвенный ТБ бронхов;
— язвенно-свищевой, бронхофистульный (ТБ легких — бронхо-
литиаз).
• Неактивный ТБ бронхов:
— концентрический рубцовый стеноз;
— пристеночный рубцовый стеноз.
Стеноз бронха может быть истинным (рубцовым) или функцио-
нальным (при воспалении).
Эндоскопическая картина инфильтративного ТБ бронхов харак-
теризуется ограниченным округлым или полуовальным невысоким
инфильтратом с достаточно четкими контурами. При прогрессиро-
вании воспаления инфильтрат распадается, в центре образуется язва,
края ее обычно неровные, рыхлые, подрытые, дно гладкое либо покры-
то фибрином, слизистая оболочка вокруг отечна, гиперемирована —
так формируется язвенный ТБ бронхов (рис. 3.7, см. цветную вклейку).
В дальнейшем появляются грануляции, исходящие из дна язвы. Они
напоминают множественные, небольшие, легкокровоточащие полипы.
У больных ВИЧ-инфекцией нередко встречается язвенно-свищевая
форма ТБ как осложнение туморозного бронхоаденита. Изначально
определяется выбухающий инфильтрат (по типу фурункула), а со вре-
менем формируется кратерообразный свищ.
Рубцовые стенозы являются исходом тяжелых поражений ТБ брон-
хов и формируются, если воспалительный процесс глубоко проникает
в стенку бронха с поражением хряща. Бронх деформируется, а сли-
зистая оболочка его остается неизмененной (отсутствуют признаки
активного воспаления).
Наиболее часто изменения обнаруживают в области бифуркации
трахеи в устьях главных, долевых и сегментарных бронхов. В целом
для туберкулезного поражения бронхов характерны ограниченность
поражения, утолщение, гиперемия, кровоточивость слизистой оболоч-
ки. Однако у больных ВИЧ-инфекцией встречается распространенное
поражение бронхиального дерева с переходом туберкулезного воспале-
ния на верхнюю треть трахеи (рис. 3.8, см. цветную вклейку).
Клинические симптомы таких поражений разнообразны. Кашель
служит основным показателем поражения бронхов. Характер и степень
кашля зависят от массивности казеозного поражения лимфатических
узлов, их топографии, морфологических особенностей поражения
бронхов. Кашель бывает сухим, незначительным или сильным, над-
садным, в ряде случаев битональным или коклюшеподобным, иногда
с выделением скудной вязкой мокроты. При значительном сдавлении
3.3. Туберкулез внутригрудных лимфатических узлов
75
бронхов извне увеличенными лимфатическими узлами могут появ-
ляться экспираторный стридор или свистящий выдох с картиной,
напоминающей приступ бронхиальной астмы. Иногда наблюдаются
боли за грудиной. При физикальном обследовании можно обнаружить
участок стойких, строго локализованных сухих хрипов, иногда свистя-
щих, в ряде случаев с характерным писком в момент кашля.
Нередко ТБ бронхов протекает без респираторной симптоматики
и выявляется только бронхоскопически.
При поражении бронхов практически всегда удается обнаружить
МБТ в мокроте.
Лечение и исходы. Назначают стартовый режим ПТТ с последующей
коррекцией согласно спектру лекарственной чувствительности МБТ,
по показаниям — APT. Для эффективного лечения ТБ бронхов необ-
ходимо, помимо общей адекватно подобранной схемы ПТТ, местное
введение ПТП, бронхолитиков, рассасывающих средств (эндобронхи-
альные заливки, лечебные бронхоскопии). Без местного лечения фор-
мируются рубцовые изменения с нарушением проходимости бронхов
вплоть до стеноза, а иногда процесс трансформируется в хронический
с образованием длительно незаживающих аденобронхиальных свищей.
Долевые, сегментарные бронхолегочные поражения и ателектаз
Долевые, сегментарные бронхолегочные поражения и ателектаз
являются следствием нарушения проходимости бронхов. Нарушения
бронхиальной проходимости подразделяются на компрессионные —
при сдавлении бронха извне увеличенными лимфатическими узлами,
и обтурационные — когда бронх закупорен изнутри за счет туберку-
лезного процесса в бронхе, сопровождающегося инфильтрацией сли-
зистой оболочки, развитием грануляций, иногда Рубцовых изменений.
Выделяют 3 степени нарушения бронхиальной проходимости:
• I — возникает при закрытии просвета бронха на 1/3 его диаметра,
развивается гиповентиляция участка легочной ткани (сегмента,
доли);
• II — развивается при закрытии просвета на 2/3. При вдохе воздух
попадает в легкое, при выдохе не выходит из данного участка —
создаются условия для острого вздутия легочной ткани (вентиль-
ной, или обтурационной, эмфиземы);
• III — полное закрытие просвета бронха, возникает ателектаз.
В участках ателектаза и окружающей легочной ткани практически
всегда развиваются очаги специфического туберкулезного воспаления,
которые являются результатом лимфо- и бронхогенного обсеменения.
76 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
Поражение бронха с нарушением его проходимости и развитием ате-
лектаза в сочетании с воспалительными изменениями (специфически-
ми, иногда неспецифическими) называется долевым, или сегментарным,
бронхолегочным поражением. Иногда воспалительный процесс в зо-
не ателектаза подвергается распаду, при этом формируется каверна.
Клинико-рентгенологическая картина ателектаза зависит от калибра
пораженного бронха и ряда других условий. Ателектаз при ТБ у боль-
ных ВИЧ-инфекцией может развиваться остро или постепенно. При
прорыве казеозного лимфатического узла в главный или долевой бронх
(что бывает редко) картина может быть аналогичной попаданию в бронх
инородного тела. В этих случаях развивается синдром острой дыхатель-
ной недостаточности. При постепенном возникновении ателектати-
ческих изменений клиническая картина нерезко выражена, и процесс
в ряде случаев выявляется только при рентгенологическом исследова-
нии. Нередко первыми клиническими проявлениями бывают высокая
температура тела (как симптом общей туберкулезной интоксикации),
боли в грудной клетке, упорный сухой кашель. При осмотре больного
иногда пораженная сторона отстает при дыхании. При перкуссии выяв-
ляют приглушение легочного звука, коробочный оттенок перкуторного
тона в окружающих ателектаз отделах легкого и, редко, смещение орга-
нов средостения в сторону поражения. Голосовое дрожание ослаблено,
иногда прослушиваются непостоянные сухие хрипы или крепитация.
При рентгенологическом исследовании затемнение строго ограни-
чено долей или сегментом легкого, вентилируемым пораженным брон-
хом. Затемнение легочной ткани имеет однородный характер, интен-
сивность которого зависит от величины пораженного участка. Если
ателектаз образуется в относительно малоизмененной легочной ткани,
обычно формируется тень треугольной формы, с четкими контурами,
хорошо определяемая в боковой проекции. Если ателектаз развивает-
ся на фоне пневмофиброза, смещение границ происходит атипично,
форма ателектазированного сегмента или доли может быть различной:
веретенообразной, неправильной треугольной, шаровидной и т.д.
Важный диагностический признак — отсутствие просветов бронхов
на фоне затемнения, тогда как тени сосудистых разветвлений могут
быть видны. Окружающая легочная ткань эмфизематозна. Объемные
изменения здоровой легочной ткани и органов средостения у взрослых
регистрируются нечасто. Иногда средостение смещается в сторону
ателектаза, а диафрагма пораженной стороны может быть приподнята.
Особенность бронхолегочного поражения у ВИЧ-инфицированных —
одинаково частое поражение различных сегментов легочной ткани, тогда
3.3. Туберкулез внутригрудных лимфатических узлов
77
как для первичного ТБ у больных с ВИЧ-негативным статусом чаще
в процесс вовлекаются передние (3-й, 4-й, 5-й) сегменты. Бронхоскопия
дает возможность выявить нарушение проходимости бронха и опреде-
лить его причину (рис. 3.9, 3.10; рис. 3.11, см. цветную вклейку).
В мокроте, мазке со слизистой оболочки бронха, промывных водах
бронхов часто выявляются МБТ.
Рис. 3.9. Обзорная рентгенограмма органов грудной клетки больного Т., 37 лет (ВИЧ-
инфекция, количество С04+-лимфоцитов — 8 кл/мкл). Туберкулез внутригрудных
лимфатических узлов, осложненный бронхолегочным поражением верхней доли
левого легкого
Рис. 3.10. Срез компьютерной томографии органов грудной клетки через бифуркацию
того же больного. Туберкулез внутригрудных лимфатических узлов, осложненный
бронхолегочным поражением верхней доли левого легкого
78 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
Лечение и исходы. Назначают стартовый режим ПТТ с последующей
коррекцией согласно спектру лекарственной чувствительности МБТ,
позже (если пациент не получал APT до развития ТБ) согласно реко-
мендациям присоединяют APT. Наряду с общим лечением осущест-
вляют введение ПТП, бронхолитиков в бронх в виде заливок, лечебных
бронхоскопий. При своевременном начале лечения наступает полное
и довольно быстрое разрешение ателектаза. Длительно существую-
щие (>1—2 мес), поздно распознанные воспалительно-ателектатиче-
ские сегментарные поражения заканчиваются образованием фиброза,
пневмосклероза, бронхоэктазов.
Лимфогематогенная и бронхогенная диссеминация
У больных ВИЧ-инфекцией ТБ ВГЛУ нередко осложняется дис-
семинацией. Казеозно-измененные лимфатические узлы средостения
блокируют движение лимфы, в результате чего наступает лимфостаз,
а затем ретроградно уже инфицированная МБТ лимфа оттекает в при-
корневую легочную ткань, формируя в легочном интерстиции по ходу
лимфатических сосудов специфическое воспаление (лимфангоит), —
так развивается лимфогенная диссеминация. Рентгенологически опре-
деляются признаки одно- или двустороннего аденита (расширенное
средостение и неструктурный корень), а также избыточность и дефор-
мация сосудистого рисунка преимущественно в прикорневой области
с угасанием к периферии, появление линейно-тяжистых теней (скиа-
логический синдром бабочки) (рис. 3.12).
Рис. 3.12. Обзорная рентгенограмма органов грудной клетки больного В., 42 года (ВИЧ-
инфекция, количество С04+-лимфоцитов — 13 кл/мкл). Туберкулез внутригрудных
лимфатических узлов, осложненный лимфогенной диссеминацией, синдром бабочки
3.3. Туберкулез внутригрудных лимфатических узлов
79
Рис. 3.13. Обзорная рентгенограмма органов грудной клетки больной Р., 29 лет
(ВИЧ-инфекция, количество С04+-лимфоцитов — 134 клетки/мкл). Туберкулез
внутригрудных лимфатических узлов, осложненный лимфогенно-милиарной
диссеминацией и плевритом слева
Нередко одновременно с лимфогенной диссеминацией проис-
ходит гематогенное распространение МБТ. При этом пораженные
ВГЛУ являются вторичным источником гематогенной генерализации.
Рентгенологически на фоне усиленного и деформированного легоч-
ного рисунка по ходу сосудов обнаруживаются мелкоочаговые тени
(рис. 3.13). Возможно также бронхогенное распространение инфекции
при поражении бронха или наличии свища.
Участи больных ВИЧ-инфекцией, особенно при глубоком иммуно-
дефиците (С04+-лимфоцитов — менее 100 кл/мкл), ТБ ВГЛУ сопрово-
ждается одновременно несколькими специфическими осложнениями
(лимфогематогенной диссеминацией, ТБ бронхов, аденобронхиальны-
ми свищами, бронхолегочным поражением) (рис. 3.14).
Дифференциальная диагностика. У больных ВИЧ-инфекцией изоли-
рованный ТБ ВГЛУ необходимо дифференцировать от таких же забо-
леваний, как и у пациентов без ВИЧ-инфекции, сопровождающихся
внутригрудной аденопатией. Наиболее распространенные из них:
• саркоидоз;
• медиастинальный рак;
• лимфогранулематоз;
• НХЛ;
• лимфолейкоз.
80 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
Рис. 3.14. Обзорная рентгенограмма органов грудной клетки больной Ж., 37 лет (ВИЧ-
инфекция, количество С04+-лимфоцитов — 46 кл/мкл). Туберкулез внутригрудных
лимфатических узлов, осложненный диссеминацией и аденомедиастиноперикар-
диальным свищом с развитием пневмоперикарда
Однако у ВИЧ-инфицированных достоверно чаще встречаются
лимфогранулематоз и НХЛ, чем в популяции в целом, а саркоидоз,
наоборот, реже.
Обследование пациента с ВИЧ-инфекцией и рентгенологическим
синдромом внутригрудной лимфаденопатии должно обязательно вклю-
чать:
• исследование мокроты на МВТ [микроскопия, посев, полимераз-
ная цепная реакция (ПЦР)], грибы, неспецифическую микрофло-
ру, опухолевые клетки;
• фибробронхоскопию со щеточной и по показаниям щипцовой
или чрезбронхиальной биопсией;
• исследование БАЛ на МВТ (микроскопия, посев, ПЦР), грибы,
неспецифическую микрофлору, опухолевые клетки;
• КТ ОГК для топического диагноза анатомического поражения
и характера изменений во ВГЛУ.
При неинформативности этого обследования (отсутствии достовер-
ных признаков в пользу этиологического диагноза) показано проведе-
ние медиастиноскопии в целях морфологической верификации диа-
гноза. При отказе больного от хирургической диагностики назначают
ПТТ exjuvantibus. Врач ориентируется на клинический эффект (купи-
рование лихорадки, кашля). При отсутствии клинического эффекта
в течение 2—3 нед проводят медиастиноскопию.
Маннановые
гликопротеиды
Миколовые
кислоты
Липоманнан
Арабиногликан
Пептидогликан
PIM
Клеточная
мембрана
Порины
Рис. 1.1. Структура клеточной стенки микобактерий туберкулеза
Незрелая
CD4+T
Антиген
АПК
TCR
МНСН
Зрелая клетка Т-хелпер
(Th1 или Th2)
Незрелая
CD8+T
Антиген
АПК
TCR
MHCI
CD84
Зрелая цитотоксическая клетка
(Тс)
АПК-антиген презентирующая клетка
Рис. 1.4. Формирование зрелых CD8+ и С04+-Т-лимфоцитов
Рис. 3.7. Бронхоскопическая картина больной Ш., 28 лет (ВИЧ-инфекция, количество
С04+-лимфоцитов — 118 кл/мкл). Инфильтративно-язвенный туберкулез нижнедоле-
вого бронха слева (снимок любезно предоставлен врачами эндоскопического отделе-
ния клиники № 2 Московского научно-практического центра борьбы с туберкулезом)
Рис. 3.8. Бронхоскопическая картина больного С, 35 лет. Язвенный туберкулез трахеи
(снимок любезно предоставлен врачами эндоскопического отделения клиники № 2
Московского научно-практического центра борьбы с туберкулезом)
Рис. 3.11. Бронхоскопическая картина больного С, 35 лет. Инфильтративно-язвенный
туберкулез верхнедолевого бронха слева (снимок любезно предоставлен врачами
эндоскопического отделения клиники № 2 Московского научно-практического центра
борьбы с туберкулезом)
Рис. 4.1. Туберкулез периферического лимфатического узла шеи справа с признаками
абсцедирования
Рис. 4.2. Хронически текущий туберкулез периферических лимфатических узлов шеи,
свищевая форма
Рис. 4.3. Больной 0., 48 лет: туберкулез периферического лимфатического узла шеи
справа (количество С04+-лимфоцитов — 53 клетки/мкл)
Рис. 4.8. Бугорковый туберкулез брюшины (интраоперационный снимок любезно
предоставлен врачами хирургического отделения клиники № 2 Московского научно-
практического центра борьбы с туберкулезом)
Рис. 4.9. Казеозно-язвенный туберкулез брюшины (интраоперационный снимок
любезно предоставлен врачами хирургического отделения клиники № 2 Московского
научно-практического центра борьбы с туберкулезом)
а
Рис. 4.17. а — разрушение тел грудных позвонков; б — спондилодез имплантатом
(интраоперационные снимки любезно предоставлены врачами Санкт-Петербургского
научно-исследовательского института фтизиовертебрологии)
Рис. 4.18. Милиарный туберкулез почек (макропрепарат) (снимок любезно предоставлен
врачом-патологоанатомом клиники № 2 Московского научно-практического центра
борьбы с туберкулезом Ю.Р. Зюзей)
Рис. 4.19. Туберкулез яичка, свищевая форма. Больной П., 37 лет (ВИЧ-инфекция,
количество С04+-лимфоцитов — 109 кл/мкл) (снимок любезно предоставлен врачами
урологического отделения клиники № 2 Московского научно-практического центра
борьбы с туберкулезом)
Рис. 5.1. Туберкулез подмышечного лимфатического узла (тотальная казеозная
трансформация ткани лимфатического узла) (снимок любезно предоставлен врачами
хирургического отделения клиники № 2 Московского научно-практического центра
борьбы с туберкулезом)
Рис. 5.2. Туберкулезный менингит с поражением конвекситальной поверхности
полушарий головного мозга (макропрепарат) (снимок любезно предоставлен врачом-
патологоанатомом клиники № 2 Московского научно-практического центра борьбы
с туберкулезом Ю.Р. Зюзей)
Рис. 5.3. Туберкулезный менингит, базилярная форма (макропрепарат) (снимок
любезно предоставлен врачом-патологоанатомом клиники № 2 Московского научно-
практического центра борьбы с туберкулезом Ю.Р. Зюзей)
Рис. 5.4. Милиарный туберкулез селезенки (макропрепарат) (снимок любезно
предоставлен врачом-патологоанатомом клиники № 2 Московского научно-
практического центра борьбы с туберкулезом Ю.Р. Зюзей)
Рис. 5.5. Туберкулезный гранулематозный лимфаденит у больного с ВИЧ-негативным
статусом (микропрепарат, окраска гематоксилин-эозином, хЮО)
Рис. 5.6. Туберкулезный казеозный лимфаденит без признаков продуктивной
реакции по периферии некротических очагов у больного ВИЧ-инфекцией (окраска
гематоксилин-эозином, хЮО)
Рис. 5.7. Обилие кислотоустойчивых бактерий в некротических массах (окраска
по Цилю-Нильсену, хЮОО, иммерс.)
Рис. 5.8. Иммуногистохимическое исследование с Мус. tuberculosis mouse monoclonal
antibody (clone 1.1/3/1, Vector, хЮОО, иммерс.)
3.4. Туберкулезный плеврит/эмпиема
81
При осложненном течении ТБ ВГЛУ (ТБ бронхов, бронхолегочное
поражение) дифференциальную диагностику проводят с центральным
раком и неспецифической бактериальной пневмонией. Обязательно
проводят фибробронхоскопию с биопсией пораженного бронха.
Диагностику облегчает частое обнаружение МБТ в мокроте/БАЛ.
Лечение и исходы. Назначают стартовый режим ПТТ с последую-
щей коррекцией согласно спектру лекарственной чувствительности
МБТ, позже (если пациент не получал APT до развития ТБ) согласно
рекомендациям присоединяют APT. Проводят адекватную дезинток-
сикационную и симптоматическую терапию. При лимфогематогенной
диссеминации увеличивается вероятность полиорганного поражения
и, как следствие, летального исхода (до 20%). При эффективной ком-
бинированной противотуберкулезной и APT происходят значительное
рассасывание диссеминации, уменьшение воспаления и уплотнение
во ВГЛУ. При излечении остаются умеренно выраженный прикорне-
вой фиброз и частичное обызвествление ВГЛУ.
3.4. ТУБЕРКУЛЕЗНЫЙ ПЛЕВРИТ/ЭМПИЕМА
Туберкулезный процесс у больных ВИЧ-инфекцией при прогресси-
ровании иммунодефицита характеризуется склонностью к поражению
серозных оболочек.
Туберкулезный плеврит/эмпиема представляет собой воспаление
плевры, вызванное МБТ. Экссудативно-воспалительная реакция плев-
ры связана с повышенной проницаемостью кровеносных и лимфа-
тических капилляров кортикального слоя легких и самой плевры,
пропускающих жидкую часть крови в межтканевые щели, поверх-
ностные слои плевры и оттуда, вследствие отрицательного давления,
в плевральную щель. Вовлечение плевры в различные патологические
процессы обусловлено тесными анатомо-топографическими связя-
ми висцеральной и париетальной плевры с легочной тканью, ВГЛУ.
Плевра, обладая барьерной функцией, реагирует на разнообразные
патофизиологические сдвиги в организме, в результате чего в ней раз-
виваются воспалительные или аллергические процессы. Туберкулезное
воспаление плевры чаще развивается в результате лимфогематогенного
распространения инфекции из пораженных ВГЛУ с формированием
на листках плевры множественных мелких или немногочисленных
крупных очагов с элементами казеозного некроза. Иногда казеоз-
но-некротические изменения распространяются на плевру по контакту
82 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
с пораженной легочной тканью. Плевральный экссудат может быть
серозным, геморрагическим или гнойным (эмпиема плевры).
Плеврит может быть как осложнением локальных форм ТБ орга-
нов дыхания, так и самостоятельной его клинической формой.
Туберкулезное поражение плевры сопровождает течение специфиче-
ского процесса у 30—40% больных ВИЧ-инфекцией.
Экссудативный плеврит у ВИЧ-инфицированных характеризуется
острым прогрессированием, злокачественным течением с длительным
накоплением экссудата при пункционном ведении в сравнении с паци-
ентами без ВИЧ-инфекции. Замедленная динамика рассасывания
плеврального выпота на фоне ВИЧ-ассоциированной иммуносупрес-
сии, вероятно, связана с морфологическими особенностями воспале-
ния у этой категории больных. В данной ситуации склонность к пре-
валированию экссудативной реакции над продуктивной не позволяет
формировать слипчивое фибринозное воспаление между плевраль-
ными листками, посредством которого формируется фиброторакс,
что обеспечивает благоприятный исход при туберкулезном плеврите.
При этом, несмотря на длительный период сохраняющегося выпота
в плевральной полости, в результате его резорбции не формируется
массивный плевральный фиброз со значительным утолщением плев-
ральных листков, который проявляется выраженными плевральными
наслоениями при рентгенологическом исследовании.
Различают две основные формы плеврита: сухой, или фибриноз-
ный {pleuritis seicca,fibrinosa), и выпотной, или экссудативный (pleuritis
exsudative).
Клиническая картина сухого плеврита характеризуется синдромом
интоксикации и сильными болями в грудной клетке, усиливающи-
мися при глубоком дыхании. Определяется уменьшение дыхательной
подвижности пораженной стороны грудной клетки, прослушивается
шум трения плевры. Рентгенологически изменения, как правило,
не выявляются. Любой экссудативный плеврит проходит стадию сухо-
го, однако не любой сухой переходит в экссудативный. У больных
ВИЧ-инфекцией клинические проявления сухого плеврита практиче-
ски всегда предшествуют выпотному.
Клиническая картина экссудативного плеврита. Начало заболевания
бывает острым (в 2/3 случаев) или постепенным (1/3). Ведущие кли-
нические симптомы: лихорадка до 39-40 °С, боли в боку, одышка.
Болевой синдром часто возникает задолго до появления выпота. Боли,
иногда в сочетании со стертым синдромом интоксикации, отмечаются
ЗА. Туберкулезный плеврит/эмпиема
83
Рис. 3.15. Обзорная рентгенограмма органов грудной клетки больного И., 28 лет
(ВИЧ-инфекция, количество СР4+-лимфоцитов — 293 клетки/мкл). Туберкулезный
экссудативный плеврит справа. Определяются рентгенологические признаки
свободного костно-диафрагмального выпота
нередко за 2-3 нед до острых клинических проявлений (продромаль-
ный период), что с большой достоверностью свидетельствует в поль-
зу ТБ при дифференциальной диагностике с парапневмоническими
плевритами. Могут наблюдаться сухой кашель, одышка, выраженность
которой зависит от объема выпота. Физикально и рентгенологически
определяются классические признаки свободного костно-диафраг-
мального выпота (рис. 3.15).
Иногда развивается осумкованный плеврит, имеющий разно-
образную рентгенологическую картину. В зависимости от локализа-
ции выделяют междолевой, медиастинальный, паракостальный, верху-
шечный, наддиафрагмальный осумкованный плеврит (рис. 3.16, 3.17).
Диагностика. Диагностика туберкулезного плеврита бывает затруд-
нена, особенно у больных ВИЧ-инфекцией, когда рентгенологические
изменения в легких носят нетипичный характер. По данным ряда авто-
ров, ошибки в диагностике этиологии плевритов и длительные сроки
распознавания ТБ, даже у пациентов без ВИЧ-инфекции, отмечаются
в 30-40% случаев.
Ультразвуковое исследование плевральной полости позволяет выя-
вить минимальное количество жидкости (свободной или осумкован-
ной), а также определить утолщение плевры и эхогенный характер
экссудата. Клиническая картина туберкулезного поражения плевры
84 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
Рис. 3.16. Осумкованный плеврит в зависимости от локализации выпота в плевраль-
ной полости: а — костно-диафрагмальный; б — диафрагмальный; в — верхушечный;
г — междолевой; д — парамедиастинальный; е — костальный
Рис. 3.17. Обзорная рентгенограмма органов грудной клетки больного Р., 38 лет
(ВИЧ-инфекция, количество С04+-лимфоцитов — 133 клетки/мкл). Туберкулез
внутригрудных лимфатических узлов справа, осложненный лимфогенной диссемина-
цией, осумкованный паракостальный туберкулезный плеврит справа
характеризуется признаками неоднородности эхоструктуры экссудата,
фибриновых перемычек, вакуолизацией выпота, у части больных —
значительным утолщением листков плевры с пристеночными наложе-
ниями фибрина.
Рентгенотомографическое исследование дает возможность выявить
туберкулезное поражение ВГЛУ или легочной ткани, ставшее источ-
ником распространения инфекции на плевру. В сложных случаях
диагностики, особенно для определения топического расположения
3.4. Туберкулезный плеврит/эмпиема
85
осумкованного плеврита, показана КТ ОГК. При отсутствии патологии
в средостении, легких и бронхах плеврит расценивается как самостоя-
тельная клиническая форма ТБ.
При сепарации листков более 15 мм, по данным ультразвукового
исследования, с лечебно-диагностической целью показано выполне-
ние торакоцентеза (плевральной пункции).
Для больных ВИЧ-инфекцией характерно развитие массивного
выпотного (до 3000 мл) серозного или геморрагического экссудативно-
го плеврита, в 10-12% случаев диагностируют туберкулезную эмпиему.
Характеристика экссудата: лимфоцитарный (50%), смешанный лимфо-
цитарно-нейтрофильный (40%), нейтрофильный (10%). Содержание
белка в экссудате — 40-50 г/л, удельный вес — 1020—1025 и более,
проба Ривальта положительная, сахар снижен, уровень аденозиндеза-
миназы выше 43 U/ml, обнаружение МВТ. Нередко в экссудате выяв-
ляют МВТ (в 20—50% случаев методом ПЦР и посевом).
Характеристика туберкулезного экссудата у ВИЧ-инфицированных
схожа с таковой у больных без ВИЧ-инфекции, однако при
ВИЧ-инфекции экссудат чаще имеет смешанный лимфоцитарно-ней-
трофильный характер (без ВИЧ-инфекции в 90% случаев — лимфоци-
тарный), и в нем достоверно чаще выявляют возбудителя.
В определении этиологии плеврита велика роль биопсии плевры.
В современной диагностической практике используют видеоторако-
скопию с биопсией плевры, открытую биопсию плевры, пункционную
игловую биопсию плевры. Выбор метода хирургической диагностики
осуществляют с учетом давности процесса, объема экссудата, наличия
внутриплеврального спаечного процесса, характера и степени организа-
ции выпота. Однако при биопсии плевры не во всех случаях удается выя-
вить специфические гистологические изменения. Неинформативные
гистологические результаты биопсии плевры у ВИЧ-инфицированных
связаны с утратой черт специфической морфологической картины
на поздних стадиях ВИЧ-инфекции. Специфическое воспаление про-
текает с преобладанием гнойно-некротического воспаления без про-
дуктивного компонента, что очень затрудняет диагностику заболева-
ния. Повысить результативность биопсийного исследования позволяет
поэтапная морфологическая диагностика с выявлением возбудителя
в тканях.
Дифференциальная диагностика. Плевральный выпот у больных
ВИЧ-инфекцией может быть обусловлен декомпенсацией сердеч-
но-сосудистой недостаточности при бактериальном эндокардите
или циррозе печени как исхода хронического вирусного гепатита.
86 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
В этих случаях выпот представлен транссудатом и не имеет воспалитель-
ного характера. Диагностика требует проведения торакоцентеза с лабо-
раторным исследованием выпота (белок, удельный вес, проба Ривальта).
Наибольшие трудности возникают при дифференциальной диа-
гностике туберкулезного плеврита с парапневмоническим неспе-
цифическим плевритом при банальной или септической пневмонии
и с метастатическим плевритом.
При диагностике туберкулезного поражения плевры рекомендуют
учитывать прямые и косвенные признаки специфической этиологии
плеврита.
Прямые (абсолютные) признаки ТБ плеврита:
• обнаружение МБТ в экссудате;
• обнаружение казеозного некроза, специфической гранулемы
или возбудителя (МБТ) в биоптате плевры;
• достоверные признаки активного ТБ ВГЛУ, легких, бронхов.
Косвенные признаки:
• указание на контакт с больным ТБ;
• гиперергическая реакция на пробу Манту или диаскинтест, поло-
жительный IGRA-тест;
• постепенное начало заболевания или наличие продромального
периода до появления манифестных клинических проявлений;
• массивный выпот;
• отсутствие патологических изменений в легочной ткани (призна-
ков пневмонии физикально и рентгенологически);
• отсутствие эффекта от неспецифической противовоспалительной
терапии;
• склонность к формированию плевральных сращений, осумкова-
нию жидкости;
• эффект от специфической ПТТ — купирование интоксикацион-
ного синдрома, резорбция выпота.
Следует отметить, что эффект от неспецифической противовос-
палительной терапии не всегда позволяет исключить туберкулезную
этиологию процесса. При гиподиагностике туберкулезного плеврита
практически всегда после периода мнимого благополучия (от несколь-
ких месяцев до 5 лет) развиваются проявления ТБ в виде диссеминации
в легочной ткани или ТБ другой локализации.
Лечение и исходы. После установления диагноза туберкулезного
плеврита/эмпиемы назначают стартовый режим ПТТ с последую-
щей коррекцией согласно спектру лекарственной чувствительности
МБТ, позже (если пациент не получал APT до развития ТБ) согласно
3.5. Острый милиарный туберкулез
87
Рис. 3.18. Обзорная рентгенограмма органов грудной клетки больного С, 31 год (ВИЧ-
инфекция, количество С04+-лимфоцитов — 167 кл/мкл): туберкулезный плеврит слева
рекомендациям присоединяют APT. Наряду с общим лечением осу-
ществляют лечебные пункции плевральной полости с максимальным
удалением экссудата, но не более 1200—1500 мл за одну манипуляцию.
Чем меньше выпота остается после пункций, тем меньше остаточных
изменений сформируется после резорбции выпота. Кратность выпол-
нения плевральных пункций зависит от скорости накопления жидко-
сти (в среднем 2-3 раза в нед). У пациентов с туберкулезной эмпиемой
при отсутствии должного эффекта при пункционном ведении показано
дренирование плевральной полости. Рано начатое специфическое лече-
ние с эвакуацией экссудата приводит к рассасыванию выпота в течение
1,5-3 мес с незначительными остаточными изменениями (рис. 3.18,
3.19). При поздно начатом лечении и без удаления экссудата остаются
большие плевральные наслоения. У небольшой части больных может
сформироваться вялотекущая хроническая эмпиема. В таких случаях
показана операция — декортикация плевры.
3.5. ОСТРЫЙ МИЛИАРНЫЙ ТУБЕРКУЛЕЗ
Острый милиарный ТБ легких был известен клиницистам ранее
всех других форм гематогенного происхождения. Это редкая форма ТБ
у людей с ВИЧ-негативным статусом (не более 0,5% в структуре общей
88 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
Рис. 3.19. Обзорная рентгенограмма органов грудной клетки того же больного:
туберкулезный плеврит слева в фазе рассасывания
заболеваемости ТБ). У больных ВИЧ-инфекцией встречается гораздо
чаще, особенно при выраженной иммуносупрессии. При снижении
СЭ4+-лимфоцитов менее 200 кл/мкл — в 10—15% случаев. Причем чем
глубже иммунодефицит, тем чаще регистрируется милиарный ТБ.
Милиарный ТБ — гематогенная, почти всегда генерализованная
форма ТБ, характеризуемая равномерным, густым высыпанием в лег-
ких и, как правило, в других органах мелких (диаметром 1-2 мм)
очажков, напоминающих просяные зернышки. Отсюда и название,
появившееся в XIX в.: от лат. milium — просо. Для него характерно спе-
цифическое поражение капилляров с образованием в межуточной
ткани множества мелких туберкулезных очажков.
Клиническая картина. Клинические проявления неспецифичны,
разнообразны и зависят от локализации поражения. Острое тече-
ние сопровождается повышением температуры тела до фебрильных
или высоких значений, которая через 4-5 дней принимает вид непра-
вильной температурной кривой с суточными колебаниями в пределах
2—2,5 °С (рис. 3.20). Резко выражены симптомы интоксикации: общая
слабость, потеря аппетита, похудание (более 10% массы тела), про-
фузные поты. Возможны диспепсические расстройства как проявле-
ния общей интоксикации и в результате специфического поражения
кишечника. Появляется сухой кашель, иногда в виде приступов. Резко
выражена одышка (частота дыхательных движений до 25—35 в минуту).
3.5. Острый милиарный туберкулез
89
Рис. 3.20. Температурная кривая больного милиарным туберкулезом в сочетании
с ВИЧ-инфекцией
У больных при осмотре отмечается цианоз губ, кончиков пальцев рук.
Перкуторно обнаруживается легочный, с тимпаническим оттен-
ком звук, аускультативно выслушивается жесткое или ослабленное
дыхание, хрипы отсутствуют. Селезенка и печень немного увеличены.
Отмечаются выраженный лабильный пульс и тахикардия.
Несоответствие между тяжелой одышкой и цианозом, с одной сторо-
ны, и отсутствием объективных изменений в легких (или их бедностью),
с другой стороны, должны вызывать подозрение на милиарный ТБ.
Иммунологические тесты на ТБ обычно ложноотрицательные (отри-
цательная пассивная анергия).
Изменения со стороны крови характеризуются анемией, иногда
умеренным лейкоцитозом (до 12*109/л), небольшим нейтрофиль-
ным сдвигом влево, лимфопенией, повышенной скоростью оседания
эритроцитов (до 50 мм/ч и выше).
Обнаружение МБТ; МБТ в мокроте обнаруживают чаще, чем при
милиарном ТБ у больных с ВИЧ-негативным статусом (микроскопи-
ей — до 30%, посевом методом ПЦР — до 60%).
Рентгенологическая картина. В первые дни и даже недели клиниче-
ские проявления патологии в легких не определяются. Позднее можно
отметить усиление легочного рисунка и добавочные тени воспалитель-
но измененной межуточной ткани. И лишь в среднем через 2—6 нед
после появления лихорадки выявляется тотальная мономорфная,
90 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
Рис. 3.21. Обзорная рентгенограмма органов грудной клетки больного К., 26 лет (ВИЧ-
инфекция, количество С04+-лимфоцитов — 77 кл/мкл). Милиарный туберкулез легких
мелкоочаговая, двусторонняя зеркальная диссеминация с мелкими
очажками. Лучевая картина милиарного ТБ достаточно патогномонич-
на. Очажки однотипны, имеют относительно ясные очертания, не сли-
ваются друг с другом, расположены по ходу легочных сосудов, поража-
ют симметрично оба легких. Глядя на обзорную рентгенографию ОГК,
создается ложное впечатление, что очаги более густо расположены
в средних и нижних отделах по сравнению с верхними вследствие
суммации теней в большем объеме легочной ткани, что не соответ-
ствует морфологическому преобладанию поражения верхних отделов.
Полости распада отсутствуют. Корни легких, как правило, расширены
с одной или обеих сторон за счет увеличенных ВГЛУ, наружные конту-
ры их расплывчаты, структурность понижена (рис. 3.21).
При диагностике милиарного ТБ важно исследование глазного дна,
где в ряде случаев сравнительно рано обнаруживают высыпание тубер-
кулезных бугорков.
При дополнительном обследовании могут быть выявлены внето-
ракальные очаги поражения в почках, печени, селезенке и в других
органах. Помогают их выявлению КТ органов брюшной полости, уль-
тразвуковое исследование, лапароскопия.
Самое грозное осложнение милиарного ТБ — туберкулезный менин-
гоэнцефалит, который может проявляться с начала заболевания или при-
соединиться позднее, в результате прогрессирования заболевания.
3.5. Острый милиарный туберкулез
91
Менингоэнцефалит сопровождается сильными головными болями,
рвотой и очаговой симптоматикой поражения ЦНС.
Дифференциальная диагностика. У больных ВИЧ-инфекцией мили-
арный ТБ прежде всего необходимо дифференцировать от ПЦП, для
которой также характерны выраженная интоксикация, одышка, неред-
ко двустороннее поражение легких. Однако клинические проявления
ПЦП развиваются постепенно, и в разгар заболевания лидирующим
клиническим симптомом является одышка (частота дыхательных движе-
ний более 40 в минуту); при аускультации выслушивается крепитация.
Рентгенологическая картина характеризуется нежными инфильтратив-
но-фокусными затемнениями, в далеко зашедших случаях бывает субто-
тальное поражение обоих легких, как раз напоминающее густую мили-
арную туберкулезную диссеминацию (рис. 3.22, 3.23). Отличительная
скиалогическая особенность милиарного ТБ — густо расположенные,
но все же отдельные, ясно очерченные очажки. При подозрении на ПЦП
показано эмпирическое назначение ко-тримоксазола в лечебной дозе.
Положительная клинико-рентгенологическая динамика является основ-
ным дифференциально-диагностическим критерием.
Лечение и исходы. При раннем выявлении милиарного ТБ и свое-
временном начале специфической ПТТ с присоединением APT у боль-
шинства больных достигается благоприятный исход заболевания даже
Рис. 3.22. Обзорная рентгенограмма органов грудной клетки больной К., 28 лет
(ВИЧ-инфекция, количество С04+-лимфоцитов — 24 клетки/мкл). Пневмоцистная
пневмония. Беременность —14 нед
92 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
Рис. 3.23. Обзорная рентгенограмма той же пациентки через 3 нед лечения ко-тримоксазо-
лом. Пневмоцистная пневмония в фазе рассасывания. Беременность —17 нед
при тотальной генерализации (рис. 3.24, 3.25). Без лечения или при
позднем его начале процесс, как правило, заканчивается леталь-
ным исходом. Непосредственной причиной летального исхода в боль-
шинстве случаев бывает присоединение туберкулезного менинго-
энцефалита. Следовательно, исход острого милиарного ТБ зависит
от своевременности диагностики процесса, что накладывает большую
ответственность на врача.
Рис. 3.24. Обзорная рентгенограмма органов грудной клетки больной К., 21 год
(ВИЧ-инфекция, количество С04+-лимфоцитов — 218 кл/мкл). Милиарный туберкулез
легких
3.6. Острейший туберкулезный сепсис
93
Рис. 3.25. Обзорная рентгенограмма органов грудной клетки той же пациентки. Милиар-
ный туберкулез легких в фазе полного рассасывания через 12 мес, противотуберкулез-
ная терапия
3.6. ОСТРЕЙШИЙ ТУБЕРКУЛЕЗНЫЙ СЕПСИС
Острейший туберкулезный сепсис (тифобациллез Ландузи, мико-
бактериальная безбугорковая септицемия, sepsis tuberculosa acutissima).
Туберкулезный сепсис описал в конце ХЕХ в. французский врач L. Th.
J. Landouzy (1845-1917). Автор отмечал возможность его развития только
при состоянии ареактивности макроорганизма, чаще на фоне алиментарной
дистрофии. До открытия ВИЧ-инфекции туберкулезный сепсис встречался
крайне редко. К 1953 г. в литературе был описан всего 81 случай подобного
состояния, а после массовой вакцинации БЦЖ — стал казуистикой.
Туберкулезный сепсис — исторический термин, не в полной мере
отражающий современное представление о сепсисе. Это всегда генера-
лизованная форма ТБ, с массивной бактериемией и наличием в органах
и тканях множественных мельчайших участков казеоза без грануляци-
онного вала. По своей патогенетической сущности острейший туберку-
лезный сепсис является более тяжелой формой мил парного ТБ.
Острейший туберкулезный сепсис приобретает все большую клини-
ческую значимость по мере распространения эпидемии ВИЧ-инфекции.
При глубоком иммунодефиците (С04+-лимфоцитов — менее 50 кл/мкл)
у 20-30% больных ТБ в сочетании с ВИЧ-инфекцией развивается
тифобациллез Ландузи.
Клиническая картина. Туберкулезный сепсис начинается остро: с вы-
сокой температуры тела, общей слабости до адинамии, сопровожда-
ется прогрессивным похудением, диспепсическими расстройствами.
94 Глава 3. Клинические проявления туберкулеза органов дыхания у больных...
Интоксикация наблюдается без локализации процесса в каком-либо
органе даже при тщательном обследовании. Заболевание прогрессиру-
ет, как правило, бурно, порой молниеносно и в течение 10-30 дней без
лечения заканчивается летально.
Особенности объективного статуса. Состояние больного тяжелое,
обусловлено интоксикационным и астеновегетативными синдромами.
Перкуторно может обнаруживаться легочный, с легким тимпаниче-
ским оттенком звук, аускультативно выслушивается везикулярное
или жесткое дыхание, хрипы отсутствуют. Отмечаются умеренная гепа-
тоспленомегалия, выраженный лабильный пульс и тахикардия.
Изменения со стороны крови: анемия тяжелой степени (инфек-
ционно-токсического генеза), может быть умеренный лейкоцитоз
(до 10—12* 109/л), нейтрофильный сдвиг влево, как правило, отсутству-
ет, лимфопения, значительное повышение скорости оседания эритро-
цитов (до 50 мм/ч и выше).
Рентгенологическая картина. Основной особенностью и диагности-
ческой трудностью туберкулезного сепсиса является то, что изменения
в легких могут не регистрироваться. При этом обзорная рентгено-
грамма ОГК не отражает истинный объем поражения легочной ткани
(рис. 3.26). У части пациентов удается визуализировать лишь усиление
и обогащение легочного рисунка. Значительно большую информацию
о характере поражения легочной ткани у таких пациентов может дать
КТ, разрешающая способность которой позволяет в ряде случаев выяв-
лять мельчайшую, субмилиарную диссеминацию.
Несмотря на отсутствие видимых изменений на рентгенограмме,
у 5—15% больных с острейшим туберкулезным сепсисом обнаруживают
МБТ в мокроте, кроме того, у 10-15% больных — бактериемию при
посевах крови.
Дифференциальная диагностика. Острейший туберкулезный сеп-
сис прежде всего необходимо дифференцировать от бактериального
(стрептококкового, стафилококкового) сепсиса.
От бактериального сепсиса туберкулезный отличается отсутствием
резких, потрясающих ознобов, высокого лейкоцитоза и кожной сыпи,
также нехарактерно значительное увеличение селезенки и печени.
Кроме того, даже тщательный диагностический поиск не выявляет
первичного очага инфекции.
Косвенные диагностические критерии туберкулезного сепсиса у ЛЖВ:
• выраженный иммунодефицит (CD4 менее 100 кл/мкл);
• упорная лихорадка до фебрильных и высоких цифр, рефрактерная
к неспецифической антибактериальной терапии;
3.6. Острейший туберкулезный сепсис
95
Рис. 3.26. Обзорная рентгенограмма органов грудной клетки больного К., 33 года
(ВИЧ-инфекция, количество С04+-лимфоцитов — 4 клетки/мкл). Легочные
поля без очаговых и инфильтративных изменений. Снимок выполнен за 7 дней
до смерти. Патолого-анатомический диагноз: генерализованный туберкулез
с поражением внутригрудных, мезентериальных лимфатических узлов. Милиарный
туберкулез легких, печени, селезенки, брюшины, туберкулез кишечника
(гистобактериоскопически МБТ+ посмертно)
• отсутствие субстрата поражения, при тщательном диагностиче-
ском поиске, объясняющего причину лихорадки.
Лечение и исходы. При туберкулезном сепсисе возможность благо-
приятного исхода может обеспечить раннее назначение адекватной
ПТТ с преимущественно парентеральным введением ПТП (для улуч-
шения доступности препаратов в различные органы и ткани). Больным
ВИЧ-инфекцией на фоне глубокого иммунодефицита при выраженном
интоксикационном синдроме и отсутствии локального поражения
показана эмпирическая ПТТ (ex juvantibus), так как у этой категории
пациентов высокая вероятность развития туберкулезного сепсиса.
Согласно алгоритму ВОЗ (2007), у тяжелых больных ВИЧ-инфекцией
при отрицательной микроскопии мазка даже пробный курс антибио-
тиков не является обязательным перед началом эмпирической ПТТ.
Алгоритм направлен на расширение показаний к раннему назначению
ПТТ у тяжелых больных ВИЧ-инфекцией, так как подобная тактика
значительно улучшила выживаемость больных в Южной Африке.
Однако даже назначение ПТТ не всегда спасает жизнь пациенту.
Летальность при туберкулезном сепсисе составляет 30—40%.
Глава 4
ВНЕТОРАКАЛЬНЫЕ ПРОЯВЛЕНИЯ ТУБЕРКУЛЕЗА
У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
Внеторакальные формы ТБ — название условное. Оно привилось
как термин, показывающий преимущественное поражение не легких,
а других органов: ПЛУ, почек, костей и суставов, кожи, половых орга-
нов, глаз и др. Возникновение поражений такого характера может быть
как проявление первичного, так и вторичного (как результат реакти-
вации эндогенной инфекции или повторного заражения) ТБ. У лиц
с ВИЧ-негативным статусом внеторакальная локализация ТБ нередко
развивается как изолированная самостоятельная клиническая форма,
без поражения органов дыхания. Иногда выявляют одновременно пора-
жение легких и внелегочный ТБ одной локализации. Генерализация
специфического процесса встречается очень редко. В свою очередь,
у больных ВИЧ-инфекцией чем глубже проявления иммунодефицита,
тем чаще встречается ТБ множественных локализаций (полиорганный
ТБ). Внелегочные проявления ТБ регистрируют более чем у полови-
ны больных с выраженным иммунодефицитом (С04+-лимфоцитов —
менее 200 кл/мкл). При этом частота поражения легких, и/или ВГЛУ,
и/или плевры при полиорганном ТБ составляет 90—100%. Однако
лидирующая клиническая симптоматика чаще связана с внеторакаль-
ным ТБ. Выявлено, что основными предикторами летального исхода
у больных с сочетанной инфекцией являются генерализованный ТБ
(поражение трех локализаций и более) и туберкулезный менинго-
энцефалит. При генерализованном ТБ у больного ВИЧ-инфекцией
вероятность летального исхода увеличивается более чем в 30 раз, а при
туберкулезном менингоэнцефалите — в 23 раза.
Из внеторакальных локализаций у больных ВИЧ-инфекцией наи-
более часто поражаются периферические мезентериальные и забрю-
шинные лимфатические узлы, брюшина, кишечник, печень, селезенка,
мозговые оболочки и вещество головного мозга, перикард, мочеполо-
вая система, кости. Встречается ТБ редких локализаций с развитием
ректальных абсцессов, поражением кожи, глаз, надпочечников и др.
4.1. Туберкулез периферических лимфатических узлов
97
4.1. ТУБЕРКУЛЕЗ ПЕРИФЕРИЧЕСКИХ ЛИМФАТИЧЕСКИХ УЗЛОВ
ТБ ПЛУ — вторая по частоте распространенности локализация
туберкулезного процесса после ТБ органов дыхания. Излюбленной
локализацией являются лимфатические узлы шеи (60—70%), реже —
подмышечные (10—15%), над- и подключичные (10%), подчелюстные
(10%). Вероятность поражения других групп лимфатических узлов
не превышает 5%. Уровень иммуносупрессии, характерный для тубер-
кулезного лимфаденита, менее 350 кл/мкл.
Классификация туберкулеза периферических лимфатических узлов
по стадиям развития
Согласно Руководству по внелегочному ТБ (2000), выделяют 5 ста-
дий эволюции ТБ.
I — начальная, пролиферативная:
• IA — ранняя гиперпластическая (предшествует специфическим
изменениям);
• 1Б — гранул ематозная.
II — казеозная без размягчения и распада.
III — абсцедирующая.
IV— свищевая.
V — стадия инволютивного процесса (индуративная).
У больных ВИЧ-инфекцией специфическое поражение лимфатиче-
ского узла происходит достаточно быстро. Наиболее часто встречаются
клинически яркие манифестные стадии: абсцедирующая и свищевая
(рис. 4.1, см. цветную вклейку). При неадекватной терапии или низкой
приверженности к лечению формируется хроническое течение с дли-
тельным существованием свищей (рис. 4.2, см. цветную вклейку).
У больных ВИЧ-инфекцией важно дифференцировать ТБ ПЛУ
от персистирующей ГЛАП, а также поражения лимфатических узлов
при лимфопролиферативных заболеваниях.
Для персистирующей ГЛАП характерно увеличение 3-4 групп
и более, и в каждой поражено более 2 узлов.
Особенно часто поражаются затылочные, заднешейные, подмы-
шечные, паховые лимфатические узлы. Обычно их размер составляет
1-2 см, консистенция плотноэластическая; безболезненные, узлы
не спаяны с окружающей тканью, кожа над ними не изменена, длитель-
но стабильные при динамическом наблюдении.
При ТБ ПЛУ в группе увеличенных узлов лидирует один, неред-
ко значительно увеличенный в размерах, или группа, объединенная
98 Глава 4. Внеторакальные проявления туберкулеза у больных ВИЧ-инфекцией
в конгломерат. Со временем появляются признаки локального вос-
паления: гиперемия кожи, флюктуация, свищ с серозно-гнойным
отделяемым без неприятного запаха. Нередко формируется специфи-
ческая аденофлегмона (распространение воспаления на прилежащие
мягкие ткани).
При лимфогранулематозе излюбленная локализация схожая.
У 80% больных первыми увеличиваются шейные узлы. Лимфати-
ческие узлы подвижные, плотноэластические, безболезненные,
по типу «картофеля в мешке». В дальнейшем могут достигать боль-
ших размеров, превращаются в плотные болезненные конгломераты.
Нехарактерны свищи. Скорость прогрессирования лимфогрануле-
матоза различна. Возможны острые формы длительностью 2-4 нед
и хроническое течение.
Диагностика ТБ ПЛУ должна включать.
• Рентгенографию ОГК — для исключения активного ТБ легких.
• При наличии свища — мазок-отпечаток и посев на МБТ.
• «Золотой стандарт» диагностики ТБ ПЛУ у больного ВИЧ-
инфекцией — диагностическая лимфаденэктомия пораженной
группы лимфатических узлов с гистологической и бактериологи-
ческой верификацией (рис. 4.3, 4.4, см. цветную вклейку).
При биопсии лимфатического узла необходимо выполнение следую-
щих правил.
• Пункционную биопсию делать не рекомендуют из-за ее малой
информативности, кроме того, биопсия пораженного узла —
не только диагностическая, но и лечебная процедура (практи-
чески всегда пораженный узел любой этиологии в дальнейшем
не выполняет свою функциональную роль в организме, а является
лишь источником реактивации).
• Необходимо хирургическое иссечение всего лимфатического узла,
а не его части. Однако проведение адекватного хирургического
пособия бывает значительно затруднено. Это связано с техниче-
скими сложностями во время операции из-за анатомических осо-
бенностей шейной и подмышечных областей.
• Для биопсии нужно выбрать не наиболее удобный для иссечения,
а доминирующий узел, а при возможности резецировать всю груп-
пу пораженных лимфатических узлов.
• Из биоптата необходимо делать мазки-отпечатки для исследова-
ния на МБТ, неспецифическую микрофлору, грибы, иммуноги-
стохимическое исследование для исключения лимфопролифе-
ративного заболевания.
4.2. Туберкулез мозговых оболочек, центральной нервной системы
99
• Обязательно небольшой кусочек биоптата следует направить
в бактериологическую лабораторию для посева на МБТ, неспе-
цифическую микрофлору, грибы.
• Желательно проведение молекулярно-генетического исследова-
ния из биоптата для выявления возбудителя в тканях (особенно
МБТ).
• При диагностических сомнениях требуется пересмотр нескольки-
ми морфологами.
• При недостаточной информативности биопсии показано повтор-
ное ее проведение.
• Микропрепараты должны храниться в течение всей жизни боль-
ного и быть доступными для пересмотра при необходимости.
Фтизионастороженность должна появиться у врача любой специ-
альности при возникновении периферического лимфаденита у боль-
ного ВИЧ-инфекцией, особенно шейной локализации, рефрактерной
к неспецифической антибактериальной терапии. Появление свища
является обязательным показанием к консультации у фтизиатра.
Лечебная тактика при ТБ ПЛУ:
• специфическая ПТТ согласно выбранному режиму;
• APT;
• при абсцедирующей и свищевой форме ТБ ПЛУ показана лечебно-
диагностическая лимфаденэктомия. В эксперименте на модели ТБ
лимфатических узлов установлено, что консервативное лечение
казеозно измененных узлов бесперспективно. При отсутствии
должной хирургической активности у больных ВИЧ-инфекцией
с ТБ ПЛУ отмечается формирование хронического свищевого
лимфаденита множественных групп с постоянно торпидно теку-
щим специфическим воспалением.
4.2. ТУБЕРКУЛЕЗ МОЗГОВЫХ ОБОЛОЧЕК,
ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Нередко у пациентов с ВИЧ-инфекцией наблюдают туберкулезное
поражение ЦНС, которое чаще проявляется менингоэнцефалитом.
Состояние относится к остропрогрессирующим формам ТБ и являет-
ся самым грозным осложнением течения специфического процесса
во фтизиатрии.
Туберкулезный менингит (классическое определение для больных
с ВИЧ-негативным статусом) — серозный микобактериальный
100 Глава 4. Внеторакальные проявления туберкулеза у больных ВИЧ-инфекцией
менингит с постепенным началом и стадийным течением, с преиму-
щественной локализацией воспаления на основании мозга, с белко-
во-клеточной диссоциацией и снижением уровня сахара в спинномоз-
говой жидкости.
Туберкулезный менингит у большинства пациентов с ВИЧ-нега-
тивным статусом развивается постепенно. Естественное течение (без
лечения) данной локализации у взрослых представляется следующим
образом. Начинается с длительного (1-3 мес) продромального периода
в виде недомогания, быстрой утомляемости, вегетососудистых наруше-
ний, субфебрилитета. Первая неделя течения непосредственно менин-
гита — развитие менингеального синдрома. Ведущим симптомом
этого периода является головная боль, с которой начинается отсчет
дней. Локализация ее неопределенная, интенсивность боли нарастает
по дням, и она становится нестерпимой, болеутоляющие препараты
не помогают. Обязательный симптом туберкулезного менингита —
повышение температуры тела до 38—40 °С. Частые симптомы — тошно-
та и рвота, не приносящая облегчения, не связанная с приемом пищи,
связанная с изменением местоположения больного. Рвота обусловлена
непосредственным или рефлекторным раздражением блуждающего
нерва и его ядер, расположенных на дне IV желудочка, или рвотного
центра в сетчатой субстанции продолговатого мозга. К концу первой
недели от появления головной боли становятся отчетливо положитель-
ными менингеальные знаки. Ригидность затылочных мышц вызывает
характерное запрокидывание головы; всякая попытка изменить это
фиксированное положение и нагнуть голову вперед вызывает резкую
болезненную реакцию. Важным и ранним диагностическим симптомом
считается симптом Кернига: больному, лежащему на спине, сгибают
ногу под прямым углом в тазобедренном и коленном суставах и затем
пытаются разогнуть ее в коленном суставе. При этом ощущается повы-
шенное сопротивление, которое зависит от рефлекторного сокращения
сгибателей голени (более сильных, чем разгибатели); это сокращение
обусловлено натяжением и сокращением нервных корешков. Менее
постоянны симптомы Брудзинского: верхний (при резком сгибании
головы происходит сгибание ног и подтягивание их к животу) и ниж-
ний (при сгибании одной ноги в коленном и тазобедренном суставах
другая также сгибается). Важно отметить, что менингеальные знаки при
туберкулезном менингите зачастую выражены слабо. Нередко отмеча-
ется диссоциация менингеальных знаков (при ригидности затылочных
мышц симптомы Кернига и Брудзинского остаются отрицательны-
ми). На второй неделе присоединяется базальная неврологическая
4.2. Туберкулез мозговых оболочек, центральной нервной системы 101
симптоматика с признаками поражения II—IV, VI, VII пары череп-
но-мозговых нервов: снижение остроты зрения, птоз века, сужение
или расширение зрачков, расходящееся или сходящееся косогла-
зие, асимметрия лица: сглаженность носогубной складки, опущение
уголков рта, отклонение языка от центральной линии, анизокория.
Сознание еще сохранено, пациент негативен, заторможен, появляются
изменения психики. На третьей неделе появляются параличи, оглу-
шенность сменяется сопором, а затем комой. К концу четвертой недели
наступает смерть от паралича дыхательного центра.
Выделяют следующие формы туберкулезного менингита:
• базилярный менингит (наиболее часто у ВИЧ-негативных паци-
ентов);
• менингоэнцефалит (наиболее часто у ВИЧ-позитивных пациен-
тов);
• менингомиелит (спинномозговая форма) — поражаются оболочки
спинного мозга.
Особенности клинических проявлений туберкулезного менин-
гоэнцефалита у больных ВИЧ-инфекцией заключаются в стертости
классической стадийности течения заболевания. У 60—70% больных
ВИЧ-инфекцией туберкулезный менингоэнцефалит характеризуется
внезапным началом с развитием острого нарушения сознания по типу
делирия и гектической лихорадки. В 1/3 случаев для начала менинго-
энцефалита характерны проявления стойкого изменения поведения:
апатия, неадекватное реагирование, дезориентация в месте и времени,
частично в личности, нарушение навыков самообслуживания, про-
явление признаков агрессии, выраженное снижение когнитивных
функций. При этом достаточно долго отсутствуют симптомы менинге-
ального синдрома.
При прогрессировании заболевания появляется очаговая симптома-
тика, причем поражение II—IV, VI, VII пары черепно-мозговых нервов
встречается не всегда. Наиболее тяжелым в прогностическом отноше-
нии является поражение бульбарной группы нервов IX, X, XII пары,
при этом характерна триада симптомов: дисфагия, дисфония, дизар-
трия. Нередко регистрируют пирамидную недостаточность, стволовые
нарушения (икота, спонтанный нистагм — горизонтальный и/или
вертикальный), парезы, связанные с поражением вещества головного
мозга, при котором в процесс всегда вовлекаются сосуды. Следствием
васкулита может быть развитие ишемического инсульта с клинически-
ми проявлениями в зависимости от участка поражения.
102 Глава 4. Внеторакальные проявления туберкулеза у больных ВИЧ-инфекцией
Переход туберкулезного процесса на спинной мозг (спинномозговая
форма) приводит к грубым спинальным нарушениям. Наблюдаются
нижние парапарезы, нарушения функций тазовых органов (задержка
или недержание мочи, императивные позывы, затруднения при моче-
испускании, дефекации), нарушение чувствительности. Нередко быва-
ют опоясывающие, очень сильные корешковые боли.
У 20% больных туберкулезным менингоэнцефалитом при когнитив-
ных расстройствах и отсутствии симптомов менингеального синдрома
регистрируются изменения в спинномозговой жидкости, что под-
тверждает воспаление мозговых оболочек.
Обследование пациента в обязательном порядке должно включать
исследование глазного дна, спинномозговой жидкости, рентгеногра-
фию черепа и ОГК. Желательно проведение магнитно-резонансной
томографии головного мозга для оценки характера и объема поражения
вещества головного мозга и вентрикулярной системы.
При исследовании глазного дна нередко отмечают изменения в виде
специфического хориоретинита, неврита, атрофии или застоя сосочков
зрительного нерва.
При туберкулезном менингоэнцефалите во время спинномозговой
пункции спинномозговая жидкость вытекает под большим давлением.
Жидкость ксантохромная, опалесцирует, при спинальном блоке она
становится густой, интенсивно-желтой.
Спинномозговую жидкость собирают в 4 пробирки и исследуют
в четырех лабораториях (клинической, биохимической, бактериологи-
ческой и лаборатории молекулярно-генетических методов). Обязательно
проводят исследование спинномозговой жидкости на выявление МБТ
(простой микроскопией, посевом и методом ПЦР).
Особенности спинномозговой жидкости у больных ВИЧ-инфекцией
с туберкулезным менингитом.
• Такие же, как у лиц с ВИЧ-негативным статусом: плеоцитоз —
сотни клеток (чаще 100—500 кл/мкл):
— повышение содержания белка (0,6-6,0 до 30 г/л при разви-
тии менингомиелита и блоке путей оттока спинномозговой
жидкости);
— снижение уровня сахара (менее 2,2 ммоль/л, чаще до 1,1 —
1,5 ммоль/л) — очень важный диагностический критерий.
• Отличные от пациентов с ВИЧ-негативным статусом:
— цитограмма — смешанный нейтрофильно-лимфоцитарный
плеоцитоз, а не лимфоцитарный;
4.2. Туберкулез мозговых оболочек, центральной нервной системы 103
- более частое обнаружение МБТ: методом микроскопии —
до 25%, методом посева и ПЦР — до 70%.
Самым ценным в дифференциальной диагностике туберкулез-
ного менингоэнцефалита с другими заболеваниями ЦНС у больных
ВИЧ-инфекцией является обнаружение МБТ в спинномозговой жид-
кости.
По однократному исследованию спинномозговой жидкости диа-
гноз туберкулезного менингита можно поставить только при одно-
временном выявлении бесспорного активного ТБ другой локализации
и типичном составе спинномозговой жидкости или при обнаружении
МБТ. Во всех остальных случаях необходимо наблюдение за ликво-
рологическими данными исследования спинномозговой жидкости
в динамике. Для этого пункции проводят каждые 3—4 дня. После
подтверждения диагноза туберкулезного менингита прослеживается
эффективность назначенной терапии. Пункции проводят 2 раза в нед,
затем 1 раз в нед, потом 1 раз в 2 нед, а затем ежемесячно до санации
спинномозговой жидкости. При ухудшении состояния пациента про-
водится внеплановая спинномозговая пункция.
Лечебная тактика при туберкулезном менингоэнцефалите:
• специфическая ПТТ согласно выбранному режиму, первые 2 мес
желательно с парентеральным введением антибактериальных пре-
паратов. Основной курс лечения — не менее 12 мес;
• постельный режим не менее 2 мес;
• поддержание водно-солевого баланса;
• контроль отека головного мозга;
• контроль судорожной активности;
• антиоксиданты (витамины группы В, аскорбиновая кислота);
• улучшение мозгового кровообращения [винпоцетин (Кавинтон*),
пентоксифиллин (Трентал4), пирацетам];
• ГКС-терапия: преднизолон перорально (1,5 мг/кг/сут в течение
2 нед, с постепенным снижением дозы);
• больным ВИЧ-инфекцией с туберкулезным поражением ЦНС
рекомендовано отложить APT до стойкого купирования явлений
отека головного мозга. Чаще всего возможность назначения APT
рассматривается не ранее чем через 2 мес ПТТ.
Течение туберкулезного менингоэнцефалита у больных
ВИЧ-инфекцией — злокачественное с неуклонным прогрессирова-
нием. Отмечается высокий уровень летальности (до 70%). Улучшить
прогноз может ранняя диагностика и своевременное назначение
адекватной ПТТ.
104 Глава 4. Внеторакальные проявления туберкулеза у больных ВИЧ-инфекцией
4.3. ТУБЕРКУЛЕЗ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ
(АБДОМИНАЛЬНЫЙ ТУБЕРКУЛЕЗ)
«Абдоминальный ТБ» (AT) — собирательный термин, объединяет
специфическое поражение органов пищеварения, лимфатических узлов
брыжейки тонкой кишки и забрюшинного пространства. Диагностика
AT является одним из самых сложных разделов фтизиатрии. У больных
с ВИЧ-негативным статусом в структуре внелегочного ТБ AT состав-
ляет 2-3%, а у ВИЧ-инфицированных на фоне иммуносупрессии —
20—30%. Уровень иммуносупрессии, характерный для AT, — менее
200 кл/мкл.
ТБ пищевода и желудка встречается крайне редко. Чаще у больных
ВИЧ-инфекцией поражение пищевода и желудка обусловлено грибко-
вой инфекцией, ЦМВ-инфекцией, саркомой Капоши.
Специфическое поражение печени встречается в трех формах, а имен-
но: как милиарное (наиболее часто), диффузное и казеозно-некротиче-
ское (крупноочаговое) поражение.
ТБ селезенки характеризуется умеренной спленомегалией и милиар-
ным или очаговым поражением.
ТБ печени и селезенки встречаются чаще, чем диагностируются.
Туберкулезный мезаденит — наиболее частая локализация AT.
Состояние характеризуется значительным увеличением казеоз-
но-трансформированных лимфатических узлов брыжейки тонкой
кишки, ворот печени и забрюшинного пространства, формировани-
ем конгломератов, натечных и межкишечных абсцессов (рис. 4.5, см.
цветную вклейку). При расплавлении казеозных масс лимфатического
узла формируются лимфожелезистые каверны, которые при прорыве
в брюшную полость ведут к туберкулезному перитониту.
ТБ кишечника чаще вовлекается в патологический процесс вторич-
но при наличии мезаденита. Патологический процесс локализуется
в основном в дистальном отделе тонкой или в слепой кишке. Нередко
язвенно-деструктивные поражения образуются в восходящей и попе-
речно-ободочной кишке. Типичное расположение язв — поперек хода
кишечника; при заживлении формируются стенозы кишки и, как след-
ствие, возникает ослабление перистальтики, приводящее к механиче-
ской кишечной непроходимости (рис. 4.6, 4.7, см. цветную вклейку).
Слепая кишка при пальпации раздутая и уплотненная. Процесс может
начинаться с ТБ червеобразного отростка с клинической картиной
аппендицита. В пораженных участках кишки появляются инфильтра-
тивно-язвенные образования или множественные мелкие плотные
4.3. Туберкулез органов брюшной полости (абдоминальный туберкулез) 105
узелки (милиарные). У больных ВИЧ-инфекцией встречается ТБ пря-
мой кишки и аноректальной области. Для него характерны пара-
ректальные абсцессы. При вскрытии такого туберкулезного абсцес-
са образуется параректальный свищ (специфический парапроктит).
ТБ кишечника у больных ВИЧ-инфекцией характеризуется быстрым,
осложненным течением с возникновением кишечной непроходимости,
кишечных кровотечений, перфорации язв и перитонита.
ТБ брюшины (туберкулезный перитонит) возникает вторично
за счет лимфогенного распространения инфекции при прогрессиро-
вании мезаденита или общей гематогенной милиарной диссеминации.
Каловый перитонит возникает как осложнение перфорации туберку-
лезных язв кишечника. У больных ВИЧ-инфекцией нередко реализу-
ются два пути одновременно.
Выделяют следующие формы специфического перитонита: слипчи-
вую, экссудативную, бугорковую, казеозно-язвенную (рис. 4.8, 4.9, см.
цветную вклейку). У больных ВИЧ-инфекцией наиболее часто встреча-
ются бугорковая и казеозно-язвенная формы.
Ведущие клинические симптомы абдоминального туберкулеза
• Болевой синдром преимущественно в правой подвздошной обла-
сти либо нечетко локализованный. Интенсивность болевого син-
дрома бывает различной, но чаще умеренно выраженной.
• Диарея.
• Лихорадка до фебрильных и высоких значений (признаки тубер-
кулезной интоксикации).
• Прогрессирующее снижение массы тела.
• Анемия средней степени тяжести и тяжелая.
Обследование пациента с подозрением на AT в обязательном
порядке должно включать обзорную рентгенограмму органов грудной
и брюшной полостей, ультразвуковое исследование органов брюшной
полости. В дальнейшем принимается решение о необходимости про-
ведения ирригоскопии и об объеме эндоскопического исследования
(эзофагогастродуоденоскопия, колоноскопия, лапароскопия).
Данные ультразвукового исследования, позволяющие заподозрить
AT у больных ВИЧ-инфекцией:
• увеличение и конгломераты забрюшинных, мезентериальных
и лимфатических узлов ворот печени;
• инфильтрация большого сальника;
• гипоэхогенные участки в печени и/или селезенке (специфическая
диссеминация).
106 Глава 4. Внеторакальные проявления туберкулеза у больных ВИЧ-инфекцией
При эндоскопическом исследовании (лапароскопии, эзофагога-
стродуоденоскопии, колоноскопии) подозрительными на туберкулез-
ное воспаление являются мелкие желтоватые бугорки и/или язвы. При
их визуализации обязательно проводят биопсию пораженных участков.
При исследовании биоптата, помимо гистологической оценки, важно
проводить гистобактериоскопическое исследование микропрепарата
с окраской по Цилю—Нильсену для выявления кислотоустойчивых
микобактерий.
Особенностью течения туберкулезного перитонита (как истинного
специфического поражения брюшины, так и калового в результате пер-
форации туберкулезных язв кишечника) у больных ВИЧ-инфекцией
являются умеренно выраженный болевой абдоминальный синдром,
сглаженные, нередко локально определяемые симптомы раздраже-
ния брюшины. Следовательно, «золотым стандартом» диагностики
AT является диагностическая лапароскопия с дальнейшим решением
вопроса об объеме оперативного вмешательства.
Лечебная тактика при абдоминальном туберкулезе
• Специфическая антибактериальная терапия согласно выбранному
режиму в пред- и послеоперационный период с парентеральным
введением АБП.
• APT.
• Коррекция метаболических нарушений, в частности белкового
обмена.
• Дополнительное энтеральное питание (сипинговое или зондовое).
• Коррекция анемии.
В 40-60% случаев течение AT сопровождается развитием ослож-
нений, требующих проведения операции (лапароскопии, лапарото-
мии, удаления пораженных лимфатических узлов, резекции участка
поражения кишечника, санации брюшной полости, дренирования).
При AT возможны два варианта хирургических вмешательств: экстрен-
ные (решение принимается по неотложным показаниям) и плановые
(решение принимается в результате клинического и ультразвукового
динамического наблюдения) операции.
4.4. ТУБЕРКУЛЕЗНЫЙ ПЕРИКАРДИТ
Туберкулезный перикардит — специфическое воспаление листков
перикарда, чаще является системным проявлением туберкулезной
4.4. Туберкулезный перикардит
107
инфекции, нежели изолированным поражением. Согласно классифи-
кации этиологических причин поражения перикарда, туберкулезный
перикардит относится к группе А — «инфекционные причины», под-
группе — «бактериальные перикардиты». ТБ является самой значимой
причиной выпотного перикардита в странах с высоким бременем ТБ.
Так, туберкулезная инфекция является этиологической причиной
перикардита у более чем 90% ВИЧ-инфицированных пациентов (чаще
при снижении количества С04+-лимфоцитов менее 350 кл/мкл) и
у 50-70% лиц без ВИЧ-инфекции.
Туберкулезный перикардит принято различать:
1) по срокам развития: острый, подострый или хронический (когда
выпот сохраняется более 3 мес);
2) по распределению жидкости: осумкованный или свободный
(окружающий);
3) по влиянию на гемодинамику: нет влияния, тампонада сердца,
констрикция.
Заболевание чаще развивается постепенно, в течение 1-2 мес.
Появляется лихорадка сначала до субфебрильных, а затем до фебриль-
ных значений. Врачебный осмотр может не дать каких-либо признаков
поражения перикарда у пациентов без нарушенной гемодинамики.
Развитие тампонады характеризуется тахикардией, тахипноэ, парадок-
сальным пульсом, артериальной гипотонией, набуханием яремных вен,
обморочным состоянием и даже развитием шока. Редко встречается
острое начало развития туберкулезного перикардита с клиническими
проявлениями острой тампонады сердца.
Обследование пациента с подозрением на туберкулезный перикар-
дит в обязательном порядке должно включать как минимум методы
визуализации выпота в полости перикарда, поражения легких, ВГЛУ.
В случае получения перикардиального выпота — его лабораторное
обследование. Диагноз выпота в полость перикарда обычно ставится
по данным эхокардиографии, которая также позволяет провести полу-
количественную оценку объема выпота и его влияние на гемодинами-
ку. Компьютерная томография (КТ) ОГК позволяет выявлять осум-
кованный выпот, образования в полости перикарда и его утолщение,
а также ассоциированные изменения в легких и ВГЛУ (рис. 4.10).
При невозможности выполнения КТ ОГК обязательным является
выполнение обзорной рентгенограммы ОГК. Рентгенологическая кар-
тина при туберкулезном перикардите зависит от объема выпота в пери-
кардиальной сорочке. При значительном объеме экссудата отмечается
сглаживание дуг сердца, значительное увеличение ее тени, нередко
108 Глава 4. Внеторакальные проявления туберкулеза у больных ВИЧ-инфекцией
Рис. 4.10. Сканы спиральной компьютерной томографии органов грудной клетки
больного ВИЧ-инфекцией с массивно-выпотным туберкулезным плевритом справа
и перикардитом
4.4. Туберкулезный перикардит
109
до шарообразной. Часто одновременно с перикардитом выявляют
поражение легких, ВГЛУ, плевры. При одновременном поражении
плевры и перикарда процесс расценивают как специфический полисе-
розит (рис. 4.11).
При ультразвуковом исследовании перикарда объем выпота реко-
мендуют классифицировать в зависимости от размера эхонегативного
пространства во время диастолы. Выпот считается небольшим, если
разобщение листков перикарда не превышает 10 мм, умеренным —
10—20 мм, большим — более 20 мм и очень большим — более 20 мм
в сочетании с тампонадой сердца.
Особенности эхокартины при туберкулезном перикардите следующие:
выпот чаще массивный, в экссудате определяются признаки неоднород-
ности и наличие свободно флотирующих нитей фибрина, нередко выявля-
ют утолщение листков перикарда с пристеночным наложением фибрина.
Показания к проведению перикардиоцентеза у больных
ВИЧ-инфекцией при подозрении на туберкулезный перикардит:
• абсолютные — угроза тампонады сердца и разобщение листков
перикарда более 20 мм;
• относительные — разобщение листков перикарда от 10 до 20 мм;
• при разобщении листков перикарда менее 10 мм показано кон-
сервативное ведение и динамическое наблюдение за эффективно-
стью назначенной этиотропной терапии.
Экссудат при туберкулезном перикардите у больных ВИЧ-инфекцией
чаще носит геморрагический, чем серозный характер. При лаборатор-
ном исследовании в основном выявляют смешанный лимфоцитарно-
Рис. 4.11. Туберкулезный перикардит в сочетании с туберкулезным плевритом справа
и туберкулез внутригрудных лимфатических узлов с лимфогенной диссеминацией
справа у больного ВИЧ-инфекцией
110 Глава 4. Внеторакальные проявления туберкулеза у больных ВИЧ-инфекцией
нейтрофильный характер экссудата и высокое содержание белка
(до 50 г/л). Нередко находят возбудителя (МВТ) в экссудате, особенно
посевом и молекулярно-генетическими методами (до 70-80%).
Лечебная тактика при туберкулезном перикардите:
• при наличии большого и очень большого выпота показано про-
ведение перикардиоцентеза и микродренирование перикарда
в течение 2—5 дней;
• специфическая ПТТ согласно выбранному режиму: эмпирическая
или по данным теста лекарственной чувствительности (ТЛЧ) воз-
будителя;
• антиретровирусная терапия.
Серьезное осложнение туберкулезного перикардита — трансфор-
мация в констриктивный перикардит. Констрикция чаще развивается
в течение 6 мес от начала заболевания. Туберкулезная констрикция
перикарда почти всегда связана с утолщением перикарда. До появле-
ния эффективной противотуберкулезной терапии у 50% пациентов
с выпотным туберкулезным перикардитом развивался констриктивный
перикардит. Лечение на основе рифампицинсодержащего режима
снизило встречаемость констрикции до 17—40%. Своевременная адек-
ватная ПТТ критически важна для предотвращения этого осложнения.
Если, несмотря на комбинированное лечение, развивается сдавление
сердца, показана перикардэктомия.
Роль назначения системных глюкокортикостероидов остается неод-
нозначной в лечении туберкулезного перикардита. В одном исследова-
нии было показано, что добавление кортикостероидов (преднизолона)
к ПТТ в течение 6 нед не влияло на летальность от всех причин, на веро-
ятность развития тампонады с необходимостью проведения перикар-
диоцентеза или развитие констрикции. При этом такая терапия была
ассоциирована с повышенным риском развития ВИЧ-ассоциированных
злокачественных новообразований. Именно поэтому в настоящее время
пролонгированное назначение системных ГКС не рекомендовано при
ведении туберкулезного перикардита у больных ВИЧ-инфекцией.
При туберкулезном перикардите смертность достигает 17-40%
в течение 6 мес от постановки диагноза.
4.5. К0СТН0-СУСТАВН0Й ТУБЕРКУЛЕЗ
Классификация фаз развития костно-суставного ТБ (КСТБ)
(КорневП.Г., 1971).
I. Преартритическая (преспондилитическая) фаза.
4.5. Костно-суставной туберкулез
111
II. Артритическая (спондилитическая) фаза:
— стадия начала;
— стадия разгара;
— стадия затихания.
III. Постартритическая (постспондилитическая) фаза.
Среди туберкулезных поражений костно-суставной системы на долю
позвоночника (спондилита) приходится 40% (рис. 4.12), тазобедренных
суставов (кокситов) — 20—25% (рис. 4.13), коленных суставов (гони-
тов) — 10-15%. Прочие суставы (плечевой, голеностопный, локтевой
и др.) поражаются значительно реже.
Костно-суставной ТБ, как правило, начинается с поражения губ-
чатого вещества: происходят некроз, разрушение и рассасывание тра-
бекулярной системы (преартритическая, или преспондилитическая,
фаза). Именно поэтому первичный туберкулезный остит обычно лока-
лизуется в частях скелета, наиболее богатых губчатой костной тканью:
в телах позвонков и в эпиметафизарных зонах трубчатых костей.
Пораженная ТБ костная ткань, по образному выражению академика
П.Г. Корнева, напоминает «тающий сахар». ТБ редко диагностируют
на этой стадии, так как в это время он не имеет никаких клинических
проявлений. Для КСТБ характерно контактное поражение нескольких
Рис. 4.12. Туберкулез грудного отдела Рис. 4.13. Туберкулезный коксит слева
позвоночника (компьютерная томография) (рентгенограмма)
112 Глава 4. Внеторакальные проявления туберкулеза у больных ВИЧ-инфекцией
позвонков или двух костей сустава (артритическая, или спондилитиче-
ская, фаза). Выраженные клинические симптомы начинают появляться
именно при распространении процесса на сустав. В дальнейшем, без
адекватного лечения, возникают анатомо-функциональные наруше-
ния, обусловленные деформацией позвоночника или суставов (постар-
тритическая фаза).
Согласно Руководству по внелегочному ТБ (2000), в клиническом
течении ТБ костей и суставов различают 5 стадий:
• I — первичный остит;
• II — прогрессирующий остеоартрит (спондилоартрит) без наруше-
ния функции;
• III — прогрессирующий артрит (спондилоартрит) с нарушением
функции сустава;
• IV — хронический деструктивный артрит (спондилит) с разруше-
нием и полной утратой его функции;
• V — метатуберкулезный артроз (спондилоартроз), представляющий
последствия перенесенного артрита (спондилита) с возникновением
в ходе заболевания грубых ана-
томических и функциональных
нарушений.
Для туберкулезного спондили-
та характерны следующие компо-
ненты: деструкция и деформация
позвоночника, абсцессы мягких
тканей, спинномозговые рас-
стройства компрессионного и сме-
шанного генеза. Формирование
абсцессов является постоянным
осложнением разрушения позвон-
ков, по локализации выделяют пре-
и паравертебральные, эпидураль-
ные, псоас-абсцессы (рис. 4.14).
При большом скоплении гноя
происходит прорыв абсцессов, что
приводит к образованию внутрен-
них и наружных свищей (рис. 4.15)
Рис. 4.14. Туберкулез грудного отдела и инфицированию костного очага
позвоночника, осложненный параверте- вторичной микрофлорой. Это
бральными абсцессами (магнитно-резо- сопровождается резким ухудшени-
нансная томография) ем состояния больного.
4.5. Костно-суставной туберкулез
113
Грубые спинномозговые расстройства возникают в тех случаях,
когда туберкулезный очаг открыт в сторону позвоночного канала,
в результате чего казеозные массы сдавливают спинной мозг, вызывая
проводниковые нарушения в виде спастических парезов и параличей.
При длительной компрессии возникают сосудистые нарушения, при-
водящие к миелопатии.
Тенденции специфического поражения костей и суставов у больных
ВИЧ-инфекцией такие же, как и у больных с ВИЧ-негативным стату-
сом, однако имеется ряд особенностей:
• характерно более злокачественное течение, практически всегда
встречается полиорганное поражение;
• отмечается большой объем костной деструкции: для спонди-
лита — разрушение трех и более позвонков (рис. 4.16), нередко
с несколькими локализациями в позвоночнике, для суставов —
множественные поражения;
• практически всегда течение КСТБ осложняется образованием
абсцессов больших размеров, нередко с образованием наружных
свищей;
Рис. 4.16. Распространенный туберкулез
Рис. 4.15. Туберкулезный спондилит L2-L3, грудного отдела позвоночника у пациента
осложненный свищевым процессом (фис- с ВИЧ-инфекцией (компьютерная томо-
тулограмма) графия)
114 Глава 4. Внеторакальные проявления туберкулеза у больных ВИЧ-инфекцией
• при развитии спондилита характерно более частое формирование
кифотической деформации у взрослых.
Обследование пациента с подозрением на КСТБ в обязательном
порядке должно включать обзорную рентгенограмму ОГК, рентгено-
грамму в двух проекциях пораженного и контралатерального суставов.
В дальнейшем обязательна консультация у врача-ортопеда, подготов-
ленного по вопросам КСТБ (фтизиоостеолога), который определяет
показания к дальнейшему дообследованию (магнитно-резонансная
томография, КТ сустава или позвоночника). При наружных свищах
обязательно выполнение мазка-отпечатка и посева на кислотоустой-
чивые микобактерии/МБТ, грибы и неспецифическую микрофлору,
по показаниям выполняют фистулографию.
Лечебная тактика при костно-суставном туберкулезе
• Специфическая ПТТ согласно выбранному режиму, желательно
с парентеральным введением препаратов (для улучшения доступ-
ности лекарственных средств в очаг поражения).
• Длительность основного курса лечения даже при лекарственной
чувствительности МБТ — не менее 12 мес.
• APT.
• Проведение радикально-восстановительной, стабилизирующей
операции, показанием к которой являются все стадии специфи-
ческого процесса. Задачи хирургического лечения: ликвидация
специфического очага, воссоздание анатомо-функциональных
взаимоотношений в пораженном органе, предотвращение гема-
тогенной диссеминации и образования дополнительных очагов
инфекции в других органах и системах, необходимость полу-
чения материала для бактериологического и гистологического
исследований в целях ускорения верификации диагноза и выбора
рациональной ПТТ. Проводят операцию в специализированном
отделении КСТБ (рис. 4.17, см. цветную вклейку).
• Патогенетическая терапия (остеотропными средствами), ней-
ротропная и сосудистая терапия, на стадии восстановительного
лечения применяют хондропротекторы.
• На этапе предоперационной подготовки — обеспечение больному
ортопедического режима и ограничение функции позвоночника
или другого пораженного сустава.
• В послеоперационном периоде — применение ортезов, восстано-
вительное лечение (лечебная физическая культура, массаж, сана-
торно-курортное лечение).
4.6. Туберкулез мочеполовой системы
115
4.6. ТУБЕРКУЛЕЗ МОЧЕПОЛОВОЙ СИСТЕМЫ
ТБ мочеполовой системы является следствием гематогенной дис-
семинации МБТ из первичного фокуса. Основные органы мишени
мочеполового ТБ:
• почки, мочеточники, мочевой пузырь;
• женские половые органы: яичники, матка, маточные трубы, вла-
галище;
• мужские половые органы: яички с придатками, предстательная
железа, семенные пузырьки.
У больных с ВИЧ-негативным статусом ТБ мочеполовой системы
в большинстве случаев начинается с поражения одной почки, в даль-
нейшем инфекция спускается сверху вниз, на мочеточник и мочевой
пузырь. При ТБ женских половых органов в 100% случаев поражаются
маточные трубы, матка — в 40-60%, яичники — в 15-20%, реже —
шейка матки и влагалище. У мужчин поражение ТБ половых органов
наиболее часто представлено эпидидимитом, орхитом или орхоэпиди-
димитом.
Выделяют следующие формы развития ТБ мочевой системы.
• Милиарный ТБ почек как проявление гематогенной генерализа-
ции.
• Паренхиматозный ТБ почек (специфическое воспаление в корко-
вом веществе почек).
• Туберкулезный папиллит — малый деструктивный процесс с пора-
жением сосочков.
• Кавернозный ТБ почек — деструктивный процесс с образованием
одной или множественных каверн.
• ТБ мочеточника с формированием стриктур и нарушением уро-
динамики.
• ТБ мочевого пузыря с формированием малого мочевого пузыря.
Симптомы мочевого синдрома, позволяющие заподозрить ТБ
мочеполовой системы: безболевая гематурия, упорная лейкоцитурия,
протеинурия. Изменения в моче сохраняются, несмотря на неспе-
цифическую антибактериальную терапию, либо эффект от нее кратко-
временный.
У больных ВИЧ-инфекцией туберкулезное поражение мочепо-
ловой системы практически всегда протекает в рамках полиорган-
ного поражения как результат лимфогематогенной генерализации.
Клиническая симптоматика неспецифична, практически всегда имеет
место интоксикационный синдром, иногда больных беспокоит тупая
116 Глава 4. Внеторакальные проявления туберкулеза у больных ВИЧ-инфекцией
боль в поясничной области. Редко пациенты отмечают дизурию
и периодическую безболевую макрогематурию. В период гематоген-
ной диссеминации часто происходит развитие милиарного или парен-
химатозного ТБ почек, причем такие изменения в почках встречаются
чаще, чем диагностируются (рис. 4.18, см. цветную вклейку). У боль-
ных ВИЧ-инфекцией нет склонности к хронизации специфического
процесса в почках, формированию множественных каверн и разви-
тию хронической почечной недостаточности в результате прямого
специфического поражения паренхимы почек. Часто встречаются
туберкулезные орхоэпидидимиты, осложненные свищами (рис. 4.19,
см. цветную вклейку).
Гинекологи могут столкнуться со специфическим абсцессом яич-
ников (туморозным аднекситом), осложненным туберкулезным пель-
виоперитонитом. Ультразвуковая картина и визуализация поражения
при лапароскопии у таких пациенток очень сильно напоминают рак
яичников с метастазами в брюшину. Окончательная расшифровка
диагноза основывается на гистологическом и бактериологическом под-
тверждении.
Обследование пациента с подозрением на мишень мочеполового
ТБ в обязательном порядке должно включать обзорную рентгенограм-
му ОГК, обзорную рентгенограмму органов брюшной полости, уль-
тразвуковое исследование мочеполовой системы, исследование мочи
на кислотоустойчивые микобактерии/МБТ троекратно методом про-
стой микроскопии и посева. По показаниям проводят экскреторную
урографию, ретроградную пиелографию и цистоскопию, лапароско-
пию. При наружных свищах обязательно выполнение из отделяемого
свища мазка-отпечатка и посева на кислотоустойчивые микобакте-
рии/МБТ, грибы и неспецифическую микрофлору, по показаниям
выполняют фистулографию. Лечебная тактика при мишени мочепо-
лового ТБ:
• специфическая ПТТ согласно выбранному режиму;
• APT;
• при осложненном течении мочеполового ТБ (наружных свищах
на мошонке, специфическом абсцессе яичников и др.) показано
хирургическое лечение.
Глава 5
МАКРО- И МИКРОСКОПИЧЕСКАЯ
ПАТОМОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
ТУБЕРКУЛЕЗА У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ1
Морфология туберкулезного воспаления тесно связана с состоя-
нием иммунной системы макроорганизма и в значительной степени
зависит от него. Именно поэтому морфологические проявления ТБ при
ВИЧ-инфекции утрачивают свои специфические признаки по мере
ее прогрессирования, что значительно осложняет верификацию тубер-
кулезного процесса.
При работе с аутопсийным материалом патологоанатомы в преоб-
ладающем большинстве исследований изучают случаи смерти у боль-
ных ВИЧ-инфекцией с выраженным иммунодефицитом (количество
С04+-лимфоцитов у большинства умерших не достигает 200 кл/мкл).
5.1. ОСОБЕННОСТИ МАКРОСКОПИЧЕСКОЙ КАРТИНЫ
ВИЧ-АСС0ЦИИР0ВАНН0Г0 ТУБЕРКУЛЕЗА ПО ДАННЫМ АУТОПСИИ
5.1.1. ПОРАЖЕНИЕ ЛЕГКИХ
На аутопсии при исследовании легких наиболее часто встречается
милиарный или мелкоочаговый двусторонний диссеминированный ТБ
легких, который при макроскопическом исследовании характеризуется
наличием во всех сегментах легких белесовато-желтоватых очажков диа-
метром 1-2 мм (милиарная диссеминация) и до 1 см (мелкоочаговая дис-
семинация). При мельчайшей диссеминации затрудняется визуализация
так называемых субмилиарных (диаметром менее 1 мм) очажков, которые
могут быть выявлены только при гистологическом исследовании микро-
препаратов. Реже обнаруживают крупноочаговую диссеминацию (слив-
ные ацинозные, ацинозно-лобулярные, лобулярные, сливные лобулярные
1 Авторы выражают искреннюю благодарность канд. мед. наук Зюзе Юлии
Рашидовне за помощь в написании главы.
118 Глава 5. Макро- и микроскопическая патоморфологическая характеристика...
очаги диаметром более 1 см) и казеозную пневмонию с формированием
обширных казеозно-некротических очагов, занимающих как сегмент
или долю, так и целое легкое. В крупных и даже мелких казеозно-некро-
тических фокусах иногда выявляют тонкостенные полости распада с жел-
товатым гноевидным содержимым с белесоватыми, творожистого вида
включениями (так называемые острые туберкулезные каверны).
5.1.2. ПОРАЖЕНИЕ ЛИМФАТИЧЕСКИХ УЗЛОВ
Лимфатические узлы всех групп (периферические, внутригрудные,
мезентериальные, забрюшинные и др.), как правило, увеличены в раз-
мерах, плотные, спаяны в конгломераты с переходом воспалительного
процесса на окружающие мягкие ткани (периаденит), в ряде случаев
с образованием наружных свищей. На разрезе ткань лимфатического
узла замещена белесовато-сероватыми крошковатыми творожистыми
некротическими массами с их секвестрацией и образованием лимфо-
железистых каверн, а также образованием свищей (бронхонодуляр-
ных, нодулярно-пищеводных и т.п.) (рис. 5.1, см. цветную вклейку).
Казеозный мезаденит при гнойном расплавлении казеозных масс может
сопровождаться формированием межкишечных туберкулезных абсцес-
сов. Пакеты увеличенных мезентериальных лимфатических узлов могут
вызывать механическую кишечную непроходимость, сдавливая извне
петли кишечника. Туберкулезный бронхоаденит может привести к ате-
лектазу сегмента или доли легкого с развитием реактивного экссудатив-
ного или туберкулезного воспаления в прикорневых отделах.
5.1.3. ПОРАЖЕНИЕ КИШЕЧНИКА
При поражении кишечника в процесс чаще вовлекаются подвздош-
ная и слепая кишка, хотя встречается и тотальное поражение желудоч-
но-кишечного тракта (желудка, тонкой и толстой кишки). На серозной
оболочке наблюдаются высыпания плотноватых, белесовато-желто-
ватых милиарных бугорков, часто сливающихся. Слизистая оболочка
кишки с язвенными дефектами различной величины, неправильной
округлой формы, также встречаются циркулярные язвы протяжен-
ностью до нескольких сантиметров. Милиарные очажки на серозной
оболочке обычно расположены в проекции язв. Наиболее частыми
осложнениями туберкулезного инфильтративно-язвенного пораже-
ния кишечника являются кишечные кровотечения из язв, перфора-
ции язвенных дефектов с формированием перитонита, стеноз кишки
5.1. Особенности макроскопической картины ВИЧ-ассоциированного... 119
и кишечная непроходимость. При поражении большого сальника нахо-
дят как мил парные высыпания, так и более крупные казеозно-некро-
тические очаговые поражения. Если фибринозно-гнойный перитонит,
вызванный перфорацией специфической язвы, развивается на фоне
туберкулезного поражения брюшины, то такое ее поражение называют
сочетанным, т.е. имеют место одновременно специфическое воспале-
ние брюшины и каловый перитонит.
5.1.4. ПОРАЖЕНИЕ МОЧЕПОЛОВОЙ СИСТЕМЫ
При поражении почек и предстательной железы обнаруживают как
милиарную диссеминацию, так и очаговую, а также (значительно реже)
кавернозную форму процесса. При наличии информации о лейкоци-
турии, прижизненном выявлении МБТ в моче, обнаружении спер-
матозоидов в общем анализе мочи (косвенный признак простатита)
необходимо морфологическое исследование почек и предстательной
железы, а также яичек с придатками в целях выявления туберкулезного
поражения этих органов.
5.1.5. ПОРАЖЕНИЕ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Туберкулезный менингит на фоне иммунодефицита у боль-
ных ВИЧ-инфекцией имеет нетипичную макроскопическую карти-
ну, часто с тотальным гнойным пропитыванием мягкой мозговой
оболочки (и базальных, и конвекситальных поверхностей головного
мозга) по типу гнойного чепчика, как при банальном бактериаль-
ном гнойном лептоменингите неспецифического характера (рис. 5.2,
см. цветную вклейку). При туберкулезном менингите без сочетания
с ВИЧ-инфекцией обычно поражается мягкая мозговая оболочка
базальных отделов головного мозга, которая принимает желеобраз-
но набухший вид с просовидными милиарными бугорками (рис. 5.3,
см. цветную вклейку). При ВИЧ-инфекции в основном развивается
не изолированный туберкулезный лептоменингит, а менингоэнце-
фалит. Очаги туберкулезного воспаления локализуются в различных
отделах серого и белого вещества головного мозга и макроскопически
имеют вид острых абсцессов.
При гематогенной генерализации специфического процесса мель-
чайшая субмилиарная, милиарная и мелкоочаговая диссеминация
обнаруживается, помимо легких, практически во всех внутренних
органах (печени, селезенке, почках, надпочечниках, головном мозге,
120 Глава 5. Макро- и микроскопическая патоморфологическая характеристика...
щитовидной железе, поджелудочной железе, яичках, придатках яичек,
предстательной железе, яичниках, матке, сердце и др.) (рис. 5.4, см.
цветную вклейку). Если туберкулезное воспаление распространяется
на прилежащие ткани, то развиваются туберкулезный паранефрит,
парапроктит, натечники и свищевые ходы.
Таким образом, при изучении секционного материала умерших
от ВИЧ-ассоциированного ТБ в преобладающем большинстве случаев
диагностируют полиорганный ТБ. Непосредственной причиной смерти
у больных с сочетанной инфекцией наиболее часто является острое про-
грессирование генерализованного ТБ. На втором месте — отек головного
мозга при развитии туберкулезного менингоэнцефалита и на третьем —
перитонит при прободении туберкулезных язв кишечника.
В свою очередь, основными причинами смерти у больных ТБ
с ВИЧ-негативным статусом наиболее часто являются распространен-
ные осложненные хронические или остропрогрессирующие формы
легочного ТБ, такие как фиброзно-кавернозный ТБ легких, дис-
семинированный ТБ легких, казеозная пневмония, а генерализо-
ванный ТБ занимает лишь четвертую позицию. При этом прева-
лирует хроническая деструктивная, длительно протекающая форма
ТБ — фиброзно-кавернозный ТБ. У умерших от диссеминированного
ТБ преобладает крупноочаговый диссеминированный ТБ, в отличие
от ВИЧ-инфицированных, у которых наблюдается преимущественно
мелкоочаговая или милиарная диссеминация. У ВИЧ-негативных
лиц диссеминированный ТБ может протекать подостро или при-
нимать хроническое течение, чего практически не встречается при
ВИЧ-инфекции. Течение фиброзно-кавернозного ТБ легких, подо-
строго и хронического диссеминированного ТБ сопровождается зна-
чительными склеротическими изменениями в легких, формированием
хронического легочного сердца. ТБ на фоне ВИЧ-ассоциированной
иммуносупрессии развивается в большинстве случаев за корот-
кий период времени, характеризуется быстрым прогрессированием
и отсутствием или слабым фиброзированием в легких.
5.2. ОСОБЕННОСТИ МИКРОСКОПИЧЕСКОЙ КАРТИНЫ
ВИЧ-АССОЦИИРОВАННОГО ТУБЕРКУЛЕЗА ПО ДАННЫМ АУТОПСИИ
При микроскопическом исследовании пораженной ткани для типич-
ного течения туберкулезного процесса характерно гранулематозное вос-
паление с формированием эпителиоидно-гигантоклеточных гранулем
5.2. Особенности микроскопической картины ВИЧ-ассоциированного... 121
с лимфоидным валом по периферии. В центре гранулем формируется
участок казеозного некроза. При образовании казеозно-некротических
очагов по их периферии наблюдается продуктивная реакция в виде
эпителиоидных и гигантских клеток Пирогова—Лангханса и инород-
ных тел. Диссеминация обычно лимфогенная или бронхогенная, т.е.
очажки туберкулезного воспаления располагаются по ходу лимфатиче-
ских сосудов или в процесс вовлекаются бронхи различных генераций.
Туберкулезный процесс протекает волнообразно, что морфологически
проявляется наличием очагов специфического воспаления различ-
ной давности: свежих очажков казеозного некроза с лейкоцитарной
инфильтрацией, очагов казеоза с формирующейся или сформирован-
ной капсулой, организованных гиалинизированных и кальцинирован-
ных очажков.
Микроскопическая картина ВИЧ-ассоциированного ТБ отличает-
ся от таковой у лиц с сохраненным иммунным статусом. На поздних
стадиях ВИЧ-инфекции отсутствует картина типичного гранулематоз-
ного воспаления, утрачиваются признаки специфичности процесса.
Участки туберкулезного воспаления имеют вид гнойно-некротических
очагов с отсутствием элементов продуктивного воспаления по пери-
ферии (практически не находят эпителиоидные и гигантские клетки
Пирогова-Лангханса и инородные тела). Таким образом, развивают-
ся альтеративно-экссудативные изменения с преобладанием некро-
тических и сосудистых тканевых реакций, при этом продуктивный
компонент воспаления отсутствует или минимален. Свидетельством
отсутствия пролиферативных явлений служит нарушение процессов
отграничения и организации очагов туберкулезного воспаления, что
способствует активному прогрессированию патологического процесса.
Кроме того, утрачивается волнообразное течение ТБ, констатируются
мономорфные фокусы туберкулезного воспаления. Туберкулезные
очажки локализуются обычно периваскулярно, развиваются различ-
ные виды специфических и неспецифических васкулитов: эндо-, пан-,
тромбоваскулиты, деструктивные формы васкулитов. На рис. 5.5, 5.6
(см. цветную вклейку) показана сравнительная микроскопическая
картина туберкулезного лимфаденита у больного без ВИЧ-инфекции
и пациента с ВИЧ-инфекцией на фоне выраженного иммунодефицита
(количество С04+-лимфоцитов — 89 кл/мкл).
Милиарная диссеминация, поражение различных органов, перива-
скулярное расположение очажков, развитие туберкулезного васкулита
свидетельствуют о гематогенной генерализации процесса. Казеозный
лимфаденит и вовлечение в процесс всех групп лимфатических узлов
122 Глава 5. Макро- и микроскопическая патоморфологическая характеристика...
подтверждают лимфогенную генерализацию ТБ. Обычно наблюдается
лимфогематогенная генерализация.
Трудности морфологической диагностики с использованием рутин-
ных обзорных гистологических окрасок не всегда позволяют верифи-
цировать этиологию процесса. Утрата признаков гранулематозного
воспаления при ТБ на фоне ВИЧ-ассоциированной иммуносупрес-
сии может препятствовать постановке правильного диагноза. При
глубоком иммунодефиците гистологическую картину ТБ можно
принять за банальное гнойно-некротическое бактериальное воспа-
ление. В зависимости от оснащения лаборатории и возможностей
клиники можно использовать достаточно широкий спектр дополни-
тельных исследований для выявления МБТ в тканях. При наличии маз-
ков-отпечатков с поверхности пораженного органа (обычно это легкие
и лимфатические узлы) выполняют цитологическое исследование
окрашенных по Цилю—Нильсену препаратов. Кислотоустойчивые бак-
терии, к которым относятся и МБТ, окрашиваются в красный цвет,
прочая микрофлора и ядра клеток — в темно-синий на голубом фоне.
В специализированных туберкулезных учреждениях распространен
метод люминесцентной микроскопии с окраской аурамин-родамином.
В тканях из парафиновых блоков возбудителя можно выявить гисто-
бактериоскопией по Цилю—Нильсену. Кислотоустойчивые бактерии
обнаруживают в некротических массах, цитоплазме нейтрофильных
лейкоцитов (рис. 5.7, см. цветную вклейку). Одним из современных
методов идентификации возбудителя ТБ является иммуногистохи-
мическая реакция с использованием моноклональных антител Мус.
tuberculosis mouse monoclonal antibody; при визуализации с помощью
хромогена диаминобензидина микобактерии окрашиваются в золоти-
сто-коричневый цвет на бледно-фиолетовом фоне препарата (рис. 5.8,
см. цветную вклейку). Иммуногистохимическое исследование позволя-
ет определить инфекционный агент до рода. Наиболее чувствительным
и специфичным является молекулярно-генетический метод ПЦР. Для
детекции возбудителя можно использовать как нативный материал, так
и ткани, подвергшиеся гистологической проводке. Метод позволяет
определить ДНК возбудителя с идентификацией до вида.
Глава 6
ДИАГНОСТИКА ТУБЕРКУЛЕЗА
У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
6.1. ПОСТАНОВКА ДИАГНОЗА ВИЧ-ИНФЕКЦИИ
Согласно Федеральному закону от 30 марта 1995 г. № 35-ФЗ «О пред-
упреждении распространения в Российской Федерации заболевания,
вызываемого вирусом иммунодефицита человека (ВИЧ-инфекции)»,
государством гарантируется доступность медицинского освидетель-
ствования для выявления ВИЧ-инфекции, в том числе и анонимного,
с предварительным и последующим консультированием (ст. 4).
Установление диагноза ВИЧ-инфекции осуществляет врач-кли-
ницист путем комплексной оценки эпидемиологических данных,
результатов клинического обследования и лабораторных исследований.
Диагностика ВИЧ-инфекции включает два последовательных этапа:
1) установление собственно диагноза ВИЧ-инфекции, т.е. факта
инфицирования ВИЧ;
2) установление развернутого клинического диагноза, т.е. определе-
ние стадии, характера течения ВИЧ-инфекции, наличия вторич-
ных (развившихся вследствие ВИЧ-инфекции) и сопутствующих
заболеваний, определение в крови маркеров прогрессирования
ВИЧ-инфекции (количества С04-клеток и уровня РНК ВИЧ).
6.1.1. УСТАНОВЛЕНИЕ ФАКТА ИНФИЦИРОВАНИЯ ВИЧ
Первым этапом диагностики ВИЧ-инфекции является сбор эпи-
демиологического анамнеза и других эпидемиологических данных
о пациенте. При этом у пациента или по представленным им медицин-
ским документам необходимо выяснить следующее.
• Факты, свидетельствующие об очень высоком риске заражения ВИЧ:
— переливание крови или ее препаратов, пересадка органов и тка-
ней от ВИЧ-инфицированного;
124 Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
— рождение обследуемой женщиной ребенка, инфицированного
ВИЧ.
• Факты, свидетельствующие о высоком риске заражения ВИЧ:
— рождение обследуемого лица от ВИЧ-инфицированной матери;
— регулярные незащищенные (без использования презерватива)
половые контакты с больным ВИЧ-инфекцией или совмест-
ный с ним парентеральный прием психоактивных веществ;
— грудное вскармливание ВИЧ-инфицированного ребенка;
— грудное (путем приложения к груди или с использова-
нием сцеженного молока) вскармливание ребенка ВИЧ-
инфицированной матерью.
• Факты, свидетельствующие об определенном риске заражения
ВИЧ:
— парентеральные вмешательства или повреждения, осущест-
вляемые инструментами, возможно, контаминированными
ВИЧ (т.е. во внутрибольничных и подобных им очагах ВИЧ-
инфекции с парентеральным путем передачи ВИЧ или на тер-
риториях с высоким уровнем распространения ВИЧ);
— повреждение кожных покровов или слизистых оболочек
инструментами, контаминированными ВИЧ (например, при
оказании медицинской помощи больному ВИЧ-инфекцией),
попадание крови больного ВИЧ-инфекцией на слизистые обо-
лочки или поврежденную кожу обследуемого;
— однократный половой контакт с больным ВИЧ-инфекцией
или регулярные половые контакты с использованием презер-
ватива;
— половые связи, парентеральный прием наркотиков на террито-
риях, где ВИЧ значительно распространен в той группе риска,
к которой относится пациент;
— переливание крови, пересадка органов и тканей, парентераль-
ные вмешательства на территориях с высоким (>1%) уровнем
распространения ВИЧ.
• Факты, свидетельствующие о возможности заражения ВИЧ:
— половые связи, прием психоактивных веществ, парентеральные
вмешательства на территориях с низким уровнем распростране-
ния ВИЧ;
— отсутствие факторов очень высокого, высокого или определен-
ного, а тем более возможного риска заражения ВИЧ ставит под
сомнение данные лабораторных исследований, которые в таких
случаях рекомендуется повторить.
6.1. Постановка диагноза ВИЧ-инфекции
125
Клинические критерии диагностики ВИЧ-инфекции
Одним из наиболее характерных для ВИЧ-инфекции симптомов,
который может встречаться практически на всех стадиях заболевания,
является так называемая генерализованная персистирующая лим-
фаденопатия. Однако увеличение лимфатических узлов у больных
ВИЧ-инфекцией может и не отмечаться или отмечаться, но не соот-
ветствовать критериям генерализованной персистирующой лимфаде-
нопатии.
Кроме того, предполагать ВИЧ-инфекцию можно при обнаруже-
нии у больного заболеваний, которые обычно не развиваются у людей
с нормальным иммунитетом. Особенно это касается тяжелых форм
этих заболеваний.
В частности, о высокой вероятности ВИЧ-инфекции свидетель-
ствует обнаружение у пациента хотя бы одного из перечисленных ниже
заболеваний (при отсутствии других причин для их развития). К ним
относятся следующие.
• Кандидоз трахеи, бронхов, легких, пищевода.
• Кокцидиоидомикоз (диссеминированный или внелегочный).
• Криптококкоз внелегочный.
• Криптоспоридиоз с диареей более 1 мес.
• ЦМВ-инфекция (поражение других органов, кроме печени, селе-
зенки, лимфатических узлов, у больных старше 1 мес, ЦМВ рети-
нит с потерей зрения).
• Инфекция, обусловленная вирусом простого герпеса (хрониче-
ские язвы, не заживающие более 1 мес, или бронхит, пневмония,
эзофагит).
• Прогрессирующая деменция, приводящая к затруднениям в пов-
седневной деятельности.
• Синдром истощения — потеря массы тела более 10% исходной,
диарея продолжительностью не менее 1 мес или лихорадка более
1 мес.
• Гистоплазмоз (диссеминированный или внелегочный).
• Изоспороз кишечника хронический (>1 мес).
• Саркома Капоши.
• Лимфома Беркитта.
• Иммунобластная саркома.
• Лимфома головного мозга первичная.
• Микобактериозы, вызванные М. avium-intracellulare, M. kansassii
или другими атипичными микобактериями (диссеминированные
126
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
или с поражениями вне легких, кожи, шейных или воротных лим-
фатических узлов).
• ТБ внелегочный.
• Сальмонеллезная (но не тифопаратифозная) возвратная септице-
мия.
• Пневмоцистная пневмония.
• Прогрессирующая многоочаговая лейкоэнцефалопатия.
• Токсоплазмоз головного мозга у пациентов старше 1 мес.
Кроме того, у многих больных ВИЧ-инфекцией имеются признаки
развивающихся на фоне иммунодефицита вторичных заболеваний,
не перечисленных в этом списке (бактериальные поражения, кандидоз-
ные стоматиты, вульвовагиниты и т.д.). Несмотря на то что они доста-
точно часто встречаются не только у больных ВИЧ-инфекцией, такие
поражения можно рассматривать как свидетельствующие об опреде-
ленной вероятности наличия ВИЧ-инфекции.
Несмотря на то что иногда наблюдается бессимптомное течение
ВИЧ-инфекции, отсутствие каких-либо ее клинических проявлений
заставляет более критично относиться к данным лабораторных иссле-
дований и повторить их.
6.1.2. ЛАБОРАТОРНОЕ ПОДТВЕРЖДЕНИЕ ДИАГНОЗА ВИЧ-ИНФЕКЦИИ
Лабораторное исследование на ВИЧ проводят при обязательном
согласии пациента, и ему должно предшествовать дотестовое консуль-
тирование пациента по вопросам ВИЧ-инфекции. После исследова-
ния, при любом его исходе, проводят послетестовое консультирование.
Цель консультирования — информирование пациента по вопросам
профилактики ВИЧ-инфекции, осознание им степени опасности свое-
го поведения с точки зрения возможности заражения ВИЧ-инфекцией
и мотивация изменения поведения в сторону более безопасного,
а также психологическая подготовка пациента к адекватному вос-
приятию возможного диагноза ВИЧ-инфекции и адаптация его к воз-
можной перспективе жизни с ВИЧ-инфекцией. Консультирование
проводит специально подготовленный специалист, необязательно
медицинский работник. В случае получения положительного результа-
та исследования на ВИЧ или подтверждения диагноза ВИЧ-инфекции
послетестовое консультирование проводит подготовленный специ-
алист с медицинским образованием.
6.1. Постановка диагноза ВИЧ-инфекции
127
Для лабораторной диагностики ВИЧ-инфекции используют различ-
ные методы обнаружения ВИЧ, его антигенов и генетического матери-
ала, а также антител к ВИЧ.
Обнаружение антител к ВИЧ
В России в настоящее время стандартной процедурой лаборатор-
ной диагностики ВИЧ-инфекции служит обнаружение антител к ВИЧ
методом иммуноферментного анализа с последующим подтверждени-
ем их специфичности в реакции иммунного блоттинга.
Антитела к ВИЧ появляются у 90-95% зараженных в течение 3 мес
после заражения, у 5—9% — через 6 мес от момента заражения и
у 0,5-1% — в более поздние сроки. Наиболее ранний срок обнаружения
антител — 2 нед от момента заражения.
Обнаружение антител к ВИЧ включает два этапа. На первом этапе
проводят выявление суммарного спектра антител к антигенам ВИЧ
с использованием различных тестов, обычно иммуноферментных.
На втором этапе методом иммунного блоттинга проводят определе-
ние антител к отдельным антигенам вируса. Заключение о наличии
или отсутствии в исследуемом образце антител к ВИЧ делают на осно-
вании результатов второго этапа.
В работе допустимо использование только тест-систем, разрешенных
к применению Министерством здравоохранения РФ. Диагностические
процедуры необходимо проводить только в соответствии с утвержден-
ными инструкциями по применению соответствующих тестов.
Серологическая диагностика ВИЧ-инфекции у детей, рожден-
ных от ВИЧ-инфицированных матерей, имеет свои особенности.
Как у инфицированных, так и у неинфицированных детей в первые
6—12 мес жизни (иногда до 18) обнаруживают антитела к ВИЧ мате-
ринского происхождения. У неинфицированных детей эти антите-
ла исчезают, а у инфицированных ВИЧ начинают вырабатываться
собственные. Критерием, свидетельствующим о наличии у ребенка
ВИЧ-инфекции, является обнаружение у него антител к ВИЧ в воз-
расте 18 мес и более. Отсутствие антител к ВИЧ у ребенка в возрасте
12 мес и более, рожденного от инфицированной ВИЧ матери, свиде-
тельствует против наличия у него ВИЧ-инфекции (если он не получал
грудного вскармливания).
Обнаружение ВИЧ, его антигенов и генетического материала
Выделение и идентификация культуры ВИЧ является достоверным
признаком инфицирования ВИЧ, однако этот метод малодоступен,
128
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
требует длительного времени, высокой квалификации исполнителей,
специального оборудования, кроме того, он достаточно дорогостоя-
щий. Именно поэтому выделение вируса и его идентификацию про-
водят только в научных целях или в исключительно сложных для диа-
гностики случаях.
В настоящее время в России разрешены к применению тест-системы
для обнаружения антигенов и генетического материала ВИЧ, чаще
методом ПЦР. Эти тест-системы могут давать положительные реак-
ции на наличие маркеров ВИЧ в ранних стадиях ВИЧ-инфекции,
до того как концентрация антител достигнет уровня, достаточного для
их определения. При положительных результатах на ВИЧ-инфекцию
в тест-системах данных типов следует провести исследование на анти-
тела к ВИЧ. При обнаружении антител следует придерживаться стан-
дартной диагностической тактики.
У детей, рожденных ВИЧ-инфицированными матерями, обнару-
жение антител к ВИЧ в течение первых полутора лет жизни не явля-
ется подтверждением ВИЧ-инфекции, и исследование, направленное
на обнаружение генетического материала ВИЧ, имеет особое практиче-
ское значение. Обнаружение с помощью лицензированных тест-систем
генетического материала (ДНК или РНК) ВИЧ в двух (взятых в разное
время) образцах крови пациента является критерием, подтверждаю-
щим наличие у него ВИЧ-инфекции (при обследовании ребенка пупо-
винную кровь не используют).
Применяемые в настоящее время генно-инженерные методы
позволяют провести не только качественный (определение наличия),
но и количественный анализ содержания генетического материала ВИЧ
в крови. Определение количества копий РНК ВИЧ в крови (так
называемой вирусной нагрузки) имеет большое значение для оценки
эффективности APT.
Неспецифические лабораторные признаки ВИЧ-инфекции
При прогрессировании ВИЧ-инфекции наблюдаются снижение
количества лимфоцитов, особенно С04+-лимфоцитов, увеличение
процентного содержания С08+-лимфоцитов, инверсия соотношения
CD4/CD8 (снижение этого значения менее 1), возрастание количе-
ства иммуноглобулинов и другие изменения. Обнаружение этих при-
знаков служит дополнительным свидетельством в пользу диагноза
ВИЧ-инфекции. Однако эти изменения неспецифические. Они могут
отсутствовать, иметь индивидуальные колебания у разных пациентов,
встречаться при других заболеваниях.
6.1. Постановка диагноза ВИЧ-инфекции
129
6.1.3. ОБОСНОВАНИЕ И ФОРМУЛИРОВКА ДИАГНОЗА ВИЧ-ИНФЕКЦИИ
При постановке диагноза ВИЧ-инфекции в медицинской докумен-
тации записывают сам диагноз и его обоснование.
При обосновании диагноза следует указать эпидемиологические,
клинические и лабораторные данные, на основании которых постав-
лен диагноз ВИЧ-инфекции. При формулировке диагноза констати-
руют наличие ВИЧ-инфекции, указывают стадию и фазу заболевания.
Стадию заболевания определяют по наиболее тяжелому состоянию,
которое когда-либо отмечалось у пациента.
Необходимо также указать вторичное заболевание (или заболева-
ния), обусловившее стадию болезни, и, если ВИЧ-инфекция находится
в стадии прогрессирования, указать заболевание (или заболевания),
обусловившее фазу прогрессирования.
Помимо вторичных заболеваний, т.е. заболеваний, развивающих-
ся вследствие характерного для ВИЧ-инфекции иммунодефицита,
у больных ВИЧ-инфекцией часто отмечаются заболевания, имеющие
сходные с ВИЧ-инфекцией механизмы передачи (сифилис и другие
инфекции, передаваемые половым путем, вирусные гепатиты) или спо-
собствующие заражению ВИЧ (наркомания). Кроме того, у больных
ВИЧ-инфекцией, как и у прочих пациентов, могут отмечаться другие
сопутствующие заболевания, которые также должны быть отражены
в диагнозе.
Примеры формулировок диагноза
• ВИЧ-инфекция. Субклиническая стадия (3).
• ВИЧ-инфекция. Стадия вторичных заболеваний (4А) в фазе
прогрессирования при отсутствии APT. Опоясывающий лишай.
Кандидозный стоматит.
• ВИЧ-инфекция. Стадия вторичных заболеваний (4Б) в фазе про-
грессирования при отсутствии APT. Рецидивирующий опоясыва-
ющий лишай. Кандидозный стоматит. Сопутствующее заболева-
ние — хронический гепатит С.
• ВИЧ-инфекция. Стадия вторичных заболеваний (4В) в фазе
прогрессирования на фоне APT. Пневмоцистная пневмония.
Кандидозный стоматит.
• ВИЧ-инфекция. Стадия вторичных заболеваний (4В) в фазе
ремиссии на фоне APT. Пневмоцистная пневмония в анамнезе.
Пациентам, наблюдаемым в связи с эпидемически значимым контак-
том по ВИЧ-инфекции, устанавливают эпидемиологический диагноз:
130
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
• детям, родившимся от ВИЧ-инфицированных матерей, — «пери-
натальный контакт по ВИЧ-инфекции»;
• другим пациентам — «контакт по ВИЧ-инфекции».
С таким диагнозом пациента наблюдают, пока ВИЧ-инфекция
не будет подтверждена или опровергнута.
Формулировка диагноза при наличии туберкулеза у больных
ВИЧ-инфекцией
Согласно МКБ-10, связанных со здоровьем (в настоящее
время действует МКБ-10), каждый случай развития ТБ у больного
ВИЧ-инфекцией расценивается как болезнь, вызванная ВИЧ, с прояв-
лениями микобактериальной инфекции (код В20.0), под которой под-
разумевается такой ТБ, который не мог бы развиться без участия ВИЧ.
Классификация МКБ-10 предназначена в основном не для определе-
ния стадии ВИЧ и прогноза течения заболевания, а для статистических
целей. Именно поэтому прямых параллелей между ней и клинически-
ми классификациями нет. Однако аналогичный подход в отношении
ТБ присутствует и в клинических зарубежных классификациях — ВОЗ
и CDC (классификации такого типа иногда называют классификация-
ми стадий ВИЧ-инфекции).
Согласно российским подходам, при выявлении ТБ у больных
ВИЧ-инфекцией полный клинический диагноз должен включать:
стадию ВИЧ-инфекции, развернутый диагноз ТБ и других имеющих
место вторичных заболеваний. Например, если у больного в стадии
первичных проявлений ВИЧ-инфекции за счет транзиторного сни-
жения иммунитета имели место обострение или рецидив ТБ, то в этом
случае больному устанавливают диагноз «ВИЧ-инфекция. Стадия
первичных проявлений (2В)». Далее следует развернутый диагноз ТБ
согласно принятой в РФ классификации ТБ и других выявленных
вторичных заболеваний. В последнюю очередь указывают сопутству-
ющие болезни.
Пример 1. Основное заболевание: ВИЧ-инфекция, стадия первичных
проявлений, вариант течения В (2В), иммуноблот положительный
№234 от 2101.2019 г.
Вторичное заболевание: диссеминированный ТБ легких, фаза инфиль-
трации, МБТ+, Jiy(S, Е), группа диспансерного учета 1 (+) (код по МКБ-
10-В20.0).
Сопутствующее заболевание: хронический вирусный гепатит С, фаза
репликации.
6.2. Диагностика туберкулеза у больных ВИЧ-инфекцией
131
Как правило, ТБ как проявление вторичного заболевания при про-
грессировании ВИЧ-инфекции развивается при снижении количества
С04+-лимфоцитов менее 350 кл/мкл.
Пример 2. Основное заболевание: ВИЧ-инфекция, стадия вторичных
заболеваний 4Б, фаза прогрессирования при отсутствии APT. Иммуно-
блот положительный № 16от 09.02.2009 г.
Вторичные заболевания: ТБ ВГЛУ с бронхолегочным поражением
средней доли справа, экссудативный плеврит слева. МВТ—, группа
диспансерного учета /(-) (код по МКБ-10 — В20.0), опоясывающий
лишай (в анамнезе).
Сопутствующее заболевание: хронический вирусный гепатит С, фаза
репликации.
Пример 3. Основное заболевание: ВИЧ-инфекция, стадия вторичных
заболеваний 4В, фаза прогрессирования при отсутствии APT. Иммуноблот
положительный № 168 от 04.11.2011 г.
Вторичные заболевания: диссеминированный ТБ легких, фаза инфиль-
трации, МБТ+, множественная ЛУ (МЛУ), ТБ брюшины, абсцедирующий
мезаденит, группа диспансерного учета /(+) (код по МКБ-10— В20.0).
Пример 4. Основное заболевание: ВИЧ-инфекция, стадия вторичных
заболеваний 4В, фаза прогрессирования при отсутствии APT. Иммуноблот
положительный № 521 от 04.06.2012 г.
Вторичные заболевания: милиарный ТБ легких, МБТ-, туберкулезный
менингоэнцефалит, группа диспансерного учета !(—) (код по МКБ-10 —
В20.7), манифестная ЦМВ-инфекция с поражением пищевода, кишечника
(код по МКБ-10 - В20.7).
Сопутствующее заболевание: хронический вирусный гепатит В, HBsAg-
позитивный, без Ъ-агента.
В случае смерти больных ТБ, сочетанным с ВИЧ-инфекцией,
основной причиной смерти устанавливают ВИЧ-инфекцию (код В20.0
по МКБ-10), а ТБ рассматривают в качестве вторичного заболевания.
Правила оформления диагноза ТБ у больных ВИЧ-инфекцией
могут меняться в зависимости от принятых нормативных и регламен-
тирующих документов по ВИЧ-инфекции, ТБ или сочетанной инфек-
ции. Важно следить за нормативной базой.
6.2. ДИАГНОСТИКА ТУБЕРКУЛЕЗА У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
Подход к диагностике туберкулеза у ВИЧ-инфицированных лиц
существенным образом не отличается от такового у неинфицированных.
132
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
Однако эффективность такого подхода у ЛЖВ может иметь ограниче-
ния по следующим причинам.
• Клинические проявления, схожие с проявлениями туберкуле-
за, могут быть связаны и с другими вторичными заболеваниями
и, следовательно, менее специфичны для туберкулеза, чем у лиц
с ВИЧ-негативным статусом.
• Иммунологические тесты у ВИЧ-позитивных лиц (у взрослых
и детей) при иммуносупрессии обладают меньшей чувствительно-
стью, чем у ВИЧ-негативных.
• ВИЧ-инфицированные лица значительно чаще, чем ВИЧ-
негативные, могут иметь заболевания, обусловленные нескольки-
ми причинами, что может маскировать ответ на противотуберку-
лезную терапию.
• У ВИЧ-инфицированных лиц рентгенологические изменения
в легких при туберкулезе могут быть схожими с другими вторич-
ными и оппортунистическими заболеваниями, что затрудняет
интерпретацию скиалогической картины специалистами лучевой
диагностики.
• Туберкулез, развивающийся у пациентов при значительной им-
муносупрессии (уровень С04+-лимфоцитов менее 200 кл/мкл),
часто носит генерализованный характер с одновременным пора-
жением нескольких систем и органов.
Все впервые выявленные больные ВИЧ-инфекцией должны быть
обследованы на предмет исключения ЛТИ и активного туберкулеза.
С другой стороны, всем больным туберкулезом должно быть предложе-
но тестирование на ВИЧ с проведением до- и послетестового консуль-
тирования.
Основной принцип диагностики ТБ у больных ВИЧ-инфекцией
такой же, как и у пациентов с ВИЧ-негативным статусом: выявление
достоверных признаков специфического воспаления (детекция воз-
будителя либо морфологическая верификация). Для диагностики ЛТИ
используются иммунологические туберкулезные тесты.
6.2.1. ВЫЯВЛЕНИЕ ВОЗБУДИТЕЛЯ (МИКОБАКТЕРИИ ТУБЕРКУЛЕЗА)
Самое важное в диагностике ТБ у больных ВИЧ-инфекцией —
выявление возбудителя.
Для оптимизации диагностики ТБ и назначения адекватных схем
химиотерапии в лабораториях противотуберкулезных учреждений при-
меняют следующий диагностический алгоритм:
6.2. Диагностика туберкулеза у больных ВИЧ-инфекцией
133
1) выявление возбудителя;
2) дифференциация МБТ от нетуберкулезных микобактерий;
3) определение лекарственной чувствительности возбудителя.
Для выявления в клиническом материале микобактерий могут быть
использованы как классические микробиологические методы (микро-
скопия, посев), основанные на фенотипических особенностях воз-
будителя (особенностях строения клеточной стенки, ростовых харак-
теристиках), так и молекулярно-генетические методы, позволяющие
выявлять возбудителя по наличию в структуре ДНК видоспецифиче-
ских последовательностей (чаще — метод ПЦР).
Микроскопия
У больных ВИЧ-инфекцией рекомендуют использовать следующие
микроскопические методы: прямую бактериоскопию мазков из пато-
логического материала, окрашенных по Цилю—Нильсену, люминес-
центную микроскопию, светодиодную микроскопию. Преимущества
методов: низкая стоимость исследования, быстрое получение резуль-
тата — через 3 ч после сбора мокроты. Микроскопическое иссле-
дование не позволяет дифференцировать микобактерий комплек-
са М. tuberculosis от нетуберкулезных микобактерий.
Микроскопия по Цилю—Нильсену позволяет выявить возбудителя,
когда в 1 мл мокроты содержится не менее 5000—10 000 МБТ, и при
условии, если просмотрены 300 полей зрения. При незначительном
количестве МБТ в мокроте метод неэффективен.
Люминесцентная микроскопия основана на использовании специ-
альных красителей (родамина, аурамина), которые окрашивают МБТ,
и в ультрафиолетовых лучах наблюдается их характерное свечение.
Метод на 10—15% повышает возможность выявления МБТ в сравне-
нии с прямой бактериоскопией мазка, позволяя просмотреть боль-
шее количество полей зрения. При традиционной люминесцентной
микроскопии обычно используют кварцево-галогенную или ртутную
лампу высокого давления в качестве источника света. Традиционная
флюоресцентная микроскопия требует значительной технической
компетенции; капиталовложения и расходы также значительно выше.
Именно поэтому применение люминесцентной микроскопии реко-
мендуют в лабораториях, выполняющих ежедневно большое количе-
ство исследований (порядка 30 и более).
Светодиодная люминесцентная микроскопия. Светодиодная техно-
логия позволяет сделать люминесцентную микроскопию более деше-
вым анализом за счет использования недорогого источника света.
134
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
Светодиодные микроскопы используют меньше электрической энер-
гии, способны работать на аккумуляторных батареях. Эксперты ВОЗ
подтвердили диагностическую точность светодиодной микроскопии
по сравнению с люминесцентной и большую эффективность по срав-
нению с микроскопией по Цилю—Нильсену.
Культуральные методы
Культивирование микобактерий и идентификация М. tuberculosis
обеспечивают точную диагностику ТБ, значительно увеличивая коли-
чество случаев выявления по сравнению с микроскопией (обыч-
но на 30—50%), и являются «золотым стандартом» диагностики ТБ.
Разрешающая способность метода — 10—50 бактериальных тел в 1 мл
диагностического материала. Культивирование обеспечивает полу-
чение изолятов, необходимых для традиционного определения лекар-
ственной чувствительности. Недостаток метода — длительный период
получения результата (от 1 до 3 мес).
В России культуральные исследования диагностического материала
традиционно осуществляют на плотных средах. В результате многочис-
ленных сравнительных испытаний установлено, что для культураль-
ной диагностики ТБ следует использовать как минимум две разные
по составу питательные среды. Наиболее широкое распространение
получил набор из 2 сред: Левенштейна—Йенсена и Финна-П.
Культивирование на жидких средах повышает выявляемость на 10%
по сравнению с плотными средами. Во всем мире, а в последнее деся-
тилетие и в ряде крупных лабораторий РФ широко используют систе-
мы автоматической детекции роста микобактерий ВАСТЕС MGIT-
960, которые позволяют ускорить получение результата по сравнению
с посевом на плотные питательные среды на недели. В среднем поло-
жительный результат получают через 14—21 день.
Выявление МВТ молекулярно-генетическими методами
Использование молекулярных методов позволило по-новому взгля-
нуть на эпидемиологию ТБ и оценить генетическое разнообразие
штаммов микобактерий, циркулирующих в РФ. С точки зрения эпи-
демиологии применение методов молекулярной диагностики дало
возможность описать штаммы, преимущественно циркулирующие
в данной местности, определить пути их передачи и проводить эпиде-
миологические расследования в клинической практике.
Для выявления возбудителя широко используют метод ПЦР, осно-
ванный на выявлении в геноме микобактерий видоспецифических
6.2. Диагностика туберкулеза у больных ВИЧ-инфекцией
135
последовательностей. Метод зарекомендовал себя как высокоспеци-
фичный и чувствительный. Предпочтительны тест-системы с детекци-
ей результата в режиме реального времени. Получение положительного
результата методом ПЦР дает возможность в течение одного дня уста-
новить наличие МВТ в диагностическом материале. Внедрение метода
ПЦР позволяет значительно сократить сроки подтверждения диагноза
ТБ. Получение положительного результата методом ПЦР не требует
дополнительной дифференциации МВТ от нетуберкулезных мико-
бактерий, поскольку положительный результат однозначно указывает
на принадлежность к МВТ. В настоящее время в РФ зарегистрировано
большое количество тест-систем для выявления ДНК МВТ методом
ПЦР, отличающихся способом детекции результатов.
Видовая идентификация микобактерий
Положительные культуры подвергают идентификации для диффе-
ренциации МВТ от нетуберкулезных микобактерий. Это особенно важно
у ВИЧ-инфицированных пациентов, так как нетуберкулезный микобак-
териоз является одним из СПИД-индикаторных заболеваний. Лечение
нетуберкулезных микобактерий принципиально отличается от лечения
ТБ. Лаборатории, проводящие определение лекарственной чувствитель-
ности, должны как минимум дифференцировать МВТ от других нету-
беркулезных микобактерий. Дополнительная идентификация до вида
обязательна только для региональных бактериологических лабораторий.
Определение лекарственной чувствительности возбудителя
Определение устойчивости микобактерий к ПТП имеет особое
значение для выбора правильной тактики химиотерапии больных,
контроля эффективности лечения, определения прогноза заболевания
и проведения эпидемиологического мониторинга ЛУ микобактерий
в пределах отдельной территории, страны и мирового сообщества.
Существует довольно много различных методов определения ЛУ.
Фенотипические методы (метод абсолютных концентраций) включа-
ют культивирование МВТ в присутствии ПТП (рост культуры указы-
вает на ЛУ, а ингибирование роста — на лекарственную чувствитель-
ность), результат получают через 21 день после добавления препара-
тов. В мире в качестве современного «золотого стандарта» выявления
Л У МВТ рекомендуются автоматизированные системы с использова-
нием жидких питательных сред. Система ВАСТЕС MGIT-960 может
быть использована для определения чувствительности МВТ к ПТП.
Результат можно получить через 7—14 дней после роста культуры.
136
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
Генотипические методы позволяют выявлять специфические мута-
ции, связанные с резистентностью к определенным препаратам.
Основным достоинством всех молекулярно-генетических методов
тестирования ЛУ МВТ являются быстрота получения результатов
и оперативное выявление больных МЛУ ТБ, так как все тест-системы
позволяют выявить ЛУ к рифампицину, которой считается маркером
МЛУ. Генотипические методы имеют много важных преимуществ для
совершенствования контроля лекарственно-устойчивого ТБ, особенно
в том, что касается скорости получения результата, стандартизации
тестов, возможности для высокой производительности и сниженной
необходимости в соблюдении биобезопасности. Конечная цель выпол-
нения молекулярных анализов — быстрая первичная идентифика-
ция МЛУ ТБ. Применение молекулярно-генетических тест-систем
позволяет проводить определение лекарственной чувствительности
МБТ непосредственно из диагностического материала. В этом случае
получение результата о наличии у больного МЛУ ТБ возможно через
1 —2 дня после поступления материала.
Однако применение молекулярно-генетических методов не исклю-
чает проведение традиционных кул ьтурал ьных методов. Часто в диагно-
стическом материале оказывается недостаточное для детекции количе-
ство МБТ. Молекулярно-генетические тест-системы на определение
ЛУ представлены четырьмя основными вариантами: биологическими
микрочипами, ПЦР в режиме реального времени, ДНК-стриповой
технологией, набором Xpert MTB/RIF. Использование набора Xpert
MTB/RIF позволяет непосредственно из нативной мокроты в очень
короткие сроки (90 мин) одновременно выявить ДНК МБТ и генети-
ческую устойчивость возбудителя к рифампицину. Бесспорные пре-
имущества метода — полностью автоматизированная система, нивели-
рование фактора человеческой ошибки и возможность проводить даже
в самых простых медицинских учреждениях.
Современный алгоритм этиологической диагностики на ТБ включа-
ет исследование минимум двух образцов мокроты. Из каждого декон-
таминированного образца мокроты выполняется: микроскопия и посев
мокроты на твердые и/или жидкие питательные среды для выявления
микобактерий, молекулярно-генетическое исследование с определе-
нием лекарственной чувствительности как минимум к рифампицину,
идентификация культуры, выросшей на питательных средах, определе-
ние чувствительности МБТ к противотуберкулезным препаратам.
При этом важно получить достаточное количество мокроты для
исследования (более 3—5 мл), откашлянной из нижних отделов
6.2. Диагностика туберкулеза у больных ВИЧ-инфекцией
137
дыхательных путей, поскольку в ином случае значительно уменьша-
ется вероятность обнаружения МБТ. Если пациент не может откаш-
лять мокроту, для стимуляции ее отхождения проводят ингаляцию 3%
гипертоническим раствором натрия хлорида в течение 10-15 мин. Если
в мазках мокроты не удается выявить кислотоустойчивые бактерии,
а клинические проявления свидетельствуют о высокой вероятности
туберкулезного процесса, показана фибробронхоскопия с исследова-
нием БАЛ. Несмотря на то что у ВИЧ-инфицированных исследование
БАЛ не является ни более чувствительным, ни более специфичным,
чем исследование мокроты, бронхоскопия бывает очень полезной
в дифференциальной диагностике ТБ и других заболеваний, потому что
у ВИЧ-инфицированных нередко развивается сразу несколько заболе-
ваний легких. Кроме того, при гистологическом исследовании брон-
хиального или трансбронхиального биоптата могут быть обнаружены
гистологические маркеры туберкулезного воспаления. На следующий
день после бронхоскопии следует снова собрать мокроту для анализа,
поскольку после этой процедуры вероятность выявления микобакте-
рии очень высока даже у пациентов, у которых в жидкости, полученной
при БАЛ, микобактерии не были обнаружены. Сбор мокроты проводят
в специально подготовленном помещении больницы или в амбулатор-
ных условиях. Собранные образцы должны быть немедленно доставле-
ны для микробиологического исследования.
Посев и приготовление мазка выполняют параллельно из осадка
одного образца диагностического материала. В случае, если лаборато-
рия оснащена автоматизированной системой ВАСТЕС MGIT-960, для
одного из трех образцов рекомендуют провести посев из осадка мате-
риала на 1 пробирку с жидкой питательной средой и параллельно —
на 1 пробирку с плотной питательной средой.
Выявить возбудителя (МБТ) в респираторном материале
у ВИЧ-инфицированных больных ТБ органов дыхания при использо-
вании современного алгоритма этиологической диагностики удается
в 70-80% случаев.
При ТБ множественных локализаций МБТ выявляют у 40-80%
пациентов в спинномозговой жидкости, экссудате, моче, содержимом
из свища, биопсийном материале и др. При этом доказано, что у боль-
ных с полиорганным ТБ чувствительность исследования различного
диагностического материала традиционными бактериологическими
методами не ниже, чем при исследовании мокроты. При глубокой
иммуносупрессии у 10-15% больных ТБ определяется бактериемия
при посевах крови.
138
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
Проблема распространения штаммов МБТ, резистентных к специфи-
ческим химиопрепаратам, имеет в настоящее время огромное значение
как для нашей страны, так и для всего мира. Особые опасения вызывает
рост количества случаев сочетания МЛУ ТБ и ВИЧ-инфекции. Во мно-
гих исследованиях отмечено, что МЛУ ТБ у ВИЧ-инфицированных
встречается достоверно чаще, чем у больных с моноинфекцией ТБ. Доля
больных ВИЧ-инфекцией с МЛУ МБТ в Российской Федерации дости-
гает 40% среди всех вновь выявленных случаев. По результатам метаа-
нализа 58 публикаций, посвященных этой проблеме, выявлена высокая
вероятность связи ВИЧ-инфекции и первичной МЛУ МБТ.
6.2.2. МОРФОЛОГИЧЕСКАЯ ДИАГНОСТИКА
Основное правило, которое касается почти всех вторичных забо-
леваний, включая ТБ, неизменно: чем тяжелее иммунодефицит, тем
раньше следует начинать интенсивно обследовать больного, включая
инвазивные методы диагностики. При неинформативности туберку-
линодиагностики, диаскинтеста и IGRA-тестов, нередко отсутствия
выявления МБТ в мокроте или другом диагностическом материале при
расширении дифференциально-диагностического ряда за счет других
вторичных заболеваний в диагностике ТБ значимую роль приобретает
морфологическая верификация заболевания с помощью малоинвазив-
ного хирургического вмешательства.
Наиболее часто биопсийный материал получают во время следую-
щих исследований и хирургических вмешательств.
• При поражении ОГК:
— фибробронхоскопия с биопсией бронха;
— фибробронхоскопия с чрезбронхиальной биопсией легкого;
— биопсия плевры: видеоторакоскопия с биопсией плевры, от-
крытая биопсия плевры, пункционная игловая биопсия
плевры;
— медиастиноскопия с биопсией ВГЛУ;
— открытая биопсия легкого.
• При поражении ПЛУ:
— игловая аспирационная биопсия лимфатического узла;
— расширенная биопсия пораженного лимфатического узла.
• При поражении органов брюшной полости:
— колоноскопия с биопсией пораженного участка кишки;
— эзофагогастродуоденоскопия с биопсией пораженного участка
пищевода и желудка;
6.2. Диагностика туберкулеза у больных ВИЧ-инфекцией
139
- диагностическая лапароскопия;
- лапаротомия.
• При поражении других органов:
- биопсия кожи;
- орхэктомия;
- любая операция по лечебным показаниям.
Морфология туберкулезного воспаления тесно связана с состоя-
нием иммунной системы макроорганизма больного и в значительной
степени зависит от него. Именно поэтому гистоморфологические про-
явления туберкулезного воспаления при ВИЧ-инфекции теряют свои
специфические признаки по мере ее прогрессирования. При гистоло-
гическом исследовании тканей у больных ВИЧ-инфекцией, умерших
от ТБ, как правило, не обнаруживают классических специфических
гранулем.
Результаты по изучению особенностей гистологической картины
операционно-биопсийного материала у больных ВИЧ-инфекцией
в зависимости от степени иммуносупрессии показали, что у боль-
ных сочетанной инфекцией с количеством С04+-лимфоцитов более
350 кл/мкл сохраняется способность к формированию типичной
гранулематозной реакции. В биоптатах пациентов с более тяже-
лой степенью иммуносупрессии (количество С04+-лимфоцитов —
от 200 до 350 кл/мкл) преобладает несовершенная стертая грану-
лематозная реакция. Это свидетельствует о смене реакции гипер-
чувствительности замедленного типа, типичной для ТБ, реакцией
гиперчувствительности немедленного типа. Состояние выраженного
иммунодефицита (при количестве С04+-лимфоцитов менее 200 кл/мкл)
характеризуется в большинстве случаев некротическими изменениями
с выраженным экссудативным компонентом воспаления, в боль-
шей степени напоминающим неспецифическое бактериальное гной-
но-некротическое воспаление. Такая картина значительно затрудняет
морфологическую диагностику ТБ. При недостаточном опыте пато-
логический процесс можно принять за неспецифическое бактериаль-
ное воспаление, что препятствует постановке правильного диагноза.
Однако при гистобактериоскопии с окраской по Цилю-Нильсену
практически всегда удается обнаружить кислотоустойчивые бактерии
в большом количестве (20—50 и более в одном поле зрения).
Таким образом, у больных ВИЧ-инфекцией, особенно на фоне
выраженной иммуносупрессии, важно комплексное поэтапное изу-
чение биопсийного материала с обязательным проведением микро-
скопической оценки биоптата, цитологического исследования,
140
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
гистобактериоскопии с окраской по Цилю—Нильсену, по возможности
иммуногистохимического исследования с мышиными моноклональ-
ными антителами Мус. tuberculosis и ПЦР для выявления ДНК МБТ
в нативном материале и из парафиновых гистологических блоков.
6.2.3. ИММУНОЛОГИЧЕСКИЕ ТУБЕРКУЛЕЗНЫЕ ТЕСТЫ
К иммунологическим тестам, характеризующим гиперчувствитель-
ность замедленного типа в ответ на введение специфического антигена,
относятся: туберкулинодиагностика, диаскинтест, IGRA-тесты. Эти
тесты являются методами диагностики ЛТИ и иногда дополняющими
клинический диагноз активного ТБ. Они указывают на наличие спе-
цифической сенсибилизации (иммунологической памяти) организма,
обусловленной прежними или текущими контактами с МБТ или (для
туберкулина) вакциной БЦЖ. Подобное состояние присуще как ЛТИ,
так и активному ТБ.
В настоящее время в клинической практике у больных
ВИЧ-инфекцией наиболее часто используют следующие тесты:
• пробу Манту;
• пробу с аллергеном туберкулезным рекомбинантным (диаскин-
тест);
• IGRA-тесты.
Проба Манту. Для ее проведения применяют туберкулин. Впервые
его выделил из продуктов жизнедеятельности МБТ Р. Кох в 1890 г.
Туберкулин представляет собой водно-глицериновый экстракт
из бульонной культуры туберкулезных бактерий. Он не обладает пол-
ными антигенными свойствами, т.е. не сенсибилизирует здоровый
организм и не вызывает образования противотуберкулезного иммуни-
тета. Туберкулин вызывает ответную реакцию только у людей, пред-
варительно сенсибилизированных МБТ или вакциной БЦЖ. На месте
внутрикожного введения туберкулина через 24-48 ч развивается спе-
цифическая аллергическая реакция замедленного типа в виде инфиль-
трата. Патоморфологически инфильтрат характеризуется отеком всех
слоев кожи с мононуклеарной и гистиоцитарной реакциями. Эти
реакции характеризуют степень аллергии — изменение чувствитель-
ности или реактивности организма на туберкулин, но не являются ме-
рой иммунитета.
Согласно рекомендациям ВОЗ и Международного союза по борьбе
с ТБ и легочными заболеваниями, пробу проводят с двумя туберкулино-
выми единицами очищенного туберкулина. В США и некоторых других
6.2. Диагностика туберкулеза у больных ВИЧ-инфекцией
141
странах вводят 5 туберкулиновых единиц очищенного туберкулина, что
считается эквивалентной по активности дозой.
Проба с аллергеном туберкулезным рекомбинантным (диаскинтест).
В препарат входит рекомбинантный белок, продуцируемый гене-
тически модифицированной культурой Escherichia coli BL21 (DE3)/
pCFP-ESAT, который содержит два антигена, абсолютно таких же,
как и в IGRA-тестах (ESAT-6 и CFP-10), присутствующих в виру-
лентных штаммах МВТ и отсутствующих в вакцинном штамме
БЦЖ. Этим определяется основное преимущество пробы с аллерге-
ном туберкулезным рекомбинантным и IGRA-тестов перед пробой
Манту. Результаты этих тестов дают строго специфичный иммунный
ответ на инфицирование МВТ, нивелируя перекрестную имму-
нологическую память на вакцинный штамм БЦЖ и большинство
нетуберкулезных микобактерий. Проба с аллергеном туберкулезным
рекомбинантным по аналогии с пробой Манту предназначена для
внутрикожного введения.
Пробу Манту и пробу с аллергеном туберкулезным рекомбинантным
выполняют следующим образом: предварительно на внутренней поверх-
ности средней трети предплечья участок кожи обрабатывают 70%
этиловым спиртом и просушивают стерильной ватой. Тонкую иглу
срезом вверх вводят в верхние слои кожи параллельно ее поверх-
ности — внутрикожно. При введении отверстия иглы в кожу тотчас
из шприца вводят строго по делению шкалы 0,1 мл раствора препарата.
При правильной технике в коже образуется папула беловатого цвета
в виде лимонной корочки диаметром 7—8 мм.
Кожные тесты выполняет по назначению врача специально обучен-
ная медицинская сестра, имеющая документ — допуск к производству.
Результаты кожных тестов могут быть оценены врачом или специально
обученной медицинской сестрой.
Оценку результатов кожных тестов проводят через 72 ч и начинают
с внешнего осмотра места введения туберкулина на предплечье.
При этом можно установить отсутствие реакции, наличие гипе-
ремии или инфильтрата. Необходимо отличать инфильтрат от гипе-
ремии. Для этого вначале пальпаторно определяют толщину складки
кожи предплечья над здоровым участком, затем — на месте введения
туберкулина. При инфильтрате кожная складка над ним утолщена
по сравнению со здоровым участком, при гиперемии — такая же. После
внешней оценки проводят измерение реакции прозрачной линейкой
(в миллиметрах). Варианты ответной реакции по кожным тестам пред-
ставлены в табл. 6.1.
142
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
Таблица 6.1
Оценка иммунологических кожных тестов по местной реакции кожи
в месте введения
Оценка теста
(реакция)
Отрицательная
Сомнительная
Положительная:
| слабо выраженная
умеренно выра-
женная
I выраженная
I Гиперергическая
Манту
1. Отсутствие папулы и гипе-
ремии.
2. Папула 1-2 мм
1. Гиперемия любого размера
при отсутствии папулы.
2. Папула 2-4 мм
1. У детей и подростков:
папула 5-17 мм.
2. У взрослых: папула
5-21 мм
Папула до 5 мм
Папула 5-9 мм
Папула 10-15 мм
1.17 (21) мм и более.
2. Папула любого размера
при наличии везикуло-некро-
тических реакций на ней,
региональный лимфангоит
АТР I
Отсутствие папулы и гипе- |
ремии,
«уколочная реакция» до 2 мм |
Гиперемия любого размера I
при отсутствии инфильтрата
(папулы) |
Папула 2-15 мм |
Папула до 5 мм ]
Папула 5-9 мм I
Папула 10-15 мм
1. Папула 15 мм и более.
2. Папула любого размера
при наличии везикуло-некро-
тических реакций на ней,
региональный лимфангоит
В целом у ВИЧ-инфицированных, даже с активным ТБ, чувстви-
тельность пробы Манту составляет всего 30—35%. Кроме того, по мере
уменьшения количества С04+-лимфоцитов чувствительность пробы
снижается еще больше ввиду пассивной анергии при иммунодефици-
те. При этом в одном из отечественных исследований было показано,
что эффективность обоих кожных тестов (АТР и проба Манту с 2 ТЕ)
снижается пропорционально уровню С04-лимфоцитов, и при сниже-
нии числа С04+-лимфоцитов мене 200 клеток/мкл становятся практи-
чески неинформативными.
При этом необходимо помнить, что положительный результат
пробы Манту будет также получен у пациентов, привитых вакциной
БЦЖ, а также у лиц, контактировавших с нетуберкулезными микобак-
териями.
6.2. Диагностика туберкулеза у больных ВИЧ-инфекцией
143
IGRA-тесты. Открытие антигенов, специфичных для Mycobacterium
tuberculosis и отсутствующих в Mycobacterium bovis BCG и большинстве
микобактерий окружающей среды, привело к разработке тестов in
vitro. В основе этих методов лежит выявление секреции интерферона-у
(Interferon-Gamma Release Assays — IGRA) мононуклеарными клетками
периферической крови в результате их взаимодействия со специфиче-
скими белками МВТ (ESAT-6 и CFP10). Гены, кодирующие эти белки,
находятся в регионе RDI {region of difference) генома МВТ, а также отсут-
ствуют в геноме Mycobacterium bovis BCG и большинстве нетуберкулез-
ных микобактерий. У людей с ВИЧ-негативным статусом эти тесты
показали высокую чувствительность и почти абсолютную специфич-
ность по выявлению ЛТИ. В Российской Федерации в клинической
практике используют тест-системы «T-SPOT-TB» и «QuantiFERON-TB
Gold». Широкому применению IGRA-тестов препятствуют высокая
стоимость исследования и необходимость специального лабораторного
оборудования.
В то же время установлено, что IGRA-тесты имеют более высо-
кие показатели информативности в диагностике ЛТИ на фоне
ВИЧ-инфекции, а уровень иммуносупрессии оказывает меньшее вли-
яние на результат.
Кроме этого, перед проведением тестирования на ЛТИ необходимо
учитывать противопоказания. Так, для кожных тестов противопо-
казаниями являются наличие аллергических и кожных заболеваний
(дерматит, псориаз в активной форме и др.), острые и хронические
инфекционные и соматические заболевания (в том числе эпилепсия)
в период обострения, бронхиальная астма, интервал менее 1 мес после
проведения профилактических прививок. Несоблюдение противопо-
казаний к постановке теста может привести к неопределенному либо
ложноположительному результату. Для IGRA-тестов подобных огра-
ничений нет, и, в случае противопоказаний к выполнению кожных
тестов, они являются тестами выбора.
Согласно данным метаанализа, ни IGRA, ни кожные тесты не имеют
высокой точности для прогнозирования активного ТВ, хотя положи-
тельные результаты IGRA-тестов все же имеют несколько более значи-
мую прогностическую ценность, что особенно важно в группах риска
по заболеванию ТВ. В целом большинство исследований полностью
не отвечали на вопрос о том, является ли положительный результат
IGRA-тестов маркером для оценки риска развития ТВ в будущем. Они
просто показали небольшую положительную связь между этими собы-
тиями.
144
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
Имеющиеся результаты исследований позволяют сделать вывод, что
пока не будут идентифицированы более специфичные прогностиче-
ские биомаркеры для диагностики ЛТИ, существующие тесты следует
выбирать на основе относительной специфичности в разных популяци-
ях и группах пациентов, логистики, стоимости и предпочтений людей.
6.2.4. ДИАГНОСТИКА ДРУГИХ, ПОМИМО ТУБЕРКУЛЕЗА,
ВТОРИЧНЫХ ЗАБОЛЕВАНИЙ
Трудность диагностики на поздних стадиях ВИЧ-инфекции нередко
определяется сочетанием нескольких вторичных заболеваний одно-
временно с ТБ. У 20—25% пациентов с количеством С04+-лимфоцитов
менее 200 кл/мкл поражение легких обусловлено одновременно
несколькими вторичными инфекциями (ТБ, пневмоцистозом, грибко-
вым поражением, ЦМВ-инфекцией и др.).
Именно поэтому у больных ВИЧ-инфекцией принципиально важно,
помимо своевременного выявления ТБ, проводить раннюю диагно-
стику других вторичных заболеваний с использованием современных
диагностических тестов (исследования крови на выявление ДНК ЦМВ
методом ПЦР для диагностики ЦМВ-инфекции; исследования спин-
номозговой жидкости на ДНК токсоплазмы, РНК ВИЧ, ДНК вируса
Эпштейна-Барр и магнитно-резонансной томографии головного мозга
при подозрении на церебральный токсоплазмоз или лимфому и др.).
6.2.5. ПРОБНАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ ТЕСТ-ТЕРАПИЯ
(EX JUVANTIBUS)
При отсутствии достоверных маркеров ТБ применяют эмпириче-
скую ПТТ ex juvantibus. Однако пробную терапию можно применять
в исключительных случаях как вынужденную меру. Согласно алгоритму
ВОЗ (2007), у тяжелого больного ВИЧ-инфекцией при отрицательной
микроскопии мазка пробный курс антибиотиков не является обяза-
тельным для постановки диагноза ТБ и начала ПТТ. Алгоритм направ-
лен на расширение показаний к раннему назначению ПТТ у тяже-
лых больных ВИЧ-инфекцией. Исследование эффективности раннего
эмпирического назначения ПТТ у тяжелых больных ВИЧ-инфекцией,
не дожидаясь результатов микробиологических анализов, значительно
улучшило выживаемость больных в Южной Африке.
Таким образом, этиологическая расшифровка ТБ у больных
ВИЧ-инфекцией на фоне иммуносупрессии представляет значительные
6.2. Диагностика туберкулеза у больных ВИЧ-инфекцией
145
затруднения. Это связано с многообразием клинических и рентгено-
логических проявлений, не характерных для классического течения
ТБ, сложностью морфологической верификации туберкулезного
процесса ввиду нетипичных характеристик специфического воспа-
ления, а также расширением дифференциально-диагностического
ряда за счет других вторичных заболеваний. Нередко изменения
в легких у таких пациентов обусловлены полиморбидным поражени-
ем, в том числе инфекционными, злокачественными и лимфопроли-
феративными заболеваниями.
При отсутствии достоверных маркеров ТБ у тяжелых больных
оправдано назначение терапии ex juvantibus с применением четырех
ПТП основного ряда с обязательным включением рифампицина/
рифабутина. Такая эмпирическая тактика позволяет значительно сни-
зить летальность у больных ТБ в сочетании с ВИЧ-инфекцией при
глубоком иммунодефиците.
Обобщая подходы к этиологической диагностике ТБ у больных
ВИЧ-инфекцией, важно отметить, что каждый диагностический тест
или методика имеют свои возможности и ограничения. Очевидно, что
система диагностики ТБ у больных ВИЧ-инфекцией будет двигаться
в направлении использования различных комбинаций тестов в зави-
симости от степени иммуносупрессии пациента и типа медицинского
учреждения.
В настоящее время для оптимизации диагностического поиска при
подозрении на ТБ у больного ВИЧ-инфекцией важно выполнять сле-
дующие рекомендации:
• соблюдать правила сбора мокроты, техники приготовления мазка
и посева на кислотоустойчивые микобактерии/МБТ, кратность
исследования;
• исследовать различный (любой возможный) диагностический
материал для выявления МБТ;
• обязательно включать в минимум диагностического обследования
молекулярно-генетические методы детекции МБТ из мокроты
и другого диагностического материала с возможностью раннего
выявления ЛУ МБТ (так как имеется высокий риск МЛУ ТБ);
• для визуализации характера диссеминации и состояния ВГЛУ
применять КТ ОГК;
• расширять показания к проведению различных инструментальных
и малоинвазивных хирургических методик для получения биоп-
сийного материала;
146
Глава 6. Диагностика туберкулеза у больных ВИЧ-инфекцией
• при исследовании операционно-биопсийного материала про-
водить поэтапную комплексную морфологическую диагностику
с выявлением возбудителя в тканях;
• применять современные диагностические методы верификации
других вторичных заболеваний (исследование крови на выявле-
ние ДНК ЦМВ методом ПЦР для диагностики ЦМВ-инфекции;
исследование спинномозговой жидкости на ДНК токсоплазмы,
ДНК вируса Эпштейна-Барр и магнитно-резонансная томогра-
фия головного мозга при подозрении на церебральный токсоплаз-
моз или лимфому и др.);
• у тяжелых больных на фоне выраженного иммунодефицита,
при отсутствии обнаружения возбудителя и видимых изменений
на рентгенограмме назначать терапию ex juvantibus с примене-
нием четырех ПТП основного ряда с обязательным включением
рифампицина/рифабутина.
Глава 7
ЛЕЧЕНИЕ ТУБЕРКУЛЕЗА
У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
Лечение ТБ и оценка его эффективности у больных ВИЧ-инфекцией
проводится врачом-фтизиатром совместно с врачом-инфекционистом,
прошедшими подготовку для работы с больными ВИЧ-инфекцией.
7.1. РЕЖИМЫ ХИМИОТЕРАПИИ ТУБЕРКУЛЕЗА
У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
Принципы лечения ТБ у больных ВИЧ-инфекцией такие же, как
и у пациентов с ВИЧ-негативным статусом.
• Своевременное начало лечения.
• Полихимиотерапия (4—6 ПТП).
• Длительное лечение.
• Использование рациональных организационных форм лечения,
удобных для больного.
• Индивидуализированный подбор схемы химиотерапии по резуль-
татам качественных исследований лекарственной чувствительно-
сти штаммов МБТ.
• Преемственность в ведении больного между стационарным
и амбулаторными этапами, при миграции, между ведомствами.
Кроме того, добавляют аспекты, имеющие принципиальное значе-
ние для успешного ведения больных ТБ в сочетании с ВИЧ-инфекцией.
• Совместное ведение пациента фтизиатром и инфекционистом.
• Своевременное назначение APT.
• По показаниям — проведение профилактики других вторичных
заболеваний в период лечения ТБ.
• Своевременная диагностика и адекватная терапия других, помимо
ТБ, вторичных заболеваний.
• Выявление и адекватная коррекция нежелательных/побочных
явлений на лекарственную терапию.
148
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
Химиотерапия ТБ у больных ВИЧ-инфекцией должна быть
начата в возможно ранние сроки после установления диагноза, а
у тяжелых больных оправдано ее эмпирическое назначение при
подозрении на ТБ.
Диагноз ТБ у больных ВИЧ-инфекцией подтверждается фти-
зиатрической Центральной врачебной контрольной комиссией.
Противотуберкулезная терапия заключается в длительном примене-
нии оптимальной комбинации лекарственных препаратов, подавляю-
щих размножение МБТ (бактериостатический эффект) или уничтожа-
ющих их в организме больного (бактерицидный эффект). Только при
подавлении размножения МБТ или их уничтожении возможен запуск
адаптационных механизмов, направленных на активацию репаратив-
ных процессов и создание в организме больного условий для полного
клинического излечения. Используют комбинацию из 4-6 ПТП одно-
временно, лечение проводят в два этапа. На первом этапе лечения —
этапе интенсивной терапии — происходит максимальное воздействие
на микобактериальную популяцию, исчезают клинические прояв-
ления и уменьшаются специфические воспалительные изменения
в органах, предотвращается развитие ЛУ. На втором этапе лечения —
этапе продолжения — подавляется оставшаяся часть микобактериаль-
ной популяции, происходит дальнейшая инволюция туберкулезного
процесса, восстанавливаются функциональные возможности орга-
низма, предотвращается обострение туберкулезного процесса.
Понятие «режим химиотерапии» включает комбинацию ПТП,
их дозы и сроки лечения. Режимы химиотерапии подразделяются
на стандартные и индивидуализированные.
Стандартный режим химиотерапии назначают всем больным при
неизвестной начальной лекарственной чувствительности возбудителя
и проводят до получения результатов идентификации выделенной
культуры возбудителя и ТЛЧ. При обнаружении ЛУ микобактерий
или при высоком риске резистентности проводят своевременную кор-
рекцию химиотерапии.
Важно отметить, что при любом режиме ПТТ в период основного
курса лечения осуществляют под непосредственным наблюдением
медицинского персонала.
Согласно современным представлениям, выделяют первичную
и приобретенную Л У (резистентность) МБТ. Под первичной лекар-
ственной резистентностью понимают устойчивость к одному препа-
рату и более у впервые зарегистрированных больных, ранее не при-
нимавших ПТП или получавших их не более 1 мес. Приобретенная
71 Режимы химиотерапии туберкулеза у больных ВИЧ-инфекцией
149
(вторичная) лекарственная резистентность — это устойчивость МБТ,
развившаяся во время лечения у больных, получавших ПТП более
1 мес. Приобретенная (вторичная) лекарственная резистентность — это
устойчивость МБТ, развившаяся во время лечения у больных, получав-
ших ПТП более 1 мес.
В отношении ранее лечившихся пациентов может применяться ком-
бинация препаратов первого ряда для лекарственно-чувствительного
ТБ или комбинация препаратов второго ряда для лекарственно-устой-
чивых форм.
В зависимости от количества и характеристики ПТП, к которым
определяется ЛУ МБТ, в настоящее время выделяют несколько следу-
ющих видов резистентности.
• Монорезистентность — устойчивость МБТ к одному ПТП.
• Полирезистентность — устойчивость МБТ к более чем одно-
му ПТП первого ряда, за исключением сочетания изониазида
и рифампицина.
• Изониазид-устойчивый ТБ (Ну-ТБ) относится к штаммам
Mycobacterium tuberculosis, у которых устойчивость к изониазиду
и чувствительность к рифампицину были подтверждены in vitro.
• МЛУ: устойчивость М. tuberculosis по крайней мере к изониазиду
и рифампицину одновременно вне зависимости от устойчивости
к другим ПТП. ТБ с МЛУ МБТ принято обозначать как МЛУ ТБ.
• ШЛУ: резистентность МБТ к изониазиду, рифампицину, хотя бы
к одному из фторхинолонов и аминогликозидов (канамицин/
амикацин) или полипептиду (капреомицин) вне зависимости
от устойчивости к другим ПТП.
На современном этапе выделяют так называемый «рифампицин-
устойчивый ТБ» (РУ ТБ), который определяется как невосприимчивый
к рифампицину по результатам ТЛЧ; для лечения такого ТБ приме-
няются режимы лечения МЛУ ТБ. Рифампицин-устойчивые штаммы
МБТ могут быть чувствительными или устойчивыми к изониазиду
(в таком случае речь идет о МЛУ ТБ) либо устойчивыми к другим
ПТП первого ряда (полирезистентность) или второго ряда (например,
ШЛУ). С практических позиций случаи МЛУ ТБ и РУ ТБ объединены
под названием МЛУ/РУ ТБ.
В настоящее время в Российской Федерации лечение туберкулеза
у больных ВИЧ-инфекцией проводится согласно режимам химио-
терапии, приведенным в клинических рекомендациях «Туберкулез
у взрослых» (РОФ, 2020 г.). Режимы химиотерапии назначаются
на основании индивидуальных результатов определения лекарственной
150
Глава 7 Лечение туберкулеза у больных ВИЧ-инфекцией
устойчивости возбудителя: I/III режимы назначаются при ле-
карственной чувствительности, II — при монорезистентности к Н
или полирезистентности, IV — при МЛУ с лекарственной чувствитель-
ностью к фторхинолонам, а V режим — при МЛУ с лекарственной
устойчивостью к фторхинолонам или на основании оценки риска МЛУ
ТБ в отсутствие лабораторного подтверждения (табл. 7.1).
Таблица 7.1
Стандартные режимы химиотерапии туберкулеза у взрослых (РОФ, 2020)
Режим
I/III
II
IV
V
Этап химиотерапии |
интенсивная терапия
Н R/Rb Z E[S]
3 Km/Am[Cm] Rb/R Z Lfx [Sfx Mfx]
[E] [Pto/Eto]
8Их[1Шх8*х]Вд*1_2с1С5Ягс]
[Cm/Km/Am] [E] [Z] [Pto/Eto] [PAS]
8Bq*LzdLfx/Mfx/SfxCsmd
[Cm/Km/Am]
[E] [Z] [Imp Mp] [Pto/Eto] [PAS]
терапия продолжения |
4HR/4HRE
12HR/Rb/12HR/RbE[Z]
6 H R/Rb E [Z]
6 Rb/R Z Lfx [Sfx Mfx] [E] [Pto/Eto]
9 Rb/R Z Lfx [Sfx Mfx] [E] [Pto/Eto]
12-18 Lfx [Mfx Sfx] Lzd [Z] СэЯгс]
[Pto/Eto] [PAS]
12-18 Lzd Lfx (1,0)/MfxCs/Trd[E]
[Z] [Pto/Eto] [PAS]
Примечание: * — Bq назначается на 6 мес.
По оценкам ВОЗ, РФ относится к 23 странам мира с самым высо-
ким уровнем МЛУ ТБ. Среди впервые выявленных больных моно-
инфекцией ТБ МЛУ возбудителя регистрируется в 15-20% случаев,
а у ранее леченных — в 2—4 раза чаще. Этот эпидемический пока-
затель значительно хуже среди популяции больных коинфекцией
(ВИЧ/ТБ). Многочисленные проведенные исследования демон-
стрируют связь эпидемий МЛУ ТБ и ВИЧ-инфекции. В России,
по данным различных региональных и госпитальных исследований,
первичная МЛУ МБТ регистрируется у 30-60% впервые выявлен-
ных больных ТБ в сочетании с ВИЧ-инфекцией. Выявленная связь,
вероятно, объясняется более значимой ролью свежего заражения,
или суперинфекции, в патогенезе развития заболевания над реакти-
вацией эндогенной инфекции у больных ВИЧ-инфекцией. По мере
прогрессирования иммунодефицита такие пациенты чаще заража-
ются штаммами МБТ с МЛУ, широко циркулирующими в настоя-
щее время в популяции.
7.1. Режимы химиотерапии туберкулеза у больных ВИЧ-инфекцией
151
Медленный рост МБТ требует значительного времени ожидания
результатов исследования. В среднем при посеве диагностического
материала для получения результатов на плотных средах требуется
21-36 дней, на жидких средах с помощью ВАСТЕС MGIT 960/320 —
12-22 дня. Длительность получения результатов культуральным мето-
дом исследования на плотных питательных средах неблагоприят-
но сказывается на эффективности химиотерапии, особенно в связи
с вероятностью неправильного выбора начальной схемы химиотера-
пии при наличии ЛУ у возбудителя и расширением спектра устойчи-
вости МБТ. Если врач будет ориентироваться только на результаты
ТЛЧ, полученные от выделенной культуры, то, учитывая быструю
прогрессию заболевания при иммуносупрессии, болезнь может завер-
шиться летально еще до начала адекватной ПТТ.
Именно поэтому выбор начального режима у больного
ВИЧ-инфекцией должен быть основан на данных о лекарственной
чувствительности МБТ как минимум к рифампицину на основании
результатов ускоренных молекулярно-генетических методов определе-
ния лекарственной чувствительности. В связи с этим принципиально
важно в диагностике ТБ у больного ВИЧ-инфекцией использовать
все возможности для выявления возбудителя и проведения ТЛЧ. Для
детекции МБТ необходимо исследовать любой диагностический мате-
риал (мокроту, БАЛ, экссудат, спинномозговую жидкость, мочу, кровь,
биопсийный материал и др.).
Для ускоренного получения результатов ТЛЧ возможно применение
различных молекулярно-генетических методов с возможностью опре-
деления ЛУ как минимум к рифампицину. Основное преимущество
молекулярных методов заключается не только в возможности быстро-
го выявления МБТ в материале, но и в определении мутаций в генах,
ассоциированных с резистентностью к тем или иным ПТП.
Имеется возможность применения различных молекулярно-гене-
тических методов (например, Xpert MTB/RIF, ТБ-БИОЧИП-МДР
или HAIN-GenoTypeDRplus и др.). ВОЗ рекомендует использовать
Xpert MTB/RIF как исходный диагностический тест для диагностики
ТБ у больных ВИЧ-инфекцией и выявления маркера МЛУ МБТ. Выбор
метода ускоренной диагностики должен быть обусловлен возможно-
стью лаборатории и количеством проводимых исследований.
Концепция лечения резистентных форм ТБ к настоящему времени
претерпела существенные изменения. В период с 2011 по 2018 г. ВОЗ
разработала и опубликовала стратегические рекомендации по лече-
нию пациентов с лекарственно-устойчивыми формами ТБ. В 2018 г.
152
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
ВОЗ объявила о знаковых изменениях в режимах лечения МЛУ ТБ
и опубликовала Руководство по лечению ТБ с МЛУ и устойчивостью
к рифампицину (редакция 2018 г.). В ноябре 2019 г. на основе фактиче-
ских данных экспертами ВОЗ было разработано Сводное руководство
по лечению лекарственно-устойчивого ТБ.
Изменения, предложенные в обзоре фактических данных, заклю-
чаются в постепенном отказе от схем, содержащих инъекционные
препараты, и введении более короткой, полностью пероральной
схемы, содержащей бедаквилин, для пациентов с МЛУ/РУ ТБ. Кроме
того, для пациентов с широкой ЛУ ТБ может использоваться более
короткая схема с бедаквилином, претоманидом^ и линезолидом.
Окончательное оформление обновления руководящих принципов
ВОЗ планируется в 2020 г.
Согласно действующей стратегии ВОЗ, при лечении ТБ с сохраненной
лекарственной чувствительностью к наиболее активным препаратам
(рифампицину и изониазиду) назначается режим, в интенсивной фазе лече-
ния включающий прием четырех препаратов основного (первого) ряда:
изониазида, рифампицина, этамбутола и пиразинамида. Стрептомицин
в настоящее время не упоминается в качестве дополнительного препара-
та в лечении лекарственно-чувствительных форм ТБ. Рифабутин назна-
чается вместо рифампицина при использовании в схеме APT ингиби-
торов протеазы и нуклеозидных ингибиторов обратной транскриптазы.
Фаза продолжения терапии чувствительных форм ТБ включает
применение двух препаратов: изониазида и рифампицина/рифабутина.
В фазе продолжения терапии допускается назначение изониазида,
рифампицина и этамбутола одновременно (при распространенных
деструктивных формах ТБ или в случаях повторного лечения). Исполь-
зование интермиттирующего приема ПТП настоятельно не рекомендуется,
так как, по данным различных исследований, рецидивы ТБ у больных,
принимавших препараты 3 раза в нед, развивались в 3-4 раза чаще
в сравнении с ежедневным приемом.
В настоящее время не получено доказательств, что удлинение сро-
ков терапии у больных ВИЧ-инфекцией улучшает результаты лечения.
При легочном ТБ у больных ВИЧ-инфекцией, получающих APT,
стандартная рекомендованная длительность основного курса лечения
не отличается от таковой у лиц, не инфицированных ВИЧ, и составляет
6 мес. В иных клинических ситуациях (внеторакальный ТБ, ТБ множе-
ственных локализаций) длительность лечения может быть аргументи-
рованно продлена по решению врачебной комиссии или Центральной
врачебной контрольной комиссии.
7.1. Режимы химиотерапии туберкулеза у больных ВИЧ-инфекцией
153
При выявлении рифампицин-чувствительного и Ну-ТБ следует
проводить лечение рифампицином, этамбутолом, пиразинамидом
и левофлоксацином в течение 6 мес. Анализ показал, что добавле-
ние стрептомицина (до 3 мес) к режиму лечения Ну-ТБ не увеличило
вероятность успешного лечения, а данных о применении других инъ-
екционных препаратов (канамицина, амикацина, капреомицина) для
лечения Ну-ТБ в настоящее время недостаточно, поэтому добавле-
ние к указанному режиму инъекционных препаратов (стрептомицина
или иных) не рекомендуется.
Эмпирическое лечение по указанной схеме, как правило, не про-
водится. Перед назначением комбинации рифампицина, этамбутола,
пиразинамида и левофлоксацина принципиально важно исключить
устойчивость к рифампицину с помощью рекомендованных ВОЗ гено-
типических или фенотипических методов. Кроме того, с целью миними-
зации риска амплификации резистентности целесообразно исключить
устойчивость к фторхинолонам и, по возможности, к пиразинамиду.
Назначение левофлоксацина рекомендовано всем пациентам с Ну-ТБ,
за исключением следующих случаев:
• при невозможности исключить устойчивость к рифампицину;
• при известной или предполагаемой устойчивости к фторхиноло-
нам;
• при известной непереносимости фторхинолонов;
• при известном или предполагаемом риске удлинения интерва-
ла Q- Т\
• в период беременности или грудного вскармливания (не является
абсолютным противопоказанием).
При невозможности применения фторхинолонов (рисктоксичности,
установленная резистентность) пациент с Ну-ТБ все же может получать
лечение в рамках 6-месячного режима REZ, при этом не рекомендуется
заменять левофлоксацин инъекционным препаратом. При известной
или предполагаемой устойчивости (например, к пиразинамиду) режим
лечения должен быть составлен индивидуально.
В случаях ТБ с риском Ну-ТБ (например, из тесного контак-
та с Ну-ТБ) режим REZ с левофлоксацином может быть назначен
до лабораторного подтверждения. Если последующие результаты ТЛЧ
укажут на сохраненную чувствительность к изониазиду, то прием
левофлоксацина прекращается, и дальнейшее лечение пациент будет
проходить по режиму ведения лекарственно-чувствительного ТБ
(2HREZ/4HR).
154
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
Продолжительность режима REZLfx составляет 6 мес вне зависи-
мости от ВИЧ-статуса пациента. Особенностью представленной схемы
является то, что режим лечения Ну-ТБ не состоит из интенсивной
и поддерживающей фаз: это облегчает его применение и монито-
ринг лечения. Увеличение продолжительности лечения по указанному
режиму более 6 мес возможно на индивидуальной основе при распро-
страненных или внелегочных формах ТБ.
При наличии технической возможности необходимо исследовать
информацию о конкретных мутациях, связанных с устойчивостью
к изониазиду (katG или inhA). Данные, полученные in vitro, позволяют
предположить, что при обнаружении специфических мутаций в гене
inhA (и при отсутствии каких-либо мутаций в гене katG) возможно
дополнительное назначение высоких доз изониазида (до 15 мг/кг
в сут), а схема лечения будет выглядеть следующим образом: 6(H)
REZLfx. При наличии мутаций katG, которые чаще всего обеспечива-
ют более высокий уровень устойчивости, использование изониазида
даже в более высокой дозе не будет эффективным.
Интерес к сокращению продолжительности лечения МЛУ ТБ в пос-
ледние годы привел к появлению ряда инициатив по лечению пациен-
тов с применением коротких режимов полихимиотерапии. Имеются
данные, что применение такого режима в когорте тщательно отобран-
ных пациентов с МЛУ ТБ позволяет добиться излечения более чем
в 85% случаев. Короткий режим лечения МЛУ/РУ ТБ — это в основ-
ном стандартный курс лечения МЛУ/РУ ТБ продолжительностью
9—12 мес, который заключается в приеме семи ПТП в период интен-
сивной фазы и четырех препаратов — в период фазы продолжения.
Режим включает применение канамицина, моксифлоксацина,
клофазимина, этионамида, пиразинамида, этамбутола и высоких доз
изониазида (4KmMfxCfzEtoZEHh/5 MfxCfzZE).
Важнейшим условием назначения такой схемы терапии МЛУ ТБ
является необходимость исключения устойчивости к фторхинолонам
и инъекционным препаратам второго ряда до назначения короткого
режима. Сведения о результатах ТЛЧ к пиразинамиду и генотипиро-
вание устойчивости к изониазиду (katG или inhA) также имеют важ-
нейшее значение и должны выполняться при наличии возможности.
Короткий режим лечения МЛУ/РУ ТБ не может быть назначен в сле-
дующих ситуациях:
• устойчивость хотя бы к одному из препаратов, используемых
в коротком режиме лечения МЛУ/РУ ТБ, или подозрение на его
неэффективность (кроме устойчивости к изониазиду);
7.1. Режимы химиотерапии туберкулеза у больных ВИЧ-инфекцией
155
• история приема одного или нескольких присутствующих в составе
режима препаратов второго ряда в течение более чем 1 мес (при
отсутствии подтвержденной чувствительности к данным препара-
там второго ряда);
• непереносимость любого препарата в составе короткого режима
лечения МЛУ/РУ ТБ или риск токсичности препарата в составе
короткого режима (например, в связи с межлекарственными взаи-
модействиями);
• беременность;
• диссеминированный ТБ, ТБ ЦНС;
• любая внелегочная форма ТБ у пациентов с ВИЧ-инфекцией.
При наличии любого из вышеперечисленных факторов пациент
должен получать лечение в соответствии с длительным режимом
лечения МЛУ/РУ ТБ.
В нашей стране невозможность использования такого режима
лечения обусловлена отсутствием клофазимина в качестве
зарегистрированного препарата для лечения резистентных форм ТБ.
Длительные режимы лечения МЛУ ТБ — это режимы, применя-
емые для лечения МЛУ/РУ ТБ. Их продолжительность составляет
18 мес или более. Эти режимы могут быть стандартными или индиви-
дуальными.
Противотуберкулезные препараты для лечения МЛУ/РУ ТБ раз-
деляются на 3 группы в зависимости от их пользы при использовании
влечении МЛУ/РУ ТБ (табл. 7.2).
Таблица 7.2
Группы препаратов, рекомендованных для длительных режимов лечения
МЛУ/РУ ТБ
Группы и этапы
Группа А. Включить все три пре-
парата
Группа В. Добавить один или оба
препарата
Препараты
левофлоксацин или моксиф-
локсацин
бедаквилин
линезолид
клофазимин
циклосерин или теризидон
Lfx или Mfx
Bq
Lzd
Cfz
Cs или Trd
156
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
Окончание табл. 7.2
Группы и этапы
Группа С. Добавить для укомплек-
тования режима или при невозмож-
ности использования препаратов
группы С
Препараты
этамбутол
Деламанид*
пиразинамид
имипенем/циластатин
или меропенем
амикацин или стрептомицин
этионамид или протионамид
парааминосалициловая кисло-
та, ПАСК*
Е I
Dim
Z
Imp-CIn J
или Mpm
Am или S
Eto или Pto '■
PAS
Примечание: * — Bq назначается на 6 мес.
При назначении схемы лечения пациентам с коинфекци-
ей ВИЧ/ТБ следует помнить, что тиоуреидоиминометилпиридиния
перхлорат и тиоацетазон не показаны к применению у пациентов
с ВИЧ-инфекцией. Тиоацетазон больше не входит в список обычно
рекомендуемых для использования препаратов, его не следует назна-
чать ВИЧ-положительным пациентам или пациентам с неизвестным
ВИЧ-статусом ввиду высокого риска развития синдрома Стивенса-
Джонсона и токсического эпидермального некролиза. В тех редких
случаях, когда тиоацетазон может рассматриваться в качестве одно-
го из компонентов лечения, ВИЧ-инфекция должна быть надежно
исключена.
При составлении длительного режима химиотерапии пациентов
с МЛУ/РУ ТБ необходимо включить в схему все три препарата группы А
и по крайней мере один препарат группы В, чтобы лечение начиналось
как минимум с четырех ПТП с вероятной высокой эффективностью
и продолжалось как минимум тремя препаратами после прекращения
приема бедаквилина.
Если для лечения используются только один или два препарата
группы А, то в режим необходимо включить оба препарата группы В.
Если режим не может быть составлен только из препаратов групп А и В,
их необходимо дополнить препаратами группы С.
Левофлоксацин или моксифлоксацин, бедаквилин ил инезол ид долж-
ны быть включены во все длительные режимы лечения МЛУ/РУ ТБ.
Клофазимин и циклосерин (или теризидон) целесообразно вклю-
чать в длительные режимы лечения МЛУ/РУ ТБ (клофазимин пока
не зарегистрирован в России в качестве ПТП).
7.1. Режимы химиотерапии туберкулеза у больных ВИЧ-инфекцией 157
Этамбутол, пиразинамид и Деламанид* можно включать в длитель-
ные режимы лечения МЛУ/РУ ТБ. Важно отметить, что применение
пиразинамида оправдано только при подтвержденной лекарственной
чувствительности к нему.
Амикацин можно включать в длительные режимы лечения МЛУ/
РУ ТБ у взрослых в случае подтверждения чувствительности к нему и при
возможности адекватного контроля нежелательных реакций. В случае
недоступности амикацина он может быть заменен на стрептомицин.
Канамицин и капреомицин не следует включать в длительные режимы
лечения МЛУ/РУ ТБ.
Этионамид или протионамид следует использовать в длительных
режимах лечения МЛУ/РУ ТБ только в том случае, если в режим не вхо-
дят бедаквилин, линезолид, клофазимин или Деламанид* или если
невозможно составить режим из более предпочтительных препаратов.
Парааминосалициловую кислоту можно включать в длительные
режимы лечения МЛУ/РУ ТБ только в том случае, если в них не входят
бедаквилин, линезолид, клофазимин или Деламанид* или при невоз-
можности составления из более предпочтительных препаратов.
Клавулановую кислоту, которая доступна только в сочетании
с амоксициллином, следует использовать только в качестве дополне-
ния к карбапенемам (имипенему/циластатину и меропенему): ее необ-
ходимо принимать с каждой дозой карбапенема и не следует рассматри-
вать как отдельный ПТП.
Режимы лечения туберкулеза, рекомендованные ВОЗ при различ-
ных вариантах лекарственной резистентности, приведены в табл. 7.3.
Таблица 7.3
Режим и схема лечения в зависимости от модели устойчивости
(адапт. Сводное руководство Всемирной организации здравоохранения
по лечению лекарственно-устойчивого туберкулеза, 2019)
Режим лечения
Лекарственная чув-
ствительность ТБ
НУ-ТБ
Короткий режим
лечения МЛУ/РУ ТБ
Длительный режим
лечения МЛУ/РУ ТБ
Этап химиотерапии
интенсивная терапия
2Н R/Rb Z Е
терапия продолжения
4 H Rb/R
4 H Rb/R E [ Z]
6 R Z E Lfx [H]
4KmMfxCfzEtoZEHh
6-7 Lfx [Mfx] BqLzdCs [Trd] Cfz
[E Dim Z Imp-Cln/Mpm Am/S
Eto/Pto PAS]
5MfxCfzZE
12-18 Lfx [Mfx] LzdCs [Trd]
[Cfz E Dim Z Eto/Pto PAS]
158
Глава 7 Лечение туберкулеза у больных ВИЧ-инфекцией
Продолжительность лечения больных, находящихся на длительном
режиме лечения МЛУ/РУ ТБ, составляет в среднем 18-20 мес.
Длительность интенсивной фазы лечения — 6—7 мес и может быть
удлинена по решению врачебной комиссии/ЦВВК. Предлагаемая дли-
тельность терапии после конверсии культуры составляет 15-17 мес.
Интенсивная фаза лечения должна содержать не менее 4 эффективных
ПТП, а фаза поддержки — не менее трех (дозы препаратов приведены
в табл. 7.4).
Таблица 7.4
Дозирование препаратов, используемых в режимах лечения МЛУ/РУ ТБ
у взрослых, в зависимости от веса
Препарат
левофлоксацин
моксифлоксацин
бедаквилин
линезолид
клофазимин
циклосерин
илитеризидон
Деламанид*
пиразинамид
имепенем/цила-
статин
меропенем
| амикацин
стрептомицин
этионамид
или протионамид
| ПАСК
Масса тела
<45 кг
750 мг
400 мг
>45 кг
1,0 г
400 мг
400 мг х 1 р/сут первые 2 нед; затем
200 мг х 3 раза в нед в течение
22 нед
600 мг
100 мг
500 мг
200 мг
1-1,5 г
600 мг
100 мг
750 мг
200 мг
1,5-2,0 г
2,0 г х 2 р/сут внутривенно
1,0 г х 3 р/сут или 2,0 г х 2 р/сут
внутривенно
625-750 мг
750 мг-1,0 г
рассчитать на массу тела
500 мг
8,0 г
750 мг-1,0 г
8,0-12,0 г
Примечание
|
|
|
|
10-15 мг/кг
200 мг в 2 приема
20-30 мг/кг
применять с клавулано-
вой кислотой (125 мг)
применять с клавулано-
вой кислотой (125 мг)
15-20 мг/кг
12-18 мг/кг
15-20 мг/кг
рекомендован прием
1 раз в день, но можно
начать с разделения
на 2 приема в день
до улучшения переноси-
мости
| 8-12 г/сут в 2-3 приема
7.2. Антиретровирусная терапия у больных с сочетанной инфекцией 159
Начальный режим лечения МЛУ/РУ ТБ может быть назначен
без лабораторного подтверждения в случае регистрации заболевания
из достоверного контакта с больным МЛУ/РУ ТБ (в таком случае МЛУ/
РУ ТБ у вероятного источника заражения должна быть документирова-
на). Для больных ТБ с отрицательным результатом посева рекомендуе-
мая длительность лечения составляет 18—20 мес, а его результаты необ-
ходимо контролировать по клинико-рентгенологическим критериям.
В случаях РУ ТБ при отсутствии устойчивости к изониазиду пациен-
ту должен быть назначен режим лечения МЛУ ТБ. Согласно современ-
ным рекомендациям ВОЗ, это могут быть либо длительный режим лече-
ния МЛУ ТБ с добавлением изониазида, либо короткий режим лечения
МЛУ ТБ с добавлением изониазида. Несмотря на то что изониазид
в высокой дозе не входит в группы А—С, он тем не менее может исполь-
зоваться при подтвержденной чувствительности или при наличии мута-
ций, которые, как правило, не дают полной устойчивости к изониазиду.
Важно отметить роль лечебных хирургических вмешательств в лече-
нии ТБ у больных ВИЧ-инфекцией. Показания к хирургическому
лечению у больных ВИЧ-инфекцией при ТБ органов дыхания и внето-
ракальном не отличаются от таковых у больных ТБ без ВИЧ-инфекции,
однако потребность в хирургической помощи у ВИЧ-инфицированных
пациентов значительно выше. При этом эффективность лечения ТБ
у больных ВИЧ-инфекцией в значительной степени зависит от свое-
временного хирургического пособия по поводу внелегочного ТБ.
7.2. АНТИРЕТРОВИРУСНАЯ ТЕРАПИЯ У БОЛЬНЫХ
С СОЧЕТАННОЙ ИНФЕКЦИЕЙ
В настоящее время основным компонентом лечения больных
ВИЧ-инфекцией является APT, с помощью которой можно добиться
контролируемого течения заболевания, т.е. состояния, при котором,
несмотря на невозможность полного излечения, удается остановить
прогрессирование болезни, добиться регресса вторичных заболеваний
(если они успели развиться) и восстановить трудоспособность паци-
ента. Антиретровирусная терапия основана на назначении пациенту
препаратов, подавляющих размножение ВИЧ.
Основной целью APT является увеличение продолжительности
и сохранение качества жизни пациентов. Приоритетной задачей APT,
позволяющей добиться этих целей, является максимальное пода-
вление размножения ВИЧ, что выражается в снижении вирусной
160
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
нагрузки до неопределяемого уровня. Подавление репликации ВИЧ
останавливает гибель С04-клеток, что приводит к восстановлению
их популяции (рост количества С04-клеток в среднем на 100 мкл в год)
и функциональной активности. Кроме того, эффективное подавление
размножения ВИЧ снижает вероятность развития мутаций, приво-
дящих к возникновению штаммов вируса, резистентных к терапии.
Восстановление иммунитета приводит к предотвращению развития
вторичных заболеваний, а если они уже развились — их исчезновению.
Это, в свою очередь, улучшает качество жизни пациента, сохраняет
или восстанавливает его трудоспособность, предотвращает преждев-
ременную смерть. Низкое содержание вирусов в крови, сперме, влага-
лищных выделениях снижает контагиозность пациентов.
К принципам APT ВИЧ-инфекции можно отнести:
• добровольность — наличие информированного согласия пациента
при назначении APT;
• своевременность — как можно раннее начало APT при появлении
показаний;
• адекватность — тщательный выбор лекарственных препаратов
с подбором оптимального для данного конкретного пациента
их сочетания на основании существующих рекомендаций;
• непрерывность — пожизненный прием антиретровирусных пре-
паратов в соответствии с рекомендациями лечащего врача.
Необходимо отметить, что в современных зарубежных и отече-
ственных рекомендациях (DHHS, 2019; EACS, 2019; ННОИ, 2019) всем
больным ВИЧ-инфекцией вне зависимости от клинических проявле-
ний заболевания, количества С04+-лимфоцитов и уровня РНК ВИЧ
показано назначение APT, которую проводят пожизненно. В настоя-
щее время большинство специалистов не рекомендуют прерывать APT.
Терапию не отменяют после родов ВИЧ-инфицированным женщинам,
которым терапия была назначена во время беременности в целях про-
филактики вертикального пути передачи вируса.
Характеристика схем антиретровирусной терапии
В настоящее время APT проводят по схемам так называемой высо-
коактивной терапии, т.е. пациенту одновременно назначают не менее
трех антиретровирусных препаратов. С целью упрощения режимов
лечения при стабильно эффективном режиме APT возможно пере-
ключение на схему, включающую 2 препарата [долутегравир (DTG) +
ламивудин (ЗТС); DTG + рилпивирин (RPV); ралтегравир (RAL) +
дарунавир, бустированный ритонавиром (DRV/r); DRV/r+3TC].
7.2. Антиретровирусная терапия у больных с сочетанной инфекцией
161
Предпочтительные схемы — схемы с доказанной вирусологической
эффективностью, благоприятной переносимостью, экономически обо-
снованные, назначаемые большинству пациентов.
Альтернативные схемы — схемы с доказанной вирусологической
эффективностью, хорошей переносимостью, назначаемые особым кате-
гориям пациентов или пациентам при противопоказаниях к использова-
нию предпочтительных схем.
Приемлемые схемы — схемы, эффективность которых менее изучена,
и нежелательные явления (НЯ) выражены в большей степени по сравне-
нию с предпочтительными или альтернативными схемами. Приемлемые
схемы применяют только при невозможности (например, из-за непере-
носимости) назначения предпочтительных и альтернативных схем.
Сочетание ВИЧ-инфекции и ТБ обусловливает особый подход
к назначению как ПТТ, так и APT. Лечение больных с сочетанной пато-
логией ВИЧ/ТБ довольно сложно, поскольку пациенту необходимо
принимать большое количество лекарственных средств (4—6 противо-
туберкулезных и 3-4 антиретровирусных препарата), между которыми
существуют лекарственные взаимодействия. Кроме того, пациент,
помимо ВИЧ-инфекции и ТБ, может страдать другими вторичны-
ми и сопутствующими заболеваниями (церебральным токсоплазмо-
зом, ЦМВ-инфекцией, ПЦП, хроническими вирусными гепатитами
и др.), лечение которых может создавать дополнительные сложно-
сти. Существенная доля пациентов — это внутривенные потребители
психоактивных веществ (>50%, по данным Федерального НМЦ ПБ
СПИД), злоупотребляют алкоголем, что приводит к нарушениям режи-
ма лечения, приверженности к терапии и в значительной степени сни-
жает вероятность успешного исхода лечения.
К февралю 2020 г. на территории Российской Федерации зареги-
стрированы антиретровирусные препараты 6 лекарственных групп:
нуклеозидные и ненуклеозидные ингибиторы обратной транскриптазы
ВИЧ (НИОТ и ННИОТ), ИП ВИЧ, ингибиторы процесса присоедине-
ния ВИЧ к клеткам (фузии), ингибиторы рецепторов CCR5 и ингиби-
торы интегразы ВИЧ.
В России получили разрешение к применению 28 антиретровирусных
препаратов (не считая дженериков и лекарственных форм, содержащих
в себе несколько препаратов, называемых также препаратами
с фиксированной комбинацией доз), в том числе 8 ингибиторов обратной
транскриптазы ВИЧ из группы НИОТ: абакавир (ABC), диданозин (ddl),
зидовудин (ZDV), ламивудин (ЗТС), ставудин (d4T), тенофовир (TDF),
фосфазид (Ф-АЗТ), эмтрицитабин (FTC), 6 — из группы ННИОТ:
162
Глава 7. Печение туберкулеза у больных ВИЧ-инфекцией
доравирин (DOR), невирапин (NVP), рилпивирин (RPV), элсульфавирин
(ESV), этравирин (ETR), эфавиренз (EFV), 9 — из группы ИП ВИЧ:
атазанавир (ATV), дарунавир (DRV), лопинавир (LPV), нелфинавир,
ритонавир (RTV), саквинавир (SQV), типранавир, фосампренавир (FPV),
1 ингибитор слияния — энфувиртид, 1 ингибитор CCR5-peuenTopoB —
маравирок (MVC) и 4 ингибитора интегразы ВИЧ: биктегравир (BIC),
долутегравир (DTG), ралтефавир (RAL), элвитегравир (EVG).
В настоящее время все специалисты считают, что у больных с соче-
танной инфекцией терапию следует начинать с лечения ТБ. В реко-
мендациях ВОЗ (2019) указано, что назначение APT показано всем
больным ВИЧ-инфекцией и активным ТБ вне зависимости от коли-
чества С04+-лимфоцитов. Подобной тактики придерживаются специ-
алисты США (2019), Европейского союза (версия 10.0, ноябрь 2019),
Международного общества борьбы со СПИДом (2018).
Данное мнение основано на результатах исследований, которые
подтверждают, что одновременное назначение APT и ПТТ у пациентов
с количеством С04+-лимфоцитов <50 кл/мкл значительно улучшает
показатели выживаемости. Было доказано, что у больных ТБ в соче-
тании с ВИЧ-инфекцией на фоне ВИЧ-ассоциированной иммуносу-
прессии APT необходимо назначать на этапе интенсивного лечения ТБ.
В соответствии с российскими «Протоколами лечения больных
ВИЧ-инфекцией», утвержденными Национальным научным обще-
ством инфекционистов (2019), у больных ВИЧ-инфекцией и ТБ при
исходном количестве С04+-лимфоцитов <50 кл/мкл высока вероят-
ность развития других вторичных заболеваний, поэтому APT рекомен-
дуют назначать как можно раньше (в течение 2—3 нед после начала
ПТТ), после того как будет достигнута адаптация больного к ПТП.
При количестве С04+-лимфоцитов >50 кл/мкл начинают с лечения
ТБ. APT присоединяют в течение первых 2—3 мес. При наличии НЯ
на ПТТ, существенных лекарственных взаимодействий между APT
и ПТТ, низкой приверженности пациента к лечению APT можно
присоединить после окончания интенсивной фазы ПТТ.
Лечение активного ТБ всегда клинически более важно, чем лечение
ВИЧ-инфекции. Несмотря на то что таким пациентам показано одно-
временное лечение обеих инфекций, сначала рекомендуют начать лече-
ние ТБ и отложить APT хотя бы на 2 нед. Если ПТП больные хорошо
переносят, можно начинать APT. Такие больные должны находиться
под медицинским наблюдением, поскольку у них высокий риск разви-
тия синдрома восстановления иммунной системы (СВИС) и тяжелых
побочных реакций на комбинированную терапию.
7.2. Антиретровирусная терапия у больных с сочетанной инфекцией
163
Особые рекомендации по назначению APT имеются при развитии
туберкулезного менингита у больных ВИЧ-инфекцией. Таким паци-
ентам назначение APT целесообразно отложить на 1—2 мес после
начала ПТТ, когда будут купированы явления отека мозга и получена
отчетливая положительная динамика изменений в ликворе (уменьше-
ние содержания белка и количества лимфоцитов). Было замечено, что
при немедленно начатой APT наблюдалось больше тяжелых побочных
эффектов и клиническое ухудшение, связанное со СВИС, по сравне-
нию с началом APT через 1-2 мес после начала противотуберкулезного
лечения. При этом раннее назначение APT не улучшило показатели
выживаемости у больных туберкулезным менингоэнцефалитом.
Помимо показаний к началу APT и срокам ее назначения у больных
ВИЧ-инфекцией и ТБ, серьезной проблемой является выбор опти-
мальной схемы APT с учетом лекарственных взаимодействий между
антиретровирусными и ПТП.
APT при назначении рифампицинов имеет свои особенности. Это
связано с тем, что рифампицины индуцируют активность фермен-
тов системы цитохрома Р450 (в первую очередь, фермента CYP3A4),
осуществляющих метаболизм ИП и в меньшей степени ненуклеозид-
ных ингибиторов обратной транскриптазы, т.е. снижают сывороточ-
ные концентрации этих антиретровирусных препаратов. Индукция
рифампицином фермента UGT1A1 (уридиндифосфатглюкуронил-
трансферазы) вызывает снижение концентрации препарата инги-
биторов интегразы (ралтегравира, долутегравира, биктегравира).
В свою очередь, ненуклеозидные ингибиторы обратной транскрипта-
зы и ИП и интегразы через тот же самый механизм повышают сыво-
роточные концентрации рифабутина и рифампицина. Таким образом,
лекарственные взаимодействия могут привести к неэффективности
антиретровирусных средств и повышению токсичности противоту-
беркулезных.
Препараты группы рифампицина различаются по своей активности
индуцирования системы CYP450:
• рифампицин — наиболее активен;
• рифапентин — средняя активность;
• рифабутин — менее активен.
Важно отметить, что рифабутин обладает сопоставимой активно-
стью с рифампицином по воздействию на МБТ. В табл. 7.5 представ-
лены рекомендации по назначению рифабутина с различными анти-
ретровирусными препаратами.
164
Глава 7 Лечение туберкулеза у больных ВИЧ-инфекцией
Таблица 7.5
Взаимодействие рифабутина и антиретровирусных препаратов
Препарат
Нуклеозидные
ингибиторы
FPV
EFV
IDV
NVP
RTV
SQV
ATV
I Схемы ИП с
усилением RTV
(SQV, ATV, IDV,
FPV, DRV, LPV)
ETR
DOR
Концентрация
Антиретровирусный
препарат
Не меняется
i на 15%
Не меняется
1 на 32%
Не меняется
Не меняется
1 на 40%
Не меняется
Не меняется
1на37%
1 на 50% (AUC)
Рифабутин
Не меняется
Т на 193%
1 на 35%
Т в 2 раза
Не меняется
Т в 4 раза
—
Т в 2,5 раза
Т в 3 раза
4 на 17%
Не меняется
Коррекция режима дозиро- I
вания
Применяют стандартные I
дозировки |
FPV — в стандартной дози- I
ровке; рифабутин —
150 мг в сут или 300 мг
3 раза в нед |
EFV — в стандартной дози- I
ровке; рифабутин — 450 мг
в сут или 600 мг 3 раза в нед |
IDV —1000 мг каждые 8 ч;
рифабутин — 150 мг в сут
или 300 мг 3 раза в нед |
NVP — 200 мг 2 раза в сут;
рифабутин — 300 мг в сут
или 300 мг 3 раза в нед |
RTV — в стандартной дози- I
ровке; рифабутин — 150 мг
через день или 3 раза в нед |
Не рекомендуется без усиле- I
ния RTV |
ATV — в стандартной дози- I
ровке; рифабутин —150 мг
через день или 3 раза в нед |
ИП — в стандартной дози- I
ровке; рифабутин —150 мг
через день или 3 раза в нед
Если ETR не применяется вмес-
те с усиленным ИП, то доза
рифабутина — 300 мг в сут.
Если ETR применяется вместе
с ИП/г и необходимо исполь-
зовать рифабутин, то следует
искать замену ETR
DOR в дозе 100 мг 2 раза
в сут с интервалом 12 ч
7.2. Антиретровирусная терапия у больных с сочетанной инфекцией 165
Окончание табл. 7.5
Препарат
RPV
ESV
RAL
DTG
EVG/Cobi
BIC
MVC
Концентрация
Антиретровирусный
препарат
Не меняется
Не меняется
Не меняется
Не меняется
Существенное 1
Существенное 1
Не меняется
Рифабутин
1 на 46%
Снижается
в 2,5 раза
Не меняется
Не меняется
Не меняется
Не меняется
1 возможно
Коррекция режима дозиро-
вания
Одновременное применение
противопоказано
Одновременное применение
противопоказано
Стандартные дозировки
обоих препаратов
Стандартные дозировки
обоих препаратов
Одновременное применение
противопоказано
Одновременное применение
противопоказано
Если MVC применяется
без ИП/r, используют стан-
дартные дозировки; если
с ИП/r — MVC назначают
в дозе 0,15 г 2 раза в сутки
Примечание, т — повышение концентрации препарата; i — снижение
концентрации препарата.
Назначая лечение, следует учитывать, что при использовании
в схемах ПТТ рифампицина для лечения ВИЧ-инфекции у больных ТБ
рекомендуется схема APT первого ряда.
При использовании в схемах ПТТ рифампицина схема APT первого
ряда для лечения ВИЧ-инфекции у больных ТБ включает:
EFV в сочетании с TDF или ABC или фосфазидом (Ф-АЗТ) или ZDV +
ЗТС или ETC.
При развитии НЯ, связанных с приемом EFV, его доза может
быть снижена до 400 мг в сут. Перед назначением ABC необходимо
провести тест на HLAB5701. ABC назначать только после получения
отрицательного результата теста. Не рекомендуется одновременный
прием рифампицина и ИП, RPV, ETR, DOR, BIC и EVG/Cobi.
Под наблюдением A.M. Пантелеева и соавторов (2010) находились
48 больных ВИЧ-инфекцией и ТБ, которые в зависимости от схемы
APT были распределены в 2 группы по 24 пациента. Пациенты
1-й группы получали APT, включавшую Ф-АЗТ + ЗТС или ddl + EFV,
а пациенты 2-й группы — ZDV/3TC + EFV. Средний возраст больных
составил 33 года. Пациенты обеих групп были сопоставимы по демо-
166
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
графическим, социальным и клиническим характеристикам. Полови-
на пациентов указывали на пребывание в местах лишения свободы.
У 83,3% больных заражение ВИЧ-инфекцией произошло при вну-
тривенном употреблении психоактивных веществ. Средний срок
от момента выявления антител к ВИЧ до начала APT составил 3,5 года.
Диагноз генерализованного ТБ был установлен у 1/3 больных обеих
групп. У всех пациентов с генерализованным ТБ выявляли сочетанное
поражение ОГК и паренхиматозных органов. Инфильтративный ТБ
легких имел место у 16,7% больных обеих групп, диссеминирован-
ный - у 20,8% и 12,5%, а ТБ ВГЛУ — у 29,2% и 27,5% пациентов соот-
ветственно. Все больные получали стандартный 1-й режим химиотера-
пии ТБ. Минимальный срок наблюдения составил 6 мес.
За время наблюдения прогрессирования ВИЧ-инфекции не было
отмечено ни у одного пациента. До начала лечения среднее коли-
чество С04+-лимфоцитов составляло у пациентов 1-й группы
127,4±27,6 кл/мл и 122,8± 17,1 кл/мкл — 2-й группы. Через 6 и 12 мес
после начала терапии у пациентов обеих групп регистрировали сопо-
ставимое повышение среднего количества С04+-лимфоцитов: 6 мес —
364,9±66,6 кл/мл и 353,5+42,5 кл/мкл; 12 мес - 407,0+115,1 кл/мл
и 402,6±28,3 кл/мкл соответственно, что свидетельствовало об эф-
фективности обеих схем APT. Через 6 мес после начала APT у 54,2%
больных 1-й группы и у 45,8% — 2-й группы уровень РНК ВИЧ был
ниже порога определения тест-системой.
Три пациента 1-й группы самовольно прекратили прием APT, при
этом прерывание APT не было связано с развитием НЯ. Среди боль-
ных 2-й группы 6 пациентов прекратили прием APT, причем у троих
из них — в связи с развитием НЯ (анемия).
До начала терапии у 14 (60,8%) больных обеих групп регистриро-
вали умеренно выраженную анемию. Средний уровень гемоглобина
до начала APT составил 107,4 и 112,2 г/л соответственно. Через 2 мес
APT у больных 1-й группы отметили повышение среднего уровня гемо-
глобина до 119,4 г/л, а через 6 мес — до 125 г/л, в то время как у паци-
ентов 2-й группы через 2 мес APT регистрировали снижение среднего
значения гемоглобина до 108 г/л, и только к 6 мес лечения отметили
тенденцию к его повышению до исходных значений (112 г/л).
Анализ динамики количества тромбоцитов крови показал, что
у больных 1-й группы через 3 мес терапии среднее число тромбоцитов
увеличилось с 233,7 до 304,5х 109/л, тогда как у больных 2-й группы —
несколько снизилось с 334,5 до 237,5><109/л. Среднее количество лей-
коцитов периферической крови у пациентов 1-й группы к концу 2 мес
7.2. Антиретровирусная терапия у больных с сочеганной инфекцией 167
лечения возросло с 5,1 до 6,Ох 109/л, в то время как у больных 2-й груп-
пы — уменьшилось с 5,6 до 3,8х 109/л.
Таким образом, применение Ф-АЗТ, в отличие от ZDV, в составе
схемы APT не приводило к угнетению гемопоэза. Только у 2 из 24 боль-
ных, получавших Ф-АЗТ, наблюдали НЯ, проявляющиеся в виде
гастритического синдрома (тошнота, рвота, тяжесть в эпигастрии).
У 9 больных заболевание закончилось летальным исходом (4 паци-
ента из группы 1 и 5 — из группы 2), в большинстве случаев обусловлен-
ным прогрессированием туберкулезного процесса. У троих пациентов
летальный исход наступил из-за отказа от APT и ПТТ. На момент смерти
пациентов средняя продолжительность APT составляла 63,6 дня, а сред-
нее количество С04+-лимфоцитов — 70,8 кл/мкл (от 9 до 163 кл/мкл).
Таким образом, использование в составе схем APT отечественно-
го препарата Ф-АЗТ продемонстрировало хорошую эффективность
и безопасность. Наличие умеренно выраженной анемии не является
противопоказанием для назначения Ф-АЗТ.
Альтернативные схемы антиретровирусной терапии у больных
туберкулезом
1. DTG 50 мг (1 таблетка) 2 раза в сут + 2НИОТ.
2. RAL 800 мг (2 таблетки) 2 раза в сут + 2НИОТ.
3. MVC 600 мг 2 раза в сут + 2 НИОТ. (Маравирок назначать только
после получения результатов теста о наличии у пациента ВИЧ,
тройного к рецепторам CCR5.)
4. ESV 20 мг (1 таблетка) в сутки + 2НИОТ.
При наличии туберкулезного менингита схему APT составляют
с учетом индекса проникновения препаратов через гематоэнце-
фалический барьер (суммарное количество баллов проникновения
через гематоэнцефалический барьер всех трех препаратов схемы APT
должно быть 7 и более).
При необходимости применения рифампицина в схеме ПТТ
и отсутствии возможности использования других вариантов схемы APT
(включающих 3 НИОТ, ННИОТ, ингибиторы интегразы или антагонист
рецепторов CCR5) в качестве приемлемого режима пациенту может
быть назначена схема APT, включающая 2 НИОТ + LPV/r в двой-
ной суточной дозе (800/200 мг 2 раза в сут) или LPV/r в стандарт-
ной суточной дозе (400/100 мг 2 раза в сут) с добавлением RTV
в дозе 300 мг 2 раза в сут.
Противотуберкулезный препарат рифабутын можно использовать
совместно со всеми ИП и со всеми ННИОТ (кроме ЯРУи ESV), а также
168
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
с ингибиторами интегразы ВИЧ (кроме EVG/Cobi и BIC) и препаратами,
блокирующими присоединение ВИЧ к клетке. В некоторых случаях
требуется коррекция дозы рифабутина или антиретровирусных
препаратов (см. табл. 7.5).
Согласно рекомендациям ВОЗ (июль 2019), больным ВИЧ-ин-
фекцией и ТБ следует назначать APT по схеме TDF + ЗТС + DTG. Если
в составе схемы ПТТ применяется рифампицин, дозу DTG необходи-
мо увеличить до 50 мг 2 раза в сут. В качестве альтернативного режи-
ма APT можно применять EFV в дозе 400 мг/сут одновременно с тера-
пией ТБ, включающей рифампицин. При одновременном приеме
EFV (400 мг) хорошо переносится и в плазме крови сохраняются кон-
центрации выше уровней, считающихся эффективными.
До настоящего времени у больных ТБ и ВИЧ-инфекцией в составе
APT, как правило, использовали EFV. Однако, учитывая профиль
безопасности EFV и высокую распространенность первичной рези-
стентности к EFV (>10% в отдельных регионах), необходимо иметь
альтернативные режимы APT. Предыдущее исследование показало,
что DTG 50 мг два раза в день, назначаемый вместе со стандартной
дозой рифампицина (R), хорошо переносился и приводил к концен-
трации DTG, аналогичной концентрации при приеме DTG 50 мг один
раз в день.
Исследование INSPIRING (NCT02178592) — рандомизированное
многоцентровое открытое несравнительное исследование фазы IIlb
с активным контролем и в параллельных группах (Dooley К. и соавторы,
2019). Целью исследования была оценка антиретровирусной актив-
ности режима, включающего DTG, через 48 нед лечения (DTG
в дозе 50 мг 2 раза в сут во время терапии ТБ и в течение 2 нед после
ее завершения, затем 50 мг 1 раз в сут с двумя НИОТ) у пациентов,
ранее не получавших APT, инфицированных ВИЧ-1, получающих
терапию ТБ, включающую R.
В исследование были включены 113 больных ВИЧ-инфекцией и ТБ.
Критериями включения были: уровень РНК ВИЧ-1 >1000 копий/мл
и количество С04+-лимфоцитов >50 кл/мкл; наличие ТБ легких, плев-
ры или лимфатических узлов, вызванный МБТ с чувствительностью
к RIF, подтвержденной данными посева или результатами исследова-
ния GeneXpert. Терапия ТБ с применением R должна была быть начата
не ранее, чем за 8 нед до рандомизации, и не позднее даты скрининга.
69 пациентов были рандомизированы в группу терапии DTG (50 мг 2 ра-
за в сут), а 44 — в группу EFV (600 мг/сут). Все пациенты в составе схемы
APT получали 2 препарата из группы НИОТ (в 68-70% — TDF/FTC).
7.2. Антиретровирусная терапия у больных с сочетанной инфекцией 169
Медиана возраста пациентов составляла 32—33 года, доля жен-
щин — 36-43%. Преобладали лица африканского происхожде-
ния (66-68%). У 55-64% больных исходное количество РНК ВИЧ
было >100 000 копий/мл, медиана количества СВ4+-лимфоцитов
составляла 208 и 202 клетки/мкл соответственно, а у 19% и 27%
больных исходное число CD4+ было <100 кл/мкл. У 94—100% боль-
ных обеих групп был установлен диагноз ТБ легких.
Основной конечной точкой была доля пациентов с уровнем РНК
ВИЧ <50 копий/мл через 48 нед APT (Модифицированная методика
одномоментного анализа — ITT-E). Через 48 нед APT у 75% (95% ДИ:
65-86%) больных группы DTG и 82% (95% ДИ: 70-93%) группы EFV
уровень РНК ВИЧ был <50 копий/мл. Отсутствие вирусологического
ответа имело место у 9% и 7% пациентов обеих групп соответственно.
Прирост количества С04+-лимфоцитов по медиане составил
220 кл/мкл в группе DTG и 190 кл/мкл — в группе EFV.
Переносимость DTG была хорошей, большинство НЯ были 1-й
или 2-й степени тяжести. Регистрировали низкую частоту развития
НЯ, связанных с применением исследуемого препарата, а также
серьезных НЯ.
Два пациента, получавших EFV, прекратили терапию в связи с раз-
витием НЯ: 1 случай развития реакции гиперчувствительности к EFV;
1 случай повышения уровня гамма-глутамилтрансферазы. В каждой
группе регистрировали по одному случаю связанного с ТБ воспалитель-
ного СВИС. Не наблюдали НЯ, которые привели к досрочному пре-
кращению участия пациентов в исследовании, в том числе по причине
медикаментозного поражения печени.
Таким образом, применение в составе схемы APT препарата DTG
в дозе 50 мг 2 раза/сут одновременно с продолжающейся терапией ТБ
режимом, включавшим RIF, в течение 48 нед было высокоэффектив-
но и безопасно. Почти у 90% больных обеих групп терапия ТБ была
успешной.
В 2019 г. были опубликованы результаты международного рандо-
мизированного открытого исследования III фазы не меньшей эффек-
тивности схемы терапии RAL + 3TC/TDF в сравнении с комбинацией
EFV + 3TC/TDF в когорте взрослых пациентов с коинфекцией
ВИЧ и ТБ, не получавших ранее APT. (Исследование: ANRS
12300 ReflateTB2.)
В исследование были включены 455 пациентов с ВИЧ-инфекцией
с подтвержденным диагнозом или подозрением на ТБ без туберкулез-
ного менингита, получавших <8 нед стандартную ПТТ, включавшую
170
Глава 7 Лечение туберкулеза у больных ВИЧ-инфекцией
рифампицин. 228 пациентов были рандомизированы в группу 1, полу-
чавшую APT по схеме RAL 400 мг дважды в день + 3TC/TDF один раз
в день, а 227 — в группу 2 — EFV 600 мг один раз в день + 3TC/TDF
один раз в день.
В качестве первичной конечной точки оценивали долю пациентов
с уровнем РНК ВИЧ-1 <50 копий/мл через 48 нед терапии в зависи-
мости от схемы APT (ITT-анализ). Предел не меньшей эффективности
был равен 12%.
Медиана возраста пациентов составляла 34 и 37 лет соответственно.
До начала APT медиана количества С04+-лимфоцитов у пациентов
1-й группы была равна 98 (39-242) кл/мкл и 108 (35-238) кл/мкл —
у больных 2-й группы. У 33—34% пациентов исходное количество
СЭ4+-лимфоцитов было <50 кл/мкл. Медиана содержания РНК ВИЧ-1
в плазме крови была равна 5,5 log10 копий/мл больных у обеих групп,
при этом у 75% и 72% больных исходное содержание РНК ВИЧ-1
> 100 000 копий/мл соответственно.
У 26 и 28 пациентов в крови обнаруживали маркеры гепатитов
В и/или С. Медиана длительности терапии ТБ на момент включения
в исследование составляла 20 (15-28) дней. У 72% и 78% больных было
получено бактериологическое подтверждение диагноза ТБ или получен
положительный результат теста на LAM-антиген. Диагноз ТБ легких
был установлен у 67% и 70% пациентов обеих групп, внелегочного
ТБ — у 19%, а ТБ легких в сочетании с внелегочными локализациями —
у 14% и 11% соответственно.
Через 48 нед APT у 61% больных 1-й группы и 66% — 2-й груп-
пы уровень РНК ВИЧ-1 был <50 копий/мл, что указывало на рав-
ную вирусологическую эффективность обоих терапевтических режи-
мов. У 66 и 50 больных обеих групп уровень РНК ВИЧ-1 был >50 ко-
пий/мл, 23 пациента 1-й группы и 27 — 2-й группы прекратили
участие в исследовании или терапии исследуемыми препаратами из-за
развития НЯ или смерти. НЯ 3-й и 4-й степени тяжести регистрировали
у 27% и 30% больных обеих групп соответственно, причем у 11%
и 10% развитие НЯ были связано с исследуемыми препаратами. Вместе
с тем, только у одного больного 1-й группы и у трех пациентов
2-й группы развитие НЯ привело к отмене схемы APT. У 10 и 13 больных
обеих групп наблюдали развитие СВИС. Развитие гепатотоксичности
3-й и 4-й степени тяжести обнаруживали у 9 больных в каждой
исследуемой группе.
Таким образом, через 48 нед APT больных ВИЧ-инфекцией и ТБ
схема, включавшая RAL в дозировке 400 мг дважды в день в сочетании
7.2. Антиретровирусная терапия у больных с сочетанной инфекцией 171
с 3TC/TDF, была не менее эффективна по сравнению со схемой тера-
пии EFV 600 мг один раз в день в комбинации с 3TC/TDF. Показатель
разницы вирусологической эффективности между схемами терапии
составил -5,1% (95% ДИ: —13,9% до 3,7%, превышение предела
не меньшей эффективности от —12,0%). На основании полученных
результатов исследователи пришли к выводу, что в настоящее время
схема APT на основе EFV остается предпочтительным режимом пер-
вой линии для данной когорты больных, а схема, включающая RAL
в дозировке 400 мг дважды в день, может быть альтернативным режи-
мом у отдельных пациентов.
На основании полученных результатов в последующие версии
рекомендаций, вероятно, будут внесены изменения суточной дози-
ровки ралтегравира с 800 до 400 мг 2 раза в сут при его сочетании
с рифампицином.
В современных рекомендациях (DHHS, 2019; EACS, 2019; ВОЗ,
2019) по APT указано, что из-за развития выраженных побочных
эффектов не следует одновременно назначать рифампицин и ИП ВИЧ,
усиленные большой дозой ритонавира (LPV/RTV или SQV/RTV —
400/400 мг 2 раза в день). Одновременный прием рифампицина и ИП
ВИЧ, усиленных стандартной дозой ритонавира (100—200 мг/сут),
противопоказан.
При назначении в составе APT ИП ВИЧ рифампицин необходимо
заменить рифабутином (150 мг/сут). При использовании в схеме APT
эфавиренза или ралтегравира целесообразно заменить рифампицин
рифабутином в среднетерапевтической дозе (300-450 мг/сут).
Если необходимо в схеме ПТТ оставить рифампицин для парен-
терального введения, увеличивают дозу долутегравира до 50 мг 2 раза
в сут, ралтегравира — до 800 мг 2 раза в сут, а маравирока — до 600 мг
2 раза в сут. Перед назначением маравирока необходимо проведение
теста на тропизм ВИЧ-1 (назначение возможно только при наличии
ССИ5-тропных вариантов вируса). В РФ разработан и доступен гено-
типический вариант методики. При замене в схеме ПТТ рифампицина
рифабутином в режимах APT можно использовать любые усиленные
ритонавиром ИП или ННИОТ (EFV и этравирин — в стандартных
дозах, доравирин — в дозе 100 мг 2 р/сут), а также ингибиторы интегразы.
При переключении с режима на основе рифампицина на рифабутин
или на режим, не содержащий рифампицин, необходимо отложить
не менее чем на 2 нед начало APT так, чтобы эффект от рифампицина
не влиял на активность антиретровирусных препаратов.
172
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
Для мониторинга эффективности APT у больных коинфекцией
проводят исследование иммунного статуса (субпопуляции лимфоци-
тов CD4+, CD8+, CD4+/CD8+) и вирусной нагрузки через месяц после
ее начала, а затем 1 раз в 3 мес в течение основного курса лечения ТБ.
Рекомендации по назначению APT у больных ВИЧ-инфекцией,
в том числе в сочетании с ТБ, ежегодно пересматриваются, дополня-
ются. Важно следить за изменениями рекомендаций основных между-
народных практик, занимающихся вопросами лечения ВИЧ-инфекции
(Российское национальное научное общество инфекционистов, ВОЗ,
EACS, CDC, DHHS).
7.3. НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ ПРИ ЛЕЧЕНИИ ТУБЕРКУЛЕЗА
И ВИЧ-ИНФЕКЦИИ У БОЛЬНЫХ КОИНФЕКЦИЕЙ
Нежелательное явление (НЯ) — любое неблагоприятное с меди-
цинской точки зрения событие, произошедшее с пациентом в период
проводимой лекарственной терапии и необязательно напрямую свя-
занное с ней.
При ПТТ побочные реакции появляются у 35—70% больных в зави-
симости от режима химиотерапии. Из них 75% развиваются в первые
2 мес лечения. При APT НЯ возникают более чем у 50% пациентов
в первый год лечения. Одновременное назначение ПТТ и APT значи-
тельно усиливает токсичность схем лечения.
Перед началом лечения традиционно проводят сбор анамнеза
и осмотр больного, целью которых является оценка исходного состо-
яния пациента и поиск заболеваний и состояний, которые могут
способствовать появлению побочных реакций на проводимую тера-
пию. К их числу относятся сахарный диабет, почечная недостаточ-
ность, острые или хронические заболевания печени, нарушения функ-
ции щитовидной железы, психические заболевания, наркотическая
или алкогольная зависимость, беременность, лактация и др.
Предупреждение побочных реакций следует начинать перед назна-
чением терапии, оно заключается в соответствующих разъяснениях
пациенту. На этом этапе больной должен быть подробно проинструк-
тирован о возможных побочных реакциях, вызываемых назначенными
ему препаратами.
Большинство побочных реакций легко распознаются. Обычно боль-
ной сам заявляет об ощущаемых им неблагоприятных симптомах. Тем
не менее очень важно систематически опрашивать больных, поскольку
7.3. Нежелательные реакции при лечении туберкулеза...
173
часть пациентов склонна умалчивать даже о тяжелых побочных эффек-
тах. Другие больные преувеличивают одни из побочных реакций, забы-
вая рассказать о других. Медицинские сестры, контролирующие лече-
ние, должны иметь опыт выявления обычных симптомов побочного
действия (сыпь, тошнота и рвота, психические отклонения типа пси-
хозов и депрессии, возбуждения, суицидальных мыслей). Следует учи-
тывать возможность нарушения слуха (ототоксические реакции), жел-
тухи, периферической нейропатии и электролитных сдвигов (судороги
и подергивания мышц). Медицинские работники, контролирующие
лечение, должны уметь преодолевать простые побочные реакции и ори-
ентироваться в состояниях, когда пациента следует направить к врачу.
Лабораторное исследование и при необходимости консультации
других специалистов позволяют своевременно выявить и устранить
побочные реакции. Мониторинг побочных реакций должен быть
более интенсивным у пациентов с ранее существовавшими или вновь
выявленными предпосылками к плохой переносимости препаратов.
Лабораторный мониторинг неоценим при выявлении преимуще-
ственно скрытых побочных реакций. Ниже приведены рекомендации
по минимальной частоте выполнения обязательных лабораторных
исследований:
• перед назначением ABC для снижения риска развития реакции
гиперчувствительности необходимо проведение теста на наличие
HLA-B*5701 аллели;
• перед назначением маравирока необходимо проведение теста
на вирусный тропизм (назначение возможно только при наличии
Я5-тропного вируса);
• клинические анализы крови и мочи, проводимые на этапе интен-
сивной терапии ТБ, — не реже 1 раза в мес, а на этапе продолже-
ния — 1 раз в 2-3 мес;
• определение содержания билирубина, аланинаминотрансферазы,
аспартатаминотрансферазы в крови, проводимое на этапе интен-
сивной терапии ТБ, — не реже 1 раза в мес, а на этапе продолже-
ния — 1 раз в 2—3 мес;
• определение содержания креатинина в сыворотке крови — еже-
месячно;
• определение уровня калия в сыворотке крови — ежемесячно при
назначении инъекционных ПТП;
• эхокардиограмма (интервал Q—T) ежемесячно при назначении
фторхинолонов, бедаквилина, особенно при одновременном при-
менении с ИП ВИЧ;
174
Глава 7 Лечение туберкулеза у больных ВИЧ-инфекцией
• исследование мочевой кислоты при назначении пиразинамида
и других лекарственных препаратов, влияющих на обмен
пуринов;
• уровень тиреотропного гормона — каждые 6 мес при назначении
протионамида и/или ПАСК;
• уровень мочевой кислоты — ежемесячно при назначении
пиразинамида;
• ежемесячный осмотр врача-отоларинголога при назначении инъ-
екционных ПТП;
• осмотр окулистом перед назначением этамбутола.
Более частое проведение подобных исследований рекомендуют
у больных с повышенной степенью риска возникновения побочных
реакций. В случае возникновения НЯ (любых отклонений от нормы
в состоянии больного) проводят внеплановое обследование в целях
уточнения их связи с проводимой терапией.
Раннее выявление, диагностика и лечение побочных реакций имеют
очень большое значение, даже если эти реакции не представляют осо-
бой опасности. У больных могут появляться чувство страха и возбуж-
дение по поводу побочных эффектов, если они не понимают причин
их возникновения. Эти эмоции, в свою очередь, способны усилить
тяжесть побочных реакций, особенно тошноты и рвоты.
К сожалению, противотуберкулезные и антиретровирусные препа-
раты часто имеют перекрестный профиль токсичности.
Ниже представлены наиболее частые НЯ, возникающие при при-
менении комбинированной терапии (ПТТ и APT), с указанием препа-
ратов, способных вызвать эти побочные реакции.
• Гепатотоксические реакции, основные «виновники»:
- ПТТ: пиразинамид > рифампицин > изониазид;
- APT: ННИОТ > ИП/г > ралтегравир > НИОТ.
• Токсическая анемия, основные «виновники»:
- APT: зидовудин > фосфазид.
• Токсическая гранулоцитопения, основные «виновники»:
- APT: зидовудин > ставудин (значительно);
- ПТТ: фторхинолоны, изониазид, ПАСК (реже).
• Нефротоксичность, основные «виновники»:
- ПТТ: аминогликозиды, капреомицин;
- APT: тенофовир, ATV.
• Ототоксичность, основные «виновники»:
- ПТТ: аминогликозиды > капреомицин.
7.3. Нежелательные реакции при лечении туберкулеза...
175
• Офтальмотоксичность, основные «виновники»:
- ПТТ: линезолид (особенно в дозе 1200 мг/сут) > этамбутол.
• Желудочная диспепсия, основные «виновники»:
- ПТТ: изониазид, рифампицин, пиразинамид, протионамид,
ПАСК;
- APT: НИОТ (зидовудин, ставудин, диданозин > фосфазид).
• Кишечная диспепсия, основные «виновники»:
- ПТТ: рифампицин, фторхинолоны, линезолид, ПАСК;
- APT: ИП/ритонавир (лопинавир/ритонавир > саквинавир/
ритонавир фосампренавир/ритонавир > дарунавир/рито-
навир>АТУ/г>АТУ).
• Периферическая полиневропатия, основные «виновники»:
- ПТТ: изониазид > фторхинолоны;
- APT: ставудин > диданозин.
• Гипотиреоз, основные «виновники»:
- ПТТ: протионамид, ПАСК > протионамид + ПАСК.
• Нарушения ЦНС (тревога, нарушение сна), основные «виновники»:
- ПТТ: циклосерин, изониазид, фторхинолоны;
- APT: эфавиренз > рилпивирин > этравирин > элсульфавирин.
• Удлинение интервала Q— Г, основные «виновники»:
- ПТТ: фторхинолоны, бедаквилин, Деламанид*, клофазимин;
- APT: ИП/ритонавир.
• Фотосенсибилизация, основные «виновники»:
- ПТТ: фторхинолоны (спарфлоксацин > левофлоксацин,
моксифлоксацин).
• Аллергическая реакция — любой препарат, но чаще:
- ПТТ: аминогликозиды > рифампицин;
- APT: ABC (РГЧ), ННИОТ (невирапин > эфавиренз > этрави-
рин > элсульфавирин).
При лечении ВИЧ-инфекции выделяют 4 степени токсичности
реакций, развившихся в период терапии:
• I — легкую;
• II — среднюю;
• III —тяжелую;
• IV — угрожающую жизни.
В табл. 7.6, 7.7 представлена градация токсичности терапии у боль-
ных ВИЧ-инфекцией по клиническим проявлениям и лабораторным
показателям.
Таблица 7.6
Градация токсичности терапии у больных ВИЧ-инфекцией по клиническим симптомам
Критерий
1 ЦНС
Периферическая
полиневропатия
Лихорадка,
связанная с пре-
паратом
Озноб
Кожные реакции
Степень 0
Полная
бодрость
Отсутствует
Отсутствует
Отсутствует
Отсутствуют
Степень 1
Нарушения
концентрации
или памяти
Постоянный лег-
кий дискомфорт,
не требующий
терапии
<38°С
Легкой или сред-
ней тяжести
Эритема
Степень II
Легкая спутанность
сознания или сон
более бодрствования
Постоянный умерен-
ный дискомфорт,
не сопровождаемый
выпадением глубо-
ких сухожильных
рефлексов
38-40 °С
Выраженный
Сухое шелушение,
везикулы, зуд
Степень III
Дезориентация
в течение >50%
времени бодр-
ствования
Постоянный
сильный диском-
форт, устойчивый
к НПВС, сопрово-
ждаемый выпаде-
нием имевшихся
ранее глубоких
сухожильных реф-
лексов
>40°С
Потрясающий <2 ч
Влажное шелуше-
ние, язвочки
Степень IV
Кома и/или судороги
Инвалидизирующий
дискомфорт, не реа-
гирующий на приме-
нение наркотических
анальгетиков
Лихорадка с гипо-
тензией
Потрясающий >2 ч
Эксфолиативный дер-
матит, некроз, требу-
ющий хирургического
вмешательства
S1
со
ш
-С
CD
а:
х
CD
I
1
I
5<
§
-С
4
CD
I
Окончание табл. 7.6
Критерий
Аллергические
реакции
Афтозный сто-
матит
Тошнота и рвота
Диарея
Запор
Степень 0
Отсутствуют
Отсутствует
Отсутствуют
Отсутствует
Отсутствует
Степень 1
Отек
Не влияет
на повседневную
активность
Тошнота
Транзиторная,
<2 дней
Легкий
Степень II
Бронхоспазм, нет
необходимости
в парентеральной
терапии
Значительно нару-
шает речь и прием
пищи
Транзиторная рвота
Транзиторная,
>2 дней
Средней тяжести,
требует терапии
Степень III
Бронхоспазм,
есть необходи-
мость в паренте-
ральной терапии
Невозможность
принимать пищу,
похудение
Рвота, требующая
терапии
Непереносимая,
требующая тера-
пии
Вздутие живота
Степень IV
Анафилаксия
Невозможность
пить, требуется в/в
введение жидкости
Неукротимая рвота
Кровянистый стул,
обезвоживание
Вздутие живота
и рвота 1
со
i
i
CD
U
Ш
1
1
1
CD
Таблица 7.7
Градация токсичности терапии у больных ВИЧ-инфекцией по лабораторным показателям
1 Критерий
1 Показатели перифериче-
ской крови
Гемоглобин, г/л
Лейкоциты, 1000/мм3
Нейтрофилы, 1000/мм3
I Тромбоциты, 1000/мм3
Биохимические показа-
тели крови
Билирубин
I Аланинаминотрансфе-
раза, аспартатамино-
трансфераза
Щелочная
фосфатаза
Амилаза
Креатинин в сыворотке
крови
[Анализ мочи
Протеинурия, г/сут
Гематурия
Степень 0
-
>9,5
>3,0
>1,5
>100
—
<1,1 хВГН*
<1,25хВГН
<1,25х ВГН
<1,1 хВГН
<1,1 хВГН
-
<0,25
Без изменений
Степень 1
-
8,0-9,4
2,0-3,0
1,0-1,5
75-99
—
1,1-1,5 х ВГН
1,25-2,5 х ВГН
1,25-2,5 х ВГН
1,1-1,5 х ВГН
1,1-1,5 х ВГН
-
0,25-1,0
Микрогемату-
рия
Степень II
-
7,0-7,9
1,5-2,0
0,75-0,99
50-74
—
1,5-2,5 х ВГН
2,6-5,0 х ВГН
2,6-5,0 х ВГН
1,5-2,0 х ВГН
>1,5-3,0 х ВГН
-
1,1-2,5
Макрогемату-
рия
Степень III
-
6,5-6,9
1,0-1,5
0,5-0,74
25-49
—
2,5-5,0 х ВГН
5-10х ВГН
5-10х ВГН
2,0-5,0 х ВГН
3,1-6,0 х ВГН
-
>2,5
Макрогема-
турия + сгустки
Степень IV
-
<6,5
<0,5
<25
<25
—
>5 х ВГН
МО х ВГН
МО х ВГН
>5 х ВГН или клиниче-
ская картина панкреатита
>6,0 х ВГН
|
Нефротический синдром
Обструктивная уропатия I
ВГН — верхняя граница нормы.
оэ
eg
1
"3
0\
§
-с
!
•е-
i
7.3. Нежелательные реакции при лечении туберкулеза...
179
При непереносимости какого-либо из противотуберкулезных
или антиретровирусных препаратов схему лечения изменяют в соот-
ветствии со спектром побочных явлений.
Рекомендуемая лечебная тактика при развитии НЯ.
• Если препарат, вызвавший НЯ, известен, то при стадии токсич-
ности необходима коррекция состояния посредством симптома-
тической терапии без отмены/замены препарата, при ее неудаче
и усилении токсичности — замена/отмена препарата.
• Если препарат, вызвавший НЯ, известен, то при III—IV стадии
токсичности проводят его отмену/замену с сохранением основной
схемы лечения.
• Если выявить препарат, вызвавший НЯ, затруднительно,
то при III—IV стадии токсичности отменяют всю схему лечения
с последующим ее возобновлением после коррекции состояния.
Коррекцию целесообразно начинать с ПТТ, так как отмена APT
ведет к значительно более быстрому развитию резистентности
ВИЧ, чем резистентности МВТ.
• Важно стараться корригировать НЯ с применением симптомати-
ческих средств без отмены препарата и/или схемы терапии.
При непереносимости одного из антиретровирусных препаратов
не рекомендуют снижать его дозу или отменять, оставляя двухком-
понентную схему терапии. При неэффективности симптоматической
терапии целесообразно заменить препарат, вызвавший НЯ, другим,
с учетом механизма действия и спектра наиболее часто встречаемых
токсических проявлений. При необходимости (III—IV степень ток-
сичности НЯ), во избежание селекции устойчивых штаммов вируса,
лучше временно прервать прием всех препаратов. При непереноси-
мости одного из ПТП можно снизить его дозу до 75% среднетера-
певтической. Необходимо учитывать и возможное взаимодействие
антиретровирусных препаратов с другими средствами (прежде всего,
с противотуберкулезными), входящими в схему лечения. При этом
нельзя забывать и о препаратах, которые больной в настоящее время
не получает, но которые, возможно, будут ему вскоре назначены.
В табл. 7.8, 7.9 представлены варианты замены антиретровирусных
препаратов при развитии НЯ.
180
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
Таблица 7.8
Смена антиретровирусных препаратов при развитии лекарственной
непереносимости
Исходный
препарат
Класс НИОТ
АЗТ (ZDV)
d4T
ddl
зтс
TDF
Ф-АЗТ
| Класс ИП
ATV
ATV/r
IDV
или IDV/r
FPV
или FPV/r
Токсическая реакция I
—
Анемия, нейтропения, астения,
бессонница, головная боль,
тошнота
Периферическая невропатия,
панкреатит
Диарея, тошнота
Панкреатит
Периферическая невропатия
Специфические токсические
реакции не выявлены
Нефропатия
Анемия, нейтропения, тошнота
—
Желтуха, гипербилирубинемия,
появление камней в почках
Повышение уровня трансаминаз
в крови
Необходимость приема антаци-
дов, ингибиторов протонного
насоса
Нефролитиаз, тромбоцито-
пения, нарушения зрения
Гипербилирубинемия
Нарушения липидного и углевод-
ного обмена
Повышение уровня трансаминаз
в крови
Нарушения липидного и углевод-
ного обмена
Повышение уровня трансаминаз
в крови
Альтернативный препарат
(очередность в порядке
приоритетности) |
— |
ABC, TDF, Ф-АЗТ, ddl
ABC, TDF, ZDV, Ф-АЗТ
TDF, ABC, Ф-АЗТ
3TC, TDF, ABC
3TC, FTC, TDF, ABC, Ф-АЗТ, ZDV
FTC, TDF, ABC
ABC, Ф-АЗТ, ZDV I
TDF, ABC, ddl
— |
DTG, HHI/IOT или другой ИП
(за исключением IDV) RAL, MVC,
DRV/r, фосампренавир, бусти-
рованный ритонавиром (FPV/r),
LPV/r, саквинавир, бустирован-
ный ритонавиром (SQV/r), ETR,
RPV
ННИОТ или LPV/r, FPV (FPV/r),
SQV/r, DRV/r, DTG, RAL, MVC
DTG, ННИОТ или другой ИП
(за исключением ATV), MVC
DTG, NVP, ATV, EFV, RPV, FPV/r/,
DRV/r, RAL, MVC
DTG, ETR, MVC, SQV/r, FPV/r,
RAL, MVC, ATV/r, DRV/r,
FPV/r, LPV/r, SQV/r, ETR, RPV
DTG, NVP, MVC, ATV, EFV, RPV,
ATV/r, DRV/r, RAL, ETR, SQV/r,
DTG, RAL, MVC, ATV/r, DRV/r,
LPV/r, SQV/r, ETR, RPV
7.3. Нежелательные реакции при лечении туберкулеза...
181
Окончание табл. 7.8
Исходный
препарат
LPV/r
SQV/r
Класс
ННИОТ
NVP
EFV
ETR
Токсическая реакция
Диарея
Повышение уровня трансаминаз
в крови
Нарушения липидного и углевод-
ного обмена
Головная боль, тошнота
Повышение трансаминаз в крови
Диарея
Нарушения липидного и углевод-
ного обмена
-
Сыпь, многоформная эритема,
лихорадка
Гепатотоксичность, повышение
трансаминаз в крови
Гепатотоксичность, повышение
трансаминаз в крови
Сыпь, многоформная эритема,
лихорадка
Психические расстройства
Гепатотоксичность, повышение
трансаминаз в крови
Сыпь
Альтернативный препарат
(очередность в порядке
приоритетности) |
DTG, ATV/r, DRV/r, FPV/r, SQV/r,
EFV, NVP, RPV, ETR,
RAL, MVC, ATV
DTG, RAL, MVC, ATV/r, DRV/r,
FPV/r, SQV/r/ ETR, RPV
DTG, NVP, ATV, EFV, RPV,
ATV/r, DRV/r, RAL, ETR, FPV/r,
MVC, SQV/r
DTG, другой ИП/г, или ННИОТ,
или RAL, или MVC
DTG, RAL, MVC, ATV/r, DRV/r,
ATV/r, FPV/r, ETR, RPV
ATV/r, ATV, DRV/r, FPV/r, EFV,
NVP, RPV, RAL, ETR, MVC
DTG, NVP, ATV, EFV, RPV, ATV/r,
DRV/r, RAL, ETR, MVC
-
DTG, ATV/r, LPV/r, DRV/r, FPV/r,
SQV/r, RAL, MVC
DTG, ATV/r, DRV/r, FPV/r, LPV/r,
SQV/r, RAL, MVC, ETR, RPV
DTG, ATV/r, DRV/r, FPV/r, LPV/r,
SQV/r, RAL, MVC, ETR, RPV
DTG, ATV/r, LPV/r, DRV/r, FPV/r,
SQV/r, RAL, MVC
ESV, DTG, NVP, ATV/r, LPV/r,
SQV/r, FPV/r, DRV/r, RPV, RAL,
MVC
DTG, ESV, ATV/r, DRV/r,
FPV/r, LPV/r, SQV/r, RAL, MVC
DTG, ATV/r, LPV/r, DRV/r,
FPV/r, SQV/r, RAL, MVC
182 Глава 7 Печение туберкулеза у больных ВИЧ-инфекцией
Таблица 7.9
Аббревиатура основных антиретровирусных препаратов
Ф-АЗТ
Ф-АЗТ/ЗТС
ABC
ABC/ZDV/3TC
АВС/ЗТС
ATV
ATV/r
BIC
ddl
DOR
DRV
DRV/r
DTG
d4T
EFV
EFV/TDF/FTC
ENF
ESV
ETR
EVG/Cobi
| FPV
| FPV/r
I FTC
| IDV/r
Фосфазид |
Комбинированный препарат, в состав которого входят фосфазид |
и эмтрицитабин |
Абакавир |
Абакавир/зидовудин/ламивудин — комбинированный препарат, |
в состав которого входят указанные препараты [
Абакавир/ламивудин — комбинированный препарат, в состав
которого входят указанные препараты |
Атазанавир |
Атазанавир, бустированный ритонавиром |
Выпускается только в фиксированной комбинации (ВЮЯАР/РТС) |
Диданозин |
Доравирин |
Дарунавир |
Дарунавир, бустированный ритонавиром |
Долутегравир |
Ставудин |
Эфавиренз |
Комбинированный препарат, в состав которого входят эфавиренз, I
тенофовир и эмтрицитабин |
Энфувиртид |
Элсульфавирин ]
Этравирин |
Элвитегравир, бустированный кобицистатом. I
Выпускается только в фиксированной комбинации с TAF/FTC
(EVG/Cot^AF/FTC)
Фосампренавир
Фосампренавир, бустированный ритонавиром
Эмтрицитабин
Бустированный ритонавиром
7.5. Синдром восстановления иммунной системы
183
Окончание табл. 7.9
LPV/r
MVC
NFV
NVP
RAL
RPV
ВРУЯйР/РТС
RTV
SQV
SQV/r
TDF
TDF/FTC
TAF
ZDV
ZDC/3TC
I 3TC
Лопинавир/ритонавир — комбинированный препарат, в состав
которого входят лопинавир и бустирующий его ритонавир |
Маравирок
Нелфинавир I
Невирапин |
Ралтегравир |
Рилпивирин |
Комбинированный препарат, в состав которого входят рилпиви-
рин, тенофовир и эмтрицитабин
Ритонавир
Саквинавир
Саквинавир, бустированный ритонавиром
Тенофовир
Тенофовир/эмтрицитабин — комбинированный препарат, в состав
которого входят указанные препараты
Тенофовира алафенамид. В Российской Федерации зарегистриро-
ван только в составе фиксированных комбинаций
(EVG/CotMAF/FTC и BICtfAF/FTC)
Зидовудин
Зидовудин/ламивудин — комбинированный препарат, в состав
которого входят указанные препараты
Ламивудин
7.4. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ТУБЕРКУЛЕЗА
У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
Экстренные и диагностические, а также плановые оперативные вме-
шательства по поводу туберкулеза и его осложнений проводятся исходя
из наличия показания, так же как и у больных с ВИЧ-негативным ста-
тусом, вне зависимости от степени иммуносупрессии пациента, нали-
чия или отсутствия APT.
7.5. СИНДРОМ ВОССТАНОВЛЕНИЯ ИММУННОЙ СИСТЕМЫ
В середине 1997 — начале 1998 гг. у больных ВИЧ-инфекцией,
несколько недель принимавших APT, впервые были описаны случаи
184
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
атипичного течения ЦМВ ретинита и абсцедирующей перифериче-
ской лимфаденопатии, вызванной Mycobacterium avium-intracellulare.
Несмотря на то что эти заболевания были вызваны различными воз-
будителями, их объединяли связь с началом APT и атипично быстрое
и бурное течение болезни на фоне хорошего иммунологического
и вирусологического ответа. Со временем установился термин «СВИС».
Термин «СВИС» используют применительно к проявлениям различ-
ных вторичных заболеваний.
Воспалительный СВИС развивается у больных ВИЧ-инфекцией
после начала APT. Наиболее часто СВИС проявляется возникно-
вением или обострением ТБ, нетуберкулезного микобактериоза,
ЦМВ-инфекцией и криптококковым менингитом.
Иммунодефицит, обусловленный ВИЧ, ослабляет реакцию воспа-
ления и в значительной степени снижает воспалительные реакции раз-
личных вторичных заболеваний. В результате выраженность клиниче-
ских проявлений этих заболеваний стирается, заболевания протекают
латентно. При восстановлении клеточного иммунитета на фоне APT
симптомы болезни «размаскировываются» проявлением яркой клини-
ко-рентгенологической картины.
Предположительным механизмом возникновения СВИС считается
количественное и качественное восстановление патогенспецифическо-
го клеточного и гуморального иммунного ответа против различных воз-
будителей. Этот синдром проявляется бурной воспалительной реакци-
ей с ухудшением симптомов уже имеющегося вторичного заболевания
либо манифестацией латентной вторичной инфекции.
Не совсем ясно, почему СВИС развивается у одних пациентов
и не развивается у других. Выдвигались предположения о генетической
предрасположенности к развитию СВИС. Некоторые ученые полага-
ют, что на частоту возникновения СВИС может влиять цитокиновый
профиль пациента. Так, в одном из исследований было показано, что
у больных, которые имели повышенный уровень ИЛ-6 (ИЛ, обладаю-
щий выраженным противовоспалительным эффектом), частота раз-
вития СВИС была выше.
ТБ как проявление СВИС может протекать в виде усиления воспа-
лительной реакции на проводимую ПТТ, и в этом случае он называется
парадоксальным синдромом, связанным с ТБ. Если же при восстанов-
лении иммунитета выявляется недиагностированный ранее ТБ, его
называют выявляющим синдромом, связанным с ТБ.
Факторами риска развития СВИС у больных ТБ являются раннее
начало APT (в течение первых 6 нед после начала химиотерапии),
7.5. Синдром восстановления иммунной системы
185
генерализованный ТБ и низкий уровень С04+-лимфоцитов на момент
начала APT. Такие реакции обычно развиваются в первые 3 мес после
начала лечения, чаще — в первый месяц. Манифестация заболевания
происходит в результате успешной APT, при существенном снижении
РНК ВИЧ в плазме крови и увеличении количества С04+-лимфоцитов.
Признаки СВИС, проявившиеся ТБ, — высокая температура тела,
одышка, увеличение и воспаление ПЛУ, внутригрудная и/или мезен-
териальная лимфаденопатия. Рентгенологически отмечается отрица-
тельная динамика в виде появления диссеминации, увеличения ВГЛУ,
появления плеврального выпота и др.
Распространенность СВИС, проявившегося ТБ, колеблется от 11
до 30% и зависит от исходной степени иммуносупрессии перед началом
APT анализируемой группы.
Ранее существовавшие критерии диагностики СВИС основывались
на клинико-лабораторных данных и включали обязательное исследо-
вание уровня С04+-лимфоцитов и РНК ВИЧ в плазме на фоне про-
водимой APT. Для подтверждения парадоксального СВИС, связанно-
го с ТБ, были необходимы: клинико-рентгенологическое ухудшение
течения ТБ; хороший ответ на APT (увеличение количества CD4+-
лимфоцитов, уменьшение в плазме РНК ВИЧ более чем 1 log 10 копий/
мл или конверсия реакции Манту из отрицательной в положительную);
надежное исключение других состояний, которые могли бы объяснить
имеющиеся клинические симптомы (например, неудачное лечение ТБ
или нежелательные лекарственные реакции).
Поскольку проведение затратных лабораторных исследований
не всегда возможно, необходимо было пересмотреть имеющиеся кри-
терии диагностики этого синдрома. Предпосылками к этому стали
не только экономические соображения, но и следующие данные:
во-первых, большинство случаев СВИС встречаются именно в первые
месяцы от начала APT, когда и происходит значительное снижение
вирусной нагрузки; во-вторых, было показано, что не во всех слу-
чаях СВИС отмечено существенное увеличение количества CD4+-
лимфоцитов, так как прирост их числа может запаздывать на некоторое
время. На основании этого было высказано предположение, что пока-
затели динамики вирусной нагрузки и С04+-лимфоцитов не являются
обязательными критериями для диагностики СВИС, связанного с ТБ.
Другое важное дополнение к критериям диагностики СВИС — введе-
ние временных сроков для возникновения этого синдрома — первые
3 мес от начала APT, так как именно в этот отрезок времени происходит
быстрое восстановление системы иммунитета.
186
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
В 2006 г. были разработаны новые критерии диагностики парадок-
сального СВИС, которые могут быть применимы в странах как с низ-
ким, так и с высоким уровнем доходов.
Критерии парадоксального СВИС, связанного с ТБ, у пациентов с под-
твержденной ВИЧ-инфекцией:
• ТБ диагностирован перед началом APT и отвечает критериям для
диагностики случая ТБ легочной и внелегочной локализации;
• улучшение или стабилизация состояния пациента на фоне адек-
ватной химиотерапии перед началом APT (уменьшение общих
и/или респираторных симптомов ТБ);
• появление симптомов СВИС не позднее 3 мес от начала или воз-
обновления APT после перерыва или смены режима терапии
вследствие неудачного лечения;
• клинические критерии (обязательно присутствие по крайней мере
одного большого или двух малых критериев).
Большие критерии СВИС: появление новых или увеличение имею-
щихся лимфатических узлов, натечных абсцессов или других локальных
поражений; появление новых или ухудшение имеющихся симптомов ТБ
(по данным рентгенографии, ультразвукового исследования или КТ/
магнитно-резонансная томография); появление новых или ухудшение
имеющихся неврологических симптомов; появление новых или ухуд-
шение течения имеющихся серозитов (плеврита, асцита, перикардита).
Малые критерии СВИС: появление новых или ухудшение имеющих-
ся общих симптомов ТБ (лихорадка, повышенная потливость); появ-
ление новых или ухудшение имеющихся респираторных симптомов
ТБ (кашель, одышка); появление новых или ухудшение имеющихся
абдоминальных симптомов, связанных с перитонитом, гепатомегали-
ей, спленомегалией, внутрибрюшной лимфаденопатией.
Обязательное исключение альтернативных состояний и заболева-
ний: неудачного лечения ТБ, плохой приверженности к лечению ТБ,
других вторичных заболеваний, нежелательных реакций на лекарствен-
ные препараты.
Критерии для выявляющего СВИС, связанного с ТБ:
• на момент начала APT пациент не получал лечения по поводу ТБ;
• в первые 3 мес APT диагностирован активный ТБ с выраженными
воспалительными проявлениями.
Клинические проявления СВИС необходимо дифференцировать
от истинного прогрессирования ТБ ввиду, например, неадекватной
этиотропной терапии из-за отсутствия сведений о ЛУ МБТ. В табл. 7.10
7.5. Синдром восстановления иммунной системы
187
представлены дифференциально-диагностические критерии СВИС
и прогрессирования ТБ.
Таблица 7.10
Дифференциально-диагностические критерии синдрома восстановления
иммунной системы и прогрессирования туберкулеза
Критерии
Клинические
Рентгенологи-
ческие
Иммунологичес-
кие и вирусоло-
гические
Эффект
от ГК-терапии
СВИС
Четкая связь ухудшения состоя-
ния с началом APT; яркая мани-
фестация ухудшения состояния:
фебрильная лихорадка, пери-
ферическая лимфаденопатия,
серозиты, появление новой
локализации ТБ
Значительное увеличение объ-
ема милиарной диссеминации;
развитие плеврита, перикар-
дита;
значительное увеличение ВГЛУ;
появление нового фокуса вос-
паления в легочной ткани
Развивается на фоне глубокой
ВИЧ-ассоциированной иммуно-
супрессии (чаще С04+-лимфо-
цитов — <100 кл/мкл) и при
высоком уровне вирусной наг-
рузки (чаще >1 млн копий/мл).
На фоне терапии в течение
1-3 мес — выраженная вирусо-
логическая (в большей степени)
и иммунологическая эффектив-
ность
Стойкий положительный
Истинное прогрессирование ТБ
Нет связи с началом APT; про-
грессирование процесса клини-
чески малозаметно, чаще выяв-
ляется при рентгенологическом
исследовании
Увеличение имеющегося объ-
ема поражения (инфильтрации),
появление дополнительных
очаговых теней, появление
или увеличение деструктивных
изменений
Нет связи прогрессирования
туберкулезного процесса
и исходных иммунологических
и вирусологических данных.
На фоне APT более характерна
замедленная динамика прироста
Сй4-клеток и снижения вирус-
ной нагрузки (ввиду истинного
прогрессирования туберкулезно-
го процесса)
Период кратковременного мни-
мого благополучия сменяется
ухудшением
Синдром почти всегда купируется на фоне продолжающейся тера-
пии, но в случае тяжелых симптомов может потребоваться дополни-
тельная противовоспалительная терапия. Обычно нетяжелые формы
СВИС требуют симптоматического лечения нестероидными противо-
воспалительными препаратами или глюкокортикостероидными гормо-
нами с продолжением противотуберкулезной и APT.
188
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
Профилактика туберкулеза, ассоциированного синдромом
восстановления иммунной системы
Иногда развитие СВИС приводит к прогрессированию ТБ с леталь-
ным исходом. Особенно опасно развитие туберкулезного менингоэн-
цефалита, прогрессирование которого сопряжено с большой вероят-
ностью неблагоприятного исхода. Согласно последним европейским
рекомендациям (EACS, 2019), для профилактики ТБ-ассоциированного
СВИС лицам с количеством С04+-лимфоцитов менее 100 кл/мкл,
начавшим ПТТ в течение 30 дней до начала APT, рекомендовать назна-
чение преднизолона из расчета 40 мг 1 раз в сут в течение 2 нед, затем
по 20 мг в сут еще 2 нед. Эксперты считают, что такой подход может
снизить риск развития ТБ-ассоциированного СВИС на 30%. Для про-
филактики выявляющего СВИС специалисты рекомендуют одновре-
менно с началом APT системное введение глюкокортикоидов из рас-
чета по пероральному преднизолону 1,5 мг/кг/сут в течение 2 нед, затем
0,75 мг/кг/сут в течение 2 нед.
7.6. ФОРМИРОВАНИЕ ПРИВЕРЖЕННОСТИ К ЛЕЧЕНИЮ
ТУБЕРКУЛЕЗА И ВИЧ-ИНФЕКЦИИ
7.6.1. ОБЩИЕ ПРИНЦИПЫ
Под приверженностью к лечению понимают степень соответствия
поведения больного (в отношении приема препаратов, соблюдения
диеты и других мер изменения образа жизни) рекомендациям, получен-
ным от врача. Курсовое лечение ТБ имеет длительный срок (от 6 до 24 мес
в зависимости от спектра ЛУ МБТ), а терапия ВИЧ-инфекции на сегод-
няшний день — пожизненная. Излечение от ТБ на фоне ВИЧ-инфекции
требует от пациентов точного соблюдения рекомендаций врачей и режи-
ма терапии. В узком смысле под приверженностью к ПТТ и APT подраз-
умевается соответствие реального количества принимаемых препаратов
предписанному. Прием некорректной дозы рекомендуемых препаратов
или не в предписанное время, пропуски в приеме представляют собой
различные формы нарушения приверженности, что ведет к активизации
ВИЧ и МБТ, удлинению сроков лечения, нарастанию спектра устойчи-
вости к противотуберкулезным и антиретровирусным препаратам и, как
следствие, неэффективному лечению.
Вопросы организации работы по повышению приверженности
пациентов к ПТТ и APT имеют принципиальное значение в оказании
медицинской помощи при сочетанной инфекции.
7.6. Формирование приверженности к лечению туберкулеза и ВИЧ-инфекции 189
В настоящее время особое значение приобретает выполнение задач
привлечения и удержания пациентов в рамках существующей системы
помощи. Эти задачи представляют трудности для восприятия как орга-
низаторами здравоохранения, так и отдельными медицинскими работ-
никами. Пассивный характер предоставления помощи, т.е. только при
запросе со стороны пациентов, не учитывает сложившуюся ситуацию,
при которой большинство пациентов:
• социально дезадаптированы, имеют многочисленные психосоци-
альные проблемы;
• не имеют установок на поддержание своего здоровья и навыков
длительного общения с медицинскими работниками в режиме
диспансерного наблюдения.
Работа по созданию и поддержанию приверженности к лечению
будет эффективна в том случае, если будет строиться исходя из кон-
кретной ситуации и потребностей пациента.
Успех лечения ВИЧ/ТБ определяется не только клиническими
и лабораторными показателями в тщательно отобранных группах
пациентов, но и способностью существующей системы оказания меди-
цинской помощи обеспечить лечение как ВИЧ-инфекции, так и ТБ
всем нуждающимся. На решение вопроса о проведении ПТТ с учетом
спектра ЛУ и APT не должны влиять ни политические, ни социальные
факторы. Лечение необходимо предоставлять всем пациентам, нужда-
ющимся в нем по медицинским показаниям, в том числе потребителям
инъекционных наркотиков, лицам, оказывающим сексуальные услуги
за деньги, другим группам населения.
При работе с наркозависимыми пациентами необходимо учитывать
их анозогнозию и отсутствие мотивации лечения. Вначале необходимо
осуществлять активную мотивационную работу в целях привлечения
таких пациентов к лечению, а также использовать ресурсы нарколо-
гической службы в целях предоставления наркозависимым пациентам
наркологической помощи.
Разностороннюю диагностику проблем пациента, выделение наи-
более приоритетных из них и согласованность действий при решении
проблем обеспечивает мультипрофессиональный подход.
Необходимо обучать специалистов этому подходу и объединять
их в мультипрофессиональные команды, в которые должны входить
врач-фтизиатр, врач-инфекционист, медицинская сестра, психолог
и социальный работник, а также по мере необходимости — нарколог,
невролог, хирург, дерматовенеролог и другие профильные специали-
сты. Врачи-фтизиатры, врачи-инфекционисты, медицинские сестры
190
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
обязательно должны обучаться мультипрофессиональному подходу
и работать в формате мультипрофессиональных команд.
7.6.2. ФОРМИРОВАНИЕ ПРИВЕРЖЕННОСТИ
К ПРОТИВОТУБЕРКУЛЕЗНОЙ ТЕРАПИИ
Прием ПТП без перерывов увеличивает вероятность излечения
пациента, так как именно при ежедневном их приеме сохраняется
необходимая концентрация препаратов в крови и происходит воздей-
ствие на МБТ. Кроме того, непрерывный прием препаратов значитель-
но снижает риск развития ЛУ.
Для улучшения приверженности к лечению ТБ (приема всех пред-
писанных препаратов согласно схеме) существует несколько подхо-
дов, из которых наиболее эффективной считается стратегия DOTS,
рекомендуемая ВОЗ, при которой прием всех препаратов прово-
дят под непосредственным наблюдением медицинского работника
и отражают в карте лечения (форма ТБ-01). Контроль за привержен-
ностью к лечению оценивают на основе метода подсчета принятых доз
ПТП. Если больной прерывает лечение ТБ более чем на 2 мес, в карте
регистрируют: «Отрыв от лечения», и курс лечения нужно начинать
сначала. В сравнении с другими подходами эта стратегия позволяет
сократить количество отрывов до минимума. Значимым фактором,
усиливающим эффективность контролируемого лечения, является
социальная поддержка пациентов, получающих противотуберкулез-
ное лечение.
Чаще больные на амбулаторном лечении прерывают курс химио-
терапии, что является проблемой для каждой противотуберкулезной
программы. У социально дезадаптированных лиц (безработных, при-
бывших из мест заключения, алкоголиков и наркоманов, бездомных),
составляющих значительную часть зарегистрированных больных
ВИЧ/ТБ в регионах, снижена или отсутствует мотивация лечения,
а у некоторых — и жизни. Организация амбулаторного лечения у таких
пациентов — очень сложная задача. Еще сложнее — добиться хорошей
приверженности пациента к лечению и достигнуть положительно-
го исхода лечения. У каждого пациента всегда возникает множество
причин, которые мешают ему принимать ежедневно ПТП. Основные
причины: злоупотребление алкоголем, семейные проблемы, работа
или учеба, побочные эффекты на ПТП и APT.
Среди методов, направленных на улучшение приверженности паци-
ентов к лечению, выделяют 4 главные группы.
7.6. Формирование приверженности к лечению туберкулеза и ВИЧ-инфекции 191
• Методы, создающие возможность пациенту прибыть к месту про-
ведения контролируемой химиотерапии (такие как оплата проезда
к месту лечения и обратно, организация места лечения наиболее
близко к месту работы/проживания) или организация видеокон-
тролируемой химиотерапии. Также немаловажен хороший психо-
логический контакт с персоналом, проводящим лечение.
• Методы, мотивирующие пациента к ежедневному приему лекарств
(такие как выдача продуктовых, гигиенических наборов, различ-
ные формы социальной поддержки).
• Отрицательное стимулирование — судебная практика в рамках
реализации ФЗ.
• Обучение пациентов.
Обучение пациентов
Обучение больных ТБ — специально организованный процесс
взаимодействия медицинского работника и пациента, направленный
на формирование знаний, необходимых для полного завершения
курса лечения ТБ, соблюдения рекомендаций врача и мер инфекци-
онного контроля для предупреждения распространения туберкулез-
ной инфекции. В процессе этой работы пациент должен осознать, что
ТБ излечим, а ВИЧ-инфекция хорошо контролируется, но только при
условии длительного и беспрерывного приема препаратов. Обучение
в группах впервые выявленных больных ТБ целесообразно органи-
зовать на стационарном этапе лечения, что позволяет охватить всех
пациентов и минимизировать количество отказов больных от обуче-
ния. Распределение на группы по 4-6 человек проводят по мере госпи-
тализации пациентов, находящихся в удовлетворительном состоянии,
по критерию наличия или отсутствия у них бактериовыделения.
В программе обучения должны быть отражены общие представления
об этиологии и патогенезе ТБ, ВИЧ-инфекции и подробно раскрыты
вопросы лечения, профилактики, поведения больного ТБ в стациона-
ре и семье. Для организации учебного процесса назначают ответствен-
ное лицо с обязанностями по организации работы «Школы пациента»,
составления расписания и информирования преподавателей о време-
ни проведения занятий. Преподаватели школы — врачи-фтизиатры
и медицинские сестры стационарного отделения противотубер-
кулезных учреждений, а также социальный работник и психолог.
К процессу обучения может привлекаться младший медицинский
персонал, а также близкие больного и другие пациенты проти-
вотуберкулезного диспансера. В качестве методических пособий
192
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
используются медицинская карта лечения больного ТБ, противо-
туберкулезные, антиретровирусные препараты, рентгенограммы
дисциплинированных больных ТБ, успешно завершивших лечение,
и пациентов, лечившихся нерегулярно, различные информационные
материалы, научно-популярная литература о ТБ, ВИЧ-инфекции,
например статьи в газетах и журналах. Расписание составляют
таким образом, чтобы основная часть занятий с пациентом была
проведена в течение первых 2 нед после выявления заболевания.
В процессе обучения необходим контроль за знаниями, как посто-
янный на каждом занятии в виде серий вопросов и ответов, так
и заключительный в качестве итогового тестирования с обязательным
пояснением пациенту, почему его ответ был неверен. При правильной
организации обучение больных ТБ может быть значимым ресурсом
для повышения приверженности и эффективности ПТТ.
7.6.3. ФОРМИРОВАНИЕ ПРИВЕРЖЕННОСТИ
К АНТИРЕТРОВИРУСНОЙ ТЕРАПИИ
При лечении ВИЧ-инфекции эксперты ВОЗ пороговым значением
рекомендуют считать 95% уровень приверженности, так как он обеспе-
чивает наилучший вирусологический ответ на проводимую терапию.
При этом предлагаются следующие уровни оценки приверженности:
• хороший — не менее 95%;
• средний — 85-94%;
• низкий — не более 85%.
Ранее контроль приверженности к лечению осуществляли на основе
метода подсчета таблеток. При данном методе пациент должен прино-
сить (чаще ежемесячно) флаконы с таблетками в лечебное учреждение
для пересчета оставшихся таблеток. Количество пропущенных при-
емов подсчитывают по несовпадению ожидаемого количества таблеток
с реально установленным. В настоящее время контроль за приемом
APT чаще осуществляют по лабораторному критерию (уровню вирус-
ной нагрузки ВИЧ в крови пациента).
В настоящее время для формирования и поддержания привержен-
ности к лечению ВИЧ-инфекции используют различные стратегии
и методы. Наиболее эффективные меры — многосторонние методики,
сфокусированные на конкретном пациенте: пациент — центрирован-
ная терапия. Методология формирования приверженности к лечению
ВИЧ-инфекции — консультирование.
7.6. Формирование приверженности к лечению туберкулеза и ВИЧ-инфекции 193
Существуют различные формы консультирования. Различают до-
и послетестовое консультирование, кризисное консультирование, кон-
сультирование по вопросам лечения, семейное консультирование, кон-
сультирование созависимых родственников, консультирование нарко-
и половых партнеров пациентов.
Консультирование — взаимодействие, конфиденциальный диалог
с пациентом, направленный на изменение его поведения, основанный
на предоставлении информации и психологической поддержки.
На первом (общем) этапе консультирования важно выяснить объем
и характер представлений пациента о ВИЧ-инфекции и лечении этого
заболевания. Необходимо спросить пациента, что он знает о лечении
ВИЧ-инфекции. Врач в доступной форме рассказывает о целях высо-
коактивной APT, выгодах ее приема, требованиях к режиму лечения.
На втором (индивидуальном) этапе консультирования врач выясня-
ет проблемы, связанные с лечением заболевания у конкретного паци-
ента. Необходимо спросить пациента, как он относится к лечению,
готов ли к нему, что может помешать регулярному приему препаратов
APT и посещению врача для получения препаратов и контроля лечения.
В случае, если у пациента имеются проблемы (социальные, меди-
цинские, психологические), которые могут препятствовать регулярно-
му приему препаратов, необходимо использовать имеющиеся ресурсы
для решения этих проблем.
В решении различных проблем пациента согласованно работают все
члены мультипрофессиональной команды.
На третьем (поведенческом) этапе консультирования при готов-
ности пациента к началу лечения обсуждают конкретные вопросы,
связанные с режимом APT, возможными побочными эффектами и спо-
собами их коррекции; оформляют добровольное информированное
согласие на лечение; подчеркивают взаимный характер обязательств,
которые принимают на себя участники терапевтического процесса.
Существенное значение в формировании приверженности к лече-
нию имеют:
• разработка конкретного плана лечения, выдача графиков приема
препаратов и визитов к врачу в письменном виде;
• выдача вспомогательных средств: коробочек для лекарственных
средств, таймера;
• предоставление контактной информации, позволяющей пациенту
при необходимости обратиться к врачу;
• предоставление информации о возможности участия в работе
групп взаимопомощи и иных ресурсах, доступных в регионе.
194
Глава 7. Лечение туберкулеза у больных ВИЧ-инфекцией
В случае, если все приложенные усилия не приносят результата
и пациент не выражает готовности начать лечение, ему можно предло-
жить подписать информированный отказ от лечения.
Основные принципы лечения туберкулеза у больных ВИЧ-инфекцией
(резюме)
Основные принципы лечения ТБ у больных ВИЧ-инфекцией сво-
дятся к следующему.
• Назначение химиотерапии ТБ с учетом лекарственной чувстви-
тельности возбудителя, определяемого ускоренными молекуляр-
но-генетическими и культуральными методами.
• В случае отсутствия бактериовыделения вопрос о назначении
эмпирической ПТТ решать при обязательной оценке риска нали-
чия МЛУ/РУ ТБ.
• В период лечения ТБ каждому больному должно быть предло-
жено лечение ВИЧ-инфекции (APT). При исходном количестве
С04+-лимфоцитов менее 50 кл/мкл APT показана через 2 нед
после начала ПТТ; при количестве С04-клеток более 50 кл/мкл —
в первые 2 мес ПТТ.
• Своевременное выявление и лечение клинически значимых вне-
торакальных локализаций ТБ.
• Организация должного клинического и лабораторного монито-
ринга за состоянием больного в целях оценки эффективности
лечения и выявления побочных реакций на препараты. Знание
правил и возможность коррекции НЯ на комбинированную поли-
химиотерапию.
• Организация системы формирования приверженности к лечению
ВИЧ-инфекции и ТБ.
Глава 8
ПРОФИЛАКТИКА ТУБЕРКУЛЕЗА
У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
В соответствии с тем, что ТБ и ВИЧ-инфекция являются инфекци-
онными заболеваниями, профилактика ТБ у ВИЧ-инфицированных
имеет четыре основных направления.
• Своевременное начало лечения ВИЧ-инфекции. Раннее назначе-
ние APT, до развития выраженного иммунодефицита и вторичных
заболеваний.
• Превентивное лечение ЛТИ ПТП (ХП).
• Инфекционный противотуберкулезный контроль.
• Уменьшение резервуара туберкулезной инфекции за счет ранней
и быстрой диагностики и эффективного лечения больных ТБ.
8.1. АНТИРЕТРОВИРУСНАЯ ТЕРАПИЯ КАК ИНСТРУМЕНТ
ПРОФИЛАКТИКИ ТУБЕРКУЛЕЗА У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
В настоящее время основной компонент лечения больных
ВИЧ-инфекцией — APT, с помощью которой можно добиться контро-
лируемого течения заболевания, т.е. состояния, при котором, несмотря
на невозможность полного излечения, удается остановить прогресси-
рование болезни, добиться регресса вторичных заболеваний и восста-
новить трудоспособность пациента.
В соответствии с российскими «Рекомендациями по лечению
ВИЧ-инфекции и связанных с ней заболеваний, ХП заражения ВИЧ»,
утвержденными Национальным научным обществом инфекционистов
(2019), всем больным ВИЧ-инфекцией, вне зависимости от наличия
или отсутствия клинической симптоматики вторичных заболеваний,
количества С04+-лимфоцитов, уровня РНК ВИЧ в плазме крови,
показано назначение APT.
При выраженном иммунодефиците (СЭ4+-лимфоциты <50 кл/мкл)
больным ВИЧ-инфекцией и ТБ назначение APT показано в течение
первых 2-3 нед после начала ПТТ.
196
Глава 8. Профилактика туберкулеза у больных ВИЧ-инфекцией
При количестве С04+-лимфоцитов >50 кл/мкл начинают лечение
ТБ. При наличии НЯ, связанных с ПТТ, существенных лекарственных
взаимодействий между APT и ПТТ, низкой приверженности пациента
лечению, APT можно присоединить после окончания интенсивной
фазы ПТТ (Тм в течение первых 2 мес).
Доказано, что своевременное назначение APT, до развития вторич-
ных заболеваний и выраженного иммунодефицита, снижает вероят-
ность ТБ на 54-92%, причем выраженность эффекта зависит от исход-
ного количества С04+-лимфоцитов у пациентов, до начала APT.
В долгосрочной перспективе заболеваемость ТБ на фоне APT в зна-
чительной степени зависит от изменения количества С04-клеток
с течением времени.
Результаты крупного клинического когортного исследования,
проведенного в Южной Африке, показали, что среди 7536 больных
ВИЧ-инфекцией, получавших APT, ТБ в течение 4 лет развился
у 501 пациента (6,6%), причем в 284 случаях (56,7% случаев ТБ) —
в первые 6 мес от начала терапии. Обращала на себя внимание тесная
корреляционная связь вероятности развития ТБ в первые 6 мес лечения
и степени иммуносупрессии. Так, у больных с исходным количеством
С04+-лимфоцитов менее 50 кл/мкл ТБ развился в 42,3% случаях, а
с количеством СЭ4+-лимфоцитов более 200 кл/мкл — у 5,5% пациентов.
Таким образом, было доказано, что своевременное назначение
APT — самый мощный инструмент профилактики ТБ у больных
ВИЧ-инфекцией.
8.2. ХИМИОПРОФИЛАКТИКА ТУБЕРКУЛЕЗА
У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
(ЛЕЧЕНИЕ ЛАТЕНТНОЙ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ)
Лучшим средством профилактики ТБ у больных ВИЧ-инфекцией
является применение APT. ХП туберкулеза (лечение латентной
туберкулезной инфекции) — предупреждение развития активного
туберкулеза с помощью противотуберкулезных препаратов. Целью ХП
ТБ у ВИЧ-инфицированных пациентов является снижение риска раз-
вития ТБ в результате заражения (первичного или повторного) и/или
реактивации ЛТИ.
Термин «латентная туберкулезная инфекция» употребляется в от-
ношении пациентов, инфицированных М. tuberculosis в отсутствие
8.2. Химиопрофилактика туберкулеза у больных ВИЧ-инфекцией... 197
признаков активности туберкулезного процесса по клиническим, лабо-
раторным и рентгенологическим данным. Лечение ЛТИ у больных
ВИЧ-инфекцией — важная составляющая контроля и борьбы с ТБ
в странах с высоким уровнем инфицированности МБТ населения.
По оценочным данным ВОЗ, в мире инфицирована ТБ 1/4 населения.
Лица с латентной формой инфекции не имеют признаков актив-
ного ТБ и не заразны. ЛТИ выявляется на оценке иммунологиче-
ских тестов, характеризующих ответ гиперчувствительности замед-
ленного типа в ответ на введение специфического антигена in vivo
или in vitro (проба Манту, проба с аллергеном туберкулезным реком-
бинантным, IGRA-тесты). У больных ВИЧ-инфекцией с выражен-
ным иммунодефицитом (при количестве С04+-лимфоцитов менее
200 кл/мкл) иммунологические кожные тесты для выявления ЛТИ
ввиду пассивной анергии оказываются неинформативными. В 80—95%
случаев у пациентов с выраженным иммунодефицитом (количество
С04+-лимфоцитов <200 кл/мкл) реакции становятся отрицательными.
Именно поэтому любой отрицательный тест у ВИЧ-инфицированного
больного при выраженном иммунодефиците (количество CD4+-
лимфоцитов <200 кл/мкл) не исключает наличия ЛТИ. Кроме того,
положительный тест не позволяет дифференцировать ЛТИ от актив-
ного ТБ. У таких пациентов более эффективной заменой кожных проб
являются IGRA-тесты, результаты которых в меньшей степени зависят
от степени иммуносупрессии, обладают высокой чувствительностью
и специфичностью в отношении М. tuberculosis и являются тестами
однократного визита (исследование крови in vitro).
ХП ТБ противопоказана при наличии признаков активного ТБ,
поэтому важно перед назначением превентивного лечения ТБ быть уве-
ренным в отсутствии активного заболевания. При постановке на дис-
пансерный учет в территориальный Центр по профилактике и борьбе
со СПИДом врач-инфекционист определяет принадлежность пациента
к группе риска по ТБ (в обязательном порядке выясняет наличие кон-
тактов с больными ТБ и проводит активный опрос о наличии клини-
ческих симптомов, характерных для ТБ: лихорадки, кашля, снижения
массы тела, ночной потливости). Эти вопросы врач-инфекционист,
врач-фтизиатр, а также врач любой другой специальности в обязатель-
ном порядке должны задать не только на первичном приеме, но и далее
при каждой консультации. Эксперты ВОЗ считают, что активный ТБ
у ЛЖВ при отсутствии кашля, лихорадки, ночной потливости, потери
массы тела маловероятен, поэтому таким больным рекомендуют про-
филактику изониазидом.
198
Глава 8. Профилактика туберкулеза у больных ВИЧ-инфекцией
Кроме того, при постановке на диспансерный учет и далее регу-
лярно с частотой 1 раз в 6 мес всем пациентам должно быть прове-
дено цифровое флюорографическое или рентгенологическое обсле-
дование ОГК.
При выявлении контакта с больным ТБ, клинических симптомов
или изменений на рентгенограмме, подозрительных на ТБ, прово-
дится консультация врача-фтизиатра и обследование, направленное
на исключение активного ТБ (Приказ МЗ РФ № 951 от 29 декабря
2014 г.).
При отсутствии признаков активного ТБ (клинических и рентгено-
логических) врач-инфекционист или врач-фтизиатр в территориаль-
ном Центре по профилактике и борьбе со СПИДом определяет пока-
зания для проведения ХП. Важно помнить, что не следует направлять
пациентов для проведения ХП в противотуберкулезные учреждения
(если в них нет возможности полностью разделить потоки пациентов
с ВИЧ-инфекцией и пациентов с ТБ) ввиду высокого риска суперин-
фекции с развитием заболевания.
Показаниями для проведения ХП ТБ у больных ВИЧ-инфекцией
в России являются:
• снижение количества С04+-лимфоцитов до 350 кл/мкл и менее;
• положительные внутрикожные пробы с туберкулином, аллергеном
туберкулезным рекомбинантным (диаскинтест) или лабораторные
тесты IGRA вне зависимости от выраженности иммунодефицита;
• принадлежность к группам высокого риска развития ТБ вне зави-
симости от количества С04+-лимфоцитов и реакции на иммуно-
логические тесты.
Лица, ранее перенесшие ТБ (до инфицирования ВИЧ), в том числе
спонтанно излеченные, лица из контакта с источниками туберкулез-
ной инфекции, в том числе из очагов смерти от ТБ, лица, вернувшиеся
из учреждений управления Федеральной службы исполнения наказаний
в течение 2 лет после освобождения (если они не получали ХП ранее),
а также лица, находящиеся под следствием и отбывающие наказание
в учреждениях Управления Федеральной службы исполнения наказа-
ний, относятся к группам больных ВИЧ-инфекцией, имеющих высо-
кий риск развития ТБ.
Согласно современной концепции, ВОЗ считает, что лечение ЛТИ
должно быть обязательным в пакете комплексного ведения каждо-
го больного с ВИЧ-инфекцией, соответственно профилактическое
лечение ТБ показано всем подросткам и взрослым, живущим с ВИЧ
8.2. Химиопрофилактика туберкулеза у больных ВИЧ-инфекцией...
199
вне зависимости от результата иммунологического теста, степени
иммуносупрессии, наличия или отсутствия APT. ВОЗ рекомендует
в качестве ХП ТБ использовать ежедневный прием изониазида из рас-
чета 5 мг на 1 кг массы тела (до 300 мг/сут) по крайней мере в течение
6 мес, CDC — до 9 мес. Известно, что результаты пробы Манту не явля-
ются условием к назначению ХП, однако ее эффективность выше
у лиц, имеющих положительную реакцию Манту. ВОЗ не рекомендует
проведение IGRA-тестов ЛЖВ для скрининга в целях решения вопро-
са о назначении ХП из-за высокой стоимости исследования, при этом
информативность подобных исследований не принципиально превос-
ходит результаты кожного теста.
Согласно рекомендациям CDC, ХП назначают ЛЖВ только при
подтверждении ЛТИ (положительные результаты реакции Манту
или IGRA-тестов), а также лицам, находящимся в контакте с больным
ТБ и ранее перенесшим ТБ, при наличии остаточных посттуберкулез-
ных изменений в легочной ткани и ВГЛУ.
По мнению экспертов ВОЗ, беременность не является противопо-
казанием для ХП. Особенность ХП ТБ у беременных состоит в том,
что им не рекомендованы комбинированные режимы лечения: ХП
проводится только изониазидом. Однако последние исследования
подняли дискуссию о целесообразности проведения ХП ТБ у бере-
менных. В редакции американских рекомендаций 2019 г. широко-
масштабное проведение ХП беременным ВИЧ-инфицированным
женщинам не рекомендована.
Согласно Российским рекомендациям (МЗ, РОФ, 2020), больному
ВИЧ-инфекцией может быть назначен один из режимов ХП ТБ, сопо-
ставимых по эффективности и безопасности (табл. 8.1).
Пациенту выдают препараты для профилактического лечения в со-
ответствии с графиком визитов для получения APT. Необходимо нали-
чие обратной связи с пациентом (в течение первого месяца ХП не реже
1 раза в 10—14 дней, далее — не реже 1 раза в мес) для своевременной
оценки развития НЯ, связанных с принимаемыми препаратами, и при-
верженности терапии.
Важно подчеркнуть, что режим ХП, включающий изониазид
и рифапентин, должен проводиться только под непосредственным
наблюдением медицинского персонала (контролируемая ХП), за пери-
од курса ХП по указанной схеме пациент делает 12 визитов к врачу
(1 раз в нед).
200
Глава 8. Профилактика туберкулеза у больных ВИЧ-инфекцией
Таблица 8.1
Режимы химиопрофилактики туберкулеза при ВИЧ-инфекции
1
2
3
Режим ХП ТБ
Изониазид (5 мг/кг) и вита-
мин В6 (15-25 мг/сут)
Изониазид (5 мг/кг) и вита-
мин В6 (15-25 мг/сут) +
рифампицин (10 мг/кг)
или рифабутин (5 мг/кг)
Изониазид 900 мг и витамин
В6 (15-25 мг/сут) + рифа-
пентин 900 мг (для пациента
с массой тела более 50 кг)
Длительность
6 мес
3-4 мес
3 мес, прием
ПТП* 1 раз
в нед
Комментарии
-
Рифапентин можно исполь-
зовать только у больных
ВИЧ-инфекцией, не получаю-
щих APT
* Рекомендуемые дозы лекарственных средств для режима ХП (изониазид +
рифапентин): изониазид — 15 мг/кг; рифапентин (по массе тела): 10,0—14,0 кг =
300 мг; 14,1-25,0 кг = 450 мг; 25,1-32,0 кг = 600 мг; 32,1-49,9 кг = 750 мг;
>50,0 кг = 900 мг.
Согласно «Инструкции по химиопрофилактике туберкулеза
у взрослых больных ВИЧ-инфекцией» 2016 г., при противопоказаниях
к назначению рифампицина, рифабутина, рифампентина в Российской
Федерации применяются альтернативные схемы лечения латентной
туберкулезной инфекции:
— изониазид (5 мг/кг) и витамин В6 (15—25 мг/сут) + пиразин-
амид (25 мг/кг) — 3—4 мес;
- изониазид (5 мг/кг) и витамин В6 (15-25 мг/сут) + этамбутол
(15 мг/кг) — 3—4 мес.
Помимо хорошо известной схемы монотерапии изониазидом,
в клинической практике изучалась эффективность альтернативных
схем применения ПТП для ХП ТБ. Наиболее эффективной и безопас-
ной была признана комбинация препаратов рифапентина и изониазида
в интермиттирующем режиме. Рифапентин (циклопентильный рифа-
мицин) — ПТП, одобрен FDA для лечения ТБ с 1998 г., был зареги-
стрирован в РФ в 2011 г. Использовали рифапентин в дозе 900 мг +
изониазид в дозе 900 мг 1 раз в нед в течение 3 мес. Выявлено, что
режим не уступает по эффективности и безопасности предложенному
ВОЗ, состоящему из приема изониазида на протяжении 6 мес, а при-
верженность пациентов к профилактике была выше. Эксперты CDC
считают, что этот краткосрочный режим ХП в интермиттирующем
8.2. Химиопрофилактика туберкулеза у больных ВИЧ-инфекцией... 201
режиме может стать хорошей альтернативой традиционному лечению
ЛТИ изониазидом.
Рифапентин в составе схемы ХП ТБ желательно использовать толь-
ко у тех больных ВИЧ-инфекцией, которые не получают APT, посколь-
ку назначение рифапентина противопоказано при терапии ИП ВИЧ
и ненуклеозидными ингибиторами обратной транскриптазы ВИЧ.
В настоящее время имеются сведения о новом эффективном режиме
ХП ТБ, который включает ежедневный прием комбинации изониазида
и рифапентина в течение месяца. Этот режим не уступал по эффектив-
ности монопрофилактике изониазидом, вместе приверженность ЛЖВ
к короткому курсу приема препаратов была отчетливо выше: курс превен-
тивной терапии завершили 97% больных, включенных в исследование.
ХП ТБ следует проводить с осторожностью при хронических забо-
леваниях печени в стадии декомпенсированного цирроза (класс В и
С по шкале Чайлд—Пью), хронической болезни почек 4—5-й стадии
(для схем с рифампицином), заболеваниях ЦНС с эпилептическим
синдромом. При хронических заболеваниях печени в стадии декомпен-
сированного цирроза (класс В и С по шкале Чайлд—Пью) вопрос назна-
чения ХП и схемы терапии решает консилиум врачей с участием фти-
зиатра, гепатолога и инфекциониста с оценкой соотношения «польза/
риск». При почечной недостаточности 4—5-й стадии противопоказаны
рифампицин, рифабутин и рифапентин. При заболеваниях ЦНС с эпи-
лептическим синдромом следует воздержаться от приема изониазида.
Длительность ХП должна быть увеличена, если пациент продолжает
находиться в очаге туберкулёзной инфекции на период существования
очага или пребывает в местах лишения свободы, где проведение ХП
изониазидом предпочтительно проводить в течение 36 мес (в связи
с высоким уровнем заболеваемости и возможным риском контакта
с больным ТБ). Приоритетным при проведении ХП является назначе-
ние комбинированных ПТП.
Во время превентивного лечения необходимо контролировать
функциональное состояние печени (уровень аминотрансфераз, обще-
го билирубина) через 1 мес после начала ХП и далее 1 раз в 3 мес при
монотерапии изониазидом и 1 раз в мес при комбинированной схеме
профилактического лечения.
При показаниях к назначению APT и ХП у больных ВИЧ-инфекцией
при количестве С04+-лимфоцитов менее 100 кл/мкл с целью про-
филактики развития СВИС первоначально назначается ХП ТБ, a APT
присоединяется через 5—7 дней.
202
Глава 8. Профилактика туберкулеза у больных ВИЧ-инфекцией
Большинство исследователей, изучающих эффективность ХП ТБ
у больных ВИЧ-инфекцией, отмечают, что основная проблема, свя-
занная с ее проведением, заключается в том, что завершают реко-
мендуемый курс лечения не более половины пациентов. Это прежде
всего связано со сложностью и малой экономической целесообраз-
ностью организации контролируемого лечения, а также низким уров-
нем мотивации пациента к длительному приему химиопрепаратов при
отсутствии клинических признаков заболевания. Для повышения при-
верженности пациентов к ХП врачу-инфекционисту или врачу-фти-
зиатру необходимо провести консультирование о важности профи-
лактического лечения, длительности его проведения и характеру НЯ,
которые могут появиться в ходе лечения. В процессе консультирования
следует разъяснить, как протекает заболевание, обосновать необходи-
мость лечения и подчеркнуть, насколько важно довести курс лечения
до конца. Кроме того, пациенту следует объяснить, что ему необходимо
обратиться в медицинское учреждение при появлении следующих сим-
птомов: отсутствие аппетита, тошнота, рвота, ощущение дискомфорта
в области живота, постоянная усталость или слабость, моча темного
цвета, светлый стул или желтуха. Если при возникновении таких сим-
птомов обратиться в медицинское учреждение не удается, то прием
препарата следует немедленно прекратить.
Эффективность противотуберкулезной ХП у больных ВИЧ-ин-
фекцией с ЛТИ была доказана в нескольких рандомизированных
контролируемых исследованиях. Доказано, что по сравнению с пла-
цебо лечение ЛТИ снижает риск развития активного ТБ на 32% у всех
ВИЧ-инфицированных и на 62% — у лиц с положительной туберку-
линовой кожной пробой. Некоторыми авторами было показано, что
6-месячная ХП изониазидом независимо от APT снижала риск смерти
на 37% при среднем периоде наблюдения, а превентивное лечение
и APT имеют аддитивный эффект.
Основным критерием эффективности ХП является отсутствие слу-
чаев развития активного ТБ у лиц, получивших ХП, в течение двух
последующих лет. Результаты длительного наблюдения за больны-
ми ВИЧ-инфекцией, получавшими ХП изониазидом, показали, что
в регионах с высоким уровнем заболеваемости ТБ (РФ входит в число
таких регионов) защитное действие ХП у ЛЖВ кратковременное
(1,5—2,5 года). Поэтому считается, что если через один год после проведе-
ния профилактического курса количество С04+-лимфоцитов у пациента
не превышает 350 кл/мкл, следует ежегодно повторять ХП независимо
от проведения APT вплоть до повышения CD4 выше уровня 350 в мкл.
8.3. Инфекционный противотуберкулезный контроль
203
Несмотря на достаточно большой накопленный опыт клинического
применения ХП ТБ у больных ВИЧ-инфекцией, некоторые аспекты пре-
вентивного лечения у этой категории пациентов требуют дальнейшей раз-
работки и уточнения. Не определено, какой режим ХП рекомендовать для
пациентов, находившихся в контакте с больным МЛУ или широкой ЛУ
ТБ. Режим ХП ТБ для лиц из контакта с МЛУ/РУ ТБ пока не разработан
и не рекомендован для широкого применения. Не определено, какова
должна быть ХП в регионе с высоким уровнем МЛУ. В настоящее время
эксперты ВОЗ не рекомендуют использовать препараты резерва для про-
ведения ХП. Также нет ясности, какова эффективность ХП изониазидом
в регионах с высоким уровнем МЛУ/РУ ТБ, так как большинство иссле-
дований по изучению эффективности профилактики изониазидом выпол-
нены в регионах с невысоким уровнем распространенности МЛУ МБТ.
8.3. ИНФЕКЦИОННЫЙ ПРОТИВОТУБЕРКУЛЕЗНЫЙ КОНТРОЛЬ
Инфекционный противотуберкулезный контроль — совокупность
мер, направленных на минимизацию контакта здоровых людей и ЛЖВ
с туберкулезной инфекцией. Основой инфекционного контроля явля-
ются ранняя и быстрая диагностика и правильное лечение больных ТБ,
уменьшение количества бактериовыделителей — основного источника
инфицирования ЛЖВ.
Для успешной реализации инфекционного контроля ТБ необходимы:
эффективное техническое руководство; координация усилий органов
управления здравоохранения, финансов, юстиции и др.; координация
между различными программами борьбы с инфекционными заболева-
ниями на национальном уровне, между национальными и субнацио-
нальными органами здравоохранения и социального развития; участие
технических партнеров и гражданского общества; массовая пропаганда
и мобилизация в целях устранения препятствий, мешающих широко-
масштабной реализации мероприятий инфекционного противотуберку-
лезного контроля; адекватное финансирование на всех уровнях.
Выделяют 4 уровня мер инфекционного контроля (указаны по сте-
пени значимости):
• управленческие мероприятия;
• административные меры;
• инженерно-технический контроль;
• индивидуальные меры.
Управленческие мероприятия обеспечивают структурную осно-
ву для реализации инфекционного противотуберкулезного контроля
204
Глава 8. Профилактика туберкулеза у больных ВИЧ-инфекцией
в учреждениях здравоохранения, местах массового скопления людей
и в домашних условиях. Управленческие мероприятия включают:
• создание и укрепление органа, который должен координиро-
вать мероприятия по инфекционному контролю ТБ; разработку
детального бюджетного плана, включающего затраты на кадровые
ресурсы, необходимые для реализации мероприятий по инфекци-
онному контролю ТБ на всех уровнях;
• обеспечение должного проектирования учреждений здравоохра-
нения, их строительство, модернизацию и эксплуатацию;
• организацию обследования на ТБ работников здравоохранения
(врачей и технического персонала), имеющих профессиональный
контакт с источником инфекции;
• направление усилий на распространение информации об инфек-
ционном контроле ТБ и его пропаганду, обеспечение социальной
мобилизации для его внедрения, вовлечения в эту деятельность
гражданского общества;
• осуществление мониторинга и оценку выполнения комплекса мер
по инфекционному противотуберкулезному контролю;
• подготовку и проведение прикладных научных исследований.
Помимо этого, в отношении ЛЖВ управленческие мероприятия
включают организацию системы кабинетов скрининговой диагно-
стики ТБ в центрах по профилактике и борьбе со СПИДом, а также
кабинетов и стационарных отделений противотуберкулезной помо-
щи больным ВИЧ-инфекцией в противотуберкулезных учреждениях.
Административные меры инфекционного контроля касаются рас-
пределения потоков больных, изоляции заразных больных, обучения
пациентов и медицинских работников. Административные мероприя-
тия в отношении ЛЖВ включают:
• санитарно-просветительную работу среди ЛЖВ о мерах профилак-
тики ТБ и путях избежания контакта с туберкулезной инфекцией;
• обеспечение изоляции (чаще — госпитализации) больного ТБ
из очага, в котором находятся больные ВИЧ-инфекцией;
• организацию госпитализации больных ВИЧ-инфекцией с подо-
зрением на заболевание ТБ в боксированные отделения инфекци-
онного стационара или в боксированные палаты специализиро-
ванных отделений противотуберкулезного учреждения;
• в противотуберкулезном стационаре — сортировку больных ВИЧ-
инфекцией по наличию бактериовыделения и спектру Л У МБТ;
• обучение персонала мерам защиты от ТБ и ВИЧ-инфекции;
• обучение пациентов этикету кашля и средствам индивидуальной
защиты от внутригоспитального инфицирования.
8.3. Инфекционный противотуберкулезный контроль
205
Инженерно-технический контроль необходим для снижения кон-
центрации М. tuberculosis в воздухе в тех местах, где зараженность воз-
духа наиболее вероятна. Инженерно-технический контроль включает
вентиляцию, ультрафиолетовое бактерицидное излучение и филь-
трацию воздуха.
Вентиляция — движение воздушных потоков в помещении (учрежде-
нии), переносящих инфекционный аэрозоль с возбудителем ТБ. В про-
тивотуберкулезном учреждении воздушные потоки следует направлять
от чистой зоны к менее чистой. Вентиляция может быть естественной
(горизонтальное проветривание) и механической.
Механическая вентиляция — принудительное движение воздушно-
го потока в определенном направлении, удаление загрязненного воз-
духа из помещения и замена его свежим. Преимущества механической
вентиляции — целенаправленное, контролируемое движение воз-
духа; создание в зонах высокого риска отрицательного давления
с 6-12-кратным воздухообменом в час, в зонах для персонала — поло-
жительного давления; подача свежего воздуха, удаление загрязненно-
го воздуха. Недостатки механической вентиляции — ее техническая
сложность от проекта до эксплуатации, высокая стоимость и необхо-
димость сервисного обслуживания.
Ультрафиолетовое бактерицидное излучение — электромагнитное
излучение ультрафиолетового диапазона в интервале от 205 до 315 нм
(1 нм = 10~9 м). Этот вид излучения обладает энергией, достаточной
для воздействия на химические связи, в том числе в живых клетках.
Губительное действие ультрафиолета на МВТ оказывается при длине
волны 254 нм. Преимуществами устройств ультрафиолетового бактери-
цидного излучения являются их невысокая стоимость, простота обслу-
живания; при наличии экрана — эффективность обеззараживания
верхней части помещения в присутствии людей. Недостаток устройств
ультрафиолетового бактерицидного излучения: при неправильном
монтаже могут оказывать побочные действия на глаза и кожу людей.
Фильтрация воздуха — очищение посредством пропускания через
фильтр любого зараженного воздуха, циркулирующего в палате
или других помещениях, который может быть выпущен рядом с воз-
духозабором вентиляции. Различают фильтры грубой очистки (G1—
G4), предназначенные для предварительной очистки воздуха (пло-
ские); фильтры тонкой очистки (F5—F9), предназначенные для грубой
и тонкой очистки воздуха (карманные), и фильтры высокой эффектив-
ности очистки (НЮ—Н14), предназначенные для высокоэффективной
финишной очистки воздуха.
206 Глава 8. Профилактика туберкулеза у больных ВИЧ-инфекцией
В палатах для больных ТБ в сочетании с ВИЧ-инфекцией обязатель-
но должны быть эффективная механическая вентиляция и ультрафио-
летовое бактерицидное излучение.
Индивидуальные меры. Для защиты дыхательных путей медицин-
ским работникам следует использовать сертифицированные респи-
раторы. Средства индивидуальной защиты медицинские работники
должны применять в помещениях с высокой концентрацией инфек-
ционных аэрозолей, например в отделениях для бациллярных больных
и бактериологических лабораториях.
Пациенты с бактериовыделением по мазку мокроты (методом
простой микроскопии) в помещении должны использовать хирурги-
ческие маски. Критерий прекращения бактериовыделения — отри-
цательные результаты двукратного исследования мазка мокроты
с интервалом 1 мес.
Таким образом, идеальная модель мероприятий по профилактике ТБ
у больных ВИЧ-инфекцией сводится к уменьшению так называемого
бациллярного ядра в обществе за счет своевременного выявления и эффек-
тивного лечения всех больных активным ТБ, и прежде всего бактериовыде-
лителей. В результате этих мероприятий значительно сокращается количе-
ство людей, инфицированных МБТ, в том числе ЛЖВ. Также значительно
уменьшается вероятность свежего заражения людей, уже инфицированных
МБТ, а для больных ВИЧ-инфекцией при выраженной иммуносупрессии
роль суперинфекции — приоритетна в развитии ТБ. Вторым важным аспек-
том снижения заболеваемости ТБ среди ВИЧ-инфицированных является
своевременное назначение APT. При этом, несмотря на ВИЧ-позитивный
статус, пациент опять становится иммунокомпетентным, а вероятность раз-
вития ТБ у таких людей не превышает общепопуляционной.
МНН: Рифапентин (Рифапекс) — оптимальный выбор химио-
профилактики — один раз в неделю, 12 визитов к врачу!
Препарат АО
«Акрихин»
Рифапекс,
таблетки,
покрытые
пленочной
оболочкой
МНН
Рифапентин,
150 мг
Рекомендуемые
суточные дозы
мг/кг
Юмг/кг,
1 раз в неделю
[1,2]
Количество
таблеток в сутки
при массе тела
более 50 кг
6
таблеток
Количество
визитов
пациента
к врачу
12
визитов
Возраст
С12 лет
8.3. Инфекционный противотуберкулезный контроль
207
• Принимать внутрь 1 раз в сутки независимо от приема пищи.
• Рифапентин — единственный из группы рифамицинов, обла-
дающий продленным действием [1].
Рекомендуемые дозы Рифапентина для проведения химиопро-
филактики (с учетом массы тела больного) [3]:
• 10,0-14,0 кг —300 мг;
• 14,1-25,0 кг-450 мг;
• 25,1-32,0 кг-600 мг;
• 32,1-49,9 кг-750 мг;
• >50,0 кг - 900 мг.
В альтернативных схемах профилактики туберкулеза у больных
ВИЧ-инфекцией приоритет отдан комбинированным препаратам.
Название
препарата
Фтизопирам® В6
Фтизоэтам® В6
Состав препарата
Изониазид 150 мг
Пиразинамид 500 мг
Пиридоксин 15 мг
Изониазид 150 мг
Этамбутол 400 мг
Пиридоксин 15 мг
Режим
дозирования,
мг/кг
Препарат
дозируется
по изониазиду
5 мг/кг
Препарат
дозируется
по изониазиду
5 мг/кг
Количество
таблеток при
массе тела
пациента 60 кг
2*
2*
Кратность
приема
1 раз в сутки,
ежедневно
1 раз в сутки,
ежедневно
Фтизопирам® В6 и Фтизоэтам® B6 дозируются по Изониазиду 5—10 мг/кг, принимаются
1 раз в сутки.
* Можно добавить этамбутол или пиразинамид.
1. Инструкция по применению лекарственного препарата, утвержденная Минздравом
России.
2. Руководство по ведению пациентов с латентной туберкулезной инфекцией. М., 2015.
3. Инструкция по химиопрофилактике туберкулеза у взрослых больных ВИЧ-инфекцией /
Под ред. И А Васильевой, Е.Е. Воронина, В.В.Покровского. 14.03.2016.
Данный материал предоставлен на правах рекламы.
Глава 9
ЭПИДЕМИОЛОГИЯ ТУБЕРКУЛЕЗА, ВИЧ-ИНФЕКЦИИ
И СОЧЕТАННОЙ ИНФЕКЦИИ (ВИЧ/ТУБЕРКУЛЕЗ)
В РФ И В МИРЕ
История развития эпидемии ВИЧ-инфекции в мире насчитывает
уже более 35 лет. В 1981 г. были опубликованы первые описания случа-
ев ПЦП и саркомы Капоши у мужчин-гомосексуалистов в США. ВИЧ,
вероятно, появился в 20—30-е годы прошлого века, когда вирус иммуно-
дефицита обезьян, преодолев межвидовой барьер, перешел от шимпан-
зе к человеку. Самый старый ВИЧ-инфицированный образец человече-
ской крови был обнаружен в Киншасе (Заире, ныне Демократической
Республике Конго) и датируется 1959 г. Вирус впервые открыт в 1983 г.
в лаборатории, руководимой Люком Монтанье. В 2008 г. Л. Монтанье
и Франсуаза Барре-Синусси были удостоены Нобелевской премии
в области физиологии и медицины за открытие ВИЧ. После первого
описания клинического случая СПИДа в 1981 г. ВИЧ-инфекция была
зарегистрирована почти во всех странах земного шара. Эта эпидемия
беспрецедентна по своим размерам и стала глобальной проблемой
здравоохранения: к концу 2018 г. ВИЧ заразились 74,9 млн человек,
более 32 млн человек умерли от причин, связанных с ВИЧ. Эпидемия
ВИЧ-инфекции вызвала глубокие демографические изменения в стра-
нах с высоким уровнем пораженности ВИЧ-инфекцией.
По оценочным данным UNAIDS, общее количество ЛЖВ на конец
2018 г. достигло в мире в среднем 37,9 млн человек (32,7—44,0), и,
как минимум, 1/3 из них инфицированы МВТ. Распространенность
ВИЧ-инфекции и последствия эпидемии в разных странах существен-
но различаются. В развитых странах ВИЧ-инфекция не входит в число
основных проблем здравоохранения, тогда как страны Африки к югу
от Сахары, Юго-Восточной Азии и Тихоокеанского бассейна наи-
более поражены данным заболеванием: 70% взрослых и почти 90%
детей, инфицированных ВИЧ, живут здесь. Пораженность населения
ВИЧ-инфекцией на Африканском континенте составляет от 5 до 20%
в зависимости от региона.
Глава 9. Эпидемиология туберкулеза, ВИЧ-инфекции...
209
ТБ в мировом масштабе — главная причина смерти больных ВИЧ-
инфекцией: на его долю приходится около одной трети случаев смерти,
связанных со СПИДом. Так, согласно данным ВОЗ, в 2017 г. зареги-
стрировано 476 774 случая туберкулеза (впервые выявленных и с реци-
дивом туберкулеза) в сочетании с ВИЧ-инфекцией. По оценке ВОЗ,
в 2016 г. от туберкулеза, сочетанного с ВИЧ-инфекцией (ТБ/ВИЧ),
умерло около 374 тыс. человек.
С 2010 г. наметились положительные тенденции в противодействии
СПИДу в виде уменьшения случаев нового заражения ВИЧ, сниже-
ния смертности от СПИДа. По данным на 2018—2019 гг., число новых
случаев ВИЧ-инфекции сократилось более чем в 1,4 раза в сравнении
с 2000 г., смертность от ВИЧ-ассоциированных заболеваний снизи-
лась вдвое (с 1,4 млн человек в 2000 г. до 770 тыс. человек в 2018 г.).
Отмеченные противоэпидемические успехи эксперты связывают
с успешным расширением доступа к APT и эффективной профилак-
тикой вертикальной передачи инфекции от матери к плоду. По состо-
янию на конец июня 2019 г., 24,5 млн человек (62% ЛЖВ) получали
лечение в рамках APT. В 2018 г. доступ к APT имели 23,3 млн ЛЖВ,
тогда как в 2010 г. возможность получать лечение ВИЧ-инфекции была
только у 7,7 млн.
В 2010 г. на каждого человека, начинающего лечение, приходилось
два новых случая заражения ВИЧ-инфекцией, а к 2019 г. это соотно-
шение изменилось: число людей, получающих APT, в 14 раз превысило
число новых зарегистрированных случаев ВИЧ-инфекции.
UN AIDS и ВОЗ выделяют три стадии развития эпидемии ВИЧ-ин-
фекции: начальную, концентрированную и генерализованную. В каж-
дой стране эпидемия может со временем переходить из одной стадии
в другую, но этот процесс не является неизбежным.
Начальная стадия. Несмотря на возможное присутствие
ВИЧ-инфекции в течение многих лет, ее распространенность не достиг-
ла значительного уровня ни в одной из групп населения.
Зарегистрированные случаи относятся в основном к людям, чье
поведение связано с повышенным риском инфицирования ВИЧ:
потребителям инъекционных наркотиков; мужчинам, имеющим секс
с мужчиной, работницам коммерческого секса.
Во всех этих группах распространенность ВИЧ устойчиво не превы-
шает 5%.
Концентрированная стадия. ВИЧ-инфекция быстро распростра-
няется среди групп населения, чье поведение связано с повышен-
ным риском, при этом не укоренившись среди населения в целом.
210
Глава 9. Эпидемиология туберкулеза, ВИЧ-инфекции...
Дальнейшее развитие эпидемии зависит от частоты и характера взаи-
мосвязей между этими группами и другими группами населения.
Распространенность ВИЧ-инфекции устойчиво превышает 5% как
минимум в одной из групп населения. Среди беременных в городских
районах распространенность ВИЧ составляет менее 1%.
Генерализованная стадия. При генерализованной эпидемии
ВИЧ-инфекция прочно укореняется среди населения в целом. Несмотря
на то что группы повышенного риска по-прежнему способствуют
ускорению распространения инфекции, сеть сексуальных связей среди
населения достаточна для дальнейшего распространения эпидемии
независимо от групп повышенного риска.
Уровень распространенности ВИЧ-инфекции среди беременных
устойчиво выше 1%.
В 1987 г. ВИЧ-инфекция была впервые диагностирована у первого
жителя нашей страны. С этого периода осуществляется эпидемиоло-
гический надзор за ВИЧ-инфекцией в Российской Федерации, кото-
рый характеризуется единой регистрацией всех случаев заболевания.
До 1998 г. выявлялись лишь единичные случаи, а в дальнейшем коли-
чество больных стало стремительно расти за счет быстрого распро-
странения инфекции в среде наркопотребителей. Пик заболеваемости
ВИЧ-инфекцией пришелся на 2001 г., когда было зарегистрировано
максимальное количество впервые выявленных случаев — 88 422 чело-
века. В период 2001—2003 гг., по данным экспертов ВОЗ, эпидемия
ВИЧ-инфекции в России распространялась быстрее, чем в других
странах мира. С этого времени отмечается стремительный рост куму-
лятивного количества ЛЖВ в нашей стране. На 30 июня 2019 г. заре-
гистрировано 1 376 907 российских граждан (по предварительным
данным), у которых выявлены антитела к ВИЧ. Кумулятивное количе-
ство умерших среди ВИЧ-позитивных россиян к концу первого полу-
годия 2019 г. составило 335 867 человек — 24,4% зарегистрированных
больных ВИЧ-инфекцией. Наиболее высокий уровень пораженности
ВИЧ-инфекцией среди населения наблюдается в возрастной группе
30-34 года. Среди мужчин в возрасте 35—39 лет 3,2% жили с уста-
новленным диагнозом ВИЧ-инфекции. Среди населения в возрасте
15-49 лет 1,2% были инфицированы ВИЧ.
Случаи ВИЧ-инфекции зарегистрированы во всех субъектах
Российской Федерации, однако распространенность этой инфек-
ции неравномерна. Самые высокие показатели заболеваемости
ВИЧ-инфекцией в пересчете на 100 тыс. населения в 2018 г. отмечались
в Кемеровской, Иркутской, Свердловской, Самарской, Оренбургской,
Глава 9. Эпидемиология туберкулеза, ВИЧ-инфекции...
211
Ленинградской областях, Ханты-Мансийском автономном округе —
Югре, Челябинской и Тюменской областях.
ВИЧ-инфекция вышла за пределы уязвимых групп населения
и активно распространяется в общей популяции. Большинство боль-
ных, впервые выявленных в первом полугодии 2019 г., заразились при
гетеросексуальных контактах (58,9%), доля инфицированных ВИЧ при
употреблении наркотиков снизилась до 37,4%. 2,6% больных инфици-
ровались при гомосексуальных контактах. Количество зараженных при
половых контактах ежегодно увеличивается.
Ввиду особенностей течения заболевания значительная часть ЛЖВ
не знают о своем ВИЧ-статусе. По оценочным данным Федерального
центра по профилактике и борьбе со СПИДом, в России прожива-
ют примерно 1 300 000-1 500 000 ВИЧ-инфицированных лиц, что
составляет 1,6—1,8% в возрастной группе 15—49 лет (расчет проводился
по методологии подхода UNAIDS/ВОЗ к оценке и прогнозированию
национальных эпидемий ВИЧ/СПИДа, 2003).
В течение всего периода развития эпидемии ВИЧ-инфекции
в Российской Федерации наиболее распространенным вторичным
заболеванием был и остается ТБ, при этом почти у 60% умерших
от ВИЧ-инфекции непосредственной причиной смерти была туберку-
лезная инфекция.
Актуальность проблемы ТБ в сочетании с ВИЧ-инфекцией стала
очевидной в последнее десятилетие XX в. ТБ и ВИЧ-инфекцию можно
рассматривать как два взаимовлияющих заболевания. Сходство отдель-
ных звеньев патогенеза, вовлечение в эпидемиологический процесс
одних и тех же групп риска, высокая инфицированность МБТ населе-
ния обусловливают крайне неблагоприятный прогноз развития соче-
танной эпидемии.
Тесная взаимосвязь между ТБ и ВИЧ-инфекцией раньше всего
продемонстрировала себя в странах Африки, а также среди наркома-
нов в США. В странах с генерализованной эпидемией ВИЧ-инфекции
вероятность развития ТБ у ВИЧ-положительных людей приблизитель-
но в 20—30 раз выше, чем у ВИЧ-отрицательных. В некоторых эпиде-
миологически неблагоприятных регионах заболеваемость ТБ среди
ЛЖВ выше общепопуляционной почти в 50 раз.
Следует отметить, что распространенность ТБ как вторичного
заболевания при ВИЧ-инфекции географически неоднородна. Подан-
ным отчетов медицинской статистики США и Западной Европы, ТБ
на стадии СПИДа развивается лишь у 5% пациентов и стоит на 6-м
месте после других СПИД-индикаторных заболеваний. В тех странах,
212
Глава 9. Эпидемиология туберкулеза, ВИЧ-инфекции...
где широко используют APT, заболеваемость ТБ идет на убыль. В стра-
нах Южной Африки, Восточной Европы и в Российской Федерации
30-75% больных ВИЧ-инфекцией на стадиях СПИДа заболевают ТБ.
Это связано с тем, что заболеваемость ТБ у больных ВИЧ-инфекцией
тесно коррелирует с общей инфицированностью населения МБТ.
ВИЧ-инфекция на стадии глубокого иммунодефицита — самый мощ-
ный фактор для прогрессирования ЛТИ в заболевание. Среди всех
инфицированных МБТ риск заболевания ТБ составляет в течение
жизни 10%, а у больных ВИЧ-инфекцией он повышается до 8-10%
в течение одного года. По оценочным данным ВОЗ, в мире инфици-
рована ТБ 1/3 населения. В России инфицировано практически все
взрослое население.
В Российской Федерации до 2004 г. эпидемии ВИЧ-инфекции и ТБ
развивались параллельно. В этот период ВИЧ-инфекция у большин-
ства пациентов была в субклинической стадии, а заболеваемость ТБ
отмечалась среди них несколько выше общепопуляционной только
за счет значительного количества пациентов, входящих в социальные
группы риска по ТБ. К 2005 г. наметилась стойкая тенденция слияния
двух эпидемий в регионах и городах с большим уровнем распростране-
ния ВИЧ-инфекции (Санкт-Петербурге, Москве, Калининградской,
Свердловской областях и др.).
Заболеваемость ВИЧ-инфекцией с 2014 г. превышает заболеваемость
ТБ (в 2017 г. больше на 20,9%), распространенность ВИЧ-инфекции
стала превышать распространенность ТБ с 2008 г. (в 2017 г. более чем
в 3,9 раза).
Заболеваемость ТБ пациентов с ВИЧ-инфекцией среди постоян-
ного населения, вставшего на учет, в 2017 г. была 53,3 раза выше (1779,6
на 100 000 инфицированных ВИЧ), чем в среднем по России без инфи-
цированных ВИЧ (33,4 на 100 000 населения).
Самые низкие показатели заболеваемости ТБ среди ЛЖВ, по дан-
ным 2017 г., отмечались в Центральном (1040,5 на 100 000 инфициро-
ванных ВИЧ) и Северо-Западном (950,5 на 100 000 инфицированных
ВИЧ) федеральных округах России, а самые высокие — в Сибирском
(2620,6) и Дальневосточном (2050,6) федеральных округах.
В РФ сокращается количество смертей от ТБ при отчетливом
увеличении количества смертей от коинфекции. ВИЧ-инфекция
выходит на одно из первых мест в структуре смертности населения
молодого трудоспособного возраста (18—44 года): от ассоциирован-
ных с ней состояний и заболеваний умирают больше, чем от заболе-
ваний органов дыхания и нервной системы, ишемической болезни
Глава 9. Эпидемиология туберкулеза, ВИЧ-инфекции...
213
сердца, цереброваскулярных болезней, злокачественных новооб-
разований и ТБ. В абсолютном большинстве случаев смертельные
исходы при коинфекции обусловлены наличием инкурабельного
генерализованного ТБ у пациентов с низким иммунным статусом.
Согласно Глобальному отчету ВОЗ по ТБ (2019 г.), частота смер-
тельных исходов при коинфекции составляет 11%, однако по данным
отдельных региональных исследований этот показатель достигает 40%
среди новых случаев ТБ и до 50% среди рецидивов.
Высокая летальность при коинфекции на современном этапе может
свидетельствовать не столько о трудностях диагностики, сколько
об остром прогрессировании ТБ при ВИЧ-ассоциированной иммуно-
супрессии в условиях недостаточного охвата адекватной APT и ХП ТБ.
В глобальном масштабе особые опасения вызывает увеличение
количества случаев сочетания МЛУ ТБ и ВИЧ-инфекции. Несмотря
на то что тесная связь между этими заболеваниями была доказа-
на многими авторами, эксперты ВОЗ все же считают необходимы-
ми дальнейшие исследования для определения того, происходит ли
в мире какое-либо совпадение эпидемий МЛУ ТБ и ВИЧ-инфекции.
Среднероссийский показатель первичной МЛУ среди больных коин-
фекцией в 2017 г. составил 33,6%, вторичной — 56,2%, а по данным
некоторых регионов с высокой распространенностью ВИЧ-инфекции
эти показатели были существенно выше среднероссийских (первичная
МЛУ составила 51,9%, вторичная достигла 82,3%) и аналогичных пока-
зателей среди лиц, не инфицированных ВИЧ.
Увеличение количества больных ВИЧ-инфекцией в России, рост
числа случаев сочетанной инфекции подтверждают значимость про-
блемы ТБ, сочетанного с ВИЧ-инфекцией, и необходимость оптими-
зации оказания помощи этой категории больных.
Глава 10
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ТУБЕРКУЛЕЗА
ОРГАНОВ ДЫХАНИЯ ПРИ ВИЧ-ИНФЕКЦИИ
На современном этапе болезни органов дыхания являются наиболее
частыми причинами госпитализаций больных ВИЧ-инфекцией. При
этом пациенты с ВИЧ-инфекцией, как правило, обращаются и госпи-
тализируются не в специализированные инфекционные учреждения,
а в терапевтические и пульмонологические отделения общелечебной
сети. Поэтому именно врачи-терапевты и пульмонологи зачастую
первыми встречаются со всем многообразием легочной патологии
при ВИЧ-инфекции, нередко до выяснения ВИЧ-статуса пациента:
по некоторым данным, до 40% больных впервые узнают о наличии
у них ВИЧ-инфекции при обращении с респираторными симптомами.
С ростом числа больных ВИЧ-инфекцией и пациентов с вторич-
ными заболеваниями на поздних стадиях возникают обоснованные
организационные сложности с обеспечением взаимодействия врачей
различных специальностей (фтизиатр, инфекционист, пульмонолог,
рентгенолог, торакальный хирург, эндоскопист, морфолог).
С одной стороны, увеличение потока больных с ВИЧ-инфекцией
в отделения терапевтического и пульмонологического профиля с изме-
нением и расширением спектра легочной патологии требует от врачей
различных специальностей (и прежде всего от терапевтов и пульмоно-
логов) новых знаний и специальной подготовки, а также диктует изме-
нение лечебно-диагностического подхода у этой категории больных,
ведь принимать клинические решения нередко приходится в отсут-
ствие современной лабораторной диагностики вторичных инфекций.
С другой стороны, неверно выбранная лечебно-диагностическая
тактика ведения ВИЧ-инфицированного с легочной патологией обу-
словливает позднее начало этиотропной терапии и, как результат,
высокую летальность.
Известно, что, помимо встречающихся в популяции, поражения
органов дыхания у больных ВИЧ-инфекцией могут вызывать более
Глава 10. Дифференциальная диагностика туберкулеза органов дыхания... 215
20 дополнительных инфекционных агентов, а также злокачественные
и лимфопролиферативные заболевания. Состояния, связанные с пора-
жением легких, являются основной причиной обращения больных
ВИЧ-инфекцией за медицинской помощью; легочная патология реги-
стрируется у 80% умерших больных ВИЧ-инфекцией в инфекционном
стационаре.
Объективные сложности дифференциальной диагностики вторич-
ных заболеваний легких у больных ВИЧ-инфекцией и типичные ошиб-
ки при легочных поражениях у ЛЖВ свидетельствуют о необходимости
совершенствования лечебно-диагностической тактики в отношении
этой сложной категории больных.
10.1. ОБЩИЕ ПРИНЦИПЫ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ
ЛЕГОЧНЫХ ПОРАЖЕНИЙ ПРИ ВИЧ-ИНФЕКЦИИ
Традиционно наиболее частыми заболеваниями легких у больных
ВИЧ-инфекцией являются бактериальные пневмонии, ТБ и пневмо-
цистоз. ЦМВ-инфекция, грибковые и паразитарные пневмонии, зло-
качественные заболевания легких встречаются реже.
Необходимо подчеркнуть, что выяснение этиологии поражений
легких у ЛЖВ представляет значительные сложности даже в специали-
зированных инфекционных стационарах, так как клинико-рентгеноло-
гическая картина и лабораторные данные при различных заболеваниях
неспецифичны, а сами заболевания, которые развиваются на фоне
ВИЧ-ассоциированной иммуносупрессии, редко встречаются в общей
популяции.
Важно знать, что спектр возможных заболеваний у ЛЖВ определя-
ется степенью иммуносупрессии. Так, при CD4 >350 кл/мкл оппорту-
нистические инфекции и опухоли маловероятны, а ТБ, как правило,
протекает классически, поэтому диагностическая и лечебная тактика
строится на тех же принципах, что и у лиц, не инфицированных ВИЧ.
При иммунносупрессии спектр вероятных заболеваний расши-
ряется по мере профессирования иммунодефицита с наличием так
называемых пороговых значений количества С04+-лимфоцитов для
большинства нозологии (табл. 10.1). В ситуациях, когда по каким-либо
причинам уровень С04+-лимфоцитов неизвестен, целесообразно исхо-
дить из предположения о глубоком иммунодефиците, пока не будет
доказано обратное.
216 Глава 10. Дифференциальная диагностика туберкулеза органов дыхания...
Таблица 10.1
Пороговые значения количества С04+-лимфоцитов и основные заболевания
органов дыхания, характерные для различных уровней иммуносупрессии
Количество
С04+-лимфоцитов,
кл/мкл
>350
<350
<200
<100
<50
Заболевание I
ТБ, бактериальная пневмония, сепсис. I
Вторичные инфекции и опухоли маловероятны |
ТБ, бактериальная пневмония, сепсис. I
Лимфогранулематоз, НХЛ, саркома Капоши |
ТБ, бактериальная пневмония, сепсис. I
Неходжкинская лимфома, лимфогранулематоз, саркома Капоши.
Пневмоцистная пневмония
ТБ (как правило, множественных локализаций), бактериальная I
пневмония, сепсис.
Неходжкинская лимфома, лимфогранулематоз, саркома Капоши.
Пневмоцистная пневмония.
ЦМВ-инфекция.
Микозы (криптококкоз, гистоплазмоз)
ТБ (как правило, множественных локализаций), бактериальная
пневмония, сепсис.
Неходжкинская лимфома, лимфогранулематоз, саркома Капоши.
Пневмоцистная пневмония.
ЦМВ-инфекция.
Микозы (криптококкоз, гистоплазмоз).
МАС-инфекция
Важно помнить, что при иммунодефиците возможно сочетание двух и более вто-
ричных заболеваний.
Опорными признаками, имеющими дифференциально-диагнос-
тическое значение, являются следующие:
• одышка (типичная для пневмоцистоза);
• лимфаденопатия различной локализации (характерная для мико-
бактериальных инфекций и опухолей);
• кожные изменения (которые возможны при некоторых грибко-
вых, вирусных инфекциях и саркоме Капоши);
• поражение слизистых (типично для ЦМВ-инфекции, саркомы
Капоши и кандидоза);
• наличие признаков менингита (характерно для ТБ и криптококкоза);
• изменения глазного дна (возможно при ЦМВ-инфекции и мико-
бактериальных инфекциях);
• выявление выпота в плевральную полость типично для внебольнич-
ной и септической пневмонии, ТБ, злокачественных заболеваний.
10.2. Бактериальная пневмония
217
Важно подчеркнуть, что лечебно-диагностические мероприятия
в отношении легочного поражения при ВИЧ-инфекции, как правило,
определяются не только основным рентгенологическим синдромом,
но и тяжестью состояния пациента.
При стабильном состоянии очевидной является тактика, направ-
ленная на верификацию диагноза (в том числе с применением инвазив-
ных методов диагностики).
В случае наличия так называемых признаков опасности (темпера-
тура >38 °С или <36 °С; одышка более 20 мин или одышка в покое/при
минимальной физической активности, цианоз; пульс более 90 ударов
в мин, частый малый пульс; артериальное давление менее 100 мм рт.ст.,
Sa02 <90%, лейкоцитоз >12 или <4хЮ9/л, нарушение со сторо-
ны ЦНС в виде общемозговой, очаговой симптоматики, менинге-
альных знаков, признаки полиорганной недостаточности, кахексия)
требуется назначение лечения с параллельным поиском достоверных
симптомов, позволяющих подтвердить или исключить наиболее частые
и опасные заболевания с неблагоприятным ближайшим прогнозом.
При дифференциальной диагностике широкого спектра легочных
поражений необходимо исходить из того, что самыми частыми заболе-
ваниями легких при ВИЧ-инфекции являются бактериальные пневмо-
нии, ТБ и пневмоцистоз. Остальные нозологии, судя по имеющимся
литературным данным, встречаются существенно реже.
Поэтому вне зависимости от уровня и профиля лечебного учрежде-
ния выбор оптимальной лечебно-диагностической тактики при тяжелом
состоянии пациента основывается на том, чтобы сузить круг вероятных
заболеваний и назначить адекватную антимикробную терапию исходя
из имеющихся ресурсов, а поиск доказательств той или иной этиологии
легочного поражения проводить на фоне антиинфекционной терапии.
10.2. БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ
Наиболее частыми заболеваниями легких у больных ВИЧ-инфек-
цией являются внебольничные бактериальные пневмонии, которые
встречаются в 10 раз чаще, чем в популяции; повторные пневмонии были
отнесены к числу «СПИД-индикаторных» заболеваний в 1992 г. С нача-
лом широкого применения APT бактериальные пневмонии заменили
пневмоцистоз в общей структуре пневмоний у больных ВИЧ-инфекцией
в США, но вместе с тем APT оказала значительное влияние на снижение
абсолютной заболеваемости бактериальной пневмонией. Известно, что
внебольничная пневмония может развиваться при любом количестве
218 Глава 10. Дифференциальная диагностика туберкулеза органов дыхания...
С04+-лимфоцитов, однако установлено, что ее частота возрастает
по мере прогрессирования иммуносупрессии.
Имеются сведения, что 80% пневмоний развиваются при коли-
честве С04+-лимфоцитов <400 кл/мкл, а повторные пневмонии —
при количестве <300 кл/мкл; тем не менее при пневмониях медиана
С04+-лимфоцитов составляет 200 кл/мкл, что существенно выше, чем
при ТБ или пневмоцистозе. Адекватная APT и профилактическое при-
менение ТМП/СМ, по некоторым данным, были связаны с уменьше-
нием риска развития бактериальной пневмонии, тогда как низкое коли-
чество С04+-лимфоцитов, неподавленная вирусная нагрузка, а также
курение сигарет и парентеральное потребление психоактивных веществ
были ассоциированы с повышенным риском пневмоний у ЛЖВ.
Этиология бактериальных пневмоний при ВИЧ-инфекции. Среди
этиологических агентов внебольничных пневмоний наиболее частым
является S. pneumoniae, на долю которого приходится около 20% всех
идентифицируемых возбудителей, при этом особое внимание уделя-
ется высокой частоте бактериемии, осложняющей пневмококковую
пневмонию у ЛЖВ (в некоторых исследованиях >50%), а также частоте
рецидивов пневмококковой пневмонии (10-25%).
Я. influenzae становится причиной в 10—15% случаев пневмоний,
вызывая заболевания у пациентов с прогрессирующей ВИЧ-инфекцией
и более чем в половине случаев протекая с двусторонним поражением.
S. ямга/дявляетсятретьейпочастотепричинойбактериальной пневмонии
у ЛЖВ, но его роль значительно возрастает среди инъекционных нар-
копотребителей, когда нередко имеется эндокардит трикуспидального
клапана с септической легочной эмболией.
P. aeruginosa играет роль в развитии внебольничных пневмоний
улиц с выраженной иммуносупрессией (С04+-лимфоциты <50 кл/мкл),
поэтому считается, что адекватная APT снижает частоту синегнойной
инфекции.
Пневмонии, вызванные Mycoplasma pneumoniae и Chlamydia pneumo-
niae, по-видимому, встречаются относительно нечасто. Легионеллезная
пневмония при ВИЧ-инфекции также диагностируется довольно редко,
однако имеются сведения, что при выраженной ВИЧ-ассоциированной
иммуносупрессии она встречается в 40 раз чаще, чем в общей популя-
ции, определяя худший прогноз с более высоким числом осложнений.
Диагностика внебольничной пневмонии при ВИЧ-инфекции осно-
вывается на общепринятых критериях, где основным является эффек-
тивность антимикробной терапии при типичной клинико-рентгено-
логической картине в отсутствие аргументов в пользу альтернативных
заболеваний.
10.2. Бактериальная пневмония
219
Различные модификации экспресс-тестов по выявлению
пневмо-кокковой антигенурии позволяют установить этиологический
диагноз у 10-68% больных вне зависимости от ВИЧ-статуса, что обо-
сновывает применение этих тестов при пневмониях у ЛЖВ, однако зача-
стую такие методы не могут быть использованы в рутинной клинической
практике; кроме того, они не позволяют исключить наличие других забо-
леваний, учитывая возможность полимикробной инфекции у больных
с иммуносупрессией.
Сведения об информативности исследования прокальцитонина
с целью дифференциальной диагностики пневмоний и других инфек-
ций (прежде всего ТБ) у ЛЖВ носят противоречивый характер, а высо-
кие значения прокальцитонина, как правило, определяются только
при бактериальном сепсисе. При пневмоцистозе, токсоплазмозе,
вирусных, грибковых, микобактериальных и локальных бактериальных
инфекциях значимого повышения прокальцитонина не выявляется.
Имеющиеся сведения о значении прокальцитонина при различных
нозологиях у ЛЖВ не позволяют рекомендовать исследование прокаль-
цитонина в обычной клинической практике с целью дифференциаль-
ной диагностики легочных поражений при ВИЧ-инфекции.
При дифференциальной диагностике пневмоний с другими легоч-
ными поражениями у ЛЖВ важно учитывать следующие факторы:
• различие в спектре вероятных возбудителей пневмоний у лиц без
ВИЧ-инфекции и ЛЖВ, вследствие чего применение имеющихся
руководств по лечению бактериальных пневмоний у лиц с им-
муносупрессией имеет определенные ограничения;
• многие антимикробные препараты, применяемые в схемах лече-
ния внебольничных пневмоний, обладают противотуберкулез-
ным эффектом (например, фторхинолоны, линезолид, кар-
бапенемы, амоксициллин с клавулановой кислотой, амино-
гликозиды) и входят в схемы лечения лекарственно-устой-
чивых форм ТБ; респираторные фторхинолоны, в частности,
являются одними из основных препаратов в схемах лечения
резистентных форм ТБ.
Следует помнить, что Россия относится к числу стран с большим
количеством больных ТБ с МЛ У МБТ, где еще одной серьезной про-
блемой становится ТБ с широкой ЛУ (дополнительная резистентность
к фторхинолонам и аминогликозидам или капреомицину при наличии
МЛУ МБТ). В этой связи необходимо отметить ограничения примене-
ния фторхинолонов при возможном ТБ на этапе дифференциаль-
ной диагностики. Схемы эмпирической антимикробной терапии вне-
больничных пневмоний приведены в табл. 10.2.
Таблица 10.2
Эмпирическая антимикробная терапия тяжелой внебольничной пневмонии
(в том числе септической эмболии)
Вид
пневмонии
Тяжелая пневмония
без факторов риска
инфицирования
P. aeruginosa и аспи-
рации
Тяжелая пневмония
с факторами риска
инфицирования
P. aeruginosa (дли-
тельная терапия
системными ГКС,
муковисцидоз, вто-
ричные бронхоэктазы,
недавний прием
системных антими-
кробных препаратов)
Наиболее
вероятный
возбудитель
Str. spp., St. aureus,
Грам (-) энтеробак-
терии,внутрикле-
точные организмы
(Mycoplasma,
Legionella,
Chlamydia)
Str. spp., St. aureus
(в том числе MRSA),
Грам (-) энтеробак-
терии, Ps. aeruginosa
Препараты выбора
Цефотаксим 3-8 г/сут в 3 введения
Цефтриаксон 1-2 г/сут в 1 введение
Цефтаролин 0,6 г х 2 р/сут
ИЛИ
Амоксициллин/клавуланат 1,2-3,4 г/сут
в 3-4 введения
Ампициллин/сульбактам 6-12 г/сут
в 3-4 введения
ИЛИ
Эртапенем 1 г в/в или в/м 1 раз/сут
+
Кларитромицин 0,5 х 2 р/сут или
Азитромицин 0,5 г каждые 24 ч
Пиперациллин/тазобактам
3,375 х 4 р/сут
Имипенем 0,5 г х 4 р/сут
Меропенем 1 г х 3 р/сут
+
Фторхинолоны с антисинегнойной
активностью:
Левофлоксацин 0,5 г х 1 р/сут
Ципрофлоксацин 0,4-0,6 г х 2 р/сут
Альтернативные
препараты
Левофлоксацин 0,5 г х 2 р/сут
Моксифлоксацин 0,4 г х 1 р/сут
+
Цефотаксим 3-8 г/сут в 3 введения
Цефтриаксон 1-2 г/сут в 1 введение
Пиперациллин/тазобактам
3,375 х 4 р/сут
Имипенем 0,5 г х 4 р/сут
Меропенем 1 г х 3 р/сут
+
Фторхинолоны с антисинегнойной
активностью:
Левофлоксацин 0,5 г х 1 р/сут
Ципрофлоксацин 0,4-0,6 г х 2 р/сут
+/-
Амикацин 15-25 мг/кг/сут
•е-
-е-
■8
CD
-С
:ъ
1
■8
I
с*>
аз
а:
5
Окончание табл. 10.2
I Вид
пневмонии
Тяжелая пневмония
у пациентов с тяже-
лой или предпола-
гаемой аспирацией
Внутривенное потре-
бление психоактив-
ных веществ
Наиболее
вероятный
возбудитель
Staph, aureus
(в том числе MRSA),
Ps. aeruginosa, Грам
(-) энтеробактерии,
Str. pneumonia, ана-
эробы
Staph, aureus
Препараты выбора
Ампициллин/сульбактам 6-12 г/сут
в 3-4 введения
Амоксициллин/клавуланат
1,2-3,4 г/сут в 3-4 введения
Пиперациллин/тазобактам
3,375 х 4 р/сут
ИЛИ
Имипенем 0,5 г х 4 р/сут
Меропенем 1 г х 3 р/сут
ИЛИ
Эртапенем 1 г в/в или в/м 1 раз/сут
ИЛИ
Цефотаксим 3-8 г/сут в 3 введения
Цефтриаксон 1-2 г/сут в 1 введе-
ние +
Метронидазол 0,5 г х 3 р/сут
Клиндамицин 0,3-0,9 г х 3-4 р/сут
Ампициллин/сульбактам 6-12 г/сут
в 3-4 введения
Амоксициллин/клавуланат
1,2-3,4 г/сут в 3-4 введения ИЛИ
Ванкомицин 1 г х 2 р/сут
Альтернативные
препараты
Цефепим 1-2 г х 2 р/сут
Линезолид 0,6 г х 2 р/сут ИЛИ
Цефтаролин 0,6 г х 2 р/сут ИЛИ
Цефтобипрол 0,5 г х 2 р/сут ИЛИ
Даптомицин 350-500 мг х 1 р/сут ИЛИ
Тейкопланин 0,2-0,4 г в 1-2 введения
222 Глава 10. Дифференциальная диагностика туберкулеза органов дыхания...
10.3. ПНЕВМОЦИСТНАЯ ПНЕВМОНИЯ
Пневмоцистная пневмония (ПЦП), вызываемая грибком Pneumo-
cystis jirovecii, является одной из трех самых частых (наряду с бактериаль-
ными пневмониями и ТБ) вторичных инфекций.
Исследования показывают, что возбудитель или его ДНК могут быть
обнаружены в образцах дыхательных путей и в отсутствие клинических
проявлений пневмоцистоза установлено, что у взрослых колонизация
пневмоцистами связана с курением и хронической обструктивной
болезнью легких.
На современном этапе ПЦП развивается, как правило, у лиц с низким
иммунным статусом (количество С04+-лимфоцитов менее 200 кл/мкл)
без APT и не получающих профилактику.
Клинико-рентгенологические проявления ПЦП (как классические,
так и атипичные) достаточно хорошо изучены и многократно описаны.
Известно, что в клинической картине ведущим синдромом является
одышка с частотой дыхания до 30—40 дыхательных движений в 1 мин
(68—90% случаев) и быстрым развитием дыхательной недостаточности,
гипоксемии со снижением Sa02; непродуктивный кашель регистриру-
ется у 50-81% больных, фебрильная лихорадка — у 80%.
При визуализации (классическая рентгенография и/или спиральная
КТ) определяются понижение прозрачности легких и усиление интер-
стиций в прикорневых отделах с развитием, как правило, двухсторон-
ней симметричной интерстициальной инфильтрации разной степени
выраженности; нередко определяются очаговоподобные тени, а также
буллезные вздутия легких, спонтанный пневмоторакс. В 5—10% случаев
ПЦП возможно отсутствие патологических изменений при классиче-
ской рентгенографии (патология выявляется только при спиральной
компьютерной томографии), в 5—20% случаев возможно выявление
асимметричных инфильтратов. Считается, что в отсутствие изменений
в легких по результатам спиральной компьютерной томографии диагноз
пневмоцистоза может быть отвергнут.
Диагностика пневмоцистоза. Критериями пневмоцистоза являются
обнаружение возбудителя в мокроте и/или бронхоальвеолярной лаваж-
ной жидкости (БАЛЖ) при наличии типичной клинико-рентгеноло-
гической картины; обнаружение ДНК Pneumocystis jiroveci в мокроте/
БАЛЖ при проведении ПЦР в реальном времени при наличии типич-
ной клинико-рентгенологической картины, а также эффективность
эмпирической терапии ко-тримоксазолом.
10.3. Пневмоцистная пневмония
223
Важно отметить, что Pneumocystis, в отличие от других значимых
респираторных патогенов, не может быть культивирована на питатель-
ных средах; поэтому «золотым стандартом» диагностики ПЦП остаются
дорогостоящие инвазивные методы: фибробронхоскопия с исследова-
нием БАЛЖ, а в сложных случаях изредка прибегают к использованию
методов гистологической верификации — чрезбронхиальной или хирур-
гической биопсии легкого. Однако проведение инвазивных методов
в подавляющем большинстве клинических ситуаций невозможно, в том
числе из-за тяжести состояния пациентов с ПЦП.
Исследование уровня лактатдегидрогеназы не является специфи-
ческим для пневмоцистоза, поскольку ее уровень может повышаться
и при других болезнях органов дыхания, в частности при бактериаль-
ных, микобактериальных инфекциях и других грибковых пневмониях.
В абсолютном большинстве случаев критерием ПЦП является эф-
фективность антимикробной терапии при типичной клинико-лучевой
картине, где препаратом выбора является триметоприм/сульфаметоксазол.
Лечение пневмоцистоза должно быть начато незамедлительно при
подозрении на ПЦП (не дожидаясь получения достоверных данных
о возбудителе).
Препаратом выбора является триметоприм-сульфаметокса-
зол (ТМП/СМ), назначаемый в суточной дозе из расчета по ТМП
15—20 мг/кг/сут и 100 мг/кг/сут по СМ в 3—4 приема. Стандартная
доза ТМП/СМ составляет 1920 мг х 4 р/сут перорально и/или парен-
терально в течение 21 дня.
Альтернативной, менее эффективной схемой при легком тече-
нии ПЦП является комбинация дапсона (100 мг х 1 р/сут) и ТМП
(5 мг/кг х 3 р/сут) в течение 21 дня. Существует также схема лече-
ния ПЦП клиндамицином (600—900 мг каждые 6—8 ч парентерально
или 300-450 мг внутрь 6 ч в течение 21 дня) в сочетании с примахином
(15-30 мг/сут в течение 21 дня).
Системные глюкокортикостероиды назначаются при среднетяже-
лом и тяжелом течении ПЦП с явлениями дыхательной недостаточ-
ности (преднизолон 0,5—1 мг/кг/сут с постепенной отменой в течение
10-15 дней). Респираторная поддержка показана при одышке в покое
или при минимальной физической нагрузке, Sa02 <90%.
Вторичная профилактика ПЦП. После перенесенного пневмоцисто-
за пациентам назначается вторичная профилактика триметопримом/
сульфаметоксазолом (480 мг ежедневно или 960 мг х 3 раза в нед).
Вторичная профилактика ПЦП прекращается при повышении количе-
ства CD4 на фоне APT >200 кл/мкл в течение 3 мес.
224 Глава 10. Дифференциальная диагностика туберкулеза органов дыхания...
10.4. ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ
ЦМВ является членом семейства герпесвирусов и широко распро-
странен повсеместно. Первичное инфицирование ЦМВ, как правило,
происходит в детском или молодом возрасте, вызывая иммунный ответ
с возможным развитием мононуклеозоподобного синдрома и гепатита,
но для большинства здоровых людей инфицирование протекает мало-
симптомно.
В дальнейшем вирус существует в латентной форме, а при иссле-
довании различных биологических материалов (генитального секре-
та, слюны, мочи, грудного молока и крови) возможно бессимптом-
ное выделение ЦМВ. При ВИЧ-инфекции количество выделенного
из биологических жидкостей вируса может значительно возрастать вне
зависимости от уровня иммуносупрессии или проведения APT, а при
иммунодефиците происходит реактивация латентной ЦМВ-инфекции
с высвобождением вирионов, инфицирующих различные клетки,
включая клетки ЦНС и эндотелий сосудов, что может вызвать опасные
для жизни состояния.
Пороговым для развития ЦМВ-инфекции является снижение коли-
чества С04+-лимфоцитов < 100 кл/мкл, манифестная ЦМВ-инфекция
может развиться и в рамках воспалительного СВИС у лиц, начавших APT
при исходно низких показателях С04+-лимфоцитов. ЦМВ-инфекция
у лиц с тяжелой иммуносупрессией встречается с различной частотой
(6-40%), являясь причиной смерти у 7—20% больных на поздних стадиях
ВИЧ-инфекции.
По некоторым данным, наиболее частыми локализациями ЦМВ-
инфекция являются офтальмологические (ретининт, на долю кото-
рого приходится до 85% всех случаев ЦМВ-инфекции) и желудоч-
но-кишечные (колит и эзофагит) — до 10%. Клиническое значение
ЦМВ как легочного патогена у больных ВИЧ-инфекцией не вполне
ясно. Пневмонии и неврологические проявления ЦМВ-инфекции
(энцефаловентрикулит, полирадикулопатия) встречаются реже, однако
их частота требует дальнейшего изучения.
Клиническая диагностика легочного поражения при ЦМВ-
инфекции сложна из-за неспецифичности клинико-рентгенологиче-
ских проявлений и требует обязательной этиологической или гисто-
логической верификации.
Учитывая объективные сложности диагностики, пневмония,
вызванная ЦМВ, должна быть заподозрена при полиорганном поражении
у больного с выраженным иммунодефицитом в случае выявления
10.5. Другие легочные микозы
225
интерстициальных инфильтратов при отсутствии аргументов в пользу
альтернативных заболеваний (прежде всего ПЦП). Вместе с тем следует
принимать во внимание, что при тяжелой иммуносупрессии возможно
сочетание нескольких заболеваний с легочным поражением.
Важно отметить, что не всякое обнаружение ДНК ЦМВ в биоло-
гическом материале является критерием диагноза ЦМВ-инфекции.
Значение имеет обнаружение ДНК ЦМВ в концентрации >2 lg ДНК
ЦМВ в 105 в лейкоцитах периферической крови или при наличии ДНК
ЦМВ в количестве > 10 тыс. копий в 1 мл плазмы, выявление ДНК ЦМВ
в ликворе (>10 000-20 000 копий/мл), БАЛЖ, плевральной жидкости
или в биоптатах пораженного органа методом ПЦР з реальном времени
при наличии клинико-рентгенологических проявлений или обнаруже-
ние типичной морфологической картины ЦМВ-инфекции в биоптате.
Серологические методы обследования на ЦМВ-инфекцию не имеют
диагностического значения.
Лечение ЦМВ-инфекции с поражением легких. Следует подчеркнуть,
что эмпирическая терапия ЦМВ-пневмонии не рекомендуется (в отли-
чие, например, от бактериальной пневмонии или ПЦП). После вери-
фикации диагноза ЦМВ-инфекции назначается ганцикловир 5 мг/кг
2 р/сут парентерально не менее 4 нед (до исчезновения клинико-рент-
генологических симптомов заболевания). Альтернативными препара-
тами для лечения манифестной ЦМВ-инфекции являются валганци-
кловир, фоскарнет*0, цидофовир^ и фомивирсен^.
Вторичная профилактика ЦМВ-инфекции. После лечебного курса
назначается вторичная профилактика валганцикловиром (900 мг/
сут), которая прекращается при повышении количества CD4 на фоне
APT > 100 кл/мкл в течение 3 мес.
10.5. ДРУГИЕ ЛЕГОЧНЫЕ МИКОЗЫ
Другие легочные микозы (кроме пневмоцистоза) при
ВИЧ-инфекции встречаются нечасто. Возможными возбудителями
являются Cryptococcus neoformans, Histoplasma capsulation, роль других
эндемичных микозов (вызванных Coccidiodes immitis и Blastomyces
dermatitidis) еще скромнее.
10.5.1. КРИПТ0К0КК03
Криптококкоз, вызываемый условно-патогенным дрожжеподобным
грибком Cryptococcus neoformans, развивается при выраженной иммуно-
226 Глава 10. Дифференциальная диагностика туберкулеза органов дыхания...
супрессии (CD4 < 100 кл/мкл). Большинство случаев криптококкоза
выявляется в Африке к югу от Сахары, сведения о частоте встречаемо-
сти криптококкоза различаются.
Этот глубокий микоз протекает, как правило, с развитием менинги-
та, который определяет тяжесть состояния и прогноз. Криптококковая
инфекция наряду с ТБ — самые частые причины менингита у ЛЖВ,
а поражение легких встречается относительно нечасто (приблизитель-
но у 50% больных криптококковым менингитом).
Криптококкоз является одним из самых тяжелых вторичных заболева-
ний, смертность от которого остается на беспрецедентно высоком уровне
и составляет 10—20% в странах с высоким доходом, достигая 35—100%
в странах с низким уровнем доходов. О тяжести течения этого микоза
и прогнозе свидетельствуют высокие показатели летальности, несмотря
на своевременность диагностики и применение адекватной антимикоти-
ческой терапии. Учитывая тяжесть течения этого микоза и высокую веро-
ятность неблагоприятного исхода, ВОЗ с 2011 г. рекомендовала проводить
скрининг на криптококковую антигенемию среди лиц, не получающих
APT и с количеством С04+-лимфоцитов менее 100 кл/мкл.
Клинические проявления криптококкоза неспецифичны и склады-
ваются из менингеальных симптомов, воспалительной интоксикации
и респираторных симптомов (при легочном поражении).
Рентгенологическая картина криптококковой пневмонии довольно
вариабельна и не имеет характерных черт: могут выявляться инфиль-
траты или диссеминация, возможны внутригрудная лифаденопатия,
деструкции и экссудативный плеврит, а в литературе приведены описа-
ния случаев диффузных интерстициальных изменений, имитирующих
картину пневмоцистоза.
Диагностика криптококкоза. Клиническая диагностика легочного
криптококкоза сложна из-за отсутствия патогномоничных признаков,
характерных для этого микоза. Считается, что криптококкоз должен
быть заподозрен во всех случаях менингита у ЛЖВ и во всех случаях
выявления легочной диссеминации на поздних стадиях ВИЧ-инфекции.
В основе диагностики лежит детекция возбудителя: выявление
криптококкового антигена в ликворе или крови методом ПЦР в реаль-
ном времени, окрашивание мазка ликвора тушью и бактериологиче-
ское исследование с выделением культуры С. neoformans.
При сочетании менингита и легочного поражения неясной этио-
логии в отсутствие возможности исследования антигена или окраски
тушью показана системная противогрибковая терапия, которая должна
быть начата, не дожидаясь результата бактериологического исследова-
ния материала.
10.5. Другие легочные микозы
227
Лечение криптококкоза длительное (не менее 6 мес), состоит из трех
следующих фаз.
1.Фаза индукции (2 нед): липосомальный амфотерицин В 0,7—
1 мг/кг/сут в комбинации с высокими дозами флуконазола
(800 мг/сут) или флуцитозином (100 мг/кг/сут).
2.Фаза закрепления (8 нед): флуконазол 400 мг/сут.
3. Поддерживающая фаза (до CD4 >200 кл/мкл в течение 6 мес
и более): флуконазол 200 мг/сут.
При невозможности применения амфотерицина для лечения гене-
рализованной или менингеальной формы криптококкоза используют-
ся высокие дозы флуконазола (до 1200 мг/сут). Итраконазол считается
менее эффективным, чем флуконазол, в лечении криптококкоза.
Вторичная профилактика криптококкоза: флуконазол 200 мг/сут
на срок не менее 12 мес. По истечении этого срока профилактика
может быть отменена при условии CD4 >100 кл/мкл и неопределяемой
вирусной нагрузки.
10.5.2. ГИСТ0ПЛАЗМ03
Гистоплазмоз считается эндемичным микозом для некоторых
районов Африки, Центральной и Северной Америки. Тем не менее
в настоящее время на фоне широкого применения APT заболевае-
мость диссеминированной формой гистоплазмоза в Северной Америке
значительно снизилась, тогда как в Центральной Америке этот микоз
остается одной из основных вторичных инфекций и развивается
у 2—25% больных с ВИЧ-ассоциированной иммуносупрессией. В стра-
нах Европы и на территории России гистоплазмоз встречается нечасто.
Histoplasma capsulatum — диморфный грибок, существующий в куль-
туральной и тканевой формах; возбудитель гистоплазмоза сохраняется
в почве, наиболее частый путь заражения — воздушно-пылевой.
Заболевание развивается при снижении количества CD4 < 100 кл/мкл
и, как правило (до 95% случаев), протекает в диссеминированной
форме, прогноз при ВИЧ-ассоциированном неэндемичном гистоплаз-
мозе неблагоприятный: летальность достигает 80%.
Клиническая картина диссеминированного гистоплазмоза
с поражением легких сходна с таковой при генерализованном ТБ
и сопровождается гепатоспленомегалией, панцитопенией, разви-
тием язвенного энтероколита, эндокардита, менингоэнцефалита,
поражением органов зрения. У 7—66% больных (в зависимости
от региона) регистрируются поражения кожи и слизистых в виде
228 Глава 10. Дифференциальная диагностика туберкулеза органов дыхания...
папул на коже, болезненных язв на языке, слизистой щек, деснах
или гортани, поэтому обнаружение таких изменений может иметь
дифференциально-диагностическое значение.
Диагностика гистоплазмоза основывается на выявлении возбуди-
теля из БАЛЖ, крови, ликвора, костного мозга или биопсийного мате-
риала. Выделение Я capsulation при культивировании на специальных
обогащенных питательных средах занимает довольно длительное время
(4-6 нед), кроме того, подобное бактериологическое исследование воз-
можно не во всех лечебных учреждениях.
Важным критерием диагностики является обнаружение типичной
картины тканевой формы гистоплазм при биопсии различных органов
(ПЛУ, кожа, слизистый или костный мозг) с использованием специ-
альных окрасок (серебром по методу Гомори-Грокотт, PAS-методом
или методом Бауэра).
Хорошие результаты дает определение антигена Я capsulatum
в моче (наиболее чувствительны исследования при генерализованной
форме, 92-100%), крови, спинномозговой жидкости и БАЛЖ (ELISA,
латекс-агглютинация, иммуноферментный анализ, определение галак-
томаннана гистоплазм методом ПЦР). Серологические реакции и вну-
трикожная проба с гистоплазмином у пациентов с ВИЧ-инфекцией,
как правило, являются ложноотрицательными.
Лечение гистоплазмоза. Итраконазол 200 мг х 3 р/сут в течение
3 дней, далее 200 мг х 2 р/сут (флуконазол менее эффективен и отно-
сится к препаратам второй линии, применяется в дозе 800 мг/сут).
Общий курс терапии гистоплазмоза должен составлять не менее 12 мес
(до 18-24 мес).
При тяжелом генерализованном прогрессирующем гистоплазмозе
назначается комбинация амфотерицина В 0,7—1 мг/кг/сут (липосо-
мальный амфотерицин В — 3 мг/кг/сут) в течение 2 нед или до кли-
нического улучшения с последующим переходом на итраконазол
200 мг х 3 р/сут в течение 3 дней, далее 200 мг х 2 р/сут.
При менингите: амфотерицин В 0,7-1 мг/кг/сут (липосомальный
амфотерицин В — 5 мг/кг/сут) в течение 4—6 нед с последующим пере-
ходом на итраконазол (200 мг 2 или 3 р/сут).
Вторичная профилактика после перенесенного гистоплазмоза включа-
ет прием итраконазола 200 мг/сут (допустимо применение флуконазола
400 мг/сут) до тех пор, пока уровень CD4 не будет превышать 150 кл/
мкл в течение не менее 6 мес на фоне эффективной APT при неопреде-
ляемой вирусной нагрузке.
10.5. Другие легочные микозы
229
10.5.3. КАНДИДОЗ
Кандидоз является самым частым грибковым заболеванием у ЛЖВ.
Основным этиологическим агентом является Candida albicans, хотя,
поданным некоторых исследований, при глубокой иммуносупрессии мо-
жет возрастать роль других возбудителей (так называемых non-albicans
Candida), в частности Candida glabrata, Candida parapsilosis, Candida
dubliniensis и Candida tropicalis.
Пороговой величины количества С04+-лимфоцитов для кандидо-
за не существует, однако в большинстве случаев он развивается при
CD4 <200 кл/мкл. Основными формами являются орофарингеальный
кандидоз и эзофагит, тогда как поражение трахеобронхиального дерева
и легких встречается довольно редко (3—8% от числа всех грибковых
пневмоний, включая пневмоцистоз, криптококкоз и аспергиллез).
Диагностика кандидоза. Диагноз устанавливается при обнаружении
типичного творожистого налета на слизистых, а лабораторное под-
тверждение с помощью микроскопического исследования соскобов
с пораженных участков требуется лишь в некоторых случаях.
При редко встречающихся локализациях (например, легочной)
диагноз верифицируют на основании гистологического исследова-
ния биоптатов или обнаружения в биологических материалах ДНК
грибов рода Candida в высокой концентрации. Важно учитывать, что
выделение Candida spp. из мокроты и других нестерильных сред не является
диагностически значимым критерием грибковой пневмонии даже
у пациентов с низким иммунным статусом.
Лечение. Препаратом выбора для лечения кандидоза является флу-
коназол, доза которого может быть увеличена до 800 мг/сутки при лече-
нии висцеральных форм (табл. 10.3).
Таблица 10.3
Схемы лечения кандидоза
Локализация
Стоматит
Эзофагит/
бронхит
Основной
режим
Флуконазол
100 мг/сут
Флуконазол
200-800 мг/сут
Альтернативный режим
Нистатин 500 000 ЕД 5 раз в день
внутрь или
Кетоконазол 200 мг/сут внутрь
Кетоконазол 200 мг/сут или
Итраконазол 200-400 мг/сут или
Амфотерицин В 0,3-0,5 мг/кг/сут
в/в капельно в течение 5-7 дней,
далее — Флуконазол 200-800 мг/сут
Длительность
10-14 дней
14-21 день
(21 день при
поражении тра-
хеобронхиаль-
ного дерева)
230 Глава 10. Дифференциальная диагностика туберкулеза органов дыхания...
Несмотря на то что длительный прием противогрибковых пре-
паратов снижает частоту рецидивов кандидоза у пациентов с имму-
носупрессией, считается, что профилактический прием системных
антимикотических препаратов не показан пациентам с рецидивами оро-
фарингеального кандидоза и кандидозного вульвовагинита по следу-
ющим причинам:
1) терапия острого эпизода кандидоза, как правило, эффективна;
2) смертность от орофарингеального кандидоза находится на низ-
ком уровне;
3) высокая стоимость профилактического приема противогрибко-
вых препаратов;
4) на фоне приема профилактической дозы азольных противо-
грибковых препаратов возникают токсичные лекарственные вза-
имодействия с препаратами для APT, а также возрастает риск
резистентности Candida spp. и замены Candida albicans на С. krusei,
С glabrata, С. tropicalis, которые могут хуже поддаваться терапии.
10.6. НЕТУБЕРКУЛЕЗНЫЙ МИК0БАКТЕРИ03
Наиболее частой этиологической причиной микобактериоза у боль-
ных ВИЧ-инфекцией являются Mycobacterium avium и Mycobacterium
intracellular, объединенные в Mycobacterium avium complex (MAC), вызы-
вая заболевания более чем в 95% наблюдений. МАС-инфекция, в отли-
чие от ТБ, является истинно оппортунистическим заболеванием и раз-
вивается при тяжелом иммунодефиците (как правило, при снижении
количества СБ4+-лимфоцитов менее 50 кл/мкл).
Развитие микобактериоза с легочным поражением определяет
повышенный риск смерти ЛЖВ после установления диагноза:
пятилетняя летальность от всех причин составляет 25—27%, что отчасти
может быть объяснимо исходно низким иммунным статусом и тяже-
стью течения вторичных заболеваний.
Клинические проявления МАС-инфекции во многом сходны с ТБ
и лимфомой, когда наиболее часто имеют место так называемые
В-симптомы (лихорадка, потеря веса и потливость). Вместе с тем
установлено, что при МАС-инфекции (в отличие от ТБ) легочное
поражение встречается реже, а абдоминальное (боли в животе, диа-
рея) — чаще, что может являться одним из дифференциально-диа-
гностических признаков. При генерализованной МАС-инфекции
наиболее уязвимы костный мозг, печень, селезенка, лимфатические
узлы, кожа, мягкие ткани. Вполне типичным для генерализованного
10.6. Нетуберкулезный микобактериоз
231
микобактериоза является развитие тяжелой анемии (нередко количе-
ство гемоглобина снижается менее 70 г/л).
У подавляющего большинства больных выявляются увеличенные
внутрибрюшные лимфатические узлы, формирующие конгломераты,
часто с распадом: такая картина очень характерна для МАС-инфекции.
При лучевом исследовании ОГК наиболее часто регистрируются при-
знаки медиастинальной лимфаденопатии, реже — инфильтраты и дис-
семинация.
Важно подчеркнуть, что деструктивные (кавитарные) формы
и выявление жидкости в плевральной полости нетипичны для этого
вторичного заболевания у ЛЖВ, более того, нередко поражение огра-
ничено только брюшной полостью, а изменения на рентгенограмме
ОГК отсутствуют.
Диагностика микобактериоза основывается на клинических и микро-
биологических критериях.
Клинические критерии: наличие клинико-лабораторных симптомов
МАС-инфекции (респираторные проявления, болевой абдоминальный
синдром, кишечная диспепсия, анемия) и изменений в легких, вну-
тригрудных и мезентеральных лимфатических узлах при визуализации.
Микробиологические критерии: два и более положительных посева
мокроты на нетуберкулезные микобактерии или один положительный
посев из БАЛЖ или из стерильной в норме биологической жидкости
или из ткани (кровь, ликвор, операционно-биопсийный материал,
синовиальная жидкость и др.).
Важным так называемым опорным дифференциально-диагностичес-
ким признаком является выделение в материале кислотоустойчивых
микобактерии в отсутствие ДНК Mycobacterium tuberculosis.
Учитывая ключевую роль микробиологической диагностики мико-
бактериозов, необходимо отметить, что в нашей стране выявление
микобактерии доступно только бактериологическим лабораториям фти-
зиатрической службы, а видовая идентификация выделенных изоля-
тов — только референс-лабораториям регионального уровня или НИИ.
Лечение МАС-инфекции. Эмпирическая терапия МАС-инфек-
ции включает назначение кларитромицина (500 мг х 2 раза в сут)
в сочетании с этамбутолом (15-20 мг/кг 1 раз в сут) и рифабутином
(5 мг/кг 1 раз в сут). При непереносимости кларитромицина
или серьезных лекарственных взаимодействиях его с антиретровирус-
ными препаратами можно назначать азитромицин (500 мг 1 раз в сут).
В случаях диссеминированной инфекции аргументировано дополнение
схемы левофлоксацином (1,0 в сут) или амикацином (15 мг/кг/сут);
232 Глава 10. Дифференциальная диагностика туберкулеза органов дыхания...
длительность курса лечения МАС-инфекции должна составлять
не менее 12 мес.
Исходя из того, что все пациенты с количеством CD4 <50 кл/мкл
составляют группу риска по развитию микобактериоза, ранее счита-
лось, что они нуждаются в специфической профилактике макролидами
(кларитромицином или азитромицином). В настоящее время имеются
данные, показывающие, что первичная профилактика МАС-инфекции
не требуется при условии эффективной APT даже при низком количе-
стве С04+-лимфоцитов.
Вторичная профилактика МАС-инфекции проводится кларитроми-
цином (1000 мг/сут) (или азитромицином, 500 мг/сут) в сочетании
с этамбутолом (15-20 мг/кг/сут) до тех пор, пока в течение 6 мес после
окончания основного курса лечения МАС-инфекции уровень CD4
не будет превышать 100 кл/мкл при неопределяемой вирусной нагрузке.
10.7. ЗЛОКАЧЕСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ
ПРИ ВИЧ-ИНФЕКЦИИ
APT оказала значительное влияние на заболеваемость и смерт-
ность ЛЖВ: с ее началом произошло уменьшение числа так называ-
емых СПИД-индикаторных новообразований (в том числе с пора-
жением органов дыхания), в частности саркомы Капоши и НХЛ.
Распространенность онкологических заболеваний среди ЛЖВ неодно-
родна в разных странах мира, они реже регистрируются в регионах
с высокой заболеваемостью ТБ.
Среди больных, не получающих APT, саркома Капоши и НХЛ оста-
ются наиболее частыми опухолевыми заболеваниями. В США доля
СПИД-индикаторных онкологических заболеваний достигает 15-19%
в структуре причин смерти больных ВИЧ-инфекцией. У лиц, прини-
мающих APT, определяется увеличение доли других злокачественных
заболеваний (например, лимфомы Ходжкина, рака легкого, гепато-
целлюлярной карциномы, опухолей головы и шеи). Такая ситуация
объяснима не только увеличением продолжительности жизни ЛЖВ,
но и хроническим воздействием репликации вирусов, обладающих
онкогенным потенциалом (вирус папилломы человека, вирус гепати-
та В, вирус Эпштейна—Барр и герпесвирус человека 8-го типа).
Саркома Капоши
Ангиосаркома Капоши, или множественный геморрагический
саркоматоз, обусловлена инфекцией, вызываемой герпесвирусом
10.7. Злокачественные поражения легких при ВИЧ-инфекции
233
человека 8-го типа. Саркома Капоши может манифестировать при лю-
бом количестве С04+-лимфоцитов, в том числе на фоне эффективной
APT; тем не менее при количестве С04+-лимфоцитов <200 кл/мкл
частота возникновения саркомы Капоши выше, она протекает тяже-
лее, с тенденцией к диссеминации и быстро прогрессирует.
Саркома Капоши, связанная с ВИЧ-инфекцией, как правило, начи-
нается с типичных кожных проявлений, часто сочетается с пораже-
нием нёба, лимфатических узлов, легких, желудочно-кишечного трак-
та. При поражении бронхов и легких клинические проявления неспе-
цифичны и состоят из нарастающей одышки и невоспалительной
интоксикации. Важно отметить, что поражение бронхов и легких обыч-
но наблюдается при выраженной иммуносупрессии (CD4 <200 кл/мкл)
и характеризуется неблагоприятным прогнозом.
Рентгенологические проявления саркомы Капоши сходны с тако-
выми при других вторичных заболеваниях: могут выявляться интерсти-
циальная или очаговая диссеминация (с нередко определяемой связью
очагов с сосудами), прикорневая лимфаденопатия (25%) и плевраль-
ный выпот (40%).
Классификация саркомы Капоши. Общепринятой классификации
саркомы Капоши не существует, но наиболее часто применяется клас-
сификация AIDS Clinical Trials Group (табл. 10.4).
Таблица 10.4
Классификация эпидемической (ассоциированной с ВИЧ-инфекцией) формы
саркомы Капоши, AIDS Clinical Trials Group
т
(опу-
холь)
I (иммун-
ный
статус)
S
(систем-
ные про-
явления)
Ранняя стадия (относитель-
но благоприятный прогноз)
ТО
Поражены только кожа и/или
лимфоузлы, поражение сли-
зистой рта минимально (очаги
на твердом нёбе отсутствуют)
Ю
CD4 >200 кл/мкл
SO
Оппортунистические инфек-
ции и кандидоз слизистых
в анамнезе отсутствуют, нет
симптомов прогрессирования
ВИЧ-инфекции
Поздняя стадия (неблагоприятный
прогноз)
Т1
Поражены легкие или желудочно-кишеч-
ный тракт; массивное поражение слизи-
стой рта; очаги с лимфатическим отеком
или изъязвлениями
И
CD4 <200 кл/мкл
S1
Оппортунистические инфекции, кандидоз
слизистых, злокачественная лимфома, ха-
рактерные для ВИЧ-инфекции неврологиче-
ские нарушения в анамнезе, наличие сим-
птомов прогрессирования ВИЧ-инфекции
234 Глава 10. Дифференциальная диагностика туберкулеза органов дыхания...
Диагностика саркомы Капоши. Для диагностики саркомы Капоши,
как правило, не требуется морфологической верификации: при нали-
чии типичных кожных элементов диагноз может быть установлен и без
гистологического подтверждения. При невозможности исключить дру-
гие заболевания со сходной клинической картиной проводят биопсию
элемента с дальнейшим гистологическим исследованием и выявлением
ДНК вируса герпеса человека 8-го типа в участках поражения методом
ПЦР.
При эндоскопических исследованиях на слизистых желудоч-
но-кишечного тракта или трахеобронхиального дерева визуализируют-
ся типичные элементы саркомы Капоши; очевидно, что биопсия этих
изменений элементов противопоказана из-за риска кровотечения.
Лечение саркомы Капоши. На фоне широкого применения APT тече-
ние саркомы Капоши стало более благоприятным: так, у 75% пациен-
тов регрессия элементов опухоли наблюдается в процессе APT на фоне
подавления репликации ВИЧ и роста количества С04+-лимфоцитов
без проведения специфической терапии саркомы Капоши. Лечение
больного ВИЧ-инфекцией и саркомы Капоши целесообразно начинать
с назначения схемы APT.
Если через 3 мес после начала APT будет достигнут выраженный
терапевтический эффект (старые элементы саркомы Капоши поблед-
неют и станут плоскими, исчезнет ореол «цветения» вокруг элемента,
не будет отмечено появления новых элементов), то специфическую
терапию саркомы Капоши можно не проводить. В случае недостаточ-
ного терапевтического эффекта пациенту следует назначить проспидия
хлорид (Проспидин*) в дозе 0,1 г в сут в/м в течение 30 дней.
Показаниями для системной терапии саркомы Капоши у больных
ВИЧ-инфекцией являются саркомы Капоши внутренних органов (лег-
кие, желудочно-кишечный тракт и др.); обширное и быстропрогресси-
рующее распространение опухоли на коже (>25 элементов); наличие
выраженных отеков; отсутствие реакции на местное лечение. Схемы
полихимиотерапии назначает онколог.
Схемы системной терапии включают пегилированный липосо-
мальный доксорубицин (20 мг/м2 каждые 2-3 нед) и липосомальный
даунорубицин (40 мг/м2 каждые 2 нед), комбинацию адриамицина,
блеомицина с винкристином или винбластином, сочетание блеомици-
на и алкалоидов барвинка, а также назначение винкристина или вин-
бластина в качестве монотерапии или проспидия хлорид (Проспидин4).
При неполном положительном ответе клинических проявлений сар-
комы Капоши на фоне APT и количестве CD4 >200 кл/мкл в качестве
10.8. Лимфома
235
терапии выбора можно применять пегилированный интерферон альфа:
альфа-2а (180 мкг/нед), альфа-2Ь (1,5 мкг/кг/нед) в течение 48 нед
(или до достижения ответа).
10.8. ЛИМФОМА
Некоторые подтипы злокачественных лимфом рассматривают как
оппортунистические, или СПИД-индикаторные: они развиваются
на фоне глубокого иммунодефицита (как правило, при снижении
CD4 <50 кл/мкл), тем не менее высокий риск возникновения лимфом
сохраняется даже на фоне эффективной APT.
Наиболее частыми вариантами НХЛ у больных с ВИЧ-инфекцией
являются лимфома Беркитта (Burkitt) (30—40% случаев НХЛ) и диф-
фузная крупноклеточная В-клеточная лимфома (до 40-60% случаев).
Развитие большинства видов ВИЧ-ассоциированных НХЛ связано
с вирусом Эпштейна-Барр.
ВИЧ-ассоциированные НХЛ отличаются очень высокой степенью
злокачественности, считается, что до 25% ВИЧ-ассоциированных лим-
фом не удается классифицировать даже в специализированных рефе-
рентных лабораториях.
Клинические проявления при НХЛ включают в себя пораже-
ние лимфатических узлов любых или нескольких групп в сочетании
с В-симптомами.
Различные экстранодальные поражения определяются пример-
но у 85% больных, и легочное поражение является наиболее частым
из них (70%); в то же время изолированное поражение органов дыха-
ния встречается редко (3—5,8%). Наиболее типичными клиническими
проявлениями при легочном поражении при НХЛ является сочетание
В-симптомов (95%) с кашлем (70%) и одышкой (60%).
При лучевом исследовании могут выявляться диффузные интер-
стициальные изменения, легочные инфильтраты, очаги, круглая тень
или их сочетание, увеличение ВГЛУ, а частота выпота в плевральную
полость достигает 60-68%.
Имеются сведения о повышении уровня лактатдегидрогеназы при
НХЛ у большинства больных (80—90%), однако это исследование
не является критерием для установления диагноза, а, скорее, является
прогностическим фактором [65].
Диагностика НХЛ основывается на гистологическом исследова-
нии биоптатов. Подчеркивается, что морфологическое исследование
236 Глава 10. Дифференциальная диагностика туберкулеза органов дыхания...
предпочтительнее цитологического. Считается, что чрезбронхиальная
биопсия информативна в 58% случаев поражений легких при НХЛ;
при вовлечении плевры информативность цитологического исследова-
ния плевральной жидкости составляет около 58%, а при пункционной
биопсии плевры достигает 90—100%, хирургическая биопсия легкого
информативна в 75% случаев.
Согласно международным руководствам по ведению пациентов
с НХЛ, настоятельно рекомендуется перед началом химиотерапии
провести спиральную компьютерную томографию (шеи, ОГК, брюш-
ной полости и малого таза) и трепанобиопсию. Большинство наци-
ональных руководств настоятельно рекомендует проводить пози-
тронно-эмиссионную томографию КТ всем пациентам с НХЛ перед
началом химиотерапии с целью точного стадирования.
Прогноз при НХЛ определяется не только общепринятыми фак-
торами (стадия, наличие экстранодальных локализаций, возраст,
уровень сывороточной лактатдегидрогеназы), но и количеством
С04+-лимфоцитов в момент установления диагноза; считается, что
уровень CD4 < 100 кл/мкл является прогностически неблагоприятным.
В лечении ВИЧ-ассоциированных лимфом используются стан-
дартные схемы, содержащие комбинацию циклофосфамида, гидрок-
сидаунорубицина, винкристина и преднизолона в сочетании с ритук-
симабом (так называемый CHOP-R режим), а полихимиотерапия, как
правило, проводится одновременно с APT.
СПИСОК ЛИТЕРАТУРЫ
1. Бактериовыделение у пациентов с ВИЧ-инфекцией и туберкулезом /
И.Б. Викторова, В.Н. Зимина, А.В. Кравченко, А.Л. Ханин // Эпидемиол.
инфекц. болезни. Актуал. вопр. № 3, 2018. С. 35-40.
2. Бартлетт Дж., Галлант Дж., Фам П. Клинические аспекты ВИЧ-инфекции:
пер. с англ. М.: Р. Валент, 2012. С. 528.
3. Берджи. Определитель бактерий Берджи. Авт.: Д.Х. (Давид Хендрискс)
Бергей, Р. Беркли, Йонн Г. Холт. Мир, 1997.
4. Васильева Т.Е., Литвинова Н.Г., Шахгильдян В.И. и др. Легочная патология
у больных ВИЧ-инфекцией //Терапевтический архив. 2007. № 11. С. 31—35.
5. Викторова И.Б., Зимина В.Н. Рецидивы туберкулеза у больных ВИЧ-
инфекцией // Инфекционные болезни. 2019, т. 17, № 1. С. 28-33.
6. Викторова И.Б., Ханин А.Л., Зимина В.Н. Летальные исходы у больных
с ВИЧ-инфекцией в крупном противотуберкулезном учреждении Кеме-
ровской области // Журнал «Инфектологии». Том 9, № 3, 2017. С. 25-31.
7. ВИЧ-инфекция и СПИД: клинические рекомендации / Под ред.
В.В. Покровского. М.: ГЭОТАР-Медиа, 2010. 185 с.
8. ВИЧ-инфекция и СПИД: национальное руководство / Под ред. акад.
РАМН В.В. Покровского. М.: ГЭОТАР-Медиа, 2013. 608 с. Глава 15.
Оппортунистические (вторичные) поражения у больных с ВИЧ-инфекцией:
А.В. Кравченко, О.П. Фролова, В. Зимина «Туберкулез у больных с ВИЧ-
инфекцией». С. 144—160.
9. ВИЧ-инфекция: Информационный бюллетень № 35 / ФГУН «Централь-
ный НИИ эпидемиологии», ФНМЦ по профилактике и борьбе со СПИДом.
М., 2011. 52 с.
10. ВИЧ-медицина: руководство для врачей / Под ред. Н.А. Белякова,
А.Г. Рахманова. СПб.: Балтийский медицинский образовательный центр,
2010. 751 с.
11. Внелегочный туберкулез: руководство для врачей / Под ред. проф.
А.В. Васильева. СПб., 2000. 560 с.
12. ВОЗ. Лечение туберкулеза: рекомендации. 4-е изд. 2011. С. 179.
13. Зимина В.Н., Батыров Ф.А., Зюзя Ю.Р. и др. Туберкулез множественных
локализаций у больных ВИЧ-инфекцией: особенности течения и диаг-
ностики // Вестник РГМУ. 2012. № 2. С. 45-50.
14. Зимина В.Н., Батыров Ф.А., Кравченко А.В. и др. Клинико-рентгеноло-
гические особенности течения впервые выявленного туберкулеза у боль-
ных с ВИЧ-инфекцией в зависимости от исходного количества CD4+-
лимфоцитов // Туберкулез и болезни легких. 2011. № 12. С. 35—41.
15. Зимина В.Н., Кравченко А.В., Батыров Ф.А. и др. Комбинированная
противотуберкулезная и антиретровирусная терапия у больных туберку-
лезом в сочетании с ВИЧ-инфекцией: эффективность и переносимость //
Туберкулез и болезни легких. 2012. № 2. С. 37—43.
238
Список литературы
16. Канестри В.Г., Зимина В.Н., Кравченко А.В. и др. Сочетанная терапия
ВИЧ-инфекции и туберкулеза: анализ безопасности и переносимости //
Инфекционные болезни. 2012. Т. 10, № 3. С. 5-9.
17. Кожная проба с препаратом «Диаскинтест» — новые возможности
идентификации туберкулезной инфекции / Под ред. акад. РАН и РАМН
М.А. Пальцева. 2-е изд., перераб. и доп. М.: Шико, 2011. 256 с.
18. Кравченко А.В., Зимина В.Н. Антиретровирусная терапия у больных ВИЧ-
инфекцией и туберкулезом // Инфекционные болезни: новости, мнения,
обучение. 2012. № 1 (1). С. 15-21.
19. Кравченко А.В., Зимина В.Н., Викторова И.Б., Ситдыкова Ю.Р. Проявле-
ние воспалительного синдрома восстановления иммунной системы на фо-
не антиретровирусной терапии у больных ВИЧ-инфекцией // Эпидемио-
логия и инфекционные болезни. Актуальные вопросы. 2011. № 1. С. 58-64.
20. Кравченко А.В., Мирошниченко А.В., Канестри В.Г. и др. ВИЧ-инфекция
на стадии первичных проявлений: особенности клинической картины
и диагностики // Инфекционные болезни. 2005. № 3. С. 18-22.
21. Лечение ВИЧ-инфекции: 2011 г. / Под ред. К. Хоффмана, Ю.К. Рокштро.
М., 2012. 720 с.
22. Нечаев В.В., Иванов А.К., Пантелеев A.M. Социально значимые
инфекции: монография: В 2 ч. СПб.: Береста, 2011. Ч. II. Микстинфекции.
2011.312 с.
23. Обновленное сводное руководство по программному ведению случаев
латентной туберкулезной инфекции [Latent tuberculosis infection: up-
dated and consolidated guide lines for programmatic management]. Женева:
Всемирная организация здравоохранения, 2018. Лицензия СС BY-NC-SA
3.0 IGO.
24. Обследование и антиретровирусная терапия у взрослых и подростков //
Клинический протокол для Европейского региона ВОЗ (обновленная
версия, 2012). Копенгаген: ВОЗ, 2012. 91 с.
25. Пантелеев A.M. Внелегочный туберкулез у ВИЧ-инфицированных /
A.M. Пантелеев, Т.А. Савина, Т.Ю. Супрун // Проблемы туберкулеза. 2007.
№2. С. 16-19.
26. Пархоменко Ю.Г. Патология легких при ВИЧ-ассоциированных инфек-
циях / Ю.Г. Пархоменко, Ю.Р. Зюзя, О.А. Тишкевич // Архив патологии.
2008. № 6. С. 44-48.
27. Пархоменко Ю.Г., Ерохин В.В., Зюзя Ю.Р. и др. Патоморфологические
изменения в легких при туберкулезе у умерших от ВИЧ-инфекции в стадии
СПИДа//Архив патологии. 2007. № 3. С. 26-28.
28. Покровский В.В., Юрин О.Г., Буравцева Е.В., Козырина Н.В. Порядок
постановки диагноза ВИЧ-инфекции. М., 2000.
29. Покровский В.В., Юрин О.Г., Кравченко А.В. и др. Рекомендации по лече-
нию ВИЧ-инфекции и связанных с ней заболеваний, химиопрофилактике
заражения ВИЧ // Эпидемиология и инфекционные болезни. Актуальные
вопросы. 2019. № 4 (приложение). 87 с.
Список литературы
239
30. Политика ВОЗ в отношении сотрудничества в области ТБ/ВИЧ. Руко-
водящие принципы для национальных программ и других заинтересован-
ных сторон. ВОЗ, 2012. 36 с.
31. Руководство по программному ведению лекарственно-устойчивого ту-
беркулеза. ВОЗ, 2007. 174 с.
32. Сводное руководство ВОЗ по лечению лекарственно-устойчивого тубе-
ркулеза. Копенгаген: Европейское региональное бюро ВОЗ; 2019. Лицензия
CCBY-NC-SA3.0IGO.
33. Туберкулез / Под ред. А.Г. Хоменко. М.: Медицина, 1996. 493 с.
34. Туберкулез у взрослых. Васильева И.А., Баласанянц Г.С., Борисов С.Е.,
Бурмистрова И.А., Валиев Р.Ш., Ваниев Э.В., Вахрушева Д.В., Весело-
ва Е.И., Воронин Е.Е., Зимина В.Н., Иванова Д.А., Казимирова Н.Е.,
Каминский Г.Д., Корниенко СВ., Краснов В.А., Кульчавеня Е.В., Ловаче-
ва О.В., Марьяндышев А.О., Мордык А.В., Морозова Т.И. и др. Клиничес-
кие рекомендации / Москва, 2020.
35. Туберкулез в Российской Федерации, 2011 г. Аналитический обзор
статистических показателей по туберкулезу, используемых в Российской
Федерации. М., 2012. 246 с.
36. Туберкулез. Патогенез, защита, контроль: пер с англ. / Под ред. Барри Р.
Блума. М.: Медицина, 2002. 678 с.
37. Туберкулез: учебное пособие / В.А. Кошечкин, З.А. Иванова. М.: ГЭОТАР-
Медиа, 2007. 301 с.
38. Фролова О.П. Определение стадии ВИЧ-инфекции у больных туберкуле-
зом / О.П. Фролова, А.В. Кравченко, О.Г. Юрин // Инфекционные болез-
ни. 2009. № 4. С. 70-74.
39. Фролова О.П., Кравченко А.В., Мартынов А.А., Батыров Ф.А. Организация
противотуберкулезной помощи больным ВИЧ-инфекцией: пособие для
врачей. М., 2006. 120 с.
40. Фтизиатрия: национальное руководство / Под общ. ред. М.И. Перельмана.
М.: ГЭОТАР-Медиа, 2007. 512 с.
41. Черноусова Л.Н., Севастьянова Э.В., Андреевская С.Н. и др. Алгоритм
микробиологических исследований для диагностики туберкулезной
инфекции: методическое пособие для врачей. М., 2011. С. 52.
42. Шахгильдян В.И., Литвинова Н.Г., Морозова СВ. и др. Клиническое
значение обнаружения ДНК микобактерий туберкулеза, цитомегаловируса,
токсоплазмы в бронхоальвеолярном лаваже и биоптатах бронхов у ВИЧ-
инфицированных больных с легочной патологией // Эпидемиология
и инфекционные болезни. 2006. № 4. С 50-54.
43. Эйсмонт Н.В. Эффективность химиопрофилактики туберкулеза у боль-
ных с глубоким иммунодефицитом при ВИЧ-инфекции // Уральский
медицинский журнал. 2011. № 14. С. 40-46.
44. Abdool Karim S.S., Naidoo К., Grobler A. et al. Integration of antiretroviral ther-
apy with tuberculosis treatment // N. Engl. J. Med. 2011 Oct 20. Vol. 365 (16).
P. 1492-1501.
240
Список литературы
45. Adapted from US Department of Health and Human Services Guidelines;
Revised March 10, 2012. Available at: http://aidsinfo.nih.gov/guidelines.
46. Akolo C, Adetifa I., Shepperd S., Volmink J. Treatment of latent tuberculosis in-
fection in HIV infected persons // Cochrane Database Syst. Rev. 2010 Jan 20. Is-
sue 1:CD000171.
47. Blanc EX., Sok Т., Laureillard D. et al. Earlier versus later start of antiretroviral
therapy in HIV-infected adults with tuberculosis // N. Engl. J. Med. 2011 Oct 20.
Vol. 365 (16). P. 1471-1481.
48. Chang K.C., Leung C.C., Yew W.W. et al. A nested case-control study on treat-
ment-related risk factors for early relapse of tuberculosis //Am. J. Respir. Crit.
Care Med. 2004 Nov 15. Vol. 170(10). P. 1124-1130.
49. Global tuberculosis report 2019. Geneva: World Health Organization; 2019. Li-
cence: CC BY-NC-SA 3.0 IGO.
50. Griffith D.E., Aksamit Т., Brown-Elliott B.A., Catanzaro A., Daley C, Gordin E
et al. An official ATS/IDSA statement: Diagnosis, treatment, and prevention of
nontuberculous mycobacterial diseases. Am. J. Respir. Crit. Care. Med. 2007,
Vol. 175(4). P. 367-416.
51. Management and Treatment of HIV-infected Adults in Europe (Version 10.0; No-
vember, 2019. European AIDS Clinical Society, http://www.eacsociety.org.
52. Guidelines for the Prevention and Treatment of Opportunistic Infections Among
HIV-Exposed and HIV-infected Children. [Internet]. 2019 [Cited 31.07.2019]
Available from: https://aidsinfo.nih.gov/contentfiles/lvguidelines/oi_guidelines_
pediatrics.pdf.
53. Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and
Adolescents. Developed by the Panel on Clinical Practices for Treatment of HIV-
Infection convened by the Department of Health and Human Services (DHHS).
December 18, 2019. http://AIDSinfo.nih.gov.
54. Guidelines for treatment of drug-susceptible tuberculosis and patient care, 2017
update ISBN 978-92-4-155000-0.
55. Gupta A. et al. Abstract 142LB. Presented at: Conference on Retroviruses and Op-
portunistic Infections; March 4-7, 2018; Boston.
56. Havlir D.V, Kendall M.A., Ive P. et al. Timing of antiretroviral therapy forHIV-1
infection and tuberculosis// N. Engl. J. Med. 2011 Oct 20. Vol. 365 (16). P. 1482-
1491.
57. Holtz Timothy H. et al. Use of a WHO-recommended algorithm to reduce mor-
tality in seriously ill patients with HIV infection and smear-negative pulmonary
tuberculosis in South Africa: an observational cohort study // Lancet Infect. Dis.
2011 Jul. Vol. 11 (7). P. 533-540. Epub 2011. Apr. 20.
58. Improving the diagnosis and treatment of smear-negative pulmonary and ex-
trapulmonary tuberculosis among adults and adolescents: recommendations for
HIV-prevalent and resource-constrained settings. Geneva: WHO, 2007.
59. Khan F.A., Minion J., Pai M. et al. Treatment of active tuberculosis in HlVcoin-
fected patients: a systematic review and meta-analysis // Clin. Infect. Dis. 2010
May 1. Vol. 50 (9). P. 1288-1299.
Список литературы
241
60. Korenromp E.L., Scano R, Williams B.G. et al. Effects of human immunodefi-
ciency virus infection on recurrence of tuberculosis after rifampinbased treatment:
an analytical review // Clin. Infect. Dis. 2003 Jul 1. Vol. 37 (1). P. 101-112. Epub
2003. Jun. 23.
61. Lawn S.D., Edwards D.J., Kranzer K. et al. Urine lipoarabinomannan assay for
tuberculosis screening before antiretroviral therapy diagnostic yield and associa-
tion with immune reconstitution disease //AIDS. 2009. Vol. 23. P. 875-1880.
62. Manosuthi W., Mankatitham W., Lueangniyomkul et al. Standard-dose efavirenz
vs. standard-dose nevirapine in antiretroviral regimens among HIV1 and tubercu-
losis co-infected patients who received rifampicin // HIV Medicine. 2008. Vol. 9.
P. 294-299.
63. Meintjes G., Lawn S.D., Scano F. et al. Tuberculosis-associated immune re-
constitution inflammatory syndrome: case definitions for use in resourcelimited
settings// Lancet Infect. Dis. 2008. Vol. 8. P. 516-523.
64. Mena P. Vazquez, A. Castro et al. Clinical experience of raltegravir containing
regimens in HIV-infected patients during rifampicin-containing treatment of tu-
berculosis//J. Antimicrob. Chemother. 2011. Vol. 66. P. 951-952.
65. Morris K. WHO recommends against inaccurate tuberculosis tests // Lancet.
2011. Vol. 377. P. 113-114.
66. Padmapriyadarsini C, Narendran G., Swaminathan S. Diagnosis & treatment of
tuberculosis in HIV со-infected patients// Indian J. Med Res. 2011 Dec. Vol. 134
(6). P. 850-865.
67. Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the
prevention and treatment of opportunistic infections in HIV-infected adults and
adolescents: recommendations from the Centers for Disease Control and Preven-
tion, the National Institutes of Health, and the HIV Medical Association of the
[Internet]. 2019 [cited 2019 Jul 15]. P. 423. Available from: http://aidsinfo.nih.gov/
contentfiles/lvguidelines/adultoi.pdf.
68. Payam Nahid, Leah С Gonzalez, Irina Rudoy et al. Treatment Outcomes of Pa-
tients with HIV and Tuberculosis // Am. J. Respir. Crit. Care Med. 2007 June 1.
Vol. 175(11). P. 1199-1206.
69. Roadmap for rolling out Xpert MTB/RIF for rapid diagnosis of ТВ and
MDR-TB. Geneva: World Health Organization, 2010.
70. Sathia L., Obiorah I., Taylor G. et al. Concomitant use of nonnucleoside analo-
gue reverse transcriptase inhibitors and rifampicin in TB/HIVtype 1-coinfected
patients//AIDS Res. Hum. Retroviruses. 2008. Vol. 24, № 7. P. 897-901.
71. Shah M., Variava E., Holmes C.B. et al. Diagnostic accuracy of a urine lipoarabi-
nomannan test for tuberculosis in hospitalized patients in a high HIV prevalence
setting//J. Acquir. Immune Defic. Syndr. 2009. Vol. 52, № 2. P. 145-151.
72. Society EAC. EACS Guidelines [Internet]. Version 9.1. [Cited 19.06.2019] Avail-
able from: http://www.eacsociety.org/files/2018_guidelines-9.l-english.pdf.
73. Suchindran S., Brouwer E.S., Van Rie A. Is HIV Infection a Risk Factor for
Multi-Drug Resistant Tuberculosis? // A Systematic Review. 2009. Vol. 4, is-
sue 5. P. 55-61.
242
Список литературы
74. Swindells S., Ramchandani R., Gupta A. One Month of Rifapentine plus Iso-
niazid to Prevent HIV-Related Tuberculosis // N Engl. J. Med. 2019. Vol. 380.
P. 1001-1011. DOI: 10.1056/NEJMoal806808.
75. Thompson M.A., Aberg J.A., Hoy J.F. et al. Antiretroviral treatment of adult HIV
infection: 2012 recommendations of the International Antiviral Society-USA pan-
el //JAMA. 2012. Vol. 308 (4). P. 387-402.
76. Thompson M.A., Aberg J.A., Hoy J.F. et al. Antiretroviral treatment of adult
HIV infection: 2012 recommendations of the International AIDS Society USA
panel. //JAMA. 2012. Vol. 308, № 4. P. 387-402.
77. Torek M.E. et al. Timing of initiation of antiretroviral therapy in human immu-
nodeficiency virus (HIV)-associated tuberculous meningitis // Clin. Infect. Dis.
2011. Vol. 52 (11). P. 1374-1383.
78. WHO. Towards universal access to diagnosis and treatment of multidrugresis-
tant and extensively drug-resistant tuberculosis by 2015: WHO progress report
2011/WHO/HTM/TB/2011.3.
ДЛЯ ЗАМЕТОК
ДЛЯ ЗАМЕТОК
ДЛЯ ЗАМЕТОК
Практическая
пульмонология
• В руководстве с позиций прак-
тического врача подробно из-
ложены современные данные
о клинической картине, этиоло-
гии, патогенезе, диагностике,
лечении заболеваний органов
дыхания и оказании неотложной
помощи таким больным. Особое
внимание уделено принципам и
методам функциональной, луче-
вой и эндоскопической диагно-
стики болезней органов дыхания,
детально освещены вопросы
клинической оценки результатов
функциональных тестов.
• Представленные дифференци-
ально-диагностические алго-
ритмы отражают доказательную
базу международных и отече-
ственных клинических рекомен-
даций и консенсусов. Особенным
достоинством руководства явля-
ется большое количество блок-
схем и рисунков, облегчающих
восприятие материала, а также
наличие резюме в конце глав
и некоторых разделов с пере-
числением ключевых положений
изложенного. При написании
книги использован богатый опыт
лечения больных с патологией
органов дыхания и преподава-
ния пульмонологии на кафедре
известнейшего отечественного
терапевта-пульмонолога - ака-
демика Н.С. Молчанова.
Руководство для врачей
\==?Ь> Под редакцией
В.В. Салухова,
М.А. Харитонова
2020 г., 416 с.
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
geotar.ru
Пульмонология
• В книге обсуждаются общие и
частные вопросы пульмоноло-
гии, даются рекомендации по
диагностике, лечению и профи-
лактике заболеваний органов
дыхания.
• В подготовке издания в качестве
авторов и рецензентов участво-
вали ведущие сотрудники НИИ
пульмонологии ФМБА России,
ЦНИИ туберкулеза РАН, Инсти-
тута иммунологии ФМБА России,
Санкт-Петербургского государ-
ственного университета, Рязан-
ского государственного меди-
цинского университета им. акад.
И.П. Павлова и других медицин-
ских учреждений страны.
• Сокращенная версия руковод-
ства включает всю основную ин-
формацию, необходимую врачу
для непрерывного последиплом-
ного образования.
• Предназначено терапевтам,
пульмонологам, интернам, ор-
динаторам, аспирантам и сту-
дентам старших курсов меди-
цинских вузов.
Национальное
руководство
Под редакцией
А.Г. Чучалина
2020 г., 768 с.
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
geotar.ru
Пульмонология
Стандарты медицинской
помощи. Критерии
оценки качества.
Фармакологический
справочник
• С 1 января 2013 г. вступила
в силу часть 1 статьи 37 Федераль-
ного закона № 323-ФЗ «Об осно-
вах охраны здоровья граждан
в Российской Федерации», закре-
пляющая норму об организации
и оказании медицинской помо-
щи в соответствии с порядками
оказания медицинской помощи,
обязательными для исполнения
на территории Российской Феде-
рации всеми медицинскими ор-
ганизациями, а также на основе
стандартов медицинской помо-
щи, утвержденных Минздравом
России и зарегистрированных
в Минюсте России.
• В данном справочнике собраны
все актуальные порядки и стан-
дарты оказания медицинской
помощи при заболеваниях дыха-
тельной системы у детей и взрос-
лых. В конце книги даны крат-
кий справочник лекарственных
средств, указанных в стандартах,
а также справочник по Междуна-
родной классификации болезней
со ссылками на стандарты меди-
цинской помощи.
Ц | Серия «Стандарты
медицинской помощи»
=Ъ Составитель
А.И. Муртазин
2019 г., 352 с.
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
geotar.ru
ВИЧ-инфекция
в терапевтической
практике
• В книге на основе собствен-
ных исследований авторов и
данных мировой литературы
представлена парадигма под-
хода к ВИЧ-инфекции/СПИДу.
В ней освещены основные во-
просы эпидемиологии, клини-
ческих проявлений, лабора-
торной диагностики и лечения
ВИЧ-инфекции. Авторы также
сообщают данные о знаниях и
информированности студен-
тов медицинского вуза о ВИЧ-
инфекции. В приложении при-
ведены российские стандарты
и рекомендации, касающиеся
ВИЧ-инфекции/СПИДа.
• Издание предназначено ис-
следователям, практикующим
врачам - терапевтам, врачам
общей практики, дерматовене-
рологам, инфекционистам, аку-
шерам-гинекологам, урологам,
слушателям курсов повышения
квалификации, клиническим ор-
динаторам и студентам медицин-
ских вузов.
Ц | Научно-практическое
издание
==Ъ Авторы
А.А. Хрянин,
О.В. Решетников
2018 г., 88 с.
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
geotar.ru
Тактика
врача-терапевта
участкового
• Практическое руководство по
терапии содержит современную
и актуальную информацию о
диагностике, лечении и профи-
лактике основных заболеваний
и синдромов, наиболее часто
встречающихся в практике вра-
ча-терапевта участкового.
• Предназначено для врачей-те-
рапевтов участковых, врачей об-
щей практики, клинических ор-
динаторов и студентов старших
курсов медицинских вузов.
• Книга имеет электронную вер-
сию, активировав доступ к ко-
торой можно получить допол-
нительные информационные ма-
териалы (уточняющие рекомен-
дации, развернутые речевые мо-
дули, нюансы взаимодействия
лекарственных препаратов).
Практическое
руководство
=^> Под редакцией
О.М. Драпкиной,
А.И. Мартынова
2020 г., 208 с.
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
geotar.ru
ГДЕ И КАК КУПИТЬ КНИГИ
115035, Москва, ул. Садовническая, д. 11, стр. 12
Отдел оптовых продаж (вузы + опт)
Тел.: (495) 921-39-07 (доб. 109, 112, 192, 143, 152);
моб.: (916) 876-90-59;
e-mail: opt@geotar.ru, iragor@geotar.ru, sa@geotar.ru
Отдел продаж медицинским училищам и колледжам
Тел./факс: (495) 228-09-74, 921-39-07 (доб. 138, 207, 252);
моб.: (926) 817-51-50, (985) 339-53-01;
e-mail: sales2@geotar.ru, zhernova@geotar.ru
Отдел розничных продаж и выставок
Тел./факс: (495) 921-39-07 (доб. 255, 280); моб.: (926) 168-42-16;
e-mail: bobyleva@medknigaservis.ru, gnezdilov@medknigaservis.ru
Интернет-магазин «Медкнигасервис»
Тел.: 8 (800) 555-99-92; www.medknigaservis.ru;
e-mail: bookpost@medknigaservis.ru;
доставка по всей России
Фирменные магазины (Москва)
М. «Фрунзенская», Комсомольский пр-т, д. 28,
подъезд 3 (здание Московского дворца молодежи,
вход в магазин со стороны Комсомольского
проспекта). Ежедневно с 9 до 20 ч.
Тел.: (499) 685-12-47; моб.: (916) 877-06-84
Детский
М. «Новокузнецкая», «Третьяковская»
ул. Садовническая, д. 13, стр. 11.
Ежедневно с 9 до 20 ч.
Тел.:(495)921-39-07 (доб. 602,603)
М. «Савёловская», ул. Сущёвский Вал, д. 9, стр. 1
(вход справа от Мебельного центра).
Ежедневно с 9 до 20 ч.
Тел.: (495) 921-39-07 (доб. 729); моб.: (985) 387-14-57
Сущёвский Вал
Книги Издательской группы «ГЭОТАР-Медиа»
вы можете приобрести у следующих региональных представителей:
Архангельск
«АВФ-книга»:
ул. Ленина, 3;
тел.: (8182) 65-38-79
Астрахань
«Медицинская книга»:
ул. Бакинская, 121 / ул. Кирова, 51
(около Медицинского
университета);
тел.: (8512) 60-87-06,
(917)170-25-22;
факс: (8512) 25-87-06
Воронеж
ИП Собацкий Б.Н.,
«Медицинская книга»:
ул. Кольцовская, 6;
тел.: (4732) 40-59-56
Екатеринбург
Магазин «Медицинская книга»:
ул. Волгоградская, 184;
тел./факс: (343) 338-77-25;
http://www.mmbook.ru/;
торговый представитель:
г. Тюмень, ул. Одесская, 59.
Магазин «Милан»,
отдел «Медкнига»
Ессентуки
«РОССЫ»:
ул. Октябрьская, 424;
тел.: (8793) 46-93-09
Иваново
«Новая мысль»:
пр-т Ленина, 5;
тел.: (4932) 41-64-16
Ижевск
Магазин «Медицинская
литература» (ИП Тюлькин А.В.):
ул. Лихвинцева, 46
(ТЦ «Виктория»);
тел.: (912) 850-71-72,
(950)165-32-15;
e-mail: alextyulkin@yandex.ru;
www.doctorbooks.ru
Иркутск
Магазин «Медкнига»:
ул. К. Либкнехта, 157;
тел.: (3952) 20-06-68,
(914)910-53-48
Казань
Магазин «Медкнига»:
ул. Бутлерова, 31;
тел.: (843) 238-82-39,
(950)312-80-27
Казань
Ул. Бутлерова, 36 (КГМА);
тел.: (952) 038-11-12
Краснодар
ИП Горбанев К.А.
(«Медицинская книга»):
ул. Седина, 6/1;
тел.: (908) 671-63-91
Краснодар
ИП Белик Е.Н.: ул. Седина, 4;
тел.: (918) 330-08-73
Москва
Дом книги «Молодая гвардия»:
ул. Б. Полянка, 28, стр. 1;
тел.: (495) 780-33-70,
238-50-01
Книги Издательской группы «ГЭОТАР-Медиа»
вы можете приобрести у следующих региональных представителей:
Москва
Торговый дом «Библио-Глобус»:
ул. Мясницкая, 6/3, стр. 1;
тел.: (495) 781-19-00;
факс: (495) 628-87-58
Нижний Новгород
«Дом книги»: ул. Советская, 14;
тел.: (831) 246-22-92,
246-22-73, 277-52-07;
e-mail: kniga@kis.ru
Новосибирск
«Книги Сибири»: ул. Часовая, 6/2;
тел.: (383) 335-61-63
Пермь
Книжный магазин «Пермкнига»:
ул. Лодыгина, 6;
тел.: (342) 278-33-23,
242-84-90, 242-72-74
Рязань
Супермаркет «Книги»:
Московское ш., 5А, ТД «БАРС-1»;
тел.: (4912) 93-29-54
Санкт-Петербург
«Санкт-Петербургский дом книги»:
Невский пр-т, 28;
тел.: (812) 318-49-15, 312-01-84
Санкт-Петербург
ИП Кузьменок И.В. (медицинская
и ветеринарная литература):
ДК им. Крупской, 2-й этаж,
место № 54, 80; тел.: (962) 708-77-64
(место №54), (911)24-22-54
(место №80);
http://krupaspb.ru/uchastniki/;
e-mail: personal/medkniga.htm
Санкт-Петербург
Магазин «Медицинская
литература»: ул. Боткинская, д. 3,
ТК «ТуКан». 2-й этаж;
тел.: (812) 642-24-67,
e-mail: Medbook-spb@bk.ru,
Medbook.shop
Саратов
«Стержень»: ул. Валовая, 92;
тел.: (8452) 23-46-44;
факс: (8452) 23-56-99
Смоленск
СГМУ, магазин «Пульс»:
ул. Крупской, 28;
тел.: (4812) 31-09-25
Ставрополь
«Мир Знаний»:
ул. Лермонтова, 191, корп. 43;
тел.: (8652) 24-28-77;
e-mail: mz@kavkazinterpress.ru
Хабаровск
«Деловая книга»:
ул. Промышленная, 20Д/1;
тел.: (4212) 45-06-65,
46-95-31,45-06-64
Челябинск
ЧП Луговых А.Ю.,
Южно-Уральский ГМУ (главный
корпус, 1-й этаж):
ул. Воровского, 64;
тел.: (351) 775-77-47,
(912)895-26-36
Фирменные магазины «Медкнига» (Республика Татарстан)
г. Казань, ул. Бутлерова, 31. Тел.: +7 (843) 238-8-239, +7 (950) 312-80-27;
e-mail: gafurovan@mail.ru, kazanmedkniga@mail.ru
Время работы: ежедневно с 09.00 до 20.00.
г. Казань, ул. Бутлерова, 36, КГМА, 1-й этаж. Тел.: +7 (952) 038-11-12
Время работы: понедельник - пятница с 09.00 до 20.00
Фирменный магазин «Медкнига» (Краснодарский край)
г. Краснодар, ул. Митрофана Седина, 6/1. Тел.: +7 (908) 671-63-91
Время работы: понедельник - суббота с 08.00 до 18.00
Представительство Издательской группы
«ГЭОТАР-КазМедиа»
ТОО «ГЭОТАР-КазМедиа»
Республика Казахстан,
010000, г. Hyp-Султан, ул. Бейбитшилик, 54, кв. 3. Тел.: (7172) 39-82-62;
e-mail: yuliya_borisenko@list.ru
Издательская группа «ГЭОТАР-Медиа» в Украине
Винница. Интернет-магазин «Медкнига». Киев. Интернет-магазин «Librabook»
г. Винница, ул. Блока, 14/2. (доставка курьером по Киеву,
Тел.: +38 (068) 834-73-89, почтой по Украине).
+38 (095) 337-12-25, Тел.: +38 (044) 383-20-95,
+38 (063) 351 -03-02, +38 (043) 266-05-10; +38 (093) 204-33-66, +38 (094) 927-90-95;
www.medkniga.com.ua; www.librabook.com.ua;
e-mail: info@medkniga.com.ua; e-mail: info@librabook.com.ua;
Viber & WhatsApp: +38 (063) 521-03-02; ICQ: 570-251 -870
Skype: medkniga_max@outlook.com
Дилер Издательской группы «ГЭОТАР-Медиа»
в Республике Беларусь ЧПТУП «Дар-Ника»
Республика Беларусь, 247760, г. Мозырь,
ул. Ленинская, 9/10.
Тел.:(37529)662-46-51,
(37529)730-13-66
Дилер Издательской группы «ГЭОТАР-Медиа»
в Республике Беларусь 000 «Лебенскрафт»
Республика Беларусь, 210024, г. Витебск,
пр-т Победы, 7/1, комн. 112.
Тел.:(37529)718-41-51
ПРИГЛАШЕНИЕ К СОТРУДНИЧЕСТВУ
Издательская группа «ГЭОТАР-Медиа» приглашает к сотрудничеству
авторов и редакторов медицинской литературы.
ИЗДАТЕЛЬСТВО СПЕЦИАЛИЗИРУЕТСЯ НА ВЫПУСКЕ
учебной литературы для вузов и колледжей, атласов,
руководств для врачей, переводных изданий.
Научно-практическое издание
Зимина Вера Николаевна
Кравченко Алексей Викторович
Викторова Ирина Борисовна
Кошечкин Владимир Анатольевич
ТУБЕРКУЛЕЗ И ВИЧ-ИНФЕКЦИЯ У ВЗРОСЛЫХ
2-е издание, переработанное и дополненное
Зав. редакцией А. В. Андреева
Менеджер проекта Е.А. Медведева
Выпускающий редактор И.А. Клепикова
Корректоры О.М. Пономарев, Е.В. Васина
Компьютерная верстка О.В. Капанина, Е.А. Боброва
Дизайн обложки И.Ю. Баранова, Т.В. Делицина
Технолог О.А. Ильина
Подписано в печать 07.07.2020. Формат 60x90 '/16.
Бумага офсетная. Печать офсетная. Объем 16 усл. печ. л.
Тираж 3000 экз. (I завод — 500 экз.). Заказ № К-9827.
ООО Издательская группа «ГЭОТАР-Медиа».
115035, Москва, ул. Садовническая, д. 11, стр. 12.
Тел.: 8 (495) 921-39-07.
E-mail: info@geotar.ru, http://www.geotar.ru.
Отпечатано в АО «ИПК «Чувашия».
428019, Чебоксары, пр-т И. Яковлева, д. 13.
ISBN 978-5-9704-5824-2
9||785970||458242||>