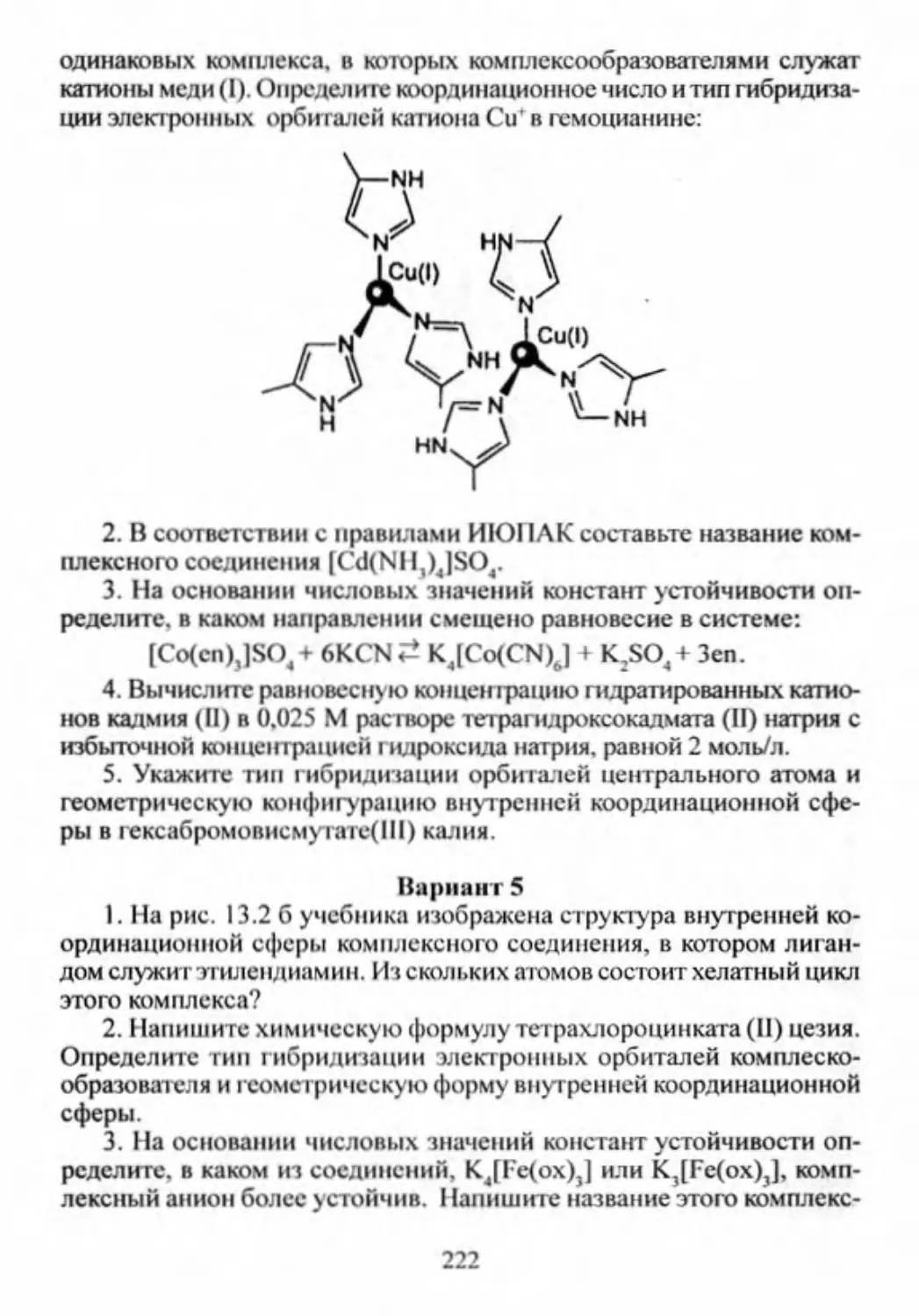
Автор: Смарыгин С.Н. Багнавец Н.Л. Дайдакова И.В.
Теги: неорганическая химия общая и неорганическая химия химия
ISBN: 978-5-9675-0233-0
Год: 2008
Текст
Российский государственный аграрный университет -
\1k4ki'l^kh!4 a' ll.*.hii\iMHlH I ML4IIIJ4 .1K.S (L'MHH
имени К.Л Тимирязева
Кафс;1ра iiL'L>pbiiiLi'iLLLKoii u :imj in i пчи^кой химии
С-Н. Смарьиин. IIJI. Багнавеи. И.В. Дандакова
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Учебное пособие
оля самостоятельной работы
Peaiue>i()(imoii? Sieomt-Mi-iiiinluseifu» объединением вузов
Российски Федерации в качестве учебного пособия
Лтя tmydetimon, обучающихся по напраялениям
11шлрмш1\шЧ1'1'К1>.\1 образования
Рец/теитн: im. кафе.чрнЧ iti.-i>[ii:iHii4L4kiiii 11 .ш.1лпшческ"и viim
lom.ithoii ичл iapai!i:i!iioii мп in ' viiiim ihl.-iih.ii ,ik.i'ii-«nii им. Н
рещагина. доцент, шот» ч.чпч^м.ч mvM.II. Щеглова ф
органически мишн Гяичмо-ч uhi |.ч:ч !..,■ > и p.i]imno уннверс
13 - МСХА имени К.Л. hiMiip4<L-iiii. iipixl"1'^1!1 чокгчр mimii-icckhx i
Н.М. Пржевальский.
< м;1[Н.Ч НИ С.Н., bill ir.Li;. n III., |. i..,. i 11.11.
C5U Неорганическая ihmhh. Уч. пособие я..я самостс
работы студентов. Ч. 1. Теорегяческие основы. М И и
РГАУ - МСХА имени К.Л. Тимирнэевп. 2008. 263 с.
ISBN 978-5-9675-0233-0
неорганической Кичин, тл
рость и энергетика химиче
1 ном шпраАсмпч lih 1.П1.1 р.и miifiiHi |'.н. iiiu|ii-i M^
© Коллектив авторок. М»1
© ФГОУ ВПО РГАУ МСХА
© Имателычно'рГЛУ -МСХА
имени К А Тимнри,сва, 3(108
ПРЕДИСЛОВИЕ
Данное учебное пособие предназначено для студентов,
обучающихся по направлениям «Агрохимия и агропочвовеление»,
«Агрономия» и по специальности «Технология производства и переработки
сел1и:м>\о11|йственной гтрод> кцинч. Оно отражает тенденцию к
переносу центра тяжести учебной деятельности с аудиторных занятий на
самостоятельную внеаудиторную работу студентов. Главными
задачами этого пособия являются:
Оорганимции ртлмршнп'пчш-кине.и.мой [таГ.шы студентов над
курсом неорганической химии:
2) помощь студентам в овладении этим сложным курсом;
3) создание дл» преподавателей возможности систематического
контроля самостоятельной работы студентов.
Данное >чебное пособие но объему и содержанию соответствует
учебнику ДА. Князева и С'.Н. Смарыгина «Неорганическая химии».
Оно состоит из 9 глав, имеющих одинаковую структуру. В начале
каждой главы пособия указано, какие главы или разделы учебника
следует изучить, прежде чем прноумьиь к решештю i-пдач или
ответам на вопросы пособия. За ссылками на главы учебника следуют
вопросы для подготовки к коллоквиуму, которые позволяют студенту
самостоятельно проверить уровень освоения материала учебника и
ПОД [О] о виться к ожидакилгчч его я avTinnpun контролю знаний в
форме контрольной работы, тестов или коллоквиума. Следующим
разделом каждой главы являются примеры решений задач. Для
удобства работы студентов примеры сгруппированы по типам задач. Там,
ются фидиятью вариантами индивидуальных заданий, каждое из
которых состоит из пяти вопросов и задач. Общее число задач и
вопросов в индивидуальных заданиях составляет 1350. Каждому студенту
при выполнении нндивндъалмшю чадагптч прилетая столкнуться с
45 задачами и вопросами.
При соскнченип ин.чшш is.i.jMit.cv ьд.'^мшн и примеров решений
авторы стремились продемонстрировать студентам, готовящимся
стать специалистами сельскою \о:ийстпа. практическую значимость
фактоло*ичеики\ ишшш и пгжикон icopci u'lL'Lhoio ;щп:1иза и
расчета химических процессов и систем, которые они приобретают при
изучении курса неорганической химии, и тем самым способствовать
формированию у студентов положтельной мошвации к изучению
этого сложного курса. Для достижения этих целей в условиях задач
рассмотрены реальные химические системы и процессы, играющие
Методические ре ко мои да пин для ciy,itiiion
Данное учебное пособие дополняет учебна* ДА. Князева и СМ.
1'мармгииа «I Il'ii|ii ;iiiu>icck.ih >.имия»(3-е издание увидело свет в ич-
дагельстве «Дрофа» в 2005 тд\ ) и прелначначено для opi имитации и
контроля самое юнтелы юн внеаудиторной работы студентов. Рабо-
П1 нал 1гим пособием, его авторы старались ИЗЛОЖИТЬ материал к
наиболее доступной дня с гудим ion форме, lloeiifiiic включает в себя
Ленятылак. Калипя uianu начинит ся С перечня глав и разделов
учебника Д.А. Кня1сва и СИ. Смарьп ииа. которые необходимо изучить
НИМ НОНЮрП I li I 14 IOf OL Ч I ЦП III о I ш.' I 111 li Э 41 h HOI IpkK I.I LI pL'JIJH I If lil^UI'IH
J.I TUM 11|1J!KO.JM 11 II I'e'lipOL t-l . Г.1М I Ki HOUillliII I. kOII I рч II,HOM\ KO.'l.'InK-
виуму. которые rio"ini>:i«ioi стллеи гам сфок>сировать свое внимание
\\\\ важнейших ф:.к1;|\ ее !.iкономtpm^ci я\. iifnuiL юпмых it изучаемых
1лава\- II при\и:|>;|\ рипгпми pat lmi^j pcni.i iNiimo il4j 'i;icks
встречающиеся типовые ИДачн, расположенные и порядке ночриетанин ич
сложности. При paooivL- пособием рекомендуется решагьвеезадачи
нчу'[аем01"о разима поселок;.ilmi,но. олн^ м ipv I ой. и пс перехм-
лить к последующей wia'ie. не поняв решения преды.чу щей. Если же
ичч'чать примеры решении нмоор.'чио. >.ч i.i^Kiihj..i4 ичи.ко ic ih ifii\.
и сложной еит>\1нии n.i honipi'.ii.noii [i;iook\ KOhip.ni завершает рабо-
ry над каждым hi jt^i.il1 юн .i;i}M[oio пособия.
Каждое дом.иипее "имапис ло-гжпо oi.it г, bi.iiio шено на
отдельном листе бума i и. г FiepxiiL'ri част мпоро] i> \ k;i <i.m;noi 1|ишилик>е|у-
дента. номер грч iiid.i. на шание i|i;iKvijbieni и тьмер napnaniG
домашнего задания. Г!о,| фамилией cie;i\ei начертить ПЯТЬ О1ГГ0К paiMC-
ром Ixl tM; "
гают подробные решения 1ада'1 обпж
сел в расчетные формулы. Это неЫ
чигь 1шслед>|о|цпй рашор допущен
|]ри решении чадач рекомендуйся и
Глава 1. СТЕХИОМЕТРИЧЕСКИЕ РАСЧЕТЫ
И"|учить: ijiany 2 учебника,
1.1. ВОПРОСЫ ДЛЯ ПОД] ОТОВКИ К КОЛЛОКВИУМУ
*ий? Для всех ли пешеств справедли-
гакое фактор эквивалентности?
10. Как вычислить молярную массу 1 квивале
1.2. ПРИМЕРЫ РЕШЕНИЯ (АДАЧ
Расчеты
па рмюди!
ШССа веше<
гд«т(|»)-м
вой It » этс
И*|
*. ем при
нометрнчсскимн расчета-
шомстрии. В НИХ опериру
;тоа и молярный обьем га
м н последующих ураит
1.1. 'и 1 ■■■ !■■ . количес
MCL-tii пренебречь.
и объемов ре
тнешюго сое
in. Такие рас
уравнения
■о иолярнм м
:ниях обо<па
1еты основаны на
it моль, молярная
асса, г/моль. Ьук-
х;юрида натрия,
ссой 1 кг. Солер-
A/(NaC1)
Массу хлорида натрия в 9VG
мах: I кг = 1000 г. Молярную и
масс атомов магрия и хлора, вчятых с И
ЩШС\) = 23.0 + 35,5 = 58,5 г/моль. Пщ
41-ния в уравнение и и рот волн м расчет:
-=17.1 t,
1000
n(NiCI) 5g5
Ответ: в шнн поваренной соли содержится Г
натрия.
1 ■ ш я .iil-l ген объем iaia, намеренный при нор:
при I!■ ■■!■ Iпи уравнении
it. хлорида
IX )СЛОВИ-
гдеК(В) - обьеы raia, л; Км- молярный объем гаэа. р
л/моль.
Пример 1.1. В 1 л воды при температуре 0°С и дав.
растворяется JS-I НЛ кислорода. Какие количество вещ
гаш растворяйся в I л воды при упашиНЖ условиях?
Решение.
в литры1 48.9 мл = 4,89 - 10 :л. Производим
; "22 4—
Ответ: и I л валы при и.у. растеряется 2,2 Ю-1 моль гачообраз-
ного кислорода.
Задачи на расчеты по уравнениям реакций
отношения между реагентами, вступающими в реакцию, и
продуктами, образующимися н результат ион реакции. Г>ги количественные
соотношения выражаются стехиометричоскнми коэффициентам!!,
1) массу, количество вещества или объем реагента, вступающего
и реакцию с данной массой, данным количеством вещества или
данным обьемом .(р>1 ню [Ч-аи'ша (см п[шм^р 1 3):
2) массу, количество вешества или объем реагента, которые
нужно дтятьдля по.пчоннч чуланной mh)lli.i. i;i.i:urjii4o количества
вещества или задании! <> оГи.смл лрол>Мн! pl.ikjuih (смг iгример 1.4);
3) выход м[П1Д^]. iii jiLMKiiHM (см пример IГ5).
Пример 1.3. И ислите объем (п.у.) азота, который вегушет в
208^
n(N,)= l/6n(Li).
k(N,) = - = 0,5 моль.
6
Ответ': 11,2 л.
Пример 1.4. Сколько i риччон фосфора нужно шин, для
получения 28.4 г оксида фосфора (V)?
m(P4O,J - 28.4 г I Решение чадачи начинаем 0 составления урав-
1Я реакции:
4Р + 5О, = Р,ОГ„.
фосфора (V):
ци hn;iuo. н |фр
ui ijnM.f|iu|i,i [ V ), i.e. Ktijiir'icL i no iicuiccTBa вступл-
и реакцию фосфора к 'iL'ii.ipi- рам больше, чум кояичеепт
вещества ofipaiyiomcrocH P4O|0:
л(Р) = 4п(Р4О|0),
л<Р) = 40,1 =0,4мо.Ч1..
Для расчета массы вступающего и реакцию фос(|н>ра нужло
воспользоваться молярной массой лого вещества:
т(Р) ■ „(Р) - ЩР),
т(Р) = 0,4-31,0= 12,4г.
Отчет: 12,4 г.
Задачи, прикс юмиые t: иримор.]\ 1..^ ч 1 t. реинн^ся по общему
а.'п орш мч мч!'рми применим ко неем подобным плачам:
1) составить уравнение реакции:
тов. для которого в условиях задачи даны масса или объем;
ьзуясь сгехиочефнческн
l продукта и количество!
IH о&ьем которого требует
i найти по услоЕ
или ripivijkTa. масс) i
задачи:
4) вычислить искомую массу или искомый объем с
использованием ВООТМТепеНнО ИШПрНОЙ массы или молярного объема.
Пример 1.5. Через колонну, заполненную катализатором, при
темперагуре 500 С и ДЕШШШИ 25 МПа пропустили газовую смесь,
состоявшую из 22.4 м'атота и 67.2 м'водорода. В результате реакции
образовалось 8.% л аммиака. Вычислите выход продукта реакции.
(Объемы п
Решение.
7-=500°С
/,-25 МПа
HJJj) = 22,4 н'
V{HA = 67,2 м1
мерены при нормаль
х условиях).
и водорода) ииродук-i а реакции (а
Lpiiic.hiiiiio ni'jV'ku1 iM oriij^Mi.i газов
М«ГрО8 в ЛИТрЫ (1 М3-= 1(Ш0л):
22400
22,4
u(H,)=3n(N,).
uueHMHMHcieMiisML-i pn'iL'LKiix ко">ффиииентов в)ранкснн
из компонентов не содержится в избытке, пот-го\*\ расчет можно
вести по любому и» компонентов, например, по азоту.
пучить 2 моль аммиака, т.о. количество вещества аммиака, которое
теоретически можно получить в результате реакции, и дна paiafionb-
чить теорс
продукты:
Т| =
4 =
тически npi
" (N11,)
"„..„(MIJ
400
2oaci IU
Ответ: 20%.
пои :oiki
ву веществ
«ли 20%.
Задачи пи расчет лииччтой <U
im, Miictiimю .ic.im
ись уравнением
). """ .
/«(соединен и я)
1я доля беаразмерш
ПИ1||<1 и II пинцетах. [
в данном примере расчет протводнлея при
го ни i р.и,1 аммония Рсл.1>,т.1с. Bihi пускаемые
промышленностью, удобрения всегда содержат примеси, поэтому содержание в
них элементов питания будет меньше, чем найденное путем расчета
по химической формуле.
Ответ: 35%.
Пример 1.7. Вычислите m:iccmh\]o ,i"-'ii'> калия {%) н пересчете
П К,О в хлористом калии.
Решен uit
Хлористый калий - это техническое н;ивание ка-
,111141(1111 удобрения, основным компонентом которого
:я хлорид калия КС1. ^>го название сохранилось
ie русской номенк-татуры химических соединений.
Выражач h MiltcoiiyHi долю племен i :i и пересчете \\а его оксид при-
иню в агрохимии и минералогии. Дли того, чтобы произвести такой
пересчет, нужно составить схему превращения оксида калия в
хлорид калия и \равнин, при помощи епкиомпричеекш мпффнциен-
шн число агамов ПЛМ в левой и правой частях этой схемы:
К,О->2КС1.
слслусг пршпводнгь по ура
ш(К,О)= . 100% =
Ответ: 63,\%.
Задачи itu определение химш
li' ti\l J \ I I.IL'l 'I" 1Ю-
hhl^ll'^t.lCH 1 Л IU4'>IK' ||>|Ю Lo LhJiIUMH.I 1 ]i ^ KhHlIIIiV О k LMH1 pVilKIIHH 11.11_" I
речь.
Пример I.H. Какая частица яиляпси химическим жиивалситам
серной khcjioli.i n pcLiKijini ее 1ЮЛНЧ1 ной 1 рал икании?
Решение. Серная кисянта M,SOa- ->iа,двухосновная киоюга. Ее
полная FieftTpLi.in 1;ц[ня :iol imp ;ic ioj. когл.г] ova кагион^ иодород^ и~*
состава ее молекулы в^шмоленсгвумт с тлриксил-тшами. Други-
'.111 i l.'IWIM II II ' 111 -Ь "■- Ш И I |'lI III HI IN 4 К IK I1 ' I |<| |||ЧЧ1|\1МИ| ".Ч . 1И .'I 111
взаимодействую с основанием, ичн.п в избытки, Примером
реакции, в pety.ibTaie которой полностью ниТпралтуется серная кнела-
ia. mii*li i- ijiMin, lv gi<i»iM().wiicifii№ l iii.ipoKcii.li™ naipnu при \с-
лонии, Tin на I моль H,SO, приходится не менее 2 моль NaOII:
HjSO, + 2NaOM = Na^SOj + 2H.O.
Данная [н;ак1|ия относится к числу кнелотио-осиовныч реакций,
в которых эквивалентом вещества является pc.s 11.1..14 или условная
■ШСТНШ, ж в и валентная одному катиону водорода. Частица 1квива-
.icifi на одним) кашонч нодорола. если она pcariipyei как один
катион водорода или вступает в реакцию с одним катионом водорода. В
рисе ми ipn км мой реакции каждая молекула серной кислоты
реагирует шк. 'Ни п|1еакцию вступают два катиона водорода шее состава.
ijnvi4iiiiiem.ini. ее мешша.и-нюм служиi условная, не сущестеуюшая
HIICIIMHM де;1с. 4SC1WUJI 1/2 молекулы M,SO,.
0ИМВШ 1Л молекулы Н^О4.
12
азотной!INO,.хлоровод^ро itn'ii
HC1,>кс_\аюйСИ.СООН,химическим эквивалентом к любой кислотно-основной реакции будет реаль-
кулы одноосновной кислоты МОЖС1 образовываться и вступать в ре-
к числу которых относится, например. I lupOKuii.'i натрии NaOH.
Электролитическая диссоциация i n.ipoKcii.i;! на i [inn описьгвлегч S р.изно
NaOH -»Na' + Oil .
тиопу водорода Н', так как в любой КНОЛОТНО-ОсновноЙ реакции с
зависимости от гого. и кик\ю кис ни ни ас пои нч ю реакцию вступает
■это основание. Однако какая же чаешцг) будлч эквивалентом
гидроксида натрия в любой кислот но-оеновной реакции? В отличие от
рассмотренных выше кислое, которые могут существовать в
молекулярной форме, гидроксид натрия и другие сильные основания -
кристалл ИЧСС К КС HCIHL'L Г IL.I. hi KjHIi I il I |.|\ hi 11 li|H.I\ Hi.' Г Mil ICK^ Л. a Cvffb lO.lh-
ko чередующш-'L я и ст рою oiipi_';ii'.icnno\t порядке катионы металла и
гидроксид-ионы. Для KpiKi.Li 1ичсс1\И.ч веществ вводится понятие
формульной единицы. Формульная единица содержит в своем
составе столько ai омов или ионов, сколько их записано в химической
формуле вещества. Например, формульная единица гидроксида натрия
состоит из одно1 о катиона натрия и одного с идроксид-иона.
Пример 1.9. Какая частица является химическим эквивалентом
гидроксида натрия в сю реакции с ч.юроиодоролнои кислотой?
Решение. Гидроксид натрия вступает в реакцию
NaOH + НС1 - NaCI + Н,О.
Так как в состав каждой формульной единицы гидроксида
натрия входит идии анион ОН', который реагирует с одним катионом
лая единица NaOH.
Ответ: формульная единица NaOH.
Пример 1.10. Какня 4;ieuii|;i ниляется химически»
1идроксида алюминия в ста реакции с избытком x;юpoвo^
л-собой неорганнчес-
■.«,. ..олимер, в ктором нет отдельных молекул А1(ОН). Поэтому в
этом случае ткжа следует говорить не о молекулах, а о формульных
При взаимодейетпии с избытком хлороводородной кислогы
происходит ПОЛН.Ш IK'll I |К1.МИч|НИЧ ill.'iptiKLH.I.I а.СЮМИНИЯ:
А1(ОМ)3 + 3HCI = А1С1, +ЗНр.
При этом из состава каждой формульной единицы А1(О! I), в
реакцию встунаюг три гидроксид-иона ОН. Каждый гидроксид-ион
взаимодействует с од1гим ка шопом нодората. полому эквивалентом
гндроксида алюминия является услоинпи чае-ища 13 формульной
единицы А1(ОН)
Ответ: 1/3 формуи-ной единицы АЦОН),.
Большинство солей представляют собой ионные кристаллы, в
которых нет oi;uMUiH\ mo.il-ksjj. no hums 11 с,1\чле солей также
говорят не о молскуи^, а о фпрмч n.iii.i\ илииимах Клж 1ый катион
металла из сосгана сопи эквивалентен в кислотно-основной реакции
такому тисл) кашолон BCnopQIlfti коюрое равно заряду этого
катиона, олнозаря.тимч капюн Mcia.i.ia эквивалентен одному катиону
водорода, двухзарядный катион металла эквивалентен двум кашоиам
водорода и т.д. Поэтому для того, чтобы сказа 1Ь. какая час Lima oVkjl
эквивалентом соли, нужно ш;чь. сколько катионов металла из
состава каждой формульной единицы соли ааупают н реакцию и каков
заряд каждоп» ii|Vp<.\ii и [юн.ни нею катиона.
Сульфата алюминии u i;io p^.ikhhh l i iix(]ioklii;iom аммония, н
результате которой обра-посн 1 идроксид алюминия?
Решение. 1'еакции. о которой идет речь в условии задачи, олисы-
A];(SO4),+ 6NH,,OH = гАЦОН),! + 3(^Н4);5Оа.
Из состава к;]*Л'>и форм\ ii.ni»iL ^липицы lojh ncivnaior н реак-
эквивалешен трем канюкам но;юрод:!, (.'ледоиагелыю формульная
да. а ее химический жнивалсш )Ю)а\овная частица 1/6
формульной единицы A1.(SO,),.
Ответ: I '(> формучымй единущи Л1.(ЯОЛ)Г
рону.
Прнмер 1.12. Какая частица является экви
пня при era окислении хлорной водой?
Решение. При взаимодействии растворен!
хлорной водой происходит реакция
2К1 + С12 - 2KCI + I,.
В результате этой реакции каж
рон:
21" -2 ё -* I,-
став один иоди.ч-ппн Соединительно, оквива.
пая единица К1.
Ответ: формульная единица KI.
Задачи на ОКрёдвПЯШЙ фактора
И i р;кл:мО1 |uniiin.i\ ih.iiiio npiiMLpi^ii ясно, no фикшор ■/
mutw/nu дня Kitc'ttiin pttiH'ii fUtinini', деленной н<
дорода ui cocnhitui \ит'к\ di Kin1 fitihi 'til"i\l'ui/fiitfii\ в данную
кислотно-основную реакцию.
Пример 1.13. Oiipe.iLMiiiL i|>;ihiop ]kKiina.icimiocTH ортофосфор-
иой кислоты в реакции ее полюй неитрапичации.
Решение. Полная ненфи.пиицин фосфорной кислоты
происходит, например, при се взаимодействии с избытком гндроксида
натрия:
HjPO, + 3NaOH = Na,PO, + ЗН,О.
Из уравнения видно, что из состава каждой молекулы ортофос-
форной кислоты вступают в реакцию три катиона водорода.
Следовательно, эквиваленшм оршфоофорВОЯ кислоты является условная
частица - 1/3 pt:;uiun> cvnict inunmtii М1'.'К'К>л.| 11.PC. а фактор эк-
Ответ: 1/3.
В реакциях нейфаличациис одним гидроксид-ионом всегда
реагирует один катион нодорпд.1 I lo iuims it tit шкопании фактор чкни-
ваъентшктн равен единице: деленной на число /идрокенд-ионив из
состава формульной единицы оенннання. т щупающих я данную кис-
е фактор а
и \jiii|)ono;io|iiviMi>ii Kin
4aHciyii.MgOHCI.
Решение, [i челонии тадачи речь иде] о реакции, которая описы-
Mg(OH), + Hci = MgOHci +1 yx
Mi состав! к,]*дчи фор\п ii.Hlui единицы i идрок^ида mjii пня в
реакцию BCiynaci "циььо один i идроксид-шш, едедокагельно,
эквивалентом гидроксида маг ним является форыулЫВШ елипица Mg(OH>.,
а фактор эквивалентности равен 1/1 = 1.
Д.1Я солей ф<и-.!И'>1< жимы: и'ншшн нш p,/>,t'u <>i)i/niuti'. (к'.н'нпоп ни
прошыч'сние 'и/с i<t клшшошуи пни иннокон) т оншииа t/'itftuv-ibmiit
единицы со./и. '-• t)i\)>ni;imi\ '.. /.htrtni.il/ргакцнт. и itt//*v/H ::ifin-uiiifio/'r-
агиронаяшего катиона (wnt аниона)
Пример 1.15. Oiipt.'ie.Hiti'фактор жнива,1е1гтостн сульфата меди
(II) в реакции i; гидроксидом натрия, и резулышекчгчрой обра^ет-
ся гидроксид меди.
Решение. И уело и и и задачи речь иле г о реакции, которая
описывается уравнением
CuSO,, + 2NaOI I -■ Cu(OH),J. + Na.SO,.
Hi состава формульной единицы сульфлга меди (II) в рСШЕЦйИ
вступает один .'ii^N^ipn.iiihifi книон mcivi. кошрмй реагирует с
двумя гилроксил-поиами и. cjiL'.inMai^.'iMLo. iKBima.iti-iTcii лнум катионам
водорода. Таким iitipa \m\. ((юрм)льная единица этой соли
эквивалентна двум качионам водоро.ча. и химическим жпигсыиигомсоли слу-
житуслопнаячас'1ИИ(1 \>2 ([шрму.чьнои единипы CuSOr Факгорэкни-
налентнчоти сульфата мели (II) в данной реакции равен 1/2.
Ответ; 1/2.
тности окислив |м p;iiiL4ii о/игмичс. .к1 юппои па чис.ю принимаемых
им элекгронов. а факшр жвивилентиосги воп-чановиаеля ранен еди-
Прниер 1.16. Определите факторы жвигмлентнос ги окислители
2Zn + О, = 2ZnO.
Решение. В iron реакции окислителем служит молекула
кислорода, которая присоединяет четыре электрона:
О, + 4ё =2О! .
Следовательно, фактор эквивалентности окислителя равен 1/4.
Восстанониимем ь пой реакции ш^.ыек'я .ном цинка, к^^юрый
Zn-2C =Zn!l.
(.'.1С lOMIe.'NpKO, ф;1КТОр 'КВИ&1ЛеН1ШК| И UOLCI.imiFUITL'.lH p
Ответ.- 1/4 и 1/2.
3(t(Ut4u ttu piii. чет mi> /и/Инги мш - ы iKntitufieiimu
Чтобы вычислить молярную максу эквивалента нужно эн
тор эквивалентности ланнот вещества в данной реакции
ную массу этого вещества. Ироичведеннс двух этих велич
р 1.17. Иычъимн ic мо iHpiivin Miice) эквивалента моиоок-
сида углерода при его окислении до диоксида у!Лерода.
Окисление moihiokch.i;i vi.iepo.iLi I^k^m.IhI \i.nnj>i\i;i (11)| ЛО ДИОК-
еида углерода [оксида углерода (IV)] описывается уравнением
2С0 + О, = 2СО,.
В тгон окиелнтелыю-восстановительной реакции степень
окисления углерода увеличивается с +2 до +4. т.е. каждая молекула СО
отдает два электрона:
СО -2 с-* СО,.
С ледова гель ло. эквивалентом монооксила углерода является
условная частица 1/2 молекулы СО, а фактор жвивалетностн равен
1/2. Для расчета молярной массы жвшш.и'нга монооксила углерода
воспользуемся уравнением:
Z
1.3. ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
Варнаш 1
I ( M
p
г ор*юфосфата к
2. Ра1бериге пример расчета, приведенный в табл. 2.1 учебника,
и, пользуясь ним onpauiovj, определите, в каком огногиенин
находятся между собой массы кислорода, rip и холящиеся на одну и ту же
массу серы ВДНОМВЦДОй'ГрнаюцдвСвры. Какой такон стехиометрии
к i тчмрирует Наш расчет?
1. Вычислите массовую долю (И) аюта в цианамиде кальция.
родной кислоты. l"l\jih она всыпает в реакцию с избытком гндрокси-
данафия?
5. Вычисли к- млырнио масс) -эквивалент;) iилроксила барня в
реакции сю полной нейтрализации.
Нарнант2
1. Какой объем (м1) углекислого rasa обрадуется при
прокаливании 125.1 кгйзмствяо,саде|аж1цн1)ЯЖка|)бояжппшьци*?Овмм
газа вычислить при нормальных условиях.
2. Напишите уравнение реакции i прения аммиака Какими
небольшими целыми числим и ныражается отношение объемов
реагирующих между собой i им и i аюобразных продуктов реакции? Какому
закону стехиометрии подчинимся пол\че В ?
1 Вычнс in к- членил ю;и> no(°i,l k;i.ii!
фате калия.
4. Какая часшпа якляося жвива.чсчиомлиокси шееры вреамш
2 SO. + О, = 2 SO,?
5. Вычислите молярную массу эквивалента ортофосфорной к
ло ты. СОЛИ 0IL1 I'LLI> IUICI II pcriKILIIUl ПО 11Ю11 ПСИ J рН.ИПЕЩИИ.
p
1. КаКОЙ OOl.t'M III > I L lf4]lllMLLl f>H4t4.h"ll I .llol't'H ^MCCII
и кислоро;|а был в'юрван. е^ли н plmv.im.liv реакции иорл'ю
мл жилкой воды?
2. Разберите пример расчета, приведенный в табл. 2.1 учебника,
и. пользуясь зтим образцом, определите, в каком отношении
находятся между собой массы водорода, приходящиеся на одну и ту же
массу азота в аммиаке и i идрачине. Какой закон стехиометрии
иллюстрирует Ваш расчет?
3. Вычислите массовую долю (%) азота в аммиаке.
4. Какая частица является иквиваленюм фосфористой кислоты в
реакции се полной нейтрализации?
5. Вычислите молярную массу -нсвивалента г илрокарбоната
натрия в реакции
NaHCO, i NaOH = Na.CO, + И.О.
(н.у.>, содержащегося в
2. Pacc4HiaiiiL- числи молекул диачша, со.ирА.шшчсч в ] л этого
газа при нормальных условиях. Проведите аналогичный расчет для
днкислорода. Различаются ли между собой полученные Вами числа?
Какому закону стехиоме1рии cootbcicihjiui реплыаш Наших рас-
3. Вычислите массовую долю (%) фосфора и пересчете на РПО; в
кормовом фосфате, техническое название котршо динагрийфосфат.
4. Какая чапвш является эквивалентом гндрокеила бария в ре-
Вычислите молярную массу эквивалента гидрокеi
щи
Zn(OH). * 2IICI = ZnCl.t 2H;O.
1. Какой ooi-ем (л КсроЕюдоролл пылслшен при н шимодействин
в водой 150 г сульфида алюминия? Объем гам вычислить при
нормальных условиях.
2. Проанализируй™ условия задач, приведенных иод номерами 2
в Вариантах № I и 3, Ич каких часгии (молекул или ионов} состоят
вещества, о коюрых швортся в этих задачах? Подчиняются ли эти
3. Вычислите массовую долю (%) фосфора в пересчете на Р,О,
фосфат.
ты в реакции ее полной нейтрализации?
5. Вычислите молярную массу эквивалента хлороводорода в ре-
4HCI + МпО, ■ С1; + MnCI2 + 2Н;О.
Вариант 6
I. Сколько .пирон (н \ ) и.'роЕ1одоро.1,1 нпрл iwii.4 при нчаимодей-
сшии с водой 92,21 г сульфида кремния?
мнана. Какими псоо.и.пшми целыми числами выражается
отношение объемов peai up; louutf между собой газов и газообразных
продуктов реакции.' Каким) икон; стехиометрии подчиняется колучен-
.1. Вычислите массовую долю (%) фосфора в пересчете на Р,О^ в
простом оуперфоофаге.
тую массу эквивалента ортофосфорной кис-
- в реакцию с i п.1роксидоч п.чрия, в резулыа-
III) идроорюфисфат натрия.
2. Разберите пример расчета, приведенный в табл. 2.1 учебника,
и, пользуясь пин образцом, определите, в каком отношении
НАХОДЯТСЯ между собой массы кислорода, приходящиеся на одну и та же
масс\ фосфора в гсксаоксиде тс 1раф<><. фора 8 дск.ипксндстетрафос-
фора. ЕйВПЙзаюв стехиометрии иллюстрирует Ваш расчет?
3. Вычислите массовую долю (%) фосфора (в пересчете на Р,О,)
4. Какая частица является эквивалентом селеиоводороднОЙ
кислоты в реакции се полной нейтрализации?
5. Вычислите молярную массу эквивалента сульфта нагрия в
реакции
Na.SO3 + I, + Н2О = Na.SO, *■ 2HL
Вариант N
1. В лаборатрныч условиях ачот можно получи
НИИ дихромата аммония. Сколько литров (н.у.) азота
ИЗ 126 Г ЭТОЙ «ИИ?
2. Вычислите плотности гаэообраэн!
углерода при нормальных условиях. 11айдите их отношение. Найлн-
те отношение мо.трни* масс iriixiirion CpaBiEiiie полученные Вами
отношения. Раэличаклся ли они ml-ж i; собой'1 ( :ilv!ciкием какою
3. Вычислите массовую долю (Ч) фосфора » пересчете на Р,0, в
диаммофосе.
5. Вычислите молярную массу эквивалента оргофпсфорной
кислоты, если она всыпает в реакцию с |цдроксидомна1рня. вречулыа-
те которой обра 1>си:я гилроортофосфат натрия.
Вариант 9
!. Сколько граммов карпор_\ n.ui M0MHQ получить Ю .10,04 г
диоксида кремния, если выход составляет 75%?
2. Разберите пример расчета, приведенный в табл. 2.1 учебника,
и. пользуясь этим обратом, определите, в каком отношении
находятся между сооой массы кислорода, приходящиеся па одну и ту же
массу хлора в монооксиде дихлорз и диоксиде хлора. Какой закон
стехиометрии иллюстрирует Haul расчет?
3. Вычислите массовую долю (%) aioia в сульфате аммония.
4. Какая частица является 9КВИМЛ№1Ш селенистой кислоты в
реакции ее полной нейтрализации?
5. Вычислите молярную массу эквивалента б ром о водород ной
2НВг + H,SO4 = Br, + SO, + 2H.O.
Вариант 10
1, Сколько граммов диоксида кремния можно получить нэ44.8л
2, Напимшк* \рн|цисиис реакции i премия LL4pi4»uopo;ia. Какими
небольшими целыми чнеллми нырлж.кч^ч (пшзшсЕгис иб"ьсмо1* рса-
гирующнх меж,г1у собой газов и гакнюр.млыл пр<.»л\кюи реакции?
Какому закон> l icmioml-j рии пплниия^чея по. гv чешите Нами
соотношение?
%) нМИ1 ;i li Д!Г.г1\ТМоф0Се.
реакции
С + Н,О(г)—'—* СО+Н,?
5. Вычислите мпляр1гуК1 массу -жвнна-'юнта 1|юсфорноватистой
кислоты, если она вступает в реакцию с гидрокеидом нагрня. в ре-
iv'iihbjne ко горой ъ<6[чн\с1к:ч i иппфосфш пагрия.
Вариант II
I. Сколько граммов карбоната аммония можно получить при
пропускании 112 л {н.у.)у>'№кие;ю1 о ra'ta'iepe-ipiicinup аммиака в воде?
^ 2.npoaiuLitHiip\iiic>i.jioniiM 0.1:1ч. привела t\ под номерами 2
н Вариантах № 7 и 9. Hi каких частиц (молекул или иоиов) состоят
иещества. о которых ГОЮркГО! в них задачах.' Поячшиюпя ли эти
.1. Вычислите массовую золю (%| крнотяяяиэацноиярй воды, со-
lepikiiiueiicn и преципитате.
ссу эквивалента серной кислоты в ре
4H,SO4 + 3Zn = S + 3ZnSO, + 4H,O.
Вариант 12
1. Сколько фаччов mi-i.ii и.||>окси i.i алюминия можно получит!
т 2 моль гндроксида алюминия?
2. Вычислите плотности газообразных аммиака и монофосфин;
при нормальных условиях Пайлигеих отношение. Найдите
отношение молярным масс этих газов. Сравните полученные Вами
отношения. Различаются ли они между собой? Следст
стехиометрии является полученное Вами соотно
3. Вычислите массив) ю долю (%) фосфора в
двойном суперфосфате.
4. Какая частица является химическим эквивэ
углерода п реакции
5. Вычислите молярную массу эквивалента фосфористой
кислоты, если она вступав? в реакцию с гилроксидом натрии, в результате
которой образуется гндрофосфит натрия.
Вариант 13
1. Сколько граммов оксида алюминия можно получить из 2 моль
чеиш.фоксида алюминия?
2. Разберите пример расчета, приведенный в табл. 2.1 учебника,
и, пользуясь этим образцом, определите, в каком отношении
находятся между собой массы хлора, приходящиеся на одну и ту же
массу кислорода в мопоокенде цихлора и диоксиде хлора. Какой закон
стехиометрии иллюстрирует Ваш расчет?
держащейся к дтпишм (лнерфосфате.
H.SO, + NaOH = NaHSO, + Н.О?
2H.SOJ + С = 2SO;+ CO, + 2Н,О.
Вариант 14
1 I "mi ii.m' in i |ion <|>oli|imiu (hi >.l MiM
действии 89 г фосфида алюминия с хлоро
2. Напшини: >|i;iuhciiiii' реакции катал
сида азота (II) до оксида .и,,,., (IV). Какими небольшими целыми
числами выражается отношение объемов реагирующих между собой
гачови гатообрачных продукт реакции? Каком; икон;
стехиометрии подчиняется полученное Вами .-ошношение?
3, Вычисли ic m;(lll>ii\io долюриJ k|imci л.ытационной воды, со-
.k'p.h.iiiicii* м и J]p>4 hiM ^л Ик'фф
yi лерода в реакции
СО + S = COS ?
Вдашп is
1. Сколько.1И1 рои иолчрида (и \ ) можно получигь при
растворении 26.9Я i алюминия в ичбытке х.1«р»нолоролмий кнелотье?
2. Разберите пример расчета, приведенный в табл. 2. ] учебника,
и. пользуясь зтим образцом, определите, в каком отношении
находятся между собой массы водорода, агричвдящиеся на одну и ту же
массу фосфора в моиофосфинс и дифосфике. Какой закон
стехиометрии иллюстрирует Ваш расчет?
3. Вычислена м.кхоичю лолю (a<.l ;iioia н мочевине.
Л. Какая частица является эквивалентом теллуроводородпой
кислоты в реакции ее полной нейТрЫИЗМШИ?
5. Вычислил: молярную массу -жиивалента диоксида серы в рс-
SO, + N.O, + Н,0 ■ H,SO4 + 2NO.
1. Сколько r piiMMHH и.шлшни» npii|K.ii HpDiia.ui с расширим 111.1-
жсила натрия, взятым в избытке, если в результате реакции образо-
шосьЗЗ.б л иодчрпда. оГи.еч миорою MiMcpL'ii мри нормальныхус-
звиях?
2. Вычислите плотности газообразных фтороводорода и хлоро-
июродапри нормальных \ljioiiiih\. Иайдшс их опюшеиии Найди-
;я ли они между собой?
закона с ге\ номе грим нвлисюч но is'iennoc Вами c
3. Вычислите мае to [л ю л*> но (%) фосфора и пересчете на Р,О, в
фосфоритной муке.
4. Какая частица я&тяелен »квивалентом гидроксида бериллия в
Ве<ОН)г + 2HCI - ВеС12 + 2Н,О?
5. Вычислите молярную массу эквивалента уксусной кислоты,
если она Вступает ь реакцию G i идроксидом натрии, в результате
которой образуется ацетат натрия.
Вариант 17
L. Сколько .in г рок Miji;tn:L In > ) можно пол \ чип. при
взаимодействии в водой ~2 г карой ы алюминия?
2. Проанали1ирун1е условия 1алач. иринсл^иных пол номерами 2
в Вариантах № 13 и 15. Из каких частип (молекул и ш ионов)состоят
вещества, о которых иширигсн в ли\ шдинахЛ Подчиняются ли Tin
3. Вычисли 1С массовую долю (%) фосфора и пересчете на РПО, в
ди аммофосе.
4. Какая частица являьчеи жнива.ichidv селенистой кислоты в
H,SeO, + NaOH = NaHSeO, + Н,О?
5. Вычислите молярную массу жвивалента меди в реакции
Си + 2H.SIV СиЗО4 + SO; + 2Н,О.
Вариант 18
I. Сколько граммов метаборной кислоты можно получить ич 2
моль орюборной кислоты?
2.11апишитс \ равнении реакции взаимодейсп пия ионооксидаазота
с водородом. Какими небольшими целыми числами выражается
отношение между оГжемамн реагирующих между собой газов и
газообразных продуктов реакции'1 Каком; закону eiesitoMeTpHH ПОДЧи-
3. Вь|чиели]е маесор> ю до но (%) фосфор*] и пересчете на Р,ОЭ в
обсефторенном фосфате.
углерода в реакции
CO+CL=COCL?
5, Вычисли к- ио'ифнут \
она вступает и реакцию с гид
образуется ГЯДроОуЛьфЯ натр
р
ГюртН! КИСЛОТЫ?
2. Рачбсрите пример расчета, приведенный в гобл. 2.1 учебника,
и, нольчуясь этим ОбрВЗНОМ, определите, в каким отношении
находится между енбнй массы нвдорича. прим'дяшисся па одну и ту же
массу кислорода и виде и мероксидс но;юрода. Какой чакон стехио-
мС1рии иллюстрирует Паш расчет?
3. Вычислите массовую долю (%) калия в пересчете на К:О в
ции ее полной нейтрализации?
Вариаш 20
1. Сколько ли I ров Mtt.iiiaO'у ) чииспо получить m4R r графита?
ла люта при iiopMiu i\ услопи>|\. lliiii.'iirti: их oiношение. Най-
ами отношении IVuiii'iaioic» ли они между toRoi'i? Следствием
каго чакопи L4L\ii4Mrj|iiin типичен [ги.|угснткп II;l\iii csioiношение?
3. Вычислите массоную лилю (%) калия к пересчете на К,О в
львинита.
4. Какая частицаавлястся химическим эквивалентом гидрокеида
льция к реакции его полной нейтрализации?
5. Вычислит молярную массу жишгалетл карбоната натрия в
еакции
NajCO, + 21ICI = 2NaCI + П,0 + СО,.
1. СКОЛЬКО ЛИТрОВ (Н.у.) KIRJIOpiVlil lit. г\ ИИ I 1! реакцию С 107,92 Г
Z Гаificpnгс пример расчета, прии^ипныН в 1абл. 2.1 учебника,
ольчуясь ним u(ipii4t|oM. пиределите, в каком опиошеини нахо-
М ML'ili,l^ LOflOl] M,KnLI,l I.MU.KipaW. ГГрИЧОЛННИКЧ'И ПН IV\II\ IT IV ЯП-
ссу хлора а гексаоксиде дихлора у
а>н стехиометрии ii;i.ik".i рируе! tiam расчет?
3. Вычислите массных hi 1ч.по ("о) а to г л у и.присвой сел игре.
в реакции ВС полной нейтрализации?
5. Вычисли ic чо.щрпчо масс; чкнивалепи 1 илроксида кальция
в реакции сто полной нейтрализации.
Вариант 22
1. Сколько граммов приборной кислоты можно получить из 0,5
MO.lb MONH4)|)IIOii КИСЛОТЫ?
2. Напишите уравнении реакции взаимодействия оксида аэота (II)
ношение оГп.емои реагирующих межд} сиПой i-аэов и газообразных
пролуктоп реакции'1 Ю|ьч.м> «лконустехиомшрнн подчиняется полу-
3.
кали!
4.
yrnef
5.
Вычисли-
il' m:ii;i:ok\iii
Ыой селитре.
Какая ча<
ода и peaк
со, + с
Вычисли
реакции
1
NaOII +
гетрахлорида у
2.
аВар
M|>iuio м:
:тица являе1ъ
= 2С0 ?
ге молярную
HCl = NaCH
массу ЗКВНШЛЙ
И.О.
Иарнаит23
IHTpOli XTOpa 'I'vl nrtrr^Rv'l1
"лерода?
Uip> M 14 VUJIO
19 и 21. Ml ка
вия задач, прим
I в трест
па гидрокеi
ику.тлиио
е на К,« в
>м диоксида
ща иагрия в
номерами 2
р у
вешества, о коюрых тцоршея и ~н и.\ "ta;uiLi.i\'N 11о.1'1и
ществаявлянпен нисгсмппиприческмчи etединениями?
3. ВычнС-imil4 \iacton\hi долю ^по-> k;i;ih4 ii ис[»осчете на К,(5 В
ватистой кислоты, ес.чм о icryiiaei 11 реакцию t шбьпком гилро-
ксида натрия'.'
5. Вычислите молярную массу эквивалента карбоната нафия в
I. Сколько граммов гетрабората натрия можно получить из 24,73
гортобормой кислоты?
диоксида хлора при нормальных условиях. Найдите их отношение.
Найдите отношение молярных масс этих газов. Сравните
полученные Вами отношения. РШШЧЯОТМ ли они между собой? Слелстпи-
ем какого закона стехиометрии является полученное Вами
соотношение?
3. Вычислите: массой) ю ;i.i.ik>(%) фосфора в пересчете наР,О; в
реакции ею
Вариант 25
1. Сколько молей ортоборной кислоты и гидроксида натрия
потребуется для получения 6.58 г метаборача натрия?
2. Разберите пример расчета, приведенный в табл. 2.1 учебника,
и, пользуясь этим образцом, определит, в каком отношении
находятся между собой массы серы, приходящиеся на одну и ту же массу
фосфора r грисчп-фили i4p;u|nKi|ni|i,i илскасчльфилететрафосфо-
ра. Какой закон стехиометрии иллюстрирует Ваш расчет?
3. Вычислите массовую долю (%) калия в пересчете на К,О в
4. Какая частица является химическим эквивалентом
хлороводородной кислотiii, если она всыпает ц реакцию с избытком гидрокси-
5. Вычислите Moirapn>ni масс} жнива, ictrra сероводорода в реакции
2H.S + О. = 2S + 2Н.О.
Вариант 26
1. Сколько литров MonraiKciua ji.icpivia (и.у.) можно получить из
92 г муравьиной кислоты?
2. Напиши к- чр.тнсТшс реакции н1аимодействия оксида диазота
с водородом. Какими небольшими целыми числами выражается
отношение объемон pl;h ируншшх мсжл> собой газов и газообразных
продуктов реакции1' Кикпмч «ihDiij ciexHiiMiMpMH подчиняется
полученное Нами tool шипение?
3. Вычислите массовую долю (%) калия в пересчете на К.О в
4. Какая частица является химическим жвивалсктом алюминия в
реакции его взаимодействия с раствором ги дроке и да натрия?
5. Вычислите молярную массу эквивалента трихлорила фосфора
в реакции
Варишп 27
[.Сколько литров водорода (н.у.) выделяется при взаимодействии
с водой 0.5 моль днборвна?
2. Разбери 1с пример расчета, чрнисденш.ш ь ью.|. 2.1 учебника.
дятся межлл собой массы ичдорода. мрлчодишиск-н на одну И ту же
массу кремния в моноеилано и дисилане. Какий 1акон стехиометрии
и i 1кч.грпр\с1 Ваш расчет?
3. Вычислите массовую долю (%) калия в пересчете на К.О в
карналлите.
4 KlJK.IN Ч.]С I ПЦ.1 ИИ HL'IL'H \HMHLILLLhHM 'MUUU К'П |ч\1 ,НЧ ИЮОП КJIl-
лоты, если она t:u\ и.ит к jK'.ikiihio l и ini.MKoM i Hrj|M>Kcn;ia нафим?
2P,Ha i 7O.= P,Ojnt 4H,O.
Вяриянт 28
1. Сколько литров либорани (и.;.] tropcio. сс.ш п результате реак-
ции in"i]i;min:i.ioLih S4.KI I оксида бора?
2. Вычислите плотности raioo6paiiibix фюра и хлора при
нормальных условиях. Найдите их отношение. Найдите отношение
молярных масс них laioB. Сравните полученные Нами отношения.
Различаются ли они между совой? Следствием какого чакона
стехиометрии является полученное Вами соотношение?
3. Вычислите массовую долго (%) калии и пересчете на К.О в
А. Какая частица является химическим -жвивалептом алюминия в
реакции его взаимодействия с хдороиолпрашой кислотой?
5. Вычислите молярную массу жкивалеша фоефина в реакции
4РН, + 80,= Р^О,„+ 6И.О.
В*рийнт29
[. Сколько граммов аморфного бора МОШО пчлуипьнри аосста-
лошгепии 64.(0 i оксида ''>ора чегалличес
туре 700°С?
2 1 l|Hi,iii;ijimiip\iiiL- \сашин «мяч, iipiint il-hih.ix пол номерами 2
в Вариантах № 25 и 27. Ич каких частиц (молекул или ИОВ») состоят
вещества, о которых говорится в ЛЯХ чадачах? Подчиняются ли эти
щесгва являются ik-ckl\liomi'i ричеикимп соединениями?
^ I4I.I4IIU 1И I <.' M-IlL1>H\ Ю Ю- 1К1 ( " 'I J П U'l lI II Kil N.llliLhUlll I LL.IИ I |llL
4. Какая частица являскн химическим -жпиналемтпм бромоводо-
родиой кислоты, цели она вступает в реакцию с избытком |-и дроке и-
ла пап рии?
5. Вычисли 1С мо.||ярн)1о m.ilc) jKiiiiu.iiLii i Ei фосфора и реакции
Р, + 6С1 = 4PCI,.
2. Hanmnmc >p.inm-nm.- реакции синкча ч.трокодорода ич иро-
тюшение обнУОВ реп нруичних между собой газов и гачообрач-
1ЫХ продуктов реакции? Какому (акту стехиометрии подчиняется
3. Вычислите массовую долю (%) фосфора в пересчете на Р;О, в
1ммофосс.
4. Какая частица является химическим ЯШИНЛМГПМ цинка в ре-
1КЦИИ cm вчаимодейсгиич с \лороводородной кислогой?
5. Вычисли...- м(1.ы|.11\к> m;lli> iKiiiiH.1 11_-11■ it iн.чрокиида калия в
2КОИ + I I,SO4 = K.SO, + 211,0.
2.1. ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К КОЛЛОКВИУМУ
Вопросы пи теме «Скорость химический реакции»
1. Что такое скорость химической реакции?
2. От чего зависит скорое "> химической реакции?
3. Как читается чакон даЙвтцукхШП масс для скорости элемо
тарной сталии химической реакции?
4. Каков фтическим lmi.k.i ьонсышы скороеiи чимиче^кои р*.
акции?
5. Как чишется правило Нант-Гоффа?
6. Что такое энергия активации?
7. Что такое катализатор?
Вопросы по теме «Химическое равновесие»
■ 1,411, I.1IM.I Г.|1ЧМК.:Ч|Ч '
it [фикции Ли Шательс?
5еличении кониентрасщи pcarcuran; б) при повышении температуры?
7. В каком случаи равновесие в реакции с участием газообразных
:ществ не смещается при изменении давления?
Вопросы по теме «Энергетика химических реакций»
1. Что такое внутренний энергия?
2. Какой L>fHi!Cii;(V4Hi.in икон ]1;пьш;ио1 мерным началом термо-
3. На что расходуется теплота, подводимая к системе?
4. Что такое тепловой ->ффскт процесса?
5. Чем терыодомнчеоое урввневив отличается от обычного хи-
ического уравнения?
6. Как выбираю i tiiin.'i.ipi пне иоишикие вещества?
7. Как читается чакон Гесса?
8. Какая функция сое шяння \ираки:ри:>е1 мер\ иероятности того
9. Какая ф\ nhiuiw loi_ ючкия нсклч 111,1 т. М11ЖС1 \о1>1вагь при
само проirs вольны \ процессах к мчкт i м\ системах?
10. Каким образом изменяется энср! ии Гиббса в
самопроизвольных реакциях, происходящих при посюянпых .i:ii^.iCTfiui и темпера-
туре?
2.2. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
В этом разделе объединены весьма разнообразные задачи по
темам «Скорость химических реакций». «Энергетика химических
реакций» и «Химическое равновесие». В темах «Скорость химических
реакций» и «Химическое равнотесие» ключевую роль играет закон
tU-ucmtiMouiru \ии < II химической kiihlihkcoh млражаетзависимость
скорости элементарной стадии реакции ог концентраций рсагирую-
васг равновесные концентрации реагентов и продуктов обратимой
реакции. Представлены также задачи по энергетике химических ре-
Зайачи ни расчет скорости химических реакций
В данном vk'ohom пособии принслепм i.i kvih. и ко юры\ дсмоп-
I I |IHpS С I С Я t.liuk LIM1 а I Ь с I.Opu, J И \ ИМИ li'i I.OH |lk.".i I-. г [11 и О [ НИПЦС1П -
р.шин |icai iipui'innx HL'mcLHi и о] юмнерагурьк
Пример 2.1. Вычислите среднюю скорость реакции
2NO (г) + О, (г)# 2NOZ (г)
НО NO. ec-iii исходили коицсн|р;1цня ион) неutec ma coci;lh iw.ini
[ мол ь)л, а через Юсекунд она сгалг равной 0.2 моль/л.
Решение.
с,(г)О) = 1 моль/л
r.(NO) = 0,2 моль/
Д/= Юс
Оксид уюта (II) является в данной |if.ihiiHH
олним из реагентов. Чтобы найти среднюю
скорость реакции но pcaiuir v и\жно и чменс-
раздептъ на Д/ величину промежутка
"времени, за который произошло это изменение:
несмотря на ее сложный механизм, рассмотренный вучебш
снмоспь скорости реакции or концентраций ганюбрашот i
и парой иола описывается уравнением
Определите, но сколько рач увеличите!
если концентрации обоВХ рМПНПЯ уЪВЯР
Решение.
iii|iaiii!ii pciiiH|)vioiiiHX веществ, I
траций t',(H.) исД!,). После сокращения получим
Ответ; OROpOCTb реакции увеличится в четыре раза.
Пример 2.3. Во сколько рач увеличится скорость реакции рачло-
2О, -> ЗО„
для которой справе
ШеСТЬ рВЭ нужно сжать газ так. чтобы его объем уме
pin. Приемки ии происходит BoipaciaHMe числа моле
[»ч1Гчл:на. го еегьувсличение кониет рации. С
|ui itnipiicTL-i н miiiiiuhiрация ui :■< иаминиц-пча и пом сосуло, i.e.
с,(О)-бс,(Од).
Jlfl» тою ЧТОбЫ определить, ВО сколько раз вичрастет скорость
Заменив в этом уравнении Cj(OJ на &-,(&,). получим
уг к[6с,(О,)]г
v, Ц»(О,)
Следует обратить внимание на то. что в числиюле лро
рую степень вочволится не только с,(О.). но и стоящий
числовой множитель 6.
Раскрыв квадратные скобки, получаем
v, te,a(Ot) '
е сокращения ч
— = 36.
Ответ: в 36 pa's.
Задачи на npaeww Вант-Гоффа
Для решения задач, в ко горы* рассматриваемся за
ости химический реакции от ТВМГИрНУры, МОЖНО щ
атематическим выражением правила Вант-П>ффа:
где v,- скорое и- реакции мри eiiwuuiciiiioii icMin-Lp,ir>'pe T t v —
скорость реакции ирн исчолисн! io\nicpiii\ fie /г Л/' разность
температур 7; - 7*,, в -т«-м[п.-|>;(гуриый ко 1ффицис1тг скорое m реакции.
Пример 2.4. Ни lkc и,ко р;н ноччк к-i cKt>pOi:n. pt-акаии при
повышении теышзрШ) ры с 20"С до 40*С, если температурный
коэффициент скорости реакции равен 3?
i ражен ис правила Вакт-
шерагурного коэффициента скорости
-1=3 "> =>-=
Ответ: в 9 раз.
Пример 2.5. На сколь
чтобы скорость реакции ;
коэффициент скорости ре;
11 одсга(
градусов нужно повысить
выражение правила Вант-Гоф-
1П0ВЫВ 9НВЧ0НИ1 отношс-
1турного коэффициента скорости
8 и 2 можно найти при помощи
.зовавшись iipiu рамчой «Кальку-
лантисс десятичных ло1арифмов. Подставив в
ые значения логарифмов, получаем
0,903 = у£ 0,301.
Решаем что уравнение ошосительно AT:
лг~<поТ |0~30-
Ответ: на 30".
Пример 2.6. Вычислите температурный козффнщинг скорости
реакции, если при iiimMMiL-jiHii luMiicpjiApin n;i 04 LKnpocTb реакции
ПЭрОСМ и-1000 pal.
Решение.
'' 4000 I Подставив в магематическо!: им рижские правила Вант-
1', I оффа донные в условиях задачи чиоловые значения от-
ЛГ Ы)" ношения скидюсгий » р.чиюсги leMiicpuiyp. получаем
У~ I 4000 = 7-'" =У-
таскорости реакции:
у= V4000.
Для того чтобы осу
овать это урахивйЙК
у= 10°™=3,98.
Ответ: 3.98.
Задачи mi расчету равновесных концептрш/ип
и констант равновесия
Для решения ЗЯДП этого типа необходимо хорошо усвоить НК0П
;iliii i кч кицм\ маис i 1ч xmmm'illk^h о ]\1и>юаесня.
В условиях таких чадач. как правило, содержится много ЧНОМЬ
выхзначский концентраций peaitiiuin и иро.г>'ктон реакции. Прнотом
следует различии, исходные с и р;ичiopit:i;ni>iin < Koi][[LLiiip;iriiiii
рЫС ИМеЛИ МСС 111 I! [H.'JKHMOIIIHlli llSIllCH ДО ИП'1.1 I I И|" ■!■ I ШИН ||;.ч.|,ч|
начальная кошгешрлшеч mmcl'i елмосбольи
в результате протекания прямой pc;iKi
it (рис. 2.2),
Следует подчеркнуть, что в ;
такие задачи, в которых исходны!
стоя! только Hi plmicfi ioii. формч.11.1 мчорых ^ши(;ц[Ы в левой части
уравнения реакции.
Равновесные концеш рации по копнет рации тлцеав в
системе, в которой установилось мимическое рак&говесис Мри ностоян-
Учитыван большое число шаченнй кошieiпрении, условии
задачи И ХОД се решения ),юбнп нрсдшавлитьи виде laijjimihi. в столбцах
которой указаны концентрации каждого из реагентов и продуктов
реакции, а в строках-типы концентраций. При ЭТОМ В ОДНОЙ из строк
таблицы целесообразно записывать разность исходной и
равновесной концентраций, т.е. количество вещества, израсходованное в
единице оГи.ема, например, в 1 литре: с - с - с .
Пример 2.7. Мри течиiqui4p,. 11)00 I, pjumoiiccnt и реакции
2SO,+ O.^SO,
установилось при слел> киши концентрациям диоксида серы 6,8
ммоль/л, кислорода 1,2 мноль/.i. триоксида серы 4.0 мчоль/л.
Вычислите исходные концентрации диоксида серы и кислорода.
Триоксида серы в исходной газовой смеси не было.
I'l-iut-iiiti: i.iiunri v ;.i i. r.i i ..i i.:',ii h mi ic i:io niui.i
|
llip.uv^ ювано в e.iiiiiiiiie ооьечи. ,
Найти иехоли\ ю KoniiL'HifMiinho кал.лою us ptjHLHi
сложить равиоиесичм юпцги i p.min^i с и ко.щчеспю вещес
Щ|мс\о;[ованпое в с 1Ш1нце оГи.ема с . Для \ою, чюГн.| найти
моль 8Ог0брачуется из 2 моль .SO,. Следо
кгтн (моль) образующегося триоксида серы ранно количеству ве-
ciBii {MOniit) ветугжвшеЕ о в (>еакцию диоксида cepjii 1ак как в со-
оянии равновесия в каждом литре газовой смеси содержится
mmoiiIi SO,, то на их образовании нфас\одовано 4 мчоль/л SO..
Там образом, в исходной смеси содержалось 6,8 + 4 - [0,8 ммоль/л
ля кислорода. № уравнения
ь SO, расходуется 1 моль О,,
(оль) образующегося триок-
сида серы в два рата больше количеста нсшсства(моль)
вступившего в реакции: кислорода. Поэтому на образование 4 ммо;]ьЗО1потре-
буется 2 ммоль Оп. Orcuvi;i ис\одп:и концентрация кнслирода. рав-
нтрации и количш; i ка нациста, трас-
Пред
I'm,",',',
тавим решение задачи в
„дсгЛ
SO,
10.Я
4,0
6,8
ПО
-.1 .,
О,
зд
2,0
1,2
на
1 so.
0
0
1.0
Ответ: исходные мчи попрании uvi.iiuh.im: SO, I (I.Я \ivint
О,3.2ммоль/)].
Пример 2.8. В реакции синтеза аммиака
исходная кош|омгр:щин:|!тасос1анл1ша 1(1 моль/л, исходная ко
центрация водорода рлимнлао, ,1(1 mojh,/,i I'^inironecite установило
при коннеш рации иммипк». равной IS моль/л. Вычисли re равнове
ные концентрации aioia и водорода, най.ште числовоечначениеко
Израсходовано в
Равновесные. сш
ие объема. t-NT
Вешчп
|
Ml,
IS
Равновесные конценграпии реагентов можно найти к:
полных конш
шнице объем;
1. Израс
ции аммиака. Из уравнения реакции видно, что на образование 2
аммиака расходуется I моль азота, т.е. количество вещества (i
вступающего в реакцию азота в два раза v
пь) образующенкя аммиака. jIo-jtopv
NH5израсходовано 9 моль/л aiora. Раы
равна ^.(N.l-c^fN.). т.е. 10-9= 1моль/л.
Аналогично находим равновесную концентрацию водорода. Из
уравнения реакции видно, что на образование 2 моль аммиака
расходуется 3 моль водорода, т.е. количество вещества (моль)
израсходованного нодородл к -'■'; р;пя Гммынц колнчесшл вещества образовав-
израсходованного в единице обьеча. i-_.,( II.) равно 3/2 ■ 18 = 27 моль/л.
Отсюда равновесная копнет р.щим ко юро м [типам рашостис (Н,)-
-скя,(Н,), составляет 30 27 = 3 моль/л. Представим теперь решение
задачи i^ пиле таблицы:
Кониентрац
Равновесные, а
е объема, е^
N, Н,
10 30
9 27
1 3
|
Ml,
0
0
IS
овееные концешр.шми ренинов и продукта
1СОбходимо г;лииеап. ;мя реакции сиккеза ам-
: выражение констангы равновесия в соответ-
действующик масс:
нтраций,получаем
Отпет: ранновесиые копией i рлшш paitiIi>i [N.J = I моль/л. [Н?] =
1 mujil/ji, константа рашювееия равна 12.
Пример 2.9. В гермегично :;жры1ыи рслюнюинмй сосудвмести-
ociMO I jiiiOMCcni.TH I ммод], hio.u)|ik\'i^Mi ! mmi'.ii. пила, сосуд иасре-
|и до ■J48DC lL'\i\ *)}.[*■ i р.ншм i i.ch piiiiiioiieLiii.i^ концентрации всех
Ни I, ^2Н1
i]hi укачанной температуре равна 50,53?
Ill
не. Прс,
Конце
ые, cfm
ставим условия за;
ининс объема, сы№
1411 |, К
II
i к- I
1
1
in
1
III
0
0
й водорода и иола вимш юн реакцию нам
неизвестные количества вещее i на. и (расходованные в
единице объема, обозначим х ммоль/л. Тогда равновесные
концентрации водорода и иона можно обозначить (\-х) ммоль/л. Из уравнения
реакции следует, та) из 1 моль иода н I моль водорода образуется
2 моль иоловодорода, i «. количсс-iи» нищее)на образующегося иодо-
водорода в Дна рази 5о!гыие. чем катчич по нещеспи нсгупившег'о в
реакцию иода или водорода. Поэтому, если в реакцию вступает
дгммоль Н, или!., то образуется ZiMMOJiblll. В виде таблицы резуль-
Равновесные. (^
Вспи
II. I,
1 1
-А 1 -V
1
N1
0
0
Найти число Bin
анты равновесия
Попел
через
шив в
(2
[I
о уравне
После преобразований это уравнен
(4 - XV +2Кх -К = 0.
Подставляем в него числовое значс
Это квадратное уравнение, которое в общ
Оно имеет два корня:
щ -b±4b! -4ас
Находим корпи квадратно! о уравнения.
_ - 101.06± УЮ1.О6: - 4 46.53■ 50.53
*«■ 2-(-46,53)
х,«0,78и^- 1.39.
Корень .t, противоречит условиям задачи и должен быть отбро-
Таким обраюм, равновесная концентрация иодоводорода 2х =
- 1.56 ммО-Чь/л. a paitmniLLNihU.' Minni;iiip;mmi пола и водорода,
равные 1 -Ж, составляют I - 0,78 = 0.22 ммоль/л.
Ответ: [HI] = 1,56ммоль/л.[Н.] = 0.22ммоль/л,[Ц =0,22ммоль/л.
Задачи на принцип Ле Шателье
Как правило, чадачи на принцип Ле Шпени W вызывают ЗП-
руднений, если хорошо усвоена соответсгнукицам теория. Следует
голыш обратить внимание на знак тепловою к|>фекта реакции. Вюш
Д//р.„ин|1 меньше нуля, то реакция идет с выделением теплоты, т.е.
И1ч iне]<_я жю1с|1мичсско11. I'.c.m -\ll Гн1 n.iikl н\;1я. 14* реак1|ия
i i II |р,>МО/К 1,11' I i':l rli и ЮН!С1 IIK'M 11 LI u> I LI II mii jmc i c;l II 1Д'11 lLpMII4L-
СКОЙ
Пример 2.10. R каком направлении сместится равновесие уепк-
NJj) + ЗК(г) i± 2NH,(r); Д/Г = -92.4 кЛж
мри повышении температуры?
Решение. Огрицапельное шачение теплового аффекта реакции
сиидшедьствусппом, чк> пряма» реакция -эк чотермическая. юееть
1|Щр11вождается выделением теллепы. Отвечая на поставленный в
шдиче вопрос теплоту >лоГжо р^имшрикеть как один ш продуктов
рОШШН. I* соответствии с принципом Ле Шагелье равновесие сме-
ВЩТСЯ в паправ-чепии той ич нчаимно пршивоположных реакций,
нее воздействие состоит в повышении температуры, т.е. увеличении
количества iciltoHiI в ciicii:\il\ io для ослабления этого воздействия
равновесие должно сместиться и сторону той реакции, которая
сопровождается поглощением теплоты, т.е. эндотермической реакции.
В данном случаи жди кармической является обратная реакция -
реакции разложения аммиаки. Поэтому при повышении температуры
рикжшесиц CML-LtiucH влепи, в строи) обратной реакции.
Ответ: раннонссис сместится влево.
Одна ИЗ важнейших целей иэучения обратимых реакций - это
выбор условий, при коюрых равновесие в исследуемой системе
смещается в желательном направлении. В химической технологии стре-
мятся достичь наиболее полною превращения реагентов в продук-
ния этой цели необходимо выбрать 1акие условия протекания
обратимой реакции, в которых в состоянии равновесия количество веше-
ства или концентрация арощукп реакции будут наибольшими, а
количество вещества или концентрации реагентов будут
наименьшими. Осущесiми11. imffflf) ПКНХ человий на качественном уровне
помогает принцип Лс Шагелье.
Пример 2,11- Увеличится ли выход продукта реакции
N,(r) +3H,(r)^2NH,(r); Д// = -92.4кДж,
если понизить температуру и повысить давление?
Решение. Прямая реакция является экзотермической {АИ < 0),
поэтому понижение 1смпсрагуры UD0NI смещение равновесия в
сторону продукта реакции Вследсгвие повышения давления равно-
приводит к у'чен|гшечи1о числа mo.'ickvi (очмм^ С1е\иометрических
коэффициснюи h icHinr 'i.iL i и ч р;тмсмик реакции I + 3 =44а в правой
части уравнения cK'MiostL ■ римч-скии ко пифииih.ii i ранен 2,
следовательно, и суммарное число молекул азота и водорода, вступив! и их в
результате реакции) Глкимобргмом, и понижение [смпературь;и
повышение давлении ш,1 H.mnioi \ исличеиис равновесной концентрации
прОЮКП реакции - аммиака, то есть увеличение его выхода.
Ответ: да.
Задочи nt> ншр.-епшке химических реакций
В данном пособии приведены шдачи двух типов. Задачи первого
типа призваны сформироил!, навыки расчетов тепловых эффектов
реакций, изменения энтропии и энергии Гиббса в результате реак-
I) £№„„,„, ■ ЦД/У^продукты)] - ЦДЯ°, .„(реагенты)],
где ЦД//0^,! продукты)] - сумма стандартных молярных энтальпий
образования продуктов реакции, 1[Д//"/пта(реагснты)| - сумма
стандартных молярных ЗВТВЛЫШЙ образования реагентов;
2> ^„И1 ■ ^"(продукты)] - 1[5°(реагснгы)],
где Е[У( продукты)] - сумма энтропии продуктов реакции.
E[S°(реагенты)[ - сумма эшропий реагентов;
3) МГсашщ = ЦДО^продукты)] - ЦАСГ„(реагенты)],
где I[AO"°JVJl(продукты)] - сумма энергий Гиббса образования
продуктов реакции, Z\A(i°l „„(реагенты)] - сумма энергий Гиббса обра-
При суммировании следует учитывать стехиомифические коэф-
фнниенты перед формулами реагентов и продуктов.
данная реакции жиисрмической (ДЯ°т-ц1|11< 0) или эилотермичес-
Прнмер'2.12. вычислите тепловой эффОП реакции:
2NO(r) + O,(r)-2NO.(r).
Является ли данная реакция imoitrpMiriL-LKOii 11 111 ш.ипермнче-
ской?
Решение. Тепловой тффект ттой реакции можно рассчитать при
ПОМОЩИ уравнения
в котором ciaiu.ipi ш.и1 ш i.i 11.11 ни ml-iii^ 1 и п.ц i n\ ioiilii\ и jhl;ikiuim,
утюжены на стеюкшвгрическив коэффициенты, сшящие в
уравнении реакции перед чимичсекнчи формулами этих веществ.
Необходимые щи расчета значения стандартных молярных эн-
иисьпий обра[онл11[гм ohLii urn люта можно найти в приложении 1.
Дчя монооксида аэота ЫР^ОЮ) = 90,25 кДж/моль. дл
auira Д//°,^(ЫО.) = 33,0 к/$к/моль. Для простого вещест
рода ДН°,^(О;) = 0 кДж/моль. Подставляя эти значения в
\ [шипение, получаем
u//°mii_n = 2 • 33,0 - [2 ■ 90,25 - 0] = -] 14,5 кДж.
Ответ: -114.5 кДж. реакция жмчермическая.
|з|>Г1Н*-п-|ИМ Л IML'IK'HHC Ml I piKtllll H plL l\ I M ,11 с pc'.lhl jHII. МОЖНО Б
данная реакция ii|ioick,iu, самоирштолыю п изолированной
системе. В изолированных системах, т.е. системах, которые не могут
обмениваться с окр) и,juitituii средой ни веществом, ни энергией,
самопроизвольно uoryi иршекать только тс реакции, в ходе которых
энтропия возрас raei.
Прнш-р2.1J. liu'iHuiiiii: iismuii-iiiii: пицщннп рек м.;атереакции
Н,(г) + С1,(г) = 2НС1(г).
Будет ли пи релкцчи нро1ск<ш> еачопроттмыю н
изолированной системе при давлении 101.3 кПа и температуре 298,15 К?
Решение- И iMfiifimc имропин h pi; iv. и.г liiс ной р^чжции можно
p.lL L 'ГИ [ 11 I I. I I|II1 IK1M1>1IU1 ^ р<ШНСНИЧ
в котором craH^'i'ipTMi.io имpumni истерт \miioai-hki мл стсхиомет-
рическис коз()|ф|1111|1;1|Т1'1' ИИЩИЯ в уравнении реакции перед хими-
Необходимкк' ии р.ючск! течения i: i.im i.ipi \\\.\\ >шропий
можно найти в приложении I. Для хлор"водорода S°(MCI) = 186,8
ДжДмоль ■ К); для водорода S=(H.) = 130.5 Дж/(моль - К); для хлора
S°(CI.) = 222.9 Дж/(моль ■ К). Подставляя ям значения в расчетное
уравнение, получаем
iy),»™- =2' '86,8-[130,5 + 222,9) = 20,2Дж/К.
виях может протекать самопроизвольно, г к ДЛЧ > 0.
Ответ: 20.2 Лж/К, да.
Расчет изменения энергии Гнббса и pewiLiare реакции потоля-
СТ сказать можеч .[И слмолр1М1 м^п и, но iijilhulk;h i. .Lnini.iu реакция при
постоянных давлении и температуре. Если ДО"° <0. то такая
реакция при постоянных давлении и темпе рагу ре^можст протекать са-
мопрои1вольно. Однако при проведении термодинамических расче-
ТИ1Са]|ва1№10Ю1 помнить, чго полученные результаты творят
только о принципиальной ночможности нрогекания реакций, но ничего
\к шпоря 1 оГ> "\ LKopocra.
Пример 2.14. При давлении 101.3 кПа и течиера^ре 298.15 К
lu.i'iiiiMini.' и tviL'MLiiln: HicpJ Mil I !и'Гч|1 " [^епкЦИИ
Na,O (к) * CO, (г) = Na;CO, (к).
Может ли rn;i реакции Hpnick.nih taMoirpiin ino.u^io n |тсизо-г1иро-
ванной CHC'ieML- мри \ k.i t.nnii.i\ условиях?
Решение. И iMi'iiciihi.* mcpi ил J iioucli h pL ^.ii.iaic >n*ii реакции
можно рассчиммн при пимощн уравнении
Л(;°и - AG"f ,4K(Na,CO,) - [AC^INa^O) + Да°/Ч!(ССу].
Стсхиоме! ричч ми1 hiHffi(jnuiiicif f м 11 vравнении 4mmhlillck>hi
реакции рлпны единице, но1 и ому 11 р.ючотчм *. ран ионии п'['с\ icirvioi
множители перед обаЭНачвНИЯМИ стандартных молярных энергий
I nooi-.i .inixumiiiiiiiN рс.-немши и проект реакции.
Необходимые ДЛЯ рвОЧвТа ЭНВЧвНИ! стандартных молярных
энергий Ги№са можно найги в приложении 1. Для оксида натрии
Ю"пщ(Нар) = -377.1 кДж/моль, д.'.м ДИОКСИда углерЧШ ДС°ггея(СО;) =
= -394,4 кДж/моль. ДНЯ карбоната натрия Aff^Na.CO,) = -1047.5
кДж/моль. Подставляй гппначеиия в растетноеуравнение, получаем
Д(;°р,„- = -1047-S - 1-377,1+1-394,4)] = -276,0 кДж.
■>га реакция может протекать самопроичвол ьно, т.к. ДО" щ < 0.
Ответ: -276.0 кДж, ла.
Задачи второ! о гииа посвящены расчетам ичменения энергии Гио-
без в результате реакции ДС° . исходя из известных значений
теплового эффеюпрслкнинД/Г^^ и изменения энтропии АУ^.^.
В этом случае для расчета исполы) ют уравнение
Это же уравнение ночволяет оценить влияние температуры на
^°pci.ii«. (в та"их случаях, как правило, пренебрегаю! небольшим
изменением АИ0^ и ДД*,.,,.,.. в зависимости от температуры), а
|акже влияние )tiia.4i,iiiiiini4.> А1Г>^ и энтропийного - /АУр,,.^,,
вкладов в числовое значение изменения энергии Гиббса.
Пример 2.15. При давлении 101.3 к11а и пемпора.уре 298,15 К
пычислшв изменение inept ии ГиОПса к piMVJihraic реакции
N1 I,NO,(k) = N;O (г) + 2Н,0 (г),
еели ДН0,,,,,^ - -36,2 кДж и &?„п,т„= 446 Дж/К.
Может ли эта реакция протекать самопроизвольно при укаэан-
НЫХ выше условиях в пси нитрованной системе?
Решение. Для расчета воспользуемся уравнением
дс;°к, - ля",™,™, - 7^1)'°К1„,И_-
Перевсдсм АГ НЗДЖОУЛСЙ на ке.чьвин в килоджоули на ксль-
вин: 446 Дж/К = оДмхДхЯС и подставим в это уравнение данные и
UGV™." "-36.2-298.I5 '0,446 = -169,2 кДж.
Реакция может протекать самопроизвольно, т.к. ДС° ^^ < 0, но,
тем не менее, нитрат аммпПия существует при обычных условиях.
Эта соль нарялу со многими другими соединениями азота
неустойчива термолиш1чкчсски. нпустйчина киештически.
Ответ: -169,2 к Л ж. да.
Пример 2.16. Вычислите изменениеэшртй Гиббса в результате
реакции
Fe.O,(K) * ЗС (графит) - 2Fe(к) + ЗСО(г);
при давлении 101.3 кГ1а и двух температурах: а) 25°С (298,15 К) и
б) 800Т (1098,15 К). При какой юэтнхтеыПфпур реакция может
протекать самой рот вольно? Для -ной реакции Д"0,,^,, = 550.5 кДж,
ii5^- 542 Дж/К.
Решение. Для рнючо*! MOLiio-И'Пемся уравнонием
Переведем iS°mi<iiii<Hi джоулей на к«львим в килоджоули на кель-
вин: 542 Дж/К = 0,542 кДж/К и вычислим сначала энтропийный вклад
в изменение энергии [Ъббм при температуре 25°С (298,15 К):
-?ЙД° - - 298,15 ■ 0,542 = - 161,6 кДж.
Очевидно, Ч1О при ж>й температуре энтропийный вклад по абсо-
ди°«,.„. = 550>5 — I б I .G = 388,9 кДж.
Итак, при температуре 25°С реакция не может протекать
самопроизвольно, т.к. UG0^^ * 0.
Теперь вычислим тмепснис nicpi ии [ ийГка и pen.ibiare
рассматриваемой реакции носе мнои.чемии oki:h;i;i жь.мсча (III) коксом при
температуре 800°С (1098,15 К), пренебрегая з
дс°и„,-. ■ 5SO-S - 1098.15 ■ 0,542 = -14,7 кДж.
При этой температуре энтропийный вклад -ГД5"
- - 1098,15 ■ 0,542 = -595,2 кДж но абсолютной величин* больше,
ции имеет oipm luck.мне шлч^нио. чичнn.iciu и.<. i h\ci о возможности
само произвольного ирспекання |*ЩГ||ЦИ при -nuii ючпературе.
„,...j) при 25°С ДС°рг„1,„ = 388,9 кДж. реакция сачопрот-
нротекать не может; 6)"при 800°С 6ХР шт = -44,7 кДж, рсак-
23. ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
Варнянт 1
1. До начала брожония в 1 Л НШ01 радногч еуОЛв содержалось 4
mi растворенною кислорода, спустя 73 часа после начала брожения
содержание кислорода уменьшились до 0.9 мг в ним же объеме
сусла. Вычислте среднюю скорость реакции потребления
растворенного кислорода в процессе брожения в ммоль/(л * час).
2. Во сколько pai увеличичеи скорость реакции при повышении
температуры на 4(1", tt.Di re'.niquijivii.iit ко i!|kjihiiiii;ht скорости рс-
:h,uii» равен 2,5?
3. Равновесие в системе
уетановилос!, при c.ilm\!iiiiiii\ кпищчи рациях: |N,| "6 моль/л, [IIJ -
18 моль/л, JNH,1 - 8 моль/л. Вычислите консынту равновесия и
исходные концентрации итога и водорода. Аммиака в исходной гачовой
СМеСИ не было
4. В каком направлении сместится равновесие реакции
2SO,(r) + O,(r)^2SO,(r); ДЯ=-284кДж
а) при uopii.ii не и и и ic4fiic|Km |4,iL п) при \i;c нгичищ oi>f.cm.i''
5. Вычислит тииловой эффект реакции:
К,0 (к) + СО,(г> = К,СО,(к).
Нар и a in 2
I г Фосфорная KJituoia, получаемая жеi p.iKuin jiiiihiM методом,
содержит мною примесей К чме.п наиболее вредных in них и пол-
скорость процесса дефгорироваппн >м. i р.наиюнпин фчофориои
кислоты в моль/(л ■ ч). если n;i'u 11.паи каином ipannя фторидов
составляла 0,22 моль/л, а через АО минут она уменьшилась до 0.12 моль/л.
2, На сколько i p.i i\cob тжно поиметь icvnepanpy. чтобы
скорость реакции возросла а 27 раз, если температурный коэффициент
скорое in реакции ранен 3?
3. И герметично шкрмгыи сосуд вместимостью 1 л поместили 0.1
моль печталлорида фосфора. 11р« нагревании до тжоюрпй
температуры 50% HC4it, и mi о ко.чнчсс1 пп iiL'iuax.iojui i;i i[hk"^k>[i;l разложилось
н установилось равновесие:
с ком пен i |i.iinm iiciii,i\ K'jin.ia фосфора и
продушов рсак1|ии, :\ также константу равновесия.
4. В каком iMiip.m leinih lмесится равновесие реакции
С (графит) + СОг (г) i± 2CO (г); ДН = 172кДж
а) при повышении температуры; б) при увеличении давления?
5. Вычислите изменение штропии для следующего процесса:
С (i-рафит) -> С (алмач).
Может ли он про ratal ь самоирои! вольно и изолированной
системе при давлении 101.3 к11а и температуре 298,15 К?
ПаркинтЗ
1. Начш ач гаорость реакции 2NO (г) + О, (г) >= 2NO,(r)
составила 0.03 мо,1ь/(д с) Ътсм реак||шнп11.1й|>|]ьем>мены11илив2раза.
Опреде^жте повое iii.nehiin: li.<>|iol hi i^rahiuiii. l'cjiit >K4:iiepvniehi ja:u.-
но установлено, что laBiituMoLi i. lkojiol i и f>^.iMiiin от концентраций
реагентов описывается уравнением
v ■-- k;(NOMOJ.
2. Вычислите Teunepai>piii.iii ЮэффНПИВ] скорости реакции, если
при повышении температуры на 40"С сескоросп. Boipaciaer в 16 pal.
3. В герметично чакрыгом сосуде при температуре 448°С
происходит реакция СИПОМ иодонодорода
НЛг) + [,(г)^ 2Н1 (г).
48
а) при п
5. При д
СКОЛЬКО МО.ЮИ НОЛОрОДЗ [1рМ\ p
емеси на 1 моль иола, се;Iи равпонеснсускшоиилос!.. koivia 90% иола
превратилось is нолоич i.'po у'1 Кшк мша рпинонилтч равна 50. Иодо-
во;юрода в исходной смеси не было.
СО(г) + 2Н,(г)£ СН5ОН(г); ДЯ=-128кДж
нии давлении, б) при понижении температуры?
р и 101,3 кПа и температуре 298,15 К вычислите
изменение энергии Гиббса я результате реакции
я которой справедлив» уравнение v = k-(N()X'(O,),ee;in увеличил,
авление в сосуде, в коюрпм turn прочекаеч, н 3 раза?
2. Во сколько ра!>«с.|]ичится скорое ihpviiKiutn. если температура
овышается с 200до250°С, а темпераг>рный кин|]фицне1П скорости
еакции ранен 2?
3. В герметично-(зкрыюм сосуде происходи! чбрлимая реакции
равновесия ЩЯ которой равна 2. Вычис
Iрацию кислорода, если раиионест.к- ко
] - 0,01 моль/л, [N0,1 = 0,02 моль/л.
Н, + |,^2Н1; Д//=54кДж
При давлении 101,.! к! к и к-миера.уре 2'»К. I 5 К вычисли!* ише-
niepi ни 1 иббеа и розультаге реакции
|
1. В технологическом процессе получения шампанского в момен i
добавления сахара н дрожжей в 100 мл вина содержите» 0.-1(1 mi fa-
створенного кислорода, через сутки его содержание уменьшается до
0,22 мг в том же объеме вина. Вычислимо срелинно скорость
ассимиляции расторжимою кислород.) и ччо.ц./(л ■ час).
2. При температуре 120°С скорость реакции составляла
2 ммоль/(л - мин). При какой геммиратуре скорое п. реакции cianci
равной 1 8 ммо;1ь/(л мин), если температурный ко )ффицнент
скорости реакции равен 3?
установилось при с км>ющи\ кчпцгмгрпминч: |N,1 = 3 ■ 10"ямодь/л,
[Н.) = 2- 10-'моль/л, |NH,j = 0.1 моль/л. Вычислите константу
равновесия. И каких единицах она измеряется?
4. В каком направлении сместится равновесие реакции
СНДгИ Н,О(г)^СО(г) + ЗН:(г); Д//=206кДж
Я) при ТЮИЫШСПИИ L.IH И'ППЯ. О) lipil UOI1P.III1CMNI1 IL4MC|^1]Ч р|,Г'
5- Вычислик- геллоаой ?ффск1 реакции:
2SO,(r) + 0,(r) = 2SO,(r)
Ч
1г Для про"1с-'к;ш>1ц|_'и> в растпорс н'4аимодеЛс1ння иодид- и 1"ипо-
клорнт-ионов:
Г(р) + ОС1 (р) =С1 (р) + О! (р)
справедливо уравнение v =Ди(1 )с(ОС1). Во сколько раэ уменьшится
скорость ЭТО11 piMi.Mnn. oejii p.i |Г>л1ти I i. рлегнор minoii is два ра^а?
2. При повышении температуры с 78°С до 92°С скорость
реакции увеличилась в S раз. Вычислите температурный коэффициент
скорости реакции.
3, Константа равновесия реакции
Fe2O, (т) + ЗН, {r)J± Fe (г) + ЗИ.О (г)
при температуре 3dO°C равна 0.064. Вычислите равновесную
концентрацию воды и исходную концентрацию водорода, если равновесная
50
концентрация полпреда cot laium-i 0,02 Md.ib/.i. Паров воды вначале
реакции не было.
4. В каком направлении смесился равновесие реакции
СО(г)+Н;О(г)^СОл(г) + Н;(г); Д// = -41 кДж
а) при повышении температуры; б) при понижении давления?
5. Вычислите изменение энтропии в результате реакции
SO2(r) + 2H;S<r> = 3S (ромб) + 2НгО(г).
Вулет ли 'i\a pi_-;iKiuiw HfHiitLK;n ij c.iMOiipon июльно в и uuiHpoimii-
ной системе при дапленни 101,3 кЛа и температуре 298,15 К?
Варив г 7
1. Скорость реакции
2NO (г) + Н;(г) = N,0 (г)Ч Н,О(г),
для которой справедливо уравнение v=ic2(NO)c(H,), равна
1,2 MMo:ih/(jj ■ с). Hh[4iiLj]inc копе i аи гч ^kojujciii ной реакции, если
концентрация мопоокси.ш ачога равна 1,2 ммоль/л, а концентрация
водорода составляет 0,37 ммоль/и.
2. Во сколько раз скорость реакции при 20°С меньше, чем при
80Х, если reuiicpaiApiii.irt mi н|н|>ициент скорости реак]|ии равен 3?
3. Вычислите равновесные концентрации реагентов в реакции
образовании дихлорид-.чиокенла серы
если I1\ hc\o.|}if.[l4 копнен j [>:miliii fiu in p.ihin.i мсжл> собой и равня-
1,5 моль/л.
4. В каком направлении сместится равновесие реакции
2СН,(г) + 3O.(r)+ 2NH,(r)^2HCN(r)+ 6Н;О(г); ДЯ = -939 кДж
р , рур
1С энергии I ибПса в pciynbiate реакции
2NO?(r) + О,(г) = N,O, (к) + О, (г)
Можеч ли эта реакция прогвкйтъ cawoi
NO(r) + О,(г) ■ NO,(r)+ О,(г).
;1ля которой справедливо уравнение v = (tc(NO)t(O,), если ЮНЦИТР-
рацию монооксида днла увеличим. » 2 рай. я копнит рацию очопа -
в 3 раза?
l.llpn температуре 238°С скорость реакции составляла
5 ммо:1ь/(л мин) 11ри клкой rcMik-|i.n>putK(ip.R и, пой реакции
будет равной 31.25 ммоль/(л - мин), если температурный коэффициент
скорости реакции равен 2,5?
2. В герметично скрытый oslvi iiuixrmioini.iii 1 л поместили0.02
моль иодоводпролл и нагрели до к'мнеритуры 4484", при этом часть
иодиводорода разланиляоь и установилось равнопссие:
а) при повышении давления; б) при удалении хлора нч сферы рсак-
5. Вычислите вменение энергии 1 иббеа в peiynbiare реакции
СО.(г) + С(]-рафит) = 2СО(|);
при лачлении 101.3 кПа и двух темнсрат>ра.\: а) 200"С (473.15 К) и б)
1200"С (1473.15 К). При какой т них темгк-paiyp реакция может
проткатьcauonptiiiuu).ihMo?,[l.iH мни^акцивЛ/Л = 172,47 кДж.
^"" I 7566 ДЖ/К
1. Цып
2NC
по NO,, ccj
чирсч 20 ее
2.
0,2 м
Выч.
Hlb/Ol
75,бе
1СЛИЛ
кунд
,елит,
<0,S
■ Дж/К.
! средню!
кадкой
|||<М it'MI
о скорое 11, реакци
2NO,(r)
1т\'рный кочффиц
icpanype 70°C она
н
«жцешраиия составила
цент скорости реакции.
равна 2SBti моль/(л j с).
3. При немчорой кчперагуре а гермешчно -икры том сосуде ус-
CS,(r) + 3O,(i )*± СО, (г) + 2SO,(r).
ВЫЧИСЛИМ кОНОТЯНту равновесия и ИСХОДНЫЙ концентрации
реагентов, если (>;iiHii>uo in.к- кит[L-idзjiauiui p.iiun.i: j('S,| = 0.2 моль/л,
[OJ = 0,1 моль/л. [СО,] = 0,35 моль/л, [SO,] - 0,7 мопь/л,
4. [) каком направлении сместится равновесие реакции
FeO (т) * СО (г) £ Fe (т) + СО; (г)
а) при удалении пи'кои.м >i.K*po.i;i и t и гfi^ p i.i реакции; Г>) при новы-
iiECiiint лап.1ения?
5. Вычислите тепловой зффеюг реакции:
2H.SO, <р> + С(фафит) = 2SO;(r) + СО3(г)+ 2Н,О(ж).
Яв-"1Н1/"КЯ ли д^инля |iLLai,iuiM 1кзтсрми'и.пскои mjjii шдш^ермиче-
для которой спр;|неллнв1>уравнение v = i(-'(NOk(H,), сели увеличить
дввяеяие в реакторе в 3 раза?
2. Скорость реакции при гемпературс 25°С рапиаО.5 md.il'(л с).
Вычисли» скорчен, ной реакции при reMiiepatype 45°C, если тем-
11срат>рный наэффнщтп скорости реакции ршм 3,5.
3. В гермеш'чю МЦЦШТЫЙ сосуд ВЫвСТИМОСТЫО I Л поместили
0.3 моль хлороводорола и 0,15 моль кислорода. В результате
протекания обрвТИМОЙ реакции
4HCI (Г) + О, (Г)^ 2СЦг) + 2НгО(г)
(«сия. если [С!,] - 0.06 моль/я.
4. Увеличится ли выход продуктов реакции
С (трафит) +Н,О(г)£ СО(г) + Н,(г); Д// = -131,3 кДж
при одновременном повышении температ> ры и лавлення?
5- lihl'lllCIH I LL И 1NU4ILMIIL »М I [hTllfli ]^ pr. 1\ HfL;|I L4 pt'ilKI|Hll
Парнаиi 11
1. Вычислите скорость реакции разложе!
та, растворенного в тетрахлоридс углерода, е<
2N2Os(p) = 4NO,(p) + O2(r)
равна 6.2 10 * с1, концентрация N,O5 составляет 0.5 моль/л и для
этой реакции вправе дли но >р;ишсние v = At(N,O,).
2. При некоторой iL'MiiqKM"\ pi. скорое п. реакции составляет 122,5
ммоль/(л ■ чип) Па lko.ij.ko ["радусов н\жно понизить температуру,
чтобы скорость этой реакции еншнлась до 10 ммоль/(л - мин), если
температурный коэффициент, скорости реакции равен 3,5?
3. Вычислите piiKnisHOLiii.rc концси ifuiiLiii I ,i ioi»opjHHbix вешесгв
FeO(т) ♦ CO (i) ?> I'e(r) + CO,(]),
если HcxojiH-iw концепфгщня монооксияи \jjKLpo;ia составляла t
0,1 моль/л, диоксида % [.юрод.! и ii;]4j.tt.- реакции lie оыдо. а константа
равновесия Л' равна 0,5.
4. В каком направлении сместится равновесие. \с!лмавливающе-
еся в водном растворе брома
Вг, (р) + Н,О (ж) ^НОВг (р) + НВг (р)
а) при уменьшении концентрации брома; 6) при ^оГкпшснии в раствор
5. При давлении 101,3 кПа и температуре 298,15 К вычислите иэ-
4NH,(r) +3O,(r) = 2N;(r) + 6HtO(r),
если ДН°И„Ц„ =-1266,16 кДж и й.^втш= 146.6 Дж/К.
Может ли эта реакция upon;к,*п. самоЕгрои то п.по при
указанных выше условиях 13 ноы in шрои.шной системе?
т 12
2NO (г) + Н, (г) = NjO (г) + НгО (г),
«угорой справедливо уравнение v = kc\NO)c(H2), равна
исходная концентрация водорода 0,74 моль/л.
2. Вычислите температурный коэффициент скорости реакции,
если при температуре 25°С скорость реакции составляет
0.1 моль/(л с), а при mnnpnypi >(ГС она ранна 3.2 моль/(л ■ с).
3. При ивюторсИ тонрлурвя 1ерметично закрытом сосуде ус-
СО(г) + 80,(00 СО, (г) + SO,(r).
Вычислите константу равновесия и исходные концентрации
реагентов, если piMLiitiiii-aiMc M)NUfiii|Kiiinii ршшы Jl'OJ - 0,4 моль/л,
[SO,] = 0,3 моль/л, [СОг] - 0,5 моль/л, [SOJ = 0,5 моль/л.
4 В я равновеи
М,<г)*Н,(г)+2С(гр.фит)г! 2HCN(r)
реакционной смеси?
5. При давлении 101,3 кПа и температуре 298,15 К
менение энергии Гнббоа в результате реакции
Может ли 'на рсакныч прои'кагь самопроичволы
Вариант 13
I л вина содержалось К.2 mi1 растворен!
же объеме вино и а ге риалов снизилось до 4 мг. Вычислите среднюю
скорость ассими 1чцин кис юродл и ммо.'1Ь.'(л ' час).
2. Во сколько pai унслН'чися скорость реакции при повышении
1емпературы на 40°. сслитемператлрпый коэффициент скорости ре-
.ihiiiii рлЕ«;н 3,5?
3. В герметичпи закрытый сосуд вместимостью ! л поместили
0,6 моль трифторида ачота и 0,4 моль водорода. В результате
протекания обратимой реакции
2NF,(r)4-3H2(r)£6HF(r> +N,(r)
«есия, если [N,] = 0,06 моль/л.
FeO (т) + Н„ (г);2 Ре (т) + Н,О (г); ДН= 23 кДж
а) при uoitMiiLL/nim къ\шср.и\ |n.i ч%> мри попившим л;ш, юния?
5- ВЫЧИСЛИТЕ ECN/1OFUHI h|ji|jl"K] рс;1к'11И[Г ОорИИНЫНИЧ МНр<ч_СрИО
Является л» данная реакция эктогсрмической iltiи эндотермической?
Вариант 14
1. Во сколько раз увеличи км скорость реакции
2NO (г) + Нг(г) = N,O (г) + Н;О(г),
для которой справедливо уравнение v = k<?(NO)c{H,). если
концентрацию моиооксида азота увеличить в три раэа, а концентрацию
водорода - в два раза?
2. На сколько i p.Li\ooii н>.км<> inmj.ii.tnb icmikl|i.m\|i\, чтобы
скорость ренкции йочросла в 64 рил, cljki i смпер^ I \ [>мыи ко k[h|)]]liiillih
скорчи I и pv'ni 1>:«ми [1авен 4?
3. В r-epML-тично закрьш.1Й сосуд вместимостью I л поместили
0»045 моль lpiioKtii ja .niacoia U \к '\.\ь кис про к1 к. i пня обратимой
реакции при никшорой геммерлчре vcjanoen юсь химическое рав-
N,O,{r)^NO(r) +NO,(r).
Вычислите константу равновесия, если [N,0,1 = 2 ммоль/л.
Fe,O, (т) + ЗН,(г>£ 2Fe (т) + ЗНгО (г)
а) при общем повышении давления в системе: б) при повышении
парциального давления водорода?
S. Вычислите изменение 1нтропии в результате реакции
ЗО,(г) =20,(1-).
МОЖС! ЛИ >И\ рСЯКЦИЧ lipoiCKilll. C;|M1ML|)OH 111(1 П.ПО li IISOr[Hpo-
ваннай сиечемс при давлении 11) 1.3 к] 1а и температуре 298,15 К?
К..|.И.,П I 15
1. Начальная скорость iii.".ih ins и p,i i.iovKcunw iii.ii i ;юьспда диазота,
раствори иною ь го г pa \.т op it до млерода:
2N,O,(p) = 4NO, (р) + 02(г),
56
равна 12.4ммаль/(л с). Вычислите концентрацию растворенного
вещества в ие\о;июм p;iLtEuif4.\ cl.ih kohci.ihki LKi>pOL"iii mm реакции
равна 6.2 - 10' с ' и для нее справедливо уравнение v = ie(N,O5).
2. Вычислите темпе р.мч рими ко иЬфшшенг скорости реакции,
если при повышении icMiicp:ii\pin на ^0""Х- се скорость возрастает в
1000 раз.
3. При некоторой гемпсра1лре в герметично закрытом сосуде ус-
SO.(r) + CO,tr)?* SO, (г) + СО(г).
Вычислите конечанту рапппвееии и исходные концентрации
реагентов, если |ым кнлчш.к' ми 1Ц1.-Ш рации p,ntni,i: |S(),j = 0,5 МОЛь/л.
[СО,]-0,1 мопь/л, |SO,1 = 0,4 моль/л. [СО] = 0,4 моль/л.
4. Увсличичсяли кмхолш'мшхлорм.'ы ([юсфира необратимойре-
РС1,(г) + С1г(г)*5 РС1,(г); 6И=- 124 кДж
а) при увеличении давлении; {i| при шшмшапш томпературы'?
5. При давлении 101.3 кПа и 1емпературе 298.15 К вычислите иv
\n.'fi,4ino 4icpi ни I i:1 "'i .i к |u- ^ ii,i.'.u ролкцчи р.] шожения
перхлората калия:
Может ли эта реакция протекать самопроизвольно в
неизолированной системе при > клчпмпмч чс.ювиях? Почему перхлорат калия
при обычны л \1\[иння\ ми pa LiaraCTCH?
1. Для про t екающей в растворе реакц
HiL'Hne v Ardx' )i'{\ } Измениich ли скорость
реешр.щшо нодид-ионов увеличить в 3 раза, а кон-
р I И Ч' PI \ Ml I IFil III! I 11 I1 K'l'.ll I 11 j")l] r '
2. Во сколько pin vrimih'ikick LKopocn, реакции, если
температура иовьшгается со I 75 до I95°C. ii темпера] j pi i коэффициент ско-
pociH реакции равен 2.8?
3. В I'epM^i m'ihi) i.iKpi.i i i.ni cocsu ммесшчостью 1 л поместили
15 ммоль иодоводорода. 13 речульгате протекания обрагимой реак-
2H]<r)i±HI(r)+l!<r).
Вычислите константу равновесия, если [HI] = 1 ммоль/л.
4. Увеличится ли выход продуктов реакции
N,(r) + 3H,(r)#2NH,(r)j ДЯ = -92кДж
а) при повышении ПНШрвПрЫ; б) при повышении давления?
5. При давлении 1(11,1 кПа и i с-vn i«.-p.i i > \ik "I'JN, 15 К вычислите
изменение энергии ГнОГшй в ptiy.nnaie реакции
СаО(к) +СО,(г) = СаСО1(к),
если Ш"^. = -177,99 кДж н &8> - -164,68 Дж/К.
Может ли )та реакция протекать самопроизвольно при укачан-
Варнаит 17
1.Скорость рыжими ииимодейсиши vicia.i.iii'ieCKoro магния с
разбавленным раствором хлороводородной кислоты составляет
4 ммоль/(.т с) I)i>i4m:;uiгс kohcijiii> LKOp^cin ">ioii рсакцик. если
концентрация IKJ р.нчш ((,> молн/;|,а экспериментально
установленная зависимость скорпсти 'мой реакции от концентрации кислоты
описывается уравнением: v = MHCI).
2. При темггерагурс 443,15K скорбен, реакции составляла 24,5
мчоль^л ■ с), llpn h,iKoi! ]llmiic|jlii}|ii.'oxopnoib реакции станет
равной 7 ммоль/(л ■ с), если 1им1и;р;ч>рный й>>ффициент скорости
реакции равен 3,5?
0,8 моль бромппо.юрод:!. И pcisjibiutt: иришкгишя опратимой реакции
при иемтирой ii-Miitp.n;pi- \ci.iiiohiijioci, мгмичееше равновесие
2НВг(г)Й Н,(г> +Вг,(г). (
Вычисли it- p;iiiniihiiLLiii.KL iioiujLLiiip.LiiiiLi iK'Muiioiu 1^с[цесгйа и про-
;[VKmii реакции, CLjiii Kofii Liniit |>лниоисе^1я К = 0*4.
4. В какую u<ipon\ lmcl i и icm [>^imiopiocnc реакции
2H:S (Г) + SO,(r) = 3S (ромб) + 2Н,О(ж).
.и», -. ■! ли данная реакция экзотермической или эндотермиче
Вариант 18
тся GHDpoen реакция ZNO * О, -> 2NO,. если
пои реакторе в 4 раза? Экспериментально
установлеи,, м'р.н mpL.iMmiioi кошип p.mnii pi-;imiinisojiH-
p ()(2)
2. При no» t-inin к-ммерагуры с 20°С до 55°С скорость р
ции увеличилась в 128 раз. Вычислите температурный коэффиц
скорости реакции.
3. При iicKoiiipiui и'мнсрапре в гсрмишчии шкрмюм сосуде
Н;(г> + СО,(г)£ Н,0 (г) + СО(г).
Вычисли ie константу равновесия и исходные кощеи |р:шии рйЛ-
гентов, если раимовесиые концентрации равны: |НП] = 0^6 моль/л,
|СОП] = 0,4 моль/л, [Н,О] - 0,8 моль/л, [СО) = 0,8 моль/л.
ZNH,(r)_j Nj (г) + Щ(г); ДН= 92,4 кДж
5. Вычисли il и вменение UII рои и 11 i^ fn: iyjihKiic реакции
Н»ч-СЦ(г)-2НС1(г).
Может ;П1 'i.i рил к пня м[нчска1ь самом ром 1иогч,ло р игю."1ирован-
ной системе при давлении 101,3 кПа и температуре 298,15 К?
Вариант 19
1. В реакторе смешали равные объемы водорода и монооксида
аэота. Начальная скорость реакции между этими веществами
2NO (I) + Н, [г) = N.O (Г) + Н,О (г)
равна 2,25 ммодь/(л ■ с). Вычислите исходные концентрации обои*
ia-гав (моль/л), если Kiiiiciaina скорости репкшш p;nsiia 22,5 С"1.
2. Во сколько рнИ cKofiocii. реакции при Л№ I' меньше, чем при
515°С, если температурный коэффициент скорости реакции равен 3?
3. В герметично чакрытый сосуд вместимостью 1 л поместили
(1.05 моль ДНиюрйд-ДИОНСИМ серы. В результате протекания
обратимой реакции при некоторой температуре установилось >
SOiCI[(r)_SO;(r)+Cl!(r).
Вычислите константу равновесия, если |SO,J = 0,01 л
. Увеличится ли ВЫХОД ПрОЦуКМИ рОШ
NiO(T) + H3(r)?±Ni(T) + H3O<r) ;
д . швитс
энергии Гиббса в реэуль
натрия:
2NaNO, (к) = 2NaNOj (к) + Ог (г>.
oimchiHiiitta >puniicHl№M v - 4t(N,O)?
2 При температуре 4443.15tf скорость реакции составляла
24.2 ммоль/(л ■ мин). При какой температуре скорость этой реакции
будет равной 5 ммоль/(л ■ мин), если температурный коэффициент
екпросш реакции равен 2,5?
3. Вычислите равновесные номцвятрЖИЛ газообразных вешеств
2СиО(к) +СО(г) = Си,О(к) + СО,(г),
nih^n i:i >исрола раина 3 моль/л.
y pv |n ml; оы ш ,i W\>\wi.mia p,iiini'J'L'i:n^
«;- is.
4. В каком мамршшимиисмисгикя рашкжесии, )Сгаиавнивающе-
еся в водном расу пирс КПОра
CI, (р) + 11,0 (ж) <ЙНОС1 (р) + BCI (р>
а) при уменьшении концепграции \лора;б) при евщынании НС1 ок-
си:юм |iisin HgU?
5. При давлении 101,3 к[ [а и температуре 298,15 К вычисли те ич-
менение энергии ГибГка в речультате реакции, используемой в
промышленности для получении мечаллическою молибдена:
МоО,(к) *ЭН!(г) = Мо(к) + ЗН;О(г),
если Дй°,.ич.. ■ 19,74 кДж п №„,_„■ 125.46 Дж/К.
60
ьно при >h..i<;ni-
ных выше условиях н пеню шгчшимнон системе?
Вариант 21
1. Во сколько pai увеличится скорость реакции
4Н/г) + 2NO;(r) = 4Н1О<г) + N:(r)
при увеличении давления в i рн pa'sa, ec;in же пер и ментально
установлено, 4TO"ianiiLiiMociip скорое 1 и реакции от концентрации
реагентов описывается уравнением v ytc-(NO,>c{] 1,)?
2. Иычислию и.'мпср;н \ рмып м. »|nlinniiLLni ско[>ос!и реакции,
если при TCMiiLhpju\ рс 2УК.15К скорость реакции составляет
0,1 моль/(л ■ с), а при ii-Miiupiviypc 3 13,1 5K она равна 0,8 моль/(л с).
Зг При Hi'Kinopoii I fMinjp;i]\ ре и lupsiciiriiio ^ihpi.noM сосуде ус-
11г<г) + SO,(r)«^ HjOtrJ + SOUr).
Вычислите константу равновесия и исходные концентрации
реагентов, сели paiiiioHixHi.ii' мищсшрЕщни равны: [HJ = 0,25 моль/л,
[SOJ - 0,15 моль/л, [i 12OJ - 0,3 моль/л, [SOJ = 0.3 моль/л.
4, Реакция горения аммиака ;ю искоюрой степени обратима, В
каком иапрагчении смещено равновесие в системе
4ЫН,(г)+ЗО:(г)г1 2N, (г) +6Н;О(г),
[>,lKHi»l'L1.1im A ' <] "' H КЛКОМ IILlLipLlH.IL'llHII
вновесие и uoi\ cutn'Mt при повышении давления?
Вычисли^гс тепловой чффект реакции образования аиьюрида-
идассры (старое нашаши: viopiiciblii сульфурнл):
SO;(r>+ С1;(г) = 8О;С1Лж).
вляется ли .uiiliuw jil^ikiihu »KioitpsHi4ei:Koii или
эндотермиче2N.O,(г)- 4NO,(г) + О;(])
концентрации itoto витс-етва
N.O,]. Но сколии р;и >Moiii,iim
и N,0, от 4
2. Скорость реакции при температуре 25О°С равна
0,2дмоль/(л с). Вычислите скорость этой реакции при температуре
20(РС, если темпера 1>рпмй ко "|>фиипет скорости реакции равен 2.
3. В герметично закрытый сосуд внсопйгасшо 1 л помеепшн
3,5 ммольдихлорил-таи.'П! \uiqjivi.i В результате протекании обра-
шмой реакции при некоторой iL-MiiL-p.siчрс уч лишилось химичес-
4, Увеличится ли им чод продукюв реакции
СоО(т) +Нг(г)«^Со(т) + Н,0(г); ДЯ = -2,5кДж
а) при повышении температуры; б) при
5. Вычисли 1С щмемоше чмромми
чмромми и рч ч\.'|ыа
Будет ли эта реакция пропекать самопроизвольно в
изолироой системе при давлении 101.3 кПа и температуре 298,15 К?
для которой справедливо уравнение v = *c;(NO)c(H.), если
концентрацию M0ifoohLLnri.i ;i un;i mil'jiiimiim. h ,ща \г,мл. л концентрацию
водорода уменьшить в четыре paia?
2. При иеюгОрОЙ ПМПерпурв скорость реакции составляет 563
ммоль/()1 ■ мин). UacKojii.Kii i|ni4\ton нужно понизить температуру,
чтобы скорое п. ной реакции смирились ,41) 20 м.чоль/(л ■ мин), если
темпераiypni.1» ктффнциет eicopoeiH реакции равен 3,8'.'
3. Вычисли 1С равпонестпе концом рации i а-шоирц'шмх вешести
СиО(к) +CO(r) = Cu(K) + CO,(i),
если ислодиля концам I |1чН|ин Mi'iMokLii.i.L ч:к'[Ю.|;| раана 4 моль/л,
ЙГ_ = 12.
С(графит) + 2Н,(г)2 СН, (г); ДЯ = -74,8 кДж
а) при повышении температуры; б) при повышении давления?
5. При давлении 101.3 кПа и температуре 298.15 К ш
мененис энергии Гнббса в результате реакции горен*
SiH,(r) + 2ОДг) - SiO; (кварц) + 2Н,О(г).
Может ни -via реакция протекать самопроизвольно в закрытой
системе при укатанных условиях?
Вариант 24
Wfifi-}ji 4N0!(r)-t-0,(r>
при увеличении давления в 1ри раза, если -жепериментально уета-
новлено.Ч'тчависныоси.стчтсшр^шцино1! копнен фации реагента
описывается уравнением v ■ te(NjOs)?
2. Вычислите ТвНПвриурныЙ коэффициент скорости реакции,
если при температуре 533.15K скорость реакции составляет
5,4 ммоль/(л ■ с), ii приюмперагуре 583,15К она равна 594 ммолЦл с).
3. При некоторой icMiicpaijpi; в герметично чакрытом сосуде
установилось химическое равновесие
Н,О(г) + SO,(r) Ji Нг (г) + SO,(r>.
Вычислите констащу равновесия и исходные кшщеш рации
реагентов, если равновесные концентрации равны: [Н,О] = 0,5 моль/л,
[SO,| = 0,2 моль/л, [Н,] = 0.-1 моль/л. [SO3] = 0.4 моль/л.
4. Реакция каталитического окисления аммиака до некоторой
степени обратима. В каком направлении смещено равновесие в
4NH, (г) + SO,(r)^ 4NO(r) +6Н.О(г>,
ся равновесие и ной chcicmc мри повышении давления?
5. При давлении 101,3 кПа и температуре 298,15 К вычислите
изменение энергии ["иббеа в результате реакции
В;О, (стекловидный) + ЗНгО(г) = 2Н,ВО} (к),
если&Н°1аш1Ш = -208,54 кДж и ДД* Л1_^-24,82 Дж/К.
Может ли эта реакция протекать самопроизвольно при указан-
2N2O = 2N; + О,
при увеличении давления в 10 pat, если эксперим!
температуры на 40°, если температурный кооффициент скорости
реакции равен 3,2?
3. В герметично закрытый сосуд вместимостью 1 л поместили
5,3 ммоль rLCHi-iviopn.'i-i фосфора li piMy.ii.i.iiL' мрок'к^мич
обратимой реакции при неко-mpnii [е\терат\ре \с1.1ппвилось химическое
равновесие
PCls{r)£PCl, (г) + С1,(г).
Вычислите константу равновесия, если [РСЦ = 2 ммОЛь/л.
4. В каком направлении сместится равновесие в системе
СО, (г) +НгО(ж)^Н;СО,(р)
5. Вычислите тепловой эффект реакиии образовании серной кис-
Н,О(ж)+ SO, (ж) = H?SOa<jK).
Вариакт 26
е среднюю скорость [какmil
2. На сколько i pa iwoii н>жич pioin.icnih iампераг\ру. чтобы
скорость реакиии возросла и 81 раз, если ioMkic[><ii>piFbiii i.u m]h|uiiieil;iii
chopocrii рк'акIlhii ;>авсп 3?
3. В рсзул1.],1гс npi4LLhann4 .u> nchoiopoii l" ion^iEt-1 обратимой
реакции г"орепич iiMM siLiK.i >i. i,ihoilh loLh \ir.iMLLL4hot равновесие
4NH, (г) + ЗО;(г) ?J 2N: (r) + 6H2O (r).
■-а скорое I и ufipai ной pL-;u;uim меньше к
анты скорое иг прямой рсакшш. I'tviit конспщшршшопссияЛГ р
а ID"4?
3. Увеличится ли выход фосгена к обратимой реакции
СО(г>+ С!;(г)£СОС1г(г); ДЯ=- 113 кДж
) при увеличении давления; б) при повышении температуры?
5. Вычисли it: и iMciiciKic ни репин к результате реакции
В2НДг) + ЗОг(г) = В:О, (гекс) + ЗН,0 (ж).
Может ли (1.1 реакция iipi'K'luii t. *м мчирои iho.ii.niui изолиров
ой системе при давлении 101.3 кПа и температуре 298,15 К?
Вариант 27
1 |
справедливо уриннение V = ted'e'1^! ). Во сколько рва уве
скорость реакции, i:c;m колцетрацию иолил-иотш увеличить в
3 рача. а кшщешрацию катионов IV - на 50%?
2. Вычислите темпера!}римн Ы1>ффициет скорости реакции,
если мри повышении температуры на 60 градусов се скорость
возросла в 4000 раз.
3. При лекширой rcMnepaiypv в герметично закрытом сосуде ус-
оси в водном растворе и
I, (р) + Н,О (ж)£НО1 (р) + Н! (р)
а) при уменьшении концентрации иода: б) при добавлении в раствор
5 При давлении 101,3 кПа итемпературе 298,15 «вычислите
изменение энер! ии Гиббса в результате реакции горения лшшана:
C;N;(r) * 2О;(г) = 2СО; (г) + N. (г).
Может ли тга реакции npoieK;iif. о^чмгтрои то.пли it закрытой
сне гене при указанных условиях?
1. При шампанизации вина рое рву арным методом до брожения в
I л вина содержалось 8.2 мг растворенного кислорода, через 10 суток
после после начала процесса шшпашмшш содержание кислорода
в том же объеме внноматсриалов сшиилось до 4 иг: Вычисли к-
среднюю скорость ассимиляции кислорода в ммоль/(л - час).
2. Во сколько pat уменьшится скорость реакции, если
температура понижается с 20» до 175°С. а температурный котффициеит
скорости реакции ранен 3?
3. В герметично закрытый сосуд вместимостью 1 л поместили
0,045 моль триоксида диатота. В результате протекания обратимой
реакции при некоюрой температуре установилось химическое ран-
N,O, (г) J±NO (г) + NO.(r).
Вычислите равновесные кон центра пни исходного вещества и
продуктов реакции, исли /f = 1.
4. Увеличится ли выход аммиака в реакции
N.+ 3HJ^2NHJ;AW= -92.4 кДж
при одновременном понижении темперагуры и повышении давления.
5. При давлении 101.Л к11аи г ич пера г у ре 298.15 К вычислите
изменение энергии Гиббса в результате реакции
В.НДг) + 6Н2О(ж) = 2Н,ВО, (к) + 6Н2 (I).
если Д«°т =-511.52 кДж и i5°miill,= 308.I2 Дж/К.
Может ли гга рсакчгин npf^ichan. 1:;пич1|>ииинм>.ло при
указанных выше ус.чонич\ н mi:ei iojiii|44^LiMb>M системе?
1. Вычислите
2N0 (г) +
среди
СЦ(г)
Няриа!
ююскороси
= 2NOCI(.)
IT 2
.рс
по NO. если его исходная концентрация составляла 0.5 моль/л, а
через 20 с она с г UU рапной 0.1 моль/л.
2. При температуре 215ПС скорость реакции составляла
25 ммоль7(л с). При какой icMiicpin>pc скорость реакции станет
равной 4 ммоль/(л ■ <:). если температурный коэффициент скорости ре-
осуд вместимостью 1 л поместили
ции при искторой температуре ус
2НВг(г)?Н,(г) + Вгг(г).
Вычиошт кинстату равновесия, если [HJ = 0,85 ммоль/л.
4. При осуществлении и замкнутом iipocipiiHci'HC реакция
СаСО,(к)^СаО(к) + СО,<г); АИ = +180 кДж
становится обратимой. В какую сторону сместите» равнове
а) при повышении давлении' Г:) при повышении температуры?
5. Вычислите leiuioBofi чффект реакции:
4FeS, (к) + 11О,(г)= 2Fe,O,(K) + 8SO, (г).
ЯвиНСК'Н.Ш l.tllirjH [".МЩПЯ IK'.mcpMlfICLKi^I И Ml 'M.lOILjnmHLC
Вариант 30
1 Э
= *c(N,O5). Вычислите скорость этой реакции, если концентрация
N,0,составляет 20 ммоль'л.а консташа ВПООСТЯ |>;шна 1,6 ч"1.
2. При повышении температуры со 125°С до I 50°С скорость
реакции увеличилась в 32 paia. Вычислите температурный
коэффициент скорости реакции.
3. В pe^vi н i ;i i ll и pott к;и inn ,ii> мскоюрой liciiuhh обратимой ре-
4NH, (г) + 5O2(r);2 4NO (г) + 6Н2О (г).
ВосКОЛ1>К1> р.п м'нн-ч.иил^ы^хч: I iniup.Nлчи [н лкции ме1^ьшско]{-
ааты ewpoem ирмчюн jilmkiihii, i^lmli kofti." mii i .i ||;нчювееич К
равна lO"*?
а) при повышении и-чмсрапры: б) при добавлен!
5. Вычислите i
энтропии в результате реам
6Н,0(ж) = 2Н5ВО, (трикл) + 6Н; (г).
Глава 3. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
Повторить: главу 2. р,1 ист - - ■> £;iK4>iiFii С1е\но.мС1рИН>> учеб-
3.1. ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К КОЛЛОКВИУМУ
!. Что такое рас [вор?
2. Какой знак имеет ДО процессов растворения? Как можег
изменяться энтропия, если процесс растворения является
экзотермическим? Какой знак имоеч AS для эцдопрничмшкх процессов раство-
рения?
3. MinoBHie rice HIFH.I н<;шм1)диш1кия межд> частицами раст-
аореппот вещее i n;i и |i;u i кори ic.iи. при но (мщио к опр;понаншо
растворов.
4. В чем заключается игавнос отличие сил Ван-дер-Ваальса от
химических сил, вызывающие образоМШИ растворов?
5. Назовите основные способы выражения состава рас i воров.
3.2. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
стаил рас] mip<>». ну^кпо ымучить ij[iиiumchiii.il' f; vicoiшке уравнения
6.1—6,7 ДЛЯ раСЧСК! МО l>Fpih'll KOIIHL'MI p.LHIHI. Mi>. IwpilON KOHLlCHTpa-
ции iKBHBii.TeiiKi. imp;i и m.тесовой доли.
Задачи на расчет концентрации и массовых /iitieu
растворенных веществ
ных веществ, масс или объемов растворов в соответствующее
уравнение и произвести вычисления. При этом следует иметь в виду, что
все уравнения 6.1-6.7 справедливы при \ с. мин и. что объем раствора
выражен в миллилитра\. поэтому но и mci,,n inc oin hook нужно быть
внима1ельными при пересчете обьсмии in одних единиц измерения
в другие. Следует помнить, что 1 л = 1000 мл.
Шшницы измерения объема литр (л) и миллилитр (мл) не входят
в систему единиц СИ. В строгом соогветствии с СИ объем следует
измерять в кубических метрах (м1) и дольных от него единицах:
кубических дециметрах (дм1) и кубических сантиметрах (см1).
Однако в ддоорагорнои 11р ih i и v рс iko i ipn\o ни *. м нчк' г к. [сю с пол Е,гин-
|]11 |1им { ! .1 I ?м i ,i b
ром(1мл= I см").
ПрнмсрЗ.I. Вычисли
.если в 100 мл рис i нора с
Решение.
. J 14 p.K'lk'l .1 Ilk'С MO LI. i\i'.K Я Ч PhIUHCHIU
створенным веществом в "чой задаче
хлорид ндтрич. поэтому имеет обобщенного
обозначения растворенною нощесгиа В и
уравнение 1ЮДС1 гшлисм (|и'рм\.1ч \.uipn;i;i Hai[1[i4
NaCI:
оюрида натрия и of>i,CMj
c(NaCI) =
5,84
1000 =
мь/п.
58.5-100
Ответ: 1 моль/л.
Пример 3.2. II 500 мл рает вора содержится 19
ie молярную котим I |].тиш )К1шнс1яс
м растворе при vc.Kmiiii iio.hioie неjiiрализ
Полная ней гра;шзация серно
тся уравнением
H.Si) . :Na(l|[ = Na,S{)
Из каждой молекулы кислоты в реакцию вступав
водорода, гюэгомч o.ihomv кашону водорода в этой ки
ной реакции ж» .ii/мша \ с киша* частица , молекулы HjSO,.
Следовательно, фактор эквивалсшносш/,„,<H,SO,) - l/r
Для расчс1а молмрноИ ыишппцишп ииишпл в уравнение
„.,»») "«W ,000,
В уравнения 6.2. подставим числовые -значения м
валентности, мо/шрпом m.iccm серной кислоты и II
У2-98.0 500
Ответ: 0.8 моль/л.
При решении задач, в которых речь идет о массовой доле
растворенного вещее та. [ЦЯбмВС с. южный )тап - это выбор ОДНОГО ОТТрех
уравнений: 6-3. 6.4 или 6.5. !-1сли в условии задачи приведена масса
раствора, то нужно взять уравнение 6.3. Если в условии даны массы
растворителя и одною или нескольких растворенных веществ, то
следует воспользоваться уравнением 6.4. Однако чаще всего
встречаются задачи, в которых фигурирует объем раствора. Это
объясняется тем. что на практике растворы редко взвешивают, обычно
проще измерить их объем. 11римсром раствора, для ко горою обычно
указывают массу, является растительное масло. Для других растворов, с
которыми приходится ПИЮ ДНЮ в лнбораюрин или в 5ыт\
(растворы кислот, оснований и солей в воде, аптечный спиртовым раствор
ИОДа. столовый \нс\с. кино. Ни ik;i) \x;i <mh;iioi h\ объем.
Пример 3.3. Вычислите массовую долю (в долях единицы)
нитрата калия в растворе, если в 450 i его содержится 90 г KNO,.
Решение.
m(p) - 450 г I в условии задачи приведена масса раствора, по-
m(KNO1) = 90r этому ;чя решения тчгшмь» oil и > равнением 6.3.
ш(КЫОл) = — =0,2.
Ответ: 0,2,
Пример 3.4. Маринад для маринования огурцов готовят
л воды. 500 г хлорида натрия. 300 г сахара и 60 г уксусной к
ты. Вычислите m;iccihs) ki дилк> (%) кпж.ито in ингредиенте
ринада.
m(NaCI) = 500 г
to(NaCI) = ?
Ш(С„Н„ОИ) = ?
uXCH,COOH) =
В условии чадачи приведены массы
растворенных веществ и объем растворителя - воды.
Плотность воды равна 1 г/мл, поэтому масса
10 л (т.е. 10000 мл воды) в соответствии с урав-
(H,O) = p(H,O)F(E!,O)
10000 граммов:
Л|(Н,О) = 1 ■ 10000 = 10000 Г.
:ы растворен нь
расчета нужно испей
идет речь в условиях i.vwiii. состой1] ш четы-
>ида вягриМ NaCl, сахара С|;Н„ОМ. уксусной
Массовая RDM ллорид
fl)(NaCI) - m(NaC|j + ,„(С
натрич и чари
00 -t60 + 10000
[СрЖ111 1,(>".н \ ГОрН L.L INllpMil 2,S"'ii l.;i\JI|U ll
Пример 3.5. Вычисти- mucous ю до. по (%} <i un мой кисло! ы в
растворе, если в 1 а его содержится 629.5 г I INOlh л плотность равна
1,30 г/мл.
2000
Ошвети: 0.0015
рр нь i>,Kiiiii^ip,uiLMiiH« операция не
только в химических лабпрагория\. но и в практической
деятельности работннкон сельского хозяйства и в быту. Проанализировав
условия задачи и установив, о каком способе выражения состава раство-
pa илсп речь в )той тадаче. следует выбрач ь и-
веденных в учебнике, нужное уравнение, за
носители к) meilcli рис торенного вещества.
Пример 3.7. Сколько граммов гидрокси/
приготовления 2 л О, I M раствора?
Решение.
II задаче речь идеи ti молярной комцошрл
цни раствора. (Ьуква М - условное оГиииа
моль/л. Читать запись cOJ М рас i imp^ м\ж
но чак: «леи и молярный раствор»).
|я расче
1.1Н11М1ЧГ ki
jeirrpaiii
Hi(NiiOH)
0,1-40.0-2000
= 8r.
10(Ю
Ответ: 8 i.
Пример 3.8. Дпн засола крупных огурцов рекомендуют 8%-й рас-
да граммов хлорида ншрим и коды нужно вэигь
;i 4%-i о рассола с плотностью 1.056 г/мл.
.■(N.CI)- ,оо' -844,8г
Учитывая, что рассол готовят только из двух комп
0)(Н,О)= 100-w{NaCI),
а(Ир) = 100-8-92%.
Для расчета 4;icli,i iuuli косшимлечоя >равнением,
тому. кгтгорое применяли ;и*я определения часа i \ три ia натрия:
Ответ: 844.8 г хлорида натрия и 9715.2 г- води.
Пример 3.9. Сколько граммов медного купороса нужно взять для
приготовления 50 л I %-го раствора сульфата меди, который
используют для опрыскивания салов в период покоя растений. Плотность
раствора принять ранной i г/мл.
I Медный купорос i рщши.пиюг л<г<панис кристал-
р = 1 г/м;1 I CuSO/ 5II.O. 1ак как риситрясмис исществосо-
1Ткриста,тлиЕаш10П11\1и mi i\. расчегегомас-
)Ы| необходимой для нриготи»ленин раствора,
^т особен мое in. ki4O[>i,il' ^Jтaн^т по}ыгными и \о it решения этой
я приготовления 50л 1%-го раствора этой соли:
■<c»so,).wc-f°*"'''.
n,(CuSO,)=l ~ '=500 г.
Найдем количесп i!o вещества сульфата меди к 500 г этой с<
" M(CuSO,) *
oj-т:
500
■3,1
159,6
Так как в I моль медного купороса CuSCJ,- 5H.O содержт
1 моль беэиолтчо i;vim|mi;i челн L'uSO . io xi4 tю. 1\чення 3,1 мс
сульфата меди нужно вчять 3.1 моль медного купороса. Вычисл
массу 3,1 моль медного купороса:
m(CuSO,- 5Н,О) = AflCuSO,- 5H,O)n(CuSO4- 5H,O),
mfCuSO,,- 5H,O)" 244,7 ■ 3,1 = 774,1 г.
Ответ; 774,1 г.
Задач*
iacc компонентов, гаобхощяшклш
Пример 3.10. Средняя соление i ыжиани'к^кчй волы равна пример-
ю35%п. Вычислите массу un.iuii (i |. еилержашикся в I кг такой воды.
Решение.
Решение.
V= 100 мл
c[V,Ca(OH).j = 0.04 н
i
m[Ca(OH),| " '.'
Полпая нейтрализация гидроксида кальция достигается,
например, при ею взаимодействии с избытком хлороводородной кислоты:
Са(ОН), + 2HCI = СаС1,+ 2Н,О.
В этой реакции оба i m,i|iokoh.i.-iioiu L ,цП1 !Квг1аимодснс1И)к11 с
катионами во юро us Ckuoiuiic 1ыю, флмчр и.]ми;;^и,ъ11гнос1И ранец
/„.[СаСОНЦ -1/,
Hi расчетного \|>iLi'in.inini mm мо 1я|!|Ьч11.I4ILU II п\111ии ihTUin;i-iLhni;i
ГС fOH^ 1
cr/c*oH)jv—|...
выражаем MhIll;\ i игроке и, \л ки;1ьция:
_ flKCalOHlJ^I
m[Ca(OH)j] —
I li ■ и i .si' i,i .i числовые (качения и пронпедя расчет
Ответ: масса 1илроксила кальция составляет 0,15 Г.
Задачи на переход от одного списчба выражении
состава раствора к другому
Потребность в таких расчетах часто вон t и каст при сравнении ЭК>
сперимешальныч данных, полученных авторами, вэторые
пользовались разными способами выражения cocrami рас i воров Для
успешного решения !^дач ною mini и\"жно помни11», 'lii> )ipum'jtr.xttth' tun
одного способа выражении состава растно/ш к другому .масса ра-
Алгоритм решении i.ikik i;i |ач слс.[ио1[щй:
Отписываем уравнения для обоих способов выражения состава
растворов, о которых илет речь в условиях задачи;
2) решаем оба ; [шшсмш (iiiiociiil-.if.eu> массы растворенного
вещества ™<В);
76
3) приравниваем правые части уравнений;
4) решаем полученное уравнение относительно искомой ел
Пример3.12. Вычислить молярную концентрацию 16%-го раство-
Решепие.
аХНС1Оа)=1б% I Пусловияхэадачиречьилсгомолярнойконцен-
р= 1,1 г/мл грации и массовой доле. Дня обоих способов
эажения сое гак* рас i n<ipa лишнем расчетные
Так как маеса растворенного вещества при переходе о
способа выражения состава раствора к другому не игмеш
левые части ИГО уравнений тождественно ранни. Значит равны
правые части уравнений:
с(НС1О,)Л/(НС1О4)Г _ tojHClO^Vp
Юоо 100
Сокращаем Оба дроби на У и на 100 и решаем уравнение относ
тельно искомом \\ол ирном ко и цен грации:
М(НСЮ.) '
Ответ: 1Л5 моль/л.
Обратите внимание на то, что при переходе от молярны*
концентраций и тнтра. т. с. способов выражения состава paui нора,
характеризующих солиржати: BcnifciEia в единице объема, к массовой доле.
алюминия и ыоларнийшхисш ранни зквивалопаэтонсолн.Дляо
их способов вираж?ими loll.if..i p.ii iihi^u i ипкивасч расчетные >р
„....
I-
ИЗ
После
и!,',.',',
к при ракмяленнн рас; во
КС1)-и
,<![< 1,1
i.i
m,(HCI
i; (III
4(1 1.
-,(НС1).
'"И",
100
■]>/', ■
■шт
l.-IUUinil-niL 11
■р 3.15. Какой <>Si.cm вол
лцроцодпродной кнслотъ
ю 1,0471/мл?
pa масса растворенного
иетн.
ЯШМ искомого объем!
гаченнйлолутсм
ы (мл) нужно прилить
1, чтобы получил. 10%-
вы ражено малярной кониентрэиисй зк|
га, нужно прнюЮБИть раствор с чень
швано массовой долей. Дли любой
фактор nun»
обоих ссвдсоГюи ь
приравнять
мри p;i i'.ii' --.ими fi.iL iiit'p.i Miitta
их прав
ые части:
c(HC])MO\C\)-V, <u(HCt)C2 р
После с
аое уравне!
С,-
Полета]
V =
1000
окраще!
IHL-tllllll
с(\ KI)
ИМ 4HCJ
6- 36.5-
100
1ия чнаменагелей обеих ;
jiiTc-ibHO обьем;! нюрок
■Л/(НС1)- V,
оные значения и произш
1Ю0.2092„л.
растворенного вещ
робей на 100 реши
раствора:
:дем расчеты:
10101.047
Объем воды, которую надо прибавить, равен раэности объемов
p:iiii;iii.iciiiio!o и hniiioi i piiponainioi'o растворов:
И(Н,О) - 2092 - 1000 и 1092 мл.
Ответ: нужно прилить 1092 ми волы.
ПримерЗ.16. В результате выбривания щ 500 г 1%-ногО
раствора хлорида nai рин И1М\чон 2'|''и-и р,и.шор КчИ.он l^Ch.l'M воды (мл)
Решение.
.п, (р) = 500 г I Содержание х.'юрида натрия в обоих растворах
tti'(NaCI)= 1% выражено массовой долей ной соли. Запишем
aUNaCI} - 26% математические выражения массовой Д1
рида натрии для обоих растворов:
m(Hp)- 500-19,2 = 480,81.
ПЛОПЮОТЬ поды равна 1 г/мл, полому объем воды
и масис. M,nx;i ui.ni.ipi;irin4i iio.ii.i |>;iiiili 4SII.S ни объем
4808
3.3. ИНДИВИДУАЛЬНЫЕ!: ЗАДАНИЯ
Партии 1
1. В приложении 2 приведены состаны раетиоров, испоньчуемых
лля [ НДрОПОННОГО выращивания раепепий и условиях tauiHuiepiiiora
грунта. []ол>.!унс;ь ними л; f.imh. iii.i'iut.iniu молярную
концентрацию каждой и] tiuiL-ii и ни мой кисло гы, ичолнщих в состав питатель-
нош раствора Кионп. ПЛОТНОСТЬ раОТВОра принял, равной 1 г/мл.
2. В 240 мл ВОДЫ paciморили 10 i хлорида калия. Вычислигемас-
смуЮДОЛК) )тойсоли п пршошвленном растворе.
3. Какова молярная концентрация 2 н. раствора фосфорной кис-
логм, сслимролукшмднмкимч iiciii |iii.io шции hilihuium 1 илрофоиф»1!
натрия?
4. Сколько' i|ilimmmh .?>'^1-ш |i;njmo|iii i илрчк^и.и! калия нужно
прилить к 400 мл полы, чтобы пригонит и, 15%-й раствор?
5.Сколькомиллилн1|1ои2 м jiiiLiiiopacupHoM kmljki (ужновить
л,1н приготовления 3 л 0.06 н раствора?
U 2
I. В 100 мл вннограднот щаа, подучвиого пост дроблен
винограда, солержигся 0,5 мг кислорода. Вычислите молярную к<
цс1гтрацию S
2. Для опрыскивания садов ранней Recirciii к период покоя рас
гений используют 0.5%-й раствор сульфата меди. Сколько граммов
медного купороса нужно взять для приготовления 50 л такого
раствора? Плотность paciuopa принт ранной I г/мл.
3. Вычисли [с mi> гнрнч ю кошки ip.irL.Hio ?П" И-1Ч piic I Hi»pa хлорида
цинка (ПЛОТНОСТЬ 1.186 г/мл).
4. Какой станет массовая лпляактюй кислоты в растворе, если к
30 мл 20%-го растнерз (ШЮШООП 1,10 \Ы:\)добмнп 70 мл воды.
5. Какой объем воды нужпо добавить к 60 мл 0.8 М сульфита
натрия, чтобы приготовить раствор, титр которого равен 0.025 г/мл?
ВцшштЭ
1. Сколько i-раммов нитрата серспрл iivai я приюти и-мия
125 г 6%-го раствора?
2. В приложении 2 приведен состав питательного раствора [ель-
ригеля для гидропоннот выращивания растений и защищенном
грунте. Вычислите молярную концентрацию (мМОЙЬ/л) сульфата магния
В УГОМ раСТВОрС. ЛЛПТМО^ЗЬ р;ич|Цкрл П|'ИИЧИ. р.ПЧЮН 1 г/МЛ.
3. Каком мо гчрп;1« коничп рппин fOll..-!n рли i «op.i CL-рион hiir
готы (плотность 1.520 г/мл)?
4. Какой обьём 10%-lfl раствора карГюиата натрия (плотность
1,105 Г/МЛ)НС(10\0.1ИМ. 'ИчГч.| lipillOTDhHTI. 1 .|'"п-Ш p.TClEHipillll.lOI-
ность 1.020 г/мл)?
5. Заключи it ii.Hinicia.infii ирииннмсим очищенной фосфорной
КИСЛОТЫ. I1CI1O ||.1>С«11Н !) llpllll 1I1O.R4 lit КОр\НШ|,|\ (JH>U(||.LIOIV SI! IWLI-
СЯ K0KU«irrptipi4t;iiti<L-ii\ iCM»i,iii;ipiinaiiiiH волы Сколько литров воды
нужно выпарить из 50 л 5.14 М рас тира фосфорной кислоты
плотностью 1.26 г/мл, чтобы luviyimi. юнарныи нрол>кт. чолержашин
7d,5% кислоты, если его плотность равна 1.57 г/мл?
Вариант 4
1. СКОЛЬКО I |UMMOH I И ||1Ч1,,|| l.lfc,IIIIIIIU,IHMII4lb I 1Я lipillOU'll
ления 200 мл 0.5 М раствора?
2. Какова vo.iHpn.iM компонента 3t.Hifna.iL- счльфата кобальта
в растворе, если в 500 мл ею шлержитея 15.5 птой сил и? Раствор
непольэую1,г1я получения марокен i;i Ki4iajibTa(ll).
3. Вычислил; MiiL-uHtvui депо \.i<irni;w пинка в 1.75 М растворе с
ПЛОТНОСТЬЮ 1,19 Г/мл.
4. В ПИШеиии 11 fie 1м р.м it. luu IKic III IMVifiiif iipMMCHL'iini: i ндрофо*.-
фат натрия (техническое imtiuimte дина: рийфпсфаО. II производстве
этой соли испольщин 4^"hi-и |Kti I пчр «чичфчсфортн! кислоты
плотностью 1,29 г/мл. Сколько лпфпи hi4iriL4iipifjninajiiumi 76%-го ра-
товления IO;i 45%-го раствора?
5. Какой станет ШСООШДОПЯ (в %) врбонжп натрии, если к 100
г ек> 30%-ю p;n i huipj прилип. MI г1 воды?
1. Какова массовая доля клорида натрия в растворе, если в 300 I
ноды растворено 45 г -этой соли?
2. Сколько граммов хлор ила бария содержится в 25 мл 0,5 н.
pact вира?
3. Вычислите молярную к
миннн н 2 М paciBope 'лой
дич нплуюним I илро^сил;! п.починия.
4. К 345 мл 17,1%-го раствора i3OTHoH кислоты (I
1,1 г/мл) прилили 500 мл воды. Определите молнриую i
цию Ik);iv 'il'IIHohi ]iacim>pa (или лчемн 1.039 г/мл).
5. Какий ибъём 12%-го раствора хлорида натрия с Ш
1.085 г/мл необходим ди пряПУЮВЛення .100 мл 0,5 и. раствора?
Вщршюп ь
1. В приложении 2 нринелеи состав питателыюга растиира Ирн-
Киганнгаввдля гидропонного выраиштапия растений н чащищеннпм
грунте. Вычислите молярную кпицешрлцию(ммоль/л) гидрофосфа-
га кальция а т>ч pacnuipc. I Lioihoc ci. p;icnuip;L приннп, рлшой
1 г/мл.
2. Какова молярная концентрация эквивалент* сульфата muHOI
(II) в20%-ном растворе этой соли, плотность которого 1.21 г/мл?
Раствор испольчуюч дли получения гидроксида железа (II).
3. Какой объем воды слелует испарить, чтобы из 250 мл 0,5 н.
раствора хлорида н;прич iu\iiyuiii> И}, i'^i-н pj^iiiop с плотностью
1,075 г/мл?
4. СКОЛЬКО МЛ 15.2%-Ю p;iUlllopLl MpfiulLllJl IhllpHH (ПЛОТНОСТЬ
1,16 г/мл) нужно гчлч 11[1И1оцц1 к-лин riO \tt ИЧ13 М раствора?
1 Ul.l'lll. Ill i:.1 M ILL l-МЛ M ■ |ih 11.1 \ kipiI.Ul I H.I I 1111M li p;H IIUipi.'. HiM\ -
чеином при расмюрснин 50 i щщ соли в 1.5 .ili jp;i\ воды?
2. В каком ооъемс ll.ii и \глс rhnp;s содержится 4.2 у ортомышьяко-
ВИС I |>И КИС.Ю I III ' К.ИС.1О1 il Ik I S M.I С I Fl pCilKllllii i !>■' II^'M I lu J! rpLl.l 11-
3. Какова молярная концентрация 20%-го раствора гидроксида
натрия (плотность 1,22 г/мл)?
4. Сколько м.i 10,22%-! о ч.к'ридл иафич с шкп иоси>к» l,!05 i/mji
нужно для мриюгон.'юиим И)0 м i (ihj M раствора?
5. До какот объёма ciu/iji-i мгаршь 240 мл 3%-ю раствора
хлорида калия {гь'ютность 1,05 i/m;i), чтобы получить 2 М раствор?
Варианте
[.Для uptripiiiuiMiiaiiHM к_ ионии ксаргофеля ncpt.i пи^адкой
используют 0h02%-ii p.i. i iu>|> с\.||.ф,п,1 Mk.Mii. С ho.ii.ко 11i.iммои медного
купороса нужно 1пм1Ь для прпююи ll'HIih 1 (Ю л |;и.чю p;nj I luipaV ll.im-
иоси. pHiLLinop,uipiiHftti, piiiuioii I г/мл.
2. Вычислив MiicLOEtvio.'iojim viopH.m магния и 1.5 M растворе с
плотностью ],12 г/мл.
3. Определите молярную концентрацию эквивалента нитрата
серебра в растворе, титр которого равен 0.ОО17.
4. Какой обьёч воды ОЛН^П добавить к 25 мл 1 М раствора гид-
рокарбогша начрия. чтоб<4 получить 0.5 н. раствор?
5. Сколььо мл Я0%-1() piiciKopij [-идриксида калия плотностью
1,29 г/мл нужна для пригон ошесния 3 л 0,5 М раствора?
Вармаш 9
1. В приложении 2 приведены шс1авы растворов, используемых
для гидропонного выращивания растении в челониыч ватищенного
фунта. Польлм^сь этими данными, вычислите молярную
концентрацию каждой и1) солей а юг нон кислоты, js\i\i я щн\ и состав
питательного раствора Хошянда и Арнона I Ijuvi not i ь рас I нора принять
равной 1 г/мл.
2. Для производства кормового фосфага, техническое название
которого динатрийфосф:!]. пс1и>л|рЧ\'Ю1 45%-ii p.icinop орт(|)осфор-
рацию эквивалента фос1|шрио^ кискны в пом рас [воре, учитывая,
что химическое название дннатрийфосфата - гидрофосфат натрия.
3. Сколько мл 5%-го раствора сульфата железа (II) (ол
1,1 г/мл) можно приготовить из 15 мл 5 М раствора?
86
4. До какого объём
ji(]|H>Hcvi<>pcviitoK кисло
218%й (
1. Бордоскую жидкость, содержащую 5W | м.фоксида-сульфата
МСДИ, ИСПОЛЬЧум* Д. lit LI pi Пи.4 liI IIIII p.UIIIL 11 IU.4 IК HI ОИрМСКИВаНИЯ
плодовых растений к начше распускания почек, (киль ко граммов
медного купороса нужно епнм. для прикпои.тенил 100 л 5%-ой
бордоской жидкости (нломкч, и, 1,05 |,'мл), если при получении ее действу-
4CuSO, + ЗСа(ОН), = CuSO, ■ ЗСи(ОН)г + 3CaSO,.
2. Вычисли се \нынричю концам j]3iiiiino ikiihii;i icifi-i серной
кислоты в 17%-ом рас I порос шюпюотыо 1.12 i/мл. Кислота вступает в
рМХЦЙЮ полной пийтрализации.
3.Определити молярную концентрацию 6 и. pat i пора фосфорной
кислоты. Кислота вступаете реакцию полной нейтрализации.
4. Сколько i|i;imm.hi -">1>%ч.> ршиюри i илрокси.ч,! магрия нужно
прилить к 2S0 мл ним. чк>Г> ригоюпии. 12%-" раствор?
5. Какой oiii.OM IS.2%-ю раемюрл K:i;»liniiii.i i[;upnn (плотность
1.16 г/мл) необходим ujh iipiiiiiii>ii.ii:ii>!H 2>() мл 0.2 п. раствора этой
соли. Получи ,iii раснюрбудс! inaiiMiviciiciHOBaTbc избытком
хлороводородной кислоты.
1. В каком объёме 0,2 М раствора содержится 5.1 г нитрата
натрия?
2. Сколько |рамм(Ш с).Т1,ф;иа мели (II) содержшся в 2 л 0,5 н.
рас i нора, предназначенного для получения iидрчкеида меди (II)?
3. Определив ЬЮССОЦЖ) долю (в %) серной кислоты в 6 н.
растворе с плотностью 1.1 Б гЛЙ. Кислота вступает в реакцию полной
4. До какого объёма следует рачбавить 1,5 л 20%-го раствора
хлорида пагрич с iuioiiuiltmo 1,5 i/m;l. чюГл.| [гриютщи i, П.2 М рас шор''
5.Какойстане1 массовли доля рас шора (в%),если к 200 г 50%-го
раствора прилить 300 г воды?
Вариант 12
1. В приложении ? при 14 ц1 и i.i ою.шы p.K"im>|ion. ъи по imvcmi,i\
i [i\ и л1. I liuibiVHUi и им и ,iai ihi,i\th им'lilt ill ic мо. i при что концентра-
цию hrivk (oil и ; lo шг .i '-'ii мни Mis: ич ы \>.\i' iwnuu iJ. ciii: 4 ;lii еш i;i ie.lt.-
ного раствора Герике ILK4iu>cn pacriuipa ириннть равной 1 г/мл.
3. Определите \ю.шрич к' концентрацию жвивалента фосфорной
кислоты, если в 300 .мл pat i нора содержится 2.94 г, а продукты
реакции нейтрализации являекч i идрофосф.м натрия?
4. Сколько мл 96%-го раствора серной кислоты с плотностью
1,84 г/мл нужно .1.1 л ippin i>h>imi:hh4 1 л p.iL i nop;i e in i pi>.\E 0,025 i/мл?
5. До какою oGi.cmli ljic;i>ot \ ипрш к [ ■■() м е ?.%-io p;icutop;i
хлорида натрия плотностью 1,03 г/мл, чтобы получить 2 М растипр?
1. Какова молярная ШШЦРИ11ИНЦИ pMTBOpti селив I мл
се"осодержится 20 мг сульфаш ml-;W (II)?
2. Сколько граммов хлорида калия нужно для приготовления
250 мл 0,3 II. раствора?
3. Вычислите молнриую И111Ц1-]П]];1ПИ1О 1кпика;шЕ1га аммиакз В
24%-м растворе ШОТВООТЫО 0,910 г/мл.
4. Определи ii: массовую.юлю (в %) хлорида натрия в растворе,
если к 40 г 15%-го рас гворл прилили 10 i воды.
5. Какой объём 15%-ю г илрокси. ui k;i.iiih (i i:u> i e ioc i ь 1,13 г/мл)
нужен дли приготовления 1,5 л 0,25 н. раствора?
Вариант 14
1. Массовая доля жира и молоье p.nnu i.S"i> (. кчлько траммов
сливочного масла, co;icpvK;ii]LL4o Я2.^"и жи|<^ можею по.еучнть иг* 1 л
жир;! и i молока?
2. Какова .молярная концентрация жвивалента расгнора нитрата
бария, в 1,5 л которот содержится 195,75 г соли?
3. ОпрСДСЛИ J О МО Iм1111ч HM.L^MIOIIl p.ULMIo 1 Кн'м Г.1 p;fC NU41.1 <\>u. фор
4. Сколько мл 60%-го раствора серной кислоты (плотность
1,5 г/мл) нужно теть пи приготовления 5 л 12%-го раствора (плот-
ностЫ.ОЯг/мл)?
5. Какой объем nan.i 111*1111 прилип, к 50 мл 10,3%-го раствора
хлорида натрия илопки п.ю 1чО75 j m.l чиюм прчюкжнть 250 мл
0,5 н. рас гвора?
Вариант IS
1. В приложении Z прицелены соеi.kh.i p.itiBopoB. испольэуемых
для гидропонного выращивания растений и >'словия\ "шнииценного
мого раствора Kitoitn llmmioci l, paciiiop.i приняв равной i г/мл.
2. Определите молярную концентрацию карбоната натрия в
13%-м растворе плотностью 1,135 г/мл.
3- Рассчи I ли re m.ilcoi^ jo ло.ио (и ""f х.мрона юрод ной кислоты в
6 н. растворе. Плотность рас шора 1,1 г/мл.
4. Какой объём воды следует прилить к 25 мл I н. раствора гидра-
карбоната натрия, чтобы приготовить 0,5 М раствор?
5. В каких hcl4>iiu\ отношими**, и>/К!м смешать 62%-й раствор
серной кислоты и воды, чтобы мри! II [ниш |, ] 2"п-н раствор?
Вариант 16
1. Сколько граммов хлорида *o:ilm;i (III] содержится в 20 мл
40%-го раствора (плотность 1,133 г/мл)?
2. Определите мо.1ярн\ю копцешрапию эквивалента мюрида
цинка в растворе, в 100 мл которого содержится 1,11 г этой соли.
Раствор ислол1-ч\к>| д [и мо.|ун.'нин i идрпкепда Нинка.
3. Какова молярная muiiil-m 1р.шин 20'Vi о pat i вора хдороиодород-
4. Какой обьвм ВОДЫ нужно ПрНЛИть к 50 мл 2 М раствора
хлорида калия, чтобы iipiuoioniiHh 4%-ii ]1;кчиор с нлоеносчыо 1,05 |Умл?
5- С^НОЛ|>К(1 МЛ I '^"■'hi-I i> pill I 111)p.I I IL [|1цИ.\ и. 1,1 1.J.II1H (п.КЧ |[|)1.'||>
1,13 г/мл) нужно для нрнпчовле-ния 1.5 л 0,25 н. раствора?
Вариант 17
1. Какова мо 1ярмам мнщим i рлпия ра^шора. сс.ш и 200 мл его
растворено 1 В,5 г ВаС1; • 2Н;О7
2. Опрсдслик- M(i.iupii\io комнен ip.innio iKiiiin.i.ieiiTa хлорида
меди{Н) в 16%-м расiворе мюрида меди (II) плотностью 1,18 г/мл.
Раствор иегюльэуют для получения гидроксида меди.
3. Вычисти- (и %| НКСОЦун НПО i.4 M раствора нитрата
серебра (плотность 1.18 г/мл).
4. Какой пГуы-м води ниибчолмми добавить к 1,0 л 3 Й%-го
раствора хлороводоро inoii кис-'ion.j (п-|опи>с"Г!. 1.] S1' r'^i.ij. чтобы
приготовить 18%-н раствор (плотность 1.089 г/ил)?
5- В каких поьёмшр]\ очппопи-чтях 1{\жно смемизть 1 н. раствор
уксусной кислоты и волу, чтобы приготовить 0,05 н. раствор?
Вариант 18
I. В приложении 2 привс;
ию гидрофосфата кальцин (в пересчете на безводную соль) в пи
;льном растворе Прянишникова. Плотность раствора принять р:
эй I г/мл. Как наэышвга фосфорное удобрение, используемое л
зшотовлкния лого раствора'.'
2. Вычисликмшярную kohlich ip.mino жвнвалента хлорида и:
ля в растворе, и I мл когорт а содержи1! си 0,028 г этой сопи.
3. Определите молярную концчмр.щиш 5%-ю раствора азоти
4. Сколько мл 12 и рас шора сирмон кислшы Е1ужно взять дня
ириншпшеппн ММ) м I .H)% in piicшора плотностью 1,14 г/мл?
5. До какою обьеч;! 1!\жио мшрпи. 2Л5 мл ().! М pueiHopa CL'p-
1,1488 г/мл?
Вариант 19
1. В каком чГ'ьсмс > М [i.ii: i iu>[i:l livic;i>k]iii_4 50 i KiiipaiLi kj.liim1'
2. Рассчитайте тнтр 0.2 н. раствора карбоната натрия.Сот*
вступает в реакцию обрачовання кислой соли.
З.Опредатгл ттрцуюнжпвнгршию 17%-го раствора серной
кислоты {плотность 1.12 г/мл).
4. СКОЛЬКО МЛ 17,7%-ю pjLmopa карГюната itai'piiH (плотность
1,19 г/мл) нужно ;lih Eipin оюиленыя 50 мл 0.5 М раствора?
5. Какой 0<ММ волы нужно прилить к 100 ми 24%-го раствора
аммиака нлотностьк10,9| г/ч;|, ччоГи.! ирт.ч.пчиь 5Гг ;.-й pacieop
плотностью 0,97 г/мл.
Вариант 20
1. Сколько i p.iMMon i и. [poi.tii. i.i iiaipim н>/кпо;и1л приготовления
3 л 10%-го раствора с плотностью 1,115 г/мл?
2. В каком ооьеме 0.' п. p;ici nopni ^imi_l|1'1.ihl4 З.'Л 5 j" карбоната
калия? Pacnsop кмичпдепс! iivl'i с m'ioi.i i ком хлороводородной кис-
3. Оирелилии: молярную кшщеиiрацию жиишленга гидроксида
кальция в 0.18 М расшорс Ооноваши кяупат и реакцию полной
4. Сколько мл виды нужно прилет
серной кисло! ы, чтобы приготовить 1,1
вступает в реакцию полной нейтрализм
5. В каких весовых соотношениях нужно смешить 50%-й раствор
гидрокенда пагрия с водой, чтобы получить 30%-й раствор?
90
liiip кант 21
1. В приложении 2 прицелим сосшнм расшнрои. используемых
для гидрононнпю in.1рнП1пи<|1 мил |VK"itHHJi и \^.юииж laiiiKiiiciiiinio
грунта. Польчучсп и ими /i.liiiil.imh, hihE'uil им с \шлнри\ю
концентрацию сульфата магния (в ПЦМСЧМ на бсчиндную соль) в питательном
растворе Хоглинда и Лрмома IIюшоси, рисшора принять равной
I г/мл.
2. Какова молярная концентрация эквивалента карбоната натрия,
если в 500 мл раствора содержится 0,075 тэтой соли? Раствор взди-
MO.lClicilUCi L LI SUM IMIM \ ЮрОИОДОрОДИОЙ КИСЛОТЫ,
3. Опрслс.шк' Mi> шричю концст рацию и ыолнрн>ю
концентрацию эквивалеш;! i iiipotnui к.\.шя к 20%-ам растворе этого
основания (плотность 1,17 г/мл).
4. Сколько мл воды irj-жно прилить к 200 г 20%-го раствора
хлороводородной кислоты плотностью 1,098 г/мл, чтобы приготовить
5%-й раствор плотностью 1,032 г/мл?
5. Какой объем П u. i илроксила аммония необходим, чтобы
после рачбавленнн munii upiiriMonitib 3 Л 4 Нг раствора?
Вариант 22
1. Вычислите м<1.|ч['и>ю котили р^нию и \н\гири\к>
концентрацию 1квивален i ;i i и.1|иж*'ид,11 ill i рмм и p;iLi поре, ^>(f \тл которого
содержат 45 г этого вещества?
2. Рассчитать пир 5%-ю рж n>np,i liii^iinipEioii кисюты
плотностью 1,027 г/мл.
3. Определит массовую долю нитрата никеля (II) (в %) в 1 М
растворе этой соли {плотность 1,14 г/мл).
4. Каной fty/ii'i милчрнаи мищешрациы ржтвора гидроксида на-
ТрИЧ, еСЛИ К Ы)() М I >.?"'||-Ю pilL. I иорл JKI] О [>LI[1HUIH11H С ПЛОТНОСТЬЮ
1,560 г/мл прилить 400 мл воды?
5. Сколько мл 30%-ю раствора гилроксида калия (плотность
1,29 г/мл) нужно для приготовления 3 л 0,5 М раствора?
Вариант 23
1. В 100 м.1 но |ы рас! пори ш 21А л i ;моообраэного члороводоро-
да (н.у.). Вычислите массовую долю растворенною вещества в полу-
чининч ржгворе,
2. Сколько граммов нитрата нл1рин iuh,iio j."i4 приготовления
500 мл 2.5 н. раствора?
3. Рассчитай ie ч11.1Я|1п\1о концентрацию эквивалента
фосфористой кислоты в 2 М растворе, если она вспупает в реакцию полной
нейтрализации.
4. Какой объём 10%-io раствора Шлроксида к;
1,1 г/мл необходим .i.ik ирииниилсши Я00 мл раствора С тигром
0,02852 г/мл?
5. До какого оГи.ема нужно ра;башчь 20 m.i 20%-го раствора
хлорида меди (II) плотностью 1,2 г/мл, чтобы приготовить 0,5 М
раствор?
Вариант 24
1. В приложении 2 приведены составы растворов, используемых
для гидропонного выращивания растении в условиях защищенного
грунта. Пользуясь ними .ушными, иычпслни' suuiHpnvio
концентрации! с\.л,ф;п;| клльцкя m iii'jh_-llil4o ii.i ou mo. ih\io соль) в
питательном растворе Пршшшникоаа. I Ьошосп, раогнора принять ранной
1 г/мл.
2. Определите массовую долю хлорида магния в растворе с
плотностью 1,02 г/мл, если ишесшо. Ч1ч в 20 мл этого раствора
содержится 3 г сопи.
3. Вычис.'шк' MiuwpnMo Koiiijtiiip.iiiHio и молчр>г\'ю
концентрацию эквнва-ifnrii a№iiiii)i кислоты в 20%-м растворе плотностью
1,22 г/мл.
4. До какого объема нужно разбавить 10 мл 20.9%-го раствора
серной кислоты плотностью 1.15 г/мл, чтобы приготовить 0.1 М ра-
5. Сколько мл 50.71%-го раствора азотной кислоты плотностью
1,32 г/мл нужно /мя ripniHUMUL'iiMn 250 \iri 0.5 н. раствора?
Варнагп 25
1. Для приготовления 100 л вор; in с кой жидкости, обладающей
фунгицидным действием, берут I м негашеной ишссти и 1 кг
медного купороса [Iciainoiyioirtnccii. upciHiipurejibHO гасят небольшим
количеством воды. Затем проводи реакцию:
4CuSO4 + 3Ca{OH)j = CuSOs- 3Cu(OH); + 3CaSOa.
Вычислите массовую долю гид pOKcnjui-cv.-ihijiiiia меди в подучен-
ной бордоской жидкости, если ее плотность равна I г/мл.
2. Определите массок>1п чи.мо opii>(|mti|nipniiii кислоты в 1,9 н.
растворе плотностью 1,031 г/мя, если она вступает в реакцию нол-
3. Какова ьимчрщм кинцсшр.тич р.югЕюра. в 1 мл которот'о
содержится 0,028 г иол ила кадия?
4. В каких обьВпных соотношениях нужно смешать 6 и. рас i вор
азотной кислоты и воды, чтобы приюговигь 2 н. раствор?
5. Какой ОбъВм поды нужно добавить к 1500 мл 13 н. раствора
шдроксида аммония, чгобм прикнопим. 14%-й растворе плогнос-
ГЫО 0,946 г/мл?
1. Какова молярная к
в 0,5 л которого содержится 50 г этой соли?
2. Сколько граммов никелевого купороса нужно взять для
приготовления 2 л 0,5 н. рас I нора l\ п.ф.п ,ч HUhnj.in ' !'lii:lhop используют
для получения г и дроке ила никеля,
3. Канона млесиипи.|п <и vmpii i.i \\м ник н 1.5 М растворе
плотностью 1,12 г/мл?
4. Сколько мл вилы нужно прилить к 10,0 мл 12 н. раствора
хлороводородной кислоты, чтобы приготовить 0,1 н. раствор?
5. Какой ciaiiLM мэссшшч .юлч \ юриои ки^кны ь pat:торе, ес;1Н
к 10 мл 20%-го раствора (плотность 1,13 г/мл) добавить 40 мл воды?
Вариант 27
1. В приложении 2 приведены составы растворов, используемых
для гидроионною ныратинанин раоенпн и \июиия\ (ащищенного
i руша Мо.г1ьз\ыс1. <| ими данными. hi»i'iiil\iiiic молярную
концентрацию каждой га солей калия, входящих в состав питательного
раствора Кнона. Нлоиюш, рас i кира прими и. ранной 1 г/мл.
2. В каком обьемс 0,0ft н. раствора содержится 2,5 г нолила
3. Какова молярная конпешрация 20%-го раствора i и дроке и да
натрия плотностью 1,22 г/мл?
4. До какого iiiii.iMH нужно раЛпчш. 1,5 л 20%-ю раствора
хлорида аммония и loiMocii.io 1,1)57 i/мл. 'iiiu'iu при ни овить 10%-й
раствор плотностью 1,029 г/мл?
5. Сколько мл ''),4%-ю paciHdp.i i идр.жсила ка,шя плотностью
1,41 г/мл нужно для приютопления 500 мл 0,1 н. раствора?
р
1. В каком oilbiive 0,5 М расторг содержится 30,3 г нитрата
калия?
2. Определите массовую долю аммиака в 15 и. растворе плопше-
тью 0.898 г/мл.
.' Hm'ihcihio Mi'inpmi" hi'Miii и i [i.uuiK' "-KFiii KlI .ien ] ;i i;\rj[,'j>,j[,i
■железа (II) в 20%-н растворе плотностью 1.21 г/мл. Соль вступает в
реакцию, в результате которой образуется гидроксид желета (II).
93
4. Во сколько pai следует упарить 3 я 0,5 М раствора гидроксида
калия, чтобы ihuyiiin, S%-ii рас шор с и ihiiiikiw 1.05 г/мл?
5. СКОЛЬКИМ 1 l'».')S".ii П CC|J![(1M KHU.riH hi IMIHIIOIME.K) 1,3 Г/МЛ НУЖНО
для приготовления ? i ]iHii. iiio[],i. иир коиi|>i4 Li I'.iiiL'ii (1,097 г/мл?
Вариант 29
1. Клубни картофеля перед посадкой протравливают раствором
сульфата мели. Дли прнпшчиинии i акт i> рас шора 3.125 кг медного
купороса растиориди и Н)0 ..i ikui,i Вычислиiс массовую долю
сульфата меди о полученном pai: 1'норе.
2. Какова молнрная концентрация I.1) а. расгворафосфорной
кислоты, который вегупас! и реакцию muiHiiii ней град шации?
3. Вычислена пир П.^ М р,и_ i nnp;i LL-piroii кислотьи
4. Какой (">ы/м iiHi'ii.i HV/KHi' мрп.иш. к 2^ мл I M раствора
гидрокарбоната натрия. чн»ш,1 и [шпионить 0,5 М раствора?
5. Ск,)Л1.К1> v.i I D.12" o-i v [чк, норл \.юри.ш нагрия (гиютность 1.105
г/мл) Егужно inn I h. юм ПрИГОПЯПШи 100 ИЛ 0,2 М раствора?
Вариант 30
1. В приложении 2 ириве.юны составы paeieopoB, испольэуемых
для гидропонного выращивания растений п \с;юШ1я\ шщшиемишч»
грунта. По.ть^чмс!. 'ними дапиммч. вычис.шге молярную
концентрацию каллой in co-iL'ii ачотиои kiic-ion.i. йчодяших в состав
питательного раствора Гсрнкс. Плотность раствора принять равной ! г/мл.
2. Какова V.K4HH.14 чили i ii ipouii i,i н.ирия в 2 и. растворе с
плотностью 1,08 г/мл?
3. Вычислиle мо.чяри) ю hiimicinpniinio эквивалента фосфорной
киенты b5%-iui рлс [ пирс <; ii.ioiiioi:ii,io I.027 г/мл при условии
полной нейтрал та цн и.
4. Сколько мл 15%-го раствора гидроксида калия плотностью
1,13 г/мл нужно 1пн jь ;uih ирнююилеиня 1 L> л 0,25 н. раствора?
5. Во сколько р,п 1_ ilviwi \пари 11. 4 ji 0ч l'!'u-m раонюра i Li.ifioKLH-
да натрия плотностью 1,0 г/мл, чтобы получить 0,125 н. раствор?
Глава 4. РАСТВОРЫ 'ЭЛЕКТРОЛИТОВ.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Повторить: глава 4, раздел 4.1 «Основные понятия и причин
нмического равновесия»: глава 6, раздел 6.2 «Способы нырпжеш»
остава растворов».
4.1. ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К КОЛЛОКВИУМУ
4. Какими Tjieinpo.iiHjuiHcii.ii. чи или слабыми) я
шнетво солей?
5. Чтотакое гидратация?
6. Чем сильная i ил ратания отличается от слабой?
7. Что такое UOmHOOn и коэффициент активности?
9. Что такое степе..- „..
>ствальла?
11. Что такое водородный и
12. Ч го такое гндроксильпь
уры?
иературы?
22°С?
16. Как етаичосичишм iio.inpo.nii.iii и i н.цн.кип.и.ш,!"
1?. Что такое буферные растворы?
18. Ич чею «живи Г>>ф(.-р1!ые растворы?
19 Опишите мсканичм лен^миш Гпф^рнич ршчиирпк
4.2. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задачи на ммш развейения 0стиа.1ы)а
Этот закон ПРИЧИНИТ взаимосвячь между константой 1
<i диссоциации с.кюок) исмролита;
к= -—,
Если степень диссоциации пренебрежимо мала по сравнению с
единицей (а« I). ГО можно считать, что ратность \ - а = 1. В этом
случае/С - CLi. <>к 10:1,1 можно Iни)чи и, > fiamieiiiii*. пошо.ыющсе оце-
для любой концентрации pact вора:
и ^ (4.1)
янная величина, не аниснишн ч h.niiii'iiiранни. Числовые значения
констант диссоциации важнейших слабых электролитов приведены
в приложении Л.
Пример 4.1. Иычислшс L-iciicHi, диссоциации (в %) ачотистой
ьисгго"1м pi ПЛ) I \1 растворе.
Решение.
e(HNOJ = 0.01 моль/л I В приложении 3
Следует отмстить, что резуль
лл'А [ipm"i.jи uiill ibiKiii оценки LTi'
Ответ: 21%.
Задачи ни определение водородного и гидрпксилышги
тжнтип1 ti'n /т и ttn'i'tiiitht if ншченини кинцентрицнм
miiltipoda u-iu .■mipriraiid-umine
Прежде
вспомнить, ч
Десятнчрф
I ц||)Ч 141 ]f\ /Kiln IL'111Ц-(. i El III. Ч 14Н]|<1 М
I ,'ltCH I il'llll I \ I N -i^'1 ■'' 4 '.'' '■!■ 'i !'■ ICI Kl.]E> SOHill l>
сякалькуляюроч или (лишними дсчинчмы.у.г.нарифчов. Ниже
приведена упрошенная таблица, пи (воняющая определи ib числовые
значения рН и рОИ. если ичвестна активность (концентрация) катионов
волорода II" и.hi i илрора'и.ч-нонов ОН , и, if;ux>opoi. находить
активность (концентрацию) катионов И1 и гидроксид-ионов ОН по данно-
огличаесся or 1нм»пмы\ Kifvnur .101 .ьрпфмпн и апги.ю/арифмов-
Приемы работы с ней разъяснены в примерах 4.2 и 4.5.
Таблица 4 I. Расчет водородного поктиатсш
Л 1 ..(КН. |!Um |.1.<М
!» ■"■ ■
"■г; п' :'! '■ "::;" :'j:- :;;:L
'<>'■*. :!Ms 'HIJ !!;'"-
■' '' "!'■■ ■■■■"
) г граций Поэтому при небольших ко «цен-
но прснсбрС! агь, рассчитывая рН раствора
ионов гидрокси.и.111.in пок;н.1 гель нужно также расе
pOll--lg[/IOH]}.
Возникает вопрос: о] "де же та граница^ которая отделяет
концентрации, при которых для расчета р[ [ и рОН нужно брать активности
ионов, от концом I p,nilш. мри hOJopi.i-. ;[|>с1а1ччм<1 е^о ррекмгым будет
расчет этих величин iV'ty^'i.i ю+ффш1иснтов акгивносч и1'»
Несложный расчет показывает, что при концентрациях порядка 10"1 моль/л
центрации рлг1.111'1лю1ся мсж'1\ соппл на ;icchii,ic дпли процента.
Таким отличием можно пренебречь. Однако при концентрациях
порядка 10' моль/л укачанное отличие уже превышает десять процентов, и
нм пренебрегать нельзя. Очевидно, что искомая граница приходится
на копцшм ранни порядки 10 молг./л.длы кошрых оничис числовых
стей и концентраций сое] ан ы*11 >'с^к > м ко 11[^о]ц''г г or 11ри коггцеггт-
рациях выше 0,01 моль/л при расчете рН следует принимать во
внимание отличие активности от концентрации. При концентрациях ниже
0,01 моль отличием активности от концентрации можно пренебречь.
Необходимые для расчета числовые значения коэффициентов
активности, как правило, приводятся в условиях задачи
Пример 4,2. вычисли 1С рЕ I юмлшши соьач пишем 1|миин
катионов водорода в когором составляет 4,79 ■ IO"Sмоль/л.
Решение.
как в томатном соке концентрация
в водорода мала, можно пренебречь
' нцентрации
[Н'] и вычислять водородный показатель по уравн
pH = -lg[H-].
Iкосiau.iчем и мо \р,пикчи|е мщ eoh.ic ш.ги'ммс i.^immunjiiimii
pH = -lg(4,79- ]0-s).
Для того чтобы восполь-юваться таблицей -1.1, пре™">р;п>ем ч
ловое выражение концентрации следующим образом: 4,79 умнож
(4,79- 10'КЮ'- 10') = 0,479- ЮЛ
С учетом этого преобразования
pH = -lg (0,479- Ю-1).
Логарифм произведения равен сумме логарифмов, поэтому
pH = -lg 0,479 -Lg 10-.
Для того чтобы получить 10 "\ лесяты
поэтому
-lg ](И=4.
Таким образом, целочисленная часть водородне
Для оиредслишш щи чисш лигарифма. которая стот после
запятой, в таблице находим значение а,,*, равное 0,479. чагем, двигаясь от
нега влево построке, находим значение десятых долей 0.3 в столбце
«Десятые доли рНч. После этого, двигаясь огО,479 вверх по столбцу,
находим в строке значение сотых долей 0,02 в строке «Сотые доли
рН»:
:а 4.32.
Пример 4.3. Вычислите рН крови человека, если концентрация
гид роке ил-ионов в ней составляет 2,24 ■ 10~'моль/л.
грация гидроксид-ионов, а для расчета
м случае активность а„* можно принять равной кон-
"о расчета будет видно, что концен-
1в водорода и гидро-
И воды:
[ОН-] = 2,24- Ю'м
лорода (в да
центрации.т
фация [Н'] очень мала). Концентрации
аны между собой
[Н-][ОН]=10".
-0.446 10 'моль/л.
l" J [OH ] '
10""
Водородный
p g[],
рН = -ig (0,446 - 10I) = 7,35.
Ответ: рН кропи человека 7,35.
Пример 4.4. Вычислите рН расин;
дорода в котором составляет 0.1 мо/
равен 0,796.
Решение.
jcoKa, поэтому при расчете pi 1
следует учитывать отличие активности от
концентрации и производить расчет при помощи
адач, обратный предыдущему Найш концентрацию или
атионов водорода по заданному значению рН можно при
ькулятора (функция ti') или при помощи приведенной
выше упрощенной 1аблицы логарифмов. Так как рН - это
отрицательный десятичный логарифм, то есть взятый ео таком «минус»
показатель степени, в которую нужно иозвести 10, чтобы получить
число, равное активности кашонов водорода, ю активность качио-
род, мо«™о «ыни.лил. пр» помощи П-ш.
Пример 4.S. I
роке ид-ионов в в*
Решение.
[]
Затем на\одич и кр.ишои lunofi ^
ые доли Дробно и 'исш иодородною
е, которая начинается с '»гой цифры,
олонкой, в верхней части которой на
|я 0,02, находим число 0.15
«Десятые доли рНвдеся-
,8. Двигаясь по стро-
направо до пересечения с
доли водородно-
[H-I = 0,151 ■ 10'= 1,51 ■ 10"» моль/л.
Следует запомнить, что концентрация катионов подорода, вычис
ленная иехолм и! шлчення р!1ч это всегда молярная концентрация.
Осталось вычислить концентрацию гидроксид-ионов. Сумма во
дородного и п
liUHO И I II 1JH1KUI II.IIDKl
рН + рОН - 14.
Подставляем числовое значение pi Ь
рОН = 14-7.82 = 6,18.
торую надо возвести 10. чтобы получить числовое значение конц
трации гидроксид-ионов, то есть
1ОН]=10<™.
Подставляем чле.инше ша'и-мие pOH:
[ОЩ=10-*«.
I ])ii iuhuhhh i.i" ищи IUVUII4
10"s=0,661 ■ 10-*.
Таким образом, концентрация г и лрокс ил-ионов равна
|ОН"] = 0.661 10-» = 6,61 ■ 10'моль/л.
Ответ: |Н'| = 1.51 ■ 10" моль/л. [ОН ■] = 6,61 ■ 10'моль/л.
Задачи на расчет рН СНАШШХ МОСМрСШМКМ
Приступая к решению задач этого типа, необходимо вспомни
ЛИСОЩ11Ир\Ю| | LlMJlllMq). СИЛЫ1ЛН ХЛОротМорОЛПЛН КИС
СТЬЮ диссоциирую ei;i кпшпиы ичдор'Ш 11 \лорид-ионы:
HCI -^ Н' + О .
Ич уравнения милно. что число про;шссоциирои;|вш
\;гороводоро;1ноГ| кислоты равно чш..'1\ обр^'юПчИчинчс
нолорпла, пояоч) концентрации
сильной OAHOiKtiiHiiioii косины piiH
Сильное основание гидроксил К1лия полное i i.m лисеоциируег
катио11Ь1^калиди^п1лроксид ионы.
Из уравнения реакции видно, что
в растворе силыни i> (i;im>Kin:.imnoi о
этого основания: [ОН ] = си„.
При решении задач этого типа необходимо также помнить, что
ДЛЯ расчета pi I цч'Гльчся мо.шрипя luiiiпатриция клпюпов во;и>р»да
Н", а для расЧ1-1,1 рП| [ моляриин ытгк-трипин i илроксид-иоион
он'.
_'MU>|1.1 Upline И. p.lBMIli
Решение.
м (КОН) = 5,6 10 '%
I /
Начинай решение чадачн.следует перейти
Е^ражсния состава раствора в массовых
В к выражению его через молярную кон-
ценграцию. потому что при расчеге
водородй ф
р у р р
гидрокенльного пока шслей пол таком логарифма могут н
раже-
диться только молярные концентрации соответствующих ион
Т ы подробно ратобраны в главе 3 «Способы
р р
ассоиой доли и молярной концентрации:
„„кон, --^Ша.
Так как масса раснюренною вешества при переходе от одного с
ciii~;j т.флж^пни ■_ч>^-1-u^t |>.ii-■ iu»p,s к i|hilai\ hl- ir 1\гсн>п.чся. левые час
оооич \p.iiiiiir'iiiin | и hi и.i и чм.мю прирчМитп. и\ ираш.ЕС част:
c(KOIi)M{KOII)V _ a(KOH)Vp
I nim [00
Решаем новое уравнение итноеительло молярной концентрации ги
щкон) ■
Подставляем числовые и ючени я же\ величин, входящих впр
уравнения, и вычисляем молярную концентрацию гидрокии
с(КОИ). "'««'1 .|0.м.,ь„.
KoHiieiupaiLiiw I и 1рчь^ил-л^ноп н p;ii_i iMpc i идрокснда i
(),
=101моль/л.
онцентрация невелика, можно пренебречь ее отличием
рассчитать гидрою и и.иый ijok.hljil il но уравнению:
рОН—itfOifl,
OHl 10J 3
жфма ионного произведения iio.ii.i и гидроксиль-
pll= 14-рОН,
рН = 14-3 = 11.
Ответ: рЧ П.
В примере 4Ъ при расчею учитывалась исключительно концент-
рация ГНДРОССЯД-ИОНОВ, образующихся при диссоциации сильною
электролита, и не принималось во внимание, чго гидроксид-ионы
образуются не только при диссоциации КОН, но и при диссоциации
воды. Однако, пренебрегать увеличением концентрации гндроксид-
ионов в растиоре сильною oLiioh.wiHw и упсл имен нем концентрации
ролита достаточно велика к превышает 10 ' моль/л. При расчетах рМ
следует принимать во внимание диссоциацию воды. Такие расчеты
выходят ia рамки данного пособия.
Задачи на расчет рН ВЯОвых }■ н-ктри.шптв
Слабые ишктролиты диссоциируют неполноегью. поэтому в
растворах слабых кислот концентрация катионов водорода не равна
концентрации кислоты: {Н'1 * с , а в растворах слабых оснований
коиценф.щнх I идроксид-иопл Hi* рлппа комцещрацни оено:
[ОН'] &с .По ной причине .ъш ;исчета pi! растворов слабы:
тролигов"необходимы консташы диссоциации, числовые ш.
которых можно найти в приложении 3.
Пример 4.7. Вычислите рН 0,1 н. раствора уксусной кисл!
Решение.
^CH^OOID^O,! моль/л I Слабая уксусна)
' руст обрати!
СН,СООН f±CH,COO +НГ.
I'.C ДИССОЦПЛКПМ IILMMIIIim'ILII UKtill) Л^ИиШу]
rcptnycicH Koiiciaiiioii равновесия:
= [СИ1СОО'||П'1
[CH.COOH] '
ИГ1 урав-F-icii-tiы |ч'.1к]|ми ли^.4 1Ч[и:щнн йндно, Ч"
CreiK
[СН,СОО] =
10
100%= 1.3%,
исшраиня мспроднссоцинровавши>
иогзту^'\ ран1Юн^снэ!
к>;1 чкс>смой кисло[i.i \т;ыч щ.1пч:къгся or ее полной концентрат
[СН,СООИ) = е(жл.
[С Н!г7х^|'м'ви1|"'):^1С1»11|!\|'ч"^>1о"йМгТ/Л"»"счЭо"]^
мерно равную ей с№:
I» ее растворов равна моляр-
[H'l = Vl.75-10''l0"' ■ 1,32- 10 'моль/л.
«рН:
pH--!g(0.)32' 10 -)- 2.S8.
Ответ: pi I 2,88.
В примере 4.7 степень диссоциации слабой ки
точно малой и полому можно было пренебречь
рации ненродисеокииринашиих молекул уксусной
ной концентрации. I или i: k-iiciii. л поищи.шин слабою
достаточно велика и пренышж! 5%. при расчете следует пр
В разбавленных растворах слабых эЛШСГрОШГОВ нужно
створа слабой кислоты прононс
му значению с ионным ирчите
онов водорода UIWQVI рассчип
Пример 4.8. 14 994hL> i поды piicinopnriii 6.72 л газообразного
аммиака, объем которою нчмерен при нормальных условиях.
Вычислите рН получение! о piitriiopd. [i.imiiocTb его равна 0.998 г/мл.
Решение.
(,) J
р(раствора) = 0.998 г/мл
сю говорят, что
ка в воде обрату
го что мплск\.1ы Lotiiiiui N[ f .ОН не с\ iuceiLByiorh 1акое
к' ок;н1.нцк'[1:ч \.u»"]mi>im л.1 л k,in.з,1нлсния уравнений
ре>м'ч1Ю111ПЛ неполные lihiiiolUhI и»1Д1И>г\ p,ic"imipoii амм>1а-
, написан реакцию-ijivKipcuiiiiH'iei: кой лис соииациигид-
к
[NH.OH]
№ уравнения реакции И
[NH/] = [ОН ].
Заменив в 4Mcnntc.it:> рапнсшм
[1.1141>ю ^'И JmiHIICII I I'.lllllli' I IL ipi'
ле [NH.OHJ как с^конце
Для того чтобы в
цию гидрокснд-ионов в растворе амм(
лярн\Н1 концентрацию а
цию несуществующего 1"илрокснла а
аммиаки разделим на молярный объем и
m(NH,)= 170,3 = 5.1 г.
Сложив массы иолы и раст воренного амм
ЧБШЯГО раствора:
т(раствора) = м(Н,О) + mCNH,),
«(раствора) ■ 994,9 + 5.1 = 1000 г.
Ратделив массу раствора на
/Краствора) '
Нрас™,ра)=^= 1002 мл.
После этого расс'|ип,1ваем мачярную концентрацию раствора а»
'<NH.'-«(N,I,H>.'.U.)'°°°'
Подспав:1ЧЧ
М'ткм i |i.ii'
ионом, получаем
[ОН] = Vl.75-10-'-3-l<r' - V5.25-10"s= 2,29 ■ 10"; моль/д.
Вычиспчем 1м.'фикиим>и1.шч a ijiifM mi.'iopiuui.in показатели раство-
pOH = -lB(2,29- 10')-2,64,
pH = 14 - pOH - 14 - 2,64 = 11,36.
Ответ: 11.36.
Зчдачи па расчет рН буферных растворов
Буферные растворы, как правило, состоя г инбо из слабой
кислоты и ее сопи, либо in слабого основания и его соли. Формулы для
расчета водоролио! и и i идроксилыюго иокачагелей для таких
буферных расгворо и приведены в таблице 8.4 учебника Д,А. Князева. С.Н.
Смарыгина llblllfHlimrnrH химия». В ттой же таблице приведены
форм\гл],; .i."iн p^lml'ij кимцемф.ишн k.ii iKiiiim m\iOf4>ja и гидроксид
ионоь ь б\<|к:рш>1\ растворах.
Пример 4.8. Вычислите pi I расгяоря, в 500 мл которого
содержится 3 г уксусной кислоты и 4.1 г ацетата натрия.
Решение.
т(СН.СООН) = 3 г
(CHC4KJN) 1
a pll буферного раствора
. молярные концентрации
остав электролитов. Вы-
т(СН;СООН)
A/(t'ii,СОПИ)''(рас iBOpj)
"""""■
рН = - lg (1,75 ■ lO'Mg —= 4,76.
Ответ: р]\ 4,76.
Пример 4.9. К 236.2 мл I п. раствора уксусной кислоты прилили
50 мл I и. раствора гидроксила натрии. Вычислите рН полученного
буферного раствора.
Решение.
f(CH,COOH) = 236.2 м
(.■(СИХ'ООН) = 1 моль/
l-'(NaUII) - 50 мл
c(NaOH) = 1 моль/л
При смешении растворов уксусной
кислои.1 и i и.[роксила ширия происходит
реакция нейтрализации:
будет нейтрализован 50 м
Таким образом, дли Hc;ii[p-iriiH;iijiiH мрилиино объема 1"нлроксида
натрия требуокч 50 мл рпсишр.] \ h^L\i.-iik^Li кислоты.
В реальных ><\кшин\ pLL;ihi<m ирот-миш нч I'CCM i>6i.l-mc и^л>-
чснногорасмюрл, и чГц.см mm> расмчфл s кс итчии-ился в результате
ирибшчлсиин к p;it;iiu>pv kikj.ioil.i |j;u i noptt iiuiiHiaiiin. Однако для
упрощении расчет можно представить i:c6c, что раствор, в котором
произошла plenum мцйфшипации, иосмсшиписеся с раствором нс-
прореагировлшисй кислты, и что общий объем piicmopa остается
неизменным, равным исходному, i.e. 236.2 мл Иольчуясь этой
моделью, можно ска-iaib, что объем 1 н. расчвора кислоты, вегупившей в
реакцию с i илриксилом натрия, равен 50 мл и в этом объеме кислота
превратилась к СОЛЬ - ацетаг натрия Концентрация образовавшейся
соли будет pa»n;i ii^Mvuioli кии lien [рации кислоты, так как согласно
уравнению реакции in I моль kvicjioim о(1р:и\^т^я I моль соли.
Таким образом, при пчаичодеистии i илрлксида натрия с уксусной
кислотой Mki.i>40inO() M.i 1 и p.iLUiop;i соли Ooi.l'm In укс>снон кисло-
ты, не вступившей в реакцию, равен разносги исходного объема и
объема кислоты, нейтра-читованнон основанием: 236,2 - 50 = 186.2 мл.
Итак, получен Гп<|и:рмми |Ui_ пчор L i>l uiMiiiiiii Hi I B6.2 мл 1 н.
раствора уксусной кислоты и 50 мл 1 и. раствора ацетата натрия.
Рассчитать рН такого раствора можно по уравнению
ло£Г™."|
молярными к
км if.itijpaiiirciinf 4iic.uiiii.it umi
1ЦП1 ф.ЩНП И 4L»h.iLML4H Л-1И iUlli41L>li
сгата натрия, у которого фактор экв
■-«п рки» С1„™»от по чнс
щцги ||);тмям]| *Minn;i;ieilTa):
и валентности равен
левому значению с
Ответ: pll Пуферниго раствора 4,18.
Пример 4.10. Вычислите концентрацию гидроксид-нонов в
буферном растворе, полученном и 10.1 н. расшира аммиака, в ре ]улыа-
те его нейтрал пь\ ни и ил ЫГ' *, \.ioj3i4io юро той кислотой.
HI
Водный раствор аммиака, как извес-
ю, проявляет свойства слабого основа-
ия. Чтобы отразить основные свойства,
асто вместо «раствор аммиака» говорят
гндроксид аммония» и записывают ею
химическую формулу как NH.OH, хотя
молекулы такою соешк,! hl' е\шес[ь>ю1 11ри убавлении
хлороводородной кислоты к распвору аммиака образуется хлорид аммония:
NHj +■ HCI - NH,CI.
Раствор, содержащим одновременно аммиак и хлорид аммония,
проявляет буферные citniiti mi lu* расчета концентрации гидроксид-
ионов в таком растворо можно воспользоваться равнением,
приведенным в табл. К.1 учебника,! т буферных pat: норов, состоящих ич
[ОН ] = Л„И гпс" .
это уравнение наряду с константой диссоциации, которую мож-
1Йти в приложении >ч ii\o,'iin 01 мощение концентраций основа-
1Торый npCRpanuieJew и tan, n р^ ^л.[;ие em нейтрализации \ло-
юродной кислоюн 1>(Рм 01 исхолпой концентрации аммиака,
" 1 моль/л, раины 0,1 0,6 = 0,06 моль/л. Концентрация
образовавшейся я рпуГОПта нейтрал и-iailHи аммиака сопи - хлорида
аммония также равна 0.06 моль/л. В растворе остается 40% от ис-
коицектрацин основания с^_. Подставив в расчетное уравнение все
числовые значекн», получаем
[ОН] ■ 1,79- 10 ' ' ■ 1,19 ■ Ю'моль/л.
Ответ: концентрация i идрокенд-ионов составляет 1.19 - Ю~*
моль/л.
Пример 4.11. Вычисли
, оПрашан р.к.сч(>1 репной е примере
шсияяс.кмчс! поснольтопатьсяурав-
к liifin N 4 учебника для рас-
чс1а1нлрчкс1Ч11.н1>ннюк;и;)Г|
ра, состоящего ич елабш о о
Зная, что сумма водородного и гндрокси.чь
на 14. по эадашшчч ччелшипп мшчснию pll m
рОН:
рОН= 14-рН,
рОН= 14- 10 = 4.
lgfCQCJL =-4-lgl,79- 10 5--4-(-4,75) = 0.75.
Помня, что десятичный ,u>i арифм числа - з
и. в которую пало вшвести 10. чюбы получить
в буферном растворе:
iiKH-= 10»"-5,б2.
'соли
Omtem: 4-j-pJjj = S.62.
4.3. ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
Вариант №1
jiiiijl-ih ргщшо K.munioii no iopo.iii.eoin не гctilv -
3. Вычисли к- pj I p,jcrhn|i,i чдороно.injiiv\iюн кислоты, в l л кото-
pom содержится 36,5 i IICI ; а)бе-»учсш шличич активности or
концентрации; 6) е учетом отличия активности oi концентрации
(значение коэффициента активности см. на стр. 76 учебника). Можно лн в
данном случае пренебречь оыичиеч лкшвности от концентрации?
4. Вычисли ie степень, днсеоциаппп \i\ ран i, и ной кпелогы в 0,2 М
Н раствора, в 2 л которого содержится 1 моль
Вариант № 2
L. Нычислтмс рМ слюны крупною poi яют cKoia. если концент-
рация гидроксид-ионов в пен равна 1,Й6 ■ 10*моль/л.
cociaiuj4ei 8,2, л п поде реки ! iop.n,iK 7.2 l-i какой реке концентрации
катионов водорода выше и во сколько раз?
3. Вычислите рОН расшора гидрокси ia naipiia. подученного hi
I лводын'Юг\.|О11 aj uu i >-il4 a oi.iiriiisaKniitmiLi и от
концентрации; б) с учетом отличия активности от концетрации,/ (NaOH) -
= 0,677. [ [лотность раствора 1,04 г/мл. Можно ли в дан1юм случае
пренебречь отличием активности от концентрации?
растворе и рН этою раствора.
5. Вычислшс рЕ1 0.2 н p.icinopa >Kevcn<'ii кпелшы. пешралию-
ванного гилрокел u»vr плгрич па 50%.
Ицич Т>1
1. Вычислите рИ сока сельдерея, концентрация катионов иолоро-
да н «чором составляет6,31 ■ Ю^моль/л.
2. Иычислите концентрацию катионов водорода и гилроксид-
ичнов и артериальной кропи взрослою человека, сед нее рН 7,39.
3. 1(ычис.ти[е р|[ рас шор» aioiumi кислои.1. полученного НЧ
999,37 мпводыи1>!.(.3| ЧЧ%-и UNO., ■ ai без учета отличия активно-
liii ш концам рации. 6) с >'1сп>ч си. и» ак-цпчюин о\
концентрации./ (UNO,) = 0,72. Плотность раствора 1,033 г/мл. Можно ли в
данном случае пренебречь отличием активное! и т концентрации?
растворе и рН утого раствора.
Вариант №4
1. Вычислите рН крови крупного рогатого скота, концентрация
катионов водорода в котором составляет 4.27 ■ 10'моль/л.
2. В соответствии с iiupMiiiiiiiiiMH Несмирной организации
здравоохранения (ВОЗ) дм питьевой полы ее рН должен находиться в
пределах oi (О до К.5 Но и.<> ii.im' р;и kohkl'iu р.тии к;м ионов
Водорода, соответствующая минимальному допустимому значению рН,
превышает концентрации» к^пишон модорач;' LoimicicTBViouryTO
максимальному значению рН?
3. Вычислите рН раствора гнлроксида калии, н I л которого
содержится 56 г КОН : а) без учета отличия активности от
концентрации; б) с учетом отличия активное in ot концентрации (значение ко-
эффниием!;» jhiHFinoci"H см IN) l 1 р. 76 \ч^ника) Можно ли в
данном случае прон^р^чь оыи'шсм JisniRiiocin o\ koililci it рации?
4. Вычислите с leiiciib диссоциации селсиоиолоролипй кислоты в
0,1 М растворе и рН этого раствора.
5. Вычислите рН раствора, в I л которого содержится 23 г
муравьиной кислоты и 21 г форчиата калия.
Вариант № 5
ко трои chl1hI",14C г 3,09 ■ И)" моль/л.
2, Вычислив концентрации кажонои нолорпда и i идроксид-
ионов в брусничном соке, р! 1 которого 2,А4.
3. Вычислите рН pacn«>|):i Г.ромово юродой кислоты, в 1 л
которою содержится 81 г 1Шг : л) Гч: ч \4cia ит.л1чии лкчипностн от кон-
центрации;Г>) L счетом о] шчинлкитмо^нич коиценiр,тцни._/" (НВг) =
= 0.871. Можно ли в данном ^д>ч,(с пренс1?»рсчьотлнЧ1
4, Вычислите рОН 0,1 М водною раствора аммил
5. Вычислите рН рисшор;). 1.олоржащсга 0,01 м
кислотьг и 0,1 моль/л ацетата натрия.
Вариант №6
1. Вычислите рО11 крови свиньи, копиекгр-щия
рода в которой составляет 2.82 п 10" моль/л,
2. Оптимальные значения рН почвы для выращивания табака
леблются :> пределах от 5.5 до 7.5. Во сколько рач концентрация к:
инов водорода, coi
чению рН. превыш
ЮЩую максимальн .
3. Вычислит pll ID M раствора \.'Н1|1о!и)лорол пой кис литы: а) без
учета отличия активности от концентрации; б) с учетом отличия
активности Ol K«*iMI |i-| 11 J3.IFLI1II { !М,1ЧС11ИГ |,о 1|Ь||]|1111И.']||П ПМИННОС'Ш СМ.
на стр. 76 учебника). Можно ли в диплом случае пренебречь огличи-
ем активности от концентрации?
4. В 100 мл волы растворили 2.24 мл газообразного сероводорода
полученной paei пори и pi I яшч ра^тнора 1 J.inuiocib pjcmopa
принять ранной 1 г/мл.
5. Вычислите рП раствора, в 2 л копорого содержится 2 моль
аммиака и 107 г хлорина аммония.
Вариант Из 1
1. Вычислите pll сока незрелого апельсина, и 200 мл которого
содержится 0,25 ммоль катионов водорода.
2. Числовые шачепия вопооодюга пока ta-геля для слюны лоша-
дн колеблются н iipe;ie.iax от 7,31 до 7,80. Во сколько рат наибольшее
значение концентрации катионов водорода п слюне лошади больше
3. Вычисли 1С р< )f I ' М p;i(jimi[>.i i n.ifniKni.iii ил рия' a) lies ^'чета
ги от концентрации./ (N;iOI0 I>.?N Можно ли в данном случае
пренебречь (пличном i'lKiHUikjcm or кошки грации?
А. Вычислите степень днесоциацнн аютчоватистой кислоты вО.01
М растворе и рН ^toi"o раствора.
5. Вычислите рМ раствора, в 5 л Kiuopoi осолержшеч 120 г уксус-
Вариант Х- N
1. Вычислиie pM kfH^Hi ИН1ЦГ.1. Боинги i [хщич h^iinoiio]M4o;topo;|J
в которой составлкст 3,80 ■ 10я моль/л.
2. Вычислите концентрацию катионов водорода и гидрокенд-
ионов в cnHHHOMoiiiiMiHi жи.1 кости человека, если ее р]| 7Л5.
3. Вычислите pll 2.75 М раствора азотной кислоты: а) без учета
ги от концентрации. / (UNO.) ■- O.Kri4. Можно .m и ланпом случае
(1.01 М растворе и рЕ I зтого раствора.
Вариант Jft 9
1. ВычислшерОП кропи опнм. мпкшцпиш к;и ионов водорода
в которой составляет 3.24 • 10"" моль/л.
2. Вычислик' концентрацию капшмоп надорода и I идрокенл-
иоиов вводе Цимлянскою водохранилища, если се рН 8.40.
3. Вычислите рН 10 М раствора гид роке и да калия: а) без учета
отличия активнос|иоп концентрации: б)с учетом оглнчия
активности от концентрации (значение мпффициста активное!и см. на спр.
76 учебника). Можно ли i' ланнчм случае ирспеб^чь отличием
активности от концен грации?
4. В 100 мл воды растворили 224 мл газообразного цианоиодоро-
полученном растворе и рН этою расiвора Илогносгъ раствора
I г/мл.
5. Вычисли il- |>||расм>ор;1. ||(>1>чс1111О]1>]ин: it: paci норення 0,5350 г
безводиого КЯОрНдя аммония в 50 мл 0.1 п. водного раствора
аммиака. Изменением объема в результате расширения соли пренебречь.
Вариант №10
1. Вычислите рОН крови крупною pou-iTomcKoi а. концентрация
катионов водорода в которой составляет 2.34 ■ 10' моль/л.
2 Вычисти' koiHieinpaiiHio к^итчюн иолоро.и* и (илрчкеил-
3. Вычислии: р]| 2 М расторг ripmmmi.uijmioii кислоты: а) без
учета отличии активноеги ,ч kohul-hграции: Г>)е >чеюм отличия ан-
тавиостиоткоицет-рации. / (ПИП- 1,67-1. Можно ли в данном сиу-
час пренебречь оынчмеч акичшпсЕП oi копцет рации?
4. Вычислите степень диссоциации бромноватнстоН кислоты в
0,001 М рас] поре и рН этого раствора.
5. Вычислите рН раствора, пни чениою иное растворения 3,280 г
безводного анетата натрия в 200 m;i 0.1 и. раствора уксусной кисло
Изменением объема в результат растворения соли пренебречь.
ф
1. Вычислил; р|| сока, отжатого из ананаса, в котором
концентрация кап ионов водорода сое гавляст 3.98 -10' моль/л.
2. Оптимальные значения рН почвы для вырашниания ржи
колеблются в пределах от 5.0 до 7,0. Но СШЯЬЯЗ рлз концентрация кати-
опои но;и>|>о,ча. аюич-гсши.чцлн минимальном; допустимому ша-
чскиюрН, iipciii.niiiici i,tиiiici11 jj;uinю k;s [ и. 1 ноши■. uipo.i^K соотвстсгву-
loruvio максимальном) шлчспию рН?
3. Вычисли 1С рП pan imp» хлогкннмо родной кислоты, если в I л
волы растворено 22.4 м i ммйциишч ч.троподорода (ir.y.): а) бет
учета отличия активности or концсш рации, о) с ; чет ом отличия
активности от концентрации ( шачеппе ко ii|n[muiii:iira активности см.
на стр. 76 учебника). [ [лотноегь раствора I г/мл. Можно ли в данном
случае пренебречь отличием активное!и oi концентрации?
4. В 1 л волы растворили 24,64 л газообразного аммиака (н.у).
Вычисли^1 рН ПОЛуЧЙНКОГй раоПОрЙ] если его плотность равна
0,99 г/мл.
5. Вычислите рОН раствора, в 400 мл которого содержится 18,4г
муравьиной кислоты и ^.1.6 i формила калия.
Вариант № 12
1. Вычислиie рЛ DOKfl икчою лшмылша. в 250 мл которого
содержится 4 l 10 * моль катионов водорода.
2. Пищеварительный фермент м.к'коичтаюших пепсин А
наилучшим образом проявляет свою активность при значениях рН от 1,50
до 2,50. Во сколько раэ концентрация катионов водорода,
соответствующая наименьшему hi этих чначений рН, превышает
концентрацию катионои по юро ui. соомч-чсил Ю1л\к> наибольшему значению
рН?
3. Иычислик- р]1 |),iL4iiop;i i илцокиидл и;ирич. если н I л воды
содержится 0.01 i NaOH: ;i)6ci>4L-ia оишчин ашииносги отконцен-
трации; б) с учетом отличия ак-.ивмоети ог концентрации, ^(NaOEl)
= 0,90. ПЛОТНОСТЬ раствора 1 г/мл. Можно ли в данном случае пре-
Fieo"pc'ii. оiлитием iiKinnnoeni oi концентрации?
4. Вычислите рН 0.001 М подпою рас тора еор о водородной
кислоты. Диссоциацией по шорой с 1)пени пренебречь.
5. Вычисти- poll p;icniopa. n 250 мл коюрою содержится
0,25 моль аммиака и i 3.375 г хлорида аммония.
Вариант №13
1. Вычислите рИ раствора, в коюром К1Ч[цс}мрация гидроксид-
нонов составляет 1.3 ■ 10*моль/п.
2. Вычислите шнцентрацню катионов водорода и гидроксид-
3. Вычислите рН расгвора атотной кислоты, в 1 л которого
содержится 0.063 г UNO,: а) беч учета отличия активности от концен-
4. Вычислите рОН О, I M раствора гидрикс ил амина.
5. Вычислите pi I p.i,. mop.i. no.iyiL'imoio hoc hj причин,гения 25 мл
и. раствора i и.фокииг! млфкя к 50 мл (1,1н. раствор;! \ксуоной
Вариант Л- 14
1, Вычисли ic р[ [ кол 1,11' рскеЛон. концентрация i ндр^ьепл-иино
в которой составляет 1,58 ■ 10* моль/л.
2. Вычислите копнем i р.щим k.it но но и in' io[>i'.];i. которая обесп
чивает наилучшее .lenei juie mii[][l'hji}hiil.li,]ioio f|iepMein;i n-амилаз
ui»»,,i шшшшпаап, если соот.етстаующм тачек™ РН р.вн
3 Вычисли [с jill piiuimipii i илр1'К1_ил;| kelihh, в I л которого с
держится D.O56 1 К' У\\ ■ ,1) Г".ч \4ci<i 01 шчим hikhihhocim от концен
рации: б) с учетом ОТЛИЧИ ЙКГШКМПН 01 концентрации {значени
коэффициента активности см. на стр. 76 учебника). Плотность р
створа 1 г/мл. Можно ли в данном случае пренебречь отличием а
miiiiLHJiHoi копии»!рации?
0hIN M pacJiLBc>pe и рН тп>и) раствора.
5 Вычисли!с pi I |i<il i nopji полччемтч о iHfL.'tL' лоо;шлспия 20 м
0,1 н. pactwipa viGpotnviopiuiioii кисло'рм к -10 мл 0.1н, расгвора а
НариантЛ» IS
1. Вычислите pll пилы Koiojiohlkoio тцочриии ihiiui, концом
грация i идрокиил-ионод и Koiof>oii .jo.jku^ihui 6,31 ■ 10 1 моль/л,
колеблмп-ся в пределах от 4,0 ло 7,5. Во виши рач концентрация
катионом водорода, соответствующая минимальному допустимому
)начснню рН. превьинает концентрацию кашошш втори. i,i. ! oo i ие i -
ствуютую \'aKU]]MLijiihinsM> ьначению рП?
3. Вычислите ]il I \*.\v i nop.i ofioMom^ юро ihoie кис л is 1ы, если в I л
ВОЛЫ растворено 22/1 мл i .i кшбра'ики и вромонодорода (п,у,): a) bss
учета шличия активное ni oi копнен ipiiitim: в) с учеюм огличия
активности от концентрации. / (НВг) = 0.966. Плотность расгвора
1 г/мл. Можно ли в данном случае пренебречь отли>
от концентрации?
II*
5- Ш'МраствороирП нога
псин пренебречь.
5. В 500 ил поды рас i мирили 11,2 л i аюобразного аммиака <н.у.).
Раствор аммиак.i in Я)"м пси i p<i mhoHhI.'im \. i о ро нодор одной
кислотой. Вычислите рОН мил у четки» раствора.
Вариант №16
1. Вычислшс poll isoju и реке Ьлоапь. молярная концентрация
клгномон нодоро. ia и мчорои lol. lau-inei 2 - 10'* моль/л.
2. Числовые значения водородного показателя л-пя
человеческого нота колеблются в прааВЯП от 4,00 /ю 6,80. Во сколько раз
наибольшее значение концентрации катионов водорода в поте человека
Гч' ibimL iiijHMtMi.tjitiч <.'(.■ (на11сния'?
3. Вычислите рН раствора, в 200 мл которого содержится 4,02 г
хлорнон кислпгы a) out) чем отличШ активности от концентрации;
б)с учетом опличияакнчинчпнч колцошрании./- (НСЮ.) - 0,778.
4. В 981.3 i волы ристяорилн 24.64 л сазообразного аммиака (ну).
Вычислите рН но i\ml-iii mm )м^. utiipa, если его (шопюсть равна 0,991/мл.
5. Сколько jpaMMOitaueiaia натрия нужно растворить в I л 0,1 М
раствора уксусной кислом,!, чюбы получить буферный растворе рН,
равным 4,76.
р
1. Вычислите pi I fipyeiin4iii)iui;»K:i, is 250 m.i ко юрою содержи i-
2. В "юИ> к\ |» м i iihi pJ [ pant л -\,fil, и ч\ик\лыгом 'Килудке он ранен
2,60. В каком и) отделов пищеварительного тракта курицы концент-
3. Сколько I pjMMini i п.чрчкеид;! н;и fiiiM счдср*шсн в 500 мл
раствора згою основания, если ею рН равен Ю'.'Огличнем концетра-
цииотактивнос1и пренебречь.
4. В I л раствора содержится й.4 г i илрашна. Вычислите рОН
тгого раствора Mlv+m<i hi itpcHtnjiu'ib iiiccoLjiiaiiiieii no иторой
ступени?
5. Для получения I л аммиачного бчферного раствора взяли
9.23 мл 20%-ге раствора аммиака шютностью 0,921 г/мл и 52 мл
|0%-|"о расторг ^ inpii i.i аммония ii.iiMiiocibii) L029 i/мл.
Вычислите рН ^того растиора.
Вариант At IS
1. Вычислите рН воды Цимлянскою подох ранилнща, малярная
концентрация пздроксил-ионов в югорой совпяжяв12£\ ■ 10* моль/л.
2. Пищеварительный фермент лнпая ртештельнчядных зверей
наилучшим образом проявляет свою активность при значениях рН or
8,40 до 9,00. Во сколько раз концентрация катионов водорода, соот-
ветствуюшан наименьшему и: этих шлченнй рН. превышает
концентрацию катионои no.iopo.i.i. cooi иск I и> khuski наибольшему значе-
нию рН?
3. Вычислите рН 0.365%-го раствора хлороводородной KI
а) без учета отличия активности от конца г грации; б) с учете
ТН См, на стр 76 \ '^чилчки) I l.ioinou м. piiLi пора I г/мл. Можно ли в
данном случае пренебречь оишчием -iki шин к in or кошк-н if>iiiiHnV
4. В 1 л patrmipn t-ivit-ржиicя 6.6 i i ii.i|H4ic[ui;i\iiiii:i. Вычислите
рОН этого раствора.
5. Каково отношение молярных концентраций уксусной кислоты
и ацетата аммония в буферном растворе, если его рН равен 4.76.
Вариант №19
1. Вычислите рОН воды и озер^.ч Барабннеюй птмошюети,
молярная концентрация катиопоа аидоролл ь которой составляет
5 ■ 10' моль/л.
2. Вычислите концентрацию катиомон водорода и [ндрокенд-
ионов в ежевичном соке. рМ которого 2.73.
3. Вычислите pil расгвора гидрокеида ка;шя. титр которого ра-
вен 0,0056 г/мл: :t) i»ei \чем омичим :1к|иипосги от концентрации;
б) С уЧСТОМ Ol.Hi'lHM ahlllUHOCril Ol KUIIIICllipjIllllIf ("ШЛ'ИЧШС КЧ">||]||]11-
циеита активности см, на стр. 7бучебникв] Можно.чи в данном
случае пренебречь отличием активности oi концентрации'.1
4. В I л раствора содержится 6.4 г i идрашна. Вычислите рОН
этого раствора.
5. Какое количество естества (мо.п.^змрмилл н;ирия.
содержится в 1 л формиатно! 1мдфс[1Ит1Г'.' раи i иор^. l'c.ih концентрация мура-
вен 3.74.
Вариант ЛЬ 20
1. Вычислите рОН фснажныч но i lio.rioipa.it^oii иоллсти.
молярная концентрация катионов водорода к которы.
ЯЯШХ от 7,15 до 7,47. Во сколько раз наибольшее
|трации кагис-ной водорода в слюне свиньи больше
3. Сколько ШШНПН^КН) г а'юобрачного хлороводорода (h.v.) взч-
то ;lih по.'|\ ченим I it I piii_ I г.*1 p.i iji' ым;чи лИ_ им I.I. pi 1 к'оторого равен
3? Нужно лн в данном случае учитывать огличне кии цент рации от
4. Вычислите рН 0.93 М растяора гидразина.
5. Какое количество вещества {ноль) ююрила аммония,
содержится в 1 л амчиачтн'илфсрркии p;tci вора, если концентрация аммиака
в этом растворе составляет 0.1 моль/л, а его рОН равен 4,75?
Вариант Л* 21
1. Вычисти*и рН нСыкчшчо сока, в 250 мл которого содержи 1Си
2. Оптимальные знлчпшн рМ мочкы ;]дя выращивания
картофеля колсблюзен к \1\1сдс:л',\\ ш ^,4 до bJ lio ски.чько pj"s К1я[цс1гтрании
■в водорода. аооШРЮИуЮЩЦ минимальному допустимому
юрИ, iipcKi.iiiiaL-1 Miiiitciii pniiitio Kiti ишюв водорода,
соответствующую MilKLIIM.I II.IIHM> 1И.1ЧС11И1О рН?
3. Вычислите pi I 50%-н) piicnuipii члорио» кисииы плотностью
!. 1 I I mi ,i)i44 \Ч1 Li. ihi ,|ЫШ'!Г1ч in .ч i.iiiii: iii[i;iui!M, filt vec-
том отличия акгиииосги m концентрации,/ (HCIOJ = 3,09. Можно
ЛИ I'i ,'1!1ИШ*М <~ l\ 'lill' ll|V]linl»[U"lh. i11 IM'IML'M ЛК I IIIUIOU П1 1*1 KOf ГIII.41 [ Г -
4. Вычислите pOI I 0.1 M раствора гндрокс ила мина.
5. Какое количество нсшеетва (моль) aiierara натрия, содержится
в I л ацетатного Глфсрною [>й!С1 fii>j>^4 cc.fh коЕшентрация уксусной
кислоты в этом растворе составляет 0.1 моль/л, а его рН равен 4.76?
Вариант № 22
1. Вычислите рН почвенного раствора чернозема
обыкновенного, молярная копнет рация i игроке ид-ионов в которой составляет
6.31 ■ 10-'моль/л.
2. Вычислите концентрацию катионов водорода и гидрокенд-
нонов в соке, отжатом из картофеля, если em рН 5.64.
3. Сколько миллилшров газообразного иодоводорода (н.у.) взято
для получении 20(1 м i pHi^ i uoj>.i mi.iono юродной кислоты. рН
которого равен 2.7? ! h>uni .ш п дампом с.rytLic >читывать отличие концепт-
4, Вычисти.' pi I p.iLMiopo x.nipiHui.u i^'ion к лею I i.i. и I u котро-
i содержится 0.525 г НОС1.
5. Вычислиill рП рл^пюр:!, no i\iiiiiiiiki L.i]iniii{HLbM р;ишм\ fOLC-
jb 0.5 M водного paciRopa аммиаки и 1 M раствора \лорнда аммония.
L Вычислите рИ и^шочного счк;1. п ко юром концентрация гидро-
1-ионов составляет 2,7 10"'моль/л.
2. Вычислите к<шцимфацию х;ипомок ко,юрода, юпорля
обеспечивает FianjiV4iлir ,ik-iiciiinc [iiiii[LLii.i|nuLL.ii.iii>iLH|ic|]Mciiia лип!1чы шго-
шидныч 'ihcpcii. l'l iи uooiiiL'iciinii'MLL'i. iiM'iL-MHL4 pi I paiuHt S,0,
3. Вычяс;1ите pll раствора vHipiwii кж юты, титр которош равен
0,3 г/мл:а)6еч уч1-[аи1.1ичияак-(11К1кч.1и ш иишетрации; б) с учетом
отличия акшвткнюг кониентрации./ (HCIO,)= 1,448. Можно ли в
данном случае нренейречь отличием актнноот от концентрации?
4. Pacc4Hiaii 1с ск-tieni» и кошлпнп .'iiicliMj.uaцни с i.iooii ivlho-
ОСНОВКОЙ KHCjIOII.I. L'CJIli [I'iHCC'IIKJ. 4i" Hpll KOMilCF-ЦраЦИИ KHCJ[O"Tbl
0,1 моль/л pll растдора равен 2,87.
5. Вычисли [с рОИ аммиачи»! 11 ii\i|H.'piii)i о раствора, в 1 л
которого содержится 1.7 1 аммиака и 5,35 г хлорида аммония.
Вариант №24
1. Вычислите рН почвенного рас7Ворд черночемаобыннчиеннога
приазовского 1я*.с.|ос\1 л штейн!', и 1 л миор.ии содержится 27 мкг
нирпкс ил-ИОНОЙ.
2. В толстой кишке утки pll ранен 6,37, а в мускулыгом желудке
онравен2,ЗЗ.Вкакомччо1;1ело1!Ш111(е»ар|иелЕ.шло i patera угки
концентрации капионов иодорода выше и но сколько рач?
3. Сколько г p.iMMon I и 1роксид.1 [>ч Гч I in ч [.одержшея и 500 мл ра-
0,18 М растворе и рН ^того paciuopa.
5. Вычисли re [>l I aMMHij'iiioi о Гл(|и ришм p^iLi ло[*;|. ;тля
получения 1 л которого пяли 100 мл 5,25%-го подмою раствора аммиака
ллотностыо (1,976 i/мл и 50 ил [0,5%-п раетвора хлороводородной
кислоты плотностью 1,05 г/мл.
Вариант №25
1. Вычисли 1с poll лизиметрически и [>й1С1вора орошаемою
чернозема обыкновенного (глубина 30 см). и 100 л которого содержится
4 мкг катионов водорода.
2 Водоролмьт поь.пеисм. ,мн hiiieoi раллого сусла
ного по шампапскшп ciioci>(i\, ранен _i.2O Вычислите концентрацию
катионов во;юрод;1 и г н фокс ид-иолов в таком сусле.
3. Сколько 1раммов аютной кислоты содержится в 500 мл
раствора этой кислоты, если его р[ [ равен 1,7? Отличием концентрации
от активности пренебречь.
4. Вычисли К" цепень гшъ.хо1ШгЩим циаионодорола в I M
растворе цизноводороднон k»il:u>ii.i и pil глого раствора.
5. Вычислив- pll (Кфсршнораш мора для приготовления которо-
ю. к НЮ мл (1.5 М рис I пора дммнак,! пршмши.н! 50 \ci 0.5 М раствора
хлороводородной кислоты.
Вариант №26
1. Вычислил: pi I jiniiMi1 jpiiML'LK^io [ml jisopii орошаемых темно-
каштановых почв (глубина 30 см), в 1 л которого содержится
2.14 МКГ ГНДрОКНД-ИОНОТ.
2. В слепой КЯШХв фйШНа pll равен 4,51, а в мускульном желудке
он равен 2.0. Н каком ич oi.ijjum leii.iphiie.u.iioio ipaKra фачана
3. BhT4Htrti1ILL |lH U)''m lOp^Lk. IliOfl.l VILtplloii ].<H..KIJhL [I.[О] 1£0СТЬЮ 1,06
г/мл: a)6ci>4L-i;iiri:iii4iin;iv,nuun>LLii ш mnii|cirrpai[Mn; б) с учетом от-
личия активности от копнен |р;щин,/ (11ГЮ,) - <ШЗ. Можно ли в
данном случае пренебречь отличием акг'ивности от концентрации?
4. Вычислите рОМ I М раствора гидроксиламина.
5. Вычисли iv pi! тфи|)1ичорлц|цф,|. ,|ля мритшвления которо-
гик200мл 6%-iop:iLi№<pii vhxjtiioii hHL-iort.i luioiiiiicibio 1,007 г/мл
прибанили 20f) м.г O.s M |>.n. i nop.i i идро^ила натрия.
Вариант №17
1. Вычислите р)1 лизиметрического раствора орошаемых темно-
каштановых почв (глубина SS ем), концентрация i илроксид-ионов в
котором составляет6,31 ■ 10 'моль/л.
пропусканием мечги череч пресс непрерывною действия, равен 3,35.
таком сусле.
3. Сколько граммов гидроксида натрия и воды нужно взять для
приготовления 250 мл раствора лого основания, если его рН равен
11,6? Плотное г I, рас цюра ] .000 г/мл.
4. Вычислите р[[ 0.01 М раствора ачиинчкашсшй кислоты.
Диссоциацией но Hiopoii crynviui пренебречь.
123
S. Для приготовления 100 мл ацетатного буфартп>растя0р*1ЗД-
ли 29,6 мл 10%-inpati пора yucwHuii кш;;нны плотностью], 013 г/мл
н4,| г ацетата натрия. Вычислите рН пою раствора.
»»риант№28
1. ВЫЧИОЛИТв рН ТОМЯГНОГО сока, в 250 мл которого содержится
0,01 MMOJU. КВТИОНОВ иодорода.
2. Пишевацшельпый формам млекопшающиха-амилаза
поджелудочной жсл он. I iMii,i>'iiiiiiM ofipa юм проявляет свою активностьпри
значениях рН от 6,40 до 7,10. Поскольку рачконцентрация катионов
водорода, слоте-icmyiouuiH наименьшему ич них шачений рН,
превышает концешрацшо кшигашв нодорода. ешчвечешукнцую
наибольшему значению pi I?
3. Вычислите рН раствора хлорной КИСЛОТЫ, титр которою
равен 0,5 г/мл: а) беч учеи оинчня акгныюеш oi кпнцен! рации; б) с
учетом огличия активности от концентрации,/ (НС1О,) = 4,76.
Можно ли в данном случае пренебречь отличием активности от
концентрации?
4. Вычислите pi 10.1 М рас: нора пиразина. Диссоциацией по
второй ступени пренебречь.
5. Для пршпнчиемия 51)0 \i.i aueiainui о 6\фсрш>го раствора
взяли 19,3 мл 30%-го раствора \ млctiuii мимшы iLioiHOcibio I.O38 i/мл
н S.2 г ацетата натрия. ВычнслшерМ этоги раствора.
Варнииг №29
1. Кончен!рации капищам K^viop.ij.t к mvncoii cscitcinHH сильно-
рОН такой суспензии.
2. Волор( V» или []ок;и:че:|]. ишич \гл, тою сока Hi пи hoi p;i ia cop I a
Чинури в момент отжатия равен 3,10. Вычислите концентрацию ка-
тионон вчдоро/ia и гидроксид-иимип к 1аком соке.
3. Сколько грамм!Ч1 i идртженда цешч содержится в 200 мл
раствора этою основания, если cm рН равен 9? Можно ли в данном
случае пренебречь отличием концентрации m активности?
4. Вычислите степень диссоциации селсЕЮнолорода в 0,1 М
раствора селе новпдп роли ой рснслоты н рН лого раствора.
Диссоциацией по второй ступени пренебречь
^ r'l-'^ iipni■• i>->l ц iili.i Ч)п \l i .г. miu'iii.'i .■ Г'\фсрногораствора
взяли 177.5 мл 10%-го раствора аммиака ПЛОТНОСТЬЮ 0,458 г/мл и 53,5 г
хлорида аммонич. Пычиелите рНэтою раствора.
скота составляет 7.41 ■ 10" моль/л. Вычислите рН и рОН такой
2. Вычислите концет рацию катионов водорода и i и дроке ид-
ионов в вине ич PHHOI рала сорта Чинури, рМ которого 2.90.
Зг Сколько I |>;immuh \. к.рмий kikj.ii.ii.i a .дс ржи гея r 1 ;! раствора
этой кислоты, если его pi I iiiiRcn 2'' Ouimhilm концентрации от ак-
4. В 93,28 i n.vih.i |i.iliihi[ih in 6.72 мл i imKu"i|>,Hiu>ni аммиака (н.у.}.
Плотность iiojiyitnm.il. рни вора 0.498 i .'мл Начислите его рН.
5. Вычисли 1С р\ I ргл\: intspa. н 250 м.[ m.iojioio LiviepjKHTCH 1 1,5 г
муравьиной кислоты и 58,8 г формиата калия.
я 5. ГИДРОЛИЗ СОЛКИ
5.1. ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К КОЛЛОКВИУМУ
1. Что такое гидролиз солей?
2. Соли каких типов подвергаются гидролиту? Приведите примеры.
3- Какие формы мшкм ^р.пшс-Ешй pci к ишн и ipi'.nna Вам
известны? Чем они различаются?
4. Какая форма (яииси уравнений реакций i идролиза самая
наглядная? Minnici показывает?
5. Что такое степень i идролиза? Oi чет oi*a лавиеит?
noil KiiiiLiain hi рмпнонееия?
7. Как CBHUiHi.1 mok;i> собой конспмпа и ciencHi, гидролиза?
S. Гидролт каких солей протекает в нисколько ступеней? Какая
ступень гидролиза преобладает?
9. В каких случаях гидролиз происходи! необратимо?
5.2. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Решение каждой m задач этого раздела надо начинать с
написания уравнении реакции гидролиза соли, о которой идет речь в
условии. Уравнение следует писать в сокращенной ионной форме,
отличающейся ihiuiui.n.iiicл изи|]прм;п innukiuo и НнИ.шдкостью. В
условиях задач чаще всего приведены названия солей, а не их
химические формулы. Если по н;пианию соли Цы не можете определить се
состав, следуе! ио(чи>.1пиоьа] ьсн прелмешмм \качл!елем, который
находится на 1мк.1слпич Lip,iiiLH[a.\ ч'кч1мик;1 14 ном указателе в
алфавитном порядке прицелены названия всех важнейших объектов,
упомянутых в учебнике, в том числе и солей. После названии
объекта указаны номера страниц, на которых он упОШнуЕ Найдя в
предметном указателе па такие соли. Вы нещ&П на cooi йетствующнх
страницах найти форы и) т!Й ео.ш л onpi: ilmhi i>. к;!кой кислотой и
Задачи на iinpetlejiemie типа ИПЙ/ШЯМ
i H,ipojiiH\]O!nii\Lnn но купону имени KiiLjiMi' piMKiimo. a paciHispi»!
солей, гид рол и дующихся но аниону имею! щелочную реакцию.
Пример 5.1. Мани миге с \MMiiLiL'Lh]h ьо фпрм\:1\ "ioil in названных
ниже солей, в водном растворе которой фенолфталеин бесцветен:
сульфит натрия, упорид аммония, карбонат калия, цианид калия?
Решение. В условиях эалачи рсчьи.кч и'1С1ырем;одя.\: сульфите
натрия Na,M.),. \.юрн.чс аммонии \II.CI. карпочаи? калня К.СО, и
цианиде калня KCN. Три соли: Na.SO,, К.СО, и KCN - образованы
слабыми кислотами и сильными основаниями. Они подвергаются
гидролизу noaiuioHv СоОПлаПртНЯМ ; равнения реакций в
сокращенной ионной форт тятпыпцукл; mi результате гидролиза
в растворах ЗПВ солей поя ил я юте я гилроксид-ионы:
SO,! + НОН ^ HSOj- + ОН ,
СО^+НОНЙНСО, +ОН-,
CN" + НОИ S11CN + ОН .
о. Кислот-
жрашива-
тся в малиновый пва.
Только одitil л Mt;Hn:miu.t\ и \с,ц>иии\ чал,1чи оо.юи - хлорид ам-
монин - гидрол I [ t\'c iu 'л пч кллишу п coomtici ьши с > равнением
NH/ + НОН ^ NHaOH + Н',
hi которою видно, чти p.iLii4i|iL iioHii.iHhoita катионы водорода и он
имеет khcjivhi рсмкииш. В милей с\шк i|)ONOji(|iiiijii;HH 6ocuneiijH
ONHCI
Задачи на расчет мнитапт гидрояша
Конста1ны 1идролита. как и константы диссоциации - частный
ле дроби активности или ринюВВСТЮЙ концентрации воды.
Например, для реакции гидролича нитрита натрия, которая описывается
уравнением
NOj + НОН ^ HNO, + ОН ,
ы иметт следующий вид:
а равновесия
Пример 5,2, !ib[4iic.inii_L i.ohitian i> г и.чро ui s;i карГюната натрия
по первой ступени.
Решение- Карбонат натрия - со.н.. оора'юваннан c;ui"oii лп>\-
основной утоЛЫЮб КИСЛОТОЙ Н.СО, и сильным основанием- гидро-
ксидом нэгрин NaOl I. она полиёрг aei ся гидролиту но аниону. Первая
ступень гидрат u i..ifH">oji.n.i HlIi ihim "iiik'i.imi-юг > [laiMieiiHcru
CO/ + HOH^HCO,- + OH ,
ИЗ Kivioporii видки, чк) про.1\кк1м plmkiuiii «is uieitu i n.ipiikapfionai-
hoel HCO, . Именно доя него нужно найти в приложении 3 числовое
значение константы ДКССОШШШН. Однако в ыблииах приводят ЮН-
кий. Для того, чтобы iiaiiiH кипеraim диссоциации г ндрокарбонат-
иона нужно майш i^ iifHi.'in.K^nini нчишн-'и и^щщую ьонстанту
диссоциации угольной кислоты. 'У\а КНС1ЮТЯ ДвуХОСИОВНЙ! и диссоции-
щепленИН одноп) h;miui[a iih,iojiiMl] и 0Г4К1 uu^iuhii т li.4pi)K:ipnini;ii
В соответствии с «коном действующих м,
[Н-ЦНСО,]
1 IH-CO,] ■
Ее числовое шачсние равно 4,45 -10'.
[ICO, t![[T + CO,!-.
I'.C \IO*IU' i:!]IIK t( J I. i..k Гч I' 'IIIIIM Ol'I"il U'\L
[H'KCO,"]
^ 1hco(-] "
Числовое шачсние эти константы составляет 4,69 10 ". Его и
трия по первой ступени:
Задачи на расчет степени гидролиза
от природы соли, ОТ концентрации и
м формулам, приведенным в табл. 8.5
учебника.
Пример SJ. Вычислите степень гидролиза (в %) гидросульфида
нагриявО.1 Мрасгворе.
Решение. Гнлросульфид натрия соль, ml рало ванная слабой се-
pGm\(i>pu.inoii KiiLjinioii II си.П|Ныч основанием - гндроксидоч
натрия. Гидролич ндс1 по аниону:
HS+HOII ? H.S+OH .
II рс (Vlhl ill <_' ^Ч' lh Hi! И ' 'I '['.I \ ^ I ■ I . ■- ;'■ .. ■ I ' j1' ■ 11! ]4 .--И^ I1 1.1. I]'' '
чу для расчета нужно испольюваи. константу диссоциации этой
кислоты по первой ступени.
Уравнение дм вычислении степени гидролиза соли,
образованной слабой кислотой и сильным основанием, имеет следующий вид:
При подстановке и пето числовых значений нужно обяза
обратить внимание на способ выражения состава раствора. Дли
расчета следует брать только молярную концентрацию соли в растворе.
|-!сли сослан paciiHipii пуслоиних ищнчи ia;iai! по-другому, то нужно
11|Ю1ННС01н m.L|iLLLLifi и \|LM^^J1|[^ и» конncin рацию.
Подстаниич 4iic.n4ii.ic чм-мс-нич и иршгчтдн ш,]числения, полу-
OHciihn noii .\i!|iaKu-|jnci икн ш;1рш]иза.
Ответ: 0.1%.
Пример 5.4. MaiinuiHie химическую формулу той из названных
ниже солей 1шрия, которая iio.iBupiairicn i и.фолиэу в большей
степени: сульфид, селенид, теллурид или метаси,1икап. Молярные кок-
Решение, iicc HhH^mihi.iok >c.ii.iriiiii\ ta. i.i'iii соли образованы
сильным основанием - гидроксилом натрия и слабыми кислотами: суль-
фид натрия Na.S - сероводородной, селеннд натрия Na,Se - селено-
кипит i рация ci
Константы ;|ии:1Щ1ииии слашпч hiiumn >ш\«ляи:и п знаменателе
пень гидролиза соли. Нее слабые кислоты, анионы которых вхоля'1 в
состав рассма! рп пасмы \ в ;ianni>ii i:i ui'il- со/к-ii. [\л чосновные. J lo-
этому соли гид роли чу юте я в две ступени. Так как первая ступень
гидролиза преобладаем следует СршНШШП С1СПВНИ гидролиза этих
солей именно по первой ступени, пренебрегая шорой ст>пенью
гидролиза. Уравнения реакций гидролиза для названных в условиях зада-
S' -+HOH0HS +ОН -,
Se= + НОН <2 HSe + ОН ,
Те!+НОНр>НТе +ОН ,
SiO,!-+HOHf^HSiO,- + ОН .
Изэтихураипепий пил но, Lno и [имч. р
пиросульфид-, гидроселе нид-, гидротеллурид- и I идросил
ветствуюши\с.1.|Гин1.ч кис.юз [го mo
ты и нужно сравнивать, не произ
какая соль гидрш1И1уется в большей сюпенн. Числовые знач
соответствующих констант диесоши1|ии можно найти в прил
для сероводкра.июй Kne.uxj.i Л"(1|)= I ■ 10 ",
для селе но водородной кислоты Л"(П) =110 ",
для теллуриполоролнои кислоты it(ll) = I ■ 10",
для метакремнисвой кислоты К(Щ =1.6 10 ".
Очевидно, что наименьшее числовое значение имеет попет
по второй ступени ДЛЯ сероводородной кислоты,
наиоолмпеи ficnenn i mt[huiu\ п\ [l'i ikhucjii ;иьея соль l
ы — сульфид натрия.
Отчет: Na.S
Задачи на impt'iU' ten иг pi I /'<г, щи<ц\ч,1 ■ittf/i» ittiyiimittxcH ca.u'ii
приведены и lafiji. H.> учебники Пдникп iivkiid miciE, и виду, что Эти
\ |l. IIIIII. НИМ 'ЫЛ11 ■ III Ti1 III II HI, и 11 Л IM I^Li-'ik I lI pi I III. i"ik lib k.II.I I.IK1 |'lI i-
бавленных paci воров (не менее 0,1 моль/л). Если произведение кон-
центрации раствора и coin BiMCiiiyionieii к.шскшты диссоциации
меньше ионного произведения воды, го ita величину рН оказывает
влияние диссошкщмч иолы И лич с: у чая \ .тля расчет лрименявот более
го пособия.
При расчетах следует также принимать во внимание, что
уравнения из табл. 8.5 справедливы юлько для температуры 22°С, так как
-- \gKw^'—\g 10"н = 7 (см. уравнение 8.39 учебника). Ионное
произведение волы /^принимаетзначение 10 "только при температуре
22°С. При друг и\ температура?! А'и имеет другие числовые значения
(ем. приложение 4). Слеповательно, при температурах, не равных
22"С, первое слагаемое в уравнениях для расчета рН расгворов гид-
рол и тую U1HXC я сол^й о>лс! (пличасься от 7.
Пример 5.5. ВычислиiepH O.I M раствора сульфита натрия при
Решение.
t(Na,SO1) = 0,l м
>l>annfiinu реакции i илролича и^окрлии.-нмой
niiiiiioii форме. Сольобрачованаслабин i:i:p-
нистои кислоюи и сильным основанием - гидроксидом натрия, гид-
SO,' HIOHPE1SO, +OII .
В результате шлро.миш образуется гидросульфит-ион, консташу
диссоциации которого можно найти в приложении 3 как константу
диссоциации сернистой кислоты по второй ступени. Следует также
чбрапгть внимание на то, что раствор в результате гидролиза имеет
щелочную реакцию (pll > 7), о чем свидетельствуют гидроксид-ионы
ОН в правой части уравнения. 'Это поможет оценить правильность
результатов расчета.
Числовое значение водородного показателя для раствора соли
слабой кислоты и сильного основания при температуре, отличной от
21%'. рассчитываем по уравнению:
pH = - i ](; (2,418- №")-■£ Ig 1.02 10 '+ -Ig 10 ' = 6,77 +
+ 4,00-0,5= 10,27.
Ответ: 10.27.
В некоторыч 1н1л.1ч.1л iiooGik^1 не MsiMKuipoisiUiHb никаких
расчетов, ПОТОМУ ЧГП pi'JIMIIIK' Среды p-ll I IIOJ1,] ( KHL.mil. МСЧфаЛЬНЗН ИЛИ
икании <>tipa;\iiiiiiHM я и рсклм.щ- i ii.ipo.iniai |;шы\ кислот iiwho-
ванин. Если A'iiki больше, чем К .. то среда кислая. 1-£ли /^„больше,
чем К-ш_г, то среды щелочная, f.c.ui обе kohci^iiiti.i равны, то среда
нейтральная.
Пример 5-6. ! l.uiiimiiie \ммицкчч.чк< форм>'.п' mii m яа^ваниьгч
ниже солей, полны ч piik i imp ко i при и iiMot'i iillhi|i.i и-[|\-ю реакцию:
хлорил гилрокси.'шминня, г
Хлорилгалроксп |;1ми1!няМ1 ()1К"1 соль, пир .и о манная слабым
Nll.Oli i IKHI, ■ N11 Oil i ||',О'.
сри;ш кислая, о чем i.mopni Kanioiii.i ошчтя и np,ii;on чист \рйкнспии
Гипонитрит ка.'1ия K.N.O, и aneiar калия СН.СООК - соли, об-
NO,2 +HOH ^ [IN.O-+OH-,
СН,СОО +IIOII ?"СН,СОО]| + ОН-.
В правых частх обоих ypaiiiiLiniii ирисутетвукуг гндроксид-ионы,
что говорит о щелочной реакции среды.
Наконец, ацетат аммонии - cn.ii, c:&aooii кисни ы и c/iauoin
инновация. Гид рол и~1 идет и по аниону, и по катиону:
СИ COO-+NH ' ( НОН ? til п)ОН -NM.OH.
Причем конггаиш дчссоиниич» cuifioii кисти 1,1 Ктсл= 1,75- 10"»
и слабого основан ни К1Ч»= 1,75 ■ 10 'не'различаются своими
числовыми шачепиями. Полому реакция среды и рас пюре ацетата
аммония практически нейтральная.
OmmkCU.COOnH,
5.3. ИНДИВИДУАЛl> : )ЛДЛ1ШЯ
1,1 объемом 11,2 л (н.у.) вступил в р.
1. Диоксид серы объемом 11,2 л (н.у) иступил и реакцию с 40 г
[идрокеида иа|рия, растворенного в волк. Напишите химическую
формулу образовавшейся соли. По какому иону (катиону или
аниону) протекает гидролиз этой соли?
2. Напиншк* химическим форч1\л\ iofi us шиванньгч ниже солей
калия, которая I n,ipiuii5M.'KLH и ii.imihi iuhch ыспени карбонат, гид-
poMpoi'iui, цианид. \лорил.
3. Напишите в сокращенной ионной форме уравнение реакции
гидролиза ортофосфа1а натрия пи нериой ступени и вычислите
константу гидролиза этой соли по первой ступени.
4. Напишите в молекулярной форме _\ равнение реакции
гидролиза хлорида же. 1с u (Ell) и hM'Liicniw си.чкчнь t ii.ipo.mia ")той соли но
первой ступени в 0,2 М растворе.
5. Вычислите pll piiuiHupa. a 400 мл которого содержится 3,28 г
ацетаганафии. Температура 50°С.
Варнинт2
1. При сливании I0D мл 0,02 М раствора ортофосфорной
кислоты и 50 мл 0.04 М раст нора i iup»kch.'i;i калии пол>чен раствор соли.
Напишите химичсск\ ю (|шрму-1> ной соли Ни каком; иону (катиону
ИЛИ аниону) пршекас! шдро.гш пой соли?
2. Напиши re mimh'ivckuo формулу той hi на-шапнмх ниже солей
натрия, когория г илролшускн и найме ней степени: селенид, гид-
роселеиид, теллурия, гндроюллурид.
3. Намишип; в сокращенной нимнон форме уравнение реакции
■ млрилща Mrinjii.Ln.iM ч1ммч|ц»1 if ni.iiiin..ni[c К(1пс1^1П1"> гилро.ш'1;ги"ой
ри сливании водных
ра? Н
4. Образуется
ит воров нитрата ;
кис формулы обр
5. Вычислив
пату ре 22 °С.
ли сульфид алюм
шюминия и сульфи
рН 0,2 М раствора
ИНИЯ П
да кал
luiopnj
ВариашЗ
I. При растворении 44.8 л газообразного аммиака (н.у.) в соляной
кислоте, содержащей 73 г хлороводорода. получек раствор солн. На-
[ЯШШТе \имичеек>ю формулу ?гай солн. По какому ион>' (катиону
или апиону) протекает гидролиз этой солн?
133
рашивается в розовы» ииег хлорид натрия, с\льфат аммония, суль-
lijitj ~.l 1ЮЧИННИ IIMlIMII L HaipiTN?
3. Напншнте в сокращений) ионшА форме уравнение реакции
гидроли!а хлорида цинка по 1-ой ступени и вычислите константу
4. Напишите и молекулярной фирме ураипение реакции
гидролиза нитрита натрия и вычислите степень ГИДРОПВМ этой соли в 0,2 М
растворе.
5. ВыЧИС/IHlL' р! М) I И р.К"] ISOp.l МИ I р.И.1 ,|ММ1Щ||Ч |||Ч| 11 ЧИер:| [Л-
Вариант -I
1. При растворении 4,48 л диоксида уинфода (н.у.) и растворе,
содержащем 22,4 г i и дроке нда калия, получек раствор соли.
Напишите кимичсск>к! формуi> )гойсш1и. Вычислите степень ее
гидролиза в полученном растноре. если его объем равен I л.
2. Налипши: 4Umm4!:lk>k> форм\л\ Hii» in ицчванныч ниже соней,
водный раствор кчмрпи hmi.^1 м[>>1к~» ичсски нон г рал ьн)~ю реакцию:
ацетат калин, гидрокароо1М1 к:ынмх i иноч.юрщ н;прия. -HR'rai аммония.
3. Напишите и социщеннои иоппои фирмг чр;]инснис petthilMH
гидроли-ta гидрофосфата натрия и вычислите ЮНСташу гидролиза
этой соли.
4. Напишите в сокращенной ионной форме чравненне гидролиза
ХЛОрила никеля но мерной l i>hl']ih и пмчш.ши' е^сиень I ндролиза
этой соли в 0.1 М растворе.
5. Вычислите рН 0.2 М раствора хлорида аммония при 22°С.
1. Газообразным ее|ют1;ифод обьемом 2.24 л (н.>.> вегупил в ре-
акциЮ С 4 I" гил роке и. ui н.ирия. }i;lli порем но i о к no;ic НЦПИШИТС хи-
MHHecKVKuJiopMv.ts tii jm ou|i.iio]^.inMieik * и p.iL шоре I [о какому иону
(катиону или аниии) ) Mpoieh.iei t ii;ipo.iiu л oil соли?
2. Напишшс\>i\ui'Kvk;iuформ}.!} юйнчназванныхнижесолей,в
рас] воре которой метиловый оранжевый пкрашнвастся в желтый цвет:
xjcopHjiПария, nopxiiopai кали», кароомш н.прмя. е>лы|тг цинка.
3. Напиши ie 1июпно|[ фо[]ме s |i:m4icjui^ реакции I идролича аце-
тата аммония и рычно пне комета!пл i ii.'ijiojii'sa зтой соли.
4. Напишите в молекулярной фор\а- s решение реакции
гидролиза цианида калия и вычисли с степени i и ipo шел отой соли в 0,2 М
растворе.
5. Каково значение рН раствора, полученного из 0,2 г
аммония и 250 мл вялы'.1 Пшчночь раствора принять равн1
Темпсрачура 22°С.
1. ] 1ри взаимодействии хлора с гидрокендом кальция образуются
торая подиергается гидроли'л но аниону.
2. Иапиште \нмическ\ю форму i> ГОН и< названных ниже солей
железа (III), кочорая подвергайся Нвобрлшюну гидролизу: «играт,
сульфш. Kiipi'ioiiar, хлорид.
3. Напишите в сокращенно!! ионной форме уравнение реакции
гидролича |{|ч fi;iill ич!нц;н II) и вычислит: пик |;им\ гидролиза тгой
4. Вычислите степень гидролиза хлорида аммония в растворе, в
500 мл которого содержится 5.35 г этой соли.
5. Вычислите рН 0.2 М раствора г нпочлорита калия при 30°С.
|ру py
ся при рас[вирении 21,4 ГГНДроШВДЯ ЖВПВЯ (Ш) I 558,3 мл 10%-ГО
раствора лчпгной кислягы плотностью 1,055 г/мл. По какому иону
{катиону или аниону) протекает гидролит этой соли?
2. Напишите \ичичиск> ю формулу той ич названных ниже солей,
врастиори кшорий фенолфшлеш! окрашивается п розовый цист: хло-
рил калия, i идрофои|>,11 и.прии. пср\.юр.и ь.иия члорид цинка.
3. Папшшпе в сокращенной nonnoii [[трмс уравнение реакции
гидролиза лиш.чрофосфан! нлрих и нычис:1ик- h-oEiuianiy 1ИДроли-
за этой соли.
4. Напиши!^ в мо.1ск\ляр1К1Й форме >p:imiLMiit роак!1нн гнлроли-
ia нитрата чре^ма (III) и ki^imii-j ihic liciichi, г ivipo.nifa в 0.2 М раство-
5. Вычислите рН О,! М раствора цианида аммония при 22"С.
1. Напиши
ЕЯ при раствор
[ПОТНОЙ КИСЛО
снни20
Вариант Я
icck.mo формул н1к11н:111иссоли,Ы
ностью 1,055 г/и
или аниону) протекает гидролиз этой о
2. Раствор
||ки алюминия
klUII 1!
С\ ]|,фи
лииши
; ЩЭМНЮОС НИЖ1
нсав239мл 10%-
UL По какому hoi
)ЛИ?
! солей: хлорид н;
ЯНОНШ --окраши
о формулу.
i разу ю те й-
(грия. суль-
tacl лакмус
гидролиз
в растворе равен 0.0033 г/мл.
5. Рассчнгайзе рН раствора, полученного i
0,3 к. азотной кислоты и 10 мл 0,1 и. широкой;
тура 22-С.
1. Напиши к- \ичи'к->;к>1о форму i> и lUHiiiiimoiomi
образующийся при смешении 50 мл I М раствор:! I H ЦЮЖСШШМИВВ и 36 мл 5%-го
pttnopaХЛОРОВОДОРОДНОЙ КИСЛОТЫ плотностью 1,023 г/мл. По
какому иону (катиону или аниону) протекайi i идролич пой соли?
2. Напиши к* ii ионном фирме vp.miii iniL реакции eli i|xviHria юй из
н,|чинных ни*!.' hi reii. hi^ii'p.i^ i н.iPl' ili ;чч^ и мч к и nous и но
;imиону: сульфат цинка, aiiciai аммония. anei.iг н,ирин. пиipar железа (111).
3. Напиннис п сокращенной iilhiiioji форме чрлинспне реакции
гидролиза HHipiiia хрома (Ш| и нычиелте Koiiciiimy гидролиз пой
соли по первой ступени.
4. Налишнгс в молекулярной форме уравнение реакции
гидролиза хлорида железа (III) и вычислите citneiih гидролиза этой соли в
0.1 М растворе.
5. Вычисли 1С р}1 pin. I мира, полуичшою при [illi.1 1 иоронии 5,3 г
хлорида ам мои и ч в 500 м.м»оды. ILiornifLii. pacinop^ принять равной
1. Напипш к' м1мП'кч i,\ км|лчшч i\ l ^i ш. m>ih|i,i4 uopai>'tKLH при
смешении 100 мл 2 М ран нора гидроксида пачрия и 200 мл 1 М
раствора азотной кислоты. Подвергается ли эта соль i идролизу?
2. Налишитс химическую формулу roil из названных ниже солей
аммония, которая гидролн i\i_hn:*i p iLLnr»ih n.iiit'ii eiL4in.'irif: хлорид,
сульфат, нитрит, нитрат.
3. Напишиiс и сокращенной ноичон i|ki]imo ^р.ичнепис реакции
гидролиза riT.ipnk.iponiiiiia п:и рии и iii.nnic.iiiii! hi>nLirun"\ |"идро:ги!а
ЭТОЙ СОЛИ.
А. Вычислите степень гид рол та бромида аммония в О,) М
растворе.
5. ВычисшиерМ pav i пора, по i_\ 'il-iiiidio рас i морением 13,4 г
хлорида алюминии в 0,5 л полы Плошос 11, pat i пора 1,0012 г/мл,
температура 22°С.
136
I г При j
IlnpiiaiiT 11
1. Диоксид серы объемом 2,24 л {н.у.) вступил в реакцию со 100
мл I М pacniopii iu,'tpt>hen,'i;i мишя. Ikiimimrru химическую формулу
образовавшейся соли. По какиму иону (катиону или аниону) проте-
кает гидролиз ЭТОЙ соли?
2. Напишите химичсск>ю формулу тй и: названных ниже солей,
которая гидролизуслен и наименьшей eienemr с\льфид аммония,
3. Напишите а сокращённой ионной форме уравнение реакции
гидролиза карбоната аммонии и вычислите константу гидролиза это и
соли по первой ступени.
4. Напишите в молск\.1ирч,)и форме j р.ншемис реакции гнлроли-
за гидрокарбона га ОДВЫ и вычислите степень гидролиза в 0.05 М
растворе "лой соли.
5. Вычислите рН 0.1 М раствора хлорида железа (III) при
температуре 60"С.
Вврнан! 12
и93 m:i 10%-ю раемюра ортофосфорной кисло-
эстью ] .053 i'/мл к I л 0,1 н. раствора гидроксила натрия
получен paciHop соли. I Ijiiiiiimmj чнмичеекмо форму.пу этой соли.
Но какому иону (катиону или anniiiij ) иршекает № i идролнз?
2. Напишите и miuick)j1M|>M(ih i|uipMi:\piiiiMuHiic реакции
гидролиза той ич персчисле х солей алюминия, которая подвергается
необратимому гидролизу: хлорид, слл1,ф:п, сульфид, нитрат.
3. Напишите в сокращенной конной форме уравнение реакции
4. Рассчитайте стонет, гидролиза хлор|
которого равен 0.0095 г/мл.
5 ПЫЧНС ГИГС р|| II : М р.К [llilp.i Е1П.1Ш
Z2X.
Вариант IJ
1. При растиорении 11.2 л гачообрлною аммиака (н.у.) в 250 мл
2 н. раствора азотной кислоты получен раствор соли. Напишите
химическую формулу этой соли. По какому иону (катиону или аниону)
протекает гидролнэ этой соли?
2. В растворе какой ич названных ниже солен лакмус приобрета-
И красный цвет: перхлорат палия, сульфат алюминия, ацетат натрия,
к.<|НЧ)И!1г калия1* Напишите химическую формулу этой соли.
137
в растворе, ти чр
при ч'емлсратурс
в 0,1 М ра-
5. ВЫЧИОЯВте pi I 0.2 М раствора формиата аммония при 22°С.
Вариант14
1. При H'taHMiutnt ituin Hh(>.i \i.Ii;mk.ioio i ;i ;;Цн \ )с 2 16 м.г ^0%-
го раствора rv^'ipokL п.1 i:i п,прин ii:iomloi:m>eo 1,21! i 4i.i поручен раствор
соли. Напишите химическим формул} лойсоли. По какому иону
(катиону или аниону) проieк;и:! i илроли* чюй соли?
2. Напишите химическую формулу шй hi названных ниже солей
ii;iifii!n. Kihio]);n hi1 по ji'.tpi ,j4n i n if in in ;> i unox. юрнг. фюрил.
перхлорат, ацетат.
1. Напишите в сокращенно» ионной форме уравнение реакции
гидролиза I ii,ifioi|nvi[]:nii иммпшчч и iin'iiii: mif kohl [анту гидролиза
4. Рассчигайгс степень гидролиза метаскликзта натрия в 0.2 М
растворе.
5. Вычисти* pll p<icihopa. получен!
безводного карбоната нафня н 0,2 л полы <р =
Вариант IS
1. I'awoGpii тын и<.-|)пш1.иф1>л (4ii.i.'Mi)M -1,48 л (н.у.) вступил в
реакцию с 65,6 м:| 20"rk-i^ p;ii;inopa i идроксиЧ'" н^грин илотлпе^ъю
1,22 г/мл. Напишите .химическую формул; ч>.ш. обраювавшейся в
растворе. По каком> иои> Ih.imoiis или iiinniiiv) протекает 1илролш
этой соли?
2. HaiimuKiv в СОЦМЩЙВНОВ ИОННОЙ 1|юрмс уравнение реакщт
г'идролича \ло]1НЛн1 >i<^ iei,i (IIII и iiIpI'iiic.iiiic hoiiLi:ini\ з чдролича jtoh
соли по перной ступели.
3. Напишик' \им11'1сск>юформу:1\ ioii ич i<<rii<iiinibi.x ниже солей
аммония, которня i n.ipojihineicn и шиоолыией С1епени- фторид,
хлорид, бромид, иодид.
4. Напиши iv imhiukj iHpiiini фирме >p,iniicnno реакции
гидролиза нитрита калия и пычи^лик* сioiюмь гидролиза в 0.1 М растворе
этой соли.
5. Вычислите рН 0,2 М p.icmop.i щпши.ш калия при 22"С.
Карпат 16
I. Напишите химическую фнрч>л\ и влше со:ш.
образующейся при растворении lt),7 i гидроксида железа (III) в 104,5 мл 10%-го
раствора соляной кислоты плотностью 1,048 г/мл. Но какому иону
(катиону или аниону) протекает ГЩрСшю этой соли?
2 I Liiiiiiiiiik1 \MMM'i^4h> м i|i4|ni\ i*. £uii [ц мешанных нн*есолен,
в растворе ко iopi>ii фсмо.|ф| .t.jl'um окрашивайся а розовый цвет: чло-
рид барин, хлорид литии, х.мрнд LjmiK<i. [ ипохлорш натрия.
3. Напишите в сокращённой ионной форме уравнение реакции
гидролиза гидрогипонитрита натрии и вычислите конста»ггу
гидролиза этой соли.
4. Рассчигтш ic с гопсти. I n.ipo.ima i iii4ih;iil:ii,i .шмоиня в полком
paciBope.
5. Вычислите pi I P.'ri-ro piitiisupit ктрата аммония при 22°C
(p = 1,002 с/мл).
ВЯриЯит17
1. Напиши ic \ммичсск\ип|н1|1\п i\ и пп inaiiiK'ai in. oop.i !>ioiik-n
ся при растворении 2Ы i шдроксидя wkw (III) a 358.3 мл 10%-го
раствора азотной кислигы плоишси.ю 1,(155 г/мл. По какому иону
(катиону или ампом>) iipoicsaci I n.ipo.ihi mi й соли?
2. Напиши it чимичеикую формулу тй irt иа!наины>: ниже солей
калив, которая подпер! ;ick-h i идроничу п наименьшей степени:
тиосульфат, сульфит, шдросу ii,i|iiir, сульфид.
3. Напити1С и сокращенно!! иоим.щ мц.рм': \рлiuil"iih6? реакции
тпидр<ч1ича дч! ил|ин|икф,и,1 ,(\т\гопнн и \\ычислиic константу гидро-
в растворе, титр
р! 1Н
1. Напишите химическую формулу и название соли,
образующейся при расширении У.У i гидроксида цинка в 119,5 мл 10%-го
раствора азотной кислоты плотностью 1,055 г/мл. По какому иону (катиону
ИЛИ аНИОНу) HpOICK,(Ot [ИДролН! НОЙ СОЛИ?
2. HliiMUHift ш мшмкуифноИ формеуршнениереакции гидроия-
!л той иэ наинишыч ниже caiefi железа (III), которая подвергается
необратимому гилролнп: viopivi, i iioiiuanai, сульфид, сульфат.
3. Напишите н сокращённой ионном форме \равнение реакции
гидр^чиза нитрона алюмгпшя и вь:чис пне кот. ];шт> i ил рол иза этой
СОЛИ по первой ступени.
4. Рассчитай 1С степень i идро.иил фшрича ичмония н 0,1 М ш
эм растворе.
5. Вычислите pi I раствора. к 0.5 i Koiopoi оиидержится 13.8 г к.
1. Налиштс \ичи'1е.ск\к>ф(1рч>ч} и нлзн.иик' lo.ih oC>p;i:> и hill1 и
ся при смешении 100 мл L М ркгвор! i щфяэинв и 73,4 мл 5%-п
раствора хлороводородной кислоты плотностью 1,023 г/мл. По како
му нону (катион) или аншн\) протекает гидролш мой соли?
2. Напишите- в сокращенной ишишй форме уравнение реакцш
гилролиэа той и) названных ниже солей аммонии, водный pacmoi
которой имеет практически нстралыгую реакцию: нитрат, aneiai
3. lianHUintL- в сократимте hl.iim.hi ^юрм.1 ■[мииемие реакции
гидролизагипоншрта натрия и вк1Ч}кмъие кончинi> i илролиитгой
оапп по первой ступени.
4. Рассчитайте степсиы идрилта нт рата никеля в раст воре, титр
m>mpi)iopiiHL']i <).1ХЗ i/мл.
5. Вычислиго рИ 0,1 М р.нлт>|и i идриклр^опата аммония.
Вариант 20
1. Напишше химическую формулу и нашанис соли, которая
образуется при смешении 16,4 мл 20%-[о pacn:[>|):i i нлроксида натрия
(плотность 1.22 г/мл) и 44,55 м/i 20%-го раствора КЛОрНОЙ кислош
(млопюигь I.I2M i'm.'O [I»,iHL-piiiuii;» ли ->га СОЛЬ силроличу'?
2. Напишите химическую форму.-iv го и ич пачвапных ниже солей,
которая подпер! .iulh i и i[>k'.in л г." к,и n.m>- i шч) n,(|k,ir натрия, хло-
рнд бария. miTp.li \hj.ih (IIк с\.гп.фит калия.
3. Напиши it и сокращенной «niiiufi форме уравнение реакции
гидролиза a uei атас вин на и вычислите ROHCtaHTJ i и; (рол ича этой соли
по первой ступени.
4. НапимЛ! iu I' M*i.iOkv.iiipm-li i|hijim^ vf,ji4k ink |ill;lkljmh гидроли-
M ИИ L pjl Г(| ,!.L И' '.А I I |П И р.]. ■ 411 I .111 I .' l. К'ILCM I. 1*1 [[Hi !И ]il "5 ГОЙ СО.1И F1
0,1 М растворе.
5. Вычислите рН раствора. I л которого содержит 6,6 г хлорида
Напишите химическую формулу о .
ион\ (катноп\ и hi ашюн\) npoi екает г»
2. Напишите в молекч.шриои форме \ решение i идролиза той из
перечисленных ниже солен, мчорли подвернется необратимому
гидролизу: сульфит калня.сульфаг меди (|[|. счльфид шелеза (III),
сульфид натрия.
гидролиза нитрата аммония и вычислите конскшту гидролиза эгой
4. Напишите в молекулярной форме уравнение реакции
гидролиза селенида натрия но первой ступени и рассчитайте степень
гидролиза этой соли иО,1 М расгнорс.
5 Вычислшс pff |UL i nop.t цианида кхшн. imp кторою раним
0,0065 г/мл.
Варняш 22
1. Првдобаадеани 95,61 НЛ 5%-ю раствора ортофосфорной
кислоты плотностью 1,025 г/мл к 0,5 л 0,2 М растора гидроксида калия
получен paensop со.tи Напишите mimhtcuk^ ю [[юрмулу этой соли.
По какому иону (ка! иону или лнионч ) про i екает г ил рол из ттой соли?
2. I (апиипис химичеекч ю форм\ \\ toii jm ii^'iiihIhiii.ix ниже солей
аммония, в pjit. i норе Koiopoii pi I > 7 \дорид, ацетат, нитрат, цианид.
3. Напишите в сокращенной ионной форме уравнение реакции
i ндролиза гипофосфита натрия и вычислите константу гидролиза тгой
4. Напишите в молекулярной форме уравнение реакции гндроли-
ia хлорида мели (II) гипюрной ct>iil-iiii ii рач-чнгайге счепень
гидролиза эюй соли в 0.2 М растворе.
5г НыЧНС.1111 С р] I \'л> I f'^'l'il 111\ IV 'U'lll k'll' 11141 lMs. [ILL'I Л1Ч 4т) МЛ 0,1 H.
paciBopa уксусной кислоты и 20 мл 0.2 н. рас шора гидроксида нэтрии.
Вариант 23
1. При растворении 5.6 л газооГф.т щщп :|ммипк.1 (и у.) в 56,7 мл
I5%-io расторг «.доршмдародной кислоты плотностью 1,073 i/мл
получен растнор со.ш Напишите чимичеекчю формулу этой соли.
I |о какому иону (катиону или анион; (протекает тидрол из ттой соли?
2. Е'аствор KilKoii и1! h<i-<ii:iiiiii>i\ ниже чыои окрашивает фенол||1-
1Ж1КИВ н роюный цвет: гипохлорит натрия, сульфа! алюминия, аце-
.1. Напишите в сокращённой и«
ролта ф горкла а>
4. Намшшпс !im»jil-k\ i)i|>iioi< форме \p;imiL4iiii: реакции
гидролиза нитрата Mill пня и нычие.чте степь пиролиз пой соли в
растворе, титр Kinnpimi p.niLii 0.0148 г/мл.
5. ВычиенмсрП 0.1 \1 pucnuipLH тми ыоччшнш при
температуре 50°С.
Вариант 24
I. ПрИ B'ldHMlVICHC I !ШИ L О,й .1 \ I I: h .'■_ ■ ' . I I \| ■ 11 '. > '- I .*■ .] I H
раствора гидрокенла натрия получен раствор сони. Напишите
химическую формулу этой соли. По какому иону (катиону или аниону)
протекает гидролиз тгой соли?
2. Напишите химическую формулу той in n;i шлихых ниже солей
натрия, растпор Kindpoii имl-oi pH -• 7 фшркд. хлорид, йромид, иодид.
3. Напишите и сокращенной ионной форме уриинсиис реакции
гидролта нитрата iKOjiv-<a (III) и вычислите константу ГИЩЮЛИЭаэтой
4. Рассчиiaiitс cicntni. i н.[роли m \.iopn i.i пммпиин й 0,2 M
растворе.
5. Вычислив piI раствора, в 250 m.i мипрпш содержится 4,9 г
цианида натрия.
Вариант 25
1. Газообрл чн.ш ее [юно. ю рол опы:\и>м hJ2 л lii.y) вступил в
реакцию с 0.5 л раствора тдроксида натрия, тнгр которого равен
0,024 г/мл. Напишите химическую форм} л> со и. пора шва вше йся в
растворе. Но какому иону (катион; или iumonv| пршекает гидролиз
2. Напиши к1 маммтгил kh|ji^>ms.i) mini i ii.nikiiiiiiji\ ниже солей,
которая не rnvmcpi :kLik'>M н цхин1'1\ (|nopn.i н:нрин с^.п.фш мели [II),
хлорид натрии, хлорид аммония.
3. Напишите в сокращенной кон мои форме' уравнение реакции
гидролиза фосфита натрии и вычислите KOiieiairry гидролиза этой
соли по первой ступени
4. Напишите в молекулярной форме уравнение реакция
гидролиза нитрата меди (II) и вычислите степень гидролита лойсолнвО.ЗМ
растворе.
5. Вычиелше pH O.I M pileiвора uiiuwiopma калия.
Вариант 26
них, которая inuncpi iiL'jfn i и'iptviH i\ f lo каком\ иок> (катиону или
ilifHOIIV) lipOlL-Kiitl IH.lpO.llll 1ГОЙСОЛИ?
2. Напишите XHMH4L'i_Kviin[ji)[!M>jiy uiii ич названных ниже солей
аммония, копирам i идро.ниускн к наиГюлынсйсюпспи: хлорит, сулъ-
3. Напииипинсикрпщпмкм ишшпй форме уравнение реакции
гидролиза сульфата чрома(Ш> и вычисли! с коноам i> i идроли ча нойсчли.
4. Рассчитай"! i: cil'iil'iil i и.чрплтл iieii p;ua uapiimua is 0,1 M
растворе,
5. Вычислите pil piicimipii, чолуюнною при смешивании 30 мл
0,1 н. растнор:! \.ioim>H" 1о|и1дн(1и к нсло i u ir 10 мл 0J ii. раствора гид-
Вариант 27
I. Напишите mi чи'«.ч: к} шторму!) и на шание to.ni.
образующейся при растворении 18 г гидрокенда желе!а (II) в 238,9 мл 10%-го
раствора азотной кислоты плотностью 1.055 v/мл. По каком>' иону
(катиону или aniii>n\) n|n>jcKlici i пдродл t (той соли?
2- Водный раочюр каким m n;rsi^urni.i\ ниже со;:сй подвергается
i и ,р. w:-,1-. и i: ii1' ■■ 11.:i ■ i'. . ■. ik ми i ичс\ и.фдт натрия, хлорид калия,
сульфат цинка, ацетаг аммония? Напишите ее химическую формулу.
3. Напишите в сокращенной ионной форме уравнение реакции
гидролиза ГМДрООуяьфйДваЫШНШЯ н вычислите константу
гидролиза этой соли.
4. Напишите в молек>.1яришн|)1)рм^> равнение реакции
гидролиза той из перечисленных ниже солен, которая подвергается
необратимому гилролшу. viiipii,] *i\il- ta (III). с\.1ьфат цинка, карбонат
алюминия, сульфид натрия.
5. Вычислите pll расi№>]);i ншрши калия, титр которого равен
0,0085 г/мл.
ВарНаш28
1. I lariEiiiniir химн'и и.vii' ф'|рм\ i\ и наемнице i"i^iii. 1Н>|1,1 л Mii.Lii
сяприрастворешш'»,1)! i ндроьаща цинка в 69.7 мл 10%-го раствора
хлороводородной кислоты плотностью 1,048 г/мл. По какому иону
(катиону или аннону! iipoicKaui шлроли! этой соли?
2. Напишите химическую формулу гои ич названных нижееолей,
раствор кото рч и hmcci pll ■ 7: бромид натрия, хлорид меди (II), суль-
''illl I LI I [111M . Ill' III I |1ММОПИЯ.
3. Напиши-и-п сократим л »t ионной форме уравнение реакции гид-
piuiHTa гидрофосфита натрия и вычислите константу гидролиза этой соли.
4, РаССЧИ Г.1И ILL 1 1 L ILL HI. [IE I|M III li] \ ll'l1!! LI il 1К>Мн|||1!И h 0.1 M p3~
створс при температуре 3Q°C.
5. Вычислите pH 0.1 M раствора карбоната калия.
Парили г 29
1. Напиши кгхичическч in фсрч\:1\ " п.пи.пик1 ч\ш. оГ>р:г» тщцй-
ся при растворении 15.2 i оксида \рома (111) в 172.1 мл 20%-го
раствора аэопюй кислоты плотностью 1.098 г/мл. Но какому иону
(катиону или аннону) протекает ] идролш ной еолн?
2. Намишии: в ионной форме уравнение реакции гидролиза той
из названных ниже u>. icii. ьотрпи inunopi aciLa i и (роличу и по каш-
ону н по аннону: гинохиорн i калим, i идросульфнд аммония, сульфат
цинка, фторид натрия.
3. Напишите в сокращенной ионной форме уравнение реакции
гидролиад сульфида iiaipn» и вычислите константу гидролиза пой
соли по первой ступени.
4. Напиши re и мо;зск\ ih^iuhi ||и'рчк" v|\niNciini.' [ilmkuiih гидро.чи-
■'. , ■. I. iii.i натрия по I -oil ступени и вычислите степень гилролига
этой соли в 0.2 М растворе.
5. Вычислите pi I раствора, получен но го pad воринием 10.6 г
карбоната натрии в ) л воды. Плотность раствора принять равной I г/мл.
Вариант 30
1. Пагпиииг^ mimm'i^l к' К' '|и'рмч.1ч и ii.uiuhhi: ^о.ш. Kin^pjn m'ip.i
зуется при смешении Kit m.i 20%-m pacnuipa i и.-цхжеи w натрия (iuiot-
ность 1.22 г/мл) и 349 мл 10%-п> раопора июромшцмтаН кислоты
(плотность 1.047 г/мл). Подвергается ;ih эта солы идролнэу?
2. Напишите \нннческуни|н1рмулу гой № названных ниже солей
натрия, которач iiinntjn .ll-k'H i и i[io nn\ ii ii.ihCio n.LUcii степени: ГИ-
похлорит. хлорит. NJiopar. перхлорат.
3. Напишите в сокращённой минной форме ураиисиис реакции
гидролиза хлорида алюминия и вычислите константу гидролиза этой
соли по первой ступени.
А. Раы:чит.Ш1с ciciilhih i плри-in i.i 'ч три w M.ipi hII
титр KOTopoi^o равен 0.0125 г/мл.
5. Вычисти 1с pll ti.l^ \\ ['.к rhnp,i i и мри i.i м;п pin
ре0°С.
Глава 6. СТРОЕНИЕ АТОМА И П ЕРИОДИЧЕСКИЙ ЗАКОН
Д.И. МЕНДЕЛЕЕВА
Жучить: главы 9 и 10.
б.!. ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К КОЛЛОКВИУМУ
Вопросы по теме «( 'тр/ч'нис и
1. Какие характеристики bojihoboit) процесса и корпускулярного
движения объединяет уравнение ле Бройля?
шеи не [Ъйэембврга?
3. Чему ранен квадрат модуля волновой функции?
4. Какие способы ншСчиж^пин нейронного облака атома водо-
ролл Имчнасте?
5. Какие исишсиныс bmvihi в \р:1!Ш<>мис Шрслингсра?
6. Что такое орбиталь?
7. Что определяй гяаанм квангоное число'.1 Какие значения око
принимает?
8. Чтоопредслясч прГш тлмки- ычшииос чис.ю? Какие значения
оно принимле]' Клкоии (iyKiu.-iiin.iu пГикмаченин числовых значений
Орбигалы101-»киа111«1н>1<1чиши|'? Какие и.-»ми1ри'1и1:кие формы Элек-
б 6
р
ожет оно принимай, при идлниочс шл'юнии орбитально
10. Что опредедяе-i спиновое квантовое число? Какие
11. Как фор«\,1И[>\01ич нрши
12. Как формулируется прими
к! г запретом ГЕаули?
13. Как формул ирунугся правила Хуида?
14. Чем электронные формулы агомов отличаются от их элек
i»iiio-crp>K-n'pithix ||юрмул?
15. Что такое тлект ронш>1Й остов?
Випрнсы по теме «Периодический закинД.И. Менделеева»
I. Какова современная формули
2. Что такое период?
3. Как читаются правила Клечковомзга?
4. Что общею у иомен тиолиой rpyiiin.i (подгруппы)
периодической системы д.и. Менделеева?
5. Чем д.'шнтчифмч.ии.ш n.ipii.411 uqinn ^гкчч.ой системы
отличается откорсняик-рно iiii'h' варианта?
6. Что такое ВЯЦМШ иониэации?
7. Каким образом НоНйеТга в зависимости m 4арклл ядра атома
первая энергии иончмции :\)\ атомов ucveiHuu <\шо[о периода; б)
у атомов элементов одной группы-
8. Что такое продет) к электрону?
9. Чтотакич1 иск^нччрицательность?
10. Каким образом меняется в эависимост in ■ чар и да ядра атома
электроотрицпк'лмюс i ь: а) ашмов элементов олнпто периода; 6) ато-
ру
11. Что такое радиус Нан-дер-Ваальса? Как на характеристика
периоде; б) в группе?
12. Какие химические ешйепиа ).ic\icnmi! щмемнются
периодическим o6paioM?
13. Что такое кларк1.'
14. Как формул ир\ с jlu i^ciioBiioii ";акои геохимии?
15. Какие элементы называют редкими?
16. Какие >лем(^1П1н1 оз носятся: а) к атмофнш.имм. G) к ;:итофиль-
ным. б) к хлл(1кос|>и;н>нмм, i ) к сидсро(|ит.г1ьным?
17. Какие племени,! на!1,шакп макрочемептами И какие
микроэлементами? Совпадают пи эти определения, если речь идет о лиюс-
6.2. ПРИМКР РЕШЕНИЯ ЗАДАЧ
гнх глав.
чначения всех четырех квантовых чисел
для послелне! lMiio ичрмльл srino.'inciiuMi Mchjpoiia и ;номс атмофиль-
ного элемента 15 группы (по нумерации ИЮПАК).
Решети1- I км^кщтм р>мп исриоличоскии cucicMi.f Д.И.
Менделеева. npc;i:ii'/i.i-iш:ы Mi,:, i\ n;ipo,ii:i.iM . "/immm i l ч 11ii. i ической и
прикладной химии (ИЮ1IAK), представлена н дликнопариолном вари-
антс периодический системы ни шаром форзаце учебника.
Предложенные ИЮПЛК иомерагрунп намечаемы арабскими цифрами под
iiciili.imiifwhinmmiioi дч си\ г гор иомгр;1лн1 i [iv им. коюрые напечата-
мы римскими LLELi|ip.iMii и iipdiincni.iuii л,и и] ilk [г ми оч киа.ми.
Согласно нумерации И1ОПАК 15 группа - это VA-группа по прежней
нумерации.
Для отнесения uiuvuiiiiiK mil или иной i руппе по геохимической
классификации ucnichioh И M I o.ii..(iiiMii,njf.ic.i\L-i
воспользоваться таблицей 10.7 учебника. Ич ной таблицы видно, что к атмофиль-
йым тшементам в VA-r-pyiuie относится только азот.
Элсктронно-Сф\кг\ри:1я формула дня Э1
сле;1уюшим обрати:
т-1 ш=0 WW1
\i L-lHlIiiL-KllSHH i НрНШШНОМ МИ1111114 M.I .111. pi III! ill C.I', liilit ) HI.-
i роны заполняют ПИМвте ншргетичееки выгодный 2/1-подуровень.
Ддч всех чре\ орбн1а;ЮЙ чимо подчрчпнч i.iaiiiKic кв^ни>№)е чи^лп
II 2. орбитальное квантовое число 1 - I. Орбитал ир-подуровня энер-
|е1ически равноценны межну собой, однако принято считать, что
яо #и = -1, затем ШЮЛНЯВГСЯ ОрбИППЬС т = 0 и последней
заполняйся орбиталь 0и™+1. Ичак, дл* ПОСПВДИВГО в порядке заполнения
игаггрона в аТОМВ aim В uai ННГПКМ ЮШНТОВОС число т = + ]. Условим-
i:4, что для "vicki pniiDii чГним,1ЧсШ1М\ 1.1 рс том. iMrip.iTVTCiinofl вверх,
Ответ:!, 1,+1,+Ш.
fi.3. ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
y pp j миг
ментов в геосферах?
энергия, которую необходимо затратить для
ктрона из изолированного свободного атома,
пц'^].1. |Ц'_"|][о О1>'НьШое рассто-
- [ I h ц 111' 11'. \ 11ч I и 4 i.L 1.1 1111 ■_ Ич' IЦ I / 'I Ln i|| 111 11111 III | [ i 4 I'
лу макроэлементов в живом веществе. ОпрсщпНП IHKWHHfl всех
тырех квантоиы* чисел ,'гдн последнего (но порядку заполнения) э
4. Для энергетических подуровней 3.1, 3/i. id и As вычислите
мi.I uaiuion1 и i^h'Mi.i ii.hoi^ Kiuinii'hi,i\ чип.1 i и. мочьлясь прлв
МИ Клечковского, распатожгле обозначении тти\ подуровней в
рядке здполненш и\ электронами.
:т |[,пп'ч i'u .iriii'ii, iMUi'jft' I ■ icvun '. -|..ч ь..|. :ч1,1 inhvi
д>тощую электронную (]юрмул>: )^2г2/?\ К какий группе относится
Вариант 2
1. В nepHiviMMi'LKoit «mil с им неги in чет илчч.чи^н свойства
всоответсгвин i- ^мпрсмечтой форм;, шрштой мсрио
на Д.И. Менделеева?
2. Напишите буквенное обозначение той и. назв
личи1г. которая п\1Ц[ц к \ [\lisiiciihc 11 I|vl ]iiiiic|^.i пчг
деление КООр.ЧИНгЧЫ. 11О.]|(11!1аЯ ф>НКГГИН, IJOJ ]1LI1III14
скорости частицы, длина волны?
3. Напиштс химические символы я-элсментовтретьего периода.
К какой группе относятся эти элементы согласно! ео\имичесюЙИ№-
сификанин 1ол1.д||гмилта?
4. Какой буквой обозначаются энергетические гкщуровли, для
кокфых орГш ki.ii.ii4l' hii.iHHJUiic 4Iil li> juniio (f? ( только значений
талей на каждом in i;ikiix полуровней?
5. Начегужк- utcKipoHtii)-cipyK-i\pH\it)i|K)|>M>jiv аюшгелия.Сколь-
Варнант 3
I k'.lhi'C M1.III14JWH' ЧИС !'.■ 14 1ГК." К 1Я(.Т 4ILf"H CMI'll'LKHll S po^fllb )."]tl\-
трона ватче'.' K^ihoii Гпкиш) шытвчиачается?
2. Как называется энергия, которая выделяется в результате
присоединения тлекп рнна к электрон с тральному атому?
т.то(1И1 М11|1НЛь-> t. p
4. Для ЭНвргетичесКЯК подуровней Л(/, 4/j. 4ii и 5.v вычислите су
гланиого и ОрбатапыюгО кваг!товых чиеел и, пользуясь правил
ми Клечковскш о. расположите ооочнячения чтн\ подуровней в по-
<: 'ic;i\ Ю1ИМО 'к'кгромпио г|шрм\г|> I s"2% 2/v. Какое место по распро-
сфаиснносш к 1СМШН1 коре :himh\uoi *ioi "х^емент?
I;..(ш ,I, [ 4
HI .1.1Я -).'11'Мр..М1Ш illl'UO» 1 10114111111 IICJIHIVIU'ICCKI)» tUCICMI.I Л И
М
то элемента на Земли в jicji
имической клао-
| д
4. ОпрвДвЛИП ЗЮТаННЛ несх ЧвТЫрвХ квантовые чисел для пос-
1Го;п1£1'0(1Ю норидк\ liiiio.iлиния) mcki]ioh;i luuoMf момента I 5
группы (по нумерации ШОНАК). имеющего наименьший радиус Ван-
. it4>-Ваал ьс а.
5. Напишисе химический епчнол licuciiih. том которою имеет
1ме;|уюш>ю >лск1рон11ую формулу: [AifitPis2. Относится ли -jtot
liitMCHt к чнеп 4m,pi>>:iv4i.-i!ii)fi. Ж11!мен1111||с>к)\оличых как для всех
ми юн pacieiiiiii. так ii.uim животных и че ювека?
1. Как
даст, что движение чикрочиешм
■Я как точной линией?
2. (>т чего согласно основному МЮН) п
V Напишисс химический ипмич i и^иГчисч' р,1см;>остраиенного
пимента яктосферы. Определите шмення Ве« четырех кнанговых
'шселдлягюс:1с.1пенМп(1111>рялк; tiiitojinciiHit) Т1ск~г)хша взгоме этого
-1. Для энергегическнх подуровней 3rf, 4/л 4i/и 5.v вычислив сум-
ми Клеч коне кот, расположив оПсшм-кния них подуровней в по-
рнлко заполнения их электронами.
5г Начерти!с "UiCKiponiii>-L i р\ кп [His jo фор\1\лч /ь'злсмеита, кп-
|1»|Ин11г KiuinLTi^r жюш'мно in.'oo\o;ni\ri.iM микро]ломсптом дпч веек
СЯ В ОСНОВНОМ СПьМ ОЧИНИ Ч'Л 2/>-IUVI\ рОНЛС?
ждает, ч
2. Как ЫИ.ИЧ1 \nvii40tKnc иечинш е к.трмчн менее 0.01-
0,001%?
3. Напишите химические символы .элементов первого периода.
К какой группе огносян;* mi жисшы coi.iaciui ivi", им и ческой
классификации Гольдшмидта?
4. Определите значения всех четырех КВШПОВЫХ чисел для
последнего (по порядк) ишилненки) ui--k1|>(>ii;i и ;номе цемента 1бгруп-
пы (по нумерации ИЮПЛК). нмеющет наименьший радиус Ван-
дер-Ваальса.
смелч ющ\ ю пик] |ioii]i\e.i <]ю[ш\.1\: j Лг| н/ '4л:. Oi носится ЛИ "зтот
видов растений, так и для животных и человека? ,
Вариант 7
1. Какиачыкаьчси оГчисфшн'кчкнй принцип, мчорый
утверждает, что наиболее устойчивым состоянием атома явлистся состояние с
VIIIII14.L 11>||l-lM inlJiiln'M Ч|Ср| ИИ1
2. От чего OQTHtOHO ffflHftllBfUifj чакону геочичии laBHCirr
распределение элементов, обусловлен!ни; их мш рацией?
место по расп|>Ок:!рлнснн<к!м и im]i4'i|il|4' ^ "iipv iu- пне Епачсния всеч
четырех квантовых чисел лля последнего (по порядку заполнения)
4. Для Э1»ср1С1 H4fthii\ II* vl> pLttii [<: й ■!/>. -hi >* и >/' >^.j числите
суммы главного и орбитального квантоныч чисел я. пользуясь
правилами Клечковского. расположите обочначения этих подуровней в
порядке заполнения их электронами.
5. Начертите элекгрокно-сп руктурн} ю форч\лу /'-элемента нто-
рого периода, который янляетси ЮВВВЯНО хеи'ко.шмым микроъпс-
элемента наминки h.i If- полу ровне?
ВарнакiЯ
\. Как называется правило, которое утверждает, что шеюроны
избегают занимать одну и i> же орбиталъ?
2 КаК HiHL.I14K»l -.ИЛШ'ИЧ MIL J K'^TL'IM] I I. к | irihiyil ML-ltL'C <H1 I -
0.001%, если они не ибрнчую] coolmichhwx чши/ра.тв. а
встречаются в виде Примесей в минералах других элементов9
3. Напишите химические символы л-алементов четвертого пери-
мтеоретической » прикладной Xi
П общие числа злекгронов на -знсргшичсских подуровнях, частраи-
иающнхея в четвертом периоде в ar<iv,i\ микрн >.icmi:imi)b. огноечщих-
ся к )тому нериолу и полезных только для отдельных видов растений
м мыкр<юрЕ;1Н11Щп|1. (.\>ilh;l uiioi ili и и Lin^.r;i <: momi_l;>.imh i'pvinu pe-
ЯЗИОНАОМШИННИ ИЮПАК?
5. НМНШИП химический символ элемента, атом которою имеет
следующую электронную формулу: [Аф(РЧз:. Относится ли этот
MicMcirr к числ> микпо-witMon юн. жи шепни исобхолммых как для всех
Вариант 9
■им ил Га илчым.'к'i l u i p\ inr;i \mm>ilicl:mi\ t.iL'MOiMOU, мморые прнсут-
стуют в атмосфире в виде атомов или двухатомных молекул нн ном
состоянии непосредственно не взаимодействуют с другими
элемента и и?
ку наиболее распространенных ■i.ioicumn лнюсфиры, н атоме
которого имеется нечетное число протонов. Опреде;гите значения всех
щектрона в атоме этою элемента.
4. Для энергетических подуровней 4с/, 5.v. 5риЬх вычислите сум-
ми Клечконскшп. рпемо южщс 1^*ннлчснин ин\ подуровней в по-
рндке !апо;1нения их "ijivhti ронами
^ Начсрмпс L[L-Ki|ni]im'-h_i]n м\|щ\1ч форм\,п /'- элемента чет-
iiepioio периода, который являете» ягшенчо необходимым микро-
р р
ода. К какой группа относятся ЯН элементы согласно геохимической
класс и ф и ка i |и и [Ълыщш ндта?
4, На втором форами" yifiiuuM прщ^.К'И 1. uiimoiiepniviiu.iii ь,1-
риант периодический системы ЛИ. Менделеева, и котором зрабскн-
МИ НифрЗМИ уХнНЛММ IIOMCpil I p\llll. pLLKOML4l [\l1MI.Ii.1 ML^'.'lMiapLVLIIhlM
союзом теоретической и прикладкой viiMtni (ИНШЛК).
Подсчитайте общие ЧвВЯЯ ЯПМСГрОМОа Ha iKepiVTII'lecKHV ПОД} ровнях, ЗДСтран-
вающимя в четвцршм ПерНСШ 1> ПОМЯЛ НШфО и см cirios-метал лов,
относящихся к иом\ пириод> « 11соб\од11М1.1\.1ля нормального роста
и рагвншя животным и Человеку. Совпадаю) ли ата числа с
номерами групп, рекомендованными ИЮПАК7
5. Напнште химический СИМВОЛ ЭЛММИП, апяи которого имеет
елсдуюшую шиктрчнн>1о формулу: | К г J-) (Л 5 д'. Опюснгся ли этот
"viс41 l-11 г к" 41 к 1> миьро 1 it-ментoii. ^^iiiiifiuii' нс1ч'ч1\ц|М1.]\ x;ik :ljih нсе\
Вариант 11
\. Как согласно геохимической классификации меыснтов Гольл-
шмидга на!ывается гр>»на химических МИМенгав, которые oGpaiy-
ют горные породы чемион коры (оксиды. силнк;пы. солсобрашыс
минералы) и I H"ip^iii[n<iMFiiL].iL h;nn^iii,i i члросферы?
2. Нагшшнк- буквенные обочначения чех ич названных ниже
величин, которые входят в уравнение да Кроил я: длина полны,
масса частицы. МОНОПН функция, могрешноегь определения коор-
ф (J
ррффр p
всех четырех кваншныч чисел :\пя ПОСПеднвЛ) (по порядку чаиолпе-
пин) > ИЖГрОиа и агаме ЭТОГО элемента.
4. Л»и анерГИШЧеских подуровней id. 4/. 5/1 и 6а вычислите
суммы главного и орбитального квантовых чисел и. пользуясь правила-
ми Клсчковскчт. pat но капп: кнщу'к'шш ии\ подуровней в
порядке заполнения их мморояшм.
5-1 ia4Cpi И [Г I.ICh I pi'Hili i-l I ||n. &■ IV |ll !■ I'1 LjiOp'.fV. IV /'- 1. ICML'H'I ij ] JH I O-
ro периода, который являс!ся жншспно нь-ооммимым
микроэлементом для животных и человека. Сколько шектронов в атоме этого
элемента находится на S/?-г году ровне?
Вариант 12
1. Как согласно (еомшической классификации элементов Гольд-
шмшпа называстсн группа ИШИЧМИИ ЭПВМвНТОВ, которые
встречаются в сульфидных pyiiix » (irviib'liiiiii большим сродством к сере?
2. Какой букной Dtioiiiii'iiiioit» )пер1С1ичсские подуровни, для
npilhl!fM;U' I li I HIM *' 14 'Г, К' Ч|;|| III! I 1114' 1.1 HI 11 1144IL 411U.H1 ( КО I III" I 1'p1 'II
гален па каж.цш in ,ikii\ нидуровней?
4. На втором форшцк учебника приведен длиннопврионныИ
вариант периодической системы Д.И Мснлс.кева, и когором
арабскими 1|ифрами >.к,и,11и.1 п.'мер.11 [>> I N1 pL-mMcii.ivL-Mi.ic \1иж,1} народным
союзом теоретической к прикладном химии (ИЮПАК). Иодсчитай-
ic общие Числа мечиронон n;i nn_-[n l-i hlilvkii\ iio;i>poBEjax, эастраи-
ггаму период) и неоГшыиыы* дня нормальною роста и развития
животным и 4ciK>nch> C'oBii^iaKrt ли эти числа с номерами групп,
реяоненлованмычи ИЮНАК?
5. l-lannntiitc \имичь-ский симиод исмеша, jhim которого имеет
i\ic;i> iom> ю » к-к! р1Ч1п\]офирм\ |ч ■ | \t|.чГ 4\"4// Ui носится ли этот
цемент к чис.1> ННКроа ЮМОШМ, ПОЯВЭННХ только для отдельных
Вариант 13
I . Как COriJ,kLn<> IC44nMMLEOLI,llfi h.lHk L II'lIIIK.lIIIIИ >.JCMl"!IjIOB ГОЛЬД-
тмидта Haii.[R:it ilj i p\i[jj;t mimiihccmix мсмопюп. спорые iipLLiK"i.u-
2. Напиши1с ypaiitictiHi: ipiiiiii<iin>ix vcjioRHii. коюрое
используется для совместною решении t ypiiiiHomcM Шрсдитера в случае од-
четырех квантовых чисел для последнею (но порядку заполнения)
электрона в атоме этою элемента.
4. Для энергетических подуровне!! 4/. Sp.SdH 6v кычиелте
суммы главного и орбитального квантовых чисел и, пользуясь
правилами Клеч невского, расположит ойошачсти тшх подуровней в
порядке заполнении их ЭЛИСГрОММИ.
5- Начерти.1 uici.i|iiiiiiiii-ci juki\ рн> iik фирм^.1\ л- >лсментз
третьего периода, который иилнегеи MiiK|)O)jit«L4imM n жиним веществе.
рых растений. (.кол!.ко >лсктропои в аюмстч о элемента находится
электронов а
-тесна. na\(i,i>
2. Как на
.качения mi
TOMOI
iiiutxc
IF III II'
1 >.li.'MCHIi
Я H OCHOBI
Вариант 14
|» периодической сит
itch забоЯвВШН! растений, том
служат- и
шговое числе
емы Д И. Me
■тных и чело!
Mllhnovit'.U'
фри. ьор\ы\ и [||>ол>к[ач питания?
3. Напишите химические символы л-элемсктов шестого периода.
К h±lhhl!1 I J'4 IHIL 111 IК n 'A \\.'A 'I II MLMt'il I M k*'l МОП* I ti'\ JIMll'fL4 r\i>H K. 1,3 k."-
сифнкапнн ]"ольдшмидта?
4. На втором i|)nputtv ччсГшнка приведен л,1иниопернодный
вариант периодической системы Д.И. Менделеева, в котором
арабскими цифрами \к;п;шы ihiml|>;i i pjiin. |x.-ho\icii,iyeMMi; Международным
союзом Teopcui4L4M'ii и iipuk/iiL'tHoii химии (ИЮПЛК).
Подсчитайте общие числа lTCKipoiinn ми iac[pjiiiii,iininn\^H н с опт детству Ю1ДИХ
периодах nicpj ltmlilllhm\ m>;i\fi4iiim\ is ашмах
микроэлементов-галогенов, необходимых для нормальною роста и ра:шития жнвожым
и человеку. Для неся ли iujioiuiihii ми числа cokiulioiot с номерами
групп, рскомеп;ю1ипн1.1мн ИЮИЛК'.'Пшшшито химический символ
5. Напиши 1С MiMii'iOL'him l им пол ^.юмеша. Нцом «oi"0|)oio itMCCi
следующую-)лсмро1!н>|1м|к1рмул}- [Ai|.W"4V4/)'. (вносится ЛИ этот
элемент к числу микро j.icmciiioi!, необходимых для нормального
роста и ра)вшия жнно!iii.iм и ■iu.ihiick) и |ц\1счнм\ для некоторых
видов растений?
2. Как в cnoincu. i miir i: ом pi.', ичгмм^м li.M !iopii;ir'ioKoi i* n;i ih.nui-
сы и энергии?
место по pacnpocipaneiiiincra в личосфс ре. Определи it значения всех
четырех квантовых чисел для последнего (по порядку заполнения)
■электрона в агоме '>ioio элемента.
4. Для энер| егических подуровней 4/ 5(/. (в и 6р вычислите
суммы главного и орбитального квантовых чисел и, пользуясь
правилами Клечковскою, расположите обошачения этих подуровней в
порядке заполнения их '.электронами,
5. Начертите электронно-структурную формулу s-злемента
третьего периода, который является макро ).цгмен юи и живом веществе,
жизненно необходим для живогных и растений. Сколько электронов
ватоме >гс>го члемсны ндчпдиюи ш\ .м-пи,]\ровне?
Вариант 16
1. Какое квантовое число характеризует пространственную
форму электронного i>i\i:ih;i" к.амщ Гчкной ouv 'Н~юзиачается?
2. Как изменяется в периоде (увеличивается или уменьшается)
число проявляемых u(cml'iii:iml! сjL'iiL'iii^ii окисления?
УША-подгрупны периодической системы Д И. Менделеева. К какой
i руппе относится -щи элемент согласно геохимической
классификации I о п. инмидта?
4. Определите значения всех четырех квантовых чисел дли
последнего (по норм ил i,ni!JjihiLiiii4) !.ii.'Ki|H)iiiiii;uoMo >;шмента 17
группы (по нумерации И1ОПЛК1. имеющего наименьший радиус П:ш-
дср-Каальса.
следующую MicK-tpdiitiyiti формулу: |l le]2i'2/i'. Огносится ли этот
темент к числ> чикро'мемоиои. жишени» нсопхпдимых для всех
пндов растении?
Вари.,,, 17
1. Как тмспии'ки и iicpni' ie (>ч1.1икиогся или ослабевают) ме-
2. VIапншитс уравнение пот
■■. i i l » для совместного решени
i > мы * ie к, рощ го I о ii, ом,,
3. Напишите химический с
мое место по распространение
4. Дпяэнер1егических полу pom left 4/! 5</. (i/ui 7s вычислите сум-
mi.i главною и орбитального квантовых чисел н. нолыуясьправила-
ми Клечковск1»Ц1. раополо.кик: пГю sii.i'ieimw них подуровней в
порядке заполнения их электронами.
5. Начерти it- ,.и.к i poimo с ■ |п к i > р,н> ю формулу (-элемента
первого периода. ко1(1|11.1Й Hii.iUL-i.-n м.|к|)ч MCML-iiKiM II живом веществе,
жичненно необходим для ЖИВОТНЫХ и растений Сколько электронов
в атоме этого элемента находится на h-поду ровне?
Вариант IS
2. Напишиic (Аквсмные ибошачения iu\ hi названных нижи
величин, которые входят в уравнение- Шрсдинп-ра: потенциальная
энергии частицы, скорость частицы, вторая частная производная
волновой функции ич координате »-, масса электрона.
рый согласно юохимкчеикои классификации I о.и.лшмидта
относится к атмофильпым элементам. На каким эиетнешчоском полуровне
находится в атоме тюго элемента последний (по порядку
заполнения) электрон?
4. Опредслше значения всех четырех квантовых чисел лля
последнего (по порядку заполнения) лекгроня в вТОЫе наиболеечлект-
К
[p|i"H n imoc<|iepe?
S. Напшшне химический cuuna'i -hieuciiiu. aimi которого имеет
следующую электронную формулу: [Аг]3(/'4л; Относится лн этот
элемент к числу микроэлементов, необходимых .uih нормальною ро-
hlL N]'-l [1;1C ICIJETH .
1 K.LK II .'1. ч.к .1
СНОСобнОСТК "MfMCKiLi
2. Первая шорт их
iU'l rjji>p;i Какая ill на
том иряда ялра: а) акр
и игио ].lch-i|K>ii(<i<. i.iiii
я перчоле (>in
; s образован in
ионтации у ат
личивастся или
о кислот?
ома серы мсньп
ванных ниже прИЧИК ОбМОНП
;го периода Тс!
пмющнх одну
■яда ядра; б) snai
нтужворбнттл
3. Напишите MiMii'K-ukuiiL-iiMisoji мемиша, un in мающего восьмое
место по paenpne i рапеннпс 1 и и ли икфчю. ()прелолн ic значения всех
четырех квангчжы.ч чисс.1 для носк-днет (но поридку "заполнения)
электрона в агаме ЭТОГО элемента.
4. Для энсргсшчсскнх подуровней 5<l, 5/,6/т 7л-вычислите сум-
мы главного и u|"~in;i;ii.iroin kii.iilioim.ix чисс.1 и, ио.1ьч\ясь
правилами Клечковского. располпжши ооО!Иачопии них подуровней в
порядке заполнения их -шектронами.
5. Начерти:l- i.itKt|)(4iiii'-tip>Ki>pn_\Ki формулу/)-элемента вто-
рою периода, который является макроэлементом в живом веществе,
жичненно необходим для ШНПНП н распеннн и относится по
геохимической к.Ык.1:ифнКн1цпи I l>.li.,uiiuh:(i;& sr атмофильным
элементам. Сколько электронов в атоме этого элемента наладится на 2р-по-
дуровне?
Вариант 20
1. Как изменяется (jcujuHai-njn ч.ш ослабевает) в i-рулпе восста-
2. Напиши г if Г»ч hntniii.it1 пГимп^чипня к\ и 5 названных ниже ве-
-чичнн, которые иходн! и сшшгишение [ ензенберга: потенциальная
|нергия, масса частицы, тарял ядра, погрешность определения коор-
3. Напишите химический символ элемента VA-подгруппы,
который согласно геохимический классификации
1ЪлЕ,дшмидтаотносится к литофильным -uiuuuifiiiM Ilii каком )нер1етичсском подуровне
днего(по ип|>ялк> taitiwiiitniiM) l.icKipoiia n агаме наиболее yi
оi о anCMBtm третьего периода. Какое место чан
по распространенности в литосфере?
гс \ичи'кч"кин оимно | ']до\[сш;1ч агом которого и
| [k|55A О
Вариант 21
в периоде (увелич
ВИЕе оз общей для любого периода тенденции к увеличению i
эстом заряда ядра: а) экранирование заряда ядра: б) взаимное
|дкивание электронов, занимающих одну и ту же орбиталь?
3. Напиши!с MiMiiHichini iiimbo.i (/-">.lUML'HTa lVB-подгруш
дц ;i
сферы. Определите значе р
последнего (по порядку заполнения) электрона в
4. Для 'incprfi ичесытх im i\[H>iiiiL'ii 5 А Ь[к (W и 7л в
МЫ 1.1 [1F1E 111 11' I! h ipi'll 1 .l.lhirol *' h h III I' 'Jil.l\ 'IMlC 1 11. 1IO. |Ь !\ЯСЬ ПрЭВНЛИ-
ми Клечконского, расположии.' обозначения них подуровней в
порядке заполнения их электронами.
5. Напиши к' \нчи41,'иан1 liimi^i ii^i Гики сипi.i\ mlik|)iплемен mis.
к^п"орыео1посчи:ч ко пгорччп iiLpito.iv. I Li'icpinio >.ickгр1.>ши»-сip>'K-
jspiiyHi ij)ofiM\.i\ наименее > n.hi]ii4npiiLL;iii;-iihii<mi in них. Сколько
электронов в атоме этого элемента находится на 2р-подуровне?
Вариант 22
1. Как HjrtMiiLR'iLH но. мшим Kp;jiLiainiiL] n p;in. ишния. ня ж»трые
могут сбли"Н11 i.kfn >np:J ди\ \ iMJii^iMiiii.rx ;iiomhii. сед и они
принадлежат разным молекулам?
2. Как изменяются (возрастают или уменьшаются) в группах ме-
I ч1 I Ш'КЧ !.|К' l. f\\ i|K I I1.* I.IL MI'1111 4' > I^:li^^ '1 i1 ' ll'Mtll ] Л I li I pv III П.! < I К'
нумерации ИЮПАК) в наибольшей степени выражены металличес-
ся к сидерит, им и,1ч почеш.ш [fa каким пи-pi и i ическом
подуровне находите а и.тлюжчо i.icuoiiiiDoc.ie шин (ни порядку
заполнения) электрон?
А. Какой (пкнпм оболип.тш-ч )норгс1нчч.кис |[ч.1\ропни. для
которых орбитальное кванн>вче 'шело равно 2? Сколько значений
[iUiL-ii на каж/юм и i iukhx iu>,:>■ ровней?
5. Напишите хныическии стимл немеша. аюм которого имеет
следующую электронную формулу: |Ne]3.v:3/i'. Относится ли этот
гчемент к числу макросе мен го в в живом веществе?
Вариант 23
1. Какое кипи ижое чис u* ikipl\ilmhl4i lihl ю о[1отадей на ИОДу-
p.'iiiiL-1' Клкчп Г(\к|ц1» lsii.i оГччкачается?
2. Как изменился ( iuhp;il];ll'i и im умсш.шасгся) и I \i\ mi rax окис-
слабым окисли кчсч и 17 i pvnnc (mi нумерации ИЮИАК)?
3. Напит hi с химический с им пол щпмнп, к которому обладают
большим сродством все ПЛЫтфкпыпм элементы. Определите эна-
4. Дпячнсри-чичсскич no.ivpo until s/. (и/. 7л и 1р вычислите
суммы главного и орбитального квантовых чисел и. нольчуяеь
правилами Клечковско! о. расположит!.- оГкчпдчсиия пил i году ров ной в
порядке ЗШЮОНенЮ их эдектронами.
5. HftiimiiniL химичив кис ^HMnu.ih.i p- )jic4L'iiiou [рсгьсго перио-
Дч|. MHOpi.IL' О I I К1* Я 11 Н К 4ITL |\ MnlKpi1 M1LMI.LM I "I' I' /I. Hli''M Kl'lULV I lit'
Пач!фти-|с-)лок1ромно-11р\к]_\|>и\1оф(>ГрЧ};|у наиболее ^лсктроотри-
дигся на Д/ыюлуровне?
1. Какие знамения ирш
буквой ОНО обозначается?
Н;||Ш:|
2. Как изменяется (возрастает и
рогголож№т1Ы1Ь|х элемент
шрый согласно геохими<1«
сится К сидерофильиым ал
рОВНС находится в атоме т
МИ1МСПИЧ) 1 1С К Т рО II''
4. Определите шачени.
poolринательного элемен-
роэлементом в литосфере?
5. Напишите химическ
следующую электроииую
Лвюкт к числу MaKpowieN
1. Как иянмктя (y»i
|}ii лиу сы В аи - дер- Ваал ьса?
2. Отиутогвш блеска, ш
ИИП1М1!
гогоэпе
i всех ч<
:а ipcn.i
ЛЙ CHMBI
|. '1
пи умвныим
'.'["MCMell'l-!
|СС1Н|)ИК1Н11<|
. На каком а
«ента после,
>Ш|ИК кват
UKIpOHl HU
;го периода.
Я1 элемента.
формулу: |Ne|3.v'V
leHTOB в
Варна
■личина!
живом нете
П 25
ишчис окраски, .чруп
тся) в группах элект-
УИВ-подгругшы.
коне ргети чес ком поду-
1ний (но порядку ча-
овых чисел для гюс-
гоме наиболее элект-
атом которого имеет
. ОТНОСИТСЯ ни лют
:тве?
«ШШОП») в груш,е
№С гь, ЭЛвЕТрО- и теп-
ф
4. В периодической системе Д.И. Менделеева семь периодов.
рнода-Вегоапиимч.ши-нбьт* 1 некпронна по.гуронме 8s. Дияэнер-
1с1ическн\ подуровней 5/", 6ft, 7/) и S.s им'пк.ш к* <л mmi.i главного и
орбитального кканювых чисел и. iio;im>ncs. мр.ти i;imii Клсчкоьско-
го, расположите обозначения этих подуровней н порядке заполнения
ir\ «лек-дюнами.
ода, которые относятся к числу макро ЦКНСЩОВ ь жипом веществе.
I l i |Ю1ГП'1 k i \>\ ki> |111\ю i|u'p'.is j\ нлпГи» ill l
а 4.i-подуровне?
троотрицательность элемен
2. Как называется ялеи
mnoi «электронных атомах
валентных подуровней лей
ГВЛШО меньший эффективг
3 Напишите химическ
носятся к лнтофнпьным эл<
ии заполняются электронам
4. Определите значения
леднего (по порядку замоли-
рЧ1О СИ.1Ы1СС ULL4O UL.ljMAL'i
Варнан1 26
1е, суть которого з
ствуст не полный
ый заряд zh6?
ьшается)вгр>-ш1сэлек-
ых удаленных от ядра
заряд ядра S, а значи-
ие символы элементов ШЛ-подгруппы,
мсп1Г1м'к";1кие-}||.
всех четырех ква
1ния)элвнтровав1
.■|HL4H4L'L-KHf IKVlVpOll-
.ементов?
нювых чисел для пос-
1Ы Ml I.L. I.ILI'IL-^MIC к."|\ОЙСТВЯ-
р р
5. Напишигс М1мн'и.чкин п^нмиол ысменi,i. ;uom кигорош и
следующую элекфпнпут формулу: 11 k\2.r2f\ {>ии>1:игся ли
элемент к числу макроэлемен гов в живом вен|естве?
Вариант 27
I. КаК ИЗМЕНЯЮ К'М (], lk-.IH4IHUk>TU>l И IJI \VU-lll.LEI,MniL4) В ПСр
ра;|И>сы Ван-лер-Ваальса?
2. Блеск, пластичность, электрическая прчиодимость, зспло
водность - это признаки металла ?
3. Напишите химические си
биосфере превышают 0,1%, но
элементов, Kuropi.iii тнинхимичискои к 1ассификапии Гольдшмидта
пиявтая лнгофяльным.
4.И периодической сне 1смсД И Mi-iuiMt-i-MiLixMi, периодов. Если
будут СИНТСШрщипЫ Ч. LJV] ;11ОЧО|*. СИ [ср-НмПИНС Oil. ICC I 1 8 [фОТОИОВ,
ТО ОНИ ДОЛЖШ.1 НОН1И II СОС 1-1И ПОПОЮ. m'CI.MOIO. IJCpilO.'UI I |рИ ЭГОМ В
помп элементов восьмого периода возможно мполненке
энергетического подуровни,,чли коюрогоорбикыыюс siuinomic числи равно
4. ">го подуровень 5у. Для ШертИЧОСКИХ ПОДУрОМИв 5j;. (н1,1р и 8s
hoi, правилами К.-шчкошммо, раишмюжкис ш'нхничсния 1тих
подуровней в порядке заполнения их элехтронмш.
юрыс относятся к числу микроэлементов, НВООйШКИШМ ДОЯ кирмпль-
ного роста и p:i urn i ич ^шимиыч iriLjiiUkfhii MhI4llphik- ffcKi|>iiiMHvcip\h-
l)pliyi4<JKif>M> \\ IIhUIMCIICC I KLKI|1i>L4f»irNMC ||.И1ЧОИН|||\. СКОЛЬКО ТЛЕ K-
тронов в агомс 11 in о уюмс'ча н;|\одн i оя ii;i S/j-подуровне?
ршш
l. Как изменяли (увеличнгаетол или унтышпнО н
ррЦ
2. I lajiHMLiiio п\ KiiciiiihiLk.- иГнпплтсипн 1сч щ НчМ^аппыч ниже
величин, котормс н\одя1 в уравнение Шродипгера: полная энергия ча-
сшЦЫ, посюяипач l|ji;uih;i. iuoj]^i« нлешлч пршннчдпая волновой
функции пи координачел. \\т рсшноеи. определения координаты.
3. Напишин1 химический символ момента 1Л-под1 руппы, кото-
I'F.m ^Ч1Г NIL JILM1 '1\ММ||Ч' ■ Ni Ml К NI.4 M'|iMh.U JIIM I ■' If. IIII МП I г ,1 hi I hlm'll I
ся к атмофильным >JC\ienniM. Клкчн'т ик'ра'прк.хкии иолуровень эа-
ILi HIIHL I СМ ц Ц'Е, I pi'П. 141П И Л |ЧМ.|\ Ч 14 О ). К'МСНГЛ?
4. Определите эименш всех четырех квантовых чисел ;шв пос-
леднего (но порядку чаполнонин) LieKipoiia и uiiniu мшмекта, у КОТо-
poi о синьнсе bcci <► ni.iiiii.hn n.i ih.lmi' i .1 1 щчеч кпе свойства
5. Напишин; мимический символ ■■лимита, атом которого имеет
следующую электронную формулу: |lle|2.i-'2/)'. Oi-ноеится ни этот
■ломент к чис.1\ M;iKfii) иемспиш в айном испюстве?
2. KaKimii:ii)ii-k»nu>;p:ii-iiici и in ; muii.iinicicx) ш руинах элскт-
макроэисметам и жшюн веществе, а погеохимической
классификации Гольдшмидта является сидерофильнмм. Определите значения
всех четырех квантовых чисел для ПОСЛСЩНГО (ПО порядку заполне-
НШ) аЛвЩЮНа В ВТОМв ЭТОГО элемента.
4. Дли чне-pici ii'1illmi\ iio.iyjiouiiuii \\..'/'. \s n ?>y? начислите сум-
ми Кнечконского, цкмшгацп- обооичсния них подуровней в
порядке адполиения их тлектронами.
5. Напнпгте химические символы мемьчаллов. которые
относятся х числу микро-ыемсикш. необходимых дли нормального роста и
развития животных и чел опека. Лачсрш ic ^ к-мроино-структурную
формулу иаибплес ijil'ki рп.ирициюлыЕот in них Сколько электро-
Варнаит 30
2. Напишите ткнинимц обозначения тех иэ названных ниже ве-
посгоянная Планка, иолиокая функции, погрешность определения
координаты.
3. Напишите химические символы цементов VlA-полгруппы,
КОТОрЫе COI i.lLHl' 1 1 . '\4'-I1'4LlK'I)] К кт ^ Hi Nil Kill lllll I I Ml. UIIMII ПЛ
ОТНОСЯТСЯ к литофнг1к1м.1м пиментам II,i k.ikdm >мср1егическом поду-
ми ми нг.ч i электроны?
4. Какой буквой обозначаются ЭНврГвТИЧвСКИв подуровни, для
которых орбитальное квантовое число равно 3! Сколько значений
принимает в этом iMyuc Mai н in нос hiuuiowi_h числа? Сколр.коорби-
■ ajjcif на каждом КЗ ГАКИХ подуровней?
Следующую элск1роЕ1п\[1) форму.-ij: |Nc|.ls •/)' Относите* ли ЭТОТ
элемент к числу м^кроин-мстон а живом веществе?
Глава 7. ХИМИЧЕСКАЯ СВЯЗЬ
7.1. ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К КОЛЛОКВИУМУ
1. Что такое \hmi
2. Что такое тли
itra?
3. Зависит ли тиг
1имодейс1 вующих
4. Какая условна
KipOOIpHli
хямтама
\я граница
И ЧОСД1Ч1С
зь? Как она образуется?
1Й связи от электроотрицателькостей
разделяет соединения с
преобладания с преобладанием июалевтной
5. Что такое ковалентная связь? Как ее изображают?
6. Как распрс.кмястся i |скфонилн плотность пары электронов
при образовании копаленгпой связи? Что такое полярная
ковалентная связь?
7. Чем p!n.iM'i;iioiLh t>C>\ii:imhiii и ги>1И1рио-акш:11н*р|{ый мсчуниi-
8. Как ouptMc.iiiii. isii.ifnтчеть атома химического элемента?
9. Что означает гибридизация атомных орбиталей?
10. Сколько л- и />-орГш i ;i. cuii уч;и; i nyo j it обра-кшаиии гибридных
ОрбитаяеЙ при х/г-, .у;-- и лу)'-ги()риливации? Сколько гибридных ор-
биталей o6paiyt-Ti;K н каждом ия лих случаен?
11. Как f'K(ipH,'i]iML-opfiiiiiuiii рпсиолш-акися в пространстве? Ка-
кокы град>счьи; мсрЕ>1 валет них углов и молекулах, орбитали uepiT-
рлльныч атомпп il Kiuofii,i\ iciMviH 11:11 ii сое Iодним ;/?-. sp1- и
^'-гибридизации?
\2. Записит ,ш icoml-i pn'iL'CK.ni форма мо кчллм oi позиция у цен-
грального атом,( псинч ч.имюиик >лск1 рмнчых пар?
13. Как и по'|1.-м\ 1пм1ИН|1>К"Н г f>si 1\^не,к- меры валентных углов в
следующим ряду молекул: CHV NH,, Н,О?
14. Как распре к вдкч j 1см|хшиая п.чошость при образовании
п- и Е-связей?
15. Чем различаются способы описания химической связи в мс-
и>де валимшыч ничьей и ml-ih.il' молекулярных орбиталей?
7.2. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задачи пи определение сип-пени иошшсти связи
Решая ча.'мчн этого типа, нужно помнить, что в соединениях.
«икают чист ковалоithi.ii: «или, дли которых характерно
расположение максим\ма момронппн плотит чл середине расстояния
Между ядрам it т"ом1ж. Cli'iicim» mmiioi:i и i;ikii\ снччсй р<шн<* нулю.
Коли же взаимодействуют атомы разных химических -цементов, то
максимум электронной плотности смещается в сторону ядра атома е
большей элекгроотрицательностью. Чем больше отличаются взаимо-
дсистнчхтшс ломы по L'mn_Lii "исмроофицаимьпосш, тем больше
Hrprtiu-iOMi'pinH1!]. pauipc [г'к'нич * Il'ki рои noli и ичпосги и тем
больше максимум 1ДСК1рошюн и ioihociii омеиюп и ciofiony ядра атома
более электроогрицатс n.irof о хтсчени li pc's>rii.ii]ic такого »н:рав-
номерного рас прело J0HH4 иск группой [|. ил нос in ином более тлект-
pi>OI p^llCll С IMILIIO IJKMLL]M,1 npilOlipL JilL'l Ol pillViLILMI.IIL.CII 'K|)l|>Ck I ИТ1-
irbiii чаряд, a lr^iHMOjL'iicTHMomiiii с ним атом litun-i: yi к-ктро положи -
nme.ibiii.iii u]"|h-ki mini.iii 1аряд. Ковалент-
ь меж,]у атомами, различающимися по ),1ск1роотрицагсль-
, имеющими разные эффект и иные
электриi полярной Kuiiiuioiinoti спя и.1о. Соединения
и * им Ч.К1 Mlm; i> ;ii4MHi^m приобретают неко-
которые и! 1Ш\ моп i диссопиигкш:!11. }ia ионы i* растворах. Такой
ггромежуточги.п'. пореходикш oi кчч^пделмюго к ЕюрпЕОчу. характер
полярной новалентной спячи примчю \.1]]лкк'ри юкать сльеиснью
зависит от разности ^и.-юроптрииак-.п.моси.-й к онмодействующих
Первая шкала элек^'отринательносш {см. i;i6:i 10.2 учебника)
была предложена американским ученым Л.Пчлинтм в тридцатых
годах прошлого века. Он же предложил шкалу, позволяющую
приблизительно оценивать степень ионности одинарной полярной
ко валентной связи в зависимости т разности иккгроотрншмьно-
стей ьзаимоде|к"1й)киип\ hIfomob (liio.i " 1) IU ной заблицы
следует» что при p[itniKiii >.IскI [loiiTpiiiiaKMi-HociL'ii. j[]4iii.iiмающей 1,75.
ИраЮ.'МД.к1' II"! Ml 1.1 Л \.ip.ll, К'Р 0114 ill I k-I CMC III. МОП MOt III OOr"[1,MLL" "ЛУ'/п).
Значенияr>.'iL'Ki|n)kiii^MH.in. ii.nocicii i.icmoiiioei 1исч 1С1иуюши\ в габл.
10.2 учебника, можно iumiii n ири-гюжении 5.
I,шиша 7.1 (imiifiiMiicii. rnncnii no cm полярной китш-н i
3,2 91
Пример 7.1. Пользуясь таблиц
ментов, определите степень ионш
N-O.
Решение. "Ьк'К-фтчршитмынхли аклнш шпирида нфтрл. ний-
дспныс в приложении 5, piii<H!>!Z(ll) 2,2. уН 3.98. Разность эле к-
фоотрицагельносгей Д^ = x(F) - Х("); Дх = 3,98-2,2 ^ 1,78. Такого
числового значения ранюеш -j.-iok i ptn>i puii.i i олыюс юй в табл. 7.1
и, | : I ы l^HL'4kll ^ I к." 11CIГ11 lli'hNIOCIU.t.*ll'iM'K |И\кИ1ЮИ iil\ ■ II f FLV UH1K'-
ну в таблице значению разности элсктроотрицательностей. рекомен-
лчется воспользоваться расчетом с ih-iumi. чтением четда линейной
денному и слел> юицч; м ним шачоihii p.ni кн. I и эдсюрошринаюл*.-
in>i:ieH. Для 1.78такиетабличньге значения равны 1,6 й 1.8.Соответ-
liкующие им ствпвни ионности связи составляют 47% и 55%. Оче-
пнлно. что искомая степень иошгости буле[ больше 47%. но меньше
•<У/а. Предполагая, что в этом интервале зависимость степени ионио-
I.IH от Дх является линейной, мы можем вычислить ее следующим
(55-47X1.78-1,6)
- 54%.
|фиГишзителы1ми \н»1\]ыер. ш.> [> чин
mmll следует окр\ jrriiM. ло ire iw\ единиц.
Проводим аналогичный расчет для с
)лсктроотринательное™ атомов амгг
1.07. Х(О)= 3.50. Pa iiiocTb шектроотрина
ДХ = 3,50-3,07 = 0,43. Такого чиклОЕши) значения рашости электро-
отрицательностен табл. 7.1 тоже нет Для оценки сгспсни ионное -
ти воспользуемся ШПОРЫ .пшенной интерполяции. Дчя 0,43 бЛВ-
жайшие предшеинличис!.- и . к •<■ их <л ним ишчения разности
электроотрицателыичмей равны 0.1 и 0.6. Оюшикгпующиеим
степени ионности ев» m сосгавлвют 4% и 9%. Очевидно, что искомая
степень ионности п\ wi lio.ibuiL- 4"м. пп меньше 9%. Предполагая, что
е этом интервале гапнеимость cierieini ионности от Ах является
линейной, мы можем пычнелигк Lbe е:к'.ч> iouihm oopst'ioxt:
(9-4X0,43-0,4) _
отшаыюнжхп» 4+ -
^4,75 = 5%
и H-F 54%, вспень hohhoi
Задачи на определение числа испаренных нектронов
Определенно1 ик м иссиа^чшыч n.illk"i |xuk'hh;iioml нужно для
оценки валентных lunMovkinitiLii даннит агама. Однако при этом следует
помнить, что числи напаренных uieicipLinoB в юонв определяет число
свячей. которые да> йатомможегобракшагъс др\тим и атомами только
по обменному М1'чл1иш\. мила каж,и.1и ашч прк-.ик-длпляет по одному
Электрону лля обра ю ml пня общей исмртппой h.l[ii.i ;Ь"1Я оценки
общих млешныл |и^*1ч,|.| кк юн jmiim.i iiwi.hio иршшм.пк mi внимание па-
ряду с неспареннммп hckiijoinlmh iijlili'iiic h ломе пссвчЕмнающих
электронных и ар и влкапгнычорупг^.и-й. (\iauviii|i" иморым могут об-
юдонорноаша'пюрпомч ме\аинэму.
ю нес11аренны\ ясоп ронок в основном
is атома кремния.
Решение. Для определения числа несиарснныч электронов
нужно рассмотреть плекфоннч-сфутлрную фирм>л\ тома данного в
условии задачи элемента.
Кремний - *iieMi:iii ipcri.uioiii-piio.ia. Слс.юнак'.'П.ио. в его атоме
три энергетических >ровня. На внешнем, третьем, энергетическом
уровне три подуроинн: 3s. Зр и W:
Пример T.Z. Укажите чис
и возбужденном состояниях
четыре электрон;
и запретом Паул» два ич i
дном подуровне Зл\ Еще
Хунда по одному 'мним.
irroB число электронов на внешнем энергетичес-
пмеру гру|тпы. Кремний - р-элемент подгруппы
тьем энергетическом уровне у
днтся на самом энергетически
Троне в соответствии с нрави-
орбитали 3/;-подуровня, имея
Построенная нами i.'icк i ponnui-с i ji\ к i ^ pn;t» формула внешнего
энергетическое \|M.iiii)i .si ома кпемвшя офажап рас пределен не
электронов ПО полуронням иорбикыяч в основном, не возбужденном со-
кремння имеется два ЩИ ИЦИИИИИ электрона на }р-п оду ровне. Два
псктрона на подуровне 3 v iiGpaiyior электронную пару. При
переходе атома кремния в вочбужденное состояние эта электронная пара
,1 по_[\ ровень Зр:
)й')лектрон!1о-с|р>ы_\|1мо11фо|1м\ ii,i внешнегоэлер-
шя атома кремния п но iiV*jiciiiiom состоянии видно,
что в этом случае имеется четыре меспаренных электрона.
Ответ: 2 нес парс иных электрона в основном состоянии, 4 не-
спареины.ч j.'itKipoiiit и побужденном сосюинии.
Притер 7.3, Укажиге число несиаренным текгронов в основном
и тмоЧж типом иоеюниияагома ЛИТИЯ.
Решение. Лигий - элемет нгорого периода. В его атоме два энер-
1сшческн\ уроимн IIjioiiihiili, iMopoii. tucfMoiif'iccKHH уровень рас-
;а подл ровня 2л н 2р. Лкгин - i
энер< el ическом уровне r out an
ринцНПОЫ минимума энер| ни в
it подгруппы
>М, НСВОЧОУЖ-
гия ft возбужденное сосго
1сргстиче1жого уровня может перейти с
v на более вмепкий подуровень 2р\
Приступая к решению задач этого типа
кие существуют типы перекрывания атомны
иозаписапн i T.i;iiiniL!L\ !■■ m ||л'рм\ i\ m.i il-вл ie.i
речь в условии sa.wn Ikt простые, o.nin.ii
это О-связи. И КрПНЬП, ДЮЙНЫХ и тройных
11 и Ю'Ьс O-Cis^ :f.. :i и i i'p;i>! и i pel 1>ч ^ия !и i
Пример 7.4. Определите число а- и тг-с
углерода (IV).
Решение. Графически формула онвн ia
у
ч\ча ич связей -
Я'!И
мо.чскулс оксида
присутствует oz
Ответ: 2 о
лей центрального а
молекул и
OlVoillL-Fri.l II l.lii I ' '
ВЫ буквой X, свмчанн
Таблица 7 2. Гсомстрн
i еометрнческую форму могут
ином гипи гнбрндииции электро
ма. Также слелуеп принимать во в
•мектронных пар на геометрич
Н
.i и\жио хорошо прол-
1. И1вестпыс Нам a
форму
о шанмоснязи геомстрн-
и их центральных атомов
гральные атомы обогначе-
ii!t'ieni»i буквой Y.
',','„';;"
sp
sp*
sp1
'|И|'н и. и \'r'.
2
3
4
2
5
4
6
S
'liiii'i'.T.iii^
"КК1,^ "■
пав
чкта-
0 XY,
0 XY,
I XY,
0 XY"
1 XY,
2 XY,
о xy;
1 XY,
0 XYB
i xyJ
2 XY,
1 иней пая
IpiLiuii.iu.ii.iHdi.KH.Kiifi грелт.-iMiiih)
Тетраэдр
Треугольная пирамида (пирамида.
основание которой правильный
треугольник)
Угловая
[ршииальнаябилирамияНдкпмра-
мплм.спелиисиныхобиитаснова-
нгея правильным треттольником)
ЦнефМИЯЯ (искаженный тетратлр,
|есвяшваюшая электронная пара
сТ^ит'н^ЗбГирам^Г™"
Зктаэлр
..: м л м i пирамида (пирамида.
основание шторой - квадрат)
1ж1скии квадрат
Пример 7.5. ({винтик- mimumcl-ksio ||юрм)л> lino
ниже вещее i n, в молекуле Kuiopoio >.ici.-ipiii< с (Щип
ного атома находятся в состоянии sp-гибридизации:
хлорид бериллия в гаюобрангам состоянии, метан.
Решение. Пачннлгь решение чадэчи нужно с напис
ких формчл вещесл', О ЮПрЫК нде! |ч;чь и УВДОВИП '*адачн. Если ПО
начатию вешееша Lp.ii> Mtn vIhIl-kh on|4l к.шп. 1:10 химическую fjKJp-
мулу то следует мриОЧм путь к помощи прелмстош \ка«пыя н чаша:
учебника. В предметом указателе >i;iiuaiiiiu iKcxiieiiuttis. упомянутых
в учебнике, приведены к порядке русского а.и|кюта. После названия
вещества сточ i m>Mi;|i.n:ip;iniMi. м;Акои>ры\ и n.Ji |х:чь<ч1 т»м пеществе.
Формулы веществ. рае(.-ми1р1чисмы\в;!:шш1Й1ала'и:,слелующис:
аммиак во.ча хлорид бериллия метан
NH, Н,О BeClj CEI,
Химические символы центральных атомов в формулах
вылелены жирным шрифюм.
При sp-гибридизации электронных орСччалси атча ибрачуетсв
две гибридных орГч1та.1и, yi ii.tml-jk.ij котрыми рШСИ 180°. Если гиб-
|Ш (И Р i С LT 4^-hi|HUl I.L Ш III |K'l. |4.ih,1k>IlM l Opi'ni I ,1.|ЧЪ.Ш ГЦ>> I Н\ inOMIIII. 10
образуются линейные \н>г|ск\лм. состягцис iri трех атомов. Такие
молекулы имени формзлу XY, (X-Y-X), тле X - центральный атом,
орбитали которою нахщпся в сое тнни и \p-i нбрнднЗЯШШ. В
данной задаче и < трех СТОИМ состоят молекулы води I I.U и хлорида
бериллия BeCI,. Молекулы аммиака и метана можно исключить И1 рас
СМОГреННН. ||ЩПМ\ <IU1 l»III1 СО
Однако TpeMiimuii.ii: иолвкузш состава XY. м
ся не только е случае лр-гнбридикации,
электронных орбшалей центрально! о ат
несвязываюшис электронные пары. Чтобы убедитьс
отсутствии пгщпмпщптпт электронных пар нужно
воспользоваться электропно-<:|р\кпр|мь1\м1 форм\ i^imh iit-inp.i п.пмх агомов:
атомов кислорода и бериллия:
Электронно-!; ip\vi>["iit4i|iopM>.i;i;iioM:i Kiit.11>|Х1.ш свидетельству-
ето наличии в нем двух иеспаренных элекгронов, когорые могутуча-
вух коваленгных сваэвЯ по обменному
механизму, и двух не связывающих электронных пар:
В молекуле воды одна л-орбитадь и три /)-орбнтали атома
кислорода гибридною re я. и образуются четыре гибридных sp'-орбитали.
Две из них. занятые нес паренным и электронами, перекрываются с s-
орбиталямиагомов водорода, к pciyjibiaie 4tioo6paiye[CH молекула
ронными парами. Итак, в молекуле воды электронные орбитали
центрального атома находя1ся в состоянии л//-гибридизации.
В атоме бериллия на внешнем чнерпчическом уровне два
-электрона. В основном состоянии они оба находятся на подуровне 2л.
образуя электронную пару. Поэтому валентность атома бериллия в ос-
При переходе ишмл \W 1°, тнп\/К и'шюч c(ilighiihl4 один из элект-
онов переходит с подуровня 2\ на подуровень 1р с более высокой
иергией. ЭпеХТрОЯВа! ПЦМ раВДВЛаетС!, и атом бериллия приобре-
зет способность к образован ню двух ковал^нтных связей но обмен-
Орбитали 2л- и 2/>-inu\p^iiin.iLi. n<l hinupi.i\ находятся неспарси-
ные электроны, j поридту 111 [сн и образ) hitch дни i-ибридные j/J-op-
битали, которые перекрываю!ся с /i-орбталями атомов хлора с об-
рачованием линейной ]рс\.чомной молекулы ВеСЦ. Следовательно,
искомая молекула с.7'-т'иГ)|>ил>г<!щис)1 i tcKipninibix орбталей
центрального атома - это молекула хлори.та Перилл ия в газообразном со-
Ответ: BeCL.
7.3. ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
С!. ПШЛЛЦСП UL-KJpOOl pillNMC IMIIlCieH MUMCllTOB, ОП-
em, ионноеiи (%) следующих святей: H-F, N-O.
2. Укажите число нос парен мы* электронов в основном и воэбуж-
3. Определила число G- и я-спичл! и mojilks.ic i pnviopii;iii r|mc-
фора.
4. НаПШПИК' 11.1 ili.lllllL1 MlHt.l. (I hOh>pi»M ilLKipONHI.IL' 1фОН|.г|.т
центрального :110мл iimlioi a;>--i nopirnn.'nLMKi СЮ . СО г', SO :,
Н,0".
5. Какова 11 ростра истин иная ГОНфнгурацнИ молекул.! метана1'
1. llonbijiiui, lao.iinir |] ,
ределите степень ионное и (%] ait.iviomnx евчэей: N-H. Ве-О.
2. Укажите число мшмаренных исктронои и основном и возЙуж-
^. Определите чис;ю ст- и я-ев« \cU и чо.кчл ic иенючлорила i|iol-
фора.
4. Напиши к- ешшлшк- нощл i иа. is uo.ici-л ia\ кои'рою хюкцюм-
ныоорбта,1н HLiiip,Lii,in'iL>.iuiM;niMiioi sp -1 iiupn.iiii.iiiiiio: SiH . UK,,
BeCl;(r),CCI,.
5. Какова upociptinc минная hnin|jiii>piiuii4 катиона оксония?
р
1. Пол ы> на. |.\Г> iiiiK'ii i.iCKipooi ршд,и t ii.hk'Licii > it ментол. i>n-
едслитс степень ионное 1 и (%)с,и;л>1О!Ц11Ч1.11Ячий: Si-Г, B-O.
2. Укажите число ниенпршшмч >.чек громок и оенпшкш и
возбуженном состочннях атома фтора.
3. Определите число о- и к-оизеЯ в молекуле хлорнла бериллия.
4. Напиши il на:1мш1с LKina. и ко юром и^кфонмыс орСитали иенг-
а.иытп> аюмл iiML'ioi -,/■ j nojii^in'..iHino Nil , N(J} , P0(', HS".
5. Какова upot 1 p.im шинная kihh|jiii ) раним mivecn> ie.i .(ММиак.Г'
yih i;io.nini.Lii lick 1 fnunpimaic m.jiolI^ii "элементов,
определи re l4i_lnllfii> пошил i и {%) i ле i\ioihm\ \uh :eii: AI-1L\ N-C.
2. Укажите число неспаренных -шсктронон п основном и
возбужденном состояниях атома кислорода.
3. Определит!' число а- и тг-связсй в молекуле сероводорода.
4. Напишите название вещества, в молекулах которого электрон-
ныеорбитали т'шр-илош пиша имени </ы иорнди гацию: SiCl, BF,.
BeF,(r), PF,.
5. КаКОВн! lip<4 fp.Hli. [Ul'MHJSH Ki'l[i|il1l 41.LLL.SL4 K.I I И141 LI ПМЧМНЛЯ'1
В.|>и,нт5
L. Польз) чи. i.i6 nuieii > iinK"ipi"npnn;iii_L.ii.}iotnici"i licvichiok.
определите ciciiu nmnDtiii ("..I l:ic.i>xuuh\ свя)сй: В-Н, C-O.
3. Определите число а- и я-евячсй в молекуле Nr
4. Напишите название иона, в котором электронные орбитали
центральною атома имею, y'-i нбрилимцию: SO,- . NO/, CO,; ,OH .
5. Какова npin. i p.nii. i и^ннлм кимфп! \ ;\щич \и\юк\лы воды?
в.,.».,., 6
1. Полыуич, i.in ни 141 > к-к-] |h.lhpiiif.i11,- ii.iuH ion liicML'Hiiin,
определите степень Hoiiiiotni (%) сли.у-юших енн шй: Si-CI, S-O.
2. Укажите число неопвренных ЫШПрОНОВ к основном и
возбужденном состояниях атома углерода.
3. Определите число о-и п-евнзей в молекуле диоксида углерода.
CO...\slL SiHt.
v K.^h, iн;i 111 m ■■ i i'.iiii i hi ни1 i Kihhn|']n ■ p;n ШЧ ми rp.iE -M'^lu '
Вариант 7
I. Польша. [JiiiMiii-ii i iL-KipiHiiiiiiioiiL1 lf.mit;leu печентов,
определи te степень ионности <%) следующих связей: P-F, H-CI.
3. Определите число а- и л-связей в молекуле воды.
4. Напишите название иона, в котором электронные ороитали
5. Камни ироир.нн-шсшыя котЬш \ паччя \ki.ii;k\.ei,i ct-noBiMO-
Паркамi8
1. Пользуясь кн'^пщеи > 1сктр<н1|рици1сльностей элементов,
редслитс степень иоинисш (%) следующих связей: H-N, Si-H.
3. Определите ЧИСЛО ст- и я-свячсй is M
4. Маииинм^ ил пицце in.1 шести,), и мол
пые орбша.ш ц<лир;1 n.iiiuii .пима имени ■,
PF,, СН4, Н,О.
5. Какова пространственная конфигурации диоксида углерода?
Вариант 9
1 Ноль'пж-t. iai> iniiL'ii i.iL-Kipsioi|iiiiwK-.4,mn:ityi исчешов.
определите степень нонности (%) следующих спичей: Bc-F, N-CI.
2. Укажи ю чис:и) iiccrki]4Lniu.i\ >jn:Kipi>noii и остит him и шпоуж-
денном состояниях анзма кремния.
3. Определите число о- к п-емзей в молекуле метана.
4. Напишите иа-иыиисиоиа. нкшигп'ч »jicki[hhiim,iu орбииши цси-
тралыино aioMii hmsthii ч/i'-i иври 1И-<:щии> ['(),' , СО,-", NO,", HS'.
5. Какова пространственная шнфИ1> ранни mi>jiuk>.iu селеиоводо-
f.l
2. Укажите число нес паре и
3. Определите число о- и л-евязей к молекуле фчсфина.
4. Напишиг'с nEHFi.iHuc nLLiu^L"i uli. и \п) illk\ isi\ kih^jioto 'зликтроц-
ныеорбиталн цопгр,) n.nimi ли'.м нмсьч ^' -i ипри.шицию: Н,О, H,S,
H,Se. Н/Ге.
5. Какова мроорамегкекизк кон(|>1и\р;шпя иу;н.фат-иоиа?
НариаигП
1. Пользуясь riio.'inHL'ir * \<Li.\ fnioipiiHaic.ri.iioLicii i.icweirroB, on-
ределите степень иокности (%| следующих си» lefl 11-F\ Mg-O.
2. Укажти число ноопареияыхзтктронов п основном и вотбуж-
3. Определите число а- и п-связок к катионе аммония.
4. Напишите НВЭМННЕ веще^гва, в
ныеорбитали центрального атома име
BF>,CO,,GellJ.
5 K.lhklEil !lpL4 . jMll, H'.CIIII.ri ЮЦ||||1| v^^illirH Mi' ILK\ tip! ТСЛЛурОВО-
it 12
льзуясь Таблицей ЮМПроотрМШПШЫЭОСтей элементов,
определите степень НОНИОС1И (%) следующих связей: Na-F, S-H.
2. Укажите число неспасенных элеш ронов в основном и возбуж-
3. Определите число о- и п-свяэей в молекуле Р4.
4. Напишите название вещества, в молекулах которого тлектрон-
мыеорбитали цен ipLi, и.пою ;iio\u hml'ioi \/>-i иори ппацию: СО ,СН ,
BCI,, Н S.
5. Каковапросгрпнсишннан конфш>раций ма|1-к\.1ьпетрафтори-
да кремния?
Вариант 13
1 П Oй
) pp
ределитс степень ионное i и (%)слсл>к>|дих свяэей: С-Н, Na-O.
2. Укажите чио.ю nctn.ipciкli>i\ ьи'кзропои и основном и иччоч'ж-
3. Определите число о- и д-связей в молекуле Sa.
4. Напиши jc и» шиши-пони, и котором i.icKipiiHin.ic ирбитали
центрального атома имекл .<./>'■ I iihpinin.iuum: NO,, СО,!", Н3О\ОН .
5. Какова пространственная конфш\р;щнч молекулы фосфина?
Вариант 14
1. Полыуяс!, liiOiiiiuuH richipooipiiuint.ii.miciovi элементов,
определите степень ионноеги {%) следующих свечей: Л1-С1, N-C.
2. Укажите число неспяренных jjiukti ронон в основном и
возбужденном состояниях атома германия.
3. Определите число о- и я-свяэей в молекуле POCI,.
4. Напишите нaiванне вещества, в молекулах которого
электронные орбитали центрального ,iM»m;i iiml'ioi */>--i ибри.|1паиию: BeF.(r).
НЛ, BF,. SiHj.
5. Каков;! upo^ip;iiiL iHvHiL.14 конфш чр.тнч \uviijkn ii.i тстрабромн-
да кремния?
he.lu opi'M i ,i. ui 114J111 p;vi м
BFj.ZnCljfr).
5. Какова nptu; j|Kim im.'njiaw kohiJuii \
Вариант 16
L 11оль'*\яин i;ir>.iifHLLii > lc [ j
ределите степень иопносш (%) следующих евшей: He-CI, Se-H.
2. УнаЖИТС ЧИС.'Ш lk'Lll.]ptJ1llil.l\ UL'M pOHiW II О0Л1Ж1И1Ч И Н1И()>Ж-
3. Определите число а- и л-евпей п мо.юкуле соронодорода,
4. Напишите naiBanne вещества, в молск>ла\ коюрчю ыекпрон-
Еи.п'орГчи^гш iiL-ii]j]ii.[i,iuii()iH(>M;iiiMi.-iiii v/i'-i m'pii шицню: Nil PH,.
AsH SbH,.
5. Какова пространственная конфигурация магекул
да германия?
Вариант 17
1. Полыуяа. |,и\ий
рсимштсси-псмь И1>11]1ПС1И(%|)
2Г Укажите чис:к> HfCii;ipoMM
.1. ОпрОМШге число о- и л-свя1сй н
4. Напишип; название вищесгва, вмолекулал когорою элекгрон-
ные орбитами ист ра и.т>ш люча iimimoi л/'-i ибрндичацию: 110.
ZnCUrXBCI^SiH,.
5r KaKOIL.I г I fH-iC I paJk I lie ли.1:1 IvOIHJ^n ч p;M!ll;l МО IOK>-:lh,L LLH1O[1I[L1J>
Варит! 1»
I г Г1олм\яа- 1-1ч in;[LLif * юм |4iihj jthm.ik1 и, мне г с и i.k^a'iiroii. оп-
рОрлите степень нояиоетн {%) вявдующнл свякй: C-F, Se-O.
2. Укажите число неспарениых шектронов и основном и
возбужденном состояниях атома калия.
3. Определите число с- и л-снячей в молекуле СОС!..
-i - rlUin^lllll ГI IilL IBM I IMl l.i JLIl^ I hl.N. I: 4111 ICJ.4.IJI 4 Ki1 J i i|ll>l О l'll'KI|IO]l-
[ibii4ip6iiia_[]iiu.-Mip.ubiio[(i;Lio\i,ui\ii.-ioi <./i'-i Ешри.ип.щию: СИ,,CO..
Ве[',(г), ВС!,.
5. Какова пространственная конфигурация молекулы хлорида
бериллия в парах?
I. Пользуясь таблицей э.
2. Укажиic числи песп,1ренпы\ ' icm poFiou и основном и ио<о\ a-
3. Опрслелшо число <7- и я-свячей в молекуле силами.
4. Намипнпе наша ни с пики, в котором олектрониьи; орбитали
центрального аюма hmcioi у>'-г ибрилизаиию: NO, . СО,1, NH/. ОМ .
5. Какова пространственна» коифщ \ рация молекулы мегана?
Варна»г 20
J. 11ол1>1уяс1. I .ими не и vick iffoi*] р ли. if С-и. нос ilm "i-'icmchtob,
определите С ICTICNl. ИОНПОС I LI ("■м) С-"1СД\ F1]IHM\ СИЯЧСЙ As-I I, К'О.
2. Укажите число иьешрсииык anexipoiKM в основном и втбуж-
3. Определите число а- и л-свя1сй в молекуле t ндрачинн.
4 Н вещества, а молекулах кигорого элсктрон-
о атома имею i yi-j порчлншпию: H.S.SiF ,
1S ((чип i 21
I. Пол1.|>яч. lao.iiuicii Litk-ipooipinviTLMLiiutiuii i.iuMeiiTOB, on-
ое in (%) СДСЯУКШЦ» связей: Cl-F, P-O.
есмлрсн|ц.1\ пек<роиол я основном Н иозбуж-
о с- и л-связей в молекуле теллуроводорода.
iiHC иона, и котором ткт ршии.и; орбшали
ioi \/> -т mlpn.iiH.niiiio: NH/, NO,, SO/, TOHJ".
кипфщ \|hiiiiih мо (скулы силана?
долите отелем ИОННОСТИ {%) следующих связей: Li-F, S-CI.
2. Укажите числа нсспаренньгх электронов в основном и возбуж-
4. MaiiHititne название пещеета, п vatcK\:i:i\ ипорош ncKipaniihic
нце1прал1,нотаюч;1нм1-1.п i//-i iiTipiuiftnwio- PH,, HI-*,.CF4,1l,Se.
p/р, _,4
акова ирпетранственхаякот^шчр.щия ккшскуш гёзрахлори-
?
2. Укажите число неепаренных электронов в основном и вотбуж-
денном состояниях атома водорода.
3. Определите чиш о- и п-свя1сй в молекуле дифосфина.
4. ElaTiiuiiiiic MjHi^ninc J4l-iih.xiHh1. h Mt.'.'it:K4 i.]\ которого
электронные орбитал и i|L4irpHi ii<iifi]o;]iovi:i и мою г */> -i m'pir шищию: BeF (j1),
СС1.ВР,,Р11,.
5. Какова иростр.ми:iисимлн к<11<фш\р:шмм молекулы гермака?
Вариант 24
]. Пользуясь таблицей нккгроотрНцатпьюскИ цементов,
определите степень ион ночи (%) следующих связей: Р-Н, Вг-О.
3. Определи ie число о- и tt-cbhil'm it miml'k* jl* пороке ида в
4. HaiiHiiimv название: iicuicctbu, в 4ivkkj-i:i\ мтюрош ч
/ llONH
р
H^BC^CCij.
гстрафтори-
цр/|
5. Какова iipiK-ipaiicutciiiiiia копани урлции мо;и
а углерода?
Вариант 25
1. Поль1>яс1. i;i-r>.i]]iiLii >.ji;KT[>oi4piiunjL4.ih.i]in;iL'ii моментов^
опеделите степень иииносги (%) Ljiu;iyioinn\ свячий: Mg-CI, Sb-Cl.
2. Vknom число нсснарениы.ч иектронов в основном и возбуж-
3. Определите число
5.
1.
редел
2.
3,
4.
Напишите мазваиго
Какова i |рост pa н с i
Пользуясь таблиц!
ите степень hohhoi
Укажите число нес
Определите число
ОрбиТЭЛИ UCircpiLLIil k'ii1 il I1'
5. Какова пространс
берш
шив в парах?
Пользуясь таблиш
рсле.-uiie cicneni. hoiiiioi
о- и п-евнзей в молеку
: нетества, в молекуле которого имеется одна
ШВ1 пара: СЦ„ NH.. Н,О, СО2.
ВСННаЯ КО1|фиГ\ раЦЫЯ unicm'rrki гтянняыя1^
Варшмп 26
il nchipooipimaifii.ii
ти (%) следующих сне
паренных адектронов
о" 'и'т-'-о'нн-юй в молеку
гвенная конфигураци!
BapMMtJ?
астей элементов, оп-
зен: Gc-O, Na-H.
i основном и возбуж-
не этилена.
которою электронные
i молекулы бромида
^й:Р-С1,и-О.
2. Укажите число неспарснпых электронов в основном и возбуж-
3. Определите число о- и я-святсй в чолек>ле триоксида серы.
■1. Напишите m;iтакие нещечка, и vo.ioKj.ie которого имеются дае
всизыиющнкагапрсмтыхтрш NH,. llns. SiF,, BeF;.
5. Каков тип гибридизации электронных ирГншыей "централыю-
11 тш и молекуле трифтприла бора?
Вариант 28
I. Пользуясь i;kiViJiiicii hcki [hhsi iiiiiuin.'.ii.miciL'H элементов, оп-
и: i и {"АЛ илсл>и.111|и\ спящей: П-1, Са-О-
ошцМ в IR0K1 роНОВ и основном и возбуж-
а фосфора.
п it jt-t-biH n-ji п mo,iu.'k>.1ic icip;i\jiiipH.iii yrjiepojia.
■I I IniiMioii i с ii.i щи пи- всщтмиа, ii,Mii.iL-Kj.iL-Kiiuipoio имеются две
КМнэывюошюс эшекгротшх нары: NH,, СН,, Н,О, СО,.
S, Каков тин шПрилтамии тсюроиммл орйталей агама углс-
Варнан! 29
I Иилмуясь i;m.[iiin:ii uicKipiniipiiiuiojibHOCTcii члементов, оп-
■. н' iiiii.l:iL-iiL-HbKOHiiocTH(%) следующих святей: H-Br, Sb-O.
.' Укажите число нсспаренных тиектронов в основном и возбуж-
* ('пределиге число о- и 1С-свя*сй и mo.icks.ic фюрида бериллия.
I Нанишиге катание иона, в котором элекгржныеирбитагшиен-
i|in .1 ii аюма имеют v/i'-i «брили гацик> Н,О', N0,\ C0,J, SiF6'.
i Kuhiiiui iipiiLipjuLiiR-nifiiH hi4ii|iiirv|i,[iiii4 MuRhN.ibi пснтафто-
|Ф''
р
ПшпфНь габпшнй Н«П|КхпршиташюспЯ цементов, оп-
I 1 №Н ЮШКЮТН fK) щщаующш связей: Pb-H, Li-F.
Укшот число нсснаренных электронов в основном и воэбуж-
Изучить: главу 12.
Повторить: главу 2, раздел 2.2, главу 6, раздел 6.1.
8.1. ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К КОЛЛОКВИУМУ
3. Назовите химические элементы, проявляющие в сложных ве-
4. Как можно определить самую высокую и самую низкую стс
5. Назовите влжис^шни окио.штели и восстановители.
6. Приведите примеры меж молекулярных и внутримолекулярным
7. Приведите примеры реакций дисироплрцнонирования и ком
пропорционнрования.
9. Как определить направление протекай]
новитсльной реакции?
8.2. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
В этом разделе объединены песр.ма разнообразны!
я. Для расчет ши'иксии.гх LiLLin_LiiiLii hkiicichii^i i]o.if,!vkijcw
прами, приведенными и учебнике. Следует запомнить степени окис-
я наиболее распространенных -элементов, проявляющих в слож-
|ствспную сте
Метод электронного баланса универсален. Его можно применять
при составлении урвШИЯЮЛ о кие, штиль но- восстановительных
реакций, в которых участвуют laioofipa шыс, жидкие и твердые вещества.
реакции мегодом ысктрошкно Сишна распадается па следующие
мулы рсаг сеггов, в правой части - продуктов).
ЛС11ИЯ,
3)соетав.1нкч уравнении ио;|\реакций окисления и восстановле-
4)уравнивая число электронов, отданных
атомом-восстановителем и принятых атомом-окислителем, определяют множители,
которые чанисывают перед химическими формулами веществ
окислителей и восстанови ю. к1 и и miul'^ iMpni'n фирм и ч p.mncFiiiH
окислительно-восстановительной реакции,
^ I iII);юнрлич множи tl'.in. ко юры с е юн j перед г|н>рм\ ими ni i .i.'ii.
пых веществ, участвующих в реакции, таким обратом, чтобы
уравнение не противоречило эакону сохранения массы.
Пример 8.1. 11оль-)уясь методом шектронного баланса, еоставь-
II' уравнение реакции сжигания фосфора при недостатке кислорода.
Решение. P;i5oi\ ii,14hh,ihh с соеижления схемы реакции: слева
ч| сфелки 'lamici.iB.iioi химические 4Jk>[im\.eiiI ре.'чеиюв, справа от
Чес химическую формул) продукта реакции:
Чатем определяют степени окисления атомов. В простых веще-
eiiiiix Рч и О, степени окисления аюмов равны 0. Степень окисления
нениях степень окислении мк iopi- ui ооычно равна -2 и что сумма
с К-'немен окисления всех лточоп. пммнщич неоемш мо.'1ек\;и,|, p;iBiia
нулю, Учитывая ciexHDMu-ipii'tuCKHC индексы в формуле РлО6,состав-
4.г I 6(-2) = 0.
И ттом уравнении Гпкнпй i ошпначена искомая степень
окислении фосфора. Умножая ее на 4 (число атомов фосфора в молекуле
1'Л^). находим сумму егеиепс4^ окисления несх аюмои фосфор.1
,М (ПАИ тень d( .) ни i cv мм\ i I с не иен о к и*, (спич iipl'l i ir ,uomi>Ii кис-
ii»|mv|ii I'ciiia» vpniiiiciiiK' относительноx, получаем
4x- 12
Итак, степень окисления фосфора в Р1ОВ равна +3.
Зная степени окисления атомов, составляем cxcmi
Р,-12е = 4Р"| 4 I I
6з+4е = 2О-2|шЗ
Число электронов, отдаваемых атомами фосфора, дол
ся числу электронов, присоединяемых атомами кислорода. Этого
можно добиться, если полуреакцию окисления умножить на 4. т.е. на
число >лик1 [ниюн. iipiti ihm.il mf i\ . iMti. mi', и м <! ih>. i\ [>ClIk i iii]i i fn
постановления умножить на 12. т.е. на число электронов, отдаваемых
восстанови)слсм Миижшо.ш опычно записывают справа от
уравнений полурсакций, отделяя их вертикальной чертой. В данном случае
оба множителя - числа кратные четырем. После деления
первоначальных множителей иа 4 получаем множители I и 3. Множи1пель 3
записываем перед формулой mo"il'k\.if>i кислорода, а множитель I,
который должен быть перед формулой молекулы белого фосфора.
Ответ: Р,+ ЗО,= Р,ОВ.
Главный недистлшх мслип viLKTfMiiiini чп,rmiк1 \\ включается в
том, что он нс отражает реальную природу частиц, участвующих в
окислитель но- восстану в тельных реакциях в водных растворах. Как
известно, в водных растворах электролиты распадаются иа ионы, н
поэтому во многих процессах с изменением степени окисления, про-
находит отражения в методе электронного баланса. [ 1о пой причине
для составления s р;п'.пин1ш окис "in if. iF.no-восстановительных
реакций, происходящих в полных растворах, рекомендуется использовать
метод полу рез к пни. кошрмй )tii<i>iHiiioi 1,ж*с ионно-электронным
методом. Основные тгапы составления vpaimennfl реакции этим
методом следующие:
1)записывают левую часть схемы реакции (химические
формулы реагентов) и определяют, какую роль (окислителя,
восстановителя или среды) играет каждое ит веществ в реакции:
2) составляют ионно-электронные уравнения полурсакций окис-
3) суммируют уравнения полурсахций. уравнивая число
электронов, отданных ионом или молекулой вещества-в
нятых ионом или молекулой вещества-окислил
4) приписываю! протинойоны;
5) соединим Hi • |н|.I I' | <щj mLi I i |чin ■ ii :n.ihMM '.iря м I м i\ 'ию j \ р;ш
ircHHC в молекулярной форме.
Пример N.2. I Uuii.-i.vhci. меюдом полурсакций. окончите уравне
ние реакции н молекулярном формг и инчсчн i;iii n: с> мч) cicmhaici
рнчески.ч ко »|н|и1цнс1гтов:
KMnO + Na;SOj + Н,0 -»...
Решение. C'ot i :iKjiciiHi:ypiiii]iuiiHH окислительно-восстановитель
ной реакции начинают с определения ролей, которые приведенные
условиях талачи вешества играют в процессе икислония-восстанов
Составляя уравнения реакций с участием пермашанага калия
исесда нужно ппмнигь. чю гн-риш/.'</н</ш катя ппып-токиСАШпа*
|ак как он содержи i si.ipi jiiicii и 1ч.к:ии-'и с il4iilliiii окисления +7 и мо
жет только принимать алейроны. При восстановлении пермангана
иона МпОд irfip.nvioicH рви&ШЫе продукты в зависимости оттог
и какой среде протекает реакция. II кнелой среде ни иоссганавлива
ется до катионов Мп;'. В нейтральной и имГниислочнпй среде - д
i;i MllO.. II СИ.И.ПОИИ'ЧО'ИПШ Срс KL i>
По условиям задачи реакция происходит в нейтральной среде.
1 ■!. гс. он принимает три олсктрона:
МпО4 +3i -»МпО2.
Для соблюдения закона сохранения вещества в левой к правой
ЧИС1ЯХ уравнении |толуреакт[ии должно быть одинаковое число ато-
Mi>h кислорода. И no.ivlii.-nuoii w.i: immii схеме реакции с левой
стороны oi стрелки имеется четыре атома кислорода, ас правой-два. Дня
двух «лишних» атомов О в левой части схемы нспользу-
форШЛЫШЯ полхоп, который чаключается в предположении, что
)мы кислорода в степени окисления -2 могут отщепляться от пер-
183
l mimllk\.i;imii подм с Обраюва-
нисм гидроксид-ионов:
<у + НгО-»2ОН-.
действуя с двумя молекулами воды, дадут четыре гидрокенд-иона:
2О= + 2Н!О-»4ОН.
ней 1 jiiiл i.i и iii <_|ik;.je ие.н лчдш i.;io,:iyioiiiHM образом:
МпО,- + 2Н3О + 3 ё -> MnO, + 4OH .
Нел и составление уравнений nojivpcaKiinii ih.i u.inaci затруднения,
в приложении 6. Однако, при этом следует помнить, что все
уравнения в зтой таблице описывают процессы восстановления. Если
нужно получить уравнение him} piMhnim окисления, то табличное
уравнение следует переписать таким образом, чтобы псе формулы
находившиеся слева от стрелки переместились в правую часть
уравнения, и, наоборот, все формулы, располагавшиеся справа от стрелки,
оказались в левой част и ниши о сравнения.
Восстановителем в данной реакции служи i с\льфит натрия,
который содержит серу в промежуточной степени окисления +4 и,
воля. Сульфит-ион окисляется до сульфат-иона, содержащего серу в
SO/ -2i->SO4;".
Чтобы уравнять число атомов кислорода в левой и правой частях
схемы, нужно оторвать один атом О от молекулы воды и
присоединить его к сульфит-иону. После отрыва атома кислорода от молекулы
воды останется два катиона водорода, которые мы запишем справа
S0,J + НгО- 2 ё -> SO,1" + 2Н*.
уравнивая числа электронов отданных восстановителем и
принятых окисдитслеч. Для этою нолуреакцию ОШОМШЯ умножаем на
число электронов, отданных восстановителем, т.е. на 2. а полуреак-
цию восстановления - на числи тпектронов. приняты?
MnCV + 2H;0 + Э с -+MnOj + 4Qff I 2
SOi:4-H3O-2 ё-*5ОГ'+2Н' |з
2 МпОн" + 4Н2О +■ 3 SO»1" + 3HiO-»2MnOi + 8ОН" + 3 SO.,2" +6H*
При сложении взаимно сократились +6е и -бе . В правой части
уравнения одновременно ij[hil\ ili u\ioi i идроксид-ионы и катионы
po.uipo.ui- кчтрыс и p[Lh_ ] m>fv ппч сиелыш iipopeai пру hit между
собой с образованием воды:
80Н +6гГ-»6Н,О + 2ОН".
Так как 1 идроксид-иоиов больше, то два из них останутся справа
от стрелки. Для них не хватило катионов водорода. С учетом
взаимодействия ионов ОН1 и Н' и суммирования молекул воды слева от
стрелки уравнение приобретает следующий вид:
2МпО, + 3 SO,'" + 7HSO -> 2МпО, + 3 50,* + 6Н,0 + 2ОН .
Сокращая по шесть молекул воды в левой и правой частях
уравнения, получаем уравнение ь сокращенной ионной форме:
2 МпО/ + 3 SO,' + Н;О -> 2МпО: + 3 SO,1" + 2OH".
Д;1Я nepexo,i;i к мо.и.'к\ ^чрмlmi фгрм!1 iiwkhi^ прноадить противо-
ионы, т.е. ионе>1. npoi илопо.южпые по шак\ ^арнла чонам,
присутствующим h сокр.! теш him пмниом уравнении, и уравновешивающие
их заряд:
2 МпО,- + 3 SO,1 + Н,0 -» 2МпО + 3 SO,;" + 2OH
2К' 6Na' rtNa' 2K"
Для гото чтобы соблюдался закон сохранения массы, в левой и
каждого из протикоионон. И данном случае ujicew и иправа от
стрелки имеется пи 2 кашоиа калия и по 6 кагионов натрия.
Соединяя ионы н ОООППОШШ с их шрядамн, получаем
уравнение в молекулярной форме;
2К.МпО, + 3Na;SO, + Н,О ^ 2МпО, + ЗНа,ЗОл + 2КОН.
Для проверки правильности составления уравнения
рекомендуйся подсчитать суммы атомов кислорода в его левой и правой
частях. Если суммы равны, то уравнение составлено верно, т.к.
соблюдается закон сохранения массы по одному из наиболее
распространенных в природе элементов- кислороду. В нашем случае в левой и
правой частях уравнения имеется по IS атомов кислорода.
В условиях задач часто требуют подсчитать сумму стехиометри-
чееккх коэффициентов. Этот расчет не имеет ника1
183
смысла. Он лишь облегчает проверку -юлам и и ре и о; мпагелем. При
подсчете суммы коэффициентов нужно помнить, что коэффициент 1
перед формулами нсществ не пишут, однако его необходимо
учитывать в расчете. Для составленного нами > равнения цчча стехиомет-
рических К1!)ф(|>»1!иснк|н равна 2+3 + 1 +2-+3 s-2 = 13.
Ответ. Сумма коэффициентов равна 13.
Пример 8.3. Пользуясь метолом полуреакций, mкончите
уравнение реакции в молекулярной форме и ШМПИПЙШДОПф стехиомет-
рическнх коэффициентов:
КМпО.+ Н^ + КОН^ ...
Решение- Приспуиая к составлению у равнения
окислительно-восстановительной реакции нужно, прежде всего, установить, какие роли
играют в ней данные вещества. Перманганат калия - всегда
окислитель. Его присупмши.- к условиях задачи облегчает работу: если в
ство, содержащее агомы элемента, который может изменять свою
степень окисления, обязательно будет мстшннппш, В данной
задаче таким веществом является пероксид водорода Н,О„ который
содержит кислород в промежуточной cil'iil'ipii омкмопия -I.
Максимальная степень кислорода в обычных условиях равна 0. (В экзоти-
чееком сои.чииснии *: ijnopow - фториде кислорода- он может
проявления кислорода равна -2. Облегчить запоминание продуктов вос-
окислення пероксида водорода позволяет приведен-
Итак, реагируя с перманганатом калия, пероксид водорода будет
проявлять свойства восстановителя. Отдавая два электрона, молекула
НгОг отщепляет молекулу Оп, в которой степень окисления кислоро-
Так как реакция происходит в щелочной среде, которую создает
присутствующий в убоинах МдаЧИ! и дроке ид калия, выделившиеся
irpir р.нрушении Mo.iL'hyibi II О. КнИ ионр.1 водорода будут
взаимодействовать с i игрокеvi.4-hoh;iми е 1И1]1.П"и.1миим молекул воды:
н*+он- -»нго.
Поэтому при окислении одной молекулы перокенда водорода в
щелочной среде выделяется одна молекула кислорода и образуется
две молекулы воды:
HjOj + 2OH - 2ё -» Oj + 2HjO.
Перманганзт-ион в щелочной среде восстанавливается до манга-
нат-нона. присоединяя один электрон:
МпО, + с -» МпО,! .
При этом степень окисления марганца уменьшается с +7 до +6.
Складываем полученные полуреакции, добиваясь равенства чи-
HjOi*2OH"-2e-c Ог + 2Н3О
МпО«" + е-> MnO, 2
+ МпО/ +2Н,0
К получен hums \р.тп11ишч pi-акции и сокращенной ионной фор-
е приписываем пртпннойоны:
НО,+ 2МпО. +20Н -* О, + 2МпО '- + 2Н,О
2К1 2К1 4К-
а от стрелки равны.
Соединяя ионы в tool иск; i »ии со -знаками чарядов, получаемурав-
ение в молекулярной форме:
Н2О,+ 2КМпО, + 2КОН -» О; + 2К;МпО4+ 2Н,О.
Проверяем правильность составления уравнения реакции,
подчитывая суммы атомов кислорода слева и справа от стрелки. Они
авны между собой и каждая их них равна 12.
t'wMUpwMi icMiosrt'£fni4LbLhiii? коэффицие!пы: 1+2+2+1+2+2= 10.
Ответ: сумма ко н^фииненгов равна 10.
Пример 8.4. Пол1.1уясь методом полу реакций, закончите уравне-
ие реакции в молекулярной ()юрме и подсчитайте сумму стехиомет-
и чес к их коэффициентов:
Решение. Прежде всего определим, какие роли играют лривс-
ьной реакции Дихрочал калия - окислитель, т.к. содержит
хром в наивысшей яля него степени окисления +6. равной номеру
группы, в которую он входнт в периодической системе элемеаггов.
Сероводород - восстановитель, полому тго солержш серу в самой
putihoii лчн ipl4 ^Г'Мк ии 1'кн^ к'пия ivii'Fh'H (> - 8 — -2., где о — номер
i-руппы, в которую входит сера. Серная кислота создает кислую
среду. Входящие в се состав -элементы не изменяют •■ данной реакции
своих степеней окисления.
Для того, чтобы определить продукты восстановления дихромат-
иона Сг От~', воспользуемся приведенной ниже схемой:
В водных растворах устойчины. две степени окисления хрома: +3
И +6. В 5ТИХ Степенях iikiil.ii.-hh>i \роч ийрачу<я ралш к соединения в
зависимости от реакции среды. В кислой среде хром в степени окис-
,1счия (Л прис> icieyoi в ьнле аквакатиоиа |Сг(И,О). Г . который для
ваясь в этой же степени окисления, он образует гсксл и;фпк<:о-
хромат(]11)-ион [Сг(ОН)л]', который для простоты часто обочначают
формулой СЮ, и называют хромит-ионом. Между этими
соединениями чр^1м;1 суЩбСЦЧЯ ИЮЮЛШНОСИОВНОв равновесие. Если
на (Cr(H.O)J1- подействовать щелочью, то он превратится в
[Сг<ОН)ь]'. и напборт. если на (Сг(<>11). ]■ молейстовать кислотой,
то образуется [C'r(H,O)r |1- M.i\o;mci, к степени окисления *6 хром в
КИСЛОЙ срелс i>ri|i;i л <; I ;iii\pi>l.i.i I -нон СгпО_" , л R щелочной среди
хромат-ион СгО,1 . Между этими анионами также существует
кислотно-основное равновесие. Хрочат-ион и щелочной среде
восстанавливается ;и> |1-"г(О1П, ] Дичромаыич! йкне mii среде
восстанавливаете* до [Cr{H,O)JJ'. Эта полуреакция и нужна нам для решения
нашей задачи. Запишем се в упрощенном виде, т.е. реально
существующие в растворе комплексные катионы [СпИ7О)е]"обсзначим как
1В!
восстановлении с +6 до +3,т.е. каждый и t дел1 ч игомон принимает по
три электрона. Так как в дихромат-ионе содержится два атома хрома,
то общее число исмрошт. принятых ним попом,ркипо 2 ■ 3 = 6.
Четырнад||;ш. к,н помок кодоро.и joo.ikkjhi.i l .юную часть
полуреакции J1J1W ioi о, 'I I ohi.i i н.ч i;i 11. ;ii ом i.i mi. i■ ■ |ti ■ i■ i i1 i i l ih'iiu hk4l.il1-
ТИОНЫ Cr:i '[ilk I' I IMI1OI101; ( ) II ihllo ^IMII [! t IK loll С ПО 1С ОКСИД-
ИОНЫ, соединяясь с катионами водорода, превращаются в молекулы
воды поэтому в правой части уравнении ноянлнкисн семь молекул
н,о.
Сероводород, окисляясь, превращается в элементную серу, при
этом образуется два катиона водорода:
Просуммируем полуреакции, уравнивая числа электронов, отдан-
жителя представляли собой четные числа, мы сокращаем их на два:
Сгг07г' + 14Н*+6 е
H3S -2с-» S +2H'
CnO7J'+ 3H:S + 14Н* -»2Сг1'+7Н3О + 6Н'
Левая и правая части уравнения содержат однородные члены
катионы Ro.iopvi.in. по ним) сокращаем ихнабН'. Мосле сокращен!
однородных чпявв» получасу уравнение реакции в сокращенной ио
ной форме:
Ct,o7j- + 3H,s ■*- 8Н' ^ген-*3S + 7н;о,
Сг:О,г + 3H,S + 8Н- -> 2СТ3' + 3S + 7Н,0
2\С' 4S0,1' 3S0^- 2K' + SO,2-
тельный '(аряд восьми катионов водорода в левой части
уравнения уравновешивают четыре сульфат-иона SO,' , 1аряд
каждою из которых равен -2. а суммарный заряд составляет 4 ■ (-2) = -8.
уравнения. Три ич них уравновешивают заряд двух катионов хрома
справа in стрелки играли роль противононов ДЛЯ CTjOj1". Соединяя
ноны ц cooiпек 1 рии i: t.i|i;i ими. по.'П'ысм ^ р.ччюлие реакции в мо-
лек\лярпон форме:
K,Cr,O,+ 3H.S + 4H,SO, -> Cr,(SO,>, + 3S + K,SO, + 7H,O.
свидстсльсмпег о coi> no. il'Hiih uikoiui l 11 ч ['.i j iu-i ч: м м^ссы. Сумма сте-
\HOMLipiiLiL.LLi,ii\ t;o ii|ii|innin п usii равна ] < 3 >4 M+3+1+7 = 20.
Отчет: сумма ко )ффициентов раина 20.
Как прини.чо. наиоо.н.шис ipj.iHOCin при а^ганлинин уравнений
полуреакни11 boiiiiikjik>l и ic\ епччаях, Ккч ул чис.ккчомоп кислорода
в ионах. пр|1с\"1"сткчнмии\ п .icmiii if np;nuMi 'i:l^ih\ \ равнении не со-
впалакп. Прнэтомво111икаетнсо6\о.шчо111,.](11).н!игы1сдостающие
или стлать «лишние» атомы кислорода в левой части уравнении.
Для o6jici чения рабоп ОЛвЗНО запомнить сле.чуннцие правила:
ления -2, слслу^1 и меримо o'icpc.ii> iitno.n. и'и,ш> il.' частицы* koio-
рые определяют реакцию v \^л\л В кислой к. рек чп катионы pivtopo-
да II . ннейтр^льнон среде mo.il'kvii.i iumi.i H t). >s щелочной цнис -
гидроксид-ноны ОН. Г.сш при помощи лих попов не удается вы-
полнии, тепшяенцую ПДВчу; то можно в любой среде
воспользоваться молекулами воды, так как мечодли.чч реакций применим, uiae-
ным ofipaiOM, к водным растворам, в которых иода всегда
присутствует в избытке;
2) если исходи 1>к' моим омерлл! бо и,|по к(и юрода, чем
образующиеся, то «лишний» кислород в форме Ог в кислой среде евпыва-
и водорода И' с образованием молекул воды:
Н;О.
ыопалия такого приема служит полурсакци»
восНапример, h
о описи I, * ic'i\ n)iiiL.Li
N0," + НгО + е - NO + 2ОН-;
б нейтрал lhoi'i и khl.ioii среле ^ч
яноккяеннк-2 в левой части уршяв-
мин реакции берут hi молекулы воды, при этом п правой части урав-
Н,0 = О* +2Н-.
(В этом уравнении буквой Ообоэначсп атом кислорода, который в
Левой части уравнения mpi.nwuii ОП МОЛвКуЛМ воды И ПГрНООСДВНЯЮТ
к другой частице, появляющийся в правой чисти уравнении.) Примс-
до нитрат-иона:
NO,+ H;O- i=NO,+2H-;
5) в щелочной ljumc «педчепмощиц» ;пом i.iil к'рчдл в степени
окисления -2 и лиши 'U</Mi > p:ih]iL4nnn реакции С)с[\\ i ич состава гид-
0Н =(У - + Н1,
ни и щелочной среде он непременно присоединится еще к одному
№ +ОН =11,0.
С'уММИруЯ ЛИ \рн11Ч1С11ИИь IHn.IVMICM 1IOM1HJ yp;ilLIEL4IIILb. К1ПХ>рОе ЮВО-
лочной среде и левую чаем. \равнении рсикнии нужно добавить два
i идроксид-иопа, при тгом в правой части уравнения появляется
молекула воды:
ОН + OIL = О? + Н,О.
Примером полурсакции, ■ которой вспольэувтоя этот прием,
служит полуреакция окисления ничрш-иона до ниграт-иона в
щелочной среде:
NO, +2OH -2e=NO3 +H30.
Задачи ни рш чаи пи тршмг ir
И окислите;
ваттам вдаьшаия реальную или условную частицу, которая экви-
НЛННПИ одному электрону.
Притер Я.5. Какай чаешцамнляск-я чишвалентом
восстановители в реакции, рассмофешшч в примере 8.3.
Решение. R примере К.Л носоаиопи-ц.-лим служи! периксидволо-
рОДД. Каждая молекула 11,0, отдает дна 1лскфона. Следовательно,
идиому тлек1роп> жиииа.п.1 устшили 'i.ilihiw '/. молекулы П;О,.
Ответ: эквивалент - это '/, молекулы Н?О,.
Припер 8.6. Какая частица является жвивале!
реакции, рассмотренной в примере S.2.
Решение. В примере 8.2 окнелтилем сл>жщ пермат анат
КМпОл. Эгокрнстмлячесяое вещее i во. кристаллы которого ci
не из молекул, а ич 'и;рсл)кч1|ихсн и определенном порядке Ki
кшшяК'ипершягеган-ноновМпО,.Днякриетадтачеекихвеществ,
необладакщих молекулярной ецп к ivpoii ыюлится понятие формуль-
ной единицы. <l>oj)M\.ibiiiiH единиц.! iLC|iu.ini,n<aia калия,
описываемая формулой КМпО,, сиеншг и'} илисто ишона к;ыия и одного иер-
манганат-иона. Гак как каждый перман га пат-ион принимает в
панной реакции 3 зпапрова, <о одном; шекгроц) йенпшкатш
условная частица 1/3 формат.] е.шпицы КМпО.,.
Ответ: жннн^чеп г - ни 1/3 фирмулыши'с-ишицы КМпО4.
Прнчср8.7. Вычиснига молярную массу
iквивалеитаокислителя В рСаКЦИИ. piKOlO] fltlHHlH Ft ИрИМСрС 8.J.
Решение. Окислителем в этой реакции служиi дихромат калия.
Каждый дихромат-и он. вое ста] шали пайс ь. принимает 6 электронов:
Сг,О7: + 14Н- +бс -»2Сг" + 7Н,О,
пая частица - l.'fjijmpvis и.тч! единицы k I i О.. ,i .[mk гор эк
тности ;ui* днхроывп калия равен 1/6. Молн'рнаи масса экв
дихромат калин рлша прин'шелемшо i|KiKiopa жниыалснт
молярную массу этого вещества:
М1/6 К,Сг,О,) =/_(КгСг,О7) ■ ЩК£'г,О.),
MI/6 К,Сг,О,)= 1/6 ■ 294 = 49 г/иоль.
Ответ: 49 г/моль.
Пример 8.8. Hi.i'ihicjinic молярную масс; жипиалсмта в
внтеля в реакции окисления иодида калия хлорной полон.
Решение. ">та реакция описывается уравнением
ZK1 + Я, -* 2КС1 + I,.
Восстанови! еле м а ней служит иод ид калия. 1 [ол урсакц
)в выглядит следующим образом:
1
= ]. Молярная мас<.а ikI4iiu.Ii.-hi;
массе, т.е. 166 г/моль.
Ответ: 166 г/моПЬ.
Задачи на расчет >л
Элсктродниж> шл м сн.1ч (Г)ДС"> реакции рассчнтывактт как раз-
HOC I If a. I .111 [ill'11 III [ \ ■ 4. m .III'. Ii.HO-K'i'-l I .11" 'i1;' . . IF.i |'.I\ ..■' I ■ Ml l-l.l li'K
окис line ы I- и шисмнившс 1Я /■'" числовые tiiii-iciiHH
которых можно найти n приложении 6 B-iiiHi iiiiijiiuis иолуреакции
объединены и группы K;i>i. ilim i pv niiii описи n;iu-1 l iicicmi.i. включающие
окисления. Начваиие i.odiiat переменными с гене чячи окисления
написана над группой пол у реакций. Группы расположены в а.тфа-
чипаекя с полуреанций. в которых участвуют соединения азота, и
!;Ш1ф1Е1.и:1ся гт-гпрслкцинми, r Koiopi.ix чкчшкися степени пкиелс-
Иолурсакции, привсдсии^гс в тао.иин.1 i i.]ii;iapiiii.i\ окис;гитсль-
величину потенциала, равна I моль/л. Знак
дареного окислительно-восстановительного norci
от способа чаписи полуреакции. Например, варил*
на полурсдкция
для которой сгандаршмй окислительно-
лурмпшю записать по-другому, поменян местами окисленную и
восстановленную формы желета:
Fe!'-e =Fe-\
то И° дли нес пс и змеи и ген и m.iei р;шш,1м. h.ih и прежде, ьО.771 В.
Пример!!,1), Bi.i'mi line )-[С лая [k.imiiiii. [uccmih репной в
примере 8.8.
Решение. И приведенной в предыд>тем примере реакции
окислителем служит молекулярный хлор, анисегапов1ггелсм -иодид-ион.
В группе полу pea к ни и пол ишмюнком ((Хлор» находим нолурсакнию,
становление молекулярного хлора до хлорид-
Clj + 2e =2CT.
пвцкша для скетемы, о
ТГкисление иодид-
реакцией
21 - - 2 е —» 1,.
ИШЮаННуН п Пронин
1,+ 2ё -»21.
Так как обе цолур
;истему: раствор, в ко
ионов равны 1 моль/л.
и для обоих полурсам
£° = +О,53(
ЭДС - «•_ -
ионов до элемент!к
вком «Иодя можно i
наложном ктравл!
1ТОЙ ПОЯ
уреаяциеП, равно
■го иода игшсывается попу-
шйтитол
го значение t:"i"ji i;i;ipi nt>[ ч i
пинала т такт от <|юрмы
В.
■£eer
>p,inii4iik- найденные числ
|ько полу реакцию,
н илу ре акцию вос-
j же химическую
taimcи уравнения
ЭДС = 1,354 - 0,536 = 0,823 В.
Ответ: ЭДС = 0,823 В.
Пример8.10. [[шыуясь-значениямистандартных окислитсльно-
шиюпшплъвгнои Fc:i.
ie значения сгандарт-
шов для полу реакций
[О соответствующих галогетд-нояок
!•„■ IJ59B
Л",.,,,,,- \.Ш В
[Я полуреакиии окисле-
Баа ряс41
как рачш
и ЭДС ре,
ення. чтс
е-ft"
учим отрицательное и
Итяет. 1
Чидачи i
кльзяокисч
га расчеты с
Я*™,-- 0,771 В
(^ д, принимает положитсльнь
■'фтором, хлором и бромом. О
кно окис;|ить Рег4до Fe1'. Если
пия катиона железа (II), исходя
и может служить элементный
1ачение этой величины. Значит,
?тьиодомИ0Я0М
использованием уравнения lit
рактернчуют системы, находящиеся s стандарты:* условиях, т,е. при
гечпературе 298,15 К (25°С) и при активностях всемютенииалопре-
делнюших веществ, равных 1 моль/л - Понятно, что при других
температурах и лрушх активиистнх (концентрациях) мшеств,
значения потен пиал ни будут ошичии.ся in iex, чю припечены в
приложении 6. Если стандартные потенциалы для двух систем достаточно
близки, то при больших отличиях реальных значений потенциала от
стандартных может происходить даже изменение направления про-
госашп реакции, т.е. окислитель и восстановитель могут поменяться
го потенциала н условиях. <.> с личных in cian.uipi ны\. иочно.]чс"1"уран-
нгаие Перепета:
потенциал (in приложения 6), Л-уиит.-рса.1.,п,1я I :ншия постоянна»
|К- 8,31 Дж/моль К), Т- температура в К, п - число электронов,
принимаемых окисленной фоцчон при превращении се в
восстановившую форму, F - постоянная Фарадся (F = 9,65 ■ I О1 Кл/моль),
1Ц„„,- произведение актин нос гей окисленной формы и всех ионов
и молекул, записываемых вместе с этой формой в левой части
уравнения полуреакции, Пя_ _ - произведение активностей восстанов-
формой в правой част уравнения полуреакции.
Вес эти обгона'к-имя от.чятся h форме :;iiiiilii пол у реакции,
рекомендованной ИЮ1IAK. в соответствии с которой все полуреакции
записывают как пату pea к ни и восстановлении, т. с. в левой части урав-
леннут форму.
Akthbiiocti. pile11ч>;>иi t-.чм волы прплим.мо] рдшюи единице и
нс записываю! ее и \ р.нчк'ние Нсриста.
Пример 8.11- Hu'iiiL.iHie чие/юное m.i-ieune ueKi родного
потенциала cepefipa в 0.05К-М растворе сувьфОП cepefipa. Плотность
раствора принять равной I г/мл.
Решение. В условиях шлачн речь идег о гетерогенной системе,
репрл и pjici unpc upjiL\ ici кч Ю1 качиопы Дjj. J)i4 llmllil4ms шшсынаст
полуреакция _
тивпости каиникч! оеребр:!. маходяишчон и растворе.
Катионы Ag' - окисленная форма. И.\ активность должна
присутствовать в числ1гге.1е дроби, стоящей пил таком логарифма в
уравнении Мсрнста. Меы.мичсекис серебри ne*eeiaHob.ieHHax форма.
Его активность с. ie iok.i.eo oi.i laruiean. к \n.t\icn.ire:ie >гой дроби, но,
С учетом nccrocK.naiiHoi опыте ур.тненпе Периста для
рассматриваемой систем].! iipiuii)pci;ierc,ie;iyioiiinii вид:
Подставив в предлог арифмнчеекии Ыв(ШМ1вль числовые таче-
НИЯ гюстоянных Rn/''.ii i;ih>Ki; ic\iLie|i;jis|Hii / 298.1 ^i К, и произведя
jspin|j4i.-i n'lcci^no ле!к ИЧ1Ч. получаем:
2.3ДГ ^ 2,3-8,31-298,15 _ 0,059
„f.- 1 ■ 9,65 ■ 10* ~ ] '
Единица, присутс! ну инцая в знамена) еле дроби -это число
электронов, принимаемых окнемнной форНйВ (ктювом серебра) при
ее ii|n-ii|i.!i!ieniiit к i ■ t i ,i>i.<ii iciim ич||.':'м\ ином ееребра).
Если концентрации потенциал определяющих веществ невелики,
то можно пренебречь отличием активности от концентрации, и чаме-
рацин. OiCjiyei обрати! ь внимание на то. что под 1 на ком логарифма
в уравнении Периста должны быть малярные концентрации. В
данной задаче col j.iii p.tt 1 лир.! iu.i|i.m,i-i[ m.h пиши .ii'.ll'ii с\льфата
серебра, поэтому нужно осуществить переход от массовой доли к моляр-
нон концентрации. Для тгого запишем уравнения для обоих
способов выражения cociana растпора:
Подставив
пеличин, HiipiHHHL-дн p;iL4iii 1,1, найдем чолярнуч концентрацию суль-
<|>ата серебра:
Ит уравнении реак!|ии шопролитической д
серебра видно, что ич 1 моль СОЛИ оСрачусгся 2 м
la больше, чем моляр-
i.c. f(Ag-) = 2 • 1,6- 1OJ = 3,2- 10 'моль/л.
Так каккоишмпрациякатонов серебра hi
небречь отличием активности от конце!гграции и подставить найд
ИМ числовое значение t(Ag') в уравнение Нернста:
£ = 0,799 + 0,059 Ig (3.2 ■ 10 >) ■ 0,799-0,147 = 0.652 В.
Числовое нмчсмис •- t.inj.i|'i m>w > 1ск1ролнол
0.799 В найдено в приложении 6.
Ответ: 0,652 В.
197
тенциал инертною ■ к'к jpo ui и pat m^[>^. ^.чиер/к.иием (К02 моль/л 1:с?'
и 0,01 моль/л Fe^.
Решение. На поверхности ннПЛТЮШ, например платинового,
электрода катио жслс-ta могу: обмениваться )лек1ронами в
соответствии с полуреакцией
В результате э
вияч 1алачк системе окисленная форма - катит
форма - катион Fe:\) Пчдсгавлям и уравнени!
имения н\(1дн1И»л и не к» не, I и Liim. получаем
£ = 0,771 +M^Lg Mi =0.771 -0,018-0,753 В.
Ответ: 0,753 II.
8J. ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
Варнан.1
в сокращенной ионной форме и подечита
ких коэффициентов:
Cr.O,-+H,S + Н" -*,..
2. Пользуясь менviom иолуреакний, -икончшеуравнение реакции
в молекулярной форме и полечи гай i с с\мму С1е\иометрических ко-
KMnO, + Na.SO, * H,SO, -* ...
3. Рассчитайте молярную массу эквивалента окислителя в рсак-
О11|кчд<.м!]111? 'i:ick"i pu imi/i^Musui 1 и |ч [км I. ни п. приг.е (ипной в задаче 2Г
5. Вычисли"! с 'iiiL'jioiuie \\ гачен иг мектролпот inm.4iim;i-i:i жоле-
м в 0.02%-м pai.-ni.4ie L->.iM|>aiii*c,iciii (II). [l;iomotib раствора ирн-
нить равной I г/мл.
Bnpiian г 2
1. Полыуясь ментом пч.чу|как]|ии, iiihiiiriiiiu y|i;iHiii!iiiieреакции
в сокращенном uniiiuiii формул цодсш ;ш ic ej mmj С1счиомсгричес-
кич коэффициентов:
СггО,=- + Ре:( + Н--»...
2. Пользуясь методой полурсакций, закончите уравнение и мале-
кулнрной фирме и подсчитайте сумму впхиомлрнчвовях тэффи-
3. Определи ic мо,шрн\ю mhlxj 'жнмкалеша окнс.чиюля в
реакции, прицеленной взашпе I.
4. Пользуясь значениями иапдаршых )jn-Ktp(i'|iu,i\ потенциалов,
определите: 1Л1чсгродвиж)1ц\1осил) реакции, прицеленной в задаче 1.
кав 1%-м pain норе с_\ ii,i|i;u;i ципь-ii. I Iiioi iiolii. paensupa цринчн,
равной 1 г/мл.
Вариант 3
П сокращенно!! iionnoii форме- и подели laiii с сумму с гсчиометричес-
кич иуи||<|]ициинтов:
1 I МпО, +Н' ->],+ ...
2. 11ользуясь мезодом полуреак
и MOjicK^'.nipiioii форме и нодсчик!
эффициентов:
К;Сг3О, + K,SO, + H.SO,, -t ...
3. Рассчитайте молярную массу эквивалента hi
реакции, приведенной в задаче 2.
4. Поль1уясьзначениямистандарчНШ wiciciponHi
5. Рассчитайте числовое значен
о)1ь/^кагиоГ^
Ви|)нннг4
I. Иолыуис!, мсюлом iio.ivpciiKiuiii. «акокчи ic уравнение реакции
ок pin цен noli ион пои форме и пп ic'riiiiLiiic LVMvn l i счиометрнчее-
1 КО,ффи1
] ] р
ур |p Л 111' k'l][f ,|И 1С ч_'\ \^ \L\ L I c\llh 1M1/I рИ'|еСКИ\ KO-
эффициенгон:
Ca(OCI);+HCI -»CI, + ...
3. Ortpcjic/i[11«j mo mpn\ju 4.kl\ ikiuuuuciiu окислителя в реак-
4 f loiii.i^ mci. 'A i.l'ici iihi'.ui * i ч1м 1лр 11 ii.i\ '. iCK 111'' и ii.i\ i mi eni in:i.h'ii и
принимай но внимание, чтп н кислой cpcw C'K ) и^-нрищается в HCIU,
рассчшай-iv олсетролвнжчщую снл_\ реакции, приеденной вэакачс2.
в 0,1%-м paeibOpc ^v ih-c|»<i t<i меди 41П. I к'ичнием. pat i пора принять
1. Пользуясь не тлим ntuiypciiKiiHH, икшпи ic jpuniiuMHc реакции
Bixmpiuiieiniini iiniiiioii [|>ii)imu и ihvichh liiiii с n\ mmj с к-мюметричес-
кич wo 1г||фнционтов:
MnO,+SO.' - + H*->...
2. Пользуясь метолом полу реакций, закончите )равкснне реакции
в молекулярной форме и подсчитайте сумму отехномстрическнх ко-
эффнциешнв:
K,CrjO, + H.S + HnSO4^SJ- + ...
реакции, приведенной и чадаче 2.
4. Полыуясь >ипчц||инми cniH.'iiipnibix ■ ■ ■_ ■. | ,i\ потенциалов
paec4Hiaiiri; uicki ро.шижуш\ ю tnjis реакции, iipiподенной в задаче 2.
в 0,1%-м растворе шчрага свинца. П.ютнос [ ь раст вора принять
равной 1 г/мл.
Вариант 6
1. Полъчуяа. Mi'iiuiiii m> i\ |)c;iKiiiiii. kimui'iiiu- \ p;inncmn: риикшш
BCOKpamciiiii'ii ишшш (Ьирмг и up ic'ihiliinl t> мм> i. u-MiOMeipn'iei-
ких коэффициентов:
MnO, +Fe:-+M- -)...
2. Польэуясь методом нолурсакцин. икончнгс уравнение в
молекулярной форме и полечимте пим; с^хшшшричисхил ко^ффи-
KIO,+ KI
3. Определит
WUHK
тного элек'1 pn;ui » рас шире, содержащем 0.(Id м
[Fe(CN>J' и 0,02 моль/л анионов [Fe(CN)J'".
Нириант?
I Il 114 IV |H\LJvl[lll1. I.1KL-11411 Ц1 \ ]^I
oii ([шрмг it полечи tuHic сумм> с
2. Польчуись моодпм полурсакиий. чакопчитс уравнение реакции
и молекулярной форме и подсчитай™ сумму впхиоыатрнчевщх «"-
Clj + KOH-^KCIOj + KCH-...
приведенной в калаче 2.
4. Пользуясь ЗКаЧвНИЯМИ ОПШирТНЫК ЛеКТрОДВЬП потенциалов
II lipilllMM^LH IUI UhlMMilllMI.1. Mill IL I.IK I-L>L1 L.|4'.'llL N1). II[JCHPhIIIU1CK^I H
UNO,, ВЫЧИСЛИЛ тлектродвижутуго силу реакции, приведенной в
чадаче 1.
5. Вычисли к- ЧМСЛО11О1.1 '{tiii'luiiiii; tiainap'noni ■i.-iuKipo.'inoi-ti чо-
генцишш желта в 2%-м рвстюре сул1.фага железа (II). Ппотнооп
раствора принять равной 1 |-/мл.
1. Польчуяа. метлам minvpL-iiKiiiiii. ыкоичик- vp.nuifiinoреакции
чч;р;ицеи1ии( ионии» фирме н iKvicuiiiiiiiic иумму^и'мшмегричее-
и\ коэффициентов;
МпО,-+ .SO/ +Н.О-»...
2. I tojlb'iyaci, ml iилом гю.ичр^лмши. ^икончии: 4p.iniKnniiL реакции
. vHi.'iLKv.iapiitni форме и пиле ,niie амч\ е к-м(о\и.-1рических ко-
ффшшмпв:
4. 1 1ользуясь значениями стандартных -электродных потенциалов,
вычислите члешри (внж\ iu\io ciu\ pen мши. приименной в задаче 2.
5. В 500 мл р;к-1 ичр.| си/иржш ей I 5.18 г ечльфача никеля ;Вычис-
створе.
Влржт 9
1. Пользуясь метлиц ни.чурсакцип. ммншме уравнение
реакции в сокращенной ионной форме:
no, Ц +1Г -NCM 1,+ ...
2. Пользуясь мсеч.чом но.1> pc;tKiiltil, икоичшс \prmni_LniiLL
реакции в MoncK)':iH|nii'ii [|]чр\и: и |м,1счпыйк' i\\i\n о
■шффщцивюв;
KMnOt + H,S + Н,5ОЛ -»S4. + ...
3. Вычислите молярную массу э р
акции. IipilRCrILbIIIILitL » ЧОДЗ'Ее 2-
4. Поньзунсь-шачсинями станлар! пых электродных потенциалов,
вычислите -»№KTpii.uiii)Kyui>'io силу реакции, приведённой в чадаче 2.
5 В!! ииер-
F'
( p р
,10ма1ь/л катионов №.
Каркайi 10
1. Пользуясь USTOADH пол у реакций, закончите уравнен
ии в сокращенной КОННОЙ форме:
АЮ2 +lI+H2O-»HAsO,: +...
подсчитайте сумму стехиометрических коэффициентов.
2. Пользуясь ml'io.'Iom молуриикний. закончите уравнен
ии в молекулярной (|>орме:
KMnO^ + Ne,SOj + И,0 -* ...
ПОЛСЧИТаЙГС Сумм\ С1и\ШЛ1С|рИЧсСМ1\ КО и|и[|ИЦИСНТОВ.
3. Вычислшс мо 1Н|>н\к> массу жшнииюша окислител
ии, приведенной и задаче I.
4. Пользуясьзначениям» епшларп них электродных поте
ычислив'шскфч 11»|жуи1>Ечсилу реакции. ирнЕаденной в
5 В
p |р
в 0,1%-М растворе ни i para серебра. I Lionioc i ь раствора принять рае-
Вариант II
1. Пользуясь метолом молуреакцнй.
ции в сок ращен кой ионной форме
рическич коэффициентов:
HjOj + Fe1' + [!■-»...
2. Пользуясь методом полуреакций, закончите уравнени
ции вмолек>-1>ф11<1Й i|ii.[iml' и iKi.K4[n;iii]LL ^\\nn и к.'\иометри
коэффициентов:
KMnOH + NaBr+H!SO4-*BrJ+...
акции, приведенной в идаче 2.
4. Пользу чи. пмчеииччи стандартных ^.'ii-'ki рпдныл но ини
вычислите ')дек i ри.ппи,\ \\\\ ю ^if.i\ релынш npniu- к иной в за
вО,5%-м раствора iiinpiiia цинка. Млотиоси. раемтра приня
ной 1 г/мл.
Варнак I 12
1. Пользуясь ullil>.u>m I h> i\ реакции, ^ikhiiimh к1 \рн1гчилш
ции в сокращен ин и им hi in и форме и mivil'ijm.iiilu ls мму стех
рических ко;)ф<11Ицнентов:
Н,О, + 1 +Н' -»],+ ...
2. Пользуяс|р ml'UMum mi> \\ реакции, i.ii.i^hi'iu к1 ур,1ииспи
ции Б МОЛ СКУЛ И р| 141 ] ||н*р\к- И ПОЛСЧИ ] all KL LL\ UM> ' Kn\m>MLLl]lll
коэффициентов:
Kl + KNO, + H.SOa-» NO + [,+ ...
3. Вычислите молярную массу эквивалента восс 1ановите
акции, приведенной в задаче 2.
4. Полыуась значениями стандартных злектроцных потен
и принимая во внимание, что в кислой среде NO, превращ
UNO,, вычислите тлектродвижущую силу реакции, приведе
Вариант 13
ользуясь методом полуреакций, закончите уравнение реак-
окращенной ионной форме и подсчитайте сумму стехномет-
х коэффициента:
:.::~5
ВО,- КИЮ. • H,SO, - ...
U 18
1. Польчуяск Mi.1 in [him nurs\ pi.Mi.uuii ■AiKi'innii-' ч равнение
реаки в COKpailLeFllli'll IП>ПIЮН Г111."s|>ЧЮ II Ilirie'Uil.lli le C)M\IV СТеХИПМе I-
ческих коэффициентов:
I, + NaOH-* Nai + NaOI + ...
3. Определите молярную массу эквивалента восстановителя в
реакции, прицелен ной и 1адаче 2.
4. ПоЛЬЗуЯС*. 1Ч1.И|СМИЧМИ CIhMI 1,1 pi ИМЧ klCKJ'pO.lllblX IIIH^HПИil.ЮН.
вычислите-i;icKi|uiiiiii:kyiuMoi:iui) реакции, прннсленной вчалаче2.
5. В 975 i вод|.1 растворили 25 i недною купороса. Рассчитайте
Плотность рж i вора припя и. равной I г/мл.
Вяриянт14
1- Польтуясь НПШЮН пмуртхций, МННГШК уравнение
реакции в сократи пион in-мм.41 фирме п п.' к'ни.lit к- |_>мму стехиомет-
рнческих коэффициентов:
Br + ВЮ, +Н' -»Вг, + ...
2. Полыуясь методом полуреакций, «кончите уравнение
реакции в молекулярной фирме и iiLViumiiaiticcjMM) с гсхиометрнческих
коэффициентов:
1С.СЮ, + H.S + H.SO, -> S4- + ...
3. Определите молярную массу эквивалента восстановителя в
реакции, приведенной а шачс 2.
4. Поль"!\яи. чмчшинми ui:lii.i:i|h iii'i1. ijk1].iродных потенциалов,
вычислите jjickj |н? iuiu,niu\ iolilji\ |iL-,ihunn. приведенной is задаче 2
5. Рассчитайiv числшюе ничепнс viokijkviiioio потенциала
серебра в 0.5%-м piiLihopi:i:y,ii.(|);iiat;epi:op;i. I Иотпоеть раствора
принять равной I г/мл.
Вариант 20
1. Пользуясь меюлим iio:i>реакции, чакннчигс уравнение
реакции в сокращенной ионной форме и полечи гайте сумму
рическич коэффициентов:
НАЮ. + ВЮ, + ll,O-+H,AsO4 t^Br+ ...
206
2. Пользуясь методом полурсакций, закончите уравнение реак
IIML МО ICK\ IHpiKUl форме Ч ИИЛСЧИ I аи 1LL t"\MMV к." И.ЛИ1АКП1 pM'IL-UKU
FeCI, + SnCI, -»SnCI4 + ...
реакции, приведенной в задаче 2.
4. Полыуясь значениями стандартных злектролнык
потенциалов, вычислите uivKTptuKHKyuiMi) tti.i> реакции, приведенной ь эа-
дачс 2.
5. В 500 г волы расгворили 2.8 г иикелмиж» купороса NiSO, ■ 7Н7О.
Рассчитайте числовое значение ЭМКТрСЙНОП) потенциала никеля в
iiii;iv4tiiik>\i p,n inopi: us ij.i|].li;l пиками 1 [;unuoCM. pai; Lttopa принять
равной t г/мл.
П., | II!.HI I 2 1
1. Пользуясь методом полурсакний. закончите уравнение
реакции в сократи mini tnnimui ijhijimu и подсчшашс елмму с
pH'ICCKHX ltt^rn|)f|lMrLIILFI IL4L
Nll; + NOj -»N; + ...
2. Пользуясь МЕТОДОМ полу реакций,
ции в молск>лярион <|inpMLL и iio.'uj'imIsLH
КМпО4 + 11С1 -»С1, + ...
3. Определтс мо;шр>н^т \iatnc\ жи
реакции, [фивеленной в задаче 2.
4. Поль'куяО' iiia'iL'iinnMii t iiiit;uipi iii'is > klki |io liii.ix iroi
вычислите >jiehi|MtjiiiF>i;uii>ni tnn;i> релкцшг. ирш^миинон H"iavui
5. РассчигаГпе иекгрочимй ri.ni-nniiii.i спиши и 0,1 M раст
р
1. Пользуясь siLLu>riiiM im.npLMKiiUM. 1й»кчичик' чрпннение
реакции В сокращенно!) mniiioii фирме и но,[считайте с;мму стехиомст-
ричееких коэффициентов:
МпО4 4-CI Щ -> ...
2. Пользуясь методом полурсакций, закончите уравнение
реакции П молоку. 1ирН1>и фирме и im.'ic'iiiiaMK' t> мм\ иемюметрических
кч)ф(|)иииентов:
3- Определ итс чолярпмо Maci_\ »квииа.1ента имк'.штелч в
реакции, ijjiiFJiLMCiEJioir I; 1а;;аче 2.
4. Пользуясь sh.i'ilmhhmh L];in.i:ipi 1гы\ uci.'ipo iui.i\ nmi.4invia-"ioHx
вычислите йгари.ипшццшсил) реакции, иршимешюй в задаче 2.
5. Рассчитайте числовое шаччш^- wil-ki pivinot ii иокъш|иала
марганца в 2%-м paci ичре сульфата марпинка (II). Плотность раствора
прннягь равной 1 г/мл.
Варнам г 23
1. Пииуясь мтщчм паяурешщий, з&внчкгъуршиважреящяя
в сокращенной но >н форме и ио.ичтайк- с>мм> \. i с\нометричес-
ких коэффициентов:
Вг + МпО4 +Н' -* Вг,+ ...
|
н молску.гнрнон ф|^|шс и г■ l>■ 1сIими к- с> мм\
эффициентов:
Н20: + FeSO4 + HjSO, -> ...
реакции, приведенной в задаче 2.
4 П
] [
ВЫЧИОЛИТС UlLN.'ipii LIILI/КЧ IILMO С11ЛЧ pLnlkmili IIJ1IEJ4LL ЕДИНОЙ \\ Jl*Uia4C 2.
5. Рассчитайте числовой шачешш чск[рчдного потенциала
серебра в 0.1%-м распюре нитрата серебра. Плитное 1Ь раствора
принять равной 1 г/мл.
ричес
2.
сокращенной ж
кил котффнниен
N,H,*I,+ OH
Полыуись Ы»Ц
Bapwun 24
шной форме и тук
тов:
-*N,+ ...
юм иолурсакций. :
Mo.ieK>-inpHoi4i.op..iL-ii niuc ame
коэффициента:
3.
KMn(>4 + KC'I
Onpeлепите мо.
реакции. 11|1п1;1\1иИ1чг
4.
Пользуясь знач
1нрп)гю uaccv чкв*1
.'ниими с raiLi.ipi nil
окончите уравнение реак-
чигаи'ге с>мму стехиомет-
шкончите уравнение рсак-
с> мму стемюметрнческнх
валента восстановителя в
i\ i.'ieKi iii> 1пых погенциа-
ов. вмчис.лие ">лек1родпичл ито
2
5. В результате растворения в воле 2,78 i же:к'5пого купороса
получили 500 IU раствора счльфдта железа. Рассчшайге "электродный
потенциал железа в полученном растворе.
Вариант 25
]. Пользуйся мсюдом по; ^реакций, закопчше уравнение
реакции в сокращенной ионной форме и подсчитай!и сумму стехиомсп-
NH.OII + Fe2* + Н' -» NH/ + ...
2 lUvn.!\net. метолом по |ч реакции, ьикомчше ч[1двнепие plmk-
^Ф™!Утов:'ЮЙ Ф0РМ6 " М0ЛСЧИТаЙТе СУММУ сте*иометРичес
NaOCl + KI + H^SO, -> NaCl + [, + ...
3. Определите молярную массу эквивалента окислителя в
реакции, приведенной в задаче 2.
4. Пользуясь значениями стандартных электродных потенциалов,
вычислите электрод в ижущу ю силу реакции, приведенной в задаче 2.
потенциала jkcjcu ii0.0t",i рлс i поре с\.Еьфак1 н.е.чечп (II). Плотность
раствора принять равной I г/мл.
Вариант 26
1. Пользуясь метолом полу реакций, з
ции в сокращенной hoe гной i|io|»ml и inviL'
рических ко'>ф(|шциентов:
Sn1* +Сг:О,- + Н' -> Sn" + ...
2. Пользуясь исголоч ho:i> [ччжцнй. мкпи'ши' чраинсние
реакции в молекулярной форме и подсчитайте е\мч> ^к-чиочетрическик
коэффициентов:
HNO, + Вг; + НгО -» HNO, +...
3. Онродслии: М1>-"1чрнч и> маии\ H\jsini,)jieii i.\ ное ста нови тел я и
реакции, приведенной в задаче 2.
4. [ [ользуясь значениями стандартных электродных потеин налов,
вычислите ъпектролвижушую силу реакции, приведенной в задаче 2.
5. Рассчитайте числовое HHNBHM элсктролною потенциала меди
в 3%-м растворе нитраь1 mc.ui (Ml 11. ют noi; i p. p.iL i пора принять
равной I r/мл.
Вариант 27
1. Польз\'ясь методом пол\рсакцин. им>нчл1с >равнение
реакции в сокращенной поппоч форме н \ю U'lni.iii re ечмчу стехиомет-
ричеекич ко >ффиппептов:
iiso, + и.о. -»hso,, + ...
2. 11оль'1\яс1' мею.мм iio.i^pc:iki|jih. i.iKoii'iiiie \раниенис
реакции в молек\.!ярпом форме и in» кчшаигс с) мм\ е1с\ном(.'тричсских
коэффициентов:
3. Определите молярную массу эквивалента восстановителя в
реакции, приведенной в задаче 2.
4. Пользуясь значениями с i;in;uipiHL.i\ чюктродных потенциалов.
ВЫЧИСЛШС шекгро !иил\1»ук1С1Г1> реакции, прицеленной и задаче 2.
5. При расширении и доле J.X7 i KpiK i.i i.iih илр.на /nSO4 - 7Н,О
ш200мл р.^ тори ечл|,ф.н,и1ипк,1 ['леечиганю числовое зна-
Варнан.28
L. пользуясь мет.юм пол\реакции, ч
ции в сокращенной ионной форме:
и подсчитайте сумму стечинмегрическ
2. Пользуясь методом полуреакцин. з:
ции в молекулярной <|юрме:
I1NO,->IINO!+NOT + ...
н подсчитайте сумму стехиомечрических 1
3. Определите молярную массу зквиш
цин. прицеленной 1' идаче 2.
,к,
ичко.фф
юэффици
4. Пользуясьги 1н1чепнями Li.мсларпных т-г1сктрод| 1
вычислите эле кч род вижу шут силу peaww
п. iipnEie i
in i.ipnio
потенциала мели г 2"ь-пом p.iLttiopc х^юрида мед!
раствора принять равной 1 г/мл.
Вариант 29
], Пользуясь мешдом полуреакций, з,
ции в сокращенной ионной форме:
Мп:' + СЮ, + ОН -» МнО,-- + С\
и подсчитайте сумму ИвхиОМОТрнчесКИХ i
ччффнщ
уравнение реак-
нциентов.
)равнение реак-
ентов.
ы\ потенциалов.
го электродного
1 (11). ПЛОТНОСТЬ
уравнение рсак-
антав.
с уравнение
реаки подсчитайте с\мм\ cicmmmciрл'кчких км >ффициеншв.
3. Онрсдслшс мчычричю siaixs ■ikhhh;i.t-'ii та носе га ловителя в
рохЦНН, приведенной в эадаче 2.
4. Пользуясь тначениямн стандартных jiiL-Kiродных потенциалов.
|1мчислитеэ1чск-фо;1пижуио1()1:ил) реакции, нривелинпой «задаче 2.
5. Рассчитай! L-'iiicjiniinciM^ifiiiii; ockipo.uioiu потенциала свинца
и 1Уи-ном paciuopc ч ц'ри.ик шине! Г l.ioi iioh.ii, |i,it uu)[w принять
ранной I г/мл.
Вариант 30
1. Пользуясь методом полуреакций, закончите уравнение
реакции II сокращенной ионной форме:
BP + Bi-j + OH- -*ВЮ, + ...
и подсчитайте сумму стехиометрических кои^фициентов.
2. 11ольг*\'яс1. мси\цл1 MO.I) реакции. uihon*nfTO \ ранне ни i; ртак-
ими и молекулярной форме:
HCI+MnO, -»С^ +...
'IMKIIITC C>MMS ClfMIOMUl |H1LK'k:hl1\ Ы> '||>|||ЦЦИСНТОВ.
Опрслелитс M0;i«p]iyin маи^
и, нривслениой н 1:иаче 2,
l
y p [
гсэлсктролвижмимоси.п реакции, приименной в задаче 2.
счнтайтсокислик'. о-восстановительный потенциал инер-
я катиона IV" равна
] 10* /
а 9. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
".! ВОПГ00.1 ДЛЯ ПОДГОТОВКИ К КОЛЛОКВИУМУ
Почему Kimii.ii.-Lriii.ii i ни imiiciiii:i 11,1 '.i.:i:;n>4 i;ik,ku коор.чип.1
1ЫМИ?
Иэ каких частиц сое ют пп\ i |кпп имя klhi p. ни i:n тонная сфера?»
Что такое координационное число?
Какие лнганды называют пол идеи тети и ми?
Каково строение макроцнклических лигат|дов?
Какие комплексные соединения называют криптатами?
I. Каково строение mjhh ондсршг1л коми;1ексов?
. Как диссоциируют комплексные соединения?
Какие реакции \apaKiepivtyioi константы устойчивости?
Как CRRtaiii.i иеЖД) собой частые и общие
16. Чти гакое w.t .lii -м^фек!1.' Что iukoc макроциклическиЙ
эффект?
17. КаК ООТ.ЯСП^С! L]|l\ МЧ |1Ч КОМИ IL'*,LH1 4i.-|iU li,].lk:UFHI.].\ LH^I'LL]1O
18. Как объясни!; i снойс i на комплексных соединений теория кри-
9.2. ПРИМЕР1.1 РЕШЕНИЯ ЗАДАЧ
itidauu с tit'no.iu ннкшичм котчшчи
В рамках данши о пособи» рассмотрены
[l.lL^KCilt'iT'p,! SOFi;HC JM. i4 HpllplN [1.1 ДИГ .ULUI '1llM rv.lblllt' W] 141 '111ft'
Пример 9.1. На о.
чикосп! опрсде.пис.
K,[fo(CN)J, кочи.игш
:ный at
прочность комплексных Соад
цоибрачоватсли?
Решение.
Для решения ной
kDHCiail'I уСТОЙЧИВОСТ!
Ill ырнне/ШИИЫЧ BVCJH
ми шести cmienn|1
..,,;,„' rir.Vt \) |"м
It, 1.0 ■ IO'hJ ">i;\ кот
Co" + 6CN i?
задачи
i, прит
виизш
„KJC
>м из соединений. К
шоп бо.-iee прочен. Паи
ния. Увеличивается hj
инсний с ростом 1иряд
НОСПОЛЫуСМСЯ ЧИСЛОВ1
МанИЫИИ в приложили
о(1 N) | l>oiii;ih кипс|;ш
10'". Эта константа щ
(Co<CN)J' ,
-КСПОК1 |'Л1к1ШН|'ино |Ч'к4хл||илн
л \ сюйчинисти для 1
1 ли 1.1 \;ip.iKILLpiT'i\ci jiiiiiiKii'ci.
констант устой-
,[Co(CN)J „ли
а иона-комплек-
>щи ашнвнвшп
и 7. Для первого
)актери1уст рав-
окойиьтто III
иестой ступени
' Исиидно. чго Mxiciajiu. л.1|мки:[п] п кчи^н \сп>иц1И1и'сть второго
■МПНкСИогосослинекия к огромное количество pai больше, что сви-
№и.<л|«-|'в,у«тобп:11>Ш1:й прочное 1И miri) соединения. Зарял иона-коми-
in>ч||Лрачовато1я больше в более прочном комплексном соединении.
юму можно слелагь вывол. что с ростом заряда иинл-комгшексооб-
|-vii ннмясля scjoiiMMMot и, <1дпо1ипш.1\ hi^in.K'Kcon мю шчикается.
Ответ: KnM.iiL[ii.iir<bh<u'>,i.ii,i;n (111) кл шя. \ ис.шчивается.
I ljih н pacnuipu L\[jini^|iLMLiiiii> npiicv к" мл сi ncinKo;ti.Ko видин ча-
i mil. ВПОрЫе могут быть ЛИГаНДЙМИ, ТО при постоянном коорлииа-
ЮЛННОН числе npeiiMjmeciBCHno обраэуепси комплексное соеднне-
ММ4 I км ни л I г. юм. ii:i. иг i не no ihjioio iio ли v i |hj fii h.lm координацион-
iii«ik сфере cooCmiaej комплексу n;inoo.rj.ni>'H) \c ипгшпость. о чем
м,i*iiii судии, но наибольшему шачению константы усптйчивости.
Н||нм|'р 9.2. Опреаелитс. в каким НЯПрМЛСНЯН смстоно равно-
|Ni(ll,O)J;' *■ 6NH^ |Ni(NH,)J;i + 6H;O.
Решение.
\, iKil'iiiiiociii для шесюйсопениобраютнш
MINKNIIJJ- 1-5Л10".
Константы устойчивости для ко
аемой СИСТОМб СНвЩеНО вправо.
Ответ: вправо.
Пример 9.3. Определите, в каком направл
я в уел они и чадами реакция является реакцией полно-
ни1м:.]Ч (II) laMumauirc» молоку ami другого лиганда
. который сокрщцынкиЧ'и'IIij'iaiui on Молекула этого
бндекгатнот ли(-аида, формула которот N11.CHX'H.NH.. содержит
льа донормы.ч .1гомл .noi.i и но nosrs uo^vi замещать в составе
комплекса две mo.'K'Kv.ii.i моио ii'iiLiiiioio ни ^h.l;i аммиака. Устойчивость
комплексного канюна ipiicl пики |иамии)ш!К1 ы i II > \.ip.ii,n.'i«i u-
етс» общей констакгойуси'пчинос i и [1(| \i(ai)J;- к равной 1,51 - 10"
и во много pa's нрсьмшакянк'н onins ю K''Hl"i,ii]i> \*:ii)iiiinBoCTH коми-
лексного катиона гексаамнинннкЬн (III [H ([Ni(NHn)J;- ), равную
SJ8- 10я. С.!сди1«1о.11.ио. ир.и.1м:и|Ч11шсмо11 иноюмо равновесие
будет смещено в сторону образования комплекса с чтилендиамином. то
есть вправо.
Ответ: пправо.
ко качеством ноо ерлиношк- ^fMii'iniuici и i."om]i.iokoiii,ix соедш^с1жй,
став которых mmvihi млпии^сиыо ciilmkiiciihh. 11аи(м>льший интерес
при этом преде i-йклякгг. как правило, остаточные концентрации ка-
Пример 9.4. IIi.i'i.ic.'Imil; |irnniom.Li.ih ю ].oiihoi]]]i;ihhhi гипратиро-
вакных ка i но ион никелн л O.ill M p;ioi№>|ic с\'Л1.ф;иа 1ексаамминнн-
келяс иэбыючмин Mimii:]ii[>.iuiiL-ii аммпига paniioii I моль/л.
e(|Ni(M! 1 |SO.) = 0.01 w
c-(NII.) 1 моль/л
I |ри раегкчрении раосматривасм<
есоциирует на
[Ni(NH,)JSO, -»[Ni(NH,)J!' + SO,2",
поэтому концентрация комплексной.) катиона равно концентрации
Гндратиршммнв.к' шпионы мпке !Ч. которые л im > прощения "Ш1И-
< и (кчмнлчлют Ni' ч почил ЯЮ1СЧ и p;iL I поре 1ч fi(.M\.ih,j^]L' Iтолimii /ihi;-
(Ni(NH3)J;' ? Ni1' + 6NH,.
Концентрация свободного аммиака и раствори и 100 Прпышап
комплексном] ^ижитт'Д.иажки и ci о p,i в но net куш концентрацию
||Ni(NH,)J;' [можно счипать равной его общей концентрации
'(|Ni(NH,)J;-). [•авноассиаикошц.-миинкичию^ш.чч аммиака[NH,|
■ :1кже практически рлпнл си1 оощен копцещрлтш cn(NHL),
I JbC'IklUJIIL I |н К^Ч IIU'll I ['iH LI1H ' I И l|5.ll N|5(^I^.Llllllil\ Kill HOI LOU IIИ КО Л Я
|Ni;"] можно. исполм\я число»™ (H.i'it-iim- ибтсй кииоанты устай-
rili([Ni(NII) |') й
собраювани
[Ni(NII.) |'). \яр.1К[сричующсй нро-
кш иона JNi(NH,)J'':
Ommtm: 1.86 10" моль/л.
Пример 9.5. Вычислите равновесную концентрацию гнлратиро-
ванных катионов кадмия в растворе комплексною соединения,
полученном n pcivii.iлте- р.имипрснмн 2.OK I l4 ii.i[ui.i кллчия в 100 мл
I M раствора цианида калия.
Решение.
m|CdSOJ = 0.16 г I Концентрации'суп.флк! кадмия вполучен-
c-(KCN)= I моль/л | ном рашворе II
[Cd;-] -
CdSO, + 4KCN £ K,|Cd(CN)J + KjSO,
ля кадмия к«>орлп11;щ|11ЧШ1.1м числом 4.
В ii ионном форме уравнение реакции образования
?lCd(CN)J2.
кюпчшкччи .(.14 1Il-i F^-pion ci>hciim (Mip.nкования
Вхолящум! в -по уравнение искомую ЮНЦнЛрЩШО гидратиро-
БЛННЫХ. HL'Ll'X :-lHhlt,l\ И II 11.111И jlIMM K'<MII K'lx. KiLllliiHOH KfLlMHH |Cd~']
обозначим буквой .v. Кшщспграция комплексного аниона [Cd(CN)J!
меньше об|ней мшист [мини к.пиончп кзлмин c(Cd:') = 6.01 моль/л
нахмоль/ллоесть^ссИСЫ},!' ] = 0,01 -.г. Всостав каждого
комплексного аннона нходт 4i.-ii.ipt Нилин i-inniii. ш< ичм\ и
)><:;>льтатсобразования iCd<CN>,]:- исходив hoiitu-iirpiiHHXiii i.l-ионов c(CN ) =
= 1 моль/л уменьшается на 4(0.(11 - v)\n>:n, 1 1пкнч in'paioM.
равновесная концентрация циапил-ионои |CN | - I -4(0,01 -1). Подставив
полученные лычемлч р-инюнс^ныч Ki'Mit4up;ninii и пиражение для
константы устойчивости. ио:1учасм
ГрВЦИвЙ комплекса, то сем, 0,01 -*»0,01.ВЭТОМйЛуЧВвВЫр8Ж*НИвДОТ
коист: ,i уеюйчшюстис^цес! ценно упрощается:
0,01
(0,96)'1,710""
Ответ: 6,92 ' 10"M моль/л.
|ук1Кои
ктойкаст,
ы устойчивое
Пример 9.6. Пользуясь числовым щнвннвы общей константы
1 K1H4I1IU1CII1 кгл1 инн;| ичр^ммпшшлк,! (II) m.i'iiicjinc 'ihc.ioii^o lhji-
Рсшение. Находим н приложении 7 чмаюкоеншчоже общей нои-
iium.i устойчивости:
PJja([Zn(NH1)J;<) = 4,2- 10".
Нычиспнсм обратную ей величину - общую константу нестойко"
[).,.1«,t(Zn<N]lA]:!')= 1'(4-2' io*)=0,24 ■ 10'1 =2,4-10*.
Ответ: 2,4 10".
Задичн по 1>нрс>>е iniuiu < iupvum
Пришли I"1 (>>4ai (iipaecMoipcitпримерно
мщлстиыхевмчсН.'Ияопре.-ц.-лепиясгрук-гурыю
ока гексаакпаалхшшшя (III). IS рамках ло! о метла с учетом
гибридизации элек1 роимых opom.i iiLiг нона-комм ц iv. оопраюватели
можно объяснитihi_ I fn м\]П комплексных соединении иееч s- и/'- i.icmcii-
TOB- МеТОД EliLlLH "IIL i4 ^liH .","11 'l|'il !■ ■ .. ih M I ,Lh*K* ! M I I|'l [ v K^ !■ IN llH ^ I | ]\ h-
ТУРЫ КОМПЛЕКСНЫХ eoe.llliieilllJI. U KO11»pi.l\ hoUII |еК1:О1Юр;1"1ОНГ]|1.1.[Н-
ми служат одмоирндные h*;iini>in<[ jZ-licmlhioh Ш-подгруппы (Cu',
Ag',Au') и диучшрядлме Kill iioiii.i i/-)ju.'muiiioh ПК-подгруппы (Zn!\
Cd2', Hg!'). В тгих катионах [/-цементов it i ибрНДВЗаюО) участвуют
орбнтали топьют внешнего энергетического уровня, номер которого
равен номеру периода, к которому ирипаллегкщ химический элсмет;
и определяется гллиныч квангчиым числом и ')т:р1е1ические поду-
рЧШНИ 11 p<J/11^1 IL' III III I'l 111С]1! ; rll'll i |м Ч 11 ^pi'lillM \' illl\ J\lII liOIIHX 1111.1ИЧ-
стьюэаня-ш >.iL-Kipon;iMH и hi иприли^ции in- yuic i isyior. Например,
в катионе меди Си' вакантны и могут участпошпь в гибри;|ичацин
электронные npGii KI.IM iiat\ pomicii 4s. 4;j и 4i/iiikliiijicio% чегаертого
энергетичестяо >'ровня. д.г:и Ki'iopttro главное типовое число
равной. Энергетические иолурокни v^. V* " ^^ прел внешнего, третьего
энергетическою уровни по шпеи.ю шня|р,1 ■ icKjpon.iMH. о чем сви-
детельствует^.екггронная формула катиона Си': I.r2j!2^3j:3/i*3rf111.
Для оиисанш! cipyKiypi.i комплекеон лругп\ d- i;icMtmoB теории ва-
Прнчер 9.7. Укажите тин i иириди^ации орошал ей центрально*
ГО атома и rc^MeipirieoKMo конфлп p,iunn> мм\ i репиеп коорлшмц^-
ОНной сферы 11чрш1(]Д1>черк\р;ма (II) калия.
Решение. Niiin.inui4.'Bj(.ju!itiiii u мчи kumi uh.-w.ihh;соединение имеет
химическую форм\.i> K.|l!gl.| I ю ппчтреппнн мщрдинационная
сфера состоит из поил Mi'iiLiuKLOoi'p.i <<'n.ui_L. n K.nisiMupiyuilli;1 ii че<м-
Катион Hg" 1И"|рл>егси а \к iv.n.iiiie mncpii гномом ртутн двух
электронов с ппдуровня 6j:
Hg"-2e -»llg:-.
В этом к д шин с имеются вакантные орбнгалн па подуровнях 6s,
6р,Ы и 6/и он может играть роль акцептора элекгронных пар.
Четыре иодид-иона. входящих в состав внутренне» кочрлинационной
сферы, являются ли и ирам и аивктрсжкш пари прелче являют для обра-
ичишин ко^ч ilhiih.i\ о-снм <eii 'п-| f.tpc >. klki ромим\ пары. Эти олект-
ронные napi.i i;liihmliioi ороп i,i in k;iimoii;i I lu.'1 в еоотвестаии с
принципом минимума энергии. То осп. они i;imr.i;in> орошали наиболее
низких 3Heprciii'i(.-i:Kiix полуровпей (i\ ч 6р. \\л подуровне 6л имеется
одна орбитапь, на подуровне 6/> - три орбитали:
211
Таким oSpusov, чсжл\ кони июкошбрп юна кчом клгионим EIgJ'H
жгандами ичдид-иомлми оПра ijuicm чшыри (квии ни дончрпо-ак-
,|епторному MCNiiiiii'ivy 4ci i.ipi; uiciripoiiiiMK пары, осуществляющих
друг с
перга»
т друга.
Д „и:
тгся лр'-т ибриди ча
ции, и рсчудьт;
">[>\iy letpa'vii:
орбн
Ответ: л/'г,
9Д ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
1, ]i процессе фотосинтеза и ныешпх рн1С1сикн\ч водорослях и
фоТОСИНТС1! VlpS 1ЧН|||\ 1^,]ЫС]1И>|\ \4;iLlH4KH Kl?MIIJILLhLI[hl0 СОСДИР1СНИЯ
магния хлорофилл.! Хлирофил рггиш'шю'шя между собой
строением ЛИГЯНДОВ, Однако во всех хлорифиллах ПИПЩДЫ имеют ОДИ1Ш-
коиуюдентатиисп.. Определи it детатноегь макрониклическога л и-
i анда, входян1его в состав хлорофилла а
шмическую формулу сульфата тпрш
внутренней координационной сферм.
3 JJil ОСНОАШ1Ш1 4lli:.IL4Llhl\ 1IIJI'[L'l[!l[l KLIEl l.llll WIOU'nlUttLl IS ОП-
peflejiHie.BKaKOMina^nuieHHi-i.KJI^CNIJminKJhclCNtJ.KOMn-
лсксный an ион oo.ice sciuiWhu M;iriifinnuL ii.i w.imtc и ого
комплексного соединения У но ih4ieil;icic4 h. in ч ml'hi.illlcilh срочность
комплексных соединений i- ростом мря;и нина-комплексообраюватсля?
4. Вычислите p;uuioueen\u> концетрацню гидрат и рова иных
катионов кобальта в 0.01 М растворе сульфата i ексаамминкобальта (ITI)
С избыточной копнет pniiiiuii аччилка. рапной 1 моль/л.
5. Укажите гиа гибрили ihiiimii I'piun.i.к'м ц
геометрически 1ч houi|nn \рнщию им\ i peiiULii kh
рмдашдиимрганмм калия.
Нариииг2
HOOC С CH COOH
I I
с правилами ИЮМЛК о-оипые на;ваине ком-
]Ni(CU)J. Определи к-CRTIL4U, окисления ком-
тсл я.
.л! и, ,,.,■ on.ii k| \-A I | K| \d't. | или K[AglJ ,
инении Ум^'псши.е^кн и ги уменьшается прочность
смяанвний серебря0) в ряду лнгандов CI ■ Вг -1 ?
■1. К SII м.| U.S M piii. I вч|1.| аммиака нрнГмшн.ш Si) M.I 0,05 М
раствора нитр;и.11;с|чпП[>н| I^i.i'iik hi jll кишмецмшшп л.Ерап1[*он;ц[ны\
катионоп Ag" h ms.iyieinioM paLiiiojiu niiEpaia диам mile (серебра (I).
5. Укажите run iiu'ipiuiriaiutii opiuuiien iicnipiUihiioui аюма и
геометрическую конфигурацию внутренний координационной
сферы тетрабромомеркурата (II) калия.
ВаржютЗ
1. Транспорт -fe.ici.i к мес им пиосиеи t м -Ke.tu юсо и.ър>ь.иг1И\ ^Пи-
слинений в оольшинс! не аэробных микроор! ани imob осушесталяет-
и - сидеро\ромами. Определи ie координационное число иона-кон-
вдакооброомти п комплексе Fe;'с сидерохромом, котог
ваетсяэнгеробакпш(темным цветом выделены донорные а\
парада):
2. Напиши к- химическую формулу к
которое называется бис(11тциана[о)6нс( ши1сн.1измин)медь (II) И
определи с киор/шиациоинои числи комн. icKcoodpa шпателя.
3. На ochiiiMiimii! 'iiilih \ ша'к-нии wiih.i.uii устойчивости
определите, В как,™ и! соединен ни, К,| /n l,|, KJCdi.J или K,[HglJ,
комплексный <ши»и()1)лис ус п)Нчив. Напиши ie ни «пинии'1гои>комплек-
14) радиуса npn'nmoi i. komli.ickchi.ix сое, hi не пин 1лсментов ПВ-под-
груППЫ, в ктч|Л,1\ .mi анламк с.1\жа! полил-но им'' Ионные радиусы
i значения: г (Zn-') = 74 пм. г (Cd:) = 92 пм.
4. В 100 мл I М раствора оксалага itaipHu растворили 0,203 г
hpucia.i.ii'i ]ijp.n;i Mut'l ■ 6Н,О. Вычислите рашговсенчю
концентрацию пшрЛНрОВШШШ катионов ШШИП п ПОЛуЧбШЮН растворе
Na,[Mg(ox),J
5. Укажиic inn i пори икании арГнп.ыии ucHipajibiioi'O атома И
геометрнчсск>И1 ьонфш урацию внутренней координационной
сферы дибромокумрдтаО) калия.
Варна.! i 4
I. Перенос кислорода в организмах iiL'Kinopi.i\ mi>. i ноской и 'i.ienii-
i итог их oc\mcciiL"iflcieft при помощи гемоцилнина. Активный цстр
1а1ек\'лу кислорода.
икакоимч M'Mii.ii-i.^.1. 11 ычорыч ко
тионымеди(1). Пи j]v,(i;jitiii;K( >op,itii
1иэлеюрошп.1\ opi'majidt к;п иона
X.
2- В соогвегсниш с криви мми МП )11 \K соста
luieKCWoroci^iHHcmislfUfMl.lJSO,.
[CoContjlSO,* 6KCN^ К^Со(СМ)4] * К,5Оа + Зеп.
4. Вычисли? i1 piiniiniwi.-ifNiDKiuiiii.-Kipiiiiiuo i it драпированных
катионов калмин([[) в 0.1CS М [xitiBopt iefpaui.ipi>Kt()Ka;iMara{I[)Han>HSC
НэбырЛЧНОЙ hoJlim'MPIi.llllitH I il lpL4.Lll.L.l ИЛ I pi 14. pjl'.lk'li 2 MO II. I
5L УНажИ 1С I MLI I HOpil IH 'ill IH I! ' 'P' ill К! К II iU.hi I p:i. IE>IKII l> ill 11 Mil И
геометрическую кинфш>|i.mnio hhj ipcinicii координационной
сферы в гексабромонпсм; liiiffMI) калия.
1. На рис 11 2 (i учипмш.л и u>op.i.i."LiNi cip\ кц рy p
ордиiшпион]гон сферы комплексного соединения, а котором
2. Напишите химическую формулу 1е-|рй\лпр(»щика-га(11)це1ия.
()iipc;icjniiLL inn j нпртн sliuimi ).ii:ki|miiiiii.i\ l^ioiiili.ich комплеско-
образоватсляи |Сомс|ричссч>ки|юрм\ имч ipLiinoii координационной
сферь,.
редслите. в каким in а^.шмс-мии К || t[.i\ij к щ К,[Гс(ох)}],
комплексный аннон более устойчив Паникин е шпвание нога комплекс-
222
ного соединении Упипичикаек:» или \меньшаяIlU прочность
комплексных соединений l- рос him заряда иона-комилсксообраювателя?
4. К 200 мл 1 М раствора иодида калия прибавили 200 чл 0,01 М
раствора ншн,i.i к.! imiim ISi.i'ihimiiil- mieikl-iii р.л nim i и [ротированных
катионов Cd:* в полученном растворе KJCdIJ.
5. Укажите тип гибридизации орбиталей ц«игрального атома и
геометрически ю конфш\ рацию em ipciincii координационной
сферы тстрафторобсрнллата([1) натрия.
i с правилами ИЮ11ЛК составьте назван
и [Zn(H:O)JCl;.
н более устойчу
ля. Увеличивается или уменынастся прочность
комплексных сои (И мел и и piyin (И) с \bo:ih4cmhi:m pa imca анионов-
нигандов: rid ) < г (Вг)< 1<Г)?
4. В 100 м.1 I M рас шора этилен дна.чина растворили 0,281 гкри-
ота-"1."Ю1 и;[рагл t oS^^ ^l 3 .(> IIj-.i'iiiciilil' рлшюниснмо концентрацию
i u;ipai npoiir4Lnihi\ к.м тчкпч коба.чы ;l и щьпмсииом растворе
[CofcnySO.,.
5. УкажиI'C [ни гиПридиишии оцГш i;uieii цсшралыюго атома и
1ИОмегрическ>1и кп1н|>и|урацию внутренней коирдинлциинной
сферы в бромиде диамминмеди([).
2. Напишите
III) h.l.ril;! II OJ1|V-
rc коор mii,niii'ним..' чис lohmiii.iL'hCiiLinp.iuiii.in114, учитывая, что
н Солщусюйчин. Нгшишиге
назвасоединения. Увеличивается или
уменьшаетс ростом ионного радиуса прочность комплексных соединений
223
>в семейства желе-ia. и которых лш аилами служат молекулы
этилыишамнна'' Moiiiii.il- pii.iiivci.1 имсич с.гс.тощие -значения:
r™<Fei"J" 75 "м- г-,<с°г") = 79 пм- r-WfJ - 83 i:m.
4. Вычисли i ^- рашюиссммо киш^щрлшю jji гримированных ка-
ТИОНОё мели (III и 0.0(15 M рлсшорс iL-ip;iMii.-(n4i>iiii)HHanaT0)Kynpa-
га(][) naipua с тбыючнон к.чничмр.щпч! пюпч.иша натрия,
равной 0,1 моль/л.
5. Укажите inn гиорнди laniin оропм.к-и iicmp.ui.noio атома и
геометр и чи с кую конфигурацию BHyipeHHtfl координационной
сферы тетра\л»роые|журага(]|) калия.
Ня ]> и я а г 8
1. Как называюi лшавды, силержшиис ;иш илч более ломорных
2. В соответствии с правилами ИЮ11АК составые название
комплексного сомимшя N:i|Snill,O)(iHI)J Определите
координационное чис.ю коми ickC'hh'ii'.H'H1. ш-'.ы и it^'.n'i |HiLk4 к> ю форму
внутренней координационной сферм.
3. На основании числовых значений юте ranr устойчивости оп-
рете'т ill и K.ihi'M i i.ii .п.к1 lcimui ^ m^ijil i i.i ilp1 iu 'B^\ iu г; системе'
[Zn(H,O)JCU j+ [Zn(l 1,O),CIJCI.
4. К 20 мл 0.2 M рас i вора шмашиамина прибавили 20 мл 0.0] М
раствора сульфата железа (II). Вычислше концентрацию гидратиро-
ваннмч KiinroFion Jv' и под\чшиом [i;n ii^ihju- l4.h.i|i,li;i грис(этилсн-
дианин(же;1сча (II).
5. Укажите тип гибрилиэации Орбиталей центральн
ричеекчт koi[i|ihi чрлшми l;ei\ iptHiitu ьо
кся(|иор1м ичмпн.икчШ ) натрия.
2. Д.-1Я нанесении 1,1 iMMiiii4LLKii\ мокримш чи.ишюй нсиопыуют
электролит, и coci.ui кои>рого n\o.ini ickl.m и ipOKcon.iaiJiHaT (JV) на-
трич. Папин неге MiMiiHicch\io i|nip\i\;i^ ною к< >м п. ickcmoio соединения.
3. На основании чнс.[ош.!\ ;n,viomni kihci.mh хскчмивокти
определите, в каком ич соединений. |C.4ei.)jSO, и.ш IC^eniJ-ISO,),,
комплексный ашюн бс.и-с \ciiiii4iiii lUiiiKiiniie ir.i тонне пою
комплексноя. Увеличивается или) меньшае1сч устойчивость
комплекй б?
р ф р
4. В 100 мл 0.9 М ркгтвора гиосуньфап иотрш растворили
0,167 г кристалле! ндрата Hg(NO,)j ■ Н,О. Вычислите равновесную
р iu.ip:iiit|H>ii:iii>iM\ кашопои рити (II) в
pacreopeNaJHglS.O,),!-
5. Укажти inn i нормди шпии opi"nti ,иси централь
ю коифи! \раииы вм\ i репной координац
-а;1Мата(][> калия.
Вариа
II)
с правилами ИЮИЛК в
и Na,|Co(NO.)J.
tn иадинсний, К[ГиСЧ,|, К|СиВг.] или K[Cul,] ,
innciuui мели (\) с \нслн'и
(В)<К1)?
4. Вычис.шк: рлкнккссичо копнит (liiniifn i члратированных ка-
шчновсви111и(11) в 0.002 М растворе три! нлроксоплюмбата (II) на-
грия с избыючпом ko>iiu'}mрацией in ipi>K0»,ia riaipun равной
0,2 моль/л.
5. Укажите тип i иорили^шш <i]iuiii.].icm центрального *ттма и
[1Ч1мегрич^скио ьонфш \pjniiini Fiirv ipemicji коорлиилннонной
сферы В тетрацнаноцинквте(П) на грим.
химическую формулу к
и"сГедЛшГе"ий!к11/"'и'! 'к '|'<"|П ^ |' и л и *K=*f HgCI J,
Dfl более устойчив. Наши
|. Увеличивает!
ионною pj;ui\La прочноси
подгруппы, в которых ЛН1
диусы имеют следующие
'4™к 15 мл 0,15 М растора оксалата и
0,00В Mpauitop.it> iM|.ii!.iiKCJieia(II). »1.1ЧН1
5. Укажи|'с гни I нирнлп ч;щли o|ioni.i к1
етрическую К{
рык
l-пинается с ростом
пений элементов IIВ-
сл\жа! \.|1>рид-Н1»ны? Ионные ра-
рич прибавили 15 м
ш ie концентрацию ги
KJFf)]
1. В структуре витам
образующий Д1)норно-ак1
редели it .iL'iiiannH 11. no
Вяршат 12
чна Вг ирисугетуег
-о л и ганда:
Kiippiiuoflbiii лнганл
ионом кобальта. Оп-
2. В соответствии с прлниачи ПК )11 \К со
плексного соединения [Cr(CO)J. Определи tec i
пле ксообрачовапел я.
3. На основании числовых значений НОНСТ
ределите, н каком шшрвллвнии сиещеио равно
[Гс(Н;О),С],1С1 + 3Na!C,01^NaJFe(ox
226
Л устойчивости
опсна в системе:
| + 3NaCI + 4H.O.
4. в 50 мл 1 м раствора гиоцльфт нщям растворили о.Пб г
оксида серебра (I) вычисли!с равновесную коптшшргщию тидрати-
рованныл капиокипссрсоры и полученном рас шире N;iJAg(S.O,),].
^ YlU.MlK Ill >|>IL 11П.1ЦЛИ l»|HUII.l I I'M ЦСИ I p.l II.II1H M .IIOM.I El
теометричсскун> конфш \ jianiiid mi\ i р^лмей коор ii потном пои сфе-
|ll,l I >' I |>.l IЩ lull HliMli.n,i( II I I.,1.(114
I. Активный центр фирмам hi «лрГюаш нлрачы, которая
руст процесс прекращения .-цшксид» углерода и гидрокарйонат-
прелставлиет собой комплексное соединение, в мотором комн.
обрачователем служзп кашоп цинка /и-'. Определите коорлиг
обрВЭОитеЛЯ в ЭТОЫ комплексе:
2. Напишиiu MiMH'icch'yio формулу кч>'
Kirropue называется ')Г'илеилиаминтетршц«
1.Л ILI1I П 1ill|HL К III II. 1,l.in|] lllll.LlllblllHLH1 'UK IV l.i ЛИ I ILNCOL >!>[!.I HI W.I 11LJIH
Я нл чете Я ли данное координационное числи распространенным?
определите, и киком ,V/ l .м- uinVmiii. 11 d I Г<)) HI 11 SO, ч.,и
|[L-(H.l>)nii|S(),. MiMIIUCkCllblii Ulllnllim.lCCU.lOIINII». iiillllllHHIC
образомюля?
4r Вычисли ic p:i]snnisi_LLii\ ю кишит |];iiuiio ml Lpiii проданных ка-
i попои cepeGpa i^ piik:imij4L. L<v'ic|iii;aimnM <)ЧП2 моль/л I
ИИНСОребря (I) и 0.2 моль/л аммиака.
227
5. Укажите гни гибрндммцнн орГшм.к'м цсшралыюго атома и
гсом стример к > ю MnnJi]ir>pHi[tiiio им> 1рииич1[ коорлмпцциониой
сферы тетрэбромоа\рага(1) калия.
К,р„:ш, 14
1. Как называются комплексы, способ е к быстрому обмену
2. В соответствии с правилами И1О11ЛК сос.авыс название
комплексного соединения Kt|V(CN),|, к котором комплексный аннон
имеет формч пещакпмльлнй Гц ширями, ни Яаинмкя '1 и обычными
координационное число кпмп.геканн'фанчижмя и геометрическая
форма нцпремкИ координационной сферы, которые имеют место в
3. Пользуясь числовым ЗНПШНЫ oiiuieii коноакгы
устойчивости для гексафтор1>ллн1мН11а1(11[)-11(Ч1а. вычис.ипе чистовое значение
4. К 40 чл 0.2 М рас шора пшпнанага натрия прибавили 40 МЛ
0,01 М раствора ншрага ueptfipa. Вычисли иг концентрацию гидра-
тированнич катионов Ag n полученном растворе бис<иютиоциана-
>)ap[ciiiiiiii(l)n атрия.
5. Ука
Укажите тип гибрили киши орбитл.кй центра-ть
ф i
Вариаш 15
1. На рис. 13.2 в учебника юобраяеш е1р\к1лра пнутренней ко-
<1р 1И Н ii НИ lMIHl'M k I'lCI'l.l NOMIIK 1м ifi'U' ! ■■' 1HMLLM]1H. I- Ki'IOpi>\l Л HE ;|H-
дом служит дютилсм грнамин. Hi скольких аюмов состоит каждый
итдвух повзшиых ка рисунке яыжных циклов пою комплекса?
2. Напиши г е химическую г[г<|рм\ i\ iikmnii.iiiomi>. iiio.iiii a [V)
калия, внутренняя координационная сфера коюросо имеет форму до-
дскатлр!! Яиликпс* .in p;iLNpi4ip,uiuiiu.iMii huipp.iiiiiamioiiiuic 41К.Ю
И геометрнЧ!:!:!-.^ форма ии> ii>l-iiiiciT яоорли iiioinioii сферы, име-
1чений консгат устойчивости
определите, в каком in соединений. K[CuL5r,|, K|,\yl)r,j нлв K|AuBr,].
комплексный ВНЙОП менее усюйчив. Напишите п;пвание этого
комплексного соединении. Увсличивле1сн или уменьшается с ростом
ионного радиуса прочность комплексных соединений элементов
IB-подтруппы. в которых ЯНГШШШН e.iv*ai брОМИД-ИОКЫ? Ионные
радиусы HMcioi следующие шлчених: г (Си*) 60 им, r-0.(Ag') =
81(Л') 97пм
1. В 200 мл I М МСТМПВ фторида 1гатрия растворили 0,135 г
;таллогнлрата 1'хеС1, 6И.О. Um'ihc.iimc pa в поносную конценгра-
П1 ф.1]1!роЕ1.!ММЫ\ h.ll MnlKiJl ibO-'IC 1'Л ( II [) 11 цо.1\ ЧС1ШОМ рЗСТВОрС
». Укажите тип i ибридизации орбнталей центрального атома и
иггрнческун) комфиглраншо внутренней координационной сфе-
стра цианом с ркураге(М) натрия.
K[Agl2] + 2KCNS K|Ag(CN)n] + 2KI
4. Вычислите равновесную концентрат
Мишин llg'1 и рас I норе, иодсржащем 0,025 ^
5. Определиie iciimci|)H'icck_\ki фирму
тип гибридичации (лскгрсчшмх npiiina.iL-й
сульфате тстра;1мминкадмия(Н).
обмениваются лиганлами с раствором?
2. Напишите химическую формулу и
которое называется хлорид нитропекгаап
ram
редел нте.Т
W Kl^MI l.k'kL 111'4-1 . ' " |ИМ
[
n ilo.nv \4iiii'iiiB. Нап
ЯШЯ. ( I ИООупьфпчюн в
ется тносульфато). Увеличивается или уменьшаетс
комплексов с pool ом иря.ы нчил-кочи 1^кс1Ч">рачов
4. К 80 мл 0,5 М рас i вора оромила калия прибави
раствора iimpai-i ссс>сор;| Hi>iLini:.riiic kuiiul->ii ji;iiimk
)BAg' в полученном растворе K,[AgBrJ.
нк1Ч)а.чи-а(Ш) и опре-
вание этого
комлиганда
называя устойчивость
?
шите н
5. Определите геометрическую форм;
сагилроксостаииате(1У) натрия.
i.i ptBHOBCOKI каждой и I с гупсней оора-
2. Для гальванического чолочсния исначьчуют электролит, в
состав которого входит K|Au(C'N(,]. tociam.ic начванис этого
комплексного соединения и соответствии с правилами ИЮПАК.
определите Координационное 'iiic.jo hoMM к'ьсопораччипмч и тсометричес-
кую форм) BiiyipcHiicii koi>[» ишшшошюй сферы.
3. Пользуясь числовым значением общей коне гаи шустойчивос-
III .4.14 itiTU\ i<4>,M|>qi|irii[llI>-n.4i;l. lU.inik iitio 'шсюиое шачение
4. В 100 мл 1 м распора пюцианап каин растворили 0.17 г
нитрата ccpenpn. l^.i'in*: икс |4Kiiotiireii> ю кмш [uiiip;mmo i ндра-inpo-
naiiiiijx катионов tepefipa и пил ученном растворе K|Ag(NCS),],
5. Укажите тип iиорнлиицни ормнилей ценiралького атома и
геометрнческ;hi ьонфш jp.mino inn гремней коор ишаиионной
сферы в ГЯДИМОДОШИМугагаРП) натрии.
Вариант 19
ральны\ш атомами или ионами?
2. Напишите mimit4cck\io форму i\ |iniKe;i.iaiok\npara (IE) натрия
и onpeT0.Ni]LL Ki4ipx[]in.iiLiiLHinoi; число комм ifkk oonp;i ч^вателя.
3. Для многих шнаплов спраМДЛКв рнл Мрвипга-Вильямса:
Ва;< Sr1* Саг < Mg1" < Мп1 < Fe" < Со-" <Ni;<Cu1",
к мчорич и» чира iiii.il i i.'in.i |>,kno iim.ohi.i н нири i)-l' wp
ння устойчивости ч\ комплексов, llpoiicpbic. снраве;длив ли ряд Ир-
вннга- Вильяме л luniiuiiiciiiiii komii/ickchlis лмпонкн е.тедуютнх си-
единений: KJF-el^Mj. K,|Co(.^),| и K,lNi(o\),|. Иагтшитс название
того комплексною сечииненнн. I! cotчiiB Kniopoivi плодит наиболее
устойчивый комплексный анион.
4. Вычислите равновесную концентрации) I илра трона иных
катионов Ni;' в растре, содержащем 0.*>r> «i>.ii,'.i кпшомов трифти-
лендиачин)нике ik (|[) и I моль/л >тилснд|ишина.
5. Онреле iiiic lenMeipii'iecKVHi форм; комплексного катиона В
сульфате гексааммннкобал1.та{11).
1. На рис. 13.3 а учеб
оединения. II коштом 'пи
01 р;1амим < (мрск-
Нариант 20
ика изображав структура комплек
лнлчм сл\жш циклический тетраэт
|
и Na,[CuCy.
торую и
н дли ичл\'11.'Ш1Ч iu.i млмоиых пок
+ N,H4 -» Pd + N,+ ...
яиоинмрических коэффициентов и
Подсчитайте сумму с
ie молярную MiitL) iKti)iH,Liunia окислителя.
4. К 30 мл 0,1 М |)лс11и)|1>1 DhCii i.ii.i ширни прибавили 30 мл
0.01 М раствор.1 *:> и.ф.Пн! кои.mi.и (II) Ничио.шк4 hoiijichtрацию гид-
ратированныч катионов Civ" в получением расiворе Na][Co(ox)J].
5. Укажтс тип гибридизации орбиталей центрального атома и
геометрическую коофшлрлшио вн> ipt-хнсй координационной
сферы в гексаг илр^ы.чн л i uiiih( HE) катрИЯ.
т 21
у
1смоглобина. Определите коорди
об^МЭОВагеля Рв* в геме гемоглоби!
да. (Ниже плоскости макроиикличс
гирую катион железа (II) обрачует i
ick>:i> к
<азанаа
ч - баи
уча-
став
;ксо-
лоро-
[Co(NH,)JCI,. комплексны!! кленом uo.iee \tniii4iiB.1 Напишите
уменыпае ген устойчивость комплексов с ростом чаряця иона-ком-
пл е ксооб р ачо вате л я ?
4. В 50 мл 2 М pacnutpii и и.к-идп^мшт р.-«с nuipiunt 0.2S9 г
кристаллогидрата ZnSO, ■ 7Н.О. Вычислите равновесную концентра-
цию гидратированных кшшчюп цинка н iui;t>4vnnoM растворе
[ZrferJ.lSO,.
5. Оирсде.-нгге iчч\кiрнчесь)ю форм> коми к-ксного аниона в
тетраиигрочеркуратеСП) калия.
Варммт 22
1. В качестве противоннччолепою npciiiipii ри лечении рака
применяли комплексное соединение платины |l'lCI,(NH,),].
Определите координации нос число и шряд иона-комплсксообразоватсля в
с правилами ИЮПАК составьте название кс
lUieKCHoiocoe.iiHieEjKH |()s(((>)J. Определите геиеньокисленияю
ii.rL'huoiH>p.i шпателя.
'Ill .LJJ1I E.il 11 LIU КЩ Г ChL:ULMMLII' 1.1 " '.I I E.I L]( 11 [ ) I "■ I ■ I' III v I;' I . 'I ill . lOIU'L' <
чение общей константы нестойкие!» для нот комплексного кап
на. Устойчив ли он в водном растворе?
4. Вычислите равновесную копнет рацию I идрашрованных
ТИОНОВ Zn;' в расшоре. содержащем 0,01
(II) натрия и 0,1 моль/л цианида натрия.
5. Укажите тип гибридичации орбит:
геометрическою га>нфи1>рации> niijipciniLii мшр.шмациоПЕШЙ с
ры в цииодоарген1Нте(1) натрия.
В,Ф.,»„,23
1. Определи к- координационное число ига
теля в лекаре г венной форме питамипа В -— и
2. HailHlJIiUl' \lt\1M4LVK\IO фор\1\.'|\ КОМИ IL'KCILOIO СИСЛННеНИН.
коюрос называется чгнлеи.шамииit:ipruiiicj.iiпмоинякпафсрра-! {Ill)
il-.ih. Яи.1Я1_-1 ия .in.i;ium>^ bnn'p.iiiii:iinuinilnL- чли.И' pinrllpncr[)iiHtmh.im''
3. Для многих лигамлов справедлив рял Ирвиша-Вильямса;
Ва; < &• < Са3'< Щ:~ < Mn;'< Fc;' < Со1- <NP< Cu:",
и коюром лвух"^|рндш>11' к:тюш>1 pjLim:u'AcnM ч н^рцдко вотраста-
тих соединении [И.КП <)),N(),|N(),. [ Sr| 11 .OI.NOJNO н
|( ;i(H.O),NOJN<>,. llaiuiiiiHi'v iiaitiannt mm комплексного
соединения, в'состав HOtOpOTO ВХОДК1 наиболее устойчивый комплексный
капюн. Нитрат-ион в качестве лиганда называется нитрат.
4. Вычисли re равновесную концентрацию j идрашрованнь^ ка-
iионов мели (II) в растворе, в I л шпорою со.и-ржтся 0.005 моль
иниоиов [Си(РпО,),]в и 0,05 моль пирофосфат нагрия Na^O,,
5. Определите iL.-ihvn;iри'кч'кvi'i ф]»[>м\ комплексного аннона в
lll)
Вариант 24
I. Активный ценффермиша iHvwi-.iyio'inoii жи.ичы млскопита-
юп^хкарбоксиисшилачы А, котораиошкилш;! коицеиуюаминокис-
miiy от белковой цени мри гнцроювв, нредставлие1 собой компнекс-
233
ГР'
Г
S
S
»b iiiui'.M i.imii П1<!|] \К ^ч-1 jhi.i i-ii:mai!ni:
комия |Ci)(en),C:UCl. Определите координационное
KctxiCipa шпателя.
3. На основании числовых значений констант устойчивости
определите, R каком мапраи ii'iinii cMifiHL4ni» |KihiiinRCLiiH_h и ни ihom растворе
хлоридахрима (III):
[Cr(H,O)5CI]CU^lCr(H;O),CI,]CI+ HjO.
4. В 200 мл 0.5 М раотнра оношип пигрии растворили 0,278 г
кристаллогидрата FeSO, ■ 71Н.О. Вы'иилшс рашкшесную кончент-
рацию] ИЛрагирим.ишых kin тиши jkc.il- i.i III) в шмучеином растворе
NaJFelo^lJ.
5. Укажиtu iни торили инии oju'iiiiii iL.ii петри [i.hioni attiMii и
reoMCTpii'iLLLiv> to ki^ii[|]iii \|i.iii]ik> ini^ l |4LiniLLii K'mp iiiiianiinii>nui ui])c-
ры втстрагил|хж>:обер1и1.|1Л1с(|[) натрия.
|
З.На
рсделитс, в каком и-з
в. Увеличивается или умен
снии с ростом наряда
234
(II) нагрия и II.D2 мол..' i оксалата натрия.
5. Определил: геометрическую форму комплексною кагиона в
кЛ.1ьф;ис icip.i;LMMiiiimniKa{JI).
Вариант 26
1. Иод каким 1гачванисм объединяют лиганды. которые могут
занимать одно координационное место у центрального атома-комплек-
Ц1!>Г|(К[ ювагеля?
2. Bcootbc-icihhiic принц i.imii I ПОИЛ К mu;iiu,rc iiatiwmic ком-
плексиого соединения Na|Л!(П.()),(()II)J. Определите
координационное число хомплексообр.пок'исля и ишморичискую форму внуг-
3. Пользуясь числовым юаявннеы обшей шнепнты устойчивое-
p||p)
общей конешнты меолЛнООТН для этот комплексною аниона. Ус-
тйчин ли он it ВОДНОМ растворе?
4. К 100 мл 2 М риемифл :iMMii.ihii прибавили 100 мл 0,2 М ра-
с г вора cyjibi|)aia никеля. Ilkftiic.-unc кошки i ринит i нлратированных
KiiimiHiiiiNi;i и полученном расiпоре |Ni(NH,)J*\
5. Укажите i иорчдн мнин opi'iinijieti uenipa,ii.noro атома и
геометрическую коифш ур.шит iinj iiiciinthi координационной
сферы в нитрате тетрааммииртути(И).
Варишгг 27
1. Чему равна леиiai 1\чсгi> окс^ДнИ-попои и ин;кч1;шамина?
2. Напишите химическую форм)лу комплексного соединения,
Kiriopociian,[ii,ii4U4 11'м.,ши[|"'кч1[ки (II) cniurn.il [I )-килня иопреле-
iii ic (аряд mis i|!ciiiicii координационной сферы.
3. Дтя многих лкганлов спранедлнв ряд Ираинга-Вильхмса:
Ва:'< Sr1" < Ca"< Mg=- < Mn!'< Fe1' < Со1' < Ni!'< Cu2>,
оны расположены в порялке воэраста-
сов. Проверьте, справс;шш ли ряд Ир-
;дннений: |Ва(П ())..(Я l]( I. |Si(ll П)/Я1|С! и |( а(П.())%ОН]С1. На-
шчиите натапие" ют комплексною соединения, в состав которою
|1\одщ 1К1нпо.1се\с1он'1Ш!1,1Й комплексный катион.
4. В 200 мл I М раствора аммиака рвепюрнпи 0.251 медного ку-
иороса ВыЧис.ш гс paiii[OMeuii\iii колцешрапню i ii;ipai Jipoiiainn.ix
mWHOI меди в полученном растворе |Cu(NH,)4|SO,,.
335
р
2. В^оота-тс!ниГ^УравиламГи^О^иГс^ч^ж^^'и^ваиисшм-
плексного соединения K,[llg(SCN)(|. Определите тип гибридизации
элсктрониыч o|>Tin ja.k'ii кочп.к'кччюр^иотлеля и геометрическую
форму внутреннем мн'рлпманиошюй сферы г
реакции и подсчитайте сумму осхиомигрнчеекпх мпффициентов
|Co(NH1)JCI;+-K,[Fe(CN)J+...-»[Co(Nil,)jfI1+K4[Fe(CN)J.
4. Вмчнс.ши: panHom'i'mio koiiimi i p;ii<ino г п.флшровзннЫЧ
катионов Cd;'в paci воре, содержащем 0.1)05 мол i>.':iKai конов трис(эти-
лендиапмин)кад.иия (II) и 0,05 моль/л этнлендйШННВ.
5. Укажите тип гийри иплцпи opfiniii/icfi поп рал mi о го атома и
геометрическую kiiiii|>[ii \р;щнн> liiiyipfiiiieii кпорд и тонной
сферы ц дициаи(1аура1и(1) натрия.
Вариант 29
3. Пользуясь числовым значением обшей константы
устойчивости для триокса.мта.иоминаМШМюпа, вычислше числовое эначе-
Уетойчив ли он и модном рас[ворс?
4. К 100н.|2 М рас тора )тлсили.1ми) ртыи» ш 100 мл 0,2 М
раствора сульфата никеля. Вычислите концетранит
гидрагированных канонов Ni;- к полученном растворе.
5. Опредслте 1сомсгр1!ческ>ю форм\ коми юксного аниона в
|ексахлоров!1Смупт:(Ш) натрия.
Вариант 30
I. На рис. 13.3 в учебники шопражена cipjinjpa комплексного
соелинення. в ко горим .пи аилом t.tv*in цнк.1и<1сский полиэфир 18-
крауи-'» (hiptMc.iiML'. [lli i гам loci ь тгого лиганда.
числокпмми.-ксоиЛр.гиии
ПО paciipoci раненным?
3. Пользуясь чиокшмм ммчииисм nfiiiicii к
ти для бие( ■ ио<:> iu|)jui)UMHKji(ll)-no»a, н
Усшнчнв ни он а волной рас пюре?
4. В 100 ми I M раствори гилроксила натрия растворили 0,27 г
металлического алюминия. Вычислтс равновесную концентрацию
| ,)
5. Опрслс:ипс ici»Mi.'ipnLici:h\io форм\
ним пори, in мини > ick-i j)4iiiii,i\ upon i.i.ioii
■ : 'Mi1 i. i.i.i'iv'iiiri. i.'i 11
СЛОВАРЬ ОСНОВНЫХ ТЕРМИНОВ И ОПРЕДЕЛЕНИЙ
|*р iELiiaitnoHkii.il l ферм кои*ры\ :' к^чс^ми: лиинчпн ИЧОДН1
молекулы волы.
Aф
>i. соответствии:!!* ее.маком тчкс на понсрмюсги
ноте hi шальной энергия и определяющая скорость химической
реакции.
Актиноиды - чсн.1рма.гш:и1. /- > icmijhii4i. с k\i>iotun\ sa актинием в
lu piiL1 пгк . I . 'Li i ml i^ mi.1 \имп'|ц.ч kli\ ' it '-it'll i mi' , 1 N Mlii.ic lediii-
Акцеигор час i ица. прелое мвляющая накатные орбитали при
образовании ковалентной химической спя (н по донорно-акцеитор-
Алмаз - аллотропная модифика11ИЯ ушерода.
опои алюминий и кремний.
с ртутью.
Аммиак - N11 . осанн-тыи use редким lanaxOM.
Аммония катион-NH/.
ну анионон при кошаки; с рас шорами >.идя ролитов.
Апатит - минерал класса фнефаюи с т'чиси формулой Са,(РО,),Х,
где X - F . реже С] , ОН , СО,:, (У .
Арсснаты - соли мышьяковой кислоты.
Арсеншы en in mi. .яыникищ кис uiii.i
Арснн - AslI,, rai без цвега и lanaxa.
Ацетнлениды - карбиды, содержащие .i»>\aio\ini,ie анноны С,: .
Бораты - соли борных кислот.
Броматы - со in opibMiioimKHi кислоты.
Бромиды - 1) бинарные соединения брома, н югорш лчектроогри-
цателы1ос1ь брома больше, чему ПОроГО элемента, входящего в
состав чтогосоединения; 2) соли бромон ЮрО 1НОЙ кислоты.
Бура- декаш.1рл1 ieip;i6npaKi илфин Na H .< > ■ 1011,0.
Буферная емкость- количес!но ikhiiiili.ichi:i (mo.ii.)сильной кислоты
или сильною основания, которое нужно прибавит к I л
буферного раствора, чтобы изменить его pil на единицу.
Буферные растворы - растворы, подчержннающие определенную
концентрацию кашопоп водорода (pill при раправлении или не-
щие ее при .юоанленнн небольших колн-
и оснований.
238
ВаЛвНТНОСТЬ - число химических ОМЭОЙ, ЮТОрМ может ОбрвК
Валентные углы - умы между свячями.
ИиСМуТИДЫ -- Гчмшрммс СЧЛИИСИИИ ИИСМЧ11,1. It КО1Ор1,|\ >ЛСК*1рО0
цатсльность висмута больше, чему шорою влечен ia, в^оли
в состав этот соединения.
Нисмутим- [Sill,, бесцветный гаю режим чапахом.
Иодорициыииоюпак'Л!. трицепс; i.iit дот тчмый логарифм
центрации Kiii№)!ii>ii водорода и растворе.
Галит - MHiicpsi.i (кпмсиная соль), NaCI.
Гало1 ениды fin пари I.к loc шпенни i ;unvi сипи, и umipux г1
ришгпльность галогена больше, тем у второго элемен
|iррч[|.'1ЮМ1 ih^ii.i Kit.MiuitKCHbiccojtii.
крисI;ijiлическисрешети которы\ civit-pvh-ai 1сксш|]-к)|№:|дюмииат-ионы [AIFJ'".
Гсксафшрнфосфаты ■ соли icKL:^|i!i>pinlioc(|>iipni]H кислоты.
I\.-кси(|>1 ороси. MKiMi.i cdjui и.-нсафкф1]кремниевой кислоты.
Гетерогенные реак1|ии - реакции, котрыс ООущесГвЛЛЮРОЯ на
поверхности 'I HL'p.'IOI О ЕНМЦСС I ВЦ. II lilMMO/lUHU IIIVIOIIIUI О С ЖИДКОСТЬЮ
или гачом. или fi;i иоисрмкклм ^илкчпи, pt-ai Н|ПЮ1НСЙ с га'юи.
Гиб рил танин 'Viciet роимых орбигалей - смешннание атомных орби-
Гиббснт- KpHciiuuMi'iixKiiN М1);1и|||>1к;н1)1я i идрокенч» алюминия.
I шроскиППЧМОСМ. способноеII. ВСЩСС 1И 11(11,loillilli, ПЛЕИЛ ИЧ |«>!Я>ГХ11
ГИДрвЗИП-NjHj, бесцветная, дымищан на ЙОЭДухе жидкость.
Гилрар! иллит - крнсггаллическм мод|»||ика\шя гидроксида алюми-
Гидратация - ич;ш\и> ickiciиис истерт i MojiL-куламн воды.
ГиДрИДЫ - fllllliipHlhU' k'LlLMNIILMini НО nt[m;ia. Г К1>]О[>Ы\ "|ЛеКТр(ЮТрИ-
цателыюсть колоролаГюпкик:, чем у шорою 1лемсн;а, нходящс-
1 идролифюрнды - соли фторовгетородиой кислоть!. содержаснис i ид-
роди|]|торид-ионы HF;".
- алюминия - А)(О11),. амфотерное основании, студенистое, белое,
мплорасгворимос iichicctbo;
- аммония -■ водный раствор аммиака, имеющий сшшетва слабого
основания, iipiiiiiii'ijiuioi фщ'муну NH f)H;
- бария- Ba(C)N).. сильнее основание;
■ бериллия - ВД011).. ,1ч||](нсрмое основание;
№1ма.лии(111) - V(OH),, слабое основание, сильный воесгановитель;
-висмута - [)]((>])>,. c.iaooc основание;
-галлия-CiallHII .1.1.и"чк-.1чф.>|1-|.11.к-основание;
■ желечаШ) 1 с«>1 П . амф.исрнос оспомш.с с прсоб
новных свойств: "
-Желеча(Ш)-1:с(()!!|..1;:1аГн1Самфок-р||11с основание с
см основных свойств:
- ннлия 1п(011)г.амфо1ернос основание:
- кадмии (Л!«)И|.. ачфшернос основание.
- кальция (..KOI 11 . tii.n.iB.t основание но первой ступе
ции;
- кобальта(]|). амфотерное основание;
- литая LiOl I, сильное основание;
- магния Mg(OH),. слабое основание:
-меди(|])Си(ОП),.ам|]ю1сри(и: основание;
- натрия NaO] I. сильное основание;
- никеия(П) Ni(OH),. слабое основание:
- рубидия КЬОН. сильное основание;
- свинна 1'1ц( )l 11 . амфшернос wm-hjiim-.
■ стронция Sr(( 111)., сильное основание;
- сурьмы Sb(UI!) . c.iaooc амфокрнос основание;
- таллия(1) 11(111. сильное основание;
■ хрома(Ш) CrtON),, амфотерное oi
- цннка Zn(OI I).. вмфогерное о<
ГидрчкарГшншы Kiic.ii.ic co.iti yuvtbiioii кислоты.
Гндроксиначнн ■ N11,011. бесцветное кристаллическое вещество.
Гидроксильнмй показатель отрицательный лесяшчный логарифм
концентрации гидроксид-ионов в растворе.
Гидролш - BiaiiMo.ieiiciBiic ионов соли, приводящее к образованию
Гидрос\'льф;иы - киоые со щ серной кислоты.
1'идрофосфап.1 - кислые .tin имешетше lo.hi фосфорной кислоты.
Пттпркты - средние соли взотшйлюпн! кислоты.
Гипохлорты - солн хлорноватистой кислоты.
|"нпофосфи11.1 io.ni фосфор! шва гнет, ни кислоты.
1'нис - ДИ1 и драг сульфата кальция.
Глаи1с|ч-ва со.н. - дек:м ii.ipai с\.н.фа1а на1рпя (мирабилит).
240
Гомогенные реакции реакции, которые протекают равномерно во
воем объеме жилкою рас i кора илн гатовой смеси.
Графит- аллотропная модификация углерода.
Гремучий I ill ra'SOFiaw t.MCci., состшклн и i iu\\ пп|,(\ич1 нодорола и
одного объема кислорода.
Дейтерий - moron водорода.
пл ексоой рачо nai ел е м.
Десиканты - химические q)t,'iein,i, П|>слп;ми,псиные для
предуборочного isue_\ штанин приемных чаасй растений,
Дефолианты - Химические cpivii-i на, иреднашаченные ДЛЯ ускори-
иия опадения лисп.сп и раскрыта коробочек хлопка.
Диаспор-Kpuuiaji.'iH'EucKiis) мо;Ш1|)ика[|ия i илрчкиила алюминии.
Диборам - npiKiciiiiiec hi бинарных соодиноннй бора с водородом.
Диг идрофоофвТЫ - кислые одночамещепные сопи фосфорной кне-
Дииольный НСМОЛ
Ди<
чаряда диполя н
на, направлен С
пропорцномцх
цесе, н котором
IIHinng LlbllLnM
Дихроматы - соли,
ДИ1
ДЛ1
|иан -C,N,- пии
ша евяэи - расе
ИуЮ свячь.
йвки кормовые
димые » пебол!
пых животных.
.1 puu'loillll
1 oipHiiaicJ
1ВЯНИС - OK
ПРОИСХОДИ!
LIlXpllMUIloil
арное Loeiii
um Полей in
:kiiii иро1Пгед-.п14Не положи i eиi.noi о
e между lapsz
ibiuiro ПОЛЮС!
ислителыю-а
одновреме hm
Зелоты!'0™
шение углеро
:ду я.чрами ат
пили биолог
I01MX в рапи'
UIKOro удовле
1 лиги
jccrai
оеув.
итог
пас а
1ческ1
)НЫ С
гаоре
IJH.II1.IX И 5ИОЛОГИЧ1
ш к пол1)жи1ель-
ювигельный про-
:лимение и умень-
элемента.
образующих лан-
и препараты, по
1НЯ ||\ IIOIIH.-i.IH"'
Доломит - минерл и дионили lojip, ка[1Й1шл1 м;и нин и кзин.цин.
ДОНОр—агом, молекула ИЛИ НО редостанлчннцие
вобщвераспоряжение электронную пару при ибри'юнннии кинплсишой спичи ни
донорпо-акцсп1орп11.м> механизму.
Железный купорос- гсшашлрш сульфл! а железа.
HiiicciHHK тарпан норилл.иОрп'юк.иш.м минералом кальцитом, кар-
Hii.tiis.nopi.] кии. ни лп-истишыс вснкч'ша.
эаинсимосш от рН раствора.
Hiii'piiii.u-i.i 11.1 \ui;i|u-i!1iiCL- и.i ш,linn i> 1:11.41.1.1111.14
V[]IA-iio;ii руины.
Иодаты - соли йодноватой кислоты.
ИОДИДЫ - СОЛИ tl(Vlotlo;ilip(i.1}l(1H КИСЛОТЫ.
Иодоводород - газ, бинарное соединения иода и водорода
Ионная сила - полусумма произведении концентрам "
сортов тчюв. присутствующих в растворе, на квалратэаряла
сорта.
Ионный обмм
ду твердым
ром члектро.
Ионофоры - ИШ
ТШНЫ через
■■■V «
t|umiiK.'Mi
UHO 3111 11
м химическая реш
)м ионообменкш
(ионнтом) и раство-
I-
1т - минерал. КС! ■ MgSO< ■ ЗН.О.
Калима| нешя k:liiihiuil- vnn'pt:niie! К,SO MgSO .
Каломель -llg.CI,-
Кальцит - минерал СаСО,.
Каолинит - минерал AI,[Si,OJ{OH),.
Карбамид - амид мольной кислоты.
Карбиды miN.ipiiihii: ччминсиин )1.Ю[ю;м. и koinpi.ix 'злектроотри-
иателынк"! k> s нерола Гю.н.тс. чем v mofxim мемента, входяще-
Карбнн - алло грош 1^14 модификация углерода.
Карбонаты - соли угольной кислоты.
Klini'l'l IN Л.I ki'MII II'k* III.U" i 1 4' Illlk HUM \' l.i '■. ■ 11Э l\ Mil .HI 1.1МИ 1. 14 Жн| I
ми, 10к\,11.1 чof 1 ооксида углерода CO.
Карборунд - карбид кремнии SiC.
Карналлит- KCI ■ MgC'l, ■ 6H,O
Катализ - hobmihuhhi: скоросГн реакции пил влнинисм катализатора.
Катализатор перасходусмый peaiciir. увеличивающий скорость
реакции.
Fl\ k.l I lk']U4'. ] J|^ll k''H J1 IK 11 . |l.lv' I I'.i'p.IMN ' ILk I |ll' |И ЦШ
Кварц- минерал, диоксид кремнии.
Квасш,1 кристаллотдрам.! двойных сульфатов, содержащих одно-
и трехзарядные катионы.
Кернит - минерал. Na.H.O, ■ 4Н,О.
Киноварь - HgS.
242
■я HNO,;
-азотноватистая II.N.O,:
-борная Н,ВО; '
-бромноватаяННК),:
- бромноиатнста» I ЮВг;
- бромоводородная НВг;
- гсксафторокрсммисиач М |Sil . |.
;|.."■';„,',.,т..1 ■
- дифосфорная ЙлРр :
-йодная Н,1О;
- ортокрсммиспая H.SiOj
- ортотеллуровая II ГсО ;
-ортофосфорначН^;
- нироссрная H,S,O,:
■ пврофосфорнйя Н,Р,О,;
- и.шкиконан III. ic л,\: 'ич фюрикп.юро [пая:
|я H,SeO,:
- селеноводородная ll.Sc:
- серная Н£О;
- сернистая И,SO,, выделить m водных растворов
-сероводородная H,S:
- синильная 11CN. то же. что и на новодородная;
-соляная НС1.Т0же.чп>хлороводородная;
- суиерфпсфприая. то жи. что фосфолеум - равио
состав которой наряду с ортофосфорной входя
-теллуристая ИЛ fO, I» tno6m»oM виде не сущест
- пенлуроводородная НгТе:
-тетрабормля П.И.О.(и
-IHOCepHM II.S.G,,
- тиоу| 1Ы1.п;1яТ IjCS .
-п^и.,.,,,,,,, IINCS.
рффдими II I1 О . in ли. -mi фиис
- угольная Н.СО,.
-фосфористая Н.РО,.
-фосфорная И,РО,, гоже, чтоортфосфорнаи.
-фосфорнсмжпюты HjTO,,
ф HF
р
рмНСЮ,,
-хлорная ИСК),'
-еторноввмяНСЮд,
|
- хлороводорч/шам IICI.
-хромовая П,СЮ4,
- щшюводорчлпая HCN.
Кларк - чисг|1). i:i.ip,i'K;iiiiiiLtv с[>слисс ^.ч^
мента на Земле и целом, к каж loii и
Концен!ранни милнриая -отношение кати
содержащегося в растворе, к объему л
Корунд - минерал, Л1,О,.
Кофсрмен I м i к.-Гн)Л i.ii i кс нииелковыс мол
с пчлимбирные ли-
Кремнсзем - диоксид кремния S
Криолит - минерал, Na,[AlF6].
Кристаллогидраты -- кричал.пинские вещества, в которых на
каждые атом, молекулы или нон приходится строго определенное
Кристаллы -твердые тела, атомы, молекулы или ионы которых
образуют упорядочению структур) -кристаллическую решетку;
- ионные - кристаллы, в уиач кршлалличеекой решетки которых
- метал;] и чес кис - кристаллы, в умах кристаллической решетки
которых находятся атомы металлов;
- молекулярные - кристаллы, в узлах кристаллической решетки
которых находятся электронен? рал ьные молекулы.
Купоросы -кристалл огилра! ы сульфагон некоторых тяжелых метал-
Лангбейнит- минерал, K,SO4 ■ 2MgSO4.
усов лантаноидов с ростом атомнот номера.
Ланатноиды - чстырнад11ачь/-элементои, следующих за лантаном в
периодическом сие кме Л М Менделеева.
Лс Шатсльс принцип - если на chcilun, iсходящуюся в состоянии
химическою равновесия, производи itи внешнее воздействие, то
раннонссис емещас1ся в сторону той из дву\ нрогшюположныч.
реакций, которая ОСДИблНП ш)следствия лсто воздействия.
Лиганды - молекулы или ионы, юпосрядствеяво связанные с комп-
лексооборазователем в составе внутренней координационной
сферы комплексною соединения.
_J|HMH"jnpvnnii;in С1;мин меллепнач llt,i in^i химической реакции,
определяющая се скорость.
Лонсдейлит - ал.ни ройная модификации углерода.
Магнетит - минерал. Ке,О,.
Магнитный железняк - минерал, Е'е.О,, то же, что магнетит;
Малахит- минерал. СиСО, Си(ОН)..
Манганит - минерал, МпО(ОН).
Манганагы - соли, в котирмч si.iprani.-n №вШЛ в состав
кислородсодержащего аннона.
Массовая доля - бе (размерная физическая величина,
характеризующая содержание компонента в системе, например, в смеси,
растворе, химическом соединении, минерале, горной породе, равна
отношению массы компонента к массе системы, выражается в
долях ели ни. в процентах, и промилле (тысячных долях), в
Menu и ipoB.ii ! ;ыюмш1ИЯ - АЮ(ОН).
Мирабилш минер;!.i. дскш лдр;и |_ч.ил[]:и ;i нлрпя. u> же, что глау-
М[>.1||Г> UMI.J Li'.FII. I kMCJOpO.liJO icpA.lrllli'.IM illlll!HI;l\lll МОЛИ^ДСН.'!
Mo.iiiu.tL-inii минерал, MoS,.
Молибдш - минерал, 1-с,(Мо"ОД ■ »H,O.
Моль - количеств iwuiocntu, wicp^iiuei: оо.н.ко же структурных
элемент». l-мчи.ки ;uomi>h содержи i<:h и I 2 г млсрода "С.
Монтмориллонит-минерал, AySiHOJ(OH);.
Мори о> и. K'kk-Mi и i]),ip |_>;иьф.]|.1 /!.<■ 1С 1;1([|)-аммонич
Мускович мппср,1л. KAl.'[AISi,() ](OM),.
Нитраты - сопи вхопюЯ кислены.
Нитр>1,'|ы - бюярШИ СОНШНЯНМ ЯЗОга, в которых элсктроотрица-
став ЭТОГО соединения.
Нитриты - соли ачотистой кислоты.
Озон-аллт роиtriifi mh.iih|hik;uihh кислорода. О,.
Оксид
- алюминия - AI.O,. ШяфОтеркЫЙ оксид;
- бериллия Hl4J, амфотернын оксид:
- бора ВуО- кислотный оксид;
- ванадия(У) V.O,, кислотный оксид;
- висм> la(lll) [ii.O,. ирсоблалаип св
- BHCMjTa(V) BLbj, и чнсюм виде н
- ia.i.Hiu(lll| (I.i.(\, амфшсриый окс
-жеиоа(1]) |Ч'<>. iipi-ofi e:i uiioi енп
-желс-saOil) IV.С),, амфотсриый
-1111 I1IH 111 О . :1М[|и1|С|ЧИ,|И ilkC
- Mapiiiiitiii(lll) Мм О . iiptnti livuiun ci
-Mapiaiiiia([V| Mn'O,'. амфои-рцык ок
- меди CuO, имфотерный оксид;
- натрии N«,O, основный оксид;
-cypi.Mi.i(V|Sb.O,. кислотный оксид;
- таллии! I» ri.O.iiciiOiiHbiii оксид,
- хром;||Ш> СгД шфотертый оксид;
- хрома(У[) С rt),, кислотный оксид;
- цинка ZnO. амфотирмый оксид.
Оксония катион -Н,О\
Олеум - растппр 1 pik'^Lir ui lll[>i.i и серной кислоте.
Оливин - минерал (Mg.Fc),[SiO4].
Ортокла-i - ШМЦШЯ K[A]S^OJ, то же. что калиевый полевой шпат.
Паули принцип - в атоме не можег быть двух вПОПрснк»С одинако-
Периодаты - коли йодной кислоты.
Пермашанты - соли марганцовой кислоты.
Перокеиды - бинарные соединен и я кислорода, содержащие перок-
сид-номы O,J".
Нероксид водорода И.О.. слабая кислота, проявляет и
окислительные и восстановительные свойства.
11срокеокислоты - кисло! ы. II молекч.мч кок>ры\ имеется пероксид-
пая группа - О - О-.
I Icpx.mpjiT >,i -коли хлорной кислоты.
Пестициды - химические средства борьбы с сорняками,
вредителями и болено^ши.лъичимпшкч ценных растений.
Пироксены - класс мииер;ш<т. ч> и рллишч ниш орикшишия фр;и-
мент [Si5O6]*-.
I litpi) ночи I минерал МпОг.
Пиросульфигы - соли с анионом S;O,? .тоже, что метабисульфиты.
Полевые шпаты - группа минералок, ЩОЫорфНЫС смеси аи ю моей-
ликатов калии, шпрщ и кальция.
Полисульфиды - соли суньфанов.
Правила
- Ваит-Гоффа - повышение температуры на каждые 10° увеличивает
скорость реакции в 2-4 раза.
- K.IC'lhOHLhOlO HK'p] L1] H'ICCKLIL' \рОН]Ш ЕЕ ЧО."1\ pilHIIJI У1Ч1МОН "lajKl.l-
ниютсяздекгронами в порядке возрастания суммы главного и
орбитального квантоных чисел. При одном и том же значении этой
с\чмм sano niciiiiL' происходит в порядке возрастания ианжчч
- Хунда - электроны избетют занимать одну и ту же орбиталь
настолько, насколько тто совместимо с принципом минимума
энергии. Электроны, поодиночке занимающиеорбитали одного и того
же пидурошш hml/ioi емшыконые (параллельные) спины.
Преципитат-фосфорное уяобрпою С'аШ'О, ■ 2Н,О.
Произведение растворимости - произведение активностей ионов в
насыщенном растворе, взятых в степенях, равных их
социометрическим кпффициентам в ураннении реакции растворения ма-
Протий - легкий i
Равновесие ХКШ1
QDTOCI водорода 41.
скорость прямой реакции равна с
Радиусы
■ Ван-дер-Наалье;
могут ебличи-i
реак
iopocm обратной реакции
i - половина кратчайше!
ься ядра двух один
ым молекулам;
- ионные - р&ССТОЖННО ОТ ядра до ТОЧ!
[1ЛШ1И1С1ЫО. Л
■ металлический -
ежащей на оси, коп
половина крагчай!
о расстояния, на которс
:исм
орая!
инимальной электронно
:оединяет ядра катиона
icro расстояния между ядрам
атомов в h|iHL-in.r семи! и i рч h i ч pi_- металлов.
Растворимое 11. способное i \> вещееп в растворяться в растворителя!!,
количественно ч.флмерипскя копнен i p;in.]ii:n насыщенного ра-
i4Biip;i i.umoin ил-пи.*, ii',I ii i.iiiiio4.! п,кпIиорителе.
Реакции
- nrrepoi енные реактпш, оеущеетв.1яюшиеся на поверхности твер-
на поверхнокгн жнлкост». реагирующей с гаюм;
- гомо1 l.-iiih,k' реакции. npiUL'h:iiomne равномерно во всем объеме
жилкою \r.\c i Е'ори и.hi i ;i ioih>h смеси;
-обрапимыс реакции, коюрые пр4.чскакч k;ik в прямом
направлении (превращение реагентов в продукты), пак и в обратном
направлении (превращение продуктов в реагенты);
- экзотермические - реакции, сопровождающиеся выделением теп-
- эндок'рчл'м1, I ,-. .^ к |ц. .■.. i.ii ч ujti_-cя поиошеннсм
теплоты.
Регуляторы роста растений - химические средства для обработки
семян с целью имтимсификацни их ti(>up:ii:iiiiiiia ii ;viя обработки
pat icmiii l iK.ii.in 4l]^o]4iiiiiw |hhj ni. \ во iii'iciuih биомассы,
усиления устойчивости к ис1л:1;и чпрпншым факторам о
среды, пош.пнепня урожайности и качесша продунц
Pencji.iciTi ы - пестициды, nuivi ипающие насекомых.
- В0Д1)|10 ШЛЯ - ВН1
Шая междл аномом водорода, связанны
с атомом наиболее >лек1роотрицателы101
я - химическая свя и, меж.ту нонами:
р
в кристалл и чес и
розультаге перекрывания электронных облаков двух атомов с
образованием лву\ максимумов электронной плотности по
сторонам от линии, соединяющей ядра атомов;
- сш ма - химическая связь, возникающая в результате перекрывании
.)ЛеКТрОНИЫ\ of>.1.!hO1'.lb>XauV.IO!U lM'|i,i Hi HiZiHSlL'M MiLKUMMVM.l (ЛСК-
"ipoFiHOH плотное i и ка линии, соедини юте и ядра атомов;
- химическая - взаимодействие атомов, приводящее к образованию
молекул и.1и h|iin r:s.uou проси,[\ н L'ju^kMMX hciul'ciji и oficcui:-
чиваю]11се их ус гойчивость.
I МНЮМАОрод - гат H,Sc.
СЪ1нтры - устаревшее "и-мшческое название солей азотной кислоты,
тоже, что нитраш.
Сероводород - газ H;S.
Синапы - бинарные соединения кремнии с водородом,
(иникагсль - прозрачные зернистые микропористые вещества,
образующиеся при ьысмиииании и прикл.шьлмии ic.ieii ноликрем-
- бинарные с
Сильвин - минерал KCI.
Си.чьвинит - ОСВДОЧни сорная порода, состоящ
Скорость реакции - количество вещества реаген
реакцию за единицу времени, или количество ру
i.j or"'pj <ог' iM к I 'ч I i.i с iiDiiii[ч кремнии, и единице о^и^.и nfni
гомогенной реакции или на единице поверхности при гпероген-
С1>льватиия -взаимодействие растворяемою мещее i на с
молекулами растворителя.
рона.
249
ентрации си щ подвергшейся
гидроi со.гл n рас пюре:
эффективного и расчетного тарядов
Стехиомет рия - р:и,ам химии, Fi кок'рим и i\ '1люи:ч количественный
o р^акпию. и количествами про;1>ктов.
р и результате реакции.
Сгибни - газ SbH,.
Суйлима1|ия- переход тис-рдого вещества непосредственна в гаюоб-
разнос состоянии, минуя плавление.
Сулема - тривиальное название ди\лоридп ртути HgCI,.
Сульфаны - полисщп.фи.чы волорола H.S^.
Сульфаг ы - cam серной кислоты.
Сульфиды - бинарные соединения серы, в которых элекгроотрица-
>||| |ф] р p p > [||
Са(1 уЮД - H,0 * аВО, НДВОЙИОЙ фпврфосфп Са(! L.POJ, ■ Цр.
Те)и[ураты-солиор1оте/1.|уровой кислоты.
Теллуриты - co;ih ncc>niecinsioiiicH и оичйо шом rii.sc гс;глурнстой
Теллчрошщород-газ Н3Тс.
Тиосул1.ф;ш.1 - соли un>n-pmiM кислоты.
Тионилнигы - соли тноцишювой
Титр - отношение масси растворе
створа (ил).
Тритий - гяжелый ичогоп водорода
i частицы эквиналеша одному катиону водорода в дан-
отпо-основной реакции или одному электрону в данной
mi ы ю- восста i m в ител ыюй реакции.
- белки, которые ка1а,шчнруют химические реакции в
Флюорит - минерал CaF3.
Фосген - дихлорид-ок^ид \ ысрола СОС1Т.
Фосфачы - co.'in op it'фосфорной кислоты.
Фосфиды - бинарные соединении фосфора, в которых элекгроотри-
цательность фосфора выше, чем у второго элемента, входящего в
Фосфины - бинарные соединения фосфора с водородом.
Фосфиты - со.'Ш i|inLif]H|4ii_ mil кислоты.
Фосфония катион - РН/.
Ч»ТОрН.11,| PMIIJI|1JII.IL' LOC LI1MCIIHH ф]|>р,1
Фгорводород - raj НГ.
Фуллерсн - алжтгро17и;1н модификация углерода, с
рическт или Липких но форме к сферам МОЛ1
Фунгицида! - химические ередеша борьбы с гриб:
ции химическом iipoMi.ini [l'iihocih ii ii[hih3iui,'(li но с целью еп>
интенсификации и шшышенин эффективности.
Химия - наука, и ij'iannniiu состав, строение, свойства и превраще-
Хлораты - соли .члорнонаюн кислоты.
Хлориды - бинарные соединения хлора, в которых электроотрица-
Хлориты -соли хлористой кислоты.
Хлороводород - гаэ HCI.
Хромоты - соли хромовой кислоты.
Хромовая смесь - растнор ьичромлл калин н к'оицеш'рированной
серной кислоте.
Целении Mimu|i.i.t SrSO,.
Циановодород - гаэ HCN.
Цианиды -соли цп.iiioii>> юро ими кис ни i.i
Шенит - минерал K.SO, M6SO, ■ 6Н,О.
III\>il и i - Mimepa.i. uotioiii и i ф> i.u'pciioii
Щелочи - сильные хорошо растворимые основания.
251
когоран в данпин кис млю-оснонной ре д мши жвивалента о
ч\ кшиот ио.['ф1М.1 h;im !i l.limi^ii oKULL":
ной реакции - одному электрону.
'1'icKi fiooipiin;iii_LJn.ii(iL4ih ML'pa иИ1и.оГпкк[[[ iiu
обретению отрицательно!и чарялп при обра
f^.illkrpu.nlты hcuil'l 11и. Мк'лск\ ц.1 и крис1;1-].н.1
вследствие rvrch'i|hirriи гическои ;пи o'hhliliiim \\
Эффект
-M.lli|H>UI1K.lH4L-i.-MIH 1ШИ1,|11ГСИ||,1>! U UHI'IIIIUV I ],
ii
Приложение
IUI.kivm.
И,[1О,0Рик„
( :,■-!
U.l-im,hI
Ci
( -1I(M
(Win
СЫг)
I.O.Ui
F=S.<K>
H.-li)
IUXi)
]!()(.,
Ii S.OlAl
КС 10,(4
N,O,(r)
NO,(M
N.O.(kI
NnNtWvl
N.iNf>,(s)
Wrt
sairi
SiH.(.)
ПРИЛОЖЕНИЯ
. тандартныв
-1254
I.B1
0
im i
0
-822,2
-163,2
0
■241.8
■285,8
-1272,3
IJ0.1
E3.3
1-.7
166. '
0
-439.0
34.7
7S
5.74
2Л
66,94
Ml.8
332 4
87,4
fl.4
130.52
70.1
186,8
Ч6.Ч
94,1
82,6
151.0
210.6
240.2
7K.0
" 106
■■ 1.9
248.1
122
204,6
-0
u <7",j«. кДж/моль
-118"1
0
2.83
-29Л
mo.;
0
-740,3
-151.8
-228.6
-237.2
-690.3
-408,0
-300,4
86,6
140,5
114,1
-365.9
0
■ 57J
пение 2 Состав питательных растворов для
I в защищенном грунте ,в tji'umik «клана магеасп.
Ди^сфорна» " "П ЦР-О,
i::ir|4ir|mi|lupiiafl)
i-liviTonii.r.i.iH MOI
(it: in1
(H) 7.08-10*
( ("BimihNVmpiuii.jM
с"""ст"
( еронодоро Ilian
Тмлуромморолнп
Фосфорист.»
Фосфорная lopinj
Ф.кф.р,,,,,,.,,,,,,.,,
Фтрппплпролмая
Хш>|>||1 1.1Я
Injucinu |О|ю;ш.1ч
Щавслсыя
n,so,
H,S
H,Tl!
HNC-S
|[,co,
H,PO,
н,га
нею
IK IO
(11)1 l(fB
:i )i'.7io-7
1 Dl.Oll)-1'
hi in"
II) 1 10"
1)2.3 10'
([1)110"
1 .■! 1 0 '
™7HS
KJAyilLUCI 1
II) Will1
1)5.1 10
11Ц.810-'
ni(i,:io'
N1)5.010"
R.4I0"
1 ) 5.4 10'
£•:• -i ; I llIlM II l|llNkCil.4
*!SUSUi
C.4iiHiuiiUi)oKHCJl
Хрич.| 1 111 i < ii:tpuK-c)IJ
, Цинка гидроиси i
NH-OH ■ [HO
FctOHh
FrtOH},
zz -
TnlUlh:
(1
(1
(1
(1
~ (1
(1
'1
^ .
■„'?
1. Г T A-
-;■■
1 g
1
1
"- ■
IBS
70
A
5
■ 10'
474
S.R
/. V
"as
inn
Л-,,-10"
30,9
ss.o
ности Эле«.нгОВ по Лопингу
[
'■'
ПОП
;:, u-
';- ',
1 :. („!
!!!
м
""'"
INI
*\\
IJ* IJS1 — 1.27
осетамовитвпьиыв
П
n. . :i!.«■":
NO," - H.0 +
NO. * 6H.0
N(1, -211.0
NO,' ♦ 7НЛ
N,11, -211.0
N0,-4H,0H
N. * »T+6e
INO." + -tt№
1NO + 2HH3
UNO, ♦ 7H"+
NOi'+ юн"*
2NO, * 2c -3
N0i"+4H"+*
HNO. + H* + «
mii.oii *;h
MO. 211,0
AIOj- + *H- +
I,,' 2u_Bi
28Ю < 2НЮ
:ню, -6Н-0
1 t 2C-2NII.OI1
- NO + ЮН'
6c MI.OII- 7OII
Jc - NO * 4OIГ
8e - Ntl.lMI - «Ml
2c-2NH, - 201Г
= 2NII,
ft-NOi'+ ЗОН'
- 2NH,'
Sc - N;'* KOH
4e ^ N. + 40H"
6e»NHi' + 2II:O
= NO + НЮ"
2c - NH,' * H,0
3c ai'+'Ioh'"'"
Бщриа
Eap
W-B-l 3H.0
• 3C - Bf; - JOH'
* !Oe = Br.+ I2OH
-1 !в7
-O.Ab
■П.15
■0.14
-0.12
0,11
0.U57
ода
0,275
0.41
0.53
пя
0.B7
O,SS
OSSJ
1,00
1J5
I.4S
-2,35
■im
:.*
■2.90S
-0.865
0.J5
0.50
МлО»* + 2Н.0 < it - MnO. ♦ 4OH"
MnO. + 4H1 + Зе - Mn:'+ IH-0
MnO/ +BH* * 5c - Mn"' t- 411-O
\1гтО4*1М • It - MnO. + 3H>0
MnO,- ■ -til ■ Л' m.io.. :ii.o
V14I1.
Cir" + 2e = Cu
HAsO- + 311.O * 2c = HiAtO, + 2H'
Ni5" + 3e - Ni
NilOlf) - "11 '■ \. 111 1!
Sn;" + 1* = Sn
SnO. • 2H' *a«" SnO • HjO
Sn'" + 3c = Sn"
lln umuu
H?1 *&"-*№?
PbS + 2e = Pb * S:'
РЬО, * AH' * 2c -ГЬ" 1 2I1-O
PbO. * 4H1 < SO,: • 2c -I'bSO, *2HJ3
Se + 2H' + 2e ' H,Se
5О(!■ + H.O - 2* - SO,1 *2OH
:so/ - ■>»,() +8c = s,o,- t iooh
SjO,;1 i 2c = 2S.O,1'
SO/ + 41Г = 11.SO, + П.О
SO,' +8H- + 8c-S;- + 4HjO
SO/" + 10H*+fe-H.S*4H«O
SO,: *EH +6c = S*4HjO
S^r +6H*+4«-3S + 3H)O
0.60
1.228
1,507
692
0.337
0 57
-0.250
0.110
-0.1 ЗА
-0.10B
0,151
0,65
-0.93
-0.126
1.449
|.6B
-0.40
0,741
-0,93
-0,76
■&4S
0.0У
0,14
0.17
0.149
0,311
OJS?
0.45
0,5 ■
AgI + e-Ag + Г
Стронции
Sr:' <■ :e - Sr
Cjpww
SbO.'+HzCH Ze-SbOj'+KW
SbO>4 2H* i 3c = SWX + IM)
H.PO.' + e = Р(йелый) + 2OH"
H,PO, + SH' * Se = Р|бслыи) ♦ 4H.0
HjPOi * 5H" * 5e = Р(красный) t 4HO
H,PO, + 2H' + le - H,PO, *■ 11.0
Фтор
1 3c " 21
Xaep
CIO ' H.O* 2е = СГ + 2ОН"
CIO, + 3H.O + 6e = СГ* 6ОН"
CI. + 2e - 2CI
HOC1 » H" + 2e = CI *1UO
2H0CI t 2H' + 2e = C1.+ 2НЮ
Хром
Cr1' + 2e = Cr
Cr*' + 3e - Cr
Cr1* * e - Cr"
CrO.!-' 4H.O ^ 3e - Cr(011h * 501Г
Cr.O,!* I4H'h Cc = 2CV" » 7H.0
Цинк
Zn" * 2e = 7л
ZnO- 411' ■ 2c /n ■ 2II.()
-0.152
0,799
-2,888
-0,43
0.353
■«,"
-2,05
-0.89
-0.499
-0.39
■0.411
-0J83
-0.276
0.88
0.63
1.359
1.470
1.494
1.630
-0.913
-0,744
-0,407
-0.13
1.333
1.477
-0.763
0,441
ПРИЛОЖЕНИЕ
Kl'MN Ilk.
ЛЁВг,|' 5
Mil;]
АЛЧНЛГ
AtfSOilit* 7
AH.]
ЛМЪОЫОНЫ
Alloxhr 2
MH-OkOKT
MClil* 7
:d(tn},l-
ColNHdJ" 2
( ullr | S
CWNCSJir 3
B,—
4.10-
1-10"
7-№
U IU~'
g in'
5-10*
5-Ю*
310"
Kowi icm
1 ■- 1
ГпГКкГ
ur. ■
Гс(П,()],ОН|-
1чк>\) 1'
lk'li',1
[НяСЦГ-
ngi,j-
Pb(OH),]
S,,H.OlA-l).|
in,]"
tii.i
7_n(S-O,)-l-
B.™
2.IH01"
l!^
7.4 10"
1.1 иГ
1.4 ICf
1.7-Ш'
1.6 1С"
i.» iu-
1 7 |0"
,.«io-
J.I III-
2.41(1'
!.51 10"
MS 1"'
UI0'1
4,(1 10'
5.2.10'
I.M0
}$ 10'
Глава 1. C'rc\H44cipMlKrLLMii: расчеты
Глава 2. Скорость и элсрч^нка химических реакций.
Глава 3. Способы выражении состава растворов 68
Глава 4. Растворы электролитов. Водородный показатель 95
Глава 5. Гидролиз солей 126
Глава 6. С]роение атома и периодический «наш
Д.Й. Менделеева 145
Глава 7. Химическая связь 163
Глава S. Окислите
['.чача 9. Комплекс
Словарь о<
Приложен)
Серп* НиштмпСиярыпм
Нат.пья ЛсоншювнвБимтиси
Нршт Никюринна ДиПлякопл
НЕОРГАНИЧЕСКАЯ ХИМИЯ
шик-чаи. W (K>2(PIIKi Фирм ill (,il.«4':
. 15.3. УЧ.-ИМ.Л 15.8. Усл. кр.-оп 15.5
аж 1WKI щ. Ии. I* 39. Ънм 327.